Клаудины представляют собой интегральные мембранные белки, расположенные в плотных контактах эпителия и эндотелия. Предполагается, что клаудины имеют четыре транс мембранных сегмента с двумя внеклеточными петлями, и N- и С-концами, расположенными в цитоплазме. Семейство трансмембранных белков клаудинов (CLDN) играет определяющую роль в поддержании плотных контактов эпителия и эндотелия, а также может играть роль в поддержании цитоскелета и передаче сигналов в клетке.
Клаудин 6 (CLDN6) представляет собой онкофетальный ген, экспрессируемый в стволовых клетках мыши и человека, а также эмбриоидных тельцах, коммитированных до линии дифференцировки эпителиальных клеток (Turksen, K. et al. (2001) Dev Dyn 222, 292-300; Anderson WJ. et al. (2008) Dev Dyn 237, 504-12; Turksen K. et al. (2002) Development, 129, 1775-84; Assou S. et al. (2007) Stem Cells 25, 961-73). В качестве опухоль-ассоциированного антигена он может быть классифицирован как дифференцировочный антиген в связи с его экспрессией во время ранней стадии эпидермального морфогенеза, где он является определяющим для эпидермальной дифференцировки и образования барьера. Кроме того, экспрессию наблюдали в эпителиальных тканях или неонатальных нормальных эпителиальных тканях языка, кожи, желудка и молочной железы (Abuazza G. et al. (2006), Am J Physiol Renal Physiol 291, 1132-1141; Troy T.C. et al. (2007), Molecular Biotechnology 36, 166-74; Zhao L. et al. (2008), Am J Physiol Regul Integr Comp Physiol 294, 1856-1862). Помимо этого, наши данные показывают низкую или очень низкую экспрессию CLDN6 в плаценте, мочевом пузыре, эндометрии, предстательной железе и периферическом нерве человека и частую сверхэкспрессию CLDN6 в различных видах рака. Было продемонстрировано, что CLDN6 сверхэкспрессируется в опухолях, в том числе опухолях головного мозга детей, аденокарциномах желудка и опухолях зародышевых клеток, а также висцеральных карциномах, таких как карциномы яичников. Также было продемонстрировано, что сверхэкспрессия CLDN6 в клетках рака желудка приводит к повышению инвазивности, миграции и пролиферации, указывая на то, что CLDN6 представляет собой маркер неблагоприятного прогноза и может играть потенциальную роль в поддержании злокачественного фенотипа. Кроме того, было показано, что CLDN6 выступает в качестве супрессора рака вследствие ингибирования клеточной пролиферации и индукции апоптоза в линиях клеток рака молочной железы.
Выравнивание последовательностей CLDN3, CLDN4, CLDN6 и CLDN9, показанное на Фиг. 1В, иллюстрирует, что имеет место высокая степень консерватизма CLDN6 по отношению к другим клаудиновым белкам. Высокая гомология CLDN6 по отношению к другим клаудиновым белкам, в частности, CLDN9 и CLDN4, делает проблематичным получение антител к CLDN6, которые характеризуются свойствами, такими как специфичность и аффинность, подходящие для диагностических целей. Авторы настоящего изобретения обнаружили, что антитела, направленные против определенного эпитопа, расположенного в С-концевом участке CLDN6, удовлетворяют критериям диагностической применимости антител, в частности, для детекции и идентификации клеток, экспрессирующих CLDN6.
Антитела по настоящему раскрытию являются пригодными, например, в диагностике рака и/или в определении того, экспрессируют ли раковые клетки CLDN6. Предпочтительно раковое заболевание или раковая клетка характеризуются поверхностной экспрессией CLDN6. Раковые клетки, экспрессирующие CLDN6, являются подходящими мишенями для видов терапии, целенаправленно воздействующих на CLDN6, таких как терапия антителами, направленными против CLDN6. В соответствии с одним вариантом осуществления раковые клетки экспрессируют или аберрантно экспрессируют CLDN6, в то время как соответствующие нормальные клетки не экспрессируют CLDN6 или экспрессируют CLDN6 при более низком уровне.
Краткое раскрытие настоящего изобретения
В соответствии с одним аспектом настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые связываются:
(i) с пептидом, имеющим аминокислотную последовательность EYPTKNY (SEQ ID NO: 38), и/или
(ii) с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность EYPTKNY (SEQ ID NO: 38), и/или
(iii) с пептидом, имеющим аминокислотную последовательность EYPTKNYV (SEQ ID NO: 29), и/или
(iv) с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность EYPTKNYV (SEQ ID NO: 29), и/или
(v) с пептидом, имеющим аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15), где антитело или его антигенсвязывающий фрагмент не связываются с пептидом, имеющим аминокислотную последовательность TSAPAISRGPSEYPT (SEQ ID NO: 14), и/или
(vi) с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15), где антитело или его антигенсвязывающий фрагмент не связываются с пептидом, имеющим аминокислотную последовательность TSAPAISRGPSEYPT (SEQ ID NO: 14).
В соответствии с вариантами осуществления аспектов, описанных в данном документе, и в соответствии с дополнительными аспектами настоящее изобретение относится к моноклональному антителу или его антигенсвязывающему фрагменту, которые
(i) связывается с пептидом, имеющим аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15), и/или
(ii) связывается с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15).
В соответствии с вариантами осуществления аспектов, описанных в данном документе, и в соответствии с дополнительными аспектами настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые связываются с одним или несколькими, предпочтительно всеми, из следующих пептидов:
PAISRGPSEYPTKNY (SEQ ID NO: 22), AISRGPSEYPTKNYV (SEQ ID NO: 15), ISRGPSEYPTKNYV (SEQ ID NO: 23), SRGPSEYPTKNYV (SEQ ID NO: 24), RGPSEYPTKNYV (SEQ ID NO: 25), GPSEYPTKNYV (SEQ ID NO: 26), PSEYPTKNYV (SEQ ID NO: 27), SEYPTKNYV (SEQ ID NO: 28) и EYPTKNYV (SEQ ID NO: 29), где антитело или его антигенсвязывающий фрагмент не связываются с пептидом, имеющим аминокислотную последовательность TSAPAISRGPSEYPT (SEQ ID NO: 14).
В соответствии с одним вариантом осуществления разница в аффинности связывания к пептиду, с которым антитело или его антигенсвязывающий фрагмент связываются с наименьшей аффинностью, и к пептиду, с которым антитело или его антигенсвязывающий фрагмент связываются с наибольшей аффинностью, составляет 50% или меньше, 40% или меньше, 30% или меньше, 20% или меньше или 10% или меньше.
Антитела или антигенсвязывающие фрагменты, описанные в данном документе, предпочтительно не связываются с пептидом, содержащим аминокислотную последовательность EYPTK (SEQ ID NO: 59) и/или аминокислотную последовательность EYPTKN (SEQ ID NO: 60), но не содержащим аминокислотную последовательность EYPTKNY (SEQ ID NO: 38). Другими словами, антитело или антигенсвязывающий фрагмент, описанные в данном документе, которые связываются с пептидом, имеющим аминокислотную последовательность EYPTKNY (SEQ ID NO: 38), и/или пептидом, имеющим аминокислотную последовательность EYPTKNYV (SEQ ID NO: 29), связываются с указанным пептидом(пептидами) вследствие присутствия второй молекулы тирозина, которая отсутствует в аминокислотной последовательности EYPTK (SEQ ID NO: 59) и/или аминокислотной последовательности EYPTKN (SEQ ID NO: 60). Как показано в данном документе, предпочтительные антитела или антигенсвязывающие фрагменты не связываются с пептидом, содержащим аминокислотную последовательность YPTKNY (SEQ ID NO: 61) и/или EYPTKN (SEQ ID NO: 60), но не содержащим аминокислотную последовательность EYPTKNY (SEQ ID NO: 38), указывая на то, что аминокислотная последовательность EYPTKNY (SEQ ID NO: 38) представляет собой последовательность, которая может рассматриваться как минимальный эпитоп для связывания этих антител.
В соответствии с аспектами, описанными в данном документе, и в соответствии с дополнительными аспектами, настоящее изобретение относится к антителу, продуцируемому гибридомой или получаемому из нее, депонированной в DSMZ (Inhoffenstr. 7В, 38124, Брауншвейг, Германия), и имеющей одно из следующих обозначений и номеров доступа:
1. 58-4В-2, номер доступа DSM АСС3311, депонированной 29 ноября 2016 года;
2. 58-3А, номер доступа DSM АСС3312, депонированной 29 ноября 2016 года; или
3. 58-1В, номер доступа DSM АСС3313, депонированной 29 ноября 2016 года.
Антитела по настоящему изобретению обозначаются в данном документе с помощью ссылки на обозначение антитела и/или с помощью ссылки на клон, продуцирующий указанное антитело.
Настоящее изобретение также относится к антителу, которое конкурирует за связывание CLDN6 с антителом, продуцируемым вышеописанными гибридомами и получаемым из них, и/или имеет специфичность по отношению к антителу к CLDN6, продуцируемому вышеописанными гибридомами или получаемому из них. В соответствии с этими и другим вариантом осуществления настоящее изобретение также относится к антителу, содержащему антигенсвязывающий участок или антигенсвязывающий сайт, в частности, вариабельную область, идентичную или высокоидентичную вариабельной области антител, продуцируемых вышеописанными гибридомами или получаемых из них. Считается, что предпочтительные антитела представляют собой антитела, имеющие области CDR, либо идентичные, либо высокогомологичные областям CDR антител, продуцируемым вышеописанными гибридомами или получаемым из них. Под «высокогомологичным» подразумевается, что от 1 до 5, предпочтительно от 1 до 4, например, от 1 до 3 или 1 или 2 замены могут быть выполнены в каждой области CDR. Особенно предпочтительными антителами являются химерные или гуманизированные формы антител, продуцируемые вышеописанными гибридомами или получаемые из них.
Соответственно, в соответствии с вариантами осуществления аспектов, описанных в данном документе, и в соответствии с дополнительными аспектами настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(i) антитела, продуцируемого клоном или получаемого из него, депонированного под номером доступа DSM АСС3313 (58-1В), DSM АСС3312 (58-3А) или DSM АСС3311 (58-4В-2),
(ii) антитела, которое представляет собой химерную или гуманизированную форму антитела в соответствии с (i),
(iii) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (i),
(iv) антитела, которое характеризуется специфичностью антитела в соответствии с (i), и
(v) антитела, содержащего антигенсвязывающий участок или антигенсвязывающий сайт антитела в соответствии с (i), или
антигенсвязывающему фрагменту антитела в соответствии с любым из (i)-(v).
В соответствии с одним вариантом осуществления антигенсвязывающий участок или антигенсвязывающий сайт антитела в соответствии с (i) содержит вариабельную область антитела в соответствии с (i).
В соответствии с вариантами осуществления аспектов, описанных в данном документе, и в соответствии с дополнительными аспектами настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего:
тяжелую цепь антитела, содержащую:
(i) последовательность тяжелой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 40, 42 или 44 или их вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности тяжелой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 40, 42 или 44 или их вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 51 или 57 или их вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 52 или 58 или их вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с вариантами осуществления аспектов, описанных в данном документе, и в соответствии с дополнительными аспектами настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(а) антитела, содержащего:
легкую цепь антитела, содержащую:
(i) последовательность легкой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 41, 43 или 45 или их вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности легкой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 41, 43 или 45 или их вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с вариантами осуществления аспектов, описанных в данном документе, и в соответствии с дополнительными аспектами настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего:
(I) тяжелую цепь антитела, содержащую:
(i) последовательность тяжелой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 40, 42 или 44 или их вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности тяжелой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 40, 42 или 44 или их вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 51 или 57 или их вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 52 или 58 или их вариант, и/или
(II) легкую цепь антитела, содержащую:
(i) последовательность легкой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 41, 43 или 45 или их вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности легкой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 41, 43 или 45 или их вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего:
(I) тяжелую цепь антитела, содержащую:
(i) последовательность тяжелой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 40 или ее вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности тяжелой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 40 или ее вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 51 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 52 или ее вариант, и
(II) легкую цепь антитела, содержащую:
(i) последовательность легкой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 41 или ее вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности легкой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 41 или ее вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(а) антитела, содержащего:
(I) тяжелую цепь антитела, содержащую:
(i) последовательность тяжелой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 42 или ее вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности тяжелой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 42 или ее вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 57 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 58 или ее вариант, и
(II) легкую цепь антитела, содержащую:
(i) последовательность легкой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 43 или ее вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности легкой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 43 или ее вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(а) антитела, содержащего:
(I) тяжелую цепь антитела, содержащую:
(i) последовательность тяжелой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 44 или ее вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности тяжелой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 44 или ее вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 57 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 58 или ее вариант, и
(II) легкую цепь антитела, содержащую:
(i) последовательность легкой цепи антитела, содержащую последовательность в соответствии с SEQ ID NO: 45 или ее вариант,
(ii) по меньшей мере одну, предпочтительно две, более предпочтительно все три из последовательностей CDR последовательности легкой цепи антитела, содержащей последовательность в соответствии с SEQ ID NO: 45 или ее вариант, или
(iii) последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и предпочтительно дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и/или последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего тяжелую цепь антитела, содержащую последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант, и легкую цепь антитела, содержащую последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего тяжелую цепь антитела, содержащую последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 51 или ее вариант и последовательность CDR2 в соответствии с SEQ ID NO: 52 или ее вариант, и легкую цепь антитела, содержащую последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего тяжелую цепь антитела, содержащую последовательность CDR3 в соответствии с SEQ ID NO: 53 или ее вариант и дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 57 или ее вариант и последовательность CDR2 в соответствии с SEQ ID NO: 58 или ее вариант, и легкую цепь антитела, содержащую последовательность CDR3 в соответствии с SEQ ID NO: 56 или ее вариант и дополнительно содержащую последовательность CDR1 в соответствии с SEQ ID NO: 54 или ее вариант и последовательность CDR2 в соответствии с SEQ ID NO: 55 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, представленную под SEQ ID NO: 40 или ее вариант, и вариабельную область легкую цепи (VL), содержащую аминокислотную последовательность, представленную под SEQ ID NO: 41 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, представленную под SEQ ID NO: 42 или ее вариант, и вариабельную область легкую цепи (VL), содержащую аминокислотную последовательность, представленную под SEQ ID NO: 43 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления настоящее изобретение относится к антителу, выбранному из группы, состоящей из:
(a) антитела, содержащего вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, представленную под SEQ ID NO: 44 или ее вариант, и вариабельную область легкую цепи (VL), содержащую аминокислотную последовательность, представленную под SEQ ID NO: 45 или ее вариант, и
(b) антитела, которое конкурирует за связывание CLDN6 с антителом в соответствии с (а) и/или имеет специфичность по отношению к CLDN6 антитела в соответствии с (а), или антигенсвязывающему фрагменту указанного антитела.
В соответствии с предпочтительными вариантами осуществления антитело по настоящему изобретению содержит тяжелую цепь антитела, содержащую константную область тяжелой цепи гамма-2а, предпочтительно константную область тяжелой цепи гамма-2а человека, и/или содержит легкую цепь антитела, содержащую константную область легкой цепи каппа.
Антитела или антигенсвязывающие фрагменты, описанные в данном документе, связываются с CLDN6. Антитело или антигенсвязывающий фрагмент по настоящему изобретению предпочтительно способны связываться с CLDN6 в его нативном, т.е., встречающемся в природе или неденатурированном состоянии, или в его денатурированном состоянии. В соответствии с одним вариантом осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению связываются с CLDN6, но не с CLDN9, и предпочтительно не связываются с CLDN4 и/или CLDN3. Предпочтительно антитело или его антигенсвязывающий фрагмент по сути не связываются с белком CLDN, отличным от CLDN6. Предпочтительно антитело или его антигенсвязывающий фрагмент по настоящему изобретению являются специфическими по отношению к CLDN6.
В соответствии с одним вариантом осуществления CLDN6 представляет собой связанный с мембраной клеточной поверхности CLDN6. В соответствии с одним вариантом осуществления CLDN6 присутствует на раковых клетках, при этом указанные раковые клетки предпочтительно представляют собой раковые клетки, экспрессирующие CLDN6. В соответствии с одним вариантом осуществления указанные раковые клетки представляют собой клетки из вида рака, выбранного из группы, состоящей из рака яичников, в частности, аденокарциномы яичника и тетракарциномы яичника, рака легкого, в том числе мелкоклеточного рака легкого (SCLC) и немелкоклеточного рака легкого (NSCLC), в частности, плоскоклеточной карциномы и аденокарциномы легкого, рака желудка, рака молочной железы, рака печени, рака поджелудочной железы, рака кожи, в частности, базально-клеточной карциномы и плоско-клеточной карциномы, злокачественной меланомы, рака головы и шеи, в частности, злокачественной плеоморфной аденомы, саркомы, в частности, синовиальной саркомы и карциносаркомы, рака желчных протоков, рака мочевого пузыря, в частности, переходноклеточной карциномы и папиллярной карциномы, рака почки, в частности, почечно-клеточной карциномы, в том числе светлоклеточной почечно-клеточной карциномы и папиллярной почечно-клеточной карциномы, рака толстого кишечника, рака тонкого кишечника, в том числе рака подвздошной кишки, в частности, аденокарциномы тонкого кишечника и аденокарциномы подвздошной кишки, эмбриональной карциномы яичка, хориокарциномы плаценты, рака шейки матки, рака яичка, в частности, семиномы яичка, тератомы яичка и эмбрионального рака яичка, рака матки, опухолей зародышевых клеток, таких как тератокарцинома или эмбриональная карцинома, в частности, опухоли зародышевых клеток яичка, и их метастатические формы.
В соответствии с одним вариантом осуществления антитело по настоящему изобретению представляет собой химерное, человеческое или гуманизированное антитело. В соответствии с одним вариантом осуществления антитело по настоящему изобретению представляет собой моноклональное антитело.
В соответствии с одним вариантом осуществления антитело по настоящему изобретению получают с помощью способа, предусматривающего стадию иммунизации животным пептидом, содержащим аминокислотную последовательность под SEQ ID NO: 49, или эквивалентным пептидом, или нуклеиновой кислотой или клеткой-хозяином, экспрессирующей указанный пептид, предпочтительно состоящим из них. Предпочтительно указанный пептид содержит не более чем 110, 100, 90, 80, 70, 60, 50 или 40 непрерывных аминокислот CLDN6.
Антитела или антигенсвязывающие фрагменты по настоящему изобретению могут быть связаны, т.е., ковалентно или нековалентно связаны, с другими фрагментами, такими как детектируемые метки.
В соответствии с дополнительным аспектом настоящее изобретение относится к конъюгату, содержащему антитело или антигенсвязывающий фрагмент, описанные в данной документе, связанные по меньшей мере с одной детектируемой меткой.
Настоящее изобретение также относится к клетке, такой как гибридома, продуцирующая антитело, описанное в данном документе.
Предпочтительные гибридомы представляют собой гибридомы, депонированные в DSMZ (Inhoffenstr. 7В, 38124, Брауншвейг, Германия) и имеющие одно из следующих обозначений и номеров доступа:
1. 58-4В-2, номер доступа DSM АСС3311, депонированная 29 ноября 2016 года;
2. 58-3А, номер доступа DSM АСС3312, депонированная 29 ноября 2016 года; или
3. 58-1В, номер доступа DSM АСС3313, депонированная 29 ноября 2016 года.
Настоящее изобретение также относится к пептиду, содержащему аминокислотную последовательность под SEQ ID NO: 49 или иммунологически эквивалентный пептид, предпочтительно состоящему из них. Предпочтительно указанный пептид содержит не более чем 110, 100, 90, 80, 70, 60, 50 или 40 непрерывных аминокислот CLDN6.
Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим антитела или их части, например, цепи или антигенсвязывающие фрагменты антитела, или пептиды, описанные в данном документе. Предпочтительно нуклеиновая кислота функционально связана с одним или несколькими элементами контроля экспрессии, обеспечивающими экспрессию в эукариотических или прокариотических клетках. Контрольные элементы, обеспечивающие экспрессию в эукариотических или прокариотических клетках, хорошо известны специалистам в данной области техники.
Нуклеиновая кислота по настоящему изобретению может содержаться в векторе, например, плазмиде, космиде, вирусе, бактериофаге или другом векторе, используемом, например, стандартно в генетической инженерии. Вектор может содержать дополнительные гены, такие как маркерные гены, которые обеспечивают селекцию вектора в подходящей клетке-хозяине и в подходящих условиях. Кроме того, вектор может содержать элементы контроля экспрессии, обеспечивающие соответствующую экспрессию кодирующих участков в подходящих хозяевах. Такие элементы контроля известны специалисту в данной области техники и могут включать в себя промотор, сплайс-кассету и кодон инициации трансляции.
Способы конструирования молекул нуклеиновой кислоты, конструирования векторов, содержащих молекулы нуклеиновой кислоты, введения векторов в соответствующим образом выбранные клетки-хозяева или инициации или достижения экспрессии молекул нуклеиновой кислоты хорошо известны в данной области техники.
Дополнительный аспект настоящего изобретения относится к клетке-хозяину, содержащей нуклеиновую кислоту или вектор, раскрываемые в данном документе.
Дополнительный аспект настоящего изобретения относится к детекции CLDN6 или клеток, экспрессирующих CLDN6, или определению количества CLDN6 или клеток, экспрессирующих CLDN6, с помощью антитела или антигенсвязывающего фрагмента по настоящему изобретению. CLDN6 или клетки, экспрессирующие CLDN6, подвергают детекции, или количество CLDN6 или клеток, экспрессирующих CLDN6, определяют с помощью детекции или определения количества комплекса между CLDN6 и антителом или антигенсвязывающим фрагментом по настоящему изобретению. Образование комплекса указывает на присутствие CLDN6 или клеток, экспрессирующих CLDN6. Такая детекция или определение количества могут быть осуществлены рядом способов, в том числе без ограничения с помощью иммунодетекции с использованием антитела или антигенсвязывающего фрагмента по настоящему изобретению. Способы применения антител для детекции пептидов или белков хорошо известны и включают в себя ELISA, анализы конкурентного связывания и т.д. Как правило, в таких анализах используют антитело или фрагмент антитела, которые связывают целевой пептид или белок, прямо или косвенно связанные с меткой, которая обеспечивает детекцию, например, индикаторными ферментами, радиометками, флуорофорами или парамагнитными частицами. Способы по настоящему изобретению обеспечивают количественные и/или качественные оценки, например, абсолютные и/или относительные оценки уровней CLDN6 или уровней клеток, экспрессирующих CLDN6.
В соответствии с одним аспектом настоящее изобретение относится к способу детекции CLDN6 или определения количества CLDN6 в образце, предусматривающему стадии:
(i) приведения в контакт образца с антителом или его антигенсвязывающим фрагментом по настоящему изобретению или конъюгатом по настоящему изобретению, и
(ii) детекции образования комплекса или определения количества комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6.
В соответствии с одним вариантом осуществления образец представляет собой клеточный образец, т.е., образец, содержащий клетки, такие как раковые клетки. В соответствии с данным вариантом осуществления комплекс предпочтительно образуется между антителом, антигенсвязывающим фрагментом и CLDN6, экспрессируемым клетками в указанном образце.
В соответствии с одним аспектом настоящее изобретение относится к способу определения того, экспрессируют ли клетки CLDN6, предусматривающему стадии:
(i) приведения в контакт клеточного образца с антителом или его антигенсвязывающим фрагментом по настоящему изобретению или конъюгатом по настоящему изобретению, и
(ii) детекции образования комплекса между антителом, антигенсвязывающим фрагментом и CLDN6, экспрессируемым клетками в указанном образце.
В соответствии с одним вариантом осуществления клетки в образце представляют собой раковые клетки. Комплекс предпочтительно образуется между антителом, антигенсвязывающим фрагментом и CLDN6, экспрессируемым клетками в указанном образце.
Дополнительные аспекты настоящего изобретения относятся к способам диагностики или классификации заболеваний с помощью целенаправленного воздействия CLDN6 с использованием антитела или антигенсвязывающего фрагмента по настоящему изобретению. Эти способы обеспечивают избирательную детекцию клеток, которые экспрессируют CLDN6, тем самым, дифференцируя эти клетки от нормальных клеток, не экспрессирующих CLDN6, или патологических клеток, не экспрессирующих CLDN6. Заболевания, характеризующиеся патологическими клетками, экспрессирующими CLDN6, подвергаются лечению с помощью терапии, целенаправленно воздействующей на CLDN6, такой как терапия терапевтическими антителами, направленными против CLDN6. Предпочтительные заболевания для терапии или диагностики представляют собой заболевания, в которых CLDN6 экспрессируется или аберрантно экспрессируется, в частности, раковые заболевания, такие как, описанные в данном документе.
В соответствии с одним аспектом настоящее изобретение относится к способам диагностики, детекции или мониторинга, т.е., определения регресса, прогресса, течения и/или начала наступления ракового заболевания, предусматривающим детекцию CLDN6 или клеток, экспрессирующих CLDN6, и/или определения количества CLDN6 или клеток, экспрессирующих CLDN6, в биологическом образце, выделенном от пациента, с использованием антитела или антигенсвязывающего фрагмента по настоящему изобретению. Такие способы могут быть применены для детекции того, имеет ли субъект раковое заболевание или имеет ли (повышенный) риск развития ракового заболевания, или, например, является ли режим лечения эффективным.
Таким образом, в соответствии с одним аспектом настоящее изобретение относится к способу диагностики, детекции или мониторинга рака, предусматривающему стадии:
(i) приведения в контакт биологического образца с антителом или его антигенсвязывающим фрагментом по настоящему изобретению или конъюгатом по настоящему изобретению, и
(ii) детекции образования комплекса и/или определения количества комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6.
В соответствии с одним вариантом осуществления биологический образец представляет собой клеточный образец, т.е., образец, содержащий клетки, такие как раковые клетки. В соответствии с данным вариантом осуществления комплекс предпочтительно образуется между антителом, антигенсвязывающим фрагментом и CLDN6, экспрессируемым клетками в указанном образце.
Способы мониторинга в соответствии с настоящим изобретением предпочтительно предусматривают детекцию и/или определение количества CLDN6 или клеток, экспрессирующих CLDN6, в первом образце в первой временной точке и в дополнительном образце во второй временной точке, при этом регресс, прогресс, течение и/или начало наступления опухолевого заболевания могут быть определены с помощью сравнения двух указанных образцов.
В типичном случае уровень CLDN6 или уровень клеток, экспрессирующих CLDN6, в биологическим образце сравнивают с референтным уровнем, при этом отклонение от указанного референтного уровня указывает на присутствие и/или стадию ракового заболевания у субъекта. Референтный уровень может представлять собой уровень, определенный в контрольном образце (например, из здоровой ткани или от субъекта, в частности, от пациента без ракового заболевания) или медианный уровень от здоровых субъектов. "Отклонение" от указанного референтного уровня обозначает любое значительное изменение, такое как повышение на по меньшей мере 10%, 20% или 30%, предпочтительно на по меньшей мере 40% или 50% или даже больше.
Предпочтительно присутствие CLDN6 или клеток, экспрессирующих CLDN6, и/или количество CLDN6 или клеток, экспрессирующих CLDN6, которое является повышенным по сравнению с референтным уровнем, например, по сравнению с пациентом без ракового заболевания, указывает на присутствие или риск развития (т.е., возможность развития) ракового заболевания у пациента.
Количество CLDN6 или клеток, экспрессирующих CLDN6, которое является сниженным по сравнению с биологическим образцом, извлеченным ранее от пациента, может указывать на регресс, положительную динамику, например, эффективное лечение, или сниженный риск начала наступления ракового заболевания у пациента.
Количество CLDN6 или клеток, экспрессирующих CLDN6, которое является повышенным по сравнению с биологическим образцом, извлеченным ранее от пациента, может указывать на прогресс, отрицательную динамику, например, неэффективное лечение, повторное развитие или метастатический характер, начало наступления или риск начала наступления ракового заболевания у указанного пациента.
В соответствии с одним аспектом настоящее изобретение относится к способу определения того, подлежит ли рак лечению с помощью терапии рака, целенаправленно воздействующей на CLDN6, предусматривающему стадии:
(i) приведения в контакт образца, содержащего раковые клетки, с антителом или его антигенсвязывающим фрагментом по настоящему изобретению или конъюгатом по настоящему изобретению, и
(ii) детекции образования комплекса между антителом, антигенсвязывающим фрагментом и CLDN6.
Комплекс предпочтительно образуется между антителом, антигенсвязывающим фрагментом и CLDN6, экспрессируемым раковыми клетками в указанном образце.
Такие способы могут быть применены для детекции того, является ли пациент подходящим для терапии, предусматривающей целенаправленное воздействие на клетки, экспрессирующие CLDN6, такой как терапия с использованием антител, проявляющих одну или несколько иммунных эффекторных функций, таких как цитотоксические CLDN6-специфические антитела, например, антитела, меченые цитотоксическим веществом, таким как токсин или радиометка, или индуцирующих механизм уничтожения клеток, такой как CDC или ADCC. Заболевания, характеризующиеся патологическими клетками, экспрессирующими CLDN6, подвергаются лечению с помощью терапии, целенаправленно воздействующей на CLDN6, такие как раковые заболевания, в частности, заболевания, описанные в данном документе.
В одном варианте осуществления любого из вышеуказанных аспектов образец, клеточный образец или биологический образец происходит от пациента, имеющего раковое заболевание, с подозрением на наличие ракового заболевания или заболевающего им или имеющего вероятность ракового заболевания. В соответствии с одним вариантом осуществления образец, клеточный образец или биологический образец происходит из ткани или органа, в которых клетки в случае, когда ткань или орган не имеют рака, по сути не экспрессируют CLDN6. Предпочтительно указанная ткань представляет собой ткань, отличную от ткани плаценты. Предпочтительно указанная ткань уже была диагностирована как пораженная раковым заболеванием, например, с помощью визуального осмотра или исследования культуры клеток указанной ткани или органа. В соответствии с данным вариантом осуществления присутствие CLDN6 или клеток, экспрессирующих CLDN6, и/или количества CLDN6 или клеток, экспрессирующих CLDN6, которое является повышенным по сравнению с референтным уровнем, например, по сравнению с пациентом без опухолевого заболевания, может указывать на то, что пациент является подходящим для терапии, предусматривающей целенаправленное воздействие на клетки, экспрессирующие CLDN6.
В соответствии с одним аспектом в настоящем изобретении предусмотрены композиции, например, диагностические композиции или наборы, содержащие антитело или антигенсвязывающий фрагмент или комбинацию антител и/или антигенсвязывающих фрагментов, описанных в данном документе. Такие диагностические композиции или тест-наборы являются пригодными в способах по настоящему изобретению, таких как способы диагностики, детекции или мониторинга по настоящему изобретению. Указанные наборы могут необязательно содержать детектируемую метку, например, индикаторные ферменты, радиометки, флуорофоры или парамагнитные частицы. Наборы могут содержать информационные проспекты, например, проспекты, содержащие информацию о том, как использовать реагенты для практического осуществления способа, описанного в данном документе.
Другие характеристики и преимущества настоящего изобретения будут очевидны из следующего подробного описания и формулы изобретения.
Подробное раскрытие настоящего изобретения
Несмотря на то, что настоящее изобретение подробно описано ниже, необходимо понимать, что настоящее изобретение не ограничивается конкретными способами, протоколами и реагентами, описанными в данном документе, поскольку таковые могут варьировать. Также необходимо понимать, что терминология, используемая в данном документе, предназначена лишь в описательных целях конкретных вариантов осуществления, и не предполагает ограничивать объем настоящего изобретения, который будет ограничиваться лишь прилагаемой формулой изобретения. Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, как и обычно понимаемые специалистом в данной области техники.
Далее будут описаны элементы настоящего изобретения. Эти элементы приведены в определенных вариантах осуществления, однако необходимо понимать, что их можно комбинировать любым способом и в любом количестве для получения дополнительных вариантов осуществления. Различным образом описанные примеры и предпочтительные варианты осуществления не должны ограничивать настоящее изобретение лишь явно описанными вариантами осуществления. Необходимо понимать, что в настоящем изобретении поддержаны и охвачены все варианты осуществления, с помощью которых комбинируют явно описанные варианты осуществления с любым числом раскрытых и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех описанных элементов в настоящей заявке следует рассматривать раскрытыми посредством описания настоящей заявки, если в контексте не указано иное.
Предпочтительно термины, используемые в данном документе, определяют, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", H.G.W. Leuenberger, B. Nagel, and H. Kölbl, Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
При практическом осуществлении настоящего изобретения будут использовать, если не указано иное, стандартные способы химии, биохимии, клеточной биологии, иммунологии и методик рекомбинантной ДНК, которые изложены в литературе в данной области техники (для сравнения, например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
Во всем настоящем описании и формуле изобретения, если контекстом не подразумевается иное, слово «содержать» и вариации, такие как «содержит» или «содержащий», будут подразумевать включение указанного представителя, целого числа или стадии или группы из представителей, целых чисел или стадий, но не исключение любого другого представителя, целого числа или стадии или группы представителей, целых чисел или стадий, несмотря на то, что в некоторых вариантах осуществления такой другой представитель, целое число или стадия или группа представителей, целых чисел или стадий могут быть исключены, т.е. предмет изучения заключается во включении указанного представителя, целого числа или стадии или группы представителей, целых чисел или стадий. Термины в единственном числе и аналогичная отсылка, используемая в контексте описания настоящего изобретения (особенно в контексте следующей далее формулы изобретения) подразумевает включение единственного и множественного числа, если в данном документе не указано иное или отчетливо не противоречит контексту. Цитирование диапазона значений в данном документе предусмотрено лишь в целях сокращенного способа отсылки на каждое в отдельности значение, находящееся в пределах диапазона. Если не указано иное в данном документе, то каждое отдельное значение включено в описание так, как если бы оно цитировалось в отдельности в данном документе. Все способы, описанные в данном документе, можно выполнять в любом подходящем порядке, если не указано иное или иным образом не находится в противоречии с контекстом. Применение любых и всех примеров или иллюстративного стиля (например, «такой как»), предусмотренных в данном документе, предусматривает лишь более эффективное описание настоящего изобретения и не ограничивает объем настоящего изобретения, если не указано иное. Никакой стиль в настоящем описании не следует воспринимать как указывающий на какой-либо не заявленный элемент в качестве необходимого для целей практического осуществления настоящего изобретения.
Несколько документов цитируют по ходу всего настоящего описания. Каждый из документов, цитируемый в данном документе (в том числе все патенты, заявки на патент, научные публикации, описания производителей, инструкции и т.п.), безотносительно выше или ниже, тем самым включены посредством ссылки в полном объеме. Ничто в данном документе не должно толковаться как признание того, что настоящее изобретение не имеет права преподносить такое изобретение в силу предшествующего изобретения.
Термин «рекомбинантный» в контексте настоящего изобретения означает «созданный с помощью генной инженерии». Предпочтительно «рекомбинантный объект», такой как рекомбинантная клетка в контексте настоящего изобретения, не встречается в природе.
Термин «встречающийся в природе», используемый в отношении объекта, относится к тому факту, что объект может быть обнаружен в природе. Например, пептид или нуклеиновая кислота, которые присутствует в организме (в том числе вирусах) и могут быть выделены из природного источника и которые не были намеренно модифицированы человеком в лаборатории, встречаются в природе.
Термин «антиген» относится к агенту, содержащему эпитоп против которого направлен и/или должен образоваться иммунный ответ.Предпочтительно антиген в контексте настоящего изобретения представляет собой молекулу, которая необязательно после процессинга индуцирует иммунную реакцию, которая предпочтительно является специфической по отношению к антигену. Термин «антиген» включает в себя определенные белки, пептиды, полисахариды, нуклеиновые кислоты, особенно РНК и ДНК, а также нуклеотиды.
Термин «эпитоп» относится к антигенной детерминанте в молекуле антигена, т.е., к части молекулы, которая распознается иммунной системой, например, которая распознается антителом. Например, эпитопы представляют собой дискретные трехмерные сайты на антигене, которые распознаются иммунной системой. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или боковые цепи сахаров, и обычно обладают специфическими трехмерными структурными характеристиками, а также специфическими характеристиками заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание первого, но не последнего, утрачивается в присутствии денатурирующих растворителей. Эпитоп белка, такого как CLDN, предпочтительно содержит непрерывный или прерывистый участок указанного белка и предпочтительно содержит от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30, наиболее предпочтительно от 10 до 25 аминокислот в длину, например, эпитоп может содержать предпочтительно 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот в длину.
Термин «прерывистый эпитоп», используемый в данном документе, означает конформационный эпитоп на белковом антигене, который образован из по меньшей мере двух разделенных участков в первичной последовательности белка.
Антигены включают в себя опухоль-ассоциированные антигены, такие как CLDN6, т.е., компоненты раковых клеток, которые могут быть получены из цитоплазмы, клеточной поверхности и клеточного ядра, в частности, такие антигены, которые продуцируются, предпочтительно в большом количестве внутриклеточно или в виде поверхностных антигенов на раковых клетках.
В контексте настоящего изобретения термины «опухоль-ассоциированный антиген» или «опухолевый антиген» относятся к белкам, которые в нормальных условиях специфически экспрессируются в ограниченном количестве тканей и/или органов или на конкретных стадиях развития, например, опухоль-ассоциированный антиген может в нормальных условиях специфически экспрессироваться в ткани желудка, предпочтительно в слизистой оболочке желудка, в половых органах, например, в семенниках, в ткани трофобласта, например, в плаценте или в клетках зародышевой линии, и экспрессируются или аберрантно экспрессируются в одной или нескольких опухолевых или раковых тканях. В этом контексте «ограниченное количество» предпочтительно означает не более чем 3, более предпочтительно не более чем 2. Опухоль-ассоциированные антигены в контексте настоящего изобретения включают в себя, например, дифференцировочные антигены, предпочтительно дифференцировочные антигены, специфические по отношению к типу клеток, т.е., белки, которые в нормальных условиях специфически экспрессируются в определенном типе клеток на определенной стадии дифференцировки, раковые антигены/антигены семенников, т.е., белки, которые в нормальных условиях специфически экспрессируются в семенниках и иногда в плаценте, а также антигены, специфические по отношению к зародышевой линии. В контексте настоящего изобретения опухоль-ассоциированный антиген по настоящему изобретению предпочтительно ассоциирован с клеточной поверхностью раковой клетки и предпочтительно не экспрессируется или только редко экспрессируется в нормальных тканях. Предпочтительно опухоль-ассоциированный антиген или экспрессию аберрантного антигена определяют раковые клетки. В контексте настоящего изобретения опухоль-ассоциированный антиген, который экспрессируется раковой клеткой у субъекта, например, пациента, страдающего от ракового заболевания, предпочтительно представляет собой собственный белок в организме указанного пациента. В соответствии с предпочтительными вариантами осуществления опухоль-ассоциированный антиген в контексте настоящего изобретения экспрессируется в нормальных условиях специфически в ткани или органе, которые являются второстепенными, т.е., тканях или органах, которые при повреждении иммунной системой не приводят к смерти субъекта, или в органах или структурах организма, которые недоступны или лишь с трудом доступны для иммунной системы. Предпочтительно аминокислотная последовательность опухоль-ассоциированного антигена является идентичной опухоль-ассоциированному антигену, который экспрессируется в нормальных тканях, и опухоль-ассоциированному антигену, который экспрессируется в раковых тканях.
Примеры дифференцировочных антигенов, которые идеально соответствуют критериям опухоль-ассоциированных антигенов в качестве целевых структур при иммунотерапии опухолей, в частности, при противоопухолевой вакцинации, представляют собой белки клеточной поверхности семейства клаудинов, такие как CLDN6. Клаудины представляют собой семейство белков, которые представляют собой наиболее важные компоненты плотных контактов, где они образуют параклеточный барьер, который контролирует поток молекул в межклеточном пространстве между клетками эпителия.
Клаудины представляют собой трансмембранные белки, охватывающие мембрану 4 раза с помощью N-терминального и С-терминального конца, каждый из которых расположен в цитоплазме.
Термин «клаудин 6» или «CLDN6» предпочтительно относится к CLDN6 человека, и, в частности, к белку, содержащему аминокислотную последовательность в соответствии с SEQ ID NO: 1 Перечня последовательностей или вариант указанной аминокислотной последовательности. По отношению к CLDN6 термин «вариант», в частности, относится к белку, содержащему аминокислотную последовательность в соответствии с SEQ ID NO: 1 Перечня последовательностей, где Ile в положении 143 замещен Val. Термин «CLDN6» включает в себя любые варианты CLDN6, такие как посттрансляционно модифицированные варианты и конформационные варианты.
Термин «CLDN9» предпочтительно относится к CLDN9 человека, и, в частности, к белку, содержащему аминокислотную последовательность в соответствии с SEQ ID NO: 2 Перечня последовательностей или вариант указанной аминокислотной последовательности.
Термин «CLDN4» предпочтительно относится к CLDN4 человека, и, в частности, к белку, содержащему аминокислотную последовательность в соответствии с SEQ ID NO: 4 Перечня последовательностей или вариант указанной аминокислотной последовательности.
Термин «CLDN3» предпочтительно относится к CLDN3 человека, и, в частности, к белку, содержащему аминокислотную последовательность в соответствии с SEQ ID NO: 3 Перечня последовательностей или вариант указанной аминокислотной последовательности.
Обнаружено, что CLDN6 экспрессировался, например, при раке яичников, раке легкого, раке желудка, раке молочной железы, раке печени, раке поджелудочной железы, раке кожи, меланомах, раке головы и шеи, саркомах, раке желчных протоков, почечно-клеточном раке и раке мочевого пузыря. CLDN6 детектируется и может претерпевать целенаправленное воздействие при раке яичников, в частности, аденокарциноме яичника и тетракарциноме яичника, раке легкого, в том числе мелкоклеточном раке легкого (SCLC) и немелкоклеточном раке легкого (NSCLC), в частности, плоскоклеточной карциноме и аденокарциноме легкого, раке желудка, раке молочной железы, раке печени, рака поджелудочной железы, раке кожи, в частности, базально-клеточной карциноме и плоско-клеточной карциноме, злокачественной меланоме, раке головы и шеи, в частности, злокачественной плеоморфной аденоме, саркоме, в частной, синовиальной саркоме и карциносаркоме, раке желчных протоков, раке мочевого пузыря, в частности, переходноклеточной карциноме и папиллярной карциноме, раке почки, в частности, почечно-клеточной карциноме, в том числе светлоклеточной почечно-клеточной карциноме и папиллярной почечно-клеточной карциноме, раке толстого кишечника, раке тонкого кишечника, в том числе раке подвздошной кишки, в частности, аденокарциноме тонкого кишечника и аденокарциноме подвздошной кишки, эмбриональной карциноме яичка, хориокарциноме плаценты, раке шейки матки, раке яичка, в частности, семиноме яичка, тератоме яичка и эмбриональном раке яичка, раке матки, опухолях зародышевых клеток, таких как тератокарцинома или эмбриональная карцинома, в частности, опухоли зародышевых клеток яичка, и их метастатических формах. В соответствии с одним вариантом осуществления раковое заболевание, ассоциированное с экспрессией CLDN6, выбирают из группы, состоящей из рака яичников, рака легкого, метастатического рака яичников и метастатического рака легкого. Предпочтительно рак яичников представляет собой карциному или аденокарциному. Предпочтительно рак легкого представляет собой карциному или аденокарциному, и предпочтительно бронхиолярный рак, такой как бронхиолярную карциному или бронхиолярную аденокарциному.
В соответствии с настоящим изобретением клетка, экспрессирующая CLDN6, предпочтительно характеризуется CLDN6, связанным с мембраной клеточной поверхности, т.е., CLDN6 ассоциируется с клеточной поверхностью. Кроме того, в соответствии с настоящим изобретением клеточный CLDN6 предпочтительно представляет собой CLDN6, связанный с мембраной клеточной поверхности. Клетка, экспрессирующая CLDN6, или клетка, характеризующаяся ассоциацией CLDN6 со своей клеточной поверхностью, предпочтительно представляет собой раковую клетку, предпочтительно раковую клетку из вида рака, описанного в данном документе.
Термин «ассоциированный с клеточной поверхностью» означает, что опухоль-ассоциированный антиген, такой как CLDN6, ассоциирован с плазматической мембраной клетки, или расположен на ней, при этом по меньшей мере часть опухоль-ассоциированного антигена обращена к внеклеточному пространству указанной клетки и доступна с наружной стороны указанной клетки, например, антителам, расположенным снаружи клетки. В данном контексте часть содержит предпочтительно по меньшей мере 4, предпочтительно по меньшей мере 8, предпочтительно по меньшей мере 12, более предпочтительно по меньшей мере 20 аминокислот. Ассоциация может быть прямой или непрямой. Например, ассоциация может осуществляться с помощью одного или нескольких транс мембранных доменов, одного или нескольких липидных якорей или с помощью взаимодействия с любым другим белком, липидом, сахаридом или другой структурой, которая может быть обнаружена на наружной части плазматической мембраны клетки. Например, опухоль-ассоциированный антиген, ассоциированный с поверхностью клетки, может представлять собой транс мембранный белок, имеющий внеклеточную часть, или может представлять собой белок, ассоциированный с поверхностью клетки с помощью взаимодействия с другим белком, который представляет собой трансмембранный белок.
Термин «клеточная поверхность» или «поверхность клетки» используется в соответствии со своим обычным значением в данной области техники, и, таким образом, включает в себя внешнюю поверхность клетки, которая доступна для связывания белками и другими молекулами.
В соответствии с настоящим изобретением CLDN6 по сути не экспрессируется в клетке, если уровень экспрессии является более низким по сравнению с клетками плаценты или тканью плаценты. Предпочтительно уровень экспрессии является ниже чем 10%, предпочтительно ниже чем 5%, 3%, 2%, 1%, 0,5%, 0,1% или 0,05% от экспрессии в клетках плаценты или ткани плаценты или даже ниже. Предпочтительно CLDN6 по сути не экспрессируется в клетке, если уровень экспрессии превышает уровень экспрессии в ткани, не относящейся к раковой, отличной от плаценты, не более чем в 2 раза, предпочтительно в 1,5 раза, и предпочтительно не превышает уровень экспрессии в указанной ткани, не относящейся к раковой. Предпочтительно CLDN6 по сути не экспрессируется в клетке, если уровень экспрессии составляет ниже предела обнаружения и/или если уровень экспрессии является слишком низким для того, чтобы обеспечить связывание CLDN6-специфическими антителами, добавляемыми к клеткам.
В соответствии с настоящим изобретением CLDN6 экспрессируется в клетке, если уровень экспрессии превышает уровень экспрессии в ткани, не относящейся к раковой, отличной от плаценты, предпочтительно более чем в 2 раза, предпочтительно более чем в 10 раз, более чем в 100 раз, более чем в 1000 раз или более чем в 10000 раз. Предпочтительно CLDN6 экспрессируется в клетке, если уровень экспрессии составляет выше предела обнаружения и/или если уровень экспрессии является достаточно высоким для того, чтобы обеспечить связывание CLDN6-специфическими антителами, добавляемыми к клеткам. Предпочтительно CLDN6, экспрессируемый в клетке, экспрессируется или подвергается воздействию на поверхности указанной клетки.
Термин «антитело» относится к гликопротеину, содержащему по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями, и включает в себя любую молекулу, содержащую его антигенсвязывающий участок. Термин «антитело» включает в себя моноклональные антитела и фрагменты или производные антител, в том числе без ограничения человеческие антитела, гуманизированные антитела, химерные антитела, одноцепочечные антитела, например, scFv и антигенсвязывающие фрагменты антител, такие как Fab- и Fab'-фрагменты, а также включает в себя все рекомбинантные формы антител, например, антитела, экспрессируемые в прокариотах, негликозилированные антитела и антигенсвязывающие фрагменты и производные антител, описанные в данном документе. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в данном документе как VH) и константной области тяжелой цепи. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном документе как VL) и константной области легкой цепи. VH- и VL-области дополнительно могут быть подразделены на области гипервариабельности, называемыми областями, определяющими комплементарность (CDR), расположенными между областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, упорядоченных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (Clq) классической системы комплемента.
Антитела, описанные в данном документе, могут представлять собой человеческие антитела. Термин «человеческое антитело», используемый в данном документе, предусматривает включение в себя антител, имеющих вариабельные и константные области, происходящие из иммуноглобулиновых последовательностей зародышевой линии человека. Человеческие антитела по настоящему изобретению могут включать в себя аминокислотные остатки, не кодируемые иммуноглобулиновыми последовательностями зародышевой линии человека (например, мутации, вводимые с помощью случайного либо сайт-специфического мутагенеза in vitro или с помощью соматической мутации in vivo).
Термин «гуманизированное антитело» относится к молекуле, имеющей антигенсвязывающий сайт, который по сути происходит из иммуноглобулина от отличного от человека вида, при этом оставшаяся структура иммуноглобулина молекулы основана на структуре и/или последовательности иммуноглобулина человека. Антигенсвязывающий сайт может содержать либо полные вариабельные домены, слитые с константными доменами, либо только области, определяющие комплементарность (CDR), привитые на соответствующие каркасные области в вариабельных доменах. Антигенсвязывающие сайты могут быть дикого типа или модифицированными с помощью одной или нескольких аминокислотных замен, например, модифицированных так, чтобы более близко напоминать иммуноглобулины человека. Некоторые формы гуманизированных антител сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиного антитела). Другие формы имеют одну или несколько CDR, которые изменяют по отношению к исходному антителу.
Термин «химерное антитело» относится к таким антителам, в которых один участок каждой из аминокислотных последовательностей тяжелой и легкой цепей является гомологичным по отношению к соответствующим последовательностям в антителах, происходящих от определенного вида или принадлежащих к определенному классу, при этом оставшийся сегмент цепи является гомологичным по отношению к соответствующим последовательностям в другом сегменте. В типичном случае вариабельная область как легкой, так и тяжелой цепей имитирует вариабельные области антител, происходящих от одного вида млекопитающих, в то время как константные участки являются гомологичными по отношению к последовательностям антител, происходящим от другого вида. Одним очевидным преимуществом таких химерных форм является то, что вариабельная область может для удобства происходить из в настоящее время известных источников, использующих легко доступные В-клетки или гибридомы из отличных от человека организмов в комбинации с константными областями, происходящими, например, из препаратов клеток человека. Несмотря на то, что вариабельная область характеризуется преимуществом легкости получения, а специфичность не находится под влиянием источника, константная область, являясь человеческой, менее вероятно вызывает иммунный ответ со стороны субъекта-человека при инъецировании антитела, чем вызывала бы константная область от отличного от человеческого источника. В то же время определение не ограничивается этим конкретным примером.
Термины «антигенсвязывающий участок» антитела (или просто «связывающий участок») или «антигенсвязывающий фрагмент» антитела (или просто «связывающий фрагмент») относятся к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может осуществляться с помощью фрагментов полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающий участок» антитела, включают в себя (i) Fab-фрагменты, моновалентные фрагменты, состоящие из VL-, VH-, CL- и СН-доменов; (ii) F(ab')2-фрагменты, бивалентные фрагменты, содержащие два Fab-фрагмента, связанных дисульфидным мостиком в шарнирном участке; (iii) Fd-фрагменты, состоящие из VH- и СН-доменов; (iv) Fv-фрагменты, состоящие из VL- и VH-доменов одного плеча антитела, (v) dAb-фрагменты (Ward et al., (1989) Nature 341: 544-546), которые состоят из VH-домена; (vi) выделенные области, определяющие комплементарность (CDR), и (vii) комбинации из двух или более выделенных CDR, которые необязательно могут быть соединены с помощью синтетического линкера. Помимо этого, несмотря на то, что два домена Fv-фрагмента, VL- и VH, кодируются отдельными генами, они могут быть соединены, с использованием рекомбинантных способов, с помощью синтетического линкера, который позволяет получать их в виде одной белковой цепи, в которой VL- и VH-области объединяются с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Подразумевается, что такие одноцепочечные антитела также охвачены выражением «антигенсвязывающий фрагмент» антитела. Дополнительным примером являются слитые белки на основе связывающего домена и иммуноглобулина, содержащие (i) полипептид связывающего домена, который сливают с полипептидом шарнирной области иммуноглобулина, (ii) константную область СН2 тяжелой цепи иммуноглобулина, слитую с шарнирной областью, и (iii) константную область СН3 тяжелой цепи иммуноглобулина, слитую с константной областью СН2. Полипептид связывающего домена может представлять собой вариабельную область тяжелой цепи или вариабельную область легкой цепи. Слитые белки на основе связывающего домена и иммуноглобулина дополнительно раскрыты в US 2003/0118592 и US 2003/0133939. Указанные фрагменты антител получают с использованием стандартных методик, известных специалистам в данной области техники, а фрагменты проверяют на пригодность таким же образом, как и интактные антитела.
Антитела, описанные в данном документе, могут представлять собой моноклональные антитела. Термин «моноклональное антитело», используемый в данном документе, относится к препарату молекул антител одномолекулярной композиции. Моноклональное антитело характеризуется одной специфичностью и аффинностью связывания. В соответствии с одним вариантом осуществления моноклональные антитела продуцируются гибридомой, которая содержит В-клетку, полученную из отличного от человека животного, например, мыши, слитую с иммортализованной клеткой.
Антитела, описанные в данном документе, могут представлять собой рекомбинантные антитела. Термин «рекомбинантное антитело», используемый в данном документе, включает в себя все антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, например, (а) антитела, выделенные из животного (например, мыши), которое является трансгенным либо трансхромосомным по отношению к генам иммуноглобулинов, или гибридомы, полученной из них, (b) антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела, например, из трасфектомы, (с) антитела, выделенные из библиотеки рекомбинантных комбинаторных антител, и (d) антитела, полученные, экспрессируемые, созданные или выделенные с помощью любых других средств, которые включают в себя сплайсинг последовательностей генов иммуноглобулинов с другими последовательностями ДНК.
Термин «трансфектома», используемый в данном документе, включает в себя рекомбинантные эукариотические клетки-хозяева, экспрессирующие антитело, такие как клетки СНО, клетки NS/0, клетки HEK293, клетки HEK293T, растительные клетки или клетки грибов, в том числе клетки дрожжевых грибов.
Используемый в данном документе термин «гетерологичное антитело» определяют в отношении к трансгенному организму, продуцирующему такое антитело. Этот термин относится к антителу, имеющему аминокислотную последовательность, или последовательности, кодирующей нуклеиновую кислоту, соответствующую ему, которые встречаются в организме, не состоящим из трансгенного организма, и, как правило, происходит от вида, отличного от трансгенного организма.
Используемый в данном документе термин «гетерогибридное антитело» относится к антителу, имеющему легкие и тяжелые цепи, происходящие из различных организмов. Например, антитело, имеющее человеческую тяжелую цепь, ассоциированную с мышиной легкой цепью, представляет собой гетерогибридное антитело.
Настоящее изобретение включает в себя все антитела и производные антител, описанные в данном документе, которые для целей настоящего изобретения охвачены термином «антитело». Термин «производные антитела» относится к любой модифицированной форме антитела, например, конъюгату антитела и другому средству или антителу, или фрагменту антитела.
Антитела, описанные в данном документе, предпочтительно являются выделенными. Термин «выделенное антитело», используемый в данном документе, относится к антителу, которое по сути не содержит других антител, имеющих другие антигенные специфичности. Более того, выделенное антитело может по сути не содержать другой клеточный материал и/или химические вещества.
В соответствии с настоящим изобретением антитело способно связываться с предварительно определенной мишенью, если оно характеризуется значительной аффинностью к предварительно определенной мишени и связывается с указанной предварительно определенной мишенью в стандартных анализах. «Аффинность» или «аффинность связывания» часто измеряется с помощью равновесной константы диссоциации (KD). Предпочтительно термин «значительная аффинность» относится к связыванию с предварительно определенной мишенью с константой диссоциации (KD), составляющей 10-5 М или ниже, 10-6 М или ниже, 10-7 М или ниже, 10-8 M или ниже, 10-9 M или ниже, 10-10 М или ниже, 10-11 М или ниже или 10-12 М или ниже.
Антитело (по сути) не способно связываться с мишенью, если оно не характеризуется значимой аффинностью по отношению к указанной мишени и не связывается значительно, в частности, не связывается детектируемо с указанной мишенью в стандартных анализах. Предпочтительно антитело не связывается детектируемо с указанной мишенью, если присутствует в концентрации до 2, предпочтительно 10, более предпочтительно 20, в частности, 50 или 100 мкг/мл или выше. Предпочтительно антитело не характеризуется значительной аффинностью по отношению к мишени, если оно связывается с указанной мишенью с KD, которая по меньшей мере в 10 раз, 100 раз, 103 раз, 104 раз, 105 раз или 106 раз выше, чем KD в случае связывания с предварительно определенной мишенью, с которой антитело способно связываться. Например, если KD в случае связывания антитела с мишенью, с которой антитело способно связываться, составляет 10-7 М, то KD в случае связывания с мишенью, по отношению к которой антитело не характеризуется значительной аффинностью, будет составлять по меньшей мере 10-6 М, 10-5 М, 10-4 М, 10-3 М, 10-2 М или 10-1 М.
Антитело является специфическим по отношению к предварительно определенной мишени, если оно способно связываться с указанной предварительно определенной мишенью, в то время как оно не способно связываться с другими мишенями, т.е., не характеризуется значительной аффинностью по отношению к другим мишеням и не связывается значительно с другими мишенями в стандартных анализах. В соответствии с настоящим изобретением антитело является специфическим по отношению к CLDN6, если оно способно связываться с CLDN6, но (по сути) не способно связываться с другими мишенями, в частности, другими белками CLDN, такими как CLDN9, CLDN4 и/или CLDN3 и/или белками, отличными от клаудиновых белков, предпочтительно белков, отличных от CLDN6. Предпочтительно антитело является специфическим по отношению к CLDN6, если аффинность по отношению к таким другим мишеням и связывание с ними значительно не превышают аффинность по отношению к несвязанным с клаудинами белкам и связывание с ними, такими как альбумин бычьей сыворотки (BSA), казеин, человеческий сывороточный альбумин (HSA) или не относящиеся к клаудинам трансмембранные белки, такие как молекулы МНС или трансферриновый рецептор или любой другой определенный полипептид. Предпочтительно антитело является специфическим по отношению к предварительно определенной мишени, если оно связывается с указанной мишенью с KD, которая по меньшей мере в 10 раз, 100 раз, 103 раз, 104 раз, 105 раз или 10б раз ниже, чем KD в случае связывания с мишенью, по отношению к которой оно не является специфическим. Например, если KD в случае связывания антитела с мишенью, по отношению к которой оно является специфическим, составляет 10-7 М, то KD в случае связывания с мишенью, по отношению к которой оно не является специфическим, будет составлять по меньшей мере 10-6 М, 10-5 М, 10-4 М, 10-3 М, 10-2 М или 10-1 М.
Связывание антитела с мишенью может быть определено экспериментально с помощью любого подходящего способа; см., например, Berzofsky et al., "Antibody-Antigen Interactions" In Fundamental Immunology, Paul, W. E., Ed., Raven Press New York, N Y (1984), Kuby, Janis Immunology, W. H. Freeman and Company New York, N Y (1992), a также способов, описанных в данном документе. Значения аффинности могут быть легко определены с помощью стандартных методик, таких как равновесный диализ; с помощью инструмента BIAcore 2000, с помощью общих процедур, описанных производителем; с помощью радиоиммунологического анализа с использованием радиомеченого целевого антигена; или с помощью другого способа, известного специалистам в данной области техники. Данные аффинности можно анализировать, например, с помощью способа Scatchard et al., Ann N.Y. Acad. ScL, 51:660 (1949). Измеренная аффинность определенного взаимодействия антитело-антиген может варьировать при измерении в различных условиях, например, концентрации солей, рН. Таким образом, измерения аффинности и других параметров связывания антигена, например, KD, IC50, предпочтительно выполняют с помощью стандартизированных растворов антитела и антигена, а также стандартизированного буфера.
Термин «конкурировать» относится к конкуренции между двумя антителами за целевой антиген. Если два антитела не блокируют друг друга за связывание с целевым антигеном, то такие антитела являются неконкурирующими, и это является показателем того, что указанные антитела не связываются с той же самой частью, т.е., эпитопом, целевого антигена. Специалисту в данной области техники хорошо известно, как исследовать конкуренцию антител за связывание с целевым антигеном. Примером такого способа является так называемый анализ перекрестной конкуренции, который, например, может осуществляться в виде ELISA или с помощью проточной цитометрии. Например, анализ на основе ELISA, может осуществляться с помощью покрытия лунок планшета для ELISA одним из антител; добавления конкурирующего антитела и меченого His антигена/мишени и детекции того, ингибировало ли добавленное антитело связывание меченого His антигена с покрытым антителом, например, с помощью добавления биотинилированного антитела к His, с последующим добавлением стрептавидин-поли-HRP, и дополнительного проведения реакции с ABTS и измерения поглощения при 405 нм. Например, проточная цитометрия может осуществляться с помощью инкубирования клеток, экспрессирующих антиген/мишень, с избытком немеченого антитела, инкубирования клеток с субоптимальной концентрацией антитела, с последующей инкубацией с флуоресцентно меченым стрептавидином и анализом с помощью проточной цитометрии.
Два антитела характеризуются «одинаковой специфичностью», если они связываются с одним и тем же антигеном и с одним и тем же эпитопом. Вне зависимости от того, распознает ли антитело, подлежащее исследованию, тот же самый эпитоп, что и определенное антигенсвязывающее антитело, т.е., антитела связываются с тем же самым эпитопом, его можно исследовать с помощью различных способов, известных специалисту в данной области техники, например, на основе конкуренции антител за тот же самый эпитоп. Конкуренция между антителами может быть выявлена с помощью анализа перекрестного блокирования. Например, конкурентный ELISA может быть использован в качестве анализа перекрестного блокирования. Например, целевой антиген может быть нанесен на лунки микротитрационного планшета и могут быть добавлены антигенсвязывающее антитело и кандидатное конкурирующее исследуемое антитело. Количество антигенсвязывающего антитела, связанного с антигеном в лунке, косвенно коррелирует со связывающей способностью кандидатного конкурирующего исследуемого антитела, которое конкурирует с ним за связывание с тем же самым эпитопом. В частности, чем большей является аффинность кандидатного конкурирующего исследуемого антитела по отношению к тому же самому эпитопу, тем меньшим является количество антигенсвязывающего антитела, связанного с покрытой антигеном лункой. Количество антигенсвязывающего антитела, связанного с лункой, может быть измерено с помощью мечения антитела детектируемыми или измеряемыми метящими веществами.
Антитело, конкурирующее за связывание с антигеном с другим антителом, например, антителом, содержащим вариабельные области тяжелых и легких цепей, описанным в данном документе, или антителом, характеризующимся специфичностью по отношению к антигену другого антитела, например, антитела, содержащего вариабельные области тяжелых и легких цепей, описанного в данном документе, может представлять собой антитело, содержащее варианты указанных вариабельных областей тяжелый и/или легких цепей, описанных в данном документе, например, модификации в CDR и/или определенную степень идентичности, описанную в данном документе.
Используемый в данном документе термин «изотоп» относится к классу антител (например, IgM или IgG1), которые кодируются генами константной области тяжелых цепей. Антитела в соответствии с настоящим изобретением включают в себя поликлональные и моноклональные антитела и включают в себя антитела IgG2a (например, IgG2a, κ, λ), IgG2b (например, IgG2b, κ, λ), IgG3 (например, IgG3, κ, λ) и антитела IgM. В то же время другие изотипы антител также охвачены настоящим изобретением, в том числе антитела IgG1, IgA1, IgA2, секреторные антитела IgA, IgD и IgE.
Используемый в данном документе термин «переключение изотипа» относится к феномену, с помощью которого класс или изотип антитела изменяется с одного класса Ig на классы других Ig.
Термин «реаранжированный», используемый в данном документе, относится к конфигурации локуса иммуноглобулина тяжелой цепи или легкой цепи, при этом V-сегмент располагается непосредственно вблизи к D-J- или J-сегменту в конформации, кодирующей полный VH- или VL-домен соответственно. Реаранжированный локус гена иммуноглобулина (антитела) может быть идентифицирован с помощью сравнения с ДНК зародышевой линии; реаранжированный локус будет иметь по меньшей мере один элемент рекомбинированной гомологии гептамер/нонамер.
Термин «неаранжированный» или «конфигурация зародышевой линии», используемый в данном документе по отношению к V-сегменту, относится к конфигурации, где V-сегмент не рекомбинируется таким образом, чтобы непосредственно прилегать к D- или J-сегменту.
В соответствии с настоящим изобретением антитела могут происходить от различных видов, в том числе без ограничения мыши, крысы, кролика, морской свинки и человека. Антитела также включают в себя химерные молекулы, в которых константную область антитела, происходящего от одного вида, предпочтительно человека, комбинируют с антигенсвязывающим сайтом, происходящим от другого вида. Более того, антитела включают в себя гуманизированные молекулы, в которых антигенсвязывающие сайты антитела, происходящего от отличного от человека вида, комбинируют с константными и каркасными областями человеческого происхождения.
Антитела могут быть получены с помощью ряда методик, в том числе стандартной методики получения моноклональных антител, например, стандартной методики гибридизации соматических клеток Kohler и Milstein, Nature 256: 495 (1975). Несмотря на то, что процедуры гибридизации соматических клеток являются предпочтительными, в принципе могут быть использованы другие методики получения моноклональных антител, например, вирусная или онкогенная трансформация В-лимфоцитов или методики фагового дисплея с использованием библиотек генов антител.
Предпочтительной животной системой для получения гибридом, которые секретируют моноклональные антитела, является мышиная система. Получение гибридом у мыши является очень отработанной процедурой. В данной области техники известны протоколы иммунизации и методики выделения иммунизированных спленоцитов для слияния. Также известны партнеры слияния (например, клетки миеломы мыши) и процедуры слияния.
Другие предпочтительные животные системы для получения гибридом, которые секретируют моноклональные антитела, представляют собой мышиную и кроличью систему (например, описанные в Spieker-Polet et al., Proc. Natl. Acad. Sci. U.S.A. 92:9348 (1995), см. также Rossi et al., Am. J. Clin. Pathol. 124: 295 (2005)).
В соответствии с еще одним предпочтительным вариантом осуществления человеческие моноклональные антитела, направленные против CLDN6, могут быть получены с помощью трансгенных либо трансхромосомных мышей, несущих части иммунной системы человека, а не системы мыши. Эти трансгенные и трансхромосомные мыши включают в себя мышей, известных как мыши HuMAb и мыши KM соответственно, и в совокупности обозначаемые в данном документе как «трансгенные мыши». Продуцирование человеческих антител в организмах таких трансгенных мышей может осуществляться, как подробно описано в случае CD20 в WO 2004 035607.
Еще одной стратегией получения моноклональных антител является непосредственное выделение генов, кодирующих антитела, из лимфоцитов, продуцирующих антитела определенной специфичности; см., например, Babcock et al., 1996; A novel strategy for generating monoclonal antibodies from single, isolated lymphocytes producing antibodies of defined specificities. Подробное описание разработки рекомбинантных антител см. также в Welschof and Kraus, Recombinant antibodes for cancer therapy ISBN-0-89603-918-8 and Benny K.C. Lo Antibody Engineering ISBN 1-58829-092-1.
Для получения антител к CLDN6 мышей можно иммунизировать конъюгированными с носителем пептидами, происходящими из последовательности CLDN6, обогащенным препаратом рекомбинантно экспрессируемого антигена CLDN6 или его фрагментов, и/или клетками, экспрессирующими CLDN6 или его фрагменты, как описано. В качестве альтернативы мышей можно иммунизировать ДНК, кодирующей полноразмерный CLDN6 человека или его фрагменты. В случае, если иммунизация с помощью очищенного или обогащенного препарата антигена CLDN6 не приводит к образованию антител, мышей можно также иммунизировать клетками, экспрессирующими CLDN6, например, для активации иммунных ответов.
Иммунный ответ можно контролировать в течение осуществления протокола иммунизации с помощью образцов плазмы крови и сыворотки крови, получаемых из хвостовой вены или с помощью ретроорбитальных кровопусканий. Мышей с достаточными титрами иммуноглобулина к CLDN6 можно использовать для слияний. Мышей можно подвергать бустингу интраперитонеально или внутривенно с помощью клеток, экспрессирующих CLDN6, за 3-5 дня до умерщвления и удаления селезенки с целью повышения уровня специфических антителосекретирующих гибридом.
Для получения гибридом, продуцирующих моноклональные антитела к CLDN6, клетки из лимфатических узлов, селезенки или костного мозга, полученные от иммунизированных мышей, могут быть выделены и слиты с подходящей иммортализированной клеточной линией, такой как линия клеток миеломы мыши. Образованные в результате гибридомы затем могут подлежать скринингу в отношении продуцирования антигенспецифических антител. Отдельные лунки затем могут подлежать скринингу с помощью ELISA в отношении антителосекретирующих гибридом. С помощью иммунофлуоресцентного анализа и FACS с использованием клеток, экспрессирующих CLDN6, могут быть определены антитела со специфичностью по отношению к CLDN6. Гибридомы, секретирующие антитела, могут быть пересеяны, подвергнуты повторному скринингу и в случае все еще положительного результата в отношении моноклональных антител к CLDN6 могут быть субклонированы с помощью предельного разведения. Стабильные субклоны затем могут быть культивированы in vitro с получением антитела для характеристики в среде для культивирования тканей.
Антитела по настоящему изобретению также могут быть получены в трансфектоме клетки-хозяина, например, с помощью комбинации методик рекомбинантной ДНК и способов трансфекции генов, как хорошо известно в данной области техники (Morrison, S. (1985) Science 229: 1202).
Например, в соответствии с одним вариантом осуществления ген(гены), пред став ляющий(пред став ляющие) интерес, например, гены антител, (может)могут быть лигирован(лигированы) в экспрессионный вектор, такой как эукариотическую экспрессионную плазмиду, такую как используется экспрессионной системой гена GS, раскрытой в WO 87/04462, WO 89/01036 и ЕР 338 841, или другие экспрессионные системы, хорошо известные в данной области техники. Очищенную плазмиду с клонированными генами антитела можно вводить в эукариотические клетки-хозяева, такие как клетки СНО, клетки NS/0, клетки HEK293T или клетки HEK293 или в качестве альтернативы другие эукариотические клетки, например, клетки растительного происхождения, клетки грибов или клетки дрожжевых грибов. Способ, применяемый для введения этих генов, может представлять собой способ, описанный в данной области техники, такой как электропорация, липофекция с использованием липофектамина или др. После введения этих генов антитела в клетки-хозяева клетки, экспрессирующие антитело, можно идентифицировать и отбирать. Эти клетки представляют собой трансфектомы, которые затем могут быть амплифицированы в отношении их уровня экспрессии и переведены в масштабное производство для продуцирования антител. Рекомбинантные антитела могут быть выделены и очищены из этих супернатантов культур и/или клеток.
В качестве альтернативы клонируемые гены антитела могут быть экспрессированы в других экспрессионных системах, таких как микроорганизмы, например, Е. coli. Более того, антитела можно продуцировать в организмах трансгенных отличных от человека животных, например, в молоке от овец и кроликов или яйцах от кур или в трансгенных растениях; см., например, Verma, R., et al. (1998) J. Immunol. Meth. 216: 165-181; Pollock, et al. (1999) J. Immunol. Meth. 231: 147-157; и Fischer, R., et al. (1999) Biol. Chem. 380: 825-839.
Химерные антитела представляют собой антитела, различные части которых происходят от различных видов животных, такие как антитела, имеющие вариабельную область, происходящую из мышиного антитела, и константную область иммуноглобулина человека. Химеризация антител достигается с помощью связывания вариабельных областей тяжелой и легкой цепи мышиного антитела с константной областью тяжелой и легкой цепи человека (например, как описано Kraus et al., в Methods in Molecular Biology series, Recombinant antibodies for cancer therapy ISBN-0-89603-918-8). В соответствии с предпочтительным вариантом осуществления химерные антитела получают с помощью связывания константной области легкой цепи каппа человека с вариабельной областью мышиной легкой цепи. Также в соответствии с предпочтительным вариантом осуществления химерные антитела могут быть получены с помощью связывания константной области легкой цепи лямбда человека с вариабельной областью мышиной легкой цепи. Предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG1, IgG3 и IgG4. Другими предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG2, IgA, IgD и IgM.
Антитела взаимодействуют с целевыми антигенами преимущественно посредством аминокислотных остатков, которые расположены в шести областях, определяющих комплементарность (CDR), тяжелой и легкой цепи. По этой причине, аминокислотные последовательности в CDR являются более разнообразными между отдельными антителами, чем последовательности за пределами CDR. Поскольку последовательности CDR отвечают за большинство взаимодействий антитело-антиген, возможно экспрессировать рекомбинантные антитела, которые имитируют свойства специфических встречающихся в природе антител с помощью конструирования экспрессионных векторов, которые включают последовательности CDR от специфического встречающегося в природе антитела, привитого на каркасные последовательности от другого антитела с другими свойствами (см., напр., Riechmann, L. et al. (1998) Nature 332: 323-327; Jones, P. et al. (1986) Nature 321: 522-525; и Queen, C. et al. (1989) Proc. Natl. Acad. Sci. U. S. A. 86: 10029-10033). Такие каркасные последовательности могут быть получены из баз данных ДНК общего пользования, которые включают в себя последовательности генов антител зародышевой линии. Эти последовательности зародышевой линии будут отличаться от последовательностей генов зрелых антител, поскольку они не будут включать в себя полностью собранных вариабельных генов, которые образуются в результате связывания V (D) J во время созревания В-клеток. Последовательности генов зародышевой линии также будут отличаться от последовательностей высокоаффинного антитела с вторичным репертуаром в отдельных положениях равномерно в пределах вариабельной области. Например, соматические мутации является сравнительно нечастыми в аминокислотном концевом участке каркасной области 1 и в карбоксиконцевой участке каркасной области 4. Кроме того, многие соматические мутации значительно не изменяют связывающих свойств антитела. По этой причине необязательно получать всю последовательность ДНК определенного антитела с целью воссоздания интактного антитела, имеющего связывающие свойства, аналогичные свойствам исходного антитела (см. WO 99/45962). Частичные последовательности тяжелой и легкой цепи, охватывающие области CDR, в типичном случае достаточны для этой цели. Частичная последовательность используется для определения того, какие вариабельные и связывающие сегменты генов зародышевой линии способствовали образованию вариабельных генов рекомбинированного антитела. Последовательности зародышевой линии затем используются для заполнения отсутствующих участков вариабельных областей. Лидерные последовательности тяжелых и легких цепей расщепляются во время созревания белка и не способствуют образованию свойств конечного антитела. Для добавления отсутствующих последовательностей клонированные последовательности кДНК можно комбинировать с синтетическими олигонуклеотидами с помощью связывания или ПЦР-амплификации. В качестве альтернативы вся вариабельная область может быть синтезирована в виде совокупности коротких перекрывающихся олигонуклеотидов и комбинирована с помощью ПЦР-амплификации для создания полностью синтетического клона вариабельной области. Этот процесс характеризуется определенными преимуществами, такими как устранение или включение определенных сайтов рестрикции, или оптимизация кодонов.
Нуклеотидные последовательности транскриптов тяжелой и легкой цепей из гибридом могут быть использованы для разработки перекрывающихся совокупностей синтетических олигонуклеотидов с целью создания синтетических V-последовательностей с идентичными возможностями кодирования аминокислот, как и в случае природных последовательностей. Синтетические последовательности тяжелой цепи и цепи каппа могут отличаться от природных последовательностей в трех направлениях: нити повторяющихся нуклеотидных оснований прерываются для облегчения синтеза олигонуклеотидов и ПЦР-амплификации; оптимальные сайты инициации трансляции включены в соответствии с правилами Козак (Kozak, 1991, J. Biol. Chem. 266: 19867-19870); и сайты HindIII разработаны выше от сайтов инициации трансляции.
В случае вариабельных областей как тяжелой, так и легкой цепей оптимизированные последовательности кодирующих и соответствующих некодирующих нитей разделяют на 30-50 нуклеотидов примерно в серединной точке соответствующего некодирующего олигонуклеотида. Таким образом, в случае каждой цепи олигонуклеотиды могут быть собраны в перекрывающиеся двухнитевые совокупности, которые охватывают сегменты из 150-400 нуклеотидов. Пулы затем используют в качестве матриц для получения продуктов ПЦР-амплификации из 150-400 нуклеотидов. В типичном случае совокупность олигонуклеотидов с одной вариабельной областью будут разделять на два пула, которые отдельно амплифицируют с получением двух перекрывающихся продуктов ПЦР. Эти перекрывающиеся продукты затем комбинируют с помощью ПЦР-амплификации с образованием полной вариабельной области. Также может быть желательным включение перекрывающегося фрагмента константной области тяжелой и легкой цепи в ПЦР-амплификацию с получением фрагментов, которые могут быть легко клонированы в конструкции экспрессионных векторов.
Реконструированные химерные или гуманизированные области тяжелой и легкой цепи затем комбинируют с клонированными промоторными последовательностями, лидерными последовательностями, последовательностями инициации трансляции, последовательностями константной области, 3'-нетранслируемыми последовательностями, последовательностями полиаденилирования и последовательностями терминации транскрипции с образованием конструкций экспрессионных векторов. Экспрессионные конструкции тяжелой и легкой цепи можно комбинировать в один вектор, котрансфицировать, последовательно трансфицировать или отдельно трансфицировать в клетки-хозяева, которые затем сливают с получением клетки-хозяина, экспрессирующей обе цепи. Описаны плазмиды для применения в конструкции экспрессионных векторов для IgGK человека. Плазмиды можно конструировать таким образом, что ПЦР-амплифицированные последовательности кДНК V-области тяжелой цепи и V-области легкой цепи каппа могут быть использованы для реконструкции полных минигенов тяжелой и легкой цепи. Эти плазмиды могут быть использованы для экспрессии полностью человеческих или химерных антител IgG1 каппа или IgG4 каппа. Аналогичные плазмиды могут быть разработаны для экспрессии других изотипов тяжелых цепей или для экспрессии антител, содержащих легкие цепи лямбда.
Таким образом, в соответствии с другим аспектом настоящего изобретения структурные характеристики антител к CLDN6, описанных в данном документе, используются для создания структурно связанных гуманизированных антител к CLDN6, которые сохраняют по меньшей мере одно функциональное свойство антител по настоящему изобретению, такое как связывание с CLDN6. Более конкретно одну или несколько областей CDR мышиных моноклональных антител можно комбинировать с известными человеческими каркасными областями и CDR с образованием дополнительных разработанных рекомбинантный путем гуманизированных антител к CLDN6.
Способность антитела связывать CLDN6 может быть определена с помощью стандартных анализов, например, ELISA, вестерн-блоттинга, иммунофлуоресцентных анализов и проточной цитометрии.
ELISA может быть использован для демонстрации присутствия антител в сыворотке иммунизированных мышей или связывания моноклональных антител с белком CLDN6 или пептидами. Пептиды или белок, используемые для иммунизации, могут быть использованы для определения специфичности супернатантов гибридом или анализа титров в сыворотке.
С целью демонстрации присутствия антител в сыворотках иммунизированных мышей или связывания моноклональных антител с живыми клетками может быть использована проточная цитометрия. Клеточные линии, экспрессирующие естественным образом или после трансфекции антиген, и отрицательные контроли, характеризующиеся отсутствием экспрессии антигена (выращенные в стандартных условиях роста), могут быть смешаны с различными концентрациями моноклональных антител в супернатантах гибридомы или в PBS, содержащей 1% FBS, и могут быть инкубированы при 4°С в течение 30 минут. После промывания меченое АРС или Alexa647 антитело к IgG может связываться со связанным с антигеном моноклональным антителом в тех же самых условиях, в которых происходит окрашивание первичного антитела. Образцы можно анализировать с помощью проточной цитометрии с использованием инструмента FACS с помощью свойств светорассеяния и бокового светорассеяния для гейтирования одиночных живых клеток. С целью разграничения антигенспецифических моноклональных антител от неспецифических связывающих веществ в одном измерении может быть использован способ котрансфекции. Клетки, временно трансфицированные плазмидами, кодирующими антиген и флуоресцентный маркер, могут быть окрашены, как описано выше. Трансфицированные клетки могут быть выявлены в другом флуоресцентном канале, отличном от окрашенных антителом клеток. Поскольку большинство трансфицированных клеток экспрессируют оба трансгена, антигенспецифические моноклональные антитела связываются предпочтительно с клетками, экспрессирующими флуоресцентный маркер, в то время как неспецифические антитела связываются в сопоставимом отношении с нетрансфицированными клетками. Альтернативный анализ с использованием флуоресцентной микроскопии может быть использован в дополнение к проточной цитометрии или вместо нее. Клетки могут быть окрашены точно так, как описано выше, и исследованы с помощью флуоресцентной микроскопии.
С целью демонстрации присутствия антител к CLDN6 в сыворотках иммунизированных мышей или связывания моноклональных антител с живыми клетками, экспрессирующими CLDN6, может быть использована иммунофлуоресцентная микроскопия. Например, клеточные линии, экспрессирующие либо спонтанно, либо после трансфекции CLDN6, и отрицательные контроли, не характеризующиеся экспрессией CLDN6, выращивают в слайд-камерах в стандартных условиях роста в среде DMEM/F12 с добавлением 10% фетальной телячьей сыворотки (FCS), 2 мМ L-глутамина, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Затем клетки можно смешивать с метанолом или параформальдегидом или оставлять необработанными. После этого клетки могут вступать в реакцию с моноклональными антителами против CLDN6 в течение 30 минут при 25°С. После промывания клетки могут реагировать с меченым Alexa555 вторичным антителом к IgG мыши (Molecular Probes) в тех же самых условиях. Затем клетки можно исследовать с помощью флуоресцентной микроскопии.
Общие уровни CLDN6 в клетках можно наблюдать, когда клетки фиксируют метанолом или фиксируют параформальдегидом или пермеабилизируют Triton Х-100. В живых клетках и непермеабилизированных фиксированных параформальдегидом клетках можно исследовать поверхностную локализацию CLDN6. В качестве дополнения целенаправленное воздействие на CLDN6 в плотных контактах можно анализировать с помощью совместного окрашивания с маркерами плотных контактов, такими как ZO-1. Кроме того, могут быть исследованы эффекты связывания антитела и локализации CLDN6 в клеточной мембране.
Антитело IgG к CLDN6 можно дополнительно исследовать в отношении реактивности к антигену CLDN6 с помощью вестерн-блоттинга. Вкратце, клеточные экстракты из клеток, экспрессирующих CLDN6, и соответствующие отрицательные контроли могут быть получены и подвергнуты воздействию электрофореза в полиакриламидном геле в присутствии додецила сульфата натрия (SDS). После электрофореза разделенные антигены будут перенесены на нитроцеллюлозные мембраны, блокированы и зондированы моноклональными антителами, подлежащими исследованию. Связывание IgG можно выявить с помощью конъюгированного с пероксидазой антитела к IgG мыши и визуализировать с помощью субстрата ECL.
Антитело IgG мыши к CLDN6 можно дополнительно исследовать в отношении реактивности к антигену CLDN6 с помощью иммуногистохимического анализа хорошо известным специалисту в данной области техники способом, например, с помощью фиксированных параформальдегидом или ацетоном замороженных срезов или заключенных в парафин срезов ткани, фиксированных параформальдегидом, из образцов не являющейся раковой ткани или образцов раковой ткани, полученных от пациентов во время стандартных хирургических процедур, или от мышей, несущих ксенотрансплантированные опухоли, инокулированные клеточными линиями, экспрессирующими спонтанно или после трансфекции CLDN6. С целью иммунологического окрашивания антитела, реагирующие с CLDN6, можно инкубировать с последующей обработкой конъюгированными с пероксидазой хрена козьими антителами к мышиным антителам или козьими антителами к кроличьим антителам в соответствии с инструкциями поставщиков.
Одной особенно предпочтительной методикой анализа CLDN6 в способах по настоящему изобретению является иммуногистохимический анализ или IHC. Иммуногистохимический анализ или IHC относится к процессу детекции антигенов (например, белков) в клетках среза ткани, например, клетках тканей, упомянутых в данном документе. Иммуногистохимическое окрашивание широко используется в диагностике патологических клеток, таких как клетки, встречающиеся в раковых опухолях. Визуализация взаимодействия антитело-антиген может осуществляться рядом способов. В наиболее частом случае антитело конъюгируют с ферментом, таким как пероксидаза, который может катализировать реакцию образования цвета. В качестве альтернативы антитело также можно метить флуорофором, таким как флуоресцеин или родамин.
Приготовление образца является определяющим для поддержания клеточной морфологии, архитектуры тканей и антигенности целевых эпитопов. Это требует соответствующего сбора, фиксации и приготовления срезов тканей. При фиксации обычно используется параформальдегид. В зависимости от цели и толщины экспериментального образца либо тонкие (приблизительно 4-40 мкм) срезы нарезают из ткани, представляющей интерес, либо если ткань не является очень плотной и является проницаемой, то она используется целиком. Приготовление срезов обычно осуществляется с помощью микротома, и срезы помещают на предметные стекла.
Для образца могут потребоваться дополнительные стадии для того, чтобы сделать эпитопы доступными для связывания антителом, в том числе депарафинизация и демаскирование антигена. Детергенты, например, Triton Х-100 широко используются в иммуногистохимическом анализе с целью снижения поверхностного натяжения, обеспечивая использование меньшего количества реагента для достижения более эффективного и более равномерного покрытия образца.
В прямом способе иммуногистохимического окрашивания применяется одно меченое антитело, которое связывается непосредственно с антигеном, подлежащим окрашиванию. В косвенном способе иммуногистохимического окрашивания, который является более распространенным, используется одно антитело против антигена, подлежащего зондированию, и второе меченое антитело против первого антитела.
С целью снижения фонового окрашивания в IHC образцы инкубируют с буфером, который блокирует реакционноспособные сайты, с которыми первичные или вторичные антитела иным образом могут связываться. Первичные антитела индуцируют против антигена, представляющего интерес, и в типичном случае они являются неконъюгированными (немечеными), в то время как вторичные антитела индуцируют против иммуноглобулинов из молекул первичных антител. Вторичное антитело обычно конъюгируют с линкерной молекулой, такой как биотин, которая затем осуществляет рекрутинг репортерных молекул, или вторичное антитело непосредственно связывают с самой репортерной молекулой. Распространенные блокирующие буферы включают в себя нормальную сыворотку, обезжиренное сухое молоко, BSA или желатин, а также коммерческие блокирующие буферы.
Репортерные молекулы варьируют на основе природы способа детекции, а наиболее распространенные способы детекции представляют собой хромогенную и флуоресцентную детекцию, опосредованную ферментами и флуорофорами. В случае хромогенных репортеров ферментативная метка реагирует с субстратом с целью получения интенсивно окрашенного продукта, который может быть проанализирован с помощью обычного светового микроскопа. Несмотря на то, что перечень субстратов ферментов является значительным, щелочная фосфатаза (АР) и пероксидаза хрена (HRP) представляют собой два фермента, используемых наиболее широко в качестве меток для детекции белка. Массив хромогенных, флуорогенных и хемилюминесцентных субстратов является доступным для применения с любым ферментом, в том числе DAB или BCIP/NBT. Флуоресцентные репортеры представляют собой малые органические молекулы, используемые для IHC детекции. В случае хромогенных и флуоресцентных способов детекции денситометрический анализ сигнала может обеспечивать полу- и полностью количественные данные соответственно, для установления корреляции уровня репортерного сигнала с уровнем экспрессии или локализации белка.
После иммуногистохимического окрашивания целевого антигена второй краситель часто применяют для обеспечения контраста, который способствует оттенению первичного красителя. Многие из этих красителей характеризуются специфичностью по отношению к дискретным клеточным компартментам или антигенам, в то время как другие красители будут окрашивать целую клетку. Как хромогенные, так и флуоресцентные красители доступны для IHC с целью обеспечения широкого разнообразия реагентов, которые соответствуют каждой экспериментальной схеме. Широко используются гематоксилин, краситель Хехста и DAPI.
Картирование эпитопов, распознаваемых антителами, может осуществляться, как подробно описано в "Epitope Mapping Protocols (Methods in Molecular Biology) Glenn E. Morris ISBN-089603-375-9 и в "Epitope Mapping: A Practical Approach" Practical Approach Series, 248 Olwyn M. R. Westwood, Frank C. Hay.
Термин «иммунные эффекторные функции» в контексте настоящего изобретения включает в себя любые функции, опосредованные компонентами иммунной системы, которые приводят к ингибированию опухолевого роста и/или ингибированию опухолевого развития, в том числе ингибированию диссеминации и метастазирования опухоли. Предпочтительно иммунные эффекторные функции приводят к уничтожению раковых клеток. Предпочтительно иммунные эффекторные функции в контексте настоящего изобретения представляют собой антителоопосредованные эффекторные функции. Такие функции включают в себя комплементзависимую цитотоксичность (CDC), антителозависимую клеточноопосредованную цитотоксичность (ADCC), антителозависимый клеточноопосредованный фагоцитоз (ADCP), индукцию апоптоза в клетках, несущих опухоль-ассоциированный антиген, например, с помощью связывания антитела с поверхностным антигеном, ингибирование CD40L-опосредованной передачи сигнала, например, с помощью связывания антитела с рецептором CD40 или лигандом CD40 (CD40L), и/или ингибирование пролиферации клеток, несущих опухоль-ассоциированный антиген, предпочтительно ADCC и/или CDC. Таким образом, антитела, которые способны опосредовать одну или несколько иммунных эффекторных функций, предпочтительно способны опосредовать уничтожение клеток с помощью индукции CDC-опосредованного лизиса, ADCC-опосредованного лизиса, апоптоза, гомотипической адгезии и/или фагоцитоза, предпочтительно с помощью индукции CDC-опосредованного лизиса и/или ADCC-опосредованного лизиса. Антитела могут также оказывать эффект всего лишь в результате связывания с опухоль-ассоциированными антигенами на поверхности раковой клетки. Например, антитела могут блокировать функцию опухоль-ассоциированного антигена или индуцировать апоптоз непосредственно с помощью связывания с опухоль-ассоциированным антигеном на поверхности раковой клетки.
ADCC описывает способность эффекторных клеток уничтожать клетки, в частности, лимфоциты, для которой предпочтительно требуется, чтобы целевая клетка была отмечена антителом. ADCC предпочтительно происходит, когда антитела связываются с антигенами на раковых клетках и Fc-домены антитела захватывают Fc-рецепторы (FcR) на поверхности иммунных эффекторных клеток. Были идентифицированы несколько семейств Fc-рецепторов, а конкретные клеточные популяции характерным образом экспрессируют определенные Fc-рецепторы. ADCC можно рассматривать в качестве механизма непосредственной индукции различной степени немедленного разрушения опухоли, который также приводит к презентации антигенов и индукции опухоль-направленных Т-клеточных ответов. Предпочтительно in vivo индукция ADCC будет приводить к опухоль-направленным Т-клеточным ответам и дополнительным ответам антитела хозяина.
CDC представляет собой другой способ уничтожения клеток, который может непосредственно направляться антителами. IgM представляет собой наиболее эффективный эпитоп для активации комплемента. Как IgG1, так и IgG3 являются очень эффективными в направлении CDC посредством классического пути активации комплемента. Предпочтительно в этом каскаде образование комплексов антиген-антитело приводит к демаскированию многочисленных сайтов связывания Clq в непосредственной близости от СН2-доменов участвующих молекул антител, таких как молекулы IgG (Clq представляет собой один из трех подкомпонентов комплемента С1). Предпочтительно эти демаскированные сайты связывания Clq приводят к превращению ранее низкоаффинного взаимодействия Clq-IgG во взаимодействие высокой авидности, которое активирует каскад событий, включающих серию других белков комплемента, и приводит к протеолитическому высвобождению хемотаксических/активирующих средств эффекторной клетки С3а и С5а. Предпочтительно каскад комплемента заканчивается образованием мембранного атакующего комплекса, который образует поры в клеточной мембране, которые облегчают свободное прохождение воды и растворенных веществ в клетку и из нее и могут приводить к апоптозу.
Термин «иммунные эффекторные клетки» в контексте настоящего изобретения относится к клеткам, которые осуществляют эффекторные функции во время иммунной реакции. Например, такие клетки секретируют цитокины и/или хемокины, приводят к уничтожению микроорганизмов, секретируют антитела, распознают раковые клетки и необязательно приводят к уничтожению таких клеток. Например, иммунные эффекторные клетки включают в себя Т-клетки (цитотоксические Т-клетки, хелперные Т-клетки, Т-клетки, инфильтрующие опухоль), В-клетки, естественные клетки-киллеры, нейтрофилы, макрофаги и дендритные клетки.
Нуклеиновая кислота в соответствии с настоящим изобретением предпочтительно представляет собой дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК), более предпочтительно РНК, наиболее предпочтительно in vitro транскрибируемую РНК (IVT РНК). Нуклеиновые кислоты включают в себя в соответствии с настоящим изобретением геномную ДНК, кДНК, мРНК, рекомбинантно полученные и химически синтезированные молекулы. Нуклеиновая кислота в соответствии с настоящим изобретением может находиться в форме молекулы, которая является однонитевой или двухнитевой или ковалентно замкнутой с образованием кольца. Нуклеиновая кислота может быть использована для введения, например, трансфекции, в клетки, в форме РНК, которая может быть получена с помощью in vitro транскрипции из матрицы ДНК. Более того, РНК может быть модифицирована перед применением с помощью стабилизации последовательностей, кэппирования и полиаденилирования.
Нуклеиновые кислоты, описанные в данном документе, могут содержаться в векторе. Термин «вектор», используемый в данном документе, включает в себя все векторы, известные специалисту в данной области техники, в том числе плазмидные векторы, космидные векторы, фаговые векторы, такие как векторы на основе фага лямбда, вирусные векторы, такие как аденовирусные или бакуловирусные векторы, или векторы на основе искусственных хромосом, таких как искусственные хромосомы бактерий (ВАС), искусственные хромосомы дрожжевых грибов (YAC) или искусственные хромосомы Р1 (РАС). Указанные векторы включают в себя экспрессионные векторы, а также клонируемые векторы. Экспрессионные векторы включают в себя плазмиды, а также вирусные векторы и, как правило, содержат необходимую кодирующую последовательность и соответствующие последовательности ДНК, необходимые для экспрессии функционально связанных кодирующих последовательностей в конкретном организме-хозяине (например, бактериях, дрожжевых грибах, растении, насекомом или млекопитающем) или в in vitro экспрессионных системах. Клонируемые векторы, как правило, используют для разработки и амплификации определенного необходимого фрагмента ДНК и у них могут отсутствовать функциональные последовательности, необходимые для экспрессии необходимых фрагментов ДНК.
В качестве вектора для экспрессии антитела может быть использован либо тип вектора, в котором цепи антитела присутствуют в различных векторах, либо типа вектора, в котором цепи антитела присутствуют в том же самом векторе.
Используемый в данном документе термин «РНК» означает молекулу, содержащую рибонуклеотидные остатки. Под «рибонуклеотидом» подразумевается нуклеотид с гидроксильной группой в 2'-положении бета-D-рибо-фуранозного фрагмента. Этот термин также включает в себя двухнитевую РНК, однонитевую РНК, выделенную РНК, такую как частично очищенную РНК, особенно чистую РНК, синтетическую РНК, рекобминантно продуцируемую РНК, а также измененную РНК, которая отличается от встречающейся в природе РНК вследствие добавления, делеции, замены и/или изменения одного или нескольких нуклеотидов. Такие изменения могут включать в себя добавление не являющегося нуклеотидом материала, например, к концу(концам) РНК или внутри, например, возле одного или нескольких нуклеотидов РНК. Нуклеотиды в молекулах РНК могут представлять собой нестандартные нуклеотиды, такие как не встречающиеся в природе нуклеотиды или химически синтезированные нуклеотиды или дезоксинуклеотиды. Эти измененные РНК могут относиться к аналогам или аналогам встречающихся в природе РНК.
В соответствии с настоящим изобретением термин «РНК» включает в себя и предпочтительно относится к «мРНК», которая означает «матричная РНК» и относится к «транскрипту», который может быть получен с помощью ДНК в качестве матрицы и кодирует пептид или белок. мРНК в типичном случае содержит 5'-нетранслируемую область, область, кодирующую белок или пептид, и 3'-нетранслируемую область. мРНК имеет ограниченное время полужизни в клетках и in vitro.
В контексте настоящего изобретения термин «транскрипция» относится к процессу, в котором генетический код в последовательности ДНК транскрибируется в РНК.
Нуклеиновые кислоты, описанные в соответствии с настоящим изобретением, предпочтительно были выделены. Термин «выделенная нуклеиновая кислота» означает в соответствии с настоящим изобретением, что нуклеиновая кислота была (i) амплифицирована in vitro, например, с помощью полимеразной цепной реакции (ПЦР), (ii) получена рекомбинантно с помощью клонирования, (iii) очищена, например, с помощью расщепления и гель-электрофоретического фракционирования, или (iv) синтезирована, например, с помощью химического синтеза. Выделенная нуклеиновая кислота представляет собой нуклеиновую кислоту, которая является доступной для обработки с помощью методик рекомбинантной ДНК.
Нуклеиновые кислоты в соответствии с настоящим изобретением могут присутствовать в отдельности или в комбинации с другими нуклеиновыми кислотами, которые могут быть гомологичными или гетерологичными. В соответствии с предпочтительными вариантами осуществления нуклеиновая кислота функционально связана с целью экспрессии контрольных последовательностей, которые могут быть гомологичными или гетерологичными по отношению к указанной нуклеиновой кислоте. Термин «гомологичный» означает, что нуклеиновые кислоты также функционально связаны в природе, а термин «гетерологичный» означает, что нуклеиновые кислоты не связаны функционально в природе.
Нуклеиновая кислота и последовательность контроля экспрессии также «функционально» связаны друг с другом, если они ковалентно связаны друг с другом таким образом, что экспрессия или транскрипция указанной нуклеиновой кислоты находится под контролем или под влиянием указанной последовательности контроля экспрессии. Таким образом, если нуклеиновая кислота, подлежащая трансляции в функциональный белок, с помощью последовательности контроля экспрессии функционально связана с кодирующей последовательностью, то индукция указанной последовательности контроля экспрессии приводит к транскрипции указанной нуклеиновой кислоты, не вызывая сдвига рамки кодирующей последовательности, или указанная кодирующая последовательность не способна транслироваться в необходимый белок или пептид.
Термин «последовательность контроля экспрессии» или «элемент контроля экспрессии» включает в себя в соответствии с настоящим изобретением промоторы, сайты связывания рибосом, энхансеры и другие элементы контроля, которые регулируют транскрипцию гена или трансляцию мРНК. В соответствии с конкретными вариантами осуществления настоящего изобретения последовательности контроля экспрессии можно регулировать. Точная структура последовательностей контроля экспрессии может варьировать в зависимости от функции молекулы или типа клеток, однако, как правило, содержит 5'-нетранскрибируемую и 5'- и 3'-нетранслируемые последовательности, которые участвуют в инициации транскрипции и трансляции соответственно, такие как ТАТА-бокс, кэппирующая последовательность, последовательность СААТ и т.п. Более конкретно, 5'-нетранскрибируемые последовательности контроля экспрессии содержат промоторную область, которая содержит промоторную последовательность для контроля транскрипции функционально связанной нуклеиновой кислоты. Последовательности контроля экспрессии также могут содержать энхансерные последовательности или вышерасположенные активирующие последовательности.
В соответствии с настоящим изобретением термин «промотор» или «промоторная область» относится к последовательности нуклеиновой кислоты, которая расположена выше (5') по отношению к последовательности нуклеиновой кислоты, подлежащей экспрессии, и контролирует экспрессию последовательности с помощью обеспечения сайта распознавания и связывания РНК-полимеразы. Термин «промоторая область» может дополнительно включать в себя сайты распознавания и связывания дополнительных факторов, которые участвуют в регуляции транскрипции гена. Промотор может контролировать транскрипцию прокариотического или эукариотического гена. Кроме того, промотор может быть «индуцируемым» и может приводить к инициации транскрипции в ответ на индуцирующий антиген или может быть «конститутивным», если транскрипция не контролируется индуцирующим средством. Ген, который находится под контролем индуцибельного промотора, не экспрессируется или экспрессируется лишь в незначительной степени, если индуцирующее средство отсутствует.В присутствии индуцирующего средства ген включается или уровень транскрипции повышается. Это опосредуется, как правило, связыванием специфического фактора транскрипции.
Промоторы, которые являются предпочтительными в соответствии с настоящим изобретением, включают в себя промоторы SP6, Т3 и Т7 полимеразы, промотор РНК U6, промотор CMV и их искусственные гибридные промоторы (например, CMV), в которых часть или части слиты с частью или частями промоторов генов других клеточных белков, таких как, например, GAPDH (глицеральдегид-3-фосфатдегидрогеназы) человека, а также содержат или не содержат дополните л ьный(д о пол нител ьные) интр он(интроны).
Термин «экспрессия» используется в данном документе в своем наиболее широком понимании и включает в себя образование РНК или РНК и белка или пептида. По отношению к РНК термин «экспрессия» или «трансляция» относится, в частности, к образованию пептидов или белков. Экспрессия может быть временной или может быть стабильной. В соответствии с настоящим изобретением термин экспрессия также включает в себя «аберрантную экспрессию» или «атипичную экспрессию».
Термин «аберрантная экспрессия» или «атипичная экспрессия» означает в соответствии с настоящим изобретением, что экспрессия изменена, предпочтительно повышена по сравнению с эталоном, например, состоянием, при котором субъект не имеет заболевания, ассоциированного с аберрантной или атипичной экспрессией определенного белка, например, опухоль-ассоциированного антигена. Повышение экспрессии относится к повышению на по меньшей мере 10%, в частности, по меньшей мере 20%, по меньшей мере 50% или по меньшей мере 100% или больше. В соответствии с одним вариантом осуществления экспрессия встречается только в пораженной ткани, в то время как экспрессия в здоровой ткани подавлена.
Термин «специфически экспрессируется» означает, что белок по сути экспрессируется только в конкретной ткани или органе. Например, опухоль-ассоциированный антиген, специфически экспрессируемый в слизистой оболочке желудка, означает, что указанный белок главным образом экспрессируется в слизистой оболочке желудка и не экспрессируется в других тканях или не экспрессируется в значительной степени в других типах тканей или органах. Таким образом, белок, который исключительно экспрессируется в клетках слизистой оболочки желудка и в значительно меньшей степени в любой другой ткани, специфически экспрессируется в клетках слизистой оболочки желудка. В соответствии с некоторыми вариантами осуществления опухоль-ассоциированный антиген также может специфически экспрессироваться в нормальных условиях в более чем одном типе тканей или органе, например, в 2 или 3 типах тканей или органах, однако предпочтительно не более чем в 3 различных типах тканей или органах. В этом случае опухоль-ассоциированный антиген, таким образом, специфически экспрессируется в этих органах.
Термин «трансляция» в соответствии с настоящим изобретением относится к процессу в рибосомах клетки, с помощью которого нить матричной РНК направляет сборку последовательности аминокислот с образованием белка или пептида.
В соответствии с настоящим изобретением термин «нуклеиновая кислота, кодирующая» означает, что нуклеиновая кислота, если присутствует в соответствующей среде, предпочтительно в клетке, может экспрессироваться с образованием белка или пептида, которые она кодирует.
Термин «пептид» включает в себя олиго- и полипептиды и относится к веществам, содержащим две или более, предпочтительно 3 или более, предпочтительно 4 или более, предпочтительно 6 или более, предпочтительно 8 или более, предпочтительно 9 или более, предпочтительно 10 или более, предпочтительно 13 или более, предпочтительно 16 или более, предпочтительно 21 или более и до предпочтительно 8, 10, 20, 30, 40 или 50, в частности, 100 аминокислот, связанных ковалентно пептидными связями. Термин «белок» относится к крупным пептидам, предпочтительно к пептидам с более чем 100 аминокислотными остатками, однако, как правило, термины «пептиды» и «белки» являются синонимами и используются в данном документе взаимозаменяемо.
Предпочтительно белки и пептиды, описанные в соответствии с настоящим изобретением, были выделены. Термины «выделенный белок» или «выделенный пептид» означают, что белок или пептид были отделены от своего естественного окружения. Выделенный белок или пептид могут находиться по сути в очищенном состоянии. Термин «по сути очищенный» означает, что белок или пептид по сути не содержат других веществ, с которыми они ассоциированы в природе или in vivo.
Описание, приведенное в данном документе по отношению к определенным аминокислотным последовательностям, например, аминокислотным последовательностям в перечне последовательностей, подлежит толкованию таким образом, чтобы также относиться к модификациям, например, вариантам указанных определенных последовательностей, приводящих к образованию последовательностей, которые являются функционально эквивалентными указанным определенным последовательностям, например, аминокислотным последовательностям, демонстрирующим свойства, идентичные или аналогичные свойствам определенных аминокислотных последовательностей. Одним важным свойством является сохранение связывания антитела со своей мишенью. Предпочтительно последовательность, модифицированная по отношению к определенной последовательности при замещении определенной последовательности в антителе, сохраняет связывание указанного антитела с мишенью.
Специалистам в данной области техники будет понятно, что, в частности, последовательности последовательностей CDR, гипервариабельных и вариабельных областей могут быть модифицированы без потери способности связываться с мишенью. Например, последовательности CDR будут либо идентичными, либо высокогомологичными по отношению к последовательностям CDR, описанным в данном документе.
Под «высокогомологичным» подразумевается, что могут быть выполнены от 1 до 5, предпочтительно от 1 до 4, например, от 1 до 3 или 1 или 2 замены.
Термин «вариант» в соответствии с настоящим изобретением также включает в себя мутанты, сплайс-варианты, конформации, изоформы, аллельные варианты, видовые варианты и видовые гомологи, в частности, такие, которые присутствуют в природе. Аллельный вариант относится к изменению в нормальной последовательности гена, значимость которого часто является неясной. При полном секвенировании генов часто определяют многочисленные варианты определенного гена. Видовой гомолог представляет собой последовательность нуклеиновой кислоты или аминокислотную последовательность с происхождением от другого вида по сравнению с определенной последовательностью нуклеиновой кислоты или аминокислотной последовательностью.
Для целей настоящего изобретения «варианты» аминокислотной последовательности включают в себя варианты со вставкой аминокислот, варианты с добавлением аминокислот, варианты с делецией аминокислот и/или варианты с заменой аминокислот. Варианты с делецией аминокислот, которые содержат делецию на N-терминальном и/или С-терминальном конце белка, также называются вариантами с N-концевыми и/или С-концевыми усечениями.
Варианты с аминокислотными вставками содержат вставки одной или двух или более аминокислот в определенной аминокислотной последовательности. В случае вариантов аминокислотных последовательностей, имеющих вставку, один или несколько аминокислотных остатков включают в определенный сайт в аминокислотной последовательности, хотя также возможна случайная вставка с соответствующим скринингом полученного продукта.
Варианты с добавлением аминокислот включают в себя амино- и/или карбоксиконцевые слияния одной или нескольких аминокислот, например, 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот.
Варианты с делецией аминокислот характеризуются удалением одной или нескольких аминокислот из последовательности, например, в результате удаления 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот. Делеции могут находиться в любом положении белка.
Варианты с заменой аминокислот характеризуются по меньшей мере одним остатком в последовательности, подлежащим удалению, и другим остатком, подлежащим вставке в это место. Предпочтение отдается модификациям в положениях в аминокислотной последовательности, которые не являются консервативными между гомологичными белками или пептидами и/или, замещению аминокислот другими аминокислотами, имеющими аналогичные свойства. Предпочтительно аминокислотные изменения в вариантах белков представляют собой консервативные аминокислотные изменения, т.е., замены аналогично заряженных или незаряженных аминокислот. Консервативное аминокислотное изменение включает в себя замену аминокислотой из семейства аминокислот, которые являются родственными по своим боковым цепям. Встречающиеся в природе аминокислоты, как правило, разделены на четыре семейства: кислые (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируют совместно как ароматические аминокислоты.
Предпочтительно степень сходства, предпочтительно идентичности между определенной аминокислотной последовательностью и аминокислотной последовательностью, которая представляет собой вариант указанной определенной аминокислотной последовательности, будет составлять по меньшей мере приблизительно 60%, 65%, 70%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Степень сходства или идентичности приводится предпочтительно для аминокислотной области, которая составляет по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или приблизительно 100% от всей длины референтной аминокислотной последовательности. Например, если референтная аминокислотная последовательность состоит из 200 аминокислот, то степень сходства или идентичности приводится для по меньшей мере приблизительно 20, по меньшей мере приблизительно 40, по меньшей мере приблизительно 60, по меньшей мере приблизительно 80, по меньшей мере приблизительно 100, по меньшей мере приблизительно 120, по меньшей мере приблизительно 140, по меньшей мере приблизительно 160, по меньшей мере приблизительно 180 или приблизительно 200 аминокислот, предпочтительно непрерывных аминокислот.В соответствии с предпочтительными вариантами осуществления степень сходства или идентичности приводится для всей длины референтной аминокислотной последовательности. Выравнивание для определения сходства последовательности, предпочтительно идентичности последовательности может быть выполнено с помощью известных в данной области техники средств, предпочтительно с помощью выравнивания последовательностей, например, с помощью Align, с использованием стандартных настроек, предпочтительно EMBOSS::needle, матрица: Blosum62, штраф за открытие гэпа 10,0, штраф за продление гэпа 0,5.
Термин «сходство последовательности» указывает на процент аминокислот, которые являются либо идентичными, либо которые представляют собой консервативные аминокислотные замены. Термин «идентичность последовательности» между двумя аминокислотными последовательностями указывает на процент аминокислот, которые являются идентичными между последовательностями.
Термин «процент идентичности» предусматривает обозначение процента аминокислотных остатков, которые являются идентичными между двумя последовательностями, подлежащими сравнению, полученного после оптимального выравнивания, при этом указанный процент является исключительно статистическим, а различия между двумя последовательностями распределены случайно и по всей их длине. Сравнения последовательностей между двумя аминокислотными последовательностями стандартным образом выполняют с помощью сравнения этих последовательностей после их оптимального выравнивания, при этом указанное сравнение выполняется посегментно или с помощью «окна сравнения» с целью определения и сравнения локальных областей сходства последовательностей. Оптимальное выравнивание последовательностей для сравнения может быть выполнено, кроме ручного способа, с помощью алгоритма локальной гомологии Smith and Waterman, 1981, Ads App.Math. 2, 482, с помощью алгоритма локальной гомологии Neddleman and Wunsch, 1970, J. Mol. Biol. 48, 443, с помощью способа поиска сходства Pearson and Lipman, 1988, Proc. Natl Acad. Sci. USA 85, 2444, или с помощью компьютерных программ, в которых применяются эти алгоритмы (GAP, BESTFIT, FASTA, BLAST Р, BLAST N и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин).
Процент идентичности рассчитывают с помощью определения количества идентичных положений между двумя последовательностями, подлежащими сравнению, деления этого количества на количество сравниваемых положений и умножения полученного результата на 100 для того, чтобы получить процент идентичности между этими двумя последовательностями.
Гомологичные аминокислотные последовательности характеризуются в соответствии с настоящим изобретением по меньшей мере 40%, в частности, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% и предпочтительно по меньшей мере 95%, по меньшей мере 98 или по меньшей мере 99% идентичностью аминокислотных остатков.
Варианты аминокислотной последовательности, описанные в данном документе, могут быть легко получены специалистом в данной области техники, например, с помощью применения рекомбинантной ДНК. Применение последовательностей ДНК для получения белков и пептидов, имеющих замены, добавления, вставки или делеции, описано, например, в Sambrook et al. (1989). Кроме того, пептиды и варианты аминокислот, описанные в данном документе, могут быть легко получены с помощью известных методик синтеза пептидов, таких как, например, твердофазный синтез и аналогичные способы.
Настоящее изобретение включает в себя производные пептидов или белков, описанных в данном документе, которые охвачены терминами «пептид» и «белок». В соответствии с настоящим изобретением «производные» белков и пептидов представляют собой модифицированные формы белков и пептидов. Такие модификации включат в себя любую химическую модификацию и содержат одну или несколько замен, делеций и/или добавлений любых молекул, ассоциированных с белком или пептидом, таких как углеводы, липиды и/или белки или пептиды. В соответствии с одним вариантом осуществления «производные» белков или пептидов включают в себя такие модифицированные аналоги, образующиеся в результате гликозилирования, ацетилирования, фосфорилирования, амидирования, пальмитоилирования, миристоилирования, изопренилирования, липидизации, алкилирования, дериватизации, введения защитных/блокирующих групп, протеолитического расщепления или связывания с антителом или другим клеточным лигандом. Термин «производное» также распространяется на все функциональные химические элементы указанных белков и пептидов. Предпочтительно модифицированный пептид характеризуется повышенной стабильностью и/или повышенной или сниженной иммуногенностью.
В соответствии с настоящим изобретением вариант, производное, модифицированная форма, фрагмент, часть или участок аминокислотной последовательности, пептида или белка предпочтительно характеризуются функциональным свойством аминокислотной последовательности, пептида или белка соответственно, из которых они произошли, т.е., они являются функционально эквивалентными. В соответствии с одним вариантом осуществления вариант, производное, модифицированная форма, фрагмент, часть или участок аминокислотной последовательности, пептида или белка являются иммунологически эквивалентными аминокислотной последовательности, пептиду или белку соответственно, из которых они произошли. В соответствии с одним вариантом осуществления функциональное свойство представляет собой иммунологическое свойство.
Термин «происходящий» означает в соответствии с настоящим изобретением, что определенная структура, в частности, определенная последовательность присутствует в объекте, из которого она происходит, в частности, организме или молекуле. В случае аминокислотных последовательностей, особенно определенных областей последовательностей, «происходящий», в частности, означает, что соответствующая аминокислотная последовательность происходит из аминокислотной последовательности, в которой она присутствует.
Термин «клетка» или «клетка-хозяин» предпочтительно представляет собой интактную клетку, т.е. клетку с интактной мембраной, которая не высвобождала свои нормальные внутриклеточные компоненты, такие как ферменты, органеллы или генетический материал. Интактная клетка предпочтительно представляет собой жизнеспособную клетку, т.е. клетку, способную выполнять свои нормальные метаболические функции. Термин «клетка» включает в себя в соответствии с настоящим изобретением прокариотические клетки (например, Е. coli) или эукариотические клетки (например, дендритные клетки, В-клетки, клетки СНО, клетки COS, клетки K562, клетки HEK293, клетки HELA, клетки дрожжевых грибов и клетки насекомых). Клетки млекопитающих являются особенно предпочтительными, такие как клетки от людей, мышей, хомяков, свиней, коз и приматов. Клетки могут происходить из большого количества типов тканей и включают в себя главным образом клетки и клеточные линии. Термин «клетка» включает в себя не относящиеся к раковым клетки и раковые клетки, такие как клетки типов рака, раскрытых в данном документе.
Клетка, которая содержит молекулу нуклеиновой кислоты, предпочтительно экспрессирует пептид или белок, кодируемый указанной нуклеиновой кислотой.
«Целевая клетка» будет обозначать клетку, которая представляет собой мишень для иммунного ответа, такого как антитело. Целевые клетки включают в себя любую нежелательную клетку, такую как раковую клетку, описанную в данном документе. В соответствии с предпочтительными вариантами осуществления целевая клетка представляет собой клетку, экспрессирующую CLDN6. Клетки, экспрессирующие CLDN6, в типичном случае включают в себя раковые клетки.
Термин «трансгенное животное» относится к животному, имеющую геном, содержащий один или несколько трансгенов, предпочтительно трансгены тяжелой и/или легкой цепей, или трансхромосом (либо интегрированных, либо неинтегрированных в естественную геномную ДНК животного), и которое предпочтительно способно экспрессировать трансгены. Например, трансгенная мышь может иметь трансген легкой цепи человека и либо трансген тяжелой цепи человека, либо трансхромосому тяжелой цепи человека, таким образом, что мышь продуцирует антитела к CLDN6 человека при иммунизации антигеном CLDN6 и/или клетками, экспрессирующими CLDN6. Трансген тяжелой цепи человека может быть интегрирован в хромосомную ДНК мыши, как в случае с трансгенными мышами, например, мышами HuMAb, такими как мыши НСо7 или НСо12, или трансген тяжелой цепи человека может поддерживаться внехромосомно, как в случае трансхромосомных (например, KM) мышей, описанных в WO 02/43478. Такие трансгенные и трансхромосомные мыши могут быть способны продуцировать многочисленные изотипы моноклональных антител человека к CLDN6 (например, IgG, IgA и/или IgE) с помощью рекомбинации V-D-J и переключения изотипов.
Термин «иммунологически эквивалентный» означает, что иммунологически эквивалентная молекула, такая как иммунологически эквивалентная аминокислота, характеризуется такими же самыми или по сути такими же самыми иммунологическими свойствами и/или оказывает такие же самые или по сути такие же самые иммунологические эффекты, например, по отношению к типу иммунологического эффекта, такого как индукция гуморальной иммунной реакции, сила и/или продолжительность индуцированной иммунной реакции или специфичность иммунной реакции. В контексте настоящего изобретения термин «иммунологически эквивалентный» предпочтительно используется по отношению к иммунологическим эффектам или свойствам пептида или варианта пептида, используемых для иммунизации или антитела. Определенное иммунологическое свойство представляет собой способность связываться с антителами и при необходимости приводить к образованию иммунного ответа, предпочтительно с помощью стимуляции образования антител. Например, аминокислотная последовательность является иммунологически эквивалентной по отношению к референтной аминокислотной последовательности, если указанная аминокислотная последовательность при воздействии на нее иммунной системы субъекта приводит к индукции иммунной реакции, предпочтительно антител, характеризующихся специфичностью вступления в реакцию с референтной аминокислотной последовательностью, такой как референтная аминокислотная последовательность, образующая часть CLDN6.
В соответствии с настоящим изобретением предусмотрены способы детекции присутствия антигена CLDN6 в образце, или измерения количества антигена CLDN6, предусматривающие приведение в контакт образца и необязательно контрольного образца с антителом по настоящему изобретению, которое связывается с CLDN6 в условиях, которые обеспечивают образование комплекса между антителом и CLDN6. Затем выявляют образование комплекса, при этом разница в образовании комплекса между указанным образцом по сравнению с контрольным образцом указывает на присутствие антигена CLDN6 в образце.
Способы, описанные выше, являются пригодными, в частности, для диагностики связанных с CLDN6 заболеваний, таких как раковые заболевания, например, раковые заболевания, описанные в данном документе. Предпочтительно количество CLDN6 в образце, которое является более высоким, чем количество CLDN6 в референтном или контрольном образце, указывает на присутствие связанного с CLDN6 заболевания у субъекта, в частности, человека, от которого образец происходит.
При использовании в способах, описанных выше, антитело, описанное в данном документе, может быть предусмотрено с меткой, которая функционирует для: (i) обеспечения детектируемого сигнала; (ii) взаимодействия со второй меткой с целью модификации детектируемого сигнала, образуемого первой или второй меткой, например, с помощью FRET (резонансного переноса энергии флуоресценции); (iii) воздействия на подвижность, например, электрофоретическую подвижность, с помощью заряда, гидрофобности, формы или других физических параметров, или (iv) обеспечения захватывающего фрагмента, например, аффинности, антитело/антиген или ионного комплексообразования. В качестве метки пригодными являются структуры, такие как флуоресцентные метки, люминесцентные метки, хромофорные метки, радио изотопные метки, изотопные метки, предпочтительно стабильные изотопные метки, изобарные метки, ферментные метки, метки в виде частиц, в частности, метки в виде металлических частиц, метки в виде магнитных частиц, метки в виде полимерных частиц, малые органические молекулы, такие как биотин, лиганды рецепторов или связывающие молекулы, такие как белки клеточной адгезии или лектины, метящие последовательности, содержащие нуклеиновые кислоты и/или аминокислотные остатки, которые могут быть выявлены с помощью применения связывающих средств и т.д. Метки включают в себя без ограничения сульфат бария, йоцетамовую кислоту, иопаноевую кислоту, иподат кальция, натрия дитриазоат, меглумина диатриазоат, метризамид, натрия тиропаноат и рентгенодиагностические, в том числе позитронные излучатели, такие как фтор-18 и углерод-11, гамма-изучатели, такие как йод-123, технеций-99 т, йод-131 и индий-111, нуклиды для ядерно-магнитного резонанса, такие как фтор и гадолиний.
В соответствии с настоящим изобретением «референтный объект», такой как референтный образец или референтный организм, может быть использован для корреляции и сравнения результатов, полученных в способах по настоящему изобретению, с исследуемым образцом или исследуемым организмом. В типичном случае референтный организм представляет собой здоровый организм, в частности, организм, который не страдает от заболевания, такого как раковое заболевание. «Референтное значение» или «референтный уровень» могут быть определены исходя из референтного объекта эмпирически с помощью измерения достаточно большого количества референтных объектов. Предпочтительно референтное значение определяют с помощью измерения по меньшей мере 2, предпочтительно по меньшей мере 3, предпочтительно по меньшей мере 5, предпочтительно по меньшей мере 8, предпочтительно по меньшей мере 12, предпочтительно по меньшей мере 20, предпочтительно по меньшей мере 30, предпочтительно по меньшей мере 50 или предпочтительно по меньшей мере 100 референтных объектов.
Термин «снижать» или «ингибировать», используемый в данном документе, означает способность вызывать общее снижение уровня предпочтительно на 5% или больше, 10% или больше, 20% или больше, более предпочтительно 50% или больше, и наиболее предпочтительно 75% или больше. Термин «ингибировать» или аналогичные выражения включают в себя полное или по сути полное ингибирование, т.е., снижение до нуля или по сути до нуля.
Термины, такие как «повышать» или «усиливать» предпочтительно относятся к повышению или усилению на приблизительно по меньшей мере 10%, предпочтительно по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, даже более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 100%.
Средства, композиции и способы, описанные в данном документе, могут быть использованы для диагностики субъекта с заболеванием. Заболевания, которые могут быть диагностированы, охватывают все заболевания, экспрессирующие CLDN6. Особенно предпочтительными заболеваниями являются раковые заболевания, такие как раковые заболевания, описанные в данном документе.
В соответствии с настоящим изобретением термин «заболевание» относится к любому патологическому состоянию, в том числе раковым заболеваниям, в частности, формам раковых заболеваний, описанных в данном документе.
Термин «нормальный», такой как используемый с точки зрения «нормальной ткани» или «нормальных состояний», относится к здоровой ткани или состояниям в организме здорового субъекта, т.е., непатологическим состояниям, при которых «здоровый» предпочтительно означает не относящийся к раковому.
Термин «заболевание, включающее клетки, экспрессирующие CLDN6», означает в соответствии с настоящим изобретением, что CLDN6 экспрессируется в клетках пораженной ткани или органа. В соответствии с одним вариантом осуществления экспрессия CLDN6 повышается по сравнению с состоянием в здоровой ткани или органе. Повышение относится к повышению на по меньшей мере 10%, в частности, по меньшей мере 20%, по меньшей мере 50%, по меньшей мере 100%, по меньшей мере 200%, по меньшей мере 500%, по меньшей мере 1000%, по меньшей мере 10000% или даже больше. В соответствии с одним вариантом осуществления экспрессия встречается только в пораженной ткани, в то время как экспрессия в здоровой ткани подавлена. В соответствии с настоящим изобретением заболевания, включающие клетки, экспрессирующие CLDN6, или ассоциированные с ними, включают в себя раковые заболевания, в частности, формы рака, описанные в данном документе.
В соответствии с настоящим изобретением термин «опухоль» или «опухолевое заболевание» относится к припухлости или поражению, образованным в результате атипичного роста клеток (называемых неопластическими или опухолевыми клетками). Под «опухолевой клеткой» подразумевается атипичная клетка, которая растет в результате быстрой неконтролируемой клеточной пролиферации и продолжает расти после того, как стимулы, которые инициировали новообразование, прекращаются. Опухоли характеризуются частичным или полным отсутствием структурной организации и функциональной координации по сравнению с нормальной тканью, и обычно образуют отчетливую массу ткани, которая может быть либо доброкачественной, предраковой, либо злокачественной.
Доброкачественная опухоль представляет собой опухоль, у которой отсутствуют все три злокачественные свойства рака. Таким образом, по определению, доброкачественная опухоль не растет неограниченным агрессивным образом, не инвазирует окружающие ткани и не распространяется в несмежные ткани (не метастазирует). Распространенные примеры доброкачественных опухолей включают в себя родинки и фибромы матки.
Термин «доброкачественный» подразумевает умеренное и непрогрессирующее заболевание, и фактически многие виды доброкачественных опухолей являются безопасными для здоровья. В то же время некоторые новообразования, которые определяют как «доброкачественные опухоли», поскольку у них отсутствуют инвазивные свойства рака, могут все же оказывать отрицательные эффекты для здоровья. Примеры этого включают в себя опухоли, которые приводят к образованию «объемного воздействия» (сдавливание жизненно важных органов, таких как кровеносные сосуды), или «функциональные» опухоли эндокринных тканей, которые могут сверхпродуцировать определенные гормоны (примеры включают в себя аденомы щитовидной железы, адренокортикальные аденомы и аденомы гипофиза).
Доброкачественные опухоли в типичном случае окружены наружной оболочкой, которая подавляет их способность функционировать злокачественным образом. В некоторых случаях определенные «доброкачественные» опухоли позже могут приводить к образованию злокачественных видов рака, которые возникают в результате дополнительных генетических изменений в субпопуляции неопластических клеток опухоли. Показательным примером этого явления является тубулярная аденома, распространенный тип полипа толстой кишки, который представляет собой важный предшественник рака толстой кишки. Клетки при тубулярных аденомах, аналогично большинству опухолей, которые часто прогрессируют до рака, характеризуются определенными нарушениями созревания и внешнего вида клеток, в совокупности известными как дисплазия. Эти клеточные нарушения незаметны в доброкачественных опухолях, которые редко становятся или никогда не становятся раковыми, однако заметны при других предраковых нарушениях тканей, которые не образуют отчетливых масс, таких как предраковые поражения шейки матки. Некоторые специалисты предпочитают обозначать диспластические опухоли как «предраковые» и оставляют термин «доброкачественный» для опухолей, которые редко приводят или никогда не приводят к образованию рака.
Новообразование представляет собой атипичную массу ткани, как результате неоплазии. Неоплазия (новообразование в переводе с греческого) представляет собой атипичную пролиферацию клеток. Рост клеток превышает и является некоординированным по сравнению с ростом клеток нормальных тканей вокруг нее. Рост продолжается тем же самым избыточным образом даже после прекращения раздражителей. Обычно он приводит к образованию припухлости или опухоли. Новообразования могут быть доброкачественными, предраковыми или злокачественными.
«Рост опухоли» или «опухолевый рост» в соответствии с настоящим изобретением относится к свойству опухоли увеличивать свой размер и/или к свойству опухолевых клеток пролиферировать.
Рак (медицинский термин: злокачественное новообразование) представляет собой класс заболеваний, в котором группа клеток характеризуется неконтролируемым ростом (делением за пределами нормы), инвазией (проникновением в смежные ткани и их разрушением) и иногда метастазированием (распространением в другие участки в организме через лимфу или кровь). Эти три злокачественные свойства различных видов рака отличают их от доброкачественных опухолей, которые являются самоограничивающими и не инвазируют или не метастазируют.Большинство различных видов рака образуют опухоль, но иногда, подобно лейкозу, не образуют. В соответствии с настоящим изобретением термины «рак» и «опухоль» или «раковое заболевание» и «опухолевое заболевание», как правило, используются в данном документе взаимозаменяемо для обозначения заболеваний, в которых клетки характеризуются неконтролируемым ростом и необязательно инвазией и/или метастазированием.
Предпочтительно «раковое заболевание» в соответствии с настоящим изобретением характеризуется клетками, экспрессирующими CLDN6. Клетка, экспрессирующая CLDN6, предпочтительно представляет собой раковую клетку, предпочтительно опухолей или различных видов рака, описанных в данном документе. Предпочтительно такая клетка представляет собой клетку, отличную от клетки плаценты.
Различные виды рака классифицируют с помощью типа клетки, которая напоминает опухоль, и, таким образом, ткань, которая предположительно является источником опухоли. Они характеризуются гистологическим строением и положением соответственно.
Термин «рак» в соответствии с настоящим изобретением включает в себя лейкозы, семиномы, меланомы, тератомы, лимфомы, нейробластомы, глиомы, рак прямой кишки, рак эндометрия, рак почки, рак поджелудочной железы, рак щитовидной железы, рак крови, рак кожи, рак головного мозга, рак шейки матки, рак кишечника, рак печени, рак толстого кишечника, рак желудка, рак кишечника, рак головы и шеи, рак желудочно-кишечного тракта, рак лимфатических узлов, рак пищевода, колоректальный рак, рак поджелудочной железы, рак уха, носа и горла (ENT), рак молочной железы, рак предстательной железы, рак матки, рак яичника и рак легкого, а также их метастазы. Примеры включают в себя карциномы легкого, карциномы молочной железы, карциномы предстательной железы, карциномы толстого кишечника, почечно-клеточные карциномы, карциномы шейки матки или метастазы типов рака или опухолей, описанных в данном документе. Термин рак в соответствии с настоящим изобретением также включает в себя метастазы рака.
Основными типами рака легкого являются мелкоклеточная карцинома легкого (SCLC) и немелкоклеточная карцинома легкого (NSCLC). Существуют три основных подтипа немелкоклеточных карцином легкого: плоскоклеточная карцинома легкого, аденокарцинома и крупноклеточная карцинома легкого. Аденокарциномы составляют примерно 10% различных видов рака легкого. Этот вид рака обычно наблюдается периферически в легких, в противоположность мелкоклеточному раку легкого и плоскоклеточному раку легкого, оба из которых имеют склонность к более центральному расположению.
В соответствии с настоящим изобретением «карцинома» представляет собой злокачественную опухоль, происходящую из эпителиальных клеток. Эта группа представляет наиболее распространенные виды рака, в том числе распространенные формы рака молочной железы, рака предстательной железы и рака толстого кишечника.
«Аденокарцинома» представляет собой рак, который происходит из железистой ткани. Эта ткань также представляет собой более крупную категорию тканей, известную как эпителиальная ткань. Эпителиальная ткань включает в себя кожу, железы и ряд других тканей, которые выстилают полости и органы организма. Эпителий происходит эмбриологически из эктодермы, энтодермы и мезодермы. Для классификации в качестве аденокарциномы клетки не обязательно должны быть частью железы, при условии что они характеризуются серкреторными свойствами. Эта форма карциномы может встречаться у некоторых высших млекопитающих, в том числе людей. Высокодифференцированные аденокарциномы имеют свойство напоминать железистую ткань, из которой они происходят, в то время как для низкодифференцированных аденокарцином это может быть не характерным. В результате окрашивания клеток, полученных при биопсии, патологоанатом будет определять то, представляет ли собой опухоль аденокарциному или некоторый другой тип рака. Аденокарциномы могут образовываться во многих тканях организма в связи с универсальной природой желез в организме. Несмотря на то, что каждая железа может не секретировать одно и то же самое вещество, при условии, что имеет место экзокринная функция в клетке, она считается железистой, а ее злокачественная форма, таким образом, называется аденокарцинома. Злокачественные аденокарциномы инвазируют другие ткани и часто метастазируют при наличии достаточного времени для этого. Аденокарцинома яичников представляет собой наиболее распространенных тип карциномы яичников. Она включает в себя серозные и муцинозные аденокарциномы, светлоклеточную аденокарциному и эндометриоидную аденокарциному.
Под «метастазированием» подразумевается распространение раковых клеток из своего исходного участка в другую часть организма. Образование метастазов представляет собой очень сложный процесс и зависит от отделения злокачественных клеток от первичной опухоли, инвазии внеклеточного матрикса, проникновения эндотелиальных базальных мембран в полости и сосуды организма и затем, после перемещения в кровь, инфильтрации целевых органов. В конечном итоге рост новой опухоли, т.е., вторичной опухоли или метастатической опухоли, в целевом участке зависит от ангиогенеза. Метастазирование опухоли часто возникает даже после удаления первичной опухоли, поскольку опухолевые клетки или компоненты могут сохраняться и проявлять метастатический потенциал. В соответствии с одним вариантом осуществления термин «метастаз» в соответствии с настоящим изобретением относится к «отдаленному метастазу», который относится к метастазу, который является удаленным от первичной опухоли и системы регионарных лимфатических узлов.
Клетки вторичной или метастатической опухоли являются подобными клеткам в исходной опухоли. Это означает, например, что, если рак яичников метастазирует в печень, то вторичная опухоль образуется из атипичных клеток яичников, а не из атипичных клеток печени. Опухоль в печени, таким образом, называется метастатическим раком яичников, а не раком печени.
Рецидив или повторное развитие возникает тогда, когда индивидуум поражается повторно состоянием, которое поражало его в прошлом. Например, если пациент страдал от ракового заболевания, получил эффективное лечение указанного заболевания и повторно заболевает указанным заболеванием, то указанное вновь развившееся заболевание может рассматриваться как рецидив или повторное развитие. В то же время в соответствии с настоящим изобретением рецидив или повторное развитие ракового заболевания может возникать, но не обязательно возникает, в участке исходного ракового заболевания. Таким образом, например, если пациент страдал от опухоли яичников и получал эффективное лечение, рецидив или повторное развитие могут представлять собой возникновение опухоли яичников или возникновение опухоли в участке, отличном от яичника. Рецидив или повторное развитие опухоли также включает в себя ситуации, в которых опухоль образуется в участке, отличном от участка исходной опухоли, а также в участке исходной опухоли. Предпочтительно исходная опухоль, по поводу которой пациент получал лечение, представляет собой первичную опухоль, а опухоль в участке, отличном от участка исходной опухоли, представляет собой вторичную или метастатическую опухоль.
Под термином «лечить» подразумевают введение соединения или композиции субъекту с целью предупреждения или устранения заболевания, в том числе уменьшения размера опухоли или количества опухолей у субъекта; остановки или замедления заболевания у субъекта; подавления или замедления развития нового заболевания у субъекта; снижения частоты или тяжести симптомов и/или повторных случаев развития у субъекта, который в настоящее время имеет или который ранее имел заболевание; и/или продления, т.е., увеличения продолжительности жизни субъекта.
В частности, термин «лечение заболевания» включает в себя излечение, уменьшение продолжительности, облегчение, предупреждение, замедление или подавление прогрессирования или ухудшения, или предупреждение или замедление начала заболевания или его симптомов.
Под термином «имеющий риск» подразумевается субъект, т.е., пациент, который определяется как имеющий более высокую, чем обычно, вероятность развития заболевания, в частности, рака, по сравнению с общей популяцией. Кроме того, субъект, который имел или в настоящее время имеет заболевание, в частности, рак, представляет собой субъекта, который имеет повышенный риск развития заболевания, поскольку у такого субъекта может продолжать развиваться заболевание. Субъекты, которые в настоящее время имеют или которые имели рак, также имеют повышенный риск развития метастазов рака.
Термин «иммунотерапия» относится к лечению, включающему специфическую иммунную реакцию.
В контексте настоящего изобретения термины, такие как «защищать», «предупреждать», «профилактический», «превентивный» или «защитный», относятся к предупреждению или лечению или тому и другому возникновения и/или распространения заболевания у субъекта, в частности, с целью сведения к минимуму вероятности того, что субъект заболеет заболеванием или с целью замедления развития заболевания. Например, индивидуум с риском развития опухоли, описанный в данном документе, будет представлять собой кандидата для терапии с целью предупреждения опухоли. Иммунотерапия может осуществляться с помощью ряда методик, в которых средства функционируют с целью устранения клеток, экспрессирующих антиген, из организма пациента.
В соответствии с определенными вариантами осуществления иммунотерапия может представлять собой активную иммунотерапию, при которой лечение основано на in vivo стимуляции эндогенной иммунной системы хозяина с целью вступления в реакцию против пораженных клеток при введении средств, модифицирующих иммунный ответ (таких как иммунореактивные пептиды и нуклеиновые кислоты).
В соответствии с другими вариантами осуществления иммунотерапия может представлять собой пассивную иммунотерапию, при которой лечение предусматривает доставку средств с установленной иммунной по отношению к опухоли реактивностью (таких как антитела), которые могут прямо или косвенно опосредовать противоопухолевые эффекты, и необязательно зависит от интактной иммунной системы хозяина.
Термин «in vivo» относится к ситуации в организме субъекта.
Термины «субъект», «индивидуум», «организм» или «пациент» используются взаимозаменяемо и относятся к позвоночным, предпочтительно млекопитающим. Например, млекопитающие в контексте настоящего изобретения представляют собой людей, не относящихся к человеку приматов, домашних животных, таких как собак, кошек, овец, крупный рогатый скот, коз, свиней, лошадей и т.д., лабораторных животных, таких как мышей, крыс, кроликов, морских свинок и т.д., а также животных, содержащихся в неволе, таких как животных зоопарков. Термин «животное», используемый в данном документе, также включает в себя людей. Термин «субъект» может также включать в себя пациента, т.е., животного, предпочтительно человека, имеющего заболевание, предпочтительно заболевание, описанное в данном документе.
В соответствии с настоящим изобретением «образец» может представлять собой любой образец, пригодный в соответствии с настоящим изобретением, в частности, биологический образец, например, образец ткани, в том числе биологические жидкости, и/или клеточный образец, и может быть получен стандартным образом, таким как биопсия тканей, в том числе щипковая биопсия, и с помощью забора крови, бронхиального аспирационного биоптата, мокроты, мочи, кала или других биологических жидкостей. В соответствии с настоящим изобретением термин «образец» также включает в себя обработанные образцы, такие как фракции или изоляты биологических образцов, например, изоляты нуклеиновых кислот и пептидов/белков. Предпочтительно образец содержит клетки или ткань органа, которые подлежат исследованию, например, которые подлежат диагностике рака. Например, если рак, подлежащий диагностике, представляет собой рак легкого, то образец может содержать клетки или ткань, полученные из легкого.
В соответствии с настоящим изобретением образец может представлять собой образец, такой как биологический образец, происходящий от пациента, содержащий или предположительно содержащий опухолевые или раковые клетки. Биологический образец может представлять собой любой образец ткани, такой как кровь, образец ткани, полученный из первичной опухоли или из метастазов опухоли, или любой другой образец, содержащий опухолевые или раковые клетки.
Настоящее изобретение подробно описано с помощью фигур и примеров ниже, которые используются только для иллюстративных целей и не предполагают носить ограничивающий характер. Посредством описания и примеров, дополнительные варианты осуществления, которые аналогичным образом включены в настоящее изобретение, доступны специалисту в данной области техники.
Описание чертежей
Фиг. 1А: Выравнивание последовательностей белков клаудина 6 и клаудина 9 (человека/мыши)
Выравнивание последовательностей показывает высокую гомологию между клаудином 6 человека и мыши и клаудином 9 человека.
Фиг. 1В: Выравнивание последовательностей белков клаудина 6 и клаудина 3, 4 и 9 (человека)
Выравнивание последовательностей показывает высокую гомологию в мультигенном семействе клаудинов.
Фиг. 2А и В: Специфичность антител, исследуемых в вестерн-блоттинге
Клеточные лизаты клеток HEK293, трансфицированные имитационным контролем, CLDN3, 4, 6 или 9 и CLDN6 положительными опухолевыми клетками человека (РА-1 SC12 и NEC-8), подвергали блоттингу и связанные антитела (кроличье антитело к CLDN3 (hwitrogen), 0,5 мкг/мл, мышиное антитело к CLDN4 (Invitrogen), 1 мкг/мл, кроличье антитело к CLDN6 (IBL), 0,2 мкг/мл, козье антитело к CLDN9 (Santa Cruz), 0,4 мкг/мл, или моноклональные мышиные антитела (5 мкг/мл) выявляли с помощью конъюгированных с пероксидазой вторичных антител.
Фиг. 3: Гистологический анализ вестерн-блоттинг-положительных антител
Связывание приоритетных mumAB 58-1В, 58-3А и 58-4В по сравнению с кроличьей антисывороткой к CLDN6 IBL со срезами FFPE рака яичников.
Фиг. 4А: Картирование эпитопов с помощью синтетических перекрывающихся пептидов
Перекрывающиеся пептиды иммобилизировали на микротитровальных планшетах и добавляли антитела. Связанные антитела визуализировали с помощью соответствующих конъюгированных с пероксидазой вторичных реагентов.
Фиг. 4В: Картирование эпитопов с помощью биотинилированных синтетических перекрывающихся пептидов
Высокоперекрывающиеся пептиды, N-терминально биотинилированные с помощью гибкого гидрофильного линкера, синтезировали и загружали на связанные со стрептавидином микротитровальные планшеты. Антитела (1 мкг/мл) наносили и связанные антитела выявляли и анализировали.
Для сравнения интенсивности сигналов mumAB 58-4В-2 с кроличьей сывороткой (IBL) максимальное связывание антител с С-концевым пептидом 19 определяли за 100%. Интенсивность связывания каждого антитела с одним пептидом рассчитывали по отношению к максимальному связыванию для каждой исследуемой системы. Связывание mumAB анализировали в 3 независимых экспериментах в трех повторах. Связывание сыворотки IBL анализировали в 2 независимых экспериментах в трех повторах.
Фиг. 4С: Сайт связывания моноклонального приоритетного 58-4В-2 и поликлональной кроличьей сыворотки к CLDN6 (IBL)
Фиг. 5: Последовательности антител 58-1В, 58-3А и 58-4В
Фиг. 6: Фоновые сигналы различных антител по отношению к нормальной ткани яичников
Сравнение приоритетных антител mumAB 58-1В, 58-3А и 58-4В по сравнению с коммерческим антителом IBL по отношению к нормальной ткани яичников (концентрация антител 5 мкг/мл; клинический протокол).
Примеры
Методики и способы, применяемые в данном документе, описаны в данном документе и осуществляются так, как хорошо известно и как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Все способы, в том числе применение наборов и реагентов, осуществляются в соответствии с информацией производителя, если не указано иное.
Пример 1. Материалы и способы
Картирование сайта связывания антител (Фиг. 4А)
Картирование эпитопов, распознаваемых антителами, может осуществляться, как подробно описано в "Epitope Mapping Protocols (Methods in Molecular Biology) Glenn E. Morris ISBN-089603-375-9 и в "Epitope Mapping: A Practical Approach" Practical Approach Series, 248 Olwyn M. R. Westwood, Frank C. Hay.
Картирование эпитопов с помощью биотинилированных пептидов (Фиг. 4В)
ELISA пептидов осуществляли с целью идентификации антигенсвязывающего сайта моноклональных мышиных приоритетных антител и кроличьей поликлональной сыворотки от IBL. Биотинилированные перекрывающиеся пептиды, охватывающие С-концевую последовательность CLDN6, связывали с покрытыми SA планшетами. Очищенное mumAB (1 мкг/мл) или кроличью сыворотку IBL (1 мкг/мл) наносили на покрытые антигенами планшеты для ELISA и несвязанные антитела вымывали. Связанные антитела выявляли с помощью соответствующего меченого ферментом вторичного антитела (связанного со щелочной фосфатазой козьего антитела к IgG(1+2a+2b+3) мыши или связанного со щелочной фосфатазой козьего антитела к IgG F(ab)2 кролика) и субстрата фермента ABTS и анализировали интенсивности сигналов. Для сравнения интенсивности сигналов mumAB 58-4В-2 с кроличьей сывороткой (IBL) максимальное связывание антител с С-концевым пептидом 19 определяли за 100%. Интенсивность связывания каждого антитела с одним пептидом рассчитывали по отношению к максимальному связыванию для каждой исследуемой системы (мышиной или кроличьей) независимо.
Связывание mumAB анализировали в 3 независимых экспериментах в трех повторах. Связывание сыворотки IBL анализировали в 2 независимых экспериментах в трех повторах.
Определение изотипов
Для определения изотипов очищенных антител использовали набор для изотипирования мышиных моноклональных антител IsoStrip (Roche, №в кат.1493027), как описано производителем.
Вестерн-блоттинг
Впервые полученное антитело IgG к CLDN6 могли дополнительно исследовать в отношении специфического связывания с антигеном CLDN6 с помощью вестерн-блоттинга. Вкратце, клеточные экстракты из клеток, экспрессирующих CLDN3, 4, 6 или 9 и соответствующие отрицательные контроли могли получать и подвергать воздействию электрофореза в полиакриламидном геле в присутствии додецила сульфата натрия (SDS). После электрофореза разделенные антигены переносили на нитроцеллюлозные мембраны, блокировали и зондировали моноклональными антителами, подлежащими исследованию. Связывание IgG выявляли с помощью конъюгированного с пероксидазой хрена антитела к IgG мыши и визуализировали с помощью субстрата ECL.
Гистологическое исследование
Иммуногистохимический анализ (IHC) осуществляли на предметных стеклах с образцами тканей, фиксированных в 4% забуференном формалине и залитых парафином. Заливку в парафин осуществляли в соответствии со стандартными протоколами.
После депарафинизации и регидратации все микроскопические препараты подвергали демаскированию антигена в результате кипячения в 0,1 М Tris/0,01 М буфере EDTA с добавлением 15 мМ азида натрия (рН 9,0) при 95-98°С в течение 30 минут, а затем эндогенные пероксидазы гасили с помощью добавления 3% Н2О2 с добавлением 15 мМ NaN3. После промывания 150 мМ буферным раствором хлорида натрия (рН 7,6) с добавлением 0,05% (масс/об.) Tween-20 и 0,005% (масс/об.) Proclin микроскопические препараты инкубировали с 1,0 или 5,0 мкг/мл диагностического моноклонального мышиного антитела к CLDN6 58-4В при комнатной температуре в течение одного часа. Связывание антитела визуализировали с помощью готового к применению раствора, содержащего меченое пероксидазой хрена вторичное антитело на основе полимера (Histofine MAX РО (М)/ UIO MAX РО (М), Nichirei, Япония). Затем срезы контрастно окрашивали гематоксилином Майера (Carl Roth GmbH, Карлсруэ, Германия) и оценивали с помощью экспертов.
Гистологическая оценка
Все образцы анализировали в зависимости от относительной пропорции положительных окрашенных клеток по отношению ко всем видимым опухолевым клеткам для каждого среза. Интенсивность окрашивания классифицировали как отрицательную (-), слабо положительную (1+), средне положительную (2+) и высокоположительную (3+). Только окрашивание мембран рассматривалось в качестве положительного. Ткань, пораженная раком яичников, выступала в качестве положительного контроля для каждого окрашивания. Кроме того, было обнаружено, что ткань эмбриона почки новозеландских белых кроликов на 29-й день гестационного периода характеризовалась высокоположительной интенсивностью окрашивания. Ее использовали в качестве внутреннего эталона интенсивности окрашивания для положительного результата окрашивания (2+ - 3+).
Пример 2. Получение моноклональных антител
Целью данной работы было получение мышиных моноклональных CLDN6-специфических антител, способных выявлять опухолевые клетки, экспрессирующие CLDN6, в ткани, пораженной раком яичника, или любой другой раковой ткани любой гистологической структуры, в том числе тканях первичных перитонеальных опухолей или опухолей маточной трубы FFPE.
Для получения высокоспецифического высокоаффинного диагностического антитела к CLDN6 было необходимо начинать протоколы иммунизации с использованием различных иммуногенов (Табл. 1) и адъювантов. В течение исследования приблизительно 130 мышей (C57BL/6 и BALB/c) подвергали различным стратегиям иммунизации с целью активации иммунного ответа по отношению к α-CLDN6 (Табл. 2).
Для активации иммунной системы мыши и преодоления иммунной толерантности использовали конъюгаты пептидов и рекомбинантные белки, кодирующие различные части CLDN6 человека, экспрессируемые в виде рекомбинантных слитых белков с различными эпитопами для облегчения аффинной очистки (полигистидин-(HIS)- и глутатион-S-трансфераза-(GST)-метка) (Табл. 1).
Из 20 различных стратегий иммунизации наилучшие результаты достигали с помощью обработки мышей GST-меченым С-терминальным рекомбинантным белком CLDN6 (Табл. 2) в комбинации с различными адъювантами (Табл. 2).
В день слияния спленоциты мышей выделяли и сливали с линией клеток миеломы мышей P3X63Ag8.653 (АТСС). Для слияния мышиных клеток с линией клеток миеломы следовали стандартному протоколу, опубликованному Köhler and Milstein 1975. После отбора с использованием гипоксантин-аминоптерин-тимидина (HAT) супернатанты исследовали в ELISA в отношении секреции антител, распознающих антиген, используемый для иммунизаций.
Осуществляли 69 слияний и более чем 25000 клонов клеток гибридомы подвергали скринингу. Клетки гибридомы из ELISA положительных супернатантов (402) субклонировали с получением моноклональных гибридом. Супернатанты субклонированных клеток гибридомы подвергали повторному скринингу в отношении связывания с антигеном клаудином 6. Клетки гибридомы из 88 положительных клонов (связывание с антигеном, но не с каркасом или меткой) экспандировали и анализировали дополнительно с помощью вестерн-блоттинга в отношении их специфичности.
Три приоритетных кандидата (58-4В, 58-1В и 58-3А) получали в результате стратегии иммунизации, состоящей из 11 стадий (иммунизация №10 в течение 123 дней). За три дня до спленэктомии мышей подвергали бустингу с целью активации целевых В-клеток с последующим слиянием с SEQ ID NO:58 (Табл. 3).
Пример 3. Скрининг моноклональных антител с помощью вестерн-блоттинга
Для исследования того, способны ли ELISA-положительные моноклональные антитела в супернатантах специфически связываться с рекомбинантный клаудином 6, их анализировали с помощью вестерн-блоттинга. Антитела, связывающиеся с CLDN6, но не с каким-либо другим меченым белком, очищали и клетки экспандировали и криоконсервировали. Антитела очищали с помощью FPLC с использованием смолы для аффинной хроматографии с белком A MABselect. Очищенные антитела, выбранные с помощью скрининга с использованием вестерн-блоттинга, повторно анализировали с помощью вестерн-блоттинга для оценки связывания с CLDN6 положительными линиями опухолевых клеток (РА-1, NEC-8) и с клетками HEK293, трансфицированными CLDN3, 4, 6 или 9 (Фиг. 2). Кроме того, антитела оценивали в отношении их способности связывать свой антиген в тканях, фиксированных формалином и залитых парафином (FFPE), с помощью иммуногистохимического анализа. Супернатанты из 33 гибридом, специфически связывающихся с клаудином 6, очищали и дополнительно анализировали в иммуногистохимическом анализе.
Пример 4. Гистологический анализ вестерн-блоттинг-положительных антител
Целью данного эксперимента было исследование специфичности и чувствительности антител к CLDN6. Это осуществляли с помощью тканей, пораженных раком яичников FFPE, экспрессирующих CLDN6 (Фиг. 3).
В первом эксперименте очищенные антитела, которые при исследовании оказались положительными в 1-м скрининге с помощью вестерн-блоттинга, анализировали в концентрации 1 мкг/мл и 5 мкг/мл на срезах рака яичников FFPE. Использовали лабораторный стандарт и введенный в течение ночи протокол окрашивания с использованием нитратного буфера для демаскирования и температуру демаскирования 120°С. Антитела, характеризующиеся тканеспецифическим окрашиванием CLDN6 без образования высоких уровней неспецифического фонового окрашивания, дополнительно титровали до 0,2, 1, 2 и 5 мкг/мл на различных тканях, пораженных раком яичников, с целью дополнительной оценки чувствительности и специфичности этих антител. В следующих стадиях разработки впервые полученные антитела исследовали непосредственно в высоких концентрациях, составляющих 1 и 5 мкг/мл, поскольку различия в интенсивностях окрашивания не могли отчетливо оцениваться в концентрации, составляющей 0,2 мкг/мл. Антитела, характеризующиеся выраженными сигналами по отношению к клеточным мембранам ткани опухоли яичников выбранных тканей и незначительной фоновой активностью или ее отсутствием по отношению к смежным здоровым тканям, выбирали для дополнительных экспериментов по определению дозы и анализу специфичности. Следующие три антитела соответствовали этим критериям и были выбраны в качестве приоритетных кандидатов для дополнительного изучения: 58-1В, 58-3А и 58-4В.
Пример 5. Картирование эпитопов mumAb (Фиг. 4)
ELISA пептидов осуществляли для идентификации антителосвязывающих эпитопов на CLDN6. Каждое очищенное антитело исследовали по отношению к пептидам, перекрывающим 11 аминокислот, охватывающих С-концевую последовательность CLDN6. Антитела 46-5А, 58-1В, 58-3А, 58-4В и 58-9В характеризовались специфическим связыванием с эпитопом, охваченным пептидом AISRGPSEYPTKNYV (пептид 7; фиг. 4А). Сайт связывания этих антител дополнительно характеризовали с помощью биотинилированных пептидов, перекрывающихся 14 из 15 аминокислот. Неожиданным образом, антитела 58-1В, 58-3А и 58-4В и субклон 58-4В-2, связывающиеся с последовательностью EYPTKNY (Фиг. 4В), были способны связываться с CLDN6 в тканях FFPE, пораженных раком, очень специфически с низкой фоновой активностью. В отличие от этого, антитело 46-5А было способно связываться с пептидами, не содержащими последовательность EYPTKNY, но содержащими ее часть, т.е, последовательность EYPTK (Фиг. 4В). Коммерчески доступная поликлональная кроличья антисыворотка к CLDN6 (IBL) связывалась с пептидами, содержащими последовательность RGPS (Фиг. 4С).
Пример 6. Анализ специфичности антител с помощью панели нормальных тканей
Антитела, характеризующиеся выраженными сигналами по отношению к ткани, пораженной раком яичников (58-1В, 58-3А и 58-4В), дополнительно анализировали с использованием лабораторного стандарта и введенного протокола окрашивания по отношению к различным, соответствующим нормальным, а именно, тканям здоровых доноров (например, легкому, семеннику, матке и яичнику) для подтверждения высокой целевой специфичности к CLDN6. Окрашивание этих выбранных тканей осуществляли с помощью лабораторного стандарта и введенного протокола окрашивания (в течение ночи; температура демаскирования 120°С, цитратный буфер для демаскирования). Ни одно из трех выбранных антител не характеризовалось неспецифическими сигналами окрашивания по отношению к исследуемой панели нормальных тканей, кроме слабых неспецифических сигналов в одном периферическом участке одного образца ткани яичника. Этот слабый сигнал был заметным в более высоких их обеих исследуемых концентраций (1 и 5 мкг/мл), не представляя подструктуры яичников.
Пример 7. Сравнение чувствительности антител с помощью образцов ткани, пораженной раком яичников, и образцов панели нормальных тканей
Незначимые различия в характере окрашивания и интенсивностях окрашивания антител 58-3А, 58-1В и 58-4В были заметны в предыдущих экспериментах. Таким образом, антитела подвергали экспериментам с окрашиванием с использованием более клинически ориентированного, а именно более быстрого протокола окрашивания. Для имитации процессов окрашивания, применяемых в стандартных патолого-анатомических лабораториях, вводили однодневный протокол с использованием 1-часового этапа инкубации первичного антитела и этапа демаскирования с помощью водяной бани (98°С). Кроме того, два различных буфера для демаскирования сравнивали для исследования того, могли ли влиять различные условия демаскирования на чувствительность исследуемых антител по отношению к детекции CLDN6. Для всех антител более интенсивные сигналы и более высокое количество положительно окрашенных опухолевых клеток получали с помощью адаптированного однодневного протокола с использованием буфера Tris для демаскирования, по сравнению со стандартным цитратным буфером для демаскирования. Более интенсивные сигналы окрашивания получали с помощью 58-4В, при этом достигали 80% 3+ окрашенных опухолевых клеток, в то время как интенсивности окрашивания кандидата 58-1В были наименее выраженными, при этом достигали лишь 30% 3+ окрашенных опухолевых клеток.
Протокол окрашивания с помощью буфера Tris для демаскирования, приводящий к образованию наиболее чувствительных сигналов окрашивания, впоследствии применяли для окрашивания панели нормальных тканей для исследования специфичности выбранных антител в стандартных клинических лабораторных условиях.
Наиболее эффективные результаты в отношении специфичности и чувствительности к CLDN6 в тканях FFPE получали с помощью кандидата на диагностическое антитело 58-4В. Никаких сигналов не выявляли по отношению к нормальным тканям. Все другие антитела характеризовались сигналами по отношению к кристаллам Рейнке образца семенников. Кроме того, антитело 58-3А характеризовалось слабым окрашиванием по отношению к кровеносным сосудам. Антитело 58-1В характеризовалось более интенсивными сигналами (1+) по отношению к семенникам и тканям нормальных яичников.
Во всех анализируемых образцах mumAb 58-4В характеризовалось более высокой эффективностью в отношении демонстрации отсутствия фонового окрашивания и интенсивного связывания по отношению к соответствующей опухолевой ткани, в то время как кандидаты mumAb 58-3А и 58-1В характеризовались интенсивным окрашиванием по отношению к соответствующей опухолевой ткани, но с более высокими фоновыми сигналами. В частности, сигналы, образующиеся с помощью mumAb 58-1В, были высокой интенсивности, однако с недостатком высокого фонового окрашивания.
Для последующего применения в клинической практике соответствующую гибридому для получения кандидатов на диагностическое антитело адаптировали к бессывороточным средам. К сожалению, адаптация клона 58-3А к бессывороточным условиям не была возможной. Таким образом, кандидата на антитело 58-3A также исключали из гистологических исследований, оставляя 58-4В в качестве окончательного приоритетного кандидата.
Пример 8. Гистологический углубленный анализ и характеристика антител
На первом этапе партию антитела 58-4В, полученную в бессывороточных условиях, сравнивали с партией антитела, полученной в сывороточных условиях с использованием панели нормальных тканей ТМА (MNO961), с целью выявления различий в целевой чувствительности и специфичности к мишени между партиями. Окрашивание осуществляли с помощью подобного клиническому однодневному протоколу (демаскирование с помощью водяной бани, буфер Tris для демаскирования) с использованием не требующих авторских выплат компонентов.
В случае обеих партий антитела слабое окрашивание выявляли в некоторых образцах нормальной ткани (см. Табл. 4). По сравнению с антителом, полученным в сывороточных условиях, партия антитела, полученного в бессывороточных условиях, была более чистой, с меньшим количеством искусственных включений в анализируемых образцах. По отношению к семенникам сигналы окрашивания были заметными по отношению к кристаллам Рейнке в случае обеих партий антитела.
На втором этапе антитело, полученное в бессывороточных условиях, исследовали по отношению к панели рака яичника ТМА и сравнивали с коммерчески доступным антителом IBL. Это коммерческое антитело уже использовали в окрашиваниях предыдущих исследований. Поликлональное антитело IBL использовали согласно протоколу исследования (в течение ночи, температура демаскирования 120°С, цитратный буфер для демаскирования). Антитело 58-4В использовали со стандартным подобным клиническому протоколом (однодневный протокол, демаскирование с помощью водяной бани, буфер Tris для демаскирования).
Из 72 обнаруженных случаев рака яичников ТМА только один образец был положительным в отношении антитела IBL. В отличие от этого, 14/72 образцов при исследовании оказались положительными в отношении CLDN6 при окрашивании антителом 58-4В.
К сожалению, качество коммерческих образцов рака яичников ТМА было низким, что привело к слабым сигналам окрашивания по отношению к положительным опухолевым образцам. Таким образом, сравнение повторяли с использованием образцов биопсии от Dr. Dhaene, представляющих более крупные участки опухолей с сохранностью в высоком качестве образцов опухоли легкого, матки и семенников.
Окрашивание 58-4В приводило к более чувствительной и специфической детекции CLDN6 в опухолевых образцах по сравнению с окрашиваниями, осуществляемыми с помощью поликлонального антитела IBL, означая, что больше опухолевых клеток были положительными и была выявлена более выраженная интенсивность окрашенных опухолевых клеток.
Пример 9. Анализ последовательности приоритетных антител
Анализ последовательности антител 58-1В, 58-3А и 58-4В представлен на Фиг. 5 и ниже


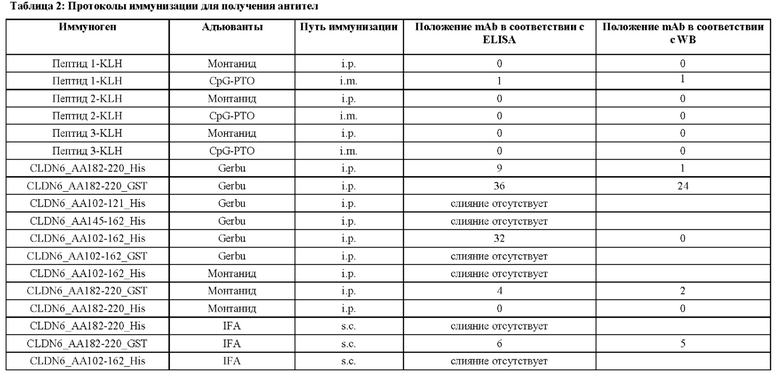
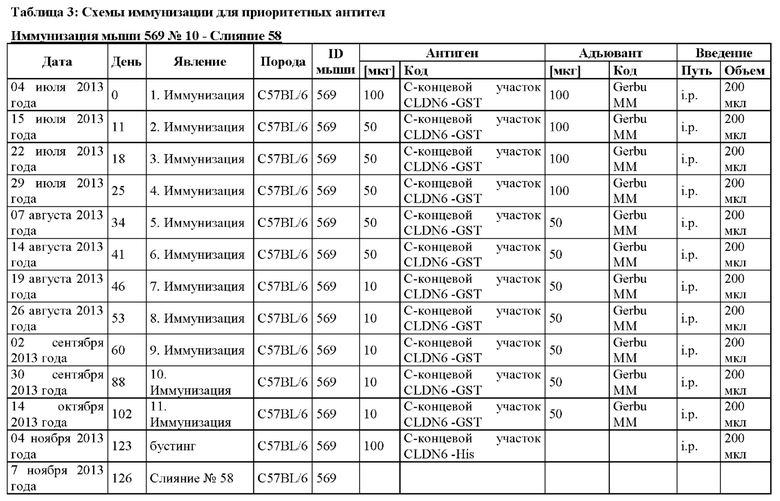
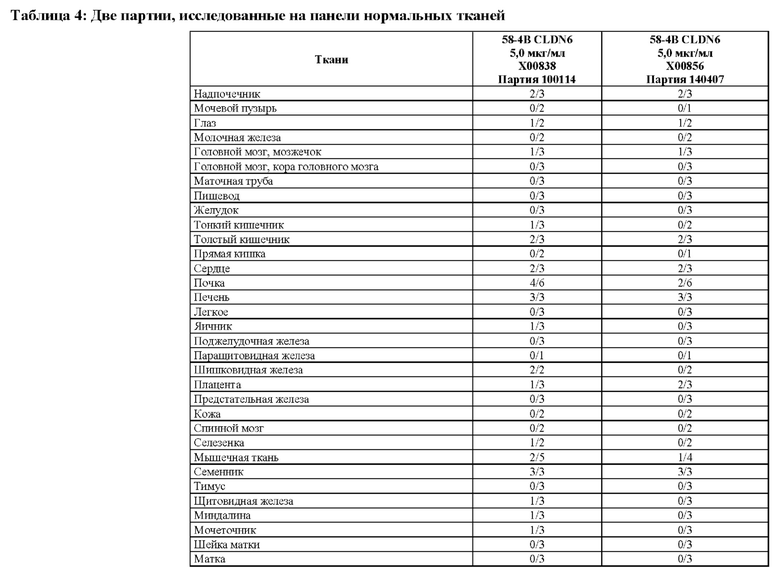

Дополнительный протокол для биологического материала
Идентификация дополнительных депозитов
1) Название и адрес учреждения для депонирования для осуществления депозитов:
Leibniz-Institut DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
Inhoffenstr. 7В
38124 Braunschweig
DE
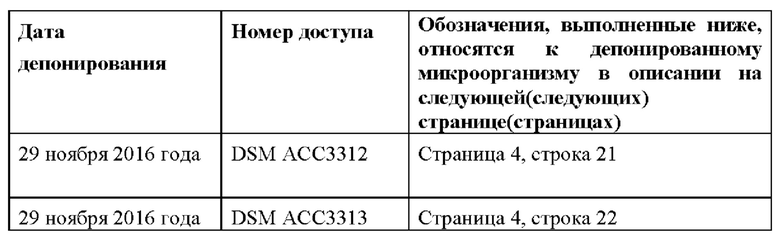
Дополнительные обозначения для всех упомянутых депозитов
- Клетки миеломы мыши (Mus musculus) Ag8.653, слитые со спленоцитами мыши (Mus musculus)
- Гибридома, секретирующая антитело против CLDN6 человека
2) Депозитор
Все вышеуказанные депозиты были выполнены:
Ganymed Pharmaceuticals AG
An der Goldgrube 12
55131 Mainz
DE
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АСТЕЛЛАС ФАРМА ИНК.и др.
<120> АНТИТЕЛА, ПРИГОДНЫЕ В ДИАГНОСТИКЕ РАКА
<130> 342-99 PCT2
<150> PCT/EP2017/072386
<151> 2017-09-06
<160> 61
<170> PatentIn version 3.5
<210> 1
<211> 220
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Ala Ser Ala Gly Met Gln Ile Leu Gly Val Val Leu Thr Leu Leu
1 5 10 15
Gly Trp Val Asn Gly Leu Val Ser Cys Ala Leu Pro Met Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Val Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Ile Ala Leu Leu Val Ala Leu Phe Gly Leu Leu
85 90 95
Val Tyr Leu Ala Gly Ala Lys Cys Thr Thr Cys Val Glu Glu Lys Asp
100 105 110
Ser Lys Ala Arg Leu Val Leu Thr Ser Gly Ile Val Phe Val Ile Ser
115 120 125
Gly Val Leu Thr Leu Ile Pro Val Cys Trp Thr Ala His Ala Ile Ile
130 135 140
Arg Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Gln Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly
180 185 190
Pro Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser
195 200 205
Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
210 215 220
<210> 2
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Ala Ser Thr Gly Leu Glu Leu Leu Gly Met Thr Leu Ala Val Leu
1 5 10 15
Gly Trp Leu Gly Thr Leu Val Ser Cys Ala Leu Pro Leu Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Val Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Ile Ala Leu Leu Leu Ala Leu Leu Gly Leu Leu
85 90 95
Val Ala Ile Thr Gly Ala Gln Cys Thr Thr Cys Val Glu Asp Glu Gly
100 105 110
Ala Lys Ala Arg Ile Val Leu Thr Ala Gly Val Ile Leu Leu Leu Ala
115 120 125
Gly Ile Leu Val Leu Ile Pro Val Cys Trp Thr Ala His Ala Ile Ile
130 135 140
Gln Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Leu Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ala Ala Leu Leu Met Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Pro Pro Gln Val Glu Arg
180 185 190
Pro Arg Gly Pro Arg Leu Gly Tyr Ser Ile Pro Ser Arg Ser Gly Ala
195 200 205
Ser Gly Leu Asp Lys Arg Asp Tyr Val
210 215
<210> 3
<211> 220
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Met Ser Met Gly Leu Glu Ile Thr Gly Thr Ala Leu Ala Val Leu Gly
1 5 10 15
Trp Leu Gly Thr Ile Val Cys Cys Ala Leu Pro Met Trp Arg Val Ser
20 25 30
Ala Phe Ile Gly Ser Asn Ile Ile Thr Ser Gln Asn Ile Trp Glu Gly
35 40 45
Leu Trp Met Asn Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys Lys
50 55 60
Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala Arg
65 70 75 80
Ala Leu Ile Val Val Ala Ile Leu Leu Ala Ala Phe Gly Leu Leu Val
85 90 95
Ala Leu Val Gly Ala Gln Cys Thr Asn Cys Val Gln Asp Asp Thr Ala
100 105 110
Lys Ala Lys Ile Thr Ile Val Ala Gly Val Leu Phe Leu Leu Ala Ala
115 120 125
Leu Leu Thr Leu Val Pro Val Ser Trp Ser Ala Asn Thr Ile Ile Arg
130 135 140
Asp Phe Tyr Asn Pro Val Val Pro Glu Ala Gln Lys Arg Glu Met Gly
145 150 155 160
Ala Gly Leu Tyr Val Gly Trp Ala Ala Ala Ala Leu Gln Leu Leu Gly
165 170 175
Gly Ala Leu Leu Cys Cys Ser Cys Pro Pro Arg Glu Lys Lys Tyr Thr
180 185 190
Ala Thr Lys Val Val Tyr Ser Ala Pro Arg Ser Thr Gly Pro Gly Ala
195 200 205
Ser Leu Gly Thr Gly Tyr Asp Arg Lys Asp Tyr Val
210 215 220
<210> 4
<211> 209
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Met Ala Ser Met Gly Leu Gln Val Met Gly Ile Ala Leu Ala Val Leu
1 5 10 15
Gly Trp Leu Ala Val Met Leu Cys Cys Ala Leu Pro Met Trp Arg Val
20 25 30
Thr Ala Phe Ile Gly Ser Asn Ile Val Thr Ser Gln Thr Ile Trp Glu
35 40 45
Gly Leu Trp Met Asn Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Val Ile Ile Ser Ile Ile Val Ala Ala Leu Gly Val Leu
85 90 95
Leu Ser Val Val Gly Gly Lys Cys Thr Asn Cys Leu Glu Asp Glu Ser
100 105 110
Ala Lys Ala Lys Thr Met Ile Val Ala Gly Val Val Phe Leu Leu Ala
115 120 125
Gly Leu Met Val Ile Val Pro Val Ser Trp Thr Ala His Asn Ile Ile
130 135 140
Gln Asp Phe Tyr Asn Pro Leu Val Ala Ser Gly Gln Lys Arg Glu Met
145 150 155 160
Gly Ala Ser Leu Tyr Val Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Asn Cys Pro Pro Arg Thr Asp Lys Pro
180 185 190
Tyr Ser Ala Lys Tyr Ser Ala Ala Arg Ser Ala Ala Ala Ser Asn Tyr
195 200 205
Val
<210> 5
<211> 219
<212> БЕЛОК
<213> Mus musculus
<400> 5
Met Ala Ser Thr Gly Leu Gln Ile Leu Gly Ile Val Leu Thr Leu Leu
1 5 10 15
Gly Trp Val Asn Ala Leu Val Ser Cys Ala Leu Pro Met Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Met Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Val Thr Leu Leu Ile Val Leu Leu Gly Leu Leu
85 90 95
Val Tyr Leu Ala Gly Ala Lys Cys Thr Thr Cys Val Glu Asp Arg Asn
100 105 110
Ser Lys Ser Arg Leu Val Leu Ile Ser Gly Ile Ile Phe Val Ile Ser
115 120 125
Gly Val Leu Thr Leu Ile Pro Val Cys Trp Thr Ala His Ser Ile Ile
130 135 140
Gln Asp Phe Tyr Asn Pro Leu Val Ala Asp Ala Gln Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Ala Cys Ser Ser Gly Gly Thr Gln Gly
180 185 190
Pro Arg His Tyr Met Ala Cys Tyr Ser Thr Ser Val Pro His Ser Arg
195 200 205
Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
210 215
<210> 6
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 6
Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly Pro Ser His
1 5 10 15
Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro
20 25 30
Ser Glu Tyr Pro Thr Lys Asn Tyr Val
35 40
<210> 7
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 7
Leu Leu Cys Cys Ala Cys Ser Ser Gly Gly Thr Gln Gly Pro Arg His
1 5 10 15
Tyr Met Ala Cys Tyr Ser Thr Ser Val Pro His Ser Arg Gly Pro Ser
20 25 30
Glu Tyr Pro Thr Lys Asn Tyr Val
35 40
<210> 8
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 8
Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly Pro Ser His Tyr Met Ala
1 5 10 15
Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr
20 25 30
Pro Thr Lys Asn Tyr Val
35
<210> 9
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ПЕПТИД
<400> 9
Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly Pro Ser His Tyr
1 5 10
<210> 10
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ПЕПТИД
<400> 10
Pro Ser Gly Gly Ser Gln Gly Pro Ser His Tyr Met Ala Arg Tyr
1 5 10 15
<210> 11
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 11
Ser Gln Gly Pro Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala
1 5 10 15
<210> 12
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 12
Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser
1 5 10 15
<210> 13
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 13
Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser
1 5 10 15
<210> 14
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 14
Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr Pro Thr
1 5 10 15
<210> 15
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 15
Ala Ile Ser Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5 10 15
<210> 16
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 16
Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly
1 5 10 15
<210> 17
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 17
Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu
1 5 10 15
<210> 18
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 18
Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr
1 5 10 15
<210> 19
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 19
Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr Pro
1 5 10 15
<210> 20
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 20
Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr Pro Thr Lys
1 5 10 15
<210> 21
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 21
Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn
1 5 10 15
<210> 22
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 22
Pro Ala Ile Ser Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr
1 5 10 15
<210> 23
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 23
Ile Ser Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5 10
<210> 24
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 24
Ser Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5 10
<210> 25
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 25
Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5 10
<210> 26
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 26
Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5 10
<210> 27
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 27
Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5 10
<210> 28
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 28
Ser Glu Tyr Pro Thr Lys Asn Tyr Val
1 5
<210> 29
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 29
Glu Tyr Pro Thr Lys Asn Tyr Val
1 5
<210> 30
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 30
Tyr Pro Thr Lys Asn Tyr Val
1 5
<210> 31
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 31
Pro Thr Lys Asn Tyr Val
1 5
<210> 32
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 32
Pro Thr Lys Asn Tyr
1 5
<210> 33
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 33
Pro Thr Lys Asn
1
<210> 34
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 34
Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly Pro Ser His Tyr
1 5 10 15
Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser
20 25 30
Glu Tyr Pro Thr Lys Asn Tyr Val
35 40
<210> 35
<211> 37
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 35
Leu Cys Cys Thr Cys Pro Pro Pro Gln Val Glu Arg Pro Arg Gly Pro
1 5 10 15
Arg Leu Gly Tyr Ser Ile Pro Ser Arg Ser Gly Ala Ser Gly Leu Asp
20 25 30
Lys Arg Asp Tyr Val
35
<210> 36
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 36
Leu Cys Cys Ser Cys Pro Pro Arg Glu Lys Lys Tyr Thr Ala Thr Lys
1 5 10 15
Val Val Tyr Ser Ala Pro Arg Ser Thr Gly Pro Gly Ala Ser Leu Gly
20 25 30
Thr Gly Tyr Asp Arg Lys Asp Tyr Val
35 40
<210> 37
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 37
Leu Cys Cys Asn Cys Pro Pro Arg Thr Asp Lys Pro Tyr Ser Ala Lys
1 5 10 15
Tyr Ser Ala Ala Arg Ser Ala Ala Ala Ser Asn Tyr Val
20 25
<210> 38
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 38
Glu Tyr Pro Thr Lys Asn Tyr
1 5
<210> 39
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 39
Arg Gly Pro Ser
1
<210> 40
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цепь антитела
<400> 40
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Arg Met Ser Cys Arg Thr Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Ile His Trp Val Lys Glu Arg Pro Gly Gln Gly Leu Val Trp Ile
35 40 45
Gly Ala Ile Phe Pro Gly Asn Ser Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Lys Ala Ser Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Asp Leu Ser Ser Leu Thr Asp Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Phe Tyr Ala Thr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 41
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цепь антитела
<400> 41
Asp Ile Val Leu Thr Gln Asn Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Thr Ala Ser Ile Ser Cys Lys Ser Ser Gln Asn Leu Leu Tyr Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Met Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Asn Thr
100 105 110
<210> 42
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цепь антитела
<400> 42
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Arg Thr Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Glu Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Glu Asn Ser Asp Ala Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ser Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Thr Asp Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Phe Tyr Ala Thr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 43
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цепь антитела
<400> 43
Asp Val Val Met Thr Gln Asn Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Thr Ala Ser Ile Ser Cys Lys Ser Ser Gln Asn Leu Leu Tyr Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Met Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
100 105 110
<210> 44
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цепь антитела
<400> 44
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Arg Thr Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Glu Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Glu Asn Ser Asp Ala Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ser Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Thr Asp Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Phe Tyr Ala Thr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 45
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цепь антитела
<400> 45
Asp Ile Val Leu Thr Gln Asn Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Thr Ala Ser Ile Ser Cys Lys Ser Ser Gln Asn Leu Leu Tyr Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Met Ser Lys Leu Glu Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Ser
100 105 110
<210> 46
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 46
Cys Arg Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Gln Lys Arg Glu
1 5 10 15
Leu
<210> 47
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 47
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly
1 5 10 15
Pro Ser His Tyr
20
<210> 48
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 48
Cys Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser
1 5 10 15
Glu Tyr Pro Thr Lys
20
<210> 49
<211> 39
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 49
Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly Pro Ser His Tyr Met
1 5 10 15
Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser Arg Gly Pro Ser Glu
20 25 30
Tyr Pro Thr Lys Asn Tyr Val
35
<210> 50
<211> 61
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 50
Ala Lys Cys Thr Thr Cys Val Glu Glu Lys Asp Ser Lys Ala Arg Leu
1 5 10 15
Val Leu Thr Ser Gly Ile Val Phe Val Ile Ser Gly Val Leu Thr Leu
20 25 30
Ile Pro Val Cys Trp Thr Ala His Ala Ile Ile Arg Asp Phe Tyr Asn
35 40 45
Pro Leu Val Ala Glu Ala Gln Lys Arg Glu Leu Gly Ala
50 55 60
<210> 51
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области тяжелой цепи
<400> 51
Gly Tyr Ile Phe Thr Thr Tyr Trp
1 5
<210> 52
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области тяжелой цепи
<400> 52
Ile Phe Pro Gly Asn Ser Asp Thr
1 5
<210> 53
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области тяжелой цепи
<400> 53
Thr Arg Glu Phe Tyr Ala Thr
1 5
<210> 54
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области легкой цепи
<400> 54
Gln Asn Leu Leu Tyr Ser Asp Gly Lys Thr Tyr
1 5 10
<210> 55
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области легкой цепи
<400> 55
Leu Met Ser
1
<210> 56
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области легкой цепи
<400> 56
Trp Gln Gly Thr His Phe Pro Trp Thr
1 5
<210> 57
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области тяжелой цепи
<400> 57
Gly Tyr Thr Phe Thr Thr Tyr Trp
1 5
<210> 58
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR вариабельной области тяжелой цепи
<400> 58
Ile Tyr Pro Glu Asn Ser Asp Ala
1 5
<210> 59
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 59
Glu Tyr Pro Thr Lys
1 5
<210> 60
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 60
Glu Tyr Pro Thr Lys Asn
1 5
<210> 61
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 61
Tyr Pro Thr Lys Asn Tyr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2798990C2 |
| Модифицированные клетки с химерным антигеновым рецептором для лечения рака, экспрессирующего CLDN6 | 2020 |
|
RU2826058C2 |
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| КОНЪЮГАТЫ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2016 |
|
RU2841168C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2014 |
|
RU2792932C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ, ПРИ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ КЛАУДИН 6 | 2012 |
|
RU2816850C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПРОГНОЗИРОВАНИЯ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И ПРОГНОЗА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2785291C2 |
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩАЯ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2014 |
|
RU2832015C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2788531C2 |
| ДИАГНОСТИКА И ЛЕЧЕНИЕ РАКА, СВЯЗАННОГО С РАКОВЫМИ СТВОЛОВЫМИ КЛЕТКАМИ | 2014 |
|
RU2749867C2 |


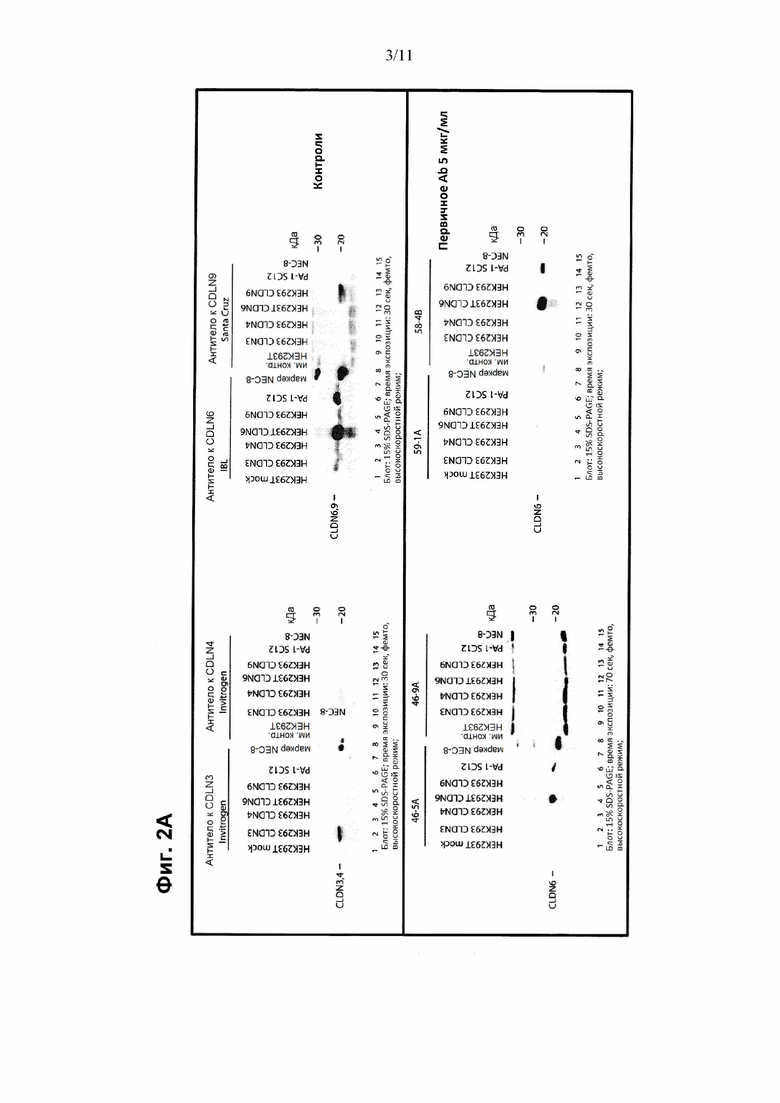
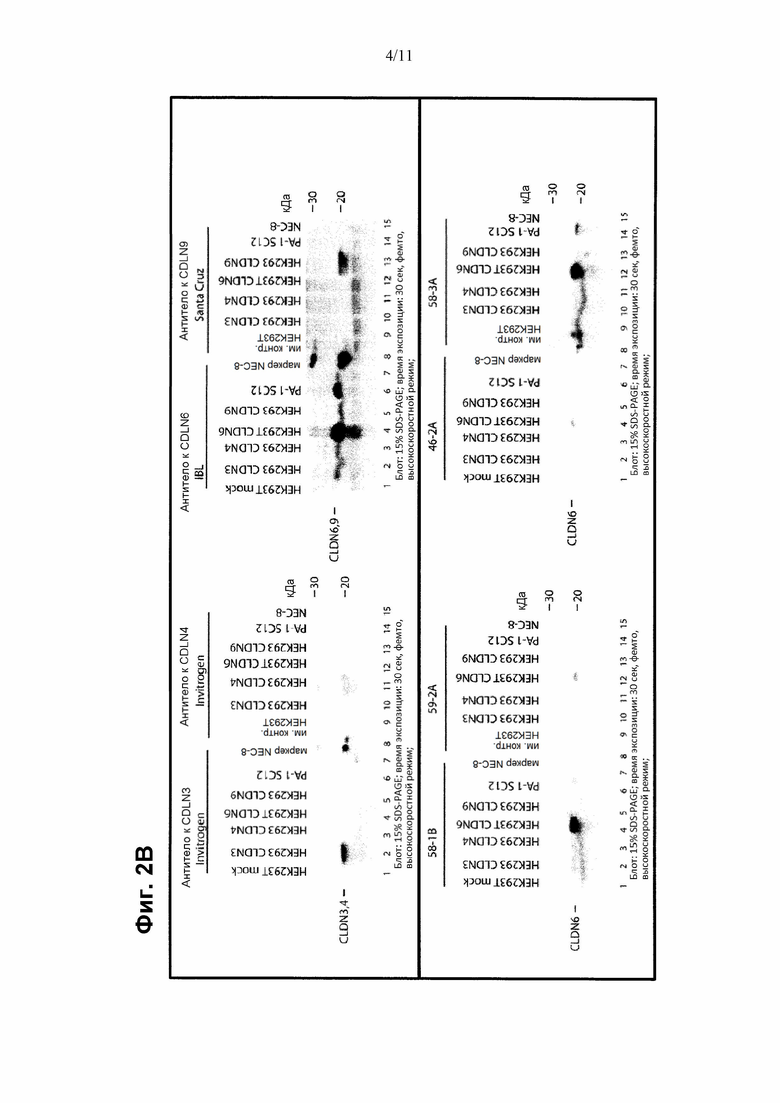
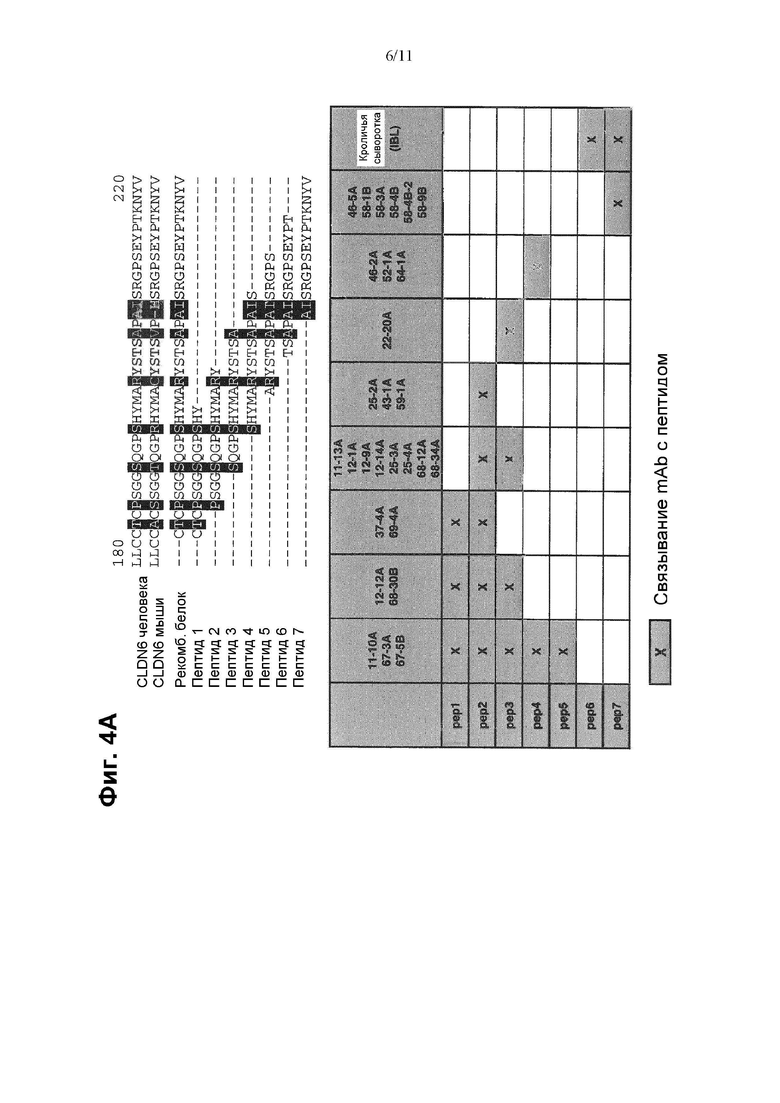




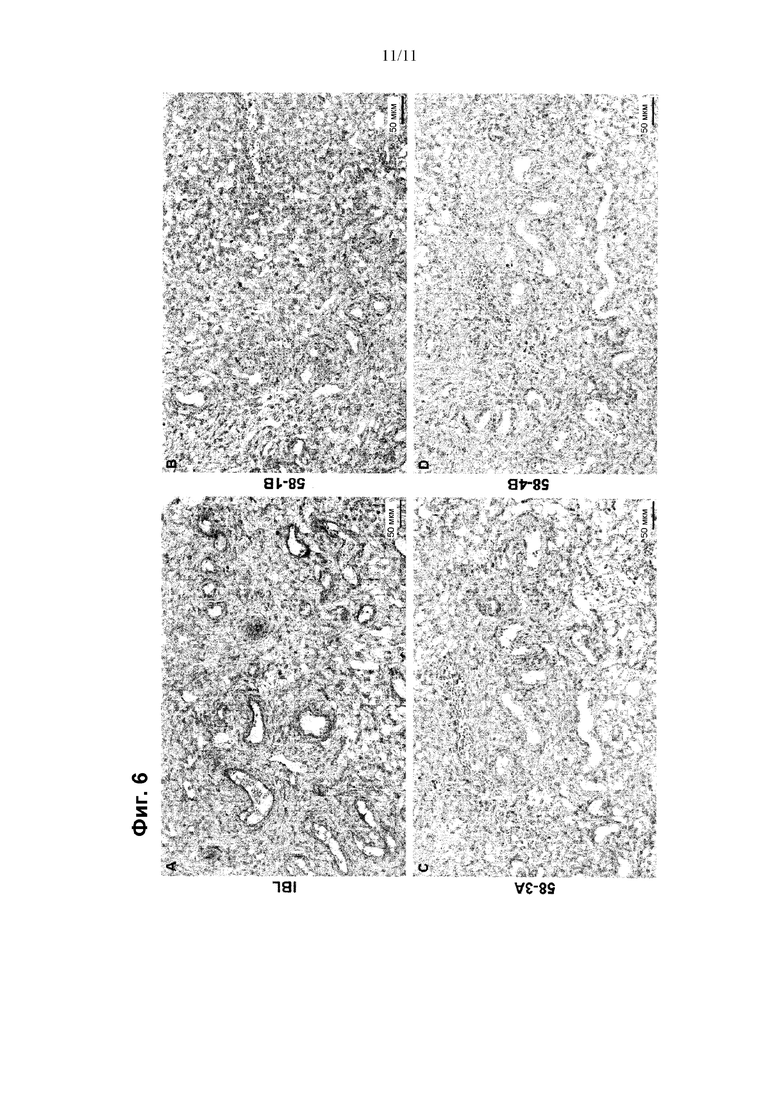
Изобретение относится к области биотехнологии. Предложены антитела и их антигенсвязывающие фрагменты, которые связываются с клаудином 6 (CLDN6), а также конъюгаты этих антител для детекции CLDN6. Также предложены гибридомы, продуцирующие указанные антитела. Антитела к CLDN6 применяются для диагностики рака и определения экспрессии раковыми клетками CLDN6. Изобретение обеспечивает связывание с CLDN6 в тканях FFPE, пораженных раком, с высокой специфичностью и низкой фоновой активностью. 16 н. и 12 з.п. ф-лы, 6 ил., 4 табл., 9 пр.
1. Антитело или его антигенсвязывающий фрагмент, которое связывается с клаудином 6 (CLDN6), причем антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи (VH) антитела, включающую:
VHCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 51 или ее вариант с заменой аминокислот, где вариант с заменой аминокислот включает одну замену, где замена представляет собой Ile в положении 3, замещенный незаряженной аминокислотой;
VHCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 52, или ее вариант с заменой аминокислот, где вариант с заменой аминокислот включает от одной до трех замен, выбранных из группы, состоящей из Phe в положении 2, замещенного ароматической аминокислотой, Gly в положении 4, замещенного кислой или незаряженной полярной аминокислотой, Thr в положении 8, замещенного незаряженной аминокислотой, и их комбинации; и
VHCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 53; и
вариабельную область легкой цепи антитела (VL), включающую:
VLCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 54;
VLCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 55; и
VLCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 56; и
которые связываются:
(i) с пептидом, имеющим аминокислотную последовательность EYPTKNY (SEQ ID NO: 38), и/или
(ii) с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность EYPTKNY (SEQ ID NO: 38), и/или
(iii) с пептидом, имеющим аминокислотную последовательность EYPTKNYV (SEQ ID NO: 29), и/или
(iv) с клаудином 6 (CLDN6), где указанное антитело или его
антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность EYPTKNYV (SEQ ID NO: 29), и/или
(v) с пептидом, имеющим аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15), где антитело или его антигенсвязывающий фрагмент не связываются с пептидом, имеющим аминокислотную последовательность TSAPAISRGPSEYPT (SEQ ID NO: 14), и/или
(vi) с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15), где антитело или его антигенсвязывающий фрагмент не связываются с пептидом, имеющим аминокислотную последовательность TSAPAISRGPSEYPT (SEQ ID NO: 14).
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где указанный CLDN6 представляет собой связанный с мембраной клеточной поверхности CLDN6.
3. Антитело или его антигенсвязывающий фрагмент по п. 1 или 2, где указанный CLDN6 присутствует на раковых клетках.
4. Антитело или его антигенсвязывающий фрагмент по п. 3, где указанные раковые клетки представляют собой раковые клетки, экспрессирующие CLDN6.
5. Антитело или его антигенсвязывающий фрагмент по п. 3 или 4, где указанные раковые клетки выбирают из группы, состоящей из клеток рака яичников, рака семенников, рака желудка, рака молочной железы, рака поджелудочной железы, рака легкого, рака матки и рака мочевого пузыря.
6. Антитело или его антигенсвязывающий фрагмент по п. 3 или 4, где указанные раковые клетки представляют собой раковые клетки, относящиеся к метастазам.
7. Антитело по любому из пп. 1-5, которое представляет собой химерное, человеческое или гуманизированное антитело.
8. Антитело по любому из пп. 1-7, которое представляет собой моноклональное антитело.
9. Моноклональное антитело или его антигенсвязывающий фрагмент, которое связывается с клаудином 6 (CLDN6), причем антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи (VH) антитела, включающую:
VHCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 51 или ее вариант с заменой аминокислот, где вариант с заменой аминокислот включает одну замену, где замена представляет собой Ile в положении 3, замещенный незаряженной аминокислотой;
VHCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 52, или ее вариант с заменой аминокислот, где вариант с заменой аминокислот включает от одной до трех замен, выбранных из группы, состоящей из Phe в положении 2, замещенного ароматической аминокислотой, Gly в положении 4, замещенного кислой или незаряженной полярной аминокислотой, Thr в положении 8, замещенного незаряженной аминокислотой, и их комбинации; и
VHCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 53; и
вариабельную область легкой цепи антитела (VL), включающую:
VLCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 54;
VLCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 55; и
VLCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 56; и
которые
(i) связываются с пептидом, имеющим аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15), и/или
(ii) связываются с клаудином 6 (CLDN6), где указанное антитело или его антигенсвязывающий фрагмент связываются с CLDN6 путем связывания по меньшей мере с эпитопом в CLDN6, имеющем аминокислотную последовательность AISRGPSEYPTKNYV (SEQ ID NO: 15).
10. Антитело или его антигенсвязывающий фрагмент, которое связывается с клаудином 6 (CLDN6), причем антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи (VH) антитела, включающую:
VHCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 51 или ее вариант с заменой аминокислот, где вариант с заменой аминокислот включает одну замену, где замена представляет собой Ile в положении 3, замещенный незаряженной аминокислотой;
VHCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 52, или ее вариант с заменой аминокислот, где вариант с заменой аминокислот включает от одной до трех замен, выбранных из группы, состоящей из Phe в положении 2, замещенного ароматической аминокислотой, Gly в положении 4, замещенного кислой или незаряженной полярной аминокислотой, Thr в положении 8, замещенного незаряженной аминокислотой, и их комбинации; и
VHCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 53; и
вариабельную область легкой цепи антитела (VL), включающую:
VLCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 54;
VLCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 55; и
VLCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 56; и
которые связываются с одним или несколькими, предпочтительно всеми из следующих пептидов:
PAISRGPSEYPTKNY (SEQ ID NO: 22), AISRGPSEYPTKNYV (SEQ ID NO: 15), ISRGPSEYPTKNYV (SEQ ID NO: 23), SRGPSEYPTKNYV (SEQ ID NO: 24), RGPSEYPTKNYV (SEQ ID NO: 25), GPSEYPTKNYV (SEQ ID NO: 26), PSEYPTKNYV (SEQ ID NO: 27), SEYPTKNYV (SEQ ID NO: 28) и EYPTKNYV (SEQ ID NO: 29), где антитело или его антигенсвязывающий фрагмент не связываются с пептидом, имеющим аминокислотную последовательность TSAPAISRGPSEYPT (SEQ ID NO: 14).
11. Антитело или его антигенсвязывающий фрагмент по п. 10, где разница в аффинности связывания к пептиду, с которым антитело или его антигенсвязывающий фрагмент связываются с наименьшей аффинностью, и к пептиду, с которым антитело или его антигенсвязывающий фрагмент связываются с наибольшей аффинностью, составляет 50% или меньше.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-11, причем антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи (VH) антитела, включающую:
VHCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 51 или аминокислотную последовательность в соответствии с SEQ ID NO: 57;
VHCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 52 или аминокислотную последовательность в соответствии с SEQ ID NO: 58; и
VHCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 53; и
вариабельную область легкой цепи антитела (VL), включающую:
VLCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 54;
VLCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 55; и
VLCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 56.
13. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-12, причем антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи (VH) антитела, включающую:
VHCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 51;
VHCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 52; и
VHCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 53; и
вариабельную область легкой цепи антитела (VL), включающую:
VLCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 54;
VLCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID
NO: 55; и
VLCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 56; или
вариабельную область тяжелой цепи (VH) антитела, включающую:
VHCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 57;
VHCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 58; и
VHCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 53; и
вариабельную область легкой цепи антитела (VL), включающую:
VLCDR1, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 54;
VLCDR2, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 55; и
VLCDR3, имеющий аминокислотную последовательность в соответствии с SEQ ID NO: 56.
14. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-13, причем антитело или его антигенсвязывающий фрагмент содержит:
последовательность тяжелой цепи антитела, содержащую аминокислотную последовательность в соответствии с SEQ ID NO: 40 и последовательность легкой цепи антитела, содержащую аминокислотную последовательность в соответствии с SEQ ID NO: 41; или
последовательность тяжелой цепи антитела, содержащую аминокислотную последовательность в соответствии с SEQ ID NO: 42 и последовательность легкой цепи антитела, содержащую аминокислотную последовательность в соответствии с SEQ ID NO: 43; или
последовательность тяжелой цепи антитела, содержащую аминокислотную последовательность в соответствии с SEQ ID NO: 44 и последовательность легкой цепи антитела, содержащую аминокислотную последовательность в соответствии с SEQ ID NO: 45.
15. Конъюгат для детекции CLDN6, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-14, связанный по меньшей мере с одной детектируемой меткой.
16. Гибридома, способная продуцировать антитело по любому из пп. 1-14, причем гибридома депонирована под номером доступа DSM ACC3313 (58-1B), DSM ACC3312 (58-3A) или DSM ACC3311 (58-4B).
17. Способ детекции CLDN6 или определения количества CLDN6 в образце, предусматривающий стадии:
(i) приведения в контакт образца с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-14 или конъюгатом по п. 15, и
(ii) детекции образования комплекса или определения количества комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6.
18. Способ определения того, экспрессируют ли клетки CLDN6, предусматривающий стадии:
(i) приведения в контакт клеточного образца с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-14 или конъюгатом по п. 15 и
(ii) детекции образования комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6, экспрессируемым клетками в указанном образце.
19. Способ диагностики, детекции или мониторинга рака, включающего раковые клетки, экспрессирующие CLDN6, предусматривающий стадии:
(i) приведения в контакт биологического образца с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-14 или конъюгатом по п. 15, и
(ii) детекции образования комплекса и/или определения количества комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6.
20. Способ определения того, поддается ли рак лечению с помощью терапии рака, целенаправленно воздействующей на CLDN6, предусматривающий стадии:
(i) приведения в контакт образца, содержащего раковые клетки, с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-14 или конъюгатом по п. 15, и
(ii) детекции образования комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6.
21. Способ определения прогноза состояния пациента, имеющего рак, предусматривающий стадии:
(i) приведения в контакт образца, содержащего раковые клетки, с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-14 или конъюгатом по п. 15, и
(ii) детекции образования комплекса между антителом, антигенсвязывающим фрагментом или конъюгатом и CLDN6.
22. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-14, конъюгат по п. 15, гибридома по п. 16, или способ по любому из пп. 17-21, где указанный CLDN6 содержит аминокислотную последовательность в соответствии с SEQ ID NO: 1 или вариант указанной аминокислотной последовательности.
23. Диагностический тестовый набор для целенаправленного воздействия на CLDN6, который содержит антитело или его антигенсвязывающий фрагмент по любому из пп. 1-14 или конъюгат по п. 15, и инструкцию.
24. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-14 или конъюгата по п. 15 для детекции CLDN6 или определения количества CLDN6 в образце.
25. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-14 или конъюгата по п. 15 для определения того, экспрессируют ли клетки CLDN6.
26. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-14 или конъюгата по п. 15 для диагностики, детекции или мониторинга рака, включающего раковые клетки, экспрессирующие CLDN6.
27. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-14 или конъюгата по п. 15 для определения того, поддается ли рак лечению с помощью терапии рака, целенаправленно воздействующей на CLDN6.
28. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-14 или конъюгата по п. 15 для определения прогноза состояния пациента, имеющего рак.
| WO 2008013948 A2, 31.01.2008 | |||
| ARABZADEH AZADEH et al., Changes in the distribution pattern of Claudin tight junction proteins during the progression of mouse skin tumorigenesis, BMC CANCER, 2007, vol.7:196, pages 1 - 8 | |||
| WO 2015150327 A1, 08.10.2015 | |||
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К КЛАУДИНУ-18 ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2445319C2 |
Авторы
Даты
2024-03-25—Публикация
2018-09-05—Подача