Декларация государственного интереса
Настоящее изобретение было осуществлено с государственной поддержкой CA154874, присужденной Национальными институтами здравоохранения. Государство имеет определенные права на изобретение.
КОММЕНТАРИЙ в отношении перечня последовательностей
Перечень последовательностей, прилагающийся к настоящей заявке, приведен в текстовом формате вместо бумажной копии и включен в настоящее описание посредствам ссылки. Название текстового файла, содержащего перечень последовательностей: 360056_441WO_SEQUENCE_LISTING.txt. Текстовый файл имеет размер 210 КВ, создан 16 марта 2017 года и подан электронно посредством EFS-Web.
Предшествующий уровень техники
Адоптивный перенос генетически модифицированных Т-клеток оказался эффективной терапией различных злокачественных новообразований. Наиболее часто используемой стратегией является инфузия Т-клеток, полученных от пациента, экспрессирующих химерные антигенные рецепторы (CAR), таргетирующие опухолеассоциированные антигены. Данный подход имеет многочисленные теоретические преимущества, включая возможность таргетирования Т-клеток на любой антиген клеточной поверхности, возможность избежать утраты главного комплекса гистосовместимости как механизма ускользания опухоли от иммунологического надзора, и использование одной векторной конструкции для лечения любого пациента, независимо от гаплотипа человеческого лейкоцитарного антигена. Например, на сегодняшний день клинические исследования CAR в отношении В-клеточной неходжкинской лимфомы (НХЛ) таргетировали антигены CD19, CD20 или CD22, экспрессирующиеся на злокачественных лимфоидных клетках, а также на нормальных В-клетках (Brentjens et al., Sci Transl Med 2013;5(177):177ra38; Haso et al.,Blood 2013;121(7):1165-74; James et al., J Immunol 2008;180(10):7028-38; Kalos et al., Sci Transl Med 2011;3(95):95ra73; Kochenderfer et al., J Clin Oncol 2015;33(6):540-9; Lee et al., Lancet 2015;385(9967):517-28; Porter et al., Sci Transl Med 2015;7(303):303ra139; Savoldo et al., J Clin Invest 2011;121(5):1822-6; Till et al., Blood 2008;112(6):2261-71; Till et al., Blood 2012;119(17):3940-50; Coiffier et al., N Engl J Med 2002;346(4):235-42). Большинство исследователей, изучающих терапии лимфолейкозов, выбирают в качестве мишени CD19, поскольку данная молекула экспрессируется с более ранних стадий В-клеточной дифференцировки, чем CD20 или CD22. Таким образом, CAR-Т-клетки, специфичные к CD19, могут быть использованы для лечения несколько более широкого диапазона В-клеточных злокачественных новообразований, включая острый лимфобластный лейкоз, который возникает на стадии дифференцировки про- или пре-В-клеток.
Однако CD20 остается привлекающим внимание антигеном из-за большого числа клинических исследований с его использованием в качестве успешной иммунотерапевтической мишени, как продемонстрировано в исследованиях с применением ритуксимаба, моноклонального антитела к CD20 (Coiffier et al., N Engl J Med 2002;346(4):235-42; Lenz et al., J Clin Oncol 2005;23(9):1984-92; Marcus R, et al., J Clin Oncol 2008;26(28):4579-86; Pfreundschuh et al., Lancet Oncol 2011;12(11):1013-22). В отличие от CD19, который быстро интернализируется при связывании антителом (Pulczynski et al., Blood 1993;81(6):1549-57), CD20 подвергается эндоцитозу намного медленнее после связывания антителом (Press et al., Blood 1994;83(5):1390-7; Pulczynski et al., Leuk Res 1994;18(7):541-52). Эта стабильность может теоретически влиять на качество иммунологического синапса и последующую стимуляцию CAR и активацию Т-клеток. Было описано, что утрата экспрессии CD19 на опухолевых является механизмом ускользания от иммунологического надзора у пациентов, получавших лечение Т-клетками к CD19 (Grupp et al., N Engl J Med 2013;368(16):1509-18). Хотя утрата CD20 также была описана после терапии антителом к CD20, CAR-T-клетки к CD20 представляют собой альтернативную мишень, которая могла бы дать возможность ступенчатой терапии или могла бы быть использована совместно с CAR-Т-клетками к CD19 для таргетирования нескольких антигенов одновременно, снижая риск ускользания от иммунологического надзора за счет утраты антигена.
Одним из потенциальных ограничений применения CD20 в качестве антигена-мишени для CAR является то, что пациенты с рецидивирующей или рефрактерной лимфомой, которые с большой вероятностью являются кандидатами для клинических исследований терапии CAR Т-клетками, часто незадолго до этого получали схемы лечения, содержащие ритуксимаб. Поскольку антитело может сохраняться в сыворотке месяцами, остаточный ритуксимаб теоретически может блокировать связывание CAR с CD20 и предотвращать или ослаблять активацию Т-клеток, потенциально делая терапию малоэффективной. В предыдущих клинических исследованиях CAR Т-клеток к CD20 (Till et al., Blood 112:2261-71, 2008; Till et al., Blood 119:3940-50, 2012) критерии включения исключали пациентов, недавно получавших лечение ритуксимабом. Однако данный подход существенно влияет на набор испытуемых в исследование и в конечном итоге будет ограничивать доступность данной терапии для пациентов, наиболее нуждающихся в новых вариантах лечения.
В настоящее время в области иммунотерапии существует потребность в композициях и способах для дополнительных или альтернативных иммунотерапий, направленных на лечение различных заболеваний, включая рак (например, лейкоз, лимфому). Раскрытые в настоящем документе варианты осуществления удовлетворяют эту потребность и обеспечивают другие сопутствующие преимущества.
Краткое описание графических материалов
На фиг. 1А и 1В показаны схематические диаграммы конструкций CAR, специфичных к CD20, содержащих scFv из различных антител к CD20 (Leu16, 1F5 и 1.5.3). На (A) показаны конструкции CAR, специфичные к CD20, и их соответствующие зрелые белки CAR. На (B) показаны дополнительные зрелые белки CAR, специфичные к CD20.
На фиг. 2A-2F показано блокирование ритуксимабом и офатумумабом связывания антигена антителом, используемым для получения scFv CAR. Клетки Ramos (CD20+) инкубировали с указанными концентрациями ритуксимаба (A-C) или офатумумаба (D-F) в течение 30 минут с последующей инкубацией с PE (фикоэритрин)-меченным антителом к CD20 (клон Leu16) или изотипическим контролем при 4°C (A и D) или 37°C (B и E) в течение 30 минут. Клетки промывали и анализировали при помощи проточной цитометрии для определения доступных сайтов связывания CD20 за счет измерения интенсивности флуоресценции PE. На графиках, изображенных на фиг. 2С и фиг. 2F, обобщается зависимость геометрической средней интенсивности флуоресценции (MFI) при 4°C или 37°C от концентрации ритуксимаба или офатумумаба, соответственно. Представлены данные трех независимых экспериментов.
На фиг. 3А и 3В показано действие ритуксимаба на функцию CAR Т-клеток in vitro. Указанные линии клеток В-клеточной НХЛ облучали и инкубировали в течение 30 минут при комнатной температуре с различными концентрациями ритуксимаба (при двукратных концентрациях в течение инкубации для получения указанных конечных концентраций после добавления Т-клеток). Окрашенные CFSE Т-клетки, экпрессирующие Leu16-28-BB-z-tEGFR CAR, специфичный к CD20, добавляли к клеткам-мишеням в объемном соотношении 1:1. (A) Пролиферацию Т-клеток анализировали 4 дня спустя при помощи проточной цитометрии в отношении разведения CFSE. Процент поделившихся CD3+ T-клеток по отношению к нестимулированным Т-клеткам показан на левой оси (закрашенные столбцы). Размер CD3+ T-клеток, как определено посредством среднего геометрического показателя прямого светорассеяния (за вычетом размера клеток только в среде) показан на правой оси (незакрашенные столбцы). (B) Секрецию цитокинов этими Т-клетками измеряли посредством системы анализа Luminex, используя супернатанты, полученные через 24 часа после повторной стимуляции. Концентрации интерлейкина (IL)-2 приведены на левой y-оси, а интерферона (IFN)-γ и фактора некроза опухоли (TNF)-α – на правой y-оси. Приведены данные трех независимых экспериментов.
На фиг. 4 показано действие ритуксимаба на цитотоксичность, опосредованную CAR Т-клетками. Указанные меченые 51Cr клетки-мишени предварительно инкубировали в течение 30 минут с ритуксимабом (при двукратных концентрациях в течение инкубации для получения указанных конечных концентраций после добавления Т-клеток), и затем добавляли CD8+ T-клетки, экпрессирующие Leu16-28-z CAR, при соотношениях Э:М, показанных в стандартном 5-часовом исследовании высвобождения 51Cr. Ложно-трансдуцированные Т-клетки и образцы только с ритуксимабом и клетками-мишенями («0:1») использовали в качестве отрицательных контролей. Показано среднее значение по двум идентичным лункам, где столбцы погрешностей представляют собой среднеквадратическое отклонение. Представлены данные 4 независимых экспериментов.
На фиг. 5A-5C показано, что чувствительность к блокаде ритуксимабом зависит от плотности антигена CD20 на клетках-мишенях. Клетки K562, трансдуцированные CD80 и CD20 («K80-20»), клонировали методом предельных разведений, отбирали, исходя из высокого, среднего или низкого уровня экспрессии CD20 (фиг. 10) и использовали в качестве клеток-мишеней в исследованиях (фиг. 5А) пролиферации и размера клеток (среднее геометрическое показателя прямого светорассеяния отобранных CD3+ клеток за вычетом размера клеток только в среде) с применением CFSE-меченных Т-клеток, трансдуцированных Leu16-28-z CAR, как описано на фиг. 3; (фиг. 5B) секреция цитокинов Т-клетками, трансдуцированными Leu16-28-z CAR, через 24 часа после вышеупомянутого (фиг. 5А), измеренная посредством системы анализа Luminex; и (фиг. 5C) цитотоксичность при помощи CD8+ T-клеток, трансдуцированных Leu16-28-z CAR, посредством исследования высвобождения 51Cr, как описано на фиг. 4. Представлены данные трех независимых экспериментов. Абсолютные значения секреции цитокинов показаны на фиг. 11.
На фиг. 6А и 6В показана пролиферация и секреция цитокинов Т-клетками, экспрессирующими CAR к CD20. Здоровые донорные Т-клетки сортировали и стимулировали гранулами с антителом к CD3/28 с последующей трансдукцией лентивирусным вектором, кодирующим конструкцию 1F5-28-BB-z CAR. (A) На 9 день после стимуляции CAR Т-клетки метили при помощи CFSE, повторно стимулировали облученными клетками-мишенями K562-CD80-CD20 («K80-20») или K562-CD80 («K80»), и измеряли разведение CFSE при помощи проточной цитометрии 4 дня спустя для измерения пролиферации Т-клеток. Показан процент поделившихся CD3+ T-клеток по отношению к нестимулированным Т-клеткам. Ложно-трансдуцированные Т-клетки использовали в качестве отрицательного контроля. (B) Секрецию цитокинов Т-клетками определяли посредством отбора образцов супернатантов вышеупомянутых культур через 24 часа после повторной стимуляции и анализа указанной концентрации цитокинов посредством системы анализа Luminex.
На фиг. 7А-7Е показано действие ритуксимаба на функцию CAR Т-клеток к CD20 in vivo. Мышам Nod-SCID-γ-/- (NSG) внутривенно (в/в) вводили 5×105 клеток рефрактерной к ритуксимабу лимфомы Raji-ffLuc, а затем проводили одно из следующих лечений: без лечения; только ритуксимабом (25 мкг или 200 мкг) внутрибрюшинно (в/б) через 5 дней; только 107 1.5.3-NQ-28-BBz CAR Т-клетками через 6 дней после опухоли, или ритуксимабом (25 мкг или 200 мкг) в/б через 5 дней, а затем 107 CAR Т-клетками через 6 дней после опухоли. Мыши проходили визуализацию два раза в неделю на предмет биолюминесценции. (A) Схема эксперимента с мышами. (B) Средняя опухолевая масса на группу с течением времени, как измерено посредством общей биолюминесценции тела. Показано среднее геометрическое значений люминесценции с 95% доверительными интервалами, и для предупреждения ложных отклонений в графиках объема опухолей последний уровень биолюминесценции каждой мыши регистрировали непосредственно после ее умерщвления до тех пор, пока в этой группе не останется ни одной мыши. Индивидуальные кривые биолюминесценции приведены на фиг. 13. (C) График Каплана-Майера, показывающий общую выживаемость каждой группы лечения. (D) Сывороточные уровни ритуксимаба в день инфузии Т-клеток (день 6) и через 1 неделю после инфузии Т-клеток (день 13). Горизонтальные полосы обозначают медианные значения. (E) Сывороточные уровни ритуксимаба у пациентов с лимфомой, получавших лечение ритуксимаб-содержащей резервной химиотерапией в течение 4 предшествующих месяцев. Серая горизонтальная линия показывает медиану, а черные горизонтальные линии показывают межквартильный размах (25-75%).
На фиг. 8А-8С показано действие офатумумаба на функцию CAR Т-клеток к CD20 in vitro. Облученные клетки Rec-1 или Raji-ffLuc или необлученные меченые 51Cr клетки Rec-1 предварительно инкубировали в течение 30 минут с двукратными указанными концентрациями офатумумаба, а затем проводили эксперименты для определения функции Т-клеток, экспрессирующих 1.5.3-NQ-28-BB-z CAR, при помощи методик, описанных в легенде фиг. 3 и 4. (A) Процент поделившихся CD3+ T-клеток по отношению к нестимулированным Т-клеткам приведен на левой оси (закрашенные столбцы). Размер CD3+ T-клеток, определенный посредством среднего геометрического показателя прямого светорассеяния (за вычетом размера клеток только в среде), показан на правой оси (незакрашенные столбцы). (B) Секрецию цитокинов этими Т-клетками измеряли при помощи системы анализа Luminex, используя супернатанты, полученные через 24 часа после повторной стимуляции. Концентрации IL-2 показаны на левой y-оси, а IFN-γ – на правой y-оси. (C) Цитотоксичность 1.5.3-NQ-28-BB-z CAR Т-клеток определяли при помощи стандартного 4-часового исследования высвобождения 51Cr при помощи клеток-мишеней Rec-1. Показано среднее значение по двум идентичным лункам, где столбцы погрешностей представляют собой среднеквадратическое отклонение.
На фиг. 9 показана экспрессия CD20 K80-20низк, K80-20средн, K80-20выс, как определено посредством проточной цитометрии. Незакрашенные гистограммы представляют собой клетки, окрашенные конъюгированным с FITC (флюоресцеин-изотиоцианатом) антителом 1F5 (антитело к CD20), а закрашенные гистограммы представляют собой клетки, окрашенные изотипическим контрольным антителом Ab.
На фиг. 10 показаны абсолютные концентрации цитокинов в супернатантах Т-клеток из эксперимента, приведенного на фиг. 5.
На фиг. 11А-11Е показана пролиферация, секреция цитокинов и цитотоксичность CAR Т-клеток с полностью человеческим scFv к CD20. Здоровые донорные CD14-CD45RA-CD62L+ центральные Т-клетки памяти стимулировали гранулами с антителом к CD3/28 с последующей трансдукцией лентивирусным вектором, кодирующим 1.5.3-NQ-28-z CAR или 1.5.3-NQ-28-BB-z CAR. CAR Т-клетки метили CFSE и повторно стимулировали клетками-мишенями, представлявшими собой облученные Raji-ffLuc, рефрактерные к ритуксимабу Raji-ffLuc (RR-Raji) или Rec-1. (A) Пролиферацию 1.5.3-NQ-28-z Т-клеток оценивали посредством анализа клеток 4 дня спустя при помощи проточной цитометрии в отношении разведения CFSE. Показан процент поделившихся CD3+ Т-клеток относительно нестимулированных Т-клеток. (B) Секрецию цитокинов 1.5.3-NQ-28-z Т-клетками определяли при помощи отбора образцов супернатантов вышеупомянутых культур через 24 часа после повторной стимуляции и анализа концентраций указанных цитокинов посредством системы анализа Luminex. Концентрации IL-2 и TNF-α показаны на левой оси y-оси, а концентрации IFN-γ нанесены на правую y-ось. (C) Секреция цитокинов 1.5.3-NQ-28-BB-z T-клетками, определенная, как описано выше в части В. (D) Цитотоксичность 1.5.3-NQ-28-BB-z CAR Т-клеток определяли при помощи стандартного 5-часового исследования высвобождения 51Cr с указанными линиями клеток-мишеней. (E) Секреция цитокинов 1.5.3-NQ-28-BB-z Т-клетками, как в части (А) выше, и стимулированными клетками Granta, Rec-1, FL-18 или K80-20.
На фиг. 12 показано, что рефрактерные к ритуксимабу клетки Raji-ffLuc имеют такую же экспрессию CD20, как и родительские клетки Raji-ffLuc. Клетки Raji-ffLuc (гистограмма сплошной линией) или рефрактерные к ритуксимабу клетки Raji-ffLuc (гистограмма пунктирной линией) окрашивали при помощи антител к CD20-PE или к CD20-APC, а затем анализировали посредством проточной цитометрии. Экспрессия CD20 относительно изотипического контрольного антитела (заштрихованная диаграмма) показана для каждой линии клеток.
На фиг. 13А и 13В показаны кривые биолюминесценции и изображения мышиной модели ксенотрансплантанта опухоли с фиг. 7, обработанной CAR Т-клетками к CD20. (A) Кривые биолюминисценции опухолевой массы отдельных мышей с течением времени. Каждая линия представляет собой отдельную мышь. Серая линия представляет собой мышь без опухоли, которая определяет исходный уровень аутофлуоресценции. (B) Иллюстративные изображения биолюминисценции мышей.
На фиг. 14A-14C показано присутствие циркулирующих Т-клеток у мышей. Мононуклеарные клетки периферической крови (МНПК) выделяли из образцов крови из ретроорбитального синуса, взятых на 28 день после введения опухоли, и анализировали при помощи проточной цитометрии в отношении человеческого CD3, мышиного CD45 мыши и человеческого CD19 (в качестве маркера трансдуцированных Т-клеток). (A) Иллюстративные точечные диаграммы циркулирующих человеческих Т-клеток (отобранных из жизнеспособных лимфоцитов) приведены на графиках слева, а CAR+ клетки (на основании экспрессии CD19), отобранные из CD3+ Т-клеток человека, приведены на графиках справа. (B) Суммарная персистенция Т-клеток на 28 день. (C) Суммарная экспрессия CAR на персистирующих Т-клетках. Как для фиг. 14В, так и для фиг. 14С разница между группами с только CAR и CAR с ритуксимабом не была статистически значимой на основании непарного двустороннего t-критерия.
На фиг. 15A-15D показана секреция цитокинов различными конструкциями CAR in vitro. Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали спустя 24 часа лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vivo. На 14 день клетки повторно стимулировали облученными клетками Raji-ffLuc (фиг. 15А и фиг. 15С), клетками Granta-519 (фиг. 15B) или клетками Jeko (фиг. 15D). Конструкция «19-BB-z» представляет собой CAR к CD19 для клинического применения, применяемый в клинических исследованиях и обеспеченный в качестве положительного контроля. Супернатанты отбирали через 24 часа и анализировали при помощи системы анализа Luminex на уровни интерферона (IFN)-γ, IL-2 и фактора некроза опухоли-α.
На фиг. 16А и 16В показана секреция цитокинов CAR Т-клетками к CD20. (A) CD4+ и CD8+ T-клетки, трансдуцированные лентивирусным вектором 1.5.3-NQ-28-BB-z и размноженные ex vivo, повторно стимулировали облученными клетками CD20+ лимфомы Raji-ffLuc. Секрецию указанных цитокинов измеряли в клеточных супернатантах спустя 24 часа при помощи системы анализа Luminex. (B) Криоконсервированные CD4+ и CD8+ CAR Т-клетки к CD20 размораживали оттаиванием и повторно стимулировали клетками K562 или клетками K562, экспрессирующими CD20, и через 24 часа анализировали при помощи внутриклеточного окрашивания на IFN-γ посредством проточной цитометрии.
На фиг. 17А и 17В показана цитотксичность различных конструкций CAR in vitro. Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали спустя 24 часа лентивирусными векторами, кодирующими конструкции CAR, и размножали in vivo. На 14 день клетки использовали в качестве эффекторов в стандартном 4-часовом исследовании высвобождения 51Cr, с клетками (фиг. 17A и 17B) Raji-ffLuc и (фиг. 17В) Jeko в качестве мишеней. Конструкция «19-BB-z» представляет собой CAR к CD19 для клинического применения, применяемый в клинических исследованиях и обеспеченный в качестве положительного контроля. Показан специфичный лизис клеток-мишеней каждой популяцией CAR Т-клеток.
На фиг. 18А и 18В показана пролиферация CAR Т-клеток к CD20. CD8+ Т-клетки трансдуцировали лентивирусным вектором 1.5.3-NQ-28-BB-z (или ложно трансдуцировали) и размножали ex vivo, а затем криоконсервировали. Затем клетки размораживали оттаиванием, окрашивали при помощи карбоксифлуоресцеин сукцинимидилового эфира (CFSE) и повторно стимулировали облученными клетками CD20+ лимфомы Raji-ffLuc, клетками K562 или клетками K562, экспрессирующими CD20. Клетки анализировали при помощи проточной цитометрии 4 дня спустя. (A) Показано разведение CFSE CAR+ клеток (отобранных из CD3+/tCD19+). Гистограмма прерывистой линией показывает флуоресценцию CFSE Т-клеток только в культуральной среде, а гистограммы со сплошными линиями представляют собой Т-клетки, инкубированные совместно с клетками-мишенями. (B) Показан процент поделившихся клеток для каждой группы.
На фиг. 19А и 19В показана противоопухолевая активность различных конструкций CAR in vivo. Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали спустя 24 часа лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vitro. Конструкция «19-BB-z» представляет собой CAR к CD19 для клинического применения, применяемый в клинических исследованиях в медицинском центре, где работают авторы изобретения, и предложенный в качестве эталонного контроля. Мышам NSG в/в вводили опухолевые клетки Raji-ffLuc с последующим через 2 дня в/в введением размноженных центральных Т-клеток памяти (CD14-CD45RA-CD62L+), трансдуцированных 1.5.3-NQ-28-BB-z CAR, 1.5.3-NQ-28-z CAR, JCAR-014 (анти-CD19-41BB-ζ) или пустым вектором. (A) Опухолевая масса с течением времени, как оценено посредством биолюминесцентной визуализации; и (B) график общей выживаемости Каплана-Майера.
На фиг. 20 показана активность CAR Т-клеток к CD20 в отношении мантийноклеточной лимфомы in vivo. CD4+ и CD8+ CAR Т-клетки к CD20 трансдуцировали 1.5.3-NQ-28-BBz CAR и применяли для лечения мышей NSG, которым за 7 дней до этого прививали клетки Granta-ffLuc мантийноклеточной лимфомы в хвостовую вену. График общей выживаемости Каплана-Майера.
На фиг. 21А и 21В показана персистенция CAR Т-клеток in vivo. Образцы крови из ретроорбитального синуса брали в ряд моментов времени после инфузии CAR Т-клеток к CD20 или Т-клеток с пустым вектором, экспрессирующих tCD19, у мышей NSG, имеющих распространенные опухоли Raji-ffLuc. CAR Т-клетки к CD20, экспрессирующие маркер трансдукции tCD19, количественно оценивали при помощи проточной цитометрии в каждый момент времени как человеческие CD3+/мышиные CD45-отрицательные/ человеческие CD19+ клетки. (фиг. 21А) Показаны tCD19+ Т-клетки в трех моментах времени после инфузии в виде процента от всех ядросодержащих клеток в крови (изначально в группе CAR Т-клеток n равно 9). Клетки с усеченным CD19+ мыши, получившей пустой вектор, приведены для сравнения. (фиг. 21B) В отдельном длительном эксперименте с еженедельными измерениями показаны tCD19+ клетки от 2 мышей в каждой группе (пустой вектор по сравнению с CAR Т-клетками).
На фиг. 22А и 22В показаны сравнительные данные для различных конструкций, имеющих спейсеры различной длины. Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали 24 часа спустя лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vitro. 1F5-28-BB-z, IgG1mut имеют полноразмерные спейсеры. «Без линкера» представляет собой почти полноразмерный, но не имеющий 6 аминокислот линкер (соединяющая аминокислота), и CH3 имеет усеченный спейсер, лишенный соединяющих аминокислот и домена CH2. (A) На 20 день клетки повторно стимулировали клетками лимфомы Granta или Rec-1 и 24 часа спустя собирали супернатанты и анализировали при помощи системы анализа Luminex на концентрации IL-2 (справа) и IFN-γ (слева). (B) Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали 24 часа спустя лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vitro. «IgG1mut NQ» имеет полноразмерный спейсер CH2CH3, только CH3 имеет промежуточную длину, как обсуждалось выше, и «короткий Leu16» не содержит обоих доменов CH2 и CH3. На 20 день клетки использовали в качестве эффекторных клеток в стандартном 4-часовом исследовании высвобождения 51Cr, используя клетки Raji в качестве мишеней.
На фиг. 23А-23F показаны сравнительные данные для различных конструкций, имеющих спейсеры с различными модификациями. Показана блок-схема CAR с соединяющими аминокислотами IgG2 (обозначенного «IgG1mut») и мутациями N297Q (обозначенного «NQ») (фиг. 23А). Т-клетки, экспрессирующие CAR со спейсером IgG1 дикого типа, мутантным спейсером IgG1 (соединяющие аминокислоты IgG1, замещенные соединяющими аминокислотами IgG2), или без соединяющих аминокислот (IgG1 соединяющие аминокислоты растворимым удалены) окрашивали биотинилированным CD64 (FcγRI), затем стрептавидином-PE, и затем анализировали при помощи проточной цитометрии, демонстрирующей связывание Fc-рецептора со спейсерами дикого типа, но не с модифицированными спейсерами (фиг. 23B). Т-клетки, экспрессирующие указанные конструкции CAR, инкубировали совместно с клетками K562, экспрессирующими CD64 (FcγRI), или родительскими K562, лишенными Fc-рецепторов. Через 24 часа после совместной инкубации Т-клетки оценивали в отношении экспрессии CD25 и CD69 посредством проточной цитометрии в качестве признака активации. Точечные диаграммы представляют CD3+CD19+ клетки (CAR+ T-клетки). Связывание спейсеров дикого типа с Fc-рецепторами приводило к активации Т-клеток, в отличие от связывания с модифицированными спейсерами (фиг. 23C). Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали 24 часа спустя лентивирусными векторами, кодирующими указанные конструкции CAR, размножали in vitro и вводили мышам NSG спустя два дня после в/в введения клеток Raji-ffLuc. (D и E) Данные опухолевой массы на основании биолюминисценции для двух различных экспериментов. (F) График выживаемости Каплана-Майера из эксперимента в части (E) выше.
На фиг. 24 показана диаграмма схемы лечения в клиническом исследовании, включающая способы иммуннотерапии и композиции согласно настоящему изобретению.
На фиг. 25А и 25В показана диаграмма способа получения и модели введения CAR Т-клеток к CD20 в клиническом исследовании.
Подробное описание изобретения
В настоящем изобретении предложены композиции и способы снижения количества клеток, экспрессирующих CD20, или лечения заболевания или расстройства, связанного с экспрессией CD20 (например, снижения количества В-клеток или лечения заболевания или расстройства, связанного с нарушенной активностью В-клеток), включающие лечение субъекта терапевтически эффективным количеством клетки-хозяина, содержащей гетерологичную молекулу нуклеиновой кислоты, кодирующую слитый белок, где слитый белок содержит внеклеточный компонент и внутриклеточный компонент, соединенный с внеклеточным компонентом посредством гидрофобной части, где внеклеточный компонент содержит связывающий домен, специфично связывающий CD20, и внутриклеточный компонент содержит эффекторный домен. Необязательно, способ может дополнительно включать терапевтически эффективное количество CD2-специфичной связывающей молекулы в комбинации с клеткой-хозяином, экспрессирующей слитый белок, специфичный к CD20. В некоторых вариантах осуществления слитый белок представляет собой химерный антигенный рецептор (CAR). В других вариантах осуществления CAR содержит scFv из антитела к CD20 или scTCR из TCR, специфичного к антигену CD20.
В качестве общей информации, обычно полагают, что остаточные уровни антитела к CD20 могут представлять основное ограничение для CAR Т-клеток к CD20. Например, ранее проведенные исследования с другими мишенями показали, что секреция цитокинов и цитотоксичность CAR Т-клеток, таргетирующих карциноэмбриональный антиген, антиген Lewis-Y или CD30, остается в значительной мере неизменной в присутствии уровней растворимого родственного антигена, составляющих вплоть до 10 мкг/мл (Hombach et al., Gene Ther 2000;7(12):1067-75; Hombach et al., Gene Ther 1999;6(2):300-4; Nolan et al., Clin Cancer Res 1999;5(12):3928-41; Westwood et al., J Immunother 2009;32(3):292-301); наблюдалось, что более высокие уровни являются потенциально ингибирующими (Hombach et al., Gene Ther 2000;7(12):1067-75). В настоящем изобретении неожиданно было обнаружено, что различные антитела к CD20 (например, ритуксимаб) в клинически значимых концентрациях практически не влияли на активность Т-клеток, экспрессирующих CAR к CD20, как in vitro, так и in vivo (см. также Gall et al., Exp. Hematol. 33:452, 2005). Более того, в экспериментах на мышах, приведенных в настоящем документе, продемонстрировано, что группы, получавшие комбинированную терапию, имели результаты такие же или лучше, чем у мышей, получавших лечение только CAR Т-клетками.
Перед более подробным изложением настоящего изобретения для лучшего его понимания может быть полезным привести определения некоторых терминов, используемых в настоящем документе. Дополнительные определения приведены на протяжении настоящего документа.
В настоящем описании любой диапазон концентрации, диапазон процентов, диапазон отношений или диапазон целочисленных значений следует понимать как включающий значение любого целого числа в пределах приведенного диапазона и в соответствующих случаях его части (такие как одна десятая и одна сотая от целого числа), если не указано иное. Кроме того, любой численный диапазон, приведенный в настоящем документе, относящийся к любому физическому свойству, такому как составные единицы полимера, размер или толщина, следует понимать как включающий любое целое число в пределах приведенного диапазона, если не указано иное. Как употреблено в настоящем документе, термин «приблизительно» означает ± 20% от указанного диапазона, значения или структуры, если не указано иное. Следует понимать, что термины в единственном числе, как употреблено в настоящем документе, относятся к «одному или более» из перечисленных компонентов. Использование альтернативы (например, «или») следует понимать как обозначающее один, оба или любую из комбинаций альтернатив. Как употреблено в настоящем документе, термины «включает», «имеет» и «содержит» используют в качестве синонимов, и данные термины и их варианты следует толковать как неограничивающие.
«Возможный» или «возможно» означает, что далее описываемый элемент, компонент, событие или обстоятельство может возникнуть или не возникнуть, и что описание включает случаи, в которых элемент, компонент, событие или обстоятельство возникает, и случаи, в которых они не возникают.
Кроме того, следует понимать, что отдельные конструкции или группы конструкций, полученные из различных комбинаций структур и составных единиц, описанных в настоящем документе, раскрыты в настоящей заявке в той же мере, как если бы каждая конструкция или группа конструкций были упомянуты по отдельности. Таким образом, выбор отдельных структур или отдельной составной единицы входит в объем настоящего изобретения.
Термин «состоящий по существу из» ограничивает объем заявленного до указанных веществ или стадий, или до таких, которые существенно не влияют на основные характеристики заявленного изобретения. Например, домен, участок, модуль или фрагмент белка (например, связывающий домен, шарнирный участок, линкерный модуль или маркер) или белок (который может иметь один или более доменов, участков или модулей) «состоит по существу из» определенной аминокислотной последовательности, если аминокислотная последовательность домена, участка, модуля, фрагмента или белка включает инсерции, делеции, замены или их комбинации (например, добавление аминокислот на амино- или карбоксильный конец, или между доменами), которые в комбинации составляют не более 20% (например, не более 15%, 10%, 8%, 6%, 5%, 4%, 3%, 2% или 1%) длины домена, участка, модуля, кассеты или белка и по существу не влияют (т.е. не снижают активность более чем на 50%, например, не более чем на 40%, 30%, 25%, 20%, 15%, 10%, 5% или 1%) на активность домена(ов), участка(ов), модуля(ей), кассеты(кассет) или белка(ов) (например, аффинность связывания мишени связывающего домена).
Как употреблено в настоящем документе, «аминокислота» относится к природным или синтетическим аминокислотам, а также аналогам аминокислот и миметикам аминокислот, выполняющим схожие функции с природными аминокислотами. Природные аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также позже модифицируемые аминокислоты, например, гидроксипролин, γ-карбоксиглутамат и O-фосфосерин. Аналоги аминокислот относятся к соединениям, имеющим такую же основную химическую структуру как и природная аминокислота, т.е. α-углерод, связанный с водородом, карбоксильную группу, аминогруппу и R-группу, например, гомосерин, норлейцин, метионин сульфоксид, метионинметилсульфоний. Такие аналоги имеют модифицированные R-группы (например, норлейцин) или модифицированные пептидные цепи, но сохраняют такую же основную химическую структуру, как и природные аминокислоты. Миметики аминокислот относятся к химическим соединениям, имеющим структуру, отличающуюся от обычной химической структуры аминокислоты, но функционирующие схожим образом с природной аминокислотой.
«Консервативная замена» относится к аминокислотным заменам, которые не оказывают существенного влияния или не изменяют характеристики связывания отдельного белка. Обычно консервативные замены представляют собой такие, при которых замещенный аминокислотный остаток заменен на аминокислотный остаток, имеющий схожую боковую цепь. Консервативные замены включают замены в одной из следующих групп: группа 1: аланин (Ala или A), глицин (Gly или G), серин (Ser или S), треонин (Thr или T); группа 2: аспарагиновая кислота (Asp или D), глутаминовая кислота (Glu или Z); группа 3: аспарагин (Asn или N), глутамин (Gln или Q); группа 4: аргинин (Arg или R), лизин (Lys или K), гистидин (His или H); группа 5: изолейцин (Ile или I), лейцин (Leu или L), метионин (Met или M), валин (Val или V); и группа 6: фенилаланин (Phe или F), тирозин (Tyr или Y), триптофан (Trp или W). Дополнительно или в качестве альтернативы, аминокислоты могут быть объединены в группы консервативных аминокислотных замен по схожим функциям, химической структуре или составу (например, кислые, основные, алифатические, ароматические или серосодержащие). Например, алифатическая группа может включать, применительно к замене, Gly, Ala, Val, Leu и Ile. Другие группы консервативных замен включают: серосодержащие: Met и цистеин (Cys или C); кислые: Asp, Glu, Asn и Gln; маленькие алифатические, неполярные или слабо полярные остатки: Ala, Ser, Thr, Pro и Gly; полярные отрицательно заряженные остатки и их амиды: Asp, Asn, Glu и Gln; полярные положительно заряженные остатки: His, Arg и Lys; большие алифатические неполярные остатки: Met, Leu, Ile, Val и Cys; и большие ароматические остатки: Phe, Tyr и Trp. Дополнительная информация приведена в Creighton (1984) Proteins, W.H. Freeman and Company.
Как употреблено в настоящем документе «белок» или «полипептид» относится к полимеру из аминокислотных остатков. Белки относится к полимерам из природных аминокислот, а также полимерам из аминокислот, в которых один или более аминокислотных остатков представляет собой искусственный химический миметик соответствующей природной аминокислоты, а также полимерам из неприродных аминокислот.
«Процент идентичности последовательностей» относится к взаимному соответствию двух или более последовательностей, как определено посредством сравнения последовательностей. Предпочтительные способы определения идентичности последовательностей направлены на получение наилучшего совпадения сравниваемых последовательностей. Например, последовательности выравнивают для оптимального сравнения (например, в одну или обе из первой и второй аминокислотной или нуклеиновокислотной последовательности могут быть введены гэпы для оптимального выравнивания). Более того, негомологичные последовательности могут не учитываться при сравнении. Процент идентичности последовательностей, упоминаемый в настоящем документе, вычисляют исходя из длины референсной последовательности, если не указано иное. Способы определения идентичности и сходства последовательностей могут быть найдены в общедоступных компьютерных программах. Выравнивание последовательностей и вычисление процента идентичности могут быть выполнены при помощи программы BLAST (например, BLAST 2.0, BLASTP, BLASTN или BLASTX). Математический алгоритм, применяемый в программах BLAST, может быть найден в Altschul et al., Nucleic Acids Res. 25:3389-3402, 1997. В контексте настоящего изобретения следует понимать, что в случае применения для анализа программного обеспечения для анализа последовательностей, результаты анализа основаны на «значениях по умолчанию» упомянутой программы. «Значения по умолчанию» означают любой набор значений или параметров, изначально загруженных в программное обеспечение при его первой инициализации.
«Молекула нуклеиновой кислоты» или «полинуклеотид» относится к полимерному соединению, включающему ковалентно связанные нуклеотиды, которое может состоять из природных субъединиц (например, пуриновых или пиримидиновых оснований) или неприродных субъединиц (например, морфолинового кольца). Пуриновые основания включают аденин, гуанин, гипоксантин и ксантин, и пиримидиновые основания включают урацил, тимин и цитозин. Молекулы нуклеиновой кислоты включают полирибонуклеиновую кислоту (РНК), полидезоксирибонуклеиновую кислоту (ДНК), которая включает кДНК, геномную ДНК и синтетическую ДНК, каждая из которых может быть одноцепочечной или двухцепочечной. Если молекула нуклеиновой кислоты является одноцепочечной, она может представлять собой кодирующую цепь или некодирующую цепь (антисмысловую цепь). Молекула нуклеиновой кислоты, кодирующая аминокислотную последовательность, включает все нуклеотидные последовательности, кодирующие одну и ту же аминокислотную последовательность. Некоторые версии нуклеотидных последовательностей могут также включать интрон(ы), при условии что эти интрон(ы) будут удалены за счет ко- или посттранскрипционных механизмов. Другими словами различные нуклеотидные последовательности могут кодировать одну и ту же аминокислотную последовательность как результат избыточности или вырожденности генетического кода, или в результате сплайсинга.
Также предполагаются варианты молекул нуклеиновых кислот согласно настоящему изобретению. Вариантные молекулы нуклеиновой кислоты по меньшей мере на 70%, 75%, 80%, 85%, 90% и предпочтительно на 95%, 96%, 97%, 98%, 99% или 99,9% идентичны молекуле нуклеиновой кислоты определенного или референсного полинуклеотида, как описано в настоящем документе, или такого, который гибридизуется с полинуклеотидом при жестких условиях гибридизации, представляющие собой 0,015 M хлорида натрия, 0,0015 M цитрата натрия при приблизительно 65-68 ºC или 0,015 M хлорида натрия, 0,0015 M цитрата натрия и 50% формамид при приблизительно 42 ºC. Варианты молекул нуклеиновой кислоты сохраняют способность кодировать слитый белок или его связывающий домен, обладающий описанной в настоящем документе функциональностью, например, специфично связывающий молекулу-мишень (например, CD20).
«Функциональный вариант» относится к полипептиду или полинуклеотиду, структурно схожему или по существу структурно схожему с родительским или референсным соединением согласно настоящему изобретению, но немного отличающемуся по составу (например, одно основание, атом или функциональная группа отличается, добавлено или заменено), так что полипептид или кодируемый полипептид способен выполнять по меньшей мере одну функцию кодируемого родительского полипептида с по меньшей мере 50% эффективностью, предпочтительно с по меньшей мере 55%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или 100% уровнем активности относительно родительского полипептида. Другими словами, функциональный вариант полипептида или кодируемого полипептида согласно настоящему изобретению имеет «схожее связывание», «схожую аффинность» или «схожую активность» в случае, когда функциональный вариант проявляет снижение характеристик не более чем на 50% в выбранном исследовании по сравнению с родительским или референсным полипептидом, таком как исследование измерения аффинности связывания (например, измерение константы ассоциации (Ka) или диссоциации (KD) при помощи Biacore® или тетрамерного окрашивания).
Как употреблено в настоящем документе «функциональная часть» или «функциональный фрагмент» относится к полипептиду или полинуклеотиду, содержащему только домен, часть или фрагмент родительского или референсного соединения, и полипептиду или кодируемому полипептиду, сохраняющему по меньшей мере 50% активности, связанной с доменом, частью или фрагментом родительского или референсного соединения, предпочтительно по меньшей мере 55%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или 100% уровень активности относительно родительского полипептида или обеспечивает биологическую выгоду (например, эффекторную функцию). «Функциональная часть» или «функциональный фрагмент» полипептида или кодируемого полипептида согласно настоящему изобретению имеет «схожее связывание» или «схожую активность» в случае, когда функциональная часть или фрагмент демонстрирует снижение характеристик в выбранном исследовании по сравнению с родительским или референсным полипептидом не более чем на 50% (предпочтительно не более чем на 20% или 10%, или не более чем на логарифмическую разницу по сравнению с родительским или референсным в отношении аффинности), например, в исследовании измерения аффинности связывания или измерения эффекторной функции (например, высвобождения цитокинов).
Как употреблено в настоящем документе, «гетерологичный», или «неэндогенный», или «экзогенный» относится к любому гену, белку, соединению, молекуле нуклеиновой кислоты или активности, изначально не присущим клетке-хозяину или субъекту, или любому гену, белку, соединению, молекуле нуклеиновой кислоты или активности, присущим клетке-хозяину или субъекту, которые были изменены. Гетерологичный, неэндогенный или экзогенный включают гены, белки, соединения или молекулы нуклеиновых кислот, которые были мутированы или иным образом изменены, так что структура, активность или как структура, так и активность у исходного и измененного генов, белков, соединений или молекул нуклеиновой кислоты различны. В некоторых вариантах осуществления гетерологичные, неэндогенные или экзогенные гены, белки или молекулы нуклеиновых кислот (например, рецепторы, лиганды и т.д.) могут быть неэндогенными в отношении клетки-хозяина или субъекта, но вместе с тем нуклеиновые кислоты, кодирующие такие гены, белки или молекулы нуклеиновых кислот могут быть добавлены к клетке-хозяину посредством конъюгации, трансформации, трансфекции, электропорации или т.п., где добавленная молекула нуклеиновой кислоты может встроиться в геном клетки-хозяина или может существовать в виде внехромосомного генетического материала (например, в виде плазмиды или другого самореплицирующегося вектора). Термин «гомологичный« или «гомолог» относится к гену, белку, соединению, молекуле нуклеиновой кислоты или активности, обнаруживаемых в или полученных из клетки-хозяина, вида или штамма. Например, гетерологичный или экзогенный полинуклеотид или ген, кодирующий полипептид, может быть гомологичным нативному полинуклеотиду или гену и кодировать гомологичный полипептид или активность, но полинуклеотид или полипептид могут иметь измененную структуру, последовательность, уровень экспрессии или любую их комбинацию. Неэндогенный полинуклеотид или ген, а также кодируемый полипептид или активность, могут происходить из одинаковых видов, различных видов или их комбинации.
Как употреблено в настоящем документе, термин «эндогенный» или «нативный» относится к полинуклеотиду, гену, белку, соединению, молекуле или активности, обычно присутствующих у клетки-хозяина или субъекта.
«Экспрессия» относится к транскрипции или трансляции молекулы нуклеиновой кислоты, функционально связанной с последовательностью, контролирующей экспрессию (например, промотором).
Как употреблено в настоящем документе, термин «сконструированный», «рекомбинантный» или «неприродный» относится к организму, микроорганизму, клетке, молекуле нуклеиновой кислоты или вектору, который включает по меньшей мере одно генетическое изменение или был модифицирован посредством введения экзогенной молекулы нуклеиновой кислоты, где такие изменения или модификации вводят при помощи генетической инженерии (т.е. вмешательства человека). Генетические изменения включают, например, модификации, посредством которых вводятся способные к экспрессии молекулы нуклеиновых кислот, кодирующих белки, слитые белки или ферменты, или другие включения молекул нуклеиновых кислот, делеции, замены или другие функциональные нарушения генетического материала клетки. Дополнительные модификации включают, например, некодирующие регуляторные участки, в которых модификации изменяют экспрессию полинуклеотида, гена или оперона.
Как употреблено в настоящем документе, «слитый белок» относится к белку, который в одной цепи имеет по меньшей мере два различных домена, где домены не встречаются вместе в белке в природе. Полинуклеотид, кодирующий слитый белок, может быть сконструирован при помощи ПЦР, генетической инженерии или тому подобного, или такие слитые белки могут быть синтезированы. Слитый белок может дополнительно содержать другие компоненты, такие как маркер, линкерный модуль или маркер трансдукции. В некоторых вариантах осуществления слитый белок, экспрессируемый или продуцируемый клеткой-хозяином (например, Т-клеткой), локализован на клеточной поверхности, где слитый белок заякорен в клеточной мембране (например, через трансмембранный домен) и содержит внеклеточную область (например, содержащую связывающий домен) и внутриклеточную область (например, содержащую сигнальный домен, эффекторный домен, костимулирующий домен или их комбинацию).
Каждый из терминов, известных специалистам в области получения антител, приведены в значении, известном в данной области техники, если в настоящем документе однозначно не указано иное. Термин «антитело» относится к интактному антителу, содержащему по меньшей мере две тяжелых (H) цепи и две легких (L) цепи, связанных дисульфидными связями, а также к антиген-связывающей части интактного антитела, которая имеет или сохраняет способность связывания молекулы-мишени. Антитела включают поликлональные и моноклональные антитела. Антитело может быть природным, рекомбинантным, сконструированным или модифицированным и включает модифицированные формы иммунноглобулинов, такие как, например, внутриклеточные антитела, пептидные антитела, наноантитела, однодоменные антитела, мультиспецифичные антитела (например, биспецифичные антитела, диатела, триатела, тетратела, тандемный ди-scFV, тандемный три-scFv). «Антигенсвязывающая часть», «антиген-связывающий фрагмент» или «антиген-связывающий домен» антитела относится к «фрагменту антитела», содержащему часть интактного антитела и содержащему антигенраспознающие вариабельные участки или участки антитела, определяющие комплементарность. Примеры фрагментов антитела включают Fab, Fab’, F(ab’)2 и Fv фрагменты, Fab’-SH, F(ab’)2, диатела, линейные антитела, одноцепочечные антитела, scFv (т.е. слитый белок вариабельного тяжелого (VH) и вариабельного легкого (VL) участков молекулы Ig, соединенных коротким линкерным пептидом, обычно состоящим из приблизительно 10-25 аминокислот), VHH, однодоменные антитела (например, sdAb, sdFv, нанотела) и мультиспецифичные антитела, содержащие фрагменты антител. Моноклональное антитело или его антигенсвязывающая часть могут быть нечеловеческими, химерными, гуманизированными или человеческими, предпочтительно гуманизированными или человеческими. Структура и функция иммунноглобулинов рассмотрены, например, в источнике Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988). Антитело может быть антителом любого класса или подкласса, включая IgG и его подклассы (IgG1, IgG2, IgG3, IgG4), IgM, IgE, IgA и IgD.
Термины «VL» и «VH» относятся к вариабельному связывающему участку легкой и тяжелой цепи антитела, соответственно. Вариабельные связывающие участки состоят из дискретных, хорошо определенных субучастков, известных как «участки, определяющие комплементарность» (CDR), и «каркасных участков» (FR).
Как известно в данной области техники, термины «участок, определяющий комплементарность» (CDR) или «гипервариабельный участок» (HVR) относятся к несмежным последовательностям аминокислот в вариабельных участках антитела, придающим специфичность к антигенам или аффинность связывания. Обычно существует три CDR в каждом вариабельном участке тяжелой цепи (HCDR1, HCDR2 и HCDR3) и три CDR в каждом вариабельном участке легкой цепи (LCDR1, LCDR2 и LCDR3).
«Каркасные участки» (FR), как употреблено в настоящем документе, относится к частям вариабельных участков тяжелой и легкой цепи, не являющимся CDR. Обычно существует четыре FR в каждом полноразмерном вариабельном участке тяжелой цепи (FR-Hl, FR-H2, FR-H3 и FR-H4), и четыре FR в каждом полноразмерном вариабельном участке легкой цепи (FR-L1, FR-L2, FR-L3 и FR-L4).
Термин «CL» относится к «константному участку легкой цепи иммуноглобулина» или «константному участку легкой цепи», т.е. константному участку легкой цепи антитела. Термин «CH» относится к «константному участку тяжелой цепи иммуноглобулина» или «константному участку тяжелой цепи», который дополнительно подразделяется в зависимости от изотипа антитела на домены CH1, CH2 и CH3 (IgA, IgD, IgG) или CH1, CH2, CH3 и CH4 (IgE, IgM).
Область «антигенсвязывающего фрагмента» (Fab) представляет собой часть антитела, связывающуюся с антигенами и включающую вариабельный участок и CH1 тяжелой цепи, связанной с легкой цепью межцепочечной дисульфидной связью. Участок «фрагмента, способного к кристаллизации» (Fc) представляет собой часть антитела, которая не является Fab-участком и включает участки CH, отличные от CH1 (например, CH2 и CH3 антитела IgG, IgA или IgD, или CH2, CH3 и CH4 антитела IgE). В качестве общей информации, Fc-участок отвечает за эффекторные функции иммунноглобулина, такие как антителозависимая клеточноопосредованная цитотоксичность (ADCC), комплементзависимая цитотоксичность (CDC) и фиксация комплемента, связывание с Fc-рецепторами (например, CD16, CD32, FcRn), большее время полужизни in vivo относительно полипептида, не имеющего Fc-участок, связывание белка А, и, возможно, даже трансплацентарная передача (см. Capon et al., Nature 337:525, 1989).
Как употреблено в настоящем документе, «часть Fc-участка» относится к сегменту константного участка тяжелой цепи Fc-фрагмента антитела, который может включать один или более константных домена, таких как CH2, CH3, CH4 или их комбинации. В некоторых вариантах осуществления часть Fc-участка включает домены CH2 и CH3 антитела IgG, IgA или IgD или любую их комбинацию, или домены CH2, CH3 и CH4 антитела IgM или IgE и любую их комбинацию. В других вариантах осуществления структура CH2CH3 или CH3CH4 имеет домены субучастка из антитела того же изотипа и является человеческой, такой как человеческое IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE или IgM (например, CH2CH3 из человеческого IgG1 или IgG4). В некоторых вариантах осуществления часть Fc-участка в составе слитых белков согласно настоящему изобретению будет способна опосредовать одну или более эффекторных функций иммуноглобулина, будет способна опосредовать одну или более усиленных эффекторных функций или не будет иметь одну или более из, или все эти активности, например, в результате одной или более мутаций, известных в данной области техники.
Кроме того, антитела имеют шарнирную последовательность, которая обычно расположена между Fab-участком и Fc-участком (но нижняя часть шарнира может включать аминотерминальную часть Fc-участка). В качестве общей информации, шарнир иммуноглобулина действует в качестве гибкого спейсера, что позволяет Fab-участку свободно двигаться в пространстве. В отличие от константных участков, шарниры имеют различные структуры, отличаясь как последовательностью, так и длиной между классами иммуноглобулинов и даже между подклассами. Например, шарнирный участок человеческого IgG1 является свободно гибким, что позволяет Fab-участкам вращаться вокруг их оси симметрии и двигаться в пределах сферы, центр которой находится на первом из двух дисульфидных мостиков между тяжелыми цепями. Для сравнения, шарнир человеческого IgG2 является относительно коротким и содержит жесткую полипролиновую двойную спираль, стабилизированную четырьмя дисульфидными мостиками между тяжелыми цепями, что ограничивает гибкость. Шарнир человеческого IgG3 отличается от других подклассов уникальным удлиненным шарнирным участком (приблизительно в четыре раза длиннее, чем шарнир IgG1), содержащим 62 аминокислоты (включая 21 пролин и 11 цистеинов), образующим негибкую полипролиновую двойную спираль и обеспечивающим большую гибкость, поскольку Fab-участки расположены относительно далеко от Fc-участка. Шарнир человеческого IgG4 короче, чем у IgG1, но имеет такую же длину, как у IgG2, и его гибкость является промежуточной между таковой для IgG1 и IgG2.
«T-клетка» представляет собой клетку иммунной системы, созревающую в тимусе и продуцирующую Т-клеточные рецепторы (TCR). Т-клетки могут быть наивными (не вступавшие в контакт с антигеном; повышенная экспрессия CD62L, CCR7, CD28, CD3, CD127 и CD45RA, и пониженная экспрессия CD45RO по сравнению с TCM), Т-клетками памяти (TM) (взаимодействовавшие с антигеном и долгоживущие) и эффекторными клетками (взаимодействовавшие с антигеном, цитотоксичные). TM могут быть дополнительно разделены на субпопуляции центральных Т-клеток памяти (TCM, повышенная экспрессия CD62L, CCR7, CD28, CD127, CD45RO и CD95, и пониженная экспрессия CD54RA по сравнению с наивными Т-клетками) и эффекторных Т-клеток памяти (TEM, пониженная экспрессия CD62L, CCR7, CD28, CD45RA и повышенная экспрессия CD127 по сравнению с наивными Т-клетками или TCM). Эффекторные Т-клетки (TE) относятся к CD8+ цитотоксическим Т-лимфоцитам, взаимодействовавшим с антигеном, которые имеют пониженную экспрессию CD62L,CCR7, CD28, и в отличие от TCM экспрессируют гранзим и перфорин. Т-хелперные клетки (TH) высвобождают цитокины, способствующие передаче сигнала об антигене, и в зрелом состоянии экспрессируют поверхностный белок CD4 (являются CD4+). Как употреблено в настоящем документе, «T-клетки» или «T-лимфоциты» представляют собой клетки любых млекопитающих, включая приматов, собак или лошадей, предпочтительно людей. В некоторых вариантах осуществления Т-клетки являются аутологичными, аллогенными или сингенными.
«T-клеточный рецептор» (TCR) относится к молекуле, находящейся на поверхности Т-клеток (или Т-лимфоцитов), которая в комплексе с CD3 обычно отвечает за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости (ГКГС). TCR большинства Т-клеток имеет связанный дисульфидной связью гетеродимер из высоковариабельных α- и β-цепей (также известных как TCRα и TCRβ, соответственно). У небольшой субпопуляции Т-клеток TCR состоит из гетеродимера из вариабельных γ- и δ-цепей (также известных как TCRγ и TCRδ, соответственно). Каждая цепь TCR является членом надсемейства иммуноглобулинов и имеет один N-терминальный вариабельный домен иммуноглобулина, один константный домен иммуноглобулина, трансмембранный участок и короткий цитоплазматический хвост на С-терминальном конце (см. Janeway et al., Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997). TCR, как употреблено в настоящем документе, может происходить от различных видов животных, включая человека, мышь, крысу, кошку, собаку, козу, лошадь или других млекопитающих. TCR могут быть связанными с клетками (т.е. иметь трансмембранный участок или домен) или находиться в растворимой форме. Как обсуждается в настоящем документе, связывающий домен согласно настоящему изобретению может содержать одноцепочечный TCR (scTCR), который аналогичен scFv, полученному из иммуноглобулина, и содержит вариабельные домены цепей TCRα и TCRβ, связанные вместе при помощи, например, пептидного или непептидного линкера и необязательно посредством дисульфидной связи.
«Молекулы главного комплекса гистосовместимости» (молекулы ГКГС) относятся к гликопротеинам, доставляющим пептидные антигены к клеточной поверхности. Молекулы ГКГС I класса представляют собой гетеродимеры, состоящие из трансмембранной α-цепи (с тремя α-доменами) и нековалентно ассоциированного β2-микроглобулина. Молекулы ГКГС II класса состоят из двух трансмембранных гликопротеинов, α и β, оба из которых являются трансмембранными. Каждая цепь имеет два домена. Молекулы ГКГС I класса доставляют пептиды из цитозоля к клеточной поверхности, где комплекс пептид:ГКГС распознается CD8+ T-клетками. Молекулы ГКГС II класса доставляют пептиды из везикулярной системы к клеточной поверхности, где они распознаются CD4+ T-клетками. Молекула ГКГС может происходить от различных видов животных, включая человека, мышь, крысу, кошку, собаку, козу, лошадь или других млекопитающих.
«Клетки Т-клеточной линии» относятся к клеткам, демонстрирующим по меньшей мере одну фенотипическую характеристику Т-клетки или ее предшественника или прогенитора, которая отличает клетки от других лимфоидных клеток и клеток эритроидной или миелоидной линий. Такие фенотипические характеристики могут включать экспрессию одного или более белков, специфичных для Т-клеток (например, CD3+, CD4+, CD8+), или физиологические, морфологические, функциональные или иммунологические признаки, свойственные Т-клетке. Например, клетки Т-клеточной линии могут представлять собой клетки-прогениторы или предшественники, коммитированные к Т-клеточной линии; CD25+ незрелые или неактивированные Т-клетки; клетки, которые подвергались коммитированию к CD4 или CD8 линии; клетки-прогениторы тимоцитов, которые являются CD4+CD8+ двойными положительными; одинарно положительные CD4+ или CD8+; TCRαβ или TCR γδ; или зрелые и функциональные или активированные Т-клетки.
Как употреблено в настоящем документе, «обогащенный» или «обедненный» в отношении количества типов клеток в смеси относится к повышению количества «обогащенного» типа, снижению количества «обедненных» клеток, или к обоим, в смеси клеток, возникающего вследствие одного или более процессов или стадий обогащения или обеднения. Таким образом, в зависимости от источника исходной популяции клеток, подвергаемых процессу обогащения, смесь или композиция могут содержать 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% или более (в числе или количестве) «обогащенных» клеток. Клетки, подвергнутые процессу обеднения, могут давать смесь или композицию, содержащую 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% или менее (в числе или количестве) «обедненных» клеток. В некоторых вариантах осуществления количества определенного типа клеток в смеси будут обогащены, а количества другого типа клеток будут обеднены, например, обогащение CD4+ клетками при одновременном обеднении CD8+ клетками, или обогащение CD62L+ клетками при одновременном обеднении CD62L– клетками, или их комбинации.
«Лечить» или «лечение» или «улучшение» относится к медицинской терапии заболевания, расстройства или состояния субъекта (например, человека или млекопитающего, не являющегося человеком, такого как примат, лошадь, кошка, собака, коза, мышь или крыса). Обычно соответствующую дозу или схему лечения, содержащую клетку-хозяин, экспрессирующую слитый белок, где слитый белок содержит внеклеточный компонент и внутриклеточный компонент, соединенные посредством гидрофобной части, где внеклеточный компонент содержит связывающий домен, специфично связывающий CD20, и внутриклеточный компонент содержит эффекторный домен согласно настоящему изобретению, и необязательно адъювант, вводят в количестве, достаточном для достижения терапевтической или профилактической пользы. Терапевтическая или профилактическая/предупредительная польза включает улучшенные клинические результаты; ослабление или облегчение симптомов, связанных с заболеванием; сниженную частоту проявления симптомов; улучшенное качество жизни; более длительный период ремиссии; уменьшение степени заболевания, стабилизацию течения заболевания; задержку прогрессирования заболевания; ремиссию; выживаемость; пролонгированное выживание; или любую их комбинацию. Как дополнительно описано в настоящем документе, схема лечения может содержать комбинированную терапию, в которой одну или более CD20-специфичных связывающих молекул, таких как, например, антитела к CD20, вводят до, одновременно с, единовременно с или после введения одного или более второго или дополнительного терапевтического средства. Иллюстративные антитела к CD20, подходящие для применения в терапевтических способах, описанных в настоящем документе, включают 1.5.3, 1F5, Leu16, ритуксимаб, офатумумаб, велтузумаб, ублитуксимаб и окрелизумаб.
«Терапевтически эффективное количество» или «эффективное количество» CD20-специфичной связывающей молекулы, слитого белка или клетки-хозяина, экспрессирующей слитый белок согласно настоящему изобретению (например, CAR к CD20), относится к количеству CD20-специфичных связывающих молекул, слитых белков или клеток-хозяев, достаточному для достижения терапевтического эффекта, включая статистически значимые улучшенные клинические результаты; ослабление или облегчение симптомов, связанных с заболеванием; сниженную частоту проявления симптомов; улучшенное качество жизни; более длительный период ремиссии; уменьшение степени заболевания, стабилизацию течения заболевания; задержку прогрессирования заболевания; ремиссию; выживаемость; или пролонгированное выживание. В отношении одного активного ингредиента или клетки, экспрессирующей один активный ингредиент, вводимых отдельно, терапевтически эффективное количество относится только к действиям этого ингредиента или клетки, экспрессирующей этот ингредиент. В отношении комбинации терапевтически эффективное количество относится к комбинированным количествам активных ингредиентов или комбинации дополнительного активного ингредиента с клеткой, экспрессирующей активный ингредиент, которые приводят к терапевтическому эффекту при введении последовательно или одновременно. Комбинация также может представлять собой клетку, экспрессирующую более одного активного ингредиента, например, два различных CAR к CD20 или один CAR к CD20 и один TCR к CD20, или CAR к CD20 и другое подходящее терапевтическое средство.
Термин «фармацевтически приемлемый эксципиент или носитель» или «физиологически приемлемый эксципиент или носитель» относится к биологически совместимым наполнителям, например, физиологическому раствору, подробно описанным в настоящем документе, подходящим для введения человеку или другому млекопитающему, не являющемуся человеком, и обычно считающимся безопасными или не вызывающими серьезных нежелательных явлений.
Как употреблено в настоящем документе, термин «статистически значимый» относится к значению p, равному 0,050 или менее, при вычислении при помощи t-критерия Стьюдента, и указывает на маловероятность случайного возникновения определенного события или результата.
Как употреблено в настоящем документе, термин «адоптивная иммунная терапия» или «адоптивная иммунотерапия» относится к введению природных или сконструированных специфичных к антигену заболевания иммунных клеток (например, Т-клеток). Адоптивная клеточная иммунотерапия может быть аутологичной (иммунные клетки получены от реципиента), аллогенной (иммунные клетки получены от донора, относящегося к тому же виду) или сингенной (иммунные клетки получены от донора, генетически идентичного реципиенту).
Слитые белки
В некоторых аспектах настоящего изобретения предложены слитые белки, содержащие внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобной частью.
«Внеклеточный компонент» содержит связывающий домен, который специфично связывает CD20. «Связывающий домен» (также называемый «связывающим участком» или «связывающим компонентом»), как употреблено в настоящем документе, относится к молекуле, такой как пептид, олигопептид, полипептид или белок, обладающей способностью специфично и нековалентно ассоциировать, объединяться или соединяться с молекулой-мишенью (например, CD20). Связывающий домен включает любой природный, синтетический, полусинтетический или рекомбинантный партнер по связыванию для биологической молекулы или другой интересующей мишени. В некоторых вариантах осуществления связывающий домен представляет собой антигенсвязывающий домен, такой как антитело или TCR, или функциональный связывающий домен или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления связывающий домен содержит линкер вариабельного участка (например, scFv). «Линкер вариабельного участка», в частности, относится к последовательности из приблизительно 5-35 аминокислот, соединяющей вариабельный участок тяжелой цепи иммуноглобулина (VH) с вариабельным участком легкой цепи иммуноглобулина (VL), или соединяющей Vα/β и Cα/β цепи TCR (например, Vα-Cα, Vβ-Cβ, Vα-Vβ), или соединяющей каждую пару из Vα-Cα, Vβ-Cβ или Vα-Vβ с шарниром или гидрофобным доменом, которая обеспечивает спейсерную функцию и гибкость, достаточные для взаимодействия двух связывающих субдоменов, так что полученный одноцепочечный полипептид сохраняет аффинность связывания, специфичную к той же молекуле-мишени, к которой специфично антитело или TCR.
В некоторых вариантах осуществления линкер вариабельного участка содержит от приблизительно десяти аминокислот до приблизительно 30 аминокислот или от приблизительно 15 аминокислот до приблизительно 25 аминокислот. В отдельных вариантах осуществления линкерный пептид вариабельного участка содержит от одного до десяти повторов GlyxSery, где x и y независимо представляют собой целое число от 0 до 10, при условии, что x и y оба не равны нулю 0 (например, Gly4Ser), Gly3Ser, Gly2Ser или (Gly3Ser)n(Gly4Ser)1, (Gly3Ser)n(Gly2Ser)n, (Gly3Ser)n(Gly4Ser)n или (Gly4Ser)n, где n представляет собой целое число, равное 1, 2, 3, 4, 5 или 6), и где связанные вариабельные участки образуют функциональный иммуноглобулин-подобный связывающий домен (например, scFv или scTCR).
Иллюстративные связывающие домены включают одноцепочечные вариабельные участки антител (например, доменные антитела, sFv, scFv или Fab), антигенсвязывающие участки TCR, такие как одноцепочечные TCR (scTCR), или синтетические полипептиды, выбранные по способности специфичного связывания с биологической молекулой.
Как употреблено в настоящем документе, «специфично связывается» относится к ассоциации или объединению связывающего домена или его слитого белка с молекулой-мишенью с афинностью или Ka (т.е. равновесной константой ассоциации конкретного связывающего взаимодействия, выраженной в единицах 1/M), равной или большей 105 M-1, в то же время без существенного ассоциирования или объединения с любыми другими молекулами или компонентами в образце. Связывающие домены (или их слитые белки) могут быть классифицированы на связывающие домены с «высокой аффинностью» (или их слитые белки) или связывающие домены с «низкой аффинностью» (или их слитые белки). Связывающие домены с «высокой аффинностью» (или их слитые белки) относятся к связывающим доменам (или их слитым белкам) с Ka, составляющей по меньшей мере 107 M-1, по меньшей мере 108 M-1, по меньшей мере 109 M-1, по меньшей мере 1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 1012 M-1 или по меньшей мере 1013 M-1. Связывающие домены с «низкой аффинностью» (или их слитые белки) относятся к связывающим доменам (или их слитым белкам) с Ka, составляющей до 107 M-1, до 106 M-1, до 105 M-1.
В качестве альтернативы, аффинность может быть как равновесная константа диссоциации (Kd) конкретного связывающего взаимодействия, выраженная в единицах M (например, от 10-5 M до 10-13 M). В некоторых вариантах осуществления связывающий домен может иметь «повышенную аффинность», которая относится к выбранному или сконструированному связывающему домену, имеющему более сильное связывание с антигеном-мишенью, чем связывающий домен дикого типа (или родительский). Например, повышенная аффинность может быть обусловлена тем, что Ka (равновесная константа ассоциации) для антигена-мишени больше, чем у связывающего домена дикого типа, тем, что Kd (константа диссоциации) для антигена-мишени меньше, чем у связывающего домена дикого типа, или тем, что скорость диссоциации (Koff) для антигена-мишени меньше, чем у связывающего домена дикого типа. Известны различные анализы для идентификации связывающих доменов согласно настоящему изобретению, которые специфично связывают конкретную мишень, а также для определения аффинностей связывающего домена или слитого белка, такие как вестерн-блоттинг, ELISA и Biacore® (см. также, например, Scatchard et al., Ann. N.Y. Acad. Sci. 51:660, 1949; и патенты США № 5,283,173, 5,468,614 или эквивалент).
Анализ или компьютерное моделирование первичной и вторичной аминокислотной структуры связывающего домена для анализа третичной структуры белка могут помочь в идентификации конкретных аминокислотных остатков, которые могут быть заменены, добавлены или удалены без существенного изменения структуры, и, как следствие, потенциального существенного снижения специфичности связывания и аффинности связывающего домена.
В некоторых вариантах осуществления связывающий домен содержит VH-участок. Например, VH-участок в связывающем домене согласно настоящему изобретению может быть получен из или на основе VH известного моноклонального антитела и может содержать одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) инсерций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) делеций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) аминокислотных замен (например, консервативных аминокислотных замен или неконсервативных аминокислотных замен), или комбинацию вышеупомянутых изменений, по сравнению с VH известного моноклонального антитела. Инсерция, делеция или замена могут быть в любом месте VH-участка, включая амино-конец, карбоксильный конец или оба конца участка, при условии, что каждый CDR не содержит изменений или содержит не более чем одно, два, три или четыре изменения относительно CDR VH-участка известного моноклонального антитела, и при условии, что связывающий домен, содержащий модифицированный VH-участок, специфично связывает свою мишень с аффинностью, схожей с таковой для связывающего домена дикого типа.
В некоторых вариантах осуществления связывающий домен содержит VL-участок. Например, VL-участок в связывающем домене согласно настоящему изобретению получают из или на основе VL известного моноклонального антитела, и он может содержать одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) инсерций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) делеций, одну или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) аминокислотных замен (например, консервативных аминокислотных замен), или комбинацию вышеупомянутых изменений, по сравнению с VL известного моноклонального антитела. Инсерция, делеция или замена могут быть в любом месте VL-участка, включая амино-конец, карбоксильный конец или оба конца участка, при условии, что каждый CDR не содержит изменений или содержит не более чем одно, два, три или четыре изменения по сравнению с CDR VL-участка известного моноклонального антитела, и при условии, что связывающий домен, содержащий модифицированный VL-участок, специфично связывает свою мишень с аффинностью, схожей с таковой для связывающего домена дикого типа.
В некоторых вариантах осуществления связывающий домен содержит аминокислотную последовательность, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичную аминокислотной последовательности вариабельного участка легкой цепи (VL); например, VL из 1.5.3 (SEQ ID NO:1), 1F5 (SEQ ID NO:3), Leu16 (SEQ ID NO:2), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба.
В других вариантах осуществления связывающий домен содержит аминокислотную последовательность, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичную аминокислотной последовательности вариабельного участка тяжелой цепи (VH); например, VH из 1.5.3 (SEQ ID NO:4), 1F5 (SEQ ID NO:6), Leu16 (SEQ ID NO:5), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба.
В других вариантах осуществления связывающий домен содержит (a) аминокислотную последовательность, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичную аминокислотной последовательности VL; например, VL из 1.5.3 (SEQ ID NO:1), 1F5 (SEQ ID NO:3), Leu16 (SEQ ID NO:2), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба; и (b) аминокислотную последовательность, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или 100% идентичную аминокислотной последовательности VH; например, VH из 1.5.3 (SEQ ID NO:4), 1F5 (SEQ ID NO:6), Leu16 (SEQ ID NO:5), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба. В любом из вышеупомянутых воплощений каждый из CDR VL, VH или оба из них не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с родительским моноклональным антителом или его фрагментом или производным, которое специфично связывается с CD20, при условии, что связывающий домен, содержащий модифицированный участок VL, VH или оба из них, специфично связывает CD20 с аффинностью, схожей с таковой для связывающего домена дикого типа.
В некоторых вариантах осуществления связывающий домен содержит аминокислотную последовательность, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичную аминокислотной последовательности scFv, например, scFv из антитела 1.5.3 (SEQ ID NO:64), 1F5 (SEQ ID NO:66), Leu16 (SEQ ID NO:65), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела.
В некоторых вариантах осуществления связывающий домен кодируется полинуклеотидом, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичным полинуклеотидной последовательности, кодирующей вариабельный участок легкой цепи (VL); например, VL-кодирующему полинуклеотиду из 1.5.3 (SEQ ID NO:70), 1F5 (SEQ ID NO:72), Leu16 (SEQ ID NO:71), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба.
В других вариантах осуществления связывающий домен содержит полинуклеотид, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичный полинуклеотидной последовательности, кодирующей вариабельный участок тяжелой цепи (VH); например, VH-кодирующему полинуклеотиду из 1.5.3 (SEQ ID NO:73), 1F5 (SEQ ID NO:75), Leu16 (SEQ ID NO:74), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба.
В других вариантах осуществления связывающий домен содержит (a) полинуклеотид, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичный полинуклеотидной последовательности, кодирующей VL; например, VL-кодирующему полинуклеотиду из 1.5.3 (SEQ ID NO:70), 1F5 (SEQ ID NO:72), Leu16 (SEQ ID NO:71), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба; и (b) полинуклеотид, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичный полинуклеотидной последовательности, кодирующей VH; например, VH-кодирующему полинуклеотиду из 1.5.3 (SEQ ID NO:73), 1F5 (SEQ ID NO:75), Leu16 (SEQ ID NO:74), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба. В любом из вышеупомянутых вариантов осуществления полинуклеотиды, кодирующие каждый из CDR VL, VH или оба из них, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительское моноклональное антитело, его фрагмент или производное, которое специфично связывается с CD20, при условии, что связывающий домен, содержащий модифицированный участок VL, VH или оба из них, специфично связывает CD20 с аффинностью, схожей с таковой для связывающего домена дикого типа.
В некоторых вариантах осуществления связывающий домен содержит полинуклеотид, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичный полинуклеотидной последовательности, кодирующей scFv, например, кодируемому scFv, содержащему вариабельные домены из антитела 1.5.3 (SEQ ID NO:67), 1F5 (SEQ ID NO:69), Leu16 (SEQ ID NO:68), ритуксимаба, офатумумаба, велтузумаба, ублитуксимаба или окрелизумаба. В каждом из вышеупомянутых вариантов осуществления полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела.
В любом из вариантов осуществления, описанных в настоящем документе, связывающий домен может, состоять из, содержать, быть основан на или получен из Vh, Vl или обоих, из ублитуксимаба (см. например, US 2015/0290317), ритуксимаба (см. например, US 2014/0004037), окрелизумаба (см. например, US 8,679,767), офатумумаба (см. например, US 2009/0169550) или велтузумаба (см. например, US 2009/0169550), нуклеотидная и аминокислотная последовательности которых включены в настоящий документ во всей полноте посредством ссылки. Кроме того, в любом из способов, описанных в настоящем документе, молекула, связывающая CD20, может содержать ритуксимаб, офатумумаб, велтузумаб или окрелизумаб, ублитуксимаб, или любую их комбинацию.
Слитый белок согласно настоящему изобретению содержит внутриклеточный компонент, содержащий эффекторный домен. Как употреблено в настоящем документе, «эффекторный домен» представляет собой внутриклеточную часть или домен слитого белка или рецептора, которая может прямо или опосредовано инициировать биологический или физиологический ответ в клетке при получении соответствующего сигнала. В некоторых вариантах осуществления эффекторный домен происходит из или представляет собой часть белка или белкового комплекса, который получает сигнал при связывании, или в случае, когда белок или его часть или белковый комплекс непосредственно связываются с молекулой-мишенью и запускает сигнал, инициируемый эффекторным доменом. Эффекторный домен может непосредственно инициировать клеточный ответ в случае, когда он содержит один или более сигнальных доменов или мотивов, таких как иммунорецепторный тирозиновый активирующий мотив (ITAM), обнаруженный в костимулирующих молекулах. Костимулирующая молекула или ее часть, содержащая ITAM, как известно, способны инициировать активационный сигнал для Т-клеток после взаимодействия с лигандом. В других вариантах осуществления эффекторный домен опосредованно инициирует клеточный ответ за счет ассоциации с одним или более других белков, непосредственно инициирующих клеточный ответ.
В некоторых вариантах осуществления эффекторный домен содержит сигнальный домен лимфоцитарного рецептора (например, CD3ζ), содержит полипептид, имеющий один или более ITAM из костимулирующей молекулы (например, CD28, 4-1BB (CD137), OX40 (CD134)), или их комбинации. В других вариантах осуществления эффекторный домен содержит цитоплазматическую часть, способную ассоциировать с цитоплазматическим сигнальным белком, где цитоплазматический сигнальный белок представляет собой лимфоцитарный рецептор или его сигнальный домен, белок, содержащий несколько ITAM, костимулирующий фактор или любую их комбинацию.
Иллюстративные эффекторные домены включают таковые из 4-1BB (CD137), CD3ε, CD3δ, CD3ζ, CD25, CD27, CD28, CD79A, CD79B, CARD11, DAP10, FcRα, FcRβ, FcRγ, Fyn, HVEM, ICOS, Lck, LAG3, LAT, LRP, NKG2D, NOTCH1, NOTCH2, NOTCH3, NOTCH4, Wnt, OX40 (CD134), ROR2, Ryk, SLAMF1, Slp76, pTα, TCRα, TCRβ, TRIM, Zap70, PTCH2 или любую их комбинацию.
В некоторых вариантах осуществления эффекторный домен содержит часть или домен костимулирующей молекулы CD28, которая может дополнительно включать мутацию LL на GG в позициях 186-187 нативного белка CD28 (SEQ ID NO:15; см. Nguyen et al., Blood 102:4320, 2003). В других вариантах осуществления эффекторный домен содержит CD3ζ или его функциональную часть (SEQ ID NO:17) и одну или более частей или доменов костимулирующей молекулы, такой как CD28 (SEQ ID NO:15), 4-1BB (SEQ ID NO:16), CD27 или OX40. В отдельных вариантах осуществления эффекторный домен слитого белка согласно настоящему изобретению содержит эффекторные домены или их функциональную часть из CD3ζ (SEQ ID NO:17) и CD28 (SEQ ID NO:15); CD3ζ (SEQ ID NO:17) и 4-1BB (SEQ ID NO:16); или CD3ζ (SEQ ID NO:17), CD28 (SEQ ID NO:15) и 4-1BB (SEQ ID NO:16).
В некоторых вариантах осуществления эффекторный домен содержит CD3ζ или его функциональную часть, кодируемую полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:86. В других вариантах осуществления эффекторный домен содержит часть или домен костимулирующей молекулы CD28, кодируемую полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:84. В других вариантах осуществления эффекторный домен содержит часть или домен костимулирующей молекулы 4-1BB, кодируемую полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:85.
Внеклеточный домен и внутриклеточный домен согласно настоящему изобретению соединены гидрофобной частью. «Гидрофобная часть», как употреблено в настоящем документе, означает любую аминокислотную последовательность, имеющую трехмерную структуру, которая термодинамически стабильна в клеточной мембране и обычно имеет от приблизительно 15 аминокислот до приблизительно 30 аминокислот в длину. Структура гидрофобной части может содержать альфа-спираль, бета-баррель, бета-лист, бета-спираль или любую их комбинацию. В некоторых вариантах осуществления гидрофобная часть содержит «трансмембранный домен» известного трансмембранного белка, который представляет собой часть трансмембранного белка, которая может встраиваться в или пронизывать клеточную мембрану. В некоторых вариантах осуществления гидрофобная часть представляет собой трансмембранный домен, такой как трансмембранный домен CD4, трансмембранный домен CD8, CD28 (например, SEQ ID NO:14), трансмембранный домен CD27 и трансмембранный домен 4-1BB. В некоторых вариантах осуществления гидрофобная часть представляет собой трансмембранный домен CD28 (SEQ ID NO:14). В других вариантах осуществления гидрофобная часть представляет собой трансмембранный домен CD28, кодируемый полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:83.
Слитый белок согласно настоящему изобретению может дополнительно содержать линкерный модуль. «Линкерный модуль» может представлять собой аминокислотную последовательность, имеющую от приблизительно двух аминокислот до приблизительно 500 аминокислот, которые могут обеспечивать гибкость и возможности для конформационных движений между двумя участками, доменами, мотивами, фрагментами или модулями, соединенными линкером. В некоторых вариантах осуществления линкерный модуль может быть расположен между связывающим доменом и гидрофобным участком. В таких вариантах осуществления линкерный модуль может располагать связывающий домен вдали от клеточной поверхности, обеспечивая надлежащий контакт клетка-клетка, связывание антигена и активацию (Patel et al., Gene Therapy 6: 412-419, 1999). Длина линкерного модуля может различаться для максимального распознавания опухоли, исходя из выбранной молекулы-мишени, выбранного эпитопа связывания или размера и аффинности антигенсвязывающего домена (см. например, Guest et al., J. Immunother. 28:203-11, 2005; публикация PCT заявки № WO 2014/031687). Иллюстративные линкерные модули включают таковые, имеющие глицин-сериновый (Gly-Ser) линкер, содержащий от одного до приблизительно десяти повторов GlyxSery, где x и y независимо представляют собой целое число от 0 до 10, при условии, что x и y оба не равны 0 (например, (Gly4Ser)2, (Gly3Ser)2, Gly2Ser или их комбинация, такая как (Gly3Ser)2Gly2Ser). В некоторых вариантах осуществления линкерный модуль содержит один или более константных участков тяжелой цепи иммуноглобулина, таких как CH3 по отдельности или структура CH2CH3, структура CH3CH4, шарнир иммуноглобулина или любую их комбинацию (например, структуру CH2CH3 вместе с шарниром). В других вариантах осуществления линкерный модуль содержит весь или часть Fc-домена, выбранную из: домена CH1, домена CH2, домена CH3 или их комбинаций (см. например, публикацию PCT заявки WO 2014/031687).
Иллюстративные линкерные модули могут иметь различную длину, например, иметь в длину от приблизительно пяти аминокислот до приблизительно 500 аминокислот, от приблизительно десяти аминокислот до приблизительно 350 аминокислот, от приблизительно 15 аминокислот до приблизительно 100 аминокислот, от приблизительно 20 аминокислот до приблизительно 75 аминокислот или от приблизительно 25 аминокислот до приблизительно 35 аминокислот. В других вариантах осуществления линкерный модуль может дополнительно содержать шарнирный участок, маркер или оба из них. Каждый такой компонент линкерного модуля не является взаимоисключающим.
В некоторых вариантах осуществления линкерный модуль слитого белка согласно настоящему изобретению может включать участок CH2 IgG1 с мутацией N297Q (SEQ ID NO:10); участок CH2 IgG4 (SEQ ID NO:11); участок CH3 IgG1 (SEQ ID NO:12); или участок CH3 IgG4 (SEQ ID NO:13). В некоторых вариантах осуществления линкерный модуль может включать глицин-сериновый линкер (SEQ ID NO:20, который может кодироваться SEQ ID NO:89, или SEQ ID NO:21, который может кодироваться SEQ ID NO:90).
В других вариантах осуществления линкерный модуль слитого белка согласно настоящему изобретению может включать участок CH2 IgG1 с мутацией N297Q, кодируемый полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:79. В других вариантах осуществления линкерный модуль слитого белка согласно настоящему изобретению может включать участок CH2 IgG4, кодируемый полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:80. В других вариантах осуществления линкерный модуль слитого белка согласно настоящему изобретению может включать участок CH3 IgG1, кодируемый полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:81. В других вариантах осуществления линкерный модуль слитого белка согласно настоящему изобретению может включать участок CH3 IgG4, кодируемый полинуклеотидом, имеющим последовательность, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичную SEQ ID NO:82.
В некоторых вариантах осуществления линкерный модуль дополнительно содержит шарнирный участок. Как употреблено в настоящем документе, «шарнирный участок» или «шарнир» относится к (a) шарнирной последовательности иммуноглобулина (состоящей, например, из верхнего и корового участков), или ее функциональному фрагменту или варианту, (b) междоменному участку (ножке) С-лектина II типа или его функциональному фрагменту или варианту, или (c) участку ножки молекулы кластера дифференцировки (CD) или ее функциональному варианту. Как употреблено в настоящем документе «шарнирный участок иммуноглобулина дикого типа» относится к природным верхней и средней шарнирной аминокислотной последовательности, распложённым между и соединяющим домены CH1 и CH2, находящиеся в тяжелой цепи антитела. В некоторых вариантах осуществления шарнирный участок является человеческим, и в отдельных вариантах осуществления содержит шарнирный участок человеческого IgG. В других вариантах осуществления шарнирный участок представляет собой измененный шарнирный участок IgG4, как описано в публикации PCT заявки № WO 2014/031687. В отдельных вариантах осуществления шарнирный участок слитого белка согласно настоящему изобретению может представлять собой шарнир IgG1 (SEQ ID NO:7). В сходных вариантах осуществления шарнирный участок слитого белка согласно настоящему изобретению может представлять собой шарнир IgG1, кодируемый полинуклеотидом с последовательностью SEQ ID NO:76.
Слитый белок согласно настоящему изобретению может дополнительно содержать соединяющие аминокислоты. «Соединяющие аминокислоты» или «соединяющие аминокислотные остатки» относится к одному или более (например, приблизительно 2-20) аминокислотным остаткам между двумя смежными доменами, мотивами, участками, модулями или фрагментами белка, например, между связывающим доменом и смежным линкерным модулем, между гидрофобным доменом и смежным эффекторным доменом, или одним или обоими концами линкерного модуля, который связывает два домена, мотива, участка, модуля или фрагмента (например, между линкерным модулем и смежным связывающим доменом или между линкерным модулем и смежным шарниром). Соединяющие аминокислоты могут быть обусловлены конструкцией слитого белка (например, аминокислотные остатки, обусловленные применением сайта фермента рестрикции при конструировании молекулы нуклеиновой кислоты, кодирующей слитый белок). Например, гидрофобная часть слитого белка может иметь одну или более соединяющую аминокислоту на амино-конце, карбоксильном конце или на обоих. Примеры соединяющих аминокислот включают соединяющие аминокислоты из IgG2 (например, SEQ ID NO:9, которая может кодироваться SEQ ID NO:78). В некоторых вариантах осуществления, где шарнирный участок происходит из IgG4, он может включать соединяющие аминокислоты (например, SEQ ID NO:8, которую может кодировать SEQ ID NO:77). В некоторых вариантах осуществления гидрофобная часть представляет собой трансмембранный домен CD28, имеющий аминокислотную последовательность SEQ ID NO:14, где трансмембранный домен CD28 содержит соединяющую аминокислоту на амино-конце, например, метионин (см. например, слитые белки согласно SEQ ID NO:30, 31, 39 и 40). Таким образом, в некоторых вариантах осуществления линкерный модуль содержит шарнир IgG4, соединяющие аминокислоты IgG4 и CH2-CH3 IgG4. В некоторых других вариантах осуществления линкерный модуль содержит шарнир IgG1, соединяющие аминокислоты IgG2 и CH2-CH3 IgG1.
В некоторых вариантах осуществления слитый белок согласно настоящему изобретению может дополнительно содержать метку. Как употреблено в настоящем документе, «метка» относится к уникальной пептидной последовательности, прикрепленной к, слитой с или представляющей собой часть интересующего белка, с которой гетерологичная или неэндогенная родственная связывающая молекула (например, рецептор, лиганд, антитело или другой партнер по связыванию) способна специфично связываться, где свойство связывания может быть применено для детекции, идентификации, выделения или очистки, отслеживания, обогащения или таргетирования меченого белка или клеток, экспрессирующих меченый белок, в частности в случае, когда меченый белок является частью гетерогенной популяции белков или другим веществом, или в случае, когда клетки, экспрессирующие меченый белок, являются частью гетерогенной популяции клеток (например, биологический образец, такой как периферическая кровь) (см. например, WO 2015/095895). В предложенных слитых белках способность метки(ок) быть специфично связанными родственной(ыми) связывающей(ими) молекулой(ами) отлична от, или является дополнительной к способности связывающего(их) домена(ов) специфично связываться с молекулой(ами)-мишенью(ами). Метка обычно не является антигенсвязывающей молекулой, например, не является антителом или TCR или его антигенсвязывающей частью. Примеры меток включают Strep-метку, His-метку, Flag-метку, Xpress-метку, Avi-метку, кальмодулиновую метку, полиглутаматную метку, HA-метку, Myc-метку, Nus- метку, S-метку, X-метку, SBP-метку, Softag, V5-метку, CBP, GST, MBP, GFP, тиоредоксиновую метку. В отдельных вариантах осуществления Strep-метка имеет аминокислотную последовательность SEQ ID NO:62 или SEQ ID NO:63.
Слитый белок согласно настоящему изобретению может содержать сигнальный пептид. «Сигнальный пептид» представляет собой короткую (например, из 5-30 аминокислот) последовательность, которую применяют для таргетирования слитого белка для экспрессии на клеточной поверхности. Примеры сигнальных пептидов включают сигнальный пептид гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) (SEQ ID NO:18, который может кодироваться SEQ ID NO:87) и мышиный каппа-сигнальный пептид (SEQ ID NO:19, который может кодироваться SEQ ID NO:88).
В некоторых вариантах осуществления слитый белок представляет собой химерный антигенный рецептор. «Химерный антигенный рецептор» (CAR) относится к слитому белку согласно настоящему изобретению, сконструированному так, что он содержит две или более природные аминокислотные последовательности, связанные вместе таким образом, как не происходит естественным путем или не происходит естественным путем в клетке-хозяине, где слитый белок выполняет функцию рецептора, когда он присутствует на поверхности клетки.
В некоторых вариантах осуществления CAR является полностью человеческим или гуманизированным. В некоторых вариантах осуществления CAR содержит scFv из антитела к CD20 или scTCR из TCR, специфичного к антигену CD20. В отдельных вариантах осуществления CAR содержит scFv из 1.5.3, 1F5, Leu16, ритуксимаба, офатумумаба, велтузумаба, окрелизумаба, ублитуксимаба или любой их комбинации. В отдельных вариантах осуществления CAR содержит линкерный модуль, содержащий шарнир IgG1, шарнир IgG4 или любую их комбинацию. В других вариантах осуществления CAR содержит линкерный модуль, содержащий участок CH2 IgG1 с мутацией N297Q, участок CH2 IgG4, участок CH3 IgG1, участок CH3 IgG4 или любую их комбинацию. В других вариантах осуществления гидрофобная часть CAR содержит трансмембранный домен CD28. В некоторых вариантах осуществления CAR содержит внутриклеточный домен, содержащий часть или домен CD3ζ, 4-1BB, CD28 или любую их комбинацию. В любом из вышеупомянутых вариантов осуществления CAR содержит соединяющие аминокислоты между двумя смежными доменами, мотивами, участками, модулями или фрагментами.
В некоторых вариантах осуществления CAR может быть по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичен 1.5.3-NQ-28-BB-z (SEQ ID NO:26); 1.5.3-NQ-28-z (SEQ ID NO:27); 1.5.3-NQ-BB-z (SEQ ID NO:28); 1.5.3-NQ-z (SEQ ID NO:29); Leu16-28-BB-z (SEQ ID NO:30); Leu16-28-z (SEQ ID NO:31); 1F5-NQ-28-BB-z (SEQ ID NO:32); 1F5-NQ-28-z (SEQ ID NO:33) или 1F5-NQ-BB-z (SEQ ID NO:34). В отдельных вариантах осуществления CAR содержит или состоит из аминокислотной последовательности любой из SEQ ID NO:26-34.
В некоторых вариантах осуществления CAR может быть по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичен последовательности молекуле нуклеиновой кислоты любой из SEQ ID NO:44-52. В конкретных вариантах осуществления CAR кодируется полинуклеотидом, содержащим или состоящим из последовательности любой из SEQ ID NO:44-52.
Способы получения слитых белков, включая CAR, хорошо известны в данной области техники и описаны, например, в патенте США № 6,410,319; патенте США № 7,446,191; патентной публикации США № 2010/065818; патенте США № 8,822,647; публикации PCT заявки № WO 2014/031687; патенте США № 7,514,537 и Brentjens et al., 2007, Clin. Cancer Res. 13:5426.
Клетки-хозяева, нуклеиновые кислоты и векторы
В некоторых аспектах настоящего изобретения предложены молекулы нуклеиновых кислот, кодирующие любой один или более слитых белков, описанных в настоящем документе. Полинуклеотид, кодирующий желаемый слитый белок, может быть получен или продуцирован при помощи способов рекомбинации, известных в данной области техники, с использованием стандартных техник, таких как скрининг библиотек из клеток, экспрессирующих желаемую последовательность или ее часть, посредством получения последовательности из вектора, если известно, что он ее включает, или посредством выделения последовательности или ее части непосредственно из содержащих ее клеток или тканей. В качестве альтернативы, интересующая последовательность может быть получена синтетически. Такие молекулы нуклеиновых кислот могут быть встроены в подходящий вектор (например, вирусный вектор или невирусный плазмидный вектор) для введения в интересующую клетку-хозяина (например, иммунную клетку, такую как Т-клетка).
«Вектор» представляет собой молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту. В некоторых вариантах осуществления векторы содержат терминаторы транскрипции или трансляции, инициирующие последовательности или промоторы для регуляции экспрессии желаемой нуклеиновокислотной последовательности. Векторы могут представлять собой, например, плазмиды, космиды, вирусы или фаги, или систему транспозонов (например, «Спящая красавица», см. например, Geurts et al., Mol. Ther. 8:108, 2003; Mátés et al., Nat. Genet. 41:753, 2009). «Экспрессионный вектор» представляет собой вектор, способный направлять экспрессию белка, кодируемого одним или более генами, которые несет вектор, в случае, когда он находится в подходящих условиях.
Вектор, кодирующий кор вируса, в настоящем документе называется «вирусным вектором». Существует большое число доступных вирусных векторов, подходящих для применения с композициями согласно настоящему изобретению, включая признанные подходящими для применения генной терапии у человека (см. Pfeifer and Verma, Ann. Rev. Genomics Hum. Genet. 2:177, 2001). Подходящие вирусные векторы включают векторы на основе РНК-вирусов, такие как векторы, полученные из ретровирусов.
«Ретровирусы» представляют собой вирусы, имеющие РНК-геном, который обратно транскрибируется в ДНК посредством фермента обратной транскриптазы, после чего обратнотранскрибированная ДНК встраивается в геном клетки-хозяина. «Гаммаретровирус» относится к роду семейства ретровиридов. Примеры гаммаретровирусов включают вирус стволовых клеток мыши, вирус мышиного лейкоза, вирус кошачьего лейкоза, вирус саркомы кошек и вирус птичьего ретикулоэндотелиоза. «Лентивирус» относится к другому роду ретровирусов, способному инфицировать делящиеся и неделящиеся клетки. Некоторые примеры лентивирусов включают вирус иммунодефицита человека (ВИЧ; включая ВИЧ типа 1 и ВИЧ типа 2); вирус инфекционной анемии лошадей; вирус иммунодефицита кошек (ВИК); вирус бычьего иммунодефицита (ВБИ) и вирус иммунодефицита обезьян (ВИО).
В некоторых вариантах осуществления вирусный вектор может представлять собой гаммаретровирус, например, векторы, производные от вируса лейкоза мышей Молони (MLV). В других вариантах осуществления вирусный вектор может представлять собой более сложный вектор, полученный из ретровируса. К данной категории относятся векторы, полученные из ВИЧ-1. Другие примеры включают лентивирусные векторы, полученные из ВИЧ-2, ВИК, вируса инфекционной анемии лошадей, ВИО и вируса Висна-Маеди (лентивирус овец). Способы применения ретровирусных и лентивирусных векторов и упаковывающих клеток для трансдукции клеток-хозяев млекопитающих вирусными частицами, содержащими трансгены CAR, известны в данной области техники и описаны ранее, например, в патенте США № 8,119,772; Walchli et al., PLoS One 6:327930, 2011; Zhao et al., J. Immunol. 174:4415, 2005; Engels et al., Hum. Gene Ther. 14:1155, 2003; Frecha et al., Mol. Ther. 18:1748, 2010; Verhoeyen et al., Methods Mol. Biol. 506:97, 2009. Ретровирусные и лентивирусные векторные конструкции и экспрессионные системы также коммерчески доступны. Другие вирусные векторы также могут быть использованы для доставки полинуклеотидов, включая ДНК-вирусные векторы, включая, например, векторы на основе аденовируса и векторы на основе аденоассоциированного вируса (AAV); векторы, полученные из вирусов простого герпеса (HSV), включая ампликон-векторы, репликативно-дефектный HSV и аттенуированный HSV (Krisky et al., Gene Ther. 5: 1517, 1998).
Другие векторы, недавно разработанные для применения в генной терапии, также могут быть использованы в композициях и способах согласно настоящему изобретению. Такие векторы включают полученные из бакуловирусов и α-вирусов (Jolly, D J. 1999. Emerging Viral Vectors. pp 209-40 in Friedmann T. ed. The Development of Human Gene Therapy. New York: Cold Spring Harbor Lab) или плазмидные векторы (такие как транспозон «спящая красавица» или другие транспозонные векторы).
В некоторых вариантах осуществления вирусный вектор применяют для введения неэндогенного полинуклеотида, кодирующего слитый белок, специфичный к мишени, такой как CD20. В таких вариантах осуществления вирусный вектор может представлять собой ретровирусный вектор или лентивирусный вектор. Вирусный вектор также может включать нуклеиновокислотные последовательности, кодирующие маркер трансдукции. Маркеры трансдукции для вирусных векторов известны в данной области техники и включают селективные маркеры, которые могут придавать устойчивость к лекарственным средствам, детектируемые маркеры, такие как флуоресцентные маркеры или белки клеточной поверхности, которые могут быть детектированы посредством таких способов, как проточная цитометрия.
В некоторых вариантах осуществления вирусный вектор содержит маркер трансдукции. Как употреблено в настоящем документе, «маркер трансдукции» может быть включен в любую конструкцию в качестве способа наблюдения за эффективностью трансфекции или для детекции клеток, экспрессирующих интересующий слитый белок. Примеры маркеров трансдукции: зеленый флуоресцентный белок, внеклеточный домен человеческого CD2, усеченный EGFR (рецептор эпидермального фактора роста) (huEGFRt; SEQ ID NO:25, который может кодироваться SEQ ID NO:94; см. Wang et al., Blood 118:1255, 2011) или усеченный CD19 (SEQ ID NO:24, который может кодироваться SEQ ID NO:93). В некоторых вариантах осуществления вирусный вектор содержит суицидальный ген, такой как iCasp9 (см. например, Gargett and Brown, Front. Pharmacol. 5:235, 2104) или HSV-TK (см. например, Fillat et al., Curr. Gene Ther. 3:13, 2003).
В случае, когда геном вирусного вектора содержит несколько полинуклеотидов, которые необходимо экспрессировать в клетке-хозяине в виде отдельных транскриптов, вирусный вектор также может содержать дополнительные последовательности между двумя (или более) транскриптами, делая возможной бицистронную или мультицистронную экспрессию. Примеры таких последовательностей, применяемых в вирусных векторах, включают участки внутренней посадки рибосомы (IRES), сайты расщепления фурина, вирусный пептид 2А, или любую их комбинацию. В некоторых вариантах осуществления векторная конструкция может содержать полинуклеотид, кодирующий саморасщепляющийся пептид (например, E2A (SEQ ID NO:22, который может кодироваться SEQ ID NO:91), T2A (SEQ ID NO:23, который может кодироваться SEQ ID NO:92), P2A (SEQ ID NO:95, который может кодироваться SEQ ID NO:97) или F2A (SEQ ID NO:96, который может кодироваться SEQ ID NO:98)), так что зрелый слитый белок не содержит маркер трансдукции или суицидальный ген. В некоторых вариантах осуществления нуклеиновокислотный вектор может кодировать слитый пептид согласно настоящему изобретению, необязательно содержащий маркер трансдукции (такой как tCD19 или tEGFR). В других вариантах осуществления молекулы нуклеиновой кислоты, кодирующие слитый белок согласно настоящему изобретению, могут быть кодон-оптимизированы для усиления или максимизации экспрессии в определенных типах клеток, таких как Т-клетки (Scholten et al., Clin. Immunol. 119: 135-145, 2006), и могут необязательно содержать маркер трансдукции (такой как tCD19 или tEGFR).
В любом из вариантов осуществления, описанных в настоящем документе, вектор, содержащий полинуклеотид, кодирующий слитый белок согласно настоящему изобретению, также может содержать полинуклеотид, кодирующий маркер трансдукции, который может быть использован для таргетирования клетки-хозяина, экспрессирующей маркер трансдукции, на разрушение или гибель. Было показано, что персистенция функциональных CAR Т-клеток, таргетирующих антиген, может вызывать продолжительное истощение здоровых клеток, эндогенно экспрессирующих антиген (см. например, Paskiewicz et al., J. Clin. Invest., 126(11):4262-4272 (2016). Таким образом, желательны механизмы контроля, которые делают возможной регуляцию (например, разрушение, уничтожение или обеспечение другого цитотоксического действия) перенесенных Т-клеток после достижения желаемого противопухолевого действия. Как употреблено в настоящем документе, термин «цитотоксическое действие» охватывает разрушение, уничтожение или иное действие, ухудшающее или снижающее способность клетки к росту, делению или выживанию. Неограничивающие примеры цитотоксических действий включают некроз, лизис, апоптоз, разбухание, потерю целостности мембраны, сниженные уровни или скорости транскрипции, сниженные уровни или скорости трансляции, сниженные уровни или скорости продуции АТФ, повышенные уровни или содержание активных форм кислорода, пониженную митохондриальную функцию, конденсацию ядра, повышенное расщепление ДНК клетки, сниженные скорости деления или пролиферации и снижение или утрату специфичной клеточной функции (например, способности В-лимфоцита продуцировать иммуноглобулины). Один из примеров подхода представляет собой применение маркера (например, tEGFR), распознаваемого антителом (например, цетуксимабом) или конъюгатом антитело-лекарственное средство, который при связывании маркера усиливает ответы антителозависимой клеточно-опосредованной цитотоксичности (ADCC) или комплемент-зависимой цитотоксичности (CDC), или доставляет цитотоксическую молекулу для разрушения, уничтожения или иным образом, оказания цитотоксического действия на перенесенные Т-клетки. Таким образом, в некоторых вариантах осуществления вектор содержит полинуклеотид, кодирующий слитый белок, и содержит полинуклеотид, кодирующий маркер трансдукции. Маркер трансдукции, который может быть специфично связан цитотоксическим антителом, конъюгатом антитело-лекарственное средство или другим цитотоксическим агентом, в настоящем документе называется «суицидальным маркером трансдукции». В некоторых вариантах осуществления способ лечения заболевания или расстройства, связанного с экспрессией CD20, включает введение терапевтически эффективного количества трансформированной клетки-хозяина субъекту согласно настоящему изобретению, где трансформированная клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, и гетерологичный полинуклеотид, кодирующий суицидальный маркер трансдукции, где способ необязательно включает введение цитотоксического антитела, конъюгата антитело-лекарственное средство или другого цитотоксического агента, который специфично ассоциируется, связывается или образует комплекс с суицидальным маркером трансдукции. В некоторых вариантах осуществления суицидальный маркер трансдукции содержит или состоит из усеченного EGFR (например, SEQ ID NO: 25), который специфично связывается антителом к EGFR, таким как, например, цетуксимаб. В других вариантах осуществления суицидальный маркер трансдукции содержит или состоит из усеченного CD19 (например, SEQ ID NO: 24), который специфично связывается цитотоксическим антителом к CD19 или конъюгатом антитело-лекарственное средство, таким как, например, блинатумомаб, колтуксимаб-равтанзин, MOR208, MEDI-551, денинтузумаб-мафодотин, антитело к CD19 согласно патенту Merck, таплитумомаб-паптокс, XmAb 5871, MDX-1342, SAR3419, SGN-19A или AFM11 (см, например, Naddafi and Davami, Int. J. Mol. Cell. Med., 4(3):143-151 (2015)).
В любом из вариантов осуществления, описанных в настоящем документе, кодируемый слитый белок согласно настоящему изобретению может представлять собой CAR, такой как CAR, специфичный к CD20. В некоторых вариантах осуществления CAR или его связывающий домен, кодируемый полинуклеотидом, содержащимся в векторе согласно настоящему изобретению, является полностью человеческим или гуманизированным. В других вариантах осуществления CAR, кодируемый вектором согласно настоящему изобретению, содержит scFv из антитела к CD20 или scTCR из TCR, специфичного к антигену CD20. В других вариантах осуществления CAR, кодируемый вектором согласно настоящему изобретению, содержит scFv из 1.5.3, 1F5, Leu16, ритуксимаба, офатумумаба, велтузумаба, окрелизумаба, ублитуксимаба или любую их комбинацию. В отдельных вариантах осуществления CAR, кодируемый полинуклеотидом, содержащимся в векторе согласно настоящему изобретению, содержит линкерный модуль, содержащий шарнир IgG1, шарнир IgG4 или любую их комбинацию. В других вариантах осуществления CAR, кодируемый полинуклеотидом, содержащимся в векторе согласно настоящему изобретению, содержит линкерный модуль, содержащий участок CH2 IgG1 с мутацией N297Q, участок CH2 IgG4, участок CH3 IgG1, участок CH3 IgG4 или любую их комбинацию. В отдельных вариантах осуществления линкерный модуль или линкер вариабельного участка CAR, кодируемого вектором согласно настоящему изобретению, содержит глицин-сериновый линкер. В других вариантах осуществления гидрофобная часть CAR, кодируемого полинуклеотидом, содержащимся в векторе согласно настоящему изобретению, содержит трансмембранный домен CD28. В некоторых вариантах осуществления CAR, кодируемый полинуклеотидом, содержащимся в векторе согласно настоящему изобретению, содержит внутриклеточный домен, содержащий часть или домен CD3ζ, 4-1BB, CD28, или любую их комбинацию. В любом из вариантов осуществления, описанных в настоящем документе, CAR, кодируемый полинуклеотидом, содержащимся в векторе согласно настоящему изобретению, содержит соединяющие аминокислоты между смежными доменами, мотивами, участками, модулями или фрагментами.
В любом из вариантов осуществления, описанных в настоящем документе, вектор может содержать полинуклеотид, кодирующий CAR, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичный 1.5.3-NQ-28-BB-z (SEQ ID NO:26); 1.5.3-NQ-28-z (SEQ ID NO:27); 1.5.3-NQ-BB-z (SEQ ID NO:28); 1.5.3-NQ-z (SEQ ID NO:29); Leu16-28-BB-z (SEQ ID NO:30); Leu16-28-z (SEQ ID NO:31); 1F5-NQ-28-BB-z (SEQ ID NO:32); 1F5-NQ-28-z (SEQ ID NO:33) или 1F5-NQ-BB-z (SEQ ID NO:34). В других вариантах осуществления вектор может содержать полинуклеотид, кодирующий CAR, содержащий или состоящий из аминокислотной последовательности любой из SEQ ID NO:26-34.
В других вариантах осуществления CAR, специфичный к CD20, кодируется полинуклеотидом, содержащимся в векторе, где полинуклеотид по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или 100% идентичен последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:44-52. В связанных вариантах осуществления CAR, специфичный к CD20, кодируется полинуклеотидом, содержащимся в векторе, где полинуклеотид содержит или состоит из последовательности любой из SEQ ID NO:44-52.
Необязательно, любой вектор согласно настоящему изобретению, содержащий полинуклеотид, кодирующий CAR согласно настоящему изобретению, также может кодировать маркер трансдукции (например, tCD19), который также может включать саморасщепляющийся пептид, так что маркер трансдукции и CAR разделены в отдельных молекулах: CAR и маркер трансдукции. В некоторых вариантах осуществления вектор может содержать полинуклеотид, кодирующий саморасщепляющийся пептид, расположенный между CAR, специфичным к CD20, и маркером трансдукции tCD19, где полинуклеотид по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или 100% идентичен последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:53-61. В других вариантах осуществления вектор может содержать полинуклеотид, кодирующий саморасщепляющийся пептид, расположенный между CAR, специфичным к CD20, и маркером трансдукции tCD19, и содержащий или состоящий из последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:53-61.
В любом из вариантов осуществления, раскрытых в настоящем документе, выделенный полинуклеотид кодирует слитый белок, способный специфично связывать CD20, где полинуклеотид: (a) по меньшей мере на 80% идентичен полинуклеотидной последовательности любой из SEQ ID NO:53-56; (b) по меньшей мере на 80% идентичен полинуклеотидной последовательности любой из SEQ ID NO:44-47; (c) содержит полинуклеотидную последовательность любой из SEQ ID NO:53-56; (d) содержит полинуклеотидную последовательность любой из SEQ ID NO:44-47; (e) состоит из полинуклеотидной последовательности любой из SEQ ID NO:53-56 или (f) состоит из полинуклеотидной последовательности любой из SEQ ID NO:44-47.
В любом из вариантов осуществления, раскрытых в настоящем документе, слитый белок кодируется выделенным полинуклеотидом, как раскрыто в настоящем документе. В некоторых вариантах осуществления слитый белок состоит из или содержит аминокислотную последовательность, где слитый белок: (a) по меньшей мере на 90% идентичен зрелому слитому белку, содержащему аминокислотную последовательность любой из SEQ ID NO:26-29 и 35-38 и 32-34 с удаленным маркером трансдукции tCD19; (b) содержит зрелый слитый белок, содержащий аминокислотную последовательность любой из SEQ ID NO: 35-38 с удаленным маркером трансдукции tCD19; (c) состоит из зрелого слитого белка, содержащего аминокислотную последовательность любой из SEQ ID NO: 35-38 с удаленным маркером трансдукции tCD19; (d) по меньшей мере на 90% идентичен аминокислотной последовательности любой из SEQ ID NO:26-29; (e) содержит аминокислотную последовательность любой из SEQ ID NO:26-29; (f) состоит из аминокислотной последовательности любой из SEQ ID NO:26-29.
В некоторых вариантах осуществления предложена клетка-хозяин, содержащая гетерологичный полинуклеотид, как раскрыто в настоящем документе, и способная экспрессировать слитый белок, кодируемый гетерологичным полинуклеотидом.
В любом из вариантов осуществления, раскрытых в настоящем документе, клетка-хозяин содержит выделенный полинуклеотид, кодирующий слитый белок, способный специфично связывать CD20, где полинуклеотид: (a) по меньшей мере на 80% идентичен полинуклеотидной последовательности любой из SEQ ID NO:53-56; (b) по меньшей мере на 80% идентичен полинуклеотидной последовательности любой из SEQ ID NO:44-47; (c) содержит полинуклеотидную последовательность любой из SEQ ID NO:53-56; (d) содержит полинуклеотидную последовательность любой из SEQ ID NO:44-47; (e) состоит из полинуклеотидной последовательности любой из SEQ ID NO:53-56; или (f) состоит из полинуклеотидной последовательности любой из SEQ ID NO:44-47.
В некоторых вариантах осуществления клетка-хозяин содержит слитый белок, состоящий из или содержащий аминокислотную последовательность, где слитый белок: (a) по меньшей мере на 90% идентичен зрелому слитому белку, содержащему аминокислотную последовательность любой из SEQ ID NO:26-29 и 35-38 и 32-34 с удаленным маркером трансдукции tCD19; (b) содержит зрелый слитый белок, содержащий аминокислотную последовательность любой из SEQ ID NO: 35-38 с удаленным маркером трансдукции tCD19; (c) состоит из зрелого слитого белка, содержащего аминокислотную последовательность любой из SEQ ID NO: 35-38 с удаленным маркером трансдукции tCD19; (d) по меньшей мере на 90% идентичен аминокислотной последовательности любой из SEQ ID NO:26-29; (e) содержит аминокислотную последовательность любой из SEQ ID NO:26-29; (f) состоит из аминокислотной последовательности любой из SEQ ID NO:26-29.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, как раскрыто в настоящем документе, и способна экспрессировать слитый белок, кодируемый гетерологичным полинуклеотидом.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий связывающий домен, где связывающий домен представляет собой: (a) scFv 1.5.3, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:64, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (b) scFv 1.5.3, содержащий или состоящий из аминокислотной последовательности SEQ ID NO:64; (c) scFv 1F5, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:66, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (d) scFv 1F5, содержащий или состоящий из аминокислотной последовательности SEQ ID NO:66; (e) scFv Leu16, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:65, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; или (f) Leu16 scFv, содержащий или состоящий из аминокислотной последовательности SEQ ID NO:65.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий scFv, где scFv кодируется: (a) полинуклеотидом, по меньшей мере на 80% идентичным последовательности молекулы нуклеиновой кислоты SEQ ID NO:67, где полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (b) полинуклеотидом, содержащим или состоящим из последовательности молекулы нуклеиновой кислоты SEQ ID NO:67; (c) полинуклеотидом, по меньшей мере на 80% идентичным последовательности молекулы нуклеиновой кислоты SEQ ID NO:69, где полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (d) полинуклеотидом, содержащим или состоящим из последовательности молекулы нуклеиновой кислоты SEQ ID NO:69; (e) полинуклеотидом, по меньшей мере на 80% идентичным последовательности молекулы нуклеиновой кислоты SEQ ID NO:68, где полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; или (f) полинуклеотидом, содержащим или состоящим из последовательности молекулы нуклеиновой кислоты SEQ ID NO:68.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, где слитый белок представляет собой химерный антигенный рецептор и содержит или состоит из аминокислотной последовательности, по меньшей мере на 90% идентичной аминокислотной последовательности любой из SEQ ID NO:26-3443.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий гидрофобную часть, где гидрофобная часть представляет собой трансмембранный домен. В некоторых вариантах осуществления гидрофобная часть представляет собой трансмембранный домен CD4, CD8, CD28 или CD27.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий эффекторный домен или его функциональную часть, где эффекторный домен или его функциональная часть представляет собой 4-1BB (CD137), CD3ε, CD3δ, CD3ζ, CD25, CD27, CD28, CD79A, CD79B, CARD11, DAP10, FcRα, FcRβ, FcRγ, Fyn, HVEM, ICOS, Lck, LAG3, LAT, LRP, NKG2D, NOTCH1, NOTCH2, NOTCH3, NOTCH4, OX40 (CD134), ROR2, Ryk, SLAMF1, Slp76, pTα, TCRα, TCRβ, TRIM, Zap70, PTCH2 или любую их комбинацию.
В некоторых вариантах осуществления клетка-хозяин содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий внутриклеточный компонент, где внутриклеточный компонент содержит: (a) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD28 или его функциональную часть и костимулирующий домен 4-1BB (CD137) или его часть; (b) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD28 или его функциональную часть и костимулирующий домен OX40 (CD134) или его часть; (c) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD27 или его функциональную часть и костимулирующий домен 4-1BB (CD137) или его часть; (d) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD27 или его функциональную часть и костимулирующий домен OX40 (CD134) или его часть; (e) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD27 или его функциональную часть и костимулирующий домен CD28 или его часть; или (f) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен 4-1BB (CD137) или его функциональную часть и костимулирующий домен OX40 (CD134) или его часть.
В любом из вариантов осуществления, описанных в настоящем документе, вектор, содержащий слитый белок согласно настоящему изобретению, трансдуцируют в клетку-хозяина. «Трансдукция» относится к введению молекулы нуклеиновой кислоты (например, вектора, кодирующего слитый белок согласно настоящему изобретению) в клетку-хозяина. После трансдукции клетка-хозяин может нести вектор экстрахромосомно или в интегрированном в хромосому виде. Интеграция в геном клетки-хозяина или самореплицирующиеся векторы обычно позволяют получать генетически стабильное наследованию трансформированного вектора. Может быть применен любой подходящий способ трансдукции. Вектор может быть перенесен в клетку-хозяина с помощью физических, химических или биологических средств. Клетку-хозяина, содержащую трансформированную молекулу нуклеиновой кислоты, называют «сконструированной», «рекомбинантной» или «неприродной».
В некоторых вариантах осуществления клетка, такая как Т-клетка, полученная от субъекта, может быть превращена в сконструированную, неприродную или рекомбинантную клетку (например, сконструированную, неприродную или рекомбинантную Т-клетку) посредством введения молекулы нуклеиновой кислоты, кодирующей слитый белок, расположенный на клеточной поверхности, как описано в настоящем документе, где клетка экспрессирует слитый белок.
В некоторых вариантах осуществления клетка-хозяин, трансфицированная для экспрессии слитого белка согласно настоящему изобретению, представляет собой функциональную Т-клетку, такую как вирус-специфичная Т-клетка, цитотоксическую Т-клетку, специфичную к опухолевому антигену, наивную Т-клетку, стволовую Т-клетку памяти, центральную или эффекторную Т-клетку памяти, γδ T-клетки или CD4+ CD25+ регуляторную Т-клетку. В других вариантах осуществления молекулу нуклеиновой кислоты, кодирующую слитый белок согласно настоящему изобретению, вводят в общую популяцию CD8+ Т-клеток, наивные CD8+ Т-клетки, CD8+ TCM-клетки, CD8+ TEM-клетки или любую их комбинацию. В других вариантах осуществления молекулу нуклеиновой кислоты, кодирующую слитый белок согласно настоящему изобретению, вводят в общую популяцию CD4+ Т-клеток, наивные CD4+ Т-клетки, CD4+ TCM-клетки, CD4+ TEM-клетки или любую их комбинацию. В других вариантах осуществления молекулу нуклеиновой кислоты, кодирующую слитый белок согласно настоящему изобретению, вводят в популяцию Т-клеток, обогащенную наивными CD8+ T-клетками и CD8+ TCM-клетками. В других вариантах осуществления молекулу нуклеиновой кислоты, кодирующую слитый белок согласно настоящему изобретению, вводят в популяцию Т-клеток, обогащенную наивными CD4+ T-клетками и CD4+ TCM-клетками. В любом из вышеупомянутых вариантов осуществления Т-клетки дополнительно содержат молекулу нуклеиновой кислоты, кодирующую сконструированный TCR, специфичный к CD20, сконструированный высокоаффинный TCR, специфичный к CD20, CAR, специфичный к CD20, или любую их комбинацию.
В некоторых вариантах осуществления перед размножением и генетической модификацией Т-клеток при помощи конструкции слитого белка согласно настоящему изобретению получают источник Т-клеток от субъекта (например, мононуклеарные клетки периферической крови (МНПК), костный мозг, ткань лимфатического узла, пуповинную кровь, ткань вилочковой железы, ткань из места инфекции, асцит, плевральный выпот или ткань селезенки), из которого Т-клетки выделяют при помощи способов, известных в данной области техники. Определенные субпопуляции Т-клеток могут быть собраны в соответствии с известными способами и обогащены или обеднены посредством известных способов, таких как аффинное связывание с антителами, проточная цитометрия или иммуномагнитное разделение. После этапов обогащения или обеднения и введения слитого белка может быть проведено размножение желаемых модифицированных Т-клеток in vitro при помощи известных способов (включая описанные в патенте США № 6,040,177) или их вариаций, которые очевидны специалистам в данной области техники.
Например, желаемая популяция или субпопуляция Т-клеток может быть размножена за счет добавления исходной популяции Т-клеток к культуральной среде in vitro, и затем добавления питающих клеток, таких как не способные делиться МНПК, к культуральной среде (например, так, что полученная популяция клеток содержит по меньшей мере приблизительно 5, 10, 20 или 40 или более питающих клеток МНПК на каждую Т-клетку в исходной популяции, подлежащей размножению); и инкубации культуры (например, в течение времени, достаточного для размножения Т-клеток). Неделящиеся питающие клетки могут содержать гамма-облученные питающие клетки МНПК. В некоторых вариантах осуществления МНПК облучают гамма-лучами в диапазоне от приблизительно 3000 до 3600 рад. Порядок добавления Т-клеток и питающих клеток к культуральной среде при желании может быть обратным. Культура обычно может быть инкубирована при условиях температуры и тому подобных, которые подходят для роста Т-клеток. Для роста человеческих Т-лимфоцитов, например, температура обычно составляет по меньшей мере приблизительно 25 ºC, предпочтительно по меньшей мере приблизительно 30 ºC, более предпочтительно приблизительно 37 ºC.
Необязательно, способы размножения могут дополнительно включать добавление в качестве питающих клеток не способных делиться лимфобластоидных клеток (ЛБК), трансформированных вирусом Эпштейна-Барр (ВЭБ). ЛБК могут быть облучены гамма-лучами в диапазоне от приблизительно 6000 до 10000 рад. Питающие клетки ЛБК могут быть обеспечены в любом подходящем количестве, так чтобы отношение питающих клеток ЛБК к исходным Т-лимфоцитам составляло по меньшей мере приблизительно 10:1.
После выделения Т-лимфоцитов как CD8+ цитотоксические, так и CD4+ хелперные Т-лимфоциты могут быть отсортированы на субпопуляции наивных Т-клеток, Т-клеток памяти и эффекторных Т-клеток до проведения генетической модификации при помощи слитого белка и размножения. В некоторых вариантах осуществления Т-клетки, модифицированные для экспрессии слитых белков согласно настоящему изобретению, представляют собой общую популяцию Т-клеток (например, общую популяцию CD4+ T-клеток или общую популяцию CD8+ T-клеток), или представляют собой субпопуляцию Т-клеток, таких как центральные Т-клетки памяти (например, центральные CD8+ Т-клетки памяти) или комбинацию центральных Т-клеток памяти (TCM) и наивных Т-клеток (TN) (например, CD4+ TCM + TN клетки).
В любом из вариантов осуществления, описанных в настоящем документе, клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий CAR, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичный 1.5.3-NQ-28-BB-z (SEQ ID NO:26); 1.5.3-NQ-28-z (SEQ ID NO:27); 1.5.3-NQ-BB-z (SEQ ID NO:28); 1.5.3-NQ-z (SEQ ID NO:29); Leu16-28-BB-z (SEQ ID NO:30); Leu16-28-z (SEQ ID NO:31); 1F5-NQ-28-BB-z (SEQ ID NO:32); 1F5-NQ-28-z (SEQ ID NO:33) или 1F5-NQ-BB-z (SEQ ID NO:34). В других вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий CAR, содержащий или состоящий из аминокислотной последовательности любой из SEQ ID NO:26-34. В любом из этих вариантов осуществления клетка-хозяин представляет собой Т-клетку, где Т-клетки представляют собой общую популяцию CD4+ Т-клеток, общую популяцию CD8+ T-клеток, центральные CD4+ Т-клетки памяти, центральные CD8+ Т-клетки памяти или комбинацию центральных CD4+ Т-клеток памяти (TCM) и наивных CD4+ T-клеток (TN). CAR-модифицированные CD4+ T-клетки и CAR-модифицированные CD8+ T-клетки могут быть смешаны в отношении от 3:1 до 1:1 до 1:3 до введения субъекту, или могут быть введены субъекту по отдельности в таких же или схожих соотношениях.
В других вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий CAR, специфичный к CD20, где полинуклеотид по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичен последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:44-52. В связанных вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий CAR, специфичный к CD20, где полинуклеотид содержит или состоит из последовательности любой из SEQ ID NO:44-52. В любом из этих вариантов осуществления клетка-хозяин представляет собой Т-клетку, где Т-клетки представляют собой общую популяцию CD4+ T-клеток, общую популяцию CD8+ T-клеток, центральные CD4+ Т-клетки памяти, центральные CD8+ Т-клетки памяти или комбинацию центральных CD4+ Т-клеток памяти (TCM) и наивных CD4+ Т-клеток (TN). CAR-модифицированные CD4+ T-клетки и CAR-модифицированные CD8+ T-клетки могут быть смешаны в соотношении от 3:1 до 1:1 до 1:3 до введения субъекту, или могут быть введены субъекту по отдельности в таком же или схожих соотношениях.
Необязательно, клетка-хозяин, содержащая любой вектор согласно настоящему изобретению, содержащий полинуклеотид, кодирующий CAR согласно настоящему изобретению, также может кодировать маркер трансдукции (например, tCD19), который также может включать саморасщепляющийся пептид, так что маркер трансдукции и CAR разделены в отдельных молекулах: CAR и маркер трансдукции. В некоторых вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий саморасщепляющийся пептид, расположенный между CAR, специфичным к CD20, и маркером трансдукции tCD19, где полинуклеотид по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичен последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:53-61. В других вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий саморасщеплящийся пептид, расположенный между CAR, специфичным к CD20, и маркером трансдукции tCD19, и содержащий или состоящий из последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:53-61.
Является ли Т-клетка или популяция Т-клеток положительной по наличию конкретного маркера клеточной поверхности, можно определить посредством проточной цитометрии при помощи окрашивания антителом, специфичным к поверхностному маркеру, и контрольного изотипического антитела. Популяция клеток, «отрицательная» по наличию маркера, относится к отсутствию значимого окрашивания популяции клеток специфичным антителом выше изотипического контроля, а «положительная» относится к однородному окрашиванию популяции клеток выше уровней, обнаруженных для изотипического контроля. В некоторых вариантах осуществления снижение экспрессии одного или более маркеров относится к потере 1 log10 в MFI (среднекратный прирост) или процентному снижению Т-клеток, несущих маркер, по меньшей мере на 20% клеток, 25% клеток, 30% клеток, 35% клеток, 40% клеток, 45% клеток, 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клеток, 95% клеток или 100% клеток, или на любой процент между 20% и 100% при сравнении с референсной популяцией Т-клеток. В некоторых вариантах осуществления популяция Т-клеток, положительная по наличию маркера, относится к проценту клеток, несущих маркер, который может составлять по меньшей мере 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клеток, 95% клеток или 100% клеток, или любой процент между 50% и 100% при сравнении с референсной популяцией Т-клеток.
Способы иммуномагнитного разделения также могут быть использованы для очистки субпопуляций Т-клеток при помощи коммерчески доступных клинически применимых конъюгатов антител с гранулами, с помощью устройства CliniMACS (см. например, Terakura et al., 2012, Blood 119:72-82; Wang et al., 2012, J. Immunother. 35:689-701). Например, для выделения CD8+ TCM-клеток человека, CD4+, CD14+ и CD45RA+ клетки отделяют от мононуклеарных клеток периферической крови посредством обеднения парамагнитными гранулами, конъюгированными с антителом, и затем фракцию CD62L+ из оставшихся клеток позитивно отбирают при помощи гранул, меченых антителом к CD62L, для обогащения субпопуляции CD45RO+, CD62L+, CD8+ TCM. Обогащенная субпопуляция CD8+ TCM может быть активирована при помощи гранул с антителом к CD3/CD28 или при помощи антигена, модифицирована CAR, специфичным к опухоли, с помощью ретровирусных или лентивирусных векторов, и размножена для применения в клеточной иммунотерапии (см. например, Terakura et al., supra; Wang et al., supra).
В качестве альтернативы, субпопуляции Т-клеток могут быть выбраны при помощи Fab-фрагментов низкой аффинности, слитых со Strep-меткой II. Мономеры Fab не имеют достаточной аффинности связывания для стабильного связывания с антигеном-мишенью на клеточной поверхности. Однако при мультимеризации на грануле StrepTactin эти реагенты стабильно связывают клетку-мишень и делают возможным отбор на основе специфичности к маркеру клеточной поверхности. Связывание Fab-мультимера может быть быстро обращено посредством добавления избытка D-биотина, который обладает более высокой аффинностью к StrepTactin и разрушает связывание между Strep-меткой на Fab-фрагменте и «скелетом» Strep-Tactin. Мономеры Fab не могут поддерживать стабильное связывание клетки. Данная технология «Fab-Streptamers» делает возможным серийное позитивное обогащение Т-клеток на основе нескольких маркеров клеточной поверхности и может быть применена для отбора любой желаемой субпопуляции Т-клеток (см. например, Stemberger et al., PloS One 7:e35798, 2012).
Общая популяция CD8+ T-клеток может быть получена при помощи стандартных способов. В некоторых вариантах осуществления общую популяцию CD8+ T-клеток дополнительно сортируют на наивные Т-клетки, центральные Т-клетки памяти и эффекторные Т-клетки посредством идентификации определенных маркеров клеточной поверхности, ассоциированных с каждым из этих типов CD8+ T-клеток. В некоторых вариантах осуществления Т-клетки памяти присутствуют как в CD62L+, так и CD62L− субпопуляциях CD8+ лимфоцитов периферической крови. Например, МНПК могут быть отсортированы на CD62L−CD8+ и CD62L+CD8+ фракции после окрашивания антителами к CD8 и CD62L. В некоторых вариантах осуществления экспрессия фенотипических маркеров центральных CD8+ Т-клеток памяти включает CD45RO, CD62L, CCR7, CD28, CD3 или CD127, или отрицательную по гранзиму В. В некоторых вариантах осуществления центральные Т-клетки памяти представляют собой CD45RO+, CD62L+, CD8+ T-клетки. В некоторых вариантах осуществления CD8+ эффекторные Т-клетки отрицательны по или имеют сниженную экспрессию CD62L, CCR7, CD28 или CD127, или положительны по или имеют повышенную экспрессию гранзима В или перфорина по сравнению с центральными CD8+ Т-клетками памяти. В некоторых вариантах осуществления наивные CD8+ T-клетки характеризуются экспрессией фенотипических маркеров наивных Т-клеток, включая CD62L, CCR7, CD28, CD3, CD127 или CD45RA.
Общая популяция CD4+ лимфоцитов может быть получена посредством стандартных способов. В некоторых вариантах осуществления общую популяцию CD4+ T-клеток дополнительно сортируют на наивные клетки, центральные клетки памяти и эффекторные клетки при помощи идентификации популяций клеток, имеющих определенные маркеры клеточной поверхности. В некоторых вариантах осуществления наивные CD4+ T-лимфоциты представляют собой CD45RO−, CD45RA+, CD62L+, CD4+ T-клетки. В некоторых вариантах осуществления центральные CD4+ клетки памяти являются положительными по CD62L и положительными по CD45RO. В некоторых вариантах осуществления эффекторные CD4+ клетки являются отрицательными по CD62L или CD45RO или имеют сниженную экспрессию CD62L или CD45RO по сравнению с центральными CD4+ клетками памяти.
Популяции CD4+ и CD8+ клеток, имеющих TCR, которые являются антигенспецифичными, могут быть получены посредством стимуляции наивных или антигенспецифичных Т-лимфоцитов при помощи антигена. Например, Т-клеточные клоны, имеющие антигенспецифичные TCR, могут быть получены к, например, антигенам цитомегаловируса при помощи выделения Т-клеток от инфицированных субъектов и стимуляции клеток in vitro этим же антигеном. Наивные Т-клетки также могут быть использованы посредством воздействия на них пептидных антигенов, презентируемых антигенпрезентирующей клеткой или комплексом пептид-ГКГС. Может быть использовано любое число антигенов из опухолевых клеток, раковых клеток или патогенных агентов. Примеры таких антигенов включают антигены ВИЧ, антигены вируса гепатита С (HCV), антигены вируса гепатита В (HBV), антигены цитомегаловируса (CMV), антигены ВЭБ, паразитарные антигены и опухолевые антигены, такие как орфанный рецептор тирозинкиназы ROR1, EGFR, EGFRvIII, GD2, GD3, HPV E6, HPV E7, Her2, L1-CAM, Lewis A, Lewis Y, MUC1, MUC16, PSMA, CD19, CD20, CD22, CD56, CD23, CD24, CD37, CD30, CD33, CD38, CD56, CD123, CA125, c-MET, FcRH5, WT1, рецептор фолиевой кислоты α, VEGF-α, VEGFR1, VEGFR2, IL-13Rα2, IL-11Rα, MAGE-A1, PSA, эфрин A2, эфрин B2, лиганды NKG2D, NY-ESO-1, TAG-72, мезотелин, CEA или т.п. Такие Т-клетки, имеющие антигенспецифичные TCR, могут быть дополнительно модифицированы таким образом, чтобы содержать слитый белок, как описано в настоящем документе, где слитый белок специфичен к тому же антигену, специфичен к другому эпитопу на том же антигене или специфичен к другому антигену. В любом из этих вариантов осуществления CD4+ T-клетки и CD8+ T-клетки будут содержать различные CAR, и, в частности, внутриклеточные сигнальные компоненты CAR будут различны.
Способы получения и модификации Т-клеток для экспрессии слитых белков согласно настоящему изобретению, подтверждения активности Т-клеток, модифицированных слитыми белками, размножения популяций Т-клеток, модифицированных слитыми белками, известны в данной области техники и описаны, например, в Hollyman et al., 2009, J. Immunother. 32:169-180; публикации PCT заявки № WO 2012/079000; патенте США № 8,802,374; Brentjens et al., Blood 118:4817-4828, 2011; патентной публикации США No. US 2014/0271635.
Применения
В настоящем изобретении предложены способы лечения заболевания, состояния или расстройства у субъекта, включающие введение субъекту любых слитых белков, описанных в настоящем документе В вариантах осуществления способы согласно настоящему изобретению включают способы снижения числа В-клеток или лечения заболевания или расстройства, связанного с нарушенной активностью В-клеток, у субъекта. В другом варианте осуществления предложен способ лечения заболевания, состояния или расстройства у субъекта, включающий анализ биологического образца от субъекта на наличие антигена, ассоциированного с заболеванием, состоянием или расстройством, и введение слитого белка, описанного в настоящем документе, где слитый белок специфично связывается с антигеном. В некоторых вариантах осуществления антиген, ассоциированный с заболеванием, состоянием или расстройством, представляет собой опухолеассоциированный антиген.
Заболевания, состояния или расстройства, подлежащие лечению при помощи композиций и способов, описанных в настоящем документе, включают рак и иммунные заболевания (например, аутоиммунные). Например, в некоторых вариантах осуществления CD20-экспрессирующая клетка включает В-клетки. В других вариантах осуществления заболевание или расстройство, связанное с экспрессией CD20, связано с В-клетками или нарушенной активностью В-клеток, такое как раковые заболевания, связанные с В-клетками. Адоптивная иммунная и генная терапия представляет собой перспективные виды лечения различных видов рака (Morgan et al., Science 314:126, 2006; Schmitt et al., Hum. Gene Ther. 20:1240, 2009; June, J. Clin. Invest. 117:1466, 2007).
Широкий круг раковых заболеваний, включая солидные опухоли и лейкозы, восприимчив к лечению композициями и способами, раскрытыми в настоящем документе. Примеры видов рака, подлежащих лечению, включают аденокарциному молочной железы, предстательной железы и толстой кишки; все формы бронхогенной карциномы легкого; миелоидный лейкоз; меланому; гепатому; нейробластому; папиллому; апудому; хористому; бранхиому; злокачественный карциноидный синдром; карциноидную болезнь сердца; и карциному (например, Уокера, базальноклеточную, базальную плоскоклеточную, Брауна-Пирс, протоковая, опухоль Эрлиха, опухоль Кребс-2, из клеток Меркеля, муцинозную, немелкоклеточную карциному легкого, овсяно-клеточную, папиллярную, скиррозную, бронхиолярную, бронхогенную, плоскоклеточную и переходно-клеточную). Дополнительные виды рака, подлежащие лечению, включают гистиоцитарные расстройства; злокачественный гистиоцитоз; лейкоз; болезнь Ходжкина; иммунопролиферативную болезнь; неходжкинскую лимфому; плазмацитому; ретикулез; меланому; хондробластому; хондрому; хондросаркому; фиброму; фибросаркому; гигантоклеточные опухоли; гистиоцитому; липому; липосаркому; мезотелиому; миксому; миксосаркому; остеому; остеосаркому; хордому; краниофарингиому; дисгерминому; гамартому; мезенхимому; мезонефрому; миосаркому; амелобластому; цементому; одонтому; тератому; тимому; трофобластическую опухоль. Более того, предполагается, что следующие виды рака также восприимчивы к лечению: аденома; холангиома; холестеатома; циклиндрома; цистаденокарцинома; цистаденома; гранулезоклеточная опухоль; гинандробластома; гепатома; гидраденома; инсулома; опухоль из клеток Лейдига; папиллома; опухоль из клеток Сертоли; текаклеточная опухоль; лейомиома; лейомиосаркома; миобластома; миома; миосаркома; рабдомиома; рабдомиосаркома; эпендимома; ганглионеврома; глиома; медуллобластома; менингиома; невринома; нейробластома; нейроэпителиома; нейрофиброма; нейрома; параганглиома; нехромаффинная параганглиома. Виды рака, подлежащие лечению, также включают ангиокератому; ангиолимфоидную гиперплазию с эозинофилией; склерозирующая ангиома; ангиоматоз; гломангиому; гемангиоэндотелиому; гемангиому; гемангиоперицитому; гемангиосаркому; лимфангиому; лимфангиомиому; лимфангиосаркому; пинеалому; карциносаркому; хондросаркому; филлоидную цистосаркому; фибросаркому; гемангиосаркому; лейомиосаркому; лейкосаркому; липосаркому; лимфангиосаркому; миосаркому; миксосаркому; карциному яичника; рабдомиосаркому; саркому; новообразования; нейрофиброматоз; и цервикальную дисплазию.
Примерами различных гиперпролиферативных расстройств, восприимчивых к композициям и способам, раскрытым в настоящем документе, являются расстройства и заболевания, связанные с экспрессией CD20, такие как нарушенная активность В-клеток, включая В-клеточный рак, такой как В-клеточные лимфомы (такие как различные формы болезни Ходжкина, неходжкинской лимфомы (НХЛ) или лимфом центральной нервной системы), лейкозы (такие как острый лимфобластный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз (ХЛЛ), волосатоклеточный лейкоз, В-клеточная бласт-трансформация хронического миелоидного лейкоза) и миеломы (такая как множественная миелома). Другие виды В-клеточного рака включают мелкоклеточную лимфоцитарную лимфому (МЛЛ), макроглобулинемию Вальденстрема, лимфому из CD37+ дендритных клеток, В-клеточную пролимфоцитарную лимфому, лимфоплазмоцитарную лимфому, лимфому маргинальный зоны селезенки, плазмоклеточную миелому, солитарную плазмоцитому кости, экстраоссальную плазмоцитому, экстранодальную В-клеточную лимфому маргинальной зоны лимфоидной ткани, ассоциированную со слизистыми оболочками (MALT), узловую В-клеточную лимфому маргинальной зоны, фолликулярную лимфому, мантийноклеточную лимфому, диффузную В-крупноклеточную лимфому, медиастинальную (тимическую) В-крупноклеточную лимфому, В-лимфобластную лимфому из клеток-предшественников, иммунобластную крупноклеточную лимфому, внутрисосудистую В-крупноклеточную лимфому, первичную эффузионную лимфому, лимфому/лейкоз Беркитта, В-клеточные пролиферации с неопределенным злокачественным потенциалом, лимфогранулематоз и посттрансплантационное лимфопролиферативное расстройство. В некоторых вариантах осуществления композиции и способы согласно настоящему изобретению могут быть применены для лечения не связанных с B-клетками расстройств или заболеваний, связанных с экспрессией CD20, включая множественную миелому, меланому, множественную миелому стволовых клеток и меланому стволовых клеток.
Воспалительные и аутоиммунные заболевания, восприимчивые к композициям и способам, раскрытым в настоящем документе, включают артрит, ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, полихондрию, псориатический артрит, псориаз, дерматит, идиопатическую воспалительную миопатию, полимиозит/дерматомиозит, миозит с включениями, воспалительный миозит, токсикодермальный некролиз, системную склеродермию и склероз, синдром CREST, воспалительное заболевание кишечника, болезнь Крона, болезнь Грейвса, язвенный колит, респираторный дистресс-синдром, респираторный дистресс-синдром взрослых (РДСВ), менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, экзему, астму, состояния, характеризующиеся Т-клеточной инфильтрацией и хроническими воспалительными ответами, атеросклероз, аутоиммунный миокардит, недостаточность адгезии лейкоцитов, системную красную волчанку (СКВ), подострую кожную красную волчанку, дискоидную волчанку, волчаночный миелит, энцефалит при системной красной волчанке, ювенильный диабет, рассеянный склероз, аллергический энцефаломиелит, оптиконевромиелит, острую ревматическую лихорадку, хорею Сиденгама, иммунные ответы, связанные с острой и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включая гранулематоз Вегенера и болезнь Черджа-Стросса, агранулоцитоз, васукулит (включая аллергический васкулит/ангиит, АНЦА-ассоциированный и ревматоидный васкулит), апластическую анемию, анемию Даймонда-Блекфена, иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию, парциальную красноклеточную аплазию костного мозга (ПККА), дефицит фактора свертывания VIII, гемофилию A, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, характеризующиеся диапедезом лейкоцитов, воспалительные заболевания центральной нервной системы (ЦНС), синдром полиорганной недостаточности, миастению гравис, заболевания, опосредованные комплексом антиген-антитело, заболевание с образованием антител к базальной мембране клубочков, антифосфолипидный синдром, аллергический неврит, болезнь Бехчета, болезнь Кастлемана, синдром Гудпасчера, миастенический синдром Ламберта-Итона, болезнь Рейно, синдром Шегрена, синдром Стивенса-Джонсона, отторжение после трансплантации отторжение солидных органов, болезнь «трансплантат против хозяина» (БТПХ), буллезный пемфигоид, пузырчатку, аутоиммунные полиэндокринопатии, серонегативные спондилоартриты, болезнь Рейтера, синдром мышечной скованности, гигантоклеточный артериит, нефрит, вызванный иммунными комплексами, IgA-нефропатию, IgM-полинейропатии или IgM-опосредованную нейропатию, идиопатическую тромбоцитопеническую пурпуру (ИТП), тромботическую тромбоцитопеническую пурпуру (ТТП), пурпуру Шенлейн-Геноха, аутоиммунную тромбоцитопению, аутоиммунное заболевание семенников и яичников, включая аутоиммунный орхит и оофорит, первичный гипотиреоз; аутоиммунные эндокринные заболевания, включая аутоиммунный тиреоидит, хронический тиреоидит (тиреоидит Хашимото), подострый тиреоидит, идиопатический гипотиреоз, болезнь Аддисона, болезнь Грейвса, аутоиммунный полигландулярный синдром (или полигландулярные эндокринопатии), сахарный диабет I типа, также называемый инсулинозависимым сахарным диабетом (ИЗСД), и синдром Шихана; аутоиммунный гепатит, лимфоидный интерстициальный пневмонит (ЛИП), облитерирующий бронхиолит (не трансплантационный), неспецифическую интерстициальную пневмонию (НИП), синдром Гийена-Барре, васкулит крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный (Такаясу) артериит), васкулит средних сосудов (включая болезнь Кавасаки и узелковый полиартериит), узелковый полиартериит (УПА), анкилозирующий спондилит, болезнь Берже (IgA-нефропатия), быстропрогрессирующий гломерулонефрит, первичный билиарный цирроз, целиакию-спру (глютеновую энтеропатию), криоглобулинемию, криоглобулинемию, ассоциированную с гепатитом, боковой амиотрофический склероз (БАС), коронарную болезнь средца, семейную средиземноморскую лихорадку, микроскопический полиангиит, синдром Когана, синдром Вискотта-Олдрича и облитерирующий тромбангиит.
Субъекты, подлежащие лечению посредством настоящего изобретения, в целом представляют собой человека и других приматов, таких как обезьяны и человекообразные обезьяны для ветеринарных медицинских целей. Субъекты могут представлять собой самцов или самок и могут быть любого подходящего возраста, включая младенцев, ювенильных субъектов, подростков, взрослых и пожилых субъектов.
Слитые белки согласно настоящему изобретению могут быть приготовлены в лекарственной форме для введения любым подходящим способом согласно представлениям специалистов в данной области техники. CD20-специфичный слитый белок (например, CAR) согласно настоящему изобретению (или слитый белок, специфичный к другой мишени) может быть введен субъекту в клеточно-связанной форме (например, ex vivo модификация популяции клеток-мишеней (зрелые Т-клетки (например, CD8+ или CD4+ T-клетки) или другие клетки Т-клеточной линии)). В отдельном варианте осуществления клетки Т-клеточной линии, экспрессирующие CD20-специфичные слитые белки согласно настоящему изобретению (или слитые белки, специфичные к другой мишени), вводимые субъекту, представляют собой клетки, сингенные, аллогенные или аутологичные для субъекта. В некоторых вариантах осуществления клетки, содержащие слитые белки согласно настоящему изобретению, получают посредством сбора клеток (из биологического образца, ткани или культуральной среды), промывки, концентрации и объединения со средой и системой упаковки, подходящей для введения.
В настоящем изобретении предложены композиции, содержащие клетки, экспрессирующие слитые белки, как раскрыто в настоящем документе, и фармацевтически приемлемый носитель, разбавители или эксципиент. Подходящие эксципиенты включают воду, раствор хлорида натрия, декстрозу, глицерин или тому подобное, и их комбинации. В вариантах осуществления композиции, содержащие клетки, экспрессирующие слитые белки, как раскрыто в настоящем документе, дополнительно содержат подходящую инфузионную среду. Подходящая инфузионная среда может представлять собой любую изотоническую среду, обычно могут быть использованы изотонический раствор, Normosol R (Abbott) или Plasma-Lyte A (Baxter), 5% раствор декстрозы в воде, лактат Рингера. Инфузионная среда может содержать добавки сывороточного альбумина человека или других компонентов сыворотки человека.
В других вариантах осуществления CD20-специфичные слитые белки согласно настоящему изобретению (или слитые белки, специфичные к другой мишени) могут быть введены субъекту в растворимой форме. Например, растворимые TCR известны в данной области техники (см. например, Molloy et al., Curr. Opin. Pharmacol. 5:438, 2005; патент США № 6,759,243).
Слитые белки согласно настоящему изобретению или включающие их клетки могут быть введены способом, соответствующим заболеванию, состоянию или расстройству, подлежащему лечению, как определено специалистами в области медицины. В любом из вышеупомянутых вариантов осуществления клетку, содержащую слитый белок, как описано в настоящем документе, вводят внутривенно, внутрибрюшинно, внутритуморально, в костный мозг, в лимфатический узел или в цереброспинальную жидкость. В некоторых вариантах осуществления клетки, содержащие слитый белок согласно настоящему изобретению, доставляют к месту опухоли.
Подходящую дозу, продолжительность и частоту введения композиций будут определять такие факторы, как состояние пациента, размер, вид и тяжесть заболевания, состояния или расстройства, конкретная форма активного ингредиента и способ введения.
В любом из вышеупомянутых вариантов осуществления способы согласно настоящему изобретению включают введение терапевтически эффективного количества клетки-хозяина, экспрессирующей слитый белок согласно настоящему изобретению, или клетки-хозяина, экспрессирующей слияние согласно настоящему изобретению. Терапевтически эффективное количество клеток в композиции составляет по меньшей мере одну клетку (например, одну субпопуляцию CD8+ T-клеток, модифицированных слитым белком; одну субпопуляцию CD4+ T-клеток, модифицированных слитым белком) или чаще более 102 клеток, например, до 106, до 107, до 108 клеток, до 109 клеток или более чем 1010 клеток. В некоторых вариантах осуществления клетки вводят в диапазоне от приблизительно 106 до приблизительно 1010 клеток/м2, предпочтительно в диапазоне от приблизительно 105 до приблизительно 109 клеток/м2. Количество клеток будет зависеть от конечного применения, для которого предназначена композиция, а также типа включенных в нее клеток. Например, клетки, модифицированные так, чтобы содержать слитый белок, специфичный к конкретному антигену, будут содержать популяцию клеток, содержащую по меньшей мере 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более таких клеток. Для применений, предложенных в настоящем документе, клетки обычно находятся в объеме, составляющем литр или менее, 500 мл или менее, 250 мл или менее или 100 мл или менее. В вариантах осуществления плотность желаемых клеток обычно составляет более 104 клеток/мл и обычно более 107 клеток/мл, обычно 108 клеток/мл или более. Клетки могут быть введены посредством одной инфузии или нескольких инфузий за определенный период времени. Клинически значимое число иммунных клеток может быть разделено на несколько инфузий, которые в совокупности равны или превышают 106, 107, 108, 109, 1010 или 1011 клеток.
В некоторых вариантах осуществления способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR согласно настоящему изобретению, который является полностью человеческим или гуманизированным. В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, который содержит scFv из антитела к CD20 или scTCR от TCR, специфичного к антигену CD20. В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, содержащий scFv из 1.5.3, 1F5, Leu16, ритуксимаба, офатумумаба, велтузумаба, окрелизумаба, ублитуксимаба или любую их комбинацию. В любом из вышеупомянутых вариантов осуществления способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, содержащий линкерный модуль, содержащий шарнир IgG1, шарнир IgG4 или любую их комбинацию. В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, содержащий линкерный модуль, содержащий участок CH2 IgG1 с мутацией N297Q, участок CH2 IgG4, участок CH3 IgG1, участок CH3 IgG4 или любую их комбинацию. В любом из вариантов осуществления настоящего изобретения способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, содержащий глицин-сериновый линкерный модуль или глицин-сериновый линкер вариабельного участка. В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, содержащий гидрофобную часть, состоящую из трансмембранного домена CD28. В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению включают введение клетки-хозяина, экспрессирующей CAR, содержащий внутриклеточный домен, содержащий домен из CD3ζ, 4-1BB, CD28 или любую их комбинацию. В любом из вышеупомянутых вариантов осуществления способы согласно настоящему изобретению включают введение CAR, содержащего соединяющие аминокислоты между соседними доменами, мотивами, участками, модулями или фрагментами.
В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению включают введение субъекту клетки-хозяина, содержащей молекулу гетерологичной нуклеиновой кислоты, кодирующую слитый белок, где слитый белок содержит внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобной частью, где внеклеточный компонент содержит связывающий домен, специфично связывающий CD20, и внутриклеточный компонент содержит эффекторный домен, где кодируемый слитый белок (например, CAR) по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичен 1.5.3-NQ-28-BB-z (SEQ ID NO:26); 1.5.3-NQ-28-z (SEQ ID NO:27); 1.5.3-NQ-BB-z (SEQ ID NO:28); 1.5.3-NQ-z (SEQ ID NO:29); Leu16-28-BB-z (SEQ ID NO:30); Leu16-28-z (SEQ ID NO:31); 1F5-NQ-28-BB-z (SEQ ID NO:32); 1F5-NQ-28-z (SEQ ID NO:33) или 1F5-NQ-BB-z (SEQ ID NO:34). В других вариантах осуществления способы согласно настоящему изобретению включают введение субъекту клетки-хозяина, содержащей молекулу гетерологичной нуклеиновой кислоты, кодирующую слитый белок, где слитый белок содержит внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобной частью, где внеклеточный компонент содержит связывающий домен, специфично связывающий CD20, и внутриклеточный компонент содержит эффекторный домен, где кодируемый слитый белок (например, CAR) содержит или состоит из аминокислотной последовательности любой из SEQ ID NO:26-34. В любом из этих вариантов осуществления клетка-хозяин представляет собой Т-клетку, где Т-клетки представляет собой общую популяцию CD4+ T-клеток, общую популяцию CD8+ T-клеток, центральные CD4+ Т-клетки памяти, центральные CD8+ Т-клетки памяти или комбинацию центральных CD4+ Т-клеток памяти (TCM) и наивных CD4+ Т-клеток (TN). CAR-модифицированные CD4+ T-клетки и CAR-модифицированные CD8+ T-клетки могут быть смешаны в соотношении от 3:1 до 1:1 до 1:3 перед введением субъекту, или могут быть введены субъекту по отдельности в том же или схожих соотношениях.
В других вариантах осуществления способы согласно настоящему изобретению включают введение субъекту клетки-хозяина, содержащей молекулу гетерологичной нуклеиновой кислоты, кодирующую слитый белок, где слитый белок содержит внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобной частью, где внеклеточный компонент содержит связывающий домен, специфично связывающий CD20, и внутриклеточный компонент содержит эффекторный домен, где слитый белок (например, CAR) кодируется полинуклеотидом, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичным последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:44-52. В связанных вариантах осуществления способы включают введение субъекту клетки-хозяина, содержащей молекулу гетерологичной нуклеиновой кислоты, кодирующую слитый белок, где слитый белок содержит внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобной частью, где внеклеточный компонент содержит связывающий домен, специфично связывающий CD20, а внутриклеточный компонент содержит эффекторный домен, где слитый белок (например, CAR) кодируется полинуклеотидом, содержащим или состоящим из последовательности любой из SEQ ID NO:44-52. В любом из этих вариантов осуществления клетка-хозяин представляет собой Т-клетку, где Т-клетки представляют собой общую популяцию CD4+ T-клеток, общую популяцию CD8+ Т-клеток, центральные CD4+ Т-клетки памяти, центральные CD8+ Т-клетки памяти или комбинацию центральных CD4+ Т-клеток памяти (TCM) и наивных CD4+ Т-клеток (TN). CAR-модифицированные CD4+ T-клетки и CAR-модифицированные CD8+ Т-клетки могут быть смешаны в соотношении от 3:1 до 1:1 до 1:3 до введения субъекту, или могут быть введены субъекту по отдельности в таком же или схожих соотношениях.
Необязательно, клетка-хозяин, содержащая любой вектор согласно настоящему изобретению, содержащий полинуклеотид, кодирующий слитый белок согласно настоящему изобретению, для применения в способах, описанных в настоящем документе, также может кодировать маркер трансдукции (например, tCD19), который может также включать саморасщепляющийся пептид, так, что маркер трансдукции и CAR разделены в отдельных молекулах: CAR и маркер трансдукции. В некоторых вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий саморасщепляющийся пептид, расположенный между CAR, специфичным к CD20, и маркером трансдукции tCD19, где полинуклеотид по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% идентичен последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:53-61. В других вариантах осуществления клетка-хозяин (например, Т-клетка) содержит вектор, содержащий полинуклеотид, кодирующий саморасщепляющийся пептид, расположенный между CAR, специфичным к CD20, и маркером трансдукции tCD19, и содержащий или состоящий из последовательности молекулы нуклеиновой кислоты любой из SEQ ID NO:53-61.
Соответственно, в любом из способов, раскрытых в настоящем документе, клетка-хозяин содержит выделенный полинуклеотид, кодирующий слитый белок, способный специфично связывать CD20, где полинуклеотид: (a) по меньшей мере на 80% идентичен полинуклеотидной последовательности любой из SEQ ID NO:53-56; (b) по меньшей мере на 80% идентичен полинуклеотидной последовательности любой из SEQ ID NO:44-47; (c) содержит полинуклеотидную последовательность любой из SEQ ID NO:53-56; (d) содержит полинуклеотидную последовательность любой из SEQ ID NO:44-47; (e) состоит из полинуклеотидной последовательности любой из SEQ ID NO:53-56; или (f) состоит из полинуклеотидной последовательности любой из SEQ ID NO:44-47.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит слитый белок, состоящий из или содержащий аминокислотную последовательность, где слитый белок: a) по меньшей мере на 90% идентичен зрелому слитому белку, содержащему аминокислотную последовательность любой из SEQ ID NO:26-29 и 35-38 и 32-34 с удаленным маркером трансдукции tCD19; (b) содержит зрелый слитый белок, содержащий аминокислотную последовательность любой из SEQ ID NO: 35-38 с удаленным маркером трансдукции tCD19; (c) состоит из зрелого слитого белка, содержащего аминокислотную последовательность любой из SEQ ID NO: 35-38 с удаленным маркером трансдукции tCD19; (d) по меньшей мере на 90% идентичен аминокислотной последовательности любой из SEQ ID NO:26-29; (e) содержит аминокислотную последовательность любой из SEQ ID NO:26-29; (f) состоит из аминокислотной последовательности любой из SEQ ID NO:26-29.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, как раскрыто в настоящем документе, и способна экспрессировать слитый белок.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий связывающий домен, где связывающий домен представляет собой: (a) scFv 1.5.3, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:64, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (b) scFv 1.5.3, содержащий или состоящий из аминокислотной последовательности SEQ ID NO:64; (c) scFv 1F5, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:66, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (d) scFv 1F5, содержащий или состоящий из аминокислотной последовательности SEQ ID NO:66; (e) scFv Leu16, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO:65, где каждый CDR scFv не содержит изменений или содержит не более чем одно, два, три, четыре, пять или шесть изменений по сравнению с соответствующим CDR родительского моноклонального антитела или его фрагмента или производного, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; или (f) scFv Leu16, содержащий или состоящий из аминокислотной последовательности SEQ ID NO:65.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий scFv, где scFv кодируется: (a) полинуклеотидом, по меньшей мере на 80% идентичным последовательности молекулы нуклеиновой кислоты SEQ ID NO:67, где полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (b) полинуклеотидом, содержащим или состоящим из последовательности молекулы нуклеиновой кислоты SEQ ID NO:67; (c) полинуклеотидом, по меньшей мере на 80% идентичным последовательности молекулы нуклеиновой кислоты SEQ ID NO:69, где полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; (d) полинуклеотидом, содержащим или состоящим из последовательности молекулы нуклеиновой кислоты SEQ ID NO:69; (e) полинуклеотидом, по меньшей мере на 80% идентичным последовательности молекулы нуклеиновой кислоты SEQ ID NO:68, где полинуклеотидные последовательности, кодирующие каждый CDR scFv, не содержат изменений или содержат не более чем от одного до шести нуклеотидных изменений по сравнению с полинуклеотидом, кодирующим родительский scFv из моноклонального антитела, которое специфично связывается с CD20, при условии, что scFv, содержащий один или более модифицированных CDR, специфично связывает CD20 с аффинностью, схожей с таковой для scFv дикого типа или соответствующего антитела; или (f) полинуклеотидом, содержащим или состоящим из последовательности молекулы нуклеиновой кислоты SEQ ID NO:68.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, кодирующий слитый белок, где слитый белок представляет собой химерный антигенный рецептор и содержит или состоит из аминокислотной последовательности, по меньшей мере на 90% идентичной аминокислотной последовательности любой из SEQ ID NO:26-43.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий гидрофобную часть, где гидрофобная часть представляет собой трансмембранный домен. В некоторых вариантах осуществления гидрофобная часть представляет собой трансмембранный домен CD4, CD8, CD28 или CD27.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий эффекторный домен или его функциональную часть, где эффекторный домен или его функциональная часть представляют собой 4-1BB (CD137), CD3ε, CD3δ, CD3ζ, CD25, CD27, CD28, CD79A, CD79B, CARD11, DAP10, FcRα, FcRβ, FcRγ, Fyn, HVEM, ICOS, Lck, LAG3, LAT, LRP, NKG2D, NOTCH1, NOTCH2, NOTCH3, NOTCH4, OX40 (CD134), ROR2, Ryk, SLAMF1, Slp76, pTα, TCRα, TCRβ, TRIM, Zap70, PTCH2 или любую их комбинацию.
В некоторых вариантах осуществления клетка-хозяин, используемая в способах, содержит гетерологичный полинуклеотид, кодирующий слитый белок, содержащий внутриклеточный компонент, где внутриклеточный компонент содержит: (a) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD28 или его функциональную часть и костимулирующий домен 4-1BB (CD137) или его часть; (b) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD28 или его функциональную часть и костимулирующий домен OX40 (CD134) или его часть; (c) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD27 или его функциональную часть и костимулирующий домен 4-1BB (CD137) или его часть; (d) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD27 или его функциональную часть и костимулирующий домен OX40 (CD134) или его часть; (e) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен CD27 или его функциональную часть и костимулирующий домен CD28 или его часть; или (f) эффекторный домен CD3ζ или его функциональную часть, костимулирующий домен 4-1BB (CD137) или его функциональную часть и костимулирующий домен OX40 (CD134) или его часть.
Композиции согласно настоящему изобретению также могут быть введены одновременно с, до или после введения одного или более других терапевтических агентов. Такая комбинированная терапия включает введение одной лекарственной формы, содержащей слитый белок согласно настоящему изобретению и один или более дополнительных активных агентов, а также введение слитого белка согласно настоящему изобретению и каждого активного агента в его собственной отдельной лекарственной форме. Например, слитый белок согласно настоящему изобретению и другой активный агент могут быть введены субъекту вместе в одной композиции для инфузии, или каждый агент может быть введен в отдельных лекарственных формах для инфузии. В случае, когда применяют отдельные лекарственные формы, слитый белок согласно настоящему изобретению и один или более дополнительных активных агентов могут быть введены в одно и тоже время, т.е. одновременно, по существу в одно и тоже время, т.е. параллельно, или в отдаленные друг от друга моменты времени, т.е. последовательно; подразумевается, что комбинированная терапия включает все данные схемы.
В настоящем изобретении предложены фармацевтические композиции, содержащие CD20-специфичные связывающие молекулы, клетки, экспрессирующие слитые белки, как раскрыто в настоящем документе, или и то, и другое, и фармацевтически приемлемый носитель, разбавители или эксципиент. В некоторых вариантах осуществления CD20-специфичная связывающая молекула представляет собой антитело. В таких вариантах осуществления антитело к CD20 может представлять собой ритуксимаб, офатумамаб, окрелизумаб, обинутузумаб, ублитуксимаб, велтузумаб, ибритумомаб тиуксетан, тозитумомаб или любую их комбинацию.
В некоторых вариантах осуществления способ лечения заболевания или расстройства, связанного с экспрессией CD20, включает введение субъекту, имеющему или предположительно имеющему заболевание или расстройство, связанное с экспрессией CD20, терапевтически эффективного количества клетки-хозяина, содержащей гетерологичную молекулу нуклеиновой кислоты, кодирующую слитый белок, содержащий внеклеточный компонент и внутриклеточный компонент, соединенные гидрофобной частью, где внеклеточный компонент содержит связывающий домен, который специфично связывающий CD20, и внутриклеточный компонент содержит эффекторный домен, и необязательно введение терапевтически эффективного количества CD20-специфичной связывающей молекулы, химиотерапевтического агента или ингибитора иммуносупрессивного компонента. В других вариантах осуществления способ снижает число В-клеток или лечит заболевание или расстройство, связанное с нарушенной активностью В-клеток.
Таким образом, в некоторых вариантах осуществления предложены способы лечения заболевания или расстройства, связанного с экспрессией CD20, включающие введение субъекту, имеющему или предположительно имеющему заболевание или расстройство, связанное с экспрессией CD20, терапевтически эффективного количества клетки-хозяина, содержащей гетерологичную молекулу нуклеиновой кислоты, кодирующей слитый белок, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности любой из SEQ ID NO: 26-29 и 32-38, и 41-43, и необязательно введение CD20-специфичной связывающей молекулы, химиомотерапевтического агента, ингибитора иммуносупрессивного компонента или их комбинации. В других вариантах осуществления способ снижает число В-клеток или лечит заболевание или расстройство, связанное с нарушенной активностью В-клеток.
В некоторых вариантах осуществления композиции, как описано в настоящем документе, вводят с химиотерапевтическими агентами или иммунномодуляторами (например, иммуносупрессорами или ингибиторами иммуносупрессивных компонентов, такими как ингибиторы иммунных контрольных точек). Ингибиторы иммунных контрольных точек включают ингибиторы CTLA-4, A2AR, B7-H3, B7-H4, BTLA, HVEM, GAL9, IDO, KIR, LAG-3, PD-1, PD-L1, PD-L2, Tim-3, VISTA, TIGIT, LAIR1, CD160, 2B4, TGFR бета, CEACAM-1, CEACAM-3, CEACAM-5, CD244 или любую их комбинацию. Молекула ингибитора иммунных контрольных точек может представлять собой антитело или его антигенсвязывающий фрагмент, слитый белок, небольшую молекулу, молекулу РНКи (например, миРНК, кшРНК, микроРНК), рибозим, аптамер или антисмысловый олигнуклеотид. Химиотерапевтический агент может представлять собой ингибитор B-Raf, ингибитор MEK, ингибитор VEGF, ингибитор VEGFR, ингибитор тирозинкиназы, антимитотический агент или любую их комбинацию.
В любом из вариантов осуществления, раскрытых в настоящем документе, способ лечения заболевания или расстройства, связанного с экспрессией CD20, включает введение субъекту, имеющему или предположительно имеющему заболевание или расстройство, связанное с экспрессией CD20, терапевтически эффективного количества клетки-хозяина, содержащей гетерологичную молекулу нуклеиновой кислоты, кодирующую слитый белок, как раскрыто в настоящем документе, и терапевтически эффективного количества ингибитора иммуносупрессивного компонента, такого как ингибитор иммунных контрольных точек. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой ингибитор CTLA-4, A2AR, B7-H3, B7-H4, BTLA, HVEM, GAL9, IDO, KIR, LAG-3, PD-1, PD-L1, PD-L2, Tim-3, VISTA, TIGIT, LAIR1, CD160, 2B4, рецептора TGF-бета, CEACAM-1, CEACAM-3, CEACAM-5, CD244 или любую их комбинацию.
Соответственно, в некоторых вариантах осуществления изобретения предложены способы лечения заболевания или расстройства, связанного с экспрессией CD20, включающие введение субъекту, имеющему или предположительно имеющему заболевание или расстройство, связанное с экспрессией CD20, терапевтически эффективного количества клетки-хозяина, содержащей гетерологичную молекулу нуклеиновой кислоты, кодирующую слитый белок, имеющий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности любой из SEQ ID NO: 26-29 и 32-38, и 41-43, и терапевтически эффективного количества ингибитора иммуносупрессивного компонента, такого как ингибитор контрольных иммунных точек. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой ингибитор CTLA-4, A2AR, B7-H3, B7-H4, BTLA, HVEM, GAL9, IDO, KIR, LAG-3, PD-1, PD-L1, PD-L2, Tim-3, VISTA, TIGIT, LAIR1, CD160, 2B4, рецептора TGF-бета, CEACAM-1, CEACAM-3, CEACAM-5, CD244 или любую их комбинацию. В некоторых вариантах осуществления ингибитор иммунных контрольных точек выбран из (a) антитела к PD-1, такого как пидилизумаб, ниволумаб или пембролизумаб; (b) антитела к PD-L1, такого как MDX-1105, BMS-936559, MEDI4736, MPDL3280A или MSB0010718C; или (c) антитела к CTLA4, такого как тремелимумаб или ипилимумаб.
В других вариантах осуществления изобретения предложены способы лечения заболевания или расстройства, связанного с экспрессией CD20, включающие введение субъекту, имеющему или предположительно имеющему заболевание или расстройство, связанное с экспрессией CD20, терапевтически эффективного количества клетки-хозяина, содержащей гетерологичную молекулу нуклеиновой кислоты, кодирующую слитый белок, содержащий или состоящий из аминокислотной последовательности любой из SEQ ID NO:26-29, 32-38 и 41-43, и терапевтически эффективного количества ингибитора иммунных контрольных точек, необязательно где ингибитор иммунных контрольных точек выбран из (a) антитела к PD-1, такого как пидилизумаб, ниволумаб или пембролизумаб; (b) антитела к PD-L1, такого как MDX-1105, BMS-936559, MEDI4736, MPDL3280A или MSB0010718C; или (c) антитела к CTLA4, такого как тремелимумаб или ипилимумаб.
Примеры химиотерапевтических агентов включают алкилирующие агенты (например, цисплатин, оксалиплатин, карбоплатин, бусульфан, нитрозомочевина, азотистые иприты, такие как бендамустин, урамустин, темозоломид), антиметаболиты (например, аминоптерин, метотрексат, меркаптопурин, фторурацил, цитарабин, гемцитабин), таксаны (например, паклитаксел, наб-паклитаксел, доцетаксел), антрациклины (например, доксорубицин даунорубицин, эпирубицин, идаруицин, митоксантрон, валрубицин), блеомицин, митомицин, актиномицин, гидроксимочевина, ингибиторы топоизомеразы (например, камптотецин, топотекан, иринотекан, этопозид, тенипозид), моноклональные антитела (например, ипилимумаб, пембролизумаб, ниволумаб, авелумаб, алемтузумаб, бевацизумаб, цетуксимаб, гемтузумаб, панитумумаб, ритуксимаб, тозитумомаб, трастузумаб), алкалоиды барвинка (винкристин, винбластин, виндезин, винорелбин), циклофосфамид, преднизон, лейкворин, оксалиплатин, гиалуронидазы или любую их комбинацию. В некоторых вариантах осуществления химиотерапевтический агент представляет собой вемурафениб, дабрафениб, траметиниб, кобиметиниб, сунитиниб, эрлотиниб, паклитаксел, доцетаксел или любую их комбинацию. В некоторых вариантах осуществления пациент сначала получает лечение химиотерапевтическим агентом, ингибирующим или уничтожающим другие иммунные клетки, а затем фармацевтической композицией, описанной в настоящем документе. В некоторых случаях можно полностью избежать использования химиотерапии.
В любом из вариантов осуществления, описанных в настоящем документе, способы согласно настоящему изобретению используют в отношении субъекта, который ранее получал лечение CD20-специфичной связывающей молекулой, необязательно где CD20-специфичная связывающая молекула представляет собой ритуксимаб, офатумумаб, окрелизумаб, ублитуксимаб, велтузумаб или любую их комбинацию; или химиотерапевтическим агентом (например, схемой CHOP [циклофосфамид-гидроксидаунорубицин-онковин-преднизон], CHOP-R [R представляет собой ритуксимаб], или CHOEP или CHOEP-R [E представляет собой этопозид]); или ингибитором иммуносупрессивного компонента (например, антителом к PD-1, PD-L1, CTLA4 или т.п.).
Введение некоторых соединений согласно настоящему изобретению (например, антител, химиотерапевтических агентов или иммуномодуляторов) или их фармацевтически приемлемых солей в чистом виде или в составе соответствующей фармацевтической композиции может быть выполнено любым способом введения для агентов, выполняющих схожие функции. Фармацевтические композиции согласно настоящему изобретению могут быть получены путем объединения соединения согласно настоящему изобретению с подходящим фармацевтически приемлемым носителем, разбавителем или эксципиентом, и могут быть приготовлены в виде препаратов в твердой, полутвердой, жидкой или газообразной форме, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, инъекции, ингаляты, гели, микросферы и аэрозоли. Примеры путей введения таких фармацевтических композиций включают пероральный, местный, трансдермальный, ингаляцинный, парентеральный, сублингвальный, буккальный, ректальный, вагинальный или интраназальный.
Термин «парентеральный», как употреблено в настоящем документе, включает подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекции или способы инфузии. Фармацевтические композиции согласно настоящему изобретению (например, химиотерапевтические агенты или иммуномодуляторы) составляют таким образом, чтобы содержащиеся в них активные ингредиенты оставались биологически доступными при введении композиции пациенту. Композиции, которые вводят субъекту или пациенту, имеют форму одной или более единиц дозирования, где, например, таблетка может представлять собой одну единицу дозирования, а упаковка с соединением согласно настоящему изобретению в виде аэрозоля может содержать множество единиц дозирования. Актуальные способы получения таких лекарственных форм известны или будут очевидны специалистам в данной области техники (см. например, Remington: The Science and Practice of Pharmacy, 22nd Edition (Pharmaceutical Press, 2012). Композиция, подлежащая введению, в любом случае будет содержать терапевтически эффективное количество соединения согласно настоящему изобретению или его фармацевтически приемлемой соли для терапевтических способов в соответствии с принципами, изложенными в настоящем документе.
В качестве твердой композиции для перорального введения фармацевтическая композиция может быть приготовлена в виде порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резинки, капсул-имплантатов или в подобной форме. Примеры твердых композиций могут включать один или более инертных разбавителей или пищевых носителей. Кроме того, могут присутствовать одна или более добавок, включая связующие вещества, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиенты, такие как крахмал, лактоза или декстрины, разрыхлители, такие как альгиновая кислота, альгинат натрия, Primogel, кукурузный крахмал и т.п.; лубриканты, такие как стеарат магния или Sterotex; скользящие вещества, такие как коллоидный диоксид кремния; подсластители, такие как сахароза и сахарин; вкусоароматические добавки, такие как перечная мята, метилсалицилат или добавка со вкусом апельсина; или краситель. В случае, когда фармацевтическая композиция имеет форму капсулы, такой как желатиновая капсула, она может содержать в дополнение к типам материалов, упомянутым выше, жидкий носитель, такой как полиэтиленглиоль или масло, или их комбинации.
Фармацевтическая композиция может иметь форму жидкости, такой как эликсир, сироп, раствор, эмульсия или суспензия. В качестве двух примеров, в некоторых вариантах осуществления жидкая композиция может быть приготовлена для перорального введения или для доставки посредством инъекции. В случае, когда композиция предназначена для перорального введения, иллюстративные композиции могут содержать, в дополнение к одному или более соединениям согласно настоящему изобретению, подсластитель, консервант, окрашивающее вещество/краситель, усилитель вкуса или любую их комбинацию.
Жидкие фармацевтические композиции согласно настоящему изобретению, будь то растворы, суспензии или другие подобные формы, могут дополнительно содержать адъюванты, включая стерильные разбавители, такие как вода для инъекций, раствор хлорида натрия, предпочтительно физиологический раствор, раствор Рингера, изотонический хлорид натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующий среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; комплексообразующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА); буферы, такие как ацетаты, цитраты или фосфаты и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть помещен в ампулы, шприцы для одноразового использования или флаконы, содержащие несколько доз, изготовленные из стекла или пластика. Физиологический раствор представляет собой предпочтительный адъювант. Инъекционная фармацевтическая композиция предпочтительно стерильна.
Фармацевтическая композиция согласно настоящему изобретению может быть предназначена для местного введения, в этом случае носитель может содержать подходящий раствор, эмульсию, мазь, гелевую основу или любую их комбинацию. Основа, например, может содержать вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, эмульгаторы, стабилизаторы или любую их комбинацию. Загустители могут присутствовать в фармацевтической композиции согласно настоящему изобретению для местного введения. Если композиция предназначена для трансдермального введения, она может включать трансдермальный пластырь или устройство для ионтофореза.
Фармацевтическая композиция согласно настоящему изобретению может быть предназначена для ректального введения, например, в форме суппозиториев, которые будут плавиться в прямой кишке и высвобождать активное(ые) соединение(ия). Композиция для ректального введения может содержать масляную основу в качестве подходящего нераздражающего эксципиента. Примеры основ включают ланолин, какао-масло, полиэтиленгликоль или любую их комбинацию.
Фармацевтическая композиция согласно настоящему изобретению может включать различные материалы, модифицирующие физическую форму твердой или жидкой лекарственной формы. Например, композиция может включать материалы, которые образующие покрывающую оболочку вокруг активного(ых) ингредиента(ов). Иллюстративные материалы для образования покрывающей оболочки могут быть инертными, такими как сахар, шеллак или другие кишечнорастворимые покрывающие агенты. В качестве альтернативы, активный(ые) ингредиент(ы) может(гут) быть заключен(ы) в желатиновую капсулу.
В некоторых вариантах осуществления соединения и композиции согласно настоящему изобретению могут быть в форме твердого вещества или жидкости. Иллюстративные твердые или жидкие препараты включают полутвердые, полужидкие, суспензионные и гелевые формы. Фармацевтическая композиция согласно настоящему изобретению в твердой или жидкой форме может дополнительно включать агент, который связывается с соединением согласно настоящему изобретению и таким образом способствует доставке соединения. Подходящие агенты, которые могут действовать таким образом, включают моноклональное или поликлональное антитело, белок или липосому.
Фармацевтическая композиция согласно настоящему изобретению может состоять из лекарственных форм, которые могут введены в виде аэрозоля. Термин «аэрозоль» применяют для обозначения ряда систем, варьирующих от имеющих коллоидную природу до систем, состоящих из аэрозольных упаковок. Доставка может быть осуществлена посредством сжиженного или сжатого газа, или при помощи подходящей насосной системы, распыляющей активные ингредиенты. Аэрозоли соединений согласно настоящему изобретению могут быть доставлены в виде однофазной, двухфазной или трехфазной систем для доставки активного(ых) ингредиента(ов). Доставка аэрозоля включает необходимый контейнер, активаторы, клапаны, субконтейнеры и т.п., которые вместе могут образовывать набор.
Фармацевтические композиции согласно настоящему изобретению могут быть получены при помощи способов, хорошо известных в области фармацевтики. Например, фармацевтическая композиция, предназначенная для введения посредством инъекции, может быть получена путем объединения соединения согласно настоящему изобретению со стерильной дистиллированной водой с образованием раствора. Может быть добавлено поверхностно-активное вещество для образования гомогенного раствора или суспензии. Поверхностно-активные вещества представляют собой соединения, нековалентно взаимодействующие с соединением согласно настоящему изобретению для усиления растворения или гомогенного суспендирования соединения в водной системе доставки.
Соединения согласно настоящему изобретению или их фармацевтически приемлемые соли вводят в терапевтически эффективном количестве, которое различается в зависимости от различных факторов, включая активность конкретного используемого соединения, метаболическую стабильность и длительность действия соединения, возраст, массу тела, общее состояние здоровья, пол и питание пациента, способ и время введения, скорость экскреции, комбинацию лекарственных средств, тяжесть конкретного расстройства или состояния, и субъекта, получающего терапию. После применения терапии согласно препаратам и способам согласно настоящему изобретению у испытуемых субъектов будет проявляться уменьшение, составляющее от приблизительно 10% до приблизительно 99%, одного или более симптомов, ассоциированных с заболеванием или расстройством, подлежащим лечению, по сравнению с субъектами, получавшими плацебо или другими подходящими контрольными субъектами.
Соединения согласно настоящему изобретению или их фармацевтически приемлемые производные также могут быть введены одновременно с, до или после введения одного или более других терапевтических агентов. Такая комбинированная терапия включает введение одной лекарственной формы, содержащей соединение согласно настоящему изобретению и один или более дополнительных активных агентов, а также введение соединения согласно настоящему изобретению и каждого активного агента в его собственной отдельной лекарственной форме. Например, соединение согласно настоящему изобретению и другой активный ингредиент могут быть введены пациенту вместе в одной пероральной композиции, такой как таблетка или капсула, или каждый агент вводят в отдельных пероральных лекарственных формах. В случае применения отдельных лекарственных форм соединения согласно настоящему изобретению и один или более дополнительных активных агентов могут быть введены в по существу одно и тоже время, т.е. параллельно, или в отдаленные друг от друга моменты времени, т.е. последовательно; подразумевается, что комбинированная терапия включает все данные схемы.
Специалистам в данной области техники будет ясно, что в способе, описанном в настоящем документе, может быть необходимо защищать функциональные группы промежуточных соединений подходящими защитными группами. Такие функциональные группы включают гидрокси, амино, меркапто и карбоновую кислоту. Подходящие защитные группы для гидрокси включают триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и т.п. Подходящие защитные группы для амино, амидино и гуанидино включают трет-бутоксикарбонил, бензилоксикарбонил или т.п. Подходящие защитные группы для меркапто включают C(O)R» (где R» представляет собой алкил, арил или арилалкил), пара-метоксибензил, тритил или т.п. Подходящие защитные группы для карбоновой кислоты включают алкиловые, ариловые или арилалкиловые сложные эфиры. Защитные группы могут быть добавлены или удалены в соответствии со стандартными спсообами, известными специалистам в данной области техники, и как описано в настоящем документе. Применение защитных групп подробно описано в источнике Green, T.W. and P.G.M. Wutz, Protective Groups in Organic Synthesis (1999), 3rd Ed., Wiley. Как будет ясно специалистам в данной области техники, защитная группа также может представлять собой полимерную смолу, такую как смола Ванга, смола Ринка или 2-хлортритил-хлоридная смола.
Специалистам в данной области техники будет ясно, что хотя такие защищенные производные соединений согласно настоящему изобретению могут не обладать фармакологической активностью как таковые, они могут быть введены млекопитающему и затем метаболизироваться в организме с образованием соединений согласно настоящему изобретению, которые являются фармакологически активными. Поэтому такие производные могут быть описаны как «пролекарства». В некоторых вариантах осуществления соединения согласно настоящему изобретению имеют форму пролекарств.
Более того, все соединения согласно настоящему изобретению, которые существуют в виде свободного основания или кислоты, могут быть превращены в их фармацевтически приемлемые соли при помощи обработки подходящим неорганическим или органическим основанием посредством способов, известных специалистам в данной области техники. Соли соединений согласно настоящему изобретению могут быть превращены в форму их свободных оснований или кислот посредством стандартных способов.
В случае трансформированных клеток-хозяев, экспрессирующих слитый белок согласно настоящему изобретению, введение может быть осуществлено с использованием отдельных аликвот клеток. В некоторых вариантах осуществления трансформированные клетки-хозяева включают Т-клетки, которые могут включать CD4+ T-клетки, CD8+ T-клетки или и те, и те. В некоторых вариантах осуществления Т-клетки содержат гетерологичную нуклеиновую кислоту, кодирующую химерный антигенный рецептор (CAR). В некоторых вариантах осуществления Т-клетки сортируют для обеспечения соотношения CD4+ и CD8+ CAR T-клеток к CD20, равного 1:1, для введения субъекту. Клетки могут быть введены внутривенно в течение приблизительно 20-30 минут в конкретной дозе клеток для каждого субъекта. Конкретные дозы клеток могут быть определены на основании уровня экспрессии маркера трансдукции, который экспрессируется в векторе координированно со слитым белком. Например, в некоторых вариантах осуществления T-клетку трансформируют при помощи одного или более векторов, координированно экспрессирующих усеченный маркер трансдукции CD19 и CAR. Примеры уровней доз CAR Т-клеток к CD20 для применения в различных вариантах осуществления настоящего изобретения приведены в Таблице 1 ниже.
Таблица 1. Препарат и инфузия CAR Т-клеток к CD20
* на кг массы реципиента; **верхний предел на уровень дозы ±15%.
В некоторых вариантах осуществления клетки получают из продукта аутологичных мононуклеарных клеток периферической крови (МНПК), получаемого от субъекта посредством стандартного лейкафереза немобилизованной крови. Для обогащения CD8+ клетками или CD4+ T-клетками может быть применено иммуномагнитное разделение. В некоторых вариантах осуществления обогащение CD8+ клетками и CD4+ T-клетками осуществляют по отдельности, и каждую субпопуляцию по отдельности стимулируют при помощи, например, парамагнитных гранул с антителом к CD3/CD28, с последующей трансдукцией вектором (например, лентивирусным вектором), кодирующим слитый белок и необязательно маркер трансдукции, такой как, например, маркер трансдукции tCD19. Трансдуцированные Т-клетки могут быть размножены, затем повторно стимулированы при помощи линии клеток-мишеней, экспрессирующих CD20, для ускорения роста, дополнительно размножены ex vivo, и затем использованы для получения препарата с определенной дозой клеток для инфузии. Например, в некоторых вариантах осуществления CAR Т-клетки к CD20 (например,1.5.3-NQ-28-BB-z) согласно настоящему изобретению могут быть получены способом, включающим:
1. Обогащение CD4+ T-клетками из фракции лейкаферезного продукта или мононуклеарных клеток периферической крови (МНПК) из цельной крови.
2. Параллельно с обогащением CD4+ T-клетками, обогащение CD8+ T-клетками из оставшегося лейкаферезного продукта или МНПК.
3. Стимуляцию обогащенных CD4+ и CD8+ клеток в отдельных культурах клинически применимыми парамагнитными гранулами, покрытыми антителом к CD3 и CD28 (гранулы с антителом к CD3/CD28), в среде RPMI 1640 с добавкой глутамина, β-меркаптоэтанола и фетальной бычьей сыворотки (среда CTL + 10% FBS), 50 МЕ/мл IL-2.
4. Трансдукцию CD4+ и CD8+ клеток при помощи лентивирусного вектора 1.5.3-NQ-28-BB-z CAR на первый день после стимуляции гранулами с антителом к CD3/CD28.
5. Размножение трансдуцированнных CD4+ и CD8+ T-клеток в среде CTL c 10% FBS и 50 МЕ/мл IL-2.
6. Двукратное удаление гранул с антителом к CD3/CD28 при помощи магнитного воздействия на 4 день после стимуляции гранулами с антителом к CD3/CD28.
7. Стимуляцию при помощи облученной клинически применимой линии трансформированных CD20+ B-клеток (TM-LCL) на 7 день после стимуляции гранулами с антителом к CD3/CD28. Эта стадия может быть пропущена, если количество клеток, подсчитываемое в ходе процесса, на 7 день позволяет предсказать достаточное размножение клеток без стимуляции TM-LCL.
8. Размножение CD4+ и CD8+ клеток во флаконах G-Rex со средой CTL с 10% FBS и 50 МЕ/мл IL-2.
9. Сбор клеток каждой субпопуляции на 15 день (диапазон 13-17) после стимуляции гранулами с антителом к CD3/CD28 и получение комбинированного продукта CD4+/CD8+ T-клеток для криоконсервации или инфузии.
10. Сбор образцов каждых из CD8+ и CD4+ T-клеток в соответствующие моменты времени в ходе процесса получения для проведения анализа высвобождения в ходе процесса и после его окончания.
11. Введение пациенту путем внутривенной инфузии в указанной дозе в соотношении tCD19+ CD4+ и tCD19+ CD8+ T-клеток, равном 1:1. Субъекты предварительно будут получать лечение лимфоистощающей химиотерапией и получать инфузии Т-клеток по меньшей мере спустя 36 часов после завершения химиотерапии.
В некоторых вариантах осуществления клетки, полученные для субъекта, могут быть предоставлены в виде свежих клеток непосредственно после получения, или могут быть сначала быть криоконсервированы и хранится в морозильной камере с жидким азотом, после чего размороженные оттаиванием клетки промывают для удаления остаточного криозащитного вещества, а затем используют для приготовления инфузии. Общее число клеток будет достаточным, чтобы нивелировать потерю клеток в ходе восстановления от оттаивания и достичь уровня дозы клеток, указанного в клиническом протоколе. В некоторых вариантах осуществления, включающих как CD4+, так и CD8+ T-клетки, общее соотношение CD4+ и CD8+ T-клеток может отличаться от 1:1 из-за различий в трансдукции отдельных субпопуляций у отдельных субъектов. По этим причинам субпопуляции могут быть трансдуцированы по отдельности для достижения желаемого состава трансдуцированных Т-клеток. CAR Т-клетки к CD4 и CD8 демонстрировали синергетические действия в моделях на животных (Sommermeyer et al., Leukemia 2015).
Трансформированные клетки могут быть суспендированы в соответствующей среде для криоконсервации (например, CryoStor CS10®) для проведения криоконсервации в программируемом криозамораживателе. Криоконсервированные клетки могут храниться в газовой фазе морозильной камеры с жидким азотом. Свежие или размороженные оттаиванием клетки затем могут быть повторно супендированы в Normosol + 1% HSA (сывороточного альбумина человека) и перенесены в транспортный контейнер при общем уровне дозы клеток, указанном в клиническом протоколе. Приготовленный продукт может храниться при 2-8°C и затем быть перенесен при соответствующих условиях в место клинического применения.
После лейкафереза субъекты могут получать циторедуктивную химиотерапию для контроля заболевания в течение получения трансформированных клеток. Например, в некоторых вариантах осуществления субъект может получать химиотерапию низкой интенсивности (например, леналидомид, ибрутиниб) после лейкафереза. Перед введением трансформированных клеток согласно настоящему изобретению может быть целесообразным проведение химиотерапии или иммуномодулирующей терапии с целью обеспечить лимфоистощение для способствования выживанию перенесенных Т-клеток и уменьшить опухолевую массу перед инфузией клеток. Например, субъекты могут получать лимфоистощающую химиотерапию в течение предварительно установленного периода времени (например, 36-96 часов) перед инфузией клеток. В некоторых вариантах осуществления субъект может изначально получать лечение разовой дозой химиотерапевтического агента, такого как циклофосфамид (CY) в/в (например, 1 г/м2). Однако если частоту ответа субъекта определяют как неадекватную, схема лимфоистощения может быть изменена так, чтобы последующие пациенты получали второй, дополнительный химиотерапевтический или иммунномодулирующий агент (например, CY + флударабин). Кроме того, субъект может, но не обязательно должен, получать премедикацию перед введением клеток.
Одна или более внутривенных инфузий клеток, описанных в настоящем документе, может быть введена субъекту после завершения лимфоистощающей химиотерапии (например, спустя 36-96 часов). Доза клеток, вводимая субъекту, может быть определена согласно уровням доз, приведенным в таблице 1, и она может быть скорректирована впоследствии путем повышения, снижения или иным образом изменения количества, состава, соотношения или расхода вводимых клеток. В некоторых вариантах осуществления субъекту вводят однократную инфузию. В других вариантах осуществления может быть сделана вторая инфузия, если первая инфузия не вызвала полный ответ (ПО), или если заболевание рецидивирует после ПО. В других вариантах осуществления могут быть сделаны третья, четвертая, пятая, шестая, седьмая, восьмая, девятая или более инфузия. В некоторых вариантах осуществления инфузия клеток может быть введена внутривенно в течение выбранного периода времени (например, приблизительно 20-30 минут), скорректирована в случае необходимости в соответствии с нормами предельных значений эндотоксинов для парентеральных лекарственных средств (5 USP ЕЭ/кг/час (USP ЕЭ – единица эндотоксина Фармакопеи США)). Скорость инфузии также может быть скорректирована, если субъект испытывает легкие инфузионные реакции (2 степени или ниже).
ПРИМЕРЫ
Пример 1
Материалы и способы
Линии клеток
Линии опухолевых клеток Raji, Daudi и Ramos (лимфома Беркитта), Rec-1 (мантийноклеточная лимфома) и K562 (CD20-негативный эритроидный лейкоз) получали от ATCC. Granta-519 (мантийноклеточная лимфома) получали от DSMZ, а FL-18 (трансформированная фолликулярная лимфома) получали от доктора Дэвида Мэлони (David Maloney) (Центр исследования раковых заболеваний Фреда Хатчинсона). Экспрессию CD20 устанавливали при помощи проточной цитометрии для всех линий клеток перед проведением экспериментов. Линии клеток культивировали в RPMI 1640 с 25 мМ HEPES, 10% фетальной бычьей сыворотки (FBS), 1% пенициллин/стрептомицина и 1% L-глутамина и инкубировали при 37 ˚C в 5% CO2. Клетки K562 трансдуцировали ретровирусным вектором для экспрессии CD20, и некоторые клетки вновь трансдуцировали лентивирусным вектором для экспрессии человеческого CD80. Линии клеток K562-CD80 с низкой, средней и высокой экспрессией CD20 получали посредством селекции после клонирования методом предельных разведений. Клетки Raji-ffLuc получали посредством трансдукции клеток Raji ретровирусом, кодирующим люциферазу светлячков-Thy1.1-Neo, и отбирали при помощи G418, как описано ранее (James et al., Blood 2009;114(27):5454-63). Ритуксимаб-рефрактерные клетки Raji-ffLuc получали при помощи повторяющихся прерывающихся циклов увеличения концентраций ритуксимаба, как описано ранее (Czuczman et al., Clin Cancer Res 2008;14(5):1561-70).
Проточная цитометрия
Клетки линии Ramos инкубировали с концентрациями ритуксимаба, составляющими от 0 до 200 мкг/мл, при комнатной температуре в течение 30 минут. После блокирования CD20 добавляли конъюгированное с PE антитело к CD20 (клон L27 [Leu16], BD Biosciences) и инкубировали клетки при 4°C или при 37°C в течение 30 минут. Клетки промывали холодным буфером FACS (0,5% фетальной бычьей сыворотки и 2,5 мМ ЭДТА в PBS) и анализировали на проточном цитометре BD Canto 2. Данные анализировали при помощи FlowJo версии 7.6.1 (TreeStar). В отдельном эксперименте клетки FL-18 блокировали различными концентрациями ритуксимаба, промывали один раз буфером FACS и затем добавляли конъюгированные с FITC антитела к CD20 (клон 1F5, полученные внутрилабораторно из гибридомы; Press et al., Blood 1987;69(2):584-91) и инкубировали с блокированными клетками в течение 15 минут при 4°C. Затем клетки промывали и анализировали, как описано выше. Аналогичные эксперименты также проводили, используя офатумумаб вместо ритуксимаба.
Векторные конструкции
CD20-специфичную конструкцию Leu16-28-BB-z-tEGFR (SEQ ID NO:57) получали путем амплифиации scFv Leu16 (Wang et al., Hum Gene Ther 2007;18(8):712-25; Wang et al., Mol Ther 2004;9(4):577-86) при помощи ПЦР и клонирования в сайты NheI и RsrII лентивирусного вектора epHIV7, кодирующего домены IgG4-Fc, CD28 и 41BB и домен CD3ζ (Hudecek et al., Clin Cancer Res 2013; 19(12):3153-64). Конструкцию Leu1628-z (SEQ ID NO:49 или 58) получали при помощи ПЦР по методу перекрывающегося сплайсинг-расширения вектора Leu16-28-BB-z-tEGFR для удаления домена 41BB и усеченного EGFR. Лентивирусный вектор, кодирующий CD20-специфичный 1F5-28-BB-z CAR, ранее был описан (Budde et al., PLoS One 2013;8(12):e82742), но был перенесен на скелет самоинактивирующегося лентивирусного вектора третьего поколения RRL.sin.cPPT.PGK.GFP.wpre на основе ВИЧ-1 (Becker et al., Gene Ther 2010;17(10):1244-52; от доктора Ганс-Питер Ким (Hans-Peter Kiem), FHCRC). Спейсер Fc-фрагмента данной конструкции модифицировали для подавления связывания с Fcγ-рецепторами посредством замены соединяющих аминокислот IgG1 соединяющими аминокислотами IgG2 (SEQ ID NO:9) и добавления мутации N297Q (SEQ ID NO:10), как описано ранее (Hudecek et al., Cancer immunology research 2014; 3(2):125-35; Hombach et al., Gene Ther 2010;17(10):1206-13), для создания конструкции 1F5-NQ-28-BB-z (SEQ ID NO:50 или 59). Для получения конструкции 1.5.3-NQ-28-BB-z CAR (SEQ ID NO:44 или 53) получали новую последовательность scFv путем синтеза последовательностей VL и VH из полностью человеческого антитела 1.5.3 к CD20 (см. например, Bornstein et al., Invest New Drugs 2010;28(5):561-74; публикация PCT заявки № WO 2006/130458) при помощи алгоритма кодонной оптимизации (GenScript), разделенных глицин-сериновым линкером из 15 аминокислот (SEQ ID NO:20), которому предшествовал сигнальный пептид GM-CSF (SEQ ID NO:18). Перекрывающийся фрагмент, полученный посредством ПЦР по методу перекрывающегося сплайсинг-расширения, использовали для замены домена scFv конструкции 1F5-NQ-28-BB-z, клонируя его в сайты рестрикции AgeI/SacII. Индуцируемый суицидальный ген каспазы 9 и расположенную ниже последовательность 2A (SEQ ID NO:22 или 23) удаляли из данной конструкции посредством ПЦР по методу перекрывающегося сплайсинг-расширения. Конструкцию 1.5.3-NQ-28-z (SEQ ID NO:27) получали при помощи удаления домена 41BB из 1.5.3-NQ-28-BB-z с помощью ПЦР по методу перекрывающегося сплайсинг-расширения. Все конструкции подтверждали при помощи секвенирвания по Сэнгеру. Лентивирус получали, используя клетки 293T, временно трансфицированные описанными каркасными векторами, а также упаковывающими векторами pCGHP-2, pCMV-Rev2 и pCMV-G, и супернатанты, содержащие упакованный лентивирус, концентрировали в 100 раз при помощи центрифугирования.
Выделение и трансдукция Т-клеток
Мононуклеарные клетки периферической крови (МНПК) получали при помощи афереза от здоровых доноров, в соответствии с исследовательскими протоколами, одобренными экспертным советом (IRB) при Центре исследований раковых заболеваний Фреда Хатчинсона (FHCRC) или из лейкоцитарных фильтров Pall, приобретенных в центре по переливанию крови (Puget Sound Blood Center). МНПК, выделенные при помощи центрифугирования в среде с градиентом плотности фиколл-пак, подвергали лизису эритроцитов при помощи буфера ACK (хлорид аммония-калий) и криоконсервировали в 10% ДМСО и 90% FBS. Для экспериментов in vitro Т-клетки негативно отбирали из размороженных оттаиванием МНПК посредством активируемой магнитным полем сортировки клеток (MACS) с применением набора Pan T cell Isolation Kit II (Miltenyi Biotec). Для исследований цитотоксичности CD8+ T-клетки перед криоконсервацией позитивно отбирали из МНПК, полученных при помощи афереза от здоровых доноров, посредством MACS при помощи гранул, покрытых антителом к CD8 (Miltenyi Biotec). Для некоторых экспериментов центральные Т-клетки памяти (TCM) перед криоконсервацией выделяли из МНПК, полученных при помощи афереза от здоровых доноров, посредством негативной селекции при помощи устройства AutoMACS после инкубации с гранулами CliniMACS с антителом к CD14 и CD45RA (Miltenyi Biotec), с последующей позитивной селекцией при помощи гранул CliniMACS CD62L. В других экспериментах CD4 и CD8 клетки обогащали посредством позитивного иммуномагнитного разделения при помощи гранул с антителом к CD4 или CD8 (Miltenyi Biotec). Выбранные Т-клетки стимулировали гранулами, покрытыми антителом к αCD3/αCD28 для размножения T-клеток человека (Invitrogen) в соотношении гранулы:T-клетки, составлявшем 3:1. Активированные Т-клетки на следующий день трансдуцировали при помощи центрифугирования (2100 об/мин в течение 60 минут при 32°C) лентивирусным вектором, кодирующим одну из конструкций CAR к CD20 (множественность заражения 2-6) с 4-8 мкг/мл полибрена. Трансдуцированные Т-клетки культивировали в среде, содержащей 50 МЕ/мл рекомбинантного человеческого интерлейкина 2 (rhIL-2), с 10 нг/мл rhIL-15 (Miltenyi Biotec) или без него, инкубировали в течение 4-5 дней после стимуляции до магнитного удаления гранул с антителами к αCD3/αCD28 и анализировали посредством проточной цитометрии для подтверждения экспрессии CAR. CAR+ T-клетки использовали в функциональных исследованиях.
Для экспериментов in vivo на мышах TCM или CD4- и CD8-обогащенные Т-клетки размораживали оттаиванием, активировали и на следующий день трансдуцировали концентрированным супернатантом лентивируса, кодирующего конструкцию, указанную в каждом эксперименте. Гранулы с антителом к CD3/CD28 удаляли на 5 день, клетки размножали в 50 МЕ/мл rhIL-2, повторно стимулировали на 7-10 день облученными CD20+ LCL в соотношении респондер:стимулятор, равном 1:1, и вводили мышам через 8-11 дней после повторной стимуляции LCL.
Исследования пролиферации и секреции цитокинов
T-клетки (всего 2×105 клеток), окрашенные при помощи 5 мкмоль сукцинимидилового сложного эфира карбоксифлуоресцеина (CFSE), затем совместно культивировали в соотношении 1:1 с опухолевыми линиями-мишенями, облученными 8000-10000 сГр. В экспериментах по блокированию ритуксимабом облученные клетки-мишени инкубировали в течение 30 минут при комнатной температуре с различными концентрациями ритуксимаба перед совместной инкубацией с Т-клетками. Супернатант собирали через 24 часа после выращивания и хранили при -20°C до последующего анализа цитокинов при помощи исследования Luminex, как описано ранее (Till et al., Blood 2012;119(17):3940-50) для определения количества интерферона-гамма (IFN-γ), интерлейкина-2 (IL-2) и TNF-α. Спустя 4-5 дней клетки окрашивали при помощи антител к CD3, меченных APC (BioLegend), и определяли с помощью проточной цитометрии разведение CFSE отобранных CD3 лимфоцитов в качестве меры пролиферации. Размер клеток в качестве другой меры активации определяли с помощью проточной цитометрии при помощи среднего геометрического параметра прямого светорассеяния (FSC-A) и вычитания размера не делящихся Т-клеток. Данные проточной цитометрии анализировали при помощи программного обеспечения FlowJo (v7.6.1; Treestar, Ashland, OR). В некоторых экспериментах офатумумаб заменяли ритуксимабом.
Оценку секреции цитокинов также проводили посредством внутриклеточного окрашивания IFN-γ. CAR+ CD4+ или CD8+ T-клетки к CD20 совместно культивировали с облученными клетками K562 или K562-CD20 в течение 24 часов. Для внутриклеточного окрашивания клетки фиксировали, пермеабилизировали при помощи набора BD Cytofix/Cytoperm kit (BD Biosciences) в течение 15 минут на льду. Затем клетки окрашивали антителами к IFN-γ (Biolegend) в течение 1 часа на льду после фиксации и пермеабилизации. Данные анализировали на BD FACSCanto (BD Biosciences). Для анализа данных использовали программное обеспечение FlowJo.
Исследования цитотоксичности
Стандартные исследования высвобождения 51Cr проводили при помощи совместной инкубации CD8+ CAR T-клеток к CD20 с мечеными 51Cr линиями клеток-мишеней в течение 4-5 часов, как описано ранее (см. Wang, et al. Hum Gene Ther. 2007;18:712-725). Максимальное высвобождение 51Cr определяли при помощи прямого измерения содержания 51Cr в супернатантах меченых клеток, лизированных при помощи 5% IGEPAL CA-630. Супернатанты собирали в 96-луночные планшеты Lumaplates, высушивали на воздухе в течение ночи и оценивали количество при помощи TopCount (PerkinElmer). Процент цитотоксичности вычисляли по формуле: [Образец - Минср] / [Максср – Минср]*100.
Для экспериментов по блокированию ритуксимабом меченые 51Cr линии клеток-мишеней инкубировали при различных концентрациях ритуксимаба (от 0 до 200 мкг/мл) в течение 30 минут (при концентрации, дважды превышающей конечную, в течение первой инкубации с получением конечных концентраций 10, 25, 50, 100 и 200 мкг/мл) перед добавлением CAR+CD8+ Т-клеток в различных соотношениях эффектор:мишень (Э:М). Клетки культивировали в двух параллельных опытах при 37 °C в течение 5 часов в среде, содержащей инактивированную нагреванием FBS, с мечеными 51Cr блокированными ритуксимабом клетками-мишенями в 96-луночных планшетах с U-образным дном. Контрольные лунки содержали клетки-мишени, инкубированные в ритуксимаб-содержащей среде без Т-клеток (обозначено на фигурах как соотношение Э:М «0:1») для исключения возможности ритуксимаб-индуцированной CDC. В некоторых экспериментах вместо ритуксимаба использовали офатумумаб.
In vivo оценка влияния ритуксимаба на эффективность CAR Т-клеток
Группам из 5-10 мышей NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NOD/SCID/γ-/- [NSG]) возрастом 6-10 недель (Jackson Laboratory) прививали 5 x 105 ритуксимаб-рефрактерных клеток лимфомы Raji-ffLuc или Granta-519 на день 2-7 в хвостовую вену. Спустя 2-7 дней (как указано для каждого эксперимента), 107 CAR Т-клеток к CD20 (tCD19+) или Т-клеток с пустым вектором вводили в хвостовую вену. В эксперименте по блокированию ритуксимабом 25 или 200 мкг ритуксимаба вводили внутрибрюшинно (в/б) спустя 5 дней после прививки опухоли и за 1 день до введения CAR Т-клеток. Биолюминесцентную визуализацию для определения роста опухолей проводили при помощи известных способов (см. James et al., Blood 2009;114(27):5454-63; Rufener et al., Cancer Immunol Res. 2016;4:509-519). Биннинг и экспозицию корректировали для достижения максимальной чувствительности без перенасыщения изображения. Кривые выживаемости получали при помощи способа Каплана-Майера посредством программного обеспечения GraphPad Prism 6.
Для исследования персистенции адоптивно перенесенных Т-клеток цельную кровь, собранную в различные моменты времени посредством кровопускания из ретроорбитального синуса, лизировали при помощи лизирующего буфера ACK (Quality Biological). Мышиную сыворотку получали посредством центрифугирования образцов коагулированной крови из ретроорбитального сплетения на 6 и 13 день после прививки опухоли, и измеряли сывороточные уровни ритуксимаба, как описано ранее (см. Gopal AK, et al., Blood 2008;112(3):830-5; Maloney DG, et al., Blood 1997;90(6):2188-95). Fc-рецепторы выделенных клеток блокировали при помощи внутривенного иммуноглобулина (IVIG), и клетки окрашивали моноклональными антителами (mAbs) к mCD45 (30-F11, Biolegend), hCD3 (HTT3a, Biolegend) и hCD19 (HIB19, BD Bioscience). Данные собирали при помощи BD Canto 2 и анализировали посредством программного обеспечения FlowJo (Treestar). Исследования на мышах были одобрены комитетом по содержанию и использованию лабораторных животных FHCRC.
Образцы сыворотки пациентов
Образцы человеческой сыворотки получали от пациентов с B-клеточной лимфомой после одобрения экспертным советом (IRB) и получения информированного согласия в соответствии с Хельсинкской декларацией. Образцы сыворотки собирали по прошествии 4 месяцев после ритуксимаб-содержащей резервной химиоиммунотерапии. Сывороточные концентрации ритуксимаба определяли, как описано ранее (Maloney et al., Blood 1997;90(6):2188-95).
Пример 2
Действие ритуксимаба на связывание CD20, осуществляемое CAR, содержащим scFv к CD20
CAR к CD20, полученные с использованием scFv из двух различных мышиных моноклональных антител, представляющих собой антитела Leu16 (L27; см. Till et al., Blood 2008;112(6):2261-71; Till et al., Blood 2012;119(17):3940-50) или 1F5 (см. Wang J, et al., Hum Gene Ther 2007;18(8):712-25; Budde et al., PLoS One 2013;8(12):e82742), каждое из которых связывается с эпитопами на большой внеклеточной петле молекулы CD20, тестировали ранее (см. Polyak et al., Blood 2002;99(9):3256-62). Эти эпитопы CD20 перекрываются с эпитопом ритуксимаба (см. Polyak et al., Blood 2002;99(9):3256-62), что дает основания предполагать, что ритуксимаб будет блокировать связывание этих CAR. При использовании проточной цитометрии способность различных концентраций ритуксимаба блокировать связывание антитела Leu16 к CD20 с CD20, экспрессируемым на клетках лимфомы Ramos, оценивали посредством предварительной инкубации данных клеток с ритуксимабом перед инкубацией с антителом Leu16. Наблюдалась дозозависимая блокада CD20 с почти полной блокадой при 50 мкг/мл ритуксимаба при 4°C. Но когда антитела к CD20, меченые РЕ (Leu16), инкубировали при физиологически значимой температуре 37°C, низкий уровень связывания CD20 наблюдался даже при 200 мкг/мл ритуксимаба (фиг. 2A-2F). Схожие результаты наблюдались в экспериментах с использованием антитела 1F5 к CD20 на клетках FL-18 (данные не приведены). Таким образом, ритуксимаб связывается с перекрывающимися эпитопами с CAR к CD20 согласно настоящему изобретению и потенциально способен мешать CAR Т-клеточной активности в отношении CD20+ клеток-мишеней.
Пример 3
Действие ритуксимаба на in vitro функцию CAR Т-клеток
Влияние блокирования CD20 ритуксимабом на функцию CAR Т-клеток к CD20 оценивали посредством измерения пролиферации, секреции цитокинов и цитотоксичности при помощи пяти различных лентивирусных конструкций CAR к CD20, после инкубации с различными линиями клеток CD20+ B-клеточной НХЛ. Конструкции CAR (фиг. 1A и 1B) представляли собой конструкции третьего поколения Leu16-28-BB-z-tEGFR и 1F5-28-BBz (см. Budde et al., PLoS One 2013;8(12):e82742), конструкцию второго поколения Leu16-28-z и два CAR к CD20 (1.5.3-NQ-28-BB-z и 1.5.3-NQ-28-z), полученные из полностью человеческого антитела 1.5.3 к CD20, которое также связывается с эпитопом, перекрывающимся с ритуксимабом (см. Bornstein et al., Invest New Drugs 2010;28(5):561-74). Экспрессия CAR обычно достигалась у 40-80% Т-клеток (данные не приведены).
Пролиферация CFSE-меченых CAR Т-клеток по большей части не изменялась при культивировании с различными линиями клеток-мишеней НХЛ (Raji, Daudi, Rec-1 и FL-18) в присутствии ритуксимаба. CAR Т-клетки, стимулированные при помощи клеток-мишеней в присутствии ритуксимаба в концентрациях до 200 мкг/мл, проявляли более 96% от пролиферации, наблюдаемой после стимуляции в отсутствие ритуксимаба (фиг. 3А). Другой мерой активации Т-клеток служил размер клеток (см. Grumont et al., Immunity 2004;21(1):19-30). CAR+ T-клетки анализировали посредством проточной цитометрии в отношении прямого светорассеяния для вычисления размера клеток, и было обнаружено, что после стимуляции опухолевыми клетками Raji, Daudi или Rec-1, предварительно инкубированными с ритуксимабом, CAR Т-клетки имели медианный размер, составлявший более 85% от размера контрольных клеток, не подвергнутых воздействию ритуксимаба (фиг. 3А). Т-клетки, инкубированные с клетками FL-18, проявляли немного более явное, но все еще умеренное снижение размера клеток после инкубации с ритуксимабом (73% от размера контрольных клеток при 200 мкг/мл).
В отличие от пролиферации, было обнаружено, что секреция цитокинов CAR Т-клетками была понижена в присутствии возрастающих уровней ритуксимаба (фиг. 3B). Однако, даже при 100 мкг/мл ритуксимаба цитокины IFN-γ, IL-2 и TNF-α продуцировались на уровне 34-51%, 70-92% и 79-108% от исходных уровней, соответственно. Схожие результаты наблюдали при использовании в качестве мишеней клеток K562, генетически модифицированных для экспрессии CD80 и CD20, с CD20-отрицательными клетками K562-CD80 в качестве контроля для демонстрации антигенспецифичности активности CAR Т-клеток к CD20 (фиг. 6A и 6B).
Также изучали влияние ритуксимаба на цитолитическую активность CAR+ T-клеток против различных линий клеток-мишеней CD20+ НХЛ. При помощи стандартных исследований высвобождения 51Cr с CAR+/CD8+ T-клетками в качестве эффекторов и Raji, FL-18, Granta или Rec-1 в качестве мишеней, было обнаружено, что цитотоксичность была минимально изменена при концентрациях ритуксимаба до 50 мкг/мл (фиг. 4), и более 65% от исходной цитолитической активности сохранялось при концентрациях ритуксимаба 100 мкг/мл в отношении всех исследуемых линий клеток-мишеней.
In vitro функциональные свойства полностью человеческих 1.5.3-NQ-28-z и 1.5.3-NQ-28-BB-z CAR Т-клеток исследовали в присутствии ритуксимаба. Как и в случае с Leu16 и 1F5 CAR, наблюдалось умеренное дозозависимое снижение в секреции цитокинов и цитотоксичности в отношении клеток-мишеней, предварительно обработанных ритуксимабом, но не пролиферации.
Пример 4
Влияние уровней экспрессии CD20 на чувствительность CAR Т-клеток в отношении CD20
Для изучения того, может ли уровень экспрессии CD20 на опухолевых клетках влиять на чувствительность к блокаде ритуксимабом, для исследования выбирали линии клеток K562-CD80 с низкими, средними и высокими уровнями экспрессии CD20 после клонирования методом предельных разведений (фиг. 10). In vitro функцию CAR Т-клеток повторно оценивали в присутствии различных концентраций ритуксимаба. Как и в случае с линиями клеток НХЛ, пролиферация CAR Т-клеток была полностью неизменной независимо от уровня экспрессии CD20 на клетках-мишенях (фиг. 5A). Размер клеток не был уменьшен при использовании в качестве мишеней клеток с CD20выс, хотя умеренное снижение размера клеток наблюдалось для клеток с более низкими уровнями экспрессии CD20. В отличие от пролиферации и размера клеток, секреция цитокинов была существенно изменена при стимуляции клетками-мишенями CD20низк, где уровни IFN-γ, IL-2 и TNF-α составили всего лишь 5%, 17% и 22% от исходных значений, соответственно, при 100-200 мкг/мл ритуксимаба (фиг. 5B; фиг. 11A-11E), тогда как Т-клетки, стимулированные мишенями с CD20выс, сохраняли более 75% от исходной активности при концентрациях ритуксимаба 100 мкг/мл.
Влияние плотности антигена CD20 на опосредованное ритуксимабом ингибирование цитолитической активности CAR Т-клеток показано на фиг. 5C. Т-клеточный цитолиз клеток-мишеней с высокими уровнями экспрессии CD20 был минимально изменен ритуксимабом, даже при низких соотношениях Э:М. Однако наблюдалось дозозависимое снижение Т-клеточной цитотоксичности в отношении мишеней K562-CD80 с CD20низк и CD20средн, которое было наиболее выраженным при более низких соотношениях эффектор:мишень (Э:М). Цитолитическая активность в отношении мишеней с CD20низк сохранялась на уровне 47% от исходного при соотношении Э:М, равном 50:1, при 200 мкг/мл ритуксимаба, но составляла только 16% от исходного при соотношении Э:М, равном 2:1.
Пример 5
In vivo противоопухолевая активность CAR Т-клеток к CD20 в присутствии остаточного ритуксимаба
Приведенные выше эксперименты in vitro показали, что CAR Т-клетки к CD20 сохраняют значительную функциональную активность в отношении опухолей CD20+ несмотря на присутствие средних уровней ритуксимаба. Для оценки того, будут ли эти результаты наблюдаться в условиях in vivo, изучали влияние остаточного ритуксимаба на активность CAR Т-клеток в мышиной модели лимфомы.
В качестве общей информации, ритуксимаб в качестве единственного агента обладает существенной противоопухолевой активностью в отношении клеток Raji в ксенотрансплантатных моделях у мышей с ослабленным иммунитетом (см. Hernandez-Ilizaliturri FJ, et al., Clin Cancer Res 2003;9(16 Pt 1):5866-73). Для преодоления потенциального затрудняющего интерпретацию терапевтического эффекта ритуксимаба в экспериментах с комбинированной терапией получали ритуксимаб-рефрактерную линию клеток Raji (RR-Raji) ранее описанными способами (см. Czuczman MS, et al., Clin Cancer Res 2008;14(5):1561-70), и было обнаружено, что в данной линии клеток сохранялась экспрессия CD20 (фиг. 12).
Мышам NSG в/в прививали клетки RR-Raji, и некоторые группы лечили при помощи высоких или низких доз ритуксимаба, как только опухоли образовывались спустя 5 дней после прививки, и затем на следующий день в/в вводили CAR+ T-клетки к CD20 (фиг. 7A). Мыши, получавшие только ритуксимаб, демонстрировали умеренное временное противоопухолевое действие, но все умирали от прогрессирования опухоли к 24 дню, в то время как мыши, получившие только CAR Т-клетки, демонстрировали значительную регрессию опухоли, с эрадикацией опухоли у 40% мышей и удвоением медианы выживаемости (52 дня). Мыши, получившие ритуксимаб в день, предшествующий инфузии Т-клеток, не демонстрировали уменьшенной активности CAR Т-клеток in vivo по сравнению с мышами, получившими только CAR Т-клетки; все кроме одной мыши в группе с дозой ритуксимаба 25 мкг/мл и все мыши в группе с дозой ритуксимаба 200 мкг/мл демонстрировали эрадикацию опухоли (фиг. 7B и 7C; фиг. 13A и 13B).
Для подтверждения того, что данные ремиссии опухолей происходили в присутствии физиологически значимых сывороточных уровней ритуксимаба, сыворотку мышей, получавших ритуксимаб, собирали в день инфузии Т-клеток и неделю спустя, и измеряли сывороточные уровни ритуксимаба. Мыши, получавшие 200 мкг/мл ритуксимаба, имели исходную медианную сывороточную концентрацию ритуксимаба 138,5 мкг/мл (диапазон 54,5-173,6) и 39,7 мкг/мл (диапазон 1,6-51,9) неделю спустя, а мыши, получившие 25 мкг/мл ритуксимаба, имели медианную концентрацию 11,7 мкг/мл (диапазон 2,8-17,8) на исходном уровне и 0 мкг/мл через неделю после инфузии Т-клеток (фиг. 7D).
Кроме того, уровни циркулирующих CAR Т-клеток количественно определяли при помощи проточной цитометрии через 28 дней после инъекции опухоли. Не наблюдалось существенной разницы в уровнях CAR Т-клеток между мышами, получившими только CAR Т-клетки, и мышами, получившими ритуксимаб плюс CAR Т-клетки, что свидетельствует о том, что присутствие ритуксимаба не снижало персистенцию CAR Т-клеток in vivo (фиг. 14A-14C).
Пример 6
Сывороточные концентрации ритуксимаба пациентов, получавших лечение резервными схемами, содержащими ритуксимаб
Для оценки вышеупомянутых результатов в клиническом контексте был сделан запрос в отношении клинически значимого диапазона остаточных сывороточных уровней ритуксимаба в целевой популяции пациентов в базе данных пациентов с В-клеточной НХЛ, подвергавшихся аутологичной трансплантации стволовых клеток по протоколам исследования, и для которых были доступны сведения об уровне сывороточного ритуксимаба, измеренном перед трансплантацией (см. Gopal et al., Blood 2008;112(3):830-5). Всего было обнаружено 103 пациента, получавших схему химиотерапии, содержавшую ритуксимаб, в пределах 4 месяцев после взятия сыворотки крови (диапазон 0,5–3,8 месяцев, медиана 1,8), и медианная концентрация ритуксимаба у этих пациентов составила 38,3 мг/мл, с межквартильным размахом 19,1–71,7 мкг/мл (фиг. 7E). Концентрация ритуксимаба составила 100 мкг/мл или ниже у 86% пациентов.
Пример 7
Действие офатумумаба на функцию CAR Т-клеток к CD20
Для определения важности локализации эпитопа для действия антител к CD20 на функцию CAR, in vitro исследования повторяли с офатумумабом – антителом к CD20, которое связывается с эпитопом, отличным от того, с которым связывается ритуксимаб, включающим меньшую внеклеточную петлю CD20, а также другую область большой петли (см. Du et al., Mol Immunol 2009;46(11-12):2419-23; Teeling et al., J Immunol 2006;177(1):362-71). Способность офатумумаба блокировать связывание антитела к CD20 Leu16 сначала оценивали при помощи проточной цитометрии, которая показала, что несмотря на отличающийся эпитоп связывание второго антитела глубоко блокировалось офатумумабом. Более того, блокирование связывания происходило даже при более низких концентрациях, чем в случае ритуксимаба (фиг. 2D-F). Затем были проведены in vitro функциональные исследования на клетках лимфомы Rec-1 и Raji-ffLuc, предварительно инкубированных с различными концентрациями офатумумаба (фиг. 8A-8C). Результаты были схожими с полученными для ритуксимаба, в том, что пролиферация и размер клеток были затронуты в минимальной степени, но на продукцию цитокинов было оказано большее воздействие дозозависимым образом. По сравнению с ритуксимабом цитотоксичность была более значительно снижена в присутствии офатумумаба. Данные результаты показывают, что ингибирующее действие антитела к CD20 обусловлено стерической затрудненностью, а не непосредственным блокированием эпитопа связывания CAR. Соответственно более сильное ингибирующее действие офатумумаба было обусловлено более медленной скоростью диссоциации по сравнению с ритуксимабом. Это было подтверждено исследованиями конкурентного клеточного связывания при помощи проточной цитометрии при 4°C или 37°C (фиг. 2D-F), которые подтвердили намного более низкую диссоциацию офатумумаба, что согласуется с ранее полученными данными (см. Teeling et al., Blood 2004;104(6):1793-800).
Пример 8
Секреция цитокинов различными конструкциями CAR in vitro
Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали спустя 24 часа лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vivo. На 14 день клетки повторно стимулировали облученными клетками Raji-ffLuc (фиг. 15A и фиг. 15C), клетками Granta-519 (фиг. 15B) или Jeko (фиг. 15D). Конструкция «19-BB-z» представляет собой клинически применимый CAR к CD19, применяемый в клинических исследованиях и обеспеченный в качестве положительного контроля. Супернатанты собирали спустя 24 часа и анализировали при помощи исследования посредством Luminex в отношении уровней интерферона (IFN)-γ, IL-2 и фактора некроза опухоли-α.
Пример 9
Секреция цитокинов CAR Т-клетками к CD20
CD4+ и CD8+ T-клетки, трансдуцированные лентивирусным вектором 1.5.3-NQ-28-BB-z и размноженные ex vivo, повторно стимулировали облученными клетками CD20+ лимфомы Raji-ffLuc. Секрецию указанных цитокинов измеряли в клеточных супернатантах спустя 24 часа при помощи исследования посредством Luminex (фиг. 16A). Криоконсервированные CD4+ и CD8+ CAR Т-клетки к CD20 размораживали оттаиванием и повторно стимулировали клетками K562 или K562, экспрессирующими CD20, и через 24 часа анализировали посредством внутриклеточного окрашивания на IFN-γ при помощи проточной цитометрии (фиг. 16B).
Пример 10
Цитотоксичность in vitro различных конструкций CAR
Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали спустя 24 часа лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vivo. На 14 день клетки использовали в качестве эффекторов в стандартном 4-часовом исследовании высвобождения 51Cr, используя клетки Raji-ffLuc (фиг. 17A и 17B) и Jeko (фиг. 17B) в качестве мишеней. Конструкция «19-BB-z» представляет собой клинически применимый CAR к CD19, применяемый в клинических исследованиях и обеспеченный в качестве положительного контроля. Показан специфичный лизис клеток-мишеней каждой популяцией CAR Т-клеток.
Пример 11
Пролиферация CAR Т-клеток к CD20
CD8+ T-клетки трансдуцировали лентивирусным вектором 1.5.3-NQ-28-BB-z (или ложно трансдуцировали) и размножали ex vivo, и затем криоконсервировали. Затем клетки размораживали оттаиванием, окрашивали сукцинимидиловым сложным эфиром карбоксифлуоресцеина (CFSE) и повторно стимулировали облученными клетками лимфомы CD20+ Raji-ffLuc, клетками K562 или клетками K562, экпрессирующими CD20. Клетки анализировали при помощи проточной цитометрии спустя 4 дня. (фиг. 18A) Показано разведение CFSE CAR+ клеток (отобранных по CD3+/tCD19+). Гистограмма пунктирной линией показывает флуоресценцию CFSE Т-клеток только в культуральной среде, а гистограммы сплошной линией представляют собой Т-клетки, совместно инкубированные с клетками-мишенями. (фиг. 18B) Показан процент поделившихся клеток для каждой группы.
Пример 12
Противоопухолевая активность различных конструкций CAR in vivo
Центральные Т-клетки памяти (CD14-CD45RA-CD62L+) стимулировали гранулами, покрытыми антителом к CD3/CD28, трансдуцировали 24 часа спустя лентивирусными векторами, кодирующими указанные конструкции CAR, и размножали in vivo. Конструкция «19-BB-z» представляет собой клинически применимый CAR к CD19, применяемый в клинических исследованиях в медицинском центре, где работают авторы изобретения, и предложенный в качестве эталонного контроля. Мышам NSG в/в вводили опухолевые клетки Raji-ffLuc, спустя два дня в/в вводили размноженные центральные Т-клетки памяти (CD14-CD45RA-CD62L+), трансдуцированные 1.5.3-NQ-28-BB-z CAR, 1.5.3-NQ-28-z CAR, JCAR-014 (анти-CD19-41BB-ζ) или пустым вектором. (фиг. 19A) Опухолевая масса в зависимости от времени, как оценено посредством биолюминесцентной визуализации; и (фиг. 19B) График общей выживаемости Каплана-Майера.
Пример 13
In vivo активность CAR Т-клеток к CD20 в отношении мантийноклеточной лимфомы
CD4+ и CD8+ CAR Т-клетки к CD20 трансдуцировали 1.5.3-NQ-28-BBz CAR и использовали для лечения мышей NSG, которым за 7 дней до этого прививали клетки мантийноклеточной лимфомы Granta-ffLuc в хвостовую вену. График общей выживаемости Каплана-Майера показан на фиг. 20.
Пример 14
Персистенция CAR Т-клеток in vivo и связанные физиологические действия
Образцы крови из ретроорбитального синуса получали в ряд моментов времени после инфузии CAR Т-клеток к CD20 или Т-клеток с пустым вектором, экспрессирующих tCD19, мышам NSG, имеющим распространенные опухоли Raji-ffLuc. Количество CAR Т-клеток к CD20, экспрессирующих маркер трансдукции tCD19, определяли посредством проточной цитометрии в каждый момент времени как человеческие CD3+/мышиные CD45-отрицательные/человеческие CD19+ клетки. (фиг. 21A) Показаны tCD19+ T-клетки в трех моментах времени после инфузии в виде процента от всех ядросодержащих клеток крови (исходно в группе CAR Т-клеток n равно 9). Клетки с усеченным CD19+ мышей с пустым вектором показаны для сравнения. (фиг. 21B) В отдельном длительном эксперименте с еженедельными измерениями показаны tCD19+ клетки от двух мышей в каждой группе (с пустым вектором по сравнению с CAR Т-клетками).
Кроме того, мышей, получивших лечение CAR Т-клетками к CD20, наблюдали в отношении проявления признаков токсичности на основании массы тела, общего поведения и внешнего вида, физической активности, положения тела, ухода за поверхностью тела, цвета кожи, наличия диареи, признаков воспаления глаз, рта или кожи, вялости или признаков тяжелой анемии (бледности наружного уха, или лап, или слизистых оболочек). Не наблюдалось каких-либо свидетельств токсичности, связанной с Т-клетками, у всех мышей в течение 11 экспериментов с использованием CAR Т-клеток к CD20, за исключением обнаружения заболевания «ксеногенный трансплантат против хозяина», развившейся у некоторых мышей в более поздние моменты времени. Данное заболевание наблюдалось как у мышей, получивших CAR Т-клетки к CD20, так и у мышей, получивших клетки с пустым вектором, и таким образом, не было связано с вектором CAR, а скорее является известным следствием переноса ксеногенных Т-клеток. В каждом эксперименте массу тела каждой мыши регистрировали по меньшей мере три раза в неделю, и она обычно была стабильна за исключением мышей с терминальной стадией прогрессирования опухоли, при которой потеря массы тела происходила в течение последних нескольких дней жизни (данные не приведены).
Наконец, брали образцы крови у субпопуляции мышей в двух экспериментах для определения физиологической функции животных. В первом эксперименте мыши, несущие опухоли мантийноклеточной лимфомы Granta, получали лечение нетрансдуцированными Т-клетками, CAR Т-клетками к CD20, которые не были повторно стимулированы клетками CD20+ TM-LCL, или CAR Т-клетками к CD20, повторно стимулированными клетками TM-LCL (или введенными в свежем виде, или сначала криоконсервированными, а затем размороженными оттаиванием и введенными). Функцию почек измеряли при помощи азота мочевины в крови (BUN) и креатинина в крови, функцию печени измеряли при помощи аланин- и аспартатаминотрансфераз (ALT и AST), и функцию костного мозга измеряли при помощи определения количества лейкоцитов (WBC), гемоглобина и количества тромбоцитов в образцах крови из ретроорбитального синуса у мышей, получивших лечение (данные не приведены). По сравнению с мышами, не получавшими лечение, у мышей, получивших лечение CAR Т-клетками, не наблюдалось повышения BUN или креатинина или существенных изменений функции печени. Мыши, получившие лечение CAR Т-клетками, которые не были повторно стимулированы клетками TM-LCL, имели снижение WBC по сравнению с мышами, не получавшими лечение, но этого не наблюдалось у мышей, получивших лечение Т-клетками, повторно стимулированными клетками TM-LCL. Небольшое уменьшение гематокрита, но не гемоглобина, наблюдалось у мышей, получивших лечение CAR T-клетками, повторно стимулированными TM-LCL, хотя данное отклонение не наблюдалось у мышей, получивших не стимулированные повторно CAR Т-клетки. Количество тромбоцитов повысилось у мышей, получивших не стимулированные повторно CAR Т-клетки, но у мышей, получивших повторно стимулированные CAR Т-клетки, не наблюдалось значительных изменений.
Во втором эксперименте мыши, имеющие опухоли Raji-ffLuc, получали лечение низкой дозой (1×106 CAR+ клеток/мышь) или высокой дозой (5×106 CAR+ клеток/мышь), и у них оценивали функцию почек и печени. Тенденция к более высокому BUN наблюдалась у мышей, получивших Т-клетки, но без изменений в сывороточном креатинине (данные не приведены). Повышения печеночных трансаминаз не наблюдалось.
Пример 15
Клиническое исследование терапии с помощью CAR к CD20
Была разработана I/II фаза исследования для оценки безопасной и максимальной переносимой дозы (МПД) адоптивной Т-клеточной терапии смесью 1:1 аутологичных CD4+ и CD8+ T-клеток, трансдуцированных для экспрессии CD20-специфичного CAR, 1.5.3-NQ-28-BB-z. Самоинактивирующийся (SIN) лентивирусный вектор, несущий данную конструкцию, используемый для трансдукции Т-клеток в данном исследовании, представляет собой лентивирус третьего поколения, полученный из ВИЧ-1, кодирующий scFv из полностью человеческого моноклонального антитела 1.5.3, распознающий эпитоп в большой внеклеточной петле человеческого CD20 и соединенный с шарнирным/спейсерным участком модифицированного человеческого IgG1, трансмембранным и внутриклеточным доменами человеческого CD28 и сигнальными доменами человеческого 4-1BB и CD3ζ (фиг. 1A). Вектор также кодирует нефункциональный усеченный человеческий CD19 (tCD19) клеточной поверхности, отделенный от CAR-кассеты саморасщепляющимся элементом E2A, который облегчает отслеживание CAR Т-клеток in vivo. Усечение CD19 приводит к укорочению внутриклеточного домена до 19 аминокислот, с удалением всех тирозиновых остатков, служащих сайтами фосфорилирования, но с сохранением внеклеточных эпитопов, распознаваемых антителами к CD19. tCD19 также может быть использован в качестве мишени для антител к CD19 или конъюгатов антитело-лекарственное средство для устранения CAR Т-клеток, например, в случае пролонгированной В-клеточной аплазии.
Предыдущие исследования терапии CAR Т-клетками к CD20 были отчасти успешны, но показали низкую эффективность трансфекции (менее 0,1%), требовавшую проведения селекции антибиотиками и увеличения времени роста ex vivo, приводящих к низкой экспрессии CAR и истощению Т-клеток (см. например, Till et al., Blood 119(17):3940-3950, 2012; см. также Till et al., Blood 112(6):2261-2271, 2008; Wang et al., J. Clin. Immunol. 155(2):160-75, 2014; da Silva et al., Blood ASH Annual Meeting Abstracts:Abstract #1851, 2016).
Клиническое исследование будет включать 30 субъектов с В-клеточной неходжкинской лимфомой, включая мантийноклеточную, фолликулярную, лимфоплазмоцитарную В-клеточную лимфому, В-клеточную лимфому маргинальной зоны, трансформированную индолентную В-клеточную лимфому (включая трансформированный ХЛЛ) или диффузную В-крупноклеточную лимфому, рецидивировавшую после ответа на по меньшей мере одну предшествующую схему терапии или являющуюся рефрактерной к предшествующей терапии. Важные критерии включения включают: возраст 18 лет или старше (любого пола, расы или этнической принадлежности); измеримое заболевание с подтвержденной экспрессией CD20; участники женского пола не должны быть беременными или кормящими грудью; адекватная функция печени, почек, легких, сердца и гематологическая функция, как указано в клиническом протоколе; отсутствие активных метастаз в центральной нервной системе или прошлой/настоящей клинически значимой патологии центральной нервной системы; отсутствие ВИЧ, активной неконтролируемой инфекции или активного аутоиммунного заболевания, требующего системной иммуносупрессивной терапии.
Пациенты с впервые обнаруженной ДВККЛ (диффузной В-крупноклеточной лимфомой) должны удовлетворять одному из следующих критериев:
- Подтвержденное биопсией рефрактерное заболевание после схемы терапии первой линии, содержащей как антрациклин, так и ритуксимаб или другое антитело к CD20 (т.е. «первично-рефрактерное»), где любое заболевание, рецидивирующее в пределах 3 месяцев после окончания схемы лечения, считают рефрактерным.
- Рецидивирующее или рефрактерное заболевание после по меньшей мере одного из следующего:
- По меньшей мере 2 линии терапии (включая по меньшей мере одну с антрациклином и антителом к CD20); аутологичный трансплантат стволовых клеток
- Аллогенный трансплантат стволовых клеток
Диаграмма общей схемы лечения приведена на фиг. 24, и схема технологии получения и модели введения CAR Т-клеток приведена на фиг. 25A и 25 B.
У каждого пациента будет проведен лейкаферез для получения мононуклеарных клеток периферической крови. Пациентам, которым не может быть проведен аферез из вены в вену, может быть чрескожно поставлен венозный катетер, позволяющий проведение данного забора клеток. Пациенты, которым не может быть проведен аферез, с гематокритом по меньшей мере 38% и общим количеством незлокачественных (нормальных) лимфоцитов более 2000/мкл, могут подвергаться флеботомии в объеме 400 мл крови для получения МНПК, необходимых для получения CAR Т-клеток. Данный подход может быть применен только к пациентам, которые будут включены при уровнях доз 0 (1×105 tCD19+ клеток/кг), 1 (3,3×105 tCD19+ клеток/кг) и 2 (1×106 tCD19+ клеток/кг). У участников буде проведена биопсия опухоли перед проведением лейкафереза. ПЭТ-КТ (позитронно-эмиссионная компьютерная томография) может быть проведена до и после биопсии опухоли и лейкафереза в зависимости от доступности лимфоузла.
CAR Т-клетки получают из продукта аутологичных мононуклеарных клеток периферической крови (МНПК), полученного посредством стандартного лейкафереза немобилизованной крови для каждого пациента. МНПК подвергают иммуномагнитному разделению для обогащения по отдельности CD8+ и CD4+ T-клетками, и каждую субпопуляцию отдельно стимулируют парамагнитными гранулами с антителом к CD3/CD28 с последующей трансдукцией лентивирусным вектором 1.5.3-NQ-28-BB-ζ, кодирующим полностью человеческий CAR к CD20 третьего поколения и маркер трансдукции tCD19. Трансдуцированные Т-клетки размножают, затем повторно стимулируют при помощи линии клеток-мишеней, экспрессирующих CD20, для ускорения роста, дополнительно размножают ex vivo и затем готовят в соотношении CD4/CD8, равном 1:1, для получения определенной дозы клеток для инфузии. Клеточные продукты могут быть введены инфузией свежими или криоконсервированы, затем разморожены оттаиванием, промыты и введены инфузией.
Продукт CAR Т-клеток к CD20 будет состоять из tCD19+ CD4+ и tCD19+ CD8+ T-клеток в соотношении 1:1, где tCD19 представляет собой маркер трансдукции, который экспрессируется совместно с CAR и идентифицирует CAR+ клетки. Продукт CAR Т-клеток к CD20, полученный для каждого пациента, может быть введен или в виде свежих клеток непосредственно после получения, или может быть сначала криоконсервирован и храниться в морозильной камере с жидким азотом, а затем размороженные оттаиванием клетки промывают для удаления остатков криозащитного вещества и готовят из них препарат для инфузии. Общее число клеток будет достаточным, чтобы нивелировать потерю клеток в ходе восстановления от оттаивания и достичь уровня дозы клеток, указанного в клиническом протоколе. Общее соотношение CD4+ и CD8+ T-клеток может отличаться от 1:1, поскольку трансдукция отдельных субпопуляций у разных пациентов схожа, но не идентична. По этой причине субпопуляции трансдуцируют по отдельности, что делает возможным точное получение препаратов трансдуцированных Т-клеток. Обоснование для данного соотношения основано на публикации, в которой продемонстрировано синергетическое действие CAR Т-клеток к CD4 и CD8 в моделях на животных (Sommermeyer et al., Leukemia 2015), и на цели авторов изобретения обеспечить унифицированный клеточный продукт для всех пациентов для содействия оценке токсичности и эффективности, которая затруднена, если каждый из пациентов получают разную композицию.
CAR Т-клетки к CD20 будут суспендированы в CryoStor CS10® или в другой подходящей среде для проведения криоконсервации в программируемом криозамораживателе. Криоконсервированные клетки будут храниться в газовой фазе морозильной камеры с жидким азотом. Свежие или размороженные оттаиванием CAR Т-клетки к CD20 будут повторно суспендированы в Normosol + 1% HSA и перенесены в транспортный контейнер при общем уровне дозы клеток, указанном в клиническом протоколе. Приготовленный продукт будет храниться при 2-8°C и затем будет перенесен на замороженных гелевых пакетах место клинического применения в Вашингтонском университете или Онкологическом альянсе Сиэтла для введения. Продукт будет выпущен Центром обработки клеток FHCRC. Клеточный продукт должен быть введен посредством инфузии участнику исследования в течение 6 часов после приготовления препарата. Центр обработки клеток FHCRC будет ответственен за документальное оформление отпуска и возврата (если требуется) исследуемого продукта.
Пациенты будут получать лимфоистощающую терапию за 36-96 часов перед инфузией CAR Т-клеток к CD20. Между последней дозой химиотерапии и инфузией Т-клеток должен быть по меньшей мере 36-часовой интервал. Целью введения химиотерапии является обеспечение лимфоистощения для способствования выживанию перенесенных Т-клеток и уменьшение опухолевой массы перед инфузией CAR Т-клеток к CD20. В соответствии со статистическими аспектами протокола пациенты изначально будут получать лечение разовой дозой циклофосфамида (CY) в/в в дозе 1 г/м2. Однако, если частота ответа неадекватна, схема лимфоистощения может быть изменена так, чтобы последующие пациенты получали CY + флударабин.
Перед получением CAR Т-клеток к CD20 участников будут оценивать на предмет отсутствия развития какой-либо легочной, сердечно-сосудистой, печеночной, почечной или неврологической токсичности, запрещенных протоколом; отсутствия развития неконтролируемых, активных и серьезных инфекций; и отсутствия полученного лечения другими исследуемыми препаратами в течение 30 дней до инфузии Т-клеток.
Премедикация не требуется перед введением продукта CAR Т-клеток к CD20. На усмотрение исследователя могут быть применены стандартные виды премедикации.
Каждый пациент получит одну внутривенную инфузию CAR Т-клеток к CD20 спустя 36-96 часов после завершения лимфоистощающей химиотерапии. Доза CAR Т-клеток к CD20, введенная каждому пациенту, будет определена согласно статистическому плану, описанному в клиническом протоколе. Уровни доз приведены в Таблице 2 ниже. Может быть проведена вторая инфузия CAR Т-клеток к CD20 в случае, если первая инфузия не привела к полному ответу (ПО), или если заболевание рецидивирует после ПО. Для этой цели пациенты должны удовлетворять критериям, определенным в клиническом протоколе, приведенном ниже.
Введение клеток: Один клеточный продукт, смешанный из отдельных аликвот CD4+ и CD8+ CAR Т-клеток к CD20 в соотношении 1:1, будет введен внутривенно в течение приблизительно 20-30 минут в определенной дозе клеток каждому субъекту. Определенная доза Т-клеток относится к CAR+ T-клеткам, определенным за счет экспрессии усеченного маркера трансдукции CD19, который экспрессируется в векторе координированно с CAR. Уровни доз, планируемые для введения согласно предложенному протоколу, представляют собой следующие:
Таблица 2. Препарат и инфузия CAR Т-клеток к CD20
* на килограмм массы реципиента,
**верхний предел для уровня дозы, ±15%; Уровень дозы 1 представляет собой начальный уровень дозы.
Всех пациентов будут наблюдать в течение каждой инфузии Т-клеток. Показатели жизненно важных функций (включая насыщение кислородом) должны регистрироваться перед и в течение инфузии и приблизительно ежечасно в течение 2 часов после инфузии. Наблюдение за насыщением кислородом должно осуществляться при помощи непрерывной пульсоксиметрии в течение инфузии Т-клеток и спустя 2 часа после инфузии Т-клеток. Субъекты будут оставаться на аппарате для инфузии клеток в течение минимум 2 часов после инфузии или до устранения любой связанной с инфузией токсичности, которая может подвергать участника исследования как амбулаторного пациента значительному риску.
Скорость инфузии: каждая инфузия клеток должна быть введена внутривенно в течение приблизительно 20-30 минут, скорректирована в случае необходимости в соответствии с нормами предельных значений эндотоксинов для парентеральных лекарственных средств (5 USP ЕЭ/кг/час). Скорость инфузии также может быть скорректирована, если субъект испытывает легкие инфузионные реакции (2 степени или ниже).
Основная задача данного исследования заключается в оценке максимальной переносимой дозы (МПД) CAR Т-клеток. МПД для данных целей будет определена как степень истинной дозолимитирующей токсичности, составляющая 25%, где ДЛТ (дозолимитирующую токсичность) определяют как негематологическую токсичность третьей или более высокой степени, связанную с инфузией CAR Т-клеток, возникающую в течение 28 дней после инфузии, длящуюся по меньшей мере 4 дня и не реагирующую на тоцилизумаб, дексаметазон или другие противовоспалительные лекарственные средства. Для оценки МПД будет применена модификация метода непрерывной переоценки (CRM). Модификации включают лечение пациентов в группах по двое (а не по одному), и возможность максимального повышения одного уровня дозы между группами. Пациенты будут получать одну внутривенную инфузию CAR Т-клеток к CD20 с одним из четырех повышающихся уровней доз начиная с 1 уровня дозы для первой группы из двух пациентов. Повышение или снижение дозы определяют посредством алгоритма CRM, принимая во внимание число пациентов, испытывающих серьезную токсичность при каждом уровне дозы (см. выше).
Лечение пациентов в группах с повышением/снижением дозы будет проведено ступенчато таким образом, что между каждой группой из двух пациентов перед повышением дозы до следующего уровня необходим интервал после инфузии, составляющий как минимум 28 дней. Данные уровни доз будут изначально оценены в комбинации только с CY, оценивая степень ПО для определения, будет ли CY по отдельности обладать достаточной активностью, или потребуется добавление флударабина (CY/flu). Если какие-либо из критериев удовлетворяют переходу на CY/flu, CRM начинают заново, начиная с дозы на один уровень ниже промежуточной рекомендуемой дозы (только с CY) в комбинации с CY/flu. Промежуточная рекомендуемая доза будет определена как более низкая относительно максимальной дозы, оцененной к настоящему времени, или следующей дозы, которая была бы выбрана на основании модифицированного CRM после 1-го, 2-го или 3-го промежуточного анализа 8-го, 16-го или 20-го пациента. Данную оценку будут продолжать до оценки в общей сложности 30 пациентов. Если ни один из данных критериев не будет удовлетворен, CRM подход будут продолжать только с CY у дополнительных 10 пациентов (до оценки в общей сложности 30 пациентов). Для пациентов, получающих вторую инфузию, показатели ДЛТ и эффективности будут оценены на основании дозы их первичной инфузии.
У пациентов, получающих CAR Т-клетки к CD20, может развиться серьезная токсичность из-за активации, пролиферации и секреции цитокинов Т-клетками после контакта с опухолевым антигеном. Могут возникать синдром выброса цитокинов, активация макрофагов и нейротоксичность, требующие интенсивной терапии, и они не будут рассмотрены как ДЛТ, если считаются результатом Т-клеточного распознавания опухоли, если только эти токсичности не будут обратимы спустя 4 последовательных лечения кортикостероидами и/или тоцилизумабом.
При существовании достаточных данных для подтверждения того, что истинная вероятность смерти, связанной с лечением, к 100 дню превышает 20% (независимо от дозы), включение в исследование пациентов будет приостановлено на время детальной экспертизы главным исследователем, лицом, контролирующим проведение исследования, специалистом по статистике и Независимым комитетом по мониторингу данных. Данные, достаточные для этой цели, будут определены как любой наблюдаемый результат, для которого нижний доверительный интервал на 80%-ном доверительном уровне превышает 20%.
Также будет проведена оценка для предварительного анализа эффективности. Вторичные цели данного исследования включают исследование эффективности (в отношении степени ремиссии, выживаемости без прогрессирования и персистенции Т-клеток in vivo). Данные анализы будут проведены у пациентов, получающих лечение всеми дозами в сочетании с конечной схемой лимфоистощения (CY по отдельности или CY/флударабин), моделируя результаты в зависимости от дозы. Регрессионная логистическая модель будет использована для оценки двойных результатов (ПО и ПО/ЧО (частичный ответ)). Модель пропорциональных рисков Кокса будет использована для оценки результатов в отношении времени до события (выживаемости без прогрессирования, ВБ; общей выживаемости, ОВ). Никакие формальные статистические гипотезы не будут исследованы в отношении данных конечных точек; напротив, оценки и связанные доверительные интервалы будут приведены описательно.
Дополнительными вторичными задачами является оценка длительности персистенции адоптивно перенесенных CAR Т-клеток к CD20 и миграции адоптивно перенесенных CAR Т-клеток к CD20. Для оценки персистенции CAR Т-клеток будет вычислена область под кривой (AUC) для отдельных пациентов, и будут оценены сводные данные AUC. Миграцию (если CAR Т-клетки присутствуют после лечения) определяют как присутствие CAR Т-клеток в опухоли на 10-16 день, и, если применимо, в костном мозге на 28 день. Связь между AUC и миграцией с клиническими результатами будет в основном описательной по сути, включая графическое представление.
Для оценки вторичных задач, связанных с оценкой биологических причин устойчивости к лечению, будут проведены следующие анализы. Будет использован парный t-критерий для сравнения профилей биомаркеров между исходными опухолями и опухолями после лечения, при необходимости с подходящей трансформацией. Будет использована регрессионная логистическая модель для оценки связи между исходными значениями биомаркеров и ответом. Лэндмарк-анализ (landmark analysis) среди пациентов, у которых был достигнут ПО или ЧО через 1 месяц, измерение продолжительности выживания (ВБ и ОВ (общая выживаемость)) исходя из начальной временной точки при помощи регрессионной модели пропорциональных рисков Кокса для оценки связи зависимостей, измеренных во время ПО/ЧО у пациентов, у которых в это время была проведена биопсия. Модели будут включать значения для всех пациентов/уровней доз и включать переменную для уровней доз.
Развитие эндогенных противоопухолевых ответов и распространение эпитопа также будет оценено главным образом экспериментально. Данные в каждый момент времени будут обобщены, и при получении достаточных данных будет использована модель со смешанными эффектами для моделирования изменяющихся во времени результатов. Будет проведен анализ дифференциальной экспрессии генов между пациентами, демонстрирующими и не демонстрирующими распространение эпитопа для выявления биомаркера, связанного с иммунным ответом.
Пациенты в исследовании, у которых не был достигнут ПО, или был достигнут полный ответ (ПО), но позже наблюдался рецидив, желающие получить вторую инфузию CAR Т-клеток к CD20, могут удовлетворять критериям для ее проведения, при условии, что может быть получено достаточное количество CAR Т-клеток к CD20 и удовлетворены критерии, приведенные ниже:
a. Существует доказательство устойчивости заболевания после первой инфузии Т-клеток или о рецидиве опухоли после ПО.
b. Не было токсичностей, связанных с первой инфузией, которые были дозолимитирующими или требовали снижения дозы.
c. Пациент спустя 30 или более дней после первой инфузии Т-клеток.
d. Не было клинических и/или лабораторных критериев исключения (у пациентов, достигших ПО и у которых позже был рецидив, должна быть проведена биопсия после рецидива, демонстрирующую продолжающуюся экспрессию CD20 на опухолевых клетках).
Участники будут подвергнуты оценкам при скрининге, перед лимфоистощающей химиотерапией, в ходе инфузий Т-клеток и в интервалах после каждой инфузии Т-клеток. Следующие данные будут получены для оценки безопасности и токсичности согласно клиническому протоколу:
• Сбор анамнеза и физикальное обследование до и в интервалах после инфузий Т-клеток.
• Пульсоксиметрия до и в ходе инфузии.
• Гематологические исследования, исследования печени, почек и ионограмма перед и в интервалах после инфузии Т-клеток.
• Лабораторные тесты, оценивающие наличие синдрома лизиса опухоли, коагулопатии и синдрома выброса цитокинов до и в интервалах после инфузии Т-клеток.
• Токсичность по шкале NCI CTCAE версия 4.0
• Сывороточные уровни цитокинов
• Восстановление В-клеток
• Сывороточные уровни иммунноглобулинов.
• Анализ на присутствие репликационно-компетентных лентивирусов
• Персистенция генетически модифицированных Т-клеток
• Отчетность о нежелательных явлениях.
Различные описанные выше варианты осуществления могут быть скомбинированы с получением дополнительных вариантов осуществления. Все патенты США, публикации патентных заявок США, патентные заявки США, иностранные патенты, иностранные патентные заявки и непатентные публикации, ссылки на которые приведены в настоящем описании и/или приведенные в информационном листе заявки, включены в настоящий документ посредством ссылки во всей полноте. Аспекты вариантов осуществления могут быть модифицированы, при необходимости для задействования принципов различных патентов, заявок и публикаций с получением дополнительных вариантов осуществления.
В варианты осуществления могут быть привнесены эти и другие изменения с учетом приведенного выше подробного описания изобретения. В общем термины, используемые в прилагаемой формуле изобретения, не должны истолковываться как ограничивающие формулу изобретения до конкретных вариантов осуществления, раскрытых в описании и формуле изобретения, но должны трактоваться как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, к которым относятся такие пункты формулы изобретения. Соответственно, формула изобретения не ограничена описанием.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Фред Хатчинсон Кэнсер Рисерч Сентер
ТИЛЛ Брайан
ПРЕСС Оливер
<120> КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ ПРОТИВ CD20
<130> 360056.441WO
<140> PCT
<141> 2017-03-17
<150> US 62/310,541
<151> 2016-03-18
<150> US 62/320,327
<151> 2016-04-08
<160> 98
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 1
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Ala
85 90 95
Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 2
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 2
Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Asn Tyr Met
20 25 30
Asp Trp Tyr Gln Lys Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Phe Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 3
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 3
Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 4
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 4
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Thr Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg His Pro Ser Tyr Gly Ser Gly Ser Pro Asn Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 5
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 5
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Asp Tyr Tyr Cys
85 90 95
Ala Arg Ser Asn Tyr Tyr Gly Ser Ser Tyr Trp Phe Phe Asp Val Trp
100 105 110
Gly Ala Gly Thr Thr Val Thr Val Ser Ser Leu Asp Glu Ser Lys Tyr
115 120 125
<210> 6
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 6
Gln Val Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser
115 120 125
<210> 7
<211> 12
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
1 5 10
<210> 8
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Gly Pro Pro Cys Pro Pro Cys Pro
1 5
<210> 9
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Pro Val Ala Gly Pro Ser
1 5
<210> 10
<211> 101
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 10
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
1 5 10 15
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
20 25 30
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
35 40 45
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val
50 55 60
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
65 70 75 80
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
85 90 95
Ile Ser Lys Ala Lys
100
<210> 11
<211> 110
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
100 105 110
<210> 12
<211> 105
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
1 5 10 15
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro
100 105
<210> 13
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
1 5 10 15
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
100 105
<210> 14
<211> 27
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 15
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 15
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg
35 40
<210> 16
<211> 42
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 17
<211> 112
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 18
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<400> 18
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro
20
<210> 19
<211> 20
<212> БЕЛОК
<213> Mus musculus
<400> 19
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 20
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 20
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 21
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 21
Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Ser
<210> 22
<211> 20
<212> БЕЛОК
<213> Неизвестный
<220>
<223> E2A саморасщепляющийся пептид
<400> 22
Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 10 15
Asn Pro Gly Pro
20
<210> 23
<211> 24
<212> БЕЛОК
<213> неизвестный
<220>
<223> T2A саморасщепляющийся пептид
<400> 23
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
1 5 10 15
Val Glu Glu Asn Pro Gly Pro Arg
20
<210> 24
<211> 323
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 24
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
1 5 10 15
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
20 25 30
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
35 40 45
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
50 55 60
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
65 70 75 80
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
85 90 95
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
100 105 110
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
115 120 125
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
130 135 140
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
145 150 155 160
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro
165 170 175
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
180 185 190
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
195 200 205
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
210 215 220
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
225 230 235 240
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
245 250 255
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
260 265 270
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
275 280 285
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
290 295 300
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg
305 310 315 320
Arg Lys Arg
<210> 25
<211> 357
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 25
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala
325 330 335
Thr Gly Met Val Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly
340 345 350
Ile Gly Leu Phe Met
355
<210> 26
<211> 695
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 26
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Ala
85 90 95
Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp
145 150 155 160
Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
180 185 190
Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Thr Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg His Pro Ser Tyr Gly Ser Gly Ser Pro Asn Phe Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser Asp Lys Thr His Thr Cys Pro
245 250 255
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu Val Val Val
465 470 475 480
Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile
485 490 495
Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr
500 505 510
Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln
515 520 525
Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Lys Arg Gly
530 535 540
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
545 550 555 560
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
565 570 575
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
580 585 590
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
595 600 605
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
610 615 620
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
625 630 635 640
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
645 650 655
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
660 665 670
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
675 680 685
Met Gln Ala Leu Pro Pro Arg
690 695
<210> 27
<211> 653
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 27
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Ala
85 90 95
Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp
145 150 155 160
Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
180 185 190
Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Thr Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg His Pro Ser Tyr Gly Ser Gly Ser Pro Asn Phe Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser Asp Lys Thr His Thr Cys Pro
245 250 255
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu Val Val Val
465 470 475 480
Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile
485 490 495
Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr
500 505 510
Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln
515 520 525
Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Arg Val Lys
530 535 540
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
545 550 555 560
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
565 570 575
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
580 585 590
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
595 600 605
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
610 615 620
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
625 630 635 640
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
645 650
<210> 28
<211> 654
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 28
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Ala
85 90 95
Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp
145 150 155 160
Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
180 185 190
Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Thr Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg His Pro Ser Tyr Gly Ser Gly Ser Pro Asn Phe Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser Asp Lys Thr His Thr Cys Pro
245 250 255
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu Val Val Val
465 470 475 480
Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile
485 490 495
Ile Phe Trp Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
500 505 510
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
515 520 525
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
530 535 540
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
545 550 555 560
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
565 570 575
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
580 585 590
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
595 600 605
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
610 615 620
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
625 630 635 640
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
645 650
<210> 29
<211> 612
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 29
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Ala
85 90 95
Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp
145 150 155 160
Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
180 185 190
Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Thr Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg His Pro Ser Tyr Gly Ser Gly Ser Pro Asn Phe Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser Asp Lys Thr His Thr Cys Pro
245 250 255
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu Val Val Val
465 470 475 480
Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile
485 490 495
Ile Phe Trp Val Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
500 505 510
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
515 520 525
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
530 535 540
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
545 550 555 560
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
565 570 575
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
580 585 590
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
595 600 605
Leu Pro Pro Arg
610
<210> 30
<211> 700
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 30
Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Asn Tyr Met
20 25 30
Asp Trp Tyr Gln Lys Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Phe Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln Leu
115 120 125
Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Asp Tyr Tyr Cys Ala Arg Ser Asn
210 215 220
Tyr Tyr Gly Ser Ser Tyr Trp Phe Phe Asp Val Trp Gly Ala Gly Thr
225 230 235 240
Thr Val Thr Val Ser Ser Leu Asp Glu Ser Lys Tyr Gly Pro Pro Cys
245 250 255
Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu
260 265 270
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
275 280 285
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
290 295 300
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
305 310 315 320
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
325 330 335
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
340 345 350
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
355 360 365
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
370 375 380
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
385 390 395 400
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
405 410 415
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
420 425 430
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
435 440 445
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
450 455 460
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Phe Trp
465 470 475 480
Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val
485 490 495
Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly
500 505 510
Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr
515 520 525
Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr
530 535 540
Arg Ser Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
545 550 555 560
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
565 570 575
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
580 585 590
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
595 600 605
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
610 615 620
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
625 630 635 640
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
645 650 655
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
660 665 670
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
675 680 685
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
690 695 700
<210> 31
<211> 658
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 31
Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Asn Tyr Met
20 25 30
Asp Trp Tyr Gln Lys Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Phe Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln Leu
115 120 125
Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Asp Tyr Tyr Cys Ala Arg Ser Asn
210 215 220
Tyr Tyr Gly Ser Ser Tyr Trp Phe Phe Asp Val Trp Gly Ala Gly Thr
225 230 235 240
Thr Val Thr Val Ser Ser Leu Asp Glu Ser Lys Tyr Gly Pro Pro Cys
245 250 255
Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu
260 265 270
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
275 280 285
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
290 295 300
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
305 310 315 320
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
325 330 335
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
340 345 350
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
355 360 365
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
370 375 380
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
385 390 395 400
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
405 410 415
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
420 425 430
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
435 440 445
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
450 455 460
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Phe Trp
465 470 475 480
Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val
485 490 495
Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly
500 505 510
Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr
515 520 525
Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr
530 535 540
Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
545 550 555 560
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
565 570 575
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
580 585 590
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
595 600 605
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
610 615 620
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
625 630 635 640
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
645 650 655
Pro Arg
<210> 32
<211> 698
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 32
Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Gln Val Gln Leu
115 120 125
Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Ser His
210 215 220
Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
225 230 235 240
Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
260 265 270
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
275 280 285
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
290 295 300
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
305 310 315 320
Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val
325 330 335
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
340 345 350
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
355 360 365
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
370 375 380
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
385 390 395 400
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
405 410 415
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
420 425 430
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
435 440 445
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
450 455 460
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu
465 470 475 480
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
485 490 495
Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His
500 505 510
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
515 520 525
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
530 535 540
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
545 550 555 560
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
565 570 575
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
580 585 590
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
595 600 605
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
610 615 620
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
625 630 635 640
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
645 650 655
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
660 665 670
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
675 680 685
Ala Leu His Met Gln Ala Leu Pro Pro Arg
690 695
<210> 33
<211> 656
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 33
Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Gln Val Gln Leu
115 120 125
Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Ser His
210 215 220
Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
225 230 235 240
Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
260 265 270
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
275 280 285
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
290 295 300
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
305 310 315 320
Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val
325 330 335
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
340 345 350
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
355 360 365
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
370 375 380
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
385 390 395 400
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
405 410 415
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
420 425 430
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
435 440 445
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
450 455 460
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu
465 470 475 480
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
485 490 495
Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His
500 505 510
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
515 520 525
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
530 535 540
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
545 550 555 560
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
565 570 575
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
580 585 590
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
595 600 605
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
610 615 620
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
625 630 635 640
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
645 650 655
<210> 34
<211> 657
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 34
Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Gln Val Gln Leu
115 120 125
Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Ser His
210 215 220
Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
225 230 235 240
Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe
260 265 270
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
275 280 285
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
290 295 300
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
305 310 315 320
Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val
325 330 335
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
340 345 350
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
355 360 365
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
370 375 380
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
385 390 395 400
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
405 410 415
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
420 425 430
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
435 440 445
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
450 455 460
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe Trp Val Leu
465 470 475 480
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
485 490 495
Ala Phe Ile Ile Phe Trp Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr
500 505 510
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
515 520 525
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
530 535 540
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
545 550 555 560
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
565 570 575
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
580 585 590
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
595 600 605
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
610 615 620
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
625 630 635 640
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
645 650 655
Arg
<210> 35
<211> 1060
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 35
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Val Met Thr Gln Thr Pro Leu Ser
20 25 30
Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
35 40 45
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln
50 55 60
Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn
65 70 75 80
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr
85 90 95
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
100 105 110
Tyr Tyr Cys Val Gln Ala Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly
115 120 125
Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
145 150 155 160
Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr
165 170 175
Ser Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys
180 185 190
Gly Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg
195 200 205
Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser
210 215 220
Ile Thr Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
225 230 235 240
Ala Met Tyr Tyr Cys Ala Arg His Pro Ser Tyr Gly Ser Gly Ser Pro
245 250 255
Asn Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Asp
260 265 270
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
305 310 315 320
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe
485 490 495
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
500 505 510
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg
515 520 525
Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro
530 535 540
Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala
545 550 555 560
Tyr Arg Ser Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
565 570 575
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
580 585 590
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
595 600 605
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
610 615 620
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
625 630 635 640
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
645 650 655
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
660 665 670
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
675 680 685
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
690 695 700
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Gln Cys Thr
705 710 715 720
Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly
725 730 735
Pro Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro
740 745 750
Met Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly
755 760 765
Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr
770 775 780
Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys
785 790 795 800
Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala
805 810 815
Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr
820 825 830
Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp
835 840 845
Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser
850 855 860
Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly
865 870 875 880
Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp
885 890 895
Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro
900 905 910
Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala
915 920 925
Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val
930 935 940
Ser Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys
945 950 955 960
Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met
965 970 975
Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp
980 985 990
Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His
995 1000 1005
Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr
1010 1015 1020
Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys
1025 1030 1035 1040
Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu
1045 1050 1055
Arg Arg Lys Arg
1060
<210> 36
<211> 1018
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 36
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Val Met Thr Gln Thr Pro Leu Ser
20 25 30
Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
35 40 45
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln
50 55 60
Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn
65 70 75 80
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr
85 90 95
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
100 105 110
Tyr Tyr Cys Val Gln Ala Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly
115 120 125
Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
145 150 155 160
Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr
165 170 175
Ser Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys
180 185 190
Gly Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg
195 200 205
Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser
210 215 220
Ile Thr Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
225 230 235 240
Ala Met Tyr Tyr Cys Ala Arg His Pro Ser Tyr Gly Ser Gly Ser Pro
245 250 255
Asn Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Asp
260 265 270
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
305 310 315 320
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe
485 490 495
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
500 505 510
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg
515 520 525
Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro
530 535 540
Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala
545 550 555 560
Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
565 570 575
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
580 585 590
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
595 600 605
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
610 615 620
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
625 630 635 640
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
645 650 655
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
660 665 670
Pro Pro Arg Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp
675 680 685
Val Glu Ser Asn Pro Gly Pro Met Pro Pro Pro Arg Leu Leu Phe Phe
690 695 700
Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val
705 710 715 720
Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly
725 730 735
Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro
740 745 750
Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile
755 760 765
His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln
770 775 780
Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys
785 790 795 800
Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu
805 810 815
Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys
820 825 830
Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser
835 840 845
Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly
850 855 860
Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser
865 870 875 880
Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly
885 890 895
Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His Val
900 905 910
His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp
915 920 925
Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro
930 935 940
Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn
945 950 955 960
Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp
965 970 975
His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu
980 985 990
Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu
995 1000 1005
Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
1010 1015
<210> 37
<211> 1019
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 37
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Val Met Thr Gln Thr Pro Leu Ser
20 25 30
Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
35 40 45
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln
50 55 60
Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn
65 70 75 80
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr
85 90 95
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
100 105 110
Tyr Tyr Cys Val Gln Ala Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly
115 120 125
Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
145 150 155 160
Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr
165 170 175
Ser Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys
180 185 190
Gly Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg
195 200 205
Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser
210 215 220
Ile Thr Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
225 230 235 240
Ala Met Tyr Tyr Cys Ala Arg His Pro Ser Tyr Gly Ser Gly Ser Pro
245 250 255
Asn Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Asp
260 265 270
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
305 310 315 320
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe
485 490 495
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
500 505 510
Val Thr Val Ala Phe Ile Ile Phe Trp Val Lys Arg Gly Arg Lys Lys
515 520 525
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
530 535 540
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
545 550 555 560
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
565 570 575
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
580 585 590
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
595 600 605
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
610 615 620
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
625 630 635 640
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
645 650 655
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
660 665 670
Leu Pro Pro Arg Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly
675 680 685
Asp Val Glu Ser Asn Pro Gly Pro Met Pro Pro Pro Arg Leu Leu Phe
690 695 700
Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu
705 710 715 720
Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys
725 730 735
Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser
740 745 750
Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly
755 760 765
Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser
770 775 780
Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu
785 790 795 800
Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu
805 810 815
Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu
820 825 830
Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met
835 840 845
Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu
850 855 860
Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu
865 870 875 880
Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys
885 890 895
Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His
900 905 910
Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp
915 920 925
Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu
930 935 940
Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly
945 950 955 960
Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu
965 970 975
Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr
980 985 990
Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His
995 1000 1005
Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
1010 1015
<210> 38
<211> 977
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 38
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Val Met Thr Gln Thr Pro Leu Ser
20 25 30
Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
35 40 45
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln
50 55 60
Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn
65 70 75 80
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr
85 90 95
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
100 105 110
Tyr Tyr Cys Val Gln Ala Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly
115 120 125
Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
145 150 155 160
Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr
165 170 175
Ser Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys
180 185 190
Gly Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg
195 200 205
Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser
210 215 220
Ile Thr Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
225 230 235 240
Ala Met Tyr Tyr Cys Ala Arg His Pro Ser Tyr Gly Ser Gly Ser Pro
245 250 255
Asn Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Asp
260 265 270
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
305 310 315 320
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Phe
485 490 495
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
500 505 510
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Val Lys Phe Ser Arg
515 520 525
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
530 535 540
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
545 550 555 560
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
565 570 575
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
580 585 590
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
595 600 605
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
610 615 620
Ala Leu His Met Gln Ala Leu Pro Pro Arg Gln Cys Thr Asn Tyr Ala
625 630 635 640
Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly Pro Met Pro
645 650 655
Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met Glu Val
660 665 670
Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala
675 680 685
Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu
690 695 700
Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu
705 710 715 720
Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu
725 730 735
Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln
740 745 750
Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn
755 760 765
Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly
770 775 780
Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser
785 790 795 800
Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp
805 810 815
Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro Arg Asp
820 825 830
Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser
835 840 845
Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly
850 855 860
Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu
865 870 875 880
Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met
885 890 895
Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys
900 905 910
Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile
915 920 925
Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp
930 935 940
Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser
945 950 955 960
Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg Arg Lys
965 970 975
Arg
<210> 39
<211> 1101
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 39
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser
20 25 30
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser
35 40 45
Val Asn Tyr Met Asp Trp Tyr Gln Lys Lys Pro Gly Ser Ser Pro Lys
50 55 60
Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
85 90 95
Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Phe
100 105 110
Asn Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Ser
115 120 125
Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
130 135 140
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
145 150 155 160
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
165 170 175
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
180 185 190
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
195 200 205
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
210 215 220
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Asp Tyr Tyr Cys
225 230 235 240
Ala Arg Ser Asn Tyr Tyr Gly Ser Ser Tyr Trp Phe Phe Asp Val Trp
245 250 255
Gly Ala Gly Thr Thr Val Thr Val Ser Ser Leu Asp Glu Ser Lys Tyr
260 265 270
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
305 310 315 320
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
485 490 495
Lys Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
500 505 510
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys
515 520 525
Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg
530 535 540
Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp
545 550 555 560
Phe Ala Ala Tyr Arg Ser Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
565 570 575
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
580 585 590
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
595 600 605
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
610 615 620
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
625 630 635 640
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
645 650 655
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
660 665 670
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
675 680 685
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
690 695 700
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
705 710 715 720
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
725 730 735
Val Glu Glu Asn Pro Gly Pro Arg Met Leu Leu Leu Val Thr Ser Leu
740 745 750
Leu Leu Cys Glu Leu Pro His Pro Ala Phe Leu Leu Ile Pro Arg Lys
755 760 765
Val Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu Ser Ile
770 775 780
Asn Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr Ser Ile Ser Gly
785 790 795 800
Asp Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp Ser Phe Thr His
805 810 815
Thr Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr Val Lys
820 825 830
Glu Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn Arg Thr
835 840 845
Asp Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg Thr Lys
850 855 860
Gln His Gly Gln Phe Ser Leu Ala Val Val Ser Leu Asn Ile Thr Ser
865 870 875 880
Leu Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly Asp Val Ile Ile
885 890 895
Ser Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp Lys Lys
900 905 910
Leu Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn Arg Gly
915 920 925
Glu Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His Ala Leu Cys Ser
930 935 940
Pro Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys Val Ser Cys Arg
945 950 955 960
Asn Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys Asn Leu Leu Glu
965 970 975
Gly Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys Ile Gln Cys His
980 985 990
Pro Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys Thr Gly Arg Gly
995 1000 1005
Pro Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp Gly Pro His Cys
1010 1015 1020
Val Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn Asn Thr Leu Val
1025 1030 1035 1040
Trp Lys Tyr Ala Asp Ala Gly His Val Cys His Leu Cys His Pro Asn
1045 1050 1055
Cys Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro Thr Asn
1060 1065 1070
Gly Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val Gly Ala Leu Leu
1075 1080 1085
Leu Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe Met
1090 1095 1100
<210> 40
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 40
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser
20 25 30
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser
35 40 45
Val Asn Tyr Met Asp Trp Tyr Gln Lys Lys Pro Gly Ser Ser Pro Lys
50 55 60
Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
85 90 95
Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Phe
100 105 110
Asn Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Ser
115 120 125
Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
130 135 140
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
145 150 155 160
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
165 170 175
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
180 185 190
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
195 200 205
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
210 215 220
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Asp Tyr Tyr Cys
225 230 235 240
Ala Arg Ser Asn Tyr Tyr Gly Ser Ser Tyr Trp Phe Phe Asp Val Trp
245 250 255
Gly Ala Gly Thr Thr Val Thr Val Ser Ser Leu Asp Glu Ser Lys Tyr
260 265 270
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
305 310 315 320
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
485 490 495
Lys Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
500 505 510
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys
515 520 525
Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg
530 535 540
Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp
545 550 555 560
Phe Ala Ala Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
565 570 575
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
580 585 590
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
595 600 605
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
610 615 620
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
625 630 635 640
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
645 650 655
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
660 665 670
Gln Ala Leu Pro Pro Arg
675
<210> 41
<211> 1061
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 41
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser
20 25 30
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser
35 40 45
Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys
50 55 60
Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
85 90 95
Val Glu Ala Glu Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser
100 105 110
Asn Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser
115 120 125
Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
130 135 140
Gln Val Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
145 150 155 160
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
165 170 175
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
180 185 190
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
195 200 205
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
210 215 220
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
225 230 235 240
Ala Arg Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp
245 250 255
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser
260 265 270
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly
275 280 285
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
290 295 300
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
305 310 315 320
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
325 330 335
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg
340 345 350
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
355 360 365
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
370 375 380
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
385 390 395 400
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
405 410 415
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
420 425 430
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
435 440 445
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
450 455 460
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
465 470 475 480
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
485 490 495
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
500 505 510
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
515 520 525
Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
530 535 540
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
545 550 555 560
Ala Tyr Arg Ser Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
565 570 575
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
580 585 590
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
595 600 605
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
610 615 620
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
625 630 635 640
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
645 650 655
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
660 665 670
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
675 680 685
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
690 695 700
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Gln Cys
705 710 715 720
Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro
725 730 735
Gly Pro Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr
740 745 750
Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu
755 760 765
Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro
770 775 780
Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu
785 790 795 800
Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu
805 810 815
Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe
820 825 830
Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly
835 840 845
Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val
850 855 860
Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu
865 870 875 880
Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val
885 890 895
Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val
900 905 910
Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met
915 920 925
Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser
930 935 940
Val Ser Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro
945 950 955 960
Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp
965 970 975
Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln
980 985 990
Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe
995 1000 1005
His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg
1010 1015 1020
Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe
1025 1030 1035 1040
Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val
1045 1050 1055
Leu Arg Arg Lys Arg
1060
<210> 42
<211> 1019
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 42
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser
20 25 30
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser
35 40 45
Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys
50 55 60
Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
85 90 95
Val Glu Ala Glu Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser
100 105 110
Asn Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser
115 120 125
Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
130 135 140
Gln Val Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
145 150 155 160
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
165 170 175
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
180 185 190
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
195 200 205
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
210 215 220
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
225 230 235 240
Ala Arg Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp
245 250 255
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser
260 265 270
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly
275 280 285
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
290 295 300
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
305 310 315 320
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
325 330 335
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg
340 345 350
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
355 360 365
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
370 375 380
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
385 390 395 400
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
405 410 415
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
420 425 430
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
435 440 445
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
450 455 460
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
465 470 475 480
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
485 490 495
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
500 505 510
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
515 520 525
Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
530 535 540
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
545 550 555 560
Ala Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
565 570 575
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
580 585 590
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
595 600 605
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
610 615 620
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
625 630 635 640
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
645 650 655
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
660 665 670
Leu Pro Pro Arg Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly
675 680 685
Asp Val Glu Ser Asn Pro Gly Pro Met Pro Pro Pro Arg Leu Leu Phe
690 695 700
Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu
705 710 715 720
Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys
725 730 735
Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser
740 745 750
Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly
755 760 765
Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser
770 775 780
Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu
785 790 795 800
Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu
805 810 815
Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu
820 825 830
Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met
835 840 845
Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu
850 855 860
Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu
865 870 875 880
Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys
885 890 895
Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His
900 905 910
Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp
915 920 925
Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu
930 935 940
Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly
945 950 955 960
Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu
965 970 975
Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr
980 985 990
Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His
995 1000 1005
Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
1010 1015
<210> 43
<211> 1020
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 43
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser
20 25 30
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser
35 40 45
Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys
50 55 60
Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
85 90 95
Val Glu Ala Glu Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser
100 105 110
Asn Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser
115 120 125
Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
130 135 140
Gln Val Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
145 150 155 160
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
165 170 175
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
180 185 190
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
195 200 205
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
210 215 220
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
225 230 235 240
Ala Arg Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp
245 250 255
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser
260 265 270
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly
275 280 285
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
290 295 300
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
305 310 315 320
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
325 330 335
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr Arg
340 345 350
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
355 360 365
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
370 375 380
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
385 390 395 400
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
405 410 415
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
420 425 430
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
435 440 445
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
450 455 460
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
465 470 475 480
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
485 490 495
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
500 505 510
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Lys Arg Gly Arg Lys
515 520 525
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
530 535 540
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
545 550 555 560
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
565 570 575
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
580 585 590
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
595 600 605
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
610 615 620
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
625 630 635 640
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
645 650 655
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
660 665 670
Ala Leu Pro Pro Arg Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala
675 680 685
Gly Asp Val Glu Ser Asn Pro Gly Pro Met Pro Pro Pro Arg Leu Leu
690 695 700
Phe Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro
705 710 715 720
Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu
725 730 735
Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu
740 745 750
Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu
755 760 765
Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val
770 775 780
Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser
785 790 795 800
Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly
805 810 815
Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly
820 825 830
Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu
835 840 845
Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp
850 855 860
Glu Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser
865 870 875 880
Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser
885 890 895
Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr
900 905 910
His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys
915 920 925
Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu
930 935 940
Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg
945 950 955 960
Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val
965 970 975
Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val
980 985 990
Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu
995 1000 1005
His Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
1010 1015 1020
<210> 44
<211> 2085
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 44
gacattgtga tgactcagac accactgagc tccccagtga ctctgggaca gccagccagt 60
atctcatgca gatctagtca gtcactggtc tacagcgacg gcaacaccta tctgagctgg 120
ctgcagcagc gaccaggaca gccacctaga ctgctgatct acaagatttc caataggttc 180
tctggagtgc ccgaccgctt tagcggatcc ggagctggaa ctgatttcac cctgaaaatc 240
tcccgcgtgg aggctgaaga tgtgggcgtc tactattgcg tccaggcaac ccagttccct 300
ctgacatttg gcgggggaac taaggtggag atcaagggag gaggaggatc tggaggagga 360
ggaagtggag gaggaggatc cgaagtgcag ctggtccagt ctggggccga ggtgaagaaa 420
cctggagaaa gtctgaagat ctcatgtaaa ggctccgggt actctttcac aagttattgg 480
attggctggg tccgacagat gccaggaaag ggcctggagt ggatgggaat catctacccc 540
ggcgacagcg atacccggta ttctcctagt tttcagggcc aggtgacaat cagcgcagac 600
aagtccatta ccacagccta tctgcagtgg tcaagcctga aagcctctga taccgctatg 660
tactattgtg ccaggcaccc tagctacggg tcaggaagcc caaactttga ctattggggc 720
caggggacac tggtgactgt ctcctctgac aaaactcaca catgcccacc gtgcccagca 780
cctcctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 840
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 900
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 960
gaggagcagt accagagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 1020
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 1080
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgcca 1140
ccatcacgag atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1200
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1260
accacgcctc ccgtgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1320
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1380
cacaaccact acacgcagaa gagcctctcc ctgtctccct tttgggtgct ggtggtggtt 1440
ggtggagtcc tggcttgcta tagcttgcta gtaacagtgg cctttattat tttctgggtg 1500
aggagtaaga ggagcagggg aggtcacagt gactacatga acatgactcc ccgccgcccc 1560
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 1620
tccaaacggg gcagaaagaa actcctgtat atattcaaac aaccatttat gagaccagta 1680
caaactactc aagaggaaga tggctgtagc tgccgatttc cagaagaaga agaaggagga 1740
tgtgaactga gagtgaagtt cagcaggagc gcagacgccc ccgcgtacca gcagggccag 1800
aaccagctct ataacgagct caatctagga cgaagagagg agtacgatgt tttggacaag 1860
agacgtggcc gggaccctga gatgggggga aagccgagaa ggaagaaccc tcaggaaggc 1920
ctgtacaatg aactgcagaa agataagatg gcggaggcct acagtgagat tgggatgaaa 1980
ggcgagcgcc ggaggggcaa ggggcacgat ggcctttacc agggtctcag tacagccacc 2040
aaggacacct acgacgccct tcacatgcag gccctgcccc ctcgc 2085
<210> 45
<211> 1959
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 45
gacattgtga tgactcagac accactgagc tccccagtga ctctgggaca gccagccagt 60
atctcatgca gatctagtca gtcactggtc tacagcgacg gcaacaccta tctgagctgg 120
ctgcagcagc gaccaggaca gccacctaga ctgctgatct acaagatttc caataggttc 180
tctggagtgc ccgaccgctt tagcggatcc ggagctggaa ctgatttcac cctgaaaatc 240
tcccgcgtgg aggctgaaga tgtgggcgtc tactattgcg tccaggcaac ccagttccct 300
ctgacatttg gcgggggaac taaggtggag atcaagggag gaggaggatc tggaggagga 360
ggaagtggag gaggaggatc cgaagtgcag ctggtccagt ctggggccga ggtgaagaaa 420
cctggagaaa gtctgaagat ctcatgtaaa ggctccgggt actctttcac aagttattgg 480
attggctggg tccgacagat gccaggaaag ggcctggagt ggatgggaat catctacccc 540
ggcgacagcg atacccggta ttctcctagt tttcagggcc aggtgacaat cagcgcagac 600
aagtccatta ccacagccta tctgcagtgg tcaagcctga aagcctctga taccgctatg 660
tactattgtg ccaggcaccc tagctacggg tcaggaagcc caaactttga ctattggggc 720
caggggacac tggtgactgt ctcctctgac aaaactcaca catgcccacc gtgcccagca 780
cctcctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 840
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 900
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 960
gaggagcagt accagagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 1020
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 1080
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgcca 1140
ccatcacgag atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1200
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1260
accacgcctc ccgtgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1320
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1380
cacaaccact acacgcagaa gagcctctcc ctgtctccct tttgggtgct ggtggtggtt 1440
ggtggagtcc tggcttgcta tagcttgcta gtaacagtgg cctttattat tttctgggtg 1500
aggagtaaga ggagcagggg aggtcacagt gactacatga acatgactcc ccgccgcccc 1560
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 1620
tccagagtga agttcagcag gagcgcagac gcccccgcgt accagcaggg ccagaaccag 1680
ctctataacg agctcaatct aggacgaaga gaggagtacg atgttttgga caagagacgt 1740
ggccgggacc ctgagatggg gggaaagccg agaaggaaga accctcagga aggcctgtac 1800
aatgaactgc agaaagataa gatggcggag gcctacagtg agattgggat gaaaggcgag 1860
cgccggaggg gcaaggggca cgatggcctt taccagggtc tcagtacagc caccaaggac 1920
acctacgacg cccttcacat gcaggccctg ccccctcgc 1959
<210> 46
<211> 1962
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 46
gacattgtga tgactcagac accactgagc tccccagtga ctctgggaca gccagccagt 60
atctcatgca gatctagtca gtcactggtc tacagcgacg gcaacaccta tctgagctgg 120
ctgcagcagc gaccaggaca gccacctaga ctgctgatct acaagatttc caataggttc 180
tctggagtgc ccgaccgctt tagcggatcc ggagctggaa ctgatttcac cctgaaaatc 240
tcccgcgtgg aggctgaaga tgtgggcgtc tactattgcg tccaggcaac ccagttccct 300
ctgacatttg gcgggggaac taaggtggag atcaagggag gaggaggatc tggaggagga 360
ggaagtggag gaggaggatc cgaagtgcag ctggtccagt ctggggccga ggtgaagaaa 420
cctggagaaa gtctgaagat ctcatgtaaa ggctccgggt actctttcac aagttattgg 480
attggctggg tccgacagat gccaggaaag ggcctggagt ggatgggaat catctacccc 540
ggcgacagcg atacccggta ttctcctagt tttcagggcc aggtgacaat cagcgcagac 600
aagtccatta ccacagccta tctgcagtgg tcaagcctga aagcctctga taccgctatg 660
tactattgtg ccaggcaccc tagctacggg tcaggaagcc caaactttga ctattggggc 720
caggggacac tggtgactgt ctcctctgac aaaactcaca catgcccacc gtgcccagca 780
cctcctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 840
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 900
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 960
gaggagcagt accagagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 1020
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 1080
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgcca 1140
ccatcacgag atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1200
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1260
accacgcctc ccgtgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1320
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1380
cacaaccact acacgcagaa gagcctctcc ctgtctccct tttgggtgct ggtggtggtt 1440
ggtggagtcc tggcttgcta tagcttgcta gtaacagtgg cctttattat tttctgggtg 1500
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 1560
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 1620
gaactgagag tgaagttcag caggagcgca gacgcccccg cgtaccagca gggccagaac 1680
cagctctata acgagctcaa tctaggacga agagaggagt acgatgtttt ggacaagaga 1740
cgtggccggg accctgagat ggggggaaag ccgagaagga agaaccctca ggaaggcctg 1800
tacaatgaac tgcagaaaga taagatggcg gaggcctaca gtgagattgg gatgaaaggc 1860
gagcgccgga ggggcaaggg gcacgatggc ctttaccagg gtctcagtac agccaccaag 1920
gacacctacg acgcccttca catgcaggcc ctgccccctc gc 1962
<210> 47
<211> 1836
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 47
gacattgtga tgactcagac accactgagc tccccagtga ctctgggaca gccagccagt 60
atctcatgca gatctagtca gtcactggtc tacagcgacg gcaacaccta tctgagctgg 120
ctgcagcagc gaccaggaca gccacctaga ctgctgatct acaagatttc caataggttc 180
tctggagtgc ccgaccgctt tagcggatcc ggagctggaa ctgatttcac cctgaaaatc 240
tcccgcgtgg aggctgaaga tgtgggcgtc tactattgcg tccaggcaac ccagttccct 300
ctgacatttg gcgggggaac taaggtggag atcaagggag gaggaggatc tggaggagga 360
ggaagtggag gaggaggatc cgaagtgcag ctggtccagt ctggggccga ggtgaagaaa 420
cctggagaaa gtctgaagat ctcatgtaaa ggctccgggt actctttcac aagttattgg 480
attggctggg tccgacagat gccaggaaag ggcctggagt ggatgggaat catctacccc 540
ggcgacagcg atacccggta ttctcctagt tttcagggcc aggtgacaat cagcgcagac 600
aagtccatta ccacagccta tctgcagtgg tcaagcctga aagcctctga taccgctatg 660
tactattgtg ccaggcaccc tagctacggg tcaggaagcc caaactttga ctattggggc 720
caggggacac tggtgactgt ctcctctgac aaaactcaca catgcccacc gtgcccagca 780
cctcctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 840
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 900
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 960
gaggagcagt accagagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 1020
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctccc agcccccatc 1080
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgcca 1140
ccatcacgag atgagctgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1200
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1260
accacgcctc ccgtgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1320
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1380
cacaaccact acacgcagaa gagcctctcc ctgtctccct tttgggtgct ggtggtggtt 1440
ggtggagtcc tggcttgcta tagcttgcta gtaacagtgg cctttattat tttctgggtg 1500
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 1560
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 1620
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 1680
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 1740
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 1800
tacgacgccc ttcacatgca ggccctgccc cctcgc 1836
<210> 48
<211> 2100
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 48
gacattgtgc tgacccaatc tccagctatc ctgtctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtgtaaat tacatggact ggtaccagaa gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agttttaatc cacccacgtt cggagggggg 300
accaagctgg aaataaaagg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gcgaggtgca gctgcagcag tctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagcctg acatctgagg actctgcgga ctattactgt 660
gcaagatcta attattacgg tagtagctac tggttcttcg atgtctgggg cgcagggacc 720
acggtcaccg tctcctcact cgacgaatct aagtacggac cgccctgccc cccttgccct 780
gcccccgagt tcctgggcgg acccagcgtg ttcctgttcc cccccaagcc caaggacacc 840
ctgatgatca gccggacccc cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat 900
cccgaggtcc agttcaattg gtacgtggac ggcgtggaag tgcacaacgc caagaccaag 960
cccagagagg aacagttcaa cagcacctac cgggtggtgt ctgtgctgac cgtgctgcac 1020
caggactggc tgaacggcaa agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc 1080
agcatcgaaa agaccatcag caaggccaag ggccagcctc gcgagcccca ggtgtacacc 1140
ctgcctccct cccaggaaga gatgaccaag aaccaggtgt ccctgacctg cctggtgaag 1200
ggcttctacc ccagcgacat cgccgtggag tgggagagca acggccagcc tgagaacaac 1260
tacaagacca cccctcccgt gctggacagc gacggcagct tcttcctgta cagccggctg 1320
accgtggaca agagccggtg gcaggaaggc aacgtcttta gctgcagcgt gatgcacgag 1380
gccctgcaca accactacac ccagaagagc ctgagcctgt ccctgggcaa gatgttctgg 1440
gtgctggtgg tggtgggcgg ggtgctggcc tgctacagcc tgctggtgac agtggccttc 1500
atcatctttt gggtgcggag caagcggagc agaggcggcc acagcgacta catgaacatg 1560
acccccagac ggcctggccc cacccggaag cactaccagc cctacgcccc acccagggac 1620
tttgccgcct acagaagcaa acggggcaga aagaaactcc tgtatatatt caaacaacca 1680
tttatgagac cagtacaaac tactcaagag gaagatggct gtagctgccg atttccagaa 1740
gaagaagaag gaggatgtga actgcgggtg aagttcagca gaagcgccga cgcccctgcc 1800
taccagcagg gccagaatca gctgtacaac gagctgaacc tgggcagaag ggaagagtac 1860
gacgtcctgg ataagcggag aggccgggac cctgagatgg gcggcaagcc tcggcggaag 1920
aacccccagg aaggcctgta taacgaactg cagaaagaca agatggccga ggcctacagc 1980
gagatcggca tgaagggcga gcggaggcgg ggcaagggcc acgacggcct gtatcagggc 2040
ctgtccaccg ccaccaagga tacctacgac gccctgcaca tgcaggccct gcccccaagg 2100
<210> 49
<211> 1974
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 49
gacattgtgc tgacccaatc tccagctatc ctgtctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtgtaaat tacatggact ggtaccagaa gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agttttaatc cacccacgtt cggagggggg 300
accaagctgg aaataaaagg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gcgaggtgca gctgcagcag tctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagcctg acatctgagg actctgcgga ctattactgt 660
gcaagatcta attattacgg tagtagctac tggttcttcg atgtctgggg cgcagggacc 720
acggtcaccg tctcctcact cgacgaatct aagtacggac cgccctgccc cccttgccct 780
gcccccgagt tcctgggcgg acccagcgtg ttcctgttcc cccccaagcc caaggacacc 840
ctgatgatca gccggacccc cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat 900
cccgaggtcc agttcaattg gtacgtggac ggcgtggaag tgcacaacgc caagaccaag 960
cccagagagg aacagttcaa cagcacctac cgggtggtgt ctgtgctgac cgtgctgcac 1020
caggactggc tgaacggcaa agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc 1080
agcatcgaaa agaccatcag caaggccaag ggccagcctc gcgagcccca ggtgtacacc 1140
ctgcctccct cccaggaaga gatgaccaag aaccaggtgt ccctgacctg cctggtgaag 1200
ggcttctacc ccagcgacat cgccgtggag tgggagagca acggccagcc tgagaacaac 1260
tacaagacca cccctcccgt gctggacagc gacggcagct tcttcctgta cagccggctg 1320
accgtggaca agagccggtg gcaggaaggc aacgtcttta gctgcagcgt gatgcacgag 1380
gccctgcaca accactacac ccagaagagc ctgagcctgt ccctgggcaa gatgttctgg 1440
gtgctggtgg tggtgggcgg ggtgctggcc tgctacagcc tgctggtgac agtggccttc 1500
atcatctttt gggtgcggag caagcggagc agaggcggcc acagcgacta catgaacatg 1560
acccccagac ggcctggccc cacccggaag cactaccagc cctacgcccc acccagggac 1620
tttgccgcct acagaagccg ggtgaagttc agcagaagcg ccgacgcccc tgcctaccag 1680
cagggccaga atcagctgta caacgagctg aacctgggca gaagggaaga gtacgacgtc 1740
ctggataagc ggagaggccg ggaccctgag atgggcggca agcctcggcg gaagaacccc 1800
caggaaggcc tgtataacga actgcagaaa gacaagatgg ccgaggccta cagcgagatc 1860
ggcatgaagg gcgagcggag gcggggcaag ggccacgacg gcctgtatca gggcctgtcc 1920
accgccacca aggataccta cgacgccctg cacatgcagg ccctgccccc aagg 1974
<210> 50
<211> 2094
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 50
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 300
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 660
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 720
actctcacag tctcctcact cgaccccaaa tcttctgaca aaactcacac atgcccaccg 780
tgcccagcac ctcctgtggc aggaccgtca gtcttcctct tccccccaaa acccaaggac 840
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 900
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 960
aagccgcggg aggagcagta ccagagcacg taccgtgtgg tcagcgtcct caccgtcctg 1020
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 1080
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 1140
accctgccac catcacgaga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc 1200
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 1260
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 1320
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 1380
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccctt ttgggtgctg 1440
gtggtggttg gtggagtcct ggcttgctat agcttgctag taacagtggc ctttattatt 1500
ttctgggtga ggagtaagag gagcagggga ggtcacagtg actacatgaa catgactccc 1560
cgccgccccg ggcccacccg caagcattac cagccctatg ccccaccacg cgacttcgca 1620
gcctatcgct ccaaacgggg cagaaagaaa ctcctgtata tattcaaaca accatttatg 1680
agaccagtac aaactactca agaggaagat ggctgtagct gccgatttcc agaagaagaa 1740
gaaggaggat gtgaactgag agtgaagttc agcaggagcg cagacgcccc cgcgtaccag 1800
cagggccaga accagctcta taacgagctc aatctaggac gaagagagga gtacgatgtt 1860
ttggacaaga gacgtggccg ggaccctgag atggggggaa agccgagaag gaagaaccct 1920
caggaaggcc tgtacaatga actgcagaaa gataagatgg cggaggccta cagtgagatt 1980
gggatgaaag gcgagcgccg gaggggcaag gggcacgatg gcctttacca gggtctcagt 2040
acagccacca aggacaccta cgacgccctt cacatgcagg ccctgccccc tcgc 2094
<210> 51
<211> 1968
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 51
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 300
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 660
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 720
actctcacag tctcctcact cgaccccaaa tcttctgaca aaactcacac atgcccaccg 780
tgcccagcac ctcctgtggc aggaccgtca gtcttcctct tccccccaaa acccaaggac 840
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 900
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 960
aagccgcggg aggagcagta ccagagcacg taccgtgtgg tcagcgtcct caccgtcctg 1020
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 1080
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 1140
accctgccac catcacgaga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc 1200
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 1260
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 1320
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 1380
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccctt ttgggtgctg 1440
gtggtggttg gtggagtcct ggcttgctat agcttgctag taacagtggc ctttattatt 1500
ttctgggtga ggagtaagag gagcagggga ggtcacagtg actacatgaa catgactccc 1560
cgccgccccg ggcccacccg caagcattac cagccctatg ccccaccacg cgacttcgca 1620
gcctatcgct ccagagtgaa gttcagcagg agcgcagacg cccccgcgta ccagcagggc 1680
cagaaccagc tctataacga gctcaatcta ggacgaagag aggagtacga tgttttggac 1740
aagagacgtg gccgggaccc tgagatgggg ggaaagccga gaaggaagaa ccctcaggaa 1800
ggcctgtaca atgaactgca gaaagataag atggcggagg cctacagtga gattgggatg 1860
aaaggcgagc gccggagggg caaggggcac gatggccttt accagggtct cagtacagcc 1920
accaaggaca cctacgacgc ccttcacatg caggccctgc cccctcgc 1968
<210> 52
<211> 1971
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 52
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 300
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 660
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 720
actctcacag tctcctcact cgaccccaaa tcttctgaca aaactcacac atgcccaccg 780
tgcccagcac ctcctgtggc aggaccgtca gtcttcctct tccccccaaa acccaaggac 840
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 900
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 960
aagccgcggg aggagcagta ccagagcacg taccgtgtgg tcagcgtcct caccgtcctg 1020
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 1080
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 1140
accctgccac catcacgaga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc 1200
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 1260
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 1320
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 1380
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccctt ttgggtgctg 1440
gtggtggttg gtggagtcct ggcttgctat agcttgctag taacagtggc ctttattatt 1500
ttctgggtga aacggggcag aaagaaactc ctgtatatat tcaaacaacc atttatgaga 1560
ccagtacaaa ctactcaaga ggaagatggc tgtagctgcc gatttccaga agaagaagaa 1620
ggaggatgtg aactgagagt gaagttcagc aggagcgcag acgcccccgc gtaccagcag 1680
ggccagaacc agctctataa cgagctcaat ctaggacgaa gagaggagta cgatgttttg 1740
gacaagagac gtggccggga ccctgagatg gggggaaagc cgagaaggaa gaaccctcag 1800
gaaggcctgt acaatgaact gcagaaagat aagatggcgg aggcctacag tgagattggg 1860
atgaaaggcg agcgccggag gggcaagggg cacgatggcc tttaccaggg tctcagtaca 1920
gccaccaagg acacctacga cgcccttcac atgcaggccc tgccccctcg c 1971
<210> 53
<211> 3180
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 53
atgctgctgc tggtcacctc actgctgctg tgcgaactgc cccaccccgc cttcctgctg 60
attcccgaca ttgtgatgac tcagacacca ctgagctccc cagtgactct gggacagcca 120
gccagtatct catgcagatc tagtcagtca ctggtctaca gcgacggcaa cacctatctg 180
agctggctgc agcagcgacc aggacagcca cctagactgc tgatctacaa gatttccaat 240
aggttctctg gagtgcccga ccgctttagc ggatccggag ctggaactga tttcaccctg 300
aaaatctccc gcgtggaggc tgaagatgtg ggcgtctact attgcgtcca ggcaacccag 360
ttccctctga catttggcgg gggaactaag gtggagatca agggaggagg aggatctgga 420
ggaggaggaa gtggaggagg aggatccgaa gtgcagctgg tccagtctgg ggccgaggtg 480
aagaaacctg gagaaagtct gaagatctca tgtaaaggct ccgggtactc tttcacaagt 540
tattggattg gctgggtccg acagatgcca ggaaagggcc tggagtggat gggaatcatc 600
taccccggcg acagcgatac ccggtattct cctagttttc agggccaggt gacaatcagc 660
gcagacaagt ccattaccac agcctatctg cagtggtcaa gcctgaaagc ctctgatacc 720
gctatgtact attgtgccag gcaccctagc tacgggtcag gaagcccaaa ctttgactat 780
tggggccagg ggacactggt gactgtctcc tctgacaaaa ctcacacatg cccaccgtgc 840
ccagcacctc ctgtggcagg accgtcagtc ttcctcttcc ccccaaaacc caaggacacc 900
ctcatgatct cccggacccc tgaggtcaca tgcgtggtgg tggacgtgag ccacgaagac 960
cctgaggtca agttcaactg gtacgtggac ggcgtggagg tgcataatgc caagacaaag 1020
ccgcgggagg agcagtacca gagcacgtac cgtgtggtca gcgtcctcac cgtcctgcac 1080
caggactggc tgaatggcaa ggagtacaag tgcaaggtct ccaacaaagc cctcccagcc 1140
cccatcgaga aaaccatctc caaagccaaa gggcagcccc gagaaccaca ggtgtacacc 1200
ctgccaccat cacgagatga gctgaccaag aaccaggtca gcctgacctg cctggtcaaa 1260
ggcttctatc ccagcgacat cgccgtggag tgggagagca atgggcagcc ggagaacaac 1320
tacaagacca cgcctcccgt gctggactcc gacggctcct tcttcctcta cagcaagctc 1380
accgtggaca agagcaggtg gcagcagggg aacgtcttct catgctccgt gatgcatgag 1440
gctctgcaca accactacac gcagaagagc ctctccctgt ctcccttttg ggtgctggtg 1500
gtggttggtg gagtcctggc ttgctatagc ttgctagtaa cagtggcctt tattattttc 1560
tgggtgagga gtaagaggag caggggaggt cacagtgact acatgaacat gactccccgc 1620
cgccccgggc ccacccgcaa gcattaccag ccctatgccc caccacgcga cttcgcagcc 1680
tatcgctcca aacggggcag aaagaaactc ctgtatatat tcaaacaacc atttatgaga 1740
ccagtacaaa ctactcaaga ggaagatggc tgtagctgcc gatttccaga agaagaagaa 1800
ggaggatgtg aactgagagt gaagttcagc aggagcgcag acgcccccgc gtaccagcag 1860
ggccagaacc agctctataa cgagctcaat ctaggacgaa gagaggagta cgatgttttg 1920
gacaagagac gtggccggga ccctgagatg gggggaaagc cgagaaggaa gaaccctcag 1980
gaaggcctgt acaatgaact gcagaaagat aagatggcgg aggcctacag tgagattggg 2040
atgaaaggcg agcgccggag gggcaagggg cacgatggcc tttaccaggg tctcagtaca 2100
gccaccaagg acacctacga cgcccttcac atgcaggccc tgccccctcg ccagtgtact 2160
aattatgctc tcttgaaatt ggctggagat gttgagagca accccgggcc gatgccacct 2220
cctcgcctcc tcttcttcct cctcttcctc acccccatgg aagtcaggcc cgaggaacct 2280
ctagtggtga aggtggaaga gggagataac gctgtgctgc agtgcctcaa ggggacctca 2340
gatggcccca ctcagcagct gacctggtct cgggagtccc cgcttaaacc cttcttaaaa 2400
ctcagcctgg ggctgccagg cctgggaatc cacatgaggc ccctggccat ctggcttttc 2460
atcttcaacg tctctcaaca gatggggggc ttctacctgt gccagccggg gcccccctct 2520
gagaaggcct ggcagcctgg ctggacagtc aatgtggagg gcagcgggga gctgttccgg 2580
tggaatgttt cggacctagg tggcctgggc tgtggcctga agaacaggtc ctcagagggc 2640
cccagctccc cttccgggaa gctcatgagc cccaagctgt atgtgtgggc caaagaccgc 2700
cctgagatct gggagggaga gcctccgtgt gtcccaccga gggacagcct gaaccagagc 2760
ctcagccagg acctcaccat ggcccctggc tccacactct ggctgtcctg tggggtaccc 2820
cctgactctg tgtccagggg ccccctctcc tggacccatg tgcaccccaa ggggcctaag 2880
tcattgctga gcctagagct gaaggacgat cgccctgcca gagatatgtg ggtaatggag 2940
acgggtctgt tgttgccccg ggccacagct caagacgctg gaaagtatta ttgtcaccgt 3000
ggcaacctga ccatgtcatt ccacctggag atcactgctc ggccagtact atggcactgg 3060
ctgctgagga ctggtggctg gaaggtctca gctgtgactt tggcttatct gatcttctgc 3120
ctgtgttccc ttgtgggcat tcttcatctt caaagagccc tggtcctgag gaggaaaaga 3180
<210> 54
<211> 3054
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 54
atgctgctgc tggtcacctc actgctgctg tgcgaactgc cccaccccgc cttcctgctg 60
attcccgaca ttgtgatgac tcagacacca ctgagctccc cagtgactct gggacagcca 120
gccagtatct catgcagatc tagtcagtca ctggtctaca gcgacggcaa cacctatctg 180
agctggctgc agcagcgacc aggacagcca cctagactgc tgatctacaa gatttccaat 240
aggttctctg gagtgcccga ccgctttagc ggatccggag ctggaactga tttcaccctg 300
aaaatctccc gcgtggaggc tgaagatgtg ggcgtctact attgcgtcca ggcaacccag 360
ttccctctga catttggcgg gggaactaag gtggagatca agggaggagg aggatctgga 420
ggaggaggaa gtggaggagg aggatccgaa gtgcagctgg tccagtctgg ggccgaggtg 480
aagaaacctg gagaaagtct gaagatctca tgtaaaggct ccgggtactc tttcacaagt 540
tattggattg gctgggtccg acagatgcca ggaaagggcc tggagtggat gggaatcatc 600
taccccggcg acagcgatac ccggtattct cctagttttc agggccaggt gacaatcagc 660
gcagacaagt ccattaccac agcctatctg cagtggtcaa gcctgaaagc ctctgatacc 720
gctatgtact attgtgccag gcaccctagc tacgggtcag gaagcccaaa ctttgactat 780
tggggccagg ggacactggt gactgtctcc tctgacaaaa ctcacacatg cccaccgtgc 840
ccagcacctc ctgtggcagg accgtcagtc ttcctcttcc ccccaaaacc caaggacacc 900
ctcatgatct cccggacccc tgaggtcaca tgcgtggtgg tggacgtgag ccacgaagac 960
cctgaggtca agttcaactg gtacgtggac ggcgtggagg tgcataatgc caagacaaag 1020
ccgcgggagg agcagtacca gagcacgtac cgtgtggtca gcgtcctcac cgtcctgcac 1080
caggactggc tgaatggcaa ggagtacaag tgcaaggtct ccaacaaagc cctcccagcc 1140
cccatcgaga aaaccatctc caaagccaaa gggcagcccc gagaaccaca ggtgtacacc 1200
ctgccaccat cacgagatga gctgaccaag aaccaggtca gcctgacctg cctggtcaaa 1260
ggcttctatc ccagcgacat cgccgtggag tgggagagca atgggcagcc ggagaacaac 1320
tacaagacca cgcctcccgt gctggactcc gacggctcct tcttcctcta cagcaagctc 1380
accgtggaca agagcaggtg gcagcagggg aacgtcttct catgctccgt gatgcatgag 1440
gctctgcaca accactacac gcagaagagc ctctccctgt ctcccttttg ggtgctggtg 1500
gtggttggtg gagtcctggc ttgctatagc ttgctagtaa cagtggcctt tattattttc 1560
tgggtgagga gtaagaggag caggggaggt cacagtgact acatgaacat gactccccgc 1620
cgccccgggc ccacccgcaa gcattaccag ccctatgccc caccacgcga cttcgcagcc 1680
tatcgctcca gagtgaagtt cagcaggagc gcagacgccc ccgcgtacca gcagggccag 1740
aaccagctct ataacgagct caatctagga cgaagagagg agtacgatgt tttggacaag 1800
agacgtggcc gggaccctga gatgggggga aagccgagaa ggaagaaccc tcaggaaggc 1860
ctgtacaatg aactgcagaa agataagatg gcggaggcct acagtgagat tgggatgaaa 1920
ggcgagcgcc ggaggggcaa ggggcacgat ggcctttacc agggtctcag tacagccacc 1980
aaggacacct acgacgccct tcacatgcag gccctgcccc ctcgccagtg tactaattat 2040
gctctcttga aattggctgg agatgttgag agcaaccccg ggccgatgcc acctcctcgc 2100
ctcctcttct tcctcctctt cctcaccccc atggaagtca ggcccgagga acctctagtg 2160
gtgaaggtgg aagagggaga taacgctgtg ctgcagtgcc tcaaggggac ctcagatggc 2220
cccactcagc agctgacctg gtctcgggag tccccgctta aacccttctt aaaactcagc 2280
ctggggctgc caggcctggg aatccacatg aggcccctgg ccatctggct tttcatcttc 2340
aacgtctctc aacagatggg gggcttctac ctgtgccagc cggggccccc ctctgagaag 2400
gcctggcagc ctggctggac agtcaatgtg gagggcagcg gggagctgtt ccggtggaat 2460
gtttcggacc taggtggcct gggctgtggc ctgaagaaca ggtcctcaga gggccccagc 2520
tccccttccg ggaagctcat gagccccaag ctgtatgtgt gggccaaaga ccgccctgag 2580
atctgggagg gagagcctcc gtgtgtccca ccgagggaca gcctgaacca gagcctcagc 2640
caggacctca ccatggcccc tggctccaca ctctggctgt cctgtggggt accccctgac 2700
tctgtgtcca ggggccccct ctcctggacc catgtgcacc ccaaggggcc taagtcattg 2760
ctgagcctag agctgaagga cgatcgcccg gccagagata tgtgggtaat ggagacgggt 2820
ctgttgttgc cccgggccac agctcaagac gctggaaagt attattgtca ccgtggcaac 2880
ctgaccatgt cattccacct ggagatcact gctcggccag tactatggca ctggctgctg 2940
aggactggtg gctggaaggt ctcagctgtg actttggctt atctgatctt ctgcctgtgt 3000
tcccttgtgg gcattcttca tcttcaaaga gccctggtcc tgaggaggaa aaga 3054
<210> 55
<211> 3057
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 55
atgctgctgc tggtcacctc actgctgctg tgcgaactgc cccaccccgc cttcctgctg 60
attcccgaca ttgtgatgac tcagacacca ctgagctccc cagtgactct gggacagcca 120
gccagtatct catgcagatc tagtcagtca ctggtctaca gcgacggcaa cacctatctg 180
agctggctgc agcagcgacc aggacagcca cctagactgc tgatctacaa gatttccaat 240
aggttctctg gagtgcccga ccgctttagc ggatccggag ctggaactga tttcaccctg 300
aaaatctccc gcgtggaggc tgaagatgtg ggcgtctact attgcgtcca ggcaacccag 360
ttccctctga catttggcgg gggaactaag gtggagatca agggaggagg aggatctgga 420
ggaggaggaa gtggaggagg aggatccgaa gtgcagctgg tccagtctgg ggccgaggtg 480
aagaaacctg gagaaagtct gaagatctca tgtaaaggct ccgggtactc tttcacaagt 540
tattggattg gctgggtccg acagatgcca ggaaagggcc tggagtggat gggaatcatc 600
taccccggcg acagcgatac ccggtattct cctagttttc agggccaggt gacaatcagc 660
gcagacaagt ccattaccac agcctatctg cagtggtcaa gcctgaaagc ctctgatacc 720
gctatgtact attgtgccag gcaccctagc tacgggtcag gaagcccaaa ctttgactat 780
tggggccagg ggacactggt gactgtctcc tctgacaaaa ctcacacatg cccaccgtgc 840
ccagcacctc ctgtggcagg accgtcagtc ttcctcttcc ccccaaaacc caaggacacc 900
ctcatgatct cccggacccc tgaggtcaca tgcgtggtgg tggacgtgag ccacgaagac 960
cctgaggtca agttcaactg gtacgtggac ggcgtggagg tgcataatgc caagacaaag 1020
ccgcgggagg agcagtacca gagcacgtac cgtgtggtca gcgtcctcac cgtcctgcac 1080
caggactggc tgaatggcaa ggagtacaag tgcaaggtct ccaacaaagc cctcccagcc 1140
cccatcgaga aaaccatctc caaagccaaa gggcagcccc gagaaccaca ggtgtacacc 1200
ctgccaccat cacgagatga gctgaccaag aaccaggtca gcctgacctg cctggtcaaa 1260
ggcttctatc ccagcgacat cgccgtggag tgggagagca atgggcagcc ggagaacaac 1320
tacaagacca cgcctcccgt gctggactcc gacggctcct tcttcctcta cagcaagctc 1380
accgtggaca agagcaggtg gcagcagggg aacgtcttct catgctccgt gatgcatgag 1440
gctctgcaca accactacac gcagaagagc ctctccctgt ctcccttttg ggtgctggtg 1500
gtggttggtg gagtcctggc ttgctatagc ttgctagtaa cagtggcctt tattattttc 1560
tgggtgaaac ggggcagaaa gaaactcctg tatatattca aacaaccatt tatgagacca 1620
gtacaaacta ctcaagagga agatggctgt agctgccgat ttccagaaga agaagaagga 1680
ggatgtgaac tgagagtgaa gttcagcagg agcgcagacg cccccgcgta ccagcagggc 1740
cagaaccagc tctataacga gctcaatcta ggacgaagag aggagtacga tgttttggac 1800
aagagacgtg gccgggaccc tgagatgggg ggaaagccga gaaggaagaa ccctcaggaa 1860
ggcctgtaca atgaactgca gaaagataag atggcggagg cctacagtga gattgggatg 1920
aaaggcgagc gccggagggg caaggggcac gatggccttt accagggtct cagtacagcc 1980
accaaggaca cctacgacgc ccttcacatg caggccctgc cccctcgcca gtgtactaat 2040
tatgctctct tgaaattggc tggagatgtt gagagcaacc ccgggccgat gccacctcct 2100
cgcctcctct tcttcctcct cttcctcacc cccatggaag tcaggcccga ggaacctcta 2160
gtggtgaagg tggaagaggg agataacgct gtgctgcagt gcctcaaggg gacctcagat 2220
ggccccactc agcagctgac ctggtctcgg gagtccccgc ttaaaccctt cttaaaactc 2280
agcctggggc tgccaggcct gggaatccac atgaggcccc tggccatctg gcttttcatc 2340
ttcaacgtct ctcaacagat ggggggcttc tacctgtgcc agccggggcc cccctctgag 2400
aaggcctggc agcctggctg gacagtcaat gtggagggca gcggggagct gttccggtgg 2460
aatgtttcgg acctaggtgg cctgggctgt ggcctgaaga acaggtcctc agagggcccc 2520
agctcccctt ccgggaagct catgagcccc aagctgtatg tgtgggccaa agaccgccct 2580
gagatctggg agggagagcc tccgtgtgtc ccaccgaggg acagcctgaa ccagagcctc 2640
agccaggacc tcaccatggc ccctggctcc acactctggc tgtcctgtgg ggtaccccct 2700
gactctgtgt ccaggggccc cctctcctgg acccatgtgc accccaaggg gcctaagtca 2760
ttgctgagcc tagagctgaa ggacgatcgc cctgccagag atatgtgggt aatggagacg 2820
ggtctgttgt tgccccgggc cacagctcaa gacgctggaa agtattattg tcaccgtggc 2880
aacctgacca tgtcattcca cctggagatc actgctcggc cagtactatg gcactggctg 2940
ctgaggactg gtggctggaa ggtctcagct gtgactttgg cttatctgat cttctgcctg 3000
tgttcccttg tgggcattct tcatcttcaa agagccctgg tcctgaggag gaaaaga 3057
<210> 56
<211> 2931
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 56
atgctgctgc tggtcacctc actgctgctg tgcgaactgc cccaccccgc cttcctgctg 60
attcccgaca ttgtgatgac tcagacacca ctgagctccc cagtgactct gggacagcca 120
gccagtatct catgcagatc tagtcagtca ctggtctaca gcgacggcaa cacctatctg 180
agctggctgc agcagcgacc aggacagcca cctagactgc tgatctacaa gatttccaat 240
aggttctctg gagtgcccga ccgctttagc ggatccggag ctggaactga tttcaccctg 300
aaaatctccc gcgtggaggc tgaagatgtg ggcgtctact attgcgtcca ggcaacccag 360
ttccctctga catttggcgg gggaactaag gtggagatca agggaggagg aggatctgga 420
ggaggaggaa gtggaggagg aggatccgaa gtgcagctgg tccagtctgg ggccgaggtg 480
aagaaacctg gagaaagtct gaagatctca tgtaaaggct ccgggtactc tttcacaagt 540
tattggattg gctgggtccg acagatgcca ggaaagggcc tggagtggat gggaatcatc 600
taccccggcg acagcgatac ccggtattct cctagttttc agggccaggt gacaatcagc 660
gcagacaagt ccattaccac agcctatctg cagtggtcaa gcctgaaagc ctctgatacc 720
gctatgtact attgtgccag gcaccctagc tacgggtcag gaagcccaaa ctttgactat 780
tggggccagg ggacactggt gactgtctcc tctgacaaaa ctcacacatg cccaccgtgc 840
ccagcacctc ctgtggcagg accgtcagtc ttcctcttcc ccccaaaacc caaggacacc 900
ctcatgatct cccggacccc tgaggtcaca tgcgtggtgg tggacgtgag ccacgaagac 960
cctgaggtca agttcaactg gtacgtggac ggcgtggagg tgcataatgc caagacaaag 1020
ccgcgggagg agcagtacca gagcacgtac cgtgtggtca gcgtcctcac cgtcctgcac 1080
caggactggc tgaatggcaa ggagtacaag tgcaaggtct ccaacaaagc cctcccagcc 1140
cccatcgaga aaaccatctc caaagccaaa gggcagcccc gagaaccaca ggtgtacacc 1200
ctgccaccat cacgagatga gctgaccaag aaccaggtca gcctgacctg cctggtcaaa 1260
ggcttctatc ccagcgacat cgccgtggag tgggagagca atgggcagcc ggagaacaac 1320
tacaagacca cgcctcccgt gctggactcc gacggctcct tcttcctcta cagcaagctc 1380
accgtggaca agagcaggtg gcagcagggg aacgtcttct catgctccgt gatgcatgag 1440
gctctgcaca accactacac gcagaagagc ctctccctgt ctcccttttg ggtgctggtg 1500
gtggttggtg gagtcctggc ttgctatagc ttgctagtaa cagtggcctt tattattttc 1560
tgggtgagag tgaagttcag caggagcgca gacgcccccg cgtaccagca gggccagaac 1620
cagctctata acgagctcaa tctaggacga agagaggagt acgatgtttt ggacaagaga 1680
cgtggccggg accctgagat ggggggaaag ccgagaagga agaaccctca ggaaggcctg 1740
tacaatgaac tgcagaaaga taagatggcg gaggcctaca gtgagattgg gatgaaaggc 1800
gagcgccgga ggggcaaggg gcacgatggc ctttaccagg gtctcagtac agccaccaag 1860
gacacctacg acgcccttca catgcaggcc ctgccccctc gccagtgtac taattatgct 1920
ctcttgaaat tggctggaga tgttgagagc aaccccgggc cgatgccacc tcctcgcctc 1980
ctcttcttcc tcctcttcct cacccccatg gaagtcaggc ccgaggaacc tctagtggtg 2040
aaggtggaag agggagataa cgctgtgctg cagtgcctca aggggacctc agatggcccc 2100
actcagcagc tgacctggtc tcgggagtcc ccgcttaaac ccttcttaaa actcagcctg 2160
gggctgccag gcctgggaat ccacatgagg cccctggcca tctggctttt catcttcaac 2220
gtctctcaac agatgggggg cttctacctg tgccagccgg ggcccccctc tgagaaggcc 2280
tggcagcctg gctggacagt caatgtggag ggcagcgggg agctgttccg gtggaatgtt 2340
tcggacctag gtggcctggg ctgtggcctg aagaacaggt cctcagaggg ccccagctcc 2400
ccttccggga agctcatgag ccccaagctg tatgtgtggg ccaaagaccg ccctgagatc 2460
tgggagggag agcctccgtg tgtcccaccg agggacagcc tgaaccagag cctcagccag 2520
gacctcacca tggcccctgg ctccacactc tggctgtcct gtggggtacc ccctgactct 2580
gtgtccaggg gccccctctc ctggacccat gtgcacccca aggggcctaa gtcattgctg 2640
agcctagagc tgaaggacga tcgccctgcc agagatatgt gggtaatgga gacgggtctg 2700
ttgttgcccc gggccacagc tcaagacgct ggaaagtatt attgtcaccg tggcaacctg 2760
accatgtcat tccacctgga gatcactgct cggccagtac tatggcactg gctgctgagg 2820
actggtggct ggaaggtctc agctgtgact ttggcttatc tgatcttctg cctgtgttcc 2880
cttgtgggca ttcttcatct tcaaagagcc ctggtcctga ggaggaaaag a 2931
<210> 57
<211> 3306
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 57
atggagacag acacactcct gctatgggtg ctgctgctct gggttccagg ttccacaggt 60
gacattgtgc tgacccaatc tccagctatc ctgtctgcat ctccagggga gaaggtcaca 120
atgacttgca gggccagctc aagtgtaaat tacatggact ggtaccagaa gaagccagga 180
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 240
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 300
gatgctgcca cttattactg ccagcagtgg agttttaatc cacccacgtt cggagggggg 360
accaagctgg aaataaaagg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 420
ggcggcagca gcgaggtgca gctgcagcag tctggggctg agctggtgaa gcctggggcc 480
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 540
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 600
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 660
agcacagcct acatgcagct cagcagcctg acatctgagg actctgcgga ctattactgt 720
gcaagatcta attattacgg tagtagctac tggttcttcg atgtctgggg cgcagggacc 780
acggtcaccg tctcctcact cgacgaatct aagtacggac cgccctgccc cccttgccct 840
gcccccgagt tcctgggcgg acccagcgtg ttcctgttcc cccccaagcc caaggacacc 900
ctgatgatca gccggacccc cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat 960
cccgaggtcc agttcaattg gtacgtggac ggcgtggaag tgcacaacgc caagaccaag 1020
cccagagagg aacagttcaa cagcacctac cgggtggtgt ctgtgctgac cgtgctgcac 1080
caggactggc tgaacggcaa agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc 1140
agcatcgaaa agaccatcag caaggccaag ggccagcctc gcgagcccca ggtgtacacc 1200
ctgcctccct cccaggaaga gatgaccaag aaccaggtgt ccctgacctg cctggtgaag 1260
ggcttctacc ccagcgacat cgccgtggag tgggagagca acggccagcc tgagaacaac 1320
tacaagacca cccctcccgt gctggacagc gacggcagct tcttcctgta cagccggctg 1380
accgtggaca agagccggtg gcaggaaggc aacgtcttta gctgcagcgt gatgcacgag 1440
gccctgcaca accactacac ccagaagagc ctgagcctgt ccctgggcaa gatgttctgg 1500
gtgctggtgg tggtgggcgg ggtgctggcc tgctacagcc tgctggtgac agtggccttc 1560
atcatctttt gggtgcggag caagcggagc agaggcggcc acagcgacta catgaacatg 1620
acccccagac ggcctggccc cacccggaag cactaccagc cctacgcccc acccagggac 1680
tttgccgcct acagaagcaa acggggcaga aagaaactcc tgtatatatt caaacaacca 1740
tttatgagac cagtacaaac tactcaagag gaagatggct gtagctgccg atttccagaa 1800
gaagaagaag gaggatgtga actgcgggtg aagttcagca gaagcgccga cgcccctgcc 1860
taccagcagg gccagaatca gctgtacaac gagctgaacc tgggcagaag ggaagagtac 1920
gacgtcctgg ataagcggag aggccgggac cctgagatgg gcggcaagcc tcggcggaag 1980
aacccccagg aaggcctgta taacgaactg cagaaagaca agatggccga ggcctacagc 2040
gagatcggca tgaagggcga gcggaggcgg ggcaagggcc acgacggcct gtatcagggc 2100
ctgtccaccg ccaccaagga tacctacgac gccctgcaca tgcaggccct gcccccaagg 2160
ctcgagggcg gcggagaggg cagaggaagt cttctaacat gcggtgacgt ggaggagaat 2220
cccggcccta ggatgcttct cctggtgaca agccttctgc tctgtgagtt accacaccca 2280
gcattcctcc tgatcccacg caaagtgtgt aacggaatag gtattggtga atttaaagac 2340
tcactctcca taaatgctac gaatattaaa cacttcaaaa actgcacctc catcagtggc 2400
gatctccaca tcctgccggt ggcatttagg ggtgactcct tcacacatac tcctcctctg 2460
gatccacagg aactggatat tctgaaaacc gtaaaggaaa tcacagggtt tttgctgatt 2520
caggcttggc ctgaaaacag gacggacctc catgcctttg agaacctaga aatcatacgc 2580
ggcaggacca agcaacatgg tcagttttct cttgcagtcg tcagcctgaa cataacatcc 2640
ttgggattac gctccctcaa ggagataagt gatggagatg tgataatttc aggaaacaaa 2700
aatttgtgct atgcaaatac aataaactgg aaaaaactgt ttgggacctc cggtcagaaa 2760
accaaaatta taagcaacag aggtgaaaac agctgcaagg ccacaggcca ggtctgccat 2820
gccttgtgct cccccgaggg ctgctggggc ccggagccca gggactgcgt ctcttgccgg 2880
aatgtcagcc gaggcaggga atgcgtggac aagtgcaacc ttctggaggg tgagccaagg 2940
gagtttgtgg agaactctga gtgcatacag tgccacccag agtgcctgcc tcaggccatg 3000
aacatcacct gcacaggacg gggaccagac aactgtatcc agtgtgccca ctacattgac 3060
ggcccccact gcgtcaagac ctgcccggca ggagtcatgg gagaaaacaa caccctggtc 3120
tggaagtacg cagacgccgg ccatgtgtgc cacctgtgcc atccaaactg cacctacgga 3180
tgcactgggc caggtcttga aggctgtcca acgaatgggc ctaagatccc gtccatcgcc 3240
actgggatgg tgggggccct cctcttgctg ctggtggtgg ccctggggat cggcctcttc 3300
atgtga 3306
<210> 58
<211> 2034
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 58
atggagacag acacactcct gctatgggtg ctgctgctct gggttccagg ttccacaggt 60
gacattgtgc tgacccaatc tccagctatc ctgtctgcat ctccagggga gaaggtcaca 120
atgacttgca gggccagctc aagtgtaaat tacatggact ggtaccagaa gaagccagga 180
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 240
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 300
gatgctgcca cttattactg ccagcagtgg agttttaatc cacccacgtt cggagggggg 360
accaagctgg aaataaaagg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 420
ggcggcagca gcgaggtgca gctgcagcag tctggggctg agctggtgaa gcctggggcc 480
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 540
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 600
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 660
agcacagcct acatgcagct cagcagcctg acatctgagg actctgcgga ctattactgt 720
gcaagatcta attattacgg tagtagctac tggttcttcg atgtctgggg cgcagggacc 780
acggtcaccg tctcctcact cgacgaatct aagtacggac cgccctgccc cccttgccct 840
gcccccgagt tcctgggcgg acccagcgtg ttcctgttcc cccccaagcc caaggacacc 900
ctgatgatca gccggacccc cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat 960
cccgaggtcc agttcaattg gtacgtggac ggcgtggaag tgcacaacgc caagaccaag 1020
cccagagagg aacagttcaa cagcacctac cgggtggtgt ctgtgctgac cgtgctgcac 1080
caggactggc tgaacggcaa agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc 1140
agcatcgaaa agaccatcag caaggccaag ggccagcctc gcgagcccca ggtgtacacc 1200
ctgcctccct cccaggaaga gatgaccaag aaccaggtgt ccctgacctg cctggtgaag 1260
ggcttctacc ccagcgacat cgccgtggag tgggagagca acggccagcc tgagaacaac 1320
tacaagacca cccctcccgt gctggacagc gacggcagct tcttcctgta cagccggctg 1380
accgtggaca agagccggtg gcaggaaggc aacgtcttta gctgcagcgt gatgcacgag 1440
gccctgcaca accactacac ccagaagagc ctgagcctgt ccctgggcaa gatgttctgg 1500
gtgctggtgg tggtgggcgg ggtgctggcc tgctacagcc tgctggtgac agtggccttc 1560
atcatctttt gggtgcggag caagcggagc agaggcggcc acagcgacta catgaacatg 1620
acccccagac ggcctggccc cacccggaag cactaccagc cctacgcccc acccagggac 1680
tttgccgcct acagaagccg ggtgaagttc agcagaagcg ccgacgcccc tgcctaccag 1740
cagggccaga atcagctgta caacgagctg aacctgggca gaagggaaga gtacgacgtc 1800
ctggataagc ggagaggccg ggaccctgag atgggcggca agcctcggcg gaagaacccc 1860
caggaaggcc tgtataacga actgcagaaa gacaagatgg ccgaggccta cagcgagatc 1920
ggcatgaagg gcgagcggag gcggggcaag ggccacgacg gcctgtatca gggcctgtcc 1980
accgccacca aggataccta cgacgccctg cacatgcagg ccctgccccc aagg 2034
<210> 59
<211> 3183
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 59
atggagacag acacactcct gctatgggtg ctgctgctct gggttccagg ttccacaggt 60
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 120
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 180
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 240
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 300
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 360
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 420
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 480
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 540
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 600
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 660
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 720
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 780
actctcacag tctcctcact cgaccccaaa tcttctgaca aaactcacac atgcccaccg 840
tgcccagcac ctcctgtggc aggaccgtca gtcttcctct tccccccaaa acccaaggac 900
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 960
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 1020
aagccgcggg aggagcagta ccagagcacg taccgtgtgg tcagcgtcct caccgtcctg 1080
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 1140
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 1200
accctgccac catcacgaga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc 1260
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 1320
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 1380
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 1440
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccctt ttgggtgctg 1500
gtggtggttg gtggagtcct ggcttgctat agcttgctag taacagtggc ctttattatt 1560
ttctgggtga ggagtaagag gagcagggga ggtcacagtg actacatgaa catgactccc 1620
cgccgccccg ggcccacccg caagcattac cagccctatg ccccaccacg cgacttcgca 1680
gcctatcgct ccaaacgggg cagaaagaaa ctcctgtata tattcaaaca accatttatg 1740
agaccagtac aaactactca agaggaagat ggctgtagct gccgatttcc agaagaagaa 1800
gaaggaggat gtgaactgag agtgaagttc agcaggagcg cagacgcccc cgcgtaccag 1860
cagggccaga accagctcta taacgagctc aatctaggac gaagagagga gtacgatgtt 1920
ttggacaaga gacgtggccg ggaccctgag atggggggaa agccgagaag gaagaaccct 1980
caggaaggcc tgtacaatga actgcagaaa gataagatgg cggaggccta cagtgagatt 2040
gggatgaaag gcgagcgccg gaggggcaag gggcacgatg gcctttacca gggtctcagt 2100
acagccacca aggacaccta cgacgccctt cacatgcagg ccctgccccc tcgccagtgt 2160
actaattatg ctctcttgaa attggctgga gatgttgaga gcaaccccgg gccgatgcca 2220
cctcctcgcc tcctcttctt cctcctcttc ctcaccccca tggaagtcag gcccgaggaa 2280
cctctagtgg tgaaggtgga agagggagat aacgctgtgc tgcagtgcct caaggggacc 2340
tcagatggcc ccactcagca gctgacctgg tctcgggagt ccccgcttaa acccttctta 2400
aaactcagcc tggggctgcc aggcctggga atccacatga ggcccctggc catctggctt 2460
ttcatcttca acgtctctca acagatgggg ggcttctacc tgtgccagcc ggggcccccc 2520
tctgagaagg cctggcagcc tggctggaca gtcaatgtgg agggcagcgg ggagctgttc 2580
cggtggaatg tttcggacct aggtggcctg ggctgtggcc tgaagaacag gtcctcagag 2640
ggccccagct ccccttccgg gaagctcatg agccccaagc tgtatgtgtg ggccaaagac 2700
cgccctgaga tctgggaggg agagcctccg tgtgtcccac cgagggacag cctgaaccag 2760
agcctcagcc aggacctcac catggcccct ggctccacac tctggctgtc ctgtggggta 2820
ccccctgact ctgtgtccag gggccccctc tcctggaccc atgtgcaccc caaggggcct 2880
aagtcattgc tgagcctaga gctgaaggac gatcgcccgg ccagagatat gtgggtaatg 2940
gagacgggtc tgttgttgcc ccgggccaca gctcaagacg ctggaaagta ttattgtcac 3000
cgtggcaacc tgaccatgtc attccacctg gagatcactg ctcggccagt actatggcac 3060
tggctgctga ggactggtgg ctggaaggtc tcagctgtga ctttggctta tctgatcttc 3120
tgcctgtgtt cccttgtggg cattcttcat cttcaaagag ccctggtcct gaggaggaaa 3180
aga 3183
<210> 60
<211> 3057
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 60
atggagacag acacactcct gctatgggtg ctgctgctct gggttccagg ttccacaggt 60
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 120
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 180
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 240
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 300
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 360
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 420
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 480
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 540
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 600
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 660
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 720
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 780
actctcacag tctcctcact cgaccccaaa tcttctgaca aaactcacac atgcccaccg 840
tgcccagcac ctcctgtggc aggaccgtca gtcttcctct tccccccaaa acccaaggac 900
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 960
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 1020
aagccgcggg aggagcagta ccagagcacg taccgtgtgg tcagcgtcct caccgtcctg 1080
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 1140
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 1200
accctgccac catcacgaga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc 1260
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 1320
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 1380
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 1440
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccctt ttgggtgctg 1500
gtggtggttg gtggagtcct ggcttgctat agcttgctag taacagtggc ctttattatt 1560
ttctgggtga ggagtaagag gagcagggga ggtcacagtg actacatgaa catgactccc 1620
cgccgccccg ggcccacccg caagcattac cagccctatg ccccaccacg cgacttcgca 1680
gcctatcgct ccagagtgaa gttcagcagg agcgcagacg cccccgcgta ccagcagggc 1740
cagaaccagc tctataacga gctcaatcta ggacgaagag aggagtacga tgttttggac 1800
aagagacgtg gccgggaccc tgagatgggg ggaaagccga gaaggaagaa ccctcaggaa 1860
ggcctgtaca atgaactgca gaaagataag atggcggagg cctacagtga gattgggatg 1920
aaaggcgagc gccggagggg caaggggcac gatggccttt accagggtct cagtacagcc 1980
accaaggaca cctacgacgc ccttcacatg caggccctgc cccctcgcca gtgtactaat 2040
tatgctctct tgaaattggc tggagatgtt gagagcaacc ccgggccgat gccacctcct 2100
cgcctcctct tcttcctcct cttcctcacc cccatggaag tcaggcccga ggaacctcta 2160
gtggtgaagg tggaagaggg agataacgct gtgctgcagt gcctcaaggg gacctcagat 2220
ggccccactc agcagctgac ctggtctcgg gagtccccgc ttaaaccctt cttaaaactc 2280
agcctggggc tgccaggcct gggaatccac atgaggcccc tggccatctg gcttttcatc 2340
ttcaacgtct ctcaacagat ggggggcttc tacctgtgcc agccggggcc cccctctgag 2400
aaggcctggc agcctggctg gacagtcaat gtggagggca gcggggagct gttccggtgg 2460
aatgtttcgg acctaggtgg cctgggctgt ggcctgaaga acaggtcctc agagggcccc 2520
agctcccctt ccgggaagct catgagcccc aagctgtatg tgtgggccaa agaccgccct 2580
gagatctggg agggagagcc tccgtgtgtc ccaccgaggg acagcctgaa ccagagcctc 2640
agccaggacc tcaccatggc ccctggctcc acactctggc tgtcctgtgg ggtaccccct 2700
gactctgtgt ccaggggccc cctctcctgg acccatgtgc accccaaggg gcctaagtca 2760
ttgctgagcc tagagctgaa ggacgatcgc ccggccagag atatgtgggt aatggagacg 2820
ggtctgttgt tgccccgggc cacagctcaa gacgctggaa agtattattg tcaccgtggc 2880
aacctgacca tgtcattcca cctggagatc actgctcggc cagtactatg gcactggctg 2940
ctgaggactg gtggctggaa ggtctcagct gtgactttgg cttatctgat cttctgcctg 3000
tgttcccttg tgggcattct tcatcttcaa agagccctgg tcctgaggag gaaaaga 3057
<210> 61
<211> 3060
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 61
atggagacag acacactcct gctatgggtg ctgctgctct gggttccagg ttccacaggt 60
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 120
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 180
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 240
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 300
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 360
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 420
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 480
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 540
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 600
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 660
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 720
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 780
actctcacag tctcctcact cgaccccaaa tcttctgaca aaactcacac atgcccaccg 840
tgcccagcac ctcctgtggc aggaccgtca gtcttcctct tccccccaaa acccaaggac 900
accctcatga tctcccggac ccctgaggtc acatgcgtgg tggtggacgt gagccacgaa 960
gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg aggtgcataa tgccaagaca 1020
aagccgcggg aggagcagta ccagagcacg taccgtgtgg tcagcgtcct caccgtcctg 1080
caccaggact ggctgaatgg caaggagtac aagtgcaagg tctccaacaa agccctccca 1140
gcccccatcg agaaaaccat ctccaaagcc aaagggcagc cccgagaacc acaggtgtac 1200
accctgccac catcacgaga tgagctgacc aagaaccagg tcagcctgac ctgcctggtc 1260
aaaggcttct atcccagcga catcgccgtg gagtgggaga gcaatgggca gccggagaac 1320
aactacaaga ccacgcctcc cgtgctggac tccgacggct ccttcttcct ctacagcaag 1380
ctcaccgtgg acaagagcag gtggcagcag gggaacgtct tctcatgctc cgtgatgcat 1440
gaggctctgc acaaccacta cacgcagaag agcctctccc tgtctccctt ttgggtgctg 1500
gtggtggttg gtggagtcct ggcttgctat agcttgctag taacagtggc ctttattatt 1560
ttctgggtga aacggggcag aaagaaactc ctgtatatat tcaaacaacc atttatgaga 1620
ccagtacaaa ctactcaaga ggaagatggc tgtagctgcc gatttccaga agaagaagaa 1680
ggaggatgtg aactgagagt gaagttcagc aggagcgcag acgcccccgc gtaccagcag 1740
ggccagaacc agctctataa cgagctcaat ctaggacgaa gagaggagta cgatgttttg 1800
gacaagagac gtggccggga ccctgagatg gggggaaagc cgagaaggaa gaaccctcag 1860
gaaggcctgt acaatgaact gcagaaagat aagatggcgg aggcctacag tgagattggg 1920
atgaaaggcg agcgccggag gggcaagggg cacgatggcc tttaccaggg tctcagtaca 1980
gccaccaagg acacctacga cgcccttcac atgcaggccc tgccccctcg ccagtgtact 2040
aattatgctc tcttgaaatt ggctggagat gttgagagca accccgggcc gatgccacct 2100
cctcgcctcc tcttcttcct cctcttcctc acccccatgg aagtcaggcc cgaggaacct 2160
ctagtggtga aggtggaaga gggagataac gctgtgctgc agtgcctcaa ggggacctca 2220
gatggcccca ctcagcagct gacctggtct cgggagtccc cgcttaaacc cttcttaaaa 2280
ctcagcctgg ggctgccagg cctgggaatc cacatgaggc ccctggccat ctggcttttc 2340
atcttcaacg tctctcaaca gatggggggc ttctacctgt gccagccggg gcccccctct 2400
gagaaggcct ggcagcctgg ctggacagtc aatgtggagg gcagcgggga gctgttccgg 2460
tggaatgttt cggacctagg tggcctgggc tgtggcctga agaacaggtc ctcagagggc 2520
cccagctccc cttccgggaa gctcatgagc cccaagctgt atgtgtgggc caaagaccgc 2580
cctgagatct gggagggaga gcctccgtgt gtcccaccga gggacagcct gaaccagagc 2640
ctcagccagg acctcaccat ggcccctggc tccacactct ggctgtcctg tggggtaccc 2700
cctgactctg tgtccagggg ccccctctcc tggacccatg tgcaccccaa ggggcctaag 2760
tcattgctga gcctagagct gaaggacgat cgcccggcca gagatatgtg ggtaatggag 2820
acgggtctgt tgttgccccg ggccacagct caagacgctg gaaagtatta ttgtcaccgt 2880
ggcaacctga ccatgtcatt ccacctggag atcactgctc ggccagtact atggcactgg 2940
ctgctgagga ctggtggctg gaaggtctca gctgtgactt tggcttatct gatcttctgc 3000
ctgtgttccc ttgtgggcat tcttcatctt caaagagccc tggtcctgag gaggaaaaga 3060
<210> 62
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 62
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 63
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 63
Trp Arg His Pro Gln Phe Gly Gly
1 5
<210> 64
<211> 249
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 64
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Ser Trp Leu Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Ile Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Ala
85 90 95
Thr Gln Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp
145 150 155 160
Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
180 185 190
Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Thr Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg His Pro Ser Tyr Gly Ser Gly Ser Pro Asn Phe Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 65
<211> 252
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 65
Asp Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Asn Tyr Met
20 25 30
Asp Trp Tyr Gln Lys Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Phe Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln Leu
115 120 125
Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Asp Tyr Tyr Cys Ala Arg Ser Asn
210 215 220
Tyr Tyr Gly Ser Ser Tyr Trp Phe Phe Asp Val Trp Gly Ala Gly Thr
225 230 235 240
Thr Val Thr Val Ser Ser Leu Asp Glu Ser Lys Tyr
245 250
<210> 66
<211> 252
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 66
Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Gly Ser Thr Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Gln Val Gln Leu
115 120 125
Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Met
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met His Trp
145 150 155 160
Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr
165 170 175
Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala
180 185 190
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
195 200 205
Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Ser His
210 215 220
Tyr Gly Ser Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
225 230 235 240
Thr Leu Thr Val Ser Ser Leu Asp Pro Lys Ser Ser
245 250
<210> 67
<211> 747
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 67
gacattgtga tgactcagac accactgagc tccccagtga ctctgggaca gccagccagt 60
atctcatgca gatctagtca gtcactggtc tacagcgacg gcaacaccta tctgagctgg 120
ctgcagcagc gaccaggaca gccacctaga ctgctgatct acaagatttc caataggttc 180
tctggagtgc ccgaccgctt tagcggatcc ggagctggaa ctgatttcac cctgaaaatc 240
tcccgcgtgg aggctgaaga tgtgggcgtc tactattgcg tccaggcaac ccagttccct 300
ctgacatttg gcgggggaac taaggtggag atcaagggag gaggaggatc tggaggagga 360
ggaagtggag gaggaggatc cgaagtgcag ctggtccagt ctggggccga ggtgaagaaa 420
cctggagaaa gtctgaagat ctcatgtaaa ggctccgggt actctttcac aagttattgg 480
attggctggg tccgacagat gccaggaaag ggcctggagt ggatgggaat catctacccc 540
ggcgacagcg atacccggta ttctcctagt tttcagggcc aggtgacaat cagcgcagac 600
aagtccatta ccacagccta tctgcagtgg tcaagcctga aagcctctga taccgctatg 660
tactattgtg ccaggcaccc tagctacggg tcaggaagcc caaactttga ctattggggc 720
caggggacac tggtgactgt ctcctct 747
<210> 68
<211> 756
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 68
gacattgtgc tgacccaatc tccagctatc ctgtctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtgtaaat tacatggact ggtaccagaa gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agttttaatc cacccacgtt cggagggggg 300
accaagctgg aaataaaagg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gcgaggtgca gctgcagcag tctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagcctg acatctgagg actctgcgga ctattactgt 660
gcaagatcta attattacgg tagtagctac tggttcttcg atgtctgggg cgcagggacc 720
acggtcaccg tctcctcact cgacgaatct aagtac 756
<210> 69
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 69
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 300
accaagctgg agctgaaggg cagtactagc ggtggtggct ccgggggcgg ttccggtggg 360
ggcggcagca gccaggtgca actgcggcag cctggggctg agctggtgaa gcctggggcc 420
tcagtgaaga tgtcctgcaa ggcttctggc tacacattta ccagttacaa tatgcactgg 480
gtaaagcaga cacctggaca gggcctggaa tggattggag ctatttatcc aggaaatggt 540
gatacttcct acaatcagaa gttcaaaggc aaggccacat tgactgcaga caaatcctcc 600
agcacagcct acatgcagct cagcagtctg acatctgagg actctgcggt ctattactgt 660
gcaagatcgc actacggtag taactacgta gactactttg actactgggg ccaaggcacc 720
actctcacag tctcctca 738
<210> 70
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 70
gacattgtga tgactcagac accactgagc tccccagtga ctctgggaca gccagccagt 60
atctcatgca gatctagtca gtcactggtc tacagcgacg gcaacaccta tctgagctgg 120
ctgcagcagc gaccaggaca gccacctaga ctgctgatct acaagatttc caataggttc 180
tctggagtgc ccgaccgctt tagcggatcc ggagctggaa ctgatttcac cctgaaaatc 240
tcccgcgtgg aggctgaaga tgtgggcgtc tactattgcg tccaggcaac ccagttccct 300
ctgacatttg gcgggggaac taaggtggag atcaag 336
<210> 71
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 71
gacattgtgc tgacccaatc tccagctatc ctgtctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtgtaaat tacatggact ggtaccagaa gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agttttaatc cacccacgtt cggagggggg 300
accaagctgg aaataaaa 318
<210> 72
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 72
gacattgttc tctcccagtc tccagcaatc ctttctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtttaagt ttcatgcact ggtaccagca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttatttctg ccatcagtgg agtagtaacc cgctcacgtt cggtgctggg 300
accaagctgg agctgaag 318
<210> 73
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 73
gaagtgcagc tggtccagtc tggggccgag gtgaagaaac ctggagaaag tctgaagatc 60
tcatgtaaag gctccgggta ctctttcaca agttattgga ttggctgggt ccgacagatg 120
ccaggaaagg gcctggagtg gatgggaatc atctaccccg gcgacagcga tacccggtat 180
tctcctagtt ttcagggcca ggtgacaatc agcgcagaca agtccattac cacagcctat 240
ctgcagtggt caagcctgaa agcctctgat accgctatgt actattgtgc caggcaccct 300
agctacgggt caggaagccc aaactttgac tattggggcc aggggacact ggtgactgtc 360
tcctct 366
<210> 74
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 74
gaggtgcagc tgcagcagtc tggggctgag ctggtgaagc ctggggcctc agtgaagatg 60
tcctgcaagg cttctggcta cacatttacc agttacaata tgcactgggt aaagcagaca 120
cctggacagg gcctggaatg gattggagct atttatccag gaaatggtga tacttcctac 180
aatcagaagt tcaaaggcaa ggccacattg actgcagaca aatcctccag cacagcctac 240
atgcagctca gcagcctgac atctgaggac tctgcggact attactgtgc aagatctaat 300
tattacggta gtagctactg gttcttcgat gtctggggcg cagggaccac ggtcaccgtc 360
tcctcactcg acgaatctaa gtac 384
<210> 75
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 75
caggtgcaac tgcggcagcc tggggctgag ctggtgaagc ctggggcctc agtgaagatg 60
tcctgcaagg cttctggcta cacatttacc agttacaata tgcactgggt aaagcagaca 120
cctggacagg gcctggaatg gattggagct atttatccag gaaatggtga tacttcctac 180
aatcagaagt tcaaaggcaa ggccacattg actgcagaca aatcctccag cacagcctac 240
atgcagctca gcagtctgac atctgaggac tctgcggtct attactgtgc aagatcgcac 300
tacggtagta actacgtaga ctactttgac tactggggcc aaggcaccac tctcacagtc 360
tcctca 366
<210> 76
<211> 36
<212> ДНК
<213> Homo sapiens
<400> 76
gacaaaactc acacatgccc accgtgccca gcacct 36
<210> 77
<211> 24
<212> ДНК
<213> Homo sapiens
<400> 77
ggaccgccct gccccccttg ccct 24
<210> 78
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 78
cctgtggcag gaccgtca 18
<210> 79
<211> 303
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 79
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 60
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 120
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta ccagagcacg 180
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 240
aagtgcaagg tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc 300
aaa 303
<210> 80
<211> 330
<212> ДНК
<213> Homo sapiens
<400> 80
gcccccgagt tcctgggcgg acccagcgtg ttcctgttcc cccccaagcc caaggacacc 60
ctgatgatca gccggacccc cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat 120
cccgaggtcc agttcaattg gtacgtggac ggcgtggaag tgcacaacgc caagaccaag 180
cccagagagg aacagttcaa cagcacctac cgggtggtgt ctgtgctgac cgtgctgcac 240
caggactggc tgaacggcaa agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc 300
agcatcgaaa agaccatcag caaggccaag 330
<210> 81
<211> 315
<212> ДНК
<213> Homo sapiens
<400> 81
gggcagcccc gagaaccaca ggtgtacacc ctgccaccat cacgagatga gctgaccaag 60
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 120
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 180
gacggctcct tcttcctcta cagcaagctc accgtggaca agagcaggtg gcagcagggg 240
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 300
ctctccctgt ctccc 315
<210> 82
<211> 321
<212> ДНК
<213> Homo sapiens
<400> 82
ggccagcctc gcgagcccca ggtgtacacc ctgcctccct cccaggaaga gatgaccaag 60
aaccaggtgt ccctgacctg cctggtgaag ggcttctacc ccagcgacat cgccgtggag 120
tgggagagca acggccagcc tgagaacaac tacaagacca cccctcccgt gctggacagc 180
gacggcagct tcttcctgta cagccggctg accgtggaca agagccggtg gcaggaaggc 240
aacgtcttta gctgcagcgt gatgcacgag gccctgcaca accactacac ccagaagagc 300
ctgagcctgt ccctgggcaa g 321
<210> 83
<211> 84
<212> ДНК
<213> Homo sapiens
<400> 83
atgttctggg tgctggtggt ggtgggcggg gtgctggcct gctacagcct gctggtgaca 60
gtggccttca tcatcttttg ggtg 84
<210> 84
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 84
cggagcaagc ggagcagagg cggccacagc gactacatga acatgacccc cagacggcct 60
ggccccaccc ggaagcacta ccagccctac gccccaccca gggactttgc cgcctacaga 120
agc 123
<210> 85
<211> 126
<212> ДНК
<213> Homo sapiens
<400> 85
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 86
<211> 336
<212> ДНК
<213> Homo sapiens
<400> 86
cgggtgaagt tcagcagaag cgccgacgcc cctgcctacc agcagggcca gaatcagctg 60
tacaacgagc tgaacctggg cagaagggaa gagtacgacg tcctggataa gcggagaggc 120
cgggaccctg agatgggcgg caagcctcgg cggaagaacc cccaggaagg cctgtataac 180
gaactgcaga aagacaagat ggccgaggcc tacagcgaga tcggcatgaa gggcgagcgg 240
aggcggggca agggccacga cggcctgtat cagggcctgt ccaccgccac caaggatacc 300
tacgacgccc tgcacatgca ggccctgccc ccaagg 336
<210> 87
<211> 66
<212> ДНК
<213> Homo sapiens
<400> 87
atgctgctgc tggtcacctc actgctgctg tgcgaactgc cccaccccgc cttcctgctg 60
attccc 66
<210> 88
<211> 60
<212> ДНК
<213> Mus musculus
<400> 88
atggagacag acacactcct gctatgggtg ctgctgctct gggttccagg ttccacaggt 60
<210> 89
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 89
ggaggaggag gatctggagg aggaggaagt ggaggaggag gatcc 45
<210> 90
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 90
ggcagtacta gcggtggtgg ctccgggggc ggttccggtg ggggcggcag cagc 54
<210> 91
<211> 60
<212> ДНК
<213> неизвестный
<220>
<223> E2A саморасщепляющийся пептид
<400> 91
cagtgtacta attatgctct cttgaaattg gctggagatg ttgagagcaa ccccgggccg 60
<210> 92
<211> 71
<212> ДНК
<213> неизвестный
<220>
<223> T2A саморасщепляющийся пептид
<400> 92
tcgagggcgg cggagagggc agaggaagtc ttctaacatg cggtgacgtg gaggagaatc 60
ccggccctag g 71
<210> 93
<211> 969
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 93
atgccacctc ctcgcctcct cttcttcctc ctcttcctca cccccatgga agtcaggccc 60
gaggaacctc tagtggtgaa ggtggaagag ggagataacg ctgtgctgca gtgcctcaag 120
gggacctcag atggccccac tcagcagctg acctggtctc gggagtcccc gcttaaaccc 180
ttcttaaaac tcagcctggg gctgccaggc ctgggaatcc acatgaggcc cctggccatc 240
tggcttttca tcttcaacgt ctctcaacag atggggggct tctacctgtg ccagccgggg 300
cccccctctg agaaggcctg gcagcctggc tggacagtca atgtggaggg cagcggggag 360
ctgttccggt ggaatgtttc ggacctaggt ggcctgggct gtggcctgaa gaacaggtcc 420
tcagagggcc ccagctcccc ttccgggaag ctcatgagcc ccaagctgta tgtgtgggcc 480
aaagaccgcc ctgagatctg ggagggagag cctccgtgtg tcccaccgag ggacagcctg 540
aaccagagcc tcagccagga cctcaccatg gcccctggct ccacactctg gctgtcctgt 600
ggggtacccc ctgactctgt gtccaggggc cccctctcct ggacccatgt gcaccccaag 660
gggcctaagt cattgctgag cctagagctg aaggacgatc gcccggccag agatatgtgg 720
gtaatggaga cgggtctgtt gttgccccgg gccacagctc aagacgctgg aaagtattat 780
tgtcaccgtg gcaacctgac catgtcattc cacctggaga tcactgctcg gccagtacta 840
tggcactggc tgctgaggac tggtggctgg aaggtctcag ctgtgacttt ggcttatctg 900
atcttctgcc tgtgttccct tgtgggcatt cttcatcttc aaagagccct ggtcctgagg 960
aggaaaaga 969
<210> 94
<211> 1074
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 94
atgcttctcc tggtgacaag ccttctgctc tgtgagttac cacacccagc attcctcctg 60
atcccacgca aagtgtgtaa cggaataggt attggtgaat ttaaagactc actctccata 120
aatgctacga atattaaaca cttcaaaaac tgcacctcca tcagtggcga tctccacatc 180
ctgccggtgg catttagggg tgactccttc acacatactc ctcctctgga tccacaggaa 240
ctggatattc tgaaaaccgt aaaggaaatc acagggtttt tgctgattca ggcttggcct 300
gaaaacagga cggacctcca tgcctttgag aacctagaaa tcatacgcgg caggaccaag 360
caacatggtc agttttctct tgcagtcgtc agcctgaaca taacatcctt gggattacgc 420
tccctcaagg agataagtga tggagatgtg ataatttcag gaaacaaaaa tttgtgctat 480
gcaaatacaa taaactggaa aaaactgttt gggacctccg gtcagaaaac caaaattata 540
agcaacagag gtgaaaacag ctgcaaggcc acaggccagg tctgccatgc cttgtgctcc 600
cccgagggct gctggggccc ggagcccagg gactgcgtct cttgccggaa tgtcagccga 660
ggcagggaat gcgtggacaa gtgcaacctt ctggagggtg agccaaggga gtttgtggag 720
aactctgagt gcatacagtg ccacccagag tgcctgcctc aggccatgaa catcacctgc 780
acaggacggg gaccagacaa ctgtatccag tgtgcccact acattgacgg cccccactgc 840
gtcaagacct gcccggcagg agtcatggga gaaaacaaca ccctggtctg gaagtacgca 900
gacgccggcc atgtgtgcca cctgtgccat ccaaactgca cctacggatg cactgggcca 960
ggtcttgaag gctgtccaac gaatgggcct aagatcccgt ccatcgccac tgggatggtg 1020
ggggccctcc tcttgctgct ggtggtggcc ctggggatcg gcctcttcat gtga 1074
<210> 95
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 95
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 96
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 96
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 10 15
Gly Asp Val Glu Ser Asn Pro Gly Pro
20 25
<210> 97
<211> 66
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 97
ggaagcggag ctactaactt cagcctgctg aagcaggctg gagacgtgga ggagaaccct 60
ggacct 66
<210> 98
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 98
ggaagcggag tgaaacagac tttgaatttt gaccttctca agttggcggg agacgtggag 60
tccaaccctg gacct 75
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Т-КЛЕТКИ С ДВУМЯ ХИМЕРНЫМИ АНТИГЕННЫМИ РЕЦЕПТОРАМИ CAR | 2021 |
|
RU2839662C1 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| АНТИ-CLL1-СПЕЦИФИЧЕСКИЕ ОДНОЦЕПОЧЕЧНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ (scCAR) ДЛЯ ИММУНОТЕРАПИИ РАКА | 2016 |
|
RU2731543C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА FLT3 | 2018 |
|
RU2820859C2 |
| НОВЫЕ КОНСТРУКЦИИ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА, СОДЕРЖАЩИЕ ДОМЕНЫ TNFR2 | 2019 |
|
RU2808254C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2829097C2 |
| СПЕЦИФИЧНЫЕ К MUC16 ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795198C2 |
| Химерные антигенные рецепторы, нацеливающиеся на CD70 | 2019 |
|
RU2801824C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2018 |
|
RU2770002C2 |

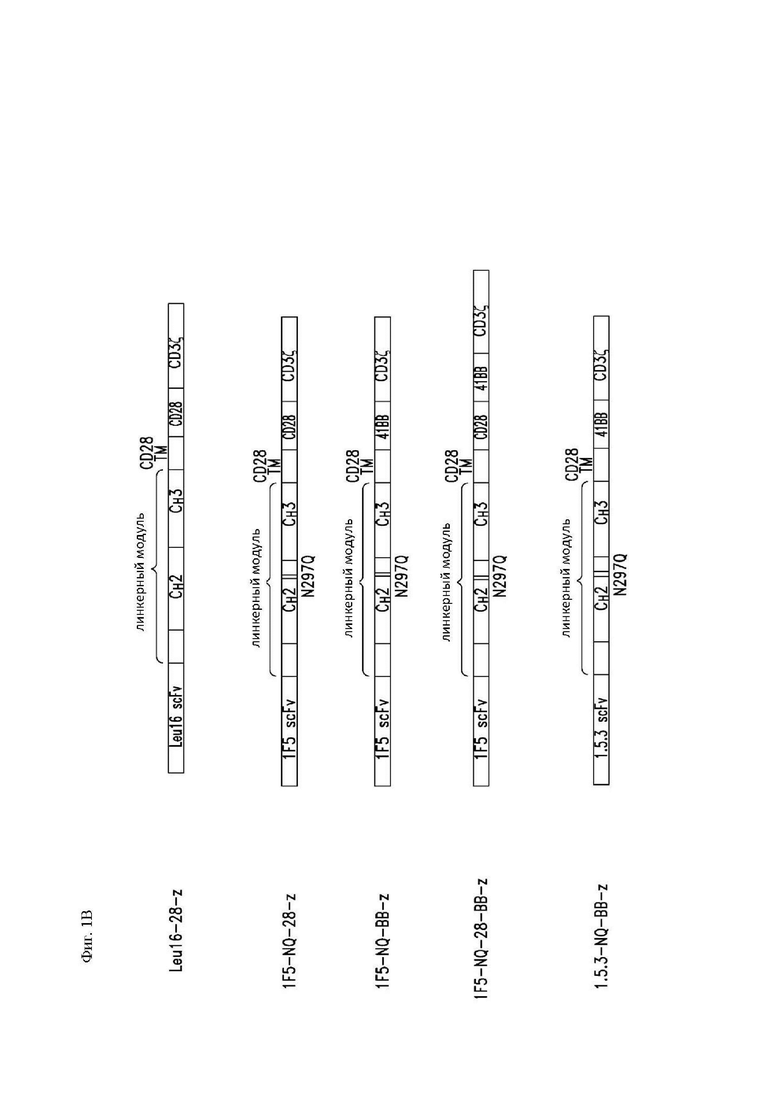
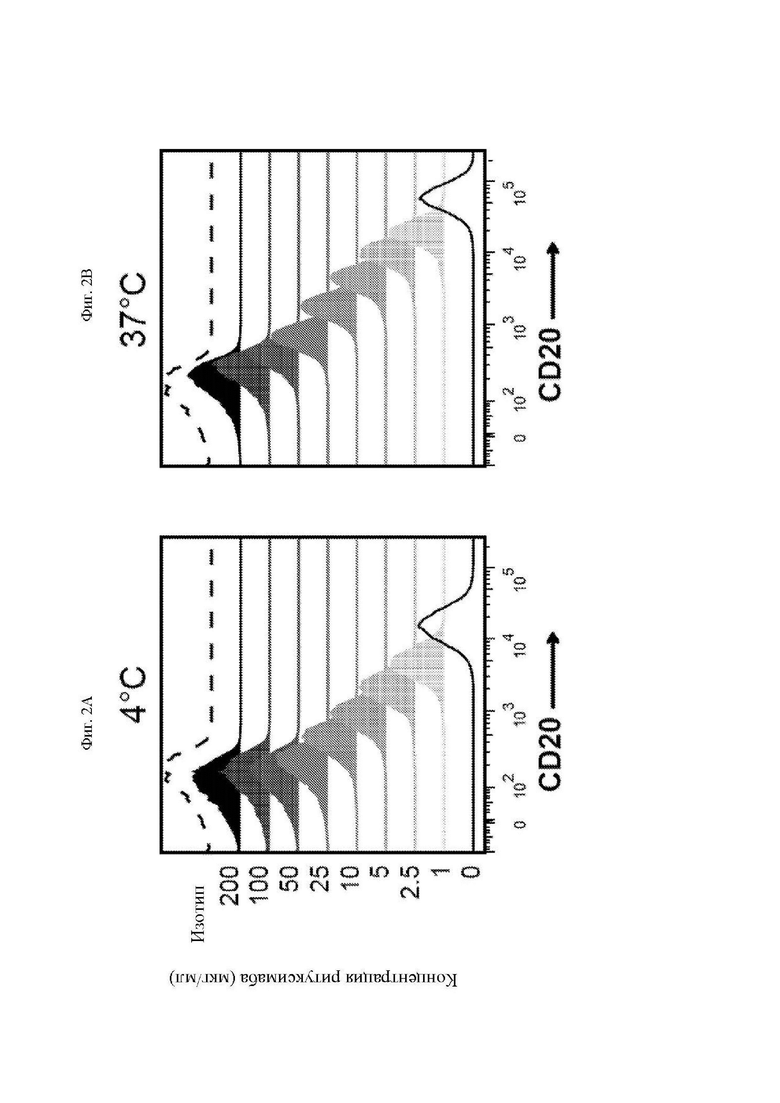
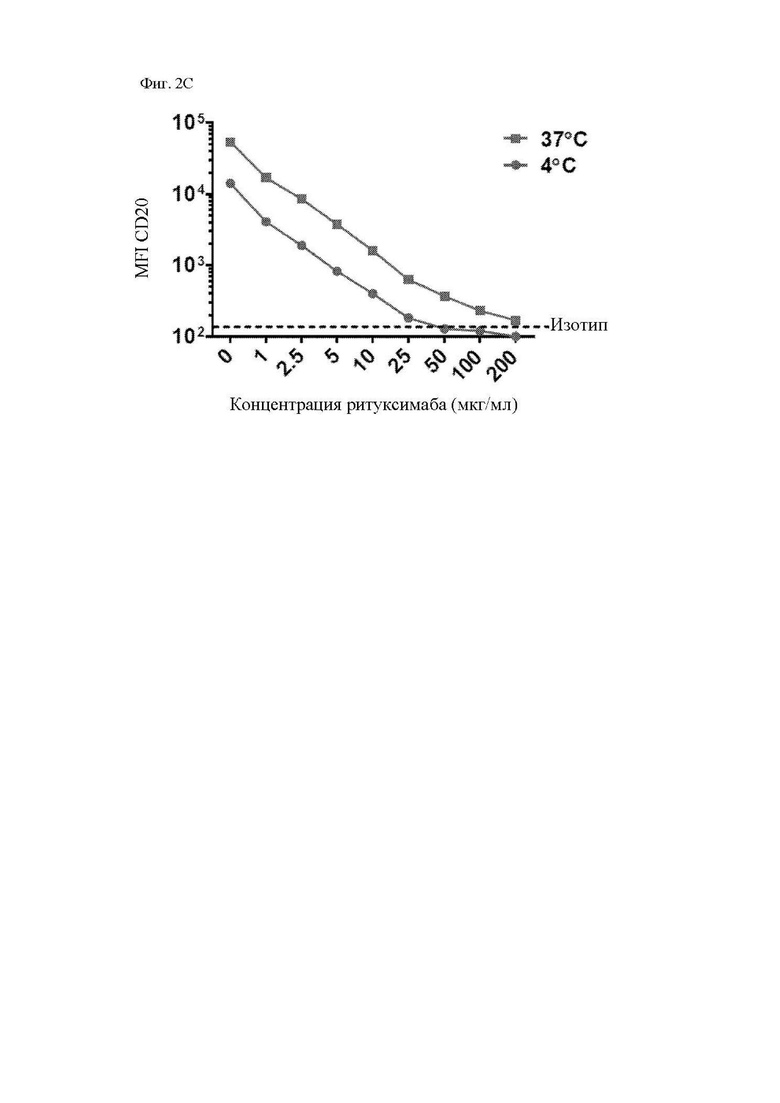
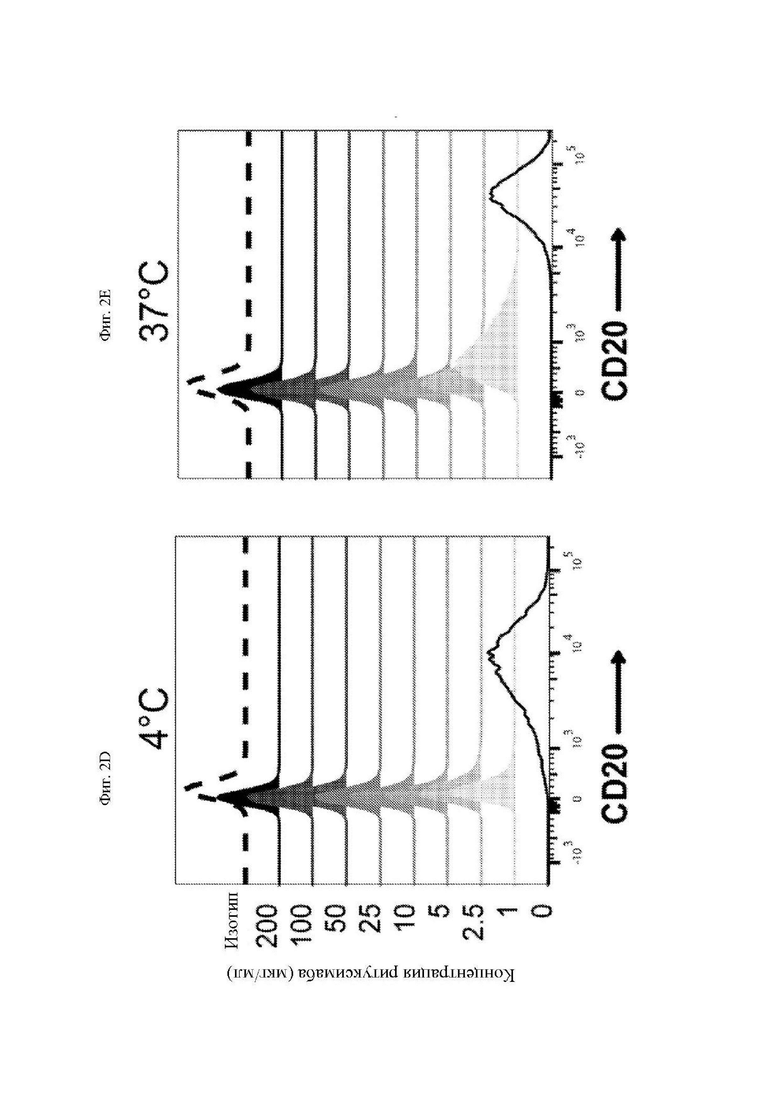
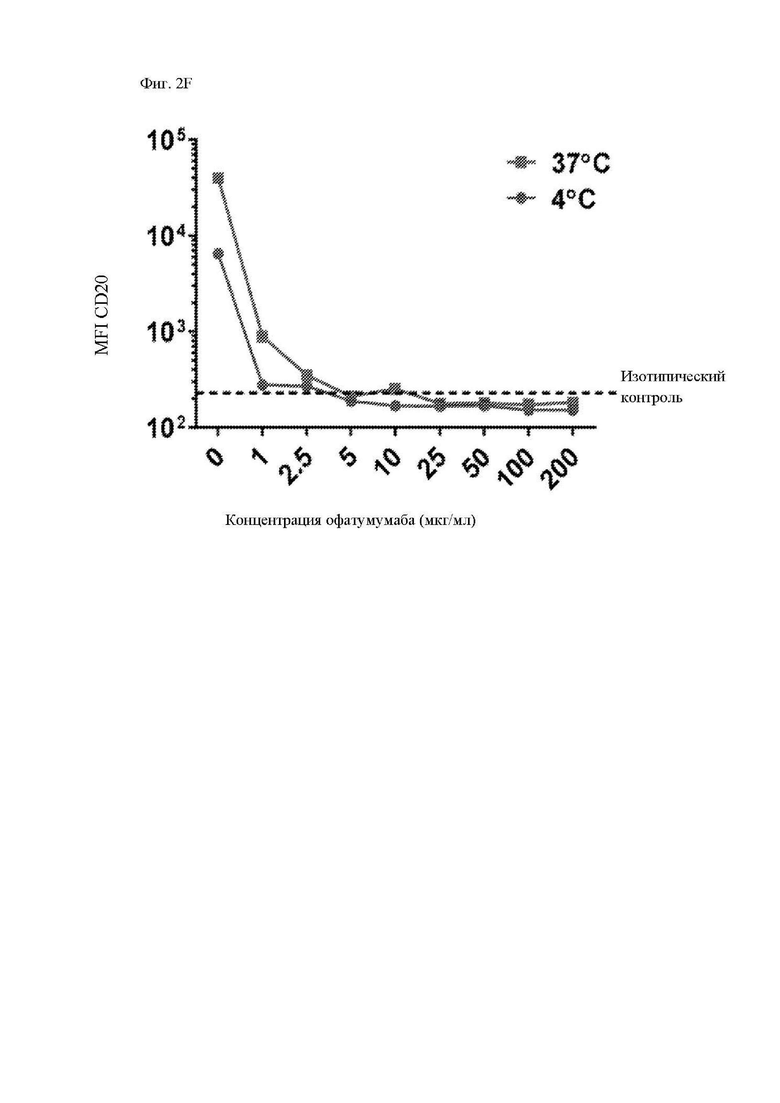
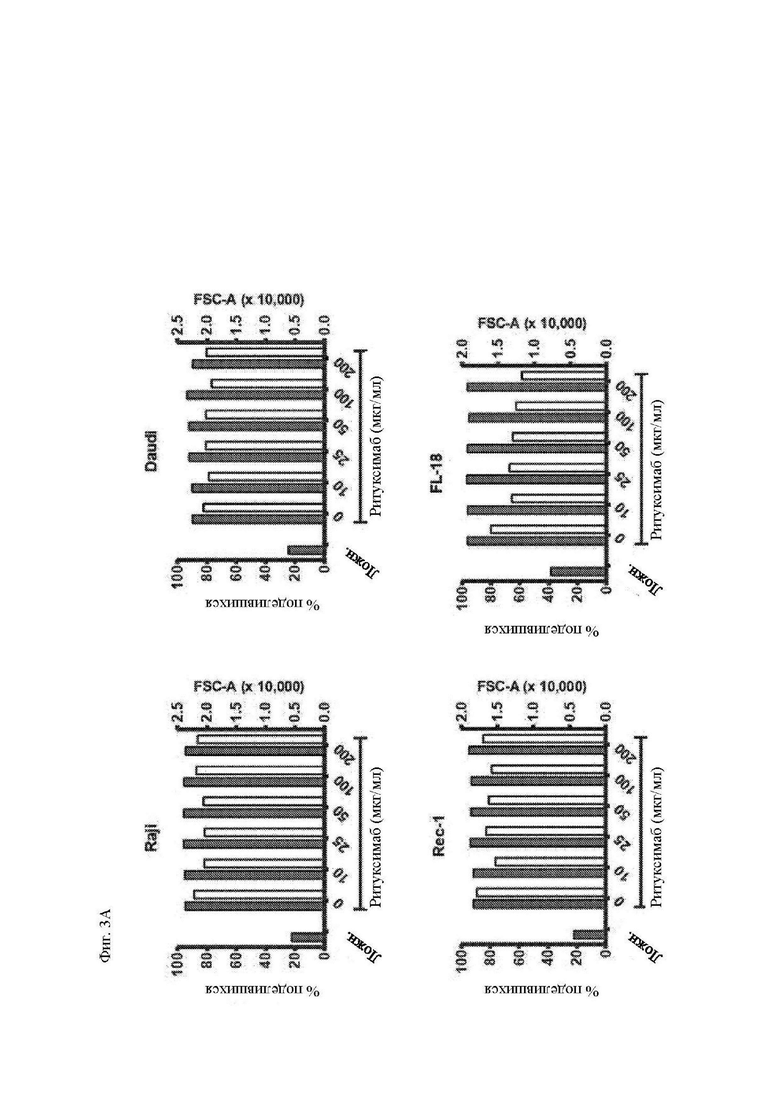
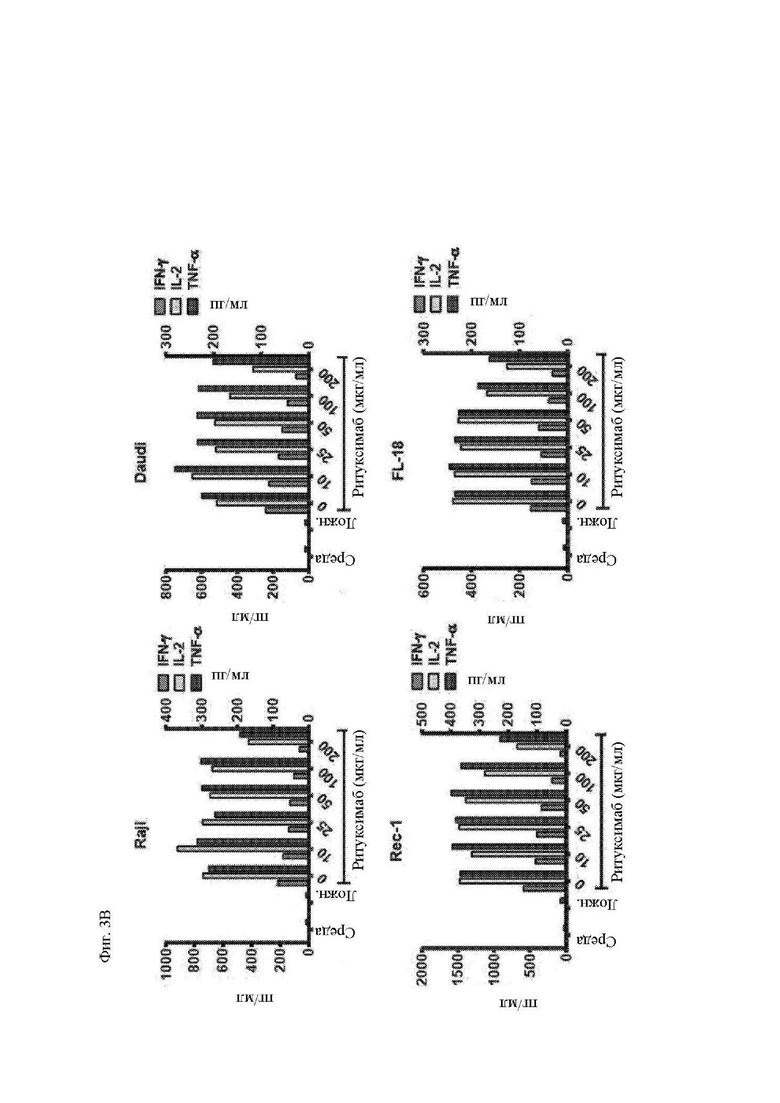
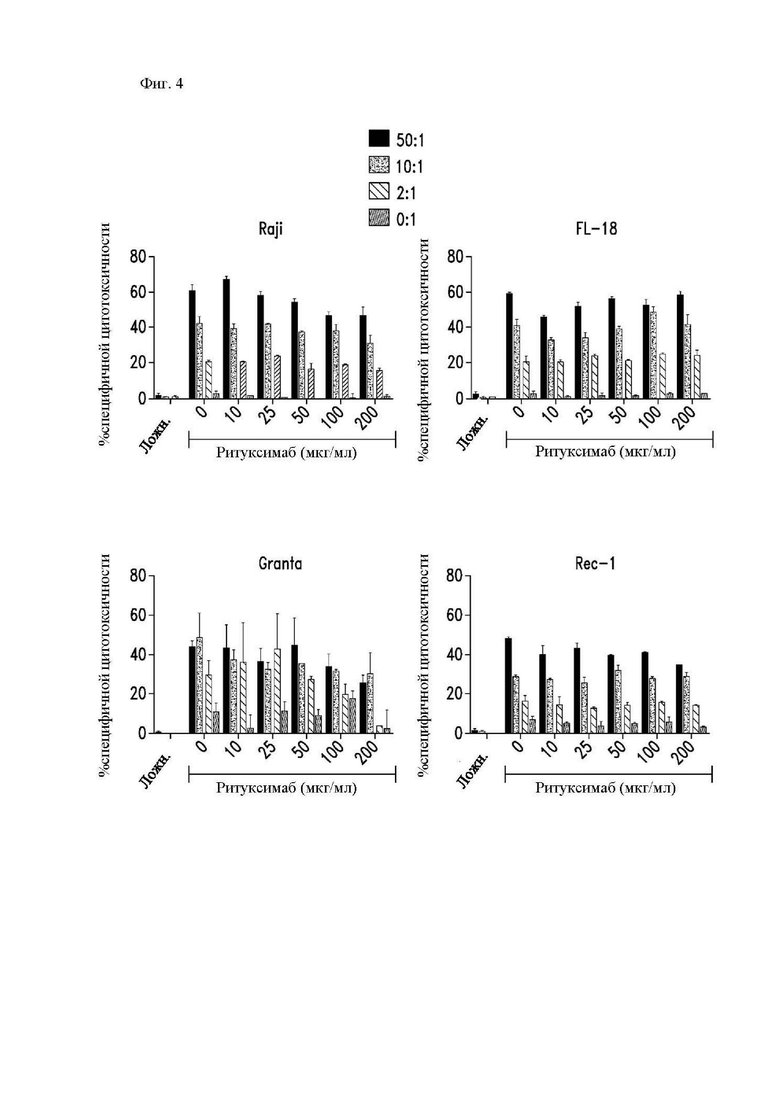
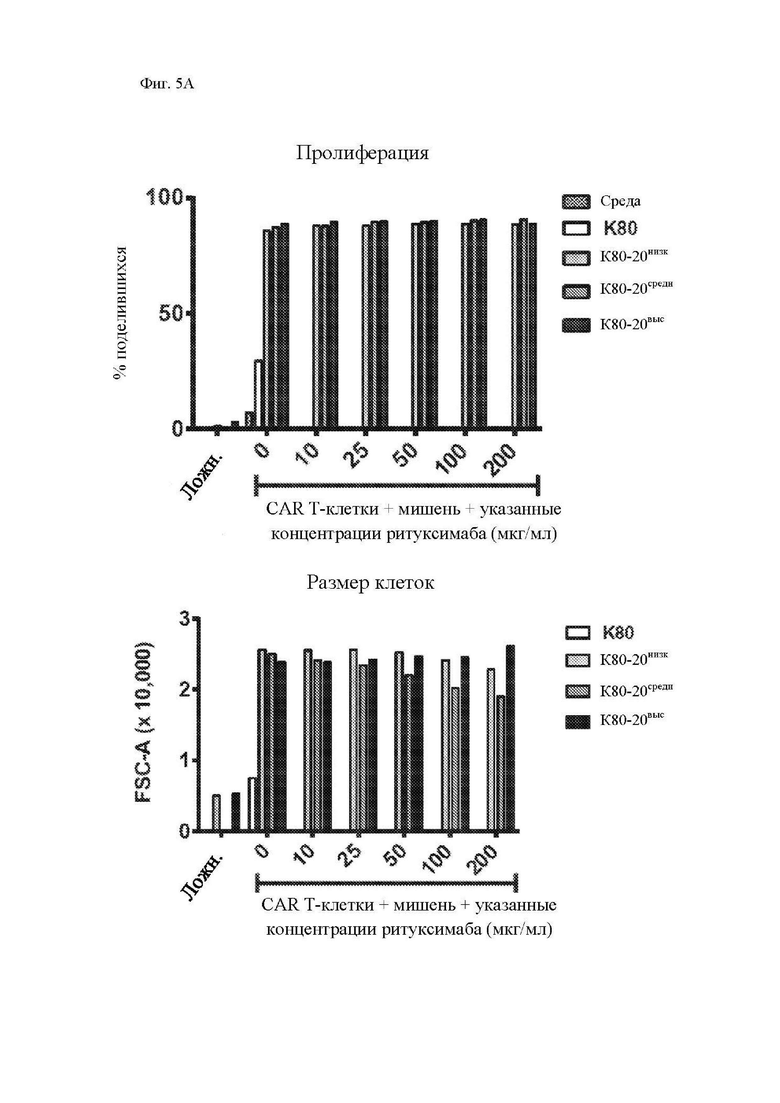
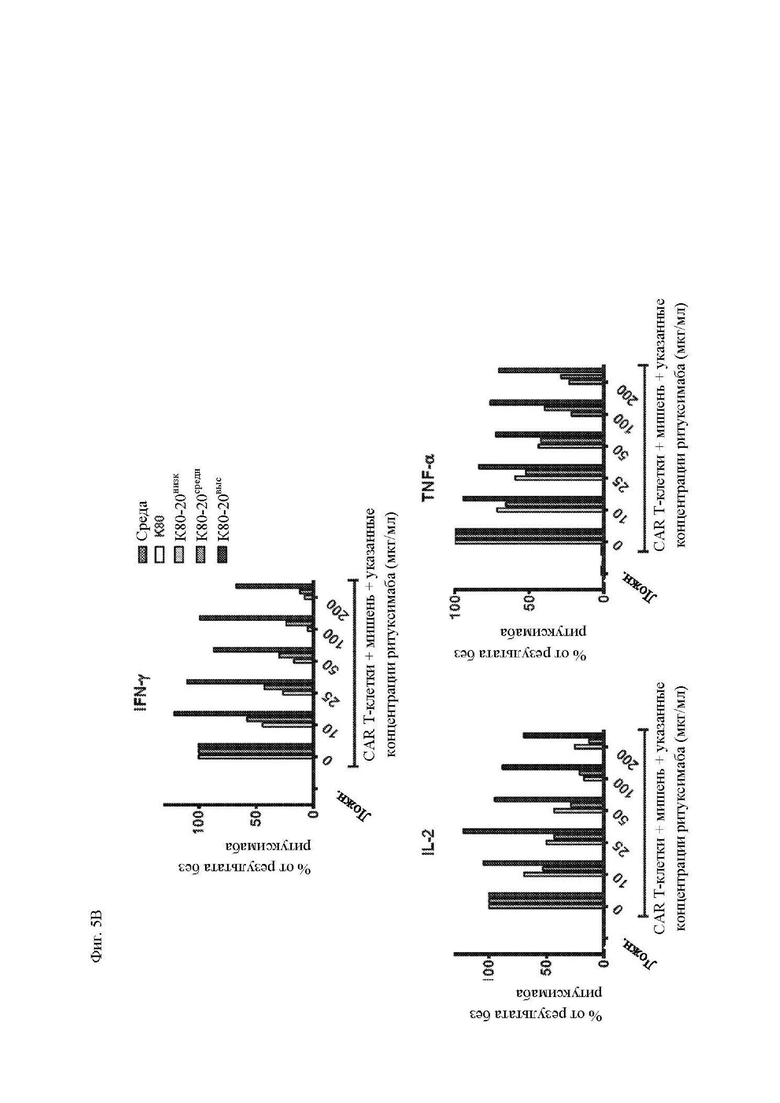
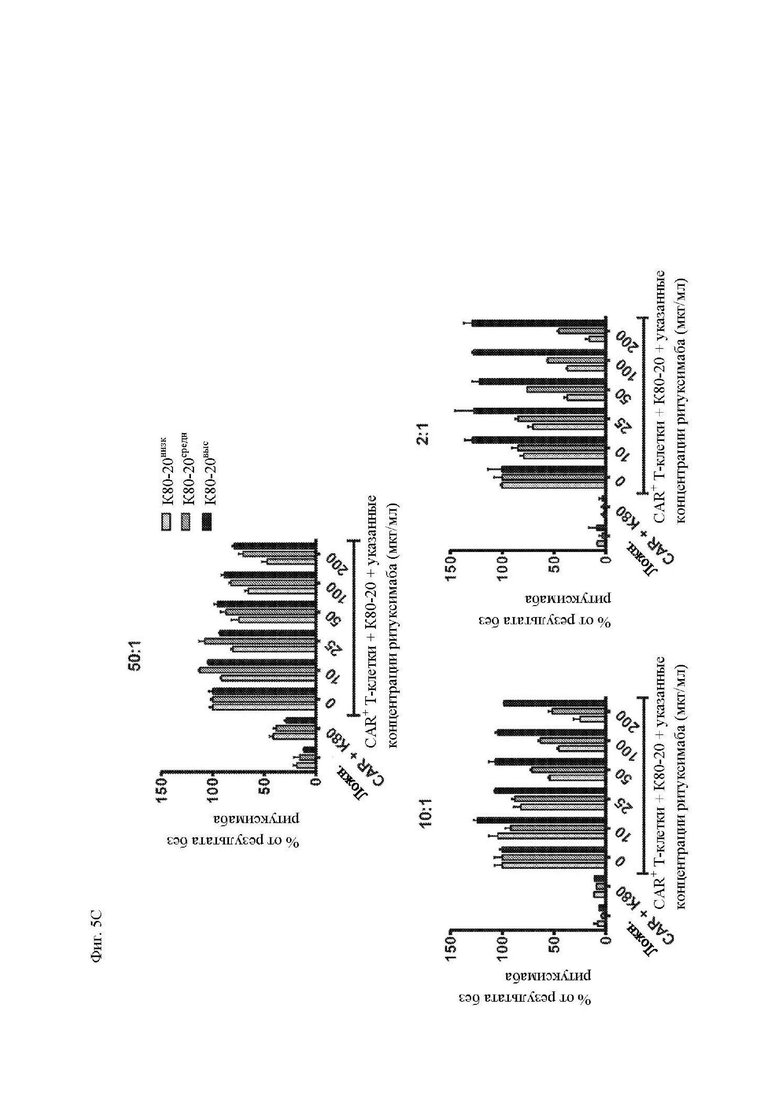
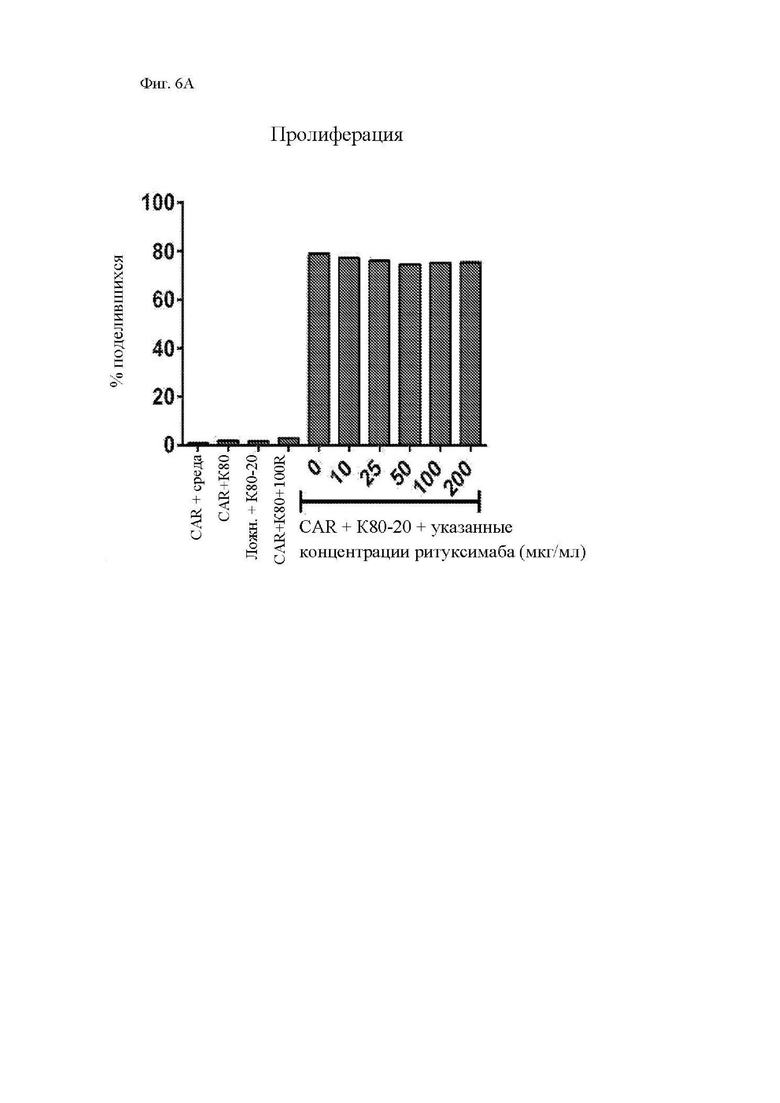
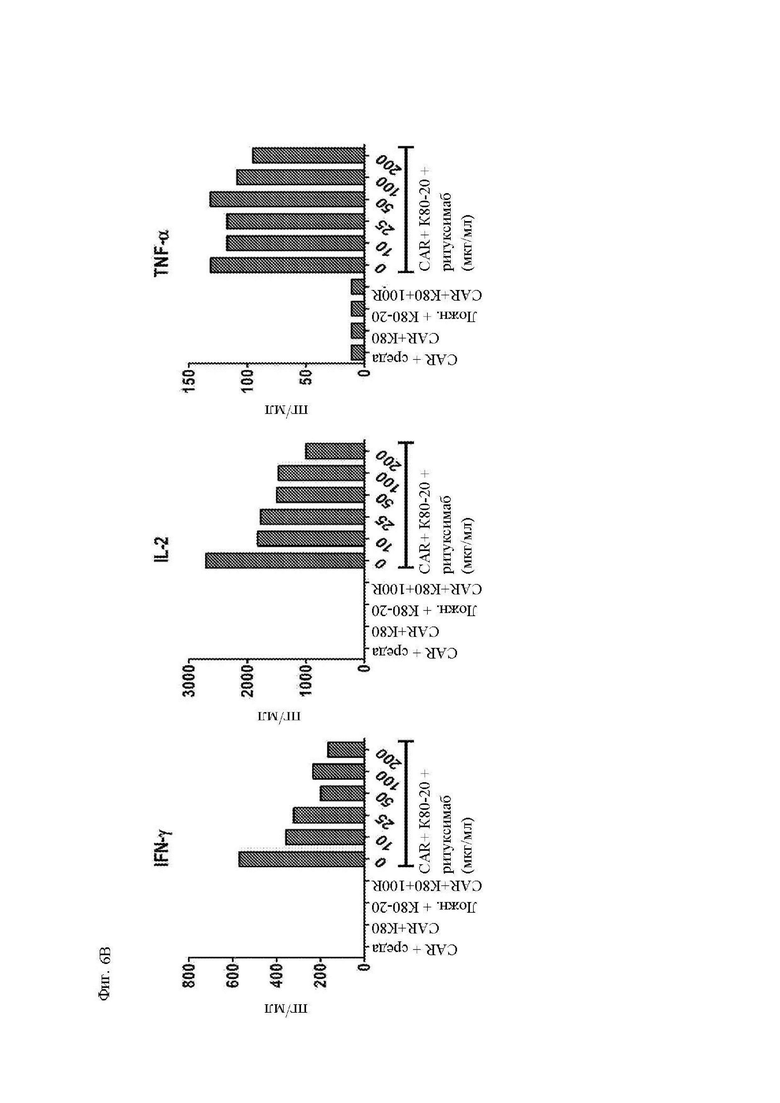
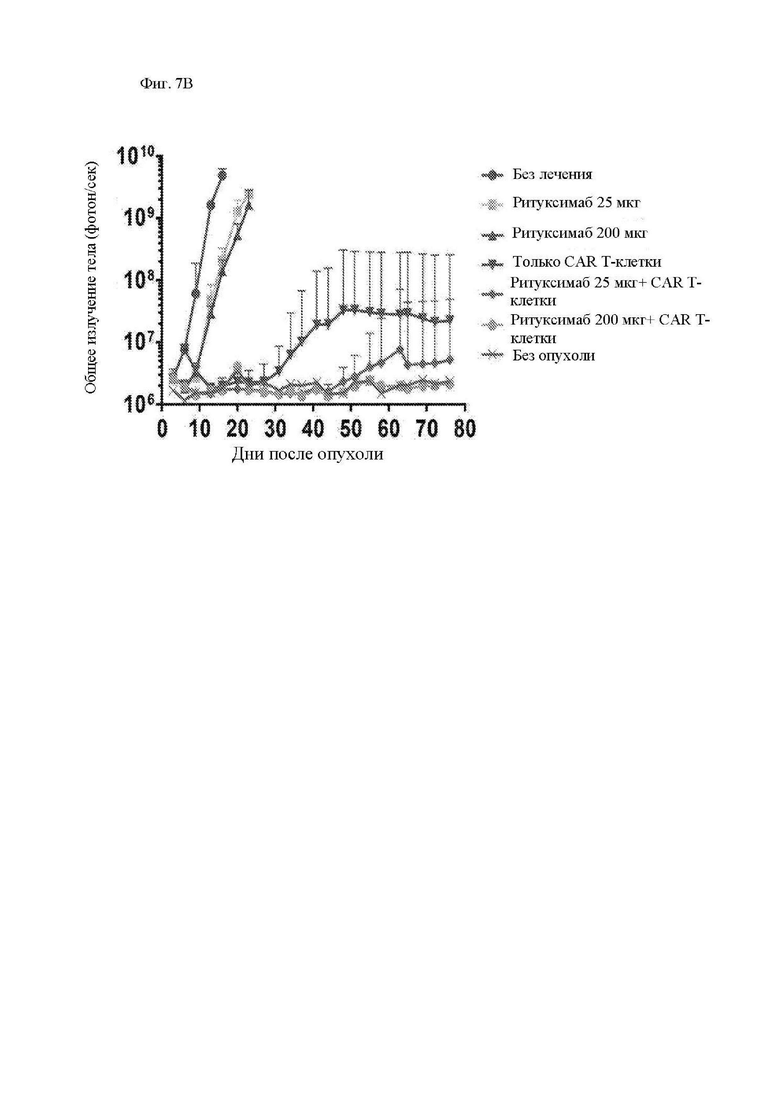
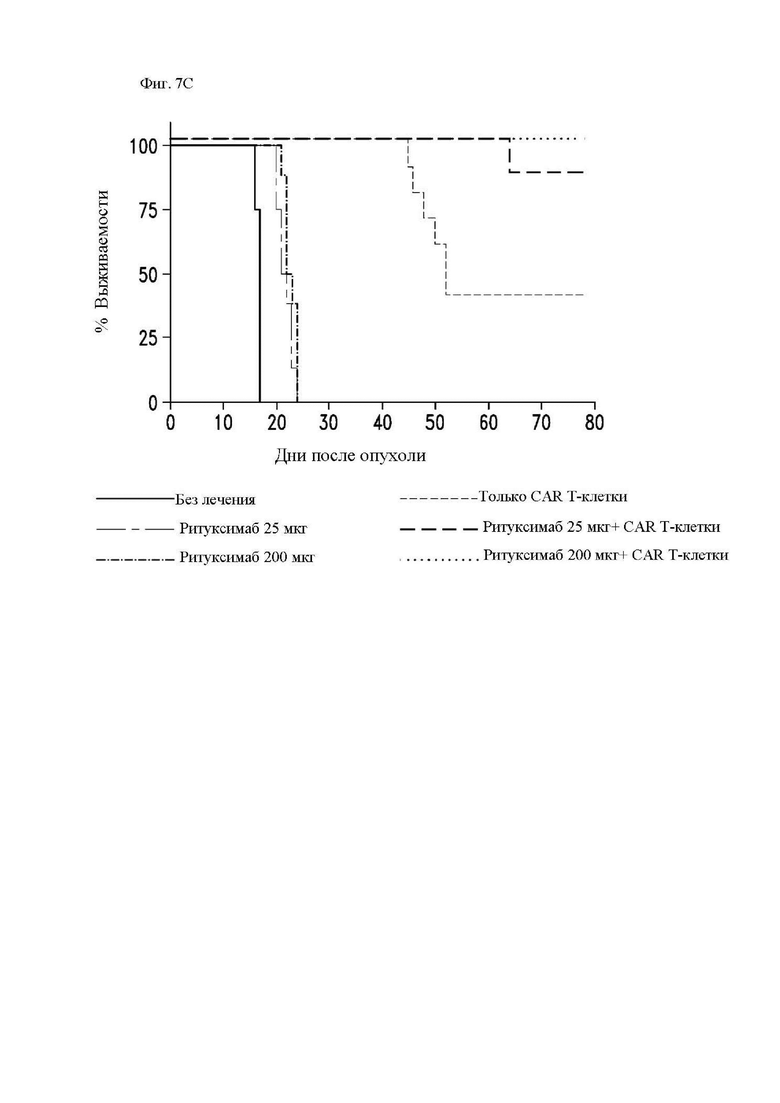
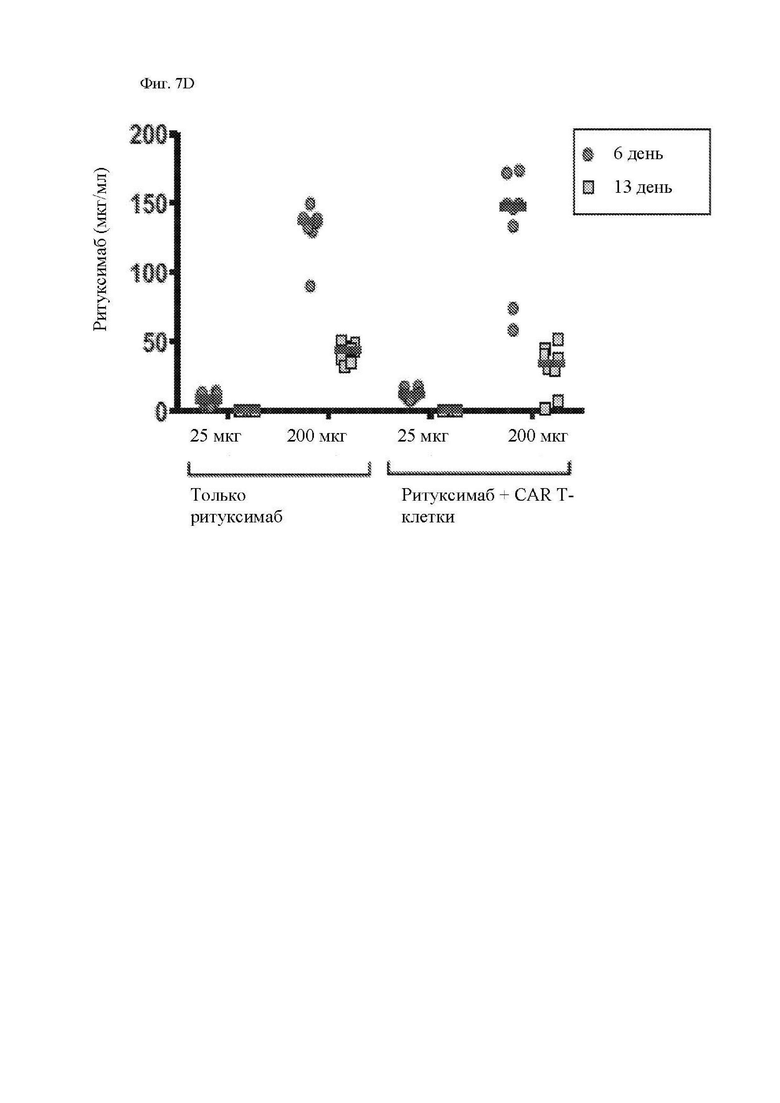
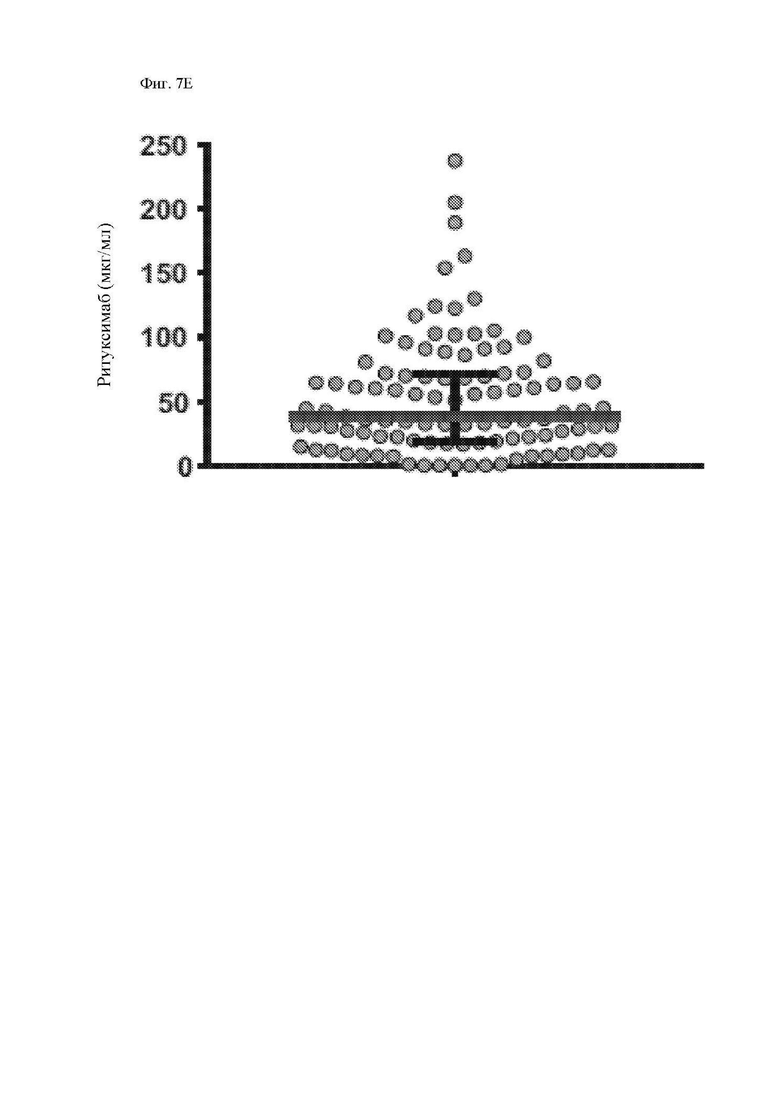
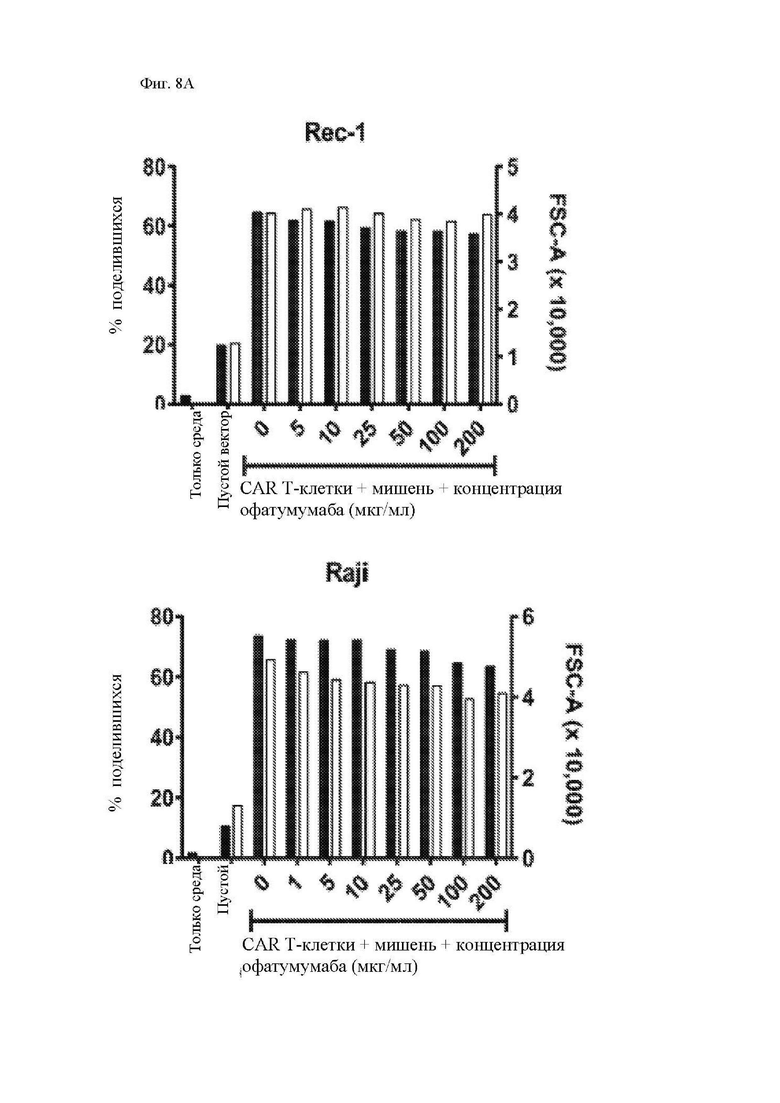
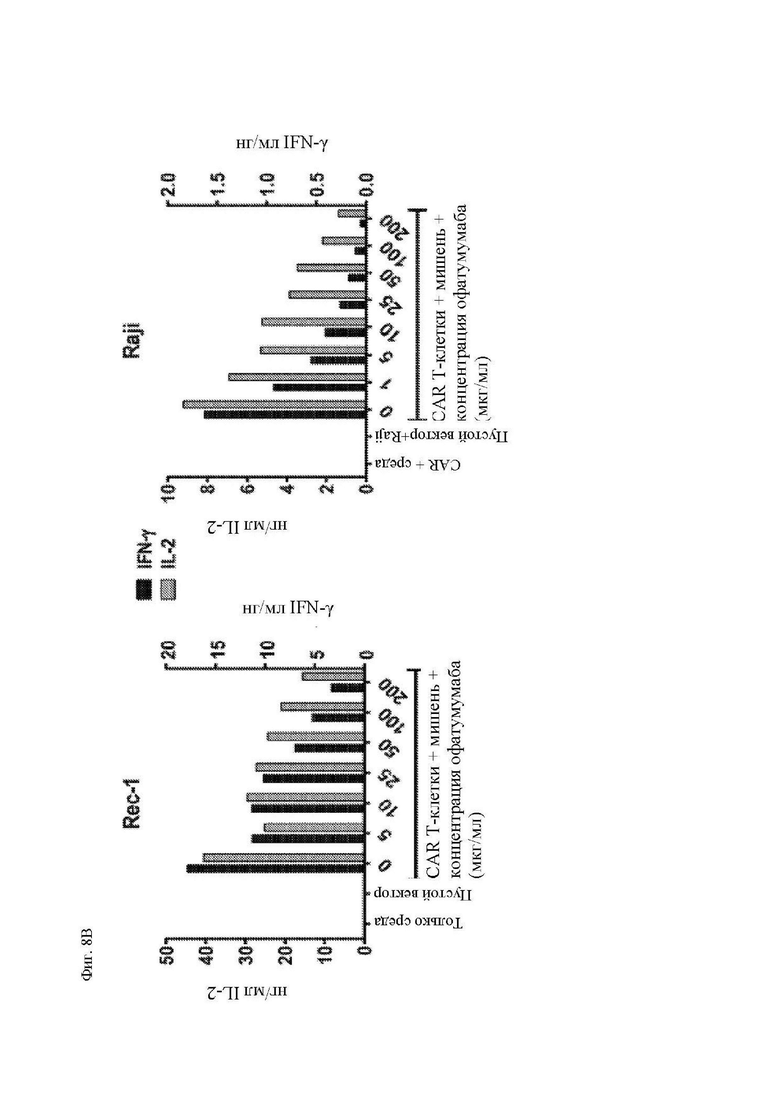
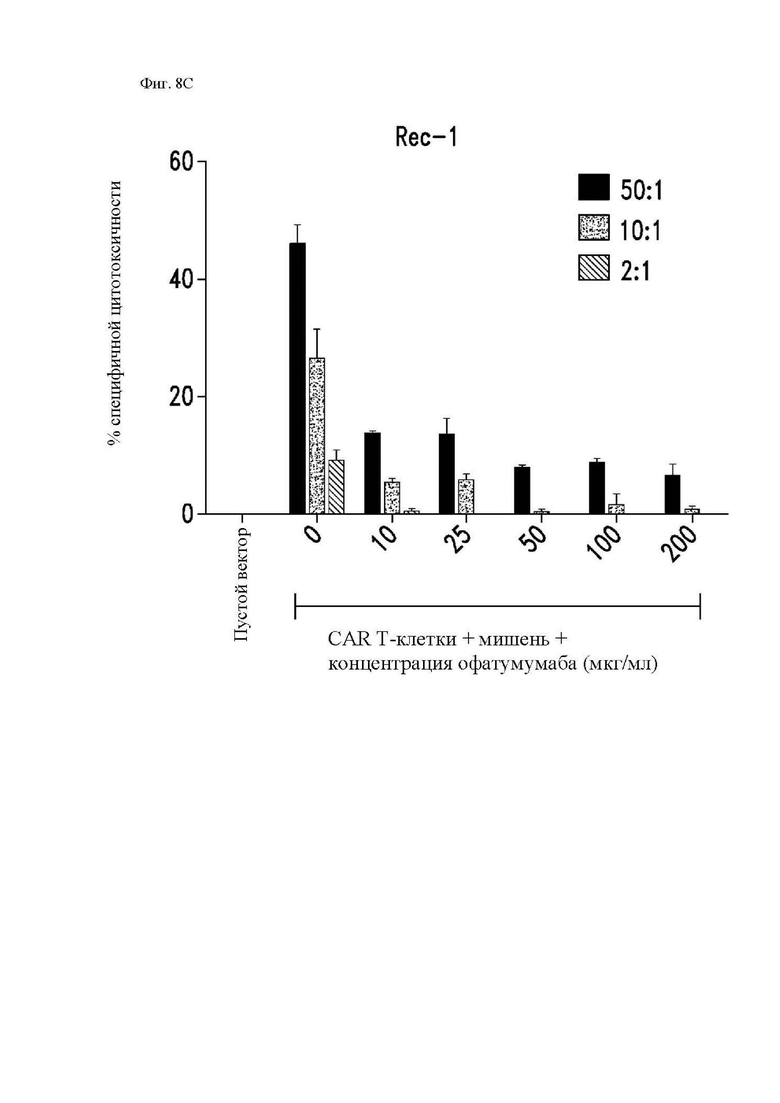
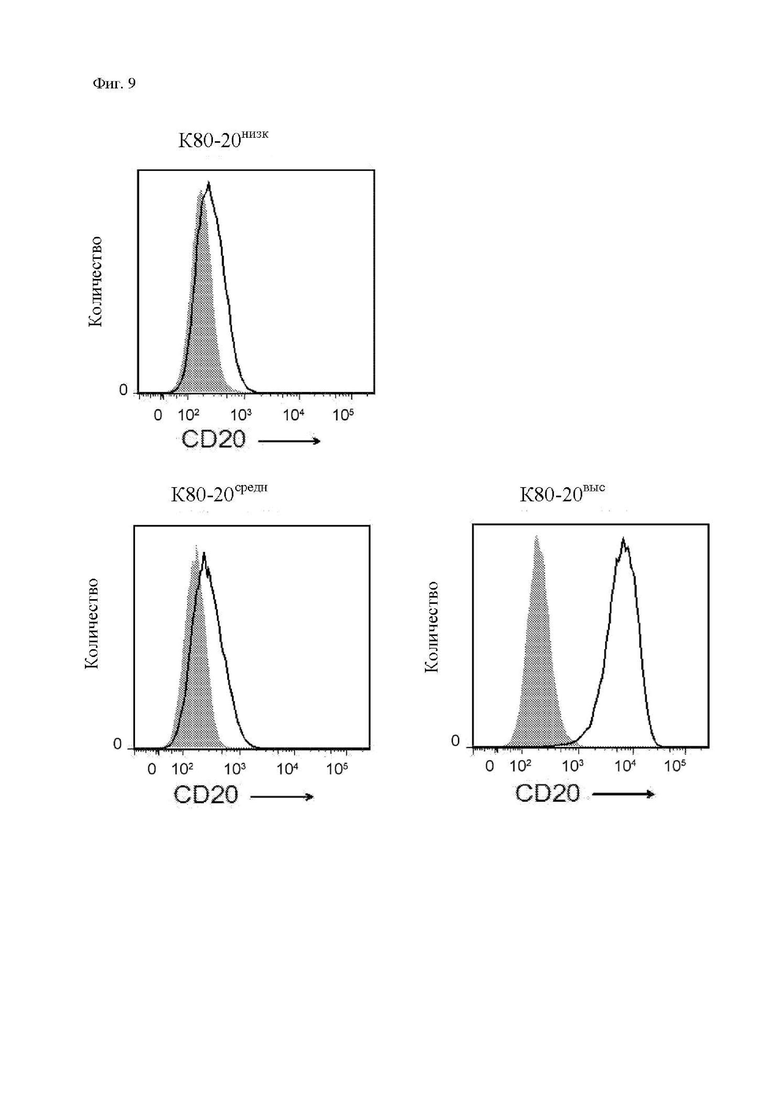
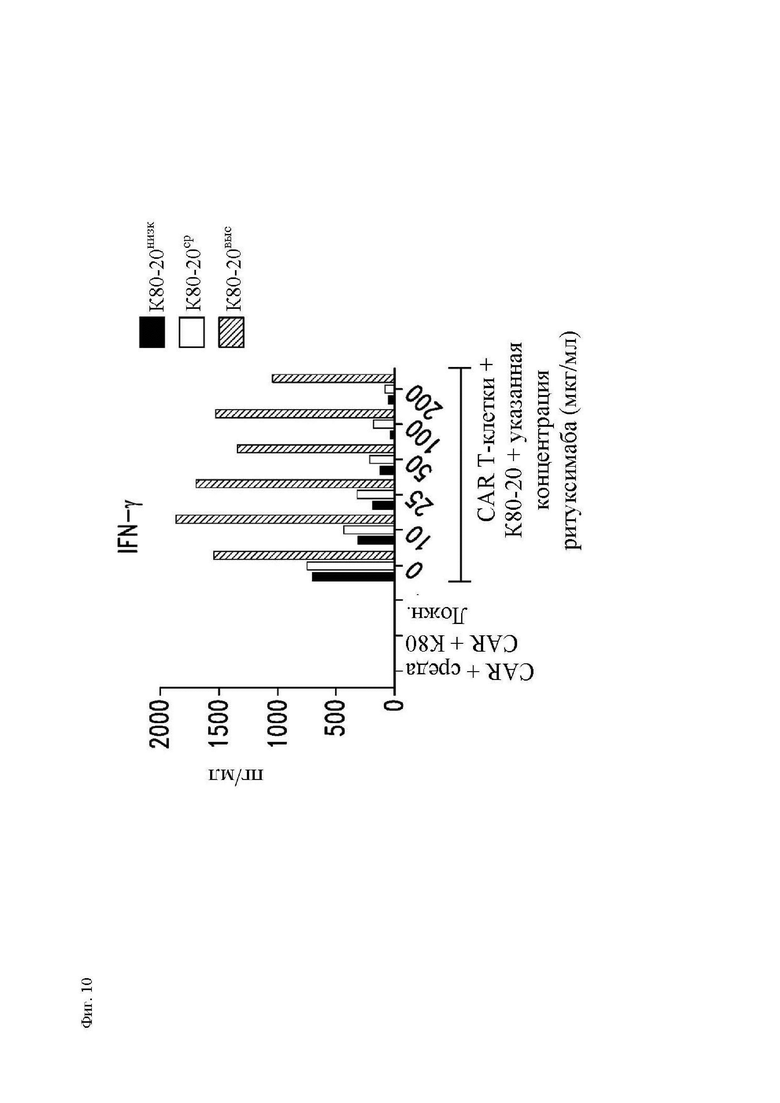

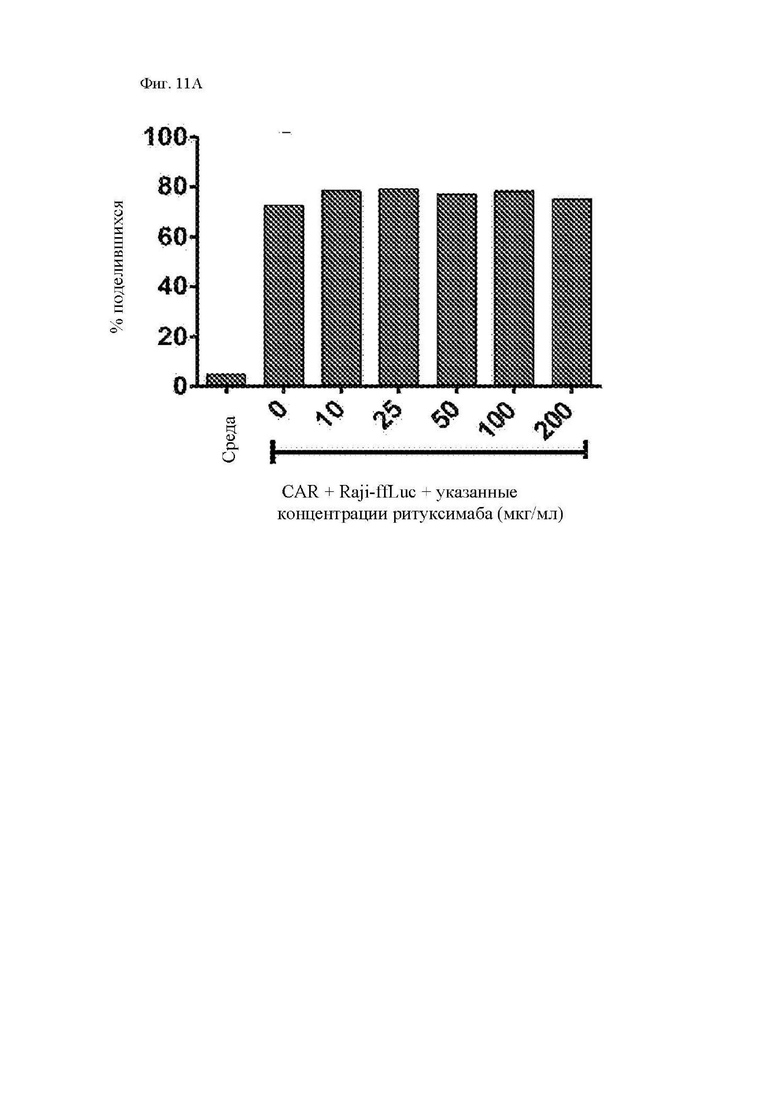
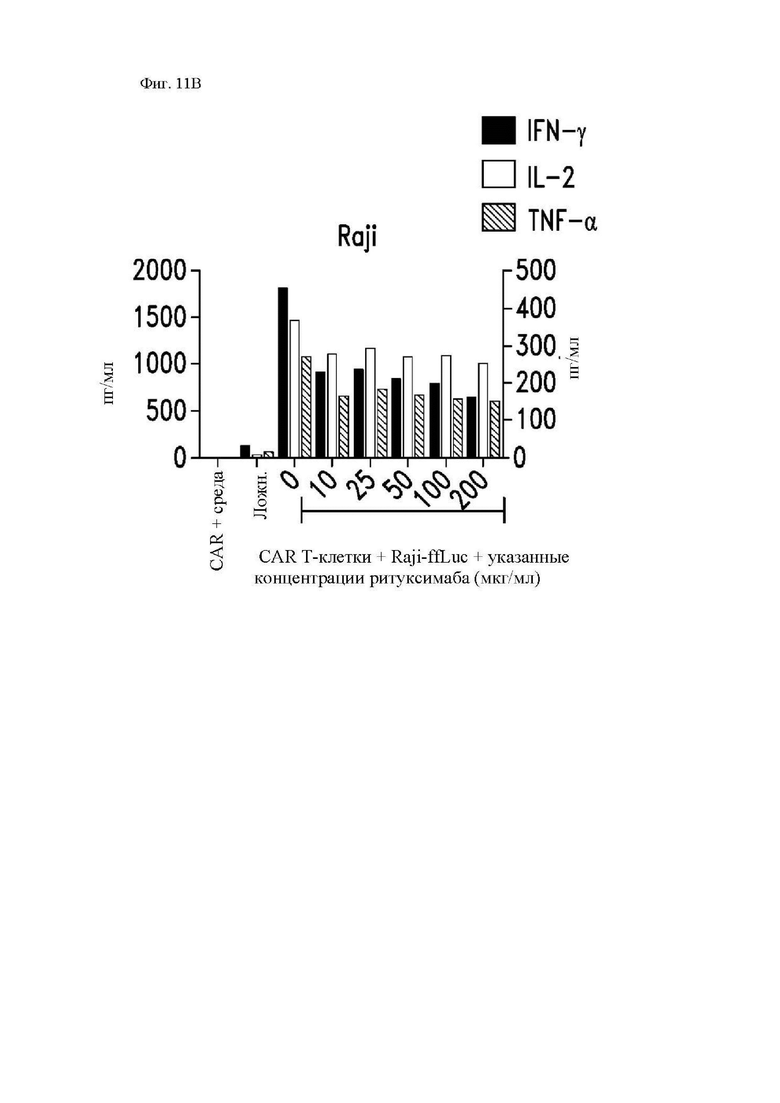
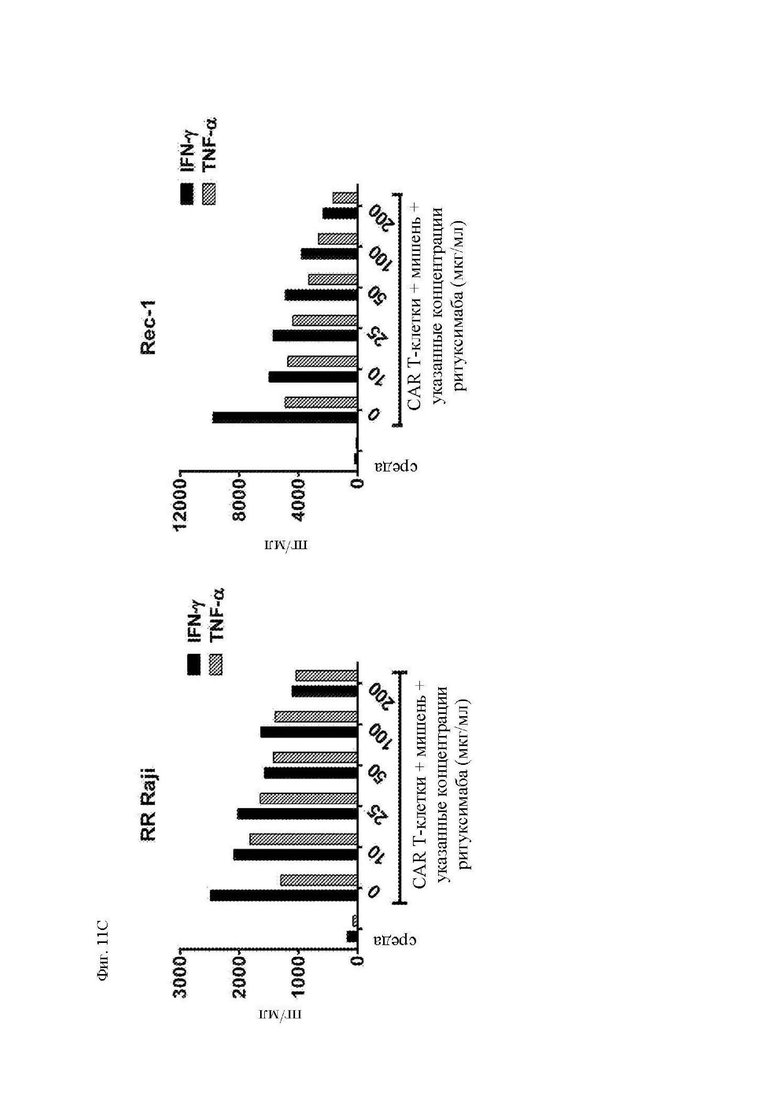

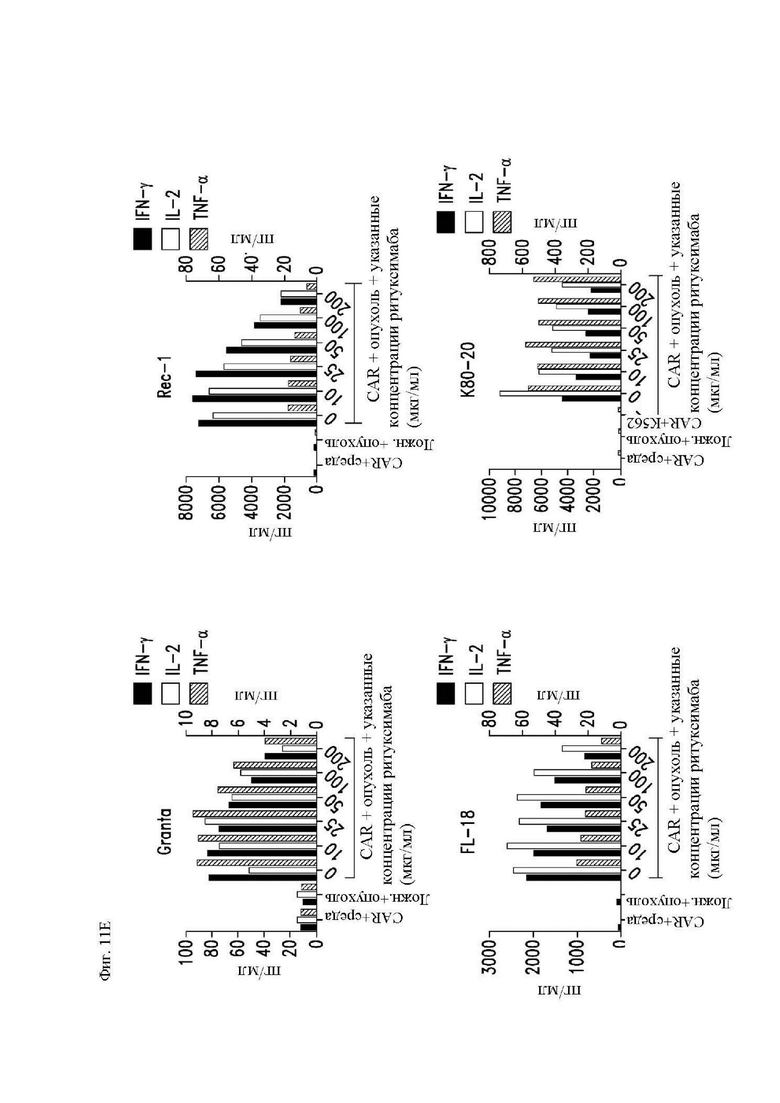
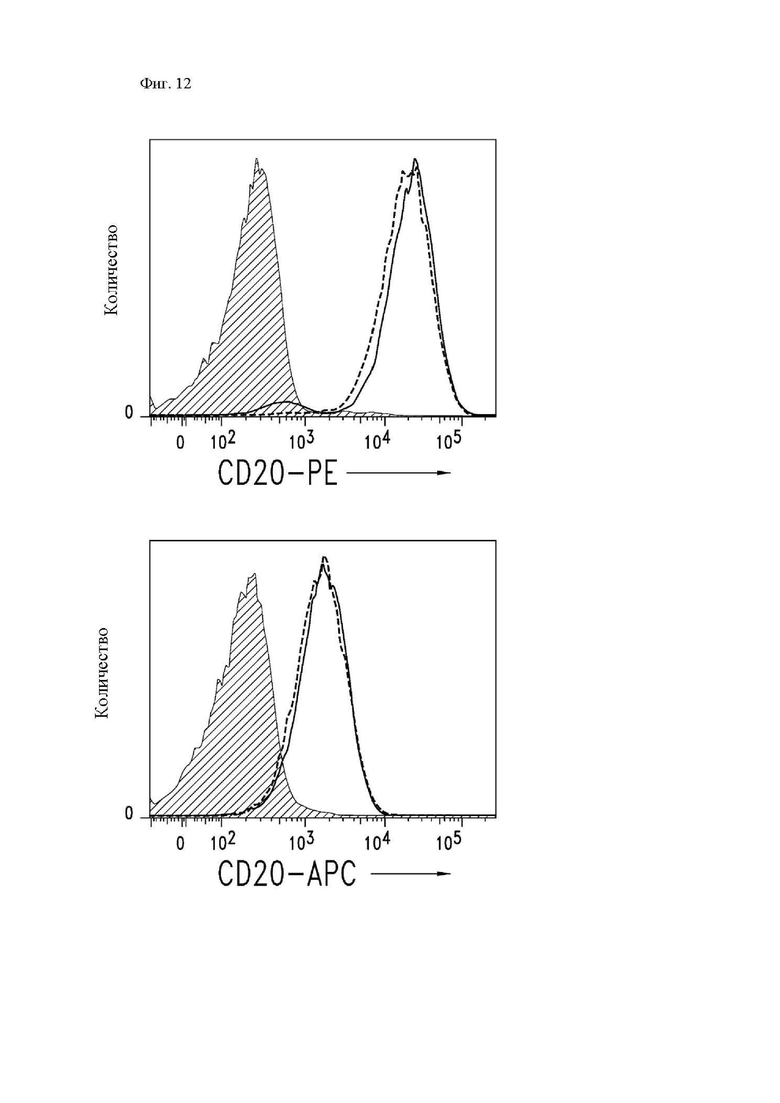
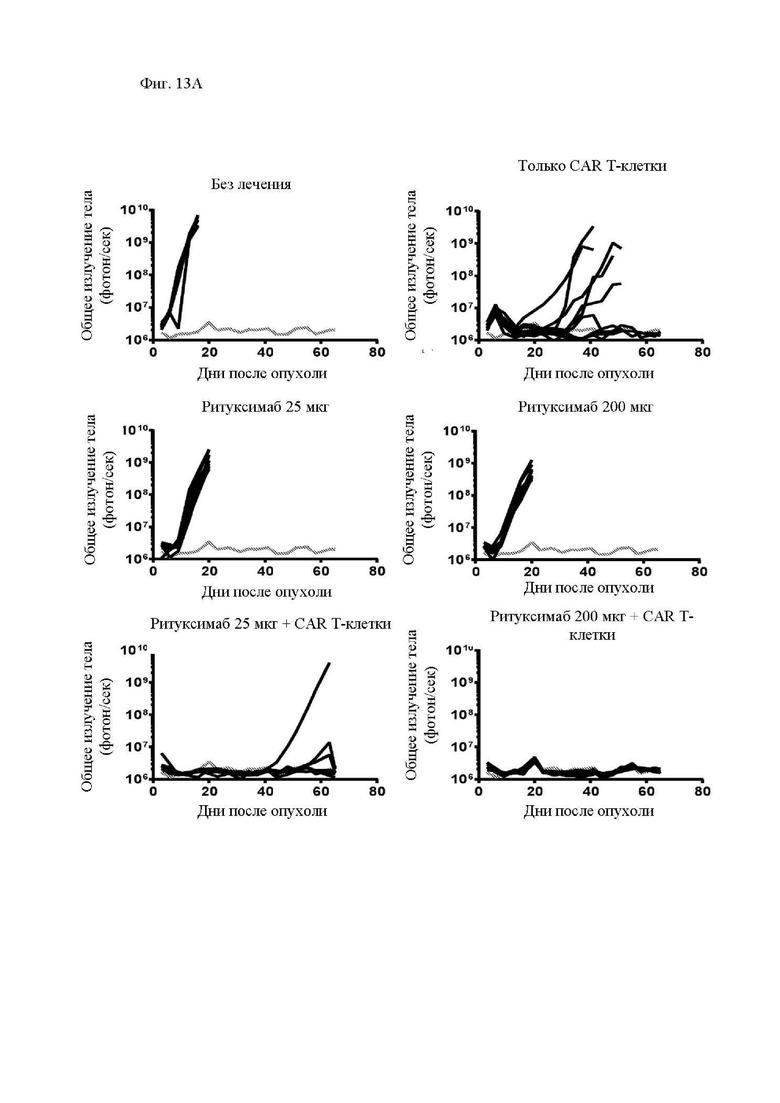
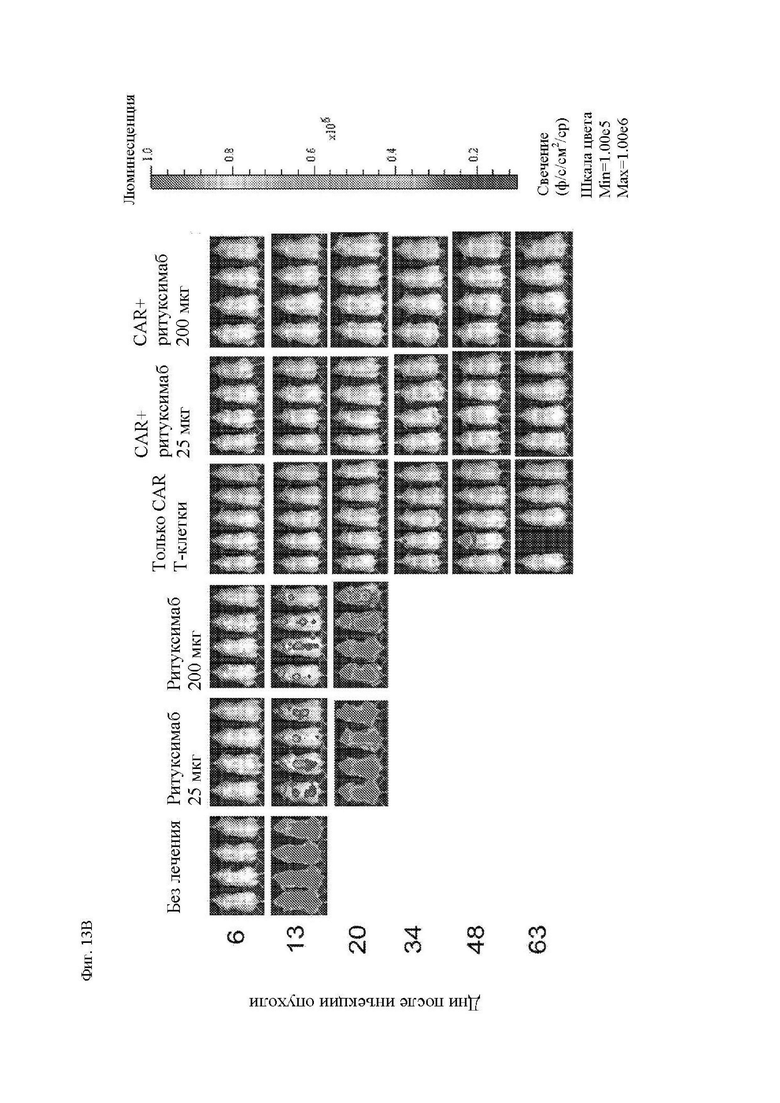
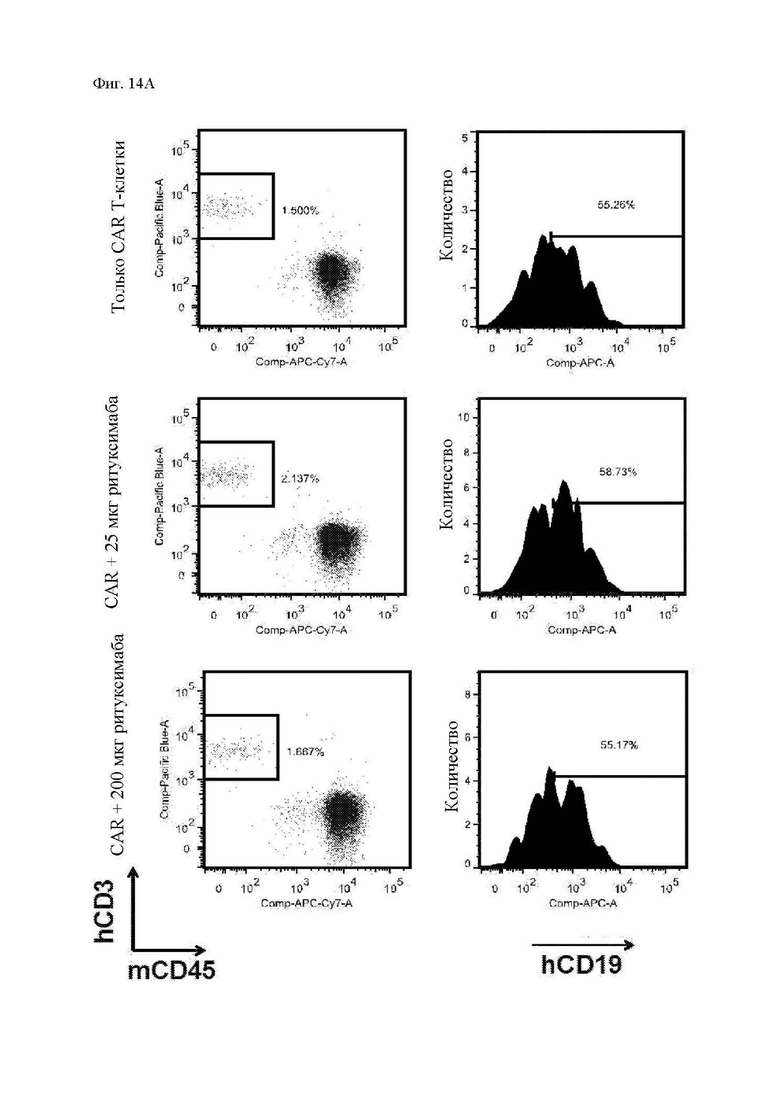
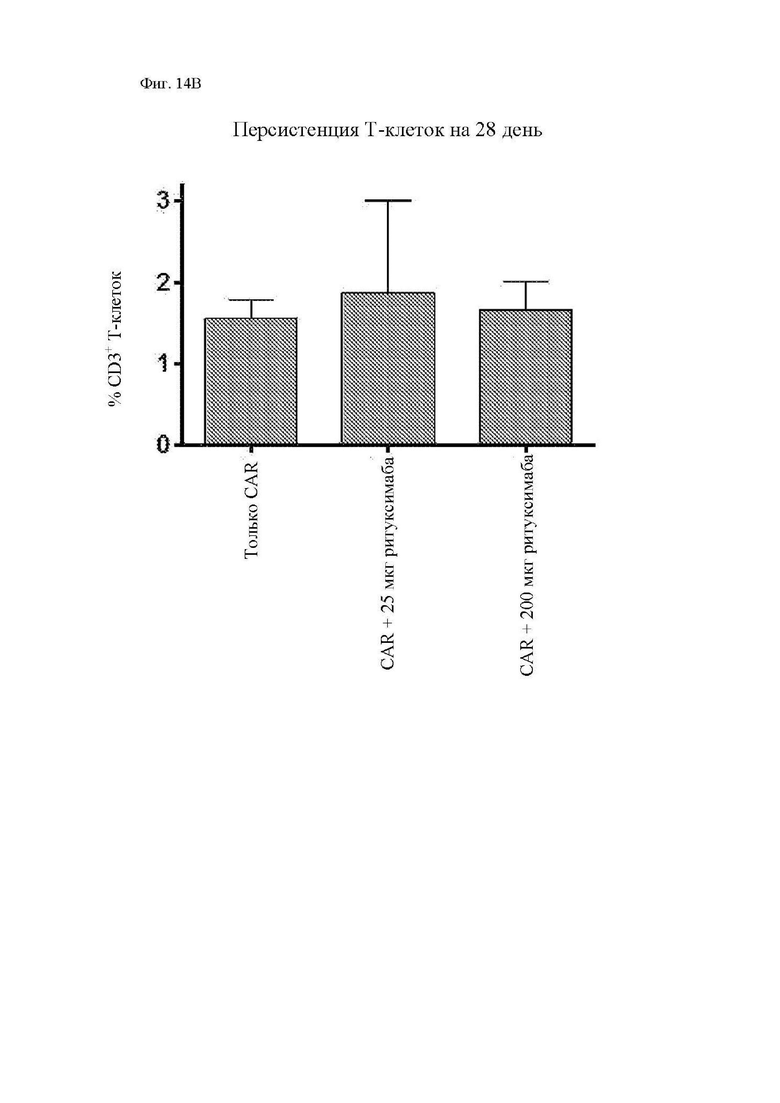
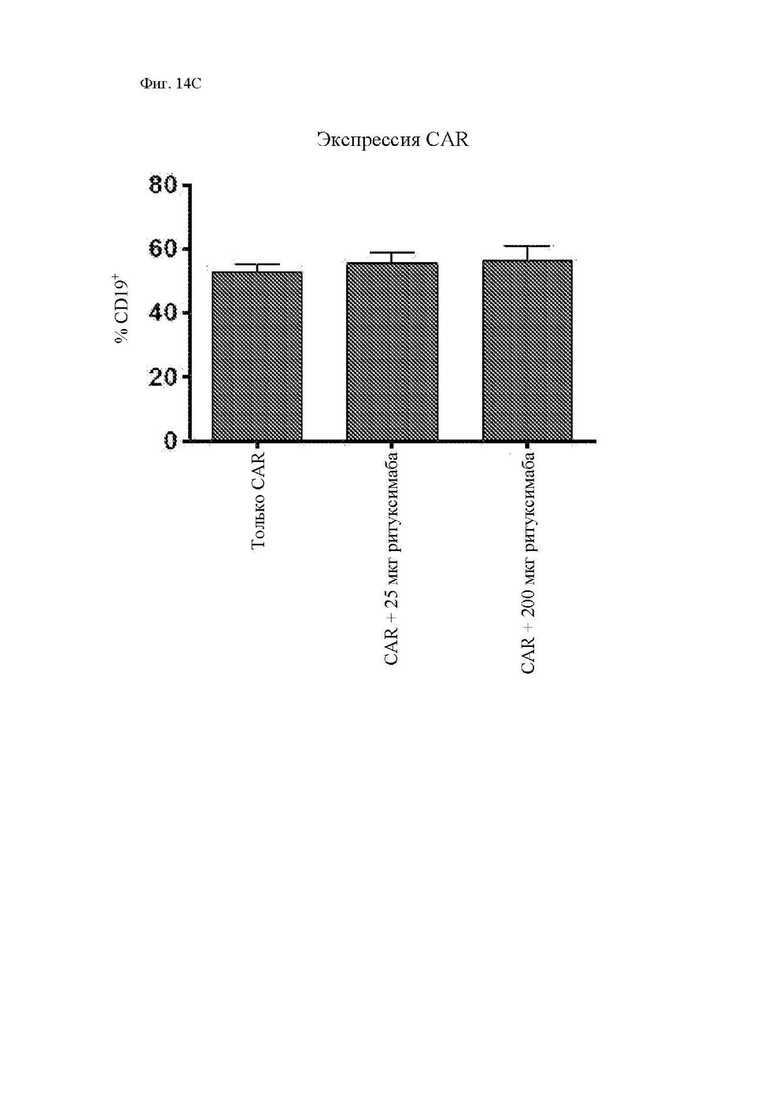
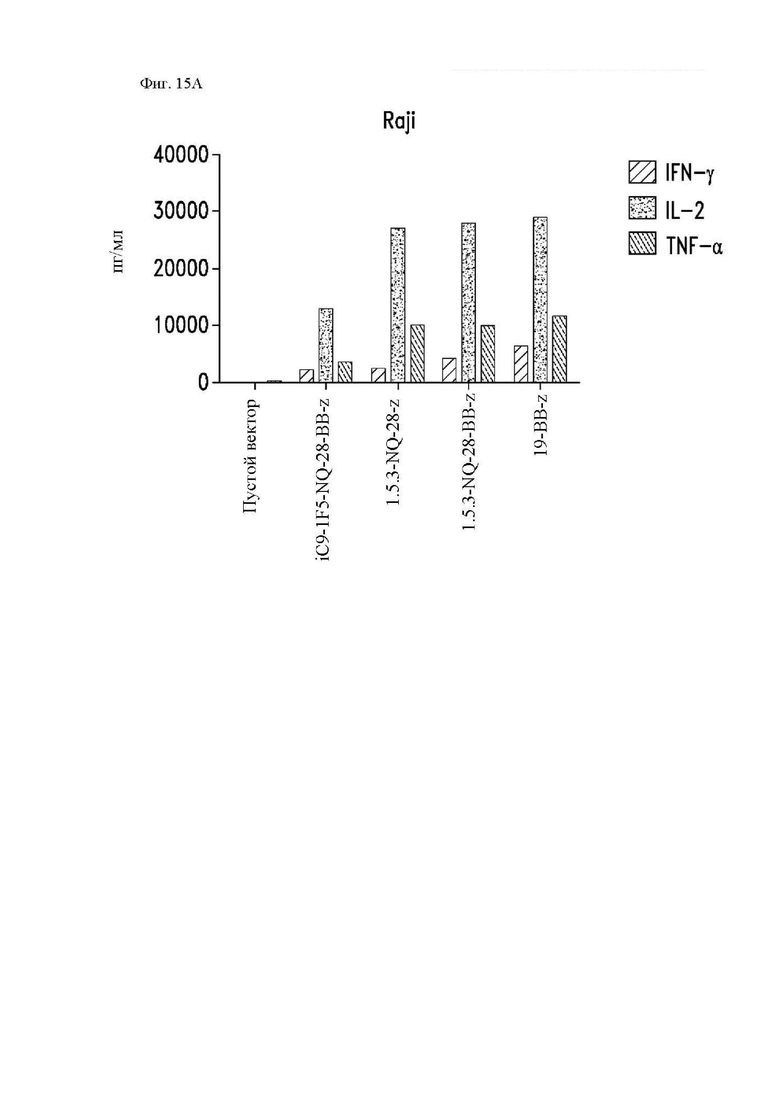
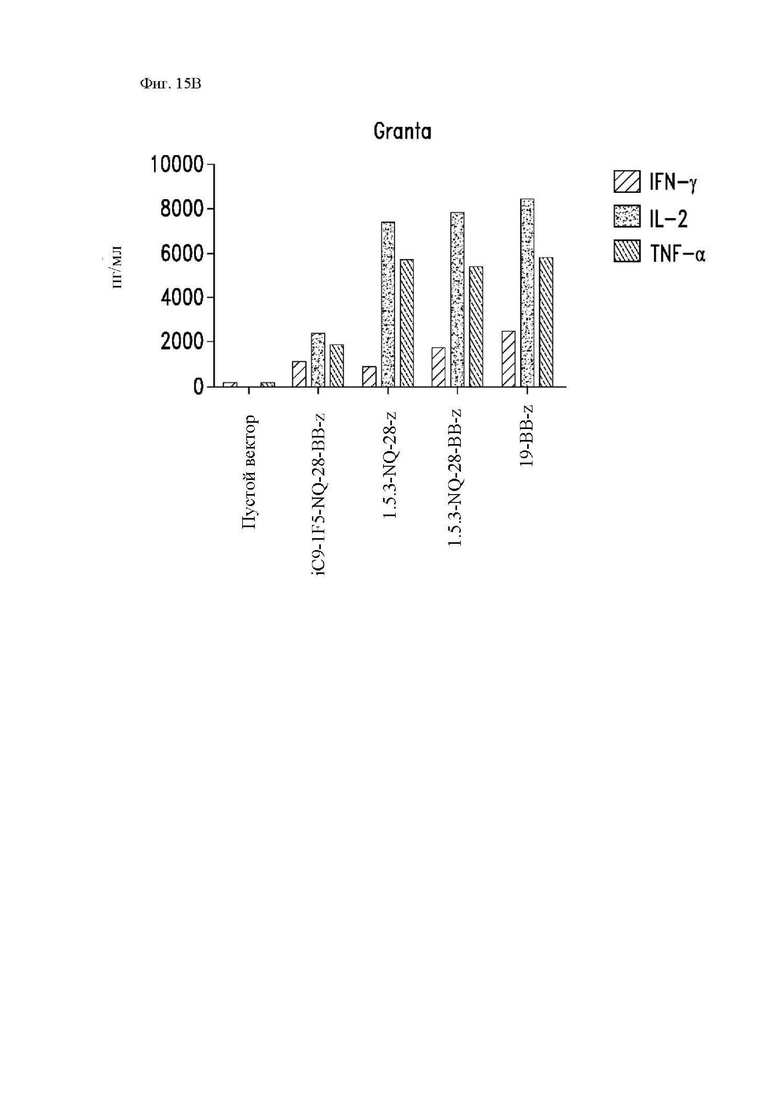
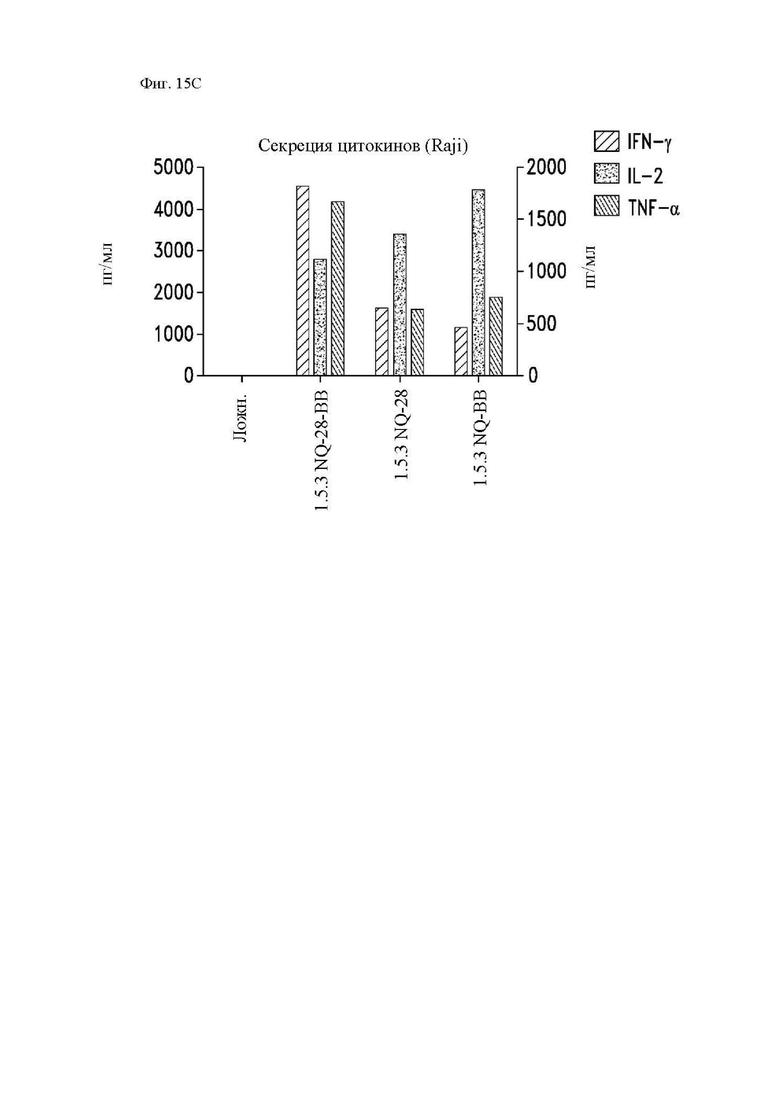
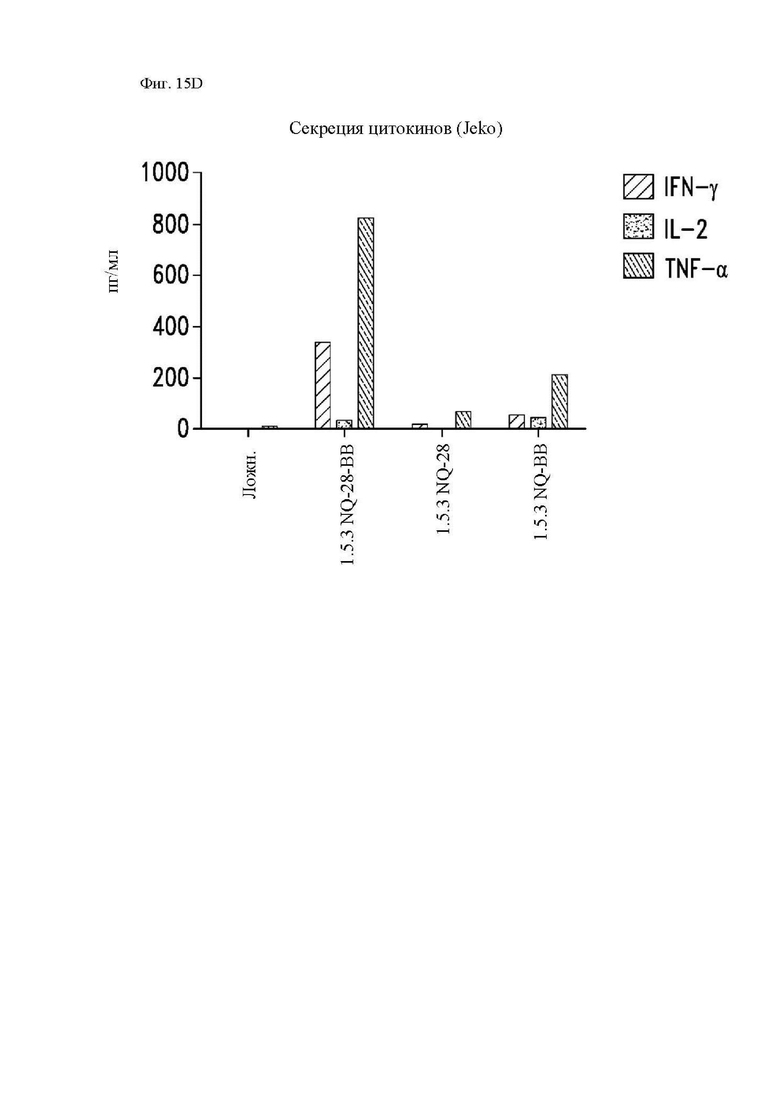
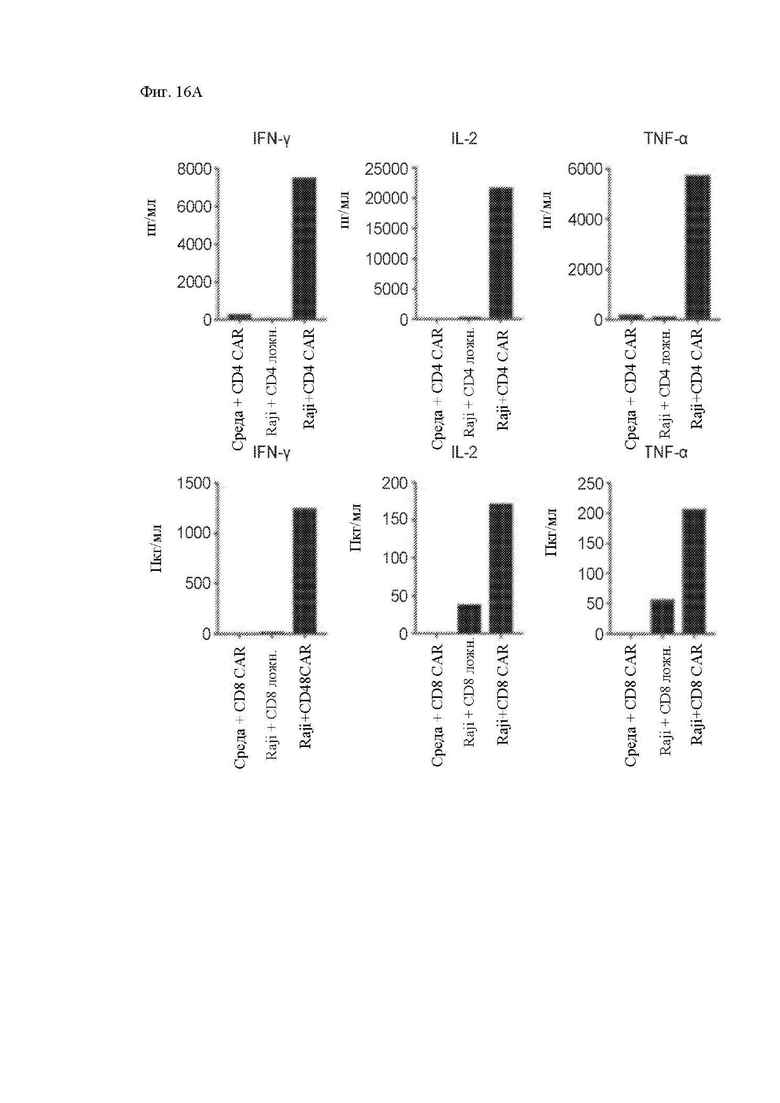
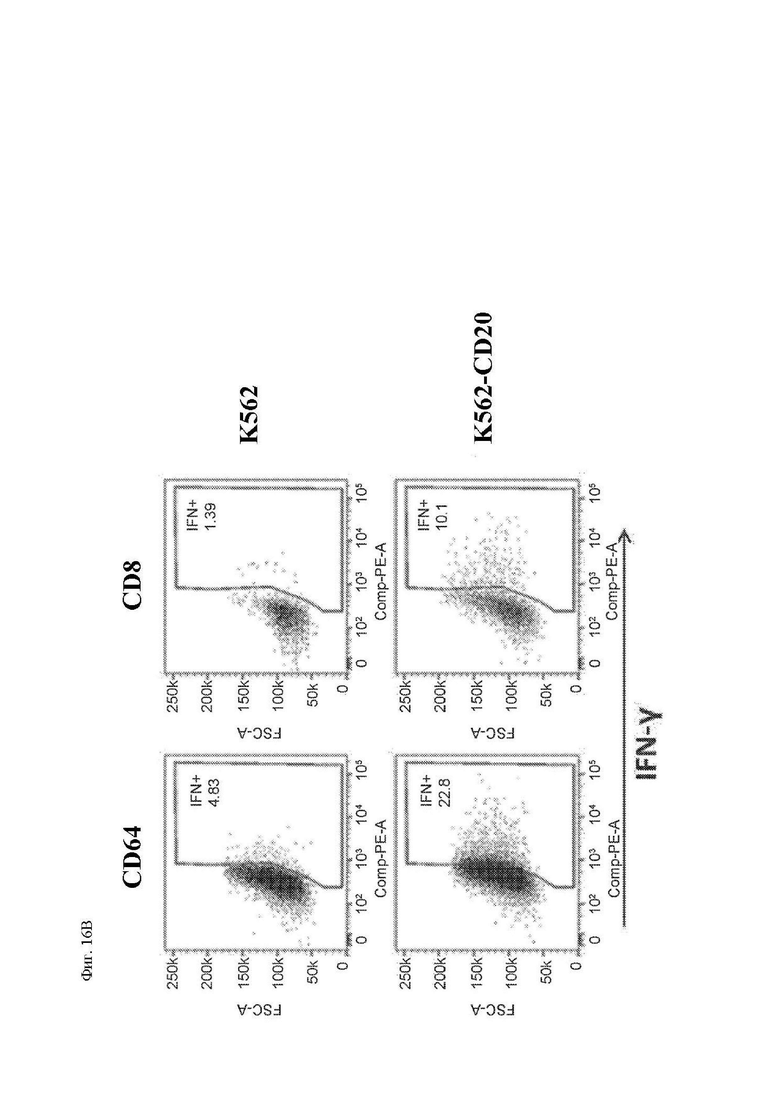
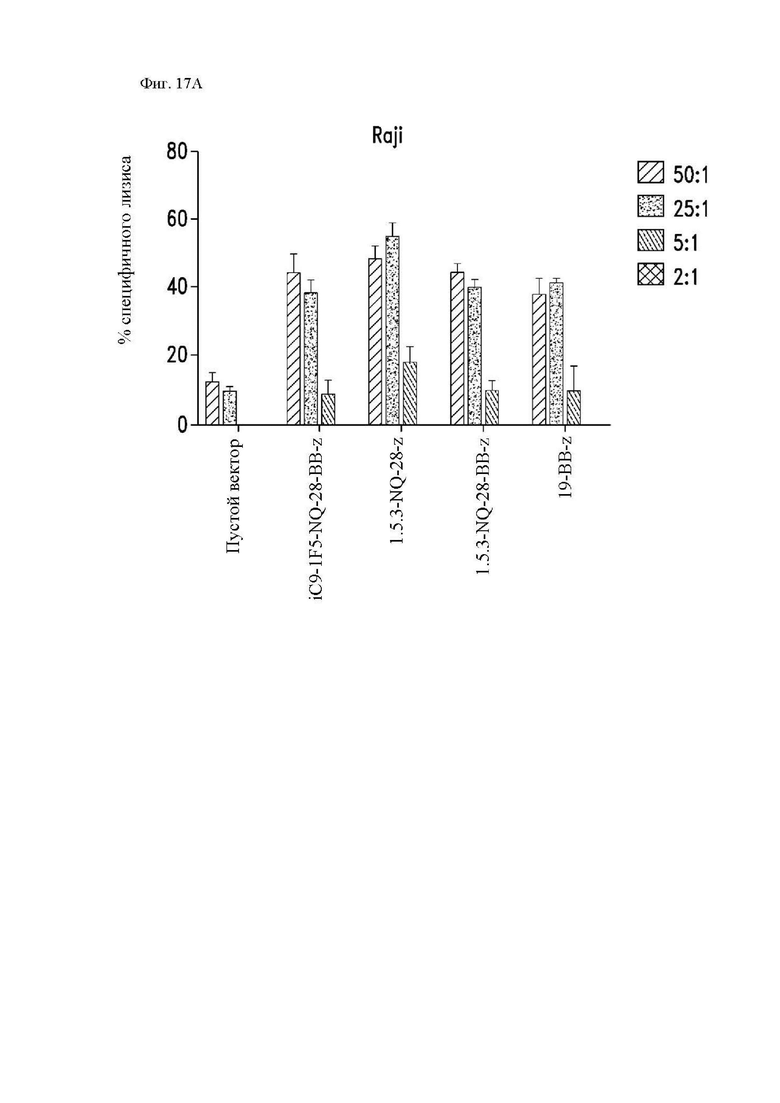
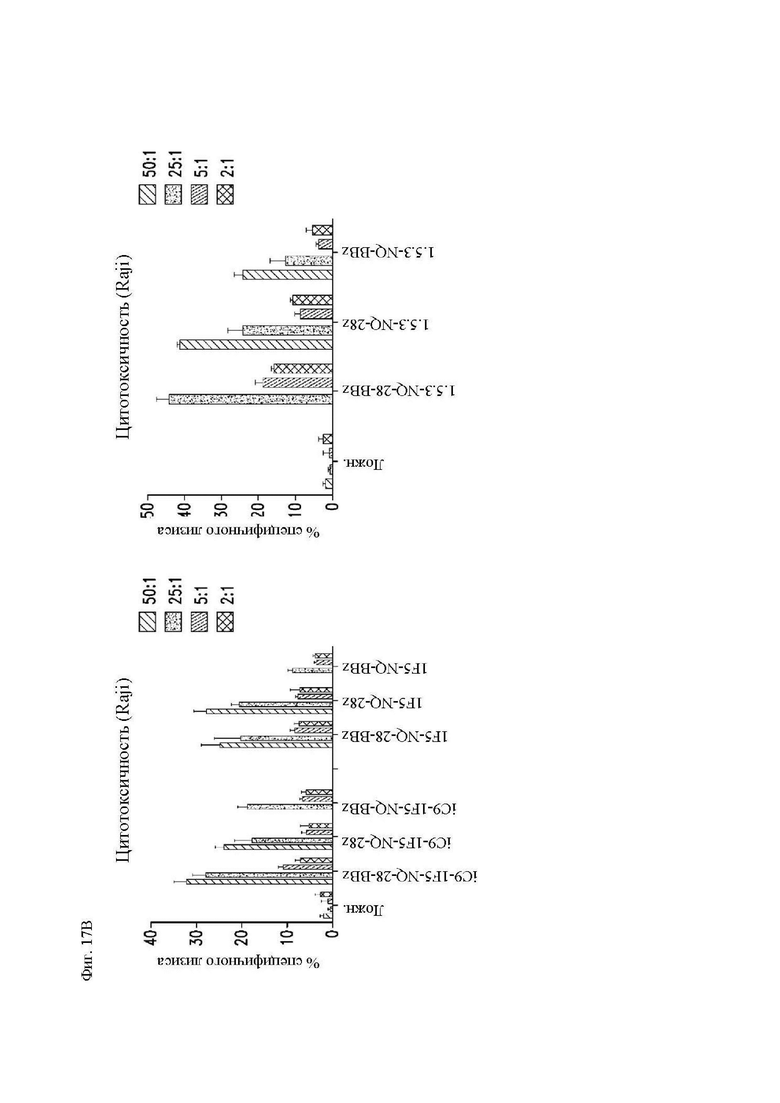
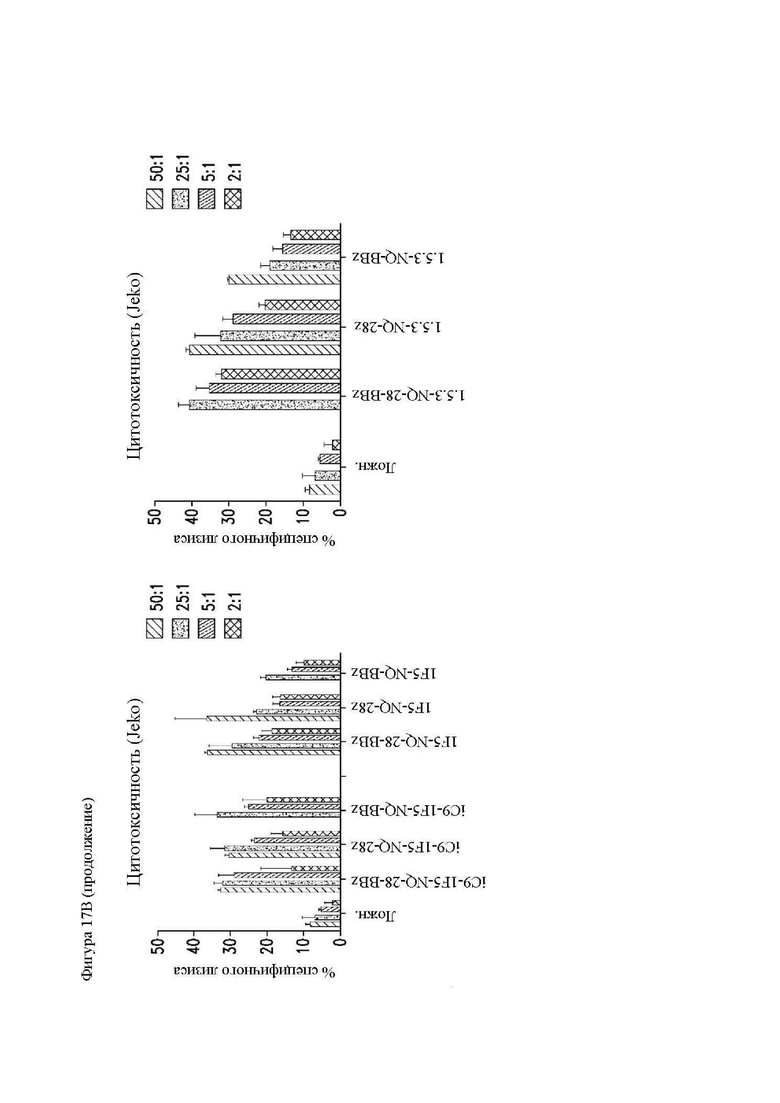
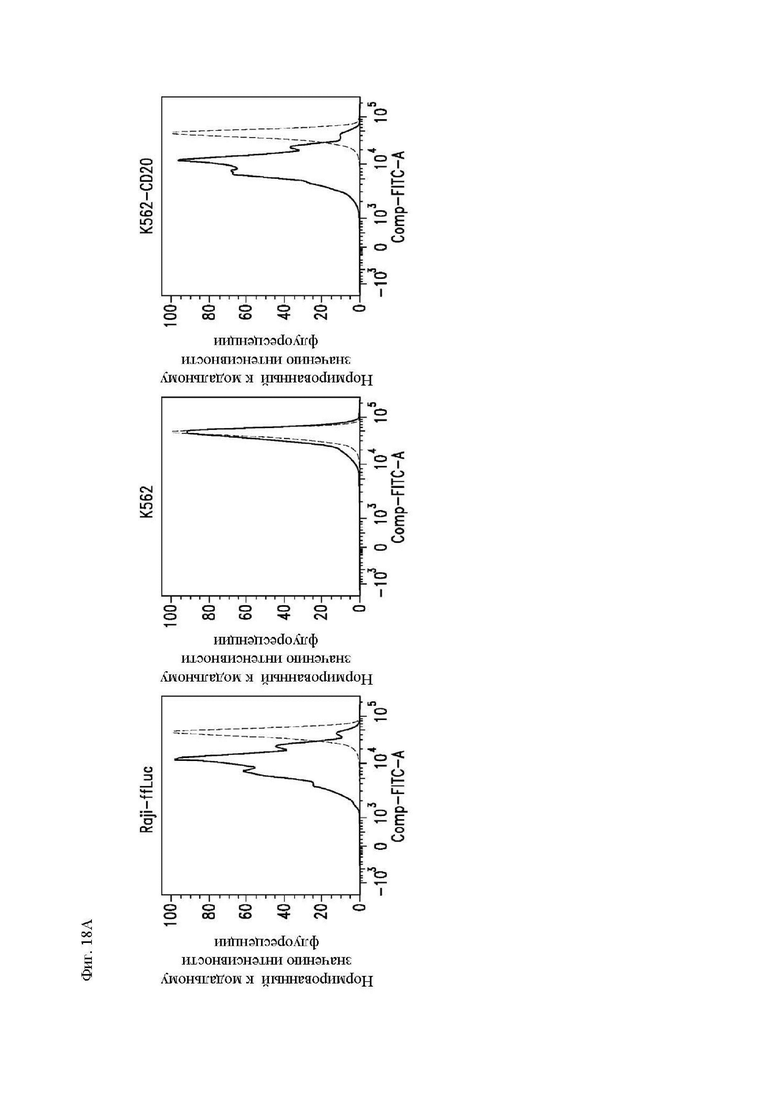
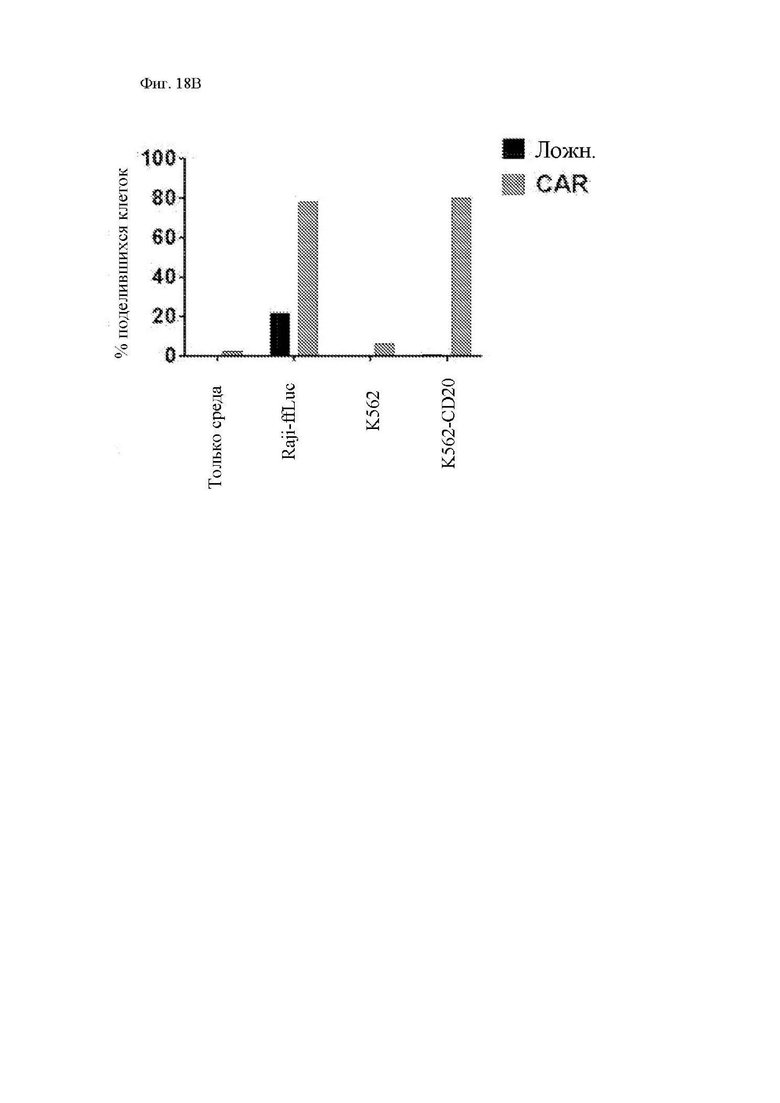
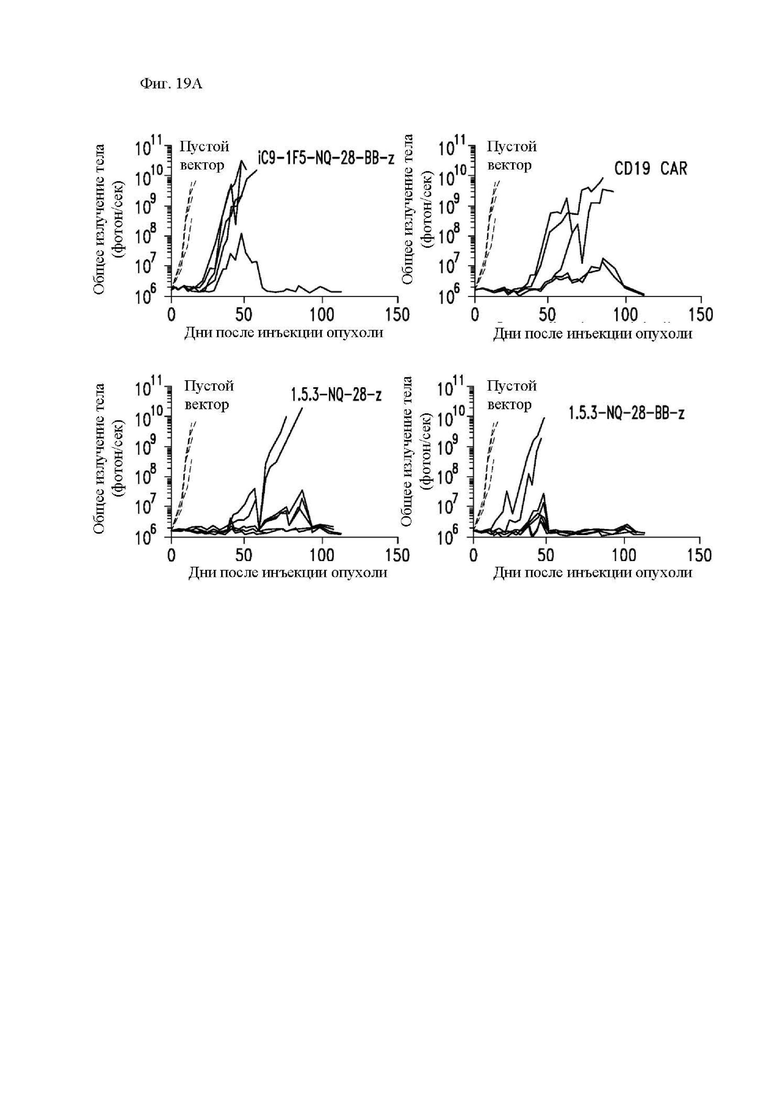
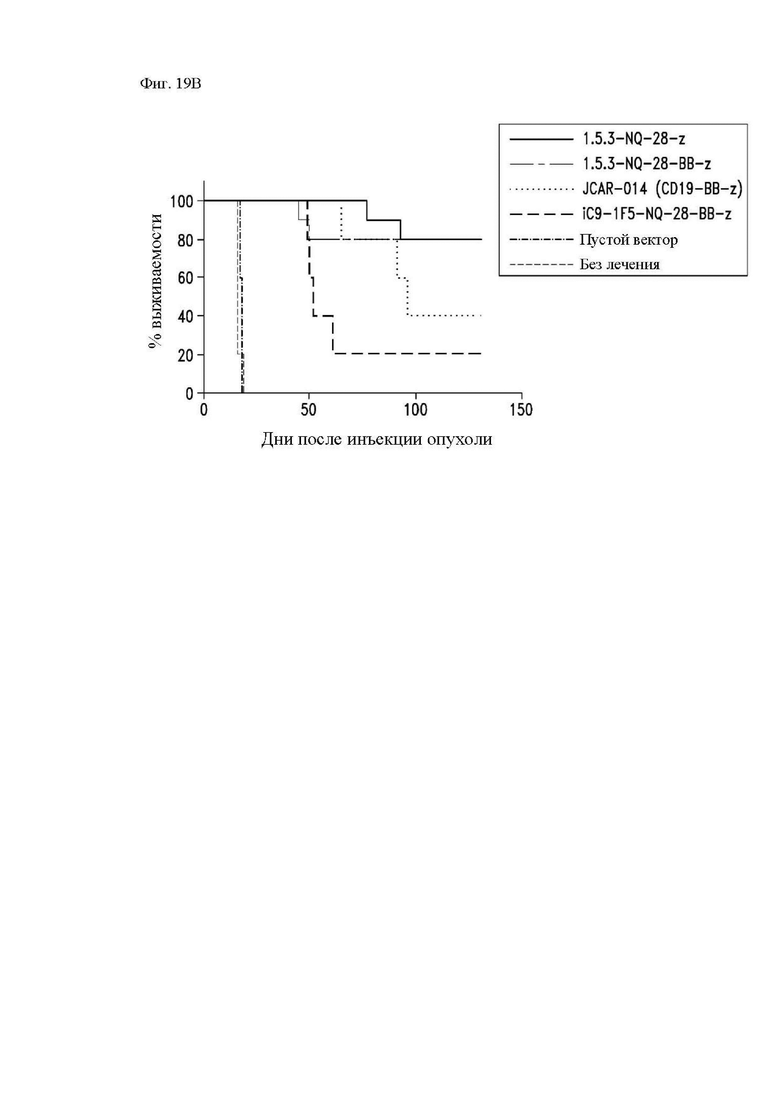
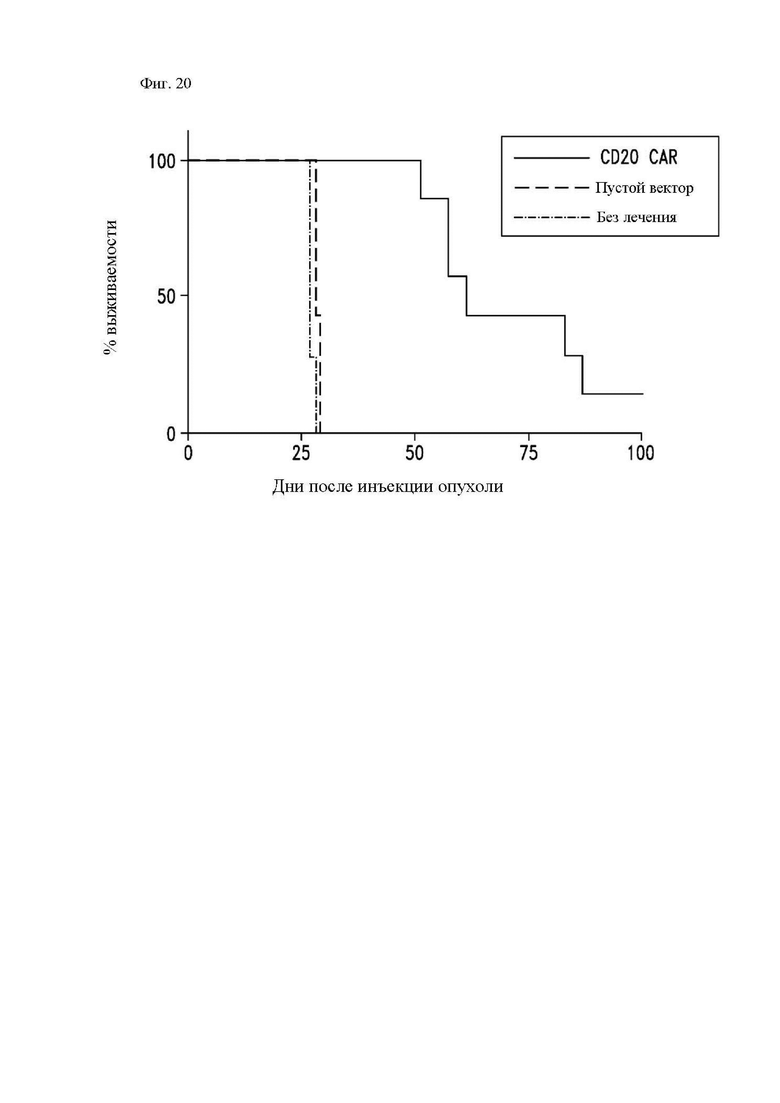
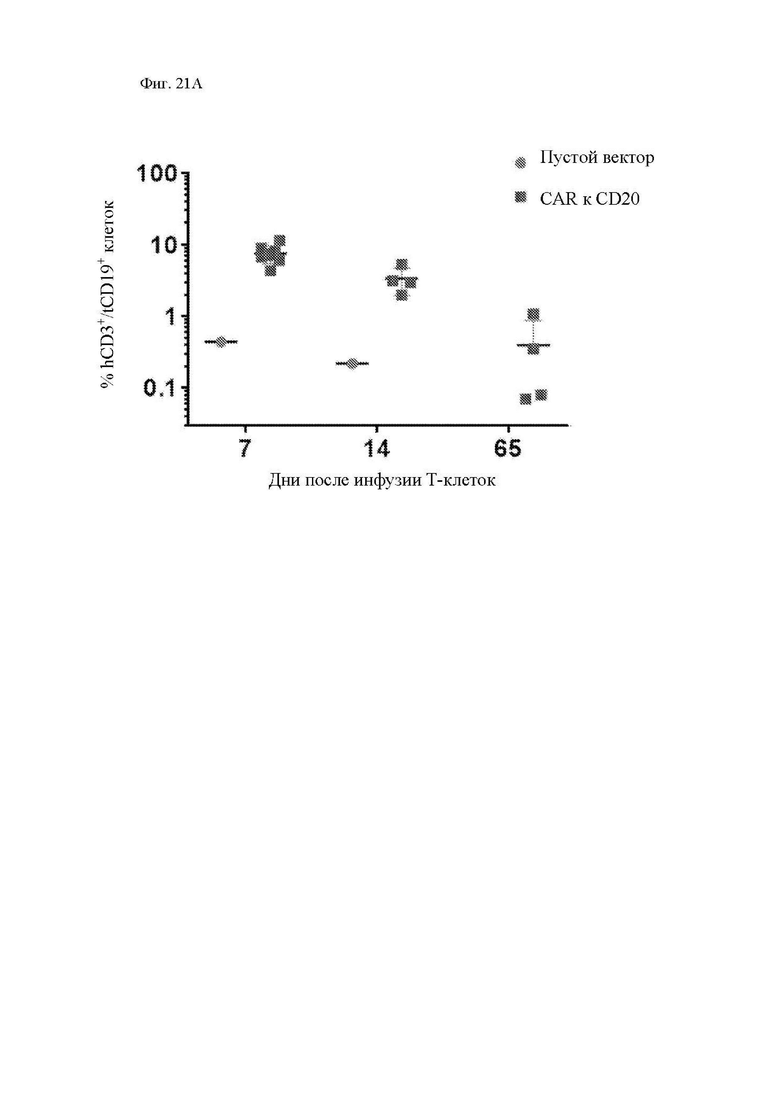
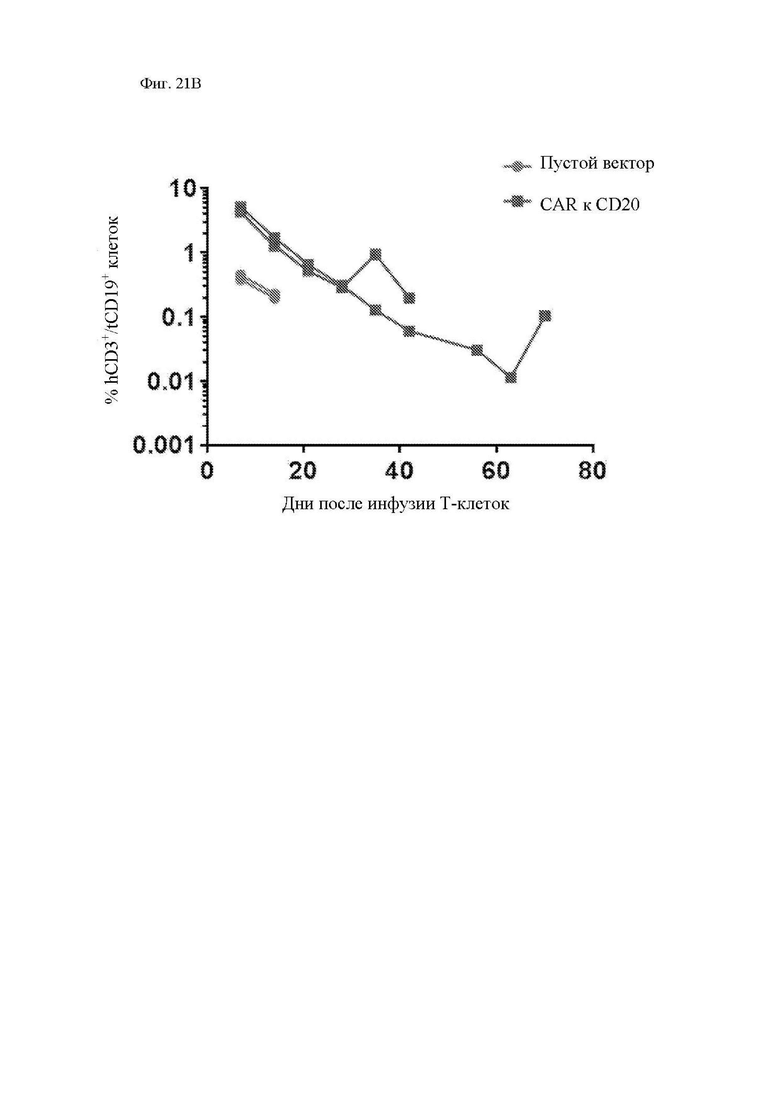
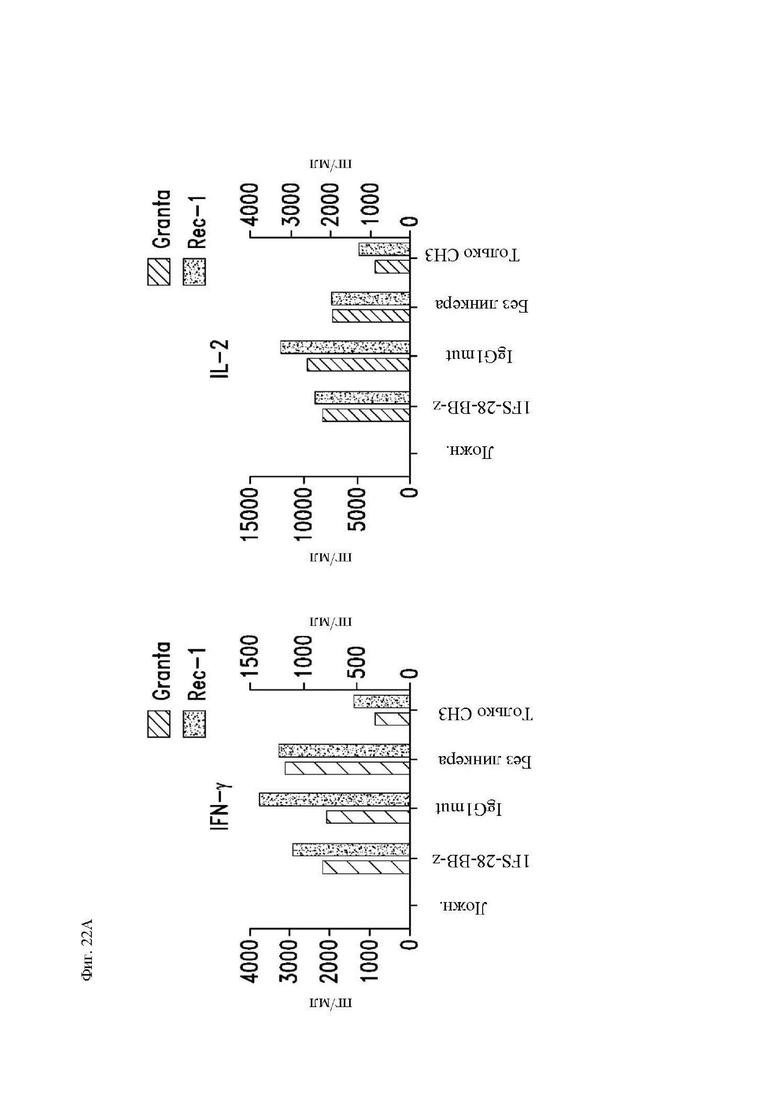

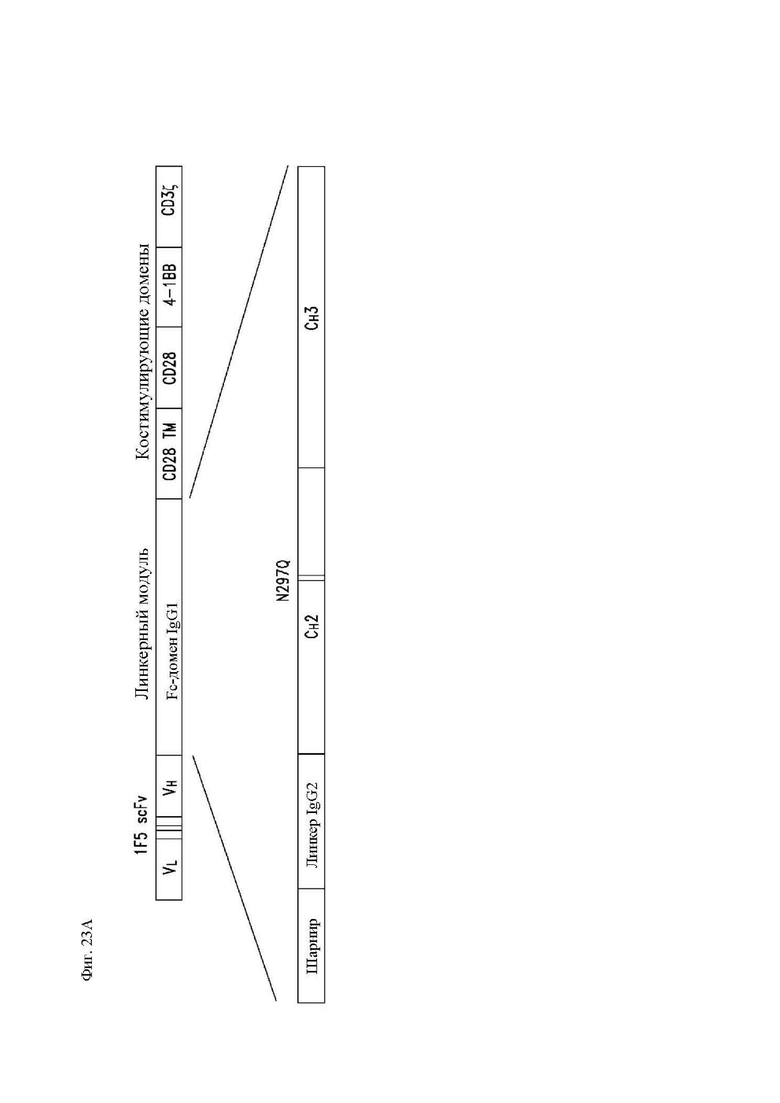

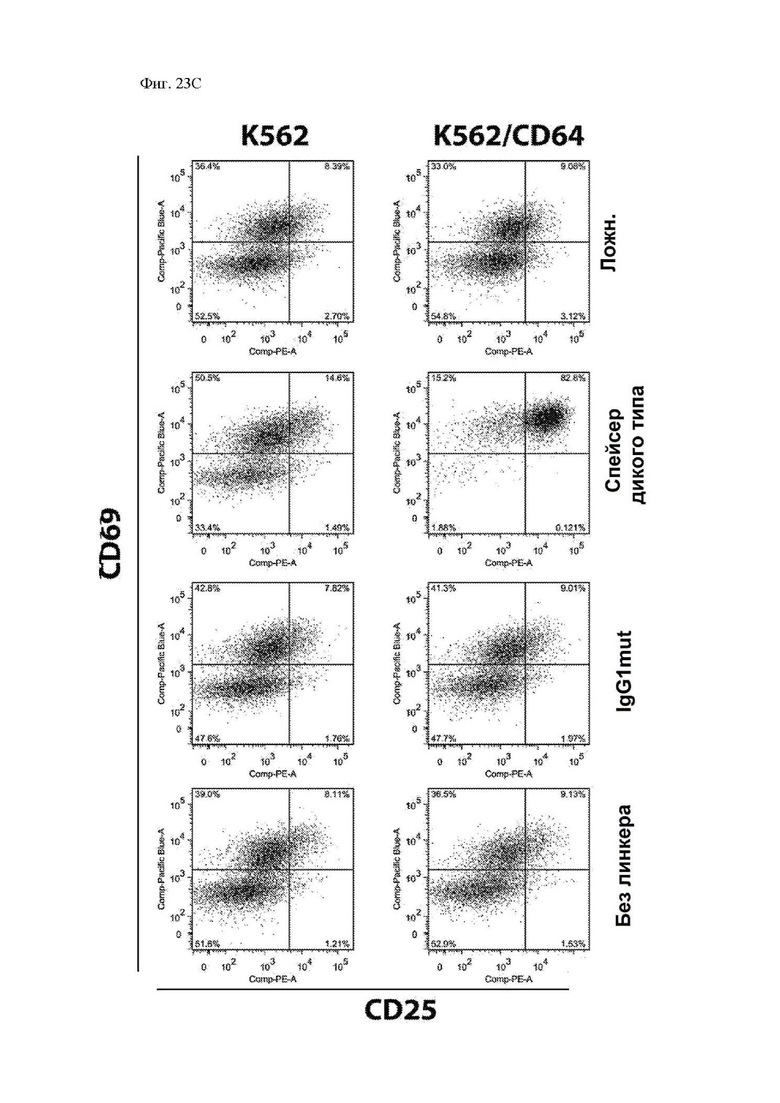
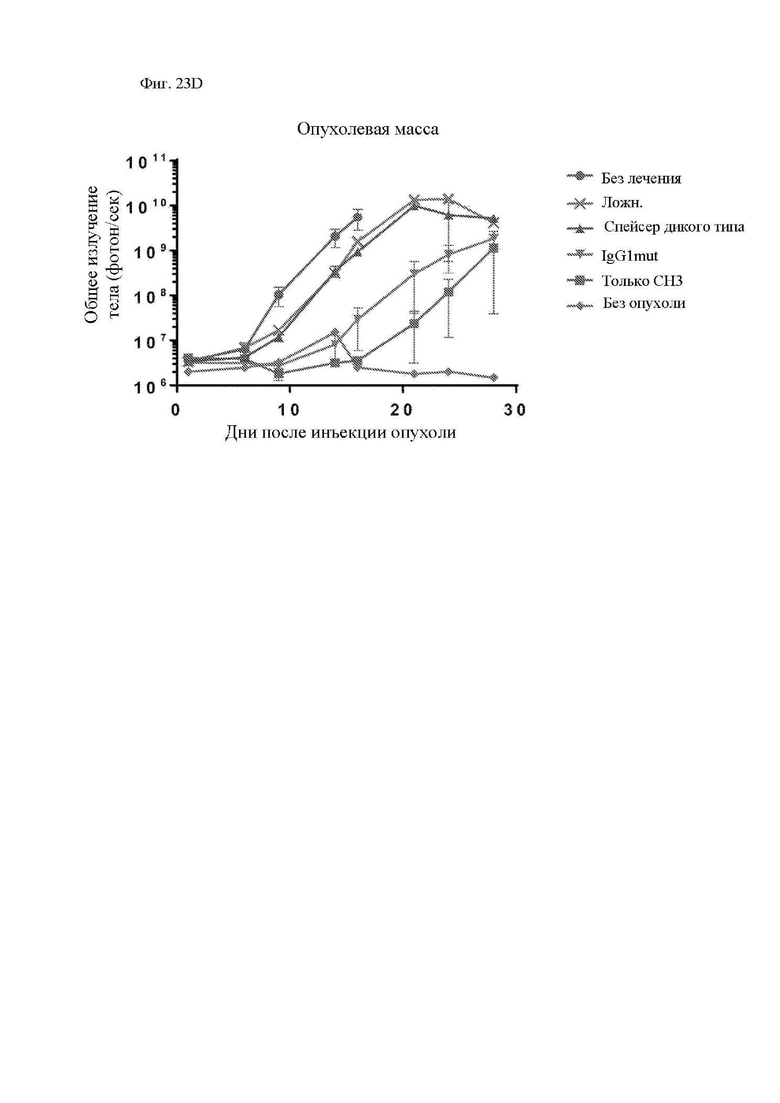
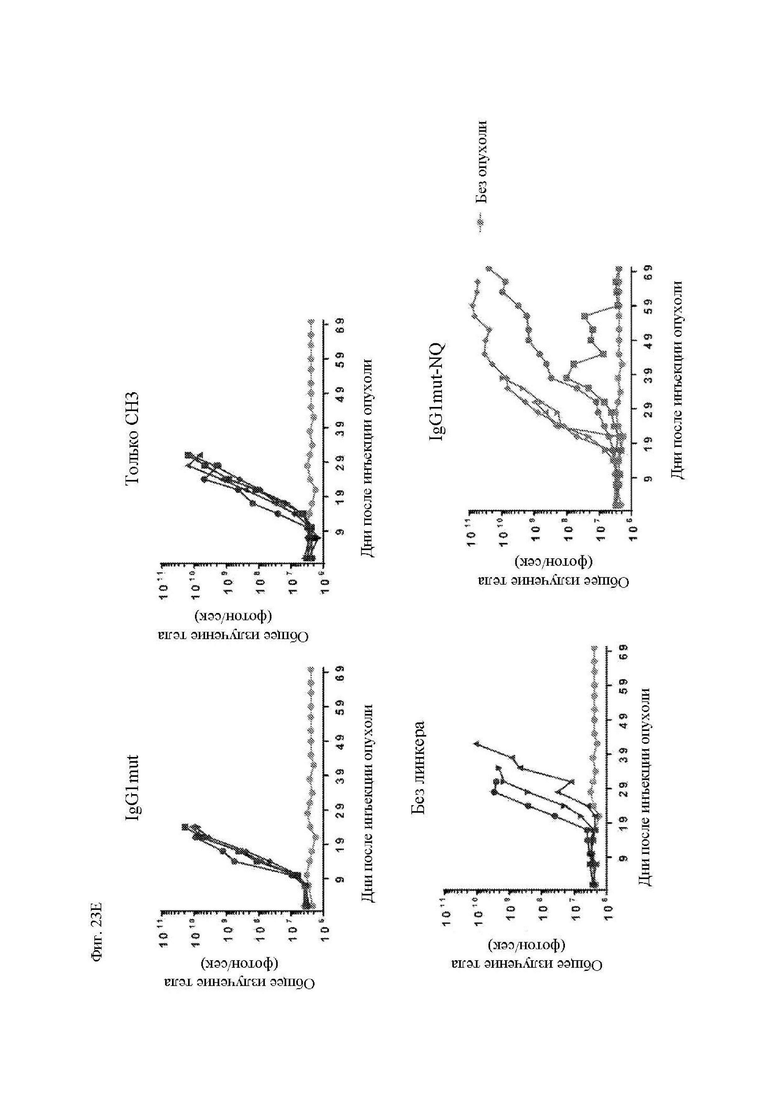
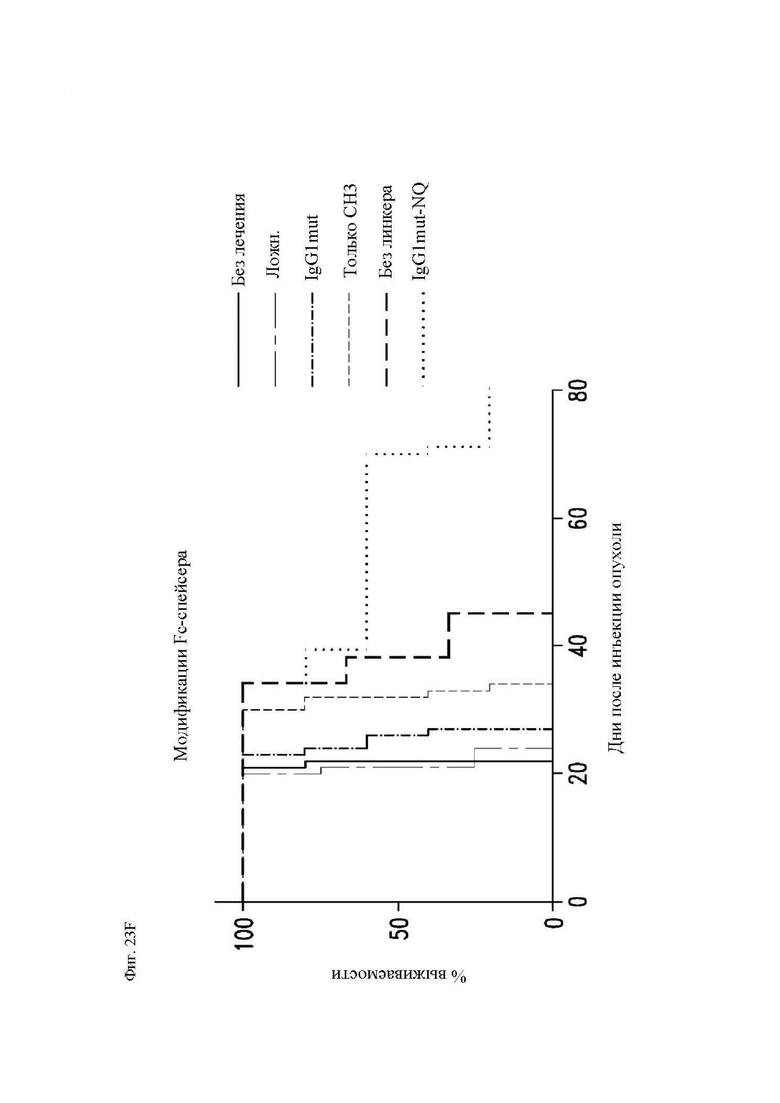
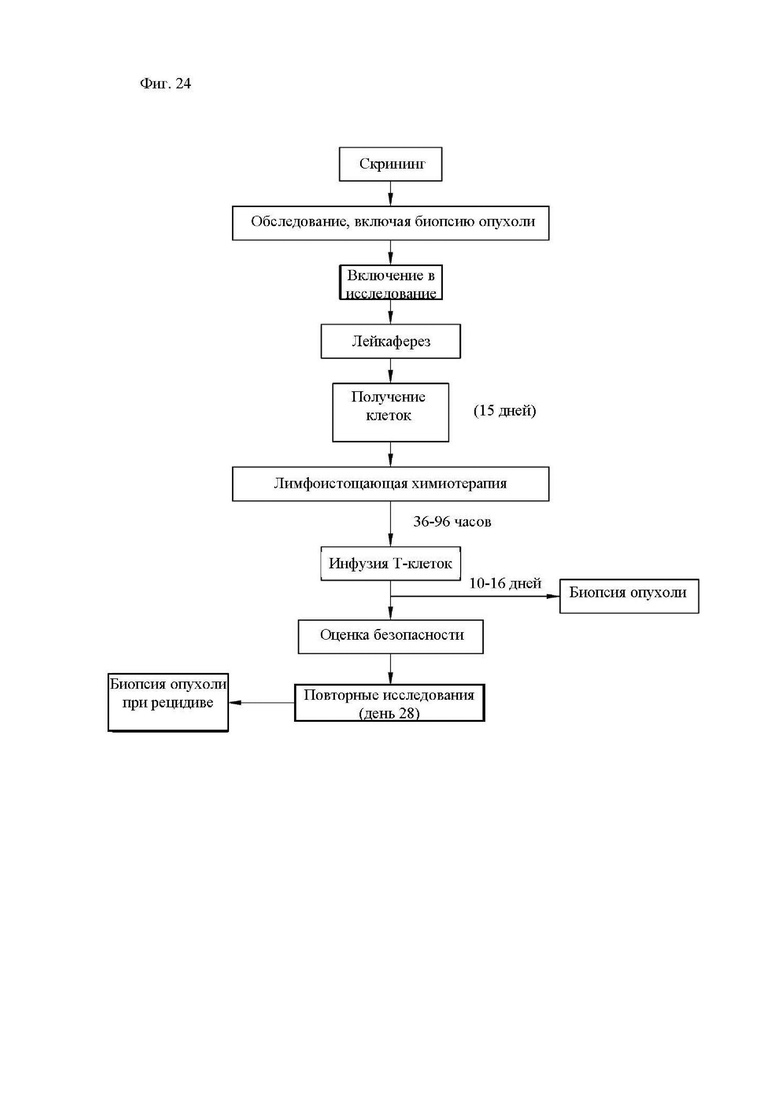
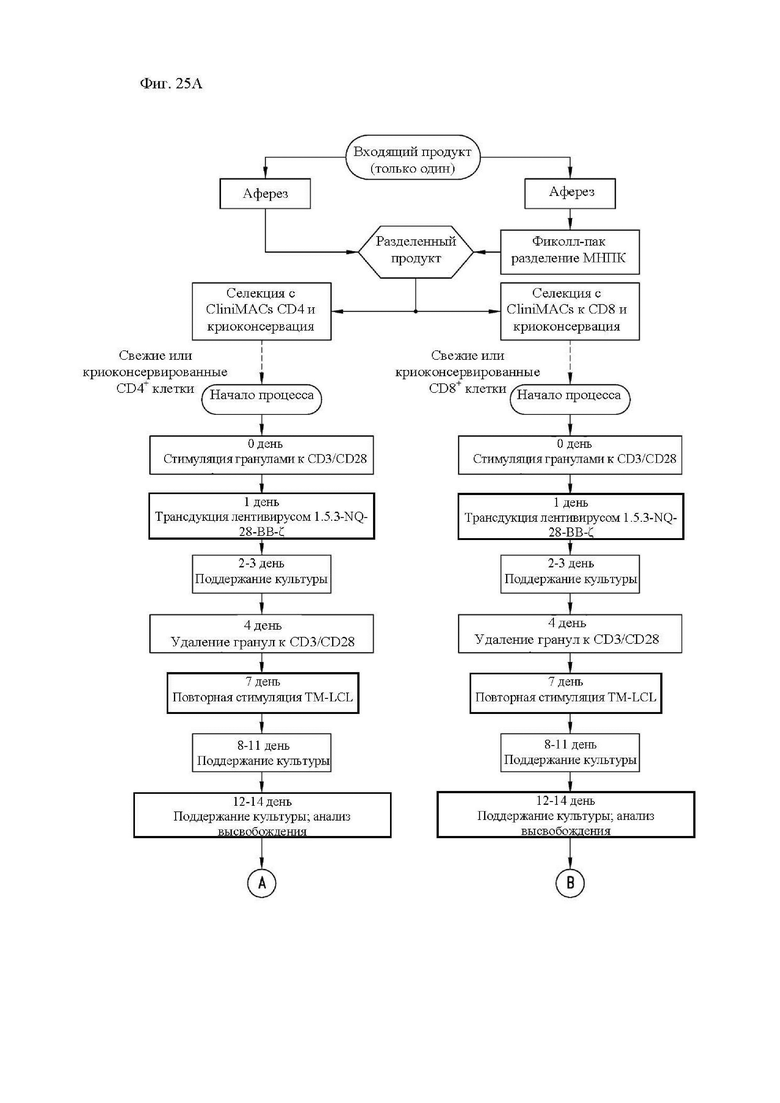
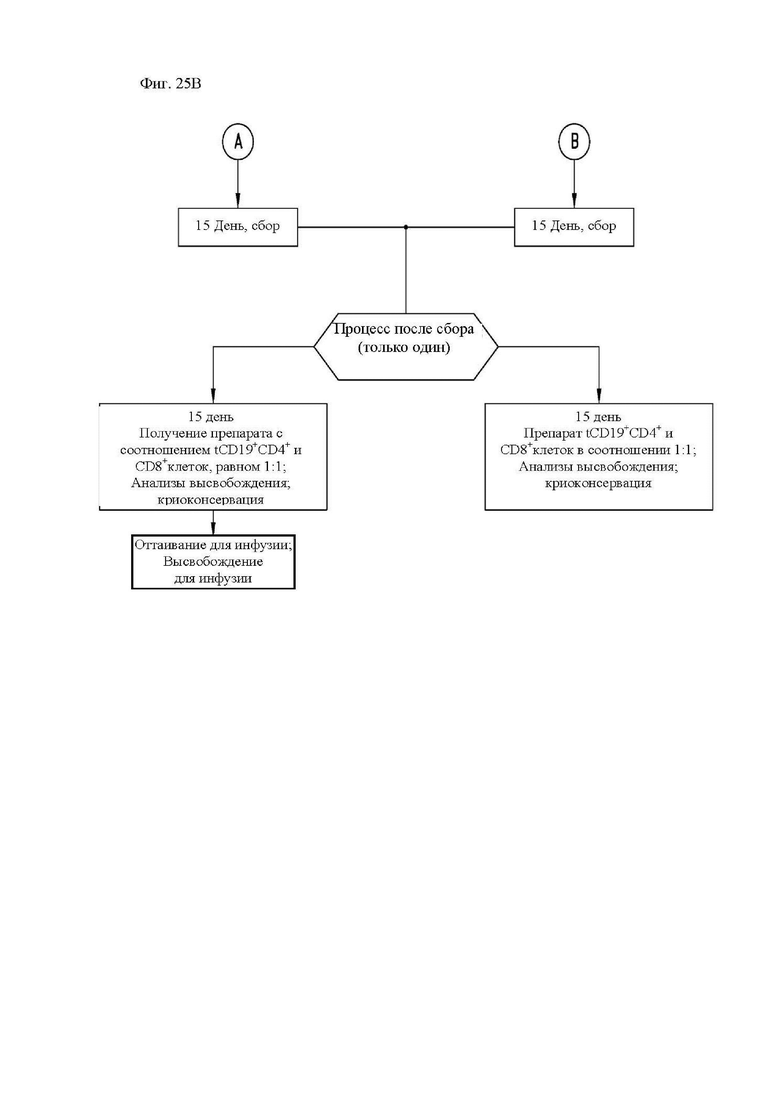
Изобретение относится к области биотехнологии, конкретно к получению полинуклеотида, кодирующего химерный антигенный рецептор (CAR), и может быть использовано для лечения рака, характеризующегося экспрессией CD20. Предложен полинуклеотид, содержащий полинуклеотидную последовательность, кодирующую CAR с SEQ ID NO:26, способный специфично связывать CD20. Иммунную клетку-хозяин, содержащую указанный полинуклеотид и способную экспрессировать кодируемый CAR, используют в составе композиций и комбинаций для лечения рака, экспрессирующего CD20. Изобретение обеспечивает активацию Т-клеток, презентирующих CAR к CD20, в присутствии антител к CD20. 12 н. и 62 з.п. ф-лы, 25 ил., 2 табл., 15 пр.
1. Выделенный полинуклеотид, содержащий полинуклеотидную последовательность, кодирующую химерный антигенный рецептор (CAR), способный специфично связывать CD20, где CAR содержит аминокислотную последовательность SEQ ID NO:26 или состоит из аминокислотной последовательности SEQ ID NO:26, где полинуклеотид:
(a) по меньшей мере на 60% идентичен полинуклеотидной последовательности SEQ ID NO:53;
(b) по меньшей мере на 60% идентичен полинуклеотидной последовательности
SEQ ID NO:44;
(c) содержит полинуклеотидную последовательность SEQ ID NO:53;
(d) содержит полинуклеотидную последовательность SEQ ID NO:44;
(e) состоит из полинуклеотидной последовательности SEQ ID NO:53; или
(f) состоит из полинуклеотидной последовательности SEQ ID NO:44.
2. Выделенный полинуклеотид по п. 1, который по меньшей мере на 70% идентичен полинуклеотидной последовательности SEQ ID NO:44 или 53.
3. Выделенный полинуклеотид по п. 1 или 2, который по меньшей мере на 75% идентичен полинуклеотидной последовательности SEQ ID NO:44 или 53.
4. Выделенный полинуклеотид по любому из пп. 1-3, который по меньшей мере на 80% идентичен полинуклеотидной последовательности SEQ ID NO:44 или 53.
5. Выделенный полинуклеотид по любому из пп. 1-4, который по меньшей мере на 85% идентичен полинуклеотидной последовательности SEQ ID NO:53 или 44.
6. Выделенный полинуклеотид по любому из пп. 1-5, который по меньшей мере на 90% идентичен полинуклеотидной последовательности SEQ ID NO:44 или 53.
7. Выделенный полинуклеотид по любому из пп. 1-6, который по меньшей мере на 95% идентичен полинуклеотидной последовательности SEQ ID NO:44 или 53.
8. Выделенный полинуклеотид по любому из пп. 1-7, который содержит полинуклеотидную последовательность SEQ ID NO:44 или состоит из полинуклеотидной последовательности SEQ ID NO:44.
9. Выделенный полинуклеотид по любому из пп. 1-8, который содержит полинуклеотидную последовательность SEQ ID NO:53 или состоит из полинуклеотидной последовательности SEQ ID NO:53.
10. Выделенный полинуклеотид по любому из пп. 1-9, кодирующий SEQ ID NO:35.
11. Экспрессионный вектор, содержащий полинуклеотид по любому из пп. 1-10.
12. Экспрессионный вектор по п. 11, где экспрессионный вектор представляет собой вирусный вектор.
13. Экспрессионный вектор по п. 12, где вирусный вектор представляет собой лентивирусный вектор.
14. Химерный антигенный рецептор (CAR), способный специфично связывать CD20, кодируемый полинуклеотидом по любому из пп. 1-10.
15. CAR по п. 14, который:
(a) содержит зрелый CAR, содержащий аминокислотную последовательность SEQ ID NO: 35 с удаленным маркером трансдукции tCD19;
(b) состоит из зрелого CAR, содержащего аминокислотную последовательность SEQ ID NO: 35 с удаленным маркером трансдукции tCD19;
(c) содержит аминокислотную последовательность SEQ ID NO:26; или
(d) состоит из аминокислотной последовательности SEQ ID NO:26.
16. CAR по п. 14 или 15, который содержит аминокислотную последовательность SEQ ID NO:26 или состоит из аминокислотной последовательности SEQ ID NO:26.
17. CAR по любому из пп. 14-16, который состоит из аминокислотной последовательности SEQ ID NO:26.
18. Клетка-хозяин, содержащая полинуклеотид по любому из пп. 1-10 и способная экспрессировать кодируемый CAR, где полинуклеотид функционально связан с последовательностью, контролирующей экспрессию, и где клетка-хозяин представляет собой иммунную клетку.
19. Клетка-хозяин по п. 18, где полинуклеотид является кодон-оптимизированным.
20. Клетка-хозяин по п. 18 или 19, представляющая собой Т-клетку или аутологичную для субъекта Т-клетку.
21. Клетка-хозяин по п. 20, где Т-клетка представляет собой CD8+ T-клетку, CD4+ T-клетку или обе из них.
22. Клетка-хозяин по п. 21, где Т-клетка представляет собой общую популяцию или субпопуляцию Т-клеток.
23. Клетка-хозяин по п. 22, где Т-клетка представляет собой субпопуляцию центральных клеток памяти или центральных клеток памяти и наивных клеток.
24. Клетка-хозяин по любому из пп. 20-23, содержащая человеческие CD4+ T-клетки и человеческие CD8+ T-клетки.
25. Химерный антигенный рецептор (CAR), способный специфично связывать CD20, где CAR содержит аминокислотную последовательность SEQ ID NO:26 или состоит из аминокислотной последовательности SEQ ID NO:26.
26. CD4+ T-клетка, содержащая CAR по п. 25, где CD4+ T-клетка необязательно является человеческой.
27. Клетка-хозяин по любому из пп. 18-24 или CD4+ T-клетка по п. 26, где клетка-хозяин или CD4+ T-клетка дополнительно содержит гетерологичный полинуклеотид, кодирующий суицидальный маркер трансдукции.
28. Клетка-хозяин или CD4+ T-клетка по п. 27, где суицидальный маркер трансдукции содержит усеченный полипептид EGFR.
29. Клетка-хозяин или CD4+ T-клетка по п. 28, где усеченный полипептид EGFR содержит аминокислотную последовательность SEQ ID NO: 25.
30. Клетка-хозяин или CD4+ T-клетка по п. 27, где суицидальный маркер трансдукции содержит усеченный полипептид CD19.
31. Клетка-хозяин или CD4+ T-клетка по п. 30, где усеченный полипептид CD19 содержит аминокислотную последовательность SEQ ID NO: 24.
32. Комбинация для лечения рака, экспрессирующего CD20, содержащая эффективное количество человеческих CD4+ T-клеток по любому из пп. 26-31 и человеческих CD8+ T-клеток, содержащих CAR по п. 25.
33. Композиция для лечения рака, экспрессирующего CD20, содержащая эффективное количество клетки-хозяина по любому из пп. 18-24 и 27-31 или CD4+ T-клетки по любому из п.п. 26-31.
34. Композиция для лечения рака, экспрессирующего CD20, содержащая эффективное количество клетки-хозяина по любому из пп. 18-24 и 27-31, CD4+ T-клетки по любому из пп. 26-31 или комбинации по п. 32, и CD20-специфичного антитела или его антигенсвязывающего фрагмента.
35. Композиция по п. 34, где антитело включает 1.5.3, 1F5, Leu16, ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, ублитуксимаб или любую их комбинацию.
36. Композиция по любому из пп. 33-35, дополнительно содержащая фармацевтически приемлемый носитель, эксципиент или разбавитель.
37. Комбинация по п. 32 или композиция по любому из пп. 33-36, содержащая CAR-экспрессирующие CD4+ T-клетки и CAR-экспрессирующие CD8+ T-клетки, где CAR экспрессирующие CD4+ T-клетки и CAR-экспрессирующие CD8+ T-клетки присутствуют в соотношении от 3:1 до 1:1.
38. Комбинация по п. 32 или композиция по любому из пп. 33-36, содержащая CAR-экспрессирующие CD4+ T-клетки и CAR-экспрессирующие CD8+ T-клетки, где CAR-экспрессирующие CD4+ T-клетки и CAR-экспрессирующие CD8+ T-клетки присутствуют в соотношении от 1:1 до 1:3.
39. Комбинация по п. 32 или композиция по любому из пп. 33-36, содержащая CAR-экспрессирующие CD4+ T-клетки и CAR-экспрессирующие CD8+ T-клетки, где CAR-экспрессирующие CD4+ T-клетки и CAR-экспрессирующие CD8+ T-клетки присутствуют в соотношении 1:1.
40. Комбинация по любому из пп. 32 и 37-39 или композиция по любому из пп. 33-39, содержащая до 106, до 107, до 108, до 109 или более чем 1010 модифицированных T-клеток.
41. Комбинация по п. 40 или композиция по п. 40, содержащая до 106, до 107 или до 108 модифицированных T-клеток.
42. Комбинация по любому из пп. 32 и 37-41 или композиция по любому из пп. 33-41, где CD4+ T-клетки, CD8+ T-клетки или и те, и те были модифицированы ex vivo с помощью вирусного вектора, чтобы они кодировали CD20-специфичные CAR, где, необязательно, вирусный вектор включает лентивирусный вектор.
43. Комбинация по любому из пп. 32 и 37-42 или композиция по любому из пп. 33-42, содержащая: общую популяцию CD4+ T-клеток, общую популяцию CD8+ T-клеток, центральные CD4+ Т-клетки памяти, центральные CD8+ Т-клетки памяти или комбинацию центральных CD4+ Т-клеток памяти (TCM) и наивных CD4+ Т-клеток (TN).
44. Способ лечения рака, экспрессирующего CD20, у субъекта, включающий введение субъекту эффективного количества клетки-хозяина по любому из пп. 18-24 и 27-31, CD4+ T-клетки по любому из пп. 26-31, комбинации по любому из пп. 32 и 37-43 или композиции по любому из пп. 33-43.
45. Применение эффективного количества клетки-хозяина по любому из пп. 18-24 и 27-31, CD4+ T-клетки по любому из пп. 26-31, комбинации по любому из пп. 32 и 37-43 или композиции по любому из пп. 33-43 в способе лечения рака, экспрессирующего CD20, у субъекта.
46. Способ по п. 44 или применение по п. 45, где Т-клетка, CD4+ T-клетка и/или CD8+ T-клетка является аутологичной, аллогенной или сингенной для субъекта.
47. Способ по п. 44 или 46 или применение по п. 45 или 46, где способ снижает число В-клеток у субъекта, и/или рак, экспрессирующий CD20, связан с нарушенной активностью В-клеток.
48. Комбинация по любому из пп. 32 и 37-43, композиция по любому из пп. 33-43, способ по любому из пп. 44 и 46-47 или применение по любому из пп. 45-47, где рак, экспрессирующий CD20, представляет собой В-клеточную лимфому или лейкоз, такие как В-клеточная неходжкинская лимфома (НХЛ) (включая лимфому Беркитта, хронический лимфоцитарный лейкоз (ХЛЛ), острый лимфобластный лейкоз (ОЛЛ), лимфому центральной нервной системы, мелкоклеточную лимфоцитарную лимфому (МЛЛ), диффузную В-крупноклеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, В-лимфобластный лейкоз из клеток-предшественников и мантийноклеточную лимфому), волосатоклеточный лейкоз, макроглобулинемия Вальденстрема, B-клеточный пролимфоцитарный лейкоз, лимфома из CD37+ дендритных клеток, лимфоплазмоцитарная лимфома, лимфома маргинальной зоны селезенки, экстранодальная В-клеточная лимфома маргинальной зоны лимфоидной ткани, ассоциированной со слизистыми оболочками (MALT), узловая В-клеточная лимфома маргинальной зоны, медиастинальная (тимическая) В-крупноклеточная лимфома, внутрисосудистая В-крупноклеточная лимфома и первичная эффузионная лимфома; множественную миелому, меланому, множественную миелому стволовых клеток, плазмоклеточную миелому, солитарную плазмоцитому кости, экстраоссальную плазмоцитому, В-клеточные пролиферации с неопределенным злокачественным потенциалом, лимфогранулематоз, меланому стволовых клеток или посттрансплантационное лимфопролиферативное расстройство.
49. Способ по любому из пп. 44 и 46-48 или применение по любому из пп. 45-48, где субъект предварительно получал лечение CD20-специфичным антителом или антигенсвязывающим фрагментом, необязательно где указанное CD20-специфичное антитело или антигенсвязывающий фрагмент включает 1.5.3, 1F5, Leu16, ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, ублитуксимаб или любую их комбинацию.
50. Способ по любому из пп. 44 и 46-49 или применение по любому из пп. 45-49, где способ включает введение эффективного количества CD20-специфичного антитела или антигенсвязывающего фрагмента параллельно с, одновременно с или после введения клетки-хозяина.
51. Способ по п. 50 или применение по п. 50, где антитело выбрано из группы, состоящей из 1.5.3, 1F5, Leu16, ритуксимаба, офатумумаба, окрелизумаба, велтузумаба и ублитуксимаба или любой их комбинации.
52. Комбинация по любому из пп. 32 и 37-43, композиция по любому из пп. 33-43, способ по любому из пп. 44 и 46-51 или применение по любому из пп. 45-51, где рак, экспрессирующий CD20, представляет собой неходжкинскую лимфому (НХЛ), хронический лимфоцитарный лейкоз (ХЛЛ), диффузную В-крупноклеточную лимфому (ДВККЛ), фолликулярную лимфому (ФЛ), мантийноклеточную лимфому (МКЛ), макроглобулинемию Вальденстрема или любую их комбинацию.
53. Комбинация по любому из пп. 32 и 37-43, композиция по любому из пп. 33-43, способ по любому из пп. 44 и 46-52 или применение по любому из пп. 45-52, где рак, экспрессирующий CD20, представляет собой неходжкинскую лимфому (НХЛ), хронический лимфоцитарный лейкоз (ХЛЛ) или и то, и другое.
54. Комбинация по любому из пп. 32 и 37-43, композиция по любому из пп. 33-43, способ по любому из пп. 44 и 46-52 или применение по любому из пп. 45-52, где рак, экспрессирующий CD20, связан с нарушенной активностью В-клеток.
55. Комбинация по любому из пп. 32 и 37-43, композиция по любому из пп. 33-43, способ по любому из пп. 44 и 46-52 или применение по любому из пп. 45-52, где рак, экспрессирующий CD20, представляет собой лейкоз или лимфому.
56. Способ по любому из пп. 44 и 46-55 или применение по любому из пп. 45-55, где способ включает введение CAR-экспрессирующих CD4+ T-клеток и CAR-экспрессирующих CD8+ T-клеток в соотношении 1:1, где T-клетки вводят в дозе 1×105 T-клеток на кг массы тела субъекта.
57. Способ по любому из пп. 44 и 46-55 или применение по любому из пп. 45-55, где способ включает введение CAR-экспрессирующих CD4+ T-клеток и CAR-экспрессирующих CD8+ T-клеток в соотношении 1:1, где T-клетки вводят в дозе 3,3×105 T-клеток на кг массы тела субъекта.
58. Способ по любому из пп. 44 и 46-55 или применение по любому из пп. 45-55, где способ включает введение CAR-экспрессирующих CD4+ T-клеток и CAR- экспрессирующих CD8+ T-клеток в соотношении 1:1, где T-клетки вводят в дозе 1×106 T-клеток на кг массы тела субъекта.
59. Способ по любому из пп. 44 и 46-55 или применение по любому из пп. 45-55, где способ включает введение CAR-экспрессирующих CD4+ T-клеток и CAR-экспрессирующих CD8+ T-клеток в соотношении 1:1, где T-клетки вводят в дозе 3,3×106 T-клеток на кг массы тела субъекта.
60. Способ по любому из пп. 44 и 46-55 или применение по любому из пп. 45-55, где способ включает введение CAR-экспрессирующих CD4+ T-клеток и CAR-экспрессирующих CD8+ T-клеток в соотношении 1:1, где T-клетки вводят в дозе 1×107 T-клеток на кг массы тела субъекта.
61. Способ по любому из пп. 44 и 46-60 или применение по любому из пп. 45-60, где субъект предварительно получал лечение: (a) CD20-специфичным антителом; или (b) химиотерапевтическим агентом.
62. Способ по п. 61 или применение по п. 61, где CD20-специфичное антитело включает ритуксимаб, офатумумаб, окрелизумаб, ублитуксимаб, велтузумаб или любую их комбинацию.
63. Способ по п. 62 или применение по п. 62, где химиотерапевтический агент включает циклофосфамид, флударабин, циклофосфамид и флударабин, CHOP, CHOP-R, CHOEP или CHOEP-R.
64. Способ по любому из пп. 44 и 46-63 или применение по любому из пп. 45- 63, где рак, экспрессирующий CD20, является рецидивировавшим или рефрактерным к по меньшей мере одной предшествующей схеме терапии.
65. Способ по любому из пп. 44 и 46-64 или применение по любому из пп. 45-64, где способ дополнительно включает осуществление лимфоистощающей химиотерапии в отношении субъекта до введения клетки-хозяина, CD4+ T-клетки, комбинации или композиции.
66. Способ по п. 65 или применение по п. 65, в котором лимфоистощающая химиотерапия включает циклофосфамид.
67. Способ, включающий введение полинуклеотида, кодирующего CAR по п. 25, в интересующую клетку-хозяина.
68. Способ по п. 67, где полинуклеотид содержится в векторе.
69. Способ по п. 68, где вектор включает вирусный вектор.
70. Способ по п. 69, где вирусный вектор включает лентивирусный вектор или ретровирусный вектор.
71. Способ по любому из пп. 67-70, где клетка-хозяин включает иммунную клетку.
72. Способ по п. 71, где иммунная клетка включает T-клетку.
73. Способ по п. 72, где T-клетка включает CD4+ T-клетку, CD8+ T-клетку, наивную T-клетку, стволовую Т-клетку памяти, центральную или эффекторную Т-клетку памяти или любую их комбинацию.
74. Способ по любому из пп. 67-73, где полинуклеотид представляет собой полинуклеотид по любому из пп. 1-10.
| WO 2000023573 А2, 27.04.2000 | |||
| BUDDE L.E | |||
| et al., Combining a CD20 chimeric antigen receptor and an inducible caspase 9 suicide switch to improve the efficacy and safety of T cell adoptive immunotherapy for lymphoma, PloS one, 2013, v.8, n.12, p.e82742 | |||
| WO 2006130458 А2, 07.12.2006 | |||
| ЛИКАРЬ Ю.Н | |||
| и др., Использование мутированного варианта |
Авторы
Даты
2022-11-01—Публикация
2017-03-17—Подача