Область изобретения
Изобретение касается химерных антигенных рецепторов (CAR). CAR способны перенаправлять специфичность и реакционную способность иммунной клетки по отношению к выбранной цели, используя свойства лигандсвязывающего домена. В частности, изобретение касается CAR, которые специфически связываются с вариантом III рецептора эпидермального фактора роста (EGFRvIII-специфические CAR). Изобретение, кроме того, касается полинуклеотидов, кодирующих EGFRvIII-специфический CAR, и выделенных клеток, экспресирующих EGFRvIII-специфические CAR на их поверхности. Изобретение, кроме того, касается способов конструирования иммунных клеток, экспресирующих EGFRvIII-специфические CAR на их поверхности. Изобретение особенно полезно для лечения солидных опухолей, таких как мультиформная глиобластома (GBM), немелкоклеточный рак легкого, рак головы и шеи, рак молочной железы, рак яичников и рак предстательной железы. Изобретение, кроме того, касается иммунных клеток, содержащих EGFRvIII-специфические CAR (EGFRvIII-специфические CAR-T клетки), композиций, содержащих EGFRvIII-специфические CAR-T клетки, и способов применения EGFRvIII-специфических CAR-T клеток для лечения патологий, опосредованных EGFRvIII.
Уровень техники
EGFR вариант III (EGFRvIII), опухолеспецифический мутант EGFR, является продуктом геномной перегруппировки, который часто ассоциируется с амплификацией гена EGFR немутантного типу. EGFRvIII образуется путем делеция внутри рамки считывания экзонов 2-7, что приводит к делеции 267 аминокислот с замещением глицина в точке соединения. Усеченный рецептор теряет способность связывать лиганды, но приобретает конститутивную активность киназы. Интересно, что EGFRvIII всегда со-экспрессирует полноразмерный EGFR немутантного типа в таких же опухолевых клетках. Более того, экспресирующие EGFRvIII клетки демонстрируют повышенную пролиферацию, инвазию, ангиогенез и устойчивость к апоптозу.
EGFRvIII чаще всего встречается в мультиформной глиобластоме (GBM). Предполагается, что 25-35% GBM несет данные усеченные рецепторы. Более того, часто экспрессия часто отражает более агрессивный фенотип и плохой прогноз. Помимо GBM, также сообщалось об экспрессии EGFRvIII в других твердых опухолях, таких как немелкоклеточный рак легкого, рак головы и шеи, рак молочной железы, рак яичников и рак предстательной железы. Напротив, EGFRvIII не экспрессируется в здоровых тканях. Отсутствие экспрессии в нормальных тканях делает EGFRvIII идеальной мишенью для развития опухолеспецифической целевой терапии.
Адоптивный перенос Т клетки, генетически модифицированных для распознавания ассоциированных с злокачественными состояниями антигенов, показала себя перспективной как новый подход к лечению рака (смотрите, например, Brenner et al., Current Opinion in Immunology, 22(2): 251-257 (2010); Rosenberg et al., Nature Reviews Cancer, 8(4): 299-308 (2008)). Т-клетки могут быть генетически модифицированными для того, чтобы экспрессировать химерные антигенные рецепторы (CAR), которые представляют собой слитые белки, состоящие из фрагмента распознавания антигена и доменов активации Т-клеток (смотрите, например, Eshhar et al., Proc. Natl. Acad. Sci. USA, 90(2): 720-724 (1993), и Sadelain et al., Curr. Opin. Immunol, 21(2): 215-223 (2009)). Соответственно, лечение солидной опухоли, такой как мультиформная глиобластома, с использованием анти-EGFRvIII антагониста, включающего EGFRvIII-специфические CAR и EGFRvIII-специфические CAR-T клетки, будет сделано обещающим терапевтическим агентом.
Соответственно, лечение солидной опухоли, такой как мультиформная форма глиобластомы, с использованием антагониста EGFRvIII, включающего специфические CARF-клетки EGFRvIII и специфические CARF-клетки EGFRvIII, сделает перспективный терапевтический агент.
Сущность изобретения
Предусмотренными являются химерные антигенные рецепторы (CAR), которые связываются с EGFRvIII. Предусмотрено, что определенные EGFRvIII-специфические CAR являются эффективными при экспрессии в Т-клетках для активации Т-клеток при контакте с EGFRvIII. Предпочтительно, EGFRvIII-специфические CAR, предусмотренные в данном документе, связывают человеческий EGFRvIII. Кроме того, предпочтительно, EGFRvIII-специфические CAR-T клетки, предусмотренные в данном документе, демонстрируют активность дегрануляции, увеличенное продуцирование интерферона гамма и/или цитотоксическую активность при контакте с EGFRvIII-экспресирующими клетками.
В одном аспекте, изобретение предусматривает EGFRvIII-специфический CAR, содержащий внеклеточный связывающий лиганд домен, первый трансмембранный домен, и внутриклеточный сигнальный домен, где внеклеточный связывающий лиганд домен включает (а) вариабельную область тяжелой цепи (VH), содержащую (i) VH область один, определяющую комплементарность, (CDR1), содержащую последовательность, показанную в SEQ ID NO: 62, 63, 64, 74, 75, 76, 80, 81, 82, 88, 89, 90, 109, 110, 111, 115, 116, 117, 121, 122, 123, 137, 138, или 139; (ii) VH CDR2, содержащую последовательность, показанную в SEQ ID NO: 70, 71, 77, 78, 83, 84, 86, 87, 91, 92, 112, 113, 118, 119, 124, 125, 127, 128, 140, или 141; и iii) VH CDR3, содержащую последовательность, показанную в SEQ ID NO: 73, 79, 85, 114, 120, 126, 129, или 142, и/или (b) вариабельную область легкой цепи (VL), содержащую (i) VL CDR1, содержащую последовательность, показанную в SEQ ID NO: 149, 156, 159, 162, 165, 182, 185, 187, или 195; (ii) VL CDR2, содержащую последовательность, показанную в SEQ ID NO: 152, 157, 160, 163, 183, 186, 188, или 196; и (iii) VL CDR3, содержащую последовательность, показанную в SEQ ID NO: 153, 158, 161, 164, 184, 189, или 197.
В другом аспекте, изобретение предусматривает EGFRvIII-специфический CAR, содержащий внеклеточный связывающий лиганд домен, первый трансмембранный домен, и внутриклеточный сигнальный домен, где внеклеточный связывающий лиганд домен включает одноцепочечный Fv-фрагмент (scFv), содержащий вариабельную область тяжелой цепи (VH), содержащую три CDR из VH области, содержащие последовательность, показанную в SEQ ID NO: 5, 9, 11, 13, 15, 37, 39, 41, 43, или 48; и/или вариабельную область легкой цепи (VL), содержащую три CDR из VL области, содержащих последовательность, показанную в SEQ ID NO: 6, 10, 12, 14, 16, 38, 40, 42, или 49. В некоторых вариантах осуществления, VH область может содержать последовательность, показанную в SEQ ID NO: 5, 9, 11, 13, 15, 37, 39, 41, 43, или 48, или ее вариант с одним или несколькими консервативными аминокислотными замещениями в остатках, которые не находятся в пределах CDR, и/или VL область может содержать аминокислотную последовательность, показанную в SEQ ID NO: 6, 10, 12, 14, 16, 38, 40, 42, или 49, или ее вариант с одним или несколькими аминокислотными замещениями в аминокислоте, которые не находятся в пределах CDR. Например, в некоторых вариантах осуществления, VH или VL область scFv может содержать аминокислотную последовательность, описанную выше или ее вариант, с не больше, чем 10, 9, 8, 7, 6, 5, 4, 3, 2, или 1 консервативными замещениями в остатках, которые не находятся в пределах CDR.
В некоторых вариантах осуществления, изобретение предусматривает EGFRvIII-специфический CAR, содержащий внеклеточный связывающий лиганд домен, первый трансмембранный домен, и внутриклеточный сигнальный домен, где внеклеточный связывающий лиганд домен включает одноцепочечный Fv-фрагмент (scFv), содержащий вариабельную область тяжелой цепи (VH) содержащую последовательность, показанную в SEQ ID NO: 11, 15, 30, 37, или 41; и/или вариабельную область легкой цепи (VL), содержащую последовательность, показанную в SEQ ID NO: 12, 16, 31, 38, или 42. В некоторых вариантах осуществления, VH включает последовательность, показанную в SEQ ID NO: 11, и VL включает последовательность, показанную в SEQ ID NO: 12. В некоторых вариантах осуществления, VH включает последовательность, показанную в SEQ ID NO: 15, и VL включает последовательность, показанную в SEQ ID NO: 16. В некоторых вариантах осуществления, VH включает последовательность, показанную в SEQ ID NO: 30, и VL включает последовательность, показанную в SEQ ID NO: 31. В некоторых вариантах осуществления, VH включает последовательность, показанную в SEQ ID NO: 37, и VL включает последовательность, показанную в SEQ ID NO: 38. В некоторых вариантах осуществления, VH включает последовательность, показанную в SEQ ID NO: 41, и VL включает последовательность, показанную в SEQ ID NO: 42.
В некоторых вариантах осуществления, внутриклеточный сигнальный домен включает СD3дзета сигнальный домен. В некоторых вариантах осуществления, внутриклеточный сигнальный домен включает 4-1ВВ сигнальный домен. В некоторых вариантах осуществления, CAR может дополнительно включать второй внутриклеточный сигнальный домен. В некоторых вариантах осуществления, второй внутриклеточный сигнальный домен может содержать 4-1ВВ сигнальный домен. В некоторых вариантах осуществления первый внутриклеточный сигнальный домен включает СD3дзета сигнальный домен, и второй внутриклеточный сигнальный домен включает 4-1ВВ сигнальный домен.
В некоторых вариантах осуществления, CAR может содержать стеблевой домен между внеклеточным, связывающим лиганд доменом и первым трансмембранным доменом. В некоторых вариантах осуществления, стеблевой домен может быть выбран из группы, состоящей из: человеческого CD8α шарнира, человеческого CD28 шарнира, IgG1 шарнира и FcγRIIIα шарнира.
В некоторых вариантах осуществления, первый трансмембранный домен может содержать трансмембранный домен CD8α цепи.
В некоторых вариантах осуществления, CAR может содержать другой внеклеточный связывающий лиганд домен, который не является специфическим для EGFRvIII.
В некоторых вариантах осуществления CAR, внеклеточный(ые) связывающий(ие) лиганд домен(ы), первый трансмембранный домен, и внутриклеточный(ые) сигнальный(ые) домен(ы) находятся на одном полипептиде.
В некоторых вариантах осуществления, CAR может содержать второй трансмембранный домен, причем первый трансмембранный домен и внеклеточный(ые) связывающий(ие) лиганд домен(ы) находятся на первом полипептиде, и где второй трансмембранный домен и внутриклеточный(ые) сигнальный(ые) домен(ы) находятся на втором полипептиде, где первый трансмембранный домен включает трансмембранный домен из α цепи высокоаффинного IgE рецептора (FcεRI), и второй трансмембранный домен включает трансмембранный домен из γ или β цепи FcεRI. В некоторых вариантах осуществления, CAR может содержать третий полипептид, содержащий третий трансмембранный домен, слитый с внутриклеточным сигнальным доменом из со-стимулирующей молекулы, причем третий трансмембранный домен включает трансмембранный домен из γ или β цепи FcεRI.
В другом аспекте, изобретение предусматривает выделенный полинуклеотид, содержащий последовательность нуклеиновой кислоты, кодирующую EGFRvIII-специфический CAR, как описано в данном документе.
В другом аспекте, изобретение предусматривает вектор экспрессии, содержащий последовательность нуклеиновой кислоты, кодирующую EGFRvIII-специфическое CAR антитело, как описано в данном документе.
В другом аспекте, изобретение предусматривает сконструированную иммунную клетку, экспресирующую на своей клеточной поверхностной мембране EGFRvIII-специфический CAR, как описано в данном документе. В некоторых вариантах осуществления, сконструированная иммунная клетка может содержать другой CAR, который не является специфическим для EGFRvIII.
В некоторых вариантах осуществления, сконструированная иммунная клетка может содержать полинуклеотид, кодирующий полипептид-«самоубийцу». В некоторых вариантах осуществления, полипептид-»самоубийца» представляет собой RQR8. В некоторых вариантах осуществления, полинуклеотид, кодирующий полипептид-«самоубийца» находится в другой молекуле нуклеиновой кислоты, чем полинуклеотид, содержащий последовательность нуклеиновой кислоты, кодирующую EGFRvIII-специфический CAR. В некоторых вариантах осуществления, полинуклеотид, кодирующий полипептид-«самоубийца» является частью той же молекулы нуклеиновой кислоты, как и полинуклеотид, содержащий последовательность нуклеиновой кислоты, кодирующую EGFRvIII-специфический CAR.
В некоторых вариантах осуществления, сконструированная иммунная клетка, содержащая EGFRvIII-специфический CAR, может содержать полипептид-«самоубийцу» в отдельной полипептидной цепи из полипептидной цепи EGFRvIII-специфического CAR.
В некоторых вариантах осуществления, EGFRvIII-специфический CAR, как описано в данном документе, также включает полипептид-«самоубийцу» в той же полипептидной цепи, что и CAR. Например, полипептид-«самоубийца» может находиться между scFv и шарнирной последовательностью CAR. В некоторых вариантах осуществления, полипептид-«самоубийца» в CAR может иметь формат R2, как предусмотрено в данном документе. В некоторых вариантах осуществления, полипептид-«самоубийца» включает эпитоп, который распознается ритуксимабом.
Кроме того, предусмотренным в данном документе является полинуклеотид, кодирующий EGFRvIII-специфический CAR, который также кодирует полипептид-«самоубийцу» в CAR.
В некоторых вариантах осуществления, иммунная клетка может быть получена из воспалительного Т-лимфоцита, цитотоксического Т-лимфоцита, регуляторного Т- лимфоцита, Т-лимфоцита памяти, хелперного Т-лимфоцита, природного киллерного Т-лимфоцита или природной киллерной клетки.
В некоторых вариантах осуществления, сконструированная иммунная клетка может включать разрушение в одном или нескольких эндогенных генах, причем эндогенный ген кодирует TCRα, TCRβ, CD52, глюкокортикоидный рецептор (GR), дезоксицитидинкиназу (dCK), или иммунный контрольный белок, такой как, например, запрограммированной смерти-1 (PD-1).
В некоторых вариантах осуществления, иммунная клетка получена от здорового донора. В некоторых вариантах осуществления, иммунная клетка получена от пациента.
В другом аспекте, изобретение предусматривает сконструированную иммунную клетку, экспресирующую на своей клеточной поверхностной мембране EGFRvIII-специфический CAR, как описано в данном документе, для использования в качестве лекарственного средства. В некоторых вариантах осуществления, лекарственное средство предназначено для использования в лечении рака, связанного с EGFRvIII (например, какого-либо вида рака с экспрессией EGFRvIII), выбранного из группы, состоящей из мультиформной глиобластомы, анапластической астроцитомы, гигантоклеточной глиобластомы, глиосаркомы, анапластической олигодендроглиомы, анапластической эпендимомы, анапластической олигоастроцитомы, карциномы хориоидного сплетения, анапластической ганглиоглиомы, пинеобластомы, пинеоцитомы, менингиомы, медуллоэпителиомы, эпендимобластомы, медуллобластомы, супратенториальной примитивной нейроэктодермальной опухоли, атипичной тератоидной/рабдоидной опухоли, смешанной глиомы, рака головы и шеи, немелкоклеточного рака легкого, рака молочной железы, рака яичников, рака предстательной железы, медуллобластомы, рака толстой и прямой кишок, рака анального канала, рака шейки матки, рака почки, рака кожи, рака поджелудочной железы, рака печени, рака мочевого пузыря, рака желудка, рака щитовидной железы, мезотелиомы, рака матки, лимфомы и лейкемии.
В другом аспекте, изобретение предусматривает способ конструирования иммунной клетки, включающий: обеспечение иммунной клетки; и экспресирование на поверхности клетки по меньшей мере одного EGFRvIII-специфического CAR, как описано в данном документе.
В некоторых вариантах осуществления, способ включает: обеспечение иммунной клетки; введение в клетку, по меньшей мере, одного полинуклеотида, кодирующего указанный EGFRvIII-специфический CAR; и экспресирование указанного полинуклеотида в клетке.
В некоторых вариантах осуществления, способ включает обеспечение иммунной клетки; введение в клетку, по меньшей мере, одного полинуклеотида, кодирующего указанный EGFRvIII-специфический CAR; и введение, по меньшей мере, одного другого CAR, который не является специфическим для EGFRvIII.
В другом аспекте, изобретение предусматривает способ лечения субъекта, страдающего от состояния, связанного со злокачественными клетками, причем способ включает в себя: обеспечение иммунной клетки, экспресирующей на поверхности EGFRvIII-специфического CAR, как описано в данном документе; и введение указанный иммунных клеток указанному пациенту.
В другом аспекте, изобретение предусматривает фармацевтическую композицию, содержащую сконструированную иммунную клетку, как описано в данном документе.
В другом аспекте, изобретение предусматривает способ лечения состояния, связанного со злокачественными клетками, экспресирующими EGFRvIII, у субъекта, включающий введение субъекту, который нуждается в этом, эффективного количества фармацевтической композиции согласно изобретению, содержащей сконструированную иммунную клетку, как описано в данном документе. В некоторых вариантах осуществления, состояние представляет собой рак. В некоторых вариантах осуществления, рак представляет собой рак, связанный с EGFRvIII, выбранный из группы, состоящей из мультиформной глиобластомы, анапластической астроцитомы, гигантоклеточной глиобластомы, глиосаркомы, анапластической олигодендроглиомы, анапластической эпендимомы, анапластической олигоастроцитомы, карциномы хориоидного сплетения, анапластической ганглиоглиомы, пинеобластомы, пинеоцитомы, менингиомы, медуллоэпителиомы, эпендимобластомы, медуллобластомы, супратенториальной примитивной нейроэктодермальной опухоли, атипичной тератоидной/рабдоидной опухоли, смешанной глиомы, рака головы и шеи, немелкоклеточный рака легкого, рака молочной железы, рака яичников, рака предстательной железы, медуллобластомы, рака толстой и прямой кишок, рака анального канала, рака почки, рака шейки матки, рака печени, рака поджелудочной железы, рака желудка, рака щитовидной железы, мезотелиомы, рака матки и рака мочевого пузыря.
В другом аспекте, изобретение предусматривает способ ингибирования роста или прогрессирования опухоли у субъекта, у которого присутствуют злокачественные клетки, экспресирующие EGFRvIII, включающий введение субъекту, который нуждается в этом, эффективного количества фармацевтической композиции, содержащей сконструированную иммунную клетку, как описано в данном документе.
В другом аспекте, изобретение предусматривает способ ингибирования метастазирования злокачественных клеток, экспресирующих EGFRvIII, у субъекта, включающий введение субъекту, который нуждается в этом, эффективного количества фармацевтической композиции, содержащей сконструированную иммунную клетку, как описано в данном документе.
В другом аспекте, изобретение предусматривает способ индуцирование регрессии опухоли у субъекта, у которого присутствуют злокачественные клетки, экспресирующие EGFRvIII, включающий введение субъекту, который нуждается в этом, эффективного количества фармацевтической композиции, содержащей сконструированную иммунную клетку, как описано в данном документе.
Краткое описание фигур/чертежей
ФИГ. 1А, ФИГ. 1В, и ФИГ. 1С показывают примеры гистограмм FACS-связывания трех антител EGFRvIII: mAb 42G9 (ФИГ. 1А), 32А10 (ФИГ. 1В) и 32G8 (ФИГ. 1С), с тремя F98 клеточными линиями: F98 (EGFR отрицательный), F98-EGFRwt, и F98-EGFRvIII. Ось X представляет собой интенсивность флуоресценции; ось Y представляет собой процент от максимального / нормализованного режима.
ФИГ. 2А показывает столбиковую диаграмму, суммирующую экспрессию EGFRvIII-специфические CAR для CAR, содержащих различные EGFRvIII-специфические клоны.
ФИГ. 2В показывает столбиковую диаграмму, суммирующую процент EGFRvIII-специфических CAR Т клеток, которые связываются с рекомбинантным EGFR-mFc и EGFRvIII-mFc.
ФИГ. 2С показывает столбиковую диаграмму, суммирующую экспрессию CAR, содержащих 10 различных EGFRvIII-специфические клонов в CAR Т клетках.
ФИГ. 3 показывает столбиковую диаграмму, суммирующую активности дегрануляции EGFRvIII-специфических CAR Т клеток, экспресирующих различные EGFRvIII-специфические клоны, самостоятельно или при совместном культивировании с различными клеточными линиями: клетками, которые не экспрессируют какой-либо белок EGFR (NCI-H522 и U87-KO), клетки, которые экспрессируют высокий уровень EGFR немутантного типа (U87-KO-EGFRwt), или клетки, которые экспрессируют низкий (NCI-H522-EGFRvIII) и высокий (U87-KO-EGFRvIII) уровни EGFRvIII.
ФИГ. 4 показывает столбиковую диаграмму, суммирующую секрецию IFNγ EGFRvIII-специфическими CAR Т клетками, экспресирующими различные EGFRvIII-специфические клоны, самостоятельно или при совместном культивировании с различными клеточными линиями: клетками, которые не экспрессируют какой-либо белок EGFR (NCI-H522 и U87-KO), клетки, которые экспрессируют высокий уровень EGFR немутантного типа (U87-KO-EGFRwt), или клетки которые экспрессируют низкий (NCI-H522-EGFRvIII) и высокий (U87-KO-EGFRvIII) уровни EGFRvIII.
ФИГ. 5 показывает столбиковую диаграмму, сравнивающую цитотоксичность EGFRvIII-специфических CAR Т клеток, экспресирующих различные EGFRvIII-специфические клоны по отношению к немутантного типа EGFR, экспресирующихся клеточной линией (U87-KO-EGFRwt) по сравнению с высоким (U87-KO-EGFRvIII) и низким EGFRvIII (NCI-H522-EGFRvIII), экспресирующегося клеточными линиями.
ФИГ. 6 показывает график, суммирующий противоопухолевые активности EGFRvIII-специфических CAR Т клеток, экспресирующих различные EGFRvIII-специфические клоны против GBM клеток в подкожной модели ксенотрансплантата GBM.
ФИГ. 7 показывает столбиковую диаграмму, суммирующую CAR экспрессию CAR Т клетками, экспресирующими четыре различных EGFRvIII-специфических клона в CAR и перенос последовательности-«самоубийцы» R2 в CAR внутри CAR на День 4, День 9/10, и День 14/15 после трансдукции Т-клеток.
ФИГ. 8 показывает столбиковую диаграмму, суммирующую CAR экспрессию CAR Т клетками, экспресирующими четыре различных EGFRvIII-специфических клона в CAR и перенос последовательности-«самоубийцы» R2 в CAR внутри CAR на День 4 и День 14/15 после трансдукции Т-клеток.
ФИГ. 9 показывает столбиковую диаграмму, суммирующую цитотоксичность CAR Т клеток, экспресирующих четыре различные EGFRvIII-специфические клоны и перенос внутри CAR последовательности-«самоубийцы» R2 по отношению к высокому уровню (U87-KO-EGFRvIII) и низкому уровню EGFRvIII (NCI-H522-EGFRvIII), экспресирующихся клеточной линией.
Детальное описание
Изобретение, раскрытое в данном документе, предусматривает химерные антигенные рецепторы (CAR) и иммунные клетки, содержащие CAR (например, CAR-T клетки), которые специфически связываются с EGFRvIII (например, человеческим EGFRvIII). Изобретение также предусматривает полинуклеотиды, кодирующие данные CAR, композиции, содержащие данные CAR-T клетки, и способы получения и использования данных CAR и CAR-T клеток. Изобретение также предусматривает способы лечения состояния, связанного с EGFRvIII-опосредованными патологиями у субъекта, такими как рак.
Общие методы
Практика изобретения будет использовать, если не указано иное, общепринятые методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии, иммунологии, вирусологии, генерирования и конструирования моноклональных антител, которые находятся в компетенции квалифицированных специалистов в данной области. Такие методы полностью объясняются в литературе, такой как, Molecular Cloning: A Laboratory Manual, второе издание (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.С.Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); ПЦР: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
Термин "внеклеточный, связывающий лиганд домен", как используется в данном документе, относится к олиго- или полипептиду, который способен связывать лиганд. Предпочтительно, домен будет способен взаимодействовать с молекулой клеточной поверхности. Например, внеклеточный связывающий лиганд домен может быть выбран для распознавания лиганда, который действует как маркер клеточной поверхности на клетках-мишенях, связанных с определенным заболеванием.
Термин "стеблевой домен" или "шарнирный домен" используются взаимозаменяемо в данном документе и относятся к какому-либо олиго- или полипептиду, который функционирует для связывания трансмембранного домена с внеклеточным связывающим лиганд доменом. В частности, стеблевые домены используются для обеспечения большей гибкости и доступности для внеклеточного связывающего лиганд домена.
Термин "внутриклеточный сигнальный домен" относится к части белка, которая трансдуцирует сигнал эффекторной функции и направляет клетку для выполнения специализированной функции.
"Co-стимулирующая молекула", как используется в данном документе, относится к родственному связывающему партнеру на Т-клетке, которая специфически связывается с со-стимулирующим лигандом, тем самым опосредуя со-стимулирующий ответ клеткой, такой как, но не ограничиваясь этим, пролиферация. Co-стимулирующие молекулы включают, но не ограничиваются этим, молекулу МНС класса I, BTLA и Toll лигандный рецептор. Примеры состимулирующих молекул включают CD27, CD28, CD8, 4-1ВВ (CD137), ОХ40, CD30, CD40, PD-1, ICOS, ассоциированный с лимфоцитной функцией антиген-1 (LFA-1), CD2, CD7, ЛЕГКОЙ, NKG2C, B7-H3 и лиганд, который специфически связывается с CD83 и подобными.
"Co-стимулирующий лиганд" относится к молекуле на антиген-представляющей клетке, которая специфически связывает родственную стимулирующую сигнальную молекулу на Т-клетке, тем самым обеспечивая сигнал, который в дополнение к первичному сигналу, обеспечиваемому, например, связыванием комплекса TCR/CD3 с молекулой МНС, нагруженной пептидом, опосредует ответ Т-клеток, включая, но не ограничиваясь этим, активацию пролиферации, дифференцирование, производство цитокинов и тому подобное. Co-стимулирующий лиганд может включать, но не ограничивается этим, CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL OX40L, индуцируемый со-стимулирующий лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM, CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, лимфотоксиновый β рецептор, 3/TR6, ILT3, ILT4, агонист или антитело, которое связывает Toll лигандный рецептор и лиганд, который специфически связывается с В7-Н3. Со-стимулирующий лиганд также охватывает, среди прочего, антитело, которое специфически связывается с со-стимулирующей молекулой, присутствующей в Т-клетке, такой как, но не ограничиваясь этим, CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, PD-1, ICOS, ассоциированный с лимфоцитной функцией антиген-1 (LFA-1), CD2, CD7, ЛЕГКОЙ, NKG2C, В7-Н3, лиганд, который специфически связывается с CD83.
"Антитело" представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.п., посредством, по меньшей мере, одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. Как используется в данном документе, термин охватывает не только интактные поликлональные или моноклональные антитела, но также их антигенсвязывающие фрагменты (такие как Fab, Fab', F(ab')2, Fv), одинарные цепи (scFv) и доменные антитела (включая, например, акулье и верблюжье антитела), и слитые белки, содержащие антитело, и какую-либо другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт распознавания антигена. Антитело включает антитело из какого-либо класса, такого как IgG, IgA, или IgM (или его подкласса), и антитело не обязательно должно принадлежать к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области антитела его тяжелых цепей, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG, и IgM, и некоторые из них могут быть далее разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Хорошо известны субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов.
Термин "антигенсвязывающий фрагмент" или "антигенсвязывающая часть" антитела, как используется в данном документе, относится к одному или нескольким фрагментам интактного антитела, которые сохраняют способность специфически связываться с данным антигеном (например, EGFRvIII). Антигенсвязывающие функции антитела могут быть выполнены фрагментами интактного антитела. Примеры связывающих фрагментов, включенных в термин "антигенсвязывающий фрагмент" антитела, включают Fab; Fab'; F(ab')2; Fd фрагмент, состоящий из VH и СН1 доменов; Fv фрагмент, состоящий из VL и VH доменов одного плеча антитела; фрагмент однодоменного антитела (dAb) (Ward et al., Nature 341:544-546, 1989), и выделенную область, определяющую комплементарность, (CDR).
Антитело, коньюгат антитела, или полипептид, который "предпочтительно связывается" или "специфически связывается" (используемый взаимозаменяемо в данном документе) с мишенью (например, EGFRvIII белком) является термином, хорошо понятым в данной области, и также хорошо известными в данной области являются способы определения такого специфического или предпочтительного связывания. Молекула, как указывается, демонстрирует "специфическое связывание" или "предпочтительное связывание", если она реагирует или ассоциируется чаще, быстрее, с большей продолжительностью и/или с большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело "специфически связывается" или "предпочтительно связывается" с мишенью, если оно связывается с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфически или предпочтительно связывается с EGFRvIII эпитопом, представляет собой антитело, которое связывает данный эпитоп с большей аффинностью, авидностью, более легко, и/или с большей продолжительностью, чем оно связывается с другими EGFRvIII эпитопами или не- EGFRvIII эпитопами. Кроме того, понятно, что, читая это определение, например, антитело (или фрагмент или эпитоп), которое специфически или предпочтительно связывается с первой мишенью, может или не может конкретно или предпочтительно связываться со второй мишенью. Таким образом, «специфическое связывание» или «предпочтительное связывание» необязательно требует (хотя и может включать) исключительного связывания. Как правило, но необязательно, ссылка на связывание означает преимущественное связывание.
"Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, или самостоятельно или в комбинации. Как известно в данной области техники, вариабельные области тяжелой и легкой цепей состоят из четырех каркасных областей (FR), связанных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в непосредственной близости от FR и с CDR из другой цепи способствуют образованию антигенсвязывающего сайта антител. Существует, по меньшей мере, два способа определения CDR: (1) подход, основанный на межвидовой вариабельности последовательности (например, Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al., 1997, J. Molec. Biol. 273:927-948). Как используется в данном документе, CDR может относиться к CDR, определенным согласно или какому-либо подходу, или согласно комбинации обоих подходов.
"CDR" вариабельного домена представляет собой аминокислотные остатки в пределах вариабельной области, которая идентифицируется в соответствии с определениями Kabat, Chothia, аккумуляцией как Kabat, так и Chothia, AbM, контактом и/или конформационными определениями или каким-либо способом определения CDR, хорошо известным в данной области. CDR антител могут быть идентифицированы как гипервариабельные области, первоначально определенные согласно Kabat et al. Смотрите, например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C. Положения CDR также могут быть идентифицированы как структурные петельные структуры, первоначально описанные Chothia и другими. Смотрите, например, Chothia et al., Nature 342:877-883, 1989. Другие подходы к идентификации CDR включают "определение AbM," которое является компромиссом между Kabat и Chothia и получено с использованием программного обеспечения моделирования антител AbM от Oxford Molecular (сейчас Accelrys®), или "контактное определение" CDR на основе наблюдаемых контактов антигенов, представленных в MacCallum et al., J. Mol. Biol., 262:732-745, 1996. В другом подходе, обозначенном в данном документе как «конформационное определение» CDR, положения CDR могут быть идентифицированы как остатки, которые делают энтальпийные вклады в антигенное связывание. Смотрите, например, Makabe et al., Journal of Biological Chemistry, 283:1156-1166, 2008. Еще другие определения границ CDR не могут строго следовать одному из указанных выше подходов, но, тем не менее, будут перекрываться, по меньшей мере, с частью CDR Kabat, хотя они могут быть сокращены или удлинены в свете предсказаний или экспериментальных данных о том, что отдельные остатки или группы остатков или даже целые CDR не оказывают существенного влияния на связывание антигена. Как используется в данном документе, CDR может относиться к CDR, определенным согласно какого-либо подхода, известного в данной области, включая комбинации подходов. Способы, используемые в данном документе, могут применять CDR, определенные в соответствии с каким-либо из данных подходов. Для какого-либо данного варианта осуществления, содержащего больше, чем одну CDR, CDR могут быть определены в соответствии с каким-либо из определений Kabat, Chothia, расширенным, AbM, контактным и/или конформационным определениями.
Как используется в данном документе, "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, то есть индивидуальных антител, составляющих популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминантов (эпитопов), каждое моноклональное антитело направлено против одного детерминанта на антиген. Модификатор «моноклональный» указывает на характер антитела, которое получено из по существу гомогенной популяции антител, и не следует истолковывать как требующий продуцирования антитела согласно какому-либо конкретному способу. Например, моноклональные антитела, которые будут использоваться в соответствии с изобретением, могут быть получены согласно гибридомному способу, впервые описанному Kohler и Milstein, Nature 256:495, 1975, или могут быть получены согласно способу с рекомбинантной ДНК, такому как описано в патенте США No 4,816,567. Моноклональные антитела также могут быть выделены из фаговых библиотек, сгенерированных с использованием методов, описанных, например, в McCafferty et al., Nature 348:552-554, 1990.
Как используется в данном документе, "гуманизированное" антитело относится к формам нечеловеческих (например, мышиных) антител, которые представляют собой химерные иммуноглобулины, цепи иммуноглобулина или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие связывающие антиген подпоследовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Предпочтительно, гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из области, определяющей комплементарность, (CDR) реципиента заменены на остатки из CDR нечеловеческих видов (донорное антитело), таких как мышь, крыса или кролик, имеющие желаемую специфичность, сродство и емкость. В некоторых случаях, остатки Fv каркасной области (FR) человеческого иммуноглобулина заменяются на соответствующие нечеловеческие остатки. Кроме того, гуманизированное антитело может содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях, но включены для дальнейшего уточнения и оптимизации эффективности антител. В общем, гуманизированное антитело будет содержать по существу все, по меньшей мере, одно и, как правило, два вариабельных домена, в которых все или, по существу, все области CDR соответствуют тем из нечеловеческого иммуноглобулина и всем или по существу всем из областей FR, которые представляют собой консенсусную последовательность иммуноглобулина человека. Гуманизированное антитело оптимально также будет содержать, по меньшей мере, часть константной области или домена иммуноглобулина (Fc), как правило, человеческого иммуноглобулина.
Предпочтительными являются антитела, имеющие Fc-области, модифицированные, как описано в WO 99/58572. Другие формы гуманизированных антител имеют одну или несколько CDR (CDR L1, CDR L2, CDR L3, CDR Н1, CDR Н2, или CDR Н3), которые изменяются по отношению к исходному антителу, которые также называются одним или несколькими CDR "производными от" одной или нескольких CDR из исходного антитела.
Как используется в данном документе, "человеческое антитело" означает антитело, имеющее аминокислотную последовательность, соответствующую той, которая из антитела, продуцтрованного человеком и/или которая была получена с использованием какого-либо из способов получения человеческих антител, известных квалифицированным специалистам в данной области или описанных в данном документе. Данное определение человеческого антитела включает антитела, содержащие, по меньшей мере, один человеческий полипептид тяжелой цепи или, по меньшей мере, один человеческий полипептид легкой цепи человека. Одним из таких примеров является антитело, включающее мышиную легкую цепь и полипептиды тяжелой цепи человека. Человеческие антитела могут быть получены с использованием различных методов, известных в данной области. В одном варианте осуществления, человеческое антитело выбирают из библиотеки фагов, где такая фаговая библиотека экспрессирует человеческие антител (Vaughan et al., Nature Biotechnology, 14:309-314, 1996; Sheets et al., Proc. Natl. Acad. Sci. (USA) 95:6157-6162, 1998; Hoogenboom и Winter, J. Mol. Biol., 227:381, 1991; Marks et al., J. Mol. Biol., 222:581, 1991). Человеческие антитела также могут быть получены путем иммунизации животных, в которые человеческие иммуноглобулиновые локусы были трансгенно введены вместо эндогенных локусов, например, мышей, у которых эндогенные гены иммуноглобулина были частично или полностью инактивированы. Этот подход описан в патенте США №№5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; и 5,661,016. Альтернативно, человеческое антитело может быть получено путем иммортализации человеческих В-лимфоцитов, которые продуцируют антитело, направленное против целевого антигена (такие В-лимфоциты могут быть выделены у индивидуума или из одноклеточного клонирования кДНК, или могут быть иммунизированы in vitro). Смотрите, например, Cole et al. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77, 1985; Boerner et al., J. Immunol., 147 (1):86-95, 1991; и патент США №5,750,373.
Термин «химерное антитело» предназначен для обозначения антител, в которых последовательности вариабельных областей получены из одного вида, и последовательности константных областей получены из другого вида, такого как антитело, в котором последовательности вариабельной области получают из мышиного антитела и последовательности константных областей получают из человеческого антитела.
Термины "полипептид", "олигопептид", "пептид" и "белок" используются взаимозаменяемо в данном документе для обозначения цепей аминокислот какой-либо длины. Например, цепь может быть относительно короткой (например, 10-100 аминокислот) или длиннее. Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может быть прервана неаминокислотами. Термины также включают аминокислотную цепь, которая была модифицирована естественным путем или путем вмешательства; например, за счет образования дисульфидных связей, гликозилирования, липидирования, ацетилирования, фосфорилирования или каких-либо других манипуляций или модификаций, таких как конъюгация с меченым компонентом. Кроме того, включенными в определение являются, например, полипептиды, содержащие один или несколько аналогов аминокислоты (включая, например, не встечающиеся в природе аминокислоты и т.д.), а также другие модификации, известные в данной области. Понятно, что полипептиды могут встречаться в виде отдельных цепей или ассоциированных цепей.
"Моновалентное антитело" включает один связывающий антиген сайт на молекулу (например, IgG или Fab). В некоторых случаях, моновалентное антитело может иметь больше, чем один связывающий антиген сайты, но сайты связывания являются из разных антигенов.
"Бивалентное антитело" включает два связывающих антиген сайтов на молекулу (например, IgG). В некоторых случаях, два сайта связывания имеют одинаковые антигенные специфичности. Однако, бивалентны антитела могут быть биспецифическими.
"Биспецифический" или "двойной специфический" представляет собой гибридное антитело, имеющее два разных связывающих антиген сайта. Два связывающих антиген сайта биспецифического антитела связываются с двумя различными эпитопами, которые могут находиться на тех же или разных белковых мишенях.
"Бифункциональный" представляет собой антитело, имеющее идентичные связывающие антиген сайты (то есть, идентичные аминокислотные последовательности) в двух плечах, но каждый сайт связывания может распознавать два различных антигена.
Антитела согласно изобретению могут быть получены с использованием технологий, хорошо известных в данной области, например, рекомбинантных технологий, технологий фагового дисплея, синтетических технологий или комбинаций таких технологий или других технологий общеизвестных в данной области (смотрите, например, Jayasena, S.D., Clin. Chem., 45: 1628-50, 1999 и Fellouse, F.A., et al, J. Mol. Biol., 373(4):924-40, 2007).
Как известно в данной области, термин "полинуклеотид" или "нуклеиновая кислота," как используется взаимозаменяемо в данном документе, относится к цепям нуклеотидов какой-либо длины и включает ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или какой-либо субстрат, который может быть включен в цепь ДНК или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если присутствует, модификация нуклеотидной структуры может быть передана до или после сборки цепи. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгации с меченым компонентом. Другие типы модификаций включают, например, «кэпы», замещение одного или нескольких из встречающихся в природе нуклеотидов аналогичными, межнуклеотидные модификации, такие как, например, с незаряженными связями (например, метилфосфонаты, сложные фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), те, которые содержат фрагменты боковой цепи макромолекулы, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), те, которые содержат интеркалаторы (например, акридин, псорален и т.д.), те, которые содержат хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), те, которые содержат алкилаторы с модифицированными связями (например, альфа аномерные нуклеиновые кислоты и т.Д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, какая-либо из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищенными стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми носителями. 5' и 3' терминальный ОН могут быть фосфорилированы или замещены аминами или органическими фрагментами блокирующих групп из от 1 до 20 атомов углерода. Другие гидроксилы также могут быть дериватизированы до стандартных защитных групп. Полинуклеотиды также могут содержать аналогичные формы сахаров рибозы или дезоксирибозы, которые обычно известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибозу, карбоциклические аналоги сахаров, альфа-или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или лизозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги абазических нуклеозидов, такие как метилрибозид. Одна или несколько фосфодисложноэфирных связей могут быть заменены альтернативными связывающими группами. Данные альтернативные связывающие группы включают, но не ограничиваются этим, варианты, в которых фосфат замещен на Р(O)S("тиоат"), P(S)S ("дитиоат"), (O)NR2 ("амидат"), P(O)R, P(O)OR', СО или СН2 ("формацеталь"), в котором каждый R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), необязательно содержащий простого эфира (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или ариладил. Не все связи в полинуклеотиде должны быть одинаковыми. Предыдущее описание относится ко всем полинуклеотидам, указанным в данном документе, включая РНК и ДНК.
Как известно в данной области термин "константная область" антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, или самостоятельно, или в комбинации.
Как используется в данном документе, "по существу чистый" относится к материалу, который является, по меньшей мере, на 50% чистым (то есть, свободным от примесей), более предпочтительно, по меньшей мере на 90% чистый, более предпочтительно, по меньшей мере, на 95% чистый, еще более предпочтительно, по меньшей мере, на 98% чистый, и наиболее предпочтительно, по меньшей мере, на 99% чистый.
"Клетка-хозяин" включает индивидуальную клетку или клеточную культуру, которая может быть или была реципиентом для вектора(ов) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и потомство может не обязательно быть полностью идентичным (по морфологии или по комплементу геномной ДНК) по отношению к исходной родительской клетке благодаря природной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами) по настоящему изобретению.
Как используется в данном документе, "иммунная клетка" относится к клетке гемопоэтического происхождения, функционально участвующей в инициации и/или осуществлении врожденного и/или адаптивного иммунного ответа.
Как известно в данной области, термин "Fc область" используется для определения С-терминальной области тяжелой цепи иммуноглобулина. "Fc область" может представлять собой нативную последовательность Fc области или вариант Fc области. Хотя границы Fc области тяжелой цепи иммуноглобулина могут варьироваться, Fc область тяжелой цепи человеческого IgG обычно определяется для того, чтобы удлиниться из аминокислотного остатка в положении Cys226, или из Pro230, до его карбоксильного конца. Нумерация остатков в Fc области соответствует нумерации индекса EU как в Kabat. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc область иммуноглобулина обычно включает две константные области, СН2 и СН3.
Как используется в данной области, "Fc рецептор" и "FcR" описывают рецептор, который связывается с Fc-областью антитела. Предпочтительный FcR представляет собой человеческий FcR с нативной последовательностью. Кроме того, предпочтительный FcR представляет собой тот, который связывает IgG антитело (гамма-рецептор) и включает рецепторы из подклассов FcγRI, FcγRII, и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. FcγRII рецепторы включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют подобные аминокислотные последовательности, которые в основном отличаются в их цитоплазматических доменах. FcR рассматриваются в Ravetch и Kinet, Ann. Rev. Immunol., 9:457-92, 1991; Capel et al., Immuno способов, 4:25-34, 1994; и de Haas et al., J. Lab. Clin. Med., 126:330-41, 1995. "FcR" также включает неонатальный рецептор, FcRn, который отвечает за передачу материнских IgG плоду (Guyer et al., J. Immunol., 117:587, 1976; и Kim et al., J. Immunol., 24:249, 1994).
Термин "конкурировать", как используется в данном документе в отношении антитела, означает, что первое антитело или его антигенсвязывающий фрагмент (или его часть) связывается с эпитопом способом, достаточно похожим на связывание второго антитела, или его антигенсвязывающей части, таким образом, что результат связывания первого антитела с его родственным эпитопом обнаруживается с понижением в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернативным может быть, когда связывание второго антитела с его эпитопом также заметно снижается в присутствии первого антитела, но это не обязательно. То есть, первое антитело может ингибировать связывание второго антитела с его эпитопом без того, что второе антитело ингибирует связывание первого антитела с его соответствующим эпитопом. Однако, когда каждое антитело обнаруживаемо ингибирует связывание другого антитела с его родственным эпитопом или лигандом, будь то в той же, большей или меньшей степени, антитела, как указывается, «перекрестно конкурируют» друг с другом для связывания их соответствующего(их) эпитопа(ов). Изобретение охватывает как конкурирующие, так и перекрестно-конкурирующие антитела. Независимо от механизма, по которому происходит такая конкуренция или перекрестная конкуренция (например, стерическое затруднение, конформационное изменение или связывание с общим эпитопом или его частью), квалифицированный специалист в данной области оценит на основе учений, предусмотренных в данном документе, что такие конкурирующие и/или перекрестно-конкурирующие антитела охватываются и могут быть полезны для способов, описанных в данном документе.
Как используется в данном документе "аутологичный" означает, что клетки, клеточная линия или популяция клеток, используемых для лечения пациентов происходят от указанного пациента или от совместимого донора человеческого лейкоцитарного антигена (HLA).
Как используется в данном документе "аллогенный" означает, что клетки или популяция клеток, используемых для лечения пациентов, происходят не от указанного пациента, а от донора.
Как используется в данном документе, термин «лечение» представляет собой подход для получения полезных или желаемых клинических результатов. Для целей настоящего изобретения полезные или желаемые клинические результаты включают, но не ограничиваются этим, одно или несколько из следующих: снижение пролиферации (или разрушение) неопластических или раковых клеток, ингибирование метастазирования неопластических клеток, сокращение или или уменьшение размера опухоли, экспресирующей EGFRvIII, ремиссию связанного с EGFRvIII заболевания (например, рака), снижение симптомов, вызванных ассоциированным с EGFRvIII заболеванием (например, раком), повышение качества жизни людей, страдающих от ассоциированного с EGFRvIII заболевания (например, рака), уменьшение дозы других лекарственных средств, необходимых для лечения ассоциированного с EGFRvIII заболевания (например, рака), задерживание прогрессирования ассоциированного с EGFRvIII заболевания (например, рака), излечение ассоциированного с EGFRvIII заболевания (например, рака), и/или продлевание выживаемости пациентов, имеющих ассоциированное с EGFRvIII заболевание (например, рак).
"Улучшение" означает уменьшение или улучшение одного или нескольких симптомов по сравнению с отсутствием введения EGFRvIII-специфического CAR. "Улучшение" также включает сокращение или уменьшение продолжительности симптома.
Как используется в данном документе, термин «эффективная доза» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления какого-либо одного или нескольких полезных или желаемых результатов. Для профилактического использования полезные или желаемые результаты включают устранение или снижение риска, уменьшение тяжести или задержку возникновения заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, возникающие во время развития заболевания. Для терапевтического использования полезные или желаемые результаты представляют собой клинические результаты, такие как снижение частоты или улучшение одного или нескольких симптомов различных связанных с EGFRvIII заболеваний или состояний (таких как, например, мультиформная глиобластома), уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, усиливая действие другого лекарственного средства, и/или замедляя прогрессирование связанного с EGFRvIII заболевания пациентов. Эффективная доза может вводиться одним или несколькими введениями. Для целей настоящего изобретения эффективная дозировка лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для проведения профилактического или терапевтического лечения или непосредственно, или опосредовано. Как понятно в клиническом контексте, эффективная дозировка лекарственного средства, соединения или фармацевтической композиции может быть достигнута или не может быть достигнута в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективная доза» может быть рассмотрена в контексте введения одного или нескольких терапевтических агентов, и один агент, как может считаться, указывается в эффективном количестве, если в сочетании с одним или несколькими другими агентами желательный результат может быть достигнут или достигается.
"Индивидуум" или "субъект" представляет собой млекопитающее, более предпочтительно, человека. Млекопитающие также включают, но не ограничиваются этим, приматов, лошадей, собак, кошек, мышей и крыс.
Как используется в данном документе, термин «вектор» означает конструкт, который способен доставлять и, предпочтительно, экспрессировать один или несколько генов или последовательностей представляющих интерес в клетке-хозяине. Примеры векторов включают, но не ограничиваются этим, вирусные векторы, векторы экспрессии депротеинизированной ДНК или РНК, плазмиду, космиду или фаговые векторы, векторы экспрессии ДНК или РНК, связанные с катионными конденсирующими агентами, векторы экспрессии ДНК или РНК, инкапсулированные в липосомы, и определенные эукариотические клетки, такие как клетки-продуценты.
Как используется в данном документе, "последовательность контроля экспрессии" означает последовательность нуклеиновой кислоты, которая направляет транскрипцию нуклеиновой кислоты. Последовательность контроля экспрессии может представлять собой промотор, такой как конститутивный или индуцибельный промотор или энхансер. Последовательность контроля экспрессии функционально связана с последовательностью нуклеиновой кислоты, которая транскрибируется.
Как используется в данном документе, термин "фармацевтически приемлемый носитель" или "фармацевтически приемлемый эксципиент" включает какой-либо материал, который в сочетании с активным ингредиентом позволяет ингредиенту сохранять биологическую активность и не реагирует с иммунной системой субъекта. Примеры включают, но не ограничиваются этим, какой-либо из стандартных фармацевтических носителей, таких как фосфатный буферный солевой раствор, вода, эмульсии, такие как эмульсия масло / вода, и различные типы смачивающих агентов. Предпочтительные разбавители для аэрозольного или парентерального введения представляют собой фосфатный буферный солевой раствор (PBS) или физиологический (0,9%) солевой раствор. Композиции, содержащие такие носители формулируются согласно хорошо известным общепринятым способам (смотрите, например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; and Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005).
Термин "kon" или "ka", как используется в данном документе, относится к константе скорости для связывания антитела с антигеном. В частности, константы скорости (kon/ka и koff/kd) и константы равновесной диссоциации могут быть измерены с использованием, например, полноразмерных антител и/или фрагментов Fab антитела и соответствующего антигена.
Термин "koff" или "kd", как используется в данном документе, относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
Термин "KD", как используется в данном документе, относится к равновесной константе диссоциации взаимодействия антитело-антиген.
Определения констант скорости ассоциации и диссоциации, kon и koff соответственно, могут быть сделаны с использованием биосенсора на основе поверхностного плазмонного резонанса для характеристики взаимодействия аналит / лиганд в условиях, когда аналит является моновалентным по отношению к лиганду связывания, который иммобилизуется при низкой емкости на поверхности датчика через реагент захвата. Анализ проводят с использованием кинетической методики титрования, как описано в Karlsson et al., Anal. Biochem 349, 136-147, 2006. Микросхема датчика, захватывающий реагент и буфер для анализа, используемые для данного анализа, выбирают так, чтобы обеспечить стабильный захват лиганда на поверхности датчика, минимизировать неспецифическое связывание анализируемого вещества с поверхностями и дают ответы связывания анализируемого вещества, которые соответствуют кинетическому анализу, в соответствии с рекомендациями в Myszka, J. Mol. Recognit 12, 279-284, 1999. Ответы связывания анализируемого вещества на взаимодействие анализируемое вещество/лиганд представляют собой двойные ссылки и согласуются с 1:1 Ленгмюровской "ограниченной моделью массового транспорта" с ka, kd и Rmax в качестве глобальных параметров, как описано в Myszka & Morton et al., Biophys. Chem 64, 127-137 (1997). Константа равновесной диссоциации, KD, выводится из соотношения констант кинетической скорости, KD=koff/kon. Такие определения предпочтительно имеют место при 25°С или 37°С.
Ссылка на «приблизительно» значению или параметра в данном документе включает (и описывает) варианты осуществления, которые направлены на это значение или параметр как таковой. Например, описание, относящееся к "приблизительно X" включает описание "X." Числовые диапазоны включают числа, определяющие диапазон. Вообще говоря, термин "приблизительно" относится к к указанному значению переменной и ко всем значениям переменной, которые находятся в пределах экспериментальной ошибки указанного значения (например, в пределах доверительного интервала 95% для среднего значения) или в пределах 10 процентов от указанное значение, в зависимости от того, что больше. Если термин "приблизительно" используется в контексте периода времени (годы, месяцы, недели, дни и т.д.), термин "приблизительно" означает, что период времени плюс или минус одно количество следующего нижестоящего периода времени (например, приблизительно 1 год означает 11-13 месяцев; приблизительно 6 месяцев означает 6 месяцев плюс или минус 1 неделю; приблизительно 1 неделя означает 6-8 дней; и т.д.), или в пределах 10 процентов от указанного значения, в зависимости от того, что больше.
Понятно, что везде, где варианты осуществления описаны в данном документе с выражением "содержащий," при иных обстоятельствах также предусмотренными являются аналогичные варианты осуществления, описанные в терминах "состоящий из" и/или " состоящий в основном из".
Если аспекты или варианты осуществления изобретения описаны в терминах группы Маркуша или другой группировки альтернатив, изобретение охватывает не только всю группу, перечисленную в целом, но каждый член группы индивидуально и все возможные подгруппы основной группы, но также если в основной группе отсутствуют один или несколько членов группы. Изобретение также предусматривает явное исключение одного или нескольких каких-либо из членов группы в заявленном изобретении.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, которое обычно понимается квалифицированным специалистом в данной области техники, к которому относится настоящее изобретение. В случае конфликта представленное описание, включая определения, будет контрольным. Во всем данном описании и формуле изобретения слово «содержать» или варианты, такие как «содержит» или «содержащий», будут подразумевать включение указанного целого числа или группы целых чисел, но не исключение какого-либо другого целого числа или группы целых чисел. Если иное не требуется по контексту, термины в единственном числе будут включать множественное число, и термины в множественном числе будут включать единственное число.
Иллюстративные способы и материалы описаны в данном документе, хотя способы и материалы, аналогичные или эквивалентные описанным в данном документе, также могут быть использованы в практике или испытаниях согласно изобретению. Материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
EGFRvIII-специфические CAR и способы их получения
Изобретение предусматривает CAR, которые связываются с EGFRvIII (например, человеческим EGFRvIII (например, SEQ ID NO: 201, номер доступа: Р00533 Идентификатор функции VAR_066493, или GenBank номер доступа No. AJN69267)). EGFRvIII-специфические CAR, предусмотренные в данном документе, включают одноцепочечные CAR и многоцепочечные CAR. CAR обладают способностью перенаправлять Т клеточную специфичность и реакционную способность в отношении EGFRvIII в не-МНС-ограничивающей манере, с использованием антиген-связывающих свойств моноклональных антител. Не-МНС-ограничивающее распознавание антигена дает Т клеткам, экспресирующие CAR, способность распознавать антиген, не зависящий от обработки антигена, таким образом, минуя основной механизм выхода опухоли.
В некоторых вариантах осуществления, CAR, предусмотренные в данном документе, включают внеклеточный связывающий лиганд домен (например, одноцепочечный вариабельный фрагмент (scFv)), трансмембранный домен, и внутриклеточный сигнальный домен. В некоторых вариантах осуществления, внеклеточный связывающий лиганд домен, трансмембранный домен и внутриклеточный сигнальный домен находятся в одном полипептиде, то есть, в одной цепи. Многоцепочечные CAR и полипептиды также являются предусмотренными в данном документе. В некоторых вариантах осуществления, многоцепочечные CAR включают: первый полипептид, содержащий трансмембранный домен и, по меньшей мере, один внеклеточный связывающий лиганд домен, и второй полипептид, содержащий трансмембранный домен и, по меньшей мере, один внутриклеточный сигнальный домен, где полипептиды собираются вместе, образуя многоцепочечный CAR.
В некоторых вариантах осуществления, EGFRvIII-специфический многоцепочечный CAR основывается на рецепторе с высокой аффинностью для IgE (FcεRI). FcεRI, экспрессированный на тучных клетках, и базофилы вызывают аллергические реакции. FcεRI представляет собой тетрамерный комплекс, состоящий из одной α-субъединицы, одной β-субъединицы и двух связанных с дисульфидом γ-субъединиц. α субъединица содержит IgE-связывающий домен. Субъединицы β и γ содержат ITAM, которые опосредуют сигнальную трансдукцию. В некоторых вариантах осуществления, внеклеточный домен FcRα цепи удаляется и заменяется EGFRvIII-специфическим внеклеточным связывающим лиганд доменом. В некоторых вариантах осуществления, многоцепочечный EGFRvIII-специфический CAR включает scFv, который специфически связывается с EGFRvIII, CD8α шарниром, и ITAM FcRβ цепи. В некоторых вариантах осуществления, CAR может включать или не может включать FcRγ цепь.
В некоторых вариантах осуществления, внеклеточный связывающий лиганд домен включает scFv, содержащий вариабельную область легкой цепи (VL) и вариабельную область тяжелой цепи (VH) целевого антиген-специфического моноклонального антитела, соединенную гибким линкером. Одноцепочечные фрагменты вариабельной области получают путем связывания вариабельных областей легкой и/или тяжелой цепи с использованием короткого связующего пептида (Bird et al., Science 242:423-426, 1988). Примером связующего пептида является линкер GS, имеющий аминокислотную последовательность (GGGGS)4 (SEQ ID NO: 202), которая мостирует приблизительно 3,5 нм между карбоксильным концом одной вариабельной области и аминоконцом другой вариабельной области. Разработанными и использованными были линкеры других последовательностей (Bird et al., 1988, supra). В общем, линкеры могут быть короткими, гибкими полипептидами и предпочтительно состоят приблизительно из 20 или меньше аминокислотных остатков. В свою очередь, линкеры могут быть модифицированы для дополнительных функций, таких как прикрепление лекарственных средств или прикрепление к твердым подложкам. Одноцепочечные варианты могут быть получены либо рекомбинантно, либо синтетически. Для синтетического получения scFv может использоваться автоматизированный синтезатор. Для рекомбинантного продуцирования scFv подходящая плазмида, содержащая полинуклеотид, который кодирует scFv, может быть введена в подходящую клетку-хозяина, либо эукариотическую, такую как дрожжи, растения, насекомые или клетки млекопитающих, или прокариотические, такие как Е. coli. Полинуклеотиды, кодирующие scFv, представляющие интерес, могут быть получены обычными манипуляциями, такими как лигирование полинуклеотидов. Полученный в результате scFv может быть выделен с использованием стандартных методов очистки белка, известных в данной области.
В некоторых вариантах осуществления, внеклеточный связывающий лиганд домен включает (a) VH область, содержащую (i) VH область, определяющую комплементарность, один (CDR1), содержащую последовательность, показанную в SEQ ID NO: 62, 63, 64, 74, 75, 76, 80, 81, 82, 88, 89, 90, 93, 94, 95, 99, 100, 101, 109, 110, 111, 115, 116, 117, 121, 122, 123, 132, 133,134, 137, 138, 139, 143, 144, ИЛИ 145; (ii) VH CDR2, содержащую последовательность, показанную в SEQ ID NO: 65, 66, 68, 69, 70, 71, 77, 78, 83, 84, 86, 87, 91, 92, 96, 97, 98, 102, 103, 105, 106, 112, 113, 118, 119, 124, 125, 127, 128, 130, 131, 135, 136, 140, 141, 146, или 147; и iii) VH CDR3, содержащую последовательность, показанную в SEQ ID NO: 67, 72, 73, 79, 85, 104, 107, 108, 114, 120, 126, 129, 142, или 148; и/или VL область, содержащую (i) VL CDR1, содержащую последовательность, показанную в SEQ ID NO: 149, 154, 156, 159, 162, 165, 166, 168, 169, 170, 171, 173, 174, 176, 178, 181, 182, 185, 187, 190, 192, 195, ИЛИ 198; (ii) VL CDR2, содержащую последовательность, показанную в SEQ ID NO: 150, 152, 155, 157, 160, 163, 172, 175, 179, 183, 186, 188, 191, 193, 196, или 199; и (iii) VL CDR3, содержащую последовательность, показанную в SEQ ID NO: 151, 153, 158, 161, 164, 167, 177, 180, 184, 189, 194, 197, или 200. В некоторых вариантах осуществления, VH и VL являются связанными вместе гибким линкером. В некоторых вариантах осуществления гибкий линкер включает аминокислотную последовательность, показанную в SEQ ID NO: 202.
В некоторых вариантах осуществления, внеклеточный связывающий лиганд домен включает (a) VH область, содержащую (i) VH область, определяющую комплементарность, один (CDR1), содержащую последовательность, показанную в SEQ ID NO: 62, 63, 64, 74, 75, 76, 80, 81, 82, 88, 89, 90, 109, 110, 111, 115, 116, 117, 121, 122, 123, 137, 138, или 139; (ii) VH CDR2, содержащую последовательность, показанную в SEQ ID NO: 70, 71, 77, 78, 83, 84, 86, 87, 91, 92, 112, 113, 118, 119, 124, 125, 127, 128, 140, или 141; и iii) VH CDR3, содержащую последовательность, показанную в SEQ ID NO: 73, 79, 85, 114, 120, 126, 129, или 142, и/или (b) VL область, содержащую (i) VL CDR1, содержащую последовательность, показанную в SEQ ID NO: 149, 156, 159, 162, 165, 182, 185, 187, или 195; (ii) VL CDR2, содержащую последовательность, показанную в SEQ ID NO: 152, 157, 160, 163, 183, 186, 188, или 196; и (iii) VL CDR3, содержащую последовательность, показанную в SEQ ID NO: 153, 158, 161, 164, 184, 189, или 197.
В другом аспекте, предусмотренным является CAR, который специфически связывается с EGFRvIII, где CAR включает внеклеточный связывающий лиганд домен, содержащий: VH область, содержащую VH CDR1, VH CDR2, и VH CDR3 из VH последовательности, показанной в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 30, 32, 34, 35, 37, 39, 41, 43, 44, 46, 48, или 50; и/или VL область, содержащую VL CDR1, VL CDR2, и VL CDR3 из VL последовательности, показанной в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 29, 31, 33, 36, 38, 40, 42, 45, 47, 49, или 51. В некоторых вариантах осуществления, VH и VL являются связанными вместе гибким линкером. В некоторых вариантах осуществления гибкий линкер включает аминокислотную последовательность, показанную в SEQ ID NO: 202.
В некоторых вариантах осуществления, CAR включает внеклеточный связывающий лиганд домен, содержащий: VH область, содержащую VH CDR1, VH CDR2, и VH CDR3 из VH последовательности, показанной в SEQ ID NO: 5, 9, 11, 13, 15, 37, 39, 41, 43, или 48; и/или VL область, содержащую VL CDR1, VL CDR2, и VL CDR3 из VL последовательности, показанной в SEQ ID NO: 6, 10, 12, 14, 16, 38, 40, 42, или 49. В некоторых вариантах осуществления, VH и VL являются связанными вместе гибким линкером. В некоторых вариантах осуществления гибкий линкер включает аминокислотную последовательность, показанную в SEQ ID NO: 202.
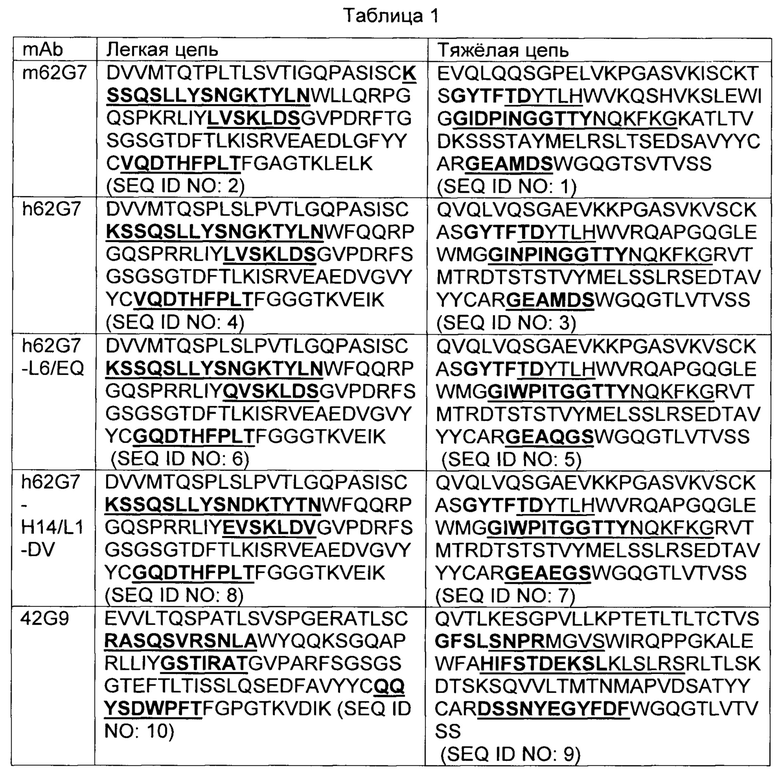
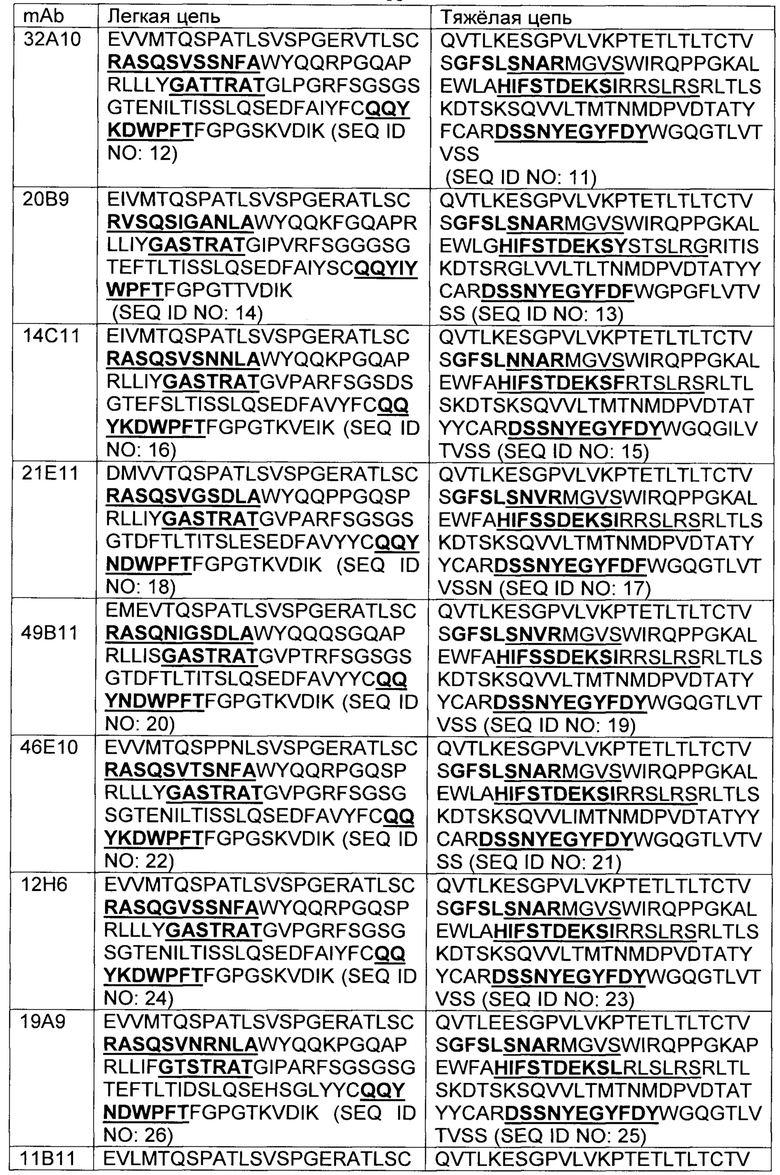
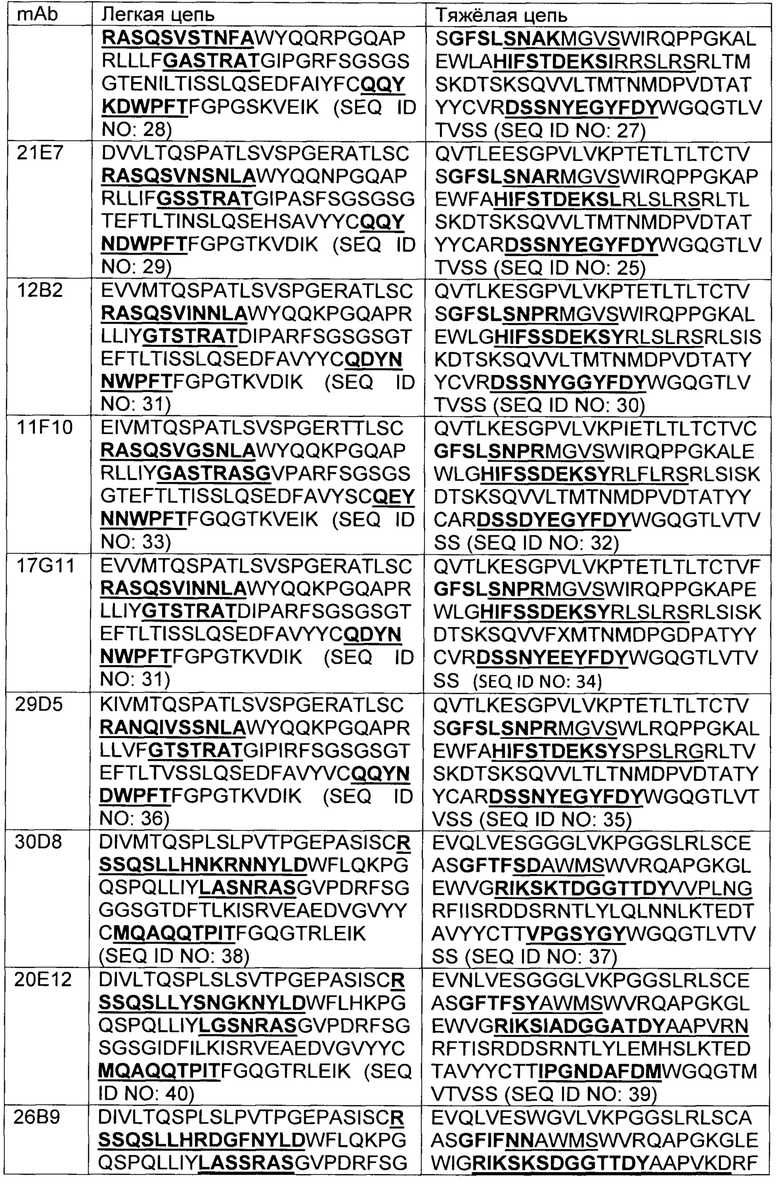
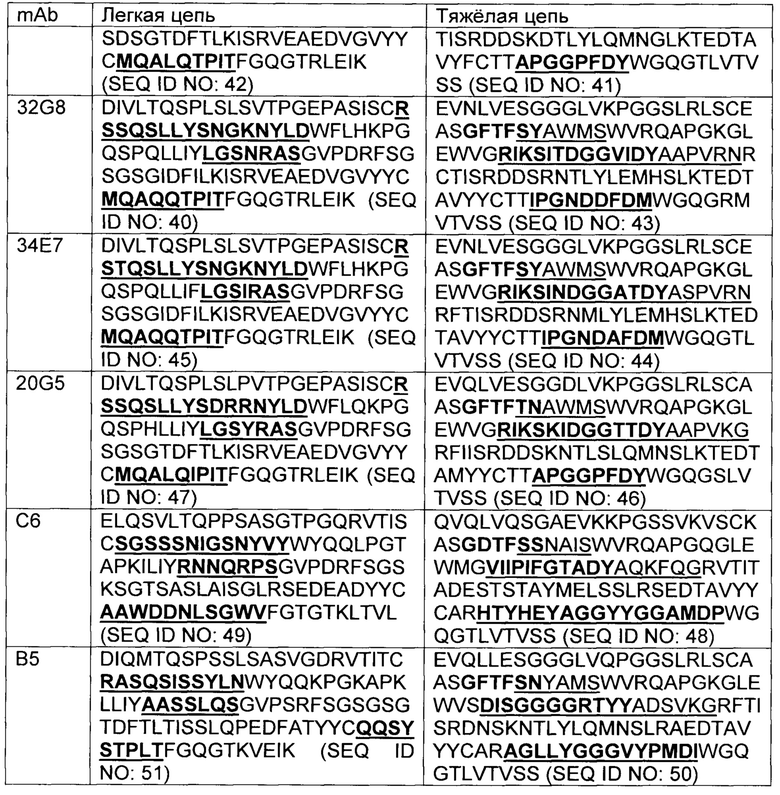
В некоторых вариантах осуществления, CAR согласно изобретению включает внеклеточный связывающий лиганд домен, имеющий какую-либо одну из частичной последовательности легкой цепи, как указано в таблице 1, и/или какую-либо одну из частичной последовательности тяжелой цепи, как указано в таблице 1. В таблице 1, подчеркнутые последовательности представляют собой последовательности CDR в соостветствии с Kabat, и выделены жирным шрифтом - в соостветствии с Chothia. Различные mAb из таблицы 1 также могут упоминаться в данном документе как различные "клоны" анти-EGFRvIII антитела.
Кроме того, предусмотренными в данном документе являются фрагменты CDR внеклеточных связывающих лиганд доменов из CAR с EGFRvIII (включая Chothia, Kabat CDRs, и CDR контактные области). Определение областей CDR хорошо известно квалифицированным специалистам. Понятно, что в некоторых вариантах осуществления, CDR могут представлять собой комбинацию из Kabat и Chothia CDR (также называемую как "комбинированные CR" или "расширенные CDR"). В некоторых вариантах осуществления, CDR представляют собой Kabat CDR. В других вариантах осуществления, CDR представляют собой Chothia CDR. Другими словами, в вариантах осуществления с больше, чем одной CDR, CDR могут представлять собой какой-либо из Kabat, Chothia, комбинаций CDR, или их комбинаций. Таблица 2 представляет примеры последовательностей CDR, предусмотренных в данном документе.
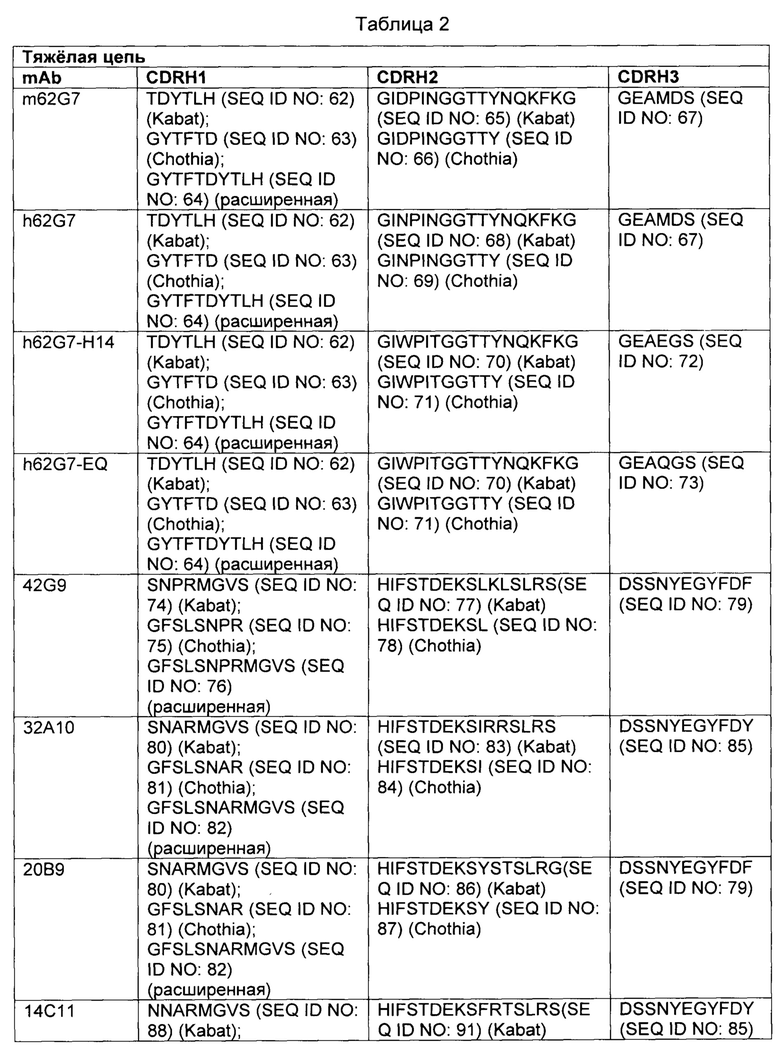
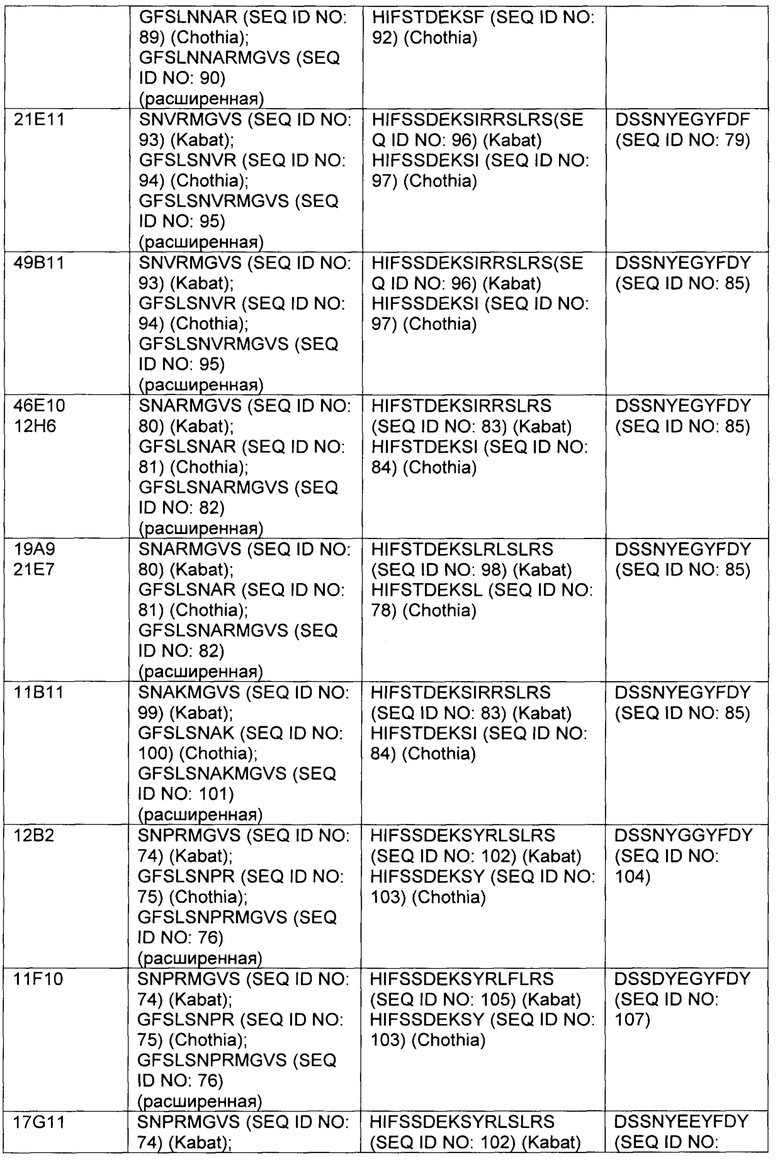
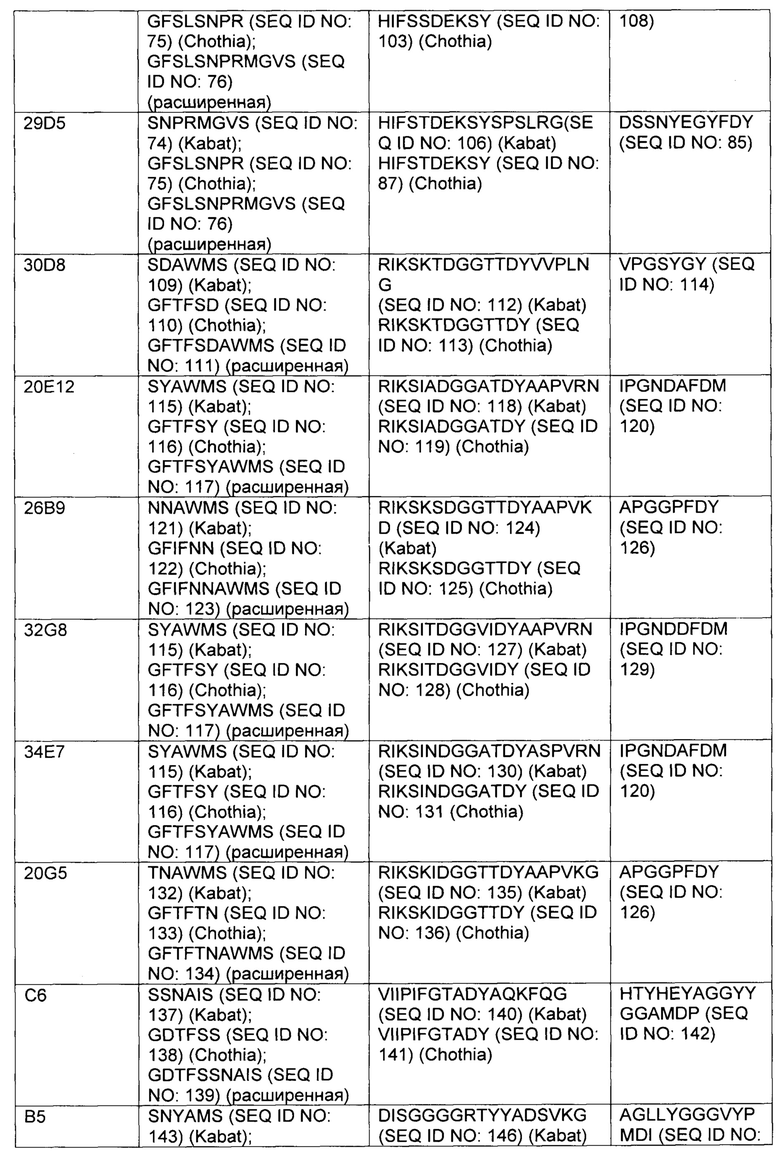
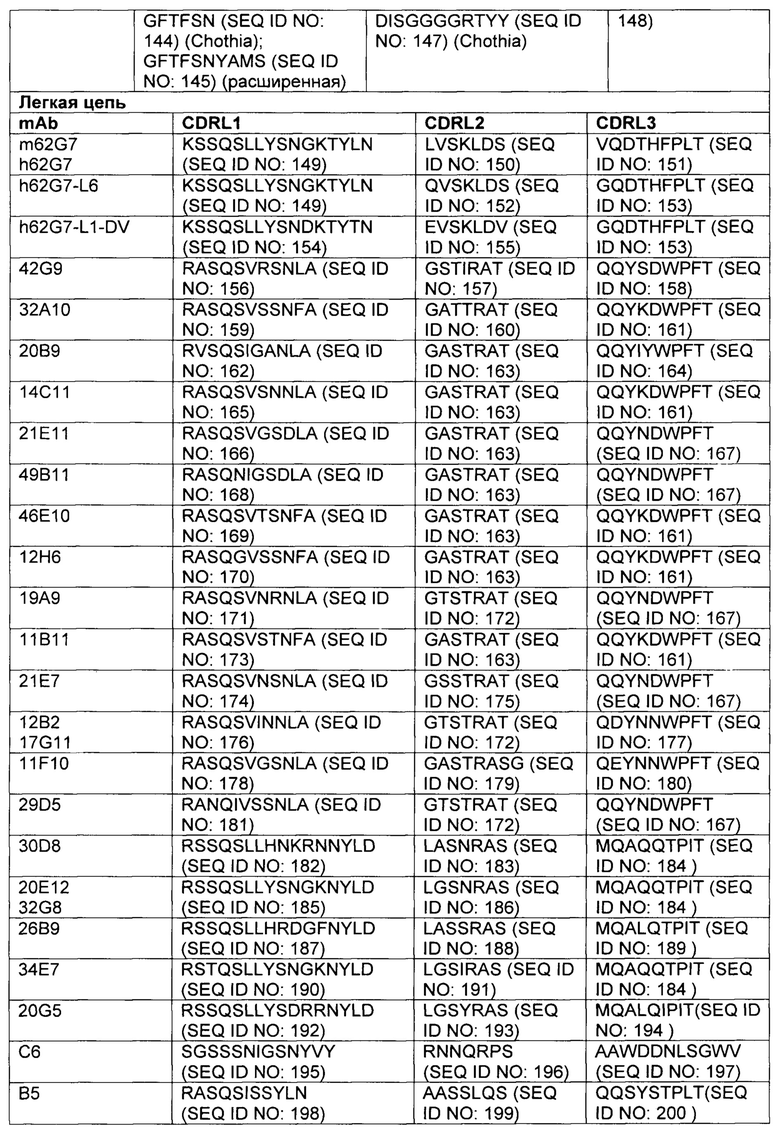
Изобретение охватывает модификации CAR и полипептидов согласно вариантам изобретения, показанных в таблице 1, включая функционально эквивалентные CAR, имеющие модификации, которые не оказывают существенного влияния на их свойства и варианты, которые имеют повышенную или уменьшенную активность и/или аффинность. Например, аминокислотная последовательность может быть мутирована с получением антитела с желаемой аффинностью связывания с EGFRvIII. Модификация полипептидов является обычной практикой в данной области и не нуждается в подробном описании в данном документе. Примеры модифицированных полипептидов включают полипептиды с консервативными замещениями аминокислотных остатков, одну или несколько делеций или добавок аминокислот, которые не оказывают значительного вредного влияния на функциональную активность или которые созревают (усиливают) аффинность полипептида к его лиганду или используют химических аналогов.
Вставки аминокислотной последовательности включают амино- и/или карбокси-терминальные слияния, имеющие длину от одного остатка, с полипептидами, содержащими сто или больше остатков, а также интраспективные вставки одного или нескольких аминокислотных остатков. Примеры терминальных вставок включают антитело с N-терминальным метионильным остатком или антитело, слитое с тегом эпитопа. Другие варианты введения молекулы антитела включают слияние с N- или С-концом антитела фермента или полипептида, который увеличивает период полувыведения антитела из кровообращения.
Варианты замещения имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, и другой остаток вставлен на свое место. Сайты, представляющие наибольший интерес для замещающего мутагенеза, включают гипервариабельные области, но также предполагают изменения FR. Консервативные замены показаны в таблице 3 под заголовком «консервативные замещения». Если такие замены приводят к изменению биологической активности, тогда могут быть введены более существенные изменения, обозначенные «иллюстративные замещения» в таблице 3, или, как описано ниже, применительно к аминокислотным классам, и продукты скринируют. В некоторых вариантах осуществления варианты замены антител, предусмотренных в данном документе, имеют не более 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 консервативное замещение в VH или VL по сравнению с контрольным исходным антителом. В некоторых вариантах осуществления замещения не находятся в пределах области VH или VL CDR.
В некоторых вариантах осуществления, изобретение предусматривает CAR, содержащий внеклеточный связывающий лиганд домен, который связывается с EGFRvIII и конкурирует за связывание с EGFRvIII с антителом, описанным в данном документе, или CAR, описанными в данном документе (например, Таблица 5А), включая m62G7, h62G7, h62G7-H14/L1-DV, h62G7-L6/EQ, 42G9, 32А10, 20В9, 14С11, 21Е11, 49В11, 46Е10, 12Н6, 19А9, 21Е7, 11В11, 12В2, 11F10, 17G11, 29D5, 30D8, 20Е12, 26В9, 32G8, 34Е7, 20G5, С6, и В5.
В некоторых вариантах осуществления, изобретение предусматривает CAR, содержащие части CDR антител с антителами EGFRvIII на основе контактных областей CDR. Контактные области CDR представляют собой области антитела, которые обладают специфичностью к антителу для антигена. Как правило, контактные области CDR включают положения остатков в CDR и зонах Вернье, которые ограничены для того, чтобы поддерживать правильную петлевую структуру антитела для связывания специфического антигена. Смотрите, например, Makabe et al., J. Biol. Chem., 283:1156-1166, 2007. Определение контактных областей CDR хорошо известно специалистам в данной области.
Аффинность связывания (KD) EGFRvIII-специфического CAR, как описано в данном документе, с EGFRvIII (такого как человеческий EGFRvIII (например, (SEQ ID NO: 201)) может составлять от приблизительно 0,001 до приблизительно 5000 нМ. В некоторых вариантах осуществления, аффинность связывания составляет приблизительно какое-либо значение из 5000 нМ, 4500 нМ, 4000 нМ, 3500 нМ, 3000 нМ, 2500 нМ, 2000 нМ, 1789 нМ, 1583 нМ, 1540 нМ, 1500 нМ, 1490 нМ, 1064 нМ, 1000 нМ, 933 нМ, 894 нМ, 750 нМ, 705 нМ, 678 нМ, 532 нМ, 500 нМ, 494 нМ, 400 нМ, 349 нМ, 340 нМ, 353 нМ, 300 нМ, 250 нМ, 244 нМ, 231 нМ, 225 нМ, 207 нМ, 200 нМ, 186 нМ, 172 нМ, 136 нМ, 113 нМ, 104 нМ, 101 нМ, 100 нМ, 90 нМ, 83 нМ, 79 нМ, 74 нМ, 54 нМ, 50 нМ, 45 нМ, 42 нМ, 40 нМ, 35 нМ, 32 нМ, 30 нМ, 25 нМ, 24 нМ, 22 нМ, 20 нМ, 19 нМ, 18 нМ, 17 нМ, 16 нМ, 15 нМ, 12 нМ, 10 нМ, 9 нМ, 8 нМ, 7.5 нМ, 7 нМ, 6.5 нМ, 6 нМ, 5.5 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0.5 нМ, 0.3 нМ, 0.1 нМ, 0,01 нМ, или 0,001 нМ. В некоторых вариантах осуществления, аффинность связывания составляет меньше, чем приблизительно какое-либо значение из 5000 нМ, 4000 нМ, 3000 нМ, 2000 нМ, 1000 нМ, 900 нМ, 800 нМ, 250 нМ, 200 нМ, 100 нМ, 50 нМ, 30 нМ, 20 нМ, 10 нМ, 7.5 нМ, 7 нМ, 6.5 нМ, 6 нМ, 5 нМ, 4.5 нМ, 4 нМ, 3.5 нМ, 3 нМ, 2.5 нМ, 2 нМ, 1.5 нМ, 1 нМ, или 0.5 нМ.
Внутриклеточный сигнальный домен CAR в соответствии с изобретением отвечает за внутриклеточную сигнализацию после связывания внеклеточного связывающего лиганд домена с мишенью, что в результате приводит к активации иммунной клетки и иммунного ответа. Внутриклеточный сигнальный домен обладает способностью активировать, по меньшей мере, одну из нормальных эффекторных функций иммунной клетки, в которой CAR экспрессируется. Например, эффекторная функция Т-клетки может быть цитолитической активностью или хелперной активностью, включая секрецию цитокинов.
В некоторых вариантах осуществления, внутриклеточный сигнальный домен для использования в CAR может представлять собой цитоплазматические последовательности, например, без ограничения, Т-клеточный рецептор и сорецепторы, которые действуют сообща, чтобы инициировать сигнальную трансдукцию после взаимодействия антиген-рецептор, а также какую-либо производную или вариант этих последовательностей и какой-либо синтетической последовательности, которая имеет такую же функциональную способность. Внутриклеточные сигнальные домены содержат два различных класса цитоплазматических сигнальных последовательностей: те, которые инициируют антиген-зависимую первичную активацию, и те, которые действуют антиген-независимым образом, чтобы обеспечить вторичный или со-стимулирующий сигнал. Первичные цитоплазматические сигнальные последовательности могут содержать сигнальные мотивы, которые известны как мотивы активации на основе иммунорецепторного тирозина ITAM. ITAM представляют собой хорошо определенные сигнальные мотивы, обнаруженные во внутрицитоплазматическом хвосте множества рецепторов, которые служат в качестве связующих сайтов для тирозинкиназ класса syk/zap70. Примеры ITAM, используемые в изобретении, могут включать в качестве неограничивающих примеров те, которые получены из TCRζ FcRγ, FcRβ, FcRε, CD3γ, CD3δ, CD3ε, CD5, CD22, CD79a, CD79b и CD66d. В некоторых вариантах осуществления, внутриклеточный сигнальный домен CAR может содержать CD3ζ (дзета) сигнальный домен, который имеет аминокислотную последовательность с, по меньшей мере, приблизительно 70%, предпочтительно, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 90%, 95%, 97%, или 99% идентичностью последовательности с аминокислотной последовательностью, показанной в SEQ. ID NO: 205. В некоторых вариантах осуществления внутриклеточный сигнальный домен CAR согласно изобретению включает домен со-стимулирующей молекулы.
В некоторых вариантах осуществления, внутриклеточный сигнальный домен CAR согласно изобретению включает часть со-стимулирующей молекулы, выбранной из группы, состоящий из фрагмента 41ВВ (GenBank: ААА53133.) и CD28 (NP_006130.1). В некоторых вариантах осуществления, внутриклеточный сигнальный домен CAR согласно изобретению включает аминокислотную последовательность, которая включает, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 90%, 95%, 97%, или 99% идентичность последовательности с аминокислотной последовательностью, показанной в SEQ. ID NO: 213 (CD28 сигнальный домен) или SEQ. ID NO: 204 (4-1ВВ сигнальный домен).
CAR являются экспрессированными на поверхности мембраны клетки. Таким образом, CAR может содержать трансмембранный домен. Приемлемые трансмембранные домены для CAR, раскрытого в данном документе, обладают способностью (а) быть экспрессированными на поверхности клетки, предпочтительно иммунной клетки, такой как, например, без ограничения, лимфоцитные клетки или встречающиеся в природе киллерные (NK) клетки, и (b) взаимодействовать со связывающим лиганд доменом и внутриклеточным сигнальным доменом для направления клеточного ответа иммунной клетки против предварительно определенной клетки-мишени. Трансмембранный домен может быть получен или из природного или из синтетического источника. Трансмембранный домен может быть получен из какому-либо связанного с мембраной или трансмембранного белка. В виде неограничивающих примеров, трансмембранный полипептид может представлять собой субъединицу Т-клеточного рецептора, такую как α, β, γ или δ, полипептид, составляющий CD3 комплекс, IL-2 рецептор р55 (α цепи), р75 (β цепи) или у цепи, цепи субъединицы Fc рецепторов, в частности Feγ рецептора III или CD белков. Альтернативно, трансмембранный домен может быть синтетическим и может содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В некоторых вариантах осуществления указанный трансмембранный домен является производным человеческой CD8α цепи (например, NP_001139345.1). CAR может дополнительно включать стеблевой домен между внеклеточным связывающим лиганд доменом и указанным трансмембранным доменом. Стеблевой домен может включать вплоть до 300 аминокислот, предпочтительно от 10 до 100 аминокислот и наиболее предпочтительно от 25 до 50 аминокислот. Стеблевая область может быть производной от всех или части встречающихся в природе молекул, например, всей или части внеклеточной области CD8, CD4, или CD28, или всей или части константной области антитела. Альтернативно стеблевой домен может представлять собой синтетическую последовательность, которая соответствует встречающейся в природе стеблевой последовательности, или может представлять собой полностью синтетическую стеблевую последовательность. В некоторых вариантах осуществления указанный стеблевой домен представляет собой часть человеческой CD8α цепи (например, NP_001139345.1). В другом конкретном варианте осуществления, указанный трансмембранный и шарнирный домены включают часть человеческой CD8α цепи, предпочтительно, которая включает, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 90%, 95%, 97%, или 99% идентичность последовательности с аминокислотной последовательностью, показанной в SEQ ID NO: 210 и SEQ ID NO: 208, соответственно. В некоторых вариантах осуществления, CAR, раскрытые в данном документе, могут содержать внеклеточный, связывающий лиганд домен, который специфически связывает EGFRvIII, CD8α человеческий шарнирный и трансмембранный домены, CD3ζ сигнальный домен, и 4-1ВВ сигнальный домен.
Таблица 4 представляет иллюстративные последовательности доменов, которые могут быть использованы в CAR, раскрытых в данном документе.


Таблица 5А представляет аминокислотные последовательности иллюстративных EGFRvIII-специфических CAR согласно представленному изобретению. В Таблице 5А, сигнальная/лидерная пептидная последовательность выделена жирным шрифтом, и GS линкер [(GGGGS)4 (SEQ ID NO: 202)] подчеркивается.

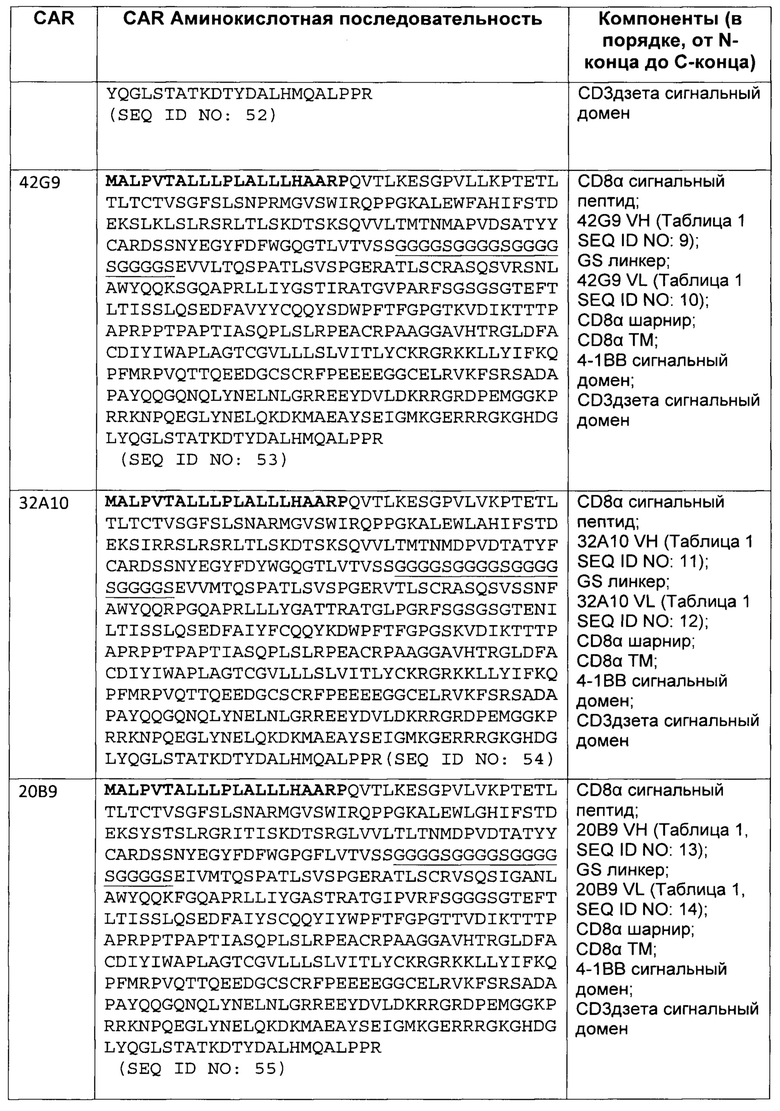

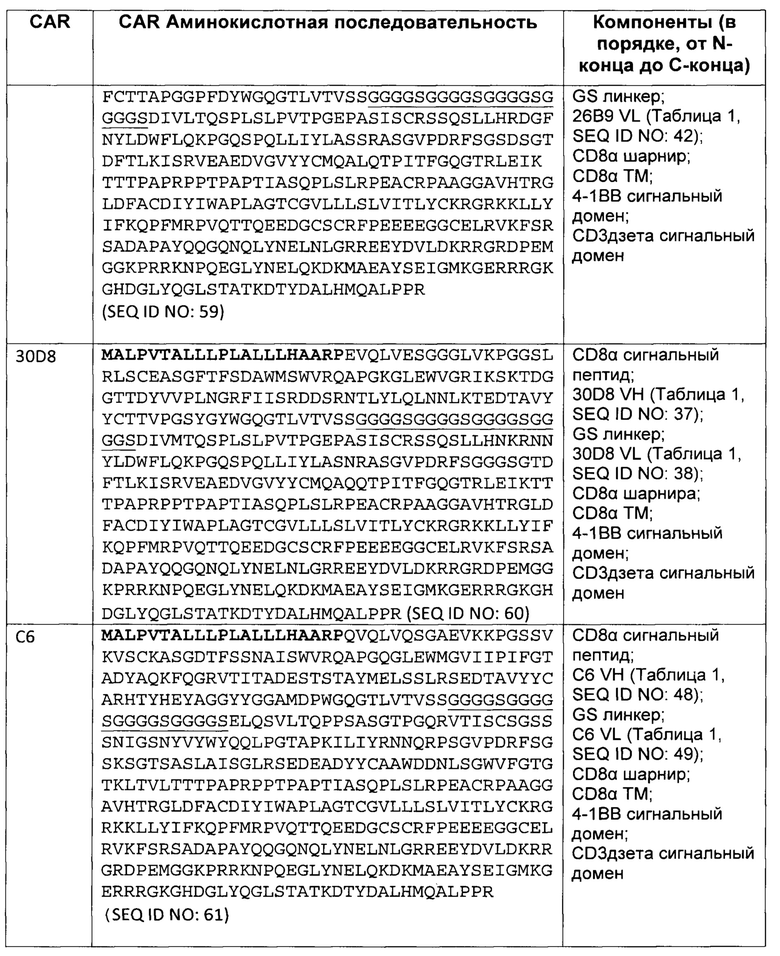
Таблица 5В представляет последовательности нуклеиновых кислот иллюстративных scFvs EGFRvIII-специфических CAR согласно представленному изобретению. В Таблице 5В, последовательность, кодирующая CD8α сигнальный/лидерный пептид, подчеркивается.

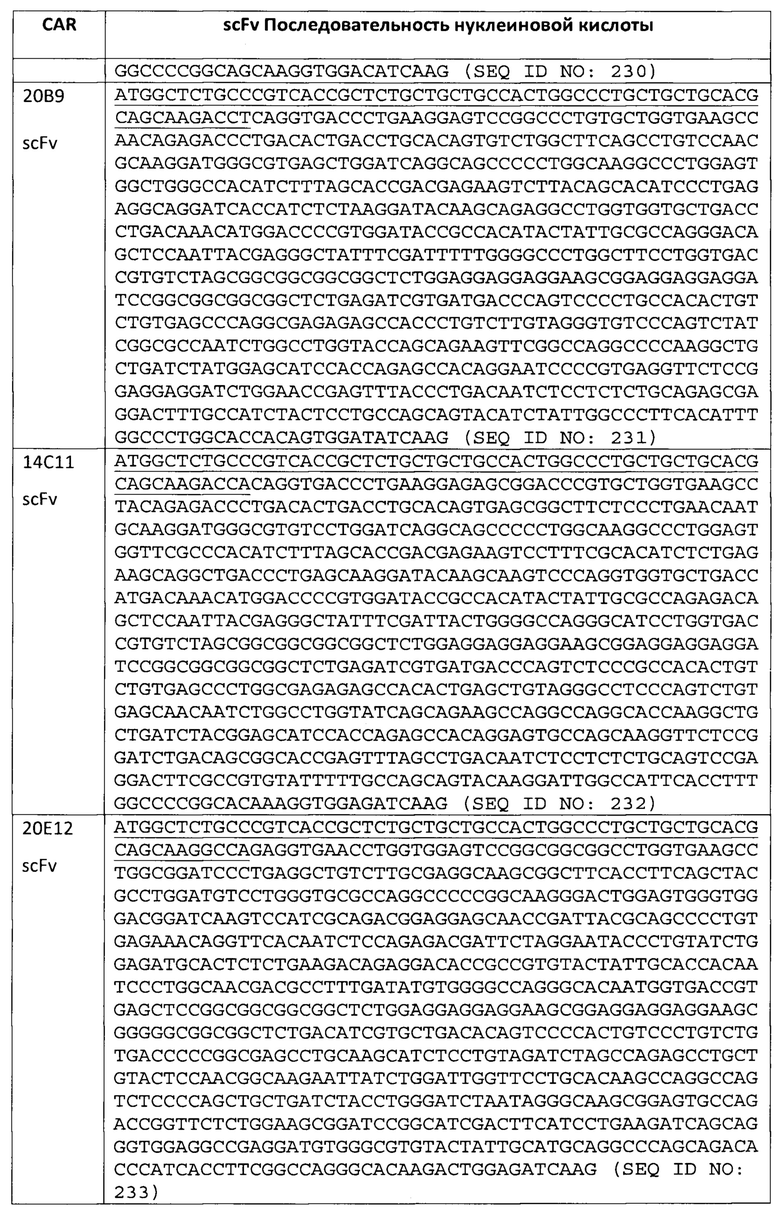

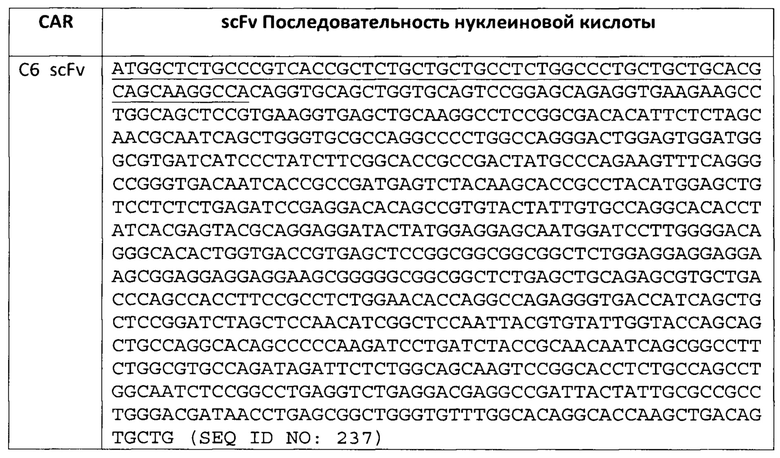
Таблица 5С представляет иллюстративные последовательности нуклеиновых кислот иллюстративных EGFRvIII-специфических CAR согласно представленному изобретению.









Даунрегуляция или мутация целевых антигенов обычно наблюдается в раковых клетках, что приводит к созданию вариантов антигена-утраченного ускользания. Таким образом, чтобы компенсировать ускользание опухоли и сделать иммунную клетку более специфической для мишени, EGFRvIII-специфический CAR может содержать один или несколько дополнительных внеклеточных связывающих лиганд доменов, чтобы одновременно связывать различные элементы в мишени, тем самым увеличивая активацию и функцию иммунной клетки. В одном варианте осуществления внеклеточные лигандсвязывающие домены могут быть расположены в тандеме на одном и том же трансмембранном полипептиде и необязательно могут быть разделены линкером. В некоторых вариантах осуществления указанные различные внеклеточные связывающие лиганд домены могут быть расположены на различных трансмембранных полипептидах, составляющих CAR. В некоторых вариантах осуществления изобретение относится к популяции CAR, причем каждый CAR содержит другой внеклеточный связывающий лиганд домен. В частности, изобретение касается способа конструирования иммунных клеток, который включает обеспечение иммунной клетки и экспресирование на поверхности клетки популяции CAR, причем каждый CAR содержит различные внеклеточные связывающие лиганд домены. В другом конкретном варианте осуществления, изобретение касается способа конструирования иммунной клетки, который включает обеспечение иммунной клетки и введение в клетку полинуклеотидов, кодирующих полипептиды, содержащие популяцию CAR, причем каждый из них содержит различные внеклеточные связывающие лиганд домены. Под популяцией CAR, имеется в виду, по меньшей мере, два, три, четыре, пять, шесть или больше CAR, причем каждый из которых содержит различные внеклеточные связывающие лиганд домены. Различные внеклеточные связывающие лиганд домены в соответствии с изобретением могут предпочтительно одновременно связывать различные элементы в мишени, тем самым, увеличивая активацию и функцию иммунной клетки. Изобретение также касается выделенной иммунной клетки, которая включает популяцию CAR, причем каждый из которых содержит различные внеклеточные связывающие лиганд домены.
В другом аспекте, изобретение предусматривает полинуклеотиды, кодирующиу какие-либо CAR и полипептиды, описанные в данном документе. Полинуклеотиды могут быть получены и экспрессированы согласно процедурам, известным в данной области.
В другом аспекте, изобретение предусматривает композиции (такие как фармацевтические композиции), содержащие какие-либо клетки согласно изобретению. В некоторых вариантах осуществления, композиция включает клетку, содержащую полинуклеотид, кодирующий какой-либо из CAR, описанных в данном документе.
Векторы экспрессии, и введение полинуклеотидных композиций далее описываются в данном документе.
В другом аспекте, изобретение предусматривает способ получения какого-либо из полинуклеотидов, описанных в данном документе.
Полинуклеотиды, комплементарные к каким-либо таким последовательностям, также охватываются изобретением. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой ДНК (геномную, кДНК или синтетическую) или молекулы РНК. Молекулы РНК включают молекулы гяРНК, которые содержат интроны и соответствуют молекуле ДНК во взаимнооднозначной манере, и молекулы мРНК, которые не содержат интронов. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно, присутствовать в полинуклеотиде согласно изобретению, и полинуклеотид может, но не обязательно, быть связан с другими молекулами и/или материалами носителя.
Полинуклеотиды могут включать нативную последовательность (то есть, эндогенную последовательность, которая кодирует антитело или его часть) или могут включать вариант такой последовательности. Полинуклеотидные варианты содержат одно или несколько замещений, добавлений, делеций и/или вставок, таким образом, что иммунореактивность кодированного полипептида не уменьшается по сравнению с нативной иммунореактивной молекулой. Влияние на иммунореактивность кодированного полипептида обычно может быть оценено, как описано в данном документе. Варианты предпочтительно демонстрируют, по меньшей мере, приблизительно 70% идентичность, более предпочтительно, по меньшей мере, приблизительно 80% идентичность, еще более предпочтительно, по меньшей мере, приблизительно 90% идентичность, и наиболее предпочтительно, по меньшей мере, приблизительно 95% идентичность к полинуклеотидной последовательности, которая кодирует нативное антитело или его часть.
Две полинуклеотидные или полипептидные последовательности, как указано, являются "идентичными", если последовательность нуклеотидов или аминокислот в двух последовательностях одинакова, когда выровнены для максимального соответствия, как описано ниже. Сравнение двух последовательностей обычно выполняется путем сравнения последовательностей над окном сравнения для идентификации и сравнения локальных областей сходства последовательностей. «Окно сравнения», как используется в данном документе, относится к сегменту из, по меньшей мере, приблизительно 20 смежных положений, обычно от 30 до приблизительно 75, или от 40 до приблизительно 50, в котором последовательность может сравниваться с эталонной последовательностью из такого же количества смежных положений после того, как две последовательности оптимально выровнены.
Оптимальное выравнивание последовательностей для сравнения может быть проведено с использованием программы Megalign в пакете программного обеспечения биоинформатики Lasergene (DNASTAR, Inc., Madison, WI) с использованием параметров по умолчанию. Данная программа воплощает несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, М.О., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E.D., 1971, Comb. Theor. 11:105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
Предпочтительно, "процент идентичности последовательности" определяют путем сравнения двух оптимально выровненных последовательностей над окном сравнения, по меньшей мере, из 20 положений, причем часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать 20 процентов или меньше добавлений или делеций (то есть, пропусков), как правило, от 5 до 15 процентов, или от 10 до 12 процентов, по сравнению с эталонными последовательностями (которые не содержат добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывается путем определения количества положений, в которых идентичные основания нуклеиновых кислот или аминокислотный остаток встречаются в обеих последовательностях для того, чтобы получить количество согласованных положений, причем количество согласованных положений делят на общее количество положений в эталонной последовательности (то есть размер окна) и полученный результат умножают на 100, получая процент идентичности последовательности.
Варианты могут также или, альтернативно, быть по существу гомологичными нативному гену, или его части, или комплементу. Такие полинуклеотидные варианты способны гибридизоваться в умеренно жестких условиях с встречающейся в природе последовательностью ДНК, кодирующей нативное антитело (или комплементарной последовательностью).
Приемлемые "умеренно жесткие условия" включают предварительную промывку в растворе 5 X SSC, 0.5% SDS, 1,0 мМ ЭДТА (рН 8,0); гибридизацию при 50°С-65°С, 5 X SSC, в течение ночи; с последующим промыванием дважды при 65°С в течение 20 минут с каждым из 2Х, 0.5Х и 0.2Х SSC, содержащим 0.1% SDS.
Как используется в данном документе, "очень жесткие условия" или "условия высокой жесткости" представляют собой те, которые: (1) используют низкую ионную силу и высокую температуру для промывания, например 0,015 М хлорида натрия / 0,0015 М цитрата натрия / 0,1% додецилсульфата натрия при 50°С; (2) используют во время гибридизации денатурирующий агент, такой как формамид, например, 50% (об./об.) формамида с 0,1% бычьего сывороточного альбумина / 0,1% Ficoll / 0,1% поливинилпирролидона / 50 мМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) используют 50% формамид, 5 × SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфата натрия, 5 × раствора Денхардта, ДНК спермы лосося, обработанной ультразвуком (50 мкг/мл), 0,1% SDS и 10% декстрансульфата при 42°C с промыванием при 42°С в 0,2 × SSC (хлорид натрия/цитрат натрия) и 50% формамида при 55°C с последующим промыванием с высокой жесткостью, включающим 0,1 × SSC, содержащий ЭДТА при 55°C. Специалист в данной области будет знать, как регулировать температуру, ионную силу и т.д., по мере необходимости для учета таких факторов, как длина зонда и тому подобное.
Специалистам в данной области техники будет понятно, что в результате вырождения генетического кода существует много нуклеотидных последовательностей, которые кодируют полипептид, как описано в данном документе. Некоторые из данных полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью какого-либо нативного гена. Тем не менее, полинуклеотиды, которые различаются в зависимости от различий в использовании кодонов, специально рассматриваются изобретением. Кроме того, аллели генов, содержащих полинуклеотидные последовательности, представленные в данном документе, входят в объем изобретения. Аллелы представляют собой эндогенные гены, которые изменяются в результате одной или нескольких мутаций, таких как делеции, добавления и/или замещения нуклеотидов. Полученная в результате мРНК и белок могут, но необязательно, иметь измененную структуру или функцию. Аллелы могут быть идентифицированы с использованием стандартных методов (таких как гибридизация, амплификация и/или сравнение последовательностей из базы данных).
Полинуклеотиды согласно данному изобретению могут быть получены с использованием химического синтеза, рекомбинантных способов или ПЦР. Способы химического полинуклеотидного синтеза хорошо известны в данной области и не нуждаются в подробном описании в данном документе. Квалифицированный специалист в данной области может использовать последовательности, предусмотренные в данном документе, и коммерческий синтезатор ДНК для получения желаемой последовательности ДНК.
Для получения полинуклеотидов с использованием рекомбинантных способов, полинуклеотид, содержащий желаемую последовательность, может быть вставлен в подходящий вектор, и вектор, в свою очередь, может быть введен в подходящую клетку-хозяин для репликации и амплификации, как дополнительно обсуждается в данном документе. Полинуклеотиды могут быть вставлены в клетки-хозяева какими-либо способами, известными в данной области. Клетки трансформируют за счет введения экзогенного полинуклеотида путем прямого поглощения, эндоцитоза, трансфекции, F-спаривания или электропорации. После введения экзогенный полинуклеотид может поддерживаться внутри клетки как неинтегрированный вектор (такой как плазмида) или интегрироваться в геном клетки-хозяина. Полинуклеотид, амплифицированный таким образом, может быть выделен из клетка-хозяина по способу хорошо известному в данной области. Смотрите, например, Sambrook et al., 1989.
Альтернативно, ПЦР позволяет воспроизводить последовательности ДНК. ПЦР-технология хорошо известна в данной области и описана в патентах США №№4,683,195, 4,800,159, 4,754,065 и 4,683,202, а также ПЦР: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК может быть получена с использованием выделенной ДНК в соответствующем векторе и введением ее в приемлемую клетку-хозяин. Когда клетка реплицируется и ДНК транскрибируется в РНК, РНК затем может быть выделена с использованием способов, хорошо известных специалистам в данной области, как указано, например, в Sambrook et al., 1989, supra.
Подходящие векторы клонирования могут быть сконструированы в соответствии со стандартными методиками или могут быть выбраны из большого количества векторов клонирования, доступных в данной области. Хотя выбранный вектор клонирования может варьироваться в зависимости от клетки-хозяина, предназначенной для использования, полезные векторы клонирования, как правило, обладают способностью к саморепликации, могут обладать одной мишенью для конкретной рестрикционной эндонуклеазы и/или могут нести гены для маркера, которые могут быть использованы при выборе клонов, содержащих вектор. Подходящие примеры включают плазмиды и бактериальные вирусы, например pUC18, pUC19, Bluescript (например, pBS SK+) и его производные, mp18, mp19, pBR322, рМВ9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и рАТ28. Эти и многие другие векторы клонирования доступны от коммерческих поставщиков, таких как BioRad, Strategene, и Invitrogen.
Векторы экспрессии, как правило, представляют собой реплицируемые полинуклеотидные конструкты, которые содержат полинуклеотид в соответствии с изобретением. Подразумевается, что вектор экспрессии должен быть реплицируемым в клетках-хозяевах либо в виде эписом, либо как неотъемлемая часть хромосомной ДНК. Приемлемые векторы экспрессии включают, но не ограничиваются этим, плазмиды, вирусные векторы, включая аденовирусы, адено-ассоциированные вирусы, ретровирусы, космиды и экспрессирующий вектор(ы), раскрытые в публикации РСТ № WO 87/04462. Векторные компоненты могут, как правило, включать, но не ограничиваются этим, одно или несколько из следующего: сигнальной последовательности; точки начала репликации; одного или нескольких маркерных генов; подходящих контролирующих транскрипцию элементов (таких как промоторы, энхансеры и терминатор). Для экспрессии (то есть, трансляции), как правило, требуются один или несколько трансляционных управляющих элементов, таких как сайты связывания рибосомы, сайты инициации трансляции и стоп-кодоны.
Векторы, содержащие интересующие полинуклеотиды, могут быть введены в клетку-хозяина по какому-либо из ряда подходящих способов, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микрочастицами; липофекцию; и инфицирование (например, когда вектор является инфекционным агентом, таким как вирус осповакцины). Выбор введения векторов или полинуклеотидов будет часто зависеть от особенностей клетки- хозяина.
Полинуклеотид, кодирующий EGFRvIII-специфический CAR, раскрытый в данном документе может существовать в кассете экспрессии или векторе экспрессии (например, плазмиде для введения в бактериальную клетку-хозяин или вирусном векторе, таком как вектор бакуловируса для трансфекции клетки-хозяина насекомого, или плазмиды или вирусного вектора, такого как лентивирус для трансфекции клетки-хозяина млекопитающего). В некоторых вариантах осуществления, полинуклеотид или вектор может включать последовательность нуклеиновой кислоты, кодирующую рибосомные скачущие последовательности, такте как, например без ограничения, последовательность, кодирующую 2А пептид. 2А пептиды, которые были идентифицированы в подгруппе афтовирусов пикорнавирусов, вызывают рибосомальное "проскакивание" от одного кодона к другому без образования пептидной связи между двумя аминокислотами, кодируемыми кодонами (смотрите (Donnelly и Elliott 2001; Atkins, Wills et al. 2007; Doronina, Wu et al. 2008)). Под «кодоном» понимают три нуклеотида на мРНК (или на смысловой цепи молекулы ДНК), которые транслируются рибосомой в один аминокислотный остаток. Таким образом, два полипептида могут быть синтезированы из единственной непрерывной открытой рамки считывания в пределах imPHK, когда полипептиды разделены олигопептидной последовательностью 2А, которая находится в рамке. Такие механизмы рибосомного проскальзывания хорошо известны в данной области и, как известно, используются несколькими векторами для экспрессии нескольких белков, кодируемых одной информационной РНК.
Для того, чтобы направлять трансмембранные полипептиды в секреторный путь клетки-хозяина, в некоторых вариантах осуществления секреторная сигнальная последовательность (также известная как сигнальный пептид, лидерная последовательность, препро последовательность или пре-последовательность) предоставляется в полинуклеотидной последовательности или векторной последовательности. Секреторная сигнальная последовательность функционально связана с последовательностью трансмембранной нуклеиновой кислоты, то есть две последовательности соединяются в правильной рамке считывания и позиционируются так, чтобы направлять вновь синтезированный полипептид в секреторный путь клетки-хозяина. Секреторные сигнальные последовательности обычно расположены в 5' положении к последовательности нуклеиновой кислоты, кодирующей представляющий интерес полипептид, хотя некоторые секреторные сигнальные последовательности могут быть расположены в другом месте интересующей последовательности нуклеиновой кислоты (смотрите, например, Welch et al., патент США №5,037,743, Holland et al., Патент США №5,143,830). В некоторых вариантах осуществления сигнальный пептид включает аминокислотную последовательность, показанную в SEQ ID NO: 206 или 214. Квалифицированному специалисту в данной области будет понятно, что принимая вов внимание вырождение генетического, существенная вариация последовательности возможно находится среди данных полинуклеотидных молекул. В некоторых вариантах осуществления, последовательности нуклеиновых кислот согласно изобретению являются кодон-оптимизированными для экспрессии в клетках млекопитающих, предпочтительно для экспрессии в клетках человека. Кодон-оптимизация относится к обмену в последовательности интерисующих кодонов, которые обычно встречаются редко в высоко экспрессированных генах данного вида кодонами, которые, как правило, встречаются в высоко экспрессируемых генах таких видов, причем такие кодоны, кодирующие идентичные аминокислоты в качестве кодонов, которыми обмениваются.
Способы конструирования иммунной клетки
Предусмотренными в данном документе являются способы получения иммунных клеток для использования в иммунотерапии. В некоторых вариантах осуществления, способы включают введение CAR в соответствии с изобретением в иммунные клетки, и расширение клеток. В некоторых вариантах осуществления, изобретение касается способа конструирования иммунной клетки, включающий: обеспечение клетки и экспресирование на поверхности клетки, по меньшей мере, одного CAR, как описывается выше. Способы конструирования иммунных клеток описывается в, например, в публикациях патентной заявки РСТ №№WO/2014/039523, WO/2014/184741, WO/2014/191128, WO/2014/184744, и WO/2014/184143, каждая их которых включена в данный документ в качестве ссылки во всей полноте. В некоторых вариантах осуществления, способ включает: трансформирование клетки, по меньшей мере, одним полинуклеотидом, кодирующим CAR как описано выше, и экспресирование полинуклеотидов в клетке.
В некоторых вариантах осуществления полинуклеотиды присутствуют в лентивирусных векторах для стабильной экспрессии в клетках.
В некоторых вариантах осуществления, способ может дополнительно включать стадию генетического модифицирования клетки путем инактивирования, по меньшей мере, одного гена, экспресирующего, например, без ограничения, компонент TCR, мишень для иммуносупрессивного агента, HLA ген, и/или белок иммунных контрольных точек, такой как, например, PDCD1 или CTLA-4. Путем инактивирования гена предполагается, что интересующий ген не экспрессируется в функциональной белковой форме. В некоторых вариантах осуществления ген, подлежащий инактивации, выбирают из группы, состоящей, например, без ограничения, из TCRα, TCRβ, dCK, CD52, GR, PD-1, и CTLA-4. В некоторых вариантах осуществления способ включает инактивирование одного или нескольких генов путем введения в клетки редкорежущей эндонуклеазы, способной избирательно инактивировать ген за счет селективного расщепления ДНК. В некоторых вариантах осуществления редкорежущая эндонуклеаза может представлять собой, например, транскрипционную активатор-подобную эффекторную нуклеазу (TALE-нуклеазу) или Cas9 эндонуклеазу.
В некоторых вариантах осуществления дополнительный каталитический домен используется с редкорежущей эндонуклеазой для повышения его способности к инактивации целевых генов. Например, дополнительный каталитический домен может быть ферментом, обрабатывающим конечную ДНК. Неограничивающие примеры ферментов, обрабатывающих конечную ДНК, включают 5-3'экзонуклеазы, 3-5'экзонуклеазы, 5-3'щелочные экзонуклеазы, 5' лоскутные эндонуклеазы, геликазы, фосфатазы, гидролазы и не зависящие от матрицы ДНК-полимеразы. Неограничивающие примеры такого каталитического домена включают белковый домен или каталитически активные производные белкового домена, выбранный из группы, состоящей из hExoI (EXO1_HUMAN), дрожжевого ExoI (EXO1_YEAST), Е. coli Exol, человеческого TREX2, мышиного TREX1, человеческого TREX1, бычьего TREX1, крысиного TREX1, TdT (терминальная дезоксинуклеотидилтрансфераза) человеческого DNA2, дрожжевого DNA2 (DNA2_YEAST). В некоторых вариантах осуществления, дополнительный каталитический домен может иметь 3'-5'-экзонуклеазную активность, и в некоторых вариантах осуществления, указанный дополнительный каталитический домен представляет собой TREX, более предпочтительно - TREX2 каталитический домен (WO 2012/058458). В некоторых вариантах осуществления, указанный каталитический домен кодирован одноцепочечным TREX полипептидом. Дополнительный каталитический домен может быть слитым с нуклеазным слитым белком или химерные белком. В некоторых вариантах осуществления, дополнительный каталитический домен слит с использованием, например, пептидного линкера.
В некоторых вариантах осуществления, способ дополнительно включает стадию введение в клетки экзогенной нуклеиновой кислоты, содержащей, по меньшей мере, последовательность гомологичную части последовательности нуклеиновой кислоты мишени, таким образом, что происходит гомологичная рекомбинация между последовательностью нуклеиновой кислоты мишени и экзогенной нуклеиновой кислоты. В некоторых вариантах осуществления, указанная экзогенная нуклеиновая кислота включает первую и вторую части, которые являются гомологичными к области 5' и 3' последовательности нуклеиновой кислоты мишени, соответственно. Экзогенная нуклеиновая кислота также может включать третью часть, расположенную между первой и второй частью, которая не включает никакой гомологии с областями 5' и 3' последовательности нуклеиновой кислоты мишени. После расщепления последовательности нуклеиновой кислоты мишени, гомологичное событие рекомбинации стимулируется между последовательностью нуклеиновой кислоты мишени и экзогенной нуклеиновой кислотой. В некоторых вариантах осуществления, гомологичные последовательности из, по меньшей мере, приблизительно 50 пар оснований, больше, чем приблизительно 100 пар оснований, или больше, чем приблизительно 200 пар оснований могут использоваться в пределах донорного матрикса. Экзогенная нуклеиновая кислота может состоять, например, без ограничения, из от приблизительно 200 пар оснований до приблизительно 6000 пар оснований, более предпочтительно от приблизительно 1000 пар оснований до приблизительно 2000 пар оснований. Общие гомологии нуклеиновых кислот расположены в областях, фланкирующих против хода транскрипции и по ходу транскрипции от сайта разрыва, и последовательность нуклеиновой кислоты, которая должна быть введена, располагается между двумя плечами.
В некоторых вариантах осуществления нуклеиновая кислота последовательно включает первую область гомологии с последовательностями против хода транскрипции указанного расщепления; последовательность для инактивации целевого гена, выбранного из группы, состоящей из TCRα, TCR(3, CD52, глюкокортикоидного рецептора (GR), дезоксицитидинкиназы (dCK) и белка иммунных контрольных точек, такого как, например, запрограммированная смерть-1 (PD-1); и вторую область гомологии к последовательностям по ходу транскрипции расщепления. Стадия введения полинуклеотида может быть одновременной до или после введения или экспрессии редкорежущей эндонуклеазы. В зависимости от местоположения последовательности нуклеиновой кислоты мишени, в которой произошло событие прерывания, такую экзогенную нуклеиновую кислоту могут использоваться для нокаут гена, например, когда экзогенная нуклеиновая кислота находится в пределах открытой рамки считывания гена или вводятся новые последовательности или гены, представляющие интерес. Последовательные вставки с использованием такой экзогенной нуклеиновой кислоты могут быть использованы для модификации целевого существующего гена путем коррекции или замены гена (замены аллеля в качестве неограничивающего примера) или для повышения или понижения регуляции экспрессии целевого гена (промоторный обмен в качестве неограничивающего примера), коррекция или замена целевого гена. В некоторых вариантах осуществления, инактивация генов, выбранных из группы, состоящей из TCRα, TCRβ, CD52, GR, dCK, и белков иммунных контрольных точек, может быть выполнена в точном геномном расположении, целенаправленном специфической TALE-нуклеазой, причем указанная специфическая TALE-нуклеаза катализирует расщепление, и где экзогенная нуклеиновая кислота, последовательно содержащая, по меньшей мере, область гомологии и последовательность для инактивации одного целевого гена, выбранного из группы, состоящий из TCRα, TCRβ, CD52, GR, dCK, белков иммунных контрольных точек, которые интегрированы гомологичными рекомбинациями. В некоторых вариантах осуществления, несколько генов могут быть, последовательно или в одно и то же время, инактивированы за счет использования нескольких TALE-нуклеаз, соответственно и специально нацеливаются на один определенный ген и несколько конкретных полинуклеотидов для специфической инактивации гена.
В некоторых вариантах осуществления, способ включает инактивирование одного или больше дополнительных генов, выбранных из группы, состоящий из TCRα, TCRβ, CD52, GR, dCK, и белков иммунных контрольных точек. В некоторых вариантах осуществления, инактивирование гена может быть осуществлено путем введения в клетки, по меньшей мере, одной редкорежущей эндонуклеазы, таким образом, что редкорежущая эндонуклеаза специфически катализирует расщепление в целевой последовательности клеточного генома; и необязательно, введение в клетки экзогенной нуклеиновой кислоты, последовательно содержащей первую область гомологии к последовательностям, против хода транскрипции расщепления, последовательности, которая должна быть вставлена в геном клетки, и вторую область гомологии к последовательностям по ходу транскрипции расщепления; причем введенная экзогенная нуклеиновая кислота инактивирует ген и интегрирует, по меньшей мере, одну экзогенную полинуклеотидную последовательность, кодирующую, по меньшей мере, один рекомбинантный белок, вызывающий интерес. В некоторых вариантах осуществления, экзогенная полинуклеотидная последовательность интегрируется в ген, кодирующий белок, выбранный из группы, состоящий из TCRα, TCRβ, CD52, GR, dCK, и белок иммунных контрольных точек.
В другом аспекте, стадия генетического модифицирования клетки может включать: модифицирование Т клетки путем инактивирования, по меньшей мере, одного гена, экспресирующего мишень для иммуносупрессивного агента, и; расширение клеток, необязательно в присутствии иммуносупрессивного агента. Иммуносупрессивный агент представляет собой агент, который подавляет иммунную функцию по одному из нескольким механизмам действия. Иммунодепрессивный агент может уменьшить степень и/или ненасытность иммунного ответа. Неограничивающие примеры иммуносупрессивных агентов включают ингибиторы кальциневрина, мишени рапамицина, блокаторы α-цепи интерлейкина-2, ингибиторы инозин-монофосфатдегидрогеназы, ингибиторы дигидрофолиевой кислоты редуктазы, кортикостероиды и иммуносупрессивные антиметаболиты. Некоторые цитотоксические иммунодепрессанты действуют путем ингибирования синтеза ДНК. Другие могут действовать посредством активации Т-клеток или путем ингибирования активации хелперных клеток. Способы в соответствии с изобретение позволяют придавать иммунодепрессивную резистентность к Т-клеткам для иммунотерапии путем инактивирования мишени иммуносупрессивного агента в Т клетках. В качестве неограничивающих примеров, мишени для иммуносупрессивного агента могут представлять собой рецептор для иммуносупрессивного агента, такой как, например, без ограничения CD52, глюкокортикоидный рецептор (GR), члены семейства генов FKBP, и члены семейства генов циклофилина.
В некоторых вариантах осуществления генетическая модификация способа включает экспрессию в предоставленных клетках для инженерии одной редкорежущей эндонуклеазы, так что редкорежущая эндонуклеаза специфически катализирует расщепление в одном целевом геном, тем самым инактивируя целевой ген. В некоторых вариантах осуществления, способ конструирования клетки включает, по меньшей мере, одну из следующих стадий: обеспечение Т клетки, такой как из клеточной культуры или из образца крови; выбор гена в Т-клетке, экспрессирующей мишень для иммуносупрессивного агента; введение в Т-клетку редкорежущей эндонуклеазы, способной селективно инактивировать за счет ДНК расщепления, предпочтительно, за счет двухцепочечного разрыва гена, кодирующего мишень для иммуносупрессивного агента, и расширение клеток, необязательно в присутствии иммуносупрессивного агента.
В некоторых вариантах осуществления, способ включает: обеспечение Т-клетки, такой как из клеточной культуры или из образца крови; выбор гена в Т-клетке, причем ген экспрессирует мишень для иммуносупрессивного агента; трансформирование Т-клетки нуклеиновой кислотой, кодирующей редкорежущую эндонуклеазу, способную селективно инактивировать за счет ДНК расщепления, предпочтительно за счет двухцепочечного разрыва гена, кодирующего мишень для иммуносупрессивного агента, и экспресирование редкорежущих эндонуклеаз в Т клетках; и расширение клеток, необязательно в присутствии иммуносупрессивного агента.
В некоторых вариантах осуществления, редкорежущая эндонуклеаза специфически нацелена на CD52 или GR. В некоторых вариантах осуществления, ген, выбранный для инактивирования, кодирует CD52, и иммуносупрессивная обработка включает гуманизированное антитело, нацеленое на CD52 антиген. В некоторых вариантах осуществления, ген, выбранный для инактивирования, кодирует GR, и иммуносупрессивная обработка включает кортикостероид, такой как дексаметазон. В некоторых вариантах осуществления, ген, выбранный для инактивирование, представляет собой член семейства генов FKBP или его вариант, и иммуносупрессивная обработка включает FK506, также известный как такролимус или фуджимицин. В некоторых вариантах осуществления, член семейства генов FKBP представляет собой FKBP12 или его вариант. В некоторых вариантах осуществления, ген, выбранный для инактивирование, представляет собой член семейства генов циклофиллина или его вариант, и иммуносупрессивная обработка включает циклоспорин.
В некоторых вариантах осуществления, редкорежущая эндонуклеаза может представлять собой, например, мегануклеазу, цинк-пальцевую нуклеазу, или TALE-нуклеазу. В некоторых вариантах осуществления, редкорежущая эндонуклеаза представляет собой TALE-нуклеазу.
Кроме того, предусмотренными в данном документе являются способы конструирования Т клеток, приемлемых для иммунотерапии, при этом способы включают: генетическое модифицирование Т клеток путем инактивирования, по меньшей мере, одного белка иммунных контрольных точек. В некоторых вариантах осуществления белок иммунных контрольных точек представляет собой, например, PD-1 и/или CTLA-4. В некоторых вариантах осуществления, способы генетического модифицирования клетки включают: модифицирование Т клеток путем инактивирования, по меньшей мере, одного белка иммунных контрольных точек; и расширение клеток. Белки иммунных контрольных точек включают, но не ограничиваются этим, запрограммированную смерть 1 (PD-1, также известный как PDCD1 или CD279, номер доступа: NM_005018), цитотоксический Т-лимфоцитарный антиген 4 (CTLA-4, также известный как CD152, GenBank номер доступа AF414120.1), LAG3 (также известный как CD223, номер доступа: NM_002286.5), Tim3 (также известный как HAVCR2, GenBank номер доступа: JX049979.1), BTLA (также известный как CD272, номер доступа: NM_181780.3), BY55 (также известный как CD160, GenBank номер доступа: CR541888.1), TIGIT (также известный как VSTM3, номер доступа: NM_173799), В7Н5 (также известный как C10orf54, ген гомолог мышиного vista, номер доступа: NM-022153.1), LAIR1 (также известный как CD305, GenBank номер доступа: CR542051.1), SIGLEC10 (GenBank номер доступа: AY358337.1), 2В4 (также известный как CD244, номер доступа: NM_01166664.1), которые непосредственно ингибируют иммунные клетки. Например, CTLA-4 представляет собой белок клеточной поверхности, экспрессируемый на определенных Т-клетках CD4 и CD8 Т; когда участвуют посредством своих лигандов (В7-1 и В7-2) на клетках, представляющих антиген, активация Т-клеток и эффекторная функция ингибируются.
В некоторых вариантах осуществления, указанный способ конструирования клеток включает, по меньшей мере, одну из следующих стадий: обеспечение Т-клетки, такой как из клеточной культуры или из образца крови; введение в Т- клетку редкорежущей эндонуклеазы, способной селективно инактивировать за счет ДНК расщепления, предпочтительно за счет двухцепочечного разрыва одного гена, кодирующего белок иммунных контрольных точек; и расширение клеток. В некоторых вариантах осуществления, способ включает: обеспечение Т-клетки, такой как из клеточной культуры или из образца крови; трансфецирование указанной Т-клетки нуклеиновой кислотой, кодирующей редкорежущую эндонуклеазу, способную селективно инактивировать за счет ДНК расщепления, предпочтительно за счет двухцепочечного разрыва гена, кодирующего белок иммунных контрольных точек; экспресирование редкорежущих эндонуклеаз в Т клетках; расширение клеток. В некоторых вариантах осуществления, редкорежущая эндонуклеаза специфически нацеливается на ген, выбранный из группы, состоящий из: PD-1, CTLA-4, LAG3, Tim3, BTLA, BY55, TIGIT, В7Н5, LAIR1, SIGLEC10, 2В4, TCRα, и TCRβ. В некоторых вариантах осуществления, редкорежущая эндонуклеаза может представлять собой мегануклеазу, цинк- пальцевую нуклеазу или TALE-нуклеазу. В некоторых вариантах осуществления, редкорежущая эндонуклеаза представляет собой TALE-нуклеазу.
В некоторых вариантах осуществления, представленное изобретение может быть особенно подходящим для аллогенной иммунотерапии. В таких вариантах осуществления, клетки могут быть модифицированы по способу, включающему: инактивирование, по меньшей мере, одного гена, кодирующего компонент Т-клеточного рецептора (TCR) в Т клетках; и расширение Т клеток. В некоторых вариантах осуществления, генетическая модификация способа основывается на экспрессии, в предоставленных клетках для конструирования, одной редкорежущей эндонуклеазы, таким образом, что редкорежущая эндонуклеаза специфически катализирует расщепление в одном целевом гене, тем самым инактивируя целевой ген. В некоторых вариантах осуществления, указанный способ конструирования клетки включает, по меньшей мере, одну из следующих стадий: обеспечение Т-клетки, такой как из клеточной культуры или из образца крови; введение в Т-клетку редкорежущей эндонуклеазы, способной селективно инактивировать за счет ДНК расщепления, предпочтительно за счет двухцепочечного разрыва, по меньшей мере, одного гена, кодирующего компонент Т-клеточного рецептора (TCR), и расширение клеток.
В некоторых вариантах осуществления, способ включает: обеспечение Т-клетки, такой как из клеточной культуры или из образца крови; трансфецирование указанной Т-клетки нуклеиновой кислотой, кодирующей редкорежущую эндонуклеазу, способную селективно инактивировать за счет ДНК расщепления, предпочтительно за счет двухцепочечного разрыва, по меньшей мере, одного гена, кодирующего компонент Т-клеточного рецептора (TCR); экспресирование редкорежущих эндонуклеаз в Т клетках; сортирование трансфицированных Т клеток, которые не экспрессируют TCR на их клеточной поверхности; и расширение клеток.
В некоторых вариантах осуществления, редкорежущая эндонуклеаза может представлять собой мегануклеазу, цинк-пальцевую нуклеазу или TALE-нуклеазу. В некоторых вариантах осуществления, редкорежущая эндонуклеаза представляет собой TALE-нуклеазу. В некоторых вариантах осуществления TALE-нуклеазы распознают и расщепляют последовательность, кодирующую TCRα или TCRβ. В некоторых вариантах осуществления TALE-нуклеаза включает полипептидную последовательность, выбранную из аминокислотной последовательности, показанной в SEQ ID NO: 218, 219, 220, 221, 222, 223, 224, или 225.
TALE-нуклеазные полипептидные последовательности:
Дупликация TRAC T01-L

Дупликация TRAC T01-R

Дупликация TRBC T01-L

Дупликация TRBC T01-R


Дупликация TRBC T02-L

Дупликация TRBC T02-R

Дупликация CD52 T02-L

Дупликация CD52 T02-R

В другом аспекте, другая стадия генетического модифицирования клетки может представлять собой способ расширения TCRα дефицитных Т клеток, содержащих введение в Т-клетку рТα (также известный как preTCRα) или ее функциональный вариант, и расширение клеток, необязательно посредством стимуляции CD3 комплекса. В некоторых вариантах осуществления, способ включает: а) трансформирование клеток нуклеиновой кислотой, кодирующей, по меньшей мере, фрагмент рТα для поддержки поверхностной экспрессии CD3; b) экспресирование указанного рТα в клетках; и с) расширение клеток, необязательно посредством стимуляции CD3 комплекса.
Кроме того, предусмотренными являются способы получения Т клеток для иммунотерапии, включающие стадии способа, предусмотренного в данном документе для расширения Т-клеток. В некоторых вариантах осуществления, рТα полинуклеотидная последовательность может быть введенная случайным образом или путем гомологичной рекомбинации. В некоторых вариантах осуществления, вставка может быть ассоциирована с инактивированием TCRα гена.
Различные функциональные варианты рТα могут использоваться. "Функциональный вариант" пептида относится к молекуле по существу аналогичной либо всему пептиду, либо его фрагменту. "Фрагмент" рТα или его функциональный вариант относится к какому-либо подмножеству молекулы, то есть более короткому пептиду, чем полноразмерный рТα. В некоторых вариантах осуществления, рТα или функциональные варианты могут представлять собой, например, полноразмерный рТα или С-терминальный усеченный вариант pTα. С-терминальный усеченный рТα испытывает недостаток на С-терминальном конце одного или больше остатков. В качестве неограничивающих примеров, вариант С-терминального усеченного рТα испытывает недостаток в 18, 48, 62, 78, 92, 110 или 114 остатках из С-конца белка. Варианты аминокислотной последовательности пептида могут быть получены путем мутаций в ДНК, которая кодирует пептид. Такие функциональные варианты включают, например, делеции из, или вставки или замещение, остатки в пределах аминокислотной последовательности. Какая-либо комбинация делеции, вставки и замещения может быть получена для окончательного конструкта, при условии, что конечный конструкт обладает желаемой активностью, в частности восстановлением функционального комплекса CD3. В предпочтительном варианте осуществления, по меньшей мере, одна мутация вводится в различные рТα варианты, как описанную выше, для воздействия на димеризацию. В качестве неограничивающего примера мутированный остаток может представлять собой, по меньшей мере, W46R, D22A, K24A, R102A или R117A человеческого рТα белка или выровненные положения, используя способ CLUSTALW для члена семейства рТα или гомолога. Предпочтительно рТα или его вариант, как описанную выше, включают мутированный остаток W46R или мутированные остатки D22A, K24A, R102A и R117A. В некоторых вариантах осуществления, указанный рТα или варианты также являются слитыми с доменом, трансформирующим сигнал, таким как CD28, ОХ40, ICOS, CD27, CD137 (4-1ВВ) и CD8 в качестве неограничивающих примеров. Внеклеточный домен рТα или варианты, как описано выше, могут быть слитыми с фрагментом TCRα белка, особенно трансмембранным и внутриклеточным доменом TCRα. pTα варианты также могут быть слиты с внутриклеточным доменом TCRα.
В некоторых вариантах осуществления, рТα варианты могут быть слитыми с внеклеточным связывающим лиганд доменом. В некоторых вариантах осуществления, рТα или его функциональные вариант является слитым с фрагментом одноцепочечного антитела (scFv), содержащим легкий и тяжелый вариабельный фрагмент целевого антигенспецифического моноклонального антитела, соединенного гибким линкером.
Термин "TCRα дефицитная Т-клетка" относится к выделенной Т-клетке, которая испытывает недостаток экспрессии функциональных TCRα цепей. Это может быть осуществлено с использованием различных способов, в качестве неограничивающих примеров, путем конструирования Т-клетки таким образом, что она не экспрессирует никакой функциональный TCRα на своей клеточной поверхности, или путем конструирования Т-клетки таким образом, что она продуцирует очень маленькие функциональные TCRα цепи на своей клеточной поверхности, или путем конструирования Т-клетки для того, чтобы экспрессировать мутированную или усеченную форму TCRα цепи. TCRα дефицитные клетки больше не могут быть расширены посредством CD3 комплекса. Таким образом, для того, чтобы преодолеть эту проблему и обеспечить пролиферацию дефицитных клеток TCRα, pTα или их функциональный вариант вводят в клетки, таким образом, восстанавливая функциональный CD3 комплекс. В некоторых вариантах осуществления, способ дополнительно включает введение в указанные Т клетки редкорежущих эндонуклеаз, способных селективно инактивировать за счет ДНК расщепления одного гена, кодирующего один компонент Т-клеточного рецептора (TCR). В некоторых вариантах осуществления, редкорежущая эндонуклеаза представляет собой TALE-нуклеазу.
В другом аспекте, сконструированные Т клетки, полученные по способам, описанным в данном документе, могут контактировать с биспецифическими антителами. Например, Т клетки могут контактировать с биспецифическими антителами ex vivo перед введением пациенту, или in vivo после введения пациенту. Биспецифические антитела включают две вариабельные области с различными антигенными свойствами, которые облегчают приведение сконструированных клеток в близость с мишенью антигена. В качестве неограничивающих примеров, биспецифическое антитело может быть направлено против опухолевого маркера и лимфоцитарного антигена, такого как, например, без ограничения, CD3, и имеет потенциал для перенаправления и активации каких-либо циркулирующих Т клеток против опухолей.
В некоторых вариантах осуществления, полинуклеотиды, кодирующие полипептиды в соответствии с представленным изобретением могут представлять собой мРНК, которая вводится непосредственно в клетки, например, путем электропорации. В некоторых вариантах осуществления, технология cytoPulse может использоваться, чтобы временно пермеабилизировать живые клетки для доставки материала в клетки. Параметры могут быть модифицированными в порядке для определения условий высокой эффективности трансфекции с минимальной смертностью.
Кроме того, предусмотренными в данном документе являются способы трансформирования Т клеток. В некоторых вариантах осуществления, способ включает: контактирование Т-клетки с РНК и применение к Т-клетке подвижной последовательности импульсов, состоящей из: (а) электрического импульса с диапазоном напряжений от приблизительно 2250 до 3000 В на сантиметр; (b) длительность импульса 0,1 мс; (с) интервал импульсов от приблизительно 0,2 до 10 мс между электрическими импульсами стадий (а) и (b); (d) электрический импульс с диапазоном напряжений от примерно 2250 до 3000 В с шириной импульса приблизительно 100 мс и интервал импульсов приблизительно 100 мс между электрическим импульсом стадии (b) и первым электрическим импульсом стадии (с); и (е) четыре электрических импульса с напряжением около 325 В с шириной импульса приблизительно 0,2 мс и интервал импульсов 2 мс между каждым из 4 электрических импульсов. В некоторых вариантах осуществления, способ трансформирования Т-клетки, включающий контактирование указанной Т-клетки с РНК и применение к Т-клетка подвижной последовательности импульсов, включающей: (а) электрический импульс с напряжением приблизительно 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2400, 2450, 2500, 2600, 2700, 2800, 2900 или 3000 В на сантиметр; (b) длительность импульса 0,1 мс; (с) и импульсный интервал приблизительно 0.2, 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 между электрическими импульсами стадии (а) и (b); (d) один электрический импульс с диапазоном напряжений от приблизительно 2250, - 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2400, 2450, 2500, 2600, 2700, 2800, 2900 или 3000 В с шириной импульса приблизительно 100 мс и импульсный интервал 100 мс между электрическим импульсом стадии (b) и первым электрическим импульсом стадии (с); и (е) 4 электрических импульса с напряжением приблизительно 325 В с шириной импульса приблизительно 0,2 мс и импульсный интервал приблизительно 2 мс между каждым из 4 электрических импульсов. Какие-либо значения, включенные в диапазон значений, описанный выше, раскрыты в настоящей заявке. Электропорационная среда может представлять собой какую-либо приемлемую среду, известную в данной области. В некоторых вариантах осуществления, электропорационная среда имеет проводимость в диапазоне от приблизительно 0,01 до приблизительно 1,0 Миллисименс.
В некоторых вариантах осуществления, в качестве неограничивающих примеры, РНК кодирует редкорежущую эндонуклеазу, один мономер редкорежущей эндонуклеазы, такой как полу-TALE-нуклеазы, CAR, по меньшей мере, один компонент многоцепочечного химерного антигенного рецептора, рТα или его функциональные вариант, экзогенную нуклеиновую кислоту, и/или один дополнительный каталитический домен.
Сконструированные иммунные клетки
Изобретение также предусматривает сконструированные иммунные клетки, содержащие какой-либо из CAR полинуклеотидов, описанных в данном документе. В некоторых вариантах осуществления, CAR могут вводиться в иммунную клетку в виде трансгена через плазмидный вектор. В некоторых вариантах осуществления, плазмидный вектор может также содержать, например, маркер выбора, который обеспечивает идентификацию и/или выбор клеток, которые принимают вектор.
CAR полипептиды могут быть синтезированы in situ в клетке после введения полинуклеотидов, кодирующих CAR полипептиды в клетке. Альтернативно, CAR полипептиды могут быть получены вне клеток и затем введены в клетки. Способы введения полинуклеотидного конструкта в клетки известны в данной области техники. В некоторых вариантах осуществления стабильные способы трансфекции могут быть использованы для интеграции полинуклеотидного конструкта в геном клетки. В других вариантах осуществления способы временной трансфекции могут быть использованы для временной экспрессии полинуклеотидного конструкта, и полинуклеотидный конструкт не интегрируется в геном клетки. В других вариантах осуществления могут быть использованы опосредованные вирусом способы. Полинуклеотиды могут быть введены в клетку какими-либо подходящими средствами, такими как, например, рекомбинантные вирусные векторы (например, ретровирусы, аденовирусы), липосомы и тому подобное. Способы временной трансфекции включают, например, без ограничения, микроинъекцию, электропорацию или бомбардировку частицами. Полинуклеотиды могут быть включены в векторы, такие как, например, плазмидные векторы или вирусные векторы.
Кроме того, предусмотренными в данном документе являются выделенные клетки и клеточные линии, полученные в соответствии со способами конструирования клетки, описанными выше, предусмотренными в данном документе. В некоторых вариантах осуществления, выделенная клетка включает, по меньшей мере, один CAR, как описано выше. В некоторых вариантах осуществления, выделенная клетка включает популяцию CAR, причем каждый CAR содержит различные внеклеточные связывающие лиганд домены.
Кроме того, предусмотренными в данном документе являются выделенные иммунные клетки, полученные в соответствии с каким-либо одним из способов, описанную выше. Какая-либо иммунная клетка, способная экспрессировать гетерологичные ДНК, может быть использована с целью экспресирования CAR, представляющего интерес. В некоторых вариантах осуществления, иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления, иммунная клетка может быть получена из, например, без ограничения, стволовой клетки. Стволовые клетки могут представлять собой взрослые стволовые клетки, нечеловеческие эмбриональные стволовые клетки, более конкретно нечеловеческие стволовые клетки, стволовые клетки пуповинной крови, клетки- предшественники, стволовые клетки костного мозга, индуцированные плюрипотентные стволовые клетки, тотипотентные стволовые клетки или гемопоэтические стволовые клетки. Представительными человеческими клетками являются CD34+ клетки. Выделенная клетка может также представлять собой дендритную клетку, киллерную дендритную клетку, тучную клетку, NK-клетку, В-клетку или Т-клетку, выбранную из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоциты, Т-лимфоциты памяти или хелперных Т-лимфоцитов. В некоторых вариантах осуществления, клетка может быть получена из группы, состоящей из CD4 + Т- лимфоцитов и CD8 + Т-лимфоцитов.
До расширения и генетической модификации источник клеток может быть получен от субъекта с использованием множества неограничивающих способов. Клетки могут быть полученные получены из ряда неограничивающих источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из места инфекции, асцит, плевральный выпот, ткань селезенки и опухоли. В некоторых вариантах осуществления может быть использовано какое-либо количество Т клеточных линий, доступных и известных квалифицированному специалисту в данной области. В некоторых вариантах осуществления клетки могут быть получены от здорового донора, от пациента с диагностированным раком или от пациента с диагностированной инфекцией. В некоторых вариантах осуществления клетки могут быть частью смешанной популяции клеток, которые представляют разные фенотипические характеристики.
Кроме того, предусмотренными в данном документе являются клеточные линии, полученные из трансфицированной Т-клетки в соответствии с каким-либо из описанных выше способов. Кроме того, предусмотренными в данном документе являются модифицированные клетки, резистентные к иммуносупрессивному лечению. В некоторых вариантах осуществления, выделенная клетка в соответствии с изобретение включает полинуклеотид, кодирующий CAR.
Иммунные клетки согласно изобретению могут быть активированы и расширены либо до, либо после генетической модификации Т-клеток, используя способы, как описано, например, без ограничения, в патентах США 6,352,694; 6,534,055; 6,905,680; 6,692,964; 5,858,358; 6,887,466; 6,905,681; 7,144,575; 7,067,318; 7,172,869; 7,232,566; 7,175,843; 5,883,223; 6,905,874; 6,797,514; 6,867,041; и публикации патентной заявки США №20060121005. Т клетки могут быть расширены in vitro или in vivo. Как правило, Т клетки согласно изобретению могут быть расширены, например, путем контактирования с агентом, который стимулирует CD3-TCR-комплекс и со-стимулирующую молекулу на поверхности Т-клеток для создания сигнала активации для Т-клетки. Например, для создания сигнала активации для Т-клетки могут быть использованы химические вещества, такие как ионофор кальция А23187, 13-ацетат форбол 12-миристат (РМА) или митогенные лектины, такие как фитогемагглютинин (РНА).
В некоторых вариантах осуществления, Т-клеточные популяции могут стимулироваться in vitro путем контакта с, например, анти-CD3-антителом или его антигенсвязывающим фрагментом, или анти-CD2 антителом, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы С (например, бриостатином) в сочетании с ионофором кальция. Для совместной стимуляции дополнительной молекулы на поверхности Т-клеток используется лиганд, который связывает дополнительную молекулу. Например, популяция Т-клеток может контактировать с анти-CD3-антителом и анти-CD28 антителом в условиях, подходящих для стимуляции пролиферации Т-клеток. Условия, подходящие для Т клеточной культуры включают подходящие среды (например, минимальные питательные среды или среды RPMI 1640 или, X-Vivo 15, (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-2, IL-15, TGFp, и TNF, или какие-либо другие добавки для роста клеток, известные квалифицированному специалисту в данной области. Другие добавки для роста клеток включают, но не ограничиваются этим, поверхностно-активное вещество, плазматат и восстанавливающие агенты, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, а-MEM, F-12, X-Vivo 10, и X-Vivo 20, Optimizer, с добавленными аминокислотами, пируватом натрия и витаминами, или без сыворотки, или с добавлением соответствующего количества сыворотки (или плазмы) или определенного набора гормонов и/или количества цитокина(ов), достаточного(ых) для роста и расширения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включены только в экспериментальные культуры, но не в культуры клеток, которые необходимо вводить субъекту. Клетки-мишени выдерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, 37°C) и атмосфере (например, воздуха плюс 5% CO2). Т-клетки, подвергшиеся воздействию различных периодов стимуляции, могут демонстрировать различные характеристики
В некоторых вариантах осуществления, клетки согласно изобретению могут быть расширены путем совместного культивирования с помощью ткани или клеток. Клетки также могут быть расширены in vivo, например, в крови субъекта после введения клетки субъекту.
В некоторых вариантах осуществления, выделенная клетка в соответствии с представленным изобретением включает один инактивированный ген, выбранный из группы, состоящей из CD52, dCK, GR, PD-1, CTLA-4, LAG3, Tim3, BTLA, BY55, TIGIT, B7H5, LAIR1, SIGLEC10, 2B4, HLA, TCRα и TCRβ и/или экспрессирует CAR, многоцепочечный CAR и/или pTa трансген. В некоторых вариантах осуществления, выделенная клетка включает полинуклеотиды, кодирующие полипептиды, содержащие многоцепочечный CAR. В некоторых вариантах осуществления, выделенная клетка в соответствии с представленным изобретением включает два инактивированных гена, выбранных из группы, состоящий из: CD52 и GR, CD52 и TCRα, CDR52 и TCRβ, GR и TCRα, GR и TCRβ, TCRα и TCRβ, PD-1 и TCRα, PD-1 и TCRβ, CTLA-4 и TCRα, CTLA-4 и TCRβ, LAG3 и TCRα, LAG3 и TCRβ, Tim3 и TCRα, Tim3 и TCRβ, BTLA и TCRα, BTLA и TCRβ, BY55 и TCRα, BY55 и TCRβ, TIGIT и TCRα, TIGIT и TCRβ, B7H5 и TCRα, B7H5 и TCRβ, LAIR1 и TCRα, LAIR1 и TCRβ, SIGLEC10 и TCRα, SIGLEC10 и TCRβ, 2B4 и TCRα, 2B4 и TCRβ и/или экспрессирует CAR, многоцепочечный CAR и pTα трансген.
В некоторых вариантах осуществления, TCR оказывается нефункциональным в клетках в соответствии с изобретение из-за инактивирования TCRα гена и/или TCRβ гена(ов). В некоторых вариантах осуществления предлагается способ получения модифицированных клеток, полученных от индивидуума, причем клетки могут пролиферировать независимо от основного сигнального пути комплекса гистосовместимости (МНС). Модифицированные клетки, которые могут пролиферировать независимо от пути передачи сигналов МНС и которые могут быть получены этим способом, охватываются объемом представленного изобретения. Модифицированные клетки, раскрытые в данном документе могут использоваться для лечения пациентов, которые нуждаются в этом, против отторжения трансплантата против хозяина (HvG) и болезни трансплантат против хозяина (GvHD); поэтому в объем представленного изобретения входит способ лечения пациентов, которые нуждаются в этом, против отторжения трансплантата против хозяина (HvG) и болезни трансплантат против хозяина (GvHD), включающий лечение указанного пациента путем введения указанному пациенту эффективного количества модифицированных клеток, содержащих инактивированные TCRα и/или TCRβ гены.
В некоторых вариантах осуществления, иммунные клетки сконструированы так, чтобы быть резистентными к одному или нескольким химиотерапевтическим лекарственным средствам. Химиотерапевтическое лекарственное средство может представлять собой, например, аналог пуринового нуклеотида (PNA), таким образом, делая иммунную клетку подходящей для лечения рака, комбинируя адоптивную иммунотерапию и химиотерапию. Иллюстративные PNA включают, например, клофарабин, флударабин и цитарабин, самостоятельно или в комбинации. PNA метаболизируются дезоксицитидинкиназой (dCK) в моно-, ди-, и три-фосфат PNA. Их трифосфатные формы конкурируют с АТФ в синтезе ДНК, действуют как проапоптотические агенты и являются мощными ингибиторами рибонуклеотидредуктазы (RNR), которая участвует в продуцировании тринуклеотидов. Предусмотренными в данном документе являются EGFRvIII-специфические CAR-T клетки, содержащие инактивированный dCK ген. В некоторых вариантах осуществления, dCK нокаутные клетки получают путем трансфекции Т-клеток с использованием полинуклеотидов, кодирующих специфическую TAL-нуклеазу, направленную против генов dCK, например, путем электропорации мРНК. dCK нокаутные EGFRvIII-специфические CAR-T клетки являются резистентными к PNA, включая, например, клорофарабин и/или флударабин, и поддерживают цитотоксическую активность Т-клеток в отношении EGFRvIII-экспрессирующих клеток. В другом примере, химиотерапевтическое лекарственное средство может представлять собой, например, молекулу, нацеленную на CD52, такую как моноклональное анти-CD52 антитело (например алемтузумаб). CD52 представлять собой белок, присутствующий на поверхности лимфоцитов, и анти-CD52 антитела могут индуцировать апоптоз и лизис иммунных клеток за счет антитело- и комплемент-зависимой цитотоксичности, приводя к лимфодеплеции. Предусмотренными в данном документе являются EGFRvIII-специфические CAR-T клетки, содержащие инактивированный CD52 ген. В некоторых вариантах осуществления, CD52 нокаутные клетки получают путем трансфекции Т клеток с использованием полинуклеотидов, кодирующих специфическую TAL-нуклеазу, направленную против CD52 гена, применяя, например, электропорацию мРНК. CD52 нокаутные EGFRvIII-специфические CAR-T клетки являются резистентными к анти-CD52 молекулам, включая, например, алемтузумаб, и поддерживают цитотоксическую активность Т-клеток по отношению к EGFRvIII-экспресирующим клеткам в присутствии анти-CD52 молекул.
В некоторых вариантах осуществления, выделенные клетки или клеточные линии согласно изобретению могут содержать рТα или его функциональный вариант. В некоторых вариантах осуществления, выделенная клетка или клеточная линия может быть дополнительно генетически модифицирована путем инактивирования TCRα гена.
В некоторых вариантах осуществления, CAR-T-клетка включает полинуклеотид, кодирующий полипептид-»самоубийцу», такой как, например, RQR8. Смотрите, например, WO 2013153391 A, который включен в настоящее описание посредством ссылки во всей своей полноте. В CAR-T клетках, содержащих полинуклеотид, кодирующий полипептид-«самоубийцу», полипептид-«самоубийца» экспрессируется на поверхности CAR-T-клетки. В некоторых вариантах осуществления, полипептид-«самоубийца» включает аминокислотную последовательность, показанную в SEQ ID NO: 226.

В некоторых вариантах осуществления, полипептид-«самоубийца» также может включать сигнальный пептид на аминоконце. Когда полипептид-«самоубийца» экспрессируется на поверхности CAR-T-клетки, связывание ритуксимаба с R-эпитопами [то есть эпитопом, распознаваемым ритуксимабом - CPYSNPSLC (SEQ ID NO: 256)]) полипептида вызывает лизис клетки. Больше, чем одна молекула ритуксимаба может связываться с одним полипептидом, экспрессируемым на поверхности клетки.. Каждый R эпитоп полипептида может связывать отдельную молекулу ритуксимаба. Удаление EGFRvIII-специфических CAR-T клеток может происходить in vivo, например, путем введения ритуксимаба пациенту. Решение удалить перенесенные клетки может быть вызвано нежелательными эффектами, которые обнаруживаются у пациента, которые относятся к переданным клеткам, например, когда обнаруживаются неприемлемые уровни токсичности.
В некоторых вариантах осуществления, полипептид-«самоубийца» может содержать один, два, три или более эпитопа, распознаваемых антителом (например, ритуксимабом).
В некоторых вариантах осуществления, полипептид-«самоубийца» может обеспечиваться в EGFRvIII-специфической CAR Т-клетке в полипептиде, который отделен от CAR-содержащего полипептида. В некоторых вариантах осуществления, полипептид-«самоубийца» может обеспечиваться в EGFRvIII-специфической CAR Т-клетке в той же полипептидной цепи, что и CAR полипептид. В CAR, содержащем полипептид-«самоубийцу», как правило, полипептид-«самоубийца» содержится во внеклеточной части CAR.
В CAR содержащем полипептид-«самоубийцу», полипептид-«самоубийца» может содержать, например, одну или несколько копий аминокислотной последовательности эпитопа, распознаваемого ритуксимабом [CPYSNPSLC (SEQ ID NO: 256)]. Полипептид-«самоубийца» может быть расположен в различных положениях в CAR. Например, полипептид-«самоубийца» может быть N-терминальным для scFv, или он может быть С-терминальным к scFv в CAR. В некоторых вариантах осуществления, пептид-«самоубийца» может располагаться между scFv и шарнирною областью CAR. В некоторых вариантах осуществления, CAR может содержать больше, чем один полипептид-«самоубийцу». Например, CAR может содержать полипептид-«самоубийцу» N-терминальный к scFv и полипептид-«самоубийцу» С-терминальный к scFv. Каждый из данных полипептидов может содержать одну или несколько копий эпитопа, распознаваемого ритуксимабом. Например, CAR может содержать первый полипептид-«самоубийцу» в положении N-терминальном к scFv, причем первый полипептид-«самоубийца» содержит одну копию эпитопа, распознаваемого ритуксимабом, и второй полипептид-«самоубийца» в положении С-терминальном к scFv, причем второй полипептид-«самоубийца» содержит две копии эпитопа, распознаваемого ритуксимабом.
Кроме того, предусмотренными в данном документе являются нуклеиновые кислоты, кодирующие EGFRvIII-специфические CAR, которые содержат последовательность полипептида-«самоубийцы» в CAR.
В одном примере, полипептид-«самоубийца» в одной и той же полипептидной цепи, что и EGFRvIII-специфический CAR, может иметь последовательность, описанную в данном документе как "R2 последовательность «самоубийца»". R2 последовательность «самоубийца» содержит две копии эпитопа, распознаваемого ритуксимабом [CPYSNPSLC (SEQ ID NO: 256)]. Такие EGFRvIII-специфические CAR могут упоминаться в данном документе как "EGFRvIII-R2 CAR". Таблица 5D представляет аминокислотные последовательности иллюстративных EGFRvIII-R2 CAR согласно представленному изобретению. В Таблице 5D, сигнальная/лидерная пептидная последовательность выделена жирным шрифтом, GS линкер [(GGGGS)4 (SEQ ID NO: 202)] подчеркивается, и R2 последовательность «самоубийца» выделена жирным шрифтом и подчеркивается. Таблица 5Е представляет иллюстративные последовательности нуклеиновых кислот, кодирующих иллюстративные EGFRvIII-R2 CAR согласно представленному изобретению.
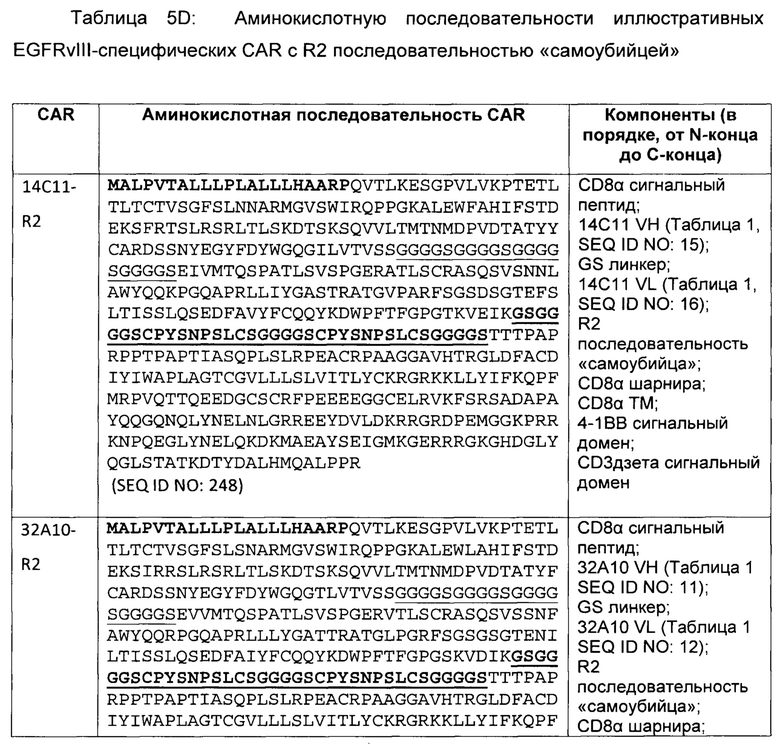
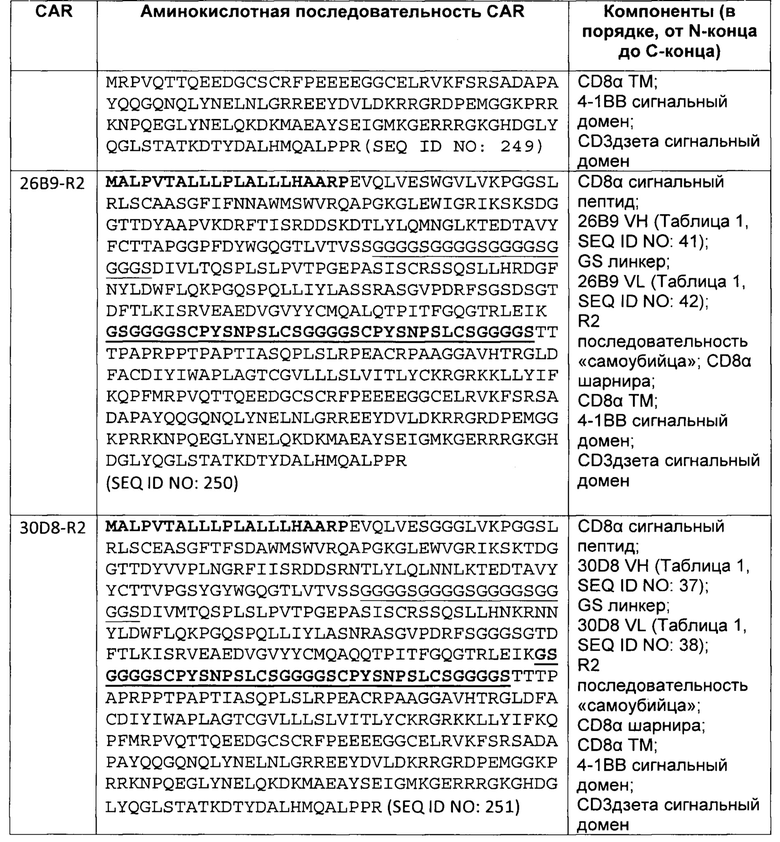





Терапевтические применения
Выделенные клетки, полученные по способам, описанным выше, или клеточные линии, полученные из таких выделенных клеток, могут использоваться в качестве лекарственного средства. В некоторых вариантах осуществления, такое лекарственное средство может использоваться для лечения рак, включая солидные опухоли и опухоли жидких тканей. В некоторых вариантах осуществления, рак представляет собой рак, связанный с EGFRvIII (например, какой-либо EGFRvIII-экспресирующий рак) включая, но не ограничиваясь этим, глиобластому (например, мультиформной глиобластомы), анапластическую астроцитому, гигантоклеточную глиобластому, глиосаркому, анапластическую олигодендроглиому, анапластическую эпендимому, анапластическую олигоастроцитому, карциному хориоидного сплетения, анапластическую ганглиоглиому, пинеобластому, пинеоцитому, менингиому, медуллоэпителиому, эпендимобластому, медуллобластому, супратенториальную примитивную нейроэктодермальную опухоль, атипичную тератоидную / рабдоидную опухоль, смешанную глиому, рак головы и шеи, немелкоклеточный рак легкого, рак молочной железы, рак яичников, рак предстательной железы, медуллобластому, рак толстой и прямой кишок, рак анального канала, рак шейки матки, рак почки, рак кожи, рак поджелудочной железы, рак печени, рак мочевого пузыря, рак желудка, рак щитовидной железы, мезотелиому, рак матки, лимфому, или лейкемию.
В некоторых вариантах осуществления, лекарственное средство, как описано в данном документе, могут использоваться для 1) ингибирования роста или прогрессирования опухоли у субъекта, который имеет злокачественные клетки, экспресирующие EGFRvIII; 2) ингибирования метастазирования злокачественных клеток, экспресирующих EGFRvIII у субъекта; и 3) индуцирования регрессии опухоли у субъекта, который имеет злокачественные клетки, экспресирующие EGFRvIII.
В некоторых вариантах осуществления, выделенная клетка в соответствии с изобретение, или клеточная линия, полученная из выделенных клеток, может использоваться в производстве лекарственного средства для лечения рака у пациента, который нуждается в этом,.
Кроме того, предусмотренными в данном документе являются способы лечения пациентов. В некоторых вариантах осуществления способ включает обеспечение иммунной клетки согласно изобретению у пациента, который нуждается в этом. В некоторых вариантах осуществления, способ включает стадию введения трансформированных иммунных клеток согласно изобретению пациенту, который нуждается в этом.
В некоторых вариантах осуществления, Т клетки согласно изобретению могут подвергаться активному расширению Т-клеток in vivo и могут сохраняться в течение длительного времени.
Способы лечения согласно изобретению могут представлять собой улучшение, лечение или профилактику. Способ согласно изобретению может быть либо частью аутологичной иммунотерапии, либо частью лечения аллогенной иммунотерапией. Изобретение особенно подходит для аллогенной иммунотерапии. Т-клетки доноров могут быть трансформированы в неаллероидные клетки с использованием стандартных протоколов и воспроизведены по мере необходимости, тем самым создавая CAR-T-клетки, которые могут вводиться одному или нескольким пациентам. Такая терапия CAR-Т-клетками может быть доступна как терапевтический продукт "имеющийся в готовом виде".
Клетки, которые могут использоваться с раскрытыми способами, описаны, например, в предыдущем разделе. Лечение может использоваться для лечения пациентов, у которых диагностирован, например, рак. Виды рака, которые могут подвергаться лечению включают, например, раковые заболевания, связанные с EGFRvIII, включая какой-либо из приведенных выше видов рака. Типы раковых образований, подлежащих лечению CAR и CAR-T-клетками согласно изобретению включают, но не ограничиваются этим определенные жидкие и солидные опухоли, такие как мультиформная глиобластома, рак головы и шеи, немелкоклеточный рак легкого, рак молочной железы, рак яичников и рак предстательной железы. Кроме того, включенными являются опухоли/виды рака у взрослых и опухоли/виды рака у детей.
В некоторых вариантах осуществления, лечение может быть в комбинации с одной или несколькими терапиями против рака, выбранными из группы, терапии антителами, терапии коньюгатом антитело - лекарственное средство, химиотерапии, нацеленной терапии, терапии цитокинами, вакцинной терапии, онколитической вирусной терапии, терапии дендритными клетками, генной терапии, терапии наночастицами, гормональной терапии, хирургической резекции, лазерной лучевой терапии, поля для лечения опухолей и лучевой терапии. Например, CAR и CAR-T клетки согласно изобретению могут вводиться пациенту в сочетании со (например, перед, одновременно, или после) 1) стандартым лечением, включая облучение, хирургическую резекцию, химиотерапию (например, темозоломид, прокарбазин, кармустин, ломустин, винкристин и т.д.), терапию антителами, такую как бевацизумаб, антиангиогенную терапию и/или области обработки опухолей; 2) вакциной, включая вакцину EGFRvIII; 3) терапией коньюгатом антитело-лекарственное средство, включая но не ограничиваясь этим, коньюгаты лекарственного средства, которые нацелены на семейство рецепторов HER, таких как EGFR, HER2, HER3, и HER4; 4) нацеленой терапией, такой как ингибиторы киназы (например, эверолимус); и 5) иммунотерапиями, включая, но не ограничиваясь этим, анти-PD-1, анти-PD-L1, анти-PD-L2, анти-41ВВ, анти-TIM3, анти-LAG3, анти-TIGIT, анти-ОХ40, анти-HVEM, анти-BTLA, анти-CD40, анти-CD47, анти-CSF1R, анти-CSF1, анти-MARCO, анти-IL8, анти-CXCR4, и анти-CTLA4 антител.
В некоторых вариантах осуществления, лечение могут проводить пациентам, подвергая иммуносупрессивному лечению. Действительно, изобретение предпочтительно основывается на клетках или популяции клеток, которые были устойчивы, по меньшей мере, к одному иммуносупрессивному агенту (например, циклоспорину, азатиоприну, метотрексату, микофеноляту и FK506) из-за инактивирования гена, кодирующего рецептор для такого иммуносупрессивного агента. В этом аспекте, иммуносупрессивное лечение должно способствовать выбору и расширению Т-клеток в соответствии с изобретением внутри пациента. Введение клеток или популяции клеток в соответствии с изобретение может быть осуществлено каким-либо удобным способом, в том числе путем аэрозольной ингаляции, инъекции, приема внутрь, трансфузии, имплантации или трансплантации. Композиции, описанные в данном документе, могут вводиться пациенту подкожно, внутрикожно, внутриопухолево, интракраниально, интранодально, интрамедуллярно, внутримышечно, путем внутривенной или интралимфатической инъекции или внутрибрюшинно. В одном варианте осуществления, клеточные композиции согласно изобретению вводят путем внутривенной инъекции.
В некоторых вариантах осуществления, лечение может проводиться пациентам, подвергающимся лимфоистощенному режиму. Истощение иммунных регуляторных элементов с цитотоксическими агентами или облучением всего тела может усилить противоопухолевую активность CAR и CAR-T клеток согласно представленному изобретению. Например, цитотоксический агент в лимфоистощенном режиме включает, но не ограничивается этим, флударабин, циклофосфамид и/или алемтузумаб.
В некоторых вариантах осуществления введение клеток или популяций клеток может включать введение, например, от приблизительно 104 до приблизительно 109 клеток на кг массы тела, включая все целочисленные значения количества клеток в этих диапазонах. В некоторых вариантах осуществления введение клеток или популяции клеток может включать введение от приблизительно 105 до 106 клеток на кг массы тела, включая все целочисленные значения количества клеток в этих диапазонах. Клетки или популяция клеток может вводиться одной или несколькими дозами. В некоторых вариантах осуществления, указанное эффективное количество клеток может вводиться в виде разовой дозы. В некоторых вариантах осуществления, указанное эффективное количество клеток может вводиться в виде больше, чем одной дозы на протяжении периода времени. Сроки введения находятся в компитенции лечащего врача и зависят от клинического состояния пациента. Клетки или популяция клеток могут быть получены из какого-либо источника, такого как банк крови или донор. В то время как индивидуальные потребности различаются, определение оптимальных диапазонов эффективных количеств данного типа клеток для конкретного заболевания или состояния, находятся в компитенции специалиста в данной области. Эффективное количество означает количество, которое обеспечивает терапевтическое или профилактическое преимущество. Дозировка будет зависеть от возраста, состояния здоровья и массы тела реципиента, вида одновременного лечения, если таковое имеется, частоты лечения и характера желаемого эффекта. В некоторых вариантах осуществления, эффективное количество клеток или композиции, содержащей данные клетки, вводят парентерально. В некоторых вариантах осуществления, введение может быть внутривенным введением. В некоторых вариантах осуществления, введение осуществляется путем непосредственной инъекции внутрь опухоли.
Наборы
Изобретение также предусматривает наборы для использования в текущих способах. Наборы согласно изобретению включают один или несколько контейнеров, содержащих полинуклеотид, кодирующий EGFRvIII-специфический CAR, или сконструированную иммунную клетку, содержащую полинуклеотид, кодирующий EGFRvIII-специфический CAR, как описано в данном документе, и инструкции по использованию в соответствии с каким-либо из способов согласно изобретению, описанных в данном документе. Как правило, данные инструкции включают описание введения сконструированной иммунной клетки для описанных выше терапевтических лечений.
Инструкции, относящиеся к использованию сконструированных иммунных клеток, как описано в данном документе, как правило, включают информацию о дозировке, графике дозирования и способе введения для предполагаемого лечения. Контейнеры могут представлять собой единичные дозы, объемные упаковки (например, пакетики с несколькими дозами) или суб-единичными дозами. Инструкции, представленные в наборах согласно изобретению, обычно представляют собой письменные инструкции на этикетке или упаковке (например, лист бумаги, включенный в набор), но машиночитаемые инструкции (например, инструкции, которые хранятся на магнитном или оптическом диске) также приемлемы.
Наборы согласно настоящему изобретению находятся в подходящей упаковке. Подходящая упаковка включает, но не ограничивается этим, флаконы, бутылки, банки, гибкую упаковку (например, герметичные майларовые или пластиковые пакеты) и тому подобное. Также рассматриваются пакеты для использования в комбинации с конкретным устройством, таким как ингалятор, устройство для введения в нос (например, распылитель) или инфузионное устройство, такое как мини-насос. Набор может иметь стерильный порт доступа (например, контейнер может быть пакетом с внутривенным раствором или флаконом, имеющим пробку, прокалываемую иглой для подкожной инъекции). Контейнер может также иметь стерильный порт доступа (например, контейнер может быть внутривенным пакетом раствора или флаконом, имеющим пробку, прокалываемую гиподермальной инъекционной иглой). По меньшей мере, один активный агент в композиции представляет собой антитело EGFRvIII. Контейнер может дополнительно содержать второй фармацевтически активный агент.
Наборы могут необязательно предоставлять дополнительные компоненты, такие как буферы и интерпретирующую информацию. Как правило, набор включает контейнер и этикетку или лист-вставку(и) для упаковки или связанные с ней.
Включенным в виде ссылки в данный документ для всех целей является содержание предварительной патентной заявки США №62/281,533 (поданной 21 января 2016 года) и 62/431,758 (поданой 8 декабря 2016 года).
Биологический депозит
Типичные материалы представленного изобретения были депонированы в Американской коллекции типовых культур, 10801 University Boulevard, Manassas, Va. 20110-2209, USA, на __. Вектор __, имеющий АТСС номер доступа No. __, представляет собой полинуклеотид, кодирующий вариабельный участок легкой цепи __, и вектор __, имеющий АТСС номер доступа No. __, представляет собой полинуклеотид, кодирующий вариабельный участок тяжелой цепи __. Депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и положений по нему (Будапештский договор). Это гарантирует поддержание жизнеспособной культуры депозита в течение 30 лет со дня внесения депозита. Депозит будет сделан доступным по АТСС в соответствии с условиями Будапештского договора и будет заключен с соглашением между Pfizer, Inc. и АТСС, которое гарантирует постоянную и неограниченную доступность потомства культуры депозита для общественности при опубликовании соответствующего патента США или открытии для общественности какой либо США или иностранной патентной заявки, в зависимости от того, что наступит раньше, и обеспечивает доступность потомства к определенному Уполномоченному по патентам и товарным знакам США, имеющему право на него согласно 35 U.S.С.§ 122 и правила Уполномоченного в соответствии с ним (в том числе 37 C.F.R. § 1.14 с уделением особого внимания 886 OG 638).
Представитель настоящей заявки согласился с тем, что если культура материалов в депозите должна погибнуть или была утерена или уничтожена при выращивании в подходящих условиях, материалы будут незамедлительно заменены на уведомление другими из таких же самых. Доступность депонированного материала не должна толковаться как лицензия на осуществление изобретения в нарушение прав, предоставляемых в соответствии с законодательством какого-либо государства в соответствии с его патентным законодательством.
Следующие примеры предлагаются только в иллюстративных целях и никоим образом не предназначены для ограничения объема изобретения. Действительно, различные модификации изобретения в дополнение к тем, которые показаны и описаны в данном документе, станут очевидными для квалифицированных специалистов в данной области техники из предшествующего описания и подпадают под объем прилагаемой формулы изобретения.
Примеры
Пример 1: Определение аффинности для рекомбинантного анти-EGFRvIII мышино-человеческого химерного антитела и гуманизированных антител
Данный пример определяет аффинность химерных и гуманизированных анти-EGFRvIII антител при 25°С и 37°С.
Анти-EGFRvIII мышиное (m) антитело, m62G7, полученное из гибридом was секвенировали и субклонировали в подходящие векторы для экспрессии в виде мышиных-человеческий химерные антител. CDR мышиного антитела m62G7 прививали на человеческий каркас и экспрессировали как человеческое рекомбинантное антитело IgG1, h62G7. Варианты аффинности h62G7 были сделаны путем введения мутаций в CDR тяжелой и легкой цепей. Аффинности рекомбинантного анти-EGFRvIII химерного антитела m62G7 и гуманизированных h62G7 антител измеряли на биосенсоре Biacore™ Т200 с поверхностным плазмонным резонансом, оснащенным исследовательского класса анти-человеческим Fc соединенным СМ4 сенсорной микросхемой (GE Healthcare Inc., Piscataway, NJ). Анти-EGFRvIII антитела затем захватывали с помощью анти- человеческого Fc. Мономерный 8-гистидиновый меченный человеческий EGFRvIII внеклеточный домен затем инъекционно вводили в качестве аналита в 10-кратных сериях разбавления с верхней концентрацией в 1000 нМ. Аффинность анти- EGFRvIII антител по отношению к человеческому EGFRvIII измеряли как при 25°С, так и 37°С (Таблица 6). Ни одно из данных антител не показало обнаруживаемого связывания с 1000 нМ 8-гистидинового меченного рекомбинантного немутантного типа белка EGFRwt в тех же условиях анализа.
В таблице 6 варианты h62G7 описаны со ссылкой на вариацию тяжелой цепи, а затем вариацию легкой цепи. Например, клон антитела "h62G7-EQ/L6" относится к h62G7 клону, содержащему вариацию "EQ" в тяжелой цепи (также называемой в данном документе как "h62G7-EQ") и вариацию "L6" в легкой цепи (также называемой в данном документе как "h62G7-L6"). Данные аминокислотные последовательности тяжелой цепи и легкой цепи представлены в таблице 2. Кроме того, в представленной заявке вариант h62G7 может упоминаться с вариантом либо тяжелой цепи, либо легкой цепью, записанным первым, так, например, "h62G7-EQ/L6" и "h62G7-L6/EQ", оба относятся к антителу, которое содержит тяжелую цепь h62G7-EQ и легкую цепь h62G7-L6.

Пример 2: Определение аффинности для человеческих анти-EGFRvIII антител
Данный пример определяет аффинность различных человеческих анти- EGFRvIII антител при 37°С.
Для того, чтобы генерировать человеческие антитела против EGFRvIII, трансгенных мышей AlivaMab (Ablexis LLC, San Francisco, CA) иммунизировали согласно чередующегося графика фиксированной параформальдегидом крысиной глиобластомной клеточной линией, экспресирующей EGFRvIII, F98-npEGFRvIII (American Type Culture Collection, Manassas, VA), и пептидами (SEQ ID NO: 227: CGSGSGLEEKKGNYVVTDH), направленными в область соединения в EGFRvIII. Гибридомы были получены с использованием стандартных методов. Для того, чтобы определить аффинность связывания и специфичность данных гибридом к EGFRvIII, антитела в культуральных супернатантах захватывали анти-мышиным Fc с использованием биосенсора Biacore™ Т200, оснащенного анти-мышиным Fc, соединенным СМ4 сенсорными микросхемами (Biacore™ АВ, Uppsala, Sweden - сейчас GE Healthcare). Мономерный 8-гистидиновый меченный человеческий EGFRvIII внеклеточный домен затем инъекционно вводили в качестве аналита в 10-кратных сериях разбавления, исходя из верхней концентрации 1000 нМ. Аффинность анти-EGFRvIII антител по отношению к человеческому EGFRvIII измеряли при 37°С (Таблица 7). Ни одно из этих гибридомных антител не показывало обнаруживаемого связывания с 1000 нМ 8-гистидинового меченного рекомбинантного немутантного типа белка EGFRwt в тех же условиях анализа.
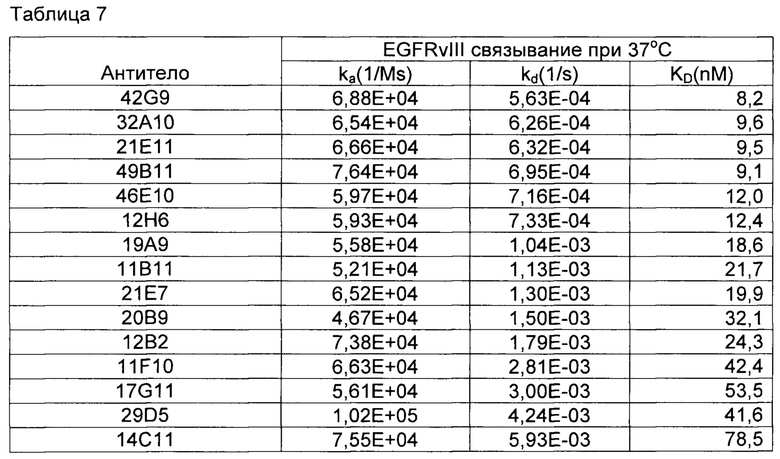

Пример 3: Специфичность связывания анти-EGFRvIII антител с EGFRvIII- экспресирующими клеточными линиями способом проточной цитометрии
Данный пример демонстрирует специфичность связывания клеток анти-EGFRvIII антител с EGFRvIII экспресирующими клетками.
Для того, чтобы оценить клеточную специфичность связывания анти- EGFRvIII антител, полученных из AlivaMab мышей, использовали три линии изогенной крысиной глиобластомы и линию клеток рака человека: F98 (не экспрессирует какую-либо форму человеческого EGFR), F98-EGFRwt (экспрессирует немутантный тип EGFR), F98-npEGFRvIII (экспрессирует EGFRvIII) и А431 (клеточная линия эпидермоидной карциномы с избыточной экспрессией EGFR немутантного типа), все полученные из Американской коллекции типовых культур (Manassas, VA). Для окрашивания клеток 500000 клеток инкубировали с 50 мкл супернатантов гибридомы в течение 45 мин при 4°С, промывали буфером для связывания (PBS (фосфатный буферный солевой раствор) + 0,5% BSA (бычий сывороточный альбумин)), с последующим инкубированием с FITC-коньюгированным козьим анти-мышиным Fc специфическим вторичным антителом от Jackson ImmunoResearch Laboratories (West Grove, PA). Таблицы 8A и 8B показывают средние интенсивности флуоресценции (MFI) антител EGFRvIII (за исключением клона 20G5) на EGFRvIII-экспресирующей клеточной линии, которые были, по меньшей мере, в 10-раз выше, чем на неэкспресирующих клеточных линиях. ФИГ. 1А, ФИГ. 1 В, и ФИГ. 1С показывают примеры гистограмм FACS связывания трех EGFRvIII-специфических клонов, которые были клонированы и экспрессированы в качестве рекомбинантных человеческих IgG1 антител, 42G9 (ФИГ. 1А), 32А10 (ФИГ. 1В) и 32G8 (ФИГ. 1С), с тремя F98 клеточными линиями.
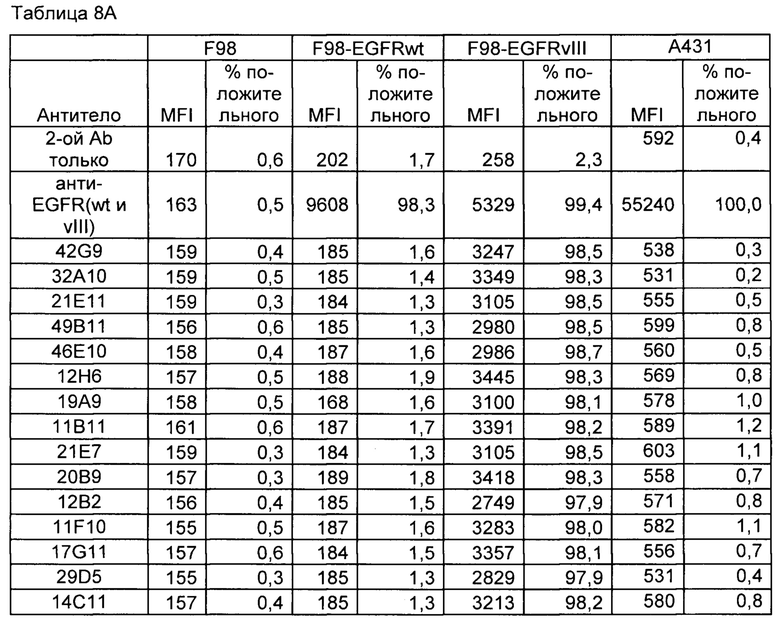
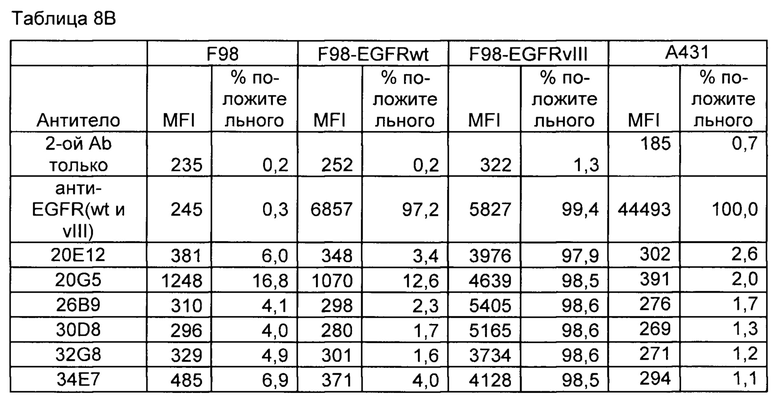
Данные результаты демонстрируют специфичность связывания анти- EGFRvIII антител с клетками, которые экспрессируют EGFRvIII.
Пример 4: Определение аффинности для полностью человеческих анти-EGFRvIII антител из библиотеки фагов
Данный пример определяет аффинность различных человеческий анти-EGFRvIII антител при 25°С.
Человеческие анти-EGFRvIII антитела секвенировали и субклонировали в приемлемые векторы для экспрессии в виде рекомбинантных человеческих IgG1 антител. Аффинности антител измеряли при 25°С (Таблица 9) на биосенсоре Biacore™ Т200 с поверхностным плазмонным резонансом, оснащенном анти-человеческим Fc, соединенным СМ4 сенсорной микросхемой (GE Healthcare Inc., Piscataway, NJ). Анти-EGFRvIII антитела захватывались анти-человеческим Fc. Мономерный 8-гистидиновый меченный человеческий EGFRvIII внеклеточный домен затем инъекционно вводили в качестве аналита в 10-кратных сериях разбавления, начиная с 1000 нМ. Среди двух антител только С6 показало очень слабое, но обнаруживаемое связывание с 1000 нМ 8-гистидинового меченного рекомбинантного немутантного типа белка EGFRwt при 25°С.

Пример 5: Определение аффинности для рекомбинантных одноцепочечных Fv, форматированных анти-EGFRvIII антител
Данный пример определяет аффинность различных рекомбинантных одноцепочечных Fv форматированных анти-EGFRvIII антител при 37°С.
Для превращения обычного антитела в одноцепочечный фрагмент Fv (scFv) вариабельный домен тяжелой цепи и вариабельный домен легкой цепи соединяли вместе посредством линкера (GGGGS) 4 (SEQ ID NO: 202). Фрагмент scFv затем был слит с фрагментом человеческого IgG1 Fc для того, чтобы облегчить рекомбинантную экспрессию и очистку. Аффинности белков слияния scFv-Fc измеряли при 37°С на биосенсоре Biacore™ Т200 с поверхностным плазмонным резонансом, оснащенным анти-человеческим Fc, соединенным СМ4 сенсорной микросхемой (GE Healthcare Inc., Piscataway, NJ), как описано выше. Белки scFv-Fc захватывались анти-человеческим Fc. Мономерный 8-гистидиновый меченный человеческий EGFRvIII внеклеточный домен затем инъекционно вводили в качестве аналита в 10-кратных сериях разбавления начиная с 1000 нМ. Таблица 10 показывает, что scFv переформатированные слитые белки сохраняют связывание с EGFRvIII и что аффинности scFv-Fc белков как в HL (с вариабельным доменом тяжелой цепи на N-конце) и LH (с вариабельным доменом легкой-цепи на N-конце) ориентации сопоставимы с их обычными антительными соискателями, перечисленными в Таблицах 6, 7 и 9. Данные scFv-Fc белки также исследовали касательно связывания с 1000 нМ 8-гистидинового меченного рекомбинантного немутантного типа белка EGFRwt при 25°С, но ни один из них не показал значительное связывание.
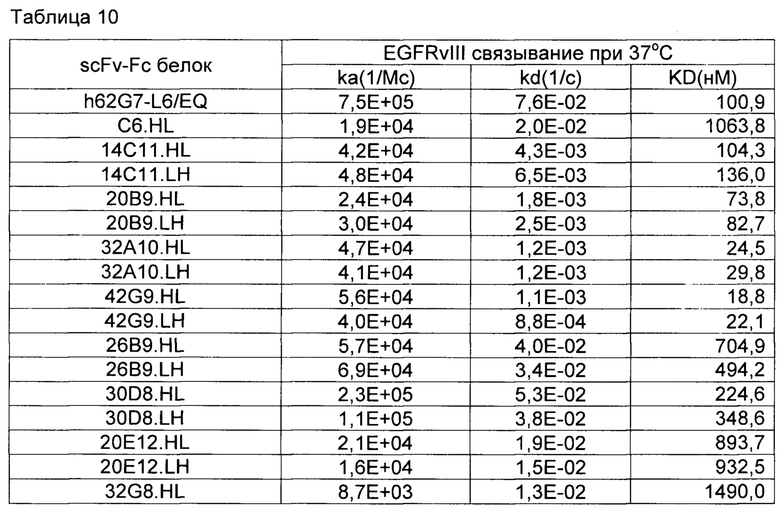
Пример 6: Получение и обнаружение Т клеток с EGFRvIII-специфическим химерным антигенным рецептором (CAR)
Данный пример определяет экспрессию и антигенсвязывающую специфичность EGFRvIII-специфических CAR Т клеток.
РВМС от здоровых доноров, предоставленных AllCells (Alameda, CA), оттаивали в соответствии со спецификацией поставщика и культивировали в течение ночи в среде X-Vivo™-15 (Lonza, Walkersville, MD), дополненной 5% человеческой сывороткой. Т-клетки активировали в течение 3 дней в среде X-Vivo™-15 (Lonza), дополненной 20 нг/мл человеческого IL-2, 5%-ной человеческой сывороткой и Dynabeads человеческим Т активатором CD3/CD28 с соотношением шарики: клетки 1:1 (Life Technologies, Carlsbad, СА). Т-клетки затем трансдуцировали бицистронным лентивирусным вектором, содержащим BFP-T2A-EGFRvIII специфическую CAR кассету экспрессии под контролем промотора EF1a при множественности инфекции (MOI) 5. В данном конструкте, EGFRvIII-специфический CAR является со-экспрессированным с BFP (синий флуоресцентный белок), для облегчения обнаружения EGFRvIII-специфического CAR. EGFRvIII-специфические CAR, содержащие VH и VL последовательности различных клонов анти-EGRRvIII (h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, С6, 20Е12, 26В9, 30D8, и 32G8; описанные в другом месте в данном документе). CAR Т клетки поддерживали в культуре в течение 14 дней после трансдукции. Процент клеток, экспресирующих EGFRvIII-специфический CAR, контролировался с течением времени (на день 4, 9 и 14 после лентивирусной трансдукции первичных Т-клеток) способом проточной цитометрии с использованием BFP (синий флуоресцентный белок) для обнаружения (ФИГ. 2А) (определяемый по проценту положительных жизнеспособных клеток BFP).
Для того, чтобы определить специфичность связывания с мишенью CAR, рекомбинантные белки EGFRvIII-mFc и EGFR-mFc, которые включают внеклеточный домен или человеческого EGFRvIII или человеческого немутантного типа EGFR, соответственно, слитого с мышиным IgG1-Fc доменом, продуцировались в HEK293 клетках. Специфичность связывания с мишенью определяли путем инкубирования различных EGFRvIII-специфических CAR Т клеток с или EGFRvIII-mFc, или EGFR-mFc белком с последующим РЕ-меченным козьим анти-мышиным Fc вторичным антителом (Jackson ImmunoResearch), и анализировали с использованием способа проточной цитометрии на 4-ый день после трансдукции Т-клеток векторами, кодирующими CAR, содержащими различные EGFRvIII-специфические клоны (h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, С6, 20Е12, 26В9, 30D8, и 32G8). Как показано на ФИГ. 2В, CAR Т клетки, содержащие VH и VL последовательности клонов h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, 20Е12, 26В9, и 30D8, связываются с EGFRvIII-mFc, но не имеют существенного связывания с EGFR-mFc. На 14-ый день после трансдукции определяли корреляцию экспрессии CAR, как определено по BFP на клетках, и рекомбинантное связывание EGFRvIII-mFc клетками. Репрезентативный набор данных показан на ФИГ. 2С, который показывает экспрессию CAR, содержащих десять различных EGFRvIII-специфических клонов (h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, С6, 20Е12, 26В9, 30D8, и 32G8) в CAR Т клетках на 14-ый день после трансдукции, как определено по BFP обнаружению на клетках и по рекомбинантному EGFRvIII-mFc связыванию клетками.
Данные результаты демонстрируют, что CAR Т клетки, содержащие CAR, содержащие VH и VL последовательности клонов h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, 20Е12, 26В9, и 30D8, связываются с EGFRvIII-mFc, но не имеют существенного связывания с EGFR-mFc.
Пример 7: Мишень-зависимая и независимая дегрануляция EGFRvIII-специфических CAR Т клеток
Данный пример определяет активность дегрануляции EGFRvIII-специфических CAR Т клеток в присутствии и в отсутствие мишень-экспрессирующих раковых клеточных линий.
Пять клеточных линий использовали для оценки активности дегрануляции CAR Т-клеток. Линию клеток рака легких человека NCI-H522 и клеточную линию глиобластомы U87MG получали из Американской коллекции типовых культур (Manassas, VA) и культивировали в среде RPMI 1640, дополненной 10%-ной инактивированной нагреванием фетальной бычьей сывороткой (Mediatech Inc., Manassas, VA). Поскольку большинство раковых клеточных линий не экспрессируют EGFRvIII, NCI-H522 (не экспрессирующие обнаруживаемый уровень EGFR немутантного типа или EGFRvIII) трансдуцировался лентивирусным вектором, кодирующим ген EGFRvIII полной длины (SEQ ID NO 201) для того, чтобы генерировать "NCI-H522-EGFRvIII", который экспрессирует низкий уровень EGFRvIII. Для того, чтобы генерировать изогенные человеческие глиобластомные клеточные линии, которые экспрессируют различные EGFR белки, эндогенный немутантного тип EGFR ген U87MG был сначала инактивирован для того, чтобы генерировать EGFR-нулевую клеточную линию "U87-KO". Затем U87-KO клетки трансдуцировали лентивирусным вектором, кодирующим полной длины немутантного типа EGFR гена (номер доступа NP_005219), чтобы получить EGFR сверхэкспрессирующую клеточную линию, "U87-KO-EGFRwt". Аналогично, "U87-KO-EGFRvIII" (который надэкспрессирует EGFRvIII), был получен из U87-KO путем транскрипции лентивируса с вектором, кодирующим полной длины EGFRvIII ген (SEQ ID NO: 201).
Для анализа дегрануляции 100000 Т-клеток, экспрессирующих различные EGFRvIII-специфические CAR (содержащие клоны h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, С6, 20Е12, 26В9, 30D8, и 32G8) инкубировали в 96-луночных планшетах с равным количеством раковых клеток, экспресирующих различные уровни EGFRvIII белка или EGFRwt белка. Co-культуры поддерживали в конечном объеме 100 мкл среды X-Vivo™-15 (Lonza, Walkersville, MD) в течение 6 часов при 37°C с 5% СО2. Окрашивание CD107a проводили во время стимуляции клеток путем добавления флуоресцентного анти-CD107a-антитела (Miltenyi Biotec, San Diego, CA) в начале совместного культивирования вместе с конечной концентрацией 1 мкг/мл aHTH-CD49d (BD Pharmingen, San Diego, CA), 1 мкг/мл анти-CD28 (Miltenyi Biotec) и 1x Monensin (eBioscience, San Diego, CA). После 6 ч периода инкубирования клетки окрашивали фиксируемым жизнеспособным красителем и конъюгированным с флуорохромом анти-CD8 антителом (Miltenyi Biotec) и анализировали с помощью проточной цитометрии. Активность дегрануляции определяли как % жизнеспособных/ CD8+/BFP+/CD107a+ клеток и определяли средний сигнал интенсивности флуоресценции (MFI) для окрашивания CD107a среди CD8+/BFP+ клеток. Дегрануляционные анализы проводили на 14-й день после трансдукции CAR. ФИГ. 3 показывает результаты от двух доноров РВМС для каждого EGFRvIII-специфического CAR. За исключением Т-клеток CAR, содержащих клоны С6 и 32G8, увеличение активности дегрануляции (сверх CAR-T самостоятельно) наблюдалось только тогда, когда EGFRvIII-специфические CAR Т клетки совместно культивировались с клеточными линиями, которые экспрессируют EGFRvIII, такой как NCI-H522-EGFRvIII и U87-KO-EGFRVIII.
Данные результаты демонстрируют, что EGFRvIII-специфические CAR Т клетки демонстрируют активность дегрануляции в присутствии EGFRvIII-экспресирующих опухолевых клеток, но не демонстрируют активность дегрануляции в присутствии опухолевых клеток, которые не экспрессируют EGFRvIII.
Пример 8: Секреция интерферона гамма (IFNγ) EGFRvIII-специфических CAR Т клеток
Данный пример показывает уровень секреции IFNγ EGFRvIII-специфическими CAR Т клетками при совместном культивировании EGFRvIII-специфических CAR Т клеток клеточными линиями, экспресирующими белок-мишень.
EGFRvIII-специфические CAR Т-клетки, экспресирующие CAR, содержащих различные EGFRvIII-специфические клоны (h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, С6, 20Е12, 26В9, 30D8, и 32G8) were инкубировали в 96-луночных планшетах (100,000 клетки/well), вместе с равным количеством клеток, экспресирующих различными уровни EGFRvIII или EGFRwt белков (клетки NCI-Н522, NCI-H522-EGFRvIII, U87-KO, U87-KO-EGFRwt, и U87-KO-EGFRvIII; каждый описан выше в Примере 7). Co-культуры поддерживали в конечном объеме 100 мкл среды X-Vivo™-15 (Lonza) в течение 18 часов при 37°C с 5% СО2. Супернатант затем собирали и замораживали. IFNγ в супернатанте измеряли с человеческим IFN-гамма набором Quantikine ELISA (R&D systems, Minneapolis, MN) в соответствии со спецификациями производителя. Как показано в ФИГ. 4, для большинства CAR Т клеток, уровень секреции IFNγ коррелирует с количеством EGFRvIII, экспрессированного совместно культивированными клетками: низкий экспрессор NCI-H522-EGFRvIII индуцировал небольшое количество IFNγ, высокий экспрессор U87-KO-EGFRvIII индуцировал большое количество IFNγ. Т клетки, экспресирующие EGFRvIII-специфический клон 32G8 CAR не секретировали значительные уровни IFNγ во всех исследованных условиях. EGFRvIII-специфические CAR Т клетки клона С6, с другой стороны, секретировал высокие уровни IFNγ на со-культуре с или U87-KO-EGFRwt, или U87-KO-EGFRvIII клетками.
Данные результаты демонстрируют, что для большинства EGFRvIII-специфических CAR Т клеток, уровень секркции IFNγ коррелирует с количеством EGFRvIII, экспрессированным совместно культивируемыми клетками.
Пример 9: Цитотоксичность EGFRvIII-специфических CAR Т клеток
Данный пример определяет цитотоксичность EGFRvIII-специфические CAR Т клеток в со-культуре EGFRvIII-специфических CAR Т клеток с клеточными линиями, экспресирующими белок-мишень.
EGFRvIII-специфические CAR Т-клетки, экспресирующие CAR, содержащий различные EGFRvIII-специфические клоны (h62G7-L6/EQ, 14С11, 20В9, 32А10, 42G9, С6, 20Е12, 26В9, 30D8, и 32G8) высевали в 96-луночных планшетах (400000 клетки/лунка), вместе с 20000 клетками-мишенями, экспресирующими различными уровни EGFRvIII белка. Клетки-мишени представляли собой: U87-KO-EGFRwt, NCI-H522-EGFRvIII, и U87-KO-EGFRvIII, описанные выше. Клетки-мишени (EGFRvIII положительный: NCI-H522-EGFRvIII и U87-KO-EGFRvIII) и контроль (EGFRvIII отрицательный: U87-KO-EGFRwt) высевали и метили флуоресцентным внутриклеточным красителем CFSE перед их совместным культивированием со EGFRvIII-специфическими CAR Т-клетками. Со-культуры инкубировали в течение 4 часов при 37°C с 5% CO2. После данного периода инкубирования, клетки метили фиксируемым жизнеспособным красителем и анализировали способом проточной цитометрии. Определяли жизнеспособность каждой клеточной популяции (EGFRvIII положительные клетки-мишени или EGFRvIII отрицательные контрольные клетки) определяли, и рассчитывали % специфического клеточного лизиса. Анализ цитотоксичность проводили через 14 дней после трансдукции Т-клеток. Все EGFRvIII-специфические CAR Т клетки, за исключением 32G8, были способны лизировать как низкоуровневые экспресирующие мишень клетки (NCI-H522-EGFRvIII), так и высокоуровневые экспресирующие мишень клетки (U87-KO-EGFRvIII) в различной степени. Кроме того, EGFRvIII-специфические CAR Т клетки клона С6 лизировали как немутантного типа EGFR, так и EGFRvIII экспресирующие клетки (ФИГ. 5).
Данные результаты демонстрируют, что EGFRvIII-специфические CAR Т клетки эффективно убивают клетки, которые экспрессируют EGFRvIII.
Пример 10: Исследование in vivo EGFRvIII-специфических CAR Т клеток в модели U87-KO-EGFRvIII
Данный пример показывает противоопухолевую активность EGFRvIII-специфических CAR Т клеток в подкожной U87-KO-EGFRvIII GBM ксенографической модели.
Три миллиона опухолевых клеток U87-KO-EGFRvIII GBM (описанных выше) имплантировали подкожно 5-6-недельным мышам NSG (Jackson Laboratory, Sacramento, СА). Объем опухоли измеряли один раз в неделю с использованием штангенциркуля и рассчитывали по следующей формуле: Объем опухоли = (длина × ширина2) / 2. На 8-й день после имплантации опухоли животные были рандомизированы по размерам опухоли по пять животных на группу, и одноразово дозировали 6 миллионов CAR положительных EGFRvIII-специфических CAR Т клеток (экспресирующих EGFRvIII-специфический клон 14С11, 32А10 или 26В9; клоны описаны в другом месте в данном документе) или эквивалентное общее количество не трансдуцированных Т клеток вводили в виде болюсной инъекции в хвостовую вену. ФИГ. 6 показывает, что 14С11, 32А10 и 26В9 EGFRvIII-специфические CAR Т клетки, но не нетрансдуцированные Т клетки, ингибировали U87-KO-EGFRvIII рост опухоли ксенотрансплантата in vivo.
Данные результаты демонстрируют, что EGFRvIII-специфические CAR Т клетки эффективно ингибируют рост опухолевых EGFRvIII-экспресирующих клеток in vivo.
Пример 11: Поверхностная экспрессия EGFRvIII-специфического CAR, содержащего R2 последовательность «самоубийцу»
Данный пример показывает экспрессию EGFRvIII-специфического CAR, содержащего R2 последовательность «самоубийцу» в Т клетках.
R2 последовательность «самоубийца» представляет собой CD20 последовательность «самоубийцу» на основе эпитопа и включает две тандемные копии эпитопа распознавания ритуксимаба. R2 последовательность вставляли между scFv и CD8α шарнирной последовательностями различных EGFRvIII-специфических CAR, описанных где-либо в данном документе (14С11, 32А10, 30D8, и 26 В9) для того, чтобы генерировать различные EGFRvIII-R2 CARs (называемые в данном документе как "14C11-R2", "32A10-R2", "30D8-R2", и "26В9-R2", соответственно). Т клетки трансдуцировали с лентивирусным вектором, несущим различные EGFRvIII-R2 CAR кассеты экспрессии под контролем EF1α промотора при множественности инфекции (MOI) 5 или 25 (для клонов 26B9-R2 и 30D8-R2). CAR Т клетки поддерживали в культуре в течение вплоть до 14 или 15 дней после трансдукции. CAR экспрессию контролировали с течением времени (в день 4, день 9/10 и день 14/15 после трансдукции Т-клеток) способом проточной цитометрии с использованием биотинилированных рекомбинантных белков: EGFRvIII-mFc или ритуксимаб в клетках (коньюгированный с EZ-Link™ Sulfo-NHS-SS-Biotin; ThermoFisher, Waltham, MA), с последующим РЕ коньюгированным стрептавидином (BD Biosciences, San Diego, CA). Проценты CAR положительных клеток как обнаруженных с биотинилированным EGFRvIII-mFc и биотинилированным ритуксимабом показаны на ФИГ. 7 и 8, соответственно. Связывание с нетрансдуцированными Т клетками (NTD) представлено в виде контроля.
Данные результаты демонстрируют экспрессию в Т клетках EGFRvIII-специфического CAR, содержащего R2 последовательность «самоубийцу».
Пример 12: Цитотоксичность EGFRvIII-специфических R2 CAR Т клеток
Данный пример показывает цитотоксичность EGFRvIII-специфических R2 CAR Т клеток на совместной культуре с клеточными линиями, экспресирующими мишень.
Анализы на цитотоксичность проводили, как описано в примере 9, используя EGFRvIII-R2 CAR 14C11-R2, 32A10-R2, 30D8-R2, и 26B9-R2, которые описаны в примере 11. Все исследованные EGFRvIII-специфические R2 CAR Т клетки были способны лизировать как низкоуровневые экспресирующие мишень клетки (NCI-H522-EGFRvIII), так и высокоуровневые экспресирующие мишень клетки (U87-KO-EGFRvIII) в различной степени (ФИГ. 9).
Данные результаты демонстрируют, что EGFRvIII-специфические R2 CAR Т клетки эффективно убивают клетки, которые экспрессируют EGFRvIII.
Хотя раскрытые положения описаны со ссылкой на различные применения, способы, наборы и композиции, будет понятно, что могут быть сделаны различные изменения и модификации без отступления от принципов данного документа и заявленного изобретения ниже. Приведенные выше примеры приведены для лучшей иллюстрации раскрытых положений и не предназначены для ограничения сферы охвата представленных в данном документе положений. Несмотря на то, что представленные положения описаны с точки зрения данных иллюстративных вариантов осуществления, квалифицированный специалист в данной области легко поймет, что многочисленные варианты и модификации данных иллюстративных вариантов осуществления возможны без чрезмерного эксперимента. Все такие изменения и модификации находятся в пределах текущих положений.
Все ссылки, цитируемые в данном документе, включая патенты, заявки на патент, статьи, учебники и т.т., а также ссылки, приведенные в них, в той мере, в которой они еще не включены, включены в настоящее описание посредством ссылки во всей их полноте. В случае, если одна или несколько из включенной литературы и аналогичных материалов отличаются или противоречат данной заявке, включая, но не ограничиваясь этим, определенные термины, использование термина, описанные способы или тому подобное, данная заявка контролирует.
В приведенном выше описании и примерах подробно описаны некоторые конкретные варианты осуществления изобретения и описан наилучший способ, предложенный авторами изобретения. Однако будет понятно, что независимо от того, насколько подробно изложено указанное выше в тексте, изобретение может быть осуществлено на практике многими способами, и изобретение должно толковаться в соответствии с прилагаемой формулой изобретения и какими-либо ее эквивалентами.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PFIZER INC.
Wong, Oi Kwan
Chou, Joyce C
Dusseaux, Mathilde Brunnhilde C
Smith, Julianne C
<120> Химерные антигенные рецепторы, нацеливающиеся на вариант III рецептора
эпидермального фактора роста
<130> ALGN-006/02WO 333466-2071
<140> PCT/IB2017/050108
<141> 2017-07-27
<150> US 62/431,758
<151> 2016-12-08
<150> US 62/281,533
<151> 2016-01-21
<160> 277
<170> PatentIn version 3.5
<210> 1
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 1
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Thr Leu His Trp Val Lys Gln Ser His Val Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asp Pro Ile Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Ala Met Asp Ser Trp Gly Gln Gly Thr Ser Val Thr
100 105 110
Val Ser Ser
115
<210> 2
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 2
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Phe Tyr Tyr Cys Val Gln Asp
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 3
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Thr Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ile Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Ala Met Asp Ser Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 4
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 4
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Asp
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 5
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Thr Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Trp Pro Ile Thr Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Ala Gln Gly Ser Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 6
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 6
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Gln Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gly Gln Asp
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 7
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 7
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Thr Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Trp Pro Ile Thr Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Ala Glu Gly Ser Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 8
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 8
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Asp Lys Thr Tyr Thr Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Glu Val Ser Lys Leu Asp Val Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gly Gln Asp
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 9
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 9
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Leu Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Pro
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys Ser Leu Lys Leu Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Ala Pro Val Asp Ser Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Phe Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 10
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 10
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ser Thr Ile Arg Ala Thr Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ser Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 11
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 11
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Ala
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys Ser Ile Arg Arg Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Phe
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 12
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 12
Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Leu
35 40 45
Tyr Gly Ala Thr Thr Arg Ala Thr Gly Leu Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Ile Tyr Phe Cys Gln Gln Tyr Lys Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Ser Lys Val Asp Ile Lys
100 105
<210> 13
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 13
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Ala
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Gly His Ile Phe Ser Thr Asp Glu Lys Ser Tyr Ser Thr Ser
50 55 60
Leu Arg Gly Arg Ile Thr Ile Ser Lys Asp Thr Ser Arg Gly Leu Val
65 70 75 80
Val Leu Thr Leu Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Phe Trp Gly
100 105 110
Pro Gly Phe Leu Val Thr Val Ser Ser
115 120
<210> 14
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 14
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Val Ser Gln Ser Ile Gly Ala Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Phe Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Val Arg Phe Ser Gly
50 55 60
Gly Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Ile Tyr Ser Cys Gln Gln Tyr Ile Tyr Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Thr Val Asp Ile Lys
100 105
<210> 15
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 15
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Asn Ala
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys Ser Phe Arg Thr Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Ile Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 16
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Asn Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Asp Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Lys Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 17
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Val
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Phe Ala His Ile Phe Ser Ser Asp Glu Lys Ser Ile Arg Arg Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Phe Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Asn
115 120
<210> 18
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 18
Asp Met Val Val Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Pro Pro Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 19
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 19
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Val
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Phe Ala His Ile Phe Ser Ser Asp Glu Lys Ser Ile Arg Arg Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 20
Glu Met Glu Val Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Ile Gly Ser Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Gln Ser Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Ser Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Thr Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 21
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 21
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Ala
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys Ser Ile Arg Arg Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Ile Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 22
Glu Val Val Met Thr Gln Ser Pro Pro Asn Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Thr Ser Asn
20 25 30
Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Arg Leu Leu Leu
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Lys Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Ser Lys Val Asp Ile Lys
100 105
<210> 23
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 23
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Ala
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys Ser Ile Arg Arg Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 24
Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Gly Val Ser Ser Asn
20 25 30
Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Arg Leu Leu Leu
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Ile Tyr Phe Cys Gln Gln Tyr Lys Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Ser Lys Val Asp Ile Lys
100 105
<210> 25
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 25
Gln Val Thr Leu Glu Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Ala
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Pro Glu
35 40 45
Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys Ser Leu Arg Leu Ser
50 55 60
Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 26
Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Arg Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Phe Gly Thr Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Asp Ser Leu Gln Ser
65 70 75 80
Glu His Ser Gly Leu Tyr Tyr Cys Gln Gln Tyr Asn Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 27
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 27
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Ala
20 25 30
Lys Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys Ser Ile Arg Arg Ser
50 55 60
Leu Arg Ser Arg Leu Thr Met Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Val Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 28
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 28
Glu Val Leu Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Asn
20 25 30
Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Leu
35 40 45
Phe Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Gly Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Ile Tyr Phe Cys Gln Gln Tyr Lys Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Ser Lys Val Glu Ile Lys
100 105
<210> 29
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 29
Asp Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Phe Gly Ser Ser Thr Arg Ala Thr Gly Ile Pro Ala Ser Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu His Ser Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 30
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 30
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Pro
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Gly His Ile Phe Ser Ser Asp Glu Lys Ser Tyr Arg Leu Ser
50 55 60
Leu Arg Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Val Arg Asp Ser Ser Asn Tyr Gly Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 31
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 31
Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ile Asn Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Thr Arg Ala Thr Asp Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Asp Tyr Asn Asn Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 32
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 32
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Ile Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Cys Gly Phe Ser Leu Ser Asn Pro
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Gly His Ile Phe Ser Ser Asp Glu Lys Ser Tyr Arg Leu Phe
50 55 60
Leu Arg Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asp Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 33
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 33
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Thr Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Ser Cys Gln Glu Tyr Asn Asn Trp Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 34
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<220>
<221> misc_feature
<222> (83)..(83)
<223> Xaa can be any naturally occurring amino acid
<400> 34
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Phe Gly Phe Ser Leu Ser Asn Pro
20 25 30
Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Pro Glu
35 40 45
Trp Leu Gly His Ile Phe Ser Ser Asp Glu Lys Ser Tyr Arg Leu Ser
50 55 60
Leu Arg Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Phe Xaa Met Thr Asn Met Asp Pro Gly Asp Pro Ala Thr Tyr Tyr
85 90 95
Cys Val Arg Asp Ser Ser Asn Tyr Glu Glu Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 35
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 35
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Pro
20 25 30
Arg Met Gly Val Ser Trp Leu Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys Ser Tyr Ser Pro Ser
50 55 60
Leu Arg Gly Arg Leu Thr Val Ser Lys Asp Thr Ser Lys Ser Gln Val
65 70 75 80
Val Leu Thr Leu Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 36
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 36
Lys Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Asn Gln Ile Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Val
35 40 45
Phe Gly Thr Ser Thr Arg Ala Thr Gly Ile Pro Ile Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Val Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Val Cys Gln Gln Tyr Asn Asp Trp Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 37
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 37
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Val Val
50 55 60
Pro Leu Asn Gly Arg Phe Ile Ile Ser Arg Asp Asp Ser Arg Asn Thr
65 70 75 80
Leu Tyr Leu Gln Leu Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Val Pro Gly Ser Tyr Gly Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 38
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 38
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Asn
20 25 30
Lys Arg Asn Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Ala Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Gln Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 39
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 39
Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Ile Ala Asp Gly Gly Ala Thr Asp Tyr Ala Ala
50 55 60
Pro Val Arg Asn Arg Phe Thr Ile Ser Arg Asp Asp Ser Arg Asn Thr
65 70 75 80
Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Ile Pro Gly Asn Asp Ala Phe Asp Met Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 40
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 40
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Asn Tyr Leu Asp Trp Phe Leu His Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Ile Asp Phe Ile Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Gln Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 41
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 41
Glu Val Gln Leu Val Glu Ser Trp Gly Val Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Asn Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Lys Ser Lys Ser Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asp Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Gly Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Phe Cys Thr Thr Ala Pro Gly Gly Pro Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 42
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 42
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
20 25 30
Asp Gly Phe Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Ala Ser Ser Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Asp Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 43
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 43
Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Ile Thr Asp Gly Gly Val Ile Asp Tyr Ala Ala
50 55 60
Pro Val Arg Asn Arg Cys Thr Ile Ser Arg Asp Asp Ser Arg Asn Thr
65 70 75 80
Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Ile Pro Gly Asn Asp Asp Phe Asp Met Trp Gly Gln
100 105 110
Gly Arg Met Val Thr Val Ser Ser
115 120
<210> 44
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 44
Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Tyr Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Ile Asn Asp Gly Gly Ala Thr Asp Tyr Ala Ser
50 55 60
Pro Val Arg Asn Arg Phe Thr Ile Ser Arg Asp Asp Ser Arg Asn Met
65 70 75 80
Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Ile Pro Gly Asn Asp Ala Phe Asp Met Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 45
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 45
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Thr Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Asn Tyr Leu Asp Trp Phe Leu His Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Phe Leu Gly Ser Ile Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Ile Asp Phe Ile Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Gln Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 46
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 46
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Ile Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Ile Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Ser Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Thr Thr Ala Pro Gly Gly Pro Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser
115
<210> 47
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 47
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asp Arg Arg Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro His Leu Leu Ile Tyr Leu Gly Ser Tyr Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Ile Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 48
<211> 126
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 48
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Asp Thr Phe Ser Ser Asn
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Ile Pro Ile Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Thr Tyr His Glu Tyr Ala Gly Gly Tyr Tyr Gly Gly Ala
100 105 110
Met Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 49
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 49
Glu Leu Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro
1 5 10 15
Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly
20 25 30
Ser Asn Tyr Val Tyr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys
35 40 45
Ile Leu Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg
50 55 60
Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly
65 70 75 80
Leu Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp
85 90 95
Asn Leu Ser Gly Trp Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 50
<211> 123
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 50
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Asp Ile Ser Gly Gly Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Leu Leu Tyr Gly Gly Gly Val Tyr Pro Met Asp Ile
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 51
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 51
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 491
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 52
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu
20 25 30
Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln
35 40 45
Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln
50 55 60
Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile Tyr Gln Val Ser Lys Leu
65 70 75 80
Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr
100 105 110
Tyr Cys Gly Gln Asp Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr
115 120 125
Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser
145 150 155 160
Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys
165 170 175
Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Thr Leu His Trp Val Arg Gln
180 185 190
Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Trp Pro Ile Thr
195 200 205
Gly Gly Thr Thr Tyr Asn Gln Lys Phe Lys Gly Arg Val Thr Met Thr
210 215 220
Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg
225 230 235 240
Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Gly Glu Ala Gln Gly
245 250 255
Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Thr Thr Thr Pro
260 265 270
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
275 280 285
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
290 295 300
Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu
305 310 315 320
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
325 330 335
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
340 345 350
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
355 360 365
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
370 375 380
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
385 390 395 400
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
405 410 415
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
420 425 430
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
435 440 445
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
450 455 460
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
465 470 475 480
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 53
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 53
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Leu Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Pro Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Leu Lys Leu Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Ala Pro Val Asp
100 105 110
Ser Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg
180 185 190
Ser Asn Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ser Thr Ile Arg Ala Thr Gly Val Pro Ala Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ser Asp Trp
245 250 255
Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 54
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 54
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Ile Arg Arg Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Phe Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Val Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Ser Asn Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu
195 200 205
Leu Leu Tyr Gly Ala Thr Thr Arg Ala Thr Gly Leu Pro Gly Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Ile Tyr Phe Cys Gln Gln Tyr Lys Asp Trp
245 250 255
Pro Phe Thr Phe Gly Pro Gly Ser Lys Val Asp Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 55
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 55
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Gly His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Tyr Ser Thr Ser Leu Arg Gly Arg Ile Thr Ile Ser Lys Asp Thr
85 90 95
Ser Arg Gly Leu Val Val Leu Thr Leu Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Phe Trp Gly Pro Gly Phe Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Val Ser Gln Ser Ile Gly
180 185 190
Ala Asn Leu Ala Trp Tyr Gln Gln Lys Phe Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Val Arg Phe
210 215 220
Ser Gly Gly Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Ile Tyr Ser Cys Gln Gln Tyr Ile Tyr Trp
245 250 255
Pro Phe Thr Phe Gly Pro Gly Thr Thr Val Asp Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 56
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 56
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Asn Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Phe Arg Thr Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Asn Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Ala Arg Phe
210 215 220
Ser Gly Ser Asp Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Lys Asp Trp
245 250 255
Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 57
<211> 496
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 57
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Tyr Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Ile Ala Asp Gly Gly Ala
65 70 75 80
Thr Asp Tyr Ala Ala Pro Val Arg Asn Arg Phe Thr Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Ile Pro Gly Asn Asp Ala Phe
115 120 125
Asp Met Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro
165 170 175
Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr
180 185 190
Ser Asn Gly Lys Asn Tyr Leu Asp Trp Phe Leu His Lys Pro Gly Gln
195 200 205
Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val
210 215 220
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ile Asp Phe Ile Leu Lys
225 230 235 240
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln
245 250 255
Ala Gln Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
260 265 270
Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile
275 280 285
Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala
290 295 300
Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr
305 310 315 320
Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu
325 330 335
Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
340 345 350
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
355 360 365
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
370 375 380
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
385 390 395 400
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
405 410 415
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
420 425 430
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
435 440 445
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
450 455 460
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
465 470 475 480
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 58
<211> 496
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 58
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Tyr Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Ile Thr Asp Gly Gly Val
65 70 75 80
Ile Asp Tyr Ala Ala Pro Val Arg Asn Arg Cys Thr Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Ile Pro Gly Asn Asp Asp Phe
115 120 125
Asp Met Trp Gly Gln Gly Arg Met Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro
165 170 175
Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr
180 185 190
Ser Asn Gly Lys Asn Tyr Leu Asp Trp Phe Leu His Lys Pro Gly Gln
195 200 205
Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val
210 215 220
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ile Asp Phe Ile Leu Lys
225 230 235 240
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln
245 250 255
Ala Gln Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
260 265 270
Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile
275 280 285
Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala
290 295 300
Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr
305 310 315 320
Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu
325 330 335
Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
340 345 350
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
355 360 365
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
370 375 380
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
385 390 395 400
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
405 410 415
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
420 425 430
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
435 440 445
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
450 455 460
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
465 470 475 480
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 59
<211> 495
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 59
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Trp Gly Val Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ile Phe Asn Asn Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Lys Ser Lys Ser Asp Gly Gly Thr
65 70 75 80
Thr Asp Tyr Ala Ala Pro Val Lys Asp Arg Phe Thr Ile Ser Arg Asp
85 90 95
Asp Ser Lys Asp Thr Leu Tyr Leu Gln Met Asn Gly Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Phe Cys Thr Thr Ala Pro Gly Gly Pro Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
165 170 175
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
180 185 190
Asp Gly Phe Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser
195 200 205
Pro Gln Leu Leu Ile Tyr Leu Ala Ser Ser Arg Ala Ser Gly Val Pro
210 215 220
Asp Arg Phe Ser Gly Ser Asp Ser Gly Thr Asp Phe Thr Leu Lys Ile
225 230 235 240
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
245 250 255
Leu Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
260 265 270
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
275 280 285
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
290 295 300
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
305 310 315 320
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
325 330 335
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
340 345 350
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
355 360 365
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
370 375 380
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
385 390 395 400
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
405 410 415
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 60
<211> 494
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 60
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr
65 70 75 80
Thr Asp Tyr Val Val Pro Leu Asn Gly Arg Phe Ile Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Gln Leu Asn Asn Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Val Pro Gly Ser Tyr Gly Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu
165 170 175
Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Asn Lys
180 185 190
Arg Asn Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser Pro
195 200 205
Gln Leu Leu Ile Tyr Leu Ala Ser Asn Arg Ala Ser Gly Val Pro Asp
210 215 220
Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
225 230 235 240
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala Gln
245 250 255
Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Thr
260 265 270
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
275 280 285
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
290 295 300
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
305 310 315 320
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
325 330 335
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
340 345 350
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
355 360 365
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
370 375 380
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
385 390 395 400
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
405 410 415
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
420 425 430
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
435 440 445
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
450 455 460
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
465 470 475 480
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 61
<211> 502
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 61
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Asp
35 40 45
Thr Phe Ser Ser Asn Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Val Ile Ile Pro Ile Phe Gly Thr Ala Asp
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg His Thr Tyr His Glu Tyr Ala Gly Gly
115 120 125
Tyr Tyr Gly Gly Ala Met Asp Pro Trp Gly Gln Gly Thr Leu Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Gly Gly Gly Gly Ser Glu Leu Gln Ser Val Leu Thr Gln Pro
165 170 175
Pro Ser Ala Ser Gly Thr Pro Gly Gln Arg Val Thr Ile Ser Cys Ser
180 185 190
Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Tyr Trp Tyr Gln Gln
195 200 205
Leu Pro Gly Thr Ala Pro Lys Ile Leu Ile Tyr Arg Asn Asn Gln Arg
210 215 220
Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser
225 230 235 240
Ala Ser Leu Ala Ile Ser Gly Leu Arg Ser Glu Asp Glu Ala Asp Tyr
245 250 255
Tyr Cys Ala Ala Trp Asp Asp Asn Leu Ser Gly Trp Val Phe Gly Thr
260 265 270
Gly Thr Lys Leu Thr Val Leu Thr Thr Thr Pro Ala Pro Arg Pro Pro
275 280 285
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
290 295 300
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
305 310 315 320
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
325 330 335
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
340 345 350
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
355 360 365
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
370 375 380
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
385 390 395 400
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
405 410 415
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
420 425 430
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
435 440 445
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
450 455 460
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
465 470 475 480
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
485 490 495
Gln Ala Leu Pro Pro Arg
500
<210> 62
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 62
Thr Asp Tyr Thr Leu His
1 5
<210> 63
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 63
Gly Tyr Thr Phe Thr Asp
1 5
<210> 64
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 64
Gly Tyr Thr Phe Thr Asp Tyr Thr Leu His
1 5 10
<210> 65
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 65
Gly Ile Asp Pro Ile Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 66
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 66
Gly Ile Asp Pro Ile Asn Gly Gly Thr Thr Tyr
1 5 10
<210> 67
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 67
Gly Glu Ala Met Asp Ser
1 5
<210> 68
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 68
Gly Ile Asn Pro Ile Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 69
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 69
Gly Ile Asn Pro Ile Asn Gly Gly Thr Thr Tyr
1 5 10
<210> 70
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 70
Gly Ile Trp Pro Ile Thr Gly Gly Thr Thr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 71
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 71
Gly Ile Trp Pro Ile Thr Gly Gly Thr Thr Tyr
1 5 10
<210> 72
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 72
Gly Glu Ala Glu Gly Ser
1 5
<210> 73
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 73
Gly Glu Ala Gln Gly Ser
1 5
<210> 74
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 74
Ser Asn Pro Arg Met Gly Val Ser
1 5
<210> 75
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 75
Gly Phe Ser Leu Ser Asn Pro Arg
1 5
<210> 76
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 76
Gly Phe Ser Leu Ser Asn Pro Arg Met Gly Val Ser
1 5 10
<210> 77
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 77
His Ile Phe Ser Thr Asp Glu Lys Ser Leu Lys Leu Ser Leu Arg Ser
1 5 10 15
<210> 78
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 78
His Ile Phe Ser Thr Asp Glu Lys Ser Leu
1 5 10
<210> 79
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 79
Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Phe
1 5 10
<210> 80
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 80
Ser Asn Ala Arg Met Gly Val Ser
1 5
<210> 81
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 81
Gly Phe Ser Leu Ser Asn Ala Arg
1 5
<210> 82
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 82
Gly Phe Ser Leu Ser Asn Ala Arg Met Gly Val Ser
1 5 10
<210> 83
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 83
His Ile Phe Ser Thr Asp Glu Lys Ser Ile Arg Arg Ser Leu Arg Ser
1 5 10 15
<210> 84
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 84
His Ile Phe Ser Thr Asp Glu Lys Ser Ile
1 5 10
<210> 85
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 85
Asp Ser Ser Asn Tyr Glu Gly Tyr Phe Asp Tyr
1 5 10
<210> 86
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 86
His Ile Phe Ser Thr Asp Glu Lys Ser Tyr Ser Thr Ser Leu Arg Gly
1 5 10 15
<210> 87
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 87
His Ile Phe Ser Thr Asp Glu Lys Ser Tyr
1 5 10
<210> 88
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 88
Asn Asn Ala Arg Met Gly Val Ser
1 5
<210> 89
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 89
Gly Phe Ser Leu Asn Asn Ala Arg
1 5
<210> 90
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 90
Gly Phe Ser Leu Asn Asn Ala Arg Met Gly Val Ser
1 5 10
<210> 91
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 91
His Ile Phe Ser Thr Asp Glu Lys Ser Phe Arg Thr Ser Leu Arg Ser
1 5 10 15
<210> 92
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 92
His Ile Phe Ser Thr Asp Glu Lys Ser Phe
1 5 10
<210> 93
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 93
Ser Asn Val Arg Met Gly Val Ser
1 5
<210> 94
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 94
Gly Phe Ser Leu Ser Asn Val Arg
1 5
<210> 95
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 95
Gly Phe Ser Leu Ser Asn Val Arg Met Gly Val Ser
1 5 10
<210> 96
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 96
His Ile Phe Ser Ser Asp Glu Lys Ser Ile Arg Arg Ser Leu Arg Ser
1 5 10 15
<210> 97
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 97
His Ile Phe Ser Ser Asp Glu Lys Ser Ile
1 5 10
<210> 98
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 98
His Ile Phe Ser Thr Asp Glu Lys Ser Leu Arg Leu Ser Leu Arg Ser
1 5 10 15
<210> 99
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 99
Ser Asn Ala Lys Met Gly Val Ser
1 5
<210> 100
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 100
Gly Phe Ser Leu Ser Asn Ala Lys
1 5
<210> 101
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 101
Gly Phe Ser Leu Ser Asn Ala Lys Met Gly Val Ser
1 5 10
<210> 102
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 102
His Ile Phe Ser Ser Asp Glu Lys Ser Tyr Arg Leu Ser Leu Arg Ser
1 5 10 15
<210> 103
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 103
His Ile Phe Ser Ser Asp Glu Lys Ser Tyr
1 5 10
<210> 104
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 104
Asp Ser Ser Asn Tyr Gly Gly Tyr Phe Asp Tyr
1 5 10
<210> 105
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 105
His Ile Phe Ser Ser Asp Glu Lys Ser Tyr Arg Leu Phe Leu Arg Ser
1 5 10 15
<210> 106
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 106
His Ile Phe Ser Thr Asp Glu Lys Ser Tyr Ser Pro Ser Leu Arg Gly
1 5 10 15
<210> 107
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 107
Asp Ser Ser Asp Tyr Glu Gly Tyr Phe Asp Tyr
1 5 10
<210> 108
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 108
Asp Ser Ser Asn Tyr Glu Glu Tyr Phe Asp Tyr
1 5 10
<210> 109
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 109
Ser Asp Ala Trp Met Ser
1 5
<210> 110
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 110
Gly Phe Thr Phe Ser Asp
1 5
<210> 111
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 111
Gly Phe Thr Phe Ser Asp Ala Trp Met Ser
1 5 10
<210> 112
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 112
Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Val Val Pro
1 5 10 15
Leu Asn Gly
<210> 113
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 113
Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr
1 5 10
<210> 114
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 114
Val Pro Gly Ser Tyr Gly Tyr
1 5
<210> 115
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 115
Ser Tyr Ala Trp Met Ser
1 5
<210> 116
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 116
Gly Phe Thr Phe Ser Tyr
1 5
<210> 117
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 117
Gly Phe Thr Phe Ser Tyr Ala Trp Met Ser
1 5 10
<210> 118
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 118
Arg Ile Lys Ser Ile Ala Asp Gly Gly Ala Thr Asp Tyr Ala Ala Pro
1 5 10 15
Val Arg Asn
<210> 119
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 119
Arg Ile Lys Ser Ile Ala Asp Gly Gly Ala Thr Asp Tyr
1 5 10
<210> 120
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 120
Ile Pro Gly Asn Asp Ala Phe Asp Met
1 5
<210> 121
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 121
Asn Asn Ala Trp Met Ser
1 5
<210> 122
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 122
Gly Phe Ile Phe Asn Asn
1 5
<210> 123
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 123
Gly Phe Ile Phe Asn Asn Ala Trp Met Ser
1 5 10
<210> 124
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 124
Arg Ile Lys Ser Lys Ser Asp Gly Gly Thr Thr Asp Tyr Ala Ala Pro
1 5 10 15
Val Lys Asp
<210> 125
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 125
Arg Ile Lys Ser Lys Ser Asp Gly Gly Thr Thr Asp Tyr
1 5 10
<210> 126
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 126
Ala Pro Gly Gly Pro Phe Asp Tyr
1 5
<210> 127
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 127
Arg Ile Lys Ser Ile Thr Asp Gly Gly Val Ile Asp Tyr Ala Ala Pro
1 5 10 15
Val Arg Asn
<210> 128
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 128
Arg Ile Lys Ser Ile Thr Asp Gly Gly Val Ile Asp Tyr
1 5 10
<210> 129
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 129
Ile Pro Gly Asn Asp Asp Phe Asp Met
1 5
<210> 130
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 130
Arg Ile Lys Ser Ile Asn Asp Gly Gly Ala Thr Asp Tyr Ala Ser Pro
1 5 10 15
Val Arg Asn
<210> 131
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 131
Arg Ile Lys Ser Ile Asn Asp Gly Gly Ala Thr Asp Tyr
1 5 10
<210> 132
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 132
Thr Asn Ala Trp Met Ser
1 5
<210> 133
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 133
Gly Phe Thr Phe Thr Asn
1 5
<210> 134
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 134
Gly Phe Thr Phe Thr Asn Ala Trp Met Ser
1 5 10
<210> 135
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 135
Arg Ile Lys Ser Lys Ile Asp Gly Gly Thr Thr Asp Tyr Ala Ala Pro
1 5 10 15
Val Lys Gly
<210> 136
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 136
Arg Ile Lys Ser Lys Ile Asp Gly Gly Thr Thr Asp Tyr
1 5 10
<210> 137
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 137
Ser Ser Asn Ala Ile Ser
1 5
<210> 138
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 138
Gly Asp Thr Phe Ser Ser
1 5
<210> 139
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 139
Gly Asp Thr Phe Ser Ser Asn Ala Ile Ser
1 5 10
<210> 140
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 140
Val Ile Ile Pro Ile Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 141
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 141
Val Ile Ile Pro Ile Phe Gly Thr Ala Asp Tyr
1 5 10
<210> 142
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 142
His Thr Tyr His Glu Tyr Ala Gly Gly Tyr Tyr Gly Gly Ala Met Asp
1 5 10 15
Pro
<210> 143
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 143
Ser Asn Tyr Ala Met Ser
1 5
<210> 144
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 144
Gly Phe Thr Phe Ser Asn
1 5
<210> 145
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 145
Gly Phe Thr Phe Ser Asn Tyr Ala Met Ser
1 5 10
<210> 146
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 146
Asp Ile Ser Gly Gly Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 147
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 147
Asp Ile Ser Gly Gly Gly Gly Arg Thr Tyr Tyr
1 5 10
<210> 148
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 148
Ala Gly Leu Leu Tyr Gly Gly Gly Val Tyr Pro Met Asp Ile
1 5 10
<210> 149
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 149
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 150
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 150
Leu Val Ser Lys Leu Asp Ser
1 5
<210> 151
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 151
Val Gln Asp Thr His Phe Pro Leu Thr
1 5
<210> 152
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 152
Gln Val Ser Lys Leu Asp Ser
1 5
<210> 153
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 153
Gly Gln Asp Thr His Phe Pro Leu Thr
1 5
<210> 154
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 154
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Asn Asp Lys Thr Tyr Thr Asn
1 5 10 15
<210> 155
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 155
Glu Val Ser Lys Leu Asp Val
1 5
<210> 156
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 156
Arg Ala Ser Gln Ser Val Arg Ser Asn Leu Ala
1 5 10
<210> 157
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 157
Gly Ser Thr Ile Arg Ala Thr
1 5
<210> 158
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 158
Gln Gln Tyr Ser Asp Trp Pro Phe Thr
1 5
<210> 159
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 159
Arg Ala Ser Gln Ser Val Ser Ser Asn Phe Ala
1 5 10
<210> 160
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 160
Gly Ala Thr Thr Arg Ala Thr
1 5
<210> 161
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 161
Gln Gln Tyr Lys Asp Trp Pro Phe Thr
1 5
<210> 162
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 162
Arg Val Ser Gln Ser Ile Gly Ala Asn Leu Ala
1 5 10
<210> 163
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 163
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 164
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 164
Gln Gln Tyr Ile Tyr Trp Pro Phe Thr
1 5
<210> 165
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 165
Arg Ala Ser Gln Ser Val Ser Asn Asn Leu Ala
1 5 10
<210> 166
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 166
Arg Ala Ser Gln Ser Val Gly Ser Asp Leu Ala
1 5 10
<210> 167
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 167
Gln Gln Tyr Asn Asp Trp Pro Phe Thr
1 5
<210> 168
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 168
Arg Ala Ser Gln Asn Ile Gly Ser Asp Leu Ala
1 5 10
<210> 169
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 169
Arg Ala Ser Gln Ser Val Thr Ser Asn Phe Ala
1 5 10
<210> 170
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 170
Arg Ala Ser Gln Gly Val Ser Ser Asn Phe Ala
1 5 10
<210> 171
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 171
Arg Ala Ser Gln Ser Val Asn Arg Asn Leu Ala
1 5 10
<210> 172
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 172
Gly Thr Ser Thr Arg Ala Thr
1 5
<210> 173
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 173
Arg Ala Ser Gln Ser Val Ser Thr Asn Phe Ala
1 5 10
<210> 174
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 174
Arg Ala Ser Gln Ser Val Asn Ser Asn Leu Ala
1 5 10
<210> 175
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 175
Gly Ser Ser Thr Arg Ala Thr
1 5
<210> 176
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 176
Arg Ala Ser Gln Ser Val Ile Asn Asn Leu Ala
1 5 10
<210> 177
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 177
Gln Asp Tyr Asn Asn Trp Pro Phe Thr
1 5
<210> 178
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 178
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala
1 5 10
<210> 179
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 179
Gly Ala Ser Thr Arg Ala Ser Gly
1 5
<210> 180
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 180
Gln Glu Tyr Asn Asn Trp Pro Phe Thr
1 5
<210> 181
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 181
Arg Ala Asn Gln Ile Val Ser Ser Asn Leu Ala
1 5 10
<210> 182
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 182
Arg Ser Ser Gln Ser Leu Leu His Asn Lys Arg Asn Asn Tyr Leu Asp
1 5 10 15
<210> 183
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 183
Leu Ala Ser Asn Arg Ala Ser
1 5
<210> 184
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 184
Met Gln Ala Gln Gln Thr Pro Ile Thr
1 5
<210> 185
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 185
Arg Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys Asn Tyr Leu Asp
1 5 10 15
<210> 186
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 186
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 187
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 187
Arg Ser Ser Gln Ser Leu Leu His Arg Asp Gly Phe Asn Tyr Leu Asp
1 5 10 15
<210> 188
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 188
Leu Ala Ser Ser Arg Ala Ser
1 5
<210> 189
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 189
Met Gln Ala Leu Gln Thr Pro Ile Thr
1 5
<210> 190
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 190
Arg Ser Thr Gln Ser Leu Leu Tyr Ser Asn Gly Lys Asn Tyr Leu Asp
1 5 10 15
<210> 191
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 191
Leu Gly Ser Ile Arg Ala Ser
1 5
<210> 192
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 192
Arg Ser Ser Gln Ser Leu Leu Tyr Ser Asp Arg Arg Asn Tyr Leu Asp
1 5 10 15
<210> 193
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 193
Leu Gly Ser Tyr Arg Ala Ser
1 5
<210> 194
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 194
Met Gln Ala Leu Gln Ile Pro Ile Thr
1 5
<210> 195
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 195
Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Tyr
1 5 10
<210> 196
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 196
Arg Asn Asn Gln Arg Pro Ser
1 5
<210> 197
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 197
Ala Ala Trp Asp Asp Asn Leu Ser Gly Trp Val
1 5 10
<210> 198
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 198
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 199
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 199
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 200
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 200
Gln Gln Ser Tyr Ser Thr Pro Leu Thr
1 5
<210> 201
<211> 943
<212> PRT
<213> Homo sapien
<400> 201
Met Arg Pro Ser Gly Thr Ala Gly Ala Ala Leu Leu Ala Leu Leu Ala
1 5 10 15
Ala Leu Cys Pro Ala Ser Arg Ala Leu Glu Glu Lys Lys Gly Asn Tyr
20 25 30
Val Val Thr Asp His Gly Ser Cys Val Arg Ala Cys Gly Ala Asp Ser
35 40 45
Tyr Glu Met Glu Glu Asp Gly Val Arg Lys Cys Lys Lys Cys Glu Gly
50 55 60
Pro Cys Arg Lys Val Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp
65 70 75 80
Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr
85 90 95
Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp
100 105 110
Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu
115 120 125
Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro
130 135 140
Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg
145 150 155 160
Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala Val Val Ser Leu
165 170 175
Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly
180 185 190
Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile
195 200 205
Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile
210 215 220
Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His
225 230 235 240
Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys
245 250 255
Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys
260 265 270
Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys
275 280 285
Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys
290 295 300
Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp
305 310 315 320
Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn
325 330 335
Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His Val Cys His Leu
340 345 350
Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly
355 360 365
Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val
370 375 380
Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe
385 390 395 400
Met Arg Arg Arg His Ile Val Arg Lys Arg Thr Leu Arg Arg Leu Leu
405 410 415
Gln Glu Arg Glu Leu Val Glu Pro Leu Thr Pro Ser Gly Glu Ala Pro
420 425 430
Asn Gln Ala Leu Leu Arg Ile Leu Lys Glu Thr Glu Phe Lys Lys Ile
435 440 445
Lys Val Leu Gly Ser Gly Ala Phe Gly Thr Val Tyr Lys Gly Leu Trp
450 455 460
Ile Pro Glu Gly Glu Lys Val Lys Ile Pro Val Ala Ile Lys Glu Leu
465 470 475 480
Arg Glu Ala Thr Ser Pro Lys Ala Asn Lys Glu Ile Leu Asp Glu Ala
485 490 495
Tyr Val Met Ala Ser Val Asp Asn Pro His Val Cys Arg Leu Leu Gly
500 505 510
Ile Cys Leu Thr Ser Thr Val Gln Leu Ile Thr Gln Leu Met Pro Phe
515 520 525
Gly Cys Leu Leu Asp Tyr Val Arg Glu His Lys Asp Asn Ile Gly Ser
530 535 540
Gln Tyr Leu Leu Asn Trp Cys Val Gln Ile Ala Lys Gly Met Asn Tyr
545 550 555 560
Leu Glu Asp Arg Arg Leu Val His Arg Asp Leu Ala Ala Arg Asn Val
565 570 575
Leu Val Lys Thr Pro Gln His Val Lys Ile Thr Asp Phe Gly Leu Ala
580 585 590
Lys Leu Leu Gly Ala Glu Glu Lys Glu Tyr His Ala Glu Gly Gly Lys
595 600 605
Val Pro Ile Lys Trp Met Ala Leu Glu Ser Ile Leu His Arg Ile Tyr
610 615 620
Thr His Gln Ser Asp Val Trp Ser Tyr Gly Val Thr Val Trp Glu Leu
625 630 635 640
Met Thr Phe Gly Ser Lys Pro Tyr Asp Gly Ile Pro Ala Ser Glu Ile
645 650 655
Ser Ser Ile Leu Glu Lys Gly Glu Arg Leu Pro Gln Pro Pro Ile Cys
660 665 670
Thr Ile Asp Val Tyr Met Ile Met Val Lys Cys Trp Met Ile Asp Ala
675 680 685
Asp Ser Arg Pro Lys Phe Arg Glu Leu Ile Ile Glu Phe Ser Lys Met
690 695 700
Ala Arg Asp Pro Gln Arg Tyr Leu Val Ile Gln Gly Asp Glu Arg Met
705 710 715 720
His Leu Pro Ser Pro Thr Asp Ser Asn Phe Tyr Arg Ala Leu Met Asp
725 730 735
Glu Glu Asp Met Asp Asp Val Val Asp Ala Asp Glu Tyr Leu Ile Pro
740 745 750
Gln Gln Gly Phe Phe Ser Ser Pro Ser Thr Ser Arg Thr Pro Leu Leu
755 760 765
Ser Ser Leu Ser Ala Thr Ser Asn Asn Ser Thr Val Ala Cys Ile Asp
770 775 780
Arg Asn Gly Leu Gln Ser Cys Pro Ile Lys Glu Asp Ser Phe Leu Gln
785 790 795 800
Arg Tyr Ser Ser Asp Pro Thr Gly Ala Leu Thr Glu Asp Ser Ile Asp
805 810 815
Asp Thr Phe Leu Pro Val Pro Glu Tyr Ile Asn Gln Ser Val Pro Lys
820 825 830
Arg Pro Ala Gly Ser Val Gln Asn Pro Val Tyr His Asn Gln Pro Leu
835 840 845
Asn Pro Ala Pro Ser Arg Asp Pro His Tyr Gln Asp Pro His Ser Thr
850 855 860
Ala Val Gly Asn Pro Glu Tyr Leu Asn Thr Val Gln Pro Thr Cys Val
865 870 875 880
Asn Ser Thr Phe Asp Ser Pro Ala His Trp Ala Gln Lys Gly Ser His
885 890 895
Gln Ile Ser Leu Asp Asn Pro Asp Tyr Gln Gln Asp Phe Phe Pro Lys
900 905 910
Glu Ala Lys Pro Asn Gly Ile Phe Lys Gly Ser Thr Ala Glu Asn Ala
915 920 925
Glu Tyr Leu Arg Val Ala Pro Gln Ser Ser Glu Phe Ile Gly Ala
930 935 940
<210> 202
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 202
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 203
<211> 42
<212> PRT
<213> Homo sapien
<400> 203
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 204
<211> 42
<212> PRT
<213> Homo sapien
<400> 204
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 205
<211> 112
<212> PRT
<213> Homo sapien
<400> 205
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 206
<211> 21
<212> PRT
<213> Homo sapien
<400> 206
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 207
<211> 16
<212> PRT
<213> Homo sapien
<400> 207
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
1 5 10 15
<210> 208
<211> 45
<212> PRT
<213> Homo sapien
<400> 208
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 209
<211> 231
<212> PRT
<213> Homo sapien
<400> 209
Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
20 25 30
Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val
35 40 45
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
50 55 60
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
65 70 75 80
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
85 90 95
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
100 105 110
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
115 120 125
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
130 135 140
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
145 150 155 160
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
165 170 175
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
180 185 190
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
195 200 205
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
210 215 220
Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 210
<211> 24
<212> PRT
<213> Homo sapien
<400> 210
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 211
<211> 52
<212> PRT
<213> Homo sapien
<400> 211
Phe Phe Ile Pro Leu Leu Val Val Ile Leu Phe Ala Val Asp Thr Gly
1 5 10 15
Leu Phe Ile Ser Thr Gln Gln Gln Val Thr Phe Leu Leu Lys Ile Lys
20 25 30
Arg Thr Arg Lys Gly Phe Arg Leu Leu Asn Pro His Pro Lys Pro Asn
35 40 45
Pro Lys Asn Asn
50
<210> 212
<211> 215
<212> PRT
<213> Homo sapien
<400> 212
Met Asp Thr Glu Ser Asn Arg Arg Ala Asn Leu Ala Leu Pro Gln Glu
1 5 10 15
Pro Ser Ser Val Pro Ala Phe Glu Val Leu Glu Ile Ser Pro Gln Glu
20 25 30
Val Ser Ser Gly Arg Leu Leu Lys Ser Ala Ser Ser Pro Pro Leu His
35 40 45
Thr Trp Leu Thr Val Leu Lys Lys Glu Gln Glu Phe Leu Gly Val Thr
50 55 60
Gln Ile Leu Thr Ala Met Ile Cys Leu Cys Phe Gly Thr Val Val Cys
65 70 75 80
Ser Val Leu Asp Ile Ser His Ile Glu Gly Asp Ile Phe Ser Ser Phe
85 90 95
Lys Ala Gly Tyr Pro Phe Trp Gly Ala Ile Phe Phe Ser Ile Ser Gly
100 105 110
Met Leu Ser Ile Ile Ser Glu Arg Arg Asn Ala Thr Tyr Leu Val Arg
115 120 125
Gly Ser Leu Gly Ala Asn Thr Ala Ser Ser Ile Ala Gly Gly Thr Gly
130 135 140
Ile Thr Ile Leu Ile Ile Asn Leu Lys Lys Ser Leu Ala Tyr Ile His
145 150 155 160
Ile His Ser Cys Gln Lys Phe Phe Glu Thr Lys Cys Phe Met Ala Ser
165 170 175
Phe Ser Thr Glu Ile Val Val Met Met Leu Phe Leu Thr Ile Leu Gly
180 185 190
Leu Gly Ser Ala Val Ser Leu Thr Ile Cys Gly Ala Gly Glu Glu Leu
195 200 205
Lys Gly Asn Lys Val Pro Glu
210 215
<210> 213
<211> 41
<212> PRT
<213> Homo sapien
<400> 213
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 214
<211> 18
<212> PRT
<213> Homo sapien
<400> 214
Met Ile Pro Ala Val Val Leu Leu Leu Leu Leu Leu Val Glu Gln Ala
1 5 10 15
Ala Ala
<210> 215
<211> 43
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 215
Leu Gly Glu Pro Gln Leu Cys Tyr Ile Leu Asp Ala Ile Leu Phe Leu
1 5 10 15
Tyr Gly Ile Val Leu Thr Leu Leu Tyr Cys Arg Leu Lys Ile Gln Val
20 25 30
Arg Lys Ala Ala Ile Thr Ser Tyr Glu Lys Ser
35 40
<210> 216
<211> 22
<212> PRT
<213> Homo sapien
<400> 216
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 217
<211> 21
<212> PRT
<213> Homo sapien
<400> 217
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 218
<211> 530
<212> PRT
<213> Homo sapien
<400> 218
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
435 440 445
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 219
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 219
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
370 375 380
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
435 440 445
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
465 470 475 480
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 220
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 220
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
165 170 175
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
340 345 350
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
435 440 445
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 221
<211> 539
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 221
Asn Pro Gln Arg Ser Thr Val Trp Tyr Leu Thr Pro Gln Gln Val Val
1 5 10 15
Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln
20 25 30
Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln
35 40 45
Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr
50 55 60
Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro
65 70 75 80
Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu
85 90 95
Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu
100 105 110
Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln
115 120 125
Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His
130 135 140
Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly
145 150 155 160
Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln
165 170 175
Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp
180 185 190
Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu
195 200 205
Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser
210 215 220
Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro
225 230 235 240
Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile
245 250 255
Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu
260 265 270
Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val
275 280 285
Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln
290 295 300
Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln
305 310 315 320
Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr
325 330 335
Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro
340 345 350
Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu
355 360 365
Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu
370 375 380
Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln
385 390 395 400
Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His
405 410 415
Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly
420 425 430
Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln
435 440 445
Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly
450 455 460
Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu
465 470 475 480
Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser
485 490 495
Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro
500 505 510
Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile
515 520 525
Ala Ser Asn Gly Gly Gly Arg Pro Ala Leu Glu
530 535
<210> 222
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 222
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
195 200 205
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
435 440 445
Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 223
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 223
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
435 440 445
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
465 470 475 480
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 224
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 224
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
340 345 350
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
435 440 445
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 225
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 225
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
165 170 175
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
435 440 445
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 226
<211> 135
<212> PRT
<213> Homo sapien
<400> 226
Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Leu Pro Thr Gln Gly Thr Phe Ser Asn Val Ser Thr Asn Val Ser Pro
20 25 30
Ala Lys Pro Thr Thr Thr Ala Cys Pro Tyr Ser Asn Pro Ser Leu Cys
35 40 45
Ser Gly Gly Gly Gly Ser Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
50 55 60
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
65 70 75 80
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
85 90 95
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
100 105 110
Ser Leu Val Ile Thr Leu Tyr Cys Asn His Arg Asn Arg Arg Arg Val
115 120 125
Cys Lys Cys Pro Arg Pro Trp
130 135
<210> 227
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 227
Cys Gly Ser Gly Ser Gly Leu Glu Glu Lys Lys Gly Asn Tyr Val Val
1 5 10 15
Thr Asp His
<210> 228
<211> 804
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 228
atggctctgc ccgtcaccgc tctgctgctg cccctggctc tgctgctgca cgctgctcgc 60
cctgatgtgg tcatgactca gtctcccctg tctctgcccg tcaccctggg acagcccgcc 120
agcatctcct gcaagagctc ccagagcctg ctgtactcca acggcaagac ctatctgaat 180
tggttccagc agagacccgg ccagagccct cggagactga tctaccaggt gtctaagctg 240
gacagcggcg tgcctgatcg cttctctgga agcggatccg gaaccgactt tacactgaag 300
atcagccggg tggaggcaga ggacgtgggc gtgtactatt gcggccagga tacccacttc 360
ccactgacat ttggcggcgg caccaaggtg gagatcaagg gaggaggagg aagcggagga 420
ggaggaagcg gcggcggcgg ctctggcggc ggcggcagcc aggtgcagct ggtgcagagc 480
ggagcagagg tgaagaagcc tggcgcctcc gtgaaggtgt cttgtaaggc cagcggctac 540
acattcaccg attatacact gcactgggtg cggcaggccc ctggccaggg actggagtgg 600
atgggaggaa tctggcctat caccggagga accacataca accagaagtt taagggcaga 660
gtgacaatga ccagggacac atctaccagc acagtgtata tggagctgtc tagcctgcgc 720
tccgaggata cagccgtgta ctattgcgcc agaggcgagg cacagggatc ttggggacag 780
ggcaccctgg tgacagtgtc ctct 804
<210> 229
<211> 807
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 229
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
cctcaggtga ccctgaagga gagcggccct gtgctgctga agccaacaga gaccctgaca 120
ctgacctgca cagtgtctgg cttcagcctg tccaaccccc ggatgggcgt gagctggatc 180
agacagcccc ctggcaaggc cctggagtgg ttcgcccaca tcttttctac cgatgagaag 240
agcctgaagc tgtccctgag atctaggctg accctgagca aggacacatc taagagccag 300
gtggtgctga ccatgacaaa catggcccct gtggactccg ccacatacta ttgcgccaga 360
gacagctcca attacgaggg ctatttcgac ttttggggcc agggcaccct ggtgacagtg 420
tctagcggcg gaggaggatc cggaggagga ggatctggcg gcggcggctc cggcggcggc 480
ggctccgagg tggtgctgac ccagagccct gccacactgt ccgtgtctcc aggcgagaga 540
gccaccctgt cttgtagggc cagccagtcc gtgcgcagca atctggcctg gtaccagcag 600
aagtccggcc aggccccaag actgctgatc tatggctcca ccatcagggc cacaggagtg 660
ccagcacgct tctctggaag cggatccggc acagagttta ccctgacaat ctcctctctg 720
cagtccgagg atttcgccgt gtactattgc cagcagtact ctgactggcc cttcaccttt 780
ggccctggca caaaggtgga tatcaag 807
<210> 230
<211> 807
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 230
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccacaggtga ccctgaagga gtccggcccc gtgctggtga agcctacaga gaccctgaca 120
ctgacctgca cagtgtccgg cttctctctg agcaacgccc gcatgggcgt gtcttggatc 180
aggcagcccc ctggcaaggc cctggagtgg ctggcccaca tcttttccac cgacgagaag 240
tctatccgga gaagcctgcg ctccaggctg accctgagca aggatacatc caagtctcag 300
gtggtgctga ccatgacaaa catggacccc gtggataccg ccacatactt ctgcgccaga 360
gacagctcca attacgaggg ctattttgat tactggggcc agggcaccct ggtgacagtg 420
tctagcggag gaggaggaag cggaggagga ggatctggcg gcggcggctc tggcggcggc 480
ggcagcgagg tggtcatgac ccagagccca gccacactga gcgtgtcccc tggcgagagg 540
gtgaccctgt cctgtagggc atctcagagc gtgtcctcta acttcgcctg gtatcagcag 600
agaccaggcc aggcaccaag gctgctgctg tacggagcaa ccacaagagc cacaggactg 660
cccggcaggt tttccggatc tggaagcggc accgagaata tcctgacaat cagctccctg 720
cagtctgagg acttcgccat ctatttttgc cagcagtaca aggattggcc attcaccttt 780
ggccccggca gcaaggtgga catcaag 807
<210> 231
<211> 807
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 231
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaaga 60
cctcaggtga ccctgaagga gtccggccct gtgctggtga agccaacaga gaccctgaca 120
ctgacctgca cagtgtctgg cttcagcctg tccaacgcaa ggatgggcgt gagctggatc 180
aggcagcccc ctggcaaggc cctggagtgg ctgggccaca tctttagcac cgacgagaag 240
tcttacagca catccctgag aggcaggatc accatctcta aggatacaag cagaggcctg 300
gtggtgctga ccctgacaaa catggacccc gtggataccg ccacatacta ttgcgccagg 360
gacagctcca attacgaggg ctatttcgat ttttggggcc ctggcttcct ggtgaccgtg 420
tctagcggcg gcggcggctc tggaggagga ggaagcggag gaggaggatc cggcggcggc 480
ggctctgaga tcgtgatgac ccagtcccct gccacactgt ctgtgagccc aggcgagaga 540
gccaccctgt cttgtagggt gtcccagtct atcggcgcca atctggcctg gtaccagcag 600
aagttcggcc aggccccaag gctgctgatc tatggagcat ccaccagagc cacaggaatc 660
cccgtgaggt tctccggagg aggatctgga accgagttta ccctgacaat ctcctctctg 720
cagagcgagg actttgccat ctactcctgc cagcagtaca tctattggcc cttcacattt 780
ggccctggca ccacagtgga tatcaag 807
<210> 232
<211> 807
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 232
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaaga 60
ccacaggtga ccctgaagga gagcggaccc gtgctggtga agcctacaga gaccctgaca 120
ctgacctgca cagtgagcgg cttctccctg aacaatgcaa ggatgggcgt gtcctggatc 180
aggcagcccc ctggcaaggc cctggagtgg ttcgcccaca tctttagcac cgacgagaag 240
tcctttcgca catctctgag aagcaggctg accctgagca aggatacaag caagtcccag 300
gtggtgctga ccatgacaaa catggacccc gtggataccg ccacatacta ttgcgccaga 360
gacagctcca attacgaggg ctatttcgat tactggggcc agggcatcct ggtgaccgtg 420
tctagcggcg gcggcggctc tggaggagga ggaagcggag gaggaggatc cggcggcggc 480
ggctctgaga tcgtgatgac ccagtctccc gccacactgt ctgtgagccc tggcgagaga 540
gccacactga gctgtagggc ctcccagtct gtgagcaaca atctggcctg gtatcagcag 600
aagccaggcc aggcaccaag gctgctgatc tacggagcat ccaccagagc cacaggagtg 660
ccagcaaggt tctccggatc tgacagcggc accgagttta gcctgacaat ctcctctctg 720
cagtccgagg acttcgccgt gtatttttgc cagcagtaca aggattggcc attcaccttt 780
ggccccggca caaaggtgga gatcaag 807
<210> 233
<211> 819
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 233
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccagaggtga acctggtgga gtccggcggc ggcctggtga agcctggcgg atccctgagg 120
ctgtcttgcg aggcaagcgg cttcaccttc agctacgcct ggatgtcctg ggtgcgccag 180
gcccccggca agggactgga gtgggtggga cggatcaagt ccatcgcaga cggaggagca 240
accgattacg cagcccctgt gagaaacagg ttcacaatct ccagagacga ttctaggaat 300
accctgtatc tggagatgca ctctctgaag acagaggaca ccgccgtgta ctattgcacc 360
acaatccctg gcaacgacgc ctttgatatg tggggccagg gcacaatggt gaccgtgagc 420
tccggcggcg gcggctctgg aggaggagga agcggaggag gaggaagcgg gggcggcggc 480
tctgacatcg tgctgacaca gtccccactg tccctgtctg tgacccccgg cgagcctgca 540
agcatctcct gtagatctag ccagagcctg ctgtactcca acggcaagaa ttatctggat 600
tggttcctgc acaagccagg ccagtctccc cagctgctga tctacctggg atctaatagg 660
gcaagcggag tgccagaccg gttctctgga agcggatccg gcatcgactt catcctgaag 720
atcagcaggg tggaggccga ggatgtgggc gtgtactatt gcatgcaggc ccagcagaca 780
cccatcacct tcggccaggg cacaagactg gagatcaag 819
<210> 234
<211> 819
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 234
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccagaggtga acctggtgga gtccggcggc ggcctggtga agcctggcgg atccctgagg 120
ctgtcttgcg aggcaagcgg cttcaccttc agctacgcct ggatgtcctg ggtgcgccag 180
gcccccggca agggactgga gtgggtgggc cggatcaagt ccatcaccga cggaggcgtg 240
atcgattacg cagcacctgt gagaaacagg tgcacaatct ccagagacga ttctaggaat 300
accctgtatc tggagatgca ctctctgaag acagaggaca ccgccgtgta ctattgtacc 360
acaatccctg gcaacgacga tttcgatatg tggggccagg gcagaatggt gaccgtgagc 420
tccggcggcg gcggctctgg aggaggagga agcggaggag gaggaagcgg gggcggcggc 480
tctgacatcg tgctgacaca gtccccactg tccctgtctg tgacccccgg cgagcctgca 540
agcatctcct gtaggtctag ccagagcctg ctgtactcca acggcaagaa ttatctggat 600
tggtttctgc acaagccagg ccagtctccc cagctgctga tctacctggg atctaatagg 660
gcaagcggag tgccagaccg gttctctgga agcggatccg gcatcgactt catcctgaag 720
atcagccgcg tggaggcaga ggacgtgggc gtgtactatt gcatgcaggc ccagcagaca 780
cccatcacct tcggccaggg cacaagactg gagatcaag 819
<210> 235
<211> 816
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 235
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccagaggtgc agctggtgga gtcttggggc gtgctggtga agcctggcgg atctctgagg 120
ctgagctgcg cagcatccgg cttcatcttt aacaatgcct ggatgtcctg ggtgcgccag 180
gcccccggca agggactgga gtggatcggc cggatcaaga gcaagtccga cggaggaacc 240
acagattacg cagcacctgt gaaggaccgc ttcacaatct ctcgggacga tagcaaggat 300
accctgtatc tgcagatgaa cggcctgaag acagaggaca ccgccgtgta cttctgcacc 360
acagcccctg gcggcccttt tgattattgg ggccagggca cactggtgac cgtgagctcc 420
ggaggaggag gaagcggcgg aggaggcagc ggcggcggcg gctctggcgg cggcggcagc 480
gacatcgtgc tgacacagag ccctctgtcc ctgccagtga cccccggcga gcctgcctct 540
atcagctgtc gctctagcca gagcctgctg caccgggacg gcttcaatta cctggattgg 600
tttctgcaga agccaggcca gtccccccag ctgctgatct atctggcctc ctctagagcc 660
tctggcgtgc cagacaggtt ctccggctct gacagcggca cagacttcac cctgaagatc 720
agcagagtgg aggccgagga tgtgggcgtg tactattgca tgcaggccct gcagacaccc 780
atcaccttcg gccagggcac aagactggag atcaag 816
<210> 236
<211> 813
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 236
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
cctgaggtgc agctggtgga gagcggcggc ggcctggtga agcctggcgg atccctgagg 120
ctgtcttgcg aggcaagcgg cttcaccttt agcgacgcat ggatgtcctg ggtgcgccag 180
gcccctggca agggactgga gtgggtggga cggatcaaga gcaagacaga cggcggcacc 240
acagattacg tggtgccact gaacggccgc ttcatcatct cccgcgacga ttctcggaat 300
accctgtatc tgcagctgaa caatctgaag acagaggata ccgccgtgta ctattgcacc 360
acagtgccag gctcctacgg ctattggggc cagggcacac tggtgaccgt gagctccggc 420
ggcggcggct ctggaggagg aggaagcgga ggaggaggaa gcgggggcgg cggctctgac 480
atcgtgatga cacagtctcc actgagcctg ccagtgaccc ctggcgagcc agcctccatc 540
tcttgtcgct ctagccagag cctgctgcac aacaagcgga acaattacct ggattggttt 600
ctgcagaagc ctggccagtc ccctcagctg ctgatctatc tggccagcaa tagagcctcc 660
ggagtgccag acaggttctc tggaggagga agcggaacag acttcaccct gaagatcagc 720
agagtggagg ccgaggacgt gggcgtgtac tattgcatgc aggcccagca gacacctatc 780
accttcggcc agggcacaag actggagatc aag 813
<210> 237
<211> 837
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 237
atggctctgc ccgtcaccgc tctgctgctg cctctggccc tgctgctgca cgcagcaagg 60
ccacaggtgc agctggtgca gtccggagca gaggtgaaga agcctggcag ctccgtgaag 120
gtgagctgca aggcctccgg cgacacattc tctagcaacg caatcagctg ggtgcgccag 180
gcccctggcc agggactgga gtggatgggc gtgatcatcc ctatcttcgg caccgccgac 240
tatgcccaga agtttcaggg ccgggtgaca atcaccgccg atgagtctac aagcaccgcc 300
tacatggagc tgtcctctct gagatccgag gacacagccg tgtactattg tgccaggcac 360
acctatcacg agtacgcagg aggatactat ggaggagcaa tggatccttg gggacagggc 420
acactggtga ccgtgagctc cggcggcggc ggctctggag gaggaggaag cggaggagga 480
ggaagcgggg gcggcggctc tgagctgcag agcgtgctga cccagccacc ttccgcctct 540
ggaacaccag gccagagggt gaccatcagc tgctccggat ctagctccaa catcggctcc 600
aattacgtgt attggtacca gcagctgcca ggcacagccc ccaagatcct gatctaccgc 660
aacaatcagc ggccttctgg cgtgccagat agattctctg gcagcaagtc cggcacctct 720
gccagcctgg caatctccgg cctgaggtct gaggacgagg ccgattacta ttgcgccgcc 780
tgggacgata acctgagcgg ctgggtgttt ggcacaggca ccaagctgac agtgctg 837
<210> 238
<211> 1476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 238
atggctctgc ccgtcaccgc tctgctgctg cccctggctc tgctgctgca cgctgctcgc 60
cctgatgtgg tcatgactca gtctcccctg tctctgcccg tcaccctggg acagcccgcc 120
agcatctcct gcaagagctc ccagagcctg ctgtactcca acggcaagac ctatctgaat 180
tggttccagc agagacccgg ccagagccct cggagactga tctaccaggt gtctaagctg 240
gacagcggcg tgcctgatcg cttctctgga agcggatccg gaaccgactt tacactgaag 300
atcagccggg tggaggcaga ggacgtgggc gtgtactatt gcggccagga tacccacttc 360
ccactgacat ttggcggcgg caccaaggtg gagatcaagg gaggaggagg aagcggagga 420
ggaggaagcg gcggcggcgg ctctggcggc ggcggcagcc aggtgcagct ggtgcagagc 480
ggagcagagg tgaagaagcc tggcgcctcc gtgaaggtgt cttgtaaggc cagcggctac 540
acattcaccg attatacact gcactgggtg cggcaggccc ctggccaggg actggagtgg 600
atgggaggaa tctggcctat caccggagga accacataca accagaagtt taagggcaga 660
gtgacaatga ccagggacac atctaccagc acagtgtata tggagctgtc tagcctgcgc 720
tccgaggata cagccgtgta ctattgcgcc agaggcgagg cacagggatc ttggggacag 780
ggcaccctgg tgacagtgtc ctctaccaca accccagcac caagaccacc tacccctgca 840
ccaacaatcg cctcccagcc tctgtctctg cgcccagagg catgtaggcc agcagcagga 900
ggagcagtgc acaccagggg cctggacttt gcctgcgata tctacatctg ggcaccactg 960
gcaggaacat gtggcgtgct gctgctgagc ctggtcatca ccctgtactg caagcgcggc 1020
cggaagaagc tgctgtatat cttcaagcag cccttcatga gacccgtgca gacaacccag 1080
gaggaggacg gctgctcctg taggttccca gaagaagagg agggcggctg tgagctgaga 1140
gtgaagtttt ccaggtctgc cgatgcacca gcataccagc agggacagaa tcagctgtat 1200
aacgagctga atctgggcag gcgcgaggag tatgacgtgc tggataagag gagaggaagg 1260
gaccctgaga tgggaggcaa gcctaggcgc aagaacccac aggagggcct gtacaatgag 1320
ctgcagaagg ataagatggc cgaggcctat tccgagatcg gcatgaaggg cgagcggaga 1380
aggggcaagg gccacgacgg gctgtaccag ggactgtcaa ccgctaccaa ggatacttac 1440
gacgccctgc atatgcaggc actgcctcca aggtga 1476
<210> 239
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 239
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
cctcaggtga ccctgaagga gagcggccct gtgctgctga agccaacaga gaccctgaca 120
ctgacctgca cagtgtctgg cttcagcctg tccaaccccc ggatgggcgt gagctggatc 180
agacagcccc ctggcaaggc cctggagtgg ttcgcccaca tcttttctac cgatgagaag 240
agcctgaagc tgtccctgag atctaggctg accctgagca aggacacatc taagagccag 300
gtggtgctga ccatgacaaa catggcccct gtggactccg ccacatacta ttgcgccaga 360
gacagctcca attacgaggg ctatttcgac ttttggggcc agggcaccct ggtgacagtg 420
tctagcggcg gaggaggatc cggaggagga ggatctggcg gcggcggctc cggcggcggc 480
ggctccgagg tggtgctgac ccagagccct gccacactgt ccgtgtctcc aggcgagaga 540
gccaccctgt cttgtagggc cagccagtcc gtgcgcagca atctggcctg gtaccagcag 600
aagtccggcc aggccccaag actgctgatc tatggctcca ccatcagggc cacaggagtg 660
ccagcacgct tctctggaag cggatccggc acagagttta ccctgacaat ctcctctctg 720
cagtccgagg atttcgccgt gtactattgc cagcagtact ctgactggcc cttcaccttt 780
ggccctggca caaaggtgga tatcaagacc acaacccctg caccaaggcc accaacccca 840
gcacctacaa tcgcaagcca gccactgtcc ctgagacccg aggcctgtag gcctgcagca 900
ggaggagcag tgcacacccg cggcctggac tttgcctgcg atatctatat ctgggcacca 960
ctggcaggaa cctgtggcgt gctgctgctg agcctggtca tcaccctgta ctgcaagcgc 1020
ggccggaaga agctgctgta tatcttcaag cagcccttca tgcggcccgt gcagacaacc 1080
caggaggagg atggctgctc ctgtagattc cctgaggagg aggagggagg atgtgagctg 1140
agggtgaagt tttctcggag cgccgacgca ccagcatacc agcagggaca gaaccagctg 1200
tataacgagc tgaatctggg ccggagagag gagtacgacg tgctggataa gaggagggga 1260
agagacccag agatgggagg caagccacgg agaaagaacc cccaggaggg cctgtacaat 1320
gagctgcaga aggataagat ggccgaggcc tattctgaga tcggcatgaa gggagagagg 1380
cgccggggca agggacacga cggactgtac cagggactgt ccaccgcaac aaaggacacc 1440
tatgatgccc tgcatatgca ggcactgcct ccaaggtga 1479
<210> 240
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 240
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccacaggtga ccctgaagga gtccggcccc gtgctggtga agcctacaga gaccctgaca 120
ctgacctgca cagtgtccgg cttctctctg agcaacgccc gcatgggcgt gtcttggatc 180
aggcagcccc ctggcaaggc cctggagtgg ctggcccaca tcttttccac cgacgagaag 240
tctatccgga gaagcctgcg ctccaggctg accctgagca aggatacatc caagtctcag 300
gtggtgctga ccatgacaaa catggacccc gtggataccg ccacatactt ctgcgccaga 360
gacagctcca attacgaggg ctattttgat tactggggcc agggcaccct ggtgacagtg 420
tctagcggag gaggaggaag cggaggagga ggatctggcg gcggcggctc tggcggcggc 480
ggcagcgagg tggtcatgac ccagagccca gccacactga gcgtgtcccc tggcgagagg 540
gtgaccctgt cctgtagggc atctcagagc gtgtcctcta acttcgcctg gtatcagcag 600
agaccaggcc aggcaccaag gctgctgctg tacggagcaa ccacaagagc cacaggactg 660
cccggcaggt tttccggatc tggaagcggc accgagaata tcctgacaat cagctccctg 720
cagtctgagg acttcgccat ctatttttgc cagcagtaca aggattggcc attcaccttt 780
ggccccggca gcaaggtgga catcaagacc acaacccctg caccaagacc accaacccca 840
gcacctacaa tcgcctctca gcctctgagc ctgcgcccag aggcatgtag gccagcagca 900
ggaggagcag tgcacacaag gggcctggac ttcgcctgcg atatctatat ctgggcacct 960
ctggcaggaa cctgtggcgt gctgctgctg agcctggtca tcaccctgta ttgcaagaga 1020
ggcaggaaga agctgctgta catcttcaag cagcctttta tgcgcccagt gcagacaacc 1080
caggaggagg acggctgcag ctgtcggttc cctgaagagg aggagggcgg ctgtgagctg 1140
agagtgaagt tttccaggtc tgccgatgcc ccagcctatc agcagggcca gaatcagctg 1200
tacaacgagc tgaatctggg caggcgcgag gagtacgacg tgctggataa gaggagagga 1260
agggatccag agatgggagg caagcctagg cgcaagaacc cacaggaggg cctgtataat 1320
gagctgcaga aggacaagat ggccgaggcc tactccgaga tcggcatgaa gggagagcgg 1380
agaaggggca agggacacga tggcctgtat cagggcctgt ctaccgccac aaaggacacc 1440
tacgatgccc tgcatatgca ggcactgcct ccaaggtga 1479
<210> 241
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 241
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaaga 60
cctcaggtga ccctgaagga gtccggccct gtgctggtga agccaacaga gaccctgaca 120
ctgacctgca cagtgtctgg cttcagcctg tccaacgcaa ggatgggcgt gagctggatc 180
aggcagcccc ctggcaaggc cctggagtgg ctgggccaca tctttagcac cgacgagaag 240
tcttacagca catccctgag aggcaggatc accatctcta aggatacaag cagaggcctg 300
gtggtgctga ccctgacaaa catggacccc gtggataccg ccacatacta ttgcgccagg 360
gacagctcca attacgaggg ctatttcgat ttttggggcc ctggcttcct ggtgaccgtg 420
tctagcggcg gcggcggctc tggaggagga ggaagcggag gaggaggatc cggcggcggc 480
ggctctgaga tcgtgatgac ccagtcccct gccacactgt ctgtgagccc aggcgagaga 540
gccaccctgt cttgtagggt gtcccagtct atcggcgcca atctggcctg gtaccagcag 600
aagttcggcc aggccccaag gctgctgatc tatggagcat ccaccagagc cacaggaatc 660
cccgtgaggt tctccggagg aggatctgga accgagttta ccctgacaat ctcctctctg 720
cagagcgagg actttgccat ctactcctgc cagcagtaca tctattggcc cttcacattt 780
ggccctggca ccacagtgga tatcaagacc acaacccctg caccaaggcc accaacccca 840
gcacctacaa tcgcaagcca gccactgtcc ctgagaccag aggcatgtag gcctgcagca 900
ggaggagccg tgcacaccag aggcctggac tttgcctgcg atatctatat ctgggcacca 960
ctggcaggaa cctgtggcgt gctgctgctg agcctggtca tcaccctgta ctgcaagcgc 1020
ggccggaaga agctgctgta tatcttcaag cagcccttca tgcgccccgt gcagacaacc 1080
caggaggagg acggctgcag ctgtcggttc cctgaagagg aggagggagg atgtgagctg 1140
agggtgaagt ttagccggtc cgccgatgca ccagcatacc agcagggcca gaaccagctg 1200
tataacgagc tgaatctggg ccggagagag gagtacgacg tgctggataa gaggagggga 1260
agagacccag agatgggagg caagccacgg agaaagaacc cccaggaggg cctgtacaat 1320
gagctgcaga aggacaagat ggccgaggcc tatagcgaga tcggcatgaa gggagagagg 1380
cgccggggca agggacacga tggcctgtac cagggcctgt ccaccgccac aaaggacacc 1440
tatgatgccc tgcatatgca ggcactgcct ccaaggtga 1479
<210> 242
<211> 1479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 242
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaaga 60
ccacaggtga ccctgaagga gagcggaccc gtgctggtga agcctacaga gaccctgaca 120
ctgacctgca cagtgagcgg cttctccctg aacaatgcaa ggatgggcgt gtcctggatc 180
aggcagcccc ctggcaaggc cctggagtgg ttcgcccaca tctttagcac cgacgagaag 240
tcctttcgca catctctgag aagcaggctg accctgagca aggatacaag caagtcccag 300
gtggtgctga ccatgacaaa catggacccc gtggataccg ccacatacta ttgcgccaga 360
gacagctcca attacgaggg ctatttcgat tactggggcc agggcatcct ggtgaccgtg 420
tctagcggcg gcggcggctc tggaggagga ggaagcggag gaggaggatc cggcggcggc 480
ggctctgaga tcgtgatgac ccagtctccc gccacactgt ctgtgagccc tggcgagaga 540
gccacactga gctgtagggc ctcccagtct gtgagcaaca atctggcctg gtatcagcag 600
aagccaggcc aggcaccaag gctgctgatc tacggagcat ccaccagagc cacaggagtg 660
ccagcaaggt tctccggatc tgacagcggc accgagttta gcctgacaat ctcctctctg 720
cagtccgagg acttcgccgt gtatttttgc cagcagtaca aggattggcc attcaccttt 780
ggccccggca caaaggtgga gatcaagacc acaacccctg caccaagacc accaacccca 840
gcacctacaa tcgcatccca gcctctgtct ctgagaccag aggcatgtag gccagcagca 900
ggaggagcag tgcacaccag gggcctggac tttgcctgcg atatctatat ctgggcacct 960
ctggcaggaa cctgtggcgt gctgctgctg agcctggtca tcaccctgta ttgcaagcgc 1020
ggccggaaga agctgctgta catcttcaag cagcctttta tgcgcccagt gcagacaacc 1080
caggaggagg acggctgctc ctgtcggttc cctgaagagg aggagggagg atgtgagctg 1140
agggtgaagt tttcccggtc tgccgatgcc ccagcctatc agcagggcca gaaccagctg 1200
tacaacgagc tgaatctggg ccggagagag gagtacgacg tgctggataa gaggagggga 1260
agagatccag agatgggagg caagcctcgg agaaagaacc cacaggaggg cctgtataat 1320
gagctgcaga aggacaagat ggccgaggcc tactccgaga tcggcatgaa gggagagagg 1380
cgccggggca agggacacga tggcctgtat cagggcctgt ctaccgccac aaaggacacc 1440
tacgatgccc tgcatatgca ggcactgcct ccaaggtga 1479
<210> 243
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 243
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccagaggtga acctggtgga gtccggcggc ggcctggtga agcctggcgg atccctgagg 120
ctgtcttgcg aggcaagcgg cttcaccttc agctacgcct ggatgtcctg ggtgcgccag 180
gcccccggca agggactgga gtgggtggga cggatcaagt ccatcgcaga cggaggagca 240
accgattacg cagcccctgt gagaaacagg ttcacaatct ccagagacga ttctaggaat 300
accctgtatc tggagatgca ctctctgaag acagaggaca ccgccgtgta ctattgcacc 360
acaatccctg gcaacgacgc ctttgatatg tggggccagg gcacaatggt gaccgtgagc 420
tccggcggcg gcggctctgg aggaggagga agcggaggag gaggaagcgg gggcggcggc 480
tctgacatcg tgctgacaca gtccccactg tccctgtctg tgacccccgg cgagcctgca 540
agcatctcct gtagatctag ccagagcctg ctgtactcca acggcaagaa ttatctggat 600
tggttcctgc acaagccagg ccagtctccc cagctgctga tctacctggg atctaatagg 660
gcaagcggag tgccagaccg gttctctgga agcggatccg gcatcgactt catcctgaag 720
atcagcaggg tggaggccga ggatgtgggc gtgtactatt gcatgcaggc ccagcagaca 780
cccatcacct tcggccaggg cacaagactg gagatcaaga ccacaacccc agcaccaagg 840
ccacctacac ctgcaccaac catcgcatcc cagccactgt ctctgaggcc tgaggcatgt 900
cggccagcag caggaggagc agtgcacacc cgcggcctgg actttgcctg cgatatctac 960
atctgggcac cactggcagg aacatgtggc gtgctgctgc tgagcctggt catcaccctg 1020
tactgcaagc gcggccggaa gaagctgctg tatatcttca agcagccttt tatgagacca 1080
gtgcagacaa cccaggagga ggacggctgc tcctgtaggt tccctgaaga ggaggagggc 1140
ggctgtgagc tgagagtgaa gttttctagg agcgccgatg caccagcata ccagcaggga 1200
cagaatcagc tgtataacga gctgaatctg ggccggagag aggagtatga cgtgctggat 1260
aagaggaggg gaagggaccc tgagatggga ggcaagcccc ggagaaagaa ccctcaggag 1320
ggcctgtaca atgagctgca gaaggacaag atggccgagg cctatagcga gatcggcatg 1380
aagggagaga ggcgccgggg caagggacac gatggcctgt accagggcct gtccacagcc 1440
accaaggaca cctatgatgc cctgcatatg caggcactgc ctccaaggtg a 1491
<210> 244
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 244
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccagaggtga acctggtgga gtccggcggc ggcctggtga agcctggcgg atccctgagg 120
ctgtcttgcg aggcaagcgg cttcaccttc agctacgcct ggatgtcctg ggtgcgccag 180
gcccccggca agggactgga gtgggtgggc cggatcaagt ccatcaccga cggaggcgtg 240
atcgattacg cagcacctgt gagaaacagg tgcacaatct ccagagacga ttctaggaat 300
accctgtatc tggagatgca ctctctgaag acagaggaca ccgccgtgta ctattgtacc 360
acaatccctg gcaacgacga tttcgatatg tggggccagg gcagaatggt gaccgtgagc 420
tccggcggcg gcggctctgg aggaggagga agcggaggag gaggaagcgg gggcggcggc 480
tctgacatcg tgctgacaca gtccccactg tccctgtctg tgacccccgg cgagcctgca 540
agcatctcct gtaggtctag ccagagcctg ctgtactcca acggcaagaa ttatctggat 600
tggtttctgc acaagccagg ccagtctccc cagctgctga tctacctggg atctaatagg 660
gcaagcggag tgccagaccg gttctctgga agcggatccg gcatcgactt catcctgaag 720
atcagccgcg tggaggcaga ggacgtgggc gtgtactatt gcatgcaggc ccagcagaca 780
cccatcacct tcggccaggg cacaagactg gagatcaaga ccacaacccc agcaccaagg 840
ccacctacac ctgcaccaac catcgcatcc cagccactgt ctctgaggcc tgaggcatgt 900
aggccagcag caggaggagc agtgcacacc agaggcctgg actttgcctg cgatatctac 960
atctgggcac cactggcagg aacatgtggc gtgctgctgc tgagcctggt catcaccctg 1020
tactgcaagc gcggccggaa gaagctgctg tatatcttca agcagccttt tatgagacca 1080
gtgcagacaa cccaggagga ggacggctgc tcctgtaggt tccctgaaga ggaggagggc 1140
ggctgtgagc tgagagtgaa gttttctagg agcgccgatg caccagcata ccagcaggga 1200
cagaatcagc tgtataacga gctgaatctg ggccggagag aggagtatga cgtgctggat 1260
aagaggaggg gaagggatcc tgagatggga ggcaagcccc ggagaaagaa ccctcaggag 1320
ggcctgtaca atgagctgca gaaggacaag atggccgagg cctatagcga gatcggcatg 1380
aagggagaga ggcgccgggg caagggacac gatggcctgt accagggcct gtccacagcc 1440
accaaggaca cctatgatgc cctgcatatg caggcactgc ctccaaggtg a 1491
<210> 245
<211> 1488
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 245
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
ccagaggtgc agctggtgga gtcttggggc gtgctggtga agcctggcgg atctctgagg 120
ctgagctgcg cagcatccgg cttcatcttt aacaatgcct ggatgtcctg ggtgcgccag 180
gcccccggca agggactgga gtggatcggc cggatcaaga gcaagtccga cggaggaacc 240
acagattacg cagcacctgt gaaggaccgc ttcacaatct ctcgggacga tagcaaggat 300
accctgtatc tgcagatgaa cggcctgaag acagaggaca ccgccgtgta cttctgcacc 360
acagcccctg gcggcccttt tgattattgg ggccagggca cactggtgac cgtgagctcc 420
ggaggaggag gaagcggcgg aggaggcagc ggcggcggcg gctctggcgg cggcggcagc 480
gacatcgtgc tgacacagag ccctctgtcc ctgccagtga cccccggcga gcctgcctct 540
atcagctgtc gctctagcca gagcctgctg caccgggacg gcttcaatta cctggattgg 600
tttctgcaga agccaggcca gtccccccag ctgctgatct atctggcctc ctctagagcc 660
tctggcgtgc cagacaggtt ctccggctct gacagcggca cagacttcac cctgaagatc 720
agcagagtgg aggccgagga tgtgggcgtg tactattgca tgcaggccct gcagacaccc 780
atcaccttcg gccagggcac aagactggag atcaagacca caaccccagc accaaggcca 840
cctacacctg caccaaccat cgcatcccag ccactgtctc tgagacctga ggcctgtagg 900
ccagcagcag gaggagcagt gcacaccagg ggcctggact ttgcctgcga tatctacatc 960
tgggcacctc tggcaggaac atgtggcgtg ctgctgctga gcctggtcat caccctgtac 1020
tgcaagagag gcaggaagaa gctgctgtat atcttcaagc agccttttat gagaccagtg 1080
cagacaaccc aggaggagga cggctgctcc tgtaggttcc ctgaagagga ggagggagga 1140
tgtgagctga gggtgaagtt ttcccggtct gccgatgcac cagcatacca gcagggacag 1200
aaccagctgt ataacgagct gaatctgggc cggagagagg agtacgacgt gctggataag 1260
aggcgcggca gagatccaga gatgggcggc aagccccgga gaaagaaccc tcaggagggc 1320
ctgtacaatg agctgcagaa ggacaagatg gccgaggcct atagcgagat cggcatgaag 1380
ggagagaggc gccggggcaa gggacacgat ggcctgtacc agggcctgtc cacagccacc 1440
aaggacacct atgatgccct gcatatgcag gcactgcctc caaggtga 1488
<210> 246
<211> 1485
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 246
atggctctgc ccgtcaccgc tctgctgctg ccactggccc tgctgctgca cgcagcaagg 60
cctgaggtgc agctggtgga gagcggcggc ggcctggtga agcctggcgg atccctgagg 120
ctgtcttgcg aggcaagcgg cttcaccttt agcgacgcat ggatgtcctg ggtgcgccag 180
gcccctggca agggactgga gtgggtggga cggatcaaga gcaagacaga cggcggcacc 240
acagattacg tggtgccact gaacggccgc ttcatcatct cccgcgacga ttctcggaat 300
accctgtatc tgcagctgaa caatctgaag acagaggata ccgccgtgta ctattgcacc 360
acagtgccag gctcctacgg ctattggggc cagggcacac tggtgaccgt gagctccggc 420
ggcggcggct ctggaggagg aggaagcgga ggaggaggaa gcgggggcgg cggctctgac 480
atcgtgatga cacagtctcc actgagcctg ccagtgaccc ctggcgagcc agcctccatc 540
tcttgtcgct ctagccagag cctgctgcac aacaagcgga acaattacct ggattggttt 600
ctgcagaagc ctggccagtc ccctcagctg ctgatctatc tggccagcaa tagagcctcc 660
ggagtgccag acaggttctc tggaggagga agcggaacag acttcaccct gaagatcagc 720
agagtggagg ccgaggacgt gggcgtgtac tattgcatgc aggcccagca gacacctatc 780
accttcggcc agggcacaag actggagatc aagaccacaa ccccagcacc aaggccacct 840
acacctgcac caaccatcgc ctcccagcct ctgtctctga gaccagaggc atgtaggcca 900
gcagcaggag gagcagtgca caccaggggc ctggactttg cctgcgatat ctacatctgg 960
gcacctctgg caggaacatg tggcgtgctg ctgctgagcc tggtcatcac cctgtactgc 1020
aagagaggca ggaagaagct gctgtatatc ttcaagcagc ccttcatgag acccgtgcag 1080
acaacccagg aggaggacgg ctgctcttgt aggttcccag aagaggagga gggaggatgt 1140
gagctgaggg tgaagtttag ccggtccgcc gatgcaccag cataccagca gggacagaac 1200
cagctgtata acgagctgaa tctgggccgg agagaggagt acgacgtgct ggataagagg 1260
aggggaaggg atccagagat gggaggcaag cctcggagaa agaacccaca ggagggcctg 1320
tacaatgagc tgcagaagga caagatggcc gaggcctatt ctgagatcgg catgaaggga 1380
gagaggcgcc ggggcaaggg acacgatggc ctgtaccagg gcctgagcac agccaccaag 1440
gacacctatg atgccctgca tatgcaggca ctgcctccaa ggtga 1485
<210> 247
<211> 1508
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 247
atggctctgc ccgtcaccgc tctgctgctg cctctggccc tgctgctgca cgcagcaagg 60
ccacaggtgc agctggtgca gtccggagca gaggtgaaga agcctggcag ctccgtgaag 120
gtgagctgca aggcctccgg cgacacattc tctagcaacg caatcagctg ggtgcgccag 180
gcccctggcc agggactgga gtggatgggc gtgatcatcc ctatcttcgg caccgccgac 240
tatgcccaga agtttcaggg ccgggtgaca atcaccgccg atgagtctac aagcaccgcc 300
tacatggagc tgtcctctct gagatccgag gacacagccg tgtactattg tgccaggcac 360
acctatcacg agtacgcagg aggatactat ggaggagcaa tggatccttg gggacagggc 420
acactggtga ccgtgagctc cggcggcggc ggctctggag gaggaggaag cggaggagga 480
ggaagcgggg gcggcggctc tgagctgcag agcgtgctga cccagccacc ttccgcctct 540
ggaacaccag gccagagggt gaccatcagc tgctccggat ctagctccaa catcggctcc 600
aattacgtgt attggtacca gcagctgcca ggcacagccc ccaagatcct gatctaccgc 660
aacaatcagc ggccttctgg cgtgccagat agattctctg gcagcaagtc cggcacctct 720
gccagcctgg caatctccgg cctgaggtct gaggacgagg ccgattacta ttgcgccgcc 780
tgggacgata acctgagcgg ctgggtgttt ggcacaggca ccaagctgac agtgctgacc 840
acaacccctg caccaagacc accaacacca gcacctacca tcgcaagcca gccactgtcc 900
ctgagacccg aggcctgtag gcctgcagca ggaggagcag tgcacaccag gggcctggac 960
tttgcctgcg atatctatat ctgggcacca ctggcaggaa catgtggcgt gctgctgctg 1020
agcctggtca tcaccctgta ttgcaagaga ggcaggaaga agctgctgta catcttcaag 1080
cagcccttta tgcgccctgt gcagacaacc caggaggagg acggctgcag ctgtcggttc 1140
ccagaagagg aggagggagg atgtgagctg agggtgaagt tttcccggtc tgccgatgca 1200
ccagcatatc agcagggaca gaatcagctg tacaacgagc tgaatctggg ccggagagag 1260
gagtacgacg tgctggataa gaggagggga agggaccctg agatgggagg caagccacgg 1320
agaaaaaccc ccaggagggc ctgtataatg agctgcagaa ggacaagatg gccgaggcct 1380
actctgagat cggcatgaag ggagagaggc gccggggcaa gggacacgat ggcctgtatc 1440
agggcctgag cacagccacc aaggacacct acgatgccct gcatatgcag gcactgcctc 1500
caaggtga 1508
<210> 248
<211> 529
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 248
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Asn Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Phe Arg Thr Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Asn Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Ala Arg Phe
210 215 220
Ser Gly Ser Asp Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Lys Asp Trp
245 250 255
Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys Gly Ser Gly
260 265 270
Gly Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly Gly
275 280 285
Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly Gly Gly
290 295 300
Gly Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
305 310 315 320
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
325 330 335
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
340 345 350
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
355 360 365
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
370 375 380
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
385 390 395 400
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
405 410 415
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
420 425 430
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
435 440 445
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
450 455 460
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
465 470 475 480
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
485 490 495
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
500 505 510
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
515 520 525
Arg
<210> 249
<211> 529
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 249
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Ile Arg Arg Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Phe Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Val Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Ser Asn Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu
195 200 205
Leu Leu Tyr Gly Ala Thr Thr Arg Ala Thr Gly Leu Pro Gly Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Ile Tyr Phe Cys Gln Gln Tyr Lys Asp Trp
245 250 255
Pro Phe Thr Phe Gly Pro Gly Ser Lys Val Asp Ile Lys Gly Ser Gly
260 265 270
Gly Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly Gly
275 280 285
Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly Gly Gly
290 295 300
Gly Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
305 310 315 320
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
325 330 335
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
340 345 350
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
355 360 365
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
370 375 380
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
385 390 395 400
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
405 410 415
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
420 425 430
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
435 440 445
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
450 455 460
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
465 470 475 480
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
485 490 495
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
500 505 510
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
515 520 525
Arg
<210> 250
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 250
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Trp Gly Val Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ile Phe Asn Asn Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Lys Ser Lys Ser Asp Gly Gly Thr
65 70 75 80
Thr Asp Tyr Ala Ala Pro Val Lys Asp Arg Phe Thr Ile Ser Arg Asp
85 90 95
Asp Ser Lys Asp Thr Leu Tyr Leu Gln Met Asn Gly Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Phe Cys Thr Thr Ala Pro Gly Gly Pro Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
165 170 175
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
180 185 190
Asp Gly Phe Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser
195 200 205
Pro Gln Leu Leu Ile Tyr Leu Ala Ser Ser Arg Ala Ser Gly Val Pro
210 215 220
Asp Arg Phe Ser Gly Ser Asp Ser Gly Thr Asp Phe Thr Leu Lys Ile
225 230 235 240
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
245 250 255
Leu Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
260 265 270
Gly Ser Gly Gly Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys
275 280 285
Ser Gly Gly Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser
290 295 300
Gly Gly Gly Gly Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro
305 310 315 320
Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys
325 330 335
Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala
340 345 350
Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
355 360 365
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
370 375 380
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
385 390 395 400
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
405 410 415
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
420 425 430
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
435 440 445
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
450 455 460
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
465 470 475 480
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
485 490 495
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
500 505 510
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
515 520 525
Leu Pro Pro Arg
530
<210> 251
<211> 531
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 251
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr
65 70 75 80
Thr Asp Tyr Val Val Pro Leu Asn Gly Arg Phe Ile Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Gln Leu Asn Asn Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Val Pro Gly Ser Tyr Gly Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu
165 170 175
Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Asn Lys
180 185 190
Arg Asn Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser Pro
195 200 205
Gln Leu Leu Ile Tyr Leu Ala Ser Asn Arg Ala Ser Gly Val Pro Asp
210 215 220
Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
225 230 235 240
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala Gln
245 250 255
Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Gly
260 265 270
Ser Gly Gly Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser
275 280 285
Gly Gly Gly Gly Ser Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly
290 295 300
Gly Gly Gly Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
305 310 315 320
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
325 330 335
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
340 345 350
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
355 360 365
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
370 375 380
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
385 390 395 400
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
405 410 415
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
420 425 430
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
435 440 445
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
450 455 460
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
465 470 475 480
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
485 490 495
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
500 505 510
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
515 520 525
Pro Pro Arg
530
<210> 252
<211> 1590
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 252
atggcactgc cagtgaccgc cctgctgctg cctctggccc tgctgctgca cgcagccaga 60
ccccaggtga cactgaagga gagcggcccc gtgctggtga agcctacaga gacactgacc 120
ctgacctgca cagtgagcgg cttctccctg aacaatgcaa ggatgggcgt gtcctggatc 180
aggcagccac ctggcaaggc cctggagtgg ttcgcccaca tctttagcac cgacgagaag 240
tcctttcgca catctctgag aagcaggctg accctgagca aggatacaag caagtcccag 300
gtggtgctga ccatgacaaa catggaccct gtggataccg ccacatacta ttgtgcccgg 360
gacagctcca attacgaggg ctatttcgat tactggggcc agggcatcct ggtgaccgtg 420
tctagcggcg gcggcggctc tggaggagga ggaagcggag gaggaggatc cggcggcggc 480
ggctctgaga tcgtgatgac ccagtcccca gccacactgt ctgtgagccc aggagagaga 540
gccaccctgt cttgcagggc ctcccagtct gtgagcaaca atctggcctg gtatcagcag 600
aagcctggcc aggccccaag gctgctgatc tacggagcaa gcaccagagc aacaggagtg 660
cctgcaaggt tctccggatc tgacagcggc accgagtttt ctctgacaat ctcctctctg 720
cagagcgagg acttcgccgt gtatttttgt cagcagtaca aggattggcc attcaccttt 780
ggccccggca caaaggtgga gatcaagggc tccggaggag gaggatcctg cccctattcc 840
aacccttctc tgtgcagcgg aggaggagga agctgtccat actccaatcc ctccctgtgc 900
tccggcggcg gaggatccac cacaacccca gcacctagac caccaacccc agcaccaaca 960
atcgcatccc agcctctgtc tctgcggccc gaggcatgca ggccagcagc aggcggcgcc 1020
gtgcacacca ggggcctgga ctttgcctgc gatatctata tctgggcacc actggcagga 1080
acctgtggcg tgctgctgct gagcctggtc atcaccctgt attgcaagcg cggccggaag 1140
aagctgctgt acatcttcaa gcagcctttt atgcgcccag tgcagacaac ccaggaggag 1200
gacggctgct cctgtcggtt ccctgaagag gaggagggag gatgtgagct gcgcgtgaag 1260
ttttcccggt ctgccgatgc cccagcctat cagcagggcc agaaccagct gtacaacgag 1320
ctgaatctgg gccggagaga ggagtacgac gtgctggata agaggagggg aagagatccc 1380
gagatgggag gcaagcctcg gagaaagaac ccacaggagg gcctgtataa tgagctgcag 1440
aaggacaaga tggccgaggc ctactctgag atcggcatga agggagagag gcgccggggc 1500
aagggacacg atggcctgta tcagggcctg tccaccgcca caaaggacac ctacgatgcc 1560
ctgcacatgc aggccctgcc tccaaggtga 1590
<210> 253
<211> 1590
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 253
atggcactgc cagtgaccgc cctgctgctg cctctggccc tgctgctgca cgcagccaga 60
ccccaggtga cactgaagga gtccggcccc gtgctggtga agcctacaga gacactgacc 120
ctgacctgca cagtgagcgg cttctctctg agcaacgcaa ggatgggcgt gtcctggatc 180
aggcagccac ctggcaaggc cctggagtgg ctggcccaca tcttttccac cgacgagaag 240
tctatccgga gaagcctgcg ctcccggctg accctgagca aggatacatc caagtctcag 300
gtggtgctga ccatgacaaa catggaccct gtggataccg ccacatactt ctgtgcccgg 360
gacagctcca attacgaggg ctattttgat tactggggcc agggcaccct ggtgacagtg 420
tctagcggag gaggaggaag cggaggagga ggatcaggcg gcggcggctc tggcggcggc 480
ggcagcgagg tggtcatgac ccagtctcca gccacactga gcgtgtcccc aggagagcgc 540
gtgaccctga gctgccgggc ctctcagagc gtgtcctcta acttcgcctg gtatcagcag 600
cggcccggac aggcaccaag gctgctgctg tacggagcaa ccacaagagc aacaggcctg 660
cctggcaggt tttccggctc tggcagcggc accgagaata tcctgacaat cagctccctg 720
cagagcgagg acttcgccat ctatttttgt cagcagtaca aggattggcc attcaccttt 780
ggccccggct ccaaggtgga catcaaggga tccggaggag gaggatcttg cccctattct 840
aaccctagcc tgtgctccgg aggaggagga tcctgtccat actctaatcc atccctgtgc 900
agcggaggag gaggatctac cacaacccca gcacctagac caccaacccc agcacccaca 960
atcgcctctc agcctctgag cctgcgccca gaggcatgca ggccagcagc aggaggagca 1020
gtgcacacca ggggcctgga cttcgcctgc gatatctata tctgggcacc actggcagga 1080
acctgtggcg tgctgctgct gtccctggtc atcaccctgt attgcaagag aggcaggaag 1140
aagctgctgt acatcttcaa gcagcctttt atgcgcccag tgcagacaac ccaggaggag 1200
gacggctgca gctgtcggtt ccctgaagag gaggagggcg gctgtgagct gagagtgaag 1260
ttttccaggt ctgccgatgc cccagcctat cagcagggcc agaatcagct gtacaacgag 1320
ctgaatctgg gcaggcgcga ggagtacgac gtgctggata agaggagagg acgcgatccc 1380
gagatgggag gcaagcctag gcgcaagaac ccacaggagg gcctgtataa tgagctgcag 1440
aaggacaaga tggccgaggc ctactctgag atcggcatga agggagagcg gagaaggggc 1500
aagggacacg atggcctgta tcagggcctg agcaccgcca caaaggacac ctacgatgcc 1560
ctgcacatgc aggccctgcc tccaaggtga 1590
<210> 254
<211> 1599
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 254
atggccctgc cagtgaccgc cctgctgctg ccactggccc tgctgctgca cgccgccaga 60
cctgaggtgc agctggtgga gagctggggc gtgctggtga agccaggagg ctctctgagg 120
ctgagctgcg cagcatccgg cttcatcttt aacaatgcct ggatgtcctg ggtgagacag 180
gcaccaggca agggcctgga gtggatcggc aggatcaaga gcaagtccga cggaggaacc 240
acagattacg cagcacccgt gaaggaccgc ttcacaatct ctcgggacga tagcaaggat 300
accctgtatc tgcagatgaa cggcctgaag acagaggaca ccgccgtgta cttctgcacc 360
acagccccag gcggcccctt tgattattgg ggccagggca cactggtgac cgtgagctcc 420
ggaggaggag gaagcggcgg aggaggcagc ggcggcggcg gctctggcgg cggcggcagc 480
gacatcgtgc tgacacagag cccactgtcc ctgcctgtga ccccaggaga gcccgcctct 540
atcagctgtc gctctagcca gagcctgctg caccgggacg gcttcaatta cctggattgg 600
tttctgcaga agcctggcca gagcccacag ctgctgatct atctggcctc ctctagagca 660
tccggagtgc ctgacaggtt ctccggatct gacagcggca cagacttcac cctgaagatc 720
tcccgcgtgg aggcagagga tgtgggcgtg tactattgca tgcaggccct gcagacacca 780
atcaccttcg gccagggcac acggctggag atcaagggat ccggaggagg aggatcttgc 840
ccctactcta accctagcct gtgcagcggc ggaggaggat cttgtccata ttctaatcca 900
agcctgtgca gcgggggagg aggaagcacc acaacccctg caccaagacc ccctacacca 960
gcacctacca tcgcatccca gccactgtct ctgcggcccg aggcatgtag gccagcagca 1020
ggaggagcag tgcacaccag gggcctggac tttgcctgcg atatctacat ctgggcacca 1080
ctggcaggaa catgtggcgt gctgctgctg agcctggtca tcaccctgta ctgcaagaga 1140
ggcaggaaga agctgctgta tatcttcaag cagcctttta tgcgcccagt gcagacaacc 1200
caggaggagg acggctgctc ctgtaggttc ccagaagagg aggagggagg atgtgagctg 1260
cgcgtgaagt tttcccggtc tgccgatgca cctgcatacc agcagggaca gaaccagctg 1320
tataacgagc tgaatctggg ccggagagag gagtacgacg tgctggataa gaggagggga 1380
cgcgatcctg agatgggagg caagccccgg agaaagaacc ctcaggaggg cctgtacaat 1440
gagctgcaga aggacaagat ggccgaggcc tattccgaga tcggcatgaa gggagagagg 1500
cgccggggca agggacacga tggcctgtac cagggcctgt ctacagccac caaggacacc 1560
tatgatgccc tgcacatgca ggccctgcca ccaaggtga 1599
<210> 255
<211> 1596
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 255
atggcactgc cagtgacagc cctgctgctg cctctggccc tgctgctgca cgcagccaga 60
ccagaggtgc agctggtgga gtccggagga ggcctggtga agccaggagg ctccctgagg 120
ctgtcttgcg aggccagcgg cttcaccttt agcgacgcct ggatgtcctg ggtgagacag 180
gcaccaggca agggcctgga gtgggtgggc aggatcaaga gcaagacaga cggcggcacc 240
acagattacg tggtgcctct gaacggccgg ttcatcatct cccgcgacga ttctcggaat 300
accctgtatc tgcagctgaa caatctgaag acagaggata ccgccgtgta ctattgcacc 360
acagtgcctg gctcctacgg ctattggggc cagggcacac tggtgaccgt gagctccggc 420
ggcggcggct ctggaggagg aggaagcgga ggaggaggaa gcgggggcgg cggctctgac 480
atcgtgatga cacagtctcc actgagcctg ccagtgaccc caggagagcc tgcctccatc 540
tcttgtcgct ctagccagtc cctgctgcac aacaagcgga acaattacct ggattggttc 600
ctgcagaagc caggccagtc tccccagctg ctgatctatc tggccagcaa tagagcctcc 660
ggagtgccag acaggttctc tggaggagga agcggaacag acttcaccct gaagatcagc 720
cgcgtggagg cagaggacgt gggcgtgtac tattgcatgc aggcccagca gacacccatc 780
acctttggcc agggaacccg gctggagatc aagggctccg gaggaggagg atcctgccct 840
tactccaacc catctctgtg cagcggagga ggaggatctt gtccatattc caatccttcc 900
ctgtgctccg gaggaggagg aagcaccaca acccctgcac caagaccccc tacaccagca 960
cctaccatcg catcccagcc tctgtctctg cggcccgagg catgtaggcc agcagcaggc 1020
ggcgccgtgc acaccagggg cctggacttt gcctgcgata tctacatctg ggcaccactg 1080
gcaggaacat gtggcgtgct gctgctgtct ctggtcatca ccctgtactg caagagaggc 1140
aggaagaagc tgctgtatat cttcaagcag cccttcatgc ggcccgtgca gacaacccag 1200
gaggaggacg gctgcagctg tcggttccct gaagaggagg agggaggatg tgagctgcgc 1260
gtgaagttta gccggtccgc cgatgcacca gcataccagc agggccagaa ccagctgtat 1320
aacgagctga atctgggccg gagagaggag tacgacgtgc tggataagag gaggggacgc 1380
gatcctgaga tgggaggcaa gcctcggaga aagaacccac aggagggcct gtacaatgag 1440
ctgcagaagg acaagatggc cgaggcctat agcgagatcg gcatgaaggg agagaggcgc 1500
cggggcaagg gacacgatgg cctgtaccag ggcctgtcca cagccaccaa ggacacctat 1560
gatgccctgc acatgcaggc cctgccacca aggtga 1596
<210> 256
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 256
Cys Pro Tyr Ser Asn Pro Ser Leu Cys
1 5
<210> 257
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 257
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu
20 25 30
Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln
35 40 45
Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln
50 55 60
Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile Tyr Gln Val Ser Lys Leu
65 70 75 80
Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr
100 105 110
Tyr Cys Gly Gln Asp Thr His Phe Pro Leu Thr Phe Gly Gly Gly Thr
115 120 125
Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser
145 150 155 160
Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys
165 170 175
Ala Ser Gly Tyr Thr Phe Thr Asp Tyr Thr Leu His Trp Val Arg Gln
180 185 190
Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Trp Pro Ile Thr
195 200 205
Gly Gly Thr Thr Tyr Asn Gln Lys Phe Lys Gly Arg Val Thr Met Thr
210 215 220
Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg
225 230 235 240
Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Gly Glu Ala Gln
245 250 255
<210> 258
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 258
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Leu Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Pro Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Leu Lys Leu Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Ala Pro Val Asp
100 105 110
Ser Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg
180 185 190
Ser Asn Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ser Thr Ile Arg Ala Thr Gly Val Pro Ala Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ser Asp
245 250 255
<210> 259
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 259
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Ile Arg Arg Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Phe Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Val Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Val Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Ser Asn Phe Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu
195 200 205
Leu Leu Tyr Gly Ala Thr Thr Arg Ala Thr Gly Leu Pro Gly Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Glu Asn Ile Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Ile Tyr Phe Cys Gln Gln Tyr Lys Asp
245 250 255
<210> 260
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 260
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Ser Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Leu Gly His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Tyr Ser Thr Ser Leu Arg Gly Arg Ile Thr Ile Ser Lys Asp Thr
85 90 95
Ser Arg Gly Leu Val Val Leu Thr Leu Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Phe Trp Gly Pro Gly Phe Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Val Ser Gln Ser Ile Gly
180 185 190
Ala Asn Leu Ala Trp Tyr Gln Gln Lys Phe Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Val Arg Phe
210 215 220
Ser Gly Gly Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Ile Tyr Ser Cys Gln Gln Tyr Ile Tyr
245 250 255
<210> 261
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 261
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu
20 25 30
Val Lys Pro Thr Glu Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe
35 40 45
Ser Leu Asn Asn Ala Arg Met Gly Val Ser Trp Ile Arg Gln Pro Pro
50 55 60
Gly Lys Ala Leu Glu Trp Phe Ala His Ile Phe Ser Thr Asp Glu Lys
65 70 75 80
Ser Phe Arg Thr Ser Leu Arg Ser Arg Leu Thr Leu Ser Lys Asp Thr
85 90 95
Ser Lys Ser Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
100 105 110
Thr Ala Thr Tyr Tyr Cys Ala Arg Asp Ser Ser Asn Tyr Glu Gly Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
165 170 175
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
180 185 190
Asn Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu
195 200 205
Leu Ile Tyr Gly Ala Ser Thr Arg Ala Thr Gly Val Pro Ala Arg Phe
210 215 220
Ser Gly Ser Asp Ser Gly Thr Glu Phe Ser Leu Thr Ile Ser Ser Leu
225 230 235 240
Gln Ser Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Lys Asp
245 250 255
<210> 262
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 262
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Tyr Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Ile Ala Asp Gly Gly Ala
65 70 75 80
Thr Asp Tyr Ala Ala Pro Val Arg Asn Arg Phe Thr Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Ile Pro Gly Asn Asp Ala Phe
115 120 125
Asp Met Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro
165 170 175
Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr
180 185 190
Ser Asn Gly Lys Asn Tyr Leu Asp Trp Phe Leu His Lys Pro Gly Gln
195 200 205
Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val
210 215 220
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ile Asp Phe Ile Leu Lys
225 230 235 240
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met
245 250 255
<210> 263
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 263
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Asn Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Tyr Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Ile Thr Asp Gly Gly Val
65 70 75 80
Ile Asp Tyr Ala Ala Pro Val Arg Asn Arg Cys Thr Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Glu Met His Ser Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Ile Pro Gly Asn Asp Asp Phe
115 120 125
Asp Met Trp Gly Gln Gly Arg Met Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
145 150 155 160
Ser Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro
165 170 175
Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr
180 185 190
Ser Asn Gly Lys Asn Tyr Leu Asp Trp Phe Leu His Lys Pro Gly Gln
195 200 205
Ser Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val
210 215 220
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ile Asp Phe Ile Leu Lys
225 230 235 240
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met
245 250 255
<210> 264
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 264
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Trp Gly Val Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ile Phe Asn Asn Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Arg Ile Lys Ser Lys Ser Asp Gly Gly Thr
65 70 75 80
Thr Asp Tyr Ala Ala Pro Val Lys Asp Arg Phe Thr Ile Ser Arg Asp
85 90 95
Asp Ser Lys Asp Thr Leu Tyr Leu Gln Met Asn Gly Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Phe Cys Thr Thr Ala Pro Gly Gly Pro Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
165 170 175
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Arg
180 185 190
Asp Gly Phe Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser
195 200 205
Pro Gln Leu Leu Ile Tyr Leu Ala Ser Ser Arg Ala Ser Gly Val Pro
210 215 220
Asp Arg Phe Ser Gly Ser Asp Ser Gly Thr Asp Phe Thr Leu Lys Ile
225 230 235 240
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln
245 250 255
<210> 265
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 265
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe
35 40 45
Thr Phe Ser Asp Ala Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr
65 70 75 80
Thr Asp Tyr Val Val Pro Leu Asn Gly Arg Phe Ile Ile Ser Arg Asp
85 90 95
Asp Ser Arg Asn Thr Leu Tyr Leu Gln Leu Asn Asn Leu Lys Thr Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Thr Thr Val Pro Gly Ser Tyr Gly Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu
165 170 175
Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Asn Lys
180 185 190
Arg Asn Asn Tyr Leu Asp Trp Phe Leu Gln Lys Pro Gly Gln Ser Pro
195 200 205
Gln Leu Leu Ile Tyr Leu Ala Ser Asn Arg Ala Ser Gly Val Pro Asp
210 215 220
Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
225 230 235 240
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
245 250 255
<210> 266
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 266
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Asp
35 40 45
Thr Phe Ser Ser Asn Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Val Ile Ile Pro Ile Phe Gly Thr Ala Asp
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg His Thr Tyr His Glu Tyr Ala Gly Gly
115 120 125
Tyr Tyr Gly Gly Ala Met Asp Pro Trp Gly Gln Gly Thr Leu Val Thr
130 135 140
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Gly Gly Gly Gly Ser Glu Leu Gln Ser Val Leu Thr Gln Pro
165 170 175
Pro Ser Ala Ser Gly Thr Pro Gly Gln Arg Val Thr Ile Ser Cys Ser
180 185 190
Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Tyr Trp Tyr Gln Gln
195 200 205
Leu Pro Gly Thr Ala Pro Lys Ile Leu Ile Tyr Arg Asn Asn Gln Arg
210 215 220
Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser
225 230 235 240
Ala Ser Leu Ala Ile Ser Gly Leu Arg Ser Glu Asp Glu Ala Asp
245 250 255
<210> 267
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 267
Gly Phe Thr Phe Ser Tyr Ala Trp Met
1 5
<210> 268
<211> 255
<212> PRT
<213> Homo sapien
<400> 268
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln
245 250 255
<210> 269
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 269
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln
245 250 255
<210> 270
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 270
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
165 170 175
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln
245 250 255
<210> 271
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 271
Asn Pro Gln Arg Ser Thr Val Trp Tyr Leu Thr Pro Gln Gln Val Val
1 5 10 15
Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln
20 25 30
Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln
35 40 45
Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr
50 55 60
Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro
65 70 75 80
Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu
85 90 95
Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu
100 105 110
Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln
115 120 125
Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His
130 135 140
Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly
145 150 155 160
Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln
165 170 175
Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp
180 185 190
Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu
195 200 205
Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser
210 215 220
Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro
225 230 235 240
Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
245 250 255
<210> 272
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 272
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
195 200 205
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln
245 250 255
<210> 273
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 273
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln
245 250 255
<210> 274
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 274
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln
245 250 255
<210> 275
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 275
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
165 170 175
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln
245 250 255
<210> 276
<211> 136
<212> PRT
<213> Homo sapien
<400> 276
Cys Pro Tyr Ser Asn Pro Ser Leu Cys Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Leu Pro Thr Gln Gly Thr Phe Ser Asn Val Ser Thr Asn Val Ser Pro
20 25 30
Ala Lys Pro Thr Thr Thr Ala Cys Pro Tyr Ser Asn Pro Ser Leu Cys
35 40 45
Ser Gly Gly Gly Gly Ser Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
50 55 60
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
65 70 75 80
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
85 90 95
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
100 105 110
Ser Leu Val Ile Thr Leu Tyr Cys Asn His Arg Asn Arg Arg Arg Val
115 120 125
Cys Lys Cys Pro Arg Pro Val Val
130 135
<210> 277
<211> 1509
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 277
atggctctgc ccgtcaccgc tctgctgctg cctctggccc tgctgctgca cgcagcaagg 60
ccacaggtgc agctggtgca gtccggagca gaggtgaaga agcctggcag ctccgtgaag 120
gtgagctgca aggcctccgg cgacacattc tctagcaacg caatcagctg ggtgcgccag 180
gcccctggcc agggactgga gtggatgggc gtgatcatcc ctatcttcgg caccgccgac 240
tatgcccaga agtttcaggg ccgggtgaca atcaccgccg atgagtctac aagcaccgcc 300
tacatggagc tgtcctctct gagatccgag gacacagccg tgtactattg tgccaggcac 360
acctatcacg agtacgcagg aggatactat ggaggagcaa tggatccttg gggacagggc 420
acactggtga ccgtgagctc cggcggcggc ggctctggag gaggaggaag cggaggagga 480
ggaagcgggg gcggcggctc tgagctgcag agcgtgctga cccagccacc ttccgcctct 540
ggaacaccag gccagagggt gaccatcagc tgctccggat ctagctccaa catcggctcc 600
aattacgtgt attggtacca gcagctgcca ggcacagccc ccaagatcct gatctaccgc 660
aacaatcagc ggccttctgg cgtgccagat agattctctg gcagcaagtc cggcacctct 720
gccagcctgg caatctccgg cctgaggtct gaggacgagg ccgattacta ttgcgccgcc 780
tgggacgata acctgagcgg ctgggtgttt ggcacaggca ccaagctgac agtgctgacc 840
acaacccctg caccaagacc accaacacca gcacctacca tcgcaagcca gccactgtcc 900
ctgagacccg aggcctgtag gcctgcagca ggaggagcag tgcacaccag gggcctggac 960
tttgcctgcg atatctatat ctgggcacca ctggcaggaa catgtggcgt gctgctgctg 1020
agcctggtca tcaccctgta ttgcaagaga ggcaggaaga agctgctgta catcttcaag 1080
cagcccttta tgcgccctgt gcagacaacc caggaggagg acggctgcag ctgtcggttc 1140
ccagaagagg aggagggagg atgtgagctg agggtgaagt tttcccggtc tgccgatgca 1200
ccagcatatc agcagggaca gaatcagctg tacaacgagc tgaatctggg ccggagagag 1260
gagtacgacg tgctggataa gaggagggga agggaccctg agatgggagg caagccacgg 1320
agaaagaacc cccaggaggg cctgtataat gagctgcaga aggacaagat ggccgaggcc 1380
tactctgaga tcggcatgaa gggagagagg cgccggggca agggacacga tggcctgtat 1440
cagggcctga gcacagccac caaggacacc tacgatgccc tgcatatgca ggcactgcct 1500
ccaaggtga 1509
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) С АНТИГЕНСВЯЗЫВАЮЩИМИ ДОМЕНАМИ К КОНСТАНТНОЙ ОБЛАСТИ β Т-КЛЕТОЧНОГО РЕЦЕПТОРА | 2015 |
|
RU2830064C2 |
| Т-КЛЕТКИ С КОСТИМУЛИРУЮЩИМ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ, НАЦЕЛЕННЫЕ НА IL13Rα2 | 2015 |
|
RU2749922C2 |
| НЕПРИРОДНЫЕ РЕЦЕПТОРЫ NKG2D, КОТОРЫЕ НЕПОСРЕДСТВЕННО НЕ ПЕРЕДАЮТ СИГНАЛ КЛЕТКАМ, С КОТОРЫМИ ОНИ СВЯЗАНЫ | 2019 |
|
RU2832538C2 |
| АНТИ-CLL1-СПЕЦИФИЧЕСКИЕ ОДНОЦЕПОЧЕЧНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ (scCAR) ДЛЯ ИММУНОТЕРАПИИ РАКА | 2016 |
|
RU2731543C2 |
| Т-КЛЕТКИ С ДВУМЯ ХИМЕРНЫМИ АНТИГЕННЫМИ РЕЦЕПТОРАМИ CAR | 2021 |
|
RU2839662C1 |
| CD123-СПЕЦИФИЧЕСКИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2015 |
|
RU2727290C2 |
| Выделенный альтернативный внутриклеточный сигнальный домен химерного антигенного рецептора и включающий его химерный антигенный рецептор | 2019 |
|
RU2742000C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2841244C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| ИНДУЦИБЕЛЬНЫЕ ХИМЕРНЫЕ ЦИТОКИНОВЫЕ РЕЦЕПТОРЫ | 2019 |
|
RU2826155C2 |
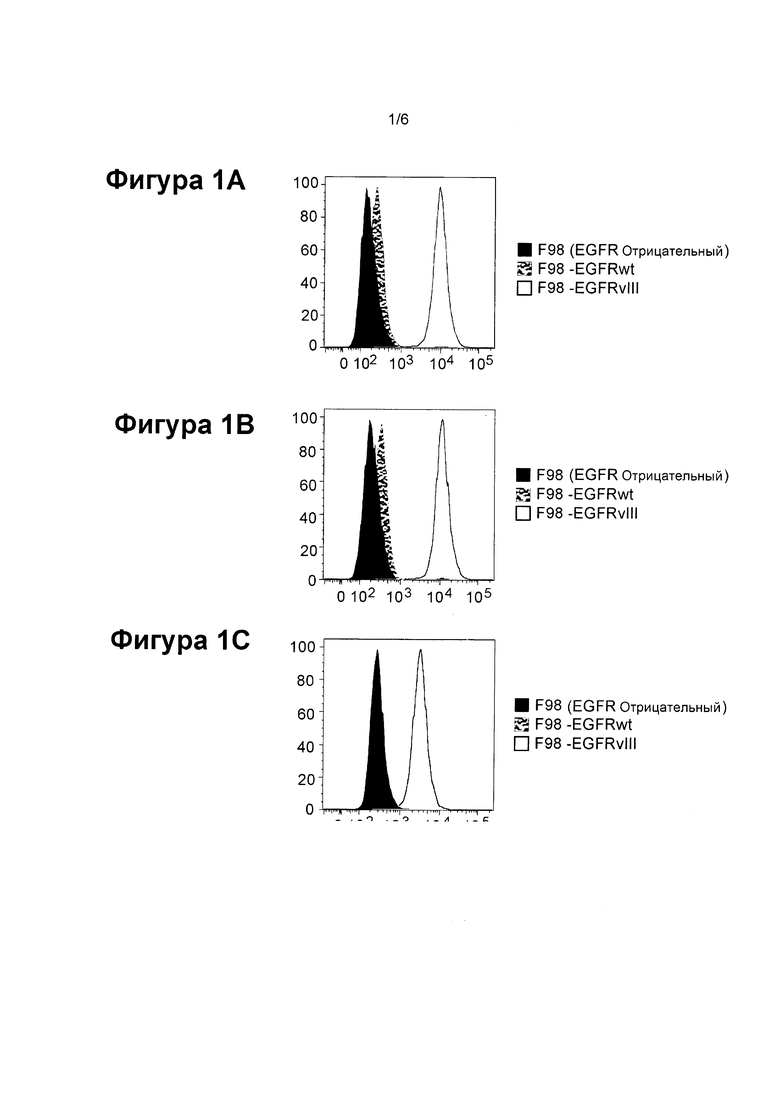
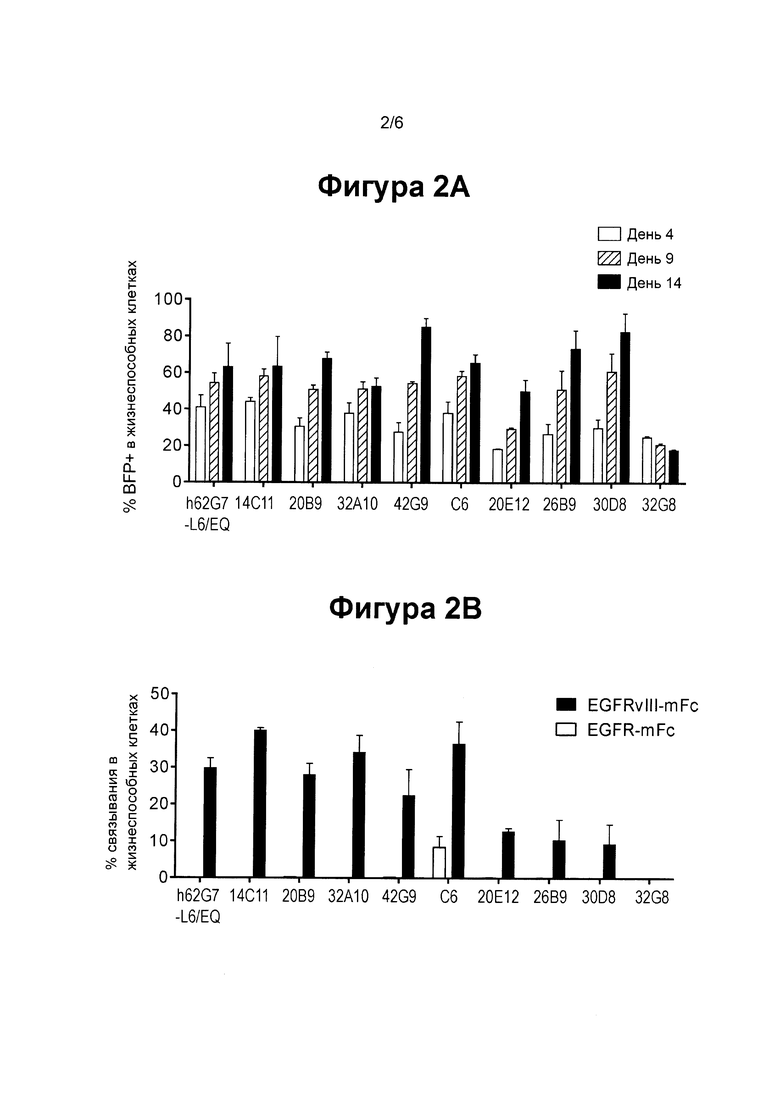
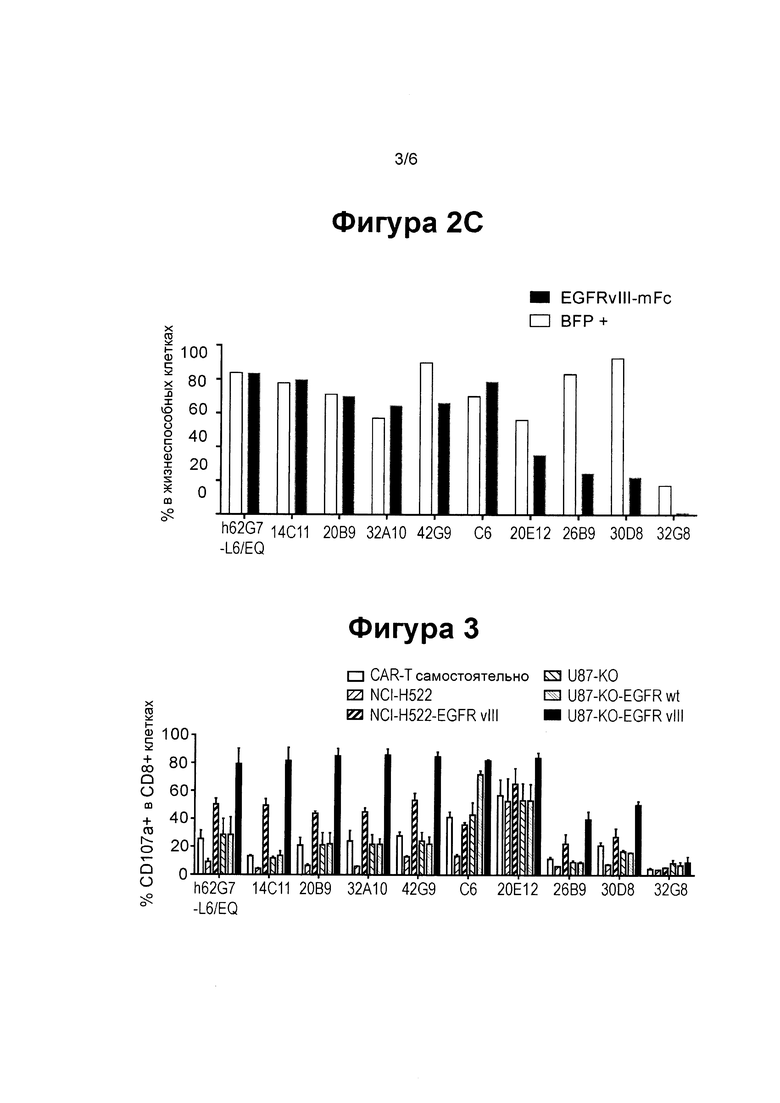
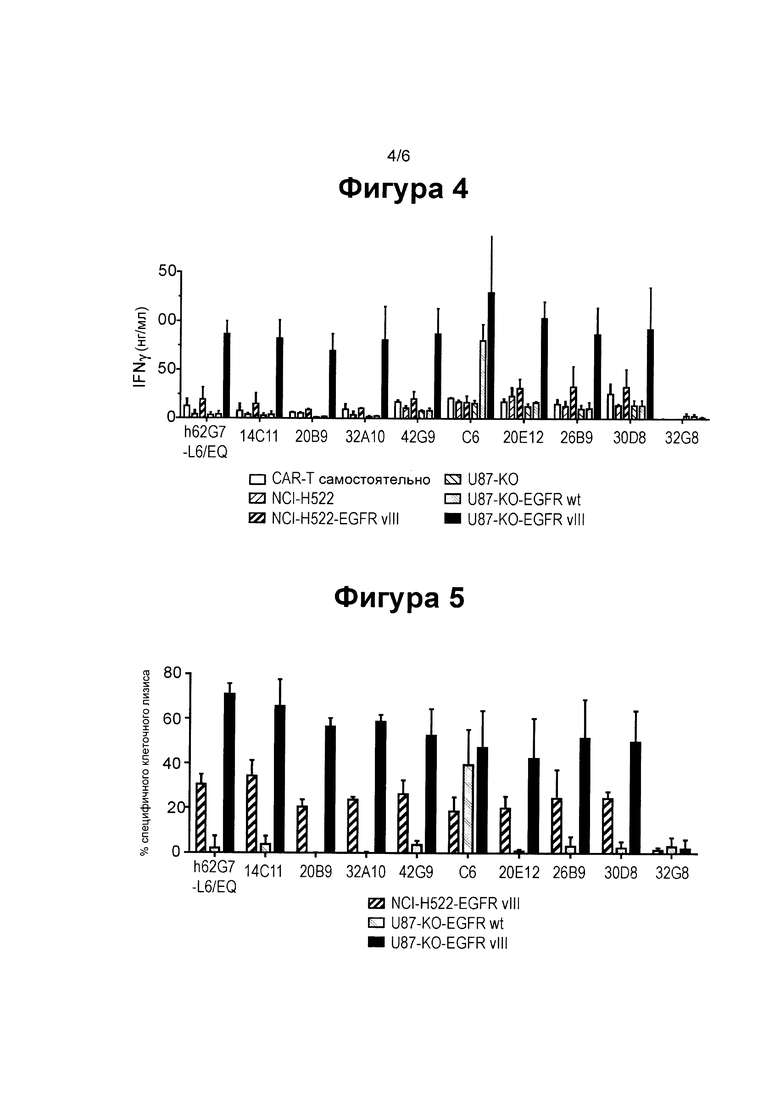
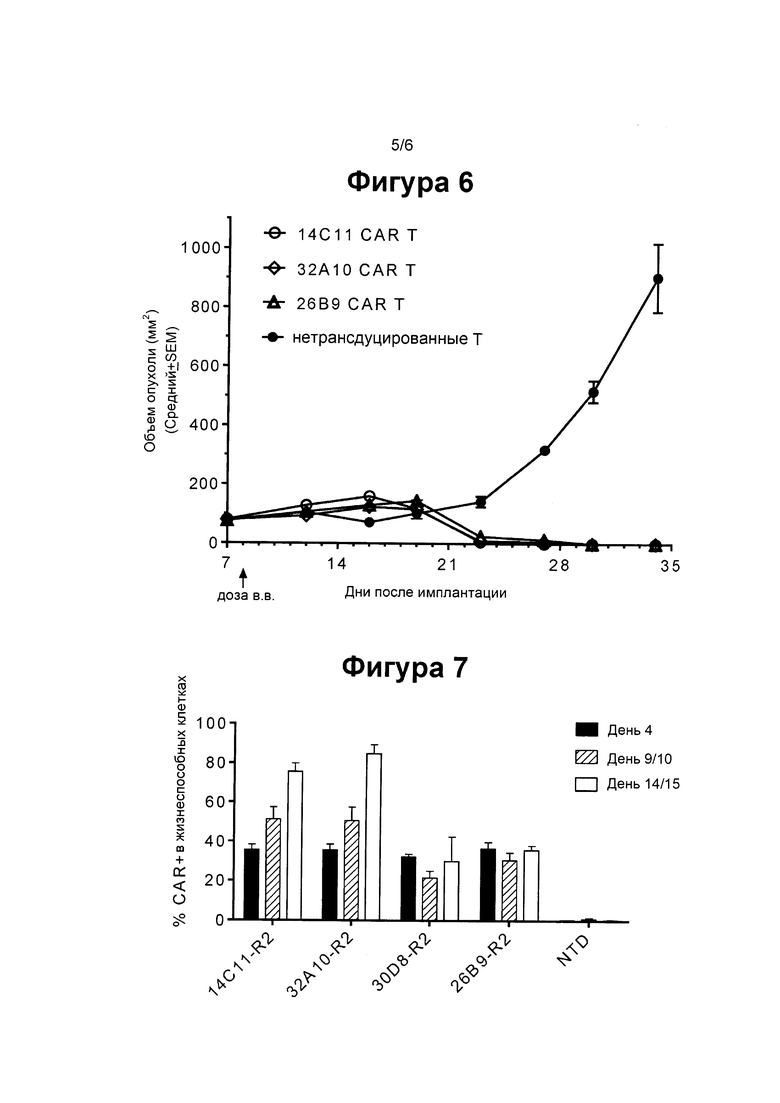
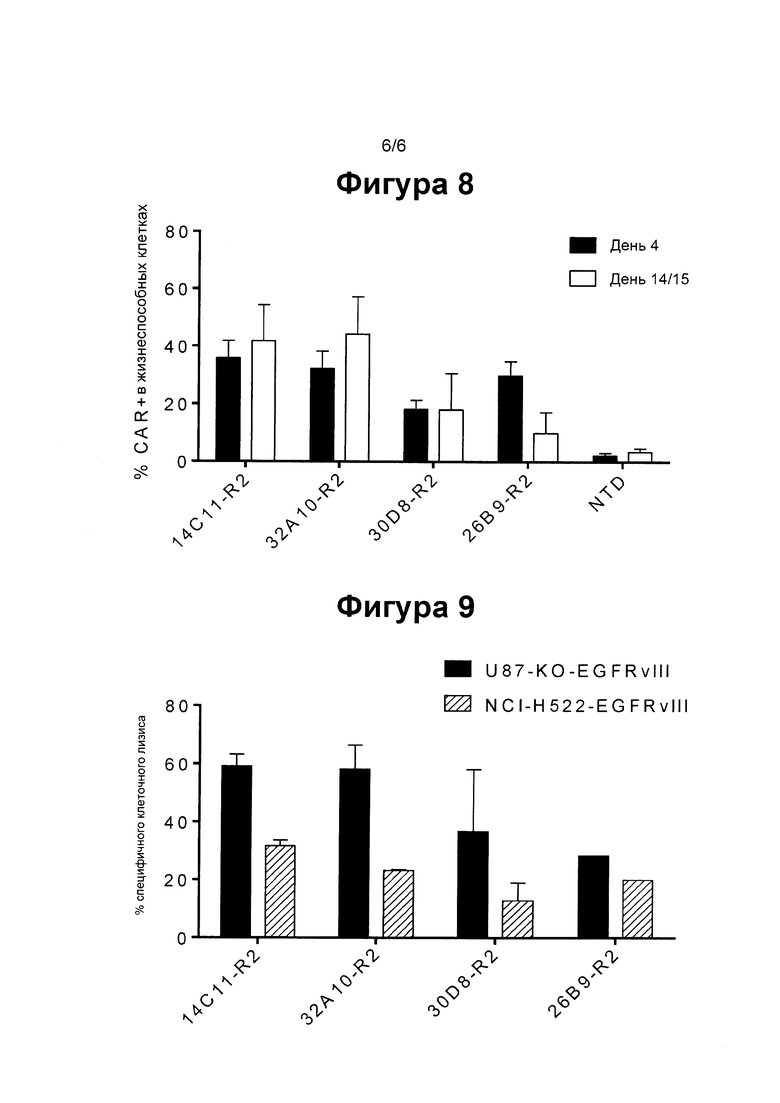
Изобретение относится к области биотехнологии, в частности к специфическому к варианту III рецептора эпидермального фактора роста (EGFRvIII), химерному антигенному рецептору (CAR), содержащему EGFRvIII-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, а также к кодирующему его полинуклеотиду. Также раскрыты вектор, клетка, содержащие вышеуказанный полинуклеотид. Изобретение также относится к иммунной клетке, содержащей вышеуказанный полинуклеотид, способу ее получения, а также фармацевтической композиции, ее содержащей. Изобретение позволяет эффективно осуществлять лечение рака. 9 н. и 8 з.п. ф-лы, 9 ил., 10 табл., 12 пр.
1. Специфический к варианту III рецептора эпидермального фактора роста (EGFRvIII) химерный антигенный рецептор (CAR), содержащий EGFRvIII-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, где EGFRvIII-связывающий домен содержит:
(a) вариабельную область тяжёлой цепи (VH), содержащую три определяющие комплементарность области: определяющую комплементарность область 1 VH (VH CDR1), определяющую комплементарность область 2 VH (VH CDR2) и определяющую комплементарность область 3 VH (VH CDR3) из 42G9, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 74-76, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 77-78 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 79; и
вариабельную область легкой цепи (VL), содержащую три определяющие комплементарность области: определяющую комплементарность область 1 VL (VL CDR1), определяющую комплементарность область 2 VL (VL CDR2) и определяющую комплементарность область 3 VL (VL CDR3) из 42G9, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 156, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 157 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 158; или
(b) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 32A10, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 80-82, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 83-84 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 85; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 32A10, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 159, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 160 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 161; или
(c) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 20B9, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 80-82, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 86-87 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 79; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 20B9, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 162, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 163 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 164; или
(d) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 14C11, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 88-90, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 91-92 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 85; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 14C11, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 165, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 163 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 161; или
(e) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 30D8, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 109-111, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 112-113 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 114; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 30D8, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 182, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 183 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 184; или
(f) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 20E12, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 115-117, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 118-119 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 120; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 20E12, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 185, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 186 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 184; или
(g) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 26B9, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 121-123, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 124-125 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 126; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 26B9, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 187, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 188 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 189;
(h) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из C6, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 137-139, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 140-141 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 142;
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из C6, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 195, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 196 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 197; или
(i) область VH, содержащую три определяющие комплементарность области VH CDR1, VH CDR2 и VH CDR3 из 12B2, расположенные последовательно от N-конца до C-конца VH CDR1, VH CDR2 и VH CDR3, где VH CDR1 содержит аминокислотную последовательность одной из SEQ ID NO: 74-76, VH CDR2 содержит аминокислотную последовательность одной из SEQ ID NO: 102 или 103 и VH CDR3 содержит аминокислотную последовательность SEQ ID NO: 104; и
область VL, содержащую три определяющие комплементарность области VL CDR1, VL CDR2 и VL CDR3 из 12B2, расположенные последовательно от N-конца до C-конца VL CDR1, VL CDR2 и VL CDR3, где VL CDR1 содержит аминокислотную последовательность SEQ ID NO: 176, VL CDR2 содержит аминокислотную последовательность SEQ ID NO: 172 и VL CDR3 содержит аминокислотную последовательность SEQ ID NO: 177.
2. Специфический к варианту III рецептора эпидермального фактора роста (EGFRvIII) химерный антигенный рецептор (CAR), содержащий EGFRvIII-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, где EGFRvIII-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv), содержащий область VH и область VL, выбранные из группы, состоящей из:
i) область VH, содержащую аминокислотную последовательность SEQ ID NO: 9, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 10 (42G9);
ii) область VH, содержащую аминокислотную последовательность SEQ ID NO: 11, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 12 (32A10);
iii) область VH, содержащую аминокислотную последовательность SEQ ID NO: 13, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 14 (20B9);
iv) область VH, содержащую аминокислотную последовательность SEQ ID NO: 15, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 16 (14C11);
v) область VH, содержащую аминокислотную последовательность SEQ ID NO: 37, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 38 (30D8);
vi) область VH, содержащую аминокислотную последовательность SEQ ID NO: 39, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 40 (20E12);
vii) область VH, содержащую аминокислотную последовательность SEQ ID NO: 41, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 42 (26B9);
viii) область VH, содержащую аминокислотную последовательность SEQ ID NO: 48, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 49 (C6); и
ix) область VH, содержащую аминокислотную последовательность SEQ ID NO: 30, и область VL, содержащую аминокислотную последовательность SEQ ID NO: 31 (B12).
3. Специфический к варианту III рецептора эпидермального фактора роста (EGFRvIII) химерный антигенный рецептор (CAR), содержащий EGFRvIII-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, где EGFRvIII-специфический химерный антигенный рецептор (CAR) содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 53-57 и 59-61.
4. EGFRvIII-специфический CAR по какому-либо одному из пп. 1-3, где внутриклеточный сигнальный домен представляет собой первый внутриклеточный сигнальный домен и необязательно CAR дополнительно содержит второй внутриклеточный сигнальный домен.
5. EGFRvIII-специфический CAR по п. 4, где первый внутриклеточный сигнальный домен содержит CD3дзета сигнальный домен и необязательный второй внутриклеточный сигнальный домен содержит 4-1BB сигнальный домен.
6. EGFRvIII-специфический CAR по какому-либо одному из пп. 1-5, дополнительно содержащий стеблевой домен между внеклеточным связывающим лиганд доменом и первым трансмембранным доменом.
7. EGFRvIII-специфический CAR по п. 6, где стеблевой домен выбран из группы, состоящей из: человеческого CD8α шарнира, человеческого CD28 шарнира, IgG1 шарнира и FcγRIIIα шарнира.
8. EGFRvIII-специфический CAR по какому-либо одному из пп. 1-7, где трансмембранный домен содержит трансмембранный домен цепи CD8α.
9. Выделенный полинуклеотид, имеющий нуклеотидную последовательность, кодирующую EGFRvIII-специфический CAR по какому-либо одному из пп. 1-8.
10. Выделенный вектор экспрессии, содержащий полинуклеотид по п. 9.
11. Выделенная сконструированная иммунная клетка гемопоэтического происхождения для лечения рака, содержащая полинуклеотид по п. 9 или вектор экспрессии по п. 10, где указанная иммунная клетка экспрессирует на своей клеточной поверхностной мембране EGFRvIII-специфический CAR по какому-либо одному из пп. 1-8, при этом иммунная клетка представляет собой воспалительный T-лимфоцит, цитотоксический T-лимфоцит, T-лимфоцит памяти, хелперный T-лимфоцит, природный киллерный T-лимфоцит или природную киллерную клетку.
12. Выделенная сконструированная иммунная клетка по п. 11, где иммунную клетку получают от здорового донора или от пациента.
13. Выделенная сконструированная иммунная клетка по п. 11 или 12, где выделенная иммунная клетка представляет собой цитотоксичный Т-лимфоцит, Т-лимфоцит памяти, хелперный T-лимфоцит и природную киллерную клетку.
14. Фармацевтическая композиция для лечения рака, содержащая эффективное количество выделенной сконструированной иммунной клетки по какому-либо одному из пп. 11-13.
15. Применение выделенной сконструированной иммунной клетки по какому-либо одному из пп. 11-13 для получения лекарственного средства для лечения рака.
16. Применение по п. 15, где рак представляет собой рак, связанный с EGFRvIII, выбранный из группы, состоящей из мультиформной глиобластомы, анапластической астроцитомы, гигантоклеточной глиобластомы, глиосаркомы, анапластической олигодендроглиомы, анапластической эпендимомы, анапластической олигоастроцитомы, карциномы хориоидного сплетения, анапластической ганглиоглиомы, пинеобластомы, пинеоцитомы, менингиомы, медуллоэпителиомы, эпендимобластомы, медуллобластомы, супратенториальной примитивной нейроэктодермальной опухоли, атипичной тератоидной/рабдоидной опухоли, смешанной глиомы, рака головы и шеи, немелкоклеточного рака легкого, рака молочной железы, рака яичников, рака предстательной железы, медуллобластомы, рака толстой и прямой кишок, рака анального канала, рака шейки матки, рака почки, рака кожи, рака поджелудочной железы, рака печени, рака мочевого пузыря, рака желудка, рака щитовидной железы, мезотелиомы, рака матки, лимфомы и лейкемии.
17. Способ конструирования иммунной клетки, включающий:
a. обеспечение иммунной клетки; и
b. экспрессирование на поверхности клетки, по меньшей мере, одного EGFRvIII-специфического CAR в соответствии с каким-либо одним из пп. 1-8.
| WO2014130657 A1, 28.08.2014 | |||
| WO2012138475 A1, 11.10.2012 | |||
| HAN, JIANFENG, et al., CAR-engineered NK cells targeting wild-type EGFR and EGFRvIII enhance killing of glioblastoma and patient-derived glioblastoma stem cells, Scientific reports, 2015, 5: 11483 | |||
| WO2014011988 A2, 16.01.2014 | |||
| SCFV ПРОТИВ EGFRvIII С УЛУЧШЕННОЙ ЦИТОТОКСИЧНОСТЬЮ И ВЫХОДОМ, ИММУНОТОКСИНЫ НА ИХ ОСНОВЕ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2001 |
|
RU2317999C2 |
Авторы
Даты
2021-07-15—Публикация
2017-01-10—Подача