ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Ахондроплазия, наиболее распространенная форма карликовости коротких конечностей, является редким генетическим заболеванием, от которого не существует лекарств. У многих пациентов замена G380R в трансмембранном домене рецептора фактора роста фибробластов 3 (FGFR3) (Fgfr3ach) приводит к мутации с приобретением функции, продлевающей внутриклеточную передачу сигналов MAPK. В ростовой пластинке передача сигналов MAPK является ингибирующей, и ее последующая конститутивная активация приводит к ингибированию пролиферации и дифференцировки хондроцитов. Клетки, экспрессирующие мутантный рецептор, не созревают и не замещаются минерализованным костным матриксом, что в итоге приводит к аномально коротким костям.
Ахондроплазия также характеризуется ранним ожирением, которое представляет собой серьезную проблему для здоровья этих пациентов, затрагивая в детстве приблизительно 50% пациентов. Ожирение увеличивает заболеваемость, связанную с поясничным лордозом, а также физическое воздействие существующих ортопедических осложнений, увеличивая, например, нагрузку на уже хрупкие колени. Это также может увеличить риск серьезных осложнений, таких как сердечно-сосудистые риски, обструктивное апноэ во сне или рестриктивные заболевания легких. Причины этой повышенной восприимчивости к ожирению у пациентов с ахондроплазией не известны, но, по-видимому, не связаны с гормональной или неврологической дисфункцией, которая может привести к снижению регуляции аппетита, такой как гиперфагия.
Пациенты с ожирением, страдающие ахондропластикой, могут также страдать от связанных метаболических осложнений, таких как дислипидемия, низкий уровень инсулина и нарушение регуляции глюкозы. Не ясно, являются ли эти осложнения изолированными и связаны ли они с внешними факторами, такими как чрезмерное потребление калорий и/или снижение физической активности, или они действительно отражают основной дефект ахондроплазии.
Аномальное отложение жира, и более конкретно, аномальное отложение висцерального жира, среди населения в целом также ассоциируется с развитием конкретных заболеваний, включая сердечно-сосудистые, метаболические, легочные, репродуктивные и неврологические заболевания. Существует необходимость в медицинских препаратах для лечения или предупреждения развития аномального отложения висцерального жира и связанных с ним заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте в заявке описан способ лечения или уменьшения аномального отложения жира (например, отложения висцерального жира) у пациента (например, человека, такого как плод, новорожденный, младенец, ребенок, подросток или взрослый), путем введения пациенту растворимого полипептида рецептора фактора роста фибробластов 3 (sFGFR3), полинуклеотида, кодирующего полипептид sFGFR3, или клетки-хозяина, которая содержит кодирующий ее полинуклеотид. В некоторых вариантах осуществления аномальное отложение висцерального жира связывает или окружает один или более из следующих органов: сердце, печень, селезенку, почки, поджелудочную железу, кишечник, репродуктивные органы и желчный пузырь; или аномальное отложение висцерального жира вызывает заболевание в одном или нескольких из следующих органов: сердце, легкие, трахея, печень, поджелудочная железа, мозг, репродуктивные органы, артерии и желчный пузырь; или аномальное отложение висцерального жира вызвано дисфункцией эндокринного органа, такого как надпочечник, гипофиз или репродуктивный орган, такой как яичник. Способ может привести к снижению или устранению или снижению риска развития одного или нескольких состояний, связанных с аномальным распределением жира, таких как обструктивное апноэ во сне, заболевание легких, сердечно-сосудистое заболевание, нарушение обмена веществ, неврологическое заболевание, дислипидемия, гипертензия, атеросклероз, инфаркт миокарда, инсульт, деменция, бесплодие, нарушения менструального цикла, нарушение регуляции секреции инсулина и нарушение регуляции глюкозы. В частности, дислипидемия представляет собой аномальный уровень одного или нескольких из триглицеридов, липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП) и холестерина; сердечно-сосудистым заболеванием является болезнь сердца или инсульт; заболеванием легких является астма и рестриктивная болезнь легких; неврологическим заболеванием является деменция или болезнь Альцгеймера; нарушением обмена веществ является диабет 2 типа, непереносимость глюкозы, неалкогольная жировая болезнь печени и гепатотоксичность; нарушением регуляции секреции инсулина является резистентность к инсулину.
В одном варианте осуществления пациент, имеющий аномальное отложение жира, не имеет избыточной массы тела, не имеет значительного отложения подкожного жира и/или может не демонстрировать значительного аномального отложения жира вне живота. Аномальное отложение жира может быть определено с использованием антропометрического метода (например, индекс массы тела (ИМТ) или соотношение андроидных:гиноидных жиров) или визуализации (например, компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и двухэнергетическая рентгеновская абсорбциометрия (DXA), способы, которые могут обнаружить аномальное распределение жира в отсутствие других жировых фенотипов.
В других вариантах осуществления у пациента может быть нарушение задержки роста скелета, такое как болезнь костной системы, связанная с FGFR3 (например, болезнь костной системы, связанная с FGFR3, вызванная экспрессией у пациента варианта FGFR3, который проявляет лиганд-зависимую избыточную активацию, такого как вариант FGFR3, имеющий аминокислотную замену остатка глицина остатком аргинина в положении 358 (G358R), как указано в SEQ ID NO: 9). Болезнь костной системы, связанная с FGFR3, может включать, например, ахондроплазию, танатофорную дисплазию типа I (TDI), танатофорную дисплазию типа II (TDII), тяжелую ахондроплазию с задержкой развития и черным акантозом (SADDEN), гипохондроплазию, синдром с краниосиностозом (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом), и камптодактилию, высокорослость и синдром потери слуха (CATSHL). Пациент, страдающий нарушением задержки роста скелета, может иметь один или более симптомов нарушения задержки роста скелета, выбранных из группы, включающей короткие конечности, короткое туловище, О-образное искривление ног, утиную походку, пороки развития черепа, синдром клеверного листа, краниосиностоз, вормиевы кости, аномалии рук, аномалии ног, удлиненный большой палец кисти и аномалии грудной клетки. Из описанных в настоящем изобретении способов может быть исключен пациент с нарушением задержки роста скелета, таким как описан выше, например, ахондроплазия, после прекращения роста костей у пациента (например, у плода, у новорожденного, у младенца, у ребенка и/или у подростка).
В альтернативном варианте осуществления у пациента нет нарушения задержки роста скелета, но его можно охарактеризовать как имеющего ожирение, синдром поликистозных яичников или форму гиперкортицизма, такую как болезнь Кушинга.
В других вариантах осуществления sFGFR3 имеет по меньшей мере 50 аминокислотных последовательностей внеклеточного домена полипептида рецептора природного фактора роста фибробластов 3 (FGFR3) (например, 100-370 аминокислотных последовательностей внеклеточного домена полипептида рецептора природного фактора роста фибробластов 3 (FGFR3) или меньше чем 350 аминокислот внеклеточного домена природного полипептида FGFR3). Полипептид sFGFR3 может иметь Ig-подобный домен C2-типа 1, 2 и/или 3 природного полипептида FGFR3. У полипептида sFGFR3, в частности, отсутствует сигнальный пептид и/или трансмембранный домен, такой как сигнальный пептид и/или трансмембранный домен природного полипептида FGFR3. Альтернативно, полипептид sFGFR3 представляет собой зрелый полипептид. Природный полипептид FGFR3 может иметь аминокислотную последовательность с номером доступа в GenBank № NP_000133.
Полипептид sFGFR3 может иметь 400 аминокислотных последовательностей или меньше внеклеточного домена природного полипептида FGFR3 (например, в диапазоне между 5 и 399 аминокислотных последовательностей, таких как 175, 150, 125, 100, 75, 50, 40, 30, 20, 15 или меньше аминокислотных последовательностей внеклеточного домена природного полипептида FGFR3). Полипептид sFGFR3 может иметь аминокислотную последовательность, имеющую по меньшей мере 90%, 92%, 95%, 97% или 99%-ную идентичность последовательности с аминокислотами 401-413 последовательности SEQ ID NO: 8 (например, полипептид sFGFR3 может иметь аминокислоты 401-413 последовательности SEQ ID NO: 8). В некоторых вариантах осуществления у полипептида sFGFR3 отсутствует тирозинкиназный домен природного полипептида FGFR3, отсутствует внеклеточный домен природного полипептида FGFR3 или его длина менее 475, 450, 425, 400, 375, 350, 300, 250, 200, 150 или 100 аминокислот. В других вариантах осуществления полипептид sFGFR3 имеет аминокислотную последовательность, имеющую по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности) с аминокислотными остатками 1-280 последовательности SEQ ID NO: 8. В еще других вариантах осуществления полипептид sFGFR3 имеет аминокислотную последовательность, имеющую по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности) с последовательностью из SEQ ID NO: 1-7. Полипептид sFGFR3 также может иметь сигнальный пептид, такой как сигнальный пептид природного полипептида FGFR3 (например, сигнальный пептид, имеющий аминокислотную последовательность SEQ ID NO: 21). Полипептид sFGFR3 также может иметь гетерологичный полипептид (например, фрагмент кристаллизуемого фрагмента иммуноглобулина (область Fc) или сывороточный альбумин человека (HSA)).
В других вариантах осуществления полинуклеотид, кодирующий полипептид sFGFR3, может иметь последовательность нуклеиновых кислот, имеющую по меньшей мере 85% и до 100%-ную идентичность последовательности с последовательностью нуклеиновых кислот любой из SEQ ID NO: 10-18 (например, полинуклеотид может состоять из последовательности нуклеиновых кислот любой из SEQ ID NO: 10-18). Полинуклеотид может быть выделенным полинуклеотидом и/или может быть в векторе (например, векторе, выбранном из группы, состоящей из плазмиды, искусственной хромосомы, вирусного вектора и фагового вектора). Вектор может быть в клетке-хозяине (например, выделенная клетка-хозяин, такая как клетка-хозяин от пациента, или клетка HEK 293 или клетка CHO). Клетка-хозяин также может быть трансформирована полинуклеотидом, кодирующим sFGFR3.
В других вариантах осуществления полипептид sFGFR3 связывается с фактором роста фибробластов (FGF), где FGF выбран из группы, включающей фактор роста фибробластов 1 (FGF1), фактор роста фибробластов 2 (FGF2), фактор роста фибробластов 9 (FGF9), фактор роста фибробластов 10 (FGF10), фактор роста фибробластов 18 (FGF18), фактор роста фибробластов 19 (FGF19), фактор роста фибробластов 21 (FGF21) и фактор роста фибробластов 23 (FGF23). Связывание с FGF может быть охарактеризовано равновесной константой диссоциации (Kd) от приблизительно 0,2 нм до приблизительно 20 нм, или Kd от приблизительно 1 нм до приблизительно 10 нм (например, Kd составляет приблизительно 1 нм, приблизительно 2 нм, приблизительно 3 нм, приблизительно 4 нм, приблизительно 5 нм, приблизительно 6 нм, приблизительно 7 нм, приблизительно 8 нм, приблизительно 9 нм или приблизительно 10 нм).
Один аспект лечения включает введение полипептида sFGFR3, полинуклеотида, кодирующего полипептид sFGFR3, или клетки-хозяина, содержащей полинуклеотид, кодирующий полипептид sFGFR3, пациенту, например, человеку, такому как «наивный» пациент, которого еще не лечили полипептидом sFGFR3). Полипептид sFGFR3 может быть введен в композиции, содержащей фармацевтически приемлемое эксципиент, носитель или разбавитель. Возможные дозы составляют от приблизительно 0,001 мг/кг до приблизительно 30 мг/кг (например, от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг). Введение может быть ежедневным, еженедельным или ежемесячным. Периодичность дозирования может составлять семь раз в неделю, шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, еженедельно, каждые две недели или один раз в месяц. Способ дозирования может быть подкожным, внутривенным, внутримышечным, внутриартериальным, интратекальным, внутрибрюшинным, парентеральным, энтеральным или местным. Может проводиться и повторное введение.
В других вариантах осуществления полипептид sFGFR3 имеет период полураспада in vivo в интервале между от приблизительно 2 часов до приблизительно 25 часов.
Вторым аспектом изобретения является композиция, содержащая растворимый полипептид рецептора фактора роста фибробластов 3 (sFGFR3), полинуклеотид, кодирующий полипептид sFGFR3, или клетку-хозяина, содержащую полинуклеотид, для лечения или уменьшения аномального распределения жира у пациента, нуждающегося в этом (например, у человек), например, в соответствии со способом первого аспекта изобретения.
Третьим аспектом изобретения является применение растворимого полипептида рецептора фактора роста фибробластов 3 (sFGFR3), полинуклеотида, кодирующего полипептид sFGFR3, или клетку-хозяина, содержащую полинуклеотид, кодирующий полипептид sFGFR3 при изготовлении лекарственного препарата для лечения или уменьшения аномального распределения жира у пациента, нуждающегося в этом (например, у человека), например, в соответствии со способом первого аспекта изобретения.
ОПРЕДЕЛЕНИЯ
В рамках изобретения, указание в единственном числе подразумевает «по меньшей мере один» или «один или более», если не указано иное. Кроме того, формы единственного числа включают множественные ссылки, если контекст явно не предписывает иное.
Фраза «аномальное отложение висцерального жира» относится к уровню отложения жира в сальнике, брыжейке, забрюшинном пространстве и перикарде, который превышает уровень отложения жира, наблюдаемый у нормального пациента, как определено антропометрическими методами или методами визуализации (см., например, «Methods of Diagnosis», ниже, где перечислены важные значения каждого метода определения порога, отличающего нормальное от анормального отложения висцерального жира). Например, пациентами с аномальным отложением висцерального жира являются такие, у которых величина отложений висцерального жира равна или превышает 10% (например, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 500%, 750%, 1000% или еще выше) предельного значения отложения висцерального жира по сравнению с нормальным пациентом. Обычно анормальное отложение висцерального жира связано с подгруппой пациентов с ожирением, например, пациентов с ИМТ >30 кг/м2. Аномальное отложение висцерального жира может быть результатом различных состояний. Они включают, например, синдромы задержки роста скелета (например, ахондроплазия), гиперкортицизм (например, болезнь Кушинга) и синдром поликистозных яичников.
В рамках изобретения термин «приблизительно» относится к количеству, которое составляет ±10% от указанного значения и, предпочтительно, составляет ±5% от указанного значения или, более предпочтительно, ±2% от указанного значения. Например, термин «приблизительно» может использоваться для изменения всех дозировок или диапазонов, указанных здесь, на ±10% от приведенных значений или конечных точек диапазона.
Фраза «антропометрические методы» относится к измерениям состава тела, основанным на росте, весе, окружности талии и окружности бедер, включая индекс массы тела (ИМТ), соотношении андроидных:гиноидных жиров, окружности талии и сагиттальном диаметре (SD); см., например, Shuster et al., Br. J. Radiol. 85(1009):1-10, 2012).
Фраза «сердечно-сосудистое заболевание» относится к заболеваниям сердца и кровеносных сосудов, в частности, к атеросклерозу, инфаркту миокарда и гипертензии.
Фраза «состояния, связанные с аномальным отложением висцерального жира» относится к заболеваниям, наблюдаемым у пациентов, у которых отложение висцерального жира показано аномальным по сравнению с нормальными пациентами. В частности, эти состояния включают сердечно-сосудистое заболевание, заболевание легких, нарушение обмена веществ, репродуктивное заболевание и неврологическое заболевание.
Термин «домен» относится к консервативной области аминокислотной последовательности полипептида (например, полипептида FGFR3), имеющей идентифицируемую структуру и/или функцию в полипептиде. Длина домена может варьировать от, например, приблизительно 20 аминокислот до приблизительно 600 аминокислот. Типичные домены включают иммуноглобулиновые домены FGFR3 (например, Ig-подобный домен C2-типа 1, Ig-подобный домен C2-типа 2 и Ig-подобный домен C2-типа 3), внеклеточный домен (ECD) FGFR3, внеклеточный домен (ICD) FGFR3 или трансмембранный домен (TM) FGFR3, такой как FGFR3, имеющий последовательность, представленную как SEQ ID NO: 8).
Термин «дозировка» относится к определенному количеству активного агента (например, полипептида sFGFR3 или его варианта, такой как полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, или его вариант, имеющий по меньшей мере от 85% до 100%-ную идентичность последовательности), рассчитанного на получение желаемого терапевтического эффекта (например, лечение аномального отложения висцерального жира или состояния, связанного с отложение висцерального жира), когда активный агент вводят пациенту (например, пациенту, имеющему аномальное отложение висцерального жира, или состояние, связанное с отложением висцерального жира). Дозировка может быть определена в терминах определенного количества активного агента или определенного количества в сочетании с определенной частотой введения. Дозированная форма может включать полипептид sFGFR3 или его фрагмент в сочетании с любым подходящим фармацевтическим наполнителем, носителем или разбавителем.
Термины «эффективное количество», «количество, эффективное для» и «терапевтически эффективное количество» относятся к количеству полипептида sFGFR3, вектора, кодирующего sFGR3, и/или композиции sFGFR3, достаточного для получения желаемого результата, например, для снижения анормального отложения жира, анормального отложения висцерального жира или уменьшения симптомов, ассоциируемых с состояниями, связанными с анормальным отложением висцерального жира.
Термины «внеклеточный домен» и «ECD» относятся к части полипептида FGFR3, которая выходит за пределы трансмембранного домена во внеклеточное пространство. ECD обеспечивает связывание FGFR3 с одним или несколькими факторами роста фибробластов (FGF). Например, ECD включает Ig-подобные домены C2-типа 1-3 полипептида FGFR3. В частности, ECD включает Ig-подобный домен 1 типа C2 полипептида FGFR3 дикого типа (wt), Ig-подобный домен 2 типа C2 полипептида FGFR3 дикого типа (wt) и/или Ig-подобный C2 домен 3 типа полипептида wt FGFR3. ECD FGFR3 также может включать, например, фрагмент IgG-подобного домена C2-типа FGFR3 дикого типа.
Фраза «отложение жира» относится к отложению висцерального жира или отложению подкожного жира.
Термин «болезнь костной системы, связанная с FGFR3», в рамках изобретения, относится к заболеванию скелета, которое вызвано аномальным увеличением активации FGFR3, такой как экспрессия мутанта с усилением функции FGFR3. Фраза «мутант с усилением функции FGFR3» относится к мутанту FGFR3, проявляющему биологическую активность, такую как запуск нисходящей передачи сигналов, которая выше, чем биологическая активность соответствующего FGFR3 дикого типа (например, полипептида, имеющего аминокислотную последовательность SEQ ID NO: 8) в присутствии лиганда FGF. Связанные с FGFR3 заболевания скелета могут включать наследственное или спорадическое заболевание. Типичные FGFR3-связанные заболевания скелета включают, но этим не ограничивается, ахондроплазию, танатофорную дисплазию типа I (TDI), танатофорную дисплазию типа II (TDII), тяжелую ахондроплазию с задержкой развития и черным акантозом (SADDAN), гипохондроплазию, синдром с краниосиностозом (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом) и камптодактилию, высокорослость и синдром потери слуха (CATSHL).
Термины «фактор роста фибробластов» и «FGF» относятся к члену семейства FGF, которое включает структурно связанные сигнальные молекулы, участвующие в различных метаболических процессах, включая эндокринные сигнальные пути, развитие, заживление ран и ангиогенез. FGF играют ключевую роль в пролиферации и дифференцировке широкого спектра типов клеток и тканей. Термин предпочтительно относится к FGF1, FGF2, FGF9, FGF 10, FGF18, FGF19, FGF21 и FGF23, которые демонстрируют связывание с FGFR3. Например, FGF могут включать FGF1 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 26), FGF2 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 27), FGF9 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 28), FGF10 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 40), FGF18 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 29), FGF19 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 30), FGF21 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 31) и FGF23 человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 41).
Термины «рецептор 3 фактора роста фибробластов», «FGFR3» или «рецептор FGFR3», используемые в данном документе, относятся к полипептиду, который специфически связывает один или более FGF (например, FGF1, FGF2, FGF9, FGF10, FGF18, FGF19, FGF 21 и/или FGF23). Ген FGFR3 человека, который расположен на дистальном коротком плече хромосомы 4, кодирует предшественника аминокислотного белка 806 (предшественник изоформы 1 рецептора фактора роста фибробластов 3), который содержит 19 экзонов и включает сигнальный пептид (например, полипептид имеющий аминокислотную последовательность SEQ ID NO: 21). Мутации в аминокислотной последовательности FGFR3, которые приводят к нарушениям роста скелета (например, ахондроплазии), включают, например, замену остатка глицина в положении 358 остатком аргинина (то есть G358R; SEQ ID NO: 9). Природный ген FGFR3 человека имеет нуклеотидную последовательность, показанную в базе генетических данных, номер доступа NM_000142.4, и природный белок FGFR3 человека имеет аминокислотную последовательность, показанную в базе генетических данных, номер доступа NP_000133, представленную в настоящем изобретении как SEQ ID NO: 8. FGFR3 дикого типа (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 8) состоит из внеклеточного иммуноглобулиноподобного мембранного домена, включающего в себя Ig-подобные домены С2-типа 1-3, трансмембранный домен и внутриклеточный домен. FGFR3 могут включать фрагменты и/или варианты (например, варианты сплайсинга, такие как варианты сплайсинга, использующие альтернативный экзон 8, а не экзон 9) полноразмерного FGFR3 дикого типа.
Термины «фрагмент» и «часть» относятся к части целого, такого как полипептид или молекула нуклеиновой кислоты, которые содержат, предпочтительно, по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более всей длины эталонной молекулы нуклеиновой кислоты или полипептида или их домена (например, ECD, ICD или TM полипептида sFGFR3). Фрагмент или часть могут содержать, например, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 500, 600, 700 или больше последовательностей аминокислотных остатков, до всей длины эталонного полипептида. Например, фрагмент FGFR3 может включать любой полипептид, имеющий по меньшей мере от приблизительно 5 последовательностей аминокислот до приблизительно 300 последовательностей аминокислот, включая конечные точки, например, по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295 или 300 последовательностей аминокислот любой из SEQ ID NO: 1-8.
Фраза «нарушение регуляции глюкозы» относится к уровню глюкозы в крови выше или ниже приемлемого нормального уровня.
В рамках изобретения, термин «клетка-хозяин» относится к несущей среде, которая включает необходимые клеточные компоненты, например, органеллы, необходимые для экспрессии полипептида sFGFR3 из соответствующего полинуклеотида. Последовательность нуклеиновых кислот полинуклеотида обычно включена в вектор нуклеиновой кислоты (например, плазмиду, искусственную хромосому, вирусный вектор или фаговый вектор), который может быть введен в клетку-хозяина обычными способами, известными в данной области (например, трансформацией, трансфекцией, электропорацией, осаждением фосфата кальция и прямой микроинъекцией). Клеткой-хозяином может являться прокариотическая клетка, например, бактериальная или архейная клетка, или эукариотическая клетка, например, клетка млекопитающего (например, клетка яичника китайского хомячка (СНО) или человеческие эмбриональные клетки почек 293 (НЕК 293)). Предпочтительно, клетка-хозяин представляет собой клетку млекопитающего, такую как клетка СНО.
Фраза «методы визуализации» относится к методам создания визуальных представлений о внутренней части тела с целью клинического анализа и медицинского вмешательства. Примеры методов визуализации включают, например, двухэнергетическую рентгеновскую абсорбциометрию (DXA), дающую индекс жировой массы, визуализацию в поперечном сечении, такую как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), получая площадь висцерального жира в см2 на заданном уровне поясничного отдела позвоночника (см., например, Shuster et al., выше).
Фраза «нарушение регуляции секреции инсулина» относится к уровню инсулина в крови, который находится выше или ниже приемлемого нормального диапазона.
Термин «выделенный» означает отделенный, извлеченный или очищенный от его естественной среды. Например, выделенный полипептид sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, или его вариант, имеющий по меньшей мере от приблизительно 85% до вплоть до приблизительно 100% идентичности последовательности) может быть охарактеризован определенной степенью чистоты после выделения полипептида sFGFR3, например, из среды для культивирования клеток. Выделенный полипептид sFGFR3 может иметь чистоту, по меньшей мере, 75%, так что полинуклеотид sFGFR3 составляет, по меньшей мере, 75 мас.% от всех веществ (например, полипептиды, полинуклеотиды, клеточный дебрис и загрязнители окружающей среды), присутствующих в препарате (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 99% или по меньшей мере 99,5% по массе от всех веществ, присутствующих в препарате). Подобным образом, выделенный полинуклеотид, кодирующий полипептид sFGFR3 (например, полинуклеотид, имеющий последовательность нуклеиновых кислот любой из SEQ ID NO: 10-18, или его вариант, имеющий идентичность последовательности по меньшей мере от приблизительно 85% до приблизительно 100%), или выделенная клетка-хозяин (например, клетка CHO, клетка HEK 293, клетка L, клетка C127, клетка 3T3, клетка BHK, клетка COS-7 или клетка пациента), содержащая полинуклеотид, может быть по меньшей мере 75% чистоты, так что полинуклеотид или клетка-хозяин составляют, по меньшей мере, 75 мас.% от всех веществ (например, полипептиды, полинуклеотиды, клеточный дебрис и загрязнители окружающей среды), присутствующих в препарате (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 99%, или по меньшей мере 99,5% по массе от всех веществ, присутствующих в препарате).
Выражение «нарушение обмена веществ» относится к нарушениям химических реакций, которые помогают при переработке энергии, в частности, к дислипидемии, нарушению регуляции секреции инсулина, нарушению регуляции глюкозы, неалкогольному жировому гепатозу и гепатотоксичности.
Выражение «неврологические заболевание» относится к заболеваниям мозга или нервов, в частности, к деменции и инсульту.
Термины «парентеральное введение», «вводимый парентерально» и другие грамматически эквивалентные фразы, используемые в настоящем изобретении, относятся к способу введения композиций, включающих полипептид sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7 (с сигнальным пептидом или без него), кроме энтерального и местного введения, обычно путем инъекций, и включают, без ограничения, подкожные, внутрикожные, внутривенные, интраназальные, внутриглазные, пульмональные, внутримышечные, внутриартериальные, интратекальные, внутрикапсульные, интраорбитальные, внутрисердечные, внутрикожные, внутрилегочные, внутрибрюшинные, транстрахеальные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные, интрацеребральные, внутричерепные, интракаротидные и интрастернальные инъекцию и инфузию.
Термины «лицо» и «пациент» относятся к млекопитающему, включая, но этим не ограничиваясь, человека (например, человека, имеющего аномальное отложение жира, аномальное отложение висцерального жира или состояния, связанные с аномальным отложением висцерального жира), или к млекопитающему не человеку (например, млекопитающему не человеку, имеющему аномальное отложение жира, аномальное отложение висцерального жира или состояния, связанные с аномальным отложением висцерального жира, например, крупный рогатый скот, лошади, собаки, овцы или кошки. Предпочтительно, пациентом является человек, имеющий аномальное отложение жира, аномальное отложение висцерального жира или состояния, связанные с аномальным отложением висцерального жира), в частности, плод, новорожденный, младенец, ребенок, подросток или взрослый, имеющий аномальное отложение жира, аномальное отложение висцерального жира или состояния, связанные с аномальным отложением висцерального жира.
Под «фармацевтической композицией» подразумевается композиция, содержащая активный агент, такой как sFGFR3, в составе по меньшей мере с одним фармацевтически приемлемым инертным вспомогательным веществом, носителем или разбавителем. Фармацевтическая композиция может быть изготовлена или продана с одобрения государственного регулирующего органа как часть терапевтической схемы лечения заболевания или события (например, аномальное отложение жира, аномальное отложение висцерального жира или состояния, связанные с аномальным отложением висцерального жира) у пациента (например, пациента, имеющего аномальное отложение жира, аномальное отложение висцерального жира или состояния, связанные с аномальным отложением висцерального жира). Фармацевтические композиции могут быть составлены, например, для парентерального введения, такого как подкожное введение (например, подкожная инъекция) или внутривенное введение (например, в виде стерильного раствора, не содержащего эмболы в виде частиц, и в системе растворителей, подходящих для внутривенного введения), или пероральное введение (например, в виде таблетки, капсулы, капсулы, желатиновой капсулы или сиропа).
Под «фармацевтически приемлемым разбавителем, инертным вспомогательным веществом, носителем или адъювантом» подразумевается разбавитель, эксципиент, носитель или адъювант, соответственно, которые являются физиологически приемлемыми для пациента (например, человека) при сохранении терапевтических свойств фармацевтической композиции (например, полипептида sFGFR3 или его варианта), в которой его вводят. Одним примером фармацевтически приемлемого носителя является физиологический раствор. Другие физиологически приемлемые разбавители, инертные вспомогательные вещества, носители или адъюванты и их составы известны специалисту в данной области.
«Полинуклеотид» и «молекула нуклеиновой кислоты», используемые в настоящем изобретении взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами или любым субстратом, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы или с помощью синтетической реакции. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если она имеется, модификация нуклеотидной структуры может быть придана до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после синтеза, например, путем конъюгации с меткой.
Фраза «заболевание легких» относится к заболеваниям нарушения вентиляции, в частности, обструктивное апноэ во сне, рестриктивная болезнь легких и астма.
Фраза «репродуктивное заболевание» относится к заболеваниям репродуктивной системы, в частности, бесплодие и нарушение менструального цикла.
В рамках изобретения, термин «идентичность последовательности» относится к процентному содержанию аминокислотных (или нуклеиновых) остатков последовательности-кандидата, например, полипептида FGFR3, которые идентичны аминокислотным (или нуклеиновым) остаткам эталонной последовательности, например, полипептида sFGFR3 дикого типа (например, полипептида, имеющего аминокислотную последовательность SEQ ID NO: 8) или полипептида sFGFR3 (например, полипептида sFGFR3 или его варианта, такого как полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7), после выравнивания последовательностей и введения гэпов, если необходимо, для достижения максимальной процентной идентичности (например, гэпы могут быть введены в один или оба кандидата, и эталонные последовательности для оптимального выравнивания и негомологичные последовательности могут быть проигнорированы в целях сравнения). Выравнивание в целях определения процента идентичности может быть достигнуто различными способами, которые известны специалисту в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL или Megalign (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Например, процент идентичности аминокислотной (или нуклеиновой) последовательности данной последовательности-кандидата с данной эталонной последовательностью или против нее (которую можно альтернативно сформулировать как данную последовательность-кандидат, которая имеет или включает определенный процент идентичности последовательности аминокислот (или нуклеиновых кислот) с данной эталонной последовательностью или против нее) рассчитывается следующим образом: 100×(фракция A/B), где A обозначает количество остатков аминокислот (или нуклеиновых кислот), оцененных как идентичные при выравнивании последовательности-кандидата и эталонной последовательности, и где B обозначает общее число остатков аминокислот (или нуклеиновых кислот) в эталонной последовательности. В частности, эталонная последовательность, выровненная для сравнения с последовательностью-кандидатом, может показать, что последовательность-кандидат демонстрирует, например, от 50% до 100% идентичности по всей длине последовательности-кандидата или выбранной части остатков заменимой аминокислоты (или нуклеиновой кислоты) последовательности-кандидата. Длина последовательности-кандидата, выровненной для целей сравнения, составляет по меньшей мере 30%, например, по меньшей мере 40%, например, по меньшей мере 50%, 60%, 70%, 80%, 90% или 100% длины эталонной последовательности. Когда положение в последовательности-кандидате занято тем же аминокислотным (или нуклеиновым) остатком, что и соответствующее положение в эталонной последовательности, то молекулы в этом положении идентичны.
Под «сигнальным пептидом» подразумевается короткий пептид (например, длиной 5-30 аминокислот, например, длиной 22 аминокислоты) на N-конце полипептида, который направляет полипептид по секреторному пути (например, в экстрацеллюлярное пространство). Сигнальный пептид обычно расщепляется во время секреции полипептида. Сигнальная последовательность может направлять полипептид во внутриклеточный компартмент или органеллу, например, аппарат Гольджи. Сигнальная последовательность может быть идентифицирована по гомологии или биологической активности с пептидом с известной функцией нацеливания полипептида на конкретную область клетки. Специалист в данной области может идентифицировать сигнальный пептид с помощью легкодоступного программного обеспечения (например, пакета программного обеспечения для анализа последовательностей Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705, BLAST, или программ PILEUP/PRETTYBOX). Сигнальный пептид может быть таким, который, например, практически идентичен аминокислотной последовательности SEQ ID NO: 21.
Термин «нарушение задержки роста скелета», в рамках изобретения, относится к заболеванию скелета, характеризующемуся деформациями и/или пороками развития костей. Эти расстройства включают, но ими не ограничиваются, нарушения задержки роста скелета, вызванные разрушениями росткового эпифизарного хряща, идиопатические нарушения задержки роста скелета или связанные с FGFR3 заболевания скелета. В частности, пациент имеющий нарушение задержки роста скелета (например, ахондроплазию), может иметь кости, которые короче, чем кости у здорового пациента. Например, нарушение задержки роста скелета может включать скелетную дисплазию, например, ахондроплазию, гомозиготную ахондроплазию, гетерозиготную ахондроплазию, ахондрогенез, акродизостоз, акромезомелическую дисплазию, ателостеогенез, кампомелическую дисплазию, точечную эпифизарную дисплазию, ризомелический тип точечной эпифизарной дисплазии, клейдокраниальный дизостоз, короткую врожденную бедренную кость, краниосиностоз (например, синдром Мюнке, синдром Крузона, синдром Аперта, синдром Джексона-Вайса, синдром Пфайфера или синдром Крузона с черным акантозом), дактилию, брахидактилию, камптодактилию, полидактилию, синдактилию, диастрофическую дисплазию, карликовость, диссегментарную дисплазию, энхондроматоз, фиброхондрогенез, фиброзную дисплазию, наследственные множественные экзостозы, гипохондроплазию, гипофосфатазию, гипофосфатемический рахит, синдром Яффе-Лихтенштейна, дисплазию Книста, синдром Книста, мезомелическую дисплазию типа Лангера, синдром Марфана, синдром Мак-Кьюна-Олбрайта, микромелию, метафизарную дисплазию, метафизарную дисплазию типа Янсена, метатропическую дисплазию, синдром Моркио, мезомелическую дисплазию Нивергельта, нейрофиброматоз, остеоартроз, остеохондродисплазию, несовершенный остеогенез, перинатальный летальный тип несовершенного остеогенеза, остеопетроз, остеопойкилию, периферический дизостоз, синдром Рейнхардта, синдром Робертса, синдром Робинова, cиндром коротких ребер-полидактилии, низкорослость, врожденную спондилоэпифизарную дисплазию и спондилоэпифизарную дисплазию.
Термины «растворимый рецептор фактора роста фибробластов 3», «растворимый FGFR3» и «sFGFR3» относятся к FGFR3, который характеризуется отсутствием или функциональным нарушением всего или значительной части трансмембранного домена и любой полипептидной части, которая могла бы связать полипептид FGFR3 с клеточной мембраной (например, тирозинкиназный домен). Полипептид sFGFR3 является не мембраносвязанной формой полипептида FGFR3. Таким образом, полипептид sFGFR3 может включать делецию части или всех аминокислотных остатков трансмембранного домена полипептидной последовательности FGFR3 дикого типа (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 8). Полипептид sFGFR3 может дополнительно включать делеции внутриклеточного домена полипептида FGFR3 дикого типа.
Примеры полипептидов sFGFR3 могут включать, но этим не ограничиваются, по меньшей мере аминокислоты 1-100, 1-125, 1-150, 1-175, 1-200, 1-205, 1-210, 1-215, 1-220, 1-225, 1-230, 1-235, 1-240, 1-245, 1-250, 1-252, 1-255, 1-260, 1-265, 1-270, 1-275, 1-280, 1-285, 1-290, 1-295 или 1-300 или 1-301 последовательностей SEQ ID NO: 1-8. Полипептиды sFGFR3 могут включать любой полипептид, имеющий по меньшей мере 50%-ную (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентичность последовательности с любым из этих полипептидов sFGFR3 последовательностей SEQ ID NO: 1-8. Кроме того, примеры полипептидов sFGFR3 могут включать, но этим не ограничиваются, по меньшей мере аминокислоты 1-100, 1-125, 1-150, 1-175, 1-200, 1-205, 1-210, 1-215, 1-220, 1-225, 1-230, 1-235, 1-240, 1-245, 1-250, 1-255, 1-260, 1-265, 1-270, 1-275, 1-280, 1-285, 1-290, 1-295, 1-300, 1-305, 1-310, 1-315, 1-320, 1-325, 1-330, 1-335, 1-340, 1-345 или 1-348 последовательностей SEQ ID NO: 1-8. Полипептиды sFGFR3 могут включать любой полипептид, имеющий по меньшей мере 50%-ную (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентичность последовательности с любым из этих полипептидов sFGFR3, имеющих аминокислотные последовательности SEQ ID NO: 1-8. Любые из вышеуказанных полипептидов sFGFR3 или их варианты необязательно могут включать сигнальный пептид в N-концевом положении, такой как аминокислоты 1-22 последовательности SEQ ID NO: 21 (MGAPACALALCVAVAIVAGASS) или аминокислоты 1-19 последовательности SEQ ID NO: 43 (например, MMSFVSLLLVGILFHATQA).
Фраза «отложение подкожного жира» относится к отложению жира в гиподерме.
Под «лечением» и «излечением» понимается уменьшение (например, по меньшей мере на приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 99% или даже 100%) аномального отложения жира или аномального отложения висцерального жира, или прогрессии, тяжести или частоты одного или нескольких состояний, связанных с аномальным отложением висцерального жира (например, сердечно-сосудистое заболевание, заболевание легких, нарушение обмена веществ или неврологическое заболевание) у пациента (например, человека, такого как плод, новорожденный, младенец, ребенок, подросток или взрослый). Лечение может происходить в течение периода, при котором полипептид sFGFR3 вводят в течение периода времени (например, дни, месяцы, годы или дольше) для лечения пациента (например, человека, такого как плод, новорожденный, младенец, ребенок, подросток или взрослый), имеющего аномальное отложение жира, аномальное отложение висцерального жира или состояние, связанное с аномальное отложение висцерального жира. Типичные симптомы, связанные с аномальным отложением висцерального жира при ахондроплазии, которую можно лечить sFGFR3 (например, полипептидом sFGFR3 или его вариантом, таким как полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1-7, или его вариант) включают, но не ограничиваются ими, атеросклероз, гипертензию, нарушение регуляции липидного обмена, обструктивное апноэ во сне, нарушение регуляции глюкозы или нарушение регуляции секреции инсулина (например, резистентность к инсулину). Примеры симптомов, связанных с аномальным отложением висцерального жира у пациента с ахондроплазией, которые можно лечить с помощью sFGFR3 (например, полипептидом sFGFR3 или его вариантами, таким как полипептид, имеющий аминокислотные последовательности SEQ ID NO: 1-7, или его варианты), включают, но этим не ограничиваются, атеросклероз, гипертензию, нарушение регуляции липидного обмена, обструктивное апноэ во сне, нарушение регуляции глюкозы или нарушение регуляции секреции инсулина (например, резистентность к инсулину).
Термин «стандартная лекарственная форма(ы)» относится к физически дискретной единице (единицам), подходящей в качестве разовой дозы для человека и других млекопитающих, причем каждая единица содержит заранее определенное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с любым подходящим фармацевтическим инертным вспомогательным веществом, носителем или разбавителем.
Термин «вариант» в отношении полипептида относится к полипептиду (например, полипептиду sFGFR3 или его варианту с сигнальным пептидом или без него), который одним или несколькими изменениями в аминокислотной последовательности отличается от полипептида, из которого вариант является производным (например, эталонный полипептид, такой как, например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7). Термин «вариант» в отношении полинуклеотида относится к полинуклеотиду, который одним или несколькими изменениями в последовательности нуклеиновых кислот отличается от полинуклеотида, из которого получен вариант (например, эталонный полинуклеотид, такой как, например, полинуклеотид, кодирующий полипептид sFGFR3, имеющий последовательность нуклеиновых кислот любой из SEQ ID NO: 10-18). Изменения в последовательности аминокислот или нуклеиновых кислот варианта могут быть, например, заменами аминокислот, нуклеиновых кислот, вставками, делециями, N-концевыми усечениями или С-концевыми усечениями или любой их комбинацией. В частности, аминокислотные замены могут быть консервативными и/или неконсервативными заменами. Вариант может характеризоваться идентичностью аминокислотной последовательности или идентичностью последовательности нуклеиновых кислот с эталонным полипептидом или исходным полинуклеотидом, соответственно. Например, вариант может включать любой полипептид, имеющий по меньшей мере 50%-ную (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%-ную или более) идентичность последовательности с эталонным полипептидом или полинуклеотидом.
Под «вектором» подразумевается конструкция ДНК, которая включает один или более полинуклеотидов или их фрагментов, кодирующих полипептид sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, или его варианты, с сигнальным пептидом или без него). Вектор может быть использован для инфицирования клетки (например, клетки-хозяина или клетки пациента с нарушением задержки роста скелета человека, таким как ахондроплазия), что приводит к трансляции полинуклеотидов вектора в полипептид sFGFR3. Одним типом вектора является «плазмида», которая относится к кольцевой двухцепочечной петле ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный источник репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэпизомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина и, таким образом, реплицируются вместе с геномом-хозяином. Более того, некоторые векторы способны направлять экспрессию генов, с которыми они оперативно связаны. Как правило, векторы экспрессии, используемые в методах рекомбинантных ДНК, часто находятся в форме плазмид.
Фраза «отложение висцерального жира» относится к внутрибрюшным жировым депо, включая брыжеечные и сальниковые, забрюшинные жировые отложения и внутригрудные жировые отложения, в том числе перикардиальные.
Перечисление в настоящем изобретении числовые диапазоны по конечным точкам предназначены для включения всех чисел, отнесенных к этому диапазону (например, указание от 1 до 5 включает 1, 1,5, 2, 2,75, 3, 3,80, 4 и 5).
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Документы патента или заявки содержат как минимум одну фигуру, выполненную в цвете. Копии этого патента или публикации патентной заявки с цветными фигурами будут предоставлены офисом по запросу и уплате необходимой пошлины.
На ФИГ. 1А-1D представлены таблицы, изображения и графики, показывающие, что у детей с ахондроплазией развивается абдоминальное ожирение без повышения уровня глюкозы в крови. ФИГ. 1A представляет собой таблицу, показывающую измерения веса, роста и ИМТ и соответствующие z-показатели роста к возрасту и ИМТ к возрасту в трех возрастных группах (n=73 точки данных в группе [0-3] года, n=61 точка данных в группе [4-8] лет и n=36 точек данных в группе [9-18] лет). Результаты последующего анализа: a: значительно различаются между [0-3] и [4-8] группами; b: значительно различаются между группами [0-3] и [9-18]; c: значительно различаются между группами [4-8] и [9-18]. ФИГ. 1B является изображением различных интересующих областей (ROI), оцененных с помощью DXA. ФИГ. 1C представляет собой график, показывающий измерение соотношения андроидного:гиноидного жира в трех возрастных группах (n=4 точки данных в группе [0-3] года, n=6 точек данных в группе [4-8] лет и n=9 точек данных в группе [9-18] лет). ФИГ. 1D представляет собой график, показывающий плазменную концентрацию глюкозы натощак в двух возрастных группах в возрасте [4-8] и [9-18] лет (n=16 точек данных в группе [4-8] лет и n=12 точек данных в группе [9-18 лет). Горизонтальные линии представляют нормальные значения. Данные представлены как среднее значение±SD, **р <0,01, ***р <0,001.
На ФИГ. 2A-2H представлены графики и изображения, показывающие, что у трансгенных мышей Fgfr3ach/+ преимущественно развивается висцеральное ожирение, которое предотвращается при обработке sFGFR3 (SEQ ID NO: 1). ФИГ. 2А представляет собой график, показывающий массу тела мышей WT и Fgfr3ach/+, обработанных несущей средой, и мышей Fgfr3ach/+, обработанных sFGFR3, после 10 недель потребления ND или HFD. На ФИГ. 2B представлены изображения и график, показывающий соотношение абдоминальных нежировой массы и жира. На ФИГ. 2C представлен график, показывающий массу эпидидимальной жировой ткани (eAT). На ФИГ. 2D представлен график, показывающий массу подкожной жировой ткани (scAT) на грамм массы тела. На ФИГ. 2E представлен график, показывающий площадь адипоцитов scAT. На ФИГ. 2F представлен график, показывающий площадь eAT адипоцитов. На ФИГ. 2G представлен график рассеяния адипоцитов в зависимости от их диаметра. Данные представлены в виде среднего +/- стандартного отклонения (n=8-10 мышей в каждой группе). Данные соответствовали нормальному распределению. *p <0,05, **p <0,01, ***p <0,001 в зависимости от WT, обработанных несущей средой, #p <0,05, ##p <0,01 в сравнении с Fgfr3ach/+, обработанных несущей средой; t-критерий Стьюдента. На ФИГ. 2H представлен график, показывающий eAT-рассеяние адипоцитов в соответствии с их диаметром. Данные представлены как среднее значение+/-стандартное отклонение (n=8-10 мышей в каждой группе). Данные соответствовали нормальному распределению. *p <0,05, **p <0,01, ***p <0,001 в зависимости от WT, обработанных несущей средой, #p <0,05, ##p <0,01 в сравнении с Fgfr3ach/+, обработанных несущей средой; t-критерий Стьюдента.
На ФИГ. 3A-3B представлены графики, показывающие, что МСК, выделенные от необработанных или обработанных sFGFR3 мышей Fgfr3ach/+, демонстрируют предварительное участие в адипогенезе без изменения ответа на инсулин по сравнению с мышами WT. На ФИГ. 3A представлен график, показывающий экспрессию генов, участвующих в различных стадиях дифференциации адипогенеза (гены, перечисленные в таблице 1). Экспрессия была нормализована к экспрессии HPRT, RPL6 и RPL13a и выражена в процентах изменения по сравнению с WT. На ФИГ. 3B представлены графики, показывающие результаты клеток, стимулированных 50 нМ инсулина в течение 0, 5, 15 или 30 мин или 0, 1, 10, 50 или 100 нМ инсулина в течение 5 мин. Экспрессию P-Erk1/2, нормализованную к общей экспрессии Erk1/2, выражали как нормализованное значение к WT. Данные представлены как среднее значение±стандартное отклонение. Данные соответствовали нормальному распределению. *p <0,05, **p <0,01, ***p <0,001 по сравнению с WT, обработанных несущей средой, #p <0,05, ##p <0,01 по сравнению с Fgfr3ach/+, обработанных несущей средой. Двухфакторный дисперсионный анализ с множественным критерием Тьюки.
На ФИГ. 4A-4E представлены графики и микроскопические изображения, показывающие, что метаболизм глюкозы изменен у трансгенных мышей Fgfr3ach/+ и восстановлен обработкой sFGFR3. На ФИГ. 4A представлен график, показывающий гликемию и инсулинемию натощак у мышей после 10 недель ND. На ФИГ. 4B представлен график, показывающий гликемию и инсулинемию натощак у мышей после 10 недель HFD. На ФИГ. 4C показаны графики результатов теста на толерантность к глюкозе HFD; уровни глюкозы были нормализованы до значения времени -15 мин и площади под кривой, соответствующей каждой группе мышей. На ФИГ. 4D впервые показана микроскопия содержания инсулина поджелудочной железы у мышей (иммуногистохимия срезов в парафине, красный: инсулин; зеленый: глюкоза; синий: окрашивание DAPI). На ФИГ. 4D также показан график содержания инсулина поджелудочной железы у мышей, среднего значения островков поджелудочной железы, нормализованного к общей поверхности, и среднего числа островков в каждой группе в состоянии HFD. На ФИГ. 4E показана микроскопия H&E печени и окрашивания PAS в условиях HFD. На ФИГ. 4F показана микроскопия окрашивания H&E печеночных узелков. Данные представлены в виде среднего значения±стандартное отклонение (n=8-10 мышей для каждой группы). Данные соответствовали нормальному распределению. **p <0,01, ***p <0,001 в зависимости от WT, обработанных несущей средой, #p <0,05, ##p <0,01 в сравнении с Fgfr3ach/+, обработанных несущей средой; t-критерий Стьюдента.
На ФИГ. 5A-5D представлены графики, показывающие, что необработанные трансгенные мыши Fgfr3ach/+ получают практически всю свою энергию из липидов. На ФИГ. 5А показан показатель базального дыхания (RQ=VCO2/VO2) в течение ночных или дневных периодов голодания и кормления после 10 недель потребления ND. На ФИГ. 5В показано окисление основного углевода и липидов у мышей WT и Fgfr3ach/+, потреблявших ND. На ФИГ. 5C показан показатель базального дыхания (RQ=VCO2/VO2) в течение ночных или дневных периодов голодания и кормления после 10 недель потребления HFD. На ФИГ. 5D показано базальное окисление углеводов и липидов у мышей WT и Fgfr3ach/+, потреблявших HFD. Данные представлены в виде среднего значения±стандартное отклонение (n=8-10 мышей для каждой группы). Данные соответствовали нормальному распределению. **p <0,01, ***p <0,001 в зависимости от WT, обработанных несущей средой, #p <0,05, ##p <0,01 в сравнении с Fgfr3ach/+, обработанных носителем; t-критерий Стьюдента.
На ФИГ. 6А-6В представлены графики, показывающие циркулирующие адипокины, изученные в сыворотке необработанных или обработанных sFGFR3 мышей Fgfr3ach/+. На ФИГ. 6А представлен график, показывающий результаты для мышей, потреблявших ND. На ФИГ. 6В представлен график, показывающий результаты для мышей, потреблявших HFD. Результаты были выражены в процентах изменения по сравнению с WT. AgRP, агутирилированный белок; ANGPT-L3, ангиопоэтин-3; CRP, С-реактивный белок; DPPIV, дипептидилпептидаза V; FGF, фактор роста фибробластов; HGF, фактор роста гепатоцитов; ICAM-1, молекула межклеточной адгезии-1; IGF, инсулиноподобный фактор роста; IGFBP, белок, связывающий инсулиноподобный фактор роста; МСР-1, моноцитарный хемотактический белок 1; M-CSF, колониестимулирующий фактор макрофагов; Pref-1, преадипоцитарный фактор 1; RAGE, конечный продукт усиленного гликозилирования; RANTES, рецептор при активации, нормальные Т-клетки экспрессированные и секретирорванные; RBP4, белок, связывающий ретинол; TIMP-1, тканевой ингибитор металлопротеиназ; VEGF, фактор роста сосудистого эндотелия.
На ФИГ. 7А-7Н представлены графики, показывающие, что у трансгенных мышей с ахондроплазией были нормальные энергетические затраты, совокупная активность и совокупное выращивание во время непрямой калориметрии. На ФИГ. 7А показано базальное потребление кислорода в течение ночных или дневных периодов голодания и кормления у мышей WT и Fgfr3ach/+, потреблявших ND. На ФИГ. 7В показана выработка базальной двуокиси углерода в течение ночных или дневных периодов голодания и кормления у мышей WT и Fgfr3ach/+, потреблявших ND. На ФИГ. 7C показан расход основной энергии во время ночных или дневных периодов голодания и кормления у мышей WT и Fgfr3ach/+, потреблявших ND. На ФИГ. 7D показана базальные совокупные активность и выращивание у мышей WT и Fgfr3ach/+, потреблявших ND. На ФИГ. 7Е показано базальное потребление кислорода в течение ночных или дневных периодов голодания и кормления у мышей WT и Fgfr3ach/+, потреблявших HFD. На ФИГ. 7F показана продукция основного диоксида углерода в течение ночных или дневных периодов голодания и кормления у мышей WT и Fgfr3ach/+, потреблявших HFD. На ФИГ. 7G показан расход основной энергии во время ночных или дневных периодов голодания и кормления у мышей WT и Fgfr3ach/+, потреблявших HFD. На ФИГ. 7H показаны базальные совокупные активность и выращивание у мышей WT и Fgfr3ach/+, потреблявших HFD. Данные представлены в виде среднего значения±стандартное отклонение (n=8-10 мышей для каждой группы). Данные следовали нормальному распределению. **p <0,01, ***p <0,001 по сравнению с обработанными носителем WT, ###p <0,001 по сравнению с обработанными носителем Fgfr3ach/+; t-критерий Стьюдента.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что растворимые полипептиды и полинуклеотиды рецептора фактора роста фибробластов 3 (sFGFR3), кодирующие полипептиды sFGFR3, и их варианты, можно использовать для лечения аномального отложения висцерального жира у пациента (например, человека, в частности, плода, новорожденного, ребенка, подростка и взрослого), нуждающегося в этом. В частности, полипептиды sFGFR3, которые можно использовать в способах лечения, описанных в настоящем изобретении, включают полипептиды, имеющие аминокислотную последовательность любой из SEQ ID NO: 1-7, и их варианты, имеющие идентичность последовательности по меньшей мере 85%. В способах лечения также можно вводить полинуклеотиды, кодирующие полипептиды sFGFR или клетки, содержащие полинуклеотиды.
Способы лечения
Изобретение относится к способам лечения пациента, имеющего аномальное отложение висцерального жира и состояния, связанные с аномальным отложением висцерального жира. В частности, пациент может иметь повышенные индекс массы тела, сагиттальный диаметр живота, соотношение андроидных:гиноидных жиров, индекс жировой массы и площадь висцерального жира. Пациент также может иметь синдром задержки роста скелета, например, ахондроплазию, танатофорную дисплазию типа I (TDI), танатофорную дисплазию типа II (TDII), тяжелую ахондроплазию с задержкой развития и черным акантозом (SADDAN), гипохондроплазию и синдромы с краниосиностозом (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом, камптодактилию, высокорослость и синдром потери слуха (CATSHL). Это может быть в случае, когда у пациента имеется синдром задержки роста скелета и состояние, связанное с аномальным отложением висцерального жира (например, атеросклероз, гипертензия, инфаркт миокарда, дислипидемия, апноэ во сне, рестриктивная болезнь легких, астма, деменция, нарушение регуляции секреции инсулина (например, резистентность к инсулину), нарушение регуляции метаболизма глюкозы, бесплодие, нарушения менструального цикла, инсульт и деменция).
Альтернативно, пациент может быть таким, у которого не имеется синдрома задержки роста скелета, но у него имеется состояние, которое приводит к аномальному отложению висцерального жира (например, ожирение, синдром поликистозных яичников и гиперкортицизм (например, болезнь Кушинга)). Например, пациент может иметь аномальное отложение висцерального жира и состояние, связанное с аномальным отложением висцерального жира (например, атеросклероз, гипертензия, инфаркт миокарда, дислипидемия, апноэ во сне, рестриктивная болезнь легких, астма, деменция, нарушение регуляции секреции инсулина (например, резистентность к инсулину), нарушение регуляции метаболизма глюкозы, бесплодие, нарушения менструального цикла, инсульт и деменция). Способ также может включать введение sFGFR3 для лечения пациента с аберрантной передачей сигналов FGF10, например, пациента, страдающего болезнью Кушинга, вызванной дисфункцией гипофиза.
Пациент также может быть охарактеризован как имеющий отложение висцерального жира, окружающее один или более из следующих органов или связанный с ним: сердце, печень, селезенка, почки, поджелудочная железа, кишечник, репродуктивные органы и желчный пузырь.
Способ включает введение полипептида sFGFR3 по изобретению, например, описанного в настоящем изобретении, пациенту, имеющему аномальное отложение висцерального жира. Пациентом может являться плод, новорожденный, младенец, ребенок, подросток или взрослый, имеющий риск развития аномальных отложений жира в брюшной полости. Пациент также может иметь синдром задержки роста скелета (например, ахондроплазию), ожирение, гиперкортицизм (например, болезнь Кушинга) или синдром поликистозных яичников. Пациент (например, человек) может проходить лечение до появления сигналов и симптомов аномального отложения висцерального жира. В частности, пациенты, которые могут быть подвергнуты лечению с помощью полипептида sFGFR3 по изобретению, описанного в настоящем изобретении, являются теми, у которых проявляются такие симптомы как, включая, но этим не ограничиваясь, аномальный индекс жировой массы, аномальная площадь висцерального жира, повышенный ИМТ, увеличенная окружность талии, увеличенный сагиттальный диаметр и увеличенное соотношение андроидных:гиноидных жиров. Кроме того, пациенты, которых можно лечить с помощью полипептида sFGFR3, имеют аномальное распределение висцерального жира и состояния, связанные с аномальным отложением висцерального жира (например, метаболические, сердечно-сосудистые, легочные, репродуктивные или неврологические заболевания). Кроме того, лечение с помощью полипептида sFGFR3 может привести к улучшению одного или нескольких из вышеупомянутых симптомов, связанных с аномальным отложением висцерального жира (например, в сравнении с пациентом, которого не лечили). Перед введением полипептида sFGFR3 у пациента (например, человека) может быть диагностировано аномальное отложение висцерального жира, например, у пациента с синдромом задержки роста скелета (например, ахондроплазия), ожирением, гиперкортицизмом (например, болезнь Кушинга) и синдромом поликистозных яичников. Помимо этого пациент, имеющий аномальное отложение висцерального жира, может быть пациентом, который ранее не проходил лечение полипептидом sFGFR3.
Пациент, которого можно лечить с помощью полипептида sFGFR3, также может быть пациентом, страдающим диабетом или имеющим риск развития диабета, например, пациентом с ожирением. Лечение этого пациента может включать местное введение растворимого FGFR3 в поджелудочную железу для лечения или предотвращения развития диабета.
Растворимые полипептиды рецептора фактора роста фибробластов 3 (sFGFR3)
Растворимые полипептиды FGFR3 и их варианты могут быть использованы в способах лечения пациента, имеющего аномальное отложение висцерального жира. Полипептид sFGFR3 может включать по меньшей мере 50 аминокислотных последовательностей внеклеточного домена (ECD) природного полипептида рецептора фактора роста фибробластов 3 (FGFR3) (например, полипептид FGFR3, имеющий последовательность, указанную под номером доступа в GenBank NP_000133; см. также SEQ ID NO: 8). В частности, полипептид sFGFR3 может включать 100-370 аминокислотных последовательностей (например, менее 350 аминокислотных последовательностей) ECD природного полипептида рецептора фактора роста фибробластов 3 (FGFR3). Полипептид sFGFR3 также может иметь Ig-подобный домен C2-типа 1, 2 и/или 3 природного полипептида FGFR3.
Полипептид sFGFR3 может иметь или может не иметь сигнальный пептид (например, сигнальный пептид полипептида FGFR3, такой как соответствующий SEQ ID NO: 21; в частности, sFGFR3 представляет собой зрелый полипептид без сигнального пептида, который отщепляется во время экспрессии и секреции из клетки). У полипептида sFGFR3 также отсутствует трансмембранный домен (TM), такой как TM природного полипептида FGFR3.
Полипептиды sFGFR3 также могут содержать весь или часть внеклеточного домена (ICD) полипептида FGFR3. Например, полипептид sFGFR3 может иметь 400 аминокислотных последовательностей или менее (например, в диапазоне между 5 и 399 аминокислотных последовательностей, например, 175, 150, 125, 100, 75, 50, 40, 30, 20, 15 или меньше аминокислотных последовательностей) ICD природного полипептида FGFR3. У ICD полипептида sFGFR3 также может отсутствовать тирозинкиназный домен природного полипептида FGFR3. Альтернативно, у полипептида sFGFR3 могут отсутствовать любые аминокислоты ICD природного полипептида FGFR3 (например, полипептида FGFR3 последовательности SEQ ID NO: 8).
Полипептид sFGFR3 также может иметь аминокислотную последовательность, имеющую по меньшей мере идентичность 90%, 92%, 95%, 97% или 99% последовательности, или иметь последовательность, аминокислот 401-413 последовательности SEQ ID NO: 8.
Полипептид sFGFR3 для применения в способах, описанных в настоящем изобретении, по длине может быть менее 475, 450, 425, 400, 375, 350, 300, 250, 200, 150 или 100 аминокислот и/или может иметь аминокислотную последовательность, имеющую по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, такую как 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности) с аминокислотными остатками 1-280 последовательности SEQ ID NO: 8. Полипептид sFGFR также может представлять собой полипептид с аминокислотной последовательностью, имеющий по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, такую как 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности) с аминокислотой последовательностью любой из SEQ ID NO: 1-7. В частности, sFGFR3 имеет аминокислотную последовательность SEQ ID NO: 5 или 6 (например, аминокислотную последовательность SEQ ID NO: 5). Полипептид sFGFR3 также может иметь последовательность SEQ ID NO: 6, за исключением того, что остаток в положении 253 представляет собой аланин, глицин, пролин или треонин.
Варианты полипептида sFGFR3, которые могут вводиться по способам, также включают фрагменты аминокислотной последовательности любой из SEQ ID NO: 1-8 (например, по меньшей мере аминокислоты 1-200, 1-205, 1-210, 1-215, 1-220, 1-225, 1-235, 1-230, 1-240, 1-245, 1-250, 1-253, 1-255, 1-260, 1-265, 1-275, 1-280, 1-285, 1-290 или 1-300 последовательности SEQ ID NO: 8) или полипептиды, имеющие по меньшей мере 50%-ную идентичность последовательности (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичность последовательности) с любой из последовательностей SEQ ID NO: 1-8 (и у которой, например, отсутствует сигнальный пептид и TM домен).
Полипептиды sFGFR3 по изобретению также могут быть охарактеризованы как связанные с фактором роста фибробластов (FGF). В частности, FGF выбран из группы, включающей фактор роста фибробластов 1 (FGF1; SEQ ID NO: 26), фактор роста фибробластов 2 (FGF2; SEQ ID NO: 27), фактор роста фибробластов 9 (FGF9; SEQ ID NO: 28), фактор роста фибробластов 10 (FGF10; SEQ ID NO: 40), фактор роста фибробластов 18 (FGF18; SEQ ID NO: 29), фактор роста фибробластов 19 (FGF19; SEQ ID NO: 30), фактор роста фибробластов 21 (FGF21; SEQ ID NO: 31) и фактор роста фибробластов 23 (FGF23; SEQ ID NO: 41). Связывание характеризуется равновесной константой диссоциации (Kd) от приблизительно 0,2 нм до приблизительно 20 нм (например, Kd от приблизительно 1 нм до приблизительно 10 нм, где необязательно Kd равно приблизительно 1 нм, приблизительно 2 нм, приблизительно 3 нм, приблизительно 4 нм, приблизительно 5 нм, приблизительно 6 нм, приблизительно 7 нм, приблизительно 8 нм, приблизительно 9 нм или приблизительно 10 нм).
Учитывая результаты, описанные в настоящем изобретении, изобретение не ограничивается конкретным полипептидом sFGFR3 или его вариантом. В дополнение к примерам полипептидов sFGFR3 и их вариантам, обсуждаемым выше, любой полипептид sFGFR3, который связывает один или более FGF с аналогичной аффинностью связывания, как полипептиды sFGFR3, имеющие аминокислотную последовательность SEQ ID NO: 1-7, также рассматривается как тот, который может использоваться для лечения аномального отложения висцерального жира у пациента. Полипептиды sFGFR3 могут представлять собой, например, фрагменты изоформы 2 FGFR3 без экзонов 8 и 9, кодирующих С-концевую половину домена IgG3, и экзона 10, включая трансмембранный домен (например, фрагменты аминокислотной последовательности SEQ ID NO: 8), соответствующие фрагментам транскрипта FGFR3 варианта 2 (номер доступа NM_022965).
Как указано выше, полипептид sFGFR3 для применения в способах по изобретению может включать сигнальный пептид в N-концевом положении. Пример сигнального пептида может включать, но этим не ограничивается, аминокислоты 1-22 последовательности SEQ ID NO: 21 (например, MGAPACALALCVAVAIVAGASS). Соответственно, полипептиды sFGFR3 включает обе выбранные формы, у которых отсутствует N-терминальный сигнальный пептид, и не секретируемые формы, которые включают N-терминальный сигнальный пептид. Например, секретируемый полипептид sFGFR3 может включать аминокислотную последовательность любой из SEQ ID NO: 1-7, но без N-терминального сигнального пептида (например, последовательности SEQ ID NO: 21). Альтернативно, полипептид sFGFR3 (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7), включает сигнальный пептид, такой как аминокислотная последовательность SEQ ID NO: 21. Специалист в данной области поймет, что положение N-терминального сигнального пептида будет варьировать в разных полипептидах sFGFR3 и может включать, например, первые 5, 8, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 27, 30 или более аминокислотных остатков на N-конце полипептида. Специалист в данной области может предсказать положение сайта расщепления сигнальной последовательности, например, с помощью соответствующего компьютерного алгоритма, такого как описан Bendtsen et al. (J. Mol. Biol. 340(4):783-795, 2004) и доступен в интернете по адресу cbs.dtu.dk/services/SignalP/.
Кроме того, полипептиды sFGFR3 по изобретению могут быть гликозилированы. В частности, полипептид sFGFR3 может быть изменен для увеличения или уменьшения степени гликозилирования полипептида sFGFR3. Добавление или удаление сайтов гликозилирования в полипептиде sFGFR3 может быть осуществлено путем изменения аминокислотной последовательности таким образом, что один или более сайтов гликозилирования создаются или удаляются. Например, N-связанное гликозилирование, при котором олигосахарид присоединяется к амидному азоту остатка аспарагина, может происходить в положении Asn76, Asn148, Asn169, Asn 203, Asn240, Asn272 и/или Asn 294 аминокислотной последовательности SEQ ID NO: 5 или 6 и ее вариантов. Один или более из этих остатков Asn также могут быть замещены для удаления сайта гликозилирования. Например, О-связанное гликозилирование, при котором олигосахарид присоединяется к атому кислорода аминокислотного остатка, может происходить в положении Ser109, Thr126, Ser199, Ser274, Thr281, Ser298, Ser299 и/или Thr301 аминокислотной последовательности SEQ ID NO: 5 или 6 и ее вариантов. Кроме того, О-связанное гликозилирование может происходить с остатком серина в sFGFR3. Один или более из этих остатков Ser или Thr также могут быть замещены для удаления сайта гликозилирования.
Слитые полипептиды sFGFR3
Полипептиды sFGFR3 по изобретению (например, полипептиды sFGFR3, имеющие аминокислотную последовательность любой из SEQ ID NO: 1-7 или ее вариант, имеющие по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности), могут быть слиты с функциональным доменом гетерологичного полипептида (например, фрагментом кристаллизуемой области (область Fc; например, полипептид, имеющий аминокислотные последовательности SEQ ID NO: 35 и 36) или сывороточного альбумина человека (HSA; например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 37)) для получения слитого полипептида sFGFR3. Необязательно, между полипептидом sFGFR3 и гетерологичным полипептидом (например, область Fc или HSA) может быть встроен гибкий линкер, такой как последовательность, богатая серином или глицином (например, линкер из полиглицина или полиглицина/серина, такой как SEQ ID NO: 38 и 39).
Например, полипептиды sFGFR3 и их варианты могут представлять собой слитый полипептид, включая, например, область Fc иммуноголобулина N-терминального или C-терминального домена. В частности, полезные области Fc могут включать фрагмент Fc любой молекулы иммуноглобулина, включая IgG, IgM, IgA, IgD или IgE и их различные подклассы (например, IgG-1, IgG-2, IgG-3, IgG-4, IgA-1, IgA-2) любого млекопитающего (например, человека). Например, фрагмент Fc IgG-1 человека (SEQ ID NO: 35) или вариант IgG-1 человека, такой как вариант, включающий замену аспарагина в положении 297 SEQ ID NO: 35 на аланин (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 36). Фрагменты Fc по изобретению могут включать, например, домены СН2 и СН3 тяжелой цепи и любую часть шарнирной области. Слитые полипептиды sFGFR3 по изобретению также могут включать, например, мономерный Fc, такой как домен CH2 или CH3. Область Fc может быть необязательно гликозилирована по любому подходящему одному или нескольким аминокислотным остаткам, известным специалистам в данной области. Фрагмент Fc, описанный в настоящем изобретении, может иметь 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50 или более добавлений, делеций или замен относительно любых фрагментов Fc, описанных в настоящем изобретении.
Кроме того, полипептиды sFGFR3 могут быть конъюгированы с другими молекулами на N-концевом или С-концевом домене с целью улучшения растворимости и стабильности белка в водном растворе. Примеры таких молекул включают человеческий сывороточный альбумин (HSA), PEG, PSA и бычий сывороточный альбумин (BSA). Например, полипептиды sFGFR3 могут быть конъюгированы с HSA человека (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 37) или его фрагментом.
Слитые полипептиды SFGFR3 могут включать область пептидного линкера между полипептидом sFGFR3 и гетерологичным полипептидом (например, область Fc или HSA). Линкерная область может иметь любую последовательность и длину, которая позволяет sFGFR3 оставаться биологически активным, например, не иметь стерического затруднения. Примерные длины линкера составляют от 1 до 200 аминокислотных остатков, например, 1-5, 6-10, 11-15, 16-20, 21-25, 26-30, 31-35, 36-40, 41-45, 46-50, 51-55, 56-60, 61-65, 66-70, 71-75, 76-80, 81-85, 86-90, 91-95, 96-100, 101-110, 111-120, 121-130, 131-140, 141-150, 151-160, 161-170, 171-180, 181-190 или 191-200 аминокислотных остатков. Например, линкеры включают или состоят из гибких частей, например, областей без значительной фиксированной вторичной или третичной структуры. Предпочтительные диапазоны составляют от 5 до 25 и от 10 до 20 аминокислот в длину. Такая гибкость обычно увеличивается, если аминокислоты небольшие и не имеют объемных боковых цепей, которые препятствуют вращению или изгибу аминокислотной цепи. Таким образом, предпочтительно, пептидный линкер по настоящему изобретению имеет повышенное содержание небольших аминокислот, в частности, глицинов, аланинов, серинов, треонинов, лейцинов и изолейцинов.
Примерами гибких линкеров являются богатые глицином линкеры, например, содержащие по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или даже 100% глициновых остатков. Линкеры также могут включать, например, богатые серином линкеры, например, содержащие по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или даже 100% сериновых остатков. В некоторых случаях аминокислотная последовательность линкера состоит только из остатков глицина и серина. Например, линкер может представлять собой аминокислотную последовательность GGGGAGGGG (SEQ ID NO: 38) или GGGGSGGGGSGGGGS (SEQ ID NO: 39). Линкер, необязательно, может быть гликозилирован по любому подходящему одному или нескольким аминокислотным остаткам. Линкер также может отсутствовать, когда полипептид sFGFR3 и гетерологичный полипептид (например, область Fc или HSA) слиты друг с другом напрямую, без промежуточных остатков.
Полинуклеотиды, кодирующий полипептиды sFGFR3
Полинуклеотиды, кодирующий полипептиды sFGFR3, могут быть использованы для лечения пациента, имеющего аномальное отложение висцерального жира (например, человека, такого как плод, новорожденный, младенец, ребенок, подросток или взрослый). Например, полинуклеотид может иметь последовательность нуклеиновых кислот любой из SEQ ID NO: 10-18 или ее варианты, имеющие по меньшей мере 85%-ную идентичность последовательности (например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%-ную или более идентичность последовательности) с последовательностью нуклеиновых кислот любой из SEQ ID NO: 10-18. Помимо этого, полинуклеотид может иметь последовательность нуклеиновых кислот SEQ ID NO: 14 или 15 или ее вариант, имеющий по меньшей мере 85%-ную идентичность последовательности (например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%-ную или более идентичность последовательности) с последовательностью нуклеиновых кислот SEQ ID NO: 14 или 15.
Также охарактеризованы полинуклеотиды, кодирующие sFGFR3 полипептиды слияния (например, полипептид sFGFR3, слитый с гетерологичным полипептидом, таким как область Fc или HSA) и полинуклеотиды, кодирующие полипептиды sFGFR3 без сигнального пептида (например, полипептиды, имеющие аминокислотную последовательность любой из SEQ ID NO: 1-7), или с сигнальным пептидом (например, полипептиды, имеющие аминокислотную последовательность любой из SEQ ID NO: 1-7). Кроме того, полинуклеотиды могут иметь одну или несколько мутаций для изменения любого из сайтов гликозилирования, описанных в настоящем изобретении или известных как присутствующие в полипептиде.
Необязательно, полинуклеотиды по изобретению могут быть оптимизированы по кодонам для изменения кодонов в нуклеиновой кислоте, в частности, чтобы отразить типичное использование кодонов организмом-хозяином (например, человеком) без изменения полипептида sFGFR3, кодируемого последовательностью нуклеиновых кислот полинуклеотида. Оптимизированные по кодонам полинуклеотиды (например, полинуклеотид, имеющий последовательность нуклеиновых кислот SEQ ID NO: 14 или 16) могут, например, облегчать генетические манипуляции за счет уменьшения содержания GC и/или для экспрессии в клетке-хозяине (например, клетка HEK 293 или клетка CHO). Специалист в данной области может выполнить оптимизацию кодонов, например, используя онлайн-инструменты, такие как JAVA Codon Adaption Tool (www.jcat.de) или Integrated DNA Technologies Tool (www.eu.idtdna.com/CodonOpt), просто вводя последовательность нуклеиновых кислот полинуклеотида и организма-хозяина, для которого кодоны должны быть оптимизированы. Использование кодонов различных организмов доступно в онлайн-базах данных, например, www.kazusa.or.jp/codon.
Клетки-хозяины для экспрессии полипептидов sFGFR3
Клетки млекопитающих могут быть использованы в качестве клеток-хозяинов для экспрессии полипептида sFGFR3 (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, и его варианты). Типичные типы клеток млекопитающих, применимые в способах, включают, но не ограничиваются ими, человеческие эмбриональные клетки почек (HEK; например, HEK 293), клетки яичника китайского хомячка (CHO), L-клетки, клетки линии C127, клетки линии 3T3, клетки линии BHK, клетки линии COS-7, клетки линии HeLa, клетки линии PC3, клетки линии Vero, клетки линии MC3T3, клетки линии NS0, клетки линии Sp2/0, клетки линии VERY, клетки линии BHK, MDCK, клетки линии W138, клетки линии BT483, клетки линии Hs578T, клетки линии HTB2, клетки линии BT20, клетки линии T47D, клетки линии NS0, клетки линии CRL7O3O и клетки линии HsS78Bst или любая другая подходящая клетка-хозяин млекопитающего, известная в данной области. Альтернативно, клетки E. coli могут быть использованы в качестве клеток-хозяев для экспрессии полипептидов sFGFR3. Примеры штаммов E. coli включают, но этим не ограничивается, E. coli 294 (ATCC® 31,446), E. coli λ 1776 (ATCC® 31,537, E. coli BL21 (DE3) (ATCC® BAA-1025), E. coli RV308 (ATCC® 31,608) или любой другой подходящий штамм E. coli, известный в данной области.
Векторы, включающие полинуклеотиды, кодирующие полипептиды sFGFR3
Также представлены рекомбинантные векторы, включающие любой один или более полинуклеотидов, описанных выше (например, полинуклеотид, кодирующие полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, и его варианты). Векторы по изобретению могут быть использованы для доставки полинуклеотида, кодирующего полипептид sFGFR3 по изобретению и его варианты, которые могут включать векторы экспрессии млекопитающих, вирусов и бактерий. Например, векторы могут быть плазмидами, искусственными хромосомами (например, BAG, PAC и YAC) и вирусными или фаговыми векторами и могут необязательно включать промотор, энхансер или регулятор для экспрессии полинуклеотида. Векторы также могут содержать один или более селектируемых маркерных генов, таких как ген устойчивости к ампициллину, неомицину и/или канамицину в случае бактериальной плазмиды или ген устойчивости для грибкового вектора. Векторы могут быть использованы in vitro для продуцирования ДНК или РНК или для трансфекции или трансформации клетки-хозяина, такой как клетка-хозяин млекопитающего, для продуцирования полипептида sFGFR3, кодируемого этим вектором. Векторы также могут быть адаптированы для использования in vivo в способе генной терапии.
Примеры вирусных векторов, которые можно использовать для доставки полинуклеотида, кодирующего полипептид sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7 и их варианты), включают ретровирус, аденовирус (например, Ad2, Ad5, Ad11, Ad12, Ad24, Ad26, Ad34, Ad35, Ad40, Ad48, Ad49, Ad50 и Pan9 (также известный как AdC68)), парвовирус (например, аденоассоциированные вирусы), коронавирус, РНК-вирусы с отрицательной цепью, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства и везикулярного стоматита), парамиксовирус (например, корь и Сендай), РНК-вирусы с положительной цепью, такие как пикорнавирус и альфа-вирус, и двухцепочечные ДНК-вирусы, включая аденовирус, вирус герпеса (например, вирусы простого герпеса типов 1 и 2, вирус Эпштейна-Барра, цитомегаловирус) и поксвирус (например, коровьей оспы, модифицированной коровьей оспы Анкары (MVA), оспы птиц и оспы канареек). Другие вирусы, используемые для доставки полинуклеотидов, кодирующих полипептиды sFGFR3, включают вирус Норволк, тогавирус, флавивирус, реовирусы, паповавирус, гепаднавирус и вирус гепатита. Примеры ретровирусов включают лейкоз-саркому птиц, млекопитающие C-типа, вирусы B-типа, вирусы D-типа, группу HTLV-BLV, лентивирус и спумавирус (Coffin, J. M., Retroviridae: The viruses and their replication, In Fundamental Virology, Third Edition, B. N. Fields, et al., Eds., Lippincott-Raven Publishers, Philadelphia, 1996).
Способы получения
Полинуклеотиды, кодирующие полипептиды sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, и его варианты), могут быть получены любым способом, известным в данной области. Например, полинуклеотид генерируется с использованием методов молекулярного клонирования и помещается в вектор, такой как плазмида, искусственная хромосома, вирусный вектор или фаговый вектор. Вектор используют для трансформации полинуклеотида в клетку-хозяина, подходящую для экспрессии полипептида sFGFR3.
Конструкция вектора нуклеиновой кислоты и клетки-хозяева
Полипептиды sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7 и их варианты) могут быть получены из клетки-хозяина. Полинуклеотиды (например, полинуклеотиды, имеющие последовательность нуклеиновых кислот SEQ ID NO: 14 или 16, и их варианты), кодирующие полипептиды sFGFR3, могут быть включены в векторы, которые могут быть введены в клетку-хозяина обычными способами, известными в данной области (например, трансформация, трансфекция, электропорация, осаждение фосфата кальция, прямая микроинъекция или инфекция). Выбор вектора зависит частично от используемых клеток-хозяев. Обычно клетки-хозяева имеют прокариотическое (например, бактериальное) или эукариотическое (например, млекопитающее) происхождение.
Полинуклеотид, кодирующий полипептид sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7 и ее варианты), может быть получен различными способами, известными в данной области. Эти способы включают, но не ограничиваются ими, олигонуклеотид-опосредованный (или сайт-направленный) мутагенез и мутагенез PCR. Полинуклеотид, кодирующий полипептид sFGFR3, может быть получен с использованием стандартных методов, например, синтеза генов. Альтернативно, полинуклеотид, кодирующий полипептид sFGFR3 дикого типа (например, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 8), может быть мутирован для содержания специфических аминокислотных замен с использованием стандартных способов в данной области техники, например, мутагенеза QuikChange™. Полинуклеотиды, кодирующие полипептид sFGFR3, могут быть синтезированы с использованием, например, методов синтеза нуклеотидов или PCR.
Полинуклеотиды, кодирующий полипептид sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, и ЕГО варианты), могут быть встроены в вектор, способный реплицировать и экспрессировать полинуклеотид в прокариотических или эукариотических клетках-хозяинах. Примеры векторов, используемых в способах, могут включать, но этим не ограничивается, плазмиду, искусственную хромосому, вирусный вектор, и фаговый вектор. Например, вирусный вектор может включать вирусные векторы, описанные выше, такие как ретровирусный вектор, аденовирусный вектор или поксвирусный вектор (например, экспрессирующий вектор на основе вируса осповакцины, такой как модифицированный вирус осповакцины (MVA)), аденоассоциированный вирусный вектор и альфа-вирусный вектор)), содержащие последовательность нуклеиновых кислот полинуклеотида, кодирующего полипептид sFGFR3. Каждый вектор может содержать различные компоненты, которые можно настраивать и оптимизировать для совместимости с конкретной клеткой-хозяином. Например, компоненты вектора могут включать, но не ограничиваются ими, источник репликации, ген маркера селекции, промотор, сайт связывания рибосомы, сигнальную последовательность, последовательность нуклеиновых кислот полинуклеотида, кодирующего полипептид sFGFR3, и/или последовательность терминации транскрипции.
Вышеописанные векторы могут быть введены в соответствующие клетки-хозяева (например, клетки HEK 293 или клетки СНО или в клетку-хозяина пациента) с использованием традиционных в данной области техники методов, например, трансформации, трансфекции, электропорации, осаждения фосфатом кальция и прямой микроинъекции. Если векторы вводят в клетки-хозяева для получения полипептида sFGFR3 по изобретению, клетки-хозяева культивируют в обычных питательных средах, модифицированных в зависимости от необходимости для индукции промоторов, отбора трансформантов или амплификации полинуклеотидов, кодирующих полипептид sFGFR3. Способы экспрессии терапевтических белков, таких как полипептиды sFGFR3, известны в данной области, см., например, Paulina Balbas, Argelia Lorence (eds.) Recombinant Gene Expression: Reviews and Protocols (Methods in Molecular Biology), Humana Press; 2nd ed. 2004 (July 20, 2004) и Vladimir Voynov and Justin A. Caravella (eds.) Therapeutic Proteins: Methods and Protocols (Methods in Molecular Biology) Humana Press; 2nd ed. 2012 (June 28, 2012), которые тем самым включены в качестве ссылки.
Получение полипептида sFGFR3, выделение и очистка
Клетки-хозяева (например, клетки HEK 293 или клетки CHO), используемые для получения полипептида sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, и его варианты), могут быть выращены в среде, известной в данной области, и подходящей для культивирования выбранных клеток-хозяев. Примеры подходящих сред для клеток-хозяев млекопитающих включают минимальную поддерживающую среду (MEM), модифицированную по способу Дульбекко среду Игла (DMEM), экспрессионную среду Expi293™, DMEM с добавлением фетальной бычьей сыворотки (FBS) и RPMI-1640. Примеры подходящей среды для бактериальных клеток-хозяев включают бульон Лурии (LB) плюс необходимые добавки, такие как селективный агент, например, ампициллин. Клетки-хозяева культивируют при подходящих температурах, таких как от приблизительно 20°С до приблизительно 39°С, например, от 25°С до приблизительно 37°С, предпочтительно, 37°С, и уровнях СО2, таких как 5-10% (предпочтительно, 8%). pН среды обычно составляет от приблизительно 6,8 до 7,4, например, 7,0, в зависимости главным образом от организма-хозяина. Если в векторе экспрессии используется индуцибельный промотор, экспрессия полипептида sFGFR3 индуцируется в условиях, подходящих для активации промотора.
Полипептид sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7 и их варианты) может быть выделен из супернатанта клетки-хозяина. Альтернативно, полипептид sFGFR3 может быть выделен путем разрушения клетки-хозяина (например, с помощью осмотического шока, обработки ультразвуком или лизиса) с последующим центрифугированием или фильтрацией для извлечения полипептида sFGFR3. После извлечения полипептида sFGFR3, полипептид sFGFR3 затем может быть дополнительно очищен. Полипептид sFGFR3 может быть очищен любым способом, известным в области очистки белка, таким как сродство к белку А, другой хроматографией (например, колоночная хроматография с ионным обменом, сродством и исключением по размеру), центрифугированием, дифференциальной растворимостью или любой другой стандартной методикой очистки белков (см. Process Scale Purification of Antibodies, Uwe Gottschalk (ed.) John Wiley & Sons, Inc., 2009, полностью включено в настоящее описание в качестве ссылки).
Необязательно, полипептид sFGFR3 по изобретению (например, полипептид, имеющий аминокислотную последовательность любой из SEQ ID NO: 1-7, и его варианты) может быть конъюгирован с детектируемой меткой для очистки. Примеры подходящих меток для использования при очистке полипептидов sFGFR3 включают, но не ограничиваются ими, белковую метку, флуорофор, хромофор, радиоактивную метку, коллоид металла, фермент или хемилюминесцентную или биолюминесцентную молекулу. В частности, белковые метки, которые могут быть использованы для очистки полипептидов sFGFR3, могут включать, но не ограничиваются ими, хроматографические метки (например, пептидные метки, состоящие из полианионных аминокислот, такие как метка FLAG или метка гемагглютинина «HA»), аффинные метки (например, поли(His) метка, хитин-связывающий белок (CBP), мальтоза-связывающий белок (MBP) или глутатион-S-трансфераза (GST)), метки солюбилизации (например, тиоредоксин (TRX) и поли(NANP)), метки эпитопа (например, метка V5, метка Myc и метка HA) или метки флуоресценции (например, варианты GFP, GFP, варианты RFP и RFP).
Методы диагностики
Пациент с аномальным отложением висцерального жира может быть идентифицирован как нуждающийся в лечении одним из многих методов, известных в данной области. Существуют две категории методов: антропометрические методы и визуализация. Антропометрические методы основаны на измерениях, основанных на рулетке и масштабе. Методы визуализации основаны на ослаблении рентгеновских лучей при прохождении через пациента или на магнитных свойствах водородных ядер у пациента.
Обычно используемым антропометрическим методом, который классифицирует пациентов как имеющих нормальный вес, избыточный вес или ожирение, является индекс массы тела (ИМТ). ИМТ рассчитывается путем деления веса пациента (в кг) на рост пациента в квадрате (в м). Граница, указывающая на ожирение у взрослых, отличается от пороговых значений у детей. Для взрослых ожирение считается имеющимся, когда ИМТ составляет 30 кг/м2 или выше (см., например, Nuttall, Nutr. Today 50(3):117-28, 2015); для детей порог ожирения варьируется в зависимости от возраста и роста (см., например, van der Sluis et al., Arch. Dis. Child. 87(4):341-347, 2002). Стандартные таблицы для ИМТ у детей имеют ограничения, когда рассматриваются ахондропластические дети (см., например, Hoover-Fong et al., Am. J. Clin. Nutr. 88, 364-371, 2008).
Среди антропометрических методов ИМТ не позволяет различить отложение подкожного и висцерального жира. В результате аномальный абдоминальный висцеральный жир лучше идентифицировать, используя окружность талии (измеренную чуть выше пальпируемой верхней части кости гребня подвздошной кости), сагиттальный диаметр (переднезаднее расстояние от нижней части спины до передней части живота) и соотношение андроидного:гиноидного жира (окружность талии, деленная на окружность бедер).
Граничное значение для аномальной окружности талии для взрослых женщин составляет более 83 см, а для взрослых мужчин более 90 см (см., например, Zhu et al., Am. J. Clin. Nutr. 76(4):743-749, 2002). Для сагиттальных диаметров граничное значение для женщин составляет более 20,1 см, а для мужчин более 23,1 см; см., например, Pimentel et al, Nutr. Hosp. 25(4):656-61, 2010. Наконец, для соотношения андроидного:гиноидного жира у женщин более 0,85, а у мужчин более 0,9; см., например, Price et al, Am. J. Clin. Nutr. 84(2):449-460, 2006).
Одним из методов визуализации, который основан на рентгеновских лучах, является двухэнергетическая рентгеновская абсорбциометрия (DXA), метод, в котором два рентгеновских пучка с различной энергией используются для определения массы жира (в отличие от нежировой массы), и из этого определения получается мера, называемая индексом массы жира (измеренная масса жира, деленная на рост в квадрате). Предельное значение для аномального отложения жира у женщин превышает 13, а предельное значение для аномального отложения жира у мужчин превышает 9; см., например, Kelly et al, PLOS One, 4(9): 2009).
Как КТ (с использованием рентгеновских лучей), так и МРТ (в зависимости от магнитных свойств тела) могут визуализировать живот в поперечном сечении и тем самым отличать отложение висцерального от подкожного жира. С помощью КТ или МРТ граничное значение аномального отложения висцерального жира у женщин составляет 110 см2, а у мужчин 132 см2; см., например, Wajchenberg, Endocr. Rev. 21(6):697-738, 2000.
Способы мониторинга терапии
Чтобы оценить эффект терапии, пациент, которого лечат полипептидом sFGFR3, может быть обследован с использованием различных биомаркеров болезненного состояния. Для пациента, которого лечат с целью уменьшения или предотвращения анормального отложения висцерального жира, методы мониторинга включают, например, определение улучшения ИМТ, сагиттального диаметра, соотношения андроид:гиноид, окружности талии, индекса массы жира и площади висцерального жира на стандартизированном поперечном сечении. Эффект терапии также можно оценить с использованием одного или нескольких биомаркеров, обнаруживаемых, например, в образце от пациента (например, в образце крови, мочи или мокроты). В случае пациента, получающего лечение для предотвращения или улучшения метаболических заболеваний, таких как диабет или ожирение печени, анализы крови для мониторинга эффекта терапии включают, например, оценку образца пациента на предмет изменения уровня глюкозы и/или инсулина, улучшение в тестировании на толерантность к глюкозе и снижение повышенных уровней аланин-трансаминазы, аспартатаминотрансферазы и/или щелочной фосфатазы.
Если пациент получает полипептидную терапию sFGFR3 для лечения или снижения риска сердечно-сосудистых заболеваний, может быть проведен анализ крови, чтобы показать улучшение уровня триглицеридов, липопротеинов высокой плотности, липопротеинов низкой плотности и/или холестерина. Альтернативно, может быть проведено радиоизотопное стресс-тестирование, чтобы показать улучшение у пациента толерантности к физической нагрузке и/или перфузии миокарда.
У пациентов, которых лечат, чтобы улучшить или уменьшить риск слабоумия, может быть выполнено серийное исследование нейропсихологии.
В тех случаях, когда полипептид sFGFR3 вводят для лечения или снижения риска бесплодия или нарушения менструального цикла, можно измерить уровень биомаркера в крови, такого как фолликулостимулирующий гормон, лютеинизирующий гормон, эстрадиол и пролактин.
Если пациент страдает или подвержен риску апноэ во сне, для оценки эффекта терапии после терапии полипептидом sFGFR3 может быть выполнено исследование, которое измеряет, например, кислород, частоту дыхания, частоту сердечных сокращений, храп и/или движения тела спящего пациента.
У пациента, для которого полипептид sFGFR3 назначен для лечения или профилактики рестриктивных заболеваний легких или астмы, можно использовать тестирование функции легких с использованием, например, спирометрии или плетизмографии, чтобы показать улучшение показателей легкого, таких как дыхательный объем, жизненная емкость, остаточный объем и/или форсированная жизненная емкость.
В случае, когда методы мониторинга показывают, что пациент может не отвечать на лечение с использованием полипептида sFGFR3 или для которого может быть желателен больший эффект лечения, введение полипептида sFGFR3 может повторяться один или более раз или частота введения может быть увеличена.
Введение полипептидов sFGFR3
Полипептид sFGFR3 может вводиться для лечения пациента, имеющего аномального отложения висцерального жира или при его риске. Примеры полипептидов sFGFR3 включают, например, полипептиды sFGFR3, имеющие аминокислотную последовательность любой из SEQ ID NO: 1-7, или их варианты, имеющие по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности). Полипептид sFGFR3 может вводиться любым путем, известным из уровня техники, таким как путем парентерального введения, энтерального введения или местного применения. В частности, полипептид sFGFR3 может вводиться пациенту, имеющему увеличенное отложение висцерального жира) подкожно (например, подкожной инъекцией), внутривенно, внутримышечно, внутриартериально, интратекально или внутрибрюшинно.
Полипептид sFGFR3 может вводиться пациенту (например, человеку) в заранее определенной дозировке, например, в эффективном количестве, для лечения повышенного отложения висцерального жира, не вызывая значительной токсичности. Например, полипептиды sFGFR3 можно вводить пациенту с повышенным отложением висцерального жира в отдельных дозах в диапазоне от приблизительно 0,002 мг/кг до приблизительно 20 мг/кг (например, от 0,002 мг/кг до 20 мг/кг, от 0,01 мг/кг до 2 мг/кг, от 2 мг/кг до 20 мг/кг, от 0,01 мг/кг до 10 мг/кг, от 10 мг/кг до 100 мг/кг, от 0,1 мг/кг до 50 мг/кг, от 0,5 мг/кг до 20 мг/кг, от 1,0 мг/кг до 10 мг/кг, от 1,5 мг/кг до 5 мг/кг или от 0,2 мг/кг до 3 мг/кг). В частности, полипептид sFGFR3 может вводиться в индивидуальных дозах, например, от 0,001 мг/кг до 7 мг/кг, таких как от 0,3 мг/кг до приблизительно 2,5 мг/кг.
Примеры доз полипептида sFGFR3 по изобретению для введения пациенту (например, человеку), имеющему увеличенное отложение висцерального жира), включают, например, 0,005, 0,01, 0,02, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 11, 12, 13, 14, 15 или 20 мг/кг. Эти дозы могут вводиться один или более раз (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 или более раз) в день, неделю, месяц или год. Например, полипептид sFGFR3 может вводиться пациентам еженедельной дозой в интервале, например, от приблизительно 0,0014 мг/кг/неделя до приблизительно 140 мг/кг/неделя, например, от приблизительно 0,14 мг/кг/неделя до приблизительно 105 мг/кг/неделя, или, например, от приблизительно 1,4 мг/кг/неделя до приблизительно 70 мг/кг/неделя (например, 5 мг/кг/неделя).
Генная терапия
Полипептид sFGFR3 может вводиться пациенту в виде молекулы нуклеиновой кислоты. Примеры молекул нуклеиновых кислот, которые могут вводиться, включает такие, которые кодируют полипептиды sFGFR3, имеющие аминокислотную последовательность любой из SEQ ID NO: 1-7, или их варианты, имеющие по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, наапример, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности). Например, молекулы нуклеиновых кислот могут иметь последовательность любой из SEQ ID NO: 10-18 или их варианты, имеющую по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности).
Молекулы нуклеиновой кислоты, кодирующие полипептид sFGFR3, могут быть доставлены генной терапией, в которой полинуклеотид, кодирующий полипептид sFGFR3, доставляется в интересующие ткани и экспрессируется in vivo. Методы генной терапии обсуждаются, например, Verme et al. (Nature 389:239-242, 1997), Yamamoto et al. (Molecular Therapy 17:S67-S68, 2009), и Yamamoto et al., (J. Bone Miner. Res. 26: 135-142, 2011), включены в настоящее описание в качестве ссылки.
Полипептид sFGFR3 по изобретению может быть продуцирован клетками пациента (например, человека), имеющего повышенное отложение висцерального жира, путем введения вектора (например, плазмиды, искусственной хромосомы (например, BAG, PAC и YAC) или вирусный вектор), содержащего последовательность нуклеиновых кислот полинуклеотида, кодирующего полипептид sFGFR3. Например, вирусный вектор может представлять собой ретровирусный вектор, аденовирусный вектор или поксвирусный вектор (например, экспрессирующий вектор на основе вируса осповакцины, такой как модифицированный вирус осповакцины (MVA)), аденоассоциированный вирусный вектор или альфа-вирусный вектор. Вектор, оказавшись внутри клетки пациента (например, человека), имеющего нарушение задержки роста скелета (например, ахондроплазию), например, путем трансформации, трансфекции, электропорации, осаждения фосфата кальция или прямой микроинъекции, будет стимулировать экспрессию полипептида sFGFR3, который затем секретируется из клетки. Изобретение дополнительно включает клеточную терапию, при которой пациенту (например, человеку) вводят клетку, экспрессирующую полипептид sFGFR3.
Фармацевтические композиции
Фармацевтические композиции, которые могут вводиться для лечения пациенту, имеющему аномальное отложение висцерального жира, как обсуждается в настоящем изобретении, содержат полипептид sFGFR3, полинуклеотид, кодирующий полипептид sFGFR3, или клетку-хозяин, которая содержит полинуклеотид sFGFR3. Полипептид sFGFR3 может иметь аминокислотную последовательность любой из SEQ ID NO: 1-7 или их варианты, имеющую по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности). Молекулы нуклеиновых кислот могут иметь последовательность любой из SEQ ID NO: 10-18 или их варианты, имеющие по меньшей мере 85%-ную идентичность последовательности (например, 86%-100%-ную идентичность последовательности, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%-ную идентичность последовательности). Композиции, включающие полипептид sFGFR3, полинуклеотид, кодирующий полипептид sFGFR3, или клетку-хозяин, которая содержит полинуклеотид sFGFR3, могут быть составлены в различных дозировках, в различных составах и в комбинации с фармацевтически приемлемыми инертными вспомогательными веществами, носителями или разбавителями.
Фармацевтическая композиция, включающая полипептид sFGFR3, полинуклеотид, кодирующий полипептид sFGFR3, или клетку-хозяина, которая содержит полинуклеотид sFGFR3, может быть составлена в определенной дозировке, такой как дозировка, которая эффективна для лечения пациента (например, человека) с увеличенным отложением висцерального жира без значительной токсичности. Например, композиции могут быть составлены так, чтобы включать от приблизительно 1 мг/мл до приблизительно 500 мг/мл полипептида или полинуклеотида sFGFR3 (например, между 10 мг/мл и 300 мг/мл, 20 мг/мл и 120 мг/мл, 40 мг/мл и 200 мг/мл, 30 мг/мл и 150 мг/мл, 40 мг/мл и 100 мг/мл, 50 мг/мл и 80 мг/мл, или 60 мг/мл и 70 мг/мл полипептида или полинуклеотида sFGFR3).
Фармацевтические композиции, включающие полипептид или полинуклеотид sFGFR3, могут быть получены в различных формах, таких как жидкий раствор, дисперсия или суспензия, порошок или другая упорядоченная структура, подходящая для стабильного хранения. Например, композиции, включающие полипептид или полинуклеотид sFGFR3, предназначенные для системной или локальной доставки, могут быть в форме инъекционных или инфузионных растворов, таких как для парентерального введения (например, подкожное, внутривенное, внутримышечное, внутриартериальное, интратекальное или внутрибрюшинное введение). Композиции sFGFR3 для инъекций (например, подкожных или внутривенных инъекций) могут быть составлены с использованием в качестве несущей среды стерильного раствора или любой фармацевтически приемлемой жидкости. Фармацевтически приемлемые носители включают, но не ограничиваются ими, стерильную воду, физиологический раствор и среды для культивирования клеток (например, модифицированная по Дульбекко среда Игла (DMEM), α-модифицированная среда Игла (α-MEM), среда F-12). Способы приготовления известны в данной области, см. например, Banga (ed.) Therapeutic Peptides and Proteins: Formulation, Processing and Delivery Systems (2nd ed.) Taylor & Francis Group, CRC Press (2006), включено в настоящий документе посредством ссылки во всей своей полноте.
Композиции, включающие полипептид или полинуклеотид sFGFR3, могут быть предоставлены пациентам (например, людям), имеющим повышенное отложение висцерального жира в сочетании с фармацевтически приемлемыми инертное вспомогательными веществами, носителями или разбавителями. Приемлемые инертные вспомогательные вещества, носители или разбавители могут включать буферы, антиоксиданты, консерванты, полимеры, аминокислоты и углеводы. Водные наполнители, носители или разбавители могут включать воду, водно-спиртовые растворы, эмульсии или суспензии, включая физиологический раствор, забуференные медицинские парентеральные несущие среды, включая раствор хлорида натрия, раствор декстрозы Рингера, раствор декстрозы плюс хлорид натрия, раствор Рингера, содержащий лактозу и жирные масла. Примерами неводных инертных вспомогательных веществ, носителей или разбавителей являются пропиленгликоль, полиэтиленгликоль, растительное масло, рыбий жир и инъецируемые органические сложные эфиры.
В композиции sFGFR3 также могут быть включены фармацевтически приемлемые соли. Типичные фармацевтически приемлемые соли могут включать соли минеральных кислот (например, гидрохлориды, гидробромиды, фосфаты и сульфаты) и соли органических кислот (например, ацетаты, пропионаты, малонаты и бензоаты). Кроме того, могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты и рН-буферные вещества. Подробное обсуждение фармацевтически приемлемых наполнителей, носителей и разбавителей доступно в обзоре Remington: The Science and Practice of Pharmacy, 22nd Ed., Allen (2012), который полностью включен в настоящее описание посредством ссылки.
Фармацевтические композиции, включающие полипептид или полинуклеотид sFGFR3, также могут быть составлены с носителем, который будет защищать полипептид или полинуклеотид sFGFR3 от быстрого высвобождения, такой как состав с контролируемым высвобождением, включая имплантаты и микрокапсулированные системы доставки. Например, композиция sFGFR3 может быть заключена в микрокапсулы, полученные методами коацервации или межфазной полимеризацией, такие как гидроксиметилцеллюлозные, желатиновые или поли(метилметацилат)ные микрокапсулы; системы доставки коллоидных лекарственных средств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы или нанокапсулы); или макроэмульсии. Кроме того, композиция sFGFR3 может быть составлена в виде композиции с замедленным высвобождением. Например, композиции с замедленным высвобождением могут включать полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие полипептид или полинуклеотид sFGFR3, в которых матрицы имеют форму профилированных изделий, таких как пленки или микрокапсулы.
ПРИМЕРЫ
Следующие примеры предназначены для иллюстрации, а не для ограничения изобретения.
Пример 1:
План исследования
Чтобы оценить потенциал терапии sFGFR3 (например, sFGFR3, имеющей последовательность SEQ ID NO: 1) для предотвращения развития абдоминального ожирения при ахондроплазии, авторы изобретения сначала охарактеризовали развитие ожирения у детей с помощью ретроспективного обзора диаграммы, а затем на мышах Fgfr3ach/+ провели исследование, на мышиных моделях, воспроизводящих большинство человеческих симптомов. Для обзора диаграммы в отделении эндокринологии, заболеваний костей, генетической и медицинской гинекологии детской больницы Пурпана в Тулузе, Франция, с рождения до 18 лет наблюдались 11 пациентов (5 девочек и 6 мальчиков) с ахондроплазией. Это ретроспективное обзорное исследование было проведено в соответствии с Хельсинской декларацией и французскими правилами по биомедицинским исследованиям, не требующими одобрения комитета по этике для неинтервенционного исследования. Все пациенты имели мутацию G380R FGFR3 (G380R относится к нумерации в полной длине FGFR3, включая сигнальный пептид; нумерация остатков без сигнального пептида является G358R (см. SEQ ID NO: 9), подтвержденная молекулярным тестированием. Пациенты, получающие любое лечение, связанное с ростом, были исключены. В среднем дети посещали специализированный центр каждые 4 месяца. Во время каждого визита определяемые данные включали рост, вес и последующий индекс массы тела (ИМТ=кг/м2). Анализы крови проводились только один раз в год, а двухэнергетическая рентгеновская абсорбциометрия (DXA) проводилась один раз. Исследование на мышах проводили на трансгенных мышах Fgfr3ach/+ или их однопометных животных (WT). Для этого пометы обрабатывали вслепую два раза в неделю подкожными инъекциями 2,5 мкг/кг sFGFR3 или несущей среды, начиная с 3 дня и до 21 дня. Мышей отлучали от материнского молока в возрасте 3 недель. После одной недели акклиматизации мышей переводили на нормальную (ND) или диету с высоким содержанием жира (HFD) в течение 10 недель. Развитие ожирения оценивали с помощью измерений состава тела, непрямой калориметрии и классической оценки профиля глюкозы и липидов, а также оценки функции печени и поджелудочной железы. Число на группу представлено в подписям к фигурам.
Клинический анализ
Антропометрические расчеты, включая z-показатель роста и возраста и z-индекс ИМТ-возраста, были выполнены с использованием программного обеспечения ВОЗ AnthroPlus (Руководство ВОЗ для персональных компьютеров AnthroPlus: Программное обеспечение для оценки роста детей и подростков в мире. Женева: ВОЗ, 2009 (www.who.int/growthref/tools/en/); z-показатели основаны на стандартах ВОЗ (от рождения до 60 месяцев) и на справочном материале ВОЗ за 2007 год (от 61 месяца до 19 лет). Состав тела оценивался DXA с использованием устройства Lunar Prodigy (GE Healthcare). Интересующие области (ROI) для регионального состава тела определялись с использованием инструкций производителя (фиг. 1B). Вкратце, ROI туловища измеряли от разреза таза (нижняя граница) до разреза шеи (верхняя граница), ROI андроида измеряли от разреза таза (нижняя граница) до разреза таза на 20% расстояния между шеей и разрезами таза (верхняя граница), ROI пупка определяли по нижней границе от андроида на 150% от расстояния андроида, и ROI гиноидов находился от нижней границы ROI пупка до линии, равной двойной высоте ROI андроида (нижняя граница). Образцы крови отбирали по меньшей мере после 12-часового периода голодания и анализировали в Федеральном институте биологии (IFB) в больнице Пурпана. Содержание глюкозы и инсулина натощак, общего холестерина, холестерина ЛПВП и ЛПНП, концентраций триглицеридов, TGO, TGP, gGT, а также общего кальция, натрия, калия, бикарбоната, фосфата, хлорида и щелочной фосфатазы в плазме крови измеряли с помощью стандартных колориметрических или колориметрических ферментативных методов на модульном анализаторе серии Cobas 8000 с использованием модуля C701 от Roche Diagnostics. Концентрацию сывороточного общего 25OH витамина D измеряли методом хемилюминесцентного иммуноанализа на модульном анализаторе серии Cobas 8000 с использованием модуля E602 от Roche Diagnostics. Все значения сравнивались с эталонными значениями, установленными для каждой возрастной группы в детской больнице и с использованием опубликованных ссылок (Mellerio et al., Pediatrics 129: e1020-1029 (2012); Fischer et al., Ann. Clin. Biochem. 49:546-553, 2012; и Haine et al., J. Bone Miner. Res. 30:1369-1376, 2015). После 12-часового ночного голодания пациентам проводили OGTT в соответствии с установленными рекомендациями (Alberti et al., Diabet. Med. 15:539-553, 1998). После перорального введения 1,75 г/кг глюкозы отбирали образцы крови в начале исследования и через 30 и 120 минут для измерения концентрации глюкозы с использованием гексокиназного метода. Регуляция уровня глюкозы оценивалась в соответствии с рекомендациями Американской ассоциации диабета: нормальная регуляция уровня глюкозы определялась как уровень глюкозы натощак <5,6 ммоль/л и 120 минут глюкозы <7,8 ммоль/л, а уровень глюкозы натощак как глюкозы натощак 5,6-6,9 ммоль/л, уровень глюкозы нарушен толерантность как 120 мин глюкозы 7,8-11,0 ммоль/л.
Животные и лечение
Эксперименты проводили на трансгенных мышах Fgfr3ach/+ (Naski et al., Development 125: 4977-4988, 1998). При отъеме от материнского молока биопсия уха использовалась для подтверждения генотипа мышей с помощью PCR геномной ДНК, как описано ранее (Garcia et al., Science Translational Medicine 5:203ra124, 2013).
Во время эксперимента мышей содержали в стандартных лабораторных условиях, и им был разрешен доступ к пище и воде ad libitum. Исследование было одобрено местным Институциональным этическим комитетом по использованию лабораторных животных (CIEPAL Azur) (разрешительные документы # NCE-2012-52 и NCE-2015-225). В день 3 новорожденным мышам вводили 2,5 мг/кг меченного FLAG sFGFR3, как описано ранее (Garcia et al., Science Translational Medicine 5:203ra124, 2013). Контрольные пометы получали 10 мкл PBS, содержащего 50% глицерина (несущая среда). С 3 дня по 22 день мыши Fgfr3ach/+ получали 6 подкожных инъекций sFGFR3 или несущей среды. Через одну неделю после отъема в возрасте 4 недель обработанные и необработанные мыши были разделены на две группы и подвергнуты воздействию в течение 10 недель нормальной (ND, A03, SAFE) или диете с высоким содержанием жира (HFD, 52% ккал в виде жира, приготовленного на заказ, содержащего 54% липидов, SAFE), соответственно. После 6 часов голодания из хвостовой вены брали кровь. Гликемию измеряли с помощью глюкометра (Abbot) и содержание инсулина в сыворотке определяли с помощью ELISA (Mercodia). Тесты на толерантность к глюкозе (GTT) проводили на мышах после 10 недель потребления ND или HFD. Через 6 часов мышам натощак вводили внутрибрюшинный раствор глюкозы (1 г/кг). Кровь брали из хвостовой вены, и уровни глюкозы контролировали в течение некоторого времени, используя глюкометр или набор для анализа глюкозы EnzyChrom (BioAssay Systems). Уровни глюкозы были нормализованы к значению времени -15 мин для каждой мыши.
Косвенная калориметрия была изучена на мышах, потреблявших в течение 10 недель нормальную (ND) диету или диету с высокой жирностью (HFD). Как указано выше, мышей обрабатывали в течение периода выращивания 2,5 мг/кг sFGFR3 или несущей среды, подвергали диете в течение 2 недель и затем помещали в метаболические камеры. После 24 ч акклиматизации в отдельных метаболических камерах измеряли потребление O2 (VO2) и продукцию CO2 (VCO2) (Oxylet; Panlab-Bioseb) у отдельных мышей с 32-минутными интервалами в течение 24-часового периода с неограниченным доступом к пище, за которой следовала одна ночь без еды. Рассчитывали коэффициент дыхания и анализировали следующим образом: RQ=VCO2/VO2, RQ=1 соответствуют окислению углеводов, а RQ~0,7 соответствует окислению жира. Расход энергии (ккал/день/вес 0,75=1,44×VO2x [3,815+1,232×RQ]), углеводов (г/мин/кг 0,75=[4,55×VCO2]-[3,21×VO2]) и липидов (г/мин/кг 0,75=[1,67×VO2]-[1,67×VCO2]). Амбулаторные активности и выращивание мышей контролировали с помощью датчика веса или метода прерывания инфракрасного фотоэлемента (Oxylet; Panlab-Bioseb).
Состав тела определяли с помощью рентгеновской микро-КТ системы SkyScan 1178. Мышей четырех и 10 недель анестезировали и сканировали, используя те же параметры: 104 мкм размера пикселя, 49 кВ, алюминиевый фильтр толщиной 0,5 мм, шаг вращения 0,9°. Общий объем жировой ткани определяли между кончиком носа и концом хвоста, а объем брюшной полости определяли между поясничным L1 и крестцовым S1. Затем количественную оценку жировой ткани проводили более точно. Анализ состава тела основан на определении границ интересующей области после трехмерной реконструкции отсканированных изображений. Анализ трехмерных реконструкций выполняли с использованием программного обеспечения NRecon и CTAn (Skyscan).
После умерщвления животных взвешивали и собирали несколько тканей и органов (подкожная, эпидидимальная жировая ткань, печень, поджелудочная железа) для дальнейшего анализа с помощью гистохимии или qPCR. В некоторых группах мезенхимальные стволовые клетки, полученные из костного мозга, собирали путем промывки бедренных костей (Zhu et al., Nat Protoc 5:550-560, 2010).
Липидный профиль оценивали путем взятия внутрисердечной крови. Общий холестерин, триглицериды (TG), липопротеин высокой плотности (HDL) и липопротеин низкой плотности (LDL) измеряли в сыворотке с использованием анализатора Beckman AU 2700. Сыворотки анализировали на уровни белка в выбранных адипокинах, связанных с воспалением, ожирением, путем инсулина или FGF, с использованием массива мышей адипокинов (#ARY013, R&D Systems) в соответствии с инструкциями производителя по нитроцеллюлозным мембранам. После стрептавидин-HRP и хемилюминесцентного обнаружения белки, связанные с каждым захваченным антителом, определяли количественно с использованием денситометрии, и уровни сравнивали с процентным изменением у мышей WT.
Исследования мезенхимальных стволовых клеток
Мезенхимальные стволовые клетки выделяли из бедренного костного мозга, получая из необработанных или sFGFR3-обработанных мышей в возрасте от 6 до 8 недель путем промывки бедренных костей (Zhu et al., Nat. Protoc. 5:550-560, 2010) и культивировали до 80% слияния в среде с добавлением 10% сыворотки. Затем среду заменяли на адипогенную среду (DMEM F12 с добавлением 2% сыворотки, 1% антиобиотиков, 66 мМ инсулина, 1 нМ трийодтиронина, 100 мМ кортизола, 10 мкг/мл трансферрина и 3 мкМ росиглитазона в DMEM-F12). Тотальные РНК экстрагировали с использованием реагента Trizol (Life Technologies) и хлороформа (Sigma). Один микрограмм тотальной РНК обратно транскрибировали в кДНК с использованием случайных гексамеров и набора обратной транскриптазы Superscript II (Invitrogen). qPCR в реальном времени выполняли в системе PCR в реальном времени StepOne Plus (Applied Biosystems) с Fast SYBR Green Master Mix (Sigma) с использованием специального RT2 Profiler PCR Array (CAPM13080). Исследуемые гены перечислены в таблице 1. Экспрессия генов была нормализована по гену «домашнего хозяйства» HPRT, RPL13a и RPL6. Экспрессию FGFR проводили с использованием следующих праймеров: FGFR1, For-5' CAGATGCACTCCCATCCTCG 3' Rev-5' TCT GGGGATGTCCAGTAGGG 3'; FGFR2 For-5' TGGCAGTGAAGATGTTGAAAG 3' Rev-5' ATCATCTTCATCATCTCCATCTCTTG 3'; FGFR3 For-5' TTATCCTTGGCTCCTGGGTG 3' Rev-5' CTGGAAGGTAGCAGTGGGAA 3'; FGFR4 For-5' GCTCGGAGGTAGAGGTCTTGT 3' Rev-5' CCACGCTGACTGGTAGGAA 3'; HSP90 For-5' TTTGGTGGACACAGGCATTG 3' Rev-5' CAAACTGCCCGATCATGGAG 3'.
Таблица 1. Перечень генов, исследованных с использованием RT2 Profiler PCR Array в мезенхимальных стволовых клетках
В экспериментах по передаче сигналов инсулина через 24 ч после выделения клетки истощали в течение 6 ч, а затем стимулировали 50 нМ инсулина в течение 0, 5, 15, 30 мин или 0, 1, 10, 50, 100 нМ в течение 5 мин. Клеточные экстракты обрабатывали для Вестерн-блот анализа. Для этого клетки лизировали в буфере для лизиса RIPA (Millipore) и гомогенизировали в течение 30 минут с использованием вихревого перемешивания. Белки осаждали центрифугированием при 1400 g в течение 15 минут, и содержание тотального белка оценивали с использованием набора для анализа белка BCA (ThermoScientific). Образцы разбавляли в буфере для уменьшения количества образцов (Life Technology), кипятили и обрабатывали для иммуноблоттинга с использованием стандартной процедуры. Моноклональные антитела использовали следующим образом: анти-р44/42 МАРК (Erk1/2) (4695S, Cell Signaling), анти-фосфо-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (4370S, Cell Signaling). Результаты были нормализованы к экспрессии HSP90 (4877S, Cell Signaling).
Гистология и иммуногистохимия
Гистологический анализ проводили на жировой ткани, печени и поджелудочной железе у мышей возраста 12 недель. Органы фиксировали в 4% формалине в течение 24 часов, добавляли по каплям в парафин и срезы толщиной 5 мкм окрашивали гематоксилином и эозином. Диаметры адипоцитов измеряли в одном или двух разных срезах в каждом образце (от 100 до 300 адипоцитов подсчитывали в каждом сечении).
Количество и площадь островков поджелудочной железы измеряли в одном сечении с использованием системы Fiji Image J (площадь островков была нормализована к общей площади поджелудочной железы). Содержание гликогена в печени оценивали путем окрашивания перйодной кислотой по Шиффу (PAS). Иммуногистохимию выполняли на 5 мкм срезах поджелудочной железы. Срезы блокировали в течение 45 минут PBS с 1% BSA, инкубировали в течение ночи во влажной камере с моноклональным первичным антителом против инсулина (4 мкг/мл) (Santa Cruz, sc-9168), поликлональным антителом против глюкагона (4 мкг/мл) (Santa Cruz, sc-7779) и 1 ч с вторичным антителом Alexa Fluor 594 (2 мкг/мл) (Life Technologies, A-21442) и вторичным антителом Alexa Fluor 488 (4 мкг/мл) (Life Technologies, A-21467). Срезы окрашивали раствором DAPI (Santa Cruz), обрабатывали реагентом для устранения флуоресценции и визуализировали под флуоресцентной микроскопией. Окрашивание без вторичных антител использовали в качестве отрицательного контроля.
Статистический анализ
Статистический анализ проводили с помощью программного обеспечения GraphPad Prism 6.0. Данные были выражены как среднее значение±стандартное отклонение. Чтобы проверить нормальность и равенство дисперсии, были выполнены тест нормальности Агостино и Пирсона (а= 0,05), тест нормальности Шапиро-Уилка (а=0,05) и тест нормальности KS (а=0,05). Значимость определяли с помощью непарного двустороннего критерия Стьюдента или критерия множественного сравнения Тьюки. Необработанные результаты роста и ИМТ пациентов были преобразованы в возрастной z-показатель из среднего значения в контрольной популяции с использованием контрольных данных. Ожидаемый средний результат этих значений в здоровой популяции равен 0. Значения P <0,05 считались значимыми (*P <0,05; **P <0,01; ***P <0,001).
Пример 2:
Развитие избытка брюшной жировой ткани у пациентов с ахондроплазией без классических осложнений
Пациентами были дети и подростки с ахондроплазией. Они были включены в продольное ретроспективное исследование, проводимое одним и тем же наблюдателем в среднем в течение 8,6±5,6 лет. Антропометрические показатели и состав тела регистрировались с рождения во время последующих посещений и сравнивались между тремя возрастными группами в возрасте от [0-3], [4-8] и [9-18] лет. Несколько метаболических показателей крови измерялись и сравнивались в разных возрастных группах. Показатели крови при визитах в возрасте до 3 лет не рассматривались из-за сложности ограничения потребления пищи у детей и, следовательно, контроля метаболических параметров в этом раннем возрасте.
Известно, что пациенты с ахондроплазией не только демонстрируют нарушения роста, но также имеют тенденцию набирать избыточный вес, что приводит к избыточному весу или даже ожирению (Hoover-Fong et al., Am. J. Med. Genet. A. 143A:2227-2235, 2007). Как видно на фиг. 1А, ИМТ пациентов с ахондроплазией значительно увеличился в детстве, достигнув значения приблизительно 30 кг/м2 в группе [9-18] лет (р=0,2407 между группами [0-3] и [4-8], P <0,0001, сравнивая группу [9-18] с обеими другими группами, тест множественных сравнений Тьюки). Отрицательная корреляция наблюдалась между ИМТ и ростом (коэффициент Пирсона r=-0,5660, р=0,0021), при этом у самых маленьких детей был самый высокий ИМТ. Для изучения их метаболического статуса и его эволюции сначала были проведены денситометрические анализы, чтобы определить распределение телесного жира и нежировой массы в разных возрастных группах (фиг. 1B). Авторы изобретения наблюдали, что в возрасте до 8 лет отношение общего содержания жировой:нежировой массы было относительно постоянным и что оно значительно возрастало в подростковом возрасте, от 0,21±0,02 и 0,20±0,05 в возрастных группах [0-3] и [4-8] до 0,84±0,29 в возрастной группе [9-18], соответственно (P=0,9954 между группами [0-3] и [4-8], P=0,0053 и P <0,0001 при сравнении возрастных групп [9-18] с [0-3] и [4-8], соответственно, критерий множественных сравнений Тьюки (таблица 2).
Таблица 2. Результаты денситометрии ахондроплазии пациентов в трех возрастных группах. Значения являются средними±SD (диапазон). Значения p представляют значимость разницы между тремя группами (односторонний тест ANOVA, с последующими множественными сравнительными тестами Тьюки, ns=несущественный). Результаты последующего анализа: значительное различие между [0-3] и [4-8] группами; b существенное различие между группами [0-3] и [9-18]; с существенное различие между группами [4-8] и [9-18].
(% от общей массы тела)
Интересно, что, как видно на фиг. 1C, увеличение жировой массы не было однородным, и у пациентов преимущественно развивалась брюшная (андроидная) жировая масса (+204%) по сравнению с бедренной (гиноидной) жировой массой (+55%) (P=0,0974 между группами [0-3] и [4-8], P=0,0002 и P=0,001, при сравнении возрастных групп [9-18] с [0-3] и [4-8], соответственно, критерий множественных сравнений Тьюки). Одновременно, массы как андроидов, так и гиноидов не изменялись в течение этого периода (таблица 1). Следовательно, соотношение жировая:нежировая масса значительно увеличивалось в брюшной области на протяжении всего детства (P=0,3187 между группами [0-3] и [4-8], P=0,0924 и P <0,0001 при сравнении возрастных групп [9-18] с [0-3] и [4-8], соответственно, критерий множественных сравнений Тьюки). Туловище, ноги и руки следовали очень похожей тенденции: увеличение массы жира в процентах и уменьшение нежировой массы в процентах с младенчества до зрелого возраста (таблица 1). Минеральную плотность позвоночника (BMD) определяли между L1 и L4 после 3-х лет. В обеих возрастных группах было установлено, что BMD ниже соответствующего нормального диапазона возраста (van der Sluis et al., Arch. Dis. Child. 87:341-347, 2002) (0,511±0,065 г/см2 и 0,898±0,223 г/см2 в возрастных группах [4-8] и [9-18], соответственно, по сравнению с 0,645±0,071 г/см2 и 0,913±0,199 г/см2 в тех же возрастных группах).
Было произведено сравнение различных показателей крови между возрастными группами [4-8] и [9-18]. Неожиданно в обеих возрастных группах и независимо от их ИМТ дети с ахондроплазией имели тенденцию к низкому плазменному общему холестерину (3,38±0,36 ммоль/л и 3,73±0,44 ммоль/л в возрастных группах [4-8] и [9-18]), соответственно, с нормальными значениями, составляющими от 3,90 до 5,70 ммоль/л у детей), и низкими триглицеридами (0,56±0,14 ммоль/л и 0,63±0,13 ммоль/л в возрастных группах [4-8] и [9-18], соответственно, с нормальными значениями от 0,60 до 1,70 ммоль/л у детей). Точно так же уровни глюкозы в крови натощак (фиг. 1D) и уровни инсулина не увеличивались с возрастом и оставались в пределах нормы (7,3±5,4 мЕд/л и 13,4±3,4 мЕд/л в возрастных группах [4-8] и [9-18]), соответственно, с нормальными значениями от 2,6 до 16 мМЕ/л у детей). Эти результаты были подтверждены уровнями глюкозы, полученными во время перорального теста на толерантность к глюкозе (OGTT), которые показали нормальные уровни глюкозы через 0, 30 и 120 минут после перорального введения (4,53±0,22 ммоль/л на 0 минуте, 7,97±1,72 ммоль/л на 30 мин и 5,17 ммоль/л на 120 мин). Статистических различий между возрастными группами обнаружено не было. Из-за высокого уровня гемолиза во время OGTT, к сожалению, не было данных об уровне инсулина.
Все остальные показатели крови были в пределах нормы (данные не показаны).
Метаболические изменения наблюдаются у худых и тучных мышей Fgfr3ach/+ и корректируются лечением sFGFR3
Чтобы определить роль FGFR3ach в этом преимущественном развитии висцерального ожирения при ахондроплазии, трансгенных мышей Fgfr3ach/+, несущих мутацию G380R, или их однопометных дикого типа (WT) обрабатывали sFGFR3 или несущей средой в течение 3 недель, начиная с 3 дня. Затем мышей содержали на нормальной (ND) или диете с высоким содержанием жира (HFD), начиная с 4-недельного возраста, в течение 10 недель для оценки развития ожирения.
После отъема в возрасте 4 недель, как и ожидалось, у необработанных мышей Fgfr3ach/+ масса тела снизилась на 20,4% по сравнению с их однопометными WT. Это было связано со снижением нежировой и жировой ткани (50% и 33,9%, соответственно). Обработанные животные показали снижение массы тела на 14,1% по сравнению с мышами WT (P <0,0001).
После 10 недель диеты во всех группах с HFD отмечалось значительное увеличение массы тела по сравнению с ND (фиг. 2А). Интересно, однако, что состав тела был различным у обоих генотипов. У необработанных мышей Fgfr3ach/+ было более высокое соотношение нежировой и жировой массы живота, измеренное между L1 и S1, по сравнению с мышами WT, независимо от рациона (фиг. 2B). При кормлении ND у необработанных мышей Fgfr3ach/+ было меньше эпидидимальной (висцеральной) и подкожной жировой ткани, чем у животных WT (фиг. 2C и 2D). Однако после 10 недель потребления HFD у необработанных мышей Fgfr3ach/+ развивалось больше эпидидимальной жировой ткани по сравнению с животными WT, у которых преимущественно развивалось подкожное жировое депо (фиг. 2C и 2D). Эти данные показали, что, как и пациенты с ахондроплазией, мыши Fgfr3ach/+ были склонны к развитию висцеральной жировой ткани.
Лечение sFGFR3 не влияет на увеличение массы тела (фиг. 2A). Тем не менее, на состав тела существенное влияние оказало лечение sFGFR3 со значительным снижением соотношения абдоминальных нежировой:жировой масс у мышей, получавших ND (фиг. 2B), вызванных уменьшением нежировой массы и увеличением жировой массы, соответственно. Очень интересно, что у мышей Fgfr3ach/+, получавших sFGFR3, наблюдались распределения жировых отложений, которые были такими же, как у животных WT, независимо от того, получали ли они ND или HFD (фиг. 2C и 2D).
После потребления HFD гистологический анализ показал меньше адипоцитов в подкожной области и увеличенную долю этих небольших адипоцитов у необработанных мышей Fgfr3ach/+ по сравнению с WT (фиг. 2E и 2G). В эпидидимальных адипоцитах не было обнаружено различий в размере или дисперсии между обоими генотипами (фиг. 2F и 2H). Лечение sFGFR3 позволило восстановить размер и рассеяние подкожных адипоцитов и индуцировало небольшое увеличение размера эпидидимальных адипоцитов (фиг. 2E-2H). Поскольку увеличение доли мелких жировых клеток было связано с воспалением (Kursawe et al., Diabetes 59: 2288-2296, 2010; и Lafontan, Diabetes Metab. 40:16-28, 2014), было измерено несколько циркулирующих адипокинов для оценки степени системного воспаления у этих животных (фиг. 6А и 6В). Адипокины были разделены на четыре категории - провоспалительные, связанные с ожирением, инсулиновый путем и FGF - все это был увеличено у трансгенных мышей по сравнению с однопометными животными WT (таблица 3). Необработанные мыши Fgfr3ach/+ имели низкую степень исходного воспаления по сравнению с животными WT, которое усугублялось при осуществлении HFD (таблица 3). Леченые животные Fgfr3ach/+ при ND или HFD имели системный профиль, который напоминал профиль их однопометников WT. In vitro мезенхимальные стволовые клетки (МСК), выделенные от мышей Fgfr3ach/+, показали, что ранние и промежуточные гены процесса дифференцировки, такие как Srebf-1, CEBP/d, CEPB/a и PPARg, уже были экспрессированы (фиг. 3A). Очень интересно, что MSC, выделенные из мышей Fgfr3ach/+, обработанных sFGFR3, показали значительное увеличение антиадипогенных маркеров и активационных маркеров в коричневой жировой ткани, а также снижение экспрессии генов, участвующих в функциях зрелых адипоцитов (фиг. 3А). Вместе с данными in vivo это свидетельствует о предрасположенности к адипогенезу у мышей Fgfr3ach/+, который можно предотвратить путем лечения с помощью sFGFR3.
Таблица 3. Необработанные мыши Fgfr3ach/+ показывали повышенный исходный уровень воспаления, предотвращенный лечением sFGFR3. Провоспаление, ожирение, путь инсулина и экспрессию циркулирующих FGF адипокинов выполняли на мышах WT и Fgfr3ach/+, обработанных несущей средой, и на мышах Fgfr3ach/+, обработанных sFGFR3, после 10 недель получения ND или HFD. «-»=<2 «+»=10-30 A.U., «++»=30-100 A.U., «+++»> 100 A.U.
По сравнению с их однопометными WT мыши, несущие мутацию FGFR3, имели низкую гликемию натощак и очень низкие исходные уровни инсулина (фиг. 4A). При потреблении HFD диеты (фиг. 4B) уровни гликемии повышались, но оставались ниже, чем у животных WT. Уровень инсулина оставался крайне низким. У обработанных sFGFR3 животных Fgfr3ach/+ гликемия была восстановлена, и уровни инсулина значительно увеличились по сравнению с необработанными мышами Fgfr3ach/+ (фиг. 4A и 4B).
Чтобы оценить развитие непереносимости глюкозы, после 10 недель диеты были выполнены тесты на толерантность к глюкозе (GTT). Необработанные мыши Fgfr3ach/+ демонстрировали более высокие уровни глюкозы и AUC по сравнению с их однопометными WT (Cmax 320,9±32,0 мг/дл и 273,3±23,9 мг/дл, AUC 1,2×104±0,7×104 и 1,7×104±0,4×104, соответственно), показывая некоторые непереносимость базальной глюкозы даже при ND. Это еще более усугублялось при HFD (фиг. 4C). Когда мышей Fgfr3ach/+ обрабатывали 2,5 мг/кг sFGFR3, нормальные ответы GTT восстанавливались (фиг. 4C). Авторы изобретения попытались выполнить тест на толерантность к инсулину у трансгенных мышей, потреблявших ND или HFD, но из-за более низкого исходного уровня гликемии мыши Fgfr3ach/+ не выдерживали инъекцию инсулина и быстро погибали. Анализ чувствительности к инсулину мезенхимальных стволовых клеток, выделенных от мышей Fgfr3ach/+ или WT, не выявил различий в уровнях фосфорилирования Erk1/2, что свидетельствует о сходном ответе на стимуляцию инсулином у мышей обоих типов (фиг. 3B). Эти результаты показывают, что мыши Fgfr3ach/+ не кажутся более чувствительными к регуляции инсулина, но что инъекция инсулина во время ITT, вероятно, вызывала летальную гипогликемию из-за их низкой исходной гликемии. Анализы поджелудочной железы показали меньшее и большее количество островков Лангерганса с более низким содержанием инсулина и глюкагона у необработанных мышей Fgfr3ach/+ (фиг. 4D), что свидетельствует об изменении выработки и/или аккумуляции инсулина. Это частично восстанавливалось у обработанных животных (фиг. 3B и 4A-4C). Аккумуляция глюкозы также оказалась нарушенной в печени необработанных животных Fgfr3ach/+, о чем свидетельствует уменьшение гликогена в срезах печени (фиг. 4E). Как и ожидалось, после 10 недель потребления HFD у мышей WT развивался макровезикулярный стеатоз III степени с более чем 75% гепатоцитов, которые имели липидные вакуоли, которые были больше, чем ядро (фиг. 4E). Напротив, после 10 недель HFD у необработанных мышей Fgfr3ach/+ развивались обратимые доброкачественные узелки в печени (фиг. 4F) и микровезикулярный стеатоз II степени: менее чем у 50% гепатоцитов обнаруживались небольшие вакуоли (фиг. 4E). Напротив, после 10 недель HFD у необработанных мышей Fgfr3ach/+ развивались обратимые доброкачественные узелки в печени (фиг. 4F) и микровезикулярный стеатоз II степени: менее чем у 50% гепатоцитов обнаруживались небольшие вакуоли (фиг. 4E). Интересно, что обработка sFGFR3 восстановила нормальный печеночный ответ у обработанных мышей Fgfr3ach/+ (фиг. 4E), и никаких узелков не наблюдалось.
Скорость метаболизма базальной энергии у мышей Fgfr3ach/+ оценивали с помощью непрямой калориметрии. Авторы изобретения обнаружили, что в то время как животные с WT без жировых отложений, которые потребляли нормальную диету (ND), получали энергию из источников углеводов (дыхательный коэффициент RQ приблизительно 1), мыши с трансгенной ахондроплазией получали свою энергию в основном из источников липидов (RQ приблизительно 0,7) (фиг. 5A). В эпизоде голодания, как и ожидалось, оба типа животных черпали свою энергию из источников липидов. Это предпочтительное использование липидов было подтверждено расчетом окисления углеводов и липидов, которые были соответственно ниже и выше у мышей Fgfr3ach/+ по сравнению с животными WT (фиг. 5B). В течение 24-часового периода мыши Fgfr3ach/+ имеют тенденцию постоянно питаться не только в течение ночного периода, однако расход энергии и потребление пищи существенно не различались между обоими генотипами (фиг. 7A-D). Как и ожидалось при HFD, все животные черпали свою энергию из источников липидов, что приводило к сходным показателям окисления углеводов и липидов (фиг. 5C-D, фиг. 7E-H). Очень интересно, что животные Fgfr3ach/+, которые получали лечение sFGFR3 в течение периода роста, вели себя как необработанные мыши WT после отлучения от материнского молока, независимо от того, потребляли ли они ND или HFD, предполагая восстановление способности метаболизма глюкозы в течение периода лечения (фиг. 5 и фиг. 7A-H).
Различия в отложении жировой ткани в разных участках тела могут быть оценены для оценки тяжести ожирения при ахондроплазии. По сравнению с z-показателями ИМТ и измерениями кожной складки соотношение андроид:гиноид тесно связано со всеми факторами риска у детей с избыточным весом и ожирением. При ахондроплазии у детей наблюдается более высокое соотношение андроид:гиноид, которое развивается очень рано в детстве. Результаты, полученные авторами изобретения, на мышах Fgfr3ach/+ свидетельствуют о предрасположенности к преимущественному висцеральному ожирению у этих пациентов. Действительно, клетки, происходящие из мезенхимной линии, оказались более склонными к адипогенезу, чем клетки, выделенные от животных WT, и, по-видимому, предварительно вовлечены в процесс дифференцировки в сторону адипоцитов. Более того, различное распределение адипоцитов наблюдалось с большей долей мелких адипоцитов в подкожной жировой ткани мышей Fgfr3ach/+ по сравнению с животными WT. Количество жировых клеток устанавливается в детстве и подростковом возрасте и остается постоянным в зрелом возрасте. Ожирение у пациентов с ахондроплазией может быть установлено очень рано в детском возрасте, и мониторинг в возрасте 4-8 лет, например, с помощью DXA-сканирования, может быть оправданным.
Развитие абдоминального ожирения обычно считается наиболее вредным типом ожирения (Smith, J. Clin. Invest. 125:1790-1792, 2015). Результаты, полученные авторами изобретения, показывают, что абдоминальное ожирение, вероятно, является следствием мутации, влияющей на FGFR3. В настоящее время три члена семейства FGF связаны с ожирением (Nies et al., Front. Endocrinol. (Lausanne) 6:193, 2015): FGF1, FGF15/19 и FGF21. FGF1 регулируется PPARg и заметно повышен в WAT (28). Известно, что FGF1 способствует пролиферации и дифференцировке преадипоцитов посредством передачи сигналов Erk1/2. Он также вызывает острый эффект снижения крови, который, по-видимому, зависит от передачи сигналов FGFR2 в WAT. FGF15/19 рассматривается как регулятор ответов на кормление. Он связывается с FGFR4/bklotho рецепторным комплексом на клеточной мембране гепатоцитов, что в конечном итоге приводит к репрессии глюконеогенеза (Tomlinson et al., Endocrinology 143:1741-1747, 2002). FGF21 в основном связывается с FGFR1 и регулирует адаптивный ответ на голодание через PPARa (Kharitonenkov et al., J. Clin. Invest. 115:1627-1635, 2005). У мышей Fgfr3ach/+ избыточная экспрессия FGFR3ach во время эмбриогенеза может модифицировать передачу сигналов FGF в клетках разных типов. В соответствии с этим авторы изобретения обнаружили, что мезенхимальные стволовые клетки мышей Fgfr3ach/+ экспрессируют высокие уровни FGFR3 по сравнению с их однопометными животными WT. Сходным образом, новорожденные мыши Fgfr3ach/+ экспрессируют повышенные уровни FGFR2 и FGFR4 в AT и печени. В целом эти данные могут объяснить низкую гликемию, связанную с абдоминальным ожирением у мышей Fgfr3ach/+. Вдоль этой линии мы также наблюдали, что пациенты даже имели тенденцию к снижению гликемии натощак и инсулинемии, и ни у одного пациента не было непереносимости глюкозы, предполагая, что подобные механизмы могут применяться у человека.
Лечение sFGFR3 применялось сразу после рождения и предотвращало большинство метаболических осложнений, включая развитие абдоминального ожирения. Обработанные мыши Fgfr3ach/+ не были защищены от ожирения как такового, но ведут себя по существу как животные WT с развитием гомогенного ожирения и восстановлением метаболизма глюкозы, приводящим к устойчивости к глюкозе при HFD. Это говорит о том, что при применении в раннем возрасте лечение могло бы обратить эффект мутации Fgfr3ach на эти атипичные метаболические ткани.
В заключение, данные авторов изобретения подтверждают, что развитие несоответствующего ожирения является преимущественно абдоминальным и, по-видимому, запускается мутацией FGFR3. Данные авторов изобретения также показывают, что лечение ахондропластических пациентов с аномальным отложением висцерального жира может применяться к другим группам пациентов с аномальным отложением висцерального жира и вытекающими из этого состояниями. Пациентов с нарушениями задержки роста скелета можно лечить для контроля анормального отложения висцерального жира и связанных с ним состояний, например, после завершения роста костей, когда полипептиды sFGFR3 в противном случае не считались бы подходящей терапией. Пациенты могут также извлечь выгоду из мониторинга сопутствующих заболеваний, таких как диабет и риск сердечно-сосудистых заболеваний.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Все публикации, патенты и заявки на патенты, упомянутые в вышеприведенном описании, тем самым включены посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент специально и отдельно указывались для включения в качестве ссылки во всей своей полноте.
Различные модификации и вариации описанных способов, фармацевтических композиций и наборов по изобретению будут очевидны для специалистов в данной области без отступления от объема и сущности изобретения. Хотя изобретение было описано в связи с конкретными вариантами осуществления, следует понимать, что возможны дальнейшие модификации и что заявленное изобретение не должно чрезмерно ограничиваться такими конкретными вариантами осуществления. Действительно, различные модификации описанных способов осуществления изобретения, которые очевидны для специалистов в данной области техники, должны находиться в пределах объема изобретения. Эта заявка предназначена для охвата любых вариаций, применений или адаптаций изобретения, соответствующих, в общем, принципам изобретения и включающих такие отступления от настоящего изобретения, в рамках известной обычной практики в области техники, к которой относится изобретение, и может быть применимы к существенным признакам здесь, прежде чем изложить.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> THERACHON
INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE
(INSERM)
<120> ЛЕЧЕНИЕ АНОМАЛЬНОГО ОТЛОЖЕНИЯ ВИСЦЕРАЛЬНОГО ЖИРА С ИСПОЛЬЗОВАНИЕМ
РАСТВОРИМЫХ ПОЛИПЕПТИДОВ РЕЦЕПТОРА 3 ФАКТОРА РОСТА ФИБРОБЛАСТОВ
(SFGFR3)
<130> 51088-011WO2
<150> US 61/561140
<151> 2017-09-20
<160> 53
<170> PatentIn version 3.5
<210> 1
<211> 672
<212> белок
<213> Homo sapiens
<400> 1
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
290 295 300
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
305 310 315 320
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
325 330 335
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
340 345 350
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
355 360 365
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
370 375 380
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
385 390 395 400
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
405 410 415
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
420 425 430
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
435 440 445
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
450 455 460
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
465 470 475 480
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
485 490 495
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
500 505 510
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
515 520 525
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
530 535 540
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
545 550 555 560
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
565 570 575
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
580 585 590
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
595 600 605
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
610 615 620
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
625 630 635 640
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
645 650 655
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
660 665 670
<210> 2
<211> 526
<212> белок
<213> Искусственная последовательность
<220>
<223> sFGFR3
<400> 2
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
290 295 300
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
305 310 315 320
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
325 330 335
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
340 345 350
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
355 360 365
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
370 375 380
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
385 390 395 400
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
405 410 415
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
420 425 430
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
435 440 445
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
450 455 460
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
465 470 475 480
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
485 490 495
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
500 505 510
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp
515 520 525
<210> 3
<211> 418
<212> белок
<213> Искусственная последовательность
<220>
<223> sFGFR3
<400> 3
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
290 295 300
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
305 310 315 320
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
325 330 335
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
340 345 350
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
355 360 365
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
370 375 380
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
385 390 395 400
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
405 410 415
Leu Tyr
<210> 4
<211> 301
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
290 295 300
<210> 5
<211> 349
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
340 345
<210> 6
<211> 301
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Ser Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
290 295 300
<210> 7
<211> 512
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Ser Gly Ser
290 295 300
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Val Val Phe Pro
305 310 315 320
Tyr Phe Pro Arg Leu Gly Arg Tyr Asn Leu Asn Phe His Glu Ala Gln
325 330 335
Gln Ala Cys Leu Asp Gln Asp Ala Val Ile Ala Ser Phe Asp Gln Leu
340 345 350
Tyr Asp Ala Trp Arg Gly Gly Leu Asp Trp Cys Asn Ala Gly Trp Leu
355 360 365
Ser Asp Gly Ser Val Gln Tyr Pro Ile Thr Lys Pro Arg Glu Pro Cys
370 375 380
Gly Gly Gln Asn Thr Val Pro Gly Val Arg Asn Tyr Gly Phe Trp Asp
385 390 395 400
Lys Asp Lys Ser Arg Tyr Asp Val Phe Cys Phe Thr Ser Asn Phe Asn
405 410 415
Gly Arg Phe Tyr Tyr Leu Ile His Pro Thr Lys Leu Thr Tyr Asp Glu
420 425 430
Ala Val Gln Ala Cys Leu Asn Asp Gly Ala Gln Ile Ala Lys Val Gly
435 440 445
Gln Ile Phe Ala Ala Trp Lys Ile Leu Gly Tyr Asp Arg Cys Asp Ala
450 455 460
Gly Trp Leu Ala Asp Gly Ser Val Arg Tyr Pro Ile Ser Arg Pro Arg
465 470 475 480
Arg Arg Cys Ser Pro Thr Glu Ala Ala Val Arg Phe Val Gly Phe Pro
485 490 495
Asp Lys Lys His Lys Leu Tyr Gly Val Tyr Cys Phe Arg Ala Tyr Asn
500 505 510
<210> 8
<211> 784
<212> белок
<213> Homo sapiens
<400> 8
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Ala Glu Glu Glu Leu Val Glu Ala Asp Glu Ala Gly Ser Val Tyr Ala
340 345 350
Gly Ile Leu Ser Tyr Gly Val Gly Phe Phe Leu Phe Ile Leu Val Val
355 360 365
Ala Ala Val Thr Leu Cys Arg Leu Arg Ser Pro Pro Lys Lys Gly Leu
370 375 380
Gly Ser Pro Thr Val His Lys Ile Ser Arg Phe Pro Leu Lys Arg Gln
385 390 395 400
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
405 410 415
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
420 425 430
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
435 440 445
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
450 455 460
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
465 470 475 480
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
485 490 495
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
500 505 510
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
515 520 525
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
530 535 540
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
545 550 555 560
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
565 570 575
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
580 585 590
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
595 600 605
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
610 615 620
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
625 630 635 640
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
645 650 655
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
660 665 670
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
675 680 685
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
690 695 700
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
705 710 715 720
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
725 730 735
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
740 745 750
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
755 760 765
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
770 775 780
<210> 9
<211> 784
<212> белок
<213> Homo sapiens
<400> 9
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Ala Glu Glu Glu Leu Val Glu Ala Asp Glu Ala Gly Ser Val Tyr Ala
340 345 350
Gly Ile Leu Ser Tyr Arg Val Gly Phe Phe Leu Phe Ile Leu Val Val
355 360 365
Ala Ala Val Thr Leu Cys Arg Leu Arg Ser Pro Pro Lys Lys Gly Leu
370 375 380
Gly Ser Pro Thr Val His Lys Ile Ser Arg Phe Pro Leu Lys Arg Gln
385 390 395 400
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
405 410 415
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
420 425 430
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
435 440 445
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
450 455 460
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
465 470 475 480
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
485 490 495
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
500 505 510
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
515 520 525
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
530 535 540
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
545 550 555 560
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
565 570 575
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
580 585 590
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
595 600 605
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
610 615 620
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
625 630 635 640
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
645 650 655
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
660 665 670
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
675 680 685
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
690 695 700
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
705 710 715 720
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
725 730 735
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
740 745 750
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
755 760 765
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
770 775 780
<210> 10
<211> 2016
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
gagtccttgg ggacggagca gcgcgtcgtg gggcgagcgg cagaagtccc gggcccagag 60
cccggccagc aggagcagtt ggtcttcggc agcggggatg ctgtggagct gagctgtccc 120
ccgcccgggg gtggtcccat ggggcccact gtctgggtca aggatggcac agggctggtg 180
ccctcggagc gtgtcctggt ggggccccag cggctgcagg tgctgaatgc ctcccacgag 240
gactccgggg cctacagctg ccggcagcgg ctcacgcagc gcgtactgtg ccacttcagt 300
gtgcgggtga cagacgctcc atcctcggga gatgacgaag acggggagga cgaggctgag 360
gacacaggtg tggacacagg ggccccttac tggacacggc ccgagcggat ggacaagaag 420
ctgctggccg tgccggccgc caacaccgtc cgcttccgct gcccagccgc tggcaacccc 480
actccctcca tctcctggct gaagaacggc agggagttcc gcggcgagca ccgcattgga 540
ggcatcaagc tgcggcatca gcagtggagc ctggtcatgg aaagcgtggt gccctcggac 600
cgcggcaact acacctgcgt cgtggagaac aagtttggca gcatccggca gacgtacacg 660
ctggacgtgc tggagcgctc cccgcaccgg cccatcctgc aggcggggct gccggccaac 720
cagacggcgg tgctgggcag cgacgtggag ttccactgca aggtgtacag tgacgcacag 780
ccccacatcc agtggctcaa gcacgtggag gtgaatggca gcaaggtggg cccggacggc 840
acaccctacg ttaccgtgct caaggtgtcc ctggagtcca acgcgtccat gagctccaac 900
acaccactgg tgcgcatcgc aaggctgtcc tcaggggagg gccccacgct ggccaatgtc 960
tccgagctcg agctgcctgc cgaccccaaa tgggagctgt ctcgggcccg gctgaccctg 1020
ggcaagcccc ttggggaggg ctgcttcggc caggtggtca tggcggaggc catcggcatt 1080
gacaaggacc gggccgccaa gcctgtcacc gtagccgtga agatgctgaa agacgatgcc 1140
actgacaagg acctgtcgga cctggtgtct gagatggaga tgatgaagat gatcgggaaa 1200
cacaaaaaca tcatcaacct gctgggcgcc tgcacgcagg gcgggcccct gtacgtgctg 1260
gtggagtacg cggccaaggg taacctgcgg gagtttctgc gggcgcggcg gcccccgggc 1320
ctggactact ccttcgacac ctgcaagccg cccgaggagc agctcacctt caaggacctg 1380
gtgtcctgtg cctaccaggt ggcccggggc atggagtact tggcctccca gaagtgcatc 1440
cacagggacc tggctgcccg caatgtgctg gtgaccgagg acaacgtgat gaagatcgca 1500
gacttcgggc tggcccggga cgtgcacaac ctcgactact acaagaagac aaccaacggc 1560
cggctgcccg tgaagtggat ggcgcctgag gccttgtttg accgagtcta cactcaccag 1620
agtgacgtct ggtcctttgg ggtcctgctc tgggagatct tcacgctggg gggctccccg 1680
taccccggca tccctgtgga ggagctcttc aagctgctga aggagggcca ccgcatggac 1740
aagcccgcca actgcacaca cgacctgtac atgatcatgc gggagtgctg gcatgccgcg 1800
ccctcccaga ggcccacctt caagcagctg gtggaggacc tggaccgtgt ccttaccgtg 1860
acgtccaccg acgagtacct ggacctgtcg gcgcctttcg agcagtactc cccgggtggc 1920
caggacaccc ccagctccag ctcctcaggg gacgactccg tgtttgccca cgacctgctg 1980
cccccggccc cacccagcag tgggggctcg cggacg 2016
<210> 11
<211> 1579
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
gagtccttgg ggacggagca gcgcgtcgtg gggcgagcgg cagaagtccc gggcccagag 60
cccggccagc aggagcagtt ggtcttcggc agcggggatg ctgtggagct gagctgtccc 120
ccgcccgggg gtggtcccat ggggcccact gtctgggtca aggatggcac agggctggtg 180
ccctcggagc gtgtcctggt ggggccccag cggctgcagg tgctgaatgc ctcccacgag 240
gactccgggg cctacagctg ccggcagcgg ctcacgcagc gcgtactgtg ccacttcagt 300
gtgcgggtga cagacgctcc atcctcggga gatgacgaag acggggagga cgaggctgag 360
gacacaggtg tggacacagg ggccccttac tggacacggc ccgagcggat ggacaagaag 420
ctgctggccg tgccggccgc caacaccgtc cgcttccgct gcccagccgc tggcaacccc 480
actccctcca tctcctggct gaagaacggc agggagttcc gcggcgagca ccgcattgga 540
ggcatcaagc tgcggcatca gcagtggagc ctggtcatgg aaagcgtggt gccctcggac 600
cgcggcaact acacctgcgt cgtggagaac aagtttggca gcatccggca gacgtacacg 660
ctggacgtgc tggagcgctc cccgcaccgg cccatcctgc aggcggggct gccggccaac 720
cagacggcgg tgctgggcag cgacgtggag ttccactgca aggtgtacag tgacgcacag 780
ccccacatcc agtggctcaa gcacgtggag gtgaatggca gcaaggtggg cccggacggc 840
acaccctacg ttaccgtgct caaggtgtcc ctggagtcca acgcgtccat gagctccaac 900
acaccactgg tgcgcatcgc aaggctgtcc tcaggggagg gccccacgct ggccaatgtc 960
tccgagctcg agctgcctgc cgaccccaaa tgggagctgt ctcgggcccg gctgaccctg 1020
ggcaagcccc ttggggaggg ctgcttcggc caggtggtca tggcggaggc catcggcatt 1080
gacaaggacc gggccgccaa gcctgtcacc gtagccgtga agatgctgaa agacgatgcc 1140
actgacaagg acctgtcgga cctggtgtct gagatggaga tgatgaagat gatcgggaaa 1200
cacaaaaaca tcatcaacct gctgggcgcc tgcacgcagg gcgggcccct gtacgtgctg 1260
gtggagtacg cggccaaggg taacctgcgg gagtttctgc gggcgcggcg gcccccgggc 1320
ctggactact ccttcgacac ctgcaagccg cccgaggagc agctcacctt caaggacctg 1380
gtgtcctgtg cctaccaggt ggcccggggc atggagtact tggcctccca gaagtgcatc 1440
cacagggacc tggctgcccg caatgtgctg gtgaccgagg acaacgtgat gaagatcgca 1500
gacttcgggc tggcccggga cgtgcacaac ctcgactact acaagaagac aaccaacggc 1560
cggctgcccg tgaagtgga 1579
<210> 12
<211> 1254
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
gagtccttgg ggacggagca gcgcgtcgtg gggcgagcgg cagaagtccc gggcccagag 60
cccggccagc aggagcagtt ggtcttcggc agcggggatg ctgtggagct gagctgtccc 120
ccgcccgggg gtggtcccat ggggcccact gtctgggtca aggatggcac agggctggtg 180
ccctcggagc gtgtcctggt ggggccccag cggctgcagg tgctgaatgc ctcccacgag 240
gactccgggg cctacagctg ccggcagcgg ctcacgcagc gcgtactgtg ccacttcagt 300
gtgcgggtga cagacgctcc atcctcggga gatgacgaag acggggagga cgaggctgag 360
gacacaggtg tggacacagg ggccccttac tggacacggc ccgagcggat ggacaagaag 420
ctgctggccg tgccggccgc caacaccgtc cgcttccgct gcccagccgc tggcaacccc 480
actccctcca tctcctggct gaagaacggc agggagttcc gcggcgagca ccgcattgga 540
ggcatcaagc tgcggcatca gcagtggagc ctggtcatgg aaagcgtggt gccctcggac 600
cgcggcaact acacctgcgt cgtggagaac aagtttggca gcatccggca gacgtacacg 660
ctggacgtgc tggagcgctc cccgcaccgg cccatcctgc aggcggggct gccggccaac 720
cagacggcgg tgctgggcag cgacgtggag ttccactgca aggtgtacag tgacgcacag 780
ccccacatcc agtggctcaa gcacgtggag gtgaatggca gcaaggtggg cccggacggc 840
acaccctacg ttaccgtgct caaggtgtcc ctggagtcca acgcgtccat gagctccaac 900
acaccactgg tgcgcatcgc aaggctgtcc tcaggggagg gccccacgct ggccaatgtc 960
tccgagctcg agctgcctgc cgaccccaaa tgggagctgt ctcgggcccg gctgaccctg 1020
ggcaagcccc ttggggaggg ctgcttcggc caggtggtca tggcggaggc catcggcatt 1080
gacaaggacc gggccgccaa gcctgtcacc gtagccgtga agatgctgaa agacgatgcc 1140
actgacaagg acctgtcgga cctggtgtct gagatggaga tgatgaagat gatcgggaaa 1200
cacaaaaaca tcatcaacct gctgggcgcc tgcacgcagg gcgggcccct gtac 1254
<210> 13
<211> 903
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 13
gagtccttgg ggacggagca gcgcgtcgtg gggcgagcgg cagaagtccc gggcccagag 60
cccggccagc aggagcagtt ggtcttcggc agcggggatg ctgtggagct gagctgtccc 120
ccgcccgggg gtggtcccat ggggcccact gtctgggtca aggatggcac agggctggtg 180
ccctcggagc gtgtcctggt ggggccccag cggctgcagg tgctgaatgc ctcccacgag 240
gactccgggg cctacagctg ccggcagcgg ctcacgcagc gcgtactgtg ccacttcagt 300
gtgcgggtga cagacgctcc atcctcggga gatgacgaag acggggagga cgaggctgag 360
gacacaggtg tggacacagg ggccccttac tggacacggc ccgagcggat ggacaagaag 420
ctgctggccg tgccggccgc caacaccgtc cgcttccgct gcccagccgc tggcaacccc 480
actccctcca tctcctggct gaagaacggc agggagttcc gcggcgagca ccgcattgga 540
ggcatcaagc tgcggcatca gcagtggagc ctggtcatgg aaagcgtggt gccctcggac 600
cgcggcaact acacctgcgt cgtggagaac aagtttggca gcatccggca gacgtacacg 660
ctggacgtgc tggagcgctc cccgcaccgg cccatcctgc aggcggggct gccggccaac 720
cagacggcgg tgctgggcag cgacgtggag ttccactgca aggtgtacag tgacgcacag 780
ccccacatcc agtggctcaa gcacgtggag gtgaatggca gcaaggtggg cccggacggc 840
acaccctacg ttaccgtgct caaggtgtcc ctggagtcca acgcgtccat gagctccaac 900
aca 903
<210> 14
<211> 1131
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
atgggagtga aggtgctgtt cgccctgatc tgtatcgccg tggccgaggc cgagtctctg 60
ggcacagaac agagagtcgt gggcagagcc gccgaagtgc ctggacctga acctggccag 120
caggaacagc tggtgtttgg cagcggcgac gccgtggaac tgagctgtcc tccacctggc 180
ggaggcccta tgggacctac cgtgtgggtc aaggatggca ccggactggt gcctagcgag 240
agggtgctcg tgggacctca gagactgcag gtgctgaacg ccagccacga ggatagcggc 300
gcctacagct gcagacagag actgacacag cgggtgctgt gccacttctc cgtcagagtg 360
accgacgccc ctagctccgg cgacgatgag gatggcgaag atgaggccga ggacaccggc 420
gtggacacag gcgctccata ctggaccaga cccgagcgga tggacaagaa actgctggcc 480
gtgcctgccg ccaacaccgt gcggtttaga tgtcctgccg ccggaaaccc cacccccagc 540
atcagctggc tgaagaacgg cagagagttc cggggcgagc acagaatcgg cggcatcaag 600
ctgagacacc agcagtggtc cctcgtgatg gaaagcgtgg tgcccagcga ccggggcaac 660
tacacctgtg tggtggaaaa caagttcggc agcatccggc agacctacac cctggacgtg 720
ctggaaagaa gcccccacag acccatcctg caggccggac tgcctgccaa tcagacagcc 780
gtgctgggca gcgacgtgga atttcactgc aaggtgtaca gcgacgccca gccccacatc 840
cagtggctga aacacgtgga agtgaacggc agcaaagtgg gccccgacgg caccccttat 900
gtgaccgtgc tgaaaaccgc tggcgccaat accaccgaca aagaactgga agtgctgagc 960
ctgcacaacg tgaccttcga ggatgccggc gagtacacct gtctggccgg caacagcatc 1020
ggcttcagcc accattctgc ctggctggtg gtgctgcccg tgtccctgga aagcaacgcc 1080
agcatgagca gcaacaccga ctacaaggac gacgacgaca agtgaaagct t 1131
<210> 15
<211> 1107
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 15
atgatgtcct ttgtctctct gctcctggtt ggcatcctat tccatgccac ccaggccgag 60
tccttgggga cggagcagcg cgtcgtgggg cgagcggcag aagtcccggg cccagagccc 120
ggccagcagg agcagttggt cttcggcagc ggggatgctg tggagctgag ctgtcccccg 180
cccgggggtg gtcccatggg gcccactgtc tgggtcaagg atggcacagg gctggtgccc 240
tcggagcgtg tcctggtggg gccccagcgg ctgcaggtgc tgaatgcctc ccacgaggac 300
tccggggcct acagctgccg gcagcggctc acgcagcgcg tactgtgcca cttcagtgtg 360
cgggtgacag acgctccatc ctcgggagat gacgaagacg gggaggacga ggctgaggac 420
acaggtgtgg acacaggggc cccttactgg acacggcccg agcggatgga caagaagctg 480
ctggccgtgc cggccgccaa caccgtccgc ttccgctgcc cagccgctgg caaccccact 540
ccctccatct cctggctgaa gaacggcagg gagttccgcg gcgagcaccg cattggaggc 600
atcaagctgc ggcatcagca gtggagcctg gtcatggaaa gcgtggtgcc ctcggaccgc 660
ggcaactaca cctgcgtcgt ggagaacaag tttggcagca tccggcagac gtacacgctg 720
gacgtgctgg agcgctcccc gcaccggccc atcctgcagg ctgggctgcc tgctaaccag 780
acagcggtgc tgggcagcga cgtggagttc cactgcaagg tgtacagtga cgcacagccc 840
cacatccagt ggctcaagca cgtggaggtg aatggcagca aggtgggccc ggacggcaca 900
ccctacgtta ccgtgctcaa gacggcgggc gctaacacca ccgacaagga gctagaggtt 960
ctctccttgc acaacgtcac ctttgaggac gccggggagt acacctgcct ggcgggcaat 1020
tctattgggt tttctcatca ctctgcgtgg ctggtggtgc tgccagtgtc cctggagtcc 1080
aacgcgtcca tgagctccaa cacatga 1107
<210> 16
<211> 987
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
atgggagtga aggtgctgtt cgccctgatc tgtatcgccg tggccgaggc cgagtctctg 60
ggcacagaac agagagtcgt gggcagagcc gccgaagtgc ctggacctga acctggccag 120
caggaacagc tggtgtttgg cagcggcgac gccgtggaac tgagctgtcc tccacctggc 180
ggaggcccta tgggacctac cgtgtgggtc aaggatggca ccggactggt gcctagcgag 240
agggtgctcg tgggacctca gagactgcag gtgctgaacg ccagccacga ggatagcggc 300
gcctacagct gcagacagag actgacacag cgggtgctgt gccacttctc cgtcagagtg 360
accgacgccc ctagctccgg cgacgatgag gatggcgaag atgaggccga ggacaccggc 420
gtggacacag gcgctccata ctggaccaga cccgagcgga tggacaagaa actgctggcc 480
gtgcctgccg ccaacaccgt gcggtttaga tgtcctgccg ccggaaaccc cacccccagc 540
atcagctggc tgaagaacgg cagagagttc cggggcgagc acagaatcgg cggcatcaag 600
ctgagacacc agcagtggtc cctcgtgatg gaaagcgtgg tgcccagcga ccggggcaac 660
tacacctgtg tggtggaaaa caagttcggc agcatccggc agacctacac cctggacgtg 720
ctggaaagaa gcccccacag acccatcctg caggccggac tgcctgccaa tcagacagcc 780
gtgctgggca gcgacgtgga atttcacagc aaggtgtaca gcgacgccca gccccacatc 840
cagtggctga aacacgtgga agtgaacggc agcaaagtgg gccccgacgg caccccttat 900
gtgaccgtgc tgaaggtgtc cctggaaagc aacgccagca tgagcagcaa caccgactac 960
aaggacgacg acgacaagtg aaagctt 987
<210> 17
<211> 1107
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
atgatgtcct ttgtctctct gctcctggtt ggcatcctat tccatgccac ccaggccgag 60
tccttgggga cggagcagcg cgtcgtgggg cgagcggcag aagtcccggg cccagagccc 120
ggccagcagg agcagttggt cttcggcagc ggggatgctg tggagctgag ctgtcccccg 180
cccgggggtg gtcccatggg gcccactgtc tgggtcaagg atggcacagg gctggtgccc 240
tcggagcgtg tcctggtggg gccccagcgg ctgcaggtgc tgaatgcctc ccacgaggac 300
tccggggcct acagctgccg gcagcggctc acgcagcgcg tactgtgcca cttcagtgtg 360
cgggtgacag acgctccatc ctcgggagat gacgaagacg gggaggacga ggctgaggac 420
acaggtgtgg acacaggggc cccttactgg acacggcccg agcggatgga caagaagctg 480
ctggccgtgc cggccgccaa caccgtccgc ttccgctgcc cagccgctgg caaccccact 540
ccctccatct cctggctgaa gaacggcagg gagttccgcg gcgagcaccg cattggaggc 600
atcaagctgc ggcatcagca gtggagcctg gtcatggaaa gcgtggtgcc ctcggaccgc 660
ggcaactaca cctgcgtcgt ggagaacaag tttggcagca tccggcagac gtacacgctg 720
gacgtgctgg agcgctcccc gcaccggccc atcctgcagg ctgggctgcc tgctaaccag 780
acagcggtgc tgggcagcga cgtggagttc cactgcaagg tgtacagtga cgcacagccc 840
cacatccagt ggctcaagca cgtggaggtg aatggcagca aggtgggccc ggacggcaca 900
ccctacgtta ccgtgctcaa gacggcgggc gctaacacca ccgacaagga gctagaggtt 960
ctctccttgc acaacgtcac ctttgaggac gccggggagt acacctgcct ggcgggcaat 1020
tctattgggt tttctcatca ctctgcgtgg ctggtggtgc tgccagtgtc cctggagtcc 1080
aacgcgtcca tgagctccaa cacatga 1107
<210> 18
<211> 1548
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
gagagcctgg gcacagagca gcgggtggtg ggaagggccg ctgaagtgcc tggccctgag 60
cctggccagc aggaacagct ggtctttggc agcggcgacg ccgtggaact gagctgtcct 120
ccacccggcg gaggccctat gggccctacc gtgtgggtga aagacggcac cggcctggtg 180
cccagcgaga gggtgctggt gggaccccag cggctgcagg tcctgaacgc cagccacgag 240
gacagcggcg cctacagctg cagacagaga ctgacccagc gggtgctgtg ccacttcagc 300
gtgcgcgtga ccgacgcccc tagctctggc gacgacgagg acggcgagga cgaggccgag 360
gataccggcg tggacacagg cgccccttac tggaccagac ccgagcggat ggacaagaaa 420
ctgctggccg tgcctgccgc caacaccgtg cggttcagat gtcccgccgc tggcaacccc 480
acccccagca tcagctggct gaagaacggc agagagttcc ggggcgagca ccggatcggc 540
ggcatcaagc tgcggcacca gcagtggtcc ctggtcatgg aaagcgtggt gccctccgac 600
cggggcaact acacctgtgt ggtggaaaac aagttcggca gcatccggca gacctacacc 660
ctggacgtgc tggaaagaag cccccaccgg cccatcctgc aggctggact gcccgccaat 720
cagacagccg tgctgggcag cgacgtggaa tttcactgca aggtgtacag cgacgcccag 780
ccccacatcc agtggctcaa gcacgtggaa gtgaacggca gcaaagtggg ccccgacggc 840
accccttacg tgaccgtgct gaaagtgtcc ctggaaagca acgccagcat gagcagcaac 900
acctgaggta ccagcggcag cggctctggc tctggaagcg gaagcggatc tgggagcgtg 960
gtgttcccct acttcccccg gctgggccgg tacaacctga acttccacga ggcccagcag 1020
gcttgcctcg accaggatgc cgtgatcgcc agcttcgacc agctgtacga tgcctggcgg 1080
ggaggcctgg actggtgcaa tgccggctgg ctgtccgacg gcagcgtcca gtaccccatc 1140
accaagccca gagagccctg cggcggacag aacacagtgc ccggcgtgcg gaactacggc 1200
ttctgggaca aggacaagag cagatacgac gtgttctgct tcaccagcaa cttcaacggc 1260
cggttctact acctgatcca ccccaccaag ctgacctacg acgaagccgt ccaggcctgt 1320
ctgaacgacg gcgcccagat cgccaaagtg ggacagatct tcgccgcctg gaagatcctg 1380
ggctacgaca gatgcgacgc cggatggctg gccgatggct ccgtgcgcta ccctatcagc 1440
agaccccgca gaagatgcag ccctaccgag gccgccgtgc gcttcgtggg cttccccgac 1500
aagaagcaca agctgtacgg cgtctactgc ttccgggcct acaactga 1548
<210> 19
<211> 2355
<212> ДНК
<213> Homo sapiens
<400> 19
gagtccttgg ggacggagca gcgcgtcgtg gggcgagcgg cagaagtccc gggcccagag 60
cccggccagc aggagcagtt ggtcttcggc agcggggatg ctgtggagct gagctgtccc 120
ccgcccgggg gtggtcccat ggggcccact gtctgggtca aggatggcac agggctggtg 180
ccctcggagc gtgtcctggt ggggccccag cggctgcagg tgctgaatgc ctcccacgag 240
gactccgggg cctacagctg ccggcagcgg ctcacgcagc gcgtactgtg ccacttcagt 300
gtgcgggtga cagacgctcc atcctcggga gatgacgaag acggggagga cgaggctgag 360
gacacaggtg tggacacagg ggccccttac tggacacggc ccgagcggat ggacaagaag 420
ctgctggccg tgccggccgc caacaccgtc cgcttccgct gcccagccgc tggcaacccc 480
actccctcca tctcctggct gaagaacggc agggagttcc gcggcgagca ccgcattgga 540
ggcatcaagc tgcggcatca gcagtggagc ctggtcatgg aaagcgtggt gccctcggac 600
cgcggcaact acacctgcgt cgtggagaac aagtttggca gcatccggca gacgtacacg 660
ctggacgtgc tggagcgctc cccgcaccgg cccatcctgc aggcggggct gccggccaac 720
cagacggcgg tgctgggcag cgacgtggag ttccactgca aggtgtacag tgacgcacag 780
ccccacatcc agtggctcaa gcacgtggag gtgaatggca gcaaggtggg cccggacggc 840
acaccctacg ttaccgtgct caagacggcg ggcgctaaca ccaccgacaa ggagctagag 900
gttctctcct tgcacaacgt cacctttgag gacgccgggg agtacacctg cctggcgggc 960
aattctattg ggttttctca tcactctgcg tggctggtgg tgctgccagc cgaggaggag 1020
ctggtggagg ctgacgaggc gggcagtgtg tatgcaggca tcctcagcta cggggtgggc 1080
ttcttcctgt tcatcctggt ggtggcggct gtgacgctct gccgcctgcg cagccccccc 1140
aagaaaggcc tgggctcccc caccgtgcac aagatctccc gcttcccgct caagcgacag 1200
gtgtccctgg agtccaacgc gtccatgagc tccaacacac cactggtgcg catcgcaagg 1260
ctgtcctcag gggagggccc cacgctggcc aatgtctccg agctcgagct gcctgccgac 1320
cccaaatggg agctgtctcg ggcccggctg accctgggca agccccttgg ggagggctgc 1380
ttcggccagg tggtcatggc ggaggccatc ggcattgaca aggaccgggc cgccaagcct 1440
gtcaccgtag ccgtgaagat gctgaaagac gatgccactg acaaggacct gtcggacctg 1500
gtgtctgaga tggagatgat gaagatgatc gggaaacaca aaaacatcat caacctgctg 1560
ggcgcctgca cgcagggcgg gcccctgtac gtgctggtgg agtacgcggc caagggtaac 1620
ctgcgggagt ttctgcgggc gcggcggccc ccgggcctgg actactcctt cgacacctgc 1680
aagccgcccg aggagcagct caccttcaag gacctggtgt cctgtgccta ccaggtggcc 1740
cggggcatgg agtacttggc ctcccagaag tgcatccaca gggacctggc tgcccgcaat 1800
gtgctggtga ccgaggacaa cgtgatgaag atcgcagact tcgggctggc ccgggacgtg 1860
cacaacctcg actactacaa gaagacaacc aacggccggc tgcccgtgaa gtggatggcg 1920
cctgaggcct tgtttgaccg agtctacact caccagagtg acgtctggtc ctttggggtc 1980
ctgctctggg agatcttcac gctggggggc tccccgtacc ccggcatccc tgtggaggag 2040
ctcttcaagc tgctgaagga gggccaccgc atggacaagc ccgccaactg cacacacgac 2100
ctgtacatga tcatgcggga gtgctggcat gccgcgccct cccagaggcc caccttcaag 2160
cagctggtgg aggacctgga ccgtgtcctt accgtgacgt ccaccgacga gtacctggac 2220
ctgtcggcgc ctttcgagca gtactccccg ggtggccagg acacccccag ctccagctcc 2280
tcaggggacg actccgtgtt tgcccacgac ctgctgcccc cggccccacc cagcagtggg 2340
ggctcgcgga cgtga 2355
<210> 20
<211> 2355
<212> ДНК
<213> Homo sapiens
<220>
<221> misc_feature
<222> (1073)..(1073)
<223> N is a or c
<400> 20
gagtccttgg ggacggagca gcgcgtcgtg gggcgagcgg cagaagtccc gggcccagag 60
cccggccagc aggagcagtt ggtcttcggc agcggggatg ctgtggagct gagctgtccc 120
ccgcccgggg gtggtcccat ggggcccact gtctgggtca aggatggcac agggctggtg 180
ccctcggagc gtgtcctggt ggggccccag cggctgcagg tgctgaatgc ctcccacgag 240
gactccgggg cctacagctg ccggcagcgg ctcacgcagc gcgtactgtg ccacttcagt 300
gtgcgggtga cagacgctcc atcctcggga gatgacgaag acggggagga cgaggctgag 360
gacacaggtg tggacacagg ggccccttac tggacacggc ccgagcggat ggacaagaag 420
ctgctggccg tgccggccgc caacaccgtc cgcttccgct gcccagccgc tggcaacccc 480
actccctcca tctcctggct gaagaacggc agggagttcc gcggcgagca ccgcattgga 540
ggcatcaagc tgcggcatca gcagtggagc ctggtcatgg aaagcgtggt gccctcggac 600
cgcggcaact acacctgcgt cgtggagaac aagtttggca gcatccggca gacgtacacg 660
ctggacgtgc tggagcgctc cccgcaccgg cccatcctgc aggcggggct gccggccaac 720
cagacggcgg tgctgggcag cgacgtggag ttccactgca aggtgtacag tgacgcacag 780
ccccacatcc agtggctcaa gcacgtggag gtgaatggca gcaaggtggg cccggacggc 840
acaccctacg ttaccgtgct caagacggcg ggcgctaaca ccaccgacaa ggagctagag 900
gttctctcct tgcacaacgt cacctttgag gacgccgggg agtacacctg cctggcgggc 960
aattctattg ggttttctca tcactctgcg tggctggtgg tgctgccagc cgaggaggag 1020
ctggtggagg ctgacgaggc gggcagtgtg tatgcaggca tcctcagcta cgnggtgggc 1080
ttcttcctgt tcatcctggt ggtggcggct gtgacgctct gccgcctgcg cagccccccc 1140
aagaaaggcc tgggctcccc caccgtgcac aagatctccc gcttcccgct caagcgacag 1200
gtgtccctgg agtccaacgc gtccatgagc tccaacacac cactggtgcg catcgcaagg 1260
ctgtcctcag gggagggccc cacgctggcc aatgtctccg agctcgagct gcctgccgac 1320
cccaaatggg agctgtctcg ggcccggctg accctgggca agccccttgg ggagggctgc 1380
ttcggccagg tggtcatggc ggaggccatc ggcattgaca aggaccgggc cgccaagcct 1440
gtcaccgtag ccgtgaagat gctgaaagac gatgccactg acaaggacct gtcggacctg 1500
gtgtctgaga tggagatgat gaagatgatc gggaaacaca aaaacatcat caacctgctg 1560
ggcgcctgca cgcagggcgg gcccctgtac gtgctggtgg agtacgcggc caagggtaac 1620
ctgcgggagt ttctgcgggc gcggcggccc ccgggcctgg actactcctt cgacacctgc 1680
aagccgcccg aggagcagct caccttcaag gacctggtgt cctgtgccta ccaggtggcc 1740
cggggcatgg agtacttggc ctcccagaag tgcatccaca gggacctggc tgcccgcaat 1800
gtgctggtga ccgaggacaa cgtgatgaag atcgcagact tcgggctggc ccgggacgtg 1860
cacaacctcg actactacaa gaagacaacc aacggccggc tgcccgtgaa gtggatggcg 1920
cctgaggcct tgtttgaccg agtctacact caccagagtg acgtctggtc ctttggggtc 1980
ctgctctggg agatcttcac gctggggggc tccccgtacc ccggcatccc tgtggaggag 2040
ctcttcaagc tgctgaagga gggccaccgc atggacaagc ccgccaactg cacacacgac 2100
ctgtacatga tcatgcggga gtgctggcat gccgcgccct cccagaggcc caccttcaag 2160
cagctggtgg aggacctgga ccgtgtcctt accgtgacgt ccaccgacga gtacctggac 2220
ctgtcggcgc ctttcgagca gtactccccg ggtggccagg acacccccag ctccagctcc 2280
tcaggggacg actccgtgtt tgcccacgac ctgctgcccc cggccccacc cagcagtggg 2340
ggctcgcgga cgtga 2355
<210> 21
<211> 22
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser
20
<210> 22
<211> 672
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Ser Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
290 295 300
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
305 310 315 320
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
325 330 335
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
340 345 350
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
355 360 365
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
370 375 380
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
385 390 395 400
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
405 410 415
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
420 425 430
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
435 440 445
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
450 455 460
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
465 470 475 480
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
485 490 495
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
500 505 510
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
515 520 525
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
530 535 540
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
545 550 555 560
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
565 570 575
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
580 585 590
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
595 600 605
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
610 615 620
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
625 630 635 640
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
645 650 655
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
660 665 670
<210> 23
<211> 720
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
340 345 350
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
355 360 365
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
370 375 380
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
385 390 395 400
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
405 410 415
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
420 425 430
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
435 440 445
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
450 455 460
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
465 470 475 480
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
485 490 495
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
500 505 510
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
515 520 525
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
530 535 540
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
545 550 555 560
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
565 570 575
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
580 585 590
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
595 600 605
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
610 615 620
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
625 630 635 640
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
645 650 655
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
660 665 670
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
675 680 685
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
690 695 700
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
705 710 715 720
<210> 24
<211> 512
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Ser Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Ser Gly Ser
290 295 300
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Val Val Phe Pro
305 310 315 320
Tyr Phe Pro Arg Leu Gly Arg Tyr Asn Leu Asn Phe His Glu Ala Gln
325 330 335
Gln Ala Cys Leu Asp Gln Asp Ala Val Ile Ala Ser Phe Asp Gln Leu
340 345 350
Tyr Asp Ala Trp Arg Gly Gly Leu Asp Trp Cys Asn Ala Gly Trp Leu
355 360 365
Ser Asp Gly Ser Val Gln Tyr Pro Ile Thr Lys Pro Arg Glu Pro Cys
370 375 380
Gly Gly Gln Asn Thr Val Pro Gly Val Arg Asn Tyr Gly Phe Trp Asp
385 390 395 400
Lys Asp Lys Ser Arg Tyr Asp Val Phe Cys Phe Thr Ser Asn Phe Asn
405 410 415
Gly Arg Phe Tyr Tyr Leu Ile His Pro Thr Lys Leu Thr Tyr Asp Glu
420 425 430
Ala Val Gln Ala Cys Leu Asn Asp Gly Ala Gln Ile Ala Lys Val Gly
435 440 445
Gln Ile Phe Ala Ala Trp Lys Ile Leu Gly Tyr Asp Arg Cys Asp Ala
450 455 460
Gly Trp Leu Ala Asp Gly Ser Val Arg Tyr Pro Ile Ser Arg Pro Arg
465 470 475 480
Arg Arg Cys Ser Pro Thr Glu Ala Ala Val Arg Phe Val Gly Phe Pro
485 490 495
Asp Lys Lys His Lys Leu Tyr Gly Val Tyr Cys Phe Arg Ala Tyr Asn
500 505 510
<210> 25
<211> 560
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 25
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Ser Gly Ser
340 345 350
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Val Val Phe Pro
355 360 365
Tyr Phe Pro Arg Leu Gly Arg Tyr Asn Leu Asn Phe His Glu Ala Gln
370 375 380
Gln Ala Cys Leu Asp Gln Asp Ala Val Ile Ala Ser Phe Asp Gln Leu
385 390 395 400
Tyr Asp Ala Trp Arg Gly Gly Leu Asp Trp Cys Asn Ala Gly Trp Leu
405 410 415
Ser Asp Gly Ser Val Gln Tyr Pro Ile Thr Lys Pro Arg Glu Pro Cys
420 425 430
Gly Gly Gln Asn Thr Val Pro Gly Val Arg Asn Tyr Gly Phe Trp Asp
435 440 445
Lys Asp Lys Ser Arg Tyr Asp Val Phe Cys Phe Thr Ser Asn Phe Asn
450 455 460
Gly Arg Phe Tyr Tyr Leu Ile His Pro Thr Lys Leu Thr Tyr Asp Glu
465 470 475 480
Ala Val Gln Ala Cys Leu Asn Asp Gly Ala Gln Ile Ala Lys Val Gly
485 490 495
Gln Ile Phe Ala Ala Trp Lys Ile Leu Gly Tyr Asp Arg Cys Asp Ala
500 505 510
Gly Trp Leu Ala Asp Gly Ser Val Arg Tyr Pro Ile Ser Arg Pro Arg
515 520 525
Arg Arg Cys Ser Pro Thr Glu Ala Ala Val Arg Phe Val Gly Phe Pro
530 535 540
Asp Lys Lys His Lys Leu Tyr Gly Val Tyr Cys Phe Arg Ala Tyr Asn
545 550 555 560
<210> 26
<211> 155
<212> белок
<213> Homo sapiens
<400> 26
Met Ala Glu Gly Glu Ile Thr Thr Phe Thr Ala Leu Thr Glu Lys Phe
1 5 10 15
Asn Leu Pro Pro Gly Asn Tyr Lys Lys Pro Lys Leu Leu Tyr Cys Ser
20 25 30
Asn Gly Gly His Phe Leu Arg Ile Leu Pro Asp Gly Thr Val Asp Gly
35 40 45
Thr Arg Asp Arg Ser Asp Gln His Ile Gln Leu Gln Leu Ser Ala Glu
50 55 60
Ser Val Gly Glu Val Tyr Ile Lys Ser Thr Glu Thr Gly Gln Tyr Leu
65 70 75 80
Ala Met Asp Thr Asp Gly Leu Leu Tyr Gly Ser Gln Thr Pro Asn Glu
85 90 95
Glu Cys Leu Phe Leu Glu Arg Leu Glu Glu Asn His Tyr Asn Thr Tyr
100 105 110
Ile Ser Lys Lys His Ala Glu Lys Asn Trp Phe Val Gly Leu Lys Lys
115 120 125
Asn Gly Ser Cys Lys Arg Gly Pro Arg Thr His Tyr Gly Gln Lys Ala
130 135 140
Ile Leu Phe Leu Pro Leu Pro Val Ser Ser Asp
145 150 155
<210> 27
<211> 288
<212> белок
<213> Homo sapiens
<400> 27
Met Val Gly Val Gly Gly Gly Asp Val Glu Asp Val Thr Pro Arg Pro
1 5 10 15
Gly Gly Cys Gln Ile Ser Gly Arg Gly Ala Arg Gly Cys Asn Gly Ile
20 25 30
Pro Gly Ala Ala Ala Trp Glu Ala Ala Leu Pro Arg Arg Arg Pro Arg
35 40 45
Arg His Pro Ser Val Asn Pro Arg Ser Arg Ala Ala Gly Ser Pro Arg
50 55 60
Thr Arg Gly Arg Arg Thr Glu Glu Arg Pro Ser Gly Ser Arg Leu Gly
65 70 75 80
Asp Arg Gly Arg Gly Arg Ala Leu Pro Gly Gly Arg Leu Gly Gly Arg
85 90 95
Gly Arg Gly Arg Ala Pro Glu Arg Val Gly Gly Arg Gly Arg Gly Arg
100 105 110
Gly Thr Ala Ala Pro Arg Ala Ala Pro Ala Ala Arg Gly Ser Arg Pro
115 120 125
Gly Pro Ala Gly Thr Met Ala Ala Gly Ser Ile Thr Thr Leu Pro Ala
130 135 140
Leu Pro Glu Asp Gly Gly Ser Gly Ala Phe Pro Pro Gly His Phe Lys
145 150 155 160
Asp Pro Lys Arg Leu Tyr Cys Lys Asn Gly Gly Phe Phe Leu Arg Ile
165 170 175
His Pro Asp Gly Arg Val Asp Gly Val Arg Glu Lys Ser Asp Pro His
180 185 190
Ile Lys Leu Gln Leu Gln Ala Glu Glu Arg Gly Val Val Ser Ile Lys
195 200 205
Gly Val Cys Ala Asn Arg Tyr Leu Ala Met Lys Glu Asp Gly Arg Leu
210 215 220
Leu Ala Ser Lys Cys Val Thr Asp Glu Cys Phe Phe Phe Glu Arg Leu
225 230 235 240
Glu Ser Asn Asn Tyr Asn Thr Tyr Arg Ser Arg Lys Tyr Thr Ser Trp
245 250 255
Tyr Val Ala Leu Lys Arg Thr Gly Gln Tyr Lys Leu Gly Ser Lys Thr
260 265 270
Gly Pro Gly Gln Lys Ala Ile Leu Phe Leu Pro Met Ser Ala Lys Ser
275 280 285
<210> 28
<211> 208
<212> белок
<213> Homo sapiens
<400> 28
Met Ala Pro Leu Gly Glu Val Gly Asn Tyr Phe Gly Val Gln Asp Ala
1 5 10 15
Val Pro Phe Gly Asn Val Pro Val Leu Pro Val Asp Ser Pro Val Leu
20 25 30
Leu Ser Asp His Leu Gly Gln Ser Glu Ala Gly Gly Leu Pro Arg Gly
35 40 45
Pro Ala Val Thr Asp Leu Asp His Leu Lys Gly Ile Leu Arg Arg Arg
50 55 60
Gln Leu Tyr Cys Arg Thr Gly Phe His Leu Glu Ile Phe Pro Asn Gly
65 70 75 80
Thr Ile Gln Gly Thr Arg Lys Asp His Ser Arg Phe Gly Ile Leu Glu
85 90 95
Phe Ile Ser Ile Ala Val Gly Leu Val Ser Ile Arg Gly Val Asp Ser
100 105 110
Gly Leu Tyr Leu Gly Met Asn Glu Lys Gly Glu Leu Tyr Gly Ser Glu
115 120 125
Lys Leu Thr Gln Glu Cys Val Phe Arg Glu Gln Phe Glu Glu Asn Trp
130 135 140
Tyr Asn Thr Tyr Ser Ser Asn Leu Tyr Lys His Val Asp Thr Gly Arg
145 150 155 160
Arg Tyr Tyr Val Ala Leu Asn Lys Asp Gly Thr Pro Arg Glu Gly Thr
165 170 175
Arg Thr Lys Arg His Gln Lys Phe Thr His Phe Leu Pro Arg Pro Val
180 185 190
Asp Pro Asp Lys Val Pro Glu Leu Tyr Lys Asp Ile Leu Ser Gln Ser
195 200 205
<210> 29
<211> 207
<212> белок
<213> Homo sapiens
<400> 29
Met Tyr Ser Ala Pro Ser Ala Cys Thr Cys Leu Cys Leu His Phe Leu
1 5 10 15
Leu Leu Cys Phe Gln Val Gln Val Leu Val Ala Glu Glu Asn Val Asp
20 25 30
Phe Arg Ile His Val Glu Asn Gln Thr Arg Ala Arg Asp Asp Val Ser
35 40 45
Arg Lys Gln Leu Arg Leu Tyr Gln Leu Tyr Ser Arg Thr Ser Gly Lys
50 55 60
His Ile Gln Val Leu Gly Arg Arg Ile Ser Ala Arg Gly Glu Asp Gly
65 70 75 80
Asp Lys Tyr Ala Gln Leu Leu Val Glu Thr Asp Thr Phe Gly Ser Gln
85 90 95
Val Arg Ile Lys Gly Lys Glu Thr Glu Phe Tyr Leu Cys Met Asn Arg
100 105 110
Lys Gly Lys Leu Val Gly Lys Pro Asp Gly Thr Ser Lys Glu Cys Val
115 120 125
Phe Ile Glu Lys Val Leu Glu Asn Asn Tyr Thr Ala Leu Met Ser Ala
130 135 140
Lys Tyr Ser Gly Trp Tyr Val Gly Phe Thr Lys Lys Gly Arg Pro Arg
145 150 155 160
Lys Gly Pro Lys Thr Arg Glu Asn Gln Gln Asp Val His Phe Met Lys
165 170 175
Arg Tyr Pro Lys Gly Gln Pro Glu Leu Gln Lys Pro Phe Lys Tyr Thr
180 185 190
Thr Val Thr Lys Arg Ser Arg Arg Ile Arg Pro Thr His Pro Ala
195 200 205
<210> 30
<211> 216
<212> белок
<213> Homo sapiens
<400> 30
Met Arg Ser Gly Cys Val Val Val His Val Trp Ile Leu Ala Gly Leu
1 5 10 15
Trp Leu Ala Val Ala Gly Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro
20 25 30
His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg His Leu Tyr
35 40 45
Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala
50 55 60
Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu
65 70 75 80
Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val His
85 90 95
Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu
100 105 110
Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro
115 120 125
Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser
130 135 140
Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu
145 150 155 160
Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro
165 170 175
Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu
180 185 190
Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala
195 200 205
Val Arg Ser Pro Ser Phe Glu Lys
210 215
<210> 31
<211> 209
<212> белок
<213> Homo sapiens
<400> 31
Met Asp Ser Asp Glu Thr Gly Phe Glu His Ser Gly Leu Trp Val Ser
1 5 10 15
Val Leu Ala Gly Leu Leu Leu Gly Ala Cys Gln Ala His Pro Ile Pro
20 25 30
Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr
35 40 45
Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg
50 55 60
Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu
65 70 75 80
Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val
85 90 95
Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly
100 105 110
Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu Leu Leu
115 120 125
Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu
130 135 140
His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly
145 150 155 160
Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu
165 170 175
Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp
180 185 190
Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser Pro Ser Tyr Ala
195 200 205
Ser
<210> 32
<211> 2019
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 32
atggagtctc tgggcacaga gcagagagtc gtgggcagag ccgctgaagt gcctggacct 60
gagcctggcc agcaggaaca gctggtcttt ggctctggcg acgccgtgga actgagctgt 120
cctccacctg gcggaggccc tatgggacct accgtgtggg tcaaggatgg caccggactg 180
gtgcctagcg agagggtgct cgtgggacct cagagactgc aggtcctgaa cgccagccac 240
gaggatagcg gcgcctacag ctgcagacag agactgaccc agcgggtgct gtgccacttc 300
agcgtcagag tgaccgatgc ccccagcagc ggagatgacg aggatggcga ggatgaggcc 360
gaggatacag gcgtggacac aggcgcccct tactggacca gacccgagcg gatggacaag 420
aaactgctgg ccgtgcctgc cgccaacacc gtgcggttta gatgccctgc cgccggaaac 480
cccaccccca gcatctcttg gctgaagaac ggcagagagt tccggggcga gcaccggatc 540
ggcggcatta agctgagaca ccagcagtgg tccctggtca tggaaagcgt ggtgcccagc 600
gaccggggca actacacctg tgtggtggaa aacaagttcg gcagcatccg gcagacctac 660
accctggacg tgctggaaag aagcccccac agacctatcc tgcaggccgg actgcctgcc 720
aatcagacag ccgtgctggg cagcgacgtg gaatttcaca gcaaggtgta cagcgacgcc 780
cagccccaca tccagtggct gaagcacgtg gaagtgaacg gcagcaaagt gggccccgac 840
ggcacccctt acgtgaccgt gctgaaagtg tccctggaaa gcaacgccag catgagcagc 900
aacacccccc tcgtgcggat cgccagactg tctagcggag agggccctac cctggccaac 960
gtgtccgaac tggaactgcc cgccgacccc aagtgggagc tgagcagagc tagactgacc 1020
ctgggcaagc ctctgggcga gggctgtttt ggacaggtgg tcatggccga ggccatcggc 1080
atcgacaagg acagagccgc caagcctgtg accgtggccg tgaagatgct gaaggacgac 1140
gccaccgaca aggacctgag cgacctggtg tccgagatgg aaatgatgaa gatgatcggc 1200
aagcacaaga acatcatcaa cctgctgggc gcctgcaccc agggcggacc tctgtacgtg 1260
ctggtggaat acgccgccaa gggcaacctg agagagttcc tgagagccag aaggccccct 1320
ggcctggact acagcttcga tacctgcaag ccccccgaag aacagctgac cttcaaggat 1380
ctggtgtcct gcgcctatca ggtggccaga ggcatggaat acctggccag ccagaagtgc 1440
atccaccggg atctggccgc cagaaacgtg ctggtcaccg aggacaacgt gatgaagatc 1500
gccgacttcg gcctggcccg ggacgtgcac aacctggact actacaagaa aaccaccaac 1560
ggccggctgc ccgtgaagtg gatggcccct gaggccctgt tcgacagagt gtacacccac 1620
cagagcgacg tgtggtcctt cggcgtgctg ctgtgggaga tctttaccct gggcggcagc 1680
ccttaccccg gcatccctgt ggaagaactg ttcaagctgc tgaaagaggg ccacagaatg 1740
gacaagcccg ccaactgcac ccacgacctg tacatgatca tgagagagtg ctggcacgcc 1800
gctcccagcc agaggcctac ctttaagcag ctggtggaag atctggaccg ggtgctgacc 1860
gtgaccagca ccgacgagta cctggatctg agcgccccct tcgagcagta ctctcctggc 1920
ggccaggata cccctagcag cagctctagc ggcgacgaca gcgtgttcgc ccacgatctg 1980
ctgcctccag cccctcctag ctctggcggc tctagaacc 2019
<210> 33
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 33
atggagagcc tgggcacaga acagagagtc gtgggcagag ccgccgaagt gcctggacct 60
gaacctggcc agcaggaaca gctggtcttt ggctctggcg acgccgtgga actgagctgt 120
cctccacctg gcggaggccc tatgggacct accgtgtggg tcaaggatgg caccggactg 180
gtgcctagcg agagggtgct cgtgggacct cagagactgc aggtcctgaa cgccagccac 240
gaggatagcg gcgcctacag ctgcagacag agactgaccc agcgggtgct gtgccacttc 300
agcgtcagag tgaccgatgc ccccagcagc ggagatgacg aggatggcga ggatgaggcc 360
gaggatacag gcgtggacac aggcgcccct tactggacca gacccgagcg gatggacaag 420
aaactgctgg ccgtgcctgc cgccaacacc gtgcggttta gatgccctgc cgccggaaac 480
cccaccccca gcatctcttg gctgaagaac ggcagagagt tccggggcga gcaccggatc 540
ggcggcatta agctgagaca ccagcagtgg tccctggtca tggaaagcgt ggtgcccagc 600
gaccggggca actacacctg tgtggtggaa aacaagttcg gcagcatccg gcagacctac 660
accctggacg tgctggaaag aagcccccac agacctatcc tgcaggccgg actgcctgcc 720
aatcagacag ccgtgctggg cagcgacgtg gaatttcact gcaaggtgta cagcgacgcc 780
cagccccaca tccagtggct gaagcacgtg gaagtgaacg gcagcaaagt gggccccgac 840
ggcacccctt acgtgaccgt gctgaaagtg tccctggaaa gcaacgccag catgagcagc 900
aacaccagcg gcagcggctc tggcagcgga tctggttctg gctccggcag cgtggtgttc 960
ccctacttcc cccggctggg ccggtacaac ctgaactttc atgaggccca gcaggcctgc 1020
ctggaccagg atgccgtgat cgccagcttc gaccagctgt acgatgcttg gagaggcggc 1080
ctggactggt gcaatgccgg ctggctgtct gacggcagcg tgcagtaccc catcaccaag 1140
cccagagagc cctgcggcgg acagaatacc gtgcccggcg tgcggaacta cggcttctgg 1200
gacaaggaca agagcagata cgacgtgttc tgcttcacca gcaacttcaa cggccggttc 1260
tactacctga tccaccccac caagctgacc tacgacgagg ccgtgcaggc ctgtctgaac 1320
gatggcgccc agatcgccaa agtgggacag atcttcgccg cctggaagat cctgggctac 1380
gacagatgtg acgccggatg gctggccgac ggctccgtgc ggtatcccat cagccggcct 1440
agaagaagat gcagccctac cgaggccgcc gtcagattcg tgggcttccc c 1491
<210> 34
<211> 1710
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 34
atgggagcac cagcttgtgc cctggctctg tgtgtggccg tggctattgt ggctggcgcc 60
tctagcgaga gcctgggcac agaacagaga gtcgtgggca gagccgccga agtgcctgga 120
cctgaacctg gccagcagga acagctggtc tttggctctg gcgacgccgt ggaactgagc 180
tgtcctccac ctggcggagg ccctatggga cctaccgtgt gggtcaagga tggcaccgga 240
ctggtgccta gcgagagggt gctcgtggga cctcagagac tgcaggtcct gaacgccagc 300
cacgaggata gcggcgccta cagctgcaga cagagactga cccagcgggt gctgtgccac 360
ttcagcgtca gagtgaccga tgcccccagc agcggagatg acgaggatgg cgaggatgag 420
gccgaggata caggcgtgga cacaggcgcc ccttactgga ccagacccga gcggatggac 480
aagaaactgc tggccgtgcc tgccgccaac accgtgcggt ttagatgccc tgccgccgga 540
aaccccaccc ccagcatctc ttggctgaag aacggcagag agttccgggg cgagcaccgg 600
atcggcggca ttaagctgag acaccagcag tggtccctgg tcatggaaag cgtggtgccc 660
agcgaccggg gcaactacac ctgtgtggtg gaaaacaagt tcggcagcat ccggcagacc 720
tacaccctgg acgtgctgga aagaagcccc cacagaccta tcctgcaggc cggactgcct 780
gccaatcaga cagccgtgct gggcagcgac gtggaatttc actgcaaggt gtacagcgac 840
gcccagcccc acatccagtg gctgaagcac gtggaagtga acggcagcaa agtgggcccc 900
gacggcaccc cttacgtgac cgtgctgaaa accgctggcg ccaacaccac cgacaaagaa 960
ctggaagtgc tgagcctgca caacgtgacc ttcgaggacg ccggcgagta cacctgtctg 1020
gccggcaata gcatcggctt cagccaccac tctgcctggc tggtggtgct gccaggcgga 1080
ggctctgtgt ccctggaaag caacgccagc atgagcagca acaccagcgg cagcggctct 1140
ggcagcggat ctggttctgg ctccggcagc gtggtgttcc cctacttccc ccggctgggc 1200
cggtacaacc tgaactttca tgaggcccag caggcctgcc tggaccagga tgccgtgatc 1260
gccagcttcg accagctgta cgatgcttgg agaggcggcc tggactggtg caatgccggc 1320
tggctgtctg acggcagcgt gcagtacccc atcaccaagc ccagagagcc ctgcggcgga 1380
cagaataccg tgcccggcgt gcggaactac ggcttctggg acaaggacaa gagcagatac 1440
gacgtgttct gcttcaccag caacttcaac ggccggttct actacctgat ccaccccacc 1500
aagctgacct acgacgaggc cgtgcaggcc tgtctgaacg atggcgccca gatcgccaaa 1560
gtgggacaga tcttcgccgc ctggaagatc ctgggctacg acagatgtga cgccggatgg 1620
ctggccgacg gctccgtgcg gtatcccatc agccggccta gaagaagatg cagccctacc 1680
gaggccgccg tcagattcgt gggcttcccc 1710
<210> 35
<211> 236
<212> белок
<213> Homo sapiens
<400> 35
Gly Gly Gly Gly Ala Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro
1 5 10 15
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
20 25 30
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
35 40 45
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
50 55 60
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
65 70 75 80
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
85 90 95
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
100 105 110
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
115 120 125
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
130 135 140
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
145 150 155 160
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
165 170 175
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
180 185 190
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
195 200 205
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
210 215 220
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
225 230 235
<210> 36
<211> 236
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 36
Gly Gly Gly Gly Ala Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro
1 5 10 15
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
20 25 30
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
35 40 45
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
50 55 60
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
65 70 75 80
Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr
85 90 95
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
100 105 110
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
115 120 125
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
130 135 140
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
145 150 155 160
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
165 170 175
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
180 185 190
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
195 200 205
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
210 215 220
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
225 230 235
<210> 37
<211> 585
<212> белок
<213> Homo sapiens
<400> 37
Asp Ala His Lys Ser Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu
1 5 10 15
Glu Asn Phe Lys Ala Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln
20 25 30
Gln Cys Pro Phe Glu Asp His Val Lys Leu Val Asn Glu Val Thr Glu
35 40 45
Phe Ala Lys Thr Cys Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys
50 55 60
Ser Leu His Thr Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu
65 70 75 80
Arg Glu Thr Tyr Gly Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro
85 90 95
Glu Arg Asn Glu Cys Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu
100 105 110
Pro Arg Leu Val Arg Pro Glu Val Asp Val Met Cys Thr Ala Phe His
115 120 125
Asp Asn Glu Glu Thr Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg
130 135 140
Arg His Pro Tyr Phe Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg
145 150 155 160
Tyr Lys Ala Ala Phe Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala
165 170 175
Cys Leu Leu Pro Lys Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser
180 185 190
Ser Ala Lys Gln Arg Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu
195 200 205
Arg Ala Phe Lys Ala Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro
210 215 220
Lys Ala Glu Phe Ala Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys
225 230 235 240
Val His Thr Glu Cys Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp
245 250 255
Arg Ala Asp Leu Ala Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser
260 265 270
Ser Lys Leu Lys Glu Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His
275 280 285
Cys Ile Ala Glu Val Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser
290 295 300
Leu Ala Ala Asp Phe Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala
305 310 315 320
Glu Ala Lys Asp Val Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg
325 330 335
Arg His Pro Asp Tyr Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr
340 345 350
Tyr Glu Thr Thr Leu Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu
355 360 365
Cys Tyr Ala Lys Val Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro
370 375 380
Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu
385 390 395 400
Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro
405 410 415
Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys
420 425 430
Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys
435 440 445
Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val Leu His
450 455 460
Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser
465 470 475 480
Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr
485 490 495
Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His Ala Asp
500 505 510
Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala
515 520 525
Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu
530 535 540
Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys
545 550 555 560
Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val
565 570 575
Ala Ala Ser Gln Ala Ala Leu Gly Leu
580 585
<210> 38
<211> 9
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 38
Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5
<210> 39
<211> 15
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 39
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 40
<211> 208
<212> белок
<213> Homo sapiens
<400> 40
Met Trp Lys Trp Ile Leu Thr His Cys Ala Ser Ala Phe Pro His Leu
1 5 10 15
Pro Gly Cys Cys Cys Cys Cys Phe Leu Leu Leu Phe Leu Val Ser Ser
20 25 30
Val Pro Val Thr Cys Gln Ala Leu Gly Gln Asp Met Val Ser Pro Glu
35 40 45
Ala Thr Asn Ser Ser Ser Ser Ser Phe Ser Ser Pro Ser Ser Ala Gly
50 55 60
Arg His Val Arg Ser Tyr Asn His Leu Gln Gly Asp Val Arg Trp Arg
65 70 75 80
Lys Leu Phe Ser Phe Thr Lys Tyr Phe Leu Lys Ile Glu Lys Asn Gly
85 90 95
Lys Val Ser Gly Thr Lys Lys Glu Asn Cys Pro Tyr Ser Ile Leu Glu
100 105 110
Ile Thr Ser Val Glu Ile Gly Val Val Ala Val Lys Ala Ile Asn Ser
115 120 125
Asn Tyr Tyr Leu Ala Met Asn Lys Lys Gly Lys Leu Tyr Gly Ser Lys
130 135 140
Glu Phe Asn Asn Asp Cys Lys Leu Lys Glu Arg Ile Glu Glu Asn Gly
145 150 155 160
Tyr Asn Thr Tyr Ala Ser Phe Asn Trp Gln His Asn Gly Arg Gln Met
165 170 175
Tyr Val Ala Leu Asn Gly Lys Gly Ala Pro Arg Arg Gly Gln Lys Thr
180 185 190
Arg Arg Lys Asn Thr Ser Ala His Phe Leu Pro Met Val Val His Ser
195 200 205
<210> 41
<211> 251
<212> белок
<213> Homo sapiens
<400> 41
Met Leu Gly Ala Arg Leu Arg Leu Trp Val Cys Ala Leu Cys Ser Val
1 5 10 15
Cys Ser Met Ser Val Leu Arg Ala Tyr Pro Asn Ala Ser Pro Leu Leu
20 25 30
Gly Ser Ser Trp Gly Gly Leu Ile His Leu Tyr Thr Ala Thr Ala Arg
35 40 45
Asn Ser Tyr His Leu Gln Ile His Lys Asn Gly His Val Asp Gly Ala
50 55 60
Pro His Gln Thr Ile Tyr Ser Ala Leu Met Ile Arg Ser Glu Asp Ala
65 70 75 80
Gly Phe Val Val Ile Thr Gly Val Met Ser Arg Arg Tyr Leu Cys Met
85 90 95
Asp Phe Arg Gly Asn Ile Phe Gly Ser His Tyr Phe Asp Pro Glu Asn
100 105 110
Cys Arg Phe Gln His Gln Thr Leu Glu Asn Gly Tyr Asp Val Tyr His
115 120 125
Ser Pro Gln Tyr His Phe Leu Val Ser Leu Gly Arg Ala Lys Arg Ala
130 135 140
Phe Leu Pro Gly Met Asn Pro Pro Pro Tyr Ser Gln Phe Leu Ser Arg
145 150 155 160
Arg Asn Glu Ile Pro Leu Ile His Phe Asn Thr Pro Ile Pro Arg Arg
165 170 175
His Thr Arg Ser Ala Glu Asp Asp Ser Glu Arg Asp Pro Leu Asn Val
180 185 190
Leu Lys Pro Arg Ala Arg Met Thr Pro Ala Pro Ala Ser Cys Ser Gln
195 200 205
Glu Leu Pro Ser Ala Glu Asp Asn Ser Pro Met Ala Ser Asp Pro Leu
210 215 220
Gly Val Val Arg Gly Gly Arg Val Asn Thr His Ala Gly Gly Thr Gly
225 230 235 240
Pro Glu Gly Cys Arg Pro Phe Ala Lys Phe Ile
245 250
<210> 42
<211> 806
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 42
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser Glu Ser Leu Gly Thr Glu Gln Arg Val Val
20 25 30
Gly Arg Ala Ala Glu Val Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln
35 40 45
Leu Val Phe Gly Ser Gly Asp Ala Val Glu Leu Ser Cys Pro Pro Pro
50 55 60
Gly Gly Gly Pro Met Gly Pro Thr Val Trp Val Lys Asp Gly Thr Gly
65 70 75 80
Leu Val Pro Ser Glu Arg Val Leu Val Gly Pro Gln Arg Leu Gln Val
85 90 95
Leu Asn Ala Ser His Glu Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg
100 105 110
Leu Thr Gln Arg Val Leu Cys His Phe Ser Val Arg Val Thr Asp Ala
115 120 125
Pro Ser Ser Gly Asp Asp Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr
130 135 140
Gly Val Asp Thr Gly Ala Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp
145 150 155 160
Lys Lys Leu Leu Ala Val Pro Ala Ala Asn Thr Val Arg Phe Arg Cys
165 170 175
Pro Ala Ala Gly Asn Pro Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly
180 185 190
Arg Glu Phe Arg Gly Glu His Arg Ile Gly Gly Ile Lys Leu Arg His
195 200 205
Gln Gln Trp Ser Leu Val Met Glu Ser Val Val Pro Ser Asp Arg Gly
210 215 220
Asn Tyr Thr Cys Val Val Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr
225 230 235 240
Tyr Thr Leu Asp Val Leu Glu Arg Ser Pro His Arg Pro Ile Leu Gln
245 250 255
Ala Gly Leu Pro Ala Asn Gln Thr Ala Val Leu Gly Ser Asp Val Glu
260 265 270
Phe His Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Leu
275 280 285
Lys His Val Glu Val Asn Gly Ser Lys Val Gly Pro Asp Gly Thr Pro
290 295 300
Tyr Val Thr Val Leu Lys Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu
305 310 315 320
Leu Glu Val Leu Ser Leu His Asn Val Thr Phe Glu Asp Ala Gly Glu
325 330 335
Tyr Thr Cys Leu Ala Gly Asn Ser Ile Gly Phe Ser His His Ser Ala
340 345 350
Trp Leu Val Val Leu Pro Ala Glu Glu Glu Leu Val Glu Ala Asp Glu
355 360 365
Ala Gly Ser Val Tyr Ala Gly Ile Leu Ser Tyr Gly Val Gly Phe Phe
370 375 380
Leu Phe Ile Leu Val Val Ala Ala Val Thr Leu Cys Arg Leu Arg Ser
385 390 395 400
Pro Pro Lys Lys Gly Leu Gly Ser Pro Thr Val His Lys Ile Ser Arg
405 410 415
Phe Pro Leu Lys Arg Gln Val Ser Leu Glu Ser Asn Ala Ser Met Ser
420 425 430
Ser Asn Thr Pro Leu Val Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly
435 440 445
Pro Thr Leu Ala Asn Val Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys
450 455 460
Trp Glu Leu Ser Arg Ala Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu
465 470 475 480
Gly Cys Phe Gly Gln Val Val Met Ala Glu Ala Ile Gly Ile Asp Lys
485 490 495
Asp Arg Ala Ala Lys Pro Val Thr Val Ala Val Lys Met Leu Lys Asp
500 505 510
Asp Ala Thr Asp Lys Asp Leu Ser Asp Leu Val Ser Glu Met Glu Met
515 520 525
Met Lys Met Ile Gly Lys His Lys Asn Ile Ile Asn Leu Leu Gly Ala
530 535 540
Cys Thr Gln Gly Gly Pro Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys
545 550 555 560
Gly Asn Leu Arg Glu Phe Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp
565 570 575
Tyr Ser Phe Asp Thr Cys Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys
580 585 590
Asp Leu Val Ser Cys Ala Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu
595 600 605
Ala Ser Gln Lys Cys Ile His Arg Asp Leu Ala Ala Arg Asn Val Leu
610 615 620
Val Thr Glu Asp Asn Val Met Lys Ile Ala Asp Phe Gly Leu Ala Arg
625 630 635 640
Asp Val His Asn Leu Asp Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu
645 650 655
Pro Val Lys Trp Met Ala Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr
660 665 670
His Gln Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Ile Phe
675 680 685
Thr Leu Gly Gly Ser Pro Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe
690 695 700
Lys Leu Leu Lys Glu Gly His Arg Met Asp Lys Pro Ala Asn Cys Thr
705 710 715 720
His Asp Leu Tyr Met Ile Met Arg Glu Cys Trp His Ala Ala Pro Ser
725 730 735
Gln Arg Pro Thr Phe Lys Gln Leu Val Glu Asp Leu Asp Arg Val Leu
740 745 750
Thr Val Thr Ser Thr Asp Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu
755 760 765
Gln Tyr Ser Pro Gly Gly Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly
770 775 780
Asp Asp Ser Val Phe Ala His Asp Leu Leu Pro Pro Ala Pro Pro Ser
785 790 795 800
Ser Gly Gly Ser Arg Thr
805
<210> 43
<211> 19
<212> белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 43
Met Met Ser Phe Val Ser Leu Leu Leu Val Gly Ile Leu Phe His Ala
1 5 10 15
Thr Gln Ala
<210> 44
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 44
cagatgcact cccatcctcg 20
<210> 45
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 45
tctggggatg tccagtaggg 20
<210> 46
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 46
tggcagtgaa gatgttgaaa g 21
<210> 47
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 47
atcatcttca tcatctccat ctcttg 26
<210> 48
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 48
ttatccttgg ctcctgggtg 20
<210> 49
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 49
ctggaaggta gcagtgggaa 20
<210> 50
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 50
gctcggaggt agaggtcttg t 21
<210> 51
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 51
ccacgctgac tggtaggaa 19
<210> 52
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 52
tttggtggac acaggcattg 20
<210> 53
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 53
caaactgccc gatcatggag 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИДЫ, ЯВЛЯЮЩИЕСЯ РАСТВОРИМЫМИ РЕЦЕПТОРАМИ 3 ФАКТОРА РОСТА ФИБРОБЛАСТОВ (SFGFR3), И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2751483C2 |
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ О-АЦЕТИЛИРОВАННОГО ГАНГЛИОЗИДА GD2 ДЛЯ УЛУЧШЕНИЯ ТЕРАПЕВТИЧЕСКОГО ПОТЕНЦИАЛА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2017 |
|
RU2771173C2 |
| ВАРИАНТЫ КИСЛОЙ АЛЬФА-ГЛЮКОЗИДАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2780410C2 |
| РЕКОМБИНАНТНЫЕ КЛЕТКИ ДРОЖЖЕЙ, ПРОДУЦИРУЮЩИЕ ПОЛИМОЛОЧНУЮ КИСЛОТУ, И ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2758138C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| Выделенное антитело к CD45RC человека, нуклеиновая кислота, вектор экспрессии, клетка, фармацевтическая композиция, их применение, in vitro способ обнаружения hCD45RC | 2019 |
|
RU2826421C2 |
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
| ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ С ВЫСОКОПЛОТНЫМ ПОКРЫТИЕМ ДЛЯ ИНДУКЦИИ ЭКСПРЕССИИ АНТИТЕЛ | 2017 |
|
RU2813282C2 |
| МОДИФИЦИРОВАННЫЙ ЭРИТРОПОЭТИН ЧЕЛОВЕКА | 2019 |
|
RU2827791C2 |

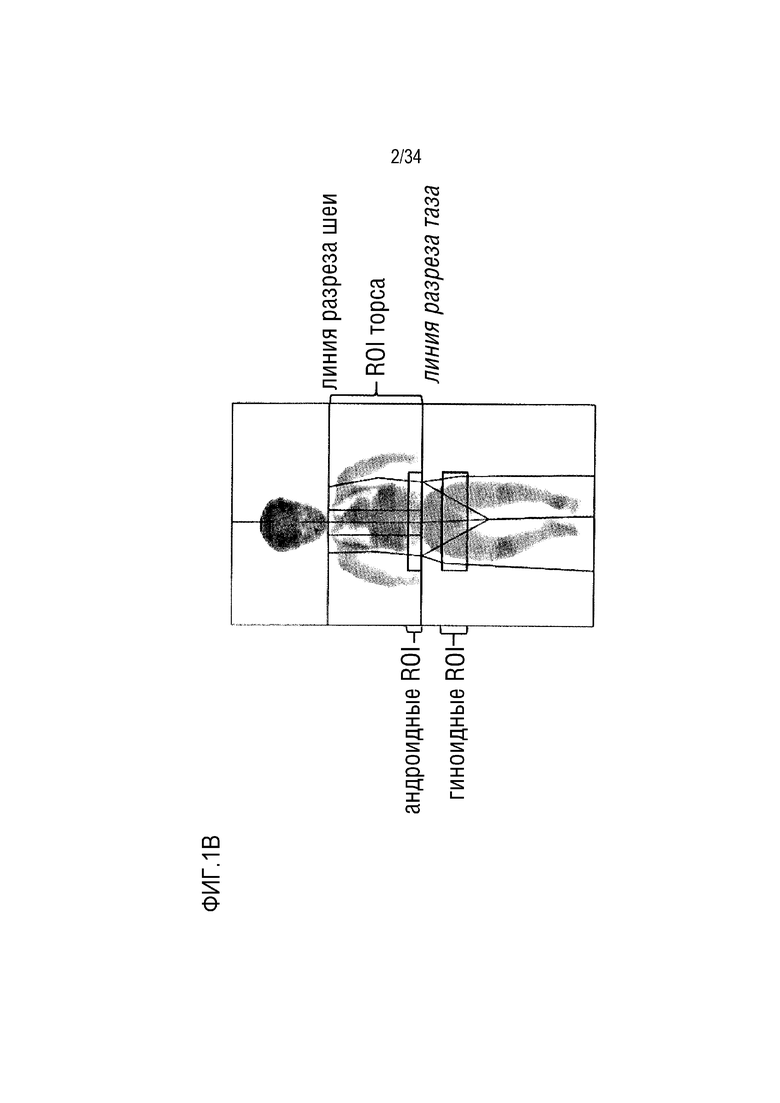
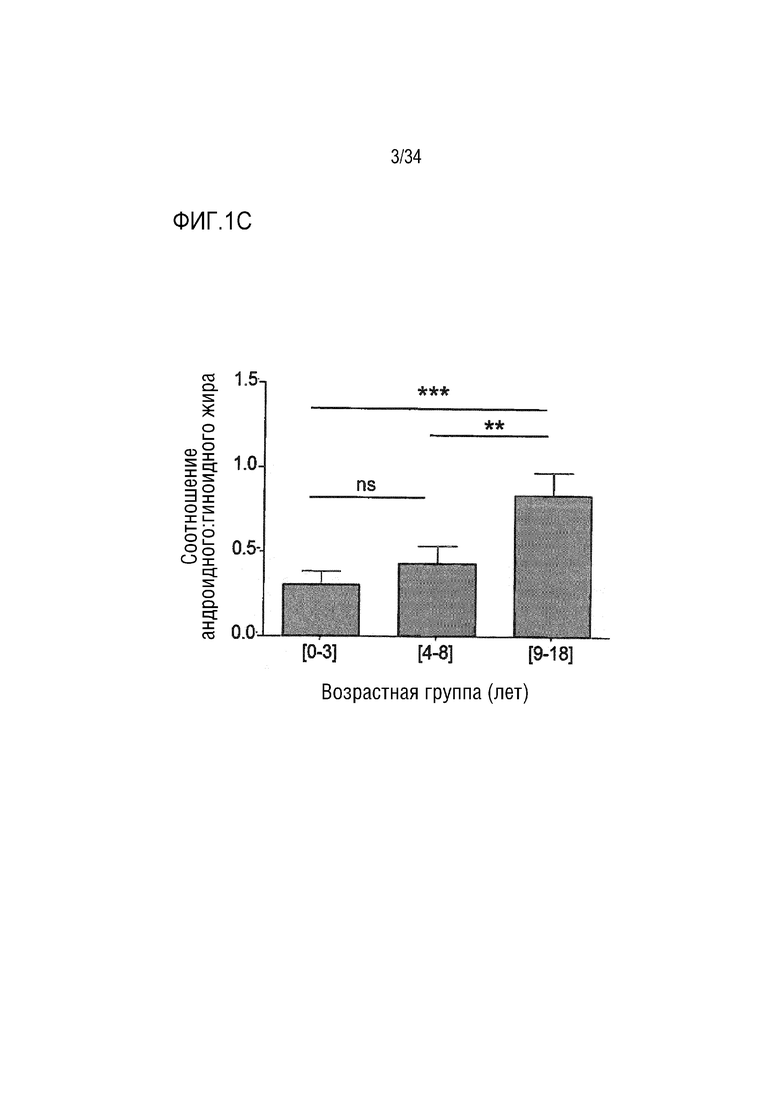
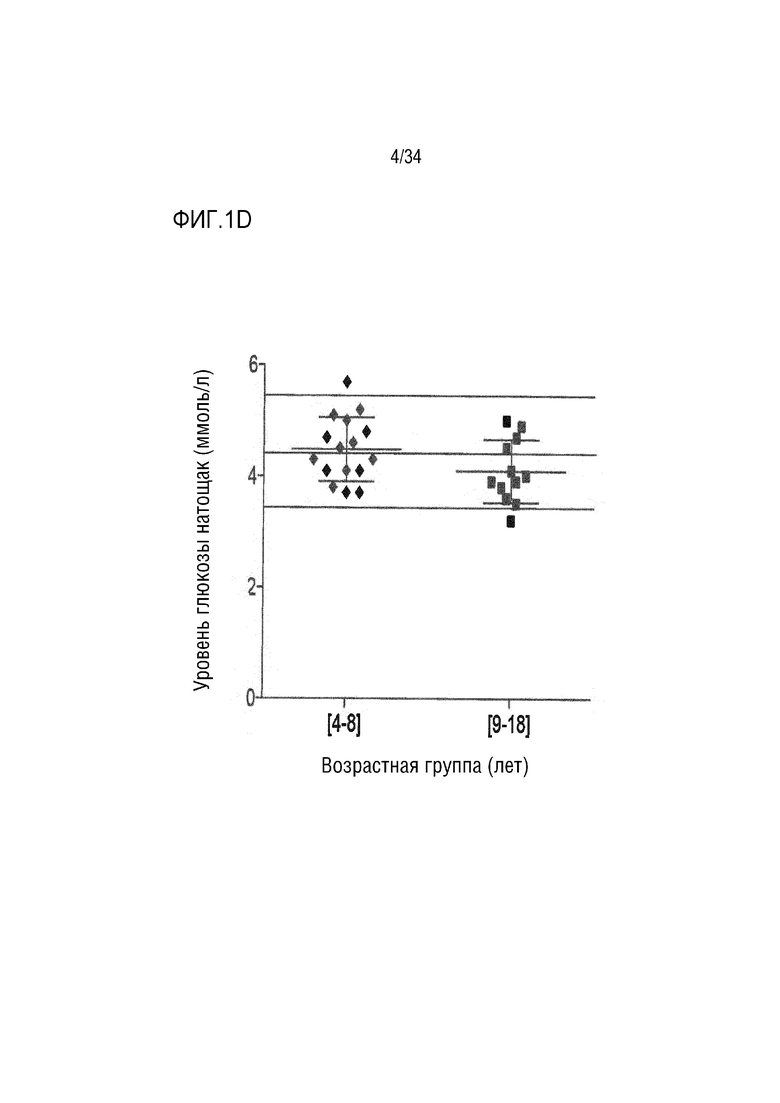

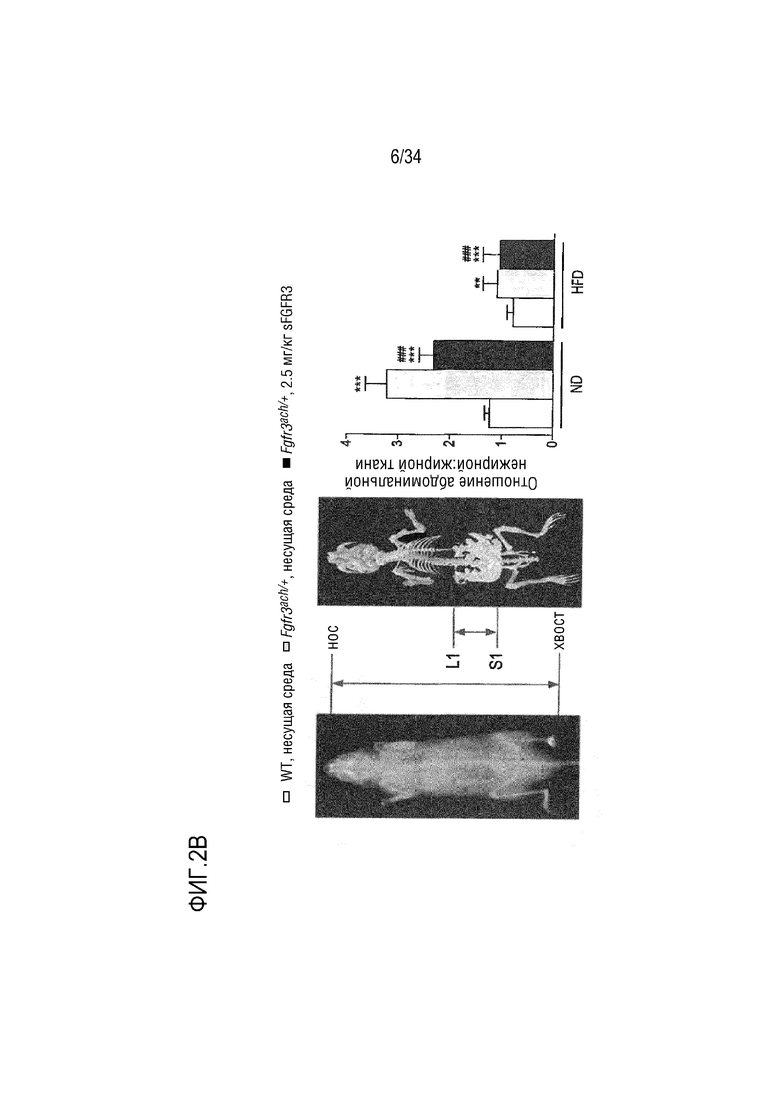
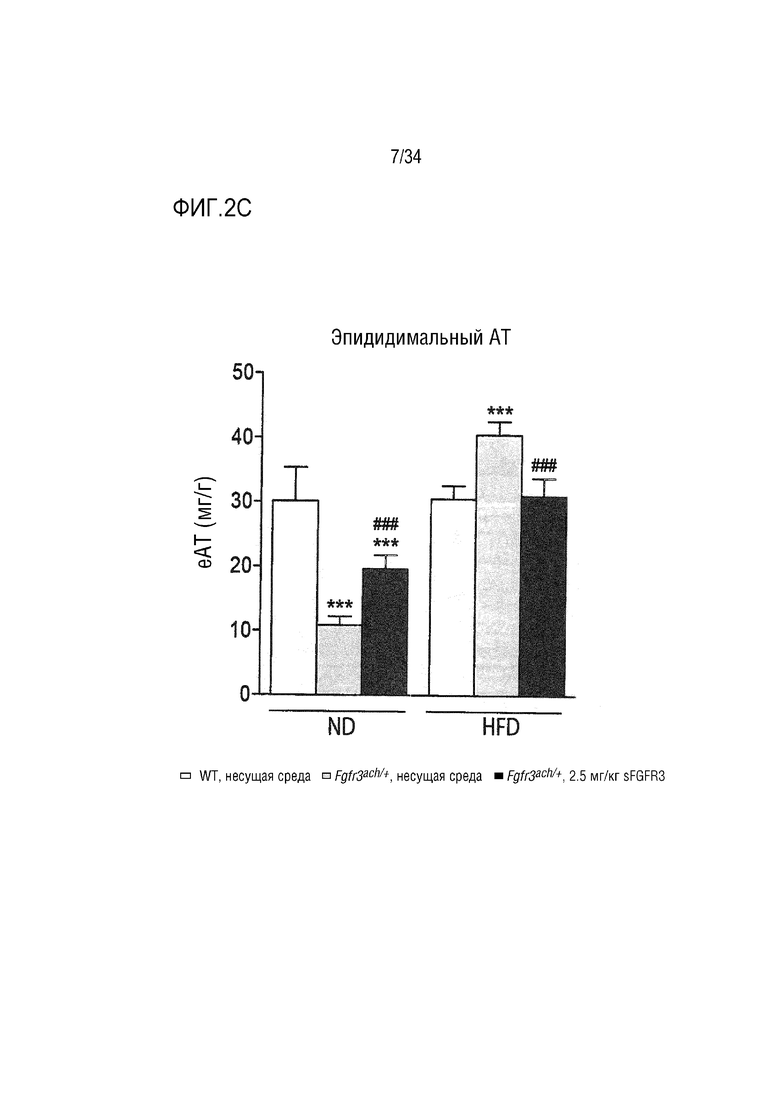
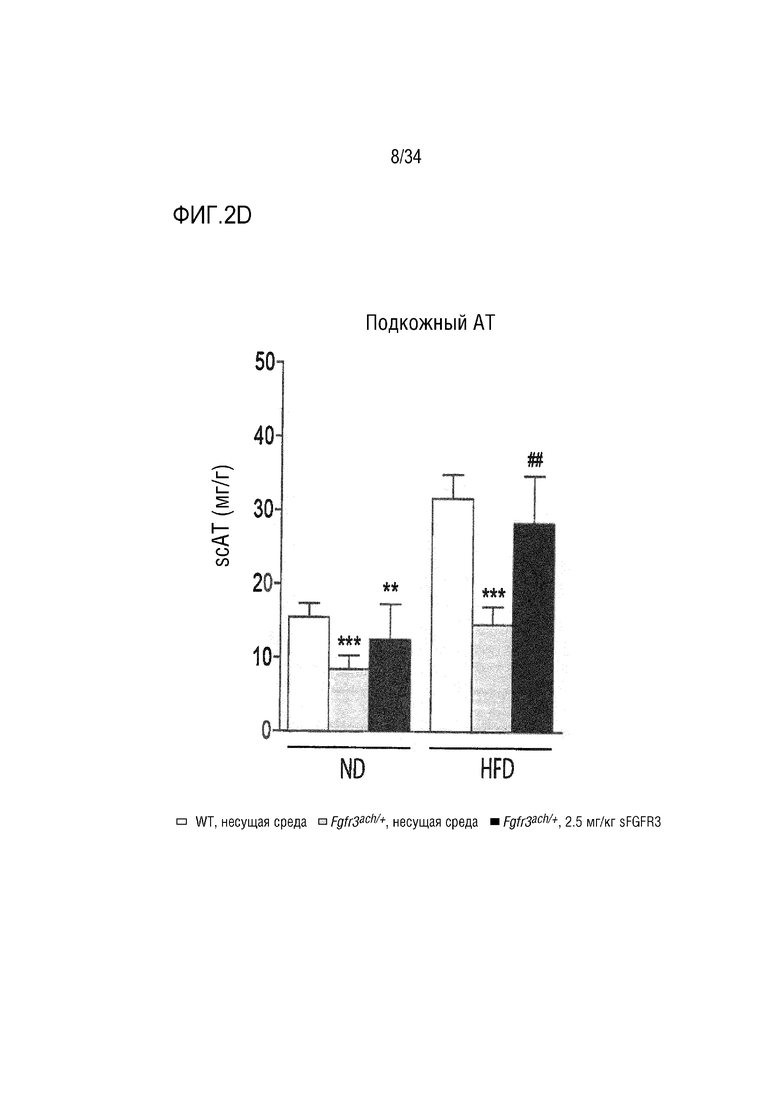
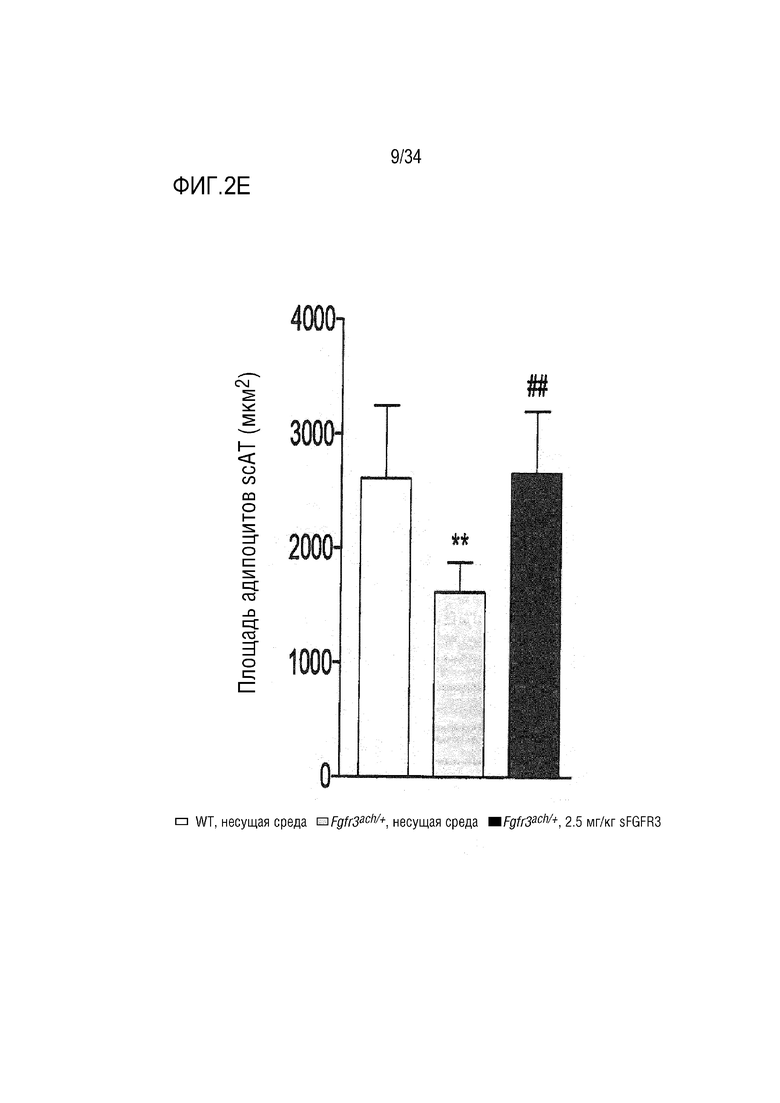
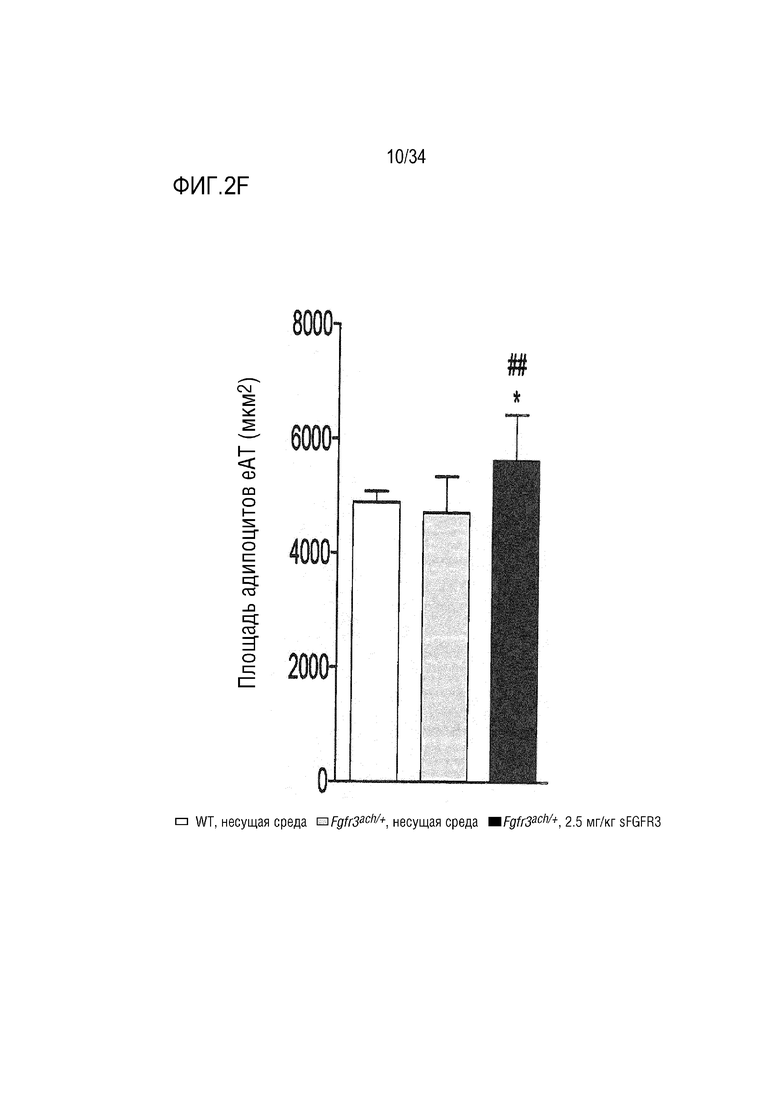
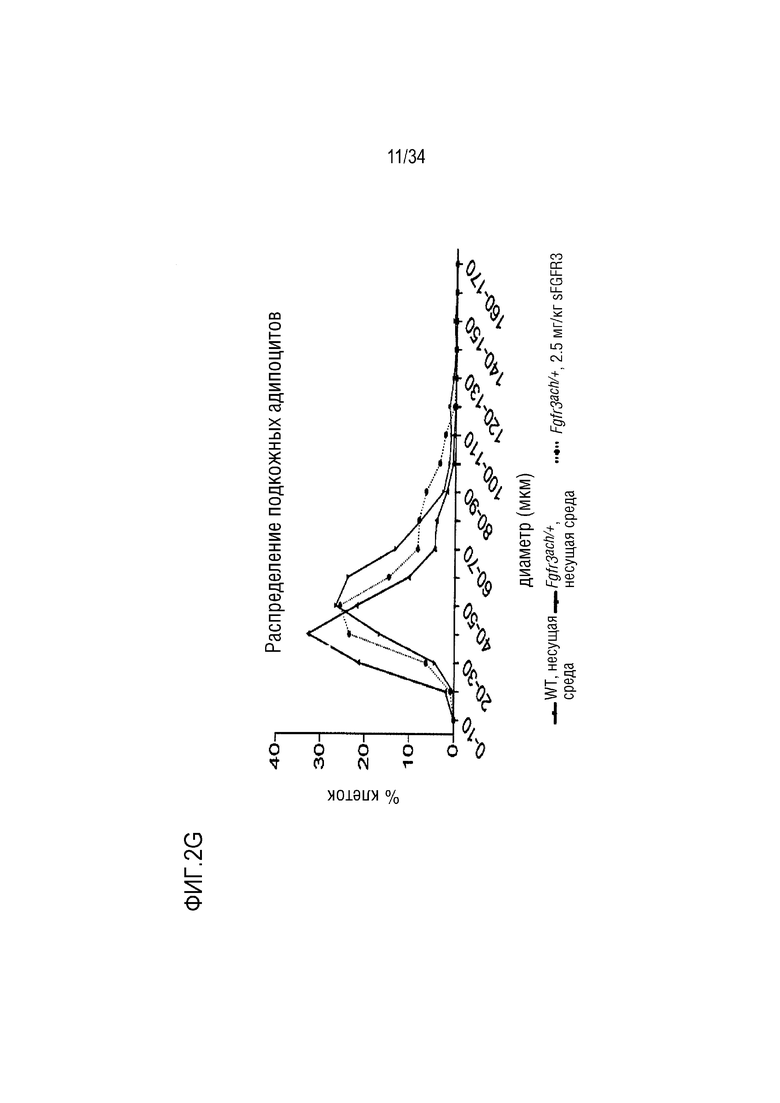
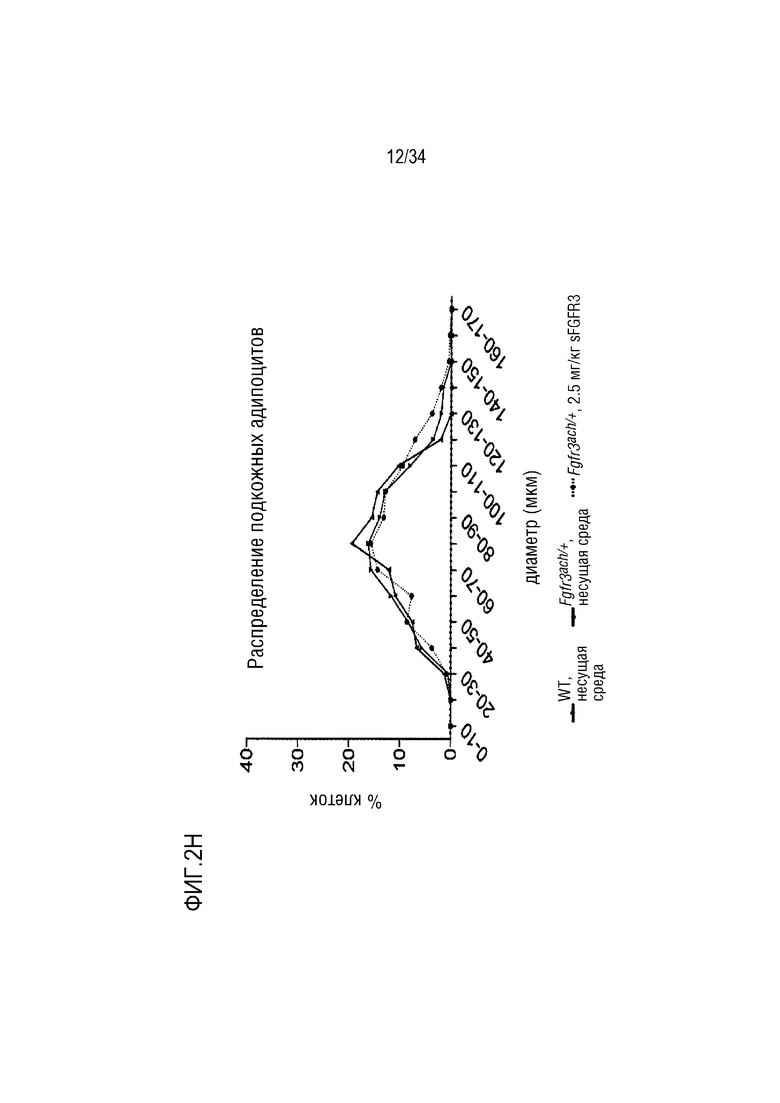
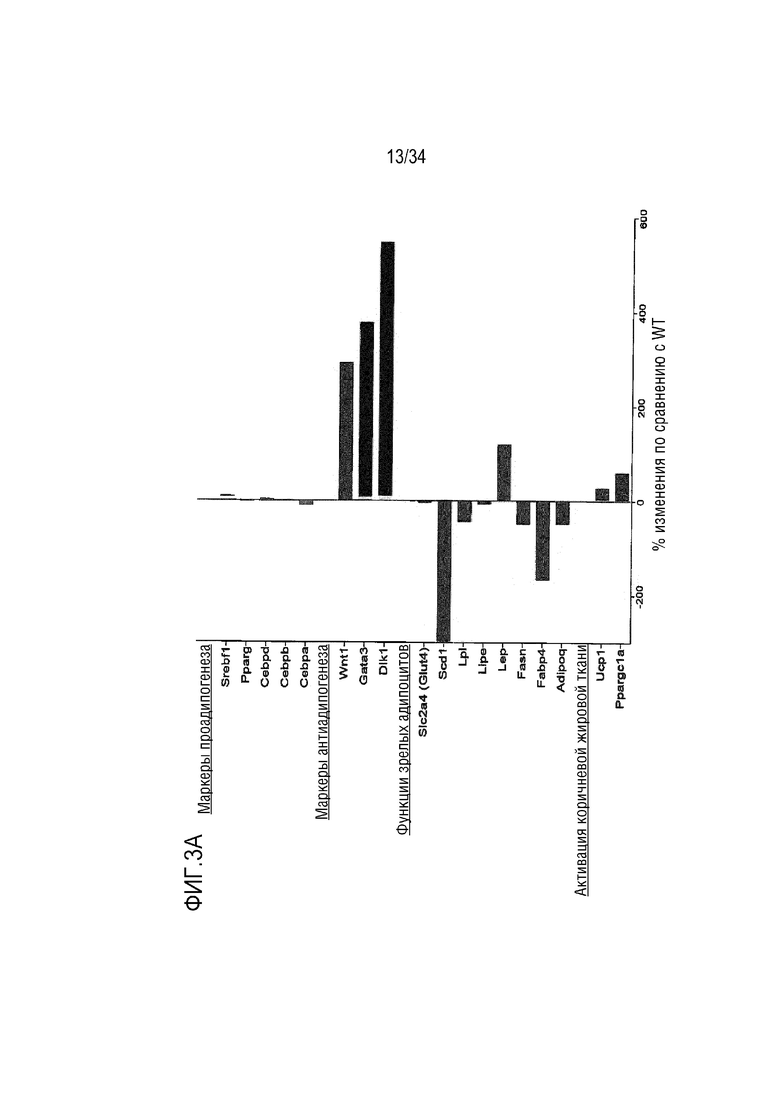
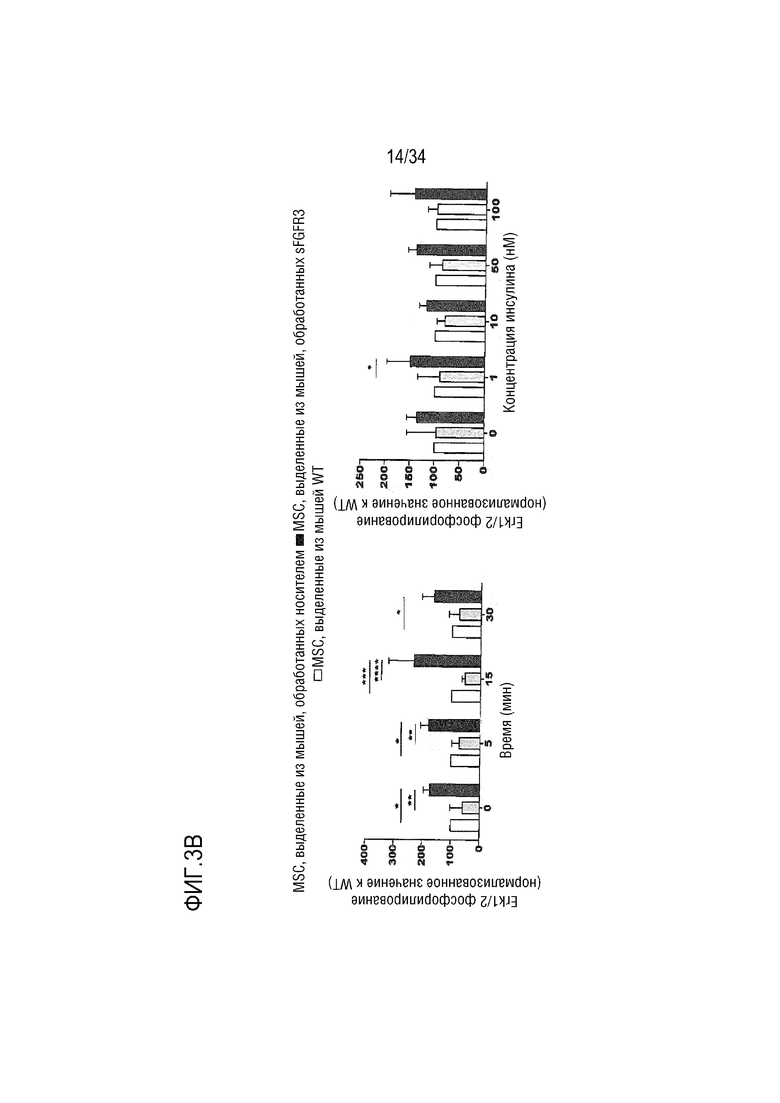
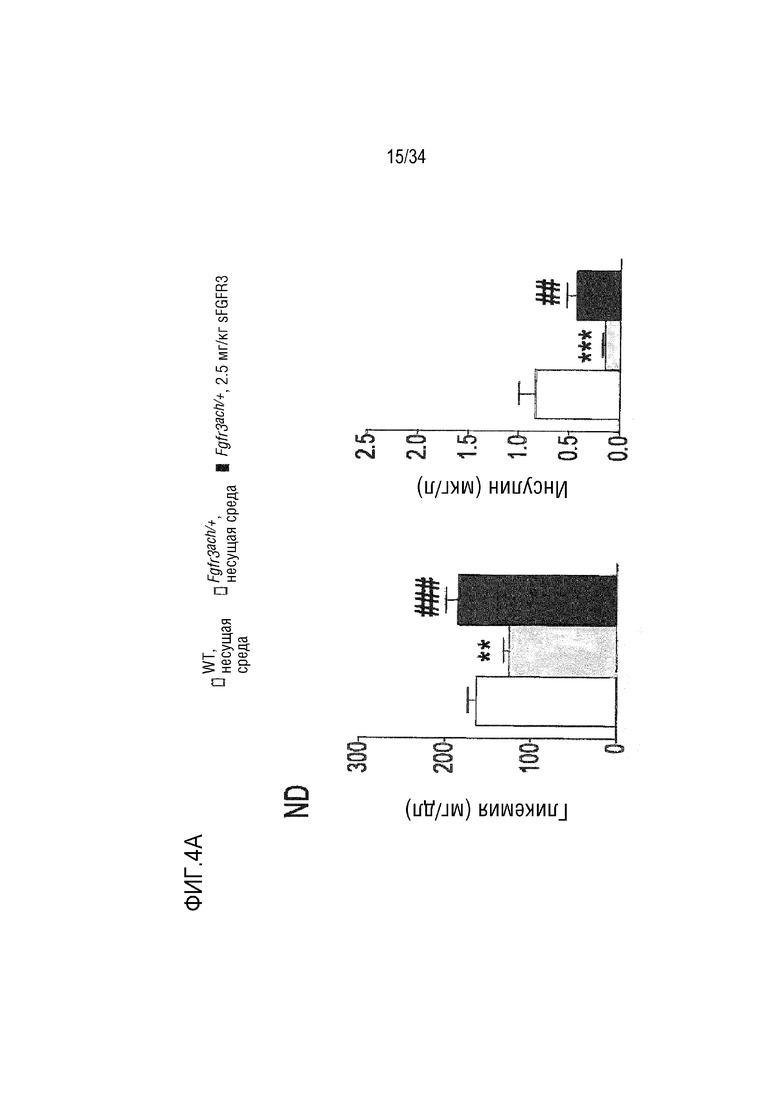
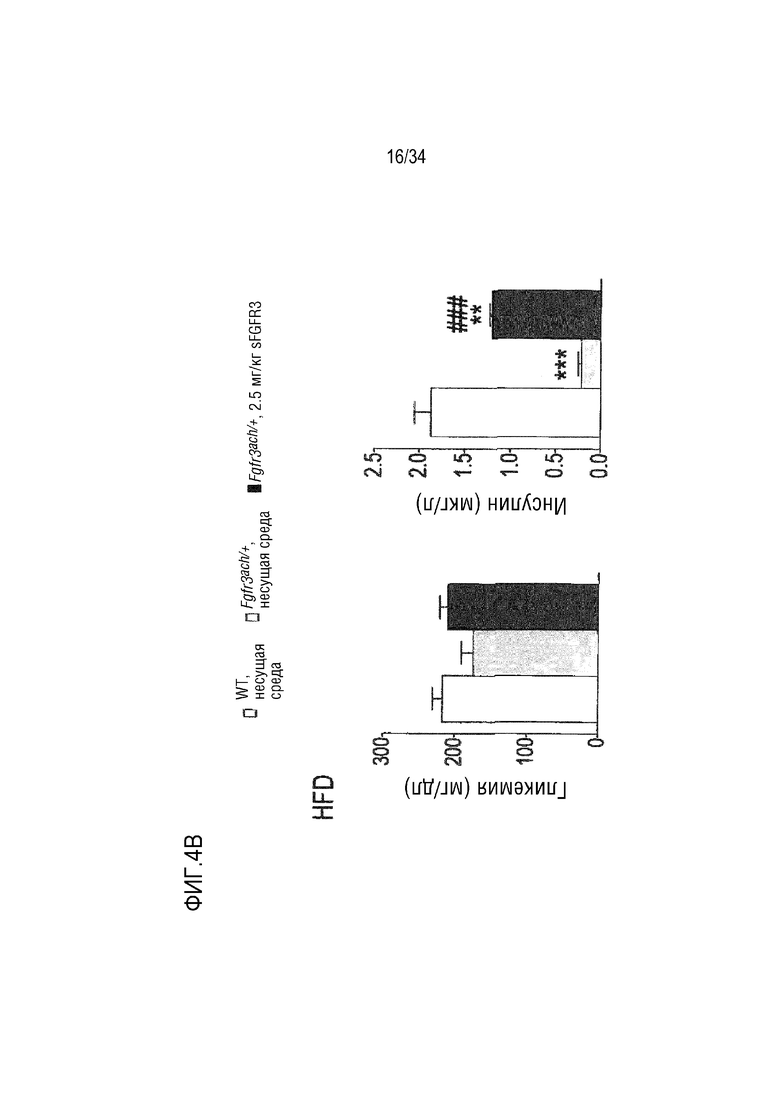
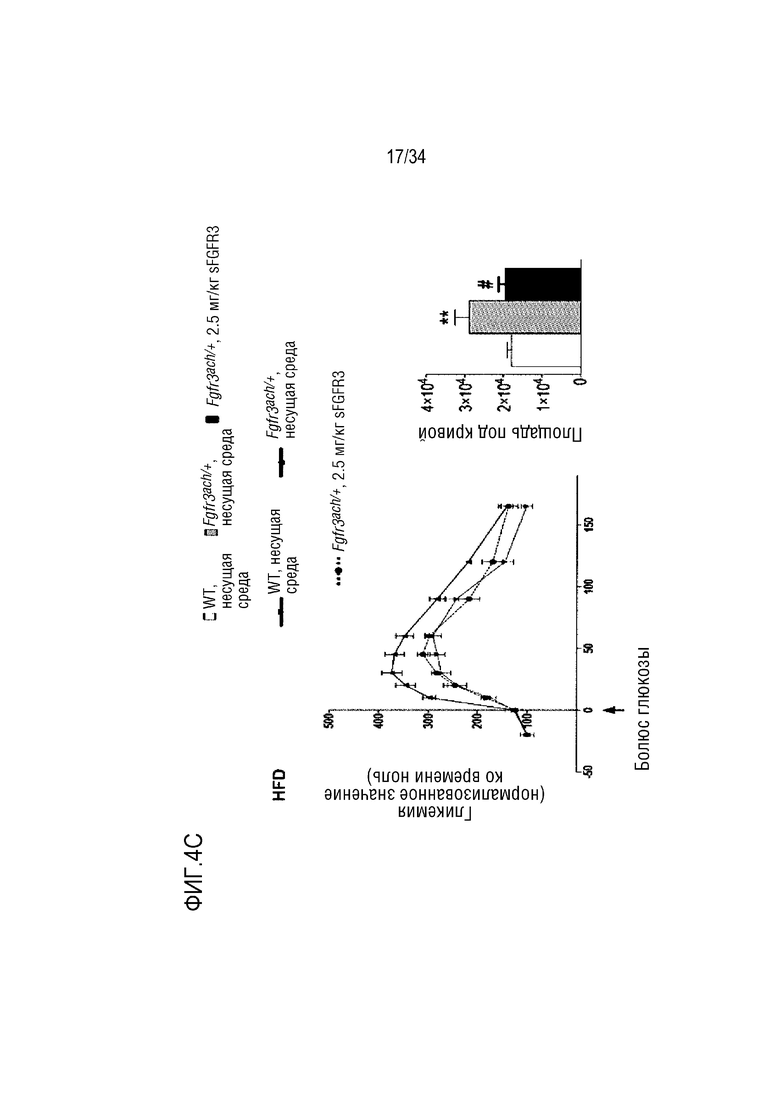
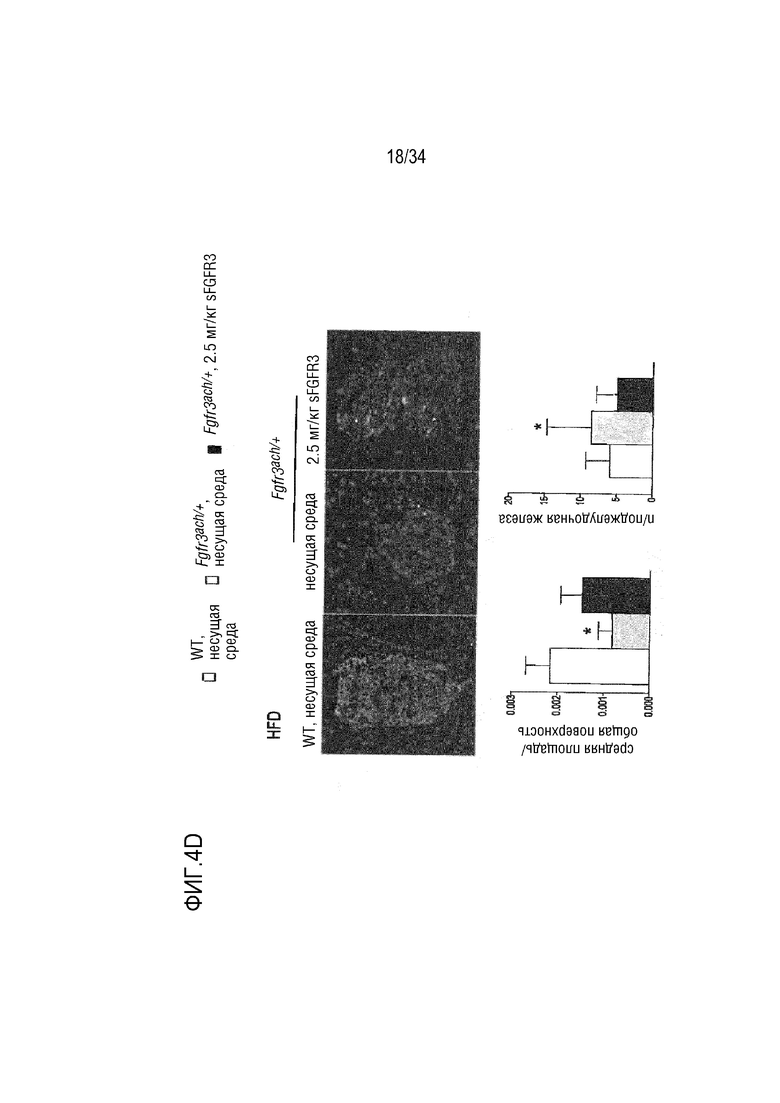
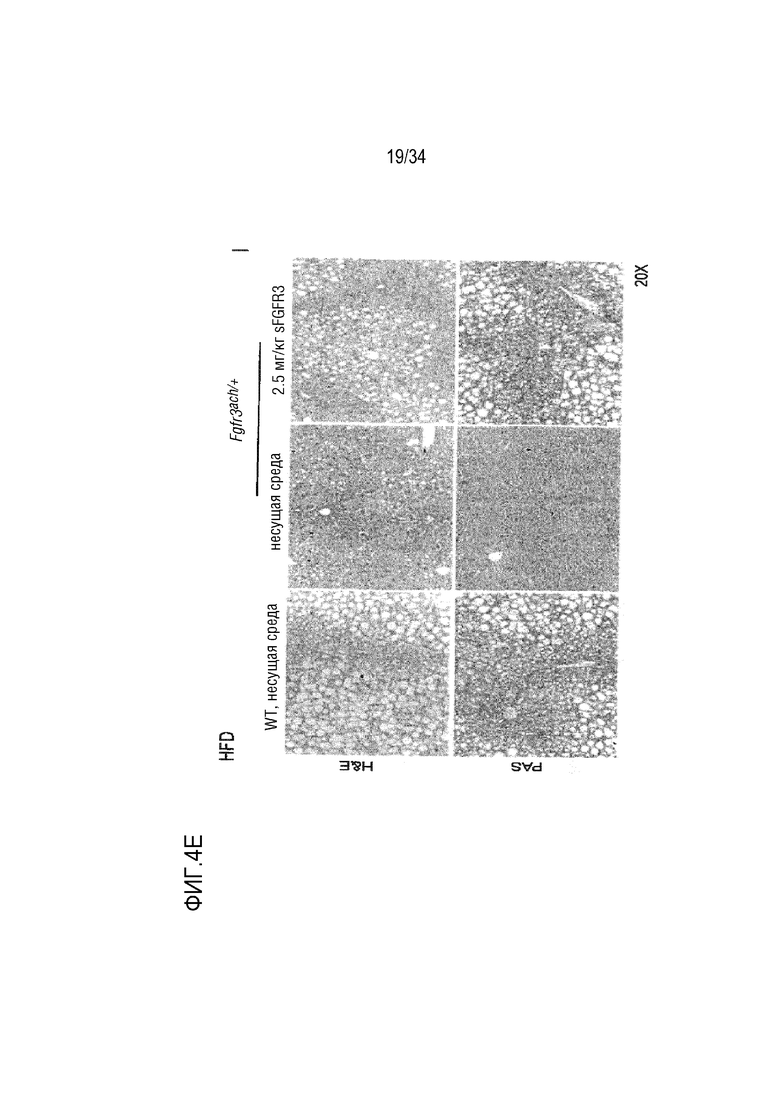
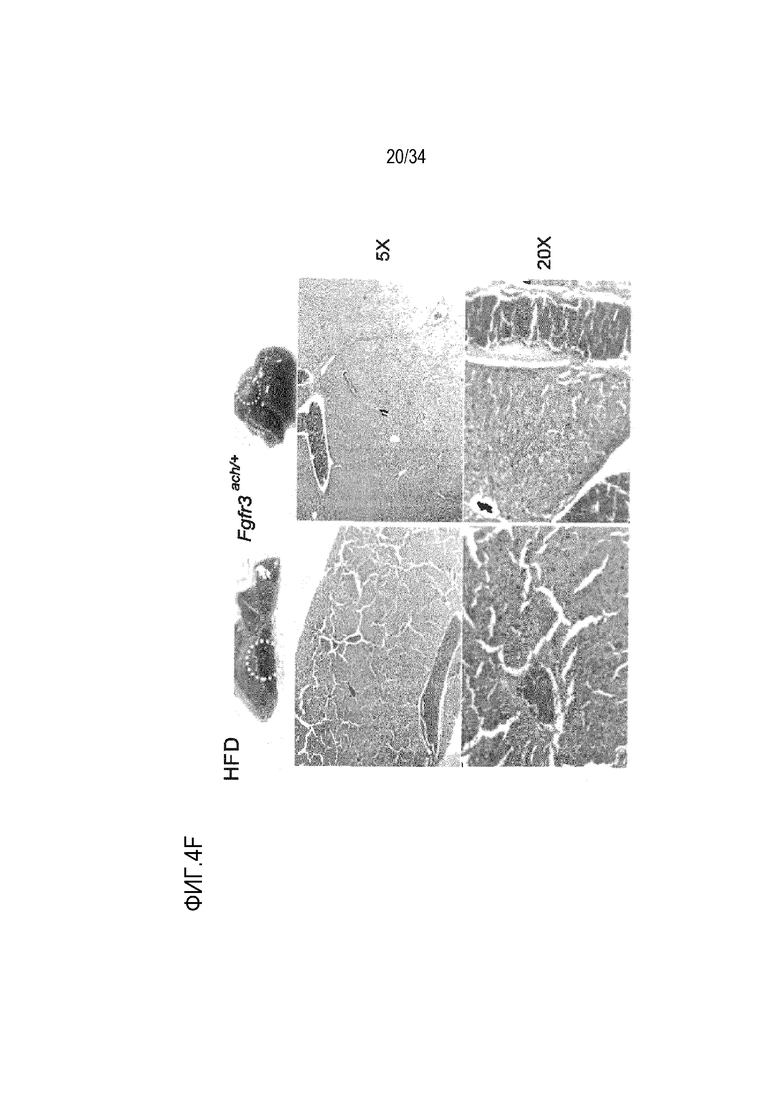
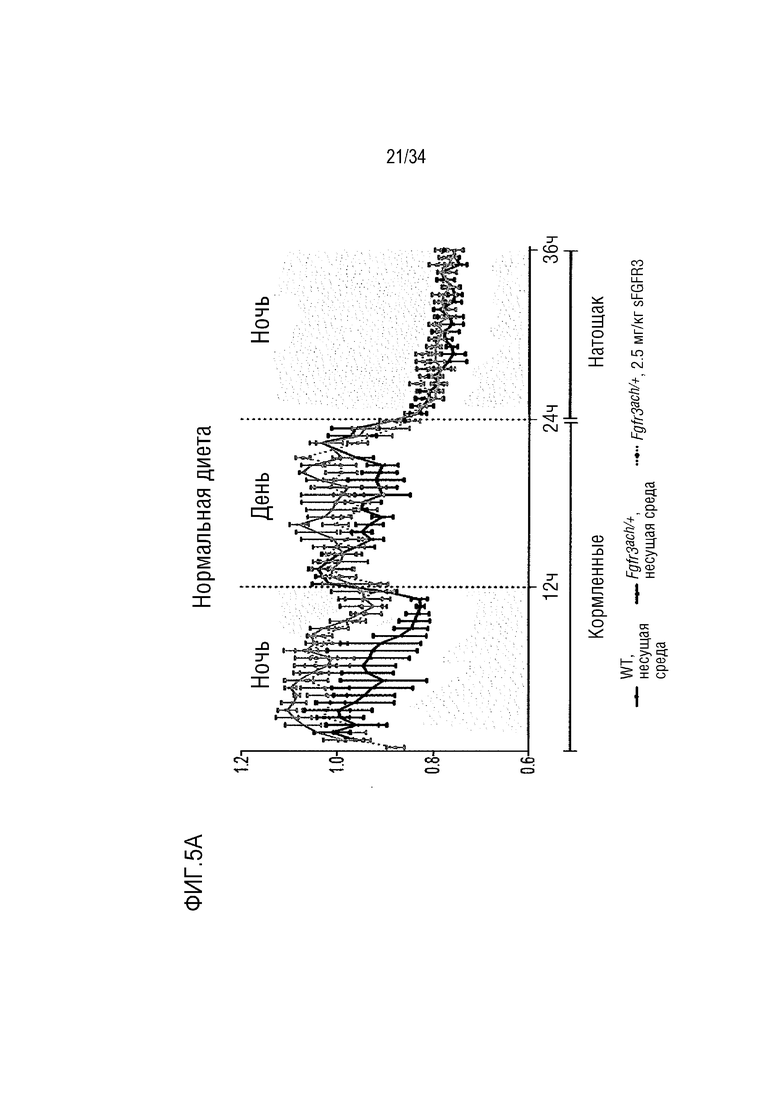
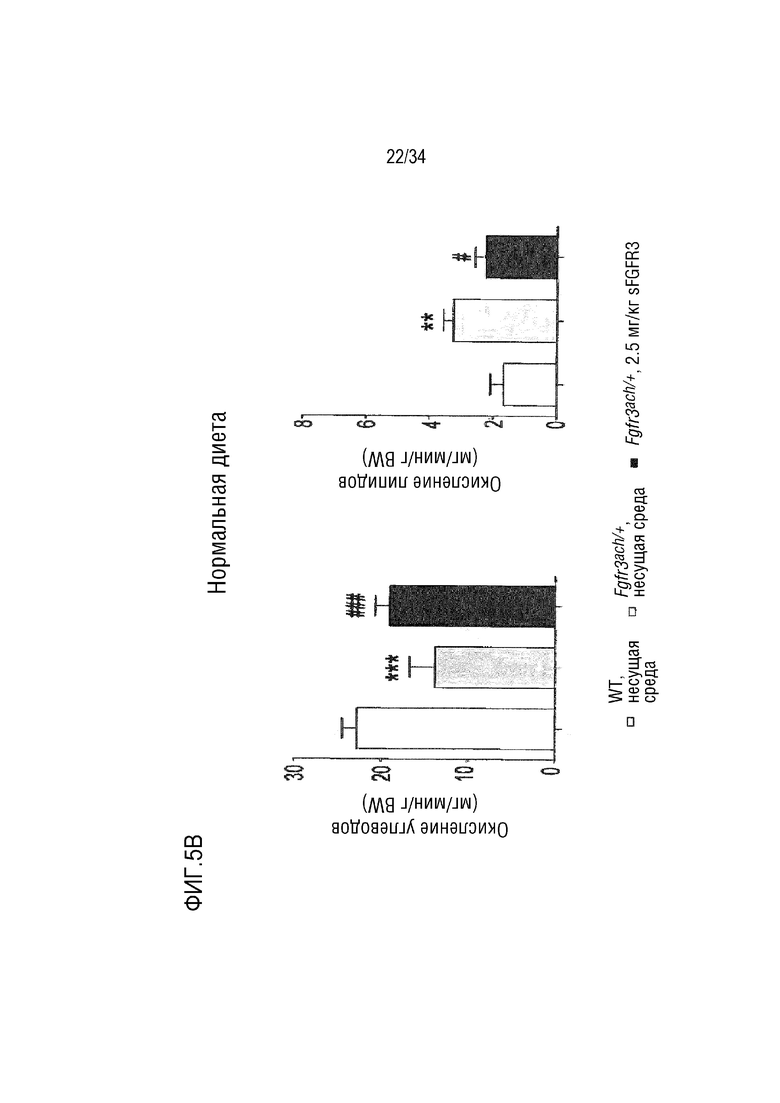
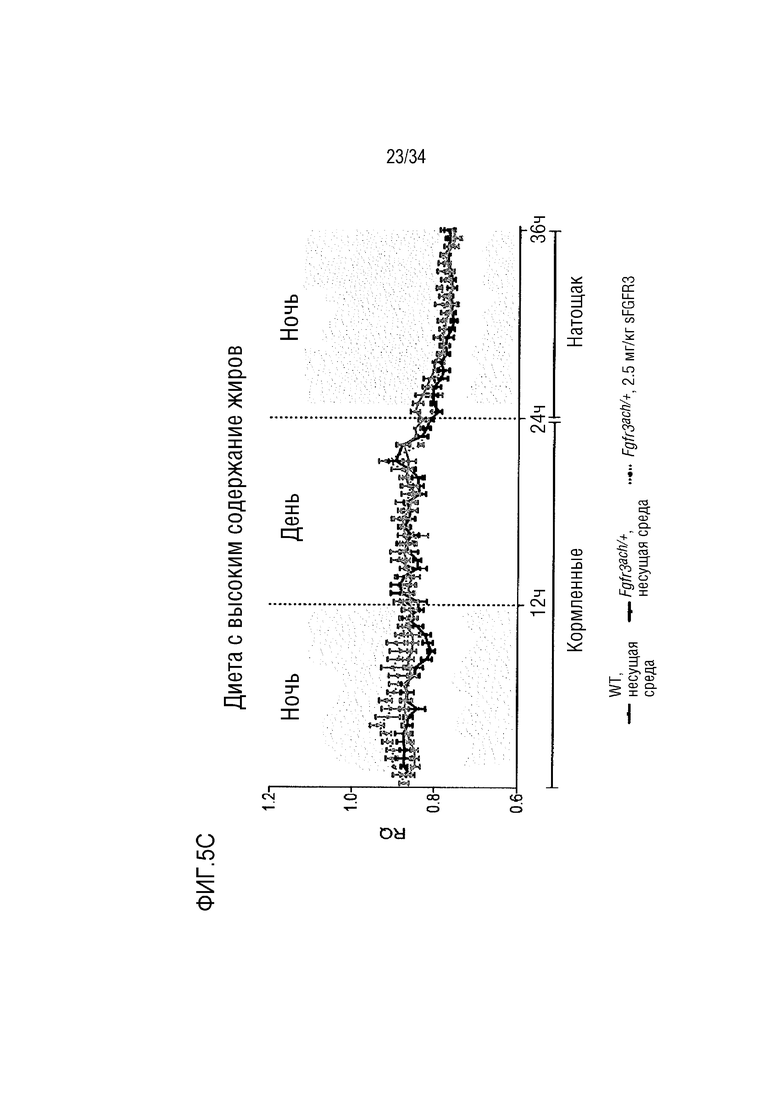
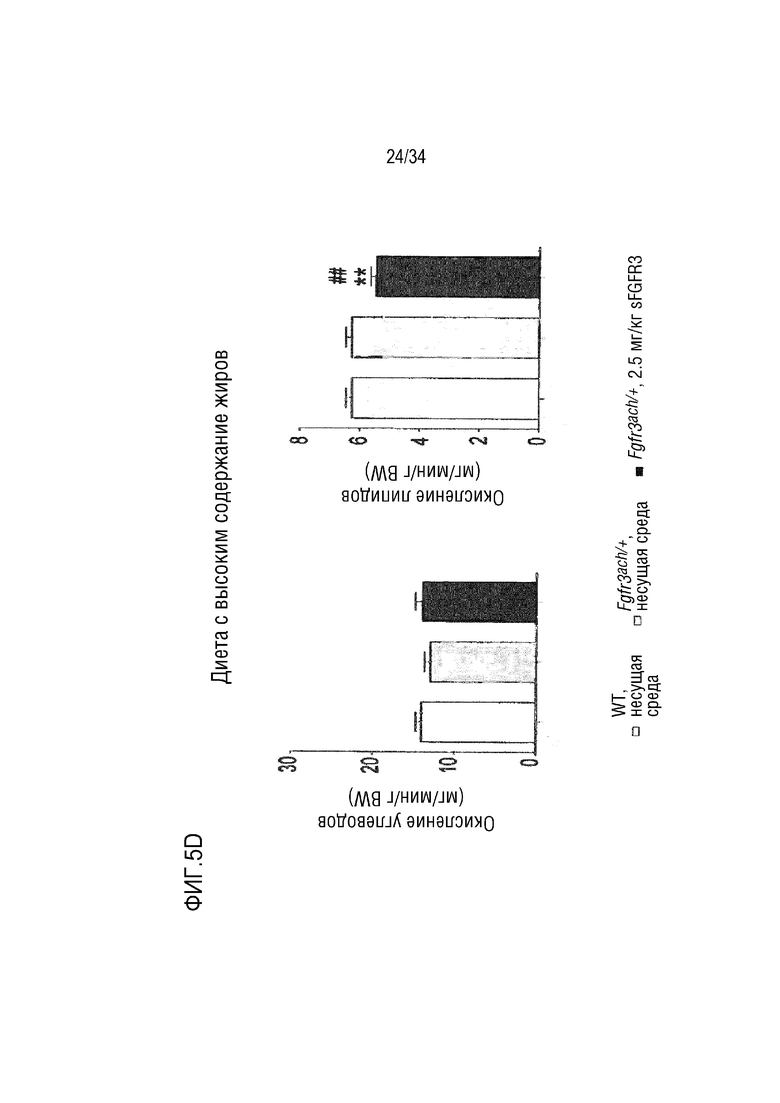
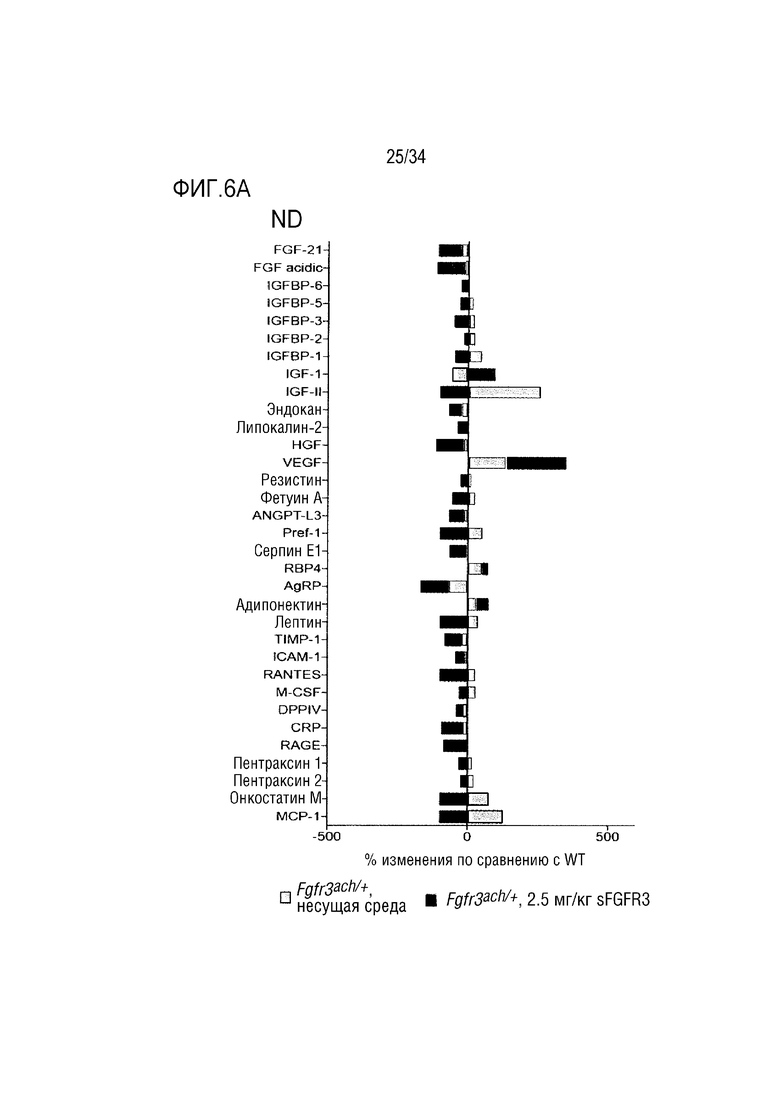
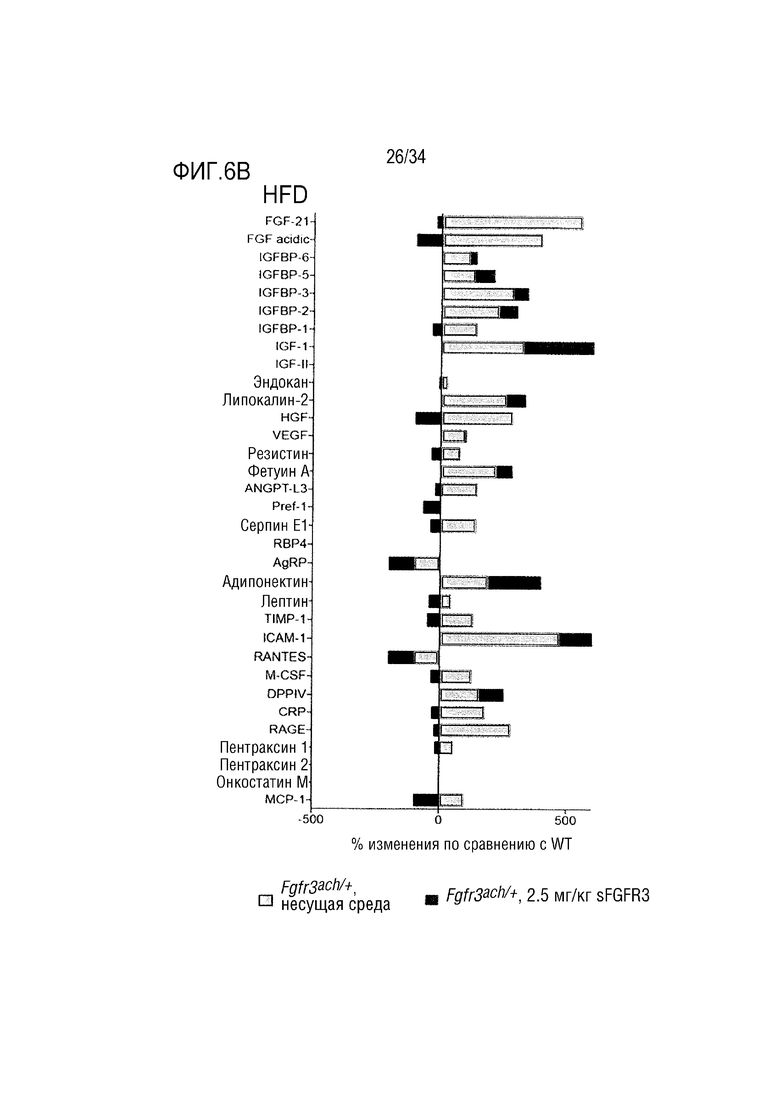
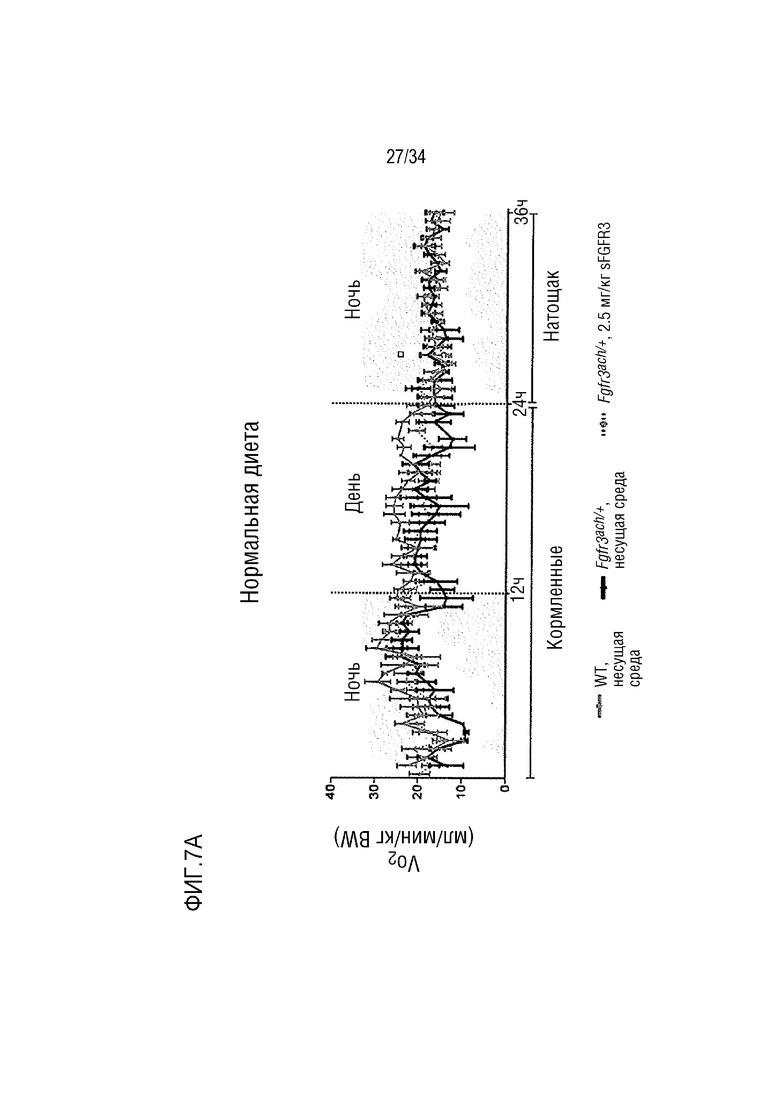
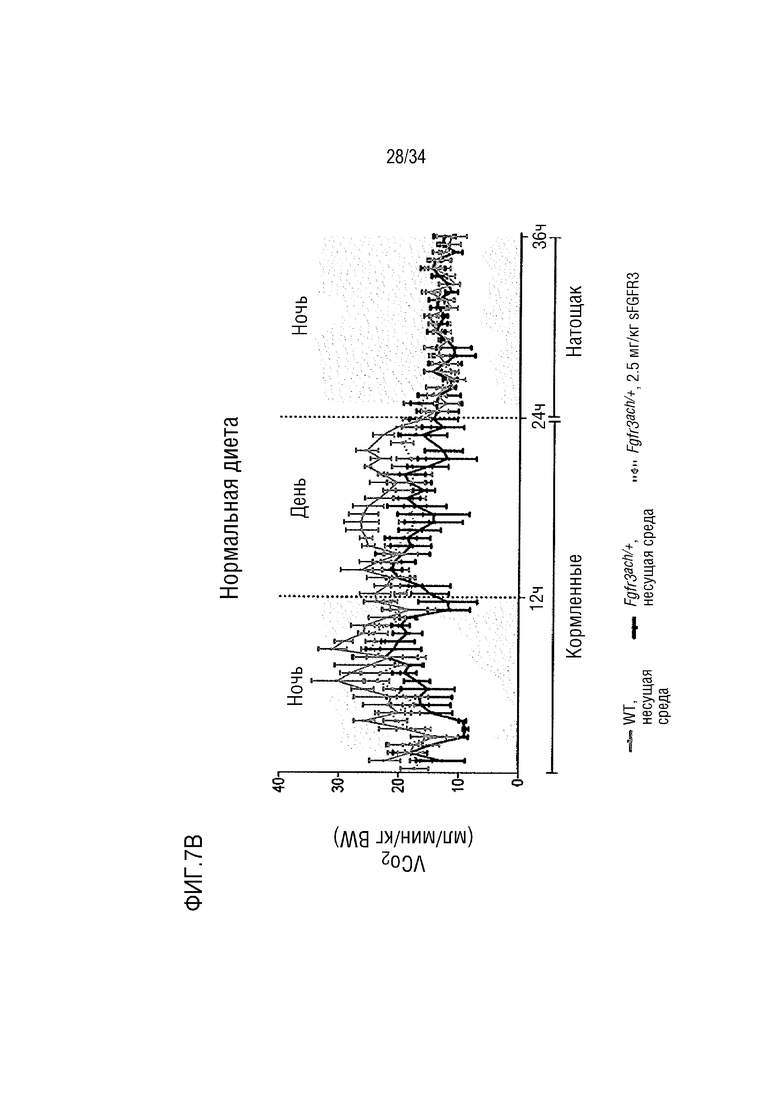
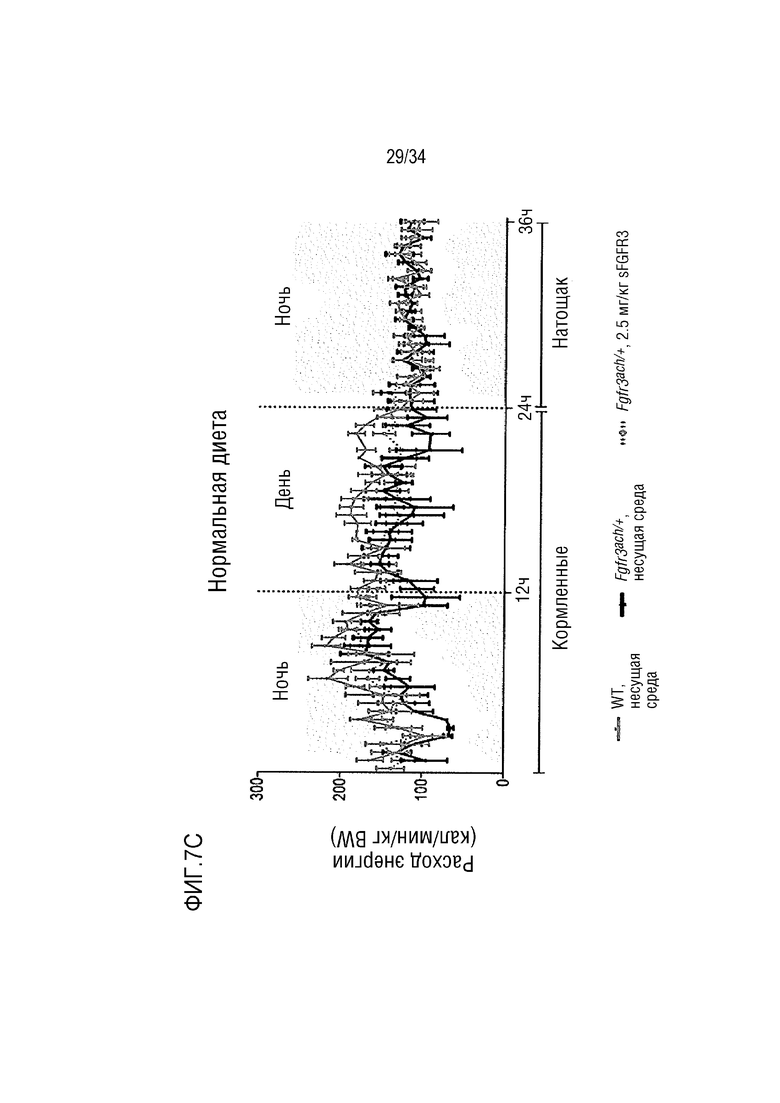
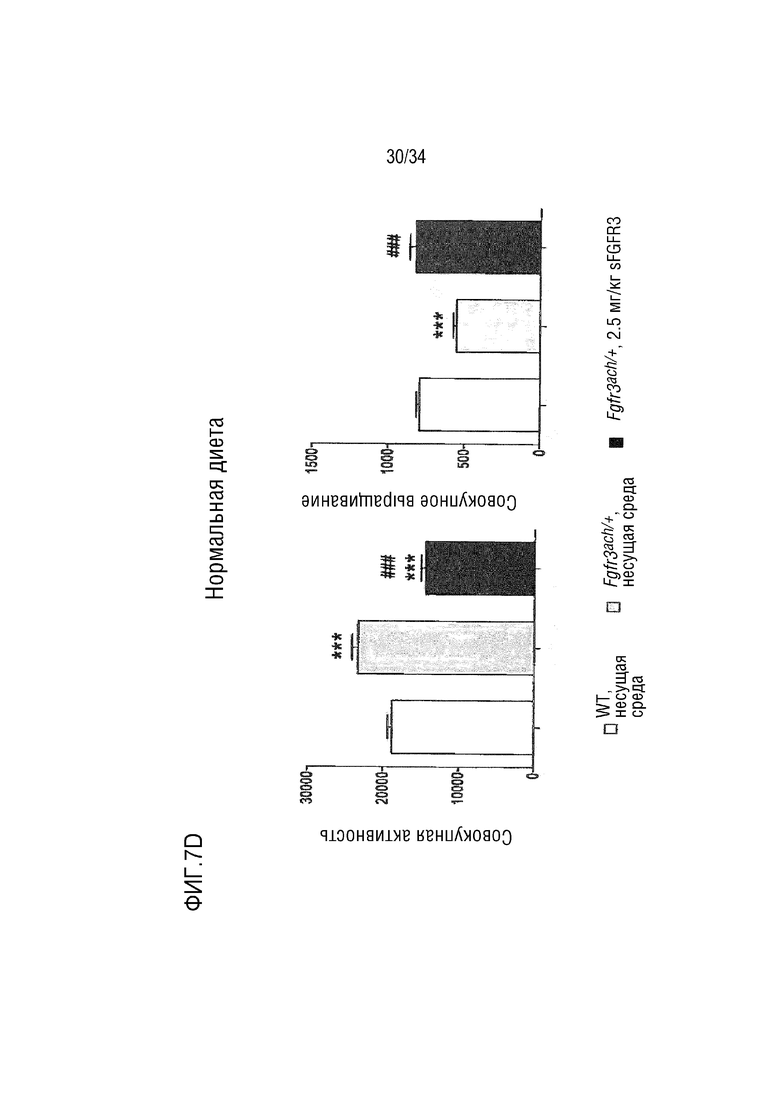
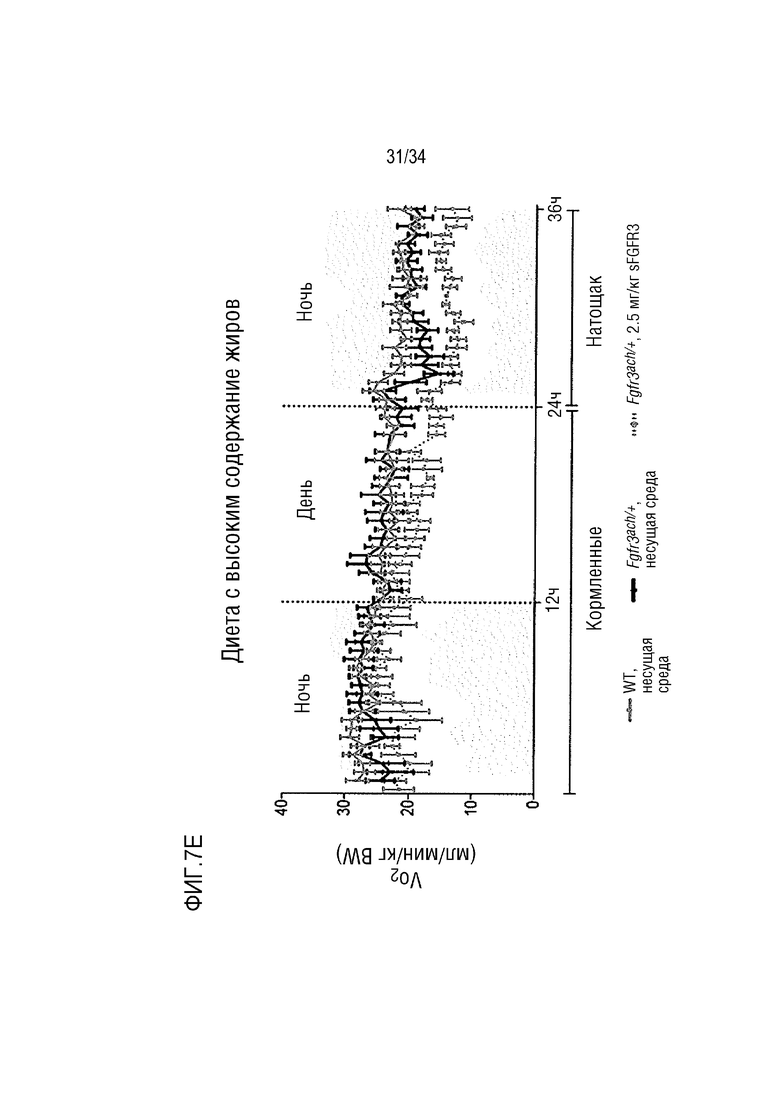
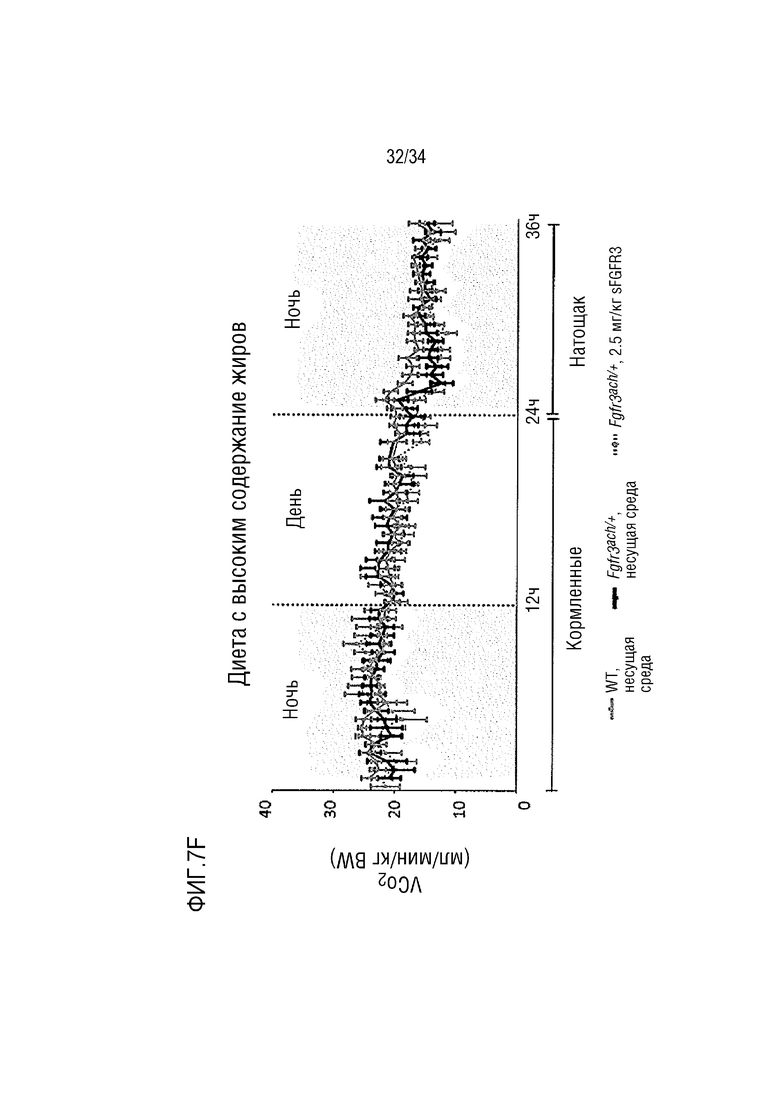
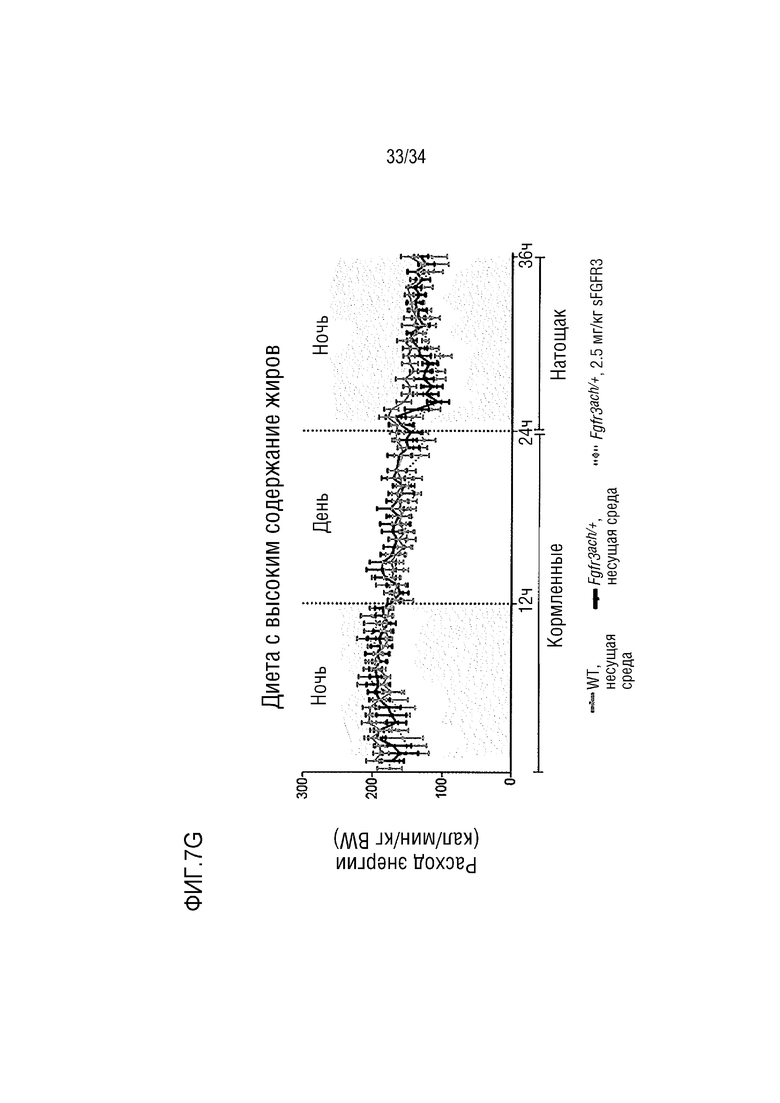
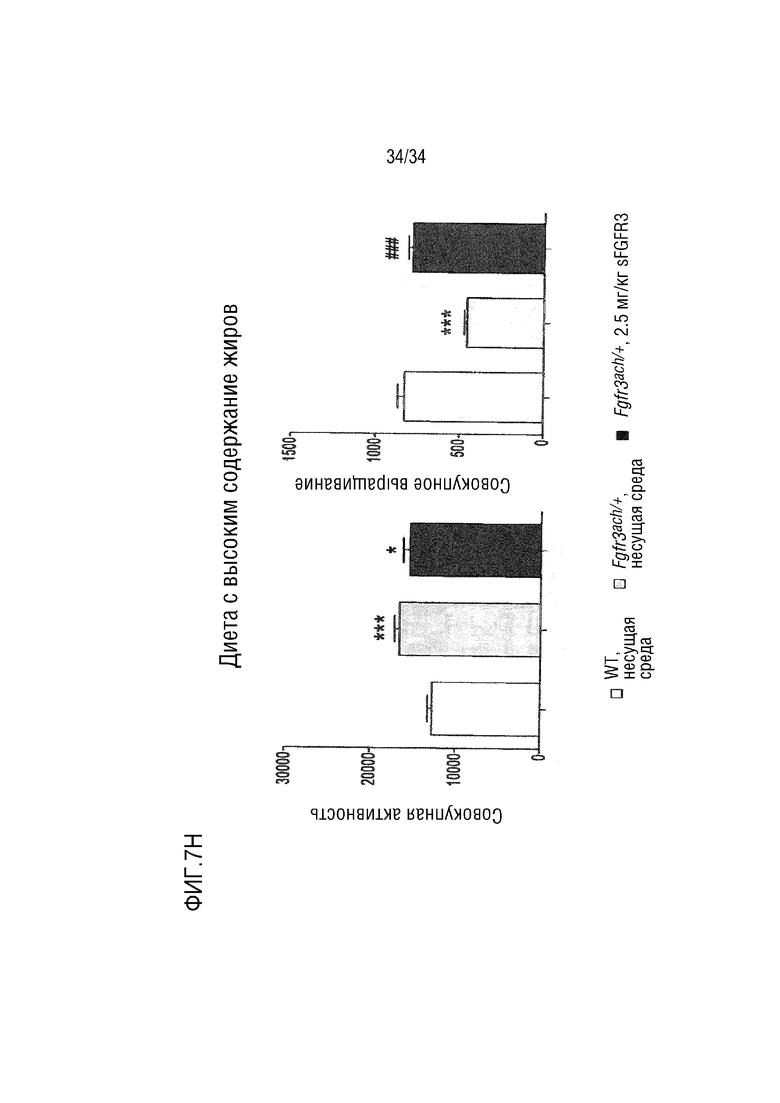
Изобретение относится к области биотехнологии, в частности к способу лечения или уменьшения аномального отложения висцерального жира у пациента, имеющего связанное с FGFR3 заболевание скелета. Изобретение позволяет контролировать аномальное отложение висцерального жира и связанных с ним состояний у пациентов с нарушениями задержки роста скелета, в том числе и после завершения роста костей. 17 з.п. ф-лы, 7 ил., 3 табл., 2 пр.
1. Способ лечения или уменьшения аномального отложения висцерального жира у пациента, имеющего связанное с FGFR3 заболевание скелета, включающий введение пациенту эффективного количества растворимого полипептида рецептора фактора роста фибробластов 3 (sFGFR3), где полипептид sFGFR3 состоит из аминокислотной последовательности SEQ ID NO: 5, и где полипептид sFGFR3 уменьшает нарушение регуляции инсулина или нарушение регуляции глюкозы.
2. Способ по п. 1, в котором аномальное отложение висцерального жира связано с одним или более из следующих органов или вокруг них: сердце, печень, селезенка, почки, поджелудочная железа, кишечник, репродуктивные органы и желчный пузырь.
3. Способ по п. 1 или 2, в котором пациента не имеет избытка массы тела или у пациента отсутствуют значительные отложения подкожного жира.
4. Способ по любому из пп. 1-3, в котором у пациента не наблюдается существенного аномального отложения жира за пределами живота.
5. Способ по любому из пп. 1-4, в котором пациентом является плод, новорожденный, младенец, ребенок, подросток или взрослый.
6. Способ по любому из пп. 1-5, в котором пациентом является человек.
7. Способ по п. 6, в котором связанное с FGFR3 заболевание скелета выбрано из ахондроплазии, танатофорной дисплазии типа I (TDI), танатофорной дисплазии типа II (TDM), тяжелой ахондроплазии с задержкой развития и черного акантоза (SADDAN), гипохондроплазии, синдрома краниосиностоза и камптодактилии, высокого роста и синдрома потери слуха (CATSHL).
8. Способ по п. 6 или 7, в котором у пациента проявляются один или более симптомов связанного с FGFR3 заболевания скелета, выбранных из коротких конечностей, короткого туловища, кривых ног, переваливающейся походки, пороков развития черепа, черепа типа клеверного листа, краниосиностоза, червивых костей, аномалий кистей, аномалий стоп, удлиненного большого пальца кисти и аномалий грудной клетки.
9. Способ по любому из пп. 1-8, в котором полипептид sFGFR3 связывается с фактором роста фибробластов (FGF), выбранным из фактора роста фибробластов 1 (FGF1), фактора роста фибробластов 2 (FGF2), фактора роста фибробластов 9 (FGF9), фактора роста фибробластов 10 (FGF10), фактора роста фибробластов 18 (FGF18) и их комбинаций.
10. Способ по любому из пп. 1-9, в котором полипептид sFGFR3 имеет период полужизни in vivo от приблизительно 2 часов до приблизительно 25 часов.
11. Способ по любому из пп. 1-10, в котором аминокислотная последовательность полипептида sFGFR3 кодируется полинуклеотидом, содержащим последовательность нуклеиновой кислоты SEQ ID NO: 15.
12. Способ по п. 11, в котором полинуклеотид, кодирующий полипептид sFGFR3, находится в векторе, причем вектор выбран из плазмиды, искусственной хромосомы, вирусного вектора и фагового вектора.
13. Способ по любому из пп. 1-12, в котором полипептид sFGFR3 вводят пациенту в дозе от приблизительно 0,001 мг/кг до приблизительно 30 мг/кг полипептида sFGFR3.
14. Способ по любому из пп. 1-13, в котором лекарственное средство на основе полипептида sFGFR3 вводят пациенту в дозе от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг полипептида sFGFR3.
15. Способ по любому из пп. 1-14, в котором полипептид sFGFR3 вводят пациенту в дозе от приблизительно 0,2 мг/кг до приблизительно 3 мг/кг полипептида sFGFR3.
16. Способ по любому из пп. 1-15, в котором полипептид sFGFR3 вводят пациенту ежедневно, еженедельно или ежемесячно.
17. Способ по любому из пп. 1-16, в котором полипептид sFGFR3 вводят пациенту семь раз в неделю, шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, еженедельно, каждые две недели или раз в месяц.
18. Способ по любому из пп. 1-17, в котором полипептид sFGFR3 вводят пациенту путем подкожного введения, внутривенного введения, внутримышечного введения, внутриартериального введения, интратекального введения или внутрибрюшинного введения.
| WO2013087744 A1, 20.06.2013 | |||
| WO2016110786 A1, 14.07.2016 | |||
| OWEN O.E | |||
| et al., Resting metabolic rate and body composition of achondroplastic dwarfs | |||
| Medicine (Baltimore) | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Vol | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
| No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Pp | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| GARCIA S | |||
| et al., Postnatal soluble FGFR3 therapy rescues achondroplasia symptoms and restores bone growth in mice | |||
| Sci Transl Med | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Vol | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2023-04-12—Публикация
2018-09-20—Подача