Изобретение относится к медицине, клинической лабораторной диагностике, в частности к проблеме изучения инфекционных вирусных заболеваний, и касается поиска новых направлений в специфической диагностике хронического вирусного гепатита В.
Одной из самых значимых проблем здравоохранения в мире остаются гепатотропные вирусы, способные вызывать как острые, так и хронические заболевания. Самым распространенным гепатотропным вирусом является вирус гепатита В (ВГВ). Хронический вирусный гепатит В (ХВГВ) представляет собой диффузно-воспалительное заболевание, связанное с персистенцией вируса гепатита В.
В Российской Федерации показана умеренная (2-7%) распространенность ВГВ. Долгосрочный анализ заболеваемости на территории РФ в период 1999-2017 гг. острым гепатитом В (ОГВ) показал значительное снижение ее уровня, заболеваемость в 2017 г. составила менее 1 случая на 100 тыс. населения (от 0,51 до 0,9 на 100 тыс. населения). Несмотря на это, отмечена тенденция к росту ХВГВ в среднем до 9,28 на 100 тыс. населения и до 31,1 на 100 тыс. населения в Дальневосточном округе, на 31.12.2015 г. в Северо-Западном федеральном округе больных ХВГВ - 233190 (прирост 5814 человек) [Эсауленко Е.В., Сухорук А.А., Иванова Н.В. Возможность элиминации парентеральных вирусных гепатитов на территории Российской Федерации и Северо-Западного федерального округа. Актуальные вопросы фундаментальной, клинической медицины и фармации. 2018. с. 230-233.].
Согласно классификации Европейской ассоциации изучения печени (European Association for the Study of the Liver, EASL), естественное течение ХВГВ проходит 5 стадий, при этом для хронической инфекции характерно устойчивое присутствие HBsAg в течение не менее чем 6 месяцев (при наличии или отсутствии сопутствующего HBeAg) за исключением HBsAg-негативной (скрытой или оккультной) формы течения заболевания [Gish R.G., Given B.D., Lai C.L., Locarnini S.A., Lau J.Y., Lewis D.L. Chronic hepatitis B: virology, natural history, current management and a glimpse at future opportunities. Antiviral research. 2015; 121: 47-58. DOI: 10.1016/j.antiviral.2015.06.008]. Скрытый гепатит В (СкГВ) определяют как стадию заболевания, при которой в ткани печени обнаруживают ДНК ВГВ при неопределяемом уровне HBsAg в сыворотке периферической крови, вне зависимости от того, выявляется или нет ДНК ВГВ методом ПЦР в периферической крови [Raimondo G., Allain J.P., Brunetto M.R., Buendia M.A., Chen D.S., Colombo M. et al. Statements from the Taormina expert meeting on occult hepatitis В virus infection. J. Hepatol. 2008; 49: 652-7. Doi: 10.1016/j.jhep.2008.07.014]. Таким образом, принятая в настоящее время оценка распространенности ХВГВ на основании выявления HBsAg, не отражает истинной распространенности ХВГВ как в популяции, так и в группах риска.
Следует отметить, что развитие СкГВ обусловлено подавлением внутриядерной транскрипции субгеномных РНК ВГВ с матрицы кольцевой ковалентно-замкнутой ДНК ВГВ (ккзДНК), способной становиться матрицей для субгеномных и прегеномных копий РНК, на основе которых синтезируется вирусный геном и вирусные белки [Guo J.T., Guo Н. Metabolism and function of hepatitis В virus cccDNA: Implications for the development of cccDNA-targeting antiviral therapeutics. Antiviral research. 2015; 122: 91-100. Doi: 10.1016/j.antiviral.2015.08.005]. В большинстве случаев при HBsAg-негативном ХВГВ репликация вируса и экспрессия генов вируса могут быть подавлены настолько, что вирусная нагрузка в периферической крови больного крайне низка, вплоть до невозможности выявить ДНК ВГВ стандартными методами, но элиминации вируса при этом не происходит.
Несмотря на низкую вирусную нагрузку, для СкГВ характерны те же факторы риска, что и при HBsAg-позитивной форме течения ХВГВ, в том числе показана роль HBsAg-негативного ВГВ в развитии фиброза печени и гепатоцеллюлярной карциномы [Raimondo G., Pollicino Т., Cacciola I., Squadrito G. Occult hepatitis В virus infection. J. Hepatol. 2007; 46: 160-70. Doi: 10.1016/j.jhep.2006.10.007], возможность внутриутробного инфицирования ребенка HBsAg- и HBeAg-негативной матерью [Gui Q.D., Yue Y.F., Li S.H., Zhang F. Study on intrauterine infection of hepatitis В virus in pregnant women with hepatitis В surface antigen and hepatitis В e antigen negative. Chinese Journal of Obstetrics and Gynecology. 2005; 40: 99-102.], возможность инфицирования реципиента переливанием крови или ее компонентов от донора со скрытым ВГВ, при этом минимальная инфекционная доза составляет приблизительно 16-100 копий [Candotti D., Assennato S.M., Laperche S., Allain J.P., Levicnik-Stezinar S. Multiple HBV transfusion transmissions from undetected occult infections: revising the minimal infectious dose. Gut. 2019; 68(2): 313-21. Doi: 10.1136/gutjnl-2018-316490.].
Поскольку уровень вирусной нагрузки в крови при HBsAg-негативном ВГВ крайне низок (<200 МЕ/мл), вплоть до невозможности обнаружения стандартными методами, выявление ДНК ВГВ в ткани печени остается не только «золотым стандартом», но и практически единственным достоверным методом лабораторной диагностики скрытого ВГВ. Идентификация и количественная оценка кольцевой ковалентно-замкнутой ДНК ВГВ в ткани печени позволяет с высокой точностью обнаружить ВГВ в скрытой фазе течения заболевания, а также предварительно оценить уровень репликации вируса в гепатоцитах [Останкова Ю. В., Семенов А. В., Тотолян Арег А. Метод количественной оценки кольцевой ковалентно-замкнутой ДНК ВГВ в пункционных биоптатах печени. Клиническая лабораторная диагностика. 2019; 64(9): 565-70. Doi: 10.18821/0869-2084-2019-64-9-565-570]. Однако необходимость инвазивного вмешательства позволяет предложить метод только в качестве дополнительной диагностики в случаях, когда пункционная биопсия печени осуществляется по клиническим показаниям, но не дает возможности использовать его для широкого скрининга популяций, доноров крови или отдельных групп пациентов.
Известен метод выявления ВГВ, основанный на полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией, представленный в коммерческом наборе "АмплиСенс® HBV-FL" (ФБУН ЦНИИЭ, Москва). Принцип тестирования основывается на экстракции ДНК из плазмы крови совместно с ВКО и проведении амплификации ДНК с гибридизационно-флуоресцентной детекцией «по конечной точке» (формат FEP) или в режиме «реального времени» (формат FRT). Данный метод позволяет выявить вирус при низких концентрациях, до 5 МЕ/мл. Однако, для обнаружения вируса столь низких концентраций необходимо соблюдение двух условий экстракции ДНК: обязателен большой объем образца (1000 мл плазмы крови) и специализированный набор для выделения ДНК, использующийся вкупе с автоматической станцией для экстракции нуклеиновых кислот.
При использовании более доступных и широко распространенных методов экстракции ДНК, включая коммерческие наборы для выделения НК «АмплиПрайм Рибо-преп» (ФБУН ЦНИИЭ, Москва), с объемом экстракции 100 мкл, предел аналитической чувствительности составляет 200 МЕ/мл и 100 МЕ/мл для форматов FEP и FRT соответственно.
Известен метод, предложенный в работе зарубежных коллег, посвященной передаче ВГВ от матери ребенку, представляющий собой гнездовую ГЩР с последовательным использованием двух пар праймеров [Candotti D., Danso К., Allain J-P. Maternofetal transmission of hepatitis В virus genotype E in Ghana, west Africa // J. Gen. Virol. - 2007. - vol. 88. - P. 2686-2695, doi: 10.1099/vir.0.83102-0]. Чувствительность предложенного метода достигала 10 МЕ/мл. Недостаток метода заключается в необходимости большого объема плазмы крови для экстракции ДНК (500 мкл).
Общим недостатком всех вышеуказанных методов является амплификация одного консервативного участка ДНК ВГВ, в то время как в 2008 году на совещании в г. Таормина (Испания) группой экспертов было рекомендовано для подтверждения обнаружения скрытого ВГВ выявление как минимум двух участков генома вируса [Raimondo G., Allain J.P., Brunetto M.R., Buendia M.A., Chen D.S., Colombo M. et al. Statements from the Taormina expert meeting on occult hepatitis В virus infection. J. Hepatol. 2008; 49: 652-7. Doi: 10.1016/j.jhep.2008.07.014].
Наиболее близким по сущности к заявляемому изобретению и выбранным за прототип является метод, предложенный нами ранее [Останкова Ю.В., Семенов А.В., Тотолян Арег А. Способ выявления в биологическом материале ДНК вируса гепатита В при низкой вирусной нагрузке на основе двухэтапной пцр. Пат.2633755 РФ. Патентообладатель Федеральное бюджетное учреждение науки «Санкт-Петербургский институт эпидемиологии и микробиологии им. Пастера». №2016144898; заявл. 15.11.2016; опубл. 17.10.2017, Бюл. изобр. №29 - 11 с.], представляющий собой способ выявления ДНК вируса гепатита В в биологическом материале на основе двухэтапной ПЦР с последующим секвенированием амплифицированных фрагментов четырех регионов вируса, отличающийся тем, что на первом этапе применяется асимметричная ПЦР с протяженными олигонуклеотидными праймерами, а именно прямой праймер 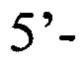
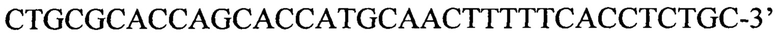 и обратный праймер
и обратный праймер 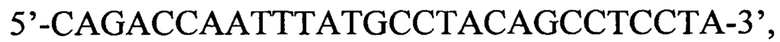 продукты которой затем используют для второго этапа амплификации с одной из следующих пар вложенных праймеров: пара 1 прямой праймер
продукты которой затем используют для второго этапа амплификации с одной из следующих пар вложенных праймеров: пара 1 прямой праймер 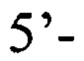
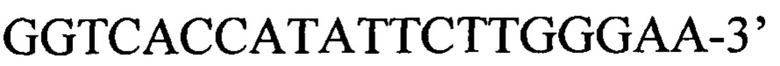 обратный праймер
обратный праймер 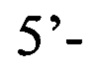
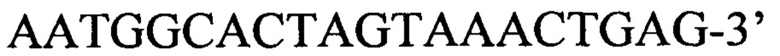 или пара 2 прямой праймер
или пара 2 прямой праймер 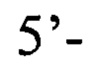
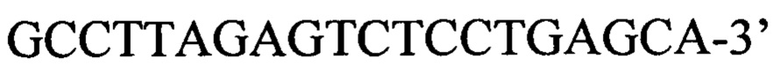 обратный праймер
обратный праймер 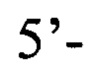
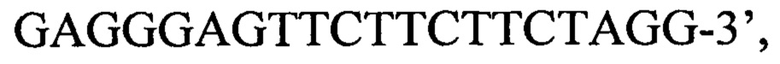 или пара 3 прямой праймер
или пара 3 прямой праймер 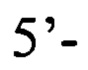
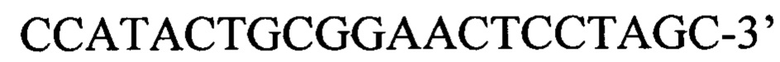 обратный праймер
обратный праймер 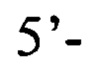
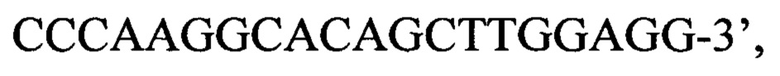 или пара 4 прямой праймер
или пара 4 прямой праймер 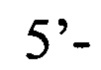
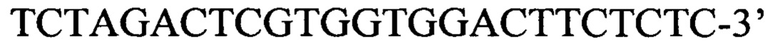 обратный праймер
обратный праймер 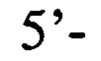
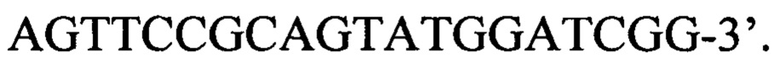 В составе амплификационной смеси на каждом этапе неравномерное соотношение дезоксинуклеозидтрифосфатов и высокая концентрация MgCl2, на первом этапе в смеси присутствуют формамид и глицерин в количестве 4% и 6% от конечного объема соответственно, а на втором этапе формамид и DMSO в количестве 4% и 10% от конечного объема соответственно.
В составе амплификационной смеси на каждом этапе неравномерное соотношение дезоксинуклеозидтрифосфатов и высокая концентрация MgCl2, на первом этапе в смеси присутствуют формамид и глицерин в количестве 4% и 6% от конечного объема соответственно, а на втором этапе формамид и DMSO в количестве 4% и 10% от конечного объема соответственно.
Недостаток метода заключается в невозможности его широкого применения для выявлении скрытого ВГВ в связи с необходимостью электрофоретического анализа продуктов амплификации второго этапа ПЦР и дальнейшего секвенирования с последующим использованием генетического анализатора (секвенатора), что требует соответствующей приборной базы и квалификации специалистов.
Авторами предложен метод выявления вируса гепатита В с применением «гнездовой» ПЦР с использованием на первом этапе олигонуклеотидов, фланкирующих участок генома 2932-3182…1-1846 нт., согласно представленному в международной базе данных GenBank изоляту Mart-B47 (НЕ974377.1) [Brichler S., Lagathu G., Chekaraou M.A. et al. African, Amerindian and European hepatitis В virus strains circulate on the Caribbean Island of Martinique // J. Gen. Virol. 2013. vol. 94 (Pt 10). P. 2318-2329], а на втором этапе двух пар олигонуклеотидов к двум регионам (ген S и ген X) генома вируса и соответствующих олигонуклеотидных флуоресцентно меченых зондов, комплементарных участкам амплифицируемых фрагментов, несущих на 5'-конце флуорофоры, а на 3'-конце не флуоресцентные тушители. Регистрируют полученные результаты посредством гибридизационно-флуоресцентной детекции в режиме реального времени.
Технический результат - повышение чувствительности и надежности диагностики.
Сущность метода заключается в том, что на первом этапе проводится амплификация ДНК вируса с использованием олигонуклеотидных праймеров, комплементарных областям наибольшего сходства геномов различных изолятов ВГВ в регионах S-гена и Х-гена. Для повышения чувствительности проводится вторая полимеразная цепная реакция с использованием продукта амплификации первой реакции, внутренних (вложенных, гнездовых) праймеров и флуоресцентно меченых зондов, комплементарных участкам амплифицируемых на втором этапе фрагментов.
На первом этапе используются следующие олигонуклеотидные праймеры:
Прямой праймер: 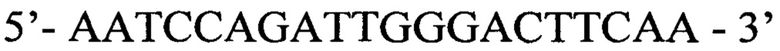
Обратный праймер: 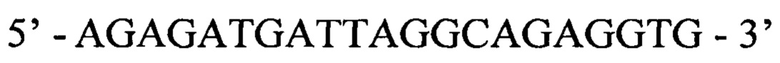
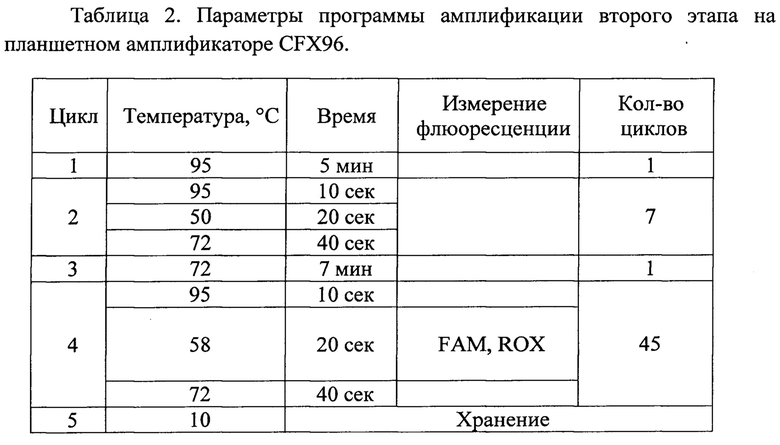
ПЦР проводят при следующих условиях:
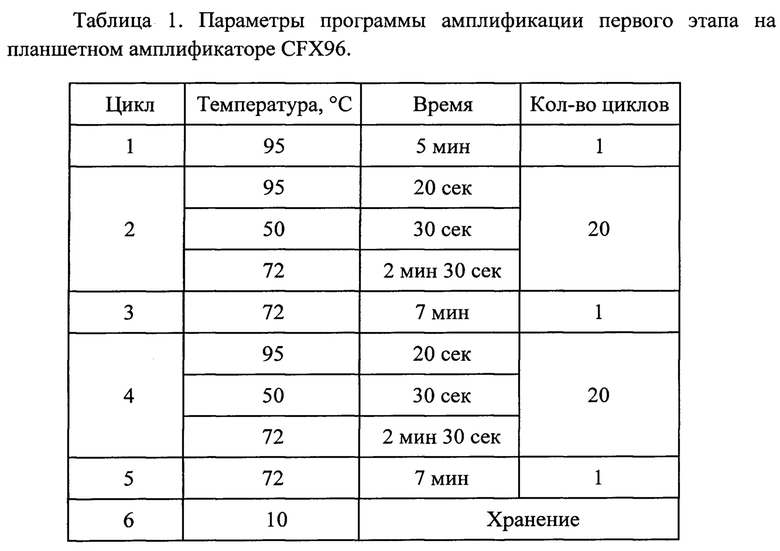
На втором этапе используют продукт амплификации первого этапа, а также следующие олигонуклеотиды, в одной пробирке:
Пара 1:
Прямой праймер 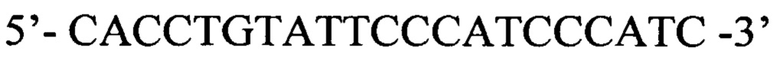
Обратный праймер 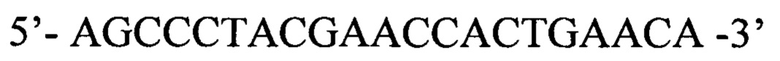
Зонд: 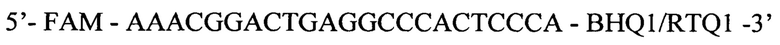
Пара 2: Прямой праймер 
Обратный праймер 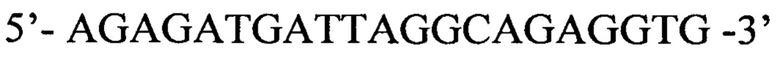
Зонд: 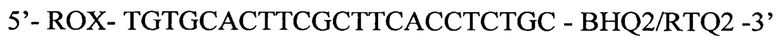
Опционно могут быть использованы следующие варианты обратного праймера в паре 2:
Обратный праймер с 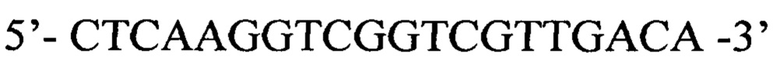
Обратный праймер d 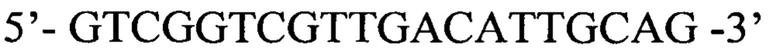
Обратный праймер е 
ПЦР проводят при следующих условиях:
Анализ результатов проводят с помощью программного обеспечения используемого прибора для проведения ПЦР с детекцией в режиме «реального времени».
Анализируют кривые накопления флуоресцентного сигнала по двум каналам:
- по каналу для флуорофора FAM регистрируется сигнал, свидетельствующий о накоплении продукта амплификации фрагмента ДНК ВГВ S-региона,
- по каналу для флуорофора ROX регистрируется сигнал, свидетельствующий о накоплении продукта амплификации фрагмента ДНК ВГВ Х-региона.
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (устанавливается в середине линейного участка прироста флуоресценции положительного контроля в логарифмической шкале), что определяет наличие (или отсутствие) для данной пробы значения порогового цикла Ct в соответствующей графе в таблице результатов.
Результат амплификации по каналу считается положительным, если кривая однократно пересекается с пороговой линией в области достоверного прироста флуоресценции, отрицательным в случае отсутствия пересечения кривой с пороговой линией (нет значения Ct или Ср), сомнительным во всех других случаях.
Принцип интерпретации результатов следующий:
- образец считается положительным по содержанию ДНК ВГВ, если на каналах FAM и ROX получено значение порогового цикла Ct.
- образец считается отрицательным по содержанию ДНК ВГВ, если на каналах FAM и ROX отсутствует значение Ct.
- получение порогового цикла Ct только по одному флуорофору FAM или ROX может свидетельствовать о наличии ДНК ВГВ в образце в нагрузке менее 10 МЕ/мл. Рекомендуется повторное ПЦР-исследование соответствующего образца с экстракцией ДНК ВГВ из увеличенного объема плазмы (200-1000 мкл).
- образец считается сомнительным в случае получения сомнительного результата по любому из каналов. Рекомендуется повторное ПЦР-исследование соответствующего образца.
Таким образом, предложенный метод отличается от прототипа тем, что на первом этапе проводится амплификация ДНК вируса с использованием олигонуклеотидных праймеров, комплементарных областям наибольшего сходства геномов различных изолятов ВГВ в регионах S-гена и Х-гена, на втором этапе проводится амплификация продукта первой реакции с использованием внутренних (вложенных, гнездовых) праймеров и флуоресцентно меченых зондов, комплементарных участкам амплифицируемых на втором этапе фрагментов, с последующей детекцией сигналов в режиме реального времени. По каналу, соответствующему флуорофору FAM, детектируется продукт амплификации ДНК ВГВ S-региона. По каналу, соответствующему флуорофору ROX, детектируется продукт амплификации ДНК ВГВ Х-региона. То есть, предлагаемая нами методика отличается от прототипа составом праймеров, способом детекции и вытекающим из этого изменением условий реакции.
Аналитическую чувствительность метода проверяли методом поэтапного разведения.
Были выбраны 10 образцов плазмы крови, содержащие различные концентрации ВГВ. Вирусную нагрузку предварительно измеряли с помощью стандартизированного набора для количественного определения ДНК ВГВ в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени». «АмплиСенс® HBV-MoHHTOp-FL» (ФБУН ЦНИИЭ, Москва).
Каждый образец поэтапно разводили предварительно проанализированной плазмой крови без ВГВ (чистой плазмой) следующим образом. Аликвоту образца объемом 100 мкл вносили в микропробирку Eppendorf объемом 1,5 мл, добавляли 100 мкл чистой плазмы, тщательно пипетировали и переносили 100 мкл полученного пула в новую микропробирку, куда снова добавляли 100 мкл чистой плазмы, пипетировали и 100 мкл нового пула переносили в третью пробирку итд. до десятикратного последовательного разведения.
После разведения осуществляли экстракцию ДНК из каждого пула разведения каждого образца с помощью комплекта реагентов для выделения РНК/ДНК из клинического материала «РИБО-преп» (ФБУН ЦНИИЭ, Москва) или любыми другими с близкими характеристиками. Полученные образцы ДНК амплифицировали, согласно предложенному методу.
Аналитическая чувствительность метода при выделении ДНК ВГВ с использованием набора реагентов «АмплиПрайм РИБО-преп» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора) или любых других с близкими характеристиками составила 10 МЕ/мл при объеме экстрагируемого материала 100 мкл, 3 МЕ/мл при объеме экстрагируемого материала 500 мкл.
Оценка аналитической специфичности набора реагентов проведена посредством добавления в реакцию амплификации геномной ДНК/кДНК следующих вирусов: вирус гепатита А, вирус гепатита С, вирус гепатита D, вирус гепатита Е, вирус гепатита G, вирус иммунодефицита человека, вирус Эпштейна-Барр, цитомегаловирус, вирус простого герпеса 1 и 2 типов, вирус герпеса 6 и 8 типов, парвовирус В19, вирус клещевого энцефалита, а также геномной ДНК человека.
При проведении тестирования образцов ДНК/кДНК вышеперечисленных вирусов и ДНК человека неспецифических реакций выявлено не было, что является подтверждением специфичности разработанного метода.
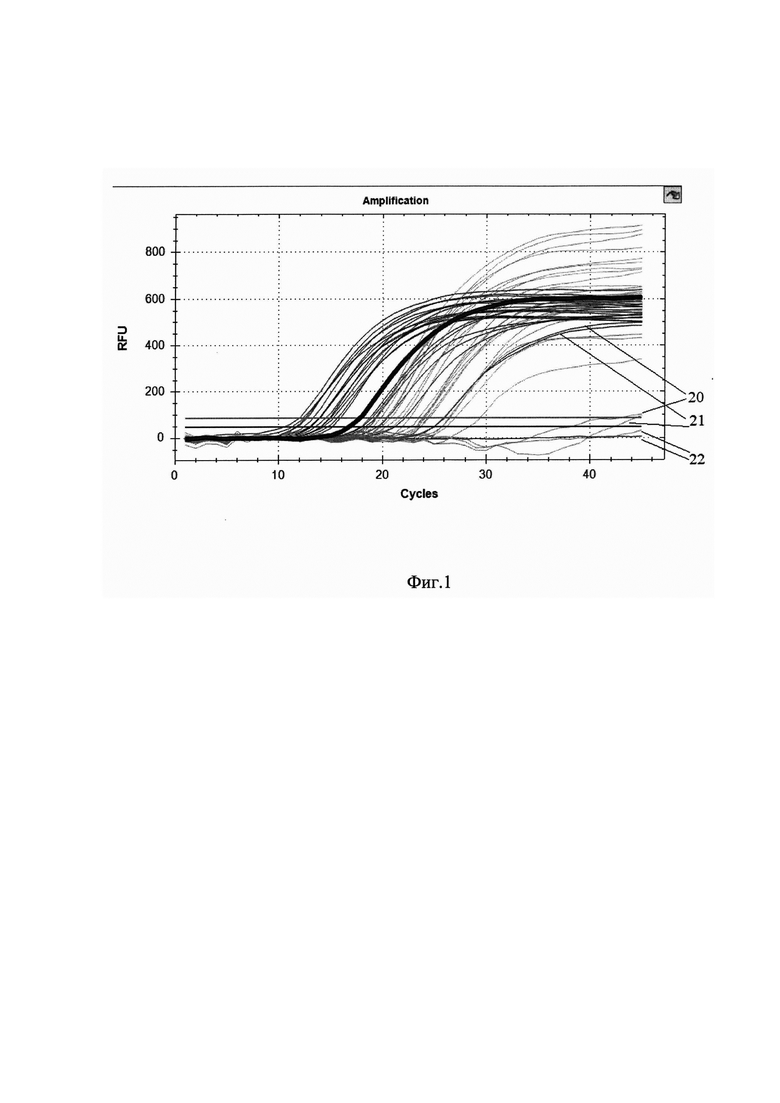
Сущность изобретения поясняется чертежом, где на фиг. 1 представлены кривые флуоресценции, отражающие динамику образования продукта реакции в ходе второго этапа предложенного метода - ПЦР-РВ по технологии TaqMan. Обозначены кривые образцов №20, №21, №22. Образцы №20 и №21 представляют собой результат выявления ДНК ВГВ при предположительной концентрации 4 МЕ/мл и 7 МЕ/мл, соответственно, при экстракции ДНК из 100 мкл плазмы. При этом не детектируется сигнал по каналу ROX, но есть сигнал по каналу FAM. Получение порогового цикла Ct только по одному флуорофору FAM или ROX может свидетельствовать о наличии ДНК ВГВ в образце в нагрузке менее 10 МЕ/мл. Рекомендуется повторное ПЦР-исследование соответствующего образца с экстракцией ДНК ВГВ из увеличенного объема плазмы (200-1000 мкл). Образец №22 представляет собой отрицательный контрольный образец.
Ниже приведены примеры конкретного использования предложенного метода.
Пример 1.
Плазма крови 96 беременных, срок беременности 10-16 недель. Все пациенты серонегативны к вирусу гепатита В. При использовании стандартных наборов ДНК вируса гепатита В не была выявлена в плазме крови. При использовании предложенного нами метода ДНК вируса гепатита В в плазме крови была выявлена у 2 пациенток. В одном случае регистрировались сигналы FAM и ROX, в другом случае регистрировался только сигнал FAM, однако при экстракции ДНК из 200 мкл плазмы регистрировались оба сигнала. Полученные результаты были подтверждены выявлением и секвенированием ДНК ВГВ с помощью метода, предложенного нами ранее.
Пример 2.
Были обследованы пациенты (n=37) гемодиализного центра. ДНК вируса гепатита В стандартными методами не выявлена. При использовании предложенного метода ДНК вируса гепатита В выявлен в плазме крови одного пациента. Полученный результат подтвержден выявлением и секвенированием ДНК ВГВ с помощью метода, предложенного нами ранее.
Пример 3.
Образцы сыворотки крови, полученные от 199 иностранных граждан, проходящих медицинское освидетельствование для получения разрешений на работу в Управлении по вопросам миграции в СЗФО. Доля лиц позитивных по серологическим маркерам ВГВ составила 36,7% в следующих соотношениях: HBsAg+- 1,7%, анти-HBs+ - 28,3%, анти-HBcor IgG+ - 18,3%. Встречаемость парных сочетаний составила 1,7% для HBsAg+ и анти-HBcor IgG+, 9,2% для анти-HBs+ и анти-HBcor IgG+. Серопозитивных пациентов по всем трем маркерам ВГВ не обнаружено. С использованием набора «АмплиСенс® HBV-FL» (ФБУН ЦНИИЭ), чувствительность 100 МЕ/мл, ДНК ВГВ обнаружена в 1,7% случаев. При использовании предложенного метода встречаемость ДНК ВГВ составила 9,2%. Среди них 7,5% случаев относятся к скрытому (HBsAg-негативному) ВГВ, в том числе негативному по всем серологическим маркерам. Полученные результаты были подтверждены выявлением и секвенированием ДНК ВГВ с помощью метода, предложенного нами ранее.
Пример 4.
В ходе работы были обследованы образцы плазмы (сыворотки) 397 условно-здоровых лиц, проживающих в Социалистической Республике Вьетнам. При анализе распространенности серологических маркеров было показано, что встречаемость HBsAg составила 12,3%, анти-HBs Ig G 38,5%, анти-HBcor Ig G 56,2%. ДНК ВГВ удалось выявить во всех HBsAg-позитивных случаях. При использовании предлагаемого метода идентифицировали вирус в 58 HBsAg-негативных образцах (в 5 из них при экстракции ДНК из 100 мкл плазмы регистрировали только сигнал FAM, а в 2 только сигнал ROX, при увеличении объема материала во всех 7 случаях регистрировали оба сигнала), что составило 14,6%. Таким образом, среди условно здоровых пациентов с учетом HBsAg-позитивных и негативных образцов ДНК ВГВ выявили в 26,95%.
Также в течение 2018-2019 гг.было проведено более 500 исследований предложенным методом на основе технологии ПЦР с детекцией в режиме реального времени. Выявлен оккультный гепатит В среди доноров крови в различных географических регионах. Показана широкая распространенность оккультного вируса гепатита В у ВИЧ-инфицированных и ВГС-инфицированных пациентов.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Федеральное бюджетное учреждение науки «Санкт-Петербургский
научно-исследовательский институт эпидемиологии и микробиологии
им. Пастера Федеральной службы по надзору в сфере защиты правпотребителей
и благополучия человека», ул. Мира, 14, Санкт-Петербург, 197101,
Российская Федерация
<120> СПОСОБ ВЫЯВЛЕНИЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ ДНК ВИРУСА ГЕПАТИТА
B ПРИ НИЗКОЙ ВИРУСНОЙ НАГРУЗКЕ НА ОСНОВЕ ДВУХЭТАПНОЙ ПЦР С ДЕТЕКЦИЕЙ
В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
<140> Текущая (данная) заявка регистрационный №2019137626/20(074310)
<141> 25.11.2019 г.
<160> 11
<210> 1
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Прямой праймер ПЦР
<400> 1
aatccagatt gggacttcaa 20
<210> 2
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Обратный праймер ПЦР
<400> 2
agagatgatt aggcagaggt g 21
<210> 3
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Прямой праймер ПЦР
<400> 3
cacctgtatt cccatcccat c 21
<210> 4
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Обратный праймер ПЦР
<400> 4
agccctacga accactgaac a 21
<210> 5
<211> 23
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Олигонуклеотидный флуоресцентно меченый зонд, несущий на 5’-конце
флуорофор FAM, а на 3’-конце не флуоресцентный тушитель BHQ1/RTQ1
<400> 5
aaacggactg aggcccactc cca 23
<210> 6
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Прямой праймер ПЦР
<400> 6
gtctgtgcct tctcatctgc c 21
<210> 7
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Обратный праймер ПЦР
<400> 7
agagatgatt aggcagaggt g 21
<210> 8
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Обратный праймер ПЦР
<400> 8
ctcaaggtcg gtcgttgaca 20
<210> 9
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Обратный праймер ПЦР
<400> 9
gtcggtcgtt gacattgcag 20
<210> 10
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Обратный праймер ПЦР
<400> 10
agtatgcctc aaggtcggtc 20
<210> 11
<211> 23
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Олигонуклеотидный флуоресцентно меченый зонд, несущий на 5’-конце
флуорофор ROX, а на 3’-конце не флуоресцентный тушитель BHQ2/RTQ2
<400> 11
tgtgcacttc gcttcacctc tgc 23
<---
Изобретение относится к медицинской биотехнологии. Изобретение представляет собой способ выявления ДНК вируса гепатита В в биологическом материале на основе двухэтапной полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени. Выявление проводят в плазме и/или сыворотке крови, сгустке крови, тканях печени. Диагностика проводится в два этапа. На первом этапе проводится амплификация ДНК вируса с использованием олигонуклеотидных праймеров, комплементарных областям наибольшего сходства геномов различных изолятов ВГВ в регионах S-гена и Х-гена (прямой праймер 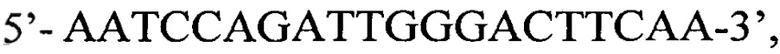 обратный праймер
обратный праймер 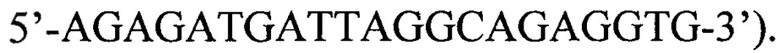 На втором этапе используют две пары олигонуклеотидов к двум регионам (ген S и ген X) генома вируса и соответствующие олигонуклеотидные флуоресцентно меченые зонды, комплементарные участкам амплифицируемых фрагментов, несущие на 5'-конце флуорофоры, а на 3'-конце не флуоресцентные тушители. Регистрируют полученные результаты посредством гибридизационно-флуоресцентной детекции в режиме реального времени. Способ обеспечивает повышение чувствительности и надежности диагностики. 1 ил., 2 табл., 4 пр.
На втором этапе используют две пары олигонуклеотидов к двум регионам (ген S и ген X) генома вируса и соответствующие олигонуклеотидные флуоресцентно меченые зонды, комплементарные участкам амплифицируемых фрагментов, несущие на 5'-конце флуорофоры, а на 3'-конце не флуоресцентные тушители. Регистрируют полученные результаты посредством гибридизационно-флуоресцентной детекции в режиме реального времени. Способ обеспечивает повышение чувствительности и надежности диагностики. 1 ил., 2 табл., 4 пр.
Способ выявления ДНК вируса гепатита В в биологическом материале на основе двухэтапной полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени, отличающийся тем, что на первом этапе применяется амплификация ДНК вируса с использованием олигонуклеотидных праймеров, комплементарных областям наибольшего сходства геномов различных изолятов ВГВ в регионах S-гена и Х-гена, а именно прямой праймер 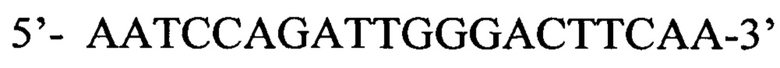 и обратный праймер
и обратный праймер 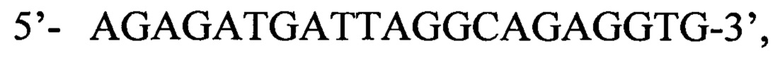 продукт которой затем используют для второго этапа амплификации, осуществляемого в одной пробирке со следующими парами вложенных праймеров и соответствующими флуоресцентно мечеными зондами: пара 1 прямой праймер
продукт которой затем используют для второго этапа амплификации, осуществляемого в одной пробирке со следующими парами вложенных праймеров и соответствующими флуоресцентно мечеными зондами: пара 1 прямой праймер 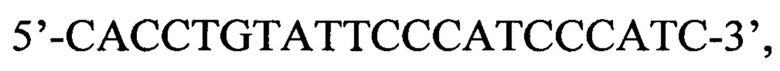 обратный праймер
обратный праймер 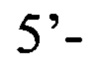
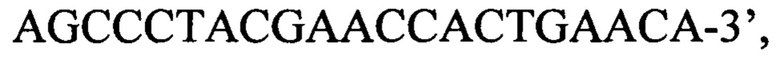 зонд
зонд 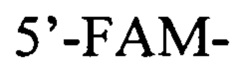
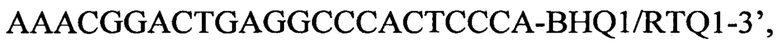 пара 2 прямой праймер
пара 2 прямой праймер 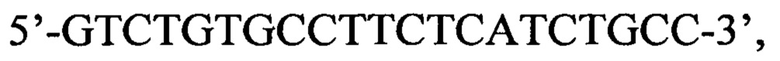 обратный праймер
обратный праймер 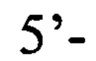
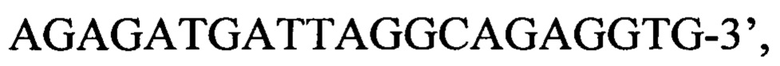 зонд
зонд 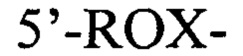
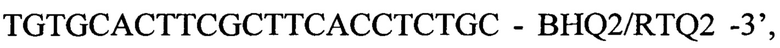 а также следующими вариантами обратного праймера в паре 2: обратный праймер с
а также следующими вариантами обратного праймера в паре 2: обратный праймер с 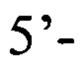
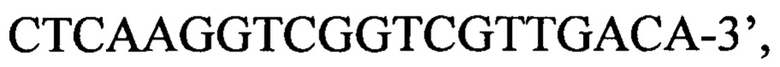 обратный праймер d
обратный праймер d 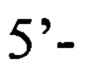
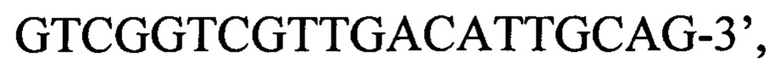 обратный праймер е
обратный праймер е 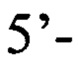
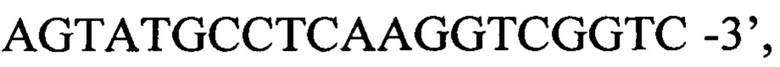 причем результаты интерпретируются на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, установленной в середине линейного участка прироста флуоресценции положительного контроля в логарифмической шкале, позволяющего определить наличие или отсутствие для данной пробы значения порогового цикла Ct в соответствующей графе в таблице результатов, при этом результат амплификации по каналу считается положительным, если кривая однократно пересекается с пороговой линией в области достоверного прироста флуоресценции, а отрицательным в случае отсутствия пересечения кривой с пороговой линией (нет значения Ct или Ср), сомнительным во всех других случаях, причем
причем результаты интерпретируются на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, установленной в середине линейного участка прироста флуоресценции положительного контроля в логарифмической шкале, позволяющего определить наличие или отсутствие для данной пробы значения порогового цикла Ct в соответствующей графе в таблице результатов, при этом результат амплификации по каналу считается положительным, если кривая однократно пересекается с пороговой линией в области достоверного прироста флуоресценции, а отрицательным в случае отсутствия пересечения кривой с пороговой линией (нет значения Ct или Ср), сомнительным во всех других случаях, причем
- образец считается положительным по содержанию ДНК ВГВ, если на каналах FAM и ROX получено значение порогового цикла Ct;
- образец считается отрицательным по содержанию ДНК ВГВ, если на каналах FAM и ROX отсутствует значение Ct;
- получение порогового цикла Ct только по одному флуорофору FAM или ROX может свидетельствовать о наличии ДНК ВГВ в образце в нагрузке менее 10 МЕ/мл, при этом рекомендуется повторное ПЦР-исследование соответствующего образца с экстракцией ДНК ВГВ из увеличенного объема плазмы 200-1000 мкл.
| Способ выявления в биологическом материале ДНК вируса гепатита В при низкой вирусной нагрузке на основе двухэтапной ПЦР | 2016 |
|
RU2633755C1 |
| BRICHLER S., et al | |||
| African, Amerindian and European hepatitis В virus strains circulate on the Caribbean Island of Martinique, J | |||
| Gen | |||
| Virol | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| vol | |||
| Экономайзер | 0 |
|
SU94A1 |
| P | |||
| Клапанное парораспределение для паровозов | 1924 |
|
SU2318A1 |
| RAIMONDO G., et al | |||
| Statements from the Taormina expert meeting on occult hepatitis В virus infection | |||
| J | |||
| Hepatol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Doi: | |||
Авторы
Даты
2021-08-13—Публикация
2019-11-21—Подача