ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к рекомбинантному диетическому белку или его удовлетворительной с точки зрения диетологии части, причем указанный белок не содержит фенилаланин, для применения в диете пациентов, страдающих оксифенилкетонурией (болезнью Феллинга).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Оксифенилкетонурия (PKU) (OMIM 261600, ORPHA716) является наследственным нарушением обмена веществ с частотой 1:10000 в Европе. В большинстве случаев это нарушение метаболизма аминокислот, обусловленное отсутствием или нарушением функции фермента печени фенилаланин-гидроксилазы (PAH). Дефицит PAH, в свою очередь, приводит к избыточному содержанию фенилаланина (Phe) в головном мозге и плазме. Дефицит PAH в конечном итоге проявляется в недостатке тирозина, который является предшественником нейромедиаторов. Вместе с мутациями, затрагивающими ферменты метаболизма птеринов, PKU сопровождается гиперфенилаланинемией (HPA).
Заболевание обычно диагностируется в большинстве стран сразу после рождения во время скрининга новорожденных из-за повышенных уровней Phe в крови. Оставленная без лечения и не подвергнутая лечению в раннем возрасте PKU приводит к необратимому повреждению нервной системы младенца, тяжелой олигофрении и слабому развитию головного мозга. Признаки, отличные от умственной отсталости у не подвергнутых лечению пациентов, включают неврологические осложнения, нейропсихологические нарушения, а также недостаточность исполнительных функций. Сообщалось, что в случае оставления без лечения младенец испытывает потерю IQ в течение первого года младенчества. В зависимости от возраста в начале лечения, уровней Phe в крови в разные возрастные периоды и соблюдения диетотерапии PKU неизменно сопровождается хотя бы некоторой потерей IQ. После выявления этого заболевания его лечат посредством назначения младенцу, а позже ребенку диеты с ограниченным содержанием Phe. В случае взрослых белковые добавки, обычно принимаемые пациентами с классической PKU, не содержат Phe, при условии, что такие взрослые будут получать достаточные количества Phe благодаря остальному рациону, контролируемому в соответствии со строгой схемой, так что общий рацион является рацион с низким содержанием Phe. В частности, беременным женщинам, страдающим этим заболеванием, рекомендуется соблюдать строгую схему питания с ограничением в рационе Phe во избежание риска нарушения развития плода и врожденных пороков развития (синдрома материнской PKU).
В последние годы было установлено, что патологические симптомы, возникающие из-за состояния избыточного содержания Phe, в совокупности называемого гиперфенилаланинемией (HPA), можно разделить на множество дискретных нарушений, которые диагностируются в зависимости от концентраций Phe в плазме и чувствительности к кофактору для PAH. На начальном уровне HPA можно подразделить на HPA, возникающую в результате недостатка кофактора 6R-L-эритро-5,6,7,8-тетрагидробиоптерина (BH4) из-за ферментативных нарушений в метаболизме биоптеринов, (злокачественную PKU) и HPA, возникающую в результате недостатка PAH. Последняя HPA дополнительно подразделяется, что приводит к по крайней мере четырем подкатегориям в зависимости от концентрации Phe в плазме в отсутствие диетотерапии или другого терапевтического вмешательства (называемой здесь «неограниченной концентрацией Phe в плазме») и чувствительности к кофактору BH4.
Нормальный гомеостаз Phe в плазме строго контролируется, в результате чего концентрация Phe в плазме составляет 60 мкмоль/л ± 15 мкмоль/л. Классическая PKU (ORPHA79254) является самой тяжелой формой PKU, и она возникает в результате нулевых или серьезных мутаций в PAH, которые приводят к неограниченным концентрациям Phe в плазме, превышающим 1200 мкмоль/л при оставлении без лечения. Индивидуумы с классической (или тяжелой) PKU должны подвергаться лечению с использованием строгой схемы питания, основанной на диете с очень низким содержанием Phe, для снижения у них концентраций Phe до безопасного уровня. Более легкие формы PKU также были охарактеризованы. Менее тяжелой формой PKU является та, которая проявляется в неограниченных концентрациях Phe в плазме, составляющих 10-20 мг/дл (600-1200 мкмоль/л) и, как правило, называется «легкой PKU» (ORPHA79253). Эту среднетяжелую PKU лечат с помощью умеренных ограничений в питании, например, сравнительно низкобелковой диеты без необходимости добавления аминокислотной смеси без Phe. Легкая HPA, также называемая доброкачественной или не являющейся PKU HPA (ORPHA79651), характеризуется неограниченными концентрациями Phe в плазме между 180-600 мкмоль/л. Индивидуумов с не являющейся PKU HPA обычно не лечат, поскольку считается, что уровни Phe в их плазме находится в «безопасном» диапазоне. При диетотерапии PKU добиваются диапазона ниже <360 мкмоль/л, при этом диапазон до 600 мкмоль/л считается приемлемым. Наконец, BH4-чувствительная PKU/HPA (ORPHA293284) характеризуется неограниченными концентрациями Phe в плазме >360 мкмоль/л, которые могут быть заметно снижены или нормализованы после перорального введения тетрагидробиоптерина (BH4; дигидрохлорида сапроптерина). Эта легкая-среднетяжелая форма PKU/HPA вызвана специфическими мутациями в гене PAH, приводящими к мутантным белкам со значительной остаточной ферментативной активностью. Добавление BH4 в качестве части лечения PKU/HPA позволяет некоторым пациентам ослабить свою схему питания с ограничением в рационе Phe. Следует понимать, что используемые здесь термины «лечение PKU» или «пациент с PKU» предназначены для обозначения лечения и пациентов со следующими формами HPA, например, классической PKU, легкой PKU, легкой HPA и BH4-чувствительной PKU/HPA.
В начале диетотерапии PKU в начале 1950-х годов пациентам предоставлялись незаменимые аминокислоты (кроме Phe) с помощью белковых гидролизатов. Следовательно, белок с относительно высокими уровнями незаменимых аминокислот, такой как казеин (обычно обнаруживаемый в молоке млекопитающих белок, составляющий 80% от белков коровьего молока) или бычий сывороточный альбумин, подвергался гидролизу с последующей стадией фильтрации пептидов для удаления как можно больше примесей Phe и/или с последующим объединением свободных аминокислот в смесь, которая включает гидролизованный белок. Сегодня пациентам предоставляются типично сбалансированные смеси свободных кристаллических аминокислот, включающих незаменимые аминокислоты (кроме Phe). Такие смеси аминокислот могут иметь горький вкус, вызывать ощущение песка во рту и могут считаться неподходящими или нежелательными для определенных применений. В результате такие смеси иногда включают ароматизаторы для маскировки вкуса свободных аминокислот и/или гидролизованного белка. В некоторых случаях, как установлено, композиции, в которых доля содержания аминокислот обеспечивается за счет полипептидов или белков, имеют лучший вкус, чем композиции с высокой долей всех аминокислот, предоставленных в виде свободных аминокислот и/или некоторых гидролизованных белков. Однако доступность таких композиций была ограничена, поскольку пищевые смеси традиционно изготавливались из белка, выделенного из натуральных пищевых продуктов, таких как сыворотка, выделенная из молока, или соевый белок, выделенный из сои. Аминокислотные профили этих белков необязательно соответствуют требованиям к аминокислотам для млекопитающего. Кроме того, товарные белки обычно состоят из смесей белков и/или белковых гидролизатов, которые могут различаться по своему белковому составу, что приводит к непредсказуемости их пищевой ценности. Более того, ограниченное количество источников таких белков с высокой биологической ценностью означает, что в большом масштабе доступны только некоторые комбинации аминокислот для приема внутрь в форме белка.
Гликомакропептид (GMP), натуральный белок молочной сыворотки, вырабатываемый во время приготовления сыра, использовался для лечения PKU. GMP в чистом виде не содержит ароматические аминокислоты фенилаланин (Phe; F), тирозин (Tyr; Y) и триптофан (Trp; W), а также аргинин (Arg; R), гистидин (His; H) и цистеин (Cys; C) но обогащен большими нейтральными аминокислотами: изолейцином (Ile; I) и треонином (Thr; T). В виде коммерчески доступного диетического белка он содержит минимальное количество Phe. Однако используемый в качестве единственного источника белка в медицинских продуктах для диетотерапии PKU, он должен быть дополнен Trp, Arg, Leu, His и Tyr для удовлетворения потребностей в ежедневном потреблении этих незаменимых и частичнозаменимых аминокислот и для обеспечения соответствующего низкого отношения Phe/Tyr (<1). Становясь необходимым для пациентов с PKU, Tyr улучшает их эмоциональное поведение в зависимости от доступности для синтеза нейромедиаторов.
Настоящее изобретение направлено на решение вышеуказанных проблем путем предоставления диетического белка, содержащего все незаменимые аминокислоты (кроме Phe), который обладает улучшенными свойствами, такими как высокая биологическая ценность или нейтральный вкус. Кроме того, диетический белок может быть предоставлен в виде продукта питания, который может составлять часть нормального рациона пациента, такого как хлебобулочные изделия, крупы или прессованные батончики. Альтернативно, диетический белок может быть предоставлен в форме, подходящей для приготовления продукта питания пациентом, такой как предварительно приготовленные смеси для выпечки или смеси для овощных супов.
Следовательно, настоящее изобретение направлено на улучшение качества жизни пациентов с PKU, поскольку все пациенты с PKU должны придерживаться специальной диеты с низким содержанием Phe для оптимального развития головного мозга. «Диета на всю жизнь» стала стандартом, рекомендованным большинством специалистов. Диета требует строгого ограничения или исключения продуктов с высоким содержанием Phe, таких как мясо, курица, рыба, яйца, орехи, сыр, бобовые, молоко и другие молочные продукты. Крахмалсодержащие продукты, такие как картофель, хлеб, макароны и кукуруза, должны контролироваться. Также следует избегать подсластителя аспартама, присутствующего во многих пищевых продуктах и безалкогольных напитках, поскольку аспартам состоит из двух аминокислот: фенилаланина и аспарагиновой кислоты.
Младенцы могут по-прежнему находиться на грудном вскармливании, чтобы обеспечить все преимущества грудного молока, но необходимо также следить за его количеством, и потребуется добавление недостающих питательных веществ. В случае этих пациентов используются дополнительные смеси для питания младенцев, чтобы обеспечить аминокислоты и другие необходимые питательные вещества, которых в противном случае было бы недостаточно в рационе с низким содержанием фенилаланина. Когда ребенок вырастет, их можно заменить таблетками, смесями и специально разработанными продуктами. Поскольку Phe необходим для синтеза многих белков, он необходим для соответствующего роста, но его уровни должны строго контролироваться у пациентов с PKU. Кроме того, тирозин, который обычно получается из фенилаланина, должен быть добавлен в рацион пациентов с PKU.
Пероральное введение тетрагидробиоптерина (или BH4) (кофактора для окисления фенилаланина) может снизить уровни Phe в крови некоторых пациентов. Таблетированный препарат соединения дигидрохлорида сапроптерина (Kuvan®), который является формой тетрагидробиоптерина, является коммерчески доступным. Kuvan® является первым лекарственным средством, которое может помочь пациентам с BH4-чувствительной PKU (ORPHA293284, в зависимости от клинической ситуации определенным среди врачей как приблизительно 25-50% популяции, страдающей PKU), снизить уровни Phe до рекомендуемых диапазонов. Работая в тесном сотрудничестве с диетологом, некоторые пациенты с PKU, которые реагируют на Kuvan®, могут увеличить количество натурального белка, которое они могут съедать. Однако пациенты по-прежнему нуждаются в рационе с ограничением в нем Phe.
Теоретически, синтетические полипептидные последовательности, содержащие желаемую смесь аминокислот, могут быть сконструированы и получены в лабораторных условиях. Однако такой подход может вызывать различные проблемы и поэтому не всегда применим. Во-первых, квалифицированным специалистам известно, что достижение высоких уровней продуцирования таких синтетических последовательностей может быть очень сложной задачей. Во-вторых, даже если бы такой синтетический белок был синтезирован, его пригодность для использования в продукте питания была бы неопределенной. Например, такой не встречающийся в природе полипептид может быть аллергеном или токсином. Таким образом, природные белки являются предпочтительными.
Замена остатков Phe в природных белках с последующей рекомбинантной продукцией этих белков также была предложена в патенте США с № 6495344, касающемся овальбумина и казеина, двух белков, присутствующих в очень больших количествах в яйцах и молоке, соответственно, и патенте США с № 6004930, в котором описываются гамма-зеины, класс белков, присутствующих в кукурузе. Однако замена Phe в природных белках не всегда возможна и может изменить структуру белка, так что белок больше не экспрессируется.
WO 2013/148332 относится к встречающимся в природе пищевым полипептидным последовательностям, состоящим из комбинаций аминокислот, которые не содержат Phe или имеют низкое содержание Phe, некоторые из которых секретируются. WO 2014/081884 относится к препаратам таких выделенных пищевых полипептидов, например, с целью питания. WO 2016/046234 относится к способу продуцирования рекомбинантного белка, не содержащего Phe или имеющего низкое содержание Phe.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление рекомбинантного, не содержащего Phe, диетического белка с высокой биологической ценностью для применения в диетических композициях для пациентов с накоплением фенилаланина в организме, чтобы достаточно сбалансировано с точки зрения диетологии обеспечить все другие незаменимые аминокислоты.
В одном аспекте настоящее изобретение относится к рекомбинантному диетическому белку, включающему полипептидную последовательность, которая на по крайней мере 70% идентична последовательности SEQ ID NO:2. В одном варианте осуществления рекомбинантный диетический белок включает полипептидную последовательность, которая на по крайней мере 75%, более предпочтительно на по крайней мере 80%, более предпочтительно на по крайней мере 85%, более предпочтительно на по крайней мере 90%, более предпочтительно на по крайней мере 95%, более предпочтительно на по крайней мере 98% идентична SEQ ID NO:2. В еще более предпочтительном варианте осуществления рекомбинантный диетический белок включает полипептидную последовательность, которая на 100% идентична SEQ ID NO:2. Рекомбинантный диетический белок может представлять собой удовлетворительную с точки зрения диетологии часть последовательности SEQ ID NO:2, которая с возрастающим предпочтением идентична на по крайней мере 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности SEQ ID NO:2.
В другом варианте осуществления рекомбинантный диетический белок или его удовлетворительная с точки зрения диетологии часть включает одну или более дополнительных белковых последовательностей, которые представляют собой метки для очистки или метку. В предпочтительном варианте осуществления дополнительная белковая последовательность включает SEQ ID NO:3.
В другом аспекте настоящее изобретение относится к вектору, включающему последовательность нуклеиновой кислоты, кодирующую рекомбинантный диетический белок или его удовлетворительную с точки зрения диетологии часть.
В другом аспекте настоящее изобретение относится к рекомбинантному микроорганизму, содержащему вектор, кодирующий рекомбинантный диетический белок или его удовлетворительную с точки зрения диетологии часть. В одном варианте осуществления микроорганизм выбирают из группы, состоящей из Escherichia, Klebsiella, Pseudomonas, Xanthomonas, Bacillus, Staphylococcus, Saccharomyces, Corynebacterium, Streptomyces, Salmonella, Aspergillus, Gluconobacter, Mycobacterium, Actinomycetes, Caulobacter, Pichia, Corynebacterium glutamicum, Saccharomyces cerevisiae, Clostridium botulinum, Flavobacterium heparinum, Lactococcus lactis, Methylobacterium extorquens, Pseudoalteromonas haloplanktis, Ralstonia eutropha, Neurospora crassa, Arxula adeninivorans, Hansenula polymorpha, Kluyveromyces lactis, Zygosaccharomyves bailii, Pseudomonas fluorescens, Bacillus subtilis и Bacillus megaterium. В предпочтительном варианте осуществления микроорганизм выбирают из группы, состоящей из Bacillus или Pseudomonas. В более предпочтительном варианте осуществления указанный микроорганизм представляет собой Bacillus subtilis или Pseudomonas fluorescens.
В другом аспекте настоящее изобретение относится к способу продуцирования диетического белка или его удовлетворительной с точки зрения диетологии части, при этом способ включает культивирование рекомбинантного микроорганизма, несущего вектор, кодирующий рекомбинантный белок или его удовлетворительную с точки зрения диетологии часть, в подходящих для продукции условиях. Рекомбинантный диетический белок или его удовлетворительная с точки зрения диетологии часть могут быть подвергнуты очистке. В одном варианте осуществления очистка выполняется с помощью метки для очистки. Предпочтительно, чтобы очищенный рекомбинантный белок или его удовлетворительная с точки зрения диетологии часть содержали не более 1 г Phe на 100 г белка, предпочтительно не более 0,45 г примеси Phe на 100 г белка, более предпочтительно не более 0,35 г примеси Phe на 100 г белок, более предпочтительно не более 0,25 г примеси Phe на 100 г белка, более предпочтительно не более 0,15 г примеси Phe на 100 г белка, более предпочтительно не более 0,13 г примеси Phe на 100 г белка и наиболее предпочтительно не более 0,10 г примеси Phe на 100 г белка.
В другом аспекте настоящее изобретение относится к диетической композиции, содержащей диетический белок или его удовлетворительную с точки зрения диетологии часть. В одном варианте осуществления диетическая композиция состоит из диетического белка или его удовлетворительной с точки зрения диетологии части. В другом варианте осуществления диетический белок или его удовлетворительную с точки зрения диетологии часть объединяют с дополнительными наполнителями. В предпочтительном варианте осуществления диетическая композиция содержит не более 0,2 г Phe на 100 г белка, предпочтительно не более 0,1 г примеси Phe на 100 г белка, более предпочтительно не более 0,05 г примеси Phe на 100 г белка, более предпочтительно не более 0,04 г примеси Phe на 100 г белка, более предпочтительно не более 0,03 г примеси Phe на 100 г белка и наиболее предпочтительно не более 0,02 г примеси Phe на 100 г белка.
Диетический белок или его удовлетворительная с точки зрения диетологии часть или диетическая композиция предназначены для применения в качестве пищи для специальных медицинских целей; делается ссылка на директивы ЕС 2009/39/EG («Diätrahmenrichtlinie») и 1999/21/EG («diätetische Lebensmittel für besondere medizinische Zwecke») а также регламент ЕС EU 609/2013 («Food for special groupsʺ; ʺLebensmittel für Säuglinge und Kleinkinder, Lebensmittel für besondere medizinische Zwecke und Tagesrationen für gewichtskontrollierende Ernährung»), который вступит в силу 20 июля 2016 года. В частности, диетический белок или его удовлетворительная с точки зрения диетологии часть или указанная диетическая композиция могут быть предназначены для применения для контролирования течения нарушения, характеризующееся накоплением фенилаланина в организме, такого как гиперфенилаланинемия (HPA), предпочтительно оксифенилкетонурия (PKU). Таким образом, в другом аспекте диетический белок или его удовлетворительная с точки зрения диетологии часть или указанная диетическая композиция предназначены для применения в качестве лекарственного средства. В предпочтительном варианте осуществления диетический белок или его удовлетворительная с точки зрения диетологии часть предназначены для применения при лечения нарушения, характеризующегося накоплением фенилаланина в организме. В более предпочтительном варианте воплощения нарушение представляет собой HPA, более предпочтительно PKU.
КРАТКОЕ ОПИСАНИЕ ФИГУР
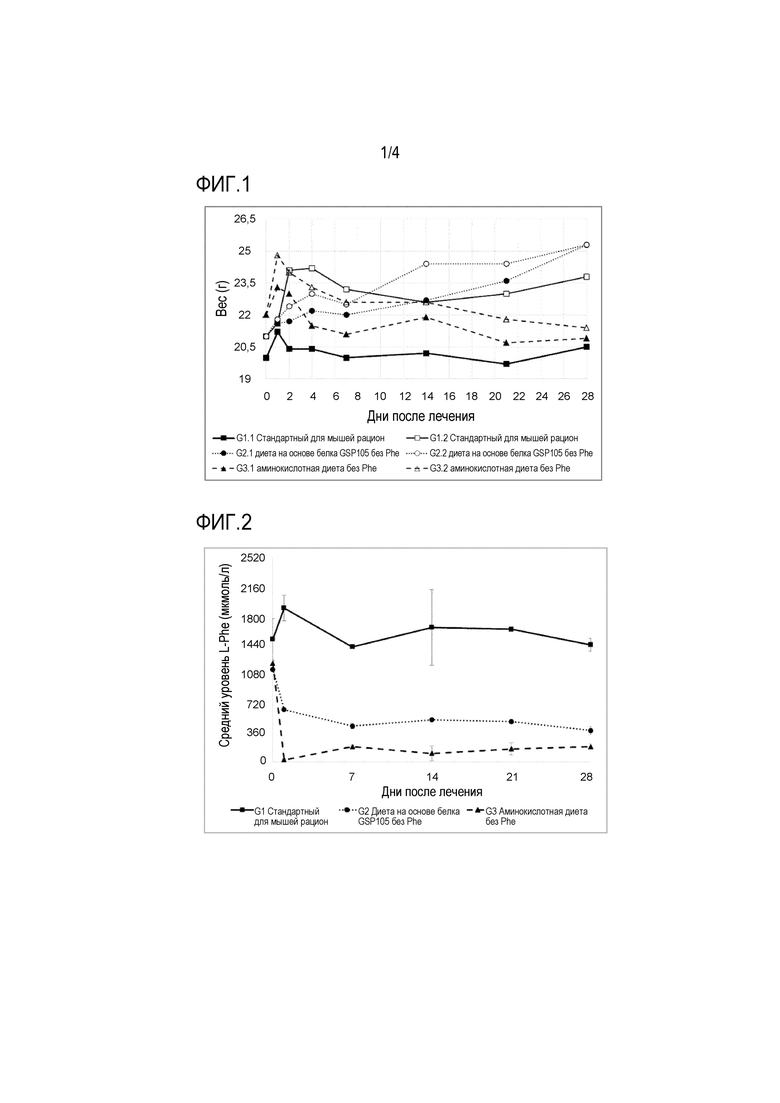
На фиг. 1 продемонстрировано изменение веса мышей с PKU, получавших стандартный для мышей рацион (группы 1, без лечения), диету на основе белка GSP105 без Phe (группы 2) или аминокислотную диету в без Phe (группы 3, стандартное лечение) на протяжении 28 дней кормления. По оси X отмечены дни периода кормления, по оси Y отмечен вес животных в граммах.
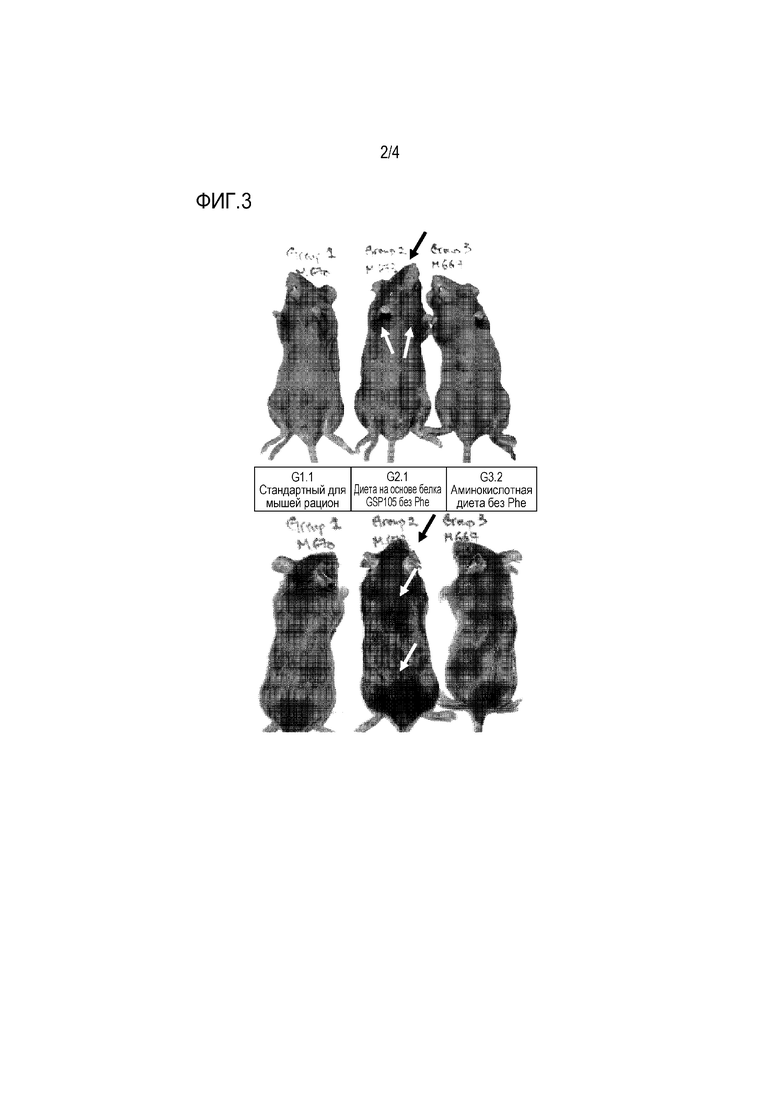
На фиг. 2 представлены в виде графиков средние концентрации Phe в плазме крови трех разных групп мышей на протяжении 28 дней кормления. По оси X отмечены дни периода кормления, по оси Y отмечен уровень L-Phe в микромолях на литр плазмы крови.
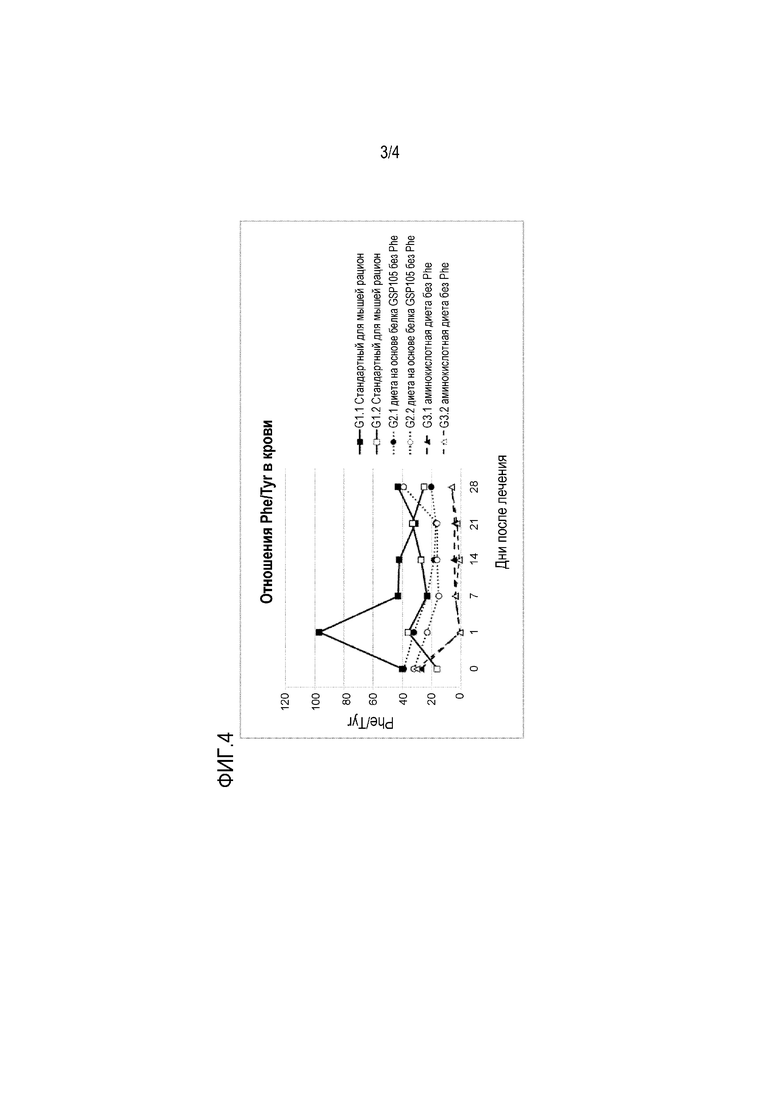
На фиг. 3 продемонстрированы типичные мыши из каждой группы диеты с дифференциально выраженными, более или менее частичными изменениями гипопигментации шерсти мыши после 28 дней кормления.
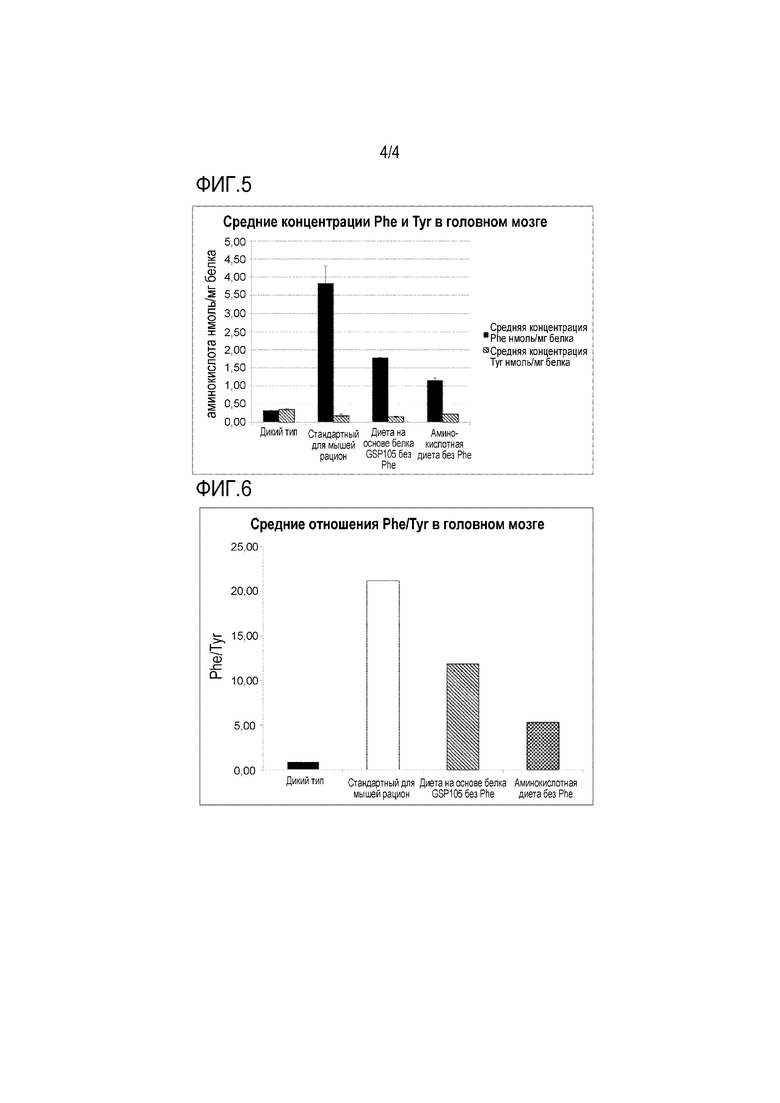
На фиг. 4 представлено отношение фенилаланина к тирозину в крови трех разных групп мышей на протяжении 28 дней кормления. По оси X отмечены дни периода кормления, по оси Y отмечено отношение фенилаланин/тирозин в крови.
На фиг. 5 представлены средние концентрации Phe и Tyr в головном мозге мышей дикого типа (WT) и страдающих PKU мышей, получавших стандартный для мышей рацион, диету на основе белка GSP105 без Phe или аминокислотную диету без Phe.
На фиг. 6 представлены средние отношения Phe/Tyr в головном мозге мышей WT и страдающих PKU мышей, получавших стандартный для мышей рацион, диету на основе белка GSP105 без Phe или аминокислотную диету без Phe.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Используемый здесь термин «рекомбинантный» относится к биомолекуле, например гену или белку, которая (1) была удалена из ее встречающегося в природе окружения, (2) не связана со всем или частью полинуклеотида, в котором ген встречается в природе, (3) функционально связана с полинуклеотидом, с которым она не связана в природе, и/или (4) не встречается в природе. Термин «рекомбинантный» может использоваться в отношении клонированных изолятов ДНК, химически синтезированных аналогов полинуклеотидов или аналогов полинуклеотидов, которые биологически синтезированы с помощью гетерологичных систем, а также белков и/или мРНК, кодируемых такими нуклеиновыми кислотами. Так, например, белок, синтезированный микроорганизмом, является рекомбинантным, если он является синтезированным из мРНК, синтезированным из рекомбинантного гена, присутствующего в клетке.
Используемый здесь термин «диетический белок» относится к белку, подходящему для приема внутрь человеком. Диетические белки, которые обеспечивают все незаменимые аминокислоты, называются белками с высокой биологической ценностью. Белок без Phe, обеспечивающий все другие незаменимые аминокислоты, также считается белком с высокой биологической ценностью. Казеин (обычно обнаруживаемый в молоке млекопитающих белок, составляющий 80% от белков коровьего молока) и сыворотка (белок в жидкости, которая остается после сворачивания и процеживания молока), являются основными источниками диетических белков с высокой биологической ценностью. Диетический белок настоящего изобретения содержит все незаменимые аминокислоты, кроме Phe. Термин «его удовлетворительная с точки зрения диетологии часть» относится к части диетического белка. Удовлетворительная с точки зрения диетологии часть диетического белка содержит меньше аминокислот, чем диетический белок настоящего изобретения, но все еще содержит все незаменимые аминокислоты, кроме Phe.
Используемый здесь термин «удовлетворительная с точки зрения диетологии» относится к полипептидной последовательности, которая включает все незаменимые аминокислоты, кроме фенилаланина, и представляет собой белок с высокой биологической ценностью.
Используемый здесь термин «незаменимые аминокислоты» относится к гистидину (His, H), аргинину (Arg, R), изолейцину (Ile, I), лейцину (Leu, L), лизину (Lys, K), метионину (Met, M), фенилаланину (Phe, F), треонину (Thr, T), триптофану (Trp, W) и валину (Val, V), которые являются аминокислотами, необходимыми для здоровья и роста, но которые не могут быть синтезированы в организме человека и должны быть получены из пищи.
Используемый здесь термин «рекомбинантный микроорганизм» относится к микроорганизму, который был модифицирован для переноса копии рекомбинантного гена.
Как здесь используется, «диетическая композиция» представляет собой композицию, подходящую для потребления человеком. Диетическая композиция может содержать в основном белок. Диетическая композиция настоящего изобретения содержит рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть и имеет низкое содержание общего фенилаланина.
Используемый здесь термин «встречающийся в природе белок» относится к белку, который образуется из не измененной человеком последовательности, присутствующей у природного хозяина. Следовательно, ни последовательность ДНК, кодирующая белок, ни аминокислотная последовательность самого белка не были изменены по сравнению с последовательностями, обнаруживаемыми у природного хозяина.
Для целей настоящего изобретения «продукт питания» представляет собой подходящий для потребления человеком продукт, который включает рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть или диетическую композицию настоящего изобретения и содержит желаемое количество незаменимых аминокислот. Желаемое количество незаменимых аминокислот, необходимое для пациента в день, зависит от возраста пациента и рациона пациента, т.е. уровня ограничения белка и/или Phe. Желаемое суточное количество может быть определено врачом и/или диетологом известными в данной области техники способами. Типичное количество основано, например, на 0,8 г белка на кг веса тела в день для взрослых или 1,2 г белка на кг веса тела в день для детей. Сам продукт питания, т.е. до добавления рекомбинантного диетического белка настоящего изобретения или его удовлетворительной с точки зрения диетологии части или диетической композиции настоящего изобретения, не содержит белок или имеет низкое содержание белковых компонентов.
Как здесь используется, «метка для очистки» представляет собой любой полипептид, который имеет партнера по связыванию, который может использоваться для обнаружения, выделения и/или очистки второй представляющей интерес белковой или полипептидной последовательности, слитой с меткой для очистки. Несколько примеров хорошо известны в данной области техники и включают His-6-метку, эпитоп FLAG, эпитоп c-myc, Strep-TAGII, биотиновую метку, глутатион-S-трансферазу (GST), хитин-связывающий белок (CBP), мальтозосвязывающий белок (MBP), метку сродства к металлу или Tag54 (Rasche et al., The Open Biotechnology Journal 2011, 5: 1-6) или их модификации.
В одном аспекте настоящее изобретение относится к рекомбинантному, не содержащему Phe диетическому белку с высокой биологической ценностью. В примере 1 описан процесс идентификации такого диетического белка, используемый для продуцирования рекомбинантного, не содержащему Phe диетического белка настоящего изобретения, который может использоваться для диетотерапии для пациентов с накоплением фенилаланина в организме. «Белок общего стресса 16O (G16O_BACSU)» (SEQ ID NO:1) (номер доступа в банке данных о белках UniprotKb - P80872) из Bacillus subtilis (штамм 168) был идентифицирован в качестве подходящего белка-кандидата. Единственный остаток Phe был заменен структурно сходным аминокислотным остатком триптофаном (Trp) путем замены триплета оснований, кодирующего Phe, на триплет оснований, кодирующий триптофан, на уровне кДНК. Эта замена приводит к получению диетического белка, не содержащего Phe, но вместо него содержащего незаменимую аминокислоту Trp, обеспечивая тем самым диетический белок, который содержит все незаменимые аминокислоты, кроме Phe. Следовательно, замена выгодна по двум причинам: во-первых, предоставляется диетический белок, не содержащий Phe, во-вторых, все другие незаменимые аминокислоты присутствуют в белке, и никаких добавок не требуется. Это особенно выгодно, поскольку Trp имеет очень горький вкус, и добавление свободного Trp в диетическую композицию приведет к горькому вкусу. Более того, неожиданно было обнаружено, что введение аминокислоты Trp с горьким вкусом не приводит к диетическому белку с горьким вкусом. Таким образом, в одном варианте осуществления рекомбинантный диетический белок с высокой биологической ценностью, который не содержит Phe и содержит все незаменимые аминокислоты, имеет полипептидную последовательность, идентичную SEQ ID NO:2. Такой диетический белок называется GSP105. В другом варианте осуществления рекомбинантный диетический белок включает полипептидную последовательность, которая на по крайней мере 70% идентична последовательности SEQ ID NO:2. Более предпочтительно, когда рекомбинантный диетический белок включает полипептидную последовательность, которая на по крайней мере 75%, более предпочтительно на по крайней мере 80%, более предпочтительно на по крайней мере 85%, более предпочтительно на по крайней мере 90%, более предпочтительно на по крайней мере 95%, более предпочтительно на по крайней мере 98%, более предпочтительно на по крайней мере 99% и наиболее предпочтительно на по крайней мере 100% идентична SEQ ID NO:2. Должно быть понятно, что идентичность последовательности должна определяться относительно последовательности SEQ ID NO:2 по всей ее длине. Например, считается, что белок, включающий последовательность SEQ ID NO:2 и имеющий на С- и/или N-конце диетического белка дополнительные аминокислоты, идентичен по последовательности на 100% последовательности SEQ ID NO:2, поскольку C- и/или N-концевые аминокислоты могут не учитываться при сравнении последовательностей.
Рекомбинантный диетический белок может включать удовлетворительную с точки зрения диетологии часть последовательности SEQ ID NO:2, которая с возрастающим предпочтением на по крайней мере 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO:2.
Рекомбинантный диетический белок или его удовлетворительная с точки зрения диетологии часть может включать одну или более дополнительных белковых последовательностей, которые являются метками для очистки или меткой. Дополнительная белковая последовательность может необязательно удаляться путем расщепления. Если диетический белок или его удовлетворительная с точки зрения диетологии часть включает более одной дополнительной белковой последовательности, каждая из них, любая их комбинация или все они могут удаляться путем расщепления. Следует понимать, что дополнительная белковая последовательность не вводит остаток Phe, или в тех случаях, когда дополнительная белковая последовательность включает остаток Phe, такая дополнительная белковая последовательность удаляется путем расщепления. В одном варианте осуществления дополнительная белковая последовательность включает SEQ ID NO:3. В предпочтительном варианте осуществления дополнительная белковая последовательность включает модифицированную TAG54 (Rasche et al.), в которой остаток Phe заменен другой аминокислотой, предпочтительно остатком тирозина или аланина. Таким образом, в конкретном предпочтительном варианте осуществления дополнительная белковая последовательность включает SEQ ID NO:4, модифицированную Tag54, в которой остаток Phe был заменен остатком аланина. В другом конкретном предпочтительном варианте осуществления дополнительная белковая последовательность включает модифицированную Tag54, в которой остаток Phe был заменен остатком тирозина (SEQ ID NO:5). Такая замена имеет то преимущество, что содержание Tyr увеличивается, а отношение Phe/Tyr в диетическом белке уменьшается. В дополнительном предпочтительном варианте осуществления рекомбинантный диетический белок или его удовлетворительная с точки зрения диетологии часть дополнительно включает С-концевую His-6-метку. В особенно предпочтительном варианте осуществления рекомбинантный диетический белок включает полипептидную последовательность, которая идентична SEQ ID NO:2, и включает в качестве дополнительных белковых последовательностей С-концевую His-6-метку и SEQ ID NO:4, в результате чего меченый рекомбинантный диетический белок имеет последовательность, указанную в SEQ ID NO:6 (=GSP105-6His-Tag54-P15). Характеристики меченого рекомбинантного диетического белка (SEQ ID NO:6) по сравнению с белком общего стресса 16O (GSP16O) B. subtilis перечислены в таблице 1.
Таблица 1: Сравнение встречающегося в природе белка GSP16O и меченого рекомбинантного диетического белка GSP105 (SEQ ID NO:6), продуцируемого в Bacillus subtilis и Pseudomonas fluorescens
His6-метка, Tag54-P15
His6-метка, Tag54-P15
His-6-метка и/или модифицированный Tag54 могут использоваться для очистки рекомбинантного диетического белка или его удовлетворительной с точки зрения диетологии части. Неожиданно было обнаружено, что метка Tag54-P15 увеличивает экспрессию белка в B. subtilis. Кроме того, дополнительная белковая последовательность модифицированной Tag54 преимущественно обеспечивает аминокислоты для общего аминокислотного состава диетического белка, тем самым улучшая общий аминокислотный состав рекомбинантного диетического белка. Кроме того, модифицированная Tag54 может служить в качестве эпитопа для обнаружения слитого белка.
Рекомбинантный диетический белок настоящего изобретения или его удовлетворительная с точки зрения диетологии часть может, кроме того, включать дизайнерский хвост. «Дизайнерский хвост» относится к короткому участку аминокислот, которые могут быть добавлены к С- или N-концу белка. Дизайнерский хвост включает от 1 до 5 аминокислот. В одном варианте осуществления диетический белок включает полипептидную последовательность, которая на по крайней мере 70% идентична последовательности SEQ ID NO:2, и дизайнерский хвост. Необязательно, диетический белок может, кроме того, включать одну или более дополнительных белковых последовательностей, таких как His-6-метка и/или модифицированную Tag54. В предпочтительном варианте осуществления дизайнерский хвост составлен из тирозина. В особенно предпочтительном варианте осуществления дизайнерский хвост содержит один тирозин, более предпочтительно два тирозина и наиболее предпочтительные три тирозина. Таким образом, в одном варианте осуществления диетический белок или его удовлетворительная с точки зрения диетологии часть включает полипептидную последовательность, которая на по крайней мере 70% идентична SEQ ID NO:2, составленный из тирозина дизайнерский хвост, включающий по крайней мере один остаток тирозина, His-6-метку и модифицированную Tag54.
В другом аспекте настоящее изобретение относится к вектору, включающему последовательность нуклеиновой кислоты, кодирующую рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть. В одном варианте осуществления вектор представляет собой плазмиду. В предпочтительном варианте осуществления плазмида представляет собой индуцируемую с помощью IPTG экспрессионную плазмиду pHT43 (MoBiTec) или индуцируемую с помощью IPTG экспрессионную плазмиду pDAB107209 (Dow; US 2008/0269070 A1).
Специалист в данной области техники может легко определить последовательность нуклеиновой кислоты, кодирующую рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть, используя известные способы, такие как обратная трансляция. Обратная трансляция представляет собой способ, в котором в качестве входных данных используется последовательность белка, и после использования таблицы использования кодонов получается последовательность ДНК, представляющая наиболее вероятную последовательность в случае невырожденного кода. Полученная последовательность нуклеиновой кислоты может быть оптимизирована с использованием известных алгоритмов оптимизации. Это позволило специалисту получить последовательность нуклеиновой кислоты, оптимизированную для экспрессии в конкретном хозяине. Специалист может также получить нуклеиновые кислоты коммерчески, предоставляя желаемую аминокислотную последовательность и организм хозяина, в котором должен быть продуцирован белок. Примерная последовательность нуклеиновой кислоты для продукции рекомбинантного диетического белка, имеющего полипептидную последовательность SEQ ID NO:6, в B. subtilis показана в SEQ ID NO:7. Однако следует понимать, что другие последовательности нуклеиновой кислоты, такие как последовательности нуклеиновой кислоты, оптимизированные в отношении частоты использования кодонов для конкретных клеток-хозяев, могут отклоняться от примерной последовательности, все еще продуцируя рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть. Даже для одного и того же организма последовательность нуклеиновой кислоты может варьировать в зависимости от коммерческого производителя и используемого алгоритма.
В другом аспекте настоящее изобретение относится к рекомбинантному микроорганизму, содержащему вектор, который включает последовательность нуклеиновой кислоты, кодирующую рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть. Таким образом, настоящее изобретение относится к рекомбинантному микроорганизму, экспрессирующему рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть. В одном варианте осуществления микроорганизм выбирают из группы, состоящей из Escherichia, Klebsiella, Pseudomonas, Xanthomonas, Bacillus, Staphylococcus, Saccharomyces, Corynebacterium, Streptomyces, Salmonella, Aspergillus, Gluconobacter, Mycobacterium, Actinomycetes, Caulobacter, Pichia, Corynebacterium glutamicum, Saccharomyces cerevisiae, Clostridium botulinum, Flavobacterium heparinum, Lactococcus lactis, Methylobacterium extorquens, Pseudoalteromonas haloplanktis, Ralstonia eutropha, Neurospora crassa, Arxula adeninivorans, Hansenula polymorpha, Kluyveromyces lactis, Zygosaccharomyves bailii, Pseudomonas fluorescens, Bacillus subtilis и Bacillus megaterium. В предпочтительном варианте осуществления микроорганизм выбирают из группы, состоящей из Bacillus или Pseudomonas. В более предпочтительном варианте осуществления микроорганизм представляет собой Bacillus subtilis или Pseudomonas fluorescens.
В другом аспекте настоящее изобретение относится к способу продуцирования рекомбинантного диетического белка настоящего изобретения или его удовлетворительной с точки зрения диетологии части, при этом способ включает культивирование рекомбинантного микроорганизма настоящего изобретения в условиях, подходящих для продуцирования диетического белка или его удовлетворительной с точки зрения диетологии части рекомбинантным микроорганизмом. В одном варианте осуществления способ включает культивирование рекомбинантного микроорганизма, выделение рекомбинантного диетического белка или его удовлетворительной с точки зрения диетологии части, очистку рекомбинантного диетического белка или его удовлетворительной с точки зрения диетологии части и сушку полученного белка. В другом варианте осуществления способ включает стадии культивирования рекомбинантного микроорганизма, такого как Bacillus, сбора супернатанта, необязательно концентрирования супернатанта, очистки рекомбинантного диетического белка или его удовлетворительной с точки зрения диетологии части, замены буфера на воду и лиофилизации и/или сушки распылением и/или сушки в барабанной сушилке и/или сушки экструзионного типа полученного белка. Культивирование рекомбинантного микроорганизма предпочтительно включает использование закваски и основных культур. Сбор и концентрирование супернатанта предпочтительно включает диафильтрацию, более предпочтительно поперечнопроточную фильтрацию с использованием полых волокон с различными размерами пор. Предпочтительно, чтобы супернатант после концентрирования концентрировался в по крайней мере 10 раз. Очистка рекомбинантного диетического белка или его удовлетворительной с точки зрения диетологии части может включать аффинную хроматографию с иммобилизованными ионами металлов (IMAC), предпочтительно с использованием ионов цинка и хелатирующей сефарозы. Необязательно очищенный белок может быть сконцентрирован после замены буфера на воду. Таким образом, в предпочтительном варианте осуществления способ включает стадии культивирования рекомбинантного микроорганизма с использованием закваски и основных культур, сбора супернатанта, концентрирования супернатанта в по крайней мере 10 раз, очистки рекомбинантного диетического белка или его удовлетворительной с точки зрения диетологии части, замены буфера на воду, необязательно концентрирования очищенного белка и лиофилизации и/или сушки распылением полученного белка.
Способ продуцирования рекомбинантного диетического белка настоящего изобретения или его удовлетворительной с точки зрения диетологии части приводит к высоким выходам белка, таким как, по крайней мере, 100-500 мг/л в B. subtilis или, по крайней мере, 2,4 г/л в Pseudomonas fluorescens. Очищенный рекомбинантный белок или его удовлетворительная с точки зрения диетологии часть содержит не более 1 г Phe на 100 г белка, предпочтительно не более 0,45 г примеси Phe на 100 г белка, более предпочтительно не более 0,35 г примеси Phe на 100 г белка, более предпочтительно не более 0,25 г примеси Phe на 100 г белка, более предпочтительно не более 0,15 г примеси Phe на 100 г белка, более предпочтительно не более 0,13 г примеси Phe на 100 г белка и наиболее предпочтительно не более 0,10 г примеси Phe на 100 г белка.
Очищенный, подвергнутый лиофилизации и/или сушке распылением и/или сушке в барабанной сушилке и/или сушке экструзионного типа белок можно хранить в замороженном состоянии, например, при -20°С, в условиях охлаждения, например, при 4°С, или при комнатной температуре. В предпочтительном варианте осуществления очищенный подвергнутый лиофилизации и/или сушке распылением и/или сушке в барабанной сушилке и/или сушке экструзионного типа белок хранится при -20°С.
В другом аспекте настоящее изобретение относится к диетической композиции, содержащей рекомбинантный диетический белок настоящего изобретения или его удовлетворительную с точки зрения диетологии часть, или отдельно, или необязательно с дополнительными наполнителями. В одном варианте осуществления диетическая композиция настоящего изобретению дополнена дополнительными наполнителями, выбираемыми из группы, состоящей из необходимых витаминов, минералов и микроэлементов, витаминоподобных веществ (таких как, но без ограничения ими, таурин, миоинозит, холин и карнитин), липидов (таких как, но без ограничения ими, жиры, масла, жирные кислоты, докозагексаеновая кислота (DHA), эйкозапентаеновая кислота (EPA), триглицериды, фосфолипиды, лецитин, эфиры жирных кислот или холестерин), углеводов (таких как, но без ограничения ими, моно-/ди-/олиго-/полисахариды, крахмал, глюканы, фруктаны или пентозаны), нуклеотидов, белков, пептидов, аминокислот (таких как тирозин) и продуктов их реакции, кислот, регуляторов кислотности, средств против спекания, противовспенивающих агентов, антиоксидантов, связующих веществ, буферов (таких как, но без ограничения ими, цитрат натрия, карбонат магния, бикарбонат магния, карбонат кальция, бикарбонат кальция), наполнителей, эмульгаторов, ферментов, укрепляющих агентов, ароматизаторов, усилителей вкуса, пенообразователей, гелеобразующих агентов (таких как, но без ограничения ими, гуар, ксантан, альгинат, карраген, пектин), средств для глазирования, увлажнителей, модифицированных крахмалов, консервантов, пропеллентов, разрыхлителей, секвестрантов, стабилизаторов, загустителей (таких как, но без ограничения ими, крахмал, целлюлоза), подсластителей, пищевых красителей, трав, специй, растительных экстрактов и фитохимических веществ. В предпочтительном варианте осуществления диетическая композиция может быть дополнена тирозином.
В одном варианте осуществления диетическая композиция готовится в виде порошка, гранул, таблетки, капсулы, агломерата, замороженной композиции, гранулы, раствора, раствора макромолекул, гидроколлоида, сложной дисперсной системы, суспензии, эмульсии, жидкости, пены, геля, золя, твердого золя, твердой пены, кристалла, аморфного твердого вещества, пилюли, экструдата или пасты. Диетическая композиция может храниться с охлаждением или без него в высушенном, лиофилизированном, высушенном распылением, высушенном в барабанной сушилке или экструзионно высушенном виде.
В предпочтительном варианте осуществления диетическая композиция содержит не более 0,2 г Phe на 100 г белка, предпочтительно не более 0,1 г примеси Phe на 100 г белка, более предпочтительно не более 0,05 г примеси Phe на 100 г белка, более предпочтительно не более 0,04 г примеси Phe на 100 г белка, более предпочтительно не более 0,03 г примеси Phe на 100 г белка и наиболее предпочтительно не более 0,02 г примеси Phe на 100 г белка.
Рекомбинантный диетический белок настоящего изобретения или его удовлетворительная с точки зрения диетологии часть или диетическая композиция настоящего изобретения могут использоваться в продукте питания. Продукт питания может быть выбран, но без ограничения этим, из группы, состоящей из напитков, супов, прессованных батончиков, вафель, галет, пудингов, гелеобразных пищевых продуктов, подобных мясу пищевых продуктов, таких как аналоги мяса, содержащие неживотные волокна, аналоги колбас, хлебобулочных изделий, соусов, заправок для салатов, каш, хлопья, хлебопекарных смесей, таких как смеси для маффинов, смеси для вафель или смеси для блинов, пищевых продуктов, печенья, крекеров, кремов, муссов, фруктовых пирогов или пирогов с сыром, заварных кремов, компотов, мороженого, щербетов, парфе, крем-соусов, спредов, сиропов, пюре, паст, желе, масел, джемов, аналогов сыра, аналогов сливочного сыра, аналогов йогурта, аналогов молока, чипсов и экструдированных сухих веществ. Продукт питания, содержащий диетическую композицию настоящего изобретения, может быть изготовлен и куплен или индивидуально приготовлен пациентом. Например, напитки или супы могут быть приготовлены путем добавления диетической композиции в воду, фруктовый сок, рисовую кашу или овощной бульон. Преимущественно, когда рекомбинантный диетический белок или его удовлетворительная с точки зрения диетологии часть выдерживает тепловые обработки без изменений его пищевой ценности, консистенции или вкуса. Таким образом, при приготовлении продукта питания, такого как, например, хлебобулочные изделия, каши, супы или прессованные батончики, рекомбинантный диетический белок или его удовлетворительную с точки зрения диетологии часть можно нагревать, запекать, варить, обжаривать, обжаривать во фритюре, слегка обжаривать, тушить, тушить, обжаривать в масле, готовить на пару, варить в кипятке, тушить на медленном огне, готовить на гриле, готовить при низкой температуре, гомогенизировать, стерилизовать, дробно стерилизовать, обрабатывать под высоким давлением и при низкой температуре, готовить в вакууме, обрабатывать замораживанием, пастеризовать или экструдировать.
В одном варианте осуществления продукт питания содержит очень низкие количества Phe. В предпочтительном варианте осуществления продукт питания не содержит Phe. Количество примеси Phe в диетической композиции настоящего изобретения, которая добавляется к продукту питания, может меняться в зависимости от продукта питания. В одном варианте осуществления продукт питания содержит не более 0,2 г Phe на 100 г белка, предпочтительно не более 0,1 г примеси Phe на 100 г белка, более предпочтительно не более 0,05 г примеси Phe на 100 г белка, более предпочтительно не более 0,04 г примеси Phe на 100 г белка, более предпочтительно не более 0,03 г примеси Phe на 100 г белка и наиболее предпочтительно не более 0,02 г примеси Phe на 100 г белка.
В другом аспекте настоящее изобретение относится к рекомбинантному диетическому белку настоящего изобретения или его удовлетворительной с точки зрения диетологии части или диетической композиции настоящего изобретения для применения в качестве лекарственного средства и/или пищевого продукта для специальных медицинских целей. Рекомбинантный диетический белок или его удовлетворительная с точки зрения диетологии часть или диетическая композиция могут быть в форме порошка, гранул, таблетки, шарика, суспензии, эмульсии, жидкости, пилюли, экструдата или пасты. Введение может осуществляться три-пять раз в день. Доза может, например, составлять, по крайней мере 5, 10, 15, 20, 30, 40 или 50 г диетического белка. Введение может быть с приемом пищи. Введение может осуществляться перорально или энтерально. Предпочтительно, когда введение осуществляется перорально. Лекарственное средство можно вводить детям, подросткам и взрослым. В предпочтительном варианте осуществления рекомбинантный диетический белок настоящего изобретения или его удовлетворительная с точки зрения диетологии часть или диетическая композиция настоящего изобретения предназначены для применения при лечении нарушения, характеризующегося накоплением фенилаланина в организме. В еще более предпочтительном варианте осуществления нарушение представляет собой гиперфенилаланинемию или оксифенилкетонурию. В еще одном предпочтительном варианте осуществления рекомбинантный диетический белок или его удовлетворительную с точки зрения диетологии часть или диетическую композицию используют в сочетании с лекарственным средством для контролирования течения PKU или HPA, таким как BH4 или его аналог.
Пригодность рекомбинантного диетического белка настоящего изобретения для применения при контролирования течения оксифенилкетонурии (PKU) продемонстрирована в примере 3. В примере 3 представлены результаты экспериментального исследования, в котором страдающих PKU мышей лечили либо с помощью диеты, в которой единственным источником аминокислот у них являлась смесь аминокислот без Phe, но с 1,5% Tyr (Harlan Teklad TD.97152; Seagraves and McBride, Mol Genet Metab 2012, 107 (4):650-658) (называемой здесь «аминокислотной диетой без Phe»), которая напоминает современный стандарт в медицинских пищевых продуктах для пациентов с PKU, или с помощью диеты, в которой единственным источником аминокислот у них является рекомбинантный диетический белок GSP105, дополненный 0,2% Phe (называемой здесь «диетой на основе белка GSP105 без Phe» или «диетой на основе GSP105 без Phe»). Дополнение этой диеты Phe в эксперименте было сделано, потому что у мышей в противном случае не было бы доступа к этой незаменимой аминокислоте. Мыши, которые получали GSP105-белковую диету без Phe, продемонстрировали сохранение веса или увеличение веса в противоположность получавшим аминокислотную диету без Phe мышам, которые продемонстрировали потерю веса (фиг. 1). Это может быть объяснено тем фактом, что рекомбинантный диетический белок является источником структурно интактного белка. Хотя в области диетологии ведутся споры о том, остаются ли белки и фрагменты белков доступными для метаболических целей по сравнению с композициями свободных аминокислот, считается, что пул доступных аминокислот из смеси кристаллических аминокислот должен метаболизироваться немедленно, поскольку организм не может хранить их для дальнейшего метаболического использования. Однако белки и фрагменты белков перевариваются постепенно, что обеспечивает непрерывное высвобождение свободных аминокислот, доступных для метаболических целей на протяжении более длительного периода времени. Таким образом, использование рекомбинантного диетического белка настоящего изобретения или его удовлетворительной с точки зрения диетологии части или диетической композиции настоящего изобретения может обеспечить аминокислоты на протяжении более длительного периода, что приводит к сохранению веса или увеличению веса.
Не ограничиваясь какой-либо теорией, потеря веса у мышей, получавших аминокислотную диету без Phe, также могла быть вызвана отсутствием минимально необходимого количества Phe в рационе, поскольку возможно, что животные достигали катаболического метаболизма, в котором эндогенный белок метаболизировался для поддержания необходимых уровней Phe в крови. Такое явление также можно наблюдать у пациентов с PKU, страдающих от недоедания, которые метаболизируют эндогенный белок и, в свою очередь, страдают от повышенных уровней Phe в крови. Полное и абсолютное отсутствие Phe в рационе пациентов с PKU нежелательно и невозможно, соответственно пациенты с PKU получают минимальное количество незаменимой аминокислоты Phe с пищей. С другой стороны, у пациентов, страдающих PKU, может иметь место недоедание, поскольку строгая диета также может привести к недостатку других незаменимых аминокислот. Таким образом, использование рекомбинантного диетического белка настоящего изобретения или его удовлетворительной с точки зрения диетологии части или диетической композиции настоящего изобретения может предотвратить недоедание у пациентов с PKU.
ПРИМЕРЫ
Пример 1 - Открытие гена-кандидата
Для идентификации потенциальных белков-кандидатов, которые соответствуют требуемым критериям для пищевого белка, не содержащего фенилаланина, был использован алгоритм поиска, разработанный авторами настоящего изобретения. Последовательности белков из разных родов или видов были получены из базы данных UniProt (http://www.uniprot.org) с использованием функции импорта CLC Main Workbench 6.6.1.
Были использованы белки, происходящие из видов, которые являются общепринятыми источниками пищи, такими как овощи (например, картофель), но также происходящие из микроорганизмов (например, дрожжей) или животных (например, крупного рогатого скота). Либо латинское, либо общепринятое название вида/рода, в зависимости от того, какое название привело к большему количеству соответствий (результатов поиска), использовалось в качестве строки поиска. Все результаты поиска, за исключением неохарактеризованных белков, были загружены, в результате чего общее количество=836037 последовательностей было получено из различных видов. Следующие строки поиска были использованы для определения соответствий (результатов поиска), перечисленных в таблице 2.
Функция «Создать статистику последовательностей» в CLC с партиями от 5000 до 10000 последовательностей была в дальнейшем использована для создания списков аминокислот, присутствующих в каждом из 836037 генов. Эти списки были импортированы в Excel, где аминокислотный состав сравнивался с двумя стандартами питания: так называемый принцип картофель-яйца (Kartoffel-Ei Standard, KES), а также с аминокислотным составом, который производитель Milupa использует в своем продукте PKU1, смесью аминокислот без Phe, применяемой для лечения больных с PKU.
Кроме того, было проанализировано общее количество Phe в аминокислотной последовательности, а также общее количество аминокислот. Все проанализированные факторы были оценены в соответствии с установками в таблице 3.
Таблица 2: Строки поиска для отбора генов и соответствующего числа соответствий (результатов поиска)
хранение
Результаты поиска с общей оценкой выше 20 (сумма оценок за содержание Phe, молекулярную массу и отклонение относительно KES и PKU1 одного белка) оценивали вручную с точки зрения состояния последовательности (полная или частичная), существования белка (доказательства на уровне белка, прогностические, выведенные исходя из гомологии), функции белка и аллергенности (http://www.allergenonline.org, скользящее 8-мерное окно). Белки с полной последовательностью, доказательствами на уровне белка и отсутствием аллергенности были предварительно отобраны и дополнительно проанализированы на предмет их молекулярной функции. Все белки, обладающие известной или предсказанной активностью связывания ДНК/РНК, а также токсичные белки были исключены из списка потенциальных кандидатов.
Среди оставшихся кандидатов был идентифицирован «Белок общего стресса 16О (G16О_BACSU)» из Bacillus subtilis (штамма 168) в качестве подходящего белка-кандидата.
На основе последовательности белка, опубликованной в UniProt (www.uniport.org), был сконструирован синтетический ген, используя функцию обратной трансляции CLC Main Workbench.
Таблица 3: Оценка белков-кандидатов
*Отклонение рассчитывается как добавленное абсолютное значение между каждой аминокислотой в анализируемой последовательности белка по сравнению с контрольным составом KES и PKU1 (в процентах).
Две последовательности эпитопных меток (Tag54-P15, His6-метку) добавляли к 3'-концу кодирующей белок общего стресса (GSP) последовательности для обеспечения возможности обнаружения конкретного белка, его количественной оценки и очистки, что приводило к нуклеотидной последовательности, представленной в SEQ ID NO:7. Кроме того, сайты рестрикции ферментов BamHI и AatII были добавлены к 5'- и 3'-концу, что позволяет клонировать генную конструкцию в экспрессионный вектор.
Последовательность гена была обозначена как GSP105 и оптимизирована в отношении частоты использования кодонов и стабильности РНК для экспрессии в Bacillus subtilis и впоследствии синтезирована GenScript (США).
Пример 2 - Продукция в B. subtilis
Синтетический ген GSP105, имеющий нуклеотидную последовательность, представленную в SEQ ID NO:7, встраивали в вектор pHT43 для экспрессии в Bacillus subtilis (MoBiTec, Gottingen, Германия), обеспечивая возможность секреции рекомбинантного белка в культуральную среду, и вводили в дефектный по протеазе штамм WB800N B. subtilis (MoBiTec), следуя инструкциям производителей.
После трансформации положительные клоны отбирали на чашках для отбора с помощью антибиотиков; присутствие экспрессионного вектора дополнительно подтверждали с помощью ПЦР, экстракции плазмиды и последующего секвенирования ДНК. Маточные культуры в глицерине были получены и хранились при -80°C.
Заквасочную культуру рекомбинантного B. subtilis GSP105 готовили путем инокуляции в 1 л TB-среды (Carl Roth, Karlsruhe, Германия), дополненной хлорамфениколом (Carl Roth) и неомицином (Carl Roth) в конечных концентрациях 5 мкг/мл каждого, 1 мл раствора маточной культуры B. subtilis GSP105. Культуру выращивали в течение 24 ч при 28°C и 160 об/мин в 2,5 л «Ultra Yield Flasks» (Thomson Instrument Company, Калифорния, США).
Для экспрессии рекомбинантного белка в TB-среду, дополненную хлорамфениколом и неомицином, инокулировали заквасочную культуру в соотношении 1:20 (объем/объем). Для индукции экспрессии целевого белка добавляли IPTG до конечной концентрации 0,5 мкМ. Культуру выращивали в течение 20 ч при 37°C и 160 об/мин.
После культивирования клетки удаляли центрифугированием с последующей стерилизацией фильтрованием с использованием модуля для фильтрации с полыми волокнами 0,22 мкм (N02-E20U-05-N, Spectrum Labs, Лос-Анджелес, США) со скоростью 2,5 л/мин при трансмембранном давлении до 1,6 бар. С целью уменьшения технологического объема осветленный супернатант культуры концентрировали в 10 раз с использованием модуля из полых волокон с отсечкой 10 кДа (N02-E010-05-N, Spectrum Lab) со скоростью 2,5 л/мин при трансмембранном давлении до 1,6 бар.
GSP105 очищали из сконцентрированного супернатанта культуры с помощью IMAC с использованием 500 мл хелатирующей сефарозы (GE Healthcare, Uppsala, Швеция), упакованной в колонку XK 50/40 и наполненной ионами Zn в соответствии с инструкциями производителя. Супернатант загружали на колонку со скоростью 76 см/час; после этого колонку промывали 5 объемами колонки (CV) PBS со скоростью 92 см/ч. Связанный белок элюировали с колонки с использованием 5 CV PBS, pH 8,0, 250 мМ имидазола со скоростью 92 см/ч. Фракции элюции с колонки для IMAC объединяли, и буфер заменяли на воду без соли с использованием модуля из полых волокон с отсечкой 10 кДа (S02-Eo10-05N, Spectrum Labs) со скоростью 900 мл/мин при трансмембранном давлении до 1,6 бар. Для обеспечения эффективного обмена буфера объем образца заменяли семь раз. Очищенный и повторно забуференный белок хранили при -20°C и затем лиофилизировали и высушивали распылением.
Концентрацию GSP105 определяли с помощью конкурентного ELISA (Piotrzkowski et al., PLoS ONE, 2012, 7 (9): e45803), целостность и степень чистоты белка подтверждали с помощью электрофореза в SDS-геле и иммуноблота (Rasche et al).
Пример 3 - Исследование кормления мышей (экспериментальное исследование)
План исследования:
Шесть взрослых самцов гомозиготных мышей с PKU (Pahenu2/2; Shedlovsky et al., Genetics 1993, 134:1205; http://www.pahdb.mcgill.ca/?Topic=Information& Section=Mouse&Page=1) были разделены на группы по 2 мыши в каждой группе. Животные, относящиеся к одной и той же группе, находились в одной клетке. Группы получали диеты, перечисленные в таблице 4. Основные различия между диетами заключались в белковом компоненте и содержании Phe, как показано в таблице 5. Перед исследованием кормления мышей с PKU кормили, используя стандартные для мышей рационы. Исследование кормления продолжалось на протяжении 28 дней, в течение которых животным давали пищу и воду неограниченно.
Таблица 4: Группы животных и диеты для животных (N=6)
Таблица 5: Диеты для животных
«Диета на основе белка GSP105 без Phe» или «диета на основе GSP105 без Phe» относится к диете, в которой единственным источником аминокислот является рекомбинантный диетический белок GSP105, дополненный 0,2% Phe. Диета на основе белка GSP105 без Phe не была полностью свободной от Phe. Очищенная фракция белка GSP105 содержала небольшое количество примеси, вероятно, вследствие следов среды или вторичных метаболитов, которое составляло 0,45 г Phe на 100 г общего белка. Сам белок GSP105 был полностью свободен от Phe. Незначительная примесь Phe не создавала каких-либо проблем для мышей с PKU. Более того, поскольку Phe является незаменимой аминокислотой, и животным не было предоставлено альтернативных источников питательных веществ, кристаллический Phe добавляли к диете на основе белка GSP105 без Phe до конечной концентрации Phe, составляющей 0,2%.
«Аминокислотная диета без Phe» относится к диете, в которой единственным источником аминокислот является смесь свободных аминокислот без Phe, но с 1,5% Tyr, которая напоминает современный стандарт в медицинских пищевых продуктах для пациентов с PKU. Аминокислотная диета без Phe не содержала совсем Phe, в то время как содержание тирозина было увеличено до 1,5%.
В «стандартном для мышей рационе» единственным источником белка был казеин.
В дни 0, 1, 7, 14, 21 и 28 отбирали 5-10 мкл крови из хвостовой вены животных после голодания в течение 4 часов. Содержание Phe и тирозина в плазме крови определяли с помощью тандемной масс-спектрометрии.
В дни 0, 1, 2, 4 и 7 мышей взвешивали и проверяли их общее состояние здоровья.
В дни 14, 21 и 28 мышей только взвешивали. В день 28 все животные были умерщвлены с помощью СО2. Печень, почки, головной мозг и сердце каждого животного собирали и замораживали в жидком азоте для дальнейших анализов.
Результаты:
Вес тела
Получение стандартного для мышей рациона в принципе приводило к сохранению веса (фиг. 1, сплошные линии с квадратами). При получении диеты на основе белка GSP105 без Phe мыши с PKU набирали вес (фиг. 1, пунктирные линии с кружками), в то время как те мыши, которые получали аминокислотную диету без Phe, продемонстрировали небольшую потерю веса (фиг. 1, разорванные линии с треугольниками). Хотя небольшой размер группы не позволил провести статистический анализ, наблюдаемая тенденция поддерживает GSP105 в качестве белкового компонента, подходящего для сохранения веса и/или увеличения веса. Наблюдаемое увеличение веса может быть связано с тем, что это диетический белок с более высокой биологической ценностью, чем казеин.
Снижение уровней Phe в крови
Мыши с PKU на стандартном для мышей рационе сохраняли повышенный средний уровень Phe в крови (фиг. 2, сплошная линия с квадратами). Аминокислотная диета без Phe привела к резкому снижению средних уровней Phe в крови (<360 микромолей на литр, физиологический диапазон, на который нацелено лечение PKU) (фиг. 2, разорванная линия с треугольниками). Средние уровни Phe в крови животных на диете на основе белка GSP105 без Phe также были явно снижены, достигая <360 микромолей на литр через 28 дней (фиг. 2, пунктирная линия с кружками). Эти результаты указывают на то, что раскрытый рекомбинантный диетический белок пригоден для диетотерапии PKU.
Не подвергнутые лечению мыши с PKU с генетическим фоном C57BL/6 имеют коричневый окрас шерсти в отличие от черного окраса шерсти, наблюдаемого у мышей дикого типа с тем же фоном, явление, называемое гипопигментацией. Повышенные уровни Phe в крови ингибируют фермент тирозиназу, который нарушает синтез пигмента меланина. Понижение уровней Phe в крови мышей, которые получали диеты, не содержащие Phe или имеющие низкое содержание Phe, приводило не к полностью полной, а к частичной реверсии гипопигментации на всем теле животных (фиг. 3). На фиг. 3 продемонстрированы типичные мыши из каждой группы диеты с дифференциально выраженными, более или менее частичными изменениями гипопигментации шерсти мыши после 28 дней кормления. Каждая мышь показана со стороны спины и с брюшной стороны. Мыши, которые получали диету на основе белка GSP105 без Phe, имели почти полностью черный окрас с брюшной стороны. Черные и белые стрелки указывают на наибольшую реверсию гипопигментации после периода кормления. Авторы настоящего изобретения допускают полную реверсию окраса шерсти с коричневого на черный в случае диет без или с низким содержанием Phe в случае продолжительного периода кормления.
Отношения Phe/Tyr в плазме крови
К наименьшему отношению Phe/Tyr в плазме крови мышей с PKU приводила аминокислотная диета без Phe (фиг. 4, разорванные линии с треугольниками), за которой следовала диета на основе белка GSP105 без Phe (фиг. 4, пунктирные линии с кружками). Мыши с PKU на стандартном для мышей рационе представлены на фиг. 4 в виде сплошных линий с квадратами в качестве контроля. Отношение Phe/Tyr в случае диеты на основе белка GSP105 без Phe можно было бы улучшить, уменьшив количество примеси Phe в очищенном рекомбинантном диетическом белке GSP105 и/или добавив кристаллический тирозин, используемый в аминокислотной диете без Phe, или добавив дизайнерский хвост, содержащий тирозин.
Пример 4 - Измерение концентраций Phe и Tyr в головном мозге мышей с PKU из примера 3
Методы:
Подготовка ткани головного мозга мыши
Использовали головной мозг животных из примера 3. Цельнозамороженный головной мозг мыши размораживали на льду и лизировали в буфере для гомогенизации (10 мкл/мг ткани), содержащем 50 мМ Трис-HCl, pH 7,5, 0,1 мМ KCl, 1 мМ EDTA, 1 мМ дитиотреитол, 0,2 мМ фенилметилсульфонилфторид, 1 мкМ лейпептин и 1 мкМ пепстатин, и гомогенизировали с использованием Quiagen TissueLyser II при 4°C. После центрифугирования при 13000хg и 4°C в течение 30 минут супернатанты хранили замороженными при -80°C.
Измерение белка
Концентрации белка в гомогенизированных тканях определяли спектрофотометрическим методом, описанным Брэдфордом, с использованием γ-глобулина в качестве калибратора.
Приготовление и дериватизация образцов
Образцы готовили в соответствии с руководством Phenomenex EZ:faast™, со следующими модификациями: перед экстракцией и дериватизацией аминокислот по 20 мкл каждого раствора внутреннего стандарта, содержащего 100 мкмоль/л Phe-d5 и 20 мкмоль/л Tyr-d4 (в 50 ммоль/л HCl), добавляли к 40 мкл лизата образца. Используя реагенты из набора, аминокислоты подвергают дериватизации с использованием пропилхлорформиата, что приводит к добавлению пропилформиата в аминный фрагмент и пропильной группы в карбоксильный конец аминокислот, соответственно. Гидроксигруппу Tyr также дериватизируют путем добавления пропилформиатной группы.
Оборудование
Для разделения аминокислот с помощью HPLC c обращенной фазой использовали колонку C18 размером 250×2 мм (Phenomenex EZ:faast™). Дериватизированные аминокислоты разделяли, используя следующую программу: (i) изократический поток 75% растворителя B в течение 6 минут; (ii) линейный градиент от 75% до 95% растворителя B (объем/объем) в течение 9 мин; (iii) линейный градиент от 95% до 100% растворителя B в течение 0,1 мин; (iv) изократический поток 100% растворителя B в течение 3 мин; (v) линейный градиент от 100% до 75% растворителя B в течение 0,1 мин; (vi) изократический поток 75% растворителя B в течение 2 мин. Растворители A и B представляли собой 10 ммоль/л формиата аммония в H2O и 10 нмоль/л формиата аммония в метаноле соответственно. Скорость потока составляла 150 мкл/мл, а объем впрыска составлял 10 мкл. Для анализа с помощью LC-ESI-MSMS использовалась система PerkinElmer SCIEX API 2000 LC-ESI-MSMS, оснащенная автодозатором PerkinElmer Series 200 и двумя микронасосами PerkinElmer Series 200. Аминокислоты получали, используя режим определения положительных ионов в режиме мониторинга множественных реакцией (MRM), со следующими переходами: 294→206 (Phe), 299→211 (Phe-d5), 302→214 (Phe-d8), 396→308 (Tyr) и 400→312 (Tyr-d4). Время выдержки составило 500 мс. Масс-спектры получали в интервале времени от 6 до 20 мин.
Результаты:
Снижение уровня Phe в головном мозге
На фиг. 5 представлены средние концентрации Phe и Tyr в головном мозге мышей дикого типа (WT) и страдающих PKU мышей, получавших стандартный для мышей рацион, диету на основе белка GSP105 без Phe или аминокислотную диету без Phe.
Средние концентрации аминокислот фенилаланина и тирозина в головном мозге мышей дикого типа (WT) были примерно одинаковыми (0,31 нмоль Phe/мг белка; 0,36 нмоль Tyr/мг белка) (фиг. 5), что напоминало ситуацию у здоровых людей.
Напротив, в средней концентрации Phe в головном мозге мышей с PKU, получавших стандартный для мышей рацион (группа 1), отмечалось 10-кратное увеличение (Phe 3,82 нмоль/мг белка) с низкой средней концентрацией Tyr, составляющей 0,18 нмоль/мг белка, что соответствует ситуации у не подвергнутых лечению пациентов с PKU.
Получение диеты на основе белка GSP105 без Phe (группа 2) привело к снижению средней концентрации Phe в головном мозге на 50% (Phe 1,78 нмоль/мг белка) по сравнению с получением стандартного для мышей рациона, в то время как средняя концентрация Tyr оставалась низкий (0,15 нмоль/мг белка).
Самый низкий средний уровень Phe в головном мозге и самый высокий средний уровень Tyr в головном мозге были достигнуты при использовании аминокислотной диеты без Phe в группе 3 (Phe 1,16 нмоль/мг белка; 0,22 нмоль/мг белка).
Результаты анализа концентраций Phe и Tyr в головном мозге мышей WT, а также подвергнутых и не подвергнутых лечению мышей с PKU были сопоставимы с соответствующими уровнями Phe и Tyr в крови у различных групп кормления животных (фиг. 2 и 4).
Самое сильное снижение концентрации Phe в головном мозге было получено в случае аминокислотной диеты без Phe. Принимая во внимание, что влияние диеты с низким содержанием Phe на уровни Phe в головном мозге отсрочено и не так резко, как влияние на концентрацию Phe в крови, авторы настоящего изобретения допускают дальнейшее снижение Phe в головном мозге в течение длительного периода кормления с использованием диеты на основе белка GSP105 без Phe. Эта гипотеза основана на наблюдении, что уровни Phe в крови в этой группе приблизительно соответствовали концентрациям Phe в крови у мышей, которые получали аминокислотную диету без Phe, после периода кормления, составляющего 28 дней.
Среднее отношение Phe/Tyr в головном мозге
На фиг. 6 представлены средние отношения Phe/Tyr в головном мозге мышей WT и страдающих PKU мышей, получавших стандартный для мышей рацион, диету на основе белка GSP105 без Phe или аминокислотную диету без Phe.
К наименьшему отношению Phe/Tyr в головном мозге мышей с PKU приводила аминокислотная диета без Phe (фиг. 6, столбец с ромбоидальными шашечками), за которой следовала диета на основе GSP105 без Phe (фиг. 6, столбец с диагонально расположенными полосками). Мыши с PKU на стандартном для мышей рационе представлены на фиг. 6 в виде белого столбца с черной рамкой. Указанное выше отношение Phe/Tyr значительно лучше, чем у мышей с PKU на стандартном рационе. Диета на основе белка GSP105 без Phe могла бы быть улучшена путем уменьшения количества примеси Phe из очищенного рекомбинантного диетического белка GSP105 и/или путем добавления кристаллического тирозина, используемого в аминокислотной диете без Phe, или добавления содержащего тирозин дизайнерского хвоста.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MetaX Institut fuer Diaetetik GmbH
<120> НЕ СОДЕРЖАЩИЙ ФЕНИЛАЛАНИНА БЕЛОК ДЛЯ ЛЕЧЕНИЯ PKU
<130> M10927WO/RN
<150> 16186895.5
<151> 1 September 2016
<160> 7
<170> Патент в версии 3.5
<210> 1
<211> 168
<212> Белок
<213> Bacillus subtilis
<400> 1
Met Ala Leu Thr Lys Glu Gln Thr Gln His Leu Tyr His Lys Leu Leu
1 5 10 15
Asp Met Gln Lys Glu Leu Ser Gly Glu Lys Lys Glu Thr Glu Ser Met
20 25 30
Thr Glu Glu Val Gly Glu Leu Ser Asn Gly Val Asp Asn His Met Ala
35 40 45
Asp His Gly Thr Leu Val Thr Asp Arg Met Thr Asp Gln Thr Val Lys
50 55 60
Glu Ile Asp Arg Glu Leu Leu Glu Glu Val Asn Arg Ala Leu Gln Lys
65 70 75 80
Met Lys Asp Gly Thr Tyr Gly Val Cys Glu Lys Thr Gly Gln Glu Ile
85 90 95
Pro Tyr Glu Arg Leu Glu Ala Val Pro Tyr Ala Arg Met Thr Val Glu
100 105 110
Ala Gln Ala Asp Val Glu Asp Asp Leu Glu Thr Asp Ala Pro Ser Tyr
115 120 125
Glu Arg Glu Phe His Glu Gln Val Lys Asp Leu Ser Asn Lys Glu Thr
130 135 140
Ile Asp Gln Lys Ser Ser Gln Thr Tyr Glu Ile Leu Asp Arg Glu Gln
145 150 155 160
Asp Ser Lys Ala Ala Ala Ser Arg
165
<210> 2
<211> 168
<212> Белок
<213> Искусственная последовательность
<220>
<223> GSP105
<400> 2
Met Ala Leu Thr Lys Glu Gln Thr Gln His Leu Tyr His Lys Leu Leu
1 5 10 15
Asp Met Gln Lys Glu Leu Ser Gly Glu Lys Lys Glu Thr Glu Ser Met
20 25 30
Thr Glu Glu Val Gly Glu Leu Ser Asn Gly Val Asp Asn His Met Ala
35 40 45
Asp His Gly Thr Leu Val Thr Asp Arg Met Thr Asp Gln Thr Val Lys
50 55 60
Glu Ile Asp Arg Glu Leu Leu Glu Glu Val Asn Arg Ala Leu Gln Lys
65 70 75 80
Met Lys Asp Gly Thr Tyr Gly Val Cys Glu Lys Thr Gly Gln Glu Ile
85 90 95
Pro Tyr Glu Arg Leu Glu Ala Val Pro Tyr Ala Arg Met Thr Val Glu
100 105 110
Ala Gln Ala Asp Val Glu Asp Asp Leu Glu Thr Asp Ala Pro Ser Tyr
115 120 125
Glu Arg Glu Trp His Glu Gln Val Lys Asp Leu Ser Asn Lys Glu Thr
130 135 140
Ile Asp Gln Lys Ser Ser Gln Thr Tyr Glu Ile Leu Asp Arg Glu Gln
145 150 155 160
Asp Ser Lys Ala Ala Ala Ser Arg
165
<210> 3
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> эпитоп из Tag54
<400> 3
Lys Asp Trp Glu His Leu
1 5
<210> 4
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Tag54 с заменой Phe-->Ala
<400> 4
Lys His Ile Lys Asp Trp Glu His Leu Glu Glu Ala
1 5 10
<210> 5
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Tag54 с заменой Phe-->Tyr
<400> 5
Lys His Ile Lys Asp Trp Glu His Leu Glu Glu Tyr
1 5 10
<210> 6
<211> 186
<212> Белок
<213> Искусственная последовательность
<220>
<223> GSP105-6His-Tag54P15
<400> 6
Met Ala Leu Thr Lys Glu Gln Thr Gln His Leu Tyr His Lys Leu Leu
1 5 10 15
Asp Met Gln Lys Glu Leu Ser Gly Glu Lys Lys Glu Thr Glu Ser Met
20 25 30
Thr Glu Glu Val Gly Glu Leu Ser Asn Gly Val Asp Asn His Met Ala
35 40 45
Asp His Gly Thr Leu Val Thr Asp Arg Met Thr Asp Gln Thr Val Lys
50 55 60
Glu Ile Asp Arg Glu Leu Leu Glu Glu Val Asn Arg Ala Leu Gln Lys
65 70 75 80
Met Lys Asp Gly Thr Tyr Gly Val Cys Glu Lys Thr Gly Gln Glu Ile
85 90 95
Pro Tyr Glu Arg Leu Glu Ala Val Pro Tyr Ala Arg Met Thr Val Glu
100 105 110
Ala Gln Ala Asp Val Glu Asp Asp Leu Glu Thr Asp Ala Pro Ser Tyr
115 120 125
Glu Arg Glu Trp His Glu Gln Val Lys Asp Leu Ser Asn Lys Glu Thr
130 135 140
Ile Asp Gln Lys Ser Ser Gln Thr Tyr Glu Ile Leu Asp Arg Glu Gln
145 150 155 160
Asp Ser Lys Ala Ala Ala Ser Arg His His His His His His Lys His
165 170 175
Ile Lys Asp Trp Glu His Leu Glu Glu Ala
180 185
<210> 7
<211> 558
<212> ДНК
<213> Искусственная последовательность
<220>
<223> G105-6His-Tag54-P15 (B. subtilis)
<400> 7
atggcactga caaaagaaca aacgcaacat ctgtatcata aactgcttga catgcaaaaa 60
gaactgagcg gagaaaagaa agaaacggaa tcaatgacag aagaagtcgg tgaattaagc 120
aatggcgtag ataaccatat ggccgatcat ggcacattgg ttacggatcg tatgacagac 180
caaacggtga aagaaattga tagagaactg cttgaagaag tcaatcgcgc attacaaaaa 240
atgaaagatg gcacatatgg agtatgcgaa aaaacgggtc aggaaatccc gtatgaacgt 300
ttagaagcgg tcccttacgc tcggatgaca gttgaagccc aagcagatgt ggaagatgac 360
ttggaaacgg acgcaccgtc ttatgaacgc gaatggcatg aacaggtgaa agatctgtcc 420
aacaaagaaa caattgacca aaaatcaagc cagacgtacg aaatccttga tagagaacag 480
gactctaaag cggccgcttc tagacatcat catcatcatc ataaacatat caaagactgg 540
gaacatctgg aagaagcc 558
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЛИКОЗИЛИРОВАННЫЕ СЛИТЫЕ БЕЛКИ VWF С УЛУЧШЕННОЙ ФАРМАКОКИНЕТИКОЙ | 2017 |
|
RU2782212C2 |
| РЕКОМБИНАНТНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2778346C2 |
| ПОЛИПЕПТИДЫ, МОДУЛИРУЮЩИЕ SIGLEC-ЗАВИСИМЫЕ ИММУННЫЕ ОТВЕТЫ | 2017 |
|
RU2776807C2 |
| АНТИ-HLA-G АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797724C2 |
| РЕКОМБИНАНТНЫЕ ВИРУСНЫЕ ЧАСТИЦЫ С МОДИФИЦИРОВАННЫМ ТРОПИЗМОМ И ПУТИ ИХ ПРИМЕНЕНИЯ ДЛЯ НАЦЕЛЕННОГО ВВЕДЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА В КЛЕТКИ ЧЕЛОВЕКА | 2018 |
|
RU2811426C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2014 |
|
RU2792932C2 |
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
| СВЯЗЫВАЮЩИЙ RGMa БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2809500C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ГЕПАТИТА, ФИБРОЗА ПЕЧЕНИ И ЦИРРОЗА ПЕЧЕНИ, ВКЛЮЧАЮЩАЯ СЛИТЫЕ БЕЛКИ | 2017 |
|
RU2795548C2 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2811991C2 |
Изобретение относится к биотехнологии и представляет собой рекомбинантный диетический белок, включающий полипептидную последовательность, которая на по крайней мере 90% идентична последовательности SEQ ID NO:2, для лечения нарушения, характеризующегося накоплением фенилаланина в организме индивидуума, причем указанный белок содержит (i) все из гистидина, аргинина, изолейцина, лейцина, лизина, метионина, треонина, триптофана и валина и не содержит фенилаланин. Диетический белок является белком с высокой биологической ценностью и может быть использован в качестве лекарственного средства для лечения нарушения, характеризующегося накоплениями фенилаланина в организме. 7 н. и 8 з.п. ф-лы, 6 ил., 5 табл., 4 пр.
1. Рекомбинантный диетический белок, включающий полипептидную последовательность, которая на по крайней мере 90% идентична последовательности SEQ ID NO:2, для лечения нарушения, характеризующегося накоплением фенилаланина в организме индивидуума, причем указанный белок содержит (i) все из гистидина, аргинина, изолейцина, лейцина, лизина, метионина, треонина, триптофана и валина, и не содержит фенилаланин.
2. Рекомбинантный диетический белок по п. 1, в котором указанная полипептидная последовательность идентична на по крайней мере 95%, предпочтительно 97%, более предпочтительно 98% последовательности SEQ ID NO:2.
3. Рекомбинантный диетический белок по п. 1 или 2, который включает метки для очистки или метку.
4. Рекомбинантный диетический белок по п. 3, в котором метка включает аминокислотную последовательность SEQ ID NO:3.
5. Экспрессионный вектор, включающий последовательность нуклеиновой кислоты, кодирующую рекомбинантный диетический белок по любому из пп. 1-4.
6. Рекомбинантный микроорганизм, содержащий вектор по п. 5, для получения рекомбинантного диетического белка по любому из пп. 1-4.
7. Рекомбинантный микроорганизм по п. 6, причем микроорганизм выбирают из группы, состоящей из Escherichia, Klebsiella, Pseudomonas, Xanthomonas, Bacillus, Staphylococcus, Saccharomyces, Corynebacterium, Streptomyces, Salmonella, Aspergillus, Gluconobacter, Mycobacterium, Actinomycetes, Caulobacter, Pichia, Corynebacterium glutamicum, Saccharomyces cerevisiae, Clostridium botulinum, Flavobacterium heparinum, Lactococcus lactis, Methylobacterium extorquens, Pseudoalteromonas haloplanktis, Ralstonia eutropha, Neurospora crassa, Arxula adeninivorans, Hansenula polymorpha, Kluyveromyces lactis, Zygosaccharomyves bailii, Pseudomonas fluorescens, Bacillus subtilis и Bacillus megaterium.
8. Рекомбинантный микроорганизм по п. 7, причем указанным микроорганизмом является микроорганизм рода Bacillus или Pseudomonas.
9. Рекомбинантный микроорганизм по п. 8, причем указанный микроорганизм представляет собой Bacillus subtilis или Pseudomonas fluorescens.
10. Способ продуцирования рекомбинантного диетического белка по любому из пп. 1-4, при этом способ включает культивирование рекомбинантного микроорганизма по любому из пп. 6-9 в условиях, подходящих для продукции диетического белка рекомбинантным микроорганизмом.
11. Диетическая композиция, содержащая рекомбинантный диетический белок по любому из пп. 1-4 и дополнительные наполнители.
12. Диетический белок по любому из пп. 1-4, содержащий не более 0,45 г фенилаланина на 100 г белка, или диетическая композиция по п. 11, содержащая не более 0,1 г фенилаланина на 100 г белка.
13. Применение диетического белка по любому из пп. 1-4 или диетической композиции по п. 11 в качестве лекарственного средства.
14. Применение диетического белка по любому из пп. 1-4 или диетической композиции по п. 11 при лечении нарушения, характеризующегося накоплением фенилаланина в организме.
15. Применение по п. 14, где указанным нарушением является гиперфенилаланинемия, предпочтительно оксифенилкетонурия.
| WO 2013148332 A1, 03.10.2013 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| RU 2014140814, 27.04.2016. | |||
Авторы
Даты
2022-01-21—Публикация
2017-08-30—Подача