Изобретение относится к области органической химии, а именно к биологически активным 4-((гет)ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-онам формулы:
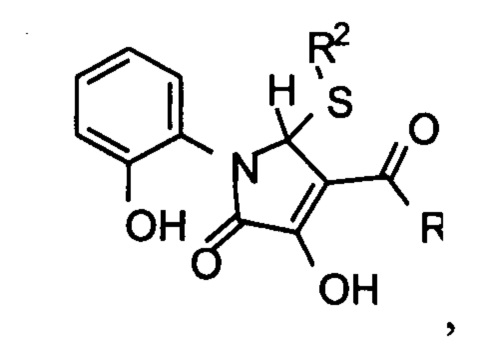
обладающим противотуберкулезной активностью, что позволяет предположить их использование в фармакологии и в медицине в качестве лекарственных средств с противотуберкулезным эффектом.
Известен структурный аналог заявленных соединений - Sudoterb (LL-3858), обладающий высокой противотуберкулезной активностью in vitro и in vivo (продолжаются доклинические исследования).
Эталонами сравнения противотуберкулезной эффективности выбраны противотуберкулезный препарат изониазид [Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции // Инфекции и антимикробная терапия. - 2001. - №.5. - С. 105-155], широко применяющийся в лечебной практике.
Задачей изобретения является поиск в ряду производных 4-(ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-онов веществ с выраженным противотуберкулезным действием и расширение арсенала средств воздействия на живой организм.
Поставленная задача достигается получением 4-((гет)ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-онов, которые обладают противотуберкулезной активностью.
Заявляемые соединения синтезируют путем взаимодействия 3-(гет)ароил-2,4-дигидро-1H-пирроло[2,1-с][1,4]бензоксазин-1,2,4-трионов (I а-с) с тиолами (II а-с) в соотношении 1:1 в среде безводного растворителя с последующим добавлением 5 экв Н2О и выделением целевых продуктов (III a-d) по представленной схеме:
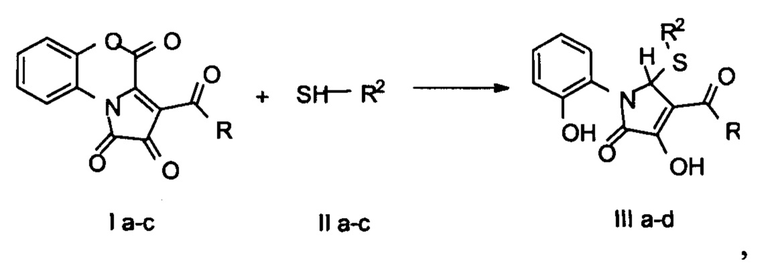
где R = 2-фурил(а), 4-C6H3Cl (b), Ph (с); R2 = Ph (a), Bn (b), СН2СН2ОН (с).
Процесс ведут при кипячении, а в качестве растворителя используют безводный ацетонитрил.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 4-(фуран-2-карбонил)-3-гидрокси-1-(2-гидроксифенил)-5-(фенилтио)-1,5-дигидро-2H-пиррол-2-она (IIIa).
К раствору 1.0 ммоль 3-(фуран-2-карбонил)-1H-бензо[b]пирроло[1,2-d] [1,4]оксазин-1,2,4-триона (Ia) в 2 мл безводного ацетонитрила добавляли 1.0 ммоль тиофенола (IIa). Реакционную массу кипятили в течение 2 минут. Добавляли 5.0 ммоль воды, образовавшийся спустя сутки осадок отфильтровывали. Выход 55%, т.пл. 185-187°С. Соединение (IIIa) C21H15NO5S.
Найдено, %:
Вычислено, %: С 64.11; Н 3.84; N 3.56; О 20.33; S 8.15.
Соединение (IIIa) - оранжевое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, трудно растворимое в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIa), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидроксильных групп гидроксифенила и пиррол-2-она 3250, 3045 см-1, карбонильных групп пиррол-2-она и фуран-2-карбонила 1698, 1636 см-1.
Спектр ЯМР 1Н (400 МГц, DMSO-d6, δ, м.д.): 9.95 с (1Н), 8.02 дд (J=1.7, 0.8 Hz, 1Н), 7.34-7.28 м (3Н), 7.25-7.19 м (3Н), 7.10-7.05 м (2Н), 6.97-6.89 м (2Н), 6.74 дд (J=3.6, 1.7 Гц, 1Н), 6.49 с (1Н). Один сигнал ОН-группы невидим в спектре ЯМР 1Н.
Пример 2. Получение (4-(4-хлорбензоил)-3-гидрокси-1-(2-гидроксифенил)-5-(фенилтио)-1,5-дигидро-2Л-пиррол-2-она (IIIb).
К раствору 1.0 ммоль 3-(4-хлоробензоил)-1H-бензо[b]пирроло[1,2-d] [1,4]оксазин-1,2,4-триона (Ib) в 2 мл безводного ацетонитрила добавляли 1.0 ммоль тиофенола (IIa). Реакционную массу кипятили в течение 5 минут. Добавляли 5.0 ммоль воды, образовавшийся спустя сутки осадок отфильтровывали. Выход 60%, т.пл. 200-202°С. Соединение (IIIb) C23H16ClNO4S.
Найдено, %:
Вычислено, %: С 63.09; Н 3.68; Cl 8.10, N 3.20; S 7.32.
Соединение (IIIb) - желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, трудно растворимое в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIb), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидроксильных групп пиррол-2-она и гидроксифенила 3184, 3080 см-1, карбонильных групп пиррол-2-она и бензоила 1681, 1636 см-1.
Спектр ЯМР 1Н (400 МГц, DMSO-d6, δ, м.д.): 11.94 с (1Н), 9.97 с (1Н), 7.54-7.47 м (4Н), 7.43-7.32 м (2Н), 7.29-7.21 м (3Н), 7.13 дт (J=7.0, 1.3 Гц, 2Н), 7.00-6.91 м (2Н),6.44 с(1Н):
Пример 3. Получение 4-бензоил-5-(бензилтио)-3-гидрокси-1-(2-гидроксифенил)-1,5-дигидро-2H-пиррол-2-она (IIIc).
К раствору 1.0 ммоль 3-бензоил-1H-бензо[b]пирроло[1,2-d][1,4]оксазин-1,2,4-триона (Ic) в 2.мл безводного ацетонитрила добавляли 1.0 ммоль фенилметантиола (IIb). Реакционную массу кипятили в течение 5 минут. Добавляли 5.0 ммоль воды, образовавшийся, спустя сутки осадок отфильтровывали. Выход 80%, т.пл. 190-191°С. Соединение (IIIc) C24H19NO4S.
Найдено, %:
Вычислено, %: С 69.05; Н 4.59; N 3.36; О 15.33; S 7.68.
Соединение (IIIc) - кремовое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, трудно растворимое в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях
В ИК спектре соединения (IIIc), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидроксильных групп гидроксифенила и пиррол-2-она 3127, 3061 см-1, карбонильных групп пиррол-2-она и бензоила 1688, 1626 см-1.
Спектр ЯМР 1Н (400 МГц, DMSO-d6, δ, м.д.): 11.51 с (1Н), 9.98 с (1Н), 7.78 д (J=7.0, 1.4 Гц, 2Н), 7.63 т (J=7.4 Гц, 1Н), 7.51 т (J=7.7 Гц, 2Н), 7.32-7.23 м (2Н), 7.21-7.15 м (3Н), 7.06-7.01 м (3Н), 6.96-6.90 м (1Н), 6.19 с (1Н), 3.58 дд (J=12.5 Гц, 2Н).
Пример 4. Получение 4-бензоил-3-гидрокси-5-((2-гидроксиэтил)тио)-1-(2-гидроксифенил)-1,5-дигидро-2H-пиррол-2-она (IIId).
К раствору 1.0 ммоль 3-бензоил-1H-бензо[b]пирроло[1,2-d][1,4]оксазин-1,2,4-триона (Ic) в 2 мл безводного ацетонитрила добавляли 1.0 ммоль 2-меркаптоэтанола (IIc). Реакционную массу кипятили в течение 5 минут. Добавляли 5.0 ммоль воды, образовавшийся спустя сутки осадок отфильтровывали. Выход 65%, т.пл. 198-200°С. Соединение (IIId) C19H17NO5S.
Найдено, %:
Вычислено, %: С 61.44; Н 4.61; N 3.77; О 21.54; S 8.63.
Соединение (IIId) - желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, трудно растворимое в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях
В ИК спектре соединения (IIId), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидроксильных групп гидроксифенила и пиррол-2-она 3131, 3068 см-1, карбонильных групп пиррол-2-она и бензоила 1686, 1630 см-1.
Спектр ЯМР 1Н (400 МГц, DMSO-d6, δ, м.д.): 11.86 с (1Н), 9.93 с (1Н), 7.86 дд (J=7.6, 2.1 Гц, 2Н), 7.67-7.61 м (1Н), 7.54 т (J=7.4 Гц, 2Н), 7.31 дд (J=7.8, 1.7 Гц, 1Н), 7.26-7.20 м (1Н), 7.00 дд (J=8.2, 1.4 Гц, 1Н), 6.92 тд (J=7.6, 1.4 Гц, 1Н), 6.16 с (1Н), 3.36-3.24 м (2Н), 2.38 тд (J=6.9, 2.2 Гц, 2Н). Один сигнал ОН-группы невидим в спектре ЯМР 1Н.
Пример 5. Фармакологическое исследование 4-((гет)ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-онов (IIIa-d) на наличие противотуберкулезной активности.
Для изучения бактерицидной активности химических соединений IIIa-d в отношении микобактерий туберкулеза штамма H37Rv использовали стандартную радиометрическую ростовую систему ВАСТЕС MGIT 960 (Becton Dickinson) [Journal of Medicinal Chemistry. - 2000. - №17. - P. 3304-3314; Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ: учеб. пособие для послевуз. проф. образования врачей; Р.У. Хабриева (ред)., Медицина, Москва (2005)].
Исследуемые вещества в количестве 10 мг растворяли в 1 мл «Диметилсульфоксида», после чего добавляли 9 мл бульона Мидлбрук 7Н9, тем самым получая исходный раствор в 1,0 мг/мл. После чего добавляли в экспериментальные пробирки MGIT в количествах, обеспечивающих получение конечной концентрации от 100 до 1,0 мкг/мл, используя двукратные разведения, в двух повторностях. В пробирках MGIT содержалось по 7 мл стерильного питательного бульона Мидлбрук 7Н9. В каждую пробирку вносили по 0,8 мл обогатительной добавки ВАСТЕС MGIT OADC (олеиновая кислота, альбумин, декстроза и каталаза). Кроме жидкой среды в пробирке содержался бескислородный флюорохром - пентагидрат трис-4,7-дифенил-1,10-фенантролин хлорид рутения, помещенный на дно пробирки и покрытый силиконом.
Из культуры М. Tuberculosis штамм H37Rv готовили бактериальную суспензию, которая была стандартизирована по оптическому стандарту мутности №5 (500 млн микробных тел в 1 мл) с использованием денситометра. Далее готовили раствор путем разведения исходной суспензии в 10 раз стерильным физиологическим раствором, таким образом получена 5×107 микробных тел в 1 мл. Затем суспензию микобактерий туберкулеза в количестве 0,5 мл добавляли в каждую из исследуемых пробирок MGIT. Параллельно инокулят культуры микобактерий туберкулеза в количестве 105 высевали в контрольные пробирки MGIT со средой Мидлбрук 7Н9 по 0,5 мл без содержания химических соединений. Для сравнения проводили аналогичные исследования с туберкулостатиком первого ряда - изониазидом.
Все пробирки инкубировали при температуре 37°С градусов с последующим анализом. Если тестируемое вещество активно по отношению к выделенным микобактериям, оно будет ингибировать рост и подавлять флюоресценцию, при этом в контрольной пробирке рост не ингибируется и, соответственно, уровень флуоресцентности в данной пробирке будет выраженный.
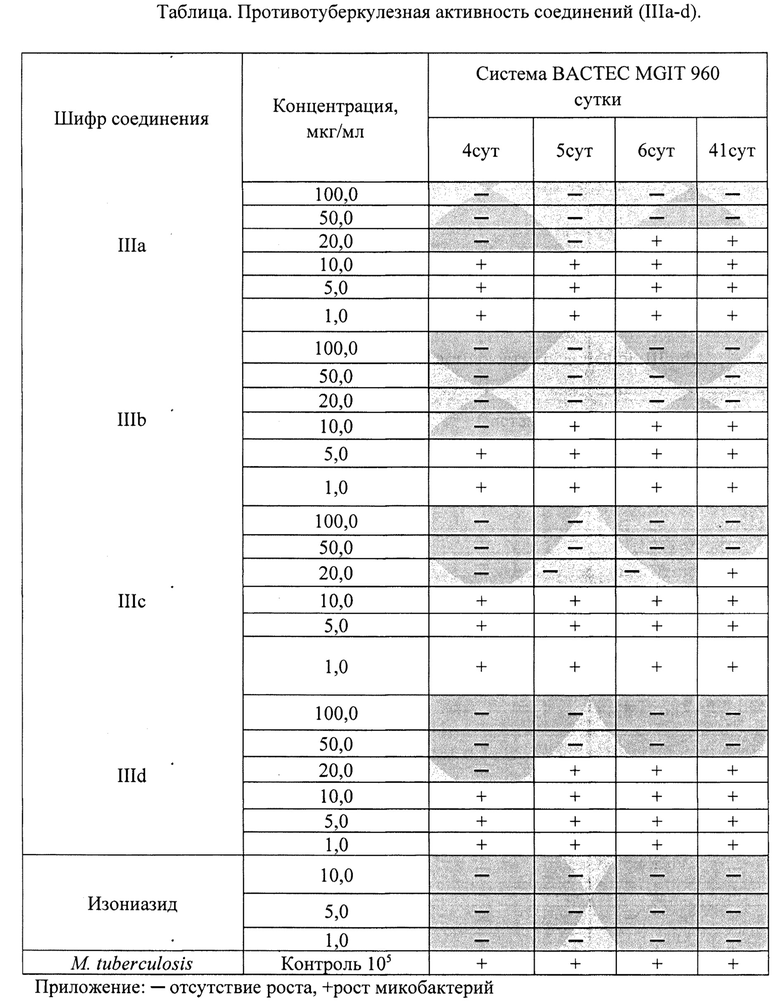
Исследуемые соединения с различными концентрациями были помещены в ВАСТЕС MGIT 960, который регистрировал наличие или отсутствие роста микобактерий ежедневно в течение 41 дня. В процессе определения происходило сравнение скорости роста М. tuberculosis - в контрольной пробирке и в пробирках с определенной концентрацией веществ.
Проведенные исследования показали (см. таблицу), что соединения IIIa,c,d оказывают губительное действие на бактерии М. tuberculosis в концентрации 50,0 мкг/мл в течение всего инкубационного времени - 41 день. Соединение IIIb в концентрации 20,0 мкг/мл полностью убивает рост возбудителя туберкулеза, отсутствие роста культуры сохраняется в течение всего инкубационного времени в течение 41-го дня
Заявляемые ранее неописанные в литературе 4-((гет)ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-оны могут найти применение в фармакологии в качестве потенциальных лекарственных средств с противотуберкулезными свойствами.
Изобретение относится к применению 4-((гет)ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-онов общей формулы I, где R=2-фурил (а), 4-C6H5Cl (b), Ph (с); R2=Ph (a), Bn (b), СН2СН2ОН (с), в качестве противотуберкулезного средства. Технический результат: разработка противотуберкулезного средства. 1 табл., 5 пр.
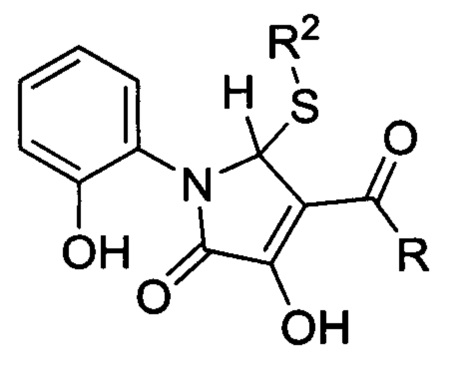 I
I
Применение 4-((гет)ароил)-3-гидрокси-1-(2-гидроксифенил)-5-(R2-тио)-1,5-дигидро-2H-пиррол-2-онов общей формулы:
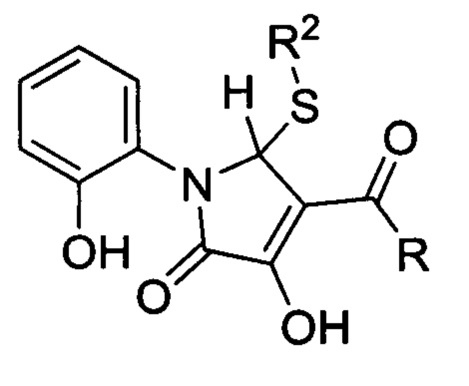 ,
,
где R=2-фурил (а), 4-C6H5Cl (b), Ph (с); R2=Ph (a), Bn (b), СН2СН2ОН (с), в качестве противотуберкулезного средства.
| Y.-Q | |||
| Hu et al | |||
| Isoniazid derivatives and their anti-tubercular activity | |||
| European Journal of Medicinal Chemistry, 2017, vol | |||
| Топочная решетка для многозольного топлива | 1923 |
|
SU133A1 |
| WO 2014037900 A1, 13.03.2014 | |||
| WO 2004026828 A1, 01.04.2004 | |||
| 3-ТРИАЗЕНОИНДОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ПРОТИВ МИКОБАКТЕРИЙ | 2016 |
|
RU2724334C1 |
| Изоляционно-папильонажный стаканчик | 1931 |
|
SU28076A1 |
Авторы
Даты
2022-03-17—Публикация
2021-05-24—Подача