ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к белковым каркасам с новыми характеристиками, включая возможность связывания с клеточными мишенями. Более конкретно, настоящее изобретение относится к белковому каркасу, основанному на консенсусной последовательности повтора фибронектина типа III (FN3).
Описание области применения
Когда необходимо добиться высокой аффинности и специфичности к молекуле-мишени, наиболее широко используется класс терапевтических белков - моноклональные антитела. Однако для биофармацевтической промышленности большой интерес также представляет конструирование не являющихся антителами белков, которые способны связываться с такими мишенями. Данные «альтернативные белковые» каркасы могут иметь преимущества перед традиционными антителами в связи с малым размером, отсутствием дисульфидных связей, высокой стабильностью и возможностью экспрессирования в прокариотических клетках-хозяевах. Для их очистки активно используют новые способы; они легко соединяются с лекарственными средствами/токсинами, эффективно проникают в ткани, и их можно без труда использовать в качестве полиспецифических связующих веществ (Skerra, 2000, J Mol Recognit 13(4): 167-87; Binz and Pluckthun, 2005, Curr Opin Biotechnol 16(4): 459-69).
Одним из таких альтернативных белковых каркасов является укладка цепи иммуноглобулинов (Ig). Данная укладка цепи встречается в вариабельных участках антител, а также в тысячах белков, не являющихся антителами. Исследования показывают, что один из таких белков Ig, десятый повтор фибронектина типа III (FN3) из фибронектина человека, может допускать ряд мутаций в поверхностных петлях при сохранении общей структуры укладки цепи Ig. Таким образом, в последовательности данных петель были встроены библиотеки аминокислотных вариантов, а также был проведен отбор специфических связующих веществ, выбранных для ряда разных мишеней (Koide et al., 1998, J Mol Biol 284(4): 1141-51; Karatan et al., 2004, Chem Biol 11(6): 835-44). Как было обнаружено, такие сконструированные домены FN3 связываются с мишенями с высокой аффинностью, сохраняя при этом свои важные биофизические характеристики (Parker et al., 2005. Protein Eng Des Sel 18(9): 435-44).
Желательные физические характеристики, которые должны иметь потенциальные альтернативные каркасные молекулы, включают в себя высокую термостабильность и обратимость термического свертывания и развертывания. Для повышения эффективной термостабильности белков и ферментов использовали несколько способов, включая детальный проект, основанный на сравнении с термостабильными последовательностями с высокой степенью сходства, конструирование стабилизирующих дисульфидных мостиков, создание мутаций для повышения склонности к образованию альфа-спирали, создание солевых мостиков, изменение поверхностного заряда белка, направленную эволюцию и изменение композиции консенсусных последовательностей (Lechmann and Wyss, 2001, Curr Opin Biotechnol 12(4): 371-5). Высокая термостабильность относится к числу желательных характеристик таких каркасов, поскольку она может увеличивать выход полученного рекомбинантного белка, повышать растворимость очищенной молекулы, повышать активность внутриклеточных каркасов, снижать иммуногенность и сводить к минимуму потребность в «холодовой цепи» при производстве.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет белковый каркас на основе белка с повтором фибронектина типа III (FN3), кодирующие или комплементарные нуклеиновые кислоты, векторы, клетки-хозяева, композиции, комбинации, составы, устройства и способы их получения и применения. В предпочтительном варианте осуществления белковый каркас содержит консенсусную последовательность множества доменов FN3 из тенасцина-C человека (в дальнейшем - «тенасцин»). В дополнительном предпочтительном варианте осуществления белковый каркас, составляющий предмет настоящего изобретения, представляет собой консенсусную последовательность 15 доменов FN3 (SEQ ID NO: 1-15) или ее вариант. В конкретном аспекте настоящего изобретения белковый каркас, составляющий предмет настоящего изобретения, имеет замещающие остатки, что повышает устойчивость каркасного белка к термической и химической денатурации. Белковые каркасы, составляющие предмет настоящего изобретения, можно сконструировать с использованием известных специалистам в данной области способов, включая вставку остатков в выбранных петлевых участках внутри каркаса, для получения связывающих доменов, селективных по отношению к партнеру по связыванию. Партнер по связыванию может представлять собой растворимую молекулу или закрепленную на клетке молекулу, например, внеклеточный домен рецепторного белка.
В одном варианте осуществления специфические замены остатков в консенсусной последовательности SEQ ID NO: 16 (Tencon), описанной в настоящем документе и выбранной за свойственную ей химическую и термостабильность, повышают термостабильность каркаса Tencon до 11°C и сдвигают среднюю точку индуцированной GdmCl денатурации с 3,4 М до более чем 5 М. В одном варианте осуществления специфические замены в последовательности SEQ ID NO: 16 (Tencon) являются одиночными, такие как N46V, E14P и E86I, тогда как в альтернативном варианте осуществления замены являются множественными, такие как N46V и E86I, все из замен E14P и N46V и E86I, а также все из замен L17A и N46V и E86I. Полипептиды на основе Tencon с повышенной стабильностью позволяют получить каркасы, допускающие более простые способы очистки, рецептуру и больший срок годности. Сконструированные партнеры по связыванию с повышенной общей стабильностью можно получить путем введения рандомизированных пептидов в петли стабилизированного каркаса.
Белковые каркасы, составляющие предмет настоящего изобретения, могут применяться в виде мономерных звеньев или быть связаны с получением полимерных структур с такой же или другой специфичностью к партнеру по связыванию. Молекулы на основе белковых каркасов Tencon можно дополнительно модифицировать для улучшения одной или более их характеристик in vivo, связанных с биораспределением, временем жизни в организме или терапевтической эффективностью, такой как способность ассоциироваться с молекулами, которые изменяют скорость поглощения клетками, в частности, клетками эпителия, например, участком Fc антитела или молекулами, выполненными с возможностью связывания с белками сыворотки, такими как альбуминсвязывающий домен. В дополнительных вариантах осуществления белковые каркасы, составляющие предмет настоящего изобретения, могут быть связаны с молекулой нуклеиновой кислоты, которая может кодировать белковый каркас.
Настоящее изобретение также представляет по меньшей мере один способ экспрессии по меньшей мере одного белкового каркасного полипептида, чья последовательность относится к консенсусной последовательности множества доменов FN3 в клетке-хозяине, включающий культивирование клетки-хозяина, как описано в настоящем документе в условиях, которые позволяют экспрессировать по меньшей мере один белковый каркас в количествах, допускающих детекцию и/или восстановление.
Настоящее изобретение также представляет по меньшей мере одну композицию, содержащую (a) белковый каркас на основе консенсусной последовательности множества доменов FN3 и/или кодирующей нуклеиновой кислоты, как описано в настоящем документе; и (b) пригодный и/или фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение дополнительно включает способ образования библиотек белкового каркаса на основе повтора фибронектина типа III (FN3), предпочтительно консенсусной последовательности множества доменов FN3, а более предпочтительно - консенсусной последовательности множества доменов FN3 тенасцина человека с повышенной химической и термостабильностью. Библиотеки можно образовать путем изменения аминокислотной композиции одной петли, одновременного изменения множества петель или дополнительных положений каркасной молекулы. Изменяемые петли можно соответствующим образом удлинить или укоротить. Такие библиотеки можно образовать так, чтобы они включали в себя все возможные аминокислоты в каждом положении или заданное подмножество аминокислот. Элементы библиотеки можно использовать для скрининга путем фенотипирования, такого как фенотипирование in vitro (ДНК, РНК, рибосомное фенотипирование и т.д.), дрожжевое, бактериальное и фаговое фенотипирование.
Белковые каркасы, составляющие предмет настоящего изобретения, обеспечивают улучшенные биофизические характеристики, такие как стабильность в условиях высокой осмотической силы и растворимость в высоких концентрациях. Домены каркасных белков не сшиты дисульфидными связями, что дает белкам возможность экспрессирования и сворачивания в системах, где отсутствуют ферменты, необходимые для образования дисульфидных связей, включая прокариотические системы, такие как E. coli, и в системах для транскрипции/трансляции in vitro, таких как система лизата ретикулоцитов кролика.
В дополнительном аспекте настоящее изобретение предоставляет способ образования каркасной молекулы, способной связываться с конкретной мишенью, включающий в себя пэннинг библиотеки каркаса, составляющей предмет настоящего изобретения, относительно мишени и выявление связующих веществ. В других связанных аспектах настоящее изобретение включает способы скрининга, которые можно использовать для образования или аффинного созревания белковых каркасов с желательной активностью, например, способных связываться с белками-мишенями с определенной аффинностью. Аффинного созревания можно достигнуть многократными итерационными циклами мутагенеза и селекции при помощи таких систем, как фаговое фенотипирование или фенотипирование in vitro. Мутагенез в ходе данного процесса может являться результатом сайтнаправленного мутагенеза по специфическим остаткам каркаса, неспецифического мутагенеза из-за ПЦР пониженной точности, перестановки в ДНК и/или комбинации данных способов. Настоящее изобретение дополнительно представляет любые изобретения, описанные в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Анализ очищенного Tencon методом ДСН-ПААГ, используя бис-трис-гель NuPAGE 4-12% (Invitrogen) и окрашивание Кумасси синим. N означает нативные условия, R - условия восстановления.
На фигуре 2 представлены результаты анализа кругового дихроизма Tencon в PBS.
На фигуре 3 представлены результаты анализа кругового дихроизма третьего домена FN3 из тенасцина и Tencon в PBS, в котором получили температуры плавления 54°C и 78°C соответственно.
На фигуре 4 представлена конструкция фагемидной плазмиды pTencon-pIX. Экспрессию стимулируют промотор Lac и секреция посредством сигнальной последовательности OmpA.
На фигуре 5 представлено, как myc-Tencon можно фенотипировать на фаге M13 с помощью твердофазного иммуноферментного анализа (ИФА), демонстрируя связывание фага с лунками, покрытыми анти-Myc, CNTO95, а также лунками без покрытия.
На фигуре 6 представлена схема, показывающая петлевую структуру третьего домена FN3 тенасцина человека.
На фигуре 7 представлены результаты скрининга с помощью твердофазного иммуноферментного анализа (ИФА) результатов селекции IgG, в котором отдельные клоны тестировали на связывание с биотинилированным IgG или биотинилированным HSA в качестве контроля.
На фигурах 8A-B представлены графики, показывающие индуцированную GdmCl денатурацию одиночных мутантов (A) и комбинаторных мутантов (B) по измерению флуоресценции с возбуждением на 280 нм и эмиссией на 360 нм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Сокращения
ADCC = антителозависимая клеточная цитотоксичность; CDC = комплементозависимая цитотоксичность; DSC = дифференциальная сканирующая калориметрия; ΔG = свободная энергия Гиббса; IgG = иммуноглобулин G; Tm = температура плавления.
Определения и объяснение терминологии
Термин «антитело» или «фрагмент антитела» означает антитела, продукты расщепления, указанные части и их варианты, включая без ограничений миметики антител или составные части антител, имитирующие структуру и/или функцию антитела или его указанного фрагмента либо части, включая без ограничений одноцепочечные антитела, однодоменные антитела, миниантитела, а также их фрагменты. Функциональные фрагменты включают в себя антигенсвязывающие фрагменты, которые обеспечивают связывание с представляющим интерес антигеном-мишенью. Например, фрагменты антитела, способные связываться с антигеном-мишенью или его участками, включая без ограничений фрагменты Fab (например, при расщеплении папаином), Fab' (например, при расщеплении пепсином и неполном восстановлении) и F(ab’)2 (например, при расщеплении пепсином), facb (например, при расщеплении плазмином), pFc’ (например, при расщеплении пепсином или плазмином), Fd (например, при расщеплении пепсином, неполном восстановлении и повторной агрегации), Fv или scFv (например, при помощи методов молекулярной биологии), включены в настоящее изобретение под термином «антитело». Антитело или фрагмент можно получить из любого млекопитающего, такого как без ограничений человек, мышь, кролик, крыса, грызун, примат, верблюд, коза или любая их комбинация, и они включают в себя выделенные антитела человека, примата, грызуна, млекопитающего, химерные, гуманизированные и/или CDR-привитые антитела, иммуноглобулины, продукты расщепления и другие указанные части и их варианты.
Термин «эпитоп» означает белковую детерминанту, способную специфически связываться с антителом, или сконструированный связывающий домен, такой как одна или более петель белков на основе каркасов. Эпитопы обычно состоят из химически активных поверхностно расположенных групп молекул, таких как аминокислотные или сахарные боковые цепи, а также обычно имеют специфическую трехмерную структуру, а также специфические зарядовые характеристики. Конформационные и неконформационные эпитопы различаются тем, что в присутствии денатурирующих растворителей теряется связывание с первыми, но не теряется связывание со вторыми. Конформационные эпитопы образуются в результате конформационного сворачивания молекулы-мишени, происходящего тогда, когда аминокислоты из разных участков линейной последовательности молекулы-мишени оказываются в трехмерном пространстве в непосредственной близости друг к другу. Такие конформационные эпитопы, как правило, распределены по внеклеточной стороне плазматической мембраны.
Используемые в настоящем документе термины «Fc», «Fc-содержащий белок» или «Fc-содержащая молекула» относятся к мономерным, димерным или гетеродимерным белкам, имеющим по меньшей мере домен CH2 и CH3 иммуноглобулина. Домены CH2 и CH3 могут образовывать по меньшей мере часть димерного участка белка или молекулы (например, антитела).
Используемый в настоящем документе термин «стабильность» относится к способности молекулы сохранять свернутое состояние в физиологических условиях, так чтобы сохранять по меньшей мере одну из своих обычных функциональных активностей, например, способность связываться с молекулой-мишенью, такой как цитокин или белок сыворотки. Измерение стабильности белка и лабильности белка можно рассматривать как один и тот же или как разные аспекты целостности белка. Белки чувствительны или «лабильны» к денатурации, вызванной нагревом, ультрафиолетовым или ионизирующим облучением, изменением осмолярности и pH при нахождении в жидком растворе, механической силой сдвига, вызванной фильтрованием через поры малого размера, ультрафиолетовым облучением, ионизирующим облучением, таким как гамма-облучение, химической или термической дегидратацией или любым другим воздействием или силой, которые могут привести к разрушению структуры белка. Стабильность молекулы можно определить стандартными способами. Например, стабильность молекулы можно определить путем измерения ее температуры теплового плавления («TM»). TM представляет собой температуру в градусах Цельсия (°C), при которой 1/2 молекул переходит в развернутое состояние. Как правило, чем выше TM, тем более стабильной является молекула. Помимо нагрева способность белка сохранять конкретную трехмерную структуру также можно изменять в зависимости от химического окружения.
Химическую денатурацию можно также измерить различными способами. Химический денатурирующий агент представляет собой агент с известной способностью разрушать нековалентные взаимодействия и ковалентные связи внутри белка, включая водородные связи, электростатические связи, Ван-дер-Ваальсовы силы, гидрофобные взаимодействия или дисульфидные связи. Химические денатурирующие агенты включают в себя гидрохлорид гуанидиния, тиоцианат гуанидиния, мочевину, ацетон, органические растворители (DMF, бензол, ацетонитрил), соли (сульфат аммония, бромид лития, хлорид лития, бромид натрия, хлорид кальция, хлорид натрия); восстановители (например, дитиотритол, бета-меркаптоэтанол, динитротиобензол, а также гидриды, такие как борогидрид натрия), неионные и ионные моющие средства, кислоты (например, соляная кислота (HCl), уксусная кислота (CH3COOH), галогензамещенные уксусные кислоты), гидрофобные молекулы (например, фосфолипиды), а также денатурирующие агенты направленного действия (Jain R.K и Hamilton A.D., Angew. Chem. 114(4), 2002). Количественная характеризация степени денатурации может основываться на степени потери функциональной характеристики, такой как способности к связыванию с молекулой-мишенью, или на физиохимических характеристиках, таких как склонность к агрегации, открытие доступа к ранее недоступным растворителю остаткам либо разрушение или образование дисульфидных связей.
В значении потери стабильности «денатурирование» или «денатурация» белка означают процесс, в котором происходит потеря некоторой части или всей трехмерной конформации, обеспечивающей функциональные характеристики белка, с соответствующей потерей активности и/или растворимости. Разрушаемые при денатурации силы включают в себя внутримолекулярные связи, включая без ограничений электростатические, гидрофобные, Ван-дер-Ваальсовы силы, водородные связи и дисульфидные связи. Денатурацию белка можно вызвать воздействием на белок или содержащий белок раствор, таким как механическое воздействие (например, сжимающая сила или сила сдвига), тепловой, осмотический стресс, изменение pH, электрические или магнитные поля, ионизирующее облучение, ультрафиолетовое облучение и дегидратация, а также воздействием химических денатурирующих агентов.
Используемый в настоящем документе термин «терапевтически эффективное» лечение или количество относится к количеству, достаточному для очевидного уменьшения или облегчения причин расстройства или его симптомов. Термин «облегчение» относится к уменьшению отрицательного эффекта расстройства на проходящего терапию пациента. В целях настоящего изобретения под объектом предпочтительно понимается человек, однако можно предположить, что для любого животного, нуждающегося в лечении патологических состояний, расстройства или болезни, можно применять разработанный для данной цели белок на основе каркасов.
Общее описание изобретения
Настоящее изобретение представляет выделенный, рекомбинантный и/или синтетический белковый каркас на основе консенсусной последовательности белка с повтором фибронектина типа III (FN3), включая без ограничений каркас, полученный из млекопитающих, а также композиции и кодирующие молекулы нуклеиновой кислоты, содержащие по меньшей мере один полинуклеотид, кодирующий белковый каркас на основе консенсусной последовательности FN3. Настоящее изобретение дополнительно включает в себя без ограничений способы изготовления и применения таких нуклеиновых кислот и белковых каркасов, включая применение в качестве платформы для изучения, а также в диагностических и терапевтических композициях, способах и устройствах.
Белковые каркасы, составляющие предмет настоящего изобретения, обладают преимуществами по сравнению с более крупными биотерапевтическими агентами на основе иммуноглобулина благодаря своим небольшим, компактным размерам. В частности, размер и форма биологической молекулы может сказываться на возможности ее введения местным или пероральным способом, способности проходить через гематоэнцефалический барьер; возможности экспрессирования в недорогих системах, таких как E. coli; возможности встраивания в би- или полиспецифические молекулы для связывания с множеством мишеней или множеством эпитопов одной мишени, пригодности к конъюгации, например, с активными компонентами, полимерами и зондами; возможности введения композиции в высоких концентрациях; а также способности таких молекул к эффективному прохождению через пораженные ткани и опухоли.
Более того, белковые каркасы обладают многими характеристиками антител с точки зрения укладки их структуры, которая имитирует вариабельный участок антитела. Данная ориентация позволяет делать петли FN3 поверхностными подобно определяющим комплементарность участкам (CDR) антител. Предполагается, что они смогут связываться с клеточными мишенями, и петли можно будет изменять, например, подвергать аффинному созреванию, для улучшения определенных связывающих или смежных характеристик.
Три из шести петель белкового каркаса, составляющего предмет настоящего изобретения, топологически соответствуют связывающим доменам антитела, расположенным в петлях вариабельного домена, известного своей гипервариабельной природой (петли гипервариабельных доменов (HVL)), в положениях, определенных Кабатом как остатки определяющих комлементарность участков (CDR), т.е. антигенсвязывающих участков антитела, а остальные три петли являются поверхностными, подобно участкам CDR антитела. Данные петли охватывают или расположены на остатках 13-16, 22-28, 38-43, 51-54, 60-64 и 75-81 последовательности SEQ ID NO: 16, как представлено в таблице 3 ниже и на фигуре 6, или около них. Для получения специфичности связывания и аффинности предпочтительно изменяют петлевые участки на остатках 22-28, 51-54 и 75-81 или около них. Один или более данных петлевых участков перемешивают случайным образом с другими петлевыми участками и/или другими нитями при сохранении их последовательности в качестве остовных участков библиотеки, при этом из библиотеки можно выбирать потенциально связующие агенты с высокой аффинностью к конкретному белку-мишени. Один или более петлевых участков могут взаимодействовать с белком-мишенью подобно тому, как участок CDR антитела взаимодействует с белком.
Каркасы, составляющие предмет настоящего изобретения, могут включать в себя другие субъединицы, например, через ковалентное взаимодействие. Весь константный участок антитела или его часть может быть связан с каркасом для придания ему имитирующих антитело характеристик, особенно характеристик, ассоциируемых с участком Fc, например, комплементарной активности (ADCC), периода полужизни и т.п. Например, можно вводить и/или регулировать эффекторную функцию, например, путем модификации связывания с C1q и/или связывания с FcγR, тем самым изменяя активность CDC и/или активность ADCC. «Эффекторные функции» отвечают за активацию или уменьшение биологической активности (например, у объекта). Примеры эффекторных функций включают в себя без ограничений: связывание с C1q; комплементозависимую цитотоксичность (CDC); связывание с рецептором Fc; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижение уровня экспрессии рецепторов на клеточной поверхности (например, рецепторов B-клеток; BCR) и т.п. Такие эффекторные функции могут требовать сочетания участка Fc со связывающим доменом (например, петлями белкового каркаса) и могут количественно характеризоваться с использованием различных анализов (например, анализов связывания с Fc, анализов ADCC, анализов CDC и т.п.).
К полипептиду на основе каркаса или его варианту можно добавить или ассоциировать с ним дополнительные фрагменты, например, для получения желательных характеристик к каркасной молекуле можно присоединить конъюгаты токсинов, альбумин или связывающиеся с альбумином вещества, молекулы полиэтиленгликоля (ПЭГ). Данные фрагменты могут представлять собой встроенные в кодирующую каркас последовательность слияния и могут быть получены стандартными способами, например, путем экспрессирования слитого белка с рекомбинантным кодирующим слияние вектором, выполненным с использованием общедоступных кодирующих нуклеотидных последовательностей. В альтернативном варианте осуществления для добавления фрагментов к рекомбинантно полученному каркасному белку можно использовать химические способы.
Каркасы, составляющие предмет настоящего изобретения, можно использовать как моноспецифические в мономерной форме или как би- или полиспецифические (для разных белков-мишеней или эпитопов одного белка-мишени) в мультимерной форме. Связи между каждой каркасной единицей могут быть ковалентными или нековалентными. Например, димерный биспецифический каркас имеет одну субъединицу со специфичностью к первому белку-мишени или эпитопу и вторую субъединицу со специфичностью ко второму белку-мишени или эпитопу. Субъединицы каркаса можно соединять в различных конформациях, что может увеличить валентность и, таким образом, антигенсвязывающую авидность.
Образование и выработка каркасного белка
По меньшей мере один каркасный белок, составляющий предмет настоящего изобретения, можно необязательно получить при помощи линии клеток, смешанной линии клеток, иммортализованной клетки или клональной популяции иммортализованных клеток, как хорошо известно специалистам в данной области. См., например, публикации под ред. Ausubel, et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2-е издание, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); под ред. Colligan, et al., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1997-2001).
Аминокислоты каркасного белка можно изменить, добавить и/или удалить для снижения иммуногенности или снижения, улучшения или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полужизни, стабильности, растворимости или любой другой пригодной характеристики, как известно специалистам в данной области.
Биоактивные каркасные белки можно сконструировать с сохранением высокой аффинности к антигену и других благоприятных биологических характеристик. Для достижения данной цели каркасные белки можно необязательно получить путем анализа родительских последовательностей и различных концептуальных сконструированных продуктов при помощи трехмерных моделей родительских и сконструированных последовательностей. Трехмерные модели широкодоступны и известны специалистам в данной области. Существуют компьютерные программы, иллюстрирующие и показывающие вероятные трехмерные конформационные структуры выбранных последовательностей-кандидатов и способные измерять потенциальную иммуногеничность (например, программа Immunofilter разработки Xencor, Inc., г. Монровия, штат Калифорния). Изучение данных иллюстраций позволяет проанализировать предполагаемую роль остатков в функционировании последовательности-кандидата, например, остатков, влияющих на способность каркасного белка-кандидата связывать его антиген. Таким образом, возможны селекция и комбинирование остатков из родительской и референсной последовательностей для получения желательной характеристики, например, аффинности к антигенам-мишеням. В альтернативном варианте осуществления или помимо описанных выше процедур можно использовать другие пригодные способы конструирования последовательностей.
Скрининг
Скрининговый подход к конструированию каркасных белков или библиотек, содержащих каркасные белки с варьируемыми остатками или доменами для специфического связывания с подобными белками или фрагментами, можно удобным образом реализовать с использованием библиотек нуклеотидного (ДНК или РНК) или пептидного фенотипирования, например, фенотипирования in vitro. Данный способ включает в себя скрининг больших наборов пептидов для выявления отдельных пептидов, имеющих желательную функцию или структуру. Фенотипированный пептид с нуклеотидной последовательностью или без нее может содержать в длину от 3 до 5 000 и более нуклеотидов или аминокислот, обычно от 5 до 100 аминокислот, часто от приблизительно 8 до 25 аминокислот. Помимо способов на основе прямого химического синтеза для образования библиотек пептидов описано несколько способов с использованием рекомбинантных ДНК. Один из таких способов предусматривает фенотипирование последовательности пептидов на поверхности бактериофага или клетки. Каждый бактериофаг или клетка содержит последовательность нуклеотидов, кодирующую конкретную последовательность пептидов для фенотипирования.
Белковые каркасы, составляющие предмет настоящего изобретения, могут связывать белки человека или других млекопитающих с разной степенью аффинности (KD). В предпочтительном варианте осуществления по меньшей мере один белковый каркас, составляющий предмет настоящего изобретения, может необязательно связываться с белком-мишенью с высокой аффинностью, например, с KD, меньшей либо равной приблизительно 10-7 М, такой как без ограничений в диапазоне 0,1-9,9 (или любом входящем в него диапазоне или значении)×10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14, 10-15, или любом входящем в него диапазоне или значении, как определено методом поверхностного плазмонного резонанса или методом Kinexa, как известно специалистам в данной области.
Аффинность или авидность белкового каркаса для антигена можно определить экспериментально любым пригодным способом (см., например, публикацию Berzofsky, et al., Antibody-Antigen Interactions, в Fundamental Immunology, под ред. Paul, W. E., Raven Press: New York, NY (1984); Kuby, Janis Immunology, W. H. Freeman and Company: New York, NY (1992); а также способы, описанные в настоящем документе). Измеренная аффинность взаимодействия в конкретной паре белковый каркас - антиген может меняться в зависимости от разных условий измерения (например, осмолярности, pH). Таким образом, измерения аффинности и других параметров связывания антигена (например, KD, Kon, Koff) предпочтительно производить при помощи стандартизированных растворов белкового каркаса и антигена, а также стандартизированного буферного раствора, например, описанного в настоящем документе.
Для определения того, какие белки, антитела и другие антагонисты конкурируют за связывание белка-мишени с белковым каркасом, составляющим предмет настоящего изобретения, и/или совместно используют один и тот же участок-эпитоп, можно провести анализ конкурентного связывания белкового каркаса, составляющего предмет настоящего изобретения. Данные анализы, как хорошо известно специалистам в данной области, предназначены для оценки степени конкуренции между антагонистами или лигандами за ограниченный ряд сайтов связывания у белка. Белок и/или антитело иммобилизуют, выделяют или фиксируют до или после конкуренции, и образец, связавшийся с белком-мишенью, отделяют от несвязавшегося образца, например, путем декантирования (если белок/антитело предварительно перевели в нерастворимую форму) или центрифугирования (если белок/антитело осадили после конкурирующей реакции). Кроме того, конкурентное связывание можно определить по степени изменения функции в результате связывания или отсутствия связывания белкового каркаса с белком-мишенью: например, молекула белкового каркаса может ингибировать или стимулировать ферментативную активность, например, метки. Для данных целей можно использовать ИФА и другие функциональные анализы, как хорошо известно специалистам в данной области.
Молекулы нуклеиновых кислот
Молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, которые кодируют белковые каркасы, могут быть в форме РНК, такой как мРНК, гяРНК, тРНК или любая другая форма, либо в форме ДНК, включая без ограничений кДНК и геномную ДНК, полученные путем клонирования или синтеза, а также любой их комбинации. ДНК может быть трехцепочечной, двухцепочечной, одноцепочечной или комбинированной. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, также известной как смысловая цепь, или некодирующей цепью, также называемой антисмысловой цепью.
Выделенные молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, могут включать в себя молекулы нуклеиновых кислот, содержащие открытую рамку считывания (ORF), необязательно с одним или более интронами, например, без ограничений по меньшей мере одну указанную часть по меньшей мере одного белкового каркаса; молекулы нуклеиновых кислот, содержащие кодирующую последовательность для белкового каркаса или петлевой участок, который связывается с белком-мишенью; и молекулы нуклеиновых кислот, содержащие последовательность нуклеотидов, по существу отличающуюся от последовательностей, описанных выше, но из-за вырожденности генетического кода по-прежнему кодирующую белковый каркас, как описано в настоящем документе и/или известно специалистам в данной области. Очевидно, что генетический код хорошо известен специалистам в данной области. Таким образом, специалист в данной области без труда может образовать такие вырожденные варианты нуклеиновой кислоты, которые кодируют специфические белковые каркасы, составляющие предмет настоящего изобретения. См., например, публикацию Ausubel, et al., приведенную выше. Такие варианты нуклеиновой кислоты включены в настоящее изобретение.
Как указано в настоящем документе, молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, которые содержат нуклеиновую кислоту, кодирующую белковый каркас, могут включать в себя без ограничений молекулы, кодирующие аминокислотную последовательность самого фрагмента белкового каркаса; кодирующую последовательность всего белкового каркаса или его части; кодирующую последовательность белкового каркаса, фрагмента или части, а также дополнительные последовательности, например, кодирующую последовательность по меньшей мере одного сигнального лидерного или слитого пептида с вышеуказанными дополнительными кодирующими последовательностями или без них, например, по меньшей мере один интрон, совместно с дополнительными некодирующими последовательностями, включая без ограничений некодирующие 5’- и 3’-концевые последовательности, например, транскрибированные, не подвергшиеся трансляции последовательности, которые играют роль в транскрипции, обработке мРНК, включая сигналы сплайсинга и полиаденилирования (например, связывание рибосом и стабильность мРНК); дополнительную кодирующую последовательность, которая кодирует дополнительные аминокислоты, например, такие, которые обеспечивают дополнительные функции. Таким образом, кодирующую белковый каркас последовательность можно слить с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку слитого белкового каркаса, содержащего фрагмент или часть белкового каркаса.
Молекулы нуклеиновых кислот
В настоящем изобретении также представлены нуклеиновые кислоты, кодирующие композиции, составляющие предмет настоящего изобретения, в виде выделенных полинуклеотидов или частей векторов экспрессии, включая векторы, совместимые с экспрессией в прокариотических, эукариотических или нитчатых фагах, выделением и/или фенотипированием композиций или их направленных мутагенов.
Выделенные нуклеиновые кислоты, составляющие предмет настоящего изобретения, можно получить при помощи:
(а) рекомбинантных способов, (b) синтетических способов, (c) способов очистки и/или (d) их комбинаций, как хорошо известно специалистам в данной области.
Полинуклеотиды, которые можно использовать в целях настоящего изобретения, кодируют функциональную часть белкового каркаса, описанного в настоящем документе. Полинуклеотиды, составляющие предмет настоящего изобретения, включают в себя последовательности нуклеиновых кислот, которые можно использовать для селективной гибридизации в полинуклеотид, кодирующий белковый каркас, составляющий предмет настоящего изобретения. Настоящее изобретение представляет выделенные нуклеиновые кислоты, которые в условиях селективной гибридизации образуют полинуклеотид, описанный в настоящем документе. Таким образом, полинуклеотиды, составляющие предмет настоящего варианта осуществления, можно использовать для выделения, детекции и/или количественного определения нуклеиновых кислот, содержащих такие полинуклеотиды. Например, полинуклеотиды, составляющие предмет настоящего изобретения, можно использовать для идентификации, выделения или амплификации частичных либо полноразмерных клонов в подготовленной библиотеке. В некоторых вариантах осуществления полинуклеотиды являются последовательностями геномной ДНК или кДНК, выделенными или иным образом комплементарными к кДНК из библиотеки нуклеиновых кислот человека или млекопитающего.
Нуклеиновые кислоты могут для удобства содержать дополнительные последовательности к полинуклеотиду, составляющему предмет настоящего изобретения. Например, в нуклеиновую кислоту можно вставить сайт множественного клонирования, содержащий один или более сайтов эндонуклеазной рестрикции, чтобы облегчить выделение полинуклеотида. Кроме того, можно вставить транслируемые последовательности, чтобы облегчить выделение транслированного полинуклеотида, составляющего предмет настоящего изобретения. К примеру, удобным способом очистки белков, составляющих предмет настоящего изобретения, является введение гексагистидинмаркированной последовательности. Нуклеиновая кислота, составляющая предмет настоящего изобретения, за исключением кодирующей последовательности, может необязательно являться вектором, адаптером или линкером для клонирования и/или экспрессии полинуклеотида, составляющего предмет настоящего изобретения.
В такие клонирующие и/или экспрессирующие последовательности можно добавить дополнительные последовательности, чтобы оптимизировать их функционирование при клонировании и/или экспрессии, способствовать выделению полинуклеотида или улучшить проникновение полинуклеотида в клетку. Использование векторов клонирования, векторов экспрессии, адаптеров и линкеров хорошо известно специалистам в данной области.
Как указано в настоящем документе, молекулы нуклеиновых кислот, составляющие предмет настоящего изобретения, которые содержат нуклеиновую кислоту, кодирующую белковый каркас, могут включать в себя без ограничений молекулы, кодирующие аминокислотную последовательность самого фрагмента белкового каркаса; кодирующую последовательность всего белкового каркаса или его части; кодирующую последовательность белкового каркаса, фрагмента или части, а также дополнительные последовательности, например, кодирующую последовательность по меньшей мере одного сигнального лидерного или слитого пептида с вышеуказанными дополнительными кодирующими последовательностями или без них, например, по меньшей мере один интрон, совместно с дополнительными некодирующими последовательностями, включая без ограничений некодирующие 5’- и 3’-концевые последовательности, например, транскрибированные, не подвергшиеся трансляции последовательности, которые играют роль в транскрипции, обработке мРНК, включая сигналы сплайсинга и полиаденилирования (например, связывание рибосом и стабильность мРНК); дополнительную кодирующую последовательность, которая кодирует дополнительные аминокислоты, например, такие, которые обеспечивают дополнительные функции. Таким образом, кодирующую белковый каркас последовательность можно слить с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку слитого белкового каркаса, содержащего фрагмент или часть белкового каркаса.
Для бактериальной экспрессии, включая инфицированные фагом бактерии, предпочтительным сигналом секреции является сигнал секреции pelB или ompA, но можно использовать другие полипептидные домены сигнала секреции, как описано в патенте США № 5658727. При фаговом фенотипировании транслируемая далее последовательность ДНК кодирует покрывающий белок нитчатого фага, например, белок pIII или pIX. Предпочтительные фаговые белки можно получить из нитчатых фагов M13, f1, fd и аналогичных эквивалентных нитчатых фагов. Таким образом, транслируемая далее последовательность ДНК кодирует последовательность аминокислотных остатков, которая соответствует и предпочтительно является идентичной гену III или гену IX покрывающего полипептида нитчатого фага. Последовательности таких покрывающих белков известны и доступны в открытых базах данных, например, в NCBI.
Скрининг по библиотеке кДНК или генома можно провести при помощи зонда на основе последовательности полинуклеотида, составляющего предмет настоящего изобретения, например, описанного в настоящем документе. Зонды можно использовать для гибридизации с последовательностями геномной ДНК или кДНК для выделения гомологичных генов в тех же самых или разных организмах. Специалисты в данной области определят, что при выполнении анализа можно использовать различные степени строгости гибридизации и что как среда для гибридизации, так и среда для отмывки клеток могут соответствовать жестким условиям. По мере того как условия гибридизации становятся все более строгими, требуемая для образования дуплекса степень комплементарности между зондом и мишенью возрастает. Жесткость условий можно контролировать одним или более из следующих параметров: температура, ионная сила, pH и присутствие частично денатурирующего растворителя, например, формамида. Например, жесткость условий гибридизации обычно изменяют путем смены полярности раствора реагентов, например, при помощи изменения концентрации формамида в диапазоне от 0 до 50%. Степень комплементарности (идентичности последовательностей), необходимая для детектируемого связывания, варьируется в соответствии со строгостью среды для гибридизации и/или среды для отмывки клеток. Оптимальная степень комплементарности составляет 100%, или от 70% до 100%, или любой диапазон или значение в этих пределах. Однако следует понимать, что небольшие вариации последовательностей в зондах и праймерах могут быть компенсированы путем уменьшения строгости среды для гибридизации и/или среды для отмывки клеток.
В одном аспекте настоящего изобретения полинуклеотиды конструируют с использованием способов введения рандомизированных кодонов для варьирования полученного полипептида по одному или более специфическим остаткам или добавлению остатков в специфических положениях внутри последовательности. Для создания библиотек измененных полипептидных последовательностей можно использовать различные стратегии, включая рандомизированные, полурациональные и рациональные способы. По сравнению с рандомизированными стратегиями рациональные и полурациональные способы имеют преимущество большего контроля над последствиями вводимых в кодирующую последовательность замен. Кроме того, фокусируя варьирование только в определенных участках гена, можно исследовать все многообразие возможных аминокислотных вариантов в выбранных положениях.
Библиотека, построенная на стандартной схеме диверсификации NNK или NNS, предусматривает возможность введения 32 разных кодонов в каждом положении и всех 20 аминокислот. Размер такой библиотеки теоретически возрастает на 32n для каждого количества n остатков. Однако в терминах практической реализуемости фаговое фенотипирование ограничено размером библиотеки образцов 109-1010 вариантов, что означает возможность целевого варьирования всего лишь 6-7 остатков, если в библиотеке должно быть обеспечено полное покрытие последовательности. Таким образом, можно применять полурациональные или «фокусированные» способы создания библиотек вариантов каркасов путем идентификации ключевых положений для варьирования и выбора соответствующего режима диверсификации. Термин «набор кодонов» относится к набору разных последовательностей триплетов нуклеотидов, используемых для кодирования желательного варианта аминокислоты. Стандартной формой обозначения кодонов является код IUB, известный специалистам в данной области и описанный в настоящем документе. Термин «нерандомизированный набор кодонов» относится к набору кодонов, кодирующему выбранные аминокислоты. Специалистам в данной области хорошо известен синтез олигонуклеотидов с выбранной «вырожденностью» нуклеотидов в определенных положениях, например, подход TRIM (Knappek et al.; J. Mol. Biol. (1999), 296:57-86); Garrard & Henner, Gene (1993), 128:103). Такие наборы нуклеотидов с определенными наборами кодонов можно синтезировать при помощи коммерчески доступных нуклеотидных или нуклеозидных реагентов и оборудования.
Набор кодонов представляет собой набор разных последовательностей триплетов нуклеотидов, используемых для кодирования желательного варианта аминокислот. Наборы кодонов можно представить с использованием символов для указания конкретных нуклеотидов или эквимолярных смесей нуклеотидов в соответствии со стандартным кодом IUB, как представлено ниже.
Коды IUB
G гуанин
A аденин
T тимин
C цитозин
R (A или G)
Y (C или T)
M (A или C)
K (G или T)
S (C или G)
W (A или T)
H (A или C или T)
B (C или G или T)
V (A или C или G)
D (A или G или T)
N (A или C или G или T)
Например, в наборе кодонов DVK символ D может означать нуклеотиды A или G или T; V может представлять собой A или G или C; а K может представлять собой G или T. Данный набор кодонов может представлять 18 разных кодонов и может кодировать аминокислоты Ala, Trp, Tyr, Lys, Thr, Asn, Lys, Ser, Arg, Asp, Glu, Gly и Cys.
Сфокусированные (т.е. нерандомизированные) библиотеки можно сформировать с использованием кодонов NNK и фокусировки варьирования на выбранных остатках, или же, в альтернативном варианте осуществления, варианты с нерандомизированными заменами можно сформировать с использованием, например, кодонов DVK, которые кодируют 11 аминокислот (ACDEGKNRSYW) и один стоп-кодон. В альтернативном варианте осуществления для варьирования желательных остатков или участков полипептида можно использовать мутагенез по Кункелю (Kunkel et al., Methods Enzymol. 154: 367-382, 1987).
Для клонирования библиотек в вектор для экспрессии используют стандартные способы клонирования. Библиотеку можно экспрессировать с использованием известной системы, например, библиотеку можно экспрессировать в качестве слитых белков. Для фенотипирования слитых белков можно использовать поверхность любого пригодного фага. Хорошо известны способы фенотипирования слитых полипептидов, содержащих фрагменты антитела на поверхности бактериофага (патент США № US6969108, принадлежащий Griffith; патент США № US6172197 принадлежащий McCafferty; патент США № US5223409 принадлежащий Ladner; патент США № US6582915 принадлежащий Griffiths; патент США № US6472147 принадлежащий Janda). Библиотеки для выделения de novo полипептидов можно фенотипировать на pIX (международная заявка на патент № WO2009085462A1). Библиотеки также можно транслировать in vitro, например, с использованием рибосомного фенотипирования (Hanes and Pluckthun, Proc. Natl. Acad. Scie. USA, 94:4937, 1997), мРНК-фенотипирования (Roberts and Szostak, Proc. Natl. Acad. Sci. USA, 94:12297, 1997), CIS-фенотипирования (Odegrip et. al., Proc. Natl. Acad. Sci. USA, 101:2806, 2004) или других бесклеточных систем (патент США № US5643768, принадлежащий Kawasaki).
Библиотеки с диверсифицированными участками можно сформировать с использованием векторов, содержащих полинуклеотид, кодирующий последовательность Tencon (SEQ ID NO: 16), или его предварительно заданного мутанта. Конструкция матрицы может иметь промоторную и сигнальную последовательности для полипептидной цепи. Для получения библиотек каркасов применяют реакции мутагенеза с использованием олигонуклеотидов, кодирующих петлевые участки (A:B, B:C, C:D, D:E, E:F и F:G) каркаса. Чтобы обеспечить включение всех выбранных положений в схему рандомизации, в каждый участок, планируемый для диверсификации, можно ввести стоп-кодон (такой как TAA). Будут получены только клоны, в которых произошла замена стоп-кодонов.
Модифицированные каркасные полипептиды
Модифицированные белковые каркасы и фрагменты, составляющие предмет настоящего изобретения, могут содержать одну или более частей, ковалентно связанных напрямую или опосредованно с другим белком.
При добавлении пептидных остатков или создании встроенных слитых белков добавление таких остатков можно осуществлять с использованием рекомбинантных способов из полинуклеотидной последовательности, как описано в настоящем документе. При расширенном, присоединенном или конъюгированном пептиде, белке, органическом химическом фрагменте, неорганическом химическом фрагменте или атоме или любой их комбинации связывание дополнительного фрагмента с белковым каркасом или фрагментом, составляющим предмет настоящего изобретения, как правило, производится связью, отличной от пептидной. Модифицированные белковые каркасы, составляющие предмет настоящего изобретения, можно получить путем реакции белкового каркаса или фрагмента с модифицирующим агентом. Например, органические фрагменты могут быть связаны с белковым каркасом не сайт-специфическим способом с использованием реагирующего с аминогруппами модифицирующего агента, например, NHS-эфира ПЭГ. Модифицированные белковые каркасы и фрагменты, содержащие органическую часть, связанную со специфическими сайтами белкового каркаса, составляющего предмет настоящего изобретения, можно получить с использованием пригодных способов, таких как обратный протеолиз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al., Bioconjugate Chem., 5:411-417 (1994); Kumaran et al., Protein Sci. 6(10):2233-2241 (1997); Itoh et al., Bioorg. Chem., 24(1): 59-68 (1996); Capellas et al., Biotechnol. Bioeng., 56(4):456-463 (1997)), а также способов, описанных в публикации Hermanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996).
Если к каркасному белку присоединить полимер или цепь, то они могут независимо представлять собой гидрофильную полимерную группу, остаток жирной кислоты или эфира жирной кислоты. Используемый в настоящем документе термин «жирная кислота» включает в себя одноосновные и двухосновные карбоновые кислоты. Используемый в настоящем документе термин «гидрофильная полимерная группа» обозначает органический полимер, обладающий более высокой растворимостью в воде, чем в октане. Например, полилизин более растворим в воде, чем в октане. Таким образом, белковый каркас, модифицированный путем ковалентного присоединения полилизина, входит в состав настоящего изобретения. Гидрофильные полимеры, которые можно использовать для модификации белковых каркасов, составляющих предмет настоящего изобретения, могут быть линейными или разветвленными и включают в себя, например, полиалкангликоли (например, ПЭГ, монометоксиполиэтиленгликоль (мПЭГ), ППГ и т.п.), углеводороды (например, декстран, целлюлозу, олигосахариды, полисахариды и т.п.), полимеры гидрофильных аминокислот (например, полилизин, полиаргинин, полиаспартат и т.п.), оксиды полиалканов (например, полиэтиленоксид, полипропиленоксид и т.п.) и поливинилпирролидон. Гидрофильный полимер, модифицирующий белковый каркас, составляющий предмет настоящего изобретения, в качестве отделенной молекулярной единицы предпочтительно имеет молекулярную массу от приблизительно 800 до приблизительно 150 000 дальтон. Например, можно использовать ПЭГ5000 и ПЭГ20 000, где нижний индекс означает среднюю молекулярную массу полимера в дальтонах. Гидрофильная полимерная группа может иметь от одного до приблизительно шести заместителей, выбираемых из алкилов, группы жирных кислот или группы эфиров жирных кислот. Гидрофильные полимеры, имеющие в качестве заместителей группу жирных кислот или группу эфиров жирных кислот, можно получить с применением пригодных способов. Например, полимер, содержащий аминогруппу, можно ввести в реакцию сочетания с карбоксилатом жирной кислоты или эфира жирной кислоты, а активированный карбоксилат (например, активированный N,N-карбонилдиимидазолом) жирной кислоты или эфира жирной кислоты можно ввести в реакцию сочетания с гидроксильной группой полимера.
Жирные кислоты и эфиры жирных кислот, которые можно использовать для модификации белковых каркасов, составляющих предмет настоящего изобретения, могут быть насыщенными или могут содержать одну или более единицы ненасыщенных связей. Жирные кислоты, которые можно использовать для модификации белковых каркасов, составляющих предмет настоящего изобретения, включают в себя, например, н-додеканоат (C12, лаурат), н-тетрадеканоат (C14, миристат), н-октадеканоат (C18, стеарат), н-эйкозаноат (C20, арахидат), н-докозаноат (C22, бегенат), н-триаконтаноат (C30), н-тетраконтаноат (C40), цис-Δ9-октадеканоат (C18, олеат), полностью цис-Δ5,8,11,14-эйкозатетраэноат (С20, арахидонат), октандикарбоновую кислоту, тетрадекандикарбоновую кислоту, октадекандикарбоновую кислоту, докозандикарбоновую кислоту и т.п. Пригодные эфиры жирных кислот включают в себя моноэфиры дикарбоновых кислот, содержащие линейную или разветвленную группу низшего алкила. Группа низшего алкила может содержать от одного до приблизительно двенадцати, предпочтительно от одного до приблизительно шести, атомов углерода.
Функциональность Fc-содержащих белков можно сравнивать при помощи нескольких хорошо известных анализов in vitro. В частности, представляет интерес аффинность к членам семейства FcγRI, FcγRII и FcγRIII рецепторов Fcγ. Данные измерения можно производить с использованием рекомбинантных растворимых форм рецепторов или клеточно-ассоциированных форм рецепторов. Кроме того, можно измерять аффинность к FcRn, рецептору, ответственному за увеличенный период полужизни IgG, например, при помощи BIAcore с использованием рекомбинантного растворимого FcRn. Функциональные клеточные анализы, такие как анализы ADCC и CDC, дают представление о вероятных функциональных последствиях конкретных вариантных структур. В одном варианте осуществления анализ ADCC проводят таким образом, чтобы основной клеткой-эффектором были клетки NK, отражая тем самым функциональные эффекты на рецептор FcγRIIIA. Для сравнения иммунных эффекторных функций разных вариантов также можно использовать анализ фагоцитоза, а также анализы, измеряющие клеточные реакции, такие как выброс супероксида или медиатора воспаления. Также можно использовать модели in vivo, например, при использовании вариантов анти-CD3 антител для измерения активации T-клеток у мышей - активности, которая зависит от связывания доменов Fc со специфическими лигандами, такими как рецепторы Fcγ.
Выбор или конструирование клеток-хозяев
Как описано в настоящем документе, клетка-хозяин, выбранная для экпрессирования каркасного белка, оказывает значительное влияние на конечную композицию, включая без ограничений вариацию в наборе окружающих белок фрагментов олигосахаридов, если последние желательны, например, в домене CH2 иммуноглобулина, если он присутствует в молекуле. Таким образом, один аспект настоящего изобретения включает в себя выбор соответствующих клеток-хозяев для использования в качестве и/или создания на ее основе производящей клетки, экспрессирующей желаемый терапевтический белок.
Дополнительно клетка-хозяин может происходить от млекопитающего или быть выбрана из клеток COS-1, COS-7, HEK293, BHK21, СНО, BSC-1, Hep G2, 653, SP2/0, 293, HeLa, клеток миеломы, лимфомы, дрожжей, насекомых или растений или любых их производных, иммортализованных или трансформированных клеток.
В альтернативном варианте осуществления клетку-хозяина можно выбрать из клеток видов или организмов, неспособных гликозилировать полипептиды, например, прокариотических клеток или организмов, таких как природные или сконструированные бактерии E. coli, Klebsiella или Pseudomonas.
Выбор связывающих доменов
Полипептиды или гибридные белки или их компоненты и домены можно получить из библиотек таких доменов или компонентов, например, библиотеки фагов. Библиотеку фагов можно создать при помощи вставки библиотеки случайных олигонуклеотидов или библиотеки полинуклеотидов, содержащих представляющие интерес последовательности, такие как домены антитела из B-клеток иммунизированного животного или человека (Smith, G.P. 1985. Science 228: 1315-1317). Библиотеки фагов антител содержат пары вариабельных участков тяжелой (H) и легкой (L) цепей в одном фаге, что позволяет экспрессировать фрагменты Fv с одной цепью или фрагменты Fab (Hoogenboom, et al., 2000, Immunol. Today 21(8) 371-8). Разнообразие фагемидной библиотеки можно адаптировать для повышения и/или изменения специфичностей полипептидов библиотеки для получения и последующей идентификации дополнительных желательных характеристик молекул и кодирующих их полинуклеотидов.
Другие библиотеки связывающих компонентов-мишеней, которые могут включать в себя участки, отличные от вариабельных участков антитела, представляют собой рибосомное фенотипирование, CIS-фенотипирование, дрожжевое фенотипирование, бактериальное фенотипирование и фенотипирование клеток млекопитающих. Рибосомное фенотипирование представляет собой способ трансляции мРНК в соответствующие белки с сохранением белка прикрепленным к РНК. Кодирующую последовательность нуклеиновой кислоты определяют методом ОТ-ПЦР (Mattheakis, L.C. et al. 1994. Proc. Natl. Acad. Sci. USA 91, 9022). CIS-фенотипирование представляет собой альтернативный способ фенотипирования in vitro, в котором библиотека конструируется в виде белка, слитого с RepA. В ходе трансляции in vitro RepA связывается в цис-положении с ДНК, из которой он был получен, обеспечивая прямую связь между гентипом и фенотипом (Odegrip et. al., Proc. Natl. Acad. Sci. USA, 101:2806, 2004). Дрожжевое фенотипирование основано на конструировании слитых белков связанного с мембраной альфа-агглютининового рецептора связывания дрожжей, aga1 и aga2, части системы типа спаривания (Broder, et al. 1997. Nature Biotechnology, 15:553-7). Бактериальное фенотипирование основано на слиянии мишени с экспортированными бактериальными белками, которые связываются с клеточной мембраной или стенкой клетки (Chen and Georgiou 2002. Biotechnol Bioeng, 79:496-503). Аналогичным образом, системы фенотипирования млекопитающих основаны на создании слитого белка из содержащего случайные последовательности полипептида и секретируемого якорного белка на мембране.
Области применения каркасных молекул
Композиции с использованием каркасных молекул, описанных в настоящем документе и образованных любым из описанных выше способов, можно применять для диагностики, мониторинга, модуляции, лечения, облегчения течения, профилактики или снижения симптомов болезней человека или специфических патологий клеток, тканей, органов, жидкостей или всего организма-хозяина. Сконструированную с конкретной целью каркасную молекулу можно применять для лечения иммуноопосредованного или иммунодефицитного заболевания, расстройства метаболизма, сердечнососудистого расстройства или заболевания; злокачественного заболевания; неврологического расстройства или заболевания; инфекции, такой как бактериальная, вирусная или паразитическая инфекция; или других известных или указанных связанных состояний, включая отеки, боль и некроз или фиброз тканей.
Такой способ может включать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере один каркасный белок, в клетку, ткань, орган, организм животного или пациента, которым требуется такое модулирование, лечение, облегчение, профилактика или сокращение симптомов, эффектов либо механизмов. Эффективное количество может составлять от приблизительно 0,001 до 500 мг/кг для однократного (например, болюсного), многократного или непрерывно введения, либо достигать сывороточной концентрации 0,01-5000 мкг/мл при однократном, многократном или непрерывном введении, либо может находиться в любом эффективном диапазоне или иметь эффективное значение в таком диапазоне, установленном или определенном известными способами, как описано в настоящем документе или известно специалистам в данной области.
Композиции, содержащие каркасные белки
Связывающиеся с мишенями каркасные белки, которые являются модифицированными или немодифицированными, одновалентными, би- или поливалентными, а также моно-, би- или мультинаправленными, можно выделить с использованием хорошо известных специалистам в данной области процедур разделения для захвата, иммобилизации, разделения или осаждения и очистить до такой степени, которая необходима для возможности коммерческого применения.
Для терапевтического применения каркасные белки можно вводить в состав композиции для соответствующего способа введения, включая без ограничений средства для парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, внутрикапсульного, внутрихрящевого, внутриполостного, внутриклеточного, внутримозжечкового, внутрицеребровентрикулярного, внутрикишечного, внутрицервикального, внутрижелудочного, внутрипеченочного, внутримиокардиального, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипредстательного, внутрилегочного, внутриректального, внутрипочечного, внутрисетчаточного, внутрипозвоночного, внутрисуставного, внутригрудного, внутриматочного, внутрипузырного, внутриочагового, болюсного, вагинального, ректального, буккального, сублингвального, интраназального или трансдермального способов введения. По меньшей мере одну композицию с каркасным белком можно получить для использования в форме таблеток или капсул; порошков, капель в нос или аэрозолей; геля, мази, лосьона, суспензии или ввести систему доставки на основе терапевтической повязки или «пластыря», как известно специалистам в данной области. Настоящее изобретение представляет стабильные композиции каркасных белков, которые предпочтительно представляют собой водный раствор на основе фосфатного буферного раствора или смешанного солевого раствора, а также растворы и композиции с консервантами, композиции с консервантами для многоразового использования, которые можно использовать в фармацевтических или ветеринарных целях, содержащие по меньшей мере один каркасный белок в фармацевтически приемлемой композиции. Пригодные для целей настоящего изобретения несущие среды и их композиция с возможностью введения других белков человека, например, сывороточный альбумин человека, описаны, например, в публикации Remington: The Science and Practice of Pharmacy, 21-е издание, под ред. Troy, D.B., Lipincott Williams and Wilkins, Philadelphia, PA 2006, часть 5, Pharmaceutical Manufacturing стр. 691-1092, см. особенно стр. 958-989.
Композиции можно использовать совместно или в составе одной рецептуры с другими активными компонентами, известными своими благоприятными характеристиками для лечения указанных расстройств, состояний или заболеваний, или тестировать путем получения комбинаций каркасных белков с новыми композициями и активными компонентами.
Хотя настоящее изобретение выше было описано в общих чертах, варианты осуществления настоящего изобретения будут дополнительно описаны в следующих примерах, которые никоим образом не ограничивают действия пунктов формулы изобретения.
ПРИМЕР 1. СОЗДАНИЕ ВАРИАНТОВ ГЛИКОЗИЛИРОВАНИЯ Fc
Конструкция Tencon
Третий домен FN3 тенасцина человека (SEQ ID NO: 3) можно использовать в качестве альтернативного каркаса, сконструированного со способностью связываться со специфическими молекулами-мишенями через поверхностные петли, структурно аналогичные определяющим комплементальность участкам (CDR) антител. Температура плавления данного домена в нативной форме в PBS составляет 54°С. Для получения каркасной молекулы с подобной структурой и улучшенными физическими характеристиками, например, улучшенной термостабильностью, сконструировали консенсусную последовательность на основе сопоставления 15 доменов FN3 тенасцина человека (SEQ ID NO: 1-15).
Результаты анализа множественного выравнивания последовательностей, приведенные в таблице 1, показывают, что данные 15 доменов имеют степень идентичности последовательностей друг друга в диапазоне от 13 до 80% со средней степенью идентичности последовательностей в парах 29%. Сконструировали консенсусную последовательность (SEQ ID NO: 16) путем включения наиболее сохраняемых (часто встречаемых) аминокислот в каждом положении из выравниваний, представленных в таблице 1. В попарных выравниваниях консенсусная последовательность, составляющая предмет настоящего изобретения (SEQ ID NO: 16), получившая название Tencon, идентична доменам FN3 тенасцина в 34-59% положений, при этом средняя степень идентичности последовательностей составляет 43%.
Экспрессия и очистка белка
Аминокислотную последовательность Tencon (SEQ ID NO: 16) подвергали обратной трансляции, получив последовательность ДНК, показанную в последовательности SEQ ID NO: 17. Данную последовательность конструировали при помощи ПЦР с перекрывающимися праймерами, субклонировали в модифицированный вектор pET15, трансформировали в BL21Star(DE3) E. coli (Invitrogen) и наносили на агаровые пластины (LB), содержащие 75 мкг/мл карбенициллина. Одну колонию выбирали и оставляли на ночь для выращивания при 37°C в 50 мл среды TB, содержащей 2% глюкозы и 100 мкг/мл карбенициллина. Данную культуру использовали для посева в 500 мл аутоиндукционной среды (среда Overnight Express Instant TB, Novagen) в колбе Ultra Yield объемом 2,5 л (Thomson Instrument Company). Рост и экспрессию осуществляли с использованием двухстадийной программы (3 часа при температуре 37°C, 300 об/мин и последующей инкубации 16 часов при температуре 30°C, 250 об/мин) в инкубаторе ATR Multitron с качающейся платформой.
Культуру собирали и центрифугировали в роторе JL8.1 при 7 000 об/мин в течение 15 минут для осаждения клеток. Клетки повторно растворяли в 30 мл буферного раствора, содержащего 20 мM фосфата натрия, pH 7,5, 500 мM NaCl, 10% глицерина, 20 мM имидазола, 0,37 мг/мл лизоцима, 1X ингибитора протеаз, не содержащего ЭДТА (Roche), и бензоназу (Sigma-Aldrich, конечная концентрация 0,25 мкл/мл) и лизировали при помощи соникатора Misonix XL2020 в течение 5 минут на льду в импульсном режиме (включение в течение 5 секунд, выключение в течение 30 секунд). Нерастворимый материал удаляли при помощи центрифугирования в роторе JA-17 при 17 000 об/мин в течение 30 минут.
Белок Tencon отделяли от растворимого лизата с помощью двухстадийного хроматографического процесса. Сначала белок захватывали путем аффинной хроматографии с использованием иммобилизованных металлов при добавлении к лизату 2 мл Ni-NTA агарозных частиц (Qiagen) и инкубировании смеси на качающейся платформе в течение 1 часа при температуре 4°C. Затем смолу помещали в колонку Poly-Prep (Bio-Rad) и промывали раствором 20 мМ фосфата натрия, рН 7,5, 500 мМ NaCl, 10% глицерина и 20 мМ имидазола для удаления несвязанного материала. Белки элюировали из смолы при помощи раствора 20 мМ фосфата натрия, рН 7,5 500 мМ NaCl, 10% глицерина и 500 мМ имидазола. Фракции анализировали при помощи ДСН-ПААГ, включая окрашивание Кумасси и вестерн-блоттинг с использованием конъюгированных с пероксидазой хрена антител к гистамину (Immunology Consultants Laboratory). Желательные фракции объединяли и диализовали в PBS при рН 7,4. На второй стадии очистки белок загружали в колонку Superdex-75 HiLoad 16/60 (GE Healthcare), уравновешенную в PBS. Фракции анализировали при помощи ДСН-ПААГ, а фракции, содержащие Tencon, объединяли и концентрировали в концентраторе Centriprep UltraCel YM-3 (Amicon).
Концентрацию белка определяли при помощи спектрофотометра вертикального сканирования BioTek для измерения оптической плотности образца на 280 нм. Конечный препарат анализировали путем окрашивания Кумасси (фигура 1), вестерн-блоттинга с использованием антител к гистамину и при помощи гель-проникающей ВЭЖХ в колонке G3000SW-XL (TOSOH Biosciences), уравновешенной в PBS. Анализ ДСН-ПААГ показывает, что масса Tencon варьируется от 6 до 14 кДа, что соответствует ожидаемой массе 10,7 кДа для мономерного белка. Выход чистого белка Tencon составил >50 мг чистого белка на литр культуры.
Биофизическая характеризация
Структуру и стабильность Tencon характеризовали при помощи спектроскопии кругового дихроизма и дифференциальной сканирующей калориметрии соответственно. Измерения кругового дихроизма проводили на спектрометре AVIV при температуре 20°C в PBS и в концентрации 0,2 мг/мл. Спектр на фигуре 8 имеет минимум при 218 нм, что свидетельствует о структуре типа бета-листа, ожидаемой для белка, принадлежащего семейству FN3. Данные ДСК получены путем нагрева 0,5 мг/мл растворов третьего домена FN3 из тенасцина или Tencon в PBS с 35°C до 95°C со скоростью 1°C/минута в калориметре N-DSCII (Applied Thermodynamics). Сначала из экспериментальных кривых вычитали кривую для контрольного образца чистого буферного раствора для получения профилей, представленных на фигуре 3. Исходя из указанных данных, с помощью программного обеспечения CpCalc (Applied Thermodynamics) рассчитывали температуры плавления 54°C и 78°С для 3-го домена FN3 и Tencon соответственно. Сворачивание и разворачивание обоих доменов при данных температурах является обратимым.
Анализ иммуногенности
Для сравнения предполагаемой иммуногенности последовательностей аминокислот, представляющих 3-й домен FN3 тенасцина человека, Tencon и несколько терапевтических антител (см. таблицу 2), использовали компьютерную программу, моделирующую иммуногенность человека к последовательностям аминокислот. После анализа химерных моноклональных антител (mAb) и моноклонального антитела (адалимумаба) человека в программе применили порог толерантности (удалив 9-мерные пептиды, на 100% идентичные последовательности, кодируемой зародышевой линией человека). К тенасцину или Tencon порог толерантности не применяли. Порог толерантности предполагает широкую толерантность Т-клеток к последовательностям моноклональных антител, кодируемым зародышевой линией, и позволяет сосредоточить внимание на анализе новой последовательности преимущественно в CDR и фланкирующих доменах.
Результаты данных анализов позволяют предположить низкий иммуногенный риск для тенасцина и Tencon, основанный на вероятности того, что 9-мерный пептид, полученный из проанализированной последовательности, свяжется с одной или более молекулами HLA. Оценка является взвешенной по распространенности каждого аллеля HLA. Оценки для моделей были суммированы для каждой последовательности для получения одного числа, описывающего общий предполагаемый иммуногенный риск каждой последовательности (суммарную оценку). Результаты данного анализа приведены в таблице 2. Тенасцин получил наименьшую общую оценку (11,9). Tencon, как и тенасцин, заработал баллы преимущественно за несвязующие вещества и агретопы с низким предполагаемым иммуногенным риском (оценка = 13,2). Оценки последовательностей тенасцина и Tencon оказались лучше оценок терапевтических антител.
Фенотипирование Tencon на фаге M13 путем слияния с pIX
Ген, кодирующий последовательность аминокислот Tencon, субклонировали в экспрессионный вектор-фагмид pPep9 при помощи ПЦР и рестрикционного клонирования с частичным расщеплением, получив вектор pTencon-pIX. Данная система экспрессирует N-терминально Myc-меченый Tencon как результат слияния C-конца с N-концом белка M13 pIX (фигура 4). Промотор Lac обеспечивает более низкий уровень экспрессии без IPTG и повышенный уровень экспрессии после добавления IPTG. К N-концу Tencon добавляли сигнальную последовательность OmpA, чтобы способствовать эффективной транслокации в периплазму. Между Tencon и pIX конструировали короткий линкер TSGGGGS (SEQ ID NO: 141) для предотвращения стерических взаимодействий между данными белками.
Чтобы подтвердить присутствие на поверхности фаговых частиц М13, pTencon-pIX трансформировали в XL1-Blue E. coli и одну колонию использовали для посева в 5 мл культуры LB с добавлением ампициллина. Данную культуру выращивали при температуре 37°С до достижения середины логарифмического роста, затем добавляли 610 БОЕ фага-помощника VCSM13 и инкубировали культуру при температуре 37°С в течение 10 минут без встряхивания, затем 50 минут со встряхиванием. Сохраненную фагом-помощником культуру затем разбавляли в 50 мл среды 2YT с добавлением ампициллина и канамицина и выращивали при температуре 37°C с встряхиванием до получения ОП600 0,7, затем добавляли IPTG до конечной концентрации 1 мМ и снижали температуру до 30°C. Спустя 16 часов культуру центрифугировали при ускорении 4 000×g в течение 20 минут, затем собирали супернатант и помещали его на хранение при температуре 4°С для анализа.
Чтобы подтвердить присутствие Myc-Tencon на поверхности фага М13, использовали связывание фаговых частиц с антителом анти-Myc (Invitrogen). Планшет Maxisorp на ночь покрывали антителом анти-Myc или анти-αv (отрицательный контроль) при концентрации 2,5 мкг/мл и блокировали при помощи SuperBlock T20 (Pierce). Описанный выше супернатант фагмидной культуры дважды последовательно разбавляли в PBS и добавляли в лунки планшета с нанесенным покрытием. Через 1 час планшет промывали TBST, в каждую лунку добавляли антитело анти-M13 HRP и после инкубации в течение 1 часа промывали TBST. Добавляли субстрат Roche BD ELISA POD и измеряли интенсивность люминесценции при помощи спектрофотометра для прочтения планшетов (Tecan). На фигуре 5 представлено, что фаговые частицы Myc-Tencon концентрационнозависимо связываются с анти-myc, но не с теми лунками планшета, которые были покрыты антителами анти-αv, или с непокрытыми контрольными лунками, что подтверждает специфическое фенотипирование Myc-Tencon на фаговой частице M13.
Можно сконструировать дополнительный вектор-фагмид для фенотипирования Tencon и элементов библиотеки (см. пример 2) на фаге M13 в виде слияний с покрывающим белком pIII. В данной системе ген pIX заменяется геном, кодирующим усеченную версию pIII (Bass et al. 1990). Дополнительные изменения по сравнению с системой, представленной на фигуре 4, включают в себя замену сигнальной последовательности OmpA сигнальной последовательностью DsbA, поскольку известно, что секреция с использованием данной последовательности благоприятна для подтверждения присутствия стабильных альтернативных каркасных молекул (Steiner et al. 2006).
ПРИМЕР 2. Образование библиотек Tencon
Библиотеки вариантов Tencon можно получить множеством разных способов в зависимости от желательной сложности и относительного расположения мутаций в молекуле. Для создания мутаций, рассеянных по гену Tencon, предпочтительны методы синтеза ДНК. Также возможно использование клонирования при помощи рестрикционных ферментов для рекомбинирования фрагментов ДНК, содержащих мутации в разных участках гена. Насыщающий мутагенез в узком участке, таком как одна петля Tencon, можно ввести методом направленного мутагенеза с использованием вырожденных олигонуклеотидов и олигонуклеотиднаправленного мутагенеза (Kunkel et al. 1987).
Создали библиотеку Tencon, библиотеку FG7, предназначенную для замены петли FG на 7 случайных аминокислот при помощи олигонуклеотиднаправленного мутагенеза. Синтезировали олигонуклеотид (TconFG7-For-5’pho) с вырожденной последовательностью NNS с 21 парой оснований (п.о.) в положениях, кодирующих петлю FG, и двумя фланкирующими последовательностями нуклеотидов с 20-27 п.о., комплементарных кодирующей последовательности Tencon. При данной конструкции в петле FG можно представить все двадцать аминокислот. Расчетное разнообразие на уровне нуклеотидов составляет 1,3×109.
TconFG7-For5’pho: (SEQ ID NO: 18)

Матрицу для олигонуклеотиднаправленного мутагенеза, pDsbA-Tencon-Asc-loop-Myc-pIII, сконструировали путем замены последовательности, кодирующей петлю F:G Tencon, на последовательность типа «стебель-петля», содержащую сайт рестрикции AscI. Данная система допускает элиминирование фоновой матрицы ДНК после мутагенеза за счет расщепления полученной ДНК с помощью AscI перед трансформацией. Для очистки одноцепочечной матрицы ДНК для мутагенеза одну колонию E. coli CJ236, содержащую pDsbA-Tencon-Asc-loop-Myc-pIII, помещали в 5 мл питательной среды 2YT с карбенициллином (50 мкг/мл конечной концентрации) и хлорамфениколом (10 мкг/мл). Спустя 6 часов добавляли фаг-помощник VCSM13 до конечной концентрации 1010 БОЕ/мл и инкубировали без встряхивания в течение 10 минут, затем переносили в 150 мл среды 2YT с карбенициллином (10 мкг/мл) и уридином (0,25 мкг/мл) и инкубировали на ночь при температуре 37°C со встряхиванием при 200 об/мин. Клетки осаждали центрифугированием, супернатант собирали и фаг осаждали при помощи ПЭГа NaCl. Одноцепочечную ДНК получали из данного осадка при помощи набора QIAprep Spin M13 (Qiagen) в соответствии с инструкциями производителя.
Чтобы ренатурировать вырожденный олигонуклеотид с матрицей, 5 мкг матрицы ДНК соединяли с олигонуклеотидом TconFG7-For-5-pho с молярным отношением 10:1 в трис-HCl (50 мМ, pH 7,5) и MgCl2 (10 мМ) и инкубировали при температуре 90°C в течение 2 минут, 60°C - в течение 3 минут, а также 20°C - в течение 5 минут. После реакции ренатурирования в реакционную смесь добавляли ATP (10 мМ), dNTP (25 мМ каждый), DTT (100 мМ), T4-лигазу (7 единиц) и T7-ДНК-полимеразу (10 единиц) и инкубировали при температуре 14°C в течение 6 часов, затем при 20°C в течение 12 часов. Полученную ДНК очищали при помощи набора для очистки ПЦР (Qiagen) и восстанавливали в 100 мкл воды. Библиотеку ДНК расщепляли при помощи 10 единиц AscI в течение 4 часов, затем снова очищали при помощи набора для очистки ПЦР (Qiagen). Конечную библиотеку ДНК восстанавливали в 50 мкл воды. Полученную двухцепочечную ДНК трансформировали в E. coli MC1061F’ электропорацией.
Продукты трансформации собирали в 20 мл среды SOC и оставляли восстанавливаться на 1 час при температуре 37°C. В конце восстановления аликвот трансформации последовательно разбавляли и наносили на пластины с карбенициллином (100 мкг/мл), содержащие 1% глюкозы, для оценки общего количества продуктов трансформации. Оставшуюся культуру SOC затем использовали для посева в 1 л среды 2xYT с карбенициллином и 1% глюкозы, которую выращивали до достижения значения ОП600 0,6. В 100 мл данной культуры сеяли фаг-помощник M13 до 1010/мл и инкубировали при температуре 37°C, затем центрифугировали. Полученный клеточный осадок повторно растворяли в 500 мл свежей среды 2xYT, содержащей карбенициллин (100 мкг/мл) и канамицин (35 мкг/мл), и оставляли на ночь для выращивания при температуре 30°C, затем центрифугировали. Фаговые частицы осаждали добавлением ПЭГ/NaCl и помещали на хранение при температуре -80°C.
Вторая библиотека, BC6/FG7, предназначалась для внесения разнообразия одновременно в петлях B:C и F:G Tencon. Для этого синтезировали два олигонуклеотида, TC-BC6-For-5’phos и POP149. Начальный олигонуклеотид был фосфорилирован и содержал 18 оснований кодона NNS в каждом положении, кодирующем петлю B:C, в то время как конечный олигонуклеотид был биотинилирован на 5’-конце и содержал 21 основание кодона NNS в каждом положении, кодирующем петлю F:G. Оба олигонуклеотида фланкируются двумя последовательностями нуклеотидов с 18 п.о., идентичными участку, идущему до и после участка, который подвергается мутагенезу (см. ниже описание праймера).
Tc-BC6-For-5’phos: (SEQ ID NO: 19)
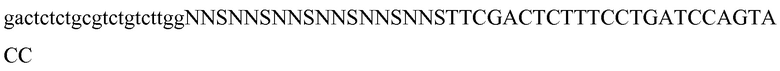
POP 2149: (SEQ ID NO: 20)
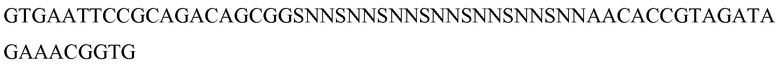
Для конструирования библиотеки проводили шестнадцать реакций ПЦР объемом 100 мкл с использованием т-олигонуклеотидов Tc-CB6-For5’phos и POP2149 для амплификации матрицы ДНК Tencon, при этом одновременно вводили кодоны NNS в петли B:C и F:G. Двухцепочечный продукт ПЦР мешали с магнитными частицами, покрытыми стрептавидином (Dynal), в буферном растворе B&W (10 мМ трис-HCl, pH 7,5, 1 мМ ЭДТА, 2М NaCl, 0,1% Tween-20), инкубировали в течение 20 минут, отделяли при помощи магнитного поля и дважды промывали буферным раствором B&W. Начальную цепь элюировали из частиц при помощи 300 мкл 150 мМ NaOH. Данный «мегапраймер», смесь длинных праймеров с теоретическим разнообразием свыше 8×1016, использовали для ренатурирования с матрицей одноцепочечной библиотеки. Библиотеку конструировали по аналогии с описанной выше библиотекой FG7.
ПРИМЕР 3. Выбор связующих с IgG веществ
Для селекции элементов библиотеки Tencon, связывающихся с IgG, рекомбинантный IgG (подтип IgG1 человека) биотинилировали при помощи сульфо-NHS-LC-биотина (Pierce), а затем диализовали в PBS. Для селекции 200 мкл библиотек FG7 или BC6/FG7 на фаговом дисплее блокировали 200 мкл Chemiblocker, затем добавляли биотинилированный IgG в концентрациях 500 нМ (цикл 1) или 100 нМ (циклы 2 и 3). Связанные фаги восстанавливали магнитными частицами, покрытыми нейтравидином (Seradyne), в цикле 1 или магнитными частицами, покрытыми стрептавидином (Promega), в циклах 2 и 3. Несвязанные фаги удаляли с частиц путем 5-10 промывок 1 мл трис-буферного физиологического раствора с Tween (TBST), затем 2 раза по 1 мл трис-буферного физиологического раствора (TBS). Связанные фаги элюировали с частиц добавлением клеток E. coli MC1061F’, находящихся в середине логарифмического роста. Инфицированные клетки наносили на планшеты с агаром LB с добавлением карбенициллина и глюкозы. На следующий день клетки соскребали с планшетов и выращивали до середины логарифмического роста, затем восстанавливали при помощи фага-помощника VCSM13 и оставляли на ночь для выращивания. Фаговые частицы выделяли осаждением ПЭГ/NaCl и использовали при следующем цикле селекции.
После 3 циклов пэннинга относительно IgG полученный продукт субклонировали в вектор pET27, модифицированный для включения лигаза-независимого сайта клонирования, путем ПЦР-амплификации гена Tencon. Данный продукт ПЦР ренатурировали с вектором и трансформировали в клетки BL21-GOLD(DE3) (Stratagene). Отдельные колонии собирали в культуры по 1 мл на 96-луночных планшетах с глубокими лунками (Corning) и оставляли на ночь для выращивания до насыщения при температуре 37°C. На следующий день 50 мкл ночной культуры использовали для посева 1 мл свежей культуры. Культуры выращивали при температуре 37°С в течение 2 часов, затем добавляли IPTG до 1 мМ и понижали температуру до 30°C. Клетки собирали центрифугированием спустя 16 часов после индукции и лизировали с 100 мкл BugBuster (Novagen). Полученные лизаты осветляли центрифугированием и использовали для тестирования связывания с IgG методом ИФА.
Планшеты Maxisorp (Nunc) на ночь покрывали 0,1 мкг анти-HIS антитела (Qiagen), промывали TBST и блокировали реагентом Starting Block T20 (Thermo Scientific). На планшеты добавляли осветленные лизаты, разведенные в соотношении 1:4 со Starting Block, и оставляли на 1 час для связывания, затем промывали TBST. Добавляли биотинилированный IgG или биотинилированный HSA в концентрации 1 мкг/мл и промывали TBST после инкубации в течение 1 часа. Детекцию связанного IgG или HSA осуществляли добавлением стрептавидин-HRP (Jackson Immunoresearch) и детектировали с использованием хемилюминесцентного субстрата POD. Результаты ИФА представлены на фигуре 7. Конструкции, связавшие биотинилированный IgG более чем в 10 раз больше, чем биотинилированный HSA согласно сигналу ИФА, секвенировали. После проведения нескольких экспериментов по селекции получили 60 индивидуальных связывающих последовательностей из библиотеки FG7 и 10 индивидуальных последовательностей из библиотеки BC6FG7. В таблице 4 представлены представительные последовательности связующих с IgG веществ, в которых петли B:C и/или F:G показаны в той мере, в которой они отличаются от петель последовательности SEQ ID NO:16. В таблице 4 также представлены многочисленные мутации в других участках каркаса.
Термостабильность сконструированного, экспрессированного и очищенного белка Tencon на 26°C лучше данного показателя у 3-го домена FN3 тенасцина человека, который использовали в качестве альтернативной каркасной молекулы. На основании данного повышения стабильности можно ожидать, что данная каркасная молекула будет более удобна для аминокислотной замены и проще в изготовлении. С повышением стабильности каркаса ожидается улучшение порога толерантности к мутациям, уменьшающим стабильность белка, таким образом, каркас с повышенной стабильностью, вероятно, обеспечит получение более функциональных, хорошо уложенных связующих веществ из библиотеки вариантов каркаса.

Петли
Каркасы, связывающиеся с IgG
Остатки 22-28
(SEQ ID NO)
Остатки 75-81
(SEQ ID NO)
Последовательности:






Последовательность Tencon с указанием петель (SEQ ID NO: 16)

ПРИМЕР 4. Стабилизирующие мутации Tencon
Для повышения стабильности сворачивания описанного выше каркаса Tencon (SEQ ID NO: 16) сконструировали специальные мутанты. Провели несколько точечных мутаций для получения замен отдельных остатков последовательности SEQ ID NO: 16, таких как N46V (Tencon17 - SEQ ID NO:142), E14P (Tencon18 - SEQ ID NO:143), E11N (Tencon19 - SEQ ID NO:144), E37P (Tencon20 - SEQ ID NO:145) и G73Y (Tencon21 - SEQ ID NO:146), для которых предсказывали повышение стабильности анализом в программе PoPMuSiC v2.0 (Dehouck, Grosfils et al. 2009). Ранее было показано, что мутант E86I (Tencon22 - SEQ ID NO:147) стабилизирует гомологичный белок, 3-й домен FN3 тенасцина человека (международная заявка на патент № WO2009/086116A2). Наконец, в экспериментах с аланиновым сканированием, в которых все остатки петли Tencon независимо заменяли на аланин, обнаружили, что мутация L17A значительно стабилизирует Tencon (данные не представлены). После проведения первого цикла экспериментов по анализу стабильности (см. ниже) для дополнительного повышения стабильности получили комбинаторные мутанты N46V/E86I (Tencon 23 - SEQ ID NO:148), E14P/N46V/E86I (Tencon24 - SEQ ID NO:149) и L17A/N46V/E86I (Tencon25 - SEQ ID NO:150).
Экспрессия и очистка
Мутации в кодирующей последовательности Tencon проводили с использованием набора для мутагенеза QuikChange (Stratagene). Полученные плазмиды трансформировали в E. coli BL21-GOLD (DE3) (Stratagene) для экспрессии. Одну колонию выбирали и оставляли на ночь для выращивания при температуре 37°C в 2 мл среды TB, содержащей 100 мкг/мл ампициллина. Данную культуру использовали для посева в 100 мл аутоиндукционной среды (Overnight Express Instant TB media, Novagen) в колбе с перегородками объемом 500 мл и выращивали при температуре 37°C в течение 16 часов.
Культуру собирали и центрифугировали при 4 000×g в течение 20 минут, осажденные клетки повторно растворяли в 5 мл буфера BugBuster HT (Novagen) на грамм влажного осадка клеток. После 30-минутного инкубирования при комнатной температуре лизаты осветляли центрифугированием при 30 000xg в течение 20 минут и загружали на Ni-NTA колонку повышенной текучести (Novagen) объемом 3 мл естественным весом. После загрузки каждую колонку промывали 15 мл буферного раствора, содержащего 50 мМ фосфата натрия, pH 7,4, 500 мМ NaCl и 10 мМ имидазола. Связанный белок затем элюировали с колонки, используя 10 мл буферного раствора, содержащего 50 мМ фосфата натрия, pH 7,4, 500 мМ NaCl и 250 мМ имидазола. Чистоту белка анализировали методом ДСН-ПААГ. Перед биофизическим анализом каждый мутант тщательно диализовали в PBS, pH 7,4. Для каждого мутанта получали 28-33 мг очищенного белка из 100 мл культуры.
Характеризация термостабильности
Характеристики термостабильности исходного Tencon и каждого мутанта определяли с использованием капиллярной дифференциальной сканирующей калориметрии (ДСК). Каждый образец тщательно диализовали в PBS, pH 7,4, и разбавляли до концентрации 2-3 мг/мл. Для данных образцов измеряли температуры плавления, используя анализатор VP-DSC с автоматическим пробоотборником (MicroCal, LLC). Образцы нагревали от 10°C до 95°C или 100°C со скоростью 1°C в минуту. Между сканированием каждого образца проводили сканирование чистого буферного раствора для расчета базовой линии для интегрирования. После вычитания сигнала от чистого буферного раствора данные фитировали с использованием модели сворачивания с двумя состояниями. Обратимость термической денатурации определяли путем повторного сканирования каждого образца без извлечения его из ячейки. Обратимость рассчитывали путем сравнения площади под фармакокинетической кривой, полученной при первом сканировании, и при втором сканировании. Результаты экспериментов по ДСК приведены в таблице 5 в виде значений, полученных на основе полных кривых плавления. Одиночные мутанты Tencon17, Tencon18, Tencon19 и Tencon22 имели повышенную термостабильность по сравнению с исходной последовательностью tencon. Значительную дестабилизацию наблюдали только для мутанта Tencon21. Комбинаторные образцы мутантов Tencon23, Tencon24 и Tencon25 все имели значительно повышенную стабильность, что указывает на аддитивный эффект таких сконструированных мутаций в отношении повышения термостабильности.
Денатурация гидрохлоридом гуанидина
Для оценки стабильности использовали измерение способности Tencon и каждого мутанта сохранять свернутую конформацию при обработке увеличиваемыми концентрациями гидрохлорида гуанидина (GdmCl) по результатам измерения флуоресценции триптофана. Tencon содержит только один остаток триптофана. Остаток триптофана находится в глубине гидрофобного ядра, таким образом, эмиссия флуоресценции на 360 нм является чувствительной мерой состояния свернутости данного белка. В лунки черных 96-луночных планшетов без связывания (Greiner) добавляли по 200 мкл раствора, содержащего 50 мМ фосфата натрия, pH 7,0, 150 мМ NaCl и вариабельную концентрацию GdmCl в диапазоне от 0,48 до 6,63 М, для получения титрования по 17 точкам. В каждую лунку планшета добавляли по 10 мкл раствора, содержащего мутанты tencon, до конечной концентрации белка 23 мкМ и перемешивали содержимое лунок осторожным пипетированием вверх и вниз. После инкубирования при комнатной температуре в течение 24 часов измеряли интенсивность флуоресценции на спектрофотометре для прочтения планшетов Spectramax M5 (Molecular Devices) с возбуждением на 280 нм и эмиссией на 360 нм. Данные, полученные из таких кривых, приведены на фигуре 8. Сигнал флуоресценции переводили в долю развернутой конформации с использованием следующего выражения (Pace 1986 Methods Enzymol 131: 266-80):
где yF - сигнал флуоресценции свернутого образца, а yU - развернутого образца.
Средние точки перехода разворачивания и наклон кривой разворачивания определяли с использованием следующего выражения (Clarke, Hamill et al. 1997):
где F - интенсивность флуоресценции при заданной концентрации денатурирующего агента, 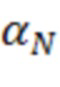 и
и 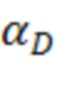 - отрезки на оси y для нативного и денатурированного состояния,
- отрезки на оси y для нативного и денатурированного состояния, 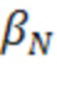 и
и  - наклоны базовых линий для нативного и денатурированного состояния, [D] - концентрация GdmCl, [D]50% - концентрация GdmCl, при которой 50% образца находится в денатурированном состоянии, m - наклон кривой разворачивания, R - газовая постоянная, а T - температура. Свободную энергию разворачивания для каждого образца оценивали с использованием следующего выражения (Pace 1986 см. выше; Clarke, Hamill et al. 1997 J Mol Biol 270(5): 771-8):
- наклоны базовых линий для нативного и денатурированного состояния, [D] - концентрация GdmCl, [D]50% - концентрация GdmCl, при которой 50% образца находится в денатурированном состоянии, m - наклон кривой разворачивания, R - газовая постоянная, а T - температура. Свободную энергию разворачивания для каждого образца оценивали с использованием следующего выражения (Pace 1986 см. выше; Clarke, Hamill et al. 1997 J Mol Biol 270(5): 771-8): 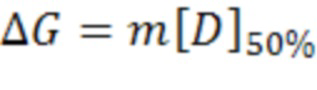 .
.
Для таких кривых часто трудно точно измерить наклон кривой разворачивания, m. Кроме того, можно ожидать, что мутации, описанные в настоящем документе, не изменят механизм разворачивания tencon. Таким образом, для каждого мутанта измеряли величину m и усредняли полученные значения (Pace 1986, см. выше), получив величину m=14,83 кДж/моль/М (3 544 кал/моль/М), которую использовали для всех расчетов свободной энергии. Результаты данных расчетов представлены в таблице 5. Результаты экспериментов по разворачиванию GdmCl показывают, что те же мутанты, которые стабилизуют термостабильность Tencon, также обеспечивают стабильность белка к индуцируемой GdmCl денатурации.
Эксклюзионная хроматография
Для оценки состояния агрегации дикого типа tencon и каждого мутанта использовали эксклюзионную хроматографию (SEC). 5 мкл каждого образца вводили шприцем в колонку Superdex 75 5/150 (GE Healthcare) со скоростью потока 0,3 мл/мин с подвижной фазой PBS. Элюирование с колонки контролировали по поглощению на 280 нм. Для оценки состояния агрегации колонку предварительно калибровали с использованием глобулярных стандартов молекулярного веса (Sigma). Все из тестированных образцов, за исключением Tencon21, элюировали одним пиком при объеме элюирования, соответствующем мономерному образцу. Tencon21 элюировали двумя пиками, что указывает на присутствие агрегатов.
(SEQ ID NO: 16)
(SEQ ID NO:142)
(SEQ ID NO:143)
(SEQ ID NO:144)
(SEQ ID NO:145)
(SEQ ID NO:146)
(SEQ ID NO:147)
(SEQ ID NO:148)
(SEQ ID NO:149)
(SEQ ID NO:150)
(SEQ ID NO:151)
Следует понимать, что настоящее изобретение можно реализовать и иными способами, отличными от конкретных способов, описанных в вышеприведенных описаниях и примерах. В свете приведенного выше описания возможны многочисленные изменения и вариации настоящего изобретения, которые, таким образом, включаются в прилагаемую формулу изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CENTOCOR ORTHO BIOTECH INC.
<120> КОМПОЗИЦИИ НА ОСНОВЕ СТАБИЛИЗИРОВАННЫХ ФИБРОНЕКТИНОВЫХ ДОМЕНОВ, СПОСОБЫ
И ОБЛАСТИ ИХ ПРИМЕНЕНИЯ
<130> CEN5292PCT
<140> PCT/US11/34512
<141> 29.04.2011 г.
<150> 61/329980
<151> 30.04.2010 г.
<160> 151
<170> FastSEQ для Windows версии 4.0
<210> 1
<211> 87
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Ser Pro Pro Lys Asp Leu Val Val Thr Glu Val Thr Glu Glu Thr Val
1 5 10 15
Asn Leu Ala Trp Asp Asn Glu Met Arg Val Thr Glu Tyr Leu Val Val
20 25 30
Tyr Thr Pro Thr His Glu Gly Gly Leu Glu Met Gln Phe Arg Val Pro
35 40 45
Gly Asp Gln Thr Ser Thr Ile Ile Gln Glu Leu Glu Pro Gly Val Glu
50 55 60
Tyr Phe Ile Arg Val Phe Ala Ile Leu Glu Asn Lys Lys Ser Ile Pro
65 70 75 80
Val Ser Ala Arg Val Ala Thr
85
<210> 2
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Thr Tyr Leu Pro Ala Pro Glu Gly Leu Lys Phe Lys Ser Ile Lys Glu
1 5 10 15
Thr Ser Val Glu Val Glu Trp Asp Pro Leu Asp Ile Ala Phe Glu Thr
20 25 30
Trp Glu Ile Ile Phe Arg Asn Met Asn Lys Glu Asp Glu Gly Glu Ile
35 40 45
Thr Lys Ser Leu Arg Arg Pro Glu Thr Ser Tyr Arg Gln Thr Gly Leu
50 55 60
Ala Pro Gly Gln Glu Tyr Glu Ile Ser Leu His Ile Val Lys Asn Asn
65 70 75 80
Thr Arg Gly Pro Gly Leu Lys Arg Val Thr Thr Thr Arg Leu Asp
85 90 95
<210> 3
<211> 88
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Asp Ala Pro Ser Gln Ile Glu Val Lys Asp Val Thr Asp Thr Thr Ala
1 5 10 15
Leu Ile Thr Trp Phe Lys Pro Leu Ala Glu Ile Asp Gly Ile Glu Leu
20 25 30
Thr Tyr Gly Ile Lys Asp Val Pro Gly Asp Arg Thr Thr Ile Asp Leu
35 40 45
Thr Glu Asp Glu Asn Gln Tyr Ser Ile Gly Asn Leu Lys Pro Asp Thr
50 55 60
Glu Tyr Glu Val Ser Leu Ile Ser Arg Arg Gly Asp Met Ser Ser Asn
65 70 75 80
Pro Ala Lys Glu Thr Phe Thr Thr
85
<210> 4
<211> 100
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Thr Gly Leu Asp Ala Pro Arg Asn Leu Arg Arg Val Ser Gln Thr Asp
1 5 10 15
Asn Ser Ile Thr Leu Glu Trp Arg Asn Gly Lys Ala Ala Ile Asp Ser
20 25 30
Tyr Arg Ile Lys Tyr Ala Pro Ile Ser Gly Gly Asp His Ala Glu Val
35 40 45
Asp Val Pro Lys Ser Gln Gln Ala Thr Thr Lys Thr Thr Leu Thr Gly
50 55 60
Leu Arg Pro Gly Thr Glu Tyr Gly Ile Gly Val Ser Ala Val Lys Glu
65 70 75 80
Asp Lys Glu Ser Asn Pro Ala Thr Ile Asn Ala Ala Thr Glu Leu Asp
85 90 95
Thr Pro Lys Asp
100
<210> 5
<211> 88
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Asp Thr Pro Lys Asp Leu Gln Val Ser Glu Thr Ala Glu Thr Ser Leu
1 5 10 15
Thr Leu Leu Trp Lys Thr Pro Leu Ala Lys Phe Asp Arg Tyr Arg Leu
20 25 30
Asn Tyr Ser Leu Pro Thr Gly Gln Trp Val Gly Val Gln Leu Pro Arg
35 40 45
Asn Thr Thr Ser Tyr Val Leu Arg Gly Leu Glu Pro Gly Gln Glu Tyr
50 55 60
Asn Val Leu Leu Thr Ala Glu Lys Gly Arg His Lys Ser Lys Pro Ala
65 70 75 80
Lys Ser Lys Pro Ala Arg Val Lys
85
<210> 6
<211> 92
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Gln Ala Pro Glu Leu Glu Asn Leu Thr Val Thr Glu Val Gly Trp Asp
1 5 10 15
Gly Leu Arg Leu Asn Trp Thr Ala Ala Asp Gln Ala Tyr Glu His Phe
20 25 30
Ile Ile Gln Val Gln Glu Ala Asn Lys Val Glu Ala Ala Arg Asn Leu
35 40 45
Thr Val Pro Gly Ser Leu Arg Ala Val Asp Ile Pro Gly Leu Lys Ala
50 55 60
Ala Thr Pro Tyr Thr Val Ser Ile Tyr Gly Val Ile Gln Gly Tyr Arg
65 70 75 80
Thr Pro Val Leu Ser Ala Glu Ala Ser Thr Gly Glu
85 90
<210> 7
<211> 91
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Glu Thr Pro Asn Leu Gly Glu Val Val Val Ala Glu Val Gly Trp Asp
1 5 10 15
Ala Leu Lys Leu Asn Trp Thr Ala Pro Glu Gly Ala Tyr Glu Tyr Phe
20 25 30
Phe Ile Gln Val Gln Glu Ala Asp Thr Val Glu Ala Ala Gln Asn Leu
35 40 45
Thr Val Pro Gly Gly Leu Arg Ser Thr Asp Leu Pro Gly Leu Lys Ala
50 55 60
Ala Thr His Tyr Thr Ile Thr Ile Arg Gly Val Thr Gln Asp Phe Ser
65 70 75 80
Thr Thr Pro Leu Ser Val Glu Val Leu Thr Glu
85 90
<210> 8
<211> 91
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Glu Val Pro Asp Met Gly Asn Leu Thr Val Thr Glu Val Ser Trp Asp
1 5 10 15
Ala Leu Arg Leu Asn Trp Thr Thr Pro Asp Gly Thr Tyr Asp Gln Phe
20 25 30
Thr Ile Gln Val Gln Glu Ala Asp Gln Val Glu Glu Ala His Asn Leu
35 40 45
Thr Val Pro Gly Ser Leu Arg Ser Met Glu Ile Pro Gly Leu Arg Ala
50 55 60
Gly Thr Pro Tyr Thr Val Thr Leu His Gly Glu Val Arg Gly His Ser
65 70 75 80
Thr Arg Pro Leu Ala Val Glu Val Val Thr Glu
85 90
<210> 9
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Asp Leu Pro Gln Leu Gly Asp Leu Ala Val Ser Glu Val Gly Trp Asp
1 5 10 15
Gly Leu Arg Leu Asn Trp Thr Ala Ala Asp Asn Ala Tyr Glu His Phe
20 25 30
Val Ile Gln Val Gln Glu Val Asn Lys Val Glu Ala Ala Gln Asn Leu
35 40 45
Thr Leu Pro Gly Ser Leu Arg Ala Val Asp Ile Pro Gly Leu Glu Ala
50 55 60
Ala Thr Pro Tyr Arg Val Ser Ile Tyr Gly Val Ile Arg Gly Tyr Arg
65 70 75 80
Thr Pro Val Leu Ser Ala Glu Ala Ser Thr Ala Lys Glu Pro Glu
85 90 95
<210> 10
<211> 91
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Lys Glu Pro Glu Ile Gly Asn Leu Asn Val Ser Asp Ile Thr Pro Glu
1 5 10 15
Ser Phe Asn Leu Ser Trp Met Ala Thr Asp Gly Ile Phe Glu Thr Phe
20 25 30
Thr Ile Glu Ile Ile Asp Ser Asn Arg Leu Leu Glu Thr Val Glu Tyr
35 40 45
Asn Ile Ser Gly Ala Glu Arg Thr Ala His Ile Ser Gly Leu Pro Pro
50 55 60
Ser Thr Asp Phe Ile Val Tyr Leu Ser Gly Leu Ala Pro Ser Ile Arg
65 70 75 80
Thr Lys Thr Ile Ser Ala Thr Ala Thr Thr Glu
85 90
<210> 11
<211> 91
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Ala Leu Pro Leu Leu Glu Asn Leu Thr Ile Ser Asp Ile Asn Pro Tyr
1 5 10 15
Gly Phe Thr Val Ser Trp Met Ala Ser Glu Asn Ala Phe Asp Ser Phe
20 25 30
Leu Val Thr Val Val Asp Ser Gly Lys Leu Leu Asp Pro Gln Glu Phe
35 40 45
Thr Leu Ser Gly Thr Gln Arg Lys Leu Glu Leu Arg Gly Leu Ile Thr
50 55 60
Gly Ile Gly Tyr Glu Val Met Val Ser Gly Phe Thr Gln Gly His Gln
65 70 75 80
Thr Lys Pro Leu Arg Ala Glu Ile Val Thr Glu
85 90
<210> 12
<211> 92
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Ala Glu Pro Glu Val Asp Asn Leu Leu Val Ser Asp Ala Thr Pro Asp
1 5 10 15
Gly Phe Arg Leu Ser Trp Thr Ala Asp Glu Gly Val Phe Asp Asn Phe
20 25 30
Val Leu Lys Ile Arg Asp Thr Lys Lys Gln Ser Glu Pro Leu Glu Ile
35 40 45
Thr Leu Leu Ala Pro Glu Arg Thr Arg Asp Leu Thr Gly Leu Arg Glu
50 55 60
Ala Thr Glu Tyr Glu Ile Glu Leu Tyr Gly Ile Ser Lys Gly Arg Arg
65 70 75 80
Ser Gln Thr Val Ser Ala Ile Ala Thr Thr Ala Met
85 90
<210> 13
<211> 89
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Gly Ser Pro Lys Glu Val Ile Phe Ser Asp Ile Thr Glu Asn Ser Ala
1 5 10 15
Thr Val Ser Trp Arg Ala Pro Thr Ala Gln Val Glu Ser Phe Arg Ile
20 25 30
Thr Tyr Val Pro Ile Thr Gly Gly Thr Pro Ser Met Val Thr Val Asp
35 40 45
Gly Thr Lys Thr Gln Thr Arg Leu Val Lys Leu Ile Pro Gly Val Glu
50 55 60
Tyr Leu Val Ser Ile Ile Ala Met Lys Gly Phe Glu Glu Ser Glu Pro
65 70 75 80
Val Ser Gly Ser Phe Thr Thr Ala Leu
85
<210> 14
<211> 88
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Asp Gly Pro Ser Gly Leu Val Thr Ala Asn Ile Thr Asp Ser Glu Ala
1 5 10 15
Leu Ala Arg Trp Gln Pro Ala Ile Ala Thr Val Asp Ser Tyr Val Ile
20 25 30
Ser Tyr Thr Gly Glu Lys Val Pro Glu Ile Thr Arg Thr Val Ser Gly
35 40 45
Asn Thr Val Glu Tyr Ala Leu Thr Asp Leu Glu Pro Ala Thr Glu Tyr
50 55 60
Thr Leu Arg Ile Phe Ala Glu Lys Gly Pro Gln Lys Ser Ser Thr Ile
65 70 75 80
Thr Ala Lys Phe Thr Thr Asp Leu
85
<210> 15
<211> 89
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Asp Ser Pro Arg Asp Leu Thr Ala Thr Glu Val Gln Ser Glu Thr Ala
1 5 10 15
Leu Leu Thr Trp Arg Pro Pro Arg Ala Ser Val Thr Gly Tyr Leu Leu
20 25 30
Val Tyr Glu Ser Val Asp Gly Thr Val Lys Glu Val Ile Val Gly Pro
35 40 45
Asp Thr Thr Ser Tyr Ser Leu Ala Asp Leu Ser Pro Ser Thr His Tyr
50 55 60
Thr Ala Lys Ile Gln Ala Leu Asn Gly Pro Leu Arg Ser Asn Met Ile
65 70 75 80
Gln Thr Ile Phe Thr Thr Ile Gly Leu
85
<210> 16
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 16
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 17
<211> 267
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотид, кодирующий связывающий полинуклеотид
<400> 17
ctgccggcgc cgaaaaacct ggttgtttct gaagttaccg aagactctct gcgtctgtct 60
tggaccgcgc cggacgcggc gttcgactct ttcctgatcc agtaccagga atctgaaaaa 120
gttggtgaag cgatcaacct gaccgttccg ggttctgaac gttcttacga cctgaccggt 180
ctgaaaccgg gtaccgaata caccgtttct atctacggtg ttaaaggtgg tcaccgttct 240
aacccgctgt ctgcggaatt caccacc 267
<210> 18
<211> 68
<212> ДНК
<213> Искусственная последовательность
<220>
<221> не известно
<222> (28)(29)(31)(32)(34)(35)(37)(38)(40)(41)(43)(44)(46)(47)
<223> Праймер, в котором n может представлять собой a, c, t или g
<400> 18
gaatacaccg tttctatcta cggtgttnns nnsnnsnnsn nsnnsnnscc gctgtctgcg 60
gaattcac 68
<210> 19
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<221> не известно
<222> (22)(23)(25)(26)(28)(29)(31)(32)(34)(35)(37)(38)
<223> Праймер, в котором n может представлять собой a, c, t или g
<400> 19
gactctctgc gtctgtcttg gnnsnnsnns nnsnnsnnst tcgactcttt cctgatccag 60
tacc 64
<210> 20
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<221> не известно
<222> (21)(22)(23)(24)(25)(26)(27)(28)(29)(30)(31)(32)(33)
(34)(35)(36)(37)(38)(39)(40)(41)
<223> Праймер, в котором n может представлять собой a, c, t или g, и
s может представлять собой g или c.
<400> 20
gtgaattccg cagacagcgg snnsnnsnns nnsnnsnnsn naacaccgta gatagaaacg 60
gtg 63
<210> 21
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 21
Ser Tyr Gly Phe Asn Asn
1 5
<210> 22
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 22
Thr Tyr Glu Gly Glu Ser
1 5
<210> 23
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 23
Thr Tyr Glu Ser Glu Ser
1 5
<210> 24
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 24
Thr Asn Trp Met Asp Ser
1 5
<210> 25
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 25
Lys Ser Val Phe Ile Met
1 5
<210> 26
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 26
Tyr Ser Ser Tyr Ala Thr
1 5
<210> 27
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 27
Arg Phe His Pro Phe Pro
1 5
<210> 28
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 28
Met Met Cys Met Pro Leu
1 5
<210> 29
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 29
Tyr Cys Arg Val Arg Asp
1 5
<210> 30
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 30
Met Asp Cys Phe Met Gly
1 5
<210> 31
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 31
Thr Tyr Arg Phe Asn Ser
1 5
<210> 32
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 32
Ala Ser Arg Arg Ser Leu
1 5
<210> 33
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов фибронектина
типа III (FN3) человека
<400> 33
Thr Ile Glu Ser Glu Ser
1 5
<210> 34
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 34
Thr Leu Met Gln Ser
1 5
<210> 35
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 35
Ile Tyr Asp Ser Glu Ser
1 5
<210> 36
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 36
Asp Arg Lys Arg Phe Ile
1 5
<210> 37
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 37
Glu Phe Trp Arg Gly Ser
1 5
<210> 38
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 38
Gly Leu Leu Asp Pro Leu
1 5
<210> 39
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 39
Gly Leu Val Leu Pro Glu
1 5
<210> 40
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 40
Met Ala Ser Asp Gly Leu
1 5
<210> 41
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 41
Asn Lys Thr Glu Thr Asn
1 5
<210> 42
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 42
Gln Ala Glu Arg Lys Val
1 5
<210> 43
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 43
Ser Gln Val Cys Thr Leu
1 5
<210> 44
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 44
Tyr Phe Asp Lys Asp Ser
1 5
<210> 45
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 45
Tyr Phe Glu Cys Glu Pro
1 5
<210> 46
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 46
Gln Ile Gly Pro Ile Ile Pro
1 5
<210> 47
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 47
Ser Ile Arg Thr Ile Asp Ser
1 5
<210> 48
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 48
Pro Lys Phe His Ser Pro Leu
1 5
<210> 49
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 49
Trp Lys Thr Thr Ile Trp Phe
1 5
<210> 50
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 50
Arg Lys Asn Trp Lys Thr Arg
1 5
<210> 51
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 51
Arg Leu Phe Arg Ile Tyr Gln
1 5
<210> 52
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 52
Trp Leu Ser Arg Ser Tyr Asp
1 5
<210> 53
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 53
Trp Leu Ser Arg Ser Cys Asp
1 5
<210> 54
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 54
Trp Met Gly Pro Tyr Cys Asp
1 5
<210> 55
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 55
Arg Arg Arg Arg Tyr Ser Phe
1 5
<210> 56
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 56
His Ile Val Pro Met Val Pro
1 5
<210> 57
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 57
Gln Ile Glu Pro Ile Ile Arg
1 5
<210> 58
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 58
Pro Ser Ala Ala Asn Asn Pro
1 5
<210> 59
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 59
Val Arg Leu Arg Tyr Val Gln
1 5
<210> 60
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 60
Gln Val Gly Pro Leu Ile Pro
1 5
<210> 61
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 61
Arg Ile Gly Pro Ile Leu Pro
1 5
<210> 62
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 62
Gln Ile Gly Pro Leu Leu Pro
1 5
<210> 63
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 63
Arg Ile Gly Pro Leu Leu Pro
1 5
<210> 64
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 64
Gln Val Gly Pro Leu Leu Pro
1 5
<210> 65
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 65
Arg Ile Gly Pro Met Leu Pro
1 5
<210> 66
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 66
Gln Ile Gly Pro Val Leu Pro
1 5
<210> 67
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 67
Arg Ile Gly Pro Val Leu Pro
1 5
<210> 68
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 68
Gln Ile Gly Pro Met Met Pro
1 5
<210> 69
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 69
Gln Val Gly Pro Leu Val Pro
1 5
<210> 70
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 70
Gln Ile Gly Pro Met Leu Pro
1 5
<210> 71
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 71
Gln Val Gly Pro Ile Leu Pro
1 5
<210> 72
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 72
Gln Val Gly Pro Met Leu Pro
1 5
<210> 73
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 73
Gln Ile Gly Pro Ile Val Pro
1 5
<210> 74
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 74
Met Ile Gly Pro Leu Leu Pro
1 5
<210> 75
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 75
Gln Ile Gly Pro Leu Phe Pro
1 5
<210> 76
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 76
Gln Ile Gly Pro Met Val Pro
1 5
<210> 77
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 77
Gln Ile Gly Pro Ile Val Pro
1 5
<210> 78
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 78
Arg Ile Glu Pro Ile Leu Pro
1 5
<210> 79
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 79
Val Ala Gly Ser Val Trp Pro
1 5
<210> 80
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 80
Arg Glu Gly Ala Thr Leu Tyr
1 5
<210> 81
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 81
Lys Gln Ile Pro Pro Ile Leu
1 5
<210> 82
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 82
Leu Ser Leu Ser Ser Val Leu
1 5
<210> 83
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 83
His Met Leu Leu Pro Leu Pro
1 5
<210> 84
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 84
Met Ile Gly Pro Leu Ile Pro
1 5
<210> 85
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 85
Thr Ile Gly Pro His Ile Pro
1 5
<210> 86
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 86
Glu Ile Gly Pro Cys Leu Pro
1 5
<210> 87
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 87
Glu Ile Gly Pro Val Leu Pro
1 5
<210> 88
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 88
Lys Ile Gly Pro Cys Leu Pro
1 5
<210> 89
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 89
Met Ile Gly Pro Val Leu Pro
1 5
<210> 90
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 90
Gln Ile Gly Pro Ile Leu Pro
1 5
<210> 91
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 91
Glu Val Gly Pro Ile Leu Pro
1 5
<210> 92
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 92
Gln Val Gly Pro Leu Leu Pro
1 5
<210> 93
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 93
Gln Ile Gly Pro Val Met Pro
1 5
<210> 94
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 94
Gln Ile Gly Pro Cys Val Pro
1 5
<210> 95
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 95
Gln Ile Gly Pro Leu Val Pro
1 5
<210> 96
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 96
Arg Gly Leu Val Met Pro Met
1 5
<210> 97
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 97
Met Ile Gly Pro Ile Leu Pro
1 5
<210> 98
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 98
Cys Ile Gly Pro Met Val Pro
1 5
<210> 99
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 99
Phe Ile Gly Pro Val Leu Pro
1 5
<210> 100
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 100
His Ile Gly Pro Ile Leu Pro
1 5
<210> 101
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 101
His Ile Gly Pro Ile Met Pro
1 5
<210> 102
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 102
His Ile Gly Pro Tyr Leu Pro
1 5
<210> 103
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 103
His Val Gly Pro Ile Leu Pro
1 5
<210> 104
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 104
Ile Ile Gly Pro Leu Leu Pro
1 5
<210> 105
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 105
Met Val Gly Pro Leu Leu Pro
1 5
<210> 106
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 106
Met Val Gly Pro Leu Leu Pro
1 5
<210> 107
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 107
Asn Ile Gly Pro Tyr Leu Pro
1 5
<210> 108
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 108
Asn Ile Gly Pro Tyr Leu Pro
1 5
<210> 109
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов фибронектина
типа III (FN3) человека
<400> 109
Gln Ile Gly Pro His Leu Pro
1 5
<210> 110
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 110
Gln Ile Gly Pro Ile Leu Gly
1 5
<210> 111
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 111
Gln Ile Gly Pro Ile Leu Ser
1 5
<210> 112
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 112
Gln Ile Gly Pro Ile Leu Thr
1 5
<210> 113
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов фибронектина
типа III (FN3) человека
<400> 113
Gln Ile Gly Pro Ile Met Pro
1 5
<210> 114
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 114
Gln Ile Gly Pro Ile Pro Ile
1 5
<210> 115
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 115
Gln Ile Gly Pro Leu Leu Asn
1 5
<210> 116
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 116
Gln Ile Gly Pro Val Phe Pro
1 5
<210> 117
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 117
Gln Ile Gly Pro Val Leu Ser
1 5
<210> 118
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 118
Gln Ile Gly Pro Trp Leu Pro
1 5
<210> 119
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 119
Gln Val Gly Pro Ile Met Asn
1 5
<210> 120
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 120
Gln Val Gly Pro Ile Met Pro
1 5
<210> 121
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 121
Gln Val Gly Pro Ile Val Pro
1 5
<210> 122
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 122
Gln Val Gly Pro Leu Leu Ser
1 5
<210> 123
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 123
Gln Val Gly Pro Val Leu Pro
1 5
<210> 124
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 124
Gln Val Gly Pro Val Leu Pro
1 5
<210> 125
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 125
Arg Ile Gly Pro Ile Met Pro
1 5
<210> 126
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 126
Arg Ile Gly Pro Ile Val Pro
1 5
<210> 127
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 127
Arg Ile Gly Pro Met Phe Pro
1 5
<210> 128
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 128
Arg Ile Gly Pro Met Ile Pro
1 5
<210> 129
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 129
Arg Ile Gly Pro Met Val Pro
1 5
<210> 130
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 130
Arg Ile Gly Pro Val Ile Pro
1 5
<210> 131
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 131
Arg Val Gly Pro Ile Leu Pro
1 5
<210> 132
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 132
Arg Val Gly Pro Leu Leu Pro
1 5
<210> 133
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 133
Thr Val Gly Pro His Ile Pro
1 5
<210> 134
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 134
Pro Ser Trp Arg Ser Asn Trp
1 5
<210> 135
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 135
Ala Leu Arg Ala Thr Leu Glu
1 5
<210> 136
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 136
Lys Tyr Gly Tyr Leu Thr Pro
1 5
<210> 137
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 137
Arg Ile Gly Pro Met Leu Pro
1 5
<210> 138
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 138
Asn Pro Phe Cys Ser Arg Phe
1 5
<210> 139
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 139
Tyr Tyr Leu His Gln Trp Cys
1 5
<210> 140
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 140
His Ile Val Pro Leu Leu Arg
1 5
<210> 141
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Белковый каркас, основанный на последовательности доменов
фибронектина типа III (FN3) человека
<400> 141
Thr Ser Gly Gly Gly Gly Ser
1 5
<210> 142
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 142
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 143
<211> 89
<212> БЕЛОК
<213> Связывающий полипептид
<400> 143
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Pro Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 144
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 144
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Asn Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 145
<211> 89
<212> БЕЛОК
<213> Связывающий полипептид
<400> 145
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Pro Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 146
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 146
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Tyr Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 147
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 147
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 148
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 148
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 149
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 149
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Pro Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 150
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 150
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 151
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий полипептид
<400> 151
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| CD8A-СВЯЗЫВАЮЩИЕ ДОМЕНЫ ТИПА III ФИБРОНЕКТИНА | 2017 |
|
RU2759952C2 |
| КОМПОЗИЦИИ IL-12, НАЦЕЛЕННЫЕ НА EDB | 2019 |
|
RU2758143C1 |
| ИММУНОКОНЪЮГАТЫ IL2 И МУТАНТНОГО TNF | 2017 |
|
RU2758139C2 |
| СКОНСТРУИРОВАННЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ДРУГИЕ МУЛЬТИМЕРНЫЕ БЕЛКИ С АСИММЕТРИЧНЫМИ МУТАЦИЯМИ В ОБЛАСТИ CH2-CH3 | 2018 |
|
RU2804031C2 |
| АНТИ-BCMA АНТИТЕЛА, СОДЕРЖАЩИЕ ТОЛЬКО ТЯЖЁЛУЮ ЦЕПЬ | 2017 |
|
RU2781301C2 |
| АНТИТЕЛО К EphA4 | 2020 |
|
RU2816371C2 |
| УСОВЕРШЕНСТВОВАННЫЕ ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2019 |
|
RU2810748C2 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ТОЛЬКО ТЯЖЕЛЫЕ ЦЕПИ, КОТОРЫЕ СВЯЗЫВАЮТСЯ С CD22 | 2018 |
|
RU2797348C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, НАЦЕЛЕННЫЕ НА CAIX, ANO1, МЕЗОТЕЛИН, TROP2, СEA ИЛИ КЛАУДИН-18.2 | 2018 |
|
RU2792671C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, НАЦЕЛЕННЫЕ НА NKG2D, CD16 И TROP2 | 2018 |
|
RU2820629C2 |

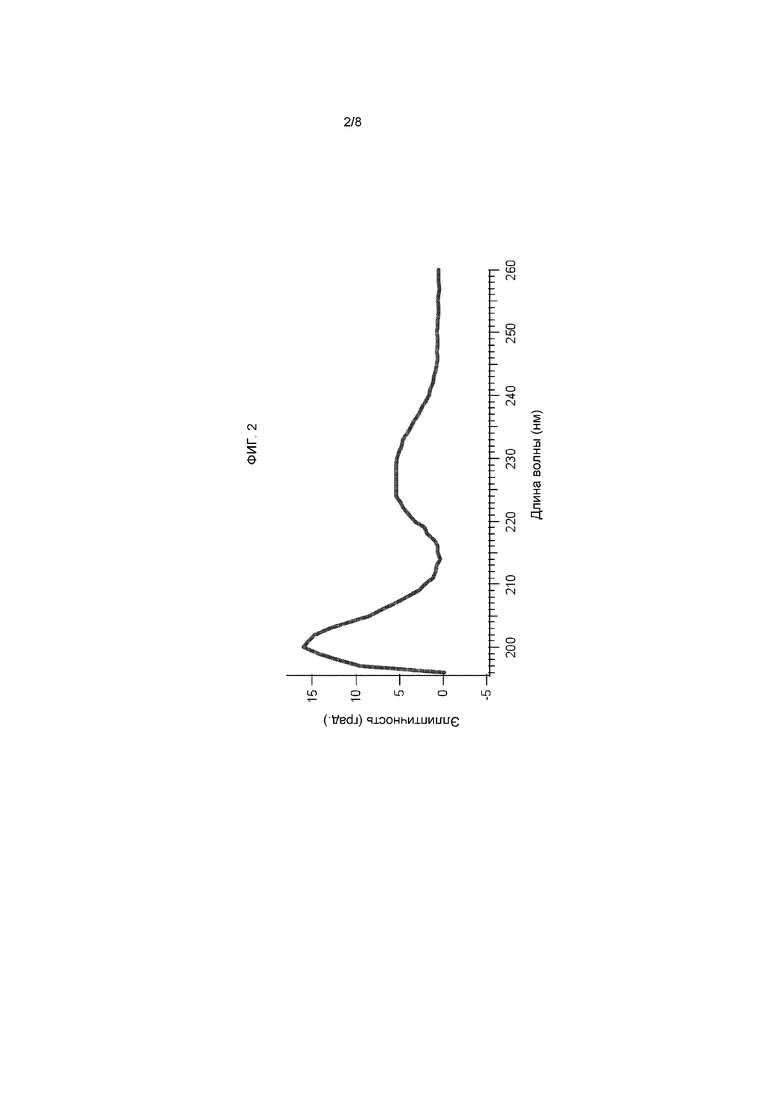
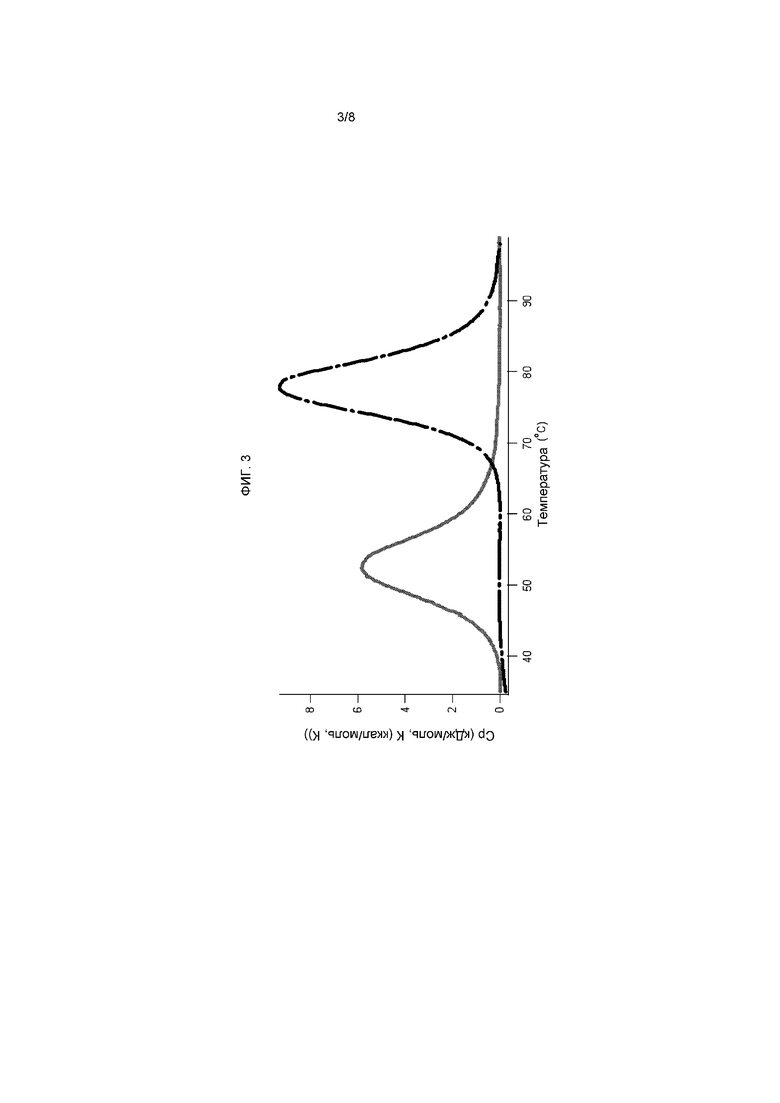

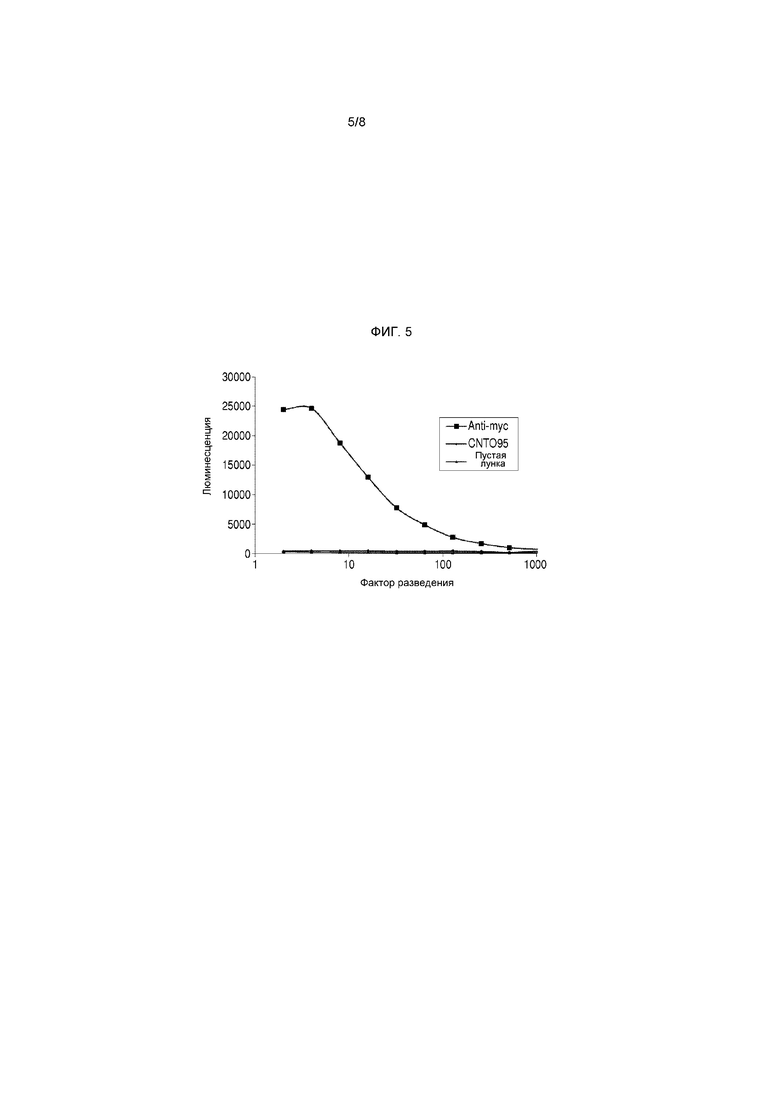
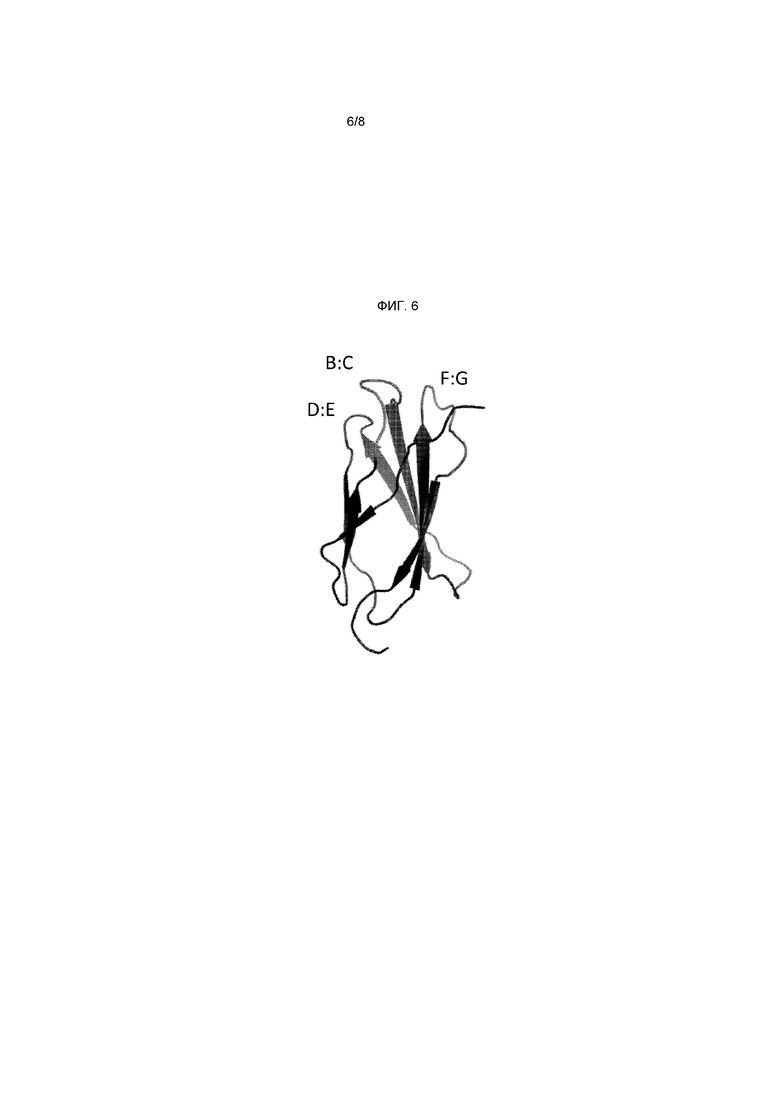
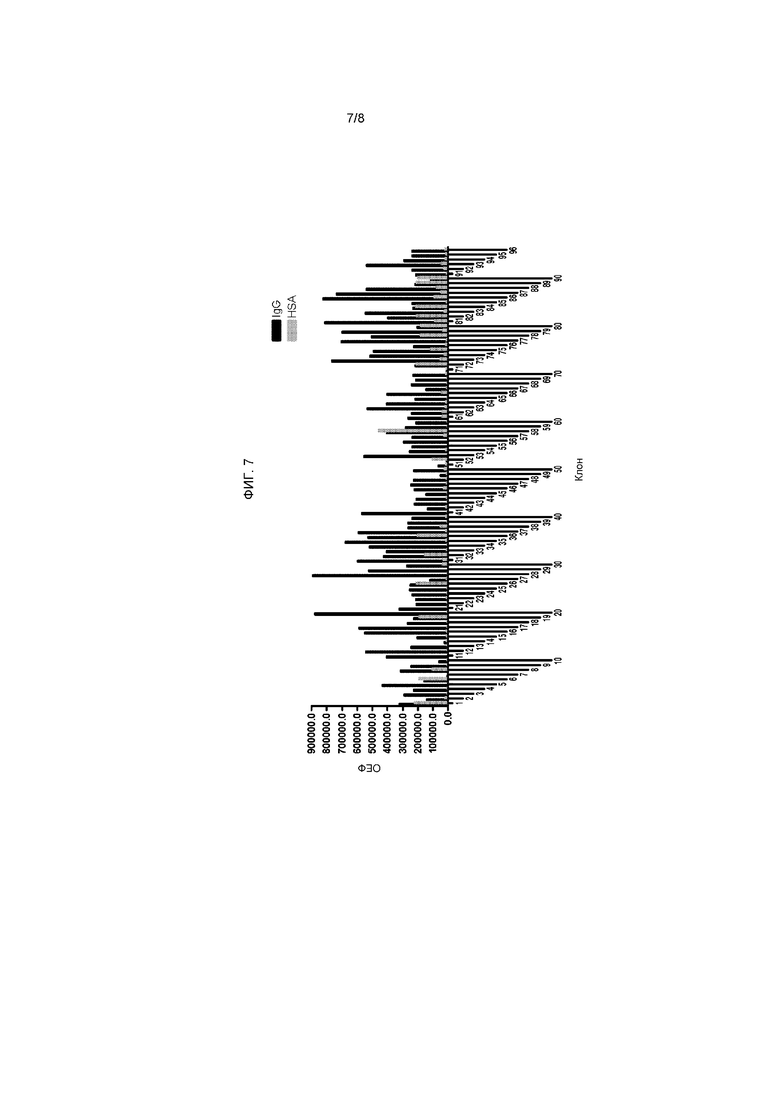
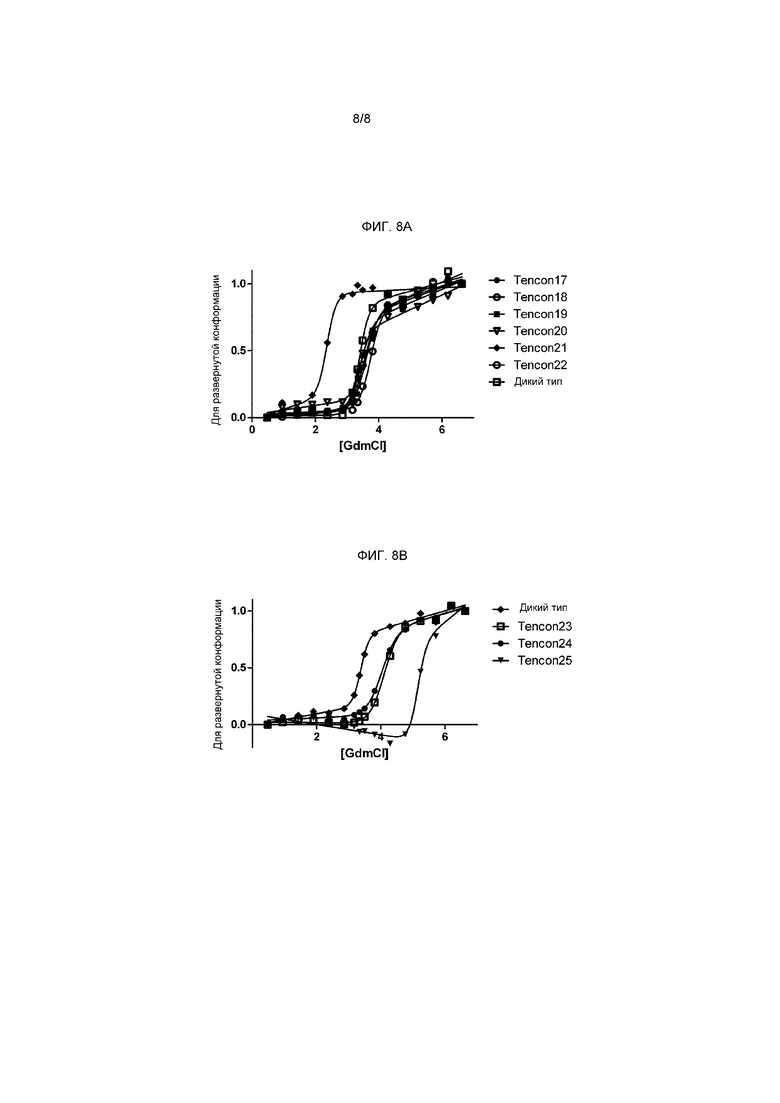
Изобретение относится к области биотехнологии, конкретно к молекуле белкового каркаса на основе доменов фибронектина типа III (FN3) для связывания с клеточной мишенью. Полученная молекула белкового каркаса содержит полипептидную консенсусную последовательность множества доменов FN3 с аминокислотной последовательностью, выбранной из группы, состоящей из последовательностей SEQ ID NO:142-151, и может использоваться для создания партнеров по связыванию для применения в диагностических или терапевтических композициях. 6 н. и 4 з.п. ф-лы, 8 ил., 5 табл., 4 пр.
1. Молекула белкового каркаса на основе доменов фибронектина типа III (FN3) для связывания с клеточной мишенью, содержащая полипептидную консенсусную последовательность множества доменов FN3 с аминокислотной последовательностью, выбранной из группы, состоящей из последовательностей SEQ ID NO:142-151.
2. Молекула по п.1 с петлями, способными к взаимодействию с мишенью, где области петель модифицированы и содержат альтернативные остатки в положениях, выбранных из группы, состоящей 13-16, 22-28, 38-43, 51-54, 60-64 и 75-81 аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO:142-151.
3. Молекула по п.2, где указанный полипептид связывается c мишенью с по меньшей мере с одним значением аффинности, выбранной из: KD, равным по меньшей мере 10-9 M, по меньшей мере 10-10 M, по меньшей мере 10-11 M, по меньшей мере 10-12 M, по меньшей мере 10-13 M, по меньшей мере 10-14 M и по меньшей мере 10-15 M, как определено методом поверхностного плазмонного резонанса или кинетического анализа исключения (Kinexa).
4. Выделенная молекула нуклеиновой кислоты, кодирующая полипептид по п.1.
5. Экспрессионный вектор, содержащий выделенную молекулу нуклеиновой кислоты по п.4.
6. Клетка-хозяин для экспрессии полипептидного каркаса, где клетка содержит вектор по п.5, и где клетка получена без разрушения эмбриона человека.
7. Клетка-хозяин по п.6, где указанная клетка-хозяин представляет собой по меньшей мере одну клетку, выбранную из E.coli BL21Star(DE3), другой клетки E.coli, дрожжевой клетки, клетки насекомого, COS-1, COS-7, HEK293, BHK21, CHO, BSC-1, Hep G2, 653, SP2/0, 293, HeLa, миеломных или лимфомных клеток.
8. Композиция для фармацевтического применения у человека, содержащая полипептидный каркас по п.1 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
9. Композиция для диагностического применения, содержащая полипептидный каркас по п.1 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
10. Композиция по п.8 или 9, дополнительно содержащая по меньшей мере одно соединение или полипептид, выбранный из группы из детектируемой метки или репортера, антагониста TNF, противоинфекционного лекарственного средства, лекарственного средства для сердечно-сосудистой системы, лекарственного средства для центральной нервной системы (ЦНС), лекарственного средства для вегетативной нервной системы (ВНС), лекарственного средства для респираторного тракта, лекарственного средства для желудочно-кишечного тракта (ЖКТ), гормонального лекарственного средства, лекарственного средства для водно-солевого баланса, гематологического лекарственного средства, противоопухолевого лекарственного средства, иммуномодулирующего лекарственного средства, лекарственного средства для органов зрения, слуха или обоняния, лекарственного средства местного действия, питательного лекарственного средства, цитокина и антагониста цитокина.
| US 20090176654 A1, 09.07.2009 | |||
| LEHMANN M | |||
| et al., Engineering proteins for thermostability: the use of sequence alignments versus rational design and directed evolution, Current opinion in biotechnology, 2001, V | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ЛУТАЙ Н | |||
| В | |||
| и др., Общая организация и роль фибронектина в норме и при патологии, Biopolymers and Cell, 2004, V | |||
Авторы
Даты
2022-03-17—Публикация
2011-04-29—Подача