ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка содержит ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, который был подан в электронном виде в формате ASCII и таким образом включен в данный документ посредством ссылки. Указанная копия ASCII, созданная 5 декабря 2017 года, называется JBI5112WOPCT_SL.txt и имеет размер 266978 байт.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к доменам типа III (FN3) фибронектина, которые специфически связываются с кластером дифференциации 8a (CD8a). Такие домены FN3 могут быть использованы, например, для терапевтической визуализации, диагностики и фармацевтической терапии. Предложены способы получения таких молекул и содержащие их диагностические агенты.
УРОВЕНЬ ТЕХНИКИ
Стремительно развивающиеся области иммунотерапии рака недавно привели к одобрению FDA нескольких новых способов иммунотерапии, и в данное время многие другие терапии проходят клинические испытания по различным видам рака. Кроме того, тщательно тестируются иммунотерапии на основе клеток, малых молекул, антител, и их комбинаций, в доклинических исследованиях для перехода к клиническому применению. Динамическое микроокружение опухоли и гетерогенность опухоли стали важными темами как в доклинических, так и в клинических исследованиях (Hanahan D, Weinberg RA. Cell 2011;144:646-74; M antovani A, Allavena P, Sica A, Balkwill F. Nature 2008; 454:436-44; Schreiber RD, Old LJ, Smyth MJ. Science 2011; 331:1565-70.), но способность наблюдать за изменениями иммунного статуса первичных поражений и метастатического рака является ограниченной. Современные способы мониторинга лимфоцитов из цельной крови или биопсий из гетерогенных опухолей не отображают динамическую и пространственную информацию, которая, вероятно, необходима для наблюдения за иммунными реакциями на терапевтическое вмешательство, многие из которых вызывают изменения количества и локализации иммунных клеток во всем теле. Таким образом, способы молекулярной визуализации, которые могут неинвазивно отслеживать как системные, так и внутриопухолевые изменения в количестве или локализации иммунных клеток во время экспериментальных терапий, способны улучшить понимание динамики иммунотерапевтического механизма с потенциалом для предоставления осуществляемых способов для прогнозирования и/или оценки иммунотерапевтических реакций.
Анализ инфильтрирующих в опухоль лимфоцитов (TIL - tumor-infiltrating lymphocytes) продемонстрировал важность иммунного микроокружения опухоли, и того, что наличие цитотоксичних CD8+ T-лимфоцитов может предсказать общую выживаемость при раке молочной железы, легких, яичников, меланоме и колоректальном раке (рассмотрено в источниках Pages F, et. al. Oncogene 2010;29:1093-102. и Gooden MJ, et al. Br J Cancer 2011;105:93-103.). Учитывая недавние клинические успехи иммунотерапий, которые изменяют иммунное микроокружение опухоли, включая адоптивный клеточный перенос (ACT - adoptive cell transfer) цитотоксических T-лимфоцитов с трансдуцированным Т-клеточным рецептором (ТКР) или рецептором химерного антигена, (Johnson LA, et al. Blood 2009;114:535-46; Rosenberg SA. Sci Transl Med 2012;4:127ps8.), агонистические антитела, нацеленные на CD137 (4-1BB) и CD40 (Melero I, et al. Clin Cancer Res 2013;19:997-1008; Melero I, et al. Nat Rev Cancer 2007;7:95-106; Vinay DS, и Kwon BS. Mol Cancer Ther 2012;11:1062-70.), и блокирование антителами ингибиторов контрольной точки CTLA-4, PD-1, и PD-L1 (Callahan MK, и Wolchok JD. J Leukoc Biol 2013;94:41-53; Shin DS, и Ribas A. Curr Opin Immunol 2015;33C:23-35; Topalian SL, et al. Cancer Cell 2015;27:450-61.), способность неинвазивного наблюдения за иммунной реакцией опухоли на терапию приобрела первостепенное значение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение включает в себя CD8A-связывающие домены типа III (FN3) фибронектина. Также описаны родственные полинуклеотиды, способные кодировать предложенные домены FN3, клетки, экспрессирующие предложенные домены FN3, а также ассоциированные векторы. Кроме того, описаны способы применения предложенных доменов FN3. Например, домены FN3 согласно данному изобретению могут быть применены для неинвазивного и количественного мониторинга наличия и количества CD8+ T-лимфоцитов.
В некоторых вариантах осуществления, данное изобретение включает в себя выделенные домены FN3, причем домены FN3 связываются с человеческим CD8A, содержащим SEQ ID NO: 35. В других вариантах осуществления, CD8A-специфичные домены FN3 связываются с CD8A человека и CD8A яванского макака. В еще других вариантах осуществления, CD8A-специфичные домены FN3 основаны на последовательности Tencon SEQ ID NO: 1. В дополнительных вариантах осуществления, CD8A-специфичные домены FN3 основаны на последовательности Tencon27 SEQ ID NO: 4. В некоторых вариантах осуществления, альбумин-специфичные домены FN3 выделяют из библиотеки, содержащей последовательность SEQ ID NO: 2, 3, 5, 6, 7 или 8. В некоторых вариантах осуществления, CD8A-специфичные домены FN3 не активируют CD8+ T-лимфоциты in vitro, как определено с помощью метода иммуноферментных пятен (ELISPOT). В некоторых вариантах осуществления, CD8A-специфичные домены FN3 связываются с человеческим CD8A с аффинностью (Kот) от около 0,02 до около 6,6 нМ, как измерено с помощью поверхностного плазмонного резонанса. В других вариантах осуществления, CD8A-специфичные домены FN3 имеют замену на цистеин в позиции остатка 54 SEQ ID NO: 79, 81, 83, 89, 122 и 68. В других вариантах осуществления, CD8A-специфичные домены FN3 содержат аминокислотную последовательность SEQ ID NO: 40-269. В других вариантах осуществления, CD8A-специфичные домены FN3 конъюгированы с меткой пригодной для обнаружения.
В дополнение к описанным CD8A-специфичным доменам FN3 также предложены полинуклеотидные последовательности, способные кодировать описанные домены FN3. Также в данном документе предложены векторы, содержащие описанные полинуклеотиды, а также клетки, экспрессирующие CD8A-специфичные домены FN3. Также описаны клетки, способные экспрессировать раскрытые векторы. Такие клетки могут представлять собой клетки млекопитающих (например, клетки 293F, клетки CHO), клетки насекомых (например, клетки Sf7), клетки дрожжей, клетки растений или клетки бактерий (например, E. coli). Также предложен способ получения описанных доменов FN3.
Данное изобретение также включает в себя способы конъюгирования или иного связывания описанных CD8A-специфичных доменов FN3 с различными молекулами для диагностических целей. Например, Zr-89 или I-124 являются идеальными партнерами по слиянию для создания диагностических агентов, способных обнаруживать присутствие CD8+ Т-лимфоцитов. Таким образом, CD8A-специфичные домены FN3 полезны в диагностике рака с использованием CD8A в качестве биомаркера.
Другой вариант осуществления изобретения представляет собой способ обнаружения CD8A-экспрессирующих клеток в биологическом образце, включающий в себя обработку биологического образца диагностическим агентом, содержащим описанные CD8A-специфичные домены FN3. Эти способы представлены в ПРИМЕРАХ.
В объем изобретения входят наборы, содержащие раскрытые CD8A-специфичные домены FN3. Наборы могут применяться для осуществления способов использования CD8A-специфичных доменов FN3, предложенных в данном документе, или других способов, известных специалистам в данной области техники. В некоторых вариантах осуществления, описанные наборы могут содержать домены FN3, описанные в данном документе, и реагенты для использования в обнаружении присутствия человеческого CD8A в биологическом образце. Описанные наборы могут содержать один или большее количество доменов FN3, описанных в данном документе, и емкость для хранения доменов FN3, когда они не используются, инструкции по использованию доменов FN3, прикрепленные к твердой подложке, и/или меченные для обнаружения формы доменов FN3, как описано в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1A-1D. Конъюгат CD8S365-DFO не активирует Т-лимфоциты de novo и не модулирует антиген-зависимую активацию Т-лимфоцитов в 24 часовом анализе ИНФγ EliSpot. ЦМВ-реактивные Т-лимфоциты обрабатывали 365-DFO в отсутствие (А) или в присутствии (В) пептидов ЦМВ. Второй реактивный донор M1 также тестировали в отсутствие (C) или в присутствии (D) пептидов M1.
Фиг. 2A и 2B. Конъюгат CD8S365-DFO не активирует Т-лимфоциты de novo и не модулирует антиген-зависимую активацию Т-лимфоцитов в 6 дневном анализе ИНФγ MSD. ЦМВ-реактивные Т-лимфоциты обрабатывали 365-DFO в отсутствие (А) или в присутствии (В) пептидов ЦМВ.
Фиг. 3. Сырьевая подготовительная ВЭЖХ малых количеств [124I]-IPEM. Подготовительную ВЭЖХ проводили с использованием бинарного ВЭЖХ-насоса Waters 1525, двухволнового детектора Waters 2489 УФ/видимого света (λ=214 и 254 нм), радиодетектора Bioscan Flow Count (B-FC-2000) и Atlantis T3, 100  , 5 мкм, колонки 150 × 4,6 мм ВЭЖХ. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% AcOH (об./об.)), растворитель B=MeCN (0,1% AcOH (об./об.)), скорость потока=1,5 мл/мин; начальное=80% A, 20 мин=0% A (линейный градиент). Поглощение множества малых молекул на записях УФ-видимого излучения при 254 нм (верхний график) и 214 нм (средний график) указывает на присутствие примесей и побочных продуктов в неочищенной реакционной смеси. Радиодетектирование (нижний график) также показывает ожидаемые пики исходного уровня из-за радиоактивно меченных примесей.
, 5 мкм, колонки 150 × 4,6 мм ВЭЖХ. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% AcOH (об./об.)), растворитель B=MeCN (0,1% AcOH (об./об.)), скорость потока=1,5 мл/мин; начальное=80% A, 20 мин=0% A (линейный градиент). Поглощение множества малых молекул на записях УФ-видимого излучения при 254 нм (верхний график) и 214 нм (средний график) указывает на присутствие примесей и побочных продуктов в неочищенной реакционной смеси. Радиодетектирование (нижний график) также показывает ожидаемые пики исходного уровня из-за радиоактивно меченных примесей.
Фиг. 4. Аналитическая ВЭЖХ малых количеств [124I]-IPEM. Аналитическую ВЭЖХ проводили с использованием бинарного ВЭЖХ-насоса Waters 1525, автосамплера Waters 2707, двухволнового детектора Waters 2489 УФ/видимого света (λ=214 и 280 нм), радиодетектора Bioscan Flow Count (B-FC-2000) и колонки ВЭЖХ Phenomenex Kinetex 5 мкм XB-C18 100  , 150 × 4,6 мм. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% TFA (об./об.)), растворитель B=MeCN (0,1% TFA (об./об.)), скорость потока=1 мл/мин; начальное=90% A, 15 мин=0% A (линейный градиент). Аналитически чистый [I-124] IPEM демонстрирует один радиоактивный пик (нижний график) с плавным исходным уровнем, подтверждающим успешную очистку. Обратите внимание, что [I-124] IPEM - это органическая малая молекула; следовательно, отсутствует поглощения при 280 нм (верхний график) и 214 нм (средний график).
, 150 × 4,6 мм. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% TFA (об./об.)), растворитель B=MeCN (0,1% TFA (об./об.)), скорость потока=1 мл/мин; начальное=90% A, 15 мин=0% A (линейный градиент). Аналитически чистый [I-124] IPEM демонстрирует один радиоактивный пик (нижний график) с плавным исходным уровнем, подтверждающим успешную очистку. Обратите внимание, что [I-124] IPEM - это органическая малая молекула; следовательно, отсутствует поглощения при 280 нм (верхний график) и 214 нм (средний график).
Фиг. 5. Радиохроматография тонкого слоя (РХТС) [124I]-IPEM CD8S365. Плашку iTLC-SG (Agilent, кат. № SGI0001) считывали на сканере визуализации РХТС Bioscan AR-2000. В плашку для РХТС (Фиг. 3) совместно наносили 1 мкл NaI (0,1 М) и проявляли, используя в качестве элюента лимонную кислоту (0,5 мМ, рН=5). Начало=20 мм, а фронт растворителя=100 мм. Элюент РХТС готовили путем растворения 96 мг лимонной кислоты (кат. № CI131 Spectrum) в 25 мл H2O Trace Select и затем добавляли Na2CO3 (245 мкл, 2 М); рН проверяли лакмусовой полоской (рН=5).
Фиг. 6. Аналитическая ВЭЖХ малых количеств очищенного [124I]-IPEM CD8S 365. Аналитическую ВЭЖХ проводили с использованием бинарного ВЭЖХ-насоса Waters 1525, автосамплера Waters 2707, двухволнового детектора Waters 2489 УФ/видимого света (λ=214 и 280 нм), радиодетектора Bioscan Flow Count (B-FC-2000) и колонки ВЭЖХ Phenomenex Kinetex 5 мкм XB-C18 100  , 150 × 4,6 мм. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% TFA (об./об.)), растворитель B=MeCN (0,1% TFA (об./об.)), скорость потока=1 мл/мин; начальное=90% A, 15 мин=0% A (линейный градиент). Показатель поглощения биомолекул (CD8S) при 280 нм (верхний график) и показатель поглощения малых молекул (I124-IPEM) при 214 нм (средний график) подтверждает успешную реакцию конъюгации. УФ и малые количества радиоактивной метки (нижний график) указывают на аналитически чистый образец.
, 150 × 4,6 мм. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% TFA (об./об.)), растворитель B=MeCN (0,1% TFA (об./об.)), скорость потока=1 мл/мин; начальное=90% A, 15 мин=0% A (линейный градиент). Показатель поглощения биомолекул (CD8S) при 280 нм (верхний график) и показатель поглощения малых молекул (I124-IPEM) при 214 нм (средний график) подтверждает успешную реакцию конъюгации. УФ и малые количества радиоактивной метки (нижний график) указывают на аналитически чистый образец.
Фиг. 7. МАЛДИ-МС IPEM CD8S365 (теоретическая ММ=10786,12). Анализ МАЛДИ-МС был выполнен в Институте биоинтерфейсов с использованием Bruker UltrafleXtreme МАЛДИ ВП/ВП в режиме положительных ионов (линейный детектор). Насыщенный раствор синапиновой кислоты готовили в растворителе TA30 (30:70 (об./об.) MeCN:0,1% TFA в воде). Образец (с=0,397 мг/мл) смешивали в соотношении 1:1 с раствором матрицы и в плашку вносили 1 мкл. Раствор белка использовали в качестве внешнего стандарта.
Фиг. 8. Ко-инъекция [124I]-IPEM CD8S365 с холодным стандартом. Аналитическую ВЭЖХ проводили с использованием бинарного ВЭЖХ-насоса Waters 1525, автосамплера Waters 2707, двухволнового детектора Waters 2489 УФ/видимого света (λ=214 и 280 нм), радиодетектора Bioscan Flow Count (B-FC-2000) и колонки ВЭЖХ Phenomenex Kinetex 5 мкм XB-C18 100  , 150 × 4,6 мм. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% TFA (об./об.)), растворитель B=MeCN (0,1% TFA (об./об.)), скорость потока=1 мл/мин; начальное=90% A, 15 мин=0% A (линейный градиент). Ко-инъекция с холодным образцом приводит к полному совпадению пиков УФ (верхний и средний графики), подтверждая молекулярную идентичность продукта (т. е. холодные и радиоактивно меченые конъюгаты идентичны, за исключением замены иода на иод-124).
, 150 × 4,6 мм. Используемый профиль элюирования был следующим: растворитель A=H2O (0,1% TFA (об./об.)), растворитель B=MeCN (0,1% TFA (об./об.)), скорость потока=1 мл/мин; начальное=90% A, 15 мин=0% A (линейный градиент). Ко-инъекция с холодным образцом приводит к полному совпадению пиков УФ (верхний и средний графики), подтверждая молекулярную идентичность продукта (т. е. холодные и радиоактивно меченые конъюгаты идентичны, за исключением замены иода на иод-124).
Фиг. 9. Репрезентативное ПЭТ-изображение, показывающее CD8S365-IPEM5, меченный радиоактивным изотопом I-124, полученное через 2 ч после инъекции. Изображение представляет собой проекцию максимальной интенсивности (передне-заднее), с селезенкой, центрированной на визире. Органы под селезенкой - это почки, а изображение ориентировано так, чтобы показать голову сверху. Поглощение в щитовидной железе является свидетельством некоторого де-иодирования белка.
Фиг. 10. Кривые зависимости активности от времени для радиоактивности в крови, у отличных от человека приматов, каждого анти-CD8A домена FN3, меченного либо Zr-89, либо I-124.
Фиг. 11A и 11B. Кривые зависимости активности от времени для радиоактивности в органах, у ОЧП, каждого центирина, меченного либо Zr-89, либо I-124. Фиг. 11A включает в себя почки, печень и селезенку, тогда как Фиг. 11B сфокусирована на селезенке. Момент времени - 24-й час для [124I]-IPEM CD8S365 отсутствует из-за технической проблемы. Высокое поглощение Zr-89 в почках из-за остаточного присутствия изотопа в значительной степени отсутствует исходя из данных I-124.
Фиг. 12А-12С. Подтверждение деплетирования CD8 Т-лимфоцитов к 3-му дню в крови, взятой у отличного от человека примата (12А). Также показаны изменения по CD4 (12B) и CD3 T-лимфоцитов (12C).
Фиг. 13. Репрезентативное изображение ПЭТ, показывающее 365 анти-CD8A домен FN3, меченный радиоактивным изотопом I-124, полученное через 2 ч после инъекции у CD8-деплетированного животного. Изображение представляет собой проекцию максимальной интенсивности (передне-заднее). Его следует сравнить с недеплетированным животным на Фиг. 9, где селезенка хорошо видна над почкой.
Фиг. 14. Кривые зависимости активность от времени для радиоактивности в крови у яванских макак, как для деплетированных, так и недеплетированных животных, после введения [124I]-IPEM CD8S365.
Фиг. 15A и 15B. Кривые зависимости активность от времени для радиоактивности в органах у яванских макак, как для деплетированных, так и недеплетированных животных. 15А включает в себя почки, печень и селезенку, в то время как 15В сфокусирована на селезенке.
Фиг. 16. Репрезентативное ПЭТ-изображение двух идентично обработанных мышей, показывающее CD8S365-IPEM, меченный радиоактивным изотопом I-124, полученное через 3 ч после инъекции. Изображение представляет собой трехмерную проекцию максимальной интенсивности, наложенную на скан из компьютерной томографии. Опухоль (образованная из HEK-293-luc, трансфицированных для сверхэкспресии huCD8+) и другие органы указаны стрелками. Поглощение в щитовидной железе является свидетельством некоторого де-иодирования белка.
Фиг. 17. Кривая зависимости активность от времени для радиоактивности в крови у мышей, имеющих опухоли из исходных либо CD8+ HEK-293-luc, либо HEK-293.
Фиг. 18. Кривая зависимости активность от времени для радиоактивности в опухоли у мышей, имеющих опухоли из исходных либо CD8+ HEK-293-luc, либо HEK-293.
Фиг. 19. Поглощение I-124 меченого CD8S365 в сверхэкспрессирующих клетках CD8 HEK293 как функция количества имплантированных клеток.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения
В описании и формуле изобретения используются различные термины, относящиеся к аспектам раскрытия изобретения. Такие термины должны иметь свое обычное значение в данной области техники, если не указано иное. Другие специально определенные термины должны толковаться таким образом, чтобы соответствовать определениям, приведенным в данном документе.
Как используется в данном описании и прилагаемой формуле изобретения, единственное число существительного включает в себя его множественное число до тех пор, пока содержание явно не указывает на иное. Таким образом, например, отсылка к «клетке» включает в себя комбинацию двух или большего количества клеток и тому подобное.
Термин «около», как применяется в данном документе, когда он относится к измеримому значению, такому как величина, промежуток времени и тому подобное, предназначен для охвата вариаций вплоть до ± 10% от указанного значения, поскольку такие вариации являются подходящими для осуществления раскрытых способов. Если не указано иное, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакции и т.д., используемые в описании и формуле изобретения, следует понимать, как модифицированные во всех случаях термином «около». Соответственно, если не указано иное, числовые параметры, изложенные в нижеследующем описании и прилагаемой формуле изобретения, являются примерными значениями, которые могут варьироваться в зависимости от желаемых свойств, которые должны быть получены с помощью данного изобретения. По меньшей мере, и не как попытка ограничить применение теории эквивалентов к объему формулы изобретения, каждый числовой параметр должен, по меньшей мере, истолковываться с учетом числа сообщаемых значащих цифр и путем применения обычных методов округления.
Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объем изобретения, являются примерными, числовые значения, приведенные в конкретных примерах, сообщаются настолько точно, насколько это возможно. Однако любое числовое значение по своей природе содержит определенные ошибки, неизбежно возникающие в результате стандартного отклонения, обнаруженного в их соответствующих тестовых измерениях.
«Выделенный» означает, что биологический компонент (такой как нуклеиновая кислота, пептид или белок) в значительной степени отделен, произведен отдельно или очищен от других биологических компонентов организма, в котором данный компонент встречается в природе, то есть других хромосомных и внехромосомных ДНК и РНК, и белков. Таким образом, нуклеиновые кислоты, пептиды и белки, которые были «выделены», включают в себя нуклеиновые кислоты и белки, очищенные стандартными способами очистки. «Выделенные» нуклеиновые кислоты, пептиды и белки могут быть частью композиции и все же быть выделенными, если такая композиция не является частью естественной среды нуклеиновой кислоты, пептида или белка. Термин также охватывает нуклеиновые кислоты, пептиды и белки, полученные путем рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные нуклеиновые кислоты. «Выделенный» домен FN3, как применяется в данном документе, предназначен для обозначения домена FN3, который по существу не содержит других доменов FN3, имеющих различные антигенные специфичности (например, выделенный домен FN3, который специфически связывается с сывороточным альбумином человека, по существу не содержит домены FN3, которые специфически связывают антигены, отличные от сывороточного альбумина человека). Однако выделенный домен FN3, который специфически связывается с эпитопом, изоформой или вариантом сывороточного альбумина человека, может иметь перекрестную реактивность с другими родственными антигенами, например, из других видов (такими как гомологи видов сывороточного альбумина).
Как применяется в данном документе термин «домен типа III (FN3) фибронектина» (домен FN3) относится к домену, часто встречающемуся в белках, включающих в себя фибронектины, тенасцин, внутриклеточные цитоскелетные белки, рецепторы цитокинов и прокариотические ферменты (Bork and Doolittle, Proc Nat Acad Sci USA 89:8990-8994, 1992; Meinke et al., J Bacteriol 175:1910-1918, 1993; Watanabe et al., J Biol Chem 265:15659-15665, 1990). Иллюстративные домены FN3 представляют собой 15 различных доменов FN3, присутствующих в человеческом тенасцине C, 15 различных доменов FN3, присутствующих в человеческом фибронектине (FN), и неприродные синтетические домены FN3, как описано, например, в патенте США № 8278419. Отдельные домены FN3 обозначаются с помощью номера домена и названия белка, например, 3-й домен FN3 тенасцина (TN3) или 10-й домен FN3 фибронектина (FN10).
Как применяется в данном документе, термин «центирин» (centyrin) относится к домену FN3, который основан на консенсусной последовательности 15 различных доменов FN3, присутствующих в тенасцине С человека.
Термин «захватывающий агент» относится к веществам, которые связываются с определенным типом клеток и позволяют отделить такую клетку от других клеток. Примеры захватывающих агентов включают в себя, но не ограничиваются лишь этими: магнитные граннулы, феррожидкости, инкапсулирующие реагенты и тому подобное.
Термин «биологический образец» относится к крови, ткани, костному мозгу, мокроте и тому подобному.
Термин «диагностический реагент» относится к любому веществу, которое может использоваться для анализа биологического образца, независимо от того, поставляется ли такое вещество в виде отдельного вещества или в комбинации с другими веществами в диагностическом наборе.
Как применяется в данном документе, термин «замещающий» или «замещенный», или «мутирующий» или «мутированный» относится к изменению, удалению или вставке одной или большего количества аминокислот или нуклеотидов в полипептидной или полинуклеотидной последовательности для создания варианта данной последовательности.
Термин «рандомизирование» или «рандомизированный» или «диверсифицированный» или «диверсифицификация», как применяется в данном документе, относится к выполнению по меньшей мере одной замены, вставки или делеции в полинуклеотидной или полипептидной последовательности.
«Вариант» в данном документе относится к полипептиду или полинуклеотиду, который отличается от исходного полипептида или исходного полинуклеотида одной или большим количеством модификаций, например заменами, вставками или делециями.
Термин «специфически связывается с» или «специфическое связывание» в данном документе относится к способности домена FN3 согласно данному изобретению связываться с заранее определенным антигеном с константой диссоциации (KД) около 1×10-6 М или меньше, например, около 1×10-7 М или меньше, около 1×10-8 М или меньше, около 1×10-9 М или меньше, около 1×10-10 М или меньше, около 1×10-11 M или меньше, около 1×10-12 М или меньше, или около 1×10-13 М или меньше. Обычно домен FN3 согласно данному изобретению связывается с заранее определенным антигеном (то есть CD8A человека) с KД, которая по меньшей мере в десять раз меньше, чем его KД для неспецифического антигена (например, BSA или казеина), как измерено поверхностным плазмонным резонансом, например, с использованием Proteon Instrument (BioRad). Однако выделенный домен FN3 согласно данному изобретению, который специфически связывается с CD8A человека, может иметь перекрестную реактивность с другими родственными антигенами, например, с тем же самым заранее определенным антигеном из других видов (ортологами), таких как Macaca Fascicularis (яванский макак) или Pan troglodytes (шимпанзе).
Термин «библиотека» относится к коллекции вариантов. Библиотека может состоять из полипептидных или полинуклеотидных вариантов.
Как применяется в данном документе, термины «CD8A» или «CD8», в частности, включают в себя белок CD8-альфа человека, например, как описано в аннотированной последовательности NCBI: NP_001139345.1, NP_0011759.3 и NP_741969.1. CD8A также известен в научной литературе как молекула CD8a, MAL, p32, Leu2, гликопротеин поверхности T-лимфоцитов, альфа-цепь CD8, антиген CD8, альфа-полипептид (p32), антиген Leu2 T-лимфоцитов, антиген OKT8 Т-лимфоцитов, T-лимфоцитарный антиген Leu2, антиген T8/Leu-2 дифференцировки Т-лимфоцитов и антиген Т8 Т-лимфоцитов.
Термин «Tencon», как применяется в данном документе, относится к синтетическому домену типа III (FN3) фибронектина, имеющему последовательность, показанную в SEQ ID NO: 1 и описанную в публикации патента США № US2010/0216708.
Термин «вектор» обозначает полинуклеотид, способный копироваться в биологической системе или который может перемещаться между такими системами. Векторные полинуклеотиды, как правило, содержат элементы, такие как точка начала репликации, сигнал полиаденилирования или маркеры отбора, которые функционируют для облегчения копирования или поддержания таких полинуклеотидов в биологической системе. Примеры таких биологических систем могут включать в себя клеточные, вирусные, животные, растительные и восстановленные биологические системы, использующие биологические компоненты, способные копировать вектор. Полинуклеотид, содержащий вектор, может представлять собой молекулу ДНК или РНК, или их гибрид.
Термин «вектор экспрессии» обозначает вектор, который может быть использован в биологической системе или в восстановленной биологической системе для управления трансляцией полипептида, кодируемого полинуклеотидной последовательностью, присутствующей в векторе экспрессии.
Термин «полинуклеотид» обозначает молекулу, содержащую цепь нуклеотидов, ковалентно соединенных с помощью сахарофосфатного остова или другой эквивалентной ковалентной химической структуры. Двух- и одноцепочечные ДНК и РНК являются типичными примерами полинуклеотидов.
Термин «полипептид» или «белок» обозначает молекулу, которая содержит, по меньшей мере, два аминокислотных остатка, соединенных пептидной связью с образованием полипептида. Небольшие полипептиды, содержащие меньше чем 50 аминокислот, могут называться «пептидами».
Как применяется в данном документе, термин «в комбинации с» означает, что два или большее количество терапевтических агентов могут быть введены субъекту вместе в смеси, одновременно в виде отдельных агентов или последовательно в виде отдельных агентов в любом порядке.
Композиция
Согласно данному изобретению предложены домены FN3, связывающиеся с CD8A человека, и домены FN3, связывающиеся с CD8A, конъюгированные с детектируемыми метками. Согласно данному изобретению предложены полинуклеотиды, кодирующие домены FN3 согласно данному изобретению или их комплементарные нуклеиновые кислоты, векторы, клетки-хозяева и способы их получения и применения.
CD8A-связывающие молекулы
Согласно данному изобретению предложены домены типа III (FN3) фибронектина, которые специфически связываются с CD8A, необязательно конъюгированные с детектируемой меткой. Данные молекулы могут широко использоваться в доклинических применениях и в диагностике рака с использованием CD8A в качестве биомаркера. Согласно данному изобретению предложены полинуклеотиды, кодирующие домены FN3 согласно данному изобретению или их комплементарные нуклеиновые кислоты, векторы, клетки-хозяева и способы их получения и применения.
Домены FN3 согласно данному изобретению связываются с CD8A с высокой аффинностью и могут локализовать клетки, экспрессирующие CD8, обеспечивая тем самым эффективный способ доставки диагностических реагентов в микроокружение опухоли.
В одном варианте осуществления изобретения, выделен домен FN3, который специфически связывается с CD8A человека, содержащий аминокислотную последовательность SEQ ID NO: 35.
В некоторых вариантах осуществления изобретения, описанных в данном документе, домен FN3 согласно данному изобретению перекрестно реагирует с CD8A яванского макака, имеющей аминокислотную последовательность SEQ ID NO: 271.
Домен FN3 согласно данному изобретению может связываться с CD8A человека, Macaca Fascicularis и/или Pan troglodytes с константой диссоциации (KД) меньшей чем около 1×10-7 M, например, меньшей чем около 1×10-8 M, меньшей чем около 1×10-9 M, меньшей чем около 1×10-10 M, меньшей чем около 1×10-11 M, меньшей чем около 1×10-12 M, или меньшей чем около 1×10-13 M, как определено поверхностным плазмонным резонансом, как это практикуется специалистами в данной области техники. Измеренная аффинность взаимодействия конкретного домена FN3 с антигеном может варьировать, при измерениях в различных условиях (например, осмолярности, pH). Таким образом, измерения аффинности и других антиген-связывающих параметров (например, KД, Kс, Kот) проводят с использованием стандартизованных растворов белкового каркаса и антигена, и стандартизированного буфера, такого как буфер, описанный в данном документе.
В некоторых вариантах осуществления, CD8A-связывающие домены FN3 содержат инициирующий метионин (Met), соединенный с N-концом молекулы.
В некоторых вариантах осуществления, CD8A-связывающие домены FN3 содержат цистеин (Cys), соединенный с доменом FN3.
Добавление N-концевого Met и/или Cys может облегчать экспрессию и/или конъюгацию других молекул.
Другим вариантом осуществления изобретения является выделенный домен FN3, который специфически связывается с CD8A человека и при этом CD8A-специфичный домен FN3 не активирует CD8+ T-лимфоциты in vitro. Активация CD8+ Т-лимфоцитов может быть измерена с использованием стандартных способов. Например, может быть использован метод иммуноферментных пятен (ELISPOT). В анализе ELISPOT используется метод сэндвич иммуноферментного анализа (ИФА). Антитело к гамма-интерферону предварительно наносят на микроплашку с PVDF (поливинилидендифторидом). Клетки, стимулированные соответствующим образом (клетки+пептиды, домены FN3 и т. д.), пипетируют в лунки и микроплашку помещают в увлажненный инкубатор с CO2 при 37°C на определенный период времени. В течение данного инкубационного периода иммобилизованное антитело к гамма-интерферону в непосредственной близости от секретирующих клеток связывается с секретируемым интерфероном гамма. После вымывания любых клеток и несвязанных веществ в лунки добавляют второе биотинилированное антитело к гамма-интерферону. После промывки для удаления любого несвязанного биотинилированного антитела добавляют щелочную фосфатазу, конъюгированную с стрептавидином. Несвязанный фермент затем удаляют промывкой и добавляют раствор субстрата (BCIP/NBT). Образуется сине-черный осадок, который проявляется в виде пятен на участках интерферон-гамма-локализации, причем каждое отдельное пятно представляет отдельную секретирующую гамма-интерферон клетку. Пятна могут быть подсчитаны с помощью автоматической системы считывания ELISpot или вручную, используя стереомикроскоп. Выделенные CD8A-связывающие домены FN3 согласно данному изобретению не активируют CD8+ T-лимфоциты in vitro при тестировании в концентрациях 1 мкМ, как описано в Примерах.
В некоторых вариантах осуществления изобретения, описанных в данном документе, выделенный домен FN3 содержит аминокислотную последовательность SEQ ID NO: 40-269.
В некоторых вариантах осуществления изобретения, описанных в данном документе, CD8A-специфичный домен FN3 имеет замену на цистеин в позиции остатка 54 SEQ ID NO: 79, 81, 83, 89, 122 и 68.
Замены, приводящие к введению цистеина в последовательность белка, могут быть использованы для химического конъюгирования малых молекул, таких как цитотоксические агенты, детектируемые метки, молекулы продления периода полужизни, хелаторы, полиэтиленгликоль и/или нуклеиновые кислоты, с доменом FN3 с использованием обычной химии.
В некоторых вариантах осуществления, домен FN3, специфически связывающийся с CD8A человека, конкурирует за связывание с CD8A человека с доменом FN3 SEQ ID NO: 229-234. Домены FN3 могут быть оценены на предмет конкуренции с референтной молекулой за связывания с CD8A человека с использованием хорошо известных способов in vitro. В одном иллюстративном способе, клетки HEK, рекомбинантно экспрессирующие CD8A человека, можно инкубировать с немеченой референтной молекулой в течение 15 минут при 4°C с последующей инкубацией с избытком флуоресцентно меченного тестового домена FN3 в течение 45 минут при 4°C. После промывки в ФСБ/БСА флуоресценция может быть измерена с помощью проточной цитометрии с использованием стандартных способов. В другом иллюстративном способе, внеклеточная часть CD8A человека может быть нанесена на поверхность плашки для ИФА. Избыток немеченой референтной молекулы может быть добавлен в течение примерно 15 минут, и затем могут быть добавлены биотинилированные тестируемые домены FN3. После промывок в ФСБ/Tween связывание тестируемого биотинилированного домена FN3 может быть обнаружено с использованием стрептавидина, конъюгированного с пероксидазой хрена (HRP), а сигнал обнаружен с использованием стандартных способов. Очевидно, что в конкурентных анализах референтная молекула может быть мечена, а тестируемый домен FN3 не мечен. Тестируемый домен FN3 может конкурировать с референтной молекулой, когда референтная молекула ингибирует связывание тестируемого домена FN3, или тестируемый домен FN3 ингибирует связывание референтной молекулы на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 100%.
В некоторых вариантах осуществления, выделенный домен FN3, который специфически связывается с CD8A человека согласно данному изобретению, конъюгирован с хелатором, который может связываться с радиоактивным металлом, и может использоваться в качестве визуализирующего агента для оценки распространения опухоли, диагностики наличия CD8-T-лимфоцитов внутри опухолей и/или эффективности лечения рака.
В некоторых вариантах осуществления, CD8A-специфичные домены FN3 удаляются из крови почечным и/или печеночным клиренсом.
Выделение CD8A-связывающих доменов FN3 из библиотеки на основе последовательности Tencon
Tencon (SEQ ID NO: 1) представляет собой не встречающийся в природе домен типа III (FN3) фибронектина, сконструированный из консенсусной последовательности пятнадцати доменов FN3 из человеческого тенасцина-C (Jacobs et al., Protein Engineering, Design and Selection, 25:107-117, 2012; публикация патента США № 2010/0216708). Кристаллическая структура Tencon демонстрирует шесть экспонированных на поверхности петель, которые соединяют семь бета-листов, что характерно для доменов FN3, бета-листы обозначаются как A, B, C, D, E, F и G, и петли обозначаются как AB, BC, CD, DE, EF и FG (Bork and Doolittle, Proc Natl Acad Sci USA 89:8990-8992, 1992; патент США № 6673901). Данные петли или выбранные остатки в каждой петле могут быть рандомизированы для конструирования библиотек доменов типа III (FN3) фибронектина, которые могут быть использованы для отбора новых молекул, которые связываются с CD8A. В Таблице 1 показаны позиции и последовательности каждой петли и бета-листа в Tencon (SEQ ID NO: 1).
Библиотека, спроектированная на основе последовательности Tencon, может, таким образом, иметь рандомизированную петлю FG или рандомизированные петли BC и FG, например, как библиотеки TCL1 или TCL2, как описано ниже. Петля Tencon BC имеет длину 7 аминокислот, таким образом, 1, 2, 3, 4, 5, 6 или 7 аминокислот могут быть рандомизированы в библиотеке, модифицированной по петле BC и спроектированной на основе последовательности Tencon. Петля Tencon FG имеет длину 7 аминокислот, таким образом, 1, 2, 3, 4, 5, 6 или 7 аминокислот могут быть рандомизированы в библиотеке, модифицированной по петле FG и спроектированной на основе последовательности Tencon. Дополнительное разнообразие в петлях в библиотеках Tencon может быть достигнуто путем вставки и/или делеции остатков в петлях. Например, петли FG и/или BC могут быть удлинены на 1-22 аминокислоты или укорочены на 1-3 аминокислоты. Петля FG в Tencon имеет длину 7 аминокислот, тогда как соответствующая петля в тяжелых цепях антител варьирует от 4-28 остатков. Чтобы обеспечить максимальное разнообразие, петля FG может быть модифицирована по последовательности, а также по длине, чтобы соответствовать диапазону длин CDR3 антитела, который составляет 4-28 остатков. Например, петля FG может быть дополнительно модифицирована по длине путем удлинения петли на дополнительные 1, 2, 3, 4 или 5 аминокислот.
Библиотека, спроектировання на основе последовательности Tencon, также может иметь рандомизированные альтернативные поверхности, которые образуются на боковой поверхности домена FN3 и содержат два или больше количество бета-листов и, по меньшей мере, одну петлю. Одна такая альтернативная поверхность сформирована аминокислотами в бета-листах C и F, и в петлях CD и FG (поверхность C-CD-F-FG). Дизайн библиотеки на основе альтернативной поверхности C-CD-F-FG Tencon описан в публикации патента США № US2013/0226834. Библиотека, спроектированная на основе последовательности Tencon, также включает в себя библиотеки, спроектированные на основе вариантов Tencon, таких как варианты Tencon, имеющие замены в аминокислотных позициях 11, 14, 17, 37, 46, 73 или 86 (нумерация остатков, соответствующая SEQ ID NO: 1), и варианты которых показывают улучшение термостабильности. Иллюстративные варианты Tencon описаны в публикации патента США № 2011/0274623 и включают в себя Tencon27 (SEQ ID NO: 4), имеющий замены E11R, L17A, N46V и E86I по сравнению с Tencon SEQ ID NO: 1.
Таблица 1. Топология Tencon
Tencon и другие библиотеки на основе последовательности FN3 могут быть рандомизированы по выбранных аминокислотных позициях с использованием случайного или определенного набора аминокислот. Например, варианты в библиотеке, имеющие случайные замены, могут быть созданы с использованием кодонов NNK, которые кодируют все 20 встречающихся в природе аминокислот. В других схемах увеличения разнообразия, могут использоваться кодоны DVK для кодирования аминокислот Ala, Trp, Tyr, Lys, Thr, Asn, Lys, Ser, Arg, Asp, Glu, Gly и Cys. В альтернативном варианте, могут быть использованы кодоны NNS для получения всех 20 аминокислотных остатков и одновременного снижения частоты стоп-кодонов. Библиотеки доменов FN3 с смещенным распределением аминокислот в позициях, подлежащих увеличению разнообразия, могут быть синтезированы, например, с использованием технологии Slonomics® (http:_//www_sloning_com). Данная технология использует библиотеку предварительно подготовленных двухцепочечных триплетов, которые действуют как универсальные строительные блоки в достаточном количестве для тысяч процессов синтеза генов. Библиотека триплетов представляет все возможные комбинации последовательностей, необходимые для построения любой желаемой молекулы ДНК. Обозначения кодонов соответствуют хорошо известному коду IUB.
Домены FN3, специфически связывающие CD8A человека согласно данному изобретению, могут быть выделены путем создания библиотеки FN3, такой как библиотека Tencon, с использованием cis-дисплея для лигирования фрагментов ДНК, кодирующих каркасные белки, с фрагментом ДНК, кодирующим RepA, для создания пула комплексов белок-ДНК, сформированных после трансляции in vitro, причем каждый белок стабильно связан с ДНК, кодирующей его (патент США № 7842476; Odegrip et al., Proc Natl Acad Sci U S A 101, 2806-2810, 2004), и анализируя библиотеку на специфическое связывание с CD8A любым способом, известным в данной области техники и описанным в Примере. Примерами хорошо известных способов, которые могут быть использованы, являются ИФА, сэндвич-иммуноанализ, и конкурентные и неконкурентные анализы (смотрите, например, Ausubel et al., eds, 1994, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York). Идентифицированные домены FN3, специфически связывающие CD8A, дополнительно характеризуются их ингибированием активности CD8A, интернализацией, стабильностью и другими желаемыми характеристиками.
Домены FN3, специфически связывающие CD8A человека согласно данному изобретению, могут быть получены с использованием любого домена FN3 в качестве матрицы для создания библиотеки и скрининга библиотеки на предмет молекул, специфически связывающих CD8A человека, с использованием способов, предусмотренных в нем. Примерами доменов FN3, которые могут быть использованы, являются 3-й домен FN3 тенасцина C (TN3) (SEQ ID NO: 145), Фибкон (SEQ ID NO: 146) и 10-й домен FN3 фибронектина (FN10) (SEQ ID NO: 147). Применяют стандартные методы клонирования и экспрессии для клонирования библиотек в вектор или для синтеза двухцепочечных кассет кДНК библиотеки, для экспрессии или трансляции библиотек in vitro. Например, может быть использован рибосомный дисплей (Hanes and Pluckthun, Proc Natl Acad Sci USA, 94, 4937-4942, 1997), мРНК дисплей (Roberts and Szostak, Proc Natl Acad Sci USA, 94, 12297-12302, 1997), или другие бесклеточные системы (патент США № 5643768). Библиотеки вариантов домена FN3 могут быть экспрессированны в виде гибридных белков, экспонируемых на поверхности, например, любого подходящего бактериофага. Способы экспонирования гибридных полипептидов на поверхности бактериофага хорошо известны (публикация патента США № 2011/0118144; публикация международного патента № WO2009/085462; патент США № 6969108; патент США № 6172197; патент США № 5223409; патент США № 6582915; патент США № 6472147).
В некоторых вариантах осуществления изобретения, описанных в данном документе, домен FN3, специфически связывающий CD8A человека, основан на последовательности Tencon SEQ ID NO: 1 или последовательности Tencon27 SEQ ID NO: 4, SEQ ID NO: 1 или SEQ ID NO: 4, необязательно имеющий «замены» в аминокислотных позициях 11, 14, 17, 37, 46, 73 и/или 86.
Домены FN3, специфически связывающие CD8A человека согласно данному изобретению, могут быть модифицированы для улучшения их свойств, таких как улучшение термостабильности и обратимости термического свертывания и развертывания. Были применены несколько способов для увеличения наблюдаемой термостабильности белков и ферментов, включающие в себя: рациональный дизайн, основанный на сравнении с очень похожими термостабильными последовательностями, конструирование стабилизирующих дисульфидных мостиков, мутации для увеличения склонности к формированию альфа-спирали, конструирование солевых мостиков, изменение поверхностного заряда белка, направленную эволюцию, и компоновку консенсусных последовательностей (Lehmann and Wyss, Curr Opin Biotechnol, 12, 371-375, 2001). Высокая термостабильность может увеличивать выход экспрессированного белка, улучшать растворимость или активность, снижать иммуногенность и минимизировать потребность в холодильной цепи в производстве. Остатки, которые могут быть замещены для улучшения термической стабильности Tencon (SEQ ID NO: 1), представляют собой остатки в позициях 11, 14, 17, 37, 46, 73 или 86, и описаны в публикации патента США № 2011/0274623. Замены, соответствующие таким остаткам, могут быть включены в домен FN3, содержащий молекулы согласно данному изобретению.
Измерение стабильности белка и лабильности белка можно рассматривать как одинаковые или разные аспекты целостности белка. Белки чувствительны или «лабильны» к денатурации, вызванной теплом, ультрафиолетовым или ионизирующим излучением, изменениями осмолярности окружающей среды и pH в жидком растворе, силой механического сдвига, создаваемой фильтрацией через поры небольших размеров, ультрафиолетовым излучением, ионизирующим излучением, таким как гамма-излучением, химическим или тепловым обезвоживанием, или любым другим действием или силой, которые могут вызвать нарушение структуры белка. Стабильность молекулы можно определить с помощью стандартных способов. Например, стабильность молекулы может быть определена путем измерения температуры термического плавления («Tm»), температуры в ° Цельсия (°C), при которой половина молекул разворачивается, с использованием стандартных способов. Как правило, чем выше Tm, тем стабильнее молекула. Помимо тепла, химическая среда также изменяет способность белка поддерживать определенную трехмерную структуру.
В одном варианте осуществления, домены FN3, специфически связывающие CD8A человека согласно данному изобретению, могут проявлять увеличенную стабильность по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или больше по сравнению с тем же доменом до конструирования, как измерено по увеличению Tm.
Химическая денатурация также может быть измерена различными способами. Химические денатурирующие вещества включают в себя: гуанидина гидрохлорид, гуадинина тиоцианат, мочевину, ацетон, органические растворители (ДМФ, бензол, ацетонитрил), соли (сульфат аммония, бромид лития, хлорид лития, бромид натрия, хлорид кальция, хлорид натрия); восстановители (например, дитиотрейтол, бета-меркаптоэтанол, динитротиобензол и гидриды, такие как борогидрид натрия), неионные и ионные детергенты, кислоты (например, соляную кислоту (HCl), уксусную кислоту (CH3COOH), галогенированные уксусные кислоты), гидрофобные молекулы (например, фософолипиды) и целевые денатураторы. Количественная оценка степени денатурации может основываться на потере функциональных свойств, таких как способность связывать молекулу-мишень, или на физико-химических свойствах, таких как склонность к агрегации, экспонирование ранее недоступных для растворителя остатков, или разрушение или образование дисульфидных связей.
Домены FN3 согласно данному изобретению могут получать в виде мономеров, димеров или мультимеров, например, в качестве способа увеличения валентности и, следовательно, авидности связывания молекулы-мишени, или для создания би- или мультиспецифических каркасов, одновременно связывающих две или большее количество различных молекул-мишеней. Димеры и мультимеры могут быть получены путем соединения моноспецифических, би- или мультиспецифических белковых каркасов, например, путем включения аминокислотного линкера, например, линкера, содержащего полиглицин, глицин и серин, или аланин и пролин. Иллюстративный линкер включает в себя (GS)2, (SEQ ID NO: 148), (GGGS)2 (SEQ ID NO: 149), (GGGGS)5 (SEQ ID NO: 150), (AP)2 (SEQ ID NO: 151), (AP)5 (SEQ ID NO: 152), (AP)10 (SEQ ID NO: 153), (AP)20 (SEQ ID NO: 154) и A(EAAAK)5AAA (SEQ ID NO: 142). Димеры и мультимеры могут быть соединены друг с другом в направлении от N- до C-конца. Использование природных, а также искусственных пептидных линкеров для соединения полипептидов в нове соединенные гибридные полипептиды хорошо известно в литературе (Hallewell et al., J Biol Chem 264, 5260-5268, 1989; Alfthan et al., Protein Eng. 8, 725-731, 1995; Robinson & Sauer, Biochemistry 35, 109-116, 1996; патент США № 5856456).
Диагностические агенты
Согласно изобретению, CD8A-специфичный домен FN3 согласно данному изобретению может содержать метку пригодную для обнаружения. В одном варианте осуществления, метка пригодная для обнаружения может образовывать комплекс с хелатирующим агентом, который конъюгирован с доменом FN3. В другом варианте осуществления, метка пригодная для обнаружения может образовывать комплекс с хелатирующим агентом, который конъюгирован с линкером, который конъюгирован с доменом FN3. В еще одном варианте осуществления, метка пригодная для обнаружения может быть соединена с линкером, который конъюгирован с доменом FN3. В еще одном варианте осуществления, метка пригодная для обнаружения может быть не прямо присоединена к пептиду согласно данному изобретению из-за способности метки специфически связываться со второй молекулой. Одним из примеров такого типа не прямо прикрепленной метки является биотиновая метка, которая может быть специфически связана с второй молекулой, стрептавидином. Одинарное, двойное или множественное мечение может быть выгодным. Как применяется в данном документе, термин «метка пригодная для обнаружения» представляет собой метку любого типа, которая, будучи присоединенной к домену FN3 согласно данному изобретению, делает пригодным для обнаружения домен FN3. Обнаруживаемая метка также может быть токсичной для клеток или цитотоксичной. В целом, как правило, метки пригодные для обнаружения могут включать в себя люминесцентные молекулы, хемилюминесцентные молекулы, флуорохромы, флуорофоры, гасящие флуоресценцию агенты, цветные молекулы, радиоизотопы, радионуклиды, цинтиллянты, массивные метки, такие как атом металла (для обнаружения через изменения массы), биотин, авидин, стрептавидин, белок A, белок G, антитела или их фрагменты, Grb2, полигистидин, Ni2+, тэги Flag, тэги myc, тяжелые металлы, ферменты, щелочную фосфатазу, пероксидазу, люциферазу, доноры/акцепторы электронов, эфиры акридиния и колориметрические субстраты. В конкретном варианте осуществления, метка пригодная для обнаружения представляет собой радионуклид. Специалист в данной области техники легко распознает другие полезные метки, которые не упомянуты выше, которые могут быть использованы в осуществление данного изобретения.
Обнаруживаемая метка испускает сигнал, который может быть обнаружен машиной для преобразования сигнала. В некоторых случаях, метка пригодная для обнаружения может испускать сигнал самопроизвольно, например, когда метка пригодная для обнаружения представляет собой радионуклид. В других случаях, метка пригодная для обнаружения испускает сигнал в результате стимуляции внешним полем, например, когда метка пригодная для обнаружения представляет собой металл, способствующий релаксации. Примеры сигналов включают в себя, без ограничения, гамма-лучи, рентгеновские лучи, видимый свет, инфракрасную энергию и радиоволны. Примеры машин для преобразования сигнала включают в себя, без ограничения, гамма-камеры, включающие в себя устройства ОФЭКТ-КТ, ПЭТ-сканеры, флуориметры и машины для магнитно-резонансной томографии (MRI). По существу, метка пригодная для обнаружения содержит метку, которая может быть обнаружена с использованием магнитно-резонансной томографии, сцинтиграфической визуализации, ультразвука или флуоресценции. Подходящие флуорофоры включают в себя, но не ограничиваются лишь этими: флуоресцеин изотиоцианат (FITC), флуоресцеин тиосемикарбазид, родамин, Texas Red, CyDyes (например, Cy3, Cy5, Cy5.5), Alexa Fluors (например, Alexa488, Alexa555, Alexa594; Alexa647), флуоресцентные красители ближнего инфракрасного (NIR) (700-900 нм), и карбоцианиновый и аминостириловый красители. Домен FN3 согласно данному изобретению может быть помечен для обнаружения флуоресценции, путем мечения агента флуорофором, используя методы, хорошо известные в данной области техники (смотрите, например, Lohse et al., Bioconj Chem 8:503-509 (1997)). Например, многие известные красители способны связываться с NH2-концевыми аминокислотными остатками. В альтернативном варианте, флуорохром, такой как флуоресцеин, может быть соединен с остатком лизина пептидного линкера.
Радионуклид может представлять собой γ-излучающий радионуклид, Оже-излучающий радионуклид, β-излучающий радионуклид, альфа-излучающий радионуклид или позитрон-излучающий радионуклид. Радионуклид может быть меткой пригодной для обнаружения и/или цитотоксическим агентом. Неограничивающие примеры подходящих радионуклидов могут включать в себя: углерод-11, азот-13, кислород-15, фтор-18, фтордезоксиглюкозу-18, фосфор-32, скандий-47, медь-64, 65 и 67, галлий-67 и 68, бром-75, 77 и 80м, рубидий-82, стронций-89, цирконий-89, иттрий-86 и 90, рутений-95, 97, 103 и 105, рений-99м, 101, 105, 186 и 188, технеций-99м, родий-105, ртуть-107, палладий-109, индий-111, серебро-111, индий-113м, лантанид-114м, олово-117м, теллур-121м, 122м и 125м, иод-122, 123, 124, 125, 126, 131 и 133, празеодим-142, прометий-149, самарий-153, гадолиний-159, тулий-165, 167 и 168, диспрозий-165, гольмий-166, лютеций-177, рений-186 и 188, иридий-192, платина-193 и 195м, золото-199, таллий-201, титан-201, астат-21 1, висмут-212 и 213, свинец-212, радий-223, актиний-225, и нитридные или оксидные формы полученные из них. В конкретном варианте осуществления, радионуклид выбирают из группы, состоящей из меди-64, циркония-89, иттрия-90, индия-111 и лютеция-177. В другом конкретном варианте осуществления, радионуклид выбирают из группы, состоящей из иттрия-90, индия-111 и лютеция-177. В иллюстративном варианте осуществления, радионуклид представляет собой цирконий-89.
В качестве метки пригодной для обнаружения могут быть использованы различные атомы металла. Атом металла в целом, как правило, может быть выбран из группы атомов металла, состоящей из металлов с атомным номером двадцать или больше. Например, атомами металла могут быть атомы кальция, атомы скандия, атомы титана, атомы ванадия, атомы хрома, атомы марганца, атомы железа, атомы кобальта, атомы никеля, атомы меди, атомы цинка, атомы галлия, атомы германия, атомы мышьяка, атомы селена, атомы брома, атомы криптона, атомы рубидия, атомы стронция, атомы иттрия, атомы циркония, атомы ниобия, атомы молибдена, атомы технеция, атомы рутения, атомы родия, атомы палладия, атомы серебра, атомы кадмия, атомы индия, атомы олова, атомы сурьмы, атомы теллура, атомы иода, атомы ксенона, атомы цезия, атомы бария, атомы лантана, атомы гафния, атомы тантала, атомы вольфрама, атомы рения, атомы осмия, атомы иридия, атомы платины, атомы золота, атомы ртути, атомы таллия, атомы свинца, атомы висмута, атомы франция, атомы радия, атомы актиния, атомы церия, атомы празеодима, атомы неодима, атомы прометия, атомы самария, атомы европия, атомы гадолиния, атомы тербия, атомы диспрозия, атомы гольмия, атомы эрбия, атомы тулия, атомы иттербия, атомы лютеция, атомы тория, атомы протактиния, атомы урана, атомы нептуния, атомы плутония, атомы америция, атомы кюрия, атомы берклия, атомы калифорния, атомы эйнштейния, атомы фермия, атомы менделевия, атомы нобелия или атомы лоренция. В некоторых вариантах осуществления, атомы металлов могут быть выбраны из группы, включающей в себя щелочные металлы с атомным номером больше чем двадцать. В других вариантах осуществления, атомы металлов могут быть выбраны из группы, включающей в себя щелочноземельные металлы с атомным номером больше чем двадцать. В одном варианте осуществления, атомы металлов могут быть выбраны из группы металлов, включающей в себя лантаноиды. В другом варианте осуществления, атомы металлов могут быть выбраны из группы металлов, включающей в себя актиниды. В еще одном варианте осуществления, атомы металлов могут быть выбраны из группы металлов, включающей в себя переходные металлы. В еще одном варианте осуществления, атомы металлов могут быть выбраны из группы металлов, включающей в себя легкие металлы. В других вариантах осуществления, атомы металлов могут быть выбраны из группы, включающей в себя атомы золота, атомы висмута, атомы тантала и атомы гадолиния. В предпочтительных вариантах осуществления, атомы металлов могут быть выбраны из группы, включающей в себя металлы с атомным номером от 53 (то есть, иод) до 83 (то есть, висмут). В альтернативном варианте осуществления, атомы металлов могут быть атомами, подходящими для магнитно-резонансной томографии. В другом альтернативном варианте осуществления, атомы металлов могут быть выбраны из группы, состоящей из металлов, которые имеют K-край в рентгеновской энергетической полосе КТ. Предпочтительные атомы металлов включают в себя, но не ограничиваются лишь этими: марганец, железо, гадолиний, золото и иод.
Атомы металла могут быть ионами металла в форме +1, +2 или +3 степени окисления. Например, неограничивающие примеры включают в себя Ba2+, Bi3+, Cs+, Ca2+, Cr2+, Cr3+, Cr6+, Co2+, Co3+, Cu+, Cu2+, Cu3+, Ga3+, Gd3+, Au+, Au3+, Fe2+, Fe3+, F3+, Pb2+, Mn2+, Mn3+, Mn4+, Mn7+, Hg2+, Ni2+, Ni3+, Ag+, Sr2+, Sn2+, Sn4+, и Zn2+. Атомы металла могут включать в себя оксид металла. Например, неограничивающие примеры оксидов металлов могут включать в себя оксид железа, оксид марганца или оксид гадолиния. Дополнительные примеры могут включать магнетит, маггемит или их комбинацию.
Согласно изобретению домен FN3, содержащий хелатирующий агент, может содержать радионуклид или атом металла. Включение радионуклида или атома металла в комплекс домен FN3-хелатирующий агент может быть достигнуто различными способами, общепринятыми в области координационной химии.
Фрагменты, продлевающие период полужизни.
Домен FN3, специфически связывающий CD8A человека согласно данному изобретению, может соединятся с другими субъединицами, например, посредством ковалентного взаимодействия. В одном аспекте изобретения, домен FN3 согласно данному изобретению дополнительно содержит фрагмент, увеличивающий время полужизни. Иллюстративными фрагментами, увеличивающими время полужизни, являются альбумин, варианты альбумина, альбумин-связывающие белки и/или домены, трансферрин и его фрагменты и их аналоги, а также области Fc.
В домен FN3 согласно данному изобретению могут быть включены дополнительные фрагменты, такие как молекулы полиэтиленгликоля (ПЭГ), такие как ПЭГ 5000 или ПЭГ 20000, жирные кислоты и сложные эфиры жирных кислот с различной длиной цепи, например лаурат, миристат, стеарат, арахидат, бегенат, олеат, арахидонат, октандиоевая кислота, тетрадекандиоевая кислота, октадекандиоевая кислота, докозандиоевая кислота и тому подобное, полилизин, октан, углеводы (декстран, целлюлоза, олиго- или полисахариды) для желаемых свойств. Такие фрагменты могут быть прямыми гибридами с последовательностями, кодирующими белковый каркас, и могут быть получены стандартными методами клонирования и экспрессии. В альтернативном варианте, хорошо известные способы химического соединения могут быть использованы для присоединения фрагментов к рекомбинантно полученным молекулам согласно данному изобретению.
ПЭГ-льный фрагмент может, например, быть добавлен к домену FN3 согласно данному изобретению путем включения остатка цистеина в С-конец молекулы, или путем конструирования цистеинов в позициях остатков, которые обращены от поверхности молекулы, связывающей CD8A человека, и присоединения ПЭГ-льной группы к цистеину с использованием хорошо известных способов. Домен FN3 согласно данному изобретению, включающий в себя дополнительные фрагменты, можно сравнить по функциональности несколькими хорошо известными анализами. Например, измененные свойства вследствие внесения доменов Fc и/или вариантов доменов Fc могут быть проанализированы в анализах связывания рецептором Fc с использованием растворимых форм рецепторов, таких как рецепторы FcγRI, FcγRII, FcγRIII или FcRn, или с использованием хорошо известных клеточных анализов, измеряющих, например, АЗКЦ или КЗЦ (комплемент зависимую цитотоксичность), или оценивающих фармакокинетические свойства молекул согласно данному изобретению на моделях in vivo.
Полинуклеотиды, векторы, клетки-хозяева
Согласно данному изобретению предложены нуклеиновые кислоты, кодирующие домены FN3, специфически связывающие CD8A человека согласно данному изобретению, в виде выделенных полинуклеотидов или в виде частей векторов экспрессии, или в виде частей линейных последовательностей ДНК, включая линейные последовательности ДНК, используемые для транскрипции/трансляции in vitro, векторы, совместимые по экспрессии с прокариотами, эукариотами или нитевидными фагами, секреция и/или представление композиций или их прямых мутантов. В данном документе раскрыты некоторые иллюстративные полинуклеотиды, однако другие полинуклеотиды, которые, учитывая вырожденность генетического кода или предпочтения кодонов в данной системе экспрессии, кодируют домены FN3 согласно данному изобретению, также входят в объем изобретения.
Одним вариантом осуществления изобретения является выделенный полинуклеотид, кодирующий домен FN3, специфически связывающий CD8A человека, содержащий аминокислотную последовательность SEQ ID NO: 40-269.
Полинуклеотиды согласно данному изобретению могут быть получены химическим синтезом, таким как твердофазный синтез полинуклеотидов, на автоматическом синтезаторе полинуклеотидов, и собраны в полные одноцепочечные или двухцепочечные молекулы. В альтернативном варианте, полинуклеотиды согласно данному изобретению могут быть получены другими способами, такими как ПЦР, с последующим обычным клонированием. Методы продуцирования или получения полинуклеотидов заданной известной последовательности хорошо известны в данной области техники.
Полинуклеотиды согласно данному изобретению могут содержать по меньшей мере одну некодирующую последовательность, такую как последовательность промотора или энхансера, интрон, сигнал полиаденилирования, cis-последовательность, облегчающую связывание RepA, и тому подобное. Полинуклеотидные последовательности также могут содержать дополнительные последовательности, кодирующие дополнительные аминокислоты, которые кодируют, например, последовательность маркера или тэга, такого как гистидиновый тэг или тэг HA, для облегчения очистки или обнаружения белка, сигнальную последовательность, партнера гибридного белка, такого как RepA, Fc, или белок оболочки бактериофага, такой как pIX или pIII.
Другим вариантом осуществления изобретения является вектор, содержащий по меньшей мере один полинуклеотид согласно данному изобретению. Такими векторами могут быть плазмидные векторы, вирусные векторы, векторы для бакуловирусной экспрессии, векторы на основе транспозонов или любой другой вектор, подходящий для введения полинуклеотидов согласно данному изобретению в данный организм или генотип любым способом. Такие векторы могут быть векторами экспрессии, содержащими элементы последовательности нуклеиновой кислоты, которые могут контролировать, регулировать, вызывать или разрешать экспрессию полипептида, кодируемого таким вектором. Такие элементы могут содержать сайты связывания энхансера транскрипции, сайты инициации РНК-полимеразы, сайты связывания рибосом и другие сайты, которые облегчают экспрессию кодируемых полипептидов в данной системе экспрессии. Такие системы экспрессии могут быть клеточными или бесклеточными системами, хорошо известными в данной области техники.
Другим вариантом осуществления изобретения, является клетка-хозяин, содержащая вектор согласно данному изобретению. Домен FN3, специфически связывающий человеческий CD8A согласно данному изобретению, может быть необязательно продуцирован клеточной линией, смешанной клеточной линией, иммортализованной клеткой или клональной популяцией иммортализованных клеток, как это хорошо известно в данной области техники. Смотрите, например, Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1997-2001).
Клетка-хозяин, выбранная для экспрессии, может происходить из млекопитающего, или может быть выбрана из COS-1, COS-7, HEK293, BHK21, CHO, BSC-1, He G2, SP2/0, HeLa, миеломы, лимфомы, дрожжей, насекомых или клетки растений, или любых их производных, иммортализованных или трансформированных клеток. В альтернативном варианте, клетка-хозяин может быть выбрана из вида или организма, неспособных к гликозилированию полипептидов, например, прокариотической клетки или организма, таких как BL21, BL21 (DE3), BL21-GOLD (DE3), XL1-Blue, JM109, HMS174, HMS174 (DE3) и любых природных или сконструированных штаммов E. coli spp, Klebsiella spp., или Pseudomonas spp.
Другой вариант осуществления изобретения представляет собой способ получения выделенного домена FN3, специфически связывающего CD8A человека согласно данному изобретению, включающий в себя культивирование выделенной клетки-хозяина согласно данному изобретению в условиях, при которых экспрессируется выделенный домен FN3, специфически связывающий CD8A человека, и очистку домена FN3.
Домен FN3, специфически связывающий CD8A человека, может быть очищен из рекомбинантных клеточных культур хорошо известными способами, например, очисткой белком A, осаждением сульфатом аммония или этанолом, кислотной экстракцией, анионообменной или катионообменной хроматографией, фосфоцеллюлозной хроматографией, хроматографией гидрофобного взаимодействия, аффинной хроматографией, гидроксилапатитной хроматографией и лектиновой хроматографией, или высокоэффективной жидкостной хроматографией (ВЭЖХ).
Наборы для обнаружения CD8A человека
В данном документе предложены наборы для обнаружения CD8A в биологическом образце. Данные наборы содержат один или большее количество CD8A-специфичных доменов FN3, описанных в данном документе, и инструкции по применению набора.
Предложенный CD8A-специфичный домен FN3 может быть в растворе; лиофилизированным; нанесенным на подложку, носитель или плашку; или меченым для обнаружения.
Описанные наборы также могут содержать дополнительные компоненты, полезные для выполнения способов, описанных в данном документе. Например, наборы могут содержать средства для получения образца из субъекта, контрольного или референтного образца, например, образца из субъекта с медленно прогрессирующим раком и/или субъекта, не имеющего рак, один или несколько отсеков для образца, и/или инструкцию, которая описывает выполнение способа согласно данному изобретению, и специфические тканевые контроли или стандарты.
Средства для определения уровня CD8A могут дополнительно включать в себя, например, буферы или другие реагенты для использования в анализе для определения уровня CD8A. Инструкции могут быть, например, печатными инструкциями для проведения анализа и/или инструкциями по оценке уровня CD8A.
Описанные наборы могут также содержать средства для выделения образца из субъекта. Такие средства могут включать в себя один или большее количество элементов оборудования или реагентов, которые можно использовать для получения жидкости или ткани из субъекта. Средства для получения образца из субъекта также могут включать в себя средства для выделения компонентов крови, таких как сыворотка, из образца крови. Предпочтительно набор предназначен для использования человеком.
Применение человеческих CD8A-связывающих доменов FN3 согласно данному изобретению
Домены FN3, специфически связывающие CD8A человека согласно данному изобретению, могут быть использованы для диагностики заболеваний человека или специфических патологий в клетках, тканях, органах, жидкости или, как правило, у хозяина, используя CD8A в качестве биомаркера. Способы согласно данному изобретению могут быть использованы на животных, принадлежащих к любой классификации. Примеры таких животных включают в себя млекопитающих, таких как люди, грызуны, собаки, кошки и сельскохозяйственные животные.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Согласно данному изобретению также предложены следующие неограничивающие варианты осуществления.
1) Выделенный домен FN3, который специфически связывает белок CD8A человека, содержащий аминокислотную последовательность SEQ ID NO: 35.
2) Выделенный домен FN3 по варианту осуществления 1, причем домен FN3 перекрестно реагирует с белком CD8A яванского макака, содержащим аминокислотную последовательность SEQ ID NO: 271.
3) Выделенный домен FN3 по варианту осуществления 2, причем
домен FN3 основан на последовательности Tencon SEQ ID NO: 1;
домен FN3 основан на последовательности Tencon27 SEQ ID NO: 4; и/или
домен FN3 выделен из библиотеки, содержащей последовательность SEQ ID NO: 2, 3, 5, 6, 7 или 8.
4) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 конъюгирован с второй молекулой.
5) Выделенный домен FN3 по варианту осуществления 4, причем вторая молекула представляет собой детектируемую метку.
6) Выделенный домен FN3 по варианту осуществления 5, причем метка пригодная для обнаружения представляет собой радиоактивный изотоп, магнитные гранулы, металлические гранулы, коллоидные частицы, флуоресцентный краситель, электронно-плотный реагент, фермент, биотин, дигоксигенин или гаптен.
7) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 имеет замену на цистеин в позиции остатка 54 SEQ ID NO: 79, 81, 83, 89, 122 и 68.
8) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 не активирует CD8+ T-лимфоциты in vitro, как измерено с помощью метода иммуноферментных пятен (ELISPOT).
9) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 конкурирует за связывание с белком CD8A человека с доменом FN3, содержащим аминокислотную последовательность одной из SEQ ID NO: 229-234.
10) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 связывает белок CD8A человека с аффинностью (KД) от около 0,02 до около 6,6 нМ, как измерено с помощью поверхностного плазмонного резонанса, выполненного в соответствии с условиями, описанными в Примере 3.
11) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 содержит любую одну из аминокислотных последовательностей SEQ ID NO: 40-269.
12) Выделенный домен FN3 по варианту осуществления 11, дополнительно содержащий метионин на N-конце домена FN3.
13) Выделенный домен FN3 по варианту осуществления 3, причем домен FN3 соединен с фрагментом, увеличивающий время полужизни.
14) Выделенный домен FN3 по варианту осуществления 13, причем фрагмент, увеличивающий время полужизни представляет собой молекулу, связывающую CD8, полиэтиленгликоль (PEG), CD8, вариант CD8 или, по меньшей мере, часть области Fc иммуноглобулина.
15) Выделенный полинуклеотид, кодирующий домен FN3 по варианту осуществления 3.
16) Вектор, содержащий полинуклеотид по варианту осуществления 15.
17) Выделенная клетка-хозяин, содержащая вектор по варианту осуществления 16.
18) Способ получения домена FN3, который специфически связывает белок CD8A человека, включающий в себя культивирование выделенной клетки-хозяина по варианту осуществления 17 в условиях, в которых экспрессируется домен FN3, и очистку домена FN3.
19) Диагностический набор, содержащий домен FN3 по варианту осуществления 3.
20) Диагностический или захватывающий агент, содержащий домен FN3 по варианту осуществления 3.
21) Диагностический или захватывающий агент по варианту осуществления 20, причем домен FN3 имеет замену на цистеин в позиции остатка 54 SEQ ID NO: 79, 81, 83, 89, 122 и/или 68.
22) Диагностический агент по варианту осуществления 21, причем замещающий цистеин конъюгирован с Zr-89 или I-124.
23) Способ обнаружения CD8-экспрессирующих клеток в биологическом образце, включающий в себя обработку биологического образца диагностическим реагентом по варианту осуществления 20, и оценивание связывания биологического образца с доменом FN3 такого диагностического агента.
24) Способ по варианту осуществления 23, причем диагностический агент имеет замену на цистеин в позиции остатка 54 SEQ ID NO: 79, 81, 83, 89, 122 и/или 68, и замещающий цистеин конъюгирован с Zr-89 или I-124.
ПРИМЕРЫ
Следующие примеры предложены для дополнения предшествующего раскрытия изобретения и для лучшего понимания объекта изобретения, описанного в данном документе. Данные примеры не должны рассматриваться как ограничивающие описанный объект изобретения. Понятно, что примеры и варианты осуществления, описанные в данном документе, предназначены только для иллюстративных целей, и что их различные модификации или изменения будут очевидны для специалистов в данной области техники и должны быть включены в данное раскрытие, и могут быть выполнены без отступления от истинного объем изобретения.
ПРИМЕР 1. Конструирование библиотек Tencon с рандомизированными петлями
Tencon (SEQ ID NO: 1) представляет собой иммуноглобулиноподобный каркас, домен типа III (FN3) фибронектина, сконструированный из консенсусной последовательности пятнадцати доменов FN3 из человеческого тенасцина-C (Jacobs et al., Protein Engineering, Design, and Selection, 25: 107-117, 2012; патент США № 8278419). Кристаллическая структура Tencon демонстрирует шесть экспонированных на поверхности петель, которые соединяют семь бета-листов. Данные петли или выбранные остатки в каждой петле могут быть рандомизированы для конструирования библиотек доменов типа III (FN3) фибронектина, которые могут быть использованы для отбора новых молекул, которые связываются с конкретными мишенями.
Tencon:
Lpapknlvvsevtedslrlswtapdaafdsfliqyqesekvgeainltvpgsersydltglkpgteytvsiygvkgghrsnplsaeftt (SEQ ID NO: 1):
Были созданы различные библиотеки с использованием каркаса tencon и различных стратегий проектирования. В целом как правило, библиотеки TCL1 и TCL2 производят хорошие связыватели. Создание библиотек TCL1 и TCL2 подробно описано в публикации международной заявки № WO2014081944A2.
Конструирование библиотеки TCL1
Библиотека, спроектированная для рандомизации только петли FG Tencon (SEQ ID NO: 1), TCL1, была сконструирована для использования с системой cis-дисплея (Jacobs et al., Protein Engineering, Design, and Selection, 25:107-117, 2012). В данное системе получают двухцепочечную ДНК, внося последовательности промотора Tac, кодирующую последовательность библиотеки Tencon, кодирующую последовательность RepA, cis-элемент и элемент ori (точка начала репликации). При экспрессии в системе транскрипции/трансляции in vitro образуется комплекс гибридного белка Tencon-RepA, связанного в cis-положении с ДНК, из которой он кодируется. Комплексы, которые связываются с молекулой-мишенью, затем выделяют и амплифицируют с помощью полимеразной цепной реакции (ПЦР), как описано ниже.
Создание библиотеки TCL1 для использования в cis-дисплее было выполнено последовательными раундами ПЦР для получения конечных линейных двухцепочечных молекул ДНК из двух частей: 5'-фрагмент содержит промотор и последовательности Tencon, а 3'-фрагмент содержит ген repA и элементы cis- и ori. Данные две части объединяли ограниченным расщеплением рестриктазами для получения полной конструкции. Библиотека TCL1 была спроектирована для включения случайных аминокислот только в петлю FG Tencon, KGGHRSN (SEQ ID NO: 32). Кодоны NNS были использованы при конструировании данной библиотеки, что дало возможность внести все 20 аминокислот и один стоп-кодон в петлю FG. Библиотека TCL1 содержит шесть отдельных суб-библиотек, каждая из которых имеет различную рандомизированную длину петли FG, от 7 до 12 остатков, для дальнейшего увеличения разнообразия.
Библиотека TCL1 (SEQ ID NO: 2)
LPAPKNLVVSEVTEDSLRLSWTAPDAAFDSFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVX7-12PLSAEFTT;
причем
X1, X2, X3, X4, X5, X6, X7 представляет собой любую аминокислоту; и
X8, X9, X10, X11 и X12 являются любой аминокислотой или удалены
Конструирование библиотеки TCL2
Была создана библиотека TCL2, в которой петли BC и FG Tencon были рандомизированы, а распределение аминокислот в каждой позиции строго контролировали. В Таблице 2 показано распределение аминокислот в желаемых позициях петли в библиотеке TCL2. Разработанное распределение аминокислот имело две цели. Во-первых, библиотека была смещена в сторону остатков, которые, как было предсказано, являются структурно важными для свертывания Тенкон и стабильности, основываясь на анализе кристаллической структуры Тенкона и/или на основе гомологичном моделировании. Например, было установлено, что позиция 29 принадлежит только к подмножеству гидрофобных аминокислот, поскольку данный остаток был погружен в гидрофобное ядро свернутого Tencon. Второй уровень проектирования включал в себя смещение распределения аминокислот к распределению остатков, преимущественно обнаруживаемых в HCDR3 тяжелой цепи антител, для эффективного продуцирования высокоаффинных связывателей (Birtalan et al., J Mol Biol 377:1518-28, 2008; Olson et al., Protein Sci 16:476-84, 2007). Для достижения данной цели «спроектированное распределение» в Таблице 1 относится к такому распределению: 6% аланина, 6% аргинина, 3,9% аспарагина, 7,5% аспарагиновой кислоты, 2,5% глутаминовой кислоты, 1,5% глютамина, 15% глицина, 2,3% гистидина, 2,5% изолейцина, 5% лейцина, 1,5% лизина, 2,5% фенилаланина, 4% пролина, 10% серина, 4,5% треонина, 4% триптофана, 17,3% тирозина и 4% валина. Данное распределение лишено метионина, цистеина и стоп-кодонов.
Библиотека TCL2 (SEQ ID NO: 3)
LPAPKNLVVSEVTEDSLRLSWX1X2X3X4X5X6X7X8SFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVX9X10X11X12X13SX14X15LSAEFTT; причем
X1 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X2 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X3 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X4 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X5 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X6 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X7 представляет собой Phe, Ile, Leu, Val или Tyr;
X8 представляет собой Asp, Glu или Thr;
X9 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X10 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X11 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X12 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X13 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X14 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val; и
X15 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val.
Таблица 1.
* нумерация остатков основана на последовательности Tencon SEQ ID NO: 1
Впоследствии, данные библиотеки были улучшены различными способами, включая создание библиотек на основе стабилизированной структуры Tencon (патент США № 8569227), которая включает в себя замены E11R/L17A/N46V/E86I (Tencon27; SEQ ID NO: 4) по сравнению с Tencon дикого типа, а также изменение позиций, рандомизированных в петлях BC и FG. Tencon27 описан в международной патентной заявке № WO2013049275. Исходя из этого были спроектированы новые библиотеки для рандомизации только петли FG Tencon (библиотека TCL9), или комбинации петель BC и FG (библиотека TCL7). Данные библиотеки были сконструированы для использования с системой cis-дисплея (Odegrip et al., Proc Natl Acad Sci U S A 101: 2806-2810, 2004). Детали данного проектирования показаны ниже:
Стабилизированный Tencon (Tencon27) (SEQ ID NO: 4)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFLIQYQESEKVGEAIVLTVPGSERSYDLTGLKPGTEYTVSIYGVKGGHRSNPLSAIFTT
TCL7 (рандомизированные петли FG и BC) (SEQ ID NO: 5)
LPAPKNLVVSRVTEDSARLSWX1X2X3X4X5X6X7X8X9FDSFLIQYQESEKVGEAIVLTVPGSERSYDLTGLKPGTEYTVSIYGVX10X11X12X13X14X15X16X17X18X19SNPLSAIFTT;
причем
X1, X2, X3, X4, X5, X6, X10, X11, X12, X13, X14, X15 и X16 представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W или Y; и
X7, X8, X9, X17, X18 и X19, представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W, Y или удален.
TCL9 (рандомизированная петля FG) (SEQ ID NO: 6)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFLIQYQESEKVGEAIVLTVPGSERSYDLTGLKPGTEYTVSIYGV X1X2X3X4X5X6X7X8X9 X10X11X12SNPLSAIFTT;
X1, X2, X3, X4, X5, X6 и X7, представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W или Y; и
X8, X9, X10, X11 и X12 представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W, Y или удален.
Для конструирования библиотеки, фрагменты ДНК, кодирующие рандомизированные петли BC (длина 6-9 позиций) или петли FG (длина 7-12 позиций), были синтезированы с использованием технологии Slonomics (Sloning Biotechnology GmbH), чтобы контролировать распределение аминокислот в библиотеке и устранить стоп-кодоны. Два разных набора молекул ДНК, рандомизирующих либо петлю BC, либо петли FG, были синтезированы независимо и позднее объединены с использованием ПЦР для получения полного библиотечного продукта.
Конструирование библиотек петель FG (TCL9)
Был получен набор синтетических молекул ДНК, состоящий из 5'-Tac-промотора, за которым следует полная последовательность гена Tencon, за исключением рандомизированных кодонов в петле FG (SEQ ID NO: 26-31). Для рандомизации петли FG все аминокислоты, кроме цистеина и метионина, кодировались в равных долях. Длины диверсифицированной части такова, что они кодируют 7, 8, 9, 10, 11 или 12 аминокислот в петле FG. Суб-библиотеки каждого варианта длины синтезировали индивидуально в масштабе 2 мкг и затем амплифицировали с помощью ПЦР с использованием олигонуклеотидов Sloning-FOR (SEQ ID NO: 9) и Sloning-Rev (SEQ ID NO: 10).
3'-фрагмент библиотеки представляет собой константную последовательность ДНК, содержащую элементы для дисплея, включая сайт рестрикции PspOMI, кодирующую область гена repA, и элементы cis и ori. Реакции ПЦР проводили для амплификации данного фрагмента с использованием плазмиды (pCR4Blunt) (Invitrogen) в качестве матрицы с праймерами M13 Forward и M13 Reverse. Полученные продукты ПЦР расщепляли PspOMI в течение ночи и очищали прогонкой в геле. Для лигирования 5'-части библиотечной ДНК с 3'-ДНК, содержащей ген repA, 2 пмоль (от примерно от 540 нг до 560 нг) 5'-ДНК лигировали с равным молярным количеством (примерно 1,25 мкг) 3'-ДНК repA в присутствии фермента NotI и PspOMI и лигазы Т4 при 37°C в течение ночи. Лигированный библиотечный продукт амплифицировали с использованием 12 циклов ПЦР с олиго POP2250 (SEQ ID NO: 11) и DigLigRev (SEQ ID NO: 12). Для каждой суб-библиотеки полученную ДНК из 12 реакций ПЦР объединяли и очищали с помощью спин-колонки Qiagen. Выход для каждой суб-библиотеки TCL9 составлял от 32 до 34 мкг.
Конструирование библиотек петель FG/BC (TCL7)
Библиотека TCL7 предоставляет библиотеку с рандомизированными петлями BC и FG Tencon. В данной библиотеке петли BC длиной 6-9 аминокислот смешивали комбинаторно с рандомизированными петлями FG длиной 7-12 аминокислот. Были получены синтетические фрагменты Tencon BC6, BC7, BC8 и BC9 (SEQ ID NO: 13-16) для внесения гена Tencon, кодирующего N-концевую часть белка, вплоть до и включающую в себя остаток VX, так что петля BC заменяется на 6, 7, 8 или 9 рандомизированных аминокислот. Данные фрагменты были синтезированы до открытия мутаций L17A, N46V и E83I (CEN5243), но эти мутации были внесены на молекулярно биологических этапах, описанных ниже. Чтобы объединить данный фрагмент с фрагментами, кодирующими рандомизированные петли FG, были предприняты следующие шаги.
Сначала фрагмент ДНК, кодирующий промотор Tac и 5'-последовательность Tencon вплоть до нуклеотида, кодирующего аминокислоту A17 (130мер-L17A, SEQ ID NO: 17), был получен с помощью ПЦР с использованием олиго POP2222ext (SEQ ID NO: 18) и LS1114 (SEQ ID NO: 19). Это было сделано для включения мутации L17A в библиотеку (CEN5243). Затем, фрагменты ДНК, кодирующие остатки Tencon R18-V75, включая рандомизированные петли BC, амплифицировали с помощью ПЦР с использованием BC6, BC7, BC8 или BC9 в качестве матриц и олиго LS1115 (SEQ ID NO: 20) и LS1117 (SEQ ID NO: 21). Данный шаг ПЦР вносил сайт BsaI в 3'-конц. Данные фрагменты ДНК были впоследствии объединены путем перекрывающейся ПЦР с использованием олиго POP2222ext и LS1117 в качестве праймеров. Полученный продукт ПЦР размером 240 п.н. объединяли и очищали с помощью набора для очистки ПЦР Qiagen. Очищенную ДНК расщепляли BsaI-HF и очищали прогонкой в геле
Фрагменты, кодирующие петлю FG, амплифицировали с помощью ПЦР с использованием FG7 (SEQ ID NO: 31), FG8 (SEQ ID NO: 30), FG9 (SEQ ID NO: 29), FG10 (SEQ ID NO: 28), FG11 (SEQ ID NO: 27) и FG12 (SEQ ID NO: 26) в качестве матриц с олигонуклеотидами SDG10 (SEQ ID NO: 22) и SDG24 (SEQ ID NO: 23) для внесения сайта рестрикции BsaI и вариаций N46V и E86I (CEN5243).
Расщепленные фрагменты BC и фрагменты FG лигировали вместе за один этап с использованием трехнаправленного лигирования. Были поставлены четыре реакции лигирования в 16 возможных комбинациях, причем каждая реакция лигирования объединяла два варианта длины петли BC и 2 варианта длины петли FG. Каждая реакция лигирования содержала примерно 300 нг всего фрагмента BC и 300 нг фрагмента FG. Данные 4 пула лигирования затем амплифицировали с помощью ПЦР с использованием олиго POP2222 (SEQ ID NO: 24) и SDG28 (SEQ ID NO: 25). 7,5 мкг каждого продукта реакции затем расщепляли с помощью Not1 и очищали с помощью колонки для очистки ПЦР Qiagen. 5,2 мкг этой ДНК лигировали с равным молярным количеством фрагмента ДНК RepA (примерно 14 мкг), расщепленного с помощью PspOMI, и продукт амплифицировали с помощью ПЦР с использованием олиго POP2222.
ПРИМЕР 2. Создание библиотек Tencon, имеющих альтернативные поверхности связывания
Выбор остатков, которые должны быть рандомизированы в конкретном проекте библиотеки, определяет общую форму создаваемой поверхности взаимодействия. Рентгенокристалографический анализ домена FN3, содержащего каркасный белок, выбранный для связывания мальтозосвязывающего белка (MBP) из библиотеки, в которой были рандомизированы петли BC, DE и FG, показал в значительной степени изогнутый интерфейс, который укладывается в активный сайт MBP (Koide et al., Proc Natl Acad Sci U S A 104: 6632-6637, 2007). Напротив, было обнаружено, что каркасный белок с анкириновыми повторами, который был выбран для связывания с MBP, имеет гораздо более плоскую поверхность взаимодействия и связывается с наружной поверхностью MBP, отдаленной от активного (Binz et al., Nat Biotechnol 22: 575-582, 2004). Данные результаты предполагают, что форма поверхности связывания каркасной молекулы (изогнутая или плоская) может диктовать, какие белки-мишени или специфические эпитопы на таких белках-мишенях могут эффективно связываться каркасом. Опубликованные усилия по конструированию белковых каркасов, содержащих домены FN3 для связывания белка, основаны на конструировании смежных петель для связывания с мишенью, таким образом, создавая кривые поверхности связывания. Данный подход может ограничить число мишеней и эпитопов, доступных для таких каркасов.
Tencon и другие домены FN3 содержат два набора CDR-подобных петель, лежащих на противоположных поверхностях молекулы, первый набор образован петлями BC, DE и FG, и второй набор образован петлями AB, CD и EF. Два набора петель разделены бета-листами, которые образуют центр структуры FN3. Если изображение Tencon повернуто на 90 градусов, можно визуализировать альтернативную поверхность. Данная слегка вогнутая поверхность сформирована петлями CD и FG и двумя антипараллельными бета-листами, бета-листами C и F, и в данном документе называется поверхностью C-CD-F-FG. Поверхность C-CD-F-FG может использоваться в качестве шаблона для проектирования библиотек поверхностей взаимодействия белковых каркасов путем рандомизации подмножества остатков, которые образуют поверхность. Бета-листы имеют повторяющуюся структуру с боковой цепью каждого второго остатка, выставленной на поверхность белка. Таким образом, библиотека может быть получена путем рандомизации некоторых или всех экспонированных на поверхности остатков в бета-листах. Выбирая соответствующие остатки в бета-листах, присущая Tencon стабильность каркасов должна быть нарушена минимально, обеспечивая уникальную поверхность каркаса для взаимодействия с другими белками.
Библиотека TCL14 (SEQ ID NO: 7) была сконструирована в каркасе Tencon27 (SEQ ID NO: 4).
Полное описание способов, использованных для создания данной библиотеки, описано в публикации патента США № 2013/0226834.
Библиотека TCL14 (SEQ ID NO: 7)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFX1IX2YX3EX4X5X6X7GEAIVLTVPG SERSYDLTGLKPGTEYX8VX9IX10GVKGGX11X12SX13PLSAIFTT;
Причем
X1, X2, X3, X4, X5, X6, X10, X11, X12 и X13 представляют собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W, Y, или M.
Два бета-листа, образующие поверхность C-CD-F-FG в Tencon27, имеют в общей сложности 9 экспонированных на поверхности остатков, которые могут быть рандомизированы; С-лист: S30, L32, Q34, Q36; F-лист: E66, T68, S70, Y72, и V74, в то время как петля CD имеет 6 потенциальных остатков: S38, E39, K40, V41, G42 и E43, и петля FG имеет 7 потенциальных остатков: K75, G76, G77, H78, R79, S80, и N81. Отобранные остатки были выбраны для включения в конструкцию TCL14 из-за большего теоретического размера библиотеки, в случае, когда все 22 остатка были бы рандомизированы.
Для рандомизации были выбраны тринадцать позиций в Tencon: L32, Q34 и Q36 в C-листе, S38, E39, K40 и V41 в CD-петле, T68, S70 и Y72 в F-листе, H78, R79 и N81 в FG-петле. В C и F листах S30 и E66 не были рандомизированы, поскольку они лежат сразу за пределами петель CD и FG и, по-видимому, не являются частью поверхности C-CD-F-FG. Для петли CD, G42 и E43 не были рандомизированы, так как глицин, обеспечивающий гибкость, может быть значимым в областях петли, а E43 лежит на стыке поверхности. Петля FG имела исключенные K75, G76, G77 и S80. Глицины были исключены по вышеуказанным причинам, в то время как тщательный осмотр кристаллических структур показал, что S80 создает ключевые контакты с ядром, чтобы помочь сформировать стабильную петлю FG. K75 размещался в сторону от поверхности C-CD-F-FG и был менее привлекательным кандидатом для рандомизации. Хотя вышеупомянутые остатки не были рандомизированы в исходной конструкции TCL14, они могли быть включены в последующие дизайны библиотек для обеспечения дополнительного разнообразия для отбора de novo или, например, для библиотеки созревания аффинности на выбранной специфической совпадающей мишени TCL14.
После получения TCL14 было создано 3 дополнительные библиотеки Tencon аналогичного дизайна. Данные две библиотеки, TCL19, TCL21 и TCL23, рандомизировали по тем же позициям, что и TCL14 (смотрите выше), однако распределение аминокислот, встречающихся в данных позициях было изменено (Таблица 2). TCL19 и TCL21 были спроектированы таким образом, чтобы включать в себя равное распределение 18 природных аминокислот в каждой позиции (5,55% каждая), исключая только цистеин и метионин. TCL23 была спроектирована таким образом, что каждая рандомизированная позиция примерно соответствует распределению аминокислот, обнаруженному в петлях HCDR3 функциональных антител (Birtalan et al., J Mol Biol 377: 1518-1528, 2008) как описано в Таблице 2. Как и в случае библиотеки TCL21, цистеин и метионин были исключены.
Была построена третья дополнительная библиотека для расширения потенциальной целевой поверхности связывания библиотеки других библиотек. В данной библиотеке TCL24 было рандомизировано 4 дополнительных позиции Tencon по сравнению с библиотеками TCL14, TCL19, TCL21 и TCL23. Данные позиции включают в себя N46 и T48 из листа D и S84 и I86 из листа G. В частности, были выбраны позиции 46, 48, 84 и 86, так как боковые цепи этих остатков экспонированы из бета-листов D и G на поверхность, и лежат структурно рядом с рандомизированными частями листов C и F, таким образом увеличивая площадь поверхности, доступной для связывания с белками-мишенями. Распределение аминокислот, используемое в каждой позиции для TCL24, идентично распределению, описанному для TCL19 и TCL21 в Таблице 2.
Библиотека TCL24 (SEQ ID NO: 8)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFX1IX2YX3EX4X5X6X7GEAIX8LX9VP GSERSYDLTGLKPGTEYX10VX11IX12GVKGGX13X14SX15PLX16AX17FTT;
причем
X1, X2, X3, X4, X5, X6, X10, X11, X12 и X13 представляют собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V или W.
Таблица 2. Частота аминокислот (%) в каждой рандомизированной позиции для TCL21, TCL23 и TCL24.
Создание библиотек TCL21, TCL23 и TCL24
Библиотека TCL21 была создана с использованием технологии библиотек Colibra (Isogenica) для контроля распределения аминокислот. Фрагменты генов TCL19, TCL23 и TCL24 были получены с использованием технологии Slonomics (Morphosys) для контроля распределения аминокислот. ПЦР использовали для амплификации каждой библиотеки после первоначального синтеза с последующим лигированием с геном RepA, чтобы использовать его в отборах с использованием системы CIS-дисплея (Odegrip et al., Proc Natl Acad Sci U S A 101: 2806-2810, 2004) как описано выше для библиотек петель.
ПРИМЕР 3. Отбор доменов типа III (FN3) фибронектина, которые связывают CD8a
Разработка и продуцирование антигенов CD8-альфа человека:
Две конструкции CD8-альфа человека (Swiss Prot P01732) экспрессировали и очищали от клеток HEK для получения рекомбинантного белка для пэннинг cis-дисплея (Таблица 3).
Таблица 3. Конструкции CD8A, созданные для использования в качестве антигенов
Каждая конструкция была разработана чтобы включать в себя сигнала секреции мышиного каппа-IgG (SEQ ID NO: 3) и была слита с фрагментом Fc человеческого IgG1 (SEQ ID NO: 4). Последовательности CD8-альфа и фрагмента Fc были соединены линкером, содержащим flag и последовательность полигистидинового тэга (SEQ ID NO: 5).
Плазмиды, кодирующие эти белки, трансфицировали в клетки HEK 293-Expi путем временной трансфекции, а культуральные супернатанты собирали центрифугированием при 6000 × g и очищали с помощью фильтра 0,2 микрометра. Супернатанты загружали в колонку HiTrap Mabsure Select (GE Healthcare) и белки CD8A элюировали в 0,1 М Na-ацетате, рН 3,5 и нейтрализовали добавлением 2М Трис, рН 7. Затем каждый образец диализовали в ФСБ 7,4 для биотинилирования с помощью набора для биотинилирования No Weigh EZ-Link-Sulfo-NHS-LC-Biotin (Thermo Scientific).
Скрининг библиотеки
Cis-дисплей использовали для отбора связывающих доменов CD8-альфа человека из библиотек TCL18, TCL19, TCL21, TCL23 и TCL24. Биотинилированные CD8W7 и CD8W13 были использованы для пэннинга. Для транскрипции и трансляции in vitro (ITT) 3 мкг библиотечной ДНК инкубировали с 0,1 мМ всех аминокислот, 1X компонентами премикса S30 и 15 мкл экстракта S30 (Promega) в общем объеме 50 мкл, и инкубировали при 30°C. Через 1 час добавляли 375 мкл блокирующего раствора ((0,1% казеина (Thermo Fisher, Рокфорд, Иллинойс)), 100 мг/мл ДНК спермы сельди (Promega, Мэдисон, Висконсин), 1 мг/мл гепарина (Sigma-Aldrich, Сент-Луис, Миссури), и реакционную смесь инкубировали на льду в течение 15 минут. Для отбора добавляли биотинилированный антиген в концентрациях 400 нМ (раунд 1), 200 нМ (раунды 2 и 3) и 100 нМ (раунды 4 и 5). Связанные члены библиотеки были извлечены с использованием магнитных гранул нейтравидина (Thermo Fisher, Рокфорд, Иллинойс) (раунды 1, 3 и 5) или магнитных гранул стрептавидина (Promega, Madison, WI) (раунды 2 и 4), и несвязанные члены библиотеки были удалены промыванием гранул 5-14 раз 500 мкл PBST и 2 раза 500 мкл ФСБ. Были выполнены дополнительные раунды отбора, чтобы идентифицировать каркасные молекулы с улучшенным сродством. Вкратце, результирующие продукты из раунда 5 были подготовлены, как описано выше, и подвергнуты дополнительным итеративным раундам отбора со следующими изменениями: концентрацию биотинилированной мишени снизили до 25 нМ (раунды 6 и 7) или до 2,5 нМ (раунды 8 и 9) и выполняли дополнительную 1-часовую промывку в присутствии избытка небиотинилированного белка мишени. Цель данных изменений состояла в том, чтобы одновременно выбрать связыватели с потенциально более высокой скоростью соединения и более медленной скоростью отсоединения, обеспечивающие существенно более низкую KД.
После пэннинга отобранные домены FN3 амплифицировали с помощью ПЦР с использованием олиго Tcon6 (SEQ ID NO: 33) и Tcon5shortE86I (SEQ ID NO:: 34), субклонировали путем отжига в pET15-LIC и трансформировали в клетки BL21-GOLD (DE3) (Agilent, Santa Clara, CA) для растворимой экспрессии в E. coli с использованием стандартных методов молекулярной биологии. Отдельные клоны отбирали и выращивали до насыщения в 1 мл LB c ампициллином в 96-луночных плашках при 37°С. На следующий день 25 мкл переносили в 1 мл свежей среды LB-Amp в 96-луночных плашках и выращивали при 37°С в течение 2 часов. IPTG добавляли при конечной концентрации 1 мМ и экспрессию белка индуцировали при 30°C в течение 16 часов. Клетки собирали центрифугированием и затем лизировали с помощью Bugbuster HT (EMD Chemicals, Гиббстаун, Нью-Джерси) с добавлением конечной концентрации лизоцима белка куриного яйца 0,2 мг/мл (Sigma-Aldrich, Сент-Луис, Миссури). Клетки собирали примерно через 16 часов центрифугированием и замораживали при -20°C. Клеточный лизис был достигнут путем инкубации каждого осадка в 0,6 мл буфера для лизиса BugBuster® HT (Novagen EMD Biosciences) при встряхивании при комнатной температуре в течение 45 минут.
Отбор доменов FN3, которые связывают CD8A
Плашки, покрытые нейтравидином, блокировали в течение 1 часа в Starting Block T20 (Pierce) и затем покрывали биотинилированным CD8W7 или CD8W13 (тем же антигеном, что и при пэннинге) или отрицательным контролем (Fc человека) в течение 1 часа. Плашки промывали TBST и добавляли к плашкам разбавленный лизат на 1 час. После дополнительных промывок лунки обрабатывали конъюгированным с HRP антителом против FN3-домена (PAB25) в течение 1 часа и затем анализировали с помощью POD (Roche). Молекулы домена FN3 с сигналами, по крайней мере, в 10 раз превышающими фон, были отобраны для дальнейшего анализа.
Экспрессия в малом масштабе и очистка идентифицированных доменов FN3, связывающих CD8A
Выделенные клоны из уникальных совпадений, идентифицированных с помощью биохимического связывания ИФА, объединяли в одну плашку для выращивания в 96-луночных блочных плашках; клоны выращивали в культурах объемом 1 мл (среда LB, дополненная канамицином для отбора) при 37°С в течение ночи при встряхивании. Для экспрессии белка в 96-блочных плашках, 1 мл среды TB с добавлением канамицина инокулировали 50 мкл ночной культуры и выращивали при 37°C с постоянным встряхиванием при 300 об/мин до OD600=0,6-1. Как только была достигнута целевая OD, экспрессию белка индуцировали добавлением IPTG до 1 мМ; плашки переносили в 30°С (300 об/мин) для роста в течение ночи. Ночные культуры центрифугировали для сбора клеток; бактериальные осадки хранили при -80°С до использования. Осадки лизировали с помощью буфера для лизиса BugBuster® HT (Novagen EMD Biosciences) и His-тэгированные центирины выделяли из очищенных лизатов с помощью плашек His MultiTrap™ HP (GE Healthcare) и элюировали в буфер, содержащий 20 мМ фосфата натрия, 500 мМ хлорида натрия и 250 мМ имидазола при рН 7,4. Очищенные образцы замещали в ФСБ pH 7,4 для анализа с использованием плашек PD MultiTrap™ G-25 (GE Healthcare).
Анализ эксклюзионной хроматографией
Эксклюзионную хроматографию использовали для определения состояния агрегации молекул домена FN3 против CD8-альфа. Аликвоты (10 мкл) каждого очищенного домена FN3 вводили в колонку Superdex 75 5/150 (GE Healthcare) со скоростью потока 0,3 мл/мин в подвижной фазе ФСБ, pH 7,4. Элюирование из колонки контролировали по абсорбции при 280 нм. Tencon дикого типа был включен в каждый прогон в качестве контроля. Для анализа профилей элюирования использовали программное обеспечение Agilent ChemStation. Только те белки с профилями элюирования, сходными с таковыми у консенсусного белка тенасцина в том же эксперименте, были рассмотрены для дополнительного охарактеризования. После пэннинга, скрининга ИФА и эксклюзионной хроматографии (SEC) было выделено в общей сложности 190 уникальных анти-CD8-альфа человека доменов FN3, которые связывались с рекомбинантным CD8-альфа человека более чем в 10 раз сильнее по сравнению с фоном, и не содержали агрегатов согласно SEC (Таблица 4, SEQ ID NO: 40-228 и 70).
Таблица 4. Обобщенные данные по CD8A-связывающих доменах FN3, идентифицированных с помощью скринингов ИФА
Скрининг на связывание с Т-лимфоцитов доноров - человека и яванского макака
Связывание 190 ИФА совпадений с первичными CD8 Т-лимфоцитами человека и яванского макака оценивали с помощью проточной цитометрии. Молекулы домена FN3 разбавляли до 2 мкМ и 0,2 мкМ в ФСБ, и инкубировали с CD8+ Т-лимфоцитами человека или яванского макак в 96-луночном формате. Через 1 час при 4°С клетки один раз промывали ФСБ и затем ресуспендировали в растворе антитела против домена FN3 (PAB25). После данной инкубации клетки дважды промывали ФСБ и добавляли PE-конъюгированное (PE - фикоэритрин) вторичное антитело и краситель для определения жизнеспособности. Наконец, клетки промывали и ресуспендировали в ФСБ для анализа с помощью проточной цитометрии с использованием инструмента BD Canto. Ворота настраивали на пропускание живых клеток, и медианную интенсивность флуоресценции связанных центиринов (PE-канал) рассчитывали с использованием программного обеспечения Cytobank. Результаты подытожены в Таблице 4.
Анализ скорости отсоединения центиринов против CD8-альфа человека
Очищенные анти-CD8A домены FN3 подвергали анализу скорости отсоединения с использованием прибора поверхностного плазмонного резонанса Proteon для отбора клонов с самыми медленными скоростями отсоединения для дополнительного охарактеризования. Измеренные скорости отсоединения варьировали от 2,64E-5 до 1,07E-2 с-1, как показано в Таблице 4.
Козий анти-Fc человека IgG (Jackson immunoresearch, кат. № 109-005-098) прямо иммобилизовали на сенсорном чипе GLC при 10 мкг/мл, pH 5,0, посредством аминного связывания (pH 5,0) во всех 6 лигандных каналах в вертикальной ориентации на чипе, со скоростью потока 30 мкл/мин в PBST (ФСБ, 0,005% Tween). Плотности иммобилизованного GAH-Fc IgG составляли в среднем около 6000 единиц ответа (Ru) с вариацией меньше чем 1% между различными каналами. CD8A-Fc человека по собственной методике захватывали в вертикальной ориентации при 3 различных плотностях лигандов, 10, 5, 2,5 мкг/мл в течение 5 минут при скорости потока 30 мкл/мин. Все домены FN3 были нормализованы до концентрации 3 мкМ и протестированы на связывание в горизонтальной ориентации. Все 6 аналитических каналов были использованы для доменов FN3, чтобы максимизировать пропускную способность скрининга. Фазу диссоциации контролировали в течение 15 минут при скорости потока 100 мкл/мин, используя PBST в качестве рабочего буфера. Регенерация поверхности достигалась коротким промыванием 0,85% фосфорной кислоты (время контакта 18 с при 100 мкл/мин). Анализ данных проводили с использованием программного обеспечения Bio-Rad ProteOn Manager (версия 3.1.0.6). Необработанные данные были проанализированы с учетом контроля в виде пустого буфера (double reference, blank buffer reference), путем вычитания из сигналов точек взаимодействия (пустая поверхность чипа, без иммобилизованного или захваченного белка) для коррекции неспецифического связывания домена FN3 с предварительно покрытой GAH-Fc IgG поверхностью с последующей двойной коррекцией с использованием пустого канала L6, в котором не был захвачен hCD8A-Fc. Обработанные данные связывания локально подгоняли к простой модели связывания Ленгмюра 1:1, чтобы получить kот для каждого связывания домена FN3 с захваченным hCD8A-Fc.
ПРИМЕР 4. Конструирование анти-CD8A доменов FN3
Был спроектирован ряд мутаций в лучших кандидатах анти-CD8A, чтобы исключить риски посттрансляционных модификаций (ПТМ): окисления (метионин или триптофан), дезамидирования (NS), изомеризации (DG) и отсечения (DP). Остатки пролина, обнаруженные в бета-листах, также подвергали мутированию, поскольку пролин обладает потенциалом дестабилизации бета-листов (Chiba T., et al. J Biol Chem. 2003;278:47016-24). Только остатки, полученные из библиотеки доменов FN3 с спроектированными позициями, рассматривались на предмет мутации. Вариантные последовательности были выбраны либо для имитации сходных химических свойств исходной молекулы (например, триптофан на тирозин), либо для замены аминокислоты с рисковой ПТМ, обнаруженной в других доменах FN3 CD8A в этой позиции. Полный список сконструированных последовательностей приведен в Таблице 5. Скорость диссоциации для каждого мутанта и рекомбинантного CD8-альфа измеряли с помощью поверхностного плазмонного резонанса для оценки относительной силы связывания.
Таблица 5. Скорости диссоциации CD8A центириновых мутантов. Мутанты сгруппированы по исходной молекуле.
Из данных, представленных в Таблице 5, очевидно, что ряд мутаций, которые снижают риски при разработке, поддерживают скорости диссоциации, сходные с таковыми у исходной молекулы. Мутанты CD8S402 (удаление сайта DP), CD8S390 (удаление остатка Trp) и CD8S403 (удаление Pro из бета-листа) давали более медленные скорости диссоциации, чем соответствующая исходная молекула, что свидетельствует о более тесном связывании. Ряд других мутаций поддерживает связывание, подобное исходной молекуле, и, следовательно, могут быть предпочтительнее исходных, поскольку данные молекулы имеют меньший риск, связанный с CMC, во время разработки.
ПРИМЕР 5. ИЗМЕРЕНИЕ АФФИННОСТИ CD8A-СВЯЗЫВАЮЩИХ ДОМЕНОВ FN3.
Девятнадцать анти-CD8A кандидатов были отобраны для полного кинетического анализа связывания с рекомбинантным CD8-альфа человека. Данные кандидаты были выбраны из указанных выше положительных совпадений (Таблица 4) с использованием критериев: 1) сильное относительное связывание с Т-лимфоцитами человека, 2) сильное относительное связывание с Т-лимфоцитами яванского макака, 3) минимальное снижение связывания клеток при 0,2 мкМ по сравнению до 2 мкМ, 4) без агрегатов при SEC, 5) скорости отсоединения медленнее, чем 2,07E-3 с-1, 6) разнообразие последовательностей в соответстви с семействами последовательностей, и 7) относительная склонность последовательностей к потенциальным проблемами разработки (окисление, дезамидирование, отсечение и гидрофобность).
Аффинности 19 лучших кандидатов, и затем повторно 6 лучших кандидатов, связывающихся с hCD8A-Fc, измеряли на приборе ProteOn XPR36 (Bio-Rad) с использованием сенсорных чипов GLC в условиях, аналогичных условиям для скрининга kот. Козье анти-Fc человека антитело прямо иммобилизировали на чипе стандартным аминным связыванием при 10 мкг/мл, pH 5,0 на всех 6 лигандных каналах в вертикальной ориентации, на чипе, со скоростью потока 30 мкл/мин в PBST (ФСБ, 0,005% Tween), достигая в среднем 6200 ЕО на каждом канале лиганда. Затем CD8A-Fc человека захватывали при пяти плотностях поверхности в диапазоне от 200 до 1200 единиц ответа, оставляя 6-й канал в качестве пустого канала контроля для поверхности GAH-Fc IgG. Связывание измеряли, пропуская пять различных концентраций анти-CD8A доменов FN3 (1 мкМ, разведенных в 3-кратной серии разведений) в качестве аналитов одновременно в горизонтальной ориентации над поверхностями с захваченными hCD8A-Fc, с шестым каналом аналита, содержащим только рабочий буфер PBST. Все взаимодействия измеряли при скорости потока 100 мкл/мин, при этом время соединение и отсоединение составляло 4, 30 минут соответственно. Восстановление поверхности лиганда достигали за 1 короткую промывку 0,85% фосфорной кислотой (время контакта 18 с при 100 мкл/мин). Анализ данных проводили с использованием программного обеспечения Bio-Rad ProteOn Manager (версия 3.1.0.6). Необработанные данные были проанализированы с учетом контроля в виде пустого буфера (double reference, blank buffer reference), путем вычитания из сигналов точек взаимодействия (пустая поверхность чипа, без иммобилизованного или захваченного белка) для коррекции неспецифического связывания домена FN3 с предварительно покрытой GAH-Fc IgG поверхностью, с последующим использованием пустого буфера в качестве контроля (для коррекции какого-либо базового отклонения возникающего при отсоединении лиганда с течением времени). В многочисленных анализах неизменно наблюдали, что данные связывания анти-CD8A-домена FN3 не соответствуют в полной мере простой модели связывания Ленгмюра 1:1, что подразумевает проблемы с реагентами и/или внутренние сложные механизмы связывания, которые нельзя объяснить для использования простой модели связывания 1:1. Учитывая, что захват GAH-Fc формы hCD8A-Fc является наименее разрушительным по сравнению с другими формами относительно внесения возможных экспериментальных артефактов (таких как потеря активности лиганда и/или искусственная популяция эптиопов/гетерогенных лигандов из-за присоединения амина), считается, что результаты экспериментов по захвату с GAH-Fc, представленные в данном документе, представляют собой наиболее надежные данные ProteOn SPR, несмотря на несовпадающие 1:1 кривые по Ленгмюру, что наблюдается во многих случаях. Модель гетерогенного лиганда была выбрана, чтобы соответствовать данным, предполагающим наличие двух разных видов лигандов, либо из-за гетерогенности в популяции белка-лиганда, либо из-за возможных различных механизмов связывания каждого домена FN3 с 2 мономерами hCD8A в гибридном белке Fc. В данном случае, поскольку каждый анти-CD8A домен FN3 будет иметь различные аффинности, результирующая сенсограмма отражает сумму двух независимых реакций с двумя наборами констант скорости, которые были зарегистрированы для каждого связывания домена FN3.
Таблица 6. Обобщенные данные кинетики аффинностей для шести лучших анти-CD8A доменов-кандидатов FN3. Примечание: Аффинность, KД=kд/kа
(SEQ ID NO:)
Mс)
Mс)
79
(81)
(83)
(89)
(122)
(68)
ПРИМЕР 6. Мечение анти-CD8A доменов FN3 с помощью DFO и 89Zr
Анти-CD8A домены FN3 были модифицированы для включения в себя одного остатка цистеина для конъюгации хелаторов, содержащих малеимид, или ПЭТ-меток. Синтетическая плазмидная ДНК, кодирующая клоны P282DR9P1359_F5, P282DR9P1359_F7, P282DR9P1359_G7, P282ER9P1360_C8, P283AR9P1362_D6, и P282DR9P1359_C5 с мутацией остатка E54 на цистеин, была синтезирована в DNA2.0 (Таблица 7). E54 был выбран в качестве позиции для мутации на основе более ранних исследований, которые продемонстрировали поддержание аффинности связывания, стабильности и уровней экспрессии других доменов FN3, мутированных по этому остатку (Goldberg S. et al. Protein Engineering Design and Selection 2016 Epub ahead of print).
Таблица 7. Модифицированные молекулы анти-CD8A домена FN3
Домены анти-CD8A FN3, модифицированные свободным цистеином, конъюгировали с дефероксамином (DFO) для хелатирования радиометаллов. 0,5 мл 100-500 мкМ раствора анти-CD8A домена FN3 объединяли с 10 мкл 500 мМ TCEP (Sigma, cat. # 646547), осторожно продували азотом и инкубировали в течение 1 часа при комнатной температуре. 1,0 мл насыщенного сульфата аммония (4,02 М) добавляли в каждую пробирку для достижения конечной концентрации 3,2 М перед инкубацией на льду в течение 10 минут и центрифугированием при 16000 × g или выше для осаждения белка. Полученный осадок ресуспендировали и промывали в 1,0 мл 3,2 М сульфата аммония с добавлением 100 мМ фосфата натрия, рН 7,2 и 1 мМ ЭДТК перед повторным центрифугированием. После второго этапа центрифугирования полученный осадок растворяли в 100 мМ фосфате натрия 7,0, 1 мМ ЭДТК и объединяли с 10 мкл 50 мМ раствора DFO, чтобы получить конечное молярное отношение 5:1 DFO к анти-CD8A. Данной реакции позволяли проходить при комнатной температуре в течение 30 минут, а затем гасили 5,0 микролитрами бета-меркаптоэтанола. Избыток DFO окончательно удаляли различными способами, включая второй раунд осаждения сульфатом аммония, как описано выше, пропусканием через обессоливающую колонку, такую как колонка Zeba 7k (Pierce кат. № 89889), или путем очистки смолой Nickle-NTA (Qiagen кат. № 30450). Конъюгаты анти-CD8A домен FN3-DFO готовили в 1X ФСБ для дополнительного анализа.
После конъюгирования с DFO связывание каждого анти-CD8A домена FN3 с рекомбинантным человеческим CD8-альфа оценивали с помощью поверхностного плазмонного резонанса, как описано ранее. Все образцы сохраняли тесное связывание с CD8A человека после мутации E54 на Cys и конъюгации с DFO (Таблица 8).
Таблица 8. Аффинность связывания после конъюгации ДФО
ПРИМЕР 7. Связывание анти-CD8a доменов FN3 с Т-лимфоцитами человека и яванского макака.
Кривая связывания ответа на полную дозу была получена для девятнадцати выбранных анти-CD8A доменов FN3. Каждого кандидата разводили до 20 мкМ в ФСБ с помощью ряда разведений 1:3, чтобы получить либо кривую зависимости от дозы из 11 или 18 точек. CD8+ Т-лимфоциты человека и яванского макака инкубировали с разведенным доменом FN3 в течение 1 часа при 4°С. Клетки промывали один раз ФСБ и инкубировали с анти-центирин антителом (PAB25) в течение 1 часа при 4°C. Клетки дважды промывали ФСБ с последующей инкубацией с PE-вторичным анти-CD3-PacB, анти-CD4-APC и красителем жизнеспособности. Наконец, клетки промывали и ресуспендировали в ФСБ для анализа с помощью проточной цитометрии с использованием инструмента BD Canto. CD8 Т-лимфоциты определяли, как живые CD3+CD4- клетки. Медианная интенсивность флуоресценции связанных центиринов (PE-канал) и % клеток, демонстрирующих положительное окрашивание, рассчитывали с использованием программного обеспечения Cytobank. Результаты были нанесены на график с использованием Prism, а значения EC50 были рассчитаны с использованием 4-рех параметрического уравнения кривой зависимости от дозы с вариабельным угловым коефициентом.
Для определения аффинности шести лучших анти-CD8A кандидатов, связывающихся с поверхностными рецепторами CD8A цитотоксического Т-лимфоцита человека, выполняли анализ равновесного связывания клеток на основе технологии MesoScale Discovery-Cell Affinity (MSD-CAT). Каждый анти-CD8A домен FN3 при неизменной концентрации 50 пМ предварительно инкубировали с 10 различными концентрациями первичных цитотоксических CD8 Т-лимфоцитов (столбцы 2-11 подряд). Жизнеспособность клеток проверяли перед измерениями связывания, и для достоверного анализа требовалась жизнеспособность >85%. Поскольку данные клетки были от разных доноров, в случае вариаций в зависимости от донора, только клетки тех же доноров объединяли вместе. Связывание каждого отдельного анти-CD8A домена FN3 измеряли в повторностях с использованием клеток от тех же доноров. Клетки и домены FN3 инкубировали в течение ночи при 4°С в встряхиватиле для достижения равновесия. После инкубации клетки центрифугировали вместе со связанными с клетками анти-CD8A доменами FN3, а несвязанные (свободные) анти-CD8A домены FN3 в супернатантах количественно определяли с использованием анализов MSD, где биотинилированный рекомбинантный белок hCD8A-Fc захватывался при 0,6 мкг/мл в аналитическом буфере в стрептавидиновой плашке MSD в течение ночи, примерно 16 часов при 4°С. После блокирования плашки, в плашку добавляли супернатант с свободными анти-CD8A доменами FN3 и инкубировали в течение 1 часа, а затем проводили детекцию с помощью SulfoTag pAb139 (собственная методика) при 1,6 мкг/мл. Был включен контроль в виде буфера без какого-либо домена FN3 и hCD8A (контроль базового связывания с плашкой) в колонке 1, а также контроль только для домена FN3 без hCD8A (100% свободный/несвязанный) в колонке 12. Мышиное анти-hCD8A мАт (mIgG1k, BD Biosciences, кат. № 555364, клон RPA-T8) было включено в качестве положительного контроля. Tencon27 был включен в первоначальную валидацию анализа в качестве отрицательного контроля и не наблюдалось значительное связывание, и поэтому, он не был включен в последующее связывание клеток из-за доступности клеток. Плашки сразу считывали на MSD Sector Imager 6000 Reader для определения уровней люминесценции после добавления буфера MSD Read путем разбавления исходного раствора 1:4 H2O.
Необработанные данные MSD экспортировали и анализировали в Prism с использованием нелинейной подгонки с функцией с переменным коэффициентом наклона для получения значений Bmax и Hillslope. Только те, у которых сходились значения Bmax и hillslope в диапазоне от -1,5 до -0,5 (идеально -1,0), учитывали в дальнейшем анализе. Затем данные по связыванию были нормализованы с использованием значений Bmax для расчета нормализованного % свободных доменов FN3. Для расчета концентрации рецепторов была использована поверхность CD8 с плотностью, составляющей 50000 рецепторов/клетка. Критерий насыщения <20% свободного центирина при самых высоких концентрациях клеток CD8 требовался для определения аффинности с использованием «Уравнения аффинности растворов для нормализованных данных» для модели связывания 1:1.
Анти-CD8A домены FN3 связываются с первичными клетками с аффинностями в диапазоне от 0,167 до 2,81 нМ (Таблица 9).
Таблица 9. Обобщенные данные по значениям EC50 для шести лучших кандидатов анти-CD8A доменов FN3.
(SEQ ID NO:)
(232)
(234)
(230)
(229)
(233)
(231)
ПРИМЕР 8. Активация Т-лимфоцитов человека
Активация de novo
Чтобы определить, активируют ли анти-CD8A домены FN3 Т-лимфоциты, был проведен анализ проточной цитометрии для наблюдения изменений маркеров активации Т-лимфоцитов. Шесть анти-CD8A доменов FN3 были проверены на активацию Т-лимфоцитов. Активацию de novo оценивали путем инкубации доменов FN3 при концентрации 1 мкМ или 10 нМ в двух повторностях с pan-Т-лимфоцитами человека в среде в течение 4 дней. Были протестированы два независимых донора. Связанный с плашкой анти-CD3 использовали в качестве положительного контроля в 2 дозах, 0,1 мкг/мл и 0,01 мкг/мл. ФСБ использовали в качестве отрицательного контроля. Затем клетки окрашивали красителем жизнеспособности и следующей панелью антител: CD4-FITC, CD3-PerCP-Cy5.5, CD69-PacB, CD45RA-BV605, CD25-BV650, CD127-PE и CD137-PE-Cy7. CD8+ лимфоциты определяли, как живые CD3+CD4-клетки и они были профилированы для каждого маркера активации Т-лимфоцитов. Медианные значения интенсивности флуоресценции рассчитывали с использованием программного обеспечения FlowJo, а значения повторностей усредняли. Результаты подытожены в Таблице 10А (донор 022) и 10В (донор 146). Для 365, 366, 367, 368 и 370 наблюдали небольшие изменения маркеров активации Т-лимфоцитов только у 1 из 2 доноров, протестированных при самом высоком уровне дозы, составляющем 1 мкМ. Такие изменения отсутствовали у обоих доноров при дозе 10 нМ, что свидетельствует о том, что молекулы не активируют Т-лимфоциты de novo при соответствующих концентрациях. Молекула 369, по-видимому, значительно активирует экспрессию CD137 у обоих доноров при самом высоком уровне дозы.
Таблица 10. Медианные значения интенсивности флуоресценции (МИФ) для различных маркеров активации Т-лимфоцитов на CD8+ Т-лимфоцитах для донора 022 (A) и донора 146 (B)
A
(SEQ ID NO:)
мл
(234)
(234)
(229)
(229)
(230)
(230)
(231)
(231)
(232)
(232)
(233)
(233)
B
(SEQ ID NO:)
мл
(234)
(234)
(229)
(229)
(230)
(230)
(231)
(231)
(232)
(232)
(233)
(233)
Активация pan-Т-лимфоцитов
Чтобы определить, могут ли анти-CD8A домены FN3 влиять на маркеры активации Т-лимфоцитов в pan-активных Т-лимфоцитах, анти-CD8A домены FN3 также оценивали в комбинации с низкой дозой CD3, связанного с плашкой. В данном анализе была использована субоптимальная концентрация (0,01 мкг/мл) связанного с плашкой анти-CD3 для активации Т-лимфоцитов в присутствии 1 мкМ или 10 нМ анти-CD8A. Через 4 дня клетки оценивали с использованием той же панели и стратегии пропускания через ворота, как описано выше. Были протестированы два независимых донора. Медианные значения интенсивности флуоресценции рассчитывали с использованием программного обеспечения FlowJo, а значения повторностей усредняли. Результаты подытожены в Таблице 11А (донор 022) и 11В (донор 146).
Таблицы 11А и В: Медианные значения интенсивности флуоресценции (МИФ) для различных маркеров активации Т-лимфоцитов на CD8+ Т-лимфоцитах для донора 022 (A) и донора 146 (B) в присутствии связанного с плашкой CD3.
A
(SEQ ID NO:)
мл
(234)
(234)
(229)
(229)
(230)
(230)
(231)
(231)
(232)
(232)
(233)
(233)
B
(SEQ ID NO:)
мл
(234)
(234)
(229)
(229)
(230)
(230)
(231)
(231)
(232)
(232)
(233)
(233)
Цитокиновый ответ
Чтобы определить, наблюдаются ли какие-либо изменения в маркерах активации, приводящих к изменениям в продуцировании цитокинов, выполняли анализы зависимой от антигена активации Т-лимфоцитов с использованием двух анти-CD8A доменов FN3. В одном наборе анализов размораживали либо ЦМВ-реактивные, либо М1 реактивные МКПК человека, и оставляли на ночь при 37°C в 6-луночных плашках. На следующий день МКПК собирали пипеткой, подсчитывали и высевали в плашки гамма-ИНФ Mabtech ELISpot в присутствии или в отсутствие 10 мкг/мл пептида. В лунки добавляли 1 мкМ конъюгата анти-CD8A-FN3-DFO, и плашки инкубировали при 37°С в течение примерно 24 часов не трогая. Клетки удаляли и плашки 5 раз промывали ФСБ. Добавляли детектирующее антитело и плашки инкубировали в течение 2 часов. Плашки снова промывали и в каждую лунку добавляли субстрат набора. Плашки выдерживали в течение примерно 5 минут, прежде чем останавливали реакцию, помещая плашку в воду. Плашки сушили вверх дном в темноте. Плашки считывали с помощью AID EliSpot Reader и подсчитывали пятна с использованием программного обеспечения AID EliSpot. Результаты были представлены в виде графике в Prism. Результаты подытожены в Фиг. 1. В данном анализе 365-DFO не увеличивает количество пятен гамма-ИНФ по сравнению с только средой (питательной) или контролем TenCon, не связывающимся с CD8A, в отсутствие пептида (Фиг. 1A, 1C). Пептид и CD3 включены в качестве положительных контролей. В присутствии пептида 365-DFO не изменяет количество пятен гамма-ИНФ по сравнению с только пептидом или пептидом с TenCon, не связывающимся с CD8A (Фиг. 1B, 1D). Среда включен в качестве отрицательного контроля, а CD3 включен в качестве положительного контроля. Данные результаты показывают, что центирин не влияет на активацию Т-лимфоцитов.
Чтобы подтвердить данные результаты в более длительном анализе, уровни гамма-ИНФ также измеряли в 6-дневном анализе активации. Для данного исследования ЦМВ-реактивные МКПК инкубировали в трех повторностях с анти-CD8A доменами FN3 при 1 мкМ в присутствии или в отсутствие 0,25 мкг/мл пептида pp65. Клетки инкубировали в течение 6 дней при 37°С. В каждый момент времени клетки центрифугировали и собирали супернатант. Образцы хранили при -80°С до анализа. Размороженные образцы были проанализированы на гамма-ИНФ с использованием ИФА на основе single-plex Meso Scale Discovery (MSD). Для данного анализа была подготовлена стандартная кривая согласно инструкциям производителя. Образцы и стандарты добавляли в предварительно покрытые 96-луночные плашки MSD. После 2-часовой инкубации добавляли детектирующее антитело набора. После еще двух часов инкубации плашки промывали трижды с последующим добавлением поставляемого буфера для считывания. Плашки считывали считыватели плашек MSD Sector Imager 6000. Файлы необработанных данных MSD были проанализированы в сравнении с стандартными кривыми, сгенерированным с использованием программного обеспечения MSD Discovery Workbench. Проанализированные данные были получены с помощью программы Tibco Spotfire. Результаты подытожены в Фиг. 2. В данном анализе 365-DFO не увеличивает секрецию гамма-ИНФ в питательной среде по сравнению с только питательной средой в отсутствие пептида (Фиг. 2A). Пептид ЦМВ включен в качестве положительного контроля. В присутствии пептида 365-DFO также не изменяет уровень секреции гамма-ИНФ по сравнению с только пептидом (Фиг. 2B). Питательная среда включена в качестве негативного контроля. Данные результаты показывают, что центирин не влияет на активацию Т-лимфоцитов.
ПРИМЕР 9. Мечение анти-CD8A доменов FN3 I124/I125
Текущий способ радиоактивного мечения CD8S365 иодом-124 для получения [124I]-IPEM CD8S 365 (схема 1) был адаптирован из литературных методик (Bioconjugate Chem. 1991, 2, 435-440; ChemistryOpen 2015, 4, 174-182).
Схема 1: Синтез [124I]-IPEM CD8S 365
В 1,5 мл эппендорф-пробирку добавляли по порядку: раствор Na124I (≤13 мкл, ≤2,5 мКи), AcOH (5 мкл для подкисления раствора), 1-(4-(трибутилстаннил)фенетил)-1Н-пиррол-2,5-дион (75 мкл, 1,00 мг/мл в MeCN) и раствор иодогена (5 мкл, 1,00 мг/мл в MeCN). Реакционную смесь оставляли на 5 мин при комнатной температуре.
Неочищенную реакционную смесь разбавляли 0,5 мл 20% EtOH/H2O и очищали непосредственно в препаративной ВЭЖХ, время удержания=14,4 мин (Фиг. 3). [124I]-IPEM собирали в флакон (1 драм), который был предварительно обработан Sigma-Cote™ (затем промыт 3 мл 70% EtOH, а затем 3 мл H2O); общий объем собранного продукта препаративной ВЭЖХ <750 мкл.
Аликвоту (примерно 5-25 мкКи) очищенной фракции затем применяли в аналитической ВЭЖХ (Фиг.4, время удержания=11,7 мин).
Очищенный [124I]-IPEM затем концентрировали в вакууме при температуре окружающей среды до объема <100 мкл.
Добавляли натрий-фосфатный буфер (1,0 М фосфат натрия, 1 мМ ЭДТК, pH=6,86) (≥25 мкл), чтобы довести pH до примерно 6,5-7 (проверено лакмусовой полоской). В конце добавляли свежеприготовленный CD8S 365 (концентрация примерно 4,57 мг/мл в 100 мМ натрий-фосфатном буфере, 1 мМ ЭДТК, pH=6,86) в соответствующем количестве для достижения целевой удельной активности (то есть, если целевая удельная активность 25 мКи/мг и собрали 2,0 мКи [124I]-IPEM, то добавляли 17,5 мкл центирина в концентрации примерно 4,57 мг/мл). Реакцию конъюгирования оставляли на 60 мин при температуре окружающей среды, и ход реакции проверяли с помощью iTLC, чтобы убедиться, что конверсия превысила 90%.
Очистка состояла из разбавления реакционного раствора ФСБ/10% EtOH (1 мл, pH=7), переноса реакционного раствора из флакона (1 драм) в центробежный фильтр Mivo Vivaspin 6 5 кДа (смотрите дополнение к документу для предварительного кондиционирования). После переноса реакционный эппендорф промывали ФСБ/10% EtOH (2 × 1 мл, pH=7) и промывки добавляли на фильтр. Неочищенную реакционную смесь центрифугировали при 4000 об/мин, при 20°С в течение 30 минут. После центрифугирования оставалось <500 мкл раствора, и с помощью радио-ТСХ было обнаружено, что он обладает радиохимической чистотой (RCP)> 95% (Фиг. 5). Очищенный [124I]-IPEM CD8S 365 разбавляли до объема 500 мкл ФСБ/10% EtOH, если объем составлял <500 мкл, а затем фильтровали через 0,22 мкм гидрофильную мембрану Durapore (PVDF) Millex-GV.
Радиохимический выход по протоколу составляет примерно 50% с радиохимической чистотой ≥95% RCP согласно радио-ТСХ). Аналитическую обращенно-фазовую ВЭЖХ использовали для определения концентрации белка и удельной активности конечного продукта. Среднее интегрирование пика при времени удержания=7,3 мин в УФ при λ=280 нм было использовано для экстраполяции концентрации белка из калибровочной кривой (на Фиг. 6 в качестве типичного примера). Также была проведена ко-инъекция с нерадиоактивным холодным стандартом IPEM CD8S 365 (анализ MALDI, показанный на Фис. 7) (смотрите Фиг. 8). Концентрацию бактериального эндотоксина измеряли с использованием портативной тест-системы Endosafe®, используя 10-кратное разбавление водой с реагентом LAL.
Пример 10. Обнаружение экспрессии CD8 у яванских макак
Две молекулы анти-CD8A FN3 (CD8S365 и CD8S368) были отобраны для получения изображений PET у отличных от человека приматов (ОЧП). Молекулы анти-CD8A были радиоактивно мечены либо Zr-89 (Zevacor, Сомерсет, штат Нью-Джерси), либо I-124 (CPDC, Гамильтон, Канада и Zevacor, Сомерсет, штат Нью-Джерси). Примерно 1-2 мКи радиоактивно меченных молекул анти-CD8A вводили в подкожную вену самки ОЧП (яванский макак), одновременно анестезируя изофлураном в кислороде. Каждое животное сканировали с помощью сканера microPET Focus 220 PET с большим отверстием (Siemens, Ноксвилл, Теннесси), при этом кровать перемещали для размещения всего тела животного (от головы до нижней части живота). Каждое сканирование длилось примерно 1 час, и сканирования были получены через 15 минут, 2 часа и 24 часа после инъекции. ПЭТ-изображения были реконструированы с использованием алгоритма 2D максимизации максимального правдоподобия (ML-EM) в трехмерные изображения с размерами вокселей 1,898×1,898×0,796 мм, с размерами 128×128×475. Образцы крови отбирали несколько раз в разные моменты времени из подкожной вены лапы, противоположной инъецированной лапе, и радиоактивность крови была подсчитана на счетчике излучения с колодцем.
Изображения ПЭТ анализировали с использованием программного обеспечения PMOD v3.7 (PMOD, Цюрих, Швейцария). Области интереса были нарисованы вручную вокруг таких органов, как селезенка, почки и печень. Подсчеты были переведены в единицы процента инъецированной дозы на грамм ткани (% ИД/г), в то время как радиоактивность крови была представлена как % ИД. Репрезентативное изображение ПЭТ показано на Фиг. 9.
Кинетика в крови для каждого ОЧП и каждой молекулы анти-CD8A домена FN3 (меченной либо Zr-89, либо I-124) показана в Таблице 11 и подытожена на Фиг. 10. Для тех же животных и молекул анти-CD8A биораспределение в органах показано в Таблице 12 (единицы измерения % ИД/г) и подытожено на Фиг. 11. Молекулы, меченные Zr-89, демонстрировали остаточное присутствие радиоизотопа в выделительных органах, что вызывало сильный фоновый сигнал в почках, потенциально затемняя другие близлежащие ткани. Подобное в значительной степени отсутствовало в меченных I-124 молекулах. Поглощение селезенкой было очень сходным для двух разных молекул и двух разных радиоизотопов для всех моментов времени.
Таблица 11. Кинетика в крови для каждого центирина, меченного радиоактивным изотопом - либо Zr-89, либо I-124 (табличные данные представляют собой % ИД (инъецированная доза)).
Для тех же животных и молекул анти-CD8A биораспределение в органах показано в Таблице 12 (единицы измерения % ИД/г) и подытожено на Фиг. 11.
Таблица 12. Накопление в органах различных центиринов, меченных либо Zr-89, либо I-124 (табличные данные представляют собой %ИД/г).
Пример 11. Специфичность анти-CD8A доменов FN3 у яванских макак
Для того чтобы проверить специфичность молекул анти-CD8A, тех же обезьян обрабатывали химерным CD8-деплетирующим антителом (CM-T807 мышиное V/человеческое Fc анти-CD8 антитело) для уменьшения количества CD8+ T-лимфоцитов перед визуализацией. Животным вводили п/к 10 мг/кг CD8-деплетирующих антител за 3 дня до визуализации. Деплетирование CD8 было подтверждено путем измерения процентного содержания CD8 T-лимфоцитов в образцах крови, взятых у каждого животного до и после истощения (Фиг. 12).
Примерно 1-2 мКи радиоактивно меченых [I-124]CD8S365 молекул анти-CD8 домена FN3 вводили в подкожную вену самки ОЧП (яванский макак), одновременно анестезируя изофлураном в кислороде. Каждое животное сканировали с помощью сканера microPET Focus 220 PET с большим отверстием (Siemens, Ноксвилл, Теннесси), при этом кровать перемещали для размещения всего тела животного (от головы до нижней части живота). Каждое сканирование длилось примерно 1 час, и сканирования были получены через 15 минут, 2 часа и 24 часа после инъекции. ПЭТ-изображения были реконструированы с использованием алгоритма 2D максимизации максимального правдоподобия (ML-EM) в трехмерные изображения с размерами вокселей 1,898×1,898×0,796 мм, с размерами 128×128×475. Образцы крови отбирали несколько раз в разные моменты времени из подкожной вены лапы, противоположной инъецированной лапе, и радиоактивность крови была подсчитана на счетчике излучения с колодцем.
Изображения ПЭТ анализировали с использованием программного обеспечения PMOD v3.7 (PMOD, Цюрих, Швейцария). Области интереса были нарисованы вручную вокруг таких органов, как селезенка, почки и печень. Подсчеты были переведены в единицы процента инъецированной дозы на грамм ткани (% ИД/г), в то время как радиоактивность крови была представлена как % ИД. Репрезентативное изображение ПЭТ показано на Фиг. 13 для деплетированного животного, показывая полное отсутствие сигнала селезенки, наблюдаемого у не деплетированного животного на Фиг. 9.
Кинетика в крови для каждого ОЧП, как деплетированного, так и не деплетированного, показана на Фиг. 14, а поглощение органами показано на Фиг. 15. Существует небольшая разница в кинетике в крови у деплетированных и не деплетированных животных. Поглощение селезенкой в самый ранний момент времени похоже между деплетированными и не деплетированными, поскольку это вызвано преобладанием в кровотоке. Однако в более поздние моменты времени (2 часа) поглощение селезенкой у деплетированных животных составляет меньше чем половину от того, что наблюдается у не деплетированных животных, и по существу находится на фоновых уровнях, демонстрируя специфичность к CD8A радиоактивно меченного центирина.
Пример 12. Чувствительность и специфичность ПЭТ-визуализации в опухолях, сверхэкспрессирующих CD8
Чтобы определить наименьшее количество клеток, которое можно обнаружить с помощью молекул анти-CD8A домена FN3 и ПЭТ, было проведено исследование на мышах с использованием различного количества клеток, сверхэкспрессирующих CD8. Использовали и акклиматизировали в течение 7-10 дней сорок 4-5-недельных мышиных самок NOD-scid IL2rγnull (NSG) (JAX Laboratory). Мышей размещали группами в клетках IVC при 12-часовом цикле свет:тьма (свет включается в 06:30 ч) при температуре от 19 до 22°C. Мышей кормили стандартным автоклавированным лабораторным кормом и водой ad libitum. Уши мышей метили, а хвосты татуировали за 5-7 дней до начала исследования для идентификации каждого животного.
Клеточные линии исходной HEK-293 и сверхэкспрессирующей CD8+ HEK-293-luc поддерживали в виде 2D-культур. Мышам имплантировали подкожно в общей сложности 106 опухолевых клеток в соотношении 1:1 среды к смеси культур, содержащей различные соотношения экспрессирующих CD8+ HEK-293-Luc клеток и исходных клеток HEK-293. После того, как опухоли начинали прощупываться, примерно через 10-14 дней и достижении размера 200-300 мм3, человеческие CD8+ клетки визуализировали с использованием [I-124]CD8-S365.
Экспрессию люциферазы клеток CD8+ HEK-293-Luc вычисляли in vivo с использованием биолюминесцентной визуализации в оптическом томографе IVIS Spectrum (Perkin Elmer). Динамическую оптическую визуализацию выполняли сразу после инъецирования 150 мг/кг D-люциферина для определения пика оптического излучения.
Примерно 0,2-0,5 мКи радиоактивно меченных молекул анти-CD8A домена FN3 инъецировали в хвостовую вену при анестезии изофлураном в кислороде. Каждое животное сканировали на сканере Inveon microPET-CT (Siemens, Ноксвилл, Теннесси) в течение 20 минут статического сканирования. Сканы были получены через 2-3 ч после инъекции меченого вещества. ПЭТ-изображения были реконструированы с использованием алгоритма 2D максимизации максимального правдоподобия (ML-EM) в трехмерные изображения с размерами вокселей 0,776×0,776×0,796 мм, с размерами 128×128×159.
Изображения ПЭТ анализировали с использованием программного обеспечения PMOD v3.7 (PMOD, Цюрих, Швейцария). Области интереса были нарисованы вручную вокруг опухоли и других органов, таких как селезенка, почки и печень. Подсчеты были переведены в единицы процента инъецированной дозы на грамм ткани (% ИД/г). Репрезентативное изображение ПЭТ показано на Фиг. 16. Экспрессию люциферазы определяли количественно, используя области интереса в программном обеспечении Living Image v4.4 (Perkin Elmer). Оптическое излучение измеряли в единицах фотоны/сек/см2/стерадиан.
Кривые время-активность радиоактивно меченных молекул анти-CD8A домена FN3 в крови и опухоли как для клеток CD8+ HEK293, так и для исходных клеток показаны на Фиг. 17 и Фиг. 18. Наблюдается значительное увеличение связывания анти-CD8A FN3 в клетках, экспрессирующих CD8, по сравнению с исходными, в то время как активность в крови одинакова для обеих. Поглощение анти-CD8A FN3 клетками CD8+ HEK293 показано на Фиг. 19 как функция числа имплантированных клеток. На основании этих данных оценено, что самый низкий уровень обнаружения составляет примерно 7,5×106 клеток.
Перечень последовательностей
SEQ ID NO: 1=Исходная последовательность Tencon
LPAPKNLVVSEVTEDSLRLSWTAPDAAFDSFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVKGGHRSNPLSAEFTT
SEQ ID NO: 2=библиотека TCL1
LPAPKNLVVSEVTEDSLRLSWTAPDAAFDSFLIQYQESEKVGEAINLTVPGSERSY DLTGLKPGTEYTVSIYGV(X)7-12PLSAEFTT;
причем
X1, X2, X3, X4, X5, X6, X7 представляет собой любую аминокислоту; и
X8, X9, X10, X11 и X12 являются любой аминокислотой или удалены
SEQ ID NO: 3=библиотека TCL2
LPAPKNLVVSEVTEDSLRLSWX1X2X3X4X5X6X7X8SFLIQYQESEKVGEAINLTVPGSERSYDLTGLKPGTEYTVSIYGVX9X10X11X12X13SX14X15LSAEFTT;
причем
X1 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X2 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X3 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X4 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X5 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X6 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X7 представляет собой Phe, Ile, Leu, Val или Tyr;
X8 представляет собой Asp, Glu или Thr;
X9 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X10 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X11 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X12 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X13 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val;
X14 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val; и
X15 представляет собой Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu, Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val.
SEQ ID NO: 4=стабилизированный Tencon (Tencon 27)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFLIQYQESEKVGEAIVLTVPGSERSYDLTGLKPGTEYTVSIYGVKGGHRSNPLSAIFTT
SEQ ID NO: 5=TCL7 (петли FG и BC)
LPAPKNLVVSRVTEDSARLSWX1X2X3X4X5X6X7X8X9FDSFLIQYQESEKVGEAIVLTVPGSERSYDLTGLKPGTEYTVSIYGVX10X11X12X13X14X15X16X17X18X19SNPLSAIFTT;
причем
X1, X2, X3, X4, X5, X6, X10, X11, X12, X13, X14, X15 и X16 представляют собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W или Y; и
X7, X8, X9, X17, X18 и X19, представляют собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W, Y или удалены
SEQ ID NO: 6=TCL9 (петля FG)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFLIQYQESEKVGEAIVLTVPGSERSYDLTGLKPGTEYTVSIYGV X1X2X3X4X5X6X7X8X9 X10X11X12SNPLSAIFTT;
причем
X1, X2, X3, X4, X5, X6 и X7, представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W или Y; и
X8, X9, X10, X11 и X12 представляет собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W, Y или удален.
SEQ ID NO: 7=библиотека TCL14
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFX1IX2YX3EX4X5X6X7GEAIVLTVPG SERSYDLTGLKPGTEYX8VX9IX10GVKGGX11X12SX13PLSAIFTT;
причем
X1, X2, X3, X4, X5, X6, X10, X11, X12 и X13 представляют собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V, W, Y, или M.
SEQ ID NO: 8=библиотека TCL24
Библиотека TCL24 (SEQ ID NO: 8)
LPAPKNLVVSRVTEDSARLSWTAPDAAFDSFX1IX2YX3EX4X5X6X7GEAIX8LX9VP GSERSYDLTGLKPGTEYX10VX11IX12GVKGGX13X14SX15PLX16AX17FTT;
причем
X1, X2, X3, X4, X5, X6, X10, X11, X12 и X13 представляют собой A, D, E, F, G, H, I, K, L, N, P, Q, R, S, T, V или W.
SEQ ID NO: 9=Sloning-FOR
GTGACACGGCGGTTAGAAC
SEQ ID NO: 10=Sloning-REV
GCCTTTGGGAAGCTTCTAAG
SEQ ID NO: 11=POP2250
CGGCGGTTAGAACGCGGCTACAATTAATAC
SEQ ID NO: 12=DigLigRev
CATGATTACGCCAAGCTCAGAA
SEQ ID NO: 13=BC9
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTGAAGTTACCGAAGACTCTCTGCGTCTGTCTTGGNNNNNNNNNNNNNNNNNNNNNNNNNNNTTYGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCAACCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTCTTAGAAGCTTCCCAAAGGC
SEQ ID NO: 14=BC8
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTGAAGTTACCGAAGACTCTCTGCGTCTGTCTTGGNNNNNNNNNNNNNNNNNNNNNNNNTTYGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCAACCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTCTTAGAAGCTTCCCAAAGGC
SEQ ID NO: 15=BC7
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTGAAGTTACCGAAGACTCTCTGCGTCTGTCTTGGNNNNNNNNNNNNNNNNNNNNNTTYGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCAACCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTCTTAGAAGCTTCCCAAAGGC
SEQ ID NO: 16=BC6
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTGAAGTTACCGAAGACTCTCTGCGTCTGTCTTGGNNNNNNNNNNNNNNNNNNTTYGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCAACCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTCTTAGAAGCTTCCCAAAGGC
SEQ ID NO: 17=130мер-L17A
CGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTG
SEQ ID NO: 18=POP222ext
CGG CGG TTA GAA CGC GGC TAC AAT TAA TAC
SEQ ID NO: 19=LS1114
CCA AGA CAG ACG GGC AGA GTC TTC GGT AAC GCG AGA AAC AAC CAG GTT TTT CGG CGC CGG CAG CAT GGT AGA TCC TGT TTC
SEQ ID NO: 20=LS1115
CCG AAG ACT CTG CCC GTC TGT CTT GG
SEQ ID NO: 21=LS1117
CAG TGG TCT CAC GGA TTC CTG GTA CTG GAT CAG GAA AGA GTC GAA
SEQ ID NO: 22=SDG10
CATGCGGTCTCTTCCGAAAAAGTTGGTGAAGCGATCGTCCTGACCGTTCCGGGT
SEQ ID NO: 23=SDG24
GGTGGTGAAGATCGCAGACAGCGGGTTAG
SEQ ID NO: 24=POP2222
CGGCGGTTAGAACGCGGCTAC
SEQ ID NO: 25=SDG28
AAGATCAGTTGCGGCCGCTAGACTAGAACCGCTGCCACCGCCGGTGGTGAAGATCGCAGAC
SEQ ID NO: 26=FG12
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTCGCGTTACCGAAGACTCTGCGCGTCTGTCTTGGACCGCGCCGGACGCGGCGTTCGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCGTGCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNTCTAACCCGCTGTCTGCGATCTTCACCACCGGCGGTCACCATCACCATCACCATGGCAGCGGTTCTAGTCTAGCGGCCGCAACTGATCTTGGC
SEQ ID NO: 27=FG11
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTCGCGTTACCGAAGACTCTGCGCGTCTGTCTTGGACCGCGCCGGACGCGGCGTTCGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCGTGCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNTCTAACCCGCTGTCTGCGATCTTCACCACCGGCGGTCACCATCACCATCACCATGGCAGCGGTTCTAGTCTAGCGGCCGCAACTGATCTTGGC
SEQ ID NO: 28=FG10
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTCGCGTTACCGAAGACTCTGCGCGTCTGTCTTGGACCGCGCCGGACGCGGCGTTCGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCGTGCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNTCTAACCCGCTGTCTGCGATCTTCACCACCGGCGGTCACCATCACCATCACCATGGCAGCGGTTCTAGTCTAGCGGCCGCAACTGATCTTGGC
SEQ ID NO: 29=FG9
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTCGCGTTACCGAAGACTCTGCGCGTCTGTCTTGGACCGCGCCGGACGCGGCGTTCGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCGTGCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTNNNNNNNNNNNNNNNNNNNNNNNNNNNTCTAACCCGCTGTCTGCGATCTTCACCACCGGCGGTCACCATCACCATCACCATGGCAGCGGTTCTAGTCTAGCGGCCGCAACTGATCTTGGC
SEQ ID NO: 30=FG8
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTCGCGTTACCGAAGACTCTGCGCGTCTGTCTTGGACCGCGCCGGACGCGGCGTTCGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCGTGCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTNNNNNNNNNNNNNNNNNNNNNNNNTCTAACCCGCTGTCTGCGATCTTCACCACCGGCGGTCACCATCACCATCACCATGGCAGCGGTTCTAGTCTAGCGGCCGCAACTGATCTTGGC
SEQ ID NO: 31=FG7
GTGACACGGCGGTTAGAACGCGGCTACAATTAATACATAACCCCATCCCCCTGTTGACAATTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGGATCTACCATGCTGCCGGCGCCGAAAAACCTGGTTGTTTCTCGCGTTACCGAAGACTCTGCGCGTCTGTCTTGGACCGCGCCGGACGCGGCGTTCGACTCTTTCCTGATCCAGTACCAGGAATCTGAAAAAGTTGGTGAAGCGATCGTGCTGACCGTTCCGGGTTCTGAACGTTCTTACGACCTGACCGGTCTGAAACCGGGTACCGAATACACCGTTTCTATCTACGGTGTTNNNNNNNNNNNNNNNNNNNNNTCTAACCCGCTGTCTGCGATCTTCACCACCGGCGGTCACCATCACCATCACCATGGCAGCGGTTCTAGTCTAGCGGCCGCAACTGATCTTGGC
SEQ ID NO: петля 32 FG Tencon
KGGHRSN
SEQ ID NO: 33=Tcon 6
AAGAAGGAGAACCGGTATGCTGCCGGCGCCGAAAAAC
SEQ ID NO: 34=Tcon5E86Ishort
GAG CCG CCG CCA CCG GTT TAA TGG TGA TGG TGA
TGG TGA CCA CCG GTG GTG AAG ATC GCA GAC AG
> SEQ ID NO: 35: CD8W7
SQFRVSPLDRTWNLGETVELKCQVLLSNPTSGCSWLFQPRGAAASPTFLLYLSQNKPKAAEGLDTQRFSGKRLGDTFVLTLSDFRRENEGYYFCSALSNSIMYFSHFVPVFLPAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAGSGSGSDYKDDDDKDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
>SEQ ID NO: 36: CD8W13
SQFRVSPLDRTWNLGETVELKCQVLLSNPTSGCSWLFQPRGAAASPTFLLYLSQNKPKAAEGLDTQRFSGKRLGDTFVLTLSDFRRENEGYYFCSALSNSIMYFSHFVPVFLPAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDGGGGSDYKDDDDKGGGGSHHHHHHDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
>SEQ ID NO: 37: сигнальный пептид mIgGK
Metdtlllwvlllwvpgstg
>SEQ ID NO: 38: Fc человека
Dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
>SEQ ID NO: 39: линкерная последовательность
Ggggsdykddddkggggshhhhhh
SEQ ID. No. 270 Tencon25
lpapknlvvsevtedsarlswtapdaafdsfliqyqesekvgeaivltvpgsersydltglkpgteytvsiygvkgghrsnplsaiftt
SEQ ID. NO: 271 CD8-альфа яванского макака
MRNQAPGRPKGATSPPPLPTGSRAPPVAPELRAEPRPGERVMAPPVTALLLPLVLLLHAARPNQFRVSPLGRTWNLGETVELKCQVLLSNPTSGCSWLFQPRGTAARPTFLLYLSQNKPKAAEGLDTQRFSGKRLGDTFVLTLRDFRQENEGYYFCSALSNSIMYFSHFVPVFLPAKPTTTPAPRPPTPAPTTASQPLSLRPEACRPAAGGSVNTRGLDFACDIYIWAPLAGACGVLLLSLVITLYCNHRNRRRVCKCPRPVVKSGGKPSLSDRYV
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> JANSSEN BIOTECH, INC.
HAWKINS, REBECCA
JACOBS, STEVEN
SEPULVEDA, MANUEL
<120> CD8A-СВЯЗЫВАЮЩИЕ ДОМЕНЫ ТИПА III ФИБРОНЕКТИНА
<130> JBI5112WOPCT
<140> БУДЕТ ПРИСВОЕНО
<141> 2017-12-13
<150> 62/434,017
<151> 2016-12-14
<160> 281
<170> Версия PatentIn 3.5
<210> 1
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 1
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Glu Phe Thr Thr
85
<210> 2
<211> 94
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES
<222> (75)..(81)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (82)..(86)
<223> Любая аминокислота или отсутствует
<400> 2
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Xaa Xaa Xaa Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa Xaa Xaa Pro Leu Ser Ala Glu Phe Thr Thr
85 90
<210> 3
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES
<222> (22)..(22)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (23)..(23)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (24)..(24)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (25)..(25)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (26)..(26)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (27)..(27)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (28)..(28)
<223> Phe, Ile, Leu, Val или Tyr
<220>
<221> MOD_RES
<222> (29)..(29)
<223> Asp, Glu или Thr
<220>
<221> MOD_RES
<222> (75)..(75)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (76)..(76)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (77)..(77)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (78)..(78)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (79)..(79)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (81)..(81)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<220>
<221> MOD_RES
<222> (82)..(82)
<223> Ala, Arg, Asn, Asp, Glu, Gln, Gly, His, Ile, Leu,
Lys, Phe, Pro, Ser, Thr, Trp, Tyr или Val
<400> 3
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Leu Arg Leu Ser Trp Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Asn Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Xaa Xaa Xaa Xaa Xaa Ser
65 70 75 80
Xaa Xaa Leu Ser Ala Glu Phe Thr Thr
85
<210> 4
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 4
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 5
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES
<222> (22)..(27)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr
<220>
<221> MOD_RES
<222> (28)..(30)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или отсутствует
<220>
<221> MOD_RES
<222> (78)..(84)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr
<220>
<221> MOD_RES
<222> (85)..(87)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или отсутствует
<400> 5
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 6
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES
<222> (75)..(81)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr
<220>
<221> MOD_RES
<222> (82)..(86)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или отсутствует
<400> 6
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Xaa Xaa Xaa Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa Xaa Xaa Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 7
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES
<222> (32)..(32)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (34)..(34)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (36)..(36)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (38)..(41)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (68)..(68)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (70)..(70)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (72)..(72)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (78)..(79)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<220>
<221> MOD_RES
<222> (81)..(81)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp, Tyr, или Met
<400> 7
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Xaa
20 25 30
Ile Xaa Tyr Xaa Glu Xaa Xaa Xaa Xaa Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Xaa Val Xaa Ile Xaa Gly Val Lys Gly Gly Xaa Xaa Ser
65 70 75 80
Xaa Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 8
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES
<222> (32)..(32)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (34)..(34)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (36)..(36)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (38)..(41)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (46)..(46)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (48)..(48)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (68)..(68)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (70)..(70)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (72)..(72)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (78)..(79)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (81)..(81)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (84)..(84)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<220>
<221> MOD_RES
<222> (86)..(86)
<223> Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu,
Asn, Pro, Gln, Arg, Ser, Thr, Val, или Trp
<400> 8
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Xaa
20 25 30
Ile Xaa Tyr Xaa Glu Xaa Xaa Xaa Xaa Gly Glu Ala Ile Xaa Leu Xaa
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Xaa Val Xaa Ile Xaa Gly Val Lys Gly Gly Xaa Xaa Ser
65 70 75 80
Xaa Pro Leu Xaa Ala Xaa Phe Thr Thr
85
<210> 9
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 9
gtgacacggc ggttagaac 19
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 10
gcctttggga agcttctaag 20
<210> 11
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 11
cggcggttag aacgcggcta caattaatac 30
<210> 12
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 12
catgattacg ccaagctcag aa 22
<210> 13
<211> 385
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (198)..(224)
<223> a, c, t, g, неизвестный или другой
<400> 13
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctgaagtt accgaagact 180
ctctgcgtct gtcttggnnn nnnnnnnnnn nnnnnnnnnn nnnnttygac tctttcctga 240
tccagtacca ggaatctgaa aaagttggtg aagcgatcaa cctgaccgtt ccgggttctg 300
aacgttctta cgacctgacc ggtctgaaac cgggtaccga atacaccgtt tctatctacg 360
gtgttcttag aagcttccca aaggc 385
<210> 14
<211> 382
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (198)..(221)
<223> a, c, t, g, неизвестный или другой
<400> 14
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctgaagtt accgaagact 180
ctctgcgtct gtcttggnnn nnnnnnnnnn nnnnnnnnnn nttygactct ttcctgatcc 240
agtaccagga atctgaaaaa gttggtgaag cgatcaacct gaccgttccg ggttctgaac 300
gttcttacga cctgaccggt ctgaaaccgg gtaccgaata caccgtttct atctacggtg 360
ttcttagaag cttcccaaag gc 382
<210> 15
<211> 379
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (198)..(218)
<223> a, c, t, g, неизвестный или другой
<400> 15
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctgaagtt accgaagact 180
ctctgcgtct gtcttggnnn nnnnnnnnnn nnnnnnnntt ygactctttc ctgatccagt 240
accaggaatc tgaaaaagtt ggtgaagcga tcaacctgac cgttccgggt tctgaacgtt 300
cttacgacct gaccggtctg aaaccgggta ccgaatacac cgtttctatc tacggtgttc 360
ttagaagctt cccaaaggc 379
<210> 16
<211> 376
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (198)..(215)
<223> a, c, t, g, неизвестный или другой
<400> 16
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctgaagtt accgaagact 180
ctctgcgtct gtcttggnnn nnnnnnnnnn nnnnnttyga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatca acctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttctta 360
gaagcttccc aaaggc 376
<210> 17
<211> 131
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 17
cggcggttag aacgcggcta caattaatac ataaccccat ccccctgttg acaattaatc 60
atcggctcgt ataatgtgtg gaattgtgag cggataacaa tttcacacag gaaacaggat 120
ctaccatgct g 131
<210> 18
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 18
cggcggttag aacgcggcta caattaatac 30
<210> 19
<211> 81
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 19
ccaagacaga cgggcagagt cttcggtaac gcgagaaaca accaggtttt tcggcgccgg 60
cagcatggta gatcctgttt c 81
<210> 20
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 20
ccgaagactc tgcccgtctg tcttgg 26
<210> 21
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 21
cagtggtctc acggattcct ggtactggat caggaaagag tcgaa 45
<210> 22
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 22
catgcggtct cttccgaaaa agttggtgaa gcgatcgtcc tgaccgttcc gggt 54
<210> 23
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 23
ggtggtgaag atcgcagaca gcgggttag 29
<210> 24
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 24
cggcggttag aacgcggcta c 21
<210> 25
<211> 61
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 25
aagatcagtt gcggccgcta gactagaacc gctgccaccg ccggtggtga agatcgcaga 60
c 61
<210> 26
<211> 485
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (357)..(392)
<223> a, c, t, g, неизвестный или другой
<400> 26
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctcgcgtt accgaagact 180
ctgcgcgtct gtcttggacc gcgccggacg cggcgttcga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatcg tgctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttnnnn 360
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nntctaaccc gctgtctgcg atcttcacca 420
ccggcggtca ccatcaccat caccatggca gcggttctag tctagcggcc gcaactgatc 480
ttggc 485
<210> 27
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (357)..(389)
<223> a, c, t, g, неизвестный или другой
<400> 27
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctcgcgtt accgaagact 180
ctgcgcgtct gtcttggacc gcgccggacg cggcgttcga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatcg tgctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttnnnn 360
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnt ctaacccgct gtctgcgatc ttcaccaccg 420
gcggtcacca tcaccatcac catggcagcg gttctagtct agcggccgca actgatcttg 480
gc 482
<210> 28
<211> 479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (357)..(386)
<223> a, c, t, g, неизвестный или другой
<400> 28
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctcgcgtt accgaagact 180
ctgcgcgtct gtcttggacc gcgccggacg cggcgttcga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatcg tgctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttnnnn 360
nnnnnnnnnn nnnnnnnnnn nnnnnntcta acccgctgtc tgcgatcttc accaccggcg 420
gtcaccatca ccatcaccat ggcagcggtt ctagtctagc ggccgcaact gatcttggc 479
<210> 29
<211> 476
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (357)..(383)
<223> a, c, t, g, неизвестный или другой
<400> 29
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctcgcgtt accgaagact 180
ctgcgcgtct gtcttggacc gcgccggacg cggcgttcga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatcg tgctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttnnnn 360
nnnnnnnnnn nnnnnnnnnn nnntctaacc cgctgtctgc gatcttcacc accggcggtc 420
accatcacca tcaccatggc agcggttcta gtctagcggc cgcaactgat cttggc 476
<210> 30
<211> 473
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (357)..(380)
<223> a, c, t, g, неизвестный или другой
<400> 30
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctcgcgtt accgaagact 180
ctgcgcgtct gtcttggacc gcgccggacg cggcgttcga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatcg tgctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttnnnn 360
nnnnnnnnnn nnnnnnnnnn tctaacccgc tgtctgcgat cttcaccacc ggcggtcacc 420
atcaccatca ccatggcagc ggttctagtc tagcggccgc aactgatctt ggc 473
<210> 31
<211> 470
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<220>
<221> модифицированное_основание
<222> (357)..(377)
<223> a, c, t, g, неизвестный или другой
<400> 31
gtgacacggc ggttagaacg cggctacaat taatacataa ccccatcccc ctgttgacaa 60
ttaatcatcg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 120
caggatctac catgctgccg gcgccgaaaa acctggttgt ttctcgcgtt accgaagact 180
ctgcgcgtct gtcttggacc gcgccggacg cggcgttcga ctctttcctg atccagtacc 240
aggaatctga aaaagttggt gaagcgatcg tgctgaccgt tccgggttct gaacgttctt 300
acgacctgac cggtctgaaa ccgggtaccg aatacaccgt ttctatctac ggtgttnnnn 360
nnnnnnnnnn nnnnnnntct aacccgctgt ctgcgatctt caccaccggc ggtcaccatc 420
accatcacca tggcagcggt tctagtctag cggccgcaac tgatcttggc 470
<210> 32
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 32
Lys Gly Gly His Arg Ser Asn
1 5
<210> 33
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 33
aagaaggaga accggtatgc tgccggcgcc gaaaaac 37
<210> 34
<211> 65
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 34
gagccgccgc caccggttta atggtgatgg tgatggtgac caccggtggt gaagatcgca 60
gacag 65
<210> 35
<211> 387
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 35
Ser Gln Phe Arg Val Ser Pro Leu Asp Arg Thr Trp Asn Leu Gly Glu
1 5 10 15
Thr Val Glu Leu Lys Cys Gln Val Leu Leu Ser Asn Pro Thr Ser Gly
20 25 30
Cys Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala Ala Ser Pro Thr Phe
35 40 45
Leu Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala Ala Glu Gly Leu Asp
50 55 60
Thr Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp Thr Phe Val Leu Thr
65 70 75 80
Leu Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr Tyr Phe Cys Ser Ala
85 90 95
Leu Ser Asn Ser Ile Met Tyr Phe Ser His Phe Val Pro Val Phe Leu
100 105 110
Pro Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
115 120 125
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
130 135 140
Pro Ala Gly Ser Gly Ser Gly Ser Asp Tyr Lys Asp Asp Asp Asp Lys
145 150 155 160
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
165 170 175
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
180 185 190
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
195 200 205
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
210 215 220
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
225 230 235 240
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
245 250 255
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
260 265 270
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
275 280 285
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
290 295 300
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
305 310 315 320
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
325 330 335
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
340 345 350
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
355 360 365
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
370 375 380
Pro Gly Lys
385
<210> 36
<211> 412
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 36
Ser Gln Phe Arg Val Ser Pro Leu Asp Arg Thr Trp Asn Leu Gly Glu
1 5 10 15
Thr Val Glu Leu Lys Cys Gln Val Leu Leu Ser Asn Pro Thr Ser Gly
20 25 30
Cys Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala Ala Ser Pro Thr Phe
35 40 45
Leu Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala Ala Glu Gly Leu Asp
50 55 60
Thr Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp Thr Phe Val Leu Thr
65 70 75 80
Leu Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr Tyr Phe Cys Ser Ala
85 90 95
Leu Ser Asn Ser Ile Met Tyr Phe Ser His Phe Val Pro Val Phe Leu
100 105 110
Pro Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
115 120 125
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
130 135 140
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
145 150 155 160
Asp Gly Gly Gly Gly Ser Asp Tyr Lys Asp Asp Asp Asp Lys Gly Gly
165 170 175
Gly Gly Ser His His His His His His Asp Lys Thr His Thr Cys Pro
180 185 190
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
195 200 205
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
210 215 220
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
225 230 235 240
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
245 250 255
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
260 265 270
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
275 280 285
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
290 295 300
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
305 310 315 320
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
325 330 335
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
340 345 350
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
355 360 365
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
370 375 380
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
385 390 395 400
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
405 410
<210> 37
<211> 20
<212> PRT
<213> Неизвестная
<220>
<223> Описание неизвестной:
сигнальный пептид mIgGK
<400> 37
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 38
<211> 227
<212> PRT
<213> Homo sapiens
<400> 38
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 39
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 39
Gly Gly Gly Gly Ser Asp Tyr Lys Asp Asp Asp Asp Lys Gly Gly Gly
1 5 10 15
Gly Ser His His His His His His
20
<210> 40
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 40
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp His Thr Ala Thr Asn Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Asp Tyr Asn Pro
65 70 75 80
Thr Gly Arg Pro Val Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 41
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 41
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Lys Arg Pro Asn Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Val Asp Tyr Glu
65 70 75 80
Gly Arg Pro Arg Trp Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 42
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 42
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ser Lys Thr Asp Ser Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Val Tyr Ile Glu
65 70 75 80
Gly Asn Pro Val Phe Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 43
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 43
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Glu Gly Asp Arg Pro Phe Phe Asp Ser Phe
20 25 30
Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp Glu
65 70 75 80
Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 44
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 44
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Arg His Glu Thr Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Arg Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Val Val Glu Tyr Asp Ala
65 70 75 80
Ala Gly Asn Pro Lys Tyr Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 45
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 45
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ile Pro Asn Pro Ser Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Val Phe Asp Pro
65 70 75 80
Val Gly Phe Pro Ser His Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 46
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 46
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Arg Lys Arg Ala Asn Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val His Val Glu Tyr Asp Gln
65 70 75 80
His Gly Arg Pro Arg Trp Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 47
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 47
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Lys Ala Asn Arg Thr Thr Asp Leu His Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Gln
65 70 75 80
Tyr Asp Gly Gln Gln Pro Leu Tyr Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 48
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 48
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Asn Pro Ser Glu Asp Pro Gln Arg Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp
65 70 75 80
Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 49
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 49
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Trp Ser Asn Asp Asn Arg Pro Ile Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp
65 70 75 80
Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 50
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 50
Leu Pro Ala Pro Asn Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Phe Val Ser Gln Asn Lys Pro His Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 51
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 51
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Gly Gln Tyr Ile Thr Ala Phe Ser Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Ala Trp
65 70 75 80
Phe Gln Gly Lys Pro Thr Trp Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 52
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 52
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ile Lys Asp Gly His Pro Arg His Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Val Tyr
65 70 75 80
Asp Arg Gly Gln Leu Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 53
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 53
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Trp Pro Arg Lys Tyr Gln Arg Pro Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Ile Glu Trp
65 70 75 80
Ile Gly Asn Arg Pro Ile Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 54
<211> 99
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 54
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Ile Ala Ser Gln Ile His Ser Pro Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Tyr Asp Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile
85 90 95
Phe Thr Thr
<210> 55
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 55
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Lys Lys Arg Glu Tyr Gln Asp Pro Gly Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 56
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 56
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Lys
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Ser Asn Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Gly Val Lys Gly Gly Ala Phe Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 57
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 57
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Asp Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Gly Val Lys Gly Gly Pro Leu Ser
65 70 75 80
His Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 58
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 58
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Ser Tyr Pro Glu Tyr Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Phe Gly Val Lys Gly Gly Asp Thr Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 59
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 59
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Ile Phe Glu Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Gln
65 70 75 80
Ser Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 60
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 60
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Pro Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Trp Gly Val Lys Gly Gly Glu Thr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 61
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 61
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Glu Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Arg Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Gln Gly Val Lys Gly Gly Glu Ile Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 62
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 62
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Arg
20 25 30
Ile Gly Tyr Pro Glu Leu Glu Lys Leu Gly Tyr Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Ile Ile Trp Gly Val Lys Gly Gly Glu
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 63
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 63
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Arg
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Glu Leu Ser
65 70 75 80
Pro Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 64
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 64
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Ala Tyr Thr Glu Trp Pro Ile Pro Tyr Glu Glu Ala Gly Gln Glu
35 40 45
Gly Glu Ala Ile Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp
50 55 60
Leu Thr Gly Leu Lys Pro Gly Thr Glu Tyr Trp Val Ser Ile Tyr Gly
65 70 75 80
Val Lys Gly Gly Pro Asn Ser Gln Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 65
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 65
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Val Tyr Pro Glu Trp Pro Thr Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Gly Val Lys Gly Gly Asn Gln Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 66
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 66
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Lys
20 25 30
Ile Ala Tyr Pro Glu Phe Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Tyr Val Ile Ile Ile Gly Val Lys Gly Gly Thr Asp Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 67
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 67
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Val Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Tyr Gly Val Lys Gly Gly Ala Leu Ser
65 70 75 80
Val Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 68
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 68
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 69
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 69
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Arg
20 25 30
Ile Ala Tyr Pro Glu Thr Ala Thr Trp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Phe Glu Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 70
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 70
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Pro Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Tyr Gly Val Lys Gly Gly Ala Ile Ser
65 70 75 80
Thr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 71
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 71
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Phe Tyr Pro Glu Ile Val Thr Trp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Asn Ile Val Gly Val Lys Gly Gly Asp Asn Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 72
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 72
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Leu Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 73
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 73
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Val Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Leu Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 74
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 74
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Gln Gly Val Lys Gly Gly Thr Pro Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 75
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 75
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Ile Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Gln Gly Val Lys Gly Gly Tyr Thr Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 76
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 76
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Phe Tyr Pro Glu Leu Pro Ile His Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Asn Ile Thr Gly Val Lys Gly Gly Asp Phe Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 77
<211> 99
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 77
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Ala Tyr Pro Glu Ala Leu His Pro Gly Tyr Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Ile Ile Gly Gly Val Lys Gly Gly Gln
65 70 75 80
Lys Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr Gly Gly His His His
85 90 95
Asp His His
<210> 78
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 78
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Val Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Tyr Gly Val Lys Gly Gly Thr Glu Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 79
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 79
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 80
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 80
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Thr Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Trp Gly Val Lys Gly Gly Asp His Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 81
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 81
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 82
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 82
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Glu
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Pro Glu Tyr Phe Val Val Ile Gln Gly Val Lys Gly Gly Asp Pro Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr Gly Gly Asn His His His His
85 90 95
His
<210> 83
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 83
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 84
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 84
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Ala Tyr Pro Glu Ala Leu His Pro Gly Tyr Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Thr
65 70 75 80
Asn Ser Glu Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 85
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 85
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Ile Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 86
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 86
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Thr Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 87
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 87
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Thr Tyr Tyr Glu Pro Asn His Gly Gly Glu Ala Ile Ser Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Pro Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 88
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 88
Leu Ser Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Ile Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 89
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 89
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Thr Ile Phe Thr Thr
85
<210> 90
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 90
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Val Gly Val Lys Gly Gly Tyr Pro Ser
65 70 75 80
Ile Pro Leu Gly Ala Ala Phe Thr Thr
85
<210> 91
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 91
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Leu Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 92
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 92
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ile Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Val Glu Ala Glu Leu Val Gly Glu Ala Ile Gln Leu Val
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Leu Gly Val Lys Gly Gly Asn Pro Ser
65 70 75 80
Asn Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 93
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 93
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Trp Tyr Val Glu Gln His Pro Phe Gly Glu Ala Ile Pro Leu Phe
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Gly Ile Arg Gly Val Lys Gly Gly Asn Phe Ser
65 70 75 80
Thr Pro Leu Ile Ala His Phe Thr Thr
85
<210> 94
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 94
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Leu Thr Thr
85
<210> 95
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 95
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Glu
20 25 30
Ile Tyr Tyr Pro Glu Trp Pro Phe Ala Gly Glu Ala Ile Gly Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Leu Ser
65 70 75 80
Glu Pro Leu Thr Ala Gln Phe Thr Thr
85
<210> 96
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 96
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Val Glu Ala Glu Leu Val Gly Glu Ala Ile Gln Leu Val
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Leu Gly Val Lys Gly Gly Asn Pro Ser
65 70 75 80
Asn Pro Leu Gly Ala Ser Phe Thr Thr Thr
85 90
<210> 97
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 97
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Val Glu Ala Glu Leu Val Gly Glu Ala Ile Gln Leu Val
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Leu Gly Val Lys Gly Gly Asn Pro Ser
65 70 75 80
Asn Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 98
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 98
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Val Gly Val Lys Gly Gly Asn Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 99
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 99
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 100
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 100
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Trp Tyr His Glu Tyr Gly Gly Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Trp Gly Val Lys Gly Gly Asp Val Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 101
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 101
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Asn Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Ser Gly Val Lys Gly Gly Pro Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 102
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 102
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Leu Gly
20 25 30
Ile Thr Tyr Trp Glu Ser Pro Tyr Ala Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Gly Val Phe Ile Leu Gly Val Lys Gly Gly Tyr Pro Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 103
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 103
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Trp Gly Val Lys Gly Gly Val Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 104
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 104
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Trp Tyr Arg Glu Tyr Gly Gly Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Trp Gly Val Lys Gly Gly Val Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 105
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 105
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Ser Gly Ile Lys Gly Gly Pro Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 106
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 106
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Ser Gly Ala Lys Gly Gly Pro Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 107
<211> 88
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 107
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Pro
20 25 30
Ile Trp Tyr Arg Glu Tyr Ala Thr Gly Glu Ala Ile Val Leu Thr Val
35 40 45
Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly Thr
50 55 60
Glu Tyr Asp Val Val Ile Thr Gly Val Lys Gly Gly Tyr Pro Ser Tyr
65 70 75 80
Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 108
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 108
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Thr Tyr Trp Glu Ser Pro Tyr Ala Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Gly Val Phe Ile Leu Gly Val Lys Gly Gly Tyr Pro Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 109
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 109
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Tyr Gly Val Lys Gly Gly Ser Pro Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 110
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 110
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Trp Tyr Ala Glu Tyr Gly Tyr Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Ala Ile Ser Gly Val Lys Gly Gly Pro Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 111
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 111
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Lys Arg Ile Asp Ser Pro Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 112
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 112
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ile Gly His Asp Ser Gly Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 113
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 113
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Lys Arg Arg Trp Asp Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Glu Trp Phe Asn
65 70 75 80
Gly Leu Pro His His Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 114
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 114
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Lys His Pro Asn Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Val Val Asn Glu
65 70 75 80
Leu Asn Asn Pro Leu Phe Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 115
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 115
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Trp Thr Ser Pro Leu Pro Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 116
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 116
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Lys Asn Leu His Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 117
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 117
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Tyr Pro Ser Asp Pro Pro Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Pro Asn Tyr His Ser Arg
65 70 75 80
Arg Ser Tyr Tyr Tyr Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 118
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 118
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Lys Arg Ala Thr Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Arg Tyr Asn Glu
65 70 75 80
Gly Gln Pro Ile Trp Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 119
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 119
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Gln Arg Pro Lys Ser Gly Phe Phe Asp Ser Phe
20 25 30
Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp
65 70 75 80
Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 120
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 120
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Val Glu Ser Asn Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Glu Tyr Asp Gln
65 70 75 80
His Gly Arg Pro Arg Trp Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 121
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 121
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Arg Glu His Asp Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 122
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 122
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Lys Arg Pro Gly Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 123
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 123
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Lys Arg Ala Thr Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 124
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 124
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Pro Ser Pro Trp Gly Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 125
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 125
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Arg Asn Ile Thr Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 126
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 126
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Arg Lys Lys Asp His Pro Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 127
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 127
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Gly Tyr Tyr His Gly His Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp Glu Gly
65 70 75 80
Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 128
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 128
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Arg Lys Glu Ala Thr Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 129
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 129
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Lys Arg Ala Thr Ser Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp Glu Gly
65 70 75 80
Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 130
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 130
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Lys Ile Gln Gly Gln His Phe Asp Ser Phe
20 25 30
Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp
65 70 75 80
Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 131
<211> 99
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 131
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Gln Arg Ala Asp Asp Ile Leu Pro Tyr Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Tyr Asp Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile
85 90 95
Phe Thr Thr
<210> 132
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 132
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Val Arg Ser Asp Thr Ala Arg Phe Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr
65 70 75 80
Asp Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 133
<211> 99
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 133
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Ser Thr Val Asp Pro His Pro Arg Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Tyr Asp Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile
85 90 95
Phe Thr Thr
<210> 134
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 134
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Gln Arg His Ser Asp Ala His Pro Leu Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 135
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 135
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Ile Val Asn Thr Pro Leu His Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Gln Tyr
65 70 75 80
Thr Ala Thr Gly Gln Pro Glu Arg Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 136
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 136
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Lys Thr Ser Asp Leu His Pro Leu Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 137
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 137
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Asn Lys Lys His Asp Gly Gln Pro Thr Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Val
65 70 75 80
Tyr Glu Gly Ser Tyr Pro Ala Ser Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 138
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 138
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ile Lys Ser Glu Thr Ser Gln Pro Ala Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 139
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 139
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Tyr Ala Arg Lys Phe Ile Ser Pro Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp
65 70 75 80
Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 140
<211> 99
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 140
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Tyr Arg Pro Asp Asn Arg Ala Gly Ala Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Tyr Asp Ile Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile
85 90 95
Phe Thr Thr
<210> 141
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 141
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Glu Arg Ile Val Gln Thr Pro His Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp
65 70 75 80
Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 142
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 142
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Glu Glu Ala Val Thr Ala Thr Ser Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 143
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 143
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Pro Lys Asn Gln Thr Asn Arg His Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp
65 70 75 80
Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 144
<211> 98
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 144
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Tyr Arg Ala Thr Thr Pro Ala Pro His Phe Asp
20 25 30
Ser Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile
35 40 45
Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu
50 55 60
Lys Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys
65 70 75 80
Trp Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe
85 90 95
Thr Thr
<210> 145
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 145
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ser Ala Lys Lys Phe Pro Arg His Phe Asp Ser
20 25 30
Phe Leu Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Trp
65 70 75 80
Glu Gly Asn Arg Pro Val Ala Ser Asn Pro Leu Ser Ala Ile Phe Thr
85 90 95
Thr
<210> 146
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 146
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Asp Trp Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 147
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 147
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Arg
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Arg Gly Asp Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Gln Gly Val Lys Gly Gly Thr Asp Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 148
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 148
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Thr Tyr Pro Glu Ile Pro Leu Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Leu Leu Ser
65 70 75 80
Ser Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 149
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 149
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ser Tyr Pro Glu Trp Glu Gln Leu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ala Leu Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 150
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 150
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Leu Gly Val Lys Gly Gly Asp Gln Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 151
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 151
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Lys Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Gly Val Lys Gly Gly Val Tyr Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 152
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 152
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Lys Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ile His Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 153
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 153
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Thr Pro Ile Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile His Gly Val Lys Gly Gly Ile Thr Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 154
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 154
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Pro Leu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Phe Gly Val Lys Gly Gly Glu Arg Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 155
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 155
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Ile Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Arg Gly Val Lys Gly Gly Thr Leu Ser
65 70 75 80
Pro Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 156
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 156
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Val Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Gln Gly Val Lys Gly Gly Lys Leu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 157
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 157
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Arg Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Tyr Gly Val Lys Gly Gly Asp Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 158
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 158
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val His Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Val Leu Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 159
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 159
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Lys Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Asn Gly Val Lys Gly Gly Trp Arg Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 160
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 160
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Phe Gly Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 161
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 161
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Thr
20 25 30
Ile Ala Tyr Pro Glu Arg Glu Gln Asp Lys Trp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Ile Ile Gln Gly Val Lys Gly Gly Arg
65 70 75 80
Pro Ser Thr Pro Leu Ser Ala Ile Leu Thr Thr
85 90
<210> 162
<211> 88
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 162
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Gly Glu Ala Ile Val Leu Thr Val
35 40 45
Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly Thr
50 55 60
Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Trp Thr Ser Pro
65 70 75 80
Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 163
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 163
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Gly Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Phe Gly Val Lys Gly Gly Ser Gln Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 164
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 164
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Trp Tyr Pro Glu Trp Pro Val Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Asn Ile Ser Gly Val Lys Gly Gly Glu Tyr Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 165
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 165
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Val His Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Trp Gly Val Lys Gly Gly Arg Gln Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 166
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 166
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Leu Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Trp Gly Val Lys Gly Gly Asp Arg Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 167
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 167
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ile
20 25 30
Ile Ala Tyr Pro Glu Thr Pro Val Arg Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Ile Gly Val Lys Gly Gly Gln Glu Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 168
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 168
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ser Tyr Ile Glu Tyr Pro Glu Ile Pro Gly Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ile
65 70 75 80
Gln Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 169
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 169
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ala Tyr Val Glu Trp Trp His Arg Gly Glu Ala Ile Ser Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asn Val Ile Ile Thr Gly Val Lys Gly Gly Ile Pro Ser
65 70 75 80
His Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 170
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 170
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Trp Glu Ser Glu Val Tyr Gly Glu Ala Ile Ala Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Gln Val Ser Ile Ile Gly Val Lys Gly Gly Val Tyr Ser
65 70 75 80
Gln Pro Leu Ala Ala Ile Phe Thr Thr
85
<210> 171
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 171
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Gly Tyr Ala Glu Pro Val Val Thr Gly Glu Ala Ile Ser Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Ile Gly Val Lys Gly Gly Ile Asn Ser
65 70 75 80
Tyr Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 172
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 172
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Trp Glu Ser Glu Val Tyr Gly Glu Ala Ile Ala Leu Pro
35 40 45
Val Thr Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Gln Val Ser Ile Ile Gly Val Lys Gly Gly Val Tyr Ser
65 70 75 80
Gln Pro Leu Ala Ala Ile Phe Thr Thr
85
<210> 173
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 173
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Arg Glu Ser Glu Phe Arg Gly Glu Ala Ile Ala Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Lys Tyr Arg Val Ile Ile Ile Gly Val Lys Gly Gly Glu Phe Ser
65 70 75 80
Gln Pro Leu Ala Ala Ile Phe Thr Thr
85
<210> 174
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 174
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Arg Glu Ser Glu Phe Arg Gly Glu Ala Ile Ala Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Lys Tyr Ser Val Ile Ile Ile Gly Val Lys Gly Gly Glu Phe Ser
65 70 75 80
Gln Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 175
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 175
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Arg Glu Ser Glu Phe Arg Gly Glu Ala Ile Ala Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Lys Tyr Arg Val Ile Ile Ile Gly Val Lys Gly Gly Glu Phe Ser
65 70 75 80
Gln Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 176
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 176
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ser Tyr Tyr Glu Trp Ala Pro Asn Gly Glu Ala Ile Gln Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr His Val Val Ile Ile Gly Val Lys Gly Gly Glu Pro Ser
65 70 75 80
His Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 177
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 177
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Arg Glu Ser Glu Phe Arg Gly Glu Ala Ile Ala Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Lys Tyr Arg Val Ile Ile Ile Gly Val Lys Gly Gly Glu Phe Ser
65 70 75 80
Gln Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 178
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 178
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Val Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Gly Val Lys Gly Gly Asp Ala Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 179
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 179
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Arg Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Pro Ser
65 70 75 80
Pro Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 180
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 180
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Ala Tyr Gly Glu Tyr Pro Gly Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Glu Leu Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 181
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 181
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Val Asn Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Trp Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Pro Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 182
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 182
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Lys
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Pro Glu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Cys Val Lys Gly Gly Glu His Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 183
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 183
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Lys
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Asp Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Ile Leu Ser
65 70 75 80
Pro Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 184
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 184
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Arg Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Ile Gly Val Lys Gly Gly Glu Asp Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 185
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 185
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Tyr Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Asn Tyr Ser
65 70 75 80
Asp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 186
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 186
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Leu Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Leu Gly Val Lys Gly Gly Asp Gln Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 187
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 187
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Phe Tyr Pro Glu Leu Val Phe Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Asn Ile Ser Gly Val Lys Gly Gly Glu His Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 188
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 188
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Val Lys Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Trp Gly Val Lys Gly Gly Thr Tyr Ser
65 70 75 80
Gly Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 189
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 189
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Glu
20 25 30
Ile Ala Tyr Pro Glu Ile Pro Ile Ala Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Asp Trp Ser
65 70 75 80
Asp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 190
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 190
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Lys Gly Val Lys Gly Gly Asn Ile Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 191
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 191
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Gly Tyr Pro Glu Trp Pro Ile Lys Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Trp Gly Val Lys Gly Gly Asp Arg Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 192
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 192
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Ile Ala Lys Trp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Val His Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 193
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 193
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe His
20 25 30
Ile Phe Tyr Pro Glu Leu Pro Ile Ala Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Asn Ile Ser Gly Val Lys Gly Gly Tyr Glu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 194
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 194
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ser Tyr Pro Glu Leu Pro Val Glu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Trp Gly Val Lys Gly Gly Ala Thr Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 195
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 195
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Tyr Pro Ala Leu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Ile Gly Val Lys Gly Gly Asp Glu Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 196
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 196
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Ile Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ile His Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 197
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 197
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asn
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Glu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly His Leu Ser
65 70 75 80
Asp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 198
<211> 88
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 198
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Gln Tyr Leu Glu Thr Ala Pro Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Tyr Val Trp Ile Pro Gly Val Lys Gly Gly Ala Phe Ser
65 70 75 80
Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 199
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 199
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Ile Lys Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Tyr Gly Val Lys Gly Gly Val Phe Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 200
<211> 87
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 200
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ile
20 25 30
Tyr Ile Glu Asn Lys Val Asn Gly Glu Ala Ile Val Leu Thr Val Pro
35 40 45
Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly Thr Glu
50 55 60
Tyr His Val Thr Ile Gly Gly Val Lys Gly Gly Thr Glu Ser Asn Thr
65 70 75 80
Leu Ser Ala Ile Phe Thr Thr
85
<210> 201
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 201
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Thr Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Phe Gly Val Lys Gly Gly Glu Arg Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 202
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 202
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Tyr Pro Ala Leu Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Ala Gly Val Lys Gly Gly Ile Gln Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 203
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 203
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ser Tyr Pro Glu Trp Pro Gly Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ala Val Phe Ile Trp Cys Val Lys Gly Gly Trp Leu Ser
65 70 75 80
Asp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 204
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 204
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Glu
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Val Asn Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Trp Gly Val Lys Gly Gly Val Asn Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 205
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 205
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 206
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 206
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Leu Tyr Tyr Glu Leu Pro Pro Ser Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Phe Gly Val Lys Gly Gly Asp Asn Ser
65 70 75 80
Phe Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 207
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 207
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly His Trp Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 208
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 208
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Glu
20 25 30
Ile Trp Tyr His Glu Tyr His Pro Arg Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Ser Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Val Ile Ser Gly Val Lys Gly Gly His Trp Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 209
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 209
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gly Tyr Pro Glu Trp Pro Leu Gly Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Ile Ile Tyr Gly Val Lys Gly Gly Glu Tyr Ser
65 70 75 80
Asp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 210
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 210
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Glu
20 25 30
Ile Trp Tyr His Glu Tyr His Pro Arg Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asp Val Val Ile Ser Gly Val Lys Gly Gly His Trp Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 211
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 211
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Tyr Gly Val Lys Gly Gly Ala Leu Ser
65 70 75 80
Arg Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 212
<211> 95
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 212
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Ala Tyr Pro Glu Tyr Val Trp Gly Gly Glu Ala Thr Ser Leu Gly
35 40 45
Glu Ala Ile Val Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu
50 55 60
Thr Gly Leu Lys Pro Gly Thr Glu Tyr Phe Val Val Ile Thr Gly Val
65 70 75 80
Lys Gly Gly Leu Gly Ser Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 213
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 213
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Gly Arg Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 214
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 214
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Asn Tyr Trp Glu Glu Asp Pro Ala Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Arg Val Leu Ile Gly Gly Val Lys Gly Gly His Gly Ser
65 70 75 80
Leu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 215
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 215
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Asp
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Thr Asp Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Gly Arg Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 216
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 216
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Phe Tyr Leu Glu Pro Phe Pro Arg Gly Glu Ala Ile Pro Leu Glu
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Ser Val Asp Ile Arg Gly Val Lys Gly Gly Asp His Ser
65 70 75 80
Asp Pro Leu Trp Ala Tyr Phe Thr Thr
85
<210> 217
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 217
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Gly Tyr Val Glu Phe Thr Arg Ala Gly Glu Ala Ile Ser Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr His Val Val Ile Ile Gly Val Lys Gly Gly Glu Pro Ser
65 70 75 80
His Pro Leu Gly Ala Pro Phe Thr Thr
85
<210> 218
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 218
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Gly Tyr Ala Glu Pro Ala Val Thr Gly Glu Ala Ile Ser Leu Ser
35 40 45
Val Pro Gly Ser Lys Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Ile Gly Val Lys Gly Gly Ile Asn Ser
65 70 75 80
Tyr Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 219
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 219
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ser Tyr Tyr Glu Trp Ala Pro Asn Gly Glu Ala Ile Gln Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr His Val Val Ile Ile Gly Val Lys Gly Gly Glu Pro Ser
65 70 75 80
His Pro Leu Gly Ala Pro Phe Thr Thr
85
<210> 220
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 220
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asn Ser Phe Gly
20 25 30
Ile Gly Tyr Ala Glu Pro Ala Val Thr Gly Glu Ala Ile Ser Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Ile Gly Val Lys Gly Gly Ile Asn Ser
65 70 75 80
Tyr Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 221
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 221
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Trp Cys Val Glu Pro Ile Pro Glu Gly Glu Ala Ile Pro Leu Phe
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Arg Val Gly Ile Arg Gly Val Lys Gly Gly Thr Phe Ser
65 70 75 80
Ser Pro Leu Ala Ala Pro Phe Thr Thr
85
<210> 222
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 222
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Pro Tyr Arg Glu Ser Glu Phe Arg Gly Glu Ala Ile Ala Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Lys Tyr Arg Val Ile Ile Ile Gly Val Lys Gly Gly Glu Phe Ser
65 70 75 80
Gln Pro Leu Gly Ala Ile Phe Thr Thr
85
<210> 223
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 223
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Gly Tyr Ile Glu Trp Val His Arg Gly Glu Ala Ile Ser Leu His
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Val Val Ala Ile Val Gly Val Lys Gly Gly Glu Pro Ser
65 70 75 80
Thr Pro Leu Gly Ala Pro Phe Thr Thr
85
<210> 224
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 224
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Thr Tyr Trp Glu Ile Glu Pro Glu Gly Glu Ala Ile Phe Leu Gly
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Arg Val Gln Ile Asn Gly Val Lys Gly Gly Thr Ile Ser
65 70 75 80
Tyr Pro Leu Phe Ala Gly Phe Thr Thr
85
<210> 225
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 225
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ala Tyr Val Glu Trp Trp His Arg Gly Glu Ala Ile Ser Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Thr Ile Leu Gly Val Lys Gly Gly Ile Ile Ser
65 70 75 80
Thr Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 226
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 226
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Gly Tyr Ala Glu Pro Ala Val Thr Gly Glu Ala Ile Ser Leu Ser
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Ile Gly Val Lys Gly Gly Ile Asn Ser
65 70 75 80
Tyr Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 227
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 227
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Ala Tyr Ile Glu Thr Ala Arg Trp Gly Glu Ala Ile Ser Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Asn Val Val Ile Ile Gly Val Lys Gly Gly Thr Pro Ser
65 70 75 80
His Pro Leu Gly Ala Pro Phe Thr Thr
85
<210> 228
<211> 88
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 228
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Thr Tyr Leu Asp Pro Arg Asn Gly Glu Ala Ile Ser Leu Asn Val
35 40 45
Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly Thr
50 55 60
Glu Tyr Trp Val Val Ile Ile Gly Val Lys Gly Gly Ile Asn Ser Tyr
65 70 75 80
Pro Leu Gly Ala Ser Phe Thr Thr
85
<210> 229
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 229
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Cys Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 230
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 230
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Cys Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 231
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 231
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Cys Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 232
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 232
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Cys Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Thr Ile Phe Thr Thr
85
<210> 233
<211> 96
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 233
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Ala Lys Arg Pro Gly Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Cys Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Asp Val Lys Tyr Asp Ile
65 70 75 80
Asp Ser Arg Pro Ile Ser Ser Asn Pro Leu Ser Ala Ile Phe Thr Thr
85 90 95
<210> 234
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 234
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Cys Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 235
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 235
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Tyr Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 236
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 236
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 237
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 237
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Ile Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Trp Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 238
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 238
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 239
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 239
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Leu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 240
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 240
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Ser Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 241
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 241
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Ala Tyr Pro Glu Trp Pro Pro Pro Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Ile Ile Gln Gly Val Lys Gly Gly Val Glu Ser
65 70 75 80
Glu Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 242
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 242
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Glu Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 243
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 243
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Ser Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 244
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 244
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Tyr Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 245
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 245
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Phe Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 246
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 246
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Ser Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 247
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 247
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Tyr Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 248
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 248
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Phe Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 249
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 249
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Ser Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 250
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 250
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Tyr Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 251
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 251
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Asn Ser Glu Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 252
<211> 91
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 252
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Thr Tyr Ile Glu Lys Glu His Ile Glu Asp Gly Glu Ala Ile Val
35 40 45
Leu Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys
50 55 60
Pro Gly Thr Glu Tyr Trp Val Pro Ile Trp Gly Val Lys Gly Gly Ala
65 70 75 80
Gln Ser Trp Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 253
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 253
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Thr Ile Phe Thr Thr
85
<210> 254
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 254
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Tyr Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Thr Ile Phe Thr Thr
85
<210> 255
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 255
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Pro
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr His Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Thr Ile Phe Thr Thr
85
<210> 256
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 256
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Tyr Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 257
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 257
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Leu Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 258
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 258
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu Ile Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 259
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 259
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Pro Glu His Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 260
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 260
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Tyr
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 261
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 261
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gln
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 262
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 262
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ser
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 263
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 263
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Tyr Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 264
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 264
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Leu Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 265
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 265
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Ile Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 266
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 266
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Pro Glu Trp Pro Pro Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 267
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 267
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Ala
20 25 30
Ile Ala Tyr Ala Glu Trp Pro Pro Gln Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Ser Tyr Ser
65 70 75 80
Ala Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 268
<211> 90
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 268
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Trp
20 25 30
Ile Thr Tyr Ala Glu Trp Pro Asp Pro Gly Gly Glu Ala Ile Val Leu
35 40 45
Thr Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro
50 55 60
Gly Thr Glu Tyr Phe Val Val Ile Tyr Gly Val Lys Gly Gly Glu Ile
65 70 75 80
Tyr Ser Pro Leu Ser Ala Ile Phe Thr Thr
85 90
<210> 269
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 269
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Arg Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Gly
20 25 30
Ile Leu Tyr Tyr Glu Pro Val Asp Ser Gly Glu Ala Ile Thr Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Trp Val Val Ile Thr Gly Val Lys Gly Gly Ala Pro Ser
65 70 75 80
Thr Pro Leu Gly Thr Ile Phe Thr Thr
85
<210> 270
<211> 89
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 270
Leu Pro Ala Pro Lys Asn Leu Val Val Ser Glu Val Thr Glu Asp Ser
1 5 10 15
Ala Arg Leu Ser Trp Thr Ala Pro Asp Ala Ala Phe Asp Ser Phe Leu
20 25 30
Ile Gln Tyr Gln Glu Ser Glu Lys Val Gly Glu Ala Ile Val Leu Thr
35 40 45
Val Pro Gly Ser Glu Arg Ser Tyr Asp Leu Thr Gly Leu Lys Pro Gly
50 55 60
Thr Glu Tyr Thr Val Ser Ile Tyr Gly Val Lys Gly Gly His Arg Ser
65 70 75 80
Asn Pro Leu Ser Ala Ile Phe Thr Thr
85
<210> 271
<211> 276
<212> PRT
<213> Macaca fascicularis
<400> 271
Met Arg Asn Gln Ala Pro Gly Arg Pro Lys Gly Ala Thr Ser Pro Pro
1 5 10 15
Pro Leu Pro Thr Gly Ser Arg Ala Pro Pro Val Ala Pro Glu Leu Arg
20 25 30
Ala Glu Pro Arg Pro Gly Glu Arg Val Met Ala Pro Pro Val Thr Ala
35 40 45
Leu Leu Leu Pro Leu Val Leu Leu Leu His Ala Ala Arg Pro Asn Gln
50 55 60
Phe Arg Val Ser Pro Leu Gly Arg Thr Trp Asn Leu Gly Glu Thr Val
65 70 75 80
Glu Leu Lys Cys Gln Val Leu Leu Ser Asn Pro Thr Ser Gly Cys Ser
85 90 95
Trp Leu Phe Gln Pro Arg Gly Thr Ala Ala Arg Pro Thr Phe Leu Leu
100 105 110
Tyr Leu Ser Gln Asn Lys Pro Lys Ala Ala Glu Gly Leu Asp Thr Gln
115 120 125
Arg Phe Ser Gly Lys Arg Leu Gly Asp Thr Phe Val Leu Thr Leu Arg
130 135 140
Asp Phe Arg Gln Glu Asn Glu Gly Tyr Tyr Phe Cys Ser Ala Leu Ser
145 150 155 160
Asn Ser Ile Met Tyr Phe Ser His Phe Val Pro Val Phe Leu Pro Ala
165 170 175
Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
180 185 190
Thr Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
195 200 205
Ala Gly Gly Ser Val Asn Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
210 215 220
Tyr Ile Trp Ala Pro Leu Ala Gly Ala Cys Gly Val Leu Leu Leu Ser
225 230 235 240
Leu Val Ile Thr Leu Tyr Cys Asn His Arg Asn Arg Arg Arg Val Cys
245 250 255
Lys Cys Pro Arg Pro Val Val Lys Ser Gly Gly Lys Pro Ser Leu Ser
260 265 270
Asp Arg Tyr Val
275
<210> 272
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 272
Gly Ser Gly Ser
1
<210> 273
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 273
Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 274
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 274
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 275
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 275
Ala Pro Ala Pro
1
<210> 276
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 276
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10
<210> 277
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 277
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10 15
Ala Pro Ala Pro
20
<210> 278
<211> 40
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 278
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10 15
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
20 25 30
Ala Pro Ala Pro Ala Pro Ala Pro
35 40
<210> 279
<211> 29
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 279
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala Ala Ala
20 25
<210> 280
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 280
Thr Ala Pro Asp Ala Ala Phe Asp
1 5
<210> 281
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 281
Lys Gly Gly His Arg Ser Asn Pro
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К ТАУ И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2787779C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ИНТЕРЛЕЙКИНА-33 (IL-33) | 2015 |
|
RU2829846C2 |
| МУЛЬТИВАЛЕНТНЫЕ И МУЛЬТИСПЕЦИФИЧЕСКИЕ 41BB-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2017 |
|
RU2789648C2 |
| МУЛЬТИВАЛЕНТНЫЕ И МУЛЬТИСПЕЦИФИЧЕСКИЕ ГИБРИДНЫЕ БЕЛКИ, СВЯЗЫВАЮЩИЕСЯ С DR5 | 2016 |
|
RU2748620C2 |
| РЕКОМБИНАНТНЫЕ МОДИФИЦИРОВАННЫЕ ФАКТОРЫ РОСТА ФИБРОБЛАСТОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2811435C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛИВАЮЩИЕСЯ НА ВАРИАНТ III РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2017 |
|
RU2751662C2 |
| АФФИМЕРЫ, СВЯЗЫВАЮЩИЕСЯ С НЕОНАТАЛЬНЫМ FC РЕЦЕПТОРОМ | 2020 |
|
RU2817008C1 |
| ТЕРАПЕВТИЧЕСКАЯ ПРОТИВОРАКОВАЯ НЕОЭПИТОПНАЯ ВАКЦИНА | 2017 |
|
RU2782422C2 |
| ПОЛИПЕПТИД, ВКЛЮЧАЮЩИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ ДОМЕН И ТРАНСПОРТИРУЮЩИЙ СЕГМЕНТ | 2018 |
|
RU2815452C2 |
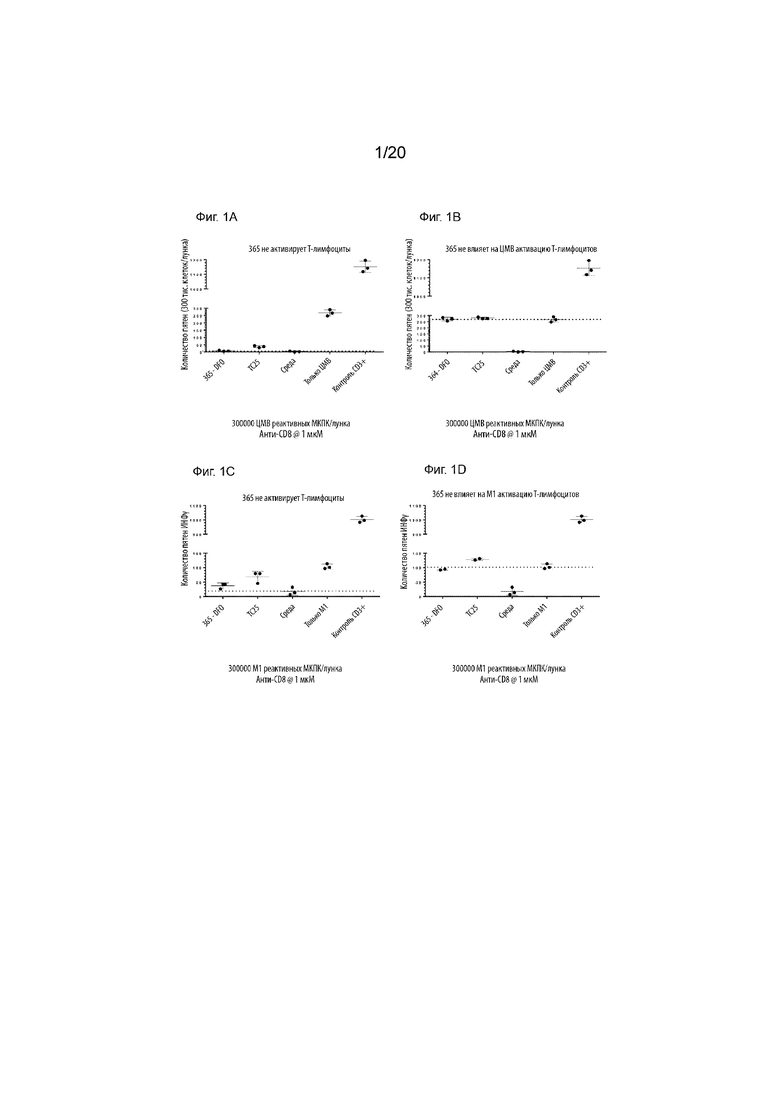
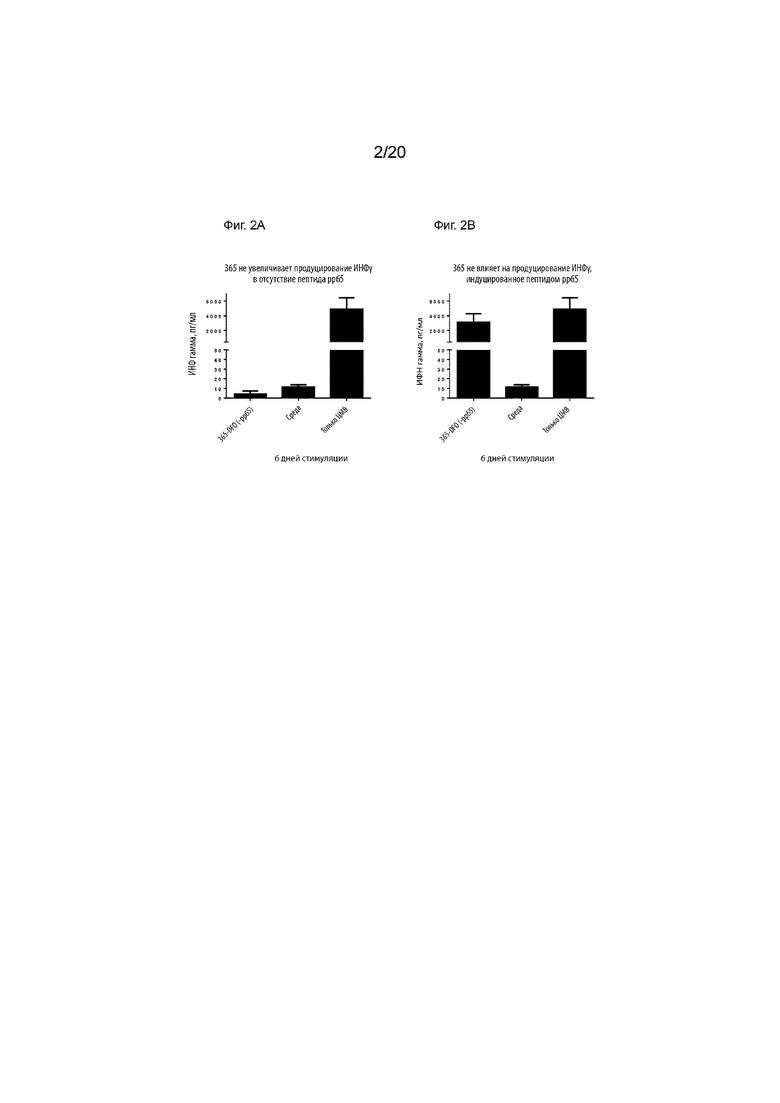
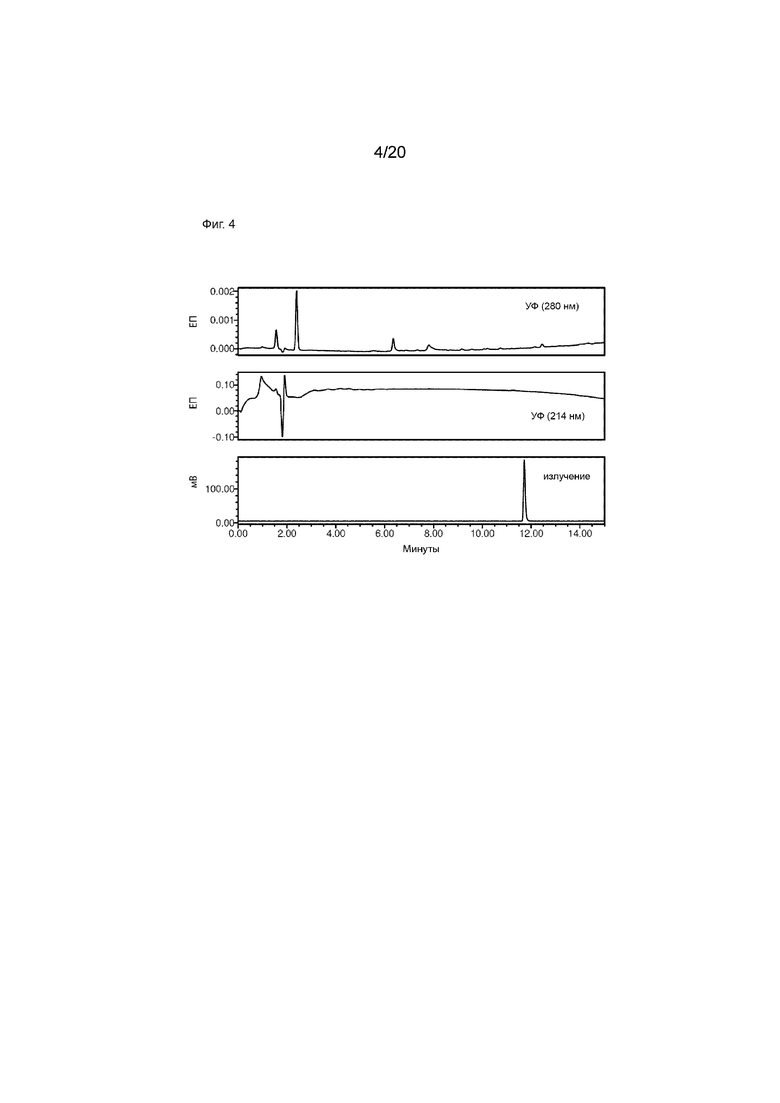
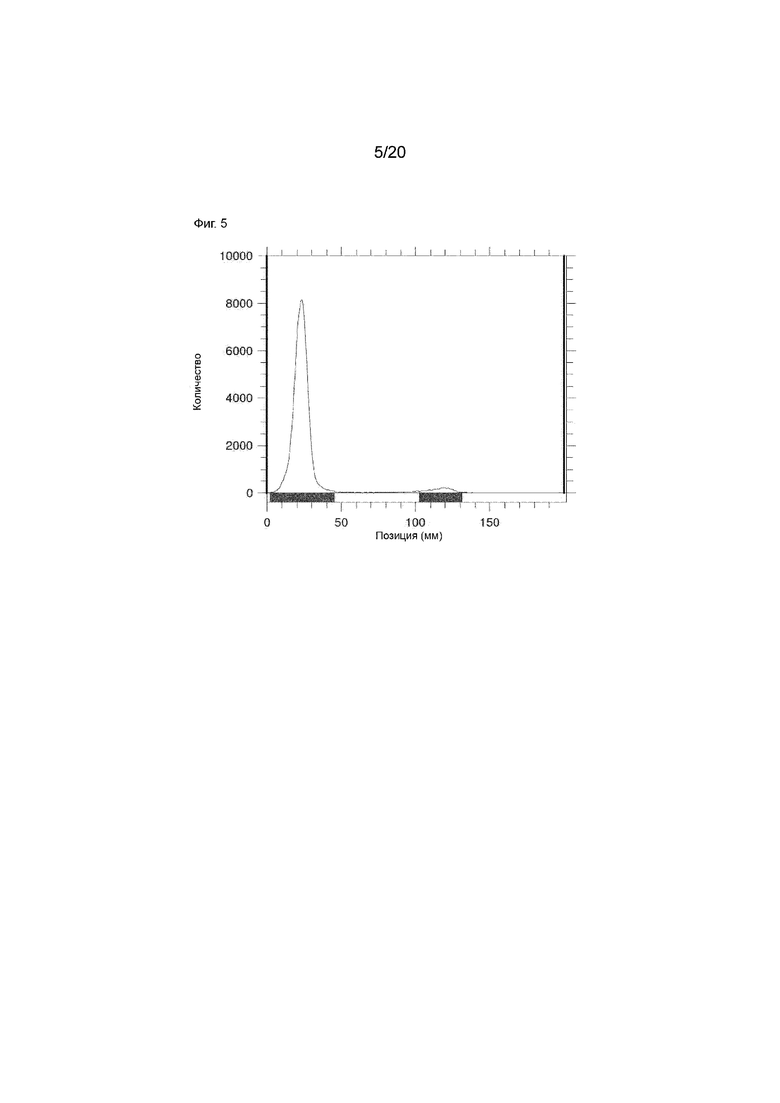
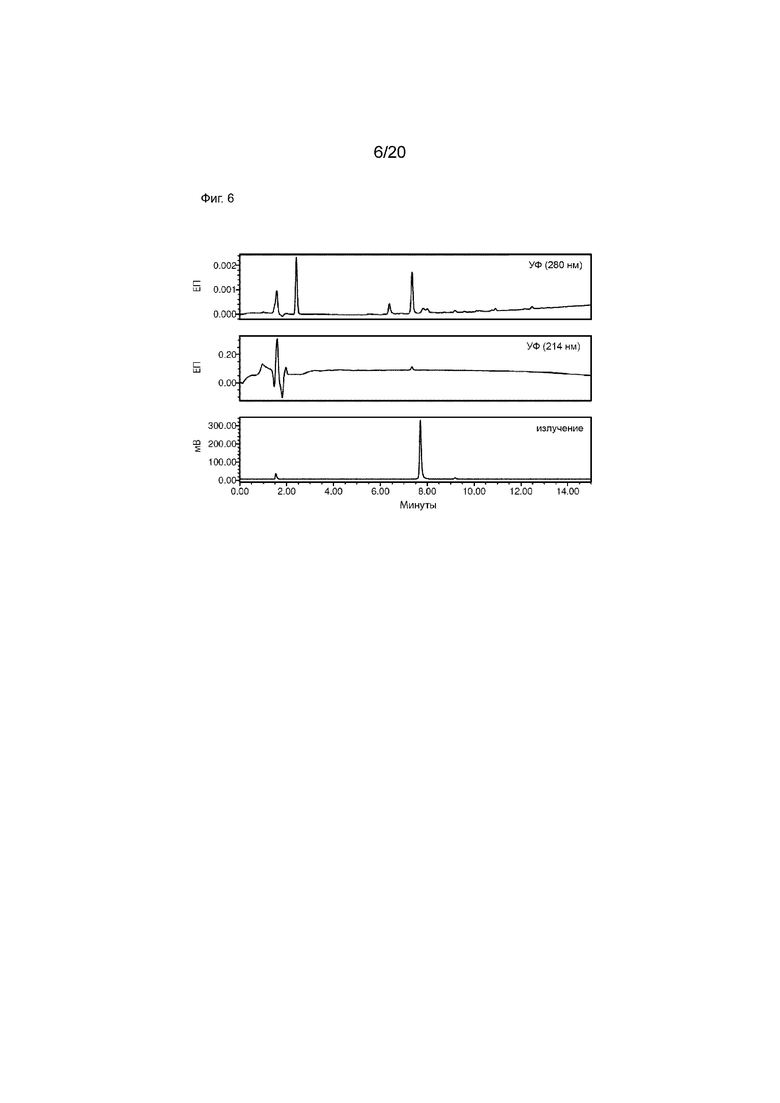
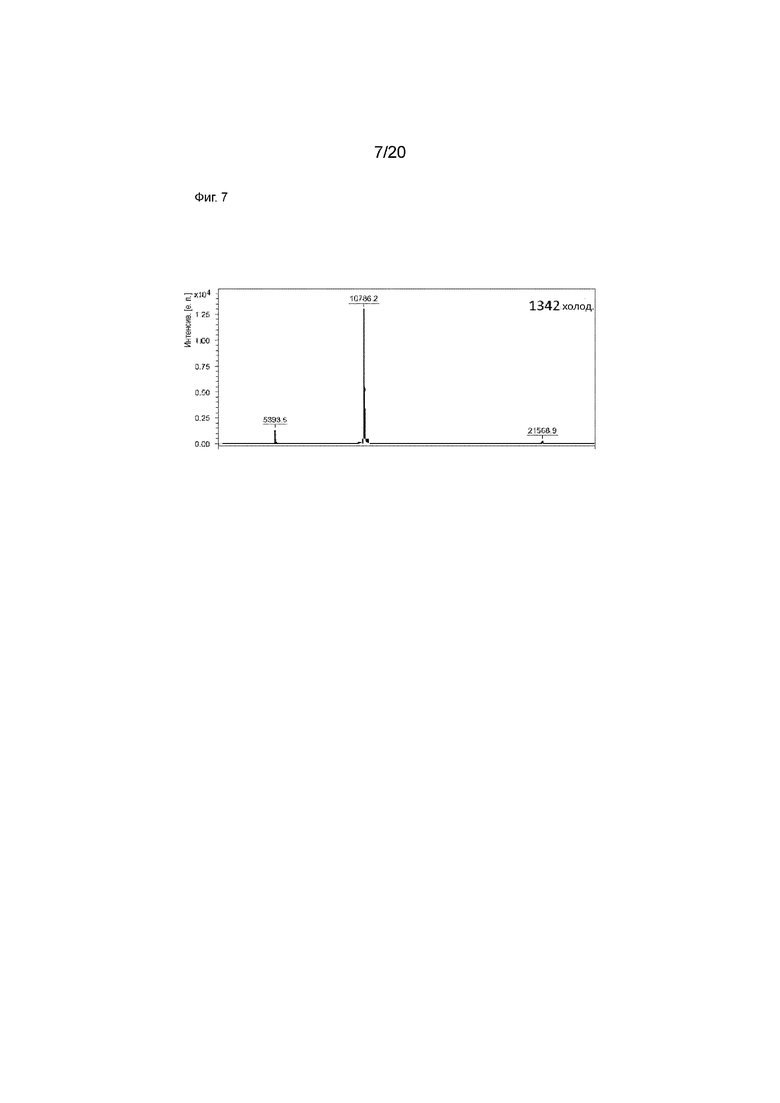
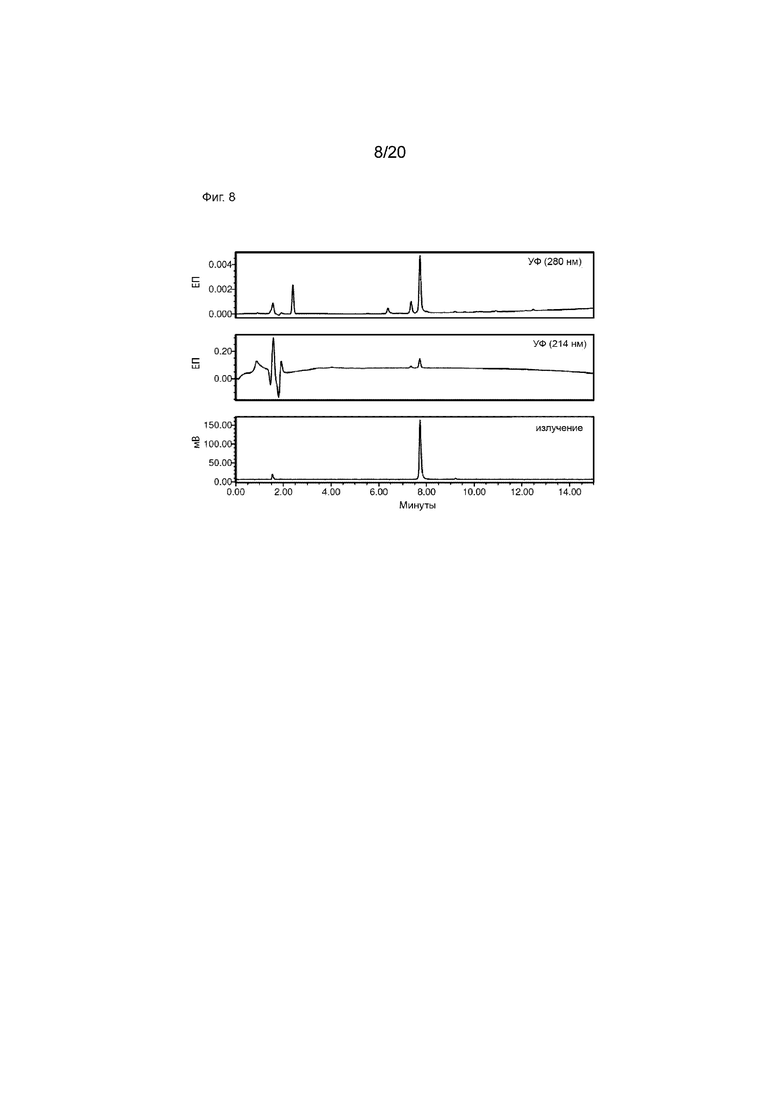

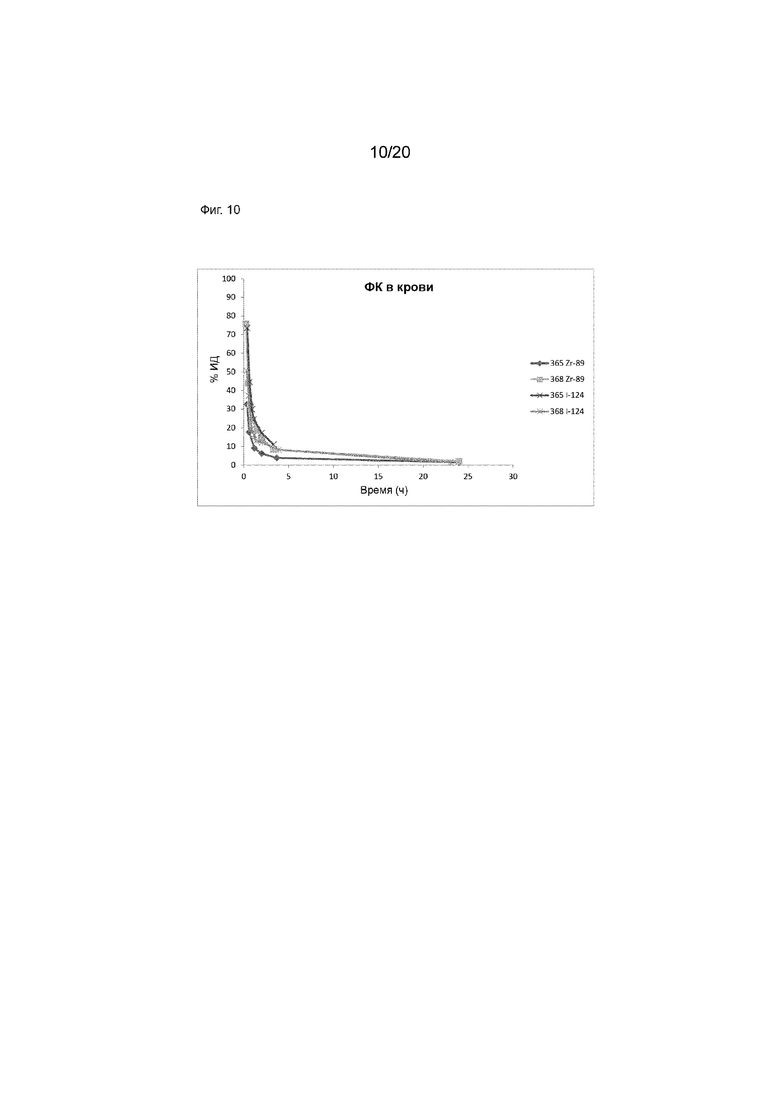
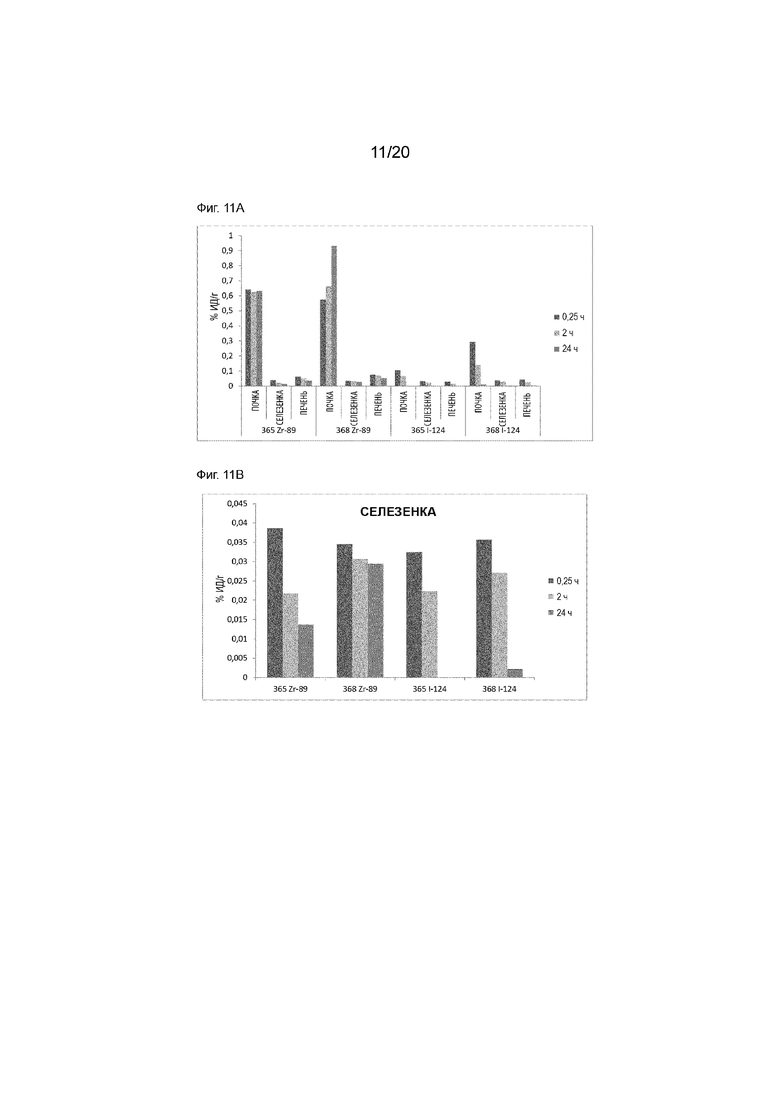
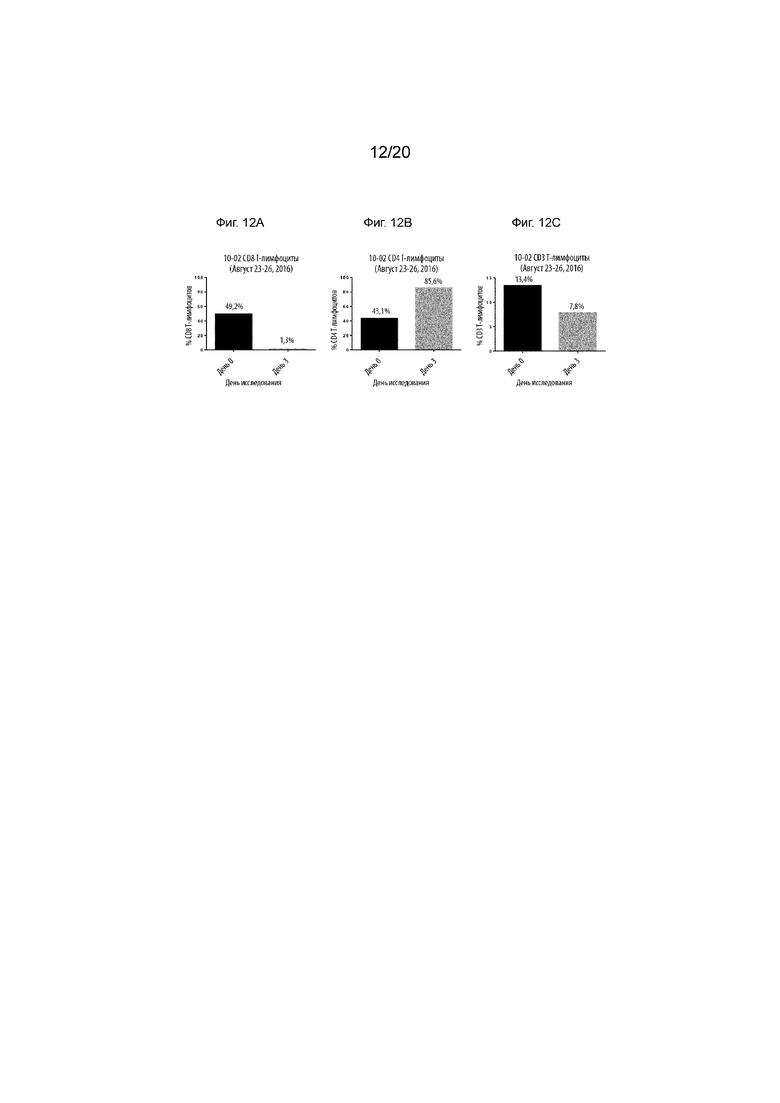

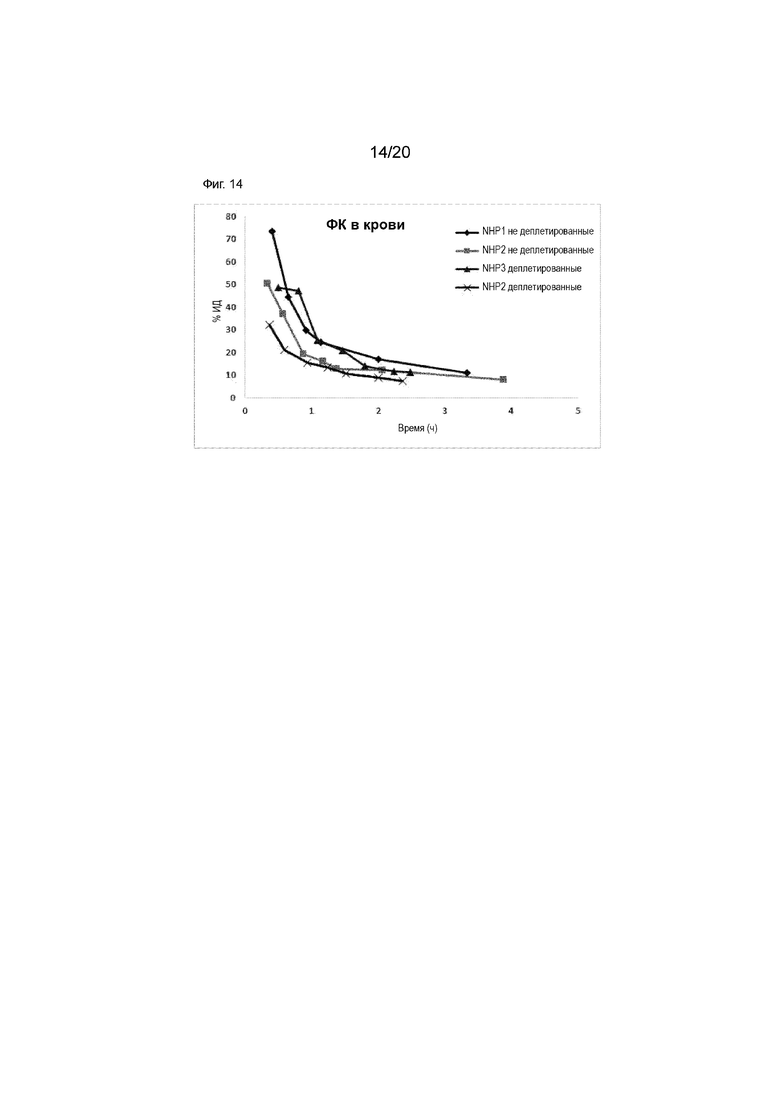
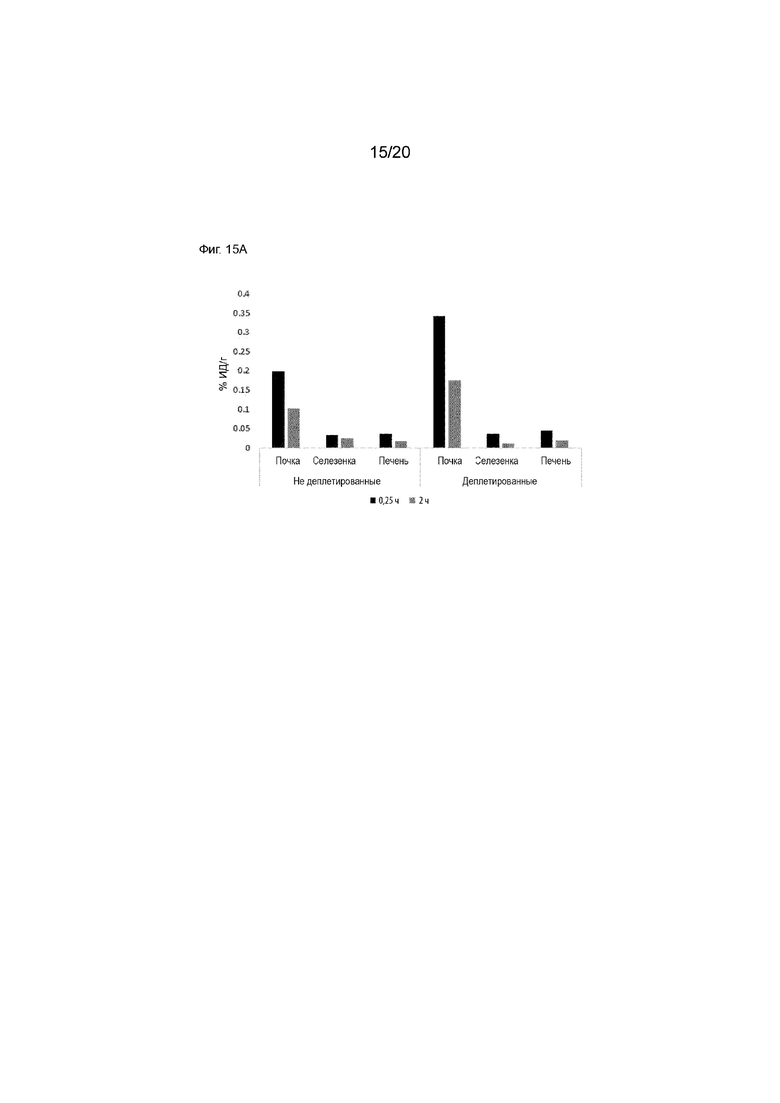
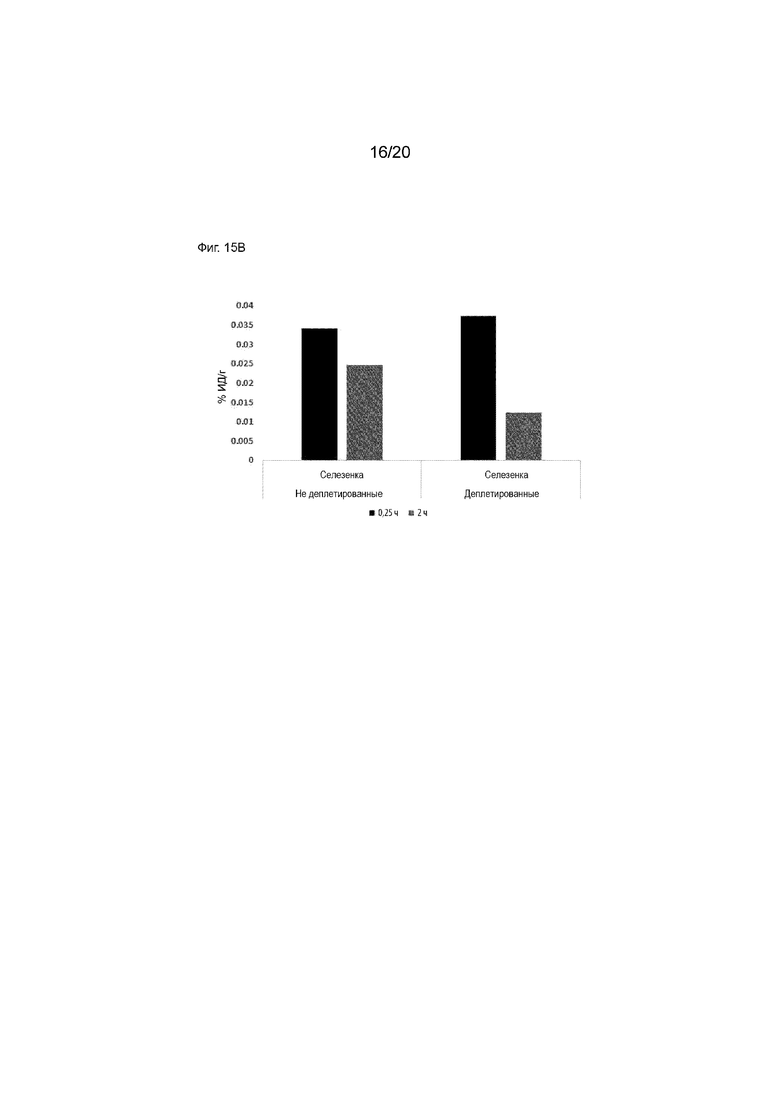
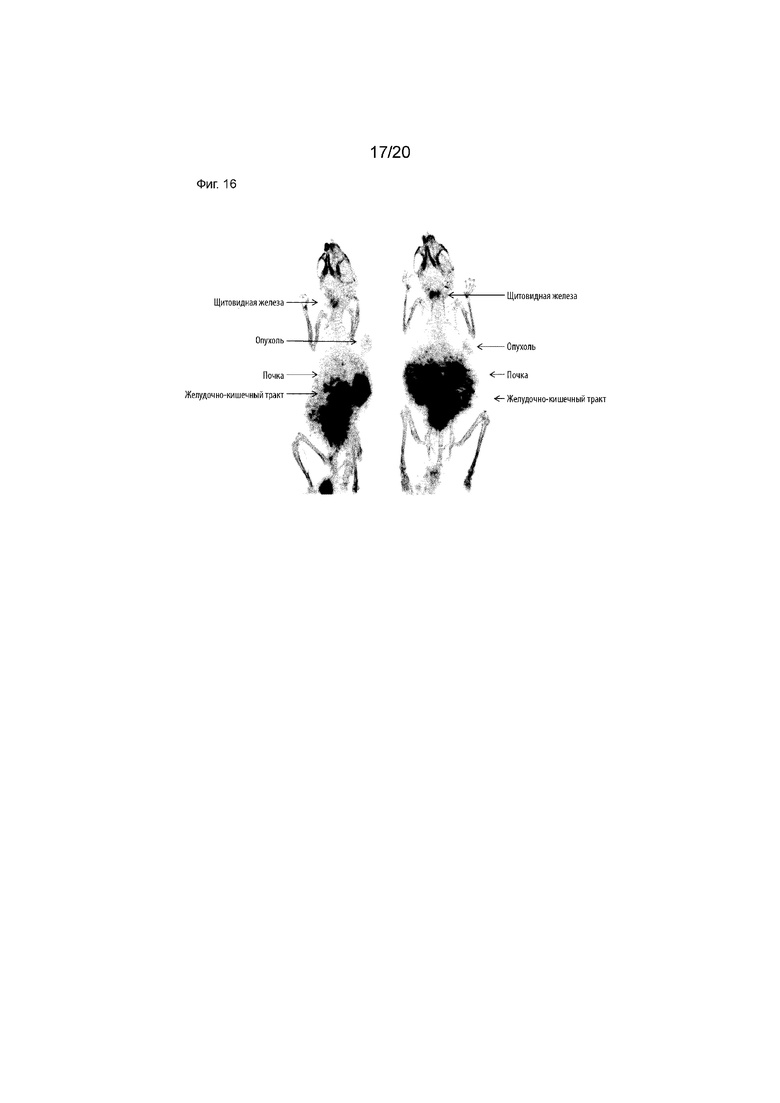


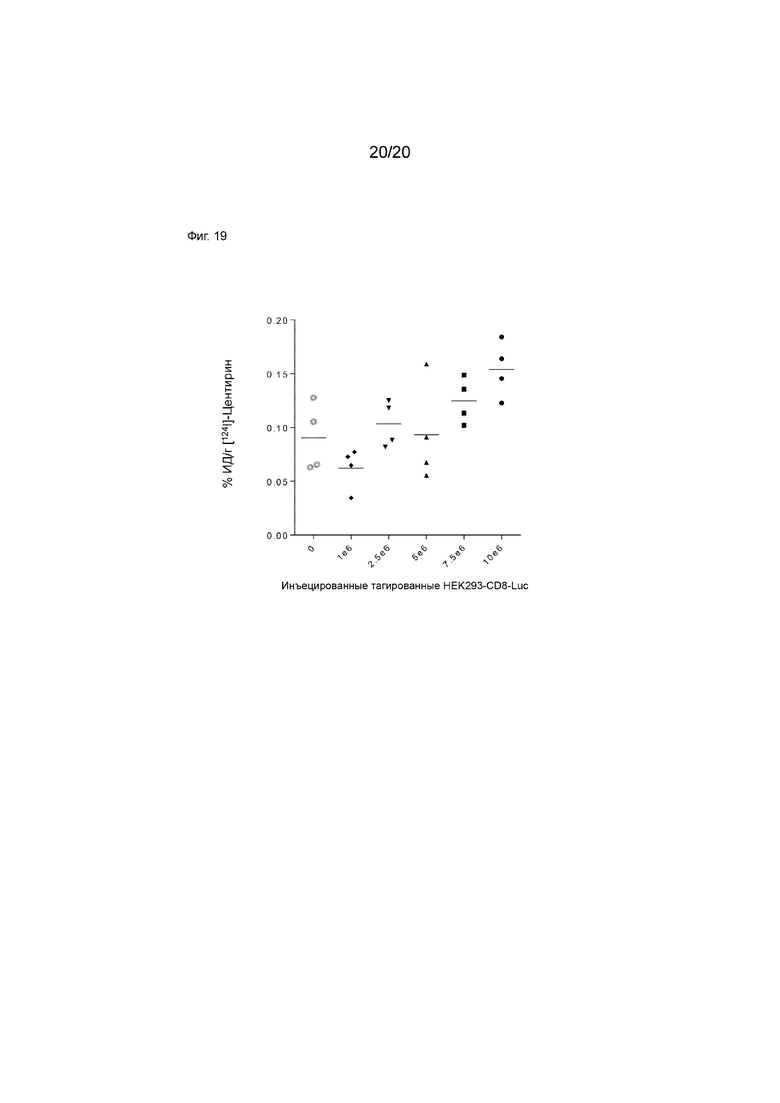
Изобретение относится к области биотехнологии, конкретно к выделенному домену FN3, который специфически связывается с белком CD8A человека, и может быть использовано в медицине. Выделенный домен FN3 содержит аминокислотную последовательность с SEQ ID NO: 40-269 и может быть использован для обнаружения CD8–экспрессирующих клеток в биологическом образце. 10 н. и 7 з.п. ф-лы, 19 ил., 14 табл., 12 пр.
1. Выделенный домен FN3, который специфически связывается с белком CD8A человека, где указанный выделенный домен FN3 содержит аминокислотную последовательность любой из SEQ ID NO: 40-269 и где в указанной аминокислотной последовательности необязательно может быть замещен цистеином остаток в положении, соответствующем остатку 54 в последовательности, выбранной из SEQ ID NO: 79, 81, 83, 89, 122 и 68.
2. Выделенный домен FN3, который специфически связывается с белком CD8A человека, где указанный выделенный домен FN3 содержит аминокислотную последовательность любой из SEQ ID NO: 40-269 и где в указанной аминокислотной последовательности необязательно может быть замещен цистеином остаток в положении, соответствующем остатку 54 в последовательности, выбранной из SEQ ID NO: 79, 81, 83, 89, 122 и 68, где указанный домен FN3 конъюгирован со второй молекулой.
3. Выделенный домен FN3 по п. 2, отличающийся тем, что указанная вторая молекула представляет собой метку, пригодную для обнаружения.
4. Выделенный домен FN3 по п. 3, отличающийся тем, что указанная метка, пригодная для обнаружения, представляет собой радиоактивный изотоп, магнитные гранулы, металлические гранулы, коллоидные частицы, флуоресцентный краситель, электронно–плотный реагент, фермент, биотин, дигоксигенин или гаптен.
5. Выделенный домен FN3 по п. 1, отличающийся тем, что указанный домен FN3 не активирует CD8+ T–лимфоциты in vitro, как измерено с помощью метода иммуноферментных пятен (ELISPOT).
6. Выделенный домен FN3 по п. 1, дополнительно содержащий метионин на N–конце домена FN3.
7. Выделенный домен FN3, который специфически связывается с белком CD8A человека, где указанный выделенный домен FN3 содержит аминокислотную последовательность любой из SEQ ID NO: 40-269 и где в указанной аминокислотной последовательности необязательно может быть замещен цистеином остаток в положении, соответствующем остатку 54 в последовательности, выбранной из SEQ ID NO: 79, 81, 83, 89, 122 и 68, где указанный домен FN3 соединен с фрагментом, продлевающим время полужизни.
8. Выделенный домен FN3 по п. 7, отличающийся тем, что фрагмент, продлевающий время полужизни, представляет собой CD8–связывающую молекулу, альбумин, вариант альбумина, альбуминсвязывающую молекулу, полиэтиленгликоль (ПЭГ), CD8, вариант CD8 или, по меньшей мере, часть Fc–области иммуноглобулина.
9. Выделенный полинуклеотид, кодирующий домен FN3 по п. 1.
10. Экспрессионный вектор, содержащий полинуклеотид по п. 9.
11. Выделенная клетка–хозяин для получения домена FN3, который специфически связывается с белком CD8A человека, содержащая экспрессионный вектор по п. 10, где указанная клетка не является эмбриональной клеткой человека.
12. Способ получения домена FN3, который специфически связывается с белком CD8A человека, включающий в себя культивирование выделенной клетки–хозяина по п. 11 в условиях, в которых экспрессируется домен FN3, и очистку домена FN3.
13. Диагностический набор для обнаружения CD8A в биологическом образце, содержащий домен FN3 по п. 1 и инструкции по оценке уровня CD8A в указанном биологическом образце.
14. Диагностический агент, способный обнаруживать присутствие CD8+ T–клеток, содержащий домен FN3 по п. 1.
15. Диагностический агент по п. 14, отличающийся тем, что замещающий цистеин конъюгирован с Zr–89 или I–124.
16. Способ обнаружения CD8–экспрессирующих клеток в биологическом образце, включающий в себя обработку указанного биологического образца диагностическим реагентом по п. 14 и оценивание связывания указанного биологического образца с доменом FN3 такого диагностического агента.
17. Способ по п. 16, отличающийся тем, что указанный диагностический агент имеет замену на цистеин в позиции остатка 54 из SEQ ID NO: 79, 81, 83, 89, 122 и/или 68 и замещающий цистеин конъюгирован с Zr–89 или I–124.
| RU 2012151366 A, 10.06.2014 | |||
| KOIDE A | |||
| et al., The fibronectin type III domain as a scaffold for novel binding proteins, Journal of molecular biology, 1998, V | |||
| СЧЕТНЫЙ ДИСК ДЛЯ РАСЧЕТА СОСТАВНЫХ ЧАСТЕЙ ПИЩИ | 1919 |
|
SU284A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| TEPLYAKOV A | |||
| et al., Antibody modeling assessment II | |||
| Structures and models, Proteins: Structure, Function, and Bioinformatics, 2014, V | |||
| Машина для разделения сыпучих материалов и размещения их в приемники | 0 |
|
SU82A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| SHEN | |||
Авторы
Даты
2021-11-19—Публикация
2017-12-13—Подача