ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет по предварительной заявке США №62/219 063, поданной 15 сентября 2015 года, которая включена в данное описание посредством ссылки в полном объеме.
ПРЕДСТАВЛЕНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ТЕКСТОВОЙ ФАЙЛЕ ФОРМАТА ASCII
Содержание следующего представления списка последовательностей в текстовом файле формата ASCII включено в данный документ посредством ссылки в полном объеме: машиночитаемая форма (CRF) списка последовательностей (имя файла: 146392026840SEQLIST.txt, дата записи: 15 сентября 2016 года, размер: 183 КБ).
УРОВЕНЬ ТЕХНИКИ
В последнее десятилетие разработка и создание новых белков из альтернативных белковых каркасов стала новой областью с широким спектром применений, начиная от структурной биологии и инструментов визуализации до терапевтических реагентов, которые в настоящее время тестируются клинических условиях (HK Binz et al., Nat Biotechnol 23, 1257-1268, 2005; HK Binz and A Pluckthun, Curr Opin Biotechnol 16, 459-469, 2005; SS Sidhu and S Koide, Curr Opin Struct Biol 17, 481-487, 2007; A Skerra, Curr Opin Biotechnol 18, 295-304, 2007; C Gronwall and S Stahl, J Biotechnol 140, 254-269, 2009; T Wurch et al., Trends Biotechnol 30, 575-582, 2012; S Banta et al., Annu Rev Biomed Eng 15, 93-113, 2013).
Желаемые физические свойства потенциальных альтернативных каркасных молекул включают высокую термическую стабильность и обратимость теплового фолдинга и анфолдинга. Для повышения видимой термической стабильности белков и ферментов были применены несколько методов, в том числе рациональный дизайн, основанный на сравнении с сильно подобными термостабильными последовательностями, создание стабилизирующих дисульфидных мостиков, мутации для увеличения α склонности к формированию спиралей, создание солевых мостиков, изменение поверхностного заряда белка, направленная эволюция и составление консенсусных последовательностей (Lehmann and Wyss, Cur Open Biotechnology 12, 371-375, 2001).
Пептиды с цистиновым узлом могут быть получены из широкого круга источников и проявляют разнообразную фармакологическую активность. Они содержат аминокислотную последовательность из около 30-50 аминокислот в длину и содержат шесть консервативных остатков цистеина, которые образуют три дисульфидные связи. Один из дисульфидов проникает в макроцикл, который образован двумя другими дисульфидами и их взаимосвязанными скелетами, что приводит к формированию характерной узловой топологии с множеством петель, находящихся на поверхности. Петли определяются как области аминокислот, которые фланкируют шесть консервативных остатков цистеина и являются сильно вариабельными по своей природе. Кроме того, уникальное расположение дисульфидных связей делает пептиды с цистиновым узлом высокостойкими к термической, протеолитической и химической деградации.
Таким образом, существует потребность в разработке небольших, стабильных, искусственных антителоподобных молекул для различных терапевтических и диагностических применений, например, при глазных заболеваниях и расстройствах. Данное изобретение отвечает этим и другим потребностям.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В некоторых вариантах реализации изобретения, описанных в данном документе, изобретение представляет собой неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), причем CKP содержит цистиновую каркасную структуру:
Z1C1L1C2L2C3L3C4L4C5L5C6Z2
где:
Z1 и Z2 представляют собой любую аминокислоту;
L1 представляет собой петлю 1 и имеет структуру, выбранную из группы, состоящей из: X1X2X3X4X5X6 (SEQ ID NO: 2), X1X2X3X4X5X6X7 (SEQ ID NO: 3), X1X2X3X4X5X6X7X8 (SEQ ID NO: 4), X1X2X3X4X5X6X7X8X9 (SEQ ID NO: 5), и X1X2X3X4X5X6X7X8X9X10 (SEQ ID NO: 6), где каждый из X1 - X10 представляет собой любую аминокислоту;
L2 представляет собой петлю 2 и имеет структуру: X1X2X3X4X5 (SEQ ID NO: 7), где каждый из X1 - X5 представляет собой любую аминокислоту или неприродную аминокислоту;
L3 представляет собой петлю 3 и имеет структуру: X1X2X3, где каждый из X1 - X3 представляет собой любую аминокислоту или неприродную аминокислоту;
L4 представляет собой петлю 4 и имеет структуру: X1, где X1 представляет собой любую аминокислоту или неприродную аминокислоту;
L5 представляет собой петлю 5 и имеет структуру: X1X2X3X4X5 (SEQ ID NO: 7), где каждый из X1 - X5 представляет собой любую аминокислоту или неприродную аминокислоту;
где неприродная аминокислота выбрана из группы, состоящей из L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, и L-4-фторфенилаланина; а также
CKP связывается с VEGF-A с аффинностью 500 пМ или выше.
В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеприведенных вариантов не встречающийся в природе (CKP), который связывается с VEGF-A, имеет измененную комбинацию дисульфидных связей в сравнении с ингибитором трипсина Ecballium elaterium EETI -II, имеющим аминокислотную последовательность, представленную в SEQ ID NO: 1; где измененная комбинация дисульфидных связей представляет собой C1-C4, C2-C3 и C5-C6.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов неприродная аминокислота выбрана из группы, состоящей из L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон(NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации Z1 и/или Z2 представляет собой более одной аминокислоты или неприродную аминокислоту. В некоторых вариантах реализации изобретения Z2 представляет собой две аминокислоты. В некоторых вариантах реализации изобретения Z2 представляет собой три аминокислоты.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения Z1 и/или Z2 представляет собой G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации в L1 X3 не является I; X5 не является M; и/или X6 не является R. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вариантов реализации изобретения, указанных выше, в L1: X1 представляет собой аминокислоту, выбранную из P, Q, R, T, V, D, N, K, L и X; X2 представляет собой аминокислоту, выбранную из T, D, L, V, I, R, P, N и X; X3 представляет собой аминокислоту, выбранную из T, P, M, L, S, F, R и X; X4 представляет собой аминокислоту, выбранную из R, T, Q, D, W, L, E, S, K и X; X5 представляет собой аминокислоту, выбранную из F, P, V, E, K, L, I и X; X6 представляет собой аминокислоту, выбранную из K, N, F, P, L, Y, T, D, M и X; X7 представляет собой аминокислоту, выбранную из Q, W, H и X; и/или X8 представляет собой аминокислоту, выбранную из Y, A, G, D, E, W, S и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L1: X9 представляет собой аминокислоту, выбранную из L, I, V, D, E и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L1: X10 представляет собой аминокислоту, выбранную из Y, T, M, N, F, и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации, X представляет неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не является пролином (P). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не является глицином (G). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой аминокислоту, выбранную из G, Q, H, R, L и Q; X2 представляет собой аминокислоту, выбранную из P, M, W, Y, F, L и H; X3 представляет собой аминокислоту, выбранную из N, F, H и Y; X4 представляет собой аминокислоту, выбранную из G, Q, D, N, K, H, E и S; и/или X5 представляет собой аминокислоту, выбранную из F, S и Т.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации L1 имеет структуру X1X2X3X4X5X6X7X8 (SEQ ID NO: 4), где: X1 представляет собой аминокислоту, выбранную из P, Q и R; X2 представляет собой аминокислоту, выбранную из T, L и D; X3 представляет собой аминокислоту, выбранную из T, M и L; X4 представляет собой аминокислоту, выбранную из R, Q и D; X5 представляет собой аминокислоту, выбранную из F, P и V; X6 представляет собой аминокислоту, выбранную из K и F; X7 представляет собой аминокислоту, выбранную из Q и W; и X8 представляет собой аминокислоту, выбранную из Y, G и D. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения L1 имеет структуру X1X2X3X4X5X6X7X8 X9 X10 (SEQ ID NO: 6), где: X1 представляет собой аминокислоту, выбранную из Q, R, T и V; X2 представляет собой аминокислоту, выбранную из Т и D; X3 представляет собой P; X4 представляет собой аминокислоту, выбранную из Т и W; X5 представляет собой аминокислоту, выбранную из F, E, P и K; X6 представляет собой аминокислоту, выбранную из N и P; X7 представляет собой аминокислоту, выбранную из W и H; X8 представляет собой аминокислоту, выбранную из A, D, E и W; X9 представляет собой аминокислоту, выбранную из L и I; и X10 представляет собой аминокислоту, выбранную из Y, T, M и N.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой аминокислоту, выбранную из G, H и Q; X2 представляет собой аминокислоту, выбранную из P, M, W и Y; X3 представляет собой аминокислоту, выбранную из N и Y; X4 представляет собой аминокислоту, выбранную из G, Q и S; и X5 представляет собой аминокислоту, выбранную из F и S.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации L1 имеет структуру X1X2X3X4X5X6X7X8 (SEQ ID NO: 4), где: X1 представляет собой аминокислоту, выбранную из D, Q, N и K; X2 представляет собой аминокислоту, выбранную из V, I, R, L и P; X3 представляет собой аминокислоту, выбранную из L, S, M, T и F; X4 представляет собой аминокислоту, выбранную из Q, L и E; X5 представляет собой P; X6 представляет собой аминокислоту, выбранную из F, L и Y; X7 представляет собой W; и X8 представляет собой G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X3 представляет собой Y; X5 представляет собой S; и X1, X2 и X4 представляют собой любую аминокислоту, за исключением того, что X1 не является G, X2 не является P, X4 не является G, и/или X5 не является F. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой аминокислоту, выбранную из H, L, R и Q; X2 представляет собой аминокислоту, выбранную из W, F и Y; X3 представляет собой Y; X4 представляет собой аминокислоту, выбранную из Q, N, K, H и E; и X5 представляет собой S.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации L1 имеет структуру X1X2X3X4X5X6X7X8X9 X10 (SEQ ID NO: 6), где: X1 представляет собой аминокислоту, выбранную из K, Q, L и R; X2 представляет собой аминокислоту, выбранную из N и D; X3 представляет собой аминокислоту, выбранную из P и L; X4 представляет собой аминокислоту, выбранную из L, T, S и K; X5 представляет собой аминокислоту, выбранную из F, V, I и L; X6 представляет собой аминокислоту, выбранную из N и D; X7 представляет собой W; X8 представляет собой аминокислоту, выбранную из А и S; X9 представляет собой аминокислоту, выбранную из L, V, E и D; и X10 представляет собой аминокислоту, выбранную из Y и F.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой Q; X2 представляет собой аминокислоту, выбранную из L, F, M и H; X3 представляет собой аминокислоту, выбранную из F, Y и H; X4 представляет собой аминокислоту, выбранную из D, Q, N и K; и X5 представляет собой аминокислоту, выбранную из S и T.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L2, X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S, и X5 представляет собой D.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации L1 имеет структуру X1X2X3X4X5X6X7X8 (SEQ ID NO: 4), где: X5 представляет собой P; X7 представляет собой W; X8 представляет собой G; и где X1, X2, X3, X4 и X6 представляют собой любую аминокислоту, за исключением того, что X1 не является P, X2 не является R, X3 не является I, и/или X6 не является R. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеописанных вариантов реализации изобретения, L1 имеет структуру X1X2X3X4X5X6X7X8 (SEQ ID NO: 4), где: X1 представляет собой аминокислоту, выбранную из N и D; X2 представляет собой аминокислоту, выбранную из I и V; X3 представляет собой аминокислоту, выбранную из M и L; X4 представляет собой аминокислоту, выбранную из L, Q, D и K; X5 представляет собой P; X6 представляет собой аминокислоту, выбранную из F, Y, T, L и М; X7 представляет собой W; и X8 представляет собой G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой аминокислоту, выбранную из Q, H, L и R; X2 представляет собой аминокислоту, выбранную из Y и W; X3 представляет собой Y; X4 представляет собой аминокислоту, выбранную из Q и N; и X5 представляет собой S. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X3 представляет собой Y; X5 представляет собой S; и X1, X2 и X4 представляют собой любую аминокислоту, за исключением того, что: X1 не является G, X2 не является P, и/или X4 не является G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L2: X1 представляет собой аминокислоту, выбранную из G или E; X2 представляет собой аминокислоту, выбранную из Q, L, P, R, E и M; X3 представляет собой аминокислоту, выбранную из S, D и N; X4 представляет собой аминокислоту, выбранную из F, Y, L, M и I; и/или X5 представляет собой аминокислоту, выбранную из Е, D, Q, L и S.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L3, X1 представляет собой L, X2 представляет собой A, и X3 представляет собой G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L4, X1 представляет собой V или F.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не является пролином (P).
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не является глицином (G).
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой любую аминокислоту, кроме G; X2 представляет собой любую аминокислоту за исключением P; X3 представляет собой любую аминокислоту за исключением N; X4 представляет собой любую аминокислоту, кроме G; и/или X5 представляет собой любую аминокислоту за исключением F.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации L1 имеет структуру X1X2X3X4X5X6X7X8 (SEQ ID NO: 4), где X1 представляет собой аминокислоту, выбранную из N, D и X; X2 представляет собой аминокислоту, выбранную из I, V и X; X3 представляет собой M или X; X4 представляет собой аминокислоту, выбранную из L, Q и X; X5 представляет собой P или X; X6 представляет собой F, Y или X; X7 представляет собой W или X; и X8 представляет собой G или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации, X представляет неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L3 каждый из X1 - X3 представляет собой любую аминокислоту или неприродную аминокислоту, за исключением того, что X1 не является лейцином (L), X2 не является аланином (A) и X3 не является глицином (G), где неприродная аминокислота выбрана из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L3: X1 представляет собой аминокислоту, выбранную из M, F, L, V и X; X2 представляет собой аминокислоту, выбранную из S, N, Q, I, Y, E, V, T и X; X3 представляет собой аминокислоту, выбранную из D, Q, T, N, E, R и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L4 X1 представляет собой любую аминокислоту, за исключением V или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-нерлеуцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина. В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L4, X1 представляет собой I, L или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X3 представляет собой Y или X; X5 представляет собой S или X; и X1, X2 и X4 представляют собой любую аминокислоту или X, за исключением того, что X1 не является G, X2 не является P, и/или X4 не является G, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не является пролином (P). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не является глицином (G). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой аминокислоту, выбранную из Q, H и X; X2 представляет собой аминокислоту, выбранную из Y, W и X; X3 представляет собой Y или X; X4 представляет собой аминокислоту, выбранную из Q, N или X; X5 представляет собой S или X, где X представляет собой неприродную аминокислоту, выбранную из группы, содержащей L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации, X представляет неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L -пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L2: X1 представляет собой G или X; X2 представляет собой R, P или X; X3 представляет собой D или X; X4 представляет собой F, I или X; и X5 представляет собой E, D или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина и L-4-фторфенилаланина.
В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLQQCICQYYQSCG (SEQ ID NO: 103). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECVERCICQYYQSCG (SEQ ID NO: 104). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 105). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECMNQCICQYYQSCG (SEQ ID NO: 106). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECMQTCICQYYQSCG (SEQ ID NO: 107). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECVYQCICQYYQSCG (SEQ ID NO: 108). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECFINCICQYYQSCG (SEQ ID NO: 109). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 110). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECVTECICQYYQSCG (SEQ ID NO: 111). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECFYECICQYYQSCG (SEQ ID NO: 112). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle).
В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любым из вышеперечисленных вариантов реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), содержит аминокислотную последовательность GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения представлен неприродный пептид с цистиновым узлом(CKP), содержащий аминокислотную последовательность, выбранную из группы, состоящей из: GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113), GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114), GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139), GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140), GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142), GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle), GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle), GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle), и GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP связывается с VEGF-A.
В некоторых вариантах реализации изобретения представлен неприродный пептид с цистиновым узлом(CKP), содержащий аминокислотную последовательность, выбранную из группы, состоящей из: GCDVX1QPYWGCGPDI-D/E-CLS-N/K/X2-CICHWYNSCG (SEQ ID NO: 534), GCDVX1QPYWGCGPDI-N/K/X2-CLS-D/E-CICHWYNSCG (SEQ ID NO: 535), GCNIX1LPYWGCGRDF-D/E-CME-N/K/X2-CICQYYQSCG (SEQ ID NO: 538), GCNIX1LPYWGCGRDF-N/K/X2-CME-D/E-CICQYYQSCG (SEQ ID NO: 539), GCNIX1LPFWGCGRDF-D/E-CVS-N/K/X2-CICQYYQSCG (SEQ ID NO: 540), и GCNIX1LPFWGCGRDF-N/K/X2-CVS-D/E-CICQYYQSCG (SEQ ID NO: 541), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVX1QPYWGCGPDI-D/E-CLS-N/K/X2-CICHWYNSCG (SEQ ID NO: 534), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVXQPYWGCGPDIDCLSKCICHWYNSCG (SEQ ID NO: 536), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVX1QPYWGCGPDIDCLSX2CICHWYNSCG (SEQ ID NO: 537), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCDVX1QPYWGCGPDI-N/K/X2-CLS-D/E-CICHWYNSCG (SEQ ID NO: 535), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIX1LPYWGCGRDF-D/E-CME-N/K/X2-CICQYYQSCG (SEQ ID NO: 538), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIXLPYWGCGRDFECMEKCICQYYQSCG (SEQ ID NO: 543), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIX1LPYWGCGRDFECMEX2CICQYYQSCG (SEQ ID NO: 544), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIX1LPYWGCGRDF-N/K/X2-CME-D/E-CICQYYQSCG (SEQ ID NO: 539), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIX1LPFWGCGRDF-D/E-CVS-N/K/X2-CICQYYQSCG (SEQ ID NO: 540), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIXLPFWGCGRDFECVSKCICQYYQSCG (SEQ ID NO: 545), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIX1LPFWGCGRDFECVSX2CICQYYQSCG (SEQ ID NO: 546), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP содержит аминокислотную последовательность, представленную в виде GCNIX1LPFWGCGRDF-N/K/X2-CVS-D/E-CICQYYQSCG (SEQ ID NO: 541), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения CKP связывается с VEGF-A.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения, изобретение представляет собой неприродный пептид с цистиновым узлом(CKP), который связывается с (VEGF-A), где CKP содержит цистиновую каркасную структуру:
Z1C1L1C2L2C3L3C4L4C5L5C6Z2
где:
Z1 и Z2 представляют собой любую аминокислоту;
L1 представляет собой петлю 1 и имеет структуру, выбранную из группы, состоящей из: X1X2X3X4X5X6X7X8, X1X2X3X4X5X6X7X8X9, и X1X2X3X4X5X6X7X8X9X10, где каждый из X1 - X10 представляет собой любую аминокислоту;
L2 представляет собой петлю 2 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
L3 представляет собой петлю 3 и имеет структуру: X1X2X3, где каждый из X1 - X3 представляет собой любую аминокислоту;
L4 представляет собой петлю 4 и имеет структуру: X1, где X1 представляет собой любую аминокислоту;
L5 представляет собой петлю 5 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
а также CKP имеет измененную комбинацию дисульфидных связей по отношению к ингибитору трипсина белку EETI-II дикого типа, имеющему аминокислотную последовательность, представленную в SEQ ID NO: 1; где измененная комбинация дисульфидных связей представляет собой связи C1-C4, C2-C3 и C5-C6; а также CKP имеет процентное содержание альфа-спиралей по меньшей мере 20%.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения Z1 и Z2 представляют собой любую аминокислоту, более одной аминокислоты или неприродную аминокислоту. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения каждый из X1 - X10 в L1 представляет собой любую аминокислоту или неприродную аминокислоту. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения каждый из X1 - X5 в L2 представляет собой любую аминокислоту или неприродную аминокислоту. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения каждый из X1 - X3 в L3 представляет собой любую аминокислоту или неприродную аминокислоту. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения X1 в L4 представляет собой любую аминокислоту или неприродную аминокислоту. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения каждый из X1 - X5 в L5 представляет собой любую аминокислоту или неприродную аминокислоту. В некоторых вариантах реализации изобретения неприродная аминокислота выбрана из группы, состоящей из: L-пропаргилглицина-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любому из вышеперечисленных вариантов не встречающийся в природе (CKP), который связывается с VEGF-A, связывается с VEGF-A с аффинностью 500 пМ или менее. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аффинность связывания определяется с помощью поверхностного плазмонного резонанса.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации Z1 и/или Z2 представляет собой более одной аминокислоты или неприродную аминокислоту. В некоторых вариантах реализации изобретения Z2 представляет собой две аминокислоты. В некоторых вариантах реализации изобретения Z2 представляет собой три аминокислоты. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не является пролином (P). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5 каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не является глицином (G).
В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любому из вышеперечисленных вариантов реализации изобретения C-концевая карбоксильная группа неприродного (CKP), который связывается с VEGF-A, модифицируется (например, кэпируется). В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любому из вышеперечисленных вариантов реализации изобретения N-концевая аминогруппа неприродного (CKP), который связывается с VEGF-A, модифицирована (например, кэпирована). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения C-концевая карбоксильная группа неприродного (CKP), который связывается с VEGF-A, кэпирована, и N-концевая аминогруппа неприродного (CKP), который связывается с VEGF-A, модифицирована (например, кэпирована).
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения C-концевая карбоксильная группа неприродного (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения в соответствии с (или применительно к) любому из вышеперечисленных вариантов реализации изобретения N-концевая аминогруппа неприродного (CKP), который связывается с VEGF-A, ацетилирована. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения C-концевая карбоксильная группа неприродного (CKP), который связывается с VEGF-A, амидирована, и N-концевая аминогруппа неприродного (CKP), который связывается с VEGF-A, ацетилирована.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации неприродный (CKP), который связывается с VEGF-A, ингибирует активность VEGF-A. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации CKP ингибирует активность VEGF-A с IC50 от около 0,5 нМ до около 1,0 нМ. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения неприродный каркасный белок EETI-II связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения неприродный CKP конкурирует с антителом G6.31 для связывания с VEGF-A. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения, изобретение предлагает не встречающийся в природе CKP, который конкурирует с неприродным (CKP), который связывается с VEGF-A любого из вышеперечисленных вариантов реализации изобретения за связывание с VEGF-A.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения неприродный CKP, который связывается с эпитопом на VEGF-A, содержит по меньшей мере один из аминокислотных остатков, выбранных из группы, состоящей из: V14, V15, F17, D19, Y21, Q22, Y25, I46, K48, N62, D63, L66, M81, I83, K84, P85, H86, G88, Q89, I91, C104, R105 и P106.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: K48, N62, и D63. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: Y21, Y25, и P106. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: H86 и Q89. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: M81, D19, и Q22. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: F17, M81, и I91. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: V14, F17, D19, Q22, M81, и I91. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения аминокислотные остатки выбраны из группы, состоящей из: Y25.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения неприродный (CKP), который связывается с VEGF-A, конъюгирован с терапевтическим агентом. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения неприродный (CKP), который связывается с VEGF-A, конъюгирован с меткой. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения метка выбрана из группы, состоящей из радиоизотопа, флуоресцентного красителя и фермента.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеприведенных вариантов реализации изобретения предлагается изолированная нуклеиновая кислота, кодирующая неприродный (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения. Также представлен вектор экспрессии, кодирующий молекулу нуклеиновой кислоты по любому из вышеперечисленных вариантов реализации изобретения. Также предложена клетка, содержащая вектор экспрессии по любому из вышеперечисленных вариантов реализации изобретения. Также представлен способ получения не встречающегося в природе (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения, включающий культивирование клетки по любому из вышеперечисленных вариантов реализации изобретения и получение не встречающегося в природе (CKP) который связывается с VEGF-A из культуры клеток.
Также представлен способ получения не встречающегося в природе (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения, включающий химический синтез не встречающегося в природе (CKP) который связывается с VEGF-A.
В данном документе представлена композиция, которая содержит неприродный (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения и фармацевтически приемлемый носитель. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения композиция содержит одно или несколько дополнительных соединений. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения дополнительное соединение связывается со второй биологической молекулой, выбранной из группы, состоящей из интерлейкина-6 (IL-6); рецептора интерлейкина-6 (IL-6R); PDGF; ангиопоэтина; ангиопоэтина 2; Tie2; S1P; интегринов αvβ3, αvβ5 и α5β1; бетацеллюлина; апелина/APJ; эритропоэтина; фактора комплемента D; TNFα; HtrA1; рецептора VEGF; рецептора ST-2; и белков, генетически связанных с возрастной макулярной дегенерацией (AMD), таких как компоненты сигнального пути комплемента C2, фактор B, фактор H, CFHR3, C3b, C5, C5a, C3a, HtrA1, ARMS2, TIMP3, HLA, интерлейкин-8 (IL-8), CX3CR1, TLR3, TLR4, CETP, LIPC, COL10A1 и TNFRSF10A. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения дополнительное соединение является неприродным CKP. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения дополнительное соединение представляет собой антитело или его антигенсвязывающий фрагмент.
В данном документе представлен способ лечения глазного заболевания, характеризующегося ангиогенезом и/или сосудистой проницаемостью или протеканием у субъекта, включающий введение субъекту эффективного количества неприродного (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения способ дополнительно включает введение одного или нескольких дополнительных соединений. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения неприродный CKP, который связывается с VEGF-A, вводят одновременно с дополнительным соединением(-ами). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения неприродный CKP, который связывается с VEGF-A, вводят до или после дополнительного соединения(-ий). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения дополнительное соединение связывается со второй биологической молекулой, выбранной из группы, состоящей из интерлейкина-6 (IL-6); рецептора интерлейкина-6 (IL-6R); PDGF; ангиопоэтина; ангиопоэтина 2; Tie2; S1P; интегринов αvβ3, αvβ5 и α5β1; бетацеллюлина; апелина/APJ; эритропоэтина; фактора комплемента D; TNFα; HtrA1; рецептора VEGF; рецептора ST-2; и белков, генетически связанных с возрастной макулярной дегенерацией (AMD), таких как компоненты сигнального пути комплемента C2, фактор B, фактор H, CFHR3, C3b, C5, C5a, C3a, HtrA1, ARMS2, TIMP3, HLA, интерлейкин-8 (IL-8), CX3CR1, TLR3, TLR4, CETP, LIPC, COL10A1 и TNFRSF10A. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения дополнительное соединение является неприродным CKP. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения дополнительное соединение представляет собой антитело или его антигенсвязывающий фрагмент. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения глазное заболевание представляет собой внутриглазное неоваскулярное заболевание, выбранное из группы, состоящей из пролиферативных ретинопатий, хориоидальной неоваскуляризации (CNV), возрастной макулярной дегенерации (AMD), диабетической и других связанных с ишемией ретинопатий, диабетического макулярного отека, патологической миопии, болезни фон Гиппеля-Линдау, гистоплазмоза глаза, венозной окклюзии сетчатки (RVO), включая окклюзию центральной вены сетчатки (CRVO) и окклюзию ветвей вены сетчатки (BRVO), неоваскуляризации роговицы, неоваскуляризации сетчатки и ретинопатии недоношенных (ROP).
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения неприродный (CKP), который связывается с VEGF-A, или композицию вводят субъекту через имплантируемое устройство. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения имплантируемое устройство, выбрано из группы, состоящей из: окулярной вставки, депо медленного высвобождения, окулярной заглушки/ резервуара, небиоразлагаемого глазного имплантата или биоразлагаемого глазного имплантата.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения предлагается композиция, содержащая неприродный (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения для использования при лечении окулярного заболевания, характеризующегося ангиогенезом и/или сосудистой проницаемостью или протеканием у субъекта. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения глазное заболевание представляет собой внутриглазное неоваскулярное заболевание, выбранное из группы, состоящей из пролиферативных ретинопатий, хориоидальной неоваскуляризации (CNV), возрастной макулярной дегенерации (AMD), диабетической и других связанных с ишемией ретинопатий, диабетического макулярного отека, патологической миопии, болезни фон Гиппеля-Линдау, гистоплазмоза глаза, венозной окклюзии сетчатки (RVO), включая окклюзию центральной вены сетчатки (CRVO) и окклюзию ветвей вены сетчатки (BRVO), неоваскуляризации роговицы, неоваскуляризации сетчатки и ретинопатии недоношенных (ROP). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения композицию вводят субъекту через имплантируемое устройство. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения имплантируемое устройство, выбрано из группы, состоящей из: окулярной вставки, депо медленного высвобождения, окулярной заглушки/ резервуара, небиоразлагаемого глазного имплантата или биоразлагаемого глазного имплантата.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения предлагается композиция, содержащая неприродный (CKP), который связывается с VEGF-A по любому из вышеперечисленных вариантов реализации изобретения для использования при лечении окулярного заболевания, характеризующегося ангиогенезом и/или сосудистой проницаемостью или протеканием у субъекта. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения глазное заболевание представляет собой внутриглазное неоваскулярное заболевание, выбранное из группы, состоящей из пролиферативных ретинопатий, хориоидальной неоваскуляризации (CNV), возрастной макулярной дегенерации (AMD), диабетической и других связанных с ишемией ретинопатий, диабетического макулярного отека, патологической миопии, болезни фон Гиппеля-Линдау, гистоплазмоза глаза, венозной окклюзии сетчатки (RVO), включая окклюзию центральной вены сетчатки (CRVO) и окклюзию ветвей вены сетчатки (BRVO), неоваскуляризации роговицы, неоваскуляризации сетчатки и ретинопатии недоношенных (ROP). В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения лекарственное средство вводят субъекту через имплантируемое устройство. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения имплантируемое устройство, выбрано из группы, состоящей из: окулярной вставки, депо медленного высвобождения, окулярной заглушки/ резервуара, небиоразлагаемого глазного имплантата или биоразлагаемого глазного имплантата.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения неприродный (CKP), который связывается с VEGF-A, применяется в готовой смеси для доставки с большим сроком действия.
Приведенная в данном документе композиция содержит неприродный (CKP), который связывается с VEGF-A по любому из вышеописанных вариантов реализации изобретения и PLGA. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения PLGA представляет собой стержень PLGA.
Также в данном документе представлен неприродный пептид с цистиновым узлом(CKP), который связывается с белком 6 родственным рецептору липопротеинов низкой плотности человека (LRP6), где CKP содержит цистиновую каркасную cтруктуру:
Z1C1L1C2L2C3L3C4L4C5L5C6Z2;
где:
Z1 и Z2 представляют собой любую аминокислоту;
L1 представляет собой петлю 1 и имеет структуру, выбранную из группы, состоящей из: X1X2X3X4X5X6, X1X2X3X4X5X6X7, X1X2X3X4X5X6X7X8, X1X2X3X4X5X6X7X8X9, и X1X2X3X4X5X6X7X8X9X10, где каждый из X1 - X10 представляет собой любую аминокислоту;
L2 представляет собой петлю 2 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
L3 представляет собой петлю 3 и имеет структуру: X1X2X3, где каждый из X1 - X3 представляет собой любую аминокислоту;
L4 представляет собой петлю 4 и имеет структуру: X1, где X1 представляет собой любую аминокислоту; и
L5 представляет собой петлю 5 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации Z1 и/или Z2 представляет собой более одной аминокислоты или неприродную аминокислоту. В некоторых вариантах реализации изобретения Z2 представляет собой две аминокислоты. В некоторых вариантах реализации изобретения Z2 представляет собой три аминокислоты.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения Z1 и/или Z2 представляет собой G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L1: X1 представляет собой аминокислоту, выбранную из R, V, M, A, G, N, S и E; X2 представляет собой аминокислоту, выбранную из T, N, S, G, R и A; X3 представляет собой аминокислоту, выбранную из N, R, H, V, K, S, G, I и Y; X4 представляет собой аминокислоту, выбранную из R, V, N, I, K, S и T; X5 представляет собой аминокислоту, выбранную из V, R, K, I, T, S, L и N; и X6 представляет собой аминокислоту, выбранную из K, G, A, I, R, N, S и V. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L1: X7 представляет собой аминокислоту, выбранную из G, R, K, E, P и Т. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L1: X8 представляет собой аминокислоту, выбранную из G, R, K, Q, A и S. В некоторых вариантах вариантов реализации согласно (или применительно к) любому из вышеперечисленных вариантов вариантов реализации в L1: X9 представляет собой аминокислоту, выбранную из R или G. В некоторых вариантах вариантов реализации согласно (или применительно к) любому из вышеперечисленных вариантов вариантов реализации в L1: X10 представляет собой аминокислоту, выбранную из Е, W и G.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L5: X1 представляет собой аминокислоту, выбранную из G, S, N, Y, A и R; X2 представляет собой аминокислоту, выбранную из P, G, S, V, E, R, F и D; X3 представляет собой аминокислоту, выбранную из N, G, S, E, P, K, H и R; X4 представляет собой аминокислоту, выбранную из G, R, H, S, Q, V и D; и X5 представляет собой аминокислоту, выбранную из F, D, N, R, G, Y, S и Т.
В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L2 X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S, а X5 представляет собой D. В некоторых вариантах реализации изобретения согласно (или применяемым к) любому из вышеописанных вариантов реализации изобретения, в L3, X1 представляет собой L, X2 представляет собой A, а X3 представляет собой G. В некоторых вариантах реализации изобретения согласно (или применительно к) любому из вышеперечисленных вариантов реализации изобретения в L4 X1 представляет собой V.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 изображена структура белка с цистиновым узлом EETI-II.
На Фиг. 2А изображены результаты экспериментов, которые были выполнены для определения того, нарушает ли EGF_CKP9.54.90 взаимодействие между VEGF-A (8-109) и KDR; VEGF-A(8-109) и Flt-1; VEGF-A 165 и KDR; VEGF-B и Flt-1; VEGF-C и Flt-4; VEGF-D и Flt-4; и PIGF-2 и FLT-1.
На Фиг. 2Б изображены результаты экспериментов, которые были выполнены для определения того, нарушает ли EGF_CKP9.54.90 взаимодействие между VEGF-A (8-109) и KDR; VEGF-A(8-109) и Flt-1; VEGF-A 165 и KDR; EGF и EGFR; PDGF и PDGFR; NGF и NGFR; и IGF и IGFR.
На Фиг. 3 изображены результаты экспериментов, проведенных для определения того, ингибируют ли VEGF_CKP9.54.90, VEGF_CKP9.54 и VEGF_CKP9.63.12 активность протеазы трипсина.
На Фиг. 4 изображены результаты экспериментов, проведенных для определения того, являются ли VEGF_CKP9.54.90 и VEGF_CKP9.63.12 устойчивыми к расщеплению трипсином.
На Фиг. 5 изображены структура VEGF_CKP9.54.90, структура EETI-II дикого типа и представлена сравнительная схема паттерна дисульфидных связей VEGF-связывающего CKP с EETI-II дикого типа.
На Фиг. 6 изображена сокристаллическая структура VEGF_CKP9.54.90 в комплексе с VEGF-A.
На Фиг. 7 изображены модели заполнения пространства, которые демонстрируют сайты связывания VEGF_CKP9.54.90, антитела G6.31 и домена 2 Flt-2 на VEGF-A.
На Фиг. 8 изображены модели ленточные диаграммы, которые демонстрируют сайты связывания VEGF_CKP9.54.90, антитела G6.31 и домена 2 Flt-2 на VEGF-A.
На Фиг. 9 изображены связующие аминокислотные остатки на VEGF-A на взаимодействующей поверхности между VEGF-A и VEGF_CKP9.54.90.
На Фиг. 10 изображены сайты связывания бевацизумаба Fab, Z-домена и рецептор-блокирующего пептида v108 на VEGF-A.
На Фиг. 11 изображены результаты эксперимента, который был проведен для определения влияния мутаций замещения аминокислот в VEGF-A на связывание VEGF_CKP9.54.90 с VEGF-A и на связывание VEGF__CKP9.63.12 с VEGFA. Результаты эксперимента показаны для двух разных осей y.
На Фиг. 12 изображены результаты экспериментов, которые были проведены для определения эффектов VEGF_CKP9.54.90 на CNV в глазах крыс.
На Фиг. 13 изображены результаты экспериментов, которые были выполнены для определения значений IC50 VEGF-связывающих вариантов CKP.
На Фиг. 14 изображены структуры VEGF_CKP9.54 и VEGF_CKP9.63. Также на Фиг. 14 изображена часть сокристаллической структуры VEGF_CKP9.63 в комплексе с VEGF-A, которая показывает, что остаток в положении 8 в петле 1 VEGF_CKP9.63 может образовывать водородную связь с боковой цепью Gln22 VEGF-A.
На Фиг. 15 изображены результаты экспериментов ELISA с фаговым дисплеем, которые были проведены для оценки аффинности связывания клонов 9.54-28, 9.54, 9.54.1-2, 9.54.1-36, 9.54.1-42, 9.54.1-63, 9.54.1-90 и 9.54.1 с hVEGF(8-109).
На Фиг. 16А изображены результаты экспериментов ELISA с фаговым дисплеем, которые были проведены для оценки аффинности связывания клонов с 9.63.44-1 по 9.63.44-7.
На Фиг. 16Б изображены результаты экспериментов ELISA с фаговым дисплеем, которые были проведены для оценки аффинности связывания клонов с 9.63.44-8 по 9.63.44-14.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Представлены не встречающиеся в природе пептиды цистиновых узлов (CKP), которые специфически связываются с VEGF-A человека. Такие неприродные CKP демонстрируют одну или несколько из следующих характеристик: ингибирование активности VEGF-A с IC50 от менее чем около 0,5 нМ до менее чем около 1,0 нМ; связывание с VEGF-A человека, мышиным VEGF-A и крысиным VEGF-A; устойчивость к расщеплению трипсином; паттерн дисульфидных связей C1-C4, C2-C3 и C5-C6; содержание альфа-спиралей, по меньшей мере от около 15% до по меньшей мере около 50%; связывание с эпитопом на VEGF-A, который отличается от эпитопа, связанного с антителом G6.31, связывание с эпитопом на VEGF-A, который отличается от эпитопа, связанного с бевацизумабом, и/или связывания с эпитопом на VEGF-A, который отличается от эпитопа, связанного с Flt-1.
Также представлены химерные молекулы и конъюгаты, содержащие не встречающиеся в природе пептиды цистиновых узлов, которые связывают VEGF-A, нуклеиновые кислоты, кодирующие неприродные CKP, которые связывают VEGF-A и композиции (такие как фармацевтические композиции). Также представлены способы использования неприродных CKP, которые связывают VEGF-A для лечения глазных заболеваний и/или расстройств (таких как сосудистые пролиферативные заболевания и/или расстройства глаз) в результате аномального (например, чрезмерного) ангиогенеза и/или аномальной сосудистой проницаемости. Также предлагается использование неприродных CKP, которые связывают VEGF-A при изготовлении лекарственного средства для лечения глазных заболеваний или расстройств.
В связанном аспекте также присутствуют неприродные CKP, которые связывают белок 6 родственный рецептору липопротеинов низкой плотности человека (LRP6).
Практика данного изобретения использует, если не указано иное, стандартные методы и обычные техники в области клеточной биологии, токсикологии, молекулярной биологии, биохимии, клеточной культуры, иммунологии, онкологии, рекомбинантной ДНК и смежных областях, которые находятся в компетенции специалистов в данных областях. Такие способы описаны в литературе и тем самым доступны специалистам в данной области техники. См., например, Alberts, B. et al., “Molecular Biology of the Cell,” 5th edition, Garland Science, New York, NY, 2008; Voet, D. et al. “Fundamentals of Biochemistry: Life at the Molecular Level,” 3rd edition, John Wiley & Sons, Hoboken, NJ, 2008; Sambrook, J. et al., “Molecular Cloning: A Laboratory Manual,” 3rd edition, Cold Spring Harbor Laboratory Press, 2001; Ausubel, F. et al., “Current Protocols in Molecular Biology,” John Wiley & Sons, New York, 1987 и периодические обновления; Freshney, R.I., “Culture of Animal Cells: A Manual of Basic Technique,” 4th edition, John Wiley & Sons, Somerset, NJ, 2000; и серию “Methods in Enzymology,” Academic Press, San Diego, CA.
Определения
Используемый в данном документе термин «неприродный» используется для обозначения, например, полипептида, содержащего аминокислотную последовательность, которая не встречается в природе, или, например, нуклеиновая кислота, содержащая нуклеотидную последовательность, которая не встречается в природе. Термины «Неприродный пептид с цистиновым узлом» или «неприродный CKP» (или нуклеиновая кислота, кодирующая его) используются в данном документе для обозначения пептидов, которые не имеют аминокислотной последовательности белка EETI-II дикого типа, то есть GCPRILMRCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 1), где Петля 1 (L1) представляет собой аминокислотную последовательность PRILMR (SEQ ID NO: 92), Петля 2 (L2) представляет собой аминокислотную последовательность KQDSD (SEQ ID NO: 93), Петля 3 (L3) представляет собой аминокислотную последовательность LAG, Петля 4 (L4) представляет собой аминокислоту V, а Петля 5 (L5) представляет собой аминокислотную последовательность GPNGF (SEQ ID NO: 15). Неприродный CKP, представленный в данном документе, может быть получен методами генной инженерии или методами химического синтеза. Таким образом, неприродный CKP, описанный в данном документе, может быть рекомбинантным, то есть продуцироваться клеткой или нуклеиновой кислотой или вектором, который был модифицирован путем введения гетерологичной нуклеиновой кислоты или изменения нативной нуклеиновой кислоты до формы не являющейся нативной для этой клетки, или в случае, когда клетка получена от модифицированной клетки. Альтернативно, неприродный CKP, описанный в данном документе, может быть получен посредством химического синтеза пептидов.
Используемый в данном документе термин «пептид с цистиновым узлом» или «CKP» относится к пептиду длиной от 26 до 50 аминокислот, который содержит шесть консервативных остатков цистеина, которые образуют три дисульфидные связи. Один из дисульфидов проникает в макроцикл, который образован двумя другими дисульфидами и их взаимосвязанными скелетами, что приводит к формированию характерной узловой топологии с множеством петель, находящихся на поверхности. Петли определяются как области аминокислот, которые фланкируют шесть консервативных остатков цистеина и являются сильно вариабельными по своей природе.
Используемый в данном документе термин «аминокислотное изменение» относится к добавлению, делеции или замещению по меньшей мере одной аминокислоты, например, в пептидной последовательности (например, в пептидной последовательности WT EETI-II для создания неприродного CKP, или в неприродном CKP для создания еще одного неприродного CKP).
Термин «изолированный» неприродный CKP или «изолированная» композиция относится к CKP или композиции, которые были идентифицированы, отделен и/или извлечен из компонента его естественной среды. Загрязняющими компонентами его природной среды являются материалы, которые могут мешать диагностическому или терапевтическому применению неприродного CKP и могут содержать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах реализации изобретения неприродный CKP или композиция будет очищаться (1) до более чем 95 мас.% неприродного CKP, как определяется методом Лоури, и наиболее предпочтительно до более чем 99 мас.% (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием спиннинг-секвенатора или (3) до гомогенности с помощью SDS-PAGE при восстановительных или невосстановительных условиях с использованием Кумасси синего или, предпочтительно, покраски серебром. Изолированный неприродный CKP содержит CKP in situ в рекомбинантных клетках, поскольку по крайней мере один компонент природной среды CKP не будет присутствовать. Изолированный неприродный CKP будет получен, по меньшей мере, на одной стадии очистки.
«Процентная идентичность аминокислотной последовательности (%)» или «гомология» в отношении идентифицированных в данном документе полипептидных последовательностей определяется как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в сравниваемом полипептиде после выравнивания последовательностей с учетом любых консервативных замен как части идентичности последовательности. Выравнивание для целей определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые входят в компетенцию в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для изучаемого выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей данного изобретения процентные значения идентичности последовательности аминокислот получены с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была создана Genentech, Inc., а исходный код был подан с пользовательской документацией в US Copyright Office, Washington D.C., 20559, где он зарегистрирован как U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 доступна через Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, предпочтительно UNIX V4.0D. Все параметры сравнения последовательностей задаются программой ALIGN-2 и не меняются.
Используемый в данном документе термин «эпитоп» относится к детерминанту белка, способному специфически связываться с неприродным CKP, описанным в данном документе. Эпитоп может содержать от 3 до 10 аминокислот в пространственной конформации, которая уникальна для эпитопа. Эти аминокислоты могут быть линейными внутри белка (т.е. размещаться последовательно в аминокислотной последовательности), или они могут быть расположены в разных частях белка (то есть, размещаться не последовательно в аминокислотной последовательности). Способы определения пространственной конформации аминокислот в белке или на границе двух белков известны в данной области и включают, например, рентгеновскую кристаллографию и двумерный ядерный магнитный резонанс.
Термины «паттерн дисульфидных связей (DBP)», «комбинация дисульфидных связей» и «структура дисульфидных связей» относятся к схеме связывания цистеинов относительно белка WT EETI-II. Белок WT EETI-II содержит шесть консервативных остатков цистеина (пронумерованы 1-6), которые образуют три дисульфидные связи со связями C1-C4, C2-C5 и C3-C6. Паттерн дисульфидных связей является топологически постоянным, что означает, что дисульфидные связи могут быть изменены только путем отсоединения одного или нескольких дисульфидов, например, при применении окислительно-восстановительных условий.
Термины «субъект», «пациент» или «индивидуум» для целей лечения относятся к любому животному, классифицированному как млекопитающее, включая людей, домашних и сельскохозяйственных животных, а также диких, спортивных или домашних животных, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающее является человеком.
«Эффективное количество» неприродного CKP (или композиции, содержащей такой неприродный CKP), как описано в данном документе, представляет собой количество, достаточное для реализации конкретно заявленной цели. «Эффективное количество» может быть определено эмпирически и известными способами, относящимися к заявленной цели.
Термин «терапевтически эффективное количество» относится к количеству не встречающегося в природе CKP или композиции, как описано в данном документе, эффективному для «лечения» заболевания или расстройства у млекопитающего (например, пациента, такого как человек). В случае глазного заболевания или глазного расстройства (такого как окулярное сосудистое пролиферативное заболевание или окулярное расстройство, характеризующееся чрезмерным ангиогенезом), терапевтически эффективное количество неприродного CKP, которое связывается с VEGF-A, описанное в данном документе (или композиции, содержащей такой не встречающийся в природе VEGF-A-связывающий CKP) относится к количеству, необходимому для уменьшения, остановки или предотвращения по меньшей мере одного симптома окулярного заболевания, такого как симптом или расстройство глазного заболевания, описанного более подробно в другом месте в данном документе. Например, эффективное количество будет рассматриваться как количество, достаточное для уменьшения или предотвращения симптома окулярного заболевания или глазного расстройства (такого как окулярное сосудистое пролиферативное заболевание или окулярное расстройство, характеризующееся чрезмерным ангиогенезом), например, полное или частичное излечение и/или поддержание окулярного заболевания, измеренное с помощью оптической когерентной томографии (ОКТ), или улучшение и/или поддержание наилучшей скорректированной остроты зрения (например, более 5 букв при оценке с помощью офтальмологической таблицы EDTRS) или уменьшение размера неоваскуляризации или неоваскулярной проницаемости при оценивании с помощью флюоресцентной ангиографии глазного дна. Эффективное количество, используемое в данном описании, также будет включать количество, достаточное для предотвращения или замедления развития, например, макулярного отека, повышенной проницаемости (такой как сосудистая проницаемость сетчатки), размера поражения CNV и потери зрения. Эффективное количество, используемое в данном описании, также будет включать количество, достаточное для предотвращения или замедления развития симптома окулярного заболевания, изменения хода заболевания (например, но не ограничиваясь этим, замедление прогрессирования симптома окулярного заболевания), или обратить вспять симптом заболевания.
Используемый в данном документе термин «лечить» или «лечение» представляет собой подход для получения полезных или желаемых результатов, включая клинические результаты. Для целей данного изобретения полезные или желаемые клинические результаты включают, но не ограничиваются ими, одно или несколько из следующего: облегчение одного или нескольких симптомов, возникающих в результате окулярного заболевания, уменьшение степени тяжести окулярного заболевания, стабилизация хода окулярного заболевания (например, предотвращение или замедление ухудшения состояния болезни), предотвращение или задержку распространения заболевания (например, на окружающие глазные ткани), предотвращение или отсрочку рецидива окулярного заболевания, задержку или замедление прогрессирования окулярной болезни, улучшение состояния при болезни, обеспечивающее ремиссию или разрешение (частичное или полное) окулярного заболевания, уменьшающее дозу одного или нескольких других лекарств, необходимых для лечения окулярного заболевания, способствующее задержке прогрессирования окулярного заболевания, увеличение или улучшение качества жизни и/или предотвращение или замедление потери зрения. Также в термин «лечение» входит уменьшение патологических последствий окулярного заболевания (такого как, например, потеря зрения). Приведенные в данном документе способы предусматривают какой-либо один или несколько из этих аспектов лечения.
Термин «расстройство» обозначает любое состояние, которое может быть улучшено при лечении неприродным CKP, который связывает VEGF-A, описанным в данном документе. Неограничивающие примеры связанных с VEGF-A расстройств, подлежащих лечению, включают в себя заболевания и расстройства глаз (такие как сосудистые пролиферативные заболевания глаз или расстройства глаз, характеризующиеся чрезмерным ангиогенезом), как описано где-либо в другом месте в данном документе.
Используемый в данном документе термин «фармацевтически приемлемый» или «фармакологически совместимый» означает материал, который не является биологически или иным образом нежелательным, например, материал может быть включен в фармацевтическую композицию, введенную пациенту, не вызывая каких-либо значительных нежелательных биологических эффектов или взаимодействующий в пагубной манере с любым из других компонентов композиции, в которой он содержится. Фармацевтически приемлемые носители или эксципиенты предпочтительно удовлетворяют требуемым стандартам токсикологических и производственных тестирований и/или включены в директиву FDA (Управлением по контролю за продуктами и лекарствами США) об ингредиентах, не являющихся действующими веществами.
Термин «обнаружение» предназначен для определения наличия или отсутствия вещества или количественной оценки количества вещества (такого как целевой лиганд). Термин, таким образом, относится к использованию материалов, композиций и способов, представленных в данном документе для качественных и количественных определений. В общем, конкретный метод, используемый для обнаружения, не является критическим для практического применения изобретения.
Например, «обнаружение» в соответствии с изобретением может включать в себя: наблюдение за наличием или отсутствием целевого лиганда (включая, но не ограничиваясь ими, человеческий белок 6 родственный рецептору липопротеинов низкой плотности человека (LRP6) или человеческий полипептид фактора роста эндотелия сосудов A (VEGF-A)); изменением уровней целевого лиганда; и/или изменением биологической функции/активности целевого лиганда. В некоторых вариантах реализации изобретения «обнаружение» может включать в себя определение уровней целевого лиганда (например, уровней полипептида человеческого LRP6 или человеческого VEGF-A). Обнаружение может включать количественную оценку изменения (увеличения или уменьшения) любого значения от 10% до 90% или любого значения от 30% до 60% или более 100% по сравнению с контролем. Обнаружение может включать в себя количественную оценку изменения любого значения от 2 до 10 раз включительно или более, например, в 100 раз.
Слово «метка» при использовании в данном документе относится к обнаруживаемому соединению или композиции, которое прямо или косвенно конъюгировано с неприродным CKP. Сама метка может обнаруживаться самостоятельно (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение субстратного соединения или композиции, которое может быть обнаружено.
Что касается связывания неприродного CKP с целевым лигандом, термин «специфическое связывание» или «специфически связывается с» или «специфичен для» конкретного целевого лиганда обозначает связывание, которое заметно отличается от неспецифического взаимодействия. Специфическое связывание может быть оценено, например, путем определения связывания молекулы по сравнению с связыванием контрольной молекулы, которая обычно представляет собой молекулу с аналогичной структурой, которая не имеет связывающей активности. Например, специфическое связывание может быть определено во время оценки конкурентного связывания при использовании контрольной молекулы, которая похожа на мишень, например, используя избыток немаркированной мишени. В этом случае специфическое связывание выявляется, если связывание меченой мишени с зондом конкурентно ингибируется избыточной немеченой мишенью. В некоторых вариантах реализации изобретения степень связывания неприродного CKP с «нецелевым» лигандом будет составлять менее около 10% связывания неприродного CKP с его целевым лигандом (таким как LRP6 или VEGF-A), при оценке, например, с помощью сортировки клеток с активированной флуоресценцией (FACS) или радиоиммунопреципитацией (RIA). В некоторых вариантах реализации изобретения неприродный CKP по данному изобретению специфически связывается с целевым лигандом (таким как белок 6 родственный рецептору липопротеинов низкой плотности человека (LRP6) или фактор роста эндотелия сосудов человека A (VEGF-A)), с константой диссоциации (Kd) равной или менее 100 нМ, необязательно менее 10 нМ, необязательно менее 1 нМ, необязательно менее 0,5 нМ, необязательно менее 0,1 нМ, необязательно менее 0,01 нМ или, необязательно, менее 0,005 нМ; измеренную при температуре около 4°С, 25°С, 37°С или 45°С.
Термин «около» при значении или параметре в данном документе относится к обычному диапазону ошибок для соответствующего значения, хорошо известному специалисту в данной области техники. Термин «около» при значении или параметре в данном документе включает (и описывает) аспекты, которые направлены на это значение или параметр как таковой. Например, описание, относящееся к «около X», включает описание «X.»
Понятно, что аспекты и варианты реализации изобретения, описанные в данном документе, включают аспекты «содержащий», «состоящий из» и «состоящий в основном из» и варианты реализации изобретения.
Все приведенные в данном документе ссылки, включая патентные заявки и публикации, полностью включены в данное описание посредством ссылки.
Неприродные пептиды с цистиновыми узлами (CKP), которые связывают фактор роста эндотелия сосудов человека A (VEGF-A)
В некоторых вариантах реализации изобретения, описанных в данном документе, изобретение представляет собой неприродный пептид с цистиновым узлом(CKP), который связывается с фактором роста эндотелия сосудов A (VEGF-A), где CKP содержит следующую цистиновую каркасную структуру (т.е. каркасную структуру I):
Z1C1L1C2L2C3L3C4L4C5L5C6Z2 (I)
где:
Z1 и Z2 представляют собой любую аминокислоту;
L1 представляет собой петлю 1 и имеет структуру, выбранную из группы, состоящей из: X1X2X3X4X5X6X7X8, X1X2X3X4X5X6X7X8X9, и X1X2X3X4X5X6X7X8X9X10, где каждый из X1 - X10 представляет собой любую аминокислоту;
L2 представляет собой петлю 2 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L -пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
L3 представляет собой петлю 3 и имеет структуру: X1X2X3, где каждый из X1 - X3 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
L4 представляет собой петлю 4 и имеет структуру: X1, где X1 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
L5 представляет собой петлю 5 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида;
и где CKP связывается с VEGF-A с аффинностью 500 пМ или менее.
В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом (CKP), который связывается с VEGF-A, имеет измененную комбинацию дисульфидных связей, при сравнении с ингибитором трипсина белком EETI-II дикого типа Ecballium elaterium, имеющему аминокислотную последовательность, представленную в SEQ ID NO: 1; где измененная комбинация дисульфидных связей представляет собой C1-C4, C2-C3 и C5-C6.
В некоторых вариантах реализации изобретения Z1 и/или Z2 неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, представляет собой G. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат более одной аминокислоты. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат 4 аминокислоты. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат 5 аминокислот. В некоторых вариантах реализации изобретения Z1 и/или Z2 представляют собой неприродную аминокислоту. В некоторых вариантах реализации изобретения неприродной аминокислотой является N-ацетилглицин или глицинамид. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L1, где X3 не представляет собой I; где X5 не представляет собой М; и/или где X6 не представляет собой R. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L1, где X1 представляет собой аминокислоту, выбранную из P, Q, R, T, V, D, N, K, L и X; где X2 представляет собой аминокислоту, выбранную из T, D, L, V, I, R, P, N и X; где X3 представляет собой аминокислоту, выбранную из T, P, M, L, S, F, R и X; где X4 представляет собой аминокислоту, выбранную из R, T, Q, D, W, L, E, S, K и X; где X5 представляет собой аминокислоту, выбранную из F, P, V, E, K, L, I и X; где X6 представляет собой аминокислоту, выбранную из K, N, F, P, L, Y, T, D, M и X; где X7 представляет собой аминокислоту, выбранную из Q, W, H и X; и/или где X8 представляет собой аминокислоту, выбранную из Y, A, G, D, E, W, S и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L1, где X9 представляет собой аминокислоту выбранную из L, I, V, D, E и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L1, где X10 представляет собой аминокислоту выбранную из Y, T, M, N, F и X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида; за исключением того, что X2 не представляет собой пролин (P).
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида, за исключением того, что X4 не представляет собой глицин (G). В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X1 представляет собой аминокислоту, выбранную из G, Q, H, R, L и Q; где X2 представляет собой аминокислоту, выбранную из P, M, W, Y, F, L и H; где X3 представляет собой аминокислоту, выбранную из N, F, H и Y; где X4 представляет собой аминокислоту, выбранную из G, Q, D, N, K, H, E и S; и/или где X5 представляет собой аминокислоту, выбранную из F, S и Т. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L2, где X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S, а X5 представляет собой D. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L3, где X1 представляет собой L, X2 представляет собой A, а X3 представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L4, где X1 представляет собой V или F.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом (CKP), который связывается с VEGF-A, содержит L1, содержащий структуру X1X2X3X4X5X6X7X8, где: X1 представляет собой аминокислоту, выбранную из P, Q и R; X2 представляет собой аминокислоту, выбранную из T, L и D; X3 представляет собой аминокислоту, выбранную из T, M и L; X4 представляет собой аминокислоту, выбранную из R, Q и D; X5 представляет собой аминокислоту, выбранную из F, P и V; X6 представляет собой аминокислоту, выбранную из K и F; X7 представляет собой аминокислоту, выбранную из Q и W; и X8 представляет собой аминокислоту, выбранную из Y, G и D. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L1, содержащий структуру X1X2X3X4X5X6X7X8 X9 X10, где X1 представляет собой аминокислоту, выбранную из Q, R, T и V; X2 представляет собой аминокислоту, выбранную из Т и D; X3 представляет собой P; X4 представляет собой аминокислоту, выбранную из Т и W; X5 представляет собой аминокислоту, выбранную из F, E, P и K; X6 представляет собой аминокислоту, выбранную из N и P; X7 представляет собой аминокислоту, выбранную из W и H; X8 представляет собой аминокислоту, выбранную из A, D, E и W; X9 представляет собой аминокислоту, выбранную из L и I; и X10 представляет собой аминокислоту, выбранную из Y, T, M и N. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X1 представляет собой аминокислоту, выбранную из G, H и Q; X2 представляет собой аминокислоту, выбранную из P, M, W и Y; X3 представляет собой аминокислоту, выбранную из N и Y; X4 представляет собой аминокислоту, выбранную из G, Q и S; и X5 представляет собой аминокислоту, выбранную из F и S. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L2, где X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S и X5 представляет собой D. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L3, где X1 представляет собой L, X2 представляет собой A, а X3 представляет собой G. В некоторых вариантах реализации изобретения, неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L4, где X1 представляет собой V или F.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом (CKP), который связывается с VEGF-A, содержит L1, имеющую структуру X1X2X3X4X5X6X7X8, где: X1 представляет собой аминокислоту, выбранную из D, Q, N и K; X2 представляет собой аминокислоту, выбранную из V, I, R, L и P; X3 представляет собой аминокислоту, выбранную из L, S, M, T и F; X4 представляет собой аминокислоту, выбранную из Q, L и E; X5 представляет собой P; X6 представляет собой аминокислоту, выбранную из F, L и Y; X7 представляет собой W; и X8 представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X3 представляет собой Y; X5 представляет собой S; и где X1, X2 и X4 представляют собой любую аминокислоту, за исключением того, что X1 не является G, X2 не является P, X4 не является G, и/или X5 не является F. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X1 представляет собой аминокислоту, выбранную из H, L, R и Q; X2 представляет собой аминокислоту, выбранную из W, F и Y; X3 представляет собой Y; X4 представляет собой аминокислоту, выбранную из Q, N, K, H и E; и X5 представляет собой S. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L2, где X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S, а X5 представляет собой D. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L3, где X1 представляет собой L, X2 представляет собой A, а X3 представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L4, где X1 представляет собой V или F.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L1, содержащий структуру X1X2X3X4X5X6X7X8 X9 X10, где X1 представляет собой аминокислоту, выбранную из K, Q, L и R; X2 представляет собой аминокислоту, выбранную из N и D; X3 представляет собой аминокислоту, выбранную из P и L; X4 представляет собой аминокислоту, выбранную из L, T, S и K; X5 представляет собой аминокислоту, выбранную из F, V, I и L; X6 представляет собой аминокислоту, выбранную из N и D; X7 представляет собой W; X8 представляет собой аминокислоту, выбранную из А и S; X9 представляет собой аминокислоту, выбранную из L, V, E и D; и X10 представляет собой аминокислоту, выбранную из Y и F. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X1 представляет собой Q; X2 представляет собой аминокислоту, выбранную из L, F, M и H; X3 представляет собой аминокислоту, выбранную из F, Y и H; X4 представляет собой аминокислоту, выбранную из D, Q, N и K; и X5 представляет собой аминокислоту, выбранную из S и Т. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L2, где X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S и X5 представляет собой D. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L3, где X1 представляет собой L, X2 представляет собой A, а X3 представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L4, где X1 представляет собой V или F.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L1, содержащий структуру X1X2X3X4X5X6X7X8, где: X5 представляет собой P; X7 представляет собой W; X8 представляет собой G; и где X1, X2, X3, X4 и X6 представляют собой любую аминокислоту, за исключением того, что X1 не является P, X2 не является R, X3 не является I, и/или X6 не является R. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L1, содержащий структуру X1X2X3X4X5X6X7X8, где X1 представляет собой аминокислоту, выбранную из N и D; X2 представляет собой аминокислоту, выбранную из I и V; X3 представляет собой аминокислоту, выбранную из M и L; X4 представляет собой аминокислоту, выбранную из L, Q, D и K; X5 представляет собой P; X6 представляет собой аминокислоту, выбранную из F, Y, T, L и М; X7 представляет собой W; и X8 представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X1 представляет собой аминокислоту, выбранную из Q, H, L и R; X2 представляет собой аминокислоту, выбранную из Y и W; X3 представляет собой Y; X4 представляет собой аминокислоту, выбранную из Q и N; и X5 представляет собой S. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X3 представляет собой Y; X5 представляет собой S; и где X1, X2 и X4 представляют собой любую аминокислоту, за исключением того, что X1 не является G, X2 не является P, и/или X4 не является G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L2, где X1 представляет собой аминокислоту, выбранную из G или E; X2 представляет собой аминокислоту, выбранную из Q, L, P, R, E и M; X3 представляет собой аминокислоту, выбранную из S, D и N; X4 представляет собой аминокислоту, выбранную из F, Y, L, M и I; и/или X5 представляет собой аминокислоту, выбранную из E, D, Q, L и S. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L3, где X1 представляет собой L, X2 представляет собой А, а X3 представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L4, где X1 представляет собой V или F.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не представляет собой пролин (P). В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не представляет собой глицин (G). В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X1 представляет собой любую аминокислоту, за исключением G; X2 представляет собой любую аминокислоту за исключением P; X3 представляет собой любую аминокислоту за исключением N; X4 представляет собой любую аминокислоту, кроме G; и/или X5 представляет собой любую аминокислоту за исключением F.
В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L1, содержащую структуру X1X2X3X4X5X6X7X8, где X1 представляет собой аминокислоту выбранную из N, D или X; X2 представляет собой аминокислоту выбранную из I, V или X; X3 представляет собой аминокислоту выбранную из M или X; X4 представляет собой аминокислоту выбранную из L, Q или X; X5 представляет собой аминокислоту выбранную из P или X; X6 представляет собой аминокислоту выбранную из F, Y или X; X7 представляет собой аминокислоту выбранную из W или X; X8 представляет собой аминокислоту выбранную из G или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L3, где каждый из X1 - X3 представляет собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон(NH-пара)-L-аланина, пиридон(NH-мета)-L-аланина, 3-(1-N-метил-индол)-L-аланина, 3-(1-N-этил-индол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентил глицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида, за исключением того, что X1 не является лейцином (L), X2 не является аланином (А), а X3 не является глицином (G), где неприродная аминокислота, выбранная из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон(NH-пара)-L-аланина, пиридон(NH-мета)-L-аланина, 3-(1-N-метил-индол)-L-аланина, 3-(1-N-этил-индол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентил глицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L3, где X1 представляет собой аминокислоту выбранную из M, F, L V или X; X2 представляет собой аминокислоту выбранную из S, N, Q, I, Y, E, V, T или X; X3 представляет собой аминокислоту выбранную из D, Q, T, N, E, R или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L4, где X1 представляет собой любую аминокислоту за исключением V или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L4, где X1 представляет собой аминокислоту, выбранную из I, L или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L -пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где X3 представляет собой Y или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон(NH-пара)-L-аланина, пиридон(NH-мета)-L-аланина, 3-(1-N-метил-индол)-L-аланина, 3-(1-N-этил-индол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4''-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентил глицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида, X5 представляет собой S или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон(NH-пара)-L-аланина, пиридон(NH-мета)-L-аланина, 3-(1-N-метил-индол)-L-аланина, 3-(1-N-этил-индол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентил глицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида;и где X1, X2 и X4 представляют собой любую аминокислоту или неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L -пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида, за исключением того, что X1 не представляет собой G, X2 не представляет собой P и/или X4 не представляет собой G. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не представляет собой пролин (P). В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не представляет собой глицин (G). В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L5, где X1 представляет собой аминокислоту выбранную из Q, H или X; X2 представляет собой аминокислоту выбранную из Y, W или X; X3 представляет собой аминокислоту выбранную из Y или X; X4 представляет собой аминокислоту выбранную из Q, N или X; X5 представляет собой аминокислоту выбранную из S или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида. В некоторых вариантах реализации изобретения неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A содержит L2, где X1 представляет собой аминокислоту, выбранную из G или X, X2 представляет собой аминокислоту, выбранную из R, P или X; X3 представляет собой аминокислоту, выбранную из D или X; X4 представляет собой аминокислоту, выбранную из F, I или X; и X5 представляет собой аминокислоту, выбранную из E, D или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из L-пропаргилглицин-ПЭГ6-, L-сульфотирозина, L-норлейцина, L-1-нафтилаланина, L-2-нафтилаланина, L-2-хлортриптофана, L-3-фтортирозина, L-4-фторфенилаланина, гамма-бензил-L-пролина, гамма-(4-фторбензил)-L-пролина, 4-OH-L-пролина, 4-фтор-L-пролина, 4-[4-(трифторметил)-бензил]-L-пролина, 3,4-дифтор-L-фенилаланина, 3,4-дихлор-L-фенилаланина, 4-хлор-L-фенилаланина, 3-F,4-Cl-L-фенилаланина, 2-пиридон-(NH-пара)-L-аланина, пиридон (NH-мета)-L-аланина, 3-(1-N-метилиндол)-L-аланина, 3-(1-N-этилиндол)-L-аланина, 3-(1-N-изопропилиндол)-L-аланина, 3-(5-аза-индол)-L-аланина, 4-метил-L-фенилаланина, 2-нафтил-L-аланина, L-4,4'-бифенилаланина, 3-(3-хинолинил)-L-аланина, 3-(2-хинолинил)-L-аланина, 3-(2-хиноксалинил)-L-аланина, 4-метил-2-пиридил-аланина, 4-этил-2-пиридил-L-аланина, бензотиазол-L-аланина, бензотиофен-L-аланина, 3-изохинолинил-L-аланина, трет-бутил-L-аланина (также известного как L-неопентилглицин), 3-циклобутил-L-аланина, циклопентил-L-аланина, 5,5,5-трифтор-L-лейцина, трет-бутил-L-глицина (также известного как L-трет-лейцин), L-циклопентилглицина, L-циклобутилглицина, 3,4-гидрокси-L-фенилаланина, 3,4-фтор-L-фенилаланина, 3-фтор,4-OH-L-фенилаланина, 2-хлор-L-тирозина, 2-метил-L-тирозина, 2-этил-L-тирозина, 4-(нафталин-1-ол)-L-аланина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метилглицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, и глицин-морфолинового амида.
В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
Также в данном документе представлен неприродный пептид с цистиновым узлом(CKP), который связывается с VEGF-A, где CKP содержит цистиновую каркасную структуру, представленную ниже (т.е. каркасную структуру I):
Z1C1L1C2L2C3L3C4L4C5L5C6Z2 (I)
где:
Z1 и Z2 представляют собой любую аминокислоту;
L1 представляет собой петлю 1 и имеет структуру, выбранную из группы, состоящей из: X1X2X3X4X5X6X7X8, X1X2X3X4X5X6X7X8X9, и X1X2X3X4X5X6X7X8X9X10, где каждый из X1 - X10 представляет собой любую аминокислоту;
L2 представляет собой петлю 2 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
L3 представляет собой петлю 3 и имеет структуру: X1X2X3, где каждый из X1 - X3 представляет собой любую аминокислоту;
L4 представляет собой петлю 4 и имеет структуру: X1, где X1 представляет собой любую аминокислоту;
L5 представляет собой петлю 5 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту; где
CKP имеет измененную комбинацию дисульфидных связей по сравнению с ингибитором трипсина белком EETI-II дикого типа Ecballium elaterium, имеющему аминокислотную последовательность, представленную в SEQ ID NO: 1; где измененная комбинация дисульфидных связей представляет собой C1-C4, C2-C3 и C5-C6; а также CKP имеет процентное содержание альфа-спиралей по меньшей мере около 15%, по меньшей мере около 20%, по меньшей мере около 25%, по меньшей мере около 30%, по меньшей мере около 35%, по меньшей мере около 40%, по меньшей мере около 45% или, по меньшей мере, около 50%, включая любой диапазон между этими значениями.
В некоторых вариантах реализации изобретения неприродный CKP связывается с VEGF-A с аффинностью около 500 пМ или менее.
В некоторых вариантах реализации изобретения аффинность связывания неприродного CKP с VEGF-A определяют, например, посредством поверхностного плазмонного резонанса или с помощью других исследований, подробно описанных в примерах ниже.
В некоторых вариантах реализации изобретения Z1 и/или Z2 неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, представляет собой G. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат более одной аминокислоты. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат 4 аминокислоты. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат 5 аминокислот. В некоторых вариантах реализации изобретения Z1 и/или Z2 представляют собой неприродную аминокислоту. В некоторых вариантах реализации изобретения неприродной аминокислотой является N-ацетилглицин или глицинамид.
В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X2 не представляет собой пролин (P). В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, содержит L5, где каждый из X1 - X5 представляет собой любую аминокислоту, за исключением того, что X4 не представляет собой глицин (G). В некоторых вариантах реализации изобретения неприродный CKP, который связывает VEGF-A, ингибирует активность VEGF-A с IC50 от около 0,5 нМ до около 1,0 нМ. В некоторых вариантах реализации изобретения степень ингибирования определяют с помощью клеточного IC50-анализа, как описано более подробно в примерах ниже.
В некоторых вариантах реализации изобретения неприродный CKP, который связывает VEGF-A, содержит L1, содержащий аминокислотную последовательность HMMYDY (SEQ ID NO: 231) или K/P/Q/R-K/T/L/D-W/T/M/L-Q/R/D-W/F/P/V-W/K/F-Y/Q/W-M/Y/G/D (SEQ ID NO: 115), или E/G/P/Q/R/T/V-T/E/A/D-D/T/I/P-W/V/Q/T/W-Y/F/N/E/P/K-P/E/W/N/P-H/Q/K/W/H-Q/F/E/A/D/W-I/L/H-D/W/P/Y/T/M/N (SEQ ID NO: 232) со ссылкой на каркасную структуру I, описанную выше. В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный CKP, который связывает VEGF-A, содержит L4, содержащую V или F. В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, содержит L5, содержащий аминокислотную последовательность G/E/Y/Q/H-P/M/W/Y-N/Y/W-G/D/T/Q/R/S-F/A/E/S (SEQ ID NO: 20) или SWWPSL (SEQ ID NO: 237).
В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, содержит L1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8-14 и 225-230, со ссылкой на каркасную структуру I, описанную выше. В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, содержит L4, содержащую V или F. В некоторых вариантах реализации изобретения неприродный CKP, который связывается с VEGF-A, дополнительно содержит L5, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15-18 и 233-238. Аминокислотные последовательности SEQ ID NO 8-18, 225-230 и 233-238 представлены в Таблице 1 ниже.
ТАБЛИЦА 1
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность согласно любой из SEQ ID NO: 21-17 и 239-244. Аминокислотные последовательности SEQ ID NO: 21-17 и 239-244 приведены в Таблице 2 ниже.
ТАБЛИЦА 2
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность Q/H/E/N/D-L/V/R/P/I-M/F/L-Q/E/R/L-P-F/A/L/S-W-G (SEQ ID NO: 358) со ссылкой на каркасную структуру I, описанную выше. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность HWYQS (SEQ ID NO: 17).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 33, 36 и 245-253, со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность HWYQS (SEQ ID NO: 17). Аминокислотные последовательности SEQ ID NO: 33, 36 и 245-253 представлены в Таблице 3 ниже:
ТАБЛИЦА 3
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность согласно любой из SEQ ID NO: 265-275. Аминокислотные последовательности SEQ ID NO: 265-275 представлены в Таблице 4 ниже.
ТАБЛИЦА 4
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L1, содержащую аминокислотную последовательность QLMQPFWG (SEQ ID NO: 10), со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L5, содержащую аминокислотную последовательность R/H-W-Y-N/Q/H-S (SEQ ID NO: 359).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L1, содержащую аминокислотную последовательность QLMQPFWG (SEQ ID NO: 10), со ссылкой на каркасную структурную I, описанную выше. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L5, содержащую аминокислотную последовательность, выбранную из группы, состоящей из HWYQS (SEQ ID NO: 17), RWYHS (SEQ ID NO: 43) и RWYNS (SEQ ID NO: 133).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, 276 и 278. SEQ ID NO: 23, 276 и 278 приведены в Таблице 5 ниже.
ТАБЛИЦА 5
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность Q/D/K/N/A/R/H-L/V/I/R/P/V/-M/L/S/T/F-Q/E/L/H-P-F/L/M/Y/S-W-G (SEQ ID NO: 40) со ссылкой на структуру I каркаса. В некоторых вариантах реализации изобретения непригодный для VEGF-A связывание CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность H/L/R/Q/-W/F/Y-Y-Q/N/K/H/D/E-S (SEQ ID NO: 360).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28-39 и 254-261, со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17, 41-46, 133, 262-264 и 567. Аминокислотные последовательности SEQ ID NO: 17, 28-39, 41-46, 133, 254-264 и 567 приведены в Таблице 6 ниже:
ТАБЛИЦА 6
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 47-59 и 279-286. Аминокислотные последовательности SEQ ID NO: 47-59 и 279-286 приведены в Таблице 7 ниже.
ТАБЛИЦА 7
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность Q/D/K/W/E/L/R-D/N-P/R/L/T-T/S/L/K-F/V/L/I-N/D-W-A/S/G-L/V/E/T/Q/D-F/Y(SEQ ID NO: 70) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения непригодный для VEGF-A связывание CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность Q/R-M/L/F/H-Y/F/H-D/Q/N/K-S/T (SEQ ID NO: 80).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-69 и 287-291. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16, 71-79, 274 и 292. Аминокислотные последовательности SEQ ID NO: 16, 60-69, 71-79, 274 и 287-292 приведены в Таблице 8 ниже.
ТАБЛИЦА 8
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 81-91 и 293-297. Аминокислотные последовательности SEQ ID NO: 81-91 и 293-297 приведены в Таблице 9 ниже.
ТАБЛИЦА 9
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33) со ссылкой на структуру I каркаса. В некоторых вариантах реализации изобретения непригодный для VEGF-A связывание CKP дополнительно содержит L2, содержащую аминокислотную последовательность K/G/Q/S/N-Q/L/P/A/V/T/R/W/K/G/Y-D/S/E/N-S/F/Y/L/F/Q/M-D/E/N/A/L/F/H/Q (SEQ ID NO: 98). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33), со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A связывание CKP дополнительно включает L2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 94-97 и 298-309. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45). Аминокислотные последовательности SEQ ID NO: 94-97 и 298-309 приведены в Таблице 10 ниже.
ТАБЛИЦА 10
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 99-102 и 310-321. Аминокислотные последовательности SEQ ID NO: 99-102 и 310-321 приведены в Таблице 11 ниже.
ТАБЛИЦА 11
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность N-I-M/L-L/S/T/Q/N/E/D-P-F/Y/S-WG (SEQ ID NO: 454) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33), со ссылкой на каркасную структурную I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность GRDFE (SEQ ID NO: 97). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность L/V/M/F-A/Q/E/S/N/Y/I/T-G/Q/R/D/T/N/E. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V или I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из NIMLPFWG (SEQ ID NO: 33), NILLPFWG (SEQ ID NO: 396), NILLPYWG (SEQ ID NO: 397), NIMSPFWG (SEQ ID NO: 398), NIMTPFWG (SEQ ID NO: 399), NIMQPFWG (SEQ ID NO: 400), NIMNPFWG (SEQ ID NO: 401), NIMEPFWG (SEQ ID NO: 402), NIMDPFWG (SEQ ID NO: 403), NIMLPSWG (SEQ ID NO: 414) и NIMLPYWG (SEQ ID NO: 141) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33), со ссылкой на каркасную структуру V или I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность GRDFE (SEQ ID NO: 97). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из: LQQ, VER, MSD, MNQ, MQT, VYQ, FIN, VSQ, VTE, FYE, MEQ и VYR. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 103-114. Аминокислотные последовательности SEQ ID NO: 103-114 представлены в Таблице 12 ниже.
ТАБЛИЦА 12
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения непригодный для VEGF-A связывание CKP дополнительно содержит L2, содержащую аминокислотную последовательность K/G/D/A/E-Q/E/R/V/P/D/M/G/N/L/A/F-D/N/Y/S-S/F/L/I/M/Y/V/N/E-D/L/Q/S/E/T/L/A/N (SEQ ID NO: 121). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35), со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A связывание CKP дополнительно включает L2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 117-120, 211 и 322-339. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46). Аминокислотные последовательности SEQ ID NO: 117-120, 211 и 322-339 приведены в Таблице 13 ниже.
ТАБЛИЦА 13
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 122-126 и 340-357. Аминокислотные последовательности SEQ ID NO: SEQ ID NO: 122-126 и 340-357 представлены в Таблице 14 ниже.
ТАБЛИЦА 14
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность D-V-M/L-Q/K/D-P-Y/M/T/L-W-G (SEQ ID NO: 130) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность
KQDSD (SEQ ID NO: 93) В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность H/L/Q/R-W-Y-N-S (SEQ ID NO: 134).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 127-129, со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 131-133. Аминокислотные последовательности SEQ ID NO: 127-129 и 131-133 представлены в Таблице 15 ниже.
ТАБЛИЦА 15
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 135-137. Аминокислотные последовательности SEQ ID NO: 135-137 представлены в Таблице 16 ниже.
ТАБЛИЦА 16
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность GPDID (SEQ ID NO: 118). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность L/F-A/V/S-G/R/N. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту, выбранную из V, I и L. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L5, содержащий аминокислотную последовательность HWYNS (SEQ ID NO: 46).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35) со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность GPDID (SEQ ID NO: 118). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность FVR и LSN. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту, выбранную из V, I и L. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит L1, L2, L3, L4 и/или L5 любого из не встречающихся в природе VEGF-A-связывающих CKP, описанных в данном документе. Таким образом, в некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8-14, 28-39, 60-69, 127-129, 141, 225-230, 245-261, 287-291, 396-403 и 414 со ссылкой на каркасную структуру I. В некоторых вариантах реализации изобретения, не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L2, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 93-97, 117-120, 211, 298-309 и 322-339. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP дополнительно содержит L3, содержащую аминокислотную последовательность, выбранную из группы, состоящей из LAG, LQQ, VER, MSD, MNQ, MQT, VYQ, FIN, VSQ, VTE, FYE, MEQ и VYR, FVR и LSN. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V, F, I или L. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP дополнительно содержит L5, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15-18, 41-46, 71-79, 131-133, 233-238, 262-264 и 292. В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота удалена из CKP, связывающегося с VEGF-A, представленного в данном документе. В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота удалена из N-конца. В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота удалена из C-конца. В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота удалена из N-конца и C-конца. В некоторых вариантах реализации изобретения удалена по меньшей мере одна внутренняя (не расположенная на N-конце или C-конце) аминокислота. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность CNIMLPYWGCGRDFECLAGCVCQYYQSC (SEQ ID NO: 217). В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит по меньшей мере одну аминокислотную вставку. В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота добавлена к N-концу. В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота добавлена к С-концу. В некоторых вариантах реализации изобретения по меньшей мере одна аминокислота добавлена к N-концу и С-концу.
В некоторых вариантах реализации изобретения две аминокислоты добавлена к N-концу неприродного VEGF-A-связывающего CKP, описанного в данном документе. В некоторых вариантах реализации изобретения две аминокислоты добавлены к N-концу не встречающегося в природе VEGF-A-связывающего CKP, представленного в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 102). В некоторых вариантах реализации изобретения две аминокислоты добавлены к N-концу SEQ ID NO: 102, представляют собой F/I/G/T/V/L-H/A/S/R. В некоторых вариантах реализации изобретения две аминокислоты добавлены к N-концу SEQ ID NO: 102, выбраны из группы, состоящей из: FH, IA, GS, TR, VH и LS. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGFH (SEQ ID NO: 379). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGIA (SEQ ID NO: 380). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGGS (SEQ ID NO: 381). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGTR (SEQ ID NO: 382). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGVH (SEQ ID NO: 383). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGLS (SEQ ID NO: 384).
В некоторых вариантах реализации изобретения две аминокислоты добавлены к N-концу не встречающегося в природе VEGF-A-связывающего CKP, представленного в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 386). В некоторых вариантах реализации изобретения две аминокислоты добавлены к N-концу SEQ ID NO: 102, представляют собой R/W/P/D/Q/E/S-T/K/E/F/Q/L/S В некоторых вариантах реализации изобретения две аминокислоты, добавленные к N-концу SEQ ID NO: 102, выбраны из группы, состоящей из: RT, WK, PL, DE, QF, EQ, PT, RL и SL. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGRT (SEQ ID NO: 387). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGWK (SEQ ID NO: 388). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGPL (SEQ ID NO: 389). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGDE (SEQ ID NO: 390). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGQF (SEQ ID NO: 391). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGEQ (SEQ ID NO: 392). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGPT (SEQ ID NO: 393). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGRL (SEQ ID NO: 394). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCDVLQPYWGCGPDIDCLSNCICHWYNSCGSL (SEQ ID NO: 395).
В некоторых вариантах реализации изобретения три аминокислоты добавлена к N-концу неприродного VEGF-A-связывающего CKP, описанного в данном документе. В некоторых вариантах реализации изобретения две аминокислоты добавлены к N-концу не встречающегося в природе VEGF-A-связывающего CKP, представленного в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 102). В некоторых вариантах реализации изобретения три аминокислоты добавлены к N-концу SEQ ID NO: 102 представляют собой P/N/T/D/E/Y/W-L/Y/F/H/D/P-I/Q/V/K/S/Y/H. В некоторых вариантах реализации изобретения три аминокислоты, добавленные к N-концу SEQ ID NO: 102, выбраны из группы, состоящей из: PLI, NYQ, PLQ, TFQ, DLV, EHK, YLS, WDY, WPH и PHQ. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGPLI (SEQ ID NO: 369). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGNYQ (SEQ ID NO: 370). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGPLQ (SEQ ID NO: 371). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGTFQ (SEQ ID NO: 372). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGDLV (SEQ ID NO: 373). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGEHK (SEQ ID NO: 374). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGYLS (SEQ ID NO: 375). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGWDY (SEQ ID NO: 376). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGWPH (SEQ ID NO: 377). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность, представленную в виде GCNIMLPFWGCGRDFECLAGCVCQYYQSCGPHQ (SEQ ID NO: 378).
В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP является вариантом не встречающегося в природе VEGF-A-связывающего CKP, описанного в данном документе. В некоторых вариантах реализации изобретения такой вариант содержит по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 аминокислотных замещений в одной или нескольких последовательностях, указанных в SEQ ID NO: 8-14, 28-39, 60-69, 127-129, 141, 225-230, 245-261, 287-291, 396-403 и 414; SEQ ID NO: 93-97, 117-120, 211, 298-309 и 322-339; аминокислотных последовательностях LAG, LQQ, VER, MSD, MNQ, MQT, VYQ, FIN, VSQ, VTE, FYE, MEQ и VYR, FVR и LSN; и/или 15-18, 41-46, 71-79, 131-133, 233-238, 262-264 и 292. В некоторых вариантах реализации изобретения аминокислотная замена (замены) представляет собой консервативную аминокислотную замену (замены). В некоторых вариантах реализации изобретения аминокислотные замены существенно не уменьшают способность неприродного VEGF-A-связывающего CKP связывать VEGF-A человека. Например, могут быть сделаны консервативные изменения (например, консервативные замены, как указано в данном документе), которые существенно не уменьшают аффинность связывания VEGF-A. Аффинность связывания варианта неприродного VEGF-A-связывающего CKP можно оценить, используя способ, описанный в примерах ниже.
Консервативные замены показаны в Таблице 17 ниже под заголовком «консервативные замены». Более существенные изменения приведены в Таблице 17 под заголовком «типовые замены» и дополнительно описаны ниже в отношении классов боковой цепи аминокислот. Аминокислотные замены могут быть введены в вариант неприродного VEGF-A-связывающего CKP и продукты исследуются для оценки желаемой активности, например, сохранения/улучшения связывания VEGF-A.
ТАБЛИЦА 17: Консервативные замены
Неконсервативные замены влекут за собой замену представителя одного из этих классов на представителя другого класса.
Типичным вариантом замещения является не встречающийся в природе VEGF-A-связывающий CKP после созревания аффинности, который может быть удобно получен, например, с использованием методов созревания аффинности на основе фагового дисплея, как описано в данном документе. Вкратце, один или несколько остатков в L1, L2, L3, L4 и или L5 изменяются (т.е. аминокислотные остатки добавляются, удаляются или замещаются), а вариант VEGF-A-связывающего CKP отображается на фаге и проверяется на предмет аффинности VEGF-A-связывания. В некоторых вариантах реализации созревания аффинности различие вводится в вариабельные гены, выбранные для созревания любым из множества методов (например, с помощью ПЦР, вносящей ошибки, перетасовки петель или олигонуклеотид-направленного мутагенеза). Затем создается вторичная библиотека. После чего библиотека подвергается скринингу, чтобы идентифицировать любые ненатуральные варианты CKP с желаемой аффинностью к VEGF-A. В некоторых вариантах реализации изобретения введение различий включает в себя подходы направленные на петли, в которых несколько остатков в L1, L2, L3, L4 и/или L5 (например, около 5, около 4-6 или около 6-10 остатков одновременно) рандомизированы. Остатки L1, L2, L3, L4 и/или L5, участвующие в связывании целевого лиганда, могут быть идентифицированы, например, с использованием аланинового сканирующего мутагенеза или моделирования.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGQSFECLAGCVCQYYQSCG (SEQ ID NO: 215).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 216).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAKCVCQYYQSCG (SEQ ID NO: 542).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 363).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 364).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECMNQCICQYYQSCG (SEQ ID NO: 222).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECFYECICQYYQSCG (SEQ ID NO: 223).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 405).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILLPYWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 406).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMSPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 407).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMTPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 408).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMQPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 409).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMNPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 410).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMEPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 411).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMDPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 412).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPSWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 415).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLSGCVCQYYQSCG (SEQ ID NO: 421).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLTGCVCQYYQSCG (SEQ ID NO: 422).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLEGCVCQYYQSCG (SEQ ID NO: 423).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCLCQYYQSCG (SEQ ID NO: 424).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCICQYYQSCG (SEQ ID NO: 425).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYYQSCS (SEQ ID NO: 431).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 435).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVLQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 386).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 547).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILQPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 548).
В некоторых вариантах реализации изобретения одна или несколько аминокислот в последовательности неприродного VEGF-A-связывающего CKP, представленного в данном документе, замещены неприродными аминокислотами. В некоторых вариантах реализации изобретения одна или несколько аминокислот замещены одной и той же неприродной аминокислотой. В некоторых вариантах реализации изобретения одна или несколько аминокислот замещены другой неприродной аминокислотой. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит неприродную аминокислоту в любом аминокислотном положении в L1, L2, L3, L4 и/или L5 по сравнению с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 216), где N-концевой глицин кэпирован с помощью C(=O)-оксетан-3-ила.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAXCVCQYYQSCG (SEQ ID NO: 568, где X представляет собой орнитин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность XCNIMLPYWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 361), где X представляет собой N-ацетилглицин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где X представляет собой сульфотирозин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где X представляет собой 3,4-дифтор-L-фенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где X представляет собой 3,4-дихлор-L-фенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где X представляет собой 4-хлор-L-фенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где X представляет собой 3-F,4-Cl-L-фенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где X представляет собой 2-пиридон-(NH-пара)-L-аланин. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPXWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 362), где Х представляет собой пиридон-(NH-мета)-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 218), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность sequence GCNIMLPFXGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 219), где X представляет собой 1-нафтилаланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность sequence GCNIMLPFXGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 219), где X представляет собой 2-нафтилаланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность XCNIMLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 221), где X представляет собой ПЭГ6-пропаргилглицин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 365), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPFWGCGRDF-D/E-CVS-N/K/X2-CICQYYQSCG (SEQ ID NO: 540), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPFWGCGRDFECVSKCICQYYQSCG (SEQ ID NO: 545), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPFWGCGRDFECVSX2CICQYYQSCG (SEQ ID NO: 546), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPFWGCGRDF-N/K/X2-CVS-D/E-CICQYYQSCG (SEQ ID NO: 541), где X1 представляет собой норлейцин и X2 представляет собой орнитин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPFWGCGRDFKCVS-D/E-CICQYYQSCG (SEQ ID NO: 561, где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность CNIXLPFWGCGRDFKCVSDCICQYYQSCG (SEQ ID NO: 562, где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность CNIXLPFWGCGRDFKCVSECICQYYQSCG (SEQ ID NO: 563, где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPFWGCGRDFX2CVS-D/E-CICQYYQSCG (SEQ ID NO: 564, где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPFWGCGRDFX2CVSDCICQYYQSCG (SEQ ID NO: 565, где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPFWGCGRDFX2CVSECICQYYQSCG (SEQ ID NO: 566, где X1 представляет собой норлейцин и X2 представляет собой орнитин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDF-D/E-CME-N/K/X2-CICQYYQSCG (SEQ ID NO: 538), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFECMEKCICQYYQSCG (SEQ ID NO: 543), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDFECMEX2CICQYYQSCG (SEQ ID NO: 544), где X1 представляет собой норлейцин и X2 представляет собой орнитин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDF-N/K/X2-CME-D/E-CICQYYQSCG (SEQ ID NO: 539), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFKCME-D/E-CICQYYQSCG (SEQ ID NO: 555), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFKCMEDCICQYYQSCG (SEQ ID NO: 556), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFKCMEECICQYYQSCG (SEQ ID NO: 557), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDFX2CME-D/E-CICQYYQSCG (SEQ ID NO: 558), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDFX2CMEDCICQYYQSCG (SEQ ID NO: 559), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDFX2CMEECICQYYQSCG (SEQ ID NO: 560), где X1 представляет собой норлейцин и X2 представляет собой орнитин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDI-D/E-CLS-N/K/X2-CICHWYNSCG (SEQ ID NO: 534), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVXQPYWGCGPDIDCLSKCICHWYNSCG (SEQ ID NO: 536), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDIDCLSX2CICHWYNSCG (SEQ ID NO: 537), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDI-N/K/X2-CLS-D/E-CICHWYNSCG (SEQ ID NO: 535), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVXQPYWGCGPDIKCLS-D/E-CICHWYNSCG (SEQ ID NO: 549), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVXQPYWGCGPDIKCLSDCICHWYNSCG (SEQ ID NO: 550), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVXQPYWGCGPDIKCLSECICHWYNSCG (SEQ ID NO: 551), где X представляет собой норлейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDIX2CLS-D/E-CICHWYNSCG (SEQ ID NO: 552), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDIX2CLSDCICHWYNSCG (SEQ ID NO: 553), где X1 представляет собой норлейцин и X2 представляет собой орнитин. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDIX2CLSECICHWYNSCG (SEQ ID NO: 554), где X1 представляет собой норлейцин и X2 представляет собой орнитин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLXFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 413), где X представляет собой гамма-бензил-L-пролин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLXFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 413), где X представляет собой гамма-(4-фтор-бензил)-L-пролин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLXFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 413), где X представляет собой 4-OH-L-пролин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLXFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 413), где X представляет собой 4-фтор-L-пролин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLXFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 413), где X представляет собой 4-[4-(трифторметил)-бензил]-L-пролин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYXGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 417), где X представляет собой N-метилиндол. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYXGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 417), где X представляет собой N-этилиндол. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYXGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 417), где X представляет собой N-изопропилиндол. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYXGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 417), где X представляет собой 5-аза-индол.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 4-метил-L-фенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 2-нафтил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 2-хинолил-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 4,4'-бифенил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 3-(3-хинолинил)-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 3-(2-хинолинил)-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 3-(2-хиноксалинил)-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 4-метил-2-пиридил-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 4-этил-2-пиридил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой бензотиазол-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой бензотиофен-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDXECLAGCVCQYYQSCG (SED ID NO: 419), где X представляет собой 3-(3-изохинолинил)-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECXAGCVCQYYQSCG (SEQ ID NO: 420), где X представляет собой трет-бутил-L-аланин (также известный как L-неопентилглицин). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECXAGCVCQYYQSCG (SEQ ID NO: 420), где X представляет собой 3-циклобутил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECXAGCVCQYYQSCG (SEQ ID NO: 420), где X представляет собой 3-циклопентил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECXAGCVCQYYQSCG (SEQ ID NO: 420), где X представляет собой 5,5,5-трифтор-L-лейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой L-трет-лейцин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность sequence GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой трет-бутил-L-аланин (также известный как L-неопентилглицин). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой L-циклопентилглицин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой 3-циклопентил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой L-циклобутил-L-глицин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой 3-циклобутил-L-аланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCXCQYYQSCG (SEQ ID NO: 426), где X представляет собой 5,5,5-трифтор-L-лейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQXYQSCG (SEQ ID NO: 428), где X представляет собой 2-пиридон. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQXYQSCG (SEQ ID NO: 428), где X представляет собой 3,4-гидрокси-L-фенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQXYQSCG (SEQ ID NO: 428), где X представляет собой 3,4-фторфенилаланин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQXYQSCG (SEQ ID NO: 428), где X представляет собой 3-фтор,4-ОН-L-фенилаланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYXQSCG (SEQ ID NO: 430), где X представляет собой 2-хлор-L-тирозин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYXQSCG (SEQ ID NO: 430), где X представляет собой 2-метил-L-тирозин. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYXQSCG (SEQ ID NO: 430), где X представляет собой 2-этил-L-тирозин или 4-(нафталин-1-ол-)-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPYWGCGRDFECLAGCVCQYYQSCX (SEQ ID NO: 432), где X представляет собой D-серин, L-бета-гомосерин, L-бета-аланина, N-альфа -метилглицин, глицин с его карбоксильным концом, превращенным в сложный эфир глицерина, глицин с его карбоксильным концом, превращенным в сложный эфир гликоля, глицин с его карбоксильным концом, превращенным в сложный эфир оксетанилового спирта или глицин-морфолиновый амид.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXQPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 436), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDFECX2EQCICQYYQSCG (SEQ ID NO: 437). В некоторых вариантах реализации изобретения X1 и X2 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1 и X2 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 и Х2 представляют собой норлейцин. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, а Х2 представляет собой 3-циклобутил-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIXLPYWGCGRDFECLEQCICQYYQSCG (SEQ ID NO: 438), где X представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIX1LPYWGCGRDFECX2EQCX3CQYYQSCG (SEQ ID NO: 439). В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой циклобутил-L-глицин. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой 3-циклобутил-L-аланин. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой норлейцин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность CNIX1QPYWGCGRDFECX2EQCX3CQYYQSCG (SEQ ID NO: 440). В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой циклобутил-L-глицин. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой 3-циклобутил-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILLPYWGCGRDFECXEQCICQYYQSCG (SEQ ID NO: 441), где X представляет собой 3-циклобутил-L-аланин или трет-бутил-L-аланин (также известный как L-неопентилглицин).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNILLPYWGCGRDFECMEQCXCQYYQSCG (SEQ ID NO: 442), где X представляет собой циклобутил-L-глицин или 3-циклобутил-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CNIX2LPYWGCGRDFECMEQCICQYYQSCX3 (SEQ ID NO: 443). В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой N-ацетилглицин, Х2 представляет собой норлейцин, а Х3 представляет собой глицинамид.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CNILLPYWGCGRDFECMEQCICQYYQSCX2 (SEQ ID NO: 444). В некоторых вариантах реализации изобретения X1 и X2 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1 и X2 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой N-ацетилглицин, а Х2 представляет собой глицинамид.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CNILQPYWGCGRDFECMEQCICQYYQSCX2 (SEQ ID NO: 445). В некоторых вариантах реализации изобретения X1 и X2 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1 и X2 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой N-ацетилглицин, а Х2 представляет собой глицинамид.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CNILQPYWGCGRDFECLEQCICQYYQSCX2 (SEQ ID NO: 446). В некоторых вариантах реализации изобретения X1 и X2 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1 и X2 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой N-ацетилглицин, а Х2 представляет собой глицинамид.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVLQPYWGCGPDIDCXSNCICHWYNSCG (SEQ ID NO: 447), где X представляет собой 3-циклобутил-L-аланин или трет-бутил-L-аланин (L-неопентилглицин).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVLQPYWGCGPDIDCLSNCXCHWYNSCG (SEQ ID NO: 448), где X представляет собой циклобутил-L-глицин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVX1QPYWGCGPDIDCX2SNC2X3CHWYNSCG (SEQ ID NO: 449). В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой циклобутил-L-глицин. В некоторых вариантах реализации изобретения Х1 представляет собой норлейцин, Х2 представляет собой 3-циклобутил-L-аланин, а Х3 представляет собой 3-циклобутил-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVLQPYWGCGPDIDCX1SNC2X2CHWYNSCG (SEQ ID NO: 450). В некоторых вариантах реализации изобретения X1 и X2 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1 и X2 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой 3-циклобутил-L-аланин, а Х2 представляет собой циклобутил-L-глицин. В некоторых вариантах реализации изобретения Х1 представляет собой 3-циклобутил-L-аланин, а Х2 представляет собой 3-циклобутил-L-аланин.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CDVLQPYWGCGPDIDCX2SNC2X3CHWYNSCX4 (SEQ ID NO: 451). В некоторых вариантах реализации изобретения X1, X2, X3 и/или X4 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1, X2, X3 и/или X4 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения X1 представляет собой N-ацетилглицин, X2 представляет собой 3-циклобутил-L-аланин, X3 представляет собой циклобутил-L-глицин, а X4 представляет собой глицинамид. В некоторых вариантах реализации изобретения X1 представляет собой ацетилглицин, X2 представляет собой циклобутил-L-аланин, X3 представляет собой циклобутил-L-аланин, а X4 представляет собой глицинамид.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CDVX2QPYWGCGPDIDCLSNCICHWYNSCX3 (SEQ ID NO: 452). В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1, X2 и/или X3 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой N-ацетилглицин, Х2 представляет собой норлейцин, а Х3 представляет собой глицинамид.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность X1CDVLQPYWGCGPDIDCLSNCICHWYNSCX2 (SEQ ID NO: 453). В некоторых вариантах реализации изобретения X1 и X2 представляют собой одну и ту же неприродную аминокислоту. В некоторых вариантах реализации изобретения X1 и X2 представляют собой разные неприродные аминокислоты. В некоторых вариантах реализации изобретения Х1 представляет собой N-ацетилглицин, а Х2 представляет собой глицинамид.
В некоторых вариантах реализации изобретения C-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения N-конец неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицирован (например, кэпирован). В некоторых вариантах реализации изобретения как C-, так и N-концы неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, модифицированы (например, кэпированы). В некоторых вариантах реализации изобретения C-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована. В некоторых вариантах реализации изобретения N-концевой амин неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, ацетилирован. В некоторых вариантах реализации изобретения С-концевая карбоксильная группа неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A, амидирована, и N-концевой амин из неприродного пептида с цистиновым узлом (CKP), который связывается с VEGF-A ацетилирован.
Структурные Характеристики
В некоторых вариантах реализации изобретения структура неприродного VEGF-А-связывающего CKP, описанная в данном документе, характеризуется комбинацией дисульфидных связей, которая отличается от белка WT EETI-II, т.е. отличается от паттерна дисульфидных связей C1-C4, C2-C5 и C3-C6, характерного для WT EETI-II. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, обладает паттерном дисульфидных связей C1-C4, C2-C3 и C5-C6. Способы определения паттерна дисульфидных связей, например, не встречающегося в природе VEGF-A-связывающего CKP, включают, например, определение и анализ сокристаллической структуры неприродного VEGF-A-связующего CKP в комплексе с VEGF-A, посредством масс-спектрометрии после частичного восстановительного алкилирования или посредством масс-спектрометрии после протеолитического расщепления, проводя структурные расчеты, как описано в Sampoli et al. (2000) Proteins Struct Funct Gen. 40, 168-174, etc.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP имеет содержание альфа-спиралей, по меньшей мере, около 10%, по меньшей мере, около 15%, по меньшей мере, около 20%, по меньшей мере, около 25%, по меньшей мере, около 30%, по меньшей мере, около 35%, по меньшей мере, около 40%, по меньшей мере, около 45% или, по меньшей мере, около 50%, включая любой диапазон между этими значениями. В некоторых вариантах реализации изобретения по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17 или по меньшей мере 18 аминокислот не встречающегося в природе VEGF-A-связывающего CKP образуют альфа-спираль. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP имеет паттерн дисульфидных связей C1-C4, C2-C3 и C5-C6 и содержание альфа-спиралей, по меньшей мере, около 10%, по меньшей мере, около 15%, по меньшей мере, около 20%, по меньшей мере, около 25%, по меньшей мере, около 30%, по меньшей мере, около 35%, по меньшей мере, около 40%, по меньшей мере, около 45% или, по меньшей мере, около 50%, включая любой диапазон между этими значениями. В некоторых вариантах реализации изобретения содержание альфа-спирали не встречающегося в природе VEGF-A-связывающего CKP определяется, например, с помощью кругового дихроизма (CD), дисперсии оптического вращения (ORD), ядерного магнитного резонанса (NMR), определением и анализом сокристаллической структуры неприродного VEGF-A-связующего CKP в комплексе с VEGF-A, посредством масс-спектрометрии после частичного восстановительного алкилирования или посредством масс-спектрометрии после протеолитического расщепления.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, конкурирует за связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33); L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, конкурирует связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCKQDSDCLAGCVCQYYQSCG (SEQ ID NO: 52).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, связывается с одним и тем же эпитопом на поверхности VEGF-A, с которым связывается второй не встречающийся в природе VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33); L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с одним и тем же эпитопом на поверхности VEGF-A, с которым связывается второй не встречающийся в природе VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCKQDSDCLAGCVCQYYQSCG (SEQ ID NO: 52).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, конкурирует за связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33); L2, содержащую аминокислотную последовательность GRDFE (SEQ ID NO: 97); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, конкурирует связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 102).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с тем же самым эпитопом на поверхности VEGF-A, с которым связывается второй неприродный VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33); L2, содержащую аминокислотную последовательность GRDFE (SEQ ID NO: 97); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения природный VEGF-A-связывающий CKP, описанный в данном документе, связываетсяс тем же самым эпитопом на поверхности VEGF-A, с которым связывается второй не встречающимся в природе VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 102).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, конкурирует за связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35); L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, конкурирует за связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVMQPYWGCKQDSDCLAGCVCHWYNSCG (SEQ ID NO: 55).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с тем же самым эпитопом на поверхности VEGF-A, с которым связывается второй неприродный VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35); L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения природный VEGF-A-связывающий CKP, описанный в данном документе, связывается с тем же самым эпитопом на поверхности VEGF-A, с которым связывается второй не встречающимся в природе VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVMQPYWGCKQDSDCLAGCVCHWYNSCG (SEQ ID NO: 55).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, конкурирует за связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35); L2, содержащую аминокислотную последовательность GPDID (SEQ ID NO: 118); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, конкурирует за связывание с VEGF-A со вторым не встречающимся в природе VEGF-A-связывающим CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCLAGCVCHWYNSCG (SEQ ID NO: 123).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с тем же самым эпитопом на поверхности VEGF-A, с которым связывается второй неприродный VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35); L2, содержащую аминокислотную последовательность GPDID (SEQ ID NO: 118); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46) при сравнении с каркасной структурой I. В некоторых вариантах реализации изобретения природный VEGF-A-связывающий CKP, описанный в данном документе, связывается с тем же самым эпитопом на поверхности VEGF-A, с которым связывается второй не встречающимся в природе VEGF-A-связывающий CKP, где второй неприродный VEGF-A-связывающий CKP содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCLAGCVCHWYNSCG (SEQ ID NO: 123).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять или более десяти аминокислот, выбранных из группы, состоящей из V14, V15, F17, D19, Y21, Q22, Y25, I46, K48, N62, D63, L66, M81, I83, K84, P85, H86, Q87, G88, Q89, I91, C104, R105 и P106. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим K48, N62 и D63. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим H86. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим Y21, Y25 и P106. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим M81, D19 и Q22. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим F17, M81 и I91. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим V14, F17, D19, Q22, M81 и I91. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом VEGF-A, содержащим Q22 и Y25.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом на поверхности VEGF-A, который перекрывается с эпитопом VEGF-A, с которым связывается анти-VEGF-A-антитело G6.31 (Fuh et al. (2006) J. Biol. Chem. 281, 6625-6631). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом на поверхности VEGF-A, который перекрывается с эпитопом VEGF-A, с которым связывается Flt-1. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, связывается с эпитопом на поверхности VEGF-A, который перекрывается с эпитопом VEGF-A, с которым связывается бевацизумаб.
Функциональные Характеристики
В некоторых вариантах реализации изобретения неприродный CKP, который «специфически связывается» с VEGF-A (таким как VEGF-A человека, VEGF-A мыши и/или VEGF-A крысы) имеет аффинность связывания (Kd) не более около 1 × 10-7 М, предпочтительно не более около 1 × 10-8 М и наиболее предпочтительно не более около 1 × 10-9 М), но имеет аффинность связывания для гомолога VEGF-A или другого фактор роста, которая составляет по меньшей мере около в 50 раз или, по меньшей мере, около в 500 раз или, по меньшей мере, около в 1000 раз, более низкую при сравнении с уровнем аффинности к VEGF-A.
В некоторых вариантах реализации изобретения степень связывания неприродного VEGF-A-связывающего CKP, описанного в данном документе, например, для нецелевого белка (например, гомолога VEGFA, такого как VEGF-B, VEGF-C и VEGF- D) или других факторов роста (таких как P1GF, EGF, NGF, IGF и PDGF) составляет менее около 10% степени связывания неприродного VEGF-A-связывающего CKP с VEGF-A, при определении способами, известными в данной области техники, такими как ELISA, сортировка клеток с активированной флуоресценцией (FACS) или радиоиммунопреципитация (RIA). Специфическое связывание может быть оценено, например, путем определения связывания молекулы по сравнению с связыванием контрольной молекулы, которая обычно представляет собой молекулу с аналогичной структурой, которая не имеет связывающей активности. Например, специфическое связывание может быть определено во время оценки конкурентного связывания при использовании контрольной молекулы, которая похожа на мишень, например, используя избыток немаркированной мишени. В этом случае специфическое связывание выявляется, если связывание меченой мишени с зондом конкурентно ингибируется избыточной немеченой мишенью. Другие способы оценки уровня связывания неприродного CKP, который «специфически связывается» с VEGF-A, описаны в Примерах.
Термин «специфическое связывание» или «специфически связывается с» или «специфичен для» конкретного полипептида или эпитопа на конкретной полипептидной мишени, как используется в данном документе, может быть описан, например, случаем, когда молекула имеет Kd для мишени, по меньшей мере, около 10-4 М, альтернативно, по меньшей мере около 10-5 М, альтернативно, по меньшей мере, около 10-6 М, альтернативно, по меньшей мере, около 10-7 М, альтернативно, по меньшей мере, около 10-8 М, альтернативно, по меньшей мере, около 10-9 М, альтернативно, по меньшей мере, около 10-10 М, альтернативно, по меньшей мере, около 10-11 М, альтернативно, по меньшей мере, около 10-12 М или более. В одном варианте реализации изобретения термин «специфическое связывание» относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на поверхности конкретного полипептида без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP связывается с VEGF-A с Kd от около 1 пМ до около 500 нМ. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP связывается с VEGF-A с Kd от около 1 пМ до около 50 пМ, в диапазоне от около 50 до около 250 пМ, от около 250 до около 500 пМ, от около 500 пМ до около 750 пМ, от около 750 пМ до около 1 нМ, от около 1 нМ до около 25 нМ, от около 25 нМ до около 50 нМ, от около 50 нМ до около 100 нМ, от около 100 нМ до около 250 нМ, или от около 250 нМ до около 500 нМ.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP связывается с VEGF-A человека, VEGF-A мыши и/или VEGF-A крысы. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы, содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33); L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45)в соответствии с каркасной структурой I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы содержит аминокислотную последовательность GCNIMLPFWGCKQDSDCLAGCVCQYYQSCG (SEQ ID NO: 52).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы, содержит L1, содержащую аминокислотную последовательность NIMLPFWG (SEQ ID NO: 33); L2, содержащую аминокислотную последовательность GRDFE (SEQ ID NO: 97); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность QYYQS (SEQ ID NO: 45)в соответствии с каркасной структурой I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы содержит аминокислотную последовательность GCNIMLPFWGCGRDFECLAGCVCQYYQSCG (SEQ ID NO: 102).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы, содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35); L2, содержащую аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46) в соответствии с каркасной структурой I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы содержит аминокислотную последовательность GCDVMQPYWGCKQDSDCLAGCVCHWYNSCG (SEQ ID NO: 55).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы, содержит L1, содержащую аминокислотную последовательность DVMQPYWG (SEQ ID NO: 35); L2, содержащую аминокислотную последовательность GPDID (SEQ ID NO: 118); L3, содержащую аминокислотную последовательность LAG; L4, содержащую аминокислоту V и L5, содержащую аминокислотную последовательность HWYNS (SEQ ID NO: 46) в соответствии с каркасной структурой I. В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, который связывается с VEGF-A человека, VEGF-A мыши и VEGF-A крысы содержит аминокислотную последовательность GCDVMQPYWGCGPDIDCLAGCVCHWYNSCG (SEQ ID NO: 123).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, имеет значение IC50 менее около 0,5 нМ, менее около 0,6 нМ, менее около 0,7 нМ, менее около 0,8 нМ, менее около 0,9 нМ или менее около 1,0 нМ, включая любой диапазон между этими значениями.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP не ингибирует протеазную активность трипсина, при исследовании расщепления пептидного субстрата (например, исследование расщепления пептидного субстрата, описанное в Примерах).
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP устойчив к расщеплению трипсином. В некоторых вариантах реализации изобретения около 30% или менее, около 25% или менее, или около 20% или менее неприродного VEGF-A-связывающего CKP расщепляется в положении Arg13 в петле 2 после 24 часов инкубации с трипсином при 37°C.
Также рассматриваются молекулы нуклеиновой кислоты, кодирующие не встречающиеся в природе VEGF-A-связывающие CKP, описанные в данном документе, экспрессирующие векторы, содержащие молекулы нуклеиновой кислоты, кодирующие неприродные VEGF-A-связывающие CKP и клетки, содержащие молекулы нуклеиновой кислоты. Также в данном документе приведены способы получения неприродного VEGF-A-связывающего CKP, описанного в данном документе, путем культивирования таких клеток, экспрессии не встречающегося в природе VEGF-A-связывающего CKP и получения неприродного VEGF-A-связывания CKP из клеточной культуры.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP получают посредством трансляции in vitro, как описано в данном документе в другом месте.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP образуется посредством химического пептидного синтеза, например, путем присоединения химически синтезированных пептидов L1, L2, L3, L4 и/или L5 на каркасную основу (такую как каркасная структура I), или полностью путем химического синтеза всего не встречающегося в природе VEGF-A-связывающего CKP.
Неприродные пептиды с цистиновым узлом (CKP), которые связываются с белком 6 родственным рецептору липопротеинов низкой плотности(LDL) (LRP6)
LDL-рецепторы представляют собой трансмембранные клеточные поверхностные белки, вовлеченные в рецептор-опосредованный эндоцитоз липопротеинов и белковых лигандов. Человеческий LDL рецепторный белок 6 (LRP6) (№ доступа: NM_002336 (мРНК) и NP_002327 (белок); UniProtKB: O75581) функционирует как рецептор или, совместно с рецепторами Frizzled, в качестве ко-рецептором для Wnt и, таким образом, участвует в сигнальном каскаде Wnt/бета-катенина (Katoh et al. (2007) Clin Cancer Res 13:4042-4045). Благодаря взаимодействию с сигнальным каскадом Wnt/бета-катенина, LRP6 играет роль в регуляции клеточной дифференцировки, пролиферации и миграции, а также в развитии многих типов рака (Li et al. (2004) Oncogene 23:9129-9135; Tung et al. (2012) PLoS ONE 7(5): e36565. doi:10.1371/journal.pone.0036565; Liu et al. (2010) Proc Natl Acad Sci USA 107:5136-5141).
Передача сигналов Wnt участвует во многих биологических путях. Что касается болезней, он связан с раком и метастатическими заболеваниями, остеопорозом и костным метаболизмом и болезнями, заболеваниями нейронов и нейродегенеративными заболеваниями, ревматоидным артритом и другими воспалительными заболеваниями. Ингибирование сигнального пути Wnt посредством блокады LRP6 может иметь широкий спектр терапевтической полезности. Потеря костной массы является серьезной медицинской проблемой не только при постменопаузальном остеопорозе, но и при ревматоидном артрите. Кость деградирует при множественной миеломе и метастазах в кости. Поэтому терапевтические стратегии, направленные на усиление костей, предотвращение трещин или восстановление поврежденной кости представляют большой интерес (Kawai et al. (2011) Nat. Rev. Drug Discov. 10, 141-156; Mason and Williams (2010) J. Osteoporosis, vol. 2010, Article ID 460120, 9 p.; doi:10.4061/2010/460120). Ингибиторы пути Wnt DKK1 и SOST из-за их роли в подавлении нового формирования кости считаются высокоперспективными терапевтическими мишенями; антитела, способные подавлять функции SOST показывают значительную активность в доклинических исследованиях (Ominsky et al. (2010) J. Bone Miner. Res. 25, 948-959) и в настоящее время находятся на стадии клинических испытаний на человеке (Padhi et al. (2011) J. Bone Miner. Res. 26, 19-26.
Неправильная передача сигнала Wnt связана с различными заболеваниями, от остеопороза до рака (Clevers (2006) Cell 127: 469-80; MacDonald et al. 2009. Dev Cell 17: 9-26; Nusse (2008) Cell Res 18: 523-7; Polakis (2007) Curr Opin Genet Dev 17: 45-51). Этот список расширился, включив метаболические нарушения (Mani et al. (2007) Science 315: 1278-82 и нейродегенерацию (Caricasole et al. (2004) J Neurosci 24: 6021-7; De Ferrari et al. (2007) Proc Natl Acad Sci USA 104: 9434-9). Особенно явная связь существует между мутациями белка adenomatous polyposis coli (APC), которые предотвращают эффективную регуляцию уровней β-катенина и колоректальным раком (Polakis (2007) Curr Opin Genet Dev 17: 45-51). Особо следует отметить сильную генетическую связь между LRP5 и гомеостазом кости. Мутации, приводящие к потери функции в LRP5 вызывают аутосомно-рецессивное расстройство синдром остеопороза-псевдоолигомы (OPPG), характеризующееся низкой массой костной ткани, глазными дефектами и предрасположенностью к переломам (Gong et al. (2001) Cell 107: 513-23).
Также в данном документе представлен неприродный CKP, который связывается с белком 6 родственным рецептору липопротеинов низкой плотности (LRP6), отличающийся тем, что неприродный CKP содержит следующую цистиновую каркасную структуру (то есть каркасную структуру I):
Z1C1L1C2L2C3L3C4L4C5L5C6Z2 (I)
где:
Z1 и Z2 представляют собой любую аминокислоту;
L1 представляет собой петлю 1 и имеет структуру, выбранную из группы, состоящей из: X1X2X3X4X5X6, X1X2X3X4X5X6X7, X1X2X3X4X5X6X7X8, X1X2X3X4X5X6X7X8X9, и X1X2X3X4X5X6X7X8X9X10, где каждый из X1 - X10 представляет собой любую аминокислоту;
L2 представляет собой петлю 2 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
L3 представляет собой петлю 3 и имеет структуру: X1X2X3, где каждый из X1 - X3 представляет собой любую аминокислоту;
L4 представляет собой петлю 4 и имеет структуру: X1, где X1 представляет собой любую аминокислоту; и
L5 представляет собой петлю 5 и имеет структуру: X1X2X3X4X5, где каждый из X1 - X5 представляет собой любую аминокислоту;
В некоторых вариантах реализации изобретения Z1 и/или Z2 неприродного пептида с цистиновым узлом (CKP), который связывается с LRP6, представляет собой G. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат более одной аминокислоты. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат 4 аминокислоты. В некоторых вариантах реализации изобретения Z1 и/или Z2 содержат 5 аминокислот.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, где X1 представляет собой аминокислоту, выбранную из R, V, M, A, G, N, S и E; где X2 представляет собой аминокислоту, выбранную из T, N, S, G, R и A; где X3 представляет собой аминокислоту, выбранную из N, R, H, V, K, S, G, I и Y; где X4 представляет собой аминокислоту, выбранную из R, V, N, I, K, S и T; где X5 представляет собой аминокислоту, выбранную из V, R, K, I, T, S, L и N; и где X6 представляет собой аминокислоту, выбранную из K, G, A, I, R, N, S и V. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, где X7 представляет собой аминокислоту, выбранную из G, R, K, E, P и Т. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, где X8 представляет собой аминокислоту, выбранную из G, R, K, Q, A и S. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, где X9 представляет собой аминокислоту, выбранную из R или G. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, где X10 представляет собой аминокислоту выбранных из E, W и G. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L5, где X1 представляет собой аминокислоту, выбранную из G, S, N, Y, A и R; где X2 представляет собой аминокислоту, выбранную из P, G, S, V, E, R, F и D; где X3 представляет собой аминокислоту, выбранную из N, G, S, E, P, K, H и R; где X4 представляет собой аминокислоту, выбранную из G, R, H, S, Q, V и D; и где X5 представляет собой аминокислоту, выбранную из F, D, N, R, G, Y, S и Т. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L2, где X1 представляет собой K, X2 представляет собой Q, X3 представляет собой D, X4 представляет собой S, а X5 представляет собой D. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L3, где X1 представляет собой L, X2 представляет собой A, а X3 представляет собой G. В некоторых вариантах реализации изобретения, не встречающийся в природе LRP6-связывающий CKP содержит L4, где X1 представляет собой V.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP конкурентно ингибирует связывание конкурирующей молекулы с человеческим LRP6. В некоторых вариантах реализации изобретения конкурирующая молекула представляет собой антитело к LRP6. В некоторых вариантах реализации изобретения конкурирующая молекула представляет собой второй неприродный LRP6-связывающий CKP.
Не встречающиеся в природе LRP6-связывающие CKP, которые связываются с перекрывающимися или подобными областями на мишени, могут быть идентифицированы с помощью конкурентных исследований ингибирования/связывания. Такие способы хорошо известны в данной области и описаны, например, в S.J. Mather (ed.) 1996. Current Directions in Radiopharmaceutical Research and Development, 169-179, Kluwer Academic Publishers; Zettner (1973) Clin. Chem. 19, 699-705; Gao (2012) Analytical Methods 4, 3718-3723.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP связывается с тем же эпитопом LRP6 человека, с которым связывается второй неприродный LRP6-связывающий CKP, содержит L1, которая содержит аминокислотную последовательность V/R/N/S/E/G-N/S/G/R-R/V/K/S/N/I/Y-V/N/I/R/S/T-R/K/I/N-G/I/R/K/S/A (SEQ ID NO: 185) или A/R/M/V/G/S-N/T/S/A-R/N/H-V/R/K-K/V/I-R/K/A/N/S/V-T/G/R/K/P-S/G/R/A (SEQ ID NO: 186) или R/A/Q-S/A-G/S/N/I-N/K-T/S/L/R-I/R/V-R/E/K-K/Q/A/R-R/G/Q-E/W/G/R (SEQ ID NO: 187); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность G/S/N/Y/A/R-P/G/S/V/E/R/F/D-N/G/S/E/P/K/H/R-G/R/H/S/Q/V/D-F/D/N/R/G/Y/S/T (SEQ ID NO: 188) согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность V/R/N/S/E/G-N/S/G/R-R/V/K/S/N/I/Y-V/N/I/R/S/T-R/K/I/N-G/I/R/K/S/A (SEQ ID NO: 185) или A/R/M/V/G/S-N/T/S/A-R/N/H-V/R/K-K/V/I-R/K/A/N/S/V-T/G/R/K/P-S/G/R/A (SEQ ID NO: 186) или R/A-S-G/S/N-N/K-T/S/L-I/R-R/E-K/Q/A-R/G-E/W/G (SEQ ID NO: 187)) согласно с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93). В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L3, которая содержит аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L4, которая содержит аминокислоту V. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L5, которая содержит аминокислотную последовательность G/S/N/Y/A/R-P/G/S/V/E/R/F/D-N/G/S/E/P/K/H/R-G/R/H/S/Q/V/D-F/D/N/R/G/Y/S/T (SEQ ID NO: 188).
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1 и/или L5 любого из не встречающихся в природе LRP6-связывающих CKP, описанных в данном документе. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность, представленную любой из SEQ ID NO: 147-168 и 367 согласно с каркасной структурой I. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L2, которая содержит аминокислотную последовательность, представленную в SEQ ID NO: 93. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L3, которая содержит аминокислотную последовательность LAG. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L4, содержащую аминокислоту V. В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP дополнительно содержит L5, которая содержит аминокислотную последовательность, указанную в любой из SEQ ID NO: 19 и 169-184.
Последовательности аминокислот L1 и L5, описанные выше, представлены в Таблице 18 ниже:
ТАБЛИЦА 18
(SEQ ID NO: 185)
(SEQ ID NO: 186)
(SEQ ID NO: 188)
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RTNRVKGG (SEQ ID NO: 147); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19) согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность VNRVRG (SEQ ID NO: 148); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность SGGRD (SEQ ID NO: 169) согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность MNHVKARR (SEQ ID NO: 149); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RSVNKI (SEQ ID NO: 150); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GSSRN (SEQ ID NO: 170), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность VNKIKG (SEQ ID NO: 151); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GVEGR (SEQ ID NO: 29), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RNSIKR (SEQ ID NO: 152); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность SVGHG (SEQ ID NO: 172), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность VSNRVNKG (SEQ ID NO: 153); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RGNIIK (SEQ ID NO: 154); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность NESRG (SEQ ID NO: 173), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RSGNTIRKRE (SEQ ID NO: 155); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GGPGG (SEQ ID NO: 174), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность ASSNSIRQGW (SEQ ID NO: 156); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPKSN (SEQ ID NO: 175), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RSNRIR (SEQ ID NO: 157); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность YGHGD (SEQ ID NO: 176), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RSNKLREARG (SEQ ID NO: 158); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GSRQD (SEQ ID NO: 177), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность VNSVKR (SEQ ID NO: 159); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность SRGVN (SEQ ID NO: 178), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность GSNKIRPR (SEQ ID NO: 160); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNDF (SEQ ID NO: 179), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность NRIRNS (SEQ ID NO: 161); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GRGDY (SEQ ID NO: 180), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность SRNSIK (SEQ ID NO: 162); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность ASGSS (SEQ ID NO: 181), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность SNYVKR (SEQ ID NO: 163); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность SPGGR (SEQ ID NO: 182), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность RANRVSGR (SEQ ID NO: 164); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность SNRVKVRA (SEQ ID NO: 165); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность ENRTKG (SEQ ID NO: 166); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GFRGT (SEQ ID NO: 183) согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность GNKIRA (SEQ ID NO: 167); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность RDRVG (SEQ ID NO: 184), согласно каркасной структуры I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность ANRVKRTS (SEQ ID NO: 168); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит L1, которая содержит аминокислотную последовательность QAINRVKRQR (SEQ ID NO: 367); L2, которая содержит аминокислотную последовательность KQDSD (SEQ ID NO: 93); L3, которая содержит аминокислотную последовательность LAG; L4, которая содержит аминокислоту V; и L5, которая содержит аминокислотную последовательность GPNGF (SEQ ID NO: 19), согласно с каркасной структурой I.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP содержит аминокислотную последовательность, представленную любой из SEQ ID NO: 189-210 и 366. SEQ ID NO: 189-210 и 366 приведены ниже.
GCRTNRVKGGCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 189)
GCVNRVRGCKQDSDCLAGCVCSGGRDCG (SEQ ID NO: 190)
GCMNHVKARRCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 191)
GCRSVNKICKQDSDCLAGCVCGSSRNCG (SEQ ID NO: 192)
GCVNKIKGCKQDSDCLAGCVCGVEGRCG (SEQ ID NO: 193)
GCRNSIKRCKQNSDCLAGCVCSVGHGCG (SEQ ID NO: 194)
GCVSNRVNKGCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 195)
GCRGNIIKCKQDSDCLAGCVCNESRGCG (SEQ ID NO: 196)
GCRSGNTIRKRECKQDSDCLAGCVCGGPGGCG (SEQ ID NO: 197)
GCASSNSIRQGWCKQDSDCLAGCVCGPKSNCG (SEQ ID NO: 198)
GCRSNRIRCKQDSDCLAGCVCYGHGDCG (SEQ ID NO: 199)
GCRSNKLREARGCKQDSDCLAGCVCGSRQDCG (SEQ ID NO: 200)
GCVNSVKRCKQDSDCLAGCVCSRGVNCG (SEQ ID NO: 201)
GCGSNKIRPRCKQDSDCLAGCVCGPNDFCG (SEQ ID NO: 202)
GCNRIRNSCKQDSDCLAGCVCGRGDYCG (SEQ ID NO: 203)
GCSRNSIKCKQDSDCLAGCVCASGSSCG (SEQ ID NO: 204)
GCSNYVKRCKQDSDCLAGCVCSPGGRCG (SEQ ID NO: 205)
GCRANRVSGRCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 206)
GCSNRVKVRACKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 207)
GCENRTKGCKQDSDCLAGCVCGFRGTCG (SEQ ID NO: 208)
GCGNKIRACKQDSDCLAGCVCRDRVGCG (SEQ ID NO: 209)
GCANRVKRTSCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 210)
GCQAINRVKRQRCKQDSDCLAGCVCGPNGFCG (SEQ ID NO: 366)
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP представляет собой вариант неприродного LRP6-связывающего CKP, описанного в данном документе. В некоторых вариантах реализации изобретения такой вариант содержит по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 аминокислотных замещений в одной или нескольких последовательностях, указанных в SEQ ID NO: 19, 93, 147-168, 169-184 и 189-210 и/или в аминокислотной последовательности LAG. В некоторых вариантах реализации изобретения аминокислотная замена (замены) представляет собой консервативную аминокислотную замену (замены). В некоторых вариантах реализации изобретения аминокислотные замены существенно не уменьшают способность неприродного LRP6-связывающего CKP связываться с человеческим LRP6. Например, могут быть сделаны консервативные изменения (например, консервативные замены, как указано в данном документе), которые существенно не уменьшают аффинность связывания LRP6. Аффинность связывания варианта неприродного LRP6-связывающего CKP можно оценить, используя способ, описанный в Примерах ниже.
Консервативные замены показаны в Таблице 17 выше под заголовком «консервативные замены». Более существенные изменения приведены в Таблице 17 под заголовком «типовые замены» и дополнительно описаны ниже в отношении классов боковой цепи аминокислот. Аминокислотные замены могут быть введены в вариант неприродного LRP6-связывающего CKP и продукты исследуются для оценки желаемой активности, например, сохранения/улучшения связывания LRP6.
Неконсервативные замены влекут за собой замену представителя одного из этих классов на представителя другого класса. Типичным вариантом замещения является не встречающийся в природе LRP6-связывающий CKP после созревания аффинности, который может быть удобно получен, например, с использованием методов созревания аффинности на основе фагового дисплея, как описано в данном документе. Вкратце, один или несколько остатков в L1, L2, L3, L4 и или L5 изменяются (т.е. аминокислотные остатки добавляются, удаляются или замещаются), а вариант LRP6-связывающего CKP отображается на фаге и проверяется на предмет аффинности связывания LRP6. В некоторых вариантах реализации созревания аффинности различие вводится в вариабельные гены, выбранные для созревания любым из множества методов (например, с помощью ПЦР, вносящей ошибки, перетасовки петель или олигонуклеотид-направленного мутагенеза). Затем создается вторичная библиотека. После чего библиотека подвергается скринингу, чтобы идентифицировать любые неприродные варианты CKP с желаемой аффинностью к LRP6. В некоторых вариантах реализации изобретения введение различий включает в себя подходы, направленные на петли, в которых несколько остатков в L1, L2, L3, L4 и/или L5 (например, около 5, около 4-6 или около 6-10 остатков одновременно) рандомизированы. Остатки L1, L2, L3, L4 и/или L5, участвующие в связывании целевого лиганда, могут быть идентифицированы, например, с использованием аланинового сканирующего мутагенеза или моделирования.
В некоторых вариантах реализации изобретения неприродный CKP, который «специфически связывается» с LRP6 человека (т.е. имеет аффинность связывания (Kd) не более около 1 × 10-7 М, предпочтительно не более около 1 × 10-8 М и наиболее предпочтительно не более около 1 × 10-9 М), но имеет аффинность связывания для другого белка LRP, которая является по меньшей мере около в 50 раз или, по меньшей мере, около в 500 раз или, по меньшей мере, около в 1000 раз, более низкой при сравнении с уровнем аффинности к LRP6.
В некоторых вариантах реализации изобретения степень связывания неприродного LRP6-связывающего CKP с нецелевым белком (например, гомологом LRP6, таким как LRP1, LRP1B, LRP2, LRP3, LRP4, LRP5, LRP8, LRP10, LRP11, и LRP12) составляет менее около 10% связывания неприродного LRP6-связывающего CKP с человеческим LRP6, при определении способами, известными в данной области техники, такими как ELISA, сортировка клеток с активированной флуоресценцией (FACS) или радиоиммунопреципитация (RIA). Специфическое связывание может быть оценено, например, путем определения связывания молекулы по сравнению с связыванием контрольной молекулы, которая обычно представляет собой молекулу с аналогичной структурой, которая не имеет связывающей активности. Например, специфическое связывание может быть определено во время оценки конкурентного связывания при использовании контрольной молекулы, которая похожа на мишень, например, используя избыток немаркированной мишени. В этом случае специфическое связывание выявляется, если связывание меченой мишени с зондом конкурентно ингибируется избыточной немеченой мишенью. Термин «специфическое связывание» или «специфически связывается с» или «специфичен для» конкретного полипептида или эпитопа на конкретной полипептидной мишени, как используется в данном документе, может быть описан, например, случаем, когда молекула имеет Kd для мишени, по меньшей мере, около 10-4 М, альтернативно, по меньшей мере около 10-5 М, альтернативно, по меньшей мере, около 10-6 М, альтернативно, по меньшей мере, около 10-7 М, альтернативно, по меньшей мере, около 10-8 М, альтернативно, по меньшей мере, около 10-9 М, альтернативно, по меньшей мере, около 10-10 М, альтернативно, по меньшей мере, около 10-11 М, альтернативно, по меньшей мере, около 10-12 М или более. В одном варианте реализации изобретения термин «специфическое связывание» относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на поверхности конкретного полипептида без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
В некоторых вариантах реализации изобретения не встречающийся в природе LRP6-связывающий CKP связывается с LRP6 с Kd от около 1 пМ до около 500 нМ. В некоторых вариантах реализации изобретения не встречающийся в природе LRP6-связывающий белок CKP, который специфически связывается с LRP6, связывается с человеческим LRP6 с Kd от около 1 пМ до около 50 пМ, в диапазоне от около 50 до около 250 пМ, от около 250 до около 500 пМ, от около 500 пМ до около 750 пМ, от около 750 пМ до около 1 нМ, от около 1 нМ до около 25 нМ, от около 25 нМ до около 50 нМ, от около 50 нМ до около 100 нМ, от около 100 нМ до около 250 нМ, или от около 250 нМ до около 500 нМ.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP ингибирует сигнальный путь Wnt1, например, как определено с использованием способов, описанных в Примерах ниже.
Также рассматриваются молекулы нуклеиновой кислоты, кодирующие не встречающиеся в природе LRP6-связывающие CKP, описанные в данном документе, экспрессирующие векторы, содержащие молекулы нуклеиновой кислоты, кодирующие неприродные LRP6-связывающие CKP и клетки, содержащие молекулы нуклеиновой кислоты. Также в данном документе приведены способы получения неприродного LRP6-связывающего CKP, описанного в данном документе, путем культивирования таких клеток, экспрессии не встречающегося в природе LRP6-связывающего CKP и получения неприродного LRP6-связывающего CKP из клеточной культуры.
В некоторых вариантах реализации изобретения не встречающийся в природе LRP6-связывающий CKP получают посредством трансляции in vitro, как описано в данном документе в другом месте.
Как описано в другом месте в данном документе, неприродный LRP6-связывающий CKP образуется посредством химического пептидного синтеза, например, путем присоединения химически синтезированных пептидов L1, L2, L3, L4 и/или L5 на каркас EETI-II или химически синтезируя весь неприродный LRP6-связывающий CKP.
В некоторых вариантах реализации изобретения неприродный LRP6-связывающий CKP является терапевтическим агентом при лечении заболеваний или состояний, в которых участвует чрезмерная активность LRP6.
Способы Производства
В некоторых вариантах реализации изобретения с помощью генной инженерии создается не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP. Ранее были описаны различные способы мутагенеза (наряду с соответствующими способами скрининга или отбора). Такие способы мутагенеза включают, но не ограничиваются ими, например, ПЦР, вносящую ошибки, перетасовку петлей или олигонуклеотид-направленный мутагенез, случайную нуклеотидную вставку или другие способы до рекомбинации. Более подробная информация об этих способах описана, например, в Abou-Nadler et al. (2010) Bioengineered Bugs 1, 337-340; Firth et al. (2005) Bioinformatics 21, 3314-3315; Cirino et al. (2003) Methods Mol Biol 231, 3-9; Pirakitikulr (2010) Protein Sci 19, 2336-2346; Steffens et al. (2007) J. Biomol Tech 18, 147-149; и другие. Соответственно, в некоторых вариантах реализации изобретения представлены неприродные VEGF-A-связывающие CKP или неприродные LRP6-связывающие CKP, полученные с помощью подходов генной инженерии.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP получают посредством трансляции in vitro. Вкратце, трансляция in vitro влечет за собой клонирование белок-кодирующей последовательности (ей) в вектор, содержащий промотор, продуцирующий мРНК путем транскрибирования клонированной последовательности (ей) с помощью РНК-полимеразы и синтез белка путем трансляции этой мРНК in vitro, например, используя бесклеточный экстракт. Желаемый вариант белка может быть получен просто путем изменения клонированной последовательности, кодирующей белок. Многие мРНК могут быть эффективно транслированы в экстрактах зародышей пшеницы или в лизатах ретикулоцитов кролика. Более подробная информация относительно трансляции in vitro описана, например, в Hope et al. (1985) Cell 43, 177-188; Hope et al. (1986) Cell 46, 885-894; Hope et al. (1987) EMBO J. 6, 2781-2784; Hope et al. (1988) Nature 333, 635-640; и Melton et al. (1984) Nucl. Acids Res.12, 7057-7070.
Соответственно, предусмотрены молекулы нуклеиновой кислоты, кодирующие неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP, описанный в данном документе. Также предлагается вектор экспрессии, функционально связанный с молекулой нуклеиновой кислоты, кодирующей неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP. Также предлагаются клетки-хозяева (включая, например, прокариотические клетки-хозяева, такие как E. coli, клетки-хозяева эукариот, такие как дрожжевые клетки, клетки млекопитающих, клетки СНО и т.д.), содержащие нуклеиновую кислоту, кодирующую неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP получают посредством трансляции in vitro. Вкратце, трансляция in vitro влечет за собой клонирование белок-кодирующей последовательности (ей) в вектор, содержащий промотор, продуцирующий мРНК путем транскрибирования клонированной последовательности (ей) с помощью РНК-полимеразы и синтез белка путем трансляции этой мРНК in vitro, например, используя бесклеточный экстракт. Желаемый мутантный белок может быть получен просто путем изменения клонированной последовательности, кодирующей белок. Многие мРНК могут быть эффективно транслированы в экстрактах зародышей пшеницы или в лизатах ретикулоцитов кролика. Более подробная информация относительно трансляции in vitro описана, например, в Hope et al. (1985) Cell 43, 177-188; Hope et al. (1986) Cell 46, 885-894; Hope et al. (1987) EMBO J. 6, 2781-2784; Hope et al. (1988) Nature 333, 635-640; и Melton et al. (1984) Nucl. Acids Res.12, 7057-7070.
В некоторых вариантах реализации изобретения с помощью химического синтеза создается не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP. В некоторых вариантах реализации изобретения химически синтезированные пептиды L1, L2, L3, L4 и/или L5 присоединяются к каркасной структуре EETI-II (такой как каркасная структура I) для создания неприродного VEGF-A-связывающего CKP или не встречающегося в природе LRP6-связывающего CKP. В некоторых вариантах реализации изобретения химически синтезируется весь не встречающийся в природе VEGF-A-связывающий CKP или весь неприродный LRP6-связывающий CKP. Методы твердофазного и жидкофазного пептидного синтеза хорошо известны в данной области и подробно описаны, например, в Methods of Molecular Biology, 35, Peptide Synthesis Protocols, (M. W. Pennington and B. M. Dunn Eds), Springer, 1994; Welsch et al. (2010) Curr Opin Chem Biol 14, 1-15; Methods of Enzymology, 289, Solid Phase Peptide Synthesis, (G. B. Fields Ed.), Academic Press, 1997; Chemical Approaches to the Synthesis of Peptides and Proteins, (P. Lloyd-Williams, F. Albericio, and E. Giralt Eds), CRC Press, 1997; Fmoc Solid Phase Peptide Synthesis, A Practical Approach, (W. C. Chan, P. D. White Eds), Oxford University Press, 2000; Solid Phase Synthesis, A Practical Guide, (S. F. Kates, F Albericio Eds), Marcel Dekker, 2000; P. Seneci, Solid-Phase Synthesis and Combinatorial Technologies, John Wiley & Sons, 2000; Synthesis of Peptides and Peptidomimetics (M. Goodman, Editor-in-chief, A. Felix, L. Moroder, C. Tmiolo Eds), Thieme, 2002; N. L. Benoiton, Chemistry of Peptide Synthesis, CRC Press, 2005; Methods in Molecular Biology, 298, Peptide Synthesis and Applications, (J. Howl Ed) Humana Press, 2005; and Amino Acids, Peptides and Proteins in Organic Chemistry, Volume 3, Building Blocks, Catalysts and Coupling Chemistry, (A. B. Hughs, Ed.) Wiley-VCH, 2011.
Химерные Молекулы, Содержащие Неприродный Белок EETI-II
Неприродный CKP, описанный в данном документе (такой как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) также может быть модифицирован, если это выгодно, способом образования химерной молекулы, содержащей не встречающийся в природе CKP слитый с (например, с помощью рекомбинантного слияния) с другим, гетерологичным полипептидом или аминокислотной последовательностью. В некоторых вариантах реализации изобретения такая химерная молекула содержит химерный белок описанного здесь неприродного CKP (такого как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) и антитела для образования, например, двухвалентной молекулы или биспецифической молекулы.
В некоторых вариантах реализации изобретения химерная молекула содержит сплав неприродного CKP, описанного в данном документе (такого как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) со второй частью (такой как домен белковой трансдукции), который направляет химерную молекулу для доставки в различные ткани или, например, через гематоэнцефалический барьер мозга, используя, например, домен белковой трансдукции белка TAT вируса иммунодефицита человека (Schwarze et al., 1999, Science 285: 1569-72).
В некоторых вариантах реализации изобретения предлагаемый в данном документе неприродный CKP может использоваться как би- или мультиспецифичный (по отношению к разным целевым лигандам или разным эпитопам на одном и том же целевом лиганде) в мультимерной форме. Например, димерный биспецифический неприродный CKP имеет одну субъединицу со специфичностью к первому целевому белку или эпитопу и вторую субъединицу со специфичностью к второму целевому белку или эпитопу. Неприродные субъединицы белка CKP могут быть объединены в различные конформации, которые могут увеличить валентность и, следовательно, силу связывания с целевым лигандом.
В некоторых вариантах реализации изобретения химерная молекула, описанная в данном документе, содержит два или более (например, три, четыре, пять, шесть, семь, восемь, девять, десять или более десяти) не встречающихся в природе CKP-белков. В некоторых вариантах реализации изобретения нуклеиновая кислота может быть сконструирована для кодирования двух или более копий одного не встречающегося в природе CKP, причем копии транскрибируются и транслируются в тандеме для получения ковалентно связанного мультимера идентичных субъединиц. В некоторых вариантах реализации изобретения нуклеиновая кислота может быть спроектирована для кодирования двух или более различных не встречающихся в природе CKP, причем копии транскрибируются и транслируются в тандеме для получения ковалентно связанного мультимера разных субъединиц, которые связываются, например, с различными эпитопами одного лиганда-мишени или, например, с различными целевыми лигандами.
В другом варианте реализации изобретения такая химерная молекула содержит сплав не встречающегося в природе CKP, описанного в данном документе (такого как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) с маркерным полипептидом, который формирует эпитоп, с которым антитело к этой метке может специфически связываться. Маркер с эпитопом обычно помещают на амино- или карбоксильный конец неприродного CKP. Присутствие таких эпитоп-меченых форм не встречающегося в природе белка CKP может быть обнаружено с использованием антитела к маркерному полипептиду. Кроме того, присоединение метки с эпитопом позволяет легко очищать неприродный CKP с помощью аффинной очистки с использованием специфического к метке антитела или другого типа аффинной матрицы, которая связывается с эпитопом метки. В данной области известны различные маркерные полипептиды и их соответствующие антитела. Примеры включают полигистидин (поли-His) или полигистидин-глицин (поли-His-Gly); маркерный полипептид гриппа HA и его антитело 12CA5 (Field et al. (1988) Mol. Cell. Biol. 8, 2159-2165); метка c-myc и антитела 8F9, 3C7, 6E10, G4, B7 и 9E10 (Evan et al. (1985) Mol. Cell. Biol. 5, 3610-3616]; и маркер в виде гликопротеина D вируса простого герпеса (gD) и его антитело (Paborsky et al. (1990) Protein Eng., 3, 547-553). Другие полипептиды метки включают Flag-пептид (Hopp et al. (1988) BioTechnology, 6,1204-1210); пептид эпитопа KT3 (Martin et al. (1992) Science, 255, 192-194]; пептид эпитопа α-тубулина (Skinner et al. (1991) J. Biol. Chem. 266, 15163-15166); и пептидная метка белка 10 гена T7 (Lutz-Freyermuth et al. (1990) Proc. Natl. Acad. Sci. USA 87, 6393-6397].
В некоторых вариантах реализации изобретения химерная молекула может содержать слияние не встречающегося в природе белка CKP, описанного в данном документе (такого как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) с иммуноглобулином или с определенным участком иммуноглобулина. Для двухвалентной формы химерной молекулы (например, «иммуноадгезина») такое слияние может быть связано с Fc-участком молекулы IgG. Слитые белки Ig, описанные в данном документе, содержат полипептиды, которые содержат приблизительно или только лишь остатки 94-243, остатки 33-53 или остатки 33-52 Ig человека вместо по меньшей мере одного вариабельного участка в молекуле Ig. В наиболее предпочтительном варианте реализации изобретения слитие белки иммуноглобулина содержат шарнирный участок, CH2 и CH3, или шарнирный участок, CH1, CH2 и CH3-участки молекулы IgG1. Для получения слитых белков иммуноглобулина см. также патент США № 5,428,130, выданный 27 июня 1995 года. В некоторых вариантах реализации изобретения описанный в данном документе CKP, не встречающийся в природе (такой как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) соединен, например, на N или C-конце с консервативным участком IgG (Fc). В некоторых вариантах реализации изобретения неприродная CKP/Fc слитая молекула активирует систему комлемента иммунного ответа. В некоторых вариантах реализации изобретения, не встречающийся в природе слитый белок CKP/Fc увеличивает терапевтическую ценность не встречающегося в природе CKP. В некоторых вариантах реализации изобретения описанный в данном документе неприродный CKP-белок (такой как не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) слит (например, рекомбинантно слитый), например, на N или C-конце с белком комплемента, таким как C1q. В различных публикациях описаны способы получения не встречающихся в природе белков, периоды полужизни которых модифицируются либо путем введения FcRn-связывающего полипептида в молекулы (WO 1997/43316, US 5869046, US 5747035, WO 1996/32478, WO 1991/14438) или путем слияния белков с антителами, чья FcRn-связывающая аффинность сохраняется, но сродство к другим Fc-рецепторам было значительно снижено (WO 1999/43713) или путем слияния с FcRn-связывающими доменами антител (WO 2000/09560, US 4703039). Специфические техники и способы увеличения периода полураспада физиологически активных молекул (например, не встречающихся в природе CKP) также можно найти в US 7083784. В некоторых вариантах реализации изобретения описанный в данном документе неприродный CKP-белок (такой как не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) слит с Fc-участком IgG, который содержит аминокислотные мутации (как указано в индексе EU, Kabat): M252Y/S254T/T256E или H433K/N434F/Y436H.
В некоторых вариантах реализации изобретения, не встречающиеся в природе белки CKP, описанные в данном документе (такие как не встречающиеся в природе VEGF-A-связывающие CKP или неприродные LRP6-связывающие CKP) слиты с молекулами, которые увеличивают или продлевают время полураспада in vivo или в сыворотке. В некоторых вариантах реализации изобретения описанный в данном документе природный CKP, не встречающийся в природе (такой как неприродный CKP-связывающий VEGF-A или неприродный LRP6-связывающий CKP) слит с альбумином, таким как человеческий сывороточный альбумин (HSA), полиэтиленгликоль (ПЭГ), полисахариды, молекулы иммуноглобулина (IgG), комплемент, гемоглобин, связывающий пептид, липопротеины или другие факторы для увеличения его периода полураспада в кровотоке и/или для увеличения его проникновения в ткани.
Дополнительные химерные молекулы, содержащие не встречающиеся в природе VEGF-A-связывающие CKP или неприродные LRP6-связывающие CKP, могут быть получены с помощью способов перетасовки генов, перетасовки мотивов, экзон-перетасовки и/или перетасовки кодонов (в совокупности называемые «перетасовка ДНК»). Перетасовка ДНК может быть использована для изменения активности не встречающихся в природе CKP (например, не встречающихся в природе CKP с более высокой аффинностью и более низкой скоростью диссоциации). См., например, US 5605793, US5811238, US 5830721, US 5834252, US 5837458, Patten et al. (1997) Curr. Opinion Biotechnol. 8, 724-33; Harayama (1998) Trends Biotechnol. 16, 76-82; Hansson, et al., (1999) J. Mol. Biol. 287, 265-76; и Lorenzo and Blasco, (1998) Biotechniques 24, 308-313
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP или не встречающийся в природе LRP6-связывающий CKP, описанный в данном документе, изменяется, подвергаясь случайному мутагенезу методом ПЦР, вносящей ошибки, случайной нуклеотидной вставкой или другими методами до рекомбинации. Одна или несколько частей полинуклеотида, кодирующего каркас, который связывается с конкретной мишенью, могут быть рекомбинированы с одним или несколькими компонентами, мотивом, участками, частями, доменами, фрагментами и т.д. одной или более гетерологичных молекул.
Любой из этих слияний может быть получено стандартными способами, например, путем экспрессии рекомбинантного гибридного гена слитого белка, созданного с использованием общедоступных последовательностей генов, или путем химического пептидного синтеза.
Конъюгаты, Состоящие из Неприродного VEGF-A-связывающего CKP, или Неприродного LRP6-связывающего CKP
В данном документе представлены иммуноконъюгаты, содержащие описанный в данном документе неприродный CKP (такой как не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP), конъюгированный с цитотоксическим агентом, таким как химиотерапевтический агент, токсин (например, бактериальный токсин с ферментативной активностью, токсин грибного, растительного или животного происхождения или фрагмент любого вышеперечисленного токсина) или радиоактивный изотоп (т.е. радиоконъюгат).
Токсины с ферментативной активностью и их фрагменты, которые могут быть использованы, включают A-цепь дифтерийного токсина, несоединяющиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), A цепь рицина, A цепь абрина, A цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецины. Другие токсины включают майтанзин и майтансиноиды, калихеамицин и другие цитотоксические агенты. Для производства радиоконъюгированных не встречающихся в природе CKP доступны различные радионуклиды. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re.
Конъюгаты не встречающегося в природе CKP, описанного в данном документе (например, не встречающегося в природе VEGF-A-связывающего CKP или неприродного LRP6-связывающего CKP) и, например, цитотоксического агента, создаются с использованием разнообразных бифункциональных белок-соединяющих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)-пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (таких как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидные соединения (такие как бис-(p-азидобензоил)-гександиамин), производные бисдиазония (такие как бис-(p-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толил-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицина может быть получен, как описано в Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типовый хелатирующий агент для конъюгации радионуклида с неприродным CKP, описанным в данном документе. См., WO94/11026.
В другом варианте реализации изобретения описанный в данном документе неприродный CKP (такой как не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP) может быть конъюгирован с «рецептором» (таким как стрептавидин) для использования в окулярном «предварительном таргетинге», в котором неприродный конъюгат белка-рецептора и каркаса EETI-II вводят пациенту с глазным заболеванием или состоянием с последующим удалением несвязанного конъюгата из кровотока с использованием очищающего агента, а затем вводят «лиганд» (например, авидин), который конъюгирован с цитотоксическим агентом (например, радионуклидом) или терапевтическим агентом.
В некоторых вариантах реализации изобретения неприродные CKP, описанные в данном документе (такие как не встречающиеся в природе VEGF-A-связывающие CKP или неприродные LRP6-связывающие CKP), могут быть использованы как би- или мультиспецифичные (по отношению к разным целевым лигандам или разным эпитопам на одном и том же целевом лиганде) в мультимерной форме. Присоединенные фрагменты могут быть ковалентными или нековалентными. Например, димерный биспецифический неприродный CKP имеет одну субъединицу со специфичностью к первому целевому белку или эпитопу и вторую субъединицу со специфичностью к второму целевому белку или эпитопу. Субъединицы неприродного CKP могут быть соединены, например, с помощью конъюгации, в различных конформациях, которые могут увеличить валентность и, следовательно, авидность связывания с целевым лигандом или обеспечить связывание множества целевых лигандов.
В некоторых вариантах реализации изобретения неприродные CKP, описанные в данном документе, сконструированы для получения реакционноспособных групп для конъюгации. В некоторых вариантах реализации изобретения N-конец и/или С-конец может также служить для обеспечения реакционноспособных групп для конъюгации. В некоторых вариантах реализации изобретения N-конец конъюгирован с одним фрагментом (таким как, но не ограничиваясь им, ПЭГ), тогда как С-конец конъюгирован с другим фрагментом (таким как, но не ограничиваясь им, биотином), или наоборот.
Также представлен неприродный CKP, описанный в данном документе (такой как не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP), конъюгированный с одним или несколькими фрагментами, включая, но не ограничиваясь ими, пептиды, полипептиды, белки, слитые белки, молекулы нуклеиновой кислоты, малые молекулы, миметические агенты, синтетические лекарственные средства, неорганические молекулы и органические молекулы. Также предусмотрено использование не встречающегося в природе CKP, описанного в данном документе (например, не встречающегося в природе VEGF-A-связывающего CKP или неприродного LRP6-связывающего CKP), химически конъюгированного (включая как ковалентные, так и нековалентные конъюгации) с гетерологичным белком или полипептидом (или его фрагментом, с полипептидом, состоящем из по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере, 80, по меньшей мере 90 или по меньшей мере 100 аминокислот). Слияние не обязательно должно быть прямым, но может происходить через линкерные последовательности, описанные в данном документе.
В некоторых вариантах реализации изобретения описанный в данном документе CKP, не встречающийся в природе (такой как неприродный VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP), или его аналоги, или их производные могут быть конъюгированы с диагностическим или детектируемым агентом. Такие неприродные CKP-конъюгаты могут быть полезны для мониторинга или прогнозирования развития или прогрессирования заболевания в рамках процедуры клинических испытаний, таких как определение эффективности конкретной терапии. Такая диагностика и обнаружение могут быть достигнуты путем связывания неприродного CKP с обнаруживаемыми веществами, включая, но не ограничиваясь ими, различные ферменты, такие как, но не ограничиваясь ими, пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; простетическими группами, такими как, но не ограничиваясь ими, стрептавиди/биотин и авидин/биотин; флуоресцентными соединениями, такими как, но не ограничиваясь ими, умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламин флуоресцеина, дансилхлорид или фикоэритрин; люминесцентными соединениями, такими как, но не ограничиваясь ими, люминол; биолюминесцентными соединениями, такими как, но не ограничиваясь ими, люцифераза, люциферин и экворин; радиоактивные соединения, такие как, но не ограничиваясь ими, йод (131I, 125I, 123I, 121I), углерод (14C), сера (35S), тритий (3H), индий (115In, 113In, 112In, 111In) и технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (133Xe), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn и 117Tn; металлы, излучающие позитроны, с использованием различных позитронно-эмиссионных томографий, нерадиоактивных парамагнитных ионов металлов и молекул, которые радиоактивно мечены или конъюгированы с конкретными радиоизотопами.
Также предусмотрены неприродные CKP (такие как не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP), конъюгированный с терапевтическим фрагментом. В некоторых вариантах реализации изобретения неприродный CKP может быть конъюгирован с терапевтическим фрагментом, таким как цитотоксин, например цитостатический или цитоцидный агент, терапевтический агент или радиоактивный ион металла, например излучающий альфа-частицы. Термины цитотоксин или цитотоксический агент включают любой агент, который вреден для клеток.
В некоторых вариантах реализации изобретения описанный в данном документе CKP, не встречающийся в природе (такой как неприродный CKP-связывающий VEGF-A или неприродный LRP6-связывающий CKP) конъюгирован с терапевтическими фрагментами, такими как радиоактивный ион металла, например, излучающий альфа-частицы, например, 213Bi или макроциклические хелаторы, пригодные для конъюгирования радиоактивных ионов металла, включая, но не ограничиваясь ими, 131In, 131Lu, 131Y, 131Ho, 131Sm, с полипептидами. В некоторых вариантах реализации изобретения макроциклический хелатор представляет собой 1, 4, 7, 10-тетраазациклододекан-N,N',N'',N'''- тетрауксусную кислоту (DOTA), которая может быть присоединена к неприродному CKP посредством молекулы-линкера. Такие молекулы-линкеры широко известны в данной области и описаны, например, в Denardo et al. (1998) Clin Cancer Res. 4, 2483-90; Peterson et al. (1999) Bioconjug. Chem. 10, 553-557; и Zimmerman et al. (1999) Nucl. Med. Biol. 26, 943-50.
Способы конъюгирования терапевтических фрагментов с антителами хорошо известны и могут быть применены к неприродным CKP, описанным в данном документе, см., например, Amon et al., «Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy,» in Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56. (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Antibodies 84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radio labeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985), и Thorpe et al., 1982, Immunol. Rev. 62:119-58. Подобные подходы могут быть адаптированы для использования с не встречающимися в природе CKP, описанными в данном документе.
Терапевтический фрагмент или лекарственное средство, конъюгированное с неприродным CKP, описанным в данном документе (например, не встречающийся в природе VEGF-A-связывающий CKP или неприродный LRP6-связывающий CKP), должно быть выбрано для достижения желаемого профилактического или терапевтического эффекта (-ов) в случае конкретного расстройства у субъекта. Врач или другой медицинский персонал должен учитывать следующее при принятии решения о том, какой терапевтический фрагмент или лекарственное средство конъюгировать с каркасом: характер заболевания, тяжесть заболевания и состояние субъекта.
В некоторых вариантах реализации изобретения описанные в данном документе неприродные CKP (такие как неприродный CKP, связывающийся с VEGF-A или неприродный LRP6-связывающий CKP) также могут быть присоединены к твердым носителям, которые особенно полезны для иммунологических исследований или очистки целевого антигена. Такие твердые носители включают, но не ограничиваются ими, стекло, целлюлозу, полиакриламид, найлон, полистирол, поливинилхлорид или полипропилен.
Ковалентные Модификации
Также предлагаются ковалентные модификации не встречающихся в природе CKP, описанных в данном документе (например, не встречающихся в природе VEGF-A-связывающих CKP или неприродных LRP6-связывающих CKP). Один тип ковалентной модификации включает взаимодействие целевых аминокислотных остатков неприродного CKP с органическим дериватизирующим агентом, который способен реагировать с выбранными боковыми цепями или N- или C-концевыми остатками неприродного CKP. Дериватизация с помощью бифункциональных агентов может быть использована, например, для сшивания неприродного CKP с нерастворимой в воде матрицей или поверхностью носителя для использования в способе очистки целевого лиганда и наоборот. Обычно используемые сшивающие агенты включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаровый альдегид, эфиры N-гидроксисукцинимида, например сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные имидоэфиры, включая дисукцинимидиловые сложные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан и агенты, такие как метил-3-[(p-азидофенил)дитио]пропиоимидат.
Другие модификации включают дезамидирование глутаминовых и аспарагиновых остатков до соответствующих глутамиловых и аспартиловых остатков, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серина или треонина, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой С-концевой карбоксильной группы.
Другой тип ковалентной модификации неприродного CKP включает связывание неприродного CKP с одним из множества небелковых полимеров, например полиэтиленгликолем (ПЭГ), полипропиленгликолем или полиоксиалкиленами, способами, описанным в патентах US 4640835, US 4496689, US 4301144, US 4670417, US 4791192 или US 4179337
Термин «полиэтиленгликоль» или «ПЭГ» означает соединение полиэтиленгликоля или его производного со связующими агентами, связующими или активирующими фрагментами (например, с тиоловым, трифлатовым, трезилатовым, азиридиновым, оксирановым, N-гидроксисукцинимидовым или малеимидовым фрагментом) или без них. Термин «ПЭГ» предназначен для обозначения полиэтиленгликоля с молекулярной массой от 500 до 150 000 Да, включая его аналоги, где, например, терминальная OR-группа заменена метоксигруппой (обозначаемый в таком случае как mПЭГ).
В некоторых вариантах реализации изобретения описанные в данном документе не встречающиеся в природе CKP (такие как не встречающиеся в природе VEGF-A-связывающие CKP или неприродные LRP6-связывающие CKP) дериватизируются с полиэтиленгликолем (ПЭГ). ПЭГ представляет собой линейный водорастворимый полимер, состоящий из повторяющихся звеньев этиленоксида с двумя концевыми гидроксильными группами. Соединения ПЭГ классифицируются по их молекулярным массам, которые обычно варьируются от примерно 500 дальтон до примерно 40 000 дальтон. В предпочтительном в данное время варианте реализации изобретения применяемые ПЭГ имеют молекулярный вес от 5000 до 20 000 дальтон. Соединения ПЭГ, связанные с не встречающимися в природе CKP, описанными в данном документе, могут иметь разветвленное или линейное строение (например, Monfardini, C. et al. 1995 Bioconjugate Chem 6:62-69). Соединения ПЭГ коммерчески доступны в Nektar Inc., Sigma Chemical Co. и других компаниях. Такие соединения ПЭГ включают, но не ограничиваются ими, монометоксиполиэтиленгликоль (MeПЭГ-OH), монометоксиполиэтиленгликольсукцинат (MeПЭГ-S), монометоксиполиэтиленгликольсукцинимидилсукцинат (MeПЭГ-S-NHS), монометоксиполиэтиленгликольамин (MeПЭГ-NH2), монометоксиполиэтиленгликоль-трезилат (MeПЭГ-TRES) и монометоксиполиэтиленгликоль-имидазолил-карбонил (MeПЭГ-IM).
В некоторых вариантах реализации изобретения гидрофильный полимер, который используют, например, ПЭГ, на одном конце кэпируют неактивной группой, такой как метокси или этоксигруппа. После этого полимер активируется на другом конце реакцией с подходящим активирующим агентом, таким как галогениды цианура (например, циануровый хлорид, бромид или фторид), diimadozle, ангидридный реагент (например, ангидрид дигало-янтарной кислоты, такой как дибромсукцинатный ангидрид), ацилазид, p-диазобензиловый эфир, 3-(p-диазофенокси)-2-гидроксипропиловый эфир) и тому подобное. Затем активированный полимер подвергают взаимодействию с не встречающимся в природе CKP (таким как не встречающийся в природе VEGF-A-связывающий CKP или не встречающийся в природе LRP6-связывающий CKP) для получения неприродного CKP, дериватизированного с помощью полимера. Альтернативно, функциональная группа в неприродном CKP, описанном в данном документе, может быть активирована для реакции с полимером или две группы могут быть соединены в согласованной реакции объединения с использованием известных способов объединения. Нетрудно понять, что описанные в данном документе неприродные CKP могут быть дериватизированы с помощью ПЭГ с использованием множества других схем реакций, известных специалистам в данной области техники и используемых специалистами.
Липосомы
Неприродные CKP, описанные в данном документе (такие как неприродные VEGF-A-связывающие CKP или неприродные LRP6-связывающие CKP), также могут быть получены в составе липосом. Липосомы, содержащие не встречающийся в природе каркасный белок EETI-II, описанный в данном документе, могут быть получены способами, известными в данной области, например, описанными в Epstein et al., Proc Natl Acad Sci USA, 82: 3688 (1985); Hwang et al., Proc Natl Acad Sci USA, 77: 4030 (1980); и U.S. Pat. Nos. 4,485,045 и 4,544,545. Липосомы с увеличенным временем циркуляции описаны в патенте США № 5,013,556.
Особенно полезные липосомы могут быть получены методом обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (ПЭГ-PE). Липосомы экструдируют через фильтры с определенным размером пор для получения липосомы с требуемым диаметром. Второй терапевтический агент необязательно также содержится в липосоме. См. Gabizon et al., J. National Cancer Inst., 81(19): 1484 (1989). Фармацевтические композиции и составы, содержащие неприродные пептиды с цистиновым узлом (CKP), которые связываются с фактором роста эндотелия сосудов человека A (VEGF-A)
В некоторых вариантах реализации изобретения, описанных в данном документе, представляет собой фармацевтическую композицию, содержащую не встречающийся в природе VEGF-A-связывающий CKP и фармацевтически приемлемый эксципиент. В некоторых вариантах реализации изобретения композиция может также содержать буферы, носители, стабилизаторы, консерванты и/или наполнители для обеспечения композиции свойствами, способствующими глазному введению пациенту для достижения желаемого эффекта или результата. В некоторых вариантах реализации изобретения фармацевтическая композиция содержит один или несколько усилителей проницаемости, которые позволяют неприродному VEGF-A-связывающему CKP проникать через роговицу. Примеры таких агентов усиления проницаемости включают, например, поверхностно-активные вещества, желчные кислоты, хелатирующие агенты, консерванты, циклодекстрины (то есть цилиндрические олигонуклеотиды с гидрофильной внешней поверхностью и липофильной внутренней поверхностью, которые образуют комплексы с липофильными лекарственными средствами) и т.д. Такие агенты усиления проницаемости повышают химическую стабильность и биодоступность и уменьшают местное раздражение. В некоторых вариантах реализации изобретения фармацевтическая композиция, описанная в данном документе, дополнительно содержит агенты, которые увеличивают поглощение и распределение не встречающихся в природе VEGF-A-связывающих CKP в различных окулярных компартментах. В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция содержит сшитую полиакриловую кислоту, которая может повысить окулярную биологическую доступность благодаря своим мукоадгезивным свойствам. В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция содержит биоадгезивный полимер.
В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция изготавливается в виде системы гелеобразования in-situ, например жидкости на вязкой основе на основе полимера, которая имеет свойство фазового перехода от золя к гелю на поверхности глаза из-за изменения определенного физико-химического параметра (ионной силы, температуры, рН или обмена растворителями), когда композиция контактирует со слезной жидкостью. В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция изготавливается в виде спрея для глаз. В некоторых вариантах реализации изобретения предлагаемая фармацевтическая композиция изготавливается в виде липосом. В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция изготавливается в виде ниосом (т.е. неионых везикул на основе поверхностно-активных веществ, содержащих, например, холестерин в качестве эксципиента). В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция изготавливается в виде фармакосом (т.е. везикул, образованных амфифильными лекарственными средствами). В некоторых вариантах реализации изобретения описанная в данном документе фармацевтическая композиция изготавливается в виде микроэмульсии. Дополнительные подробности, касающиеся различных офтальмических фармацевтических композиций, представлены, например, в Gaikwad et al. (2013) Indo Amer J Pharm Res. 3, 3216-3232; Achouri et al. (2012) Drug Dev Indust Pharm. 39, 1599-1617; Lu (2010) Recent Pat Drug Deliv Formul. 4, 49-57; Baranowski et al. (2014) Sci World J. doi.org/10.1155/2014/861904; Lang (1995) Adv Drug Deliv Rev. 16, 39-43; Short (2008) Toxicologic Path. 36, 49-62; и др.
В некоторых вариантах реализации изобретения фармацевтическая композиция, содержащая не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, стабильна при комнатной температуре (например, при температуре около 20-25°C) в течение около 0,5 недель, около 1,0 недель, около 1,5 недель, около 2,0 недель, около 2,5 недель, 3,5 недели, около 4,0 недель, около 1 месяца, около 2 месяцев, около 3 месяцев, около 4 месяцев, около 5 месяцев, около 6 месяцев или более 6 месяцев, включая любой диапазон между этими значениями. В некоторых вариантах реализации изобретения фармацевтическая композиция, содержащая не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, стабильна при условиях ускоренной деградации (например, при температуре около 37°C) в течение около 0,5 недель, около 1,0 недель, около 1,5 недель, около 2,0 недель, около 2,5 недель, 3,5 недели, около 4,0 недель, около 1 месяца, около 2 месяцев, около 3 месяцев, около 4 месяцев, около 5 месяцев, около 6 месяцев или более 6 месяцев, включая любой диапазон между этими значениями.
Способы Лечения с Использованием Неприродных пептидов с цистиновыми узлами (CKP), которые связываются с фактором роста эндотелия сосудов человека A (VEGF-A)
Фактор роста эндотелия сосудов (VEGF-A), димерный гликопротеин приблизительно 40 кДа, является мощным митогеном эндотелиальных клеток, который стимулирует пролиферацию, миграцию и образование сосудов, приводя к ангиогенному росту новых кровеносных сосудов и повышенной проницаемости сосудов. Низкие уровни кислолрода в сетчатке или роговице вызывают экспрессию фактора роста эндотелия сосудов (VEGF-A), а аномальный (например, чрезмерный или неадекватный) рост кровеносных сосудов с высокой проницаемостью способствует развитию патологии в виде нескольких истощающих глазных заболеваний, включая, например, диабетическую слепоту, ретинопатию, прежде всего диабетическую ретинопатию, возрастную макулярную дегенерацию (AMD), пролиферативную диабетическую ретинопатию (PDR), ретинопатию недоношенных (ROP), хориоидальную неоваскуляризацию (CNV), диабетический макулярный отек, патологическую миопию, болезнь фон Риппель-Линдау, гистоплазмоз глаза, окклюзию вен сетчатки (включая окклюзию ветвей вены сетчатки (BRVO) и окклюзию центральной вены сетчатки (CRVO), неоваскуляризацию роговицы, неоваскуляризацию сетчатки и рубеоз. Возникновение индуцированных с помощью VEGF-A новых кровеносных сосудов является пагубным, а ретинальная, интратрабекулярная или роговичная неоваскуляризация может в конечном итоге привести к потере зрения.
В некоторых вариантах реализации изобретения, описанных в данном документе, представлен способ лечения окулярного заболевания или расстройства у субъекта, включающий введение субъекту эффективного количества не встречающегося в природе VEGF-A-связывающего CKP, описанного в данном документе, или композиции (такой как фармацевтическая композиция), содержащей не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе. В некоторых вариантах реализации изобретения представлены композиции (такие как фармацевтические композиции), содержащие не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, для использования при лечении глазного заболевания или расстройства у субъекта. В некоторых вариантах реализации изобретения предусматривается использование не встречающегося в природе VEGF-A-связывающего CKP, описанного в данном документе (или композиции, содержащей такой неприродный CKP) при изготовлении лекарственного средства для лечения глазного заболевания или расстройства у субъекта.
В некоторых вариантах реализации изобретения субъектом, подлежащим лечению, является млекопитающее (например, человек, не являющийся человеком примат, крыса, мышь, корова, лошадь, свинья, овца, коза, собака, кошка и т.д.). В некоторых вариантах реализации изобретения субъектом является человеком. В некоторых вариантах реализации изобретения субъектом является клинический пациент, доброволец клинических испытаний, экспериментальное животное и т.д. В некоторых вариантах реализации изобретения субъект подозревается в наличии или под угрозой наличия окулярного заболевания или расстройства, характеризующегося аномальным ангиогенезом и/или аномальной сосудистой проницаемостью (например, описанного в данном документе). В некоторых вариантах реализации изобретения у субъекта обнаруживается окулярное заболевание или расстройство, характеризующееся аномальным ангиогенезом и/или аномальной сосудистой проницаемостью (например, описанное в данном документе).
В некоторых вариантах реализации изобретения глазное заболевание или расстройство представляет собой окулярное сосудистое пролиферативное заболевание, такое как окулярное сосудистое пролиферативное заболевание, выбранное из группы, состоящей из диабетической слепоты, ретинопатии, прежде всего диабетической ретинопатии, возрастной макулярной дегенерации (AMD), пролиферативной диабетической ретинопатии (PDR), ретинопатии недоношенных (ROP), хориоидальной неоваскуляризации (CNV), диабетического макулярного отека, патологической миопии, болезни фон Риппель-Линдау, гистоплазмоза глаза, окклюзии вен сетчатки (включая окклюзию ветвей вены сетчатки (BRVO) и окклюзию центральной вены сетчатки (CRVO), неоваскуляризации роговицы, неоваскуляризации сетчатки и рубеоза. В некоторых вариантах реализации изобретения неоваскуляризация роговицы приводит к инфицированию глаза, воспалению в глазу, травме глаза (включая химические ожоги) или к потере защитного барьера клеток. В некоторых вариантах реализации изобретения неоваскуляризация роговицы возникает в результате герпетического кератита, трахомы или онхоцеркоза.
В некоторых вариантах реализации изобретения эффективное количество не встречающегося в природе VEGF-A-связывающего CKP, описанного в данном документе, (или композицию, содержащую такой неприродный VEGF-A-связывающий CKP, описанный в данном документе) вводят непосредственно в глаз субъекта (например, интравитрально или местно), как описано более подробно в другом месте в данном документе.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, (или композицию, содержащую такой неприродный CKP), вводят в комбинации со вторым агентом. Для пациентов, у которых глазное заболевание или расстройство вызвано воспалительным ответом, можно рассматривать применение комбинированной терапии с противовоспалительным средством. Например, совместное использование стероидов и неприродного VEGF-A-связывающего CKP, описанного в данном документе (или композиции, содержащей такой неприродный CKP) для уменьшения воспаления и предотвращения образования новых кровеносных сосудов, соответственно, может быть особенно выгодным для пациентов с, например, неоваскуляризацией роговицы. Пациенты, которые страдают от глазного заболевания или расстройства, вторичного по отношению к бактериальной, вирусной, грибковой или акантамебальной инфекции, могут получить пользу при введении неприродного VEGF-A-связывающего CKP, описанного в данном документе (или композиции, содержащей такой неприродный CKP) в комбинации с антимикробным агентом и, возможно, противовоспалительным агентом. Пациенты с кровеносными сосудами в строме роговицы в результате окулярного заболевания или расстройства подвергаются значительному риску иммунного отторжения после трансплантации роговицы. Введение неприродного VEGF-A-связывающего CKP, описанного в данном документе (или композиции, содержащая такой неприродный CKP) перед (и необязательно также после) трансплантацией роговицы может быть особенно выгодным для пациентов с кровеносными сосудами в строме роговицы, поскольку успешное сокращение васкуляризации роговицы уменьшит риск отторжения трансплантата. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, (или композицию, содержащую такой неприродный CKP), вводят в комбинации со вторым антиангиогенным агентом. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, (или композицию, содержащую такой неприродный CKP), вводят в комбинации с ингибитором матриксной металлопротеиназы (MMP).
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP, описанный в данном документе, (или композицию, содержащую такой неприродный CKP), вводят в комбинации со второй терапией. В некоторых вариантах реализации изобретения вторая терапия представляет собой лазерную фотокоагуляционную терапию (LPT). LPT использует лазерный луч, чтобы вызвать контролируемое повреждение сетчатки для получения полезного терапевтического эффекта. Небольшие вспышки лазерного луча могут запечатывать кровеносные сосуды с высокой проницаемостью, разрушать аномальные кровеносные сосуды, запечатывать небольшие участки отслоения сетчатки или разрушать аномальные ткани в задней части глаза. Этот способ является быстрым, неинвазивным и обычно не требует никакой анестезии, кроме обезболивающих глазных капель. Методы и аппараты LPT легко доступны офтальмологам (см. Lock et al. (2010) Med J Malaysia 65:88-94). Дополнительную подробную информацию относительно LPT можно найти, например, в документе WO 2014/033184.
В некоторых вариантах реализации изобретения вторая терапия представляет собой фотодинамическую терапию (PDT). В PDT используется активируемая светом молекула чтобы вызвать локализованное повреждение неоваскулярного эндотелия, что приводит к окклюзии сосудов. Свет подается в сетчатку в виде одного круглого пятна через оптоволоконный кабель и щелевую лампу, используя подходящую офтальмологическую увеличивающую линзу (лазерная терапия). Активируемое светом соединение вводят в кровоток до лазерной обработки, а повреждение производят путем фотоактивации соединения в области, пораженной неоваскуляризацией. Одним широко используемым активируемым светом соединением является вертепорфин (Visudyne®). Вертепорфин переносится в плазме преимущественно липопротеинами. Когда вертепорфин активируется светом в присутствии кислорода, продуцируется высокореактивный, короткоживущий синглетный кислород и реактивные кислородные радикалы, которые повреждают эндотелий окружающих кровеносных сосудов. Известно, что поврежденный эндотелий высвобождает прокоагулянты и вазоактивные факторы через пути липооксигеназы (лейкотриен) и циклооксигеназы (эйкозаноиды, такие как тромбоксан), что приводит к агрегации тромбоцитов, образованию фибринового сгустка и вазоконстрикции. По-видимому, вертепорфин преимущественно накапливается в сети новообразованных сосудов. Длина волны лазера, используемого для фотоактивации активируемого светом соединения, может варьироваться в зависимости от конкретного используемого активируемого светом соединения. Дополнительную подробную информацию относительно PDT можно найти, например, в документе WO 2014/033184.
В некоторых вариантах реализации изобретения вторая терапия представляет собой диатермию и прижигание, при которых сосуды запечатываются либо путем применения коагулирующего тока через однополюсный прибор для диатермии, либо термическим прижиганием с использованием иглы для эдектродеструкции, вставленной в питающие сосуды в лимбе роговицы.
Введение
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP), вводят, например, путем инъекции, например, субконъюнктивальной инъекции, внутрикорнеальной инъекции или внутримышечной инъекции. Введение в водной форме является обычным, с типичным объемом 20-150 мкл, например 40-60 мкл, или 50 мкл. Инъекция может быть выполнена через иглу размером 30G × 1/2 дюйма (12,7 мм). В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) предоставляется в предварительно заполненном стерильном шприце, готовом для введения. В некоторых вариантах реализации изобретения шприц имеет низкое содержание силикона или не содержит силикона. Шприц может быть сделан из стекла. Использование предварительно заполненного шприца для доставки имеет то преимущество, что любого загрязнения раствора стерильного антагониста до введения можно избежать. Предварительно заполненные шприцы также обеспечивают более легкое использование лечащим офтальмологом. См., например, WO 2014/033184, Fagan et al. (2013) Clin Exp Ophthalmol. 41, 500-507; Avery et al. (2014) Retina. 34 Suppl 12, S1-S18; и Doshi et al. (2015) Seminar Ophthalmol. 26, 104-113 для получения дополнительной информации об интравитреальном введении.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) вводят местно, например, в виде глазных капель. Дополнительные сведения о местном введении лекарственного средства в глаз могут быть получены, например, в Loftsson et al. (2012) Acta Ophthalmologica. 90, 603-608; Patel et al. (2013) World J. Pharmacol. 2, 47-64; Freeman et al. (2009) Exp Rev Ophthalmol. 4, 59-64; и Boddu et al. (2014) Recent Patents on Drug Delivery and Formulation. 8, 27-36.
В некоторых вариантах реализации изобретения для непрерывной доставки в глаза не встречающегося в природе VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP) используется интравитреальное устройство. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) вводят с помощью окулярной вставки (включая, но не ограничиваясь ими, например, Ocuserts, Lactisers, Soluble Ocular Drug Inserts (SODI), минидисков, контактных линз, пленок, полосок фильтровальной бумаги, искусственных слез и коллагеновых пленок). См., например, Gaikwad et al. (2013) Indo Amer J Pharm Res. 3, 3216-3232). В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композицию, содержащую такой неприродный CKP), вводят в виде депо медленного высвобождения, окулярной вствки/резервуара, глазного имплантата (такого как склеральный или витреальный имплантат). В данной области известны различные склеральные и интравитреальные системы введения. Эти системы доставки обычно не являются биоразлагаемыми и могут быть активными или пассивными. Например, документ WO 2010/088548 описывает систему доставки, имеющую жесткое тело, с использованием пассивной диффузии для доставки терапевтического агента. В документе WO 2002/100318 описана система доставки, имеющая гибкий корпус, который позволяет осуществлять активное введение с помощью перепада давления. Альтернативно, активная доставка может быть достигнута за счет имплантируемых миниатюрных помп. Примером интравитреальной системы доставки, использующей миниатюрную помпу для доставки терапевтического агента, является Ophthalmic MicroPump System™, продаваемая компанией Replenish, Inc., которая может быть запрограммирована на доставку определенного количества терапевтического агента за заранее определенное количество раз. В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) заключен в небольшой капсоподобный контейнер (например, силиконовую эластомерную емкость). Контейнер обычно имплантируется в глаз над радужной оболочкой. Контейнер содержит выпускное отверстие. Выведение неприродного VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP) может контролироваться мембраной, расположенной между неприродным VEGF-A-связывающим CKP (или композицией, естественно встречающийся CKP) и отверстием, или с помощью миниатюрной помпы, подключенной к контейнеру. Альтернативно, неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) может быть осажден в матрикс медленного высвобождения, которая предотвращает быструю диффузию антагониста из контейнера. Предпочтительно, интравитреальное устройство предназначено для высвобождения не встречающегося в природе VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP) с начальной скоростью, которая является более высокой в течение первого месяца. Скорость высвобождения медленно уменьшается, например, в течение первого месяца после имплантации до скорости, которая примерно на 50% ниже начальной. Контейнер может иметь такой размер, который достаточен для обеспечения подачи не встречающегося в природе VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP), которая длится около четырех-шести месяцев. Поскольку уменьшенная доза не встречающегося в природе VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP) может быть достаточной для эффективного лечения, когда введение является непрерывным, высвобождение из контейнера может продолжаться один год или более, предпочтительно около двух лет, наиболее предпочтительно около трех лет. Поскольку для имплантации системы доставки требуется небольшая операция и интравитреальные инъекции не проводятся, можно избежать проблем с согласием пациента на повторные интравитреальные инъекции. Интравитреальные концентрации неприродного VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP) снижаются и, следовательно, потенциальный риск побочных эффектов от неприродного VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP), поступающего в кровоток, уменьшается.
В некоторых вариантах реализации изобретения не встречающийся в природе VEGF-A-связывающий CKP (или композицию, содержащую такой неприродный CKP) вводят посредством ионтофореза. Ионтофорез является неинвазивным методом, в котором применяется небольшой электрический ток для усиления проникновения ионизированного лекарственного средства в ткань (см., например, Myles et al. (2005) Adv Drug Deliv Rev 57, 2063-79 и Eljarrat-Binstock et al. (2006) J Controlled Release 110, 479-89). Препарат применяется с электродом, несущим тот же заряд, что и лекарственное средство, и заземляющий электрод, который имеет противоположный заряд, помещается в другое место на теле для замыкания цепи. Препарат служит проводником тока через ткань.
Дополнительные данные, касающиеся введения лекарственного средства в глаз, представлены, например, в Kuno et al. (2011) Polymers 3, 193-221; Short (2008) Toxicologic Path. 36, 49-62; Ghateet al. (2006) Expert Opin Drug Deliv 3, 275-87; Davis et al. (2004) Curr Opin Mol Therap 6, 195-205; Gaudana et al. (2010) AAPS J. 12, 348-360; и др.
Медленное Высвобождение/Композиции Длительного Действия
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) используется в виде препаратов с медленным высвобождением. Композиции с медленным высвобождением обычно получают путем смешивания терапевтического агента с биодеградируемым полимером или его инкапсулирования в микрочастицы.
Композиция с медленным высвобождением в соответствии с изобретением обычно содержит неприродный VEGF-A-связывающий CKP (или композицию, содержащую такой неприродный CKP), полимерный носитель и модификатор высвобождения для изменения скорости высвобождения неприродного VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP) из полимерного носителя. Изменяя условия изготовления композиций для высвобождения на основе полимера, кинетические характеристики высвобождения полученных композиций могут быть модулированы. Полимерный носитель обычно содержит один или несколько биодеградируемых полимеров или сополимеров или их комбинаций. Например, полимерный носитель может быть выбран из полимолочной кислоты (PLA), полигликолевой кислоты (PGA), полилактид-ко-гликолида (PLGA), сложных полиэфиров, поли(ортоэфира), поли(фосфазена), поли(фосфата сложного эфира), поликапролактонов или их комбинации.
В некоторых вариантах реализации изобретения полимерный носитель представляет собой PLGA. Модификатор высвобождения обычно представляет собой длинноцепочечный жирный спирт, предпочтительно содержащий от 10 до 40 атомов углерода. Обычно используемые модификаторы высвобождения включают каприловый спирт, пеларгоновый спирт, каприновый спирт, лауриловый спирт, миристиловый спирт, цетиловый спирт, пальмитиловый спирт, стеариловый спирт, изостеариловый спирт, элайдиловый спирт, олеиловый спирт, линолевый спирт, полиненасыщенный элайдолинолеиловый спирт, полиненасыщенный линоленовый спирт, элайдолинолениловый спирт, полиненасыщенный рицинолеиловый спирт, арахидиловый спирт, бегениловый спирт, эруциловый спирт, лигноцериновый спирт, цериловый спирт, монтаниловый спирт, октакозаноловый спирт, мирициловый спирт, мелиссиловый спирт и геддиловый спирт.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) включен в композицию с медленным высвобождением на основе микросфер. В некоторых вариантах реализации изобретения микросферы изготовлены из PLGA. Количество неприродного VEGF-A-связывающего CKP (или композиции, содержащего такой неприродный CKP) заключенное в микросферы, и скорость высвобождения не встречающегося в природе VEGF-A-связывающего CKP (или композиции, содержащей такой не встречающийся в природе CKP) можно контролировать, изменяя условия, используемые для изготовления микросфер. Способы получения таких препаратов с медленным высвобождением описаны в документах US 2005/0281861 и US 2008/0107694.
В некоторых вариантах реализации изобретения неприродный VEGF-A-связывающий CKP (или композиция, содержащая такой неприродный CKP) заключен в биоразлагаемый имплантат (такой как микроигольчатый имплантат). Матричные имплантаты (такие как микроигольчатые имплантаты) обычно используются для лечения глазных заболеваний, требующих ударной дозы, сопровождаемой уменьшаюшимися дозами препарата в течение периода от 1 дня до 6 месяцев (Davis et al. (2004) Curr Opin Mol Therap 6, 195-205). Они чаще всего изготавливаются из сополимеров полимолочной кислоты (PLA) и/или поли-молочно-гликолевой кислоты (PLGA), которые разлагаются до воды и двуокиси углерода. Скорость и степень высвобождения лекарственного средства из имплантата можно уменьшить, изменяя относительные концентрации лактида (для замедления) и гликолида (для ускорения), изменяя весовые соотношения полимера, добавляя дополнительные слои полимера или используя гидрофобные нерастворимые лекарственные средства. Высвобождение препарата обычно происходит согласно кинетике первого порядка с начальным всплеском высвобождения лекарственного средства с последующим быстрым снижением уровня лекарственного средства. Биоразлагаемые имплантаты не требуют удаления, поскольку они растворяются со временем (Hsu (2007) Curr Opin Ophthalmol 18, 235-9). Биоразлагаемые имплантаты также обеспечивают гибкость в дозировке и лечении от короткой продолжительности (недель) до более значительной продолжительной (от месяца до года), в зависимости от соотношения PLA/PLGA полимера, что является еще одним преимуществом при адаптации высвобождения лекарств к прогрессированию заболевания, поскольку требования к дозе и лечению могут меняться со временем. Дополнительная информация, касающаяся изготовления и имплантации биоразлагаемых имплантатов (таких как PLGA или PLA имплантаты) для глазного введения, представлены, например, в документах WO 2006/093758, US 2006/0182783, WO 2009/026461, US 2008/0181929, US 2009/0263460, US 2010/0015158, US 2011/0207653 и US 2014/0154321. Дополнительные сведения о микроиглах для введения лекарственного средства в глаз приведены, например, в Donnelly et al. (2010) Drug Deliv 14, 187-207; USP7918814, Yavux et al. (2013) Sci World J. doi.org/10.1155/2013/732340, и др.
Изделия и Наборы
В некоторых вариантах реализации изобретения данное изобретение относится к изделию, содержащему не встречающийся в природе VEGF-A-связывающий CKP, и материалам, пригодным для лечения глазного заболевания или расстройства (такого как сосудистое пролиферативное заболевание или окулярное расстройство, характеризующееся чрезмерным ангиогенезом). Изделие может содержать контейнер и этикетку или листок-вкладыш на контейнере или вместе с ним. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. В некоторых вариантах реализации изобретения контейнер содержит композицию, которая эффективна для лечения окулярного заболевания или расстройства (такого как окулярное сосудистое пролиферативное заболевание или окулярное расстройство, характеризующееся чрезмерным ангиогенезом) и может иметь полный набор элементов, необходимых для имплантации окулярной или внутриглазной системы медленного высвобождения лекарственного средства, включая, но не ограничиваясь ими, инъекционные устройства, местные и инъекционные лекарственные средства, хирургические инструменты, шовный материал, шовные иглы и глазные накладки. В некоторых вариантах реализации изобретения контейнер содержит стерильные упаковки унифицированной дозировки. По меньшей мере один активный агент в композиции представляет собой неприродный VEGF-A-связывающий CKP, описанный в данном документе. Этикетка или листок-вкладыш в упаковке указывает, что композиция используется для лечения глазного заболевания или расстройства (такого как сосудистое пролиферативное заболевание или окулярное расстройство, характеризующееся чрезмерным ангиогенезом). Этикетка или вкладыш в упаковке будут дополнительно содержать инструкции по введению пациенту не встречающегося в природе VEGF-A-связывающего CKP (или композиции, содержащей такой неприродный CKP). Также предлагаются изделия и наборы для комбинированных способов лечения, описанных в данном документе.
Листок-вкладыш относится к инструкциям, обычно содержащимся в коммерческих упаковках терапевтических продуктов, которые содержат информацию о показаниях, использовании, дозировке, ведении, противопоказаниях и/или предупреждениях относительно использования таких терапевтических продуктов. В некоторых вариантах реализации изобретения листок-вкладыш указывает, что композиция, содержащая неприродный VEGF-A-связывающий CKP, используется для лечения глазного заболевания или расстройства (такого как окулярное сосудистое пролиферативное заболевание или окулярное расстройство, характеризующееся чрезмерным ангиогенезом, описанные в данном документе).
Также предлагаются наборы, которые могут быть использованы для различных целей, например для изолирования или обнаружения VEGF-A, необязательно в сочетании с изделиями. Для выделения и очистки VEGF-A набор может содержать не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе, связанный с шариками (например, сефарозные шариками). Предложенные наборы могут содержать не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе для обнаружения и количественного определения VEGF-A in vitro, например, с помощью ELISA или блоттинга. Как и в случае с изделием, набор содержит контейнер и этикетку или листок-вкладыш на контейнере или вместе с ним. Например, контейнер содержит композицию, содержащую, по меньшей мере, один не встречающийся в природе VEGF-A-связывающий CKP, описанный в данном документе. Могут быть включены дополнительные емкости, которые содержат, например, разбавители и буферы, контрольные антитела и т.д. Этикетка или листок-вкладыш могут содержать описание композиции, а также инструкции для предполагаемого использования in vitro или диагностики.
ПРИМЕРЫ
Пример 1: Материалы и Способы для примеров 2-3 Отображение EETI-II на фаге M13.
EETI-II был отображен на поверхности бактериофага M13 путем модификации ранее описанной фазмиды pS2202b (Skelton, N. J., Koehler, M. F., Zobel, K., Wong, W. L., Yeh, S., Pisabarro, M. T., Yin, J. P., Lasky, L. A., and Sidhu, S. S. (2003) Origins of PDZ domain ligand specificity. Structure determination and mutagenesis of the Erbin PDZ domain. J Biol Chem 278, 7645-7654). Стандартные методы молекулярной биологии были использованы для замены фрагмента pS2202d, кодирующего домен Erbin PDZ фрагментом ДНК, кодирующим EETI-II. Полученная в результате фазмида (p8EETI-II) содержала открытую рамку считывания, которая кодировала сигнальный пептид секреции белка, связывающего мальтозу, метку gD и EETI-II и основной белок оболочки p8 фага M13. E. Coli, содержащие p8EETI-II, были совместно инфицированы фагом-хелпером M13-KO7, и культуры выращивали в 30 мл среды 2YT с добавлением 50 μг/мл карбенециллина и 25 μг/мл канамицина при температуре 30°С в течение ночи. Размноженный фаг очищали в соответствии со стандартным протоколом (Tonikian, R., Zhang, Y., Boone, C., and Sidhu, S. S. (2007) Identifying specificity profiles for peptide recognition modules from phage-displayed peptide libraries. Nat Protoc 2, 1368-1386) и повторно суспендировали в 1 мл PBT-буфера (PBS, 0,5% BSA и 0,1% TWEEN®20), в результате чего получали фаговые частицы, которые содержали ДНК p8EETI-II и несли на своей поверхности EETI-II. Уровень дисплея анализировали с использованием ELISA с фаговыми частицами.
Создание Библиотеки и Сортировка
Библиотеки EETI-II были получены по методу мутагенеза Kunkel (Kunkel, T. A., Roberts, J. D., and Zakour, R. A. (1987) Rapid and efficient site-specific mutagenesis without phenotypic selection. Methods Enzymol 154, 367-382). Были построены три библиотеки: Библиотека 1, в которой петля 1 (3-8) была рандомизирована с вырожденным кодоном, кодирующим все природные аминокислоты, за исключением Cys, длиной 6, 8 или 10 аминокислот; или Библиотека 2, в которой петля 5 (22-26) была рандомизирована с тем же набором вырожденного кодона с фиксированной длиной 5 аминокислот; или Библиотека 3, в которой как петля 1 были рандомизирована с 6, 8 и 10 аминокислотами, так и петля 5 одновременно с 5 аминокислотами с вырожденным кодоном, кодирующим 19 аминокислот. Олигонуклеотиды для мутагенеза синтезировали с использованием изготовленных на заказ смесей тримеров фосфорамидитов, кодирующих 19 аминокислот при эквимолярной концентрации. (Glen Research, Sterling, VA). Стоп-матрица представляет собой одноцепочечную ДНК p8EETI-II, содержащую три стоп-кодона в области 3-26, и использовался для построения всех трех библиотек. Пул из трех библиотек содержал ~3 × 1010 уникальных представителей и был подвергнут отбору во время раундов отбора по связыванию с hVEGF (8-109), иммобилизованного на подложке в течение четырех раундов по стандартному протоколу (Tonikian, R., Zhang, Y., Boone, C., and Sidhu, S. S. (2007) Identifying specificity profiles for peptide recognition modules from phage-displayed peptide libraries. Nat Protoc 2, 1368-1386) с изменением того, что 25 г/мл hVEGF (8-109) использовали для покрытия пластины и элюированный фаг размножали путем выращивания ночной культуры при 30°С.
Spot Phage ELISA
После четырех раундов отбора на основе связывания индивидуальные фаговые клоны отбирали и вносили в 450 μмкл 2YT среды, содержащей 50μ мкг/мл карбенициллина и фаг-хелпер M13-KO7 в 96-луночных штативах, и выращивали при температуре 37°C в течение ночи. Супернатант анализировали с помощью spot phage ELISA следующим образом: hVEGF (8-109) или BSA наносили на 384-луночные планшеты для иммунологических исследований MAXISORP™ и добавляли к лункам фаговый супернатант, разбавленный с помощью PBT-буфера (1:3). Планшеты промывали и связанный фаг детектировали с помощью анти-M13-HRP с последующим добавлением TMB. В этих тестах фаговое связывание только с BSA тестировалось параллельно для оценки фонового связывания. Клоны, сигналы связи которых с hVEGF-A (8-109) были более чем в 3 раза выше, чем для BSA (фон), считались положительными. Положительные клоны подвергали анализу последовательности ДНК.
Кристаллография
Для образования стабильного комплекса VEGF-A концентрировали до 7 мг/мл и инкубировали с 6-кратным молярным избытком варианта VEGF_CKP9.54.90. Кристаллы VEGFA/VEGF_CKP9.54.90 примитивной моноклинной сингонии пространственной группы P1211 выращивали при 19°С методом висячей капли посредством диффузии в парах с использованием соотношения белок: резервуарный раствор в капле равным 2:1. Резервуарный раствор содержал 100 мМ HEPES pH 7,4 и 26% ПЭГ 3350. Кристаллы подвергали криопротектированию в резервуарном растворе, дополненном 25% ПЭГ 200, и замораживали в жидком азоте до сбора данных.
Сбор Данных и Определение Структуры
Данные рентгеновской дифракции были получены при разрешающей способности 1,64 Å при пучке излучения 21IDF на усовершенствованной установке синхротронного излучения. Данные обрабатывались с использованием iMosflm. Структура была определена путем молекулярного замещения с использованием ПО Phaser в Phenix с ранее опубликованной структуры VEGF-A (PDB: 1VPF) в качестве модели для поиска и одного димера VEGF-A в асимметричной единице. Четкая плотность Fo - Fc присутствовала для варианта VEGF_CKP9.54.90, поэтому структура этого варианта была встроена в плотность вручную с помощью Coot, а затем подвергнута итерациям раундов уточнения и перестройки с использованием Phenix и Coot.
Анализ KDR-CHO VEGF для определения клеточного IC50
Клетки KDR-CHO (клетки СНО, стабильно трансфицированные gD-меченым-KDR) выращивали в среде для роста клеток (DMEM/Ham's -F-12, 10% диафильтрованного FBS (GIBCO кат. № 26400), 25 мМ HEPES, 2 мМ L-GLUTAMAX™). Для исследования VEGF стюимуляции 5×104 клеток/лунку высевали в 100 μмкл клеточной среды (DMEM/Ham's F-12, 0,2% BSA, 0,25% диафильтрованного FBS, 25 мМ HEPES, 2 мМ L-GLUTAMAX™) в 96-луночном планшете для культивирования тканей и инкубировали при 37°C в течение ночи. Среду заменяли 100 μмкл свободной от сыворотки среды для стимуляции клеток (DMEM/Ham's F-12, 0,5% BSA, 25 мМ HEPES) и клетки инкубировали при 37°C в течение 2 часов. За 1 час до стимуляции среду заменяли 50 μмкл среды для стимуляции клеток без сыворотки. Одновременно VEGF (50 нг/мл hVEGF, 100 нг/мл mVEGF и rVEGF) предварительно инкубировали с титрованным количеством CKP или анти-VEGF в 50 μмкл свободной от сыворотки среды для стимуляции клеток при температуре 37°C в течение 1 часа и добавляли к клеткам. Клетки стимулировали в течение 15 мин при температуре 37°С и среду удаляли. Клетки лизировали с помощью130 мкл ледяного буфера для лизиса (150 мМ NaCl, 50 мМ HEPES, 0,5% Triton-X 100, HALT-протеазы и смеси фосфатазного ингибитора (ThermoFisher Scientific, Inc. кат. № 78444), 5 мМ ЭДТА). VEGF-опосредованное фосфорилирование Tyr KDR определяли с помощью ELISA-анализа. Кратко, планшеты MAXISORP™ на 96 лунок(ThermoFisher Scientific, Inc. кат. № 439454) покрывали 100 μмкл анти-gD антитела, разведенного в PBS (1 μмкг/мл) при температуре 4°C в течение ночи, и три раза промывали промывочным буфером (PBS, 0,05% TWEEN®20, pH 7,4). Планшеты блокировали с помощью300 мкл блокирующего буфера (PBS, 0,5% BSA) при комнатной температуре в течение 1 часа с последующим промыванием три раза промывочным буфером. Вышеуказанный клеточный лизат KDR-CHO (100 μмкл) добавляли в каждую лунку и инкубировали при комнатной температуре в течение 2 часов. Планшеты промывали четыре раза промывочным буфером с последующей инкубацией со 100 μмкл 0,5 μмкг/мл биотин-конъюгированного анти-фосфотирозина (клон 4G10, Millipore кат. № 16-103) в блокирующем буфере при комнатной температуре в течение 2 часов. После четырехкратной промывки планшеты инкубировали со 100 μмкл конъюгированного с HRP стрептавидином в блокирующем буфере при комнатной температуре в течение 30 мин. После четырехкратной промывки планшеты обрабатывались 100 μмкл TMB (BD Biosciences) при комнатной температуре в течение 20-30 мин и останавливали добавлением 50 μмкл раствора H2SO4. Оптическая плотность каждой лунки определялась с использованием считывателя микропланшетов, установленного на 450 нм.
Конкурентный ELISA
Специфичность связывания каждого пептида была установлена с помощью конкурентного ELISA. Вначале связывание каждого фактора роста с соответствующим рецептором при проведении ELISA на планшете было подтверждено с помощью покрытия VEGF-A, VEGF-B, VEGF-C, VEGF-D, PlGf-2, NGF, EGF, PDGF-ββ или IGF-1 в количестве 2 или 5 μмкг/мл на планшетах MAXISORP™ в течение ночи при температуре 4°C в PBS. После остановки блокирующим буфером (PBS с 0,5% BSA и 0,05% TWEEN®20) в течение 2 часов при комнатной температуре объединения Fc-рецептор или биотинилированные рецепторы серийно разводили с использованием буфера для анализа (PBS с 0,5% BSA и 0,05% TWEEN® 20) и инкубировали в течение 1 часа при комнатной температуре. Количество объединений рецептор-Fc или биотинилированного рецептора было обнаружено путем инкубации с анти-человеческим Fc-HRP (Life Technologies) или высокоаффинным стрептавидином-HRP (ThermoFisher Scientific, Inc.) соответственно в течение 30 мин. Конкурентный ELISA проводили таким же образом, как описано выше, за исключением того, что после блокирования добавляли смесь серийно разведенного пептида, содержащего постоянную концентрацию объединения рецептор-Fc или биотинилированного рецептора (концентрация рецептора была установлена при EC60) и инкубировали в течение 1 часа. Все рекомбинантные человеческие белки и антитела были приобретены у R&D Systems (Minneapolis, MN).
Анализ Связывания SPR
Кинетику связывания и аффинность ингибиторов VEGF-A оценивали с использованием технологии поверхностного плазмонного резонанса на приборе BIACORE™ 3000 (GE Healthcare) при 37°C с использованием буфера HBS-EP (10 мМ HEPES pH 7,4, 150 мМ NaCl, 3 мМ EDTA и 0,005% об./об. поверхностно-активного вещества Р20), содержащего 0,1% DMSO (об./об.). В зависимости от формата анализа использовали либо стрептавидиновый сенсор (SA), либо датчик с декстраном (CM5), как описано ниже.
Для использования с сенсором SA VEGF-A был вначале биотинилирован (не более 2 биотина на VEGF-A) путем инкубации белка с EZ-link NHS-ПЭГ4-Biotin (Pierce) в молярном соотношении 1:1,5 соответственно, в PBS в течение 2 часов на льду. Реакцию затем останавливали добавлением 10-молярного избытка глицина с pH 8,0 и буфер образца заменяли буфером PBS с использованием ультрацентрифужных фильтров Amicon 0,5 мл 3000 MWCO (EMD Millipore). Состояние биотинилирования белка проверяли с помощью LC-MS-анализа. Затем биотинилированный VEGF-A иммобилизировали на поверхности до тех пор, пока уровень сигнала резонанса (RU) не достиг около ~400. Для иммобилизации VEGF-A на сенсоре CM5 поверхность сначала активировали смесью гидрохлорида N-этил-N'-(3-диметиламинопропил) карбодиимида и N-гидроксисукцинимида (EDC/NHS) в соответствии с инструкциями поставщика. Затем VEGF-A разбавляли в буфере для связывания (0,1 М ацетатный буфер, pH 5,0) и вводили до тех пор, пока сигнал не достиг уровня около 400 RU, а затем промывали с помощью 1 М этаноламина с pH 8,0 для гашения оставшихся активированных сайтов.
После стадии захвата ряд концентраций пептидов получали в буфере HBS-EP с соответствующими концентрациями DMSO до 0,1% и вводили при скорости потока 80 μмкл/мин. Полученные сенсорные диаграммы затем анализировали с использованием модели связывания 1:1 для получения кинетических данных и данных аффинности с использованием Scrubber 2.0 (BioLogic Software).
Синтез CKP и фолдинг
Линейные пептиды-предшественники LRP6 растворяли в DMSO (0,5 мг/мл) в 0,1 М бикарбоната аммония (рН 9), 1 мМ восстановленного глутатиона в 50% DMSO и инкубировали при встряхивании при комнатной температуре в течение 24 часов. После фолдинга CKP очищали с помощью RP-HPLC на колонке C18, а затем собранные фракции анализировали с помощью масс-спектрометрии, объединяли в пул и лиофилизировали перед использованием.
Культура клеток и трансфекция
Клетки HEK293, стабильно трансфицированные люциферазным репортером Wnt светлячка (Gong et al. (2010) PLoS ONE 5,9: e12682). и pRL-SV40 люциферазой Renilla (Promega) выращивали до 90% слияния в DMEM: F12 (50:50) с добавлением 10% FBS, 2 мМ GLUTAMAX™ и 40 мкг/мл гигромицина. Клетки инкубировали в 5% СО2 во влажной камере при 37°С в течение 24 часов. После инкубации клетки трипсинизировали (0,05% Gibco 15400-54 в PBS), затем разбавляли до уровня 4×105 клеток/мл в DMEM: F12 (50:50), с добавлением 10% FBS, 2 мМ GLUTAMAX™. 20 000 клеток загружали в отдельные лунки белых 96-луночных планшетов для микроанализа optilux (кат. № 353947) и инкубировали в течение ~24 ч. Каждую лунку подвергали трансфицированию с использованием FUGENE® HD с Wnt1-pCDNA3.2 (5 нг/лунка) или Wnt3a-pCDNA3.2 (25 нг/лунка), затем выращивали в течение 24 часов. Все LRP6-связывающие варианты разбавляли в DMSO и добавляли к клеткам при конечной концентрации DMSO 1% при концентрациях пептида 0, 0,1, 0,1, 1,0, 10 и 100 μмкМ в течение 6 часов. Для стимуляции рекомбинантным Wnt3a (5036-WN-010/CF, R&D Systems) разбавляли в PBS до 50 нг/мл и добавляли к инкубационным средам с указанным CKP.
Реакцию люциферазы во всех анализах затем измеряли с помощью набора Promega DUAL-GLO® в соответствии с инструкциями производителя, за исключением того, что использовалась половина объема каждого реагента. Люминесценцию светлячка и люминесценцию Renilla измеряли на многоканальном считывающем устройстве Multilabel Reader Perkin Elmer ENVISION™. Уровни люминесценции светлячка: Люминесценцию Renilla рассчитывали и нормировали по отношению к уровню в контрольных клетках, экспрессирующих или обработанных указанным белком Wnt. Ингибирующие константы рассчитывались с использованием нормированных данных в Prism Graphpad с использованием переменной кривой, полученной зависимостью log (ингибитор) от нормализированного ответа Y=100/(1+10^((LogIC50-X)*HillSlope)). Статистическую значимость определяли с использованием метода Holm-Sidak с альфа=5.000%. Вычисления предполагают, что все строки являются образцами из популяций с одинаковым разбросом (SD), а IC50 были идентифицированы как существенно отличающиеся, с использованием теста Фишера (Extra sum-of-squares F test), при уровне статистической значимости P<0,05.
Пример 2A: Получение не встречающихся в природе вариантов EETI-II, связывающих VEGF-A
EETI-II (Фиг. 1) был выбран в качестве каркаса для отображения на поверхности бактериофага M13. EETI-II был слит с N-концом основного белка оболочки M13 p8. Кроме того, gD-метка была соединена с N-концом последовательности EETI-II, чтобы проверить уровни отображения. Три библиотеки пептидных фагов были получены на основе структуры EETI-II следующим образом: библиотека I, в которой аминокислотные остатки петли 1 были рандомизированы и длина петли варьировалась (6, 8, 10 остатков); библиотека II, в которой в петле 5 аминокислотные остатки были рандомизированы и длина нативной петли была фиксирована; и библиотека III, в которой обе петли 1 и 5 одновременно содержали рандомизированные аминокислоты, а длина петли 1 варьировалась от 6 до 10 аминокислотных остатков, в то время как длина петли 5 была фиксирована. В общей сложности три библиотеки содержали 3×1010 уникальных представителей и были задействованы в раундах отбора с VEGF-A.
Пэннинг с VEGF-A выделил тринадцать уникальных вариантов, связанных с hVEGF8-109 (см. Таблицу 19). Эти варианты содержали вариации в составе аминокислот в петле 1 или обеих петлях 1 и 5 одновременно. Кроме того, ряд вариантов имел более длинную петлю по сравнению с нативной петлей, присутствующей в EETI-II. Консервативный мотив YXS также проявился в петле 5. Мы получили растворимые свернутые пептиды с цистиновым узлом, которые соответствуют семи из этих уникальных вариантов, и все они продемонстрировали связывание с hVEGF-A в ELISA с фаговой конкуренцией (Таблица 19). Более того, мы оценили некоторые варианты в клеточном анализе и продемонстрировали кросс-видовое ингибирование активности VEGF-A человека, мыши и крысы с IC50 при низких мкМ.
ТАБЛИЦА 19: Варианты на основе EETI-II, связывающиеся с hVEGF-A
(SEQ ID NO: 92)
(SEQ ID NO: 15)
(SEQ ID NO: 225)
(SEQ ID NO: 15)
(SEQ ID NO: 226)
(SEQ ID NO: 15)
(SEQ ID NO: 227)
(SEQ ID NO: 235)
(SEQ ID NO: 228)
(SEQ ID NO: 236)
(SEQ ID NO: 229)
(SEQ ID NO: 237)
(SEQ ID NO: 8)
(SEQ ID NO: 15)
(SEQ ID NO: 9)
(SEQ ID NO: 16)
(SEQ ID NO: 230)
(SEQ ID NO: 238)
(SEQ ID NO: 10)
(SEQ ID NO: 17)
(SEQ ID NO: 11)
(SEQ ID NO: 18)
(SEQ ID NO: 12)
(SEQ ID NO: 15)
(SEQ ID NO: 13)
(SEQ ID NO: 15)
(SEQ ID NO: 14)
(SEQ ID NO: 15)
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
ТАБЛИЦА 20: ELISA (Фаговая конкуренция) и ингибирующая активность в клеточном анализе растворимых вариантов, на основе EETI-II, связывающихся с hVEGF-A
Чтобы еще больше повысить эффективность этих вариантов, мы сконцентрировали внимание на VEGF_CKP7 и VEGF_CKP9. Мягкая рандомизация проводилась на петлях 1 и 5 в рамках VEGF-CKP7, что привело к 16 уникальным вариантам, связывающимися с человеческим VEGF-A (см. Таблицу 21 ниже).
ТАБЛИЦА 21: CKP_7 варианты, связывающиеся с hVEGF-A после созревания аффинности
(SEQ ID NO: 9)
(SEQ ID NO: 16)
(SEQ ID NO: 287)
(SEQ ID NO: 292)
(SEQ ID NO: 60)
SEQ ID NO: 71)
(SEQ ID NO: 61)
(SEQ ID NO: 72)
(SEQ ID NO: 62)
(SEQ ID NO: 73)
(SEQ ID NO: 288)
(SEQ ID NO: 76)
(SEQ ID NO: 62)
(SEQ ID NO: 16)
(SEQ ID NO: 289)
(SEQ ID NO: 16)
(SEQ ID NO: 290)
(SEQ ID NO: 16)
(SEQ ID NO: 63)
(SEQ ID NO: 74)
(SEQ ID NO: 64)
(SEQ ID NO: 75)
(SEQ ID NO: 65)
(SEQ ID NO: 76)
(SEQ ID NO: 66)
(SEQ ID NO: 274)
(SEQ ID NO: 291)
(SEQ ID NO: 73)
(SEQ ID NO: 67)
(SEQ ID NO: 77)
(SEQ ID NO: 68)
(SEQ ID NO: 78)
(SEQ ID NO: 69)
(SEQ ID NO: 79)
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
Мягкая рандомизация проводилась на петлях 1 и 5 в рамках VEGF-CKP9, что привело к 16 уникальным вариантам, связывающимися с человеческим VEGF-A (см. Таблицы 22-24 ниже).
ТАБЛИЦА 22: Петля 1 Вариантов VEGF_CKP9, Связывающихся с VEGF-A После Созревания Аффинности
(SEQ ID NO: 10)
(SEQ ID NO: 245)
(SEQ ID NO: 246)
(SEQ ID NO: 247)
(SEQ ID NO: 248)
(SEQ ID NO: 249)
(SEQ ID NO: 368)
(SEQ ID NO: 250)
(SEQ ID NO: 36)
(SEQ ID NO: 251)
(SEQ ID NO: 252)
(SEQ ID NO: 253)
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
ТАБЛИЦА 23: Петля 5 Вариантов VEGF_CKP9, Связывающихся с VEGF-A После Созревания Аффинности
(SEQ ID NO:17)
(SEQ ID NO: 133)
(SEQ ID NO: 17)
(SEQ ID NO: 43)
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
ТАБЛИЦА 24: Петли 1 и 5 Вариантов VEGF_CKP9, Связывающихся с VEGF-A После Созревания Аффинности
(SEQ ID NO: 10)
(SEQ ID NO:17)
(SEQ ID NO: 28)
(SEQ ID NO: 17)
(SEQ ID NO: 29)
(SEQ ID NO: 41)
(SEQ ID NO: 30)
(SEQ ID NO: 42)
(SEQ ID NO: 254)
(SEQ ID NO: 46)
(SEQ ID NO: 255)
(SEQ ID NO: 44)
(SEQ ID NO: 256)
(SEQ ID NO: 262)
(SEQ ID NO: 31)
(SEQ ID NO: 43)
(SEQ ID NO: 32)
(SEQ ID NO: 44)
(SEQ ID NO: 257)
(SEQ ID NO: 263)
(SEQ ID NO: 258)
(SEQ ID NO: 17)
(SEQ ID NO: 33)
(SEQ ID NO: 45)
(SEQ ID NO: 34)
(SEQ ID NO: 44)
(SEQ ID NO: 35)
(SEQ ID NO: 46)
(SEQ ID NO: 259)
(SEQ ID NO: 133)
(SEQ ID NO: 37)
(SEQ ID NO: 44)
(SEQ ID NO: 260)
(SEQ ID NO: 264)
(SEQ ID NO: 261)
(SEQ ID NO: 43)
(SEQ ID NO: 39)
(SEQ ID NO: 567)
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
Эти клоны отбирали для дальнейшей валидации в анализе титрования фагом, а растворимые свернутые формы, соответствующие десяти из этих последовательностей, были получены для дальнейшей оценки in vitro (см. Таблицу 25 ниже). Из этого набора вариантов, VEGF_CKP9.2, VEGF_CKP9.54 и VEGF_CKP9.63 демонстрировали улучшенную эффективность с VEGF-A по сравнению с исходным VEGF-CKP9 в исследовании in vitro и в клеточном анализе с IC50 в диапазоне 100-200 нМ (см. Таблицу 25).
ТАБЛИЦА 25: Ингибирующая активность в фаговой конкуренции ELISA и ELISA взаимодействия VEGF-A-KDR
Чтобы повысить эффективность, мы выбрали молекулы-лидеры 9.54 и 9.63 и создали новые библиотеки фагов на основе этих молекул, в которых цикл 2 был рандомизирован. Новые библиотеки были подвергнуты пэннингу с hVEGF-A и дали несколько вариантов цикла 2, которые продемонстрировали значительно улучшенную эффективность с VEGF-A по сравнению с исходными молекулами 9.54 и 9.63 (см. Таблицы 26 и 27 ниже соответственно), причем наиболее эффективные молекулы проявляют IC50 в диапазоне 0,5-2 нМ (см. Таблицу 28 ниже).
ТАБЛИЦА 26: Варианты 9.54, связывающиеся с VEGF-A с Рандомизированной Петлей 2 После Созревания Аффинности
(SEQ ID NO: 10)
(SEQ ID NO: 93)
(SEQ ID NO: 17)
(SEQ ID NO: 33)
(SEQ ID NO: 93)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 94)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 95)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 298)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 299)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 300)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 301)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 302)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 303)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 304)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 305)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 96)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 306)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 307)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 308)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 309)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
ТАБЛИЦА 27: Варианты VEGF_CKP9.63, связывающиеся с VEGF-A с рандомизированной петлей 2 после созревания аффинности *S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем
(SEQ ID NO: 10)
(SEQ ID NO: 322)
(SEQ ID NO: 17)
(SEQ ID NO: 35)
(SEQ ID NO: 323)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 118)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 324)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 325)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 326)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 327)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 328)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 119)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 329)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 330)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 331)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 332)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 120)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 333)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 334)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ IDNO: 335
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 336)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 337)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 338)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 211)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 339)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 322)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 323)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 118)
(SEQ ID NO: 46)
ТАБЛИЦА 28: Ингибирующая активность вариантов VEGF_CKP9.54 и VEGF_CKP9.63, связывающихся с VEGF-A, с рандомизированной петлей 2
(нМ)
IC50
(нМ)
(SEQ ID NO: 10)
(SEQ ID NO: 93)
(SEQ ID NO: 17)
(SEQ ID NO: 33)
(SEQ ID NO: 93)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 94)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 95)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 96)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 35)
(SEQ ID NO: 93)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 117)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 119)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 120)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 211)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 118)
(SEQ ID NO: 46)
Аффинность/эффективность VEGF_CKP9.63.1, VEGF_CKP9.63.27, VEGF_CKP9.63.44, VEGF_CKP9.63.69 и VEGF_CKP9.63.12 с hVEGF-A (8-109) приведены ниже в Таблице 29.
ТАБЛИЦА 29
Варианты VEGF_CKP9.54.90 (см. строку 2 Таблицы 26) и VEGF_CKP9.63.12 (см. строку 6 Таблицы 27), а также исходные варианты VEGF_CKP9.54 (см. строку 12 Таблицы 24) и VEGF_CKP9.63 (см. строку 15 Таблицы 24), связываются с аналогичной аффинностью к VEGF-A человека, мыши, крысы и кролика, как определено поверхностным плазмонным резонансом. См. Таблицу 30 ниже.
ТАБЛИЦА 30: Кинетика связывания и аффинность VEGF_CKP9.54.90, VEGF_CKP9.63.12, VEGF_CKP9.54 и VEGF_CKP9.63 для различных изоформ VEGF.
VEGF_CKP9.54.90 также является высокоселективным по отношению к VEGF-A и не связывается с или не ингибирует активность других изоформ VEGF, таких как VEGF-B, VEGF-C и VEGF-D или другие факторы роста, такие как P1GF, EGF, NGF, IGF и PDGF. Как показано на Фиг. 2А и 2В вариант VEGF_CKP9.54.90 нарушает взаимодействие между VEGF-A и KDR, а также взаимодействие между VEGF-A и Flt-1, но не нарушает взаимодействие между VEGF-B и Flt-1, между VEGF-C и Flt-4, между VEGF-D и Flt-4, между PIGF-2 и Flt-1, между EGF и EGFR, между PDGF и PDGFR, между NGF и NGFR или между IGF и IGFR.
В отличие от EETI-II, VEGF_CKP9.54.90, VEGF_CKP9.54 и VEGF_CKP9.63.12 не ингибируют активность протеазы трипсина, как определено при исследовании расщепления пептидного субстрата (Stanger et al. (2014) FEBS Lett. 588 (23), 4487-96). См. Фиг. 3. Однако VEGF_CKP9.54.90 и VEGF_CKP9.63.12 сохраняют уровень устойчивости к трепсиновому расщеплению (см. Фиг. 4). Примерно 20% VEGF_CKP9.54.90 расщеплялось в положении Arg13 в петле 2 после 24-часовой инкубации с трипсином при температуре 37°C.
VEGF_CKP9.54, VEGF_CKP9.63 и VEGF_CKP9.54.90 содержат примерно альфа-спираль длиной около 3 оборотов, и каждый из них принимает дисульфидную сигнатуру, отличную от таковой для EETI-II дикого типа (C1-C4, C2-C3, C5-C6 для VEGF_CKP9.54.90 при сравнении с C1-C4, C2-C5, C3-C6 EETI-II дикого типа). См. Фиг. 5. С одной стороны спирали VEGF_CKP9.54.90 образует конденсированную бициклическую структуру, которая соединяется двумя дисульфидными связями (C1-C4 и C2-C3), охватывая петли 1, 2 и 3 и ~ 1,5 оборота альфа-спирали. Петля 5 образуется на противоположной стороне спирали и ограничена дисульфидной связью С5-С6.
Получены сокристаллические структуры VEGF_CKP9.54, VEGF_CKP9.63 и VEGF_CKP9.54.90 в комплексе с VEGF-A. Сокристаллические структуры VEGF_CKP9.54, VEGF_CKP9.63 и VEGF_CKP9.54.90 в комплексе с VEGF-A очень подобны. См. Фиг. 5 и 6, на которых изображена сокристаллическая структура VEGF_CKP9.54 в комплексе с VEGF-A. Учитывая, что структуры VEGF_CKP9.54, VEGF_CKP9.63 и VEGF_CKP9.54.90 очень похожи, (см. Фиг. 5 и 6) дальнейшие исследования проводились с VEGF_CKP9.54.90. Спираль, определяемая остатками Phe15 - Tyr26 VEGF_CKP9.54.90, формирует обширные гидрофобные и полярные взаимодействия с поверхностью VEGF-A (см. Таблицу 31 ниже). Кроме того, существует сеть опорных H-связей, которая образуется внутри и стабилизирует альфа-спираль, длиной в 3 оборота. В целом, VEGF_CKP9.54.90 демонстрирует компактную и жесткую структуру, стабилизированную внутримолекулярными полярными и гидрофобными связями, включая связи остов-остов, связи боковых цепей с остовом и связи между боковыми цепями (Таблица 32). Поверхность VEGF_CKP9.54.90, которая контактирует с VEGF-A, в основном является гидрофобной по своей природе с несколькими полярными боковыми цепями (Таблица 31), тогда как противоположная поверхность пептида, которая не взаимодействует с VEGF-A, контактирует с растворителем и в основном является полярной по своей природе.
ТАБЛИЦА 31: Остатки VEGF_CKP9.54.90, которые находятся в пределах 4 Å димера VEGF-A
ТАБЛИЦА 32: Краткое описание внутримолекулярных связей VEGF_CKP9.54.90
Участок связывания VEGF_CKP9.54.90 на VEGF-A перекрывается с таковым для связывания природных рецепторов и антитела G6.31 (Фиг. 7 и 8). Контактные остатки на VEGF-A, которые находятся в сайте связывания пептида, указаны в Таблице 33 и показаны на Фиг. 9. Эпитоп связывания VEGF_CKP9.54.90 на VEGF-A отличается от такового для связывания с ранибизумабом и бевацизумабом (Фиг. 10), которые не связываются с VEGF-A мыши или крысы, поскольку их взаимодействие с VEGF-A человека зависит от ключевого остатка Gly88, который замещен на Ser у грызунов. Модель связывания VEGF_CKP9.54.90 предполагает, что оно существенно не зависит от Gly88, и это утверждение подтверждается наблюдением, что пептид эффективно связывается как с человеческим, так и с VEGF-A грызуна. Сайт-направленный мутагенез использовался для проверки ряда контактов на границе белок-пептид, известной из кристаллической структуры. Как и ожидалось, мутации Y21A, Q89A и F17A/M81A в VEGF-A приводили к уменьшенному связыванию VEGF_CKP9.54.90 с VEGF-A. См. Фиг. 11. Однако мутация K48A улучшала связывание VEGF_CKP9.54.90 примерно в 2-3 раза, поведение, аналогичное поведению, наблюдаемому с антителом G6.31 (Fuh et al. (2006) J. Biol. Chem. 281, 6625-6631). См. Таблицу 34 ниже и Фиг. 11.
ТАБЛИЦА 33: Остатки димера VEGF-A, которые находятся в пределах 4 Å от VEGF_CKP9.54.90
ТАБЛИЦА 34: Кинетика связывания и аффинность VEGF_CKP9.54.90, VEGF_CKP9.63.12, VEGF_CKP9.54 и VEGF_CKP9.63 для различных мутантов hVEGF-A.
(ошибка)
(ошибка)
(нМ)
(ошибка)
Затем связывающие варианты VEGF-A VEGF_CKP9.54.90, VEGF_CKP9.63.12 и VEGF_CKP9.63.44 были оценены на их эффективность in vivo в модели VEGF-A-опосредованной хориоидальной неоваскуляризации. Выжженные лазером пятна были созданы в глазах крыс, и образование новых сосудов оценивалось после 14-дневного периода в присутствии и отсутствии пептида, который вводился внутримышечно с различными интервалами. Пептид VEGF_CKP9.54.90 продемонстрировал эффективное ингибирование вызванной лазером хориоидальной неоваскуляризации в глазах у крыс, что было выявлено с помощью значительного снижения, наблюдаемого в неоваскулярной области в глазах, обработанных пептидом, по сравнению с глазами контрольной группы. См. Фиг. 12.
Сокристаллическая структура VEGF_CKP9.54.90 в комплексе с VEGF-A показала, что нативные аминокислотные остатки в петлях 3 и 4 необязательно находятся в оптимальных ориентациях для связывания с VEGF-A (см. Фиг. 9) и могут быть модифицированы для усиления их взаимодействия с поверхностью VEGF-A или для обеспечения внутримолекулярных взаимодействий внутри пептида, которые могут улучшить фолдинг и стабильность пептидов. Поэтому с целью дальнейшего улучшения эффективности и поведения молекул-лидеров были созданы новые библиотеки фагов на основе последовательностей 9.54, 54.1 и 9.63, 63.12, в которых были рандомизированы только петли 3 и 4. Эти специфические структуры, хотя и немного слабее, чем молекулы-лидеры, были выбраны для того, чтобы обеспечить достаточный динамический диапазон в анализе для выявления улучшения аффинности. Было идентифицировано много новых клонов, содержащих вариации в петлях 3 и 4, которые показали улучшенное связывание с VEGF-A. Четырнадцать из полученных последовательностей были отобраны и перенесены на петли 3 и 4 внутри молекул-лидеров VEGF_CKP9.54.90 или VEGF_CKP9.63.12 и соответствующие растворимые молекулы затем были получены в уложенном после фолдинга виде. Аминокислотные последовательности четырнадцати вариантов после созревания аффинности представлены в Таблице 35 ниже.
ТАБЛИЦА 35: Варианты VEGF-A связывающей петли 3/петли 4 после созревания аффинности на основе каркасов VEGF_CKP9.54.90 или VEGF_CKP9.63.12
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 33)
(SEQ ID NO: 97)
(SEQ ID NO: 45)
(SEQ ID NO: 35)
(SEQ ID NO: 118)
(SEQ ID NO: 46)
(SEQ ID NO: 35)
(SEQ ID NO: 118)
(SEQ ID NO: 46)
Все растворимые молекулы, содержащие вариации L3/L4, показали улучшенную эффективность в клеточном анализе относительно 54.90 или 63.12.12. Три молекулы-лидера, VEGF_CKP9.54.90.67, VEGF_CKP9.54.90.53 и VEGF_CKP9.63.12.12 имели клеточные значения IC50 в диапазоне от около 0,5 до около 1 нМ. См. Фиг. 13 и Таблицу 36 ниже.
ТАБЛИЦА 36: Значения IC50 для вариантов в Таблице 35
IC50 (нМ)
Сокристаллическая структура VEGF_CKP9.63 в комплексе с VEGF-A показала, что остаток Tyr в положении 8 внутри петли 1 может образовывать водородную связь с боковой цепью Gln22 на VEGF-A. См. Фиг. 14. В вариантах, полученных из VEGF_CKP9.54 (таких, как варианты в Таблице 35), аминокислота в положении 8 представляет собой Phe. Поэтому мы стремились мутировать Phe8 в Tyr I в некоторых вариантах в Таблице 35 с целью улучшения аффинности и/или растворимости результирующего F8Y-варианта. Мутация F8Y показала умеренное улучшение аффинности/активности некоторых молекул (например, VEGF_CKP9.54.1.F8Y, VEGF_CKP9.54.90.F8Y и VEGF_CKP9.54.90.67.F8Y), тогда как в немногих других случаях она демонстрировала минимальные или слегка отрицательные эффекты (например, VEGF_CKP9.54.90.13.F8Y и VEGF_CKP9.54.90.62.F8Y). См. Таблицу 37, в которой сравниваются аффинность связывания определенных вариантов (при определении с помощью поверхностного плазмонного резонанса) и Таблицу 38, в которой сравнивается эффективность некоторых вариантов (при определении IC50 в клеточном анализе). Замена F8Y помогла улучшить растворимость VEGF_CKP9.54.90.67.F8Y примерно на 2 мг/мл. VEGF_CKP9.54.90.67.F8Y был выбран для дальнейших исследований.
ТАБЛИЦА 37: Кинетика связывания и аффинность VEGF_CKP9.54.1.F8Y, VEGF_CKP9.54.90.F8Y, VEGF_CKP9.54.90.67.F8Y, VEGF_CKP9.54.90.13.F8Y и VEGF_CKP9.54.90.62.F8Y с VEGF-A
Окислительную стабильность различных вариантов CKP анализировали следующим образом: 5 мкл 11 мМ AAPH (Calbiochem кат. № 100110) в воде добавляли к 50 мкл образца варианта пептида (полученного в виде 1 мг/мл пептида в 20 мМ ацетата гистидина, рН 5,5) и смесь инкубировали в течение 16 часов при температуре 40°С. В конце инкубации реакцию в образце останавливали добавлением 27,5 мкл 40 мМ метионина с последующим добавлением 160 мкл 20 мМ ацетата гистидина и 100 мМ сахарозы при рН 5,5 для разбавления образцов. Реакции анализировали с помощью LC-MS.
Было замечено, что VEGF_CKP9.54.90 подвергается ~30% окислению в в положении Met5 в петле 1. Замена Met 5 неприродной аминокислотой норлейцином формирует VEGF_CKP9.54.90, полностью устойчивый к окислению. Замена Met5 норлейцином также оказала благоприятное влияние на эффективность связывания (~2-кратное улучшение). Были получены варианты VEGF_CKP9.54.90.67 F8Y M5Nle, VEGF_CKP9.54.90.53 M5Nle и VEGF_CKP9.63.12.12 M5Nle. Все три варианта Met5Nle показали умеренное улучшение клеточной активности в 1,5-2 раза по сравнению с их исходными молекулами.
Затем оценивали влияние нафталиновых аминокислотных замен в положении Trp9 в петле 1 VEGF_CKP9.54.90 на аффинность связывания VEGF-A. Кристаллические структуры VEGF_CKP9.54.90 в комплексе с VEGF показывают, что остаток Trp9 VEGF_CKP9.54.90 (и полученные от него варианты) взаимодействует с поверхностью VEGF-A с остаточным пространством, которое может позволить встраивать более крупные кольцевые системы. Для проверки этой гипотезы были получены растворимые варианты VEGF_CKP9.54.90, в которых индольное кольцо Trp9 заменено 1- или 2-нафтильными изомерами. Эти молекулы показали снижение клеточной активности относительно исходного VEGF_CKP9.54.90. Дополнительные данные о активности вариантов, полученных от VEGF_CKP9.54.90, содержащих замещение F8Y и/или замещение неприродной аминокислотой, приведены в Таблице 38:
ТАБЛИЦА 38: IC50 вариантов, полученных от VEGF_CKP9.54.90, содержащих замену F8Y и/или замену неестественной аминокислотой.
IC50 (нМ)
Укорачивание молекулы-лидера VEGF_CKP9.54.90. F8Y путем удаления двух глициновых остатков на N- и С-концах для получения варианта VEGF_CKP9.54.90 F7Y Δ2G) приводило к небольшому снижению клеточной активности по сравнению с VEGF_CKP9.54.90. См. Таблицу 38 выше.
Пример 2Б: Получение VEGF-A-связывающих неприродных вариантов EETI-II, содержащих C-концевые аминокислотные вставки
Чтобы идентифицировать дополнительные варианты пептидов с повышенным сродством к VEGF-A, мы выбрали молекулы 9.54 (SEQ ID NO: 52), 9.54.1 (SEQ ID NO: 99) и создали новые библиотеки фагов на основе этих структур, в которых две дополнительных аминокислоты добавляли к их С-концам.
Из библиотеки 9.54 было идентифицировано двадцать два клона, уровни сигнала связывания которых с hVEGF-A (8-109) были более чем в 3 раза выше, чем для BSA (фон) (Таблица 39). Эти молекулы содержали изменения в составе аминокислот в петле 2, в петлях 2 и 4, или в петлях 2, 4 и 5.
ТАБЛИЦА 39: Варианты 9.54 с Двумя Аминокислотными Вставками на C-конце
Из библиотеки 9.54.1 было идентифицировано двадцать два клона, уровни сигнала связывания которых с hVEGF-A (8-109) были более чем в 3 раза выше, чем для BSA (фон) (Таблица 40).
ТАБЛИЦА 40: Варианты 9.54.1 с Двумя Аминокислотными Вставками на C-конце
Клон 9.54-28 (в Таблице 39) показал приблизительно 10-кратное улучшение аффинности связывания с hVEGF-A (8-109) по сравнению с 9.54, что было определено с помощью ELISA с фаговой конкуренцией (описано выше). См. Фиг. 15). Клоны 9.54.1-2, 9.54.1-36, 9.54.1-42, 9.54.1-63 и 9.54.1-90 (в Таблице 40) также показали приблизительно 10-кратное увеличение аффинности связывания с hVEGF-A (8-109) по сравнению с 9.54.1, что было определено с помощью ELISA с фаговой конкуренцией. См. Фиг. 15).
Пептиды 9.63 (SEQ ID NO: 55) и 9.63.44 (SEQ ID NO: 125) были выбраны для дальнейшей модификации, как описано выше. Были созданы новые библиотеки фагов на основе этих структур, в которые были добавлены две дополнительные аминокислоты к их С-концам.
Из библиотеки 9.63 было идентифицировано 28 клонов, уровень сигнала связывания которых с hVEGF-A (8-109) был более чем в 3 раза выше, чем для BSA (фон) (Таблица 41). Эти молекулы содержали изменения в составе аминокислот в петлях 2 и 4.
ТАБЛИЦА 41: Варианты 9.63 с Двумя Аминокислотными Вставками на C-конце
Из библиотеки 9.63.44 было идентифицировано 17 клонов, уровни сигнала связывания которых с hVEGF-A (8-109) были более чем в 3 раза выше, чем для BSA (фон) (Таблица 42). Эти молекулы содержали изменения в составе аминокислот в петле 4. Клон 9.63.44-55 содержал изменение в составе аминокислот в петле 2, а клон 9.63.44-10 содержал изменение в составе аминокислот в петле 3. Интересно, что клон 9.63.44-12 в Таблице 42 и клон 9.63-70 в Таблице 41 имеют одну и ту же аминокислотную последовательность.
ТАБЛИЦА 42: Варианты 9.63.44 с Двумя Аминокислотными Вставками на C-конце
Клоны с 9.63.44-1 по 9.63.44-14 (в Таблице 42) показали улучшенную аффинность связывания с hVEGF-A (8-109) по сравнению с 9.63.44, что было определено с помощью ELISA с фаговой конкуренцией. (См. Фиг. 16A и 16Б).
В совокупности приведенные выше результаты показывают, что удлинение пептидов 9.54 (SEQ ID NO: 52), 9.54.1 (SEQ ID NO: 99), 9.63 (SEQ ID NO: 55) и 9.63.44 путем добавления двух аминокислот к C-концам этих вариантов, имеют в ~10-крат большую аффинность связывания с hVEGF-A (8-109).
Затем для дальнейшей модификации, как описано выше, были выбраны пептиды 9.54.90 (SEQ ID NO: 102) и 63.12.12.M5L (SEQ ID NO: 386). Кратко, новые библиотеки фагов были созданы на основе 9.54.90, в которых на С-конце были добавлены две дополнительные аминокислоты, три дополнительные аминокислоты или четыре дополнительные аминокислоты. Второй набор библиотек был создан на основе 63.12.12.M5L, в котором на С-конце были добавлены две дополнительные аминокислоты.
Из библиотек 9.54.90, содержащих две дополнительные аминокислоты на C-конце, были идентифицированы 6 клонов, уровень сигнала связывания которых с hVEGF-A (8-109) был более чем в 3 раза выше, чем для BSA (фон) (Таблица 43).
ТАБЛИЦА 43: Варианты 9.54.90 с Двумя Аминокислотными Вставками на C-конце
Из библиотек 9.54.90, содержащих три дополнительные аминокислоты на C-конце, были идентифицированы 10 клонов, уровень сигнала связывания которых с hVEGF-A (8-109) был более чем в 3 раза выше, чем для BSA (фон) (Таблица 44).
ТАБЛИЦА 44: Варианты 9.54.90 с Тремя Аминокислотными Вставками на C-конце
Все пептиды из библиотек 9.54.90, содержащие 4 дополнительные аминокислоты на С-конце, содержали 3 дополнительные аминокислоты на С-конце.
Из библиотек пептидов 63.12.12.M5L, содержащих 2 дополнительные аминокислоты на C-конце, были идентифицированы 9 клонов, уровень сигнала связывания которых с hVEGF-A (8-109) был более чем в 3 раза выше, чем для BSA (фон) (Таблица 45).
ТАБЛИЦА 45: Варианты 63.12.12.M5L с Двумя Аминокислотными Вставками на C-конце
Пример 2C: Характеристика VEGF-A-связывающих неприродных вариантов EETI-II, содержащих C-концевые аминокислотные вставки
Варианты, приведенные в Таблицах 43-45 выше, анализировали с помощью ELISA с фаговой конкуренцией, как описано выше, для определения вариантов с большей аффинностью связывания с hVEGF-A (8-109).
Клоны (например, такие, как указанные в Таблицах 39-45), демонстрирующие большую аффинность к hVEGF (8-109), включая, например, 9.54.1-2, 9.54.1-36, 9.54.1-42, 9.54.1-63 и 9.54.1-90 и 9.63.44-1-9.63.44-14 были затем выбраны для дальнейшего оценивания in vitro, например для исследования ингибирующей активности в ELISA с фаговой конкуренцией и с помощью ELISA для исследования взаимодействия VEGF-KDR, как описано выше.
Затем клоны анализировали с помощью поверхностного плазмонного резонанса для определения их аффинности к различным изоформам VEGF, включая hVEGF-A (8-109), hVEGF-A 165, VEGF-A 164 мыши, VEGF-A крысы и VEGF-A кролика.
Дальнейшие исследования проводили для оценки специфичности клонов к VEGF-A. Например, конкурентные ELISA выполняли, как описано выше, с VEGF-A, VEGF-B, VEGF-C, VEGF-D, PlGf-2, NGF, EGF, PDGF-β или IGF-1.
Клоны также анализировали на их способность ингибировать активность протеазы трипсина при исследовании расщепления пептидного субстрата (Stanger et al. (2014) FEBS Lett. 588 (23), 4487-96).
Кинетика связывания и аффинность клонов к различным мутантам hVEGF, включая, например, Y21A, K48A, Q89A и F17A/M81A, определяли способами, описанными выше.
Далее, оценивали эффективность клонов in vivo в модели VEGF-A-опосредованной хориоидальной неоваскуляризации способами, описанными выше.
Окислительную стабильность вариантов анализировали способами, описанными выше.
Пример 3: Получение не встречающихся в природе вариантов EETI-II, связывающих LRP6
Нативные библиотеки EETI-II, описанные в примере 2А, подвергались циклическому отбору с белком LRP6 E1E2. Было идентифицировано двадцать два уникальных клона, которые связывались с LRP6 E1E2 (Таблица 46). Эти исходные молекулы содержали изменения содержания аминокислот в петлях 1 и 5. В нескольких вариантах длина петли 1 является большей по сравнению с петлей нативной структуры EETI-II. Примечательно, что эволюционно молодые последовательности, связывающиеся с LRP6, содержали консенсусный мотив в петле 1 (NXI), который похож на мотив (NAI), присутствующий в нативных молекулах Dkk1, которые являются эндогенными LRP6-лигандами. Эволюционно молодые варианты повторяют мотив, который встречается в природных лигандах.
ТАБЛИЦА 46: Варианты на основе EETI-II, связывающиеся с LRP6 E1E2
*S/N=соотношение уровня сигнала к шуму при сравнении с BSA контролем.
Внеклеточный домен LRP6 состоит из четырех пропеллерных доменов (E1-E4), которые взаимодействуют с рецепторами Frizzled и белками Wnt для передачи сигнала Wnt. Используя модульный подход, LRP6 различает сигналы Wnt1 или Wnt3a посредством избирательного связывания как своих доменов E1-E2, так и E3-E4 с определенными соответствующими изоформами Wnt (Hannoush et al. (2010) J. Biol. Chem. 285, 9172-9179). Для фармакологического определения сигнальных цепей Wnt1 и Wnt3a мы стремились идентифицировать лиганды, которые избирательно связываются с LRP6 E1-E2.
Из идентифицированных последовательностей R1, LRP6_CKP6 и LRP6_CKP19 были получены упакованные, растворимые формы для проверки их фармакологической активности относительно передачи сигналов Wnt1 или Wnt3a. Как показано в Таблицах 47 и 48 ниже, значительная селективность не наблюдалась у R77 относительно Wnt1 или Wnt3a в клеточном сигнальном репортерном исследовании. С другой стороны, R1 и R19 демонстрировали избирательное ингибирование по отношению к передаче сигнала Wnt1 относительно Wnt3a (в 160 раз и 11 раз для Wnt1 относительно Wnt3a, соответственно) при репортерном люциферазном исследовании, подтверждая представление о том, что эти варианты не таргетируют LRP6 E3-E4 домены (IC50> 44 мкМ). В целом, данные указывают на специфику эволюционно молодых вариантов и эффектов при их подражании мотиву, который обнаруживается в естественных лигандах. Что более важно, идентифицированные варианты предоставляют фармакологические средства для выяснения путей передачи сигналов Wnt1 и Wnt3.
ТАБЛИЦА 47: Ингибирующая активность LRP6-связывающих CKP-вариантов относительно передачи сигналов Wnt1
Wnt1 (5нг/лунку)
ТАБЛИЦА 48: Ингибирующая активность LRP6-связывающих CKP-вариантов относительно передачи сигналов Wnt3a
Wnt3a (5нг/лунку)
F1, F2 и F3 в Таблицах 47 и 48 относятся к пиковым фракциям 1, 2 и 3 соответственно, которые были получены при очистке R1, LRP6_CKP6 и LRP6_CKP19.
Вышеприведенные примеры предлагаются только в иллюстративных целях и не должны рассматриваться как каким-либо образом ограничивающие объем данного изобретения. Различные модификации изобретения в дополнение к тем, которые показаны и описаны в данном документе будут очевидными для специалистов в данной области техники исходя из предшествующего описания и входят в объем прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Genentech, Inc.
<120> ПЛАТФОРМА НА ОСНОВЕ КАРКАСА ЦИСТИНОВОГО УЗЛА
<130> 146392026840
<150> US 62/219,063
<151> 2015-09-15
<160> 568
<170> FastSEQ для Windows Версии 4.0
<210> 1
<211> 28
<212> БЕЛОК
<213> Ecballium elaterium
<400> 1
Gly Cys Pro Arg Ile Leu Met Arg Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25
<210> 2
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1, 2, 3, 4, 5, 6
<223> Xaa = Любая Аминокислота
<400> 2
Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 3
<211> 7
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1, 2, 3, 4, 5, 6, 7
<223> Xaa = Любая Аминокислота
<400> 3
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 4
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1, 2, 3, 4, 5, 6, 7, 8
<223> Xaa = Любая Аминокислота
<400> 4
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 5
<211> 9
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1, 2, 3, 4, 5, 6, 7, 8, 9
<223> Xaa = Любая Аминокислота
<400> 5
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 6
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1, 2, 3, 4, 5, 6, 7, 8, 9, 10
<223> Xaa = Любая Аминокислота
<400> 6
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 7
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1, 2, 3, 4, 5
<223> Xaa = Любая Аминокислота или неприродная аминокислота
<400> 7
Xaa Xaa Xaa Xaa Xaa
1 5
<210> 8
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 8
Pro Thr Thr Arg Phe Lys Gln Tyr
1 5
<210> 9
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 9
Gln Asp Pro Thr Phe Asn Trp Ala Leu Tyr
1 5 10
<210> 10
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 10
Gln Leu Met Gln Pro Phe Trp Gly
1 5
<210> 11
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 11
Arg Asp Leu Asp Val Lys Trp Asp
1 5
<210> 12
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 12
Arg Thr Pro Trp Glu Pro His Asp Ile Thr
1 5 10
<210> 13
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 13
Thr Thr Pro Trp Pro Pro His Glu Ile Met
1 5 10
<210> 14
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 14
Val Thr Pro Trp Lys Pro His Trp Ile Asn
1 5 10
<210> 15
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 15
Gly Pro Asn Gly Phe
1 5
<210> 16
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 16
Gln Met Tyr Gln Ser
1 5
<210> 17
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 17
His Trp Tyr Gln Ser
1 5
<210> 18
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 18
Gln Tyr Tyr Ser Ser
1 5
<210> 19
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 19
Gly Pro Asn Gly Phe
1 5
<210> 20
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = G или E или Y или Q или H
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = P или M или W или Y
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = N или Y или W
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = G или D или T или Q или R или S
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = F или A или E или S
<400> 20
Xaa Xaa Xaa Xaa Xaa
1 5
<210> 21
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 21
Gly Cys Pro Thr Thr Arg Phe Lys Gln Tyr Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 22
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 22
Gly Cys Gln Asp Pro Thr Phe Asn Trp Ala Leu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Gln Ser Cys Gly
20 25 30
<210> 23
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 23
Gly Cys Gln Leu Met Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 24
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 24
Gly Cys Arg Asp Leu Asp Val Lys Trp Asp Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Phe Cys Gln Tyr Tyr Ser Ser Cys Gly
20 25 30
<210> 25
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 25
Gly Cys Arg Thr Pro Trp Glu Pro His Asp Ile Thr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 26
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 26
Gly Cys Thr Thr Pro Trp Pro Pro His Glu Ile Met Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 27
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 27
Gly Cys Val Thr Pro Trp Lys Pro His Trp Ile Asn Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 28
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 28
Asp Val Leu Gln Pro Phe Trp Gly
1 5
<210> 29
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 29
Gln Ile Ser Gln Pro Phe Trp Gly
1 5
<210> 30
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 30
Asp Arg Met Gln Pro Leu Trp Gly
1 5
<210> 31
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 31
Asn Leu Met Leu Pro Phe Trp Gly
1 5
<210> 32
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 32
Gln Arg Thr Gln Pro Phe Trp Gly
1 5
<210> 33
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 33
Asn Ile Met Leu Pro Phe Trp Gly
1 5
<210> 34
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 34
Asp Pro Met Gln Pro Phe Trp Gly
1 5
<210> 35
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 35
Asp Val Met Gln Pro Tyr Trp Gly
1 5
<210> 36
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 36
Asp Ile Met Gln Pro Leu Trp Gly
1 5
<210> 37
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 37
Gln Leu Leu Gln Pro Leu Trp Gly
1 5
<210> 38
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 38
Asn Pro Met Leu Pro Leu Trp Gly
1 5
<210> 39
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 39
Lys Leu Phe Glu Pro Leu Trp Gly
1 5
<210> 40
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Q или D или K или N или A или R или H
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = L или V или I или R или P или V
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = M или L или S или T или F
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Q или E или L или H
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = F или L или M или Y или S
<400> 40
Xaa Xaa Xaa Xaa Pro Xaa Trp Gly
1 5
<210> 41
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 41
His Phe Tyr Asn Ser
1 5
<210> 42
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 42
Leu Trp Tyr Lys Ser
1 5
<210> 43
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 43
Arg Trp Tyr His Ser
1 5
<210> 44
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 44
Arg Trp Tyr Gln Ser
1 5
<210> 45
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 45
Gln Tyr Tyr Gln Ser
1 5
<210> 46
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 46
His Trp Tyr Asn Ser
1 5
<210> 47
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 47
Gly Cys Asp Val Leu Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 48
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 48
Gly Cys Gln Ile Ser Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Phe Tyr Asn Ser Cys Gly
20 25 30
<210> 49
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 49
Gly Cys Asp Arg Met Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Leu Trp Tyr Lys Ser Cys Gly
20 25 30
<210> 50
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 50
Gly Cys Asn Leu Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr His Ser Cys Gly
20 25 30
<210> 51
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 51
Gly Cys Gln Arg Thr Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 52
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 52
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 53
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 53
Gly Cys Asn Pro Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 54
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 54
Gly Cys Asp Pro Met Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 55
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 55
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 56
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 56
Gly Cys Asp Ile Met Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 57
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 57
Gly Cys Gln Leu Leu Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 58
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 58
Gly Cys Asn Pro Met Leu Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 59
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 59
Gly Cys Lys Leu Phe Glu Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Glu Ser Cys Gly
20 25 30
<210> 60
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 60
Lys Asn Pro Leu Phe Asn Trp Ala Leu Tyr
1 5 10
<210> 61
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 61
Gln Asp Pro Thr Val Asn Trp Ala Val Tyr
1 5 10
<210> 62
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 62
Gln Asp Pro Thr Phe Asn Trp Ala Glu Tyr
1 5 10
<210> 63
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 63
Gln Asp Pro Ser Leu Asn Trp Ala Asp Tyr
1 5 10
<210> 64
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 64
Leu Asp Arg Thr Leu Asn Trp Ala Leu Tyr
1 5 10
<210> 65
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 65
Leu Asp Pro Ser Phe Asn Trp Ser Leu Tyr
1 5 10
<210> 66
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 66
Arg Asp Leu Thr Ile Asn Trp Ala Leu Phe
1 5 10
<210> 67
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 67
Leu Asp Pro Thr Val Asn Trp Ala Leu Phe
1 5 10
<210> 68
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 68
Gln Asp Pro Lys Leu Asn Trp Ala Val Tyr
1 5 10
<210> 69
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 69
Leu Asp Pro Ser Phe Asp Trp Ala Leu Tyr
1 5 10
<210> 70
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Q или D или K или W или E или L или R
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = D или N
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = P или R или L или T
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = T или S или L или K
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = F или V или L или I
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = N или D
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = A или S или G
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa = L или V или E или T или Q или D
<220>
<221> ВАРИАНТ
<222> 10
<223> Xaa = F или Y
<400> 70
Xaa Xaa Xaa Xaa Xaa Xaa Trp Xaa Xaa Xaa
1 5 10
<210> 71
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 71
Gln Leu Phe Asp Ser
1 5
<210> 72
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 72
Gln Phe Tyr Gln Ser
1 5
<210> 73
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 73
Gln Leu Tyr Gln Ser
1 5
<210> 74
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 74
Gln Met His Gln Ser
1 5
<210> 75
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 75
Gln Met Tyr Asn Ser
1 5
<210> 76
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 76
Gln Met Tyr Asp Ser
1 5
<210> 77
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 77
Gln His Tyr Lys Thr
1 5
<210> 78
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 78
Gln Leu Phe Asn Ser
1 5
<210> 79
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 79
Gln Leu Tyr Asn Ser
1 5
<210> 80
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Q или R
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = M или L или F или H
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = Y или F или H
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = D или Q или N или K
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = S или T
<400> 80
Xaa Xaa Xaa Xaa Xaa
1 5
<210> 81
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 81
Gly Cys Lys Asn Pro Leu Phe Asn Trp Ala Leu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Leu Phe Asp Ser Cys Gly
20 25 30
<210> 82
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 82
Gly Cys Gln Asp Pro Thr Val Asn Trp Ala Val Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Phe Tyr Gln Ser Cys Gly
20 25 30
<210> 83
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 83
Gly Cys Gln Asp Pro Thr Phe Asn Trp Ala Glu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Leu Tyr Gln Ser Cys Gly
20 25 30
<210> 84
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 84
Gly Cys Gln Asp Pro Thr Phe Asn Trp Ala Glu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Gln Ser Cys Gly
20 25 30
<210> 85
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 85
Gly Cys Gln Asp Pro Ser Leu Asn Trp Ala Asp Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met His Gln Ser Cys Gly
20 25 30
<210> 86
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 86
Gly Cys Leu Asp Arg Thr Leu Asn Trp Ala Leu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Asn Ser Cys Gly
20 25 30
<210> 87
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 87
Gly Cys Leu Asp Pro Ser Phe Asn Trp Ser Leu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Asp Ser Cys Gly
20 25 30
<210> 88
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 88
Gly Cys Arg Asp Leu Thr Ile Asn Trp Ala Leu Phe Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Phe Asn Ser Cys Gly
20 25 30
<210> 89
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 89
Gly Cys Leu Asp Pro Thr Val Asn Trp Ala Leu Phe Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln His Tyr Lys Thr Cys Gly
20 25 30
<210> 90
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 90
Gly Cys Gln Asp Pro Lys Leu Asn Trp Ala Val Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Leu Phe Asn Ser Cys Gly
20 25 30
<210> 91
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 91
Gly Cys Leu Asp Pro Ser Phe Asp Trp Ala Leu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Leu Tyr Asn Ser Cys Gly
20 25 30
<210> 92
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 92
Pro Arg Ile Leu Met Arg
1 5
<210> 93
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 93
Lys Gln Asp Ser Asp
1 5
<210> 94
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 94
Gly Gln Ser Phe Glu
1 5
<210> 95
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 95
Gly Leu Asp Tyr Asp
1 5
<210> 96
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 96
Gly Pro Asp Leu Gln
1 5
<210> 97
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 97
Gly Arg Asp Phe Glu
1 5
<210> 98
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = K или G или Q или S или N
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = Q или L или P или A или V или T или R или W или K или G или Y
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = D или S или E или N
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = S или F или Y или L или F или Q или M
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = D или E или N или A или L или F или H или Q
<400> 98
Xaa Xaa Xaa Xaa Xaa
1 5
<210> 99
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 99
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 100
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 100
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Leu Asp Tyr Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 101
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 101
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Pro Asp Leu Gln
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 102
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 102
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 103
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 103
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Gln Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 104
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 104
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Glu Arg Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 105
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 105
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 106
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 106
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Asn Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 107
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 107
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Gln Thr Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 108
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 108
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Tyr Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 109
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 109
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Phe Ile Asn Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 110
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 110
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Ser Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 111
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 111
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Thr Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 112
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 112
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Phe Tyr Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 113
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 113
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 114
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 114
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Tyr Arg Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 115
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = K или P или Q или R
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = K или T или L или D
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = W или T или M или L
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Q или R или D
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = W или F или P или V
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = W или K или F
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = Y или Q или W
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = M или Y или G или D
<400> 115
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 116
<400> 116
000
<210> 117
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 117
Gly Glu Asn Phe Leu
1 5
<210> 118
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 118
Gly Pro Asp Ile Asp
1 5
<210> 119
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 119
Gly Arg Asp Met Asp
1 5
<210> 120
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 120
Glu Met Asp Phe Asp
1 5
<210> 121
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = K или G или D или A или E
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = Q или E или R или V или P или D или M или G или N или
L или A или F
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = D или N или Y или S
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = S или F или L или I или M или Y или V или N или E
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = D или L или Q или S или E или T или L или A или N
<400> 121
Xaa Xaa Xaa Xaa Xaa
1 5
<210> 122
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 122
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Glu Asn Phe Leu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 123
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 123
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 124
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 124
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Arg Asp Met Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 125
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 125
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 126
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 126
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Glu Ser Leu Ser
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 127
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 127
Asp Val Met Lys Pro Met Trp Gly
1 5
<210> 128
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 128
Asp Val Leu Asp Pro Thr Trp Gly
1 5
<210> 129
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 129
Asp Val Leu Gln Pro Leu Trp Gly
1 5
<210> 130
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = M или L
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Q или K или D
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = Y или M или T или L
<400> 130
Asp Val Xaa Xaa Pro Xaa Trp Gly
1 5
<210> 131
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 131
Gln Trp Tyr Asn Ser
1 5
<210> 132
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 132
Leu Trp Tyr Asn Ser
1 5
<210> 133
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 133
Arg Trp Tyr Asn Ser
1 5
<210> 134
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = H или L или Q или R
<400> 134
Xaa Trp Tyr Asn Ser
1 5
<210> 135
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 135
Gly Cys Asp Val Met Lys Pro Met Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 136
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 136
Gly Cys Asp Val Leu Asp Pro Thr Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Leu Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 137
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 137
Gly Cys Asp Val Leu Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 138
<400> 138
000
<210> 139
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 139
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Phe Val Arg Cys Leu Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 140
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 140
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 141
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 141
Asn Ile Met Leu Pro Tyr Trp Gly
1 5
<210> 142
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 142
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 143
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = норлейцин
<400> 143
Asn Ile Xaa Leu Pro Tyr Trp Gly
1 5
<210> 144
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 144
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 145
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 145
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Ser Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 146
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 146
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 147
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 147
Arg Thr Asn Arg Val Lys Gly Gly
1 5
<210> 148
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 148
Val Asn Arg Val Arg Gly
1 5
<210> 149
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 149
Met Asn His Val Lys Ala Arg Arg
1 5
<210> 150
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 150
Arg Ser Val Asn Lys Ile
1 5
<210> 151
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 151
Val Asn Lys Ile Lys Gly
1 5
<210> 152
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 152
Arg Asn Ser Ile Lys Arg
1 5
<210> 153
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 153
Val Ser Asn Arg Val Asn Lys Gly
1 5
<210> 154
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 154
Arg Gly Asn Ile Ile Lys
1 5
<210> 155
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 155
Arg Ser Gly Asn Thr Ile Arg Lys Arg Glu
1 5 10
<210> 156
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 156
Ala Ser Ser Asn Ser Ile Arg Gln Gly Trp
1 5 10
<210> 157
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 157
Arg Ser Asn Arg Ile Arg
1 5
<210> 158
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 158
Arg Ser Asn Lys Leu Arg Glu Ala Arg Gly
1 5 10
<210> 159
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 159
Val Asn Ser Val Lys Arg
1 5
<210> 160
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 160
Gly Ser Asn Lys Ile Arg Pro Arg
1 5
<210> 161
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 161
Asn Arg Ile Arg Asn Ser
1 5
<210> 162
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 162
Ser Arg Asn Ser Ile Lys
1 5
<210> 163
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 163
Ser Asn Tyr Val Lys Arg
1 5
<210> 164
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 164
Arg Ala Asn Arg Val Ser Gly Arg
1 5
<210> 165
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 165
Ser Asn Arg Val Lys Val Arg Ala
1 5
<210> 166
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 166
Glu Asn Arg Thr Lys Gly
1 5
<210> 167
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 167
Gly Asn Lys Ile Arg Ala
1 5
<210> 168
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 168
Ala Asn Arg Val Lys Arg Thr Ser
1 5
<210> 169
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 169
Ser Gly Gly Arg Asp
1 5
<210> 170
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 170
Gly Ser Ser Arg Asn
1 5
<210> 171
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 171
Gly Val Glu Gly Arg
1 5
<210> 172
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 172
Ser Val Gly His Gly
1 5
<210> 173
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 173
Asn Glu Ser Arg Gly
1 5
<210> 174
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 174
Gly Gly Pro Gly Gly
1 5
<210> 175
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 175
Gly Pro Lys Ser Asn
1 5
<210> 176
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 176
Tyr Gly His Gly Asp
1 5
<210> 177
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 177
Gly Ser Arg Gln Asp
1 5
<210> 178
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 178
Ser Arg Gly Val Asn
1 5
<210> 179
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 179
Gly Pro Asn Asp Phe
1 5
<210> 180
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 180
Gly Arg Gly Asp Tyr
1 5
<210> 181
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 181
Ala Ser Gly Ser Ser
1 5
<210> 182
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 182
Ser Pro Gly Gly Arg
1 5
<210> 183
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 183
Gly Phe Arg Gly Thr
1 5
<210> 184
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 184
Arg Asp Arg Val Gly
1 5
<210> 185
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = V или R или N или S или E или G
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = N или S или G или R
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = R или V или K или S или N или I или Y
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = V или N или I или R или S или T
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = R или K или I или N
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = G или I или R или K или S или A
<400> 185
Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 186
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = A или R или M или V или G или S
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = N или T или S или A
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = R или N или H
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = V или R или K
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = K или V или I
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = R или K или A или N или S или V
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = T или G или R или K или P
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = S или G или R или A
<400> 186
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 187
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = R или A или Q
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = S или A
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = G или S или N или I
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = N или K
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = T или S или L или R
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = I или R или V
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = R или E или K
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = K или Q или A или R
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa = R или G или Q
<220>
<221> ВАРИАНТ
<222> 10
<223> Xaa = E или W или G или R
<400> 187
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 188
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = G или S или N или Y или A или R
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = P или G или S или V или E или R или F или D
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = N или G или S или E или P или K или H или R
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = G или R или H или S или Q или V или D
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = F или D или N или R или G или Y или S или T
<400> 188
Xaa Xaa Xaa Xaa Xaa
1 5
<210> 189
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 189
Gly Cys Arg Thr Asn Arg Val Lys Gly Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 190
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 190
Gly Cys Val Asn Arg Val Arg Gly Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Ser Gly Gly Arg Asp Cys Gly
20 25
<210> 191
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 191
Gly Cys Met Asn His Val Lys Ala Arg Arg Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 192
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 192
Gly Cys Arg Ser Val Asn Lys Ile Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Gly Ser Ser Arg Asn Cys Gly
20 25
<210> 193
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 193
Gly Cys Val Asn Lys Ile Lys Gly Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Gly Val Glu Gly Arg Cys Gly
20 25
<210> 194
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 194
Gly Cys Arg Asn Ser Ile Lys Arg Cys Lys Gln Asn Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Ser Val Gly His Gly Cys Gly
20 25
<210> 195
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 195
Gly Cys Val Ser Asn Arg Val Asn Lys Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 196
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 196
Gly Cys Arg Gly Asn Ile Ile Lys Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Asn Glu Ser Arg Gly Cys Gly
20 25
<210> 197
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 197
Gly Cys Arg Ser Gly Asn Thr Ile Arg Lys Arg Glu Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Gly Pro Gly Gly Cys Gly
20 25 30
<210> 198
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 198
Gly Cys Ala Ser Ser Asn Ser Ile Arg Gln Gly Trp Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Lys Ser Asn Cys Gly
20 25 30
<210> 199
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 199
Gly Cys Arg Ser Asn Arg Ile Arg Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Tyr Gly His Gly Asp Cys Gly
20 25
<210> 200
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 200
Gly Cys Arg Ser Asn Lys Leu Arg Glu Ala Arg Gly Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Ser Arg Gln Asp Cys Gly
20 25 30
<210> 201
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 201
Gly Cys Val Asn Ser Val Lys Arg Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Ser Arg Gly Val Asn Cys Gly
20 25
<210> 202
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 202
Gly Cys Gly Ser Asn Lys Ile Arg Pro Arg Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Asp Phe Cys Gly
20 25 30
<210> 203
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 203
Gly Cys Asn Arg Ile Arg Asn Ser Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Gly Arg Gly Asp Tyr Cys Gly
20 25
<210> 204
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 204
Gly Cys Ser Arg Asn Ser Ile Lys Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Ala Ser Gly Ser Ser Cys Gly
20 25
<210> 205
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 205
Gly Cys Ser Asn Tyr Val Lys Arg Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Ser Pro Gly Gly Arg Cys Gly
20 25
<210> 206
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 206
Gly Cys Arg Ala Asn Arg Val Ser Gly Arg Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 207
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 207
Gly Cys Ser Asn Arg Val Lys Val Arg Ala Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 208
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 208
Gly Cys Glu Asn Arg Thr Lys Gly Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Gly Phe Arg Gly Thr Cys Gly
20 25
<210> 209
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 209
Gly Cys Gly Asn Lys Ile Arg Ala Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Arg Asp Arg Val Gly Cys Gly
20 25
<210> 210
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 210
Gly Cys Ala Asn Arg Val Lys Arg Thr Ser Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 211
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 211
Gly Glu Ser Leu Ser
1 5
<210> 212
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = 3,4-дифтор-L-фенилаланин,
3,4-дихлор-L- фенилаланин, 4-хлор-L-фенилаланин,
3-F,4-Cl-L-фенилаланин, 2-пиридон(NH para)-L-аланин,
пиридон(NH мета)-L-аланин, или сульфотирозин
<400> 212
Asn Ile Met Leu Pro Xaa Trp Gly
1 5
<210> 213
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = 1-нафтилаланин, 2-нафтилаланин или
2-хлориндол
<400> 213
Asn Ile Met Leu Pro Phe Xaa Gly
1 5
<210> 214
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = норлейцин
<400> 214
Asp Val Xaa Gln Pro Tyr Trp Gly
1 5
<210> 215
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 215
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 216
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 30
<223> глицин может быть кфпирован с помощью C(=O)-оксетан-3-ила
<400> 216
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 217
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 217
Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu Cys
1 5 10 15
Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys
20 25
<210> 218
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 218
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 219
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa = 1-нафтилаланин, или 2-нафтилаланин
<400> 219
Gly Cys Asn Ile Met Leu Pro Phe Xaa Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 220
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = 3-фтортирозин, или 4-фторфенилаланин
<400> 220
Gln Tyr Xaa Gln Ser
1 5
<210> 221
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = PEG6-пропаргилглицин
<400> 221
Xaa Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 222
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 222
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Asn Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 223
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 223
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Phe Tyr Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 224
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 224
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 225
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 225
Glu Thr Asp Trp Tyr Pro His Gln Ile Asp
1 5 10
<210> 226
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 226
Gly Glu Thr Val Phe Glu Gln Phe Leu Trp
1 5 10
<210> 227
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 227
His Met Met Tyr Asp Tyr
1 5
<210> 228
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 228
Lys Lys Trp Gln Trp Trp Tyr Met
1 5
<210> 229
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 229
Pro Ala Ile Gln Asn Trp Lys Glu His Pro
1 5 10
<210> 230
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 230
Gln Leu Met His Pro Phe Trp Gly
1 5
<210> 231
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 231
His Met Met Tyr Asp Tyr
1 5
<210> 232
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = E или G или P или Q или R или T или V
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = T или E или A или D
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = D или T или I или P
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = W или V или Q или T или W
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = Y или F или N или E или P или K
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = P или E или W или N или P
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = H или Q или K или W или H
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = Q или F или E или A или D или W
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa = I или L или H
<220>
<221> ВАРИАНТ
<222> 10
<223> Xaa = D или W или P или Y или T или M или N
<400> 232
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 233
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 233
Gly Pro Asn Gly Phe
1 5
<210> 234
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 234
Gly Pro Asn Gly Phe
1 5
<210> 235
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 235
Glu Met Tyr Asp Ala
1 5
<210> 236
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 236
Tyr Pro Trp Thr Glu
1 5
<210> 237
<211> 6
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 237
Ser Trp Trp Pro Ser Leu
1 5
<210> 238
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 238
His Trp Tyr Arg Ser
1 5
<210> 239
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 239
Gly Cys Glu Thr Asp Trp Tyr Pro His Gln Ile Asp Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 240
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 240
Gly Cys Gly Glu Thr Val Phe Glu Gln Phe Leu Trp Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 241
<211> 28
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 241
Gly Cys His Met Met Tyr Asp Tyr Cys Lys Gln Asp Ser Asp Cys Leu
1 5 10 15
Ala Gly Cys Val Cys Glu Met Tyr Asp Ala Cys Gly
20 25
<210> 242
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 242
Gly Cys Lys Lys Trp Gln Trp Trp Tyr Met Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Tyr Pro Trp Thr Glu Cys Gly
20 25 30
<210> 243
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 243
Gly Cys Pro Ala Ile Gln Asn Trp Lys Glu His Pro Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Ser Trp Trp Pro Ser Leu Cys
20 25 30
Gly
<210> 244
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 244
Gly Cys Gln Leu Met His Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Arg Ser Cys Gly
20 25 30
<210> 245
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 245
His Leu Phe Glu Pro Leu Trp Gly
1 5
<210> 246
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 246
Gln Val Met Arg Pro Phe Trp Gly
1 5
<210> 247
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 247
Gln Val Met Gln Pro Ala Trp Gly
1 5
<210> 248
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 248
His Arg Leu Gln Pro Leu Trp Gly
1 5
<210> 249
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 249
Glu Leu Leu Gln Pro Ser Trp Gly
1 5
<210> 250
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 250
Asn Val Leu Leu Pro Leu Trp Gly
1 5
<210> 251
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 251
Asp Leu Met Gln Pro Leu Trp Gly
1 5
<210> 252
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 252
Asn Pro Met Leu Pro Leu Trp Gly
1 5
<210> 253
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 253
Gln Val Leu Gln Pro Ser Trp Gly
1 5
<210> 254
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 254
Gln Leu Leu Glu Pro Met Trp Gly
1 5
<210> 255
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 255
Lys Leu Leu Gln Pro Met Trp Gly
1 5
<210> 256
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 256
Asp Arg Met Gln Pro Tyr Trp Gly
1 5
<210> 257
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 257
Lys Ile Met Gln Pro Leu Trp Gly
1 5
<210> 258
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 258
Asn Leu Met His Pro Phe Trp Gly
1 5
<210> 259
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 259
Ala Leu Leu Gln Pro Leu Trp Gly
1 5
<210> 260
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 260
Arg Leu Leu Glu Pro Ser Trp Gly
1 5
<210> 261
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 261
His Leu Leu Leu Pro Leu Trp Gly
1 5
<210> 262
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 262
Gln Trp Tyr Lys Ser
1 5
<210> 263
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 263
Leu Trp Tyr Asp Ser
1 5
<210> 264
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 264
Gln Trp Tyr Gln Ser
1 5
<210> 265
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 265
Gly Cys His Leu Phe Glu Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 266
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 266
Gly Cys Gln Val Met Arg Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 267
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 267
Gly Cys Gln Val Met Gln Pro Ala Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 268
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 268
Gly Cys His Arg Leu Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 269
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 269
Gly Cys Glu Leu Leu Gln Pro Ser Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 270
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 270
Gly Cys Asn Pro Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 271
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 271
Gly Cys Asn Val Leu Leu Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 272
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 272
Gly Cys Asp Ile Met Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 273
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 273
Gly Cys Asp Leu Met Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 274
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 274
Gln Met Phe Asn Ser
1 5
<210> 275
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 275
Gly Cys Gln Val Leu Gln Pro Ser Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 276
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 276
Gly Cys Gln Leu Met Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 277
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = норлейцин
<400> 277
Asn Ile Xaa Leu Pro Phe Trp Gly
1 5
<210> 278
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 278
Gly Cys Gln Leu Met Gln Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr His Ser Cys Gly
20 25 30
<210> 279
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 279
Gly Cys Gln Leu Leu Glu Pro Met Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 280
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 280
Gly Cys Lys Leu Leu Gln Pro Met Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 281
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 281
Gly Cys Asp Arg Met Gln Pro Tyr Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Trp Tyr Lys Ser Cys Gly
20 25 30
<210> 282
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 282
Gly Cys Lys Ile Met Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Leu Trp Tyr Asp Ser Cys Gly
20 25 30
<210> 283
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 283
Gly Cys Asn Leu Met His Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 284
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 284
Gly Cys Ala Leu Leu Gln Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 285
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 285
Gly Cys Arg Leu Leu Glu Pro Ser Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Trp Tyr Gln Ser Cys Gly
20 25 30
<210> 286
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 286
Gly Cys His Leu Leu Leu Pro Leu Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Arg Trp Tyr His Ser Cys Gly
20 25 30
<210> 287
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 287
Asp Asp Pro Ser Phe Asp Trp Ser Val Tyr
1 5 10
<210> 288
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 288
Trp Asp Pro Thr Phe Asn Trp Ala Leu Tyr
1 5 10
<210> 289
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 289
Gln Asp Pro Thr Leu Asn Trp Ala Thr Tyr
1 5 10
<210> 290
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 290
Glu Asp Pro Thr Val Asp Trp Ala Gln Tyr
1 5 10
<210> 291
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 291
Lys Asp Thr Thr Phe Asn Trp Gly Leu Phe
1 5 10
<210> 292
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 292
Arg Met Tyr Asp Ser
1 5
<210> 293
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 293
Gly Cys Asp Asp Pro Ser Phe Asp Trp Ser Val Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Arg Met Tyr Asp Ser Cys Gly
20 25 30
<210> 294
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 294
Gly Cys Trp Asp Pro Thr Phe Asn Trp Ala Leu Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Asp Ser Cys Gly
20 25 30
<210> 295
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 295
Gly Cys Gln Asp Pro Thr Leu Asn Trp Ala Thr Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Gln Ser Cys Gly
20 25 30
<210> 296
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 296
Gly Cys Glu Asp Pro Thr Val Asp Trp Ala Gln Tyr Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Met Tyr Gln Ser Cys Gly
20 25 30
<210> 297
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 297
Gly Cys Lys Asp Thr Thr Phe Asn Trp Gly Leu Phe Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gln Leu Tyr Gln Ser Cys Gly
20 25 30
<210> 298
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 298
Gly Pro Glu Leu Asn
1 5
<210> 299
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 299
Gln Ala Asp Tyr Ala
1 5
<210> 300
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 300
Gly Val Asp Tyr Leu
1 5
<210> 301
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 301
Gly Thr Asn Phe Leu
1 5
<210> 302
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 302
Ser Arg Asp Phe Asp
1 5
<210> 303
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 303
Asn Arg Asp Phe Leu
1 5
<210> 304
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 304
Gly Trp Asp Gln Phe
1 5
<210> 305
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 305
Gly Lys Asp Phe His
1 5
<210> 306
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 306
Ser Gly Asp Phe Ala
1 5
<210> 307
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 307
Gly Lys Glu Leu Asn
1 5
<210> 308
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 308
Gly Trp Ser Met Asp
1 5
<210> 309
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 309
Gly Tyr Asp Leu Gln
1 5
<210> 310
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 310
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Pro Glu Leu Asn
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 311
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 311
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gln Ala Asp Tyr Ala
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 312
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 312
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Val Asp Tyr Leu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 313
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 313
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Thr Asn Phe Leu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 314
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 314
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Ser Arg Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 315
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 315
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Asn Arg Asp Phe Leu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 316
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 316
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Trp Asp Gln Phe
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 317
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 317
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Lys Asp Phe His
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 318
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 318
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Ser Gly Asp Phe Ala
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 319
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 319
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Lys Glu Leu Asn
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 320
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 320
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Trp Ser Met Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 321
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 321
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Tyr Asp Leu Gln
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 322
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 322
Gly Arg Asp Leu Gln
1 5
<210> 323
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 323
Gly Val Asp Leu Ser
1 5
<210> 324
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 324
Gly Asp Asp Leu Glu
1 5
<210> 325
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 325
Gly Val Asp Met Thr
1 5
<210> 326
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 326
Gly Met Asp Ile Glu
1 5
<210> 327
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 327
Asp Gly Asp Tyr Gln
1 5
<210> 328
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 328
Gly Asn Asp Val Ser
1 5
<210> 329
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 329
Ala Gly Asp Glu Leu
1 5
<210> 330
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 330
Gly Leu Asp Glu Glu
1 5
<210> 331
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 331
Asp Gly Asp Phe Asp
1 5
<210> 332
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 332
Ala Gly Asp Phe Glu
1 5
<210> 333
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 333
Gly Asn Ser Phe Glu
1 5
<210> 334
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 334
Gly Gln Asp Leu Thr
1 5
<210> 335
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 335
Gly Glu Asn Leu Ala
1 5
<210> 336
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 336
Gly Gln Asp Tyr Asn
1 5
<210> 337
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 337
Gly Ala Asp Leu Ser
1 5
<210> 338
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 338
Gly Phe Asp Met Asp
1 5
<210> 339
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 339
Asp Leu Asn Tyr Glu
1 5
<210> 340
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 340
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Arg Asp Leu Gln
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 341
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 341
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Val Asp Leu Ser
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 342
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 342
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Asp Asp Leu Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 343
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 343
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Val Asp Met Thr
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 344
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 344
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Met Asp Ile Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 345
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 345
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Asp Gly Asp Tyr Gln
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 346
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 346
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Asn Asp Val Ser
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 347
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 347
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Ala Gly Asp Glu Leu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 348
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 348
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Leu Asp Glu Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 349
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 349
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Asp Gly Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 350
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 350
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Ala Gly Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 351
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 351
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Asn Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 352
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 352
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Gln Asp Leu Thr
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 353
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 353
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Glu Asn Leu Ala
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 354
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 354
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Gln Asp Tyr Asn
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 355
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 355
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Ala Asp Leu Ser
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 356
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 356
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Gly Phe Asp Met Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 357
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 357
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Asp Leu Asn Tyr Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 358
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Q или H или E или N или D
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = L или V или R или P или I
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = M или F или L
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Q или E или R или L
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = F или A или L или S
<400> 358
Xaa Xaa Xaa Xaa Pro Xaa Trp Gly
1 5
<210> 359
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = R или H
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = N или Q или H
<400> 359
Xaa Trp Tyr Xaa Ser
1 5
<210> 360
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = H или L или R или Q
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = W или F или Y
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Q или N или K или H или D или E
<400> 360
Xaa Xaa Tyr Xaa Ser
1 5
<210> 361
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<400> 361
Xaa Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 362
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = сульфотирозин, 3,4-дифтор-L-фенилаланин,
3,4-дихлор-L- фенилаланин, 4-хлор-L- фенилаланин,
3-F,4-Cl-L-фенилаланин, 2-пиридон(NH пара)-L-аланин,
или пиридон(NH мета)-L-аланин
<400> 362
Gly Cys Asn Ile Met Leu Pro Xaa Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 363
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 363
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 364
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 364
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 365
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 365
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 366
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 366
Gly Cys Gln Ala Ile Asn Arg Val Lys Arg Gln Arg Cys Lys Gln Asp
1 5 10 15
Ser Asp Cys Leu Ala Gly Cys Val Cys Gly Pro Asn Gly Phe Cys Gly
20 25 30
<210> 367
<211> 10
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 367
Gln Ala Ile Asn Arg Val Lys Arg Gln Arg
1 5 10
<210> 368
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 368
Asn Pro Met Leu Pro Phe Trp Gly
1 5
<210> 369
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 369
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Pro Leu
20 25 30
Ile
<210> 370
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 370
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Asn Tyr
20 25 30
Gln
<210> 371
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 371
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Pro Leu
20 25 30
Gln
<210> 372
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 372
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Thr Phe
20 25 30
Gln
<210> 373
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 373
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Asp Leu
20 25 30
Val
<210> 374
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 374
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Glu His
20 25 30
Lys
<210> 375
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 375
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Tyr Leu
20 25 30
Ser
<210> 376
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 376
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Trp Asp
20 25 30
Tyr
<210> 377
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 377
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Trp Pro
20 25 30
His
<210> 378
<211> 33
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 378
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Pro His
20 25 30
Gln
<210> 379
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 379
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Phe His
20 25 30
<210> 380
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 380
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Ile Ala
20 25 30
<210> 381
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 381
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Gly Ser
20 25 30
<210> 382
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 382
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Thr Arg
20 25 30
<210> 383
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 383
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Val His
20 25 30
<210> 384
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 384
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Leu Ser
20 25 30
<210> 385
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 385
Asp Val Leu Gln Pro Tyr Trp Gly
1 5
<210> 386
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 386
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 387
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 387
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Arg Thr
20 25 30
<210> 388
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 388
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Trp Lys
20 25 30
<210> 389
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 389
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Pro Leu
20 25 30
<210> 390
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 390
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Asp Glu
20 25 30
<210> 391
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 391
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Gln Phe
20 25 30
<210> 392
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 392
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Glu Gln
20 25 30
<210> 393
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 393
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Pro Thr
20 25 30
<210> 394
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 394
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Arg Leu
20 25 30
<210> 395
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 395
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Ser Leu
20 25 30
<210> 396
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 396
Asn Ile Leu Leu Pro Phe Trp Gly
1 5
<210> 397
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 397
Asn Ile Leu Leu Pro Tyr Trp Gly
1 5
<210> 398
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 398
Asn Ile Met Ser Pro Phe Trp Gly
1 5
<210> 399
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 399
Asn Ile Met Thr Pro Phe Trp Gly
1 5
<210> 400
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 400
Asn Ile Met Gln Pro Phe Trp Gly
1 5
<210> 401
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 401
Asn Ile Met Asn Pro Phe Trp Gly
1 5
<210> 402
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 402
Asn Ile Met Glu Pro Phe Trp Gly
1 5
<210> 403
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 403
Asn Ile Met Asp Pro Phe Trp Gly
1 5
<210> 404
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = бензил-L-пролин, 4-фтор-бензил-L-пролин,
3-OH-L-пролин, 3-фтор-L-пролин, или
трифторметил-бензил-L-пролин
<400> 404
Asn Ile Met Leu Xaa Phe Trp Gly
1 5
<210> 405
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 405
Gly Cys Asn Ile Leu Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 406
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 406
Gly Cys Asn Ile Leu Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 407
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 407
Gly Cys Asn Ile Met Ser Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 408
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 408
Gly Cys Asn Ile Met Thr Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 409
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 409
Gly Cys Asn Ile Met Gln Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 410
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 410
Gly Cys Asn Ile Met Asn Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 411
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 411
Gly Cys Asn Ile Met Glu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 412
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 412
Gly Cys Asn Ile Met Asp Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 413
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = бензил-L-пролин, 4-фтор-бензил-L- пролин,
3-OH-L-пролин, 3-фтор-L-пролин, или трифторметил-бензил-L-пролин
<400> 413
Gly Cys Asn Ile Met Leu Xaa Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 414
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 414
Asn Ile Met Leu Pro Ser Trp Gly
1 5
<210> 415
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 415
Gly Cys Asn Ile Met Leu Pro Ser Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 416
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = N-метил индол, N-этил индол,
N-изопропил индол, или 5-аза-индол
<400> 416
Asn Ile Met Leu Pro Tyr Xaa Gly
1 5
<210> 417
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 9
<223> Xaa = N-метил индол, N-этил индол, N-изопропил индол,
или 5-аза-индол
<400> 417
Gly Cys Asn Ile Met Leu Pro Tyr Xaa Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 418
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = 4-метил-L-фенилаланин, 2-нафтил-L-аланин,
2-хинолил-аланин, 4-бифенил-L-аланин
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = 3-(3-хинолинил)-L-аланин, 3-(2-хинолинил)-L-аланин,
3-(2-хиноксалинил)-L-аланин, 4-метил-2-пиридил-аланин
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = 4-этил-2-пиридил-L-аланин, бензотиазол-L-аланин, или
бензотиофен-L-аланин, 3-изохинолинил-L-аланин
<400> 418
Gly Arg Asp Xaa Glu
1 5
<210> 419
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 15
<223> Xaa = 4-метил-L-фенилаланин, 2-нафтил-L-аланин,
2-хинолил-аланин, 4-бифенил-L-аланин
<220>
<221> ВАРИАНТ
<222> 15
<223> Xaa = 3-(3-хинолинил)-L-аланин, 3-(2-хинолинил)-L-аланин,
3-(2-хиноксалинил)-L-аланин, 4-метил-2-пиридил-аланин
<220>
<221> ВАРИАНТ
<222> 15
<223> Xaa = 4-этил-2-пиридил-L-аланин, бензотиазол-L-аланин,
бензотиофен-L-аланин, или 3-изохинолинил-L-аланин
<400> 419
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Xaa Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 420
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = трет-бутил-L-аланин, циклобутил-L-аланин,
циклопентил-L-аланин, или 5,5,5-трифтор-L-лейцин
<400> 420
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Xaa Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 421
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 421
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ser Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 422
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 422
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Thr Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 423
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 423
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Glu Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 424
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 424
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Leu Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 425
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 425
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 426
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = t-бутил-L-глицин (также известный как L-трет-Лейцин),
трет-бутил-L-аланин, L-циклопентилглицин, циклопентил-L-аланин
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = L-циклобутил-L-глицин, циклобутил-L-аланин, или
5,5,5-Трифтор-L-лейцин
<400> 426
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Xaa Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 427
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = 2-пиридон, 3,4-гидрокси фенилаланин,
3,4-фтор фенилаланин, или 3-фтор,4-OH фенилаланин
<400> 427
Gln Xaa Tyr Gln Ser
1 5
<210> 428
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 25
<223> Xaa = 2-пиридон, 3,4-гидрокси фенилаланин,
3,4-фтор фенилаланин, или 3-фтор,4-OH фенилаланин
<400> 428
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Xaa Tyr Gln Ser Cys Gly
20 25 30
<210> 429
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = 2-хлор тирозин, 2-метил тирозин,
2-этил тирозин, или 1-нафтил аланин
<400> 429
Gln Tyr Xaa Gln Ser
1 5
<210> 430
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 26
<223> Xaa = 2-Хлор тирозин, 2-метил тирозин,
2-этил тирозин, или 1-нафтол аланин
<400> 430
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Xaa Gln Ser Cys Gly
20 25 30
<210> 431
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 431
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Ser
20 25 30
<210> 432
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = D-серин, L-бэта-гомосерин, L-бэта-аланин,
N-альфа-метил Глицин, глициамид, глициновый сложный эфир глицерола
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глициновый сложный эфир глицерола, глициновый сложный эфир
оксетан-3-илового спирта, глицинморфолиновый амид
<400> 432
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Xaa
20 25 30
<210> 433
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = норлейцин
<400> 433
Asn Ile Xaa Gln Pro Tyr Trp Gly
1 5
<210> 434
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 434
Asn Ile Leu Gln Pro Tyr Trp Gly
1 5
<210> 435
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 435
Gly Cys Asn Ile Leu Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 436
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 436
Gly Cys Asn Ile Xaa Gln Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 437
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = норлейцин или циклобутил-L-аланин
<400> 437
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Xaa Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 438
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 438
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 439
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин, циклобутил-L-аланин
или норлейцин
<400> 439
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Xaa Glu Gln Cys Xaa Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 440
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин или циклобутил-L-аланин
<400> 440
Gly Cys Asn Ile Xaa Gln Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Xaa Glu Gln Cys Xaa Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 441
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин или трет-бутил-L-аланин
<400> 441
Gly Cys Asn Ile Leu Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Xaa Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 442
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин или циклобутил-L-аланин
<400> 442
Gly Cys Asn Ile Leu Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Xaa Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 443
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 443
Xaa Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Xaa
20 25 30
<210> 444
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 444
Xaa Cys Asn Ile Leu Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Xaa
20 25 30
<210> 445
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 445
Xaa Cys Asn Ile Leu Gln Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Xaa
20 25 30
<210> 446
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 446
Xaa Cys Asn Ile Leu Gln Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Glu Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Xaa
20 25 30
<210> 447
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин или трет-бутил-L-аланин
<400> 447
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Xaa Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 448
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин
<400> 448
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Xaa Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 449
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин или циклобутил-L-аланин
<400> 449
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Xaa Ser Asn Cys Xaa Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 450
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин или циклобутил-L-аланин
<400> 450
Gly Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Xaa Ser Asn Cys Xaa Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 451
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 18
<223> Xaa = циклобутил-L-аланин
<220>
<221> ВАРИАНТ
<222> 22
<223> Xaa = циклобутил-L-глицин или циклобутил-L-аланин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 451
Xaa Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Xaa Ser Asn Cys Xaa Cys His Trp Tyr Asn Ser Cys Xaa
20 25 30
<210> 452
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 452
Xaa Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Xaa
20 25 30
<210> 453
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = ацетилглицин
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = глицинамид
<400> 453
Xaa Cys Asp Val Leu Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Asn Cys Ile Cys His Trp Tyr Asn Ser Cys Xaa
20 25 30
<210> 454
<211> 8
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = M или L
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = L или S или T или Q или N или E или D
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = F или Y или S
<400> 454
Asn Ile Xaa Xaa Pro Xaa Trp Gly
1 5
<210> 455
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 455
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Phe His
20 25 30
<210> 456
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 456
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Ser Leu
20 25 30
<210> 457
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 457
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Gly Glu
20 25 30
<210> 458
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 458
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Val Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Ser Ile
20 25 30
<210> 459
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 459
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Gly Arg
20 25 30
<210> 460
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 460
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Arg Pro
20 25 30
<210> 461
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 461
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Gln Tyr
20 25 30
<210> 462
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 462
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Glu Asn
20 25 30
<210> 463
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 463
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Asp Thr
20 25 30
<210> 464
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 464
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Gln His
20 25 30
<210> 465
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 465
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Gln Asn
20 25 30
<210> 466
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 466
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Glu Glu
20 25 30
<210> 467
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 467
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Asp Asp
20 25 30
<210> 468
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 468
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Asp Gly
20 25 30
<210> 469
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 469
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Leu Glu
20 25 30
<210> 470
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 470
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Thr Asp
20 25 30
<210> 471
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 471
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Ser Glu
20 25 30
<210> 472
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 472
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Pro Glu
20 25 30
<210> 473
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 473
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Thr Asn
20 25 30
<210> 474
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 474
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Pro His
20 25 30
<210> 475
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 475
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Met Asp
20 25 30
<210> 476
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 476
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly Ser Asp
20 25 30
<210> 477
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 477
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Ile Ala
20 25 30
<210> 478
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 478
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Gly Ser
20 25 30
<210> 479
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 479
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Thr Arg
20 25 30
<210> 480
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 480
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Val His
20 25 30
<210> 481
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 481
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Pro Ser
20 25 30
<210> 482
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 482
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Phe Ser
20 25 30
<210> 483
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 483
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gly Lys
20 25 30
<210> 484
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 484
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Lys Gln Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Tyr Leu
20 25 30
<210> 485
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 485
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Asp Leu
20 25 30
<210> 486
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 486
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Glu Lys
20 25 30
<210> 487
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 487
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Thr Asp
20 25 30
<210> 488
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 488
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Gln Val
20 25 30
<210> 489
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 489
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Arg Leu
20 25 30
<210> 490
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 490
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Tyr Ala
20 25 30
<210> 491
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 491
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Ala Ser
20 25 30
<210> 492
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 492
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Ser Arg
20 25 30
<210> 493
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 493
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Pro Thr
20 25 30
<210> 494
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 494
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Trp Asp
20 25 30
<210> 495
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 495
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Ser Met
20 25 30
<210> 496
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 496
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Thr Arg
20 25 30
<210> 497
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 497
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Lys Gln Asp Ser Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Glu Asn
20 25 30
<210> 498
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 498
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Asn Asn
20 25 30
<210> 499
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 499
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Pro Glu
20 25 30
<210> 500
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 500
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gly Ile
20 25 30
<210> 501
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 501
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Val Glu
20 25 30
<210> 502
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 502
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Pro Leu
20 25 30
<210> 503
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 503
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Pro Leu
20 25 30
<210> 504
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 504
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Arg Pro
20 25 30
<210> 505
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 505
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Asn Asp
20 25 30
<210> 506
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 506
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Leu Gln
20 25 30
<210> 507
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 507
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Asp Glu
20 25 30
<210> 508
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 508
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Arg Thr
20 25 30
<210> 509
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 509
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Ile Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gln Val
20 25 30
<210> 510
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 510
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gly Ile
20 25 30
<210> 511
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 511
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Tyr Met
20 25 30
<210> 512
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 512
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gly Gln
20 25 30
<210> 513
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 513
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Thr Pro
20 25 30
<210> 514
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 514
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Val Asn
20 25 30
<210> 515
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 515
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Phe Asn
20 25 30
<210> 516
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 516
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Glu Pro
20 25 30
<210> 517
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 517
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Asn Ser
20 25 30
<210> 518
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 518
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Ser Thr
20 25 30
<210> 519
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 519
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Arg Tyr
20 25 30
<210> 520
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 520
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Phe Ser
20 25 30
<210> 521
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 521
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Gln Val
20 25 30
<210> 522
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 522
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Tyr Ala
20 25 30
<210> 523
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 523
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Ser Arg
20 25 30
<210> 524
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 524
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Pro Thr
20 25 30
<210> 525
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 525
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Ser Met
20 25 30
<210> 526
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 526
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gly Ile
20 25 30
<210> 527
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 527
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Thr Ser
20 25 30
<210> 528
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 528
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Leu Gln
20 25 30
<210> 529
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 529
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Val Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Asp Glu
20 25 30
<210> 530
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 530
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Asp Leu
20 25 30
<210> 531
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 531
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Val Cys His Trp Tyr Asn Ser Cys Gly Gln Phe
20 25 30
<210> 532
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 532
Gly Cys Asp Val Met Gln Pro Tyr Trp Gly Cys Glu Met Asp Phe Asp
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys His Trp Tyr Asn Ser Cys Gly Trp Lys
20 25 30
<210> 533
<211> 32
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 533
Gly Cys Asn Ile Met Leu Pro Phe Trp Gly Cys Gly Gln Ser Phe Glu
1 5 10 15
Cys Leu Ala Gly Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly Leu Ser
20 25 30
<210> 534
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = D или E
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = N, K, или орнитин
<400> 534
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Xaa
1 5 10 15
Cys Leu Ser Xaa Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 535
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = N, K, или орнитин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 535
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Xaa
1 5 10 15
Cys Leu Ser Xaa Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 536
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 536
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Lys Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 537
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = орнитин
<400> 537
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Asp
1 5 10 15
Cys Leu Ser Xaa Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 538
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = D или E
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = N, K, или орнитин
<400> 538
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Met Glu Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 539
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = N или K или орнитин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 539
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Met Glu Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 540
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = D или E
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = N или K или орнитин
<400> 540
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Val Ser Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 541
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = N или K или орнитин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 541
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Val Ser Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 542
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 542
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Lys Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 543
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 543
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Lys Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 544
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = орнитин
<400> 544
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Met Glu Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 545
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 545
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Ser Lys Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 546
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = орнитин
<400> 546
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Ser Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 547
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 547
Gly Cys Asn Ile Leu Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Ser Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 548
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 548
Gly Cys Asn Ile Leu Gln Pro Phe Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Val Ser Gln Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 549
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 549
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Lys
1 5 10 15
Cys Leu Ser Xaa Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 550
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 550
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Lys
1 5 10 15
Cys Leu Ser Asp Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 551
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 551
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Lys
1 5 10 15
Cys Leu Ser Glu Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 552
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 552
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Xaa
1 5 10 15
Cys Leu Ser Xaa Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 553
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<400> 553
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Xaa
1 5 10 15
Cys Leu Ser Asp Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 554
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<400> 554
Gly Cys Asp Val Xaa Gln Pro Tyr Trp Gly Cys Gly Pro Asp Ile Xaa
1 5 10 15
Cys Leu Ser Glu Cys Ile Cys His Trp Tyr Asn Ser Cys Gly
20 25 30
<210> 555
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 555
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Lys
1 5 10 15
Cys Met Glu Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 556
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 556
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Lys
1 5 10 15
Cys Met Glu Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 557
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<400> 557
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Lys
1 5 10 15
Cys Met Glu Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 558
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 558
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Met Glu Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 559
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<400> 559
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Met Glu Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 560
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5, 16
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<400> 560
Gly Cys Asn Ile Xaa Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Met Glu Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 561
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 561
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Lys
1 5 10 15
Cys Val Ser Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 562
<211> 29
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = норлейцин
<400> 562
Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Lys Cys
1 5 10 15
Val Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25
<210> 563
<211> 29
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = норлейцин
<400> 563
Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Lys Cys
1 5 10 15
Val Ser Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25
<210> 564
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = D или E
<400> 564
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Val Ser Xaa Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 565
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 16
<223> Xaa = орнитин
<400> 565
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Val Ser Asp Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 566
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = норлейцин
<220>
<221> ВАРИАНТ
<222> 516
<223> Xaa = орнитин
<400> 566
Gly Cys Asn Ile Xaa Leu Pro Phe Trp Gly Cys Gly Arg Asp Phe Xaa
1 5 10 15
Cys Val Ser Glu Cys Ile Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
<210> 567
<211> 5
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 567
Arg Trp Tyr Glu Ser
1 5
<210> 568
<211> 30
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> ВАРИАНТ
<222> 20
<223> Xaa = орнитин
<400> 568
Gly Cys Asn Ile Met Leu Pro Tyr Trp Gly Cys Gly Arg Asp Phe Glu
1 5 10 15
Cys Leu Ala Xaa Cys Val Cys Gln Tyr Tyr Gln Ser Cys Gly
20 25 30
1<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2019 |
|
RU2747735C2 |
| СУБСТРАТЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ И ДРУГИЕ РАСЩЕПЛЯЕМЫЕ ФРАГМЕНТЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2014 |
|
RU2832636C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| ЭЛЕМЕНТЫ, СВЯЗЫВАЮЩИЕСЯ С ИЛ-1 БЕТА | 2013 |
|
RU2711118C2 |
| ВАРИАНТНЫЕ СВЯЗЫВАЮЩИЕ CD3 ДОМЕНЫ И ИХ ПРИМЕНЕНИЕ В КОМБИНИРОВАННОЙ ТЕРАПИИ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2810222C2 |
| Новые производные оксинтомодулина и содержащая их фармацевтическая композиция для лечения ожирения | 2012 |
|
RU2739209C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| АНТИТЕЛА ПРОТИВ НtrА1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2750285C2 |
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |
| CD40L-СПЕЦИФИЧНЫЕ КАРКАСНЫЕ СТРУКТУРЫ, ПРОИСХОДЯЩИЕ ИЗ TN3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2826189C2 |
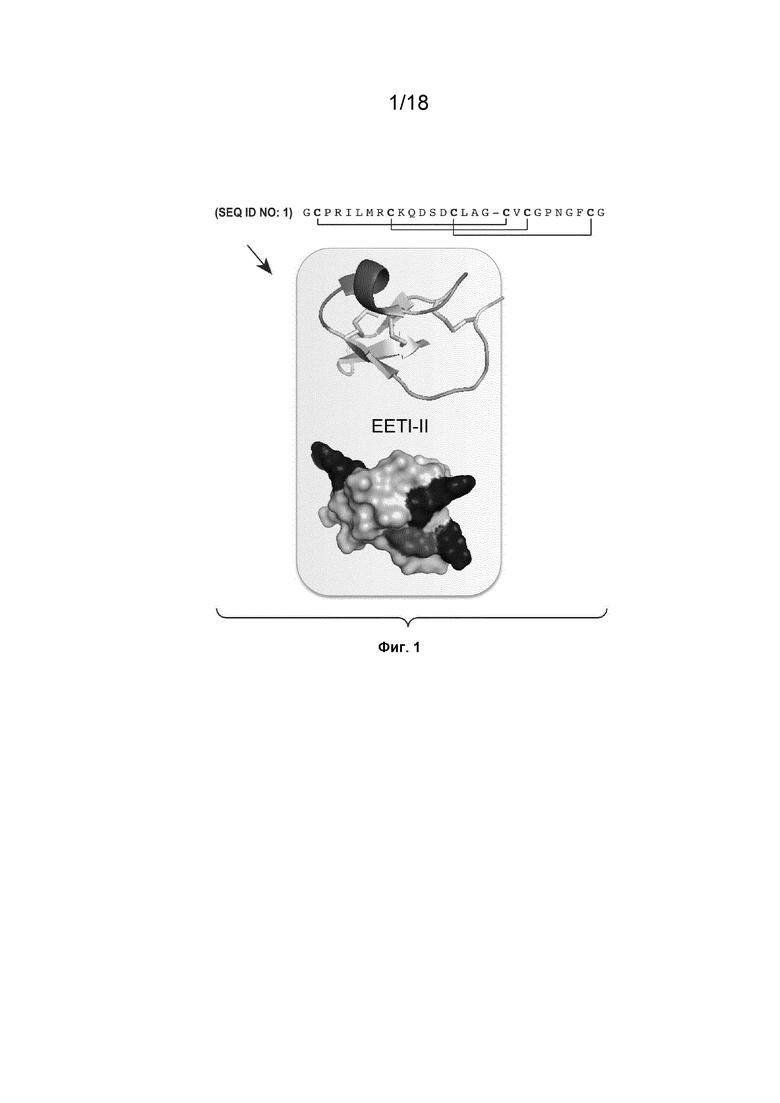
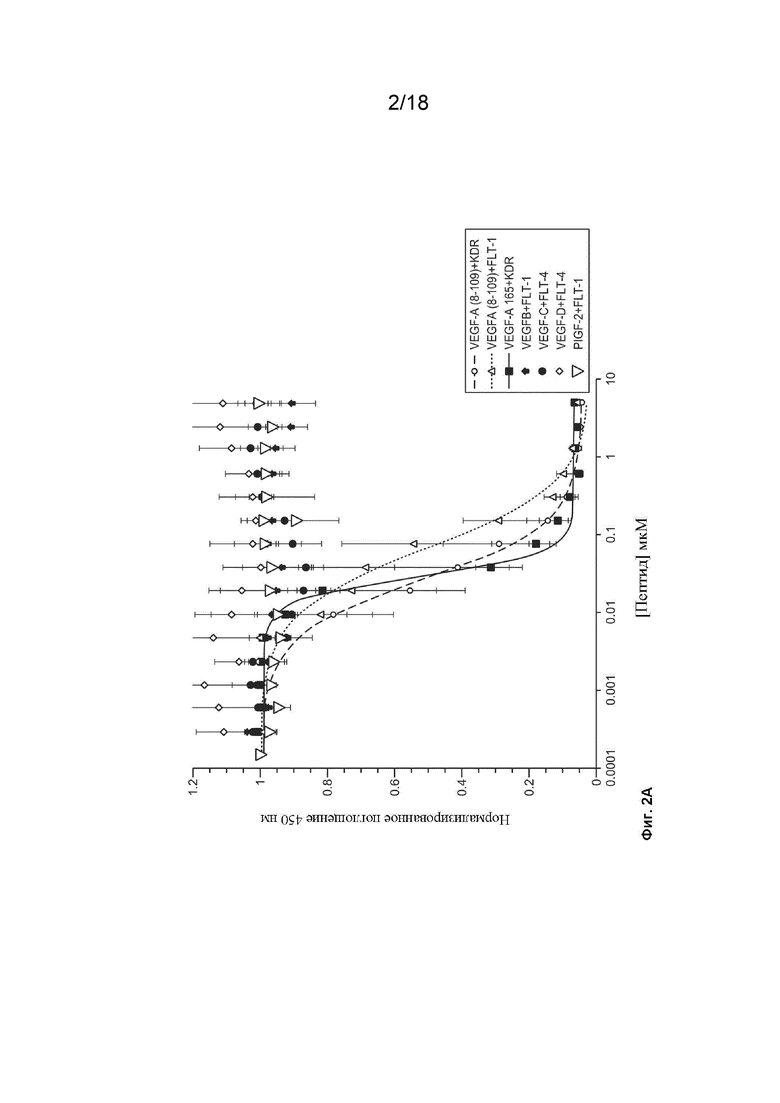
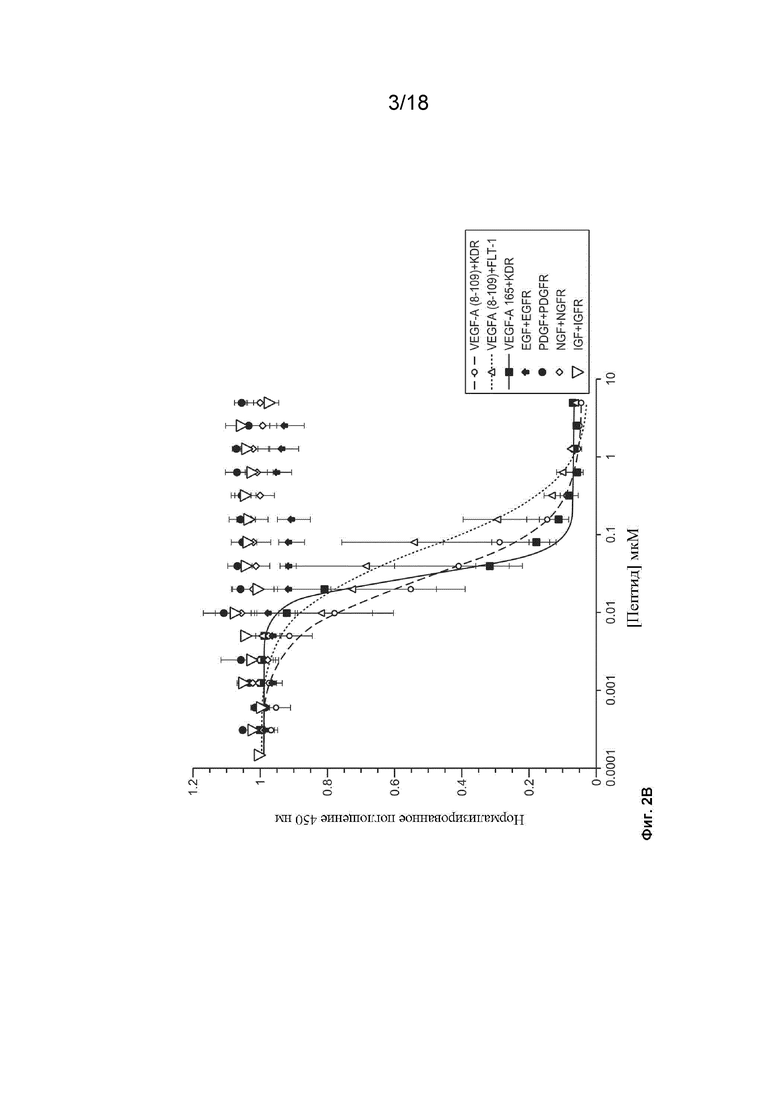
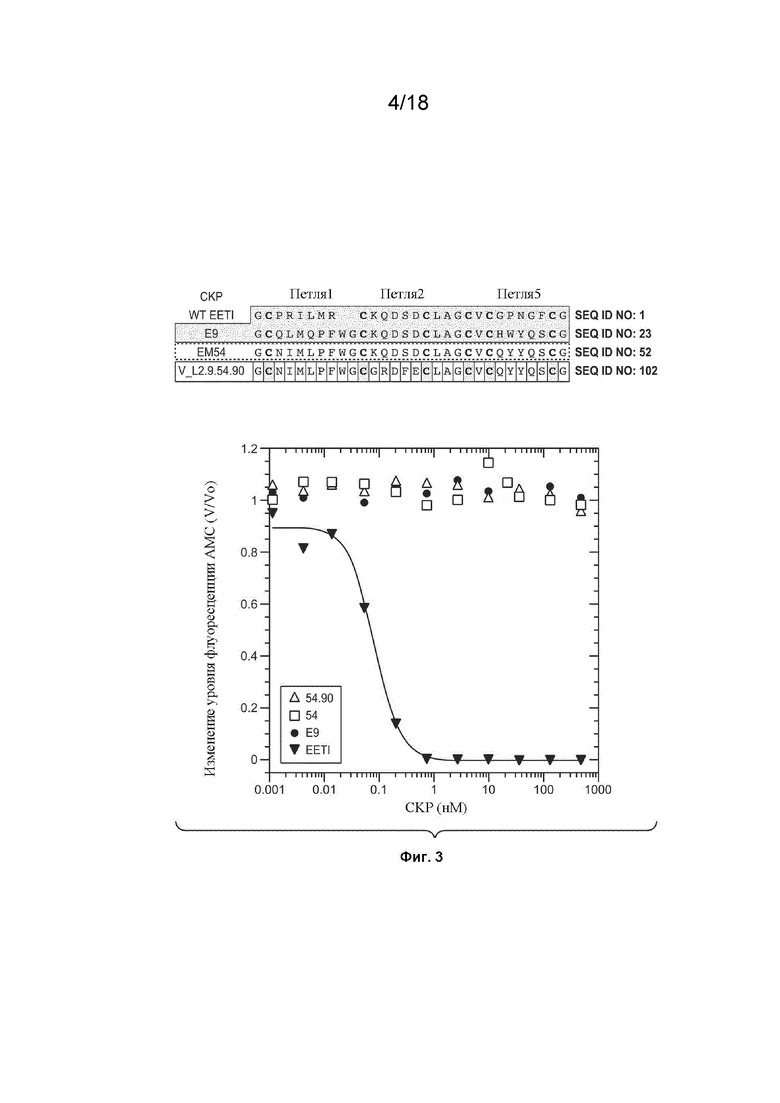
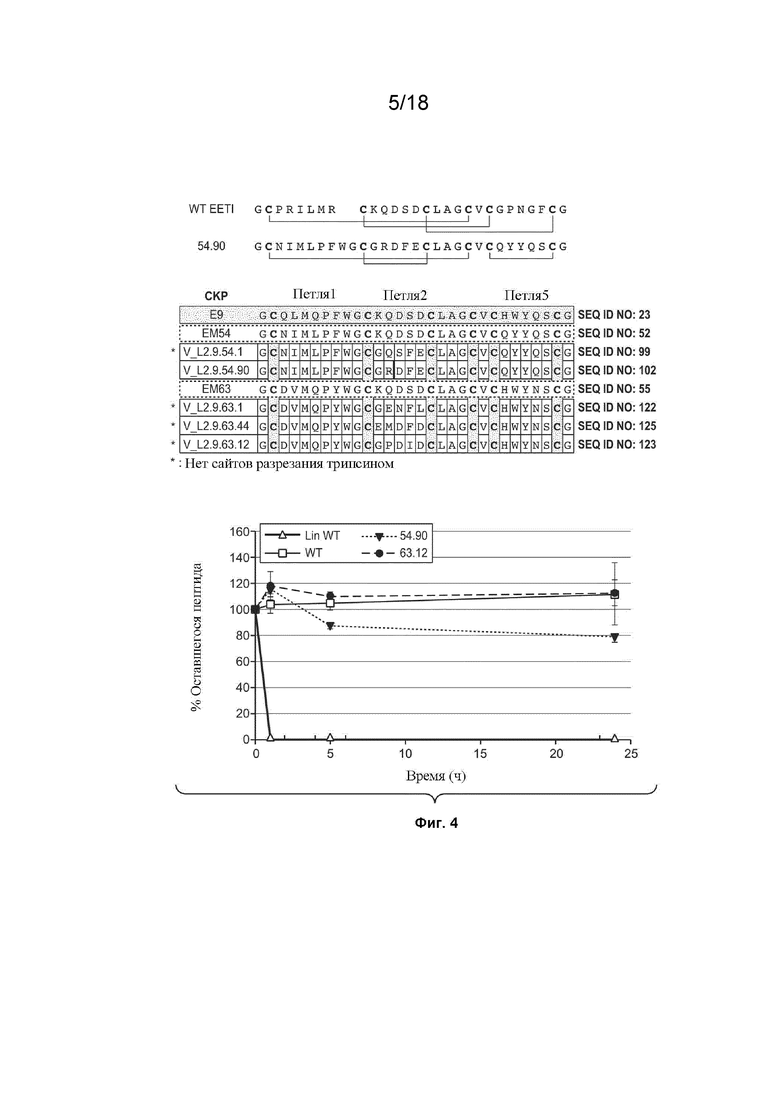
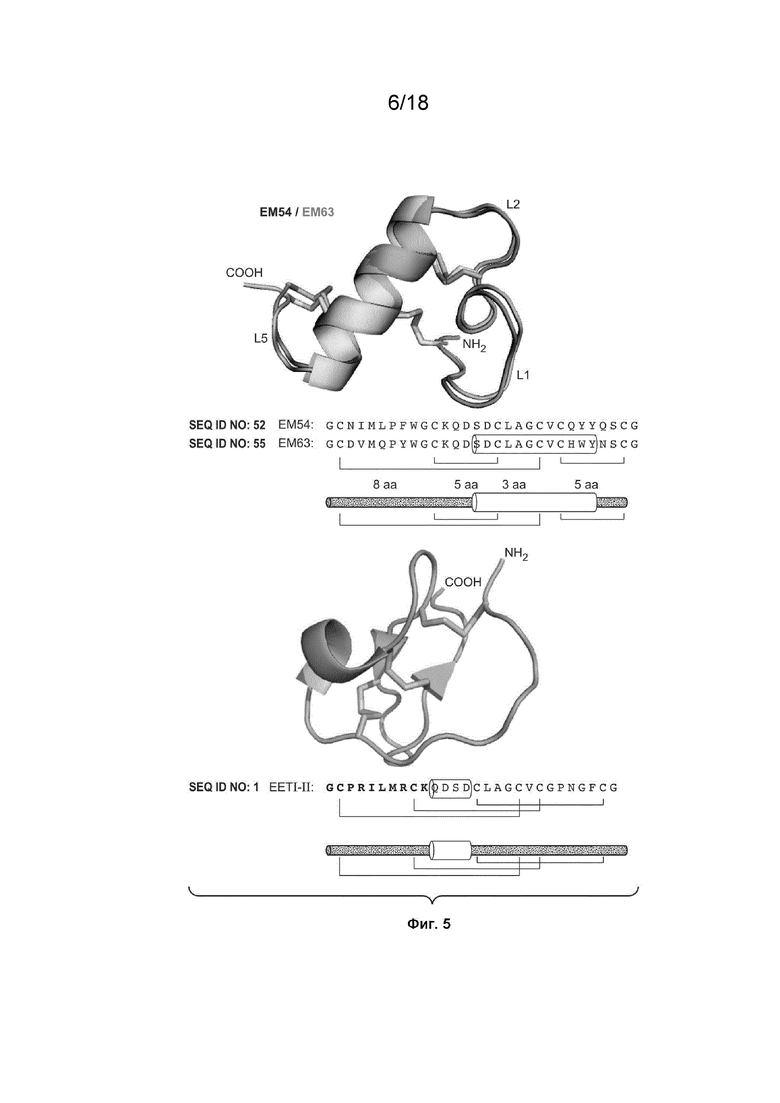
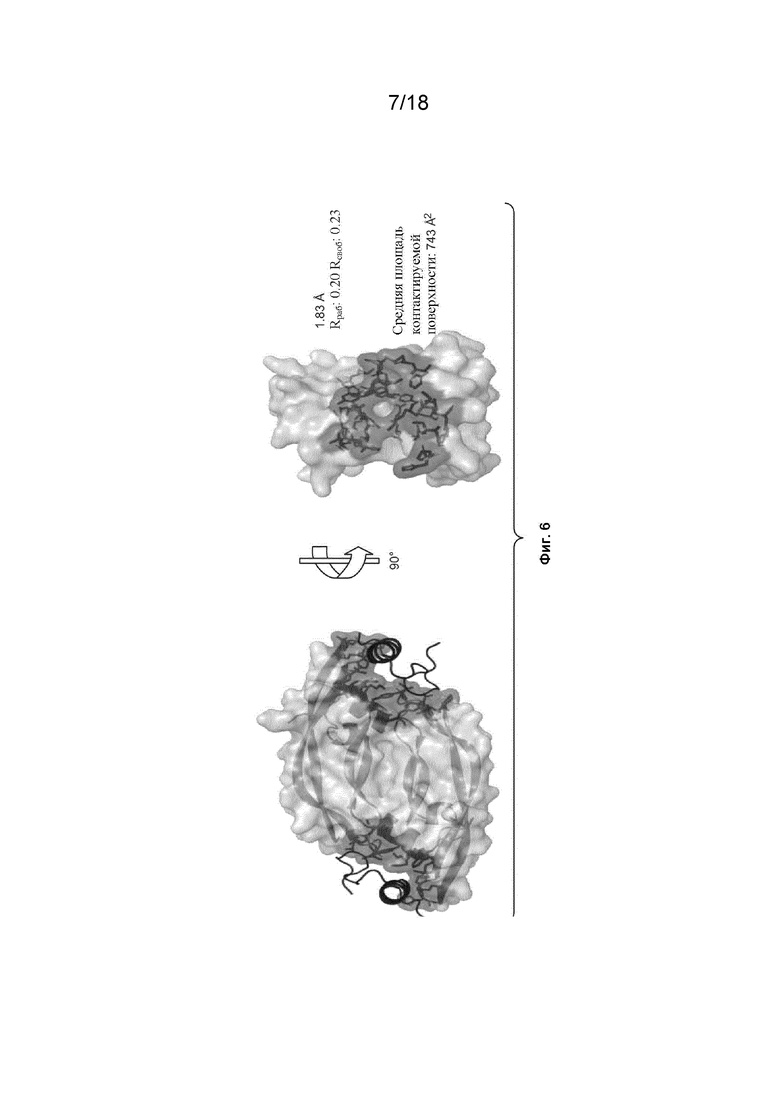
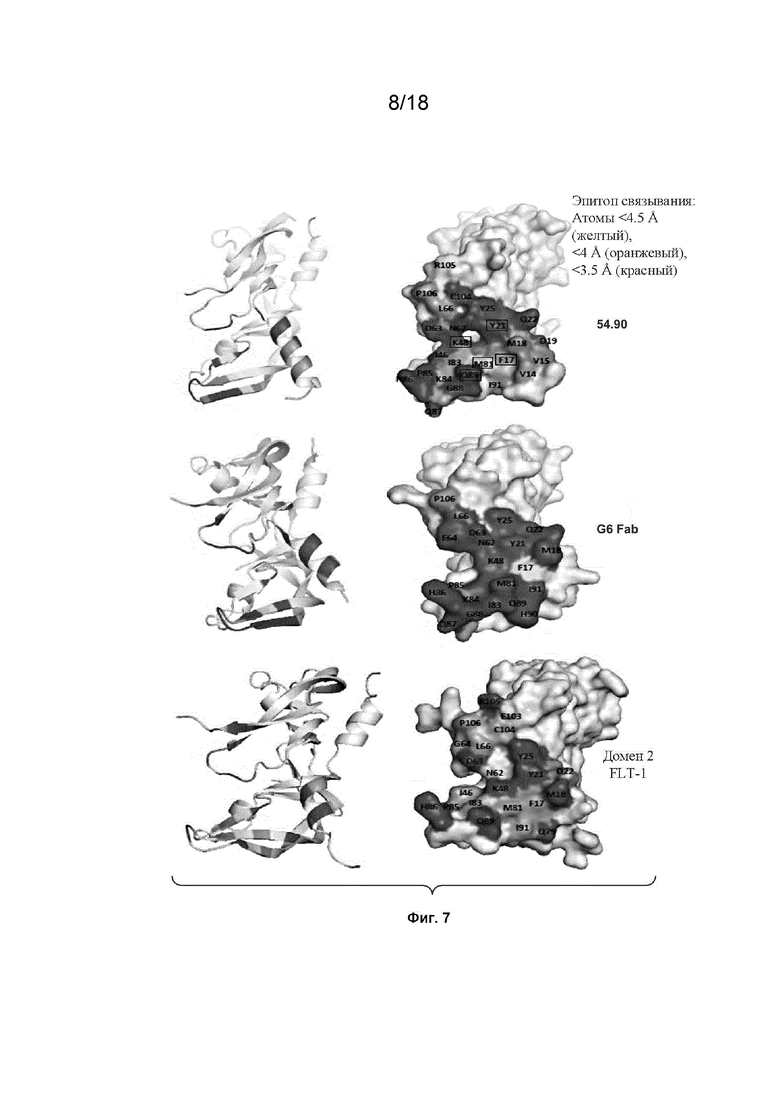
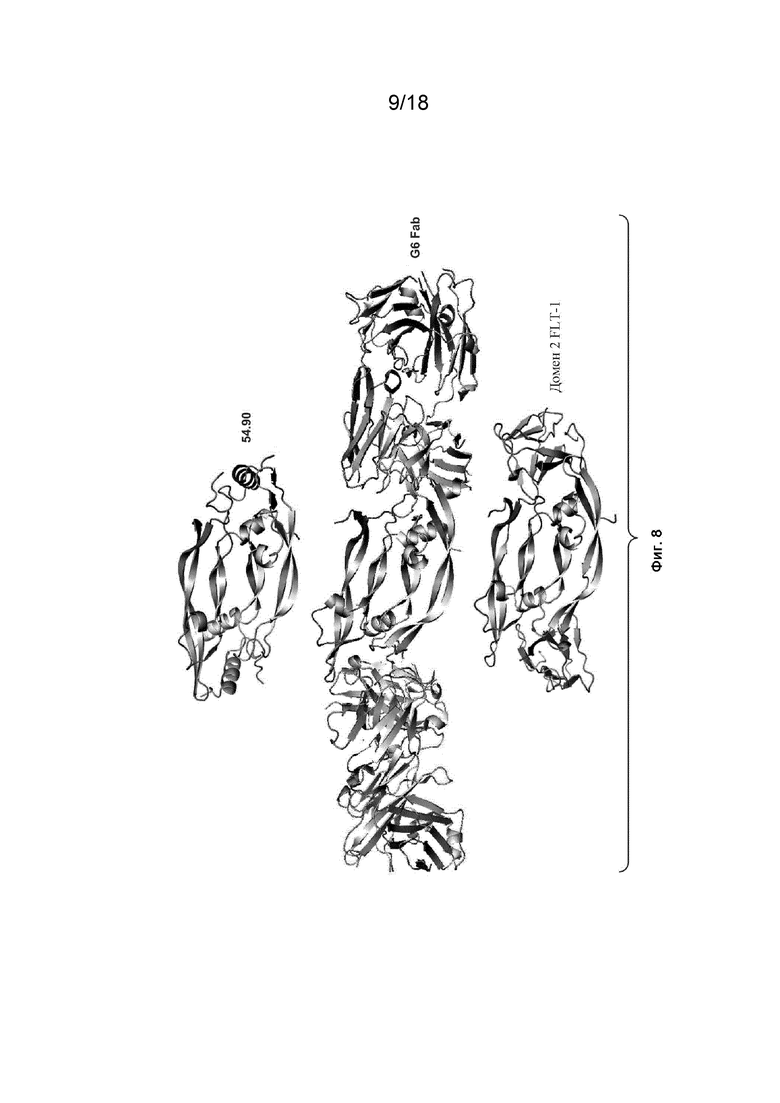
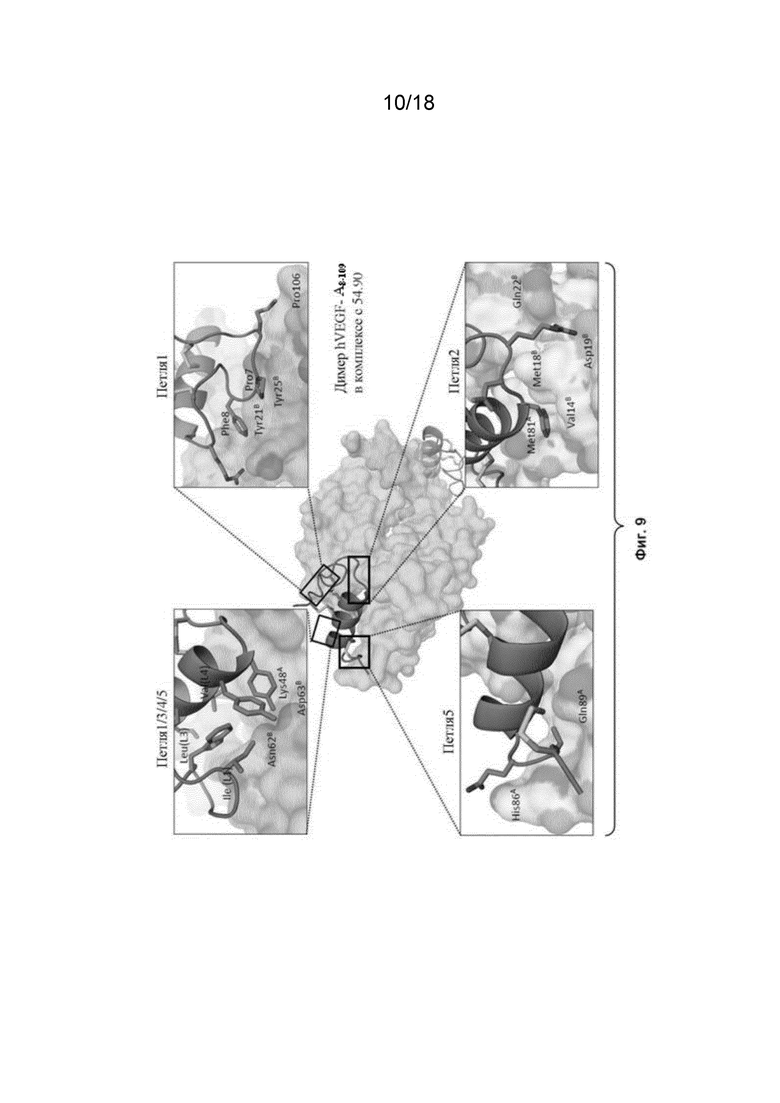
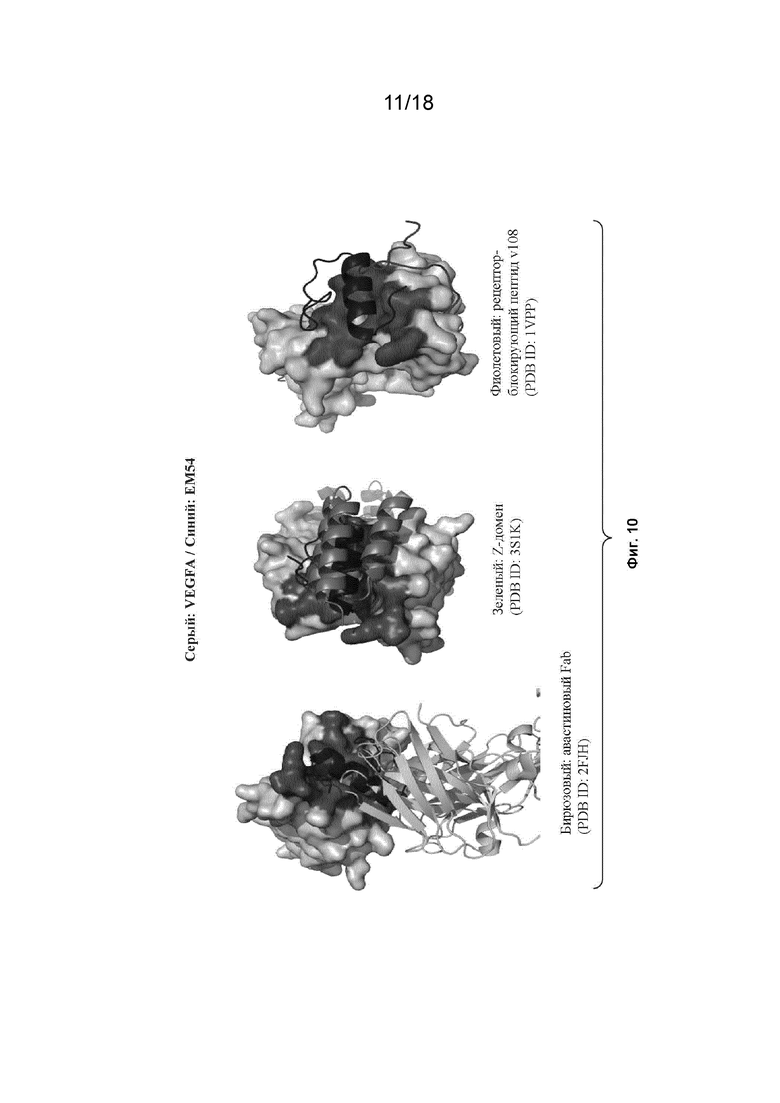
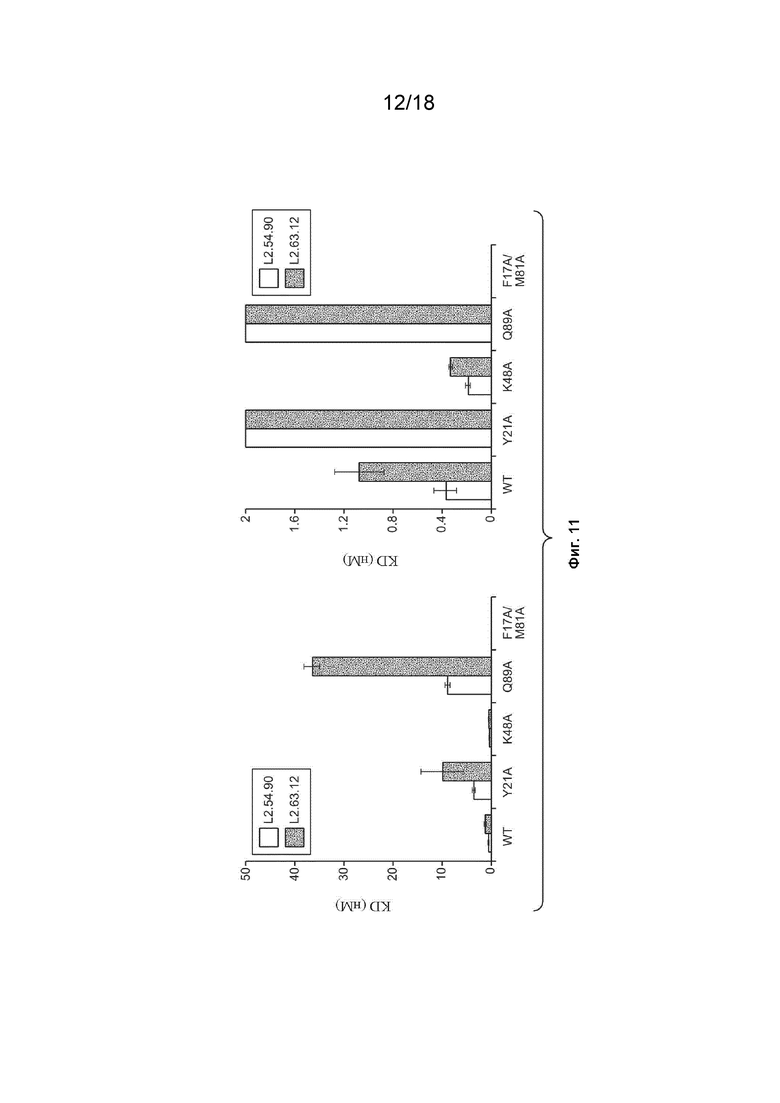
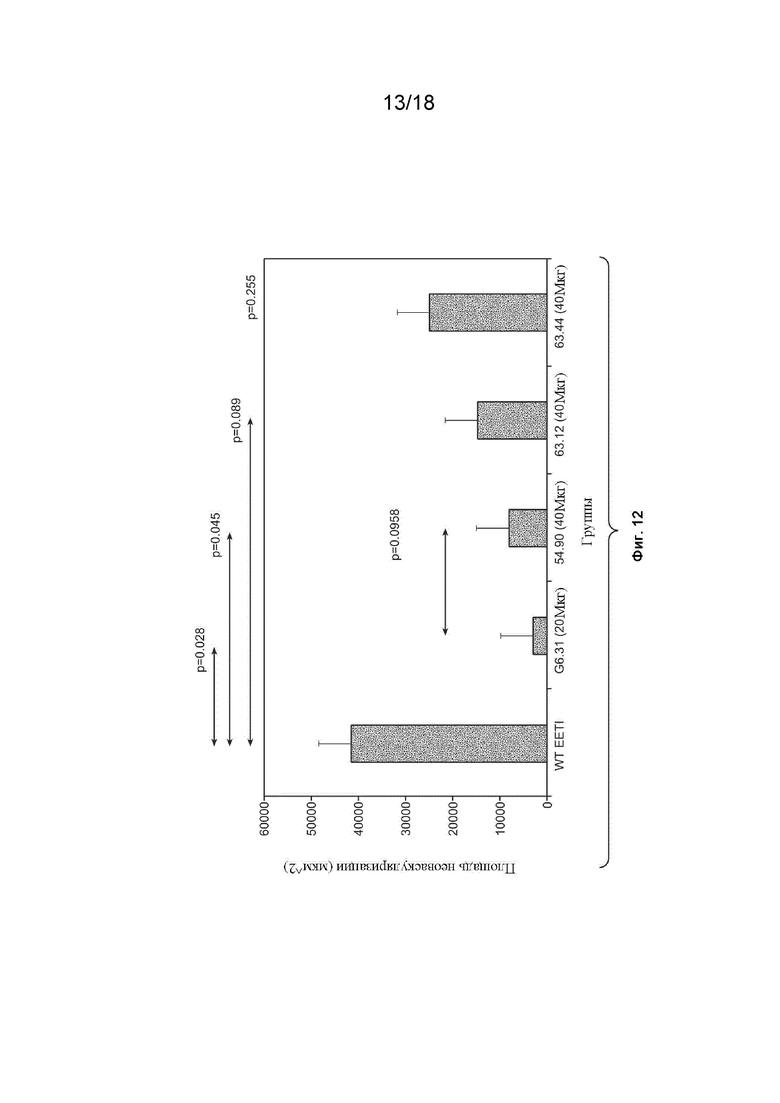


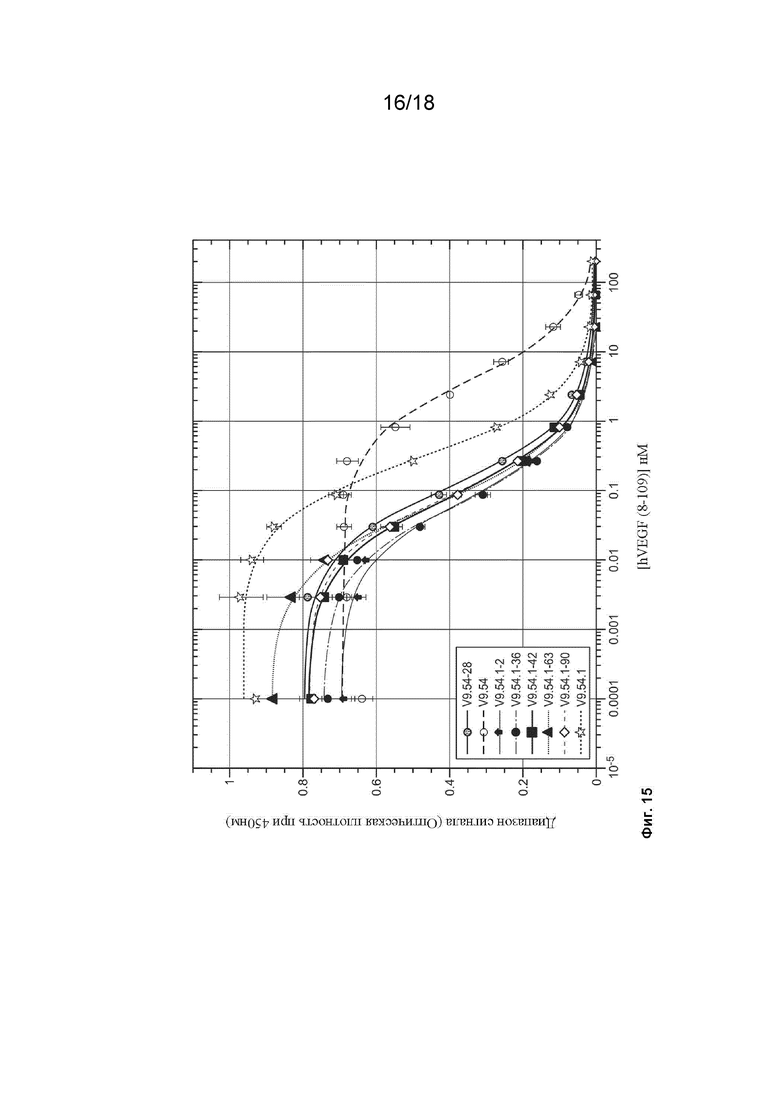
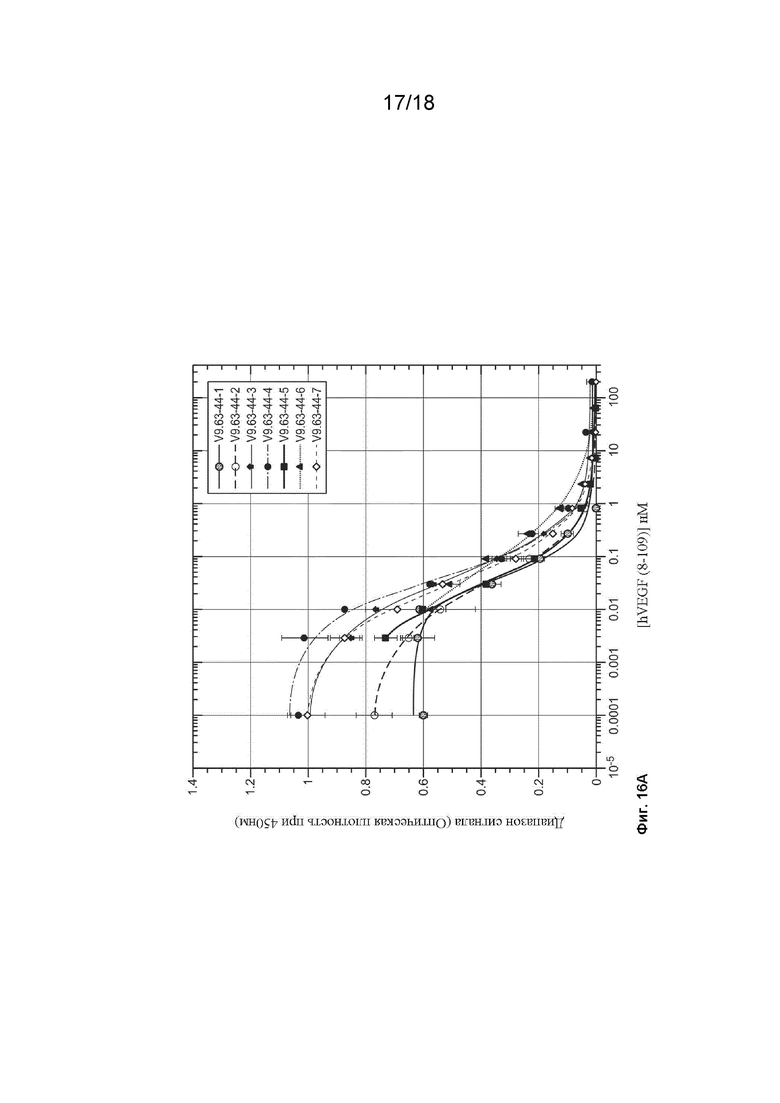
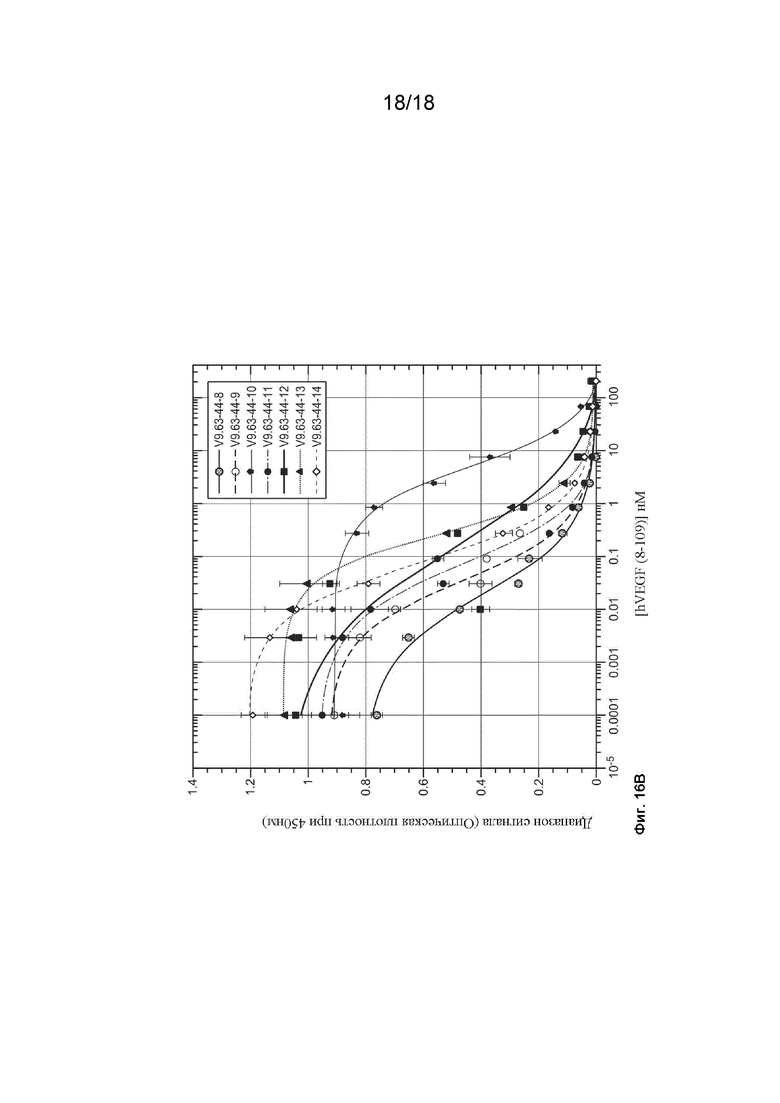
Настоящее изобретение относится к области биотехнологии, конкретно к не встречающимся в природе пептидам с цистиновым узлом (CKP), и может быть использовано в медицине. Изобретение позволяет получить новые пептиды, способные к эффективному связыванию и ингибированию VEGF-A. Пептиды в соответствии с настоящим изобретением содержат цистеиновый узел и способны к образованию внутримолекулярного каркаса, повышающего общую стабильность белка. Изобретение может быть применимо в медицинской практике для лечения окулярных заболеваний, характеризующихся аномальным ангиогенезом и аномальной сосудистой проницаемостью. 20 н. и 38 з.п. ф-лы, 48 табл., 3 пр., 16 ил.
1. Пептид, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит каркасную структуру:
Z1C1L1C2L2C3L3C4L4C5L5C6Z2
где
Z1 соответствует N-концу пептида и выбран из группы, состоящей из G, никакой аминокислоты и X, где X представляет собой ацетилглицин или ПЭГ6-пропаргилглицин;
Z2 соответствует C-концу пептида и выбран из группы, состоящей из G, никакой аминокислоты, L-серина, D-серина, X, где X выбран из группы, состоящей из: L-бета-гомосерина, L-бета-аланина, N-альфа-метил-глицина, глицина, содержащего амидированную карбоксильную группу, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила, глицинамида и глицин-морфолинового амида, GFH, GIA, GGS, GTR, GVH, GLS, и аминокислот 30-33 любой из последовательностей SEQ ID NO: 369-378;
C1, C2, C3, C4, C5, и C6 представляют собой остатки цистеина; и
L1 представляет собой петлю 1, L2 представляет собой петлю 2, L3 представляет собой петлю 3, L4 представляет собой петлю 4, и L5 представляет собой петлю 5;
где
L1 выбран из группы, состоящей из SEQ ID NO: 33, 141, 143, 212, 213, 277, 396-404, 414, 416, 433, 434, аминокислот 3-10 последовательности SEQ ID NO: 548;
L2 выбран из группы, состоящей из SEQ ID NO: 97, 418 и аминокислот 12-16 последовательностей SEQ ID NO: 538, 539, 540 и 541;
L3 выбран из группы, состоящей из LAG, LQQ, VER, MSD, MNQ, MQT, VYQ, FIN, VSQ, VTE, FYE, MEQ, LEQ, VYR, VSD, VSE, VSK, VSN, VSX, где X представляет собой орнитин, LAK, MED, MEE, MEK, MEN и MEX, где X представляет собой орнитин, LAX, где X представляет собой орнитин, LSG, LTG, LEG и XAG, где X выбран из группы, состоящей из: t-бутил-L-аланина, циклобутил-L-аланина, циклопентил-L-аланина и 5,5,5-трифтор-L-лейцина, и XEQ, где X выбран из группы, состоящей из: норлейцина, t-бутил-L-аланина и циклобутил-L-аланина;
L4 выбран из группы, состоящей из V, L, I, и X, где X выбран из группы, состоящей из: норлейцина, бутил-L-глицина, t-бутил-L-аланина, L-циклопентилглицина, циклопентил-L-аланина, циклобутил-L-глицина, циклобутил-L-аланина и 5,5,5-трифтор-L-лейцина; и
L5 выбран из группы, состоящей из SEQ ID NO: 45, 220, 427 и 429; и
где C1 формирует дисульфидную связь с C4, C2 формирует дисульфидную связь с C3, и C5 формирует дисульфидную связь с C6.
2. Пептид по п. 1, где:
(a) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 33;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG, LQQ, VER, MSD, MNQ, MQT, VYQ, FIN, VSQ, VTE, FYE, MEQ или VYR;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
(b) Z1 и Z2 представляют собой G;
L1 выбран из группы, состоящей из SEQ ID NO: 33, 277 и 396-403;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(c) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 404;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(d) Z1 представляет собой G, никакую аминокислоту или X, где X выбран из группы, состоящей из ацетилглицина или ПЭГ6-пропаргилглицина;
Z2 представляет собой G или никакую аминокислоту;
L1 представляет собой SEQ ID NO: 33, 141, 212 или 414;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(e) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 213 или 416;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(f) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 141,
L2 представляет собой SEQ ID NO: 418;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(g) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 141,
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAK, LAX, где X представляет собой орнитин, или XAG, где X выбран из группы, состоящей из: t-бутил-L-аланина, циклобутила-L-аланина, циклопентила-L-аланина и 5,5,5-трифтор-L-лейцина;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(h) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 33;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LSG, LTG или LEG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(i) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 141;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой L, I или X, где X представляет собой неприродную аминокислоту, выбранную из группы, состоящей из: бутил-L-глицина, t-бутил-L-аланина, L-циклопентилглицина, циклопентил-L-аланина, L-циклобутил-L-глицина, циклобутил-L-аланина и 5,5,5-трифтор-L-лейцина, и L5 представляет собой SEQ ID NO: 45;
(j) Z1 представляет собой G;
Z2 представляет собой G, S, или X, где X представляет собой D-серин, представляет собой L-бета-гомосерин или L-бета-аланин;
L1 представляет собой SEQ ID NO: 141;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V и
L5 представляет собой SEQ ID NO: 220, 427 или 429;
(k) Z1 представляет собой G;
Z2 представляет собой X, где X выбран из группы, состоящей из: L-серина, D-серина, L-бета-гомосерина, L-бета-аланина, N-альфа-метил-глицина, глицинамида, сложного эфира глицина и глицерина, сложного эфира глицина и этиленгликоля, сложного эфира глицина оксетан-3-ила или глицин-морфолинового амида;
L1 представляет собой SEQ ID NO: 141,
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(l) Z1 представляет собой G;
Z2 представляет собой аминокислоты 30-33 любой из последовательностей SEQ ID NO: 369-378;
L1 представляет собой SEQ ID NO: 33;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(m) Z1 представляет собой G;
Z2 представляет собой аминокислоты 30-32 любой из последовательностей SEQ ID NO: 379-384;
L1 представляет собой SEQ ID NO: 33;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 45;
(n) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 33, 141, 143, 397 или 433;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой MEQ;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
(o) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 143 или 433;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой LEQ или XEQ, где X выбран из группы, состоящей из: норлейцина и циклобутил-L-аланина;
L4 представляет собой I или X, где X выбран из группы, состоящей из циклобутил-L-глицина, циклобутил-L-аланина и норлейцина; и
L5 представляет собой SEQ ID NO: 45;
(p) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 397;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой MEQ или XEQ, где X выбран из группы, состоящей из: циклобутил-L-аланина и t-бутил-L-аланина;
L4 представляет собой I или X, где X выбран из группы, состоящей из: циклобутил-L-глицина и циклобутил-L-аланина; и
L5 представляет собой SEQ ID NO: 45;
(q) Z1 представляет собой X, где X представляет собой ацетилглицина;
Z2 представляет собой X, где X представляет собой гицинамид;
L1 представляет собой SEQ ID NO: 143, 397 или 434;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой MEQ или LEQ;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
(r) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 33, 396 или аминокислоты 3-10 последовательности SEQ ID NO: 548;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой VSQ;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
(s) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 141, 143 или 277;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой MSD, MNQ, FYE или VSQ;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
(t) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 143;
L2 представляет собой SEQ ID NO: 97, аминокислоты 12-16 последовательности SEQ ID NO: 538 или аминокислоты 12-16 последовательности SEQ ID NO: 539;
L3 представляет собой MED, MEE, MEK, MEN и MEX, где X представляет собой орнитин;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
(u) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 277;
L2 представляет собой SEQ ID NO: 97, аминокислоты 12-16 последовательности SEQ ID NO: 540 или аминокислоты 12-16 последовательности SEQ ID NO: 541;
L3 представляет собой VSD, VSE, VSK, VSN или VSX, где X представляет собой орнитин;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45;
или
(v) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 433;
L2 представляет собой SEQ ID NO: 97;
L3 представляет собой XEQ, где X представляет собой норлейцин;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 45.
3. Пептид по п. 2(a), где пептид содержит последовательность, представленную любой из SEQ ID NO: 103-114.
4. Пептид по п. 2(b), где пептид содержит последовательность, представленную любой из SEQ ID NO: 102 и 218, 405-412.
5. Пептид по п. 2(c), где пептид содержит последовательность SEQ ID NO: 413.
6. Пептид по п. 2(d), где пептид содержит последовательность, представленную любой из SEQ ID NO: 216, 217, 221, 361, 362 и 415.
7. Пептид по п. 2(e), где пептид содержит последовательность, представленную любой из SEQ ID NO: 219 или 417.
8. Пептид по п. 2(f), где пептид содержит SEQ ID NO: 419.
9. Пептид по п. 2(g), где пептид содержит последовательность, представленную любой из SEQ ID NO: 420, 542 и 568.
10. Пептид по п. 2(h), где пептид содержит последовательность, представленную любой из SEQ ID NO: 421-423.
11. Пептид по п. 2(i), где пептид содержит последовательность, представленную любой из SEQ ID NO: 424-426.
12. Пептид по п. 2(j), где пептид содержит последовательность, представленную любой из SEQ ID NO: 428 или 430.
13. Пептид по п. 2(k), где пептид содержит последовательность, представленную любой из SEQ ID NO: 431 или 432.
14. Пептид по п. 2(l), где пептид содержит последовательность, представленную любой из SEQ ID NO: 369-378.
15. Пептид по п. 2(m), где пептид содержит последовательность, представленную любой из SEQ ID NO: 379-384.
16. Пептид по п. 2(n), где пептид содержит последовательность, представленную любой из SEQ ID NO: 113, 142, 146, 435 и 436.
17. Пептид по п. 2(o), где пептид содержит последовательность, представленную любой из SEQ ID NO: 437-440.
18. Пептид по п. 2(p), где пептид содержит последовательность, представленную любой из SEQ ID NO: 441 или 442.
19. Пептид по п. 2(q), где пептид содержит последовательность, представленную любой из SEQ ID NO: 443-446.
20. Пептид по п. 2(r), где пептид содержит последовательность, представленную любой из SEQ ID NO: 110, 547 и 548.
21. Пептид по п. 2(s), где пептид содержит последовательность, представленную любой из SEQ ID NO: 144-145, 222-223 и 365.
22. Пептид по п. 2(t), где пептид содержит последовательность, представленную любой из SEQ ID NO: 538-539, 543-544 и 555-560.
23. Пептид по п. 2(u), где пептид содержит последовательность, представленную любой из SEQ ID NO: 540-541, 545-546 и 561-566.
24. Пептид, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит аминокислотную последовательность, выбранную их группы, состоящей из:
GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113),
GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114),
GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139),
GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140),
GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142),
GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle),
GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle),
GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle),
GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин (Nle), и
GCNILLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 435).
25. Пептид по п. 24, содержащий SEQ ID NO: 139.
26. Пептид по п. 24, содержащий SEQ ID NO: 142.
27. Пептид по п. 24, содержащий SEQ ID NO: 146.
28. Пептид по п. 24, содержащий SEQ ID NO: 435.
29. Пептид, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит аминокислотную последовательность, выбранную их группы, состоящей из:
GCDVX1QPYWGCGPDI-D/E-CLS-N/K/X2-CICHWYNSCG (SEQ ID NO: 534),
GCDVX1QPYWGCGPDI-N/K/X2-CLS-D/E-CICHWYNSCG (SEQ ID NO: 535),
GCNIX1LPYWGCGRDF-D/E-CME-N/K/X2-CICQYYQSCG (SEQ ID NO: 538),
GCNIX1LPYWGCGRDF-N/K/X2-CME-D/E-CICQYYQSCG (SEQ ID NO: 539),
GCNIX1LPFWGCGRDF-D/E-CVS-N/K/X2-CICQYYQSCG (SEQ ID NO: 540),
GCNIX1LPFWGCGRDF-N/K/X2-CVS-D/E-CICQYYQSCG (SEQ ID NO: 541), где X1 представляет собой норлейцин, и X2 представляет собой орнитин, и
GCNIX1LPYWGCGRDFECX2EQCICQYYQSCG (SEQ ID NO: 437), где оба из X1 и X2 представляют собой норлейцин.
30. Пептид, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит каркасную структуру:
Z1C1L1C2L2C3L3C4L4C5L5C6Z2
где:
Z1 соответствует N-концу пептида и выбран из группы, состоящей из: G или X, где X представляет собой неприродную аминокислоту ацетилглицин;
Z2 соответствует C-концу пептида и выбран из группы, состоящей из: G, аминокислот 30-32 любой из последовательностей SEQ ID NO: 387-395, 481-501 и 503-532; и X, где X представляет собой неприродную аминокислоту глицинамид;
C1, C2, C3, C4, C5 и C6 представляют собой остатки цистеина; и
L1 представляет собой петлю 1, L2 представляет собой петлю 2, L3 представляет собой петлю 3, L4 представляет собой петлю 4, и L5 представляет собой петлю 5;
где
L1 выбран из группы, состоящей из: SEQ ID NOs: 35, 127, 128, 129, 214 и 385;
L2 выбран из группы, состоящей из: SEQ ID NO: 93, 117-120, 322-339 и аминокислот 12-16 любой из последовательностей SEQ ID No: 481, 509, 534-537 и 549-554;
L3 выбран из группы, состоящей из: LAG, FVR, LSN, XSN, где X представляет собой неприродную аминокислоту циклобутил-L-аланин или t-бутил-L-аланин, и аминокислоты 18-20 любой из последовательностей SEQ ID No: 529, 534-537 и 549-554;
L4 выбран из группы, состоящей из: V, L, I, X где X представляет собой неприродную аминокислоту циклобутил-L-глицин или циклобутил-L-аланин; и
L5 выбран из группы, состоящей из: SEQ ID NO: 46, 121, 132 и 133; и
где C1 формирует дисульфидную связь с C4, C2 формирует дисульфидную связь с C3, и C5 формирует дисульфидную связь с C6.
31. Пептид по п. 30, где:
(a) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 35;
L2 представляет собой последовательность, выбранную из группы, состоящей из: SEQ ID NO: 93, 117-120, 211 и 322-339;
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 46;
(b) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 127, 128 или 129;
L2 представляет собой SEQ ID NO: 93
L3 представляет собой LAG;
L4 представляет собой V; и
L5 представляет собой SEQ ID NO: 131, 132 или 133;
(c) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 35 или 214, где X представляет собой норлейцин;
L2 представляет собой SEQ ID NO: 118;
L3 представляет собой LAG, FVR, или LSN;
L4 представляет собой V, L или I; и
L5 представляет собой SEQ ID NO: 46;
(d) Z1 представляет собой G;
Z2 представляет собой G или аминокислоты 30-32 любой из последовательностей SEQ ID NO: 387-395;
L1 представляет собой SEQ ID NO: 385;
L2 представляет собой SEQ ID NO: 118;
L3 представляет собой LSN;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 46;
(e) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 214 или SEQ ID NO: 385;
L2 представляет собой SEQ ID NO: 118;
L3 представляет собой LSN или XSN, где X представляет собой циклобутил-L-аланин или t-бутил-L-аланин;
L4 представляет собой I или X, где X представляет собой циклобутил-L-глицин или циклобутил-L-аланин; и
L5 представляет собой SEQ ID NO: 46;
(f) Z1 представляет собой G или X, где X представляет собой ацетилглицин;
Z2 представляет собой G или глицинамид;
L1 представляет собой SEQ ID NO: 214 или SEQ ID NO: 385;
L2 представляет собой SEQ ID NO: 118;
L3 представляет собой LSN или XSN, где X представляет собой циклобутил-L-аланин;
L4 представляет собой I или X, где X представляет собой циклобутил-L-глицин или циклобутил-L-аланин; и
L5 представляет собой SEQ ID NO: 46;
(g) Z1 и Z2 представляют собой G;
L1 представляет собой SEQ ID NO: 214, где X представляет собой норлейцин;
L2 представляет собой SEQ ID NO: 118 или аминокислоты 12-16 любой из последовательностей SEQ ID NO: 534-537 и 549-554;
L3 представляет собой аминокислоты 18-20 любой из последовательностей SEQ ID No: 534-537 и 549-554;
L4 представляет собой I; и
L5 представляет собой SEQ ID NO: 46;
(h) Z1 представляет собой G;
Z2 представляет собой G или аминокислоты 30-32 любой из последовательностей SEQ ID NO: 481-501, 503-507 и 527;
L1 представляет собой SEQ ID NO: 35;
L2 представляет собой SEQ ID NO: 93, 120 или аминокислоты 12-16 последовательности SEQ ID NO: 481;
L3 представляет собой LAG;
L4 представляет собой V или I; и
L5 представляет собой SEQ ID NO: 46;
или
(i) Z1 представляет собой G;
Z2 представляет собой G или аминокислоты 30-32 любой из последовательностей SEQ ID NO: 503 и 508-532;
L1 представляет собой SEQ ID NO: 35;
L2 представляет собой SEQ ID NO: 120 или аминокислоты 12-16 последовательности SEQ ID NO: 509;
L3 представляет собой LAG или аминокислоты 18-20 последовательности SEQ ID NO: 529;
L4 представляет собой V или I; и
L5 представляет собой SEQ ID NO: 46.
32. Пептид по п. 31(a), где пептид содержит последовательность, представленную любой из SEQ ID NO: 55, 122-126 и 340-357.
33. Пептид по п. 31(b), где пептид содержит последовательность, представленную любой из SEQ ID NO: 135-137.
34. Пептид по п. 31(c), где пептид содержит последовательность, представленную любой из SEQ ID NO: 123, 139, 140 и 224.
35. Пептид по п. 31(d), где пептид содержит последовательность, представленную любой из SEQ ID NO: 386-395.
36. Пептид по п. 31(e), где пептид содержит последовательность, представленную любой из SEQ ID NO: 224 и 447-450.
37. Пептид по п. 31(f), где пептид содержит последовательность, представленную любой из SEQ ID NO: 451-453.
38. Пептид по п. 31(g), где пептид содержит последовательность, представленную любой из SEQ ID NO: 534-537 и 549-554.
39. Пептид по п. 31(h), где пептид содержит последовательность, представленную любой из SEQ ID NO: 456, 481-501, 503-507 и 527.
40. Пептид по п. 31(i), где пептид содержит последовательность, представленную любой из SEQ ID NO: 508-532.
41. Пептид, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит кэпированную C-концевую карбоксильную группу, кэпированную N-концевую аминную группу, кэпированную C-концевую карбоксильную группу и кэпированную N-концевую аминную группу, где пептид содержит последовательность, представленную в любом из пп. 1-40.
42. Пептид по любому из пп. 1-41, где пептид ингибирует активность VEGF-A.
43. Конъюгат, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит пептид по любому из пп. 1-42, конъюгированный с терапевтическим средством.
44. Конъюгат, который связывается с фактором роста эндотелия сосудов A (VEGF-A) и содержит пептид по любому из пп. 1-42, конъюгированный с меткой, необязательно где метка представляет собой радиоизотоп, флуоресцентный краситель или фермент.
45. Выделенная нуклеиновая кислота, кодирующая пептид по любому из пп. 1-42.
46. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 45.
47. Клетка для получения пептида по любому из пп. 1-42, содержащая экспрессионный вектор по п. 46.
48. Способ получения пептида по любому из пп. 1-42, включающий культивирование клетки по п. 47 и выделение пептида, экспрессированного клеткой из клеточной культуры.
49. Способ получения пептида по любому из пп. 1-42, включающий химическое синтезирование пептида.
50. Фармацевтическая композиция для лечения окулярного заболевания, характеризующегося аномальным ангиогенезом, аномальной сосудистой проницаемостью или аномальным ангиогенезом и аномальной сосудистой проницаемостью, содержащая эффективное количество пептида по любому из пп. 1-42 или конъюгат по п. 43 и фармацевтически приемлемый носитель.
51. Фармацевтический препарат для лечения окулярного заболевания, характеризующегося аномальным ангиогенезом, аномальной сосудистой проницаемостью или аномальным ангиогенезом и аномальной сосудистой проницаемостью, содержащий эффективное количество пептида по любому из пп. 1-42 или конъюгата по п. 43 и полилактид-ко-гликолида (PLGA), необязательно где PLGA представляет собой PLGA в виде стержней.
52. Способ лечения окулярного заболевания, характеризующегося аномальным ангиогенезом у субъекта, включающий введение субъекту эффективного количества пептида, который связывается с фактором роста эндотелия сосудов A (VEGF-A) у субъекта, где пептид содержит аминокислотную последовательность, представленную в любом из пп. 2-23 и 31-42.
53. Способ лечения окулярного заболевания, характеризующегося аномальной сосудистой проницаемостью у субъекта, включающий введение субъекту эффективного количества пептида, который связывается с фактором роста эндотелия сосудов A (VEGF-A) у субъекта, где пептид содержит аминокислотную последовательность, представленную в любом из пп. 2-23 и 31-42.
54. Способ лечения окулярного заболевания, характеризующегося аномальным ангиогенезом и аномальной сосудистой проницаемостью у субъекта, включающий введение субъекту эффективного количества пептида, который связывается с фактором роста эндотелия сосудов A (VEGF-A) у субъекта, где пептид содержит аминокислотную последовательность, представленную в любом из пп. 2-23 и 31-42.
55. Способ лечения окулярного заболевания, характеризующегося аномальным ангиогенезом у субъекта, включающий введение субъекту эффективного количества пептида, который связывается с фактором роста эндотелия сосудов A (VEGF-A) у субъекта, где пептид содержит аминокислотную последовательность, представленную в любом из
GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113), GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114), GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139), GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140), GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142), GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle),
GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle),
GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle), GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин (Nle), GCNILLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 435), и
GCNIX1LPYWGCGRDFECX2EQCICQYYQSCG (SEQ ID NO: 437), где X1 и X2 представляют собой норлейцин.
56. Способ лечения окулярного заболевания, характеризующегося аномальной сосудистой проницаемостью у субъекта, включающий введение субъекту эффективного количества пептида, который связывается с фактором роста эндотелия сосудов A (VEGF-A) у субъекта, где пептид содержит аминокислотную последовательность, представленную в любом из
GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113), GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114), GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139), GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140), GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142), GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle),
GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle), GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle), GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин (Nle), GCNILLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 435), и
GCNIX1LPYWGCGRDFECX2EQCICQYYQSCG (SEQ ID NO: 437), где X1 и X2 представляют собой норлейцин.
57. Способ лечения окулярного заболевания, характеризующегося аномальным ангиогенезом и аномальной сосудистой проницаемостью у субъекта, включающий введение субъекту эффективного количества пептида, который связывается с фактором роста эндотелия сосудов A (VEGF-A) у субъекта, где пептид содержит аминокислотную последовательность, представленную в любом из
GCNIMLPFWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 113), GCNIMLPFWGCGRDFECVYRCICQYYQSCG (SEQ ID NO: 114), GCDVMQPYWGCGPDIDCFVRCLCHWYNSCG (SEQ ID NO: 139), GCDVMQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 140), GCNIMLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 142), GCNIXLPFWGCGRDFECMSDCICQYYQSCG (SEQ ID NO: 144), где X представляет собой норлейцин (Nle),
GCNIXLPFWGCGRDFECVSQCICQYYQSCG (SEQ ID NO: 145), где X представляет собой норлейцин (Nle), GCNIXLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 146), где X представляет собой норлейцин (Nle), GCDVXQPYWGCGPDIDCLSNCICHWYNSCG (SEQ ID NO: 224), где X представляет собой норлейцин (Nle), GCNILLPYWGCGRDFECMEQCICQYYQSCG (SEQ ID NO: 435), и
GCNIX1LPYWGCGRDFECX2EQCICQYYQSCG (SEQ ID NO: 437), где X1 и X2 представляют собой норлейцин.
58. Способ по любому из пп. 52-57, где окулярное заболевание представляет собой внутриглазное неоваскулярное заболевание, выбранное из группы, состоящей из пролиферативных ретинопатий, хориоидальной неоваскуляризации (CNV), возрастной макулярной дегенерации (AMD), диабетической и других связанных с ишемией ретинопатий, диабетического макулярного отека, патологической миопии, болезни фон Гиппеля-Линдау, гистоплазмоза глаза, венозной окклюзии сетчатки (RVO), включая окклюзию центральной вены сетчатки (CRVO) и окклюзию ветвей вены сетчатки (BRVO), неоваскуляризации роговицы, неоваскуляризации сетчатки и ретинопатии недоношенных (ROP).
| US 20140039162 A1, 09.06.2011 | |||
| WO 2012064658 A1, 18.05.2012 | |||
| WO 2007038619 A2, 05.04.2007 | |||
| KRATZNER R | |||
| et al.: Structure of Ecballium elaterium trypsin inhibitor II (EETI-II): A rigid molecular scaffold, ACTA CRYSTALLOGRAPHY SECTION D, 2005, v | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Украшение для пуговицы, запонки или броши | 1923 |
|
SU1255A1 |
| GUNASEKERA S | |||
| et al.: Engineering Stabilized Vascular Endothelial Growth Factor-A | |||
Авторы
Даты
2022-04-15—Публикация
2016-09-15—Подача