ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Настоящая заявка испрашивает преимущество приоритета предварительной заявки США № 62/873,603, поданной 12 июля 2019 г., содержание которой полностью включено в настоящий документ посредством ссылки для любых целей.
ОПИСАНИЕ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящая заявка относится к способам и системам для процессинга молекул нуклеиновых кислот в библиотеки нуклеиновых кислот с использованием электрофореза. Настоящая заявка также относится к способам, устройствам и системам для получения библиотеки с использованием электрофореза.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0003] Существует множество способов и сфер применения, для которых желательно создать библиотеку молекул фрагментированной и меченой нуклеиновой кислоты (например, ДНК) из целевых молекул двухцепочечной нуклеиновой кислоты (например, двухцепочечной ДНК (дцДНК)). Часто целью является создание меньших молекул нуклеиновых кислот (например, фрагментов нуклеиновых кислот или ДНК) из более крупных молекул целевых нуклеиновых кислот для использования в качестве матриц в реакциях секвенирования. Получение библиотек для секвенирования сопряжено с трудностями при использовании больших молекул нуклеиновых кислот: большие молекулы являются хрупкими и легко повреждаются (например, генерируют сайты, лишенные азотистого основания, или одноцепочечные разрывы) при чрезмерных транспортировках и манипуляциях посредством множества различных физических процессов, таких как лизис клеток, центрифугирование, пипетирование, перенос образцов и интенсивное перемешивание. Такое повреждение приводит к ошибкам при секвенировании целевых нуклеиновых кислот.
[0004] В настоящем документе описаны способы выполнения множества стадий объединения и разделения с использованием электрофореза для получения библиотек нуклеиновых кислот для секвенирования (например, тагментации), которые снижают риск физического повреждения нуклеиновых кислот. Эти подходы также можно легко применять для выполнения других процессов, таких как подготовка образца, экстракция образца, биохимические реакции, очистка продукта и выбор размера фрагмента нуклеиновой кислоты.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0005] Настоящая заявка относится к способам и устройствам для объединения и разделения субстратов, реагентов и продуктов для ферментативной реакции с использованием гель-электрофореза. Настоящая заявка также относится к способам, системам и устройствам для фрагментирования и мечения нуклеиновых кислот, таких как ДНК, с помощью транспосомных комплексов с использованием гель-электрофореза. Способы, системы и устройства, описанные в настоящем документе, относятся к способам и композициям для фрагментирования и мечения ДНК с помощью транспосомных комплексов с использованием гель-электрофореза. Способы, системы и устройства, представленные в настоящем документе, можно применять, например, для создания библиотек меченых фрагментов нуклеиновых кислот (например, ДНК) для применения, например, в способах секвенирования следующего поколения и т. п. В некоторых вариантах осуществления настоящая заявка относится к получению фрагментов ДНК из целевой ДНК, содержащей любую интересующую двухцепочечную ДНК (включая двухцепочечную кДНК, полученную из РНК), из любого источника для геномного, субгеномного, транскрипционного или метагеномного анализа или анализа экспрессии РНК.
[0006] В соответствии с приведенным в настоящем документе описанием в одном варианте осуществления способ выполнения ферментативной реакции с использованием электрофореза включает:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента;
второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента;
реакционный участок между первым участком и вторым участком и содержащий фермент; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
(b) приложение электрического поля между парой электродов для перемещения первого кофактора фермента из первого участка на реакционный участок и перемещения второго кофактора фермента из второго участка на реакционный участок с образованием активированного ферментного комплекса, содержащего фермент, первый кофактор фермента и второй кофактор фермента.
[0007] В некоторых вариантах осуществления предложен способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно;
(b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок;
(c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, адаптор полинуклеотидной транспозазы и первый кофактор транспозазы; и
(d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0008] В некоторых вариантах осуществления предложен способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
реакционный участок между первым участком и вторым участком и содержащий транспозазу; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно;
(b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок;
(c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок и перемещения второго кофактора транспозазы из второго участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и
(d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0009] В некоторых вариантах осуществления предложен способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок, содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
третий участок, содержащий лизирующий реагент;
четвертый участок, содержащий транспозазу;
реакционный участок между первым участком и вторым участком; и
первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца;
(b) нанесение цельных клеток, содержащих целевую двухцепочечную нуклеиновую кислоту, на реакционный участок;
(c) приложение первого электрического поля для перемещения лизирующего агента на реакционный участок и/или через него для лизиса клеток, таким образом нанося целевую двухцепочечную нуклеиновую кислоту на участок для образца;
(d) приложение второго электрического поля для перемещения первого кофактора транспозазы из первого участка на реакционный участок, перемещения второго кофактора транспозазы из второго участка на реакционный участок и/или перемещения транспозазы из участка транспозазы на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и
(e) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0010] В некоторых вариантах осуществления устройство электрофореза содержит гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента; второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента; реакционный участок между первым участком и вторым участком и содержащий фермент; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0011] В некоторых вариантах осуществления устройство электрофореза содержит гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла; реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0012] В некоторых вариантах осуществления устройство электрофореза содержит гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла; второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; реакционный участок между первым концом и вторым концом и содержащий транспозазу; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0013] В некоторых вариантах осуществления устройство электрофореза содержит гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла; второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; третий участок, содержащий лизирующий реагент; четвертый участок, содержащий транспозазу; реакционный участок между первым концом и вторым концом; и первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца.
[0014] Дополнительные цели и преимущества будут частично изложены в представленном ниже описании и частично будут очевидны из описания или могут быть изучены на практике. Цели и преимущества будут реализованы и достигнуты с помощью элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
[0015] Следует понимать, что как приведенное выше общее описание, так и последующее подробное описание приводятся только с целью примера и пояснения и не ограничивают формулу изобретения.
[0016] Сопроводительные графические материалы, включенные в настоящее описание и составляющие его часть, иллюстрируют один (несколько) вариант(-ов) осуществления и вместе с описанием служат для объяснения принципов, описанных в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0017] На Фиг. 1A представлены общие схемы выполнения химической реакции с использованием гель-электрофореза. A, B: реагенты; C: продукт.
[0018] На Фиг. 1B представлены общие схемы выполнения ферментативной реакции с использованием гель-электрофореза. E: фермент; S: подложка; C1, C2: кофакторы ферментов; P: продукт.
[0019] На Фиг. 2A представлен вариант осуществления способов получения меченых фрагментов нуклеиновых кислот с использованием гель-электрофореза. Tn5: транспосомный комплекс, содержащий транспозазу (например, транспозазу Tn5) и адаптор полинуклеотидной транспозазы.
[0020] На Фиг. 2B представлен другой вариант осуществления способов получения меченых фрагментов нуклеиновых кислот с использованием гель-электрофореза. Tn5: транспозаза (например, транспозаза Tn5); Ад.: адаптор полинуклеотидной транспозазы.
[0021] На Фиг. 3A-3C представлен другой вариант осуществления способов получения меченых фрагментов нуклеиновых кислот с использованием гель-электрофореза, содержащего несколько реакционных участков в гелевой матрице и выполняющих несколько последовательных стадий (t0-t5). Tn5: транспозаза (например, транспозаза Tn5); Ад.: адаптор полинуклеотидной транспозазы; Лизир. ргт: лизирующий реагент.
[0022] На Фиг. 4 представлены общие схемы выполнения множества биохимических реакций во множестве реагентов, имеющих разные электрофоретические подвижности, помещенных на разные участки гелевой матрицы.
ПОДРОБНОЕ ОПИСАНИЕ
[0023] Заголовки разделов, используемые в настоящем описании, предназначены только для организационных целей и не должны толковаться как ограничивающие описанный предмет.
[0024] Настоящее изобретение относится к способам и системам для выполнения химических и/или ферментативных процессов с помощью электрофореза и, в частности, относится к получению библиотеки для секвенирования нуклеиновых кислот (например, ДНК).
[0025] Система гель-электрофореза обеспечивает перемещение молекул между положениями в трехмерной матрице. Электрическое поле прикладывают для перемещения молекул через трехмерную матрицу по траекториям пересечения. Разные молекулы мигрируют через электрическое поле с разными электрофоретическими подвижностями. Способы, описанные в настоящем документе, обеспечивают множество реакций в различных местоположениях в трехмерной матрице посредством заданного расположения реагентов таким образом, что они перемещаются по траекториям, которые пересекаются в последовательных интервалах времени и положения, таким образом, обеспечивая возможность выполнения многостадийных процессов: например, получение библиотеки нуклеиновых кислот, экстракция образца, биохимия, очистка продукта и выбор размеров, все из которых осуществляются в геле.
[0026] В одном из вариантов осуществления две молекулы с известной электрофоретической подвижностью могут располагаться в гелевой матрице и подвергаться воздействию одного и того же электрического поля таким образом, что они мигрируют в разных направлениях и с разной скоростью, но пересекаются в определенный момент времени. Как показано на Фиг. 1A, два реагента, A и B, мигрируют в противоположных, но встречных направлениях от их исходных положений в момент времени t0, в конечном счете объединяясь по истечении некоторого времени в электрическом поле (в момент времени t2), где они вступают в реакцию с образованием продукта C. В следующий интервал времени (t3) непрореагировавшие молекулы A и B продолжают мигрировать в противоположных направлениях, но молекула C благодаря своей подвижности либо остается в том местоположении, где она была образована, либо перемещается с другой подвижностью, чем молекулы A и B, и таким образом отделяется и очищается от непрореагировавших молекул.
Получение транспозаза-опосредованной библиотеки
[0027] Способы и композиции, представленные в настоящем документе, обеспечивают ряд преимуществ при получении библиотеки для секвенирования. Библиотеки фрагментированных нуклеиновых кислот часто создают из геномных нуклеиновых кислот для применения в областях, связанных с секвенированием следующего поколения (NGS). В настоящем описании предложены способы, устройства и система для получения транспозиционной библиотеки. В текущих протоколах секвенирования образцов нуклеиновых кислот, как правило, применяют способ получения образца, который преобразует ДНК или РНК в библиотеку матриц. В стандартных способах получения библиотек каждая матрица содержит адаптор на каждом конце вставки, и часто требуется несколько стадий как для модификации ДНК, так и для очистки требуемых продуктов реакций модификации. Количество стадий, необходимых для преобразования ДНК в модифицированные адаптором матрицы в растворе, готовом к образованию кластеров и секвенированию, можно свести к минимуму за счет использования транспозаза-опосредованной фрагментации и мечения. Данный процесс, упоминаемый в настоящем документе как «тагментация», относится к модификации ДНК транспосомным комплексом, содержащим фермент транспозазу в комплексе с адапторами, содержащими концевую последовательность транспозона. Тагментация обеспечивает одновременную фрагментацию ДНК и лигирование адапторов к 5’-концам обеих цепей дуплексных фрагментов. Меченые фрагменты амплифицируют, интересующие ампликоны необязательно захватываются (например, посредством зондов гибридизации), и меченые фрагменты секвенируют.
[0028] Получение библиотек для секвенирования посредством тагментации может быть сопряжено с трудностями при использовании больших молекул нуклеиновых кислот: большие молекулы являются хрупкими и легко повреждаются (например, генерируют сайты, лишенные азотистого основания, или одноцепочечные разрывы) при чрезмерных транспортировках и манипуляциях посредством множества различных физических и химических процессов, таких как лизис клеток, центрифугирование, пипетирование, перенос образцов, интенсивное перемешивание и другие манипуляции с материалом.
[0029] В настоящей заявке предлагаются способы получения библиотеки с использованием гель-электрофореза в пределах трехмерной матрицы. Электрическое поле прикладывают для перемещения молекул через трехмерную матрицу по траекториям пересечения, таким образом выполняя стадии объединения и стадии разделения. За счет выполнения манипуляций с экстракцией образца и получения библиотеки на основании электрофоретических подвижностей реагентов в гелевой матрице можно снизить риск физического повреждения нуклеиновых кислот. Повреждение также уменьшается вследствие физического внедрения и защиты нуклеиновых кислот внутри гелевой матрицы. Кроме того, после дальнейших манипуляций с ДНК можно выполнить очистку меченых фрагментов ДНК и реагентов на основании разных подвижностей.
[0030] В некоторых вариантах осуществления предложен способ выполнения ферментативной реакции с использованием электрофореза, включающий (a) обеспечение системы электрофореза, содержащей: гелевую матрицу для электрофореза, имеющую первый конец и второй конец и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента; второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента; реакционный участок между первым участком и вторым участком и содержащий фермент; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и (b) приложение электрического поля между парой электродов для перемещения первого кофактора фермента из первого участка на реакционный участок и перемещения второго кофактора фермента из второго участка на реакционный участок с образованием активированного ферментного комплекса, содержащего фермент, первый кофактор фермента и второй кофактор фермента.
[0031] В дополнительных вариантах осуществления когда первый кофактор фермента представляет собой ион металла, второй кофактор фермента представляет собой полинуклеотид. В дополнительных вариантах осуществления способ дополнительно включает нанесение субстрата для активированного ферментного комплекса на реакционный участок перед стадией (с), причем приложение электрического поля включает в себя реагирование активированного ферментного комплекса с субстратом на реакционном участке с образованием продукта реакции. В дополнительных вариантах осуществления приложение электрического поля включает в себя миграцию непрореагировавших первого и второго кофакторов ферментов из реакционного участка для отделения непрореагировавших первого и второго кофакторов ферментов от продукта реакции на реакционном участке.
[0032] В некоторых вариантах осуществления первый электрод представляет собой положительный электрод, а первый кофактор фермента имеет положительный заряд, при этом второй электрод представляет собой отрицательный электрод, а второй кофактор фермента имеет отрицательный заряд.
[0033] В некоторых вариантах осуществления субстрат представляет собой целевую двухцепочечную нуклеиновую кислоту. В дополнительных вариантах осуществления целевая двухцепочечная нуклеиновая кислота представляет собой двухцепочечную ДНК, двухцепочечную РНК или ДНК/РНК гибрид.
[0034] В некоторых вариантах осуществления фермент представляет собой транспозазу. В некоторых вариантах осуществления фермент представляет собой транспозазу Tn5. В дополнительных вариантах осуществления первый кофактор фермента представляет собой Mg2+. В некоторых вариантах осуществления концентрация Mg2+ находится в миллимолярном диапазоне. В некоторых вариантах осуществления концентрация Mg2+ составляет от 0,5 до 10 мМ. В некоторых вариантах осуществления концентрация Mg2+ составляет от 1 до 10 мМ. В некоторых вариантах осуществления концентрация Mg2+ составляет от 1 до 5 мМ. В некоторых вариантах осуществления концентрация Mg2+ составляет 2 мМ. В некоторых вариантах осуществления катионы Mg2+ представлены в виде Mg(OAc)2. В некоторых вариантах осуществления катионы Mg2+ представлены в виде MgCl2.
[0035] В дополнительных вариантах осуществления второй кофактор фермента представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки. В дополнительных вариантах осуществления второй кофактор фермента представляет собой смесь двух адапторов полинуклеотидной транспозазы, причем каждый адаптор содержит одну и ту же двухцепочечную концевую последовательность транспозона и другую одноцепочечную область метки.
[0036] В некоторых вариантах осуществления могут применяться более сложные электрические поля, например с изменяющейся амплитудой или направлением электрического поля, или обеспечение различных электрических полей под углом 90 градусов друг к другу. В таком варианте осуществления возможны более сложные траектории отдельных реагентов. В таких случаях реагенты можно размещать в заданных местоположениях в пределах матрицы в зависимости от их известных или ожидаемых подвижностей таким образом, чтобы реагенты можно было объединять и/или разделять посредством чередования электрофоретических полей и перемещения молекул по выбранным траекториям между положениями на гелевой матрице. В некоторых вариантах осуществления один или более реагентов (таких как ферменты) могут быть иммобилизованы на твердой подложке (гранулах на реакционном участке) в трехмерной матрице, таким образом предотвращая их перемещение в электрических полях, в то время как другие реагенты могут свободно перемещаться в соответствии с их подвижностью в электрических полях.
[0037] В некоторых вариантах осуществления способ включает изменение величины или направления электрического поля через гелевую матрицу для электрофореза. В некоторых вариантах осуществления способ включает изменение величины или направления электрического поля через гелевую матрицу для электрофореза. В некоторых вариантах осуществления система электрофореза содержит дополнительные участки вдоль ширины и длины, каждый из которых содержит различные реагенты. В некоторых вариантах осуществления вторая пара из положительного и отрицательного электродов может быть предусмотрена на противоположных сторонах ширины на одном из первого конца или второго конца для приложения дополнительного электрического поля. Электрические поля, создаваемые первой и второй парами электродов, могут быть расположены в разных направлениях. Электрические поля, создаваемые первой и второй парами электродов, могут быть перпендикулярны друг другу.
[0038] На Фиг. 1A представлен пример конфигурации системы электрофореза, описанной в настоящем документе, для выполнения химической реакции в соответствии с некоторыми вариантами осуществления. При приложении электрического поля два реагента, A и B (такие как, без ограничений, первый кофактор фермента и второй кофактор фермента), мигрируют в противоположных, но встречных направлениях от их исходных положений в момент времени t0, в конечном счете объединяясь по истечении некоторого времени в электрическом поле (в момент времени t2), когда они вступают в реакцию друг с другом или с третьим реагентом с образованием продукта C. В следующий интервал времени (t3) непрореагировавшие A и B продолжают мигрировать в противоположных направлениях, но молекула продукта C, благодаря своей подвижности, либо остается на месте, либо перемещается с другой подвижностью, чем A и B, и таким образом очищается от непрореагировавших реагентов.
[0039] На Фиг. 1B представлен пример конфигурации системы электрофореза, описанной в настоящем документе, для выполнения ферментативной реакции в соответствии с некоторыми вариантами осуществления. Первый кофактор С1 фермента и второй кофактор C2 фермента расположены на первом и втором участках вблизи противоположных концов гелевой матрицы для электрофореза соответственно. Реакционный участок между первым участком и вторым участком содержит фермент E. На реакционном участке дополнительно предусмотрена подложка S. При приложении электрического поля первый кофактор С1 фермента и второй кофактор C2 фермента мигрируют в противоположных, но встречных направлениях от их исходных положений в момент времени t0. В момент времени t2, когда они вступают в реакцию друг с другом и ферментом, образуется активированный ферментный комплекс, содержащий фермент, первый кофактор фермента и второй кофактор фермента (E+C1+C2), который катализирует реакцию субстрата S с образованием продукта P. В последующий момент времени t3 непрореагировавшие C1 и C2 продолжают мигрировать в противоположных направлениях, но продукт P, благодаря своей подвижности, либо остается на месте, либо перемещается с другой подвижностью, отличной от подвижности A и B, и, таким образом, очищается от непрореагировавших реагентов.
[0040] В некоторых вариантах осуществления предложен способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты. В некоторых вариантах осуществления способ включает: (a) обеспечение системы электрофореза, содержащей: гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла; реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; (b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок; (c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, адаптор полинуклеотидной транспозазы и первый кофактор транспозазы; и (d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот. В дополнительных вариантах осуществления транспосомный комплекс иммобилизуют на твердой подложке на реакционном участке. Транспосомный комплекс необязательно иммобилизуют посредством взаимодействия стрептавидин-биотин. В дополнительных вариантах осуществления способ дополнительно включает высвобождение транспосомного комплекса из твердой подложки после создания меченых фрагментов нуклеиновой кислоты. В дополнительных вариантах осуществления способ дополнительно включает изменение величины первого электрического поля после стадии введения меченых фрагментов нуклеиновой кислоты, связанных с транспосомным комплексом, высвобожденным из твердой подложки на участке для сбора.
[0041] На Фиг. 2A представлен пример способа, выполненного с использованием устройства для электрофореза, содержащего две лунки. В начале первый участок слева содержит ион металла, такой как Mg2+, а реакционный участок в центре содержит нуклеиновую кислоту с высокой молекулярной массой (например, ДНК) и транспосомный комплекс. При приложении электрического поля (момент времени t1) Mg2+ перемещается к отрицательному электроду, и содержимое реакционного участка остается на месте благодаря его размеру и, следовательно, недостаточной подвижности в гелевой матрице. В следующий интервал времени (t2) Mg2+ достигает реакционного участка с образованием активированного транспосомного комплекса, а затем активированный комплекс связывается с фрагментами и метками (тагментированными фрагментами) больших молекул ДНК с малыми матрицами библиотеки. После завершения реакции (момент времени t3) Mg2+ переходит к отрицательному электроду. Тагментированные фрагменты можно собирать или дополнительно процессировать на реакционном участке. В альтернативном варианте осуществления, благодаря значительно уменьшенному размеру, тагментированные фрагменты теперь могут перемещаться к положительному электроду, таким образом отделяя и необязательно очищая фрагменты, которые можно собрать из участка для сбора (не показан).
[0042] В некоторых вариантах осуществления предложен способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты. Способ включает: (a) обеспечение системы электрофореза, содержащей: гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла; второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; реакционный участок между первым участком и вторым участком и содержащий транспозазу; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; (b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок; (c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок и перемещения второго кофактора транспозазы из второго участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и (d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0043] В дополнительных вариантах осуществления ион металла представляет собой Mg2+, необязательно в виде Mg(OAc)2 или MgCl2. В некоторых вариантах осуществления концентрация Mg2+ находится в миллимолярном диапазоне. В некоторых вариантах осуществления концентрация Mg2+ составляет от 0,5 до 10 мМ. В некоторых вариантах осуществления концентрация Mg2+ составляет от 1 до 10 мМ. В некоторых вариантах осуществления концентрация Mg2+ составляет от 1 до 5 мМ. В некоторых вариантах осуществления концентрация Mg2+ составляет 2 мМ. В некоторых вариантах осуществления катионы Mg2+ представлены в виде Mg(OAc)2. В некоторых вариантах осуществления катионы Mg2+ представлены в виде MgCl2. При нанесении целевой нуклеиновой кислоты на реакционный участок на стадии (b) транспозаза или транспосомный комплекс сначала связывается с целевой нуклеиновой кислотой в отсутствие Mg2+. При приложении электрического поля на стадии (c) транспозаза не мигрирует, так как связана с большой целевой нуклеиновой кислотой, тогда как Mg2+ мигрирует на реакционный участок.
[0044] В некоторых вариантах осуществления одноцепочечная область метки содержит одно или более из: праймерной последовательности, штрихкодовой последовательности, последовательности уникального молекулярного идентификатора (UMI), метки амплификации, метки обогащения или метки очистки.
[0045] В некоторых вариантах осуществления транспозаза представляет собой транспозазу Tn5, MuA или транспозазу Vibrio Haryi либо их активный мутант. В некоторых вариантах осуществления транспозаза представляет собой транспозазу Tn5. В некоторых вариантах осуществления транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5. В некоторых вариантах осуществления транспозазу иммобилизуют на твердой подложке внутри реакционного участка. В некоторых вариантах осуществления реакционный участок содержит лунку, а твердая подложка представляет собой гранулированную частицу в лунке или твердая подложка представляет собой поверхность лунки.
[0046] В некоторых вариантах осуществления целевая двухцепочечная нуклеиновая кислота представляет собой двухцепочечную ДНК, двухцепочечную РНК или ДНК/РНК гибрид.
[0047] В некоторых вариантах осуществления при приложении первого электрического поля на стадии (c) целевая двухцепочечная нуклеиновая кислота остается в пределах реакционного участка вследствие ее большого размера, таким образом отсутствует подвижность в гелевой матрице. В некоторых вариантах осуществления величину первого электрического поля, приложенного на стадии (c), устанавливают таким образом, чтобы целевая двухцепочечная нуклеиновая кислота по существу не имела электрофоретической подвижности в пределах матрицы для электрофореза.
[0048] В некоторых вариантах осуществления система электрофореза содержит участок для сбора вдоль длины между первым участком и реакционным участком. В дополнительных вариантах осуществления приложение первого электрического поля на стадии (c) включает в себя перемещение меченых фрагментов нуклеиновых кислот на участок для сбора. В дополнительных вариантах осуществления способ включает увеличение величины первого электрического поля после стадии (d) введения меченых фрагментов нуклеиновых кислот на участок для сбора.
[0049] В некоторых вариантах осуществления способ включает изменение величины или направления первого электрического поля через гелевую матрицу для электрофореза. В некоторых вариантах осуществления система электрофореза содержит дополнительные участки вдоль ширины и длины, каждый из которых содержит различные реагенты для тагментации, и вторую пару из положительного и отрицательного электродов на противоположных сторонах ширины на одном из: первого конца или второго конца. В некоторых вариантах осуществления способ включает приложение второго электрического поля между второй парой электродов, причем направление второго электрического поля отличается от направления первого электрического поля, приложенного на стадии (с). В некоторых вариантах осуществления способ включает приложение второго электрического поля между второй парой электродов, причем направление второго электрического поля перпендикулярно направлению первого электрического поля, приложенного на стадии (с).
[0050] В некоторых вариантах осуществления система электрофореза содержит третий участок, содержащий лизирующий реагент; причем реакционный участок содержит цельные клетки. В некоторых вариантах осуществления способ дополнительно включает приложение третьего электрического поля для перемещения лизирующего агента на реакционный участок и/или через него для лизиса клеток, таким образом нанося целевую двухцепочечную нуклеиновую кислоту на участок для образца.
[0051] В некоторых вариантах осуществления нанесение целевой двухцепочечной нуклеиновой кислоты включает в себя добавление биологического образца на реакционный участок. Биологический образец может относиться к любому типу, который содержит нуклеиновую кислоту (например, ДНК) и который может быть депонирован на реакционный участок для тагментации. Например, образец может содержать нуклеиновую кислоту в различных состояниях очистки, включая очищенную нуклеиновую кислоту. Однако образец не обязательно должен быть полностью очищен и может содержать, например, ДНК, смешанную с белком, другими видами нуклеиновых кислот, другими клеточными компонентами и/или любым другим загрязняющим веществом. В некоторых вариантах осуществления биологический образец содержит смесь ДНК, белка, других видов нуклеиновых кислот, других клеточных компонентов и/или любого другого загрязняющего вещества, приблизительно в той же пропорции, что и in vivo.
[0052] Биологический образец может содержать, например, неочищенный клеточный лизат или цельные клетки. Например, неочищенный клеточный лизат, нанесенный на твердую подложку посредством способа, описанного в настоящем документе, необязательно необходимо подвергнуть одной или более стадиям разделения, которые традиционно применяют для выделения нуклеиновых кислот из других клеточных компонентов. Примеры стадий разделения представлены в публикации Maniatis et al., Molecular Cloning: A Laboratory Manual, 2d Edition, 1989, and Short Protocols in Molecular Biology, ed. Ausubel, et al, включенной в настоящий документ путем ссылки.
[0053] Таким образом, в некоторых вариантах осуществления биологический образец может содержать, например, кровь, плазму, сыворотку, лимфу, слизь, мокроту, мочу, сперму, спинномозговую жидкость, бронхиальный аспират, фекалии и мацерированную ткань или их лизат, или любой другой биологический образец, содержащий ДНК.
[0054] На Фиг. 2B показан пример способа, описанного в настоящем документе, с использованием системы электрофореза, содержащей 4 лунки a), b), c) и d) и пару электродов. В начале процесса лунка a) содержит Mg2+, b) является пустой, c) содержит ДНК с высокой молекулярной массой и транспозазу (например, транспозазу Tn5) и d) содержит адаптор полинуклеотидной транспозазы (например, адапторы NexteraTM, Illumina). При приложении электрического поля (момент времени t1) Mg2+ перемещается к отрицательному электроду, тогда как небольшие адапторы перемещаются к положительному электроду, причем содержимое c) остается на месте благодаря его размеру и, следовательно, недостаточной подвижности в гелевой матрице. В следующий интервал времени (t2) адапторы и Mg2+ пересекаются в лунке c) с образованием активированного транспосомного комплекса, содержащего транспозазу, Mg2+ и адапторы. Затем активированный транспосомный комплекс связывается с фрагментами и метками (тагментированными фрагментами) больших молекул ДНК с малыми матрицами библиотеки. После завершения реакции (момент времени t3) Mg2+ переходит к отрицательному электроду. Тагментированные фрагменты можно собирать или дополнительно процессировать на реакционном участке. В альтернативном варианте осуществления, благодаря значительно уменьшенному размеру, тагментированные фрагменты перемещаются к положительному электроду, таким образом отделяя и необязательно очищая фрагменты, которые можно собрать из лунки b) в следующий интервал во времени (t4).
[0055] В некоторых вариантах осуществления могут применяться более сложные электрические поля, например с изменяющейся амплитудой или направлением электрического поля, или обеспечение различных электрических полей под углом 90 градусов друг к другу. В таком варианте осуществления возможны более сложные траектории отдельных реагентов. В таких случаях реагенты можно размещать в заданных местоположениях в пределах матрицы в зависимости от их известных или ожидаемых подвижностей таким образом, чтобы реагенты можно было объединять и/или разделять посредством чередования электрофоретических полей и перемещения молекул по выбранным траекториям между положениями на гелевой матрице.
[0056] В некоторых вариантах осуществления предложен способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты с использованием более чем одного электрического поля. В некоторых вариантах осуществления настоящего изобретения способ включает: (a) обеспечение системы электрофореза, содержащей: гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами; и содержащую первый участок, второй участок, третий участок и четвертый участок; первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца. Первый участок содержит первый кофактор транспозазы для транспозазы. Первый кофактор транспозазы представляет собой ион металла. Второй участок содержит второй кофактор транспозазы для указанной транспозазы. Второй кофактор транспозазы имеет электрический заряд, противоположный заряду первого кофактора транспозазы. Второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки. Третий участок содержит лизирующий реагент. Четвертый участок содержит транспозазу. Система дополнительно содержит реакционный участок между первым участком и вторым участком.
[0057] В некоторых вариантах осуществления способ дополнительно включает: (b) нанесение цельных клеток, содержащих целевую двухцепочечную нуклеиновую кислоту, на реакционный участок; (c) приложение первого электрического поля для перемещения лизирующего агента на реакционный участок и/или через него для лизиса клеток, таким образом нанося целевую двухцепочечную нуклеиновую кислоту на участок для образца; (d) приложение второго электрического поля для перемещения первого кофактора транспозазы из первого участка на реакционный участок, перемещения второго кофактора транспозазы из второго участка на реакционный участок и/или перемещения транспозазы из участка транспозазы на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и (e) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0058] В других вариантах осуществления первое электрическое поле и второе электрическое поле отличаются, а стадию (с) выполняют перед стадией (d). В дополнительных вариантах осуществления первое электрическое поле и второе электрическое поле являются одинаковыми, а стадию (с) выполняют одновременно со стадией (d). В дополнительных вариантах осуществления способ включает приложение одного или более электрических полей после создания библиотеки меченых фрагментов нуклеиновых кислот для перемещения из реакционного участка одного или более из: лизирующего реагента, транспосомного комплекса, транспозазы, адаптора транспозазы, иона металла и меченых фрагментов нуклеиновых кислот. В некоторых вариантах осуществления способ дополнительно включает перемещение меченых фрагментов нуклеиновых кислот на участок для сбора. В некоторых вариантах осуществления способ дополнительно включает перемещение лизирующего реагента, транспосомного комплекса, иона металла и меченых фрагментов нуклеиновых кислот из реакционного участка на отдельные приемные участки.
[0059] На Фиг. 3A-3C проиллюстрирован вариант осуществления способа, описанного в настоящем документе. Система электрофореза содержит Mg2+, транспозазу (например, транспозазу Tn5), адапторы и лизирующие реагенты, помещенные в лунки в начале t0. Образец (например, клетки, имеющие целевую ДНК с высокой молекулярной массой) загружают на реакционный участок. Два переменных электрических поля под углом 90 градусов друг к другу прикладываются контролируемым образом, что приводит к перемещению реагентов и субстратов через гелевую матрицу. В следующий интервал времени (t1) лизирующие реагенты поступают на реакционный участок и объединяются с образцом для лизиса клеток. Одновременно другие реагенты мигрируют к реакционной части в соответствии с их подвижностью. В следующий интервал времени (t2) лизирующие реагенты мигрируют из реакционной части, оставляя после себя очищенную ДНК с высокой молекулярной массой. В следующий интервал времени (t3) реагенты для тагментации (транспозаза (например, транспозаза Tn5), Mg2+ и адапторы) входят в лунку образца и образуют активированный комплекс, который затем связывается с фрагментами и метками (тагментированными фрагментами) целевой ДНК. В следующий интервал времени (t4) реагенты для тагментации дополнительно мигрируют, оставляя после себя очищенные тагментированные матрицы библиотеки. Тагментированные фрагменты можно собирать или дополнительно процессировать на реакционном участке. В альтернативном варианте осуществления в следующий интервал времени (t5) тагментированные матрицы библиотеки дополнительно мигрируют в лунку для сбора образцов.
[0060] В некоторых вариантах осуществления транспосомные комплексы связываются с целевой нуклеиновой кислотой и создают одноцепочечные разрывы в основной цепи, по 9 оснований друг от друга на любой из цепей. В других вариантах осуществления транспосома создает гэп между одноцепочечными разрывами 7, 8, 9, 10, 11 или 12 пар нуклеотидов (п. н.). В некоторых вариантах реализации способ дополнительно включает заполнение гэпов и лигирующих одноцепочечных разрывов в фрагментах нуклеиновых кислот. Можно использовать любую известную лигазу, способную к лигированию одноцепочечного разрыва (прилегающий 5’-фосфатный конец и 3’-OH). Лигаза может быть предусмотрена на втором реакционном участке, причем второй реакционный участок является таким же как реакционный участок для тагментации или отличается от него.
[0061] В некоторых вариантах осуществления заполнение гэпов и лигирование одноцепочечных разрывов в фрагментах нуклеиновых кислот включает в себя инкубирование меченых фрагментов с замещающей цепь полимеразой в условиях и в течение достаточного времени, при котором заполняются гэпы в меченых фрагментах. В некоторых вариантах осуществления заполнение гэпов и лигирующих одноцепочечных разрывов в фрагментах нуклеиновых кислот включает в себя инкубирование меченых фрагментов с незамещающей цепь полимеразой, чтобы охватить гэп, а затем с лигазой в условиях и в течение достаточного времени, при котором заполняются одноцепочечные гэпы в меченых фрагментах.
[0062] В некоторых вариантах осуществления способ дополнительно включает амплификацию полученных фрагментов нуклеиновых кислот. Фрагменты нуклеиновых кислот, полученные посредством транспосом-опосредованной тагментации, можно амплифицировать в соответствии с любыми подходящими способами амплификации, известными в данной области. В некоторых вариантах осуществления амплификация включает применение одного или более из: реакции амплификации нуклеиновых кислот, амплификации с замещением цепей, амплификации по типу катящегося кольца (RCA), лигазной цепной реакции, транскрипционно-опосредованной амплификации или петлевой амплификации.
[0063] В некоторых вариантах осуществления процессированные фрагменты нуклеиновых кислот могут быть снабжены штрих-кодом для сохранения непрерывности информации о секвенировании из целевой нуклеиновой кислоты. В настоящем документе термин «смежность» относится к пространственным отношениям между двумя или более фрагментами ДНК на основе общей информации. Общий аспект информации может относиться к ближним, компартментным и дистантным пространственным отношениям. Информация об этих отношениях в молекулах, в свою очередь, облегчает иерархическую сборку или картирование чтений последовательностей, полученных из фрагментов ДНК. В некоторых вариантах осуществления одноцепочечная область метки адаптора полинуклеотидной транспозазы дополнительно содержит штрихкодовую последовательность. В некоторых вариантах осуществления способы, описанные в настоящем документе, дополнительно включают приведение в контакт меченых фрагментов с твердой подложкой-связанной штрихкодовой последовательностью для переноса информации штрихкодовой последовательности в фрагменты целевой нуклеиновой кислоты. В некоторых вариантах осуществления штрихкодовую последовательность добавляют в то время как фрагмент остается связанным с транспозазой. Информацию о непрерывности целевой нуклеиновой кислоты определяют посредством идентификации штрихкодовых последовательностей. Примеры препаратов штрих-кодированных фрагментов целевой нуклеиновой кислоты, которые можно легко адаптировать для применения со способами настоящей заявки, описаны, например, в публикациях US 2019/0040382, WO2014142850A1 и WO 2014/108810, каждая из которых полностью включена в настоящий документ путем ссылки.
[0064] Когда цельные клетки наносят на реакционный образец, экстракцию и процессинг нуклеиновых кислот выполняют перед тагментацией, для которой требуются дополнительные реагенты. Не имеющие ограничительного характера примеры реагентов для такого предварительного процессинга включают в себя лизирующие агенты; растворы, содержащие ферменты для расщепления стенок бактериальных, грибковых или растительных клеток; растворы протеазы; и растворы, содержащие ферменты для ДНК-процессинга. В некоторых вариантах осуществления они могут быть загружены в одно или более разных местположений гелевой матрицы. В некоторых вариантах осуществления система может быть выполнена с возможностью последовательного добавления и удаления ряда реагентов из одного местоположения. Добавление и удаление реагентов можно осуществлять из верхней части контейнера с помощью стандартных средств для транспортировки жидкостей (таких как, например, роботы для транспортировки жидкостей с подвижным порталом, поставляемые компанией Beckman, Agilent, Tecan, Hamilton и т. д.). В других вариантах осуществления добавление и удаление реагентов может осуществляться посредством каналов для текучей среды внутри контейнера.
[0065] В некоторых вариантах осуществления транспозазы транспосомных комплексов удаляют из фрагментов нуклеиновых кислот после транспозиции. В некоторых вариантах осуществления транспозазы удаляют из фрагментов нуклеиновых кислот после транспозиции и после последующей гибридизации адапторных последовательностей транспозона с комплементарной последовательностью для захвата. В некоторых вариантах осуществления транспозазы удаляют посредством обработки SDS. В некоторых вариантах осуществления транспозазы удаляют путем лечения протеиназой.
[0066] В некоторых вариантах осуществления процессированные фрагменты нуклеиновых кислот можно переносить из гелевой матрицы для электрофореза для анализа или для других процессов для получения библиотек, таких как, например, процессы выбора размера, таких как процессы, описанные в патентах США № 8,361,298 и 8,361,299, оба из которых полностью включены в настоящий документ путем ссылки.
[0067] В некоторых вариантах осуществления процессированные фрагменты нуклеиновых кислот, формируемые посредством транспосом-опосредованной тагментации можно собирать и секвенировать в соответствии с любой подходящей методикой секвенирования, такой как прямое секвенирование, включая секвенирование путем синтеза, секвенирование путем лигирования, секвенирование путем гибридизации, секвенирование через нанопоры и т. п. В некоторых вариантах осуществления фрагменты требуемого размера или диапазона размеров (например, от 25 до 500 пар нуклеотидов (п. н.), или от 50 до 500 п. н., или от 50 до 350 п. н., или от 100 до 300 п. н. или около 50, 150, 250 или 300 п. н.) могут быть избирательно собраны на участок для сбора. После приложения электрического поля процессированные фрагменты нуклеиновых кислот могут дополнительно мигрировать из реакционного участка. Поскольку фрагменты разных размеров имеют разные подвижности, фрагменты необходимого размера или диапазона размеров можно избирательно отделять и собирать из участка для сбора.
[0068] В некоторых вариантах осуществления предложен способ выполнения множества последовательных химических и/или ферментативных процессов. В некоторых вариантах осуществления могут применяться более сложные электрические поля, например с изменяющейся амплитудой или направлением электрического поля, или обеспечение различных электрических полей под углом 90 градусов друг к другу. В таком варианте осуществления возможны более сложные траектории отдельных реагентов. В таких случаях реагенты можно размещать в заданных местоположениях в пределах матрицы в зависимости от их известных или ожидаемых подвижностей таким образом, чтобы реагенты можно было объединять и/или разделять посредством чередования электрофоретических полей и перемещения молекул по выбранным траекториям между положениями на гелевой матрице. В некоторых вариантах осуществления один или более реагентов (таких как ферменты) могут быть иммобилизованы на твердой подложке (гранулах на реакционном участке) в трехмерной матрице, таким образом предотвращая их перемещение в электрических полях, в то время как другие реагенты могут свободно перемещаться в соответствии с их подвижностью в электрических полях.
[0069] На Фиг. 4 проиллюстрирована общая схема способа выполнения множества биохимических реакций с использованием гель-электрофореза. Устройство электрофореза содержит множество участков вдоль ширины и длины, каждый из которых содержит различные реагенты. Две пары из положительного и отрицательного электродов предусмотрены на противоположных сторонах ширины на одном из первого конца или второго конца для приложения переменных электрических полей, перпендикулярных друг другу. Реагенты мигрируют на первый реакционный участок для выполнения первой биохимической реакции. За счет изменения амплитуды или направления электрического(-их) поля(-ей) продукт первой биохимической реакции мигрирует во второй реакционный участок и реагирует с реагентом для выполнения второй биохимической реакции. Эти стадии можно повторить для последующих биохимических реакций на дополнительных реакционных участках.
Устройства/системы
[0070] В некоторых вариантах осуществления предложена система электрофореза для выполнения ферментативной реакции. В некоторых вариантах осуществления указанная система электрофореза содержит гелевую матрицу для электрофореза, имеющую первый конец и второй конец и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента; второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента; реакционный участок между первым участком и вторым участком и содержащий фермент; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно. В дополнительных вариантах осуществления на реакционном участке предусмотрен субстрат для фермента.
[0071] В некоторых вариантах осуществления предложено устройство электрофореза, содержащее гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами; первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла; реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0072] В некоторых вариантах осуществления предложено устройство электрофореза, содержащее гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами; первый участок вблизи первого конца; второй участок вблизи второго конца; реакционный участок между первым концом и вторым концом; и пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно. Первый участок содержит первый кофактор транспозазы для транспозазы. В некоторых вариантах осуществления первый кофактор транспозазы представляет собой ион металла. Второй участок содержит второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный заряду первого кофактора транспозазы. В некоторых вариантах осуществления второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки. Реакционный участок содержит транспозазу. В некоторых вариантах осуществления на реакционном участке предусмотрена целевая нуклеиновая кислота.
[0073] В некоторых вариантах осуществления предложено устройство электрофореза, содержащее гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами; первый участок; второй участок; третий участок и четвертый участок; реакционный участок; первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца. Первый участок содержит первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла. Второй участок содержит второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный заряду первого кофактора транспозазы. Второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки. Третий участок содержит лизирующий реагент. В некоторых вариантах осуществления на реакционном участке предусмотрены цельные клетки, содержащие целевую нуклеиновую кислоту. В некоторых вариантах осуществления устройство содержит дополнительные участки вдоль ширины и/или длины, каждый из которых содержит различные реагенты для тагментации. В некоторых вариантах осуществления устройство содержит участок сбора для приема меченых фрагментов нуклеиновых кислот. В некоторых вариантах осуществления устройство содержит один или более приемных участков для приема непрореагировавших реагентов.
[0074] В некоторых вариантах осуществления первый участок, второй участок, третий участок, четвертый участок, реакционный участок и/или дополнительные участки содержат лунку. Лунка может содержать ферменты, молекулы целевой нуклеиновой кислоты или любой другой субстрат или реагенты. В некоторых вариантах осуществления реакционный участок содержит лунку, а твердая подложка представляет собой гранулированную частицу в лунке или твердая подложка представляет собой поверхность лунки.
[0075] В некоторых вариантах осуществления устройство электрофореза может содержать контейнер, содержащий электрофорезный буфер и выполненный с возможностью удержания гелевой матрицы для электрофореза. В некоторых вариантах осуществления устройство электрофореза может содержать более одного контейнера, описанного в настоящем документе.
[0076] Гелевая матрица для электрофореза может представлять собой агар, агарозу или полиакриламид. В некоторых вариантах осуществления гелевая матрица для электрофореза представляет собой агарозу. Электрофорезный буфер может иметь pH в диапазоне от pH 7 до pH 9 и может содержать этилендиаминтетрауксусную кислоту (ЭДТК) в качестве хелатирующего агента. Когда целевая нуклеиновая кислота фрагментирована на размеры в диапазоне от нескольких сотен до нескольких тысяч п. н. в длину, более высокая концентрация агарозы на реакционном участке поможет ограничить диффузию библиотечных продуктов из реакционного участка, позволяя эффективно удалять свободные реагенты/адапторы.
[0077] В некоторых вариантах осуществления устройство электрофореза также может содержать одну или более пар из положительного и отрицательного электродов. В некоторых вариантах осуществления пара из положительного и отрицательного электродов находится в прямом контакте с гелевой матрицей для электрофореза. В некоторых вариантах осуществления один или более электродов встроены в гелевую матрицу. В некоторых вариантах осуществления пара из положительного и отрицательного электродов не находится в прямом контакте с гелевой матрицей для электрофореза. В некоторых вариантах осуществления один или более электродов встроены в камеры, заполненные электрофорезным буфером, который соединен по текучей среде с гелевой матрицей для электрофореза.
[0078] В некоторых вариантах осуществления устройство электрофореза также может включать барьер или ультрафильтрационную мембрану с порами, достаточно малыми для удержания фрагментов нуклеиновых кислот. Одним из таких примеров мембраны является полиэфирсульфоновая мембрана с отсечкой по молекулярной массе 10 кДа (Biomax® 10 кДа от EMD Millipore).
[0079] В некоторых вариантах осуществления предложена система электрофореза. В некоторых вариантах осуществления предложена система электрофореза для получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты. В некоторых вариантах осуществления система электрофореза содержит устройство электрофореза, описанное в настоящем документе, источник питания и контроллер, выполненный с возможностью управления направлением и/или величиной одного или более электрических полей для перемещения реагентов и/или меченых фрагментов нуклеиновых кислот на реакционный участок, участок для сбора и/или приемные участки, и/или через них.
[0080] Когда к электродам прикладывают напряжение, реагенты могут перемещаться через гелевую матрицу для электрофореза, а также на реакционный участок и через него. Изменение направления напряжения на обратное может направить молекулы в противоположном направлении. Кроме того, при приложении напряжения к одной и/или другой паре электродов реагенты перемещаются на один и/или другой соответствующий реакционный участок или участок для сбора, в зависимости от электрофоретических подвижностей.
[0081] В некоторых вариантах осуществления можно осуществлять манипулирование электрическим полем для избирательного восстановления реагентов и фрагментов нуклеиновых кислот в определенных диапазонах размеров. Например, можно использовать способы с импульсным полем для элюирования процессированных фрагментов нуклеиновых кислот длиной 50-500 т. п. н., оставляя фрагменты нуклеиновых кислот размером более около 2000 т. п. н. Если требуется фрагмент большего размера, не содержащий фрагмент меньшего размера, более низкую фракцию можно элюировать сначала в условиях селективного по размеру импульсного поля, а затем более высокую фракцию можно извлечь в других условиях импульсного поля или в условиях постоянного поля. Более подробная информация представлена в публикации Jann Noolandi, and Chantal Turmel in In Methods in Molecular Biology Volume 12: Pulsed-field gel electrophoresis, Protocols, Methods, and Theories. Ed. Burmeister, Margit, and Ulanovsky, Levy. Humana., pp. 73-103 and 135-143, которая полностью включена в настоящий документ путем ссылки.
[0082] Кроме того, концентрацию геля, напряжение и/или продолжительность электрофореза можно выбирать таким образом, чтобы компоненты реагента эффективно перемещались и/или чтобы целевая нуклеиновая кислота оставалась на реакционном участке. Такие условия подходят для нуклеиновой кислоты с очень высокой молекулярной массой, которая мигрирует настолько медленно в агарозном геле. При обращении с более короткой целевой нуклеиновой кислотой (например, размер фрагмента около 500 п. н.) можно использовать гели с более высокой концентрацией, более низкие напряжения и более высокую степень оптимизации.
Определения
[0083] Если не указано иное, все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно применяет специалист в данной области. Все патенты, заявки, опубликованные заявки и другие публикации, на которые даны ссылки в настоящем документе, полностью включены в настоящий документ посредством ссылки, если не указано иное. Если не указано иное, при наличии множества определений для термина, представленного в настоящем документе, преимущественными являются определения, приведенные в данном разделе. Применяемые в данном описании и приложенной формуле изобретения формы единственного числа включают упоминания форм множественного числа, если в контексте явно не указано иное. Применение союза «или» или «и» означает «и/или», если не указано иное. Более того, применение термина «включая», а также других форм, таких как «включают», «включает» и «включенный», не имеет ограничительного характера. При использовании в настоящем описании, либо в переходной фразе, либо в структуре формулы изобретения, термины «содержит(-ат)» и «содержащий» следует интерпретировать как имеющие неограниченное значение. Другими словами, термины следует интерпретировать как синонимы фраз «имеющий по меньшей мере» или «включающий по меньшей мере». В контексте процесса термин «содержащий» означает, что процесс включает в себя по меньшей мере указанные стадии, но может включать в себя дополнительные стадии. В контексте соединения, композиции или устройства термин «содержащий» означает, что соединение, композиция или устройство включает по меньшей мере указанные особенности или компоненты, но может включать дополнительные особенности или компоненты.
Целевая нуклеиновая кислота
[0084] Используемый в настоящем документе термин «целевая нуклеиновая кислота» относится к любой интересующей двухцепочечной нуклеиновой кислоте, которая подвергается транспозиции, например, для создания библиотеки меченых фрагментов нуклеиновых кислот (например, 5'- и 3'-меченых или димеченных линейных фрагментов оцДНК или дцДНК или меченных фрагментов кольцевых оцДНК). «Целевая нуклеиновая кислота» может быть получена из любого источника in vivo или in vitro, включая одну или множество клеток, тканей, органов или организмов, будь то живые или мертвые или из любого биологического источника или источника окружающей среды (например, вода, воздух, почва). Например, в некоторых вариантах осуществления целевая нуклеиновая кислота содержит или состоит из эукариотическую и/или прокариотическую двухцепочечную нуклеиновую кислоту, которая происходит или получена из людей, животных, растений, грибов (например, плесневых грибов или дрожжей), бактерий, вирусов, вироидов, микоплазмы или других микроорганизмов. В некоторых вариантах осуществления целевая нуклеиновая кислота содержит или состоит из геномной ДНК, субгеномной ДНК, хромосомной ДНК (например, из выделенной хромосомы или части хромосомы, например, из одного или более генов или локусов из хромосомы), митохондриальной ДНК, ДНК хлоропластов, плазмидов или другой эпизомальной ДНК (или размещенной в ней рекомбинантной ДНК), или двухцепочечной кДНК, полученной путем обратной транскрипции РНК с использованием РНК-зависимой ДНК-полимеразы или обратной транскриптазы для получения первой цепи кДНК и последующего удлинения праймера, ренатурированного с первой цепью кДНК, для получения дцДНК. В некоторых вариантах осуществления целевая нуклеиновая кислота содержит множество молекул дцДНК в молекулах нуклеиновой кислоты или полученных из них (например, множество молекул дцДНК в геномной ДНК или полученных из них) или кДНК, полученных из РНК в биологическом источнике (например, клетка, ткань, орган, организм) или источнике в окружающей среде (например, вода, воздух, почва, слюна, мокрота, моча, фекалии) или из них. В некоторых вариантах осуществления целевая нуклеиновая кислота получена из источника in vitro. Например, в некоторых вариантах осуществления целевая нуклеиновая кислота содержит или состоит из дцДНК, полученной in vitro из одноцепочечной ДНК (оцДНК) или из одноцепочечной или двухцепочечной РНК (например, с использованием способов, хорошо известных в данной области, таких как достройка праймера с использованием подходящей ДНК-зависимой и/или РНК-зависимой ДНК-полимеразы (обратной транскриптазы). В некоторых вариантах осуществления целевая нуклеиновая кислота представляет собой целевую ДНК, которая содержит или состоит из дцДНК, полученной из всей или части одной или более двухцепочечных или одноцепочечных молекул ДНК или РНК, с использованием любых способов, известных в данной области, включая способы для: амплификации ДНК или РНК (например, ПЦР или ПЦР с обратной транскрипцией (ОТ-ПЦР), способы опосредованной транскрипцией амплификации, с амплификацией всех или части одной или более молекул нуклеиновых кислот); молекулярное клонирование всех или части одной или более молекул нуклеиновой кислоты в плазмиде, фосмиде, BAC или другом векторе, который впоследствии реплицируют в приемлемой клетке-хозяине; или захват одной или более молекул нуклеиновых кислот путем гибридизации, например, путем гибридизации с ДНК-зондами на матрице или микроматрице (например, «захват последовательности»; например, с применением наборов и/или матриц от компании ROCHE NIMBLEGEN, AGILENT или FEBIT).
[0085] В некоторых вариантах осуществления «целевая нуклеиновая кислота» или «целевая ДНК» означает двухцепочечную нуклеиновую кислоту, которую получают или модифицируют (например, с использованием различных биохимических или молекулярно-биологических методов) перед использованием для создания библиотеки меченных фрагментов нуклеиновых кислот (например, 5'- и 3'-меченых или димеченых линейных оцДНК или фрагментов дцДНК или меченных кольцевых оцДНК).
Транспосомные комплексы, адапторы полинуклеотидной транспозазы, метки и транспозазы
[0086] Технологию на основе транспозонов можно применять для фрагментации нуклеиновой кислоты (например, ДНК), например, как показано в примере рабочего процесса для наборов подготовки образцов NEXTERA™ XT и FLEX DNA (Illumina, Inc.), в которых целевые нуклеиновые кислоты, такие как геномная ДНК, обрабатывают транспосомными комплексами, которые одновременно фрагментируют и метят («тагментация») мишень, таким образом создавая популяцию фрагментированных молекул нуклеиновой кислоты, меченных уникальными адапторными последовательностями на концах фрагментов.
[0087] Реакция транспозиции представляет собой реакцию, в которой один или более транспозонов вводят в целевые нуклеиновые кислоты в случайных сайтах или практически случайных сайтах. Компоненты реакции транспозиции включают в себя транспозазу (или другой фермент, способный к фрагментированию и мечению нуклеиновой кислоты, как описано в настоящем документе, такой как интеграза) и адаптор полинуклеотидной транспозазы, который включает в себя двухцепочечную концевую последовательность транспозона, связывающуюся с ферментом, и метку, присоединенную к одной или обеим из двух концевых последовательностей транспозона. Одну цепь двухцепочечной концевой последовательности транспозона переносят в одну цепь целевой нуклеиновой кислоты в сайте фрагментации (цепь с переносом), при этом комплементарная цепь концевой последовательности транспозона не связана ковалентно с фрагментированной нуклеиновой кислотой (цепь без переноса), а остается гибридизированной с цепью с переносом. При необходимости или по желанию адаптор полинуклеотидной транспозазы может содержать метку с одной или более функциональными последовательностями (например, праймерными последовательностями).
[0088] «Транспосомный комплекс» состоит по меньшей мере из одного фермента транспозазы и последовательности распознавания транспозона. В некоторых таких системах транспозаза связывается с последовательностью распознавания транспозона с образованием функционального комплекса, который способен катализировать реакцию транспозиции. В некоторых аспектах последовательность распознавания транспозона представляет собой двухцепочечную концевую последовательность транспозона. Транспозаза или интеграза связывается с сайтом распознавания транспозазы в целевой нуклеиновой кислоте и вставляет последовательность распознавания транспозона в целевую нуклеиновую кислоту. В некоторых таких явлениях вставки одну цепь последовательности распознавания транспозона (или концевой последовательности) переносят в целевую нуклеиновую кислоту, что приводит также к явлению расщепления. Примеры процедур и систем транспозиции, которые можно легко адаптировать к использованию с транспозазами настоящего описания, описаны, например, в публикации PCT № WO2010/048605, патентной публикации США № 2012/0301925, патентной публикации США № 2012/13470087 или патентной публикации США № 2013/0143774, каждая из которых полностью включена в настоящий документ путем ссылки.
[0089] Примеры транспозаз, которые можно применять с определенными вариантами осуществления, представленными в настоящем документе, включают следующие (или кодируются следующими): транспозазу Tn5 (см. Reznikoff et al., Biochem. Biophys. Res. Commun. 2000, 266, 729-734), Vibrio Haryi (транспозазу, охарактеризованную Agilent и используемую в продукте SureSelect QXT), транспозазу MuA и сайт распознавания транспозазы Mu, содержащий концевые последовательности R1 и R2 (Mizuchi, K., Cell, 35: 785, 1983; Savilahti, H, et al., EMBO J., 14:4893, 1995), Staphylococcus aureus Tn552 (Colegio, O. et al., J. Bacteriol., 183:2384-8, 2001; Kirby, C. et al., Mol. Microbiol., 43:173-86, 2002), Tyl (Devine & Boeke, Nucleic Acids Res., 22:3765-72, 1994 и публикация PCT № WO95/23875), Transposon Tn7 (Craig, N.L., Science, 271:1512, 1996; Craig, N. L., Curr. Top. Microbiol. Immunol., 204:27-48, 1996), Tn/O и IS10 (Kleckner N. et al., Curr. Top. Microbiol. Immunol., 204:49-82, 1996), транспозазу Mariner (Lampe, D. J. et al., EMBO J., 15:5470-9, 1996), Tc1 (Plasterk, R. H., Curr. Top. Microbiol. Immunol., 204:125-43, 1996), P Element (Gloor, G. B., Methods Mol. Biol., 260:97-114, 2004), Tn3 (Ichikawa & Ohtsubo, J. Biol. Chem., 265:18829-32, 1990), бактериальные инсерционные последовательности (Ohtsubo & Sekine, Curr. Top. Microbiol. Immunol. 204:1-26, 1996), ретровирусы (Brown et al., Proc. Natl. Acad. Sci. USA, 86:2525-9, 1989) и ретротранспозон дрожжей (Boeke & Corces, Ann. Rev. Microbiol. 43:403-34, 1989). Дополнительные примеры включают в себя IS5, Tn10, Tn903, IS911 и сконструированные версии ферментов семейства транспозаз (Zhang et al., (2009) PLoS Genet. 5:e1000689. Epub October 16; Wilson C. et al. (2007) J. Microbiol. Methods 71:332-5).
[0090] В некоторых вариантах осуществления транспозаза представляет собой транспозазу Tn5, MuA или транспозазу Vibrio Haryi либо их активный мутант. В других вариантах осуществления транспозаза представляет собой транспозазу Тn5 или ее активный мутант. В некоторых вариантах осуществления транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5 (см., например, Reznikoff et al., публикация PCT № WO2001/009363, патенты США № 5,925,545, 5,965,443, 7,083,980 и 7,608,434 и Goryshin и Reznikoff, J. Biol. Chem. 273:7367, 1998) или ее активный мутант. В некоторых аспектах транспозаза Tn5 представляет собой транспозазу Tn5, описанную в публикации PCT № WO2015/160895, которая включена в настоящий документ посредством ссылки. В некоторых вариантах осуществления транспозаза Tn5 представляет собой белок слияния. В некоторых вариантах осуществления белок слияния транспозазы Tn5 содержит метку слитого фактора удлинения Ts (Tsf). В некоторых вариантах осуществления транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5, содержащую мутации по аминокислотам 54, 56 и 372 относительно последовательности дикого типа. В некоторых вариантах осуществления гиперактивная транспозаза Tn5 представляет собой белок слияния, причем необязательно белок слияния представляет собой фактор удлинения Ts (Tsf). Способы, описанные в настоящем документе, также могут включать комбинации транспозаз, а не только одну транспозазу. В некоторых вариантах осуществления сайт распознавания представляет собой сайт распознавания транспозазы типа Tn5 (Goryshin and Reznikoff, J. Biol. Chem., 273:7367, 1998). В одном варианте осуществления применяют сайт распознавания транспозазы, образующий комплекс с гиперактивной транспозазой Tn5 (например, транспозаза EZ-Tn5™, Epicentre Biotechnologies, Madison, Wis.).
[0091] В некоторых вариантах осуществления фермент транспозаза представляет собой димер (например, димер транспозазы Tn5). В некоторых указанных вариантах осуществления транспосомный комплекс содержит димер двух молекул транспозазы. В некоторых вариантах осуществления комплекс транспозазы содержит димер транспозазы (например, транспозазу Tn5), содержащий первый и второй мономеры. Каждый мономер содержит первый транспозон и второй транспозон, причем первый транспозон содержит первую концевую последовательность транспозона на своем 3'-конце и первую адапторную последовательность (причем адапторные последовательности в каждом мономере димера являются одинаковыми или отличаются), а второй транспозон содержит вторую концевую последовательность транспозона, по меньшей мере частично комплементарную первой концевой последовательности транспозона. В некоторых вариантах осуществления транспосомный комплекс представляет собой гомодимер, в котором каждая из двух молекул транспозазы связана с полинуклеотидной адапторной последовательностью с той же концевой последовательностью транспозона и меткой (например, каждый мономер связан с молекулой той же полинуклеотидной адапторной последовательности, образуя «гомодимер»). В некоторых вариантах осуществления в композициях и способах, описанных в настоящем документе, применяют две популяции комплексов транспосом. В некоторых вариантах осуществления транспозазы в каждой популяции представляют собой димеры и являются одним и тем же ферментом. В некоторых вариантах осуществления транспосомные комплексы в каждой популяции являются гетеродимерами, причем первая популяция имеет первый адаптор полинуклеотидной транспозазы в каждом из двух мономеров, а вторая популяция имеет второй адаптор полинуклеотидов (который отличается от первого адаптора полинуклеотидной транспозазы) в каждом мономере. В некоторых вариантах осуществления концевая последовательность транспозона в каждом гетеродимере является одинаковой, но адапторы полинуклеотидной транспозазы содержат разные метки. В некоторых вариантах осуществления каждая популяция содержит различную последовательность метки. В некоторых вариантах осуществления первая популяция содержит адаптор с меткой, содержащей праймерную последовательность A14, а вторая популяция содержит адаптор с меткой, содержащей праймерную последовательность В15.
[0092] В некоторых вариантах осуществления адаптор полинуклеотидной транспозазы представляет собой смесь двух адапторов полинуклеотидной транспозазы, каждый из которых содержит одну и ту же концевую последовательность транспозона и другую метку. Когда смесь адапторов объединяется с димером транспозазы Tn5, получают смесь трех транспосомных комплексов: (a) первый транспосомный димерный комплекс, содержащий транспозазу и два из первых адапторов полинуклеотидной транспозазы (первый гомодимер); (b) второй транспосомный димерный комплекс, содержащий транспозазу и два из вторых адапторов полинуклеотидной транспозазы (второй гомодимер); и (c) третий транспосомный димерный комплекс содержит транспозазу и один мономер с первым адаптором и один мономер со вторым адаптором (гетеродимер). При выполнении тагментации этой смесью трех комплексов полученные фрагменты соответствующим образом помечают с получением трех популяций фрагментов (одна, меченная на каждом 5'-конце с помощью первого адаптора; вторая, меченная на каждом 5'-конце с помощью второго адаптора; и третья, меченная на одном 5'-конце с помощью первого адаптора и на втором 5'-конце с помощью второго адаптора).
[0093] Адапторы транспозазы содержат: (a) 3’-участок, содержащий двухцепочечную концевую последовательность транспозона, и (b) метку. Концевая последовательность транспозона распознается транспозазой. Связывание транспозазы с концевой последовательностью транспозона образует транспосомный комплекс. В процессе тагментации цепь с переносом адаптора транспозазы переносят на (ренатурируют) 5'-конец фрагмента двухцепочечной нуклеиновой кислоты. Комплементарная цепь без переноса ковалентно не связана с полученным фрагментом, а гибридизуется с цепью с переносом и, таким образом, включена в фрагмент продукта.
[0094] Используемые в настоящем документе термины «метка» и «область метки» относятся к части адаптора полинуклеотидной транспозазы, показывающего последовательность для требуемого назначения или применения. Некоторые варианты осуществления, представленные в настоящем документе, включают в себя транспосомный комплекс, содержащий адаптор полинуклеотидной транспозазы, имеющий 3'-участок, содержащий двухцепочечную концевую последовательность транспозона, и область метки. Области меток могут содержать любую последовательность, предусмотренную для любой требуемой цели. В некоторых вариантах осуществления метка содержит одну или более функциональных последовательностей, выбранных из группы, состоящей из: универсальных последовательностей, праймерных последовательностей, индексных последовательностей, последовательностей для захвата, штрихкодовых последовательностей (используемых, например, для подсчета или коррекции ошибок), последовательностей расщепления, последовательностей, связанных с секвенированием, последовательностей для обогащения и их комбинаций. Например, в некоторых вариантах осуществления область метки содержит один или более сайтов распознавания рестрикционной эндонуклеазы. В некоторых вариантах осуществления метка содержит праймерную последовательность. В других вариантах осуществления метка содержит праймерную последовательность и индексную или штрихкодовую последовательность. Праймерная последовательность также может представлять собой универсальную последовательность. Универсальная последовательность представляет собой область нуклеотидной последовательности, которая является общей для двух или более фрагментов нуклеиновых кислот. Необязательно два или более фрагментов нуклеиновых кислот также имеют области различий последовательности. Универсальная последовательность, которая может присутствовать в разных членах множества фрагментов нуклеиновых кислот, может обеспечивать репликацию или амплификацию множества разных последовательностей с использованием одного универсального праймера, комплементарного универсальной последовательности.
[0095] В некоторых вариантах осуществления область метки содержит одну или более областей, подходящих для гибридизации с праймером для реакции кластерной амплификации. В некоторых вариантах осуществления область метки содержит одну или более областей, подходящих для гибридизации с праймером для реакции секвенирования. Следует понимать, что в область метки может быть включен любой другой приемлемый элемент. В некоторых вариантах реализации область метки содержит последовательность, имеющую длину от 5 до 200 п. н. В некоторых вариантах реализации область метки содержит последовательность, имеющую длину от 10 до 100 п. н. В некоторых вариантах реализации область метки содержит последовательность, имеющую длину от 20 до 50 п. н. В некоторых вариантах реализации область метки содержит последовательность, имеющую длину от 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 до 200 п. н. Данное изобретение не ограничено типом меток, которые можно применять, и квалифицированный специалист распознает дополнительные последовательности, которые можно применять для получения библиотеки и секвенирования следующего поколения.
Иммобилизованные реагенты
[0096] В некоторых вариантах осуществления реагенты, такие как ферменты, могут быть иммобилизованы на поверхностях, таких как гранулы в местоположениях или лунках в гелевой матрице для электрофореза, таким образом предотвращая их перемещение в электрических полях, в то время как другие реагенты могут свободно перемещаться в соответствии с их подвижностью в электрических полях.
[0097] Когда речь идет о иммобилизации молекул на твердой подложке, термины «иммобилизованный», и «закрепленный» используются в настоящем документе взаимозаменяемо, и предполагается, что, если прямо или косвенно из контекста не следует иное, оба термина охватывают прямое или опосредованное, ковалентное или нековалентное присоединение. В некоторых вариантах осуществления может быть предпочтительным ковалентное присоединение.
[0098] Иммобилизация реагентов может быть достигнута другими способами, известными в данной области. В некоторых вариантах реализации транспозаза или транспосомный комплекс иммобилизуют на субстрате, например грануле, за счет ковалентных или нековалентных партнеров по связыванию, например аффинного элемента и аффино связывающегося партнера. В некоторых таких вариантах реализации аффинный элемент представляет собой биотин, а твердая подложка содержит стрептавидин. Например, транспосомный комплекс иммобилизуют на покрытой стрептавидином грануле за счет биотинилированного линкера, связанного с транспосомным комплексом. В некоторых вариантах осуществления транспосомный комплекс иммобилизуют на грануле посредством биотина или другого аффинного элемента, ковалентно связанного с адаптором полинуклеотидной транспозазы (или одним или обоими адапторами полинуклеотидной транспозазы, если транспозаза представляет собой димер).
[0099] В некоторых вариантах осуществления фермент транспозаза и полинуклеотид иммобилизуют на твердой подложке. В некоторых вариантах осуществления ферменты транспозазы иммобилизуют только на твердой подложке, в то время как полинуклеотиды адаптора могут свободно мигрировать. В некоторых вариантах осуществления транспосомный комплекс иммобилизуют на твердой подложке на реакционном участке. В некоторых вариантах осуществления транспозазу иммобилизуют на твердой подложке на реакционном участке. В дополнительном варианте осуществления твердая подложка содержит или представляет собой гранулу. В одном варианте осуществления гранула представляет собой парамагнитную гранулу.
[0100] В контексте настоящего документа аффинный элемент представляет собой фрагмент, который можно использовать для связывания, ковалентно или нековалентно, с аффинно связывающимся партнером. В некоторых аспектах аффинный элемент находится на комплексе транспосом, а аффинно связывающийся партнер находится на твердой подложке. Примеры комбинаций аффинного элемента/партнеров по связыванию, которые могут быть легко адаптированы для использования с настоящим изобретением, описаны, например, в WO 2018/156519 или патентной публикации США № 2018/0245069, каждая из которых полностью включена в настоящий документ путем ссылки. В других вариантах осуществления комбинация аффинного элемента/партнера по связыванию содержит или представляет собой FITC/антитело к FITC, дигоксигенин/антитело дигоксигенин или гаптен/антитело. Другие подходящие аффинные пары включают без ограничения дитиобиотинавидин, иминобиотинавидин, биотинавидин, дитиобиотинсукцинилированный авидин, иминобиотинсукцинилированный авидин, биотинстрептавидин и биотинсукцинилированный авидин.
[0101] В настоящем документе расщепляемый линкер представляет собой молекулу с двумя функциональными головками, соединенными вместе посредством расщепляемой связи. Две функциональные головки служат для присоединения линкера к другим функциональным группам; в данном случае расщепляемый линкер соединяет 5'-конец первой последовательности транспозона с аффинным элементом. В контексте настоящего документа отщепляемый линкер представляет собой линкер, который может быть отщеплен химическими или физическими способами, такими как, например, фотолиз, химическое отщепление, термическое отщепление или ферментативное отщепление. В некоторых вариантах осуществления отщепление может осуществляться биохимическими, химическими, ферментативными, нуклеофильными, чувствительными к восстановлению средствами или иными способами. Обзор расщепляемых линкеров, классифицированных в соответствии с условиями их расщепления и биологическими применениями, приведен в работе Wagner et al., Bioorg. Med. Chem. 20, 571-582 (2012), которая включена в настоящий документ путем ссылки; см. также, например, патентные публикации США № 2012/0208705 и 2012/0208724, а также публикацию PCT № WO 2012/061832, каждая из которых полностью включена путем ссылки.
[0102] Термины «твердая поверхность», «твердая подложка» и другие грамматические эквиваленты относятся к любому материалу, подходящему или выполненному с возможностью присоединения комплексов транспосом. Как будет понятно специалистам в данной области, количество возможных подложек является широким. Возможные подложки включают в себя без ограничения стекло и модифицированное или функционализированное стекло, пластмассы (включая акрилы, полистирол и сополимеры стирола и других материалов, полипропилен, полиэтилен, полибутилен, полиуретаны, тефлон и т. п.), полисахариды, нейлон или нитроцеллюлозу, керамику, смолы, кремнезем или материалы на основе кремнезема, в том числе кремний и модифицированный кремний, углерод, металлы, неорганические стекла, пластмассы, волоконно-оптические жгуты, гранулы, парамагнитные гранулы и множество других полимеров.
[0103] В способах и устройствах, представленных в настоящем документе, транспосомные комплексы иммобилизуют на твердой подложке. В одном варианте осуществления твердая подложка представляет собой гранулу. Подходящие композиции на основе гранул включают без ограничения пластмассы, керамику, стекло, полистирол, метилстирол, акриловые полимеры, парамагнитные материалы, золь тория, углерод в виде графита, диоксид титана, латекс или поперечно-сшитые декстраны, такие как сефароза, целлюлоза, нейлон, поперечно-сшитые мицеллы и тефлон, а также любые другие материалы, описанные в настоящем документе применительно к твердым подложкам. В определенных вариантах осуществления микросферы представляют собой магнитные микросферы или гранулы, например парамагнитные частицы, сферы или гранулы. Гранулы необязательно должны быть сферическими; могут применяться частицы, имеющие неправильную форму. В качестве альтернативы или дополнительно гранулы могут быть пористыми. Размеры гранул варьируют от нанометров, например 100 нм, до миллиметров, например 1 мм, предпочтительно от 0,2 микрон до 200 микрон и особенно предпочтительно от 0,5 до 5 микрон, несмотря на то, что в некоторых вариантах осуществления можно применять гранулы меньшего или большего размера. Гранула может быть покрыта аффинно связывающимся партнером, например, гранула может быть покрыта стрептавидином. В некоторых вариантах осуществления гранулы представляют собой парамагнитные гранулы, покрытые стрептавидином, например гранулы Dynabeads MyOne streptavidin C1 (Thermo Scientific, № по кат. 65601), парамагнитные частицы Streptavidin MagneSphere (Promega, № по кат. Z5481), магнитные гранулы стрептавидина (NEB, № по кат. S1420S) и MaxBead Streptavidin (Abnova, № по кат. U0087). Твердая подложка также может представлять собой предметное стекло, например проточную кювету или иное предметное стекло, измененное таким образом, чтобы на нем можно было иммобилизовать транспосомный комплекс.
[0104] В некоторых вариантах осуществления настоящего изобретения твердые подложки, состоящие из инертного субстрата или матрицы (например, стеклянных предметных стекол, полимерных гранул и т. д.), которые были функционализированы, например, посредством нанесения слоя или покрытия из промежуточного материала, содержащего реакционноспособные группы, которые обеспечивают ковалентное присоединение к молекулам, таким как полинуклеотиды. Примеры таких подложек включают без ограничения полиакриламидные гидрогели, нанесенные на инертный субстрат, такой как стекло, в частности, полиакриламидные гидрогели, описанные в WO2005/065814 и US2008/0280773, содержание которых полностью включено в настоящий документ посредством ссылки. Способы тагментации (фрагментирования и нанесения метки) ДНК на твердой поверхности для конструирования тагментированной библиотеки ДНК описаны в WO2016/189331 и US2014/0093916A1, которые полностью включены в настоящий документ посредством ссылки.
Амплификация
[0105] Следует понимать, что для амплификации фрагментов ДНК можно использовать любую из методологий амплификации, описанную в настоящем документе или по существу известных в данной области, с универсальными или специфичными для мишени праймерами. Подходящие способы амплификации включают, без ограничений, полимеразную цепную реакцию (ПЦР), амплификацию с замещением цепей (SDA), транскрипционно опосредованную амплификацию (ТМА) и амплификацию на основе последовательности нуклеиновой кислоты (NASBA), как описано в патенте США № 8,003,354, который полностью включен в настоящий документ путем ссылки. Вышеуказанные способы амплификации можно использовать для амплификации одной или более интересующих нуклеиновых кислот. Например, для амплификации фрагментов нуклеиновых кислот можно использовать ПЦР, включая мультиплексную ПЦР, SDA, ТМА, NASBA и т. п. В некоторых вариантах осуществления в реакцию амплификации включены праймеры, специфично нацеленные на интересующую нуклеиновую кислоту.
[0106] Другие подходящие способы амплификации нуклеиновых кислот могут включать удлинение и лигирование олигонуклеотидов, амплификацию по типу катящегося кольца (RCA) (Lizardi et al., Nat. Genet. 19:225-232 (1998), который включен в настоящий документ путем ссылки) и метода лигирования олигонуклеотидных зондов (OLA) (см. в основном патенты США № 7,582,420, 5,185,243, 5,679,524 и 5,573,907; EP 0 320 308 B1; EP 0 336 731 B1; EP 0 439 182 B1; WO 90/01069 WO 89/12696 и WO 89/09835, все из которых включены в настоящий документ путем ссылки). Следует понимать, что данные методологии амплификации могут быть выполнены с возможностью амплификации фрагментов нуклеиновых кислот. Например, в некоторых вариантах осуществления способ амплификации может включать реакции амплификации с лигирующим зондом или метода лигирования олигонуклеотидных зондов (OLA), которые включают праймеры, конкретно нацеленные на интересующую нуклеиновую кислоту. В некоторых вариантах осуществления способ амплификации может включать в себя реакцию удлинения праймеров - лигирования, которая содержит праймеры, напрямую нацеленные на интересующую нуклеиновую кислоту. В качестве не имеющего ограничительного характера примера праймеров для удлинения и лигирования праймера, которые могут быть специально выполнены с возможностью амплификации интересующей нуклеиновой кислоты, амплификация может включать праймеры, используемые для анализа GoldenGate (Illumina, Inc., г. Сан-Диего, штат Калифорния, США), как показано в патентах США № 7,582,420 и 7,611,869, каждый из которых полностью включен в настоящий документ путем ссылки.
[0107] Примеры способов изотермической амплификации, которые могут использоваться в способе настоящего изобретения, включают в себя, без ограничений, амплификацию с множественным вытеснением (MDA), пример которой приведен в публикации Dean et al., Proc. Natl. Acad. Sci. USA 99:5261-66 (2002), или амплификацию нуклеиновых кислот с изотермическим замещением цепей, пример которой приведен в патенте США № 6,214,587, каждый из которых полностью включен в настоящий документ путем ссылки. Другие способы, не основанные на ПЦР, которые можно использовать в настоящем описании, включают, например, амплификацию с замещением цепей (SDA), описанную, например, в Walker et al., Molecular Methods for Virus Detection, Academic Press, Inc., 1995; патентах США №№ 5,455,166 и 5,130,238 и публикации Walker et al., Nucl. Acids Res. 20:1691-96 (1992), или амплификацию с замещением гиперразветвленных цепей, описанную, например, в Lage et al., Genome Research 13:294-307 (2003), каждый из которых полностью включен в настоящий документ путем ссылки. Для амплификации геномной ДНК со случайным праймером можно применять способы изотермической амплификации с полимеразой Phi 29, которая замещает цепи, или крупным фрагментом ДНК-полимеразы Bst, 5′->3′ экзо-. Полимеразы позволяют использовать преимущества, которые дает их высокая процессивность и активность по замещению цепей. Высокая процессивность позволяет полимеразам производить фрагменты длиной 10-20 тыс. п. н. Как указано выше, более мелкие фрагменты могут быть получены в изотермических условиях с использованием полимераз, обладающих низкой процессивностью и активностью замещения цепей, например полимеразы Кленова. Дополнительное описание реакций, условий и компонентов амплификации подробно изложено в описании патента США № 7,670,810, который полностью включен в настоящий документ путем ссылки.
[0108] Другим способом амплификации нуклеиновых кислот, используемым в настоящем описании, является ПЦР с мечением, в которой используют популяцию двухдоменных праймеров, имеющих константную область 5′-области, за которой следует случайная 3′-область, как описано, например, в публикации Grothues et al. Nucleic Acids Res. 21(5):1321-2 (1993), которая полностью включена в настоящий документ путем ссылки. Первые циклы амплификации выполняют для обеспечения множества инициаций на денатурированной нагреванием ДНК на основе индивидуальной гибридизации со случайно синтезированной 3’-областью. Вследствие характера 3’-области предполагается, что сайты инициации случайно распределены по всему геному. После этого несвязанные праймеры можно удалять и проводить дальнейшую репликацию с использованием праймеров, комплементарных константной 5′-области.
Получение фрагментов секвенирования - амплификация меченных фрагментов
[0109] Как описано в настоящем документе, в некоторых аспектах предлагаются способы получения фрагментов секвенирования из целевой нуклеиновой кислоты, включающие обеспечение твердой подложки, содержащей иммобилизованный на ней транспосомный комплекс, описанный в настоящем документе; приведение твердой подложки в контакт с целевой нуклеиновой кислотой в условиях, позволяющих фрагментировать целевую нуклеиновую кислоту и лигировать первый транспозон с 5'-концами фрагментов, посредством чего фрагмент иммобилизуют на твердой подложке. В некоторых аспектах способ дополнительно включает амплификацию фрагментированных нуклеиновых кислот. В некоторых вариантах осуществления состояние фрагмента представляет собой состояние, подходящее для тагментации с использованием комплекса транспосом для фрагмента и нанесения метки на целевую нуклеиновую кислоту.
[0110] В некоторых вариантах осуществления способов, описанных в настоящем документе, после фрагментации и мечения способы дополнительно включают удаление транспозазы из 5'-меченных целевых фрагментов для получения несвязанных в комплекс 5'-меченных целевых фрагментов. Удаление транспозазы можно осуществлять в химических условиях, таких как обработка денатурирующим агентом, таким как додецилсульфат натрия (SDS). Такие способы могут дополнительно включать создание полностью дуплексных версий 5'-меченых целевых фрагментов. Получение полного дуплекса может включать в себя удаление ренатурированного (но не лигированного) второго транспозона из 5'-меченых целевых фрагментов и удлинение 5' -меченых целевых фрагментов для получения полностью дуплексированных 5 '-меченых целевых фрагментов. Получение может быть осуществлено, например, путем нагревания не связанных в комплекс 5'-меченых целевых фрагментов до температуры, достаточной для селективной денатурации второго транспозона, оставляя оставшуюся дуплексную область фрагмента интактной. Удлинение можно выполнять в присутствии dNTP и подходящей полимеразы. В альтернативном варианте осуществления получение можно осуществлять в одной реакции путем инкубирования не связанных в комплекс 5'-меченных целевых фрагментов в присутствии одиночных нуклеотидов (dNTP) и полимеразы. В некоторых вариантах осуществления инкубирование включает нагревание при одной или более температурах, достаточных для денатурации второго ренатурированного транспозона и удлинения оставшихся дуплексов. В других вариантах осуществления полимераза представляет собой замещающую цепь полимеразу, которая служит для удаления второго транспозона и удлинения оставшегося дуплекса для получения полностью дуплексированных 5'-меченых целевых фрагментов. Приемлемые полимеразы включают в себя KAPA HiFi, Pfu и аналогичные ферменты. Приемлемые полимеразы включают в себя замещающие цепь полимеразы, такие как Bst, Bsu Vent, Klenow и аналогичные ферменты.
[0111] В некоторых аспектах способы дополнительно включают амплификацию полностью дуплексированных целевых 5′-меченых фрагментов. Амплификацию можно проводить любым подходящим способом амплификации, таким как полимеразная цепная реакция (ПЦР), амплификация по типу катящегося кольца (RCA) или амплификация со множественным замещением (MDA). В некоторых вариантах осуществления амплификацию выполняют посредством ПЦР. В некоторых вариантах осуществления амплификацию и удлинение выполняют за одну реакционную стадию посредством реагирования с dNTP в присутствии полимеразы.
[0112] В некоторых вариантах осуществления амплификация служит для добавления одной или более последовательностей вторичных адапторов к полностью дуплексированным 5'-меченым целевым фрагментам с образованием фрагментов секвенирования. Амплификацию выполняют путем инкубирования полностью дуплексированного 5'-меченого целевого фрагмента, содержащего праймерную последовательность на каждом конце, с носителем вторичного адаптора, одиночными нуклеотидами, и полимеразой в условиях, достаточных для амплификации целевых фрагментов и включения носителя вторичного адаптора (или его комплемента), причем носитель вторичного адаптора содержит комплемент праймерной последовательности и последовательности вторичного адаптора.
[0113] В некоторых вариантах осуществления носитель вторичного адаптора содержит праймерную последовательность, индексную последовательность, штрихкодовую последовательность, метку очистки или их комбинацию. В некоторых вариантах осуществления носитель вторичного адаптора содержит праймерную последовательность. В некоторых вариантах осуществления носитель вторичного адаптора содержит индексную последовательность. В некоторых вариантах осуществления носитель вторичного адаптора содержит индексную последовательность и праймерную последовательность.
[0114] В некоторых вариантах осуществления полностью дуплексированные 5'-меченые целевые фрагменты содержат другую праймерную последовательность на каждом конце. В таких вариантах осуществления каждый носитель вторичного адаптора содержит комплемент для одной из двух праймерных последовательностей. В некоторых вариантах осуществления две праймерные последовательности представляют собой праймерную последовательность A14 или праймерную последовательность B15.
[0115] В некоторых вариантах осуществления множество вторичных адапторов добавляют посредством амплификации. В некоторых вариантах осуществления каждый из носителей вторичного адаптора содержит одну из двух праймерных последовательностей. В некоторых вариантах осуществления каждый из носителей вторичного адаптора содержит одну из множества индексных последовательностей. В некоторых вариантах осуществления носители вторичного адаптора содержат вторичные адапторы с праймерной последовательностью P5 и вторичные адапторы с праймерной последовательностью P7.
[0116] В некоторых аспектах меченые фрагменты содержат гомо- и гетеро-меченные фрагменты, например, некоторые фрагменты, которые имеют одинаковую метку на обоих концах (гомо-меченные фрагменты), и некоторые фрагменты, которые имеют первую метку на одном конце и вторую метку на другом конце (гетеро-меченные фрагменты). В некоторых аспектах для обогащения гетеро-меченых фрагментов используют амплификацию смеси с помощью «супрессионной ПЦР». В других аспектах амплификацию выполняют с использованием «вильчатого» адаптора для установки другой метки, отличной от первой метки. После получения популяции гетеро-меченых фрагментов можно выполнить дополнительную амплификацию и секвенирование.
[0117] В некоторых вариантах осуществления фрагменты секвенирования депонируют на проточной кювете. В некоторых вариантах осуществления фрагменты секвенирования гибридизуют с комплементарными праймерами, привитыми на проточную кювету или поверхность. В некоторых вариантах осуществления последовательности фрагментов секвенирования обнаруживают с помощью секвенирования матрицы или способов секвенирования следующего поколения, таких как секвенирование посредством синтеза.
[0118] Праймеры P5 и P7 используют на поверхности коммерческих проточных кювет, поставляемых компанией Illumina, Inc., для секвенирования на различных платформах Illumina. В патентной публикации США № 2011/0059865 A1 описаны последовательности праймеров, которые полностью включены в настоящий документ путем ссылки. Примеры праймеров P5 и P7, которые могут иметь алкиновую концевую группу на 5’-конце, включают в себя следующие:
P5: AATGATACGGCGACCACCGAGAUCTACAC (SEQ ID NO. 1)
P7: CAAGCAGAAGACGGCATACGAG*AT (SEQ ID NO. 2)
и их производные. В некоторых примерах последовательность Р7 включает модифицированный гуанин в положении G*, например, 8-оксогуанин. В других примерах * указывает на то, что связь между G* и смежным 3’ A представляет собой тиофосфатную связь. В некоторых примерах праймеры Р5 и/или Р7 включают линкеры не природного происхождения. Необязательно один или оба праймера P5 и P7 могут включать хвост поли-T. Хвост поли-T по существу расположен на 5’-конце указанной выше последовательности, например, между 5’-основанием и концевым алкиновым звеном, но в некоторых случаях может быть расположен на 3’-конце. Последовательность поли-T может включать любое число Т-нуклеотидов, например от 2 до 20. Хотя в качестве примеров приведены праймеры P5 и P7, следует понимать, что в примерах, представленных в настоящем документе, можно использовать любые подходящие праймеры для амплификации.
[0119] В некоторых вариантах осуществления стадия амплификации способа включает ПЦР или изотермическую амплификацию. В некоторых вариантах осуществления стадия амплификации способа включает ПЦР.
Способы секвенирования
[0120] Некоторые из способов, предложенных в настоящем документе, включают способы анализа нуклеиновых кислот. Такие способы включают в себя получение библиотеки матричных нуклеиновых кислот целевой нуклеиновой кислоты, получение данных последовательности из библиотеки матричных нуклеиновых кислот и сборку представления последовательности целевой нуклеиновой кислоты. В некоторых вариантах осуществления способы, описанные в настоящем документе, можно использовать в технологических процессах секвенирования следующего поколения, включая, без ограничений, секвенирование путем синтеза (SBS). Примеры процедур секвенирования путем синтеза (SBS; sequencing by synthesis), жидкостных систем и платформ для обнаружения, которые можно легко адаптировать для использования с библиотеками нуклеиновых кислот, полученными посредством способов настоящего изобретения, описаны, например, в публикациях Bentley et al., Nature 456:53-59 (2008), WO 04/018497; US 7,057,026; WO 91/06678; WO 07/123744; US 7,329,492; US 7,211,414; US 7,315,019; US 7,405,281 и US 2008/0108082, каждый из которых включен в настоящий документ путем ссылки.
[0121] Некоторые варианты осуществления SBS включают в себя обнаружение протона, высвобождаемого при встраивании нуклеотида в продукт удлинения. Например, при секвенировании на основе обнаружения высвобожденных протонов может использоваться электрический детектор и связанные с ним методики, которые доступны в продаже от компании Ion Torrent (г. Гилфорд, штат Коннектикут, США, филиал компании Life Technologies), или способы и системы секвенирования, описанные в US 2009/0026082 A1; US 2009/0127589 A1; US 2010/0137143 A1; US 2010/0282617 A1, каждый из которых включен в настоящий документ путем ссылки.
[0122] Другой используемой методикой секвенирования является секвенирование через нанопоры (см., например, Deamer et al. Trends Biotechnol. 18, 147-151 (2000); Deamer et al. Acc. Chem. Res. 35:817-825 (2002); Li et al. Nat. Mater. 2:611-615 (2003), описания которых включены в настоящий документ путем ссылки). Способы, описанные в настоящем документе, не ограничиваются каким-либо конкретным применяемым типом аппаратуры для секвенирования.
[0123] Следующие пронумерованные пункты обеспечивают дополнительную поддержку и описание вариантов осуществления, представленных в настоящем документе.
[0124] Пункт 1. Способ выполнения ферментативной реакции с использованием электрофореза, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента;
второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента;
реакционный участок между первым участком и вторым участком и содержащий фермент; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
(b) приложение электрического поля между парой электродов для перемещения первого кофактора фермента из первого участка на реакционный участок и перемещения второго кофактора фермента из второго участка на реакционный участок с образованием активированного ферментного комплекса, содержащего фермент, первый кофактор фермента и второй кофактор фермента.
[0125] Пункт 2. Способ по пункту 1, в котором когда первый кофактор фермента представляет собой ион металла, второй кофактор фермента представляет собой полинуклеотид.
[0126] Пункт 3. Способ по пункту 1, дополнительно включающий нанесение субстрата для активированного ферментного комплекса на реакционный участок перед стадией (с), причем приложение электрического поля включает в себя реагирование активированного ферментного комплекса с субстратом на реакционном участке с образованием продукта реакции.
[0127] Пункт 4. Способ по любому одному из пунктов 1-3, в котором приложение электрического поля включает в себя миграцию непрореагировавших первого и второго кофакторов ферментов из реакционного участка для отделения непрореагировавших первого и второго кофакторов ферментов от продукта реакции на реакционном участке.
[0128] Пункт 5. Способ по любому одному из пунктов 1-4, в котором первый электрод представляет собой положительный электрод, а первый кофактор фермента имеет положительный заряд, при этом второй электрод представляет собой отрицательный электрод, а второй кофактор фермента имеет отрицательный заряд.
[0129] Пункт 6. Способ по любому одному из пунктов 3-5, в котором субстрат представляет собой целевую двухцепочечную нуклеиновую кислоту.
[0130] Пункт 7. Способ по пункту 6, в котором целевая двухцепочечная нуклеиновая кислота представляет собой двухцепочечную ДНК, двухцепочечную РНК или ДНК/РНК гибрид.
[0131] Пункт 8. Способ по любому одному из пунктов 1-7, в котором фермент представляет собой транспозазу, причем необязательно транспозаза представляет собой транспозазу Tn5.
[0132] Пункт 9. Способ по пункту 8, в котором первый кофактор фермента представляет собой Mg2+, необязательно в виде Mg(OAc)2 или MgCl2.
[0133] Пункт 10. Способ по пункту 8 или пункту 9, в котором второй кофактор фермента представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки.
[0134] Пункт 11. Способ по пункту 10, в котором второй кофактор фермента представляет собой смесь двух адапторов полинуклеотидной транспозазы, причем каждый адаптор содержит одну и ту же двухцепочечную концевую последовательность транспозона и другую одноцепочечную область метки.
[0135] Пункт 12. Способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно;
(b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок;
(c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, адаптор полинуклеотидной транспозазы и первый кофактор транспозазы; и
(d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0136] Пункт 13. Способ по пункту 12, в котором транспосомный комплекс иммобилизуют на твердой подложке на реакционном участке, необязательно посредством взаимодействия стрептавидин-биотин.
[0137] Пункт 14. Способ по пункту 13, включающий высвобождение транспосомного комплекса из твердой подложки после создания меченых фрагментов нуклеиновой кислоты.
[0138] Пункт 15. Способ по пункту 14, дополнительно включающий изменение величины первого электрического поля после стадии для перемещения меченых фрагментов нуклеиновой кислоты, связанных с транспосомным комплексом, высвобожденным из твердой подложки на участке для сбора.
[0139] Пункт 16. Способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
реакционный участок между первым участком и вторым участком и содержащий транспозазу; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно;
(b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок;
(c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок и перемещения второго кофактора транспозазы из второго участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и
(d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0140] Пункт 17. Способ по любому одному из пунктов 12-16, в котором ион металла представляет собой Mg2+, необязательно в виде Mg(OAc)2 или MgCl2.
[0141] Пункт 18. Способ по любому одному из пунктов 12-17, в котором одноцепочечная область метки содержит одно или более из: праймерной последовательности, штрихкодовой последовательности, последовательности уникального молекулярного идентификатора (UMI), метки амплификации, метки обогащения или метки очистки.
[0142] Пункт 19. Способ по любому одному из пунктов 12-18, в котором транспозаза представляет собой транспозазу Tn5.
[0143] Пункт 20. Способ по любому одному из пунктов 16-19, в котором транспозазу иммобилизуют на твердой подложке на реакционном участке, причем реакционный участок необязательно содержит лунку, при этом твердая подложка представляет собой гранулированную частицу или поверхность лунки.
[0144] Пункт 21. Способ по любому одному из пунктов 12-20, в котором целевая двухцепочечная нуклеиновая кислота представляет собой двухцепочечную ДНК, двухцепочечную РНК или ДНК/РНК гибрид.
[0145] Пункт 22. Способ по любому одному из пунктов 12-21, в котором величину первого электрического поля, приложенного на стадии (c), устанавливают таким образом, чтобы целевая двухцепочечная нуклеиновая кислота по существу не имела электрофоретической подвижности в пределах матрицы для электрофореза.
[0146] Пункт 23. Способ по любому одному из пунктов 12-22, в котором система электрофореза содержит участок для сбора вдоль длины между первым участком и реакционным участком.
[0147] Пункт 24. Способ по пункту 23, в котором приложение первого электрического поля на стадии (c) включает в себя перемещение меченых фрагментов нуклеиновых кислот на участок для сбора.
[0148] Пункт 25. Способ по пункту 23, включающий увеличение величины первого электрического поля после стадии (d) для перемещения меченых фрагментов нуклеиновых кислот на участок для сбора.
[0149] Пункт 26. Способ по любому одному из пунктов 12-25, включающий изменение величины или направления первого электрического поля через гелевую матрицу для электрофореза.
[0150] Пункт 27. Способ по любому одному из пунктов 12-26, в котором система электрофореза содержит дополнительные участки вдоль ширины и длины, каждый из которых содержит различные реагенты для тагментации, и вторую пару из положительного и отрицательного электродов на противоположных сторонах ширины на одном из: первого конца или второго конца.
[0151] Пункт 28. Способ по пункту 27, включающий приложение второго электрического поля между второй парой электродов, причем направление второго электрического поля перпендикулярно направлению первого электрического поля, приложенного на стадии (с).
[0152] Пункт 29. Способ по любому одному из пунктов 12-28, в котором нанесение целевой двухцепочечной нуклеиновой кислоты включает в себя добавление биологического образца на реакционный участок.
[0153] Пункт 30. Способ по пункту 29, в котором биологический образец содержит клеточный лизат.
[0154] Пункт 31. Способ по пункту 29, в котором биологический образец содержит цельные клетки.
[0155] Пункт 32. Способ по любому одному из пунктов 12-31, в котором система электрофореза содержит третий участок, содержащий лизирующий реагент, а реакционный участок содержит цельные клетки, причем способ дополнительно включает приложение третьего электрического поля для перемещения лизирующего агента на реакционный участок и/или через него для лизиса клеток, таким образом нанося целевую двухцепочечную нуклеиновую кислоту на участок для образца.
[0156] Пункт 33. Способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок, содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
третий участок, содержащий лизирующий реагент;
четвертый участок, содержащий транспозазу;
реакционный участок между первым участком и вторым участком; и
первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца;
(b) нанесение цельных клеток, содержащих целевую двухцепочечную нуклеиновую кислоту, на реакционный участок;
(c) приложение первого электрического поля для перемещения лизирующего агента на реакционный участок и/или через него для лизиса клеток, таким образом нанося целевую двухцепочечную нуклеиновую кислоту на участок для образца;
(d) приложение второго электрического поля для перемещения первого кофактора транспозазы из первого участка на реакционный участок, перемещения второго кофактора транспозазы из второго участка на реакционный участок и/или перемещения транспозазы из участка транспозазы на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и
(e) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
[0157] Пункт 34. Способ по пункту 33, в котором первое электрическое поле и второе электрическое поле отличаются, а стадию (с) выполняют перед стадией (d).
[0158] Пункт 35. Способ по пункту 33, в котором первое электрическое поле и второе электрическое поле являются одинаковыми, а стадию (с) выполняют одновременно со стадией (d).
[0159] Пункт 36. Способ по любому одному из пунктов 33-35, включающий приложение одного или более электрических полей после создания библиотеки меченых фрагментов нуклеиновых кислот для перемещения из реакционного участка одного или более из: лизирующего реагента, транспосомного комплекса, транспозазы, адаптора транспозазы, иона металла и меченых фрагментов нуклеиновых кислот.
[0160] Пункт 37. Способ по пункту 36, включающий перемещение меченых фрагментов нуклеиновых кислот на участок для сбора.
[0161] Пункт 38. Способ по пункту 36, включающий перемещение лизирующего реагента, транспосомного комплекса, иона металла и меченых фрагментов нуклеиновых кислот из реакционного участка на отдельные приемные участки.
[0162] Пункт 39. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента;
второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента;
реакционный участок между первым участком и вторым участком и содержащий фермент; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0163] Пункт 40. Устройство по пункту 39, в котором на реакционном участке предусмотрен субстрат для фермента.
[0164] Пункт 41. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0165] Пункт 42. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
реакционный участок между первым концом и вторым концом и содержащий транспозазу; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
[0166] Пункт 43. Устройство по пункту 41 или 42, в котором на реакционном участке предусмотрена целевая нуклеиновая кислота.
[0167] Пункт 44. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
третий участок, содержащий лизирующий реагент;
четвертый участок, содержащий транспозазу;
реакционный участок между первым концом и вторым концом; и
первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца.
[0168] Пункт 45. Устройство по пункту 44, в котором на реакционном участке предусмотрены цельные клетки, содержащие целевую нуклеиновую кислоту.
[0169] Пункт 46. Устройство по любому одному из пунктов 41-45, содержащее дополнительные участки вдоль ширины и/или длины, каждый из которых содержит различные реагенты для тагментации.
[0170] Пункт 47. Устройство по любому одному из пунктов 41-46, содержащее участок для сбора для приема меченых фрагментов нуклеиновых кислот.
[0171] Пункт 48. Устройство по любому одному из пунктов 41-47, содержащее один или более приемных участков для приема непрореагировавших реагентов.
[0172] Пункт 49. Устройство по любому из пунктов 41-48, в котором пара из положительного и отрицательного электродов непосредственно контактирует с гелевой матрицей для электрофореза, необязательно встроенной в гелевую матрицу.
[0173] Пункт 50. Система для получения библиотеки меченных фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, содержащая:
устройство по любому одному из пунктов 41-49;
источник питания;
контроллер, выполненный с возможностью управления направлением и/или величиной первого и второго электрических полей для перемещения реагентов и/или меченых фрагментов нуклеиновых кислот на реакционный участок, участок для сбора и/или приемные участки, и/или через них.
[0174] В тексте настоящей заявки были приведены ссылки на различные публикации, патенты и/или заявки на патенты. Описание этих публикаций полностью включено в настоящую заявку путем ссылки.
[0175] Приведенное выше письменное описание считается достаточным для того, чтобы специалист в данной области мог реализовать на практике варианты осуществления. Предшествующее описание и примеры подробно описывают определенные варианты осуществления и описывают наилучший способ, предусмотренный авторами изобретения. Однако следует понимать, что независимо от того, насколько подробно изложенное выше может появляться в тексте, вариант осуществления может быть реализован на практике различными способами и должен толковаться в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
[0176] Используемый в настоящем документе термин «около» относится к числовому значению, включая, например, целые числа, доли и процентные доли, независимо от того, указано ли это явным образом или нет. Каждое число в описании или формуле изобретения может считаться модифицированным термином «около». Термин «около» по существу относится к диапазону численных значений (например, +/-5-10% от указанного диапазона), который специалист в данной области считает эквивалентным указанному значению (например, имеющему такую же функцию или результат). Когда термины, такие как «по меньшей мере» и «около» предшествуют списку численных значений или диапазонов, термины изменяют все значения или диапазоны, приведенные в списке. В некоторых случаях термин «около» может включать в себя численные значения, округленные до ближайшей значащей цифры.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМА АНАЛИЗА ДЛЯ ОРТОГОНАЛЬНОГО ДОСТУПА К БИОМОЛЕКУЛАМ И ИХ МЕЧЕНИЯ В КЛЕТОЧНЫХ КОМПАРТМЕНТАХ | 2017 |
|
RU2771892C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2761432C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717491C2 |
| СЛОЖНЫЕ КОМПЛЕКСЫ СВЯЗАННОЙ НА ПОВЕРХНОСТИ ТРАНСПОСОМЫ | 2020 |
|
RU2790295C2 |
| СПОСОБЫ ДИСКРЕТНОЙ АМПЛИФИКАЦИИ ПОЛНОГО ГЕНОМА | 2016 |
|
RU2736351C2 |
| ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ | 2018 |
|
RU2783536C2 |
| СПОСОБЫ АМПЛИФИКАЦИИ ДНК ДЛЯ СОХРАНЕНИЯ СТАТУСА МЕТИЛИРОВАНИЯ | 2018 |
|
RU2754038C2 |
| СПОСОБЫ И СРЕДСТВА ПОЛУЧЕНИЯ БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2815513C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838946C2 |
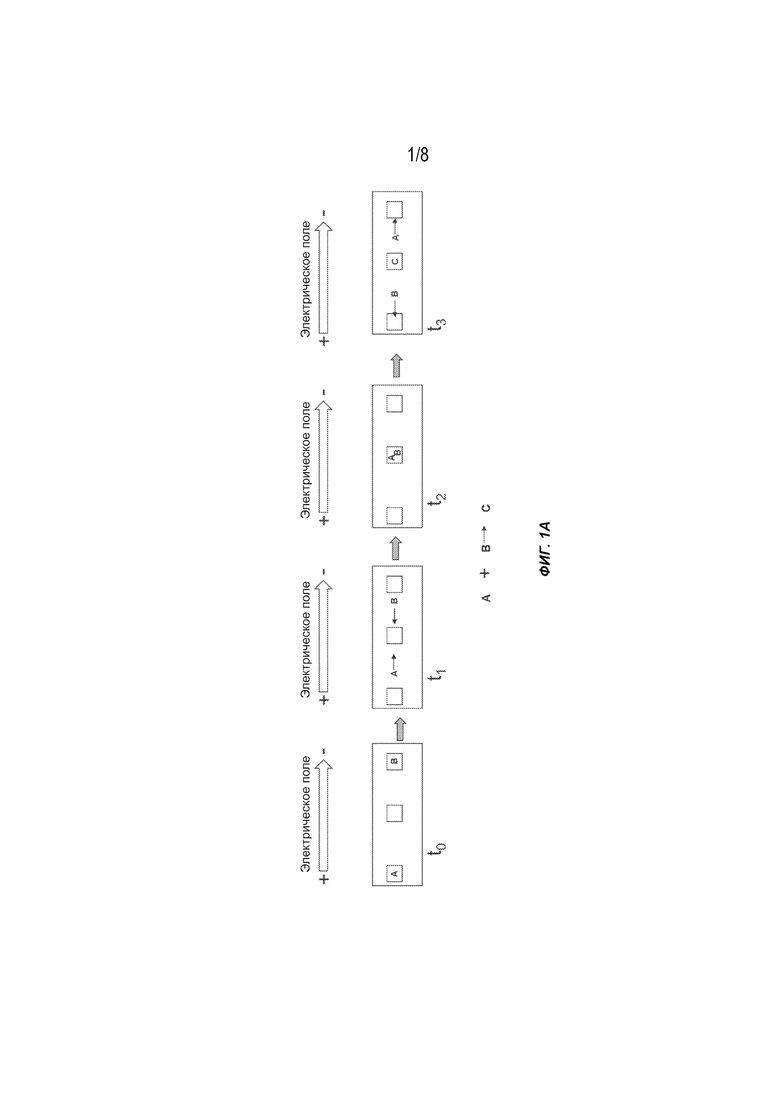
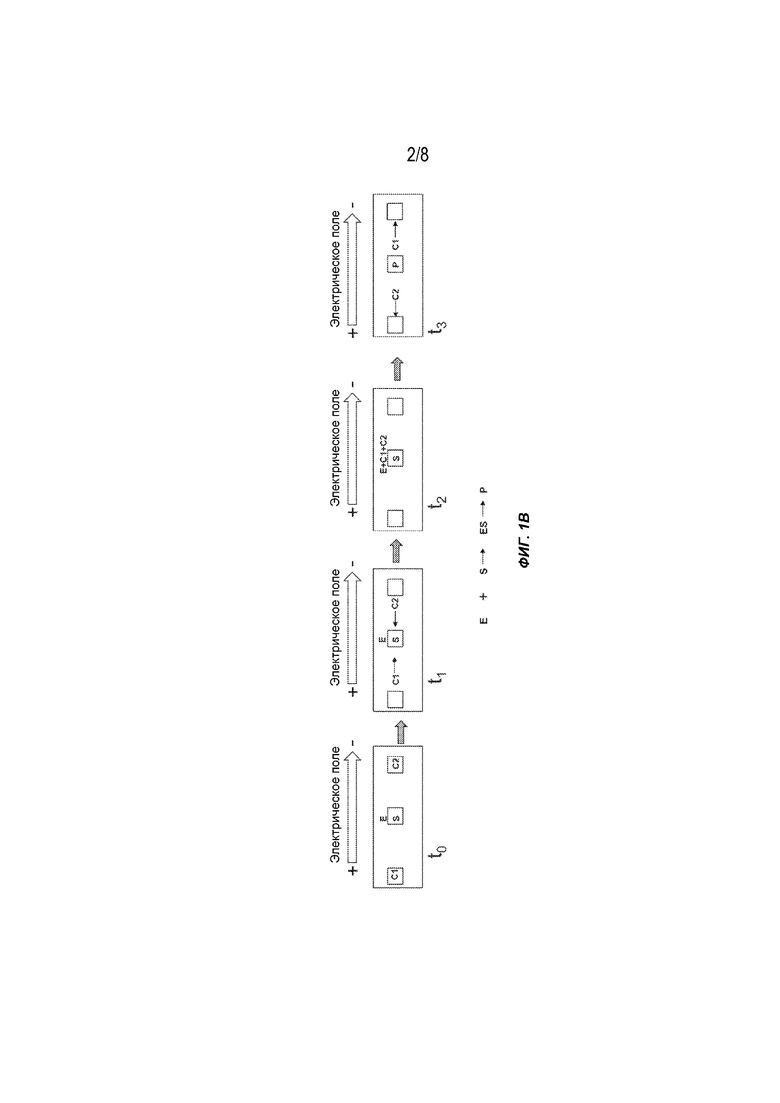
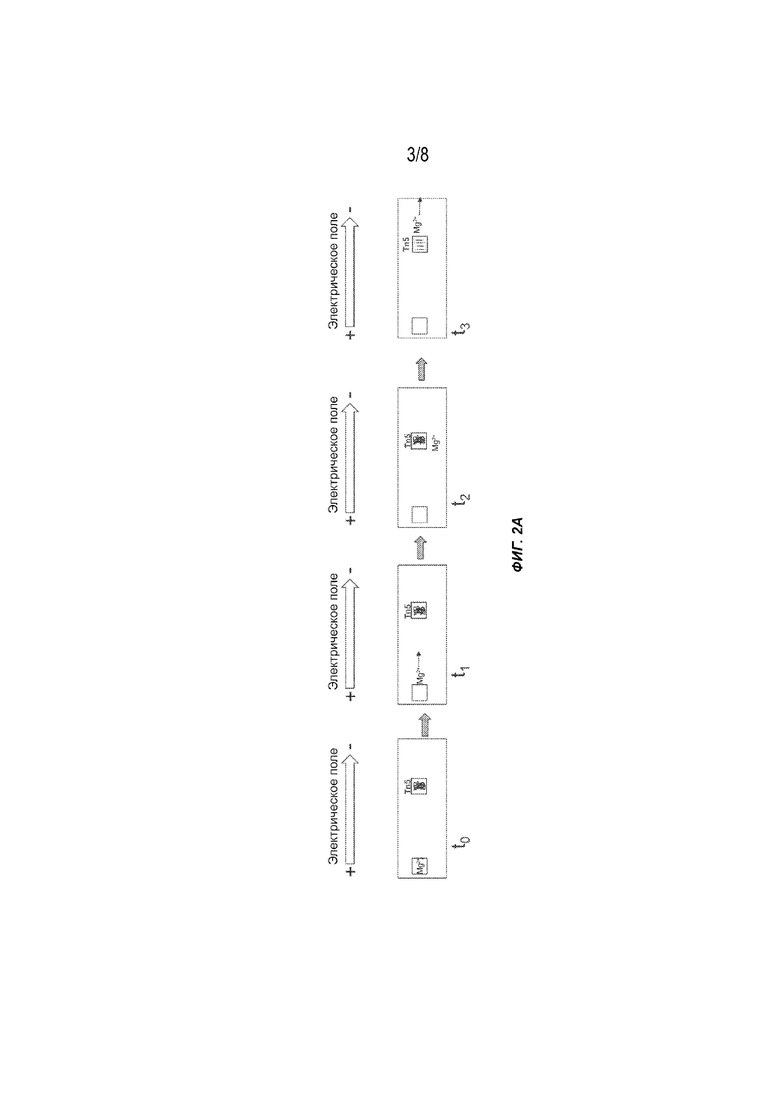
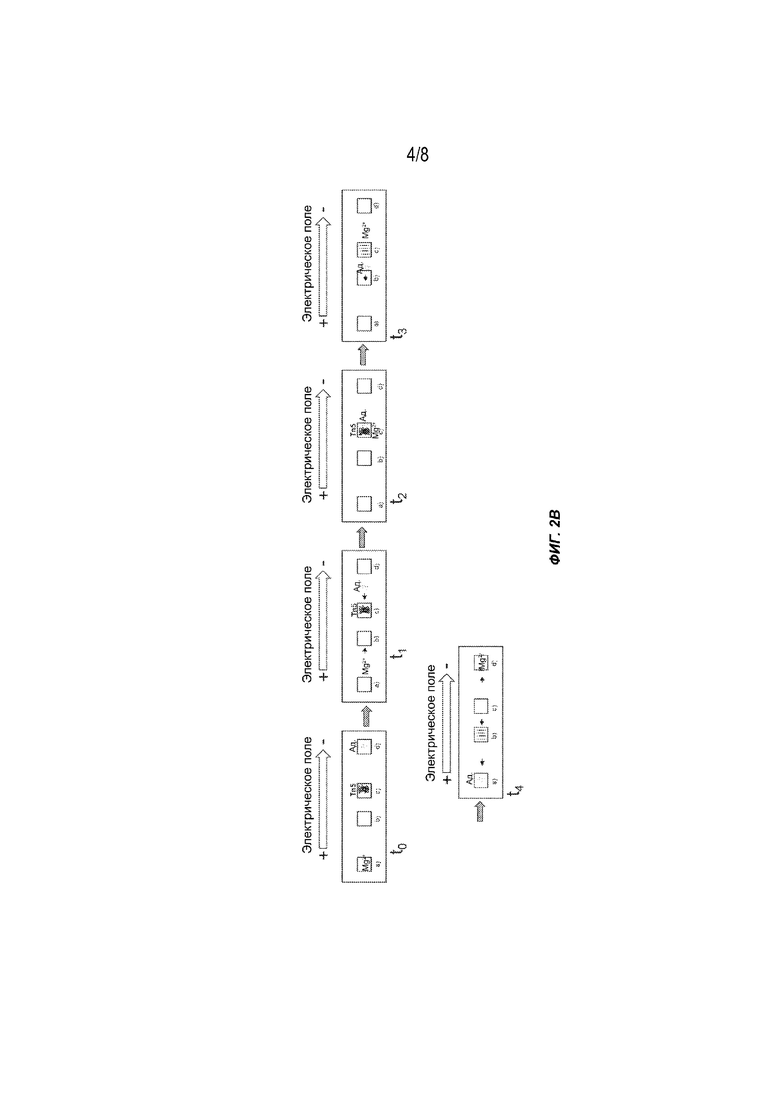
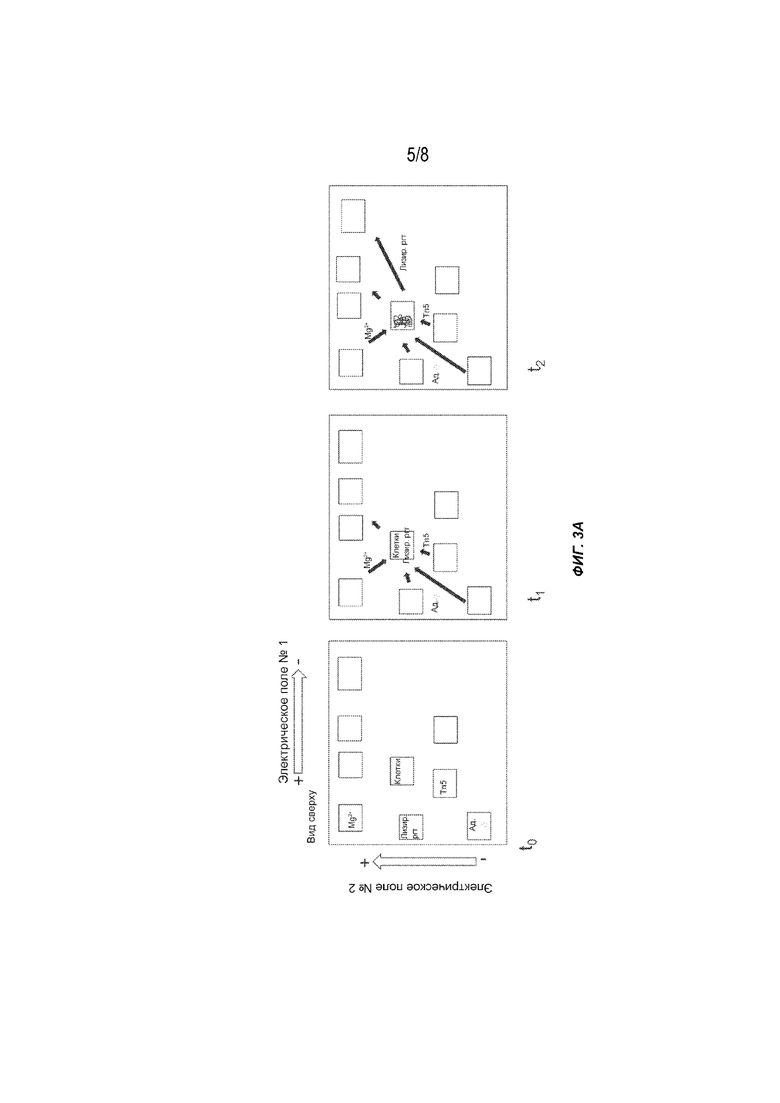
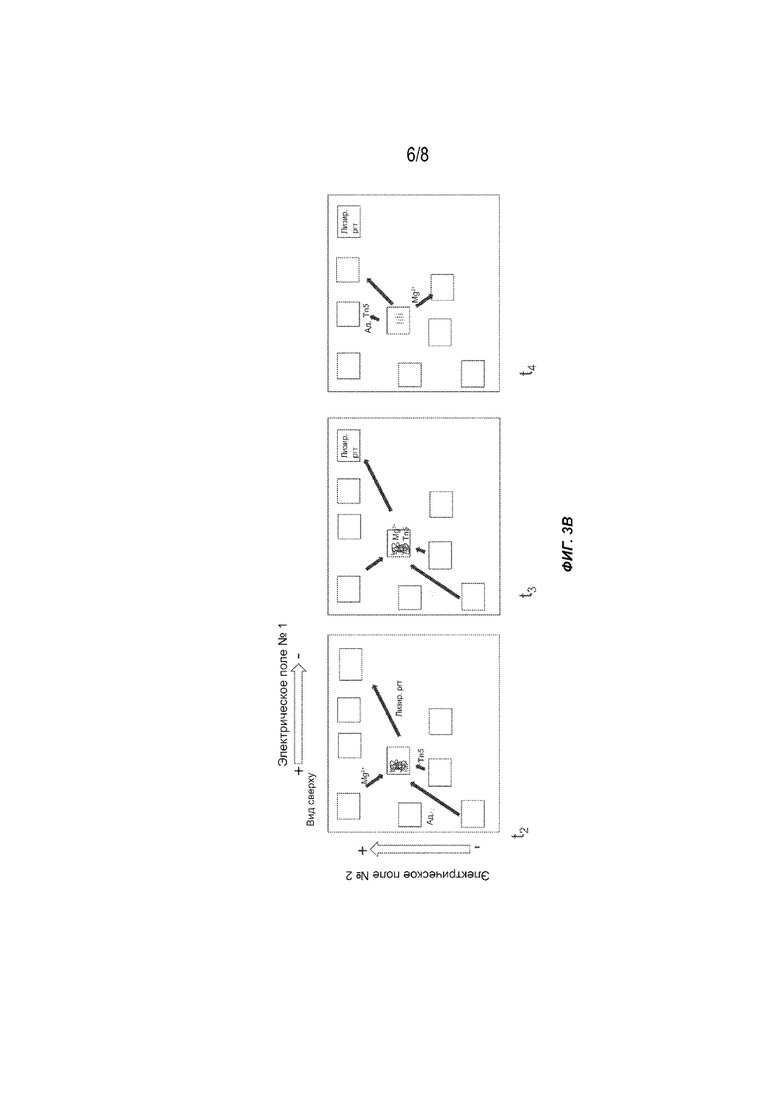
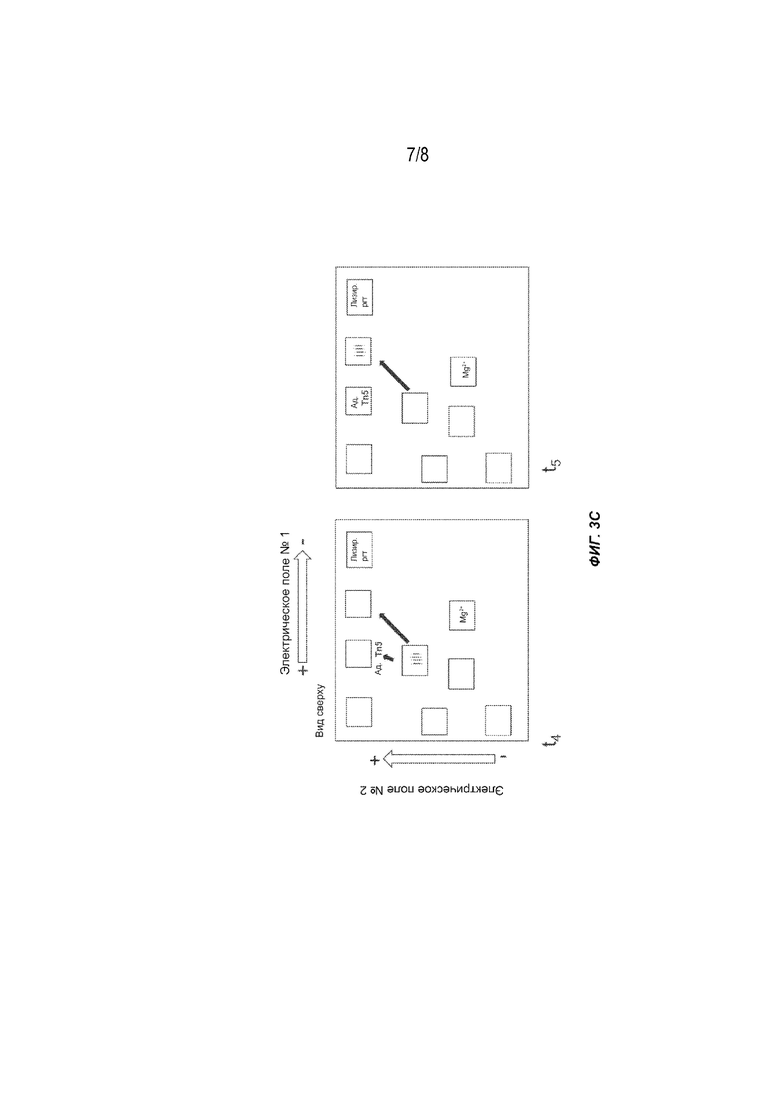
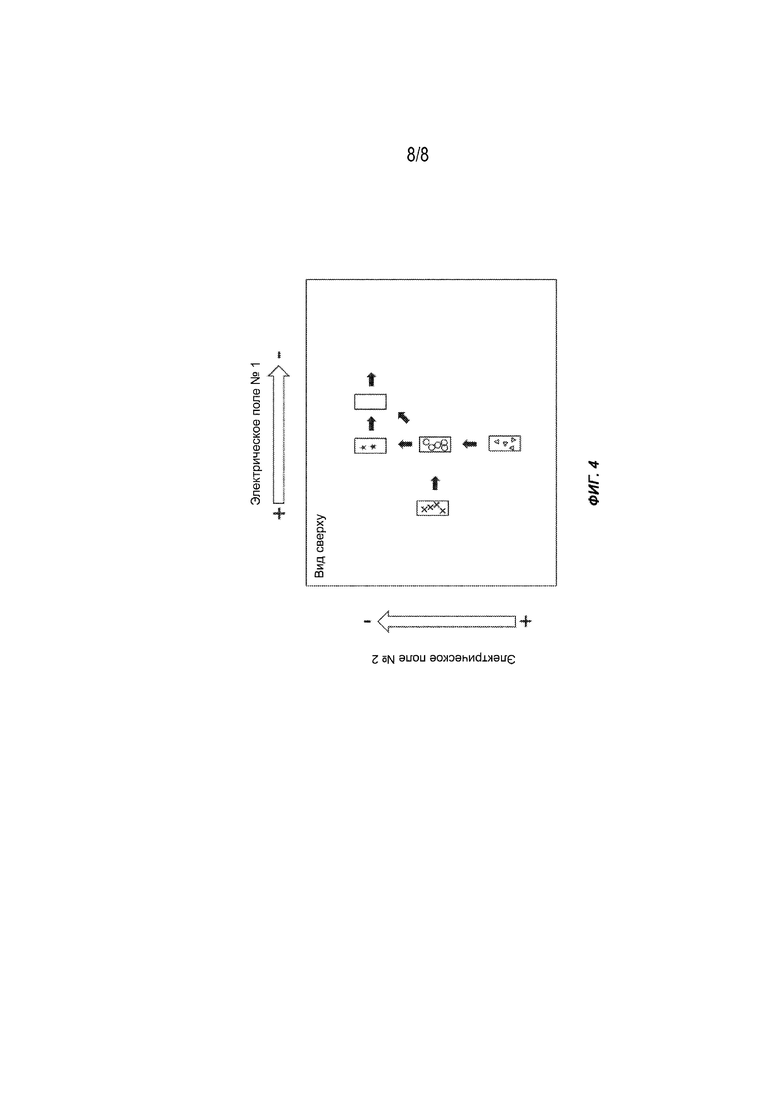
Группа изобретений относится к способу выполнения ферментативной реакции с использованием электрофореза, способу получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, к устройству электрофореза и системе для получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты. Система электрофореза содержит гелевую матрицу для электрофореза, имеющую первый и второй конец и длину между первым и вторым концами. На первом и втором концах соответственно расположена пара из положительного и отрицательного электродов. Первый участок вблизи первого конца содержит первый кофактор фермента. Второй участок вблизи второго конца содержит второй кофактор фермента. Второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента. Реакционный участок между первым участком и вторым участком содержит фермент. Приложение электрического поля между парой электродов приводит к миграции молекул через гелевую матрицу для электрофореза с получением целевого продукта. Осуществление группы изобретений обеспечивает снижение риска физического повреждения нуклеиновых кислот. 9 н. и 18 з.п. ф-лы, 8 ил.
1. Способ выполнения ферментативной реакции с использованием электрофореза, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента;
второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента;
реакционный участок между первым участком и вторым участком и содержащий фермент; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
(b) приложение электрического поля между парой электродов для перемещения первого кофактора фермента из первого участка на реакционный участок и перемещения второго кофактора фермента из второго участка на реакционный участок с образованием активированного ферментного комплекса, содержащего фермент, первый кофактор фермента и второй кофактор фермента.
2. Способ по п. 1, в котором когда первый кофактор фермента представляет собой ион металла, второй кофактор фермента представляет собой полинуклеотид.
3. Способ по п. 1, дополнительно включающий нанесение субстрата для активированного ферментного комплекса на реакционный участок перед стадией (с), причем приложение электрического поля включает в себя реагирование активированного ферментного комплекса с субстратом на реакционном участке с образованием продукта реакции.
4. Способ по п. 1, в котором приложение электрического поля включает в себя миграцию непрореагировавших первого и второго кофакторов ферментов из реакционного участка для отделения непрореагировавших первого и второго кофакторов ферментов от продукта реакции на реакционном участке.
5. Способ по п. 1, в котором первый электрод представляет собой положительный электрод, а первый кофактор фермента имеет положительный заряд, при этом второй электрод представляет собой отрицательный электрод, а второй кофактор фермента имеет отрицательный заряд.
6. Способ по п. 3, в котором субстрат представляет собой целевую двухцепочечную нуклеиновую кислоту, причем необязательно целевая двухцепочечная нуклеиновая кислота представляет собой двухцепочечную ДНК, двухцепочечную РНК или ДНК/РНК гибрид.
7. Способ по п. 1, в котором фермент представляет собой транспозазу, причем необязательно транспозаза представляет собой транспозазу Тn5, и при этом необязательно первый кофактор фермента содержит Mg2+, необязательно в виде Mg(OAc)2 или MgCl2 и необязательно второй кофактор фермента представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки.
8. Способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно;
(b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок;
(c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, адаптор полинуклеотидной транспозазы и первый кофактор транспозазы; и
(d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
9. Способ по п. 8, в котором транспосомный комплекс иммобилизуют на твердой подложке на реакционном участке, необязательно посредством взаимодействия стрептавидин-биотин.
10. Способ по п. 9, включающий высвобождение транспосомного комплекса из твердой подложки после создания меченых фрагментов нуклеиновой кислоты.
11. Способ по п. 10, дополнительно включающий изменение величины первого электрического поля после стадии для перемещения меченых фрагментов нуклеиновой кислоты, связанных с транспосомным комплексом, высвобожденным из твердой подложки на участке для сбора.
12. Способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
реакционный участок между первым участком и вторым участком и содержащий транспозазу; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно;
(b) нанесение целевой двухцепочечной нуклеиновой кислоты на реакционный участок;
(c) приложение первого электрического поля между парой электродов для перемещения первого кофактора транспозазы из первого участка на реакционный участок и перемещения второго кофактора транспозазы из второго участка на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и
(d) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
13. Способ по п. 12, в котором одноцепочечная область метки содержит одно или более из: праймерной последовательности, штрихкодовой последовательности, последовательности уникального молекулярного идентификатора (UMI), метки амплификации, метки обогащения или метки очистки.
14. Способ по п. 12, в котором транспозазу иммобилизуют на твердой подложке на реакционном участке, причем реакционный участок необязательно содержит лунку, при этом твердая подложка представляет собой гранулированную частицу или поверхность лунки.
15. Способ по п. 12, в котором величину первого электрического поля, приложенного на стадии (c), устанавливают таким образом, чтобы целевая двухцепочечная нуклеиновая кислота по существу не имела электрофоретической подвижности в пределах матрицы для электрофореза.
16. Способ по п. 12, в котором система электрофореза содержит участок для сбора вдоль длины между первым участком и реакционным участком.
17. Способ по п. 16, в котором приложение первого электрического поля на стадии (c) включает в себя перемещение меченых фрагментов нуклеиновых кислот на участок для сбора.
18. Способ по п. 12, включающий изменение величины или направления первого электрического поля через гелевую матрицу для электрофореза.
19. Способ по п. 12, в котором система электрофореза содержит дополнительные участки вдоль ширины и длины, каждый из которых содержит различные реагенты для тагментации, и вторую пару из положительного и отрицательного электродов на противоположных сторонах ширины на одном из: первого конца или второго конца.
20. Способ по п. 19, включающий приложение второго электрического поля между второй парой электродов, причем направление второго электрического поля перпендикулярно направлению первого электрического поля, приложенного на стадии (с).
21. Способ получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, включающий:
(a) обеспечение системы электрофореза, содержащей:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок, содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
третий участок, содержащий лизирующий реагент;
четвертый участок, содержащий транспозазу;
реакционный участок между первым участком и вторым участком; и
первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца;
(b) нанесение цельных клеток, содержащих целевую двухцепочечную нуклеиновую кислоту, на реакционный участок;
(c) приложение первого электрического поля для перемещения лизирующего агента на реакционный участок и/или через него для лизиса клеток, таким образом нанося целевую двухцепочечную нуклеиновую кислоту на участок для образца;
(d) приложение второго электрического поля для перемещения первого кофактора транспозазы из первого участка на реакционный участок, перемещения второго кофактора транспозазы из второго участка на реакционный участок и/или перемещения транспозазы из участка транспозазы на реакционный участок с образованием активированного транспосомного комплекса, содержащего транспозазу, первый кофактор транспозазы и второй кофактор транспозазы; и
(e) инкубирование целевой двухцепочечной нуклеиновой кислоты с активированным транспосомным комплексом на реакционном участке в условиях, достаточных для фрагмента целевой двухцепочечной нуклеиновой кислоты, а не множества фрагментов нуклеиновых кислот, и мечение фрагментов нуклеиновых кислот, таким образом создавая библиотеку меченых фрагментов нуклеиновых кислот.
22. Способ по п. 21, в котором первое электрическое поле и второе электрическое поле отличаются, а стадию (с) выполняют перед стадией (d); или
в котором первое электрическое поле и второе электрическое поле являются одинаковыми, а стадию (с) выполняют одновременно со стадией (d).
23. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор фермента для фермента;
второй участок вблизи второго конца и содержащий второй кофактор фермента для указанного фермента, причем второй кофактор фермента имеет электрический заряд, противоположный электрическому заряду первого кофактора фермента;
реакционный участок между первым участком и вторым участком и содержащий фермент; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
24. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
реакционный участок, расположенный на расстоянии от первого конца и содержащий транспосомный комплекс, содержащий транспозазу и адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
25. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец, второй конец и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
реакционный участок между первым концом и вторым концом и содержащий транспозазу; и
пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно.
26. Устройство электрофореза, содержащее:
гелевую матрицу для электрофореза, имеющую первый конец и второй конец, ширину и длину между первым и вторым концами;
первый участок вблизи первого конца, содержащий первый кофактор транспозазы для транспозазы, причем первый кофактор транспозазы представляет собой ион металла;
второй участок вблизи второго конца и содержащий второй кофактор транспозазы для транспозазы, причем второй кофактор транспозазы имеет электрический заряд, противоположный электрическому заряду первого кофактора транспозазы, при этом второй кофактор транспозазы представляет собой адаптор полинуклеотидной транспозазы, содержащий двухцепочечную концевую последовательность транспозона и одноцепочечную область метки;
третий участок, содержащий лизирующий реагент;
четвертый участок, содержащий транспозазу;
реакционный участок между первым концом и вторым концом; и
первую пару из положительного и отрицательного электродов, расположенных на первом и втором концах соответственно; и
вторую пару из положительного и отрицательного электродов, расположенных на противоположных сторонах ширины на одном из: первого конца или второго конца.
27. Система для получения библиотеки меченых фрагментов нуклеиновых кислот из целевой двухцепочечной нуклеиновой кислоты, содержащая:
устройство по любому одному из пп. 23-26;
источник питания;
контроллер, выполненный с возможностью управления направлением и/или величиной первого и второго электрических полей для перемещения реагентов и/или меченых фрагментов нуклеиновых кислот на реакционный участок, участок для сбора и/или приемные участки, и/или через них.
| WO 2016073690 A1, 12.05.2016 | |||
| WO 2015189636 A1, 17.12.2015 | |||
| WO 2016003814 A1, 07.01.2016 | |||
| WO 2013131962 A1, 12.09.2013 | |||
| Способ получения алкил-и диалкилдихлорсиланов | 1959 |
|
SU123960A1 |
| HELLMAN LANCE M et al., "Electrophoretic mobility shift assay (EMSA) for detecting protein-nucleic acid interactions", NATURE PROTOCOLS 2007,Vol | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Паровая установка высокого давления | 1923 |
|
SU1849A1 |
| SALIMULLAH MD et | |||
Авторы
Даты
2023-06-29—Публикация
2020-07-10—Подача