Область техники
Настоящее изобретение относится к области диагностики, в частности диагностики по образцам крови, и, в частности, к диагностике и прогнозированию рака и аневризм путем обнаружения деградации внеклеточного матрикса.
Уровень техники
Рак представляет собой частую и растущую причину смертности. По оценкам Всемирной организации здравоохранения в течение следующих 2-3 десятилетий рак будет основной причиной смертности во всем мире. Самым эффективным оружием в борьбе с повышенной смертностью от рака является ранняя диагностика. Многие типы рака можно эффективно лечить, если обнаруживать их на ранних стадиях. Эта реальность подчеркивает необходимость разработки простого, надежного и экономичного набора молекулярных маркеров для обнаружения рака на начальных стадиях канцерогенеза. Другой важной стратегией эффективной борьбы с раком является раннее выявление пациентов с риском развития метастазов с целью более частого наблюдения за ними, а также применение более агрессивных терапевтических вмешательств в этой подгруппе пациентов.
Недавний прогресс также подчеркнул важность неклеточных компонентов локального микроокружения или ниш, особенно внеклеточного матрикса (ЕСМ), во время прогрессирования рака. ЕСМ представляет собой смесь внеклеточных молекул, секретируемых поддерживающими клетками, которые обеспечивают структурную и биохимическую поддержку окружающим клеткам. ЕСМ млекопитающих включает в себя интерстициальный матрикс и базальную мембрану. Интерстициальный матрикс присутствует между различными клетками млекопитающих (т.е. в межклеточных пространствах). Гели полисахаридов и фибриллярных белков заполняют интерстициальное пространство и действуют как буфер сжатия против растягивающего напряжения, приложенного к ЕСМ. Базальные мембраны представляют собой пластинчатые отложения ЕСМ, на которых покоятся различные эпителиальные клетки. Каждый тип соединительной ткани у млекопитающих характеризуется типом ЕСМ: коллагеновые волокна и костный минерал составляют ЕСМ костной ткани; ретикулярные волокна и основное вещество составляют ЕСМ рыхлой соединительной ткани; а плазма крови представляет собой ЕСМ крови.
Хотя ЕСМ давно рассматривается как стабильная структура, которая играет в основном вспомогательную роль в поддержании морфологии ткани, он представляет собой важную часть среды резидентных клеток, которая на удивление динамична и универсальна и влияет на фундаментальные аспекты клеточной биологии. Клеточная адгезия, межклеточная коммуникация и дифференцировка представляют собой общие функции ЕСМ. Этот плейотропный аспект функции ЕСМ зависит от высокодинамичной структуры ЕСМ и его ремоделирования как эффективного механизма, посредством которого можно регулировать разнообразное клеточное поведение. Основная задача биологии ЕСМ состоит в том, чтобы понять роль ЕСМ в нормальном развитии и то, как нарушение динамики ЕСМ может способствовать развитию таких заболеваний, как рак.
Другой пример заболевания, на которое могут сильно повлиять изменения ЕСМ, представляет собой аневризму аорты. При аневризмах аорты происходит деградация ЕСМ стенки аорты, ведущая сначала к дилатации аорты, а затем к образованию аневризмы.
Аневризмы аорты представляют собой серьезное клиническое заболевание, которое бессимптомно прогрессирует до разрыва или расслоения. Это ведущая причина смертности в развитых странах. Разрыв аневризмы аорты, который обычно является первым и одновременно последним симптомом, приводит к летальности 75%. Подсчитано, что частота аневризм аорты будет продолжать расти во всем мире в следующие годы из-за старения населения в целом. Патогенез и молекулярные механизмы, приводящие к образованию аневризмы, изучаются, и в настоящее время не существует простого лабораторного теста, который позволил бы надежно обнаружить аневризмы аорты.
Ввиду вышеперечисленных эпидемиологических данных существует острая необходимость в предоставлении простых и надежных тестов для ранней диагностики рака и аневризмы аорты, а также способов эффективного наблюдения за пациентами с целью раннего выявления пациентов с риском развития метастазов или рецидивирующих пациентов. Кроме того, как правило, необходимы более эффективные стратегии для оптимизации схем лечения больных раком и аневризмой.
Подробное описание настоящего изобретения
Авторы настоящего изобретения неожиданно обнаружили, что аномальная функция или деградация ЕСМ может быть точно обнаружена путем определения уровня экспрессии определенных генов в периферической крови. Сверхэкспрессия этого конкретного набора генов в периферической крови выявляет уровень активации молекулярного механизма, который способствует ремоделированию ЕСМ с последствиями для развития рака и аневризмы.
Опознание по характерным признакам для обнаружения деградации или ненормальной функции ЕСМ предусматривает гены, которые показаны в таблице 1.
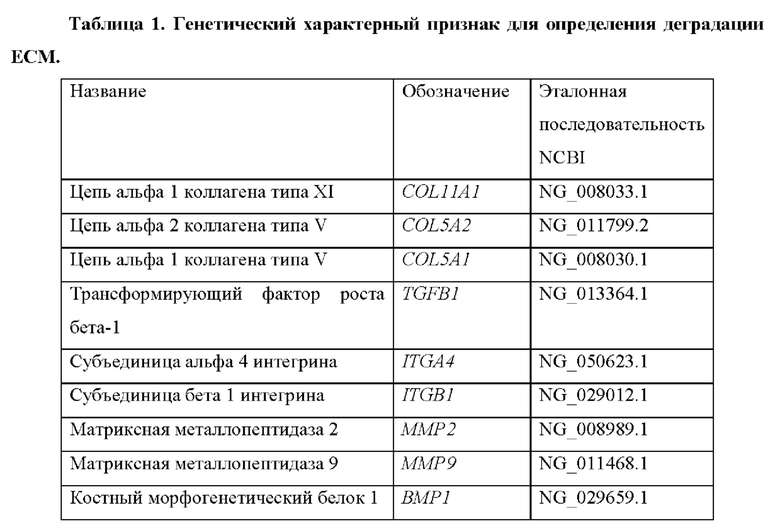
Таким образом, согласно первому аспекту настоящего изобретения предусмотрен способ in vitro для определения деградации внеклеточного матрикса (ЕСМ) у субъекта, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, перечисленных в таблице 1, причем, когда уровень продукта экспрессии выше эталонного значения, это свидетельствует о неорганизованном/деградированном ЕСМ.
В контексте настоящего изобретения выражение «деградация ЕСМ» также понимается как ремоделирование, приводящее к неорганизованному ЕСМ или аномальным механическим и динамическим свойствам ЕСМ.
Термин «диагноз» известен специалисту в настоящей области техники. Используемый в настоящем документе термин «диагноз» понимается как осознание конкретного медицинского состояния, осложнения; определение характера состояния или отличия одного состояния от другого. Это относится как к процессу попытки определить или идентифицировать возможное состояние, так и к мнению, достигнутому в ходе этого процесса. Диагноз в смысле диагностической процедуры можно рассматривать как попытку классификации состояния индивидуума на отдельные и отличные категории, которые позволяют принимать медицинские решения о лечении и прогнозе. Впоследствии диагностическое заключение часто описывается с точки зрения состояния. Используемый в настоящем документе термин «прогноз» относится к прогнозированию вероятного прогрессирования и исхода заболевания, а также к мониторингу прогрессирования заболевания.
В настоящем изобретении термин «продукт экспрессии» гена следует понимать как охватывающий продукт мРНК, полноразмерный белковый продукт или его протеолитический фрагмент, в зависимости от используемой техники обнаружения. Таким образом, когда определяется «уровень продукта экспрессии», он может относиться к уровню мРНК или к уровню кодируемого полноразмерного белка, или к уровню его протеолитического фрагмента.
Термин «эталонное значение» в контексте настоящего изобретения следует понимать как заранее определенный уровень продукта экспрессии генов в образце или группе образцов. Это значение используется в качестве порогового значения для различения субъектов, у которых присутствует анализируемое состояние, от субъектов, у которых такое состояние отсутствует. Образцы берутся у четко определенного контрольного субъекта или группы контрольных субъектов, у которых отсутствует деградированный ЕСМ и он нормально функционирует, что также означает, что у контрольных субъектов нет какого-либо состояния, которое связано с аномальной функцией и/или деградацией ЕСМ. Специалист в настоящей области техники, используя общие знания, может выбрать субъекта или группу субъектов, более подходящих для получения эталонного значения. Способы получения эталонного значения от выбранной группы субъектов хорошо известны в настоящей области техники. Согласно одному варианту осуществления настоящего изобретения эталонное значение определяется у субъекта или группы субъектов, у которых нет рака или аневризмы. Согласно конкретному варианту осуществления эталонное значение определяется у здорового субъекта или группы здоровых субъектов.
В контексте настоящего изобретения выражение «выше эталонного значения» понимается как любое увеличение уровня продукта экспрессии, например, увеличение по меньшей мере в 1,2 раза или 1,5 раза продукта экспрессии по сравнению с эталонным значением. Согласно конкретным вариантам осуществления «выше эталонного значения» понимается как по меньшей мере 2-кратное увеличение продукта экспрессии по сравнению с эталонным значением.
Согласно конкретным вариантам осуществления способа по настоящему изобретению определяется уровень продукта экспрессии по меньшей мере COL11A1 и/или COL5A2. Согласно другому конкретному варианту осуществления способ предусматривает определение уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из COL5A1, TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, причем по меньшей мере один ген определяется необязательно в комбинации с одним или обоими из COL11A1 и COL5A2, причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это указывает на деградированный ЕСМ. Согласно одному варианту осуществления определяются продукты экспрессии как COL11A1, так и COL5A2.
Согласно одному варианту осуществления обнаружение деградации ЕСМ выполняется путем определения уровня продукта экспрессии по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми или по меньшей мере девяти из раскрытых в таблице 1 генов. Согласно конкретному варианту осуществления определяется продукт экспрессии по меньшей мере COL11A1, COL5A2 и ММР2. Согласно другим конкретным вариантам осуществления определяется продукт экспрессии по меньшей мере следующих генов: COL11A1, COL5A2, ММР2 и ММР9 или по меньшей мере COL11A1, COL5A2, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, BMP1 и ITGA4, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4 и ITGB1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, BMP1, ITGA4, ITGB1 и COL5A1, или по меньшей мере COL11A1, COL5A2, ММР9, ITGA4, ITGB1, COL5A1 и TGFB1. Согласно другому конкретному варианту осуществления определяется продукт экспрессии девяти генов.
Таким образом, авторы настоящего изобретения обнаружили, что вышеуказанный набор генов может адекватно анализировать молекулярный механизм, который контролирует ремоделирование ЕСМ. Не желая быть связанными теорией, авторы настоящего изобретения предполагают, что повышенная экспрессия и синтез минорных фибриллообразующих коллагенов (коллаген V альфа-2, коллаген V альфа-1 и коллаген XI альфа-1) способствует образованию меньшего размера и диаметра гетеротипических фибрилл основных фибриллообразующих коллагенов (коллаген I и коллаген III). Минорные фибриллообразующие коллагены обладают способностью ингибировать сборку основных фибриллообразующих коллагенов за счет стерических затруднений с их большим глобулярным аминоконцевым доменом, который частично сохраняется в конечном белковом комплексе. Кроме того, высвобожденные большие глобулярные аминоконцевые домены содержат хорошо охарактеризованный гепарин-связывающий домен, который может взаимодействовать со специфическими рецепторами интегрина, которые, в свою очередь, контролируют экспрессию и активность матриксных металлопротеиназ, ответственных за деградацию компонентов ЕСМ. Этот молекулярный механизм приводит к более тонкому, дезорганизованному и деградированному ЕСМ, и, таким образом, он более восприимчив к дилатации и образованию аневризмы аорты, а также к росту и метастазированию рака.
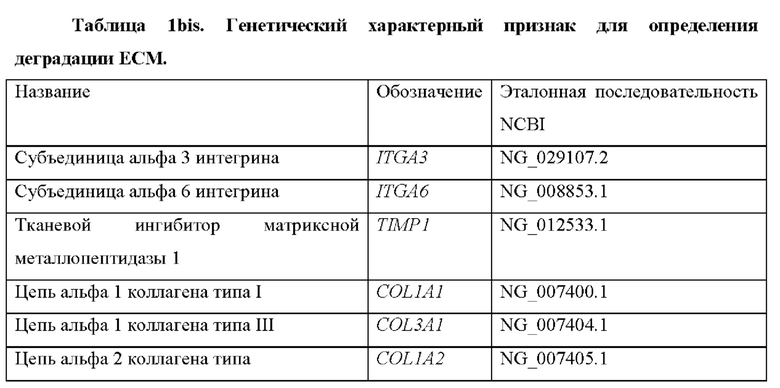
Обширные исследования, проведенные авторами настоящего изобретения, также привели к идентификации дополнительных генетических маркеров, которые могут предоставить дополнительную диагностическую информацию о деградации ЕСМ. Эти гены перечислены в таблице 1bis. Таким образом, согласно конкретному варианту осуществления настоящего изобретения обнаружение деградации ЕСМ выполняется путем дополнительного определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из генов в таблице 1bis. Согласно некоторым вариантам осуществления обнаружение деградации ЕСМ выполняется путем определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из генов в таблице 1bis, в дополнение по меньшей мере к одному гену, раскрытому в таблице 1, или любой из их комбинаций, как определено выше.
Биологический образец, выделенный от субъекта, может представлять собой любую ткань или жидкость организма, такую как кровь, плазма, слюна, моча, спинномозговая жидкость или сперма. Однако согласно одному предпочтительному варианту осуществления настоящего изобретения биологический образец представляет собой периферическую кровь. Это важно, потому что это значительно ускоряет и упрощает способ обнаружения, а также является неинвазивным. Действительно удивительно, что дифференциальная экспрессия набора генов, раскрытых в таблице 1, может быть обнаружена в периферической крови субъектов, имеющих деградированный ЕСМ.
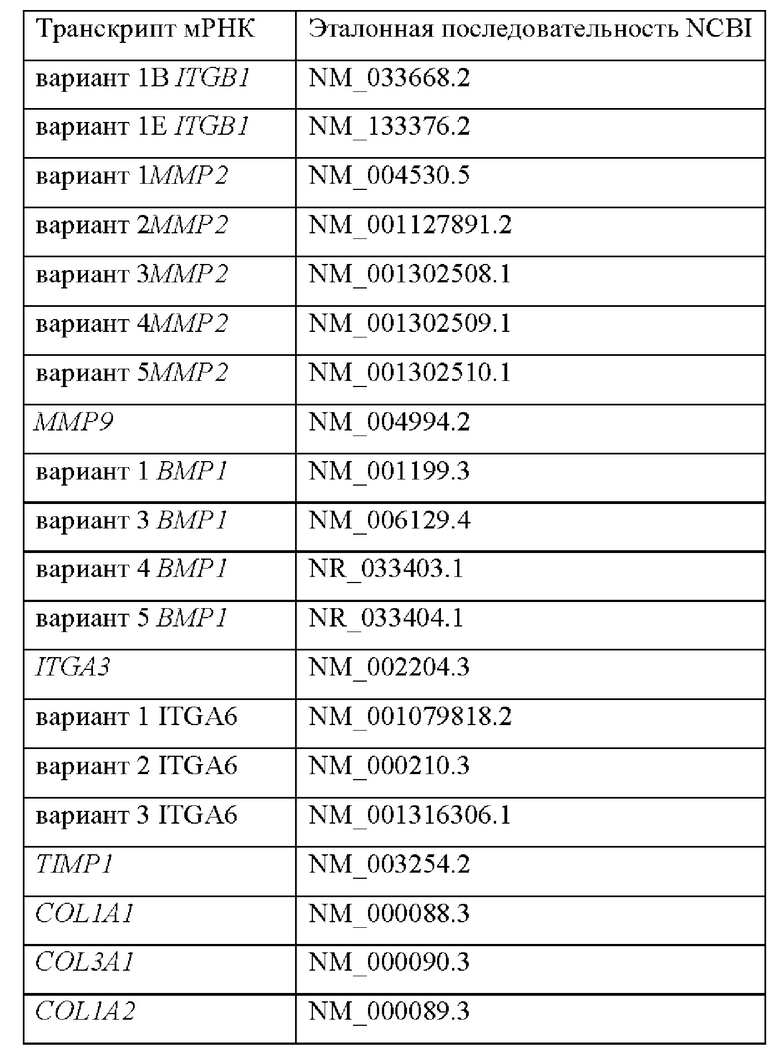
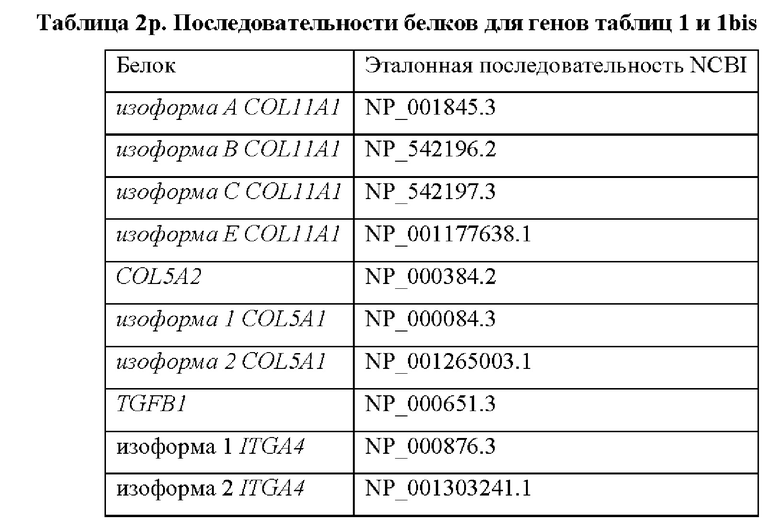
Согласно одному варианту осуществления продукт экспрессии генов, который определяется в контексте настоящего изобретения, представляет собой мРНК. Согласно предпочтительным вариантам осуществления количество мРНК исследуемого субъекта определяется количественно и сравнивается с контрольным значением, которое представляет собой количество такой же мРНК у контрольного субъекта или среднее количество мРНК в группе контрольных субъектов. Известные последовательности мРНК для генов, составляющих характерный признак по настоящему изобретению, раскрыты в таблице 2, а известные белковые последовательности тех же генов раскрыты в таблице 2р. Отмечено, что для некоторых генов возможно несколько транскриптов, например для COL11A1. Однако способ по настоящему изобретению предпочтительно определяет все возможные транскрипты генов, так что определяется вся транскрибируемая мРНК от конкретного гена.

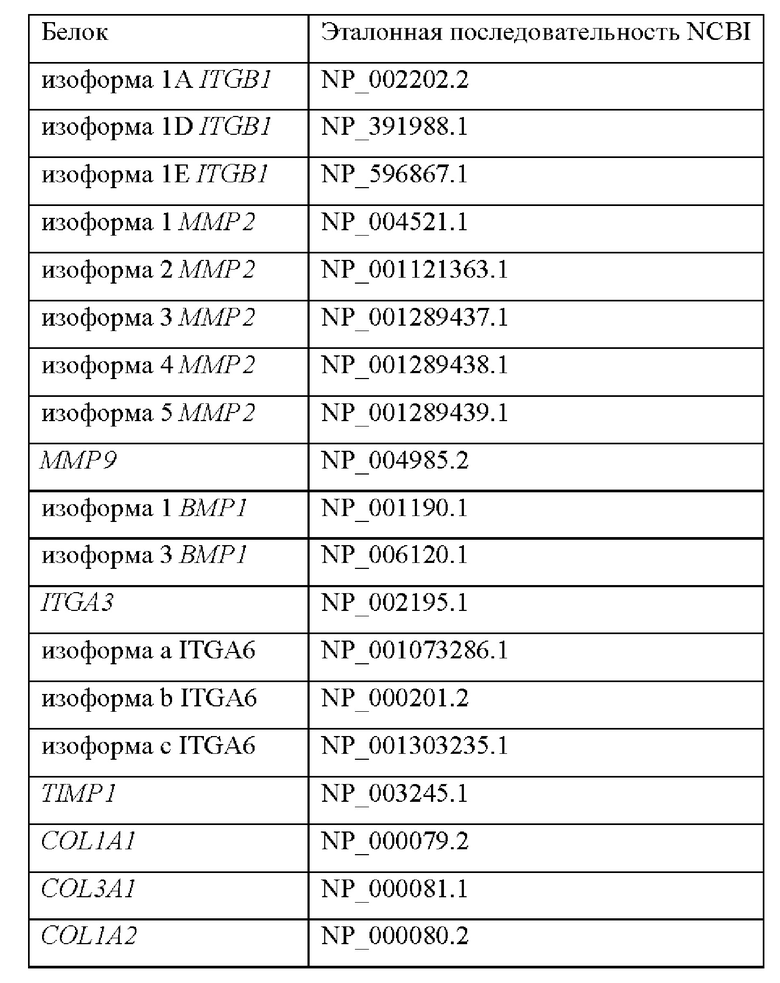
Определение количества мРНК может быть выполнено любым способом, известным специалисту в настоящей области техники, при условии, что указанный способ позволяет обнаруживать и количественно определять мРНК в биологическом образце. В число примеров этих процедур входят ПЦР, количественная ПЦР в реальном времени (QPCR), мультиплексная ПЦР, NASBA, LCR, RT-PCR, секвенирование РНК, гибридизация матрицы или Нозерн-блоттинг или их комбинации. В большинстве способов обнаружения и количественного определения РНК, упомянутых выше, перед выполнением этой процедуры необходимо преобразовать РНК в комплементарную ДНК (кДНК). Это преобразование выполняется известными специалистам в настоящей области техники способами, такими как, среди прочего, обратная транскрипция.
Согласно конкретному варианту осуществления настоящего изобретения уровень продукта экспрессии генов определяется путем количественной оценки мРНК обратной транскрипцией с последующей количественной ПЦР в реальном времени. Для этого способа, а также для многих других способов обнаружения/количественной оценки экспрессии генов требуется использование праймеров для амплификации. Согласно предпочтительному варианту осуществления настоящего изобретения последовательности праймеров происходят из последовательностей транскриптов генов, раскрытых в таблице 2. Согласно конкретным вариантам осуществления праймеры, используемые для определения уровня продукта экспрессии генов, а именно мРНК, выбирают из тех, которые показаны в таблице 3. Определение уровня мРНК вышеуказанных генов с помощью обратной транскрипции с последующей количественной ПЦР в реальном времени подробно описано в примерах ниже.
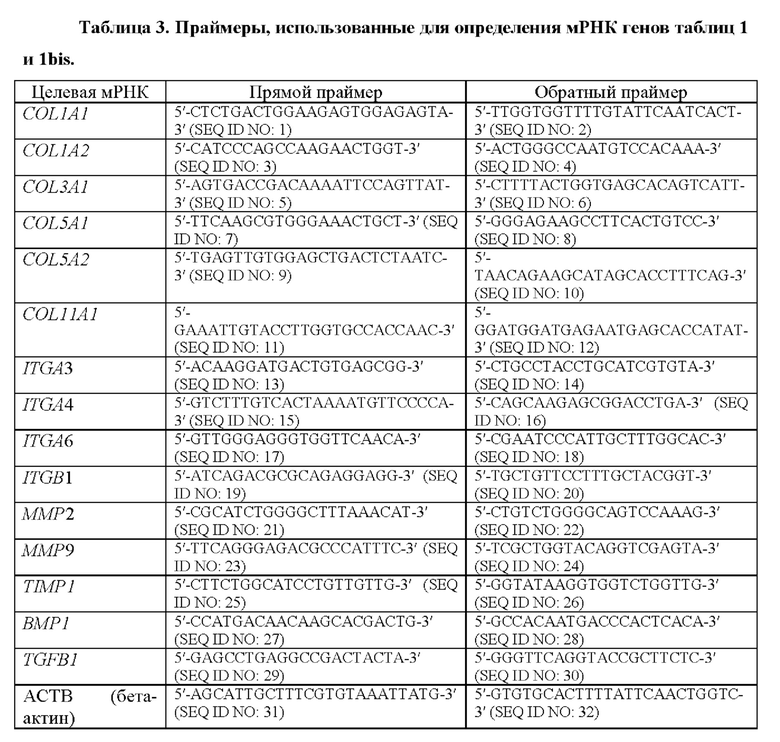
В настоящем изобретении требуется сравнение уровня экспрессии продуктов экспрессии генов с эталонным значением. Эталонное значение, как упомянуто выше, получают от контрольного субъекта или группы контрольных субъектов. Специалист может использовать любой доступный способ для проведения описанного сравнения. Например, в качестве способа относительной количественной оценки можно использовать 2-ΔΔCt Ливака и Шмиттгена {Methods, 2001 vol. 25, issue 4, p.402-8).
Согласно другому варианту осуществления используются микроматрицы, которые включают в себя один или несколько зондов, соответствующих одному или нескольким биомаркерам, указанным в таблице 2. Этот способ приводит к получению паттернов гибридизации меченых целевых нуклеиновых кислот на поверхности матрицы. Полученные в результате паттерны гибридизации меченых нуклеиновых кислот могут быть визуализированы или обнаружены различными способами, причем конкретный способ обнаружения выбирается на основе конкретной метки целевой нуклеиновой кислоты. Типичные средства обнаружения включают в себя счет сцинтилляций, авторадиографию, измерение флуоресценции, калориметрическое измерение, измерение эмиссии света, рассеяние света и т.п.
Согласно другим вариантам осуществления продукт экспрессии генов, который определяется в контексте настоящего изобретения, представляет собой кодируемый генами полноразмерный белок или фрагмент указанного белка. Согласно конкретному варианту осуществления способов, предусмотренных настоящим изобретением, содержание белковых маркеров или их фрагментов определяется с помощью количественного теста, выбранного из группы, состоящей из иммунологического теста, биолюминесценции, флуоресценции, хемилюминесценции, электрохимии и масс-спектрометрии. Согласно некоторым вариантам осуществления белки, которые необходимо определить, представлены в таблице 2р.
Согласно одному варианту осуществления содержание кодируемого белка или его фрагмента определяется масс-спектрометрией, например, масс-спектрометрией с жидкостной хроматографией способом дробовика (LC-MS/MS) или масс-спектрометрией с мониторингом множественных реакций (MRM).
Согласно альтернативному варианту осуществления уровень экспрессии определяется иммунохимией.
Используемый в настоящем документе термин «иммунохимия» относится к разнообразным способам обнаружения антигенов (в данном случае любого из белков, кодируемых указанными выше генами или их антигенными фрагментами) в образце с использованием принципа специфического связывания антител с целевым белком(ами). Визуализация взаимодействия антитело-антиген затем может быть достигнута несколькими способами, как правило, путем конъюгирования антитела с ферментом, таким как пероксидаза, который может катализировать реакцию образования цвета, или с флуорофором, таким как флуоресцеин или родамин. Способ иммунохимии может быть прямым или непрямым.
Подходящие процедуры иммуноанализа включают в себя твердофазные иммуноферментные анализы (ELISA, например, мультиплексный ELISA), иммуноферментный анализ, анализ агглютинации, сэндвич-анализ антитело-антиген-антитело, сэндвич-анализ антиген-антитело-антиген, иммунохроматография или другие хорошо известные обычному специалисту в настоящей области техники форматы иммуноанализа, например, радиоиммуноанализ, а также форматы белковых микроматриц. Согласно одному варианту осуществления содержание белка определяют иммуноанализом. Согласно другим вариантам осуществления уровень экспрессии белка определяют с помощью ELISA.
Термин «антитело или его фрагмент, способное связываться с целевым белком (белками)» следует понимать как любой иммуноглобулин или его фрагмент, способный селективно связывать целевой белок(белки), упомянутый в аспектах и вариантах осуществления настоящего изобретения. Он включает в себя моноклональные и поликлональные антитела. Термин «его фрагмент» охватывает любую часть антитела, имеющую размер и конформацию, подходящие для связывания эпитопа целевого белка. Подходящие фрагменты включают в себя F(ab), F(ab') и Fv. «Эпитоп» представляет собой часть антигена, распознаваемого иммунной системой (В-клетками, Т-клетками или антителами).
Другой аспект настоящего изобретения относится к использованию средств для определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 1, в способе обнаружения деградации ЕСМ, как определено выше. Согласно конкретному варианту осуществления средства предназначены по меньшей мере для определения уровня продукта экспрессии COL11A1 и/или COL5A2. Согласно другому конкретному варианту осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из COL5A1, TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, необязательно в комбинации с одним или обоими из COL11A1 и COL5A2. Предпочтительно средства предназначены как для COL11A1, так и для COL5A2. Согласно конкретным вариантам осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере трех генов, по меньшей мере четырех генов, по меньшей мере пяти генов, по меньшей мере шести генов, по меньшей мере семи генов, по меньшей мере восьми или по меньшей мере девяти генов, выбранных из группы генов, раскрытых в таблице 1. Согласно другим конкретным вариантам осуществления средства включают в себя средства для определения уровня продукта экспрессии по меньшей мере следующих генов: для COL11A1, COL5A2 и ММР2 или по меньшей мере для COL11A1, COL5A2, ММР2 и ММР9, или по меньшей мере для COL11A1, COL5A2, ММР2, ММР9 и BMPI, или по меньшей мере для COL11A1, COL5A2, ММР2, ММР9, ВМР1 и ITGA4, или по меньшей мере для COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4 и ITGA4 и ITGA4, или по меньшей мере для COL11A1, COL5A2, ММР2, ММР9, BMP1, ITGA4, ITGB1 и COL5A1, или по меньшей мере для COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4, ITGB1, COL5A1 и TGFB1. Согласно другим вариантам осуществления средства предназначены для определения уровня продукта экспрессии всех генов, раскрытых в таблице 1. Согласно другим вариантам осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере одного гена, раскрытого в таблице 1bis, в дополнение по меньшей мере к одному гену, описанному в таблице 1, или любые их комбинации, как определено выше.
Согласно конкретным вариантам осуществления средства предназначены для определения мРНК. Согласно одному варианту осуществления средства включают в себя праймеры для амплификации. Согласно конкретным вариантам осуществления праймеры в каждом случае представлены в таблице 3.
Согласно другим вариантам осуществления средства предназначены для определения белков или их фрагментов. Согласно конкретным вариантам осуществления средства представляют собой антитела или их фрагменты, которые специфически связываются с целевым белком(ами).
Согласно другому варианту осуществления средства составляют часть набора. Кроме того, в настоящем изобретении также предусмотрено применение наборов, содержащих средства для определения уровня продукта экспрессии, как определено выше, для выполнения любого из способов, представленных в настоящем документе. Наборы могут содержать указанные средства и инструкции по их применению при обнаружении ухудшения ЕСМ у субъекта. Инструкция может включать в себя информацию, касающуюся пороговых значений для определения ухудшения ЕСМ, степени такого ухудшения и/или эталонные значения.
Согласно другому аспекту в настоящем изобретении предусмотрено использование продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 1, для обнаружения деградации ЕСМ у субъекта. Согласно некоторым вариантам осуществления по меньшей мере COL11A1 и/или COL5A2 представляют собой выбранные биомаркеры. Согласно другим вариантам осуществления использование продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из COL5A1, TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, необязательно в комбинации с одним или обоими из COL11A1 и COL5A2, в качестве биомаркеров in vitro для обнаружения деградации ЕСМ у субъекта. Предпочтительно как COL11A1, так и COL5A2 входят в число выбранных биомаркеров.
Согласно одному варианту осуществления биомаркеры для обнаружения деградации ЕСМ у субъекта представляют собой продукты экспрессии по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми или по меньшей мере девяти генов, раскрытых в таблице 1. Согласно конкретному варианту осуществления выбраны по меньшей мере COL11A1, COL5A2 и ММР2. Согласно другим конкретным вариантам осуществления выбраны следующие гены: COL11A1, COL5A2, ММР2 и ММР9 или по меньшей мере COL11A1, COL5A2, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1 и ITGA4, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, BMP1, ITGA4 и ITGB1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4, ITGB1 и COL5A1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGB1 и TGFB1. Согласно другому конкретному варианту осуществления выбраны девять генов. Согласно другим вариантам осуществления биомаркеры для обнаружения деградации ЕСМ у субъекта представляют собой продукты экспрессии по меньшей мере одного гена, описанного в таблице 1bis, в дополнение по меньшей мере к одному гену, раскрытому в таблице 1, или любой из их комбинаций, как определено выше.
Было обнаружено, что деградация ЕСМ связана с раком и, в частности, со злокачественным развитием опухолей и метастазами. Также было обнаружено, что деградация ЕСМ тесно связана с ростом и риском разрыва аневризм. Таким образом, дополнительный вариант осуществления настоящего изобретения относится к способу обнаружения деградации ЕСМ у субъекта, как определено выше, причем деградация ЕСМ указывает на пациента, у которого имеется рак, аневризма или как рак, так и аневризма.
Рак
Как показано в примере 1, авторы настоящего изобретения неожиданно обнаружили, что некоторые из генов, перечисленных в таблице 1, значительно активированы в периферической крови больных раком по сравнению с эталонным значением, что позволяет быстро и легко диагностировать рак. Авторы настоящего изобретения показали, что можно различать пациентов с немелкоклеточным раком легкого и контрольную группу (субъекты без каких-либо злокачественных новообразований) с чувствительностью 0,98 (95% доверительный интервал: 0,89-1,00, Р<0,001) и специфичностью 1,00 (95% доверительный интервал: 0,61-1,00, Р<0,001). Эти результаты показывают, что способ по настоящему изобретению может точно диагностировать рак периферической крови с высокой специфичностью и чувствительностью.
Опознание по характерным признакам для диагностики рака включает в себя гены, которые показаны в таблицах 4 и 4bis.
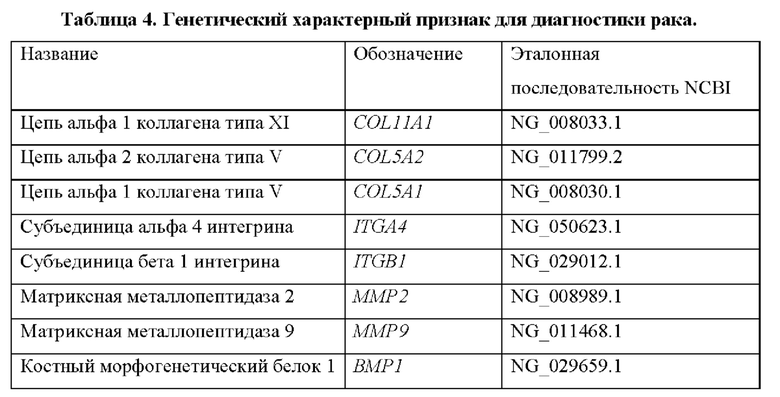
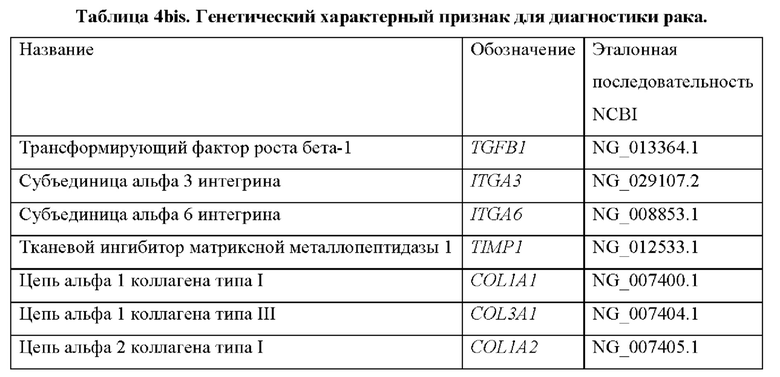
Следовательно, другой аспект настоящего изобретения относится к способу диагностики рака у субъекта in vitro, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы генов, перечисленных в таблице 4, причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это указывает на то, что у субъекта имеется рак.
«Эталонное значение» и «выше эталонного значения» понимаются так, как объяснено выше. Согласно предпочтительному варианту осуществления аспектов настоящего изобретения, относящихся к раку, эталонное значение получают от субъекта или группы субъектов, у которых нет злокачественных опухолей. Согласно некоторым предпочтительным вариантам осуществления аспектов настоящего изобретения, относящихся к раку, «выше эталонного значения» понимается как следующее кратное увеличение уровня экспрессии (сверхэкспрессии) каждого из продуктов экспрессии гена по отношению к эталонному значению: по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 2-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 2-кратная сверхэкспрессия относительно эталонного значения для COL5A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 7-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 2-кратная сверхэкспрессия относительно эталонного значения для BMP1, по меньшей мере однократная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 2-кратная сверхэкспрессия относительно эталонного значения для ITGB1.
Авторы настоящего изобретения также обнаружили, что существует прямая корреляция между уровнями мРНК в периферической крови генов, раскрытых в таблице 4, и стадией рака.
У большинства типов рака есть 4 стадии, пронумерованные от I до IV. Стадия I, как правило, означает, что рак относительно невелик по размеру и содержится в органе, в котором он начался. Стадия II, как правило, означает, что опухоль больше, чем на стадии I, но рак еще не начал распространяться на окружающие ткани. Иногда стадия II означает, что раковые клетки распространились в лимфатические узлы, расположенные рядом с опухолью. Это зависит от конкретного типа рака. Стадия III, как правило, означает, что рак крупнее и, возможно, начал распространяться на окружающие ткани, а в лимфатических узлах в этой области есть раковые клетки. Стадия IV означает, что рак распространился от того места, где он возник, на другую отдаленную ткань или орган.
Корреляция между сверхэкспрессией генов в таблице 4 и стадией рака показана в примере 1. Хотя все гены из таблицы 4 сверхэкспрессированы, измеренные как уровень мРНК по сравнению с эталонной группой, можно наблюдать, что сверхэкспрессия генов ниже, хотя и статистически значимо, у пациентов с немелкоклеточным раком легкого на стадии I и неуклонно растет на стадиях II, III и IV. Авторы настоящего изобретения продемонстрировали, что пациенты с метастатическим немелкоклеточным раком легкого на поздней стадии (стадии III и IV) могут быть дифференцированы от пациентов с немелкоклеточным раком легкого на ранней стадии (стадии I и II) с чувствительностью 0,95 (95% доверительные интервалы: 0,78-0,99, Р<0,001) и специфичность 0,96 (95% доверительные интервалы: 0,80-0,99, Р<0,001).
Таким образом, настоящее изобретение также относится к способу in vitro дифференциальной диагностики пациентов в соответствии со стадией их рака, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы генов, перечисленных в таблице 4. Повышение уровней продукта(ов) экспрессии коррелирует с увеличением стадии рака. Пациентов с раком III или IV стадии часто называют пациентами с распространенным раком. В частности, когда продукты) экспрессии характеризуется следующим уровнем(ями):
по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A1, по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 11-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ВМР1, по меньшей мере 6-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ITGB1, это свидетельствует о том, что у субъекта имеется метастатический рак на стадии III или IV (распространенный рак).
Способ по настоящему изобретению также предназначен для дифференциальной диагностики in vitro пациентов с распространенным раком (стадии III и IV) и пациентов с раком на ранних стадиях (стадии I и II), причем, когда продукты) экспрессии характеризуется уровнем(ями), как определено выше, это указывает на то, что у пациента распространенная стадия рака, в то время как, когда продукты) экспрессии характеризуется уровнем(ями) ниже пороговых значений, определенных выше, это указывает на то, что у пациента ранняя стадия рака.
Стадии III и IV рака также часто рассматриваются как предполагающие высокий риск метастазирования. «Метастаз» в контексте настоящего изобретения, как правило, понимается в настоящей области техники как процесс, посредством которого раковые клетки распространяются в новые области организма, отличные от первичного очага рака (часто через лимфатическую систему или кровоток). Опухоли, образованные из распространившихся клеток, называются вторичными опухолями. Рак мог распространиться на участки рядом с первичным очагом (регионарный метастаз) или на части организма, находящиеся дальше (отдаленные метастазы). Способ по настоящему изобретению обеспечивает надежный тест для идентификации больных раком с высоким риском развития метастазов или на ранних стадиях метастатического процесса. Это большое преимущество для клинического ведения онкологических больных, которые могут получать наиболее подходящую терапию в зависимости от их прогрессирования и подвергаться строгому графику последующего наблюдения, если это необходимо, когда риск метастазирования высок.
Таким образом, в настоящем изобретении также предусмотрен способ определения риска метастазирования рака у субъекта, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы генов, перечисленных в таблице 4. Высокие уровни продукта(ов) экспрессии указывают на высокий риск метастазирования. В частности, когда продукт(ы) экспрессии характеризуется следующим уровнем(ями):
по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A1, по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 11-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ВМР1, по меньшей мере 6-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ITGB1, это указывает на то, что у субъекта высокий риск метастазирования рака.
В соответствии со всем вышеизложенным, категоризация больных раком в соответствии с их стадией рака, таким образом, возможна с использованием способа по настоящему изобретению. Следовательно, другой аспект настоящего изобретения относится к способу in vitro классификации больных раком в соответствии с их стадией рака, указанный способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, перечисленных в таблице 4, и корреляцию указанного уровня продукта экспрессии со стадией рака.
Настоящий способ может также предоставить раннюю информацию о риске рецидивов у пациентов, которые подвергались лечению от рака и преодолели заболевание. «Рецидив» представляет собой, как обычно понимается в настоящей области техники, ухудшение состояния здоровья после временного улучшения. Это очень важно с клинической точки зрения, поскольку раннее выявление и последующее лечение рецидива у онкологических больных может значительно улучшить прогноз пациента, перенесшего рецидив.
Таким образом, другой аспект настоящего изобретения относится к способу in vitro обнаружения рецидива у субъекта, который подвергался лечению рака, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов из таблицы 4, причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это указывает на то, что пациент находится в группе высокого риска рецидива.
Еще один аспект настоящего изобретения относится к способу прогнозирования рака пациента in vitro, причем способ предусматривает определение уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, перечисленных в таблице 4. Высокий уровень экспрессии продукта(ов) указывает на плохой прогноз. В частности, когда продукт(ы) экспрессии характеризуется следующим уровнем(ями):
по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A1, по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 11-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ВМР1, по меньшей мере 6-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ITGB1, это указывает на плохой прогноз.
Настоящий способ не ограничен конкретным типом рака. Общие механизмы прогрессирования и распространения рака, вызывающие метастазирование, в связи с деградацией внеклеточного матрикса в некоторой степени являются общими для почти всех типов рака. Изменения уровней экспрессии генов, происходящие на тканевом уровне, были четко обнаружены в периферической крови с чувствительностью 98% и специфичностью 100% при сравнении контроля с пациентами с немелкоклеточным раком легкого и с чувствительностью 95% и специфичностью 96% при сравнении пациентов с раком легкого на ранних стадиях (стадии I и II) с пациентами на поздних метастатических стадиях (стадии III и IV). Подобные паттерны экспрессии в тканях авторы настоящего изобретения подтвердили у пациентов-женщин с диагнозом рака молочной железы. Следовательно, поскольку эти обнаруженные изменения на самом деле отражают изменения в ЕСМ, они могут быть использованы для различения пациентов с другими типами рака, в частности тех, которые характеризуются способностью метастазировать посредством деградации ЕСМ.
Согласно конкретным вариантам осуществления рак представляет собой немелкоклеточный рак легкого, рак молочной железы, рак толстой кишки, рак прямой кишки, рак тонкой кишки, рак предстательной железы, мелкоклеточный рак легкого, мезотелиому, рак почки, рак поджелудочной железы, рак желудка, рак пищевода, рак гортани, рак ротоглотки, рак печени, рак желчных протоков, рак желчного пузыря, рак мочевого пузыря, рак щитовидной железы, рак эндометрия, рак яичников, рак влагалища, рак уретры, рак яичек, рак костей, рак головного мозга, рак кожи, меланому, саркому, ангиосаркому, липосаркому и т.д. Согласно конкретным вариантам осуществления рак представляет собой немелкоклеточный рак легкого или рак молочной железы, например, немелкоклеточный рак легкого.
Предоставляя надежную и раннюю диагностику рака, включая в себя категоризацию пациентов в отношении прогрессирования их заболевания и метастазов, настоящий способ диагностики применим для клинициста в том смысле, что этот способ позволяет ему/ей выбрать наиболее подходящие решения о лечении пациента. Поскольку схемы противоракового лечения могут сильно зависеть от стадии рака и, в частности, от наличия метастазов или высокого риска метастазов, врач может, принимая во внимание дифференциальную диагностику, выполняемую, как описано выше, порекомендовать наиболее подходящую (консервативную или агрессивную) противораковую терапию.
Таким образом, согласно другому аспекту настоящее изобретение направлено на способ in vitro рекомендации противораковой терапии для субъекта, способ, предусматривающий: (а) диагностику, имеется ли у субъекта рак, или определение плохого прогноза для субъекта, у которого имеется рак, способами, как определено выше, и (b) рекомендации противораковой терапии, если у субъекта диагностирован рак или плохой прогноз рака. Этот аспект также может рассматриваться как способ лечения онкологического пациента, предусматривающий (а) диагностику, имеется ли у субъекта рак, или определение плохого прогноза у субъекта, у которого имеется рак, способами, как определено выше, и (b) введение противораковой терапии пациенту, если у субъекта диагностирован рак или плохой прогноз рака. Если у пациента не диагностирован рак, врач может порекомендовать наблюдение за субъектом.
Согласно некоторым вариантам осуществления способ предназначен для рекомендации способа лечения метастатического рака у субъекта, когда диагноз указывает, что у субъекта имеется метастатический рак.
Противораковая терапия включает в себя хирургическое вмешательство, химиотерапию, лучевую терапию, иммунотерапию, таргетную терапию и гормональную терапию. Большинству онкологических больных назначают комбинацию видов лечения в зависимости от типа рака и степени его распространенности на момент постановки диагноза. Предпочтительно противораковое лечение выбирают из вышеупомянутых вариантов на основе типа и стадии рака, результатов клинических испытаний, а также гистопатологических данных. Терапевтические схемы лечения метастатического рака зависят от типа первичного рака, места распространения, применяемого в прошлом лечения и общего состояния здоровья пациента. В большинстве случаев терапевтические схемы для лечения метастатического рака включают в себя комбинацию по меньшей мере двух способов лечения, выбранных из хирургического вмешательства, химиотерапии, лучевой терапии, иммунотерапии, таргетной терапии и гормональной терапии в их наиболее агрессивных формах. Хотя некоторые типы метастатического рака можно вылечить с помощью современных способов лечения, большинство из них - нет. В большинстве случаев метастатического рака целью этих способов лечения является остановка или замедление роста рака или облегчение симптомов (паллиативная терапия), тогда как в некоторых случаях лечение метастатического рака может помочь продлить жизнь. Также важно отметить, что терапевтические вмешательства при метастатическом раке в большинстве случаев включают в себя химиотерапию и/или лучевую терапию со значительными побочными эффектами, которые не могут переноситься значительным числом пациентов до завершения терапевтических циклов, подчеркивая, таким образом, необходимость в ранней диагностике даже в случае метастазирования.
Кроме того, в соответствии с настоящим изобретением за онкологическими больными, которые получали специфическое лечение, можно наблюдать, чтобы гарантировать эффективность терапевтического вмешательства или предупредить о начале рецидива или возникновения метастатического заболевания. Настоящий способ обеспечивает удобное последующее наблюдение и улучшенное ведение онкологических больных, что позволяет избежать ненужных страданий и/или минимизировать побочные эффекты. Успешное терапевтическое вмешательство, например, приведет к уровням экспрессии этих генов, близким к контрольным, и этот эффект должен поддерживаться до тех пор, пока не будет рецидива или метастатического заболевания.
Таким образом, согласно одному дополнительному аспекту настоящего изобретения предложен способ in vitro для определения ответа онкологического больного на противораковую терапию, причем способ предусматривает определение в выделенном образце от пациента уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов из таблицы 4, и сравнение указанного уровня продукта экспрессии с уровнем продукта экспрессии того же гена(ов), определенным для того же пациента перед началом лечения или на более ранней фазе лечения, причем уменьшение продукта экспрессии гена(ов) по сравнению с началом лечения или более ранней фазой лечения указывает на хороший ответ.
Другой аспект может быть определен как способ in vitro для рекомендации альтернативного и/или дополнительного способа лечения онкологического больного, способ предусматривает определение в выделенном образце от пациента уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, указанных в таблице 4, и сравнение указанного уровня продукта экспрессии с уровнем продукта экспрессии того же гена(ов), определенного для того же пациента до начала способа лечения или на более ранней фазе способа лечения, причем, когда продукт экспрессии гена(ов) увеличивается по сравнению с началом способа лечения или более ранней фазой способа лечения, это указывает на рекомендацию альтернативного и/или дополнительного способа лечения. Это также можно сформулировать как способ лечения онкологического больного, который не отвечает на противораковую терапию, причем способ предусматривает определение в выделенном образце от пациента уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, указанных в таблице 4, и сравнение указанного уровня продукта экспрессии с уровнем продукта экспрессии того же гена(ов), определенным для того же пациента до начала способа лечения или на более ранней фазе способа лечения, и введение альтернативного и/или дополнительного способа лечения, когда продукт экспрессии гена(ов) увеличивается по сравнению с началом способа лечения или более ранней фазой способа лечения. Иногда клиницист может даже порекомендовать или назначить альтернативный и/или дополнительный способ лечения, если продукт экспрессии гена(ов) не изменился относительно начала способа лечения или более ранней фазы способа лечения.
Во всех вышеуказанных способах, относящихся к раку, предпочтительно определяется уровень продукта экспрессии по меньшей мере COL11A1 и/или COL5A2. Согласно конкретным вариантам осуществления способы предусматривают определение уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из COL5A1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, причем по меньшей мере один ген определяется необязательно в комбинации с одним или как COL11A1, так и COL5A2, причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это указывает на то, что у субъекта имеется рак. Предпочтительно определяются продукты экспрессии как COL11A1, так и COL5A2. Согласно другим вариантам осуществления способы предусматривают определение уровня продукта экспрессии по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми генов, раскрытых в таблице 4. Согласно конкретному варианту осуществления определяется продукт экспрессии по меньшей мере COL11A1, COL5A2 и COL5A1. Согласно другим конкретным вариантам осуществления определяется продукт экспрессии по меньшей мере следующих генов: COL11A1, COL5A2, COL5A1 и ММР2, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2 и ММР9, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9, ВМР1 и ITGA4, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9, ВМР1, ITGA4 и ITGB1. Согласно другому конкретному варианту осуществления определяется продукт экспрессии восьми генов. Согласно другим вариантам осуществления настоящего изобретения дополнительно определяется уровень продукта экспрессии по меньшей мере одного гена, выбранного из генов в таблице 4bis. Согласно некоторым вариантам осуществления вышеуказанные способы, относящиеся к раку, предусматривают определение уровня продукта экспрессии по меньшей мере одного гена, выбранного из генов в таблице 4bis, в дополнение по меньшей мере к одному гену, раскрытому в таблице 4, или любой из их комбинаций, как определено выше.
Биологический образец, полученный от пациента, может представлять собой, как уже описано выше, любую ткань или физиологическую жидкость, такую как кровь, плазма, слюна, моча, спинномозговая жидкость или сперма, предпочтительно периферическая кровь. Диагностический тест, основанный на образцах периферической крови, довольно прост, менее инвазивен и экономичен для широкого применения среди населения в целом. В частности, пожилые пациенты с ограниченным доступом к центрам третичной диагностики смогут проводить диагностику и наблюдение с помощью простых и экономичных анализов крови. В клинических условиях хорошо зарекомендовал себя мониторинг онкологических больных после терапевтического вмешательства с помощью компьютерной томографии каждые шесть месяцев в течение первых двух лет, а затем ежегодно. Точно так же диагностический анализ крови согласно настоящему изобретению имеет многообещающий потенциал для надежного мониторинга онкологических больных после терапевтических вмешательств. Поскольку анализ крови является относительно более простым, удобным и экономичным, без побочных эффектов излучения, которые несут серийные компьютерные томографии, можно использовать более часто. Диагностический тест по настоящему изобретению можно использовать каждые три месяца для выявления более ранних рецидивов злокачественных новообразований, а также перед сканированием пациентов с помощью компьютерных томографий таким образом, чтобы, если они показывают низкие или нормальные уровни экспрессии генов, которые связаны со злокачественными новообразованиями и метастазами, они могли повлиять на перенос компьютерной томографии на будущий момент времени, когда его вклад в потенциальный диагноз рецидива может быть адекватно оправдан.
Уровень продукта экспрессии генов определяется, как описано выше. Согласно некоторым вариантам осуществления продукт экспрессии представляет собой мРНК и предпочтительно определяется обратной транскрипцией с последующей количественной ПЦР в реальном времени. Праймеры для амплификации получены из последовательностей мРНК транскриптов генов, раскрытых в таблицах 4 и 4bis (как показано в таблице 2), а соответствующие праймеры для амплификации последовательностей транскриптов представлены в таблице 3. Согласно другим вариантам осуществления продукт экспрессии представляет собой кодируемый белок(белки) и определяется масс-спектрометрией или иммунохимией, как описано выше.
Другой аспект настоящего изобретения относится к применению средств для определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 4, в способах, связанных с раком, как определено выше. Согласно конкретному варианту осуществления средства предназначены по меньшей мере для определения уровня продукта экспрессии COL11A1 и/или COL5A2. Согласно другому конкретному варианту осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из COL5A1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, необязательно в комбинации с одним или обоими из COL11A1 и COL5A2. Предпочтительно средства предназначены для определения продуктов экспрессии как COL11A1, так и COL5A2. Согласно конкретным вариантам осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере трех генов, по меньшей мере четырех генов, по меньшей мере пяти генов, по меньшей мере шести генов, по меньшей мере семи генов или по меньшей мере восьми генов, выбранных из группы генов, раскрытых в таблице 4. Согласно другим конкретным вариантам осуществления средства включают в себя средства для определения уровня продукта экспрессии по меньшей мере следующих генов: COL11A1, COL5A2 и COL5A1 или по меньшей мере COL11A1, COL5A2, COL5A1 и ММР2, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2 и ММР9, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9, BMP1 и ITGA4, или по меньшей мере COL11A1, COL5A1, COL5A1, ММР2, ММР9, ВМР1, ITGA4 и ITGB1. Согласно другим вариантам осуществления средства предназначены для определения уровня продукта экспрессии всех генов, раскрытых в таблице 4. Согласно другим вариантам осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере одного гена, раскрытого в таблице 4bis в дополнение по меньшей мере к одному гену, описанному в таблице 4, или любых их комбинаций, как определено выше.
Согласно конкретным вариантам осуществления средства предназначены для определения мРНК. Согласно одному варианту осуществления средства включают в себя праймеры для амплификации. Согласно конкретным вариантам осуществления праймеры в каждом случае представляют собой праймеры, показанные в таблице 3. Согласно другим вариантам осуществления средства предназначены для определения белков или их фрагментов. Согласно конкретным вариантам осуществления средства представляют собой антитела или их фрагменты, которые специфически связываются с целевым белком(ами).
Согласно другому варианту осуществления средства составляют часть набора. Наборы по настоящему изобретению могут содержать указанные средства для определения уровня продукта экспрессии и инструкции по применению для диагностики/прогноза рака/риска метастазирования/категоризации в соответствии со стадией, как определено выше. Инструкции могут включать в себя информацию, касающуюся пороговых значений для определения диагноза/прогноза рака/риска метастазирования/категоризации в соответствии со стадией, как определено выше, и/или эталонные значения.
Согласно другому аспекту в настоящем изобретении также предусмотрено применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, перечисленных в таблице 4, в качестве биомаркера(ов) для диагностики рака у субъекта in vitro. Настоящее изобретение также относится к применению указанных биомаркеров для дифференциальной диагностики in vitro онкологических больных в соответствии со стадией рака. Некоторые варианты осуществления относятся к применению указанных биомаркеров для дифференциальной диагностики онкологических больных, характеризующихся наличием рака на стадии III или IV. Другие варианты осуществления относятся к применению указанных биомаркеров для дифференциальной диагностики пациентов с распространенным раком (стадии III и IV) и пациентов с раком на ранних стадиях (стадии I и II). Конкретные варианты осуществления относятся к применению указанных биомаркеров для диагностики высокого риска метастазирования рака у субъекта. Другой аспект предусматривает применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 4, в качестве биомаркера(ов) для диагностики рецидива у пациентов, которые уже подвергались лечебному вмешательству в отношении рака.
Другой аспект настоящего изобретения предусматривает применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, перечисленных в таблице 4, в качестве биомаркера(ов) для прогноза рака у субъекта in vitro. Другой аспект предусматривает применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 4, в качестве биомаркера(ов) для рекомендации противораковой терапии субъекту, у которого имеется рак. Согласно одному варианту осуществления применение предназначено для рекомендации способа лечения метастатического рака субъекту, характеризующемуся высоким риском метастазирования.
Еще один аспект предусматривает применение продукта экспрессии гена, выбранного из группы, состоящей из генов, перечисленных в таблице 4, в качестве биомаркера(ов) для определения ответа онкологического пациента на специфическую противораковую терапию.
Согласно некоторым вариантам осуществления вышеуказанных аспектов по меньшей мере COL11A1 и/или COL5A2 представляют собой выбранные биомаркеры. Другой вариант осуществления предусматривает применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из COL5A1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, необязательно в комбинации с одним или обоими из COL11A1 и COL5A2, в качестве биомаркеров in vitro. Предпочтительно как COL11A1, так и COL5A2 входят в число выбранных биомаркеров. Согласно другим вариантам осуществления выбранные биомаркеры представляют собой продукты экспрессии по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми генов, раскрытых в таблице 4. Согласно конкретному варианту осуществления выбирается продукт экспрессии по меньшей мере из COL11A1, COL5A2 и COL5A1. Согласно другим конкретным вариантам осуществления выбирается продукт экспрессии по меньшей мере следующих генов: по меньшей мере COL11A1, COL5A2, COL5A1 и ММР2, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2 и ММР9, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9 и BMP1, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9, ВМР1 и ITGA4, или по меньшей мере COL11A1, COL5A2, COL5A1, ММР2, ММР9, ВМР1, ITGA4 и ITGB1. Согласно другому конкретному варианту осуществления выбирается продукт экспрессии восьми генов. Согласно другим вариантам осуществления биомаркеры представляют собой продукты экспрессии по меньшей мере одного гена, описанного в таблице 4bis, в дополнение по меньшей мере к одному гену, раскрытому в таблице 4, или любой из их комбинаций, как определено выше.
Аневризма
Также было обнаружено, что уровень экспрессии некоторых генов, раскрытых в таблице 1, тесно связан с аневризмами. Генетический отличительный признак для диагностики аневризм включает в себя гены, которые показаны в таблицах 5 и 5bis.
Как показано в примере 2, авторы настоящего изобретения неожиданно обнаружили, что некоторые из этих генов значительно активируются в периферической крови пациентов с аневризмой грудного отдела аорты, по сравнению с контрольным значением, что позволяет быстро и легко диагностировать это состояние. Авторы настоящего изобретения также показали, что можно различать пациентов с аневризмой грудного отдела аорты и лиц из контрольной группы (субъектов без аневризмы грудного отдела аорты или рака) с чувствительностью 0,95 (95% доверительный интервал: 0,89-1,00, Р<0,001) и специфичностью 0,92 (95% доверительный интервал: 0,78-1,00, Р<0,001). Эти результаты показывают, что способ по настоящему изобретению может точно диагностировать аневризмы по образцу периферической крови.
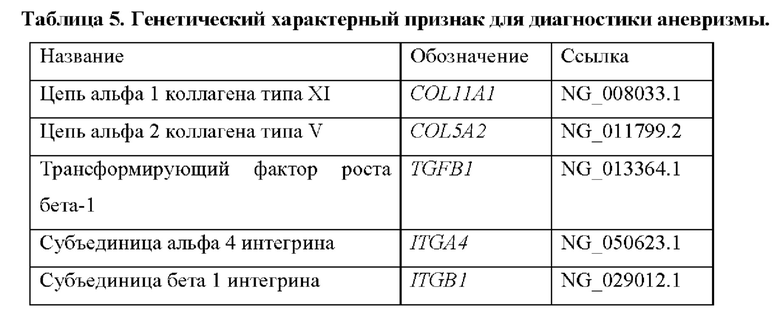
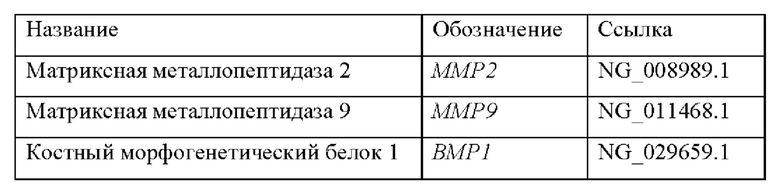
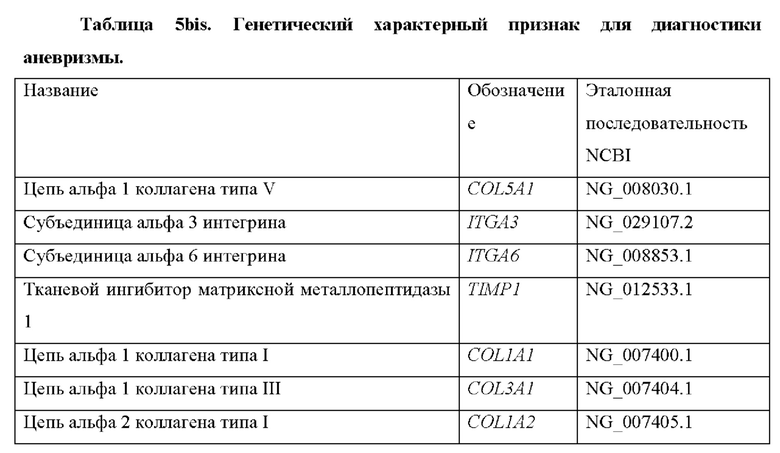
Следовательно, другой аспект настоящего изобретения относится к способу диагностики аневризмы у субъекта in vitro, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов, раскрытых в таблице 5, причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это указывает на то, что у субъекта имеется аневризма.
«Эталонное значение» и «выше эталонного значения» понимаются так, как объяснено выше. Согласно предпочтительному варианту осуществления аспектов настоящего изобретения, относящихся к аневризме, эталонное значение получают от субъекта или группы субъектов, у которых нет аневризм. Согласно некоторым предпочтительным вариантам осуществления аспектов настоящего изобретения, относящихся к аневризме, «выше эталонного значения» понимается как следующее кратное увеличение уровня экспрессии (сверхэкспрессия) каждого из продуктов экспрессии гена по отношению к эталонному значению:
по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 1,5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 3-кратная сверхэкспрессия относительно эталонного значения для TGFB1, по меньшей мере 3-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 2,5-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ВМР1, по меньшей мере 1,5-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 3-кратная сверхэкспрессия относительно эталонного значения для ITGB1.
Более того, как показывают результаты примера 2, изобретатели обнаружили, что существует прямая корреляция между уровнями мРНК в периферической крови генов, показанных в таблице 5, и размером аневризмы грудного отдела аорты.
Аневризмы, как правило, делятся по размеру и симптоматике. Аневризма любого кровеносного сосуда в организме определяется в целом как увеличенный наружный диаметр кровеносного сосуда более чем на 50% от нормального диаметра здорового человека, исходя из нормальных значений пола и возраста. Нормальный диаметр грудного отдела аорты взрослого составляет от 2 до 3 см. Грудной отдел аорты диаметром 4,5 см (увеличение на 50% по сравнению с 3 см) считается аневризмой аорты. Было подсчитано, что риск разрыва или расслоения аневризмы грудного отдела аорты значительно выше, когда диаметр аорты превышает 5 см, а риск разрыва становится еще выше при больших диаметрах. Аневризму грудного отдела аорты диаметром от 5 до 6 см следует рассматривать для вмешательства с клинической точки зрения. При больших аневризмах грудного отдела аорты (6-7 см в диаметре) или даже при очень больших аневризмах грудного отдела аорты (диаметр >7 см) необходимость вмешательства считается неотложной и срочной, соответственно.
Корреляция между сверхэкспрессией генов в таблице 5 и размером аневризмы аорты показана в примере 2. Можно заметить, что сверхэкспрессия генов, измеренная как уровень экспрессии мРНК, ниже, хотя и статистически значима, у пациентов с меньшим размером аневризмы аорты (т.е. диаметр аорты 5-6 см против диаметра аорты 6-7 см против диаметра аорты >7 см). Напротив, сверхэкспрессия генов значительно повышена у пациентов с очень большими аневризмами аорты (наружный диаметр аорты более 7 см). Авторы настоящего изобретения продемонстрировали, что с помощью способа по настоящему изобретению пациенты с относительно большими аневризмами аорты (диаметр аорты равный или больше 6 см) могут быть дифференцированы от пациентов с аневризмами аорты относительно небольшого размера (диаметр аорты от 4,5 до 6 см) с чувствительностью 0,95 (95% доверительный интервал: 0,86-1,00, Р<0,001) и специфичностью 0,86 (95% доверительный интервал: 0,71-1,00, Р<0,001).
Согласно одному варианту осуществления способ по настоящему изобретению предназначен для дифференциальной диагностики пациентов в соответствии с размером аневризмы, способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы генов, перечисленных в таблице 5. Повышение уровней продукта(ов) экспрессии коррелирует с увеличением размера аневризмы. Согласно другим вариантам осуществления способ предназначен для дифференциальной диагностики пациентов с аневризмой большого размера. Согласно другим вариантам осуществления способ предназначен для дифференциальной диагностики пациентов с аневризмой большого размера и пациентов с аневризмой небольшого размера. В частности, когда продукт(ы) экспрессии характеризуется следующим уровнем(ями):
по меньшей мере 15-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для TGFB1, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 12-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для BMP 1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ITGB1, это свидетельствует о наличии у пациента большой аневризмы, например, большой аневризмы аорты (равной или больше 6 см в диаметре). Когда уровень продукта(ов) экспрессии выше эталонного значения, но ниже этих пороговых значений, это свидетельствует о том, что аневризма пациента представляет собой аневризму относительно небольшого размера, в частности, для аневризм аорты, менее чем 6 см в диаметре.
Аневризмы, в особенности аневризмы большого диаметра, считаются подверженными риску разрыва. Разрыв сосуда, такого как аорта, приводит к массивному внутреннему кровотечению и, если не лечить немедленно, может произойти шок и смерть. Во избежание разрыва рекомендуется хирургическое вмешательство, если размер аневризмы достигает определенного диаметра (т.е. более чем 5 см в диаметре в восходящей грудной аорте или более 6 см в нисходящей грудной аорте) и/или она быстро растет (более 0,5 см в год). На сегодняшний день наиболее экономичным скрининговым тестом для определения наличия у пациента аневризмы с риском разрыва является компьютерная томография. Способ по настоящему изобретению представляет собой надежный, удобный и более экономичный тест для выявления пациентов с риском разрыва. Соответствующее медицинское вмешательство, такое как хирургическое вмешательство, может быть рекомендовано клиницистом с учетом характера экспрессии генов из таблицы 5 после простого забора крови. Кроме того, при необходимости пациент может быть подвергнут строгому наблюдению. Таким образом, настоящее изобретение также относится к способу in vitro диагностики риска разрыва аневризмы у субъекта, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов из таблицы 5. Высокий уровень продукта(ов) экспрессии указывает на риск разрыва. В частности, когда продукт(ы) экспрессии характеризуется следующим уровнем(ями):
по меньшей мере 15-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для TGFB1, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для ММР2, по меньшей мере 12-кратная сверхэкспрессия относительно эталонного значения для ММР9, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для BMP 1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ITGB1, это указывает на высокий риск разрыва аневризмы.
Сверхэкспрессия генов таблицы 5 прямо пропорциональна размеру аневризмы. Следовательно, классификация пациентов с аневризмой в соответствии с размером аневризмы или в соответствии с высоким или низким риском разрыва возможна при применении способа по настоящему изобретению. Следовательно, другой аспект настоящего изобретения относится к способу in vitro классификации пациентов с аневризмой в соответствии с размером аневризмы, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов из таблицы 5, и корреляцию указанного уровня(ей) с размером аневризмы и риском разрыва. Соответствующие пороговые значения для такой категоризации определены выше.
Один дополнительный аспект настоящего изобретения относится к способу прогноза аневризмы у пациента in vitro, причем способ предусматривает определение в выделенном образце от пациента уровня продукта экспрессии по меньшей мере одного гена, выбранного из генов таблицы 5, причем уровень продукта экспрессии напрямую коррелирует с плохим прогнозом. Таким образом, высокий уровень продуктов экспрессии указывает на плохой прогноз. В частности, когда продукты) экспрессии характеризуется(ются) уровнем(ями), определенным(и) выше для риска разрыва, это указывает на плохой прогноз.
Настоящий способ не ограничен конкретным типом аневризмы. Общие механизмы прогрессирования аневризмы по отношению к деградации ЕСМ являются общими для всех аневризм. Согласно конкретным вариантам осуществления аневризма выбрана из аневризмы аорты, которая может быть либо грудного отдела (аневризма восходящей грудной аорты или дуги, либо нисходящей грудной аорты), либо аневризмы брюшного отдела или грудно-брюшного отдела аорты. Другими сосудами, у которых наблюдается аневризматическое заболевание с плохим прогнозом на поздних стадиях, являются церебральные артериальные сосуды, подвздошные и подключичные артерии. Согласно предпочтительному варианту осуществления аневризма представляет собой аневризму грудного отдела аорты.
Предоставляя надежную и раннюю диагностику аневризмы, включая в себя категоризацию пациентов в отношении прогрессирования их заболевания и риска разрыва, настоящий способ диагностики применим для клинициста в том смысле, что способ позволяет ему/ей принять наиболее подходящие решения для лечения пациента. Поскольку схема лечения может зависеть от размера аневризмы и, в частности, от риска разрыва, клиницист может с учетом дифференциальной диагностики, выполненной, как описано выше, порекомендовать наиболее подходящий способ лечения, включающий в себя хирургическое вмешательство. Рекомендация к хирургическому вмешательству также может быть рекомендована даже при аневризмах небольшого диаметра, если они экспрессируют высокие уровни молекулярных индикаторов, предложенных в настоящем изобретении, учитывая тот факт, что, хотя и редко, есть небольшие аневризмы, склонные к разрыву, и есть спорадические случаи разорванных аневризм относительно небольшого диаметра. Биомаркеры по настоящему изобретению в целом являются хорошим индикатором прогноза в отношении риска разрыва аневризмы. Таким образом, в спорадических случаях небольшая аневризма может приводить к высоким уровням продуктов экспрессии раскрытых маркеров, что, тем не менее, может указывать на плохой прогноз и высокий риск разрыва, что дает очень полезную информацию для клинического ведения конкретного пациента.
Таким образом, согласно другому аспекту настоящее изобретение направлено на способ рекомендации терапевтической схемы лечения аневризмы у субъекта in vitro, предусматривающий: (а) диагностику, имеется ли у субъекта аневризма, или определение плохого прогноза способами, как определено выше, и (b) рекомендации терапевтической схемы лечения аневризмы, если у субъекта диагностирована аневризма или установлен плохой прогноз. Этот аспект также можно рассматривать как способ лечения пациента, имеющего аневризму, предусматривающий (а) диагностику, имеется ли у субъекта аневризма, или определение плохого прогноза способами, как определено выше, и (b) введение терапевтической схемы лечения аневризмы пациенту, если способ указывает, что у субъекта имеется аневризма или плохой прогноз. Если у пациента не диагностирована аневризма, врач может порекомендовать наблюдение за пациентом.
Терапевтические схемы лечения аневризмы включают в себя хирургическое замещение аневризмы синтетическим трансплантатом или эндоваскулярный доступ и трансплантацию стента в попытке выделить аневризматическую часть сосуда от циркуляции крови. Предпочтительно, схема лечения аневризмы выбирается на основе анатомии и местоположения аневризмы (существуют определенные анатомические ограничения, которые полностью исключают возможность эндоваскулярного доступа), а также возраста и общего состояния пациента.
Согласно некоторым вариантам осуществления способ предназначен для рекомендации соответствующей терапевтической схемы для пациентов с высоким риском разрыва кровеносного сосуда, когда диагноз указывает на существование такого риска. Обычно подходящим лечением в этих случаях является хирургическое вмешательство, либо открытая операция, либо эндоваскулярная терапия с имплантацией стент-графта с минимально инвазивным доступом. Другие дополнения к фармакологическому вмешательству, но не терапевтическое лечение, включают в себя введение статинов, бета-блокаторов и агрессивных антигипертензивных средств.
Кроме того, согласно настоящему изобретению пациенты с аневризмой, получившие специальное лечение, могут находиться под наблюдением, чтобы гарантировать эффективность терапевтического вмешательства или заранее предупредить о риске разрыва пораженного кровеносного сосуда. Настоящий способ позволяет упростить последующее наблюдение и улучшить ведение пациентов с аневризмами, что позволяет избежать ненужных страданий и/или минимизировать побочные эффекты. Например, успешное терапевтическое вмешательство приведет к тому, что уровни экспрессии этих генов близки к контрольным.
Таким образом, еще один аспект настоящего изобретения обеспечивает способ in vitro для определения ответа пациента, у которого имеется аневризма, на терапевтическую схему лечения аневризмы, причем способ предусматривает определение в выделенном образце от пациента уровня продукта экспрессии по меньшей мере одного гена, выбранного из таблицы 5, и сравнение указанного уровня продукта экспрессии с уровнем продукта экспрессии того же гена(ов), который определен для того же пациента до начала способа лечения или на более ранней фазе способа лечения, причем снижение продукта экспрессии гена(ов) относительно начала способа лечения или более ранней фазы способа лечения указывает на хороший ответ.
Другой аспект может быть определен как способ in vitro для рекомендации альтернативной и/или дополнительной терапевтической схемы для пациента, у которого имеется аневризма, причем способ предусматривает определение в выделенном образце от пациента уровня продукта экспрессии по меньшей мере одного гена, выбранного из таблицы 5, и сравнение указанного уровня продукта экспрессии с уровнем продукта экспрессии того же гена(ов), который определен для того же пациента перед началом способа лечения или на более ранней фазе способа лечения, причем увеличение продукта экспрессии гена(ов) относительно начала способа лечения или более ранней фазы способа лечения указывает на необходимость альтернативной и/или дополнительной терапевтической схемы. Это также может быть сформулировано как способ лечения пациента с аневризмой, которая не отвечает на терапевтическую схему лечения аневризмы, особенно в случае эндоваскулярного доступа, когда аневризма остается в организме, причем указанный способ предусматривает определение в выделенном у пациента образце уровня продукта экспрессии по меньшей мере одного гена, выбранного из таблицы 5, и сравнение указанного уровня продукта экспрессии с уровнем продукта экспрессии того же гена(ов), который определен для того же пациента перед началом способа лечения или в более ранней фазе способа лечения, и введение альтернативной и/или дополнительной терапевтической схемы для аневризмы, когда продукт экспрессии гена(ов) увеличивается по сравнению с началом способа лечения или более ранней фазой способа лечения. Иногда клиницист может даже порекомендовать или назначить альтернативный и/или дополнительный способ лечения, если продукт экспрессии гена(ов) не изменился относительно начала способа лечения или более ранней фазы способа лечения.
Настоящий способ может также предоставить раннюю информацию о риске рецидивов у пациентов, получавших лечение от аневризмы. Успешное терапевтическое вмешательство приведет к уровням экспрессии генов, близким к контрольным. Тем не менее, у одного пациента, у которого развилась аневризма аорты, сохраняется риск развития другой аневризмы аорты в другом месте нативной аорты. Раннее выявление и последующее лечение рецидива могут значительно улучшить прогноз пациента с аневризмой.
Таким образом, другой аспект настоящего изобретения относится к способу in vitro обнаружения рецидива у субъекта, который подвергался лечению от аневризмы, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов из таблицы 5, причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это указывает на то, что субъект находится в группе высокого риска рецидива.
Во всех вышеуказанных способах, относящихся к аневризме, предпочтительно определяется уровень продукта экспрессии по меньшей мере COL11A1 и/или COL5A2. Согласно конкретным вариантам осуществления способы предусматривают определение уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, причем по меньшей мере один ген определяется необязательно в комбинации с одним или как COL11A1, так и COL5A2, причем, когда уровень продукта(ов) выше эталонного значения, это указывает на то, что у субъекта имеется аневризма. Предпочтительно определяются продукты экспрессии как COL11A1, так и COL5A2. Согласно другим вариантам осуществления способы предусматривают определение уровня продукта экспрессии по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми генов, раскрытых в таблице 5. Согласно конкретному варианту осуществления определяется продукт экспрессии по меньшей мере COL11A1, COL5A2 и ММР2. Согласно другим конкретным вариантам осуществления определяется продукт экспрессии по меньшей мере следующих генов: COL11A1, COL5A2, ММР2 и ММР9 или по меньшей мере COL11A1, COL5A2, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1 и ITGA4, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4 и ITGB1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4, ITGB1 и TGFB1. Согласно другому конкретному варианту осуществления определяется продукт экспрессии восьми генов. Согласно другим вариантам осуществления настоящего изобретения дополнительно определяется уровень продукта экспрессии по меньшей мере одного гена, выбранного из генов в таблице 5bis. Согласно некоторым вариантам осуществления вышеуказанные способы, относящиеся к аневризме, предусматривают определение уровня продукта экспрессии по меньшей мере одного гена, выбранного из генов в таблице 5bis, в дополнение по меньшей мере к одному гену, раскрытому в таблице 5, или любой из их комбинаций, как определено выше.
Биологический образец, полученный от пациента, может представлять собой, как уже описано выше, любую ткань или жидкость организма, такую как кровь, плазма, слюна, моча, спинномозговая жидкость или сперма. Предпочтительно образец представляет собой периферическую кровь.
В клинических условиях широко распространено наблюдение за пациентами с аневризмами, например, аневризмами аорты, с помощью компьютерной томографии каждые шесть месяцев до операции (до тех пор, пока диаметр аорты не достигнет точки хирургического вмешательства), а также каждые шесть месяцев после операции после хирургического вмешательства в течение первого года, а затем ежегодно. Точно так же диагностический анализ крови по настоящему изобретению имеет многообещающий потенциал для надежного мониторинга пациентов с аневризмой, например, аневризмой аорты, после терапевтических вмешательств, включая в себя также случаи эндоваскулярных вмешательств стентирования. В случае эндоваскулярных вмешательств во многих случаях аневризма аорты продолжает увеличиваться в диаметре, несмотря на ее изоляцию от кровообращения и влияние артериального давления, что приводит к серьезным осложнениям, таким как миграция стента. Диагностический тест крови по настоящему изобретению также может служить хорошим прогностическим индикатором осложнений эндоваскулярных процедур. Поскольку анализ крови относительно более удобен и экономичен, без побочных эффектов излучения, которые несут серийные компьютерные томографии, можно использовать более часто. Диагностический анализ крови по настоящему изобретению можно использовать каждые три месяца для более раннего обнаружения изменений диаметра аорты, а также перед сканированием пациентов с помощью компьютерных томографий таким образом, чтобы, если они показывают низкие или нормальные уровни экспрессии генов, которые связаны с расширением аневризмы аорты, они могут диктовать перенос компьютерного томографического сканирования на будущий момент времени, когда его вклад в потенциальный диагноз аневризмы аорты большего размера может быть адекватно оправдан.
Уровень продукта экспрессии генов определяется, как описано выше. Согласно некоторым вариантам осуществления продукт экспрессии представляет собой мРНК и предпочтительно определяется обратной транскрипцией с последующей количественной ПЦР в реальном времени. Праймеры для амплификации получены из последовательностей мРНК транскриптов генов, раскрытых в таблицах 5 и 5bis (как показано в таблице 2), а соответствующие праймеры для амплификации последовательностей транскриптов представлены в таблице 3. Согласно другим вариантам осуществления продукт экспрессии представляет собой кодируемый белок и определяется масс-спектрометрией или иммунохимией, как описано выше.
Другой аспект настоящего изобретения относится к применению средств для определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 5, в способах, относящихся к аневризме, как определено выше. Согласно конкретному варианту осуществления средства предназначены по меньшей мере для определения уровня продукта экспрессии COL11A1 и/или COL5A2. Согласно другому конкретному варианту осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, необязательно в комбинации с одним или обоими из COL11A1 и COL5A2. Предпочтительно средства предназначены для определения продуктов экспрессии как COL11A1, так и COL5A2. Согласно конкретным вариантам осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере трех генов, по меньшей мере четырех генов, по меньшей мере пяти генов, по меньшей мере шести генов, по меньшей мере семи генов или по меньшей мере восьми генов, выбранных из группы генов, раскрытых в таблице 5. Согласно конкретному варианту осуществления выбран продукт экспрессии по меньшей мере COL11A1, COL5A2 и ММР2. Согласно другим конкретным вариантам осуществления выбран продукт экспрессии по меньшей мере следующих генов: COL11A1, COL5A2, ММР2 и ММР9 или по меньшей мере COL11A1, COL5A2, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1 и ITGA4, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4 и ITGB1, или по меньшей мере COLUA1, COL5A2, ММР2, ММР9, ВМР1, ITGA4, ITGB1 и TGFB1. Согласно другим вариантам осуществления средства предназначены для определения уровня продукта экспрессии всех генов, раскрытых в таблице 5. Согласно другим вариантам осуществления средства предназначены для определения уровня продукта экспрессии по меньшей мере одного гена, раскрытого в таблице 5bis, в дополнение по меньшей мере к одному гену, описанному в таблице 5, или любые их комбинации, как определено выше.
Согласно конкретным вариантам осуществления средства предназначены для определения мРНК. Согласно одному варианту осуществления средства включают в себя праймеры для амплификации. Согласно конкретным вариантам осуществления праймеры в каждом случае представлены в таблице 3. Согласно другим вариантам осуществления средства образуют часть набора. Наборы по настоящему изобретению могут содержать указанные средства для определения уровня продукта экспрессии и инструкции по применению для диагностики/прогноза аневризмы/риска разрыва/категоризации в соответствии с размером, как определено выше. Инструкции могут включать в себя информацию, касающуюся пороговых значений для определения диагноза/прогноза аневризмы/риска разрыва/категоризации в соответствии с размером, как определено выше, и/или эталонными значениями.
Согласно другому аспекту в настоящем изобретении также предусмотрено применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 5, в качестве биомаркера(ов) для диагностики аневризмы у субъекта in vitro. Согласно некоторым вариантам осуществления указанные биомаркеры предназначены для дифференциальной диагностики пациентов в соответствии с размером их аневризмы. Согласно другим вариантам осуществления указанные биомаркеры предназначены для дифференциальной диагностики пациентов с большой аневризмой, например, в случае аневризмы аорты размером более чем 6 см. Согласно другим вариантам осуществления способ предназначен для диагностики пациентов с аневризмой с риском разрыва. Согласно другим вариантам осуществления способ предназначен для дифференциальной диагностики пациентов с аневризмой большого размера и пациентов с аневризмой малого или среднего размера, например, для аневризмы аорты, дифференциальной диагностики пациентов с аневризмой диаметром более чем 6 см и пациентов с аневризмой диаметром менее чем 6 см.
Согласно другому аспекту в настоящем изобретении предусмотрено применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 5, в качестве биомаркера(ов) для прогноза in vitro пациентов с аневризмой. Согласно другому аспекту в настоящем изобретении предусмотрено применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из генов таблицы 5, в качестве биомаркера(ов) для определения ответа пациента с аневризмой, на терапевтическую схему лечения аневризмы.
Согласно некоторым вариантам осуществления вышеуказанных аспектов по меньшей мере COL11A1 и/или COL5A2 представляют собой выбранные биомаркеры. Другой вариант осуществления предусматривает применение продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из TGFB1, ITGA4, ITGB1, ММР2, ММР9 и ВМР1, необязательно в комбинации с одним или обоими из COL11A1 и COL5A2, в качестве биомаркеров in vitro. Предпочтительно как COL11A1, так и COL5A2 входят в число выбранных биомаркеров. Согласно другим вариантам осуществления выбранные биомаркеры представляют собой продукты экспрессии по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи или по меньшей мере восьми генов, раскрытых в таблице 5. Согласно конкретному варианту осуществления выбрана экспрессия продукта по меньшей мере из COL11A1, COL5A2 и ММР2. Согласно другим конкретным вариантам осуществления выбран продукт экспрессии по меньшей мере следующих генов: COL11A1, COL5A2, ММР2 и ММР9 или по меньшей мере COL11A1, COL5A2, ММР2, ММР9 и ВМР1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1 и ITGA4 или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4 и ITGB1, или по меньшей мере COL11A1, COL5A2, ММР2, ММР9, ВМР1, ITGA4, ITGB1 и TGFB1. Согласно другому конкретному варианту осуществления выбран продукт экспрессии восьми генов. Согласно другим вариантам осуществления биомаркеры представляют собой продукты экспрессии по меньшей мере одного гена, раскрытого в таблице 5bis, в дополнение по меньшей мере к одному гену, раскрытому в таблице 5, или любой из их комбинаций, как определено выше.
Способы in vitro по настоящему изобретению обеспечивают диагностический прогноз и/или информацию об ответе на лечение (мониторинг). Согласно одному варианту осуществления способы по настоящему изобретению дополнительно предусматривают стадии (i) сбора диагностической, прогностической информации и/или информации об ответе на лечение (мониторинг) и (ii) сохранение информации на носителе данных.
В отношении настоящего изобретения «носитель данных» следует понимать как любое средство, такое как бумага, которое содержит значимые информационные данные для диагностики и/или прогноза деградации ЕСМ, рака или аневризмы у субъекта. Такое средство можно рассматривать как носитель. Носителем также может быть любое юридическое лицо или устройство, способное передавать данные прогноза. Например, носитель может включать в себя носитель данных, такой как ROM, например, CD ROM или полупроводниковый ROM, или магнитный носитель записи, например, гибкий диск или жесткий диск. Кроме того, носитель может представлять собой передающий носитель, такой как электрический или оптический сигнал, который может передаваться по электрическому или оптическому кабелю, по радио или другим средствам. Когда диагноз/прогноз/ответ на данные о лечении воплощены в сигнале, который может быть передан напрямую с помощью кабеля или другого устройства или средства, носитель может состоять из такого кабеля или другого устройства или средства. Другие носители относятся к USB-устройствам и компьютерным архивам. Примеры подходящего носителя данных: бумага, компакт-диски, USB, компьютерные архивы на ПК или звуковая регистрация с той же информацией.
Наконец, другой аспект настоящего изобретения предусматривает алгоритм для выполнения любого из способов диагностики, прогноза и/или ответа на лечение, как определено в вышеуказанных аспектах. В отношении настоящего изобретения термин «алгоритм» также является синонимом панелей или диаграмм решений, предикторов и комбинаций данных для правильной категоризации отдельной выборки.
Согласно аспектам и вариантам осуществления настоящего изобретения, диагностика, прогноз и/или ответ на лечение деградации ЕСМ, рака или аневризмы могут быть выполнены с использованием математического алгоритма, который оценивает определяемый уровень биомолекул, белков, фрагментов белков, антител и/или мРНК, содержащей один или несколько биомаркеров, как определено выше, либо в сочетании с другими клиническими параметрами, либо независимо от них, чтобы правильно классифицировать индивидуальный образец как полученный от здорового пациента, пациента с деградированным ЕСМ, раком (включая в себя конкретную стадию рака и риск метастазирования) или аневризмы (включая в себя размер аневризмы и риск разрыва).
Алгоритм классификации может быть таким же простым, как определение того, является ли количество определенного биомаркера или подмножества измеренных биомаркеров выше или ниже определенного порога (эталонного значения). Когда используются несколько биомаркеров, алгоритм классификации может представлять собой формулу линейной регрессии. В качестве альтернативы алгоритм классификации может представлять собой продукт любого из множества алгоритмов обучения. В случае сложных алгоритмов классификации может оказаться необходимым выполнить алгоритм для данных, тем самым определяя классификацию, с использованием компьютера, например, программируемого цифрового компьютера. В любом случае можно записать статус на материальный носитель, например, в машиночитаемом формате, таком как накопитель памяти или диск, или просто распечатать на бумаге. Результат также может быть отображен на экране компьютера. Этот алгоритм используется как диагностический и/или прогностический способ, и он, в частности, представляет собой часть наборов для выполнения раскрытых в предыдущих аспектах способов.
В описании и формуле настоящего изобретения слово «содержать» и варианты этого слова не предназначены для исключения других технических характеристик, добавок, компонентов или стадий. Кроме того, слово «содержать» охватывает случай «состоящий из». Все термины, используемые в настоящей заявке, если не указано иное, следует понимать в их обычном значении, известном в настоящей области техники. Другие более конкретные определения некоторых терминов, используемых в настоящей заявке, такие, как изложено выше, предназначены для единообразного применения во всем описании и формуле изобретения, если иное четко сформулированное определение не обеспечивает более широкое определение.
Дополнительные цели, преимущества и особенности настоящего изобретения станут очевидными для специалистов в настоящей области техники после изучения описания или могут быть изучены при практическом применении настоящего изобретения. Следующие ниже примеры и графические материалы представлены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения. Кроме того, настоящее изобретение охватывает все возможные комбинации конкретных и предпочтительных вариантов осуществления, описанных в настоящем документе.
Краткое описание чертежей
Фиг. 1. Количественные реакции RT-PCR в реальном времени у онкологических больных. На панелях от А до F показаны кривые количественной амплификации в реальном времени для альфа-1 коллагена XI, альфа-2 коллагена V, альфа-1 коллагена V, альфа-1 коллагена I, альфа-2 коллагена I и альфа-1 коллагена III.
Фиг. 2. Количественные реакции RT-PCR в реальном времени у онкологических больных. На панелях от А до D показаны кривые количественной амплификации в реальном времени для альфа-4 рецептора интегрина, бета-1 рецептора интегрина, альфа-3 рецептора интегрина и альфа-6 рецептора интегрина.
Фиг. 3. Количественные реакции RT-PCR в реальном времени у онкологических больных. На панелях от А до F показаны кривые количественной амплификации в реальном времени для матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, тканевого ингибитора-1 матриксных металлопротеиназ, костного морфогенетического белка-1, трансформирующего фактора роста бета-1 и бета-актина.
Фиг. 4. Количественные реакции RT-PCR в реальном времени у пациентов с аневризмой. На панелях от А до F показаны кривые количественной амплификации в реальном времени для альфа-1 коллагена XI, альфа-2 коллагена V, альфа-1 коллагена V, альфа-1 коллагена I, альфа-2 коллагена I и альфа-1 коллагена III.
Фиг. 5. Количественные реакции RT-PCR в реальном времени у пациентов с аневризмой. На панелях с А по D показаны кривые количественной амплификации в реальном времени для субъединицы альфа-4 рецептора интегрина, субъединицы бета-1 рецептора интегрина, субъединицы альфа-3 рецептора интегрина и субъединицы альфа-6 рецептора интегрина.
Фиг. 6. Количественные реакции RT-PCR в реальном времени у пациентов с аневризмой. На панелях от А до F показаны кривые количественной амплификации в реальном времени для матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, тканевого ингибитора-1 матриксных металлопротеиназ, костного морфогенетического белка-1, трансформирующего фактора роста бета-1 и бета-актина.
ПРИМЕРЫ
Пример 1. Паттерн экспрессии у онкологических больных.
Способы: Общую РНК экстрагировали из образцов периферической крови пациентов с немелкоклеточным раком легкого (всего 46 пациентов: 13 пациентов I стадии, 11 пациентов II стадии, 13 пациентов III стадии и 9 пациентов IV стадии) и пациентов без злокачественных новообразований (контроль, n=6), что подтверждено компьютерной томографией.
ДНК удаляли обработкой рекомбинантной ДНКазой в колонке. Общую РНК элюировали водой, свободной от РНКазы, и хранили при температуре -80°С до дальнейшего использования. Концентрацию РНК определяли с помощью набора Quant-iT RNA Assay на флуорометре Qubit 1.0 (Invitrogen/Thermo Fisher, США), который использует краситель, специфичный для РНК, а не для ДНК. Все РНК были в достаточном количестве.
кДНК синтезировали из 1 мкг общей РНК и случайных гексамеров и в общем объеме 20 мкл, согласно набору RT2 First Strand (Qiagen, Германия) в термоциклере Primus 25 (MWG-Biotech, Германия). Набор RT2 First Strand включает в себя запатентованную стадию удаления геномной ДНК для удаления любых остаточных загрязнений в образцах РНК перед обратной транскрипцией, тем самым устраняя ложно положительные сигналы. Также использовали отрицательный контроль РНК (холостую пробу). Концентрацию кДНК определяли с помощью набора для анализа ДНК Quant-iT во флуориметре Qubit 1.0 (Invitrogen/Thermo Fisher, США), который использует краситель, специфический для ДНК, а не для РНК. Затем образцы кДНК хранили при температуре -20°С до количественного ПНР-анализа в реальном времени.
Для изучения уровней экспрессии мРНК COL11A1 (все варианты), COL5A2, COL5A1 (все варианты), TGFB1, ITGA4 (все варианты), ITGB1 (все варианты), ММР2 (все варианты), ММР9, ВМР1 (все варианты), ITGA3, ITGA6 (все варианты), TIMP1, COL11A1, COL3A1 и COL11A2 анализ RT-qPCR в реальном времени проводили в термоциклере реального времени Rotor-Gene Q MDX (Qiagen, Германия) в общем объеме 20 мкл с использованием соответствующих RT2 qPCR Primer Assays (Qiagen, Германия) и RT2 SYBR Green Mastermix (Qiagen, Германия). Все продукты (варианты) транскрипции определяли для каждого из генов. Праймеры представлены в таблице 3 выше. В качестве эталонного гена использовали бета-актин. При проведении амплификации следовали инструкциям производителя.
Все продукты проверяли на размер и чистоту электрофорезом на 2% мас./об. агарозных гелях и анализом температуры плавления. В каждом прогоне каждый образец кДНК амплифицировали для одного гена за раз. Также для внутреннего контроля качества в лаборатории авторов настоящего изобретения выбирали случайный образец кДНК для включения во все прогоны. Идентификация исследуемых генов следующая:
1. COL11A1 [Homo sapiens (человек)], в настоящем документе также называется как альфа-1 коллагена XI.
ID гена: 1301
Расположение: 1р21.1
Количество экзонов: 71
2. COL5A2 [Homo sapiens (человек)], в настоящем документе также называется как альфа-2 коллагена V.
ID гена: 1290
Расположение: 2q32.2
Количество экзонов: 55
3. COL5A1 [Homo sapiens (человек)], в настоящем документе также называется как альфа-1 коллагена V.
ID гена: 1289
Расположение: 9q34.3
Количество экзонов: 68
4. COL3A1 [Homo sapiens (человек)], в настоящем документе также называется как альфа-1 коллагена III.
ID гена: 1281
Расположение: 2q32.2
Количество экзонов: 51
5. COL1A1 [Homo sapiens (человек)], в настоящем документе также называется как альфа-1 коллагена I.
ID гена: 1277
Расположение: 17q21.33
Количество экзонов: 51
6. COL1A2 [Homo sapiens (человек)], в настоящем документе также называется как альфа-2 коллагена I.
ID гена: 1278
Расположение: 7q21.3
Количество экзонов: 52
7. ITGA3 [Homo sapiens (человек)], в настоящем документе также называется как субъединица альфа-3 рецептора интегрина.
ID гена: 3675
Расположение: 17q21.33
Количество экзонов: 26
8. ITGA4 [Homo sapiens (человек)], в настоящем документе также называется как субъединица альфа-4 рецептора интегрина.
ID гена: 3676
Расположение: 2q31.3
Количество экзонов: 29
9. ITGA6 [Homo sapiens (человек)], в настоящем документе также называется как субъединица альфа-6 рецептора интегрина.
ID гена: 3655
Расположение: 2q31.1
Количество экзонов: 28
10. ITGB1 [Homo sapiens (человек)], в настоящем документе также называется как субъединица бета-1 рецептора интегрина.
ID гена: 3688
Расположение: 10р11.22
Количество экзонов: 18
11. ММР2 [Homo sapiens (человек)], в настоящем документе также называется как субъединица бета-1 рецептора интегрина, матриксная металлопептидаза 2.
ID гена: 4313
Расположение: 16q12.2
Количество экзонов: 17
12. ММР9 [Homo sapiens (человек)], в настоящем документе также называется как матриксная металлопептидаза 9.
ID гена: 4318
Расположение: 20q13.12
Количество экзонов: 13
13. TIMP1 [Homo sapiens (человек)], в настоящем документе также называется как ингибитор 1 металлопептидазы TIMP.
ID гена: 7076
Расположение: Xp11.3
Количество экзонов: 6
14. ВМР1 [Homo sapiens (человек)], в настоящем документе также называется как костный морфогенетический белок 1
ID гена: 649
Расположение: 8р21.3
Количество экзонов: 25
15. TGFB1 [Homo sapiens (человек)], в настоящем документе также называется как трансформирующий фактор роста бета 1.
ID гена: 7040
Расположение: 19q13.2
Количество экзонов: 7
16. АСТВ [Homo sapiens (человек)], в настоящем документе также называется как актин бета.
ID гена: 60
Расположение: 7р22.1
Количество экзонов: 6
Эталонная последовательность NCBI для гена АСТВ представляет собой NG 007992.1 (NG 007992.1 для его транскрипта)
Чтобы подготовить калибраторы (стандарты) для анализа гена бета-актина, несколько продуктов ПЦР объединяли и затем очищали с помощью набора для очистки PureLink PCR Purification Kit (Invitrogen/Thermo Fisher) с последующим измерением концентрации с помощью набора Quant-iT dsDNA Broad range Assay kit во флуорометре Qubit 1.0 (Invitrogen/Thermo Fisher, США). Количество копий/мкл рассчитывали, как описано ранее (Kroupis С.et al, Clin Biochem. 2005, vol. 38, issue 1, p.50-57). Высококонцентрированный калибратор серийно разводили и получали стандартные кривые для обоих генов. В качестве способа относительной количественной оценки использовали 2-ΔΔCt Ливака и Шмиттгена (смотрите выше) (RQ=2-ΔΔCt, где RQ представляет собой экспрессию мРНК).
Статистические способы. Чувствительность и специфичность qRT-PCR для комбинации генов рассчитывали с 95% доверительным интервалом. Результаты по чувствительности/специфичности измеряли как биомаркеры активированного транскрипта в группе пациентов с немелкоклеточным раком легкого (n=46, чувствительность) и биомаркеры подавленного транскрипта в группе контрольных пациентов (n=6, специфичность). Кроме того, результаты чувствительности/специфичности измеряли как биомаркеры активированного транскрипта в подгруппе пациентов с поздними метастатическими стадиями немелкоклеточного рака легкого (n=22, пациенты на стадиях III и IV - чувствительность) и биомаркеры подавленного (или менее активированного по сравнению с контролем) транскрипта в подгруппе пациентов с ранними стадиями немелкоклеточного рака легкого (n=24, пациенты с I и II стадиями - специфичность). Значения Р получали с помощью точных тестов Фишера, сравнивающих пропорции между сравниваемыми подгруппами. Результаты:
На фиг. 1 показаны репрезентативные кривые qRT-PCR в реальном времени для различных типов коллагена у пациентов с немелкоклеточным раком легкого. Четко показано, что у пациентов с немелкоклеточным раком легкого были более высокие уровни экспрессии мРНК коллагена типов XI альфа-1, V альфа-2 и V альфа-1 по сравнению с контрольной группой. Также показано, что уровни экспрессии этих минорных фибриллообразующих коллагенов были еще более сверхэкспрессированы на поздних и метастатических стадиях немелкоклеточного рака легкого (стадии III и IV). В таблице 6 показана кратность изменения паттерна экспрессии по сравнению с контрольной группой (пациенты без рака).
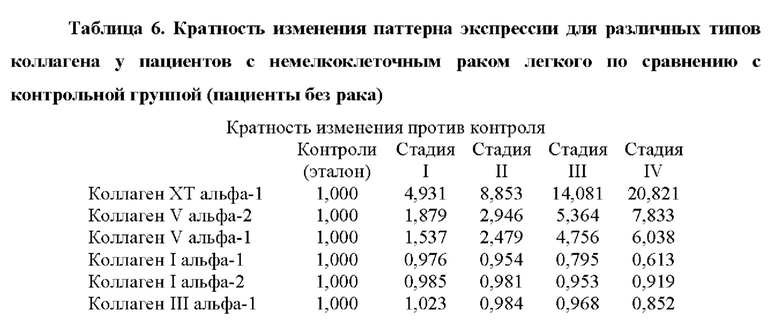
На фиг. 2 показаны репрезентативные кривые RT-PCR в реальном времени для различных типов рецепторов интегрина у пациентов с немелкоклеточным раком легкого. Четко показано, что были более высокие уровни экспрессии мРНК альфа-4, бета-1, альфа-3 и альфа-6 рецептора интегрина у пациентов с немелкоклеточным раком легкого по сравнению с контрольной группой. Следует отметить, что уровни экспрессии этих рецепторов интегрина были выше на стадии II и даже более сверхэкспрессированы на поздних и метастатических стадиях немелкоклеточного рака легкого (стадии III и IV).
Таблица 7 показывает кратность изменения паттерна экспрессии по сравнению с контрольной группой (пациенты без рака).
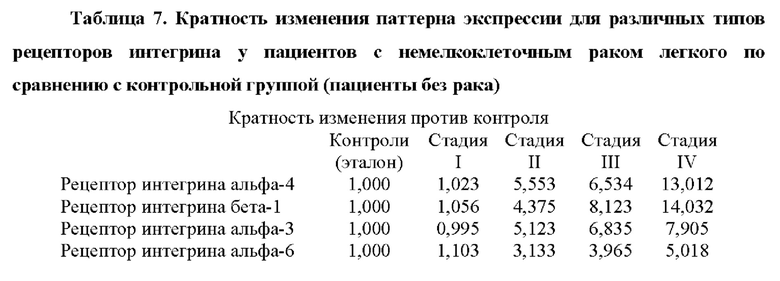
На фиг. 3 показаны репрезентативные кривые RT-PCR в реальном времени для матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, тканевого ингибитора-1 матриксных металлопротеиназ, костного морфогенетического белка-1, трансформирующего фактора роста бета-1 и эталонного гена бета-актина у пациентов с немелкоклеточным раком легкого. Четко показано, что были более высокие уровни экспрессии мРНК матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, тканевого ингибитора-1 матриксных металлопротеиназ, костного морфогенетического белка-1, трансформирующего фактора роста бета-1 у пациентов с немелкоклеточным раком легких по сравнению с контролем. Также показано, что уровни экспрессии этих мРНК, которые контролируют ремоделирование ЕСМ, были еще более сверхэкспрессированы на поздних и метастатических стадиях немелкоклеточного рака легкого (стадии III и IV). Не было изменений в уровнях экспрессии бета-актина среди пациентов контрольной группы и на разных стадиях немелкоклеточного рака легкого. В таблице 8 показана кратность изменения паттерна экспрессии по сравнению с контрольной группой (пациенты без рака).


Все продукты реакций RT-PCR исследовали посредством электрофореза в агарозном геле. Все амплифицированные продукты были представлены одним продуктом с ожидаемой молекулярной массой. Дальнейший анализ секвенирования ДНК подтвердил ожидаемые последовательности амплифицированных продуктов ПЦР.
В заключение было установлено, что характер экспрессии генов альфа-1 коллагена XI, альфа-2 коллагена V, альфа-1 коллагена V, альфа-4 рецептора интегрина, бета-1 рецептора интегрина, матриксной металлопротеиназы-2, матриксной металлопротеиназы-9 и костного морфогенетического белка-1 обеспечивают надежную диагностическую информацию для рака, в данном случае, в частности, немелкоклеточного рака легкого, в периферической крови. Также существует корреляция между сверхэкспрессией этих генов и стадией рака. Этот набор генов может адекватно анализировать новый молекулярный механизм, который контролирует ремоделирование/деградацию ЕСМ, как описано выше. Более конкретно, с помощью этих 8 ядерных генов можно было различать пациентов с немелкоклеточным раком легкого и контрольную группу с чувствительностью 0,98 (95% доверительный интервал: 0,89-1,00, Р<0,001) и специфичностью 1,00 (95% доверительные интервалы: 0,61-1,00, Р<0,001). Наконец, паттерн экспрессии 8 генов может различать пациентов с метастатическим немелкоклеточным раком легкого (стадии III и IV) и пациентов с немелкоклеточным раком легкого на ранних стадиях (стадии I и II) с чувствительностью 0,95 (95% доверительные интервалы: 0,78 0,99, Р<0,001) и специфичностью 0,96 (95% доверительные интервалы: 0,80 0,99, Р<0,001).
Набор генов не только показал высокую чувствительность и специфичность в различении между контрольными и онкологическими пациентами, а также между онкологическими пациентами на ранних стадиях и поздних метастатических стадиях, но, кроме того, возможно было количественное определение между ранними и метастатическими стадиями. Более конкретно, поскольку это может быть получено из таблиц 6-8 и фиг. 1-3, можно было представить кратные изменения уровней экспрессии генов для целей количественной оценки между ранней и метастатической стадиями (таблица 9).
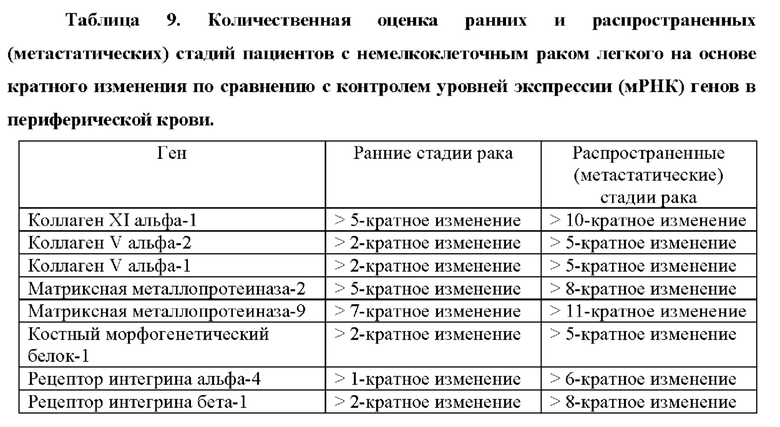
Панель генов является отражением ремоделирования внеклеточного матрикса, что имеет важное значение для мониторинга и последующего наблюдения за пациентами, особенно после лечебного вмешательства. Успешное терапевтическое вмешательство приведет к тому, что уровни экспрессии этих генов будут близки к контрольным. В приведенных выше экспериментальных измерениях, как подробно представлено, было обнаружено, что уровни минорных фибриллообразующих коллагенов, а также уровни генов, участвующих в деградации ЕСМ у пациентов без рака (подтверждено сканированием компьютерной томографии), экспрессируются на значительно более низких уровнях в периферической крови. Хотя описанные выше эксперименты проводили на пациентах с немелкоклеточным раком легкого, аналогичные паттерны экспрессии авторы настоящего изобретения подтвердили у пациентов-женщин с диагнозом рака молочной железы. Следовательно, поскольку эти обнаруженные изменения фактически отражают изменения в ЕСМ, они могут быть потенциально использованы для распознавания пациентов с другими типами рака, которые характеризуются способностью метастазировать через деградацию ЕСМ.
Пример 2. Паттерн экспрессии у пациентов с аневризмой.
Способы: общую РНК экстрагировали из образцов периферической крови пациентов с аневризмами грудного отдела аорты, а именно из восходящей грудной аорты (всего 42 пациента: 21 пациент с аневризмами грудного отдела с диаметром аорты от 5 до 6 см, 13 пациентов с аневризмами грудного отдела аорты с диаметр аорты от 6 до 7 см и 8 пациентов с аневризмами грудного отдела аорты с диаметром аорты более чем 7 см) и от пациентов без аневризмы аорты (контроль, n=13), что подтверждено сканированием компьютерной томографии.
Методология такая же, как в примере 1.
Результаты:
На фиг. 4 показаны репрезентативные кривые RT-PCR в реальном времени для различных типов коллагена в контрольной группе и у пациентов с малым (диаметр аорты 5-6 см), средним (диаметр аорты 6-7 см) и большим размером аневризмы грудного отдела аорты (диаметр аорты >7 см). Четко показано, что были более высокие уровни экспрессии мРНК коллагена типов XI альфа-1, V альфа-2 и V альфа-1 у пациентов с аневризмами грудного отдела аорты по сравнению с контрольной группой. Также показано, что уровни экспрессии этих второстепенных фибриллообразующих коллагенов еще более сверхэкспрессируются при аневризмах грудного отдела аорты большого размера (диаметр аорты >7 см). В таблице 10 показана кратность изменения профиля экспрессии по сравнению с контрольной группой (пациенты с нормальным диаметром грудной аорты, который находится в диапазоне от 2,5 до 3,0 см).
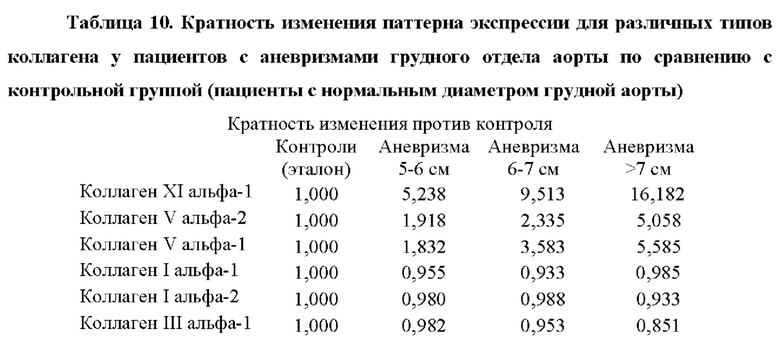
На фиг. 5 показаны репрезентативные кривые RT-PCR в реальном времени для различных типов рецепторов интегрина у пациентов с аневризмами грудного отдела аорты. Четко показано, что у пациентов с аневризмами грудного отдела аорты были более высокие уровни экспрессии мРНК субъединицы альфа-4, бета-1, альфа-3 и альфа-6 рецептора интегрина по сравнению с контрольной группой. Следует отметить, что повышенные уровни экспрессии этих рецепторов субъединиц интегрина проявлялись в аневризмах относительно небольшого размера (диаметр аорты 5-6 см) и были еще более сверхэкспрессированы в аневризмах грудного отдела аорты большего размера (диаметр аорты 6-7 см и >7 см). В таблице 11 показана кратность изменения паттерна экспрессии по сравнению с контрольной группой (пациенты с нормальным диаметром грудной аорты).

На фиг. 6 показаны репрезентативные кривые RT-PCR в реальном времени для матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, тканевого ингибитора-1 матриксных металлопротеиназ, костного морфогенетического белка-1, трансформирующего фактора роста бета-1 и эталонного гена бета-актина у пациентов с аневризмами грудного отдела аорты. Показано, что у пациентов с аневризмами грудного отдела аорты были более высокие уровни экспрессии мРНК матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, тканевого ингибитора-1 матриксных металлопротеиназ, костного морфогенетического белка-1, трансформирующего фактора роста бета-1 по сравнению с контролями. Также показано, что уровни экспрессии этих мРНК, которые контролируют ремоделирование ЕСМ, были еще более сверхэкспрессированы при аневризмах грудного отдела аорты большего диаметра. Не было изменений в уровнях экспрессии бета-актина среди пациентов контрольной группы и пациентов с аневризмой грудного отдела аорты разного размера. В таблице 12 показана кратность изменения профиля экспрессии по сравнению с контрольной группой (пациенты с нормальным диаметром грудного отдела аорты).

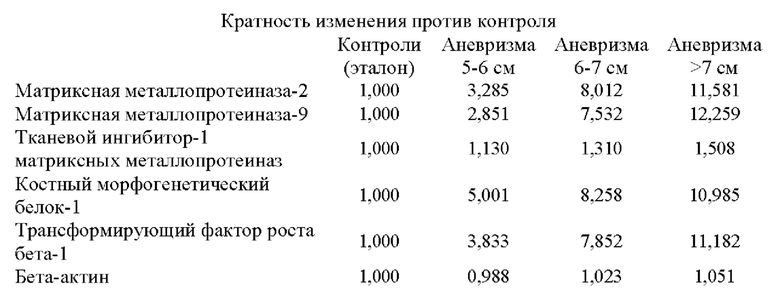
Все продукты реакций RT-PCR исследовали в агарозном геле для электрофореза. Все амплифицированные продукты были представлены одним продуктом с ожидаемой молекулярной массой. Дальнейший анализ секвенирования ДНК подтвердил ожидаемые последовательности амплифицированных продуктов ПЦР.
В заключение было установлено, что паттерн экспрессии генов коллагена XI альфа-1, коллагена V альфа-2, рецептора интегрина альфа-4, рецептора интегрина бета-1, матриксной металлопротеиназы-2, матриксной металлопротеиназы-9, трансформирующего фактора роста бета-1 и костного морфогенетического белка-1 обеспечивают надежную диагностическую информацию об аневризме, в данном случае аневризме грудного отдела аорты, в периферической крови. Также существует корреляция между сверхэкспрессией этих генов и размером аневризмы. Этот набор генов может адекватно анализировать предложенный новый молекулярный механизм, который контролирует ремоделирование ЕСМ. Более конкретно, с помощью этих генов (все из которых были значительно активированы у пациентов с аневризмами грудного отдела аорты, и была значительная активация при аневризмах грудного отдела аорты большего диаметра) стало возможным различать пациентов с аневризмами грудного отдела аорты и пациентов контрольной группы с чувствительностью 0,95 (95% доверительный интервал: 0,89 1,00, Р<0,001) и специфичностью 0,92 (доверительный интервал 95%: 0,78 1,00, Р<0,001). Наконец, с помощью этих генов стало возможным различать пациентов с аневризмами аорты большего размера (диаметр более чем 6 см) и пациентов с аневризмами аорты меньшего размера (диаметр от 5 до 6 см) с чувствительностью 0,95 (95% доверительный интервал: 0,86-1,00, Р<0,001) и специфичностью 0,86 (95% доверительный интервал: 0,71-1,00, Р<0,001).
Установленные гены не только показали высокую чувствительность и специфичность в определении различий между контрольной группой и пациентами с аневризмами грудного отдела аорты, а также между пациентами с аневризмами аорты относительно небольшого размера и пациентами с аневризмами грудного отдела аорты относительно большого размера, но, кроме того, возможно количественное определение отличий между аневризмами грудного отдела аорты небольшого размера (диаметр аорты 5-6 см) и большего размера (диаметр аорты >6 см) по сравнению с контролем. Более конкретно, поскольку это может быть получено из таблиц 10-12 и фиг. 4-6, можно было представить кратные изменения уровней экспрессии генов для целей количественной оценки между аневризмами грудного отдела аорты малого и большого размера (таблица 13).
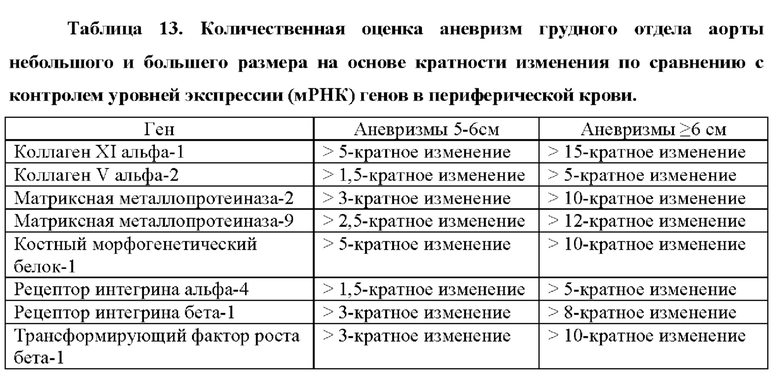
Панель выбранных генов является отражением ремоделирования/деградации ЕСМ, что важно для мониторинга и последующего наблюдения за пациентами, особенно до или после лечебного вмешательства. У одного пациента, у которого развилась аневризма аорты, сохраняется риск развития другой аневризмы аорты на другом участке аорты. Успешное терапевтическое вмешательство приведет к тому, что уровни экспрессии этих генов будут близки к контрольным. В ходе экспериментальных измерений было обнаружено, что уровни минорных фибриллообразующих коллагенов, а также уровни генов, которые участвуют в деградации ЕСМ у пациентов без аневризмы аорты (подтверждено сканированием компьютерной томографии) экспрессируются на значительно более низких уровнях в периферической крови. Хотя вышеуказанные результаты были получены у пациентов с аневризмами грудного отдела аорты, аналогичные паттерны экспрессии можно было обнаружить у пациентов с аневризмами брюшной или торакоабдоминальной аорты. Следовательно, дифференциальная экспрессия вышеуказанных генов может потенциально использоваться для дискриминации пациентов с другими типами аневризм.
Наконец, очень важно, что в клинических сериях авторов настоящего изобретения, которые были подтверждены другими большими наборами клинических данных, приблизительно 19% пациентов, которым был поставлен диагноз аневризмы грудного отдела аорты, имели в анамнезе ранее пролеченные злокачественные новообразования, которые обычно включали в себя одно из следующих злокачественных новообразований: немелкоклеточный рак легкого, рак толстой кишки и рак предстательной железы у пациентов мужского пола и немелкоклеточный рак, рак толстой кишки и рак молочной железы у пациентов женского пола. И наоборот, у пациентов, у которых была диагностирована злокачественная опухоль, также обнаруженная при компьютерной томографии, наличие аневризмы аорты (в основном аневризмы грудного отдела аорты) составляет приблизительно 24%. Такое сосуществование злокачественных новообразований с аневризмами аорты и наоборот указывает на то, что эти заболевания действительно имеют общие молекулярные механизмы для ремоделирования внеклеточного матрикса, поскольку в обоих случаях их прогрессирование (расширение аорты или метастатическое заболевание) основано на изменениях состава и физиологических/биологических свойства ЕСМ.
Список цитирования
Непатентная литература:
Livak and Schmittgen, "Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method". Methods, 2001, vol. 25, issue 4, p.402-8
Kroupis C. et al, "Development and applications of a real-time quantitative RT-PCR method (QRT-PCR) for BRCA1 mRNA". Clin Biochem, 2005, vol. 38, issue 1, p.50-57
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки риска разрыва аневризмы брюшной аорты | 2022 |
|
RU2808645C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ И ПРОГНОЗА МИОМЫ И РАКА ЭНДОМЕТРИЯ | 2010 |
|
RU2430371C1 |
| Метод определения уровня метилирования промоторной области гена COL1A2 для диагностики рака толстой кишки | 2015 |
|
RU2612890C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВООПУХОЛЕВЫМ ЭФФЕКТОМ, И СПОСОБ СНИЖЕНИЯ ИНГИБИРУЮЩЕГО ЭФФЕКТА PD-L1 НА Т-КЛЕТКИ ЧЕЛОВЕКА | 2016 |
|
RU2688692C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР С КОСТИМУЛИРУЮЩИМ ДОМЕНОМ 4-1BB | 2020 |
|
RU2830540C2 |
| СПОСОБ ПРЕДСКАЗАНИЯ РЕЦИДИВА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ ЭНДОКРИННОМ ЛЕЧЕНИИ | 2011 |
|
RU2654587C2 |
| РЕГУЛЯЦИЯ МЕТАБОЛИЗМА С ПОМОЩЬЮ MIR-378 | 2011 |
|
RU2585491C2 |
| ИСПОЛЬЗОВАНИЕ ЛХАТ ДЛЯ ЛЕЧЕНИЯ АНЕМИИ И ДИСФУНКЦИИ КРАСНЫХ КРОВЯНЫХ КЛЕТОК | 2010 |
|
RU2576838C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ММР9 | 2015 |
|
RU2714043C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРОВ NKG2D ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ И МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ, ТАКИХ КАК ДИАБЕТ 2 ТИПА | 2010 |
|
RU2566264C2 |






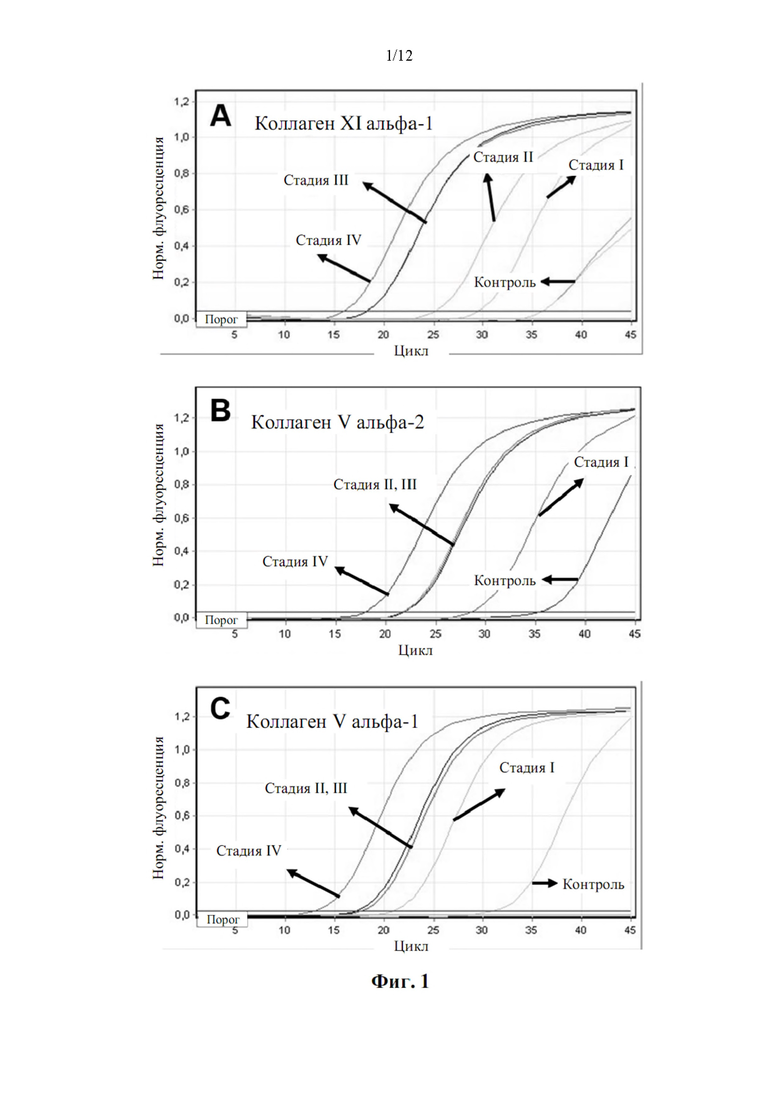
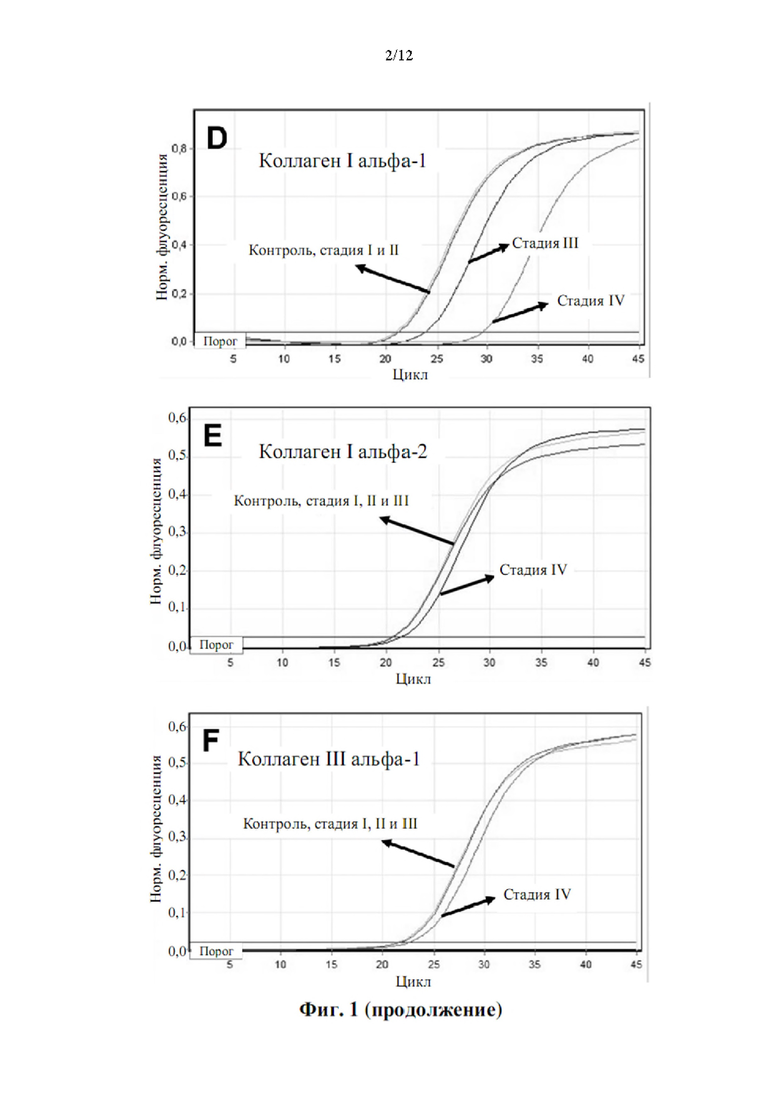
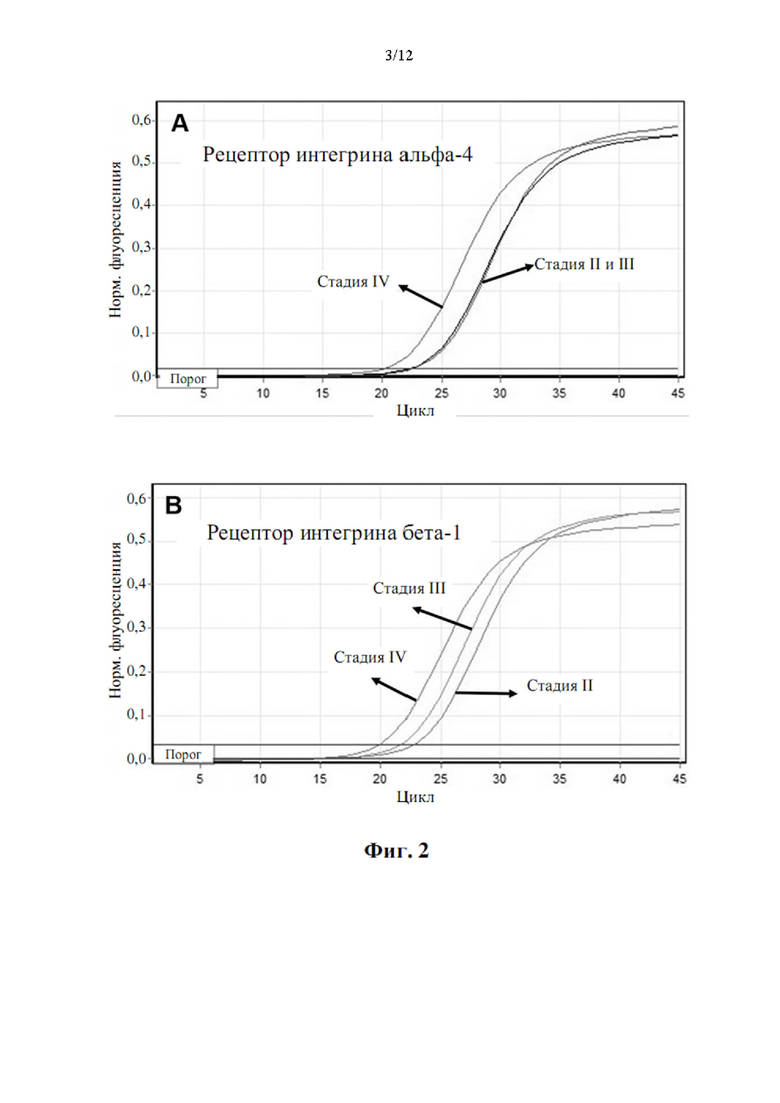
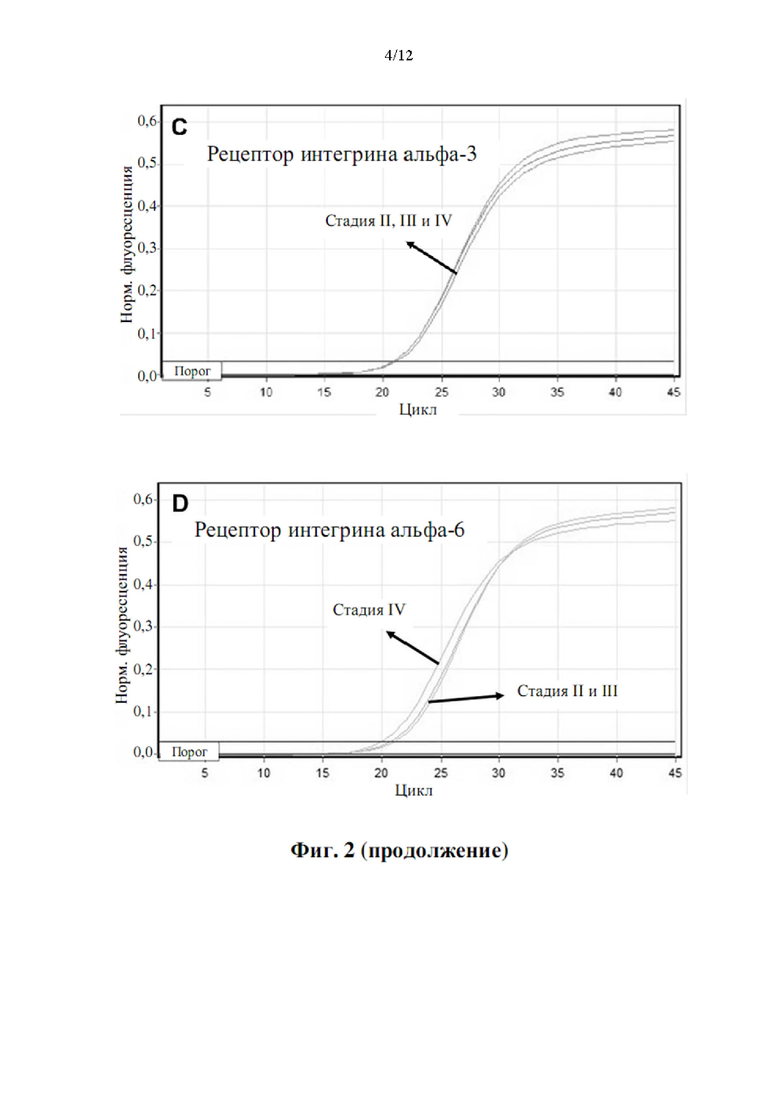
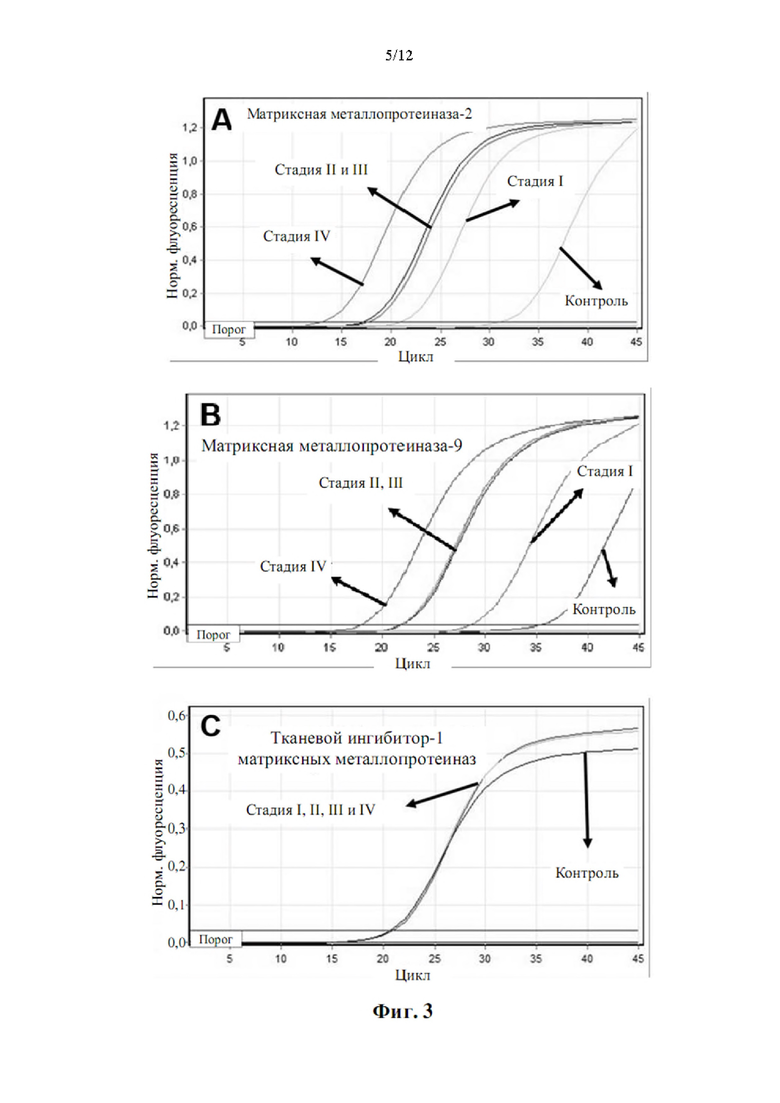
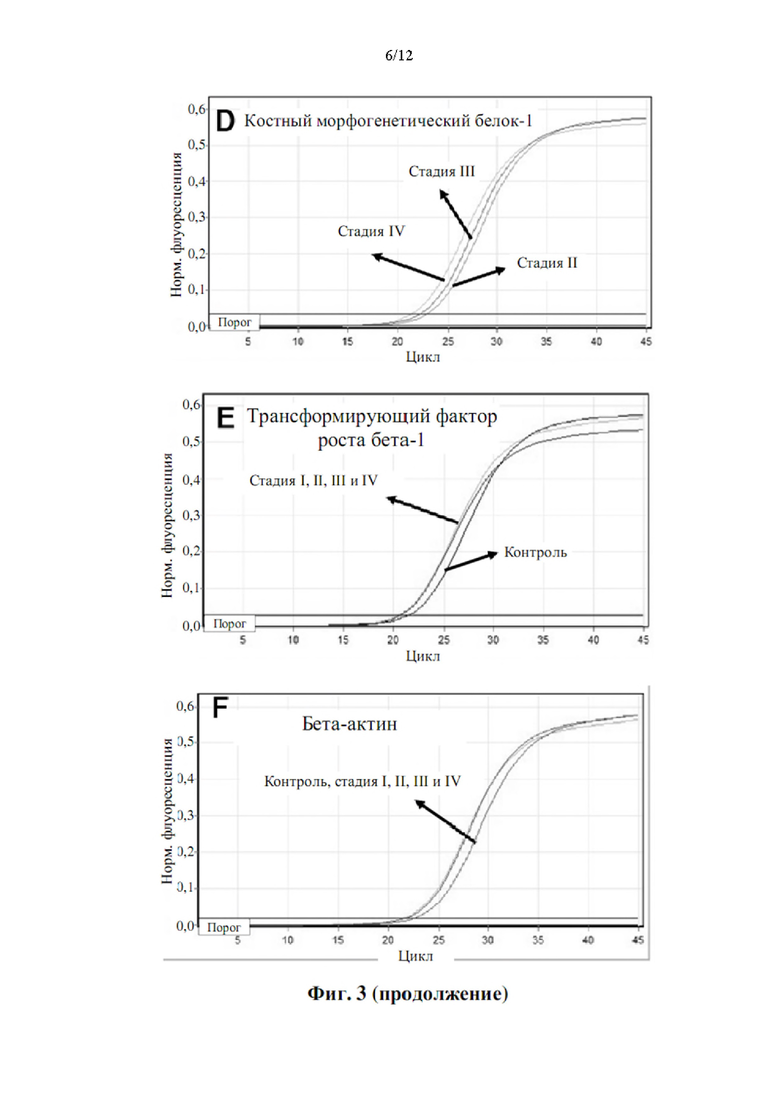
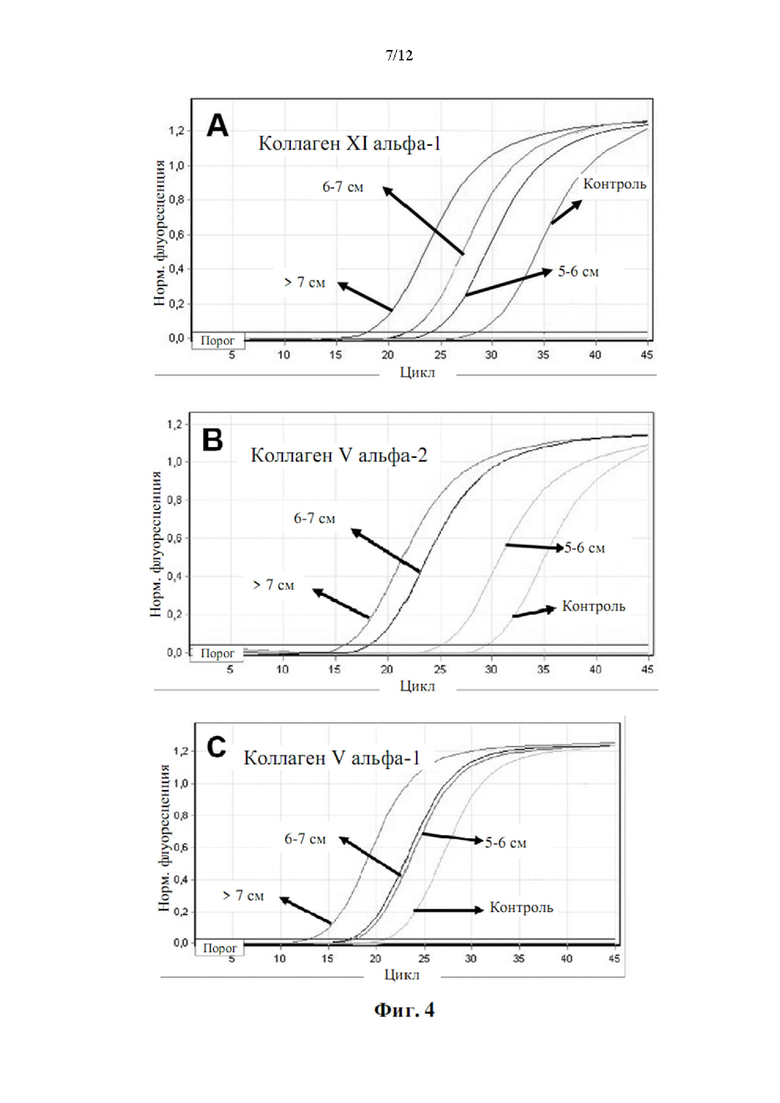
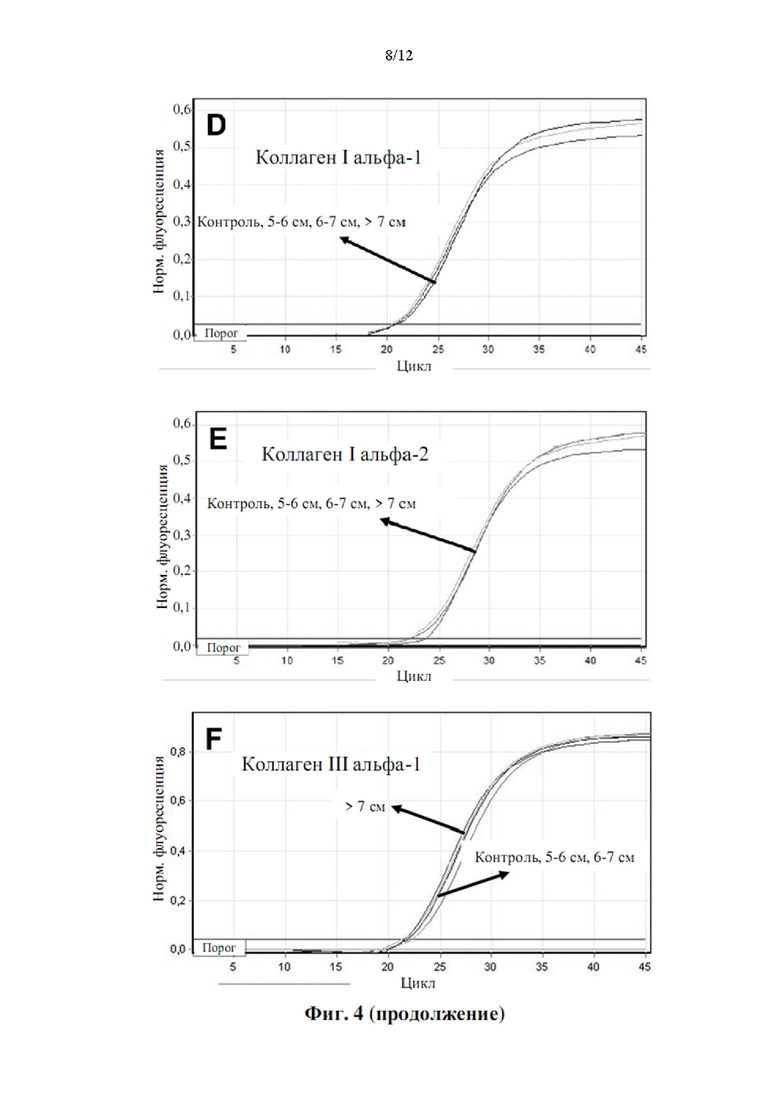
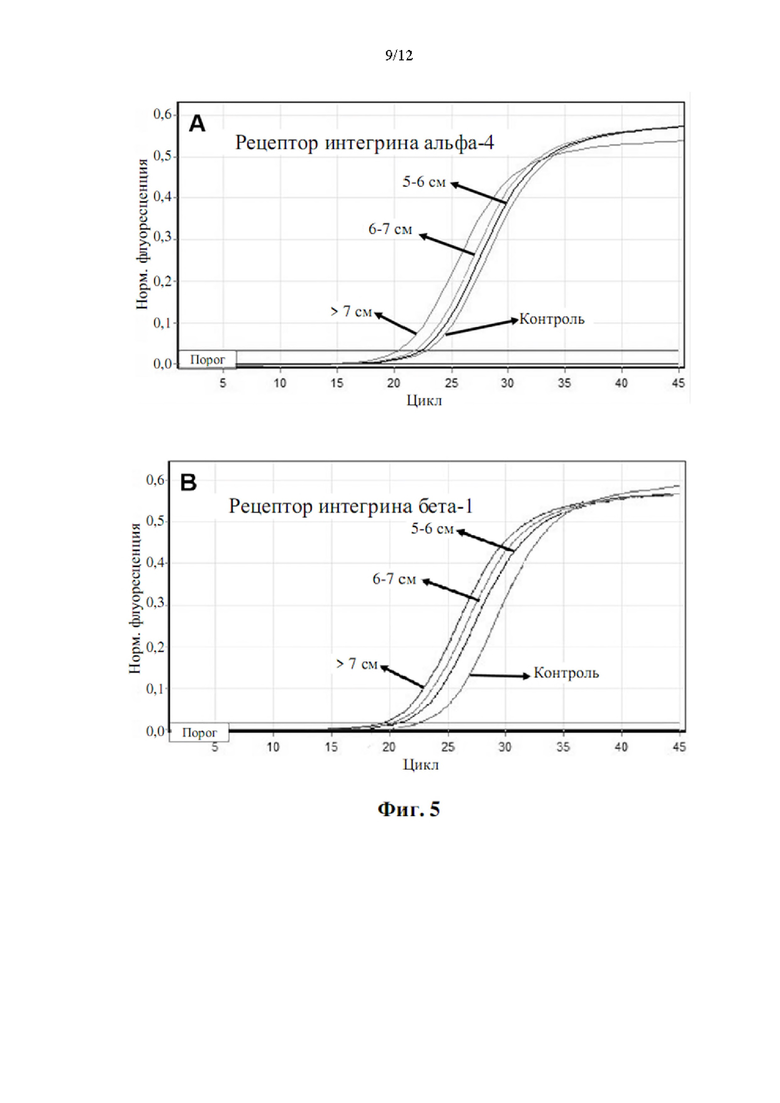
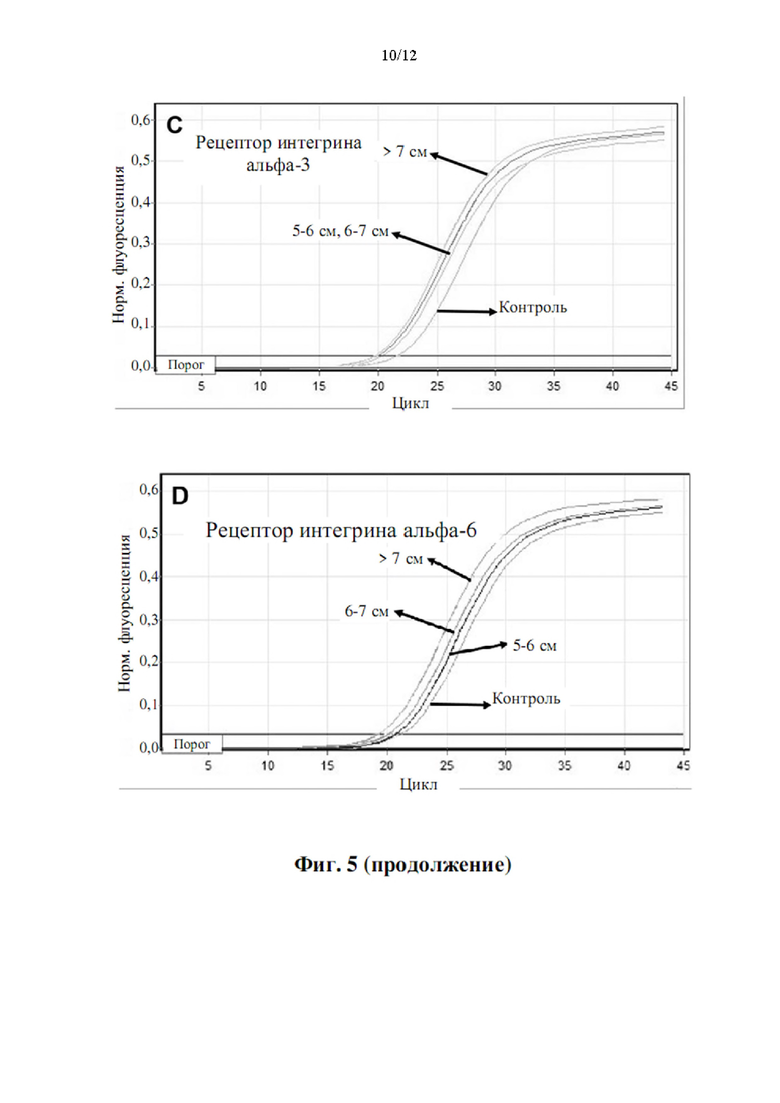
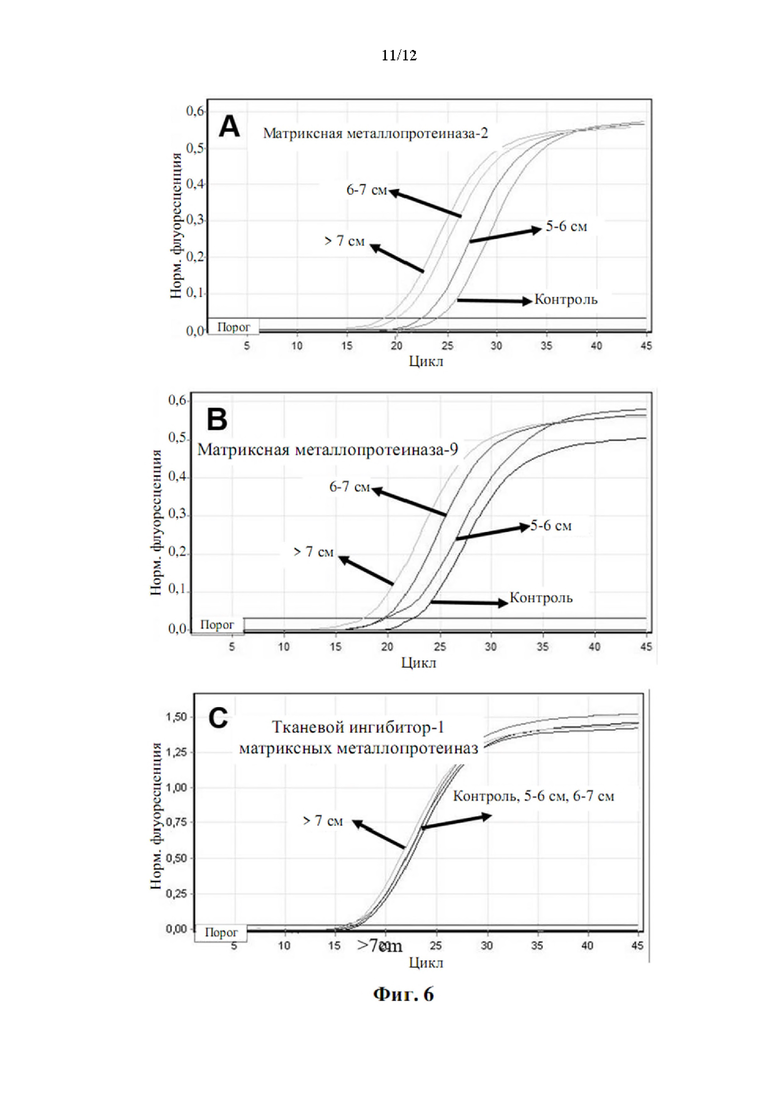
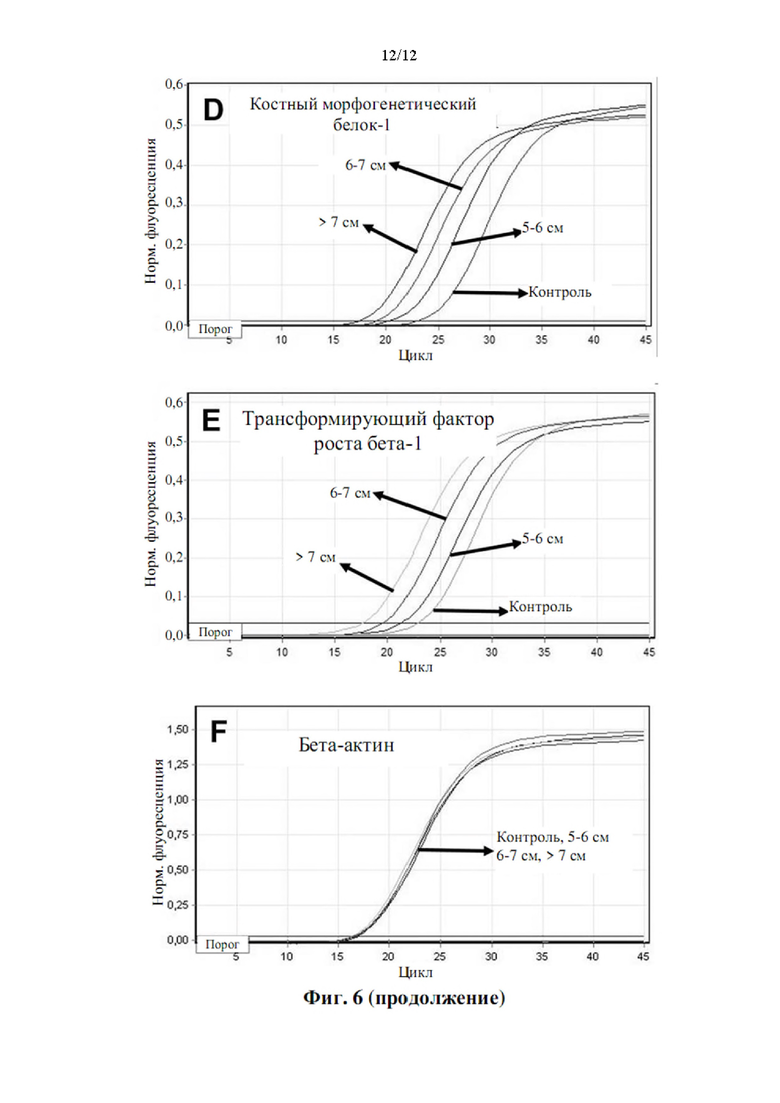
Изобретение относится к биотехнологии, в частности к способу in vitro определения деградации внеклеточного матрикса (ЕСМ) у субъекта, причем способ предусматривает определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере одного гена, выбранного из группы, состоящей из цепи альфа-1 коллагена типа V (COL5A1), трансформирующего фактора роста бета-1 (TGFB1), субъединицы альфа-4 интегрина (ITGA4), субъединицы бета-1 интегрина (ITGB1), матриксной металлопептидазы 2 (ММР2), матриксной металлопептидазы 9 (ММР9) и костного морфогенетического белка 1 (ВМР1), причем по меньшей мере один ген определяется необязательно в комбинации с одним или обоими из цепи альфа-1 коллагена типа XI (COL11A1) и цепи альфа-2 коллагена типа V (COL5A2), причем, когда уровень продукта(ов) экспрессии выше эталонного значения, это свидетельствует о деградированном ЕСМ. 3 н. и 7 з.п. ф-лы, 6 ил., 13 табл., 2 пр.
1. Способ in vitro диагностики аневризмы у субъекта, предусматривающий определение в выделенном образце от субъекта уровня продукта экспрессии по меньшей мере COL11A1, COL5A2, TGFB1, ITGA4, ITGB1, MMP2, MMP9 и BMP1, причем, когда уровень продуктов экспрессии выше эталонного значения, это указывает на то, что у субъекта имеется аневризма, и причем эталонное значение представляет собой заранее определенный уровень продукта экспрессии, полученный от здорового субъекта или группы здоровых субъектов.
2. Способ in vitro по п. 1, причем, когда продукты экспрессии характеризуются следующими уровнями:
по меньшей мере 15-кратная сверхэкспрессия относительно эталонного значения для COL11A1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для COL5A2, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для TGFB1, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для MMP2, по меньшей мере 12-кратная сверхэкспрессия относительно эталонного значения для MMP9, по меньшей мере 10-кратная сверхэкспрессия относительно эталонного значения для BMP1, по меньшей мере 5-кратная сверхэкспрессия относительно эталонного значения для ITGA4 или по меньшей мере 8-кратная сверхэкспрессия относительно эталонного значения для ITGB1, это дополнительно указывает на высокий риск разрыва аневризмы.
3. Способ in vitro по п. 1, причем уменьшение продукта экспрессии генов после применения схемы лечения аневризмы по сравнению с началом способа лечения или более ранней фазой способа лечения свидетельствует о хорошем ответе субъекта на схему лечения.
4. Применение продукта экспрессии по меньшей мере COL11A1, COL5A2, TGFB1, ITGA4, ITGB1, MMP2, MMP9 и BMP1 в качестве биомаркеров для in vitro диагностики аневризмы, как определено в любом из пп. 1-3.
5. Способ по любому из пп. 1-3 или применение по п. 4, при котором продукт экспрессии представляет собой мРНК.
6. Способ по любому из пп. 1-4, причем мРНК определяют с помощью количественной полимеразной цепной реакции с обратной транскрипцией (RT-qPCR).
7. Способ по любому из пп. 1-4 или 6, при котором биологический образец представляет собой периферическую кровь.
8. Набор для диагностики аневризмы, как определено в любом из пп. 1-4, 6 или 7, при этом указанный набор содержит средство для определения уровня продукта экспрессии по меньшей мере COL11A1, COL5A2, TGFB1, ITGA4, ITGB1, MMP2, MMP9 и BMP1.
9. Набор по п. 8, причем указанный набор содержит средство для определения уровня мРНК из по меньшей мере COL11A1, COL5A2, TGFB1, ITGA4, ITGB1, MMP2, MMP9 и BMP1.
10. Набор по п. 9, причем средство содержит праймеры для амплификации мРНК из по меньшей мере COL11A1, COL5A2, TGFB1, ITGA4, ITGB1, MMP2, MMP9 и BMP1.
| Badylak S | |||
| F., Freytes D | |||
| O., Gilbert T | |||
| W., Extracellular matrix as a biological scaffold material: Structure and function, Acta biomaterialia, 2009, Т | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| pp | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Sundquist E | |||
| et al., Neoplastic extracellular matrix environment promotes cancer invasion in vitro, Experimental Cell Research, 2016, Т | |||
| Способ получения жидкой протравы для основных красителей | 1923 |
|
SU344A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Приспособление для подачи воды в паровой котел | 1920 |
|
SU229A1 |
| ЛИОФИЛИЗИРОВАННЫЙ БИОЛОГИЧЕСКИЙ БИОДЕГРАДИРУЕМЫЙ МИНЕРАЛИЗОВАННЫЙ КОСТНОПЛАСТИЧЕСКИЙ МАТЕРИАЛ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2019 |
|
RU2722266C1 |
Авторы
Даты
2022-05-16—Публикация
2018-05-17—Подача