Изобретение относится к областям медицины, а именно микробиологии, клинической и лабораторной диагностике и иммунологии, касается способа получения гипериммунных сывороток, предназначенных для приготовления иммунобиологических диагностических препаратов (ИДП), с использованием кроликов в качестве животных-продуцентов, и может найти применение при выявлении риккетсий в клинических, эпидемиологических, энзоотических и экспериментальных материалах.
Как известно, патогенные риккетсий вызывают у человека развитие различной тяжести лихорадочных заболеваний (риккетсиозы) [1-5]. Наиболее эпидемиологически значимыми среди них являются заболевания группы лихорадки Ку (возбудитель - С.burnetii), клещевые пятнистые лихорадки - клещевой сыпной тиф Северной Азии (возбудитель - R.sibirica) и эпидемический сыпной тиф (возбудитель - R.prowazekii). Эпидемиология и эпизоотология этих риккетсиозов характеризуются распространением среди людей и животных с помощью членистоногих-переносчиков (вши, блохи), которые выделяют риккетсий с фекалиями или коксальной жидкостью (клещи). Заражение людей, как правило, происходит трансмиссивным, алиментарным, а также, что особо важно, воздушно-пылевым путем или контаминацией выделений переносчиков. Помимо этого распространение риккетсиозов может происходить посредством различных выделений больных животных [1, 6-14].
По распространенности на территории России постоянных природных очагов с циклической активацией и постоянным расширением границ ареалов, а также тяжести протекания болезни с ее возможной хронизацией клещевой сыпной тиф Северной Азии (R.sibirica) и лихорадка Ку (С.burnetii) на сегодняшний день актуальны и имеют высокое эпидемиологическое значение [9, 15-23].
Также, несмотря на почти повсеместную ликвидацию в развитых странах эпидемического сыпного тифа, R.prowazekii продолжают являться угрозой применения их в качестве биологического оружия или завоза данного заболевания с эндемичных территорий. По данным официальной статистики, эпидемический сыпной тиф (R.prowazekii) в России регистрируется только в виде его носительства - болезни Брилля-Цинсснера, однако в других странах с неблагоприятными санитарно-эпидемиологическими условиями он часто вызывает эпидемии. В то же время возрастающий уровень заболеваемости педикулезом на территории России и одновременно отсутствие иммунизированных групп населения могут явиться причиной и благоприятным условием для развития эпидемии сыпного тифа. Велика также вероятность завоза риккетсиозов из стран (трудовая миграция, беженцы), эндемичных по данным заболеваниям [18, 24-28].
Вместе с тем, следует отметить, что при регистрации стабильной заболеваемости риккетсиозами наблюдается гиподиагностика данных инфекций ввиду отсутствия ИДП, выпускаемых в промышленных условиях, предназначенных для выявления риккетсий вышеперечисленных групп.
На сегодняшний день для диагностики риккетсиозов предложено использовать следующие группы лабораторных методов:
- серологические (реакция нейтрализации, реакция агглютинации (РА) реакции торможения гемагглютинации, реакция связывания комплемента (РСК), реакция диффузионной преципитации в агаре и др.);
- иммунохимические (иммуноферментный анализ (ИФА), радиоиммунный анализ, метод флюоресцирующих антител (МФА), иммунная хроматография и др.);
- молекулярно-биологические (полимеразная цепная реакция (ПЦР), реакция молекулярной гибридизации, анализ полиморфизма длин регистрационных фрагментов, секвенирование геномных нуклеиновых кислот и др.).
При этом наиболее быстрыми, специфичными и чувствительными, по мнению большинства исследователей, являются МФА и ПЦР [10, 18, 21, 29-32]. Для ПЦР в настоящее время созданы наборы праймеров для идентификации почти всех представителей риккетсиозов. Указанный метод является высокоспецифичным и чувствительным, однако в силу необходимости использования специального оборудования и стационарных условий проведения реакций, а также из-за значительной стоимости исследованных проб его проводят в основном при осуществлении научных исследований. Кроме того, в случаях присутствия в пробах «уклоняющихся» (генетически модифицированных) штаммов риккетсий метод ПЦР становится нечувствителен. В связи с этим данный метод пока недоступен как для проведения массовых клинико-диагностических исследований, так и для осуществления индикации и идентификации риккетсий в полевых условиях [26].
МФА, напротив, не требует оснащения дорогостоящим приборным оборудованием, высокоспецифичен, чувствителен и экономичен, не требует больших затрат времени, позволяет проводить массовые обследования при минимальных трудозатратах и в любых условиях, поэтому вполне доступен большинству медицинских учреждений. Однако следует отметить проблемы, возникающие при приготовлении риккетсиозных ИДП для МФА, связанные прежде всего с их невысокой иммуногенностью при иммунизации животных-продуцентов и получением иммунных сывороток с низкими титрами, а также с большими материальными затратами на содержание животных в течение достаточно длительного цикла иммунизации (до 6 мес и более). Повышение при этом эффективности иммунизации, то есть получение гипериммунных сывороток (иммунных сывороток с высоким содержанием специфических антител) - основного субстрата для приготовления ИДП - за минимальные сроки, является наиболее сложной задачей, реализацию которой осуществляют либо путем совершенствования схем иммунизации, либо использованием при иммунизации препаратов, способных усиливать иммунный ответ на введение антигенов [33-42].
Учитывая, что все звенья иммунореактивности находятся под контролем цитокинов, экспрессия генов иммуноглобулинов в клетках-мишенях (В-лимфоцитах), отвечающих за гуморальный ответ, происходит под влиянием цитокинов - ИЛ 1, 2, 3, 4, 5 и 6, а действие традиционных адъювантов на дальнейший ход иммунных процессов также опосредуется определенными цитокинами [36, 41, 43-45]. В начале 1990 гг. было высказано предположение о возможности использования цитокинов в качестве адъювантов вакцин [46]. Результаты последующих исследований подтвердили правильность этого предположения. При этом среди цитокинов перспективными в плане адъювантной активности рассматриваются ИЛ-2 и препараты на его основе, что, по-видимому, неслучайно, поскольку данный цитокин - один из ключевых компонентов цитокиновой сети, занимающий важное место в иммуногенезе вследствие своих биологических и иммунотропных эффектов: индукция пролиферации В-лимфоцитов, активация цитотоксических Т-лимфоцитов, стимуляция естественных киллеров, стимуляция синтеза и секреции ИЛ-4, ИЛ-6, интерферона-γ, колониестимулирующего фактора и фактора некроза опухоли [47, 48]. Мишенью действия ИЛ-2 являются клетки, имеющие на поверхности мембраны специфический высокоаффинный рецептор, взаимодействуя с которым цитокин способствует активации и пролиферации иммунокомпетентных клеток и развитию иммунного ответа на антигенное воздействие вне зависимости от его природы. Именно благодаря таким иммунотропным эффектам ИЛ-2 проявил себя иммунологическим адъювантом в отношении вакцин против ящура, бронхопневмоний и вирусных диарей крупного рогатого скота, а также гемофильной плевропневмонии свиней [49, 50]. В экспериментальных условиях ИЛ-2 достаточно эффективно повышал иммуногенные свойства ДНК-вакцин против ВИЧ-инфекции [51-53], осповакцины [54] и герпеса [55]. В клинической практике адъювантный эффект низких доз ИЛ-2 продемонстрирован при сочетанном его введении с гриппозной вакциной. При этом пациенты, получавшие вакцину вместе с ИЛ-2, были более устойчивы к гриппозной инфекции [56].
Не менее выраженными адъювантными свойствами обладали рекомбинантные аналоги ИЛ-2. Так, в экспериментальных условиях под влиянием пролейкина повышалась иммуногенность ДНК-вакцины вирусного гепатита В, поксвирусной рекомбинантной вакцины, экстракта вируса простого герпеса (HSV-2) или рекомбинантного гликопротеина D, выделенного из HSV-2. В аналогичных условиях адъювантные свойства были установлены и у другого рекомбинантного аналога ИЛ-2 - отечественного препарата ронколейкина, применение которого способствовало повышению в среднем на 30% иммуногенности вакцины герпетической культуральной инактивированной сухой, вакцины венесуэльского энцефаломиелита лошадей инактивированной сорбированной жидкой, полианатоксина против ботулизма и раневых клостридиозов по сравнению с их применением без иммунологического адъюванта [48, 57, 58].
В то же время данные об использовании препаратов на основе ИЛ-2 с целью повышения иммуногенных свойств риккетсиозных антигенов, в том числе для получения гиперимунных сывороток, в настоящее время в доступных источниках информации отсутствуют.
В качестве прототипа принят способ [59-62], широко применяемый в технологии получения риккетсиозных ИДП и наиболее близкий к предлагаемому изобретению по технической сущности и качеству получаемых риккетсиозных иммунных сывороток. В соответствии со способом-прототипом проводится иммунизация кроликов-самцов породы «Шиншилла» 10-12-месячного возраста и массой 2,5-3,0 кг поэтапно (в два этапа - первичная иммунизация и реиммунизация) и при первичной иммунизации предусматривается введение внутримышечно дважды, с интервалом в 7 сут, смеси 10% суспензии инфекционного риккетсиозного материала, представляющего собой гомогенизированные оболочки желточных мешков куриных эмбрионов, инфицированных R.prowazekii, с равным по объему количеством полного адъюванта Фрейнда (по 0,5 мл каждого при первой инъекции и по 0,75 мл каждого при повторной инъекции). Для риккетсий вида С.burnetii или R.sibirica используется 10% суспензия инфекционного риккетсиозного материала, полученного из селезенок беспородных белых мышей массой 16-18 г, инфицированных этими возбудителями.
Через 120 сут при условии снижения титров антител, продуцированных в результате первичной иммунизации, до 1:20-1:80 осуществляется второй этап иммунизации (реиммунизация), предусматривающий четыре внутрибрюшинные инъекции и введение инфекционного материала (10% суспензии риккетсий) без адъюванта в возрастающих дозах, составляющих 1,0, 1,5, 2,0 и 2,5 мл, и с интервалом после каждого введения 3 сут.
Тотальный забор крови для приготовления сывороток осуществляется на 21 сут после последней внутрибрюшинной инъекции и при титрах специфических антител в непрямом методе флюоресцирующих антител (НМФА) не ниже 1:1280-1:2560. Продолжительность полного цикла иммунизации при этом составляет 158 сут.
Широкому использованию способа-прототипа препятствуют низкий титр специфических антител в получаемой иммунной сыворотке по окончании проведения иммунизации, высокая разовая нагрузка на организм животных антигенным материалом, что может привести к их гибели, а также продолжительное нахождение животных в эксперименте и связанный с этим высокий уровень материальных затрат на расходы по уходу за ними и кормлению. Следует также отметить высокую трудоемкость способа-прототипа в связи с необходимостью проведения на этапе реиммунизации четырех внутрибрюшинных инъекций инфекционного материала, связанных с повышенной травматизацией животного-продуцента.
Указанные существенные недостатки свидетельствуют о невозможности широкого использования способа-прототипа при производстве риккетсиозных ИДП на основе получаемых иммунных сывороток в промышленных условиях.
Цель изобретения заключается в изыскании способа получения гипериммунных кроличьих сывороток, пригодных для приготовления иммунобиологических диагностических препаратов, предназначенных для выявления актуальных в эпидемиологическом отношении риккетсиозов, отличающегося простотой проведения и низким уровнем материальных затрат на содержание животных и оплату труда персонала, минимальными сроками иммунизации, а полученные сыворотки - высокой специфической активностью.
Указанная цель достигается путем создания и применения способа, обеспечивающего получение в существенно более короткие сроки риккетсиозных гипериммунных сывороток с высокой специфической активностью, пригодных для приготовления ИДП, предназначенных для выявления актуальных в эпидемиологическом отношении риккетсиозов.
Основу заявляемого способа составляет двухэтапная схема иммунизации кроликов-самцов породы «Шиншилла» 10-12-месячного возраста массой 2,5-3,0 кг как наиболее эффективная для приготовления риккетсиозных иммунных сывороток, при которой после первой инъекции антигена с последующим перерывом делают повторные инъекции антигенов. Для проведения первичной иммунизации использовался опыт получения антител к низкомолекулярным гормонам - паравертебральная внутрикожная многоточечная иммунизация кроликов микродозами смеси антигена с полным адъювантом Фрейнда [40]. Паравертебральный внутрикожный способ аппликации антигенного материала был выбран не случайно, поскольку он отличается от других путей введения антигена вследствие наличия в коже большого числа различных специфических и неспецифических антигенпрезентирующих иммунных клеток [39, 63]. Помимо этого кожные покровы содержат большое количество различных субпопуляций Т-лимфоцитов, осуществляющих функции местного адаптивного иммунитета кожи [64, 65], дендритных клеток, естественных киллеров, синтезирующих и секретирующих гуморальные факторы врожденного иммунитета. За счет этого в коже могут самостоятельно происходить все необходимые этапы полноценного иммунного ответа на антигенное воздействие: первичное распознавание антигена, фагоцитоз, презентация антигена, клональная экспансия специфических Т-лимфоцитов и генерация эффекторных иммунных реакций [66]. Кроме того, освобождение небольших количеств (микродоз) антигена из многих участков происходит значительно быстрее, чем освобождение его большого объема из одного участка.
Сущность заявляемого способа заключается также в том, что в отличие от способа-прототипа в схеме реиммунизации (на втором этапе) используют основной противовоспалительный цитокин - интерлейкин-2, запускающий весь «цитокиновый каскадный механизм», что способствует коррекции цитокинового дисбаланса и стимуляции более эффективного антителообразования у животных-продуцентов.
Кроме того, указанный цитокин вводят в виде рекомбинантного ИЛ-2 - ронколейкина, являющегося структурным и функциональным аналогом эндогенных белков [67]. Данное обстоятельство позволяет, с одной стороны, снизить вероятность возникновения аллергических реакций при иммунизации и, с другой стороны, направленно влиять на клеточное и гуморальное звено иммунного ответа.
Возможность достижения цели изобретения подтверждается результатами проведенных исследований, представленными в следующих примерах.
Пример 1. Реализация заявляемого способа получения риккетсиозных гипериммунных сывороток.
Для иммунизации использовали кроликов-самцов породы «Шиншилла» 10-12-месячного возраста массой 2,5-3,0 кг. Суть заявляемого способа заключается в том, что иммунизацию кроликов проводят поэтапно (в два этапа) и для его осуществления используют 10% суспензию инфекционного риккетсиозного материала (на первом этапе иммунизации) и инактивированные антигены соответствующих возбудителей риккет-сиозов (на этапе реиммунизации).
На первом этапе иммунизации (первичная иммунизация) инфекционный риккетсиозный материал вводят однократно и совместно с адъювантом Фрейнда (вводится в объеме, в 1,5 раза превышающем объем инфекционного материала), внутрикожно в 40 точек паравертебрально (вдоль позвоночника животного-продуцента). Паравертебральный внутрикожный способ аппликации антигенного материала с повышенным содержанием адъюванта осуществляется с целью стимуляции максимального первичного иммунного ответа на введение антигена на первом этапе иммунизации.
При первичной иммунизации в соответствии с заявляемым способом внутрикожно вводят смесь 10% суспензии инфекционного материала, взятого в объеме 0,5 мл, и полного адъюванта Фрейнда, взятого в объеме 0,75 мл.
В качестве инфекционного риккетсиозного материала используют гомогенизированные оболочки желточных мешков куриных эмбрионов, инфицированных R.prowazekii, или гомогенизированные селезенки беспородных белых мышей массой 16-18 г, инфицированных С.burnetii или R.sibirica.
Смесь 10% суспензии инфекционного риккетсиозного материала и полного адъюванта Фрейнда вводят микродозами в 40 точек вдоль позвоночника животного-продуцента.
Через 45 сут при условии снижения титров антител, продуцированных в результате первичной иммунизации, до 1:20-1:80, начинают второй этап иммунизации (реиммунизацию), предусматривающий четыре внутривенные инъекции инактивированных антигенов соответствующих возбудителей риккетсиозов в концентрации не менее 4-х антигенных единиц в 1 мл и в возрастающих дозах, составляющих 1,0, 1,5, 2,0 и 2,5 мл, с интервалом после каждого введения антигена 3 сут. При этом используют коммерческие диагностикумы, содержащие инактивированные антигены возбудителей риккетсиозов для проведения серодиагностики по реакции связывания комплемента (РСК): диагностикум риккетсиозный Провачека для РСК сухой (ФСП 42-0504-7378-06), диагностикум риккетсиозный Сибирика для РСК сухой (ФСП 42-0504-7377-06), диагностикум коксиеллезный Бернета для РСК сухой (ФС 42-2 ВС-91) (НПО «Микроген», Москва).
В отличие от способа-прототипа на этапе реиммунизации при осуществлении заявляемого способа наряду с внутривенными инъекциями инактивированных антигенов соответствующих возбудителей риккетсиозов дополнительно подкожно вводят рекомбинантный ИЛ-2 челевека (ронколейкин) в объеме 1,0 мл и в дозе 250000 ME для коррекции цитокинового дисбаланса и дополнительной стимуляции антителообразования.
Забор крови для приготовления сывороток осуществляют на 14 сут после последней внутривенной инъекции инактивированных антигенов соответствующих возбудителей риккетсиозов и при титрах специфических антител в НМФА не ниже 1:5120-1:10240.
Продолжительность полного цикла иммунизации в соответствии с заявляемым способом составляет 68 сут.
Пример 2. Сравнительная оценка уровней специфической активности кроличьих сывороток, полученных заявляемым способом и способом-прототипом.
Для сравнительной оценки в НМФА уровней специфической активности кроличьих сывороток, полученных заявляемым способом и способом-прототипом, использовали кроликов-самцов породы «Шиншилла» 10-12-месячного возраста массой 2,5-3,0 кг.
Критериями специфической активности приготовленных кроличьих сывороток служили титры антител в реакции НМФА при разведении сывороток от 1:160 до 1:10240.
Забор крови для оценки специфической активности осуществляли из краевой вены уха кроликов на 10 сут после последнего введения инактивированных антигенов соответствующих возбудителей риккетсиозов, а на 14 сут осуществляли тотальный забор крови. Ретракцию сгустков крови осуществляли в термостате при температуре 37°С в течение 30-40 мин, после чего сосуды с забранной кровью отстаивали в течение 1 сут при температуре 4°С. Отделившуюся от сгустка крови сыворотку в дальнейшем использовали для последующих этапов производства риккетсиозных ИДП.
Результаты сравнительной оценки уровней специфической активности риккетсиозных сывороток, полученных заявляемым способом и способом-прототипом, и статистической обработки данных, полученных при титровании соответствующих кроличьих сывороток в НМФА с использованием критерия Манна-Уитни, представлены в таблице 1.
Как видно, заявляемый способ по сравнению со способом-прототипом имеет ряд преимуществ. Так, получаемые при его использовании иммунные кроличьи сыворотки обеспечивают более высокие (в 4-8 раз) титры антител, причем ко всем изучаемым эпидемиологически значимым возбудителям риккетсиозов (R.prowazekii, R.sibirica, С.burnetii). Кроме того, заявляемый способ позволяет получить риккетсиозные сыворотки в более короткие сроки (68 сут вместо 158 сут).
Пример 3. Сравнительная оценка количественных показателей γ-глобулинов, полученных заявляемым способом и способом-прототипом.
Критериями оценки служили объем, содержание белка и процентный выход γ-глобулиновых фракций при их экстракции из полученных сывороток. Оценку проводили с применением стандартного метода по Нечаевой А.С. [68].
Среднегеометрические количественные показатели фракций γ-глобулинов, выделенных из полученных с применением способа-прототипа или заявляемого способа сывороток, представлены в таблице 2. Установлено, что в случае использования заявляемого способа объем получаемой γ-глобулиновой фракции в 2 раза больше и содержание в ней белка увеличено в 2,9 раз. При этом выход γ-глобулиновой фракции по белку также увеличился в 2,1 раз.
Для приготовления 1000 мл 1% по белку флюоресцирующих иммуноглобулинов с применением способа-прототипа необходимо получить от животных-продуцентов около 700-800 мл исходной авидной иммунной сыворотки, содержащей примерно 6-7% белка. При этом необходимо иммунизировать 20 кроликов. В то же время для получения 1000 мл 1% по белку флюоресцирующих иммуноглобулинов в соответствии с заявляемым способом достаточно 300-400 мл гипериммунной сыворотки, содержащей 17-18% белка, что можно обеспечить при иммунизации 5 кроликов.
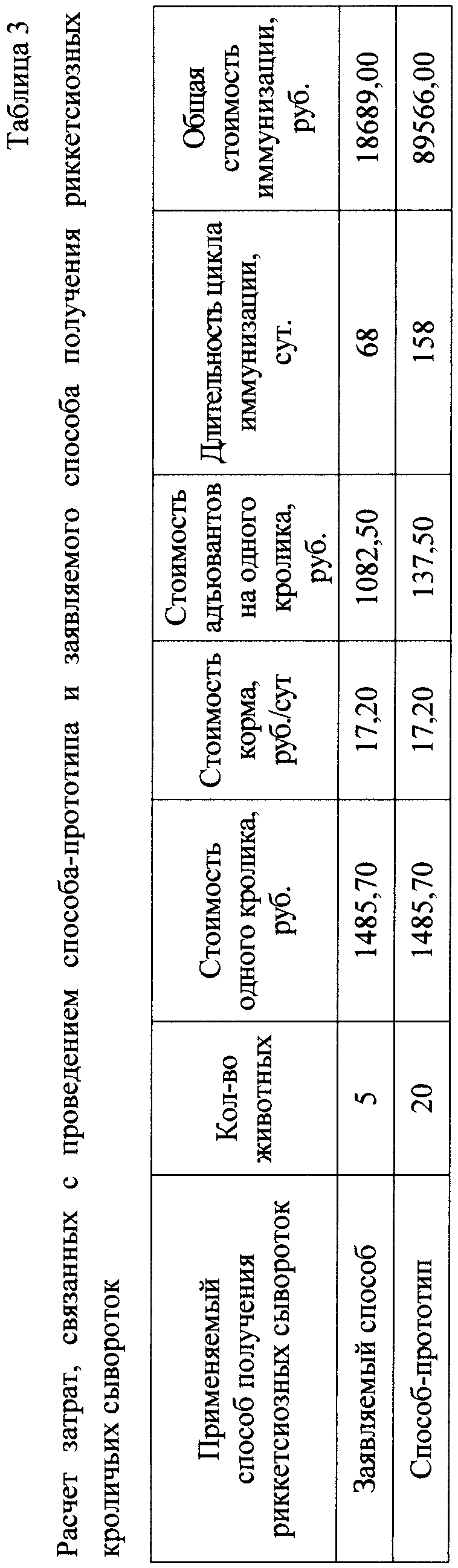
Пример 4. Результаты расчета затрат на проведение способа-прототипа и заявляемого способа получения риккетсиозных кроличьих сывороток.
Критериями при расчете затрат, связанных с проведением применяемых способов получения риккетсиозных сывороток, служили: стоимость животных-продуцентов и нормативы их кормления, а также стоимость адъювантов, используемых при иммунизации, трудозатраты и заработная плата сотрудников за один производственный цикл получения сывороток.
Результаты расчета затрат на проведение заявляемого способа и способа-прототипа приведены в таблице 3, из которой следует, что материальные затраты на содержание животных-продуцентов и приобретение адъювантов, использованных при иммунизации с применением заявляемого способа, уменьшились с 89566,00 руб. до 18689,00 руб., то есть снизились в 4,7 раз по сравнению со способом-прототипом.
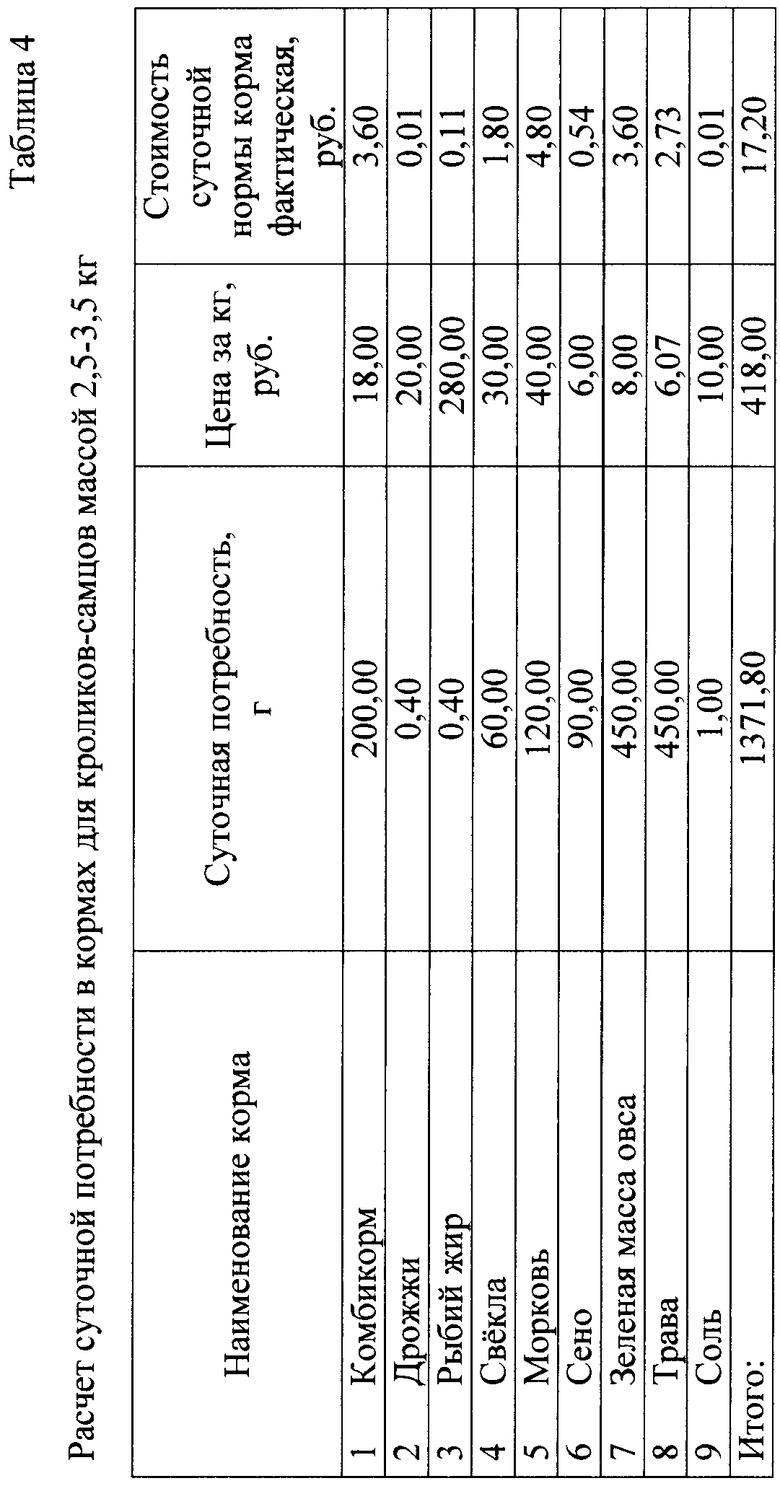
При расчете стоимости полного рациона корма на одного кролика в течение суток исходили из норм довольствия на кг веса животного и средних рыночных цен на корма. Так, например, для одного кролика массой 2,5-3,5 кг в течение суток необходимо 200 г комбикорма, 120 г моркови, 60 г свеклы, 90 г сена, по 450 г зеленой массы овса и травы, по 4 г дрожжей и рыбьего жира и 1 г соли. Расчеты суточной потребности в кормах для кроликов и затрат на их приобретение по среднерыночным ценам приведены в таблице 4.
В таблице 5 приведены расчеты трудозатрат и заработной платы сотрудников за один производственный цикл получения риккетсиозных сывороток при средней заработной плате лаборанта, составляющей 17000 руб., и научного сотрудника - 28000 руб. Как видно, заявляемый способ получения гипериммунных сывороток позволяет снизить трудозатраты в 5,2 раз по сравнению со способом-прототипом.
Для иммунизации 20 кроликов с применением способа-прототипа необходимо как минимум два лаборанта и два научных сотрудника. Из 158 сут нахождения животных-продуцентов в иммунизации 116 сут являлись полными рабочими днями. При расчете трудозатрат ориентировались только на рабочие дни, и общая величина трудозатрат в данном случае составила 449,4 чел./ч. Заработная плата начислялась с учетом количества проработанных месяцев (5,26 мес) за 158 сут и составила для двух лаборантов 179066,60 руб., для двух научных сотрудников - 294933,33 руб., что в сумме составило 428999,93 руб.
В то же время для иммунизации 5 животных заявляемым способом достаточно всего двух человек: лаборанта и научного сотрудника. Иммунизация длилась 68 сут, из которых 50 сут являлись полными рабочими днями. Трудозатраты на 2 сотрудников составили 86,4 чел./ч, что в 5,2 раз меньше трудозатрат при производстве сывороток способом-прототипом. Заработная плата учитывалась за фактическое количество проработанных мес (68 сут или 2,26 мес) и составила для научного сотрудника 63280,00 руб., для лаборанта - 3842 0,00 руб., а в сумме - 101700,00 руб. Как видно, использование заявляемого способа позволяет обеспечить экономию фонда заработной платы, то есть снизить его в 4,2 раз.
Установлено, что получение риккетсиозных гипериммунных сывороток - основного субстрата для приготовления ИДП, с использованием многоточечной внутрикожной аппликации риккетсиозных антигенов при первичной иммунизации и применением ИЛ-2 при реиммунизации позволяет снизить материальные затраты на содержание животных-продуцентов и приобретение адъювантов в 4,7 раз, в 5,2 раз уменьшить уровень трудозатрат за один производственный цикл получения гипериммунных риккетсиозных сывороток, а также снизить фонд заработной платы в 4,2 раз.
Таким образом, положительный эффект от использования заявляемого способа получения риккетсиозных сывороток заключается в следующем:
1. Существенно сокращается (в 2,3 раз) время иммунизации животных-продуцентов (со 158 сут до 68 сут), снижаются в 4,7 раз материальные затраты на содержание животных-продуцентов и приобретение адъювантов, уменьшается в 5,2 раз уровень трудозатрат за один производственный цикл получения гипериммунных риккетсиозных сывороток, снижается в 4,2 раз фонд заработной платы.
2. Полученные гипериммунные сыворотки по накопленным титрам риккетсиозных антител в 4-8 раз превосходят сыворотки, полученные с применением способа-прототипа.
3. Для накопления 1% по белку флюоресцирующих иммуноглобулинов требуется иммунизация всего 5 кроликов вместо 20.
4. Заявляемый способ одинаково применим как к сильноиммуногенным (С.burnetii и R.prowazekii), так и к слабоиммуногенным (R.sibiricd) возбудителям риккетсиозов.
Заявляемое изобретение удовлетворяет критерию «новизна», так как впервые предложен способ получения гипериммунных риккетсиозных сывороток, пригодных для приготовления иммунобиологических диагностических препаратов, необходимых для выявления актуальных в эпидемиологическом отношении возбудителей риккетсиозов (С.burnetii, R.prowazekii, R.sibiricd), обеспечивающий за счет многоточечной внутрикожной паравертебральной аппликации антигенов при первичной иммунизации и введения рекомбинантного человеческого ИЛ-2 (ронколейкина) при реиммунизации стимуляцию более эффективного антителообразования у животных-продуцентов и получение риккетсиозных сывороток с высокой специфической активностью в существенно более короткие сроки.
Заявляемое изобретение удовлетворяет критерию «изобретательский уровень», так как из доступных источников информации не является очевидным целесообразность включения в схему первичной иммунизации животных-продуцентов внутрикожной паравертебральной аппликации антигенов, предусматривающей введение в 40 точек микродоз смеси риккетсиозных антигенов с полным адъювантом Фрейнда, использования при реиммунизации рекомбинантного ИЛ-2 человека и его оптимальная доза, а также возможность повышения за счет этого уровня титров специфических антител в получаемых сыворотках до 1:10240.
Соответствие критерию «пригодность для применения» доказывается результатами проведенных экспериментальных исследований, из которых видно, что заявляемый способ прост в проведении, отличается высокой эффективностью иммунизации, достаточной для практического применения в качестве схемы получения кроличьих гипериммунных сывороток в высоких титрах как к сильно-, так и слабоиммуногенным возбудителям риккетсиозов. Предлагаемый способ позволяет в более короткий срок и с меньшими материальными затратами получать гипериммунные сыворотки (основной субстрат для изготовления риккетсиозных иммунобиологических диагностических препаратов) в производственных масштабах и может быть легко освоен отечественной промышленностью.
Источники инфомации
1. Балашов Ю.С. Кровососущие членистоногие и риккетсии / Ю.С.Балашов, А.Б.Дайтер. - Л.: Наука, 1973. - 251 с.
2. Лобзин Ю.В. Руководство по инфекционным болезням / Ю.В.Лобзин. - СПб.: Фолиант, 2003. - 1040 с.
3. Лукин Е.П. Риккетсиозы: эпидемиологическая оценка / Е.П.Лукин, А.А.Махлай, B.C.Перепелкин // Воен. мед. журн. - 1997. - №8. - С.25-33.
4. Мусабаев И.К. Руководство по риккетсиозам, геморрагическим лихорадкам и энцефалитам / И.К.Мусабаев. - Ташкент: Медицина. - 1986. - 470 с.
5. Rickettsial infections and fever, Vientiane, Laos / S. Phongmany [et al.] // Emerg Infect Dis. - 2006. - Vol.12. - P.256-262.
6. Алексеев В.В. Аэрогенные инфекции в аспекте проблемы биотерроризма / В.В.Алексеев, Н.Г.Тихонов, А.В.Липницкий // Пробл. особо опасн. инф. - Вып.85. - 2003. - С.20-28.
7. Воробьев А.А. Оценка вероятности использования биоагентов в качестве биологического оружия / А.А.Воробьев // Эпидемиология и инфекционные болезни. - 2001. - №6. - С.54-56.
8. Здродовский П.Ф. Учение о риккетсиях и риккетсиозах / П.Ф.Здродовский, Е.М.Голиневич. - М.: Медицина, 1972. - 496 с.
9. Зуева Л.П. Эпидемиология / Л.П.Зуева, Р.X.Яфаев. - СПб.: Фолиант, 2005. - 752 с.
10. Лобан К.М. Риккетсиозы человека: руководство для врачей / К.М.Лобан, Ю.В.Лобзин, Е.П.Лукин. - СПб.: Элби, 2002. - 474 с.
11. Лукин Е.П. Элементы патогенеза риккетсиозов в свете современных данных / Е.П.Лукин, А.А.Воробьев, А.А.Махлай // Вестник РАМН. - 1999. - №12. - С.7-13.
12. Biological weapons / Kerwat К. [et al.] // Dtsch. Med. Wochenschr. - 2010 - Vol.135, №33. - P.1612-1616.
13. Kagawa F.T. Q fever as a biological weapon / F.T.Kagawa, J.Н.Wehner, V.Mohindra // Semin Respir Infect. - 2003. - Vol.18. - P.183-195.
14. Oyston P.C. Q fever: the neglected biothreat agent / P.C.Oyston, C.Davies // J. Med. Microbiol. - 2011. Vol.60, Pt.1. - P.9-21.
15. Дайтер А.Б. Лихорадка Ку. Руководство по эпидемиологии инфекционных болезней / А.Б.Дайтер, И.В.Тарасевич / М.: Медицина. - 1993. - Т.1. - С.333-420.
16. Лобан К.М. Лихорадка Ку / К.М.Лобан. - М.: Медицина, 1987. - 128 с.
17. Новые и возвращающиеся природно-очаговые инфекции и проблемы эндоцитобиоза клещевых микроорганизмов / Н.В.Рудаков // Медицина в Кузбассе. Спец. выпуск №5. - 2008. - С.129-133.
18. Опасные инфекционные заболевания. Учебное пособие / Под ред. В.В.Алексеева. - Волгоград: НП «Здоровье и экология», 2006. - 368 с.
19. Рудаков Н.В. Коксиеллез в Российской Федерации / Н.В.Рудаков, Н.Ф.Фетисова, Т.Г.Сыскова // ЗниСО. - 1994. - №2 (11). - С.10-12.
20. Рудаков Н.В. Современное состояние очагов клещевого риккетсиоза / Н.В.Рудаков, И.Е.Самойленко, С.Н.Шпынов // ЗниСО. - 1998. - №1 (приложение). - С.12-14.
21. Тарасевич И.В. Риккетсиозы. Природная очаговость болезней: исследования Ин-та Гамалеи РАМН / И.В.Тарасович, Н.Ф.Фетисова, В.А.Макарова // Ред. Коренберга Э.И. - М.: Русаки, 2003. - С.64-98.
22. Тарасеви, И.В. Коксиеллез (лихорадка Ку) / И.В.Тарасевич // Частная эпидемиология. - М.: Медицина, 2002. - Т.2. - 287 с.
23. Baca О.G. Q fever and Coxiella burnetii: a model for host-parasite interactions / О.G. Baca, D.Paretsky // Microbiol. Rev. - 1983. - Vol.47. - P.127-149.
24. Громашевский Л.В. Сыпной тиф / Л.В.Громашевский // Общая и частная эпидемиология. - М.: Медицина, 1973. - Т.2 - 124 с.
25. Инфекционная заболеваемость в Северо-Западном федеральном округе России. Закономерности и особенности эпидемического процесса в современный период. Аналитический обзор. - СПб.: Феникс, 2007. - 216 с.
26. Тарасевич И.В. Современные представления о риккетсиозах / И.В.Тарасевич // Клиническая микробиология и антимикробная химиотерапия. - 2005. - №2. - Т.7. - С.119-129.
27. Тихонов Н.Г. Лихорадка Ку и сыпной тиф в Волгоградской области / Н.Г.Тихонов, Т.П.Пашанина, В.Ф.Игнатович // Эпидемиол. и инфекц. болезни. - 1999. - №4. - С 12-15.
28. Токаревич Н.К. Изменение сыпного тифа на протяжении последнего столетия / Н.К.Токаревич, Ф.И.Красник // Тр. Ин-та им. Пастера. - Л., 1975. - Т.43. - С.21-25.
29. Behbehani A.М. Laboratory diagnosis of viral, bedsonial and rickettsial diseases / A.М.Behbehani // Springfield (III). - 1972. - P.229.
30. Detection of Coxiella burnetii in different biological samples by polymerase chain reaction (PCR) / N.K.Tokarevich [et al.] // American society for rickettsiology - Bartonella as an emerging pathogen group. Big Sky, Montana. - 2001. - P.86.
31. Fournier P.E. Diagnosis of Q fever / P.E.Fournier, T.J.Marrie, D.Raoult // J. Clin. Microbiol. - 1998. - Vol.36, №7. - P.1823-1834.
32. Peruski A.Н. Immunological Methods for Detection and Identification of Infectious Disease and Biological Warfare Agents / A.H.Peruski, L.F.Peruski // Clin. Diagn. Lab. Immunol. - 2003. - Vol.10(4). - P.506-513.
33. Антитела. Методы: Кн. 1: пер. с англ. / Под ред. Д.Кэтти. - М.: Мир, 1991. - 287 с.
34. Антитела. Методы: Кн. 2: пер. с англ. / Под ред. Д.Кэтти. - М.: Мир, 1991. - 384 с.
35. Иммунология / Д.Мейл [и др.] - М.: Логосфера. - 2007. - 556 с.
36. Медуницын Н.В. Цитокины и вакцины / Н.В.Медуницын [и др.] // Медицинская иммунология. - 2001. - Т.3, №3. - С.439-447.
37. Медуницын Н.В. Основы иммунопрофилактики и иммунотерапии инфекционных болезней / Н.В.Медуницын, В.И.Покровский - М.: ГЭОТАР-Медиа, 2005. - 512 с.
38. Ройт А. Иммунология / А.Ройт, Дж.Бростофф, Д.Мейл. - М.: Мир, 2000. - 592 с.
39. Сепиашвили Р.И. Основы физиологии иммунной системы / Р.И.Сепиашвили. - М.: Медицина. - 2003. - 239 с.
40. Чард Т. Радиоиммунологические методы / Т.Чард. - М.: Мир, 1981. - 248 с.
41. Heath A.W. Cytocines as immunological adjuvants / A.W.Heath, J.H.L. Playfair // Vaccine. - 1992. - Vol.10. - P.427-434.
42. Pasquini S. Cytokines and costimulatory molecules as genetic adjuvants / S.Pasquini [et al.] // Immunol. Cell Biol. - 1997. - Vol.75. - №4. - P.397-401.
43. Возианов А.Ф. Цитокины: биологические и противоопухолевые свойства / А.Ф.Возианов, А.К.Бутенко, К.П.Зак. - Киев.: Наукова думка, 1998. - 317 с.
44. Дранник Г.Н. Клиническая иммунология и аллергология. / Г.Н.Дранник. - Одесса: АстроПринт. - 1999. - 604 с.
45. Никитина Т.Н. Иммуноадъювантное действие цитокинов при иммунизации животных вакциной против гепатита В / Т.Н.Никитина, Ж.И.Авдеева // Цитокины и воспаление. - 2009. - Т.8, №1. - С.28-31.
46. Notria A. Cytokines as potencial vaccine adjuvants / A.Notria, R.H.Rubin // Biotherapy. - 1994. - Vol.7. - P.261-269.
47. Авдеева Ж.И. Цитокины и вакцины / Ж.И.Авдеева [и др.] // Тихоокеанский медицинский журнал. - 2009. - №3. - С.22-27.
48. Перспективы применения ронколейкина в качестве адъюванта вакцин / А.В. Степанов [и др.] - СПб.: Изд. Дом, 2006. - 54 с.
49. Influence of recombinant bovine interleukin-1 and interleukin-2 in pigs vaccinated and challenged with Streptococcus suis / F.Blecha [et al.] // Vet. Immunol. Immunopathol. - 1995. - Vol.44, №3-4. - P.329-346.
50. Intrleukin 2 and protective immunity in Hemophilus pleuropneumoniae. Preliminary studies / G.Anderson [et al.] // In: Vaccines, Cold Spring Harbor Press. - 1987. - Vol.38. - P.22-25.
51. Coimmunization with IFN-gamma or IL-2, but not IL-13, or IL-4 cDNA can enhance Th-1 type DNA vaccine-induced immune responses in vivo / J.J.Kim [et al.] // J. Interferon Cytokine Res. - 2000. - Vol.20, №3. - P.311-319.
52. Cytokine molecular adjuvants modulate immune responses induced by DNA vaccine constructs for HIV-1 and SIV / J.J.Kim [et al.] // J. Interferon Cytokine Res. - 1999. - Vol.19, №1. - P.77-84.
53. Intranasal administration of human immunodeficiency virus type-1 (HIV-1) DNA vaccine with interleukin-2 expression plasmid enhances cell-mediated immunity against HIV-1 / K.Q.Xin [et al.] // Immunology. - 1998. - Vol.94, №3. - P.438-444.
54. IL-2 enhances the function of recombinant poxivirus-based vaccines in the treatment of established pulmonary metastases / V.Bronte [et al.] // J. Immunol. - 1995. - Vol.154. - P.5282-5292.
55. Adjuvant-independent enhanced immune responses to recombinant herpes simplex virus type I glycoprotein D by fusion with biologically active interleukin-2 / M.Hazama [et al.] // Vaccine. - 1993. - Vol.11. - P.629-636.
56. Adjuvant effects of low dose interleukin-2 on antibody response to influenza virus vaccination in healthy elderly subjects / M. Provincial [et al.] // Mech. Aging Dev. - 1994. - Vol.77. - P.75-82.
57. Козлов В.К. Коррекция дисфункций иммунной системы Ронколейкином / В.К.Козлов, М.Ф.Лебедев, В.Н.Егорова // Terra Medica. - 2001. - №2. - С.12-14.
58. Коррекция иммунореактивности рекомбинантным интерлейкином-2: пособие для врачей / В.К.Козлов [и др.]. - СПб.: Изд. СПбГУ, 2001. - 24 с.
59. Инструкция по изготовлению и контролю иммуноглобулина люминесцирующего диагностического к риккетсиям группы клещевой пятнистой лихорадки мышиного сухого / Р.Б.Гольдин [и др.] // Утверждена начальником Научно-исследовательского института военной медицины 24.12.1982. - Л.: [Б.и.], 1982. - 40 с.
60. Инструкция по изготовлению и контролю иммуноглобулинов диагностических риккетсиозных полигрупповых люминесцирующих кроличьих сухих / Р.Б.Гольдин [и др.] // Утверждена начальником Научно-исследовательского института военной медицины 18.06.1986. - Л.: [Б.и.], 1986. - 96 с.
61. Лабораторный регламент получения иммуноглобулинов диагностических риккетсиозных полигрупповых люминесцирующих кроличьих сухих, №170 / Р.Б.Гольдин [и др.] // Утвержден Председателем КВС при Минздраве СССР 10.02.1981. - 1980. - Л.: [Б.и.], - 48 с.
62. Лабораторный регламент получения сухой люминесцирующей кроличьей сыворотки для выявления риккетсий группы клещевой пятнистой лихорадки №338-73 / З.М.Прусакова [и др.] // Утвержден Председателем КВС при Минздраве СССР 05.06.1973-1973. - Л.: [Б.и.]. - 79 с.
63. Белова О.В. Иммунологическая функция кожи и нейроиммунокожная система / Белова О.В., Арион В.Я. // Аллергология и иммунология. - 2006. - Т.7, №4. - С.492-497.
64. Niyonsaba F. Human defensins and cathelicidins in the skin: beyond direct antimicrobial properties / Niyonsaba F., Nagaoka I., Ogawa H. // Crit Rev Immunol. - 2006. - №26 (6). - P.545-547.
65. The Skin Immune System (SIS): Distribution and Immunophenotype of Lymphocyte Subpopulations in Normal Human Skin / J.D.Bos [et al.] // Journal of Investigative Dermatology. - 1987. - №88. - P.569-573.
66. Schauber J. Antimicrobial peptides and the skin immune defense system / J.Schauber, R.L.Gallo // J Allergy Clin Immunol. - 2008. - №122 (2). - P.261-266.
67. Егорова В.Н. Новые возможности иммунотерапии с использованием Ронколейкина - рекомбинантного интерлейкина-2 человека / В.Н.Егорова, М.Н.Смирнов // Terra Medica. - 1999. - №2. - С.15-17.
68. Нечаева А.С. Практическое руководство по производству гамма-глобулина / А.С.Нечаева, H.А.Пономарева. - М.: Медицина, 1956. - 67 с.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения набора флуоресцирующих риккетсиальных и коксиеллезного диагностикумов и их применение для серологической диагностики риккетсиозов и коксиеллеза, способ серологической диагностики | 2019 |
|
RU2728340C1 |
| Способ получения флуоресцирующего иммуноглобулинового диагностикума для выявления возбудителей риккетсиозов и коксиеллезов, флуоресцирующий иммуноглобулиновый диагностикум и его применение | 2021 |
|
RU2769578C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК R1/S-5A6 ЖИВОТНЫХ MUS MUSCULUS L., ПРОДУЦИРУЮЩИХ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К РИККЕТСИЯМ ПРОВАЧЕКА | 2001 |
|
RU2198922C2 |
| СРЕДСТВО ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ РИККЕТСИОЗА, ВЫЗЫВАЕМОГО RICKETTSIA SIBIRICA subsp. SIBIRICA BJ-90 | 2013 |
|
RU2560581C2 |
| Способ получения иммунной сыворотки к риккетсиям Провачека | 1990 |
|
SU1733004A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОЙ СЫВОРОТКИ | 1997 |
|
RU2135210C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУННОЙ ПОЛИВАЛЕНТНОЙ СЫВОРОТКИ ПРОТИВ ГИСТАМИНА И СЕРОТОНИНА | 1995 |
|
RU2129012C1 |
| Способ диагностики риккетсиозов группы клещевой пятнистой лихорадки, иммуноферментная диагностическая тест-система для его осуществления | 2019 |
|
RU2726484C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ СПЕЦИФИЧЕСКОЙ ТЕРАПИИ ХЛАМИДИОЗА У ПЛОТОЯДНЫХ ЖИВОТНЫХ | 2003 |
|
RU2259849C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПЕРИММУННОЙ СЫВОРОТКИ К АДЕНОВИРУСУ BOVINE-10 КРУПНОГО РОГАТОГО СКОТА | 2020 |
|
RU2772751C1 |
Изобретение относится к медицине, а именно микробиологии, клинической и лабораторной диагностике и иммунологии. Способ получения гипериммунных риккетсиозных сывороток заключается в следующем. Иммунизацию кроликов-самцов породы «Шиншилла» 10-12-месячного возраста массой 2,5-3,0 кг проводят в два этапа. При первичной иммунизации вводят смесь 10% суспензии инфекционного риккетсиозного материала (0,5 мл) и полного адъюванта Фрейнда, взятого в объеме, в 1,5 раза превышающем объем инфекционного материала (0,75 мл). Для стимуляции первичного иммунного ответа смесь вводят однократно внутрикожно микродозами паравертебрально в 40 точек. В качестве инфекционного риккетсиозного материала используют гомогенизированные оболочки желточных мешков куриных эмбрионов, инфицированных R.prowazekii, или гомогенизированные селезенки беспородных белых мышей массой 16-18 г, инфицированных риккетсиями вида C.burnetii или R.sibirica. Через 45 сут при условии снижения титров антител, продуцированных в результате первичной иммунизации, до 1:20-1:80, начинают реиммунизацию: четырехкратно осуществляют внутривенные инъекции инактивированных антигенов соответствующих возбудителей риккетсиозов для реакции связывания комплемента в концентрации не менее 4-х антигенных единиц в 1 мл и в возрастающих дозах, составляющих 1,0, 1,5, 2,0 и 2,5 мл, с интервалом после каждого введения антигена 3 сут. Для коррекции цитокинового дисбаланса и дополнительной стимуляции образования антител на этапе реиммунизации дополнительно подкожно вводят рекомбинантный ИЛ-2 человека (ронколейкин) в объеме 1,0 мл и в дозе 250000 ME. Тотальный забор крови для приготовления сывороток осуществляют на 14 сут после последней внутривенной инъекции и при титрах специфических антител в НМФА не ниже 1:5120-1:10240. Продолжительность полного цикла иммунизации в соответствии с заявляемым способом составляет 68 сут. Изобретение обеспечивает сокращение в 2,3 раз времени иммунизации (со 158 сут до 68 сут) и получение гипериммунных сывороток, в 4-8 раз превосходящих по накопленным титрам риккетсиозных антител, снижение в 4,7 раз материальных затрат на содержание животных-продуцентов и приобретение адъювантов, уменьшение в 5,2 раз уровня трудозатрат за один производственный цикл получения гипериммунных риккетсиозных сывороток, экономии в 4,2 раза фонда заработной платы. 3 табл., 4 пр.
Способ получения гипериммунных риккетсиозных сывороток, пригодных для приготовления иммунобиологических диагностических препаратов, предназначенных для выявления актуальных в эпидемиологическом отношении возбудителей риккетсиозов - R.prowazekii, C.burnetii, R.sibirica, предусматривающий двухэтапную схему иммунизации кроликов-самцов породы «Шиншилла» 10-12-месячного возраста массой 2,5-3,0 кг - первичную иммунизацию и реиммунизацию - с использованием при первичной иммунизации смеси 10% суспензии инфекционного риккетсиозного материала и полного адъюванта Фрейнда, взятых в определенных объемах и при определенном соотношении, применение в качестве инфекционного риккетсиозного материала гомогенизированных оболочек желточных мешков куриных эмбрионов, инфицированных R.prowazekii, или гомогенизированных селезенок беспородных белых мышей массой 16-18 г, инфицированных риккетсиями вида C.burnetii или R.sibirica, предусматривающий начало этапа реиммунизации при снижении титров антител, продуцированных в результате первичной иммунизации, до 1:20-1:80 и тотальный забор крови для приготовления сывороток после окончания циклов иммунизации, отличающийся тем, что при первичной иммунизации вводят смесь 10% суспензии инфекционного риккетсиозного материала, взятую в объеме 0,5 мл, и полного адъюванта Фрейнда, взятого в объеме 0,75 мл, то есть в 1,5 раза превышающем объем инфекционного материала, вводят указанную смесь однократно внутрикожно микродозами паравертебрально в 40 точек, последующий этап реиммунизации начинают через 45 суток с использованием при этом инактивированных антигенов соответствующих возбудителей риккетсиозов, для чего осуществляют четырехкратно внутривенно инъекции инактивированного антигена соответствующего возбудителя риккетсиоза для реакции связывания комплемента в концентрации не менее 4 антигенных единиц в 1 мл и в возрастающих дозах, составляющих 1,0, 1,5, 2,0 и 2,5 мл, с интервалом после каждого введения антигена 3 сут, причем на этапе реиммунизации наряду с внутривенными инъекциями инактивированных антигенов соответствующих возбудителей риккетсиозов дополнительно подкожно вводят рекомбинантный ИЛ-2 человека - ронколейкин - в объеме 1,0 мл и в дозе 250000 ME, тотальный забор крови для приготовления сывороток осуществляют на 14 сут после последней внутривенной инъекции инактивированных антигенов соответствующих возбудителей риккетсиозов и при титрах специфических антител в непрямом методе флюоресцирующих антител не ниже 1:5120-1:10240, а продолжительность полного цикла иммунизации составляет 68 сут.
| Инструкция по изготовлению и контролю иммуноглобулина люминесцирующего диагностического к риккетсиям группы клещевой пятнистой лихорадки мышиного сухого / Гольдин Р.Б | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| - Л.: [В.и.], 1982 | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| СПОСОБ ПОЛУЧЕНИЯ СЫВОРОТКИ ДЛЯ ДИАГНОСТИКИ КОКСИЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА В РЕАКЦИИ НЕПРЯМОЙ ИММУНОФЛУОРЕСЦЕНЦИИ | 2009 |
|
RU2413533C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЫВОРОТКИ ДЛЯ ДИАГНОСТИКИ АНАПЛАЗМОЗА КРУПНОГО РОГАТОГО СКОТА В РЕАКЦИИ НЕПРЯМОЙ ИММУНОФЛУОРЕСЦЕНЦИИ ПУТЕМ ГИПЕРИММУНИЗАЦИИ КРОЛИКОВ | 2007 |
|
RU2368393C2 |
| Способ получения иммунной сыворотки к риккетсиям Провачека | 1990 |
|
SU1733004A1 |
Авторы
Даты
2013-05-27—Публикация
2011-12-06—Подача