ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области технологии полипептидов. В частности, настоящее изобретение относится к модифицированным жирной кислотой производным аналогов полипептида GLP-1(7-37). Кроме того, изобретение также относится к способу получения производного пептида, лекарственному средству, содержащему производное пептида, и его применению для получения лекарственного средства.
УРОВЕНЬ ТЕХНИКИ
Диабет представляет собой нарушение метаболизма глюкозы, вызываемое генетическими факторами и факторами окружающей среды. Он стал третьим по значимости заболеванием после опухолей, сердечно-сосудистых и цереброваскулярных заболеваний, угрожающим здоровью и безопасности жизни человека. Сам по себе диабет не обязательно причиняет вред, но длительные высокие уровни глюкозы в крови повреждают крупные кровеносные сосуды и микрососуды и подвергают опасности сердце, головной мозг, почки, периферические нервы, глаза, ноги и т.д. Согласно статистике Всемирной организации здравоохранения существует более 100 осложнений диабета - заболевания с наиболее известными осложнениями. Более половины смертей от диабета вызваны сердечно-сосудистыми и цереброваскулярными заболеваниями, а 10% - нефропатией. Число ампутаций из-за диабета в 10-20 раз выше, чем в отсутствие диабета. Поэтому лечение диабета и предупреждение его осложнений являются жизненно важными социальными вопросами.
Диабет можно разделить на несколько типов в зависимости от патогенеза. Большинство из них относятся к диабету II типа (около 90%), в основном из-за избыточного веса и недостаточной физической активности. Пациенты с диабетом II типа часто имеют патологии инсулинорезистентности и недостаточную секрецию инсулина, кроме того, на средней и поздней стадиях этого заболевания часто возникает апоптоз островковых β-клеток. В настоящее время механизм действия пероральных гипогликемических препаратов для клинического применения заключается в основном в повышении чувствительности к инсулину или стимулировании секреции инсулина для стабилизации уровня глюкозы в крови, что не может решить проблему апоптоза β-клеток. Лекарственные средства на основе глюкагоноподобного пептида-1 (GLP-1) и его аналога замедляют апоптоз β-клеток, способствуя их регенерации и способствуя дифференцировке и пролиферации островковых β-клеток, что делает его центром исследований в отношении лечения диабета II типа.
В 1983 году Bell et al. обнаружили глюкагоноподобный пептид-1 (GLP-1) при анализе последовательности гена проглюкагона (PG) (Bell G. I., Sanchez-Pescador R., Laybourn P. J., et al., Exon duplication and divergence in the human preproglucagon gene [J]. Nature, 1983, 304(5924): 368-371). Последовательность гена PG состоит из 6 экзонов и 5 интронов, включающих 3 основных домена: глюкагон (33-61), GLP-1 (72-108) и GLP-2 (126-158). мРНК PG экспрессируется в А-клетках поджелудочной железы, L-клетках кишечника и головном мозге, и в клетках этих тканей осуществляется определенная трансляционная модификация с образованием разных конечных продуктов.
Существует два подтипа GLP, аналог GLP-1 и аналог GLP-2. Их аминокислотная последовательность почти наполовину идентична глюкагону, и между ними также имеется около 35% гомологии. Аналог GLP-1 представляет собой полипептидный гормон, секретируемый клетками Лангерганса терминального отдела тощей кишки, подвздошной и ободочной кишки, имеющий множество функций, таких как глюкозозависимое стимулирование секреции и биосинтеза инсулина, ингибирование секреции глюкагона и опорожнение желудка. Аналог GLP-2 синтезируется в ткани кишечника и нейронах ствола головного мозга и гипоталамуса центральной нервной системы, и в основном способствует нормальному росту тонкой кишки и восстановлению повреждений слизистой оболочки кишечника (Fu Gang, Gong Min, Xu Weiren; Research progress of glucagon-like peptide 1 and its receptor agonists [J]. Tianjin Medical Journal, 2012, 40(2): 181-184).
GLP-1 представляет собой эндогенный гормон, который стимулирует секрецию инсулина, в основном секретируемого L-клетками кишечника, и играет роль в регулировании уровней инсулина и глюкозы.
Первичная структура GLP-1 представляет собой: гистидин (His)-аланин (Ala)-глутаминовая кислота (Glu)-фенилаланин (Phe)-глутаминовая кислота (Glu)-аргинин (Arg)-гистидин (His)-аланин (Ala)-глутаминовая кислота (Clu)-глицин (Gly)-треонин (Thr)-фенилаланин (Phe)-треонин (Thr)-серин (Ser)-аспарагиновая кислота (Asp)-валин (Val)-серин (Ser)-серин (Ser)-тирозин (Tyr)-лейцин (Leu)-глутаминовая кислота (Glu)-глицин (Gly)-глутамин (Gln)-аланин (Ala)-аланин (Ala)-лизин (Lys)-глутаминовая кислота (Glu)-фенилаланин (Phe)-изолейцин (Ile)-аланин (Ala)-триптофан (Trp)-лейцин (Leu)-валин (Val)-лизин (Lys)-глицин (Gly)-аргинин (Arg)-глицин (Gly). DDP-IV может быстро расщеплять гистидин (Н)-аланин (А) в положениях 7-8 на N-конце. DDP-IV в основном опосредовал гидролиз конца пептидной цепи, где положение 8 представляет собой аланин или пролин, фермент будет расщеплять его и вызывать быструю потерю GLP-1 его активности (Aertgeerts K, Ye S, Tennant М, G, et al., Crystal structure of human dipeptidyl peptidase IV in complex with a dipeptide peptidase reveals details on substrate specificity and tetrahedral intermediate [J]. Protein Sci., 2004, 13(2):412-421). Sarrauste De Menthiere et al. предложили модели GLP-1 для наблюдения за изменениями аффинности к рецептору и собственной активности аналогов GLP-1 путем замены аминокислот. Гистидин в положении 7 является определяющим фактором для аффинности и собственной активности, ароматическое кольцо гистидина меньше, чем у триптофана, и у него нет полярного заместителя; боковая цепь аланина в положении 8 имеет полярную группу, которая влияет на активность GLP-1; размер боковой цепи не должен быть слишком большим, при превышении определенного предела активность снизится; при замене глутаминовой кислоты в положении 9 определенными аминокислотами, такими как кислые, полярные и гидрофобные аминокислоты, активность не изменится, однако будет снижаться или даже будет утрачена при ее замене основными аминокислотами. Как только GLP-1 связывается со своим рецептором, между аминокислотами в положениях 7-15 образуется кольцевая структура с ионной связью, и Ala8-Glu9-Gly10-Thr11 сформирует β-виток, эти изменения конформации приведут к образованию трех ароматических ядер, так что гистидин в положении 7, фенилаланин в положении 12 и тирозин в положении 19 взаимодействуют друг с другом, что соответствует гидрофобным карманам ароматических кластеров, присутствующих на рецепторе; предполагается, что они активируют рецептор; глицин в положении 22 представляет собой гибкую аминокислоту, которая действует как гибкий линкер, поддерживая изгиб спирали. Разрушение глицина вызовет кластеризацию всех ароматических аминокислот, в результате чего аффинность к рецептору снижается на 1/40 (Sarauste De Menthierec, Chavanieua, Grassyg, et al. Structural requirements of the N-terminal region of GLP-1-[7-37]-NH2 for receptor interaction and cAMP production [J]. Eur J Med Chem, 2004, 39(6):473-480).
GLP-1 включает производные GLP-1(1-37), GLP-1(1-36), GLP-1(7-37) глицин и GLP-1 (7-36) NH2, и другие молекулярные формы. Согласно широко распространенному мнению последние два имеют одинаковую биологическую активность. GLP-1 (1-37), секретируемый L-клетками слизистой оболочки кишечника, неактивен, и для того, чтобы он стал активным GLP-1(7-37), необходим дальнейший гидролиз и удаление 6 аминокислот на N-конце. GLP-1(7-37) существует в организме относительно короткое время и быстро разлагается. Поэтому были проведены различные исследования аналогов GLP-1 с функцией анти-DPP IV. Например, в патенте США №5545618 описана модификация N-конца алкильной или ацильной группой, a Gallwitz et al. описывают N-метилирование или альфа-метилирование His в положении 7 или замену всего His имидазолом для повышения устойчивости к DPP-IV и поддержания физиологической активности.
В дополнение к этим модификациям аналог GLP-1 эксендин-4 (патент США №5424686), выделенный из слюнных желез ящерицы аризонский ядозуб (Heloderma suspectum), обладает устойчивостью к DPP IV и более высокой физиологической активностью, чем GLP-1. Следовательно, он имеет период полувыведения in vivo, равный 2-4 часам, что больше, чем у GLP-1. Однако это применимо только к способу повышения устойчивости к DPP IV, физиологическая же активность не может поддерживаться в достаточной степени, и в случае использования коммерчески доступного эксендина-4 (эксенатида) его необходимо вводить пациенту дважды в сутки, что все еще очень болезненно для пациента.
Эти инсулинотропные пептиды имеют очень малую молекулярную массу и поэтому быстро выводятся почками. Некоторые ученые используют химические методы для добавления хорошо растворимых полимеров (таких как полиэтиленгликоль) на поверхность пептида, чтобы ингибировать почечный клиренс. Например, в патенте США №692464 описано связывание ПЭГ с остатком лизина эксендина-4, которое увеличивает время удержания в организме. Однако, хотя этот метод позволяет увеличить время удержания пептидных лекарственных средств в организме, он также приводит к увеличению молекулярной массы, концентрация пептидного лекарственного средства значительно снижается, а также снижается реакционная способность по отношению к пептидам.
Кроме того, существует ряд других методов модификации структуры соединений глюкагоноподобного пептида-1 в попытке увеличить продолжительность их действия. Например, в WO 96/29342 описаны производные пептидного гормона, модифицированные введением липофильного заместителя при С-концевом аминокислотном остатке или N-концевом аминокислотном остатке исходного пептидного гормона. В WO98/08871 раскрыто производное GLP-1 (лираглутид), в котором по меньшей мере один аминокислотный остаток исходного пептида связан с липофильным заместителем. В WO 99/43708 раскрыты производные GLP-1(7-35) и GLP-1(7-36) с липофильными заместителями, присоединенными к С-концевому аминокислотному остатку. В WO 00/34331 раскрыты дважды ацилированные аналоги GLP-1. В WO 00/69911 раскрыты активированные инсулинотропные пептиды для инъекций, и полагают, что у пациентов они реагируют с компонентами крови с образованием конъюгатов, продлевая продолжительность действия в организме.
В WO 2006/097537 раскрыт еще один ацилированный аналог GLP-1 (семаглутид), полученный путем мутирования аминокислоты в положении 8 для увеличения периода полувыведения по сравнению с ацилированным GLP-1 (лираглутидом) в WO 98/08871.
В WO 02/046227 раскрыто получение слитых белков путем комбинирования GLP-1, эксендина-4 или его аналогов с человеческим сывороточным альбумином или областью иммуноглобулина (Fc) с использованием технологии генетической рекомбинации, это может решить такие проблемы, как низкий выход и неспецифичность ПЭГилирования, но их эффект увеличения периода полувыведения из крови, тем не менее, является не столь значительным, как ожидалось. Что касается комплексного глюкозоснижающего действия, ожидаемое действие не достигается, и данный препарат не достигает даже результата семаглутида. Чтобы продлить период полувыведения из крови, предпринимались попытки использования различных типов пептидных линкеров, но проблема этого метода заключается в том, что он может вызвать иммунный ответ.
В CN 107033234 A раскрыт модифицированный жирной кислотой конъюгат аналога GLP-1. Сайт модификации жирной кислотой находится при Lys26. Первые эксперименты на животных показали, что его глюкозоснижающее действие превосходит семаглутид. Этот метод может надлежащим образом продлить время действия аналогов GLP-1 in vivo, но период полувыведения из плазмы все еще не идеален.
В настоящее время доступные на рынке разрешенные к медицинскому применению лекарственные средства на основе GLP-1 в основном включают эксендин-4, выделенный из слюны ящерицы, и аналоги GLP-1 человеческого происхождения, модифицированные жирными кислотами или слитые с Fc или человеческим сывороточным альбумином. Период полувыведения эксендина-4 является слишком коротким (всего 2-4 часа), поэтому требуются инъекции два раза в сутки. Модифицированный жирной кислотой лираглутид от Novo Nordisk является наиболее эффективным лекарственным средством для снижения уровня гликированного гемоглобина (HbA1c) с меньшим числом побочных действий, однако, поскольку период полувыведения составляет всего 13 часов, требуется введение один раз в сутки. В целях дальнейшего увеличения периода полувыведения in vivo и уменьшения частоты введения в последние годы были разработаны мутантные по аминокислотной последовательности аналоги GLP-1 и аналоги GLP-1 длительного действия, модифицированные Fc, жирными кислотами или альбумином и т.д., например, дулаглутид от Eli Lilly and Company и семаглутид от Novo Nordisk. Период полувыведения этих аналогов GLP-1 длительного действия из организма человека может быть увеличен до различных степеней, и может быть достигнута частота введения один раз в неделю как максимально длительное действие.
После долгих исследований авторы настоящей заявки разработали новый аналог GLP-1 и его производные, в аналогичных экспериментальных условиях они обладают эквивалентной активностью in vitro по сравнению с семаглутидом, который в настоящее время считается лучшим лекарственным средством; в моделях как на нормальных мышах, так и на мышах с диабетом продолжительность глюкозоснижающего действия in vivo может быть увеличена примерно в 1 раз, что означает, что у людей может быть достигнута частота дозирования по меньшей мере один раз в неделю, два раза в неделю или даже с более длительными интервалами. Более того, когда дозировка составляет 1/10 от дозировки семаглутида, его галюкозоснижающее действие сопоставимо с семаглутидом, поэтому он более перспективен для применения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является создание нового аналога GLP-1(7-37) и ацилированного производного указанного аналога. Кроме того, настоящее изобретение также относится к способу получения указанного аналога или производного, фармацевтической композиции и продукту, содержащим указанный аналог или производное, и их применению для предупреждения и лечения заболеваний.
В частности, в одном из аспектов настоящее изобретение относится к производному аналога GLP-1(7-37) или его фармацевтически приемлемой соли, где указанный аналог GLP-1 содержит пептид, состоящий из аминокислотной последовательности следующей формулы:
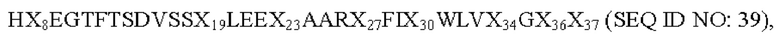
где X8 выбран из V, Т, I, L, G или S; Х19 представляет собой Y или K; Х23 представляет собой Q или K; Х27 представляет собой Е или K; Х30 представляет собой А или K; Х34 представляет собой R или K; Х36 представляет собой R или K; и Х37 представляет собой G или K;
при условии, что только один из X19, Х23, Х27, Х30, Х34, Х36 или Х37 представляет собой остаток K, и
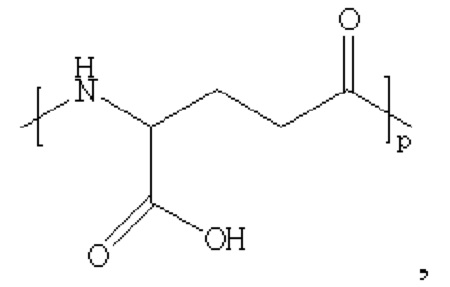
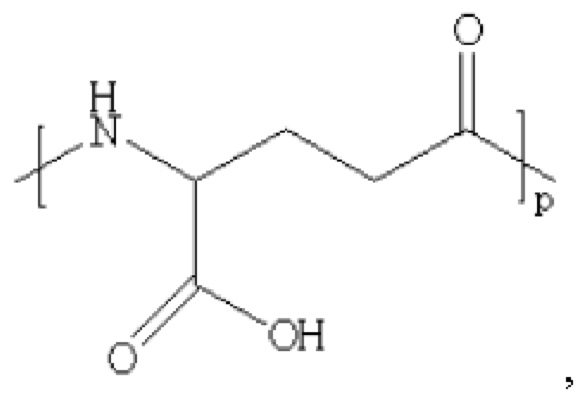
производное содержит удлиняющую часть, связанную с остатком К аналога GLP-1(7-37), где удлиняющая часть представляет собой 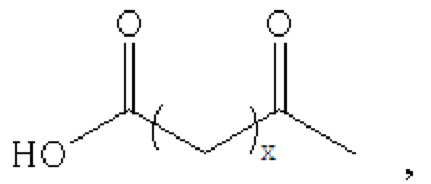
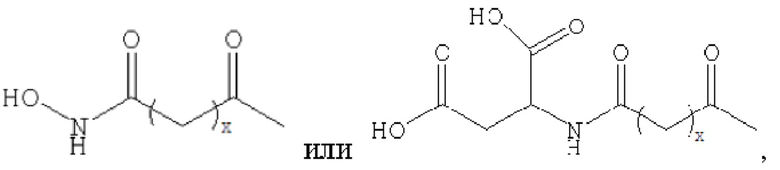
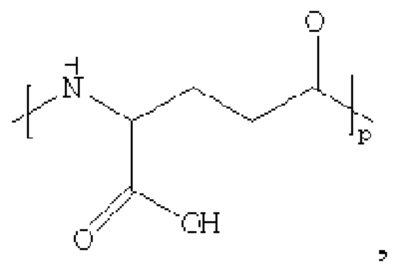
где х представляет собой целое число от 4 до 38.
При этом удлиняющая часть предпочтительно представляет собой: HOOC(CH2)14CO-, HOOC(CH2)15CO-, HOOC(CH2)16CO-, HOOC(CH2)17CO-, HOOC(CH2)18CO-, HOOC(CH2)19CO-, НООС(СН2)20СО-, НООС(СН2)21СО- и НООС(СН2)22СО-; более предпочтительно HOOC(CH2)16CO-.
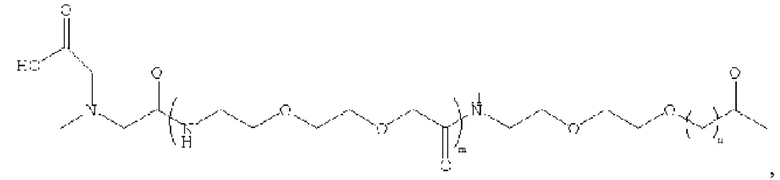
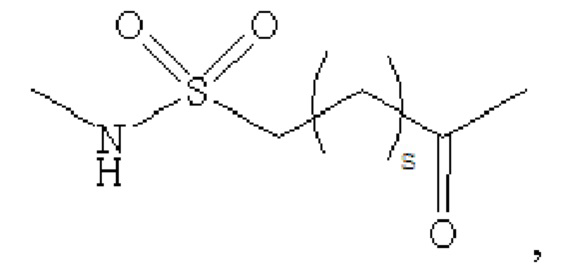
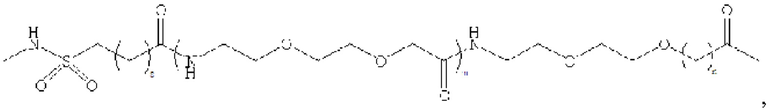
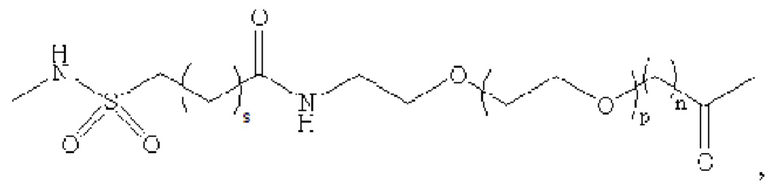
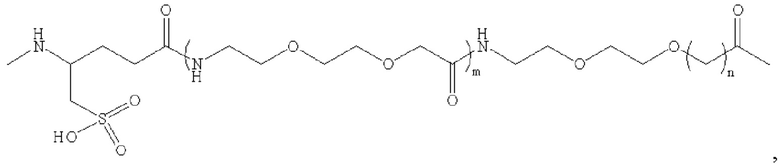
В предпочтительном варианте осуществления удлиняющая часть производного аналога GLP-1 или его фармацевтически приемлемой соли согласно изобретению связана с остатком K GLP-1 через линкер. Линкер содержит любую из следующих структур:
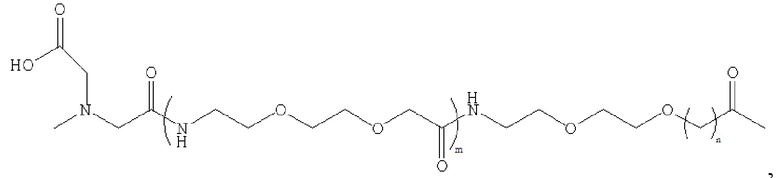
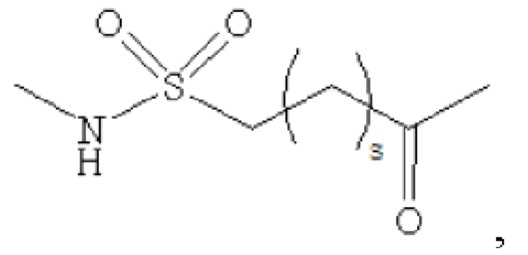
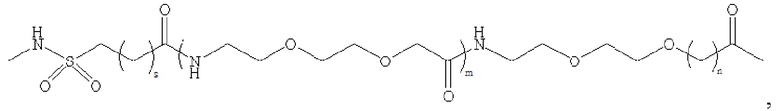
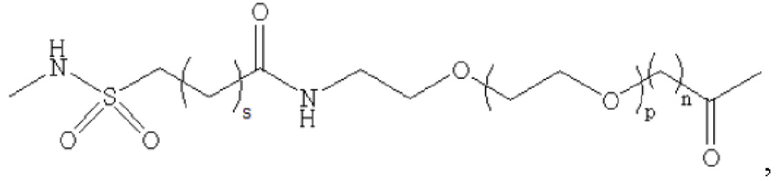
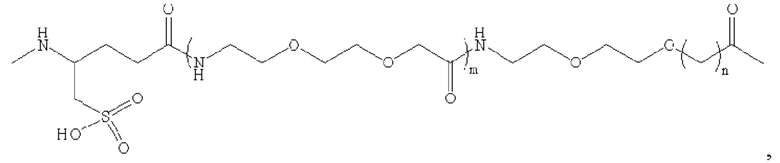
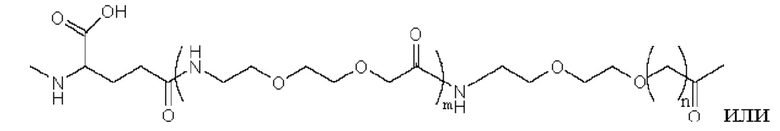
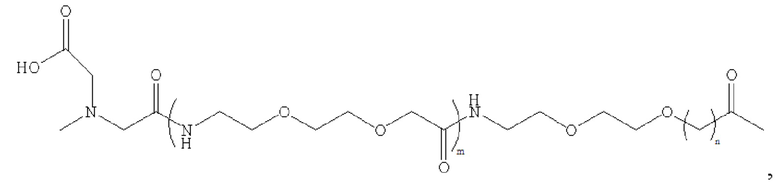
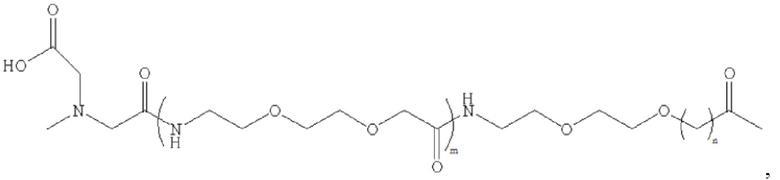
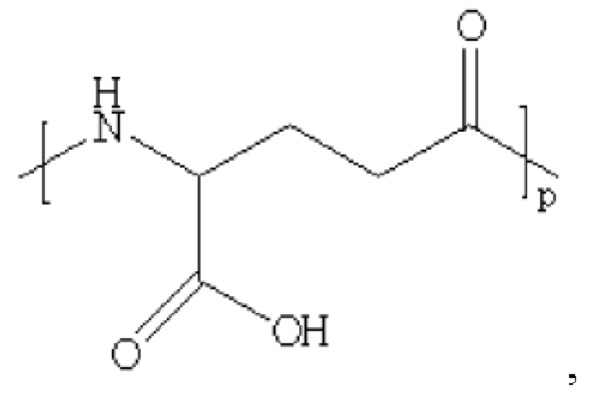
 где m равно 0, 1, 2 или 3; n равно 1, 2 или 3; s представляет собой любое целое число от 0 до 6; и р представляет собой любое целое число от 1 до 8.
где m равно 0, 1, 2 или 3; n равно 1, 2 или 3; s представляет собой любое целое число от 0 до 6; и р представляет собой любое целое число от 1 до 8.
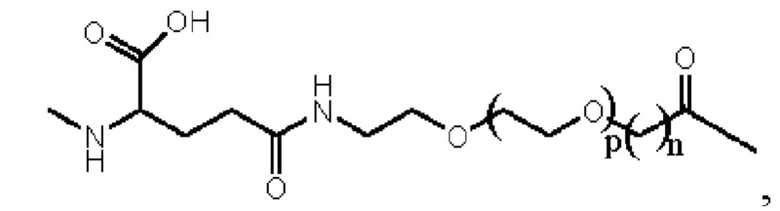
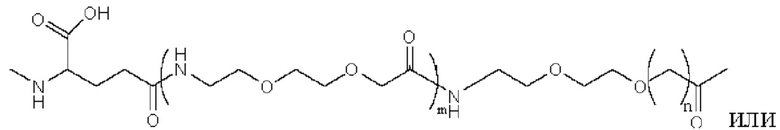
Предпочтительно линкер представляет собой:
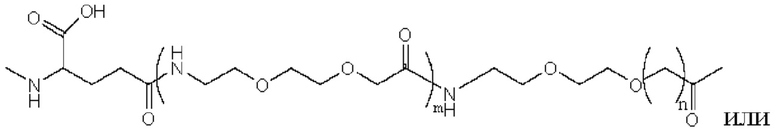
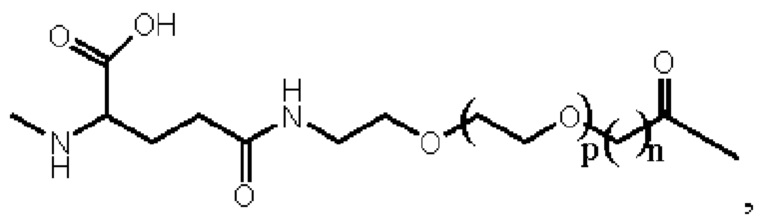
где m равно 1 или 2; n равно 1 или 2; и р представляет собой любое целое число от 1 до 5.
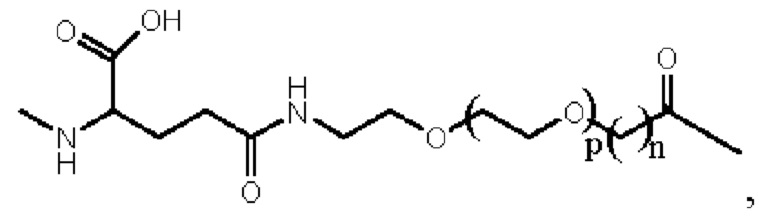
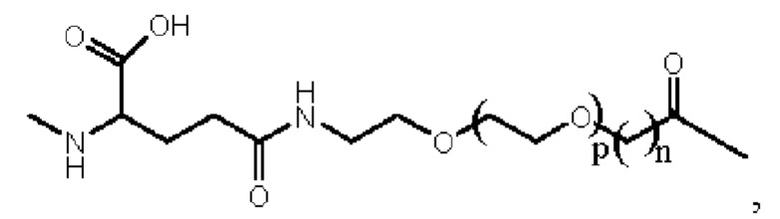
Более предпочтительно линкер представляет собой:
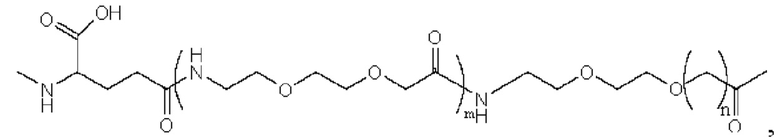 где m равно 1, и n равно 1 или 2.
где m равно 1, и n равно 1 или 2.
Изобретение также относится к аналогу GLP-1(7-37), содержащему следующую последовательность:
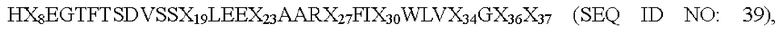 которая содержит мутации, выбранные из одного или более из следующих положений:
которая содержит мутации, выбранные из одного или более из следующих положений:
положения 8, 19, 23, 27, 30, 34, 36 и 37. В предпочтительном варианте осуществления аминокислотный остаток в положении 8 выбран из V, Т, I, L, G или S; аминокислотный остаток в положении 19 представляет собой Y или K; аминокислотный остаток в положении 23 представляет собой Q или K; аминокислотный остаток в положении 27 представляет собой Е или K; аминокислотный остаток в положении 30 представляет собой А или K; аминокислотный остаток в положении 34 представляет собой R или K; аминокислотный остаток в положении 36 представляет собой R или K; аминокислотный остаток в положении 37 представляет собой G или K; при условии, что только одно из положений 19, 23, 27, 30, 34, 36 или 37 представляет собой остаток K.
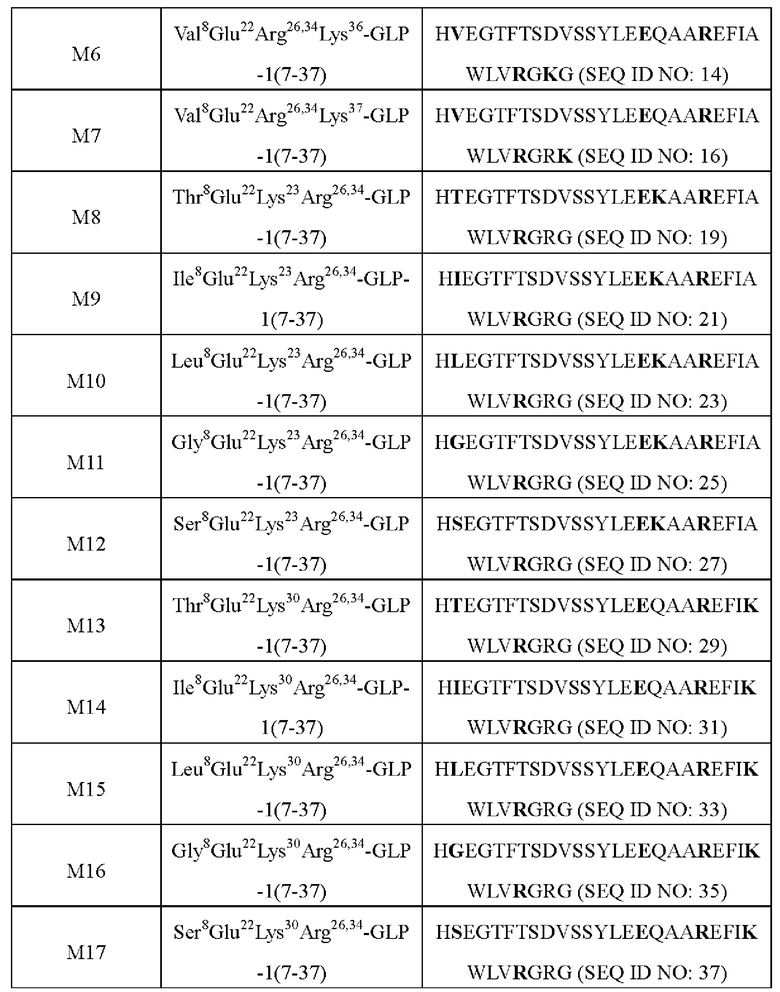
Связывающая активность in vitro ацилированных производных вышеуказанных аналогов GLP-1 показывает, что аффинность связывания с рецептором GLP-1R выше, чем у семаглутида или МО (Lys в положении 26, раскрыт в CN 107033234 А). Эксперимент по снижению уровня глюкозы in vivo также доказывает, что по сравнению с ацилированным продуктом GLP-1 семаглутидом ацилированные производные вышеуказанных аналогов GLP-1 могут проявлять более длительное галюкозоснижающее действие у нормальных мышей; у мышей с диабетом вышеуказанные производные обладают значительно лучшим глюкозоснижающим действием и действием повышения толерантности к глюкозе, чем семаглутид, и когда доза составляет всего лишь 1/10 от дозы семаглутида или М0, его галюкозоснижающее действие сопоставимо с таковым для семаглутида или М0. В то же время исследования, проведенные авторами настоящего изобретения, доказывают, что производные вышеуказанных аналогов GLP-1(7-37) обладают лучшей устойчивостью к ферментативному разложению по сравнению с коммерчески доступным семаглутидом. В частности, настоящее изобретение относится к следующему: 1. Производное аналога GLP-1(7-37) или его фармацевтически приемлемая соль, где аналог GLP-1(7-37) содержит аминокислотную последовательность следующей формулы:
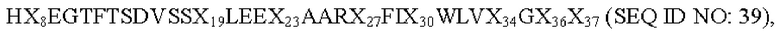
где Х8 выбран из V, Т, I, L, G или S; Х19 представляет собой Y или K; Х23 представляет собой Q или K; Х27 представляет собой Е или K; Х30 представляет собой А или K; Х34 представляет собой R или K; Х36 представляет собой R или K; и Х37 представляет собой G или K;
при условии, что только один из Х19, Х23, Х27, Х30, Х34, Х36 или Х37 представляет собой остаток K, и
производное содержит удлиняющую часть, связанную с остатком K аналога GLP-1(7-37), где удлиняющая часть представляет собой 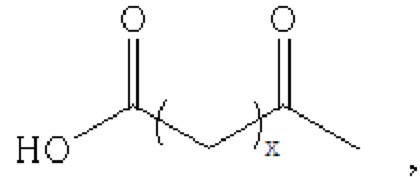
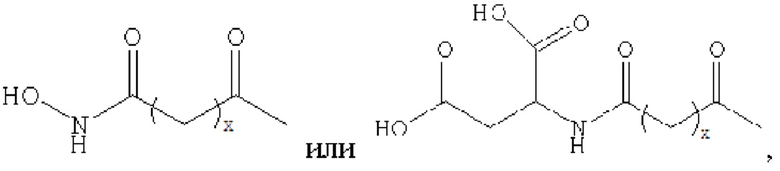
где х представляет собой целое число от 4 до 38.
2. Производное или его фармацевтически приемлемая соль по п. 1, где удлиняющая часть выбрана из:
НООС(СН2)14СО-, HOOC(CH2)15CO-, HOOC(CH2)16CO-, НООС(СН2)17СО-, НООС(СН2)18СО-, НООС(СН2)19СО-, НООС(СН2)20СО-, НООС(СН2)21СО- и НООС(СН2)22СО-.
3. Производное или его фармацевтически приемлемая соль по п. 1 или п. 2, где удлиняющая часть связана с остатком К аналога GLP-1(7-37) через линкер.
4. Производное или его фармацевтически приемлемая соль по п. 3, где линкер представляет собой:
 где m равно 0, 1, 2 или 3; n равно 1, 2 или 3; s представляет собой любое целое число от 0 до б; и р представляет собой любое целое число от 1 до 8.
где m равно 0, 1, 2 или 3; n равно 1, 2 или 3; s представляет собой любое целое число от 0 до б; и р представляет собой любое целое число от 1 до 8.
Предпочтительно линкер представляет собой:
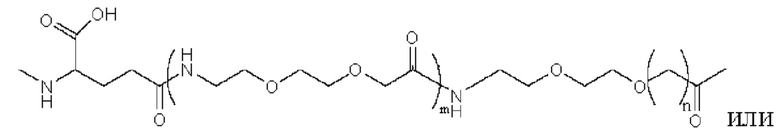
где m равно 1 или 2; n равно 1 или 2; и р представляет собой любое целое число от 1 до 5.
5. Производное или его фармацевтически приемлемая соль по п. 4, где линкер представляет собой: 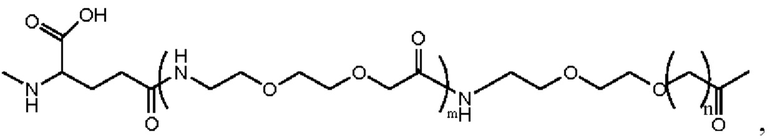 и где m равно 1, и n равно 1 или 2.
и где m равно 1, и n равно 1 или 2.
6. Производное или его фармацевтически приемлемая соль по любому из пи. 1-5, представляющее собой любое производное, выбранное из группы, состоящей из: пептида
N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Lys23Arg26,34-GLP-1(7-37)) (M2), пептида N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Lys30Arg26,34-GLP-1(7-3 7))(M4),
пептида N-ε34-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Arg26Lys34-GLP-1(7-37)) (M5),
пептида N-ε37-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил])(Val8Glu22Arg26,34Lys37-GLP-1(7-3 7))(M7),
пептида N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Ile8Glu22Lys23Arg26,34-GLP-1(7-37))(M9) \
пептида N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Thr8Glu22Lys30Arg26,34-GLP-1(7-37))(M13) \
пептида N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Ile8Glu22Lys30Arg26,34-GLP-1(7-37)) (M14), или его фармацевтически приемлемую соль.
7. Способ получения производного или его фармацевтически приемлемой соли по любому из пп. 1-6, включающий:
(1) смешивание раствора, в котором растворен аналог GLP-1 по любому из пп. 1-6, с раствором, в котором растворена удлиняющая часть по любому из пп. 1-6;
(2) доведение рН до 4-5 для остановки реакции, выдерживание до образования осадка, а затем сбор осадка; и
(3) добавление к осадку TFA (трифторуксусной кислоты) и доведение рН до 7,5-8,5 для остановки реакции.
8. Способ по п. 7, дополнительно включающий: добавление триэтиламина к раствору, в котором растворен аналог GLP-1, с последующим смешиванием с раствором, в котором растворена удлиняющая часть по любому из пп. 1-7.
9. Способ по п. 7 или п. 8, где раствор удлиняющей части по любому из пп. 1-8 получен в ацетонитриле.
10. Фармацевтическая композиция, содержащая производное или его фармацевтически приемлемую соль по любому из пп. 1-6 и фармацевтически приемлемое вспомогательное вещество.
11. Применение производного или его фармацевтически приемлемой соли по любому из пп. 1-6 для получения лекарственного средства для предупреждения и/или лечения диабета (включая диабет I типа и диабета II типа) или осложнений диабета.
12. Применение по п. 11, где осложнение диабета представляет собой диабетическую нефропатию.
13. Применение производного или его фармацевтически приемлемой соли по любому из пп. 1-6 для получения лекарственного средства для снижения уровня глюкозы в крови, повышения толерантности к глюкозе, уменьшения апоптоза островковых β-клеток, усиления функции островковых β-клеток, увеличения количества островковых β-клеток и/или восстановления чувствительности островковых β-клеток к глюкозе.
14. Применение по п. 13, где указанное снижение уровня глюкозы в крови включает снижение уровня глюкозы в крови натощак и/или уровня глюкозы в крови после приема пищи.
15. Способ предупреждения и/или лечения диабета (включая диабет I типа и диабета II типа) или осложнений диабета, включающий введение профилактически или терапевтически эффективного количества производного или его фармацевтически приемлемой соли по любому из пп. 1-6 субъекту.
16. Способ по п. 15, где осложнение диабета представляет собой диабетическую нефропатию.
17. Способ снижения уровня глюкозы в крови, повышения толерантности к глюкозе, уменьшения апоптоза островковых β-клеток, усиления функции островковых β-клеток, увеличения количества островковых β-клеток и/или восстановления чувствительности островковых β-клеток к глюкозе, включающий введение терапевтически эффективного количества производного или его фармацевтически приемлемой соли по любому из пп. 1-6 субъекту.
18. Применение по п. 17, где указанное снижение уровня глюкозы в крови включает снижение уровня глюкозы в крови натощак и/или уровня глюкозы в крови после приема пищи.
19. Аналог GLP-1(7-37), содержащий полипептид, состоящий из следующей аминокислотной последовательности:
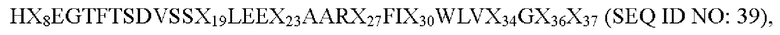
где Х8 выбран из V, Т, I, L, G или S; Х19 представляет собой Y или K; Х23 представляет собой Q или K; Х27 представляет собой Е или K; Х30 представляет собой А или K; Х34 представляет собой R или K; Х36 представляет собой R или K; Х37 представляет собой G или K; и только один из Х19, Х23, Х26, Х27, Х30, Х34, Х36 или Х37 представляет собой K.
20. Фармацевтическая композиция, содержащая аналог по п. 19.
21. Применение аналога по п. 19 для получения лекарственного средства для предупреждения или лечения диабета и осложнений диабета.
22. Продукт, содержащий: контейнер, в котором содержится фармацевтическая композиция по п. 10 или п. 20, и листок-вкладыш в упаковку, содержащий инструкции по применению фармацевтической композиции.
23. Продукт по п. 22, дополнительно содержащий контейнер, содержащий одно или более других лекарственных средств.
24. Продукт по п. 23, где одно или более других лекарственных средств представляют собой другие лекарственные средства для лечения диабета или осложнений диабета.
«Уровень глюкозы в крови натощак» относится к значению уровня глюкозы в крови, определенному после голодания субъекта (например, человека) и, например, значению уровня глюкозы в крови, измеренному после ночного голодания, голодания (без какой-либо пищи, кроме питьевой воды) в течение по меньшей мере 6 часов, например, 6-8 часов, 8-10 часов.
«Уровень глюкозы в крови после приема пищи» относится к уровню глюкозы в крови, определенному после приема пищи, например, значению уровня глюкозы в крови, измеренному через 15 минут - 2 часа, 30 минут - 2 часа, 1 час - 2 часа или через 2 часа после приема пищи.
Один из аспектов настоящего изобретения относится к способу получения аналога GLP-1(7-37), включающему экспрессию пептида клеткой-хозяином, содержащей последовательность ДНК, кодирующую полипептид, в условиях, обеспечивающих возможность экспрессии пептида, и затем выделение полученного пептида.
Среда, используемая для культивирования клеток, может представлять собой любую обычную среду, используемую для культивирования клеток-хозяев, например, минимальную среду или комплексную среду, содержащую подходящие добавки. Подходящая культуральная среда может быть приобретена на коммерческом рынке, или подходящая культуральная среда может быть приготовлена в соответствии с описанным способом приготовления. Полипептид, продуцируемый клетками-хозяевами, затем может быть выделен из культуральной среды обычными методами, например, белковый компонент в супернатанте или фильтрате осаждают солью, такой как сульфат аммония, и далее очищают различными хроматографическими методами, такими как ионообменная колоночная хроматография, гель-фильтрационная хроматография, аффинная хроматография и т.д., в зависимости от типа пептидов.
Вышеуказанная кодирующая последовательность ДНК может быть вставлена в любой подходящий вектор. Как правило, выбор вектора часто зависит от клетки-хозяина, в которую должен быть введен вектор. Следовательно, вектор может представлять собой автономно реплицирующийся вектор, то есть вектор, существующий как внехромосомный объект, репликация которого не зависит от репликации хромосом, такой как плазмида. В качестве альтернативы, вектор может быть вектором такого типа, который при введении в клетку-хозяина будет встраиваться в геном клетки-хозяина и реплицироваться вместе с хромосомой, в которую он встроен.
Вектор предпочтительно представляет собой вектор экспрессии, в котором последовательность ДНК, кодирующая пептид, функционально связана с другими сегментами, необходимыми для транскрипции ДНК (такими как промотор). Примеры промоторов, подходящих для управления транскрипцией ДНК, кодирующей пептиды согласно настоящему изобретению, в различных клетках-хозяевах хорошо известны в данной области техники, см., например, Sambrook, J, Fritsch, EF and Maniatis, T, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989.
Вектор также может содержать маркер отбора, такой как ген, продукт которого будет восполнять дефект в клетке-хозяине, или может придавать устойчивость к лекарственным средствам, таким как ампициллин, доксорубицин, тетрациклин, хлорамфеникол, неомицин, стрептомицин или метотрексат, и т.п.
Чтобы ввести пептид, экспрессируемый согласно настоящему изобретению, в секреторный путь клетки-хозяина, в рекомбинантном векторе может быть предусмотрена последовательность сигнала секреции (также называемая лидерной последовательностью). Последовательность сигнала секреции связана с последовательностью ДНК, кодирующей пептид, в правильной рамке считывания. Последовательность сигнала секреции обычно расположена на 5'-конце последовательности ДНК, кодирующей пептид. Последовательность сигнала секреции может представлять собой последовательность сигнала секреции, обычно связанную с пептидом, или может происходить из гена, кодирующего другой секретируемый белок.
Специалисту в данной области техники известен способ раздельного соединения последовательности ДНК, кодирующей пептид согласно настоящему изобретению, промотора и необязательного терминатора, и/или пептидной последовательности сигнала секреции, и вставки ее в подходящий вектор, содержащий информацию, необходимую для репликации.
Клетка-хозяин, в которую будет введена последовательность ДНК или рекомбинантный вектор, может представлять собой любую клетку, способную продуцировать пептид согласно настоящему изобретению, включая бактерии, дрожжи, грибы и клетки высших эукариот. Примеры подходящих клеток-хозяев, которые хорошо известны и используются специалистами в данной области техники, включают, не ограничиваясь перечисленным: Е. coli, S. cerevisiae или линии клеток ВНК или СНО млекопитающих.
Настоящее изобретение относится к лекарственному средству или фармацевтической композиции, содержащим вышеуказанный аналог GLP-1(7-37), а также относится к применению указанного аналога для получения лекарственного средства, например, применению для получения лекарственного средства для лечения или предупреждения диабета (предпочтительно диабета II типа), осложнений диабета (например, диабетической нефропатии, диабетической болезни сердца) и снижения уровня глюкозы в крови или улучшения толерантности к глюкозе.
В еще одном аспекте изобретение также относится к способу предупреждения или лечения диабета (например, диабета I и II типов), осложнений диабета (например, диабетической васкулопатии, диабетической нейропатии, диабетической офтальмопатии, диабетической нефропатии, диабетической болезни сердца), снижения уровня глюкозы в крови (например, глюкозы в крови натощак и глюкозы в крови после приема пищи) или повышения толерантности к глюкозе путем введения субъекту вышеуказанного аналога GLP-1(7-37) или его производного. В еще одном аспекте настоящее изобретение также относится к применению вышеуказанного аналога GLP-1(7-37) или его производного для получения лекарственного средства для предупреждения или лечения диабета (например, диабета I и II типов), осложнений диабета (например, диабетической васкулопатии, диабетической нейропатии, диабетической офтальмопатии, диабетической нефропатии, диабетической болезни сердца), снижения уровня глюкозы в крови (например, глюкозы в крови натощак и глюкозы в крови после приема пищи) или повышения толерантности к глюкозе.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, препарату или набору, содержащим вышеуказанный аналог GLP-1(7-37).
Настоящее изобретение также относится к фармацевтической композиции, препарату или набору, содержащим производное вышеуказанного аналога GLP-1(7-37).
Фармацевтическая композиция согласно настоящему изобретению помимо активного ингредиента, представляющего собой аналог GLP-1(7-37) или его производное или соль, также содержит фармацевтически приемлемое вспомогательное вещество. Специалисты в данной области техники знакомы с фармацевтически приемлемыми вспомогательными веществами, такими как нетоксичные наполнители, стабилизаторы, разбавители, носители, растворители или другие вспомогательные вещества для получения препаратов. Например, разбавители, вспомогательные вещества, такие как микрокристаллическая целлюлоза, маннит и т.д.; наполнители, такие как крахмал, сахароза и т.д.; связующие, такие как крахмал, производные целлюлозы, альгинат, желатин и/или поливинилпирролидон; разрыхлители, такие как карбонат кальция и/или бикарбонат натрия; усилители абсорбции, такие как соединения четвертичного аммония; поверхностно-активные вещества, такие как цетиловый спирт; носители, растворители, такие как вода, физиологический раствор, каолин, бентонит и т.д.; скользящие вещества, такие как тальк, стеарат кальция/магния, полиэтиленгликоль и т.д. Кроме того, фармацевтическая композиция согласно настоящему изобретению предпочтительно представляет собой инъекционную лекарственную форму.
Настоящее изобретение также относится к способу уменьшения апоптоза островковых β-клеток, усиления функции островковых β-клеток, увеличения количества островковых β-клеток и/или восстановления чувствительности островковых β-клеток к глюкозе, включающему введение эффективного количества вышеуказанного аналога, производного или лекарственного средства, фармацевтической композиции нуждающемуся субъекту.
Настоящее изобретение также относится к применению вышеуказанного аналога, производного или лекарственного средства, фармацевтической композиции для получения лекарственного средства для уменьшения апоптоза островковых β-клеток, усиления функции островковых β-клеток, увеличения количества островковых β-клеток и/или восстановления чувствительности островковых β-клеток к глюкозе.
В настоящем изобретении термины «полипептид GLP-1(7-37)», «аналог полипептида GLP-1(7-37)» и «аналог GLP-1(7-37)» могут использоваться взаимозаменяемо и относятся к полипептиду, содержащему следующую аминокислотную последовательность:
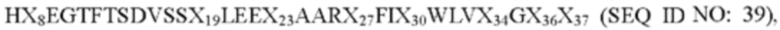
где X8 выбран из V, Т, I, L, G или S; Х19 представляет собой Y или K; Х23 представляет собой Q или K; Х27 представляет собой Е или K; Х30 представляет собой А или K; Х34 представляет собой R или K; Х36 представляет собой R или K; Х37 представляет собой G или K. Аналог полипептида GLP-1(7-37) связан с удлиняющей частью с образованием производного аналога полипептида GLP-1(7-37). В частности, изобретение относится к ацилированному производному аналога GLP-1(7-37). По сравнению с семаглутидом, который в настоящее время считается лучшим лекарственным средством, ацилированное производное не только обладает значительным терапевтическим действием, но также демонстрирует продолжительность активности in vivo, увеличенную примерно в 1 раз, что означает, что у людей частота дозирования составляет по меньшей мере недельные интервалы, могут быть достигнуты даже двухнедельные интервалы или более длинные интервалы.
Термины «производное аналога GLP-1(7-37)», «ацилированное производное аналога GLP-1(7-37)», «производное GLP-1(7-37)» и «производное GLP-1» согласно настоящему изобретению могут использоваться взаимозаменяемо.
В еще одном аспекте настоящее изобретение также относится к способу получения вышеуказанного производного или его фармацевтически приемлемой соли, включающему:
(1) смешивание раствора, в котором растворен вышеуказанный аналог GLP-1, с раствором, в котором растворена удлиняющая часть (например, жирная кислота);
(2) доведение рН до 4-5 для остановки реакции, выдерживание до образования осадка, а затем сбор осадка; и
(3) добавление к осадку TFA и доведение рН до 7,5-8,5 для остановки реакции.
В предпочтительном варианте осуществления вышеуказанный способ включает добавление триэтиламина к раствору аналога GLP-1.
В предпочтительном варианте осуществления вышеуказанная удлиняющая часть (например, жирная кислота) растворена в растворе ацетонитрила.
Иллюстративный способ получения согласно настоящему изобретению включает:
(1) обеспечение раствора аналога GLP-1(7-37) и доведение рН до 9-12;
(2) затем добавление триэтиламина к раствору, полученному на стадии (1);
(3) взвешивание жирной кислоты следующей структуры и взятие количества, не менее чем в 2 раза превышающего количество аналога GLP-1 (молярное отношение), предпочтительно не менее чем в 3 раза превышающего количество аналога GLP-1, и растворение ее в ацетонитриле;
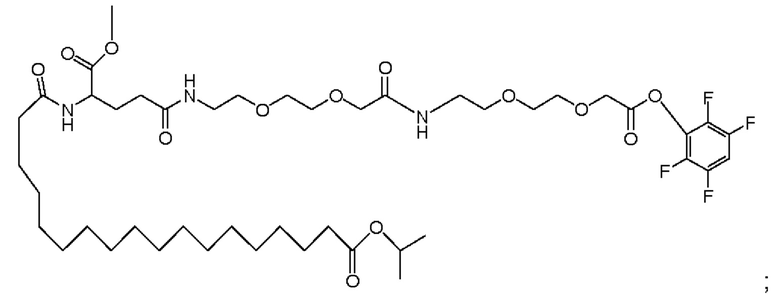
(4) смешивание раствора аналога GLP-1, полученного на стадии (2), с раствором жирной кислоты, полученным на стадии (3), и выдерживание при низкой температуре, например, в течение одного часа;
(5) доведение рН до 4-5 для остановки реакции, выдерживание при низкой температуре для осаждения кислотой и затем сбор осадка;
(6) добавление TFA к осажденному кислотой образцу, полученному на стадии (5), до конечной концентрации полипептида 5-15 мг/мл, выдерживание в течение 0,5-2 часов и вливание по каплям щелочного раствора, такого как NaOH, в реакционный раствор, с доведением рН 7,5-8,5 для остановки реакции;
(7) выделение и очистку полученного продукта.
Настоящее изобретение относится к получению фармацевтической композиции, содержащей производное аналога GLP-1(7-37) или его фармацевтически приемлемую соль. В некоторых вариантах осуществления производное аналога GLP-1(7-37) или его фармацевтически приемлемая соль согласно настоящему изобретению содержится в концентрации 0,1-25 мг/мл, предпочтительно содержится в концентрации 0,1-10,0 мг/мл. В предпочтительном варианте осуществления фармацевтическая композиция имеет рН 3,0-9,0. В предпочтительном варианте осуществления фармацевтическая композиция может дополнительно включать буферную систему, консервант, агент, модифицирующий поверхностное натяжение, хелатирующий агент, стабилизатор и поверхностно-активное вещество. В некоторых вариантах осуществления лекарственное средство или препарат, описанные в настоящем документе, представляют собой водное лекарственное средство или препарат, например, обычно это может быть раствор или суспензия. В частном варианте осуществления настоящего изобретения лекарственное средство или препарат представляет собой стабильный водный раствор. В других частных вариантах осуществления настоящего изобретения лекарственное средство или препарат представляет собой лиофилизированный препарат, и к нему перед использованием добавляют растворитель и/или разбавитель.
Настоящее изобретение также относится к коробке или набору медицинского назначения, содержащим вышеуказанную фармацевтическую композицию, препарат или лекарственное средство. В дополнение к вышеуказанному лекарственному средству или препарату коробка или набор медицинского назначения также содержат другое лекарственное средство, фармацевтическое соединение или композицию, которые могут быть использованы в комбинации с указанными фармацевтической композицией, препаратом или лекарственным средством, например, другое лекарственное средство, фармацевтическое соединение или композиция могут быть выбраны из противодиабетических лекарственных средств, лекарственных средств для лечения и/или предупреждения осложнений, вызываемых диабетом или связанных с ним. Примеры этих лекарственных средств включают: инсулин, сульфонилмочевину, бигуаниды, меглитиниды, ингибиторы глюкозидазы, антагонисты глюкагона, ингибиторы ферментов печени, участвующих в стимуляции глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, антагонисты NPY, агонисты PYY, агонисты PYY2, агонисты PYY4, агонисты TNF, агонисты кортикотропин-рилизинг фактора, 5НТ, агонисты церулеина, антагонисты пептидов ганглиев, гормон роста, агонисты тиреотропин-рилизинг-гормона, агонисты TRβ; антагонисты Н3-гистаминовых рецепторов, ингибиторы липазы/амилазы, агонисты или антагонисты желудочного ингибиторного полипептида, гастрин и аналоги гастрина, и т.д. В некоторых вариантах осуществления фармацевтическая композиция, препарат, лекарственное средство и другие лекарственные средства, фармацевтические соединения или композиции согласно настоящему изобретению помещены в отдельные контейнеры.
Настоящее изобретение также относится к способу предупреждения или лечения диабета (например, диабета I и II типов), осложнений диабета (например, диабетической васкулопатии, диабетической нейропатии, диабетической офтальмопатии, диабетической нефропатии, диабетической болезни сердца), снижения уровня глюкозы в крови (например, глюкозы в крови натощак и глюкозы в крови после приема пищи), включающему: введение вышеуказанного аналога, производного или лекарственного средства, фармацевтической композиции нуждающемуся субъекту, где аналог, производное или лекарственное средство, фармацевтическая композиция и другое лекарственное средство, фармацевтическое соединение или композиция используются в комбинации, например, другое лекарственное средство, фармацевтическое соединение или композиция могут быть выбраны из противодиабетических лекарственных средств, лекарственных средств для лечения и/или предупреждения осложнений, вызываемых диабетом или связанных с ним. Примеры этих лекарственных средств включают: инсулин, сульфонилмочевину, бигуаниды, меглитиниды, ингибиторы глюкозидазы, антагонисты глюкагона, ингибиторы ферментов печени, участвующих в стимуляции глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, агонисты CART; антагонисты NPY, агонисты PYY, агонисты PYY2, агонисты PYY4, агонисты TNF, агонисты кортикотропин-рилизинг фактора, 5НТ, агонисты церулеина, антагонисты пептидов ганглиев, гормон роста, агонисты тиреотропин-рилизинг-гормона, агонисты TRβ; антагонисты Н3-гистаминовых рецепторов, ингибиторы липазы/амилазы, агонисты или антагонисты желудочного ингибиторного полипептида, гастрин и аналоги гастрина, и т.д. В предпочтительных вариантах осуществления диабет представляет собой диабет типа II или диабетическую нефропатию.
«Осложнение диабета» в настоящем изобретении относится к заболеванию, связанному с повреждением или дисфункцией других органов или тканей организма, вызванным плохим контролем уровня глюкозы в крови при диабете, включая повреждение или дисфункцию печени, почек, сердца, сетчатки, нервной системы и т.д. Осложнения диабета можно разделить на пять аспектов: 1. сердечно-сосудистое заболевание: включает микрососудистые поражения сердца и крупных сосудов, кардиомиопатию, сердечную вегетативную нейропатию, которая является основной причиной смерти пациентов с диабетом; 2. цереброваскулярное заболевание: относится к внутричерепным макрососудистым и микрососудистым заболеваниям, вызываемым диабетом, в основном проявляющимся как церебральный атеросклероз, ишемическое цереброваскулярное заболевание, внутримозговое кровоизлияние, церебральная атрофия и т.д.; 3. почечно-сосудистое заболевание: в основном проявляется в виде диабетической нефропатии, которая является одним из наиболее серьезных сопутствующих заболеваний у пациентов с диабетом; 4. заболевание артерий нижних конечностей: в основном проявляется как диабетическая стопа; 5. микрососудистое заболевание глазного дна: в основном проявляется как диабетическая ретинопатия.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами. Однако описанные примеры не следует толковать как ограничивающие объем охраны патента. Признаки (по отдельности и в любой комбинации), раскрытые в предшествующем описании и следующих далее примерах, могут быть материалами, используемыми для реализации настоящего изобретения в совершенно разных формах, и они могут быть объединены произвольным образом. Кроме того, в настоящем изобретении цитируются общедоступные документы, и эти документы предназначены для ясного описания настоящего изобретения. Их полное содержание включено в настоящий документ посредством ссылки, как если бы их тексты были целиком воспроизведены в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
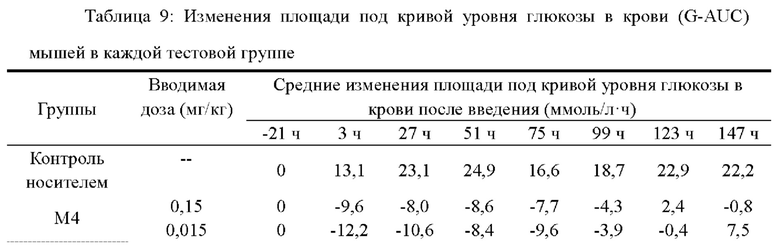
На фиг.1 показаны глюкозоснижающие действия различных молекул ацилированных производных GLP-1 на мышах db/db с диабетом II типа.
На фиг.2 показан график тренда действий различных доз М0, М4 и семаглутида на уровень глюкозы в крови натощак у мышей с диабетом.
На фиг.3 показаны действия различных доз М0, М4 и семаглутида на случайный уровень глюкозы в крови у мышей с диабетом.
На фиг.4 показаны действия различных доз М0, М4 и семаглутида на площадь под кривой уровня глюкозы в крови у мышей с диабетом.
На фиг.5 показан график тренда противодействия молекул М4 и семаглутида разложению под действием пепсина.
На фиг.6 показан график тренда противодействия молекул М4 и семаглутида разложению под действием трипсина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРИМЕРЫ
Далее изобретение будет описано на конкретных примерах. Если не указано иное, его можно реализовать в соответствии с методами, перечисленными в руководствах по проведению экспериментов, таких как «Molecular Cloning: A Laboratory Manual» и «Cells: A Laboratory Manual», знакомых специалистам в данной области техники, а также руководствах по проведению экспериментов CFDA (Государственное управление Китая по контролю продуктов питания и медикаментов). Среди них все используемые исходные реагенты представляют собой коммерчески доступные продукты, которые могут быть приобретены через общедоступные каналы.
Пример 1. Конструирование плазмид экспрессии аналогов GLP-1
Конструирование ДНК Val8Glu22Lys23Arg26,34-GLP-1(7-37)
6-His-метку, метку SUMO и последовательность гена, кодирующего Val8Glu22Lys23Arg26,34-GLP-1(7-37) (SEQ ID NO: 7), по порядку последовательно гибридизовали, а фрагмент гена (SEQ ID NO: 18) получали химическим синтезом. Через сайты BamHI и XhoI вышеуказанный фрагмент вставляли в прокариотическую плазмиду экспрессии рЕТ-24(+) и подтверждали секвенированием. Полученная плазмида экспрессии для анализа трансформации названа pET-24(+)-His-SUMO-Val8Glu22Lys23Arg26,34-GLP-1(7-37).
Согласно описанному выше методу последовательно конструировали соответствующие плазмиды экспрессии следующих пептидов:
Val8Glu22Lys26Arg34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 3),
Val8Glu22Lys30Arg26.34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 11),
Val8Glu22Lys19Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 5),
Val8Glu22Lys27Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 9),
Val8Glu22Lys34Arg26-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 13),
Val8Glu22Arg26,34Lys36-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 15),
Val8Glu22Arg26,34Lys37-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 17),
Thr8Glu22Lys23Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 20),
Ile8Glu22Lys23Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 22),
Leu8Glu22Lys23Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 24),
Gly8Glu22Lys23Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 26),
Ser8Glu22Lys23Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 28),
Thr8Glu22Lys30Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 30),
Ile8Glu22Lys30Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 32),
Leu8Glu22Lys30Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 34),
Gly8Glu22Lys30Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 36),
Ser8Gm22Lys30Arg26,34-GLP-1(7-37) (кодирующий ген - SEQ ID NO: 38).
Пример 2. Экспрессия слитых белков
Конструкцию ДНК, описанную в примере 1, трансформировали в клетки-хозяева BL21 (TrabsGenBiotech., номер по каталогу CD601) для получения целевого белка согласно настоящему изобретению. 50 мкл компетентных клеток BL21 помещали на ледяную баню для оттаивания, затем добавляли представляющую интерес ДНК и осторожно встряхивали, и помещали на ледяную баню на 30 мин. Затем проводили тепловой шок на водяной бане при 42°С в течение 30 секунд с последующим быстрым переносом центрифужной пробирки на ледяную баню на 2 мин, не встряхивая центрифужную пробирку во время этого процесса. 500 мкл стерильной среды LB (без антибиотиков) добавляли в центрифужную пробирку, затем перемешивали и культивировали при 37°С, 180 об/мин в течение 1 часа для выделения бактерий. Пипеткой переносили 200 мкл трансформированных компетентных клеток и добавляли в планшет с агаровой средой LB с устойчивостью к канамицину, равномерно распределяя клетки; помещали планшет при 37°С до тех пор, пока жидкость не впиталась, затем переворачивали планшет и инкубировали при 37°С в течение ночи. На следующий день моноклональные колонии в чашке для трансформации собирали с использованием инокуляционного кольца для инокуляции в 15 мл стерильной среды LB (содержащей антибиотики), затем культивировали при 30°С в течение ночи.
Пример 3. Ферментация рекомбинантных аналогов GLP-1
50 мкл бактериальной суспензии (бактериальная суспензия, экспрессирующая GLP-1) добавляли к 50 мл среды LB, одновременно добавляя 50 мкл канамицина, перемешивали и помещали в шейкер при постоянной температуре 30°С, затем инокулировали в течение ночи. 10 мл бактериальной суспензии, инокулированной в течение ночи, добавляли к 1000 мл среды LB, одновременно добавляя 1000 мкл канамицина; затем встряхивали и помещали в шейкер при 37°С при 200 об/мин. После инокуляции в течение 4 часов в среду добавляли IPTG (изопропил-β-D-1-тиогалактопиранозид) с конечной концентрацией 0,1 моль/л, затем встряхивали и помещали в шейкер при 30°С и 180 об/мин, чтобы вызвать экспрессию в течение ночи. Бактериальную суспензию после экспрессии в течение ночи, центрифугировали при 13000 g в течение 60 мин. Выход бактерий составил около 4 г бактерий/л ферментативного бульона, а экспрессия представляющего интерес белка, определенная с помощью SDS-PAGE (электрофорез белков в полиакриламидом геле в присутствии додецилсульфата натрия), составила примерно до 40%.
Пример 4. Очистка рекомбинантных аналогов GLP-1
100 г клеточной суспензии взвешивали и повторно суспендировали в 500 мл 50 мМ Трис-HCl, рН 8,0, 50 мМ NaCl, затем обрабатывали ультразвуком в ультразвуковом дезинтеграторе клеток в течение 30 минут для разрушения клеток. Гомогенат центрифугировали при 13000 g в течение 60 мин при 4°С. После центрифугирования собирали супернатант в виде образца для колоночной хроматографии на Ni.
Полученный супернатант концентрировали с помощью Chelating Sepharose FF, предварительно уравновешенной 50 мМ Трис-HCl, рН 8,0, 500 мМ NaCl, 10 мМ имидазола (уравновешивающая жидкость 1); после промывки уравновешивающей жидкостью 1 его элюировали 50 мМ Трис-HCl, рН 8,0, 50 мМ NaCl и 0,3 М имидазола (элюент). Согласно анализу SDS-PAGE чистота промежуточного продукта GLP-1, полученного с помощью указанного выше процесса очистки, превышала 70%.
Вырезание последовательности метки Sumo с помощью фермента ULP: добавляли 20 мМ буфера РВ, рН 7,4 к промежуточному продукту для получения трехкратного разведения, добавляли фермент ULP для перемешивания и расщепления в течение ночи при 4°С при соотношении фермент ULP промежуточный продукт, равном 1:150. Степень расщепления согласно анализу SDS-PAGE составила почти 100%.
Очистка аналога GLP-1: продукт, полученный после расщепления, концентрировали с использованием среды Tosoh Butyl 550С, предварительно уравновешенной 20 мМ Na2HPO4, 0,7 М NaCl (уравновешивающая жидкость 2), после промывки уравновешивающей жидкостью 2 его элюировали 20% этанолом, и чистота согласно анализу SDS-PAGE составила около 90%.
К элюированному образцу добавляли 0,2 М Na2HP04 для достижения конечной концентрации 20 мМ Na2HPO4, затем доводили рН до 4,8-5,0 с помощью 1 М лимонной кислоты для осаждения кислотой при 4°С в течение ночи. Согласно анализу SDS-PAGE выход составил более 90%. Проводили центрифугирование при 13000 g в течение 30 минут при 4°С, затем собирали осадок и хранили при -20°С.
Пример 5. Получение производных аналогов GLP-1
Получение производного аналога GLP-1, как показано ниже, пептида N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Lys23Arg26,34-GLP-1(7-37)) (сокращенно обозначаемого М2)
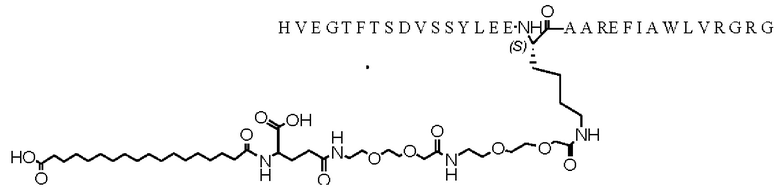
1. Модификация жирной кислотой: к осадку Val8Glu22Lys23Arg26,34-GLP-1(7-37), полученному и собранному в приведенном выше примере, добавляли воду, чтобы приготовить раствор концентрацией 4-6 мг/мл, затем добавляли 1 М гидроксид натрия, чтобы довести рН до 11,0-11,5, встряхивая, чтобы белок полностью растворился, и количественно определяли концентрацию пептида с помощью ВЭЖХ (высокоэффективная жидкостная хроматография). Порошок жирной кислоты взвешивали и растворяли в ацетонитриле при молярном соотношении пептида к жирной кислоте, равном 1:4 (структура представляла собой следующую). К этому раствору полипептида добавляли две тысячных триэтиламина, смешивали с раствором жирной кислоты и оставляли смесь при 4°С на один час.
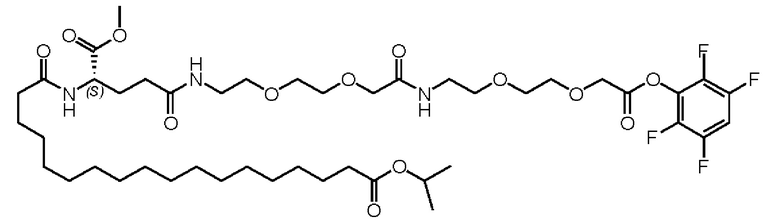
Образец пятикратно разбавляли водой, затем доводили рН до 4,8 с помощью 1 М лимонной кислоты (или 10% уксусной кислоты), чтобы остановить реакцию, выдерживали при 4°С для осаждения кислотой в течение 10 минут, центрифугировали при 13000 g после осаждения кислотой и центрифугировали при 4°С в течение 30 мин, а затем хранили осадок при -80°С.
2. Снятие защиты жирной кислоты и очистка: к осажденному кислотой образцу добавляли TFA до конечной концентрации пептида около 10 мг/мл, затем встряхивали для растворения осадка, оставляли его при комнатной температуре для снятия защиты на 30 минут и по каплям добавляли 4 М NaOH в реакционный раствор, чтобы довести рН до 7,5-8,5 для остановки реакции.
С помощью препаративной ВЭЖХ (Shimadzu LC-8A) реакционную жидкость после остановки реакции перекачивали в UniSil 10-120 С18 (приобретенную у Suzhou Nanomicro Technology Co., Ltd.), предварительно уравновешенную 10 мМ ацетатом аммония, 20% этанолом (уравновешивающая жидкость 3), для концентрирования. После промывки уравновешивающей жидкостью 3 для элюирования использовали градиент 0-100% элюента (10 мМ ацетат аммония, 80% этанол). Пик элюирования собирали, и чистота согласно анализу ОФ-ВЭЖХ (обращенно-фазовая высокоэффективная жидкостная хроматография) составила около 90%.
Пик элюирования трижды разбавляли водой, затем доводили рН осаждения кислотой до 4,80 и проводили осаждение кислотой при 4°С в течение 30 минут. После центрифугирования к осадку добавляли буфер PBST (рН 7,0) для его восстановления, затем замораживали и хранили при -80°С.
В соответствии с приведенным выше способом последовательно получали следующие пептиды:
пептид N-ε26-[2-(2-[2-(2-[2-(2[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил]Val8Glu22Lys26Arg34-GLP-1(7-37) (М0),
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил])(Val8Glu22Lys30Arg26,34-GLP-1(7-3 7))(M4),
пептид N-ε19-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Lys19Glu22Arg26,34LP-1(7-37))(M1),
пептид N-ε27-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Lys27Arg26,34-GLP-1(7-37))(M3),
пептид N-ε34-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Arg26Lys34-GLP-1(7-37)) (M5),
пептид N-ε3б-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Arg26,34Lys36-GLP-1(7-37))(M6),
пептид N-ε37-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Arg26,34Lys37-GLP-1(7-37))(M7);
пептид N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Thr8Glu22Lys23Arg26,34-GLP-1(7-37))(M8),
пептид N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Ile8Glu22Lys23Arg26,34-GLP-1(7-37)) (M9),
пептид N-ε23-(2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Leu8Glu22Lys23Arg26,34-GLP-1(7-37))(M10),
пептид N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Gly8Glu22Lys23Arg26,34-GLP-1(7-37)) (M11),
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил)](Ser8Glu22Lys23Arg26,34-GLP-1(7-37)) (M12);
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(8)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил])(Thr8Glu22Lys30Arg26,34-GLP-1(7-37))(M13),
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Ile8Glu22Lys30Arg26,34-GLP-1(7-37) )(М14),
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Leu8Glu22Lys30Arg26,34-GLP-1(7-37))(M15),
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Gly8Glu22Lys30Arg26,34-GLP-1(7-37))(M16),
пептид N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Ser8Glu22Lys30Arg26,34-GLP-1(7-37))(M17).
Пример 6. Определение активности производных аналогов GLP-1 в клетках RIN-m5F in vitro
Отбирали клетки RIN-m5F с хорошим статусом культивирования. Затем клетки собирали, подсчитывали и готовили из них клеточную суспензию с 1×105 клеток/мл в минимальной среде RPMI1640. Клеточную суспензию высевали в 96-луночный планшет для клеточных культур при 100 мкл на лунку, затем инкубировали в течение ночи при 37°С и 5% СО2. Активность производных аналогов GLP-1 in vitro измеряли с помощью набора для анализа цАМФ (циклический аденозинмонофосфат) (Promega): готовили разбавленные средой для анализа до 300 нг/мл образцы (Aib, М0, M1, М2, М3, М4, М5, М6 и М7), затем выполняли трехкратное последовательное разведение в 96-луночных планшетах, получая в общей сложности 8 концентраций, и делая 2 дублирующие лунки для каждого разведения, где М0, M1, М2, М3, М4, М5, М6 и М7 были получены, как описано выше, и Aib представляет собой:
пептид N-ε26-[2-(2-[2-(2-[2-(2[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил][Aib8, Arg34]GLP-1-(7-37) (см. CN 101133082 В, пример 4), торговое наименование - семаглутид, и он был получен в соответствии со способом, раскрытым в патенте CN 101133082 В.
Полученный планшет для клеточных культур вынимали, затем отбрасывали среду и промакивали его насухо на фильтровальной бумаге. Растворы образцов соответственно переносили в планшет для клеточных культур при 40 мкл/лунку; обрабатывали с открытой крышкой в течение 15 мин при 37°С и 5% СО2. Планшет для клеточных культур вынимали из инкубатора, затем добавляли в каждую лунку 10 мкл раствора CD (набор для анализа цАМФ, Promega), выдерживали планшет для клеточных культур при 22-25°С и горизонтальном встряхивании при 500 об/мин в течение 20 минут. В каждую лунку добавляли 50 мкл раствора KG (набор для анализа цАМФ, Promega), затем горизонтально встряхивали при 22-25°С, 500 об/мин и прятали от света на 10 минут. Величину хемилюминесценции считывали с помощью прибора для регистрации хемилюминесценции Molecular Devices SpectraMax L, завершая измерение за 30 мин. ЕС50 образца рассчитывали с использованием четырехпараметрической регрессии в программном обеспечении softmax Pro.
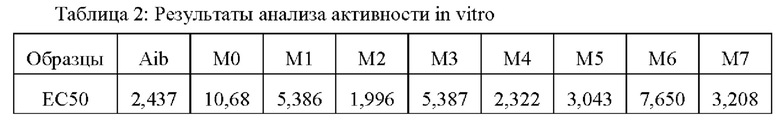
Фармакодинамика in vitro в клетках PJN-m5F показывает, что in vitro активности семаглутида, М2, М4, М5 и М7 сопоставимы и, как правило, немного выше, чем активности М0, M1, М3 и М6.
Пример 7. Определение активности производных аналогов GLP-1 в клетках HEK293/CRE-Luc/GLPlPv in vitro
Основываясь на том факте, что GLP-1 может связываться с рецептором на клеточной мембране, была сконструирована линия клеток HEK293/CRE-Luc/GLP1R, цАМФ-ответные элементы (CRE) активируются посредством серии передачи сигналов, инициируется экспрессия нижестоящей люциферазы, и величина этой экспрессии положительно коррелирует с биологической активностью GLP-1. После добавления субстрата люциферазы проводили хемилюминесцентный анализ для определения интенсивности свечения, тем самым определяя биологическую активность GLP-1.
Материалы для проведения эксперимента
96-луночный планшет для клеточных культур (белый и непрозрачный), среда DMEM (модифицированная по способу Дульбекко среда Игла) (GIBCO), 0,05% ТРИПСИН-ЭДТА (GIBCO), фетальная бычья сыворотка (GIBCO), G418, гигромицин В, набор для анализа люциферазы Bright-Glo™ Luciferase Assay System Kit (Promega) и клетки HEK293/CRE-luc/GLP1R.
Операции при проведении эксперимента
(1) Подготовка клеток: клетки культивировали до тех пор, пока они не начали интенсивно расти и не достигли достаточного количества, отбрасывали культуральную среду в культуральной колбе, добавляли 3 мл раствора Версена и однократно встряхивали; затем добавляли 2 мл 0,05% дигестирующего раствора ТРИПСИН-ЭДТА, накрывали колбу и выдерживали в течение 1 минуты, а затем добавляли 6 мл среды для анализа для остановки расщепления; после центрифугирования при 1000 об/мин в течение 3 минут супернатант отбрасывали, клетки повторно суспендировали в 5 мл среды для анализа и подсчитывали на гемоцитометре. Плотность клеток доводили до подходящего диапазона для последующего использования с помощью среды для анализа DMEM.
(2) Подготовка образца: производные различных аналогов GLP-1 в таблице 1 разбавляли до 20 нг/мл средой для анализа, затем последовательно разбавляли с получением 8 концентраций в 96-луночных планшетах и использовали среду для анализа вместо образца в качестве ячейки холостого контроля. Для каждой разведенной концентрации делали 2 дублирующих лунки.
(3) Культивирование с добавлением образцов: приготовленные растворы контрольных и тестируемых образцов переносили в 96-луночный планшет для клеточных культур (белый), добавляя по 50 мкл раствора в каждую лунку; затем добавляли приготовленную клеточную суспензию, добавляя по 50 мкл суспензии в каждую лунку; и затем инкубировали в течение определенного периода времени в условиях 37°С и 5% CO2.
(4) Хемилюминесцентный анализ: добавляли субстрат, затем вынимали 96-луночный планшет для клеточных культур, добавляли 100 мкл реагента Bright Glo в каждую лунку и оставляли в темноте на 3 мин.
(5) Считывание: определение проводили с помощью анализатора хемилюминесценции для микропланшетов SpectraMax L, затем считывали планшет в течение 30 мин и записывали полученные результаты.
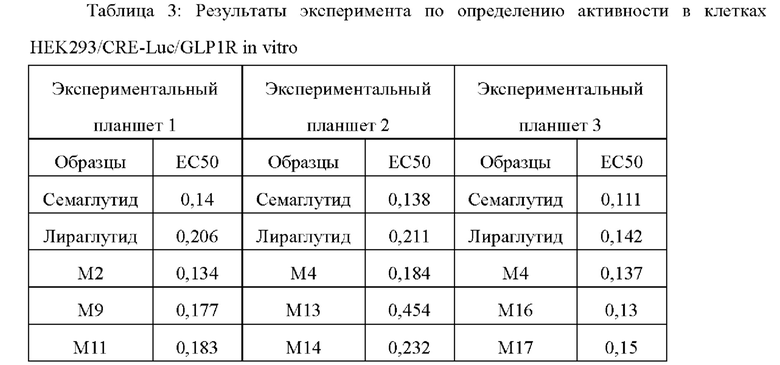
Фармакодинамика в клетках HEK293/CRE-Luc/GLP1R показывает, что in vitro активности семаглутида, М2, М4, М9, М11, М14, М16 и М17 сопоставимы и, как правило, немного выше, чем активность М13.
Пример 8. Исследование глюкозоснижающего действия модифицированных жирной кислотой производных аналогов GLP-1 на нормальных мышах
Двадцать восемь здоровых самок мышей CD-1 в возрасте 4-6 недель отбирали и делили на 4 группы, которым подкожно вводили соответственно М2, М4, М0 и семаглутид (Aib) в дозе 0,15 мг/кг массы тела. 20% глюкозу внутрижелудочно вводили до введения и через интервалы в 6 часов, 1 день, 2 дня, 3 дня и 4 дня после введения в дозе 2 г/кг массы тела и при голодании за 6 часов до введения глюкозы; затем брали кровь с кончика хвоста соответственно в 0 ч, 0,5 ч, 1 ч и 2 ч после введения глюкозы и измеряли значение уровня глюкозы в крови в реальном времени с помощью тест-полосок для определения глюкозы в крови от Roche; и рассчитывали AUC глюкозы в крови (площадь под кривой зависимости уровня глюкозы в крови от времени) в пределах 0-120 мин, получая степень ингибирования глюкозы в крови (таблица 4).
Степень ингибирования глюкозы в крови = [(AUC глюкозы в крови мышей до введения - AUC глюкозы в крови мышей после введения) / AUC глюкозы в крови мышей до введения] × 100%
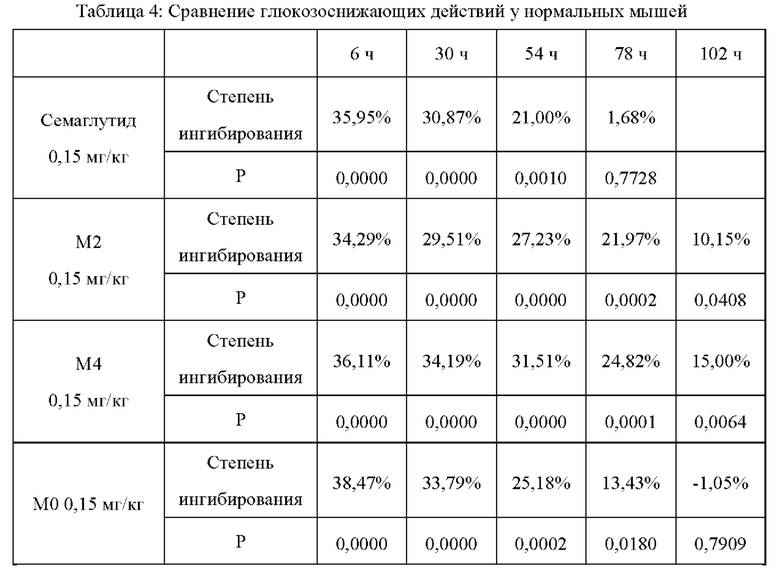
Р-значение: по сравнению с уровнем глюкозы в крови до введения
Из таблицы 4 можно видеть, что глюкозоснижающее действие семаглутида у нормальных мышей длится около 2 дней, а глюкозоснижающее действие М0 у нормальных мышей длится около 3 дней; тем не менее, глюкозоснижающее действие М2 и М4 у нормальных мышей все еще очевидно на 4 день, а продолжительность их устойчивого глюкозоснижающего действия в организме значительно больше, чем у семаглутида или М0, и в различных временных точках после 3-го дня введения глюкозоснижающие действия как М2, так и М4 также значительно сильнее, чем у семаглутида или М0.
Двадцать восемь здоровых самок мышей CD-1 в возрасте 4-6 недель отбирали и делили на 4 группы, которым подкожно вводили М4, М5, М7 и М0 в дозе 0,15 мг/кг массы тела. 20% глюкозу внутрижелудочно вводили до введения и через интервалы в 6 часов, 1 день, 2 дня, 3 дня и 4 дня после введения в дозе 2 г/кг массы тела и при голодании за 6 часов до внутрижелудочного введения 20% глюкозы; и брали кровь с кончика хвоста соответственно в 0 ч, 0,5 ч, 1 ч и 2 ч после введения глюкозы, затем измеряли значение уровня глюкозы в крови в реальном времени с помощью тест-полосок для определения глюкозы в крови от Roche, и рассчитывали AUC глюкозы в крови (площадь под кривой зависимости уровня глюкозы в крови от времени) в пределах 0-120 мин, получая степень ингибирования глюкозы в крови (таблица 5).
Степень ингибирования глюкозы в крови = [(AUC глюкозы в крови мышей до введения - AUC глюкозы в крови мышей после введения) / AUC глюкозы в крови мышей до введения] × 100%
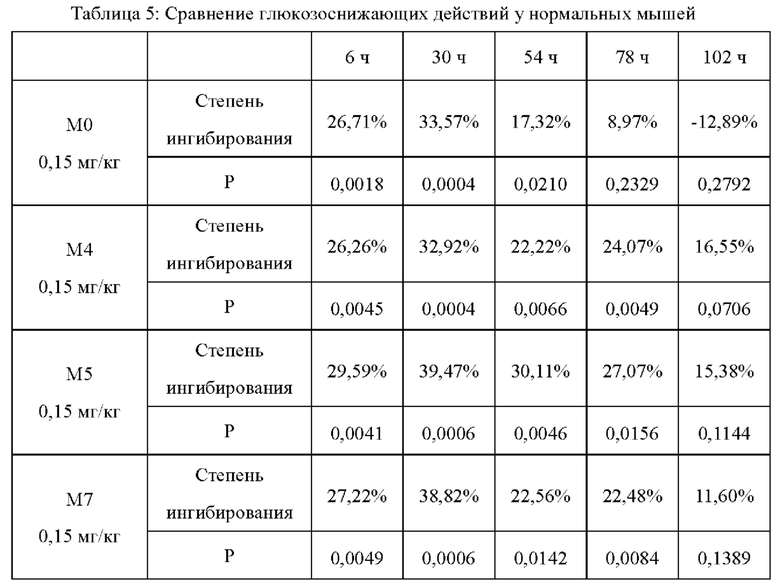
Из результатов, приведенных в таблицах 4 и 5, можно видеть, что глюкозоснижающие действия М2 и М4 лучше, чем у М0 и семаглутида; и глюкозоснижающие действия М2, М4, М5 и М7 сопоставимы, и между ними нет значимой разницы.
Пример 9. Исследование глюкозоснижающего действия с использованием мышей ICR
ПТТГ-тест на мышах ICR: отбирали 30 мышей ICR в возрасте 4-6 недель и делили на 6 групп, по 5 мышей на группу, и подкожно вводили им М0, семаглутид, М2, М4, М5 и М7, соответственно, в дозе 0,15 мг/кг массы тела путем однократного введения. 20% глюкозу внутрижелудочно вводили каждый день в соответствии с графиком 4 ч, 1 день, 2 день, 3 день, 4 день и 5 день, в дозе 2 г/кг массы тела и при голодании за 6 часов до введения глюкозы; и брали кровь с кончика хвоста соответственно в 0 ч, 0,5 ч, 1 ч и 2 ч после введения 20% глюкозы, затем измеряли значение уровня глюкозы в крови в реальном времени с помощью тест-полосок для определения глюкозы в крови от Roche. Кровь брали с кончика хвоста, значение уровня глюкозы в крови измеряли в реальном времени с помощью тест-полосок для определения глюкозы в крови от Roche и рассчитывали AUC глюкозы в крови (площадь под кривой зависимости уровня глюкозы в крови от времени) в пределах 0-120 мин, получая степень ингибирования глюкозы в крови (таблица 6).
Степень ингибирования глюкозы в крови = [(AUC глюкозы в крови мышей до введения - AUC глюкозы в крови мышей после введения) / AUC глюкозы в крови мышей до введения] × 100% 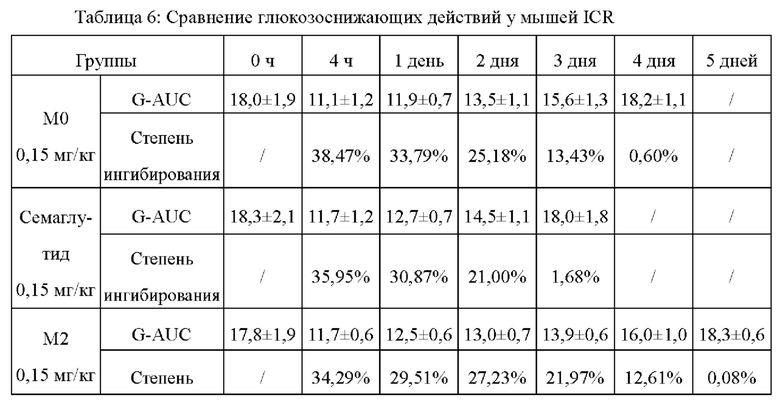
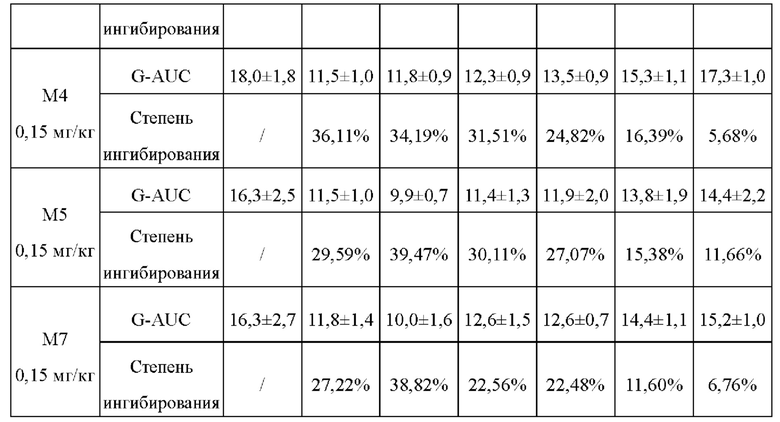
Из результатов, приведенных в таблице 6, можно видеть, что уровень глюкозы поддерживается постоянным: глюкозоснижающие действия М4, М5, М2 и М7 могут сохраняться в течение по меньшей мере 4 дней, что намного лучше, чем у М0 (сохраняется только в течение 3 дней) и семаглутида (сохраняется только в течение 2 дней), и все они являются статистически значимыми.
Пример 10. Фармакокинетический тест на снижение уровня глюкозы у мышей db/db с диабетом типа II
Пятьдесят 8-9-недельных самок мышей db/db делили на 10 равных групп на основании массы тела и уровня глюкозы в крови натощак (FBG) до введения, по 5 мышей на группу; и им соответственно осуществляли введение путем однократной подкожной инъекции носителя, М2, М4, семаглутида, М9, М11, М13, М14, М16 и М17 в дозе 10 мл/кг. Дозировка составляла 0,05 мг/кг для каждого, а время введения было установлено равным 0 часам. Уровень глюкозы в крови натощак измеряли каждый день после голодания в течение 6-8 часов, а уровень глюкозы в крови натощак после введения измеряли каждый день до тех пор, пока значение уровня глюкозы в крови натощак каждого животного из тестовой группы не вернулось к значению, измеренному до введения. Значение уровня глюкозы в крови, измеренное до введения, называется значением базального уровня глюкозы в крови, и было установлено равным 0.
Изменение уровня глюкозы в крови натощак (Δ: дельта) = значение уровня глюкозы в крови после введения - значение базального уровня глюкозы в крови до введения.
Результаты показаны на фиг.1, можно видеть, что с 4-го и 5-го дня глюкозоснижающие действия М9, М13 и М14 лучше, чем у семаглутида, а также не ниже, чем у М2; однако глюкозоснижающие действия М11, М16 и М17 ниже, чем у семаглутида, на 2-й день.
Пример 11. Глюкозоснижающее действие различных доз семаглутида, М0 и М4 у мышей db/db с диабетом II типа
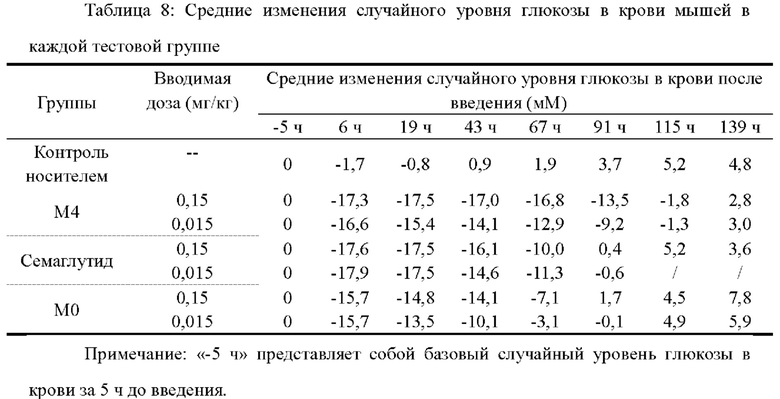
Тридцать пять 8-9-недельных самок мышей db/db делили на 7 равных групп на основании массы тела и площади под кривой уровня глюкозы в крови (G-AUC) до введения, по 5 мышей на группу; и им соответственно осуществляли введение путем однократной подкожной инъекции носителя, М4 (0,15, 0,015 мг/кг), семаглутида (0,15, 0,015 мг/кг) и М0 (0,15, 0,015 мг/кг) в дозе 10 мл/кг. Время введения было установлено равным 0 часам, и каждый день после голодания в течение 7-8 часов определяли уровень глюкозы в крови натощак и ПТТГ (пероральный тест на толерантность к глюкозе), затем внутрижелудочно вводили 10% глюкозу в дозе 1 г/кг массы тела, а затем брали кровь с кончика хвоста для измерения уровня глюкозы в крови в реальном времени через 0, 0,5, 1 и 2 ч после нагрузки глюкозой. После введения уровень глюкозы в крови измеряли каждый день перед голоданием как случайный уровень глюкозы в крови до тех пор, пока значение уровня глюкозы в крови натощак каждого животного из тестовой группы не вернулось к значению до введения. Все из значения базального уровня глюкозы в крови, значения случайного уровня глюкозы в крови и значения площади под кривой уровня глюкозы в крови (G-AUC), определенные до введения, использовали в качестве базовых для оценки эффективности лекарственного средства, и они были установлены равными 0.
Изменение уровня глюкозы в крови (Δ: дельта) = значение уровня глюкозы в крови после введения - значение базального уровня глюкозы в крови до введения.
Изменение площади под кривой уровня глюкозы в крови (Δ: дельта) = площадь под кривой уровня глюкозы в крови после введения - площадь под кривой уровня глюкозы в крови до введения.
Результаты представлены в таблицах 7, 8 и 9, а также на фиг. 2, 3 и 4.
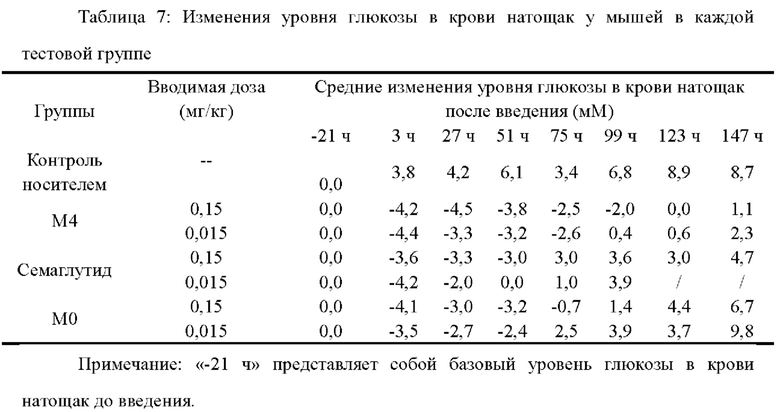

Результаты в таблицах 7-9 и на фиг.2-4 свидетельствуют о следующем: Уровень глюкозы в крови натощак: для М4 через 123 часа после введения данный уровень в группе с дозировкой 0,15 мг/кг возвращается к базовому базальному уровню глюкозы в крови до введения, а через 99 часов после введения данный уровень в группе с дозировкой 0,015 мг/кг возвращается к базовому базальному уровню глюкозы в крови до введения; для семаглутида через 51 час после введения данный уровень в группе с дозировкой 0,15 мг/кг возвращается к базовому базальному уровню глюкозы в крови до введения, а через 27 часов данный уровень в группе с дозировкой 0,015 мг/кг возвращается к базовому базальному уровню глюкозы в крови до введения; для М0 через 75 часов после введения данный уровень в группе с дозировкой 0,15 мг/кг возвращается к базовому базальному уровню глюкозы в крови до введения, а через 51 час после введения данный уровень в группе с дозировкой 0,015 мг/кг возвращается к базовому базальному уровню глюкозы в крови до введения; где все значения снижения уровня глюкозы в крови натощак в группе с дозировкой 0,015 мг/кг М4 в каждой временной точке проведения измерения не ниже, чем указанные значения в группе с дозировкой 0,15 мг/кг семаглутида или М0.
Случайный уровень глюкозы в крови: для М4 через 115 часов после введения данный уровень в группе с дозировкой 0,15 мг/кг возвращается к базовому случайному уровню глюкозы в крови до введения, а через 115 часов после введения данный уровень в группе с дозировкой 0,015 мг/кг возвращается к базовому случайному уровню глюкозы в крови до введения; для семаглутида через 67 часов после введения данный уровень в группе с дозировкой 0,15 мг/кг возвращается к базовому случайному уровню глюкозы в крови до введения, а через 67 часов после введения данный уровень в группе с дозировкой 0,015 мг/кг возвращается к базовому случайному уровню глюкозы в крови до введения; для М0 через 67 часов после введения данный уровень в группе с дозировкой 0,15 мг/кг возвращается к базовому случайному уровню глюкозы в крови до введения, а через 67 часов после введения данный уровень в группе с дозировкой 0,015 мг/кг возвращается к базовому случайному уровню глюкозы в крови до введения; где все ингибирующие действия в отношении случайного уровня глюкозы в крови в группе с дозировкой 0,015 мг/кг М4 в каждой временной точке проведения измерения не ниже, чем указанные действия в группе с дозировкой 0,15 мг/кг семаглутида или М0.
Площадь под кривой уровня глюкозы в крови (G-AUC): для М4 через 99 часов после введения данный параметр в группе с дозировкой 0,15 мг/кг возвращается к базовому значению площади под кривой уровня глюкозы в крови до введения, а через 99 часов после введения данный параметр в группе с дозировкой 0,015 мг/кг возвращается к базовому значению площади под кривой уровня глюкозы в крови до введения; для семаглутида через 51 час после введения данный параметр в группе с дозировкой 0,15 мг/кг возвращается к базовому значению площади под кривой уровня глюкозы в крови до введения, а через 51 час после введения данный параметр в группе с дозировкой 0,015 мг/кг возвращается к базовому значению площади под кривой уровня глюкозы в крови до введения; для М0 через 51 час после введения данный параметр в группе с дозировкой 0,15 мг/кг возвращается к базовому значению площади под кривой уровня глюкозы в крови до введения, а через 27 часов после введения данный параметр в группе с дозировкой 0,015 мг/кг возвращается к базовому значению площади под кривой уровня глюкозы в крови до введения; где все значения площади под кривой уровня глюкозы в крови в группе с дозировкой 0,015 мг/кг М4 в каждой временной точке проведения измерения не ниже, чем указанные значения в группе с дозировкой 0,15 мг/кг семаглутида или М0.
Эти результаты в отношении снижения уровня глюкозы показывают, что после однократной подкожной инъекции М4, или семаглутида, или М0 каждая группа демонстрирует значительное глюкозоснижающее действие, однако М4 обладает наилучшим глюкозоснижающим действием. Глюкозоснижающее действие при дозировке 0,015 мг/кг М4 сопоставимо с таковым для дозировки 0,15 мг/кг семаглутида или дозировки 0,15 мг/кг М0.
Пример 12. Исследование стабильности М4 и семаглутида при ферментативном разложении
Пепсин (3200-4500 ЕД/мг белка, от Sigma, номер по каталогу: Р6887), трипсин (приблизительно 10000 АЕЕ ЕД/мг белка, от Sigma, номер по каталогу: Т8003).
(1) Реакционный раствор
А: Реакционный буфер пепсина: готовили три 20 мМ цитрат-фосфатных буфера с разным рН (2,6, 4,0 и 7,4), затем добавляли 0,005% Твин 20 и 0,001% БСА (бычий сывороточный альбумин) для приготовления реакционного буфера пепсина.
В: Реакционный буфер трипсина: готовили три 20 мМ цитрат-фосфатных буфера с разным рН (4,0, 6,8 и 8,0), затем добавляли 0,005% Твин 20 и 0,001% БСА для приготовления реакционного буфера трипсина.
С: Искусственный желудочный сок, содержащий пепсин (SGF): был получен путем взятия 5 мл 0,1 М соляной кислоты и добавления и растворения 0,019 г пепсина.
D: Искусственный кишечный сок, содержащий трипсин (SIF): был получен путем взятия 0,0684 г дигидрофосфата калия, добавления 2,5 мл воды для его растворения, добавления 0,77 мл 0,2 М раствора гидроксида натрия и 5 мл воды, а затем добавления и растворения 0,1001 г трипсина; измеренное значение рН составило 6,82, затем разбавления путем добавления воды до 10 мл.
(2) Подготовка образцов
Брали образцы М4 и семаглутида и соответственно разбавляли до 1,33 мг/мл буфером РВ при рН 7,4 в качестве исходных растворов тестируемых образцов.
(3) Эксперименты по разложению пепсином
Брали соответствующее количество исходного раствора каждого тестируемого образца, соответственно, затем разбавляли до 0,06 мг/мл реакционными буферами пепсина с различным рН; реакционный раствор каждой группы разделяли по 1 мл/пробирку, в общей сложности на 7 пробирок, затем тщательно перемешивали и инкубировали на водяной бане при 37°С в течение 30 мин. 1 пробирку без SGF вынимали в качестве 0 точки реакции без фермента (была записана как точка -5 мин), а затем вынимали другие 6 пробирок, по отдельности добавляли в них SGF и хорошо перемешивали, к одной из них немедленно добавляли соответствующий объем 1 М NaOH для остановки реакции в качестве 0 точки после добавления фермента (была записана как точка 0 мин), а остальные 5 пробирок выдерживали при 37°С для протекания реакции; и одну группу вынимали через 5 мин, 10 мин, 20 мин, 35 мин и 50 мин, соответственно, и добавляли соответствующий объем 1 М NaOH, соответственно, для остановки реакции. Все пробирки во всех экспериментальных группах проверяли, чтобы общий объем после прекращения реакции был одинаковым.
(4) Эксперименты по разложению трипсином
Брали соответствующее количество исходного раствора тестируемого образца, соответственно, затем разбавляли его до 0,06 мг/мл реакционными буферами трипсина с различным рН; реакционный раствор каждой группы разделяли по 1 мл/пробирку, в общей сложности на 7 пробирок, затем тщательно перемешивали и инкубировали на водяной бане при 37°С в течение 30 мин. 1 пробирку без SIF вынимали в качестве 0 точки реакции без фермента (была записана как точка -5 мин), а затем вынимали другие 6 пробирок, чтобы по отдельности добавить в них SIF, и хорошо перемешивали, к одной из них немедленно добавляли соответствующий объем 6 М HCl для остановки реакции в качестве 0 точки после добавления фермента (была записана как точка 0 мин), а остальные 5 пробирок выдерживали при 37°С для протекания реакции; и одну группу вынимали соответственно через 5 мин, 10 мин, 20 мин, 35 мин и 50 мин, чтобы добавить соответствующий объем 6 М HCl, соответственно, для остановки реакции. Все пробирки во всех экспериментальных группах проверяли, чтобы общий объем после прекращения реакции был одинаковым.
Образцы из эксперимента по ферментативному разложению подвергали ВЭЖХ-анализу. Площадь пика основного пика образца без ферментативной реакции в 0 точке (записанной как -5 мин) использовали в качестве базовой площади пика, а оставшийся процент площади пика основного пика в различных временных точках после добавления фермента рассчитывали.
Экспериментальные данные по разложению пепсином (n=3) свидетельствуют (фиг.5) о том, что скорости разложения молекул М4 и семаглутида в кислых условиях (рН 2,6) сопоставимы, что связано с самой высокой активностью пепсина при этом рН; при нейтральном рН 7,4 обе молекулы практически не разлагаются, и в этих условиях активность желудочного белка является самой низкой; в то время как при рН 4,0 скорость разложения семаглутида значительно выше, чем у М4, t1/2 первого составляет около 10 минут, a t1/2 последнего составляет около 45 минут, что указывает на то, что способность М4 противостоять разложению пепсином значительно лучше, чем у семаглутида.
Экспериментальные данные по разложению трипсином (n=4) свидетельствуют (фиг.6) о том, что скорости разложения этих двух веществ практически одинаковы в условиях рН 6,8 и 8,0, поскольку трипсин обладает самой высокой активностью в этом диапазоне рН; М4 и семаглутид также демонстрируют способность противостоять разложению трипсином в условиях рН 4,0, и между ними практически нет никакой разницы.
--->
Перечень последовательностей
<110> Hangzhou Sciwind Biosciences Co., Ltd.
<120> Ацилированное производное GLP-1
<130> Отсутствует
<160> 38
<170> PatentIn версии 3.5
<210> 1
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 1
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
10 15 20
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
25 30 35
<210> 2
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 2
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 3
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная 2
<400> 3
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctaaa 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 4
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 4
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Lys Leu Glu Glu
10 1520
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
253035
<210> 5
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 5
cacgttgaag gtaccttcac ctctgacgtt tcttctaaac tggaagaaca ggctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 6
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 6
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Lys Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 7
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 7
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaaa agctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 8
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 8
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Lys Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 9
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 9
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
aaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 10
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 10 4
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Lys Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 11
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 11
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatca aatggctggt tcgtggtcgt ggt 93
<210> 12
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 12
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
25 30 35
<210> 13
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 13
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatcg cttggctggt taaaggtcgt ggt 93
<210> 14
<211> 31 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 14
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Lys Gly
25 30 35
<210> 15
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 15
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatcg cttggctggt tcgtggtaaa ggt 93
<210> 16
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 16
His Val Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Lys
25 30 35
<210> 17
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная 6
<400> 17
cacgttgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt aaa 93
<210> 18
<211> 421
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 18
attttgttta actttaataa ggagatatac catgcatcac catcatcacc acgctaaacc 60
ggaagttaaa ccggaagtta aaccggaaac ccacatcaac ctgaaagttt ctgacggttc 120
ttctgaaatc ttcttcaaaa tcaaaaaaac caccccgctg cgtcgtctga tggaagcttt 180
cgctaaacgt cagggtaaag aaatggactc tctgcgtttc ctgtacgacg gtatccgtat 240
ccaggctgac cagaccccgg aagacctgga catggaagac aacgacatca tcgaagctca 300
ccgtgaacag atcggtggtc acgttgaagg taccttcacc tctgacgttt cttcttacct 360
ggaagaaaaa gctgctcgtg aattcatcgc ttggctggtt cgtggtcgtg gttaataata 420
a 421
<210> 19
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 19
His Thr Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Lys Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 20
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>7
<223> Искусственная
<400> 20
cacaccgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaaa agctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 21
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 21
His Ile Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Lys Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 22
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 22
cacattgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaaa agctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 23
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 23
His Leu Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Lys Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 24
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 24
cacctggaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaaa agctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 25
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 25
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Lys Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 26
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 26
caccgcgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaaa agctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 27
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная 9
<400> 27
His Ser Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Lys Ala Ala Arg Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 28
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 28
cacagcgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaaa agctgctcgt 60
gaattcatcg cttggctggt tcgtggtcgt ggt 93
<210> 29
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 29
His Thr Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Lys Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 30
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 30
cacaccgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatca aatggctggt tcgtggtcgt ggt 93
<210> 31
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 31
His Ile Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Lys Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 32
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 32
cacattgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatca aatggctggt tcgtggtcgt ggt 93
<210> 33
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 33
His Leu Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Lys Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 34
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>11
<223> Искусственная
<400> 34
cacctggaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatca aatggctggt tcgtggtcgt ggt 93
<210> 35
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 35
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 1520
Gln Ala Ala Arg Glu Phe Ile Lys Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 36
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 36
cacggcgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatca aatggctggt tcgtggtcgt ggt 93
<210> 37
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 37
His Ser Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
10 15 20
Gln Ala Ala Arg Glu Phe Ile Lys Trp Leu Val Arg Gly Arg Gly
25 30 35
<210> 38
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная
<400> 38
cacagcgaag gtaccttcac ctctgacgtt tcttcttacc tggaagaaca ggctgctcgt 60
gaattcatca aatggctggt tcgtggtcgt ggt 93
<210> 39
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> формула аминокислотной последовательности, содержащейся в аналоге GLP-1
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa выбраниз Val, Thr, Ile, Leu, Gly или Ser
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> Xaa представляет собой Tyr или Lys
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> Xaa представляет собой Gln или Lys
<220>
<221> MISC_FEATURE
<222> (21)..(21)
<223> Xaa представляет собой Glu или Lys
<220>
<221> MISC_FEATURE
<222> (24)..(24)
<223> Xaa представляет собой Ala или Lys
<220>
<221> MISC_FEATURE
<222> (28)..(28)
<223> Xaa представляет собой Arg или Lys
<220>
<221> MISC_FEATURE
<222> (30)..(30)
<223> Xaa представляет собой Arg или Lys
<220>
<221> MISC_FEATURE
<222> (31)..(31)
<223> Xaa представляет собой Gly или Lys
<400> 39
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Xaa Leu Glu Glu
1 5 10 15
Xaa Ala Ala Arg Xaa Phe Ile Xaa Trp Leu Val Xaa Gly Xaa Xaa
20 25 30
<210> 40
<211> 31
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> последовательность семаглутида
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Aib
<400> 40
His Xaa Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
20 25 30
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДНЫЙ АНАЛОГ АЦИЛИРОВАННОГО ОКСИНТОМОДУЛИНА | 2018 |
|
RU2752787C1 |
| ТВЕРДЫЕ КОМПОЗИЦИИ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2018 |
|
RU2777206C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1, СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ И СМАЗЫВАЮЩЕЕ ВЕЩЕСТВО | 2019 |
|
RU2807183C2 |
| МУЛЬТИРЕЦЕПТОРНЫЙ АГОНИСТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2816492C2 |
| ДВОЙНОЙ АГОНИСТ РЕЦЕПТОРОВ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 И ГЛЮКАГОНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2021 |
|
RU2799327C1 |
| Новые производные оксинтомодулина и содержащая их фармацевтическая композиция для лечения ожирения | 2012 |
|
RU2739209C2 |
| ПРИМЕНЕНИЕ ДОЛГОДЕЙСТВУЮЩИХ ПЕПТИДОВ GLP-1 | 2013 |
|
RU2657573C2 |
| АЦИЛИРОВАННЫЕ GLP-1 СОЕДИНЕНИЯ | 2006 |
|
RU2434019C2 |
| НОВЫЙ БЕЛКОВЫЙ КОНЪЮГАТ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА, ОЖИРЕНИЯ И ДИАБЕТА | 2021 |
|
RU2822001C1 |
| СОЕДИНЕНИЯ-АГОНИСТЫ GIP И СПОСОБЫ | 2015 |
|
RU2716985C2 |
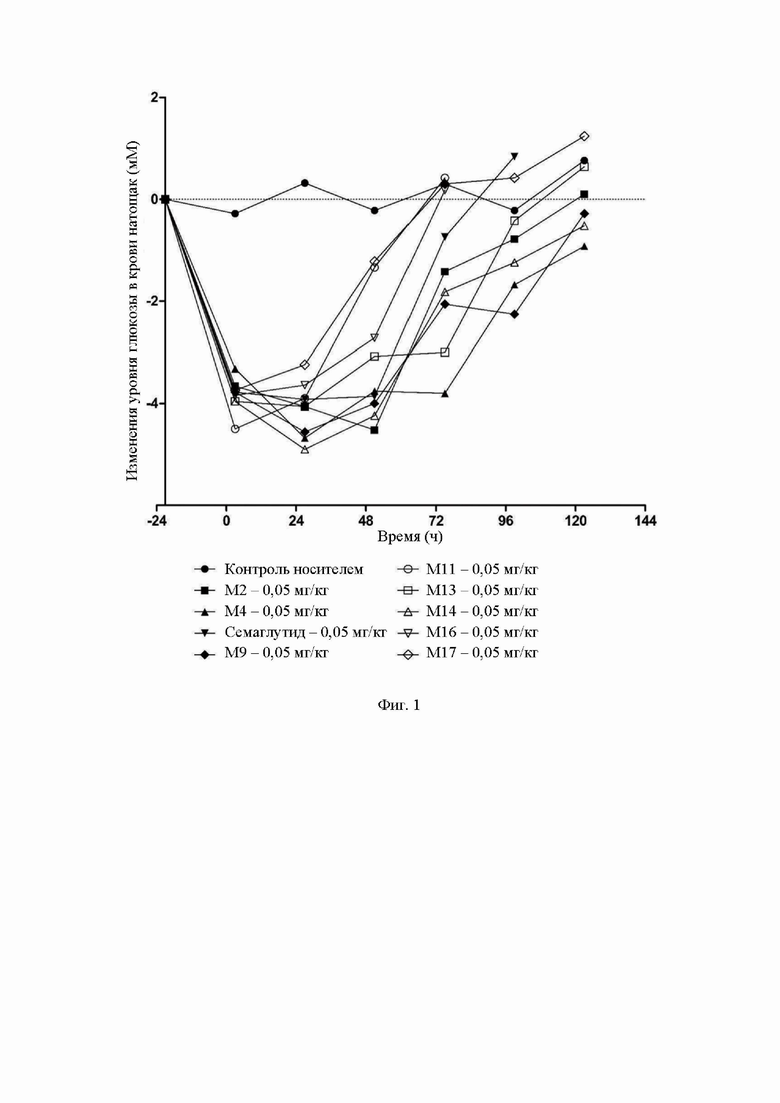
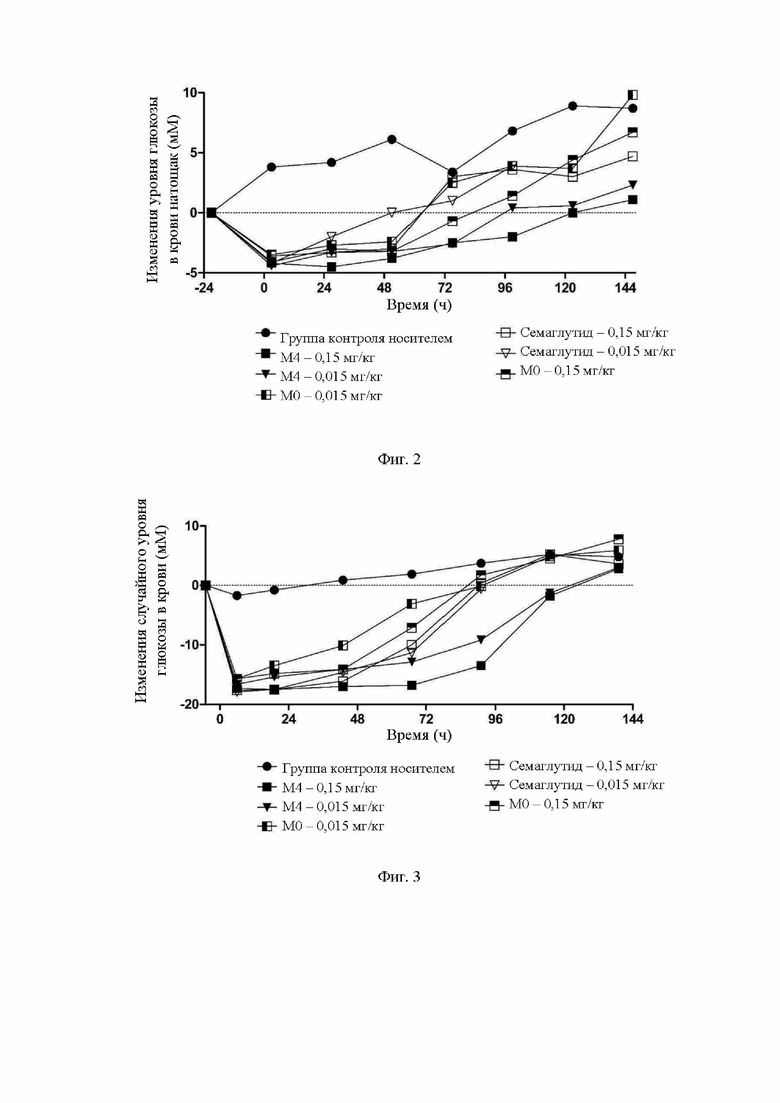
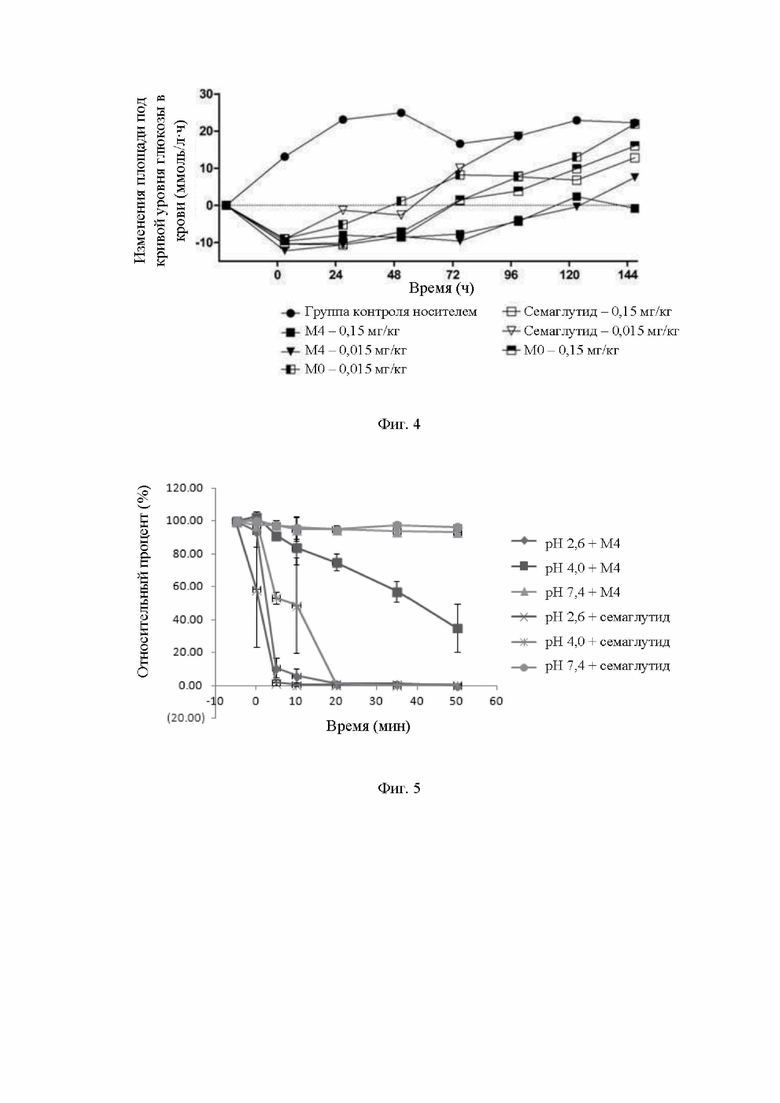
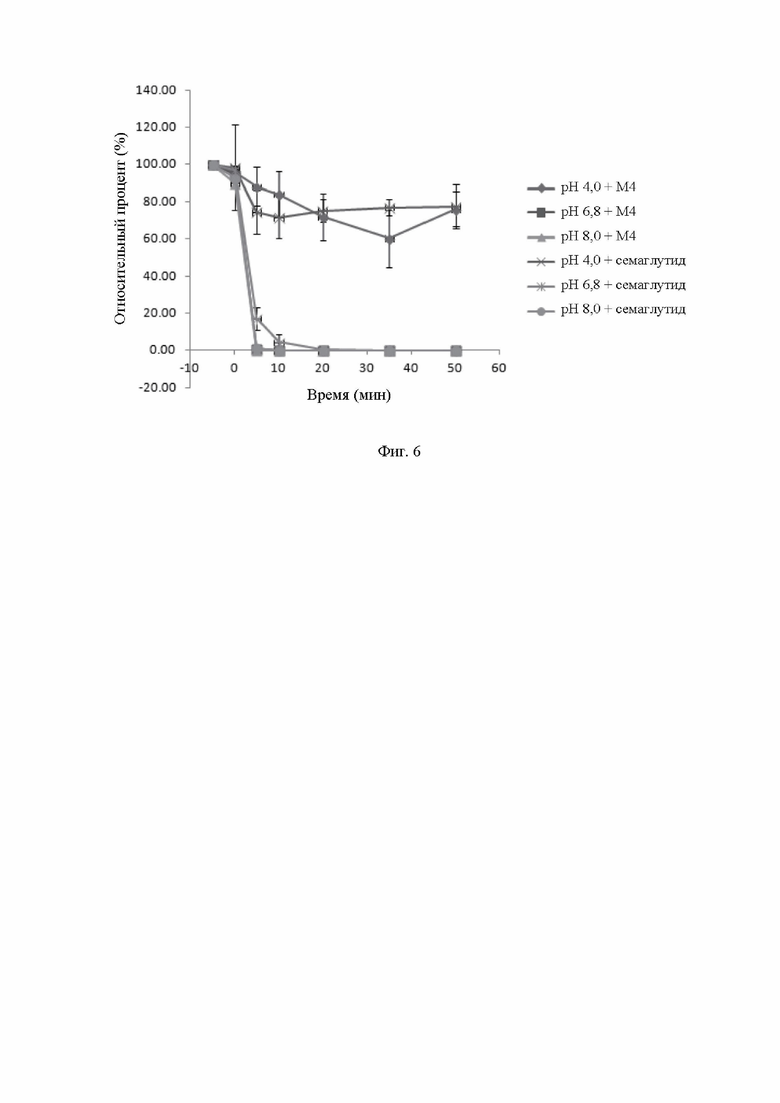
Изобретение относится к ацилированному производному GLP-1(7-37), которое предназначено для предупреждения и/или лечения диабета. Предложены аналог полипептида GLP-1(7-37), модифицированное жирной кислотой производное указанного аналога и лекарственное средство, содержащее указанное производное. Также предложен способ получения указанного производного и его применение для получения лекарственного средства. 7 н. и 7 з.п. ф-лы, 6 ил., 9 табл., 12 пр.
1. Производное аналога GLP-1(7-37) или его фармацевтически приемлемая соль, где аналог GLP-1(7-37) содержит аминокислотную последовательность следующей формулы:
HX8EGTFTSDVSSX19LEEX23AARX27FIX30WLVX34GX36X37 (SEQ ID NO: 39),
где X8 выбран из V; X19 представляет собой Y или K; X23 представляет собой Q или K; X27 представляет собой E или K; X30 представляет собой A или K; X34 представляет собой R или K; X36 представляет собой R или K; и X37 представляет собой G или K;
при условии, что только один из X19, X23, X27, X30, X34, X36 или X37 представляет собой остаток K, и
производное содержит удлиняющую часть, связанную с остатком K аналога GLP-1(7-37) через линкер, где удлиняющая часть представляет собой HOOC(CH2)14CO-, HOOC(CH2)15CO-, HOOC(CH2)16CO-, HOOC(CH2)17CO-, HOOC(CH2)18CO-, HOOC(CH2)19CO-, HOOC(CH2)20CO-, HOOC(CH2)21CO-, и HOOC(CH2)22CO-,
где линкер представляет собой 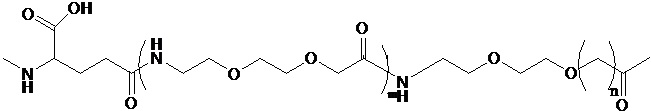 , где m равно 1; n равно 1.
, где m равно 1; n равно 1.
2. Производное или его фармацевтически приемлемая соль по п. 1, представляющее собой любое производное, выбранное из группы, состоящей из:
пептида N-ε23-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Lys23Arg26,34-GLP-1(7-37)) (M2),
пептида N-ε30-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Lys30Arg26,34-GLP-1(7-37)) (M4),
пептида N-ε34-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил](Val8Glu22Arg26Lys34-GLP-1(7-37)) (M5),
пептида N-ε37-[2-(2-[2-(2-[2-(2-[4-(17-карбоксигептадеканоиламино)-4(s)-карбоксибутириламино]этокси)этокси]ацетиламино)этокси]этокси)ацетил])(Val8Glu22Arg26,34Lys37-GLP-1(7-37)) (M7), или его фармацевтически приемлемую соль.
3. Способ получения производного или его фармацевтически приемлемой соли по п. 1, включающий:
(1) смешивание раствора, в котором растворен аналог GLP-1, с раствором, в котором растворена удлиняющая часть;
(2) доведение pH до 4-5 для остановки реакции, выдерживание до образования осадка, а затем сбор осадка; и
(3) добавление к осадку TFA (трифторуксусной кислоты) и доведение pH до 7,5-8,5 для остановки реакции.
4. Способ по п. 3, дополнительно включающий: добавление триэтиламина к раствору, в котором растворен аналог GLP-1, с последующим смешиванием с раствором, в котором растворена удлиняющая часть.
5. Способ по п. 3, где раствор удлиняющей части получен в ацетонитриле.
6. Фармацевтическая композиция для предупреждения и/или лечения диабета или осложнений диабета, содержащая терапевтически эффективное количество производного или его фармацевтически приемлемой соли по п. 1 и фармацевтически приемлемое вспомогательное вещество.
7. Способ предупреждения и/или лечения диабета или осложнений диабета, включающий введение профилактически или терапевтически эффективного количества производного или его фармацевтически приемлемой соли по п. 1 субъекту.
8. Способ по п. 7, где осложнение диабета представляет собой диабетическую нефропатию.
9. Способ снижения уровня глюкозы в крови, повышения толерантности к глюкозе, уменьшения апоптоза островковых β-клеток, усиления функции островковых β-клеток, увеличения количества островковых β-клеток и/или восстановления чувствительности островковых β-клеток к глюкозе, включающий введение терапевтически эффективного количества производного или его фармацевтически приемлемой соли по п. 1 субъекту.
10. Способ по п. 9, где указанное снижение уровня глюкозы в крови включает снижение уровня глюкозы в крови натощак и/или уровня глюкозы в крови после приема пищи.
11. Аналог GLP-1(7-37), содержащий полипептид, состоящий из следующей аминокислотной последовательности:
HX8EGTFTSDVSSX19LEEX23AARX27FIX30WLVX34GX36X37 (SEQ ID NO: 39),
где X8 выбран из V; X19 представляет собой Y или K; X23 представляет собой Q или K; X27 представляет собой E или K; X30 представляет собой A или K; X34 представляет собой R или K; X36 представляет собой R или K; X37 представляет собой G или K; и только один из X19, X23, X27, X30, X34, X36 или X37 представляет собой K.
12. Продукт для предупреждения и/или лечения диабета или осложнений диабета, содержащий: контейнер, в котором содержится фармацевтическая композиция по п. 6, и листок-вкладыш в упаковку, содержащий инструкции по применению фармацевтической композиции.
13. Продукт по п. 12, дополнительно содержащий контейнер, содержащий одно или более других лекарственных средств.
14. Продукт по п. 13, где одно или более других лекарственных средств представляют собой другие лекарственные средства для лечения диабета или осложнений диабета.
| RU2007134155 A, 27.04.2009 | |||
| WO 2009030771 A1, 12.03.2009 | |||
| CN 107033234 B, 26.06.2018 | |||
| WO 2006097537 A2, 21.09.2006 | |||
| WO 2013167454 A1, 14.11.2013 | |||
| WO 2015022400 A1, 19.02.2015. |
Авторы
Даты
2022-06-01—Публикация
2019-04-19—Подача