Изобретение относится к ветеринарной микробиологии и биотехнологии, касается нового штамма Escherichia coli, имеющего фенотипическую устойчивость к ампициллину, амоксициллину, ципрофлоксацину, энрофлоксацину, тетрациклину, гентамицину, стрептомицину, хлорамфениколу, сульфаметоксазолу, триметоприму, колистину и содержащего генетические детерминаты резистентности к тем же антимикробным препаратам: blaTEM-1, gyrA_D87N, S83L, parC_S80I, parE_S458A , tetB, aadA1, aadA2, aac(3)-IIa, aph(3')-Ia, cmlA1, dfrA14, sul3, mcr-1, который может быть использован в качестве контрольного штамма для определения эффективности бактерицидного действия разрабатываемых лечебных антибактериальных препаратов в ветеринарии.
Причина возникновения микробной антибиотикорезистентности, лежащая на стыке медицинской и ветеринарной науки - применение антибиотиков в животноводстве и передача устойчивых микроорганизмов человеку при непосредственном его контакте с животными-носителями и/или через продукты питания. К этой категории микроорганизмов относятся возбудители пищевых токсикоинфекций (сальмонеллы, кампилобактерии и листерии) и зооантропонозов (болезней, общих для человека и животных), вызванных поли- либо панрезистентными энтерококками, синегнойной палочкой, кишечными палочками различных типов и пр.
Устойчивость изолятов кишечной палочки к антибактериальным препаратам обусловлена как природной резистентностью микроорганизма к основным клинически значимым антимикробным веществам, так и реализацией генетически детерминированных молекулярных механизмов устойчивости и вирулентности, приобретенных главным образом за счет горизонтального переноса кодирующих их носителей генетической информации [1-4]. При этом для проведения рациональной антибактериальной терапии у сельскохозяйственных животных необходимо изучение устойчивости кишечной палочки к антимикробным препаратам.
Предлагаемый нами штамм Escherichia coli содержит все актуальные маркеры резистентности к антимикробным препаратам: бета-лактамам, фторхинолонам, тетрациклинам, аминогликозидам, фениколам, триметоприму, сульфаниламидам, полимиксинам, поэтому может быть эффективным для стандартизации оценки разрабатываемых перспективных антимикробных препаратов в ветеринарии.
Наиболее близким по сущности к заявляемому изобретению является штамм бактерий Acinetobacter baumannii для стандартизации оценки эффективности разрабатываемых антимикробных препаратов и дезинфицирующих средств, однако он не имеет устойчивости к важным для ветеринарии антимикробным средствам класса фторхинолонов (энрофлоксацин, ципрофлоксацин) и фениколов (хлорамфеникол), как предлагаемый штамм Escherichia coli ВКШМ-Б-891М [5].
Известно изобретение Штамм бактерий Salmonella infantis, используемый в качестве положительного контроля для молекулярно-генетических, а также микробиологических исследований, связанных с определением чувствительности микроорганизмов к антибактериальным препаратам, однако он не имеет устойчивости к полимиксинам и не содержит генетической детерминанты mcr-1, как предлагаемое изобретение [6].
Известно изобретение «Штамм бактерий SALMONELLA ENTERICA SBSP. ENTERICA SEROVAR KENTUCKY B-9045 международного полирезистентного клона SALMONELLA KENTUCKY ST198, используемый в качестве контрольного штамма для фенотипических и молекулярных исследований при диагностике сальмонеллезов» по патенту на изобретение 2744203 C1. В патенте описан штамм, который может быть использован в качестве контрольного штамма для контроля качества при диагностике брюшного тифа: на этапах фенотипических исследований (определение чувствительности к антибиотикам: выявление устойчивости высокого уровня к фторхинолонам) и молекулярных исследований (определение механизма устойчивости к фторхинолонам путем детекции мутаций в генах gyrA и parC; филогенетические исследования методом MLST (от анг. Multi Locus Sequence Typing, мультилокусное сиквенстипирование), однако предлагаемое изобретение более универсально, т.к. как имеет устойчивость к более широкому спектру антибактериальных препаратов и идентичных генетических детерминант устойчивости [7].
Техническим результатом предлагаемого изобретения является расширение ассортимента штаммов Escherichia coli, пригодных для разработки эффективных антимикробных препаратов.
Указанный технический результат изобретения достигается выделением полирезистентного штамма Escherichia cоli для оценки эффективности бактерицидного действия разрабатываемых антибактериальных препаратов, депонированный во «Всероссийской коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве» под номером ВКШМ-Б-891М, имеющий фенотипическую устойчивость к ампициллину, амоксициллину, ципрофлоксацину, энрофлоксацину, тетрациклину, гентамицину, стрептомицину, хлорамфениколу, сульфаметоксазолу, триметоприму, колистину и содержащего генетические детерминаты резистентности к тем тем же антимикробным препаратам: blaTEM-1 gyrA_D87N, S83L, parC_S80I, parE_S458A , tetB, aadA1, aadA2, aac(3)-IIa, aph(3')-Ia, cmlA1, dfrA14, sul3, mcr-1. Штамм Escherichia coli ВКШМ-Б-891М природный, выделен из биологического материала птицы (помет) при осуществлении мониторинга антибиотикорезистентности в Центральном федеральном округе Российской Федерации.
Полногеномное секвенирование штамма Escherichia coli ВКШМ-Б-891М осуществлено на платформе Illumina (MiSeq), тагментацию и индексирование проводили согласно инструкции Illumina «NexteraXT DNA Library Prep Kit. Reference Guide» с использованием набора реактивов NexteraXT. Нормализацию и денатурацию проводили согласно инструкции Illumina «Denature and Dilute Libraries Guide». Оценку качества тагментации ДНК и расчет молярной концентрации очищенных ПЦР продуктов осуществляли с использованием системы микрокассетного электрофореза TapeStation 4200. Подготовку образцов, электрофоретичекое разделение ПЦР продуктов проводили в соответствии с руководством по эксплуатации прибора и инструкциям G2991-90030 / G2991-90050. Анализ данных и расчет молярной концентрации очищенных ПЦР продуктов осуществляется автоматически с помощью встроенного программного обеспечения Agilent TapeStation Analisis.
Для биоинформатического анализа данных полногеномного секвенирования и сборки геномов de novo использовались следующие программы: FastQC 0.11.17, Trimmomatic v.0.36, SPAdes 2.11.1, QUAST 4.6.3, MAUVE v.20150226, IntegronFinder v5.
Характеристика штамма:
По современным представлениям вид Escherichia coli относится к роду Escherichia, семейству Enterobacteriaceae, порядку Enterobacteriales, классу Gamma proteobacteria, типу Proteobacteria, царство- бактерии.
Морфологические, культуральные, антигенные, ферментативные свойства штамма изучали согласно методических указаний по бактериологической диагностике колибактериоза (эшерихиоза) животных (утверждены Министерством сельского хозяйства Российской Федерации 27.07.2000 № 13-7-2/2117).
Морфологические свойства штамма - мелкие полиморфные грамотрицательные палочки с закругленными концами, спор и капсул не образуют. Патогенные свойства: штамм патогенный для человека, 4 группа патогенности согласно СП 1.2.036-95 и СП 1.3.2322-08 (с изм. от 29.06.2011).
Культуральные свойства - на МПБ равномерное помутнение среды, небольшой легко разбивающийся аморфный осадок; на МПА в чашках Петри - формируют круглые выпуклые, с гладкой поверхностью колонии в «S» форме, диаметром 2-3 мм; в ПЖА - диффузный рост (подвижный).
Антигенная структура: штамм полиагглютинабельный, агглютинируется поливалентными О-коли агглютинирующими сыворотками (группа 2 и 4)
Ферментативные свойства: ферментирует с образованием кислоты и газа глюкозу, лактозу, маннит, арабинозу, сорбит, ксилозу, мальтозу, трегалозу, фруктозу. Образует индол, не образует сероводород, не разжижает желатин.
Стабильность морфологических, культуральных и ферментативных свойств штамма Escherichia cоli ВКШМ-Б-891М проверяли путем трехкратного пассажа на питательных средах различных производителей: ФБУН ГНЦ ПМБ (Россия), НИЦФ (Россия), Oxoid (Великобритания), HiMedia Laboratories Pvt. Limited (Индия), BioMerieux (Франция), Merck (Германия). Установлено, что штамм давал стабильные результаты на питательных средах всех производителей.
Выросшие на плотной питательной среде колонии были исследованы с помощью масс-спектрометра MALDI-TOF Biotyper Microflex. Для этого проводили экстракцию белков посредством последовательной обработки микробной взвеси этиловым спиртом, 70% муравьиной кислотой с последующим добавлением ацетонитрила. На чистую MALDI-мишень наносили 1 мкл супернатанта с последующим подсушиванием образцов в ламинарном боксе при комнатной температуре и нанесением по 1 мкл масс-спектрометрической матрицы НССА (a-циано-4-гидроксикоричная кислота, 99%), также с подсушиванием. Анализ осуществлялся в автоматическом режиме. Полученные результаты были проанализированы с помощью программного обеспечения по величине логарифмического роста показатель подобия был больше 2,0 - что соответствует достоверному результату идентификации микроорганизма.
Проведенные исследования позволяют заключить, что исследуемый штамм был идентифицирован как Escherichia coli с высокой степенью достоверности и не содержит примеси других бактериальных культур.
Аннотация геномов была выполнена с помощью сервера RAST на открытой платформе для сравнительного анализа геномов SEED. Система высокопроизводительного полногеномного секвенирования не выявила ни одного гена антибиотикорезистентности, который не имел бы соответствующего микробиологического признака антибиотикорезистентности (таблица 1). У штамма выявлены следующие биохимические механизмы устойчивости к антибиотикам различных классов:
- модификация мишени действия - обусловливается генами dfrA14, mcr-1 или мутациями в генах gyrA_D87N, S83L, parC _S80I, parE_S458A;
- инактивация антибиотика - обусловливается генами aadA1, aadA2, aac(3)-IIa, aph(3')-Ia, blaTEM.
- активное выведение антибиотика из микробной клетки (эффлюкс) - обусловливается генами tetВ, cmlA.
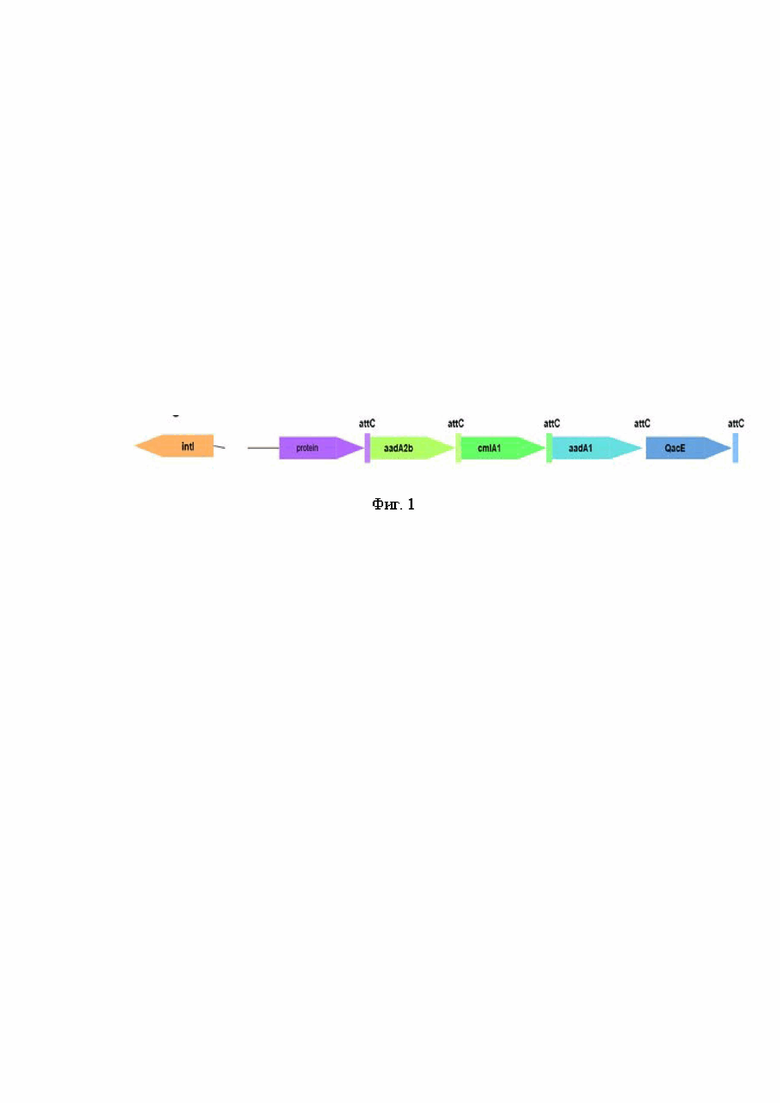
С помощью программы IntegronFinder обнаружен интегрон 1 класса (фиг.1) со следующим составом Int, attI, sat2, attC, aadA2b, attC, cmlA1, attC, aadA1, attC, qacE, attC. Выявлены факторы вирулентности - идентифицирован кластер fim с фимбриями 1 - и 2- типов B, C, D, E, F, G, I.
Стабильность наличия генетических факторов устойчивости предлагаемого штамма подтверждалась повторным секвенированием и анализом нуклеотидный последовательности после хранения штамма в течение 6 месяцев в лиофилизированном виде в ампулах под вакуумом при температуре 2-8°С.
Изобретение реализуется следующим образом:
Пример 1.
Контроль качества при определении чувствительности к антимикробным препаратам методом серийных разведений. Руководствовались следующими методическими рекомендациями: МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам»; VET01-A4 Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated From Animals, Approved Standard - Fourth Edition.
Выбор референтных (контрольных) штаммов определяется видом микроорганизма. В качестве контрольного тест-штамма использовали типичный штамм с хорошо изученными фенотипическими характеристиками, включая чувствительность к АБП, отличающиеся генетической стабильностью Escherichia coli ВКШМ-Б-891М.
Тестирование проводили микрометодом с использованием 96-ти луночных планшетов. Для исследования готовили инокулюм мутностью 0,5 стандарта McFarland (108, затем разбавляли в 100 раз). Для этого использовали суточную культуру, отбирали 3-5 колоний и растворяли их в 0,9% физиологическом растворе, растворяли в бульоне и вносили в 96- луночные планшеты, в соотношении 1:1 с раствором антибиотика (итоговая концентрация 105). Затем планшеты инкубировали 24 часа при 37°С. Учет результатов проводили визуально. За минимальную подавляющую концентрацию антибактериального препарата принимали первую лунку, в которой не наблюдалось видимого роста микроорганизма (помутнение среды).
Контрольный штамм проявил выраженную устойчивость к ампициллину, амоксициллину, ципрофлоксацину, энрофлоксацину, тетрациклину, гентамицину, стрептомицину, хлорамфениколу, сульфаметоксазолу, триметоприму, колистину.
Пример 2.
Оценку эффективности бактерицидного действия коммерческих антибактериальных препаратов, используемых в ветеринарии, проводили с помощью инокулюма рефератного штамма Escherichia coli ВКШМ-Б-891М.
Для приготовления инокулюма использовали 5-6-часовую бульонную культуру микроорганизма. Для этого отбирали несколько однотипных изолированных колоний с суточной культуры микроорганизмов, выросших на МПА, петлей переносили незначительное количество материала в пробирку с 4,0-5,0 мл МПБ. Инкубировали при 37°С. Через 5-6 ч инкубации плотность микробной суспензии приблизительно соответствовало необходимой, и ее точно доводили до 0,5 по МакФарланду путем добавления стерильного МПБ с таким расчетом, чтобы ее концентрация составила 1,5⋅108 КОЕ/мл.
Для приготовления растворов АБП использовали субстанции АБП с известной активностью. Для взвешивания АБП использовали электронные лабораторные весы с точностью до 4 знака. В пробирки, содержащие 1,0 мл МПБ, вносили по 1,0 г антибактериального препарата, встряхивали до полного его растворения.
По 0,5 мл инокулюма вносили в каждую пробирку, содержащую по 1,0 мл соответствующего антибактериального препарата, и в одну пробирку с 1,0 мл МПБ без АБП ("отрицательный" контроль).
Пробирки закрывали стерильными ватно-марлевыми пробками и инкубировали при температуре 37°С в течение 16-20 ч, кроме пробирки "отрицательный" контроль. Пробирку "отрицательный" контроль помещали в холодильник при 4°С, где хранили до учета результатов.
Для определения наличия роста микроорганизма пробирки с посевами просматривали визуально в проходящем свете. Рост культуры в присутствии АБП сравнивали с референтной пробиркой ("отрицательный" контроль), содержащей исходный инокулюм и хранившейся в холодильнике.
Результаты представлены в таблице 1.
Эффективность бактерицидного действия коммерческих лечебных антибактериальных препаратов для ветеринарного применения.
п/п
Антибактериального препарата
действующего вещества
Действующего вещества
(в форме натриевой соли)
Согласно указанным в таблице данным, исследуемый штамм обладал резистентными свойствами к препаратам групп: аминогликозидов, тетрациклинов, пенициллинов, полимиксинов, фторхинолонов и чувствителен к препаратам группы цефалоспоринов.
Полученные результаты подтверждают возможность использования штамма Escherichia coli ВКШМ-Б-891М с целью определения бактерицидного действия антибактериальных препаратов в ветеринарии.
Литературные источники:
1. Reshadi P., Heydari F., Ghanbarpour R., Bagheri M., Jajarmi M., Amiri M., et al. Molecular characterization and antimicrobial resistance of potentially human-pathogenic Escherichia coli strains isolated from riding horses. BMC Vet. Res. 2021; 17 (1):131. DOI: 10.1186/s12917-021-02832-x.
2. Poirel L., Madec J.Y., Lupo A., Schink A. K., Kieffer N., Nordmann P., SchwarzS. Antimicrobial resistance in Escherichia coli. Microbiol. Spectr. 2018; 6(4). DOI: 10.1128/microbiolspec.ARBA-0026-2017.
3. Al'-KhammashN. M., Ignatenko A.V. Analiz antibiotikorezistentnosti mikroorganizmov E. coli =ARM analysis of E. coli. Proceedings of BSTU. Chemistry, organic substances technology and biotechnology. 2012; 4(151):173-175. eLIBRARYID:22002362.
4. Brettin T. [et al] RASTtk: a modular and extensible implementation of the RAST algorithm for building custom annotation pipelines and annotating batches of genomes / T. Brettin [et al] // Scientific reports. - 2015. - Т. 5. - С. 8365;
5. Катаева Л.В., Колотова О.Н., Степанова Т.Ф., Богун А.Г., Кисличкина А. А. Мультирезистентный штамм бактерий Acinetobacter baumannii для стандартизации оценки эффективности разрабатываемых антимикробных препаратов и дезинфицирующих средств // Патент на изобретение 2711922 C1, 23.01.2020. Заявка № 2019119531 от 21.06.2019.
6. Киш Л.К., Иванова О.Е., Солтынская И.В., Ленев С.В., Прасолова О.В., Богомазова А.Н., «Штамм бактерий Salmonella infantis, используемый в качестве положительного контроля для молекулярно-генетических, а также микробиологических исследований, связанных с определением чувствительности микроорганизмов к антибактериальным препаратам».// Патент на изобретение 2782213 С1, 24.10.2022. Заявка 2021139600 от 29.12.2021.
7. Егорова С.А., Кафтырева Л.А. Штамм бактерий SALMONELLA ENTERICA SBSP. ENTERICA SEROVAR KENTUCKY B-9045 международного полирезистентного клона SALMONELLA KENTUCKY ST198, используемый в качестве контрольного штамма для фенотипических и молекулярных исследований при диагностике сальмонеллезов // Патент на изобретение 2744203 C1, 03.03.2021. Заявка № 2020122129 от 29.06.2020.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ SALMONELLA INFANTIS, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНОГО КОНТРОЛЯ ДЛЯ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ, А ТАКЖЕ МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ, СВЯЗАННЫХ С ОПРЕДЕЛЕНИЕМ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ | 2021 |
|
RU2782213C1 |
| ШТАММ БАКТЕРИЙ SALMONELLA ENTERICA VGNKI-11 (ВКШМ-Б-848М) В КАЧЕСТВЕ КОНТРОЛЬНОГО ШТАММА ДЛЯ ФЕНОТИПИЧЕСКИХ И МОЛЕКУЛЯРНЫХ ИССЛЕДОВАНИЙ В ДИАГНОСТИКЕ САЛЬМОНЕЛЛЁЗА | 2020 |
|
RU2752895C1 |
| ШТАММ БАКТЕРИЙ SALMONELLA ENTERICA (ВКШМ-Б-849М) В КАЧЕСТВЕ КОНТРОЛЬНОГО ШТАММА ДЛЯ МИКРОБИОЛОГИЧЕСКИХ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ В ОПРЕДЕЛЕНИИ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ | 2020 |
|
RU2759396C1 |
| ШТАММ БАКТЕРИЙ CAMPYLOBACTER JEJUNI ДЛЯ МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ, СВЯЗАННЫХ С ОПРЕДЕЛЕНИЕМ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ | 2022 |
|
RU2796348C1 |
| Штамм Lactobacillus salivarius ВКШМ-Г-08ПД | 2024 |
|
RU2822455C1 |
| Штамм бактерий Lactobacillus plantarum ВКШМ-Г-06ПД | 2024 |
|
RU2827608C1 |
| Способ подавление роста бактериальной микрофлоры у коров с субклиническим маститом | 2022 |
|
RU2784728C1 |
| Способ идентификации уропатогенных Enterococcus faecalis у детей | 2022 |
|
RU2788842C1 |
| ШТАММ БАКТЕРИЙ SALMONELLA ENTERICA SBSP. ENTERICA SEROVAR KENTUCKY B-9045 МЕЖДУНАРОДНОГО ПОЛИРЕЗИСТЕНТНОГО КЛОНА SALMONELLA KENTUCKY ST198, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ КОНТРОЛЬНОГО ШТАММА ДЛЯ ФЕНОТИПИЧЕСКИХ И МОЛЕКУЛЯРНЫХ ИССЛЕДОВАНИЙ ПРИ ДИАГНОСТИКЕ САЛЬМОНЕЛЛЕЗОВ | 2020 |
|
RU2744203C1 |
| ДНК-ЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА, НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИММОБИЛИЗАЦИИ НА ДНК-ЧИПЕ | 2016 |
|
RU2685188C2 |
Изобретение относится к области биотехнологии. Предложен штамм Escherichia coli, выделенный из биологического материала птицы (помет) при осуществлении мониторинга антибиотикорезистентности в Центральном федеральном округе Российской Федерации, депонированный во «Всероссийской коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве» под номером ВКШМ-Б-891М. Штамм обладает фенотипической устойчивостью к ампициллину, амоксициллину, ципрофлоксацину, энрофлоксацину, тетрациклину, гентамицину, стрептомицину, хлорамфениколу, сульфаметоксазолу, триметоприму, колистину, содержит генетические детерминанты резистентности к тем же антимикробным препаратам: blaTEM-1, gyrA_D87N, S83L, parC_S80I, parE_S458A , tetB, aadA1, aadA2, aac(3)-IIa, aph(3')-Ia, cmlA1, dfrA14, sul3, mcr-1 и может быть использован в качестве контрольного штамма для оценки эффективности бактерицидного действия разрабатываемых лечебных антибактериальных препаратов в ветеринарии. 1 ил., 1 табл., 2 пр.
Полирезистентный штамм бактерий Escherichia coli, используемый в качестве контрольного штамма для определения эффективности бактерицидного действия разрабатываемых лечебных антибактериальных ветеринарных препаратов, депонированный во «Всероссийской коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве» под номером ВКШМ-Б-891М.
| ШТАММ БАКТЕРИЙ SALMONELLA ENTERICA SBSP. ENTERICA SEROVAR KENTUCKY B-9045 МЕЖДУНАРОДНОГО ПОЛИРЕЗИСТЕНТНОГО КЛОНА SALMONELLA KENTUCKY ST198, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ КОНТРОЛЬНОГО ШТАММА ДЛЯ ФЕНОТИПИЧЕСКИХ И МОЛЕКУЛЯРНЫХ ИССЛЕДОВАНИЙ ПРИ ДИАГНОСТИКЕ САЛЬМОНЕЛЛЕЗОВ | 2020 |
|
RU2744203C1 |
| Мультирезистентный штамм бактерий Acinetobacter baumannii для стандартизации оценки эффективности разрабатываемых антимикробных препаратов и дезинфицирующих средств | 2019 |
|
RU2711922C1 |
| POIREL L., et al, Antimicrobial resistance in Escherichia coli | |||
| Microbiol | |||
| Spectr | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2023-06-05—Публикация
2022-10-26—Подача