Изобретение относится к пищевой промышленности, в частности к области оценки безопасности пищевой продукции, а именно к методам количественного определения содержания в рыбе гормонов и может быть использовано в процессе экспертизы и государственного надзора за безопасностью рыбы.
Официально утвержденного способа определения стероидных гормонов в моллюсках в Российской Федерации в настоящее время нет.
Аналогом предлагаемого способа является метод определения метилтестостерона в рыбе {Cyprinus carpio). Этот способ заключается в предварительном удалении жира из тканей, добавлении фосфатного буфера, экстракции метил-трет-бутилового эфиром, твердофазной экстракции на колонке, заполненной обращено-фазовым сорбентом и последующим иммуноферментным анализом [Risto, U., Zehra, Н. М., Biljana, S.D., Elizabeta, D.S., Aleksandra, Т., & Velimir, S. (2013). Validation of screening method for determination of methyltestosterone in fish. Maced. Vet. Rev, 36, 19-23]. Недостатком способа является низкая чувствительность (564,43 нг/кг) и возможность определения в образцах рыбы только одного гормона - метилтестостерона.
Наиболее близким по технической сущности к предлагаемому способу является метод определения остаточного содержания гормонов в рыбе и рыбных продуктах (Tilapia, Rainbow trout, Salmon). Этот способ заключается в гомогенизации материала, экстракции гормонов ацетонитрилом, очистке органического раствора гексаном, твердофазной экстракцией с использованием картриджей, заполненных ионно-обменными (четвертичный аминный сорбент) и нормально-фазовыми сорбентами (синтетический аморфный силикат магния), хроматографическом разделении с использованием ВЭЖХ системы на колонке 2,0×150 мм зернением 5 мкм, заполненной обращенно-фазовым сорбентом С8 в изократическом режиме на основе воды и ацетонитрила с добавлением 0,1% муравьиной кислоты и последующем масс-спектрометрическом анализе с источником ионизации электроспреем в положительном режиме [Watson, L., Potter, R., Murphy, С, & Gibbs, R. (2015). The development and single-laboratory validation of a method for the determination of steroid residues in fish and fish products. Journal of AOAC International, 98(3), 580-587; https://doi.org/10.5740/jaoacint.14-281]. Недостатком способа являются использование сложной схемы пробоподготовки с применением картриджей, возможность определения только одного вида стероидного гормона, низкая чувствительность метода детектирования (от 0,05 до 25 нг/г).
Техническим результатом предлагаемого способа является увеличение чувствительности метода до 20 нг/кг за счет получения производных гормонов (оксимов) эстрона, дигидротестостерона, метилтестостерона и местанонолона, полученных путем дериватизации гидроксиламином и их определения в тканях рыб в положительном режиме ионизации по ионам [M+NH+H]+с использованием ВЭЖХ-МС/МС метода.
Указанный технический результат достигается гомогенизацией мяса рыб, добавлением в образцы дистиллированной воды и их обработкой в ультразвуковой ванне для более полного извлечения гормонов из гомогенизатов, экстракцией гормонов из образцов 1% раствором муравьиной кислоты в ацетонитриле, очисткой аликвоты селикагелем с привитыми октадецильными группами С18 и анионообменным сорбентом на основе первичных и вторичных аминов PSA, дериватизацией гормонов раствором гидроксиламина, упариванием образцов на роторном испарителе, перерастворением образцов в ацетонитриле, хроматографическим разделением с использованием хроматографической колонки 2,1×75 мм зернением 3,5 мкм, заполненной обращено-фазовым сорбентом С18 при температуре 40°С, где в качестве градиента подвижной фазы используют смесь вода-метанол с добавлением 0,1% муравьиной кислоты и последующим анализом содержания гормонов в образцах на тройном квадрупольном масс-детекторе с источником ионизации электроспрей в положительном режиме (ВЭЖХ-МС/МС анализ).
ОПИСАНИЕ СПОСОБА
Для приготовления калибровочных стандартов мясо рыб (радужная форель, карп, толстолобик), не содержащее гормоны в пределах обнаружения метода, гомогенизируют, добавляют стандартные растворы гормонов в ацетонитриле с перемешиванием в течение 1 минуты на перемешивающем устройстве типа «вортекс», выдерживают при комнатной температуре в течение 1 часа, повторно перемешивают в течение 1 минуты с последующим замораживанием. Для построения градуировочной кривой необходимо не менее 6 контрольных точек.
Для осуществления пробоподготовки навеску измельченного образца или калибровочного стандарта массой 5 г, помещают в центрифужную полипропиленовую пробирку вместимостью 50 см3. Вносят 10 см3 дистиллированной воды, перемешивают и помещают в ультразвуковую ванну на 10 минут. Добавляют 10 см3 1%-го раствора муравьиной кислоты в ацетонитриле и перемешивают в течение 30 минут на лабораторном мультиротаторе. В пробу добавляют 1 г NaCl и 4 г MgSO4. После добавления солей, раствор тщательно перемешивают в течение 5 минут. Затем пробу центрифугируют в течение 10 минут со скоростью 10000 g. Аликвоту экстракта объемом 6 см3 с помощью пипеточного дозатора помещают в центрифужную пробирку объемом 15 см3, содержащую 150 мг С18 и 150 мг PSA. Перемешивают в течение 1 минуты на перемешивающем устройстве типа «вортекс» и центрифугируют в течение 10 минут со скоростью 18000 g. Аликвоту экстракта объемом 5 см3 с помощью пипеточного дозатора помещают в остродонную колбу объемом 15 см3 и упаривают на роторном испарителе. После упаривания с помощью пипеточного дозатора помещают 0,5 см3 раствора гидроксиламина в метаноле с концентрацией 100 ммоль и перемешивают в течение 1 минуты на перемешивающем устройстве типа «вортекс». Дериватизацию проводят с помощью термостатируемого шейкера при температуре 40°С в течение 20 минут. Полученный раствор повторно упаривают на роторном испарителе, с помощью пипеточного дозатора помещают 0,1 см3 ацетонитрила и перемешивают в течение 1 минуты на перемешивающем устройстве типа «вортекс». Аликвоту экстракта объемом 0,06 см3 с помощью пипеточного дозатора помещают в полипропиленовую вставку для проведения ВЭЖХ-МС/МС анализа.
Для осуществления хроматографического анализа используют ВЭЖХ систему «Agilent 1200 Series» с хроматографической колонкой «Agilent ZORBAX XDB-C18 2.1×75 mm 3.5 μm» длиной 75 мм, внутренним диаметром 2,1 мм, заполненной обращенно-фазным сорбентом С18 с двойным энд-кэппированием, зернением 3,5 мкм, температура хроматографической колонки 40°С. В качестве градиента подвижной фазы используют смесь растворителей, включающую компонент А: раствор - 0,1% муравьиной кислоты в воде, и компонент В: раствор - 0,1% муравьиной кислоты в метаноле.
Для осуществления масс-спектрометрической детекции используют подключенный к выходу из хроматографической колонки тройной квадрупольный масс-спектрометр «Thermo Fisher Scientific TSQ Quantum Access МАХ». Параметры масс-спектрометрического детектора:
- Источник ионизации: электроспрей в положительном режиме ионизации (ESI+);
- Режим работы: детектирование проводится методом «регистрации множественных реакций» (MRM). Для гормонов измеряется сигнал двух фрагментных ионов (m/z). Первый, более интенсивный пик, служит для количественного определения концентрации гормонов в рыбе, второй используется для подтверждения правильности определения (Таблица 1);
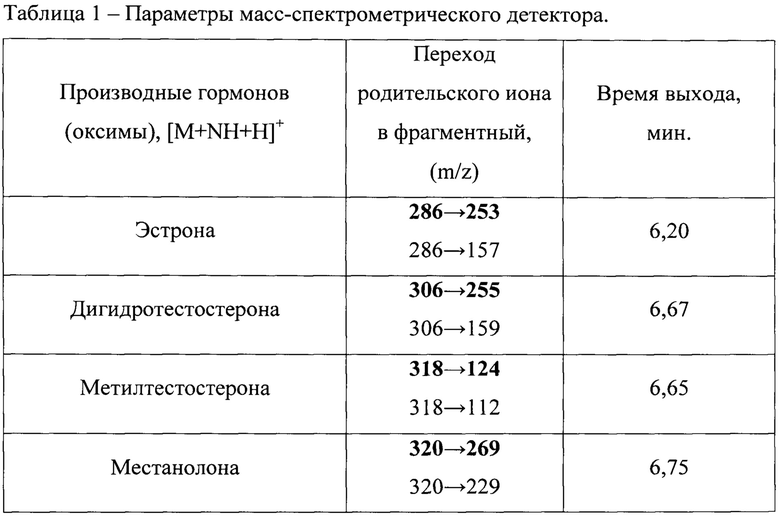
- Напряжение на капилляре электроспрея (Spray Voltage): 3 кВ;
- Sheath Gas Pressure: 35 относительных единиц;
- Aux Gas Pressure: 10 относительных единиц;
- Температура капилляра интерфейса (Capillary Temperature): 300°С;
- Температура испарителя (Vaporizer Temperature): 350°С;
- Хроматографическая колонка стальная длиной 75 мм, внутренним диаметром 2,1 мм, заполненная обращенно-фазным сорбентом С18 с двойным энд-кэппированием (двойной блокировкой концевых групп), зернением 3,5 мкм;
- Температура колонки: 40°С;
- Скорость потока элюента: 0,4 см3/мин;
- Объем вводимой пробы: 0,01 см3;
- Режим элюирования (градиентный), время анализа 13 минут (Таблица 2).
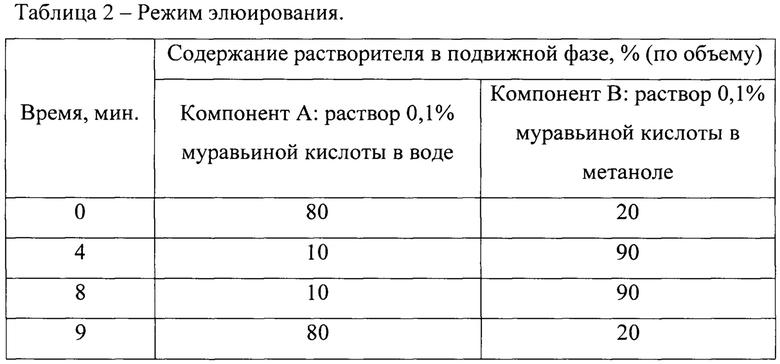
Построение градуировочной кривой проводится по отношению площади хроматографического пика фрагментного иона (S., I*сек) к массовой концентрации (пг/см3) в 6 калибровочных стандартах. Зависимость линейная, взвешивание равное.
Построение графиков может проводиться при помощи встроенной программы обработки данных ВЭЖХ-МС/МС или при помощи программы Excel (Microsoft Office).
Градуировочная зависимость считается приемлемой, если рассчитанное значение квадрата коэффициента корреляции для градуировочной кривой каждого фрагментного иона не менее 0,98.
Массовую долю гормонов (в виде индивидуальных веществ) в пробе (X, нг/кг) вычисляют по формуле:
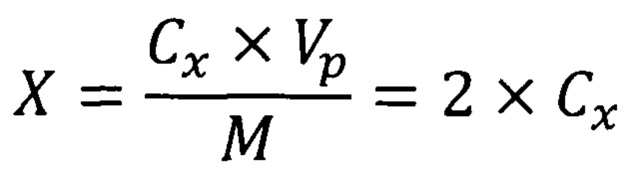
где Сх - массовая концентрация гормона, пг/см3;
Vp - объем раствора для экстракции; в данном случае 10 см3;
М - масса анализируемой пробы; в данном случае 5 г.
Нижний предел количественного определения гормонов при использовании предлагаемого способа составляет 20 нг/кг. Ошибка измерения не более 15%. Пределы и точность определения гормонов, достаточны для целей экспертизы и государственного надзора за безопасностью продукции аквакультуры.
Пример 1
Количественное определение остаточного количества гормонов в мясе радужной форели.
Для елах обнаружения метода, гомогенизируют, добавляют исходные растворы гормонов в априготовления калибровочных стандартов мясо радужной форели, не содержащее гормоны в предцетонитриле с перемешиванием в течение 1 минуты на перемешивающем устройстве типа «вортекс», выдерживают при комнатной температуре в течение 1 часа, повторно перемешивают в течение 1 минуты с последующим замораживанием. Для построения градуировочной кривой необходимо не менее 6 контрольных точек.
Для осуществления пробоподготовки навеску измельченного образца или калибровочного стандарта массой 5 г, помещают в центрифужную полипропиленовую пробирку вместимостью 50 см3. Вносят 10 см3 дистиллированной воды, перемешивают и помещают в ультразвуковую ванну на 10 минут. Добавляют 10 см3 1%-го раствора муравьиной кислоты в ацетонитриле и перемешивают в течение 30 минут на лабораторном мультиротаторе. В пробу добавляют 1 г NaCl и 4 г MgSO4. После добавления солей, раствор интенсивно перемешивают в течение 5 минут. Затем пробу центрифугируют в течение 10 минут со скоростью 10000 g. Аликвоту экстракта объемом 6 см3 с помощью пипеточного дозатора помещают в центрифужную пробирку объемом 15 см3, содержащую 150 мг С18 и 150 мг PSA. Перемешивают в течение 1 минуты на перемешивающем устройстве типа «вортекс» и центрифугируют в течение 10 минут со скоростью 18000 g.
Аликвоту экстракта объемом 5 см3 с помощью пипеточного дозатора помещают в остродонную колбу объемом 15 см3 и упаривают на роторном испарителе. После упаривания с помощью пипеточного дозатора помещают 0,5 см3 раствора гидроксиламина в метаноле с концентрацией 100 ммоль и перемешивают в течение 1 минуты на перемешивающем устройстве типа «вортекс». Дериватизацию проводят с помощью термостатируемого шейкера при температуре 40°С в течение 20 минут. Затем полученный раствор повторно упаривают на роторном испарителе, с помощью пипеточного дозатора помещают 0,1 см3 ацетонитрила и перемешивают в течение 1 минуты на перемешивающем устройстве типа «вортекс». Аликвоту экстракта объемом 0,06 см3 с помощью пипеточного дозатора помещают в полипропиленовую вставку для проведения ВЭЖХ-МС/МС анализа.
Для осуществления хроматографического анализа используют ВЭЖХ систему «Agilent 1200 Series» с хроматографической колонкой «Agilent ZORBAX XDB-C18 2.1×75mm 3.5 μm» длиной 75 мм, внутренним диаметром 2,1 мм, заполненной обращенно-фазным сорбентом С18 с двойным энд-кэппированием, зернением 3,5 мкм, температура хроматографической колонки 40°С. В качестве градиента подвижной фазы используют смесь растворителей, включающую компонент А: раствор - 0,1% муравьиной кислоты в воде, и компонент В: раствор - 0,1% муравьиной кислоты в метаноле.
Для осуществления масс-спектрометрической детекции используют подключенный к выходу из хроматографической колонки тройной квадрупольный масс-спектрометр «Thermo Fisher Scientific TSQ Quantum Access МАХ». Параметры масс-спектрометрического детектора:
- Источник ионизации: электроспрей в положительном режиме ионизации (ESI+);
- Режим работы: детектирование проводится методом «регистрации множественных реакций» (MRM). Для гормонов измеряется сигнал двух фрагментных ионов (m/z). Первый, более интенсивный пик, служит для количественного определения концентрации гормонов в радужной форели, второй используется для подтверждения правильности определения (Таблица 1);
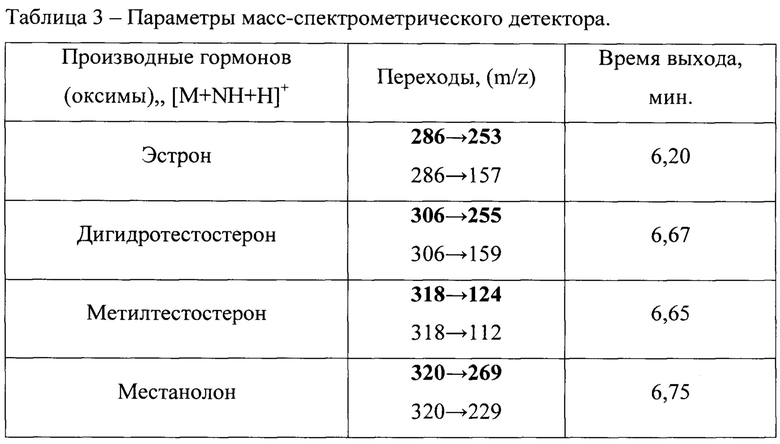
- Напряжение на капилляре электроспрея (Spray Voltage): 3 кВ;
- Sheath Gas Pressure: 35 относительных единиц;
- Aux Gas Pressure: 10 относительных единиц;
- Температура капилляра интерфейса (Capillary Temperature): 300°С;
- Температура испарителя (Vaporizer Temperature): 350°С;
- Хроматографическая колонка стальная длиной 75 мм, внутренним диаметром 2,1 мм, заполненная обращенно-фазным сорбентом С18 с двойным энд-кэппированием (двойной блокировкой концевых групп), зернением 3,5 мкм;
- Температура колонки: 40°С;
- Скорость потока элюента: 0,4 см3/мин;
- Объем вводимой пробы: 0,01 см3;
- Режим элюирования (градиентный), время анализа 13 минут (Таблица 2).
Построение градуировочной кривой проводится по отношению площади хроматографического пика фрагментного иона (S., I*сек) к массовой концентрации (пг/см3) в 6 калибровочных стандартах. Зависимость линейная, взвешивание равное.
Построение графиков может проводиться при помощи встроенной программы обработки данных ВЭЖХ-МС/МС или при помощи программы Excel (Microsoft Office).
Градуировочная зависимость считается приемлемой, если рассчитанное значение квадрата коэффициента корреляции для градуировочной кривой каждого фрагментного иона не менее 0,98.
Нижний предел количественного определения гормонов при использовании предлагаемого способа составляет 20 нг/кг. Ошибка измерения не более 15%. Пределы и точность определения гормонов, достаточны для целей экспертизы и государственного надзора за безопасностью продукции аквакультуры.
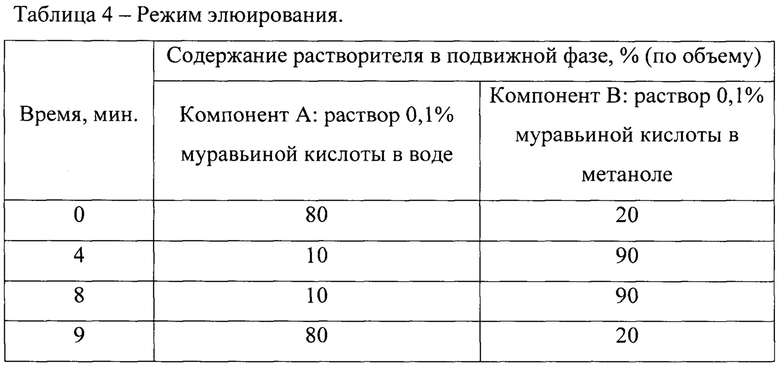
Концентрации эстрона, дигидротестостерона и метилтестостерона в образце мяса радужной форели составляют 40 нг/кг, а местанолона - 50 нг/кг.
Результаты:
Площади пиков (АА) на хроматограмме 55008, 42256, 50921, 5181 соответствуют содержанию эстрона, дигидротестостерона и метилтестостерона в образце мяса радужной форели 40±15% нг/кг, а местанолона - 50±5% нг/кг (фиг. 1).
Пример 2
Количественное определение остаточного количества гормонов в мясе карпа.
Приготовление калибровочных стандартов для построения градуировочных кривых, пробоподготовка, оборудование и режимы проведения хроматографического анализа, построение градуировочных кривых и регистрация хроматограмм, нижний предел количественного определения гормонов, ошибки измерения как в примере 1.
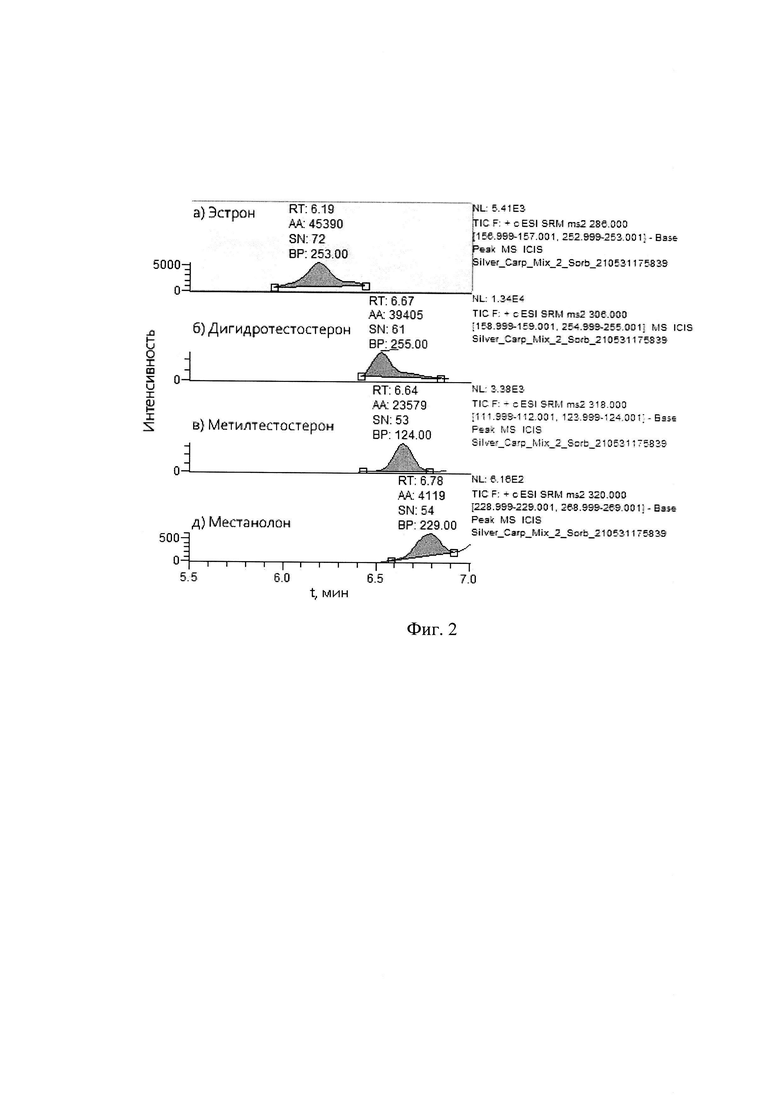
Концентрации эстрона, дигидротестостерона и метилтестостерона в образце мяса карпа составляют 40 нг/кг, а местанолона - 50 нг/кг.
Результаты:
Площади пиков (АА) на хроматограмме 58496, 39323, 49405, 4894 соответствуют содержанию эстрона, дигидротестостерона и метилтестостерона в образце мяса карпа 40±15% нг/кг, а местанолона - 50±15% нг/кг (фиг. 2).
Пример 3
Количественное определение остаточного количества гормонов в мясе толстолобика.
Приготовление калибровочных стандартов для построения градуировочных кривых, пробоподготовка, оборудование и режимы проведения хроматографического анализа, построение градуировочных кривых и регистрация хроматограмм, нижний предел количественного определения гормонов, ошибки измерения как в примере 1.
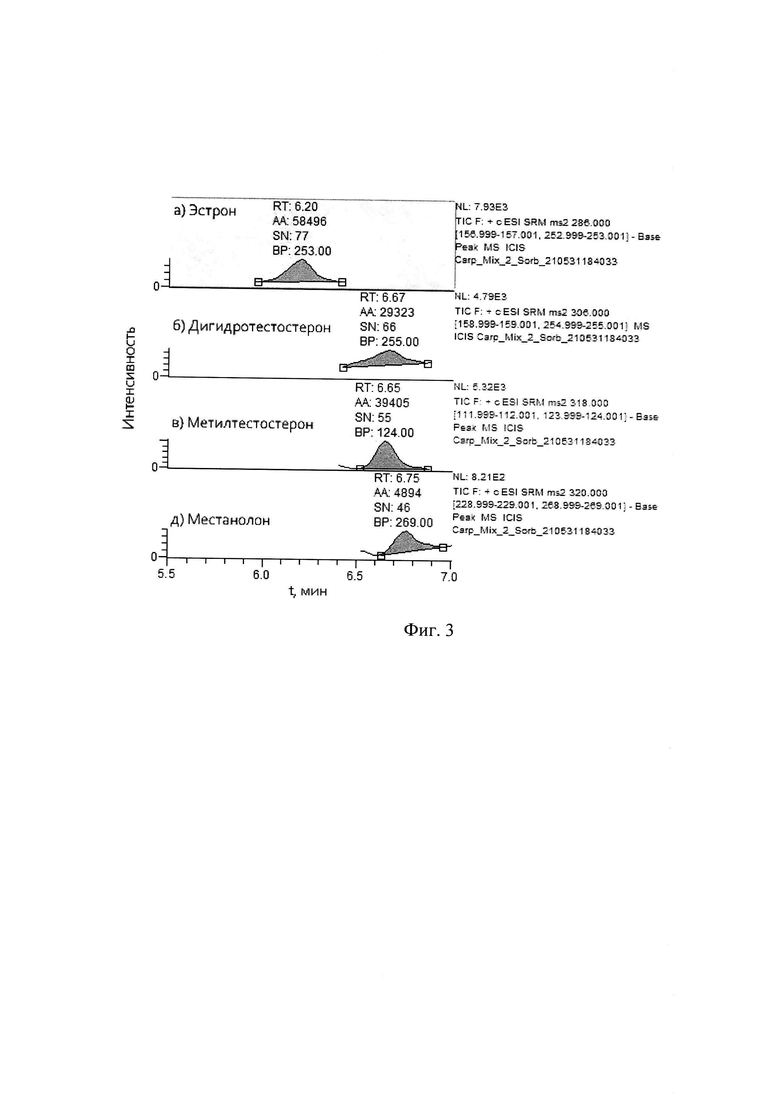
Концентрации эстрона, дигидротестостерона и метилтестостерона в образце мяса толстолобика составляют 40 нг/кг, а местанолона - 50 нг/кг.
Результаты:
Площади пиков (АА) на хроматограмме 55390, 39405, 53579, 5119 соответствуют содержанию эстрона, дигидротестостерона и метилтестостерона в образце мяса толстолобика 40±15% нг/кг, а местанолона - 50±15% нг/кг (фиг. 3).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЙЕССОТОКСИНОВ В МОЛЛЮСКАХ | 2018 |
|
RU2716233C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОСТАТОЧНЫХ КОЛИЧЕСТВ ПИПЕРАЗИНА В БИОЛОГИЧЕСКИХ ТКАНЯХ И ОБЪЕКТАХ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2024 |
|
RU2837303C1 |
| Способ определения производных стероидных гормонов в моче | 2021 |
|
RU2764363C1 |
| Способ определения амиодарона и его основного метаболита дезэтиламиодарона в сыворотке крови человека | 2020 |
|
RU2749566C1 |
| Способ определения дабигатрана в сыворотке крови человека | 2018 |
|
RU2683032C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РИВАРОКСАБАНА В КРОВИ МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ | 2025 |
|
RU2839935C1 |
| Способ определения лозартана, его основного метаболита лозартан карбоновой кислоты и глибенкламида в сыворотке крови и моче человека | 2020 |
|
RU2749567C1 |
| Способ количественного определения окадаиковой кислоты в морепродуктах | 2017 |
|
RU2666247C1 |
| СПОСОБ РАСПОЗНАВАНИЯ И КЛАССИФИКАЦИИ 3-ОКСОСТЕРОИДОВ И ИХ МЕТАБОЛИТОВ ПРИ ДОПИНГОВОМ КОНТРОЛЕ СПОРТСМЕНОВ | 2010 |
|
RU2452967C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПЕСТИЦИДОВ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ С ИСПОЛЬЗОВАНИЕМ ВЭЖХ | 2014 |
|
RU2598733C2 |

Изобретение относится к пищевой промышленности. Предложен способ количественного определения остаточного содержания стероидных гормонов - эстрона, дигидротестостерона, метилтестостерона и местанонолона в рыбе, заключающийся в гомогенизации мяса рыб, добавлении в образцы дистиллированной воды с их обработкой в ультразвуковой ванне для более полного извлечения гормонов из гомогенизатов, экстракции гормонов из образцов 1% раствором муравьиной кислоты в ацетонитриле, очистке аликвоты селикагелем с привитыми октадецильными группами С18 и анионообменным сорбентом на основе первичных и вторичных аминов PSA, дериватизации гормонов раствором гидроксиламина, упаривании образцов на роторном испарителе. Далее проводят перерастворение образцов в ацетонитриле, хроматографическое разделение с использованием хроматографической колонки 2,1×75 мм зернением 3,5 мкм, заполненной обращенно-фазовым сорбентом С18, в качестве градиента подвижной фазы используют смесь вода-метанол с добавлением 0,1% муравьиной кислоты. Затем проводят анализ содержания гормонов в образцах на тройном квадрупольном масс-детекторе с источником ионизации электроспрей в положительном режиме. Способ обеспечивает увеличение чувствительности метода определения. 3 ил., 4 табл., 3 пр.
Способ количественного определения остаточного содержания стероидных гормонов – эстрона, дигидротестостерона, метилтестостерона и местанонолона в рыбе, заключающийся в гомогенизации мяса рыб, добавлении в образцы дистиллированной воды с их обработкой в ультразвуковой ванне для более полного извлечения гормонов из гомогенизатов, экстракции гормонов из образцов 1% раствором муравьиной кислоты в ацетонитриле, очистке аликвоты селикагелем с привитыми октадецильными группами С18 и анионообменным сорбентом на основе первичных и вторичных аминов PSA, дериватизации гормонов раствором гидроксиламина, упаривании образцов на роторном испарителе, перерастворении образцов в ацетонитриле, хроматографическом разделении с использованием хроматографической колонки 2,1×75 мм зернением 3,5 мкм, заполненной обращенно-фазовым сорбентом С18 при температуре 40°С, где в качестве градиента подвижной фазы используют смесь вода-метанол с добавлением 0,1% муравьиной кислоты, и последующем анализе содержания гормонов в образцах на тройном квадрупольном масс-детекторе с источником ионизации электроспрей в положительном режиме (ВЭЖХ-МС/МС анализ).
| Способ количественного определения стероидных гормонов | 1987 |
|
SU1490650A1 |
| Прибор для определения коэффициента трения при скольжении | 1929 |
|
SU20838A1 |
| CN 104020240 B, 30.03.2016 | |||
| CN 105866292 B, 12.04.2019 | |||
| US 20170328921 A1, 16.11.2017 | |||
| CN 110187043 A, 30.08.2019 | |||
| CN 110824091 A, 21.02.2020. | |||
Авторы
Даты
2022-07-12—Публикация
2021-07-09—Подача