Изобретение относится к медицине, а именно к фтизиатрии и урологии, и может быть использовано для моделирования туберкулеза почки в эксперименте, изучения механизмов формирования, развития нефротуберкулеза и поиска оптимальной тактики его лечения.
Доля туберкулезного поражения мочеполовой системы занимает одну из лидирующих позиций в структуре внелегочных форм данного заболевания. Инфицирование почек микобактерией способствует образованию гранулем в клубочках и их кальцификации, что приводит к терминальной хронической почечной недостаточности у 5,7% пациентов [1]. Патологический процесс, развивающийся в почечной ткани, в дальнейшем распространяется на уротелий, приводя в 54,5-84,7% случаев к образованию стриктур мочеточников и затем к формированию гидронефротической трансформации почек [2, 3, 4], что в последующем требует реконструктивно-пластических операций на верхних мочевых путях, зачастую с применением различных отделов желудочно-кишечного тракта [5, 6]. Несмотря на высокую эффективность противотуберкулезных препаратов, развитие фиброзных изменений в мочевых путях в ряде случаев ведет к утрате функции органа [7, 8]. Излечение в 60-80% случаев связано с хирургическим лечением в объеме нефрэктомии [8, 9, 10].
Поиск новых способов комбинированной терапии нефротуберкулеза, направленный на сохранение функционирующей почечной паренхимы, неустанно продолжается, в связи с чем актуальным является создание модели туберкулезного поражения почки у лабораторных животных.
Известно научное исследование, цель которого - моделирование туберкулезного поражения почки у кроликов при внутривенном введении культуры микобактерий бычьего типа, где непременным условием воспроизводимости модели является дополнительное формирование нарушения оттока мочи из почек путем наложения лигатуры на мочеточник [11]. К основному недостатку этого метода следует отнести высокую летальность лабораторных животных, обусловленную развитием острого генерализованного специфического процесса.
Известен способ моделирования деструктивного туберкулеза почки, позволяющий добиться приближения модели к клиническому течению путем создания туберкулезной каверны у экспериментального животного (собаки), предварительно сенсибилизированной с помощью лошадиной сыворотки [12]. Под наркозом проводят компрессию верхнего полюса почки, охлаждают ее до -2 -6°С и заражают культурой М. tuberculosis H37Rv (в дозе 50 мг в 0.5 мл лошадиной сыворотки). Однако предложенная модель не воспроизводит реально существующий механизм развития туберкулезного поражения почки, поскольку формирование деструктивных форм (каверн) в почке происходит путем искусственно создания участка ишемии в результате экспериментального воздействия. К недостаткам данного способа следует также отнести и выбор в качестве модельных животных собак, что существенно ограничивает широту использования предложенного способа в связи высокими материальными затратами на приобретение и содержание животных, а также на выполнение операционных и лечебных процедур.
Э.Н. Беллендиром и соавторами [13] проведено исследование по созданию модели ограниченного деструктивного туберкулеза почек у кроликов путем выполнения люмботомии для инокуляции культуры микобактерий (прототип). Однако такой метод травматичен и сложен в осуществлении: сама манипуляция формирования канала в корковом слое почки (около 1 мм диаметром и 8-10 мм длиной) сопровождается кровопотерей, механической травмой с последующим развитием неспецифической воспалительной реакции. К недостаткам способа следует также отнести неизвестность качественной (фенотипической и генотипической) характеристики клинического штамма, используемого для инфицирования, а также отсутствие четких данных в отношении заражающей дозы (количество микобактериальных клеток в 1 мг сухой культуры). Кроме того, метод не позволяет осуществлять прижизненный контроль за ходом развития туберкулезного процесса, что не дает возможности получения сопоставимых результатов по клиническому течению заболевания.
Задачей предлагаемого изобретения является создание экспериментальной высокопроизводимой модели туберкулеза почки, наиболее точно отражающей клиническое течение заболевания, с использованием малоинвазивного хирургического вмешательства и снижением риска послеоперационных осложнений.
Поставленная задача решается тем, что под ультразвуковым контролем лабораторным животным (кроликам) производят тонкоигольную пункцию коркового слоя паренхимы нижнего полюса почки, после чего через пункционную иглу вводят суспензию стандартизированного штамма М. tuberculosis H37Rv в дозе 106 микробных клеток в 0,2 мл физиологического раствора.
Предлагаемый способ моделирования туберкулезного поражения почки прост в исполнении и характеризуется малой травматичностью. Выбор для создания модели кроликов, достаточно крупных лабораторных животных, открывает возможность проведения надежного мониторинга патофизиологических изменений с самого начала инфекционного процесса и вплоть до его завершения, не прибегая к эвтаназии.
Сущность изобретения поясняется чертежами.
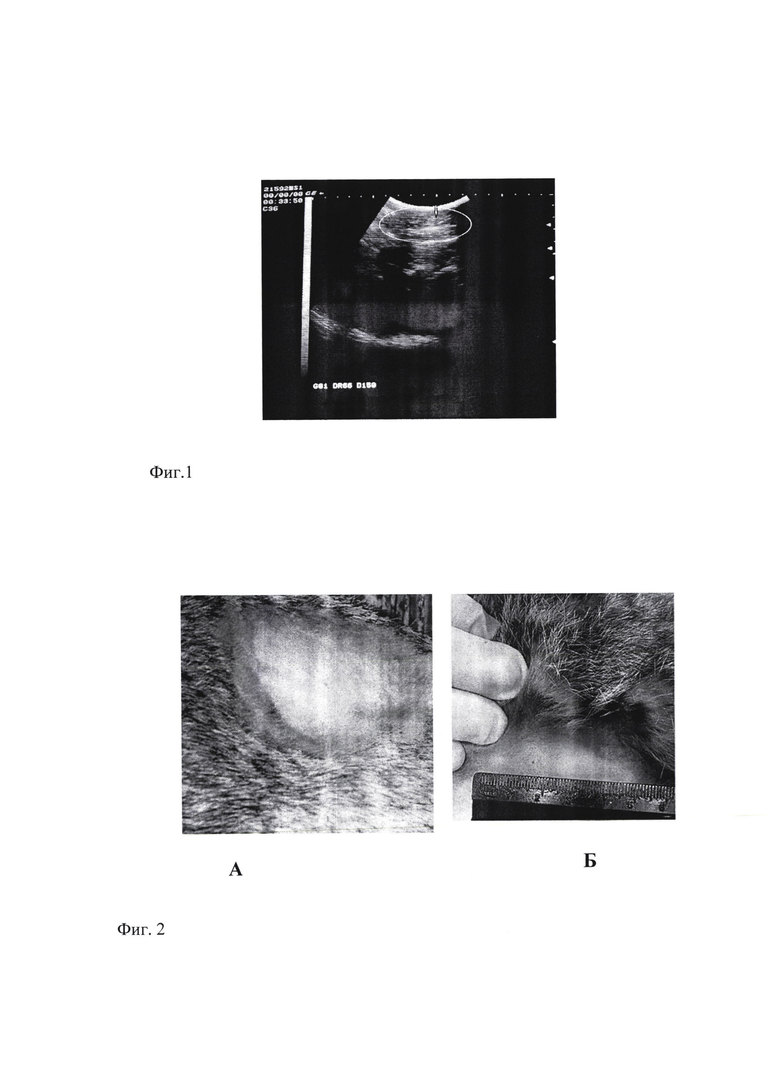
Фиг. 1 - УЗ изображение почки кролика №9, инфицированного M. tuberculosis H37Rv в дозе 106 КОЕ/0,2 мл. Стрелкой указано место введения инфекта - корковый слой паренхимы нижнего полюса левой почки.
Фиг. 2 - гиперергическая реакция (эритема) в ответ на внутрикожное введение АТР через 30 дней после инокуляции M. tuberculosis H37Rv в корковый слой паренхимы нижнего полюса левой почки в дозе 106 микробных клеток/0,2 мл. А - интактный, Б - зараженный кролик №9.
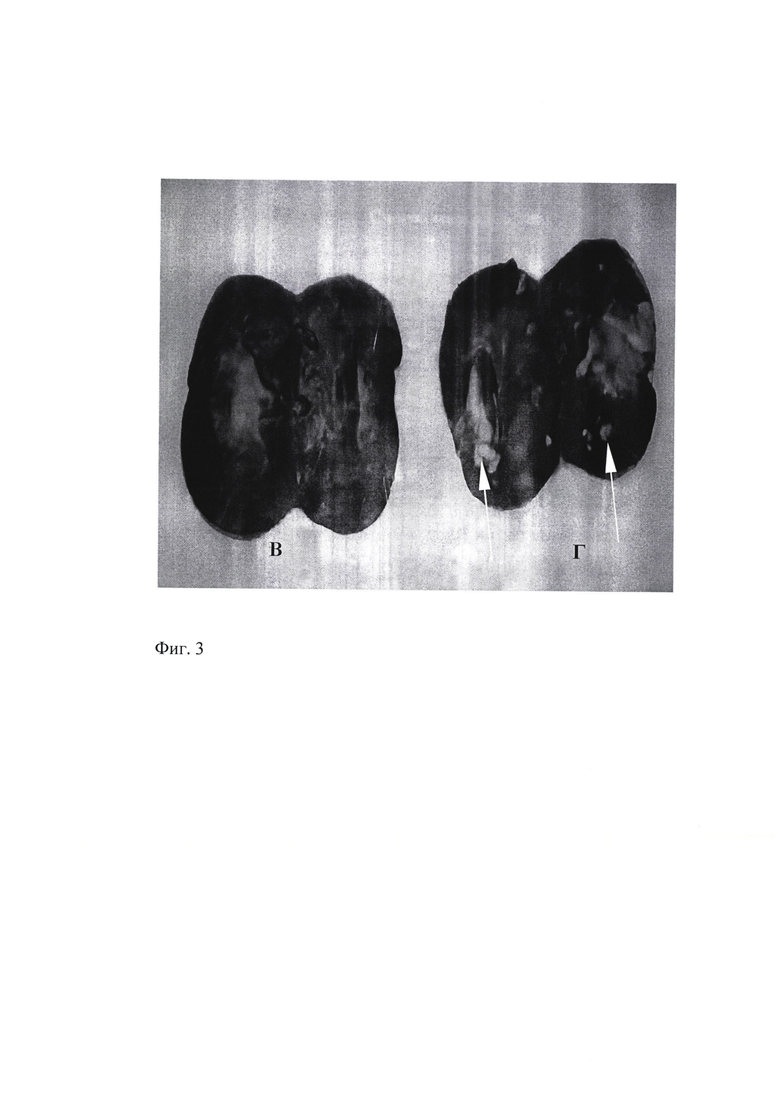
Фиг. 3 - Макропрепараты почек кролика №9. А - контрлатеральная (правая, неинфицированная) почка. Б - левая почка через 5 месяцев после инокуляции M. tuberculosis H37Rv в корковый слой паренхимы нижнего полюса почки в дозе 106 микробных клеток /0,2 мл. Вблизи капсулы полость размером 1×1 мм, заполненная рыхлыми казеозными массами, в окружающей ткани отдельные казеозные фокусы 0.1×0.1 мм
Фиг. 4 - Микропрепарат левой почки кролика №9 через 5 месяцев после инокуляции M. tuberculosis H37Rv в корковый слой паренхимы нижнего полюса в дозе 106 микробных клеток/0,2 мл. Некротические массы, окруженные псевдоэозинофильными лейкоцитами, макрофагами и формирующимися гигантскими многоядерными клетками. Окраска гематоксилином и эозином, ув. ×600
Фиг. 5 - Микропрепарат левой почки кролика №9 через 5 месяцев после инокуляции M. tuberculosis H37Rv в корковый слой паренхимы нижнего полюса в дозе 106 микробных клеток/0,2 мл. Кислотоустойчивые бактерии. Окраска по Цилю-Нельсену, ув. ×1000.
Фиг. 6 - Микропрепарат левой почки кролика №9 через 5 месяцев после инокуляции M. tuberculosis H37Rv в корковый слой паренхимы нижнего полюса в дозе 106 микробных клеток/0,2 мл. Формирующийся очаг некроза, окруженный лимфоидно-лейкоцитарным инфильтратом и формирующейся капсулой. Окраска гематоксилином и эозином, ув. ×300
Предлагаемый способ осуществляется следующим образом.
Кроликов самцов породы "Советская шиншилла" массой 3,2-3,5 кг в условиях операционной под общей анестезией с использованием внутримышечно препаратов для анестезии «Золетил» [золозепам + тилетамин (Вирбак СА, Франция) в дозе 25 мг/кг массы тела] и «Ксила» [(Xylazinum, Interchemie Werken «de Adelaar» BV, Нидерланды) в виде 2% раствора в объеме 1,0-1,5 мл] фиксировали на специальном станке в положении на правом боку, удаляли шерсть в левом подреберье в области проекции левой почки, поверхность обрабатывали 5% раствором йода. За час до операции проводилась антибиотикопрофилактика с использованием цефазолина (в дозе 50 тыс. ЕД/кг, 1,5 мл внутримышечно). Далее под УЗ контролем производили тонкоигольную пункцию коркового слоя паренхимы нижнего полюса левой почки (Фиг. 1). Для повышения точности позиционирования пункционной иглы использовали пункционный адаптер для ультразвукового сканера. Через пункционную иглу в корковый слой почечной паренхимы инокулировали микобактериальную суспензию 3-х недельного (вторая генерация) стандартизованного вирулентного тест-штамма M. tuberculosis H37Rv (получен из Федерального государственного бюджетного учреждения "Научный центр экспертизы средств медицинского применения" Министерства здравоохранения Российской Федерации), приготовленной ex tempore в день заражения животных и содержащую 106 клеток микобактерий в 0,2 мл физиологического раствора. В течение 5 дней после инфицирования проводили профилактику инфекционных осложнений с помощью антибиотиков широкого спектра действия, не обладающих противотуберкулезной активностью (пенициллины, цефалоспорины 1 или 2 поколения) курсом 5 дней в средних терапевтических дозах.
Контроль за развитием и течением туберкулезной инфекции у лабораторных животных:
- клинические методы исследования: ежедневная оценка общего состояния животных (удовлетворительное / неудовлетворительное), осмотр области инокуляции инфекта (абсцессы, гематомы - есть /нет); динамика массы тела животных (кг) один раз в 10 дней;
- исследование периферической крови, включающее оценку активности воспаления по концентрации реактантов острой фазы (альбумин и церулоплазмин методом Равина), активности ферментов пуринергической системы - общей аденозиндезаминазы (АДА) и ее изоферментов (экто-АДА-1 и экто-АДА-2) методом G. Giusti [14]; концентрацию биомаркера острого повреждения почек - креатинина. Кроме того, изучен уровень ферментов деструктивного процесса: металлопротеиназ (ММП), в том числе коллагеназы ММП-1 (CSB-E09744Rb), стромелезина ММП-3 (Rb) и их ингибиторов (тканевого ингибитора ТИМП-1 (CSB-E06935Rb) и α2-макроглобулина (МГ) и эластолитическая активность (ЭЛ) методом L. Visser и Е.R. Blout [15];
- постановка пробы с аллергеном туберкулезным рекомбинантным Диаскинтест®, который вводили в концентрации 2 мкг/мл в 0,1 мл физиологического раствора кроликам внутрикожно на спине в области проекции почки;
- бактериологическое исследование мочи кроликов через 30 и 60 дней (посев на плотную питательную среду Левенштейна-Йенсена методом серийных разведений), титр микобактерий выражали в десятичных логарифмах (lg) от числа КОЕ (колониеобразующих единиц);
- УЗ исследование через 60 дней после инокуляции суспензии M. tuberculosis H37Rv;
- компьютерная томография (томограф Toshiba Aquilion 32) легких через 60 дней после инокуляции МВТ для исключения генерализации специфического процесса;
- патоморфологическое исследование, в том числе макроскопическое исследование внутренних органов грудной и брюшной полости, гистологическое исследование микропрепаратов почек при окраске гематоксилином и эозином, а также по методу Циля-Нельсена для обнаружения кислотоустойчивых микобактерий.
Статистическая обработка данных проводилась с использованием пакета прикладных программ Statistica 7.0 (StatSoftInc, USA). В случае отклонения от нормального распределения (критерий Шапиро-Уилка) рассчитывали медиану (Me), первый и третий квартили (Q1-Q3). Оценивали достоверность различий метрических величин (критерий Вилкоксона), их корреляционную зависимость между собой (критерий Спирмена) и с количественными признаками (критерий Крускала-Уоллеса).
Через 30 дней после инокуляции МВТ в ответ на введение аллергена у инфицированных кроликов регистрировали появление эритемы размером 15,3±2,8 мм, что свидетельствует о наличии сенсибилизации и подтверждает развитие туберкулезного процесса (Фиг. 2).
Развитие туберкулезного процесса в почках сопровождалась повышением показателей воспалительного ответа в периферической крови. На всех сроках исследования была повышена концентрация креатинина, отмечался рост активности общей АДА за счет ее изофермента АДА-1, наиболее значимый на высоте воспаления (через 2 месяца после инфицирования) АДА - в 4, АДА-1 - в 3,8 раза по сравнению с показателями интактных кроликов. Выявлено наличие корреляционных связей между маркерами деструкции (ММП-1, ММП-3, ТИМП-1, эластаза) с показателями РОФ и креатинином, а также между активностью АДА-1 и концентрацией креатинина (r=0,9; p=0,037) на высоте воспаления.
Через 60 дней после заражения ультразвуковое исследование показало прогрессирующую отечность в области нижнего полюса левой почки со значимым утолщением паренхимы, расширением ЧЛС. В посевах мочи на этом сроке выявляли умеренный рост культуры МВТ (4,19±0,06 lg КОЕ).
Рентгенологически в легких у кролика специфические патологические изменения не обнаружены.
Через 5 месяцев после инфицирования выполнена эвтаназия животных путем введения в латеральную вену уха препарата для анестезии золетила в дозе в 5 раз, превышающей терапевтическую.
При макроскопическом обследовании вблизи капсулы левой почки (инфицированной) визуализировались: полость размером 1×1 мм, заполненная рыхлыми казеозными массами, в окружающей ткани - отдельные казеозные фокусы 0.1×0.1 мм с переходом патологического процесса на мочеточник и его облитерацией (Фиг. 3).
При гистологическом исследовании микропрепаратов тканей левой почки подтверждено наличие специфического воспаления с образованием полостей с некротическими массами, окруженных псевдоэозинофильными лейкоцитами, макрофагами и формирующимися гигантскими многоядерными клетками Лангханса (Фиг. 4). Кроме того, выявлен формирующийся очаг некроза, окруженный лимфоидно-лейкоцитарным инфильтратом и формирующейся капсулой (Фиг. 5). При окраске микропрепаратов ткани левой почки по методу Циля-Нельсена выявлены кислотоустойчивые микобактерий (Фиг. 6).
Способ проверен на 20-ти половозрелых кроликах-самцах.
Эффективность способа: Время наблюдения составило 5 месяцев. Результаты проведенных опытов свидетельствуют, что инокуляция под УЗ-контролем через пункционную иглу в корковый слой почечной паренхимы суспензии стандартного лабораторного вирулентного тест-штамма H37Rv в дозе 106 микробных клеток/0,2 мл приводит к развитию у подопытных животных специфических воспалительных изменений в почке, при этом сочетается с минимальным интраоперационным поражением и небольшим риском генерализации процесса.
Таким образом, предлагаемый способ позволяет воспроизвести в экспериментальных условиях на кроликах туберкулезное поражение почки с использованием малоинвазивного хирургического доступа, а также осуществлять прижизненный мониторинг развития и оценку тяжести течения специфического воспалительного процесса от момента заражения до эвтаназии у конкретного животного, включенного в исследование. Заявляемая модель имеет научно-прикладную ценность для фтизиатрии и урологии, поскольку раскрывает механизм структурно-функциональных нарушений на разных этапах развития заболевания и дает возможность корректировать тактику лечения нефротуберкулеза.
Список литературы
1. Figueiredo A.A., Lucon A.М. Urogenitaltuberculosis: updateandreviewof 8961 casesfromtheworldliterature // Reviewsinurology. - 2008. - Vol. 10. - №. 3. - P. 207.
2. Lima N.A., Vasconcelos С.C., FilgueiraP. H.O., Ticiano M.K. et al. Review of genitourinary tuberculosis with focus on end-stage renal disease // Revista do Institute de Medicina Tropical de  Paulo. - 2012. - Vol. 54, №. 1. - P. 57-60.
Paulo. - 2012. - Vol. 54, №. 1. - P. 57-60.
3. Merchant S., Bharati A., Merchant N. Tuberculosis of the genitourinary system Urinary tract tuberculosis: Renal tuberculosis Part I // Indian. J. Radiol. Imaging. - 2013. - Vol. 23. - P. 46-63.
4. Kim E.J., Lee W., Jeong W.Y., Choi H. et al. Chronic kidney disease with genitourinary tuberculosis: old disease but ongoing complication // BMC nephrology. - 2018. - Vol. 19. - №. 1. - P. 1-8. https://doi.org/10.U86/s12882-018-0994-2
5. Муравьев A.H., Зубань О.H. Роль суправезикального отведения мочи в комплексном лечении больных туберкулезом почек и мочеточников // Урология. - 2012. - №6. - С. 16-20.
6. Комяков Б.К., Гулиев Б.Г. Лапароскопическая кишечная пластика мочеточника // Эндоскопическая хирургия. - 2015. - №3. - С. 8-12
7. Нерсесян А.А. Особенности клинического течения, диагностики и лечения мочеполового туберкулеза: автореф. дис. д-ра мед. наук. - Москва, 2007. - 38 с.
8. Зубань О.Н., Волков А.А., Сущий Е.А., Муравьев А.Н. Мочеполовой туберкулез в современных эпидемиологических условиях // ТубИнформ. - 2017. - Т. 1, №1. - С. 9-12.
9. Семенов С.А., Муравьев А.Н. Влияние хронической задержки мочеиспускания на качество жизни больных туберкулезом мочевого пузыря, перенесших аугментационную илеоцистопластику // Туберкулез и социально значимые заболевания. - 2014. - №3. - С. 13-18.
10. Нечаева О.Б. Эпидемическая ситуация по туберкулезу в России // Туберкулез и болезни легких. - 2018. - Т. 96, №8. С. 15-24. https://doi.org/10.21292/2075-1230-2018-96-8-15-24
11. Минаков Н.К. Сочетанное поражение почки туберкулезом и хроническим пиелонефритом и его особенности на Крайнем Севере: автореф. дис. д-ра мед. наук. - Москва, 1987.
12. А.с. №1443019 SU Способ моделирования деструктивного туберкулеза почки: №4145923: заявл. 11.11.1986: опубл. 07.12.1988 / Козин Ю.И.
13. Беллендир Э.Н., Наконечный Г.Д., Шапкин А.Г. Очагово-казеозные поражения и ангиографические исследования при туберкулезе почек в эксперименте // Проблемы туберкулеза. - 1973. - №9. - С. 70-75.
14. Giusti G. Adenosine deaminase. Methods of enzymatic analysis / Ed. H. Bergmeyer. New York: Academic Press. - 1974. - Vol. 2. - P. 1092-1099.
15. Visser L., Blout E. The use of P-Nitrophenil- N-Tertbutyloxylcarbonyl L-Alaninate as substate for elastase // Biochim. Biophys. Acta. - 1972. - Vol. 268, Issue 1. - P. 257-260.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования туберкулеза плевры | 2024 |
|
RU2832685C1 |
| Способ моделирования сочетанной патологии карциномы легкого и туберкулеза | 2022 |
|
RU2800964C1 |
| Способ моделирования деструктивного туберкулеза почки | 1986 |
|
SU1443019A1 |
| РЕКОМБИНАНТНЫЕ ШТАММЫ ВИРУСА ГРИППА, ЭКСПРЕССИРУЮЩИЕ МИКОБАКТЕРИАЛЬНЫЙ ПРОТЕКТИВНЫЙ АНТИГЕН ESAT-6, И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2005 |
|
RU2318872C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТУБЕРКУЛЕЗА ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ | 2015 |
|
RU2600926C2 |
| Способ инактивации лекарственно чувствительных и лекарственно устойчивых штаммов Mycobacterium tuberculosis в экспериментальных условиях in vitro | 2018 |
|
RU2702646C1 |
| Способ моделирования туберкулеза мужских половых органов | 1988 |
|
SU1532970A1 |
| ИНАКТИВИРОВАННЫЕ МИКОБАКТЕРИИ ДЛЯ ОРАЛЬНОГО ПРИМЕНЕНИЯ В ПРЕДОТВРАЩЕНИИ ТУБЕРКУЛЁЗА | 2013 |
|
RU2657753C2 |
| ВАКЦИНА ПРОТИВ ТУБЕРКУЛЕЗА | 2017 |
|
RU2647831C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ПИЕЛОНЕФРИТА | 2008 |
|
RU2363055C1 |



Изобретение относится к медицине, а именно к фтизиатрии и урологии, и может быть использовано для моделирования туберкулеза почки в эксперименте. Способ включает введение культуры микобактерий туберкулеза в корковый слой почки. При этом под ультразвуковым контролем кролику производят тонкоигольную пункцию коркового слоя паренхимы нижнего полюса почки, после чего через пункционную иглу вводят суспензию стандартизированного штамма М. tuberculosis H37Rv в дозе 106 микробных клеток в 0,2 мл физиологического раствора. Изобретение обеспечивает создание экспериментальной модели, приближенной к клиническому течению заболевания, с использованием малоинвазивного хирургического вмешательства и снижением риска послеоперационных осложнений. 6 ил.
Способ моделирования туберкулеза почки путем введения культуры микобактерий туберкулеза в корковый слой почки, отличающийся тем, что под ультразвуковым контролем кролику производят тонкоигольную пункцию коркового слоя паренхимы нижнего полюса почки, после чего через пункционную иглу вводят суспензию стандартизированного штамма М. tuberculosis H37Rv в дозе 106 микробных клеток в 0,2 мл физиологического раствора.
| Способ моделирования деструктивного туберкулеза почки | 1986 |
|
SU1443019A1 |
| СПОСОБ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ТУБЕРКУЛЕЗА | 2000 |
|
RU2165761C1 |
| МИНАКОВ Н.К | |||
| Сочетанное поражение почки туберкулезом и хроническим пиелонефритом и его особенности на Крайнем Севере / Автореферат диссерт | |||
| на соиск | |||
| уч | |||
| степ | |||
| д.м.н., Москва, 1987 | |||
| Мочеполовой туберкулез: великий мистификатор не сдает позиций / Эффективная фармакотерапия | |||
| Урология и | |||
Авторы
Даты
2022-07-13—Публикация
2021-07-14—Подача