Коронавирусная Болезнь 2019 (COVID-19) - это острая респираторная инфекция, которая была впервые зарегистрирована в декабре 2019 года в г.Ухань (КНР). Заболевание стало быстро распространяться и 11 февраля 2020 года Всемирная организация здравоохранения (ВОЗ) назвала его «чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение», а через месяц объявила о начале пандемии.
Для COVID-19 характерными симптомами являются: повышение температуры тела, сухой кашель, отдышка, утомляемость. Реже встречаются - боль в горле, в суставах, насморк, головная боль. Болезнь может протекать как в легкой, так и тяжелой форме. При этом тяжелая форма заболевания чаще развивается у пациентов старше 60 лет и имеющих хронические заболевания. Наиболее грозными осложнениями данного заболевания являются - пневмония, острый респираторный дистресс-синдром, острая дыхательная недостаточность, острая сердечная недостаточность, острая почечная недостаточность, септический шок, кардиомиопатии, и др.
Проведенные научные исследования позволили быстро выявить возбудителя заболевания, которым оказался одноцепочечный РНК-содержащий вирус, относящийся к семейству Coronaviridae, к линии Beta-CoV B. Согласно международной номенклатуре, вирус получил название SARS-CoV-2. Коронавирус SARS-CoV-2 может передаваться воздушно-капельным, воздушно-пылевым, контактным, фекально-оральным способами, а также через контаминированные предметы и поверхности (фомиты), через кровь, от матери ребенку и от животных к человеку (Механизмы передачи вируса SARS-CoV-2 и их значение для выбора мер профилактики, Резюме научных исследований, 9 июля 2020 г. ВОЗ).
SARS-CoV-2 быстро распространился по всем странам. В настоящее время количество людей, зараженных коронавирусом SARS-CoV-2 превысило 274 млн человек, а количество погибших - 5,35 млн человек и эти числа продолжают расти.
Быстрое распространение SARS-CoV-2 и высокий процент смертности создали острую необходимость в разработке эффективных средств для лечения и профилактики заболеваний, вызываемых данным вирусом.
Разработка безопасных и эффективных средств для терапии, экстренной профилактики и профилактики SARS-CoV-2 в настоящее время является важнейшим глобальным приоритетом.
В настоящий момент, для терапии и экстренной профилактики COVID-19 разрешено к применению несколько препаратов на основе моноклональных антител. 21 ноября 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало разрешение на экстренное использование (EUA) препарата REGEN-COV (Regeneron Pharmaceuticals), для лечения COVID-19 от легкой до умеренной степени у людей в возрасте от двенадцати лет и старше с массой тела не менее 40 кг (88 фунтов) с положительными результатами прямого тестирования на вирус SARS-CoV-2 и которые имеют высокий риск развития тяжелой формы COVID-19. Сюда входят лица в возрасте 65 лет и старше или лица, страдающие определенными хроническими заболеваниями. REGEN-COV состоит из двух моноклональных антител: казиривимаба (REGN10933) и имдевимаба (REGN10987), которые связываются с неперекрывающимися эпитопами S белка SARS-CoV-2. Результаты клинических исследований данного препарата показали, что он способен снижать вирусную нагрузку, с большим эффектом у пациентов, у которых иммунный ответ еще не был инициирован или у которых исходно была высокая вирусная нагрузка (Weinreich DM, Sivapalasingam S, Norton T, AliS, GaoH, Bhore R, Musser BJ, SooY, RofailD, ImJ, Perry C, Pan C, Hosain R, Mahmood A, Davis JD, Turner KC, Hooper AT, Hamilton JD, Baum A, Kyratsous CA, Kim Y, Cook A, Kampman W, Kohli A, Sachdeva Y, Graber X, Kowal B, Di Cioccio T, Stahl N, Lipsich L, Braunstein N, Herman G, Yancopoulos GD; TrialInvestigators. REGN-COV2, a Neutralizing Antibody Cocktail, in Outpatients with Covid-19. N Engl J Med. 2021 Jan 21;384(3):238-251. doi: 10.1056/NEJMoa2035002. Epub 2020 Dec 17. PMID: 33332778; PMCID: PMC7781102).
Другой препарат на основе моноклонального антитела - бамланивимаб (LY-CoV555,
разработчик: Eli Lilly) получил разрешение FDA на экстренное применение для лечения COVID-19 от легкой до умеренной степени тяжести у негоспитализированных взрослых и детей. Однако результаты клинических исследований неоднозначны. Среди госпитализированных пациентов с COVID-19 одновременное применение бамланивимаба с ремдесивиром не было эффективно. (ACTIV-3/TICO LY-CoV555 Study Group, Lundgren JD, Grund B, Barkauskas CE, Holland TL, Gottlieb RL, Sandkovsky U, Brown SM, Knowlton KU, Self WH, Files DC, Jain MK, Benfield T, Bowdish ME, Leshnower BG, Baker JV, Jensen JU, Gardner EM, Ginde AA, Harris ES, Johansen IS, Markowitz N, Matthay MA, Østergaard L, Chang CC, Davey VJ, Goodman A, Higgs ES, Murray DD, Murray TA, Paredes R, Parmar MKB, Phillips AN, Reilly C, Sharma S, Dewar RL, Teitelbaum M, Wentworth D, Cao H, Klekotka P, Babiker AG, Gelijns AC, Kan VL, Polizzotto MN, Thompson BT, Lane HC, Neaton JD. A Neutralizing Monoclonal Antibody for Hospitalized Patients with Covid-19. N Engl J Med. 2021 Mar 11;384(10):905-914. doi: 10.1056/NEJMoa2033130. Epub 2020 Dec 22. PMID: 33356051; PMCID: PMC7781100). Клинические исследования на амбулаторных пациентах показали, что только одна из трех доз исследуемого препарата (2800 мг LY-CoV555) достоверно ускоряла естественное снижение вирусной нагрузки. (Chen P, Nirula A, Heller B, Gottlieb RL, Boscia J, Morris J, Huhn G, Cardona J, Mocherla B, Stosor V, Shawa I, Adams AC, Van Naarden J, Custer KL, Shen L, Durante M, Oakley G, Schade AE, Sabo J, Patel DR, Klekotka P, Skovronsky DM; BLAZE-1 Investigators. SARS-CoV-2 Neutralizing Antibody LY-CoV555 in Outpatients with Covid-19. N Engl J Med. 2021 Jan 21;384(3):229-237. doi:10.1056/NEJMoa2029849. Epub 2020 Oct 28. PMID: 33113295; PMCID: PMC7646625).
Наилучший эффект наблюдался при комбинированной терапии двумя моноклональными антителами: бамланивимаб и этесевимаб. (Gottlieb RL, Nirula A, Chen P, Boscia J, Heller B, Morris J, Huhn G, Cardona J, Mocherla B, Stosor V, Shawa I, Kumar P, Adams AC, Van Naarden J, Custer KL, Durante M, Oakley G, Schade AE, Holzer TR, Ebert PJ, Higgs RE, Kallewaard NL, Sabo J, Patel DR, Klekotka P, Shen L, Skovronsky DM. Effect of Bamlanivimab as Monotherapy or in Combination With Etesevimab on Viral Load in Patients With Mild to Moderate COVID-19: A Randomized Clinical Trial. JAMA. 2021 Feb 16;325(7):632-644. doi: 10.1001/jama.2021.0202. PMID: 33475701; PMCID: PMC7821080).
Также в октябре 2021 года разрешен к применению препарат Регданвимаб от компании Celltrion на основе человеческого моноклонального антитела. Данный препарат показан к применению у взрослых, которым не требуется дополнительная кислородная терапия и которые имеют высокий риск прогрессирования до тяжелой формы COVID-19 (EMA issues advice on use of regdanvimab for treating COVID-19).
В мае 2021 года FDA и EMA одобрили к применению препарат Сотровимаб (VIR-7831) для лечения, подтвержденного COVID-19 у взрослых и подростков (в возрасте от 12 лет и старше и с массой тела не менее 40 кг), которым не требуется дополнительный кислород и которые подвержены риску прогрессирования в тяжелую форму COVID-19 (EMA issues advice on use of sotrovimab (VIR-7831) for treating COVID-19). Препарат представляет собой человеческое моноклональное антитело с мутацией Fc LS (M428L/N434S), обеспечивающая повышенное связывание с неонатальным рецептором Fc (Assessment Report: Use of sotrovimab for the treatment of COVID-19), что приводит к увеличению периода полувыведения препарата и потенциально улучшает его распространение в легких
В целом, препараты на основе моноклональных антител применимы для терапии и экстренной профилактики заболевания COVID-19, однако не подходят для длительной профилактики данного заболевания вследствие ограниченного периода циркуляции в организме.
Самым эффективным способом продолжительной профилактики инфекций является вакцинация. Одними из наиболее перспективных разработок в данной области являются вакцины на основе аденовирусных экспрессионных векторов. В настоящее время несколько независимых фармацевтических компаний и научных организаций разработали вакцины против SARS-CoV-2 на основе аденовирусных векторов.
Оксфордский университет в сотрудничестве с фармацевтической компанией AstraZeneca разработал векторную вакцину ChAdOx1 nCoV-19 (AZD1222). Активным компонентном данной вакцины является аденовирус шимпанзе ChAdOx1, содержащий кодон-оптимизированную кодирующую последовательность полноразмерного S белка вируса SARS-CoV-2 (GenBank MN908947) с лидерной последовательностью тканевого активатора плазминогена. (M. Voysey et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. TheLancet. Vol. 397, Issue 10269, P99-111, 2021).
Компания CanSino разработала векторную вакцину против COVID-19, в основе которой репликативно-дефектный аденовирус человека 5 серотипа (Ad5), экспрессирующий полноразмерный S гликопротеин SARS-CoV-2. (GenBankYP_009724390) (Feng-Cai Zhu et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. The Lancet. Vol. 369, Issue 10249, P479-488, 2020).
В ФГБУ «НИЦЭМ им. Н.Ф.Гамалеи» Минздрава России была разработана вакцина Sputnik V против COVID-19, в основе которой лежат два гетерологичных репликативно-дефектных аденовируса человека 26 и 5 серотипов (Ad26 и Ad5), экспрессирующих полноразмерный S гликопротеин SARS-CoV-2 (Logunov D.Y. et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021 Feb 20;397(10275):671-681.doi: 10.1016/S0140-6736(21)00234-8. Epub 2021 Feb 2. Erratum in: Lancet. 2021 Feb20;397(10275):670. PMID: 33545094; PMCID: PMC7852454.).
Исследовательские группы Johnson and Johnson и Janssen Pharmaceutical в сотрудничестве с Медицинским центром Beth Israel Deaconess, с помощью технологии Janssen AdVac® создали несколько кандидатных вакцин. После проведенных исследований безопасности и эффективности была выбрана кандидатная вакцина Ad26.COV2.S (Ad26COVS1). Активным компонентном данной вакцины является рекомбинантный аденовирусный вектор 26 серотипа с делецией Е1 и Е3 области, содержащий ген S белка SARS-CoV-2, с мутацией сайта расщепления фурина и с двумя пролин-стабилизирующими мутациями. (J. Sadoff et al. Interim Results of a Phase 1-2a Trial of Ad26.COV2.S Covid-19 Vaccine. NEnglJMed, 2021 Jan 13. DOI: 10.1056 /NEJMoa2034201).
Однако вакцины на основе аденовирусов обеспечиваю формирование стойкого протективного иммунного ответа лишь через, как минимум, 14 дней после введения препарата. Таким образом, в первые две недели после вакцинации человек по-прежнему остается не защищенным. Следовательно, данные препараты не подходят для экстренной профилактики COVID-19.
В патенте CN112500480A описано создание однодоменных антител и их модификаций против коронавируса SARS-CoV-2. Кроме того, разработан способ применения однодоменных антител и их модификаций для терапии и экстренной профилактики заболеваний, вызванных коронавирусом SARS-CoV-2. Данное решение, как наиболее близкое к заявляемому, было выбрано авторами патента за прототип. Однако, недостатком прототипа является то, что однодоменные антитела и их модификации обладают ограниченным периодом циркуляции в организме (до 336 часов), таким образом, не подходят для применения в качестве средства длительной профилактики.
Таким образом, в уровне техники существует потребность в создании нового антитела или вектора, который возможно использовать как в качестве профилактики, так и в качестве экстренной профилактики и терапии заболеваний, вызванных вирусом SARS-CoV-2.
Раскрытие сущности изобретения
Технической задачей заявленной группы изобретений является расширение арсенала рекомбинантных вирусных векторов для терапии, экстренной профилактики и профилактики заболеваний, вызываемых вирусом SARS-CoV-2.
Технический результат заключается в создании аденоассоциированного вирусного вектора, экспрессирующего рекомбинантное антитело, представляющее собой однодоменное антитело, слитое с Fc-фрагментом IgG1 человека, специфичное к RBDS-белка вируса SARS-CoV-2, и который может быть использован для индукции пролонгированной экспрессии в организме указанного рекомбинантного антитела. Кроме того, технический результат достигается тем, что созданный аденоассоциированный вирусный вектор может быть использован для терапии, экстренной профилактики и профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Указанный технический результат достигается тем, что создан рекомбинантный аденоассоцированный вирусный вектор, несущий генетическую конструкцию, экспрессирующую рекомбинантное антитело, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:1, CDR2, представленный аминокислотной последовательностью SEQ ID NO:2, CDR3, представленный аминокислотной последовательностью SEQ ID NO:3, либо экспрессирующую рекомбинантное антитело, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:4, CDR2, представленный аминокислотной последовательностью SEQ ID NO:5, CDR3, представленный аминокислотной последовательностью SEQ ID NO:6, либо экспрессирующую рекомбинантное антитело, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:7, CDR2, представленный аминокислотной последовательностью SEQ ID NO:8, CDR3, представленный аминокислотной последовательностью SEQ ID NO:9, соответственно.
Также технический результат достигается тем, что экспрессируемое в составе вектора рекомбинантное антитело специфически связывает рецептор-связывающий домен (RBD) S белка вируса SARS-CoV-2 и обладает защитной активностью против вируса SARS-CoV-2.
Также технический результат достигается тем, что введение созданного препарата рекомбинантного аденоассоциированного вирусного вектора в эффективном количестве обеспечивает продолжительную экспрессию в организме рекомбинантного антитела.
Кроме того, введение созданного препарата рекомбинантного аденоассоциированного вирусного вектора в эффективном количестве обеспечивает длительную защиту в отношении вируса SARS-CoV-2.
Разработан способ экстренной профилактики и профилактики заболевания, вызванного вирусом SARS-CoV-2, заключающийся во введении в эффективном количестве рекомбинантного аденоассоциированного вирусного вектора, экспрессирующего рекомбинантное антитело, специфически связывающее рецептор-связывающий домен (RBD) S белка вируса SARS-CoV-2.
Краткое описание чертежей
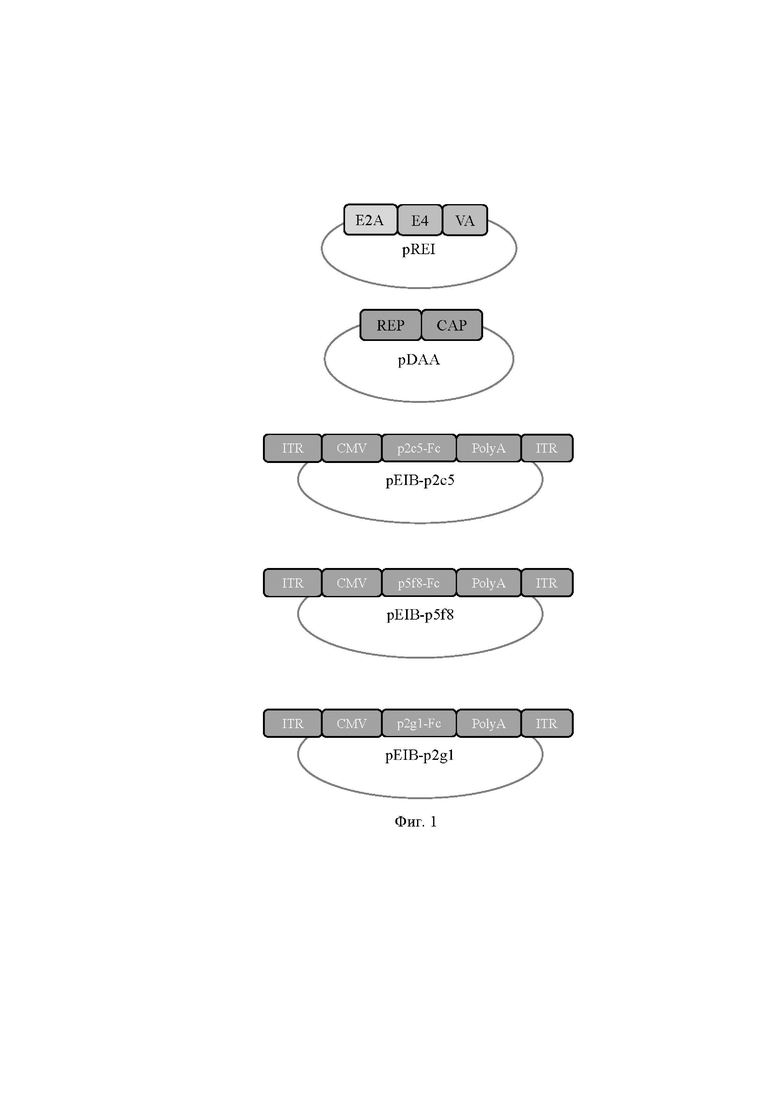
На фиг. 1 представлены схематические изображения плазмид pREI, pDAA, pEIB-p2c5, pEIB-p5f8, pEIB-p2g1.
E2A, E4, VA - гены аденовируса человека 5-ого серотипа, необходимые для репликации аденоассоциированного вируса;
REP - ген белков репликативного комплекса аденоассоциированного вируса;
CAP - ген структурных белков аденоассоциированного вируса;
ITR - инвертированные концевые повторы генома аденоассоциированного вируса человека 2-го серотипа;
CMV - промотор цитомегаловируса человека;
p2c5-fc, p5f8-fc, p2g1-fc - гены соответствующих рекомбинантных антител;
PolyA - сигнал полиаденилирования.
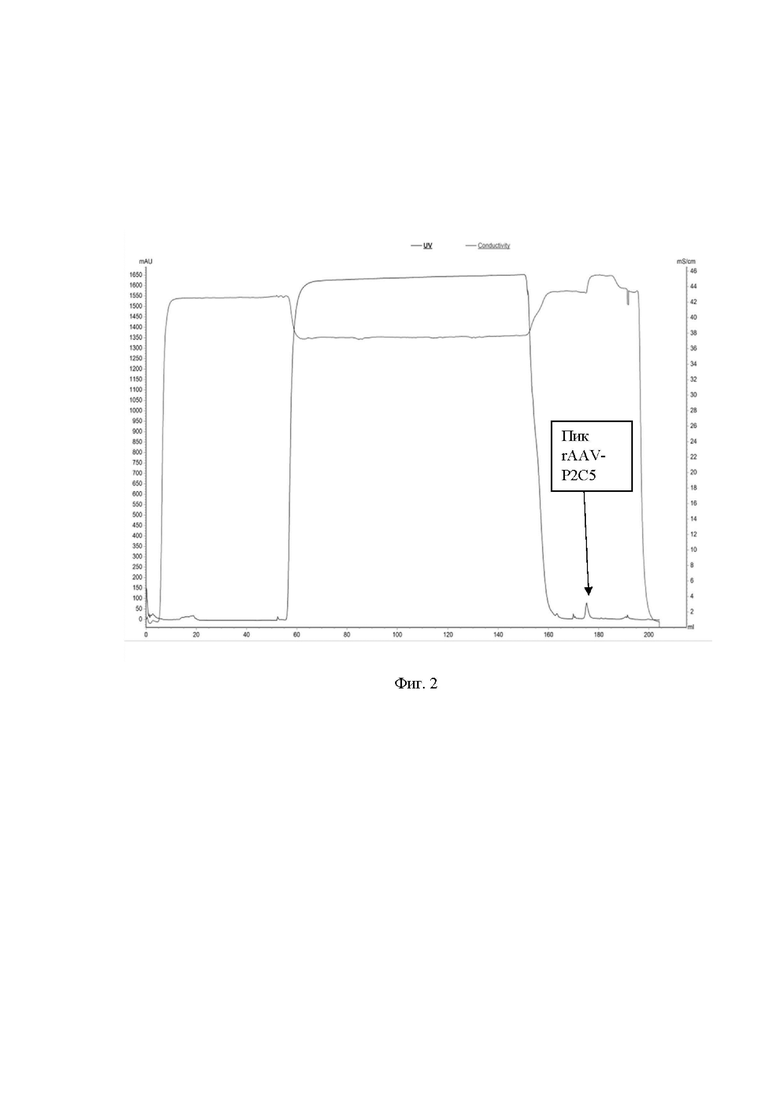
На фиг. 2 представлена хроматограмма аффинной очистки препарата rAAV-P2C5
mAU - поглощение при длине волны 280 нм;
mS/cm - проводимость в мили Сименсах.
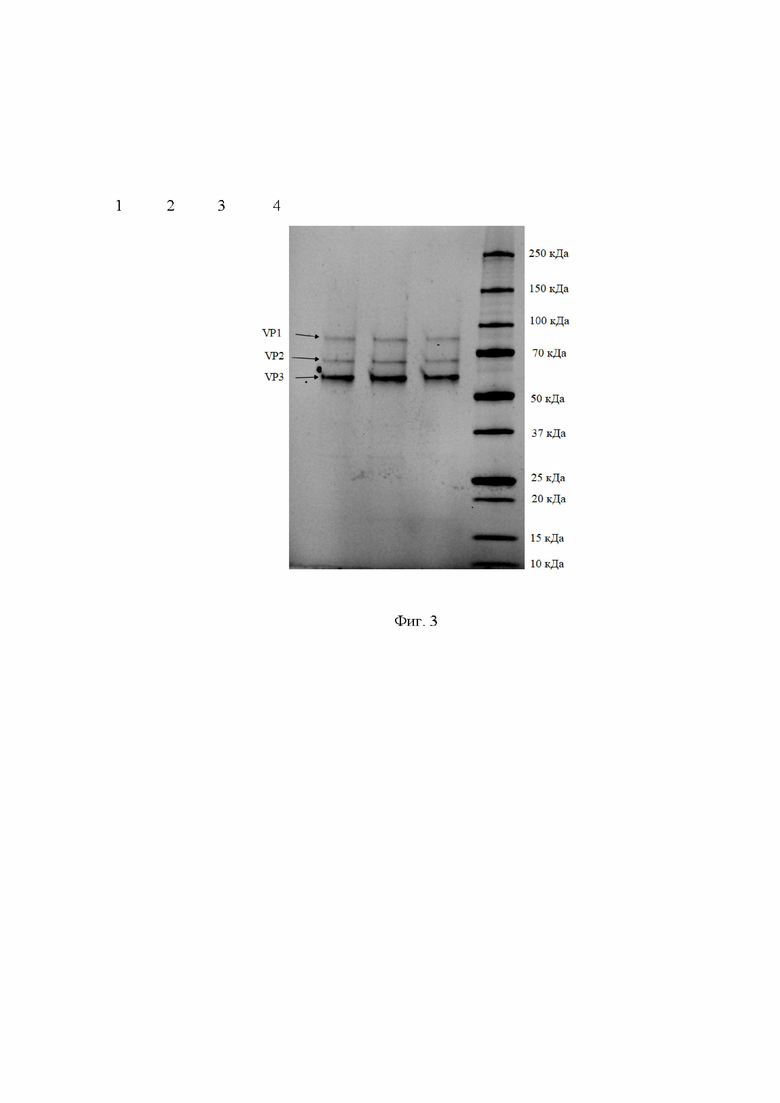
На фиг. 3 представлена электрофореграмма оценки чистоты и подлинности препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
1 - препарат rAAV-P2C5;
2 - препарат rAAV-P5F8;
3 - препарат rAAV-P2G1;
4 - маркер молекулярного веса;
VP1, VP2, VP3 - структурные белки аденоассоциированного вируса.
На фиг. 4 представлены результаты количественной оценки экспрессии рекомбинантных антител в клетках НЕК 293, трансдуцированных полученными препаратами rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Ось ординат - концентрация рекомбинантных антител, мкг/мл
Ось абсцисс - название образцов
p2c5-fc, p5f8-fc, p2g1-fc - концентрация соответствующих антител в культуральной жидкости
К - отрицательный контроль (культуральная жидкость от не трансдуцированных клеток)
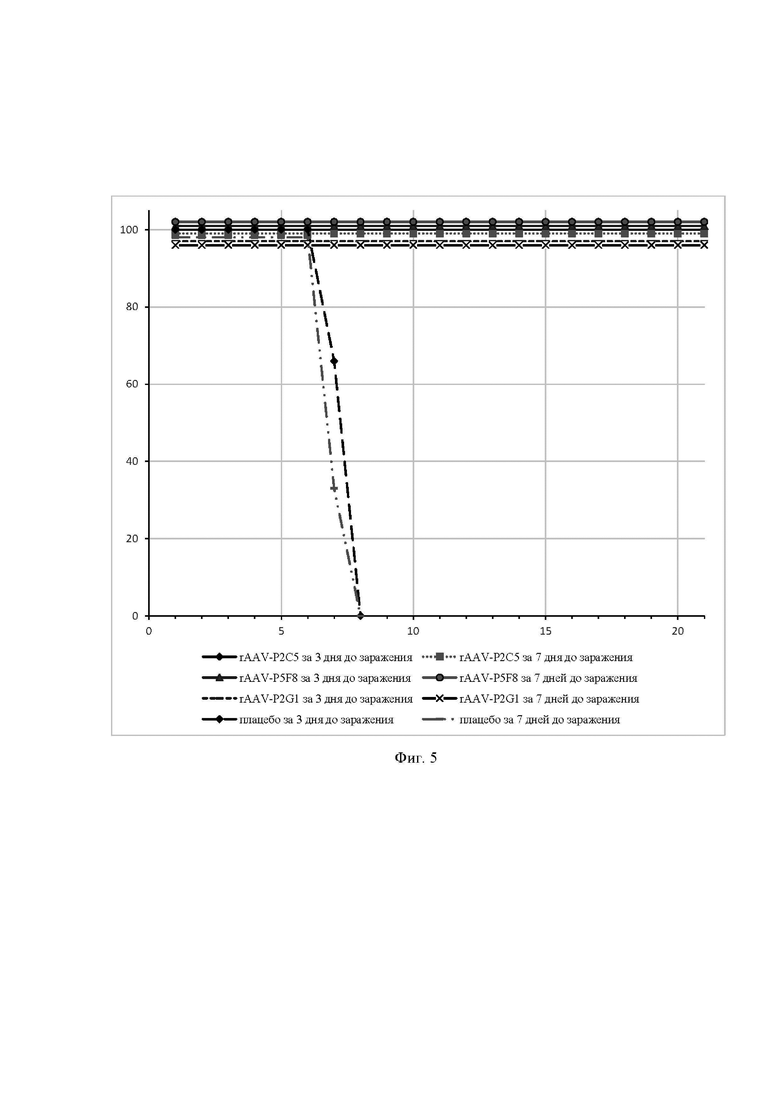
На фиг. 5 представлены данные эксперимента по оценке протективной активности препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Ось ординат - процент выживаемости мышей;
Ось абсцисс - дни после инфицирования вирусом SARS-CoV-2.
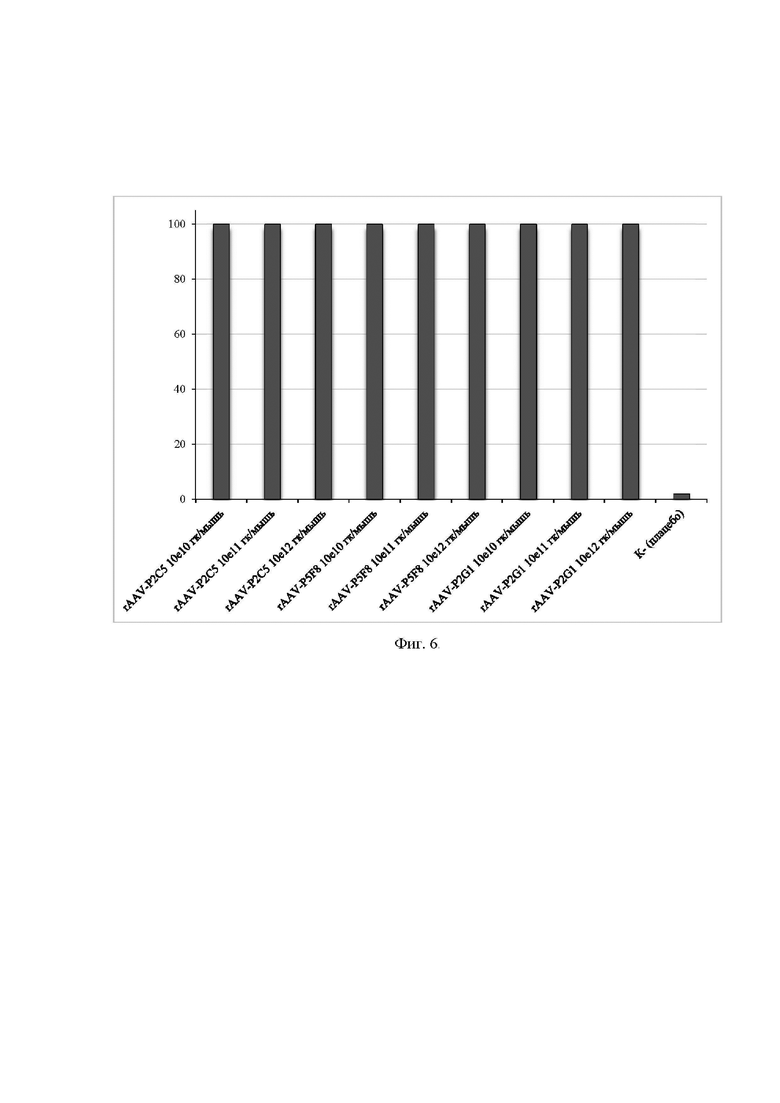
На фиг. 6 представлены результаты изучения протективной активности различных доз препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1
Ось ординат - процент выживаемости мышей;
Ось абсцисс - названия групп животных.
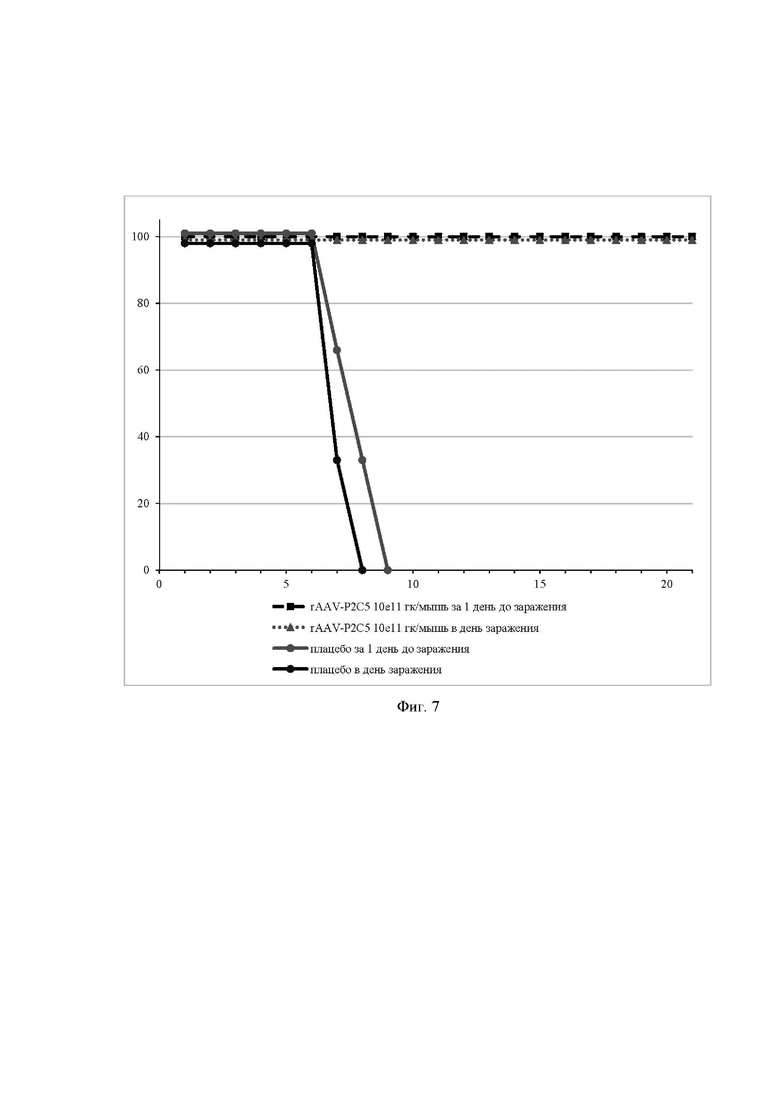
На фиг. 7 представлены данные эксперимента по разработке способа экстренной профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Ось ординат - процент выживаемости мышей;
Ось абсцисс - дни после заражения вирусом SARS-CoV-2.
На фиг. 8 представлены данные эксперимента по разработке способа профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Ось ординат - процент выживаемости мышей;
Ось абсцисс - дни после заражения вирусом SARS-CoV-2.
Осуществление изобретения
Для осуществления настоящего изобретения на первом этапе получали плазмидные системы необходимые для сборки рекомбинантных аденоассоциированных вирусных векторов. Для этого, были использованы следующие плазмидные конструкции:
pREI, несущая гены аденовируса человека 5-ого серотипа, необходимые для репликации рекомбинантного аденоассоциированного вируса;
pDAA, несущая гены REP и CAP, аденоассоциированного вируса человека 2-го серотипа;
pEIB-P2C5, несущая инвертированные концевые повторы (ITR) аденоассоциированного вируса человека 2-го серотипа и генетическую конструкцию, экспрессирующую рекомбинантное антитело p2c5-fc;
pEIB-P5F8, несущая инвертированные концевые повторы (ITR) аденоассоциированного вируса человека 2-го серотипа и генетическую конструкцию, экспрессирующую рекомбинантное антитело p5f8-fc;
pEIB-P2G1, несущая инвертированные концевые повторы (ITR) аденоассоциированного вируса человека 2-го серотипа и генетическую конструкцию, экспрессирующую рекомбинантное антитело p2g1-fc;
Специалистам в данной области известно, что для получения рекомбинантного аденоассоциированного вирусного вектора можно использовать любые другие плазмидные системы. Таким образом, любые плазмидные системы могут быть использованы для получения рекомбинантного аденоассоциированного вирусного вектора, содержащие нуклеотидную последовательность, кодирующую рекомбинантное антитело, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:1, CDR2, представленный аминокислотной последовательностью SEQ ID NO:2, CDR3, представленный аминокислотной последовательностью SEQ ID NO:3, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:4, CDR2, представленный аминокислотной последовательностью SEQ ID NO:5, CDR3, представленный аминокислотной последовательностью SEQ ID NO:6, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:7, CDR2, представленный аминокислотной последовательностью SEQ ID NO:8, CDR3, представленный аминокислотной последовательностью SEQ ID NO:9.
Также, специалистам в данной области известно, что в целях осуществления настоящего изобретения последовательность рекомбинатного антитела, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:1, CDR2, представленный аминокислотной последовательностью SEQ ID NO:2, CDR3, представленный аминокислотной последовательностью SEQ ID NO:3, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:4, CDR2, представленный аминокислотной последовательностью SEQ ID NO:5, CDR3, представленный аминокислотной последовательностью SEQ ID NO:6, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:7, CDR2, представленный аминокислотной последовательностью SEQ ID NO:8, CDR3, представленный аминокислотной последовательностью SEQ ID NO:9, может содержать в себе аминокислотные замены, которые не сказываются на вторичной и третичной структуре рекомбинантного антитела и не влияют на его способность связывать и нейтрализовать вирус SARS-CoV-2. Более того, поскольку в связывании с антигеном участвуют только антигенсвязывающие петли (CDR домены) однодоменных антител, то, как известно специалистам в данной области, любой иммуноглобулин или его аналог, содержащий такие же аминокислотные последовательности CDR доменов, попадает под объем настоящего изобретения. Более того, последовательности CDR доменов могут содержать замены/делеции/вставки аминокислот, которые при парном выравнивании аминокислотных последовательностей обеспечивают гомологичность не менее 70% и не оказывают качественного влияния на способность связываться с антигеном. Таким образом, любые плазмидные системы могут быть использованы для получения рекомбинантного аденоассоциированного вирусного вектора, содержащие нуклеотидную последовательность, кодирующую последовательности CDR доменов, гомология которых составляет не менее 70% с предлагаемыми последовательностями.
Кроме того, специалистам в данной области известно, что в целях осуществления настоящего изобретения нуклеотидная последовательность, кодирующая рекомбинантное антитело, может отличаться, основываясь на принципе вырожденности генетического кода. Таким образом, любые плазмидные системы могут быть использованы для получения рекомбинантного аденоассоциированного вирусного вектора, содержащие последовательности нуклеотидов, кодирующие аминокислотную последовательность рекомбинантного антитела, имеющего CDR1, представленный аминокислотной последовательностью SEQ ID NO:1, CDR2, представленный аминокислотной последовательностью SEQ ID NO:2, CDR3, представленный аминокислотной последовательностью SEQ ID NO:3, либо имеющего CDR1, представленный аминокислотной последовательностью SEQ ID NO:4, CDR2, представленный аминокислотной последовательностью SEQ ID NO:5, CDR3, представленный аминокислотной последовательностью SEQ ID NO:6, либо имеющего CDR1, представленный аминокислотной последовательностью SEQ ID NO:7, CDR2, представленный аминокислотной последовательностью SEQ ID NO:8, CDR3, представленный аминокислотной последовательностью SEQ ID NO:9.
Все плазмидные конструкции получали в препаративных количествах путем трансформации клеток E. coli штамма Dh5α. После трансформации компетентных бактерий E.coli и их лизиса выделение суперскрученной ДНК проводили на наборе PlasmidSelectXtraStarterKit согласно инструкции производителя. После хроматографической очистки плазмидные ДНК переосаживали ацетатом натрия для избавления от ЭДТА и других составляющих буфера, способных к ингибированию процесса трансфекции.
Далее для получения рекомбинантных аденоассоциированных вирусов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1, экспрессирующих рекомбинантные антитела p2c5-fc, p5f8-fc и p2g1-fc соответственно, специфично связывающие RBD S белка вируса SARS-CoV-2, полученными плазмидами трансфецировали клеточную линию НЕК293, в которой происходила продукция и сборка рекомбинантного аденоассоциированного вируса, несущего ген рекомбинантного антитела P2C5, P5F8 и P2G1 соответственно. Таким образом, для получения препарата rAAV-P2C5 использовали плазмиды pREI, несущую гены аденовируса человека 5-ого серотипа, необходимые для репликации рекомбинантного аденоассоциированного вируса, pDAA, несущую гены REP и CAP, аденоассоциированного вируса человека 2-го серотипа и pEIB-P2C5, несущую инвертированные концевые повторы (ITR) аденоассоциированного вируса человека 2-го серотипа и генетическую конструкцию, экспрессирующую рекомбинантное антитело p2c5. Для получения препарата rAAV-P5F8 использовали плазмиды pREI, несущую гены аденовируса человека 5-ого серотипа, необходимые для репликации рекомбинантного аденоассоциированного вируса, pDAA, несущую гены REP и CAP, аденоассоциированного вируса человека 2-го серотипа и pEIB-p5f8, несущую инвертированные концевые повторы (ITR) аденоассоциированного вируса человека 2-го серотипа и генетическую конструкцию, экспрессирующую рекомбинантное антитело p5f8. Для получения препарата rAAV-P2G1 использовали плазмиды pREI, несущую гены аденовируса человека 5-ого серотипа, необходимые для репликации рекомбинантного аденоассоциированного вируса, pDAA, несущую гены REP и CAP, аденоассоциированного вируса человека 2-го серотипа и pEIB-P2G1, несущую инвертированные концевые повторы (ITR) аденоассоциированного вируса человека 2-го серотипа и генетическую конструкцию, экспрессирующую рекомбинантное антитело p2g1.
Клетки НЕК293 культивировали в одноразовом биореакторе BioBLU 5p на матрице из дисков Fibra-Cel (Eppendorf, Германия). Трансфекцию клеток указанными плазмидами осуществляли при помощи реагента PEI 25kDa (Polyscience, США).
Очистку препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 осуществляли при помощи тангенцальной фильтрации с использованием системы AKTAFluxS и картриджа Hollowfiber50 kDa (Cytiva, США) и аффинной хроматографии и с использованием системы AKTAPURE 25 (Cytiva, США) и колонки, упакованной сорбентом AVBsepharose (Cytiva, США).
Специалистам в данной области известно, что в целях осуществления настоящего изобретения для продукции и сборки рекомбинантного аденоассоциированного вирусного вектора можно использовать другие эукариотические системы экспрессии. При необходимости способ получения дополнительно включает в себя выделение и очистку любым способом, известным в данной области.
Далее, были изучены количественные и качественные характеристики препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1, была изучена трансдуцирующая активность и продукция рекомбинантных антител в составе полученных препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
При изучении полученных препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 invivo, была оценена фармакокинетика рекомбинантных антителр2с5-fc, p5f8-fc и p2g1-fc в сыворотке крови мышей, получивших препараты rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 соответственно.
Была подобрана эффективная доза препаратов, обеспечивающая 100-ную защиту от заболеваний, вызванных вирусом SARS-CoV-2.
Кроме того, разработан способ экстренной профилактики и профилактики заболевания, вызванного вирусом SARS-CoV-2, заключающийся во введении млекопитающим в эффективной дозе препарата rAAV-P2C5. Разработан способ профилактики заболевания, вызванного вирусом SARS-CoV-2, заключающийся во введении млекопитающим в эффективной дозе препарата rAAV-P2C5.
Осуществление изобретения подтверждается следующими примерами.
Пример 1. Получение плазмидных конструкций
Плазмиды pREI, pDAA, pEIB-P2C5, pEIB-P5F8, pEIB-P2G1 наращивали в клетках E.coli. Для этого бактерии трансформировали целевыми плазмидами методом теплового шока. Компетентные клетки получали по стандартным протоколам. При проведении трансформации к компетентным клеткам штамма Dh5α добавляли 5-10 нг целевой плазмидной ДНК, инкубировали на льду 30 минут. После инкубации пробирку с клетками помещали в водяную баню при температуре 42°C на 45 секунд. Затем инкубировали на льду в течение 10 минут, добавляли 1 мл среды SOB и инкубировали при 37°C в течение 1 часа на шейкер-инкубаторе. Впоследствии с помощью селективных антибиотиков их помещали в чашки Петри на твердую среду и инкубировали при 37°С в течении ночи. После 16 часов инкубации отобранные колонии высевали в колбы с 100 мл среды LB и инкубировали в шейкер-инкубаторе при 210 об/мин 16-18 часов при 37°С.
Целевые плазмидные ДНК полученные из бактерий Е.coli штаммов DH5α выделяли с помощью 3-стадийной хроматографической очистки PureLink HiPure Plasmid Maxiprep Kit (Invitrogen, Thermo Fisher Scientific). Выделение выполняли согласно протоколу производителя. Результат оценивали с помощью горизонтального электрофореза в агарозном геле (0,8%). Визуализировали результаты с помощью системы гель-документирования Gel Doc EZ (Bio-Rad). Схематичные изображения плазмид представлены на фиг. 1.
Таким образом, в данном примере была получена система плазмидных векторов (pREI, pDAA, pEIB-P2C5, pEIB-P5F8, pEIB-P2G1), необходимая для продукции рекомбинантных аденоассоциированных вирусов, несущих гены рекомбинантных антител p2c5, p5f8 и p2g1 (rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1).
Пример 2. Продукция и очистка препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Для получения препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1, полученные в примере 1 плазмиды трансфецировали в культуру клеток линии HEK293. Для этого суспензионную культуру клеток HEK293 культивировали в среде BalanCDHEK293 (FujifilmIrvineScientifics) приготовленной согласно инструкции производителя. Для культивации использовали колбы Эрленмейера с вентилируемой крышкой объемами 125, 500 и 1000 мл (Corning) с помощью шейкер-инкубатора Multitron (Infors HT) со скоростью перемешивания 110 об/мин при амплитуде 50 мм. В условиях культивирования использовали 37°С, 80% влажности и 5% CO2. Пассажи проводили при достижении концентрации клеток 2-3*106 кл/мл. Далее клеточную суспензию засевали в одноразовом биореакторе BioBLU 5p на матрице из дисков Fibra-Cel (Eppendorf, Германия), добавляя свежую питательную среду до получения концентрации клеток 0,5*106 на мл (2,5 литра). Для адгезии клеток на матрице из дисков Fibra-Cel в полученную суспензию добавляли 1% фетальной бычьей сыворотки (HyClone, США).
Трансфекцию проводили в одноразовом биореакторе BioBLU 5p через сутки после засева клеточной суспензии. Трансфекцию осуществляли с использованием трансфецирующего агента PEIlinear 25 kDa (Polyscience). Конечная концентрация ДНК, используемая для трансфекции, составляла 1 мкг/мл культуральной среды. В качестве среды для трансфекции использовали Opti-MEM™ I Reduced Serum Medium (Gibco™, Thermo Fisher Scientific) в объеме 10% от конечного объема среды. Трансфецирующий агент использовали в концентрации 1 мг/мл. Объем PEI к ДНК брали в соотношении 3:1. Процентное содержание плазмидных ДНК составляло pREI - 50%, pDAA - 25%, pEIB-P2C5 или pEIB-P5F8 или pEIB-P2G1 - 25% соответственно. Полученную смесь инкубировали при комнатной температуре 7 минут для образования транфецирующего комплекса. После, смесь вносили в одноразовый биореактор BioBLU 5p. После трансфекции клетки культивировали в течение 5 суток со скоростью агитации 100-200 об/мин, сатурации 50%, рН=7-7,4. Скорость потока воздуха от 0,2 до 0,8 л/мин и содержание СО2 в воздушной смеси от 8 дот 0%.
Количественный выход рекомбинантных вирусных частиц оценивали по количеству геномных копий в клетках на 5 сутки после трансфекции при помощи набора QuickTiter™ AAV Quantitation Kit (Cell Biolabs) согласно инструкции производителя. Количественный выход рекомбинантных rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 составил от 108до 109 геномных копий на мл культуральной жидкости и тотальный выход от 1013 до 2,5*1013 геномных копий на одноразовый биореактор.
Таким образом, в результате проделанной работы была получена клеточная суспензия, содержащая рекомбинантные аденоассоциированные вирусные частицы rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 соответственно, содержащие гены однодоменного антитела, слитых с Fc-фрагментом человеческого IgG1, специфичных к RBDS белка вируса SARS-CoV-2.
Пример 3. Очистка препарата rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 из клеточной суспензии.
По истечении 5 дней культивирования проводили лизис клеточной суспензии добавлением в биореактор 1% твин-20, трис-HCl до 20 мМ, хлорида натрия до 50 мМ, хлорида магния до 2 мМ, бензонуклеаза (Merck) 20U на мл культуральной жидкости. Лизис проводили при комнатной температуре в течение 4 часов при слабом перемешивании. После лизиса проводили осветление культуральной жидкости при помощи фильтрации через капсульный фильтр Sartopore2 XLG0,8/0.2 мкм (SartoriusStedimBiotech, Германия).
Очистку rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 проводили с использованием сорбента AVB Sepharose (Cytiva Life Sciences, Швеция) согласно инструкции производителя. Пример хроматограммы очистки препарата rAAV-P2C5 представлен на фиг. 2. Полученный препарат концентрировали с использованием центрифужных концентраторов 50 кДа Amicon Ultra-15 (Merck, Германия) и стерилизовали мембранным фильтром 0,22 мкм (MF-Millipore). Концентрацию вирусных частиц (препарата) оценивали с помощью спектрофотометра NanoDrop 2000 (Thermo Scientific, USA) при длине волны 260нм. Препарат замораживали и хранили при -70°С. Для определения титра полученных препаратов использовали набор AAVpro® Titration Kit (for Real Time PCR) Ver.2 согласно инструкции производителя.
Таким образом, в данном примере были получены очищенные препараты rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 в количестве достаточном для проведения экспериментов in vivo и iv vitro.
Пример 4.Изучение чистоты и подлинности rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Для оценки чистоты и подлинности, полученных препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1, применяли метод электрофореза в ПААГ. Для этого очищенный препарат вносили в 4-20% полиакриламидном геле (4-20% Mini-PROTEAN TGX Precast Protein Gels,15-well, 15 μl #4561096, Bio-Rad) с использованием красителя для образцов 4xLaemmli Sample Buffer (#161-0747, BioRad) с добавлением 2-Mercaptoethanol(Sigma-Aldrich) для анализа в восстанавливающих условиях. Визуализацию геля проводили при помощи прибора GelDocEZimager (Bio-Rad, США). В результате в препаратах rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 были детектированы белки VP1, VP2 и VP3, значимого количества примесей детектировано не было. Электрофореграмма результатов анализа представлена на фиг. 3.
Из полученных результатов следует, что полученный препарат действительно является аденоассоциированным вирусом, так в нем присутствуют все структурные белки, а именно VP1, VP2, VP3. Молекулярные массы белков полностью совпадают с теоретическими.
Таким образом, в данном примере была подтверждена чистота и подлинность препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Пример 5. Оценка трансдуцирующей способности и экспрессии рекомбинантных антител в составе препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Для оценки трансдуцирующей способности и экспрессии трансгена в составе препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1, очищенным препаратом трансдуцировали культуру клеток HEK293. Для этого на 96-луночный планшет высевали клетки в среде DMEM (4 мМ глутамина, 10% FBS, бикарбонат натрия 3,8 г/л) в объеме 100 мкл с концентрацией 0,5*106 клеток/мл. Спустя 4 часа вносили по 10 мкл препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 после очистки. Спустя 48 часов отбирали культуральную жидкость для дальнейшего анализа. Присутствие рекомбинантных антител P2C5, P5F8 и P2G1 соответственно, оценивали при помощи метода ИФА. Для этого в лунки 96-луночного планшета сорбировали рекомбинантный RBD (100 нг/лунку). Затем планшет отмывали 3-кратно раствором PBS-Ти далее инкубировали 30 мин при комнатной температуре с раствором обезжиренного молока на PBS-T. Далее вносили культуральную жидкость от клеток, трансдуцированных полученными препаратами, в нескольких повторах. Планшет с образцами инкубировали в течении 30 мин при 37°С и далее проводили 3-кратную отмывку. После добавляли раствор вторичных антител 933 NA (GElifescience, США). Планшет с образцами снова инкубировали в течении 30 мин при 37°С и далее проводили 5-ти кратную отмывку. Далее добавляли субстрат ТМВ на 15 мин, после чего реакцию останавливали добавлением раствора 1М соляной кислоты. Оптическую плотность измеряли при 450 нм.
Концентрацию антител p2c5-fc, p5f8-fc и p2g1-fc в культуральной рассчитывали исходя из оптической плотности специфического сигнала испытуемых образцов относительно стандартов (образцы антител p2c5-fc, p5f8-fc и p2g1-fc в заданных концентрациях). Результаты представлены на фиг. 4.
Из полученных результатов следует, что клетки, трансдуцированные препаратами rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1, экспрессируют рекомбинантные антитела P2C5, P5F8 и P2G1, соответственно, специфичные к RBD S белка вируса SARS-CoV-2.
Таким образом, в данном примере была подтверждена экспрессия рекомбинантных антител, специфичных к RBD S белка вируса SARS-CoV-2, в составе препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Пример 6. Изучение протективной активности препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 против летальной дозы вируса SARS-CoV-2.
Протективную активность препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 оценивали на модели инфекции, вызванной вирусом SARS-CoV-2, у АСЕ2-трансгенных мышей. Данные животные были выбраны, так как они высокочувствительны к инфекции SARS-CoV-2. Летальность животных после заражения вирусом SARS-CoV-2 составляет 100%.
В работе использовали вирус SARS-CoV-2 (hCoV-19/Russia/Moscow_PMVL-1/2020), изолированный в 2020 году в ФГБУ «НИЦЭМ им. Н.Ф.Гамалеи» Минздрава России, хранящийся в Государственной коллекции вирусов. Инфекционный титр вируса 107 TCID50/мл и 3,5×107 БОЕ/мл. Животным вводили внутримышечно в заднюю поверхность бедра 2*1011 гк препарата и далее заражали вирусом SARS-CoV-2 интраназально в дозе 105TCID50 на животное, в разные временные интервалы, согласно табл.1.
В течение 21 дня после заражения оценивали выживаемость животных.
На фиг. 5 представлены данные выживаемости животных после заражения. По результатам исследования было показано, что однократное внутримышечное введение препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 за 3, 7 и 14 дней до заражения позволяет защитить животных от инфекции, вызванной вирусом SARS-CoV-2.
Гибель зараженных животных, получивших препараты, отсутствовала, тогда как в контрольной группе, к 8 суткам все животные погибли.
Таким образом, в данном примере было продемонстрировано, что разработанные препараты rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 могут быть использованы для защиты от заболевания, вызванного вирусом SARS-CoV-2.
Пример 7. Изучение протективной активности различных доз препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1.
Протективную дозу препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 оценивали на модели инфекции, вызванной вирусом SARS-CoV-2, у АСЕ2-трансгенных мышей. Данные животные были выбраны, так как они высокочувствительны к инфекции SARS-CoV-2. Летальность животных после заражения вирусом SARS-CoV-2 составляет 100%.
В работе использовали вирус SARS-CoV-2 (hCoV-19/Russia/Moscow_PMVL-1/2020), изолированный в 2020 году в ФГБУ «НИЦЭМ им. Н.Ф.Гамалеи» Минздрава России, хранящийся в Государственной коллекции вирусов. Инфекционный титр вируса 107 TCID 50/мл и 3,5×107 БОЕ/мл. Животным вводили внутримышечно в заднюю поверхность бедра 1010, 1011 и 1012гк препарата и далее заражали вирусом SARS-CoV-2 интраназально в дозе 105 TCID50 на животное, на 3 день после инъекции препаратов, согласно таблице 2.
В течение 21дня после заражения оценивали выживаемость животных.
На фиг. 6 представлены данные выживаемости животных после заражения. По результатам исследования было показано, что однократное внутримышечное введение препаратов rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 в дозах от 1010 до 1012 гк/животное позволяет защитить животных от инфекции, вызванной вирусом SARS-CoV-2.
Гибель зараженных животных, получивших препараты, отсутствовала, тогда, как в контрольной группе животных к 9 суткам все животные погибли.
Таким образом, можно сделать вывод, что разработанные препараты rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 могут быть использованы в концентрациях от 1011до 1013 гк/кг веса.
Пример 8. Способ экстренной профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Эффективность препарата rAAV-P2C5 в режиме экстренной профилактики оценивали также на модели инфекции, вызванной вирусом SARS-CoV-2 (hCoV-19/Russia/Moscow_PMVL-1/2020), у АСЕ2-трансгенных мышей. Животных заражали вирусом SARS-CoV-2 интраназально в дозе 105 TCID50 на животное, за день и в тот же день после введения препарата rAAV-P2C5 в дозе 1011гк/мышь.
В течение 21дня после заражения оценивали выживаемость животных.
На фиг. 7 представлены данные выживаемости животных после заражения. По результатам исследования было показано, что однократное внутримышечное введение препарата rAAV-P2C5 в дозе от 1011 гк/животное позволяет защитить животных от инфекции, вызванной вирусом SARS-CoV-2, в режиме экстренной профилактики.
Таким образом, можно сделать вывод, что разработанные препараты rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 могут быть использованы для экстренной профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Пример 9. Способ профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Эффективность препарата rAAV-P2C5 в режиме профилактики оценивали также на модели инфекции, вызванной вирусом SARS-CoV-2(hCoV-19/Russia/Moscow_PMVL-1/2020), у АСЕ2-трансгенных мышей. Животных заражали вирусом SARS-CoV-2 интраназально в дозе 105 TCID50 на животное, за 28, 60, 90 и 120 день после введения препарата rAAV-P2C5 в дозе 1011 гк/мышь. Схема эксперимента представлена в таблице 4.
В течение 21дня после заражения оценивали выживаемость животных.
На фиг. 8 представлены данные выживаемости и динамики изменения веса животных после заражения. По результатам исследования было показано, что однократное внутримышечное введение препарата rAAV-P2C5 в дозе от 1011 гк/животное позволяет защитить животных от инфекции, вызванной вирусом SARS-CoV-2 как минимум через 120 дней после введения. Все животные в контрольных группах погибали на 7-9 день после инфицирования.
Таким образом, можно сделать вывод, что разработанные препараты rAAV-P2C5, rAAV-P5F8 и rAAV-P2G1 могут быть использованы для профилактики заболеваний, вызванных вирусом SARS-CoV-2.
Промышленная применимость
Все приведенные примеры подтверждают эффективность и промышленную применимость созданных векторов на основе аденоассоциированного вируса человека 2-го серотипа, экспрессирующих рекомбинантные антитела и обладающих защитными свойствами против инфекции, вызванной вирусом SARS-CoV-2.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ID NO:1.
<110> ФГБУ "НИЦЭМ им. Н.Ф.Гамалеи" Минздрава России
<120> Экспрессионный вектор на основе аденоассоциированного вируса,
и способ его применения для экстренной профилактики и
профилактики заболеваний, вызываемых вирусом SARS-CoV-2
(варианты).
<160> 4
<170> BISSAP1.3.6
<210>1
<211> 8
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR1 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P2C5
<400> 1
Gly Tyr Thr Tyr CysSer Tyr Asp
1 5
<210>2
<211> 8
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR2 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P2C5
<400>2
Ile IleArgArg Asp GlySerThr
1 5
<210>3
<211> 15
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR3 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P2C5
<400>3
Lys SerTrp Ala CysSerSerGlyGlu Tyr Leu Tyr GlnGly Asp
1 5 10 15
<210>4
<211>8
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR1 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P5F8
<400>4
Gly AspThr Asp Met ThrAsnSer
1 5
<210>5
<211>8
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR2 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P5F8
<400>5
Cys IleGlyGlyGlyGlySerThr
1 5
<210> 6
<211>14
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR3 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P5f8
<400>6
Ala AlaGlyThrTrp AspThr Tyr Gly Tyr Asp Tyr Asn Tyr
1 5 10
<210>7
<211> 8
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR1 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P2G1
<400>7
Gly Tyr Thr Tyr SerSer Tyr Cys
1 5
<210>8
<211>8
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR2 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P2G1
<400>8
Ala IleGlyArg AspGlyMetThr
1 5
<210>9
<211> 19
<212>PRT
<213>ArtificialSequence
<220>
<223> аминокислотная последовательность CDR2 рекомбинантного
антитела, экспрессируемого в составе препарата rAAV-P2G1
<400>9
Ala AlaAlaGlyGlyAsnTrpTyr Gly Tyr SerLeu Met GluTyr Asp
1 5 10 15
PheGly Tyr
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Экспрессионный вектор на основе аденоассоциированного вируса, несущий гены рекомбинантных антител, и его применение для профилактики заболеваний, вызываемых вирусом гриппа А и вирусом SARS-CoV-2 | 2023 |
|
RU2817792C1 |
| Средство и способ терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 на основе рекомбинантного антитела и гуманизированного моноклонального антитела | 2021 |
|
RU2769223C1 |
| Однодоменное антитело и его модификации, специфически связывающиеся с RBD S белка вируса SARS-CoV-2, и способ их применения для терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 | 2021 |
|
RU2763001C1 |
| Однодоменное антитело ламы Н5 и его производное H5-Fc, специфически связывающие RBD-домен S-белка вируса SARS-CoV-2, обладающие вируснейтрализующей активностью | 2022 |
|
RU2793967C1 |
| Тяжелоцепочечные моноклональные антитела, специфически связывающиеся с S белком вируса SARS-CoV-2, и способ их применения для терапии заболеваний, вызываемых различными вариантами вируса SARS-CoV-2 | 2024 |
|
RU2836313C1 |
| Однодоменные наноантитела против шиповидного белка вируса SARS-CoV-2 | 2021 |
|
RU2794141C2 |
| Гуманизированное моноклональное антитело, специфически связывающиеся с RBD S белка вируса SARS-CoV-2, средство и способ для терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 | 2021 |
|
RU2765731C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |
| РЕКОМБИНАНТНЫЙ ВИРУС ГРИППА, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПРОФИЛАКТИКИ COVID-19 И ГРИППА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2802058C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |


Группа изобретений относится к биотехнологии, иммунологии и микробиологии. Создан экспрессионный вектор на основе рекомбинантного аденоассоциированного вируса, со встроенной генетической конструкцией, экспрессирующий рекомбинантное антитело, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:1, CDR2, представленный аминокислотной последовательностью SEQ ID NO:2, CDR3, представленный аминокислотной последовательностью SEQ ID NO:3, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:4, CDR2, представленный аминокислотной последовательностью SEQ ID NO:5, CDR3, представленный аминокислотной последовательностью SEQ ID NO:6, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:7, CDR2, представленный аминокислотной последовательностью SEQ ID NO:8, CDR3, представленный аминокислотной последовательностью SEQ ID NO:9, а также предложено применение данного вектора для экстренной профилактики и профилактики заболевания, вызванного вирусом SARS-CoV-2. Группа изобретений обеспечивает создание рекомбинантного вирусного вектора, который обеспечивает длительную защиту в отношении вируса SARS-CoV-2. 2 н. и 5 з.п. ф-лы, 8 ил., 4 табл., 9 пр.
1. Экспрессионный вектор на основе рекомбинантного аденоассоциированного вируса, со встроенной генетической конструкцией, экспрессирующий рекомбинантное антитело, имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:1, CDR2, представленный аминокислотной последовательностью SEQ ID NO:2, CDR3, представленный аминокислотной последовательностью SEQ ID NO:3, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:4, CDR2, представленный аминокислотной последовательностью SEQ ID NO:5, CDR3, представленный аминокислотной последовательностью SEQ ID NO:6, либо имеющее CDR1, представленный аминокислотной последовательностью SEQ ID NO:7, CDR2, представленный аминокислотной последовательностью SEQ ID NO:8, CDR3, представленный аминокислотной последовательностью SEQ ID NO:9.
2. Экспрессионный вектор по п.1, отличающийся тем, что представляет собой рекомбинантный аденоассоциированный вирус 2-го серотипа.
3. Экспрессионный вектор по п.1, отличающийся тем, что экспрессируемое в его составе рекомбинантное антитело, представляющее собой однодоменное антитело, слитое с Fc-фрагментом иммуноглобуллина G1 человека.
4. Экспрессионный вектор по п.1, отличающийся тем, что экспрессируемое в его составе рекомбинантное антитело специфично связывает рецептор-связывающий домен (RBD) S белка вируса SARS-CoV-2.
5. Экспрессионный вектор по п.1, отличающийся тем, что его введение млекопитающим в эффективном количестве обеспечивает продолжительную экспрессию в организме рекомбинантного антитела, специфичного к RBD S белка вируса SARS-CoV-2.
6. Экспрессионный вектор, по п.4, отличающийся тем, что его введение млекопитающим в эффективном количестве обеспечивает длительную защиту от заболевания, вызванного вирусом SARS-CoV-2.
7. Применение экспрессионного вектора по пп. 1-6 для экстренной профилактики и профилактики заболевания, вызванного вирусом SARS-CoV-2.
| WO 2021169167 A1, 02.09.2021 | |||
| WO 2022072829 A1, 07.04.2022 | |||
| КОМПОЗИЦИЯ И СПОСОБЫ ВЫСОКОЭФФЕКТИВНОГО ПЕРЕНОСА ГЕНОВ С ПОМОЩЬЮ ВАРИАНТОВ КАПСИДА AAV | 2013 |
|
RU2683497C2 |
| WO 2013158879 A1, 24.10.2013 | |||
| RU 2020122141 А, 04.01.2022 | |||
| WO 2021211416 A1, 21.10.2021 | |||
| ВЕКТОРЫ, СОДЕРЖАЩИЕ СПЕЙСЕРНЫЕ/ФИЛЛЕР ПОЛИНУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2725813C2 |
Авторы
Даты
2022-08-03—Публикация
2022-05-06—Подача