ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к ингибиторам IL–8 для профилактики и/или лечения вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций. Указанные вторичные бактериальные инфекции связаны с предшествующей инфекцией гриппа, сепсисом, тяжелой ишемией или реперфузионным повреждением.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Легкие состоят из огромного множества древовидных разветвлений, которые заканчиваются интенсивно васкуляризованными альвеолами. Поверхность слизистой оболочки легкого невероятно велика (90 м²) и ежедневно подвергается воздействию большого количества частиц и микроорганизмов, включая патогены [Kopf, M., C. Schneider, and S.P. Nobs, The development and function of lung–resident macrophages and dendritic cells. Nat Immunol, 2015. 16(1): p. 36–44]. Поэтому большое количество физических и биологических барьеров, включая врожденную иммунную систему, защищают легкие от возможной инфекции. Провоспалительные цитокины и хемокины вырабатываются резидентными иммунными клетками и эпителиальными клетками легких, способствуя рекрутингу нейтрофилов и возникновению воспаления, что важно для контроля распространения и пролиферации микроорганизмов. Однако неконтролируемый воспалительный ответ, вызванный инфекцией, также может привести к увеличению повреждения легких, заболеваемости и смертности [Garcia, C.C., et al., The development of anti–inflammatory drugs for infectious diseases. Discov Med, 2010. 10(55): p. 479–88].
Вирус гриппа A (IAV) является респираторным патогеном, имеющим большое значение во всем мире, вызывающим от 3 до 5 миллионов тяжелых заболеваний и более 300000 смертей во время эпидемий. Вторичные бактериальные инфекции в значительной степени способствуют увеличению смертности и заболеваемости во время сезонного гриппа, а также пандемий. Подсчитано, что бактериальные коинфекции являются причиной примерно 25% смертей, связанных с гриппом [Gupta, R.K., R. George, and J.S. Nguyen–Van–Tam, Bacterial pneumonia and pandemic influenza planning. Emerg Infect Dis, 2008. 14(8): p. 1187–92].
Среди различных бактерий, связанных с вторичными инфекциями при гриппе, Streptococcus pneumoniae (S. pneumoniae) является одним из наиболее распространенных возбудителей [Short, K.R., et al., Interactions between Streptococcus pneumoniae and influenza virus: a mutually beneficial relationship? Future Microbiol, 2012. 7(5): p. 609–24] и рассматривается как основная причина смертности при сезонном гриппе [McCullers, J.A., Insights into the interaction between influenza virus and pneumococcus. Clin Microbiol Rev, 2006. 19(3): p. 571–82]. Действительно, S. pneumoniae является основной причиной внебольничной пневмонии среди детей и взрослых, особенно тех, кто перед этим болел гриппом. [Madhi, S.A., K.P. Klugman, and G. Vaccine Trialist, A role for Streptococcus pneumoniae in virus–associated pneumonia. Nat Med, 2004. 10(8): p. 811–3]. Несмотря на наличие антибиотиков, частота и летальность вторичных пневмококковых инфекций после гриппа все еще высоки. Действительно, во время IAV и пневмококковой коинфекции лечение антибиотиками вызывает лизис бактерий, чрезмерную стимуляцию иммунной системы и массивный рекрутинг нейтрофилов, события, которые могут привести к интенсивному повреждению тканей и смертности [Karlstrom, A., et al., Toll–like receptor 2 mediates fatal immunopathology in mice during treatment of secondary pneumococcal pneumonia following influenza. J Infect Dis, 2011. 204(9): p. 1358–66].
Нейтрофилы являются основными воспалительными клетками, рекрутируемыми в легкие при IAV и пневмококковых инфекциях [Jose, R., et al., Regulation of neutrophilic inflammation in lung injury induced by community–acquired pneumonia. Lancet, 2015. 385 Suppl 1: p. S52]. Как только микроорганизмы достигают эпителия легких, они распознаются иммунными и неиммунными клетками, что приводит к секреции хемокинов, таких как CXCL8 (CXCL1/CXCL2 у мышей) [Wang, J.P., et al., Toll–like receptor–mediated activation of neutrophils by influenza A virus. Blood, 2008. 112(5): p. 2028–34]. Эти хемокины действуют через свои рецепторы CXCR1 и CXCR2, экспрессируемые в множестве типов клеток, таких как моноциты, CD8+ T–клетки, природные киллеры и нейтрофилы. В нейтрофилах активация CXCR1 и CXCR2 приводит к хемотаксису, секреции ферментных гранул и продуцированию активных форм кислорода [Russo, R.C., et al., The CXCL8/IL–8 chemokine family and its receptors in inflammatory diseases. Expert Rev Clin Immunol, 2014. 10(5): p. 593–619]. Эти события очень важны для контроля пролиферации и распространения вирусов или бактерий, но избыточная активация нейтрофилов может быть вредной для хозяина, так как это может привести к интенсивному повреждению легких. Это справедливо как для IAV, так и для пневмококковых инфекций, поскольку интенсивный приток высокоактивированных нейтрофилов связан с серьезностью заболевания. [Ramos, I. and A. Fernandez–Sesma, Modulating the Innate Immune Response to Influenza A Virus: Potential Therapeutic Use of Anti–Inflammatory Drugs. Front Immunol, 2015. 6: p. 361; Tavares, L.P., et al., Inhibition of PDE4 During Pneumococcal Pneumonia Reduces Inflammation and Lung Injury in Mice. Am J Respir Cell Mol Biol, 2015]. Следовательно, стратегии контроля воспалительного ответа при респираторных инфекциях могли бы уменьшить масштабы заболевания.
Как указано выше, предшествующая инфекция гриппа может увеличить риск последующей бактериальной (другие возбудители заболевания) инфекции. Эта ситуация не является уникальной для гриппа, так как другие виды тяжелых инфекций (например, сепсис) могут вызывать аналогичную ситуацию в экспериментальных системах и способствовать увеличению показателей летальности, наблюдаемых после сепсиса у людей. Другие тяжелые состояния также могут быть связаны с риском вторичной инфекции, включая тяжелую ишемию и реперфузионное повреждение.
Интерлейкин–8 (IL–8; CXCL8) считается основным медиатором рекрутирования PMN (полиморфноядерных нейтрофилов) и вовлечен в некоторые патологии, включая псориаз, ревматоидный артрит, хроническую обструктивную болезнь легких и реперфузионное повреждение в трансплантированном органе (Griffin et al, Arch Dermatol 1988, 124: 216; Fincham et al, J Immunol 1988, 140: 4294; Takematsu et al, Arch Dermatol 1993, 129: 74; Liu et al, 1997, 100:1256; Jeffery, Thorax 1998, 53: 129; Pesci et al, Eur Respir J. 1998, 12: 380; Lafer et al, Br J Pharmacol. 1991, 103: 1153; Romson et al, Circulation 1993, 67: 1016; Welbourn et al, Br J Surg. 1991, 78: 651; Sekido et al, Nature 1993, 365, 654). Биологическая активность IL–8 опосредуется взаимодействием с двумя рецепторами, CXCR1 и CXCR2, принадлежащими к семейству 7TM–GPCR, которые экспрессируются на поверхности PMN человека. В то время как CXCR1 является селективным, связывая с высокой аффинностью только два хемокина, CXCL6 и IL–8, и демонстрируя гораздо более высокую аффинность к IL–8 (Wolf et al., Eur. J. Immunol. 1998, 28: 164), CXCR2 человека является более неизбирательным рецептором, связывающим ряд различных цитокинов и хемокинов. Следовательно, CXCR2 опосредует активность ряда различных биологических молекул.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В связи с бактериальными инфекциями, и как сообщалось выше, авторы настоящего изобретения обнаружили, что в нейтрофилах активация CXCR1 и CXCR2 приводит к хемотаксису, секреции ферментных гранул и продуцированию активных форм кислорода, которые очень важны для контроля пролиферации и распространения бактерий. Ввиду вышесказанного, не было никакой мотивации использовать ингибиторы IL–8 для лечения бактериальных инфекций. Действительно, инфекции, которые вызваны бактериями, лечат антибиотиками.
Авторы настоящего изобретения неожиданно обнаружили, что модуляция воспалительного ответа путем блокирования CXCR1/CXCR2 улучшает исход заболевания без ущерба для иммунного ответа против патогенов во время вторичных инфекций, предпочтительно респираторных инфекций и более предпочтительно пневмококковых инфекций.
Соответственно, первым объектом настоящего изобретения является ингибитор IL–8, выбранный из молекул с малой молекулярной массой, предпочтительно ингибитор CXCR1, более предпочтительно двойной ингибитор CXCR1/CXCR2, для применения в профилактике и/или лечении вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций.
Вторым объектом настоящего изобретения является применение указанного ингибитора IL–8, определенного выше, для получения лекарственного средства для профилактики и/или лечения вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций.
Третьим объектом настоящего изобретения является способ для профилактики и/или лечения вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций, включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества указанного ингибитора IL–8, определенного выше.
Четвертым объектом настоящего изобретения является фармацевтическая композиция для профилактики и/или лечения вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций, включающая ингибитор IL–8 в соответствии с изобретением и фармацевтически приемлемые эксципиенты и/или разбавители.
В соответствии с одним предпочтительным вариантом осуществления, указанные вторичные респираторные инфекции связаны с предшествующей инфекцией гриппа, сепсисом, тяжелой ишемией или реперфузионным повреждением.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
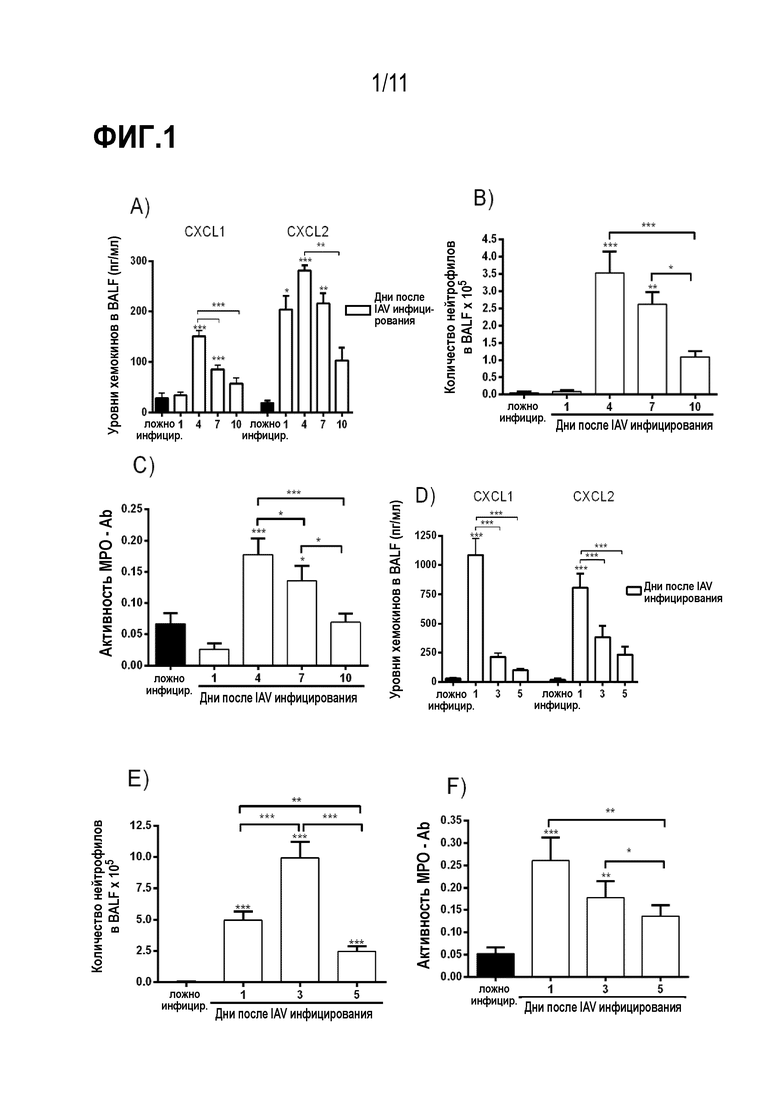
Фиг. 1. Кинетика воспалительных реакций, вызванных IAV–инфекцией. Мышей инфицировали IAV (104 и 106 БОЕ) или закапывали им PBS (имитация заражения) и через 1, 3, 4, 5, 7 и 10 дней после инфицирования умерщвляли. Уровни хемокинов CXCL1 и CXCL2 (A и D), количество нейтрофилов в дыхательных путях (B и E) и легких (C и F) оценивали в разное время после заражения. (n=5–6 мышей на группу). Результаты выражены в виде числа клеток, уровней цитокинов (пг/мл), поглощающей способности или процента от исходной массы тела и показаны как среднее значение ± SEM. *, P < 0,05; **, P < 0,01; ***, P < 0,001, по сравнению с ложно инфицированными мышами или указанными группами.
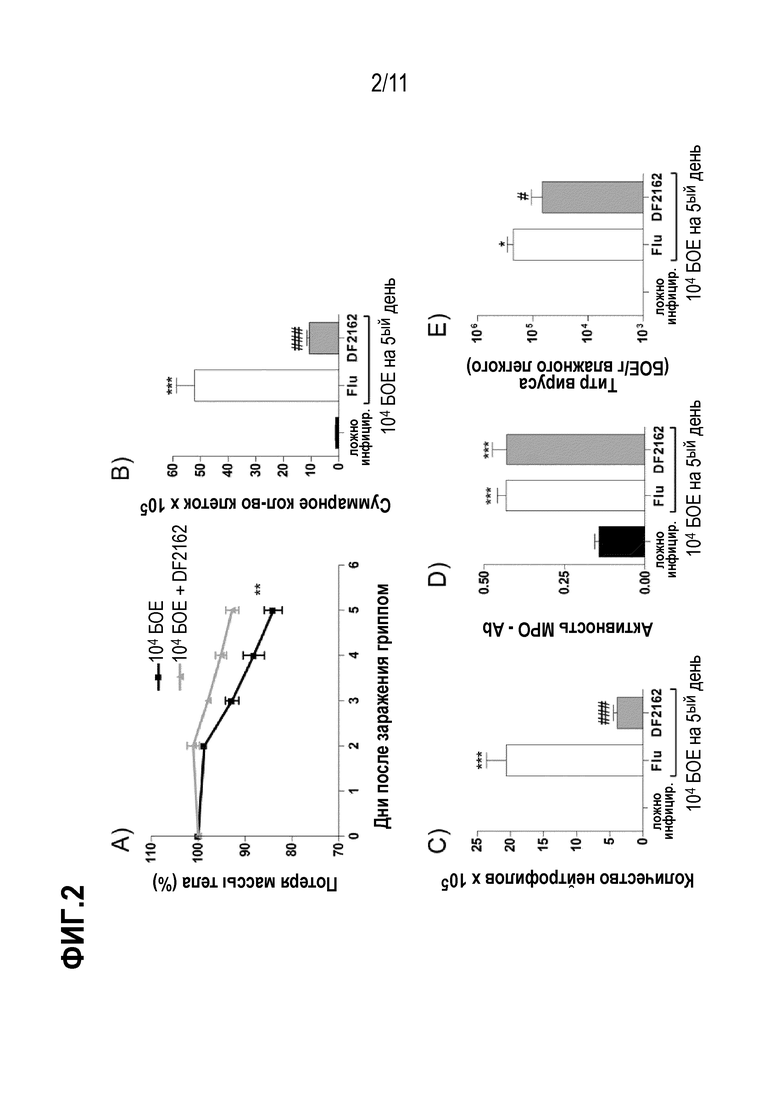
Фиг. 2. Антагонизм CXCR1/CXCR2 уменьшает воспалительные ответы во время IAV инфекции и защищает мышей от заболеваемости. Мышей инфицировали 104 БОЕ IAV и два раза в день в течение первых 5 дней после инфицирования обрабатывали DF2162 (10 мг/кг) или носителем лекарственного средства (CMC 0,1% в PBS). Контрольным животным интраназально закапывали PBS (имитация заражения). Потерю массы (A), количество лейкоцитов (B) и нейтрофилов (C) в дыхательных путях или легких (D) и количество вируса в легких (E) оценивали через 5 дней после инфицирования. (n= 5–6 мышей на группу). Данные представлены как среднее значение ± SEM. * для P < 0,05; ** для P <0,01 и *** для P < 0,001, по сравнению с ложно инфицированными мышами, и # для P < 0,05 и ### для P < 0,001 по сравнению с группой введения носителя (грипп).
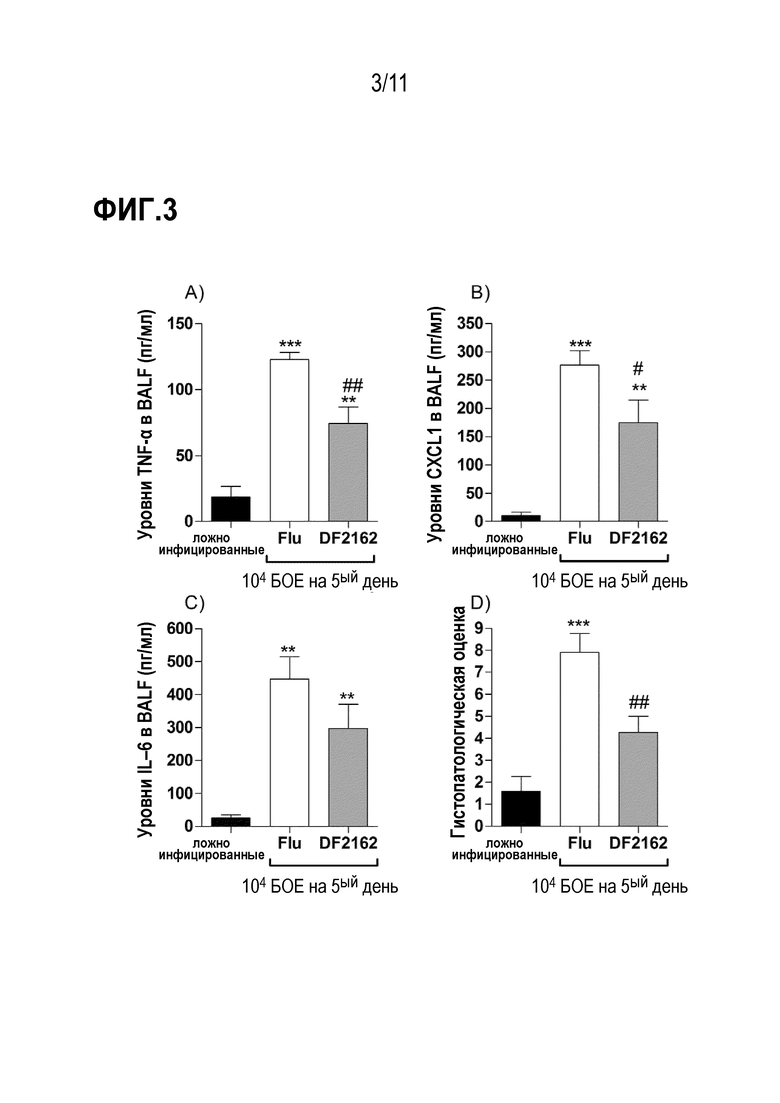
Фиг. 3. Уровни провоспалительных цитокинов и повреждения легких уменьшаются после лечения DF2162. Мышей инфицировали 104 БОЕ IAV и два раза в день в течение первых 5 дней после инфицирования обрабатывали DF2162 (10 мг/кг) или носителем лекарственного средства (CMC 0,1% в PBS). Контрольным животным интраназально закапывали PBS (имитация заражения). Измеряли уровни TNF–α (A), CXCL1 (B) и IL–6 (C) в дыхательных путях мышей. Осуществляли гистологические анализы, и гистопатологическая оценка представлена в (D) – максимально 18 баллов (воспаление дыхательных путей, сосудистое, паренхиматозное воспаление, нейтрофильная инфильтрация и повреждение эпителия). Результаты представлены как среднее значение ± SEM (n=5–6 мышей на группу). ** для P < 0,01 и *** для P < 0,001 по сравнению с ложно инфицированными мышами; # для P < 0,05 и ## для P < 0,01 по сравнению с группой введения носителя.
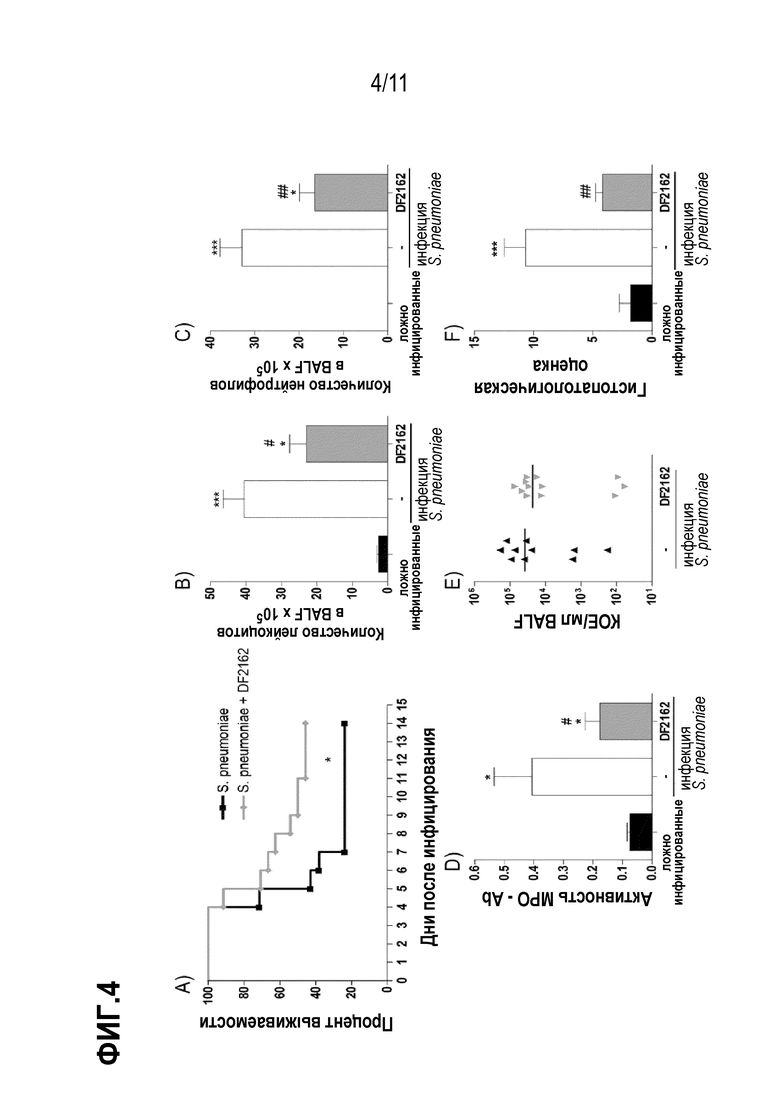
Фиг. 4. Эффекты антагонизма CXCR1/CXCR2 на течение пневмококковой пневмонии у мышей. Мышей инфицировали интраназально (и/н) 104 КОЕ S. pneumoniae или PBS (имитация заражения) и два раза в день в течение первых 2 дней после инфицирования обрабатывали DF2162 (10 мг/кг) или носителем лекарственного средства (CMC 0,1% в PBS). Что касается летальности, мышей отслеживали ежедневно в течение 10 дней (A). Через 48 часов после инфицирования мышей умерщвляли и определяли общее количество лейкоцитов (B) и нейтрофилов в BALF (C) и в легких (D). Также измеряли количество бактерий в BALF (E). График F показывает общую патологическую оценку (максимально 18 баллов). Результаты представлены в виде медианного (E) или среднего значения ± SEM (все остальные графики) по меньшей мере для шести мышей в каждой группе.* для P < 0,05; *** для P< 0,001 по сравнению с ложно инфицированными мышами, и # для P < 0,05 и ## для P < 0,01 по сравнению с группой, получавшей носитель.
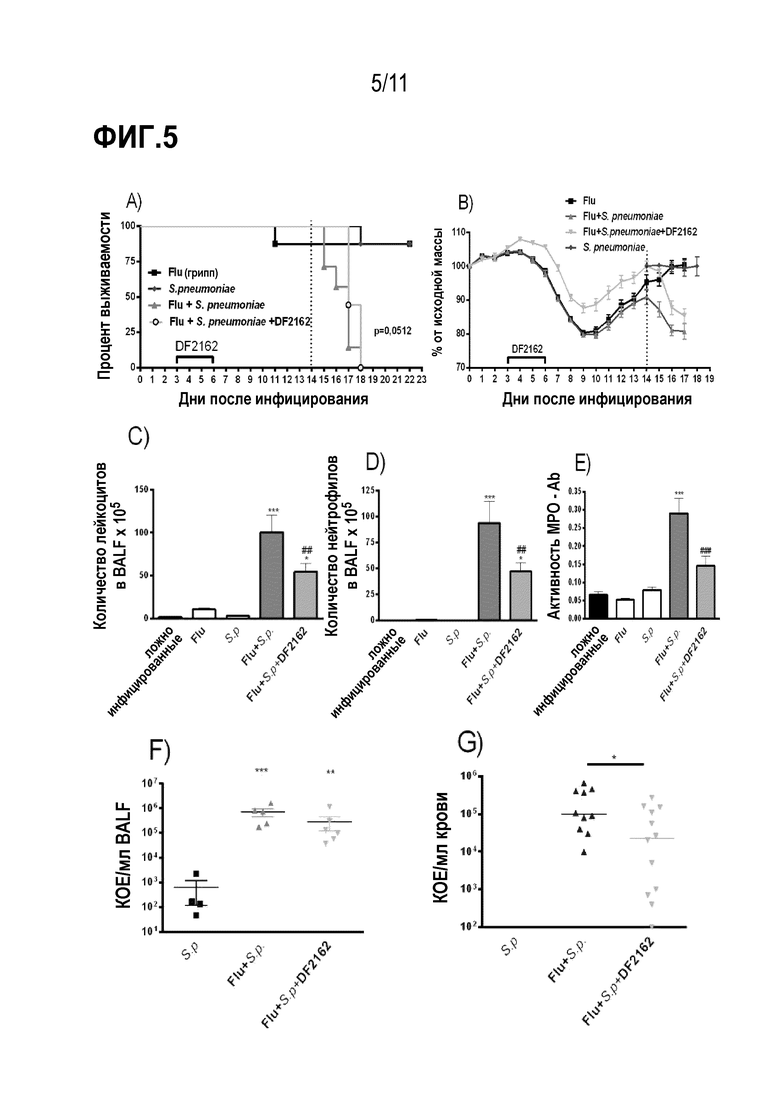
Фиг. 5. Потеря массы тела, рекрутинг нейтрофилов и бактерии в крови вторично инфицированных мышей снижаются после CXCR1/CXCR2 обработки. Мышей инфицировали IAV (5×102 БОЕ, и/н) и через 3, 4, 5 и 6 дней после инфицирования дважды в день обрабатывали DF2162 (10 мг/кг – желудочный зонд) или носителем лекарственного средства. Через 14 дней после IAV–инфицирования мышей вторично инфицировали S. pneumoniae (103 КОЕ, и/н). Также осуществляли заражения только одной инфекцией. Контрольным мышам (имитация заражения) закапывали (и/н) PBS. Отслеживали летальность (A) и потерю массы (B). В другом эксперименте мышей в тех же условиях обработки и инфицирования умерщвляли через 48 часов после вторичного инфицирования. Оценивали общее число лейкоцитов (C) и нейтрофилов (D) в дыхательных путях, нейтрофилов в легких (E – MPO анализ) и бактерий в BALF (F) или в крови (G). Результаты представлены как среднее значение ± SEM. * для P < 0,05; ** для P <0,01 и *** для P < 0,001 по сравнению с ложно инфицированными мышами; ## для P < 0,01 и ### для P < 0,001 по сравнению с группой введения носителя (n= 10 мышей на группу).
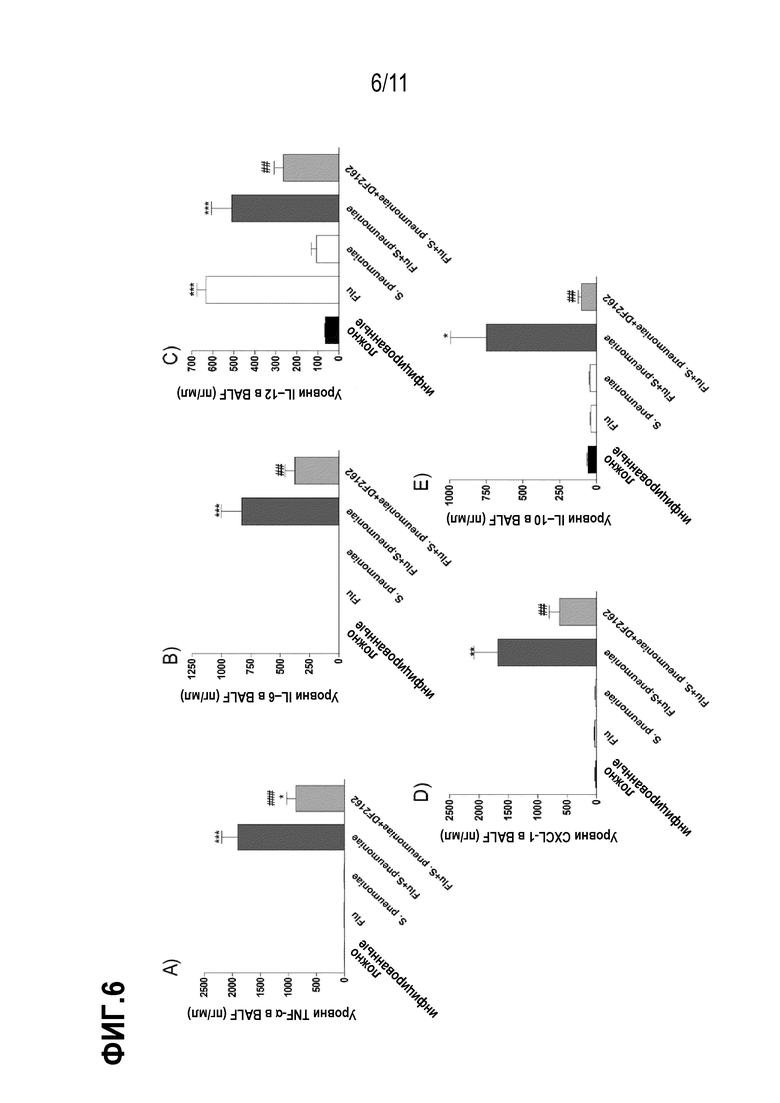
Фиг. 6. Антагонизм CXCR1/CXCR2 во время первичной IAV инфекции снижает уровни цитокинов во время вторичной пневмококковой инфекции. Мышей инфицировали IAV (5×102 БОЕ, и/н) и на 3, 4, 5 и 6 дни после заражения дважды в день обрабатывали DF2162 (10 мг/кг – желудочный зонд) или носителем лекарственного средства. Животные получали лекарственное средство только во время IAV инфекции. Через 14 дней после IAV–инфицирования мышей вторично инфицировали S. pneumoniae (103 КОЕ, и/н). Также осуществляли заражения только одной инфекцией. Контрольным мышам (имитация заражения) закапывали (и/н) PBS. Через 48 часов после инфицирования S. pneumoniae мышей умерщвляли и уровни TNF–α (A), IL–6 (B), IL–12 (C), CXCL–1 (D) и IL–10 (E) измеряли в жидкости бронхоальвеолярного лаважа (BAL). Данные представлены как среднее значение ± SEM. * для P < 0,05; ** для P <0,01 и *** для P <0,001 по сравнению с ложно инфицированными мышами; ## для P < 0,01 и ### для P < 0,001 по сравнению с группой введения носителя (n= 10 мышей на группу).
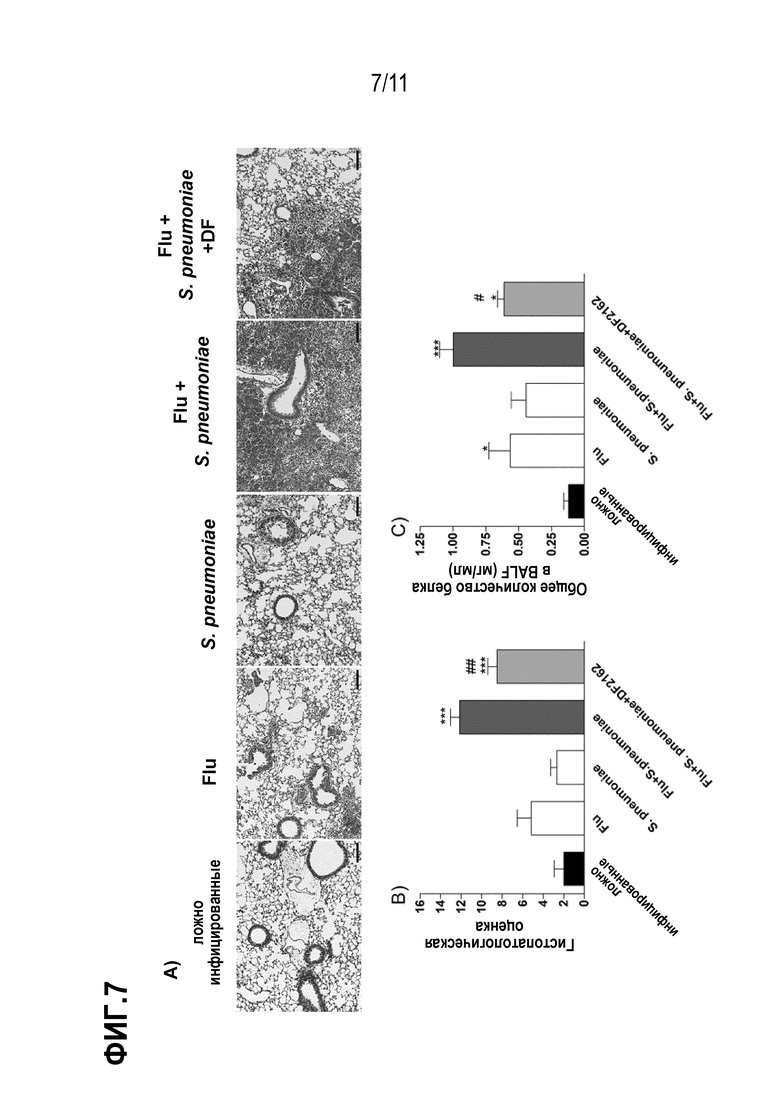
Фиг. 7. Повышенное повреждение легких из–за вторичной пневмококковой инфекции уменьшается после DF2162 лечения. Мышей инфицировали IAV (5×102 БОЕ, и/н) и на 3, 4, 5 и 6 день после инфицирования дважды в день обрабатывали DF2162 (10 мг/кг – желудочный зонд) или носителем лекарственного средства. Животные получали лекарственное средство только во время IAV инфекции. Через 14 дней после IAV–инфицирования мышей вторично инфицировали S. pneumoniae (103 КОЕ, и/н). Также осуществляли заражения только одной инфекцией. Контрольным мышам (имитация заражения) закапывали (и/н) PBS. Через 48 часов после вторичного инфицирования легкие собирали, обрабатывали и осуществляли гистологический анализ. Репрезентативные слайды ложно инфицированных мышей, моноинфицированных мышей (IAV и S. pneumoniae) и вторично инфицированных мышей (обработанные носителем и DF2162) показаны на графике A (столбцы представляют 150 мкм при увеличении 100x). График B показывает общую оценку повреждения легких у инфицированных мышей. BAL жидкость использовали для измерения утечки белка из–за инфекции (C). Данные представлены как среднее значение ± SEM. * для P < 0,05; ** для P <0,01 и *** для P <0,001, по сравнению с ложно инфицированными мышами; # для P < 0,05 и ## для P < 0,01 по сравнению с группой введения носителя (n= 10 мышей на группу).
Фиг. 8. Гистопатологические изменения в легких IAV–инфицированных мышей уменьшаются после лечения DF2162. Мышей инфицировали 104 БОЕ IAV и два раза в день в течение первых 5 дней после инфицирования обрабатывали DF2162 (10мг/кг) или носителем лекарственного средства (CMC 0,1% в PBS). Контрольным животным интраназально закапывали PBS (имитация заражения). Представлены репрезентативные H&E окрашенные слайды легких ложно инфицированных и IAV–инфицированных животных (обработанных носителем и DF) – 100х увеличение.
Фиг. 9. Лечение антагонистом CXCR1/CXCR2 предотвращает гистопатологические изменения в легких у мышей, инфицированных S. pneumoniae. Мышей интраназально инфицировали 104 КОЕ S. pneumoniae или PBS (имитация заражения) и два раза в день в течение первых 2 дней после инфицирования обрабатывали DF2162 (10мг/кг) или носителем лекарственного средства (CMC 0,1% в PBS). Представлены репрезентативные H&E окрашенные слайды легких ложно инфицированных и S. pneumoniae–инфицированных животных (обработанных носителем и DF) – 100х увеличение.
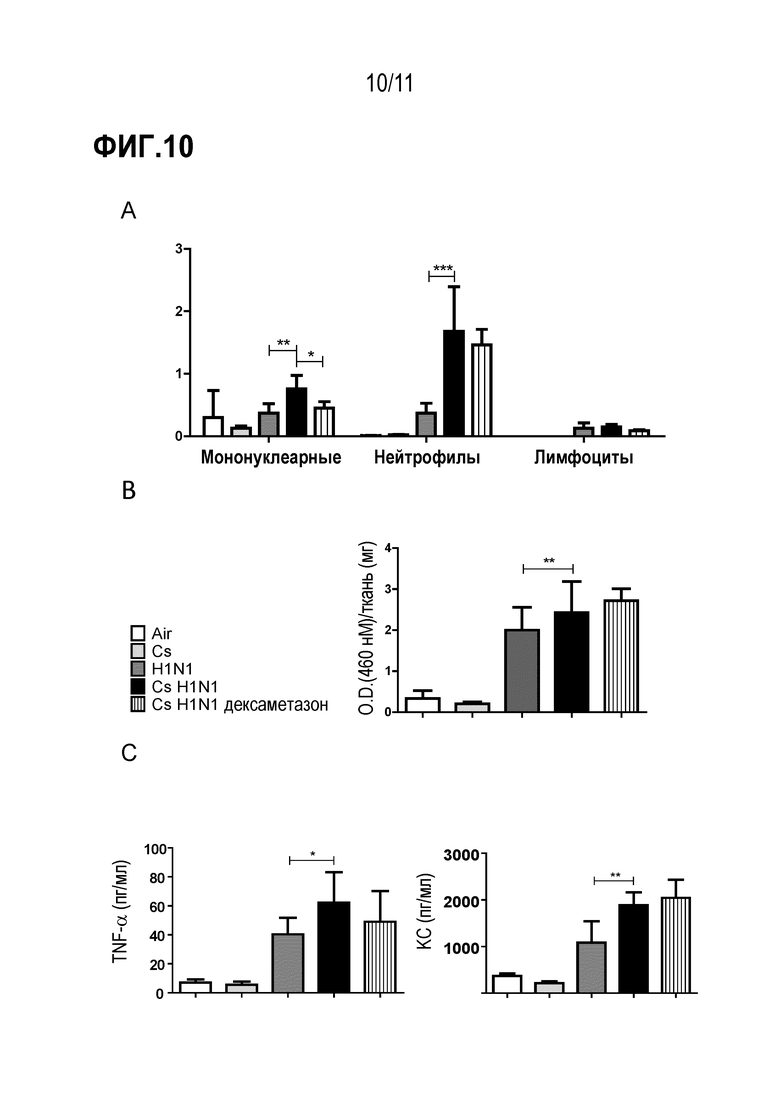
Фиг. 10. Лечение дексаметазоном Cs–H1N1 мышей. (A) концентрация цитокинов в ткани легких, (B) общее число лейкоцитов, полученное из анализов BAL, и (C) активность MPO в ткани легких мышей, подвергшихся воздействию окружающего воздуха (воздух), сигаретного дыма (Cs), инфицированных H1N1 вирусом (H1N1)), инфицированных H1N1 вирусом и подвергшиеся воздействию Cs (Cs H1N1) и Cs H1N1, получавших дексаметазон (1 мг/кг перорально) один раз в день через 48 часов после заражения в течение 4 дней (Cs H1N1 дексаметазон).
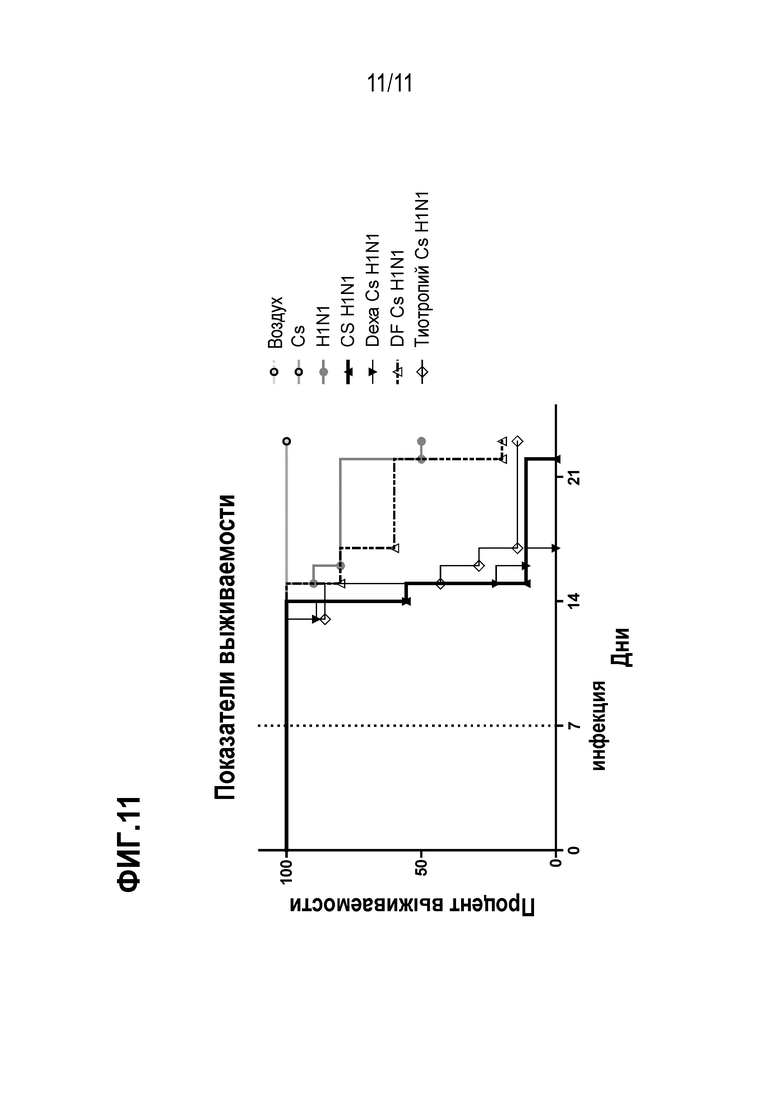
Фиг. 11. Анализ выживаемости мышей Cs–H1N1 при лечении DF2156A, антагонистом CXCR1/CXCR2. Показатели выживаемости мышей, подвергшихся воздействию окружающего воздуха (воздух), сигаретного дыма (Cs), инфицированных H1N1 вирусом (H1N1), инфицированных H1N1 вирусом и подвергающихся воздействию Cs (Cs H1N1), Cs H1N1, получавших дексаметазон (1 мг/кг) один раз в день в течение 7 дней, начиная с дня инфицирования (Cs H1N1 дексаметазон v.o), Cs H1N1, обрабатываемых при помощи DF2156A (10 мг/кг п/о) один раз в день в течение 7 дней, начиная с дня инфицирования, и Cs H1N1, обрабатываемых 3 мл тиотропия (0,3 мг/мл аэрозоль) один раз в день в течение 7 дней, начиная с дня инфицирования.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как будет подробно описано в Экспериментальном разделе, авторы настоящего изобретения обнаружили, что молекулы по настоящему изобретению, действующие как ингибиторы активности IL–8, предпочтительно двойные ингибиторы CXCR1/CXCR2 рецепторов, обладают терапевтической эффективностью в лечении и/или профилактике вторичных бактериальных инфекций.
Следовательно, первым объектом настоящего изобретения является ингибитор IL–8 для применения в лечении и/или профилактике вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций, где ингибитор IL–8 выбран из молекул с малой молекулярной массой.
В соответствии с предпочтительным вариантом осуществления, указанные вторичные бактериальные инфекции связаны с предшествующей инфекцией гриппа, сепсисом, тяжелой ишемией или реперфузионным повреждением.
Термин “ингибитор IL–8”, в соответствии с настоящей заявкой, относится к любому соединению, способному ингибировать, частично или полностью, биологическую активность IL–8. Такое соединение может действовать, уменьшая экспрессию или активность IL–8 или ингибируя запуск внутриклеточной передачи сигналов, активируемой рецепторами IL–8. Предпочтительно, чтобы указанный ингибитор IL–8 был способен ингибировать по меньшей мере 50%, предпочтительно по меньшей мере 60% хемотаксиса, индуцированного IL–8 в PMN, при концентрации, равной или ниже 500 нМ, предпочтительно ниже 100 нМ.
В соответствии с предпочтительным вариантом осуществления, ингибитор IL–8 в соответствии со всеми объектами настоящего изобретения ингибирует активность IL–8, опосредованную рецептором CXCR1 или опосредованную обоими рецепторами CXCR1 и CXCR2.
Предпочтительно, в соответствии с этим вариантом осуществления, указанный ингибитор IL–8 является либо аллостерическим ингибитором, либо ортостерическим антагонистом рецептора CXCR1 или обоих рецепторов CXCR1 и CXCR2.
Предпочтительно, указанный ингибитор IL–8 является селективным в отношении рецептора CXCR1 или одинаково активен в отношении рецепторов CXCR1 и CXCR2. Более предпочтительно, указанный ингибитор IL–8 одинаково активен в отношении рецепторов CXCR1 и CXCR2.
Под “селективным в отношении CXCR1”, в соответствии с настоящим изобретением, подразумевается соединение, которое показывает значение IC50 по меньшей мере на 2, предпочтительно 3, log выше по отношению к CXCR1, чем по отношению к CXCR2. (Bertini R. et al., Proc. Nat. Acad. Sci. USA (2004), 101 (32), pp. 11791–11796).
Под “одинаково активен в отношении CXCR1 и CXCR2” подразумевают соединение, которое показывает значение IC50 в диапазоне 10 пикомоль (10–11M) – 1 микромоль (10–6M) по отношению к CXCR1 и CXCR2. (Bertini R. et al., Br. J. Pharm. (2012), 165, pp. 436–454).
Более предпочтительно, ингибитор IL–8 в соответствии с изобретением имеет значение IC50 по отношению к рецептору CXCR1 в низком наномолярном диапазоне, предпочтительно в диапазоне 0,02–5 наномоль.
В соответствии с настоящим изобретением, также в сочетании с предшествующим вариантом осуществления, указанный ингибитор IL–8 выбран из молекул с малой молекулярной массой.
В соответствии с альтернативным вариантом осуществления, указанный ингибитор IL–8 выбран из антител, предпочтительно антител против рецептора CXCR1/CXCR2.
Ингибиторы IL–8 в соответствии с приведенным выше определением, способные ингибировать активность IL–8, опосредованную рецептором CXCR1 или опосредованную обоими рецепторами CXCR1 и CXCR2, известны в данной области техники.
Предпочтительными ингибиторами IL–8 в соответствии с изобретением являются двойные ингибиторы рецепторов CXCR1/CXCR2, выбранные из производных 1,3–тиазол–2–иламинофенилпропионовой кислоты, производных 2–фенилпропионовой кислоты и их фармацевтически приемлемых солей.
Среди вышеуказанных соединений указанное производное 1,3–тиазол–2–иламинофенилпропионовой кислоты предпочтительно представляет собой соединение формулы (I):
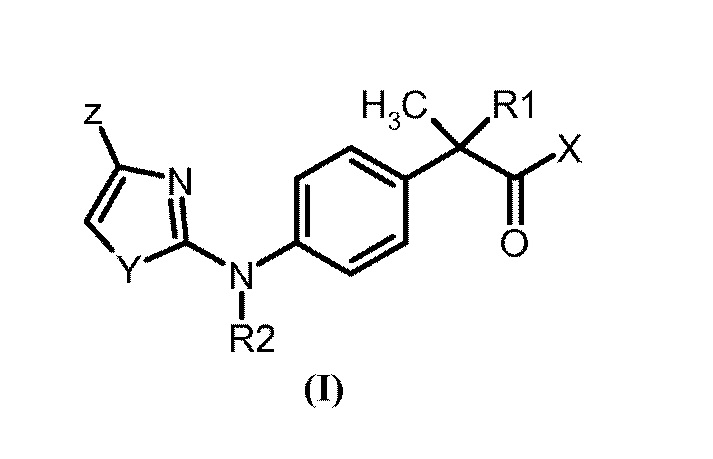
или его фармацевтически приемлемую соль, где
–R1 представляет собой водород или CH3;
–R2 представляет собой водород или линейный C1–C4 алкил, предпочтительно он представляет собой водород;
–Y представляет собой гетероатом, выбранный из S, O и N; предпочтительно он представляет собой S;
–Z выбран из галогена, линейного или разветвленного C1–C4 алкила, C2–C4 алкенила, C2–C4 алкинила, C1–C4 алкокси, гидроксила, карбоксила, C1–C4 ацилокси, фенокси, циано, нитро, амино, C1–C4 ациламино, галоген C1–C3 алкила, галоген C1–C3 алкокси, бензоила, линейного или разветвленного C1–C8 алкансульфоната, линейного или разветвленного C1–C8 алкансульфонамида, линейного или разветвленного C1–C8 алкилсульфонилметила; предпочтительно он представляет собой трифторметил;
–X представляет собой ОН или остаток формулы NHR3; где R3 выбран из:
–водорода, гидроксила, линейного или разветвленного C1––C6 алкила, C3–C6 циклоалкила, C2––C6 алкенила, C1–C5 алкокси или C1–C6 фенилалкила, где алкильная, циклоалкильная или алкенильная группа может быть замещена COOH остатком;
– остатка формулы SO2R4, где R4 представляет собой C1–C2 алкил, C3–C6 циклоалкил, C1–C3 галогеналкил.
Предпочтительно, в вышеуказанных соединениях X представляет собой ОН.
Среди вышеуказанных соединений особенно предпочтительными являются соединения указанной формулы (I) или их фармацевтически приемлемые соли, где:
R1 представляет собой CH3;
R2 представляет собой водород или линейный C1–C4 алкил, предпочтительно он представляет собой водород;
Y представляет собой гетероатом, выбранный из S, O и N; предпочтительно он представляет собой S;
Z выбран из галогена, линейного или разветвленного C1–C4 алкила, C2–C4 алкенила, C2–C4 алкинила, C1–C4 алкокси, гидроксила, карбоксила, C1–C4 ацилокси, фенокси, циано, нитро, амино, C1–C4 ациламино, галоген C1–C3 алкила, галоген C1–C3 алкокси, бензоила, линейного или разветвленного C1–C8 алкансульфоната, линейных или разветвленных C1–C8 алкансульфонамидов, линейного или разветвленного C1–C8 алкилсульфонилметила; предпочтительно он представляет собой трифторметил;
X представляет собой ОН или остаток формулы NHR3; где R3 выбран из:
– водорода, гидроксила, линейного или разветвленного C1–C6 алкила, C3–C6 циклоалкила, C2–C6 алкенила, C1–C5 алкокси или C1–C6 фенилалкила, где алкильная, циклоалкильная или алкенильная группа может быть замещена COOH остатком;
– остатка формулы SO2R4, где R4 представляет собой C1–C2 алкил, C3–C6 циклоалкил, C1–C3 галогеналкил.
Предпочтительно, в этих соединениях X представляет собой ОН.
Среди вышеуказанных соединений особенно предпочтительными также являются соединения указанной формулы (I) или их фармацевтически приемлемые соли, где
R1 представляет собой водород;
R2 представляет собой водород или линейный C1–C4 алкил, предпочтительно он представляет собой водород;
Y представляет собой гетероатом, выбранный из S, O и N; предпочтительно он представляет собой S;
Z выбран из галогена, линейного или разветвленного C1–C4 алкила, C2–C4 алкенила, C2–C4 алкинила, C1–C4 алкокси, гидроксила, карбоксила, C1–C4 ацилокси, фенокси, циано, нитро, амино, C1–C4 ациламино, галоген C1–C3 алкила, галоген C1–C3 алкокси, бензоила, линейного или разветвленного C1–C8 алкансульфоната, линейных или разветвленных C1–C8 алкансульфонамидов, линейного или разветвленного C1–C8 алкилсульфонилметила; предпочтительно, он выбран из трифторметила;
X представляет собой ОН или остаток формулы NHR3; где R3 выбран из
– водорода, гидроксила, линейного или разветвленного C1–C6 алкила, C3–C6 циклоалкила, C2–C6 алкенила, C1–C5 алкокси или C1–C6 фенилалкила, где алкильная, циклоалкильная или алкенильная группа может быть замещена COOH остатком;
– остатка формулы SO2R4, где R4 представляет собой C1–C2 алкил, C3–C6 циклоалкил, C1–C3 галогеналкил.
Более предпочтительно X представляет собой NH2.
Предпочтительно, в вышеуказанных соединениях X представляет собой ОН.
Среди вышеуказанных соединений особенно предпочтительными также являются соединения указанной формулы (I) или их фармацевтически приемлемые соли, где:
R1 представляет собой водород или CH3;
R2 представляет собой водород или линейный C1–C4 алкил, предпочтительно он представляет собой водород;
Y представляет собой гетероатом, выбранный из S, O и N; предпочтительно он представляет собой S;
Z выбран из линейного или разветвленного C1–C4 алкила, линейного или разветвленного C1–C4 алкокси, галоген C1–C3 алкила и галоген C1–C3 алкокси; предпочтительно он выбран из метила, метокси, трифторметокси, трифторметила, более предпочтительно он представляет собой трифторметил;
X представляет собой ОН.
Среди вышеуказанных соединений особенно предпочтительными также являются соединения указанной формулы (I) или их фармацевтически приемлемые соли, где:
R1 представляет собой CH3;
R2 представляет собой водород или линейный C1–C4 алкил, предпочтительно он представляет собой водород.
Y представляет собой гетероатом, выбранный из S, O и N; предпочтительно он представляет собой S.
Z выбран из линейного или разветвленного C1–C4 алкила, линейного или разветвленного C1–C4 алкокси, галоген C1–C3 алкила и галоген C1–C3 алкокси; предпочтительно он выбран из метила, метокси, трифторметокси, трифторметила, более предпочтительно он представляет собой трифторметил.
Среди вышеуказанных соединений особенно предпочтительными также являются соединения указанной формулы (I) или их фармацевтически приемлемые соли, где
R1 представляет собой водород;
X представляет собой ОН;
R2 представляет собой водород или линейный C1–C4 алкил, предпочтительно он представляет собой водород;
Y представляет собой гетероатом, выбранный из S, O и N; предпочтительно он представляет собой S;
Z выбран из линейного или разветвленного C1–C4 алкила, линейного или разветвленного C1–C4 алкокси, галоген C1–C3 алкила и галоген C1–C3 алкокси; предпочтительно он представляет собой трифторметил.
Предпочтительно, во всех вышеуказанных соединениях формулы (I), где R1 представляет собой водород, хиральный атом углерода фенилпропионовой группы находится в S–конфигурации.
Особенно предпочтительными являются соединения формулы (I) в соответствии с изобретением, выбранные из 2–метил–2–(4–{[4–(трифторметил)–1,3–тиазол–2–ил]амино}фенил)пропановой кислоты (в настоящей заявке также обозначенная как DF2726Y) и ее фармацевтически приемлемой соли, предпочтительно ее натриевой соли (в настоящей заявке также указывается как DF2726A) и 2–(4–{[4–(трифторметил)–1,3–тиазол–2–ил]амино}фенил)пропановой кислоты и ее фармацевтически приемлемой соли, предпочтительно (2S)–2–(4–{[4–(трифторметил)–1,3–тиазол–2–ил]амино}фенил)пропановой кислоты (также известной как DF2755Y) и ее натриевой соли, также известной как DF2755A.
Соединения формулы (I) раскрыты в WO2010/031835, в которой также раскрыт способ их синтеза, их активность в качестве ингибиторов IL–8, а также их применение в лечении IL–8–зависимых патологий, таких как транзиторная церебральная ишемия, буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз, гломерулонефрит и повреждения, вызванные ишемией и реперфузией.
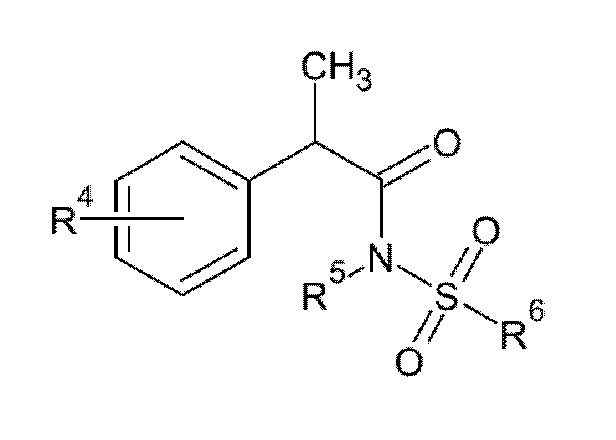
Среди указанных выше ингибиторов IL–8 указанное производное 2–фенил–пропионовой кислоты предпочтительно представляет собой соединение формулы (II):
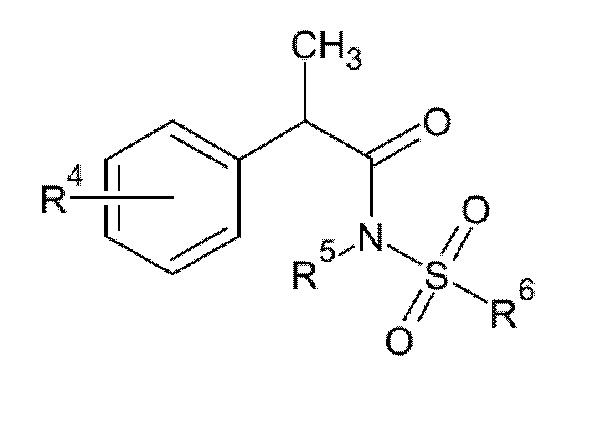
(II)
или его фармацевтически приемлемую соль,
где
R4 представляет собой линейный или разветвленный C1–C6 алкил, бензоил, фенокси, трифторметансульфонилокси; предпочтительно он выбран из бензоила, изобутила и трифторметансульфонилокси.
Также, в соответствии с предпочтительным вариантом осуществления R4 находится в положении 3 или 4 на фенильном кольце, более предпочтительно он представляет собой 3–бензоил, 4–изобутил или 4–трифторметансульфонилокси.
R5 представляет собой H или линейный или разветвленный C1–C3 алкил, предпочтительно он представляет собой H;
R6 представляет собой линейный или разветвленный C1–C6 алкил или трифторметил, предпочтительно, он представляет собой линейный или разветвленный C1–C6 алкил, более предпочтительно он представляет собой CH3.
Среди вышеуказанных соединений предпочтительными являются соединения формулы (II) или их фармацевтически приемлемые соли, где:
R4 представляет собой C1–C6 алкил или бензоил; предпочтительно он находится в положении 3 или 4, более предпочтительно, он представляет собой 3–бензоил или 4–изобутил.
R5 представляет собой H или линейный или разветвленный C1–C3 алкил, предпочтительно он представляет собой H,
R6 представляет собой линейный или разветвленный C1–C6 алкил или трифторметил; предпочтительно он представляет собой линейный или разветвленный C1–C6 алкил, более предпочтительно он представляет собой CH3.
Среди вышеуказанных соединений предпочтительными являются соединения формулы (II) или их фармацевтически приемлемые соли, где:
R4 представляет собой трифторметансульфонилокси, предпочтительно 4–трифторметансульфонилокси,
R5 представляет собой H или линейный или разветвленный C1–C3 алкил, предпочтительно он представляет собой H,
R6 представляет собой линейный или разветвленный C1–C6 алкил или трифторметил; предпочтительно он представляет собой линейный или разветвленный C1–C16 алкил, более предпочтительно он представляет собой CH3.
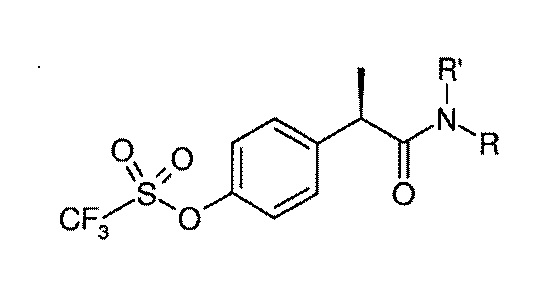
Среди вышеуказанных соединений также предпочтительными являются соединения формулы (III):
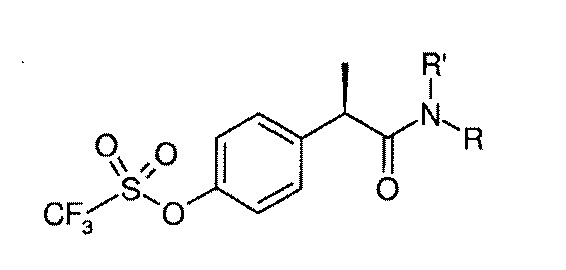
(III)
или их фармацевтически приемлемые соли,
где
R’ представляет собой водород;
R представляет собой H или остаток формулы SO2Ra, где Ra представляет собой линейный или разветвленный C1–C4 алкил или галоген C1–C3 алкил, предпочтительно Ra представляет собой CH3.
Предпочтительно, в вышеуказанном соединении формулы (II) или (III) хиральный атом углерода фенилпропионовой группы находится в R–конфигурации.
Особенно предпочтительные соединения формулы (II) в соответствии с изобретением выбраны из R–(–)–2–(4–изобутилфенил)пропионилметансульфонамида (также известного как Репариксин) и его фармацевтически приемлемых солей. Предпочтительно, указанное соединение представляет собой лизиновую in situ соль R(–)–2–(4–изобутилфенил)пропионилметансульфонамида (в настоящей заявке также указана как DF1681B).
Другими особенно предпочтительными соединениями формулы (II) или (III) в соответствии с изобретением являются 2–(4–трифторметансульфонилокси)фенил]–N–метансульфонилпропионамид и его фармацевтические соли, предпочтительно его натриевая соль, предпочтительно R(–)–2–(4–трифторметансульфонилокси)фенил]–N–метансульфонилпропионамид (также известный как DF2156Y) и его натриевая соль (также известная как Ладариксин или DF2156A).
Еще одним особенно предпочтительным соединением формулы (III) в соответствии с изобретением является R(–)–2–[(4'–трифторметансульфонилокси)фенил]пропионамид (также известный как DF2162).
Ингибиторы IL–8 формулы (II) и (III) раскрыты в WO0024710 и WO2005/090295, которые также раскрывают способ их синтеза, их активность в качестве ингибиторов IL–8, а также их использование в качестве ингибиторов хемотаксиса и дегрануляции нейтрофилов, индуцированных IL–8, и в лечении IL–8–зависимых патологий, таких как псориаз, язвенный колит, меланома, хроническое обструктивное заболевание легких (ХОЗЛ), буллезный пемфигоид, ревматоидный артрит, идиопатический фиброз, гломерулонефрит и повреждения, вызванные ишемией и реперфузией.
Вторым объектом настоящего изобретения является применение ингибитора IL–8, определенного выше, для получения лекарственного средства для лечения и/или профилактики вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, указанное лекарственное средство предназначено для лечения и/или профилактики вторичных бактериальных инфекций, связанных с предшествующей инфекцией гриппа, сепсисом, тяжелой ишемией или реперфузионным повреждением.
Третьим объектом настоящего изобретения является способ лечения и/или профилактики вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций, включающий стадию введения нуждающемуся в этом субъекту терапевтически эффективного количества ингибитора IL–8, определенного выше.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, указанный способ предназначен для лечения и/или профилактики вторичных бактериальных инфекций, связанных с предшествующей инфекцией гриппа, сепсисом, тяжелой ишемией или реперфузионным повреждением.
В контексте настоящей заявки "терапевтически эффективное количество” относится к количеству, достаточному для достижения лечения или профилактики заболевания. Определение эффективных количеств находится в пределах компетенции специалистов в данной области на основании достижения желаемого эффекта. Эффективное количество будет зависеть от факторов, включающих, но не ограничивающихся этим, массу тела субъекта и/или степень заболевания или нежелательного состояния, которым страдает субъект.
Термины “лечение” и “профилактика” в контексте настоящей заявки относятся к ликвидации/облегчению или предотвращению/задержке начала, соответственно, расстройства, которое лечат, или одного или нескольких связанных с ним симптомов, несмотря на тот факт, что пациент все еще может быть поражен первопричинным расстройством.
Четвертым объектом настоящего изобретения является фармацевтическая композиция, включающая ингибитор IL–8, определенный выше, для применения в лечении и/или профилактике вторичных бактериальных инфекций, предпочтительно вторичных респираторных инфекций, более предпочтительно пневмококковых инфекций, в сочетании с фармацевтически приемлемыми эксципиентами и/или разбавителями.
В соответствии с предпочтительным вариантом осуществления, указанные вторичные бактериальные инфекции связаны с предшествующей инфекцией гриппа, сепсисом, тяжелой ишемией или реперфузионным повреждением.
Для целей настоящего изобретения, ингибиторы IL–8 в соответствии с настоящим изобретением сформулированы в фармацевтические композиции, подходящие для применения в пероральной лекарственной форме, такой как таблетки, капсулы, сиропы, предпочтительно в формах с контролируемым высвобождением, или для парентерального введения, предпочтительно в форме стерильных растворов, подходящих для внутривенного или внутримышечного введения. Фармацевтические композиции можно получить в соответствии с общепринятыми способами, например, как описано в Remington, "The Science and Practice of Pharmacy", 21st ed. (Lippincott Williams and Wilkins).
Средняя суточная доза зависит от нескольких факторов, таких как тяжесть заболевания, состояние, возраст, пол и масса тела пациента. Доза будет варьироваться в основном от 1 до 1500 мг соединений формулы (I) в день, необязательно разделенных на несколько приемов.
Изобретение будет дополнительно проиллюстрировано более подробно в следующем экспериментальном разделе.
Экспериментальный раздел
ПРИМЕР 1
Материалы и методы
Мыши
Самцов мышей C57BL/6J (в возрасте от 8 до 12 недель) получали из центрального вивария Федерального Университета Минас–Жерайс (CEBIO UFMG/Бразилия) и содержали при свободном доступе к коммерческому корму и воде. Все описанные процедуры были предварительно одобрены местным комитетом по этике обращения с животными (CETEA/UFMG 13/2010 и 381/2015).
Бактериальные и вирусные штаммы
Streptococcus pneumoniae (ATCC 6303 серотип 3) выращивали в течение 12 часов на планшетах с кровяным агаром при 37°C и 5% CO2 и исходные растворы для инфицирования получали, как описано [Tavares, L.P., et al., Inhibition of PDE4 During Pneumococcal Pneumonia Reduces Inflammation and Lung Injury in Mice. Am J Respir Cell Mol Biol, 2015]. Инокулят всегда подтверждали посевом бактериальной суспензии.
Адаптированный вирус мышиного гриппа A/WSN/33 H1N1– называемый в настоящей заявке IAV– выращивали в культивируемых клетках MDCK (Madin–Darby Canine Kidney), как описано [Garcia, C.C., et al., Platelet–activating factor receptor plays a role in lung injury and death caused by Influenza A in mice. PLoS Pathog, 2010. 6(11): p. e1001171]. Перед заражением исходные растворы размораживали на льду и разбавляли стерильным фосфатно– солевым буферным раствором (PBS).
Мышиные инфекции
Для одиночных инфекций IAV и S.pneumoniae мышей анестезировали 60 мг/кг кетамина и 4мг/кг ксилазина и интраназально закапывали 104 БОЕ IAV или 104 КОЕ Streptococcus pneumoniae. Для модели вторичной пневмококковой инфекции анестезированных мышей инфицировали 500 БОЕ IAV и через 14 дней после заражения вирусом мышей анестезировали изофлуораном и затем инфицировали 103 КОЕ S. pneumoniae. Контрольные мыши получали PBS (ложное заражение).
Протокол лечения
Чтобы оценить влияние антагонизма CXCR1/CXCR2 во время респираторных инфекций, мышам вводили неконкурентный аллостерический антагонист CXCR1/CXCR2, R(–)–2–[(4'–трифторметансульфонилокси)фенил]пропионамид (DF2162) (100 мкл – 10 мг/кг), разведенный в 0,1% карбоксиметилцеллюлозе (CMC), через желудочный зонд. Животные, которых обрабатывали носителем, получали только 100 мкл 0,1% CMC [Russo, R.C., et al., Role of the chemokine receptor CXCR2 in bleomycin–induced pulmonary inflammation and fibrosis. Am J Respir Cell Mol Biol, 2009. 40(4): p. 410–21]. Было показано, что эта доза и схема введения вызывают значительное ингибирование притока нейтрофилов в других моделях и согласуются с длительным периодом полужизни молекулы [Cunha, T.M., et al., Treatment with DF 2162, a non–competitive allosteric inhibitor of CXCR1/2, diminishes neutrophil influx and inflammatory hypernociception in mice. Br J Pharmacol, 2008. 154(2): p. 460–70].
Для одиночной IAV инфекции, инфицированных мышей (104 БОЕ) обрабатывали два раза в день в течение 5 дней со дня заражения. Мышей умерщвляли через 5 дней после заражения для оценки воспаления, титра вируса и повреждения легких. Также оценивали потерю массы.
Для одиночной пневмококковой инфекции, инфицированных мышей (105 КОЕ) обрабатывали через 6 часов после заражения, а затем через 12, 24 и 36 часов. Через 48 часов после заражения мышей умерщвляли для оценки повреждения легких, количества бактерий и воспаления. Для экспериментов на летальность мышей обрабатывали два раза в день в течение 2 дней и отслеживали в течение 10 дней.
Наконец, для экспериментов с вторичной пневмококковой инфекцией мышей инфицировали 500 БОЕ IAV и обрабатывали с 3 по 6 день после заражения (два раза в день). Через 14 дней после IAV инфицирования мышей инфицировали 103 КОЕ S. pneumoniae. Этому сопутствовали случаи летальности и потери массы тела. Мышей умерщвляли через 16 дней после IAV инфекции (2 дня после заражения пневмококком) для анализа повреждения легких, воспаления и количества бактерий в дыхательных путях и крови.
Бронхоальвеолярный лаваж (BAL) и извлечение тканей
В указанные моменты времени мышей умерщвляли летальной дозой кетамина/ксилазина (180 мг/кг и 15 мг/кг, соответственно), собирали кровь для подсчета бактерий и осуществляли бронхоальвеолярный лаваж (BAL). Для этого трахеи мышей обнажали, вставляли 1,7 мм катетер и две аликвоты по 1 мл PBS трижды пропускали в бронхоальвеолярное пространство для выделения лейкоцитов и бактерий в дыхательных путях мышей [Garcia, C.C., et al., Platelet–activating factor receptor plays a role in lung injury and death caused by Influenza A in mice. PLoS Pathog, 2010. 6(11): p. e1001171]. 100 мкл 100 мкл BAL–жидкости высевали в кровяной агар для подсчета бактерий. После центрифугирования клеточный осадок использовали для общего и дифференциального подсчета клеток. Супернатанты BAL использовали для измерений количества цитокинов (IL–12p40, IL–10, TNF–α, IL–6, CXCL1 и CXCL2) методом ELISA в соответствии с инструкциямми изготовителя (R&D Systems, USA) и количественного определения общего белка с использованием анализа Брэдфорд (Biorad). Правое легкое мышей собирали для непрямого количественного определения рекрутирования нейтрофилов в ткань (анализ миелопероксидазы – MPO) и титров вируса. Левую долю легких фиксировали в формалине для дальнейшего гистологического исследования.
Анализ миелопероксидазы в легких
Пятьдесят мг ткани легкого гомогенизировали в забуференном растворе, содержащем антипротеазы, как описано ранее [Russo, R.C., et al., Role of the chemokine receptor CXCR2 in bleomycin–induced pulmonary inflammation and fibrosis. Am J Respir Cell Mol Biol, 2009. 40(4): p. 410–21]. Уровни MPO оценивали с использованием 25 мкл супернатанта гомогенизированного образца и 25 мкл раствора 1,6 мМ 3,39–5,59–тетраметилбензидина (TMB; Sigma – растворенный в диметилсульфоксиде) и 0,01 мМ H2O2, растворенного в фосфатном буфере (pH 5,4), содержащем HTAB [Russo, R.C., et al., Role of the chemokine receptor CXCR2 in bleomycin–induced pulmonary inflammation and fibrosis. Am J Respir Cell Mol Biol, 2009. 40(4): p. 410–21].
Количественный анализ вируса – анализ бляшкообразования
Для определения титра вируса легкие, собранные в стерильных условиях, взвешивали и гомогенизировали в стерильном холодном PBS. Серийные разведения образцов инкубировали в монослоях клеток MDCK в течение 1 часа, покрывали агарозой на 72 часа, как описано ранее [Garcia, C.C., et al., Platelet–activating factor receptor plays a role in lung injury and death caused by Influenza A in mice. PLoS Pathog, 2010. 6(11): p. e1001171]. Количество бляшкообразующих единиц выражали на грамм легкого.
Гистологические анализы
Для оценки повреждения легких после IAV и пневмококковых инфекций фиксированные левые доли легких постепенно дегидратировали в этаноле и погружали в парафин. Срезы 4 мм вырезали и окрашивали H&E для исследования под оптическим микроскопом. Гистопатологическую оценку осуществлял специалист по лабораторной диагностике, не осведомленный об экспериментальных группах, и он оценивал воспаление дыхательных путей, сосудов и паренхимы, а также общее нейтрофильное воспаление по 5–балльной шкале, в сумме 18 баллов [Garcia, C.C., et al., Platelet–activating factor receptor plays a role in lung injury and death caused by Influenza A in mice. PLoS Pathog, 2010. 6(11): p. e1001171].
Статистические анализы
Статистика и графики были выполнены с использованием GraphPad Prism 4.0. Однофакторный дисперсионный анализ (ANOVA), затем апостериорный тест Ньюмена–Кейлса использовали для сравнения более чем двух групп, а непарный t–критерий Стьюдента использовали для сравнения между двумя группами. Кривые выживания анализировали при помощи логарифмического рангового критерия и кривые потери массы сравнивали с использованием анализа площади под кривой. Результаты с р<0,05 считались статистически значимыми.
Результаты
IAV инфекция повышает уровни CXCL1 и CXCL2 и увеличивает приток нейтрофилов в дыхательные пути и легкие мышей
Для исследования инфильтрации нейтрофилов и уровней хемокинов CXCL1 и CXCL2 после летальной и тяжелой инфекции IAV, мышей инфицировали 104 (тяжелый инокулят) или 106 БОЕ (летальный инокулят) вируса. Через 1, 4, 7 и 10 дней для более слабого инокулята и через 1, 3 и 5 дней для более сильного инокулята собирали BAL и легкие. Уровни обоих хемокинов в дыхательных путях достигли пика через 4 дня после инфицирования 104 БОЕ IAV и затем снижались (Фиг. 1A). Заражение летальным инокулятом приводило к более быстрой и более высокой продукции хемокинов в дыхательных путях мышей (Фиг. 1D). Повышенная продукция CXCL1 и CXCL2 коррелировала с массивным притоком нейтрофилов в дыхательные пути и легкие мышей, и это было инокулят–зависимым (Фиг. 1B–C и E–F).
Антагонизм CXCR1/CXCR2 защищает мышей во время IAV инфекции
Для исследования роли CXCR1/2 в отношении инфекции гриппа в терапевтическом плане, мышей инфицировали 104 БОЕ IAV и затем дважды в день (с дня 0 по день 5 после заражения) обрабатывали DF2162 при дозе, которая эффективно снижала количество нейтрофилов в легких мышей [Russo, R.C., et al., Role of the chemokine receptor CXCR2 in bleomycin–induced pulmonary inflammation and fibrosis. Am J Respir Cell Mol Biol, 2009. 40(4): p.410–21]. Обработка DF2162 снижала заболеваемость, что видно по уменьшению потери массы тела (Фиг. 2A). Медикаментозное лечение также снижало некоторые параметры воспалительного ответа, в том числе количество лейкоцитов, рекрутированных в дыхательные пути (Фиг. 2B), особенно нейтрофилов (Фиг. 2C), и уровни про–воспалительных цитокинов TNF–α и CXCL1 (Фиг. 3A–B). Обработка при помощи DF2162 не снижала уровни MPO в легких инфицированных мышей (Фиг. 2D) или уровни IL–6 (Фиг. 3C). Удивительно, что вирусные нагрузки в легких обработанных мышей уменьшались по сравнению с обработанными носителем животными (Фиг. 2F). Кроме того, обработка DF2162 уменьшала повреждение легких, связанное с IAV инфекцией (Фиг. 3D). Гистологический анализ показал более сохраненные участки легкого с уменьшенным бронхиальным и сосудистым воспалением в легких обработанных животных (Фиг. 8).
Антагонизм CXCR1/CXCR2 защищает мышей во время S. pneumoniae инфекции
Известно, что нейтрофилы имеют решающее значение для контроля репликации и распространения бактерий, но также коррелируют с повреждением легких и смертностью при пневмококковой пневмонии [Tavares, L.P., et al., Inhibition of PDE4 During Pneumococcal Pneumonia Reduces Inflammation and Lung Injury in Mice. Am J Respir Cell Mol Biol, 2015]. Поэтому мышей обрабатывали DF2162 начиная с дня 0–6 часов после заражения – до дня 2, и наблюдали показатели летальности и параметры воспаления. Обработка DF2162 в контексте пневмококковой инфекции защищала мышей от летальности (Фиг. 4A), и это было связано с уменьшением количества лейкоцитов (Фиг. 4B), особенно нейтрофилов (Фиг. 4C), рекрутированных в дыхательные пути инфицированных мышей. Удивительно, что, несмотря на уменьшение нейтрофилов в дыхательных путях и легких (Фиг. 4D) инфицированных обработанных мышей, DF2162 не модифицировал способность хозяина контролировать инфекцию, как видно по одинаковому количеству бактерий в дыхательных путях мышей (Фиг. 4E). Кроме того, гистологический анализ легких инфицированных мышей показал, что обработка при помощи DF2162 уменьшала повреждение легких в результате инфекции (Фиг. 4F и Фиг. 9).
Антагонизм CXCR1/CXCR2 защищает от пневмококковой инфекции после IAV инфекции
Вторичная бактериальная пневмония, в основном вызываемая Streptococcus pneumoniae, является важным фактором, способствующим худшему прогнозу у пациентов, инфицированных IAV, что приводит к увеличению смертности и заболеваемости [Klein, E.Y., et al., The Frequency of Influenza and Bacterial Co–infection: A Systematic Review and Meta–Analysis. Influenza Other Respir Viruses, 2016]. Во время пандемии гриппа, такой как была в 2009 году, значительный процент смертельных случаев был из–за вторичных пневмококковых инфекций, несмотря на использование антибиотиков [Palacios, G., et al., Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza. PLoS One, 2009. 4(12): p. e8540; Jain, S., et al., Hospitalized patients with 2009 H1N1 influenza in the United States, April–June 2009. N Engl J Med, 2009. 361(20): p. 1935–44; Dominguez–Cherit, G., et al., Critically Ill patients with 2009 influenza A(H1N1) in Mexico. JAMA, 2009. 302(17): p. 1880–7]. Усиленный воспалительный ответ, вызванный вторичной бактериальной инфекцией, является одной из причин этой повышенной смертности.
Для того, чтобы исследовать роль CXCR1/2 в отношении вторичных бактериальных инфекций, мышей инфицировали сублетальным инокулятом IAV (500 БОЕ) и обрабатывали DF2162 или носителем в дни 3–6 после инфицирования. Через 14 дней после IAV–инфицирования никакого вируса не было обнаружено в легких инфицированных мышей (данные не показаны). Затем мыши получали вторичную инфекцию с сублетальной дозой S. pneumoniae (103 КОЕ, вторичная инфекция). Контрольные мыши получали одиночную инфекцию либо IAV, либо S. pneumoniae. Обе одиночные инфекции приводили к легкому заболеванию с низким уровнем летальности и небольшой потерей массы тела (Фиг. 5A–B). Через 16 дней после заражения одиночной IAV инфекцией или через 2 дня после заражения низким инокулятом пневмококка не было увеличения количества нейтрофилов в дыхательных путях или легких мышей (Фиг. 5D–E). Кроме того, в дыхательных путях можно было обнаружить только небольшое количество бактерий, а в крови мышей, зараженных только S. pneumoniae, не было обнаружено никаких бактерий (Фиг. 5F–G). Напротив, пневмококковая инфекция после IAV инфекции приводила к массовому притоку нейтрофилов в дыхательные пути и легкие мышей (Фиг. 5C–E), чрезмерному росту бактерий в дыхательных путях (Фиг. 5F) и их распространению в кровь (Фиг. 5G). Это приводило к 100% смертности у вторично инфицированных мышей (Фиг. 5A).
Введение DF2162 во время инфекции гриппа показало, что антагонизм CXCR1/2 замедляет смертность после вторичной инфекции (Фиг. 5A) и снижает потерю массы тела (Фиг. 5B). Это было связано со снижением рекрутинга нейтрофилов в дыхательные пути (Фиг. 5D) и легкие (Фиг. 5E) после вторичной инфекции. Как сообщалось выше, несмотря на уменьшение количества нейтрофилов, авторы настоящего изобретения наблюдали, что количество бактерий в дыхательных путях мышей не изменялось (Фиг. 5F). Удивительно, но произошло снижение количества бактерий в крови вторично инфицированных мышей (Фиг. 5G). Кроме того, лечение DF2162 предотвращало повышение уровней про–воспалительных цитокинов IL–6, TNF–α, CXCL–1 и IL–12, которые возникали во время вторичной инфекции (Фиг. 6A–D). Удивительно, но уровни IL–12 оставались более высокими после 16 дней одиночной инфекции IAV (Фиг. 6C). Уровни противовоспалительного цитокина IL–10 также снижались у DF2162–обработанных мышей по сравнению с вторично инфицированными мышами, обработанными носителем (Фиг. 6E).
В общей сложности, уменьшение притока нейтрофилов и продукции цитокинов у мышей, обработанных DF2162, приводило к снижению интенсивного повреждения легких, связанного с вторичной инфекцией (Фиг. 7A–B). Одиночные инфекции IAV или S.pneumoniae, вызванная сублетальным инокулятом, вызывали легкое воспаление дыхательных путей, сосудов и паренхимы, характеризующиеся дискретным инфильтратом лейкоцитов. Напротив, вторичная пневмококковая инфекция вызывала массовую миграцию полиморфных и мононуклеарных клеток в дыхательные пути со значительной потерей архитектуры паренхимы. Легкие некоторых мышей демонстрировали некоторые участки некроза и фиброзной ткани. Лечение при помощи DF2162 уменьшало такое гистопатологическое повреждение легких (Фиг. 7C). Для подтверждения этих результатов, уровни белка в BAL жидкости использовали в качестве маркера утечки из плазмы и, таким образом, разрушения эпителиального барьера легкого или повреждения ткани [Garcia, C.C., et al., Platelet–activating factor receptor plays a role in lung injury and death caused by Influenza A in mice. PLoS Pathog, 2010. 6(11): p. e1001171]. Оценка утечки белка показала, что через 16 дней после IAV инфицирования у инфицированных мышей все еще наблюдается повышение уровня белка в BALF. Вторичная, но не первичная, пневмококковая инфекция приводит к поразительной утечке белка, и, в соответствии с гистологическими результатами, DF обработка снижает уровни белка в BALF (Фиг. 7C).
Авторы настоящего изобретения наблюдали, что лечение при помощи DF2162 снижало рекрутирование нейтрофилов, а также заболеваемость и смертность, связанные как с IAV, так и с S.pneumoniae инфекциями. Соединение по изобретению также предотвращало повреждение легких и смерть, связанные с последующими инфекциями IAV и S.pneumoniae. Несмотря на уменьшение воспаления, лечение при помощи DF2162 не снижало способность контролировать инфекцию.
ПРИМЕР 2
Влияние пути CXCR1/2 в модели обострения воспаления легких при сочетании вирусной инфекции (грипп A) и воздействия сигаретного дыма у мышей
Хроническое обструктивное заболевание легких (ХОЗЛ) является проблемой здравоохранения, имеющей глобальное значение и растущую распространенность, на долю которого приходится примерно 5% всех случаев смертей во всем мире. Заболевание характеризуется постоянным ограничением воздушного потока, которое обычно прогрессирует и связано с усиленным хроническим воспалительным ответом в дыхательных путях легких на вредные частицы или газы (Sethi, S. et al. Am. J. Med. 125, 1162 –1170; 2012). Курение является основным фактором риска, и надлежащей терапии не существует.
Повышенное присутствие нейтрофилов в легочной ткани является отличительным признаком у пациентов с ХОЗЛ, часто сопровождающимся сверхпродукцией воспалительных цитокинов, таких как TNF–α, IL–6 и IL–8 и других. Хотя нейтрофилы, несомненно, являются основными эффекторами острого воспаления, некоторые данные свидетельствуют о том, что они также могут способствовать развитию хронических воспалительных состояний (Kolaczkowska, E. & Kubes, Nat. Rev. Immunol. 13, 159 –75; 2013). Основные клинические проявления ХОЗЛ включают хронический бронхит, ограничение воздушного потока и эмфизему, и часто пациенты с ХОЗЛ испытывают обострения этих симптомов, которые резко увеличивают заболеваемость и смертность (Rabe KF et al. Am. J. Respir. Crit. Care Med. 532 –555; 2007; Jeffery, P. Chest Filley Lec, 251S –260S; 2000).
Во время этих обострений количество нейтрофилов в легочной ткани значительно увеличивается, параллельно повышению уровня матриксных металлопротеиназ и активных форм кислорода (ROS), усиливающих ремоделирование легочной ткани (Oostwoud, L. C. et al. Nat. Publ. Gr. 1 –16, 2016). Примечательно, что, несмотря на важность воспаления в патофизиологии ХОЗЛ, лечение глюкокортикоидами не позволяет избежать прогрессирования заболевания или предотвратить его обострения. Следовательно, крайне необходимы новые безопасные и эффективные методы лечения пациентов с ХОЗЛ (Barnes, P. Nat Rev Drug Discov 1, 437 –446; 2002; Garnock–Jones, K. P. Drugs 75, 1645 –1656; 2015).
Вирусные инфекции являются одними из основных причин обострения ХОЗЛ (Mackay, A. J. & Hurst, J. R. Immunol Allergy Clin North Am 33, 95 –115; 2013). По этой причине авторы изобретения объединили заражение мышей гриппом и воздействие на них сигаретного дыма (Cs), чтобы смоделировать обострение ХОЗЛ. Авторы изобретения по существу подвергали самок мышей C57BL/6 воздействию Cs в течение 12 дней и инфицировали их 1000 БОЕ вируса гриппа H1N1 на 7–й день после начала ежедневного воздействия Cs (Cs–H1N1). Анализы легочной ткани и бронхоальвеолярного лаважа (BAL) на 5–й день после заражения показали, что комбинация вирусной инфекции и Cs синергично увеличивала инфильтрацию нейтрофилов в BAL и MPO активность в легочной ткани по сравнению с только вирусной инфекцией (H1N1) или Cs (Cs) (Фиг. 10 A–B). Это также значительно повышало уровни провоспалительных хемокинов и цитокинов, таких как KC и TNF–α, по сравнению с CS или H1N1 инфекцией в отдельности (Фиг. 10 C).
Анализ выживаемости с использованием LD50 вируса гриппа показал, что в сочетании с Cs смертность мышей достигает 80–100% (Фиг. 11).
Лечение дексаметазоном (1 мг/кг п/о) в этой модели уменьшало инфильтрацию мононуклеарных клеток в BAL, но не могло изменить повышенную инфильтрацию нейтрофилов или повышенный уровень смертности (Фиг. 10 и 11). Поскольку эти данные свидетельствуют о том, что нейтрофилы могут быть основными причинами обострения воспаления и увеличения смертности в этой модели, авторы изобретения осуществили еще один анализ выживаемости, обрабатывая Cs–H1N1 мышей DF2156A, антагонистом CXCR1/2, в дозе 10 мг/кг п/о один раз в день в течение 7 дней, начиная со дня заражения. Лечение при помощи DF2156A в соответствии с настоящим изобретением значительно задерживало смертность мышей (p <0,0021), которая также была слегка снижена. В отличие от этого, лечение дексаметазоном или тиотропием не показало никакой существенной разницы с группой Cs–H1N1 мышей.


Настоящее изобретение относится к области медицины и раскрывает применение ингибитора IL–8 для профилактики и/или лечения вторичных бактериальных респираторных инфекций, связанных с предшествующей инфекцией гриппа, где ингибитор IL–8 представляет собой молекулы с малой молекулярной массой, которые ингибируют активность IL–8, опосредованную рецептором CXCR1 или обоими рецепторами CXCR1 и CXCR2, и представляют собой соединение формулы (II) или фармацевтически приемлемую соль такого соединения, где: R4 представляет собой линейный или разветвленный C1–C6 алкил, бензоил, фенокси, трифторметансульфонилокси; R5 представляет собой H или линейный или разветвленный C1–C3 алкил; R6 представляет собой линейный или разветвленный C1–C6 алкил или трифторметил; или соединение формулы (III) или фармацевтически приемлемую соль такого соединения, где R' представляет собой водород; R представляет собой H или остаток формулы SO2Ra, где Ra представляет собой линейный или разветвленный C1–C4 алкил или галоген C1–C3 алкил. Техническим результатом настоящего изобретения является эффективность ингибитора IL–8 для профилактики и/или лечения вторичных бактериальных респираторных инфекций, связанных с предшествующей инфекцией гриппа. 6 з.п. ф-лы, 11 ил., 2 пр.
 (II)
(II)
 (III)
(III)
1. Применение ингибитора IL–8 для профилактики и/или лечения вторичных бактериальных респираторных инфекций, связанных с предшествующей инфекцией гриппа, где ингибитор IL–8 представляет собой молекулы с малой молекулярной массой, которые ингибируют активность IL–8, опосредованную рецептором CXCR1 или обоими рецепторами CXCR1 и CXCR2, и представляют собой соединение формулы (II)
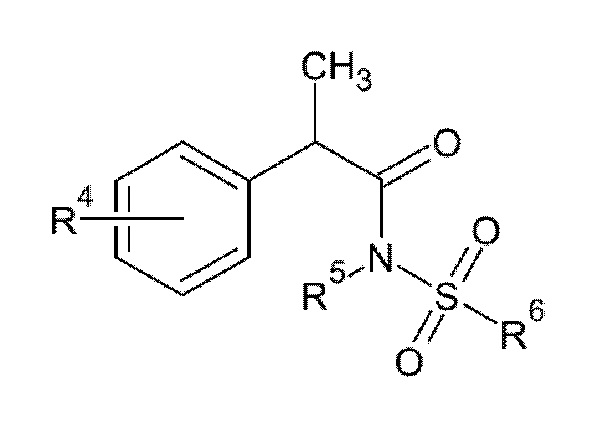
(II)
или фармацевтически приемлемую соль такого соединения,
где:
R4 представляет собой линейный или разветвленный C1–C6 алкил, бензоил, фенокси, трифторметансульфонилокси;
R5 представляет собой H или линейный или разветвленный C1–C3 алкил;
R6 представляет собой линейный или разветвленный C1–C6 алкил или трифторметил;
или соединение формулы (III)
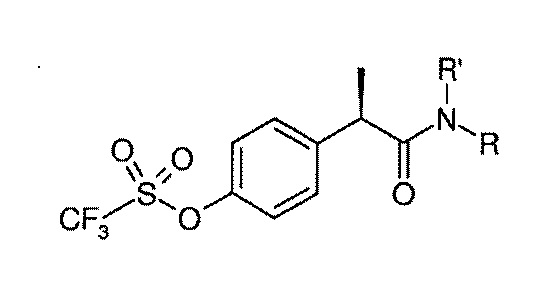
(III)
или фармацевтически приемлемую соль такого соединения,
где
R' представляет собой водород;
R представляет собой H или остаток формулы SO2Ra, где Ra представляет собой линейный или разветвленный C1–C4 алкил или галоген C1–C3 алкил.
2. Применение ингибитора IL-8 по п.1, где указанная вторичная бактериальная респираторная инфекция представляет собой вторичную пневмококковую инфекцию.
3. Применение ингибитора IL-8 по п.1 или 2, где ингибитор IL–8 представляет собой соединение формулы (II), в котором R4 выбран из бензоила, изобутила и трифторметансульфонилокси, предпочтительно R4 представляет собой 3–бензоил, 4–изобутил или 4–трифторметансульфонилокси; R5 представляет собой H; и R6 представляет собой линейный или разветвленный C1–C6 алкил, предпочтительно R6 представляет собой CH3; или
соединение формулы (III), в котором Ra представляет собой CH3.
4. Применение ингибитора IL–8 по любому из пп. 1-3, где хиральный атом углерода фенилпропионовой группы находится в R–конфигурации.
5. Применение ингибитора IL–8 по любому из пп. 1-4, где указанное соединение выбрано из R–(–)–2–(4–изобутилфенил)пропионилметансульфонамида и его фармацевтически приемлемых солей, предпочтительно лизиновой соли in situ.
6. Применение ингибитора IL–8 по любому из пп. 1-4, где указанное соединение представляет собой R(–)–2–(4–трифторметансульфонилокси)фенил]–N–метансульфонилпропионамид и его фармацевтически приемлемые соли, предпочтительно его натриевую соль.
7. Применение ингибитора IL–8 по любому из пп. 1-4, где указанное соединение представляет собой R(–)–2–[(4'–трифторметансульфонилокси)фенил]пропионамид.
| C.-T | |||
| CHIU et al | |||
| Reparixin attenuates neuronal injury in experimental Klebsiella pneumoniae meningoencephalitis through dual effects on neuroprotection and neuroinflammation | |||
| Neuropathology and applied neurobiology, vol | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| US 5677426 A1, 14.10.1997 | |||
| HIDAKA HIDEKL et al | |||
| Curcumin inhibits | |||
Авторы
Даты
2022-10-11—Публикация
2018-05-28—Подача