[1] Настоящая заявка испрашивает приоритет на основании предварительной заявки США 62/593184, поданной 30 ноября 2017, полное содержание которой включено посредством ссылки в данный документ.
УРОВЕНЬ ТЕХНИКИ
[2] Многие лекарства, в частности противораковые, имеют узкое терапевтическое окно, в котором их побочные эффекты ограничивают их благоприятные эффекты. Системное введение таких лекарств часто приводит к ограниченному терапевтическому эффекту, поскольку доза, необходимая для получения более сильного эффекта, приводит к неприемлемым побочным эффектам для пациента. Это особенно важно в случае тех лекарств, которые обладают высоким цитотоксическим потенциалом, таких как цитостатические средства, вирусостатические средства или иммуносупресоры. Это еще более важно в случае определенных цитотоксических средств, которые ингибируют рост опухолевых клеток в пикомолярном диапазоне. Эти средства обычно слишком токсичны для использования в качестве химиотерапевтических средств. Например, тубулин-связывающий майтанзин является высокоэффективным в ингибировании роста опухолевых клеток, но потерпел неудачу в различных клинических испытаниях из-за неприемлемого профиля токсичности.
[3] Многочисленные исследования направлены на то, чтобы доставить конкретное лекарство в конкретное место действия. Часто такой подход приводит к более высокой концентрации лекарственного средства в месте действия, чем это было бы достигнуто системным введением, в то же время ограничивая побочные эффекты.
[4] Доставка лекарств в онкологии представляет особый интерес из-за узкого терапевтического окна средств, используемых при таком показании к применению. Многочисленные попытки исследований были сосредоточены на конъюгировании противоопухолевых препаратов с широким спектром низко- и высокомолекулярных носителей, включая сахара, факторы роста, витамины, пептиды, антитела, полисахариды, лектины, белки сыворотки и синтетические полимеры. В большинстве этих систем доставки лекарств лекарственное средство связывается с носителем через спейсер, который включает заранее определенную точку разрыва, которая позволяет связанному лекарственному средству высвобождаться в месте клеточной мишени (Kratz et al., ChemMedChem, 3:20-53 (2008)).
[5] Известны конъюгаты, в которых цитостатические агенты связываются с белками сыворотки, преимущественно со специфическими молекулами-носителями, такими как человеческий сывороточный альбумин и человеческий сывороточный трансферрин, а затем вводятся. В других случаях конъюгаты, содержащие терапевтически эффективное вещество, спейсерную молекулу и белково-связывающую молекулу, ковалентно связываются с циркулирующим сывороточным альбумином при введении, что приводит к транспортировке терапевтически эффективного вещества в целевой сайт, где оно высвобождается (США 7387771). В других случаях конъюгаты антител с лекарственными средствами (ADC) могут транспортировать лекарственное средство в целевой сайт для местного высвобождения (Kratz et al., ChemMedChem, 3:20-53 (2008); Panowski et al., mAbs, 6, 34-45 (2014); Chari et al., Angewandte Chem. Int. Ed., 53, 3796-3827 (2014)).
[6] Однако при разработке систем доставки лекарств следует соблюдать надлежащий баланс между сохранением нацеливающих свойств носителя лекарственного средства при одновременном обеспечении контролируемого высвобождения лекарственного средства. Система доставки лекарственного средства должна иметь достаточную стабильность в кровотоке и в то же время обеспечивать эффективное высвобождение лекарственного средства в месте опухоли путем ферментативного расщепления, восстановления или в зависимости от рН (Kratz et al., ChemMedChem, 3:20-53 (2008)). В отношении высокоэффективных цитотоксических агентов из класса майтанзиноидов (полученных из майтанзина) сообщалось только о системах доставки лекарств, в которых активные вещества на основе майтанзиноидов высвобождаются неспецифически или восстановительно. Среди них в клиническую стадию разработки вступили только те, которые используют моноклональное антитело в качестве молекулы-носителя и только один конъюгат антитело-майтанзиноид, а именно T-DM1 (Kadcyla®), получил одобрение на рынке против определенных подтипов рака молочной железы. Следовательно, все еще существует потребность в эффективных и менее сложных системах доставки и высвобождения лекарственного средства, которые эффективно высвобождали бы высокоэффективные цитотоксические агенты на основе майтанзиноидов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
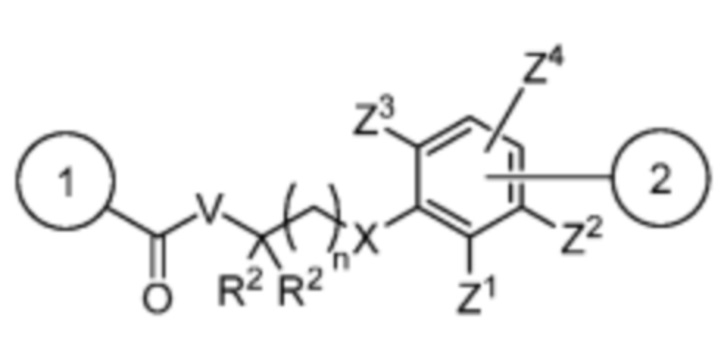
[7] Настоящее изобретение предлагает соединение со структурой формулы (I):
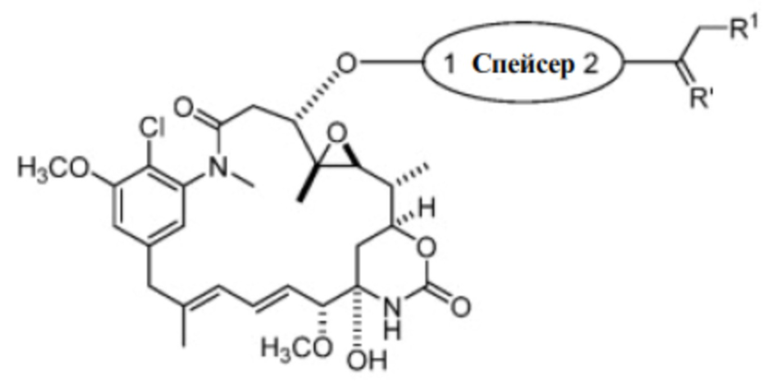
Формула (I)
или его фармацевтически приемлемую соль, гидрат, сольват или изомер, где:
R1 выбран из -H и C1-C4 алкила;
Спейсер выбран из:
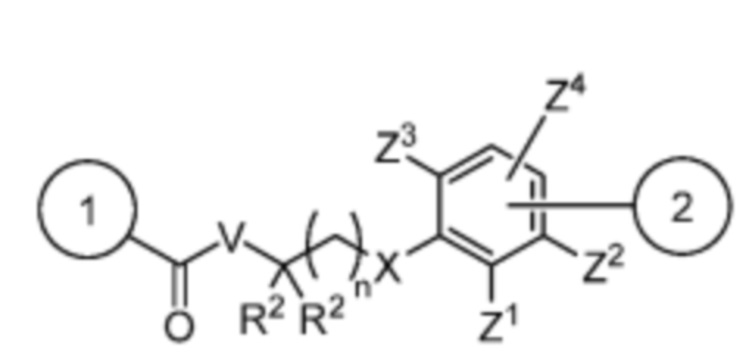 и
и 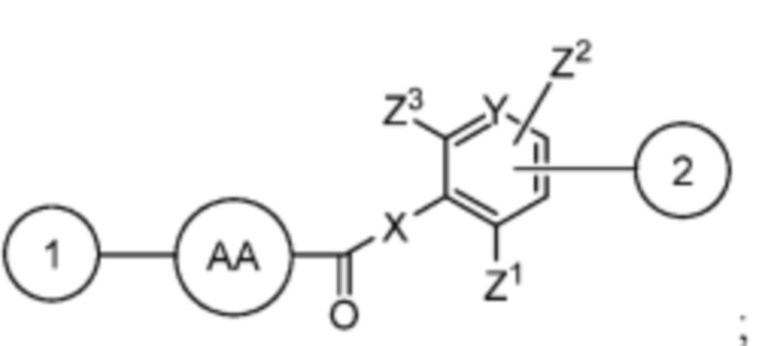
V отсутствует или выбран из -CH2-, -O- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
каждый R2 независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
n равно 0-3;
X отсутствует или выбран из -CH2-, -O-, -S-, -Se- и -NR4-, где R4 представляет собой -H или C1-C4 алкил;
Y выбран из =CH- и =N-;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -CN, -NO2, C1-C4 алкила и C2-C4 алкокси;
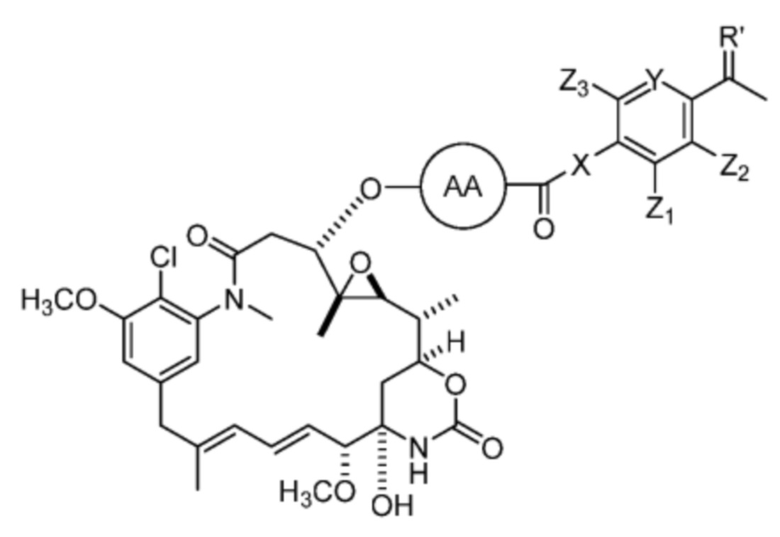
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этил-глицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты;
R’ выбран из O и 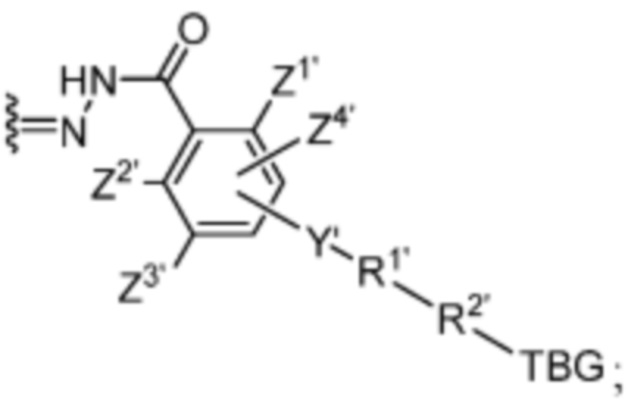
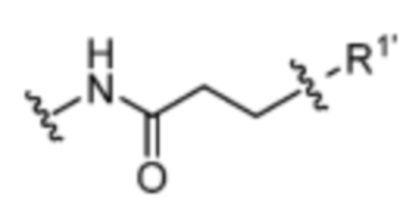
Y’ отсутствует или выбран из необязательно замещенного C1-C6 алкила, -NH-C(O)- и -C(O)-NH-; или Y’ выбран из группы, состоящей из:
 и
и 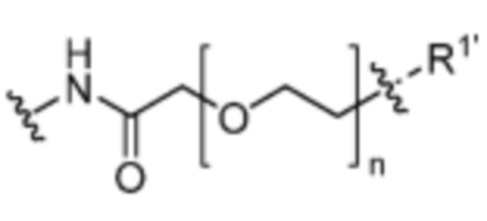 где n=0-6;
где n=0-6;
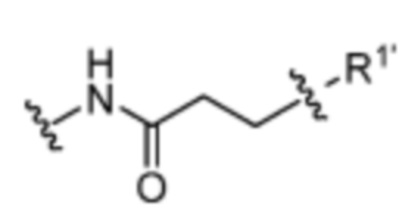
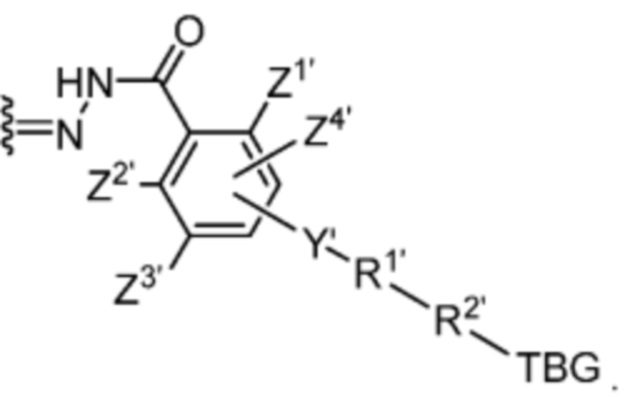
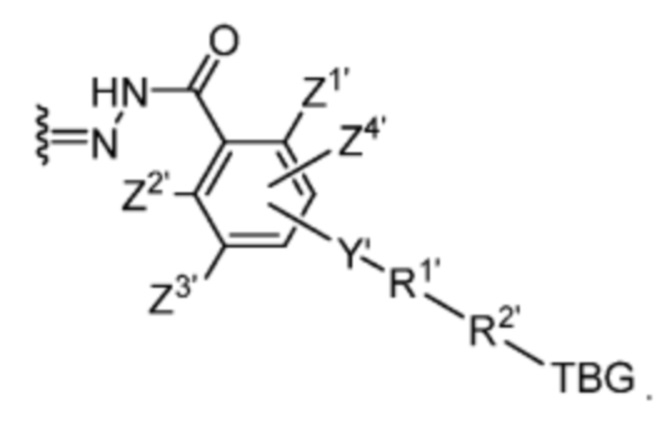
R1’ отсутствует или выбран из группы, состоящей из:
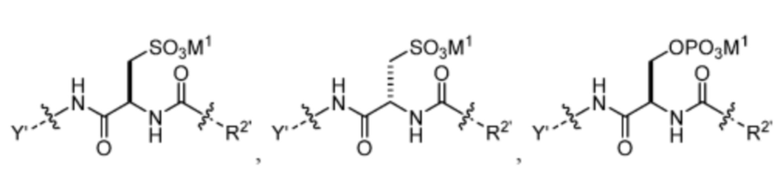 и
и
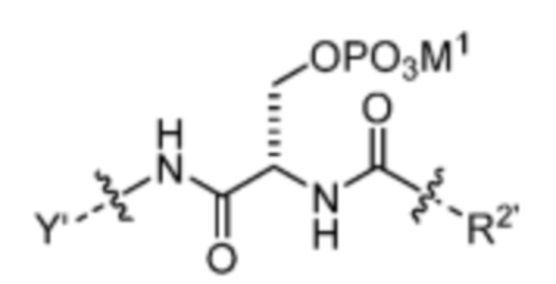
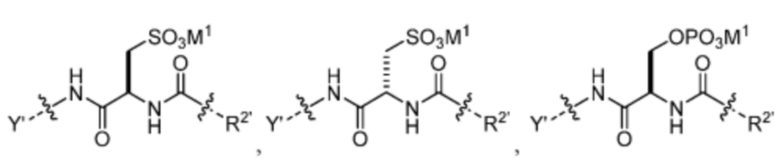
где M1 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
R2’ представляет собой необязательно замещенный C1-C18 алкил, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-;
Z1’, Z2’, Z3’ и Z4’ каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) -CF3, -OCH3, -CN, -NO2, -SO3M2 и C1-C4 алкила, где M2 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
TBG представляет собой тиолсвязывающую группу, выбранную из необязательно замещенной малеимидной группы, необязательно замещенной галоацетамидной группы, необязательно замещенной галоацетатной группы, необязательно замещенной пиридилтиогруппы, необязательно замещенной изотиоцианатной группы, необязательно замещенной винилкарбонильной группы, необязательно замещенной азиридиновой группы, необязательно замещенной дисульфидной группы, необязательно замещенной ацетиленовой группы и необязательно замещенной N-гидроксисукцининидной эфирной группы;
где указанная TBG необязательно связана с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли.
[8] В некоторых вариантах воплощения настоящее изобретение предусматривает соединение со структурой формулы (I):
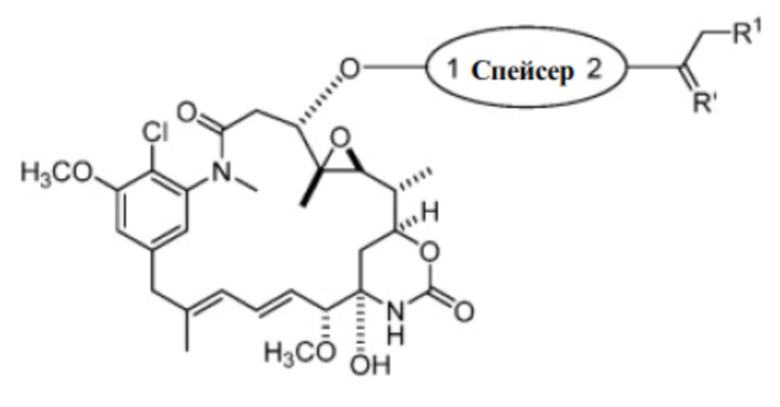
Формула (I)
или его фармацевтически приемлемую соль, гидрат, сольват или изомер, где: R1 выбран из -H и C1-C4 алкила;
Спейсер выбран из:
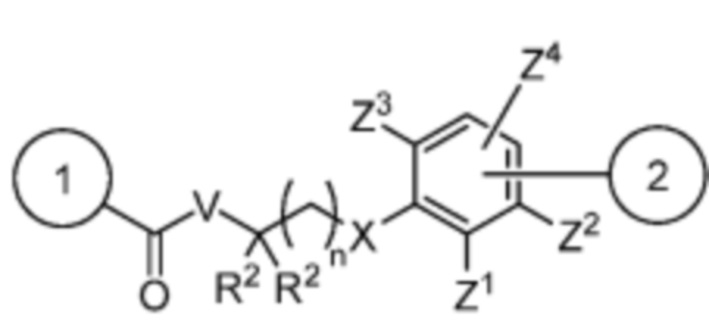 и
и 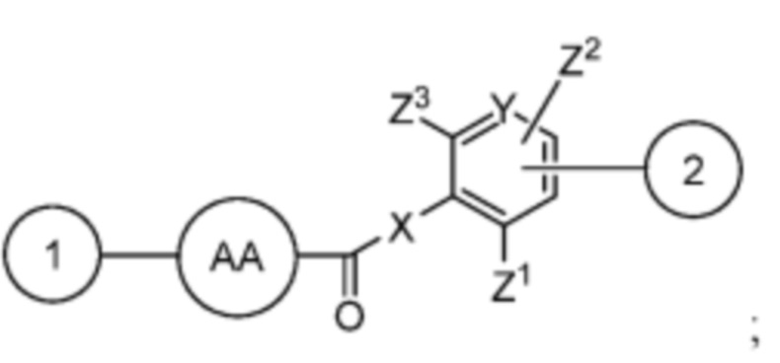
V отсутствует или выбран из -CH2-, -O- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
каждый R2 независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
n равно 0-3;
X отсутствует или выбран из -CH2-, -O-, -S-, -Se-, и -NR4-, где R4 представляет собой -H или C1-C4 алкил;
Y выбран из =CH- и =N-;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -CN, -NO2, C1-C4 алкила и C2-C4 алкокси;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты;
R’ выбран из O и 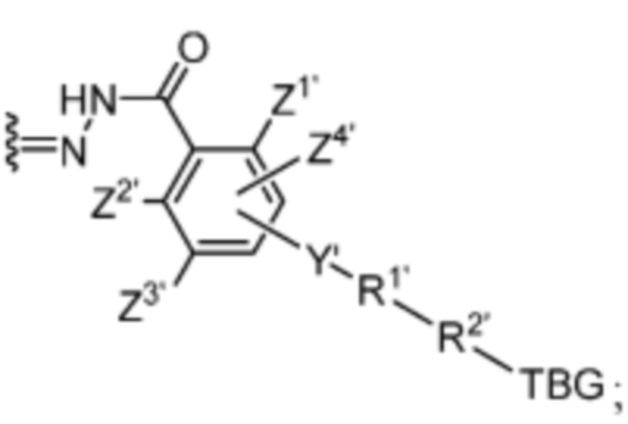
Y’ отсутствует или выбран из необязательно замещенного C1-C6 алкила, -NH-C(O)-, и -C(O)-NH-; или Y’ выбран из группы, состоящей из:
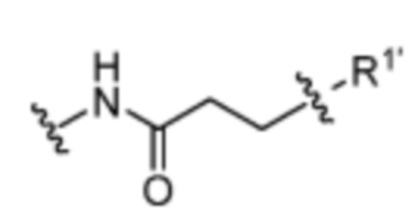 и
и 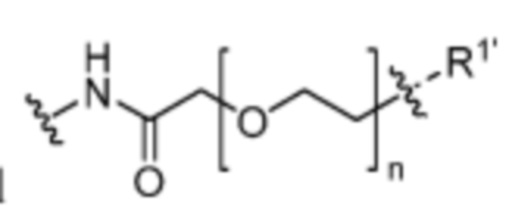 , где n=0-6;
, где n=0-6;
R1’ отсутствует или выбран из группы, состоящей из:
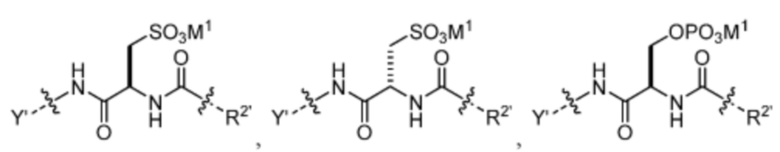 и
и
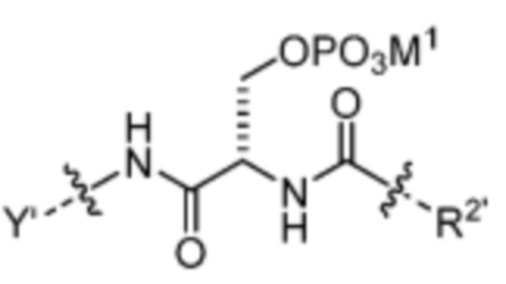
где M1 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
R2’ представляет собой необязательно замещенный C1-C18 алкил, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-;
Z1’, Z2’, Z3’ и Z4’ каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) -CF3, -OCH3, -CN, -NO2, -SO3M2 и C1-C4 алкила, где M2 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
TBG представляет собой тиолсвязывающую группу, выбранную из необязательно замещенной малеимидной группы, необязательно замещенной галоацетамидной группы, необязательно замещенной галоацетатной группы, необязательно замещенной пиридилтиогруппы, необязательно замещенной изотиоцианатной группы, необязательно замещенной винилкарбонильной группы, необязательно замещенной азиридиновой группы, необязательно замещенной дисульфидной группы, необязательно замещенной ацетиленовой группы и необязательно замещенной N-гидроксисукцининидной эфирной группы;
где указанная TBG необязательно связана с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли.
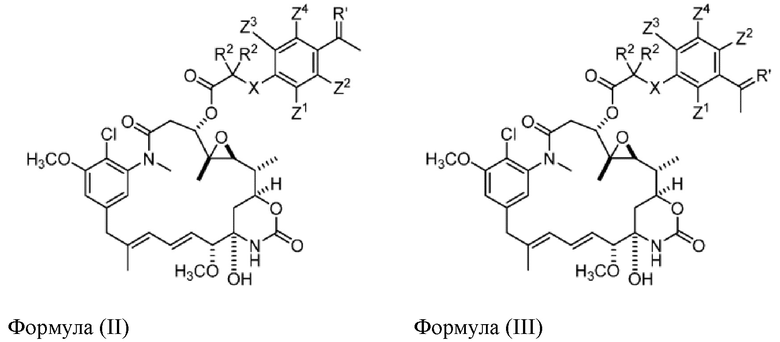
[9] В некоторых вариантах воплощения соединение имеет структуру формулы (II):
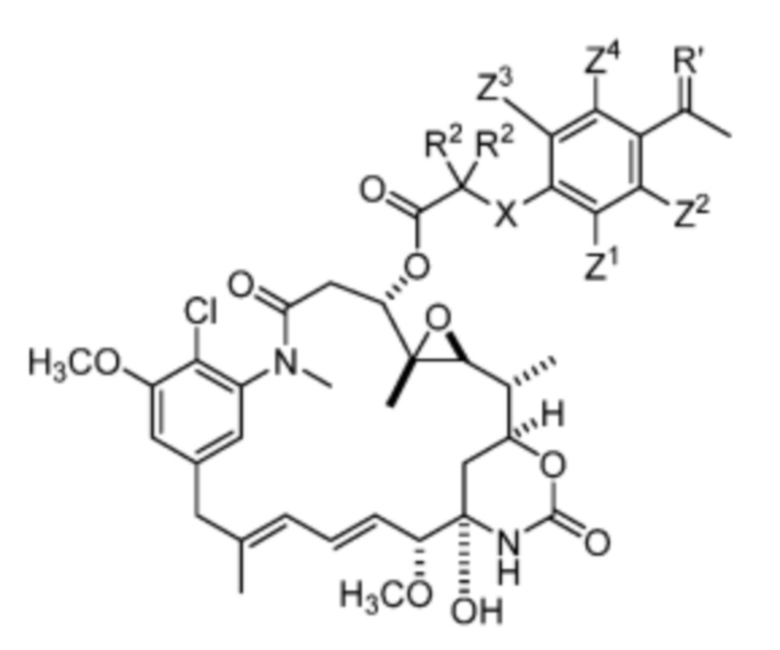
Формула (II)
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
каждый R2 независимо выбран из -H и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
Z1, Z2, Z3 и Z4 каждый независимо выбраны из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -NO2 и -CH3.
[10] В некоторых вариантах воплощения соединение имеет структуру формулы (III):
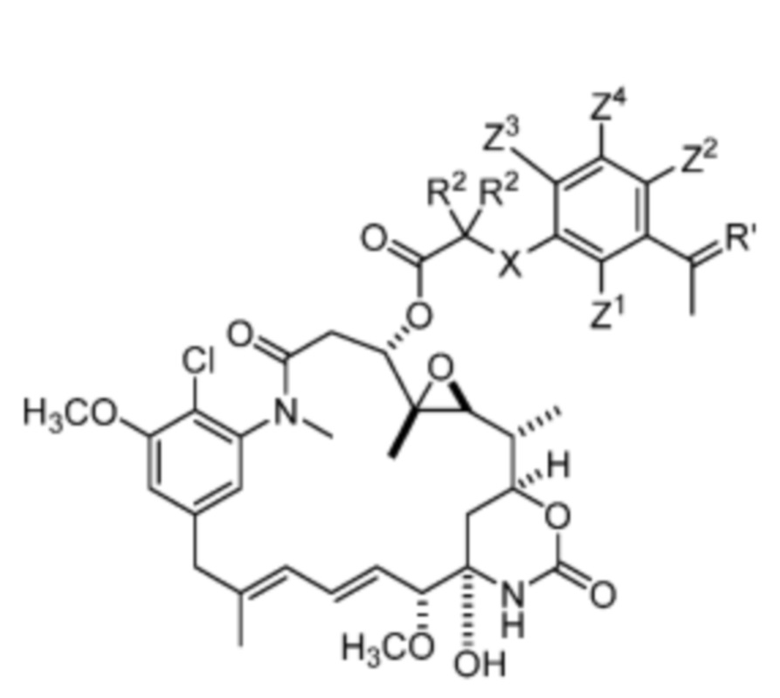
Формула (III)
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
каждый R2 независимо выбран из -H, и C1-C4 алкила или два R2вместе образуют C3-C6, циклоалкил;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I),
-CF3, -OCH3, -NO2 и -CH3.
[11] В некоторых вариантах воплощения соединение имеет структуру формулы (IV):
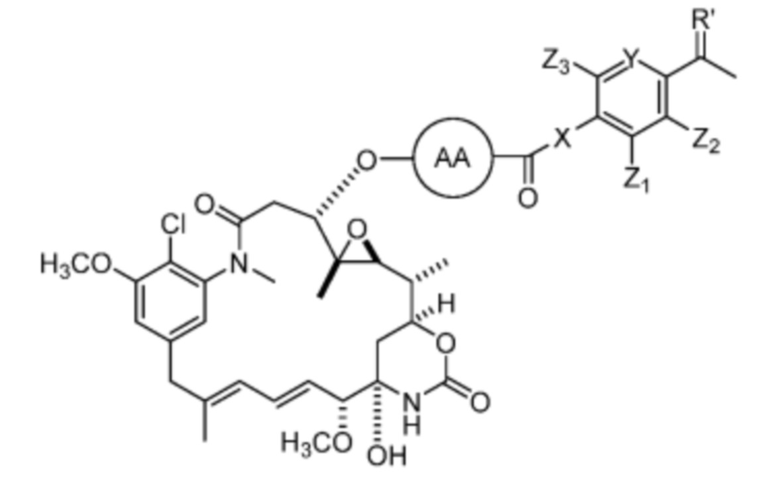
Формула (IV)
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера,
где:
X отсутствует или выбран из -CH2- и -NH-;
Y представляет собой =CH- или =N-;
Z1, Z2, Z3 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I),
-CF3, -OCH3, -NO2 и -CH3;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этил-глицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты.
[12] В некоторых вариантах воплощения соединение имеет структуру формулы (IV):
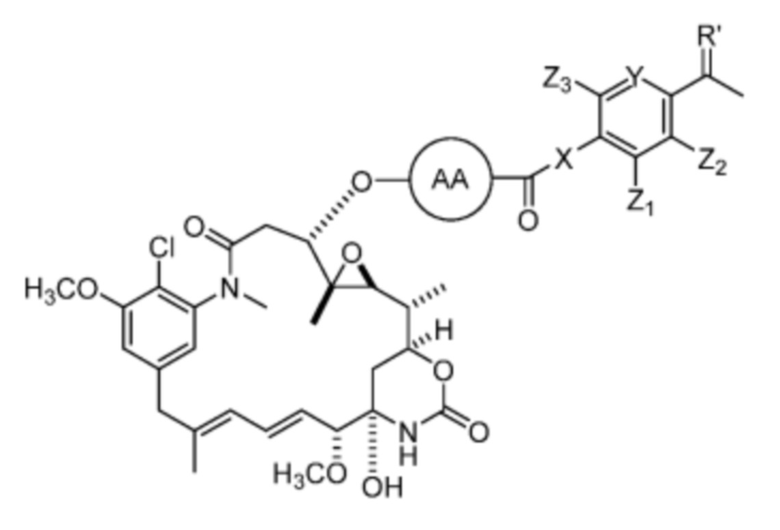
Формула (IV)
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
X отсутствует или выбран из -CH2- и -NH-;
Y представляет собой =CH- или =N-;
Z1, Z2, Z3 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -NO2 и -CH3;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты.
[13] В некоторых вариантах воплощения R1 представляет собой -H. В некоторых вариантах воплощения по меньшей мере один из Z1, Z2, Z3 и Z4 не является H. В некоторых вариантах воплощения по меньшей мере один из Z1, Z2, Z3 и Z4 представляет собой -F или -NO2. В некоторых вариантах воплощения n равно 0, а X отсутствует. В некоторых вариантах воплощения n равно 0, а X представляет собой -CH2-. В некоторых вариантах воплощения n равно 0, а X представляет собой -O-, NHMe или -S-. В некоторых вариантах воплощения соединение выбрано из:
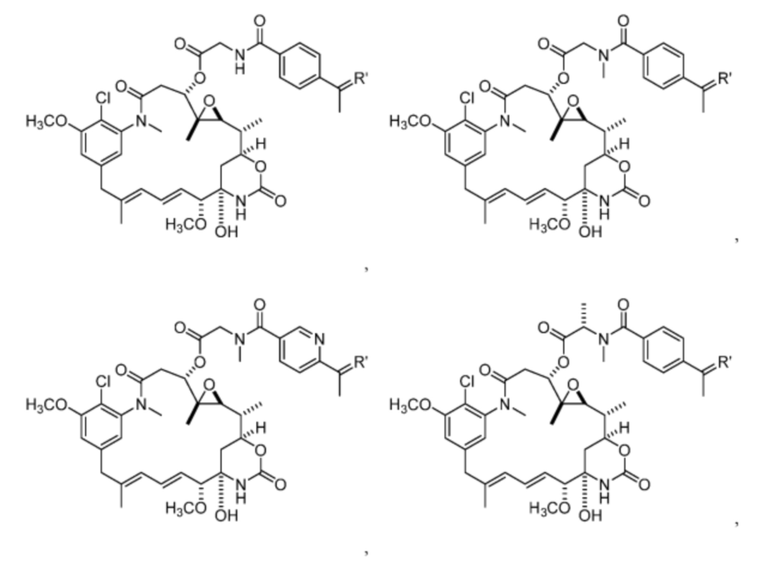
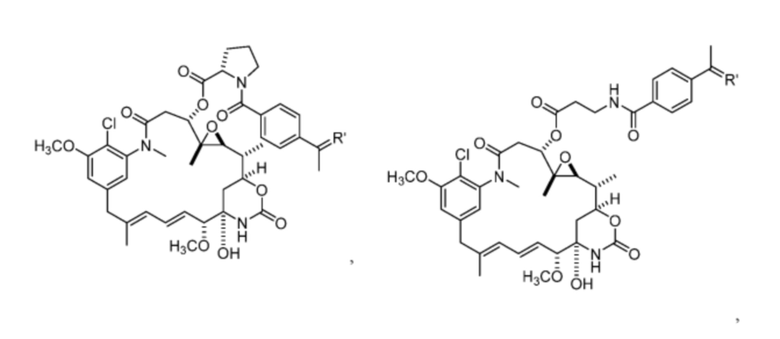
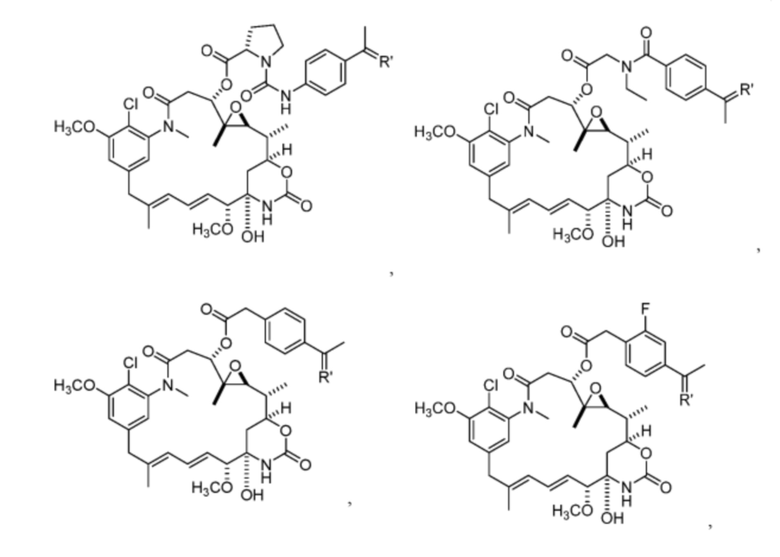
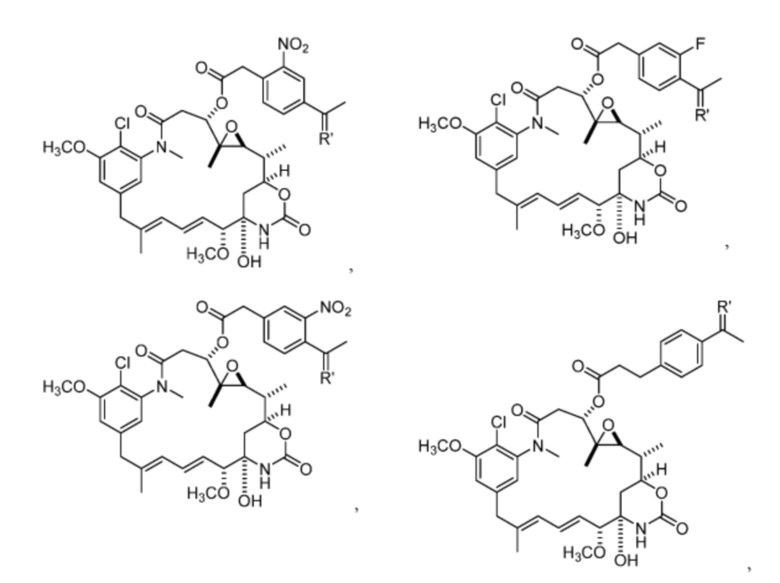
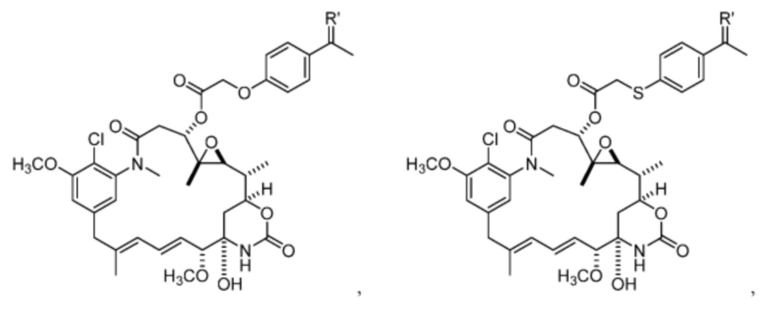
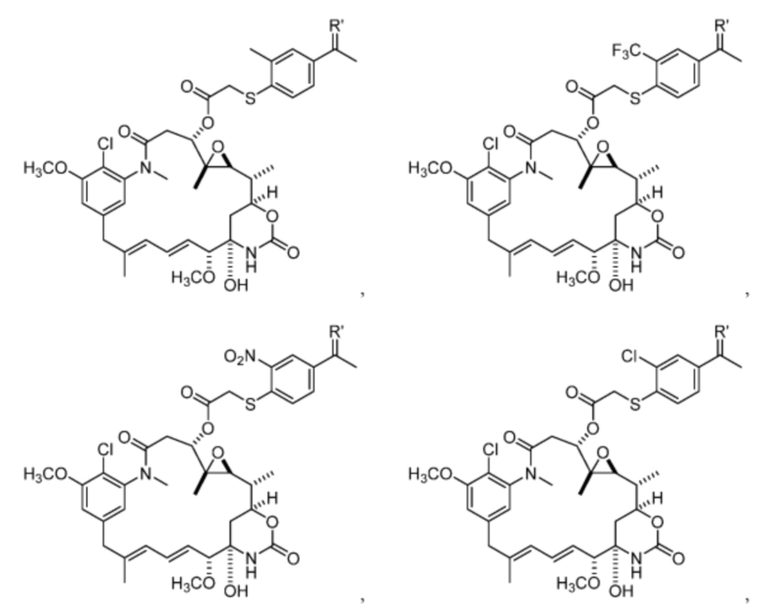
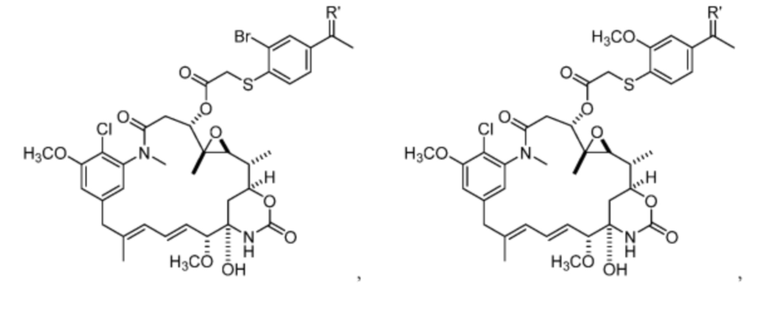
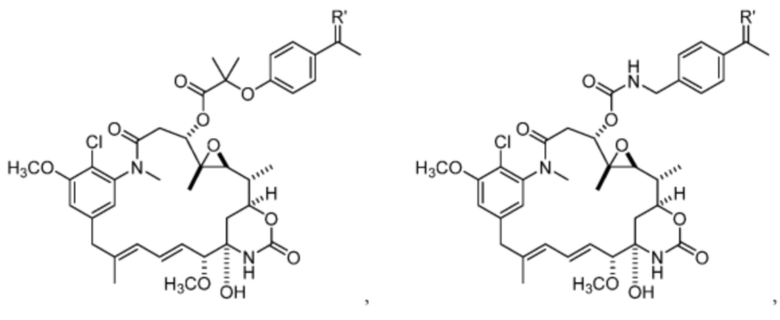
и 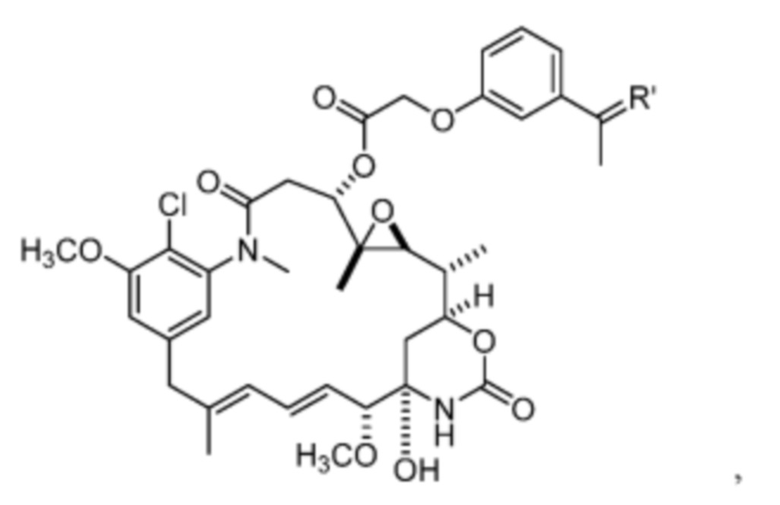
или их фармацевтически приемлемой соли, гидрата, сольвата или изомера.
[14] В некоторых вариантах воплощения фармацевтически приемлемый противоион выбран из H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил.
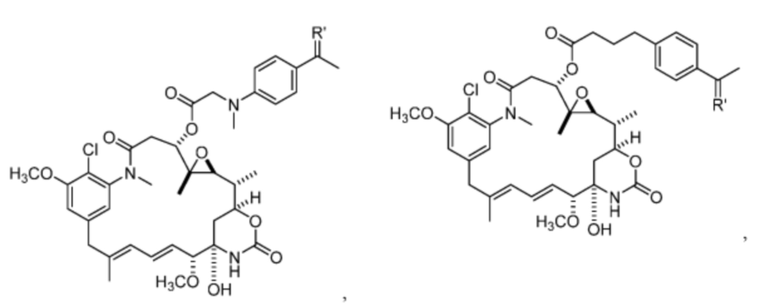
[15] В некоторых вариантах воплощения R’ представляет собой O. В некоторых вариантах воплощения R’ представляет собой: 
[16] В некоторых вариантах воплощения соединение не связывается с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли. В некоторых вариантах воплощения соединение связывается с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли. В некоторых вариантах воплощения тиолсодержащий макромолекулярный носитель или тиолсодержащий носитель, специфичный для опухоли, выбран из эндогенного альбумина, экзогенного альбумина, антитела, фрагмента антитела, пептида, природного или синтетического полимера, липосомы и наночастицы. В некоторых вариантах воплощения TBG представляет собой необязательно замещенную малеимидную группу. В некоторых вариантах воплощения Z1’ выбран из - NO2 или -SO3M2;
и Y’ выбран из -NHC(O)- или 
[17] В некоторых вариантах воплощения R1’ представляет собой 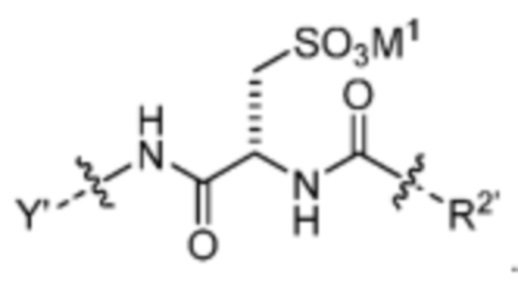
[18] В некоторых вариантах воплощения R’ представляет собой: 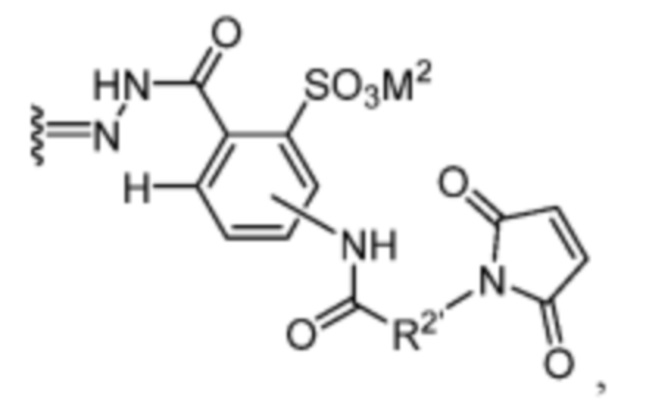
или его фармацевтически приемлемую соль, гидрат, сольват или изомер,
где R2’ выбран из необязательно замещенного C1-C18 алкила, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-.
[19] В некоторых вариантах воплощения R’ представляет собой: 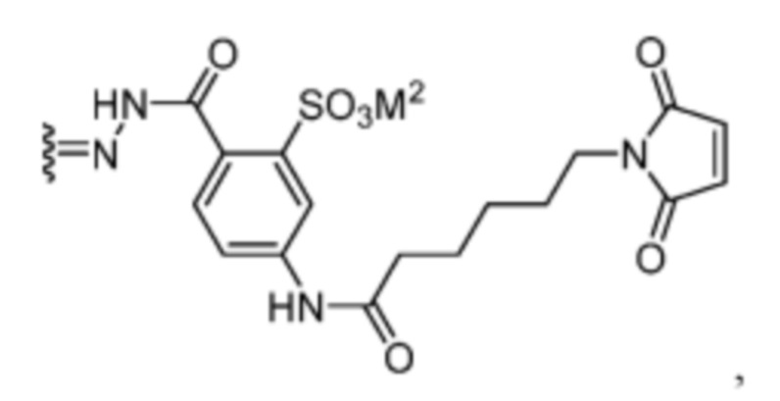 или его фармацевтически приемлемую соль, гидрат, сольват или изомер.
или его фармацевтически приемлемую соль, гидрат, сольват или изомер.
[20] В некоторых вариантах воплощения соединение выбрано из:
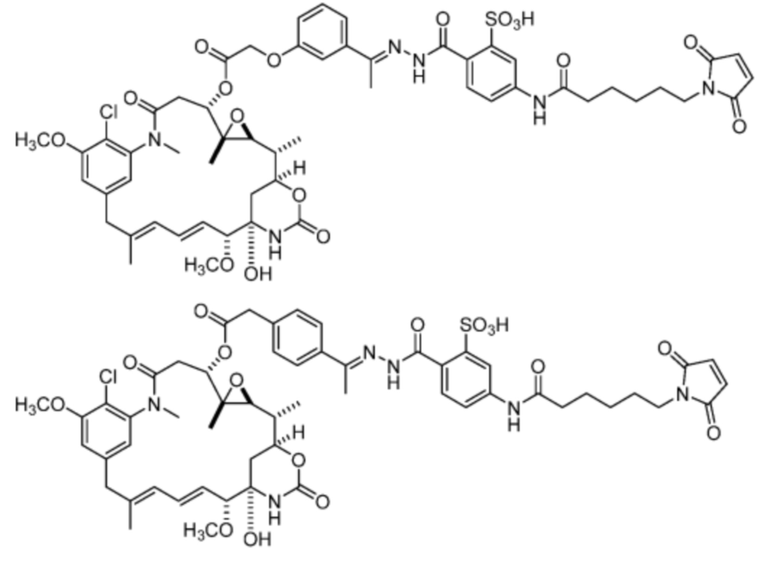
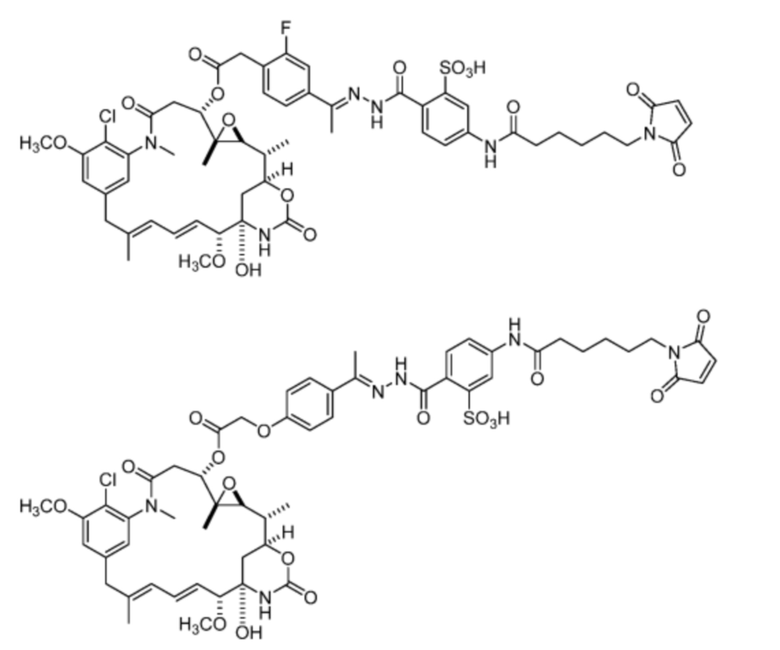
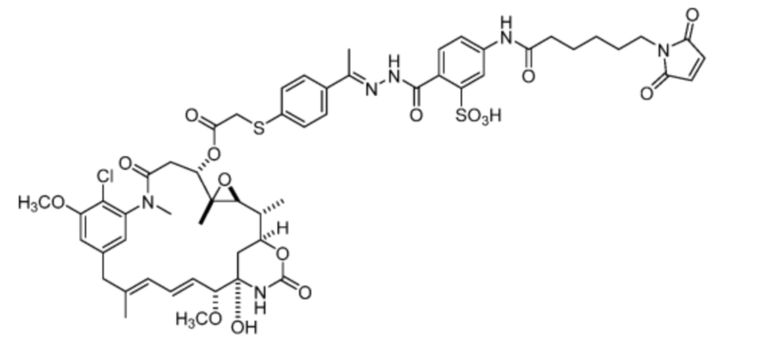
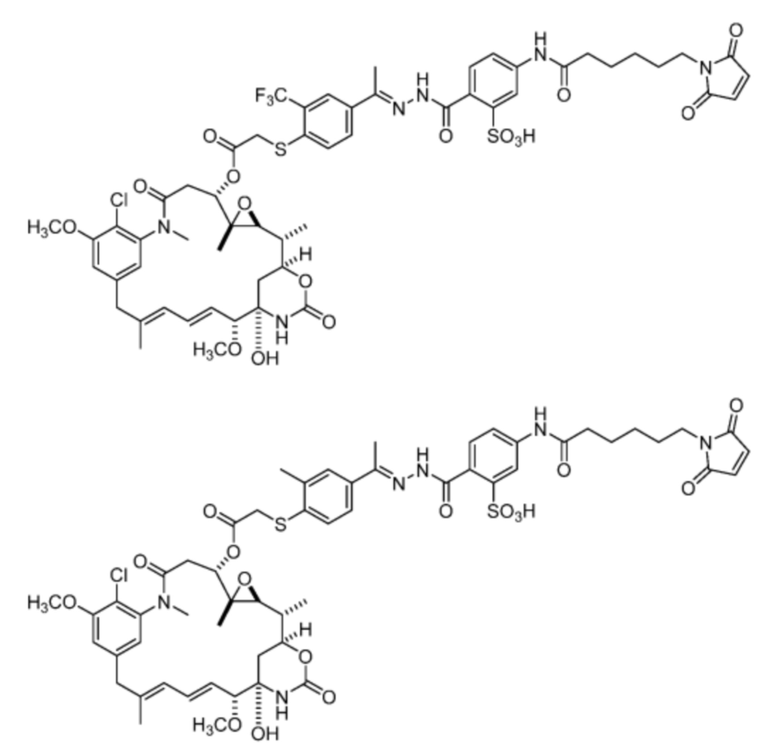
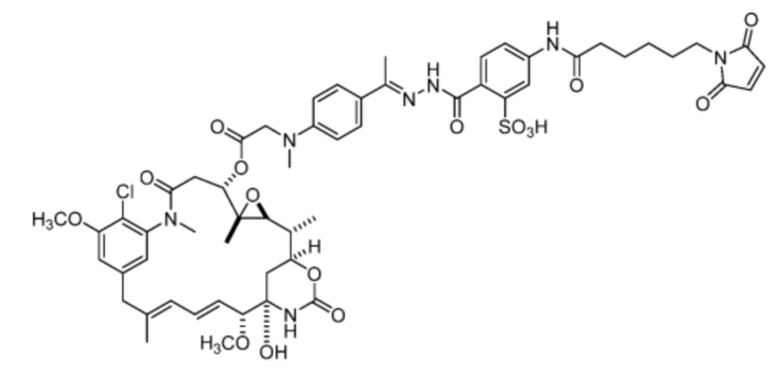
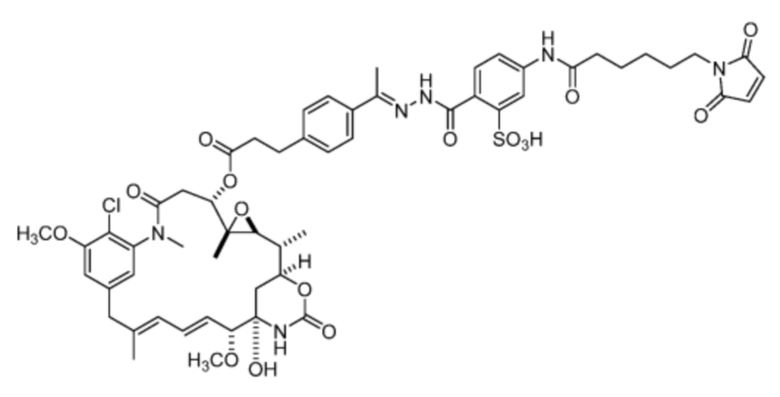
или их фармацевтически приемлемой соли, гидрата, сольвата или изомера.
[21] В некоторых вариантах воплощения R’ представляет собой:
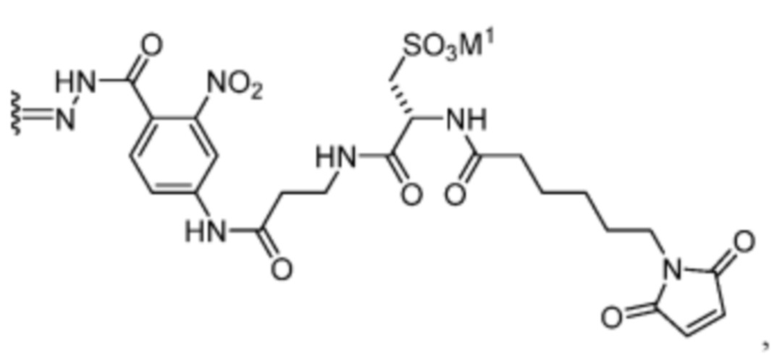
или его фармацевтически приемлемую соль, гидрат, сольват или изомер; где M1 представляет собой фармацевтически приемлемый противоион.
[22] В некоторых вариантах воплощения соединение выбрано из:
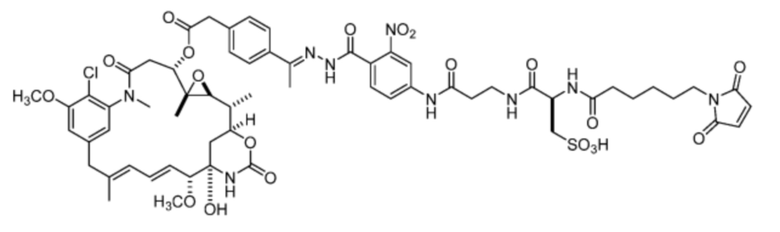
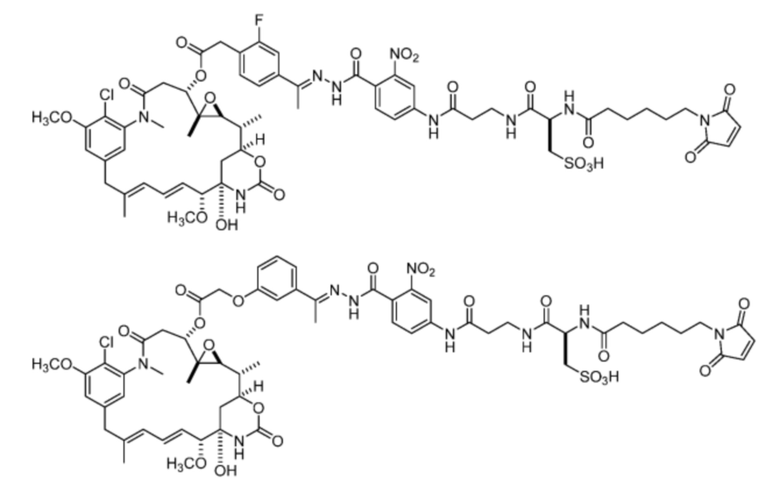
или их фармацевтически приемлемой соли, гидрата, сольвата или изомера.
[23] В некоторых вариантах воплощения соединение по любому из п.п.14-20, в котором R’ представляет собой:
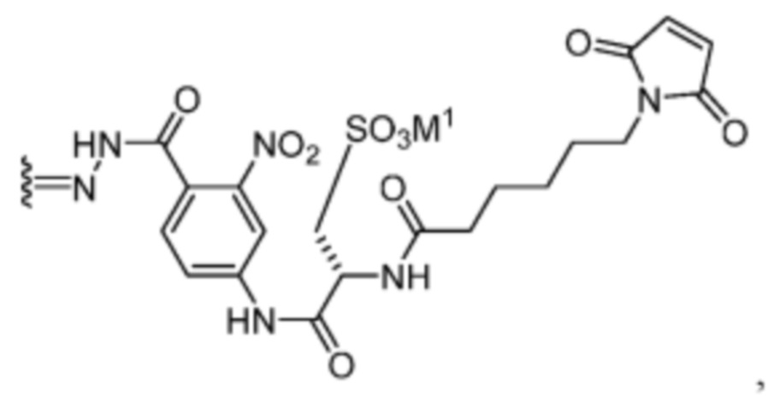
или его фармацевтически приемлемую соль, гидрат, сольват или изомер; при этом M1 представляет собой фармацевтически приемлемый противоион.
[24] В некоторых вариантах воплощения соединение по п.26, представляет собой:
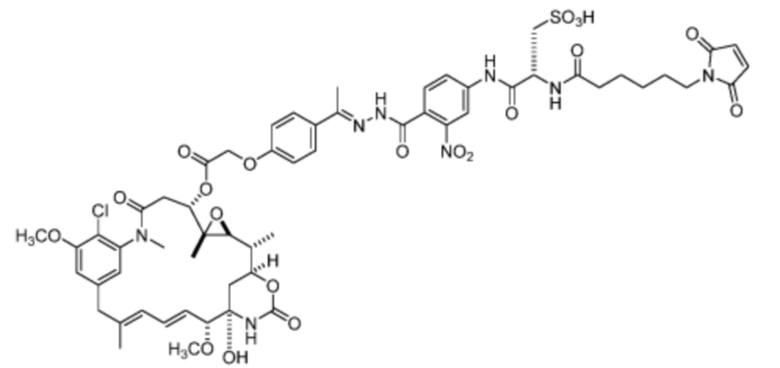
[25] Другие варианты воплощения включают фармацевтическую композицию, содержащую соединение, как описано в данном документе, и фармацевтически приемлемый носитель.
[26] Другие варианты воплощения включают способ лечения заболевания или состояния, выбранного из рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами, включающий введение пациенту, в случае необходимости в этом, терапевтически эффективного количества соединения или фармацевтической композиции, как описано в данном документе. В некоторых вариантах воплощения заболевание представляет собой рак, например, рак выбран из аденокарциномы, увеальной меланомы, острого лейкоза, акустической невромы, рака амплулярного отдела толстой кишки, анальной карциномы, астроцитомы, базалиомы, рака поджелудочной железы, опухоли соединительной ткани, рака мочевого пузыря, бронхиальной карциномы, немелкоклеточной бронхиальной карциномы, рака молочной железы, лимфомы Беркитта, карциномы тела, синдрома CUP, рака толстого кишечника, рака тонкого кишечника, рака яичника, карциномы эндометрия, рак желчного пузыря, карциномы желчного пузыря, рака матки, рака шейки матки, опухоли шеи, носа и ушей, гематологической неоплазии, лейкоза ворсистых клеток, рака уретры, рака кожи, глиомы, рака яичка, саркомы Капоши, рака гортани, рака кости, колоректального рака, опухолей головы/шеи, карциномы толстой кишки, краниофарингеомы, рака печени, лейкоза, рака легких, немелкоклеточного рака легких, лимфомы Ходжкина, неходжкинской лимфома, рака желудка, рака толстой кишки, медуллобластомы, меланомы, менингиомы, рака почки, почечно-клеточной карциномы, олигодендроглиомы, рака пищевода, остеолитической и остеопластической карциномы, остеосаркомы, карциномы яичников, карциномы поджелудочной железы, рака полового члена, рака простаты, рака языка, карциномы яичника и рака лимфатического узла.
[27] Другие варианты воплощения включают способ снижения цитотоксичности соединения, включающий введение соединения или фармацевтической композиции, как описано в данном документе, нуждающемуся в этом пациенту, где введение приводит к снижению цитотоксичности по сравнению с эквивалентной дозой немодифицированного активного агента.
[28] Другие варианты воплощения включают способ увеличения концентрации метаболита соединения в опухоли, включающий введение соединения или фармацевтической композиции, как описано в данном документе, нуждающемуся в этом пациенту, где увеличение сравнивают с эквивалентной дозой немодифицированного активного агента.
[29] Другие варианты воплощения включают соединение, раскрытое в данном документе, для применения в качестве лекарственного средства.
[30] Другие варианты воплощения включают описанное в данном документе соединение для применения при лечении заболевания или состояния, выбранного из группы, состоящей из рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами.
[31] Другие варианты воплощения включают применение соединения или композиции, как описано в данном документе, для получения лекарственного средства для лечения заболевания или состояния, выбранного из рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[32] На фигуре 1 показана стабильность различных линкеров с 4 в плазме мышей CD1.
[33] На фигуре 2 показана тепловая карта средних геометрических значений IC50 на панели разных клеточных линий.
[34] На фигуре 3 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30, 42, 31 и 35 в модели почечно-клеточной опухоли RXF631.
[35] На фигуре 4 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30, 42, 31 и 35 в модели почечно-клеточной опухоли RXF631.
[36] На фигуре 5 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 32, 30 и 31 в модели плоскоклеточной карциномы легкого LXFE 937.
[37] На фигуре 6 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 32, 30 и 31 в модели плоскоклеточной карциномы легкого LXFE 937.
[38] На фигуре 7 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31 в модели плоскоклеточной карциномы легкого LXFE 937.
[39] На фигуре 8 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31 в модели плоскоклеточной карциномы легкого LXFE 937.
[40] На фигуре 9 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31 в модели аденокарциномы легкого LXFA 737.
[41] На фигуре 10 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31 в модели аденокарциномы легкого LXFA 737.
[42] На фигуре 11 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 32, 30 и 31 в модели рака молочной железы MDA-MB 231.
[43] На фигуре 12 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 32, 30 и 31 в модели опухоли молочной железы MDA-MB 231.
[44] На фигуре 13 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31 в модели рака яичников A2780.
[45] На фигуре 14 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31 в модели рака яичников A2780.
[46] На фигуре 15 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31 в модели рака молочной железы MDA-MB 468.
[47] На фигуре 16 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31 в модели опухоли молочной железы MDA-MB 468.
ПОДРОБНОЕ ОПИСАНИЕ
[48] Если не указано иное, научные и технические термины, используемые в данной заявке, должны иметь значения, которые обычно понимаются специалистами в данной области техники. Как правило, номенклатура, которая относится к методам химии, молекулярной биологии, биологии клетки и рака, иммунологии, микробиологии, фармакологии и химии белка, описанным здесь, является хорошо известной и широко используемой в данной области техники.
[49] Все публикации, патенты и опубликованные патентные заявки, упомянутые в данной заявке, специально включены в настоящий документ посредством ссылки. В случае конфликта настоящее описание, включая его конкретные определения, будет иметь преимущественную силу. Если не указано иное, следует понимать, что каждый вариант осуществления, раскрытый в данном документе, может использоваться отдельно или в сочетании с любым одним или более другими вариантами воплощения изобретения.
Определения
[50] В данном описании слово «содержать» или его варианты, такие как «содержит» или «содержащий», следует понимать как подразумевающее включение указанного целого числа (или компонентов) или группы целых чисел (или компонентов), но не исключение какого-либо другого целого числа (или компонентов) или группы целых чисел (или компонентов).
[51] Во всей заявке, где соединение или композиция описываются как имеющие, включающие или содержащие конкретные компоненты, предполагается, что такое соединение или композиция также может состоять практически из или состоять из перечисленных компонентов. Аналогичным образом, когда способы или процессы описаны как имеющие, включающие или содержащие конкретные этапы процесса, процессы также могут состоять практически из или состоять из перечисленных этапов процесса. Кроме того, следует понимать, что порядок этапов или порядок выполнения определенных действий не существенны, поскольку соединения, композиции и способы, описанные в настоящем документе, остаются работоспособными. Кроме того, два или более шагов или действий могут быть выполнены одновременно.
[52] Формы существительного единственного числа включают формы множественного числа, если контекст четко не определяет иное.
[53] Термин «включающий» используется для обозначения «включающий, но не ограниченный». «Включающий» и «включающий, но не ограничивающий» используются взаимозаменяемо.
[54] Используемый в данном документе термин «или» следует понимать как означающий «и/или», если контекст явно не указывает на иное.
[55] Термины «лекарственное средство», «агент», «терапевтический агент», «терапевтически активный агент», «цитотоксический агент или лекарственное средство», «высоко цитотоксический агент или лекарственное средство» или «терапевтически эффективное вещество» используются для обозначения любого соединения, которое вызывает фармакологический эффект либо само по себе, либо после его превращения в рассматриваемом организме и, следовательно, также включает производные от этих превращений. Фармакологический эффект лекарственных средств по композиции согласно настоящему изобретению может быть только единичным, например, цитостатическим и/или цитотоксическим эффектом или широким фармакологическим спектром действия, таким как иммунодепрессивный и противовоспалительный эффект одновременно.
[56] Термины «пациент», «субъект» или «индивидуум» используются взаимозаменяемо и относятся к человеку или животному, не являющемуся человеком. Эти термины включают млекопитающих, таких как люди, приматы, сельскохозяйственные животные (например, коровы, свиньи), домашние животные (например, собаки, кошки) и грызуны (например, мыши и крысы). В определенных вариантах воплощения пациентом или субъектом является пациент или субъект-человек, такой как пациент-человек, имеющий состояние, которое необходимо лечить.
[57] Термин «фармацевтическая композиция» относится к композиции, подходящей для фармацевтического применения у субъекта-животного, включая людей и млекопитающих, например, в сочетании с одним или более фармацевтически приемлемыми носителями, наполнителями или растворителями. Такая композиция может также содержать разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы, защитные средства и другие материалы, хорошо известные в данной области техники. В некоторых вариантах воплощения фармацевтическая композиция включает композицию, содержащую активный ингредиент(ы) и инертный ингредиент(ы), которые образуют наполнитель, носитель или разбавитель, а также любой продукт, который прямо или косвенно возникает в результате комбинации, комплексообразования или агрегации любых двух или более ингредиентов, или диссоциации одного или более ингредиентов, или других типов реакций или взаимодействий одного или более ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную путем смешивания соединения по настоящему изобретению и одного или более фармацевтически приемлемых наполнителей, носителей и/или разбавителей.
[58] Термин «фармацевтически приемлемый носитель» относится к нетоксичному носителю, который может быть введен пациенту вместе с терапевтически эффективным веществом, раскрытым в данном документе, и который не нарушает фармакологическую активность агента. Термин «наполнитель» относится к добавке в составе или композиции, которая не является фармацевтически активным ингредиентом. В определенных вариантах воплощения «фармацевтически приемлемое» вещество подходит для применения в контакте с клетками, тканями или органами животных или людей без чрезмерной токсичности, раздражения, аллергической реакции, иммуногенности или других нежелательных реакций в количестве, используемом в лекарственной форме согласно к графику дозирования и соразмерно с разумным соотношением пользы/риска. В некоторых вариантах воплощения «фармацевтически приемлемое» вещество, которое является компонентом фармацевтической композиции, является, кроме того, совместимым с другим ингредиентом(ами) композиции. В некоторых вариантах воплощения термины «фармацевтически приемлемый наполнитель», «фармацевтически приемлемый носитель» и «фармацевтически приемлемый разбавитель» охватывают, без ограничения, фармацевтически приемлемые неактивные ингредиенты, материалы, композиции и носители, такие как жидкие наполнители, твердые наполнители, разбавители, наполнители, носители, растворители и герметизирующие материалы. Носители, разбавители и наполнители также включают все фармацевтически приемлемые дисперсионные среды, покрытия, буферы, изотонические агенты, стабилизаторы, агенты, замедляющие абсорбцию, антимикробные агенты, антибактериальные агенты, противогрибковые агенты, адъюванты и т.д. За исключением тех случаев, когда любые обычные наполнители, носители или разбавители несовместимы с активным ингредиентом; настоящее изобретение охватывает использование в фармацевтических композициях обычных наполнителей, носителей и разбавителей. См., например, Remington: The Science and Practice of Pharmacy, 21st Ed., Lippincott Williams & Wilkins (Philadelphia, Pennsylvania, 2005); Handbook of Pharmaceutical Excipients, 5th Ed., Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association (2005); Handbook of Pharmaceutical Additives, 3rd Ed., Ash and Ash, Eds., Gower Publishing Co. (2007); и Pharmaceutical Preformulation and Formulation, Gibson, Ed., CRC Press LLC (Boca Raton, Florida, 2004).
[59] Термины «фармацевтически эффективное количество», «терапевтически эффективное количество» или «терапевтически эффективная доза» относятся к количеству, эффективному для лечения заболевания или состояния у пациента, например, для воплощения полезного и/или желательного изменения общего состояния здоровья пациента, страдающего заболеванием (например, раком) или состоянием, лечения, заживления, ингибирования или ослабления физиологического ответа или состояния и т.д. Полный терапевтический эффект необязательно возникает при введении одной дозы и может происходить только после введения серии доз. Таким образом, терапевтически эффективное количество может быть введено за одно или более введений. Точное эффективное количество, необходимое для субъекта, будет зависеть, например, от размера, состояния здоровья и возраста субъекта, природы и степени заболевания, терапевтических средств или комбинации терапевтических средств, выбранных для введения, и способа введения. Специалист может легко определить эффективное количество для данной ситуации путем рутинных экспериментов. Специалист поймет, что лечение рака включает, но не ограничивается этим, уничтожение раковых клеток, предотвращение роста новых раковых клеток, вызов регрессии опухоли (уменьшение размера опухоли), вызов уменьшения метастазирования, улучшение жизненных функций пациента, улучшение самочувствия пациента, уменьшение боли, улучшение аппетита, улучшение веса пациента и любую их комбинацию. Термины «фармацевтически эффективное количество», «терапевтически эффективное количество» или «терапевтически эффективная доза» также относятся к количеству, необходимому для улучшения клинических симптомов пациента. Терапевтические способы или способы лечения рака, описанные в данном документе, не должны интерпретироваться или иным образом ограничиваться «лечением» рака.
[60] Используемый в данном документе термин «лечащий» или «лечение» включает изменение, уменьшение или остановку симптомов, клинических признаков и патологии, лежащей в основе состояния, таким образом, чтобы улучшить или стабилизировать состояние субъекта. Как используется в данном документе и хорошо понятно в данной области техники, «лечение» представляет собой подход для получения полезных или желаемых результатов, включая клинические результаты. Благоприятные или желательные клинические результаты могут включать, но не ограничиваются этим, уменьшение, улучшение или замедление прогрессирования одного или более симптомов или состояний, связанных с состоянием, например, раком, уменьшение степени заболевания, стабилизированное состояние заболевания (т.е. не ухудшение), задержку или замедление прогрессирования заболевания, улучшение или смягчение состояния заболевания и ремиссию (частичную или полную), определяемую или не определяемую. «Лечение» также может означать увеличение выживаемости по сравнению с ожидаемой выживаемостью, если лечение не проводится. Типичные полезные клинические результаты описаны в данном документе.
[61] «Назначение» или «введение» вещества, соединения или агента субъекту может осуществляться с использованием одного из множества способов, известных специалистам в данной области. Например, соединение или агент можно вводить внутривенно, артериально, внутрикожно, внутримышечно, внутрибрюшинно, подкожно, через глаза, сублингвально, перорально (путем приема внутрь), интраназально (путем ингаляции), интраспинально, интрацеребрально и трансдермально (путем абсорбции, например, через кожный проток). Соединение или агент также можно соответствующим образом вводить с помощью перезаряжаемых или биоразлагаемых полимерных устройств или других устройств, например пластырей и насосов, или составов, которые предусматривают пролонгированное, медленное или контролируемое высвобождение соединения или агента. Введение также может быть выполнено, например, один раз, множество раз и/или в течение одного или более продолжительных периодов. В некоторых аспектах введение включает как прямое введение, включая самостоятельное введение, так и косвенное введение, включая действие назначенного лекарственного средства. Например, как используется в данном документе, врач, который инструктирует пациента как самостоятельно вводить лекарственное средство или назначает лекарственное средство другому лицу и/или который предоставляет пациенту рецепт на лекарство, вводит лекарственное средство пациенту. Когда способ является частью терапевтического режима, включающего более одного агента или метода лечения, в раскрытии изобретения предполагается, что агенты могут вводиться в одно и то же или в разное время и одним и тем же или разными путями введения. Подходящие способы введения вещества, соединения или агента субъекту также будут зависеть, например, от возраста субъекта, является ли субъект активным или неактивным во время введения, имеет ли субъект когнитивное нарушение во время введения, степени нарушения и химического и биологического свойства соединения или агента (например, растворимости, усвояемости, биодоступности, стабильности и токсичности).
[62] Термин «замещенный» относится к фрагментам, имеющим заместители, замещающие водород в одном или более из атомов углерода основной цепи химического соединения. Понятно, что «замещение» или «замещенный» включает неявное условие, что такое замещение соответствует допустимой валентности замещенного атома и заместителя, и что замещение приводит к стабильному соединению, например, которое самопроизвольно не подвергается трансформации, такой как перегруппировка, циклизация, удаление и т. д. Используемый в данном документе термин «замещенный» предполагает включение всех допустимых заместителей органических соединений. В широком аспекте допустимые заместители включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Допустимые заместители могут быть одним или более, одинаковыми или разными для соответствующих органических соединений. Для целей настоящего изобретения, гетероатомы, такие как азот, могут иметь водородные заместители и/или любые допустимые заместители органических соединений, описанных в данном документе, которые удовлетворяют валентности гетероатомов. Заместители могут включать любые заместители, описанные в данном документе, например, галогенный, гидроксильный, карбонильный (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонильный (такой как тиоэфир, тиоацетат или тиоформиат) алкоксильный, алкилтио, ацилокси, фосфорильный, фосфатный, фосфонатный, амино, амидо, амидин, имин, циано, нитро, азидо, сульфгидрильный, алкилтио, сульфатный, сульфонатный, сульфоноильная, сульфонамидо, сульфонильный, гетероциклильный, аралкильный или ароматический (например, C6-C12 арил) или гетероароматический (например, гетероарильная) фрагмент.
[63] «Необязательный» или «необязательно» означает, что описанное далее обстоятельство может возникать или не возникать, поэтому в заявку включаются случаи, когда это обстоятельство возникает, и случаи, когда этого не происходит. Например, фраза «необязательно замещенный» означает, что неводородный заместитель может присутствовать или не присутствовать на данном атоме, и, таким образом, заявка включает структуры, в которых присутствует неводородный заместитель, и структуры, в которых неводородный заместитель не присутствует.
[64] Если специально не указано, что они являются «незамещенными», ссылки на химические фрагменты в данном документе понимаются как включающие замещенные варианты. Например, ссылка на «алкильную» группу или фрагмент неявно включает как замещенные, так и незамещенные варианты. Примеры заместителей на химических фрагментах включают, но не ограничиваются ими, фрагменты: галоген, гидроксил, карбонил (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонил (такой как тиоэфир, тиоацетат или тиоформиат), алкоксил, алкилтио, ацилокси, фосфорил, фосфат, фосфонат, амино, амидо, амидин, имин, циано, нитро, азидо, сульфгидрил, алкилтио, сульфат, сульфонат, сульфамоил, сульфонамидо, сульфонил, гетероциклил, аралкил или арил или гетероарил.
[65] «Арил» обозначает ароматическое углеродное кольцо, имеющее указанное число атомов углерода, например, от 6 до 12 или от 6 до 10 атомов углерода в кольце. Арильные группы могут быть моноциклическими или полициклическими (например, бициклическими, трициклическими). В некоторых случаях оба кольца полициклической арильной группы являются ароматическими (например, нафтил). В других случаях полициклические арильные группы могут включать неароматическое кольцо (например, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил), конденсированный с ароматическим кольцом, при условии, что полициклическая арильная группа связана с исходной структурой через атом в ароматическом кольце. Таким образом, 1,2,3,4-тетрагидронафталин-5-ильная группа (где фрагмент связан с исходной структурой через ароматический атом углерода) считается арильной группой, тогда как 1,2,3,4-тетрагидронафталин-1-ил (где фрагмент связан с исходной структурой через неароматический атом углерода) не считается арильной группой. Точно так же, l, 2,3,4-тетрагидрохинолин-8-ильная группа (где фрагмент связан с исходной структурой через ароматический атом углерода) считается арильной группой, тогда как 1,2,3,4-тетрагидрохинолин-1-ильная группа (где фрагмент связан с исходной структурой через неароматический атом азота) не считается арильной группой. Однако термин «арил» не охватывает или не перекрывается с «гетероарилом», как определено в настоящем документе, независимо от точки присоединения (например, как хинолин-5-ил, так и хинолин-2-ил являются гетероарильными группами).
[66] «Гетероарил» означает ароматическое кольцо, содержащее указанное число атомов кольца (например, 5-12- или 5-10-членный гетероарил), состоящее из одного или более гетероатомов (например, 1, 2, 3 или 4 гетероатома), выбранных из N , O и S, и с остальными атомами кольца, являющимися углеродом. 5-членный гетероарил является гетероарилом с 5ью атомами в кольце. 6-членный гетероарил является гетероарилом с 6-тью атомомами в кольце. Гетероарильные группы не содержат соседних атомов S и O. В некоторых вариантах воплощения общее количество атомов S и O в гетероарильной группе равно не более 2. В некоторых вариантах воплощения общее количество атомов S и O в гетероарильной группе равно не более 1. Если не указано иное, гетероарильные группы могут быть связаны с исходной структурой атомом углерода или азота, если позволяет валентность. Например, «пиридил» включает 2-пиридильную, 3-пиридильную и 4-пиридильную группы, а «пирролил» включает 1-пирролильную, 2-пирролильную и 3-пирролильную группы. Когда азот присутствует в гетероарильном кольце, он может, где позволяет природа соседних атомов и групп, существовать в окисленном состоянии (то есть, N+-O-). Кроме того, когда сера присутствует в гетероарильном кольце, она может, где позволяет природа соседних атомов и групп, существовать в окисленном состоянии (то есть S+-O- или SO2). Гетероарильные группы могут быть моноциклическими или полициклическими (например, бициклическими, трициклическими).
[67] В некоторых случаях гетероарильная группа является моноциклической. Примеры включают пиррол, пиразол, имидазол, триазол (например, 1,2,3-триазол, 1,2,4-триазол, 1,3,4-триазол), тетразол, фуран, изоксазол, оксазол, оксадиазол (например, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,3,4-оксадиазол), тиофен, изотиазол, тиазол, тиадиазол (например, 1,2,3-тиадиазол, 1,2,4-тиадиазол, 1,3,4-тиадиазол), пиридин, пиридазин, пиримидин, пиразин, триазин (например, 1,2,4-триазин, 1,3,5-триазин) и тетразин.
[68] Термин «ацил» известен в данной области техники и относится к группе, представленной общей формулой гидрокарбил-C(O)-, например, алкил-C(O)-.
[69] Термин «алкил» относится к радикалу насыщенных алифатических групп, включая алкильные группы с прямой цепью и алкильные группы с разветвленной цепью. В некоторых вариантах воплощения алкил с прямой или разветвленной цепью имеет 30 или менее атомов углерода в своей основной цепи (например, C1-C30 для прямых цепей, C4-C30 для разветвленных цепей), а в других вариантах воплощения 20 или менее. В некоторых вариантах воплощения алкильные группы представляют собой низшие алкильные группы, например, метил, этил, n-пропил, i-пропил, n-бутил и n-пентил. Кроме того, термин «алкил», используемый в описании, примерах и формуле изобретения, предназначен для обозначения как «незамещенных алкилов», так и «замещенных алкилов», последний из которых относится к алкильным группам, имеющим заместители, замещающие водород на одном или более атомах углерода В некоторых вариантах воплощения алкил с прямой или разветвленной цепью имеет 30 или менее атомов углерода в своей основной цепи (например, C1-C30 для прямых цепей, C3-C30 для разветвленных цепей). В некоторых вариантах воплощения цепь имеет десять или менее атомов углерода (C1-C10) в своей основной цепи. В других вариантах воплощения цепь имеет шесть или менее атомов углерода (C1-C6) в своей основной цепи.
[70] Термины «гидразоновый фрагмент» или «гидразон» относятся к E и/или Z гидразонам, например, 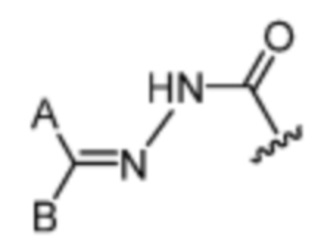 или
или 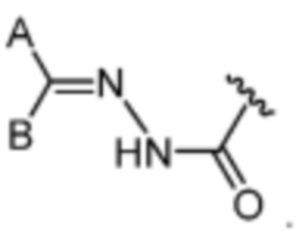 Стереохимия гидразонового фрагмента может быть E или Z. Термин гидразон, используемый в данном документе, включает как E, так и Z-изомеры. Гидразоновые фрагменты, раскрытые в данном документе, в общем, нарисованы в одной конфигурации, но понятно, что это изобретение может включать как E, так и/или Z.
Стереохимия гидразонового фрагмента может быть E или Z. Термин гидразон, используемый в данном документе, включает как E, так и Z-изомеры. Гидразоновые фрагменты, раскрытые в данном документе, в общем, нарисованы в одной конфигурации, но понятно, что это изобретение может включать как E, так и/или Z.
[71] В различных местах в настоящем описании заместители соединений согласно изобретению раскрыты в группах или в диапазонах. В частности, подразумевается, что настоящее изобретение включает каждую отдельную субкомбинацию членов таких групп и диапазонов. Например, термин «C1-C6 алкил» специально предназначен для индивидуального раскрытия метила, этила, пропила, изопропила, n-бутила, sec-бутила, изобутила и т.д.
[72] «Фармацевтически приемлемая соль» представляет собой соль соединения, которая подходит для фармацевтического применения, включая, но не ограничиваясь ими, соли металлов (например, натрия, калия, магния, кальция и т.д.), кислотно-аддитивные соли (например, минеральные кислоты, карбоновые кислоты и т.д.) и основные аддитивные соли (например, аммиак, органические амины и т. д.). Форма кислотно-аддитивной соли соединения, которое встречается в свободной форме в виде основания, может быть получена обработкой указанной формы свободного основания подходящей кислотой, такой как неорганическая кислота, например, галогенводородной, такой как соляная или бромистоводородная, серная, азотная, фосфорная кислота и т.п.; или органическая кислота, такая как, например, уксусная, гидроксиуксусная, пропановая, молочная, пировиноградная, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, p-толуолсульфоновая, циклическая, салициловая, p-аминосалициловая, памоевая и т.п. (см., например, WO 01/062726. Некоторые фармацевтически приемлемые соли перечислены в Berge et al., Journal of Pharmaceutical Sciences, 66: 1-19 (1977), полностью включенной в настоящий документ посредством ссылки). Соединения, содержащие кислотные протоны, могут быть преобразованы в их терапевтически активную нетоксичную основную аддитивную соль, например, соли металлов или аминов путем обработки соответствующими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, соли аммония, соли или ионы щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, N-метил-D-глюкамин, соли гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. И наоборот, указанные солевые формы можно превратить в свободные формы путем обработки подходящим основанием или кислотой. Соединения и их соли могут быть в форме сольватов, что входит в объем настоящего изобретения. Такие сольваты включают, например, гидраты, алкоголяты и т.п. (см., например, WO 01/062726).
[73] Настоящее изобретение дополнительно предусматривает фармацевтические композиции, содержащие одно или более соединений по изобретению вместе с фармацевтически приемлемым носителем или наполнителем. Соединения или фармацевтические композиции по изобретению могут быть использованы in vitro или in vivo.
[74] Используемый в данном документе термин «изомер» включает, но не ограничивается ими, таутомеры, цис- и транс-изомеры (E (entgegen), Z (zusammen)), R- и S-энантиомеры (указанные обозначения R и S используются в соответствии с правилами, описанными в Pure Appl. Chem. (1976), 45, 11-30), диастереомеры, (D)-изомеры, (L)-изомеры, стереоизомеры, их рацемические смеси и другие их смеси. Все такие изомеры, а также их смеси предназначены для включения в данное изобретение. Таутомеры, хотя это явно не указано в формулах, описанных в настоящем документе, предназначены для включения в объем настоящего изобретения.
[75] Настоящее изобретение дополнительно включает изотопно-меченные или обогащенные соединения настоящего изобретения. «Изотопно» или «радиоактивно меченное» соединение представляет собой соединение по настоящему изобретению, в котором один или более атомов заменены или замещены атомом, атомная масса или массовое число которого отличается от атомной массы или массового числа, обычно встречающихся в природе (т.е., природного происхождения). Подходящие радионуклиды, которые могут быть включены в соединения по настоящему изобретению, включают, но не ограничиваются ими, 2H (также обозначаемый как D для дейтерия), 3H (также обозначаемый как T для трития), 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 18F, 35S, 36Cl,82Br, 75Br, 76Br и 77Br. Радионуклид, который включен в настоящие радиомеченые соединения, будет зависеть от конкретного применения этого радиомеченного соединения. Например, для мечения металлопротеаз и конкурентного анализа in vitro соединения, которые включают 3H, 14C, 82Br, 35S или, как правило, будут наиболее используемыми. Для применений радиовизуализации, 11C, 18F, 75Br, 76Br или 77Br будут наиболее используемыми. Тритий (3H) и 14С могут использоваться для исследований ADME. В некоторых вариантах воплощения каждый алкил, циклоалкил, алкен, алкилен и алкокси необязательно замещен одним или более -D или -F.
Соединения согласно настоящему изобретению
[76] Варианты воплощения настоящего изобретения предусматривают соединение со структурой представленной формулы (I):
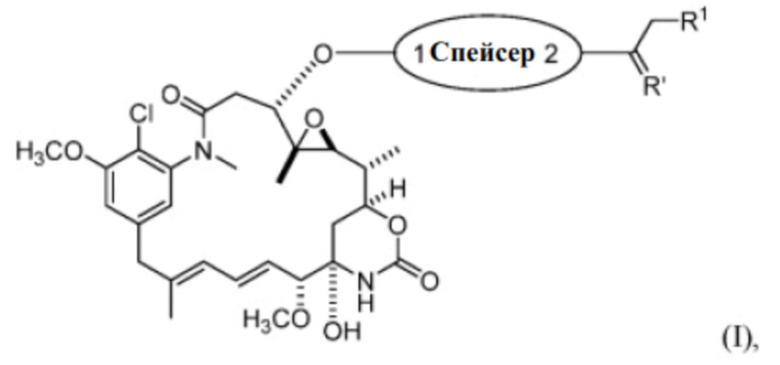
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
R1 выбран из -H и C1-C4 алкила;
Спейсер выбран из:
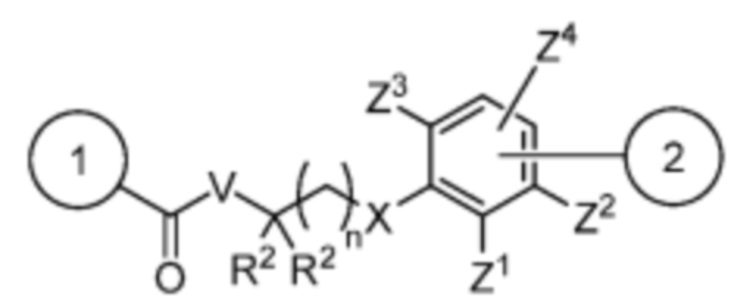 и
и 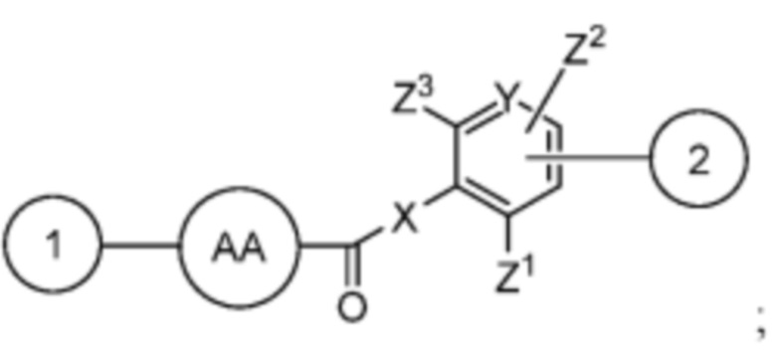
V отсутствует или выбран из -CH2-, -O- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
каждый R2 независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
n равно 0-3;
X отсутствует или выбран из -CH2-, -O-, -S-, -Se-, и -NR4-, где R4 представляет собой -H или C1-C4 алкил;
Y выбран из =CH- и =N-;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -CN, -NO2, C1-C4 алкила и C2-C4 алкокси;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этил-глицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты;
R’ выбран из O и 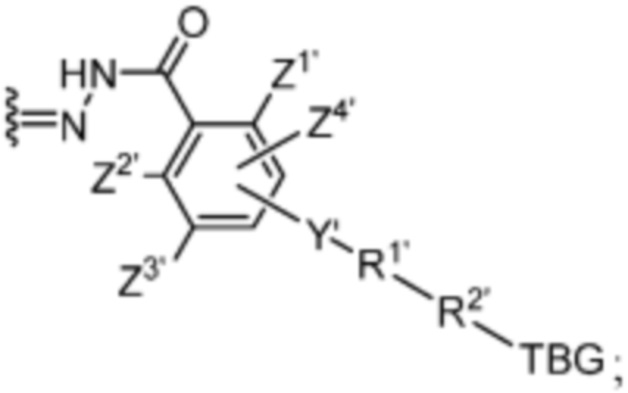
Y’ отсутствует или выбран из необязательно замещенного C1-C6 алкила, -NH-C(O)- и -C(О)-NH-; или Y’ выбран из группы, состоящей из:
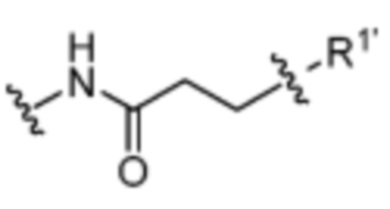 и
и 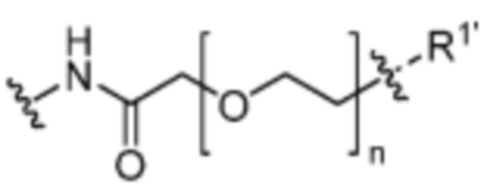
где n=0-6; R1’ отсутствует или выбран из группы, состоящей из:
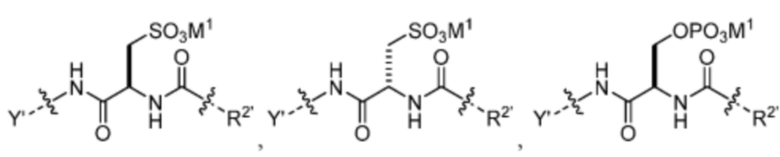 и
и 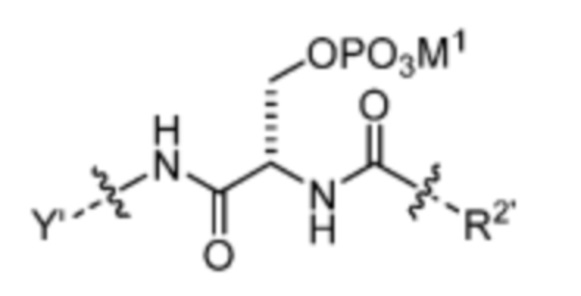
где M1 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
R2’ представляет собой необязательно замещенный C1-C18 алкил, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-;
Z1’, Z2’, Z3’ и Z4’ каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -CN, -NO2, -SO3M2 и C1-C4 алкила, где M2 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
TBG представляет собой тиолсвязывающую группу, выбранную из необязательно замещенной малеимидной группы, необязательно замещенной галоацетамидной группы, необязательно замещенной галоацетатной группы, необязательно замещенной пиридилтиогруппы, необязательно замещенной изотиоцианатной группы, необязательно замещенной винилкарбонильной группы, необязательно замещенной азиридиновой группы, необязательно замещенной дисульфидной группы, необязательно замещенной ацетиленовой группы и необязательно замещенной N-гидроксисукцининидной эфирной группы;
где указанная TBG необязательно связана с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли.
[77] В некоторых вариантах воплощения в соединении формулы (I), R1 выбран из -H и C1-C4 алкила;
Спейсер выбран из:
 и
и 
V отсутствует или выбран из -CH2-, -O- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
каждый R2 независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
n равно 0-3;
X отсутствует или выбран из -CH2-, -О-, -S-, -Se-, и -NR4-, где R4 представляет собой -H или C1-C4 алкил;
Y выбран из =CH- и =N-;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), - CF3, -OCH3, -CN, -NO2, C1-C4 алкила и C2-C4 алкокси;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты; R’ выбран из O и 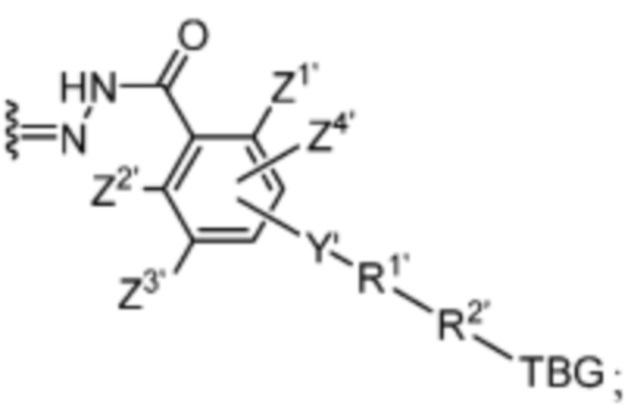
Y’ отсутствует или выбран из необязательно замещенного C1-C6 алкила, -NH-C(O)- и -C(О)-NH-; или Y’ выбран из группы, состоящей из:
 и
и 
где n=0-6;
R1’ отсутствует или выбран из группы, состоящей из:
 и
и 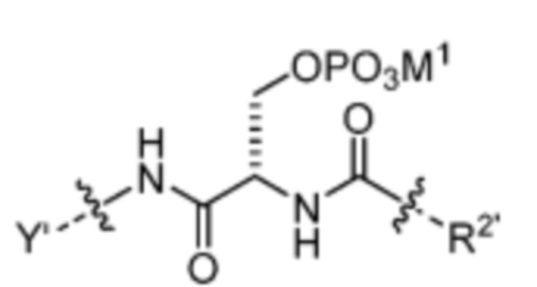
где M1 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
R2’ представляет собой необязательно замещенный C1-C18 алкил, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-;
Z1’, Z2’, Z3’ и Z4’ каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -CN, -NO2, -SO3M2 и C1-C4 алкила, где M2 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
TBG представляет собой тиолсвязывающую группу, выбранную из необязательно замещенной малеимидной группы, необязательно замещенной галоацетамидной группы, необязательно замещенной галоацетатной группы, необязательно замещенной пиридилтиогруппы, необязательно замещенной изотиоцианатной группы, необязательно замещенной винилкарбонильной группы, необязательно замещенной азиридиновой группы, необязательно замещенной дисульфидной группы, необязательно замещенной ацетиленовой группы и необязательно замещенной N-гидроксисукцининидной эфирной группы;
[78] при этом, указанная TBG, необязательно связана с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли.
[79] В некоторых вариантах воплощения R’ представляет собой O. Эти новые соединения могут представлять собой активные вещества и могут быть, например, активным компонентом системы доставки лекарств или активным метаболитом, который высвобождается из системы доставки лекарств.
[80] В некоторых вариантах воплощения соединение формулы (I), где R’ представляет собой O, имеет структуру любой из формул (II’), (III’) и (IV’):
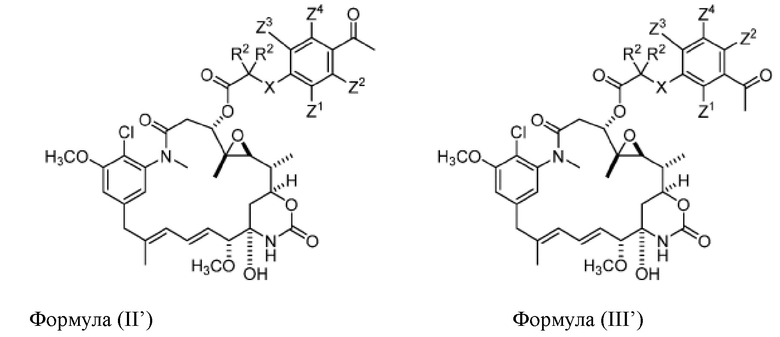
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
каждый R2 независимо выбран из -H и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -NO2 и -CH3;
Формула (IV’)
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
X отсутствует или выбран из -CH2- и -NH-;
Y представляет собой =CH- или =N-;
Z1, Z2, Z3 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I),
-CF3, -OCH3, -NO2 и -CH3;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этил-глицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты.
[81] В других вариантах воплощения в соединениях формулы (IV’):
X отсутствует или выбран из -CH2- и -NH-; Y представляет собой =CH- или =N-;
Z1, Z2, Z3 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I),
-CF3, -OCH3, -NO2 и -CH3;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты.
[82] В некоторых вариантах воплощения соединение выбрано из следующих конкретных соединений:
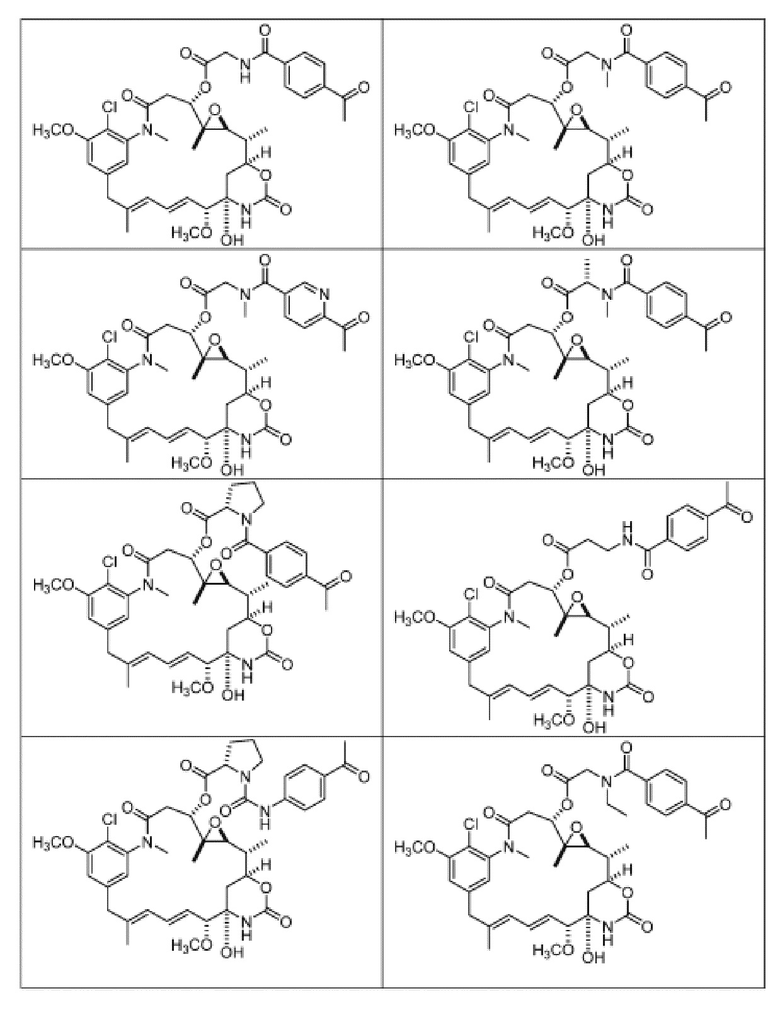
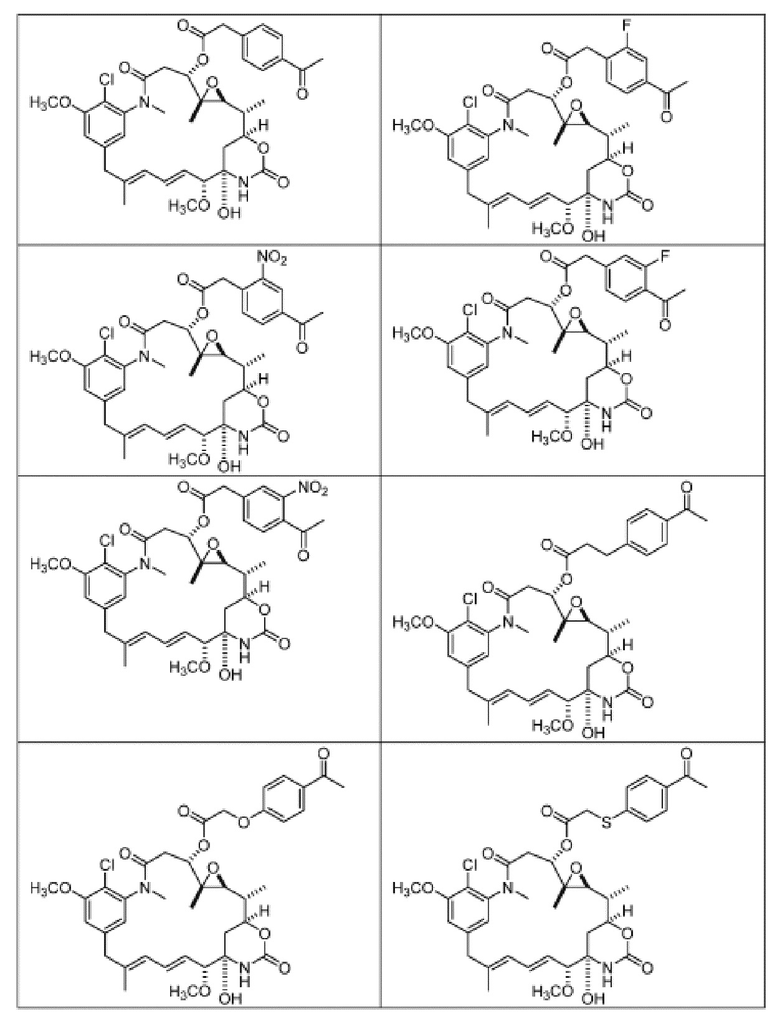
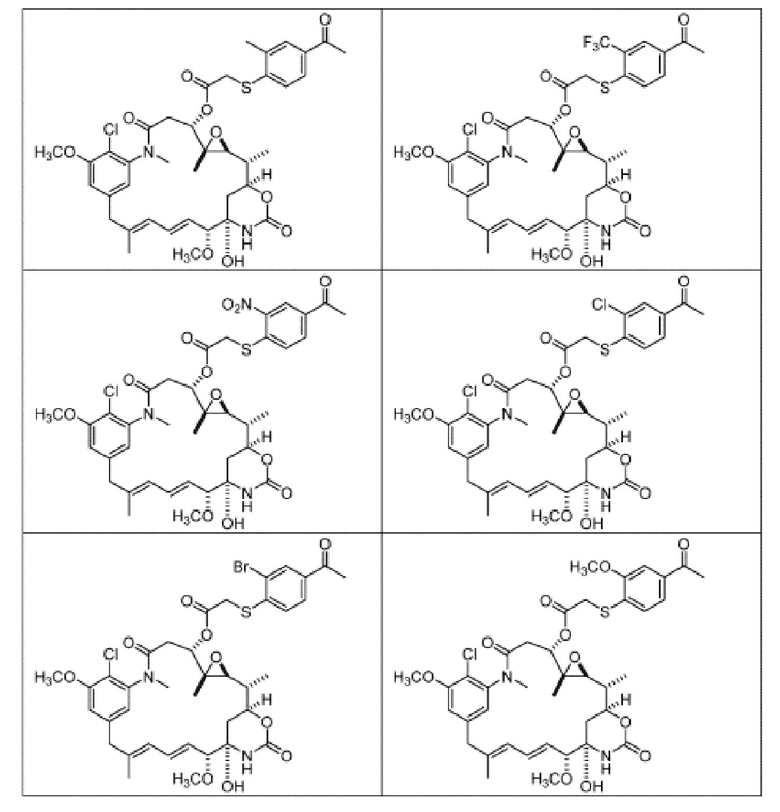
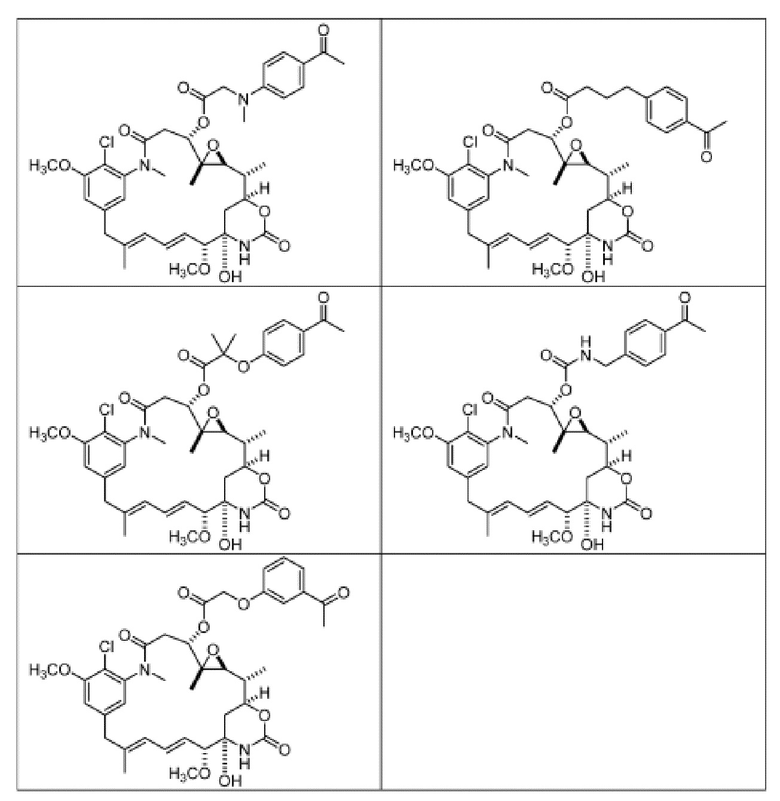
или их фармацевтически приемлемой соли, гидрата, сольвата или изомера.
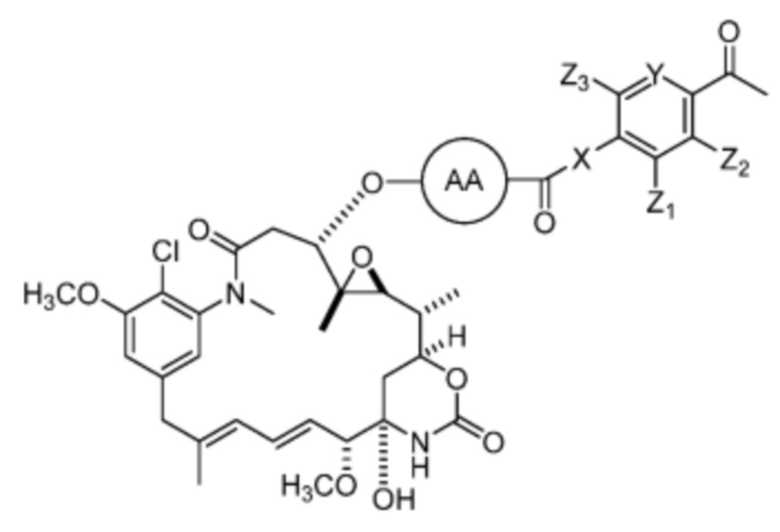
[83] Другие варианты воплощения включают пролекарства, например пролекарства, представленные формулой (I), где R’ представляет собой: 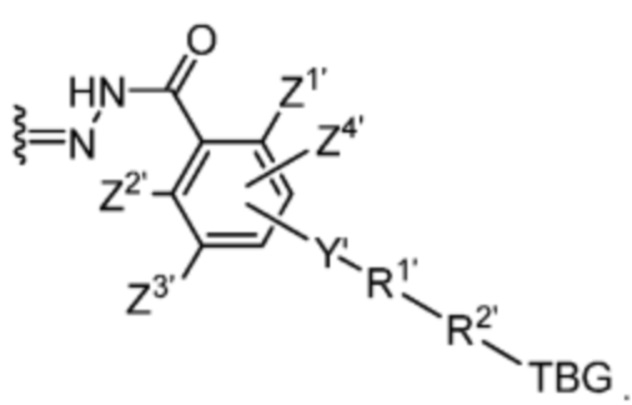
Эти новые соединения могут представлять собой систему доставки лекарств, посредством которой активный метаболит селективно высвобождается из системы доставки лекарств. Они включают, например, альбумин-связывающие пролекарства.
[84] В определенных вариантах воплощения эти соединения имеют структуру любой из формул (II), (III) и (IV):
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
каждый R2 независимо выбран из -H, и C1-C4 алкила или два R2 вместе образуют C3- C6-циклоалкил;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -NO2 и -CH3;
Формула (IV)
или его фармацевтически приемлемой соли, гидрата, сольвата или изомера, где:
X отсутствует или выбран из -CH2- и -NH-;
Y представляет собой =CH- или =N-;
Z1, Z2, Z3 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), - CF3, -OCH3, -NO2 и -CH3;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этил-глицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты; и
где R’ представляет собой:
[85] В других вариантах воплощения в соединениях формулы (IV’):
X отсутствует или выбран из -CH2- и -NH-;
Y представляет собой =CH- или =N-; Z1, Z2, Z3 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), - CF3, -OCH3, -NO2 и -CH3;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, D или L аланина, D или L N-метилаланина, β-аланина, N-метил-β-аланина, α-аминоизобутановой кислоты и N-метил-α-аминоизобутановой кислоты; и
где R’ представляет собой:
[86] В некоторых вариантах воплощения R1 представляет собой -H. В других вариантах воплощения по меньшей мере один из Z1, Z2, Z3 и Z4 не является H и/или по меньшей мере один из Z1, Z2, Z3 и Z4 представляет собой -F или -NO2. В некоторых вариантах осуществления, когда n равно 0, X отсутствует. В других вариантах осуществления, когда n равно 0, X представляет собой -CH2-. В некоторых вариантах воплощения n равно 0, а X представляет собой -O- или -S-. Дополнительные варианты воплощения включают фармацевтически приемлемые соли, сольваты, гидраты, таутомеры и твердые формы соединений по настоящему изобретению.
[87] В некоторых вариантах воплощения соединение выбрано из следующих конкретных соединений:
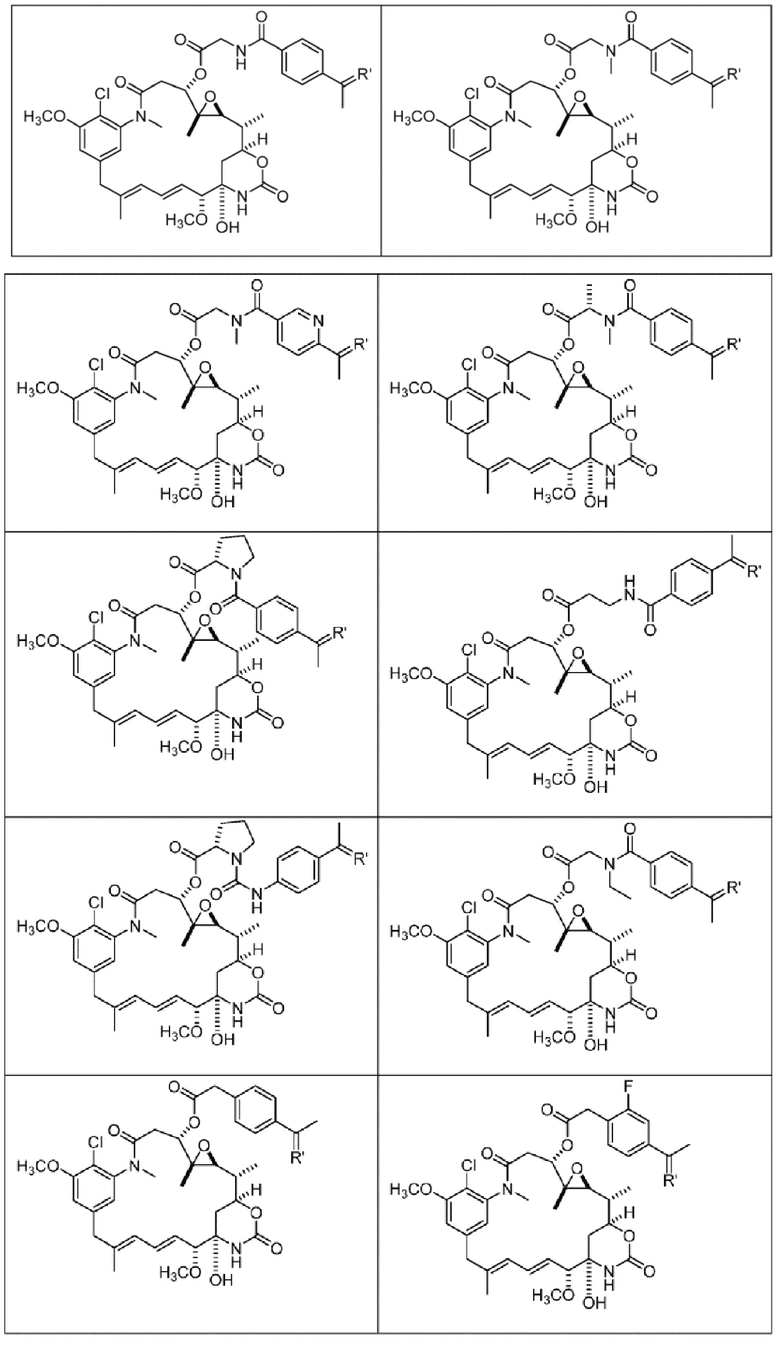
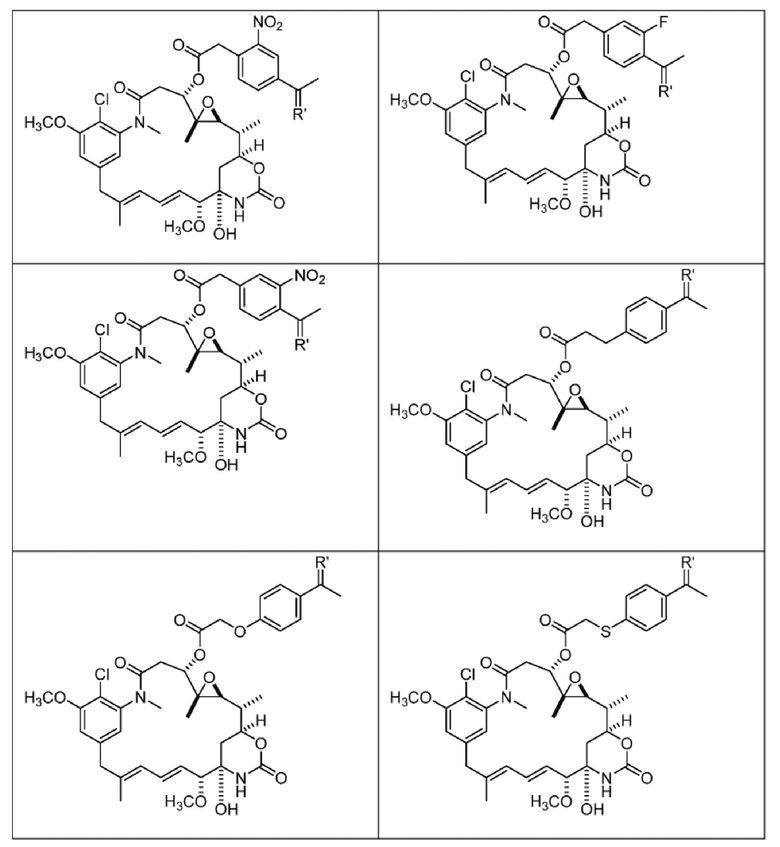
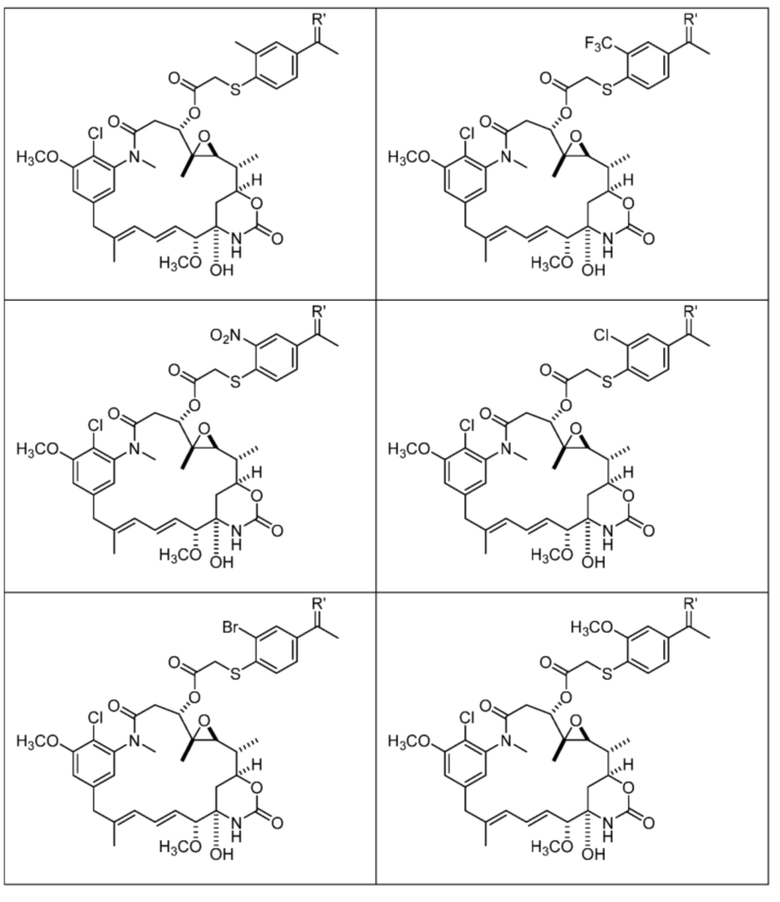
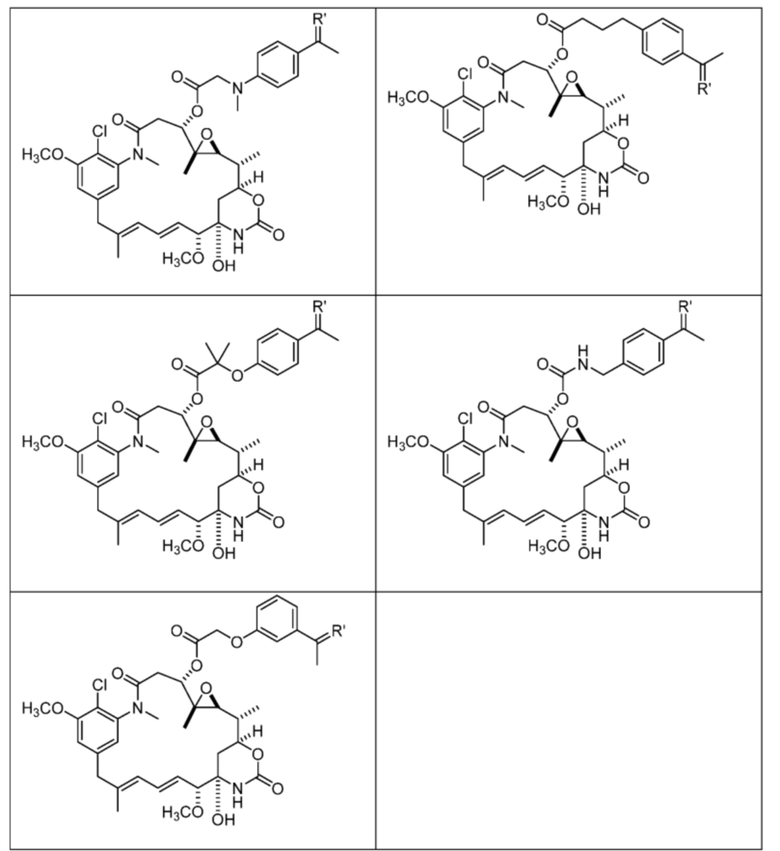
или их фармацевтически приемлемой соли, гидрата, сольвата или изомера.
[88] В определенных вариантах воплощения соединение не связываться с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли. В других вариантах воплощения соединение связываться с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли. Например, тиолсодержащий макромолекулярный носитель или тиолсодержащий носитель, специфичный для опухоли, выбран из эндогенного альбумина, экзогенного альбумина, антитела, фрагмента антитела, пептида, природного или синтетического полимера, липосомы и наночастицы.
[89] В некоторых вариантах воплощения TBG является необязательно замещенной малеимидной группой, например, незамещенной малеимидной группы. В некоторых вариантах воплощения малеимидная группа связывается быстро и селективно с цистеином-34 альбумина после введения субъекту, такому как человек.
[90] В некоторых вариантах воплощения Z1’ выбран из -NO2 или -SO3M2 и/или и Y’ выбран из -NHC(O)- или 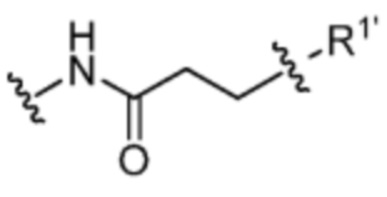 . В некоторых вариантах воплощения R1’ представляет собой
. В некоторых вариантах воплощения R1’ представляет собой 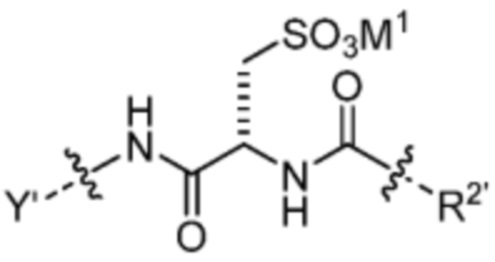 . В некоторых вариантах воплощения R2’ выбран из необязательно замещенного C1-C18 алкила, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2- (например, 1, 2, 3, 4, 5 или 6 атомы углерода заменены с -OCH2CH2-).
. В некоторых вариантах воплощения R2’ выбран из необязательно замещенного C1-C18 алкила, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2- (например, 1, 2, 3, 4, 5 или 6 атомы углерода заменены с -OCH2CH2-).
[91] В некоторых вариантах воплощения R’ представляет собой:
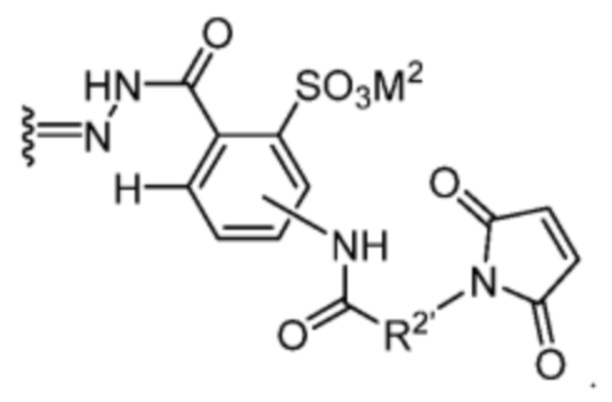
Например, R’ может быть: 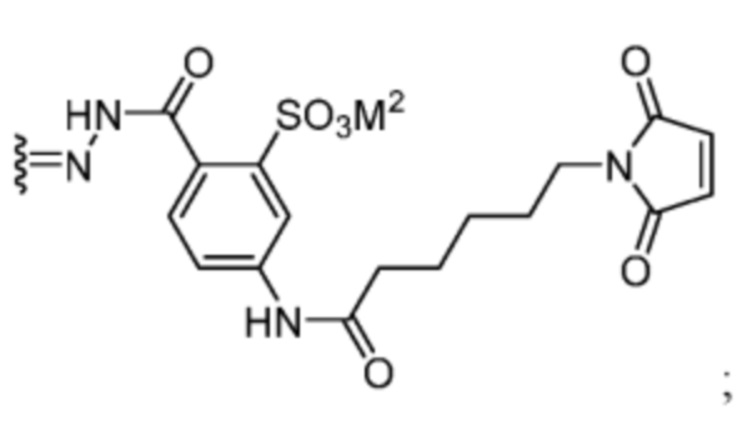
 или
или 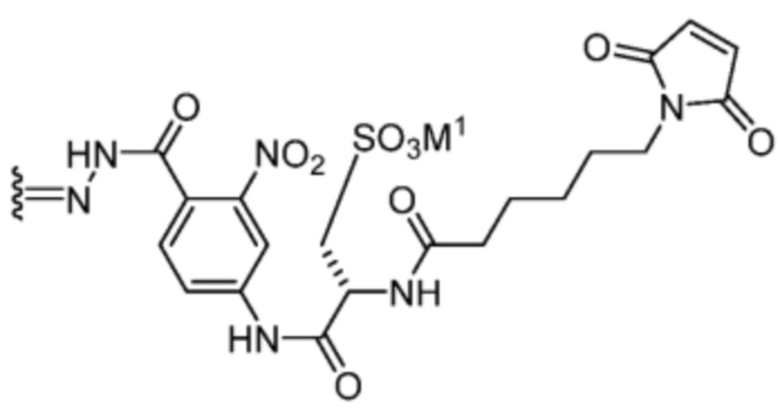
[92] Конкретные соединения в рамках настоящего изобретения включают следующие:
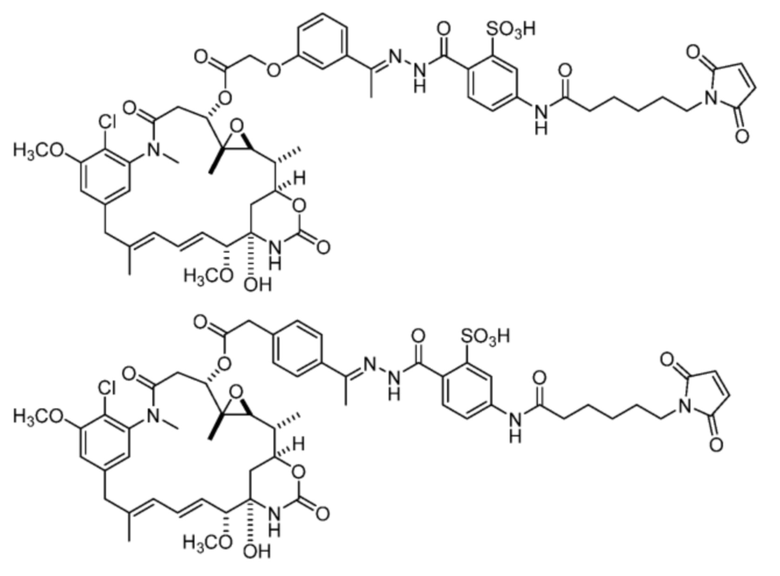
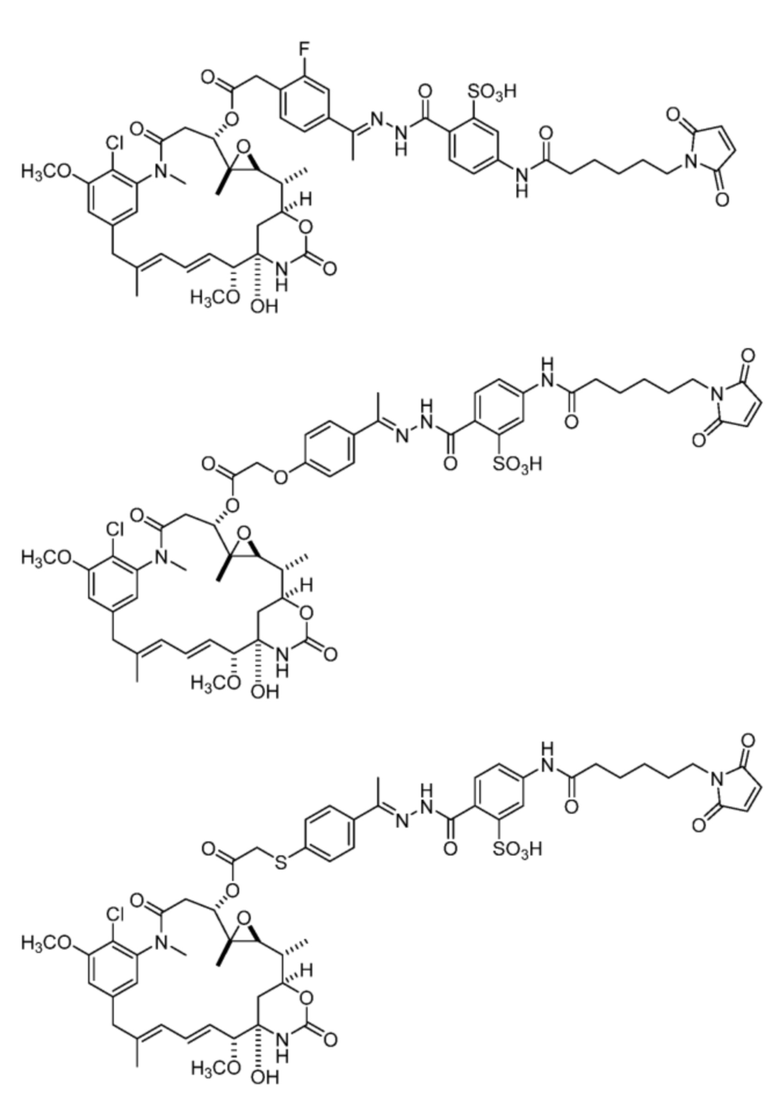
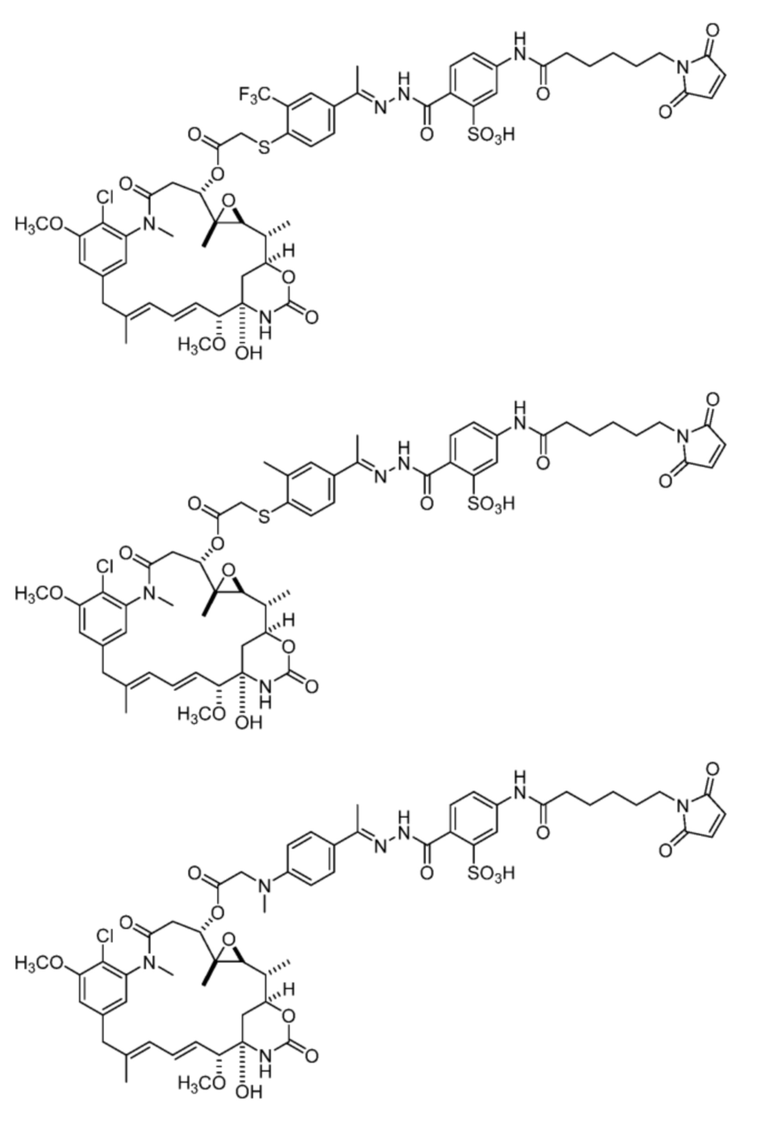
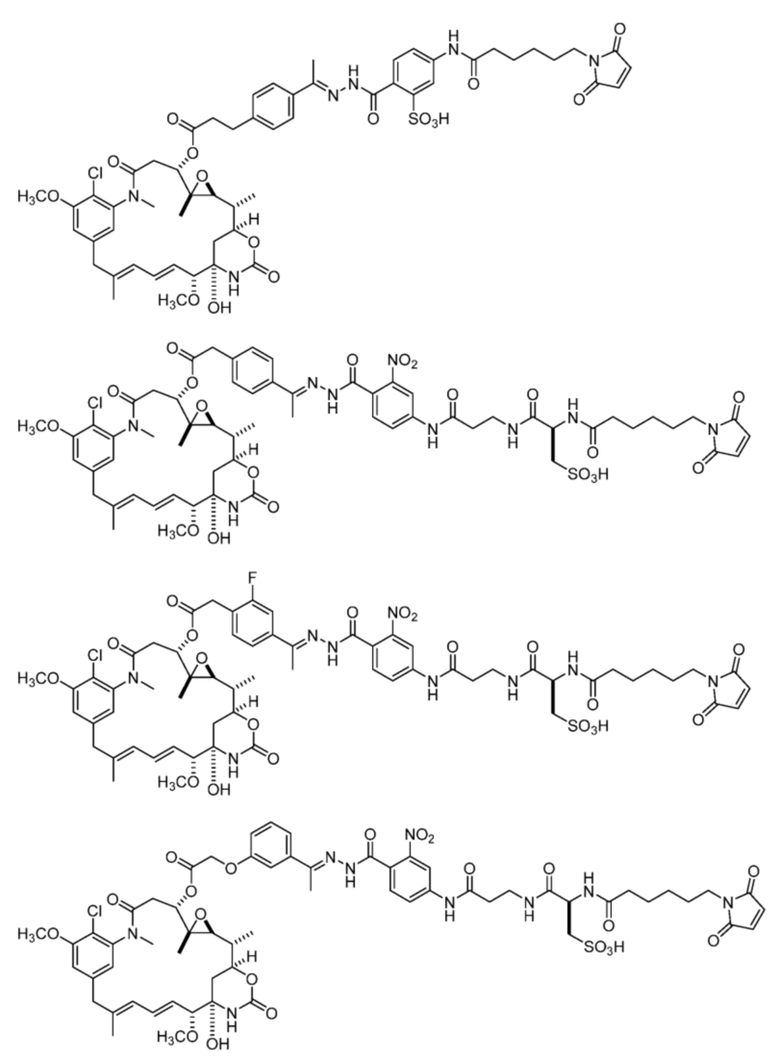
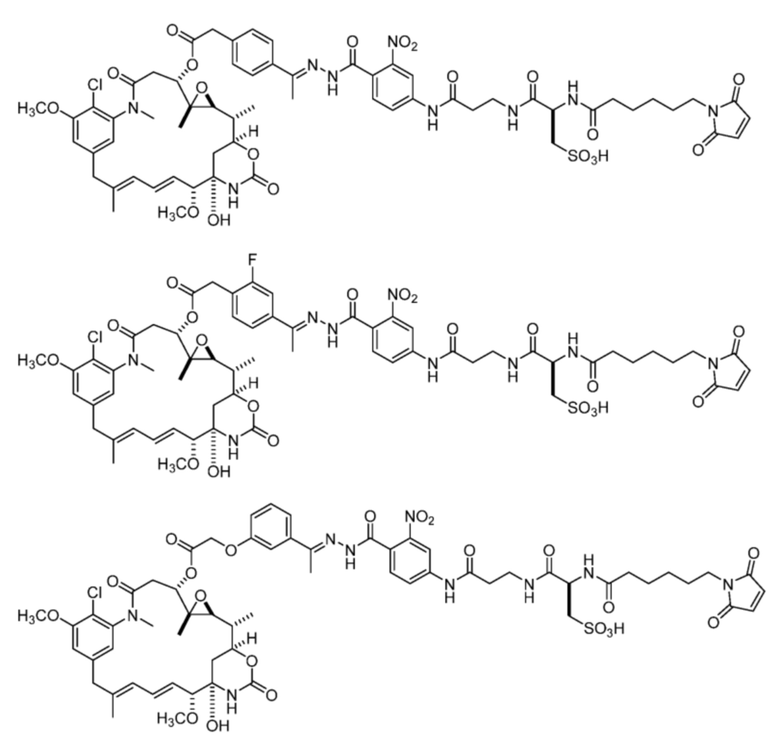
или их фармацевтически приемлемую соль, гидрат, сольват или изомер.
Фармацевтические композиции
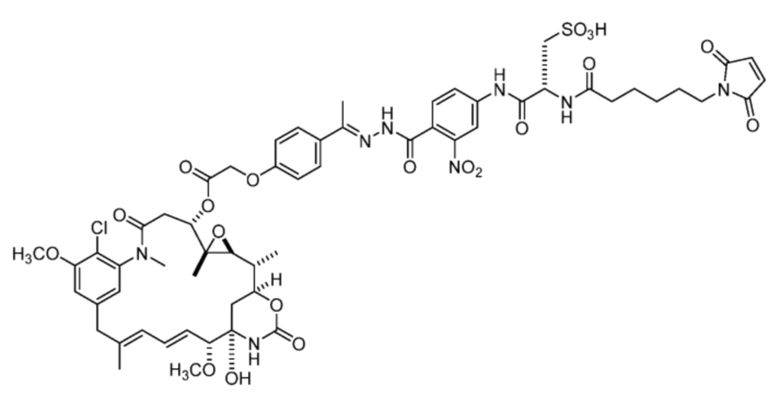
[93] В некоторых вариантах воплощения настоящее изобретение относится к фармацевтической композиции, содержащей соединение, описанное в данном документе. В некоторых вариантах воплощения композиция включает соединение формулы (I), где R’ представляет собой: 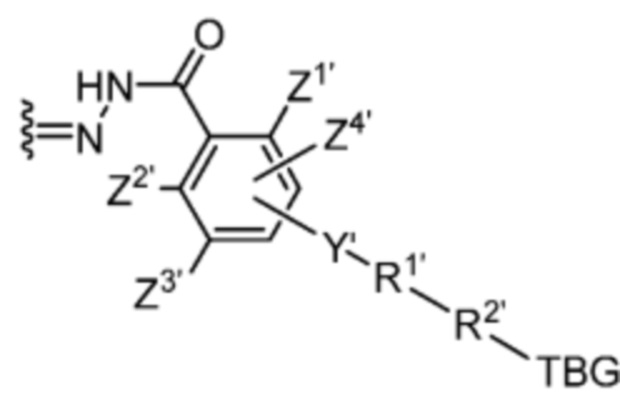 , или различные варианты осуществления, раскрытые в данном документе.
, или различные варианты осуществления, раскрытые в данном документе.
[94] Общее количество соединения в композиции для введения пациенту является таким, которое подходит для этого пациента. Специалист в данной области техники поймет, что разным людям может потребоваться разное общее количество терапевтически эффективного вещества. В некоторых вариантах воплощения количество соединения представляет собой фармацевтически эффективное количество. Специалист в данной области сможет определить количество соединения в композиции, необходимое для лечения пациента, на основе таких факторов, как, например, возраст, вес и физическое состояние пациента. Концентрация соединения зависит от его растворимости в растворе для внутривенного введения и от объема жидкости, который можно вводить. Например, концентрация соединения может составлять от приблизительно 0,1 мг/мл до приблизительно 50 мг/мл в инъецируемой композиции. В некоторых вариантах воплощения концентрация соединения может находиться в диапазоне от приблизительно 0,1 до приблизительно 40 мг/мл.
[95] Фармацевтические композиции и наборы по настоящему изобретению могут также содержать разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы, защитные средства и другие материалы, хорошо известные в данной области техники. Термин «фармацевтически приемлемый» означает нетоксичный материал, который не влияет на эффективность биологической активности активного ингредиента(ов). Характеристики носителя будут зависеть от способа введения.
[96] Композиции можно вводить различными обычными способами. Типичные пути введения, которые можно использовать, включают пероральный, парентеральный, внутривенный, внутриартериальный, кожный, подкожный, внутримышечный, местный, внутричерепной, интраорбитальный, офтальмологический, интравитреальный, интравентрикулярный, внутрикапсулярный, интраспинальный, внутрицистернальный, внутрибрюшинный, интраназальный, аэрозольный, аэрозольный, введение через центральную нервную систему (ЦНС) или суппозиторий. В некоторых вариантах композиции подходят для парентерального введения. Эти композиции можно вводить, например, внутрибрюшинно, внутривенно или интратекально. В некоторых вариантах композиции вводят внутривенно. В некоторых вариантах воплощения восстановленную композицию можно приготовить путем восстановления композиции лиофилизированного соединения в восстановительной жидкости, содержащей, например, спирт, ДМСО и/или полиэтиленгликоль и воде и/или солевом буфере. Такое восстановление может включать добавление восстановительной жидкости и перемешивание, например, путем перемешивания или встряхивания смеси. Затем восстановленную композицию можно сделать подходящей для инъекции путем смешивания, например, раствора лактированного Рингера, 5% раствора глюкозы, изотонического солевого раствора или подходящего солевого буфера с композицией для создания инъецируемой композиции. Специалист в данной области техники поймет, что способ введения терапевтически эффективного состава или композиции вещества будет зависеть от таких факторов, как возраст, вес и физическое состояние пациента, которого лечат, и заболевания или состояния, которое лечат. Таким образом, квалифицированный специалист сможет выбрать способ введения, оптимальный для пациента, в каждом конкретном случае.
[97] В некоторых вариантах воплощения соединения и композиции, раскрытые в данном документе, предназначены для применения при лечении рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами.
[98] В некоторых вариантах воплощения соединение, раскрытое в данном документе, может быть использовано при производстве лекарственного средства для лечения заболевания, выбранного из рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами.
[99] В некоторых вариантах воплощения рак представляет собой рак крови или солидный рак. В некоторых вариантах воплощения рак выбран из карциномы, саркомы, лейкоза, лимфомы, множественной миеломы и меланомы.
[100] В некоторых вариантах раком является аденокарцинома, увеальная меланома, острый лейкоз, акустическая неврома, карцинома левого желудочка, анальная карцинома, астроцитома, базалиома, рак поджелудочной железы, опухоль соединительной ткани, рак мочевого пузыря, бронхиальная карцинома, немелкоклеточная бронхиальная карцинома, рак молочной железы, лимфома Беркитта, карцинома тела, синдром CUP, рак толстой кишки, рак тонкой кишки, рак яичников, карцинома эндометрия, рак желчного пузыря, карцинома желчного пузыря, рак матки, рак шейки матки, опухоли шеи, носа и ушей, гематологические неоплазии, лейкоз ворсистых клеток, рак уретры, рак кожи, глиомы, рак яичка, саркома Капоши, рак гортани, рак кости, колоректальный рак, опухоли головы/шеи, карцинома толстой кишки, краниофарингеома, рак печени, лейкоз, рак легких, немелкоклеточный рак легких, Лимфома Ходжкина, неходжкинская лимфома, рак желудка, рак толстой кишки, медуллобластома, меланома, менингиома, рак почки, почечно-клеточная карцинома, олигодендроглиома, рак пищевода, остеолитическая и остеопластическая карцинома, остеосаркома, рак яичника, карцинома поджелудочной железы, рак полового члена, рак простаты, рак языка, рак яичника или рак лимфатического узла.
[101] В некоторых вариантах воплощения настоящее изобретение относится к набору, включающему соединение, как описано в настоящем документе, и фармацевтически приемлемый наполнитель, носитель и/или разбавитель.
[102] В некоторых вариантах воплощения в композицию могут быть включены один или боле наполнителей. Специалист в данной области поймет, что выбор любого одного наполнителя может влиять на выбор любого другого наполнителя. Например, выбор наполнителя может препятствовать использованию одного или более дополнительных наполнителей, поскольку комбинация наполнителей будет вызывать нежелательные эффекты. Специалист в данной области техники эмпирически сможет определить, какие наполнители, если таковые имеются, включать в композиции. Наполнители могут включать, но не ограничиваются ими, сорастворители, солюбилизирующие агенты, буферы, регуляторы рН, объемообразующие агенты, поверхностно-активные вещества, инкапсулирующие агенты, регуляторы тоничности, стабилизаторы, защитные средства и модификаторы вязкости. В некоторых вариантах воплощения может быть выгодным включение фармацевтически приемлемого носителя в композиции.
[103] В некоторых вариантах воплощения в композиции может быть включен солюбилизирующий агент. Солюбилизирующие агенты могут использоваться для повышения растворимости любого из компонентов композиции, включая соединение или наполнитель. Описанные в данном документе солюбилизирующие агенты не предназначены для составления исчерпывающего списка, а представлены только в качестве примерных солюбилизирующих агентов, которые можно использовать в композициях. В некоторых вариантах воплощения солюбилизирующие агенты включают, но не ограничиваются ими, этиловый спирт, трет-бутиловый спирт, полиэтиленгликоль, глицерин, пропиленгликоль, метилпарабен, пропилпарабен, полиэтиленгликоль, поливинилпирролидон, циклодекстрины, такие как диметил-β-циклодекстрин, гидроксиэтил-β-циклодекстрин, гидроксипропил-β-циклодекстрин и триметил-β-циклодекстрин и их комбинации, а также любые фармацевтически приемлемые соли и/или их комбинации
[104] pH композиций может быть любым pH, который обеспечивает желательные свойства для состава или композиции. Желательные свойства могут включать, например, стабильность соединения, повышенное удержание соединения по сравнению с композициями при других значениях рН и улучшенную эффективность фильтрации. В некоторых вариантах воплощения значение рН композиций может составлять от приблизительно 3,0 до приблизительно 9,0, например, от приблизительно 5,0 до приблизительно 7,0. В конкретных вариантах воплощения значение рН композиций может составлять 5,5±0,1, 5,6±0,1, 5,7±0,1, 5,8±0,1, 5,9±0,1, 6,0±0,1, 6,1±0,1, 6,2±0,1, 6,3±0,1, 6,4±0,1, 6,5±0,1,6,6±0,1, 6,7±0,1, 6,8±0,1, 6,9±0,1, 7,0±0,1, 7,1±0,1 и 7,2±0,1.
[105] В некоторых вариантах воплощения может быть выгодно буферировать рН путем включения одного или более буферов в композиции. В некоторых вариантах воплощения буфер может иметь pKa, например, приблизительно 5,5, приблизительно 6,0 или приблизительно 6,5. Специалист в данной области техники поймет, что подходящий буфер может быть выбран для включения в композиции на основе его pKa и других свойств. Буферы хорошо известны в данной области техники. Соответственно, описанные в данном документе буферы не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных буферов, которые могут использоваться в составах или композициях настоящего изобретения. В некоторых вариантах воплощения буфер включает, но не ограничивается ими, трис, трис-HCl, фосфат калия, фосфат натрия, цитрат натрия, аскорбат натрия, комбинации фосфата натрия и калия, трис/трис-HCl, бикарбонат натрия, фосфат аргинина, гидрохлорид аргинина, гидрохлорид гистидина, какодилат, сукцинат, 2-(N-морфолино)этансульфоновую кислоту (MES), малеат, бис-трис, фосфат, карбонат и любые фармацевтически приемлемые соли и/или их комбинации.
[106] В некоторых вариантах воплощения в композиции может быть включен регулятор рН. Изменение рН композиции может оказывать благоприятное воздействие, например, на стабильность или растворимость соединения, или может быть полезным при получении композиции, подходящей для парентерального введения. Регуляторы рН хорошо известны в данной области техники. Соответственно, регуляторы рН, описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных регуляторов рН, которые могут использоваться в композициях. Регуляторы рН могут включать, например, кислоты и основания. В некоторых вариантах воплощения регулятор рН включает, но не ограничивается ими, уксусную кислоту, соляную кислоту, фосфорную кислоту, гидроксид натрия, карбонат натрия и их комбинации.
[107] В некоторых вариантах воплощения в композиции может быть включен объемообразующий агент. Объемообразующие агенты обычно используются в лиофилизированных композициях, чтобы придать композиции дополнительный объем и обеспечить визуализацию композиции, особенно в тех случаях, когда лиофилизированный осадок будет трудно увидеть. Объемообразующие агенты также могут помочь предотвратить выброс активного компонента(ов) фармацевтической композиции и/или придать композиции криозащиту. Объемообразующие агенты хорошо известны в данной области техники. Соответственно, объемообразующие агенты, описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных объемообразующих агентов, которые могут использоваться в композициях.
[108] Типичные объемообразующие агенты могут включать углеводы, моносахариды, дисахариды, полисахариды, сахарные спирты, аминокислоты и сахарные кислоты и их комбинации. Углеводные объемообразующие агенты включают, но не ограничиваются ими, моно-, ди- или поликарбогидраты, крахмалы, альдозы, кетозы, аминосахары, глицеральдегид, арабинозу, ликсозу, пентозу, рибозу, ксилозу, галактозу, глюкозу, гексозу, идозу, маннозу, талозу, гептозу, глюкозу, фруктозу, метил-α-D-глюкопиранозид, мальтозу, лактон, сорбоз, эритрозу, треозу, арабинозу, аллозу, альтрозу, гулозу, идозу, талозу, эритрулозу, рибулозу, ксилозу, аллюлозу, тагатозу, глюкозамин, галактозамин, арабинаны, фруктаны, фуканы, галактаны, галактуронаны, глюканы, маннаны, ксиланы, инулин, леван, фукоидан, каррагинан, галактокаролоза, пектины, амилоза, пулулан, гликоген, амилопектин, целлюлозу, пустулан, хитин, агарозу, кератин, хондроитин, дерматан, гиалуроновую кислоту, ксантиновую камедь, сахарозу, трегалозу, декстран и лактозу. Объемообразующие агенты на основе сахарного спирта включают, но не ограничиваются ими, альдиты, инозиты, сорбит и маннит. Объемообразующие агенты на основе сахарной кислоты, включают, но не ограничиваются ими, альдоновые кислоты, уроновые кислоты, альдаровые кислоты, глюконовую кислоту, изоаскорбиновую кислоту, аскорбиновую кислоту, глюкарную кислоту, глюкуроновую кислоту, глюконовую кислоту, глюкариновую кислоту, галактуроновую кислоту, маннуроновую кислоту, нейраминовую кислоту, пектиновые кислоты и альгиновую кислоту. Аминокислотные объемообразующие агенты включают, но не ограничиваются ими, глицин, гистидин и пролин.
[109] В некоторых вариантах воплощения в композиции может быть включено поверхностно-активное вещество. Поверхностно-активные вещества, как правило, снижают поверхностное натяжение жидкой композиции. Это может обеспечить полезные свойства, такие как улучшенная простота фильтрации. Поверхностно-активные вещества также могут действовать как эмульгирующие агенты и/или солюбилизирующие агенты. Поверхностно-активные вещества хорошо известны в данной области техники. Соответственно, поверхностно-активные вещества, описанные в данном документе, не предназначены для составления исчерпывающего перечня, а представлены только в качестве примерных поверхностно-активных веществ, которые могут быть использованы в составах или композициях настоящего изобретения. Поверхностно-активные вещества, которые могут быть включены, включают, но не ограничиваются ими, сложные эфиры сорбита, такие как полисорбаты (например, полисорбат 20 и полисорбат 80), липополисахариды, полиэтиленгликоли (например, PEG 400 и PEG 3000), полоксамеры (то есть плуроники), этилен оксиды и полиэтиленоксиды (например, Triton X-100), сапонины, фосфолипиды (например, лецитин) и их комбинации.
[110] В некоторых вариантах воплощения в композиции может быть включен инкапсулирующий агент. Инкапсулирующие агенты могут изолировать молекулы и способствовать их стабилизации или растворению. Инкапсулирующие агенты хорошо известны в данной области техники. Соответственно, инкапсулирующие агенты, описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных инкапсулирующих агентов, которые могут использоваться в композициях. Инкапсулирующие агенты, которые могут быть включены в композиции, включают, но не ограничиваются ими, α-циклодекстрины, β-циклодекстрины, γ-циклодекстрин и их комбинации (например, α-циклодекстрин, диметил-α-циклодекстрин, гидроксиэтил-α-циклодекстрин, гидроксипропил-α-циклодекстрин, триметил-α-циклодекстрин, β-циклодекстрин, диметил-β-циклодекстрин, гидроксиэтил-β-циклодекстрин, гидроксипропил-β-циклодекстрин, триметил-β-циклодекстрин, γ-циклодекстрин, диметил-γ-циклодекстрин, гидроксиэтил-γ-циклодекстрин, гидроксипропил-γ-циклодекстрин, триметил-γ-циклодекстрин и их комбинации.
[111] В некоторых вариантах воплощения в композиции может быть включен регулятор тоничности. Тоничность жидкой композиции является важным фактором при введении композиции пациенту, например, путем парентерального введения. Таким образом, агенты, регулирующие тоничность, могут быть использованы для создания композиции, подходящей для введения. Регуляторы тоничности хорошо известны в данной области техники. Соответственно, регуляторы тоничности, описанные в данном документе, не предназначены для составления исчерпывающего списка, а представлены просто в качестве примерных регулирующих тоничность агентов, которые могут использоваться в композициях. Регуляторы тоничности могут быть ионными или неионными и включают, но не ограничиваются ими, неорганические соли, аминокислоты, углеводы, сахара, сахарные спирты и углеводы. Типичные неорганические соли могут включать хлорид натрия, хлорид калия, сульфат натрия и сульфат калия. Типичной аминокислотой является глицин. Типичные сахара могут включать сахарные спирты, такие как глицерин, пропиленгликоль, глюкоза, сахароза, лактоза, декстроза и маннит.
[112] В некоторых вариантах воплощения в композиции может быть включен стабилизирующий агент. Стабилизирующие агенты помогают увеличить стабильность соединения в композициях. Это может происходить, например, путем уменьшения дерадации или предотвращения агрегации соединения. Не желая ограничиваться какой-либо теорией, механизмы повышения стабильности могут включать секвестрацию соединения из растворителя или ингибирование свободнорадикального окисления терапевтически эффективного вещества. Стабилизирующие агенты хорошо известны в данной области. Соответственно, стабилизирующие агенты, описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных стабилизирующих агентов, которые могут использоваться в композициях. Стабилизирующие агенты могут включать, но не ограничиваются ими, эмульгаторы и поверхностно-активные вещества.
[113] В некоторых вариантах воплощения в композиции может быть включено защитное средство. Защитные средства представляют собой агенты, которые защищают фармацевтически активный ингредиент (например, терапевтически эффективное вещество или соединение) от нежелательного состояния (например, нестабильности, вызванной замораживанием или лиофилизацией или окислением). Защитные вещества могут включать, например, криопротекторы, лиопротекторы и антиоксиданты. Криопротекторы используются для предотвращения потери активности активного фармацевтического ингредиента (например, антрациклинового соединения), когда композиция подвергается воздействию температуры ниже ее точки замерзания. Например, криопротектор может быть включен в восстановленную лиофилизированную композицию, так что композицию можно заморозить перед разбавлением для внутривенного введения. Криопротекторы хорошо известны в данной области техники. Соответственно, криопротекторы, описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных криопротекторов, которые могут использоваться в композициях. Криопротекторы включают, но не ограничиваются ими, растворители, поверхностно-активные вещества, инкапсулирующие агенты, стабилизирующие агенты, модификаторы вязкости и их комбинации. Криопротекторы могут включать, например, дисахариды (например, сахарозу, лактозу, мальтозу и трегалозу), полиолы (например, глицерин, маннит, сорбит и дульцит), гликоли (например, этиленгликоль, полиэтиленгликоль и пропиленгликоль).
[114] Лиопротекторы используются для стабилизации компонентов композиции, подвергаемой лиофилизации. Например, терапевтически эффективное вещество может быть лиофилизировано с лиопротектором до восстановления. Лиопротекторы хорошо известны в данной области техники. Соответственно, лиопротекторы , описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных лиопротекторов, которые могут использоваться в композициях. Лиопротекторы включают, но не ограничиваются ими, растворители, поверхностно-активные вещества, инкапсулирующие агенты, стабилизирующие агенты, модификаторы вязкости и их комбинации. Типичными лиопротекторами могут быть, например, сахара и полиолы. Трегалоза, сахароза, декстран и гидроксипропил-бета-циклодекстрин являются неограничивающими примерами лиопротекторов.
[115] Антиоксиданты используются для предотвращения окисления компонентов композиции. Окисление может привести к агрегации лекарственного продукта или другим вредным воздействиям на чистоту лекарственного продукта или его эффективность. Антиоксиданты хорошо известны в данной области техники. Соответственно, антиоксиданты, описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных антиоксидантов, которые могут использоваться в композициях. Антиоксидантами могут быть, например, аскорбат натрия, цитрат, тиолы, метабисульфит и их комбинации.
[116] В некоторых вариантах воплощения в композицию может быть включен модификатор вязкости. Модификаторы вязкости изменяют вязкость жидких композиций. Это может быть выгодно, потому что вязкость играет важную роль в легкости фильтрации жидкой композиции. Композиция может быть отфильтрована до лиофилизации и восстановления или после восстановления. Модификаторы вязкости хорошо известны в данной области техники. Соответственно, модификаторы вязкости , описанные в данном документе, не предназначены для того, чтобы составлять исчерпывающий список, а представлены только в качестве примерных модификаторов вязкости, которые могут использоваться в композициях. Модификаторы вязкости включают растворители, солюбилизирующие агенты, поверхностно-активные вещества и инкапсулирующие агенты. Типичные модификаторы вязкости, которые могут быть включены в композиции, включают, но не ограничиваются ими, N-ацетил-DL-триптофан и N-ацетил-цистеин.
Противоопухолевая активность на мышиных моделях ксенотрансплантатов опухоли человека
[117] Альбумин-связывающие майтанзиноиды 30 и 31 продемонстрировали исключительную противоопухолевую активность в пяти моделях ксенотрансплантата опухоли человека у голых мышей, индуцируя частичную и полную регрессию опухоли во всех оцененных ксенотрансплантатах опухоли человека (см. фигуры 3-16). Это включало начальные объемы опухолей в диапазоне приблизительно 80-110 мм3, но также и начальные исходные объемы опухолей до приблизительно 400 мм3. Кроме того, в большинстве случаев терапия альбумин-связывающими майтанзиноидами 30 и 31 вызывала длительные ремиссии и уменьшение относительного объема опухоли (ООО). Исходное соединение майтанзин было в основном неактивным в тестируемых моделях или показывало лишь незначительное ингибирование опухоли. Экспериментальная процедура и результаты на моделях мышей с опухолями подробно описаны в примерах 11-19 и на фигурах 3-16.
Способы лечения
[118] Соединения и композиции, описанные в данном документе, используются для различных клинических применений. В вариантах воплощения способы лечения используют соединение композиции, которое включает соединение формулы (I), где R’ представляет собой:
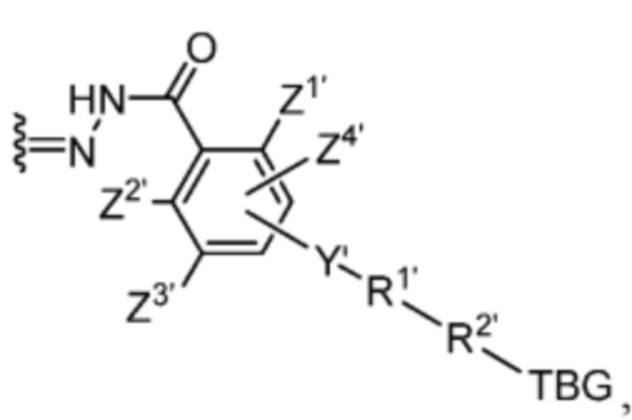
или различные варианты осуществления, раскрытые в данном документе.
[119] Описанные в данном документе соединения и композиции могут вызывать пролонгированное или длительное ингибирование роста опухоли. В определенных вариантах воплощения пролонгированное или длительное ингибирование роста опухоли происходит без какой-либо потери массы тела, или какой-либо или исключительной незначительной токсичности для костного мозга.
[120] В некоторых вариантах воплощения настоящее изобретение относится к способу лечения злокачественного заболевания, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции, содержащей соединение, описанное в настоящем документе. Например, некоторые варианты воплощения включают способ лечения пациента, страдающего от заболевания или состояния, выбранного из рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами, включающий введение пациенту, в случае необходимости в этом, терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению.
[121] Настоящее изобретение относится к способам лечения состояния или заболевания у пациента, указанного состояния или заболевания, выбранного из рака, вирусного заболевания, аутоиммунного заболевания, острого или хронического воспалительного заболевания и заболевания, вызванного бактериями, грибами или другими микроорганизмами, включающим введение пациенту соединения или фармацевтической композиции, как описано в данном документе.
[122] В некоторых вариантах воплощения рак включает васкуляризованную опухоль. В некоторых вариантах воплощения рак представляет собой рак крови или солидный рак. В некоторых вариантах воплощения рак выбран из карциномы, саркомы, лейкоза, лимфомы, множественной миеломы и меланомы.
[123] В некоторых вариантах воплощения рак выбран из аденокарциномы, увеальной меланомы, острого лейкоза, акустической невромы, рака амплулярного отдела толстой кишки , анальной карциномы, астроцитомы, базалиомы, рака поджелудочной железы, опухоли соединительной ткани, рака мочевого пузыря, бронхиальной карциномы, немелкоклеточной бронхиальной карциномы, рака молочной железы, лимфомы Беркитта, карциномы тела, синдрома CUP, рака толстого кишечника, рака тонкого кишечника, рака яичника, карциномы эндометрия, рака желчного пузыря, рака матки, рака шейки матки, опухоли шеи, носа и ушей, гематологической неоплазии, лейкоза ворсистых клеток, рака уретры, рака кожи, глиомы, рака яичка, саркомы Капоши, рака гортани, рака кости, колоректального рака, опухолей головы/шеи, карциномы толстой кишки, краниофарингеомы, рака печени, лейкоза, рака легких, немелкоклеточного рака легких, лимфомы Ходжкина, неходжкинской лимфома, рака желудка, рака толстой кишки, медуллобластомы, меланомы, менингиомы, рака почки, почечно-клеточной карциномы, олигодендроглиомы, рака пищевода, остеолитической и остеопластической карциномы, остеосаркомы, карциномы яичников, карциномы поджелудочной железы, рака полового члена, рака простаты, рака языка, карциномы яичника и рака лимфатического узла.
[124] Некоторые варианты воплощения включают способ увеличения концентрации метаболита соединения в опухоли, включающий введение соединения в соответствии с настоящим изобретением. В вариантах воплощения соединение представляет собой соединение формулы(I) где R’ представляет собой:
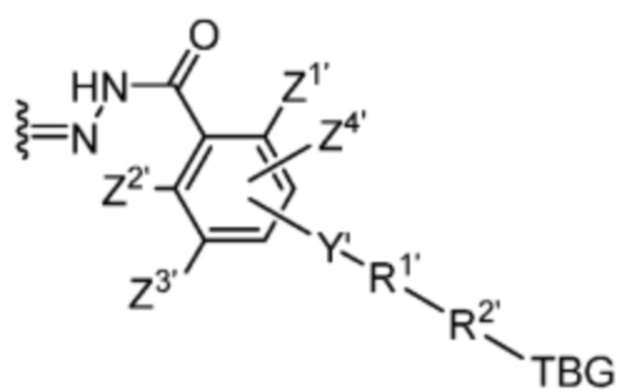 ,
,
или различные варианты осуществления, раскрытые в данном документе. В некоторых вариантах воплощения увеличение сравнивают с эквивалентной дозой немодифицированного активного агента, например, «немодифицированный активный агент» может быть тем же соединением формулы (I) где R’ представляет собой O.
[125] Некоторые варианты воплощения включают способ снижения цитотоксичности соединения, включающий введение соединения или фармацевтической композиции по настоящему изобретению нуждающемуся в этом пациенту, где введение приводит к снижению цитотоксичности по сравнению с эквивалентной дозой немодифицированного активного агента. Например, в некоторых вариантах воплощения способ снижения цитотоксичности включает введение соединения формулы (I) где R’ представляет собой:
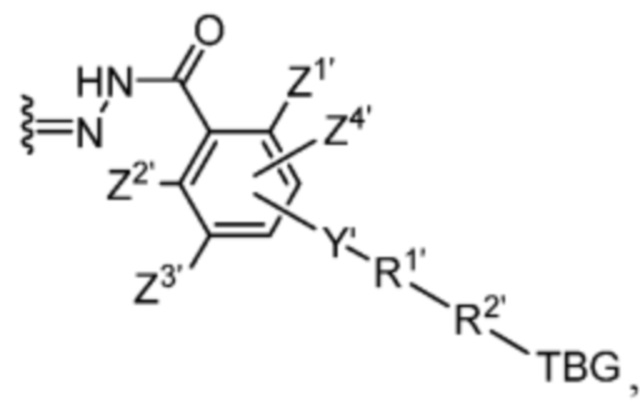
или различные варианты осуществления, раскрытые в данном документе, и «немодифицированный активный агент» представляет собой то же соединение формулы (I) где R’ представляет собой O.
Пояснение на примере
[126] Теперь, когда аспекты настоящего раскрытия в целом описаны, они будут более понятны со ссылкой на следующие примеры, которые включены только в целях иллюстрации определенных признаков и вариантов воплощения настоящего изобретения и не предназначены для ограничения.
Эквиваленты
[127] Специалисты в данной области техники поймут или смогут установить, используя не более чем обычные эксперименты, многочисленные эквиваленты соединений, композиций и способов их применения, описанных в настоящем документе. Такие эквиваленты считаются находящимися в рамках настоящего изобретения.
Примеры
[128] Следующие примеры демонстрируют различные варианты воплощения и аспекты изобретения.
Сокращения
[129] Ниже приведен список сокращений, используемых в примерах, с их полными химическими названиями. Если они не определены, термины имеют общепринятые значения.
водн. = водный
Boc=N-трет-бутоксикарбонил
рассч.=рассчитано
ДХМ=дихлорометан
ДИК=N, N’-диизопропилкарбодиимид
ДМАП=N, N-диметил-4-аминопиридин
ДМФА=N, N-диметилформамид
ДМСО=диметилсульфоксид
об.кол.=объем колонки
ЕДК=1-этил-3-(3-диметиламинопропил)карбодиимид
экв.=эквивалент
ИЭР=электрораспылительная ионизация
Fmoc=флуоренилметилоксикарбонил
HATU=(l-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксид гексафторфосфат)
HOAt=1-гидрокси-7-азабензотриазол
HOBt=N-гидроксибензотриазол
ВЭЖХ=высокоэффективная жидкостная хроматография
МСВР=масс-спектрометрия высокого разрешения
HSA=человеческий сывороточный альбумин
ИХ=ионная хроматография
ЖХ-МС=жидкостная хроматография - масс-спектроскопия
МСНР=масс-спектрометрия с низким разрешением.
MeCN=ацетонитрил
MeOH=метанол
ЯМР=спектроскопия ядерного магнитного резонанса
НФ=нормальная фаза
Np=4-нитрофеноксикарбонил
nd=не обнаруживается
na= не доступно
PBS=фосфатно-солевой буфер, pH 7
ОФ=обратная фаза
ТФК=трифторуксусная кислота
Трис=2-амино-2-(гидроксиметил)-1,3-пропандио
Пример 1
Получение линкера 1
[130] Линкер 1 может быть получен, как описано ниже и показано на схеме 1.
Схема 1
Синтез 4-нитро-2-сульфобензойной кислоты ( A )
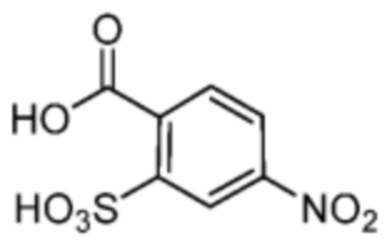
[131] К перемешиваемому раствору перманганата калия (72 г, 460 ммоль, 4,5 экв.) в воде (450 мл) в течение 10 с добавляли раствор гидрата 4-нитро-2-сульфоновой кислоты (26 г, 102 ммоль, 1,0 экв.) в воде Millipore (100 мл). Полученную пурпурную смесь перемешивали при 115°С в течение 5 часов и по истечении этого времени она становилась коричневой. Анализ ВЭЖХ (PDA 220 нм) подтвердил, что реакция завершилась через 5 часов (конверсия более 90%). Реакционную смесь охлаждали до комнатной температуры. Коричневое твердое вещество, образовавшееся в ходе реакции, удаляли фильтрованием с отсасыванием на подушке из целита, промывали водой Millipore (300 мл) и коричневый/желтый фильтратный раствор концентрировали до приблизительно 125 мл с помощью роторного испарителя при 40°С, медленно подкисляли 5 М раствором HCl (около 2 мл) до образования белой суспензии (рН приблизительно 1,0). Белую суспензию затем нагревали при 100°С до получения прозрачного раствора, который затем оставляли в ледяной ванне на 10 минут до образования белого твердого вещества. Белое твердое вещество получали фильтрованием отсосом с использованием фриттового фильтра. Затем белое твердое вещество сушили в высоком вакууме, получая 4-нитро-2-сульфобензойную кислоту. Выход: 18 г (72%). Чистота по ОФ-ВЭЖХ, 220 нм, более 95%. МСНР-ИЭР (m/z) рассч. для C7H4NO7S [M-H]-: 245,98. Найдено: 245,83.
Синтез 4-амино-2-сульфобензойной кислоты ( B )
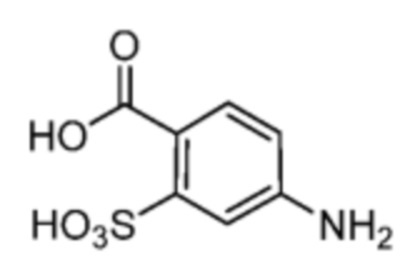
[132] Перемешиваемую суспензию 4-нитро-2-сульфобензойной кислоты (13 г, 51 ммоль, 1,0 экв.) в воде (75 мл) нагревали с обратным холодильником до полного растворения 4-нитро-2-сульфобензойной кислоты. При этой температуре затем добавляли уксусную кислоту (7,2 мл), а затем порошок железа (9,5 г, 180 ммоль, 3,5 экв.), который добавляли порциями (~ 1 г/мин) в течение 10 минут, чтобы избежать экзотермической реакции. Затем реакционную смесь оставляли перемешиваться с обратным холодильником в течение 1 часа. В течение этого времени образовывалось коричневое твердое вещество, а анализ ВЭЖХ (PDA 220 нм) подтвердил, что реакция завершилась (конверсия более 95%). Коричневое твердое вещество удаляли фильтрованием с отсосом непосредственно на подушке из целита (когда она еще была горячей) и затем промывали горячей водой. Фильтрат повторно фильтровали. Полученный фильтрат концентрировали на роторном испарителе при 40°С до конечного объема 100 мл. Концентрированную HCl добавляли по каплям до достижения pH 1, после чего выпадал белый/желтый осадок. Суспензию оставляли при 4°С на 1 час. Твердое вещество собирали фильтрованием с отсосом, используя фриттовый фильтр, и сушили в высоком вакууме, получая 4-амино-2-сульфобензойную кислоту в виде белого твердого вещества. Выход: 9 г (81%). Чистота по ОФ-ВЭЖХ, 220 нм, более 95%. МСНР-ИЭР (m/z) рассч. для C7H4NO5S [M-H]-: 216,00. Найдено: 216,16.
Синтез 6-малеимидогексаноилхлорида или EMC-Cl ( C )
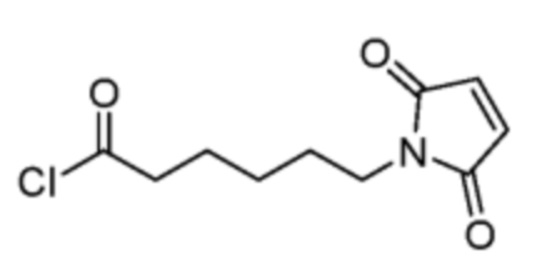
[133] К перемешиваемому желтому раствору 6-малеимидокапроновой кислоты (EMC) (33 г, 156 ммоль, 1,0 экв.) в сухом ДХМ (150 мл) при комнатной температуре и в атмосфере N2 в течение 30 мин (~ 0,5 мл/мин) добавляли оксалилхлорид (15 мл, 171 ммоль, 1,1 экв.) с использованием капельной воронки. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Цвет реакционного раствора изменялся на темно-желтый в течение времени реакции, а анализ ВЭЖХ (PDA 220 нм) подтвердил, что реакция завершилась через 5 часов (конверсия более 95%). Растворитель удаляли с помощью роторного испарителя при 40°С до получения масла. Это остаточное масло сушили в высоком вакууме в течение ночи (затвердевало в течение ночи). Полученное светло-коричневатое твердое вещество измельчали и сушили в течение еще 20 часов в высоком вакууме, получая 6-малеимидогексаноилхлорид в виде желтого микрокристаллического твердого вещества. Соединение использовали в следующей реакции без дополнительной очистки. Выход: 34 г (95%). Чистота по ОФ-ВЭЖХ, 220 нм, более 95% как и метиловый эфир. МСНР-ИЭР (m/z) рассч. для C11H16NO4 (как метиловый эфир) [M+H]+: 226,10. Найдено: 225,97.
Синтез 4-(6-малеимидогексамидо)-2-сульфобензойной кислоты ( D )
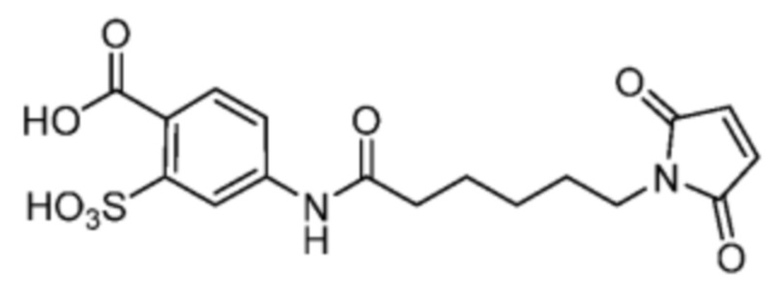
[134] 4-Амино-2-сульфобензойную кислоту (18,5 г, 85,0 ммоль, 1,0 экв.) растворяли в безводном ДМФА (300 мл) в атмосфере N2. Раствор охлаждали до 4°С и оставляли перемешиваться на 10 минут. Затем к охлажденному раствору по каплям добавляли 4-N-метилморфолин (18,7 мл, 170 ммоль, 2,0 экв.) (~0,3 мл/мин) в течение 1 часа с использованием капельной воронки. К этой темно-коричневой смеси по каплям (~0,5 г/мин) в течение 1 часа с использованием капельной воронки добавляли раствор EMC-Cl (29,3 г, 127 ммоль, 1,5 экв.) в безводном ДМФА (200 мл). Реакционную смесь перемешивали в течение ночи и затем оставляли нагреваться до комнатной температуры в течение 10 часов. После завершения реакции, как показано анализом ВЭЖХ (PDA 220 нм, конверсия более 95%), реакционный раствор распределяли в 8 х 50 мл пробирках фирмы Falcon.
[135] Образцы центрифугировали в течение 20 минут при 10°С и 4000 об/мин. Надосадочные жидкости удаляли декантацией, а твердые вещества повторно суспендировали в 10 мл ДМФА на каждую пробирку и снова центрифугировали в течение 20 мин при 10°С и 4000 об/мин. Все супернатанты ДМФА объединяли и концентрировали при пониженном давлении и температуре 50°С в течение 3 часов с получением светло-оранжевого твердого вещества. Твердое вещество повторно суспендировали в метаноле (250 мл) и переносили в 8 × 50 мл пробирок фирмы Falcon. Образцы центрифугировали в течение 20 минут при 10°С и 4000 об/мин. Надосадочные жидкости удаляли декантацией, и твердые вещества повторно суспендировали в 5 мл метанола на каждую пробирку и снова центрифугировали в течение 20 минут при 10°С и 4000 об/мин. Все твердые вещества объединяли и сушили в высоком вакууме в течение 24 часов, чтобы получить кристаллическое желтое твердое вещество. Выход: 17 г (48%). Чистота по ОФ-ВЭЖХ обратной фазы, 220 нм, 80%. МСНР-ИЭР (m/z) рассч. для C17H17N2O8S [M-H]-: 409,08. Найдено: 409,13.
Синтез 2-(2-(трет-бутоксикарбонил)гидразин-1-карбонил)-5-(6-малеимидогексанамидо)бензолсульфоновой кислоты или Boc-защищенного линкера 1 ( E )
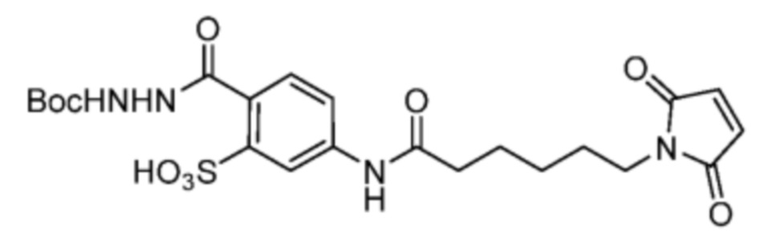
[136] К раствору 4-(6-малеимидогексанамидо)-2-сульфобензойной кислоты (17,0 г, 41,4 ммоль, 1,0 экв.) в безводном ДМФА (350 мл) в атмосфере N2 добавляли ЕДК-HCl (8,72 г, 45,5 ммоль, 1,1 экв.) и 1HOBt (6,15 г, 45,5 ммоль, 1,1 экв.). Реакционную смесь оставляли перемешиваться в течение 30 минут при комнатной температуре, а затем добавляли трет-бутилкарбазат (7,12 г, 53,9 ммоль, 1,3 экв.) и раствор становился прозрачным желтым до красноватого. Реакционную смесь перемешивали при комнатной температуре в течение ночи. По истечении этого времени завершение реакции подтверждало ВЭЖХ (PDA 220 нм, конверсия более 95%). Растворитель удаляли с помощью роторного испарителя при 40°C и в высоком вакууме в течение 1 часа, чтобы получить пурпурно-коричневое масло, которое очищали с помощью системы быстрой очистки Biotage Isolera One с двумя предварительно упакованными картриджами SNAP ULTRA 340 г, со сферическим диоксидом кремния Biotage® HP-Sphere ™. Пробирки, содержащие желаемый продукт, объединяли и сушили на роторном испарителе и в высоком вакууме в течение 10 часов, получая 2-(2-(трет-бутоксикарбонил)гидразин-1-карбонил)-5-(6-малеимидогексанамидо)бензолсульфокислоту в виде пенистого желтого твердого вещества. Выход: 9 г (42%). ОФ-ВЭЖХ (220нм) более 95%. МСНР-ИЭР (m/z) рассч. для C22H27N4O9S [M-H]-: 523,16. Найдено: 523,15.
Синтез линкера 1
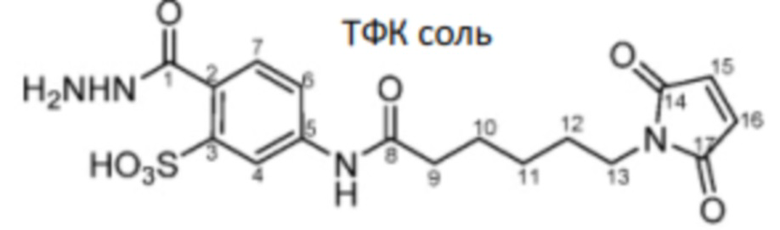
[137] К охлажденному (4-5°C) раствору Boc-защищенного линкера 1 (10,2 г, 19,4 ммоль, 1,0 экв.) в безводном ДХМ (30 мл) по каплям добавляли (~ 0,5 мл/мин) ТФК (15 мл) в течение 30 минут. После этого, холодную ванну убирали, а реакционную смесь оставляли перемешиваться при комнатной температуре в течение 3 часов. По истечении этого времени завершение реакции подтверждали анализом ВЭЖХ (PDA 220 нм). Реакционную смесь выливали по каплям в шесть пробирок фирмы Falcon, каждая из которых содержит приблизительно 35 мл холодного диэтилового эфира. Белый осадок образовывался сразу. Пробирки оставляли при 4°С на 3 часа. После центрифугирования пробирок фирмы Falcon (4000 об/мин, 20 мин, 10°С) супернатанты удаляли декантацией и твердые вещества повторно суспендировали в 5 мл диэтилового эфира на каждую пробирку и снова центрифугировали (4000 об/мин, 20 мин, 10°C. Супернатанты снова удаляли декантацией, а твердые вещества собирали и сушили в высоком вакууме, получая линкер 1 в виде белого микрокристаллического твердого вещества в виде соли ТФК. Выход: 10 г (96%). ОФ-ВЭЖХ (220 нм) более 95%. МСНР-ИЭР (m/z) рассч. для C17H21N4O7S [M+H]+: 425,11. Найдено: 425,07. МСНР-ИЭР (m/z) рассч. для C17H19N4O7S [M-H]-: 423,11. Найдено: 423,12. МСВР-ИЭР (m/z) рассч. для C17H21N4O7S [M+H]+: 425,1125. Найдено: 425,1125. МСВР-ИЭР (m/z) рассч. для C17H19N4O7S [M-H]-: 423,0978. Найдено: 423,0980.
[138] Структура была подтверждена с помощью 1H ЯМР и 13С ЯМР: 1H ЯМР (400 МГц, ДМСО-d6) δ 11,94 (s, 1H; Cl-NH), 10,27 (s, 1H; C8-NH), 8,01 (d, J= 2,2 Гц, 1H; C4-CH), 7,93 (dd, J= 8,5, 2,2 Гц, 1H; C6-CH), 7,68 (d, J= 8,4 Гц, 1H; C7-CH), 7.00 (s, 2H; C15-CH, C16-CH), 3,40 (t, J= 7,0 Гц, 2H; C13-CH2), 2,32 (t, J= 7,4 Гц, 2H; C9-CH2), 1,60 (p, J= 7,5 Гц, 2H; C10-CH2), 1,52 (p, J= 7,2 Гц, 2H; C12-CH2), 1,26 (q, J= 8,8 Гц, 2H; C11-CH2); 13C ЯМР (101 МГц, ДМСО-d6) δ 172,20 (C8), 171,54 (C14, C17), 167,59 (C1), 145,73 (C5), 142,09 (C3), 134,90 (C15, C16), 132,09 (C7), 123,79 (C2), 119,44 (C6), 117,47 (C4), 37,42 (C13), 36,65 (C9), 28,22 (C12), 26,21 (C11), 24,90 (C10). Анал. рассч. для C17H21N4O7S 1/2ТФК C, 45,71; H, 4,26; N, 11,85; S, 6,78. Найдено: C, 46,2917; H, 4,4836; N, 12,8879; S, 6,7886. Содержание ТФК 0,51%.
[139] Линкер 1 также может быть получен, как описано ниже и показано на схеме 2.
Схема 2
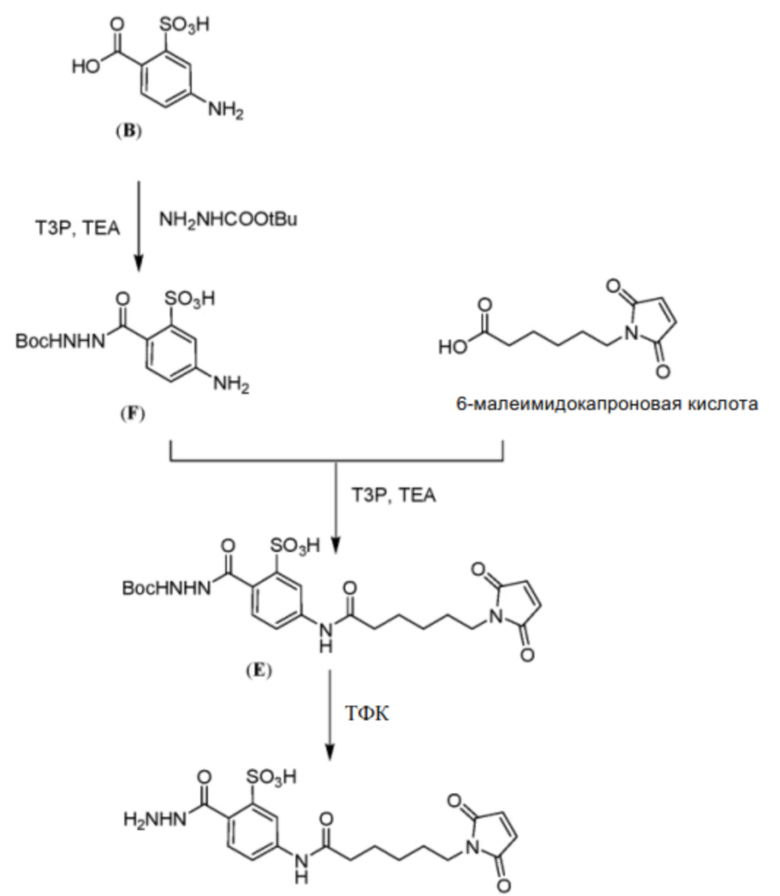
Линкер 1
Синтез 5-амино-2-(2-(трет-бутоксикарбонил)гидразин-1-карбонил) бензолсульфоновой кислоты ( F )
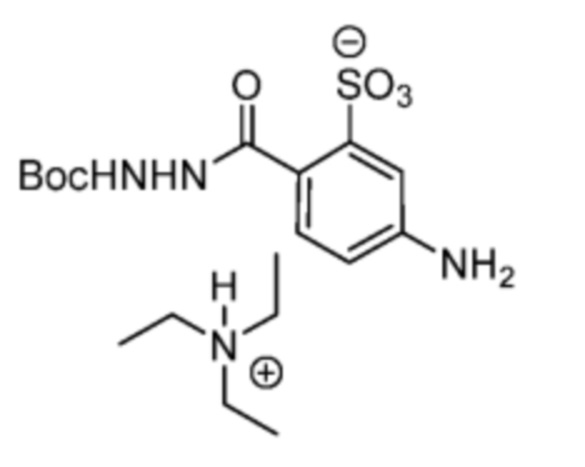
[140] К суспензии B (30,00 г, 138,12 ммоль, 1,00 экв.) в безводном ацетонитриле (600 мл) добавляли триэтиламин (41,93 г, 57,76 мл, 414,37 ммоль, 3,00 экв.) и смесь перемешивали в течение 10 минут. Затем добавляли трет-бутилкарбазат (27,38 г, 207,19 ммоль, 1,50 экв.) и смесь охлаждали до минус 35°C. При этой температуре по каплям в течение 1 часа добавляли раствор пропилфосфонового ангидрида, T3P, (114,27 г, 106,79 мл, 179,56 ммоль, 50% раствор в этилацетате, 1,3 экв.). Реакционную смесь перемешивали при минус 35°С в течение 2 часов. Смеси давали нагреться до комнатной температуры и фильтровали через Celite® 545 (100 г). Celite® дополнительно промывали ацетонитрилом (500 мл). Оба фильтрата объединяли и концентрировали до 250 мл. Раствор разделяли поровну на 6 порций и растворитель удаляли при пониженном давлении. Каждую порцию растворяли в дихлорметане, содержащем 1% Et3N (50 мл), и очищали флэш-хроматографией НФ на системе быстрой очистки Biotage Isolera ™ One, с предварительно упакованной колонкой SNAP Ultra 340 г, используя ступенчатый градиент от 2% до 12% метанола (содержащий 1% NEt3) в ДХМ (содержащий 1% NEt3) в 7 объемах колонки. Затем очищенные фракции из всех частей объединяли, растворитель удаляли при пониженном давлении и твердое вещество сушили в высоком вакууме, получая указанное в заголовке соединение F в виде не совсем белого твердого вещества. Выход: 53,25 г, 108,0 ммоль, 78,2% (ЯМР в ДМСО-d6 показал присутствие 1,6 экв. триэтиламина). ВЭЖХ (способ 9, 220 нм) более 99%. МСНР-ИЭР (m/z) рассч. для C12H16N3O6S [M-H]-: 330,08. Найдено: 330,08.
Синтез N-этил-N-изопропилпропан-2-аминия 2-(2-(трет-бутоксикарбонил)гидразин-1-каргонил)-5-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-)гексанамидо) бензолсульфонат ( E )
[141] К смеси F (45,00 г, 91,24 ммоль, 1,00 экв.) и 6-малеимидокапроновой кислоты (19,27 г, 91,24 ммоль, 1,00 экв.) добавляли ацетонитрил (450 мл), триэтиламин (13,85 г, 19,08 мл, 136,86). ммоль) и T3P (43,55 г, 40,70 мл, 136,86 ммоль, 50% раствор в этилацетате) добавляли одной порцией при комнатной температуре. Раствор перемешивали при комнатной температуре в течение 24 часов. Растворитель удаляли при пониженном давлении. Затем неочищенный продукт очищали с помощью системы флэш-очистки с использованием семи предварительно упакованных картриджей SNAP Ultra 340 г с линейным градиентом от 2% метанола до 15% метанола в дихлорметане с получением указанного в заголовке соединения E в виде не совсем белого твердого вещества. Выход: 30,55 г, 53.5% (ЯМР в ДМСО-d6 показал присутствие 1,1 экв. триэтиламина). ВЭЖХ (способ 9, 220 нм) более 99%. МСНР-ИЭР (m/z) рассч. для C22H27N4O9S [M-H]-: 523,15. Найдено: 523,26.
Синтез 5-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамидо)-2-(гидразинкарбонил)бензолсульфоновой кислоты (Линкер 1 )
[142] К холодной суспензии (4°С) Е (10,00 г, 15,98 ммоль, 1,00 экв.) в дихлорметане (50 мл) добавляли трифторуксусную кислоту (18,22 г, 12,31 мл, 159,81 ммоль, 10,17 экв.) в течение 15 мин. Смесь дополнительно перемешивали при 4°С в течение 15 минут, а затем давали постепенно нагреться до комнатной температуры и перемешивали в течение 150 минут. Реакционную смесь добавляли по каплям через делительную воронку к перемешиваемому раствору метил-трет-бутилового эфира, МТВЕ (400 мл) и дихлорметана (200 мл). Полученное белое твердое вещество фильтровали через воронку с пористостью 4 А и промывали последовательно дихлорметаном (2 × 150 мл) и МТВЕ (1 × 50 мл), МеОН (1 × 50 мл) и снова МТВЕ (2 × 150 мл). Твердое вещество оставляли сушиться на воронке с фриттой в течение ночи при комнатной температуре в течение 10 минут. Дальнейшую сушку проводили в высоком вакууме при 25°С в течение 18 часов. Конечный продукт Линкер 1 был получен в виде желтого твердого вещества. Выход: 5,786 г, 13,63 ммоль, 98,7%, ВЭЖХ (способ 9, 220 нм) более 96%. МСНР-ИЭР (m/z) рассч. для C17H19N4O7S [M-H]-: 423,10. Найдено: 422,95.
Пример 2
Получение кето-майтанзиноидов прямой этерификацией майтанзинола кетокислотой
[143] Общий способ А: Майтанзинол (500 мг, 0,88 ммоль, 1 экв.) и соответствующую кетокислоту (3,52 ммоль, 4 экв.) растворяли в безводном ДХМ (40 мл) в присутствии активированных молекулярных сит и охлаждали до 4-5°C с использованием ледяной ванны. К этому раствору затем в течение 10 с добавляли раствор хлорида цинка (II) в диэтиловом эфире (2,64 мл, 2,64 ммоль, 3,0 экв., 1 М раствор). Полученный раствор перемешивали в течение 40 минут при 4-5°C с последующим добавлением N, N’-диизопропилкарбодиимида (0,55 мл, 3,52 ммоль, 4 экв.). Смесь, погруженную в ледяную ванну, перемешивали при 4°С, а затем давали медленно нагреться до комнатной температуры в течение ночи. Конверсию контролировали с помощью ЖХ-МС и после достижения 60% реакционную смесь концентрировали при пониженном давлении при 40°C до половины объема, фильтровали через шприцевой фильтр 0,45 мкм (Macherey-Nagel, Chromafil® PTFE-O-45/25), а фильтрат упаривали. Конечный продукт очищали с помощью системы быстрой очистки Biotage Isolera One с предварительно упакованным картриджем SNAP ULTRA 50 г, со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% ДХМ до 90/10 ДХМ/метанол в 25 об.кол.). Пробирки, содержащие продукт, объединяли и сушили в течение 1 часа с помощью роторного испарителя и в высоком вакууме с получением соответствующего кетомайтанзиноида.
[144] Общий способ B: Майтанзинол (758 мг, 1,34 ммоль, 1,0 экв.), соответствующую кетокислоту (1,47 ммоль, 1,1 экв.) и ДМАП (181 мг, 1,47 ммоль, 1,1 экв.) растворяли в атмосфере N2 в безводном ДХМ (30 мл) в присутствии активированных молекулярных сит (0,8 г, 4 Å, размер частиц 325 меш, Sigma Aldrich). Смесь охлаждали в течение 10 мин до 4°С, используя ледяную ванну. Раствор ЕДК-HCl (283 мг, 1,47 ммоль, 1,1 экв.) в сухом ДХМ (15 мл) добавляли в течение 30 мин (~ 0 мг/мин) к охлажденной смеси и реакционную смесь перемешивали при 4°C в течение 2 ч. По истечении этого времени добавляли еще одну порцию кетокислоты (1,47 ммоль, 1,1 экв.) с последующим добавлением раствора ЕДК-HCl (283 мг, 1,47 ммоль, 1,1 экв.) в сухом ДХМ (10 мл) в течение 30 мин (~10 мг/мин) к охлажденной смеси, и реакционную смесь перемешивали в инертной атмосфере при 4°С в течение 2 часов. По истечении этого времени добавление реагентов повторяли еще раз, и реакционную смесь оставляли в течение ночи перемешиваться при 4°С до постепенного достижения смесью комнатной температуры. Смесь фильтровали (Macherey-Nagel, Chromafil® PTFE-O-45/25) и растворитель удаляли с помощью роторного испарителя при 40°C до конечного объема приблизительно 10 мл. Неочищенный продукт очищали с помощью системы быстрой очистки Biotage Isolera One, с предварительно упакованным картриджем SNAP ULTRA 100 г, со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% ДХМ до 90/10 ДХМ/метанол в 25 об.кол.). Пробирки, содержащие продукт, объединяли и растворитель удаляли с помощью роторного испарителя для получения твердого вещества. Твердое вещество сушили в высоком вакууме, получая соответствующий кетомайтанзиноид.
Получение майтанзиноида 2
[145] Из реакции майтанзинола с 2-(4-ацетил-2-фторфенил)уксусной кислотой с использованием способа А: Майтанзиноид 2 был получен в виде желтоватого твердого вещества. Выход: 47%. Чистота по ОФ-ВЭЖХ, 220 нм, 96%. МСНР-ИЭР (m/z) рассч. для: C38H45C1FN2O10 [M+H]+: 743,22. Найдено: 743,25. МСНР-ИЭР (m/z) рассч. для: C38H43C1FN2O10 [M-H]-: 741,22. Найдено: 741,41.
[146] Структура была подтверждена с помощью 1H ЯМР и 13С ЯМР: 1H ЯМР (400 МГц, CDCl3) δ 7,73 (dd, J=7,9, 1,6 Гц, 1H; C31-CH), 7,66 (dd,7=10,5, 1,6 Гц, 1H; C27-CH), 7,46 (t, J=7,6 Гц, 1H; C32-CH), 6,82 (d, J= 1,8 Гц, 1H; C17-CH), 6,59 (d, J= 1,8 Гц, 1H; C21-CH), 6,48 (dd, J= 15,5, 11,0 Гц, 1H; C12-CH), 6,43 (s, 1H; C9-NH), 6,25 (d, J= 10,9 Гц, 1H; C13-CH), 5,63 (dd, J= 15,4, 8,8 Гц, 1H; C11-CH), 4,99 (dd, J= 11,8, 2,7 Гц, 1H; C3-CH), 4,27 (td, J=11,2, 10,4, 1,8 Гц, 1H; C7-CH), 3,97 (s, 3H; C20-OCH3), 3,90 (d, J= 15,7 Гц, 1H; C24-CH2), 3,76 (d, J= 15,5 Гц, 1H; C24-CH2), 3,54 (d, J= 8,8 Гц, 1H; C10-CH), 3,46 (d, J= 12,8 Гц, 1H; C15-CH2), 3,38 (s, 3H; C10-OCH3), 3,19 (d, J= 12,8 Гц, 1H; C15-CH2), 3,00 (s, 3H; Cl- NCH3), 2,87 (d, J= 9,7 Гц, 1H; C5-CH), 2,57 (s, 3H; C29-CH3), 2,51 (dd, J= 14,1, 11,9 Гц, 1H; C2-CH2), 2,17 (dd, J= 13,9, 2,6 Гц, 1H; C2-CH2), 1,72 (d, J=13,6 Гц, 1H; C8-CH2), 1,68 (s, 3H; CM-CH3), 1,50 (m, 1H; C6-CH), 1,28 (d, J= 6,3 Гц, 4H; C6-CH3, C8-CH2), 0,87 (d, J=1,4 Гц, 3H; C4-CH3); 13C ЯМР (101 МГц, CDCl3) δ 196,50 (C28), 168,86 (C23), 168,30 (Cl), 160,78 (d, 1JC-F=247,0 Гц; C26), 156,13 (C20), 152,46 (C22), 142,53 (C18), 140,30 (C19), 140,24 (C14), 138,49 (d, 3JC-F= 6,4Гц; C30), 132,58 (C12), 131,68 (d, 3JC-F=3,6 Гц; C32), 128,32 (C11), 126,38 (d, 2JC-F= 16,1 Гц; C25), 124,82 (d, 4JC-F= 3,3 Гц; C31), 124,56 (C13), 122,04 (C21), 119,52 (C16), 114,73 (d, 2JC-F=23,2 Гц; C27), 113,13 (C17), 88,23 (C10), 81,25 (C9), 77,95 (C3), 74,37 (C7), 66,24 (C5), 60,39 (C4), 56,91 (C20-OCH3), 56,71 (C10-OCH3), 47,26 (C15), 38,37 (C6), 36,01 (C8), 35,46 (C1-NCH3), 33,86 (C24), 32,76 (C2), 26,78 (C29), 15,88 (C14-CH3), 14,60 (C6-CH3), 12,35 (C4-CH3).
Получение майтанзиноида 3
[147] Из реакции майтанзинола с 2-(3-ацетилфенокси)уксусной кислотой с использованием способа B: Майтанзиноид 3 был получен в виде желтоватого твердого вещества. Выход: 49%. Чистота по ОФ-ВЭЖХ, 220 нм, 98%. МСНР-ИЭР (m/z) рассч. для: C38H46ClN2O11 [M+H]+: 741,23. Найдено: 741,23.
[148] Структура была подтверждена с помощью 1H ЯМР и 13С ЯМР: 1H ЯМР (400 МГц, CDCl3) δ 7,58 (dt, J= 7,8, 1,1 Гц, 1H; C30-CH), 7,55 (s, 1H; C26-CH), 7,44 (d, J= 7,9 Гц, 1H; C31- CH), 7,12 (dd, J= 8,3, 2,8 Гц, 1H; C32-CH), 6,79 (d, J= 1,8 Гц, 1H; C17-CH), 6,65 (d, J= 1,8 Гц, 1H; C21-CH), 6,46 (dd, J= 15,4, 11,0 Гц, 1H; C12-CH), 6,37 (s, 1H; C9-NH), 6,26 (d, J=11,0 Гц, 1H; C13-CH), 5,62 (dd, J= 15,4, 8,9 Гц, 1H; C11-CH), 5,08 (dd, J= 11,9, 2,7 Гц, 1H; C3-CH), 4,90 (d, J=15,9 Гц, 1H; C24-CH2), 4,66 (d, J= 15,9 Гц, 1H; C24-CH2), 4,28 (t, J= 10,6 Гц, 1H; C7-CH), 3,96 (s, 3H; C20-OCH3), 3,68 (s, 1H; C9-OH), 3,53 (d, J= 8,9 Гц, 1H; C10-CH), 3,47 (d, J= 12,9 Гц, 1H; C15-CH2), 3,36 (s, 3H; C10-OCH3), 3,15 (d, J=12,8 Гц, 1H; C15-CH2), 2,92 (d, J= 9,7 Гц, 1H; C5-CH), 2,87 (s, 3H; C1-NCH3), 2,59 (s, 3H; C29-CH3), 2,55 (d, J=11,9 Гц, 1H; C2-CH2), 2,22-2,14 (m, 1H; C2-CH2), 1,71 (d, J= 1,8 Гц, 1H; C8- CH2), 1,67 (s, 3H; C14-CH3), 1,55-1,45 (m, 1H; C6-CH), 1,28 (d, J= 6,4 Гц, 3H; C6-CH3), 1,28- 1,25 (m, 1H; C8-CH2), 0,86 (s, 3H; C4-CH3); 13C ЯМР (101 МГц, CDCl3) δ 197,99 (C28), 168,09 (C1), 168,07 (C23), 158,27 (C25), 156,09 (C20), 152,36 (C22), 142,46 (C18), 140,38 (C19), 139,83 (C14), 138,84 (C27), 132,85 (C12), 130,48 (C31), 128,22 (C11), 124,95 (C13), 122,41 (C30), 122,12 (C21), 119,67 (C32), 119,25 (C16), 113,73 (C26), 113,02 (C17), 88,18 (C1O), 81,16 (C9), 78,13 (C3), 74,18 (C7), 66,37 (C24), 66,26 (C5), 60,26 (C4), 56,87 (C20-OCH3), 56,68 (C10-OCH3), 47,05 (C15), 38,41 (C6), 36,34 (C8), 35,31 (C1-NCH3), 32,67 (C2), 26,88 (C29), 15,86 (C14-CH3), 14,58 (C6-CH3), 12,50 (C4-CH3).
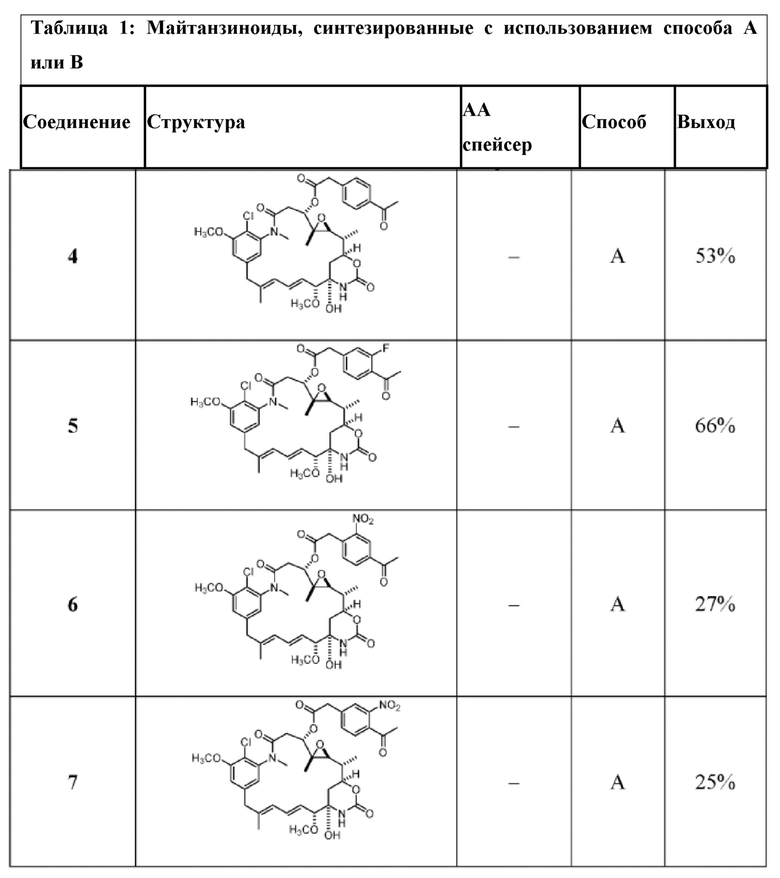
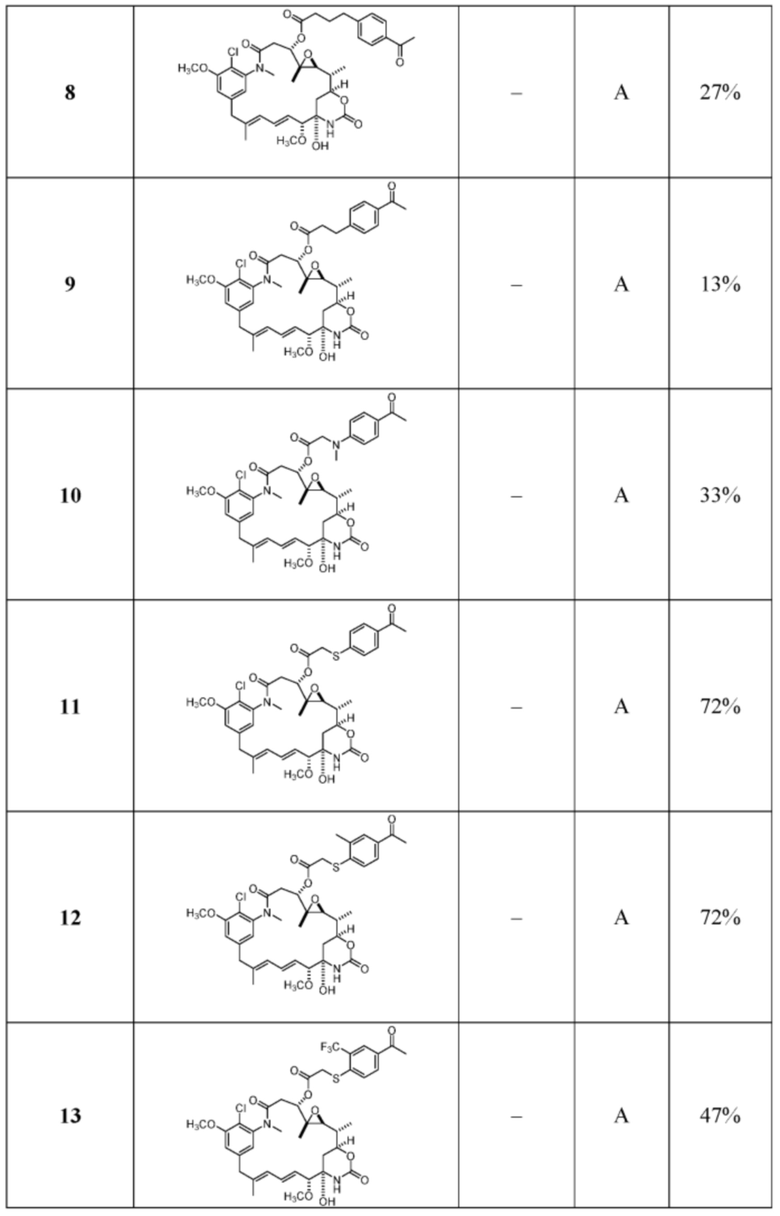
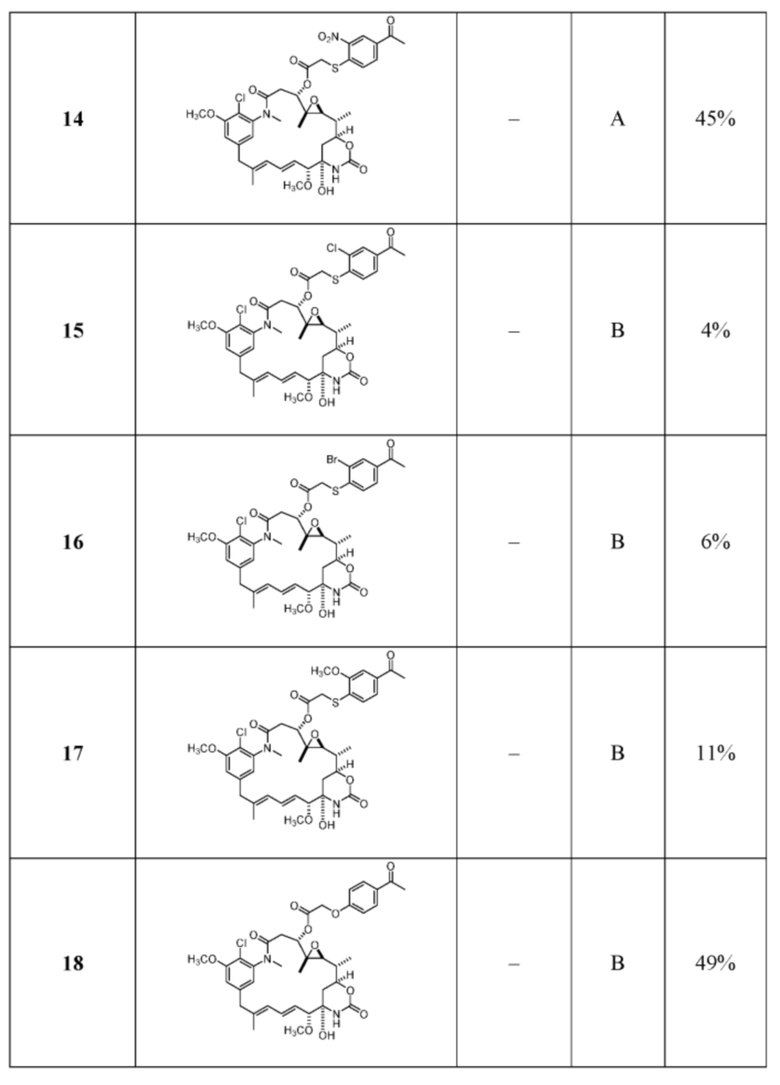
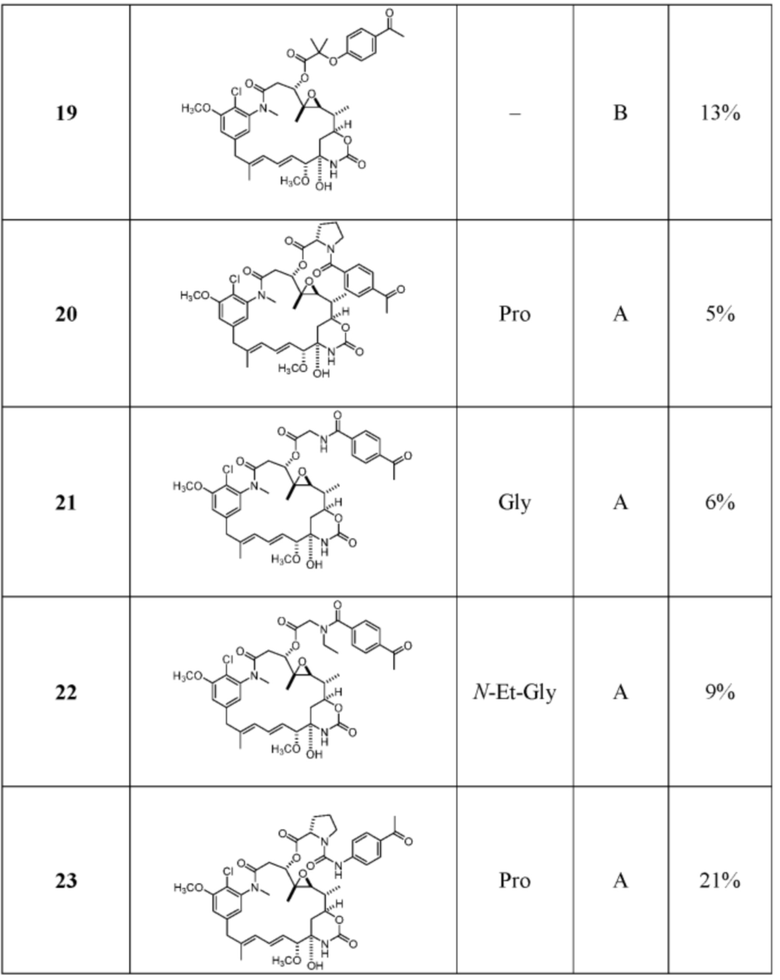
Пример 3
[149] Трехстадийный синтез кетомайтанзиноидов путем этерификации с Fmoc-защищенной аминокислотой, расщепления группы Fmoc и конденсации с кетокислотой.
[150] Общий способ С - Стадия 1: реакция майтанзинола с Fmoc-защищенной аминокислотой. Майтанзинол (565 мг, 1,00 ммоль, 1,0 экв.), аминокислота, защищенная Fmoc (3,00 ммоль, 3,0 экв.), ДМАП (982 мг, 8,00 ммоль, 8,0 экв.) и трифторметансульфонат скандия (III) (541 мг, 1,1 ммоль). 1,1 экв.) растворяли в атмосфере N2 в безводном ДХМ (10 мл) в присутствии активированных молекулярных сит (1 г, 4 Å, размер частиц 325 меш, Sigma Aldrich). Смесь охлаждали до 4°C, используя ледяную/водную ванну, и оставляли перемешиваться в течение 30 минут для достижения этой температуры. По истечении этого времени в течение 10 минут добавляли ДИК (2,47 мл, 16,0 ммоль, 16,0 экв.) (~0,25 мл/мин) и реакционную смесь перемешивали при 4°C в течение 2 часов и оставляли постепенно достигать комнатной температуры в течение этого времени. Смесь фильтровали под действием силы тяжести. Фильтрат разбавляли ДХМ (50 мл) и затем промывали натрий-фосфатным буфером (50 мл × 3, pH 7,5) и солевым раствором (50 мл). Органический слой затем сушили над безводным сульфатом натрия, фильтровали под действием силы тяжести и растворитель удаляли на роторном испарителе при 40°С до конечного объема приблизительно 10 мл. Неочищенное вещество очищали в системе быстрой очистки Biotage Isolera One с предварительно упакованным картриджем SNAP ULTRA 50 г со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% ДХМ до 90/10 ДХМ/метанол в 25 об.кол.). Растворитель удаляли с помощью роторного испарителя при 40°C в течение 2 часов, чтобы получить соответствующий продукт в виде твердого вещества от желтоватого до желтого.
[151] Общий способ С - Стадия 2: снятие защиты группы Fmoc. Промежуточное соединение, защищенное Fmoc (0,53 ммоль, 1,0 экв.), растворяли в ДХМ (5 мл) и к этому раствору добавляли трис-(2-аминоэтил)амин (0,320 мл, 2,13 ммоль, 4,0 экв.) в течение 10 с. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1 часа. Образовавшийся белый осадок отфильтровывали через слой целита, промывали ДХМ (20 мл) и желтый фильтрат упаривали досуха на роторном испарителе при 40°C в течение 2 часов и затем сушили в высоком вакууме в течение 4 часов до получения свободного амина, который сразу же использовали на следующей стадии без дальнейшей очистки.
[152] Общий способ С - Стадия 3: реакция амин-майтанзиноида с кетокислотой. Промежуточный свободный амин (77,0 мкмоль, 1,0 экв.), кетокислота (150 мкмоль, 2,0 экв.), HATU (35 мг, 94,0 мкмоль, 1,2 экв.), HOAt (13 мг, 94,0 мкмоль, 1,2 экв.) и N-метилморфолин (17 мкл, 150 мкмоль, 2,0 экв.) растворяли в атмосфере N2 в безводном ДМФА (1 мл). Смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь разбавляли ДХМ (5 мл) и промывали насыщенным раствором хлорида аммония (5 мл × 5) и рассолом (5 мл). Органическую фазу затем сушили над безводным сульфатом натрия, фильтровали под действием силы тяжести и удаляли растворитель на роторном испарителе при 40°С. Неочищенное вещество очищали в системе быстрой очистки Biotage Isolera One с помощью предварительно упакованного картриджа SNAP ULTRA C-18 12 г, Biotage® HP-Sphere ™ C18, сферического диоксида кремния 25 мкм (система линейного градиента от 80/20 вода/MeCN до 100% MeCN в 20 об.кол.). Фракции, содержащие продукт, объединяли, замораживали в жидком азоте и лиофилизировали в течение 24 часов с получением соответствующего кето-майтанзиноида.
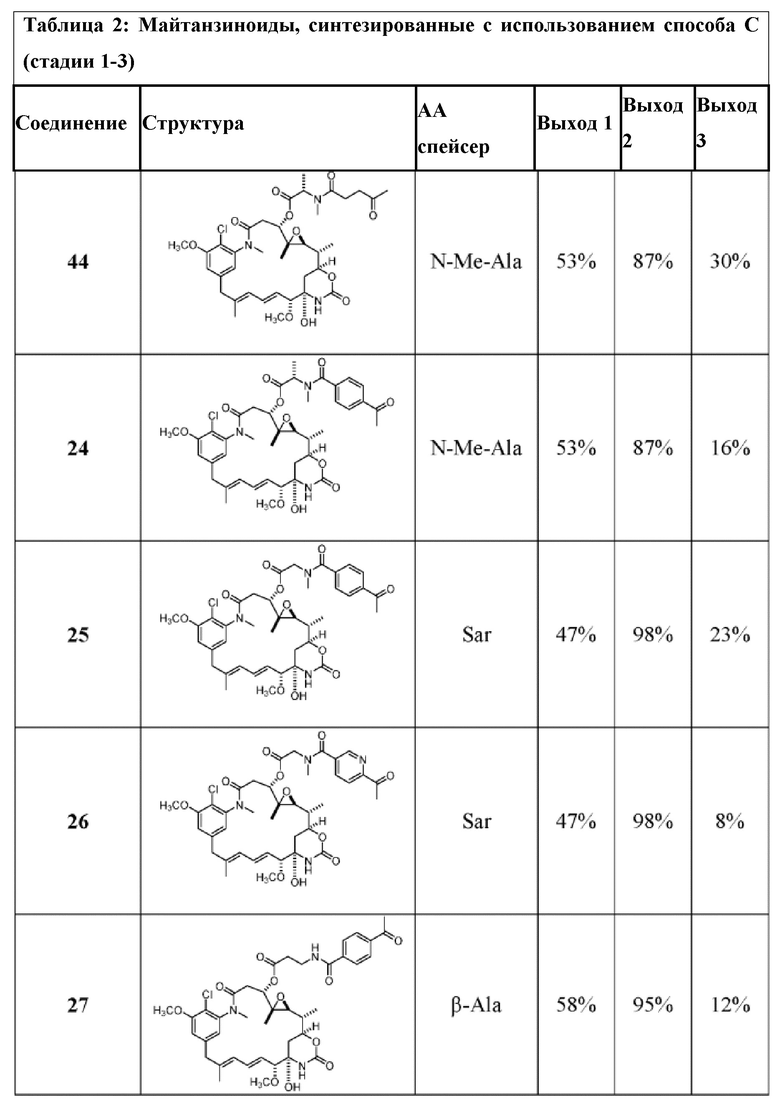
Пример 4
Получение майтанзиноида 28
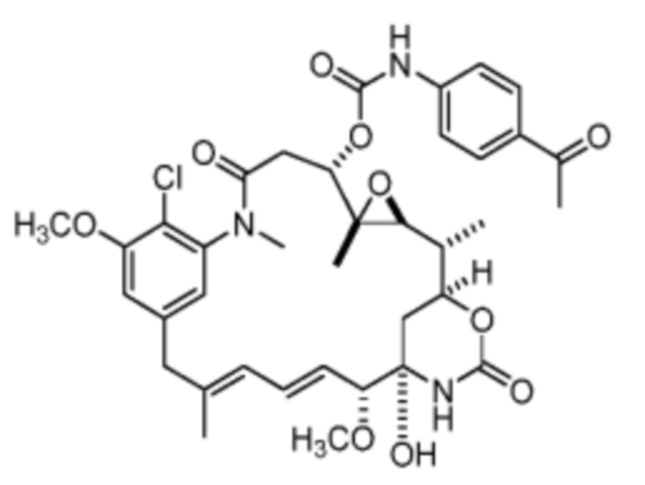
Майтанзинол (56,5 мг, 0,10 ммоль, 1,0 экв.) растворяли в сухом ДХМ (10 мл), раствор хлорида цинка (II) в диэтиловом эфире (0,3 мл, 0,30 ммоль, 3,0 экв., 1 М раствор) добавляли при комнатной температуре в атмосфере N2 и оставляли перемешиваться в течение 10 мин. В течение 10 с добавляли 4-ацетилфенилизоцианат (48,3 мг, 0,30 ммоль, 3,0 экв.) и полученный раствор перемешивали при комнатной температуре в течение 5 часов. По истечении этого времени завершение реакции подтверждали анализом ВЭЖХ (PDA 220 нм). Летучие вещества удаляли с помощью роторного испарителя при 40°С. Неочищенный продукт очищали с помощью НФ-хроматографии с использованием системы быстрой очистки Biotage Isolera One с предварительно упакованным картриджем SNAP ULTRA 10 г, содержащим сферический диоксид кремния Biotage® HP-Sphere ™ (система с линейным градиентом от 100% ДХМ до 90/10 ДХМ/метанол в 13 об.кол.) с последующей ОФ-хроматографией с использованием предварительно упакованного SNAP ULTRA C-18 12 г картриджа Biotage® HP-Sphere ™ C18, сферического диоксида кремния 25 мкм (линейный градиент от 80/20 вода/MeCN до 100% MeCN в 30 об.кол.). Фракции, содержащие продукт, объединяли, замораживали в жидком азоте и лиофилизировали в течение 24 часов, получая соединение 28 в виде белого твердого вещества. Выход: 20 мг (28%). Чистота по ОФ-ВЭЖХ (220 нм) более 95%. МСНР-ИЭР (m/z) рассч. для: C37H45ClN3O10 [M+H]+: 726,27. Найдено: 726,25. МСНР-ИЭР (m/z) рассч. для: C37H43ClN3O10 [M-H]-: 724,27. Найдено: 724,43.
Пример 5
Получение майтанзиноида 29
[153] Синтез May-ONp: К раствору майтанзинола (88 мг, 155 мкмоль, 1,0 экв.) в ДХМ (8 мл) добавляли пиридин (25 мкл, 310 мкмоль, 2,0 экв.) при комнатной температуре. Полученный прозрачный раствор перемешивали в течение 15 мин, затем охлаждали до 4°С и добавляли p-нитрофенилхлорформиат (219 мг, 1,08 ммоль, 7,0 экв.) в ДХМ (4 мл), после чего сразу же образовывался белый осадок. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Сырой материал концентрировали с использованием роторного испарителя при 40°C в течение 1 часа и очищали с помощью системы быстрой очистки Biotage Isolera One с использованием предварительно упакованного картриджа SNAP ULTRA 25 г со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% этилацетат до 40/60 этилацетат/ДХМ в 50 об.кол.). Фракции, содержащие продукт, сушили на роторном испарителе при 40°C в течение 30 минут и в высоком вакууме еще в течение 30 минут, чтобы получить промежуточное соединение May-ONp в виде белого твердого вещества. Выход: 102 мг (90%). МСНР-ИЭР (m/z) рассч. для C35H41ClN3O12 [M+H]+: 730,23. Найдено: 730,01.
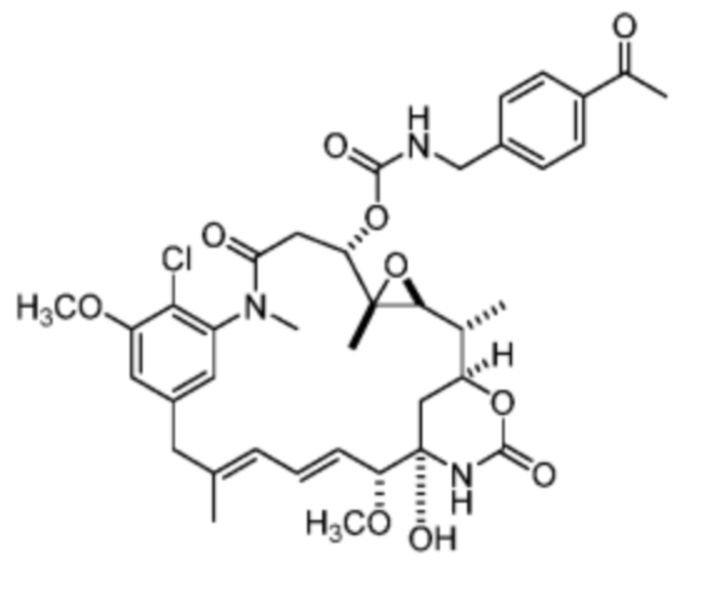
[154] Синтез майтанзиноида 29: К раствору соединения May-ONp (3,7 мг, 5,00 мкмоль, 1,0 экв.) в ДХМ (1 мл) добавляли раствор 4-(аминометил)ацетофенона (1,1 мг, 7,50 мкмоль, 1,5 экв.) в ДХМ/ДМФА (2:0,1 по объему) при комнатной температуре и перемешивали в течение 5 минут перед добавлением триэтиламина (2 мкл, 10,0 мкмоль, 2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и при 60°С в течение ночи. Сырой материал концентрировали при 40°C в течение 1 часа и очищали с помощью системы быстрой очистки Biotage Isolera One с использованием предварительно упакованного картриджа SNAP ULTRA 10 г со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% хлороформа до 90/10 хлороформ/метанол в 20 об.кол.). Фракции, содержащие продукт, сушили на роторном испарителе при 40°С в течение 30 минут и в высоком вакууме еще в течение 30 минут с получением соединения 29 в виде белого твердого вещества. Выход: 1 мг (27%). Чистота по ОФ-ВЭЖХ (220 нм) более 95%. МСНР-ИЭР (m/z) рассч. для C38H46ClN3O10 [M+H]+: 739,28. Найдено: 739,96.
Пример 6
Получение альбумин-связывающих майтанзиноидов
[155] Общий способ D для синтеза альбумин-связывающих майтанзиноидов из кетомайтанзиноида и малеимидо-гидразидного линкера: К перемешиваемому раствору кетомайтанзиноида (1,0 экв.) в сухом растворителе (подходящими растворителями являются ДХМ, ДМСО, диоксан, 2-метилтетрагидрофуран) при комнатной температуре в атмосфере N2 добавляли молекулярные сита (от 1:1 до 5:1 об./об.) и катализатор (ТФК, p-толуолсульфоновая кислота, форма амберлист-H, форма амберлит-Na), а затем раствор гидразидного линкера (от 1,0-5,0 экв.) в сухом ДМСО. Реакционную смесь перемешивали при комнатной температуре, а конверсию подтверждали с помощью ВЭЖХ-анализа (PDA 220 нм) (конверсия более 90%). Реакционную смесь фильтровали, концентрировали на роторном испарителе при 30°C и очищали хроматографией с использованием системы быстрой очистки Biotage Isolera One с использованием предварительно упакованного сферического диоксида кремния SNAP ULTRA Biotage® HP-Sphere ™ (линейный градиент от 100% ДХМ до 90/10 ДХМ/метанол), сушили в роторном испарителе при 30°С в течение 30 минут и в высоком вакууме еще в течение 30 минут, чтобы получить свободную кислоту. Продукт повторно растворяли в подходящем растворителе (метанол, ацетон, 2-метилтетрагидрофуран или других органических полярных растворителях) и затем нейтрализовали с использованием растворов солей (натриевых солей, калиевых солей, солей триэтиламмония) до достижения рН в диапазоне 5,5-7,5. Раствор замораживали в жидком азоте и лиофилизировали в течение 24 часов, получая соединение в виде соли. Содержание противоиона определяли по ИХ. Содержание ионов натрия находилось в диапазоне от 2 до 1,0 экв. (примерно 0,2-0,9%), а содержание ионов триметиламмония - от 0,8 до 2,0 экв. (примерно 6-16%).
Получение альбумин-связывающего майтанзиноида 30
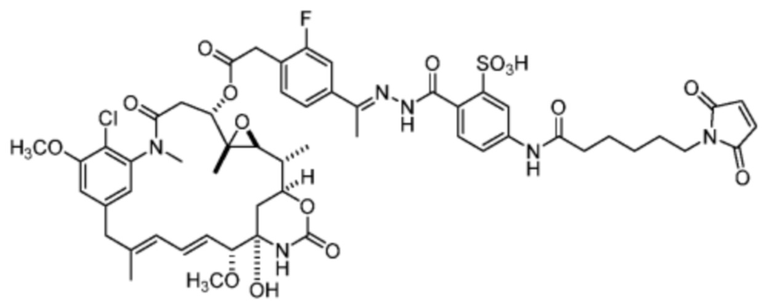
[156] Из реакции майтанзиноида 2 с линкером 1: К перемешиваемому раствору майтанзиноида 2 (170 мг, 0,23 ммоль, 1,0 экв.), молекулярные сита (0,2 г, порошок, активированный, 4 Å, размер частиц 325 меш) и Amberlyst®-H (20 мг, макропористый, 30-60 меш) в сухом ДХМ (2 мл) при комнатной температуре в атмосфере N2 добавляли раствор линкера 1 (51 мг, 0,12 ммоль, 2,0 экв.) в сухом ДМСО (0,6 мл). Реакционную смесь перемешивали при комнатной температуре и через 3 ч анализ ВЭЖХ (PDA 220 нм) подтвердил завершение реакции (конверсия более 98%). Реакционную смесь концентрировали на роторном испарителе при 30°C, фильтровали через шприцевой фильтр 0,45 мкм (Macherey-Nagel, Chromafil® PTFE-O-45/25). Фильтрат разбавляли сухим ДХМ (8 мл) и очищали с помощью системы быстрой очистки Biotage Isolera One с использованием предварительно упакованного картриджа SNAP ULTRA 10 г со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% ДХМ до 90/10 ДХМ/MeOH в 22 об.кол.). Объединенные фракции, содержащие продукт, сушили на роторном испарителе при 30°C в течение 30 минут и в высоком вакууме еще в течение 30 минут, чтобы получить форму свободной кислоты 30 в виде бело-желтого твердого вещества. Твердое вещество растворяли в MeOH/ацетоне (50:50 об./об., всего приблизительно 4 мл), а затем его нейтрализовали 5 мМ раствором NaHCO3 в воде Millipore до pH 6,8-7,1 (pH измеряли с помощью pH-метра). Раствор замораживали в жидком азоте и лиофилизировали в течение 24 часов, получая пролекарство майтанзиноида 30 в виде бело-желтой пены. Выход: 161 мг (60%). МСНР-ИЭР (m/z) рассч. для: C55H61ClFN6O16S [M-H]-: 1147,36. Найдено: 1147,84. Содержание Na+ находилось в диапазоне 0,2-0,8%.
Получение альбумин-связывающего майтанзиноида 31
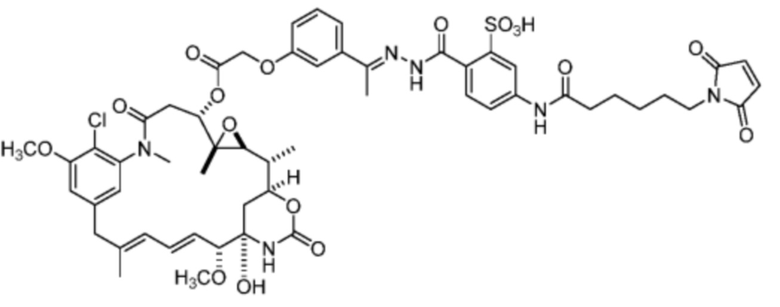
[157] Из реакции майтанзиноида 3 с линкером 1: К перемешиваемому раствору майтанзиноида 3 (186 мг, 0,25 ммоль, 1,0 экв.), молекулярные сита (0,4 г, порошок, активированный, 4 Å, размер частиц 325 меш, Sigma Aldrich) и Amberlite® (форма IR120 Na, 484 мг, 2,1 ммоль/мл, 4.0 экв.) в сухом дихлорметане (4 мл) при комнатной температуре в атмосфере N2 добавляли раствор линкера 1 (329 мг, 0,77 ммоль, 2,5 экв.) в сухом ДМСО (4 мл). Реакционную смесь перемешивали при комнатной температуре и через 6 ч анализ ВЭЖХ (PDA 220 нм) подтвердил завершение реакции (конверсия более 98%). Реакционную смесь концентрировали на роторном испарителе при 30°С, фильтровали через шприцевой фильтр 0,45 мкм (Macherey-Nagel, Chromafil® PTFE-O-45/25). Фильтрат нейтрализовали гидроксидом натрия (318 мкл 1 М раствора NaOH, 1,3 экв.). Нейтрализованную смесь по каплям добавляли в 50-мл пробирку Falcon, содержащую охлажденную смесь (ледяная ванна при 4°C) метил t-бутилового эфира (27 мл) и изопропилового спирта (14 мл), и центрифугировали при 4°C в течение 5 минут. Надосадочную жидкость декантировали, а осадок ресуспендировали в дихлорметане (10 мл) и очищали с помощью системы быстрой очистки Biotage Isolera One с использованием предварительно упакованного картриджа SNAP ULTRA 10 г со сферическим диоксидом кремния Biotage® HP-Sphere ™ (линейный градиент от 100% ДХМ до 90/10 ДХМ/MeOH в 22 об.кол.). Объединенные фракции, содержащие продукт, сушили на роторном испарителе при 30°С в течение 30 минут и в высоком вакууме еще в течение 10 часов, получая 31 в виде бело-желтого твердого вещества. Выход: 156 мг (52%). Чистота по ОФ-ВЭЖХ (220 нм) более 95%. МСНР-ИЭР (m/z) рассч. для: C55H62ClN6O17S [M-H]-: 1145,36. Найдено: 1145,87. Содержание Na имеет окно 0,2-0,8%.
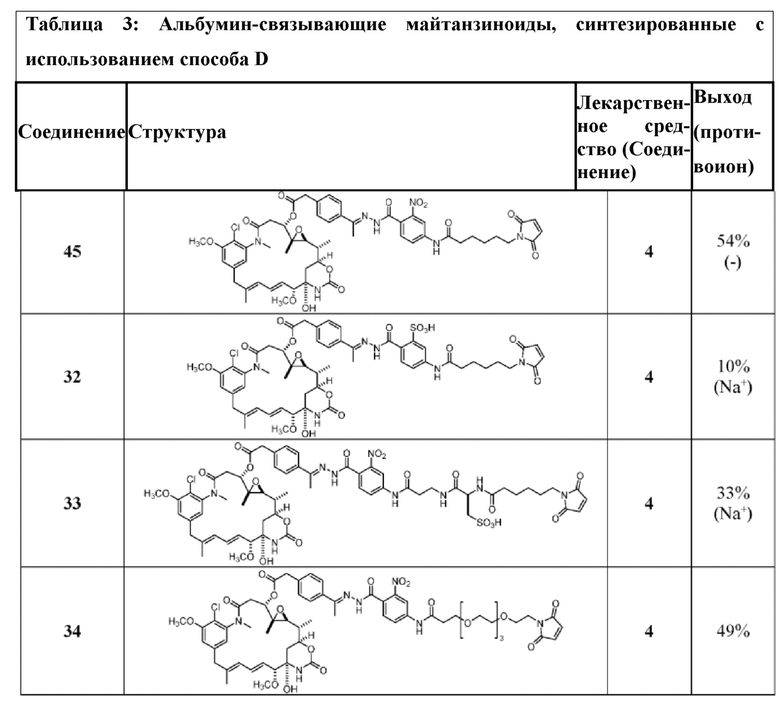
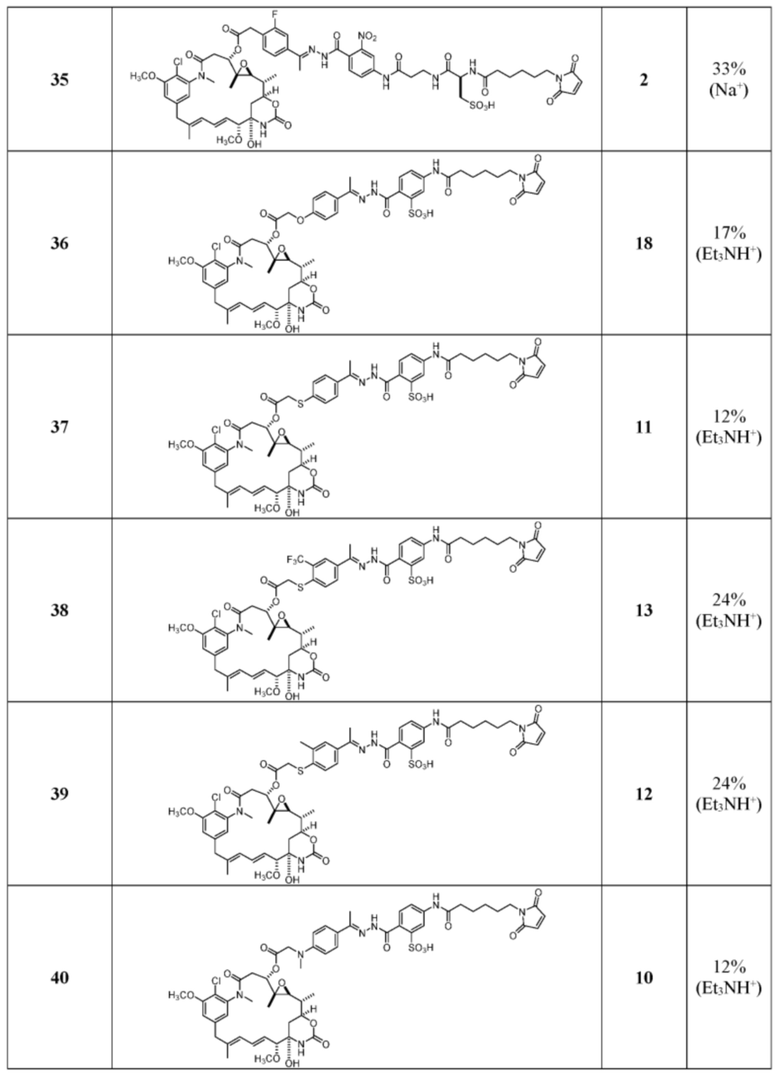
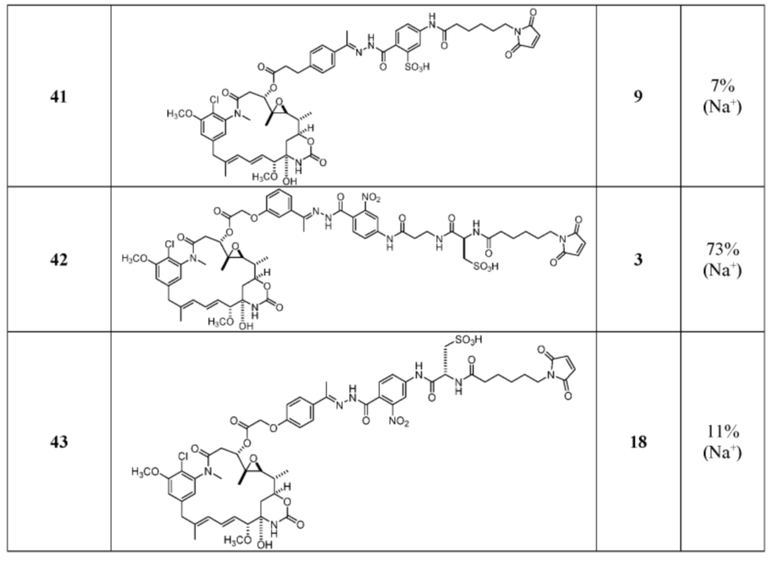
Пример 7
Кинетика стабильности и высвобождения конъюгатов майтанзиноид-HSA в буферном растворе при рН 4,0 и рН 7,4
[158] Для получения HSA-конъюгатов альбумин-связывающих майтанзиноидов, HSA (200 мкМ: 361,8 мкл, 1078 мкМ свободного Cys34; 100 мкМ: 180,9 мкл, 1078 мкМ свободного Cys34) разбавляли буфером PBS (4 мМ фосфата натрия, 150 мМ NaCl, pH 7,4) (200 мкМ: 678,2 мкл; 100 мкМ: 859,1 мкл) и ДМСО (200 мкМ: 130,0 мкл; 100 мкМ: 195,0 мкл) и инкубировали в нагревательном блоке при 37°С в течение 30 минут. Альбумин-связывающий майтанзиноид добавляли в виде 2 мМ исходного раствора в ДМСО (200 мкМ: 130,0 мкл; 100 мкМ: 65,0 мкл) в предварительно инкубированный образец HSA для получения 200 мМ или 100 мкМ раствора пролекарства майтанзиноида и 300 мкМ или 150 мкМ свободного Cys34. Смеси, имеющей рН 7,4, давали прореагировать в течение 10 минут при 37°С и затем анализировали каждый час в течение 24 часов с помощью ОФ-ВЭЖХ (Phenomenex Aeris WP XB-C18, 3,6 мкм, 250 × 4,6 мм).
[159] Для изучения кинетики высвобождения при рН 4,0 смесь подкисляли смесью 50 мМ натрий-ацетатного буфера рН 3,0 (200 мкМ: 119,3 мкл; 100 мкМ: 125,2 мкл) и 1 M HCl (200 мкМ: 12,7 мкл; 100 мкМ: 6,8 мкл) для достижения рН 4,0. Затем смесь анализировали каждый час в течение 24 часов с помощью ОФ-ВЭЖХ (Phenomenex Aeris WP XB-C18, 3,6 мкм, 250 × 4,6 мм).
[160] Были использованы следующие условия ОФ-ВЭЖХ: Phenomenex Aeris WP XB-C18 3,6 мкм, 250 х 4,6 мм; элюент A (100% 20 мМ Трис-буфер, pH 8,0) и элюент B (90:10, MeCN: вода), элюирующий градиентом элюента B (25% 0-0,5 мин, 25-35% 0,5-2,5 мин, 35- 85% 2,5-16 мин, 85-95% 16-17 мин, 95% 17-20 мин, 95-25% 20-25 мин, 25% 25-30 мин, скорость потока 1,0 мл/мин). Температура колоночного термостата 37°С; температура автосэмплера 37°С; 20 мкл инъекционного объема.
[161] Для количественного определения процента высвобожденного свободного лекарственного средства были получены стандартные кривые свободных майтанзиноидов при различных концентрациях (200 мкМ, 100 мкМ, 50 мкМ, 25 мкМ и 12,5 мкМ). Площадь под кривой (AUC) была определена при 250 нм.
майтанзиноид после 24 ч при pH 7,4
3,7%**
* измерено при 200 мкМ
** измерено при 100 мкМ
Пример 8
[162] Стабильность майтанзиноидов и конъюгатов майтанзиноид-HSA в плазме мышей CD1 и человека: Для изучения стабильности майтанзиноидов, а также конъюгатов майтанзиноид-HSA в плазме CD1 и человека соединения инкубировали при 37°С в течение 24 часов. Оставшийся свободный майтанзиноид или высвобождение соответствующего майтанзиноида количественно определяли методом ЖХ-МС/МС (или ВЭЖХ) в определенные моменты времени.
[163] Процедура количественного определения ЖХ-МС: Смешанную плазму мыши CD1 или человека (K2EDTA, Innovative Research) центрифугировали (1 мин при 12,044 g). Надосадочную жидкость сначала фильтровали через фильтрующую иглу (5 мкм, стерильная, Becton Dickinson), а затем через мембрану из ацетата целлюлозы (0,45 мкм, стерильная, Carl Roth). Отфильтрованную плазму (1710 мкл) предварительно инкубировали при 37°С в течение 30 мин в нагревательном блоке. Свободный майтанзиноид или альбумин-связывающий майтанзиноид в виде исходного раствора с концентрацией 300 мкМ в ДМСО (190 мкл) добавляли к предварительно инкубированному образцу плазмы для получения 30 мкМ раствора соответствующего конъюгата майтанзиноид или майтанзиноид-HSA. Смеси давали прореагировать в течение 10 мин при 37°С, а затем в каждый момент времени (0, 1, 2, 3, 4, 5, 21 и 24 часа) три образца (70 мкл) отбирали в 96-луночную плашку, запечатанную пластиковой пленкой, немедленно замораживали жидким азотом и хранили при минус 20°С. В конце эксперимента 96-луночный планшет оставляли оттаивать при комнатной температуре. Образцы (30 мкл) затем непосредственно переносили с помощью многоканальной пипетки в 96-луночный планшет для осаждения белка Impact ™ (Strata®), который один раз промывали MeCN (150 мкл) и затем загружали внутренним стандартом (120 мкл, MeCN, содержащий 5 мкг/мл майтанзина). Планшет для осаждения Impact ™ закрывали силиконовой пленкой и встряхивали в течение 2 минут при 420 об/мин. Затем осаждающий планшет Impact ™ помещали в 96-луночный пробоотборник, а фильтрат собирали в другой 96-луночный планшет, применяя мягкий вакуум. 96-луночный планшет закрывали силиконовой пленкой и хранили при комнатной температуре до количественного определения методом ЖХ-МС/МС. Фильтрат вводили в ЖХ-МС для количественного определения с использованием режима MRM.
[164] ЖХ-МС способ: Phenomenex Luna® OmegaPolar C18, 1,6 мкм, 100 Å, 50 × 2,1 мм, колонка; элюент A (0,1% муравьиная кислота в воде) и элюент B (0,1% муравьиная кислота в MeCN), элюирующий градиентом элюента B (20% 0-0,5 мин, поток 0,4 мл/мин; 20-60% 0,5-9,0 мин. 0,4 мл/мин; 60-100% 9,0-9,5 мин, поток 0,4 мл/мин; 100-20% 9,5-10,5 мин, поток 0,4 мл/мин; 20% 10,5-12 мин, 0,6 мл/мин). Температура колоночного термостата 25°С; температура автосэмплера комнатная; 10 мкл инъекционного объема.
[165] Площадь под кривой (AUC) для каждого свободного лекарства в момент времени 0 была установлена как значение 100% для соответствующего пролекарства. AUC для каждого образца нормализовали на основе AUC майтанзина.
[166] Процедура количественного определения ВЭЖХ: Образцы готовили, как ранее описано, с использованием 2 мМ исходного раствора в ДМСО свободного лекарственного средства, а также пролекарства. После инкубации при 37°С образцы непосредственно вводили в ВЭЖХ каждый час в течение 24 часов. Площадь под кривой (AUC) для каждого свободного майтанзиноида (200 мкМ в 10% ДМСО в буфере PBS) использовали в качестве значения 100% для соответствующего альбумин-связывающего майтанзиноида.
[167] ВЭЖХ способ: Phenomenex Aeris WP XB-C18 , 3,6 мкм, 250 х 4,6 мм ,; колонка, элюент A (20 мМ Трис-буфер, pH 8,0) и элюент B (90:10, MeCN: вода), элюирующий градиентом элюента B (25% 0-0,5 мин, 25-35% 0,5-2,5 мин, 35- 85% 2,5-16 мин, 85-95% 16-17 мин, 95% 17-20 мин, 95-25% 20-25 мин, 25% 25-30 мин, скорость потока=1,0 мл/мин). Температура колоночного термостата 37°С; температура автосэмплера 37°С; 20 мкл инъекционного объема.
[168] Относительное высвобождение свободного майтанзиноида, а также превращение в майтанзинол перечислены ниже в таблице 5.
связывающий
майтанзиноид
(Соединение)
майтанзиноида высвобожденного после 24 ч
мышь
мышь
* данные получены с помощью ВЭЖХ
[169] Количество оставшегося свободного майтанзиноида, а также степень превращения в майтанзинол приведены ниже в таблице 6.
(Соединение)
мышь
мышь
[170] Стабильность различных линкеров с (майтанзиноид 4) в мышиной плазме CD1 показана на фиг.1.
Пример 9
[171] In vitro кинетика связывания альбумин-связывающих майтанзиноидов с альбумином в смешанной цельной крови и плазме человека: Для изучения кинетики связывания альбумин-связывающих майтанзиноидов в смешанной плазме человека и в смешанной цельной крови человека соединения инкубировали вместе со смешанной плазмой человека при 37°С и отбирали образцы в определенные моменты времени. Оставшиеся альбумин-связывающие майтанзиноиды количественно определяли с помощью ВЭЖХ.
[172] Процедура количественного определения ВЭЖХ: Для изучения кинетики связывания в цельной крови человека кровь (K2EDTA, 36 доноров, Zen-Bio; 900 мкл) предварительно инкубировали при 37°C в течение 30 минут в нагревательном блоке. Для изучения кинетики связывания в смешанной человеческой плазме смешанную цельную кровь центрифугировали (10 минут, 1811 g), супернатантную плазму собирали и затем предварительно инкубировали при 37°С в течение 30 минут.
[173] Альбумин-связывающий майтанзиноид добавляли к предварительно инкубированной пробе цельной крови/плазмы в 10-кратном разведении в PBS 1,2 мМ исходного раствора в 2,5% пропиленгликоле в 10 мМ натрий-фосфатном буфере и 1,48 мМ цитрате (100 мкл) для получения раствор 12,0 мкМ соответствующего альбумин-связывающего майтанзиноида. Образцы (190 мкл) отбирали через 15 с, 2 мин, 4 мин, 8 мин и 15 мин. Образцы непосредственно добавляли к 760 мкл MeCN, содержащего майтанзин (5 мкг/мл) в качестве внутреннего стандарта, и встряхивали в течение 1 мин. После центрифугирования (1 мин при 12,044 g) супернатант (850 мкл) концентрировали в высоком вакууме. Остаток растворяли в смеси ДМСО/вода (1:1 об./об.; 95 мкл) и затем анализировали с помощью ОФ-ВЭЖХ. Процент связывания определяли путем сравнения площади под кривой (AUC) при 220 нм альбумин-связывающего майтанзиноида относительно контрольного образца (значение 100%) в буфере PBS. Все эксперименты были выполнены в трех повторах.
[174] Способ ВЭЖХ: Phenomenex Kinetex Polar C18, 2,6 мкМ, 100 Å, 150 х 4,6 мм; элюент А (95:5 5 мМ ацетат аммония: MeCN) и элюент B (5:95 5 мМ ацетат аммония: MeCN), элюирующий с градиентом элюента B (30% 0-0,5 мин, 30-95% 0,5-9,0 мин, 95% 11,0 мин, 95-30%, 11,0-14,5 мин, 30%, 15,0 мин, скорость потока=1,0 мл/мин). Температура колоночного термостата соответствует температуре окружающей среды; температура автосэмплера 4°С; 50 мкл инъекционного объема.
[175] Относительные количества связанного альбумин-связывающего майтанзиноида через 0 и 8 мин приведены в таблице ниже:
майтанзиноид
Пример 10
Цитотоксичность майтанзина, DM1, DM1-SMe, майтанзинола и майтанзиноидов in vitro в различных клеточных линиях с использованием анализа жизнеспособности клеток CellTiter-Blue®
[176] Исследование проверило эффективность всех соединений in vitro с помощью анализа жизнеспособности клеток Promega CellTiter-Blue®. Были протестированы раковые клеточные линии: LXFL 529 (крупноклеточный рак легкого), RKO (рак толстой кишки), SW-620 (рак толстой кишки), CAL-27 (рак головы и шеи), LXFL 1674L (крупноклеточный рак легкого), MDA-MB 468 (рак молочной железы), SK-OV-3 (рак яичников), PAXF 1657 (рак поджелудочной железы), MCF7 (рак молочной железы), COLO 205 (рак толстой кишки), MDA-MB 231 (рак молочной железы), BT-474 (рак молочной железы) и Hep G2 (рак печени).
[177] Клетки собирали из экспоненциально-фазовых культур, подсчитывали и высевали в 96-луночные планшеты с плоским дном для микротитрования при плотности клеток в зависимости от скорости роста клеточной линии (4000 и 60000 клеток). 10 pL of culture medium (four control wells/plate) or of culture medium with the test compound are added.
[178] Соединения наносили на стадии половины логарифмического разведения в 10 концентрациях в двух повторах и клетки обрабатывали непрерывно в течение 96 часов. После обработки и инкубации клеток добавляли 20 мкл/лунку реагента Cell Titer-Blue®. После инкубации в течение до 4 часов флуоресценцию (FU) измеряли с использованием многослойного ридера EnSpire (возбуждение λ=531 нм, излучение λ=615 нм). Кривые отклика сигмоидальной концентрации подгоняют к точкам данных (значениям T/C), полученным для каждой клеточной линии, с использованием нелинейного подбора по 4 параметрам (Oncotest Warehouse Software). Значения IC50 представлены как относительные значения IC50, представляющие собой концентрацию тестируемого соединения, которая дает ответ (ингибирование образования/жизнеспособности колонии) на половине пути между верхним и нижним плато кривой реакции сигмоидальной концентрации (точка перегиба кривой), или как абсолютные значения IC50, являющиеся концентрацией испытуемого соединения на пересечении кривых концентрация-отклик с T/C=50%. Для расчета средних значений IC50 используется среднее геометрическое. Результаты представлены в виде графиков среднего значения или тепловых карт (отдельные значения IC50 относительно среднего геометрического значения IC50) по всем клеточным линиям при тестировании. См. таблицу 8 и фигуру 2. На фигуре 2 показана тепловая карта IC50 для всех протестированных соединений.
Пример 11
Общая процедура оценки майтанзина и альбумин-связывающих майтанзиноидных соединений на модели ксенотрансплантата опухоли, полученной от пациента
[179] Самки голых мышей NMRI с иммунодефицитом от Charles River получали односторонние опухолевые имплантаты подкожно на левом боку, находясь под изофлурановой анестезией, с раковыми опухолями человека до тех пор пока опухоли не стали ощутимыми и не достигли объема 80-200 мм3 (если не указано иное).
[180] Животных содержали в клетках, температуру внутри клеток поддерживали на уровне 25 ± 1°С с относительной влажностью 45-65% и скоростью воздухообмена в клетке 60 раз в час. Их держали 14 часов на свету: 10 часов в темноте, цикл искусственного освещения. Животных кормили автоклавированной 19% протеиновой экструдированной диетой Teklad Global (T.2019S.12) от Envigo RMS SARL и они имели доступ к стерильной отфильтрованной и подкисленной (pH 2,5) водопроводной воде, которую меняли два раза в неделю. Корм и вода обеспечивались ad libitum. До начала терапии животные были рандомизированы (7 мышей в группе, если не указано иное) с учетом сравнимой медианы и среднего группового объема опухоли. Животных регулярно контролировали два раза в день в рабочие дни и раз в день по субботам и воскресеньям. Начиная с 0-го дня животных взвешивали два раза в неделю. Относительную массу тела (ОМТ) отдельных животных рассчитывали путем деления индивидуальной абсолютной массы тела в день X (МТХ) на индивидуальную массу тела в день рандомизации, умножая на 100%. Объем опухоли определяли двумерным измерением с помощью штангенциркуля в день рандомизации (день 0) и затем дважды в неделю. Объемы опухолей рассчитывали по следующему уравнению: Объем опухоли [мм3] = l [мм] x w2 [мм2] x 0,5, где «l» - длина, а «w» - ширина опухоли. Относительный объем отдельной опухоли в день X (OOOx) рассчитывали путем деления абсолютного индивидуального объема опухоли [мм3] соответствующей опухоли в день X (Tx) на абсолютный объем отдельной опухоли той же опухоли в день рандомизации, умноженный на 100%. Графики применялись в той степени, в которой это позволяет порядок проведения в области защиты животных. Уничтожение отдельных мышей проводили при объеме опухоли больше 2000 мм3 (односторонняя). Все тестируемые соединения вводили в 1, 8, 15 и 22 день и поставляли в виде лиофилизированных твердых веществ, содержащих сахарозу. В день обработки лиофилизированные образцы растворяли в 10 мМ натрий-фосфатном буфере, рН 6,8, содержащем 20% пропиленгликоля, и вводили внутривенно (100 мкл/20 г мыши) вместе с наполнителем (10 мМ натрий-фосфатный буфер, 20% пропиленгликоль и 5% сахароза - рН 6,8).
Пример 12
Общая процедура оценки майтанзина и альбумин-связывающих майтанзиноидных соединений на модели ксенотрансплантата, происходящего от раковой клеточной линии
[181] Самки голых мышей NMRI с иммунодефицитом от Janvier France получали 5×106 трансплантант культивируемых раковых клеток в буфере/Matrigel (1:1) подкожно (если не указано иное) до тех пор пока опухоли не стали ощутимыми и не достигли объема 80-200 мм3 (если не указано иное). Животных содержали в клетках, температуру внутри клеток поддерживали на уровне 22°С ± 1°С с относительной влажностью 50±10% и скоростью воздухообмена в клетке 60 раз в час. Их держали 12 часов на свету: 12 часов в темноте, цикл искусственного освещения. Животных кормили автоклавированной Ssniff NM от Ssniff® и они имели доступ к стерильной фильтрованной и подкисленной (pH 4,0) водопроводной воде, которую меняли два раза в неделю. Корм и вода обеспечивались ad libitum. До начала терапии животные были рандомизированы (7 мышей в группе, если не указано иное) с учетом сравнимой медианы и среднего группового объема опухоли. Животных регулярно контролировали два раза в день в рабочие дни и раз в день по субботам и воскресеньям. Начиная с 0-го дня, индивидуальную массу тела мышей определяли два или три раза в неделю, а среднюю массу тела на группу соотносили с начальным значением в процентах для расчета изменения массы тела (BWC). Объем опухоли определяли двумерным измерением с помощью штангенциркуля в день рандомизации (день 0) и затем дважды или трижды в неделю. Объемы опухолей рассчитывали по следующему уравнению:
[182] Объем опухоли [мм3] = l [мм] x w2 [мм2] x 0,5, где «l» - длина, а «w» - ширина опухоли. Относительный объем отдельной опухоли в день X (OOOx) рассчитывали путем деления абсолютного индивидуального объема опухоли [мм3] соответствующей опухоли в день X (Tx) на абсолютный объем отдельной опухоли той же опухоли в день рандомизации, умноженный на 100%. Графики применялись в той степени, в которой это позволяет порядок проведения в области защиты животных. Уничтожение отдельных мышей проводили при объеме опухоли больше 1500 мм3 (односторонняя) или когда наблюдалось образование язвы. Все тестируемые соединения вводили в 1, 8, 15 и 22 день и поставляли в виде лиофилизированных твердых веществ, содержащих сахарозу. В день обработки лиофилизированные образцы растворяли в 10 мМ натрий-фосфатном буфере, рН 6,8, содержащем 20% пропиленгликоля, и вводили внутривенно (100 мкл/20 г мыши) вместе с наполнителем (10 мМ натрий-фосфатный буфер, 20% пропиленгликоль и 5% сахароза - рН 6,8).
Пример 13
Оценка майтанзина и альбумин-связывающих майтанзиноидов 30, 42, 31 и 35 в модели почечно-клеточного рака человека PDX RXF 631
[183] Оценка майтанзина и альбумин-связывающих соединений 30, 42, 31 и 35 в модели RXF 631 на почечных раковых клетках проводилась в соответствии с общей процедурой для модели ксенотрансплантата, полученного от пациента. Лечение начинали после того, как опухоли достигли среднего размера 100 мм3. На фигуре 3 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30, 42, 31 и 35. На фигуре 4 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30, 42, 31 и 35.
Пример 14
Оценка майтанзина и альбумин-связывающих майтанзиноидов 32, 30 и 31 в модели плоскоклеточной карциномы легкого LXFE 937
[184] Оценка майтанзина и альбумин-связывающих соединений 32, 30 и 31 в модели LXFE 937 плоскоклеточной карциномы легкого проводилась в соответствии с общей процедурой для модели ксенотрансплантата, полученного от пациента. Лечение начинали после того, как опухоли достигли среднего размера 117 мм3. На фигуре 5 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 32, 30 и 31. На фигуре 6 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 32, 30 и 31.
Пример 15
Оценка майтанзина и альбумин-связывающих майтанзиноидов 30 и 31 в плоскоклеточной карциноме легкого человека PDX на модели LXFE 937 опухолей (большие опухоли)
[185] Оценка майтанзина и альбумин-связывающих соединений 31 и 31 в модели LXFE 937 плоскоклеточной карциномы легкого проводилась в соответствии с общей процедурой для модели ксенотрансплантата, полученного от пациента. Лечение начинали после того, как опухоли достигли среднего размера 270 мм3. На фигуре 7 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31. На фигуре 8 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31.
Пример 16
Оценка майтанзина и альбумин-связывающих майтанзиноидов 30 и 31 в модели аденокарциномы легкого человека PDX LXFA 737.
[186] Оценка майтанзина и альбумин-связывающих соединений 30 и 31 в модели аденокарциномы легкого человека LXFA 737 проводилась в соответствии с общей процедурой для модели ксенотрансплантата, полученного от пациента. Лечение начинали после того, как опухоли достигли среднего размера 311 мм3. На фигуре 9 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31. На фигуре 10 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31.
Пример 17
Оценка майтанзина и альбумин-связывающих майтанзиноидов 32, 30 и 31 в модели ксенотрансплантанта карциномы молочной железы человека MDA-MB-231
[187] Оценка майтанзина и альбумин-связывающих соединений 32,30 и 31 в модели карциномы молочной железы MDA-MB-231 проводилась в соответствии с общей процедурой для модели ксенотрансплантата, происходящего от раковой клеточной линии. Лечение начинали после того, как опухоли достигли среднего размера 80 мм3. На фигуре 11 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 32, 30 и 31. На фигуре 12 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 32, 30 и 31.
Пример 18
Оценка майтанзина и альбумин-связывающих майтанзиноидов 30 и 31 в модели ксенотрансплантанта рака яичников человека A2780
[188] Оценка майтанзина и альбумин-связывающих соединений 30 и 31 в модели рака яичников A2780 проводилась в соответствии с общей процедурой для модели ксенотрансплантата, происходящего от раковой клеточной линии. Лечение начинали после того, как опухоли достигли среднего размера 380 мм3. На фигуре 13 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31. На фигуре 14 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31.
Пример 19
Оценка майтанзина и альбумин-связывающих майтанзиноидов 30 и 31 в модели ксенотрансплантанта карциномы молочной железы человека MDA-MB 468
Оценка майтанзина и альбумин-связывающих соединений 30 и 31 в модели карциномы молочной железы MDA-MB-468 проводилась в соответствии с общей процедурой для модели ксенотрансплантата, происходящего от раковой клеточной линии. Лечение начинали после того, как опухоли достигли среднего размера 94 мм3. На фигуре 15 показаны кривые роста опухоли контрольной группы, группы майтанзина и групп, обработанных соединениями 30 и 31. На фигуре 16 показаны кривые изменения массы тела в контрольной группе, группе майтанзина и группах, обработанных соединениями 30 и 31.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИМИДАЗОПИРИМИДИНЫ КАК ИНГИБИТОРЫ EED И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2836176C2 |
| СРЕДСТВА ВИЗУАЛИЗАЦИИ ДЛЯ МЕЧЕННОГО РАДИОАКТИВНЫМ ИЗОТОПОМ ЭКЗОГЕННОГО И ЭНДОГЕННОГО АЛЬБУМИНА | 2019 |
|
RU2819907C2 |
| ИНГИБИТОРЫ RAD51 | 2018 |
|
RU2795882C2 |
| ПОЛИМОРФНАЯ ФОРМА ДИАРИЛЬНОГО МАКРОЦИКЛА | 2016 |
|
RU2765181C2 |
| АЛЬБУМИН-СВЯЗЫВАЮЩИЕ ПРОЛЕКАРСТВА НА ОСНОВЕ ПРОИЗВОДНЫХ АУРИСТАТИНА Е | 2018 |
|
RU2795101C2 |
| ПИРРОЛОПИРРОЛОВЫЕ КОМПОЗИЦИИ В КАЧЕСТВЕ АКТИВАТОРОВ ПИРУВАТКИНАЗЫ (PKR) | 2018 |
|
RU2736217C2 |
| СИСТЕМЫ ДОСТАВКИ ДЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2748992C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИНДОЛ-5-ОЛА И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2674249C2 |
| СОЕДИНЕНИЕ 3,4-ДИГИДРОИЗОХИНОЛИНА И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2825312C1 |
| СУЛЬФОНАМИДСОДЕРЖАЩИЕ СВЯЗЫВАЮЩИЕ СИСТЕМЫ ДЛЯ ЛЕКАРСТВЕННЫХ КОНЪЮГАТОВ | 2014 |
|
RU2729194C2 |
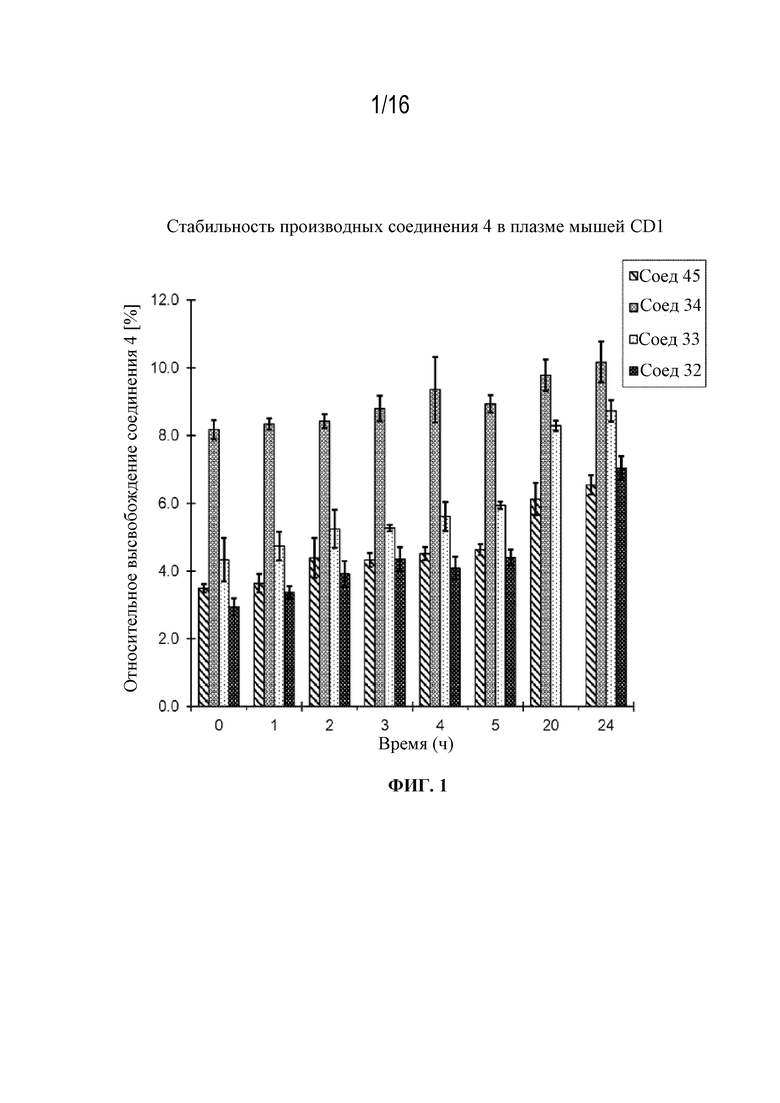
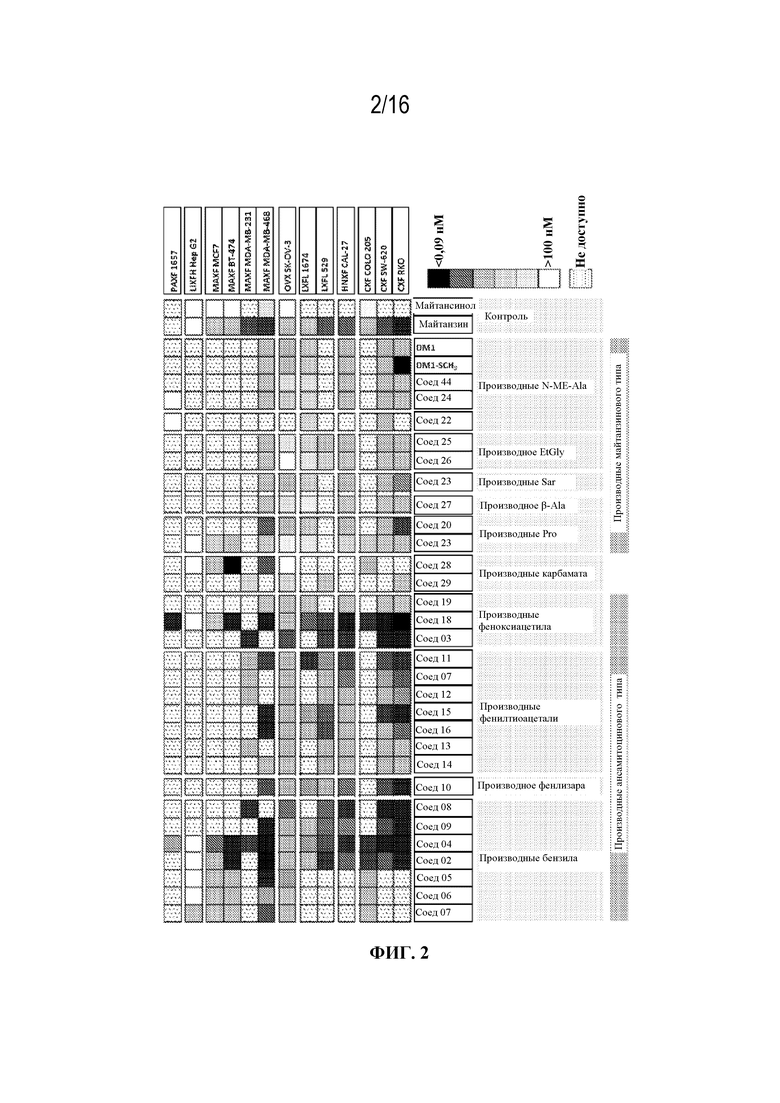
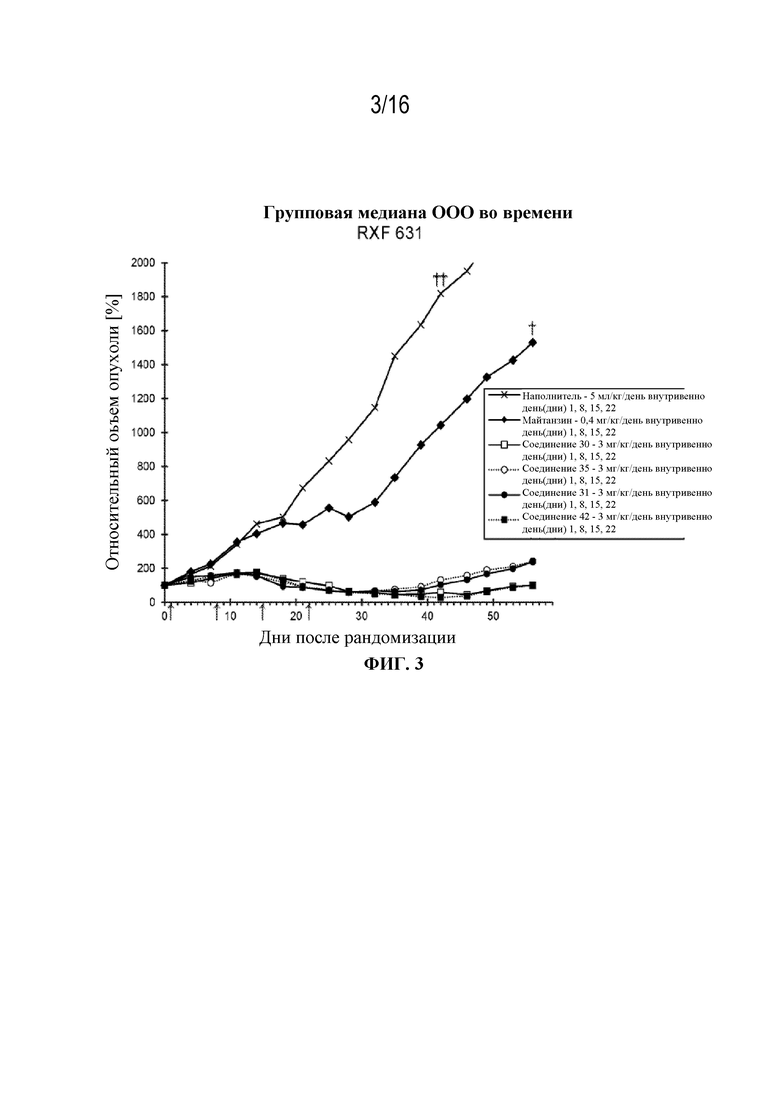
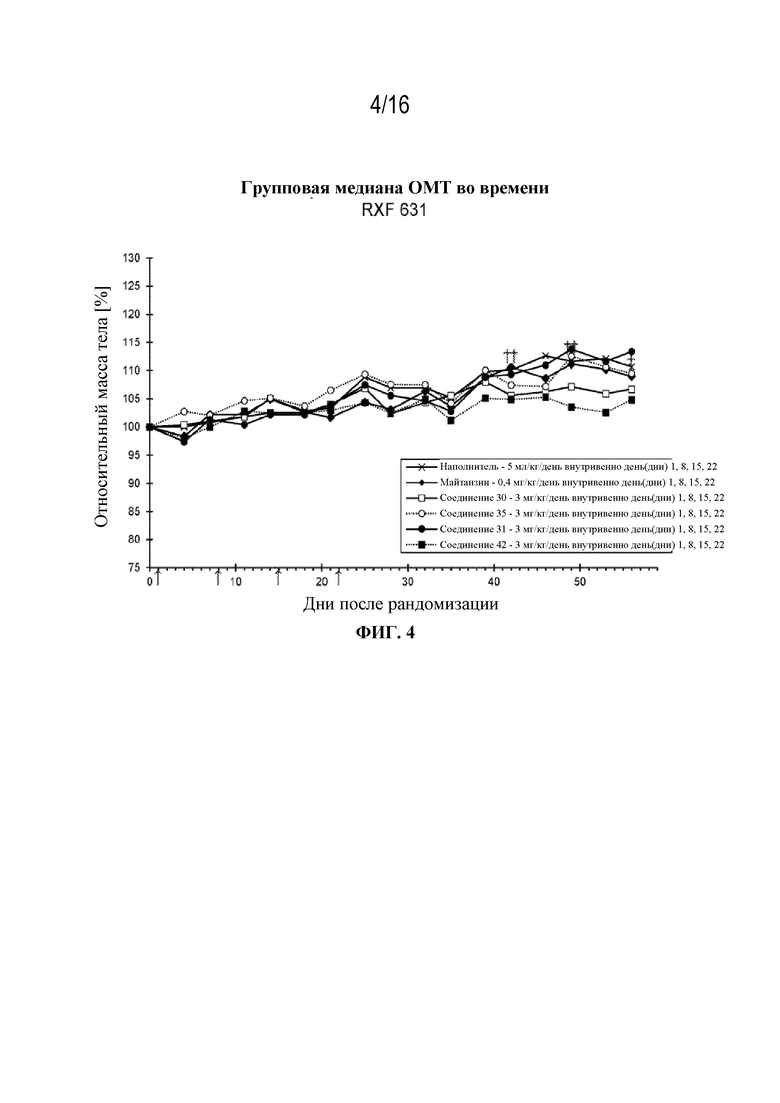
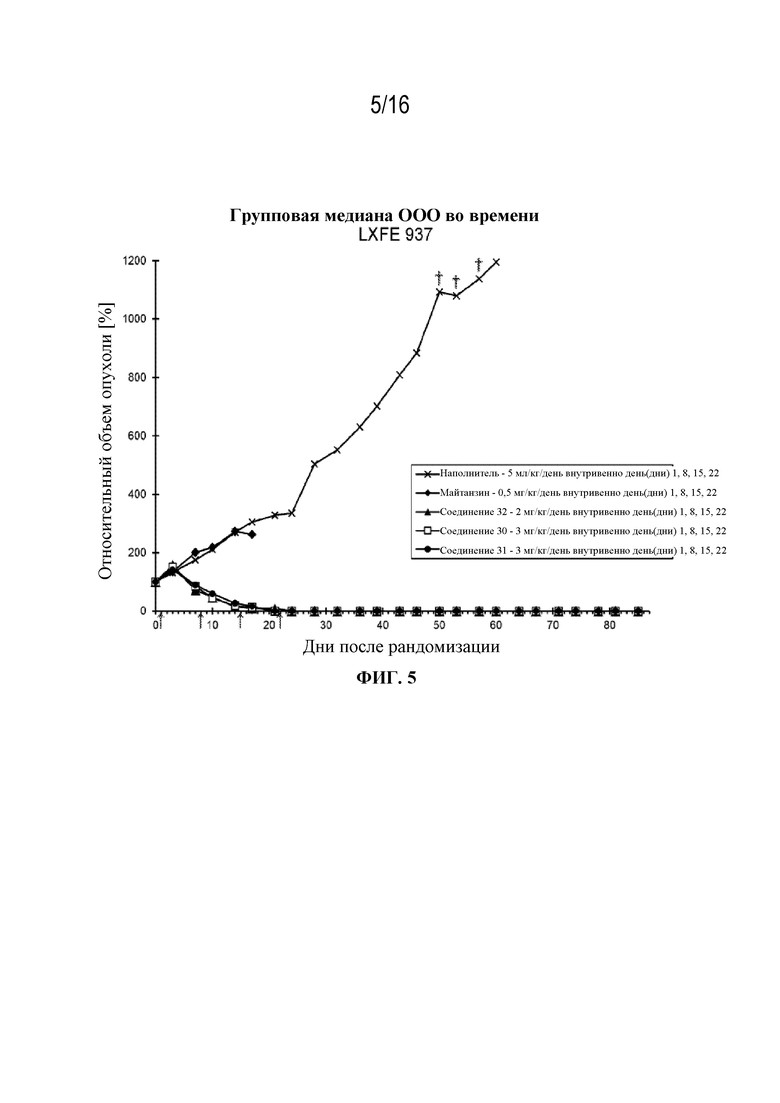
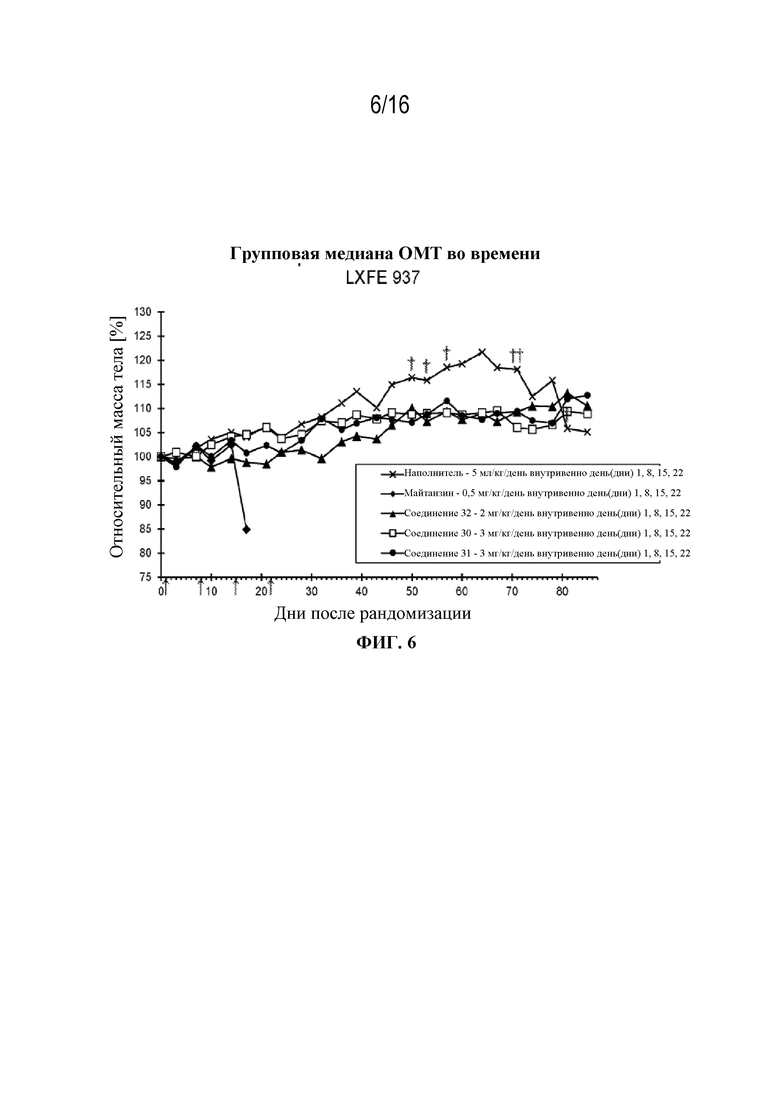
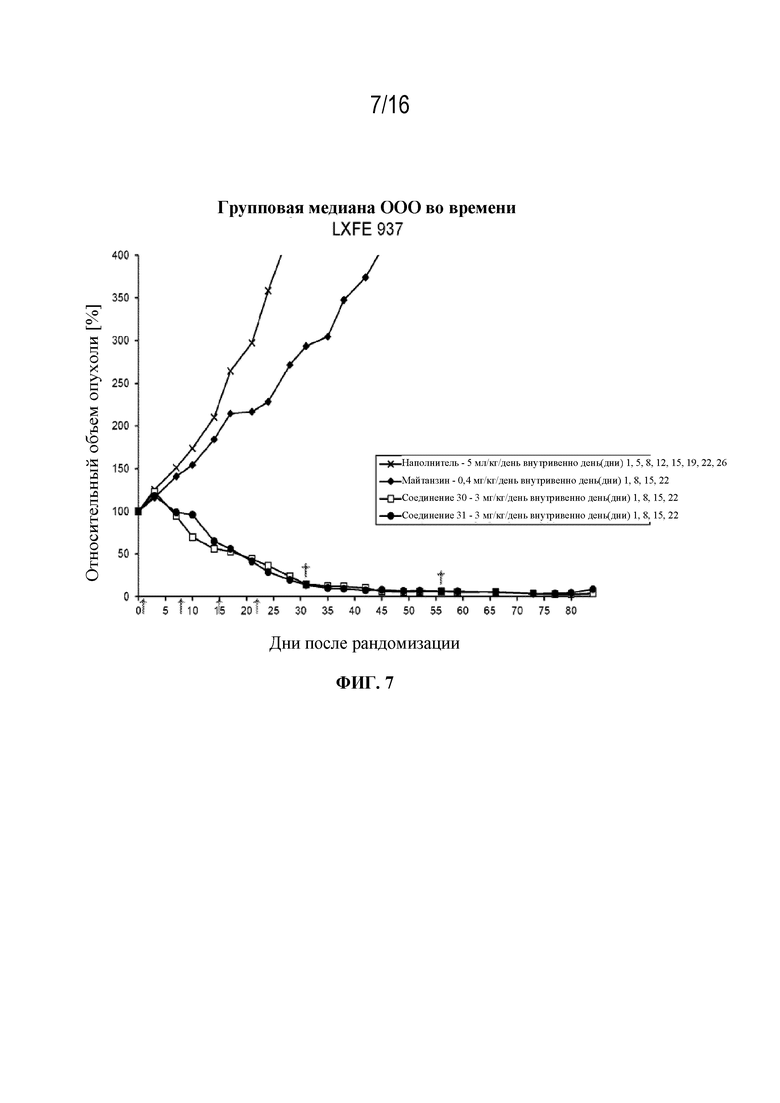
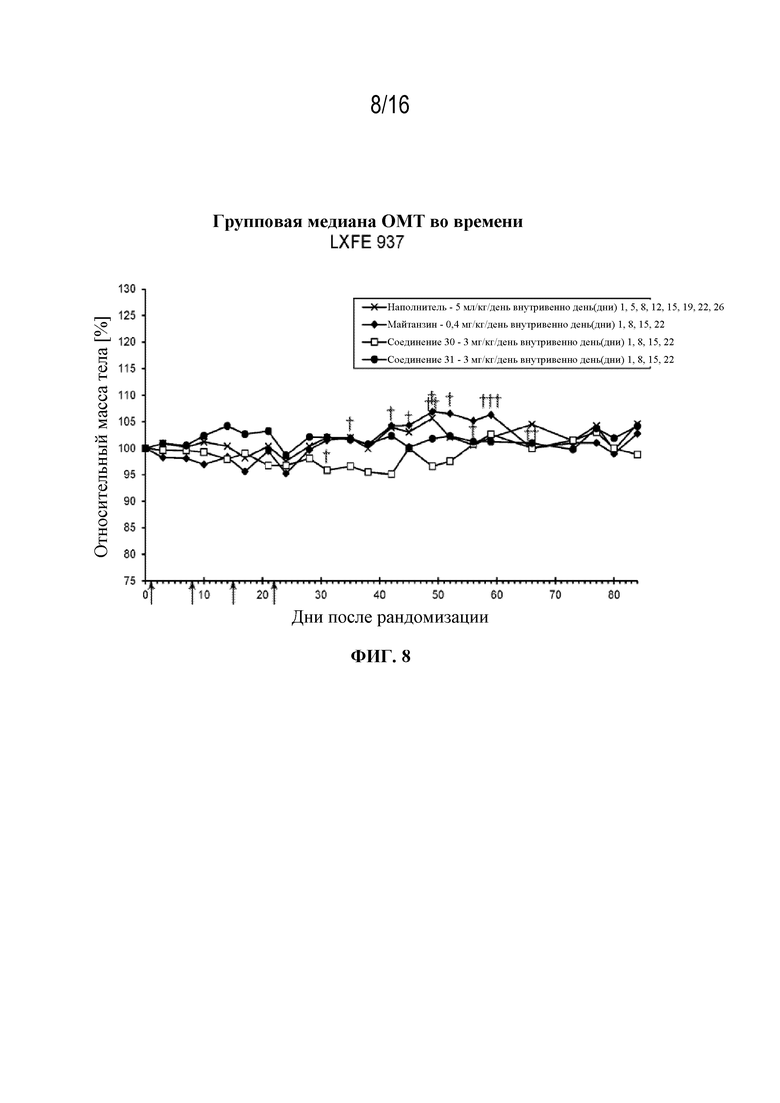
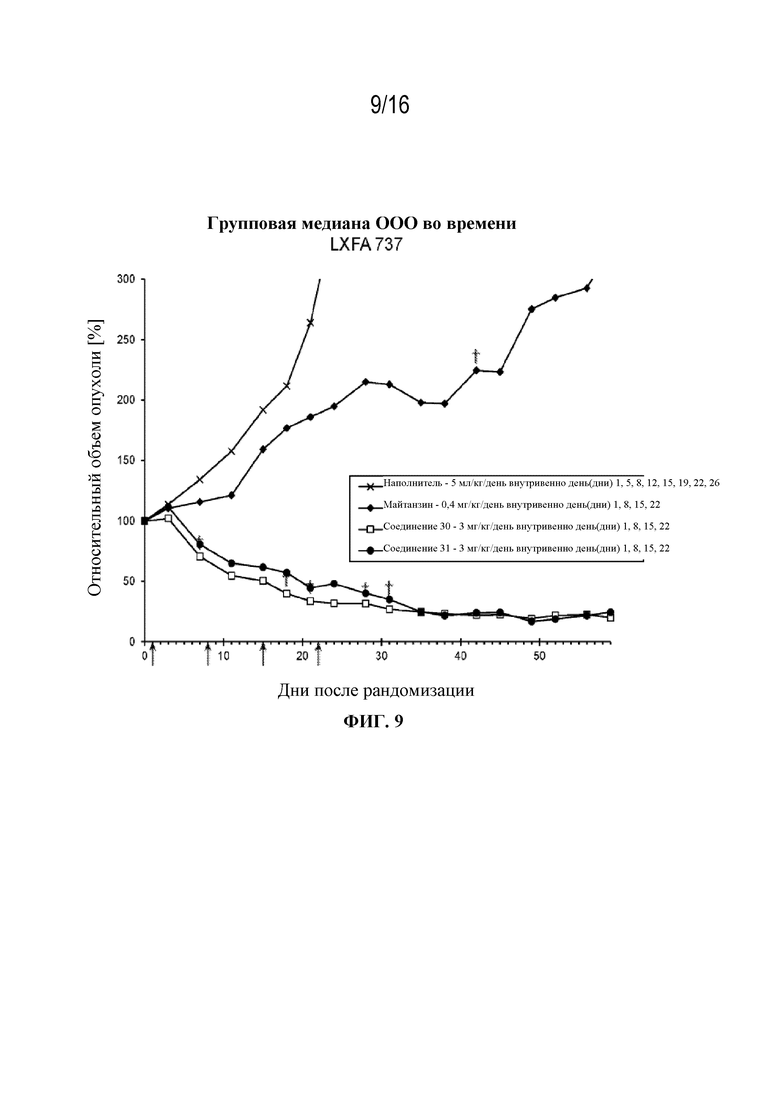
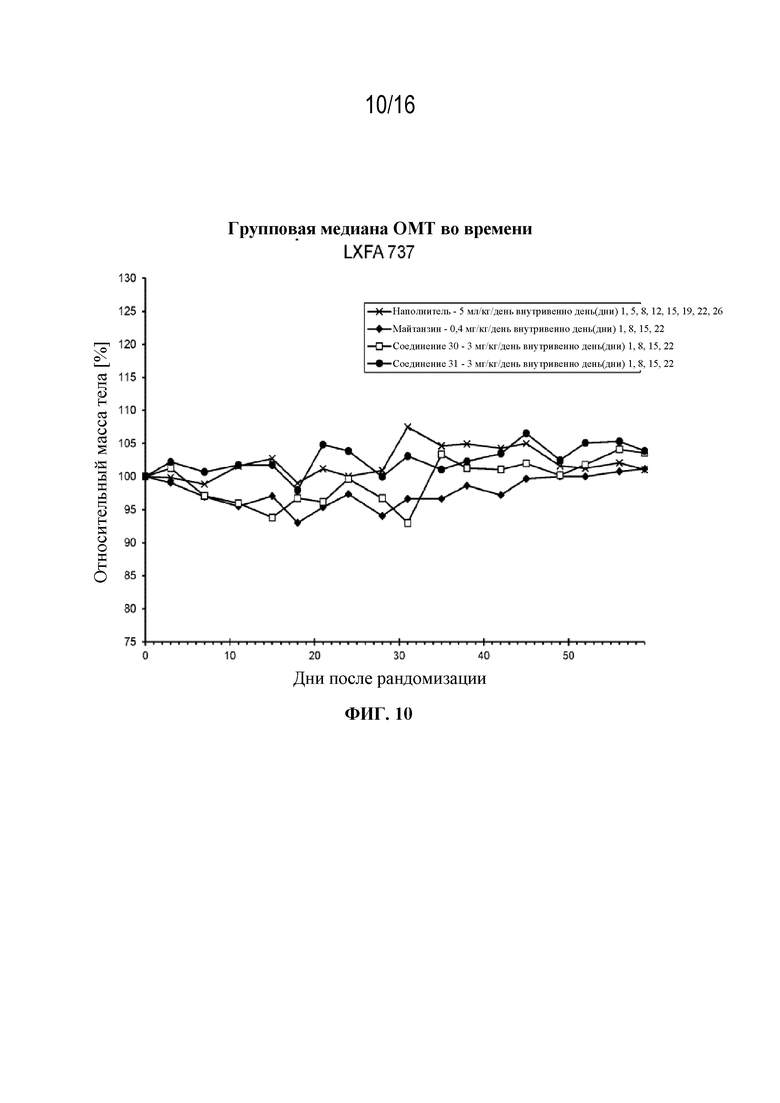
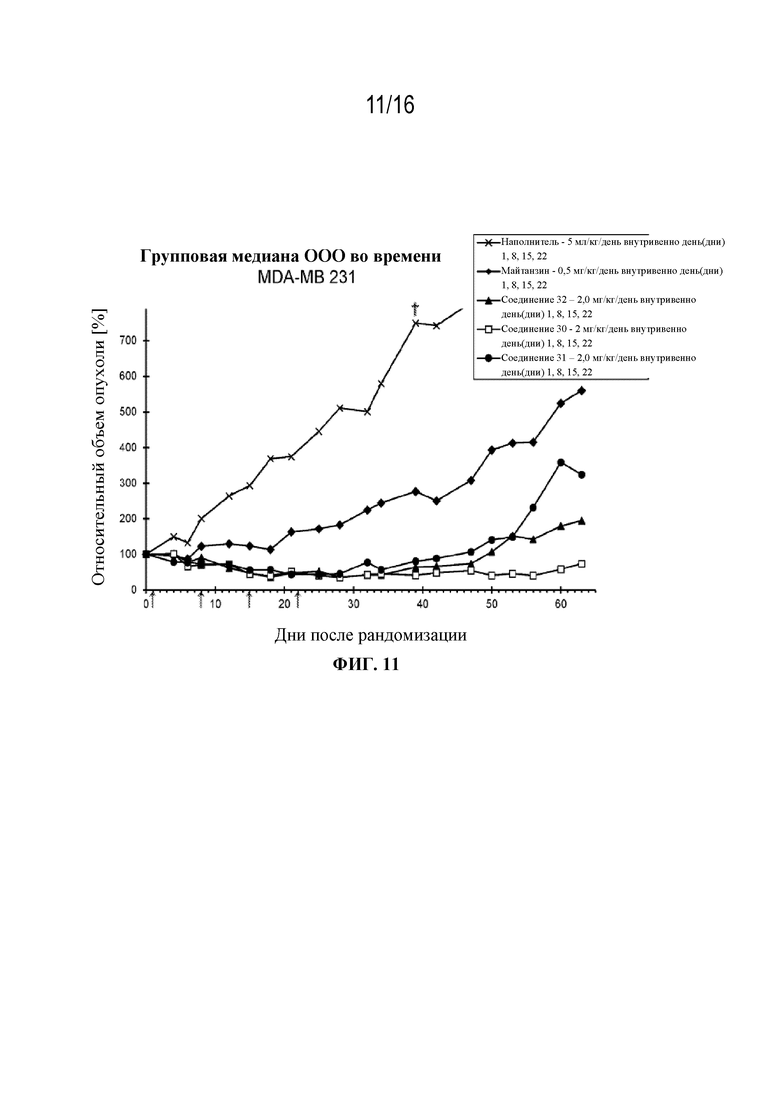
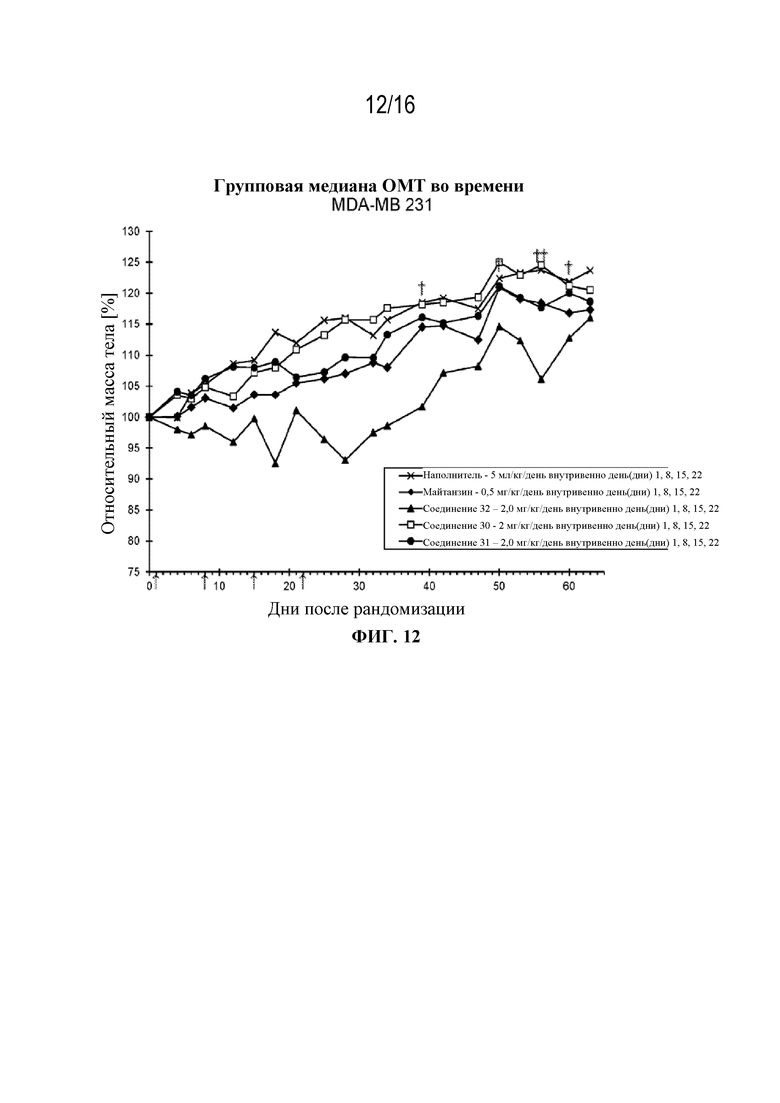
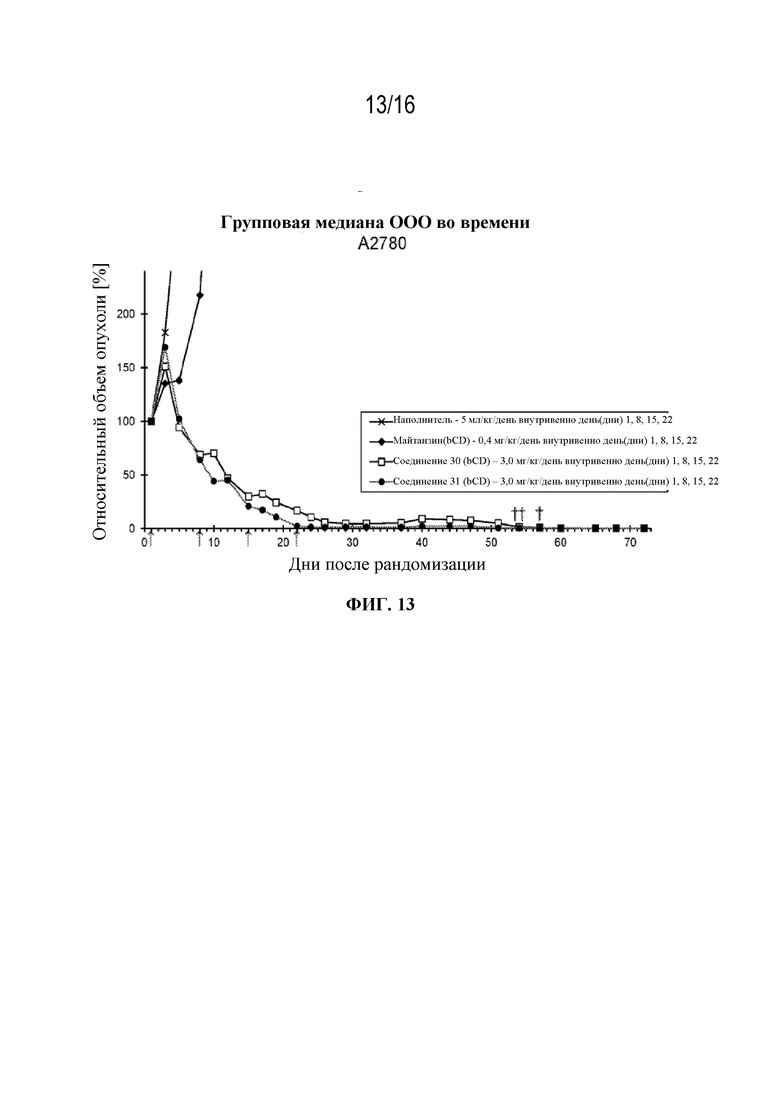
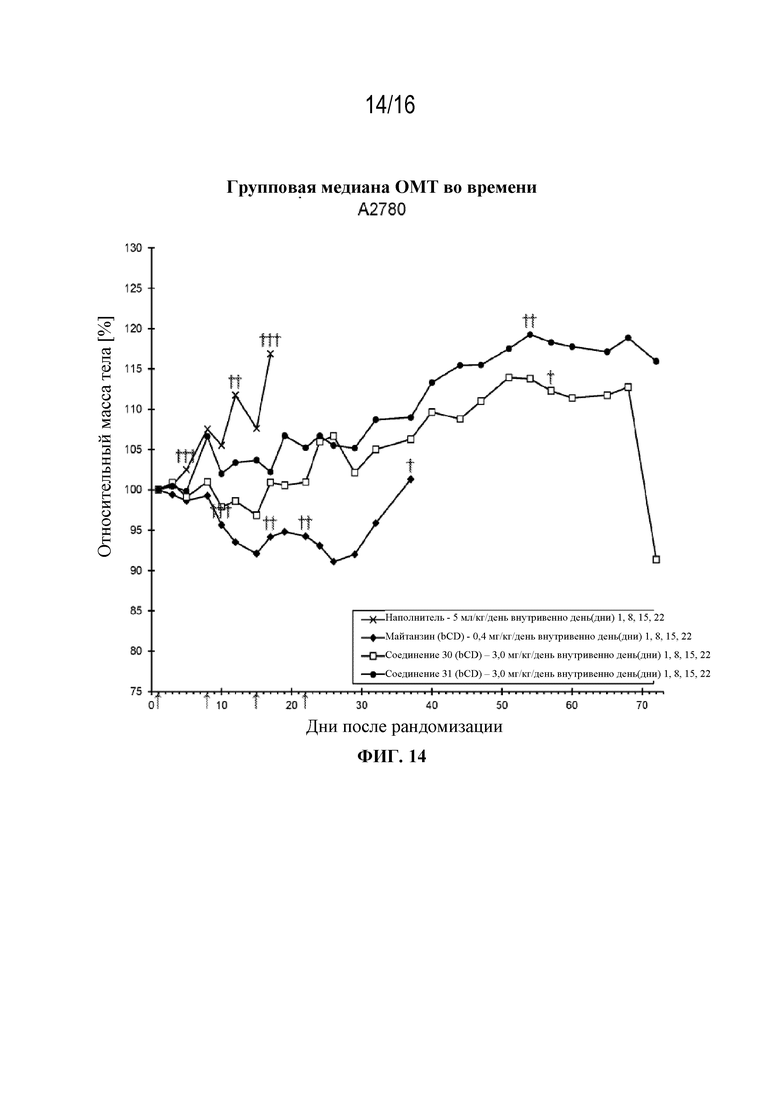
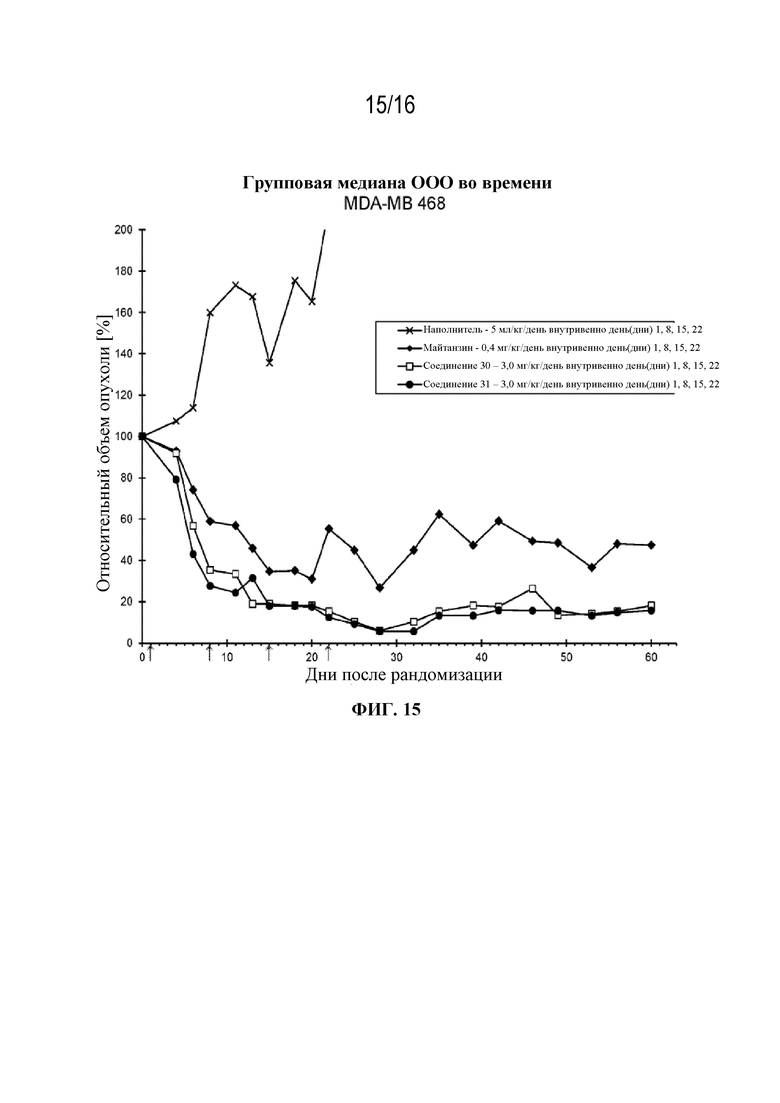
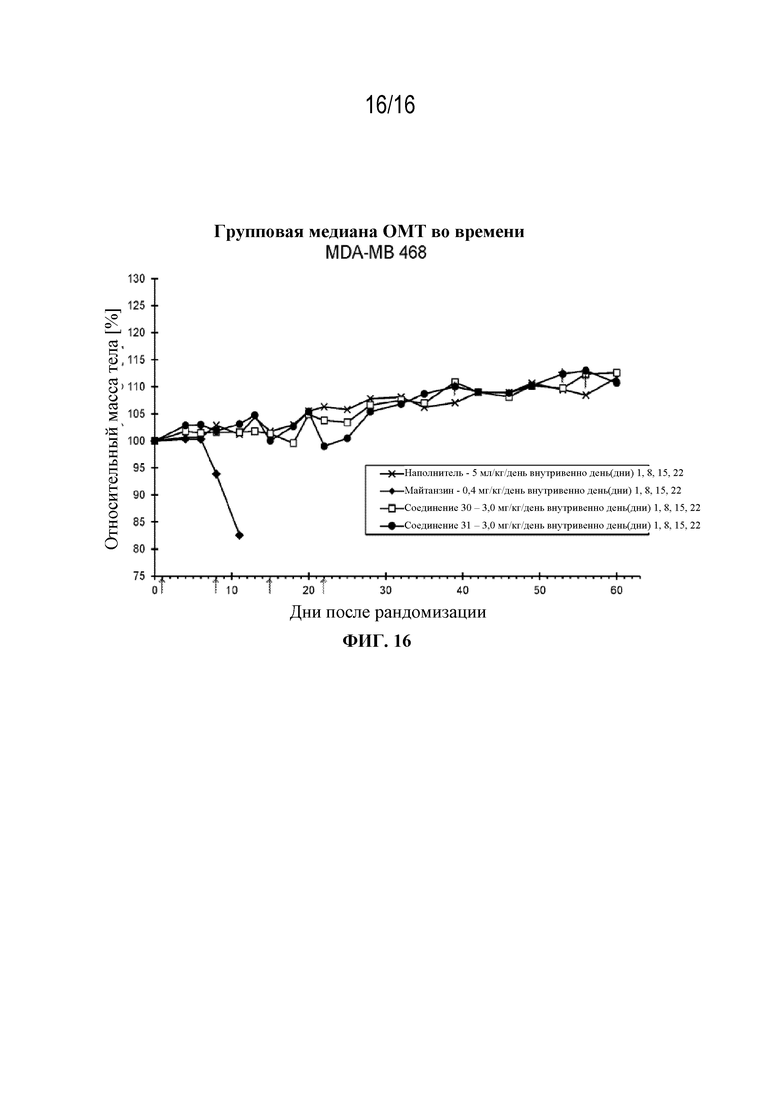
Настоящее изобретение относится к альбуминсвязывающим пролекарствам, соединениям на основе майтанзиноида и их применению в системе доставки лекарств для лечения рака. 5 н. и 20 з.п. ф-лы, 16 ил., 8 табл., 19 пр.
1. Соединение, имеющее структуру формулы (I):
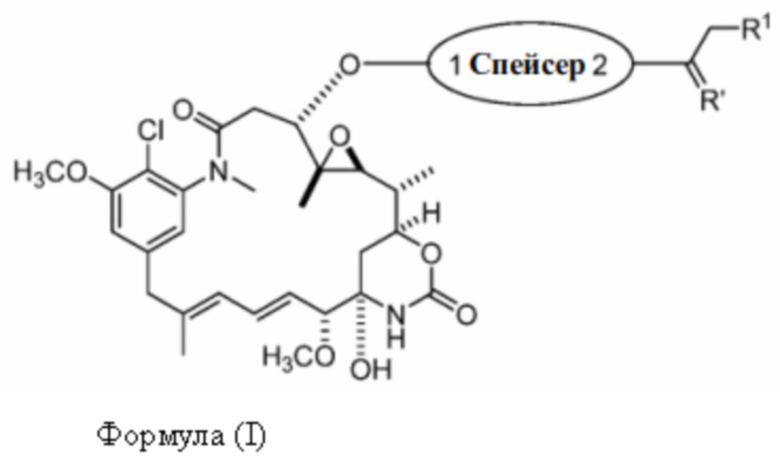
или его фармацевтически приемлемая соль, где:
R1 выбран из -H и C1-C4 алкила;
Спейсер выбран из:
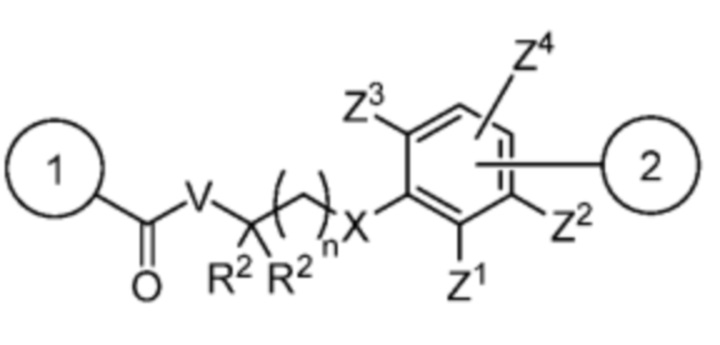 и
и 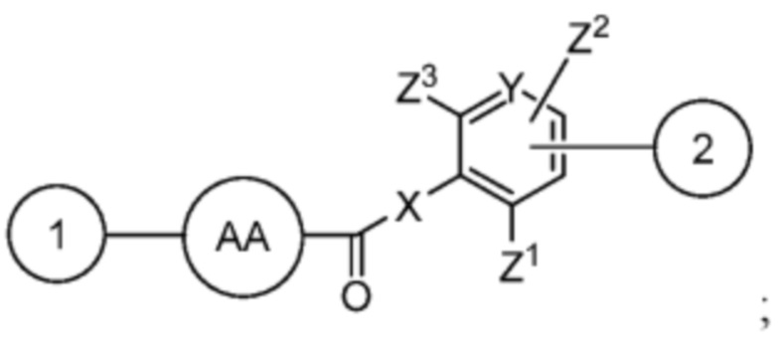
V отсутствует или выбран из -CH2- и -NR3-, где R3 представляет собой -H или C1-C4 алкил;
каждый R2 независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I) и C1-C4 алкил или два R2 вместе образуют C3-C6, циклоалкил;
n равно 0-2;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR4-, где R4 представляет собой -H или C1-C4 алкил; Y выбран из =CH- и =N-;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -CN, -NO2, C1-C4 алкила и C2-C4 алкокси при условии, что когда Y представляет собой=N-, то каждый из Z1, Z2, Z3 независимо представляет собой -H;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этилглицина, D или L аланина, D или L N-метилаланина, β-аланина и N-метил-β-аланина;
R’ выбран из O и 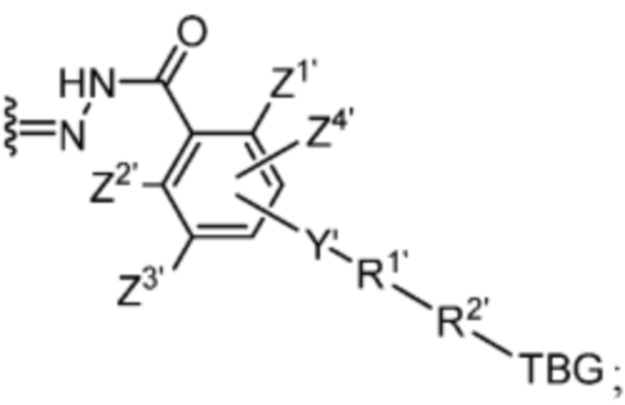
Y’ отсутствует или выбран из необязательно замещенного C1-C6 алкила, -NH-C(O)- и -C(О)-NH- или Y’ выбран из группы, состоящей из:
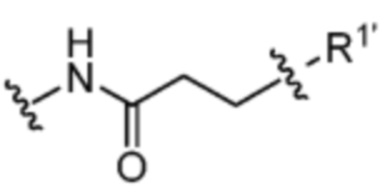 и
и 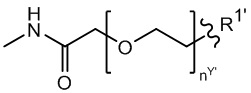 ,
,
где nY’=0-6;
R1’ отсутствует или выбран из группы, состоящей из:
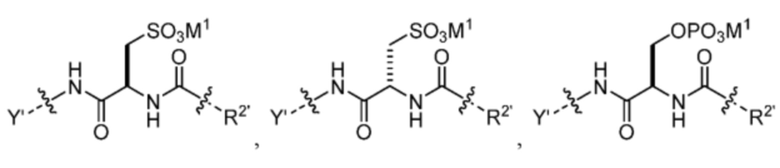 и
и
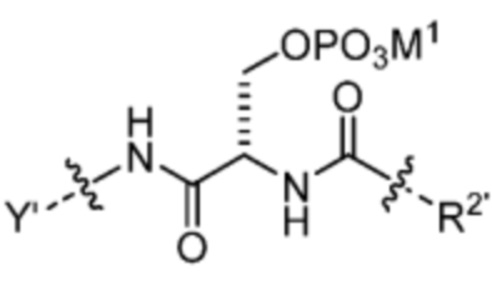
где M1 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
R2’ представляет собой необязательно замещенный C1-C18 алкил, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-;
Z1’, Z2’, Z3’ и Z4’ каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3,
-CN, -NO2, -SO3M2 и C1-C4 алкил, где M2 представляет собой фармацевтически приемлемый противоион (например, H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил);
TBG представляет собой тиолсвязывающую группу, выбранную из необязательно замещенной малеимидной группы, необязательно замещенной галоацетамидной группы, необязательно замещенной галоацетатной группы, необязательно замещенной пиридилтиогруппы, необязательно замещенной изотиоцианатной группы, необязательно замещенной винилкарбонильной группы, необязательно замещенной азиридиновой группы, необязательно замещенной дисульфидной группы, необязательно замещенной ацетиленовой группы и необязательно замещенной N-гидроксисукцинимидной эфирной группы;
где указанная TBG необязательно связана с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли.
2. Соединение по п.1, отличающееся тем, что имеет структуру формулы (II):
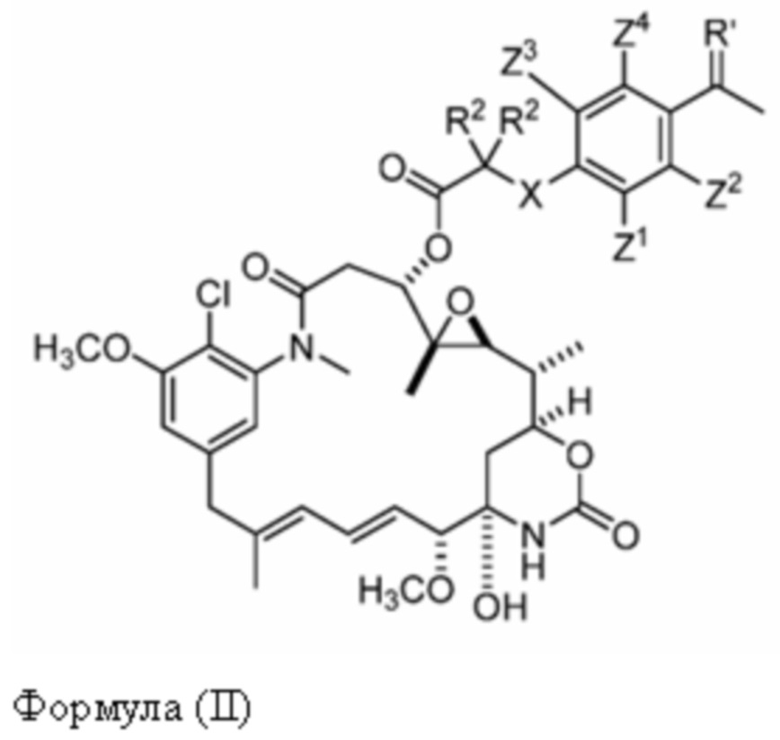
или его фармацевтически приемлемая соль, где:
каждый R2 независимо выбран из -H и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR4-, где R4 представляет собой -H или C1-C4 алкил;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -NO2 и -CH3.
3. Соединение по п.1, отличающееся тем, что имеет структуру формулы (III):
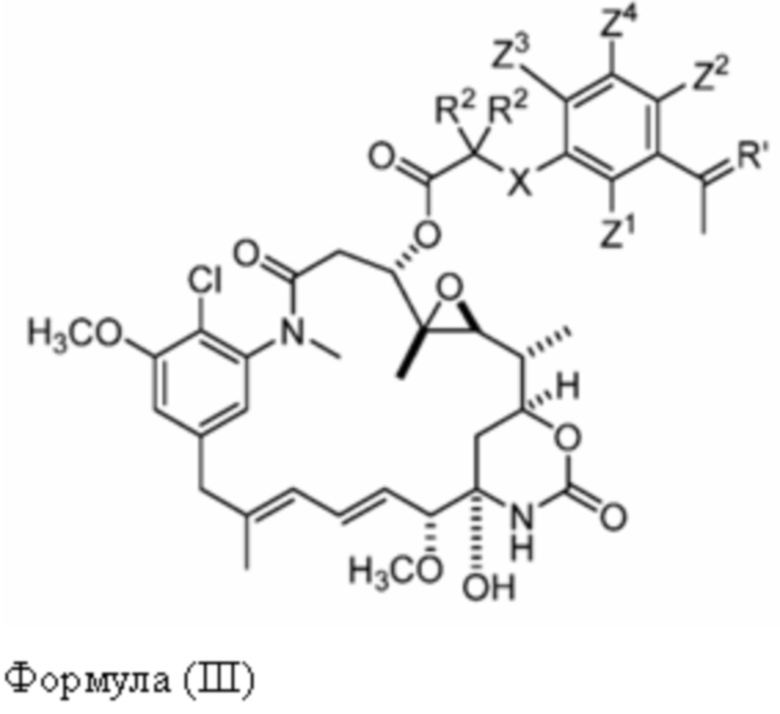
или его фармацевтически приемлемая соль, где:
каждый R2 независимо выбран из -H и C1-C4 алкила или два R2 вместе образуют C3-C6, циклоалкил;
X отсутствует или выбран из -CH2-, -O-, -S- и -NR4-, где R4 представляет собой -H или C1-C4 алкил;
Z1, Z2, Z3 и Z4 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или - I), -CF3, -OCH3, -NO2 и -CH3.
4. Соединение по п.1, отличающееся тем, что имеет структуру формулы (IV):
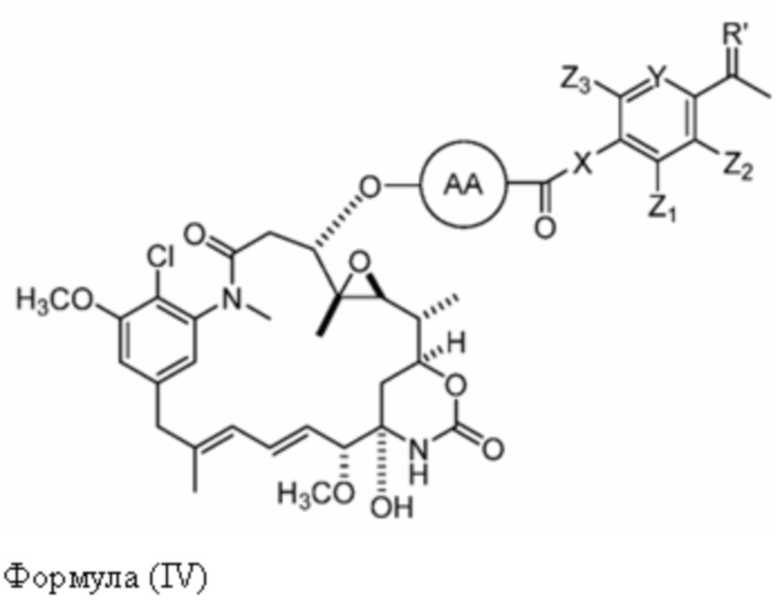
или его фармацевтически приемлемая соль, где:
X отсутствует или выбран из -CH2- и -NH-;
Y представляет собой =CH- или =N-;
Z1, Z2 и Z3 каждый независимо выбран из -H, галогена (например, -F, -Cl, -Br или -I), -CF3, -OCH3, -NO2 и -CH3, при условии, что когда Y представляет собой=N-, то каждый из Z1, Z2 и Z3 независимо представляет собой -H;
AA представляет собой аминокислоту, выбранную из глицина, D или L пролина, метилглицина, N-этил-глицина, D или L аланина, D или L N-метилаланина, β-аланина и N-метил-β-аланина.
5. Соединение или его фармацевтически приемлемая соль по любому из пп.1-4, отличающееся тем, что R1 представляет собой -H.
6. Соединение или его фармацевтически приемлемая соль по любому из пп.1-3, отличающееся тем, что по меньшей мере один из Z1, Z2, Z3 и Z4
а) не является H; или
b) является -F или -NO2.
7. Соединение или его фармацевтически приемлемая соль по любому из пп.1-4, отличающееся тем, что:
а) n равно 0, а X отсутствует;
b) n равно 0, а X представляет собой -СН2-; или
с) n равно 0, а X представляет собой -О- или -S-.
8. Соединение или его фармацевтически приемлемая соль по п.1, отличающееся тем, что соединение выбрано из:
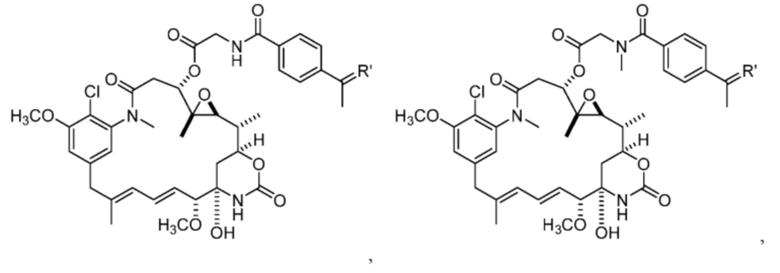
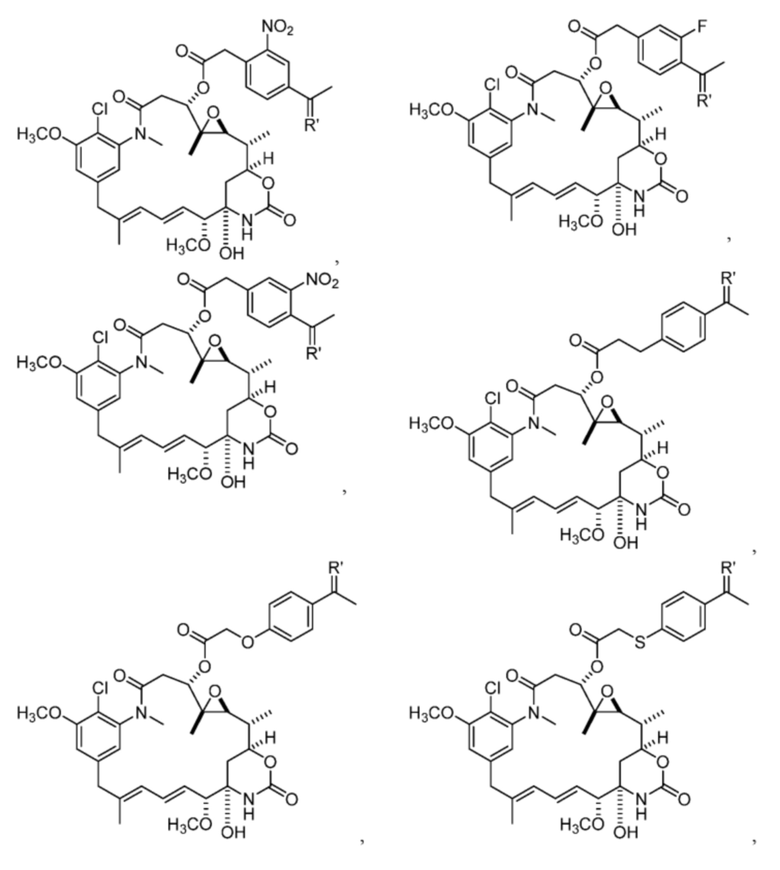
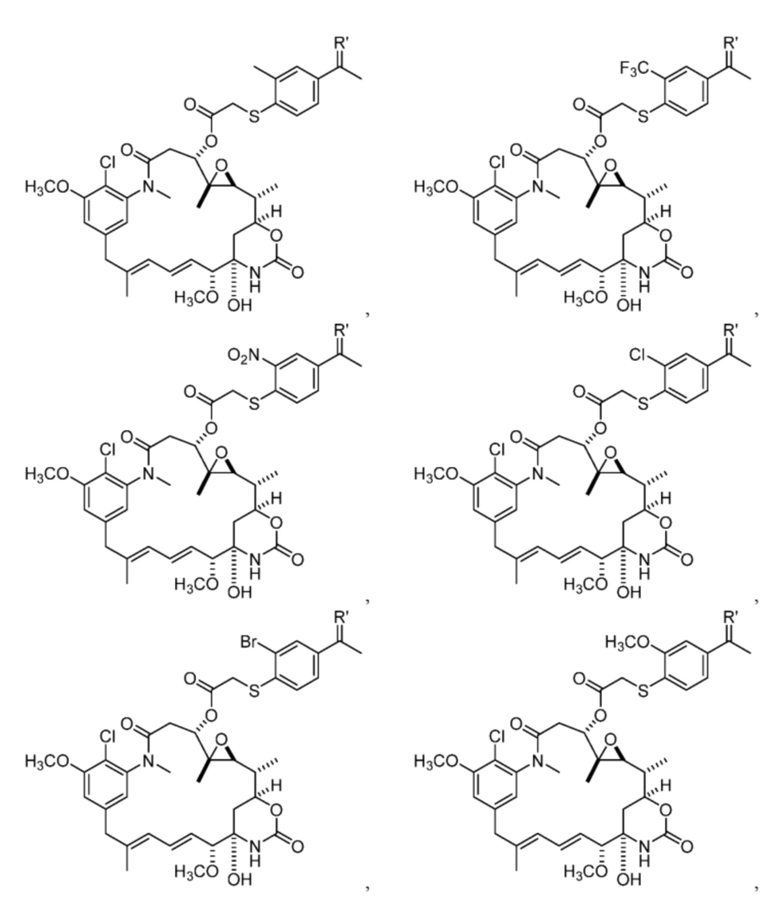
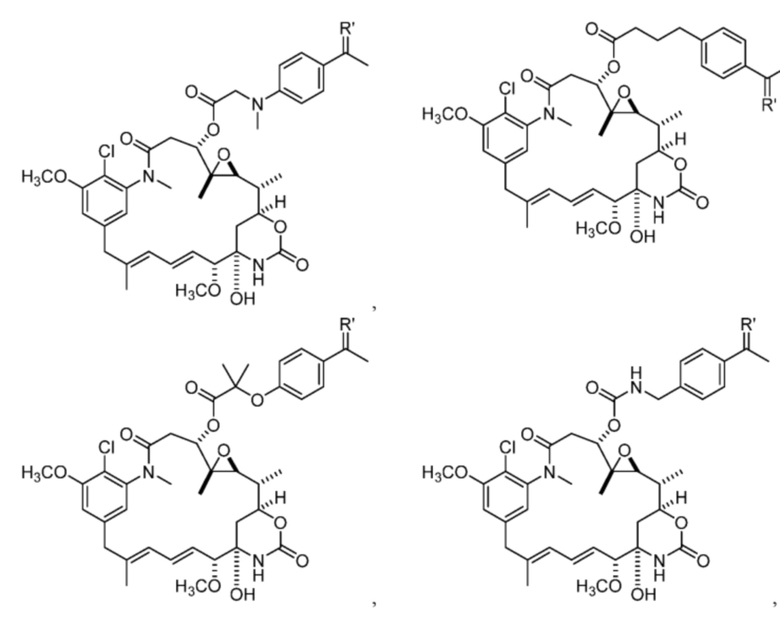
и 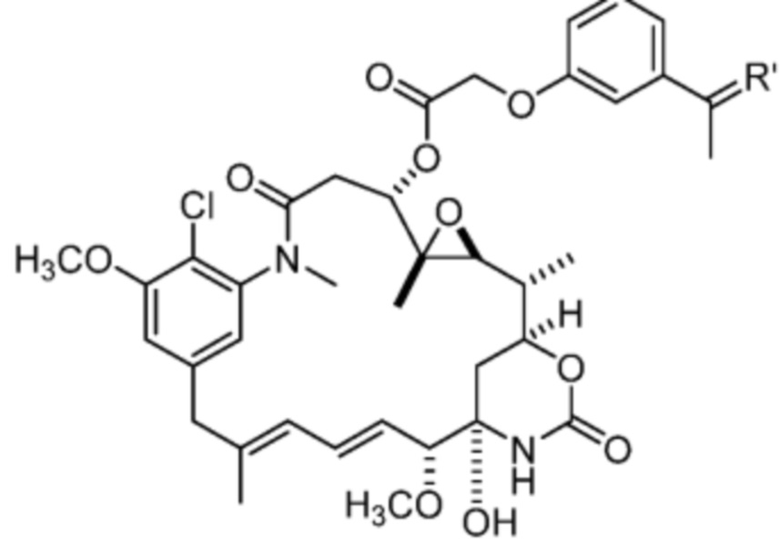 ,
,
или из их фармацевтически приемлемой соли.
9. Соединение или его фармацевтически приемлемая соль по пп.1-8, отличающееся тем, что фармацевтически приемлемый противоион выбран из H+, Na+, K+, Ca2+, Mg2+, NR4+ и NHR3+; где R представляет собой H или C1-C4 алкил.
10. Соединение или его фармацевтически приемлемая соль по пп.1-9, отличающееся тем, что R’ представляет собой:
а) O; или
b) 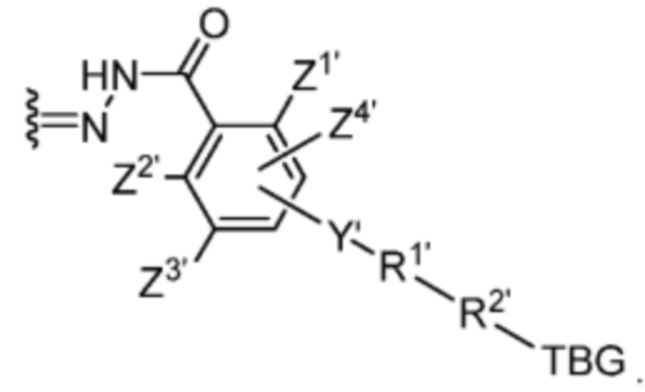
11. Соединение или его фармацевтически приемлемая соль по п.10, отличающееся тем, что
а) соединение не связываться с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли; или
b) соединение связывается с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли.
12. Соединение или его фармацевтически приемлемая соль по п.11, отличающееся тем, что соединение связывается с тиолсодержащим макромолекулярным носителем или тиолсодержащим носителем, специфичным для опухоли, выбранным из группы, состоящей из эндогенного альбумина, экзогенного альбумина, антитела, фрагмента антитела, пептида, природного или синтетического полимера, липосомы и наночастицы.
13. Соединение или его фармацевтически приемлемая соль по пп.10-12, отличающееся тем, что TBG представляет собой необязательно замещенную малеимидную группу.
14. Соединение или его фармацевтически приемлемая соль по пп.10-13, отличающееся тем, что Z1’ выбран из -NO2 или -SO3M2;
и Y’ выбран из -NHC(O)- или 
15. Соединение или его фармацевтически приемлемая соль по пп.10-14, отличающееся тем, что R1’ представляет собой
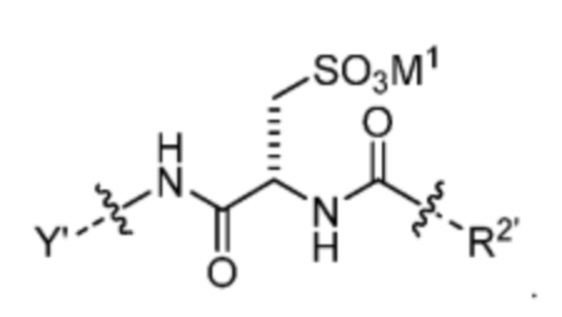
16. Соединение по пп.10-14, отличающееся тем, что R’ представляет собой:
а) 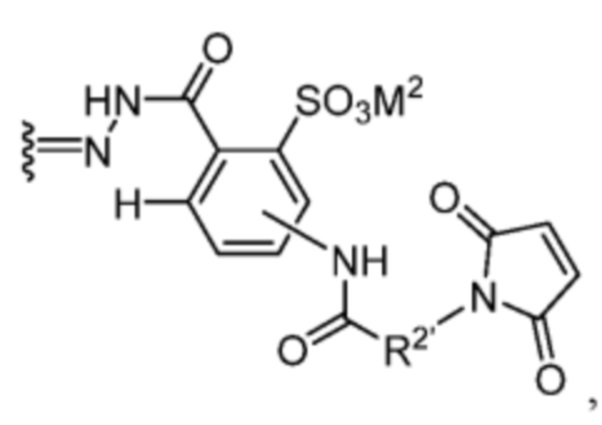
или его фармацевтически приемлемую соль, где
R2’ выбран из необязательно замещенного C1-C18 алкила, где необязательно до шести атомов углерода в указанном C1-C18 алкиле каждый независимо замещены с -OCH2CH2-; или
b) 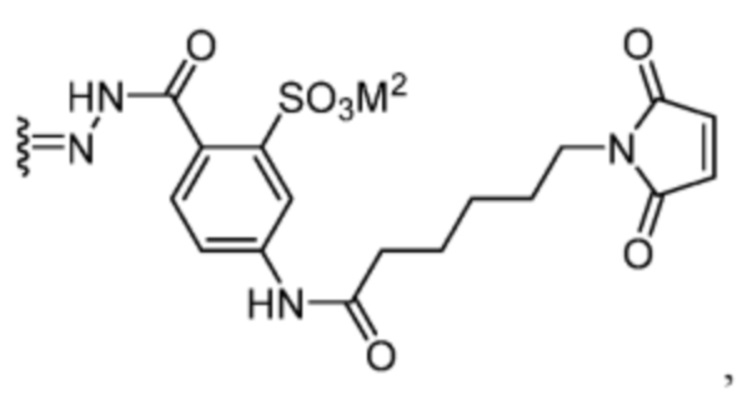
или его фармацевтически приемлемую соль.
17. Соединение по п.16, отличающееся тем, что соединение выбрано из:
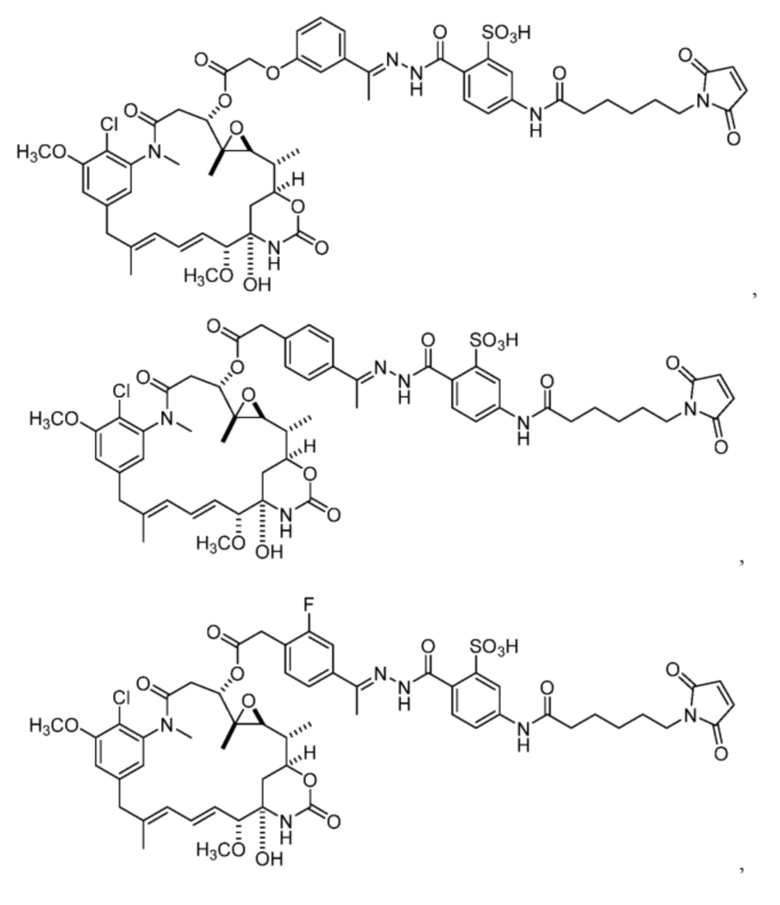
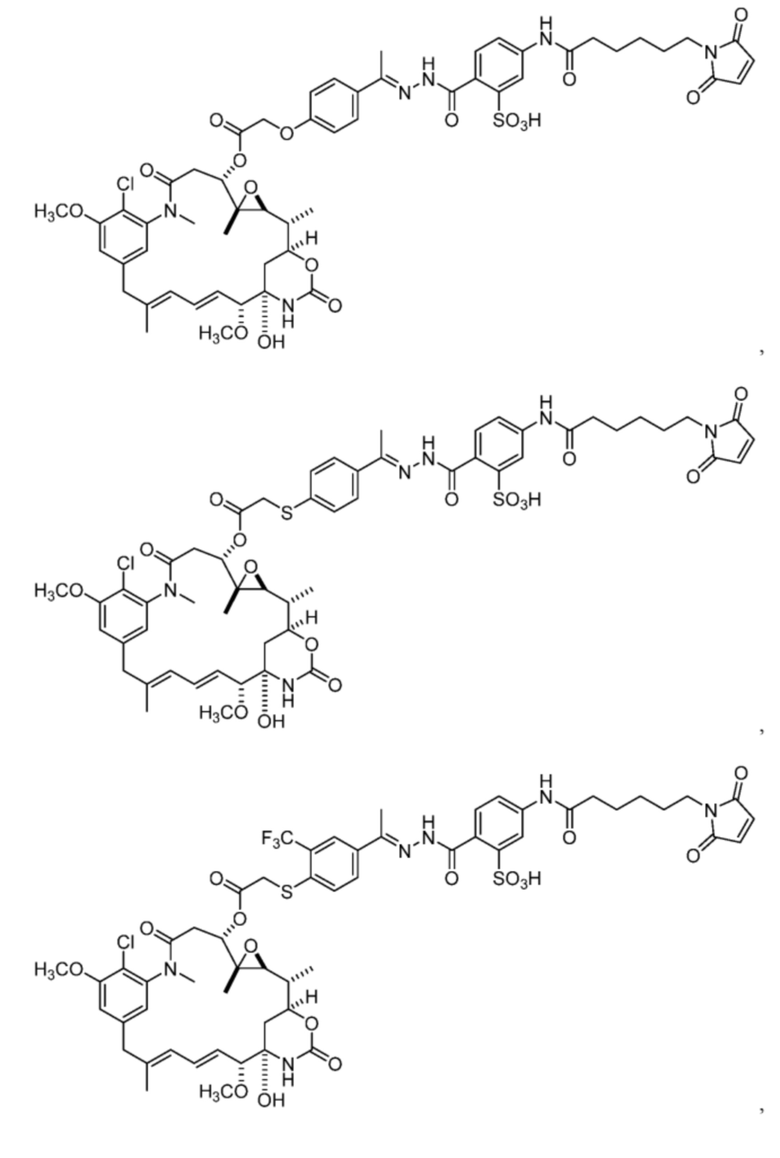
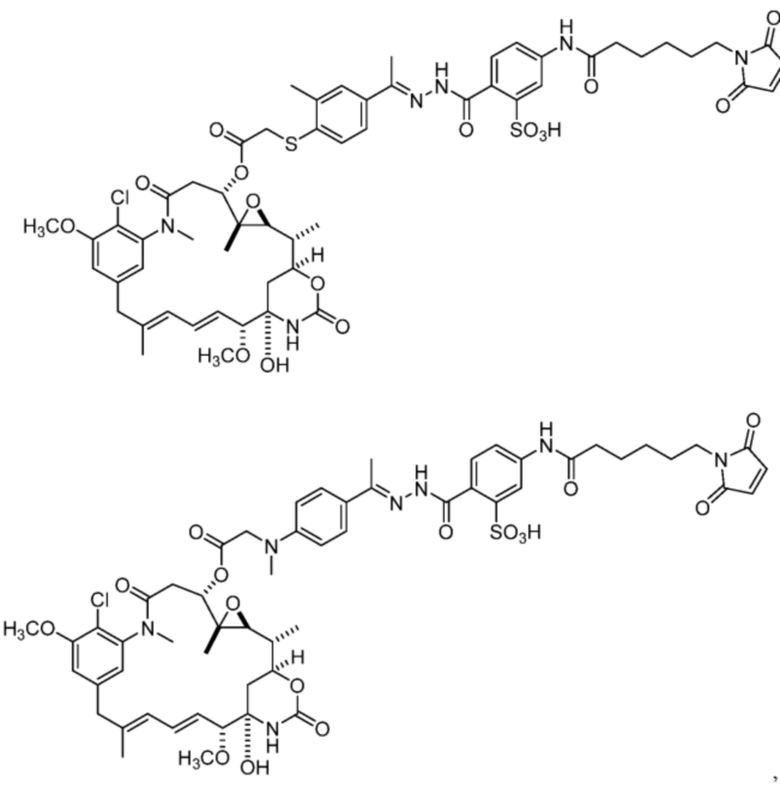 и
и
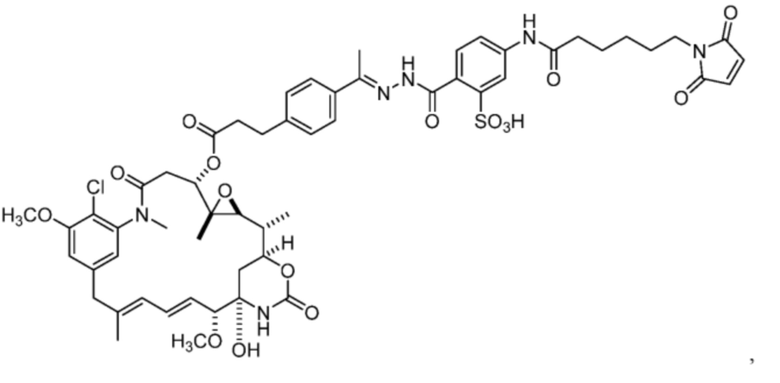
или из их фармацевтически приемлемой соли.
18. Соединение по пп.10-15, отличающееся тем, что R’ представляет собой:
a) 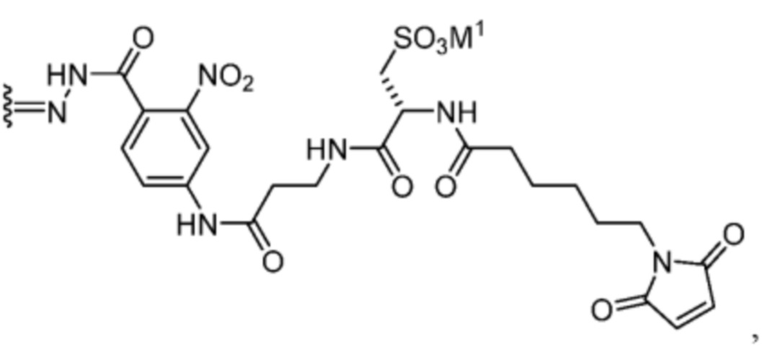
или его фармацевтически приемлемую соль; где M1 представляет собой фармацевтически приемлемый противоион; или
b) 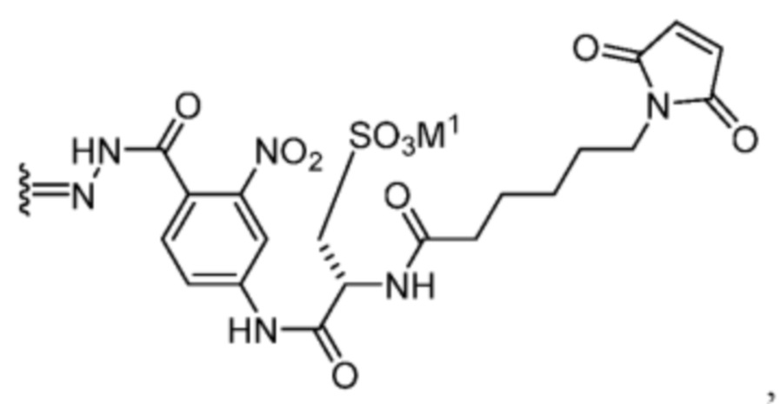
или его фармацевтически приемлемую соль; где M1 представляет собой фармацевтически приемлемый противоион.
19. Соединение по п.18, отличающееся тем, что соединение выбрано из:
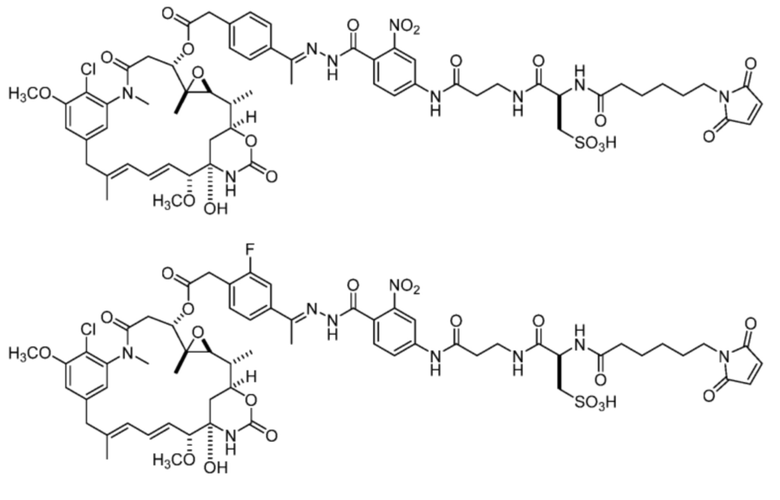
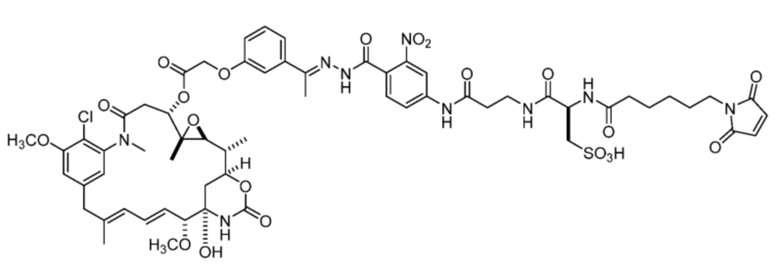
или из их фармацевтически приемлемой соли.
20. Соединение или его фармацевтически приемлемая соль по п.18, отличающееся тем, что соединение представляет собой:
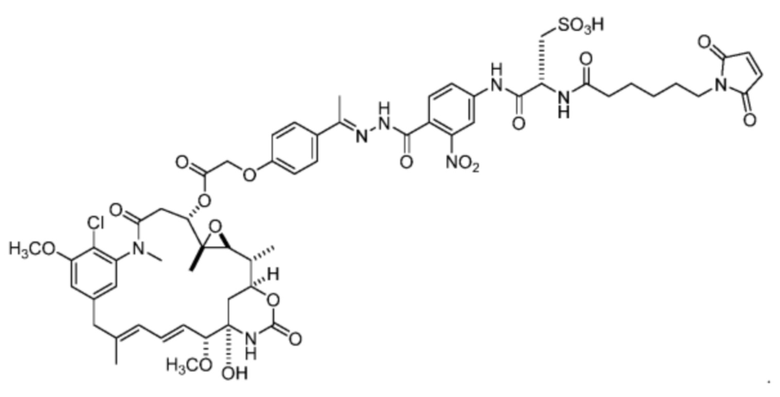
21. Фармацевтическая композиция для лечения рака у нуждающегося в этом пациента, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-20 и фармацевтически приемлемый носитель.
22. Способ лечения рака, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по пп.1-20 или фармацевтической композиции по п.21.
23. Способ по п.22, отличающийся тем, что рак выбран из аденокарциномы, рака амплулярного отдела толстой кишки, анальной карциномы, бронхиальной карциномы, немелкоклеточной бронхиальной карциномы, рака молочной железы, карциномы тела, рака яичника, карциномы эндометрия, рака желчного пузыря, колоректального рака, карциномы толстой кишки, рака легких, немелкоклеточного рака легких, карциномы яичников, карциномы поджелудочной железы и карциномы яичника.
24. Способ снижения цитотоксичности соединения, включающий введение соединения или его фармацевтически приемлемой соли по любому из пп.1-20 или фармацевтической композиции по п.21 нуждающемуся в этом пациенту, при этом введение приводит к снижению цитотоксичности по сравнению с эквивалентной дозой немодифицированного активного агента.
25. Способ увеличения концентрации метаболита соединения в опухоли, включающий введение соединения или его фармацевтически приемлемой соли по любому из пп.1-20 или фармацевтической композиции по п.21 нуждающемуся в этом пациенту, при этом увеличение сравнивают с эквивалентной дозой немодифицированного активного агента.
| WO 2014094353 A1, 2014.06.26 | |||
| US 7387771 B1, 2008.06.17 | |||
| WO 2016205738 A2, 2016.12.22 | |||
| Hao Chen et al., Tubulin Inhibitor-Based Antibody-Drug Conjugates for Cancer Therapy, Molecules | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2022-11-08—Публикация
2018-11-30—Подача