Изобретение относится к области органической химии, к новым биологически активным веществам класса 2,4-диоксогексановых кислот, а именно к замещенным гидразидам 2-диарилметиленгидразоно-5,5-диметил-4-оксогексановых кислот (1-5) структурной формулы:
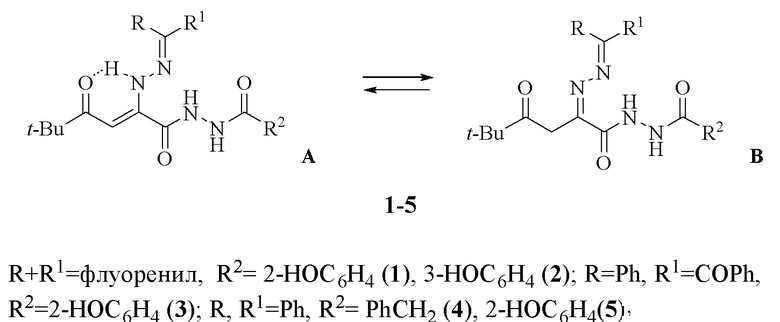
обладающим противовоспалительной активностью, что позволяет предположить их использование в медицине в качестве лекарственных средств с противовоспалительными свойствами.
Аналогом по структуре заявляемым соединениям является N-(1,3-тиазол-2-ил)амид 2-дифенилметиленгидразоно-5,5-диметил-2,4-диоксогексановой кислоты (6), обладающий выраженным анальгетическим и противовоспалительным действием [пат. №2345072, РФ, з. 2007128279/04; заявл. 23.07.07; опубл. 27.01.09, Бюл. № 3] структурной формулы:
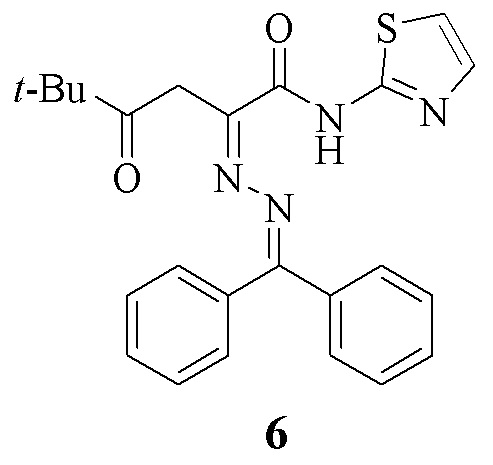
Приведены данные по противовоспалительной активности и острой токсичности соединения (6):
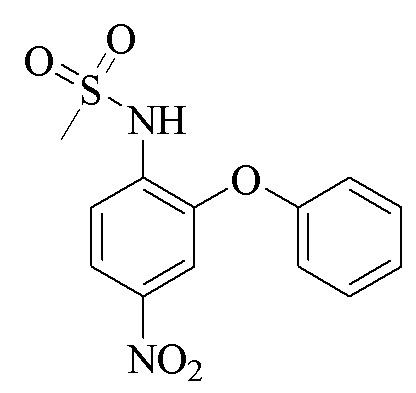
Эталоном сравнения выбран нимесулид структурной формулы:
 ,
,
который широко применяется в лечебной практике и является аналогом по действию [Машковский М.Д. Лекарственные средства / М.Д. Машковский. - 16-е изд., перераб., испр. и доп. - Москва: ООО «Новая волна», 2020. - С. 164, 185].
Задачей изобретения является поиск в ряду производных 2-имино(гидразоно)-4-оксогексановых кислот веществ с выраженным противовоспалительным действием, а также низкой токсичностью.
Поставленная задача достигается получением замещенных гидразидов 2-диарилметиленгидразоно-5,5-диметил-4-оксогексановых кислот (1-5), обладающих противовоспалительным действием.
Заявляемые соединения (1-5) синтезируют взаимодействием 3-арилиденгидразоно-5-трет-бутил-3Н-фуран-2-онов (7-9) с гидразидами кислот (10-12) при кипячении в среде абсолютного толуола или диоксана с последующим выделением целевого продукта известными методами по схеме
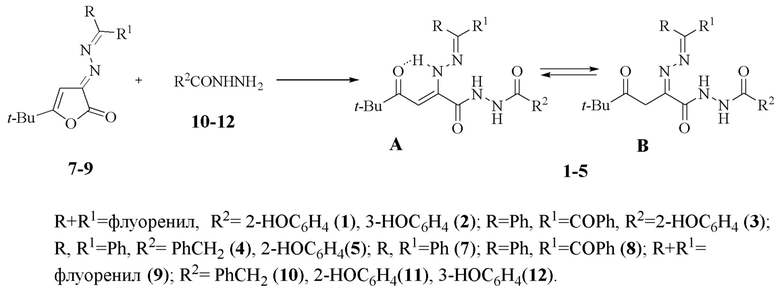
Пример 1. Получение соединения (1)
К смеси 0.0006 моль гидразонофуранона (9) и 0.0006 моль гидразида (11) добавляли 5 мл абсолютного толуола. Реакционную смесь кипятили при перемешивании в течение 10-15 мин. Раствор охлаждали при комнатной температуре и оставляли в течение 24 ч для дальнейшего протекания реакции. Полученный осадок отфильтровывали и перекристаллизовывали из толуола. Выход 0.286 г (99%), т. пл. 205-207°С. Спектр ЯМР 1Н (DMSO-d6), δ, м. д. (форма В): 1.06 с (9Н, t-Bu), 4.04 с (2Н, СН2), 7.49 м (14Hаром), 10.66 с (1Н, NH). Найдено, %: C 69.68; H 5.44; N 11.60. C28H26N4O4. Вычислено, %: C 69.70; H 5.43; N 11.61. Полученное соединение (1) представляет собой оранжевое кристаллическое вещество, растворимое в хлороформе, ацетоне, ДМСО, труднорастворимое в толуоле, нерастворимое в воде и гексане.
Пример 2. Получение соединения (2)
К смеси 0.0006 моль гидразонофуранона (9) и 0.0006 моль гидразида (12) добавляли 5 мл абсолютного диоксана. Реакционную смесь кипятили при перемешивании в течение 10-15 мин. Раствор охлаждали при комнатной температуре и оставляли в течение 24 ч для дальнейшего протекания реакции. Полученный осадок отфильтровывали и перекристаллизовывали из ацетонитрила. Выход 0.261 г (90%), т. пл. 213-215°С. Спектр ЯМР 1Н (DMSO-d6), δ, м. д. (форма А): 1.25 с (9Н, t-Bu), 5.90 с (1Н, СН), 7.58 м (14Hаром), 9.72 с (1Н, ОН), 10.54 с (1Н, CONHNHCO), 10.70 с (1Н, CONHNHCO), 13.44 с (1Н, NHN). Найдено, %: C 69.69; H 5.43; N 11.60. C28H26N4O4. Вычислено, %: C 69.70; H 5.43; N 11.61. M 482.54. Полученное соединение (2) представляет собой оранжевое кристаллическое вещество, растворимое в хлороформе, ацетоне, ДМСО, труднорастворимое в толуоле, нерастворимое в воде и гексане.
Пример 3. Получение соединения (3)
К смеси 0.0006 моль гидразонофуранона (8) и 0.0006 моль гидразида (11) добавляли 5 мл абсолютного толуола. Реакционную смесь кипятили при перемешивании в течение 10-15 мин. Раствор охлаждали при комнатной температуре и оставляли в течение 24 ч для дальнейшего протекания реакции. Полученный осадок отфильтровывали и перекристаллизовывали из толуола. Выход 0.304 г (99%), т. пл. 191-193°С. Спектр ЯМР 1Н (DMSO-d6), δ, м. д. (форма В): 1.18 с (9Н, t-Bu), 4.18 с (2Н, СН2), 7.49 м (14Hаром), 9.75 с (1Н, NH). Найдено, %: C 67.94; H 5.52; N 10.91. C29H28N4O5. Вычислено, %: C 67.96; H 5.51; N 10.93. Полученное соединение (3) представляет собой желтое кристаллическое вещество, растворимое в хлороформе, ацетоне, ДМСО, труднорастворимое в толуоле, нерастворимое в воде и гексане.
Пример 4. Получение соединения (4)
К смеси 0.0006 моль гидразонофуранона (7) и 0.0006 моль гидразида (10) добавляли 5 мл абсолютного толуола. Реакционную смесь кипятили при перемешивании в течение 10-15 мин. Раствор охлаждали при комнатной температуре и оставляли в течение 24 ч для дальнейшего протекания реакции. Полученный осадок отфильтровывали и перекристаллизовывали из толуола. Выход 0.25 г (88%), т. пл. 136-138°С. Спектр ЯМР 1Н (DMSO-d6), δ, м. д. (форма А): 1.01 с (9Н, t-Bu), 3.59 с (2Н, CH2), 5.48 с (1Н, СН), 7.27 м (2Hаром), 7.30 м (3Hаром), 7.37 м (4Hаром), 7.51 м (4Hаром), 7.68 м (2Hаром), 10.36 с (1Н, CONHNHCO), 10.50 с (1Н, CONHNHCO), 12.19 с (1Н, NHN). Спектр ЯМР 13C (DMSO-d6), δ, м. д.: 27.42, 42.42, 91.35, 126.99, 127.82, 128.69, 129.56, 130.35, 132.37, 136.12, 137.17, 151.76, 153.39, 162.25, 169.31, 205.84. Найдено, %: C 72.20; H 6.29; N 11.64. C29H30N4O3. Вычислено, %: C 72.18; H 6.27; N 11.61. Полученное соединение (4) представляет собой желтое кристаллическое вещество, растворимое в хлороформе, ацетоне, ДМСО, труднорастворимое в толуоле, нерастворимое в воде и гексане.
Пример 5. Получение соединения (5)
К смеси 0.0006 моль гидразонофуранона (7) и 0.0006 моль гидразида (11) добавляли 5 мл абсолютного толуола. Реакционную смесь кипятили при перемешивании в течение 10-15 мин. Раствор охлаждали при комнатной температуре и оставляли в течение 24 ч для дальнейшего протекания реакции. Полученный осадок отфильтровывали и перекристаллизовывали из толуола. Выход 0.26 г (89%), т. пл. 184-186°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: форма А (29%): 1.10 с (9Н, t-Bu), 6.43 с (1Н, СН), 6.83 м (3Hаром), 6.93 м (2Hаром), 7.01 м (2Hаром), 7.39 м (4Hаром), 7.50 м (3Hаром), 11.51 с (1Н, ОН), 12.56 д (1Н, J = 6.0 Hz, CONHNHCO), 13.07 с (1Н, NH); форма В (71%): 1.18 с (9Н, t-Bu), 4.22 с (2Н, СН2), 7.39 м (4Hаром), 7.50 м (4Hаром), 7.63 м (2Hаром), 7.72 м (4Hаром), 9.11 д (1Н, J = 4.7 Hz, CONHNHCO), 9.17 д (1Н, J = 4.7 Hz, CONHNHCO), 11.34 с (1Н, ОН). Спектр ЯМР 13C (CDCl3), δ, м. д.: 26.47, 27.02, 35.69, 44.86, 95.62, 105.63, 112.41, 118.40, 118.50, 119.07, 119.27, 125.89, 126.04, 127.89, 128.21, 128.31, 128.49, 129.54, 129.84, 129.96, 130.16, 130.24, 130.34, 130.81, 134.79, 137.30, 144.89, 153.53, 154.53, 158.14, 161.12, 161.33, 165.42, 166.89, 206.40, 210.3. Найдено, %: C 69.43; H 5.84; N 11.58. C28H28N4O4. Вычислено, %: C 69.41; H 5.82; N 11.56. M 484.55. Полученное соединение (5) представляет собой желтое кристаллическое вещество, растворимое в хлороформе, ацетоне, ДМСО, труднорастворимое в толуоле, нерастворимое в воде и гексане.
Пример 6. Биологическая активность соединений (1-5)
Острая токсичность определялась в опытах на белых нелинейных мышах-самцах массой 20-22 г, содержащихся на обычном рационе вивария. Для расчетов использован метод Прозоровского В.Б. [Прозоровский В.Б. Статистическая обработка результатов фармакологических исследований / В.Б. Прозоровский // Психофармакология и биологическая наркология. - 2007. - № 7. - C. 2090-2120]. Исследуемое соединение вводили внутрижелудочно в виде взвеси в 2% растворе крахмала. Каждую дозу вводили двум животным. За животными вели наблюдение в течение 14 суток. Регистрировали общее состояние и поведение животных, состояние шерстного покрова, определяли массу тела. В каждой группе животных учитывали число смертельных исходов за весь срок наблюдения. Для исследуемых соединений (1-5) ЛД50 составляет >2000 мг/кг. Согласно классификации токсичности препаратов по Hodge, Sterner [Hodge, H. C. Tabulation of toxicity classes / H. C. Hodge, J. H Sterner // Amer. Industr. Hyd. Ass. Quart. - 1943. - № 10. - P. 93] и ГОСТ 32419-2013 соединения (1-5) относятся к V классу практически нетоксичных препаратов.
Исследование противовоспалительной активности проводилось на белых нелинейных крысах массой 160 - 180 г, самках (контрольная и опытные группы включали по 6 животных) на модели острого воспалительного отека, вызванного субплантарным введением в заднюю лапу крысы 0,1 мл 1% водного раствора каррагенина. Объем стопы оценивали онкометрически [Руководство по проведению доклинических исследований лекарственных средств: монография / А.Н. Миронов, Н.Д. Бунятян, А.Н. Васильева [и др.]. - Москва: Гриф и К, 2012. - C. 944] до введения и через 3 часа после введения каррагенина. Увеличение объема стопы, свидетельствующее о развитии отека, рассчитывали в процентах к исходной величине. Исследуемые вещества вводили перорально в дозе 50 мг/кг за 1 час до введения флогогенного агента. Контролем служили животные, получавшие 1% раствор крахмала в эквиобъемных количествах. В качестве препарата сравнения использовали нимесулид («Unimark Remedies», Индия), который вводили перорально в дозе 50 мг/кг. О наличии противовоспалительного действия судили по выраженности торможения воспалительной реакции.
Результаты экспериментов обрабатывали статистически с вычислением критерия Фишера-Стьюдента [Беленький М.Л. Элементы количественной фармакологического эффекта / М.Л. Беленький. - 2-е изд. - Ленинград, 1963. - C. 152]. Результаты испытаний представлены в таблице 1.
Таблица 1.
Противовоспалительная активность и острая токсичность соединений (1-5) и препарата сравнения нимесулида
p <0.05 по сравнению с контролем.
Как видно из таблицы 1, эффект заявляемых соединений (1-5) превышает эффект препарата сравнения нимесулида при меньшей токсичности. Следовательно, заявляемые соединения (1-5) могут найти применение в медицинской практике в качестве противовоспалительных лекарственных средств.
Изобретение относится к области органической химии, к новым биологически активным веществам класса производных 2,4-диоксогексановых кислот. Предложены замещенные гидразиды 2-диарилметиленгидразоно-5,5-диметил-4-оксогексановых кислот (1-5), где R, R1, R2 определены в формуле изобретения, обладающие выраженной противовоспалительной активностью при низкой токсичности. 1 табл., 6 пр.
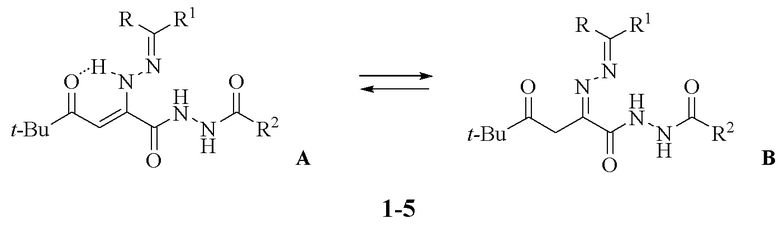
Замещенный гидразид 2-диарилметиленгидразоно-5,5-диметил-4-оксогексановой кислоты (1-5) структурной формулы:
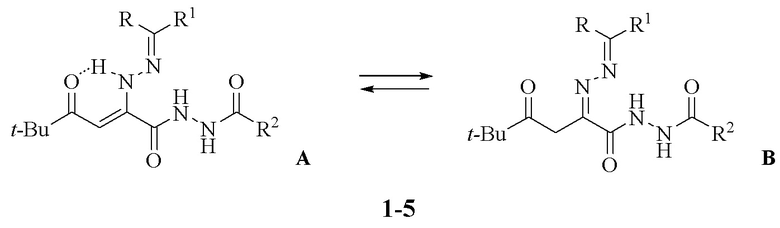
где
когда R и R1 совместно представляют собой флуоренил,
тогда R2 выбирают из 2-НОС6Н4- (соединение 1) или 3-НОС6Н4- (соединение 2);
когда R представляет собой Ph и R1 представляет собой -COPh,
тогда R2 представляет собой 2-НОС6Н4- (соединение 3);
когда каждый из R и R1 представляет собой Ph-,
тогда R2 представляет собой PhCH2- (соединение 4) или 2-НОС6Н4- (соединение 5),
обладающий противовоспалительной активностью.
| N-(1,3-ТИАЗОЛ-2-ИЛ) АМИДЫ 2-ДИФЕНИЛМЕТИЛЕНГИДРАЗОНО-5,5-ДИМЕТИЛ-2,4-ДИОКСОГЕКСАНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ, И СПОСОБ ПОЛУЧЕНИЯ | 2007 |
|
RU2345072C1 |
| Сюткина А.И | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Bykov, R | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2022-11-09—Публикация
2021-04-05—Подача