Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к противоопухолевому средству против раковых опухолей, включающих мутантный рецептор эпидермального фактора роста (в дальнейшем также называемый "EGFR") с мутацией в экзоне 18 и/или в экзоне 21.
Уровень техники
[0002]
EGFR является тирозинкиназой рецепторного типа, проявляет свою физиологическую функцию в нормальной ткани при связывании с эпидермальным фактором роста (в дальнейшем также называемым EGF), который является лигандом и способствует росту и ингибированию апоптоза в эпителиальных тканях (NPL 1). Кроме того, соматическая мутация гена EGFR была известна в качестве гена, вызывающего рак; например, EGFR, в котором удалены кодоны 746-750 в экзоне 19 (в дальнейшем также называемом "экзоном 19 с делеционной мутацией"), и EGFR, в котором лейцин, кодируемый кодоном 858 в экзоне 21, мутирован с заменой на аргинин (в дальнейшем также называемый "мутацией L858R"), постоянно индуцирует EGF-независимую киназную активность и способствует росту и выживанию раковых клеток (NPL 2). Такие мутации наблюдаются, например, в 30-50% случаев немелкоклеточного рака легкого в Восточной Азии. Эти мутации также наблюдаются приблизительно в 10% случаев немелкоклеточного рака легкого в Европе и США, и рассматриваются как одна из причин различных форм рака (NPL 3).
[0003]
Таким образом, научные исследования ингибитора EGFR в качестве противоопухолевого средства активно проводили и включали в лечение различных форм рака легкого, положительных на мутацию EGFR (NPL 2 и NPL 4). Гефитиниб, эрлотиниб и афатиниб применялись в качестве терапевтического средства против форм рака легкого, положительных на делеционную мутацию в экзоне 19 и мутацию L858R EGFR. Мутация с делецией в экзоне 19 и мутация L858R составляют 90% всех мутаций EGFR. Кроме того, было известно о возникновении приобретенной резистентности в процессе лечения с применением этих средств, при этом 50% таких случаев было вызвано придающей резистентность мутацией EGFR, при которой кодон 790 экзона 20 содержал изменение треонина на метионин (в дальнейшем также называемой "мутацией T790M"). Для лечения рака легкого с такой мутацией, в качестве терапевтического средства использовался осимертиниб. Поэтому способы лечения с применением ингибиторов EGFR находятся в процессе подтверждения для больных раком легкого с основными мутациями EGFR.
[0004]
С другой стороны, в настоящее время не было утверждено никаких способов лечения с применением ингибиторов EGFR в отношении некоторых редких мутаций EGFR, таких как точечная мутация или делеционная мутация экзона 18, точечная мутация экзона 21 и т.п.; при этом имеются сообщения, что чувствительность к лекарственным средствам таких мутантных форм EGFR варьирует в зависимости от типа мутации (NPL 4). Например, чувствительность рака легкого с точечной мутацией, при которой глицин, кодируемый кодоном 719 экзона 18, заменен произвольной аминокислотой (в дальнейшем также называемой "мутацией G719X"), или рака легкого, в котором лейцин, кодируемый кодоном 861 экзона 21, заменен глутамином (в дальнейшем также называемый "мутацией L861Q") по отношению к гефитинибу, эрлотинибу и афатинибу ниже, чем в случае рака легкого с делеционной мутацией в экзоне 19 и мутацией L858R, которые являются мутациями, чувствительными к лекарственным средствам. Кроме того, существуют сообщения о заболеваниях кожи и заболеваниях пищеварительного тракта как распространенных побочных эффектах при введении терапевтических доз афатиниба, гефитиниба и эрлотиниба. Широко распространено мнение, что такие побочные эффекты связаны с ингибированием функции EGFR дикого типа, экспрессируемого в нормальных тканях, таких как кожа или пищеварительный тракт, при воздействии терапевтического средства (NPL 1); создание ингибитора, отличающегося более низкой ингибирующей активностью по отношению к EGFR дикого типа в нормальных тканях, по сравнению с мутантным EGFR, экспрессируемым в опухолевых тканях, было бы желательным, принимая во внимание снижение побочных эффектов.
[0005]
Таким образом, разработка лекарственного средства, обладающего высокой ингибирующей активностью в отношении мутантного EGFR с мутациями в экзоне 18 и экзоне 21, а также высокой селективностью по отношению к мутантному EGFR по сравнению с EGFR дикого типа, как ожидают, позволит ингибировать рост клеток рака легкого, содержащих мутантный EGFR, при более низкой дозе, чем доза, вызывающая побочные эффекты в коже или пищеварительном тракте, что будет способствовать увеличению продолжительности жизни или улучшению показателей качества жизни (QOL) пациентов с раковыми опухолями, положительными на мутацию EGFR, для которых не были разработаны способы лечения. Кроме того, лекарственное средство, обладающее высокой ингибирующей активностью в отношении T790M, которая является приобретенной мутацией, связанной с резистентностью к лечению ингибиторами EGFR, как ожидают, уменьшит частоту случаев приобретенной резистентности при лечении ингибиторами EGFR против мутантного EGFR с мутациями в экзоне 18 или экзоне 21, которая является de novo мутацией; и поэтому, как ожидают, будет способствовать увеличению продолжительности жизни больных раком.
Список цитируемых источников
Патентная литература
[0006]
PTL 1: WO2015/175632A1
PTL 2: WO2015/025936A1
Непатентная литература
[0007]
NPL 1: Nat. Rev. Cancer, Vol. 6, pp. 803-812 (2006)
NPL 2: Nature Medicine, Vol. 19, pp. 1389-1400 (2013)
NPL 3: Nat. Rev. Cancer, Vol. 7, pp. 169-181 (2007)
NPL 4: Lancet Oncol. Vol. 13, e. 23-31 (2012)
Сущность изобретения
Техническая задача
[0008]
Цель настоящего изобретения состоит в предоставлении противоопухолевого средства, не вызывающего ингибирования EGFR дикого типа, и, таким образом, вызывающего меньше побочных эффектов, выступая в качестве ингибитора, который может гарантировать высокую селективность в отношении EGFR с мутацией в экзоне 18 и/или экзоне 21, для которого терапевтические эффекты ранее известных ингибиторов EGFR являются недостаточными.
Решение задачи
[0009]
Авторы настоящего изобретения провели обширное исследование и обнаружили, что EGFR с мутацией в экзоне 18 и/или экзоне 21 является подходящей мишенью при лечении онкологических заболеваний, и что ингибиторы EGFR, традиционно используемые для лечения, имеют низкую селективность по отношению к EGFR с мутацией в экзоне 18 и/или экзоне 21. Кроме того, авторы изобретения также подтвердили, что соединение настоящего изобретения проявляет превосходную селективность и эффекты ингибирования роста опухоли в отношении EGFR с мутацией в экзоне 18 и/или экзоне 21. Благодаря этому открытию авторы изобретения осуществили настоящее изобретение.
[0010]
Настоящее изобретение охватывает следующие варианты осуществления.
[0011]
Пункт 1.
Противоопухолевое средство для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток, при этом противоопухолевое средство содержит (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль.
[0012]
Пункт 2.
Противоопухолевое средство согласно Пункту 1, где мутация экзона 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0013]
Пункт 3.
Противоопухолевое средство согласно Пункту 1 или 2, где мутацией в экзоне 21 является L861Q.
[0014]
Пункт 4.
Противоопухолевое средство согласно любому из Пунктов 1-3, где EGFR дополнительно имеет мутацию T790M.
[0015]
Пункт 5.
Способ лечения пациента со злокачественной опухолью, включающий стадию введения (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его соли пациенту со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
[0016]
Пункт 6.
Способ согласно Пункту 5, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0017]
Пункт 7.
Способ согласно Пункту 5 или 6, где мутацией в экзоне 21 является L861Q.
[0018]
Пункт 8.
Способ согласно любому из Пунктов 5-7, где EGFR дополнительно имеет мутацию T790M.
[0019]
Пункт 9.
(S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
[0020]
Пункт 10.
(S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль согласно Пункту 9, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0021]
Пункт 11.
(S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль согласно Пункту 9 или 10, где мутацией в экзоне 21 является L861Q.
[0022]
Пункт 12.
(S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль согласно любому из Пунктов 9-11, где EGFR дополнительно имеет мутацию T790M.
[0023]
Пункт 13.
Применение (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его соли для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
[0024]
Пункт 14.
Применение согласно Пункту 13, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0025]
Пункт 15.
Применение согласно Пункту 13 или 14, где мутацией в экзоне 21 является L861Q.
[0026]
Пункт 16.
Применение согласно любому из Пунктов 13-15, где EGFR дополнительно имеет мутацию T790M.
[0027]
Пункт 17.
Применение (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его соли для производства фармацевтического средства для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
[0028]
Пункт 18.
Применение согласно Пункту 17, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0029]
Пункт 19.
Применение согласно Пункту 17 или 18, где мутацией в экзоне 21 является L861Q.
[0030]
Пункт 20.
Применение согласно любому из Пунктов 17-19, где EGFR дополнительно имеет мутацию T790M.
[0031]
Пункт 21.
Фармацевтическая композиция, содержащая (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль и фармацевтически приемлемый носитель, для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
[0032]
Пункт 22.
Фармацевтическая композиция согласно Пункту 21, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0033]
Пункт 23.
Фармацевтическая композиция согласно Пункту 21 или 22, где мутацией в экзоне 21 является L861Q.
[0034]
Пункт 24.
Фармацевтическая композиция согласно любому из Пунктов 21-23, где EGFR дополнительно имеет мутацию T790M.
[0035]
Пункт 25.
Способ прогнозирования терапевтических эффектов химиотерапии с применением противоопухолевого средства, содержащего в качестве активного ингредиента (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль, у пациента со злокачественной опухолью, где способ включает нижеследующие стадии (1) и (2):
(1) стадия обнаружения присутствия или отсутствия мутации гена EGFR, содержащегося в биологическом образце, полученном от пациента; и
(2) стадия прогнозирования, что химиотерапия с высокой вероятностью продемонстрирует достаточные терапевтические эффекты в отношении пациента, если результаты обнаружения на стадии (1) покажут, что ген EGFR имеет по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
[0036]
Пункт 26.
Способ согласно Пункту 25, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0037]
Пункт 27.
Способ согласно Пункту 25 или 26, где мутацией в экзоне 21 является L861Q.
[0038]
Пункт 28.
Способ согласно любому из Пунктов 25-27, где EGFR дополнительно имеет мутацию T790M.
[0039]
Пункт 29.
Способ лечения пациента со злокачественной опухолью, включающий нижеследующие стадии (1)-(3):
(1) стадия обнаружения присутствия или отсутствия мутации гена EGFR, содержащегося в биологическом образце, полученном от пациента;
(2) стадия прогнозирования, что химиотерапия с применением противоопухолевого средства, содержащего в качестве активного ингредиента (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль, с высокой вероятностью продемонстрирует достаточные терапевтические эффекты в отношении пациента, если результаты обнаружения на стадии (1) покажут, что ген EGFR имеет по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток; и
(3) стадия введения (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его соли пациенту со злокачественной опухолью, который согласно прогнозу, сделанному на стадии (2), с высокой вероятностью будет в достаточной мере отвечать на химиотерапию с применением противоопухолевого средства, содержащего в качестве активного ингредиента (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль.
[0040]
Пункт 30.
Способ согласно Пункту 29, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
[0041]
Пункт 31.
Способ согласно Пункту 29 или 30, где мутацией в экзоне 21 является L861Q.
[0042]
Пункт 32.
Способ согласно любому из Пунктов 29-31, где EGFR дополнительно имеет мутацию T790M.
Полезные эффекты изобретения
[0043]
Противоопухолевое средство настоящего изобретения проявляет высокую селективность в отношении EGFR с мутацией в экзоне 18 и/или экзоне 21. Таким образом, противоопухолевое средство настоящего изобретения полезно с точки зрения предоставления противоопухолевого средства, проявляющего превосходные терапевтические эффекты у пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21, для которой терапевтические эффекты ранее известных ингибиторов EGFR являются недостаточными.
[0044]
Настоящее изобретение также полезно с точки зрения предоставления способа лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21.
[0045]
Ранее известные ингибиторы EGFR обладают низкой селективностью в отношении EGFR с мутацией в экзоне 18 и в экзоне 21 по сравнению с EGFR дикого типа; таким образом, разница между дозой для обеспечения противоопухолевого действия и дозой, вызывающей побочные эффекты (кожные нарушения, нарушения пищеварительного тракта и т.д.), обусловленные ингибированием EGFR дикого типа, была небольшой. Соответственно, ранее известные ингибиторы EGFR оказывают недостаточные терапевтические эффекты. Напротив, поскольку противоопухолевое средство согласно настоящему изобретению обладает высокой селективностью в отношении EGFR с мутацией в экзоне 18 и в экзоне 21, можно увеличить дозу, не вызвав побочных эффектов, обусловленных ингибированием EGFR дикого типа. Следовательно, противоопухолевое средство согласно настоящему изобретению оказывает превосходные терапевтические эффекты у пациента со злокачественной опухолью, экспрессирующей EGFR с мутацией в экзоне 18 и/или в экзоне 21.
[0046]
Кроме того, противоопухолевое средство согласно настоящему изобретению демонстрировало высокую ингибирующую активность в отношении EGFR с мутацией в экзоне 18 и в экзоне 21 в присутствии мутации T790M, которая является приобретенной мутацией, связанной с резистентностью, в области экзона 20. Таким образом, противоопухолевое средство настоящего изобретения оказывает превосходные терапевтические эффекты в отношении пациента со злокачественной опухолью, ответ которого на существующее лекарственное средство является низким из-за приобретенной мутации, связанной с резистентностью, вызванной применением существующего противоопухолевого средства.
[0047]
Кроме того, противоопухолевое средство настоящего изобретения также полезно с точки зрения снижения частоты появления приобретенной резистентности во время лечения с применением ингибиторов EGFR против EGFR с мутацией в экзоне 18 или в экзоне 21, которая является de novo мутацией, из-за его высокой ингибирующей активности против EGFR с мутацией в экзоне 18 или в экзоне 21 даже в случае присутствия мутации T790M, которая является приобретенной мутацией, связанной с резистентностью, в области экзона 20.
Краткое описание чертежей
[0048]
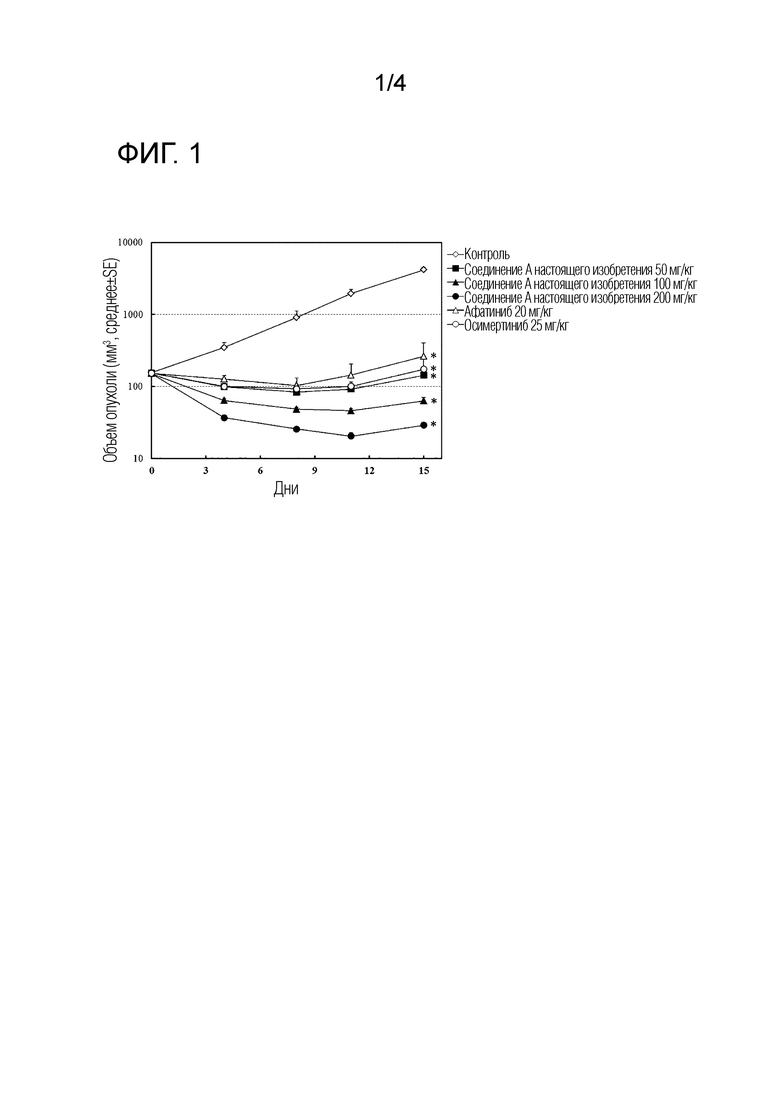
На Фиг. 1 показан объем опухоли (который может в дальнейшем именоваться "TV") в моделях на мышах с подкожной трансплантацией линии клеток, экспрессирующих EGFR с мутацией G719A, для измерения противоопухолевого действия соединения A.
На Фиг. 2 показано изменение массы тела в течение периода введения дозы соединений в моделях на мышах с подкожной трансплантацией линии клеток, экспрессирующих EGFR с мутацией G719A, для измерения токсического действия соединения A.
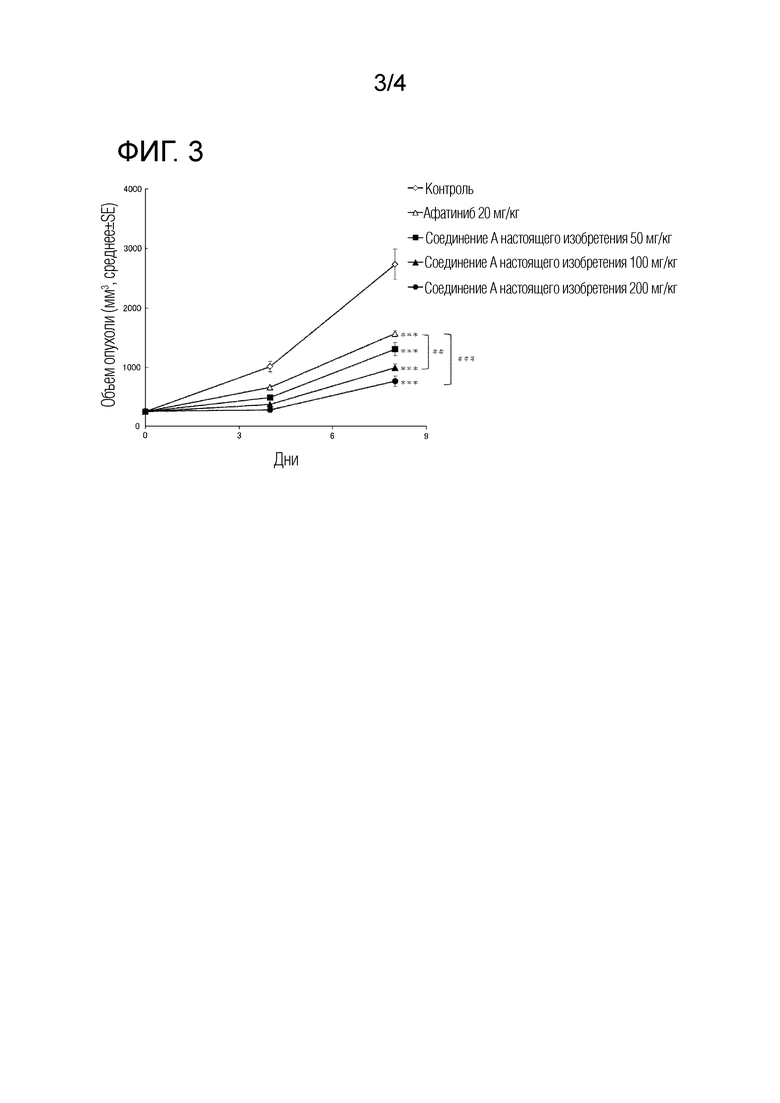
На Фиг.3 показан объем опухоли в моделях на мышах с подкожной трансплантацией линии клеток, экспрессирующих EGFR с мутациями G719A+T790M, для измерения противоопухолевого действия соединения A.
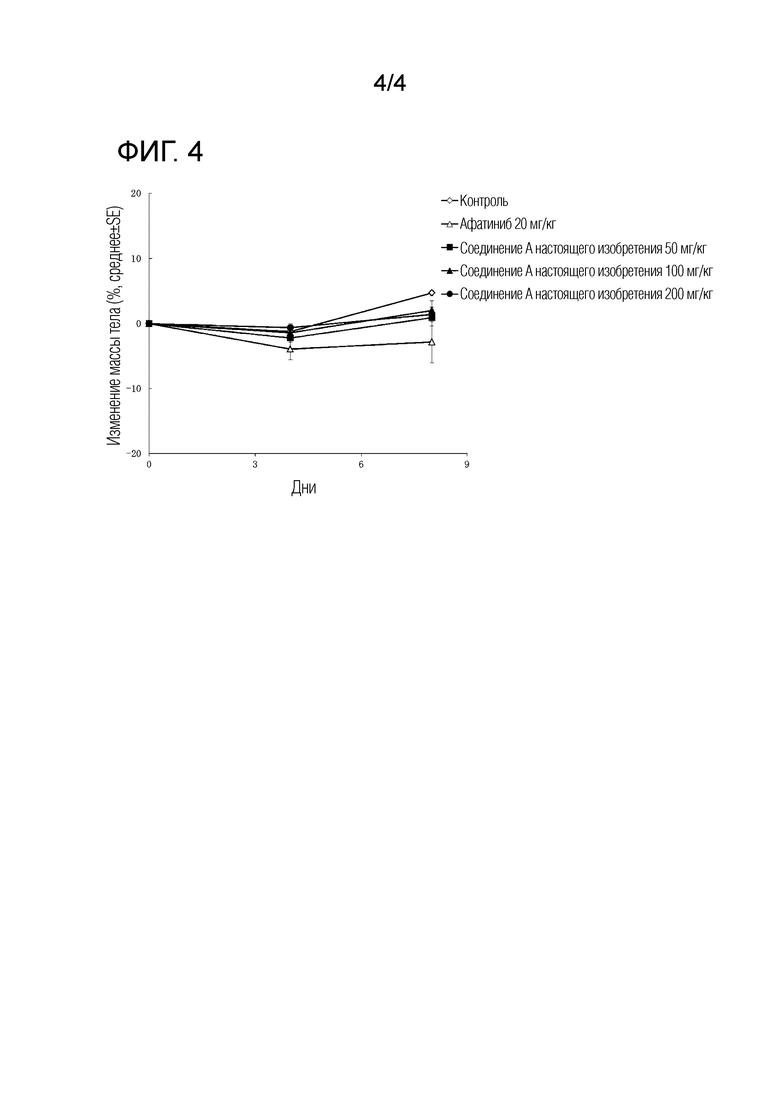
На Фиг. 4 показано изменение массы тела в период введения дозы соединений в моделях на мышах с подкожной трансплантацией линии клеток, экспрессирующих EGFR с мутациями G719A+T790M, для измерения токсического действия соединения A.
Описание вариантов осуществления
[0049]
Предпочтительные примеры различных определений в рамках объема настоящего изобретения, используемых в данном описании, подробно объяснены ниже.
[0050]
В настоящем описании "EGFR" относится к человеческому белку рецептора эпидермального фактора роста и также именуется ErbB-1 или HER1.
[0051]
В настоящем описании "EGFR дикого типа" относится к EGFR, не имеющему соматической мутации, который является белком, включающим аминокислотную последовательность, представленную в SEQ ID NO: 1 (регистрационный номер в GenBank: NP_005219.2).
[0052]
В настоящем описании "экзон 18" относится к области 688-728 в аминокислотной последовательности EGFR дикого типа (SEQ ID NO: 1).
[0053]
В настоящем описании "мутация в экзоне 18" относится к точечной мутации аминокислоты в области экзона 18 EGFR дикого типа (SEQ ID NO: 1). Предпочтительная мутация в экзоне 18 является точечной мутацией или делеционной мутацией с 1 аминокислотной заменой в области экзона 18. Более предпочтительно мутация в экзоне 18 является мутацией E709X, которая является точечной мутацией, при которой глутаминовая кислота, кодируемая кодоном 709 в экзоне 18, заменена произвольной аминокислотой; или G719X, которая является точечной мутацией, при которой глицин, кодируемый кодоном 719 в экзоне 18, заменен произвольной аминокислотой. В частности, предпочтительные примеры E709X включают E709K, которая является точечной мутацией, при которой глутаминовая кислота, кодируемая кодоном 709 в области экзона 18, заменена лизином; и E709A, которая является точечной мутацией, при которой глутаминовая кислота, кодируемая кодоном 709 в области экзона 18, заменена аланином. Предпочтительные примеры G719X включают G719A, которая является точечной мутацией, при которой глицин, кодируемый кодоном 719 в области экзона 18, заменен аланином; G719S, которая является точечной мутацией, при которой глицин, кодируемый кодоном 719 в области экзона 18, заменен серином; и G719C, которая является точечной мутацией, при которой глицин, кодируемый кодоном 719 в области экзона 18, заменен цистеином. Из них наиболее предпочтительна G719A.
[0054]
В настоящем изобретении "экзон 21" относится к области 824-875 в аминокислотной последовательности EGFR дикого типа (SEQ ID NO: 1).
[0055]
В настоящем описании "мутация в экзоне 21" относится к точечной мутации аминокислоты в области экзоне 21 EGFR дикого типа (SEQ ID NO: 1). Предпочтительная мутация в экзоне 21 является точечной мутацией с заменой 1 аминокислоты в области экзона 21. Более предпочтительно, мутация в экзоне 21 является мутацией L861X, которая является точечной мутацией, при которой лейцин, кодируемый кодоном 861 в области экзона 21, заменен произвольной аминокислотой. В частности, предпочтительна L861Q, которая является точечной мутацией, при которой лейцин, кодируемый кодоном 861 в области экзона 21, заменен глутамином.
[0056]
В настоящем изобретении "мутация в экзоне 18 и/или в экзоне 21" охватывает "мутацию в экзоне 18", "мутацию в экзоне 21" и "мутацию в экзоне 18 и в экзоне 21".
[0057]
В настоящем изобретении "точечная мутация" относится к мутации, приводящей к замене, вставке или делеции одного или более (например, приблизительно 1-10, предпочтительно приблизительно 1-5, более предпочтительно приблизительно 1, 2 или 3) аминокислотных остатков; и может включать мутацию с вставкой в рамку считывания и/или делецией в формате нуклеиновой кислоты.
[0058]
"EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21" охватывает "EGFR, имеющий мутацию в экзоне 18", "EGFR, имеющий мутацию в экзоне 21" и "EGFR, имеющий мутацию в экзоне 18 и в экзоне 21".
[0059]
В настоящем описании "EGFR, имеющий мутацию в экзоне 18" относится к EGFR, имеющему по меньшей мере одну мутацию в экзоне 18. EGFR может иметь две или больше различных мутаций в экзоне 18, и предпочтительно имеет одну мутацию в экзоне 18. Кроме того, EGFR также может иметь другую мутацию помимо мутации в экзоне 18 (такую как мутацию с делецией в экзоне 19, мутацию L858R или мутацию L790M).
[0060]
В настоящем описании "EGFR, имеющий мутацию в экзоне 21" относится к EGFR, имеющему по меньшей мере одну мутацию в экзоне 21. EGFR может иметь две или больше различных мутаций в экзоне 21, и предпочтительно имеет одну мутацию в экзоне 21. Кроме того, EGFR также может иметь другую мутацию помимо мутации в экзоне 21 (такую как мутацию с делецией в экзоне 19, мутацию L858R или мутацию L790M).
[0061]
Кроме того, EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21, может также иметь мутацию T790M. T790M является приобретенной мутацией, связанной с резистентностью, в области экзона 20. Как известно, T790M возникает в результате применения существующих ингибиторов EGFR. Приобретение T790M часто ослабляет действие существующего лекарственного средства в отношении пациентов со злокачественной опухолью.
[0062]
В настоящем изобретении, в частности, EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21, дополнительно имеющий мутацию T790M, является предпочтительно одним из EGFR, имеющего мутацию E709X и/или G719X в области экзона 18, дополнительно имеющего мутацию T790M, и EGFR, имеющего мутацию L861X в области экзона 21, дополнительно имеющего мутацию T790M. В настоящем изобретении, в частности, EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21, дополнительно имеющий мутацию T790M, является предпочтительно одним из EGFR, имеющего мутацию E709K или E709A, дополнительно имеющего мутацию T790M, EGFR, имеющего мутацию G719A, G719S или G719C, дополнительно имеющего мутацию T790M, и EGFR, имеющего мутацию L861Q, дополнительно имеющего мутацию T790M. Из них наиболее предпочтителен EGFR, имеющий мутацию G719A, дополнительно имеющий мутацию T790M, и EGFR, имеющий мутацию L861Q, дополнительно имеющий мутацию T790M.
[0063]
В настоящем изобретении способ обнаружения мутации в экзоне 18 и/или в экзоне 21 EGFR, экспрессируемого у пациента со злокачественной опухолью, не имеет конкретного ограничения при условии, что способ обеспечивает обнаружение мутаций, при этом могут использоваться любые известные способы обнаружения.
[0064]
Образец, используемый при обнаружении мутации в экзоне 18 и/или экзоне 21, не имеет конкретного ограничения при условии, что образец является биологическим образцом, выделенным у пациента со злокачественной опухолью, в частности образцом, полученным у пациента со злокачественной опухолью, и содержит клетки злокачественной опухоли. Примеры биологических образцов включают физиологические жидкости (например, кровь, мочу и т.д.), ткани, их экстракты и культуры полученных тканей. Способ получения биологического образца может быть соответствующим образом выбран в зависимости от типа биологического образца.
[0065]
Биологический образец подготавливают путем надлежащей обработки в соответствии со способом измерения. Кроме того, реактив, содержащий праймер или зонд, используемый для обнаружения, может быть приготовлен стандартным способом в соответствии со способом измерения для этого.
[0066]
В одном варианте осуществления настоящего изобретения стадия обнаружения присутствия мутации в экзоне 18 и/или в экзоне 21 EGFR, экспрессируемого у пациента со злокачественной опухолью, может быть выполнена до введения противоопухолевого средства пациенту со злокачественной опухолью.
[0067]
Злокачественная опухоль может включать два или более различных типов клеток злокачественных опухолей. Кроме того, две или больше злокачественных опухоли могут возникнуть у одного пациента. Поэтому один пациент может иметь разные мутации в одном и том же положении аминокислотной последовательности EGFR (например, мутация в экзоне 18 является мутацией G719A, G719S и G719C; мутацией в экзоне 18E709K и E709A) одновременно.
[0068]
Противоопухолевое средство настоящего изобретения содержит, в качестве активного ингредиента, (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид (Соединение (A)) или его соль. Соединение (A) представлено следующей химической формулой.
[0069]
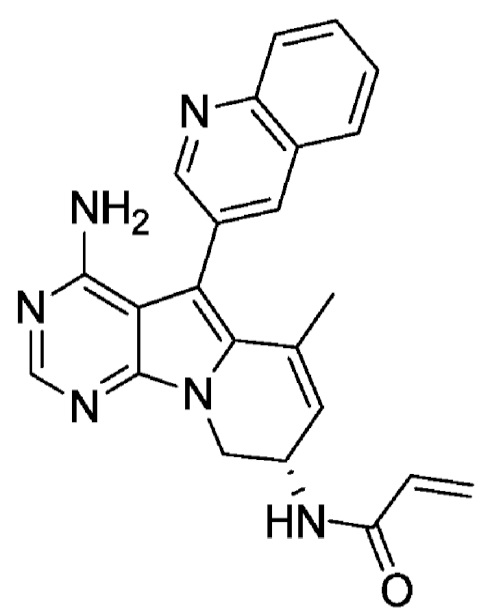
[0070]
Способ получения соединения настоящего изобретения описан ниже.
Соединение A настоящего изобретения может быть получено, например, способом получения, раскрытым в WO2015/025936A1, способами, описанными в Примерах, и т.п. Однако способ получения соединения настоящего изобретения не ограничен этими примерами реакций.
[0071]
Если Соединение A настоящего изобретения имеет изомеры, такие как оптические изомеры, стереоизомеры и таутомеры, любые из изомеров и их смесей включены в рамки соединения настоящего изобретения, если не указано иное. Например, если Соединение A настоящего изобретения имеет оптические изомеры, то рацемические смеси и оптические изомеры, выделенные из рацемической смеси, также включены в рамки соединения настоящего изобретения, если не указано иное.
[0072]
Соли Соединения A относятся к любым фармацевтически приемлемым солям; примеры включают соли присоединения оснований и соли присоединения кислот.
[0073]
Примеры солей присоединения оснований включают соли щелочных металлов, такие как соли натрия и соли калия; соли щелочноземельных металлов, такие как соли кальция и соли магния; соли аммония; и соли органических аминов, такие как соли триметиламина, соли триэтиламина, соли дициклогексиламина, соли этаноламина, соли диэтаноламина, соли триэтаноламина, соли прокаина и соли N, N'-дибензилэтилендиамина.
[0074]
Примеры солей присоединения кислот включают соли неорганических кислот, такие как гидрохлориды, сульфаты, нитраты, фосфаты и перхлораты; соли органических кислот, такие как ацетаты, формиаты, малеаты, фумараты, тартраты, цитраты, аскорбаты и трифторацетаты; и сульфонаты, такие как метансульфонаты, изетионаты, бензолсульфонаты и п-толуолсульфонаты.
[0075]
Соединение настоящего изобретения и его соли также охватывают пролекарства. Пролекарство относится к соединению, которое может быть превращено в соединение настоящего изобретения или его соль в реакции с ферментом, желудочным соком и т.п., при физиологических условиях in vivo, т.е. соединению, которое может быть превращено в соединение настоящего изобретения или его соль в результате ферментативного окисления, восстановления, гидролиза и т.п.; или соединению, которое может быть превращено в соединение настоящего изобретения или его соль в результате гидролиза и т.п. желудочным соком и т.п. Кроме того, пролекарство может быть соединениями, которые могут быть превращены в соединение настоящего изобретения или его соль при физиологических условиях, такими как описанные в "Iyakuhin no Kaihatsu [Development of Pharmaceuticals]", Vol. 7, Molecular Design, опубликовано в 1990 году Hirokawa Shoten Co., стр. 163-198.
[0076]
Описание заболеваний
Конкретные примеры опухолей, являющихся мишенями в настоящем изобретении, включают, без ограничения перечисленными, рак головы и шеи, рак желудочно-кишечного тракта (рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчевыводящих путей (например, рак желчного пузыря и желчных протоков), рак поджелудочной железы, колоректальный рак (например, рак толстой кишки и рак прямой кишки) и т.д.), рак легкого (например, немелкоклеточный рак легкого, мелкоклеточный рак легкого и мезотелиому), рак молочной железы, рак половых органов (рак яичника, рак матки (например, рак шейки матки и рак эндометрия) и т.д.), урологический рак (например, рак почки, рак мочевого пузыря, рак предстательной железы и опухоль яичка), гемопоэтическую опухоль (например, лейкоз, злокачественную лимфому и множественную миелому), остеосаркому, саркому мягких тканей, рак кожи, опухоль головного мозга и т.п. Предпочтительные примеры включают рак легкого, рак молочной железы, рак головы и шеи, опухоль головного мозга, рак матки, рак органов пищеварения, гемопоэтическую опухоль или рак кожи. Рак легкого является наиболее предпочтительным.
[0077]
Когда Соединение A или его соль применяется в качестве фармацевтического средства, при необходимости может быть добавлен фармацевтический носитель, с получением, таким образом, подходящей лекарственной формы в соответствии с целями предупреждения и лечения. Примеры лекарственной формы включают препараты для приема внутрь, препараты для инъекций, суппозитории, мази, трансдермальные пластыри и т.п. Пероральные препараты являются предпочтительными. Такие лекарственные формы могут быть изготовлены способами, традиционно известными специалистам в данной области.
[0078]
В одном варианте осуществления противоопухолевого средства настоящего изобретения предоставляют в виде фармацевтической композиции, включающей Соединение A или его соль и фармацевтически приемлемый носитель.
[0079]
В качестве фармацевтически приемлемого носителя различные стандартные органические или неорганические материалы-носители, используемые в качестве материалов для изготовления препаратов, могут быть смешаны в качестве вспомогательного вещества, связующего вещества, разрыхлителя, смазывающего вещества или красителя в твердых препаратах; или в качестве растворителя, солюбилизирующего вещества, суспендирующего вещества, изотонизирующего вещества, буфера или смягчающего средства в жидких препаратах. Кроме того, добавки, включаемые в фармацевтические препараты, такие как антисептики, антиоксиданты, красители, подсластители и стабилизаторы, также могут использоваться при необходимости.
[0080]
Твердые препараты для перорального введения изготавливают следующим образом. После добавления вспомогательного вещества, необязательно со вспомогательным веществом, связующим веществом, разрыхлителем, смазывающим веществом, красителем, корригентом или ароматизатором и т.д., к соединению настоящего изобретения, из полученной смеси изготавливают таблетки, таблетки, покрытые оболочкой, гранулы, порошки, капсулы и т.п. стандартными методами.
[0081]
Примеры вспомогательных веществ включают лактозу, сахарозу, D-маннит, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу и ангидрид кремниевой кислоты. Примеры связующих веществ включают воду, этанол, 1-пропанол, 2-пропанол, простой сироп, глюкозный сироп, жидкий α-крахмал, жидкий желатин, D-маннит, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилкрахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция, поливинилпирролидон и т.п. Примеры разрыхлителей включают сухой крахмал, альгинат натрия, порошкообразный агар, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерид стеариновой кислоты, лактозу и т.п. Примеры смазывающих веществ включают очищенный тальк, стеарат натрия, стеарат магния, тетраборат натрия, полиэтиленгликоль и т.п. Примеры красителей включают оксид титана, оксид железа и т.п. Примеры корригентов или ароматизаторов включают сахарозу, померанцевую корку, лимонную кислоту, винную кислоту и т.п.
[0082]
При изготовлении жидкого препарата для перорального введения, корригент, буфер, стабилизатор, ароматизатов и т.п. может быть добавлен к соединению настоящего изобретения; и из полученной смеси могут изготавливать жидкий препарат для перорального введения, сироп, настойку и т.д. согласно стандартному методу.
[0083]
При изготовлении препарата для инъекций, регулятор pH, буфер, стабилизатор, изотонизирующее вещество, местный анестетик и т.п. могут быть добавлены к соединению настоящего изобретения; и из смеси могут изготавливать препарат для подкожной, внутримышечной или внутривенной инъекции согласно стандартному методу.
[0084]
Примеры регулятора pH и буфера, используемого в настоящем документе, включают цитрат натрия, ацетат натрия и фосфат натрия. Примеры стабилизатора включают пиросульфит натрия, ЭДТА, тиогликолевую кислоту и тиомолочную кислоту. Примеры местного анестетика включают прокаина гидрохлорид и лидокаина гидрохлорид. Примеры регулятора тоничности включают натрия хлорид, глюкозу, D-маннит и глицерин.
[0085]
При изготовлении суппозитория к Соединению A могут быть добавлены фармацевтически приемлемые носители, известные в данной области техники, такие как полиэтиленгликоль, ланолин, масло какао и триглицерид жирной кислоты; и, при необходимости, поверхностно-активные вещества, такие как Tween 80 (зарегистрированная торговая марка), и из полученной смеси могут изготавливать суппозиторий согласно обычному методу.
[0086]
При изготовлении мази с Соединением A при необходимости могут быть смешаны обычно используемая основа, стабилизатор, смачивающее вещество, консервант и т.п.; и полученную смесь могут смешивать и изготавливать из нее мазь согласно обычному методу.
[0087]
Примеры основы включают жидкий парафин, белый петролатум, белый воск, октилдодециловый спирт и парафин.
[0088]
Примеры консерванта включают метилпараоксибензоат, этилпараоксибензоат и пропилпараоксибензоат.
[0089]
При изготовлении пластыря вышеописанную мазь, крем, гель, пасту и т.п. могут наносить на стандартную основу согласно обычному методу.
[0090]
Примеры основ включают тканые или нетканые материалы, включающие вату, штапельное волокно или химическое волокно; при этом также могут использоваться пленки или вспененные листы из мягкого винилхлорида, полиэтилена, полиуретана и т.д.
[0091]
Количество Соединения A для включения в каждую из таких единичных лекарственных форм зависит от состояния пациента, которому вводят соединение, лекарственной формы и т.д. Как правило, в случае средства для перорального применения количество соединения предпочтительно составляет 0,05-1000 мг на единичную лекарственную форму. В случае препарата для инъекций количество соединения предпочтительно составляет 0,01-500 мг на единичную лекарственную форму; и в случае суппозитория количество соединения предпочтительно составляет 1-1000 мг на единичную лекарственную форму.
[0092]
Кроме того, суточная доза лекарственного средства в такой лекарственной форме зависит от состояния, массы тела, возраста, пола пациента и т.д., и не может быть универсальной или ограниченной. Обычно суточная доза Соединения A для взрослого (масса тела: 50 кг) может в большинстве случаев составлять 0,05-5000 мг и предпочтительно 0,1-1000 мг; и предпочтительно вводить в одной дозе или в двух - трех раздельных дозах в сутки.
[0093]
В настоящем изобретении также предложен способ лечения пациента со злокачественной опухолью, включающий стадию введения Соединения A или его соли пациенту со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21.
[0094]
В настоящем изобретении также предложено Соединение A или его соль для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21.
[0095]
В настоящем изобретении также предложено применение Соединения A или его соли для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21.
[0096]
В настоящем изобретении также предложено применение Соединения A или его соли для производства фармацевтического средства для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21.
[0097]
В настоящем изобретении также предложена фармацевтическая композиция для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий мутацию в экзоне 18 и/или в экзоне 21, включающая Соединение A или его соль и фармацевтически приемлемый носитель.
[0098]
В настоящем изобретении также предложен способ прогнозирования терапевтических эффектов химиотерапии с применением противоопухолевого средства, содержащего в качестве активного ингредиента Соединение A или его соль, у пациента со злокачественной опухолью, где способ включает нижеследующие стадии (1) и (2):
(1) стадия обнаружения присутствия или отсутствия мутации гена EGFR, содержащегося в биологическом образце, полученном от пациента; и
(2) стадия прогнозирования, что химиотерапия с высокой вероятностью продемонстрирует достаточные терапевтические эффекты в отношении пациента, если результаты обнаружения на стадии (1) покажут, что ген EGFR имеет мутацию в экзоне 18 и/или в экзоне 21.
[0099]
В настоящем изобретении также предложен способ лечения пациента со злокачественной опухолью, включающий нижеследующие стадии (1)-(3):
(1) стадия обнаружения присутствия или отсутствия мутации гена EGFR, содержащегося в биологическом образце, полученном от пациента; и
(2) стадия прогнозирования, что химиотерапия с применением противоопухолевого средства, содержащего в качестве активного ингредиента (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль, с высокой вероятностью продемонстрирует достаточные терапевтические эффекты в отношении пациента, если результаты обнаружения на стадии (1) покажут, что ген EGFR имеет мутацию в экзоне 18 и/или в экзоне 21; и
(3) стадия введения (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его соли пациенту со злокачественной опухолью, который согласно прогнозу, сделанному на стадии (2), с высокой вероятностью будет в достаточной мере отвечать на химиотерапию с применением противоопухолевого средства, содержащего в качестве активного ингредиента (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его соль,.
[0100]
Последовательность оснований гена EGFR общеизвестна. Регистрационный номер в GenBank последовательности оснований кДНК - NM_005228.4.
[0101]
"Терапевтические эффекты" можно оценивать по эффектам уменьшения опухоли, эффектам подавления рецидивов, эффектам увеличения продолжительности жизни и т.п. Эффект подавления рецидивов может проявляться как степень увеличения продолжительности безрецидивного периода или степень уменьшения частоты рецидивов; и увеличивающие продолжительность жизнь эффекты могут быть представлены как степень полной продолжительности выживания или степень увеличения медианной выживаемости без прогрессирования и т.п. "Достаточные терапевтические эффекты" химиотерапии с применением противоопухолевого средства, содержащего в качестве активного ингредиента Соединение A или его соль, означают, например, что при введении противоопухолевого средства, содержащего в качестве активного ингредиента Соединение A или его соль, достигаются превосходные терапевтические эффекты, такие как увеличение продолжительности выживания, подавление рецидива и т.п., по сравнению с отсутствием введения.
Примеры
[0102]
Далее настоящее изобретение описывается более подробно со ссылкой на следующие Тестовые примеры. Однако настоящее изобретение не ограничивается такими примерами (Тестовыми примерами).
[0103]
Тестовый пример 1: Анализ эффективности лекарственного средства in vitro
Оценка результатов внутриклеточного фосфорилирования в системе индуцированной экспрессии мутантного EGFR с применением клеток HEK293 (ингибирующая активность)
Ингибирующую активность соединений в отношении внутриклеточной мишени оценивали по следующим показателям: внутриклеточное фосфорилирование EGFR в системе индуцированной экспрессии EGFR с использованием клеток HEK293 Jump-In (товарный знак) Grip (товарный знак) (Thermo Fisher Scientific Inc.) (которые могут в дальнейшем именоваться "клетками HEK293").
Клетки HEK293 поддерживали в D-MEM с GlutaMAX (торговая марка)-I (с высоким содержанием глюкозы) (Thermo Fisher Scientific Inc.), которая содержала 10% диализированной FBS и 100 Е/мл пенициллина/100 мкг/мл стрептомицина (Thermo Fisher Scientific Inc.); и вектор pATI™R4DEST CMV pA, который кодировал ген EGFR человека (G719A, G719S, G719C, E709K, E709A, L861Q, G719A+T790M или L861Q+T790M; знак "+" означает, что включены обе мутации), вводили в клетки HEK293 вместе с Opti-MEM (товарный знак) I (Thermo Fisher Scientific Inc.) при использовании реактива для трансфекции ViaFect (товарный знак) (Promega Corporation).
Клетки HEK293, экспрессирующие мутантный EGFR человека, сеяли в каждую лунку 384-луночного микропланшета с плоскодонными лунками так, чтобы число клеток в каждой лунке составляло 10000, и инкубировали в содержащем 5% CO2 инкубаторе при 37°C в течение 1 дня. Соединение A, эрлотиниб, афатиниб и осимертиниб (эрлотиниб, афатиниб и осимертиниб могут далее именоваться "сравнительным соединением") отдельно растворяли в ДМСО и разбавляли ДМСО или средой, используемой для суспендирования клеток. Затем растворы по отдельности добавляли в каждую лунку культурального планшета с клетками и инкубировали клетки в инкубаторе, содержащем 5% CO2, при 37°С в течение 6 часов. После инкубирования клетки иммобилизовали с использованием 20% нейтрального буферного формалина (Wako Pure Chemical Industries, Ltd.) и блокировали с использованием блокирующего буфера Odyssey (торговая марка) (PBS) (M&S TechnoSystems Inc.). Затем клетки подвергали реакции с первичным антителом (моноклональным антителом к EGFR (R19/48MIX) #AHR5062) (Thermo Fisher Scientific Inc.), которое разводили в блокирующем буфере Odyssey (товарный знак) (PBS) до 1/200, и антителом к фосфо-EFFR рецептору (Tyr1068) #2234L (CST), с последующей пермеабилизацией клеток при 4°C в течение ночи. На следующий день клетки подвергали реакции с вторичным антителом (козье антитело IRDye 800CW против иммуноглобулина кролика, #926-32211, и козье антитело IRDye 680RD против иммуноглобулина мыши, #926-68070 (M&S TechnoSystems Inc.)), разведенным в блокирующем буфере (PBS) Odyssey (торговая марка) до 1/800 и подвергали пермеабилизации при комнатной температуре в течение 1 часа. Интенсивность флуоресценции (которая далее может именоваться "FI") регистрировали с помощью системы Odyssey Infrared Imaging System (LI-COR Bioscience) при длине волны флуоресценции 800 нм и 700 нм.
[0104]
Значение, полученное при вычитании FI в лунке без клеток из FI, зарегистрированной при длине волны флуоресценции 800 нм или 700 нм, указано как FI(800, EGFR)-Blank (для 800 нм) и FI(700,p-EGFR)-Blank (для 700 нм). Значение, полученное при делении FI(700,p-EGFR)-Blank каждой лунки на FI(800, EGFR)-Blank, было определено как FI(p-EGFR/EGFR). Процент ингибирования фосфорилированного EGFR вычисляли при использовании следующей формулы, определив концентрацию тестируемого соединения, при которой фосфорилированный EGFR был ингибирован на 50% (IC50 (мкМ)). Результаты представлены в Таблице 1.
[0105]
Процент фосфорилированного EGFR (%)=T/C×100
T: FI(p-EGFR/EGFR) в лунке, в которую добавляли тестируемое соединение.
C: FI(p-EGFR/EGFR) в лунке, в которую не добавляли тестируемое соединение.
[0106]
Как видно из Таблицы 1, соединение A демонстрировало высокую ингибирующую активность против внутриклеточного фосфорилирования EGFR с мутацией в экзоне 18 или в экзоне 21; и активность была выше, чем у эрлотиниба или осимертиниба, и была эквивалентна активности афатиниба. Ингибирующая активность соединения A против EGFR с мутацией в экзоне 18 или в экзоне 21 была выше, чем у афатиниба в присутствии мутации T790M, которая является приобретенной резистентной мутацией.
[0107]
Таблица 1
T790M
T790M
[0108]
Тестовый пример 2
Оценка эффекта ингибирования роста клеток против клеточной линии, экспрессирующей EGFR дикого типа и мутантный EGFR ( in vitro )
Ингибирующую активность соединений против EGFR дикого типа и мутантного EGFR оценивали с использованием клеток Ba/F3, которые представляют собой линию клеток-предшественников B-лимфоцитов мыши, в которые был введен человеческий ген EGFR. Клетки Ba/F3 поддерживали в среде RPMI-1640 (Thermo Fisher Scientific Inc.), содержащей 10% эмбриональной бычьей сыворотки (FBS), 100 Е/мл пенициллина/100 мкг/мл стрептомицина (Thermo Fisher Scientific Inc.) и 1 нг/мл интерлейкина-3 мыши (mIL-3) (CST). Вектор APB-CMV-MCS-EF1-GFP+Puro или вектор PB-CMV-MCS-EF1-RFP+Puro, кодирующий человеческий ген EGFR (дикого типа (WT), G719A или L861Q), вводили в клетки вместе с вектором экспрессии транспозазы Super PiggyBac с помощью электропорации при использовании набора Amaxa (товарный знак) Cell Line Nucleofector (товарный знак) Kit V, с последующим отбором при использовании пуромицина (SIGMA). Клетки Ba/F3, экспрессирующие EGFR дикого типа (которые могут в дальнейшем именоваться "Ba/F3-EGFR_WT"), продемонстрировали mIL-3-независимый рост в присутствии 50 нг/мл EGF (R&D Systems); и клетки Ba/F3, экспрессирующие активный EGFR с мутацией в экзоне 18 или в экзоне 21 (которые могут в дальнейшем именоваться "Ba/F3-EGFR G719A" и "Ba/F3-EGFR L861Q"), продемонстрировали mIL-3-независимый рост в отсутствие EGF.
[0109]
Для оценки эффекта ингибирования роста клеток, клетки Ba/F3-EGFR_WT суспендировали в среде RPMI-1640, содержащей 10% FBS, 100 Е/мл пенициллина, 100 мкг/мл стрептомицина и 50 нг/мл EGF; и суспензию клеток сеяли в каждую лунку 96-луночного микропланшета с плоскодонными лунками так, чтобы количество клеток в каждой лунке составило 30000. Клетки Ba/F3-EGFR G719A и клетки Ba/F3-EGFR L861Q суспендировали в соответствующих средах RPMI-1640, содержащих 10% FBS, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина; и суспензии клеток отдельно сеяли в каждую лунку 96-луночного микропланшета с плоскодонными лунками так, чтобы количество клеток в каждой лунке составило 15000. Затем соединение A, гефитиниб, эрлотиниб, афатиниб и осимертиниб (гефитиниб, эрлотиниб, афатиниб и осимертиниб в дальнейшем могут именоваться "сравнительным соединением") индивидуально растворяли в ДМСО и разбавляли ДМСО или средой, используемой для суспендирования клеток. Затем растворы добавляли в каждую лунку культурального планшета с клетками и инкубировали клетки в инкубаторе с 5% CO2 при 37°C в течение 3 дней. Количество клеток после инкубирования измеряли с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (торговая марка) (Promega Corporation) в соответствии с методикой, рекомендованной производителем. Показатель роста вычисляли при использовании следующей формулы для определения концентрации каждого тестируемого соединения, требуемой для 50% ингибирования (IC50 (мкМ)).
[0110]
Показатель роста (%)=T/C×100
T: Интенсивность люминесценции в лунке, в которую добавляли тестируемое соединение.
C: Интенсивность люминесценции в лунке, в которую не добавляли тестируемое соединение.
[0111]
Отношение IC50 между EGFR дикого типа и G719A мутантным EGFR или между EGFR дикого типа и L861Q мутантным EGFR определяли с использованием следующей формулы. Результаты представлены в Таблице 2.
[0112]
Отношение IC50=IC50 (WT)/IC50 (G719A или L861Q)
[0113]
Как видно из Таблицы 2, соединение A демонстрировало селективную ингибирующую активность против мутации G719A и мутации L861Q.
[0114]
Таблица 2
[0115]
Тестовый пример 3: Анализ эффективности лекарственного средства in vivo
Оценка противоопухолевого действия в модели на мышах с подкожным трансплантатом линии клеток, экспрессирующих EGFR с мутацией G719A
Оценку в моделях на мышах, которым подкожно трансплантировали линию клеток, экспрессирующих G719A мутантный EGFR, проводили с использованием клеток NIH-3T3, которые представляют собой клеточную линию фибробластов мыши, в которую был введен человеческий ген EGFR. Клетки NIH-3T3 поддерживали в среде D-MEM (с высоким содержанием глюкозы) (Wako Pure Chemical Industries, Ltd.), содержащей 10% сыворотки новорожденных телят (NBCS), 1500 мг/л гидрокарбоната натрия и 100 Е/мл пенициллина/100 мкг/мл стрептомицина (Thermo Fisher Scientific Inc.); и вектор PB-CMV-MCS-EF1-RFP+Puro, кодирующий ген человеческого EGFR (G719A), вводили в клетки вместе с вектором экспрессии транспозазы Super PiggyBac путем электропорации с использованием набора Amaxa (торговая марка) Cell Line Nucleofector (торговая марка) Kit R, с последующим отбором при использовании пуромицина (SIGMA). Клетки NIH-3T3, экспрессирующие EGFR с мутацией в экзоне 18 (которые в дальнейшем могут именоваться "NIH3T3-EGFR G719A"), демонстрировали рост в отсутствие EGF в среде с 1% NBCS.
[0116]
При оценке с использованием моделей на мышах с подкожными трансплантатами линии клеток, экспрессирующих G719A мутантный EGFR, "голым" мышам подкожно трансплантировали клетки NIH3T3-EGFR G719A, в которые был введен человеческий мутантный EGFR. В момент, когда объем перевитой опухоли у мышей увеличился до приблизительно 100-200 мм3, мышей распределяли в группы, по 5 или 6 мышей в каждой группе, путем стратифицированной рандомизации, чтобы средний объем опухоли в группах был одинаковым. Затем мышам перорально вводили соединение A, афатиниб или осимертиниб, один раз в день в течение 14 дней подряд.
[0117]
Доза афатиниба составляла 20 мг/кг/день, что является максимальной переносимой дозой (максимальная доза, при которой потеря веса в течение периода введения составляет меньше 20%), в течение 14 дней, периода введения доз в данном исследовании. Доза осимертиниба составляла 25 мг/кг/день, что является клинически эффективной дозой. Для соединения A были установлены три типа доз: 200 мг/кг/день (максимальная переносимая доза), 100 мг/кг/день и 50 мг/кг/день. Максимальную переносимую дозу определяли в соответствии с "Руководством по вариантам исследования неоплазий на мышах и крысах" Национального института рака (NCI) исходя из гуманитарной точки зрения.
[0118]
Для сравнения изменений в росте опухоли в динамике, вызванных введением отдельных тестируемых соединений, объем опухоли (который может в дальнейшем именоваться "TV") использовали в качестве индекса. Для индекса токсичности массу тела измеряли в динамике, и изменение массы тела (которое может в дальнейшем именоваться "BWC (%)") начиная со дня, в который мышей разделяли на группы, вычисляли в соответствии со следующей формулой.
[0119]
BWC (%)=(масса тела, измеренная в день измерения массы тела)/(масса тела в день, в который мышей разделяли на группы),
[0120]
Если различие по среднему значению TV между контрольной группой и группой, которой вводили тестируемое соединение, в заключительный день оценки было статистически значимым (критерий Даннетта, p<0,05), и значение лечение/контроль (T/C), вычисленное с использованием следующей формулы, составляло меньше 100, тестируемое соединение считали эффективным. Такой случай обозначен знаком "*" на фигурах.
[0121]
T/C (%)=(среднее значение TV группы, получавшей тестируемое соединение)/(среднее значение TV контрольной группы)×100
[0122]
Как видно из результатов, представленных на Фиг. 1, соединение A настоящего изобретения продемонстрировало заметный противоопухолевый эффект в отношении линии клеток, экспрессирующих G719A мутантный EGFR, подкожно трансплантированных "голым" мышам, сопровождавшееся регрессией опухоли. Данный эффект также был выше, чем у афатиниба или осимертиниба. У мышей не проявлялись такие симптомы, как серьезная потеря веса, как показано на Фиг. 2, нарушения стула или патологии кожи.
[0123]
Тестовый пример 4: Анализ эффективности лекарственного средства in vitro
Оценка эффекта ингибирования роста клеток в отношении линии клеток, экспрессирующих T790M мутантный EGFR ( in vitro )
Ингибирующую активность соединения в отношении T790M мутантного EGFR оценивали при использовании клеток Ba/F3, которые являются линией клеток-предшественников B-лимфоцитов мыши, в которые был введен ген EGFR человека. Клетки Ba/F3 поддерживали в среде RPMI-1640 (Thermo Fisher Scientific Inc.), содержащей 10% эмбриональной бычьей сыворотки (FBS), 100 Е/мл пенициллина/100 мкг/мл стрептомицина (Thermo Fisher Scientific Inc.) и 1 нг/мл интерлейкина-3 мыши (mIL-3) (CST); и вектор PB-CMV-MCS-EF1-GFP+Puro или вектор PB-CMV-MCS-EF1-RFP+Puro, кодирующий человеческий ген EGFR (дикого типа (WT), G719A+T790M или 861Q+TL790M), вводили в клетки вместе с вектором экспрессии транспозазы Super PiggyBac с помощью электропорации при использовании набора Amaxa (товарный знак) Cell Line Nucleofector (товарный знак) Kit V, с последующим отбором при использовании пуромицина (SIGMA). Клетки Ba/F3, экспрессирующие G719A+T790M мутантный EGFR или L861Q+T790M мутантный EGFR (который может в дальнейшем именоваться "Ba/F3-EGFR G719A+T790M" и "Ba/F3-EGFR 861Q+TL790M"), показали mIL-3-независимый рост в отсутствие EGF.
[0124]
Для оценки эффекта ингибирования роста клеток, клетки Ba/F3-EGFR G719A+T790M и клетки Ba/F3-EGFR L861Q+T790M отдельно суспендировали в среде RPMI-1640, содержащей 10% FBS, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина; и суспензии клеток отдельно сеяли в каждую лунку 96-луночного микропланшета с плоскодонными лунками так, чтобы количество клеток в каждой лунке составляло 15000. Затем соединение A, гефитиниб, эрлотиниб, афатиниб и осимертиниб (гефитиниб, эрлотиниб, афатиниб и осимертиниб могут в дальнейшем именоваться "сравнительным соединением") отдельно растворяли в ДМСО и разбавляли ДМСО или средой, используемой для суспендирования клеток. Эти растворы затем добавляли в каждую лунку культурального планшета с клетками и инкубировали в инкубаторе с 5% CO2 при 37°C в течение 3 дней. Количество клеток после инкубирования измеряли с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (торговая марка) (Promega Corporation) в соответствии с методикой, рекомендованной производителем. Показатель роста вычисляли с использованием следующей формулы для определения концентрации каждого тестируемого соединения, требуемой для 50% ингибирования (IC50 (мкМ)).
[0125]
Показатель роста (%)=T/C×100
T: интенсивность люминесценции в лунке, в которую добавляли тестируемое соединение.
C: интенсивность люминесценции в лунке, в которую не добавляли тестируемое соединение.
[0126]
Кроме того, отношение IC50 между EGFR дикого типа и G719A+T790M мутантным EGFR или между EGFR дикого типа и 861Q+TL790M мутантным EGFR вычисляли при использовании следующей формулы. Результаты представлены в Таблице 3.
[0127]
Отношение IC50=IC50(WT)/IC50(G719A+T790M или 861Q+TL790M)
[0128]
Как видно из Таблицы 3, соединение A продемонстрировало селективную ингибирующую активность против мутации G719A+T790M и мутации 861Q+TL790M.
[0129]
Таблица 3
[0130]
Тестовый пример 5: Анализ эффективности лекарственного средства in vivo
Оценка противоопухолевого действия в модели на мышах с подкожной трансплантацией линии клеток, экспрессирующих G719A+T790M мутантный EGFR
Оценку в моделях на мышах, которым подкожно трансплантировали линию клеток, экспрессирующих G719A+T790M мутантный EGFR, проводили с использованием клеток NIH-3T3, которые являются клеточной линией мышиных фибробластов, в которые введен ген EGFR человека. Клетки NIH-3T3 поддерживали в среде D-MEM (с высоким содержанием глюкозы) (Wako Pure Chemical Industries, Ltd.), содержащей 10% сыворотки новорожденных телят (NBC), 1500 мг/л гидрокарбоната натрия и 100 Е/мл пенициллина/100 мкг/мл стрептомицина (Thermo Fisher Scientific Inc.); и вектор PB-CMV-MCS-EF1-RFP+Puro, кодирующий ген EGFR человека (G719A+T790M), вводили в клетки вместе с вектором экспрессии транспозазы Super PiggyBac с помощью электропорации при использовании набора Amaxa (товарный знак) Cell Line Nucleofector (товарный знак) Kit R, с последующим отбором при использовании пуромицина (SIGMA). Клетки NIH-3T3, экспрессирующие EGFR с мутацией в экзоне 18 (который может в дальнейшем именоваться "NIH3T3-EGFR G719A+T790M"), демонстрировали рост в отсутствие EGF в среде с 1% NBCS.
[0131]
При оценке с использованием моделей на мышах с подкожными трансплантатами линии клеток, экспрессирующих G719A+T790M мутантный EGFR, "голым" мышам подкожно трансплантировали клетки NIH3T3-EGFR G719A+T790M, в которые был введен человеческий мутантный EGFR человека. В момент, когда объем перевитой опухоли у мышей увеличился до приблизительно 100-300 мм3, мышей распределяли в группы, по 5 мышей в каждой группе, путем стратифицированной рандомизации таким образом, чтобы средний объем опухоли в группах был одинаковым. Затем мышам перорально вводили соединение A настоящего изобретения или афатиниб один раз в день в последовательные дни.
[0132]
Доза афатиниба составляла 20 мг/кг/день, что является максимальной переносимой дозой (максимальная доза, при которой потеря веса в течение периода введения составляет меньше 20%), в течение 14 дней, периода введения доз в данном исследовании. Для соединения A настоящего изобретения были установлены три типа доз: 200 мг/кг/день (максимальная переносимая доза), 100 мг/кг/день и 50 мг/кг/день. Максимальную переносимую дозу определяли в соответствии с "Руководством по вариантам исследования неоплазий на мышах и крысах" Национального института рака (NCI) исходя из гуманитарной точки зрения.
[0133]
Чтобы сравнивать изменения в росте опухоли в динамике, вызванные введением отдельных тестируемых соединений, объем опухоли (который может в дальнейшем именоваться "TV") использовали в качестве индекса. На Фиг. 3 показаны изменения TV в динамике. Для индекса токсичности массу тела измеряли в динамике, и изменение массы тела (которое может в дальнейшем именоваться "BWC (%)") начиная со дня, в который мышей разделяли на группы, вычисляли в соответствии со следующей формулой. На Фиг. 4 показаны изменения массы тела в динамике.
BWC (%)=(масса тела, измеренная в день измерения массы тела)/(масса тела в день, в который мышей разделяли на группы),
[0134]
Критерий Даннетта применяли с использованием среднего значения TV в последний день оценки в качестве индекса. Если различие по среднему значению TV между контрольной группой и группой, в которой вводили тестируемое соединение, было статистически значимым (p<0,05), и значение лечение/контроль (T/C), вычисленное с использованием следующей формулы, составляло меньше 100, тестируемое соединение считали эффективным. Такой случай обозначен знаком "*" на Фиг. 3 и в Таблице 4 (*: р<0,05, **: р<0,01, ***: р<0,001). Кроме того, если различие по среднему значению TV между группой, в которой вводили соединение А согласно настоящему изобретению, и группой, в которой вводили афатиниб, было статистически значимым (р<0,05), и значение T/C в группе, в которой вводили соединение A настоящего изобретения, было меньше, чем значение T/C в группе, в которой вводили афатиниб, определяли, что соединение A обладает более высоким противоопухолевым эффектом, чем афатиниб. Такой случай обозначен знаком "#" на Фиг. 3 и в Таблице 4 (#: p<0,05, ##: p<0,01, ###: p<0,001).
[0135]
T/C (%)=(среднее значение TV группы, получавшей тестируемое соединение)/(среднее значение TV контрольной группы)×100
[0136]
Как видно из результатов, представленных на Фиг. 3, соединение A настоящего изобретения показало значительный противоопухолевый эффект в отношении линии клеток, экспрессирующих G719A+T790M мутантный EGFR, подкожно трансплантированных "голым" мышам. Кроме того, как показано в Таблице 4, эффект был выше, чем у афатиниба, без таких симптомов, как серьезная потеря веса (как показано на Фиг. 4), нарушения стула или патологии кожи у мышей.
[0137]
Таблица 4
N.S.: Отсутствие значимого различия
***: p<0,001 (критерий Даннетта в сравнении с Контрольной группой)
##: p<0,01 (критерий Даннетта в сравнении с группой афатиниба)
###: p<0,001 (критерий Даннетта в сравнении с группой афатиниба)
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> TAIHO PHARMACEUTICAL CO., LTD.
<120> Селективный ингибитор EGFR с мутацией в экзоне 18 и/или 21
<130> P18-145WO
<150> JP 2017-168606
<151> 2017-09-01
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 1210
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Arg Pro Ser Gly Thr Ala Gly Ala Ala Leu Leu Ala Leu Leu Ala
1 5 10 15
Ala Leu Cys Pro Ala Ser Arg Ala Leu Glu Glu Lys Lys Val Cys Gln
20 25 30
Gly Thr Ser Asn Lys Leu Thr Gln Leu Gly Thr Phe Glu Asp His Phe
35 40 45
Leu Ser Leu Gln Arg Met Phe Asn Asn Cys Glu Val Val Leu Gly Asn
50 55 60
Leu Glu Ile Thr Tyr Val Gln Arg Asn Tyr Asp Leu Ser Phe Leu Lys
65 70 75 80
Thr Ile Gln Glu Val Ala Gly Tyr Val Leu Ile Ala Leu Asn Thr Val
85 90 95
Glu Arg Ile Pro Leu Glu Asn Leu Gln Ile Ile Arg Gly Asn Met Tyr
100 105 110
Tyr Glu Asn Ser Tyr Ala Leu Ala Val Leu Ser Asn Tyr Asp Ala Asn
115 120 125
Lys Thr Gly Leu Lys Glu Leu Pro Met Arg Asn Leu Gln Glu Ile Leu
130 135 140
His Gly Ala Val Arg Phe Ser Asn Asn Pro Ala Leu Cys Asn Val Glu
145 150 155 160
Ser Ile Gln Trp Arg Asp Ile Val Ser Ser Asp Phe Leu Ser Asn Met
165 170 175
Ser Met Asp Phe Gln Asn His Leu Gly Ser Cys Gln Lys Cys Asp Pro
180 185 190
Ser Cys Pro Asn Gly Ser Cys Trp Gly Ala Gly Glu Glu Asn Cys Gln
195 200 205
Lys Leu Thr Lys Ile Ile Cys Ala Gln Gln Cys Ser Gly Arg Cys Arg
210 215 220
Gly Lys Ser Pro Ser Asp Cys Cys His Asn Gln Cys Ala Ala Gly Cys
225 230 235 240
Thr Gly Pro Arg Glu Ser Asp Cys Leu Val Cys Arg Lys Phe Arg Asp
245 250 255
Glu Ala Thr Cys Lys Asp Thr Cys Pro Pro Leu Met Leu Tyr Asn Pro
260 265 270
Thr Thr Tyr Gln Met Asp Val Asn Pro Glu Gly Lys Tyr Ser Phe Gly
275 280 285
Ala Thr Cys Val Lys Lys Cys Pro Arg Asn Tyr Val Val Thr Asp His
290 295 300
Gly Ser Cys Val Arg Ala Cys Gly Ala Asp Ser Tyr Glu Met Glu Glu
305 310 315 320
Asp Gly Val Arg Lys Cys Lys Lys Cys Glu Gly Pro Cys Arg Lys Val
325 330 335
Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu Ser Ile Asn
340 345 350
Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr Ser Ile Ser Gly Asp
355 360 365
Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp Ser Phe Thr His Thr
370 375 380
Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr Val Lys Glu
385 390 395 400
Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn Arg Thr Asp
405 410 415
Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg Thr Lys Gln
420 425 430
His Gly Gln Phe Ser Leu Ala Val Val Ser Leu Asn Ile Thr Ser Leu
435 440 445
Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly Asp Val Ile Ile Ser
450 455 460
Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp Lys Lys Leu
465 470 475 480
Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn Arg Gly Glu
485 490 495
Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His Ala Leu Cys Ser Pro
500 505 510
Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys Val Ser Cys Arg Asn
515 520 525
Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys Asn Leu Leu Glu Gly
530 535 540
Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys Ile Gln Cys His Pro
545 550 555 560
Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys Thr Gly Arg Gly Pro
565 570 575
Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp Gly Pro His Cys Val
580 585 590
Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn Asn Thr Leu Val Trp
595 600 605
Lys Tyr Ala Asp Ala Gly His Val Cys His Leu Cys His Pro Asn Cys
610 615 620
Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro Thr Asn Gly
625 630 635 640
Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val Gly Ala Leu Leu Leu
645 650 655
Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe Met Arg Arg Arg His
660 665 670
Ile Val Arg Lys Arg Thr Leu Arg Arg Leu Leu Gln Glu Arg Glu Leu
675 680 685
Val Glu Pro Leu Thr Pro Ser Gly Glu Ala Pro Asn Gln Ala Leu Leu
690 695 700
Arg Ile Leu Lys Glu Thr Glu Phe Lys Lys Ile Lys Val Leu Gly Ser
705 710 715 720
Gly Ala Phe Gly Thr Val Tyr Lys Gly Leu Trp Ile Pro Glu Gly Glu
725 730 735
Lys Val Lys Ile Pro Val Ala Ile Lys Glu Leu Arg Glu Ala Thr Ser
740 745 750
Pro Lys Ala Asn Lys Glu Ile Leu Asp Glu Ala Tyr Val Met Ala Ser
755 760 765
Val Asp Asn Pro His Val Cys Arg Leu Leu Gly Ile Cys Leu Thr Ser
770 775 780
Thr Val Gln Leu Ile Thr Gln Leu Met Pro Phe Gly Cys Leu Leu Asp
785 790 795 800
Tyr Val Arg Glu His Lys Asp Asn Ile Gly Ser Gln Tyr Leu Leu Asn
805 810 815
Trp Cys Val Gln Ile Ala Lys Gly Met Asn Tyr Leu Glu Asp Arg Arg
820 825 830
Leu Val His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Lys Thr Pro
835 840 845
Gln His Val Lys Ile Thr Asp Phe Gly Leu Ala Lys Leu Leu Gly Ala
850 855 860
Glu Glu Lys Glu Tyr His Ala Glu Gly Gly Lys Val Pro Ile Lys Trp
865 870 875 880
Met Ala Leu Glu Ser Ile Leu His Arg Ile Tyr Thr His Gln Ser Asp
885 890 895
Val Trp Ser Tyr Gly Val Thr Val Trp Glu Leu Met Thr Phe Gly Ser
900 905 910
Lys Pro Tyr Asp Gly Ile Pro Ala Ser Glu Ile Ser Ser Ile Leu Glu
915 920 925
Lys Gly Glu Arg Leu Pro Gln Pro Pro Ile Cys Thr Ile Asp Val Tyr
930 935 940
Met Ile Met Val Lys Cys Trp Met Ile Asp Ala Asp Ser Arg Pro Lys
945 950 955 960
Phe Arg Glu Leu Ile Ile Glu Phe Ser Lys Met Ala Arg Asp Pro Gln
965 970 975
Arg Tyr Leu Val Ile Gln Gly Asp Glu Arg Met His Leu Pro Ser Pro
980 985 990
Thr Asp Ser Asn Phe Tyr Arg Ala Leu Met Asp Glu Glu Asp Met Asp
995 1000 1005
Asp Val Val Asp Ala Asp Glu Tyr Leu Ile Pro Gln Gln Gly Phe
1010 1015 1020
Phe Ser Ser Pro Ser Thr Ser Arg Thr Pro Leu Leu Ser Ser Leu
1025 1030 1035
Ser Ala Thr Ser Asn Asn Ser Thr Val Ala Cys Ile Asp Arg Asn
1040 1045 1050
Gly Leu Gln Ser Cys Pro Ile Lys Glu Asp Ser Phe Leu Gln Arg
1055 1060 1065
Tyr Ser Ser Asp Pro Thr Gly Ala Leu Thr Glu Asp Ser Ile Asp
1070 1075 1080
Asp Thr Phe Leu Pro Val Pro Glu Tyr Ile Asn Gln Ser Val Pro
1085 1090 1095
Lys Arg Pro Ala Gly Ser Val Gln Asn Pro Val Tyr His Asn Gln
1100 1105 1110
Pro Leu Asn Pro Ala Pro Ser Arg Asp Pro His Tyr Gln Asp Pro
1115 1120 1125
His Ser Thr Ala Val Gly Asn Pro Glu Tyr Leu Asn Thr Val Gln
1130 1135 1140
Pro Thr Cys Val Asn Ser Thr Phe Asp Ser Pro Ala His Trp Ala
1145 1150 1155
Gln Lys Gly Ser His Gln Ile Ser Leu Asp Asn Pro Asp Tyr Gln
1160 1165 1170
Gln Asp Phe Phe Pro Lys Glu Ala Lys Pro Asn Gly Ile Phe Lys
1175 1180 1185
Gly Ser Thr Ala Glu Asn Ala Glu Tyr Leu Arg Val Ala Pro Gln
1190 1195 1200
Ser Ser Glu Phe Ile Gly Ala
1205 1210
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| L718 И/ИЛИ L792 МУТАНТНЫЙ ИНГИБИТОР РЕЗИСТЕНТНОГО К ЛЕЧЕНИЮ EGFR | 2019 |
|
RU2809621C2 |
| СЕЛЕКТИВНЫЙ ИНГИБИТОР МУТАНТА EGFR СО ВСТАВКОЙ В ЭКЗОНЕ 20 | 2017 |
|
RU2774629C2 |
| КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2740996C2 |
| НЕОАНТИГЕНЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813924C2 |
| БИСПЕЦИФИЧЕСКИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ БЕЛОК EGFR/CD16 | 2019 |
|
RU2792240C2 |
| КОНСТРУКТЫ Т-КЛЕТОЧНОГО РЕЦЕПТОРА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2785954C2 |
| НОВОЕ АНТИ-С-МЕТ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2751720C2 |
| МОЛЕКУЛА TGFβR2 С УКОРОЧЕННЫМ ВНЕКЛЕТОЧНЫМ ДОМЕНОМ, СЛИТЫЙ БЕЛОК МОЛЕКУЛЫ TGFβR2 С УКОРОЧЕННЫМ ВНЕКЛЕТОЧНЫМ ДОМЕНОМ, И АНТИТЕЛА ПРОТИВ EGFR, И ПРОТИВООПУХОЛЕВОЕ ПРИМЕНЕНИЕ СЛИТОГО БЕЛКА | 2021 |
|
RU2824199C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ T-КЛЕТОК И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2835034C2 |

Группа изобретений относится к селективному ингибитору EGFR с мутацией в экзоне 18 и/или 21. Предложены применения (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли в способах лечения пациента со злокачественной опухолью и прогнозирования терапевтических эффектов химиотерапии с применением противоопухолевого средства у пациента со злокачественной опухолью, где опухоль имеет мутацию гена EGFR, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток. Изобретения обеспечивают превосходную селективность и эффекты ингибирования роста опухоли в отношении EGFR с мутацией в экзоне 18 и/или экзоне 21, не вызывая ингибирования EGFR дикого типа. 5 н. и 15 з.п. ф-лы, 4 ил., 4 табл., 5 пр.
1. Способ лечения пациента со злокачественной опухолью, включающий стадию введения (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли пациенту со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
2. Способ по п.1, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
3. Способ по п.1 или 2, где мутацией в экзоне 21 является L861Q.
4. Способ по любому из пп.1-3, где EGFR дополнительно имеет мутацию T790M.
5. Применение (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
6. Применение по п.5, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
7. Применение по п.5 или 6, где мутацией в экзоне 21 является L861Q.
8. Применение по любому из пп.5-7, где EGFR дополнительно имеет мутацию T790M.
9. Применение (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли для производства фармацевтического средства для лечения пациента со злокачественной опухолью, экспрессирующей EGFR, имеющий по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
10. Применение по п.9, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
11. Применение по п.9 или 10, где мутацией в экзоне 21 является L861Q.
12. Применение по любому из пп.9-11, где EGFR дополнительно имеет мутацию T790M.
13. Способ прогнозирования терапевтических эффектов химиотерапии с применением противоопухолевого средства, содержащего в качестве активного ингредиента (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламид или его фармацевтически приемлемую соль, у пациента со злокачественной опухолью, где опухоль имеет мутацию гена EGFR, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток, где способ включает нижеследующие стадии (1) и (2):
(1) стадия обнаружения присутствия или отсутствия мутации гена EGFR, содержащегося в биологическом образце, полученном у пациента, где мутация гена EGFR выбрана из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток; и
(2) стадия прогнозирования, что химиотерапия с высокой вероятностью продемонстрирует достаточные терапевтические эффекты в отношении пациента, если результаты обнаружения на стадии (1) покажут, что ген EGFR имеет по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток.
14. Способ по п.13, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
15. Способ по п.13 или 14, где мутацией в экзоне 21 является L861Q.
16. Способ по любому из пп.13-15, где EGFR дополнительно имеет мутацию T790M.
17. Способ лечения пациента со злокачественной опухолью, где опухоль имеет мутацию гена EGFR, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток, включающий нижеследующие стадии (1)-(3):
(1) стадия обнаружения присутствия или отсутствия мутации гена EGFR, содержащегося в биологическом образце, полученном у пациента, где мутация гена EGFR выбрана из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток;
(2) стадия прогнозирования, что химиотерапия с применением противоопухолевого средства, содержащего в качестве активного ингредиента эффективное количество (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли, с высокой вероятностью продемонстрирует достаточные терапевтические эффекты в отношении пациента, если результаты обнаружения на стадии (1) покажут, что ген EGFR имеет по меньшей мере одну мутацию, выбранную из группы, состоящей из мутации G719X в экзоне 18, мутации E709X в экзоне 18 и мутации L861X в экзоне 21, где X представляет собой произвольный аминокислотный остаток; и
(3) стадия введения эффективного количества (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли пациенту со злокачественной опухолью, который согласно прогнозу, выполненному на стадии (2), с высокой вероятностью будет в достаточной мере отвечать на химиотерапию с применением противоопухолевого средства, содержащего в качестве активного ингредиента эффективное количество (S)-N-(4-амино-6-метил-5-(хинолин-3-ил)-8,9-дигидропиримидо[5,4-b]индолизин-8-ил)акриламида или его фармацевтически приемлемой соли.
18. Способ по п.17, где мутация в экзоне 18 является по меньшей мере одной мутацией, выбранной из группы, состоящей из G719A, G719S, G719C, E709K и E709A.
19. Способ по п.17 или 18, где мутацией в экзоне 21 является L861Q.
20. Способ по любому из пп.17-19, где EGFR дополнительно имеет мутацию T790M.
| US 2016194332 A1, 07.07.2016 | |||
| KOBAYASHI, Yoshihisa and MITSUDOMI, Tetsuya, "Not all epidermal growth factor receptor mutations in lung cancer are created equal: Perspectives for individualized treatment strategy", Cancer Science, 2016, v.107, no.9, p.1179-1186, doi: 10.1111/cas.12996 | |||
| YANG, James C-H et al., "Clinical activity of afatinib in |
Авторы
Даты
2022-12-12—Публикация
2018-08-31—Подача