Область техники, к которой относится изобретение
Настоящее изобретение относится к четырехвалентным, биспецифическим антигенсвязывающим белкам EGFR/CD16A, приводящим NK-клетки в контакт с EGFR-позитивными клетками и к их использованию для лечения EGFR-позитивных злокачественных новообразований, таких как EGFR-позитивные опухоли.
Предпосылки создания изобретения
Рецептор эпидермального фактора роста (EGFR) представляет собой валидированную мишень для лечения нескольких солидных опухолей. Существующие моноклональные антитела (mAb), нацеленные на EGFR, и ингибиторы тирозинкиназы (TKI) функционируют главным образом посредством блокировки сигнальной трансдукции. Кроме того, эффективность лечения этими агентами зависит либо от мутационного статуса рецептора или сигнального пути, такого как мутация привратника T790M в домене тирозинкиназы, либо от мутаций, находящихся ниже в каскаде сигнальной трансдукции (например, RAS или RAF), которые могут вызывать первичную или приобретенную терапевтическую резистентность у большого количества пациентов. Кроме того, виды терапии, нацеленные на EGFR, были связаны с побочными эффектами, которые, как считалось, влияют на количество выписываемых препаратов.
Рецептор эпидермального фактора роста (EGFR) является членом семейства рецепторных тирозинкиназ HER, состоящего из четырех членов: EGFR (ErbB1/HER1), HER2/neu (ErbB2), HER3 (ErbB3) и HER4 (ErbB4). Стимуляция рецептора посредством связывания лиганда (например, EGF, TGFa, HB-EGF, нейрегулинов, бетацеллюлина, амфирегулина) активирует первичную рецепторную тирозинкиназу посредством фосфорилирования тирозина и способствует гомо- или гетеродимеризации рецептора с членами семейства HER. Эти фосфотирозины служат в качестве докинг-сайтов для различных адаптерных белков или ферментов, включая MAPK и PI(3)K/Akt, которые одновременно инициируют множество сигнальных каскадов, влияющих на пролиферацию клеток, ангиогенез, резистентность к апоптозу, инвазию и метастазирование.
Семейство рецепторов эпидермального фактора роста (EGFR) рецепторных тирозинкиназ было описано как движущий фактор в развитии и росте широкого спектра патофизиологических состояний, таких как злокачественные опухоли, и аберрантная экспрессия или активность EGFR идентифицирована у многих видов эпителиального рака человека. В частности, было описано, что ген EGFR амплифицируется при многих видах рака, и был описан и хорошо охарактеризован ряд мутаций, активирующих киназу в EGFR. EGFRvIII является внеклеточным мутантом домена EGFR, возникающим в результате делеции в рамке экзонов 2-7, содержащих пары оснований, кодирующей последовательности EGFR, и делает мутант неспособным связываться с лигандом. Сообщалось, что передача сигналов EGFR в опухолях с мутацией EGFRvIII является конститутивно активной, что приводит к прогрессированию опухоли. Также документально подтверждено, что лиганды, связывающиеся с членами семейства HER и активирующие их, включая EGFR, сверхэкспрессируются или участвуют в петлях аутокринной стимуляции. Кроме того, было описано, что HER2 амплифицируется геном при многих видах рака, что приводит к аутофосфорилированию рецепторов HER2 (гомодимеризация) или конститутивному активированию гетеродимеров (например, EGFR/HER2).
TKI, специфические для EGFR, были разработаны и продаются для лечения некоторых видов рака, но, как и другие противораковые лекарственные препараты, они продемонстрировали серьезные побочные эффекты. Причиной этих побочных эффектов является одновременное ингибирование активности EGFR и активности молекул, находящихся ниже, таких как MAPK, в тканях, нормальное функционирование которых зависит от передачи сигналов EGFR. Наиболее часто эти лекарственные препараты отрицательно влияют на кожу. Побочные эффекты включают сыпь, типа акне, сухость кожи, зуд, изменения ногтей и волос. Из-за важности передачи сигналов EGFR в коже, кожную токсичность зачастую описывали с помощью TKI. Возникающий в результате этого значительный физический и психосоциальный дискомфорт может привести к прерыванию или изменению дозы противоопухолевых агентов.
Если говорить конкретнее, ингибирование активности EGFR в этих сайтах может привести к аномальной пролиферации, миграции и/или дифференциации здоровых EGFR-позитивных клеток, таких как кератиноциты, и к нарушению целостности кожи с рекрутированием воспалительных клеток. Фармакологически или терапевтически опосредованная блокада передачи сигналов EGFR приводит к блокировке роста и апоптозу здоровых клеток, выживание которых зависит от EGFR. Кожа состоит из трех слоев: эпидермис - самый поверхностный слой, который покрывает дерму (обеспечивая поддержку и прочность на разрыв) и гиподерму (жировую ткань). Эпидермис состоит в основном из кератиноцитов (примерно, 90% клеток), которые экспрессируют наибольшее количество EGFR (рецептора эпидермального фактора роста) в базальном и супрабазальном слоях. Базальный слой и выпуклость волосяного фолликула содержат пролиферирующие стволовые клетки, которые дают начало терминально дифференцирующимся кератиноцитам, которые мигрируют наружу и образуют роговой слой эпидермиса, в котором безъядерные клетки образуют защитный барьер. Наружное корневое влагалище волосяного фолликула прилегает к базальному слою, разделяя биохимические свойства и высокую экспрессию EGFR.
Общепризнано, что TKI отрицательно влияют на базальные кератиноциты, что приводит к развитию кожных побочных эффектов. Было продемонстрировано, что во время терапии ингибитором, нацеленным на EGFR, уровень фосфорилирования EGFR снижался или отменялся в эпидермальных клетках, и уровень этого дефосфорилирования коррелирует со степенью токсического поражения кожи. Ингибирование EGFR в базальных кератиноцитах приводит к блокировке роста и преждевременной дифференциации. Впоследствии, ингибирование сигнальной трансдукции EGFR отрицательно влияет на EGFR-экспрессирующие клетки, такие как кератиноциты, индуцируя блокировку роста и апоптоз, уменьшая миграцию клеток, увеличивая прикрепление и дифференциацию клеток, и стимулируя воспаление, все это приводит к характерным кожным проявлениям, таким как сильная кожная сыпь. Хотя воспаление ответственно за многие признаки и симптомы, связанные с сыпью, первичным явлением, по-видимому, является медикаментозно индуцированная, индуцированная антителами или TKI-индуцированная измененная передача сигналов EGFR.
В клинических исследованиях, эффективность была связана с токсическим поражением кожи, проявлявшимся, в основном, в виде сыпи. Это относится как к mAb, нацеленному на EGFR, таким как цетуксимаб и панитумумаб, так и к TKI. В целом, многие клинические испытания фаз II и III с использованием агентов, нацеленных на EGFR, продемонстрировали связь между частотой появления сыпи, тяжестью и продолжительностью существования.
Цетуксимаб вводили еженедельно в рамках базового исследования токсичности повторных доз обезьянам в дозах 7,5, 24 и 75 мг/кг после начальной более высокой ударной дозы. Начало проявления токсического поражения кожи при приеме цетуксимаба наблюдалось через 15, 22 и 64 дня в группах с высокой, средней и низкой дозой, соответственно. Кроме того, токсическое поражение кожи наблюдалось после введения панитумумаба в течение 7-14 дней (то есть, после двух или трех доз).
Клинический опыт применения моноклонального антитела нимотузумаба предполагает, что клиническая эффективность может также сопровождаться низким профилем токсичности. При приеме нимотузумаба, типичная тяжелая дерматологическая токсичность, связанная с другими моноклональными антителами, нацеленными на EGFR, не наблюдалась, и это может быть результатом связывания, которое ограничено клетками, экспрессирующими от умеренного до высокого уровни EGFR.
Альтернативным подходом к устранению опухолевых клеток EGFR+ было использование биспецифического рекрутера T-клеток, такого как конструкции BiTE, описанные в работе Люттербюзе и др. (PNAS 2010, 107(28), стр. 12605). Однако этот тип подхода продемонстрировал, что простое изменение способа действия от блокады рецептора к элиминации клеток-мишеней посредством рекрутирования иммунных клеток и, таким образом, к уничтожению клеток-мишеней, не помогло избежать серьезных побочных эффектов, поскольку в ходе экспериментов по определению диапазона доз, измеряемых в мкг/кг/день, проводимых на яванских макаках, сразу после введения относительно низких доз было выявлено тяжелое токсическое поражение печени и почек, и эксперименты пришлось прекратить.
Краткое изложение сущности изобретения
Таким образом, задача изобретения состоит в том, чтобы предложить терапевтический агент, нацеленный на EGFR, который обладает опухолеспецифической способностью к уничтожению и оказывает сниженное воздействие на фосфорилирование или не оказывает такого воздействия вовсе, в результате чего происходит незначительное токсическое поражении кожи или такого поражения не происходит вовсе.
Эта задача решается посредством объекта, определенного в формуле изобретения.
Для подхода, применяющего нацеливание на EGFR на основе естественных клеток-киллеров (NK), предложены антигенсвязывающие белки EGFR/CD16A, демонстрирующие отсутствие или лишь незначительное ингибирующее воздействие на EGF-индуцированное фосфорилирование EGFR (Пример 6). Это предполагает, что антигенсвязывающий белок EGFR/CD16A, предложенный в настоящем документе, проявляет сниженную токсичность в тканях, тканевой гомеостаз которых зависит от передачи сигналов EGFR, например, в коже.
Воздействие на EGF-опосредованное фосфорилирование EGFR должно быть связано с первичными свойствами конкретной трехмерной структуры антигенсвязывающих белков.
Кроме того, описанный в настоящем документе антигенсвязывающий сайт для EGFR также связывается с EGFRvIII (Пример 3). Таким образом, антигенсвязывающий белок EGFR/CD16A можно использовать для лечения как EGFR-экспрессирующего рака, так и EGFRvIII-экспрессирующего рака. EGFRvIII, в отличие от EGFR, экспрессируется исключительно на раковых клетках, а не на здоровой ткани. Следовательно, с помощью описанного в настоящем документе антигенсвязывающего белка EGFR/CD16A можно нацелиться на более широкий круг EGFR- и/или EGFRvIII-позитивных опухолей и, таким образом, на более широкую популяцию пациентов.
Настоящее изобретение предлагает различные мультиспецифические, в частности, биспецифические, рекрутирующие NK-клетки антигенсвязывающие белки с различными фармакокинетическими (PK) свойствами, предназначенные для перенаправления опосредованного NK-клетками уничтожения EGFR-позитивных и/или EGFRvIII-позитивных опухолей. Различные биспецифические антигенсвязывающие белки EGFR/CD16A, нацеленные на EGFR и CD16A человека и яванского макака, были сконструированы с использованием доменов связывания антитела Fv, и различных форматов слияния антител или фрагментов антител.
Увеличенный период полужизни в сыворотке крови благоприятен для практического применения в условиях in vivo. Антигенсвязывающие белки EGFR/CD16A имеют различные периоды полужизни в сыворотке крови, включая антитела с фармакокинетическим (PK) профилем, что позволяет осуществлять их дозирование, сравнимое с антителами на основе IgG. Несмотря на увеличение периода полужизни в сыворотке крови, описанные в настоящем документе антигенсвязывающие белки Fc-слияния также ответственны за улучшенный профиль безопасности, например, за сниженное токсическое поражение кожи, по сравнению с другими видами терапии, нацеленными на EGFR, в которых предлагается конкретная трехмерная конформация выбранных антигенсвязывающих белков Bi-scFv-Fc и scFv-IgAb. Следовательно, настоящее изобретение предлагает антигенсвязывающие белки, имеющие фармакокинетический профиль, как у моноклонального антитела, но, которые дополнительно имеют улучшенный профиль безопасности.
Когда NK-клетка, посредством своего рецептора CD16A, приводится мультиспецифическим антигенсвязывающим белком в контакт с EGFR-позитивной опухолевой клеткой (посредством ее антигена EGFR), она образует иммунологический синапс, который генерирует сильный активирующий сигнал. Одновременное приведение мультиспецифического антигенсвязывающего белка в контакт с NK-клеткой, посредством ее рецептора CD16A, и с опухолевой клеткой, посредством EGFR, индуцирует активацию CD16A-опосредованных NK-клеток и образование иммунологического синапса, что приводит к поляризованному экзоцитозу литических гранул, содержащих перфорин и гранзимы, а также к экспрессии на клеточной поверхности FasL, TRAIL и TNF-α, что индуцирует гибель опухолевых клеток в результате инициации последовательности дальнейшей активности ферментов (каспазный каскад), что приводит к апоптозу опухолевых клеток (запрограммированная гибель клеток).
Таким образом, такой мультиспецифический антигенсвязывающий белок способен селективно перенаправлять NK-клеточный лизис EGFR-позитивных раковых клеток. В отличие от этого, полноразмерные антитела изотипа IgG связываются посредством своей активирующей Fc-области и ингибирующих рецепторов Fcγ, включая CD16A, CD16B (Fcγ RIIIB), CD32A (FcγRIIA), CD32B (FcγRIIB) и CD64 (FcγRI). Однако антигенсвязывающий белок, обладающий специфичностью для CD16A, селективно нацелен на активирующий подтип CD16A, который обнаруживается на NK-клетках и макрофагах, но не на нейтрофилах. Кроме того, рекрутирующий NK-клетки антигенсвязывающий белок бивалентно взаимодействует с CD16A, что приводит к более высокой аффинности, примерно, в 1000 раз, по сравнению с обычными антителами.
CD16A представляет собой активирующий рецептор, запускающий цитотоксическую активность NK-клеток. Аффинность антител к CD16A напрямую коррелирует с их способностью запускать активацию NK-клеток. Антигенсвязывающие белки обеспечиваются бивалентным связыванием с CD16A, то есть, с двумя антигенсвязывающими сайтами, что тем самым повышает аффинность из-за более высокой авидности к CD16A. Введение этих антигенсвязывающих белков не приведет к токсическому поражению (кожи) или лишь к незначительному поражению, в зависимости от следующего механизма действия:
В одном варианте осуществления настоящего изобретения, мультиспецифический антигенсвязывающий белок представляет собой биспецифическое тандемное диатело EGFR/CD16A. По своей структуре, тандемные диатела содержат только вариабельные домены Fv EGFR и антигенсвязывающие сайты CD16A и не содержат Fc-участок. Из-за отсутствия Fc-участка, они не транспортируются посредством FcRn из сосудистого пространства в интерстиций в здоровых тканях и в основном остаются в сосудистой системе. В опухолях, соответствующие уровни тандемных диател EGFR/CD16A достигаются благодаря селективной и высокой проницаемости кровеносных сосудов опухоли для макропротеинов, таких как тандемные диатела (повышенная проницаемость и эффект удержания [EPR]).
Регулярное ежедневное дозирование тандемного диатела EGFR/CD16A у яванских макак не вызывало какого-либо токсического поражения кожи. Отсутствие Fc-участка в тандемном диателе могло быть ответственно за отсутствие его переноса или за его перенос, по меньшей мере, в значительно меньшей степени в здоровые ткани посредством FcRn, по сравнению с IgG или другими Fc-содержащими фрагментами антител.
В другом варианте осуществления настоящего изобретения, мультиспецифический антигенсвязывающий белок представляет собой биспецифический антигенсвязывающий белок EGFR/CD16A, содержащий Fc-участок. Благодаря присутствию Fc-участка, он может транспортироваться в здоровые ткани посредством FcRn. Однако здоровые ткани не инфильтрируются NK-клетками в интерстициальном пространстве, что делает маловероятным опосредованное NK-клетками уничтожение здоровых EGFR-позитивных клеток. В опухолях NK-клетки присутствуют в гораздо большем количестве, и антигенсвязывающий белок, содержащий Fc-участок, достигнет соответствующих уровней, благодаря воздействию EPR, как было объяснено выше в отношении тандемных диател.
Кроме того, как было подробно описано, ингибирование сигнальной трансдукции EGFR Fc-участком, содержащим антигенсвязывающий белок EGFR/CD16A, значительно снижается, по сравнению с цетуксимабом в условиях in vitro.
Кроме того, описанные в настоящем документе антигенсвязывающие белки EGFR/CD16A продемонстрировали гиперактивность и эффективность, по сравнению с ранее известными моноклональными антителами (mAb) или другими Fc-усиленными антителами при проведении количественных анализов цитотоксичности. Эффективность выбранных антител в условиях in vivo была продемонстрирована на модели опухоли A-431 на гуманизированных мышах.
Следовательно, антигенсвязывающие белки EGFR/CD16A представляют собой потенциальные лекарственные препараты, подходящие для лечения EGFR-экспрессирующих видов рака, и они предлагают потенциально улучшенный профиль безопасности.
Включение в описание изобретения сведений посредством ссылки
Все публикации, патенты и заявки на патент, упомянутые в описании настоящего изобретения, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент были бы определенным образом и отдельно указаны для включения посредством ссылки.
Описание Фигур
На Фигуре 1 продемонстрирован IgG-подобный антигенсвязывающий белок с константными доменами тяжелой цепи CH1, CH2 и CH3 IgG1 человека. Вариабельные домены анти-CD16A включены в качестве антигенсвязывающих сайтов в N-концевую часть Fab-фрагмента IgG, а анти-EGFR scFv слит с каждым полипептидом гомодимера CH2-CH3 на С-конце (H: вариабельный домен тяжелой цепи; L: вариабельный домен легкой цепи, C: C-конец, λ: константный домен легкой цепи Cлямбда, 1: антигенсвязывающий сайт CD16A, 2: антигенсвязывающий сайт EGFR).
На Фигуре 2 продемонстрирован антигенсвязывающий белок scFv-Fc слияния с гомодимером двух полипептидов CH2-CH3. В каждом полипептиде часть scFv CD16A слита посредством шарнирной области на N-конце с CH2, а scFv анти-EGFR слит с гомодимером CH2-CH3 на C-конце (H: вариабельный домен тяжелой цепи; L: вариабельный домен легкой цепи, C: C-конец, 1: антигенсвязывающий сайт CD16A, 2: антигенсвязывающий сайт EGFR).
На Фигуре 3 продемонстрировано биспецифическое тандемное диатело EGFR/CD16A, состоящее из двух полипептидных цепей, при этом, в каждой полипептидной цепи вариабельные домены легкой цепи (L) и тяжелой цепи (H) сцеплены друг за другом посредством пептидных линкеров, и два из этих полипептидов нековалентно связаны друг с другом, образуя таким образом четырехвалентный антигенсвязывающий белок (N: N-конец; H6: гексагистидиновая метка, 1: антигенсвязывающий сайт CD16A, 2: антигенсвязывающий сайт EGFR).
На Фигуре 4 продемонстрирован триспецифический антигенсвязывающий белок aTriFlex EGFR/CD16A/HSA, состоящий из первого полипептида, содержащего на N-конце часть scFv анти-EGFR, слитую с частью диатела анти-CD16A, а на С-конце - часть scFv анти-HSA, слитую с частью диатела CD16A (H: вариабельный домен тяжелой цепи; L: вариабельный домен легкой цепи; N: N-конец; H6: гексагистидиновая метка, 1: антигенсвязывающий сайт CD16A, 2: антигенсвязывающий сайт EGFR, 3: антигенсвязывающий сайт HSA).
На Фигуре 5 продемонстрировано изображение геля SDS PAGE, визуализированное посредством технологии визуализации без окрашивания Stain-free Imaging (Bio-Rad), примененного в отношении scFv-IgAb_02 и Bi-scFv-Fc_02 после очистки.
На Фигуре 6 продемонстрировано зависящее от концентрации связывание тандемного диатела EGFR/CD16A с (A) EGFR- или (B) CD16A-антигеном.
На Фигуре 7 продемонстрировано зависящее от концентрации связывание (A) scFv EGFR/CD16A с мономерным EGFR-mFc или (B) CD16A- или CD16B-антигена с scFv-IgAb EGFR/CD16A.
На Фигуре 8 продемонстрировано зависящее от концентрации связывание (A) Bi-scFv-Fc EGFR/CD16A с мономерным EGFR-mFc или (B) CD16A- или CD16B-антигена с Bi-scFv-Fc EGFR/CD16A.
На Фигуре 9 продемонстрировано зависящее от концентрации связывание aTriFlex EGFR/CD16A с (A) EGFR- или (B) CD16A-антигеном.
На Фигуре 10 продемонстрирована оценка аффинности связывания нескольких биспецифических антигенсвязывающих белков EGFR/CD16A в присутствии и в отсутствие 10 мг/мл поликлонального IgG человека (Гамманорм) на первичных NK-клетках человека. Средняя интенсивность флуоресценции при повышении концентраций.
На Фигуре 11 продемонстрирована оценка аффинности связывания нескольких биспецифических антигенсвязывающих белков EGFR/CD16A на EGFR-экспрессирующих опухолевых клетках A-431.
На Фигуре 12 продемонстрирована цитотоксическая активность биспецифических антигенсвязывающих белков EGFR/CD16A в 4-часовых количественных анализах высвобождения кальцеина, проводимых на клетках-мишенях A-431 (A) и HCT-116 (B) с обогащенными NK-клетками человека в качестве эффекторных клеток при соотношении E:T, составляющем 5:1.
На Фигуре 13 продемонстрировано ингибирование EGF-индуцированного фосфорилирования EGFR посредством различных конструкций на основе анти-EGFR антитела и контрольных антител на клетках A-431. Фосфорилированный EGFR измеряли методом ELISA при фосфорилировании, и строили график оптической плотности при длине волны 450 нм.
На Фигуре 14 продемонстрировано ингибирование EGF-индуцированного фосфорилирования EGFR посредством различных конструкций на основе анти-EGFR антитела и контрольных антител на клетках A-431. Фосфорилированный EGFR измеряли методом ELISA при фосфорилировании, и строили график оптической плотности при длине волны 450 нм.
На фигуре 15 продемонстрировано ингибирование EGF-простимулированного фосфорилирования EGFR в клетках A-431 (Фигура 15a) и клетках A-549 (Фигура 15b). Фосфорилированный EGFR измеряли методом ELISA при фосфорилировании, и строили график оптической плотности при длине волны 450 нм.
На фигуре 16 продемонстрированы мембраны Вестерн-блоттинга образцов, простимулированных EGF в течение 5 минут. Фосфопротеины (левая панель блотов) и общий белок (правая панель блотов) изображены, соответственно.
На фигуре 17 продемонстрированы мембраны Вестерн-блоттинга образцов, простимулированных EGF в течение 15 минут. Фосфопротеины (левая панель блотов) и общий белок (правая панель блотов) изображены, соответственно.
На Фигуре 18 продемонстрировано количественное определение интенсивности полос pEGFR. Интенсивность GAPDH-сигнала соответствующей линии нормировали по интенсивности GAPDH-сигнала необработанного контроля. Интенсивность pEGFR нормировали по pEGFR необработанного контроля. Изображенная относительная интенсивность полосы соответствует нормированному pEGFR-сигналу, относительно нормированного GAPDH-сигнала. Белые столбики: стимуляция в течение 5 минут, Черные столбики: стимуляция в течение 15 минут.
На Фигуре 19 продемонстрировано количественное определение интенсивности полос pAkt. Интенсивность GAPDH-сигнала соответствующей линии нормировали по интенсивности GAPDH-сигнала необработанного контроля. Интенсивность pAkt нормировали по pAkt необработанного контроля. Изображенная относительная интенсивность полосы соответствует нормированному pAkt-сигналу, относительно нормированного GAPDH-сигнала. Белые столбики: стимуляция в течение 5 минут, Черные столбики: стимуляция в течение 15 минут.
На Фигуре 20 продемонстрировано количественное определение интенсивности полос pErk. Интенсивность GAPDH-сигнала соответствующей линии нормировали по интенсивности GAPDH-сигнала необработанного контроля. Интенсивность pErk нормировали по pErk необработанного контроля. Изображенная относительная интенсивность полосы соответствует нормированному pErk-сигналу, относительно нормированного GAPDH-сигнала. Белые столбики: стимуляция в течение 5 минут, Черные столбики: стимуляция в течение 15 минут.
На Фигуре 21 продемонстрировано scFv-IgAb_02-индуцированное высвобождение IL-6 посредством PBMC при кокультивировании с клетками EGFR+ A-431. Указано время инкубации кокультивирования в присутствии или в отсутствие возрастающих концентраций scFv_IgAb_02. Фоновый уровень высвобождения IL-6 в отсутствие клеток-мишеней A-431 указан под графиком.
На Фигуре 22 продемонстрировано scFv-IgAb_02-индуцированное высвобождение TNF-α посредством PBMC при кокультивировании с клетками EGFR+ A-431. Указано время инкубации кокультивирования в присутствии или в отсутствие возрастающих концентраций scFv_IgAb_02. Фоновый уровень высвобождения TNF-α в отсутствие клеток-мишеней A-431 указан под графиком.
На Фигуре 23 продемонстрировано scFv-IgAb_02-индуцированное высвобождение IFN-γ посредством PBMC при кокультивировании с клетками EGFR+ A-431 после 4-часового кокультивирования. Фоновый уровень высвобождения IFN-γ в отсутствие клеток-мишеней A-431 указан под графиком.
На Фигуре 24 продемонстрированы активированные NK-клетки после 24-часового кокультивирования PBMC с scFv-IgAb_02 в присутствии или в отсутствие клеток EGFR+ A-431. scFv-IgAb_02 индуцировал повышение количества активированных NK-клеток CD56+, экспрессирующих CD69 и CD25 в культурах PBMC (A) и клеток PBMC+A-431 (B).
На Фигуре 25 продемонстрированы активированные NK-клетки после 48-часового кокультивирования PBMC с scFv-IgAb_02 в присутствии или в отсутствие клеток EGFR+ A-431. scFv-IgAb_02 индуцировал повышение количества активированных NK-клеток CD56+, экспрессирующих CD69 и CD25 в культурах PBMC (A) и клеток PBMC+A-431 (B).
На Фигуре 26 продемонстрирован рост опухоли с Дня 7 по День 35 в профилактическом исследовании, проведенном компанией Transcure.
На Фигуре 27 продемонстрирован рост опухоли в профилактическом исследовании, проведенном компанией Transcure.
Фигура 28: Воздействие RSV-EGFR и различных концентраций scFv-IgAB_02 на рост опухоли A431 в профилактических (A) и терапевтических (B) схемах.
Условные обозначения: Среднее значение ± стандартное отклонение (SD) роста опухоли представлено для каждой группы. N=7-8 на терапевтические группы, N=12 на профилактические группы.
На Фигуре 29 продемонстрирована профилактическая группа, участвующая в исследовании, проведенном компанией Transcure. В ходе проведения исследования роста опухоли, scFv-IgAb_02 и контрольную конструкцию на основе антитела RSV/EGFR вводили, как описано в прилагаемом примере 11.
На Фигуре 30 продемонстрирована терапевтическая группа, участвующая в исследовании, проведенном компанией Transcure. Наблюдалось значительное снижение роста опухоли при лечении 10 мг/кг scFv-IgAb_02 и контрольной конструкцией на основе антитела RSV/EGFR.
На Фигуре 31 продемонстрированы результаты распределения в тканях scFv-IgAb_02, как описано в примере 13. Процент восстановленного исследуемого препарата (ID) (% ID/г) в крови и органах/тканях, собранных после внутривенного введения 125I-scFv-IgAB_02 мышам с ксенотрансплантатом A431.
На Фигуре 32 продемонстрировано соотношение Опухоль/Орган после внутривенного введения 125I-scFv-IgAB_02 мышам с ксенотрансплантатом A431, как описано в примере 13.
На Фигуре 33 продемонстрированы ауторадиограммы всего тела мышей, умерщвленных через 336 часов (14 дней) после внутривенного введения 125I-scFv-IgAB_02, как подробно описано в прилагаемом примере 13.
На Фигуре 34 продемонстрированы уровни IL-6 в сыворотке крови отдельных животных, наблюдаемых в токсикологическом исследовании, описанном в прилагаемом примере 14.
Подробное описание изобретения
Настоящее изобретение относится к мультиспецифическому, например, биспецифическому антигенсвязывающему белку, содержащему антигенсвязывающие сайты для EGFR и CD16A.
Термин «мультиспецифический» относится к антигенсвязывающему белку, содержащему антигенсвязывающие сайты, которые связываются, по меньшей мере, с двумя различными мишенями, то есть, с различными антигенами. Термин «мультиспецифический» включает, но этим не ограничивается, термины: биспецифический, триспецифический и тетраспецифический. Антигенсвязывающий белок связывается, по меньшей мере, специфически с антигенами EGFR и CD16A и, таким образом, является, по меньшей мере, биспецифическим. В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающая молекула может содержать третью специфичность по отношению к третьему антигену. Например, третья специфичность может представлять собой антигенсвязывающий участок, специфический для сывороточного альбумина, в частности, человеческого сывороточного альбумина (HSA). Примером триспецифического антигенсвязывающего белка является четырехвалентный aTriFlex, описанный ниже, который содержит антигенсвязывающий сайт, специфический для EGFR, два антигенсвязывающих сайта, специфических для CD16A, и один антигенсвязывающий сайт, специфический для HSA. В других вариантах осуществления настоящего изобретения, третья специфичность может представлять собой второй опухолевый антиген для создания двойного антигенсвязывающего белка, нацеленного на опухоль, например, антигенсвязывающий белок может содержать, по меньшей мере, один дополнительный антигенсвязывающий сайт для второго опухолевого антигена, например, HER2, HER3, HER4, c-MET, AXL, FGFR4, VEGF-A, HGF.
Термин «антигенсвязывающий белок» относится к производному иммуноглобулина (Ig) с антигенсвязывающими свойствами. В предпочтительном варианте осуществления настоящего изобретения, антигенсвязывающий белок является белком человека или гуманизированным белком. То есть, антигенсвязывающий белок состоит в основном из последовательностей из зародышевой линии Ig человека. Если антигенсвязывающий белок является белком человека или гуманизированным белком, он может содержать единичные нечеловеческие остатки или нечеловеческие участки, например, в CDR, линкерах или включенные посредством мутаций. Ig представляет собой мультимерный белок, состоящий из двух идентичных полипептидов легкой цепи (L) и двух идентичных полипептидов тяжелой цепи (H), которые соединены в комплекс ковалентными межцепочечными дисульфидными связями. На N-концевом участке вариабельный домен легкой цепи (VL) связывается с вариабельным доменом (VH) тяжелой цепи (H) с образованием антигенсвязывающего сайта Ig, Fv. Кроме того, каждая из легкой (L) и тяжелой (H) цепей имеет постоянную область. Таким образом, легкие (L) цепи имеют один вариабельный (VL) домен и один константный (CL) домен, например, лямбду или каппу, а тяжелые цепи (H) имеют три константных домена, обозначенных как CH1, CH2 и CH3. Таким образом, тяжелые (H) цепи имеют один вариабельный (VH) домен и три константных домена (CH1, CH2, CH3). Тяжелая (H) цепь также может быть разделена на три функциональные части: Fd-область, содержащую VH и CH1, шарнирную область и Fc-участок, содержащий полипептидную цепь CH2-CH3. Fc-участок ответственен за эффекторные функции, такие как антителозависимая клеточно-опосредованная цитотоксичность (ADCC), комплемент-зависимая цитотоксичность (CDC), антителозависимый клеточный фагоцитоз (ADCP) и связывание с рецепторами Fc, и обеспечивает пролонгированный период полужизни в условиях in vivo (посредством связывания с неонатальным рецептором Fc (FcRn)) относительно полипептида, лишенного Fc-участка. Кроме того, в IgG гомдимер двух полипептидных цепей CH2-CH3, связанных друг с другом, образует Fc-область антитела. Антигенсвязывающий белок содержит иммунологически функциональный участок иммуноглобулина, способный связываться с антигеном-мишенью.
Иммунологически функциональный участок иммуноглобулина может содержать участки иммуноглобулинов (например, Fv, Fab), пептиды слияния, полученные из участков иммуноглобулина, или конъюгаты, объединяющие участки иммуноглобулина, которые образуют антигенсвязывающий сайт. В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий сайт является частично или полностью сайтом человека или гуманизированным сайтом. Связывающий белок содержит антигенсвязывающие сайты, которые представляют собой области, участки или домены связывающего белка, которые связываются с антигенами-мишенями. Каждый антигенсвязывающий сайт содержит, по меньшей мере, CDR иммуноглобулина тяжелой или легкой цепей, из которых был получен антигенсвязывающий сайт. Термин «антигенсвязывающий белок» относится, в некоторых вариантах осуществления настоящего изобретения, к производным антител или к антителоподобным связывающим белкам, которые сохраняют специфичность и аффинность к своему антигену, включая, например, IgG-подобные или не-IgG-подобные пептиды слияния на основе антигенсвязывающих сайтов, слитых с Fc-участком из любого класса Ig, в частности, из подкласса IgG, такого как, IgG1, содержащего, по меньшей мере, CH2, в некоторых вариантах осуществления настоящего изобретения - полипептидную цепь CH2-CH3, в частности, гомодимер двух полипептидных цепей CH2-CH3. Константная область может содержать полную константную область Ig, то есть, CH1-Шарнир-CH2-CH3 или только Fc-участок, то есть, домены CH2-CH3, например, scFv-IgAb, Bi-scFv-Fc или Fc-scFv, как описано в настоящем документе. В других вариантах осуществления настоящего изобретения, антигенсвязывающий белок относится к производным антител на основе доменов Fv либо без дополнительных константных доменов, либо с ними, например, фрагменты Fv, одноцепочечный Fv, тандемный одноцепочечный Fv ((scFv)2), Би-специфические рекрутеры NK-клеток (BiKE), переориентирующиеся антитела с двойной аффинностью (DARTTM), диатело, одноцепочечное диатело и тандемное диатело (TandAb®); aTriFlex, триатело, триотело или Три-специфические рекрутеры NK-клеток (TriKE). Разнообразие каркасов антигенсвязывающих белков рассматривается в работе Бринкманн и Контерманн, mAbs, 2017, 9(2):182-192 или в работе Списс и др., 2015, Molecular Immunology, 67:95-106.
Термин «антигенсвязывающий сайт» относится к объединенному сайту антитело-антиген или к паратопу антигенсвязывающего белка, который связывается, в частности специфически, с антигенной детерминантой (эпитопом) антигена. Антигенсвязывающий сайт может представлять собой сайт человека или гуманизированный сайт. Антигенсвязывающий сайт представляет собой связывающий участок антигенсвязывающего белка, который способен распознавать антиген и специфически связывается с антигеном. Антигенсвязывающий сайт содержит вариабельные домены как легкой (VL), так и тяжелой (VH) цепей, которые объединяются с антигеном, то есть, связываются с эпитопом антигена. В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий сайт может представлять собой одиночный домен (sdAb), например, фрагменты VHH верблюдовых или фрагменты VNAR хрящевых рыб.
Каждый антигенсвязывающий сайт образован антителом, то есть, иммуноглобулином, вариабельным доменом тяжелой цепи (VH) антитела и вариабельным доменом легкой цепи (VL) антитела, связывающимися с одним и тем же эпитопом, в свою очередь вариабельный домен тяжелой цепи (VH) содержит три области, определяющие комплементарность тяжелой цепи (CDR): HCDR1, HCDR2 и HCDR3; а вариабельный домен легкой цепи (VL) содержит три области, определяющие комплементарность легкой цепи (CDR): LCDR1, LCDR2 и LCDR3. Вариабельные домены тяжелой и легкой цепей антигенсвязывающего сайта могут быть ковалентно сцеплены друг с другом, например, пептидным линкером, или они могут нековалентно связываться друг с другом с образованием антигенсвязывающего сайта Fv.
«Одноцепочечный вариабельный фрагмент антитела» или «scFv» содержит антигенсвязывающий сайт, состоящий из вариабельного домена тяжелой цепи (VH), присоединенного посредством пептидного линкера к вариабельному домену легкой цепи (VL). scFv может представлять собой полипептидную цепь: VL-Линкер-VH или VH-Линкер-VL, находящийся на конце от N- до C-конца полипептидной цепи, (Хьюстон и др., Proc. Natl. Acad.Sci. США, 1988, 85:5879-83).
«Антигенсвязывающий (Fab) фрагмент» или «Fab» содержит один константный (CH1, CL) и один вариабельный домен (VH, VL) каждой из тяжелой (H) и легкой (L) цепей, при этом, вариабельные домены VH и VL связаны с антигенсвязывающим сайтом. Два Fab'-фрагмента присоединены как F(ab')2-фрагмент на N-конце к Fc-участку посредством Шарнирной области.
«Линкер» представляет собой пептид, который сцепляет другие пептиды. Обычно пептидный линкер содержит от 1 до, примерно, 50, в предпочтительном варианте осуществления настоящего изобретения - до, примерно, 30, в наиболее предпочтительном варианте осуществления настоящего изобретения - до, примерно, 20 аминокислот. Длина линкеров влияет на гибкость полипептидной цепи. Желаемая гибкость зависит от плотности антигена-мишени и доступности антигена-мишени. Более длинные линкеры обеспечивают более подвижные антигенсвязывающие сайты. Если линкер, соединяющий домены VH и VL, состоит из, по меньшей мере, примерно, 12 аминокислотных остатков, полипептид может складываться по системе «голова к хвосту» и образовывать scFv. В некоторых вариантах осуществления настоящего изобретения, линкер доменов VH и VL в scFv состоит из от, примерно, 15 до, примерно, 25, в предпочтительном варианте осуществления настоящего изобретения - от, примерно, 15 до, примерно, 20, например, из 18 аминокислот. Укорочение линкера до, примерно, 12 или менее аминокислотных остатков обычно предотвращает взаимодействие соседних доменов одной и той же полипептидной цепи друг с другом. Однако такие линкеры можно использовать для слияния scFv с Fc-участком. В конкретном варианте осуществления настоящего изобретения, scFv непосредственно слит с Fc-участком посредством пептидной связи. Что касается аминокислотного состава линкеров, в некоторых вариантах осуществления настоящего изобретения, выбраны пептиды, которые не препятствуют сборке антигенсвязывающего сайта. Например, линкеры, содержащие остатки глицина и серина, обычно обеспечивают гибкость и устойчивость к протеазам. В некоторых вариантах осуществления настоящего изобретения, линкер содержит аминокислотную последовательность (GaSb)c, при этом, a=1-5, b=1-3 и c=1-8. В конкретных вариантах осуществления настоящего изобретения, линкер может содержать аминокислотную последовательность (GGS)x, при этом, x=1-8, или (GGGGS)y, при этом, y=1-5.
Термин «полипептид» или «полипептидная цепь» относится к полимеру аминокислотных остатков, сцепленных амидными связями. Полипептидная цепь, в предпочтительном варианте осуществления настоящего изобретения, представляет собой одноцепочечный белок слияния, который не является разветвленным. Антигенсвязывающий белок содержит, по меньшей мере, две полипептидные цепи. Такой антигенсвязывающий белок представляет собой мультимер, например, димер, тример или тетрамер. В некоторых вариантах осуществления настоящего изобретения, где речь идет о тандемном диателе или о Bi-scFv-Fc, антигенсвязывающий белок представляет собой гомодимер и состоит из двух идентичных полипептидных цепей. В других вариантах осуществления настоящего изобретения, антигенсвязывающий белок представляет собой гетеродимер, такой как aTriFlex, или гетеротетрамер, такой как scFv-IgAb.
Антигенсвязывающий сайт специфически связывается с EGFR или CD16A.
«EGFR» относится к рецептору эпидермального фактора роста (EGFR; ErbB-1; HER1 у человека, включая все изоформы или варианты, описанные с активационными мутациями и вовлеченные в патофизиологические процессы. Антигенсвязывающий сайт EGFR распознает эпитоп во внеклеточном домене EGFR. В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий сайт специфически связывается с EGFR человека и яванского макака.
EGFRvIII относится к мутанту внеклеточного домена EGFR, возникающему в результате делеции в рамке экзонов 2-7, содержащих пары оснований, кодирующей последовательности EGFR (Гэн Х. К. и др., FEBS 2013, 280:5350-5370).
В конкретном варианте осуществления настоящего изобретения, антигенсвязывающий сайт для EGFR содержит вариабельный домен тяжелой и легкой цепей, специфический для EGFR, при этом, (i) вариабельный домен тяжелой цепи (VH), специфический для EGFR, содержит CDR1 тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:21; CDR2 тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:22; CDR3 тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:23, а вариабельный домен легкой цепи (VL), специфический для EGFR, содержит CDR1 легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:24; CDR2 легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:25; и CDR3 легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:26; или
(ii) вариабельный домен тяжелой цепи (VH), специфический для EGFR, имеет аминокислотную последовательность, представленную в SEQ ID NO:1; и/или
(iii) вариабельный домен легкой цепи (VL), специфический для EGFR, имеет аминокислотную последовательность, представленную в SEQ ID NO:2.
Антигенсвязывающий сайт для EGFR также связывается с EGFRvIII (Пример 3). Таким образом, использование этого антигенсвязывающего сайта в терапевтических целях позволяет лечить как EGFR-экспрессирующий рак, так и EGFRvIII-экспрессирующий рак. EGFRvIII, в отличие от EGFR, экспрессируется исключительно на раковых клетках, а не на здоровой ткани. Другие виды терапии, нацеленные на EGFR, могут быть менее эффективными при EGFRvIII-позитивных видах рака из-за повышенной онкогенности и конститутивной активации сигнального пути EGFR в результате воздействия EGFRvIII.
Термин «CD16A» относится к активирующему рецептору CD16A, также известному как FcγRIIIA, экспрессированному на клеточной поверхности NK-клеток. CD16A представляет собой активирующий рецептор, запускающий цитотоксическую активность NK-клеток. Аффинность антител к CD16A напрямую коррелирует с их способностью запускать активацию NK-клеток, таким образом, более высокая аффинность к CD16A снижает дозу антител, необходимую для активации. Антигенсвязывающий сайт антигенсвязывающего белка связывается с CD16A, а не с CD16B. Например, антигенсвязывающий сайт, содержащий вариабельные домены тяжелой (VH) и легкой (VL) цепей, связывающийся с CD16A, но не связывающийся с CD16B, может быть обеспечен посредством антигенсвязывающего сайта, который специфически связывается с эпитопом CD16A, который содержит аминокислотные остатки С-концевой последовательности SFFPPGYQ (SEQ ID NO:3) и/или остатки G130, и/или Y141 CD16A (SEQ ID NO:4), которые не присутствуют в CD16B.
В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий сайт CD16A содержит вариабельный домен тяжелой и легкой цепей, специфический для CD16A, при этом, (i) вариабельный домен тяжелой цепи (VH), специфический для CD16A, содержит CDR1 тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:5; CDR2 тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:6 или 11; CDR3 тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:7, а вариабельный домен легкой цепи (VL), специфический для CD16A, содержит CDR1 легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:8; CDR2 легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:9; и CDR3 легкой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:10; или
(ii) вариабельный домен тяжелой цепи (VH), специфический для CD16A, имеет аминокислотную последовательность, представленную в SEQ ID NO:12 или 14; и/или
(iii) вариабельный домен легкой цепи (VL), специфический для CD16A, имеет аминокислотную последовательность, представленную в SEQ ID NO:13.
Этот антигенсвязывающий сайт для CD16A не связывается с CD16B, а связывается с известными аллотипами CD16A, F158 и V158, с аналогичной аффинностью. Два аллельных однонуклеотидных полиморфизма были идентифицированы в CD16A человека, у которых изменена аминокислота в положении 158, что важно для взаимодействия с шарнирной областью IgG. Частота аллелей у гомозиготного 158 F/F и гетерозиготного 158 V/F аллелей у Европеоидной популяции схожа и составляет от 35 до 52% или от 38 до 50%, соответственно, тогда как частота гомозиготного 158 V/V аллеля составляет только 10-15% (Лопез-Эскамез Дж. А. и др.; BMC Med Genet 2011;12:2). Следовательно, активация NK-клеток этим доменом анти-CD16A у всех пациентов, благодаря сходной аффинности, является предпочтительной. Дополнительные антигенсвязывающие сайты CD16A, содержащие вариабельные домены тяжелой и легкой цепей, которые связываются с CD16A, а не с CD16B, описаны в документе WO 2006/125668.
В альтернативных вариантах осуществления настоящего изобретения, домены тяжелой и легкой цепей включают иммунологически активные гомологи или варианты CDR, или каркасные последовательности, описанные в настоящем документе. Соответственно, в некоторых вариантах осуществления настоящего изобретения, последовательность CDR в домене тяжелой или легкой цепи, который связывается с CD16A или EGFR, подобна, но не идентична, аминокислотной последовательности, представленной в SEQ ID NO:5-11 или 21-26. В некоторых случаях, вариант последовательности CDR имеет идентичность последовательностей, составляющую 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81% или 80%, по сравнению с последовательностью 5-11 или 21-26, и которая является иммунологически активной.
В других случаях, вариант последовательности CDR модифицируют для изменения некритических остатков или остатков в некритических областях. Аминокислоты, которые не являются критическими, можно идентифицировать известными методами, такими как созревание аффинности, CDR-ходящий мутагенез, сайт-направленный мутагенез, кристаллизация, ядерный магнитный резонанс, фотоаффинное мечение или аланин-сканирующий мутагенез.
Антигенсвязывающий белок является многовалентным. Термин «многовалентный» относится к, по меньшей мере, двум присутствующим антигенсвязывающим сайтам, например, 2, 3, 4, 5, 6 или более. Естественное антитело IgG имеет два сайта связывания и является бивалентными. Мультиспецифический антигенсвязывающий белок имеет, по меньшей мере, четыре антигенсвязывающих сайта и является, по меньшей мере, четырехвалентным. В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий белок имеет два антигенсвязывающих сайта для EGFR и два антигенсвязывающих сайта для CD16A, то есть, антигенсвязывающий белок связывается бивалентно с EGFR и бивалентно с CD16A.
В одном варианте осуществления настоящего изобретения, каркас антигенсвязывающего белка EGFR/CD16A обеспечивается тандемным диателом (Фигура 3). Термин «тандемное диатело» относится к антигенсвязывающему белку, сконструированному путем сцепления, по меньшей мере, четырех вариабельных доменов (двух вариабельных доменов тяжелой цепи (VH) и двух вариабельных доменов легкой цепи (VL)) в одном полипептиде, который связан с другим идентичным полипептидом с образованием антигенсвязывающего гомодимера. В таких тандемных диателах длина линкера такова, что он предотвращает внутримолекулярное спаривание вариабельных доменов, в результате чего полипептидная цепь не может сложиться обратно на себя с образованием мономерного одноцепочечного белка, а скорее вынуждена спариваться с комплементарными доменами другой цепи. Вариабельные домены также расположены таким образом, что соответствующие вариабельные домены спариваются во время этой димеризации (Вайхель и др., 2015, European Pharmaceutical Review, 20(1):27-32). Следовательно, тандемное диатело представляет собой антигенсвязывающий белок, при этом, в каждой полипептидной цепи вариабельные домены сцеплены друг за другом посредством пептидных линкеров L1, L2 и L3 и расположены в пределах каждой из двух полипептидных цепей от N-конца до C-конца в следующем порядке:
(i) VH-L1-VL-L2-VH-L3-VL, или
(ii)VL vl-L1-VH-L2-VL-L3-VH,
В конкретном варианте осуществления настоящего изобретения, вариабельные домены в центре полипептидной цепи, сцепленные посредством линкера L2, являются специфическими для CD16A, а периферические домены на N- и C-конце, соответственно, являются специфическими для EGFR. В таком варианте осуществления настоящего изобретения, вариабельные домены расположены в пределах каждой полипептидной цепи от N-конца до C-конца в следующем порядке:
(i) VH(EGFR)-L1-VL(CD16A)-L2-VH(CD16A)-L3-VL(EGFR), или
(ii)VL(EGFR)-L1-VH(CD16A)-L2-VL(CD16A)-L3-VH(EGFR),
В предпочтительном варианте осуществления настоящего изобретения, вариабельные домены расположены в следующем порядке: (i) VH (EGFR)-L1-VL(CD16A)-L2-VH(CD16A)-L3-VL(EGFR).
Согласно опубликованным исследованиям, длина линкеров влияет на гибкость такого мультиспецифического антигенсвязывающего белка. Длина пептидных линкеров L1, L2 и L3 в тандемном диателе - «короткая», то есть, состоит из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 аминокислотных остатков, которые вариабельные домены полипептидной цепи связывают межмолекулярным образом с доменами другого полипептида с образованием тандемного диатела. Таким образом, в некоторых случаях линкеры состоят из, примерно, 12 или менее аминокислотных остатков, например, из 3-12, 3-10 или 3-9 аминокислотных остатков.
После экспрессии из одиночной генетической конструкции две идентичные полипептидные цепи складываются по системе «голова к хвосту» с образованием функционального нековалентного гомодимера с молекулярной массой, составляющей, примерно, 105 кДа. Несмотря на отсутствие межмолекулярных ковалентных связей, гомодимер очень стабилен после образования, остается интактным и не возвращается обратно в мономерную форму. Тандемные диатела содержат только вариабельные домены антител и не имеют константных доменов. Тандемные диатела позволяют осуществлять бивалентное связывание с CD16A и бивалентное связывание с EGFR. Размер тандемного диатела, составляющий, примерно, 105 кДа - меньше, чем у IgG, но он намного выше порога для первого прохождения почечного клиренса, предлагая фармакокинетическое преимущество, по сравнению с меньшими биспецифическими форматами на основе антителосвязывающих доменов или каркасов не антител. Кроме того, тандемные диатела имеют преимущество перед другими биспецифическими связывающими белками, такими как молекулы BiTE® или DARTTM, поскольку имеют такие фармакокинетические свойства и авидность, которые приводит к более длительным первичным периодам полужизни и повышенной цитотоксичности. Тандемные диатела хорошо экспрессируются в клетках-хозяевах, например, в клетках СНО млекопитающих. Предполагается, что для тандемных диател доступен надежный процесс их получения, проходящий выше и ниже.
В другом варианте осуществления настоящего изобретения, антигенсвязывающий белок представляет собой асимметричное, триспецифическое гибкое тело (aTriFlex), как описано в документе WO 2017/064221. Такой aTriFlex представляет собой димер первого полипептида, содержащего, по меньшей мере, шесть вариабельных доменов, и второго полипептида, содержащего, по меньшей мере, два вариабельных домена (Фигура 4). В таком варианте осуществления настоящего изобретения, второй полипептид является частью молекулы диатела, и, в предпочтительном варианте осуществления настоящего изобретения, она нековалентно связана с другой парой двух прилежащих вариабельных доменов, интегрированных в первый полипептид. В вариантах осуществления настоящего изобретения, где первая полипептидная цепь состоит из шести вариабельных доменов, а второй полипептид состоит из двух вариабельных доменов, вариабельные домены могут быть расположены от N-конца до С-конца полипептидов, например, в следующих ориентациях: VH-VL-VH-VH-VL-VH (первый полипептид) и VL-VL (второй полипептид); VL-VH-VH-VH-VH-VL (первый полипептид) и VL-VL (второй полипептид); VH-VL-VL-VL-VH-VL (первый полипептид) и VH-VH (второй полипептид); VL-VH-VL-VL-VH-VL (первый полипептид) и VH-VH (второй полипептид) или VH-VL-VL-VL-VL-VH (первый полипептид) и VH-VH (второй полипептид). Молекулы диатела, имеющие одну пару из двух вариабельных доменов в ориентации VH-VH и другую пару из двух вариабельных доменов в ориентации VL-VL, способствуют правильному складыванию, в частности, мультиспецифических, например, триспецифических, молекул антитела. В предпочтительных вариантах осуществления настоящего изобретения, вариабельные домены, специфические для CD16A, расположены в центре первой полипептидной цепи, состоящей из шести вариабельных доменов, а второй полипептид состоит из комплементарных вариабельных доменов, специфических для CD16A. Такой aTriFlex является четырехвалентным, биспецифическим или триспецифическим. В одном из вариантов осуществления настоящего изобретения, aTriFlex является триспецифическим и содержит один антигенсвязывающий сайт для EGFR, два антигенсвязывающих сайта для CD16A и один антигенсвязывающий сайт для HSA (человеческий сывороточный альбумин). В конкретном варианте осуществления настоящего изобретения, aTriFlex состоит из первой полипептидной цепи, имеющей вариабельные домены, расположенные в следующем порядке: (i) VH(EGFR)-VL(EGFR)-VL(CD16A)-VL(CD16A)-VH(HSA)-VL(HSA) и второй полипептидной цепи, имеющей вариабельные домены, расположенные в следующем порядке: VH(CD16A)-VH(CD16A) или (ii) VH(EGFR)-VL(EGFR)-VH(CD16A)-VH(CD16A)-VH(HSA)-VL(HSA), и второй полипептидной цепи, имеющей вариабельные домены, расположенные в следующем порядке: VL(CD16A -VL(CD16A). Генерация и продуцирование такого антигенсвязывающего белка aTriFlex описаны в документе WO 2017/064221.
В дополнительных вариантах осуществления настоящего изобретения, антигенсвязывающий белок представляет собой белок Fc-слияния, содержащий константные домены иммуноглобулина, а именно, иммуноглобулина, выбранного из классов IgG, IgM, IgA, IgD и IgE, и scFv, содержащие антигенсвязывающие сайты, прикрепленные к ним. Предпочтительными являются константные домены IgG, в частности, IgG1. Следовательно, в некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий белок Fc-слияния содержит Fc-участок. Из-за связывания Fc-участка с FcRn, период полужизни в сыворотке крови антигенсвязывающего белка Fc-слияния значительно увеличивается, по сравнению с антигенсвязывающими белками на основе Fv-домена, такими как, например, тандемное диатело или aTriFlex.
Термин «антигенсвязывающий белок Fc-слияния» относится к антигенсвязывающим белкам, содержащим комбинацию Fc-участка иммуноглобулина и, по меньшей мере, одного антигенсвязывающего сайта, слитого на N-конце и/или C-конце с Fc-участком. Настоящее изобретение предлагает мультиспецифический и, по меньшей мере, четырехвалентный антигенсвязывающий белок Fc-слияния, имеющий два антигенсвязывающих сайта, прикрепленных к N-концам, и два антигенсвязывающих сайта, прикрепленных к C-концам Fc-участка. Два антигенсвязывающих сайта, прикрепленные к N-концам, могут представлять собой антигенсвязывающие Fab'-фрагменты или scFv'-фрагменты, присоединенные посредством Шарнирного домена к N-концу CH2 Fc-участка. Каждый из двух антигенсвязывающих сайтов, размещенных на C-концах, представляет собой scFv, слитый посредством пептидного линкера с C-концами CH3 Fc-участка. В некоторых вариантах осуществления настоящего изобретения, два антигенсвязывающих сайта, размещенные на N-концах Fc-участка, являются специфическими для первого антигена, а два антигенсвязывающих сайта, размещенных на C-концах, являются специфическими для второго антигена. Следовательно, четырехвалентная антигенсвязывающая молекула связывается бивалентно с первым антигеном и бивалентно со вторым антигеном, в свою очередь, это двухвалентное связывание повышает авидность и, таким образом, аффинность связывания с каждым из двух антигенов. В конкретном варианте осуществления настоящего изобретения, антигенсвязывающие сайты, размещенные на N-концах Fc-участка, являются специфическими для CD16A, а антигенсвязывающие сайты, размещенных на C-концах Fc-участка, являются специфическими для EGFR.
Термин «Fc-участок» относится к полипептиду, сохраняющему, по меньшей мере, одну функциональность Fc-области константной области Ig, в частности, функцию связывания с FcRn, и содержит, по меньшей мере, домен CH2, в предпочтительном варианте осуществления настоящего изобретения - полипептидную цепь CH2-CH3. Полипептидная цепь CH2-CH3 собирается с другой полипептидной цепью CH2-CH3 в гомодимер двух полипептидов CH2-CH3, объединенных друг с другом, при этом, димеризация продвигается С-концом Шарнирной области к домену CH2. Следовательно, в некоторых вариантах осуществления настоящего изобретения, Fc-участок содержит гомодимер двух полипептидных цепей CH2-CH3 и Шарнирную область. В предпочтительном варианте осуществления настоящего изобретения, Fc-участок содержит константные домены класса IgG, в частности, константные домены IgG1.
Кроме того, «Шарнирный домен» может быть присоединен на N-конце к Fc-участку. Шарнирный домен может принадлежать к одному и тому же или другому классу IgG, что и Fc-участок, или он может являться сконструированным, не встречающимся в природе Шарнирным доменом.
Такие антигенсвязывающие белки Fc-слияния могут быть сгенерированы путем модульного объединения антигенсвязывающих сайтов для CD16A и EGFR с, в предпочтительном варианте осуществления настоящего изобретения - Fc-участком IgG1, в результате чего два антигенсвязывающих сайта сливаются либо как Fab-фрагмент, либо как scFv посредством Шарнирного домена на N-конце с Fc-участком, а два антигенсвязывающих сайта scFv сливаются на C-конце с Fc-участком, тем самым обеспечивая биспецифические и четырехвалентные антигенсвязывающие белки.
В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий белок Fc-слияния представляет собой scFv-IgAb (Фигура 1) или Bi-scFv-Fc (Фигура 2).
Следовательно, в другом варианте осуществления настоящего изобретения, мультиспецифический антигенсвязывающий белок представляет собой четырехвалентный и биспецифический белок Fc-слияния (Bi-scFv-Fc) (Фигура 2), содержащий гомодимер двух полипептидов CH2-CH3, и каждый из двух полипептидов CH2-CH3 слит на N-конце и C-конце с scFv, содержащим вариабельной домен тяжелой цепи (VH) и вариабельной домен легкой цепи (VL), ковалентно присоединенные гибким линкером для образования антигенсвязывающего сайта scFv. Следовательно, такой антигенсвязывающий белок Bi-scFv-Fc состоит из двух полипептидных цепей, и каждый полипептид содержит первый одноцепочечный Fv (scFv(1)), состоящий из VL, сцепленного посредством пептидного линкера с VH первого антигенсвязывающего сайта, причем scFv(1) слит посредством шарнирной области на N-конце с доменом CH2 полипептидной цепи CH2-CH3, и второй одноцепочечный Fv (scFv(2)), состоящий из VL, сцепленного посредством пептидного линкера с VH второго антигенсвязывающего сайта, который слит посредством пептидного линкера на С-конце с доменом СН3 полипептидной цепи СН2-СН3. Таким образом, такой антигенсвязывающий белок Bi-scFv-Fc состоит из двух полипептидных цепей, имеющих структуру от N-конца до С-конца: scFv(1)-Шарнир-CH2-CH3-scFv(2). В частности, (i) scFv(1) представляет собой антигенсвязывающий сайт для CD16A, а scFv(2) представляет собой антигенсвязывающий сайт для EGFR, или (ii) scFv(1) представляет собой антигенсвязывающий сайт для EGFR, а scFv(2) представляет собой антигенсвязывающий сайт для CD16A. В предпочтительном варианте осуществления настоящего изобретения, Fc-участок, состоящий из гомодимера CH2-CH3, выключен, то есть, по существу не связывается с рецептором Fc-гамма, но сохраняет связывание с FcRn. В конкретном варианте осуществления настоящего изобретения, антигенсвязывающий белок содержит константные домены тяжелой цепи CH2-CH3, имеющие аминокислотную последовательность, представленную в SEQ ID NO:20.
В другом варианте осуществления настоящего изобретения, мультиспецифическая антигенсвязывающая молекула Fc-слияния представляет собой четырехвалентный и биспецифический антигенсвязывающий белок scFv-Ig (scFv-IgAb; Фигура 1). Такой scFv-IgAb состоит из IgG, в предпочтительном варианте осуществления настоящего изобретения - из IgG1, каркаса и двух scFv, слитых с ним на С-конце. Следовательно, такой scFv-IgAb собран из двух тяжелых (H) и двух легких (L) цепей. Тяжелая (H) цепь состоит из вариабельного домена тяжелой цепи (VH), присоединенного на С-конце к домену CH1, который сцеплен посредством Шарнирной области на С-конце с полипептидной цепью CH2-CH3, а домен CH3 слит с scFv, содержащим антигенсвязывающий сайт, имеющий вариабельный домен легкой цепи (VL), сцепленный посредством гибкого линкера с вариабельным доменом тяжелой цепи (VH). Легкая (L) цепь состоит из вариабельного домена легкой цепи (VL), присоединенного к константному домену легкой цепи (CL), такому как константный домен легкой цепи лямбда или каппа. Антигенсвязывающий белок scFv-IgAb собран из двух тяжелых (H) и двух легких (L) цепей, при этом, вариабельные домены тяжелой (VH) и легкой (VL) цепей связываются с образованием на N-конце двух антигенсвязывающих сайтов Fv связывания Fab'-фрагментов. В одном варианте осуществления настоящего изобретения, N-концевые антигенсвязывающие сайты Fv Fab'-фрагментов являются специфическими для CD16A, а C-концевые антигенсвязывающие сайты scFv являются специфическими для EGFR. В другом варианте осуществления настоящего изобретения, N-концевые антигенсвязывающие сайты Fv Fab'-фрагментов являются специфическими для EGFR, а C-концевые антигенсвязывающие сайты scFv являются специфическими для CD16A.
В частности, мультиспецифический антигенсвязывающий белок содержит тяжелую (H) цепь и легкую (L) цепь, при этом, (i) тяжелая (H) цепь имеет структуру VH(CD16A)-CH1-Шарнир-CH2-CH3-VH(EGFR)-VL(EGFR), а легкая цепь имеет структуру VL(CD16A)-CL, или (ii) тяжелая цепь имеет структуру VH(EGFR-CH1-Шарнир-CH2-CH3-VH(CD16A)-VL(CD16A), а легкая цепь имеет структуру VL(EGFR)-CL, или (iii) VH(EGFR)-CH1-CH2-CH3-VL(CD16A)-VH(CD16A), а легкая цепь имеет структуру VL(EGFR)-CL. В некоторых вариантах осуществления настоящего изобретения, Fc-участок, состоящий из гомодимера CH2-CH3, выключен, то есть, по существу, не связывается с FcγR, но сохраняет связывание с FcRn.
В некоторых вариантах осуществления настоящего изобретения, антигенсвязывающий белок содержит выключенный Fc-участок. Такой Fc-участок выключен для связывании с FcγR, по сравнению с IgG. В конкретном варианте осуществления настоящего изобретения, антигенсвязывающий белок содержит константный домен тяжелой цепи, имеющий аминокислотную последовательность, представленную в SEQ ID NO:15, и/или домен легкой цепи лямбда, имеющий аминокислотную последовательность, представленную в SEQ ID NO:16.
Термин «выключенный Fc-участок» относится к модифицированному Fc-участку, который не связывается с рецептором Fc-гамма (FcγR), но сохраняет связывание с неонатальным рецептором Fc (FcRn) для увеличения периода полужизни и длительной персистенции в сыворотке крови. Антигенсвязывающий белок предназначен для специфического рекрутинга NK-клеток посредством антигена CD16A, и, таким образом, в предпочтительных вариантах осуществления настоящего изобретения, следует предотвращать связывание Fc с рецептором Fc-гамма. Кроме того, сообщалось, что FcRn защищает IgG от деградации и отвечает за транспорт IgG через эпителиальные барьеры. Следовательно, модификации в Fc-участке антигенсвязывающих белков Fc-слияния, которые сохраняют или усиливают связывание FcRn, являются предпочтительными.
Было описано несколько наборов мутаций или изменений для генерации IgG1 со сниженным связыванием с рецептором Fc-гамма или без связывания, которые выбраны из мутаций группы, состоящей из: C220S, C229S, E233P, L234A, L234V, L234F, L235A, L235E, P238S, D265A, N297A, N297Q, P331S; или мутаций для генерирования IgG2 со сниженным связыванием с рецептором Fc-гамма, которые могут быть выбраны из группы, состоящей из: H268Q, V309L, A330S, A331S, или мутаций для генерирования IgG4 со сниженным связыванием с рецептором Fc-гамма, которые могут быть выбраны из группы, состоящей из L235A, G237A, E318A (Штрол В., Current Opinion in Biotechnology 2009, 20:1-7; Канеко Э. и Нива Р., Biodrugs 2011, 25(1):1-11; Баудино Л., Ж. Immunology 2008, 181: 6664-6669).
Кроме того, Fc-участок может быть сконструирован для увеличения периода полужизни в сыворотке крови. Были описаны следующие мутации в Fc-участке IgG1, которые увеличивают период полужизни антигенсвязывающего белка в сыворотке крови: T250Q, M252Y, S254T, T256E, T307A, E380A, M428L, H433K, N434A, N434Y (Штрол В., Current Opinion in Biotechnology 2009, 20:1-7; Боррок М. Дж. и др., Ж. Pharmaceutical Sciences 2017, 106(4):1008-1017).
В некоторых вариантах осуществления настоящего изобретения, Fc-участок IgG1 содержит набор мутаций в положениях 234, 235 и 265, в соответствии с нумерацией Кабата, в частности, набор мутаций выбран из L234F/V/A, L235A/E и D265A. Особенно предпочтительным является Fc-участок IgG1, содержащий набор мутаций L234F, L235E и D265A (SEQ ID NO:20). Соответственно, в некоторых вариантах осуществления настоящего изобретения, антигенсвязывающая молекула Fc-слияния, такая как Bi-scFv-Fc или scFv-IgAb, содержит выключенный Fc-участок IgG1 с набором мутаций L234F, L235E и D265A. Все перечисленные мутации соответствуют системе нумерации Кабата (Кабат, Е. А. и др., Sequences of proteins of immunological interest. 5-е издание - Министерство здравоохранения и социальных служб США, публикация NIH № 91-3242, стр. 662, 680, 689 (1991).
В альтернативных вариантах осуществления настоящего изобретения, период полужизни в сыворотке крови антигенсвязывающего белка EGFR/CD16A может быть увеличен путем (i) слияния, по меньшей мере, одного антигенсвязывающего сайта для человеческого сывороточного альбумина (HSA) с антигенсвязывающим белком или (ii) слияния или присоединения человеческого сывороточного альбумина (HSA) к антигенсвязывающему белку.
Антигенсвязывающий белок по любому из вариантов осуществления настоящего изобретения, описанных в настоящем документе, может быть получен путем экспрессии полинуклеотидов, кодирующих отдельные полипептидные цепи, которые образуют антигенсвязывающий белок. Таким образом, другими вариантами осуществления настоящего изобретения являются полинуклеотиды, например, ДНК или РНК, кодирующие полипептиды антигенсвязывающего белка, как описано в настоящем документе выше. Полинуклеотиды могут быть сконструированы способами, известными специалисту в данной области техники, например, путем объединения генов, кодирующих вариабельные домены, и константных доменов, разделенных пептидными линкерами или непосредственно сцепленных посредством пептидной связи полипептидных цепей, в генетическую конструкцию, функционально сцепленную с подходящим промотором и, необязательно, с подходящим терминатором транскрипции, которые экспрессируют ее в бактерии или другую подходящую систему экспрессии, такую как, например, клетки СНО (Пример 1).
Настоящее изобретение также относится к мультиспецифическому антигенсвязывающему белку, в частности, к композиции, содержащей мультиспецифическую антигенсвязывающую молекулу, как описано выше в настоящем документе, и, по меньшей мере, один дополнительный компонент.
В другом варианте осуществления настоящего изобретения, мультиспецифический антигенсвязывающий белок предназначен для использования в качестве терапевтического соединения. В предпочтительном варианте осуществления настоящего изобретения, мультиспецифический антигенсвязывающий белок предназначен для использования при лечении рака, характеризующегося EGFR-позитивными или EGFRvIII-позитивными клетками.
В другом варианте осуществления настоящего изобретения, предложен способ лечения или уменьшения интенсивности пролиферативного заболевания, или опухолевого заболевания, при этом, способ содержит этап введения субъекту, нуждающемуся в этом, мультиспецифического антигенсвязывающего белка по настоящему изобретению. Подлежащий лечению субъект может быть человеком. В конкретном варианте осуществления настоящего изобретения, пролиферативное заболевание или опухолевое заболевание характеризуется EGFR-позитивными или EGFRvIII-позитивными клетками.
Для использования в качестве терапевтического соединения или для лечения EGFR-позитивного заболевания или EGFR-позитивного и/или EGFRvIII-позитивного рака, композицию, содержащую мультиспецифический антигенсвязывающий белок, в предпочтительном варианте осуществления настоящего изобретения, комбинируют с подходящим фармацевтически приемлемым носителем. Термин «фармацевтически приемлемый носитель» означает любой носитель, который не влияет на эффективность биологической активности ингредиентов и который не токсичен для пациента, которому его вводят. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают забуференные фосфатом физиологические растворы, воду, эмульсии, такие как эмульсии масло/вода, различные типы смачивающих агентов, стерильные растворы и так далее. Такие носители могут быть составлены обычными способами и могут вводиться субъекту в подходящей дозе. В предпочтительном варианте осуществления настоящего изобретения, композиции являются стерильными. Эти композиции могут также содержать адъюванты, такие как консерванты, эмульгирующие агенты и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено включением различных антибактериальных и противогрибковых агентов. Введение подходящих композиций может осуществляться разными способами, например, путем внутривенного, интраперетонеального, подкожного, внутримышечного, наружного или внутрикожного введения. Путь введения, конечно, зависит от вида терапии и вида соединения, содержащегося в фармацевтической композиции. Режим дозирования будет определяться лечащим врачом и другими клиническими факторами.
EGFR-позитивные и/или EGFRvIII-позитивные виды рака, которые можно лечить с использованием антигенсвязывающего белка по настоящему изобретению, включают, но этим не ограничиваются, например, колоректальный рак, рак головы и шеи, рак легких и глиобластому.
Нижеприведенные примеры должны дополнительно проиллюстрировать описанные варианты осуществления настоящего изобретения без ограничения объема настоящего изобретения. Продемонстрировано, что антигенсвязывающий белок по настоящему изобретению способен индуцировать опосредованную NK-клетками цитотоксичность при отсутствии или незначительном ингибирующем воздействии на EGF-индуцированное фосфорилирование EGFR:
Пример 1: Генерация и продуцирование антигенсвязывающих белков EGFR/CD16A
Материал
Генерация антигенсвязывающих белков EGFR/CD16A
Тандемное диатело
Тандемные диатела (Фигура 3) сконструированы, как описано в работе Реуш и др., 2014, mAbs 6:3, 728-739. Для конструирования тандемного диатела, домены Fv анти-EGFR (SEQ ID NO:1,2) комбинируют с доменами Fv анти-CD16A (SEQ ID NO:12,13). Кассету экспрессии для тандемного диатела клонируют таким образом, чтобы домены анти-EGFR и домены анти-CD16A располагались в следующем порядке: VH_EGFR-L1-VL_CD16A-L2-VH_CD16A-L3-VL_EGFR. Линкер 9 аминокислот (G2S)3 (SEQ ID NO:36) используется для линкеров L1 и L3, а линкер 6 аминокислот (G2S)2 (SEQ ID NO:35) используется для линкера L2. Полученное тандемное диатело EGFR/CD16A состоит из двух полипептидов, имеющих аминокислотную последовательность, представленную в SEQ ID NO:27.
aTriFlex
aTriFlex (Фигура 4) сконструирован, как описано в WO 2017/064221. Для конструирования aTriFlex, домены Fv анти-EGFR (SEQ ID NO:1,2) комбинируют с доменами Fv анти-CD16A (SEQ ID NO:12,13) и доменами Fv анти-HSA (SEQ ID NO:31,32). Кассету экспрессии для aTriFlex клонируют таким образом, чтобы домены анти-EGFR и домены анти-CD16A располагались в первом полипептиде: VH_EGFR-L1-VL_EGFR-L2-VL_CD16A-L2-VL_CD16A-L2-VH_HSA-L1-VL_HSA и во втором полипептиде в следующем порядке: VH(CD16A)-L2-VH(CD16A), а линкер 18 аминокислот (G2S)6 (SEQ ID NO:18) используется для линкера L1, а линкер 9 аминокислот (G2S)3 (SEQ ID NO: 36) используется для линкера L2.
Bi-scFv-Fc
Для экспрессии антигенсвязывающего белка Bi-scFv-Fc (Фигура 2) в клетках СНО, кодирующую последовательность молекулы клонировали в систему векторов экспрессии млекопитающих. Говоря кратко, последовательности генов, кодирующие домены Fv анти-EGFR (SEQ ID NO:1,2) и домены Fv анти-CD16A (SEQ ID NO:12,13), соединенные пептидными линкерами, были синтезированы компанией Thermo Fisher Scientific GeneArt (Регенсбург, Германия). PCR-ампликоны различных вариабельных доменов и F-участка, содержащего выключенные точковые мутации (SEQ ID NO:20), были созданы с соответствующими праймерами. После этого, различные перекрывающиеся ДНК-фрагменты и линеаризованный вектор основной цепи объединяют вместе в одной изотермической реакции. Экспрессирующая конструкция Bi-scFv-Fc была разработана для содержания кодирующих последовательностей для N-концевого сигнального пептида и Fc-участка для облегчения секреции антитела и очистки, соответственно. Последовательность конструкции была подтверждена секвенированием ДНК в компании GATC (Кельн, Германия) с использованием пары праймеров 5'-TAATACGACTCACTATAGGG-3' (SEQ ID NO:33) и 5'-TAGAAGGCACAGTCGAGG-3' (SEQ ID NO:34). Кассету экспрессии для Bi-scFv-Fc клонируют таким образом, чтобы домены анти-EGFR и домены анти-CD16A располагались в следующем порядке: VL_CD16A-L1-VH_CD16A-Шарнир-CH2-CH3-L2-VH_EGFR-L3-VL_EGFR, а (G2S)7 используют для линкера L1, (G4S)2 используют для линкера L2, а (G2S)6 используют для линкера L3. Полученный Bi-scFv-Fc-_02 состоит из двух полипептидов, имеющих аминокислотную последовательность, представленную в SEQ ID NO:30.
scFv-IgAb (Фигура 1):
Экспрессирующую конструкцию ДНК, кодирующую scFv-IgAb, генерируют путем клонирования кодирующих последовательностей доменов Fv анти-D16A (SEQ ID NO:12,13) в модифицированный вектор экспрессии млекопитающих, содержащий CMV-контролируемые кассеты экспрессии, включая константные домены тяжелой и легкой цепей с точковыми мутациями выключенного Fc (SEQ ID NO:15,16) для коэкспрессии из того же вектора. После этого, генерируют PCR-ампликоны из последовательностей генов, кодирующих домены Fv анти-EGFR (SEQ ID NO:1,2), разделенные пептидным линкером, имеющим аминокислотную последовательность, представленную в SEQ ID NO:18 (VH-(G2S)6-VL) с соответствующими праймерами. Полученный перекрывающийся ДНК-фрагмент вставляют в вектор коэкспрессии в соответствующем положении. Все необходимые последовательности генов, кодирующие вариабельные домены и константные домены, содержащие точковые мутации выключенного Fc, были синтезированы компанией Thermo Fisher Scientific GeneArt (Регенсбург, Германия). Экспрессирующая конструкция scFv-IgAb была разработана для содержания кодирующих последовательностей для N-концевых сигнальных пептидов и Fc-участка для облегчения секреции антитела и очистки, соответственно. Последовательности всех конструкций были подтверждены секвенированием ДНК в компании GATC (Кельн, Германия) с использованием праймеров, изготовленных по спецзаказу. Кассету экспрессии для scFv-IgAb клонируют таким образом, чтобы домены анти-EGFR, домены анти-CD16A и константные домены располагались в первом полипептиде: VH_CD16A-CH1-Шарнир-CH2-CH3-L1-VH_EGFR-L2-VL_EGFR и во втором полипептиде в следующем порядке: VL_CD16A-CЛямбда. (G4S)2 (SEQ ID NO:35) используют для линкера L1, а (G2S)6 (SEQ ID NO: 18) используют для линкера L2. Полученный scFv-IgAb_02 состоит из тяжелой цепи, имеющей аминокислотную последовательность, представленную в SEQ ID NO:28, собранную с легкой цепью, имеющей аминокислотную последовательность, представленную в SEQ ID NO:29.
Культура клеток-хозяев
Клетки Flp-In CHO (Life Technologies), производные клеток яичника китайского хомячка CHO-K1 (ATCC, CCL-61) (Као и Пак, 1968), культивировали в смеси питательных веществ Ham's F-12 Nutrient Mix с добавлением L-Глутамина, 10% FCS и 100 мкг/мл Зеоцина. Адгезивные клетки отделяли 0,25% раствором Трипсина-ЭДТА и субкультивировали в соответствии со стандартными протоколами получения клеточных культур, предоставленными компанией Life Technologies.
Для адаптации к росту в суспензии, клетки отделяли от колб для культур тканей и помещали в бессывороточную среду HyClone CDM4 CHO для последующей инкубации во встряхиваемых колбах при 37°C, с 5% CO2 и со скоростью 120 об/мин. Стандартная среда для культивирования суспензионно адаптированных клеток-хозяев Flp-In CHO представляла собой HyClone CDM4 CHO с добавлением L-Глутамина, HT Supplement, Пенициллина/Стрептомицина и 100 мкг/мл Зеоцина. Суспензионно адаптированные клетки криоконсервировали в среде с 10% ДМСО и подвергали отрицательному контролю на присутствие Микоплазмы, используя набор для определения микоплазм MycoAlert Mycoplasma Detection Kit (Lonza).
Генерация стабильно трансфицированных пулов клеток
Рекомбинантные клеточные линии Flp-In СНО, стабильно экспрессирующие секретированные рекомбинантные антитела, конструкции Fc-слияния или антитела сравнения, а также заякоренные в мембране антигены, были сгенерированы путем трансфекции суспензионно адаптированных клеток-хозяев. Для этого, клетки помещали в стандартную среду без Зеоцина за один день до котрансфекции с экспрессионными плазмидами (2,5 мкг), кодирующими интересующий белок (pcDNA5-FRT), и рекомбиназу Flp (pOG44, Life Technologies) с использованием Полиэтиленимина (PEI). Говоря кратко, векторную ДНК и реагент для трансфекции смешивали при соотношении ДНК:PEI 1:3 (мкг/мкг) в общей сложности в 100 мкл среды OptiMEM I и инкубировали в течение 10 минут перед добавлением к клеткам 2E+6 Flp-In CHO, суспендированным в 1 мл среды CHO-S-SFMII (Life Technologies). После инкубации в течение 24-48 часов, отбор стабильно трансфицированных клеток начинали посредством добавления 6-7 мкг/мл Пуромицин дигидрохлорида после разведения культур с получением плотности 0,1Е+6 жизнеспособных клеток/мл в среде CHO-S-SFMII. Рекомбиназа Flp опосредует встраивание экспрессирующей конструкции Flp-In в геном в интегрированном сайте FRT посредством сайт-специфической рекомбинации ДНК (О' Горман и др., 1991). Во время отбора дважды в неделю измеряли плотность жизнеспособных клеток, и клетки центрифугировали, и ресуспендировали в свежей селективной среде при максимальной плотности 0,1Е+6 жизнеспособных клеток/мл. Пулы клеток, стабильно экспрессирующие рекомбинантные белковые продукты, восстанавливали через 2-3 недели отбора, после чего клетки переносили в стандартную культуральную среду во встряхиваемых колбах. Экспрессию рекомбинантных секретированных или заякоренных в мембране белков подтверждали посредством электрофореза в белковом геле супернатантов клеточной культуры с использованием технологии без окрашивания Criterion Stain-Free (Bio-Rad) (см. ниже) или Проточной цитометрии, соответственно. Пулы стабильных клеток криоконсервировали в среде, содержащей 7,5 % ДМСО.
Продуцирование рекомбинантного белка в суспензионных культурах клеток CHO в режиме периодического культивирования с подпиткой (Fed-batch)
Рекомбинантные белки получали в 10- или 11-дневных культурах в режиме fed-batch стабильно трансфицированных клеток CHO путем секреции в супернатант клеточной культуры. Для этого клетки, стабильно экспрессирующие рекомбинантные антитела, антигены Fc-слияния или антитела сравнения высевали при начальной плотности 6E+5 клетк/мл в стандартную культуральную среду в поликарбонатные колбы Эрленмейера с газопроницаемыми крышками (Corning) и инкубировали при 37°C и 5° CO2 при перемешивании со скоростью 140 об/мин. Во время культивирования в режиме fed-batch, в среду добавили 40 мл/л ActiCHO Feed A (GE Healthcare) и 4 мл/л ActiCHO Feed B (GE Healthcare) на День 0 (начальный день) и двойные количества на День 3, 5 и 7. Супернатанты клеточной культуры собирали через 10 или 11 дней при жизнеспособности культур, составляющей, как правило >75%. Образцы собирали из культур для продуцирования регулярно через день перед подпиткой и оценивали плотность и жизнеспособность клеток. В день сбора, супернатанты клеточной культуры очищали центрифугированием и вакуумной фильтрацией (0,22 мкм) с использованием мембранных фильтров Millipore Express PLUS Membrane Filters (Millipore) перед дальнейшим использованием.
Количественное определение титров экспрессии:
Титры экспрессии белка и целостность продукта в супернатантах клеточной культуры (CSS) анализируют с помощью ДНС-ПААГ (SDS-PAGE) на Дни 5, 7 и 10 или 11 культур для продуцирования. Образцы смешивают с буфером для образцов ДНС-ПААГ перед загрузкой в 4-20% гели Criterion TGX Precast SDS PAGE Gels (Biorad). Общее количество белка визуализируют в геле с использованием системы молекулярной визуализации без окрашивания Criterion Stain-free Molecular Imaging System (Biorad). Титры продуктов определяют полуколичественным анализом путем сравнения с контрольными антителами известной концентрации.
Очистка антител анти-EGFR
Антигенсвязывающие белки анти-EGFR очищали от осветленных супернатантов клеточной культуры СНО, проводя двухэтапную процедуру, содержащую Белок А и препаративную Эксклюзионную хроматографию (SEC). Для Белка A, осветленный супернатант загружали в колонку HiTrap MabSelectSuRe. После промывания забуференным фосфатом физиологическим раствором с pH 7,4 и 10 мМ фосфата натрия с pH 7,0, белок элюировали в двухступенчатом градиенте с 50 мМ ацетата натрия с pH 3,5 и 10 мМ глицина/HCl с pH 2,0. Чистоту фракций анализировали с использованием Эксклюзионной ВЭЖХ и ДНС-ПААГ. Фракции, демонстрирующие приемлемую чистоту, объединяли в пул и подвергали препаративной гель-фильтрации с использованием препаративной колонки для получения чистоты продукта Superdex 200. Фракции элюата, содержащие очищенные антигенсвязывающие белки анти-EGFR, объединили в пул, и у них заменили буфер с использованием колонки Sephadex G-25 против 10 мМ ацетата натрия, 4,5% сорбита с pH 5,0, и увеличили концентрацию посредством ультрафильтрации до типичной концентрации, составляющей, примерно, 1 мг/мл. Гомогенность конечных образцов (scFv-IgAb_2, примерно, 79% и Bi-scFv-Fc_2, примерно, 85%) оценивали посредством ДНС-ПААГ в восстанавливаемых и невосстанавливаемых условиях (см. Фигуру 5). Образцы смешивали с буфером для невосстанавливаемых образцов 2x ДНС-ПААГ или с буфером для восстанавливаемых образцов 2x ДНС-ПААГ, содержащим дитиотреитол (DTT) в качестве восстанавливающего агента. Все образцы нагревали при 95°C в течение 5 минут перед загрузкой в гель 4-20% Criterion TGX Precast SDS Page Gel. Использовали образец очищенного белка 2 мкг/линия. Для разделения белков в геле, проводили ДНС-ПААГ в 1х Трис/Глицин/ДСН буфере при 300 В в течение, примерно, 22 минут. Общий белок визуализировали в геле с использованием системы молекулярной визуализации без окрашивания Criterion Stain-free Molecular Imaging System (BioradBio-Rad). В качестве маркера молекулярной массы использовали лестницу неокрашенного белка Page Ruler Unstained Protein. Чистоту (scFv-IgAb_2, примерно, 99% и Bi-scFv-Fc_2, примерно, 97%) оценивали посредством аналитической Эксклюзионной ВЭЖХ с использованием колонки Superdex 200 Increase 10/300GL. Очищенные белки хранили в виде аликвот при -80°C до их дальнейшего использования.
Анализ связывания антигенсвязывающих белков EGFR/CD16A в ELISA
Анализ связывания в ELISA
96-луночные планшеты для ELISA (Immuno MaxiSorp; Nunc) покрывали в течение ночи при 4°C рекомбинантным антигеном или антителами в 100 мМ Карбонат-бикарбонатного буфера. Антиген EGFR-mFc был покрыт при концентрации 2,5 мкг/мл, EGFR-Fc - в концентрации 3 мкг/мл, CD16A-Fc - при концентрации 1,5 мкг/мл, scFv-IgAb EGFR/CD16A - при концентрации 3,8 мкг/мл или Bi-scFv-Fc EGFR/CD16A - при концентрации 3 мкг/мл. После этапа блокировки с 3% (масса/объем) сухого обезжиренного молока (Merck), растворенного в PBS, серийные разведения различных антител или растворимых антигенов в PBS, содержащем 0,3% (масса/объем) сухого обезжиренного молока, инкубировали на планшетах в течение 1,5 часа при комнатной температуре. После трехкратной промывки 300 мкл/лунка PBS, содержащего 0,1% (об.%) Tween 20, планшеты инкубировали с детекторными антителами в течение 1 часа при комнатной температуре. Для определения His-меченных (гистидиновой меткой) аналитов, использовали Penta-HIS-HRP (Qiagen) с разведением 1:3000. Для определения scFv-IgAb EGFR/CD16A или Bi-scFv-Fc EGFR/CD16A, связанных с антигеном EGFR-mFc, биотинилированный CD16-Fc инкубировали на планшетах при концентрации 1 мкг/мл в течение 1 часа при комнатной температуре с последующей промывкой и инкубацией с конъюгатом Стрептавидин-HRP (Roche) с разведением 1:10000 в течение 1 часа при комнатной температуре. После трехкратной промывки 300 мкл/лунка PBS, содержащего 0,1% (об.%) Tween 20, планшеты инкубировали с субстратом Тетраметилбензидина (TMB) (Seramun) до тех пор, пока проявление цвета не будет четко видно. Реакцию останавливали посредством добавления 100 мкл/лунка 0,5 М H2SO4. Абсорбцию измеряли при 450 нм с использованием многофункционального планшетного анализатора (Victor, Perkin Elmer). Значения абсорбции были нанесены на график и проанализированы с использованием нелинейной регрессии, сигмоидальной зависимости доза-ответ (переменный угловой коэффициент), метода наименьших квадратов (обычного), приведенных в соответствии с GraphPad Prism версии 6.07 (GraphPad Software, Ла-Хойя, Калифорния, США).
Связывание с FcRn и различными Fcγ-рецепторами
Для характеристики выключенного Fc в антигенсвязывающих белках EGFR/CD16A, связывание с различными Fcγ-рецепторами и FcRn (pH 6,0) измеряли с использованием Поверхностной плазмонной резонансной спектроскопии (SPR).
Материалы и способы:
Молекулы лиганда
Различные Fcγ-рецепторы (человека, собаки, яванского макака, мыши), слитые с моно Fc (mFc) и Avi-меткой, были экспрессированы в CHO и очищены посредством Белка A и Эксклюзионной хроматографии (SEC). Молекулы биотинилировали в присутствии Avi-метки с использованием набора с биотин-протеин лигазой Biotin-Protein Ligase/BirA Kit (GeneCopoeia).
CD64 человека FcγRI-mFc-Avi
CD32A человека FcγRIIa-mFc-Avi
CD32B человека FcγRIIb-mFc-Avi
CD32C человека FcγRIIc-mFc-Avi
CD16A человека FcγRIIIa (48R-158V)-mFc-Avi
CD16B человека FcγRIIIb (NA1)-mFc-Avi
CD64 мыши FcγRI-mFc-Avi
CD32 мыши FcγRIIb-mFc-Avi
CD16 мыши FcγRIII-mFc-Avi
CD16-2 мыши FcγRIV-mFc-Avi
CD16 собаки FcγRIII-mFc-Avi
CD32A яванского макака FcγRIIa-mFc-Avi
CD32B/C яванского макака FcγRIIb/c-mFc-Avi
CD16 яванского макака FcγRIII-mFc-Avi
Были приобретены молекулы биотинилированного FcRn (человека, мыши, яванского макака):
FcRn (FCGRT/B2M), с His-меткой, меченный биотином, HiP™ (человека), № по каталогу 71283
FcRn (FCGRT/B2M), с His-меткой, меченный биотином, HiP™ (мыши), № по каталогу 71286
FcRn (FCGRT/B2M), с Avi-меткой, меченный биотином, Acro™ (яванского макака), № по каталогу FCM-C82W5
Способы SPR
A) Связывание с различными Fcγ-рецепторами
Связывание антигенсвязывающего белка EGFR/CD16A с различными Fcγ-рецепторами измеряли на приборе Biacore T200 Instrument при 25°C с использованием HBS-P+.
b) Связывание с FcRn
Связывание антигенсвязывающих белков EGFR/CD16A с FcRn (человека, яванского макака, мыши) измеряли на приборе Biacore T200 Instrument при 25°C с использованием буфера PBS-T при pH 6,0 в качестве подвижного буфера и для разбавления (1x Gibco PBS, 0,005% Tween20 , титрованный до pH 6,0 с использованием 4 М HCl). С этой целью был проведен Многоцикловый кинетический эксперимент с использованием набора Biotin CAPture Kit (GE Healthcare). Для активации сенсорной поверхности, реагент Biotin CAPture (GE Healthcare) вводили в Проточные кюветы Fc 1-4 (100 сек, 5 мкл/мин), что привело к ответу 2100 RU - 2800 RU. Биотинилированный FcRn различных видов вводили в Проточный кювет Fc 2 (5 мкл/мин), что привело к ответу, примерно, 8-15 RU. Серия разведений антигенсвязывающих белков EGFR/CD16A служила (pH 7,4) в качестве подвижного буфера и для разведения. С этой целью был проведен Одноцикловый кинетический эксперимент с использованием набора Biotin CAPture Kit (GE Healthcare). Для активации сенсорной поверхности, реагент Biotin CAPture (GE Healthcare) вводили в Проточные кюветы Fc 1-4 (100 сек, 5 мкл/мин), что привело к ответу 2100 RU - 2800 RU. Биотинилированные Fcγ-рецепторы были захвачены (35 RU-55 RU) в Проточных кюветах Fc 2, Fc 3, Fc 4. Серию разведений конструкций антител анти-EGFR вводили в Проточные кюветы Fc 1-4 в Одноцикловом кинетическом режиме (30 мкл/мин, ассоциация 180 сек, диссоциация 240 сек, 6000 нМ - 1,47 нМ разведение 1:4). Чип регенерировали с использованием Раствора для регенерации (GE Healthcare) (10 мкл/мин, Проточные кюветы 1-4, 120 сек). Сенсорграммы представлены в виде таблиц, с вычитанием цикла нулевой концентрации и вычитанием сигналов в контрольном канале Fc 1 (Fc 2-1, Fc 3-1, Fc 4-1). Кинетику связывания оценивали путем приведения данных в соответствие с Моделью связывания (Binding Model) 1:1 (установив константу RI на ноль) с использованием оценочного программного обеспечения Biacore T200 Evaluation Software, подключенного к Проточным кюветам Fc 1, 2 (30 мкл/мин, ассоциация 240 секунд, диссоциация 100 секунд, 3000 нМ - 12,5 нМ разведение 1:3). Чип регенерировали с использованием Раствора для регенерации (GE Healthcare) (10 мкл/мин, Проточные кюветы 1-4, 120 сек). Сенсорграммы представлены в виде таблиц, с вычитанием цикла нулевой концентрации и вычитанием сигналов в контрольном канале Fc 1 (Fc 2-1). Кинетику связывания оценивали путем приведения данных в соответствие с Моделью связывания 1:1 (Rmax и RI приведены в соответствие локально) с использованием оценочного программного обеспечения Biacore T200 Evaluation Software.
Результаты:
В количественных анализах связывания Fcγ-рецептора, scFv-IgAb_02 продемонстрировал связывание с CD16A FcγRIIIa (48R-158V)-mFc-Avi (KD 12,5 нМ) человека и CD16 FcγRIII-mFc-Avi (KD 19,9 нМ) яванского макака, тогда как связывающее взаимодействие для всех других подвергнутых испытаниям Fcγ-рецепторов не определяли (Таблица 1). Bi-scFv-Fc_02 продемонстрировал связывание только с CD16A FcγRIIIa (48R-158V)-mFc-Avi (KD 12,2 нМ) и CD16 FcγRIII-mFc-Avi (KD 25,2 нМ) яванского макака. Контрольная молекула тандемного диатела EGFR/CD16A продемонстрировала связывание только с CD16A FcγRIIIa (48R-158V)-mFc-Avi (KD 4,4 нМ) человека и CD16 FcγRIII-mFc-Avi (KD 8,9 нМ) яванского макака. Функциональность всех подвергнутых испытаниям Fcγ-рецепторов была продемонстрирована различными контрольными молекулами IgG1 (Данные не показаны).
Выключение Fc в scFv-IgAb_02 и Bi-scFv-Fc_02 можно проверить по отсутствию связывающего взаимодействия с подвергнутыми испытаниям Fcγ-рецепторами (за исключением специфического связывания с CD16A человека и CD16 яванского макака посредством домена анти-CD16A).
FcRn-связывание scFv-IgAb_02 и Bi-scFv-Fc-02 при pH 6,0 было продемонстрировано для FcRn человека (scFv-IgAb_2 KD 430 нМ, Bi-scFv-Fc_02 KD 410 нМ), FcRn мыши (scFv-IgAb_02 KD 180 нМ, Bi-scFv-Fc_02 KD 121 нМ) и FcRn яванского макака (scFv-IgAb_02 KD 842 нМ, Bi-scFv-Fc_02 KD 268 нМ). Связывающее взаимодействие для контрольной молекулы тандемного диатела EGFR/CD16A не измеряли. Сохранение способности связывания FcRn в выключенном Fc scFv-IgAb_02 и Bi-scFv-Fc_02 можно проверить.
Таблица 1 - Сводная таблица количественных анализов связывания Fcγ-рецептора с антигенсвязывающими белками EGFR/CD16A.
FcγRI-mFc-Avi человека
FcγRIIb-mFc-Avi человека
FcγRIII-mFc-Avi собаки
Таблица 2 - Сводная таблица связывания FcRn при pH 6,0 с антигенсвязывающими белками EGFR/CD16A.
KD 430 нМ
KD 410 нМ
KD 180 нМ
KD 121 нМ
Пример 2:
Связывание биспецифического антигенсвязывающего белка EGFR/CD16A с первичными NK-клетками человека в присутствии или в отсутствие 10 мг/мл поликлонального IgG человека
Способы:
Выделение PBMC из лейкоцитарных пленок и обогащение NK-клеток человека
PBMC выделяли из лейкоцитарных пленок (Немецкий Красный Крест, Мангейм, Германия) центрифугированием в градиенте плотности. Образцы лейкоцитарных пленок разбавляли двукратным или трехкратным объемом PBC (Invitrogen, № в каталоге: 14190-169), наносили слоями на подушку Lymphoprep (Stem Cell Technologies, № в каталоге: 07861) и центрифугировали при 800×g в течение 25 минут при комнатной температуре без перерыва. PBMC, расположенные на поверхности раздела фаз, собирали и промывали 3 раза посредством PBS до их культивирования в полной среде RPMI 1640 с добавлением 10% FCS в течение ночи без стимуляции. Для обогащения NK-клеток, PBMC собирали из культур, полученных за ночь, и использовали для одного раунда негативной селекции с использованием набора для обогащения NK-клеток человека EasySep™ Human NK-Cell Enrichment Kit (Stem Cell Technologies, № в каталоге: 19955) для иммуномагнитного выделения необработанных NK-клеток человека и магнита Big Easy EasySep™ Magnet (Stem Cell Technologies, № в каталоге: 18001), в соответствии с инструкциями производителя.
Количественные анализы связывания клеток и анализы проточной цитометрии
Аликвоты указанных типов клеток инкубировали с 100 мкл серийных разведений различных биспецифических антигенсвязывающих белков EGFR/CD16A с присутствием или без присутствия 10 мг/мл поликлонального IgG человека (Гамманорм, Octapharma) в FACS буфере (PBS, Invitrogen, № в каталоге: 14190-169), содержащем 2% инактивированной нагреванием FCS (Invitrogen, № в каталоге: 10270-106), 0,1% азида натрия (Roth, Карлсруэ, Германия, № в каталоге: A1430.0100) в течение 45 минут при 37°C. После повторной промывки FACS буфером, связанные с клетками антитела определяли посредством 10 мг/мл mAb анти-EGFR (клон 62-1-1 Biogenes), а затем - посредством 15 мкг/мл FITC-конъюгированного козьего антимышиного IgG (Dianova, № в каталоге: 115-095-062). Биотинилированный цетуксимаб, а также биотинилированные антитела IgG анти-EGFR (IgAb_wtFc, IgAb_enhFc) определяли посредством AlexaFluor 488-конъюгированного Стрептавидина (Dianova 016-540-084). После последнего этапа окрашивания, клетки снова промывали и ресуспендировали в 0,2 мл FACS буфера, содержащего 2 мкг/мл пропидиум йодида (PI) (Sigma, № в каталоге: P4170) для того, чтобы исключить мертвые клетки. Флуоресценцию 2-5×103 живых клеток измеряли с использованием проточного цитометра Millipore Guava EasyCyte (Merck Millipore, Швальбах, Германия). Средние значения интенсивности флуоресценции образцов клеток рассчитывали с использованием программного обеспечения Incyte (Merck Millipore, Швальбах, Германия). После вычитания значений интенсивности флуоресценции клеток, окрашенных только вторичными и третичными реагентами, эти значения использовали для анализа нелинейной регрессии с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США). Для расчета KD, использовали уравнение связывания с одним сайтом (гипербола).
Результаты
Чтобы оценить влияние физиологических концентраций IgG человека на связывающую способность биспецифических антигенсвязывающих белков EGFR/CD16A, были выполнены количественные анализы связывания с несколькими биспецифическими антигенсвязывающими белками EGFR/CD16A на первичных NK-клетках человека в присутствии или в отсутствие 10 мг/мл поликлонального IgG человека, пример которых продемонстрирован на Фигуре 10. В Таблице 3 приведены обобщенные оценки аффинности связывания указанных биспецифических антигенсвязывающих белков в этих двух условиях. Кажущаяся аффинность тандемного диатела EGFR/CD16A на первичных NK-клетках человека существенно не изменяется в присутствии 10 мг/мл поликлонального IgG человека. Однако добавление IgG снижает аффинность Bi-scFv-Fc_02, примерно, в 4 раза с 5 нМ до 20 нМ.
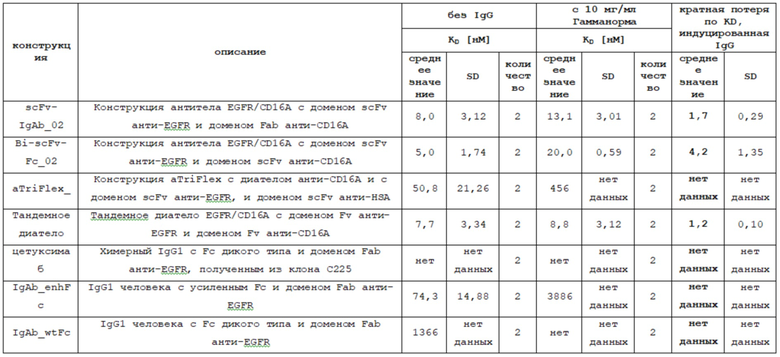
Таблица 3: Кажущуюся аффинность биспецифических антигенсвязывающих белков EGFR/CD16A на первичных NK-клетках человека в присутствии или в отсутствие 10 мг/мл поликлонального IgG человека определяли в двух независимых количественных анализах связывания. Представлены средние значения KD и SD независимых экспериментов. SD, стандартное отклонение; количество, количество независимых экспериментов; отсутствие, связывание отсутствует; нет данных, не применимо.
Пример 3:
Связывание тандемного диатела EGFR/CD16A на клетках CHO, экспрессирующих рекомбинантный EGFR или EGFRvIII человека
Количественные анализы связывания клеток и анализ проточной цитометрии
Аликвоты указанных клеток инкубировали со 100 мкл серийных разведений His-меченных тандемных диател в FACS буфере (PBC, Invitrogen, № в каталоге: 14190-169), содержащем 2% инактивированной нагреванием FCS (Invitrogen, № в каталоге: 10270-106), 0,1% азида натрия (Roth, Карлсруэ, Германия, № в каталоге: A1430.0100) в течение 45 минут при 37°C. После повторной промывки FACS буфером, связанные с клетками антитела определяли посредством 10 мг/мл анти-His mAb 13/45/31-2 (Dianova, Гамбург, Германия, № в каталоге: DIA910-1MG), а затем - посредством 15 мкг/мл FITC-конъюгированного козьего антимышиного IgG (Dianova, № в каталоге: 115-095-062). После последнего этапа окрашивания, клетки снова промывали и ресуспендировали в 0,2 мл FACS буфера, содержащего 2 мкг/мл пропидиум йодида (PI) (Sigma, № в каталоге: P4170) для того, чтобы исключить мертвые клетки. Флуоресценцию 2-5×103 живых клеток измеряли с использованием проточного цитометра Beckman-Coulter FC500 MPL с использованием программного обеспечения MXP (Beckman-Coulter, Крефельд, Германия) или проточного цитометра Millipore Guava EasyCyte (Merck Millipore, Швальбах, Германия). Средние значения интенсивности флуоресценции образцов клеток рассчитывали с использованием программного обеспечения CXP (Beckman-Coulter) или программного обеспечения Incyte (Merck Millipore, Швальбах, Германия). После вычитания значений интенсивности флуоресценции клеток, окрашенных только вторичными и третичными реагентами, эти значения использовали для анализа нелинейной регрессии с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США). Для расчета KD, использовали уравнение связывания с одним сайтом (гипербола).
Результаты
Тандемное диатело EGFR/CD16A обладает сходной кажущейся аффинностью к клеткам, экспрессирующим EGFR или EGFRvIII человека при 37°C (Таблица 4).
Таким образом, антигенсвязывающий белок EGFR/CD16A можно использовать для лечения как EGFR-экспрессирующего рака, так и EGFRvIII-экспрессирующего рака. EGFRvIII, в отличие от EGFR, экспрессируется исключительно на раковых клетках, а не на здоровой ткани.
Таблица 4: Кажущаяся аффинность тандемного диатела EGFR/CD16A на клетках CHO, экспрессирующих рекомбинантный EGFR или EGFRvIII человека при 37°C.
Пример 4:
Связывание конструкций EGFR/CD16A с клетками A-431 EGFR+ и HCT-116
Способы:
Культуру клеточных линий
A-431 (ATCC, № в каталоге: CRL-1555, RAS дикого типа) культивировали в стандартных условиях в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen).
HCT-116 (ATCC, № в каталоге: CRL-247, RAS дикого типа) культивировали в стандартных условиях в среде RPMI 1640 с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen, именуемые в дальнейшем как полная среда RPMI 1640). Все клеточные линии культивировали при 37°C в увлажненной воздушной среде с 5% CO2.
Количественные анализы связывания клеток и анализы проточной цитометрии
Аликвоты указанных типов клеток инкубировали со 100 мкл серийных разведений указанного биспецифического антигенсвязывающего белка EGFR/CD16A в FACS буфере (PBS, Invitrogen, № в каталоге: 14190-169), содержащем 2% инактивированной нагреванием FCS (Invitrogen, № в каталоге: 10270-106), 0,1% азида натрия (Roth, Карлсруэ, Германия, № в каталоге: A1430.0100) в течение 45 минут при 37°C. После повторной промывки FACS буфером, связанные с клетками антитела определяли посредством 10 мг/мл mAb анти-EGFR (клон 4-1-1 (Biogenes)), а затем - FITC-конъюгированного козьего антимышиного IgG минимальный X (Dianova, № в каталоге: 115-095-062). Связанный с клеточной поверхностью цетуксимаб, анти-EGFR с Fc дикого типа (IgAb_wtFc; IgAb_49), анти-EGFR с усиленным Fc (IgAb_enhFc, IgAb_53) определяли посредством FITC-конъюгированного козьего античеловеческого IgG (Dianova; № в каталоге: 109-095-08). После последнего этапа окрашивания, клетки снова промывали и ресуспендировали в 0,2 мл FACS буфера, содержащего 2 мкг/мл пропидиум йодида (PI) (Sigma, № в каталоге: P4170) для того, чтобы исключить мертвые клетки. Флуоресценцию 2-5×103 живых клеток измеряли с использованием проточного цитометра Millipore Guava EasyCyte (Merck Millipore, Швальбах, Германия). Средние значения интенсивности флуоресценции образцов клеток рассчитывали с использованием программного обеспечения Incyte (Merck Millipore, Швальбах, Германия). После вычитания значений интенсивности флуоресценции клеток, окрашенных только вторичными и третичными реагентами, эти значения использовали для анализа нелинейной регрессии с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США). Для расчета KD, использовали уравнение связывания с одним сайтом (гипербола).
Результаты
Кажущуюся аффинность биспецифических антигенсвязывающих белков EGFR/CD16A на линиях опухолевых клеток EGFR+ определяли в независимых экспериментах по связыванию и обобщали в Таблице 5.
Таблица 5: Кажущуюся аффинность антигенсвязывающих белков EGFR/CD16A определяли в независимых количественных анализах по связыванию на линиях опухолевых клеток EGFR+. Представлены средние значения KD и SD независимых экспериментов. SD, стандартное отклонение; количество, количество независимых экспериментов; нет данных, не применимо.
Пример 5:
Цитотоксическая активность биспецифических антигенсвязывающих белков EGFR/CD16A на линиях опухолевых клеток EGFR+
Способы:
Культуру клеточных линий
A-431 (ATCC, № в каталоге: CRL-1555) культивировали в стандартных условиях в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen). HCT-116 (ATCC, № в каталоге: CCL-247) культивировали в стандартных условиях в среде RPMI 1640 с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen, именуемые в дальнейшем как полная среда RPMI 1640). Все клеточные линии культивировали при 37°C в увлажненной воздушной среде с 5% CO2.
Выделение PBMC из лейкоцитарных пленок и обогащение NK-клеток человека
PBMC выделяли из лейкоцитарных пленок (Немецкий Красный Крест, Мангейм, Германия) центрифугированием в градиенте плотности. Образцы лейкоцитарных пленок разбавляли двукратным или трехкратным объемом PBC (Invitrogen, № в каталоге: 14190-169), наносили слоями на подушку Lymphoprep (Stem Cell Technologies, № в каталоге: 07861) и центрифугировали при 800×g в течение 25 минут при комнатной температуре без перерыва. PBMC, расположенные на поверхности раздела фаз, собирали и промывали 3 раза посредством PBS до их культивирования в полной среде RPMI 1640 с добавлением 10% смешанной сыворотки человека (Sigma, каталог: H4522) вместо 10% FCS в течение ночи без стимуляции. Для обогащения NK-клеток, PBMC собирали из культур, полученных за ночь, и использовали для одного раунда негативной селекции с использованием набора для обогащения NK-клеток человека EasySep™ Human NK-Cell Enrichment Kit (Stem Cell Technologies, каталог: 19055) для иммуномагнитного выделения необработанных NK-клеток человека и магнита Big Easy EasySep™ Magnet (Stem Cell Technologies, каталог: 18001), в соответствии с инструкциями производителя.
4-часовые количественные анализы цитотоксичности при высвобождении кальцеина
Для количественных анализов цитотоксичности при высвобождения кальцеина, указанные клетки-мишени собирали из культур, промывали средой RPMI 1640 без FCS и метили посредством 10 мкМ кальцеина AM (Invitrogen/Molecular Probes, № в каталоге: C3100MP) в течение 30 минут в среде RPMI без FCS при 37°C. После осторожной промывки, меченые клетки ресуспендировали в полной среде RPMI (среда RPMI 1640 с добавлением 10% инактивированной нагреванием FCS, 4 мМ L-глутамина, 100 ед/мл пенициллина G-натрия, 100 мкг/мл стрептомицина сульфата) до плотности 1×105/мл. Затем 1×104 клеток-мишеней высевали вместе с обогащенными первичными NK-клетками человека при соотношении Е:Т, составляющем 5:1, и указанными антителами при 12 серийных разведениях в отдельные лунки круглодонного 96-луночного микропланшета в общем объеме, составляющем 200 мкл/лунка, в двух повторностях. Спонтанное высвобождение, максимальное высвобождение и уничтожение мишеней эффекторами в отсутствие антител определяли в четырех повторностях на каждом планшете.
В этом количественном анализе, после центрифугирования в течение 2 минут при 200 g, проводили инкубацию в течение 4 часов при 37°C в увлажненной воздушной среде с 5% CO2. За 15 мин до окончания инкубации, в лунки, содержащие клетки-мишени, добавляли 20 мкл 10% Triton X-100 в среде RPMI. Во все остальные лунки добавляли 20 мкл среды RPMI. 100 мкл супернатанта клеточной культуры собирали из каждой лунки после дополнительного центрифугирования в течение 5 минут при 500 g, и измеряли флуоресценцию высвободившегося кальцеина при 520 нм с использованием флуоресцентного считывателя планшетов (мультимодальный считыватель планшетов EnSight Multimode Plate Reader, Perkin Elmer). На основании измеренного количества импульсов, был рассчитан специфический лизис клеток по следующей формуле: [флуоресценция (образец) - флуоресценция (спонтанная)] / [флуоресценция (максимальная) - флуоресценция (спонтанная)] × 100%. Флуоресценция (спонтанная) представляет собой количество импульсов флуоресценции, испускаемые клетками-мишенями в отсутствие эффекторных клеток и антител, а флуоресценция (максимальная) представляет собой общий лизис клеток, индуцированный добавлением Triton X-100. Сигмоидальные кривые доза-ответ и значения ЕС50 рассчитывали посредством нелинейная регрессия/4-параметрическую логистическую модель с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США).
Результаты:
Различные биспецифические антигенсвязывающие белки EGFR/CD16A подвергали испытаниям вместе с контрольными конструкциями в 4-часовых количественных анализах цитотоксичности при высвобождении кальцеина на клетках-мишенях A-431 EGFR+ и HCT-116. Антигенсвязывающие белки не продемонстрировали цитотоксичности вне мишени. На Фигуре 12 продемонстрированы результаты одного примерного эксперимента. Результаты 3 независимых экспериментов обобщены в Таблице 6 (клетки-мишени A-431) и Таблице 7 (клетки-мишени HCT-116).

Таблица 6: Цитотоксичность биспецифических антигенсвязывающих белков EGFR/CD16A на клетках-мишенях A-431
Среднее значение и SD значений EC50 [пМ] для антигенсвязывающих белков EGFR/CD16A определяли в трех независимых 4-часовых количественных анализах цитотоксичности при высвобождении кальцеина на опухолевых клетках-мишенях A-431 EGFR+ с обогащенными NK-клетками человека в качестве эффекторных клеток при соотношении E:T, составляющем 5:1. SD, стандартное отклонение; отсутствие, лизис отсутствует; нет данных, не применимо.

Таблица 7: Цитотоксичность биспецифических антигенсвязывающих белков EGFR/CD16A на клетках-мишенях HCT-116
Среднее значение и SD значений EC50 [пМ] для антигенсвязывающих белков EGFR/CD16A определяли в трех независимых 4-часовых количественных анализах цитотоксичности при высвобождении кальцеина на опухолевых клетках-мишенях HCT-116 EGFR+ с обогащенными NK-клетками человека в качестве эффекторных клеток при соотношении E:T, составляющем 5:1. SD, стандартное отклонение; отсутствие, лизис отсутствует; нет данных, не применимо.
Пример 6:
Ингибирование фосфорилирования EGFR
Чтобы сравнить ингибирующее воздействие различных антигенсвязывающих белков EGFR/CD16A на EGF-индуцированную передачу сигналов EGFR, проводили количественные анализы фосфорилирования с клетками A-431.
Материалы и способы:
Культуру клеточных линий
A-431 (ATCC, № в каталоге: CRL-1555) культивировали в стандартных условиях в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen) при 37°C в увлажненной воздушной среде с 5% CO2.
Количественный анализ фосфорилирования
Говоря кратно, аликвоты 5×104 клеток A-431 (ATCC, № в каталоге: CRL-1555) высевали в отдельных лунках 96-луночного планшета в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen) в течение 20 часов при 37°C в увлажненной воздушной среде с 5% CO2. Затем клеткам не давали питание в течение 4 часов в среде без сыворотки крови перед добавлением серийных разведений указанных конструкций антител. Через 30 мин инкубации при 37°C, EGF (Sigma, № в каталоге: 10605-HNAE-250) добавляли до конечной концентрации 100 нг/мл, и далее культуры инкубировали в течение 10 минут при 37°C перед промыванием клеток ледяным PBS (Invitrogen, № в каталоге: 14190-169), и лизировали, и использовали для относительного количественного определения фосфорилированного EGFR с использованием набора Phospho-EGFR ELISA Kit (RayBiotech, № в каталоге: PEL-EGFR-Y), в соответствии с инструкциями производителя. Абсорбцию измеряли при 450 нм с использованием многопластинчатого считывателя (Victor 3, Perkin Elmer). Значения абсорбции анализировали и строили график с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США).
Количественные анализы связывания клеток и анализ проточной цитометрии
Аликвоты указанных клеток инкубировали со 100 мкл серийных разведений указанных антител в FACS буфере (PBS, Invitrogen, № в каталоге: 14190-169), содержащем 2% инактивированной нагреванием FCS (Invitrogen, № в каталоге: 10270-106), 0,1% азида натрия (Roth, Карлсруэ, Германия, № в каталоге: A1430.0100) в течение 45 минут при 37°C. После повторной промывки FACS буфером, связанные с клетками тандемные диантитела определяли посредством 10 мг/мл анти-His mAb 13/45/31-2 (Dianova, Гамбург, Германия, № в каталоге: DIA910-1MG), а затем - посредством 15 мкг/мл FITC-конъюгированного козьего антимышиного IgG (Dianova, № в каталоге: 115-095-062) или посредством mAb 4-1-1, сгенерированного против домена Fv анти-CD16A ((SEQ ID NO:12,13), а затем - посредством 15 мкг/мл FITC-конъюгированного козьего антимышиного IgG. Связанный с клеточной поверхностью Bi-scFv-Fc_02 (SEQ ID NO:30), scFv-IgAb_01 и scFv-IgAb_02 (SEQ ID NO:28,29) определяли посредством FITC-конъюгированного козьего античеловеческого IgG (Dianova; № в каталоге: 109-095-088), или посредством mAb 4-1-1, а затем - посредством 15 мкг/мл FITC-конъюгированного козьего антимышиного IgG. Связанный с клеточной поверхностью цетуксимаб и IgAb_wtFc (IgAb_049) определяли посредством FITC-конъюгированного козьего античеловеческого IgG (Dianova; № в каталоге: 109-095-088). После последнего этапа окрашивания, клетки снова промывали и ресуспендировали в 0,2 мл FACS буфера, содержащего 2 мкг/мл пропидиум йодида (PI) (Sigma, № в каталоге: P4170) для того, чтобы исключить мертвые клетки. Флуоресценцию 2-5×103 живых клеток измеряли с использованием проточного цитометра Beckman-Coulter FC500 MPL с использованием программного обеспечения MXP (Beckman-Coulter, Крефельд, Германия) или проточного цитометра Millipore Guava EasyCyte (Merck Millipore, Швальбах, Германия). Средние значения интенсивности флуоресценции образцов клеток рассчитывали с использованием программного обеспечения CXP (Beckman-Coulter) или программного обеспечения Incyte (Merck Millipore, Швальбах, Германия). После вычитания значений интенсивности флуоресценции клеток, окрашенных только вторичными и третичными реагентами, эти значения использовали для анализа нелинейной регрессии с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США). Для расчета KD, использовали уравнение связывания с одним сайтом (гипербола).
Результаты:
Цетуксимаб IgG анти-EGFR, используемый в качестве позитивного контроля, и IgG1 человека с Fab-доменами анти-EGFR из имгатузумаба (IgAb_065) ингибировали EGF-индуцированным фосфорилированием EGFR дозозависимым образом со значениями EC50 в диапазоне 7 мкг/мл - 9 мкг/мл.
Тандемное диатело EGFR/CD16A, scFv-IgAb_01 EGFR/CD16A, Fc-выключенный IgG1 (IgAb_047) и IgG1 дикого типа (IgAb_049), при этом, все они содержат Fab-домен анти-EGFR, содержащий вариабельные домены, как представлено в SEQ ID NO:1 и 2, ингибировали фосфорилирование EGFR со значительно более низкой активностью со значениями EC50, которые были выше 100 мкг/мл.
Примечательно, что scFv-IgAb_02, содержащий домены анти-EGFR, как представлено в SEQ ID NO:1 и 2, и scFv, слитый с С-концом Fc, не продемонстрировали или продемонстрировали лишь очень незначительное ингибирующее воздействие на EGF-индуцированное фосфорилирование EGFR.
Эти данные предполагают, что scFv-IgAb_02 проявляет сниженный антагонизм на уровне рецепторов, по сравнению с цетуксимабом и имгатузумабом и, следовательно, проявляет сниженную токсичность в тканях, зависящих от передачи сигналов EGFR для тканевого гомеостаза, например, в коже.
Тандемное диатело CD19/CD16A, используемое в качестве негативного контроля, не продемонстрировало ингибирования фосфорилирования EGFR. Результаты эксперимента, представленные на Фигуре 13 и Фигуре 14, обобщены в Таблице 8.
Таблица 8: Сводная таблица количественных анализов фосфорилирования EGFR с использованием клеток A-431.
>100 мкг/мл
>100 мкг/мл
>100 мкг/мл
>100 мкг/мл
>100 мкг/мл
9,9 мкг/мл
8,9 мкг/мл
8,3 мкг/мл
7,7 мкг/мл
не подвергалось исследованиям
Различия между подвергнутыми испытаниям конструкциями на основе антител и форматами в их ингибирующем воздействии на EGF-индуцированное фосфорилирование EGFR нельзя объяснить различиями в их аффинности к EGFR, поскольку кажущаяся аффинность связывания с клетками A-431 (значение KD) не коррелирует с активностью в ингибировании EGF-индуцированного фосфорилирования EGFR (Таблица 9; Фигура 14).
Например: Тандемное диатело EGFR/CD16A проявляет немного более низкую/или аналогичную аффинность связывания с клетками A-431, по сравнению с scFv-IgAb_02 или Bi-scFv-Fc_02, но обладает значительно более сильным ингибирующим воздействием на фосфорилирование, чем scFv-IgAb_02 или Bi-scFv-Fc_02. Или: кажущаяся аффинность к EGFR на клетках A-431 scFv-IgAb_01 или Bi-scFv-Fc_02 находится в том же диапазоне, что и для цетуксимаба, но ингибирующее воздействие на фосфорилирование EGFR scFv-IgAb_01 или Bi-scFv-Fc_02 - существенно ниже в отношении цетуксимаба.
Поскольку все подвергнутые испытаниям антигенсвязывающие белки EGFR/CD16A содержат одинаковые домены связывания с EGFR и с CD16A, то воздействия на EGF-опосредованное фосфорилирование EGFR должны быть связаны с внутренними свойствами трехмерной структуры антигенсвязывающих белков. Только scFv-IgAb_02 и Bi-scFv-Fc_02, которые содержат EGFR-связывающие домены в C-концевом положении, демонстрируют это специфическое свойство (отсутствие или лишь незначительное ингибирующее воздействие на фосфорилирование).
Поэтому предполагается, что это уникальное свойство транслируется в улучшенный профиль побочных эффектов, по сравнению, например, с цетуксимабом. Причина этого предположения заключается в том, что токсическое поражение кожи, наблюдаемое с ингибиторами EGFR, обусловлена нежелательным ингибирующим воздействием на передачу сигналов EGFR кератиноцитов кожи, как было описано ранее.
Таблица 9: Кажущаяся аффинность различных антигенсвязывающих белков анти-EGFR, определенная в экспериментах по связыванию клеток на клетках A-431 при 37°C
количество, количество независимых экспериментов; среднее значение KD определенного количества экспериментов; SD, стандартное отклонение, не подвергалось исследованиям, не применимо
Пример 7:
Оценка фармакокинетических (PK) свойств:
Определение сывороточных концентраций scFv-IgAb_02 и Bi-scFv-Fc_02 у CD1 мышей после однократного внутривенного введения соответствующего антитела:
Оценку PK антигенсвязывающих белков EGFR/CD16A проводили в исследованиях PK с однократной дозой на CD1 мышах. Следует отметить, что у CD1 мышей отсутствует связывание с номинальными мишенями, и опосредованные мишенями воздействия не могут быть исследованы в этой модели. Однако подвергнутые испытаниям элементы, которые в полной мере перекрестно реагируют на рецептор FcRn мыши, и воздействия FcRn на период полужизни должны быть отражены полностью. Для оценки антигенсвязывающих белков EGFR/CD16A в PK-анализе в сыворотке мыши были использованы две системы проведения испытаний. Первая система проведения испытаний была установлена в формате ELISA, а впоследствии, эту платформу перевели на платформу считывателя MSD. Два количественных анализа показали согласование между сывороточными концентрациями и данными PK.
Аппликационные растворы scFv-IgAb_02 и Bi-scFv-Fc_02 для внутривенного медленного болюсного введения дозы 300 мкг/мышь были приготовлены для получения конечной концентрации 300 мкг/250 мкл.
Было проведено два исследования PK:
Забор крови (сбор образцов осуществляли до проведения лечения (Предварительная доза), временной период - до 168 часов после проведения лечения (исследование 1) и временной период - до 504 часов после проведения лечения (исследование 2).
Количество кровотечений/животное: 3
Количество животных на временную точку: 4
Забор крови проводили посредством пункции ретробульбарного венозного сплетения под анестезией Изофлураном. Объем крови составлял 100-150 мкл (примерно, 30 мкл сыворотки крови).
Животных умерщвляли сразу же после 3-го терминального кровотечения.
Цельную кровь перерабатывали в сыворотку, и все образцы немедленно замораживали и хранили при температуре ниже -65°C.
В первом исследовании, оценку фармакокинетики сыворотки крови за временной период 168 часов (7 дней) проводили посредством MSD и ELISA. Периодами полужизни были:
 scFv-IgAb_02: 79 часов
scFv-IgAb_02: 79 часов
 Bi-scFv-Fc_02: 96 часов
Bi-scFv-Fc_02: 96 часов
Затем было проведено следующее исследование, так как период забора крови был слишком коротким, и время терминальной элиминации нельзя было рассчитать надлежащим образом. Поэтому, во втором исследовании, оценку фармакокинетики сыворотки крови проводили за временной период 504 часа (21 день) только для scFv-IgAb_02 (определение сывороточных концентраций посредством ELISA). Период наблюдения был достаточным, и можно было выполнить абсолютно надежный расчет периода полужизни в фазе элиминации. Периодом полужизни для scFv-IgAb_02 было:
• 329,2 часа
Определение периодов полужизни у мышей:
Фармакокинетические параметры определяли посредством некомпартментного использования программы PK Solutions (версия 2.0) компании Summit Research Services (68911 Open Field Dr., Монтроз, штат Колорадо 81401 США).
Пример 8:
Ингибирование EGF-стимулированного фосфорилирования EGFR в клетках A-431 и A-549
Чтобы сравнить ингибирующее воздействие различных антигенсвязывающих белков EGFR/CD16A на EGF-индуцированную передачу сигналов EGFR, проводили количественные анализы фосфорилирования с клетками A-431 и A-549.
Материалы и способы:
Культуру клеточных линий
A-431 (ATCC, № в каталоге: CRL-1555) и A-549 (DSMZ, № в каталоге: ACC 107) культивировали в стандартных условиях в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen) при 37°C в увлажненной воздушной среде с 5% CO2.
Количественный анализ фосфорилирования
Говоря кратко, аликвоты 5×104 клеток A-431 или A-549 высевали в отдельных лунках 96-луночного планшета в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen) в течение 20-22 часов при 37°C в увлажненной воздушной среде с 5% CO2. Затем клетки не давали питательные вещества в течение 4 часов в бессывороточной среде перед добавлением серийных разведений указанных конструкций антител. Через 30 мин инкубации при 37°C, EGF (Sigma, № в каталоге: 10605-HNAE-250) добавляли до конечной концентрации 100 нг/мл, и далее культуры инкубировали в течение 10 минут при 37°C перед промыванием клеток ледяным PBS (Invitrogen, № в каталоге: 14190-169), и лизировали, и использовали для относительного количественного определения фосфорилированного EGFR с использованием набора Phospho-EGFR ELISA Kit (RayBiotech, № в каталоге: PEL-EGFR-Y), в соответствии с инструкциями производителя. Абсорбцию измеряли при длине волны 450 нм с использованием многопластинчатого считывателя (Victor 3, Perkin Elmer). Значения абсорбции анализировали и строили график с использованием программного обеспечения GraphPad Prism (GraphPad Prism версии 6.00 для Windows, GraphPad Software, Ла-Хойя, Калифорния, США).
Результаты:
Ингибирующее воздействие scFv-IgAb (scFv-IgAb_02) EGFR/CD16A, эталонных IgG анти-EGFR цетуксимаба и панитумумаба, и различных контрольных антител на фосфорилирование EGFR при стимуляции посредством EGF оценивали с использованием клеток A-431 (Фигура 15a) и клеток A-549 (Фигура 15b). Описание антител и сводные значения ЕС50, определенные для дозозависимого ингибирования фосфорилирования EGFR, представлены в Таблице 10.
IgG анти-EGFR цетуксимаба и панитумумаба, используемые в качестве эталонных антител, ингибировали EGF-индуцированное фосфорилирование EGFR дозозависимым образом со значением EC50, составляющим 7,7 мкг/мл и 8,2 мкг/мл на клетках A-431, и 0,1 мкг/мл и 0,3 мкг/мл на клетках A-549, соответственно. scFv-IgAb (scFv-IgAb_44) RSV/CD16A использовали в качестве негативного контроля, и он не продемонстрировал ингибирующее воздействие на EGF-стимулированное фосфорилирование EGFR.
IgG1 дикого типа (IgAb_49) и Fc-усиленный IgG1 (IgAb_53), при этом, все они содержали домен Fab анти-EGFR, содержащий вариабельные домены, представленные в SEQ ID NO:1 и 2, ингибировали фосфорилирование EGFR со значительно более низкой активностью, чем цетуксимаб или панитумумаб, со значениями EC50, которые были в 5-6 раз выше на клетках A-431 и в 75-300 раз выше на клетках A-549.
Примечательно, что scFv-IgAb_02 и scFv-IgAb_45, содержащие домены анти-EGFR, представленные в SEQ ID NO:1 и 2 в виде scFv, слитого с С-концом Fc, и отличающиеся только доменами Fab, продемонстрировали только ингибирующее воздействие на EGF-индуцированное фосфорилирование EGFR при высоких концентрациях со значениями EC50 в диапазоне от 1,1 мг/мл до 1,5 мг/мл на клетках A-431 и от 478 мкг/мл до 643 мкг/мл на клетках A-549.
Эти данные предполагают, что scFv-IgAb_02 проявляет сниженный антагонизм на уровне рецепторов, по сравнению с антителами IgG1, содержащими идентичные домены Fv анти-EGFR (IgAb_49 и IgAb_53). По сравнению с ингибированием, опосредованным цетуксимабом, разница была даже более существенной, и в отношении scFv-IgAb_02 EGFR/CD16A можно было наблюдать, примерно, в 200 раз меньшую активность на клетках A-431 и, примерно, в 5000 раз меньшую активность на клетках A-549. Исходя из этих данных, можно сделать вывод, что сниженное ингибирование передачи сигналов EGFR со стороны scFv-IgAb_02 связано с улучшенным профилем побочных эффектов и транслируется в менее сильное токсическое поражение кожи, которое обычно наблюдается при использовании антител анти-EGFR, обладающих мощными антагонистическими свойствами на уровне рецепторов, таких как цетуксимаб и панитумумаб.
Таблица 10: Сводная таблица количественных анализов фосфорилирования EGFR с использованием клеток A-431 и A-549.
§, нижняя граница, ограниченна до 0,25 для анализа нелинейной регрессии и расчета значений EC50. $, нижняя граница, ограниченная до 0,1 для анализа нелинейной регрессии и расчета значений EC50.
Пример 9:
Оценка ингибирования фосфорилирования сигнальных белков EGFR при обработке EGF посредством scFv-IgAb_02
Способы:
Культивирование клеточных линий.
A-431 (ATCC, № в каталоге: CRL-1555) культивировали в стандартных условиях в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen). Клетки культивировали в среде, не содержащей питательные вещества (среда RPMI 1640 (Invitrogen) с 1% FCS) в течение 1 часа до использования в экспериментах.
Ингибирование передачи сигналов EGFR посредством антител.
3×106 клеток, если указано, инкубировали с 20 мкг/мл соответствующего антитела в течение 1 часа при 37°C в увлажненной воздушной среде. Впоследствии, клетки стимулировали добавлением рекомбинантного EGF человека (ThermoFisher, №10605HNAE250) в концентрации 100 нг/мл в течение либо 5, либо 15 минут при 37°C в увлажненной воздушной среде. Затем клетки промывали и лизировали буфером для количественного анализа радиоиммунопреципитации (RIPA), содержащим 150 мМ NaCl (AppliChem, № 131659.1211), 1% Triton X 100 (Roth, № 30512), 0,05% Дезоксихолата натрия (Sigma, № D6750), 0,1% SDS (Roth, № CN30.1), 50 мМ Трис (Biomol, № 08003.1), ингибиторы протеазы (Roche, № 11697498001) и ингибиторы фосфатазы (Roche, № 4906845001), в течение 45 минут на льду. После центрифугирования в течение 15 минут при 300xg и 4°C, супернатанты смешивали в соотношении 1:1 с восстанавливающим буфером для образцов, содержащим 62,5 мМ Трис-HCl с pH 6,8, 2% SDS, 5% Глицерина (Applichem, № A2926,055), 200 мМ Бромфенолового синего (Roth, № A512.1), 0,1 М DTT (Roth, № 6908.2), и нагревали до 95°C в течение 10 минут, а затем подвергали ДНС-ПААГ на 4-20% геле Criterion TGX Precast SDS-PAGE Gel (Bio-Rad, № 5678095) в 1x буфер Трис/Глицин/SDS (Bio-Rad, № 1610732) при 300 В в течение 22 минут. Для иммуноблоттинга, белки переносили на мембраны из PVDF (BioRad, № 1704157) с использованием системы Trans-Blot Turbo Transfer System (Bio-Rad), в соответствии с инструкциями производителя. Затем мембраны блокировали в 5% обезжиренном молоке (Sigma, № 70166) в TBS в течение 1 часа при комнатной температуре, трижды промывали посредством TBS и инкубировали первичные антитела, разведенные, как рекомендовано поставщиком, в 5% BSA (Sigma, № A3059), 0,05% NaN3 (Roth, № K305.1) в TBS, в течение 1 часа при комнатной температуре или в течение ночи при 4°C. Затем мембраны трижды промывали посредством TBS и инкубировали с HRP-конъюгированным вторичным антителом в TBS и 5% обезжиренном молоке в течение 1 часа при комнатной температуре. После промывки посредством TBS, хемилюминесценцию после добавления раствора ECL (ThermoFisher, № 32209) измеряли с использованием системы визуализации ChemiDoc MP Imaging System (Bio-Rad) и анализировали с использованием программного обеспечения Image Lab Software (BioRad). Список подвергнутых испытаниям антител представлен в Таблице 11, список антител, используемых для определения белков, представлен в Таблице 12.
Таблица 11: Антитела подвергли испытаниям.

Таблица 12: Антитела, используемые для определения сигнальных белков.
Результаты
Чтобы оценить воздействие scFv_IgAb_02 EGFR/CD16A на ингибирование EGF-индуцированной передачи сигналов EGFR, клетки A-431 инкубировали с scFv-IgAb_02 и, в качестве контроля, с scFv-IgAb_45 EGFR/RSV или IgG1 анти-EGFR цетуксимабом. Стимуляцию проводили в течение 5 минут и 15 минут, соответственно, а индукцию фосфорилирования оценивали посредством Вестерн-блоттинга.
Изображения блотов представлены на Фигурах 16 и 17. Количественное определение относительной интенсивности полос для соответствующих фосфопротеинов представлено на Фигурах 18, 19 и 20.
Результаты, представленные в этом примере, демонстрируют фосфорилирование EGFR, Akt и Erk при стимуляции клеток A-431 посредством EGF. Фосфорилирование EGFR и его ингибирование измеряли после 5-минутной и 15-минутной стимуляции посредством EGF (Фигура 18), тогда как различия в pAkt и pErk были наиболее выражены через 5 минут (Фигура 19) или 15 минут (Фигура 20), соответственно.
Предварительная инкубация клеток с цетуксимабом блокировала EGF-стимуляцию EGFR, Akt и Erk, тогда как предварительная инкубация с scFv-IgAb_02 EGFR/CD16A или scFv-IgAb_45 EGFR/RSV не оказывала или оказывала лишь незначительное ингибирующее воздействие на EGF-стимулированное фосфорилирование EGFR, Akt и Erk. EGF-стимуляция и обработка антител не влияли на уровни общего белка EGFR, Akt и Erk.
Пример 10:
Высвобождение цитокинов из PBMC, индуцированное scFv-IgAb_02
Выделение PBMC из лейкоцитарных пленок
PBMC выделяли из лейкоцитарных пленок (Немецкий Красный Крест, Мангейм, Германия) центрифугированием в градиенте плотности. Образцы лейкоцитарных пленок разбавляли двукратным или трехкратным объемом PBC (Invitrogen, № в каталоге: 14190-169), наносили слоями на подушку Lymphoprep (Stem Cell Technologies, № в каталоге: 07861) и центрифугировали при 800×g в течение 25 минут при комнатной температуре без перерыва. PBMC, расположенные на поверхности раздела фаз, собирали и промывали 3 раза посредством PBS до их культивирования в полной среде RPMI 1640 с добавлением 10% FCS в течение ночи без стимуляции.
Культуру клеточных линий
A-431 (ATCC, № в каталоге: CRL-1555) культивировали в стандартных условиях в среде DMEM с добавлением 10% инактивированной нагреванием FCS, 2 мМ L-глутамина и 100 МЕ/мл пенициллина G-натрия, и 100 мкг/мл стрептомицина сульфата (все компоненты - от компании Invitrogen) при 37°C в увлажненной воздушной среде с 5% CO2.
Проводили количественное определение цитокинов, высвобождаемых из PBMC, стимулированных scFv-IgAb_02 в присутствии или в отсутствие клеток-мишеней EGFR+.
5×105 первичных PBMC человека кокультивировали с клетками-мишенями A-431 EGFR+ при соотношении эффектора к мишени, составляющем 50:1. Кокультуры инкубировали в полной среде RPMI 1640 с добавлением 10% FCS в присутствии или в отсутствие возрастающих концентраций scFv-IgAb_02 в общем объеме 200 мкл. Фоновые уровни цитокинов в культурах оценивали путем включения культур PBMC или только клеток A-431 в присутствии или в отсутствие scFv-IgAb_02. В качестве позитивного контроля, кокультуры инкубировали с активатором DynaBeads Human T-Activator CD3/CD28 (Gibco, № в каталоге: 11132D), стимулируя высвобождение всех подвергаемых испытаниям цитокинов из Т-клеток в популяции PBMC. Все культуры инкубировали в течение 4 часов, 24 часов или 48 часов при 37°C и 5% CO2 в увлажненном инкубаторе перед центрифугированием при 70×g в течение 2 минут при комнатной температуре. Супернатанты клеточных культур (70 мкл) собирали из каждой лунки и переносили в круглодонные 96-луночные микропланшеты для хранения при -80°C до проведения количественного определения цитокинов посредством мультиплексной методики на основе гранул в компании Bioassay GmbH (Гейдельберг, Германия) с использованием набора BD™ Cytometric Bead Array (CBA) Human Th1/Th2 Cytokine Kit II (BD Bioscience). Результаты были проанализированы, и на их основании построен график с использованием GraphPad Prism для Windows (версия 6.00/7.03, GraphPad Software, Ла-Хойя, Калифорния, США).
Определение состояния активации NK при кокультивировании PBMC в присутствии или в отсутствие клеток-мишеней и scFv-IgAb_02.
Активацию NK-клеток оценивали с помощью проточной цитометрии клеточных осадков после сбора супернатанта для количественного определения цитокинов. Для этого, клетки промывали и ресуспендировали в CD56-PC7 (5 мкл/испытание; Beckman Coulter, A21692), CD25-PE (10 мкл/испытание; Beckman Coulter, A07774) и CD69-PC5 (5 мкл/испытание; Beckman Coulter, IM2656) в окрашивающем FACS буфере с общим объемом 100 мкл (PBS, содержащий 2% инактивированной нагреванием FCS и 0,1% азида натрия). После 15 минут инкубации на льду в темноте, клетки промывали, ресуспендировали в FACS буфере и анализировали проточной цитометрией.
Результаты
Высвобождение шести цитокинов, а именно, Интерлейкина-2 (IL-2), Интерлейкина-4 (IL-4), Интерлейкина-6 (IL-6), Интерлейкина-10 (IL-10), Фактора некроза опухоли (TNF) и Интерферона-γ (IFN-γ) оценивали в супернатантах клеточных культур после 4 часа, 24 часа и 48 часов кокультивирования PBMC и A-431 в присутствии или в отсутствие возрастающих концентраций scFv-IgAb_02.
Инкубация только PBMC и в присутствии A-431 не привела к определяемому повышению уровней IL-2, IL-4, IL-6, IL-10, TNF-α или IFN-γ при стимуляции посредством гранул активатора CD3/CD28 привело к заметному высвобождению всех подвергшихся испытаниям цитокинов (данные не показаны). Воздействие PBMC на возрастающие концентрации scFv-IgAb_02 привело к маргинальному высвобождению всех цитокинов. Максимальное высвобождение цитокинов из PBMC, индуцированное только scFv-IgAb_02, было расценено как фоновый уровень соответствующего цитокина (Таблица 13).
Уровни цитокинов в супернатантах клеточных культур PBMC и клеток-мишеней A-431, которые повысили фоновые уровни, примерно, в 5 раз, были расценены как позитивные сигналы и были обобщены в Таблице 13. Эти анализы выявили scFv-IgAb_02-индуцированное, дозозависимое высвобождение IL-6, TNF-α и IFN-γ в кокультурах PBMC и клетках-мишенях EGFR+ в указанные временные точки. Какого-либо scFv-IgAb_02-индуцированного высвобождения всех других подвергнутых испытаниям цитокинов свыше фонового уровня определить не удалось.
Таблица 13: Сводная таблица высвобожденных цитокинов при кокультивировании первичных PBMC человека и клеток-мишеней A-431 EGFR+, и возрастающих концентраций scFv-IgAb_02. Продемонстрированы активность (EC50) и максимальный ответ (Emax) scFv-IgAb_02-индуцированного высвобождения цитокинов.
ScFv-IgAb_02-индуцированное, дозозависимое высвобождение IL-6 определяли после 24 часов и 48 часов кокультивирования PBMC и A-431 со значениями активности (EC50), составляющими 3,7 и 7,1 пМ, соответственно (Таблица 13; Фигура 21).
ScFv-IgAb_02-индуцированную секрецию TNF-α можно было оценить через 4 часа и 24 часа, соответственно (Таблица 13; Фигура 22), тогда как повышенные уровни IFN-γ можно было измерить исключительно через 4 часа (Таблица 13; Фигура 23).
Дозозависимое повышение количества антител NK-клеток CD69+ можно было определить через 24 часа и 48 часов кокультивирования PBMC и клеток A-431 с максимальной 44% активацией, поддерживающей NK-клети в применяемой схеме количественного анализа (Фигура 24B, фигура 25B). Повышенные уровни NK-клеток CD69+ также можно было определить через 24 часа культивирования в отсутствие клеток A-431, но исключительно при высоких концентрациях scFv-IgAb_02. Явного scFv-IgAb_02-индуцированного увеличения маркера поздней активации CD25 NK-клеток при кокультивировании PBMC в присутствии клеток A-431 в течение 24 часов и 48 часов, соответственно, определено не было.
Пример 11:
Фармакодинамические исследования (POC) в условиях in vivo
Несколько POC исследований scFv-IgAb_02 в условиях in vivo были проведены с профилактическим и терапевтическим режимами дозирования на модели гуманизированной мыши, несущей ксенотрансплантированные опухоли EGFR+ человека. Модель состояла из гидродинамически IL-15-простимулированных NOD/Shi-scid/IL-2Rгnull (NOG) мышей, которым предварительно пересадили гемопоэтические стволовые клетки CD34+ человека, полученные из пуповинной крови. Опухоли были пересажены подкожной инокуляцией в объеме 1×106 клеток А-431 в День 0 (D0). Модель была предоставлена компанией TransCure BioServices SAS, Франция. В ходе предварительных исследований, было продемонстрировано достижение стабильного воссоздания иммунологических эффекторных клеток человека (включая NK-клетки человека) и последовательного захвата и роста опухолевых клеток A-431. Очевидно, в настоящее время эта модель является лучшей моделью гуманизированной мыши для воссоздания NK-клеток человека (с получением порядка 1-2×104 NK-клеток человека на мл периферической крови).
Четыре исследования с использованием scFv-IgAB_02 в вышеуказанной модели мыши более подробно представлены ниже.
В схемах профилактического лечения (то есть, лечения, начинающееся с момента инокуляции опухоли), наблюдалась тенденция к снижению роста опухоли при лечении посредством scFv-IgAB_02 в дозе 5 мг/кг и значительное ингибирование роста опухоли в дозе 10 мг/кг и выше. В схемах терапевтического лечения (то есть лечения, начинающегося тогда, когда опухоль достигала объема 50-100 мм3), значительное ингибирование роста опухоли при лечении scFv-IgAB_02 также наблюдалось, начиная с уровня дозы 10 мг/кг и выше, что продемонстрировало противоопухолевую эффективность scFv-IgAB_02 в модели мыши.
Согласно вышеописанным примерам, показывающим исследования в условиях in vitro, сделан вывод, что scFv-IgAB_02 обладает двойным противоопухолевым механизмом действия, состоящим из:
A) индукции ADCC и/или ADCP против опухолевых клеток EGFR+ посредством принудительного взаимодействия с NK-клетками CD16A+ и/или макрофагами
B) прямого ингибирующего воздействия на опухолевые клетки EGFR+ посредством блокирования рецептора EGFR,
при этом, индукция ADCC (и/или ADCP) обладает доминирующим противоопухолевым действием, проявляемым scFv-IgAB_02 (в отличие от цетуксимаба, где доминирует прямое ингибирование роста посредством блокирования фосфорилирования EGFR).
Два исследования POC на мышах были проведены с намерением отделить ADCC от прямого ингибирования роста посредством включения RSV/EGFR в качестве эталонного объекта. RSV/EGFR в этом случае представляет собой молекулу, содержащую идентичную EGFR-связывающую область и Fc-участок scFv-IgAB_02, но лишенную CD16A-связывающего фрагмента молекулы, который заменен нерелевантным RSV-связывающим доменом (Респираторно-синцитиальный-вирус) - которая, таким образом, не может индуцировать ADCC.
Первое из двух исследований RSV/EGFR показало немного лучшее противоопухолевое действие scFv-IgAB_02, чем RSV/EGFR (что указывает на вклад ADCC в общую противоопухолевую эффективность у модели опухоли A-431 мыши). Однако второе исследование, сравнивающее несколько различных уровней доз scFv-IgAB_02 и RSV/EGFR в группах профилактического и терапевтического лечения, показало одинаковую активность обоих вариантов у модели опухоли A-431 мыши. Таким образом, предполагается, что доминирование перекрывающихся фармакодинамических эффектов scFv-IgAB_02 у модели мыши с воссозданными клетками происходит, как представляется, благодаря ингибированию фосфорилирования (передача сигналов EGFR), что потенциально связано с низким количеством NK-клеток, присутствующих в этой модели, по сравнению с человеком.
Таким образом, модель гуманизированной мыши, хотя и обеспечивает общие POC для противоопухолевой эффективности scFv-IgAB_02 в условиях in vivo, не подходит для определения индукции ADCC против опухолей EGFR+ в качестве доминирующего эффекторного механизма scFv-IgAB_02.
В первоначальном исследовании сравнивали различные биспецифические антигенсвязывающие белки EGFR/CD16 (scFv-IgAB_02 и структурные/контрольные варианты) в профилактической схеме в eHIS-IL15-huNOG мышей, несущих опухолевые клетки A431. IL-15-простимулированные NOD/Shi-scid/IL-2Rгnull (NOG) мышей, которым пересадили гемопоэтические стволовые клетки (HuNOG) CD34+, полученные из пуповинной крови, вводили подкожной инокуляцией в объеме 1×106 клеток A431 в День 0 (D0). Животным еженедельно вводили внутривенно scFv-IgAB_02 и Bi-scFv_Fc_02 в дозах 5 мг/кг и 10 мг/кг в течение четырех недель (q7d×4), начиная с Дня 1. Цетуксимаб служил в качестве позитивного контроля в дозах 5 и 0,5 мг/кг с использованием одинаковых интервалов дозирования.
Цетуксимаб (5 мг/кг), scFv-IgAB_02 (15 мг/кг) и Bi-scFv_Fc_02 (15 мг/кг) индуцировали значительную задержку роста опухоли, по сравнению с носителем, у всех получавших их животных уже через двенадцать дней после пересадки опухолевых клеток (Фигура 26). Низкая доза (5 мг/кг) scFv-IgAB_02 и Bi-scFv_Fc_02 имеет тенденцию замедлять рост опухоли (незначительно), тогда как цетуксимаб (0,5 мг/кг) не оказывал никакого водействия.
В последующем исследовании эффективности, scFv-IgAB_02 подвергали испытаниям при различных уровнях доз в профилактической схеме. IL-15-простимулированные NOD/Shi-scid/IL-2Rгnull (NOG) мышей, которым пересадили гемопоэтические стволовые клетки (HuNOG) CD34+, полученные из пуповинной крови, вводили подкожной инокуляцией в объеме 1×106 клеток A431 в День 0 (D0). Исходя из степени гуманизации и процентного содержания NK-клеток в лейкоцитах человека, HuNOG мышей были рандомизированы в группы лечения (количество=7). Животным еженедельно вводили внутривенно scFv-IgAB_02 в дозах 5, 15 и 45 мг/кг; (q7d×4), начиная с D1.
Уже через 11 дней после пересадки опухолевых клеток, между группой, получавшей носитель, и группами, получавшими scFv-IgAB_02 (15 мг/кг) и scFv-IgAB_02 (45 мг/кг), наблюдалось значительное уменьшение объема опухоли. Через 41 день после пересадки опухолевых клеток (при умерщвлении), еженедельное введение scFv-IgAB_02 (5 мг/кг) уменьшало объем опухоли на 70%, по сравнению с носителем. scFv-IgAB_02 (15 и 45 мг/кг) уменьшал объем опухоли на 95%, по сравнению с носителем (Фигура 27).
Таким образом, наблюдалась тенденция к снижению роста опухоли при лечении scFv-IgAB_02 в дозе 5 мг/кг. Было замечено значительное ингибирование при 15 мг/кг и 45 мг/кг, что указывает на дозозависимость.
В другом исследовании, проводимом компанией Transcure, оценку эффективности проводили при терапевтической схеме.
Параллельно, в том же исследовании, scFv-IgAB_02 сравнивали с контрольной конструкцией RSV-EGFR при профилактической схеме. RSV/EGFR представляет собой молекулу, содержащую EGFR-связывающую область scFv-IgAB_02 и идентичный Fc-участок, но лишенную CD16A-связывающего фрагмента молекулы, который заменен нерелевантным RSV-связывающим доменом.
IL-15-простимулированные NOD/Shi-scid/IL-2Rгnull (NOG) мышей, которым пересадили гемопоэтические стволовые клетки (HuNOG) CD34+, полученные из пуповинной крови, вводили подкожной инокуляцией в объеме 1×106 клеток A431 в День 0 (D0). Исходя из степени гуманизации и процентного содержания NK-клеток в лейкоцитах человека, HuNOG мышей были рандомизированы в группы лечения (количество=7).
Терапевтическое лечение:
Когда опухоли A-431 достигли размера 50-100 мм3 на D17, животным вводили еженедельно внутривенно scFv-IgAB_02 в дозах 5, 15 и 45 мг/кг; (q7d×4).
Две самые высокие дозы scFv-IgAB_02 (15 мг/кг и 45 мг/кг) значительно снижали рост опухоли A431, соответственно на 70 и 90%. scFv-IgAB_02 в дозе 5 мг/кг не оказывал значительного воздействия на рост опухоли (Фигура 28A).
Профилактическое лечение:
Животным еженедельно вводили внутривенно scFv-IgAB_02 или RSV-EGFR в дозе 45 мг/кг, начиная с D1 (q7d×4).
Лечение посредством scFv-IgAB_02 (45 мг/кг) и RSV-EGFR (45 мг/кг) полностью предотвращало рост опухоли в течение первых 24 дней после пересадки опухолевых клеток. Начиная с D24, рост опухоли в группе с RSV-EGFR происходил быстрее, чем в группе с scFv-IgAB_02. На момент умерщвления, средний объем опухоли достиг 837 мм3 в группе с RSV-EGFR, а в группе с scFv-IgAB_02 - только 449 мм3 (Фигура 28B). Это различие было статистически значимым, что свидетельствовало о дополнительном фармакодинамическом воздействии scFv-IgAB_02, посредством ADCC, на максимальное прямое ингибирующее воздействие на опухолевые клетки EGFR+ посредством блокирования фосфорилирования EGFR обеими конструкциями.
Чтобы исследовать влияние/доказательство существования ADCC, как механизма действия в модели опухоли A431 у гуманизированных мышей, профилактическое лечение было подвергнуто испытаниям в диапазоне низких доз scFv-IgAB_02 и RSV-EGFR. Кроме того, терапевтическое лечение посредством scFv-IgAB_02 и RSV-EGFR сравнивали на уровне однократной дозы.
Девяносто IL-15-простимулированных гуманизированных мышей были рандомизированы в две группы, исходя из их степени гуманизации и количества NK-клеток (CD56+ клетки).
Профилактическая группа: Мышам в профилактических группах (по 6 мышей на группу) пересадили 1×106 клеток A431 в правый бок. Через день после инокуляции опухолевых клеток, мыши получали лечение (внутривенное введение, один раз в неделю в течение четырех недель и последнее введение за три дня до умерщвления). День 0 определен как день инокуляции опухолевых клеток. Было осуществлено следующее лечение:
• Группа 1: IL15-huNOG + A431 + Носитель (еженедельно, внутривенное введение)
• Группа 2: IL15-huNOG + A431 + scFv-IgAB_02 (1,25 мг/кг, еженедельно, внутривенное введение)
• Группа 3: IL15-huNOG + A431 + scFv-IgAB_02 (2,5 мг/кг, еженедельно, внутривенное введение)
• Группа 4: IL15-huNOG + A431 + scFv-IgAB_02 (5 мг/кг, еженедельно, внутривенное введение)
• Группа 5: IL15-huNOG + A431 + scFv-IgAB_02 (10 мг/кг, еженедельно, внутривенное введение)
• Группа 6: IL15-huNOG + A431 + RSV/EGFR (1,25 мг/кг, еженедельно, внутривенное введение)
• Группа 7: IL15-huNOG + A431 + RSV/EGFR (2,5 мг/кг, еженедельно, внутривенное введение)
• Группа 8: IL15-huNOG + A431 + RSV/EGFR (5 мг/кг, еженедельно, внутривенное введение)
• Группа 9: IL15-huNOG + A431 + RSV/EGFR (10 мг/кг, еженедельно, внутривенное введение)
Всех мышей умерщвляли через 35 дней после пересадки опухолевых клеток. Анализ проточной цитометрии был выполнен на периферической крови и инфильтрирующих опухоль клетках.
Терапевтическая группа: Мышам в терапевтических группах пересадили 1×106 клеток A431 в правый бок. Когда опухоль достигла объема 50-100 мм3, мышей рандомизировали, исходя из объема опухоли, степени гуманизации и количества NK-клеток, и начали лечение. День 0 определен как день первого лечения. Животные группы 10, а также 6 дополнительных животных из Групп 11 и 12 служили в качестве сателлитных животных для анализа проточной цитометрии.
Было осуществлено следующее лечение (внутривенное введение, один раз в неделю в течение четырех недель и последнее введение за три дня до умерщвления):
• Группа 10: IL15-huNOG + A431 + Носитель (еженедельно, внутривенное введение) количество=6
• Группа 11: IL15-huNOG + A431 + scFv-IgAB_02 (10 мг/кг, еженедельно, внутривенное введение) количество=15
• Группа 12: IL15-huNOG + A431 + RSV/EGFR (10 мг/кг, еженедельно, внутривенное введение) количество=15
Сателлитных мышей умерщвляли через 3 дня и 10 дней после начала лечения. В каждую временную точку умерщвляли трех мышей из Группы 11 и трех мышей из Группы 12. Через 24 дня после начала лечения, трех мышей с наибольшим объемом опухоли из каждой группы умертвили. Все оставшиеся мыши из терапевтических групп были умерщвлены через 30 дней после начала лечения. Анализ проточной цитометрии был выполнен на периферической крови и инфильтрирующих опухоль клетках сателлитных мышей. Через 30 дней после начала лечения, лимфоциты также были фенотипированы посредством проточной цитометрии.
Профилактическое лечение у модели гуманизированной мыши с опухолевыми клетками A431 эпидермоидной карциномы человека посредством scFv-IgAB_02 и RSV/EGFR значительно уменьшало объем опухоли при использовании дозы 10 мг/кг. Более низкая доза (1,25, 2,5 и 5 мг/кг) существенно не ингибировала рост опухоли, по сравнению с носителем. Лечение посредством RSV/EGFR и лечение посредством scFv-IgAB_02 оказывало одинаковое воздействие на рост опухоли при каждой дозе, подвергнутой испытаниям (Фигура 29). Количество NK-клеток у этой модели гуманизированной мыши может быть слишком низким для полного инициирования эффективного ADCC против опухолевых клеток.
Анализ проточной цитометрии на периферической крови сателлитных животных выявил, что количество клеток крови оставалось постоянным с течением времени, но уровень маркеров активации на NK-клетках (CD69 и NKp44) значительно повысился после пересадки опухолевых клеток.
Также исследовали фенотип инфильтрирующих опухоль иммунных клеток. По количеству клеток, значительной разницы между группами в отношении CD45, Т и NK-клеток не наблюдалось. Примечательно, что самая высокая доза как scFv-IgAB_02, так и RSV/EGFR, значительно повышала экспрессию CD69 и NKp44 на поверхности NK-клеток, по сравнению с группой, получавшей носитель.
Терапевтическое лечение посредством scFv-IgAB_02 и RSV/EGFR в дозе 10 мг/кг значительно уменьшало объем опухоли, по сравнению с носителем (Фигура 30). Значительной разницы между лечением посредством RSV/EGFR и scFv-IgAB_02 не наблюдалось.
Анализ проточной цитометрии на периферической крови продемонстрировал, что количество CD45, NK, T-клеток и CD14-позитивных клеток с течением времени остается постоянным. Значительной разницы между группами не наблюдалось.
Через 30 дней после начала лечения посредством scFv-IgAB_02, в опухоли наблюдалось масштабное повышение уровня CD45, NK и T-клеток и CD14-позитивных клеток. Экспрессия маркеров активации имела тенденцию быть выше у мышей, получавших scFv-IgAB_02, по сравнению с группой, получавшей носитель, и группой, получавшей RSV/EGFR. В селезенке, значительной разницы между группами не наблюдалось.
Пример 12:
Фармакокинетика
Программа фармакокинетики scFv-IgAB_02 включала:
• разработку аналитического количественного анализа чувствительности в матрице сыворотки крови яванского макака
• исследование PK однократной дозы, введенной внутривенно яванским макакам (три уровня доз)
• оценку PK/TK на основе исследования по определению диапазона доз у яванских макак (данные еще не получены)
• оценку PK/TK по результатам базового 28-дневного токсикологического исследования на яванских макаках (данные еще не получены)
Биоанализ фармакокинетических образцов, взятых у яванских макак
Для биоанализа Фармакокинетических образцов, взятых у яванских макак, был проведен электрохемилюминесцентный иммуноанализ на основе платформы MSD®. Платформа MSD® использует установку, аналогичную ELISA, но главное отличие состоит в том, что считывание не основано на ферментативной конверсии субстрата, как в классическом ELISA, а на реакции электрохемилюминесценции. Поэтому используют специальные микропланшеты с электродной поверхностью, которая адсорбирует антитело захвата. Кроме того, требуется детектор с электрохемилюминесцентной меткой, называемый SULFO-TAGTM (Трис-бипиридин рутения(II), конъюгированный в виде эфира NHS). В присутствии буфера считывания MSD (содержит Трипропиламин, TPA) обеспечивается соответствующая химическая среда для электрохемилюминесценции. Формирователь изображения MSD® подает напряжение на пластинчатые электроды, заставляя SULFO-Tag в непосредственной близости от дна пластины излучать свет через серию реакций восстановления и окисления. Интенсивность излучаемого света будет определена. Сигнал может быть амплифицирован несколькими циклами возбуждения каждой метки для повышения уровней освещенности и улучшения чувствительности. Поскольку механизм стимуляции (электричество) отделен от сигнала (свет), то возможны минимальные фоновые сигналы и высокие значения соотношения сигнал/фон. Количественный анализ имеет LLOQ, составляющий 5 нг/мл с превосходной селективностью по LLOQ. У 14/14 особей выявлено RE% <20.
Этот способ будет полностью валидирован в соответствии с GLP для подтверждения оценки TK в базовом исследовании токсичности.
Однократная доза PK у яванских макак
В исследование, проведенное компанией Citoxlab, всего было включено девять самцов яванских макак. Животные были разделены согласно нижеследующей таблице на три группы и получали scFv-IgAB_02 на уровне следующих доз: 8 мг/кг (три самца), 25 мг/кг (три самца) и 75 мг/кг (три самца). Введение осуществляли путем 2-часовой инфузии со скоростью 5 мл/кг/час.
мг/кг
Каждое животное проверяли на предмет смертности и заболеваемости дважды в день в ходе исследования. Их наблюдали, по меньшей мере, дважды в день с целью регистрации клинических признаков. Особое внимание уделяли любым местным реакциям в сайте введения.
Массу животного регистрировали дважды за период, предшествовавший лечению, затем в День 1 и, по меньшей мере, один раз в неделю до конца исследования.
Забор крови осуществляли в день дозирования (День 1) перед введением дозы и сразу после окончания инфузии, через 5 минут, 0,5, 1, 4, 8, 12, 24 и 48 часов и в День 5 (96 часов), 8 (168 часов), 11 (240 часов), 15 (336 часов) и 22 (504 часа) после прекращения инфузии. У каждого животного брали образец для установления иммуногенности до начала лечения и в Дни 8, 15 и 22 одновременно с образцом PK.
Биоанализ и анализ иммуногенности были выполнены в компании Chimera Biotec. На момент оформления настоящего документа результат иммуногенности еще не был получен. Фармакокинетический анализ был выполнен в компании Citoxlab France с использованием некомпартментного анализа на программном обеспечении WinNonlin® версии 6.4. Следующие параметры: Cmax, Tmax, AUC0-last и AUC0-inf, t1/2, VZ, CL, MRT и AUMC определяли на основании измеренных концентраций в анализируемых образцах.
По завершении периода наблюдения, в День 27, на всех животных воздействовали седативным средством посредством внутримышечного введения гидрохлорида кетамина, обезболивали посредством внутривенного введения пентобарбитала натрия и подвергали эвтаназии путем обескровливания.
Что касается результатов PK, то в образцах перед введением дозы не было обнаружено scFv-IgAB_02 в объемах, поддающихся количественному определению.
На основании полученных данных, можно сделать следующие выводы (см. Таблицу 14):
• системное воздействие на объект испытания было достигнуто у всех животных,
• как и ожидалось, Tmax был достигнут в конце инфузии scFv-IgAB_02,
• конечный период полужизни находился в диапазоне от 33,4 до 154 часов,
• на основании нормализованных по дозе значений AUC0-t было отмечено сверхпропорциональное дозозависимое повышение экспозиции объекта испытания в сыворотке крови в диапазоне на уровне введенных доз, в то время как при рассмотрении нормализованного по дозе Cmax наблюдалось, примерно, пропорциональное дозозависимое повышение.
• Наблюдалось небольшое повышение конечного значения периода полужизни по мере повышения уровня дозы, что подтверждает дозозависимое изменение наблюдаемого системного CL scFv-IgAB_02.
• Конечный объем распределения VZ приблизительно соответствует общему объему плазмы у обезьяны, что указывает на тот факт, что scFv-IgAB_02 в основном локализован в объеме плазмы.
• Уменьшение конечного объема значений распределения наблюдалось с повышением дозы, что указывает на возможный механизм насыщения распределения/интернализации в тканях объекта испытания.
Таблица 14: Фармакокинетические параметры отдельных животных в исследовании, проведенном компанией Citoxlab
мг/кг
час
мкг/мл
час⋅мкг/мл
мл/кг
мл/час/кг
Пример 13:
Распределение scFv-IgAB_02 в тканях мышей с опухолью EGFR+
Оценку распределения scFv-IgAB_02 в тканях проводили путем внутривенного введения 125I-scFv-IgAB_02 в Модель мыши с ксенотрансплантатом с клетками A431.
scFv-IgAB_02 метили радиоактивным йодом с использованием Йодогена в качестве окислителя до конечной специфической активности, составляющей 2 мКи/мг. Целостность меченой молекулы подтверждали эксклюзионной хроматографией по размеру и ДНС-ПААГ.
Биологическую активность подтверждали посредством количественного анализа RIA на huCD16A и количественного анализа насыщения связывания на клетках A-431 для определения соответствующих значений KD (KD: 0,729 нМ и 6,982, соответственно; в настоящем документе данные не показаны). Стабильность в плазме мыши подтверждали за период 7 дней.
38 мышам подкожно в правый бок ксенотрансплантировали 5 Ч 106 клеток А-431. В день введения 125I-scFv-IgAB_02, средний объем опухоли составлял, примерно, 289±83 мм3; и соответствовал ее росту за 2-х недельный период после инокуляции.
Распределение в тканях (включая нацеливание на опухоль) оценивали в 8 конечных временных точках: 30 минут, 8, 24, 48, 72, 96, 168 и 336 часов. Кроме того, трех животных поместили в метаболические клетки на срок до 168 часов для сбора мочи и кала, что позволило определить путь экскреции и баланс массы. Параллельно с этим, через 48 и 336 часов после введения дозы проводили количественное аутографическое исследование всего тела.
Самая высокая концентрация радиоактивности в опухоли наблюдалась между 8 и 48 часами, а максимальное поглощение опухолью 125I-scFv-IgAB_02 произошло через 24 часа после введения дозы, достигнув 8,56% ID/г. В более поздние временные точки, радиоактивность в опухоли постепенно снижалась и составила 5,62% ID/г через 96 часов. Радиоактивность не полностью исчезла из опухоли через 336 часов (1,21% ID/г), что указывает на удержание scFv-IgAB_02 в опухолевой ткани (Фигура 31).
Для большинства органов (кроме желудка и шейки матки) соотношение опухоль/орган увеличилось между 30 мин и 24-48 часами, что позволяет предположить, что радиоактивность, накопленная в опухоли, удалялась медленнее, чем радиоактивность, измеренная в органах, что снова указывает на удержание scFv-IgAB_02 в опухолевой ткани (Фигура 32).
Пик поглощения радиоактивности наблюдался в течение первых 30 минут после введения 125I-scFv-IgAB_02 практически у всех здоровых тканей (за исключением кожи, шейки матки, мышцы и пищеварительного тракта, где максимальная концентрация наблюдалась через 8 и 24 часа). Затем уровень радиоактивности в этих тканях со временем снижался без выраженного удерживания, что соответствовало снижению активности пула крови.
На протяжении всего периода наблюдения, самая высокая нормальная концентрация радиоактивности в органах была обнаружена в органах, участвующих в метаболизме белков и выведении из системного кровотока, в таких как печень, селезенка и почки, с %ID/г, составляющем 7,25, 8,37 и 14,75, соответственно, а также в органах, участвующих в селективном накоплении свободного йода, например, в желудке (4,14% ID/г через 8 часов). Кроме того, высокие уровни радиоактивности были обнаружены в легких, где концентрация радиоактивности составила 10,02% ID/г через 30 мин; предположительно, из-за наличия агрегатов в дозируемом растворе (примерно, 3%, согласно анализу, проведенному методом Эксклюзионной ВЭЖХ), а также в яичниках и шейке матки, где концентрация радиоактивности составила 11,22% ID/г через 30 мин и 6,54% ID/г через 24 часа, соответственно.
После внутривенного введения 125I-scFv-IgAB_02, примерно половина активности введенного препарата восстанавливалась с экскретами через 168 часов с кумулятивным экскрецией с мочой и калом 43,27% и 7,40%, соответственно. Радиоактивность, выводимая через почку, вряд ли была связана с scFv-IgAB_02, но должна соответствовать свободному йоду-125, высвобождаемому в процессе дегалогенирования.
Для проведения ауторадиографии, мышей умерщвляли через 48 и 336 часов после введения дозы. Результаты ауторадиографии всего тела продемонстрировали ожидаемую картину биораспределения, по сравнению с результатами, полученными в соответствии с методикой диссекции ткани. Действительно, через 48 часов после введения дозы радиоактивность была обнаружена в основном в опухоли, легких и органах, участвующих в метаболизме и механизмах выделения, таких как печень, почки и селезенка. Снимки, сделанные через 336 часов, показали почти полное снижение радиоактивности во всех органах/тканях, в то время как большая часть оставшейся активности была обнаружена в опухоли (Фигура 33).
Пример 14:
Токсикология
Токсикологические исследования биспецифических антигенсвязывающих белков EGFR/CD16, подтверждающих исследование FIM у пациентов с опухолями на поздней стадии, были проведены на яванских макаках, используемых в качестве релевантных видов. Токсикологические исследования у других видов не проводились.
Проведенная на данный момент программа токсикологии scFv-IgAB_02 включала:
• исследование по определению диапазона повторных доз, вводимых внутривенно, продолжительностью 28 дней, проводимое на яванских макаках (не GLP)
• базовое исследование по определению токсичности повторных доз, вводимых внутривенно, продолжительностью 28 дней, проводимое на яванских макаках (GLP)
Можно ожидать, что у scFv-IgAB_02 может быть одинаковый с Цетуксимабом профиль токсичности из-за структурного сходства и частично одинакового механизма действия. Однако важно отметить, что благодаря сниженному потенциалу scFv-IgAB_02 в ингибировании фосфорилирования EGFR, можно ожидать улучшения профиля побочных эффектов (отсутствие или сниженное токсического поражения кожи). Тем не менее, уровни доз были адаптированы на основании результатов 39-недельного исследования, поведенного на яванских макаках, которым внутривенно вводили Цетуксимаб (Исследование 070-087, EMEA 2004; Научное обсуждение по вопросу одобрения Эрбитукса).
В исследовании по определению диапазона повторных доз, вводимых внутривенно, scFv-IgAB_02 не индуцировал системную или локальную токсичность. scFv-IgAB_02 не повлиял на результаты клинических наблюдений, массу тела, температуру тела, клиническую паталогию или патологическую анатомию на уровне максимальной подвергнутой испытаниям дозы 75 мг/кг (q7d×5). Единственными отмеченными проявлениями было транзиторное повышение уровней циркулирующего IL-6 после первой дозы на всех уровнях доз (в течение 6 часов после введения). Уровни IL-6 вернулись к норме в течение 24 часов после первой дозы. scFv-IgAB_02 не воздействовал негативно на уровни IL-2, IFN-г и TNF-б после первой дозы. Кроме того, scFv-IgAB_02 вызывал транзиторное снижение абсолютного количества NK-клеток (CD3-CD20-CD159+ позитивные) и NK-клеток, активированных CD69+, в периферической крови в дозе ≥24 мг/кг через 7 дней после первой дозы.
В базовом 28-дневном исследовании внутривенной токсичности scFv-IgAB_02, объект испытания хорошо переносился на уровне максимальной дозы 75 мг/кг (q7d×5). Единственными подтвержденными на данный момент результатами, связанными с объектом испытания, была рвота у двух животных при дозе 75 мг/кг в День 1 и повышение количества WBC, и особенно нейтрофилов, через 4 часа после введения дозы в День 1. Транзиторное повышение количества нейтрофилов может быть вызвано транзиторным повышением уровней IL-6 в сыворотке крови (по меньшей мере, на это указывают литературные данные). Некоторые конечные точки базового исследования еще не были получены на момент оформления настоящего документа.
Исследование по определению диапазона повторных доз, вводимых внутривенно, проведенное на яванских макаках
Цель исследования состояла в том, чтобы определить максимально переносимую дозу объекта испытания после повторной еженедельной внутривенной инфузии (2-часовая инфузия, проводимая в кресле), проводимой яванскому макаку в течение 4 недель (всего 5 инфузий), и 5-недельной фазы восстановления. Десять яванских макак маврикийского происхождения (пять самцов и пять самок) были распределены по дозовым группам следующим образом.
F=Самки; M=Самцы.
Из-за структурного и функционального сходства уровни доз и режим дозирования были выбраны в строгом соответствии с оценкой токсичности Цетуксимаба (EMA 2004 Научное обсуждение: WC5000291131).
Оценка токсичности была основана на клинических наблюдениях, массе тела, температуре тела и клинической патологии и патологической анатомии.
Уровни цитокинов IL-2, IL-6, IL-8, TNF-б и INF-г определяли посредством технологии Multiplex, а также посредством оценки проточной цитометрии субпопуляций лимфоцитов после каждого уровня дозы (CD45, CD3, CD4, CD8, CD20, CD16, CD159a).
Полную некропсию выполняли у всех животных, у которых были зарегистрированы макроскопические отклонения во всех тканях. Были проведены взвешивание органов и микроскопическое исследование.
Забирали кровь для оценки токсикокинетики scFv-IgAB_02 и противолекарственных антител. Биоанализ токсикокинетических образцов и анализ противолекарственных антител еще не завершены.
scFv-IgAB_02 не повлиял на клинические наблюдения, массу тела, температуру тела или на клиническую патологию и патологическую анатомию.
Фармакологическое действие scFv-IgAB_02 проявлялось посредством транзиторного повышения уровней циркулирующего IL-6 на всех уровнях дозы через 2-4 часа после первой дозы, с быстрым понижением уровней IL-6 через 4 часа, а также с возвращением к исходному уровню через 24 часа (см. Фигуру 34).
Учитывая динамический характер гомеостаза NK-клеток и малочисленный размер групп, участвовавших в этом исследовании, невозможно однозначно оценить воздействия, оказываемые scFv-IgAB_02, на количество NK-клеток и состояние активации. Почти все данные находились в пределах вариабельности совокупности данных, полученных до приема дозы. Считают, что тенденция к транзиторному снижению абсолютного количества NK-клеток (CD3-CD20-CD159+) и NK-клеток, активированных CD69+, в дозе ≥24 мг/кг, появившемуся в День 8, связана с scFv-IgAB_02, поскольку контрольная группа не пострадала.
Таким образом, scFv-IgAB_02 не индуцировал системную или локальную токсичность. scFv-IgAB_02 хорошо переносился на уровне максимальной дозы (75 мг/кг) при введении яванским макакам один раз в неделю в течение 28 дней посредством внутривенной инфузии, проводимой в течение 2 часов в кресле для инфузии.
Базовое 28-дневное исследование токсичности при внутривенном введении, проведенное на яванских макаках
Было проведено базовое исследование токсичности повторных доз, соответствующее требованиям GLP, продолжительностью четыре недели, на яванских макаках (Контрактно-исследовательская организация: Covance). На момент написания настоящего документа, практическая фаза исследования была завершена, и были доступны первоначальные или частичные результаты. Однако некоторые окончательные анализы этого исследования (например, гистопатология, токсикокинетика) еще не были завершены.
Цель исследования состояла в том, чтобы определить токсичность scFv-IgAB_02 после проведения повторной внутривенной инфузии (2-часовая инфузия, один раз в неделю) яванскому макаку в течение 28 дней (всего 5 инфузий) и оценить обратимость наблюдаемых проявлений, если таковые имеются, в течение 28-дневной фазы восстановления. Был выбран внутривенный путь введения, поскольку он предназначен для лечения человека.
Уровни вводимых доз scFv-IgAB_02 составляли 0, 8, 24 и 75 мг/кг. Исследование состояло из четырех конечных групп умерщвления, как указано в таблице ниже, включая животных групп приема носителя, средней и высокой дозы и группы восстановления.
Во время периода дозирования, обезьян наблюдали на предмет проявления клинических признаков, измеряли температуры тела и массу тела, проводили гематологический и биохимический анализы крови, анализ мочи, а также ЭКГ, измеряли артериальное давление и проводили офтальмоскопию. Кроме того, уровни цитокинов IL-2, IL-6, IL-8, TNF-б и INF-г определяли посредством технологии Multiplex, а также посредством оценки проточной цитометрии субпопуляций лимфоцитов после каждого уровня дозы (CD45, CD3, CD4, CD8, CD20, CD16, CD159a, CD14).
Особое внимание уделяли токсическому поражению кожи (особенно отсроченной токсичности), поскольку кожа является основной мишенью Цетуксимаба. Наиболее заметными проявлениями применения Цетуксимаба были поверхностные гнойные поражения кожи.
После завершения исследования, все ткани по списку EMA были собраны и подвергнуты гистопатологическому исследованию, при этом, дополнительное внимание уделяли вторичной суперинфекции, вызванной эрозивно-язвенным дерматитом с последующим поражением внутренних органов.
Исследование включает комплексную оценку TK и оценку ADA.
Случаев предтерминальной смертности не наблюдалось, а также не потребовалось какого-либо ветеринарного лечения в связи с объектом испытания.
Некоторые изменения кожи произошли у отдельных животных в Группах 1-4 в ходе исследования без очевидной дозозависимости. Эти результаты были сочтены случайными и не связанными с дозой объекта испытания.
Что касается клинических наблюдений, то у двух самцов, принимавших высокую дозу (Животные P0301 и P0305), наблюдалась рвота во время приема первой дозы (рвота жидкостью и/или слизью). Поскольку это наблюдалось только при приеме высокой дозы, то считается, что этот результат связан с объектом испытания.
Дальнейшие клинические наблюдения, такие как опухоли и мягкий кал, сочли случайными, поскольку они были редкими, у них отсутствовала зависимость доза-ответ, или результаты наблюдения были сопоставимы с результатами, обычно наблюдаемыми у этого вида лабораторных животных.
Лечение посредством scFv-IgAB_02 в дозе до 75 мг/кг не повлияло на развитие массы тела. Развитие массы тела было сопоставимо с таковым в контрольной группе во время фазы дозирования и восстановления.
Лечение посредством scFv-IgAB_02 в дозе до 75 мг/кг не повлияло на температуру тела. Значительные различия между животными из группы со средней температурой тела, получавшими дозы объекта испытания, и животными из контрольной группы имели место, но их сочли случайными, поскольку у них отсутствовала зависимость доза-ответ.
Не было замечено каких-либо офтальмологических проявлений в связи с объектом испытания. Такие результаты, как кровотечение, более светлые участки, уплотнение, друзы, эпипапиллярная мембрана, поражения, помутнение, пигментация или рубцы, наблюдались единично у животных, получавших лечение, и у контрольных животных, и/или возникали также в фазе до приема дозы и были сопоставимы с результатами, обычно наблюдаемыми у яванских макак.
Лечение посредством scFv-IgAB_02 в дозе до 75 мг/кг не повлияло на артериальное давление и частоту дыхательных движений.
В отношении гематологии,
• животные всех групп продемонстрировали повышенное количество ретикулоцитов, начиная с Дня 8 фазы дозирования. Это считается физиологическим компенсаторным эффектом частых заборов крови.
• Количество WBC и, конечно, количество нейтрофилов повысилось у животных Групп 2-4 в День 1 фазы дозирования через 4 часа после введения дозы. Различие не было связано с дозозависимостью. У двух животных из группы со средней дозой (24 мг/кг) такое повышение было полностью обратимым через 24 часа после введения дозы. У других животных и групп через 24 часа образца не брали. Восстановление было продемонстрировано у всех остальных групп в День 8. Однако полное восстановление через 24 часа ожидается во всех группах.
Лечение посредством scFv-IgAB_02 в дозе до 75 мг/кг не повлияло на клиническую химию, коагуляцию и параметры мочи.
В настоящее время, гистопатология, оценка TK и ADA, а также некоторые другие конечные точки, такие как анализ ЭКГ, анализ на иммунофенотипирование, анализ цитокинов, все еще не завершены. Все предварительные макроскопические наблюдения были согласованы со спонтанными фоновыми изменениями, обычно встречающимися у этого вида. Однако окончательное заключение Патологоанатома, участвующего в Исследовании, еще не получено. Аналогичная ситуация и с массой органов.
Обобщая сказанное, подтвержденные на данный момент результаты, относящиеся к объекту испытания, являются следующими:
•Рвота у двух животных при дозе 75 мг/кг в День 1
•Повышение количества WBC и особенно ANEU через 4 часа после введения дозы в День 1.
Список последовательностей
QVQLQESGPGLVKPSETLSLTCTVSGGSVSSGSYYWSWIRQPPGKGLEWIGYIYYSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARNPISIPAFDIWGQGTMVTVSS
SFFPPGYQ
GMRTEDLPKAVVFLEPQWYRVLEKDSVTLKCQGAYSPEDNSTQWFHNESLISSQASSYFIDAATVDDSGEYRCQTNLSTLSDPVQLEVHIGWLLLQAPRWVFKEEDPIHLRCHSWKNTALHKVTYLQNGKGRKYFHHNSDFYIPKATLKDSGSYFCRGLFGSKNVSSETVNITITQGLAVSTISSFFPPGYQ
GYTFTSYY
INPSGGST
ARGSAYYYDFADY
NIGSKN
QDN
QVWDNYSVL
IEPMYGST
QVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGIINPSGGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSS
SYVLTQPSSVSVAPGQTATISCGGHNIGSKNVHWYQQRPGQSPVLVIYQDNKRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQVWDNYSVLFGGGTKLTVL
QVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGAIEPMYGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSS
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG
GQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
GGGGSGGGGS
GGSGGSGGSGGSGGSGGS
EPKSCDKTHTCPPCP
APEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG
GGSVSSGSYY
IYYSGST
ARNPISIPAFDI
NIGSKS
YDS
QVWDTSSDHVL
QVQLQESGPGLVKPSETLSLTCTVSGGSVSSGSYYWSWIRQPPGKGLEWIGYIYYSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARNPISIPAFDIWGQGTMVTVSSGGSGGSGGSSYVLTQPSSVSVAPGQTATISCGGHNIGSKNVHWYQQRPGQSPVLVIYQDNKRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQVWDNYSVLFGGGTKLTVLGGSGGSQVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGIINPSGGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSSGGSGGSGGSQPVLTQPPSVSVAPGKTARITCGGNNIGSKSVHWYQQKPGQAPVLVIYYDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDTSSDHVLFGGGTKLTVLAAAGSHHHHHH
QVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGIINPSGGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGGGGGSGGGGSQVQLQESGPGLVKPSETLSLTCTVSGGSVSSGSYYWSWIRQPPGKGLEWIGYIYYSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARNPISIPAFDIWGQGTMVTVSSGGSGGSGGSGGSGGSGGSQPVLTQPPSVSVAPGKTARITCGGNNIGSKSVHWYQQKPGQAPVLVIYYDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDTSSDHVLFGGGTKLTVL
SYVLTQPSSVSVAPGQTATISCGGHNIGSKNVHWYQQRPGQSPVLVIYQDNKRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQVWDNYSVLFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
SYVLTQPSSVSVAPGQTATISCGGHNIGSKNVHWYQQRPGQSPVLVIYQDNKRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQVWDNYSVLFGGGTKLTVLGGSGGSGGSGGSGGSGGSGGSQVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGIINPSGGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSSEPKSCDKTHTCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGGGGGSGGGGSQVQLQESGPGLVKPSETLSLTCTVSGGSVSSGSYYWSWIRQPPGKGLEWIGYIYYSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARNPISIPAFDIWGQGTMVTVSSGGSGGSGGSGGSGGSGGSQPVLTQPPSVSVAPGKTARITCGGNNIGSKSVHWYQQKPGQAPVLVIYYDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDTSSDHVLFGGGTKLTVL
EVQLLESGGGLVQPGGSLRLSCAVSGIDLSNYAINWVRQAPGKGLEWIGIIWASGTTFYATWAKGRFTISRDNSKNTVYLQMNSLRAEDTAVYYCARTVPGYSTAPYFDLWGQGTLVTVSS
DIQMTQSPSSVSASVGDRVTITCQSSPSVWSNFLSWYQQKPGKAPKLLIYEASKLTSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCGGGYSSISDTTFGGGTKVEIK
TAATACGACTCACTATAGGG
TAGAAGGCACAGTCGAGG
GGSGGS
GGSGGSGGS
GGSGGSGGSGGSGGSGGSGGS
GYTFTSYY
ARGSAYYYDFADY
NIGSKN
QDN
QVWDNYSVL
QVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGAIEPMYGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGGGGGSGGGGSQVQLQESGPGLVKPSETLSLTCTVSGGSVSSGSYYWSWIRQPPGKGLEWIGYIYYSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARNPISIPAFDIWGQGTMVTVSSGGSGGSGGSGGSGGSGGSQPVLTQPPSVSVAPGKTARITCGGNNIGSKSVHWYQQKPGQAPVLVIYYDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDTSSDHVLFGGGTKLTVL
SYVLTQPSSVSVAPGQTATISCGGHNIGSKNVHWYQQRPGQSPVLVIYQDNKRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQVWDNYSVLFGGGTKLTVLGQPKAAPSVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADSSPVKAGVETTTPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
SYVLTQPSSVSVAPGQTATISCGGHNIGSKNVHWYQQRPGQSPVLVIYQDNKRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQVWDNYSVLFGGGTKLTVLGGSGGSGGSGGSGGSGGSGGSQVQLVQSGAEVKKPGESLKVSCKASGYTFTSYYMHWVRQAPGQGLEWMGAIEPMYGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGSAYYYDFADYWGQGTLVTVSSEPKSCDKTHTCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGGGGGSGGGGSQVQLQESGPGLVKPSETLSLTCTVSGGSVSSGSYYWSWIRQPPGKGLEWIGYIYYSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARNPISIPAFDIWGQGTMVTVSSGGSGGSGGSGGSGGSGGSQPVLTQPPSVSVAPGKTARITCGGNNIGSKSVHWYQQKPGQAPVLVIYYDSDRPSGIPERFSGSNSGNTATLTISRVEAGDEADYYCQVWDTSSDHVLFGGGTKLTVL
--->
Перечень последовательностей
<110> АФФИМЕД ГМБХ
<120> БИСПЕЦИФИЧЕСКИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ БЕЛОК EGFR/CD16
<130> A 3317PCT
<150> EP18161871.1
<151> 2018-03-14
<160> 45
<170> BiSSAP 1.3.6
<210> 1
<211> 120
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи
<400> 1
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Ser Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asn Pro Ile Ser Ile Pro Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 2
<211> 108
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен легкой цепи
<400> 2
Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Thr Ser Ser Asp His
85 90 95
Val Leu Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 3
<211> 8
<212> ПРТ
<213> homo sapiens (c лат. человек разумный)
<400> 3
Ser Phe Phe Pro Pro Gly Tyr Gln
1 5
<210> 4
<211> 192
<212> ПРТ
<213> homo sapiens (c лат. человек разумный)
<400> 4
Gly Met Arg Thr Glu Asp Leu Pro Lys Ala Val Val Phe Leu Glu Pro
1 5 10 15
Gln Trp Tyr Arg Val Leu Glu Lys Asp Ser Val Thr Leu Lys Cys Gln
20 25 30
Gly Ala Tyr Ser Pro Glu Asp Asn Ser Thr Gln Trp Phe His Asn Glu
35 40 45
Ser Leu Ile Ser Ser Gln Ala Ser Ser Tyr Phe Ile Asp Ala Ala Thr
50 55 60
Val Asp Asp Ser Gly Glu Tyr Arg Cys Gln Thr Asn Leu Ser Thr Leu
65 70 75 80
Ser Asp Pro Val Gln Leu Glu Val His Ile Gly Trp Leu Leu Leu Gln
85 90 95
Ala Pro Arg Trp Val Phe Lys Glu Glu Asp Pro Ile His Leu Arg Cys
100 105 110
His Ser Trp Lys Asn Thr Ala Leu His Lys Val Thr Tyr Leu Gln Asn
115 120 125
Gly Lys Gly Arg Lys Tyr Phe His His Asn Ser Asp Phe Tyr Ile Pro
130 135 140
Lys Ala Thr Leu Lys Asp Ser Gly Ser Tyr Phe Cys Arg Gly Leu Phe
145 150 155 160
Gly Ser Lys Asn Val Ser Ser Glu Thr Val Asn Ile Thr Ile Thr Gln
165 170 175
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
180 185 190
<210> 5
<211> 8
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 5
Gly Tyr Thr Phe Thr Ser Tyr Tyr
1 5
<210> 6
<211> 8
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 6
Ile Asn Pro Ser Gly Gly Ser Thr
1 5
<210> 7
<211> 13
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 7
Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr
1 5 10
<210> 8
<211> 6
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 8
Asn Ile Gly Ser Lys Asn
1 5
<210> 9
<211> 5
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 9
Gln Asp Asn Lys Arg
1 5
<210> 10
<211> 9
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 10
Gln Val Trp Asp Asn Tyr Ser Val Leu
1 5
<210> 11
<211> 8
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 11
Ile Glu Pro Met Tyr Gly Ser Thr
1 5
<210> 12
<211> 120
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 13
<211> 106
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен легкой цепи
<400> 13
Ser Tyr Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly His Asn Ile Gly Ser Lys Asn Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asn Tyr Ser Val Leu
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 14
<211> 120
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Glu Pro Met Tyr Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 15
<211> 328
<212> ПРТ
<213> искусственная последовательность
<220>
<223> подавленный кристаллизуемый фрагмент антитела
<400> 15
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
65 70 75 80
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
85 90 95
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
100 105 110
Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
115 120 125
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
130 135 140
Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
145 150 155 160
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
165 170 175
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
180 185 190
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
195 200 205
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
210 215 220
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
225 230 235 240
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
245 250 255
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
260 265 270
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
275 280 285
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
290 295 300
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
305 310 315 320
Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 16
<211> 106
<212> ПРТ
<213> homo sapiens (с лат. человек разумный)
<400> 16
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 17
<211> 10
<212> ПРТ
<213> искусственная последовательность
<220>
<223> линкер
<400> 17
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 18
<211> 18
<212> ПРТ
<213> искусственная последовательность
<220>
<223> линкер
<400> 18
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
1 5 10 15
Gly Ser
<210> 19
<211> 15
<212> ПРТ
<213> (с лат. человек разумный)
<400> 19
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 20
<211> 216
<212> ПРТ
<213> искусственная последовательность
<220>
<223> подавленный кристаллизуемый фрагмент антитела
<400> 20
Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly
210 215
<210> 21
<211> 10
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 21
Gly Gly Ser Val Ser Ser Gly Ser Tyr Tyr
1 5 10
<210> 22
<211> 7
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 22
Ile Tyr Tyr Ser Gly Ser Thr
1 5
<210> 23
<211> 12
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 23
Ala Arg Asn Pro Ile Ser Ile Pro Ala Phe Asp Ile
1 5 10
<210> 24
<211> 6
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 24
Asn Ile Gly Ser Lys Ser
1 5
<210> 25
<211> 4
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 25
Tyr Asp Ser Asp
1
<210> 26
<211> 11
<212> ПРТ
<213> искусственная последовательность
<220>
<223> участки молекулы антитела, распознающие антиген
<400> 26
Gln Val Trp Asp Thr Ser Ser Asp His Val Leu
1 5 10
<210> 27
<211> 489
<212> ПРТ
<213> искусственная последовательность
<220>
<223> тандемное диатело
<400> 27
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Ser Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asn Pro Ile Ser Ile Pro Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly
115 120 125
Ser Ser Tyr Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly
130 135 140
Gln Thr Ala Thr Ile Ser Cys Gly Gly His Asn Ile Gly Ser Lys Asn
145 150 155 160
Val His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Ile
165 170 175
Tyr Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly
180 185 190
Ser Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala
195 200 205
Met Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asn Tyr Ser Val
210 215 220
Leu Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Ser Gly Gly
225 230 235 240
Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
245 250 255
Glu Ser Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
260 265 270
Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
275 280 285
Met Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys
290 295 300
Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val
305 310 315 320
Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr
325 330 335
Cys Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly
340 345 350
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Ser Gly Gly Ser Gly
355 360 365
Gly Ser Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro
370 375 380
Gly Lys Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys
385 390 395 400
Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val
405 410 415
Ile Tyr Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser
420 425 430
Gly Ser Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu
435 440 445
Ala Gly Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Thr Ser Ser
450 455 460
Asp His Val Leu Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ala Ala
465 470 475 480
Ala Gly Ser His His His His His His
485
<210> 28
<211> 705
<212> ПРТ
<213> искусственная последовательность
<220>
<223> тяжелая цепь
<400> 28
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln
450 455 460
Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr
465 470 475 480
Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly Ser Tyr Tyr Trp Ser
485 490 495
Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile
500 505 510
Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val
515 520 525
Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser
530 535 540
Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asn Pro
545 550 555 560
Ile Ser Ile Pro Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr
565 570 575
Val Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
580 585 590
Gly Ser Gly Gly Ser Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser
595 600 605
Val Ala Pro Gly Lys Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile
610 615 620
Gly Ser Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
625 630 635 640
Val Leu Val Ile Tyr Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu
645 650 655
Arg Phe Ser Gly Ser Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser
660 665 670
Arg Val Glu Ala Gly Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp
675 680 685
Thr Ser Ser Asp His Val Leu Phe Gly Gly Gly Thr Lys Leu Thr Val
690 695 700
Leu
705
<210> 29
<211> 212
<212> ПРТ
<213> искусственная последовательность
<220>
<223> легкая цепь
<400> 29
Ser Tyr Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly His Asn Ile Gly Ser Lys Asn Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asn Tyr Ser Val Leu
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala
100 105 110
Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn
115 120 125
Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val
130 135 140
Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu
145 150 155 160
Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser
165 170 175
Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser
180 185 190
Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro
195 200 205
Thr Glu Cys Ser
210
<210> 30
<211> 734
<212> ПРТ
<213> искусственная последовательность
<220>
<223> Bi-scFv-Fc
<400> 30
Ser Tyr Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly His Asn Ile Gly Ser Lys Asn Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asn Tyr Ser Val Leu
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Ser Gly Gly Ser
100 105 110
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Tyr
145 150 155 160
Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
180 185 190
Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met
195 200 205
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Glu Pro Lys Ser Cys Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Gly
465 470 475 480
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly
485 490 495
Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val
500 505 510
Ser Gly Gly Ser Val Ser Ser Gly Ser Tyr Tyr Trp Ser Trp Ile Arg
515 520 525
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Tyr Tyr Ser
530 535 540
Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser
545 550 555 560
Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr
565 570 575
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asn Pro Ile Ser Ile
580 585 590
Pro Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
595 600 605
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
610 615 620
Gly Ser Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro
625 630 635 640
Gly Lys Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys
645 650 655
Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val
660 665 670
Ile Tyr Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser
675 680 685
Gly Ser Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu
690 695 700
Ala Gly Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Thr Ser Ser
705 710 715 720
Asp His Val Leu Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
725 730
<210> 31
<211> 121
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен тяжелой цепи
<400> 31
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Ile Asp Leu Ser Asn Tyr
20 25 30
Ala Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Trp Ala Ser Gly Thr Thr Phe Tyr Ala Thr Trp Ala Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Thr Val Pro Gly Tyr Ser Thr Ala Pro Tyr Phe Asp Leu Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 32
<211> 110
<212> ПРТ
<213> искусственная последовательность
<220>
<223> вариабельный домен легкой цепи
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Pro Ser Val Trp Ser Asn
20 25 30
Phe Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Glu Ala Ser Lys Leu Thr Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Gly Gly Tyr Ser Ser Ile
85 90 95
Ser Asp Thr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 33
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> праймер
<400> 33
taatacgact cactataggg 20
<210> 34
<211> 18
<212> ДНК
<213> искусственная последовательность
<220>
<223> праймер
<400> 34
tagaaggcac agtcgagg 18
<210> 35
<211> 6
<212> ПРТ
<213> искусственная последовательность
<220>
<223> линкер
<400> 35
Gly Gly Ser Gly Gly Ser
1 5
<210> 36
<211> 9
<212> ПРТ
<213> искусственная последовательность
<220>
<223> линкер
<400> 36
Gly Gly Ser Gly Gly Ser Gly Gly Ser
1 5
<210> 37
<211> 21
<212> ПРТ
<213> искусственная последовательность
<220>
<223> линкер
<400> 37
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
1 5 10 15
Gly Ser Gly Gly Ser
20
<210> 38
<211> 8
<212> ПРТ
<213> искусственная последовательность
<220>
<223> определяющая комплементарность область 1 тяжелой цепи
<400> 38
Gly Tyr Thr Phe Thr Ser Tyr Tyr
1 5
<210> 39
<211> 13
<212> ПРТ
<213> искусственная последовательность
<220>
<223> определяющая комплементарность область 3 тяжелой цепи
<400> 39
Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr
1 5 10
<210> 40
<211> 6
<212> ПРТ
<213> искусственная последовательность
<220>
<223> определяющая комплементарность область 1 легкой цепи
<400> 40
Asn Ile Gly Ser Lys Asn
1 5
<210> 41
<400> 41
000
<210> 42
<211> 9
<212> ПРТ
<213> искусственная последовательность
<220>
<223> определяющая комплементарность область 1 легкой цепи
<400> 42
Gln Val Trp Asp Asn Tyr Ser Val Leu
1 5
<210> 43
<211> 705
<212> ПРТ
<213> искусственная последовательность
<220>
<223> тяжелая цепь
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Glu Pro Met Tyr Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln
450 455 460
Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr
465 470 475 480
Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly Ser Tyr Tyr Trp Ser
485 490 495
Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile
500 505 510
Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val
515 520 525
Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser
530 535 540
Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asn Pro
545 550 555 560
Ile Ser Ile Pro Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr
565 570 575
Val Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
580 585 590
Gly Ser Gly Gly Ser Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser
595 600 605
Val Ala Pro Gly Lys Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile
610 615 620
Gly Ser Lys Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
625 630 635 640
Val Leu Val Ile Tyr Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu
645 650 655
Arg Phe Ser Gly Ser Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser
660 665 670
Arg Val Glu Ala Gly Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp
675 680 685
Thr Ser Ser Asp His Val Leu Phe Gly Gly Gly Thr Lys Leu Thr Val
690 695 700
Leu
705
<210> 44
<211> 212
<212> ПРТ
<213> искусственная последовательность
<220>
<223> легкая цепь
<400> 44
Ser Tyr Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly His Asn Ile Gly Ser Lys Asn Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asn Tyr Ser Val Leu
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala
100 105 110
Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn
115 120 125
Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val
130 135 140
Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu
145 150 155 160
Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser
165 170 175
Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser
180 185 190
Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro
195 200 205
Thr Glu Cys Ser
210
<210> 45
<211> 734
<212> ПРТ
<213> искусственная последовательность
<220>
<223> тяжелая цепь
<400> 45
Ser Tyr Val Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Thr Ile Ser Cys Gly Gly His Asn Ile Gly Ser Lys Asn Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Asn Tyr Ser Val Leu
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Ser Gly Gly Ser
100 105 110
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Tyr
145 150 155 160
Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Ala Ile Glu Pro Met Tyr Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
180 185 190
Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met
195 200 205
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Ser Ala Tyr Tyr Tyr Asp Phe Ala Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Glu Pro Lys Ser Cys Asp Lys Thr His
245 250 255
Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Gly
465 470 475 480
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly
485 490 495
Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val
500 505 510
Ser Gly Gly Ser Val Ser Ser Gly Ser Tyr Tyr Trp Ser Trp Ile Arg
515 520 525
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Tyr Tyr Ser
530 535 540
Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser
545 550 555 560
Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr
565 570 575
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asn Pro Ile Ser Ile
580 585 590
Pro Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
595 600 605
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
610 615 620
Gly Ser Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro
625 630 635 640
Gly Lys Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys
645 650 655
Ser Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val
660 665 670
Ile Tyr Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser
675 680 685
Gly Ser Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu
690 695 700
Ala Gly Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Thr Ser Ser
705 710 715 720
Asp His Val Leu Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
725 730
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИВАЛЕНТНЫЕ FV-АНТИТЕЛА | 2016 |
|
RU2785766C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ, ОБЛАДАЮЩИЕ ОГРАНИЧЕННЫМ СВЯЗЫВАНИЕМ С СD3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2813816C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| КРИОКОНСЕРВИРОВАННЫЕ КЛЕТКИ-ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ, ПРЕДВАРИТЕЛЬНО НАГРУЖЕННЫЕ КОНСТРУКЦИЕЙ АНТИТЕЛА | 2019 |
|
RU2819927C2 |
| НОВОЕ АНТИ-С-МЕТ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2751720C2 |
| ИНДУЦИБЕЛЬНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2800034C2 |
| АКТИВИРУЕМЫЕ ПРОТЕАЗОЙ СВЯЗЫВАЮЩИЕ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ | 2017 |
|
RU2830288C2 |
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2815683C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2022 |
|
RU2824285C2 |
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2727836C2 |
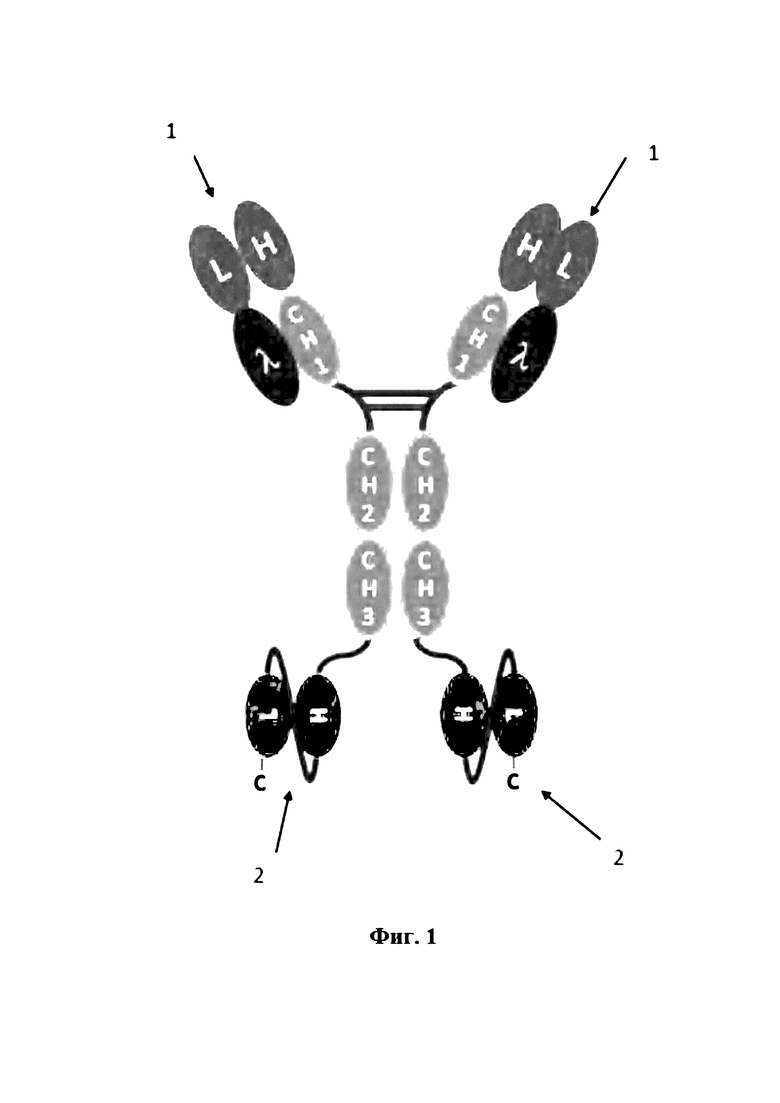
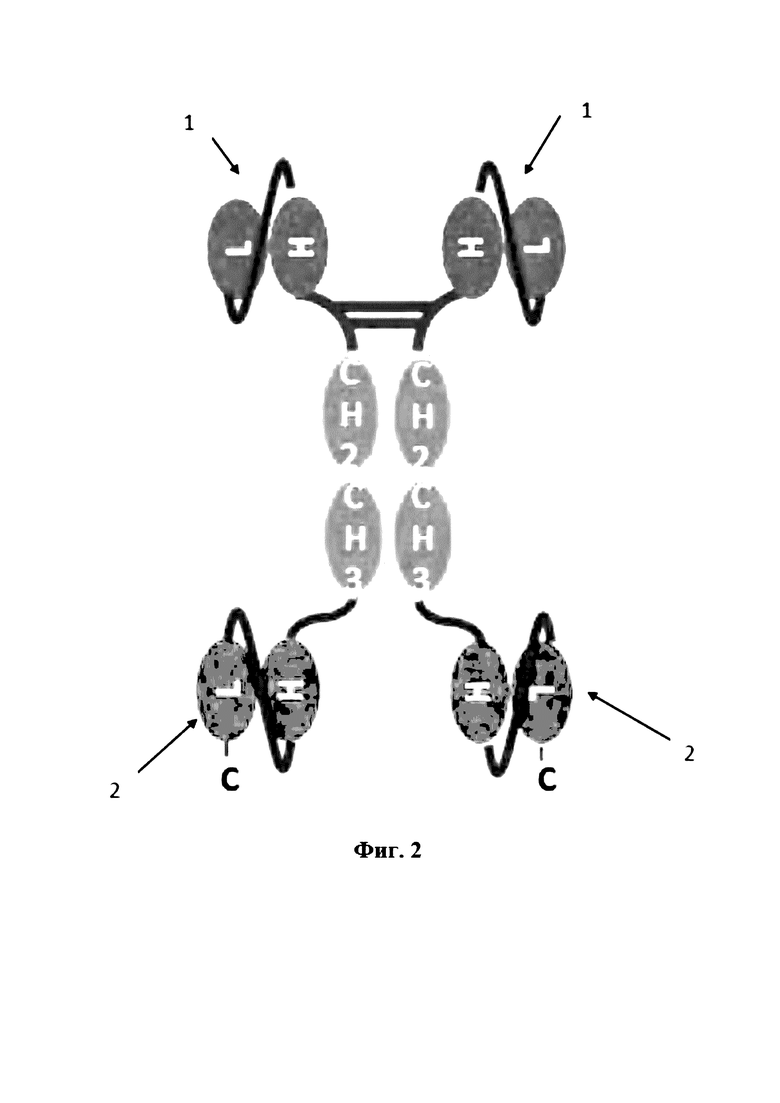


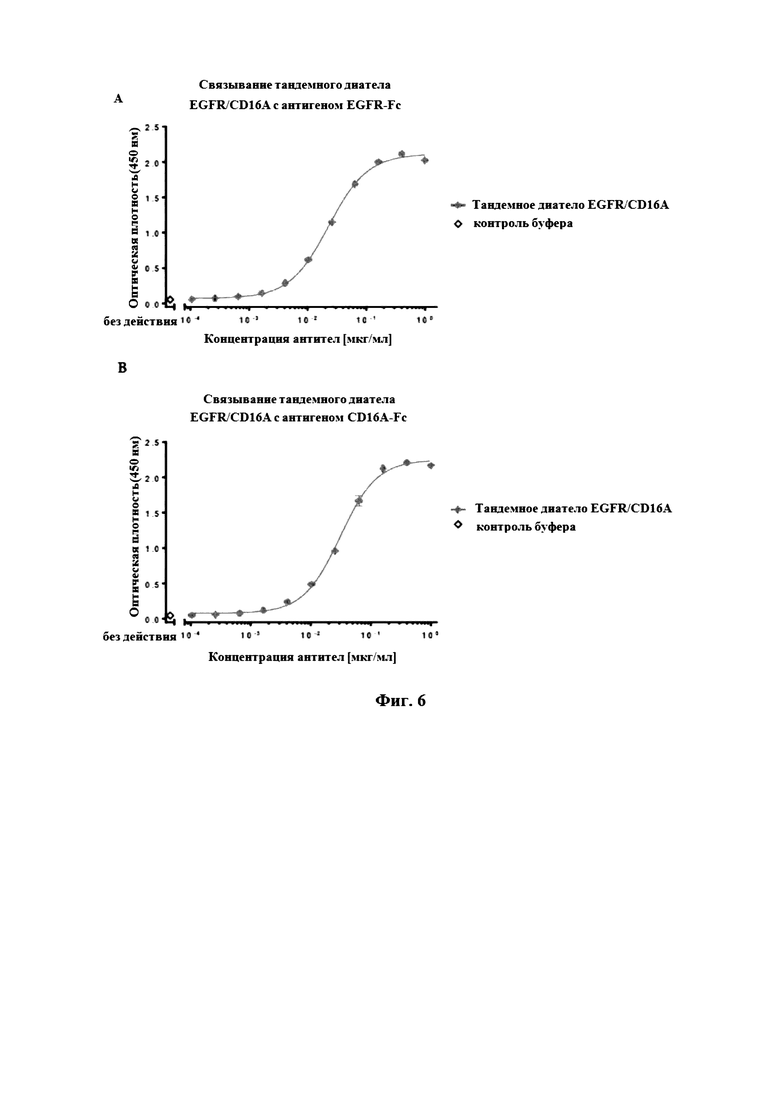

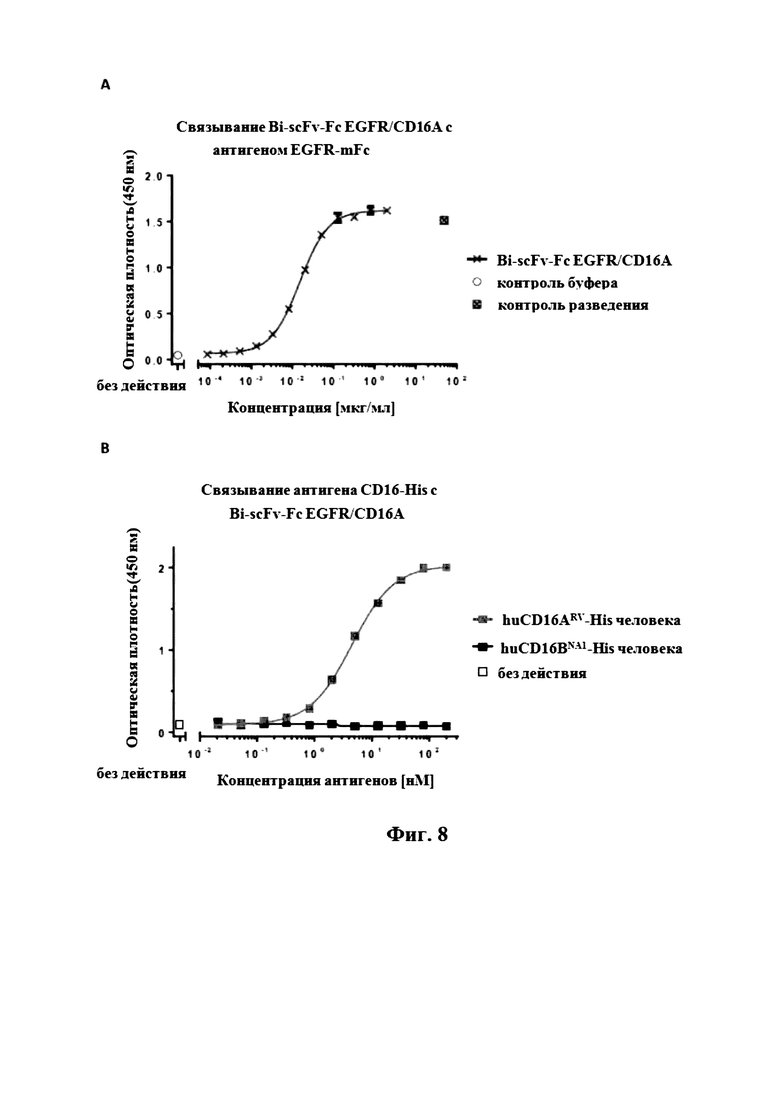
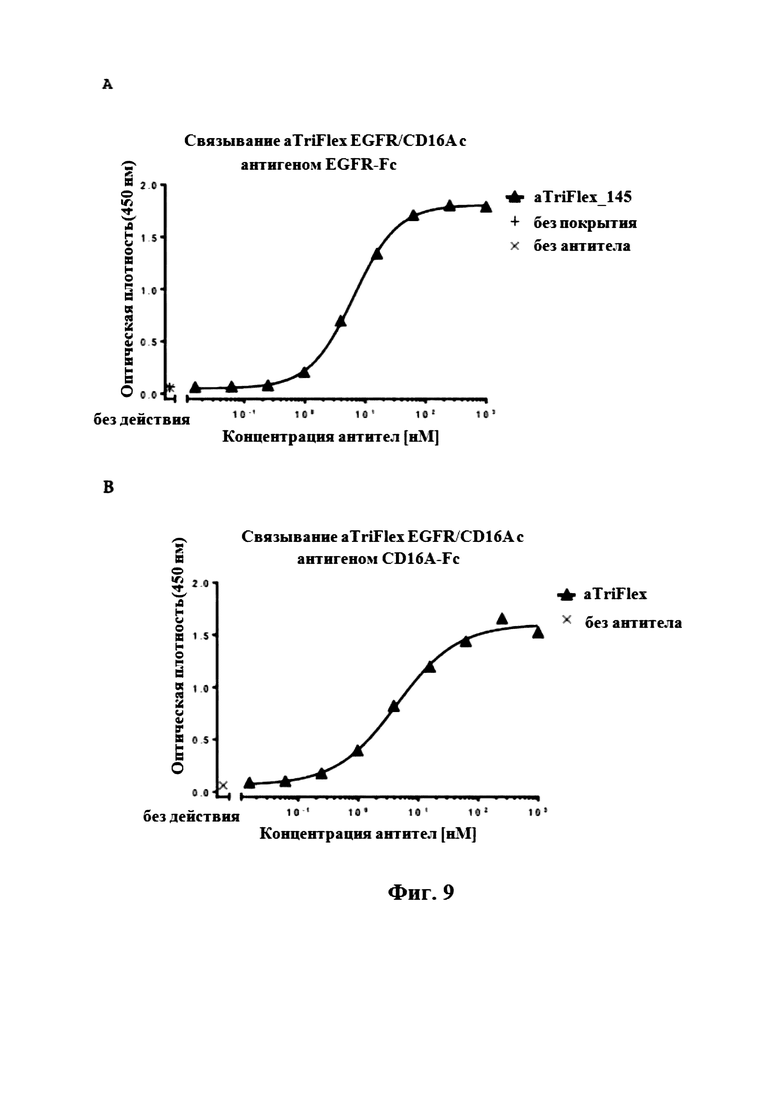

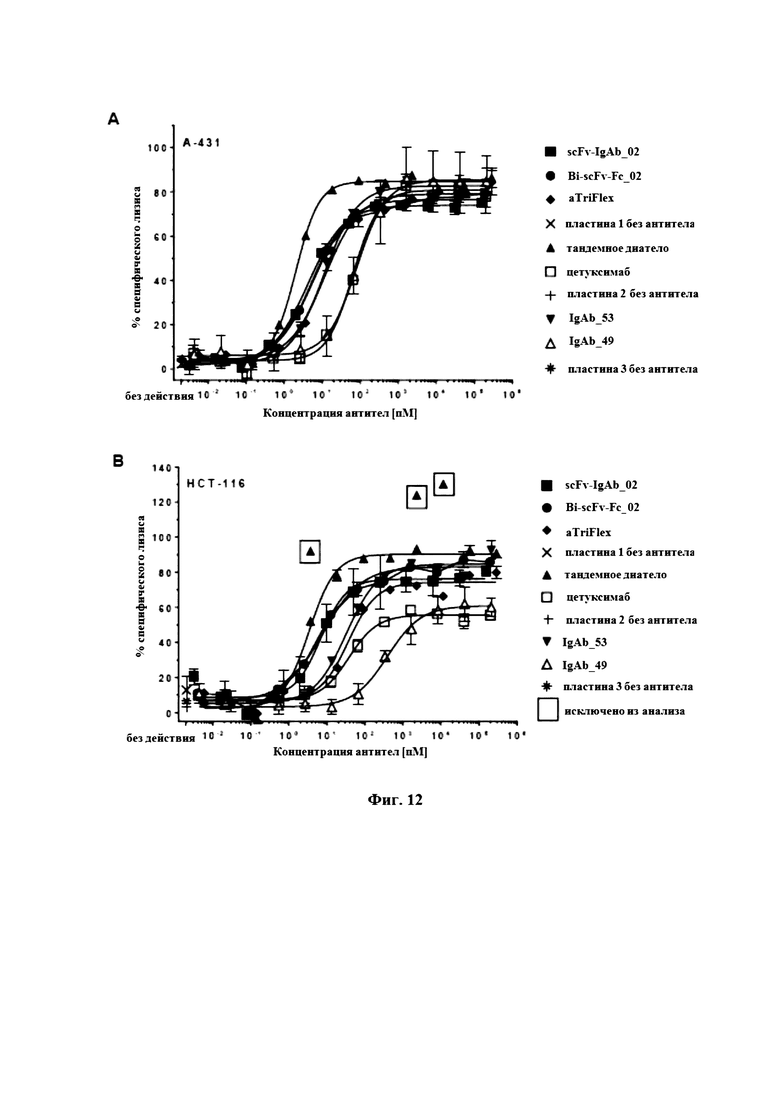
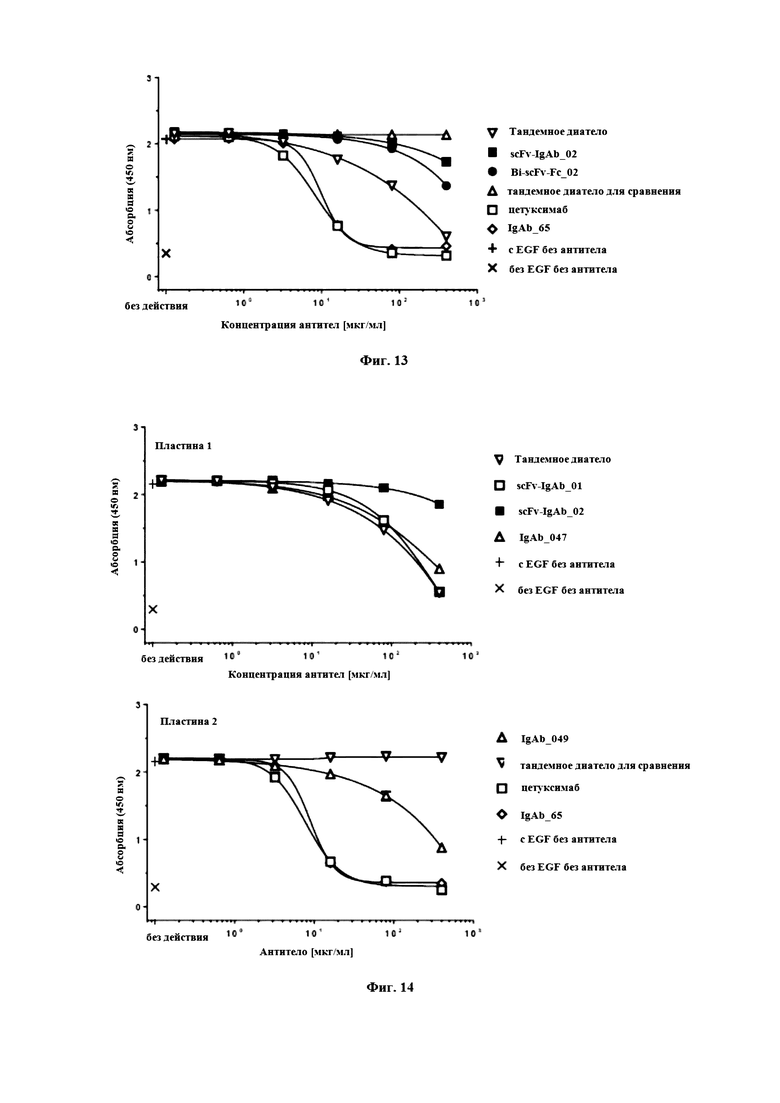
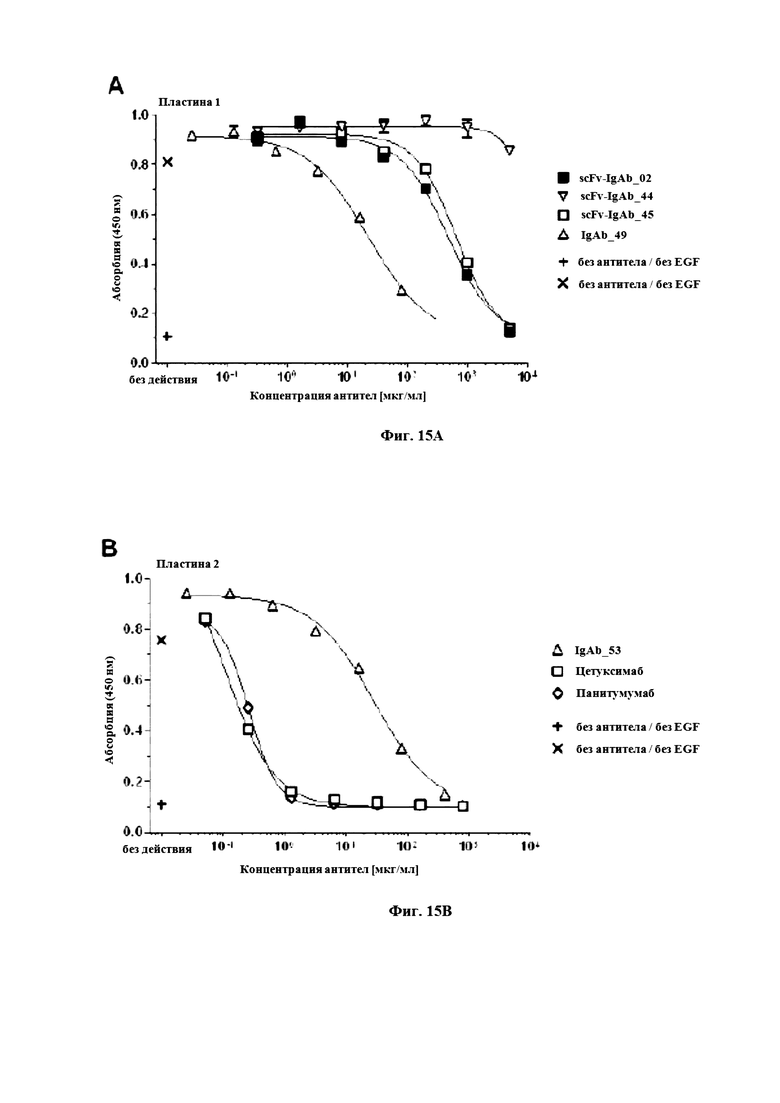
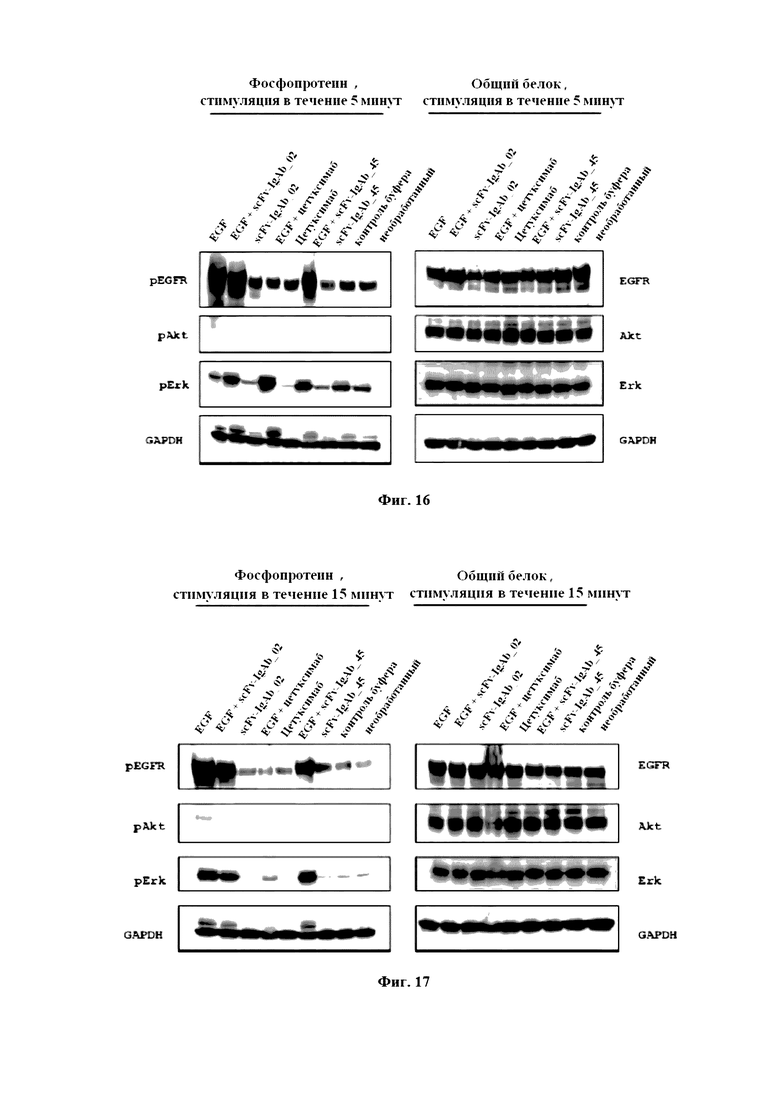
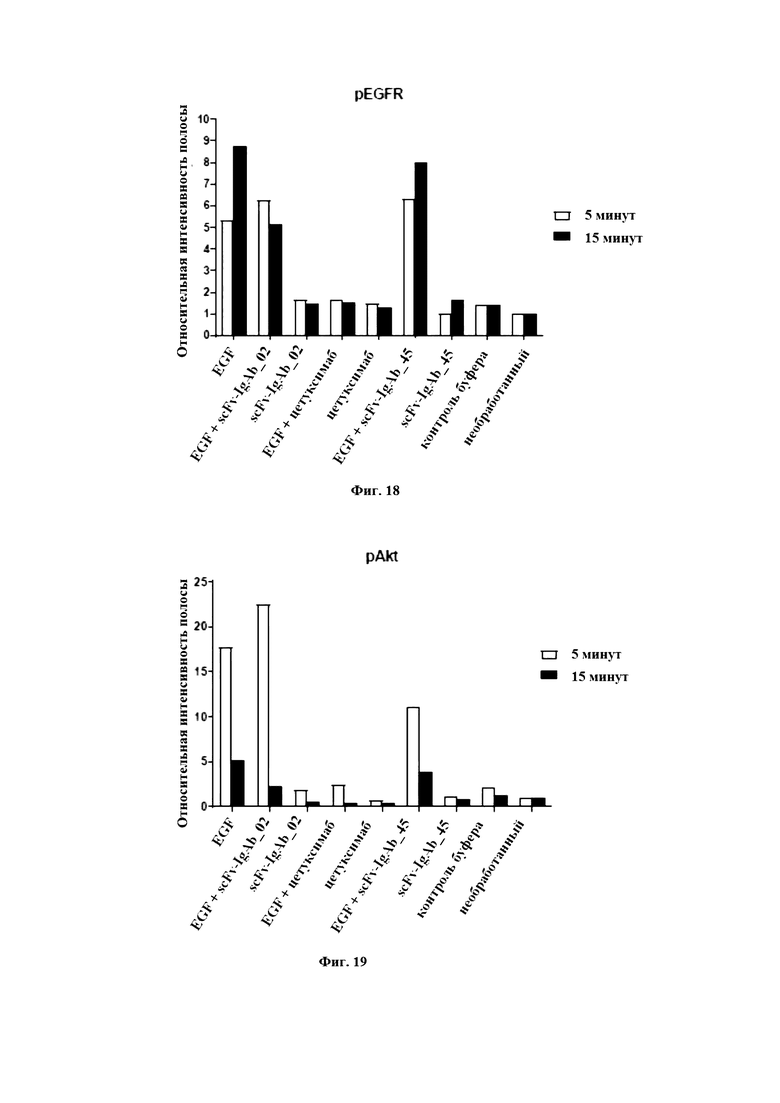
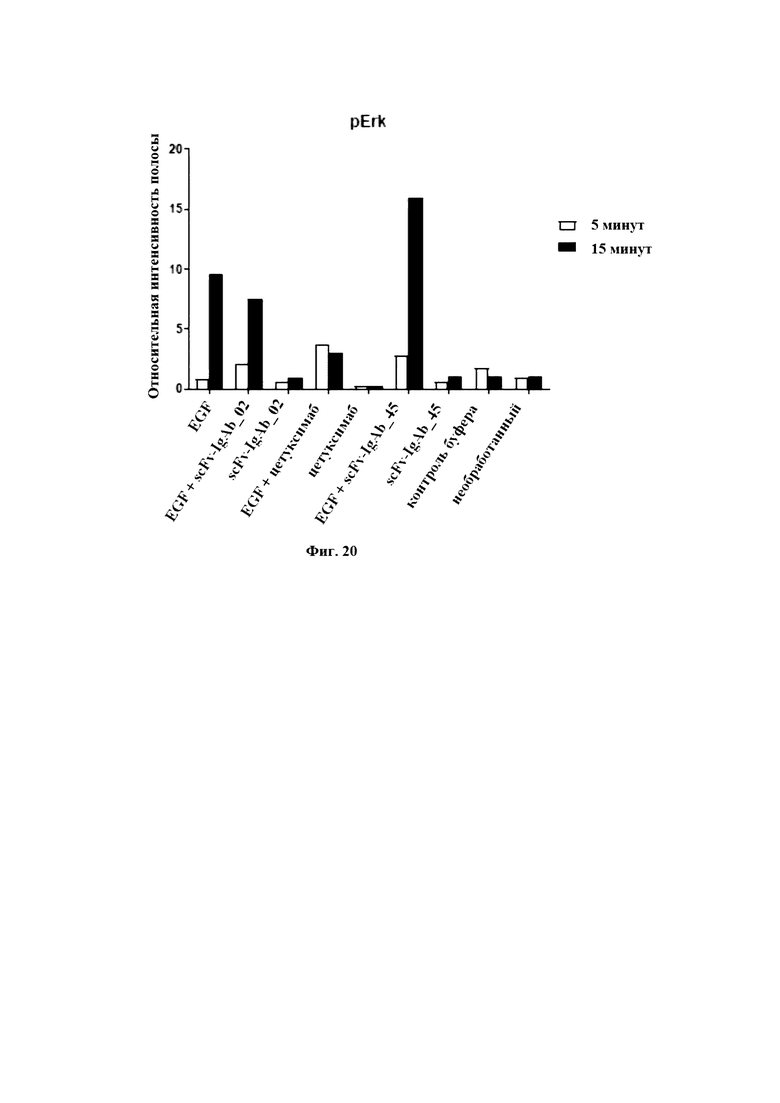
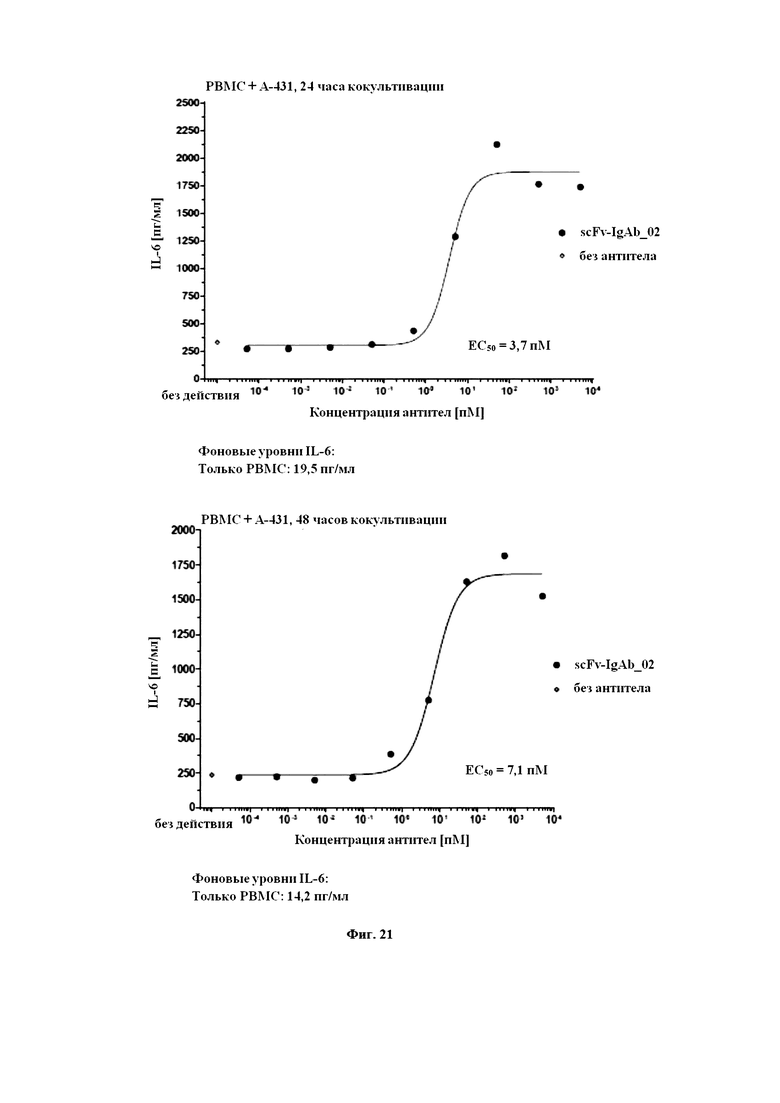
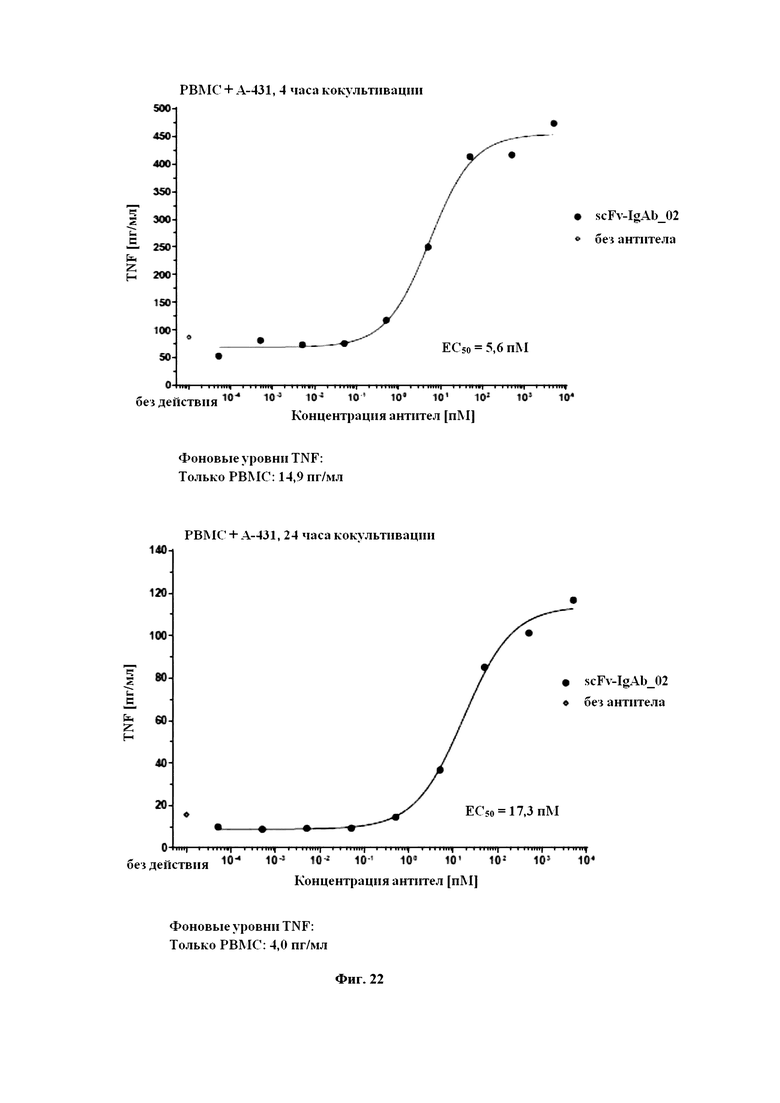
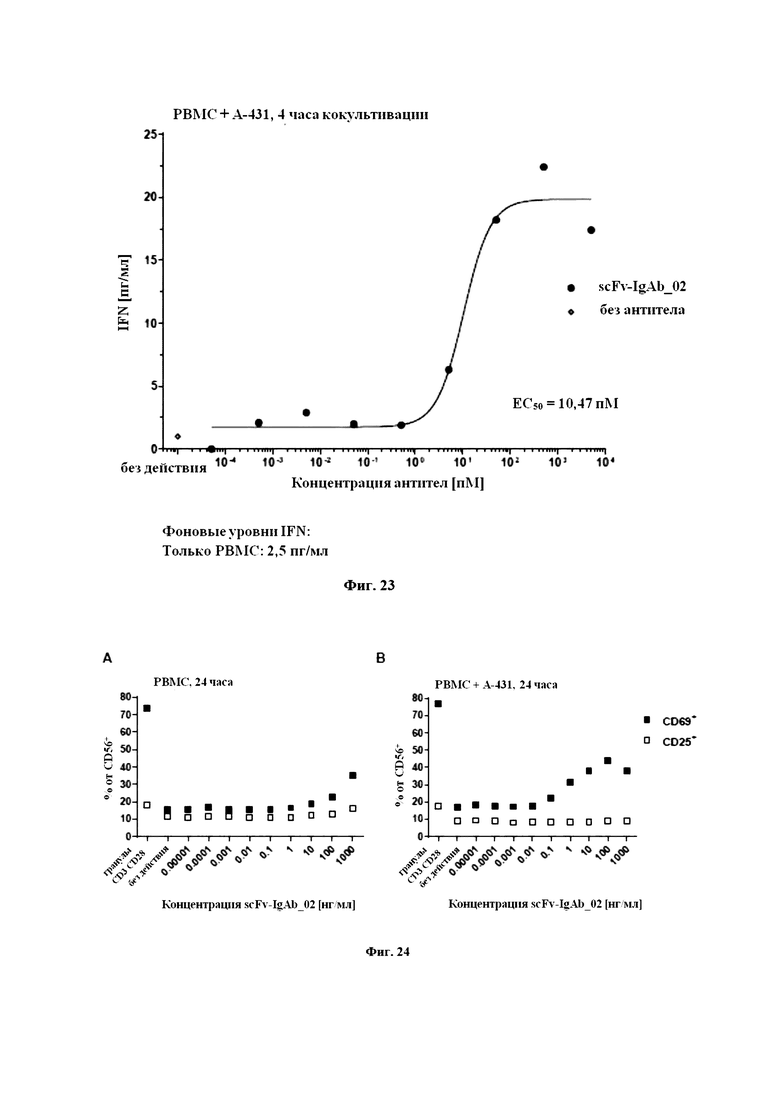
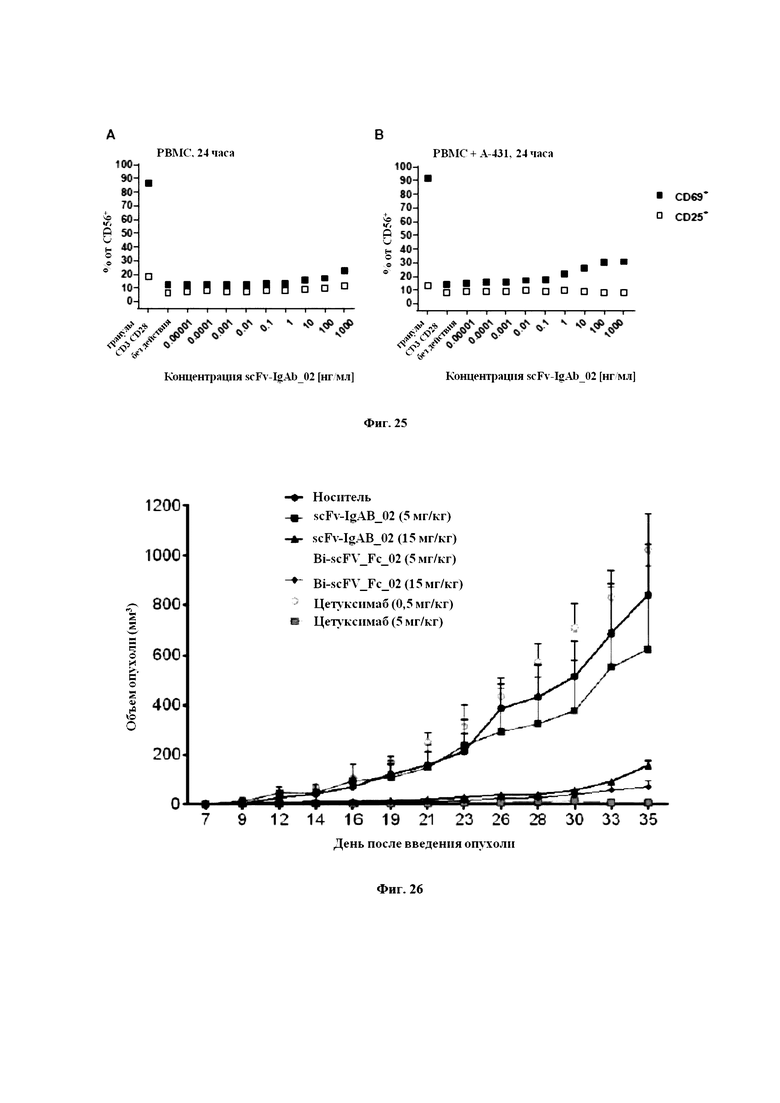
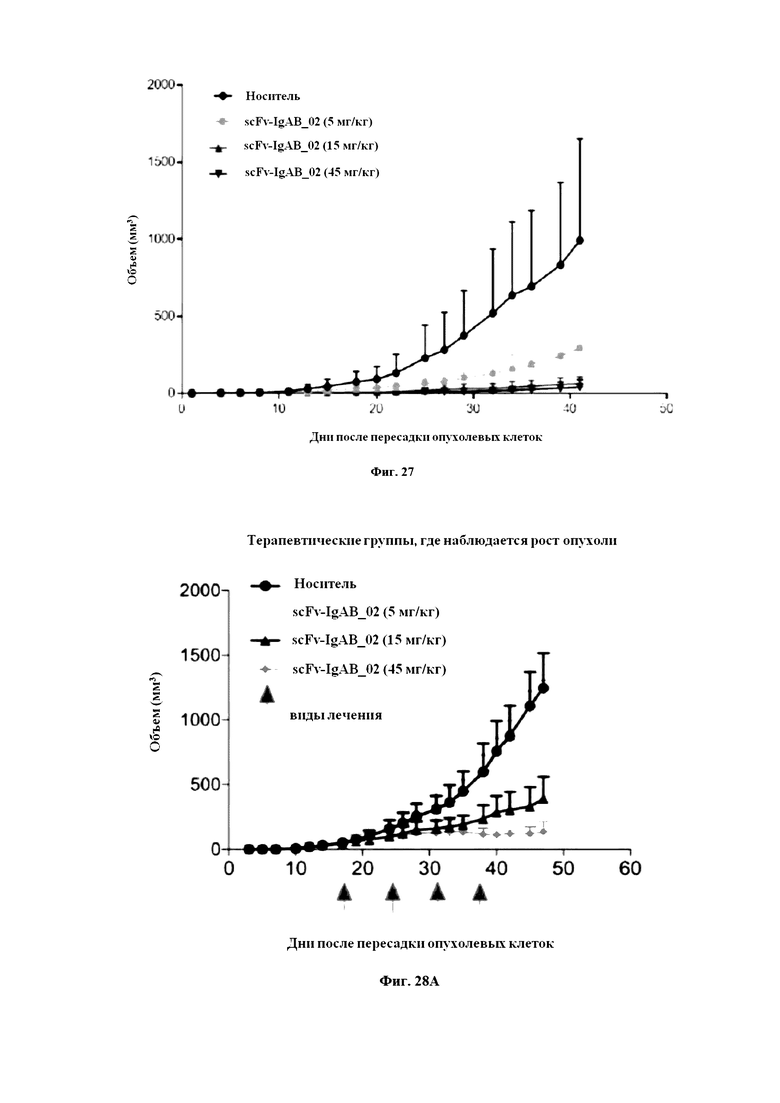
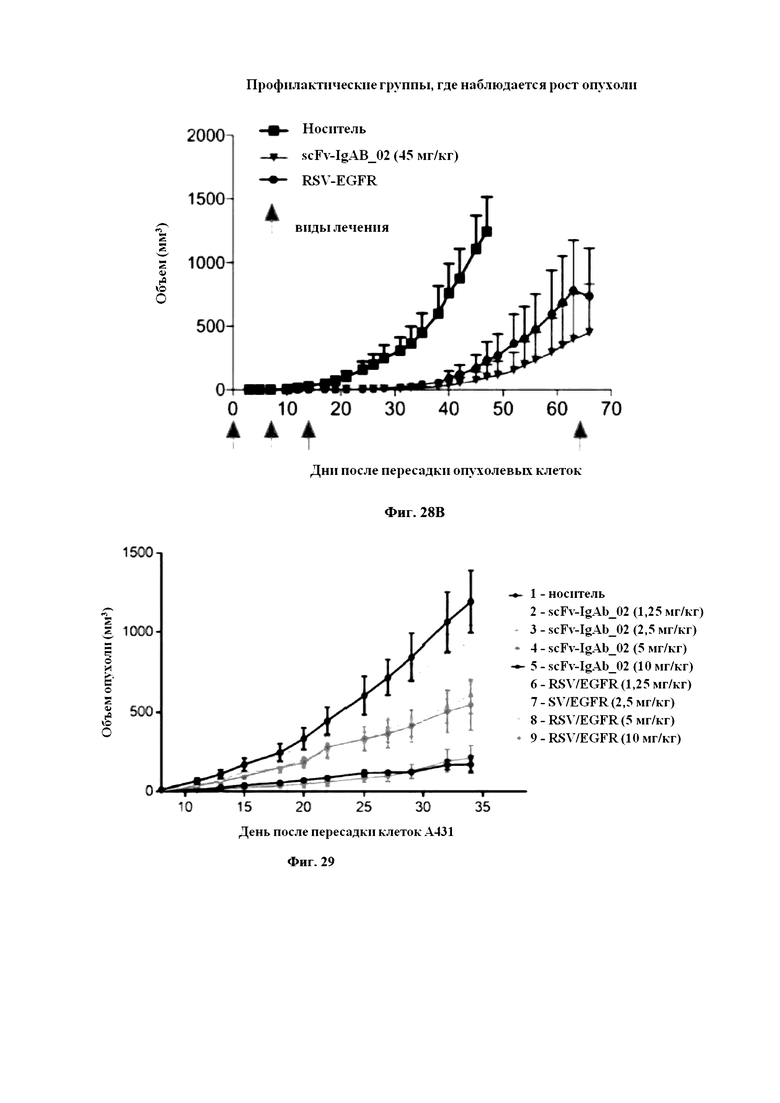
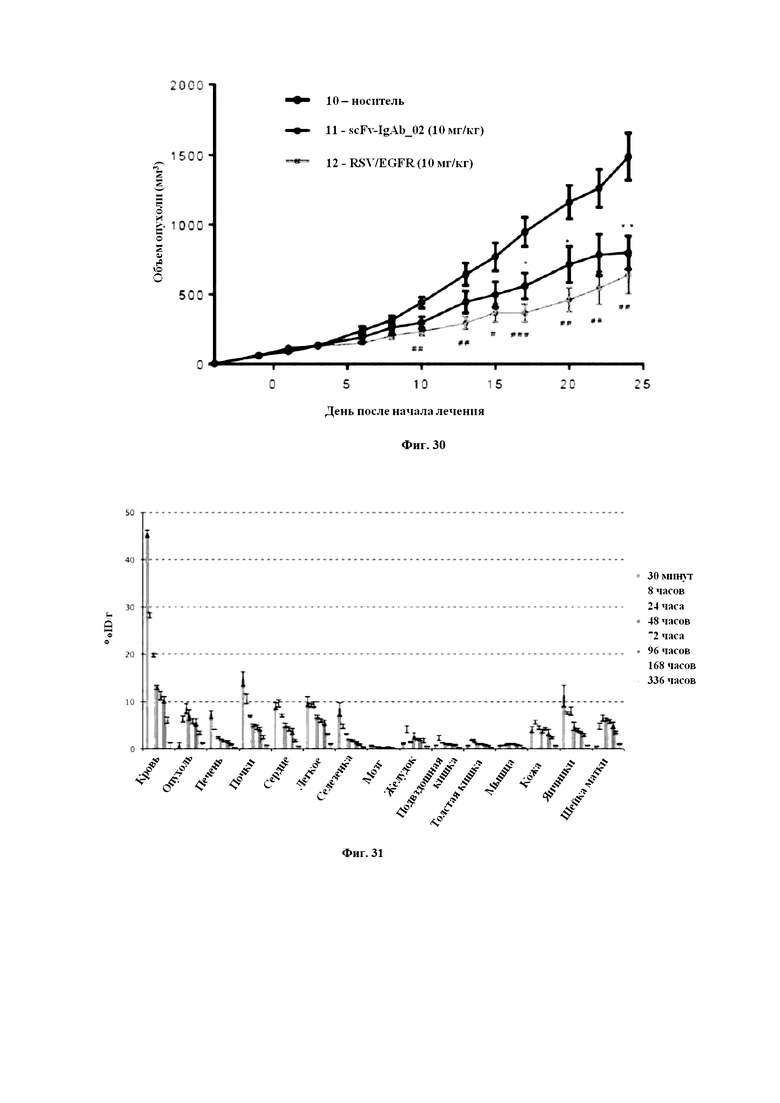
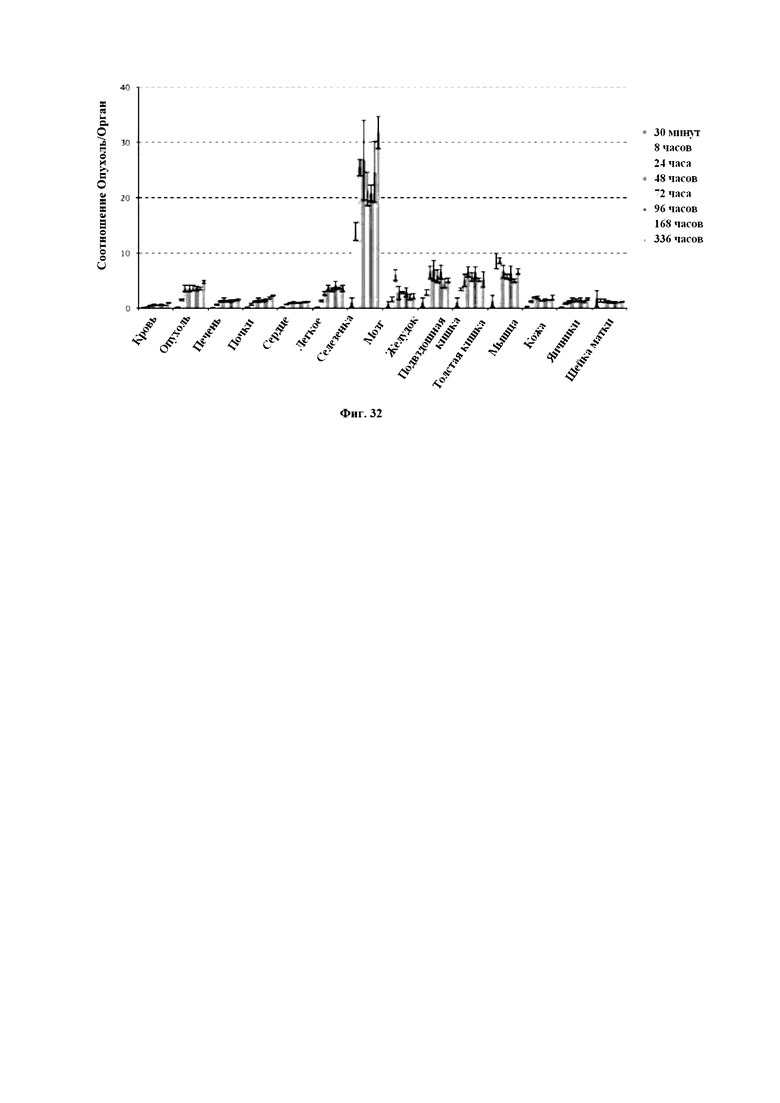

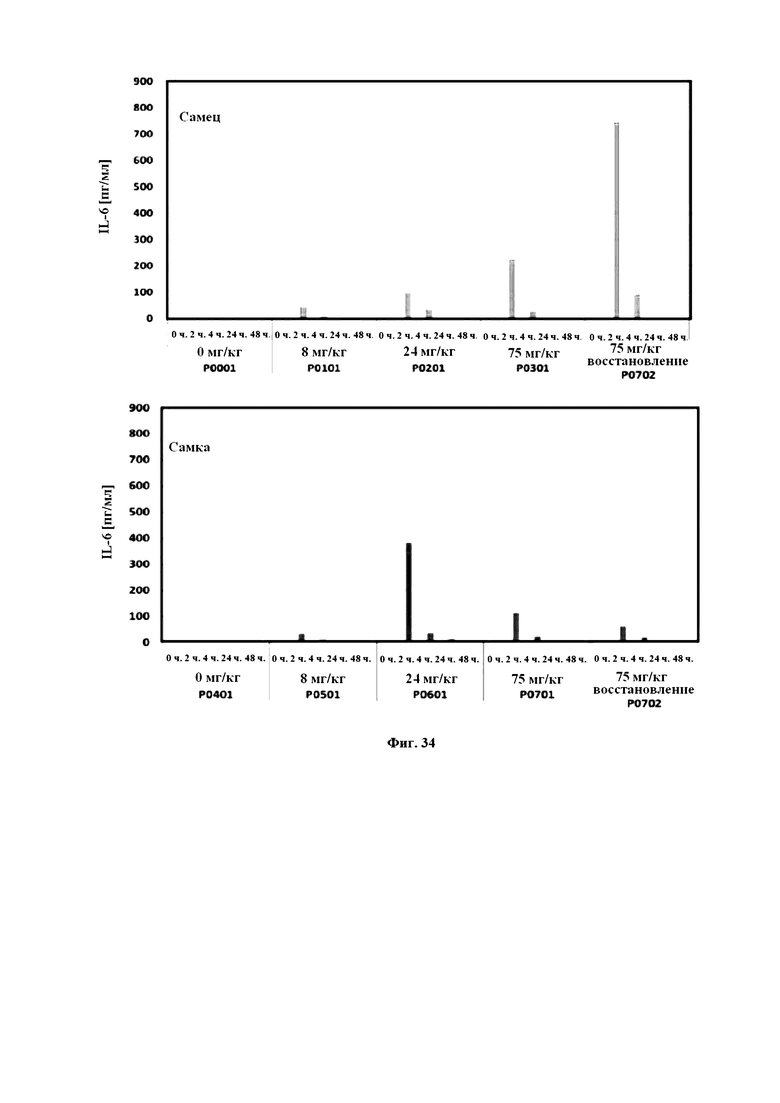
Изобретение относится к области биотехнологии, в частности к антигенсвязывающему белку, который специфически связывается с EGFR и CD16A, содержащему антигенсвязывающие сайты для EGFR и CD16A. Изобретение эффективно при лечении рака, характеризующегося EGFR-позитивными или EGFRvIII-позитивными клетками. 2 н. и 9 з.п. ф-лы, 34 ил., 14 табл., 14 пр.
1. Антигенсвязывающий белок, который специфически связывается с EGFR и CD16A, содержащий антигенсвязывающие сайты для EGFR и CD16A, отличающийся тем, что антигенсвязывающие сайты слиты с полипептидом, содержащим константные домены тяжелой цепи CH2 и CH3, и при этом антигенсвязывающий сайт для EGFR содержит вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), при этом:
(i) VH содержит тяжелую цепь CDR1, имеющую аминокислотную последовательность, представленную в SEQ ID NO:21; тяжелую цепь CDR2, имеющую аминокислотную последовательность, представленную в SEQ ID NO:22; тяжелую цепь CDR3, имеющую аминокислотную последовательность, представленную в SEQ ID NO:23, а VL содержит легкую цепь CDR1, имеющую аминокислотную последовательность, представленную в SEQ ID NO:24; легкую цепь CDR2, имеющую аминокислотную последовательность, представленную в SEQ ID NO:25; и легкую цепь CDR3, имеющую аминокислотную последовательность, представленную в SEQ ID NO:26; или
(ii) VH имеет аминокислотную последовательность, представленную в SEQ ID NO:1, а VL имеет аминокислотную последовательность, представленную в SEQ ID NO:2; и
антигенсвязывающий сайт для CD16A содержит:
(i) вариабельный домен тяжелой цепи (VH), содержащий тяжелую цепь CDR1, имеющую аминокислотную последовательность, представленную в SEQ ID NO:5; тяжелую цепь CDR2, имеющую аминокислотную последовательность, представленную в SEQ ID NO:6 или 11; тяжелую цепь CDR3, имеющую аминокислотную последовательность, представленную в SEQ ID NO:7, и вариабельный домен легкой цепи (VL), содержащий легкую цепь CDR1, имеющую аминокислотную последовательность, представленную в SEQ ID NO:8; легкую цепь CDR2, имеющую аминокислотную последовательность, представленную в SEQ ID NO:9; и легкую цепь CDR3, имеющую аминокислотную последовательность, представленную в SEQ ID NO:10; или
(ii) VH, содержащий аминокислотную последовательность, представленную в SEQ ID NO:12 или 14, и VL, содержащий аминокислотную последовательность, представленную в SEQ ID NO:13.
2. Антигенсвязывающий белок по п. 1, отличающийся тем, что антигенсвязывающий белок содержит по меньшей мере два антигенсвязывающих сайта для EGFR и по меньшей мере два антигенсвязывающих сайта для CD16A.
3. Антигенсвязывающий белок по п. 2, отличающийся тем, что два антигенсвязывающих сайта слиты с N-концами, и два антигенсвязывающих сайта слиты с С-концами полипептида CH2-CH3, и антигенсвязывающие сайты, слитые с N-концами, являются специфическими для CD16A, а антигенсвязывающие сайты, слитые с С-концами, являются специфическими для EGFR.
4. Антигенсвязывающий белок по п. 2, отличающийся тем, что антигенсвязывающий белок состоит из двух полипептидных цепей и каждая полипептидная цепь содержит первый одноцепочечный Fv-участок (scFv1), содержащий VL, сцепленный посредством пептидного линкера с VH первого антигенсвязывающего сайта, при этом упомянутый первый одноцепочечный Fv-участок (scFv1) слит посредством шарнирной области на N-конце с доменом CH2 полипептида CH2-CH3, и второй одноцепочечный Fv-участок (scFv2), содержащий VL, сцепленный посредством пептидного линкера с VH второго антигенсвязывающего сайта, при этом упомянутый второй одноцепочечный Fv-участок (scFv2) слит посредством пептидного линкера на С-конце с доменом СН3 полипептида СН2-СН3.
5. Антигенсвязывающий белок по п. 4, отличающийся тем, что scFv1 представляет собой антигенсвязывающий сайт для CD16A, а scFv2 представляет собой антигенсвязывающий сайт для EGFR.
6. Антигенсвязывающий белок по п. 2, отличающийся тем, что антитело содержит фрагмент F(ab´)2 и Fc-участок, при этом:
(i) фрагмент F(ab´)2 содержит два антигенсвязывающих сайта Fv для CD16A, а два одноцепочечных Fv (scFv), содержащих антигенсвязывающие сайты для EGFR, слиты с Fc-участком, при этом каждый из scFv слит на С-конце с доменом СН3 Fc-участка; или
(ii) фрагмент F(ab´)2 содержит два антигенсвязывающих сайта Fv для EGFR, а два одноцепочечных Fv (scFv), содержащих антигенсвязывающие сайты для CD16A, слиты с Fc-участком, при этом каждый из scFv слит на С-конце с доменом СН3 Fc-участка.
7. Антигенсвязывающий белок по п. 6, содержащий тяжелую цепь и легкую цепь, отличающийся тем, что
(i) тяжелая цепь имеет структуру VH(CD16A)-CH1-CH2-CH3-VH(EGFR)-VL(EGFR), а легкая цепь имеет структуру VL(CD16A)-CL или
(ii) тяжелая цепь имеет структуру VH(EGFR)-CH1-CH2-CH3-VL(CD16A)-VH(CD16A), а легкая цепь имеет структуру VL(EGFR)-CL.
8. Антигенсвязывающий белок по любому из пп. 1-7, отличающийся тем, что антигенсвязывающий белок не связывается с Fc-гамма-рецептором, но связывается с неонатальным Fc-рецептором.
9. Антигенсвязывающий белок по любому из пп. 1-8, отличающийся тем, что белок содержит тяжелую цепь, имеющую аминокислотную последовательность, представленную в SEQ ID NO:28, и легкую цепь, имеющую аминокислотную последовательность, представленную в SEQ ID NO:29; тяжелую цепь, имеющую аминокислотную последовательность, представленную в SEQ ID NO:43, и легкую цепь, имеющую аминокислотную последовательность, представленную в SEQ ID NO:44; или тяжелую цепь, имеющую аминокислотную последовательность, представленную в SEQ ID NO:45, и легкую цепь, имеющую аминокислотную последовательность, представленную в SEQ ID NO:44.
10. Применение антигенсвязывающего белка по любому из пп. 1-9 при лечении рака, характеризующегося EGFR-позитивными или EGFRvIII-позитивными клетками.
11. Применение по п. 10, отличающееся тем, что вид рака выбран из группы, состоящей из колоректального рака, рака головы и шеи, рака легких и глиобластомы.
| MARTIN TREDER et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| WO 2014144357 A1, 18.09.2014 | |||
| WO 2011140254 A1, 10.11.2011 | |||
| RYUTARO ASANO et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2023-03-21—Публикация
2019-03-14—Подача