Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к области клинической диагностики. В частности, изобретение относится к прогнозированию, оценке риска, стратификации риска, мониторированию и/или контролю терапии рака мочевого пузыря на основании хромогранина A (CgA) в качестве маркера.
Уровень техники для изобретения
[0002] Рак пузыря (рак мочевого пузыря) является наиболее распространенным злокачественным новообразованием мочевыводящих путей. Принимая во внимание новые диагностированные случаи и его высокую частоту рецидивов, рак мочевого пузыря является одной из наиболее распространенных злокачественных опухолей во всем мире (Chamie et al. 2011, Goodison, Rosser and Urquidi 2013). Западные страны поражены в большей степени, и мужчины имеют в 3-4 раза более высокий риск развития по сравнению с женщинами (Burger et al. 2013a).
На основании клеток, которые становятся злокачественными, можно различать различные типы рака мочевого пузыря. Наиболее распространенным типом рака мочевого пузыря является переходноклеточная карцинома (90%), за которой следуют плоскоклеточная карцинома и аденокарцинома (2-5%). Менее 1% рака мочевого пузыря возникает из нейроэндокринных клеток (Bertaccini et al. 2008, Pompas-Veganzones, Gonzalez-Peramato and Sanchez-Carbayo 2014). При диагностике приблизительно 70-75% пациентов имеют поверхностный рак мочевого пузыря (стадии Ta-T1), также известный как не мышечно-инвазивный рак мочевого пузыря (NMIBC). 25-30% пациентов имеют мышечно-инвазивный рак мочевого пузыря (MIBC, стадии T2-T4) и/или метастазирующий рак мочевого пузыря (Clark et al. 2013, Mossanen and Gore 2014).
Частота рецидивов и/или прогрессирования рака мочевого пузыря является чрезвычайно высокой, где 50-70% пациентов с NMIBC могут иметь рецидив, прогрессирование или возникновение нового заболевания в пределах 5-7 лет после лечения (Clark et al. 2013), и 10% - 30% этих рецидивов являются инвазивными (Chamie et al. 2011, Goodison et al. 2013, Witjes et al. 2014). Приблизительно в половине (43%) случаев MIBC присутствовали неинвазивные опухоли при диагностике, которые прогрессировали несмотря на органосохраняющее лечение (EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer 2014).
[0003] В настоящее время, ключевым элементом диагностики и наблюдения рака мочевого пузыря является гистопатологическое исследование биоптатов уротелия мочевого пузыря в ходе цистоскопии/трансуретральной резекции опухоли мочевого пузыря (TURBT). Цистоскопия в белом свете является полезным диагностическим инструментом в руках медицинских работников, но имеет большие ограничения. Действительно, она часто недооценивает стадии опухолей, что может привести к недостаточному лечению (Cauberg Evelyne, de la Rosette and de Reijke 2011). Она также является умеренно чувствительной, дорогой и инвазивной. Некоторые чрезвычайно редкие осложнения, такие как перфорация из-за запирательного рефлекса, кровотечение, ТУР-синдром, обструкция мочевыводящих путей, перфорация (вне- или внутрибрюшинная) и инфекции, могут возникать в ходе этой процедуры.
Цитология мочи, полученной естественным путем (VUC), также является широко используемым способом диагностики и наблюдения NMIBC с высокой специфичностью, но низкой чувствительностью при высокодифференцированных опухолях (низкой степени злокачественности). Ее точность лежит в диапазоне от только 20 до 40% для опухолей на ранней стадии (AUA Guidelines 2007-2014, Goodison et al., 2013). Для нее показана лучшая точность для опухолей высокой степени злокачественности и в частности, для карциномы in situ. Это свойство делает ее дополнительным инструментом для трансуретральной резекции (см. ниже). Цистоскопия и VUC позволяют первичную диагностику и первичную оценку признаков опухолей, включая количество, тип, степень злокачественности и оцененную стадию.
Компьютерную томографию (КТ) и магнитно-резонансную томографию (ЯМР) также можно использовать для оценки первичной опухоли. Однако, во вплоть до 40% случаев, они недооценивают заболевания и могут только с ограничениями различать стадии опухолей Ta-T3a (степень точности лежит в диапазоне 55-92%), даже хотя опубликована лучшая точность различения инвазивных от неинвазивных (Maurer et al. 2013).
Оценка статуса метастазирования, и особенно состояния узлов, является ключевым пунктом прогностической оценки рака мочевого пузыря. Метастазирование в лимфатические узлы увеличивается от низкой частоты 5-10% для не мышечно-инвазивных опухолей мочевого пузыря до 15-20% для поверхностных мышечно-инвазивных опухолей, до 25-30% для глубоких мышечно-инвазивных опухолей и до >40% для внепузырных опухолей (Shariat et al. 2012). Диагностика отдаленного или регионарного метастазирующего рака мочевого пузыря по большей части основана на множество способов визуализации, включая радиографию, ультразвуковое исследование, компьютерную томографию (КТ) и магнитно-резонансную томографию (ЯМР). Ультразвуковое исследование является самым простым, наиболее неинвазивным, и экономически эффективным, но зависит от квалификации оператора. КТ и ЯМР также являются неинвазивными, и хотя чувствительность этих способов недавно была улучшена, их эффективность остается недостаточной.
В случае, если первичный диагноз является положительным по раку мочевого пузыря вне зависимости от статуса метастазирования, проводят трансуретральную резекцию опухоли мочевого пузыря (TURBT). Этот лечебно-диагностический способ является начальной терапевтической стадией, характеризующейся эндоскопической абляцией всей опухоли. Он подтверждает диагноз и позволяет более точную оценку стадии опухоли, особенно глубину инвазии стенки мочевого пузыря. Однако, TURBT ассоциирована со значительным риском недооценки, особенно для опухолей T1 (Babjuk 2009).
Более того, из-за неполной резекции, рост рецидивирующей опухоли можно наблюдать в течение первого года (Kamat et al. 2013, Babjuk 2009). По этой причине повторную TURBT или максимальную TURBT настоятельно рекомендуют в руководствах (Brausi et al. 2011).
[0004] В то время как течением заболевания пациентов с NMIBC часто можно безопасно управлять посредством «точной» TURBT с наличием или отсутствием дополнительных терапевтических мер (например, иммунотерапии, химиотерапии), радикальная цистэктомия (RCE) с двусторонним удалением тазовых лимфатических узлов (PLND) стала стандартом лечения для пациентов с MIBC (Clark et al. 2013, Witjes et al. 2014). Для некоторых неоадъювантных химиотерапевтических средств показано преимущество для выживаемости (Sharma, Ksheersagar and Sharma 2009), и они рекомендованы для избранных пациентов. RCE рекомендована также для имеющих высокую степень злокачественности и/или невосприимчивых NMIBC и карциномы in situ (CIS). Множество пациентов с радикальным хирургическим вмешательством подвергают отведению мочи или реконструкции новообразованного мочевого пузыря. В руководстве Национальной всеобщей онкологической сети (NCCN) рекомендовано, что пациентов без поражения лимфатических узлов с наиболее высоким риском по патологическим оценкам можно подвергать дополнительной адъювантной радиотерапии с радиосенсибилизирующей терапией или химиотерапией. Однако, эти дополнительные виды терапии могут усиливать токсичность и сопутствующие заболевания (Clark et al. 2013).
После только RCE в общей группе рака мочевого пузыря (BCa) (всех стадий и степеней злокачественности), значения 5-летней общей выживаемости, безрецидивной выживаемости и онкоспецифической выживаемости составляли только 57%, 48% и 67%, соответственно, с частотой отдаленных и местных рецидивов 37% и 6%, соответственно (Yafi et al. 2011).
Преимущества стандартного удаления тазовых лимфатических узлов (PLND) для выживаемости пациентов для случаев MIBC показаны в большой степени, и PLND в настоящее время является неотъемлемой частью RC, рекомендованной на основе консенсуса в руководствах. Однако, его преимущество в способе хирургической монотерапии является умеренным, и лимфаденэктомию (LND) часто рассматривают больше как диагностическую/прогностическую (может предоставлять состояние узлов), чем терапевтическую (Skinner and Sagalowsky 2014). Действительно, регионарная LND является необходимой стадией в оценке стадий из-за ограничений чувствительности современных способов визуализации. Несмотря на совершенствование хирургической техники, визуализации, периоперационного управления течением заболевания и способов терапии, приблизительно у 50% пациентов развиваются метастазы, и они умирают от рака мочевого пузыря (Stein JP, Skinner DG 2006).
Таким образом, неоадъювантные/адъювантные химиотерапевтические средства или радиотерапию и PLND, или расширенную LND предусматривают (Skinner and Sagalowsky 2014) для улучшения выживаемости пациентов с высоким риском. Однако, из-за увеличения токсичности, риска возникновения сопутствующих заболеваний и стоимости, преимущества этих серьезных вмешательств необходимо тщательно взвешивать с учетом изменений качества жизни и потенциальных осложнений, включая кровотечение, повреждение нерва, лимфокистоз или тромбы в конечностях (Scarpato et al. 2015), и предназначать их только для случаев с наивысшим риском.
Одной из проблем для этого вида злокачественных новообразований на поздних стадиях является ответ на вопрос: какое лечение предназначено для какого пациента?
[0005] После RCE с LND или без LND, спиральная КТ представляет собой предпочтительный способ визуализации для идентификации метастазирования в легких, лимфатических узлах и печени (ICUD-EAU Bladder cancer Edition 2012), и в руководствах EAU рекомендовано раз в 3-4 месяца сканирование брюшной полости, верхних мочевыводящих путей (UUT), таза и радиография или КТ грудной клетки (Sharma et al. 2009) в течение первого года, раз в 6 месяцев до третьего года, и после этого периода мониторирование посредством ежегодной визуализации по клиническим показаниям. Для RCE с кожным отведением мочи (UD) рекомендована также промывочная цитология мочеиспускательного канала каждые шесть - 12 месяцев (Sharma et al. 2009). Частота и способы последующего наблюдения после радикальной цистэктомии не строго согласуются между руководствами, однако, только немногим отличаются.
[0006] Отдаленный рецидив обычно возникает в пределах 24 месяцев, где боле высокая стадия и состояние лимфатических узлов являются наиболее важными факторами риска. Рецидив в тазе, как правило, возникает (у 5-15% пациентов) в пределах 6-18 месяцев после хирургической операции, снова в зависимости от исходной стадии и состояния лимфатических узлов. Вторичные опухоли мочеиспускательного канала являются редкими, возникающими через 1-3 года после цистэктомии, и имеют плохой показатель выживаемости. Рецидив в верхних мочевыводящих путях наблюдают редко, и обычно он проявляется поздно (через 28-49 месяцев после цистэктомии) (Witjes et al. 2014). Наконец, некоторые поздние рецидивы могут возникать через более чем 10 лет, тогда после RCE пациенты нуждаются также в очень длительном наблюдении.
[0007] Из-за прогностической гетерогенности как NMIBC, так и MIBC, в руководствах по лечению рака мочевого пузыря подчеркнута важность и неудовлетворенная необходимость лучшего прогнозирования (руководства EAU). Для NMIBC доступны таблицы риска для улучшения лечебных решений и/или последующего наблюдения (Vedder et al. 2014). Однако, систему оценки Европейской организации по исследованию и лечению онкологических заболеваний (EORTC), рекомендованную в руководствах EAU и AUA, редко используют в повседневной практике.
В ряде недавних публикаций показано, что эти модели не являются очень надежными. Например, Vedder et al. опубликовали, что система оценки может целесообразно прогнозировать прогрессирование, но не рецидив (Vedder et al. 2014).
Завышенная оценка рецидива и прогрессирования по таблице EORTC также показана при NMIBC, также в подгруппе после лечения BCG (Fernandez-Gomez et al., 2011).
Наконец, Xylinas et al. показали, что система оценки EORTC имеет плохую дискриминацию как для рецидива, так и для прогрессирования, и подчеркнули необходимость улучшения современных прогностических инструментов (Xylinas et al. 2013).
До настоящего времени не существует таблицы или системы оценки для специфической оценки прогноза MIBC, таких, чтобы управлять выбором лечения. Присутствие метастазов в регионарном лимфатическом узле является наиболее сильным прогностическим фактором для рецидива опухоли и специфической для заболевания выживаемости (DSS) у пациентов для MIBC (Skinner and Sagalowsky 2014). Однако, приблизительно половина поверхностных опухолей может иметь микрометастазы, не детектируемые посредством инструментов визуализации, в то время как только 25% пациентов после радикального хирургического вмешательства имеют метастазы в лимфатических узлах (LN) на время хирургического вмешательства (Svatek et al. 2010, EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer 2014).
Даже несмотря на то, что специфическая для заболевания выживаемость (DSS) лежит в диапазоне от 85% до 90% после радикальной цистэктомии из-за CIS, раннюю радикальную цистэктомию можно рассматривать как избыточное лечение приблизительно у 50% пациентов (Burger et al. 2013b).
[0008] Рак мочевого пузыря представляет собой гетерогенную неоплазию, нуждающуюся в крупномасштабном алгоритме лечения (последовательное химическое или биологическое лечение, радиотерапия и хирургические вмешательства) и обширном длительном наблюдении. Опухоли со сходной гистологией могут иметь различное клиническое развитие, и эти нюансы являются критическими для правильного управления течением заболевания. Его комплексность приводит к прямой и опосредованной экономической нагрузке и делает его наиболее дорогостоящим злокачественным новообразованием применительно к стоимости медицинской помощи в течении жизни при пересчете на пациента (Brausi 2013, Chamie et al. 2011, Goodison et al. 2013, Mossanen and Gore 2014). В 2010 г. стоимость медицинской помощи при BCa составляла приблизительно 4 миллиарда $ в США (Mossanen and Gore 2014) и 3 миллиарда € в 2012 г. в Европейском союзе (EU), включая непосредственно стационарное лечение как основной компонент стоимости (насчитывающий 58%). Общая экономическая нагрузка составляла 5 миллиардов € в EU (Leal et al. 2015). В США оцененная стоимость управления течением заболевания в течение жизни индивидуума с BCa лежит в диапазоне от 96000 $ до 280000 $ (Hansel et al. 2013). Медицинские затраты, ассоциированные с диагнозом MIBC, составляют приблизительно $150000, однако, из-за длительного клинического течения заболевания на ранних стадиях, его преобладания относительно MIBC и его процедурно ориентированного наблюдения, экономическую нагрузку NMIBC, как правило, считают более повышенной (Svatek et al. 2014).
Недооценка стадии опухоли является основным ограничением современных диагностических и прогностических инструментов. Более того, до настоящего времени не существует надежных инструментов ни для прогнозирования прогрессирования NMIBC до MIBC, ни для прогнозирования исхода MIBC.
[0009] Использование биомаркеров для прогнозирования или стратификации риска для пациентов с раком мочевого пузыря может помочь терапевту начать подходящее лечение и уменьшить затраты, ассоциированные с наблюдением пациента.
Некоторые коммерчески определяемые маркеры мочи получили одобрение FDA для диагностики и/или последующего наблюдения рака мочевого пузыря, но не вошли в клиническую практику. В отличие от этого, в настоящее время никакие прогностические маркеры крови или мочи не одобрены национальными институтами здравоохранения или не рекомендованы в каких-либо руководствах. Это не согласуется со стратегией управления течением заболевания BCA на основании глобального риска.
[0010] В недавнем крупном мета-анализе (Schmitz-Drager et al. 2015), эффективность большинства коммерчески доступных маркеров (BTA Stat®, NMP22, включая BladderCheck® и FISH Urovysion™) сравнивали с VUC. Он подтверждает, что эти молекулярные маркеры имеют намного лучшую чувствительность, особенно для опухолей высокого риска (pT1G3, CIS), чем цитология мочи, несмотря на отсутствие продемонстрированного использования для прогнозирования. Однако, он также подтверждает, что более низкие специфичность и воспроизводимость таких маркеров являлись основным ограничением. Кроме того, эти маркеры не имели прогностической ценности.
[0011] Хромогранин A (CgA) представляет собой гликопротеин, обычно экспрессированный на нейроэндокринных (NE) клетках. CgA является составляющим секреторных гранул большинства продуцирующих пептид эндокринных клеток (Chuang и Liao 2003). Он физиологически высвобождается посредством экзоцитоза и может быть детектирован в крови. Когда опухоль развивается в нейроэндокринной ткани, она становится основным источником циркулирующего CgA. Секреция CgA в мочевом пузыре ассоциирована с редкими случаями нейроэндокринных дифференцированных опухолей, которые, как известно, имеют плохой прогноз (Alijo Serrano et al. 2007, Bertaccini et al. 2008). Маркеры нейроэндокринной ткани, например, CgA, часто используют для различения нейроэндокринной карциномы (NEC) и переходноклеточной карциномы (TCC), и используют для подтверждения диагноза NEC и как правило, для мелкоклеточного рака мочевого пузыря (SCBC) (Bertaccini et al. 2008, Cerulli et al. 2012, Iczkowski et al. 1999) или параганглиом (Bagchi et al. 2015, Feng et al. 2013).
Однако показано, что CgA экспрессируется в ткани нейроэндокринной злокачественной опухоли мочевого пузыря (NEBC), но до настоящего времени, ни в одном исследовании не оценивали прогностический эффект уровней CgA в ткани и сыворотке ни для нейроэндокринных, ни для уротелиальных BCA.
Более того, присутствие как мелких клеток, так и переходных клеток, также не прогнозировало исходы (Chuang and Liao 2003).
Chuang et al. показали, что CgA был экспрессирован в 4 из 10 образцов ткани SCBC, но не обнаружили ассоциаций с прогнозом для пациентов. Однако, из-за небольшого количества случаев и гетерогенной когорты, это исследование имеет ограниченную надежность (Chuang and Liao 2003).
Для CgA не показали какой-либо связи с выживаемостью при крупноклеточной и мелкоклеточной нейроэндокринной карциноме мочевого пузыря. В одном исследовании, единственным прогностическим фактором для выживаемости оставалась классификация TNM (Alijo-Serrano, 2007). Авторы не рассматривали CgA в качестве полезного для прогностических целей. Кроме того, Soukup et al. недавно обнаружили, что CgA в моче не был связан ни с присутствием первичного NMIBC, ни с рецидивом злокачественной опухоли (Soukup et al. 2015). Тем не менее, Bertaccini et al. обнаружили, что через 1 месяц после цистопростатэктомии из-за мелкоклеточной уротелиальной карциномы (SCUC), уровень CgA в сыворотке уменьшался в 10 раз по сравнению с уровнем до операции, но не оценивали ни предоперационный прогноз, ни значение при последующем наблюдении (Bertaccini et al. 2008).
[0012] Матриксная металлопротеиназа-7 (MMP7) описана в качестве независимого маркера в сыворотке и моче для метастазов в лимфатических узлах (Gunes et al. 2013, Jager et al. 2013, Szarvas et al. 2010, Szarvas et al. 2011b), а также в качестве независимого прогностического маркера для BCa перед хирургической операцией (Svatek et al. 2010, Szarvas et al. 2010, Szarvas et al. 2011a). Высокие уровни MMP-7 также описаны в качестве независимого фактора риска плохой выживаемости при специфических видах метастазирующего рака мочевого пузыря (El Demery et al. 2014). См. также WO 2007/144144 A1.
[0013] Настоящее изобретение основано на неожиданном обнаружении того, что хромогранин A имеет высокую прогностическую ценность при не нейроэндокринном раке мочевого пузыря. Таким образом, он может помочь преодолеть вышеуказанные недостатки диагностических инструментов предшествующей области техники для рака мочевого пузыря.
Сущность изобретения
[0014] Настоящее изобретение относится к применению хромогранина A (CgA) в качестве маркера (в частности, прогностического маркера) для рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря, и предпочтительно, уротелиальной карциномы. В частности, CgA можно использовать в качестве маркера в анализе in vitro для прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы.
[0015] Изобретение, кроме того, относится к способу прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы, у субъекта, включающему определение уровня CgA и необязательно, MMP7 в образце физиологической жидкости указанного субъекта. Настоящее изобретение, кроме того, относится к применению диагностических наборов, содержащих одно или несколько антител, специфических для CgA, для прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря, в частности не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы, у субъекта. Изобретение относится также к способам лечения рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы, у субъекта, в которых определяют уровень CgA в образце от указанного субъекта.
Описание чертежей
Фигура 1: Концентрация CgA в сыворотке для контроля и случаев
Фигура 2: Прогностическая ценность уровней CgA и MMP-7, и их комбинации у пациентов, подвергнутых хирургическому лечению (TURBT или RCE) (кривые Каплана-Мейера с логарифмическими ранговыми критериями). DSS: специфическая для заболевания выживаемость.
Фигура 3: Прогностическая ценность уровней CgA и MMP7, и их комбинаций в подгруппе пациентов, подвергнутых лечению RCE (кривые Каплана-Мейера с логарифмическими ранговыми критериями)
Подробное описание изобретения
[0016] Настоящее изобретение относится к применению хромогранина A (CgA) в качестве маркера для рака мочевого пузыря (в частности, не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы), в частности в качестве прогностического маркера для рака мочевого пузыря, в частности, для не нейроэндокринного рака мочевого пузыря, предпочтительно, уротелиальной карциномы. Таким образом, CgA можно использовать в качестве маркера в анализе in vitro для прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря, предпочтительно, уротелиальной карциномы. Иными словами, CgA оказался хорошим биомаркером для оценки тяжести заболевания у пациентов с раком мочевого пузыря, в частности, у пациентов с не нейроэндокринным раком мочевого пузыря, предпочтительно, у пациентов с уротелиальной карциномой. CgA можно, таким образом, также использовать в управлении течением заболевания пациентов («ведении пациентов») с раком мочевого пузыря, в частности, не нейроэндокринным раком мочевого пузыря и предпочтительно, уротелиальной карциномой.
[0017] Настоящее изобретение относится к способам прогнозирования для субъектов с раком мочевого пузыря (в частности, субъектов с не нейроэндокринным раком мочевого пузыря, предпочтительно, субъектов с уротелиальной карциномой), включающим стадию определения уровня CgA (и необязательно, MMP7) в образце физиологической жидкости указанного субъекта. Изобретение, в частности, относится к способу прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря (в частности, не нейроэндокринного рака мочевого пузыря, предпочтительно, уротелиальной карциномы) у субъекта, включающему стадию определения уровня CgA в образце физиологической жидкости указанного субъекта. Необязательно, уровень MMP7, кроме того, определяют в том же или другом образце от указанного субъекта. Уровень CgA (и необязательно, MMP7, в зависимости от ситуации) в образце от субъекта в одном аспекте является показателем тяжести и агрессивности рака мочевого пузыря (в частности не нейроэндокринного рака мочевого пузыря, предпочтительно, уротелиальной карциномы) и/или исхода для субъекта. Увеличенный уровень CgA (и необязательно, MMP7, в зависимости от ситуации) в образце от субъекта, по сравнению с контрольным уровнем или предопределенным порогом, является показателем плохого исхода для субъекта. Например, уровень CgA в образце от субъекта является показателем для общей выживаемости субъекта или специфической для заболевания выживаемости субъекта, или выживаемости субъекта без прогрессирования.
[0018] В некоторых вариантах осуществления сначала определяют уровень CgA в образце от субъекта и затем проводят дополнительные тесты, если уровень CgA выше предопределенного порога в другом образце от того же субъекта, например, затем определяют уровень MMP7, чтобы уточнить или подтвердить первоначальный прогноз, основанный на уровне CgA. В других, более предпочтительных, вариантах осуществления сначала определяют уровень MMP7 в образце от субъекта и затем проводят дополнительные тесты, если уровень MMP7 выше предопределенного порога в другом образце от того же субъекта, например, затем определяют уровень CgA, чтобы уточнить или подтвердить первоначальный прогноз, основанный на уровне MMP7. Таким образом, уровни MMP7 и CgA можно использовать вместе, чтобы уточнить первоначальный прогноз, основанный только на одном из этих двух маркеров.
[0019] Термин «рак пузыря» (также обозначаемый как «рак мочевого пузыря») в контексте настоящего изобретения предпочтительно относится к раку мочевого пузыря не нейроэндокринного происхождения. Таким образом, предпочтительно, «рак мочевого пузыря» не является нейроэндокринной опухолью (NET). Термин «нейроэндокринный» относится к нервному или эндокринному влиянию, и в частности, к взаимодействию между нервной и эндокринной системой. В частности, термин «нейроэндокринный» относится к клеткам, высвобождающим гормон в кровь в ответ на нервный стимул. «Нейроэндокринные злокачественные опухоли», следовательно, представляют собой злокачественные неоплазии, возникающие из клеток эндокринной (гормональной) и нервной систем. Нейроэндокринный рак мочевого пузыря включает, например, мелкоклеточную карциному (SCC), карциноидную опухоль и крупноклеточную нейроэндокринную карциному (LCNEC).
Таким образом, «рак мочевого пузыря» в настоящем описании предпочтительно относится к раку мочевого пузыря, не возникающему из клеток эндокринной (гормональной) и нервной систем. Таким образом, предпочтительно в настоящем описании, рак мочевого пузыря не представляет собой мелкоклеточную карциному, не представляет собой карциноидную опухоль и не представляет собой крупноклеточную нейроэндокринную карциному. Рак мочевого пузыря в контексте настоящего изобретения предпочтительно выбран из группы, состоящей из переходноклеточной карциномы (TCC) (т.е. уротелиальной карциномы (UC) мочевого пузыря, также известной как карцинома из уротелиальных клеток (UCC)), плоскоклеточной карциномы и аденокарциномы, более предпочтительно, рак мочевого пузыря в контексте настоящего изобретения представляет собой переходноклеточную карциному. Термин «уротелиальная» конкретно относится к карциноме уротелия, обозначая TCC мочевыделительной системы. Таким образом, уротелиальная карцинома в контексте настоящего изобретения означает уротелиальную карциному мочевого пузыря. Переходноклеточная карцинома (= уротелиальная карцинома) может представлять собой поверхностный рак мочевого пузыря (т.е. не мышечно-инвазивный рак мочевого пузыря (NMIBC)) или мышечно-инвазивный рак мочевого пузыря (MIBC). NMIBC может, например, представлять собой папиллярную карциному или плоскую карциному (например, карциному in situ (CIS)). Как правило, уротелиальную карциному мочевого пузыря можно, например, также классифицировать как микропапиллярную, гнездовую, плазмоцитоидную, саркоматоидную или другие варианты, или она может иметь смешанную гистологию. Микропапиллярный или гнездовой варианты уротелиальной карциномы являются особенно агрессивными.
Эти виды рака мочевого пузыря можно, например, классифицировать в соответствии с таблицей TNM от UICC/AJCC (Международного союза по борьбе с онкологическими заболеваниями/Американского объединенного онкологического комитета) и оценивать по степени злокачественности в соответствии с классификациями WHO 1973-2004.
[0020] Субъект в контексте настоящего изобретения страдает не нейроэндокринным раком мочевого пузыря и/или имеет диагноз не нейроэндокринный рак мочевого пузыря до указанного определения уровня CgA. Предпочтительно, в настоящем описании, субъект не имеет нейроэндокринный рак мочевого пузыря (т.е. не страдает нейроэндокринным раком мочевого пузыря). Таким образом, предпочтительно, у субъекта не диагностирован нейроэндокринный рак мочевого пузыря.
[0021] Термин «субъект» в настоящем описании относится к живому человеку или не относящемуся к человеку животному, предпочтительно, млекопитающему, наиболее предпочтительно, человеку. Субъект предпочтительно представляет собой пациента. Термин «пациент», как применяют в настоящем документе, относится к живому человеку или не относящемуся к человеку животному (наиболее предпочтительно, человеку), который получает медицинскую помощь или который должен получать медицинскую помощь из-за заболевания, в частности, не нейроэндокринного рака мочевого пузыря. Это включает индивидуумов без установленного заболевания, у которых исследуют признаки патологии. Таким образом, способы и анализы, описанные в настоящем документе применимы как к заболеванию человека, так и к ветеринарному заболеванию.
[0022] Термин «уровень» в контексте настоящего изобретения относится к концентрации (предпочтительно, выраженной как масса/объем; масс./об.; например, как «нг/мл») маркера (например, CgA и/или MMP7), полученной из образца от субъекта, например, пациента с раком мочевого пузыря.
[0023] «Диагноз» в контексте настоящего изобретения относится к распознаванию и (ранней) детекции заболевания или клинического состояния у субъекта и может также включать дифференциальную диагностику. Также оценку тяжести заболевания или клинического или гистопатологического состояния можно в конкретных вариантах осуществления включать в термин «диагностика».
«Прогноз» относится к прогнозированию исхода или специфического риска для субъекта, страдающего конкретным заболеванием или клиническим состоянием, в настоящем описании, не нейроэндокринного рака мочевого пузыря. Это может включать оценку шанса восстановления или шанса неблагоприятного исхода для указанного субъекта.
[0024] «Мониторирование» или «мониторирование терапии» относится к отслеживанию уже диагностированного заболевания, нарушения, осложнения или риска, например, для анализа прогрессирования заболевания (в настоящем описании: не нейроэндокринного рака мочевого пузыря) или влияния конкретного лечения на прогрессирование заболевания или нарушения. По настоящему изобретению, термин «стратификация риска» относится к группировке субъектов в различные группы риска в соответствии с их прогнозами на будущее. Стратификация риска также относится к стратификации для принятия профилактичеких и/или терапевтических мер.
[0025] Термин «управление течения заболеванием пациента» в контексте настоящего изобретения относится к:
• решению о поступлении в больницу или отделение интенсивной терапии,
• решению о перемещении пациента в специализированную больницу или в специализированное отделение больницы,
• оценке для ранней выписки из отделения интенсивной терапии или больницы,
• распределению ресурсов (например, штата врачей и/или медицинских сестер, диагностических, терапевтических, хирургических средств).
[0026] Термин «оценка тяжести заболевания» относится к оценке статуса заболевания у пациента, включающей гистопатологию опухоли, статус метастазирования и прогрессирование заболевания, вероятность неблагоприятных событий (включая смерть), вероятность высоких затрат на госпитализированного пациента и вероятность длительной госпитализации.
[0027] Термин «исход» в контексте настоящего изобретения относится к степени тяжести заболевания, например, к состоянию здоровья пациента через определенное время, например, через 3 суток, 5 суток, 10 суток, 14 суток, 20 суток, 3 недели, 4 недели, 30 суток, 45 суток, 60 суток, 90 суток, 3 месяца, 6 месяцев, 1 год, 2 года или 5 лет. Исход можно выражать как показатель (процент) в популяции (например, в исследуемой группе или в группе лечения) или как показатель для индивидуума (т.е. вероятность для конкретного субъекта или пациента). Таким образом, «общий исход» можно выражать как «показатель общей выживаемости», который представляет собой процент людей в группе (например, в исследуемой группе или в группе лечения), которые все еще живы в течение конкретного периода времени, после того, как у них диагностировано заболевание, или их начали подвергать лечению заболевания, такого как, в настоящем случае, не нейроэндокринный рак мочевого пузыря. Показатель общей выживаемости часто указывают как показатель пятилетней выживаемости, который представляет собой процент людей в исследуемой группе или в группе лечения, которые живы через пять лет после того, как им поставили диагноз, или их начали подвергать лечению заболевания. Таким образом, «общий исход» или «общая выживаемость» для конкретного субъекта или пациента представляет собой вероятность выжить в течение конкретного периода времени, т.е. он относится к ожидаемой продолжительности жизни указанного субъекта или пациента.
«Специфическую для заболевания выживаемость» можно выражать как «показатель специфической для заболевания выживаемости», который представляет собой процент людей в популяции (например, в исследуемой группе или в группе лечения), которые не умерли от специфического заболевания в определенный период времени. Период времени обычно начинается на время диагностики или начала лечения и заканчивается на время смерти. Пациентов, которые умерли от причин, отличных от исследуемого заболевания (в настоящем описании: не нейроэндокринного рака мочевого пузыря) не учитывают в этом измерении. Таким образом, «специфические для заболевания» выживаемость или исход для индивидуального субъекта или пациента означает вероятность не умереть от не нейроэндокринного рака мочевого пузыря в определенный период времени.
«Выживаемость без прогрессирования» представляет собой продолжительность периода времени во время и после лечения заболевания, такого как не нейроэндокринный рак мочевого пузыря, который субъект или пациент проживает с заболеванием, но оно не становится хуже. «Прогрессирование» может, например, представлять собой появление новой опухоли (в первичном или отдаленном участке) («рецидив») или увеличение размера, гистологической стадии, степени злокачественности или симптома, в частности, после данного излечивающего или паллиативного лечения. Прогрессирование можно, например, детектировать радиографически или биохимически. Например, в случае NMIBC, прогрессирование может относится к прогрессированию от стадии Ta до T1, до T2, до T3, до T4; или от стадии G1/2 до G3, или от стадии LN0 до LN+, или от стадии M0 до M+. Для не метастазирующего MIBC, прогрессирование может относится к послеоперационному рецидиву, прогрессированию от стадии LN0 to LN+ или от стадии M0 to M+. Специфическую для заболевания смерть также можно рассматривать как прогрессирование. При метастазирующем MIBC, прогрессирование можно, например, детектировать радиографически, например, в соответствии с критериями RECIST.
В некоторых аспектах, плохой исход представляет собой, например, увеличенный риск уменьшения ожидаемой продолжительности жизни, увеличенный риск прогрессирования, увеличенный риск связанной со злокачественной опухолью смерти и/или увеличенный риск рецидива после хирургического лечения и/или лечения с использованием лекарственного средства, и/или радиотерапии.
[0028] Способы и применения по настоящему изобретению можно использовать в различных ситуациях и на различных стадиях заболевания, например, перед вмешательством или после вмешательства. Термины «перед вмешательством», «проведенный перед вмешательством» и «до вмешательства» в настоящем описании относятся к времени до того, как начали вмешательство для лечения не нейроэндокринного рака мочевого пузыря. Под «вмешательством» понимают любое медицинское вмешательство, используемое для модификации исхода для состояния здоровья. Это определение включает введение лекарственного средства, хирургические процедуры, применение устройств, виды лечения для коррекции поведения, изменение ухода и т.п. Предпочтительно, образец отбирают после поступления пациента в больницу или перед подтверждением диагноза не нейроэндокринного рака мочевого пузыря.
Например, в одном аспекте у субъекта диагностирован не нейроэндокринный рак мочевого пузыря, и его (до настоящего времени) не подвергали хирургическому лечению указанного не нейроэндокринного рака мочевого пузыря. В таком случае, способы по изобретению можно использовать для прогнозирования исхода или для выбора подходящего лечения (например, вида хирургического вмешательства).
Термины «после вмешательства», «проведенный после вмешательства» и «за вмешательством» относятся к времени после того, как начали вмешательство или лечение.
Например, в одном аспекте, субъекта уже подвергали хирургическому лечению указанного не нейроэндокринного рака мочевого пузыря, например, радикальной цистэктомии указанного не нейроэндокринного рака мочевого пузыря. В таком случае, способы по изобретению можно использовать для прогнозирования исхода и/или для выбора подходящего последующего лечения, и/или для мониторирования субъекта (например, по прогрессированию заболевания). Таким образом, уровень CgA (и любого другого дополнительного маркера, включая MMP7, в зависимости от ситуации) можно использовать для послеоперационного контроля. Термин «послеоперационный контроль» в контексте настоящего изобретения относится к мониторированию указанного субъекта после хирургической процедуры у указанного субъекта.
[0029] «Прогнозирование» в контексте настоящего изобретения в одном случае относится к прогнозированию осложнения, прогрессирования или симптома до того, как другие симптомы или маркеры станут очевидными или значительно изменятся. В контексте настоящего изобретения, такие термины, как «прогностическая ценность» относятся к статистической значимости конкретного определенного результата измерения. Таким образом, увеличение прогностической ценности или прогностической мощности в контексте настоящего изобретения означает, что вероятность правильного диагноза, прогноза, стратификации или т.п., основанная на конкретном значении, определенном из измерения уровня конкретного маркера в образце, увеличивается.
[0030] Как описано в настоящем описании выше, уровень CgA в образце от указанного субъекта (так же как уровни любых других дополнительных маркеров, таких как MMP7) можно сравнивать с контрольным уровнем или предопределенным порогом. Эти контрольные уровни или предопределенные пороги могут представлять собой абсолютные значения или относительные значения.
В зависимости от конкретного применения, контрольный уровень может представлять собой уровень CgA в наиболее раннем образце от того же самого субъекта, например, контрольный уровень может представлять собой уровень CgA в образце, взятом от того же самого субъекта до хирургического вмешательства (например, RCE), и определенный уровень может происходить из образца, взятого после хирургического лечения (например, RCE). То же самое применимо для других маркеров, которые можно дополнительно определять, например, MMP7.
Предопределенный порог для уровня CgA можно, например, выбирать в диапазоне от 100 нг/мл до 431 нг/мл, предпочтительно, в диапазоне от 103 нг/мл до 191 нг/мл, более предпочтительно, от 130 нг/мл до 160 нг/мл, и наиболее предпочтительно, 147 нг/мл. Выбор порога для специфического применения может быть основан, например, на желательной специфичности и/или избирательности анализа; см. ниже.
[0031] Как описано в настоящем описании выше, в дополнение к уровню CgA, уровень других маркеров, в частности, биомаркеров, можно определять у того же самого субъекта, предпочтительно, в одном и том же образце. Одним маркером, как оказалось, обладающим особенной ценностью вместе с CgA, является матриксная металлопротеиназа-7 (MMP7). Таким образом, в контексте настоящего изобретения, предпочтительно, дополнительно уровень матриксной металлопротеиназы 7 (MMP7) определяют в указанном образце от указанного субъекта или в другом образце от указанного субъекта, и уровень MMP7 в образце от субъекта является показателем тяжести не нейроэндокринного рака мочевого пузыря и/или исхода для субъекта. Увеличенный уровень MMP7 в образце от субъекта по сравнению с контрольным уровнем или предопределенным порогом может являться показателем плохого исхода для субъекта, в частности, увеличенного риска уменьшения ожидаемой продолжительности жизни, увеличенного риска прогрессирования, увеличенного риска связанной с злокачественной опухолью смерти и/или увеличенного риска рецидива после хирургического лечения и/или лечения с использованием лекарственного средства, и/или радиотерапии. Уровень MMP7 в одном и том же образце или в другом образце от субъекта может в одном аспекте является показателем общей выживаемости субъекта или специфической для заболевания выживаемости субъекта, или выживаемости субъекта без прогрессирования. Предварительно определенный порог для уровня MMP7 можно, например, выбирать в диапазоне от 4,4 до 21 нг/мл, предпочтительно, в диапазоне от 5,4 до 10,1 нг/мл, более предпочтительно, в диапазоне от 6 до 9 нг/мл. Наиболее предпочтительно, предопределенный порог для уровня MMP7 составляет 7,75 нг/мл. Выбор порога для конкретного применения может быть основан. например, на желательной специфичности и/или избирательности анализа; см. ниже.
[0032] В конкретном варианте осуществления способов по настоящему изобретению,
(i) уровень CgA в указанном образце выше предопределенного порога для CgA является показателем высокого риска связанной с злокачественной опухолью смерти после хирургического лечения (например, TURBT, частичной цистэктомии (PCE), RCE, RCE в комбинации с регионарной или расширенной LND, метастазэктомии), или видов лечения с использованием лекарственных средств (химиотерапии, направленной терапии, иммунотерапии) или радиотерапии и
(ii) уровень CgA в указанном образце выше предопределенного порога для CgA и уровень MMP7 в указанном образце выше предопределенного порога для MMP7 является показателем очень высокого риска связанной с злокачественной опухолью смерти и более короткой продолжительности жизни после хирургического лечения (например, TURBT, PCE, RCE, RCE в комбинации с регионарной или расширенной LND, метастазэктомии), или видов лечения с использованием лекарственных средств (химиотерапии, направленной терапии, иммунотерапии), или радиотерапии.
[0033] С использованием способов по настоящему изобретению, медицинский работник является способным выбирать наиболее подходящее лечение на основании определенного для пациента риска. Как описано, изобретение относится к послеопрационному, неинвазивному, недорогому и простому для манипуляций инструменту для мониторированя эффективности лечения и рецидивов рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы. Например, уровень CgA и необязательно, MMP7, можно определять в через регулярные интервалы времени в ходе последующего наблюдения, и контрольный уровень может представлять собой уровень, определенный до указанного хирургического лечения и/или на начальной стадии последующего наблюдения.
[0034] В одном конкретном аспекте, предоперационный уровень (предпочтительно, уровень в сыворотке) CgA используют в качестве маркера для общей и специфической для заболевания выживаемости у пациентов после хирургического вмешательства (например, RCE). В конкретном аспекте изобретения MMP7 используют в качестве дополнительного маркера для плохой специфической для заболевания выживаемости у пациентов, подвергнутых лечению RCE. MMP7 можно также использовать в качестве дополнительного маркера для мышечно-инвазивной опухоли и/или метастазирования.
[0035] Как обсуждали, в дополнение к определению уровня CgA, дополнительно можно определять уровень других маркеров, в частности, биомаркеров (включая MMP7), и другие клинические параметры для субъекта. Такой клинический параметр(ы) для субъекта можно, например, выбирать из группы, состоящей из гистологического подтипа опухоли, статуса метастазирования (в лимфатических узлах и отдаленного), лимфаденопатии, курения или употребления табака, возраста, пола, семейного анамнеза, этнической принадлежности, массы тела, индекса массы тела (BMI), цистоскопических данных, цитологии мочи (VUC), ультразвукового исследования, сканирования КТ, ЯМР и TURBT, и кровяного давления. В конкретном варианте осуществления, дополнительно определяют по меньшей мере один клинический параметр, выбранный из группы, включающий возраст, пол, систолическое кровяное давление, диастолическое кровяное давление, антигипертензивное лечение, анамнез заболеваний мочевыводящих путей и их лечения, инсульт в анамнезе, свистящее дыхание, индекс массы тела, частоту сердечных сокращений, температуру, присутствие сахарного диабета и текущую привычку к курению.
[0036] Кроме того, уровень маркера, выбранного из группы, состоящей из родственного фактору комплемента H белка и фактора комплемента H, белка ядерного матрикса BLCA-4, сурвивина (BIRC5, EPR-1), цитокератина 8 (CK8), цитокератина 18 (CK18), цитокератина 20 (CK20), белка CEA и ассоциированных с клетками опухоли мочевого пузыря муцинов, изменений на хромосомах 3, 7, 17 и 9p21, белка CEA (CEA), CYFRA 21-1 (CK19), карбоангидразы, неврологического сенсорного белка (NSE), c-реактивного белка (CRP), белка 22 ядерного митотического аппарата (NMP22), щелочной фосфатазы, матриксной металлопротеиназаы 1 (MMP-1), матрикснойметаллопротеиназы 2 (MMP-2), матриксной металлопротеиназы 3 (MMP-3), матриксной металлопротеиназы 9 (MMP-9), матриксной металлопротеиназы 10 (MMP-10), матриксной металлопротеиназы 13 (MMP-13), матриксной металлопротеиназы 26 (MMP-26), тканевого ингибитора металлопротеиназ 1 (TIMP-1), тканевого ингибитора металлопротеиназ 2 (TIMP-2), тканевого ингибитора металлопротеиназ 3 (TIMP-3), тканевого ингибитора металлопротеиназ 4 (TIMP-4), альфа-1-антитрипсина, фактора роста эндотелия сосудов (VEGF), плацентарного фактора роста (PLGF), рецептора 1 фактора роста эндотелия сосудов (VEGFR-1), растворимого рецептора 1 фактора роста эндотелия сосудов (sVEGFR-1, sfLT-1), рецептора 2 фактора роста эндотелия сосудов (VEGFR-2), рецептора 3 растворимого фактора роста эндотелия сосудов (sVEGFR-3), фактора роста эндотелия сосудов A (VEGFA), фактора роста эндотелия сосудов C (VEGFC), связывающего инсулиноподобный фактор роста белка 1 (IGFBP-1), связывающего инсулиноподобный фактор роста белка 2 (IGFBP-2), связывающего инсулиноподобный фактор роста белка 3 (IGFBP-3), связывающего инсулиноподобный фактор роста белка 4 (IGFBP-4), связывающего инсулиноподобный фактор роста белка 5 (IGFBP-5), связывающего инсулиноподобный фактор роста белка 6 (IGFBP-6), трансформирующего фактора роста β (TGF-β), инсулиноподобного фактора роста (IGF), рецептора инсулиноподобного фактора роста (IGFR), инсулиноподобного фактора роста 1 (IGF-1), рецептора инсулиноподобного фактора роста 1 (IGF1R), эндотелиального фактора роста (EGF), рецептора эндотелиального фактора роста (EGFR), связывающего прогепарин подобного EGF фактора роста (proHB-EGF), связывающего мРНК инсулиноподобного фактора роста 2 белка 3 (IGFBP3), связывающего мРНК инсулиноподобного фактора роста 2 белка 7 (IGFBP7), ангиостатина, эндостатина, плазминогена (PLG), аквапорина 1 (AQP-1), перилипина 2 (PLIN-2), хорионического гонадотропина человека (hCG), рецептора андрогенов (AR), рецептора эстрогенов (ER), простатспецифического антигена (PSA), свободного простатспецифического антигена (свободного PSA), общего простатспецифического антигена антиген (общего PSA), фактора некроза опухоли α (TNFα), E-кадгерина, эластина, фибронектина, коллагенв и витронектина, можно определять в указанном образце или другом образце от субъекта. Среди них, предпочтительные дополнительные маркеры выбраны из родственного фактору комплемента H белка и фактора комплемента H, белка ядерного матрикса BLCA-4, цитокератина 8 (CK8), цитокератина 18 (CK18), белка CEA и ассоциированных с клетками опухоли мочевого пузыря муцинов, изменений на хромосомах 3, 7, 17 и 9p21, белка CEA (CEA), белка 22 ядерного митотического аппарата (NMP22), щелочной фосфатазы, тканевого ингибитора металлопротеиназ 1 (TIMP-1) и тканевого ингибитора металлопротеиназ 2 (TIMP-2).
[0037] Термин «биомаркер» (биологический маркер) относится к поддающимся измерению и количественной оценке биологическим параметрам (например, концентрации специфического фермента, концентрации специфического гормона, распределению фенотипа специфического гена в популяции, присутствию биологических веществ), которые служат показателями связанных с состоянием здоровья и физиологией оценок, таких как риск заболевания, психиатрические нарушения, воздействие окружающей среды и его эффекты, диагноз заболевания, метаболические процессы, наркотическая зависимость и токсикомания, беременность, развитие линии клеток, эпидемиологические исследования и т.д. Кроме того, биомаркер определяют как характеристику, которую объективно измеряют и оценивают в качестве показателя нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркер можно измерять в биологическом образце (например, цельной крови, сыворотке, плазме, моче), он может представлять собой запись показаний, полученную для индивидуума (кровяное давление, ЭКГ или холтеровское мониторирование ЭКГ), или он может представлять собой тест визуализации (эхокардиограмму или сканирование КТ) (Vasan et al. 2006, Circulation 113:2335-2362). Биомаркеры могут указывать на множество характеристик состояния здоровья или заболевания, включая уровень или тип воздействия фактора окружающей среды, генетическую предрасположенность, генетические ответы на воздействия, биомаркеры субклинического или клинического заболевания, или показатели ответа на терапию. Таким образом, упрощенным способом понимания биомаркеров является понимание в качестве показателей признака заболевания (фактора риска или биомаркера риска), состояния заболевания (доклинического или клинического), или скорости развития заболевания (прогрессирования). Соответственно, биомаркеры можно классифицировать как предшествующие биомаркеры (идентифицирующие риск развития заболевания), скринирующие биомаркеры (скринирующие субклиническое заболевание), диагностические биомаркеры (распознающие явное заболевание), определяющие степень биомаркеры (категоризирующие тяжесть заболевания), или прогностические биомаркеры (прогнозирующие будущее течение заболевания, включая рецидив и ответ на терапию, и мониторирующие эффективность терапии). Биомаркеры могут также служить суррогатными конечными точками. Суррогатная конечная точка представляет собой точку, которую можно использовать в качестве исхода в клинических исследованиях для оценки безопасности и эффективности лекарственных средств вместо измерения действительного представляющего интерес исхода. Лежащим в основе принципом является то, что изменения суррогатной конечной точки следуют близко с изменениями представляющего интерес исхода. Суррогатные конечные точки имеют то преимущество, что их можно получать в более короткие временные рамки и с меньшими затратами, чем конечные точки, такие как заболеваемость и смертность, требующие крупных клинических исследований для оценки. Дополнительная ценность суррогатных конечных точек включает тот факт, что они находятся ближе к представляющему интерес воздействию/вмешательству, и их можно проще причинно-следственно связать с ним, чем более отдаленные клинические события. Важным недостатком суррогатных конечных точек является то, что если на представляющий интерес клинический исход влияют многочисленные клинические факторы (в дополнение к суррогатной конечной точке), остаточное искажение может уменьшать обоснованность суррогатной конечной точки. Предположили, что обоснованность суррогатной конечной точки является большей, если она может объяснить по меньшей мере 50% эффекта воздействия или вмешательства на представляющий интерес исход. Например, биомаркер может представлять собой белок, пептид или молекулу нуклеиновой кислоты.
Национальный институт здравоохранения (NIH) определяет биомаркер как биологический маркер, который объективно измеряют и оценивают как показатель нормального биологического процесса, патогеного процесса или фармакологических ответов на терапевтические вмешательства (Danesh et al. Clin Pharmacol Ther 2001. 169:416-468).
Некоторые из маркеров (в частности, биомаркеров) представляют собой «маркеры злокачественных опухолей», т.е. они представляют собой маркеры, ассоциированные с диагнозом и/или прогнозом злокачественной опухоли, в настоящем описании: не нейроэндокринного рака мочевого пузыря.
[0038] Способы по настоящему изобретению могут включать начальную стадию получения образца физиологической жидкости от указанного субъекта. Термин «образец», как используют в контексте настоящего изобретения, относится к образцу физиологической жидкости, полученной для целей диагностики, прогнозирования или оценки представляющего интерес субъекта, такого как пациент. Предпочтительные тестируемые образцы включают (цельную) кровь, сыворотку, плазму и мочу. Некоторые тестируемые образцы более просто анализируют после процедуры фракционирования или очистки, например, разделения цельной крови на компоненты сыворотки или плазмы. Таким образом, в предпочтительном варианте осуществления изобретения, образец выбран из группы, содержащей образец (цельной) крови, образец сыворотки, образец плазмы и образец мочи или экстракт любого из вышеупомянутых образцов. Предпочтительно, образец представляет собой образец цельной крови, наиболее предпочтительно, образец сыворотки или образец плазмы. Как применяют в настоящем документе, «образец цельной крови» обозначает не переработанный или по существу не переработанный образец крови. Когда это целесообразно, образец может являться необходимым гомогенизировать, или экстрагировать растворителем перед использованием по настоящему изобретению, чтобы получить жидкий образец. Жидкий образец, таким образом, может представлять собой раствор или суспензию. Жидкие образцы можно подвергать одной или нескольким предварительным обработкам перед использованием по настоящему изобретению. Такие предварительные обработки включают, но без ограничения, разведение, фильтрацию, центрифугирование, концентрирование, седиментацию, преципитацию или диализ. Предварительные обработки могут также включать добавление в раствор химических или биохимических веществ, таких как кислоты, основания, буферы, соли, растворители, реакционноспособные красители, детергенты, эмульгаторы или хелаторы.
«Плазма» в контексте настоящего изобретения представляет собой фактически бесклеточный супернатант крови, содержащей антикоагулянт, полученный после центрифугирования. Иллюстративные антикоагулянты включают связывающие ион кальция соединения, такие как ЭДТА или цитрат, и ингибиторы тромбина, такие как гепаринаты или гирудин. Бесклеточную плазму можно получать посредством центрифугирования подвергнутой воздействию антикоагулянта крови (например, подвергнутой воздействию цитрата, ЭДТА или гепарина крови) в течение по меньшей мере 15 минут при 2000-3000 g. Таким образом, является предпочтительным, чтобы образцы плазмы, используемые в контексте настоящего изобретения, подвергали центрифугированию при более чем 1500 g в течение 30 мин, предпочтительно, по меньшей мере при 2000 g в течение по меньшей мере 30 мин, более предпочтительно, по меньшей мере при 3000 g в течение по меньшей мере 20 мин, наиболее предпочтительно, по меньшей мере при 3000 g в течение по меньшей мере 30 мин.
«Сыворотка» в контексте настоящего изобретения представляет собой неразведенную, внеклеточную часть крови после завершения адекватного свертывания. Свертывание обычно завершается через 30 мин. Сыворотку можно получать посредством центрифугирования коагулированного образца в течение по меньшей мере 10 минут при минимальной скорости 1500 g. Таким образом, является предпочтительным, чтобы образцы сыворотки, используемые в контексте настоящего изобретения, подвергали центрифугированию по меньшей мере при 1500 g в течение по меньшей мере 10 мин, предпочтительно в течение по меньшей мере 15 мин, более предпочтительно, в течение по меньшей мере 20 мин. Наиболее предпочтительно, образец сыворотки подвергают центрифугированию по меньшей мере при 3000 g в течение по меньшей мере 20 мин.
[0039] Уровень CgA можно определять с использованием соответствующих анализов. «Анализ» или «диагностический анализ» может относиться к любому типу, используемому в области диагностики. Такой анализ может быть основан на связывании подлежащего детекции аналита с одним или несколькими связывающими зондами с определенной аффинностью. Что касается взаимодействия между связывающими молекулами и молекулами-мишенями или представляющими интерес молекулами, константа аффинности предпочтительно превышает 108 M-1.
[0040] Предпочтительные способы детекции включают иммуноанализы в различных форматах, например, таких как радиоиммунный анализ (RIA), хемилюминесцентные и флюоресцентные иммуноанализы, твердофазные иммуноферментные анализы (ELISA), массивы на основе бусин с Luminex, анализы микромассивов белка, форматы экспресс-анализа или анализа на месте оказания медицинской помощи (PoC), например, такие как тесты на иммунохроматографических полосках, и автоматизированные системы иммуноанализа, например, такие как система BRAHMS KRYPTOR. Особенно предпочтительными являются форматы тестов PoC; например, см. St. John & Price, Clin Biochem Rev. 2014 Aug; 35(3): 155-167. Кроме того, способы масс-спектрометрии можно использовать для детекции и количественной оценки CgA, MMP7 и/или дополнительных биомаркеров, например, можно использовать количественный контроль избирательных реакций (qSRM). Для масс-спектрометрических измерений, химическую дериватизацию обычно проводят перед анализом и количественной оценкой белка-мишени.
[0041] Иммуноанализы могут представлять собой гомогенные или гетерогенные анализы, конкурентные и не конкурентные анализы. В особенно предпочтительном варианте осуществления, анализ находится в форме сэндвич-анализа, который представляет собой не конкурентный иммуноанализ, в котором молекула, подлежащая детекции и/или количественной оценке, связывается с первым антителом и с вторым антителом. Первое антитело может являться связанным с твердой фазой, например, бусиной, поверхностью лунки или другого контейнера, чипом или полоской, и второе антитело представляет собой антитело, которое является меченным, например, с использованием красителя, радиоактивного изотопа или реакционноспособной или каталитически активной группы. Затем количество меченого антитела, связанного с аналитом, измеряют подходящим способом. Общая композиция и способы, вовлеченные в «сэндвич-анализы», хорошо разработаны и известны специалисту в данной области ((The Immunoassay Handbook, Ed. David Wild, Elsevier LTD, Oxford; 3rd ed. (May 2005), ISBN-13: 978-0080445267; Hultschig C et al., Curr Opin Chem Biol. 2006 Feb;10(1):4-10, содержание которого приведено в настоящем документе в качестве ссылки).
[0042] В особенно предпочтительном варианте осуществления анализ включает две связывающие молекулы, предпочтительно, антитела, которые обе присутствуют в форме дисперсий в жидкой реакционной смеси, где первый метящий компонент присоединен к первой связывающей молекуле, где указанный первый метящий компонент является частью системы мечения, основанной на гашении или усилении флуоресценции или хемилюминесценции, и второй метящий компонент указанной системы мечения присоединен к второй связывающей молекуле, так что при связывании обеих связывающих молекул с аналитом образуется поддающийся измерению сигнал, позволяющий детекцию сформированных сэндвич-комплексов в растворе, содержащем образец.
Даже более предпочтительно, указанная система мечения содержит криптаты редкоземельных металлов или хелаты редкоземельных металлов в комбинации с флуоресцентным красителем или хемилюминесцентным красителем, в частности, красителем цианинового типа.
[0043] В контексте способов по настоящему изобретению, уровень CgA и/или MMP7 предпочтительно определяют с использованием иммуноанализа. Пригодные иммуноанализы и антитела для детекции CgA описаны, например, в WO 2015/158701 A1 и Popovici et al. (2014. Clin Biochem 47: 87-91) (содержание которых, таким образом, приведено в качестве ссылки). Например, можно использовать анализ хромогранина A B·R·A·H·M·S KRYPTOR (B·R·A·H·M·S GmbH, Hennigsdorf, Germany). Дополнительные коммерческие анализы для детекции хромогранина A являются доступными и могут быть использованы: в анализе Cis-Bio ELISA (Cisbio Bioassays, Codolet, France) используют два моноклональных антитела, нацеленные против эпитопов, соответствующих аминокислотам 145-197 и 219-234, в анализе DAKO ELISA (Dako Denmark A/S, Glostrup, Denmark) используют поликлональные антитела кролика, нацеленные против C-концевого фрагмента 23 кДа, в сэндвич-анализе ELISA Euro-Diagnostica NEOLISA™ (Euro Diagnostica AB, Malmö, Sweden) используют два моноклональных антитела, нацеленные против эпитопов, соответствующих аминокислотам 236-251 и 264-279 (см. также WO 2011/135035 A1 и WO 99/58980 A1).
Пригодные иммуноанализы для детекции MMP7 описаны, например, в WO 2007/144144 A1 (содержание которого, таким образом, приведено в качестве ссылки).
Коммерчески доступные анализы для MMP7 включают в себя: набор Human Total MMP-7 Quantikine ELISA или анализ для скрининга Human Magnetic Luminex Screening Assay или анализ для скрининга Human Luminex Screening Assay или анализ активности MMP-7 человека Human MMP-7 Luminex Performance Assay, или анализ активности MMP-7 человека Human MMP-7 Magnetic Luminex Performance Assay, или анализ общей MMP-7 человека Human Total MMP-7 DuoSet ELISA, или готовый набор для анализа активности MMP человека Human MMP Premixed Luminex Performance Assay Kit или набор Proteome Profiler Human Protease Array Kit (R&D Systems Minneapolis, MN 55413, USA), набор для ELISA общей MMP-7 человека Human Total MMP-7 ELISA Kit (Aviva Systems Biology Corporation, San Diego, CA 92121, USA), набор для ELISA MMP7 (человека) MMP7 (Human) ELISA Kit (Abnova, Taipei 114, Taiwan), набор для ELISA MMP7/матрилизина человека Human MMP7/Matrilysin ELISA Kit (сэндвич-ELISA) (LifeSpan Biosciences, Seattle, Washington 98121, USA), набор для ELISA MMP7 человека MMP7 Human ELISA Kit (Abcam, Cambridge, United Kingdom), набор для флуориметрического анализа MMP-7 SensoLyte® 490 MMP-7 Assay Kit *Fluorimetric* (ANASPEC, Fremont, CA 94555, USA), анализы Bio-Plex Pro™ для MMP и TIMP человека (Bio-Rad Laboratories, Inc., Hercules, CA, U.S.A.), набор для ELISA матриксной металлопротеиназы 7 (MMP7) ELISA Kit for Matrix Metalloproteinase 7 (MMP7) (Wuhan USCN Business Co., Ltd., Wuhan City, China).
[0044] Иммуноанализы для детекции CgA, описанные в WO 2015/158701 A1, являются предпочтительными в контексте настоящего изобретения. Они основаны на использовании двух антител против CgA (сэндвич-иммуноанализ). (Первые и/или вторые) антитела или их антигенсвязывающие фрагменты или производные из способа иммуноанализа, как описано в WO 2015/158701 A1, могут, например, представлять собой поликлональные антитела, моноклональные антитела или генетически модифицированные моноклональные антитела. Указанное первое антитело является специфическим для эпитопа в последовательности CgA (SEQ ID NO:1), предпочтительно, в последовательности, охватывающей аминокислоты 124-144 из SEQ ID NO:1. Первое антитело, предпочтительно, представляет собой моноклональное антитело. Указанное второе антитело является специфическим для эпитопа в последовательности CgA (SEQ ID NO:1), предпочтительно, в последовательности, охватывающей аминокислоты 280-301 из SEQ ID NO:1. Второе антитело предпочтительно представляет собой моноклональное антитело. В конкретном иммуноанализе, первое антитело является специфическим для эпитопа в последовательности CgA (SEQ ID NO:1), охватывающей аминокислотные остатки 124-144, и второе антитело является специфическим для эпитопа в последовательности CgA (SEQ ID NO:1), охватывающей аминокислотные остатки 280-301. Первое и второе антитела, предпочтительно, представляют собой моноклональные антитела. Первое антитело или его антигенсвязывающий фрагмент или производное можно, например, получать в линии клеток гибридомы 537/H2, депонированной как DSM ACC3231. Антитело, полученное в линии клеток гибридомы 537/H2, специфически связывается с аминокислотными остатками 124-144 из последовательности CgA (SEQ ID NO:1). Второе антитело или его антигенсвязывающий фрагмент или производное можно, например, получать в линии клеток гибридомы 541/E2, депонированной как DSM ACC3232. Антитело, полученное в линии клеток гибридомы 541/E2, специфически связывается с аминокислотными остатками 280-301 из последовательности CgA (SEQ ID NO:1). В конкретном варианте осуществления иммуноанализа, первое антитело получено в линии клеток гибридомы 537/H2, депонированной как DSM ACC3231, и второе антитело получено в линии клеток гибридомы 541/E2, депонированной как DSM ACC3232.
[0045] Биомаркеры, такие как CgA, могут являться фрагментированными на более короткие пептиды или белки. Таким образом, в некоторых случаях также фрагменты CgA или других пептидных биомаркеров, таких как MMP7, можно детектировать, и их уровень в образце можно определять. Термин «фрагмент» относится к более мелким белкам или пептидам, которые можно получать из более крупных белков или пептидов, которые, таким образом, содержат частичную последовательность более крупного белка или пептида. Указанные фрагменты можно получать из более крупных белков или пептидов посредством сапонификации одной или нескольких из их пептидных связей. Указанные пептидные фрагменты предпочтительно имеют длину по меньшей мере от приблизительно 15 до приблизительно 20 аминокислот, более предпочтительно, по меньшей мере от приблизительно 25 до приблизительно 45 аминокислот.
[0046] Измеренные уровни маркеров (CgA, MMP7 и других, в зависимости от ситуации) можно коррелировать с конкретным диагнозом и/или прогнозом, например, с использованием конкретного математического алгоритма. В контексте настоящего изобретения, «алгоритм» или «математический алгоритм» относится к использованию математического или статистического способа или модели, используемых для сравнения конкретного измеренного значения со значениями в эталонной популяции, для стратификации указанного измеренного значения. Это может, например, представлять собой медиану уровня конкретной молекулы в ансамбле подвергнутых предварительному определению образцов, что означает, что измеренный уровень указанной молекулы сравнивают с математической медианой уровня указанной молекулы в данном количестве образцов. Количество образцов, используемых для определения медианы, не является конкретно ограниченным, однако, должно быть достаточным, чтобы обеспечивать статистическую значимость медианы. Количество образцов, используемых для определения медианы, может даже увеличиваться с течением времени, поскольку значения результатов дальнейших измерений для клинических образцов добавляют, чтобы увеличивать статистическую значимость медианы. Предпочтительно, количество образцов выбирают таким образом, чтобы обеспечивать статистическую значимость медианы. Таким образом, указанную медиану используют в качестве эталонного значения, посредством чего измеренный уровень вышеупомянутой молекулы можно статистически коррелировать с конкретным физиологическим состоянием, например, предрасположенностью к неблагоприятному исходу для пациента, в зависимости от относительного уровня выше или ниже медианы, и степени отклонения измеренного значения от указанной медианы. Вместо медианы, другие статистические способы, такие как определения квантилей (например, квартилей или процентилей), или математические модели, предпочтительно, регрессию Кокса, можно использовать аналогично вышеприведенному описанию, чтобы получать вышеупомянутое эталонное значение и/или иным образом определять значимость измеренного значения применительно к физиологическому статусу данного субъекта, от которого получен образец. Указанные математические или статистические способы или модели хорошо известны специалисту в данной области, и их использование в контексте медицинских применений хорошо разработано.
[0047] Термин «коррелированный» или «корреляция», как применяют в настоящем документе применительно к использованию диагностического и прогностического маркера(маркеров), относится к сравнению присутствия или уровня маркера(маркеров) у пациента с его присутствием или уровнем у индивидуумов, как известно, страдающих от, или, как известно, подверженных риску данного состояния. Уровень маркера в образце от пациента можно сравнивать с уровнем, как известно, ассоциированным со специфическим диагнозом. Говорят, что уровень маркера в образце коррелирован с диагнозом; то есть, специалист в данной области может использовать уровень маркера для определения того, страдает ли пациент специфическим типом заболевания, и принимать соответствующие ответные меры. Альтернативно, уровень маркера в образце можно сравнивать с уровнем маркера, как известно, ассоциированным с хорошим исходом (например, отсутствием заболевания и т.д.). В предпочтительных вариантах осуществления, панель уровней маркеров коррелирует с глобальной вероятностью или конкретным исходом.
[0048] В других вариантах осуществления, отношение правдоподобия положительного результата исследования, отношение правдоподобия отрицательного результата исследования, отношение шансов или отношение рисков используют в качестве показателя способности теста предсказывать риск или диагностировать заболевание. В случае отношения правдоподобия положительного результата исследования, значение 1 показывает, что положительный результат является равновероятным среди субъектов как в «пораженной заболеванием», так и в «контрольной» группах; значение больше чем 1 показывает, что положительный результат является более вероятным в пораженной заболеванием группе; и значение меньше чем 1 показывает, что положительный результат является более вероятным в контрольной группе. В случае отношения правдоподобия отрицательного результата исследования, значение 1 показывает, что отрицательный результат является равновероятным среди субъектов как в «пораженной заболеванием», так и в «контрольной» группах; значение больше чем 1 показывает, что отрицательный результат является более вероятным в тестируемой группе; и значение меньше чем 1 показывает, что отрицательный результат является более вероятным в контрольной группе. В конкретных предпочтительных вариантах осуществления, выбирают маркеры и/или панели маркеров, предпочтительно, имеющие отношение правдоподобия положительного или отрицательного результата исследования по меньшей мере приблизительно 1,5 или более или приблизительно 0,67 или менее, более предпочтительно, по меньшей мере приблизительно 2 или более или приблизительно 0,5 или менее, еще более предпочтительно, по меньшей мере приблизительно 5 или более или приблизительно 0,2 или менее, даже более предпочтительно, по меньшей мере приблизительно 10 или более или приблизительно 0,1 или менее, и наиболее предпочтительно, по меньшей мере приблизительно 20 или более или приблизительно 0,05 или менее. Термин «приблизительно» в этом контексте относится к +/- 5% от данного измерения.
[0049] В случае отношения шансов, значение 1 показывает, что положительный результат является равновероятным среди субъектов как в «пораженной заболеванием», так и в «контрольной» группах; значение больше чем 1 показывает, что положительный результат является более вероятным в пораженной заболеванием группе; и значение меньше чем 1 показывает, что положительный результат является более вероятным в контрольной группе. В конкретных предпочтительных вариантах осуществления, выбирают маркеры и/или панели маркеров, предпочтительно, имеющие отношение шансов по меньшей мере приблизительно 2 или более, или приблизительно 0,5 или менее, более предпочтительно, по меньшей мере приблизительно 3 или более или приблизительно 0,33 или менее, еще более предпочтительно, по меньшей мере приблизительно 4 или более или приблизительно 0,25 или менее, даже более предпочтительно, по меньшей мере приблизительно 5 или более, или приблизительно 0,2 или менее, и наиболее предпочтительно, по меньшей мере приблизительно 10 или более или приблизительно 0,1 или менее. Термин «приблизительно» в этом контексте относится к +/- 5% от данного измерения.
[0050] В случае отношения рисков, значение 1 показывает, что относительный риск конечной точки (например, смерти) является равным как в «пораженной заболеванием», так и в «контрольной» группах; значение больше чем 1 показывает, что риск является более высоким в пораженной заболеванием группе; и значение меньше чем 1 показывает, что риск является более высоким в контрольной группе. В конкретных предпочтительных вариантах осуществления, выбирают маркеры и/или панели маркеров, предпочтительно, имеющие отношение рисков по меньшей мере приблизительно 1,1 или более, или приблизительно 0,91 или менее, более предпочтительно, по меньшей мере приблизительно 1,25 или более, или приблизительно 0,8 или менее, еще более предпочтительно, по меньшей мере приблизительно 1,5 или более, или приблизительно 0,67 или менее, даже более предпочтительно, по меньшей мере приблизительно 2 или более, или приблизительно 0,5 или менее, и наиболее предпочтительно, по меньшей мере приблизительно 2,5 или более или приблизительно 0,4 или менее. Термин «приблизительно» в этом контексте относится к +/- 5% от данного измерения.
[0051] Чувствительность и специфичность диагностического и/или прогностического теста зависит от большего, чем просто аналитическое «качество» теста, они также зависят от определения того, что составляет аномальный результат. На практике, рабочие характеристические кривые (кривые ROC), как правило, рассчитывают посредством нанесения на график значения переменной в зависимости от ее относительной частоты в «нормальной» (т.е., по-видимому, здоровой) и «пораженной заболеванием» популяциях (т.е., у пациентов, страдающих раком мочевого пузыря, в частности, не нейроэндокринным раком мочевого пузыря и предпочтительно, уротелиальной карциномой). Для любого конкретного маркера, распределение уровней маркера для субъектов с заболеванием и без, вероятно, могут перекрываться. В таких условиях, тест не отличает абсолютно норму от заболевания со 100% точностью, и область перекрывания показывает, где тест не может отличать норму от заболевания. Выбирают порог, выше которого (или ниже которого, в зависимости от того, как маркер изменяется при заболевании) тест рассматривают как аномальный, и ниже которого тест рассматривают как нормальный. Площадь под кривой ROC является показателем вероятности того, что наблюдаемое измерение может позволять корректную идентификацию состояния. Кривые ROC можно использовать, даже когда результаты теста не обязательно дают точное количество. При условии, что можно ранжировать результаты, можно получать кривую ROC. Например, результаты теста для «пораженных заболеванием» образцов можно ранжировать в соответствии со степенью (например, 1=низкая, 2=нормальная, и 3=высокая). Это ранжирование можно коррелировать с результатами в «нормальной» популяции, и получать кривую ROC. Эти способы хорошо известны в данной области (см., например, Hanley et al.1982. Radiology 143: 29-36). Предпочтительно, для кривых ROC получают AUC больше чем приблизительно 0,5, более предпочтительно, больше чем приблизительно 0,7, еще более предпочтительно, больше чем приблизительно 0,8, даже более предпочтительно, больше чем приблизительно 0,85, и наиболее предпочтительно, больше чем приблизительно 0,9. Термин «приблизительно» в этом контексте относится к +/- 5% от данного измерения.
[0052] Горизонтальная ось кривой ROC представляет (1-специфичность), которая увеличивается с долей ложноположительных результатов. Вертикальная ось кривой представляет чувствительность, которая увеличивается с долей истинно положительных результатов. Таким образом, для конкретного выбранного порога отсечения, можно определять значение (1-специфичность), и можно получать соответствующую чувствительность. Площадь под кривой ROC является мерой вероятности того, что измеренный уровень маркера может позволять корректную идентификацию заболевания или состояния. Таким образом, площадь под кривой ROC можно использовать для определения эффективности теста.
[0053] В конкретных вариантах осуществления, выбирают маркеры и/или панели маркеров, чтобы они имели по меньшей мере приблизительно 70% чувствительность, более предпочтительно, по меньшей мере приблизительно 80% чувствительность, даже более предпочтительно, по меньшей мере приблизительно 85% чувствительность, еще более предпочтительно, по меньшей мере приблизительно 90% чувствительность, и наиболее предпочтительно, по меньшей мере приблизительно 95% чувствительность, в сочетании с по меньшей мере приблизительно 70% специфичностью, более предпочтительно, по меньшей мере приблизительно 80% специфичностью, даже более предпочтительно, по меньшей мере приблизительно 85% специфичностью, еще более предпочтительно, по меньшей мере приблизительно 90% специфичностью, и наиболее предпочтительно, по меньшей мере приблизительно 95% специфичностью. В особенно предпочтительных вариантах осуществления, как чувствительность, так и специфичность составляют по меньшей мере приблизительно 75%, более предпочтительно, по меньшей мере приблизительно 80%, даже более предпочтительно, по меньшей мере приблизительно 85%, еще более предпочтительно, по меньшей мере приблизительно 90%, и наиболее предпочтительно, по меньшей мере приблизительно 95%. Термин «приблизительно» в этом контексте относится к +/- 5% от данного измерения.
[0054] Подходящие пороговые уровни для «стратификации субъектов» на различные группы (категории) следует определять для каждой конкретной комбинации уровня CgA, дополнительных маркеров (таких как MMP7) и/или параметров, лекарственных средств и заболевания. Это можно, например, осуществлять посредством группировки эталонной популяции пациентов в соответствии с их уровнем CgA на конкретные квантили, например, квартили, квинтили, или даже в соответствии с подходящими процентилями. Для каждой из квантилей или групп выше и ниже определенных процентилей, можно рассчитывать отношения рисков, сравнивающие риск неблагоприятного исхода, т.е. «неблагоприятный эффект», например, в отношении показателя выживаемости, между теми пациентами, которым вводили конкретное лекарственное средство, и теми, которым не вводили. По такому сценарию, отношение рисков (HR) выше 1 указывает на более высокий риск неблагоприятного исхода для пациентов, которых подвергали лечению, чем для пациентов, которых не подвергали. HR ниже 1 указывает на благоприятные эффекты конкретного лечения в группе пациентов. HR около 1 (например, +/- 0,1) указывает на отсутствие увеличения риска, но также на отсутствие преимущества от лекарственного средства для конкретной группы пациентов. Посредством сравнения HR между конкретными квантилями пациентов друг с другом и с HR общей популяции пациентов, является возможным идентифицировать те квантили пациентов, которые имеют увеличенный риск, и те, которые получают преимущество от лекарственного средства, и таким образом стратифицировать субъектов в соответствии с настоящим изобретением.
[0055] Термин «стратификация по терапевтическому лечению» или «стратификация терапии» в контексте настоящего изобретения относится к оценке подходящего терапевтического лечения для указанного пациента. Подклассификация относится к дополнительному определению диагноза в соответствии с подклассами диагностированного заболевания, нарушения, осложнения или риска, например, к определению в соответствии с мягкой и тяжелой формами заболевания. Термин «мониторирование терапии» в контексте настоящего изобретения относится к контролю и/или корректировке терапевтического лечения указанного пациента.
[0056] Настоящее изобретение также относится к способам лечения не нейроэндокринного рака мочевого пузыря, где уровень CgA (и необязательно, дополнительных маркеров и/или клинических параметров, таких как уровень MMP7) определяют, чтобы определить наиболее подходящее лечение. Например, пациент, имеющий, в соответствии с определенным увеличенным уровнем CgA, относительно плохой прогноз, может получать преимущество от более агрессивного лечения, например, частичной цистэктомии вместо TURBT или трехкомпонентного сохранения мочевого пузыря, RCE вместо TURBT или трехкомпонентного лечения с сохранением мочевого пузыря, или частичной цистэктомии, RCE в комбинации с PLND вместо RCE, расширенной или суперрасширенной LND вместо PLND, адъювантной химиотерапии или радиотерапии вместо одного хирургического вмешательства, дополнительной метастазэктомии. Этого пациента с высоким риском можно также выбирать для клинических исследований, тестирующих новые лекарственные средства.
[0057] Кроме того, настоящее изобретение относится к использованию наборов, содержащих антитела, специфические для CgA, и необязательно, антитела, специфические для MMP7, для прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря, в частности, не нейроэндокринного рака мочевого пузыря и предпочтительно, уротелиальной карциномы. Наборы могут также содержать дополнительные компоненты, такие как буферы и инструкции для использования. Предпочтительный набор для детекции CgA описан в WO 2015/158701 A1 и содержит
(i) первое антитело или его антигенсвязывающий фрагмент или производное, являющееся специфическим для CgA или его фрагмента; и
(ii) второе антитело или его антигенсвязывающий фрагмент или производное, являющееся специфическим для CgA или его фрагмента.
Первое и второе антитела из набора, предпочтительно, являются специфическими для одних и тех же фрагмента или фрагментов CgA. Например, (i) первое антитело или его антигенсвязывающий фрагмент или производное являются специфическими для эпитопа, содержащегося внутри последовательности из SEQ ID NO:1; и/или (ii) второе антитело или его антигенсвязывающий фрагмент или производное являются специфическими для эпитопа, содержащегося внутри последовательности из SEQ ID NO:1. Предпочтительно, первое антитело из набора представляет собой моноклональное антитело против CgA, полученное в линии клеток гибридомы 537/H2, депонированной как DSM ACC3231, и/или второе антитело представляет собой моноклональное антитело против CgA, полученное в линии клеток гибридомы 541/E2, депонированной как DSM ACC3232.
Набор может содержать одно или несколько антител для детекции MMP7. Например, набор (кроме того) содержит
(i) первое антитело или его антигенсвязывающий фрагмент или производное, являющееся специфическим для MMP7 или ее фрагмента; и
(ii) второе антитело или его антигенсвязывающий фрагмент или производное, являющееся специфическим для MMP7 или ее фрагмента.
Первое и второе антитела из набора, предпочтительно, являются специфическими для одних и тех же фрагмента или фрагментов MMP7. Например, (i) первое антитело или его антигенсвязывающий фрагмент или производное являются специфическими для эпитопа, содержащегося внутри последовательности из SEQ ID NO:2; и/или (ii) второе антитело или его антигенсвязывающий фрагмент или производное являются специфическими для эпитопа, содержащегося внутри последовательности из SEQ ID NO:2.
[0058] Настоящее изобретение в предпочтительных аспектах относится к:
1. Применению хромогранина A (CgA) в качестве прогностического маркера для рака мочевого пузыря.
2. Применению в соответствии с аспектом 1, где рак мочевого пузыря представляет собой не нейроэндокринный рак мочевого пузыря.
3. Применению в соответствии с аспектом 1, где рак мочевого пузыря выбран из группы, состоящей из уротелиальной карциномы мочевого пузыря, плоскоклеточной карциномы мочевого пузыря и аденокарциномы мочевого пузыря, предпочтительно, где рак мочевого пузыря представляет собой уротелиальную карциному мочевого пузыря.
4. Применению в соответствии с аспектом 3, где рак мочевого пузыря представляет собой не мышечно-инвазивный рак мочевого пузыря (NMBC) или мышечно-инвазивный рак мочевого пузыря (MIBC).
5. Применению в соответствии с аспектами 1-4, где CgA используют в качестве маркера в анализе in vitro для прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря.
6. Способу прогнозирования, оценки риска, стратификации риска, мониторирования и/или контроля терапии рака мочевого пузыря у субъекта, включающему стадию определения уровня CgA в образце физиологической жидкости указанного субъекта.
7. Способу в соответствии с аспектом 6, где рак мочевого пузыря представляет собой не нейроэндокринный рак мочевого пузыря.
8. Способу по п.5 или 6, где рак мочевого пузыря выбран из группы, состоящей из уротелиальной карциномы мочевого пузыря, плоскоклеточной карциномы мочевого пузыря и аденокарциномы мочевого пузыря, предпочтительно, где рак мочевого пузыря представляет собой уротелиальную карциному мочевого пузыря.
9. Способу в соответствии с аспектом 8, где рак мочевого пузыря представляет собой не мышечно-инвазивный рак мочевого пузыря (NMBC) или мышечно-инвазивный рак мочевого пузыря (MIBC).
10. Способу в соответствии с аспектами 6-9, где уровень CgA в образце от субъекта является показателем тяжести рака мочевого пузыря и/или исхода для субъекта.
11. Способу в соответствии с аспектом 10, где увеличенный уровень CgA в образце от субъекта по сравнению с контрольным уровнем или предопределенным порогом является показателем плохого исхода для субъекта.
12. Способу в соответствии с аспектом 10, где уровень CgA в образце от субъекта является показателем для общей выживаемости субъекта или специфической для заболевания выживаемости субъекта, или выживаемости субъекта без прогрессирования.
13. Способу в соответствии с аспектом 12, где плохой исход представляет собой увеличенный риск уменьшенной ожидаемой продолжительности жизни, увеличенный риск прогрессирования, увеличенный риск связанной со злокачественной опухолью смерти и/или увеличенный риск рецидива после хирургического лечения и/или лечения с использованием лекарственного средства, и/или радиотерапии.
14. Способу в соответствии с любым из аспектов 6-13, где у субъекта диагностирован рак мочевого пузыря, и где субъекта не подвергали хирургическому лечению указанного рака мочевого пузыря.
15. Способу в соответствии с любым из аспектов 6-13, где субъекта подвергали хирургическому лечению указанного рака мочевого пузыря.
16. Способу в соответствии с аспектом 15, где субъекта подвергали радикальной цистэктомии указанного рака мочевого пузыря.
17. Способу в соответствии с любым из аспектов 11-16, где предопределенный порог для уровня CgA выбран в диапазоне от 100 нг/мл до 431 нг/мл, предпочтительно, в диапазоне от 103 нг/мл до 191 нг/мл, более предпочтительно, от 130 нг/мл до 160 нг/мл, и наиболее предпочтительно, порог составляет 147 нг/мл.
18. Способу по любому из аспектов 6-17, где кроме того, уровень матриксной металлопротеиназы 7 (MMP7) определяют в указанном образце от указанного субъекта, и где уровень MMP7 в образце от субъекта является показателем тяжести рака мочевого пузыря и/или исхода для субъекта.
19. Способу в соответствии с аспектом 18, где увеличенный уровень MMP7 в образце от субъекта по сравнению с контрольным уровнем или предопределенным порогом является показателем плохого исхода для субъекта, в частности, увеличенного риска уменьшенной ожидаемой продолжительности жизни, увеличенного риска прогрессирования, увеличенного риска связанной с злокачественной опухолью смерти и/или увеличенного риска рецидива после хирургического лечения и/или лечения с использованием лекарственного средства, и/или радиотерапии.
20. Способу в соответствии с аспектом 18, где уровень MMP7 в образце от субъекта является показателем для общей выживаемости субъекта или специфической для заболевания выживаемости субъекта, или выживаемости субъекта без прогрессирования.
21. Способу в соответствии с аспектом 19, где предопределенный порог для уровня MMP7 выбран в диапазоне от 4,4 до 21 нг/мл, предпочтительно, в диапазоне от 5,4 до 10,1 нг/мл, более предпочтительно, в диапазоне от 6 до 9 нг/мл, наиболее предпочтительно, предопределенный порог для уровня MMP7 составляет 7,75 нг/мл.
22. Способу в соответствии с любым из аспектов 11-21, где
(i) уровень CgA в указанном образце выше предопределенного порога для CgA является показателем высокого риска связанной со злокачественной опухолью смерти после хирургического лечения и/или лечения с использованием лекарственного средства, и/или радиотерапии, и
(ii) уровень CgA в указанном образце выше предопределенного порога для CgA и уровень MMP7 в указанном образце или другом образце от того же субъекта выше предопределенного порога для MMP7 является показателем очень высокого риска связанной со злокачественной опухолью смерти и более короткой продолжительности жизни после хирургического лечения и/или лечения с использованием лекарственного средства, и/или радиотерапии.
23. Способу в соответствии с любым из аспектов 11-22, где уровень CgA и необязательно, MMP7 определяют через регулярные интервалы времени в ходе последующего наблюдения, и где контрольный уровень представляет собой соответствующий уровень, определенный до указанного хирургического лечения и/или на начальной стадии последующего наблюдения.
24. Способу в соответствии с любым из аспектов 6-23, где дополнительно определяют клинический параметр для субъекта, выбранный из группы, состоящей из гистологического подтипа опухоли, статуса метастазирования (в лимфатических узлах и отдаленного), лимфаденопатии, курения или употребления табака, возраста, пола, семейного анамнеза, этнической принадлежности, массы тела, индекса массы тела (BMI), цистоскопических данных, цитологии мочи (VUC), ультразвукового исследования, сканирования КТ, ЯМР и TURBT, и кровяного давления.
25. Способу в соответствии с любым из аспектов 6-24, где дополнительно определяют уровень маркера, выбранного из группы, состоящей из родственного фактору комплемента H белка и фактора комплемента H, белка ядерного матрикса BLCA-4, цитокератина 8 (CK8), цитокератина 18 (CK18), белка CEA и ассоциированных с клетками опухоли мочевого пузыря муцинов, изменений на хромосомах 3, 7, 17 и 9p21, белка CEA (CEA), белка 22 ядерного митотического аппарата (NMP22), щелочной фосфатазы, тканевого ингибитора металлопротеиназ 1 (TIMP-1) и тканевого ингибитора металлопротеиназ 2 (TIMP-2) в указанном образце или другом образце от субъекта.
26. Способу в соответствии с любым из аспектов 6-25, где образец происходит из физиологической жидкости, выбранной из цельной крови, сыворотки, плазмы и мочи.
27. Способу в соответствии с любым из аспектов 6-26, где уровень CgA и/или MMP7 определяют с использованием иммуноанализа.
28. Способу по аспекту 27, где иммуноанализ выбран из группы, состоящей из радиоиммунного анализа (RIA), хемилюминесцентного и флюоресцентного иммуноанализа, иммуноферментного анализа (EIA), твердофазного иммуноферментного анализа (ELISA), анализа массива на основе бусин с Luminex, анализа микромассива белка и теста на иммунохроматографических полосках.
29. Способу по аспекту 28, где иммуноанализ представляет собой сэндвич-иммуноанализ с использованием первого и второго антитела, специфических для CgA.
30. Способу в соответствии с аспектом 29, отличающемуся тем, что одно из антител является меченым, а другое антитело является связанным с твердой фазой или может быть избирательно связано с твердой фазой.
31. Способу иммуноанализа в соответствии с аспектом 30, где первое и второе антитело присутствуют в форме дисперсий в жидкой реакционной смеси, и где первый метящий компонент, являющийся частью системы мечения, основанной на гашении или усилении флуоресценции или хемилюминесценции, связан с первым антителом, и второй метящий компонент указанной системы мечения связан с вторым антителом, так что после связывания обоих антител с CgA образуется поддающийся измерению сигнал, позволяющий детекцию полученных сэндвич-комплексов в измеряемом растворе.
32. Способу иммуноанализа в соответствии с аспектом 31, отличающемуся тем, что система мечения содержит криптаты или хелаты редкоземельных металлов в комбинации с флуоресцентным красителем или хемилюминесцентным красителем, в частности, красителем цианинового типа.
33. Способу использования уровней хромогранина A (CgA) в образце физиологической жидкости субъекта в качестве прогностического маркера для рака мочевого пузыря.
Процитированные ссылки
[0059] Полное содержание ссылок, процитированных в настоящем описании, таким образом, приведено в качестве ссылки.
Alijo Serrano, F., N. Sanchez-Mora, J. Angel Arranz, C. Hernandez & E. Alvarez-Fernandez (2007) Large cell and small cell neuroendocrine bladder carcinoma: immunohistochemical and outcome study in a single institution. Am J Clin Pathol, 128, 733-9.
Babjuk, M. (2009) Transurethral Resection of Non-muscle-invasive Bladder Cancer. European Urology Supplements, 8, 542-548.
Bagchi, A., K. Dushaj, A. Shrestha, A. L. Leytin, S. A. Bhuiyan, F. Radparvar, S. Topchik, S. S. Tuli, P. Kim & S. Bakshi (2015) Urinary bladder paraganglioma presenting as micturition-induced palpitations, dyspnea, and angina. Am J Case Rep, 16, 283-6.
Bertaccini, A., D. Marchiori, A. Cricca, M. Garofalo, C. Giovannini, F. Manferrari, T. G. Gerace, R. Pernetti & G. Martorana (2008) Neuroendocrine carcinoma of the urinary bladder: case report and review of the literature. Anticancer Res, 28, 1369-72.
Brausi, M., J. A. Witjes, D. Lamm, R. Persad, J. Palou, M. Colombel, R. Buckley, M. Soloway, H. Akaza & A. Bohle (2011) A review of current guidelines and best practice recommendations for the management of nonmuscle invasive bladder cancer by the International Bladder Cancer Group. J Urol, 186, 2158-67.
Brausi, M. A. (2013) Primary prevention and early detection of bladder cancer: two main goals for urologists. Eur Urol, 63, 242-3.
Burger, M., J. W. Catto, G. Dalbagni, H. B. Grossman, H. Herr, P. Karakiewicz, W. Kassouf, L. A. Kiemeney, C. La Vecchia, S. Shariat & Y. Lotan (2013a) Epidemiology and risk factors of urothelial bladder cancer. Eur Urol, 63, 234-41.
Burger, M., W. Oosterlinck, B. Konety, S. Chang, S. Gudjonsson, R. Pruthi, M. Soloway, E. Solsona, P. Sved, M. Babjuk, M. A. Brausi, C. Cheng, E. Comperat, C. Dinney, W. Otto, J. Shah, J. Thurof, J. A. Witjes & C. International Consultation on Urologic Disease-European Association of Urology Consultation on Bladder (2013b) ICUD-EAU International Consultation on Bladder Cancer 2012: Non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol, 63, 36-44.
Cauberg Evelyne, C. C., J. J. de la Rosette & T. M. de Reijke (2011) Emerging optical techniques in advanced cystoscopy for bladder cancer diagnosis: A review of the current literature. Indian J Urol, 27, 245-51.
Cerulli, C., G. M. Busetto, G. Antonini, R. Giovannone, M. Di Placido, G. Soda, E. De Berardinis & V. Gentile (2012) Primary metastatic neuroendocrine small cell bladder cancer: a case report and literature review. Urol Int, 88, 365-9.
Chamie, K., C. S. Saigal, J. Lai, J. M. Hanley, C. M. Setodji, B. R. Konety, M. S. Litwin & P. Urologic Diseases in America (2011) Compliance with guidelines for patients with bladder cancer: variation in the delivery of care. Cancer, 117, 5392-401.
Chuang, C. K. & S. K. Liao (2003) A retrospective immunohistochemical and clinicopathological study of small cell carcinomas of the urinary tract. Chang Gung Med J, 26, 26-33.
Clark, P. E., N. Agarwal, M. C. Biagioli, M. A. Eisenberger, R. E. Greenberg, H. W. Herr, B. A. Inman, D. A. Kuban, T. M. Kuzel, S. M. Lele, J. Michalski, L. C. Pagliaro, S. K. Pal, A. Patterson, E. R. Plimack, K. S. Pohar, M. P. Porter, J. P. Richie, W. J. Sexton, W. U. Shipley, E. J. Small, P. E. Spiess, D. L. Trump, G. Wile, T. G. Wilson, M. Dwyer & M. Ho (2013) Bladder cancer. J Natl Compr Canc Netw, 11, 446-75.
El Demery, M., G. Demirdjian-Sarkissian, S. Thezenas, W. Jacot, Y. Laghzali, B. Darbouret, S. Culine, X. Rebillard & P.-J. Lamy (2014) Serum Matrix Metalloproteinase-7 is an independent prognostic biomarker in advanced bladder cancer. Clinical and Translational Medicine, 3.
Feng, N., X. Li, H. D. Gao, Z. L. Liu, L. J. Shi & W. Z. Liu (2013) Urinary bladder malignant paraganglioma with vertebral metastasis: a case report with literature review. Chin J Cancer, 32, 624-8.
Fernandez-Gomez, J., R. Madero, E. Solsona, M. Unda, L. Martinez-Pineiro, A. Ojea, J. Portillo, M. Montesinos, M. Gonzalez, C. Pertusa, J. Rodriguez-Molina, J. E. Camacho, M. Rabadan, A. Astobieta, S. Isorna, P. Muntanola, A. Gimeno, M. Blas, J. A. Martinez-Pineiro & O. Club Urologico Espanol de Tratamiento (2011) The EORTC tables overestimate the risk of recurrence and progression in patients with non-muscle-invasive bladder cancer treated with bacillus Calmette-Guerin: external validation of the EORTC risk tables. Eur Urol, 60, 423-30.
Goodison, S., C. J. Rosser & V. Urquidi (2013) Bladder cancer detection and monitoring: assessment of urine- and blood-based marker tests. Mol Diagn Ther, 17, 71-84.
Gunes, M., A. S. Kemik, N. Pirincci, I. Gecit, K. Taken, M. B. Yuksel, M. Kaba & R. Eryilmaz (2013) Preoperative levels of matrix metalloproteinase-7 and -9 and tissue inhibitor of matrix metalloproteinase-1 relation to pathologic parameters in bladder carcinoma patients. Asian Pac J Cancer Prev, 14, 873-6.
Hansel, D. E., J. S. Miller, M. S. Cookson & S. S. Chang (2013) Challenges in the Pathology of Non-Muscle-invasive Bladder Cancer: A Dialogue Between the Urologic Surgeon and the Pathologist. Urology.
Iczkowski, K. A., J. H. Shanks, W. C. Allsbrook, A. Lopez-Beltran, C. G. Pantazis, T. R. Collins, R. W. Wetherington & D. G. Bostwick (1999) Small cell carcinoma of urinary bladder is differentiated from urothelial carcinoma by chromogranin expression, absence of CD44 variant 6 expression, a unique pattern of cytokeratin expression, and more intense gamma-enolase expression. Histopathology, 35, 150-6.
Jager, T., S. Tschirdewahn, F. Vom Dorp, G. Piechotta, H. Rubben & T. Szarvas (2013) [Siliconchiptechnology-based MMP-7 analysis in urine: An option for preoperative identification of lymph node metastasis in bladder cancer]. Urologe A, 52, 853-8.
Kamat, A. M., P. K. Hegarty, J. R. Gee, P. E. Clark, R. S. Svatek, N. Hegarty, S. F. Shariat, E. Xylinas, B. J. Schmitz-Drager, Y. Lotan, L. C. Jenkins, M. Droller, B. W. van Rhijn, P. I. Karakiewicz & C. International Consultation on Urologic Disease-European Association of Urology Consultation on Bladder (2013) ICUD-EAU International Consultation on Bladder Cancer 2012: Screening, diagnosis, and molecular markers. Eur Urol, 63, 4-15.
Leal, J., R. Luengo-Fernandez, R. Sullivan & J. A. Witjes (2015) Economic Burden of Bladder Cancer Across the European Union. Eur Urol.
Maurer, T., T. Horn, M. Heck, J. Gschwend, M. Eiber & A. Beer (2013) Current Staging Procedures in Urinary Bladder Cancer. Diagnostics, 3, 315-324.
Mossanen, M. & J. L. Gore (2014) The burden of bladder cancer care: direct and indirect costs. Curr Opin Urol.
Pompas-Veganzones, N., P. Gonzalez-Peramato & M. Sanchez-Carbayo (2014) The neuroendocrine component in bladder tumors. Curr Med Chem, 21, 1117-28.
Scarpato, K. R., A. K. Morgans & K. A. Moses (2015) Optimal management of muscle-invasive bladder cancer - a review. Res Rep Urol, 7, 143-51.
Schmitz-Drager, B. J., M. Droller, V. B. Lokeshwar, Y. Lotan, M. A. Hudson, B. W. van Rhijn, M. J. Marberger, Y. Fradet, G. P. Hemstreet, P. U. Malmstrom, O. Ogawa, P. I. Karakiewicz & S. F. Shariat (2015) Molecular markers for bladder cancer screening, early diagnosis, and surveillance: the WHO/ICUD consensus. Urol Int, 94, 1-24.
Shariat, S. F., B. Ehdaie, M. Rink, E. K. Cha, R. S. Svatek, T. F. Chromecki, H. Fajkovic, G. Novara, S. G. David, S. Daneshmand, Y. Fradet, Y. Lotan, A. I. Sagalowsky, T. Clozel, P. J. Bastian, W. Kassouf, H. M. Fritsche, M. Burger, J. I. Izawa, D. Tilki, F. Abdollah, F. K. Chun, G. Sonpavde, P. I. Karakiewicz, D. S. Scherr & M. Gonen (2012) Clinical nodal staging scores for bladder cancer: a proposal for preoperative risk assessment. Eur Urol, 61, 237-42.
Sharma, S., P. Ksheersagar & P. Sharma (2009) Diagnosis and treatment of bladder cancer. Am Fam Physician, 80, 717-23.
Skinner, E. C. & A. I. Sagalowsky (2014) Is extended lymphadenectomy of beneficial therapeutic value for T2 urothelial cancer? J Urol, 191, 1206-8.
Soukup, V., M. Kalousova, O. Capoun, R. Sobotka, Z. Breyl, M. Pesl, T. Zima & T. Hanus (2015) Panel of Urinary Diagnostic Markers for Non-Invasive Detection of Primary and Recurrent Urothelial Urinary Bladder Carcinoma. Urol Int, 95, 56-64.
Svatek, R. S., B. K. Hollenbeck, S. Holmang, R. Lee, S. P. Kim, A. Stenzl & Y. Lotan (2014) The Economics of Bladder Cancer: Costs and Considerations of Caring for This Disease. Eur Urol.
Svatek, R. S., J. B. Shah, J. Xing, D. Chang, J. Lin, D. J. McConkey, X. Wu & C. P. Dinney (2010) A multiplexed, particle-based flow cytometric assay identified plasma matrix metalloproteinase-7 to be associated with cancer-related death among patients with bladder cancer. Cancer, 116, 4513-9.
Szarvas, T., M. Becker, F. vom Dorp, C. Gethmann, M. Totsch, A. Bankfalvi, K. W. Schmid, I. Romics, H. Rubben & S. Ergun (2010) Matrix metalloproteinase-7 as a marker of metastasis and predictor of poor survival in bladder cancer. Cancer Sci, 101, 1300-8.
Szarvas, T., T. Jager, M. Becker, S. Tschirdewahn, C. Niedworok, I. Kovalszky, H. Rubben, S. Ergun & F. vom Dorp (2011a) Validation of circulating MMP-7 level as an independent prognostic marker of poor survival in urinary bladder cancer. Pathol Oncol Res, 17, 325-32.
Szarvas, T., B. B. Singer, M. Becker, F. Vom Dorp, T. Jager, A. Szendroi, P. Riesz, I. Romics, H. Rubben & S. Ergun (2011b) Urinary matrix metalloproteinase-7 level is associated with the presence of metastasis in bladder cancer. BJU Int, 107, 1069-73.
Vedder, M. M., M. Marquez, E. W. de Bekker-Grob, M. L. Calle, L. Dyrskjot, M. Kogevinas, U. Segersten, P. U. Malmstrom, F. Algaba, W. Beukers, T. F. Orntoft, E. Zwarthoff, F. X. Real, N. Malats & E. W. Steyerberg (2014) Risk prediction scores for recurrence and progression of non-muscle invasive bladder cancer: an international validation in primary tumours. PLoS One, 9, e96849.
Witjes, J. A., E. Comperat, N. C. Cowan, M. De Santis, G. Gakis, T. Lebret, M. J. Ribal, A. G. Van der Heijden & A. Sherif (2014) EAU guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2013 guidelines. Eur Urol, 65, 778-92.
Xylinas, E., M. Kent, L. Kluth, A. Pycha, E. Comploj, R. S. Svatek, Y. Lotan, Q. D. Trinh, P. I. Karakiewicz, S. Holmang, D. S. Scherr, M. Zerbib, A. J. Vickers & S. F. Shariat (2013) Accuracy of the EORTC risk tables and of the CUETO scoring model to predict outcomes in non-muscle-invasive urothelial carcinoma of the bladder. Br J Cancer, 109, 1460-6.
Yafi, F. A., A. G. Aprikian, J. L. Chin, Y. Fradet, J. Izawa, E. Estey, A. Fairey, R. Rendon, I. Cagiannos, L. Lacombe, J. B. Lattouf, D. Bell, D. Drachenberg & W. Kassouf (2011) Contemporary outcomes of 2287 patients with bladder cancer who were treated with radical cystectomy: a Canadian multicentre experience. BJU Int, 108, 539-45.
Последовательности
Последовательность 1 (SEQ ID NO:1): Хромогранин A (CgA) человека без сигнального пептида (номер доступа в UniProt P10645):
1 11 21 31 41
LPVNSPMNKG DTEVMKCIVE VISDTLSKPS PMPVSQECFE TLRGDERILS
51 61 71 81 91
ILRHQNLLKE LQDLALQGAK ERAHQQKKHS GFEDELSEVL ENQSSQAELK
101 111 121 131 141
EAVEEPSSKD VMEKREDSKE AEKSGEATDG ARPQALPEPM QESKAEGNNQ
151 161 171 181 191
APGEEEEEEE EATNTHPPAS LPSQKYPGPQ AEGDSEGLSQ GLVDREKGLS
201 211 221 231 241
AEPGWQAKRE EEEEEEEEAE AGEEAVPEEE GPTVVLNPHP SLGYKEIRKG
251 261 271 281 291
ESRSEALAVD GAGKPGAEEA QDPEGKGEQE HSQQKEEEEE MAVVPQGLFR
301 311 321 331 341
GGKSGELEQE EERLSKEWED SKRWSKMDQL AKELTAEKRL EGQEEEEDNR
351 361 371 381 391
DSSMKLSFRA RAYGFRGPGP QLRRGWRPSS REDSLEAGLP LQVRGYPEEK
401 411 421 431
KEEEGSANRR PEDQELESLS AIEAELEKVA HQLQALRRG
Последовательность 2 (SEQ ID NO:2): Матриксная металлопротеиназа 7 (MMP7) человека (номер доступа в UniProt P09237)
1 11 21 31 41
MRLTVLCAVC LLPGSLALPL PQEAGGMSEL QWEQAQDYLK RFYLYDSETK
51 61 71 81 91
NANSLEAKLK EMQKFFGLPI TGMLNSRVIE IMQKPRCGVP DVAEYSLFPN
101 111 121 131 141
SPKWTSKVVT YRIVSYTRDL PHITVDRLVS KALNMWGKEI PLHFRKVVWG
151 161 171 181 191
TADIMIGFAR GAHGDSYPFD GPGNTLAHAF APGTGLGGDA HFDEDERWTD
201 211 221 231 241
GSSLGINFLY AATHELGHSL GMGHSSDPNA VMYPTYGNGD PQNFKLSQDD
251 261
IKGIQKLYGK RSNSRKK
Примеры
Пример 1: Детекция хромогранина A и MMP7 у пациентов с раком мочевого пузыря
Дизайн исследования
[0060] Образцы сыворотки собирали у 188 пациентов, которых подвергали хирургическому лечению рака мочевого пузыря (BCa): трансуретральной резекции o мочевого пузыря (TURB) или радикальной цистэктомии (RCE). Пациентов регистрировали в Department of Urology of the University Hospital Duisburg-Essen между августом 2008 г. и ноябрем 2011. Критериями для регистрации для исследования являлись гистопатологичекий диагноз переходноклеточной карциномы мочевого пузыря, отсутствие другой опухоли в анамнезе, отсутствие химиотерапии перед хирургией, доступность образца сыворотки и потенциал для отслеживания. Нейроэндокринного рака мочевого пузыря не диагностировано в популяции. Гистологическую степень злокачественности и T-стадию классифицировали по классификации WHO от 1973 г. и 2004 г., и классификации 2009 TNM, соответственно. Образцы сыворотки от 97 здоровых индивидуумов без злокачественной опухоли в анамнезе использовали в качестве контроля.
[0061] Исследование проведено в соответствии с этическими стандартами Хельсинкской декларации и одобрено советом по этике больницы. Образцы центрифугировали при 1500 об./мин в течение 15 минут, немедленно разделяли на аликвоты и сохраняли при -80°C до анализа.
Клинические характеристики пациентов представлены в таблице 1.
[0062] Конечными точками этого исследования являлись общая и специфическая для злокачественной опухоли выживаемость. Причину смерти получали из свидетельств о смерти. Медиана последующего наблюдении для всех пациентов составляла 24 месяца, и медиана последующего наблюдения у выживших составляла 31 месяц. Пятьдесят шесть из 188 пациентов умерли в ходе периода последующего наблюдения, 39 из них - в связи с BCa.
Детекция хромогранина A
[0063] Уровни хромогранина A измеряли в полностью автоматизированном устройстве B.R.A.H.M.S KRYPTOR® (Thermo Scientific B.R.A.H.M.S GmbH, Hennigsdorf/Berlin, Germany) с использованием усовершенствованного гомогенного флуоресцентного сэндвич-иммуноанализа, выпущенного на рынок под ссылкой CgA II #839.050 (патентная заявка WO 2015/158701 A1).
[0064] В этой системе используют чувствительную технологию усиленного излучения криптата с временным разрешением (TRACE®) на основе безызлучательного переноса энергии между донором (криптатом европия) и акцептором (XL665). В анализе используют два моноклональных антитела мыши. Эпитоп антитела LK2H10 локализован между последовательностью аминокислот 280-301, и эпитоп моноклонального антитела PHE5 локализован между аминокислотами 124-144. Коэффициент изменчивости (CV) между анализами составляет ≤ 12%, и CV внутри анализа для анализа Kryptor составляет ≤ 7%. Функциональная чувствительность анализа составляет 13,7 нг/мл, и предел количественного определения составляет 13,71 нг/мл.
Детекция MMP7
[0065] Уровни MMP-7 измеряли в полностью автоматизированном устройстве B.R.A.H.M.S KRYPTOR® (Thermo Scientific B.R.A.H.M.S GmbH, Hennigsdorf/Berlin, Germany) с использованием прототипа усовершенствованного гомогенного флуоресцентного сэндвич-иммуноанализа (еще не выпущенного на рынок).
[0066] В этой системе используют чувствительную технологию усиленного излучения криптата с временным разрешением (TRACE®) на основе безызлучательного переноса энергии между донором (криптатом европия) и акцептором (XL665). В анализе используют поликлональное антитело козы и моноклональное антитело мыши против MMP7 человека, меченные криптатом европия -EuC- (Cis Bio International, Bagnols/Cèze, France) и Alexa Fluor 647 (Molecular Probes - Life technologies, Eugene, USA), в качестве донора, соответственно. Эпитопы поликлональных и моноклональных антител не описаны. Рекомбинантный MMP-7 (R&D Systems Europe), разведенный в сыворотке новорожденных телят (Trina Bioreactives AG, Nänikon, Switzerland), использовали в качестве калибратора. Коэффициент изменчивости (CV) между анализами составляет ≤ 11%, и CV внутри анализа для анализа Kryptor составляет ≤ 9%. Функциональная чувствительность анализа составляет 1,95 нг/мл
Измерения
[0067] Одиночные измерения проводили автоматически посредством инкубации 50 мкл каждого образца от пациента с 50 мкл раствора каждого конъюгированного антитела при 37°C в течение 29 мин. Для оценки воспрозводимости и повторяемости, по 2 и 3 образца для контроля качества (QC) измеряли в двух повторах для каждого проведения анализа CgA и MMP7, соответственно.
Статистический анализ
[0068] Отсутствие нормального распределения данных концентрации в сыворотке (контролируемого посредством критерия Шапиро-Уилка) указывает на использование непараметрического двухстороннего критерия суммы рангов Уилкоксона (критерия Манна-Уитни) для сравнений независимых групп.
Для однофакторного и многофакторного анализа пациентов подразделяли на группы с низкой и высокой концентрацией применительно к их уровням CgA и MMP7. Пороги отсечения определяли для максимизации прогностической ценности, это соответствует 147 нг/мл для CGA (80-й процентиль) и 7,75 нг/мл для MMP7 (66-й процентиль). Однофакторный анализ специфической для заболевания выживаемости проводили с использованием как логарифмического рангового критерия Каплана-Мейера, так и однофакторного анализа Кокса. Для многофакторного анализа использовали регрессионную модель пропорциональных рисков Кокса. Во всех тестах значение p по меньшей мере 0,05 рассматривали как значимое. Все статистические анализы выполняли с использованием пакета программного обеспечения SPSS, версии 21.0 (Chicago, IL, USA).
Пример 2: Предоперационная прогностическая ценность CgA в популяции, подвергнутой лечению с использованием хирургии (исследование из примера 1)
Сравнение уровней CgA в сыворотке между образцами для опухоли и контрольными образцами
[0069] Концентрации CgA были значимо увеличены в образцах сыворотки от пациентов с опухолью по сравнению с контролем (медиана 3,9 нг/мл по сравнению с 29,4 нг/мл, соответственно, P < 0,0001, фигура 1).
Концентрация CgA и клинико-патологические параметры
[0070] У пациентов с опухолью, концентрации CgA являлись значимо более высокими у более старших пациентов и у мужчин (p=0,026 и p=0,009 соответственно, таблица 2). Концентрации CgA коррелировали со стадиями и степенями злокачественности, но не с метастазированием (таблица 2).
Прогностическая ценность уровней CgA в популяции, подвергнутой лечению с использованием хирургии
[0071] Однофакторный анализ: Результаты однофакторного анализа перечислены в таблице 3 и на фигуре 2. Возраст пациентов не влиял на общую или специфическую для заболевания выживаемость, в отличие от пола, который вносил вклад в специфическую для заболевания выживаемость (HR=0,447, CI 0,247-0,918, p=0,027). Стадия, степень злокачественности и метастазирование опухолей являются значимыми прогностическими факторами общей и специфической для заболевания выживаемости (P≤0,001, таблица 3). Уровень CgA в сыворотке также является сильным прогностическим фактором общей и специфической для заболевания выживаемости. Высокая концентрация CgA в сыворотке являлась значимо ассоциированной с плохой общей и специфической для заболевания выживаемостью у пациентов, подвергнутых лечению посредством хирургии (HR=2,553, 95% CI, 1,406-4,566, p=0,002 и HR=2,295, 95% CI, 1,106-4,764, p=0,026, соответственно, таблица 3; и p=0,021, фигура 2). Более того, CgA являлся также значимым прогностическим фактором общей выживаемости при учете в качестве непрерывной переменной (HR= 1,001, 95% CI, 1,000-1,002, p=0,024).
[0072] Многофакторный анализ: Результаты многофакторного анализа представлены в таблице 4. Многофакторный анализ показал, что высокая концентрация CgA в сыворотке является независимым от стадии, степени злокачественности и метастазирования прогностическим фактором общей и специфической для заболевания выживаемости (HR=3,424, 95% CI, 1,856-6,319, p<0,001 и HR=3,629; 95% CI, 1,692-7,784; P=0,001, соответственно, таблица 4).
Показатель двадцатимесячной выживаемости после лечения составлял 87% у пациентов с низкой предоперационной концентрацией CgA по сравнению с 70% у пациентов с высоким предоперационным уровнем CgA (фигура 2).
Пациенты с высокой предоперационной концентрацией CgA подвержены высокому риску смерти, связанной с раком мочевого пузыря, и общей смертности, и могут получать преимущество от более агрессивного или экспериментального лечения, как описано в разделе [0054].
Предоперационная прогностическая ценность уровней CgA и MMP7 в популяции, подвергнутой лечению с использованием хирургии
[0073] Сравнение уровней MMP7 в сыворотке между образцами для опухоли и контрольными образцами:
Концентрации MMP7 в сыворотке измеряли в той же самой популяции. Концентрации MMP7 были значимо увеличены в образцах сыворотки от пациентов с опухолью по сравнению с контролем (медиана 2,9 нг/мл по сравнению с 4,4 нг/мл, соответственно, P < 0,001).
Концентрация MMP7 и клинико-патологические параметры
[0074] У пациентов с опухолью, концентрации MMP7 являлись значимо более высокими у более старших пациентов (p < 0,001, таблица 5), но не у мужчин. Концентрации MMP7 были ассоциированы с присутствием мышечно-инвазивной опухоли и метастазирования (p=0,008, p=0,05, соответственно, таблица 5), но не со степенью злокачественности.
Прогностическая ценность уровней MMP7 в популяции, подвергнутой лечению с использованием хирургии
[0075] Однофакторный анализ: Результаты однофакторного анализа представлены в таблице 3 и на фигуре 2.
Уровень MMP7 в сыворотке является значимым прогностическим фактором общей и специфической для заболевания выживаемости. Высокая концентрация MMP7 в сыворотке являлась значимо ассоциированной с плохой общей и специфической для заболевания выживаемостью у пациентов, подвергнутых лечению посредством хирургии (HR=3,764, 95% CI, 1,983-7,148, p<0,001 и HR=3,905, 95% CI, 2,291-6,655, p<0,001 соответственно, Таблица 3; и p < 0,001, Фигура 2).
[0076] Многофакторный анализ: Многофакторный анализ показал, что высокая концентрация MMP7 в сыворотке является независимым от стадии, степени злокачественности и метастазирования прогностическим фактором общей и специфической для заболевания выживаемости (HR=2,750, 95% CI 1,557-4,855, p<0,001 и HR=2,324; 95% CI, 1,187-4,548; P=0,014, соответственно, таблица 6).
Показатель двадцатимесячной выживаемости составлял 89% у пациентов с низкой предоперационной концентрацией MMP7 по сравнению с 59% у пациентов, имевших высокую предоперационную концентрацию (фигура 2).
Прогностическая ценность комбинированных уровней CgA и MMP7 в популяции, подвергнутой лечению с использованием хирургии
[0077] Многофакторный анализ показал, что высокая концентрация MMP7 и высокая концентрация CgA в сыворотке являются независимым от стадии, степени злокачественности и метастазирования прогностическим фактором общей и специфической для заболевания выживаемости (таблица 9). Высокая концентрация CgA в сыворотке в комбинации с высокими концентрациями MMP7 являлись ассоциированными с плохой специфической для заболевания выживаемостью у пациентов, подвергнутых лечению посредством хирургии (p < 0,001, фигура 2).
Показатель двадцатимесячной выживаемости после лечения составлял более 90% у пациентов с низкими предоперационными концентрациями CgA и MMP7, по сравнению с 71% у пациентов с повышенной концентрацией одного маркера в сыворотке и 50% с повышенной концентрацией как CgA, так и MMP7 (фигура 2).
Пациенты с высокой предоперационной концентрацией CgA и MMP7 подвержены высокому риску связанной с раком мочевого пузыря и общей смертности, и могут получать преимущество от более агрессивного или экспериментального лечения, как описано в разделе [0054].
Пример 3: Предоперационная прогностическая ценность CgA/MMP7 в популяции, подвергнутой RCE (исследование из примера 1)
[0078] Стратификация риска для пациентов, подвергнутых лечению посредством радикальной цистэктомии, представляет особенный интерес. Таким образом, авторы настоящего изобретения анализировали также прогностическую значимость уровней CgA, сфокусировавшись единственно на этой группе.
Прогностическая ценность уровней CgA для пациентов, подвергнутых лечению RCE
[0079] Высокая концентрация CgA в сыворотке являлась сильным независимым прогностическим фактором для общей и специфической для заболевания выживаемости (HR=2,405, 95 CI 1,000-5,784, p=0,050 и HR=4,003, 95% CI 1,491-10,748, p=0,006, соответственно, таблица 7). Высокая концентрация CgA являлась значимо ассоциированной с плохой специфической для заболевания выживаемостью у пациентов, подвергнутых лечению посредством радикальной цистэктомии (p=0,008, фигура 3).
Показатель двадцатимесячной выживаемости после радикальной цистэктомии составлял 76% у пациентов, для которых показана низкая предоперационная концентрация CgA по сравнению с 33% у пациентов, для которых показана высокая предоперационная концентрация.
Пациенты с высокой предоперационной концентрацией CgA подвержены высокому риску связанной с раком мочевого пузыря и общей смертности, и могут получать преимущество от более агрессивного или экспериментального лечения, как описано в разделе [0054].
Прогностическая ценность уровней MMP7 для пациентов, подвергнутых лечению RCE
[0080] Высокая концентрация MMP7 в сыворотке являлась сильным независимым прогностическим фактором для общей и специфической для заболевания выживаемости (HR=2,456, 95% CI 1,294-4,662, p=0,006 и HR=2,195, 95% CI 1,057-4,560, p=0,035 соответственно, таблица 8). Высокая концентрация MMP7 являлась значимо ассоциированной с плохой специфической для заболевания выживаемостью у пациентов, подвергнутых лечению посредством радикальной цистэктомии (p=0,028, фигура 3)
[0081] Показатель двадцатимесячной выживаемости после радикальной цистэктомии составлял 78% у пациентов, для которых показаны низкие предоперационные уровни MMP7, по сравнению с 54% у пациентов, имеющих высокую предоперационную концентрацию MMP7 (фигура 3).
Прогностическая ценность комбинированных уровней CgA и MMP7 для пациентов, подвергнутых лечению RCE
[0082] Многофакторный анализ показал, что высокая концентрация MMP7 и высокая концентрация CgA в сыворотке являются независимым от стадии, степени злокачественности и метастазирования прогностическим фактором общей и специфической для заболевания выживаемости (таблица 10). Высокая концентрация CgA в сыворотке в комбинации с высокой концентрацией MMP7 являлись значимо ассоциированными с плохой специфической для заболевания выживаемостью у пациентов, подвергнутых лечению посредством радикальной цистэктомии (p=0,001, фигура 3).
Показатель двадцатимесячной выживаемости после радикальной цистэктомии составлял 79% у пациентов с низкими предоперационными уровнями CgA и MMP7, по сравнению с 47% у пациентов с повышенным уровнем одного маркера в сыворотке и 20% с повышенными уровнями как CgA, так и MMP7.
Пациенты с высокой предоперационной концентрацией CgA и MMP7 подвержены высокому риску связанной с раком мочевого пузыря и общей смертности, и могут получать преимущество от более агрессивного или экспериментального лечения, как описано в разделе [0056].
Таблицы
Таблица 1: Клинические характеристики пациентов
NA: неприменимо
Таблица 2: Ассоциация концентрации CgA и клинико-патологических параметров популяции опухолей
Таблица 3: Ассоциация уровней CgA, уровней MMP7 и клинико-патологических параметров с прогнозом для пациентов (однофакторный анализ)
Таблица 4: Ассоциация уровней CgA и клинико-патологических параметров с прогнозом для пациентов (многофакторный анализ)
Таблица 5: Ассоциация концентрации MMP7 с клинико-патологическими параметрами пациентов
Таблица 6: Ассоциация уровней MMP7 и клинико-патологических параметров с прогнозом для пациентов (многофакторный анализ)
Таблица 7: Ассоциация уровней CgA и клинико-патологических параметров с прогнозом для пациентов в популяции, подвергнутой лечению RCE (многофакторный анализ)
Таблица 8: Ассоциация уровней MMP7 и клинико-патологических параметров с прогнозом для пациентов в популяции, подвергнутой лечению RCE (многофакторный анализ)
Таблица 9: Ассоциация уровней MMP7 и CgA, и клинико-патологических параметров с прогнозом для пациентов (многофакторный анализ)
Таблица 10: Ассоциация уровней MMP7 и CgA, и клинико-патологических параметров с прогнозом для пациентов в популяции, подвергнутой лечению RCE (многофакторный анализ)
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Cézanne S.A.S.
<120> Хромогранин A как маркер рака мочевого пузыря
<130> Z1039 PCT BLN
<150> EP 16 15 9474.2
<151> 2016-03-09
<160> 2
<170> BiSSAP 1.3
<210> 1
<211> 439
<212> PRT
<213> Homo sapiens
<220>
<223> Хромогранин A (CgA) человека без сигнального пептида
<400> 1
Leu Pro Val Asn Ser Pro Met Asn Lys Gly Asp Thr Glu Val Met Lys
1 5 10 15
Cys Ile Val Glu Val Ile Ser Asp Thr Leu Ser Lys Pro Ser Pro Met
20 25 30
Pro Val Ser Gln Glu Cys Phe Glu Thr Leu Arg Gly Asp Glu Arg Ile
35 40 45
Leu Ser Ile Leu Arg His Gln Asn Leu Leu Lys Glu Leu Gln Asp Leu
50 55 60
Ala Leu Gln Gly Ala Lys Glu Arg Ala His Gln Gln Lys Lys His Ser
65 70 75 80
Gly Phe Glu Asp Glu Leu Ser Glu Val Leu Glu Asn Gln Ser Ser Gln
85 90 95
Ala Glu Leu Lys Glu Ala Val Glu Glu Pro Ser Ser Lys Asp Val Met
100 105 110
Glu Lys Arg Glu Asp Ser Lys Glu Ala Glu Lys Ser Gly Glu Ala Thr
115 120 125
Asp Gly Ala Arg Pro Gln Ala Leu Pro Glu Pro Met Gln Glu Ser Lys
130 135 140
Ala Glu Gly Asn Asn Gln Ala Pro Gly Glu Glu Glu Glu Glu Glu Glu
145 150 155 160
Glu Ala Thr Asn Thr His Pro Pro Ala Ser Leu Pro Ser Gln Lys Tyr
165 170 175
Pro Gly Pro Gln Ala Glu Gly Asp Ser Glu Gly Leu Ser Gln Gly Leu
180 185 190
Val Asp Arg Glu Lys Gly Leu Ser Ala Glu Pro Gly Trp Gln Ala Lys
195 200 205
Arg Glu Glu Glu Glu Glu Glu Glu Glu Glu Ala Glu Ala Gly Glu Glu
210 215 220
Ala Val Pro Glu Glu Glu Gly Pro Thr Val Val Leu Asn Pro His Pro
225 230 235 240
Ser Leu Gly Tyr Lys Glu Ile Arg Lys Gly Glu Ser Arg Ser Glu Ala
245 250 255
Leu Ala Val Asp Gly Ala Gly Lys Pro Gly Ala Glu Glu Ala Gln Asp
260 265 270
Pro Glu Gly Lys Gly Glu Gln Glu His Ser Gln Gln Lys Glu Glu Glu
275 280 285
Glu Glu Met Ala Val Val Pro Gln Gly Leu Phe Arg Gly Gly Lys Ser
290 295 300
Gly Glu Leu Glu Gln Glu Glu Glu Arg Leu Ser Lys Glu Trp Glu Asp
305 310 315 320
Ser Lys Arg Trp Ser Lys Met Asp Gln Leu Ala Lys Glu Leu Thr Ala
325 330 335
Glu Lys Arg Leu Glu Gly Gln Glu Glu Glu Glu Asp Asn Arg Asp Ser
340 345 350
Ser Met Lys Leu Ser Phe Arg Ala Arg Ala Tyr Gly Phe Arg Gly Pro
355 360 365
Gly Pro Gln Leu Arg Arg Gly Trp Arg Pro Ser Ser Arg Glu Asp Ser
370 375 380
Leu Glu Ala Gly Leu Pro Leu Gln Val Arg Gly Tyr Pro Glu Glu Lys
385 390 395 400
Lys Glu Glu Glu Gly Ser Ala Asn Arg Arg Pro Glu Asp Gln Glu Leu
405 410 415
Glu Ser Leu Ser Ala Ile Glu Ala Glu Leu Glu Lys Val Ala His Gln
420 425 430
Leu Gln Ala Leu Arg Arg Gly
435
<210> 2
<211> 267
<212> PRT
<213> Homo sapiens
<220>
<223> Матриксная металлопротеиназа 7 (MMP7) человека
<400> 2
Met Arg Leu Thr Val Leu Cys Ala Val Cys Leu Leu Pro Gly Ser Leu
1 5 10 15
Ala Leu Pro Leu Pro Gln Glu Ala Gly Gly Met Ser Glu Leu Gln Trp
20 25 30
Glu Gln Ala Gln Asp Tyr Leu Lys Arg Phe Tyr Leu Tyr Asp Ser Glu
35 40 45
Thr Lys Asn Ala Asn Ser Leu Glu Ala Lys Leu Lys Glu Met Gln Lys
50 55 60
Phe Phe Gly Leu Pro Ile Thr Gly Met Leu Asn Ser Arg Val Ile Glu
65 70 75 80
Ile Met Gln Lys Pro Arg Cys Gly Val Pro Asp Val Ala Glu Tyr Ser
85 90 95
Leu Phe Pro Asn Ser Pro Lys Trp Thr Ser Lys Val Val Thr Tyr Arg
100 105 110
Ile Val Ser Tyr Thr Arg Asp Leu Pro His Ile Thr Val Asp Arg Leu
115 120 125
Val Ser Lys Ala Leu Asn Met Trp Gly Lys Glu Ile Pro Leu His Phe
130 135 140
Arg Lys Val Val Trp Gly Thr Ala Asp Ile Met Ile Gly Phe Ala Arg
145 150 155 160
Gly Ala His Gly Asp Ser Tyr Pro Phe Asp Gly Pro Gly Asn Thr Leu
165 170 175
Ala His Ala Phe Ala Pro Gly Thr Gly Leu Gly Gly Asp Ala His Phe
180 185 190
Asp Glu Asp Glu Arg Trp Thr Asp Gly Ser Ser Leu Gly Ile Asn Phe
195 200 205
Leu Tyr Ala Ala Thr His Glu Leu Gly His Ser Leu Gly Met Gly His
210 215 220
Ser Ser Asp Pro Asn Ala Val Met Tyr Pro Thr Tyr Gly Asn Gly Asp
225 230 235 240
Pro Gln Asn Phe Lys Leu Ser Gln Asp Asp Ile Lys Gly Ile Gln Lys
245 250 255
Leu Tyr Gly Lys Arg Ser Asn Ser Arg Lys Lys
260 265
<---
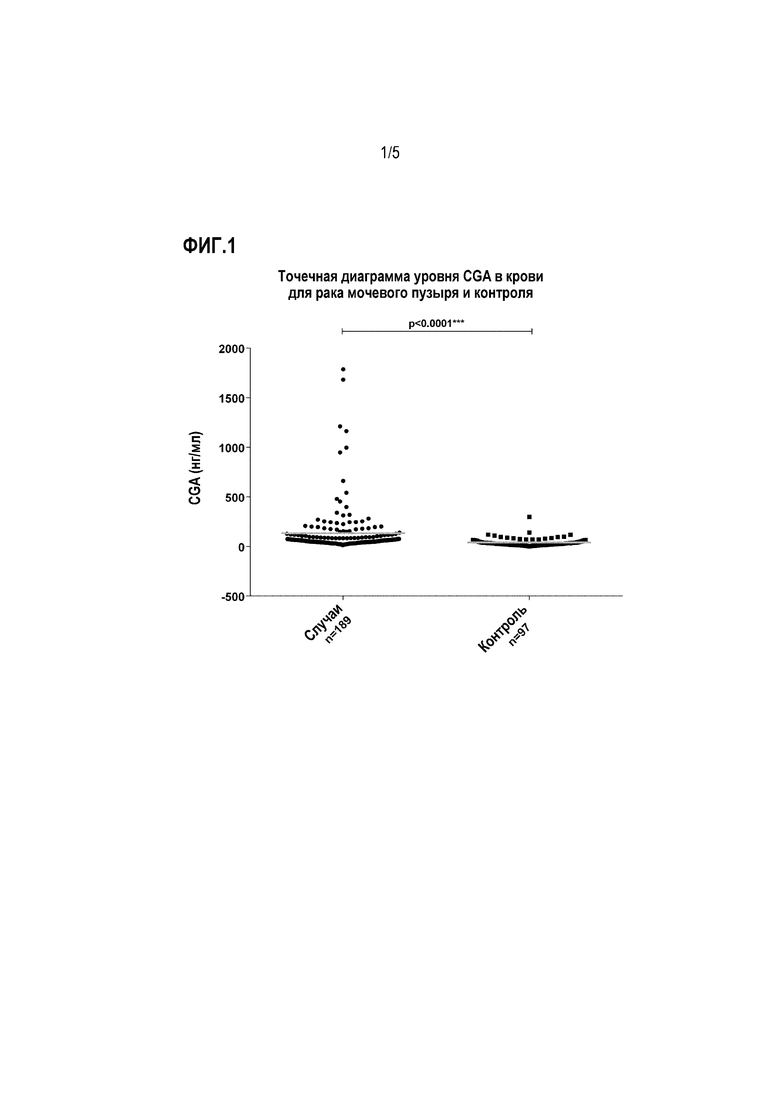
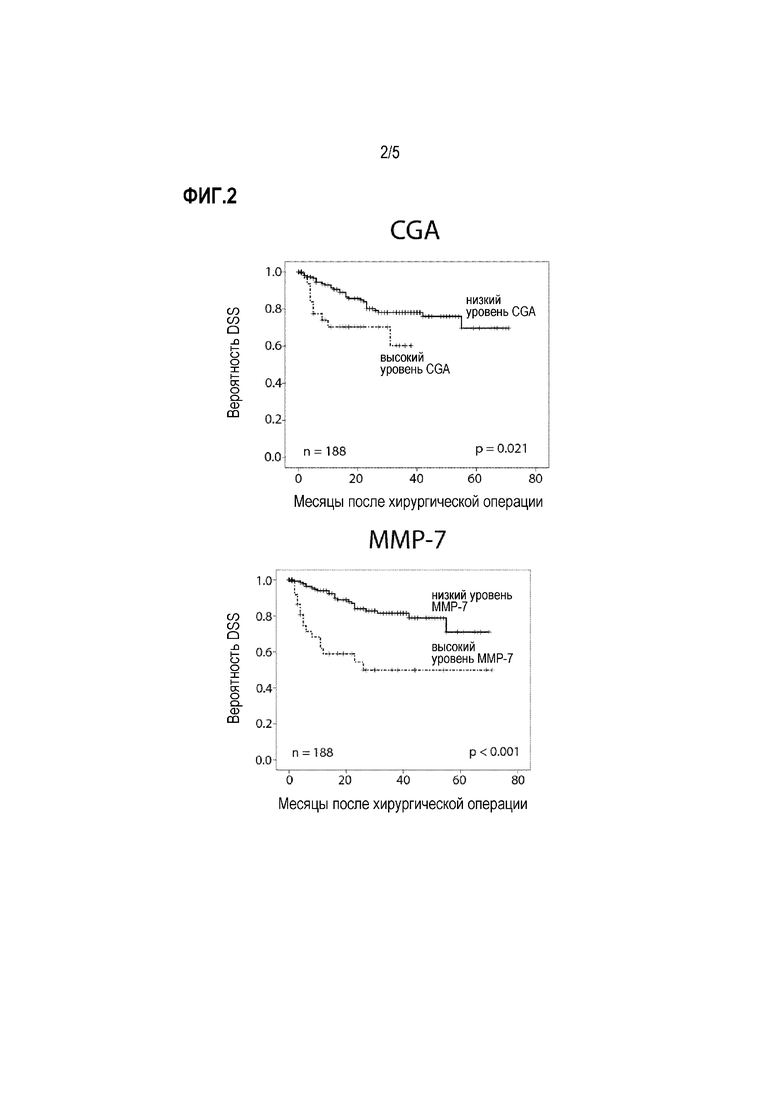
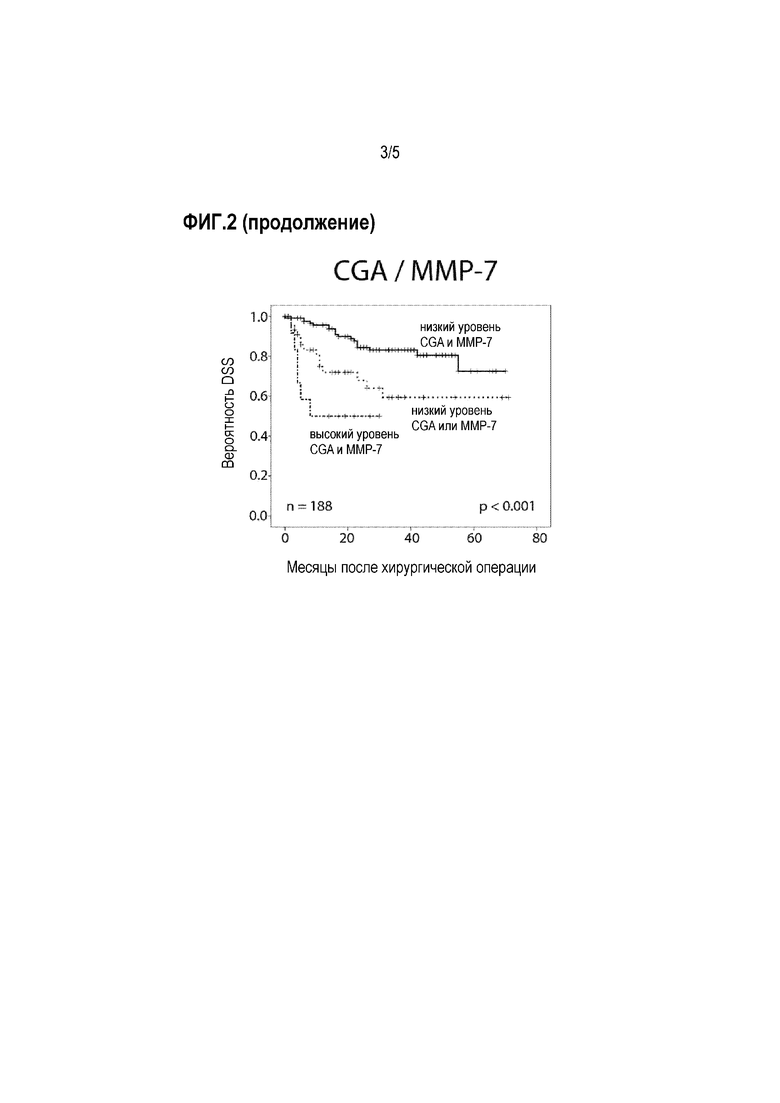
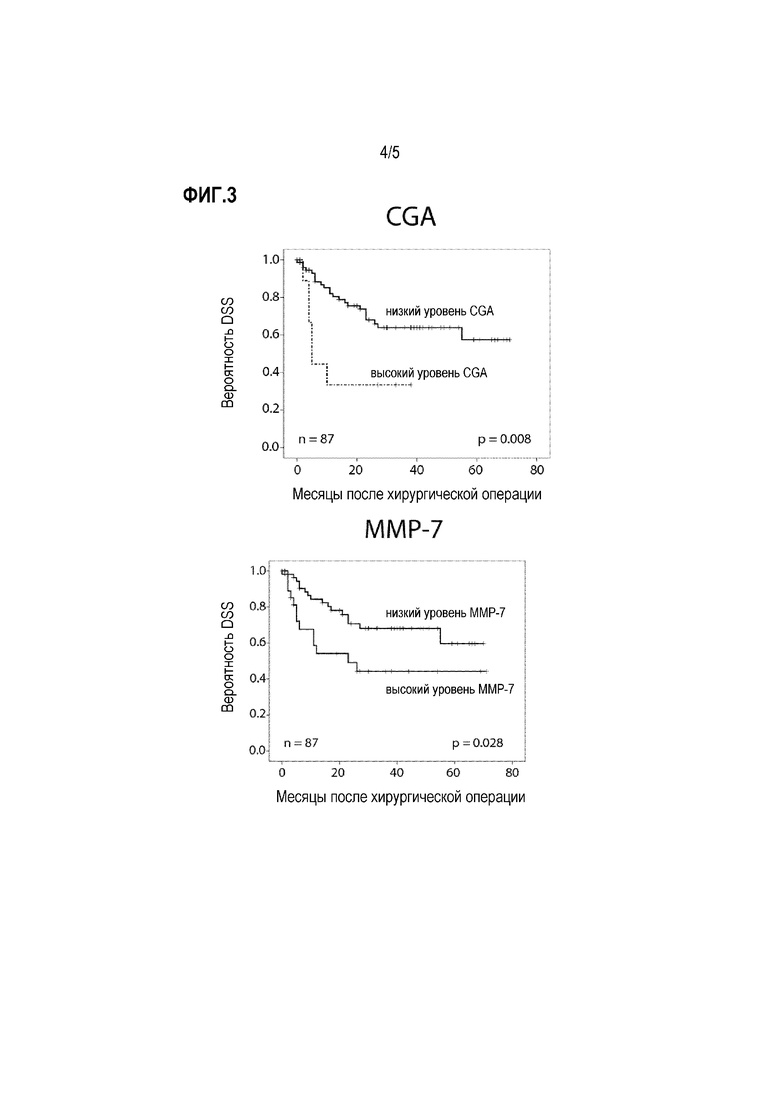
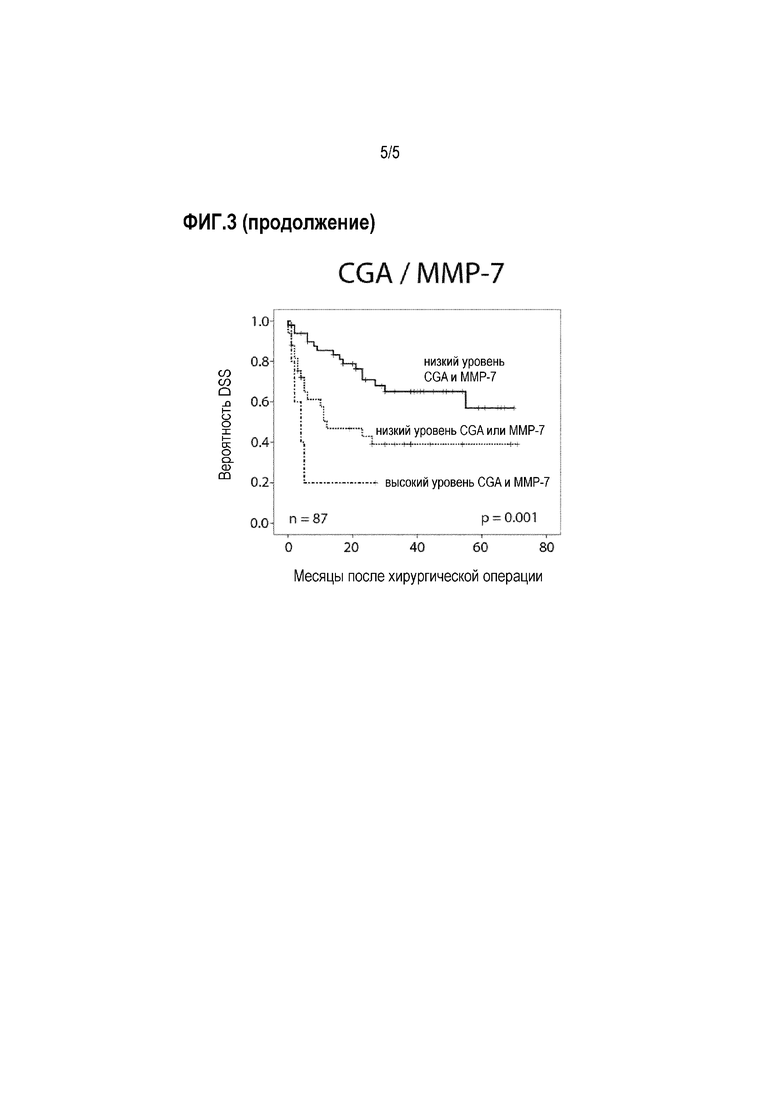
Изобретение относится к прогнозированию рака мочевого пузыря. Способ прогнозирования не нейроэндокринного рака мочевого пузыря у индивида включает определение уровня CgA в образце жидкости организма индивида: если уровень CgA выше предопределенного порога, то это является показателем высокого риска связанной со злокачественной опухолью смерти после хирургического лечения, и/или лечения с использованием лекарственного средства, и/или радиотерапии, и у пациента, подвергнутого трансуретральной резекции мочевого пузыря, показатель двадцатимесячной выживаемости после лечения составляет 87% у пациентов с низкой предоперационной концентрацией CgA и 70% у пациентов с высоким предоперационным уровнем CgA, или у пациента, подвергнутого радикальной цистэктомии, показатель двадцатимесячной выживаемости после лечения составляет 76% у пациентов низкой предоперационной концентрацией CgA и с 33% у пациентов с высоким предоперационным уровнем CgA; уровень CgA рассматривается по сравнению с контрольным уровнем или предопределенным порогом, где последний составляет от 100 нг/мг до 147 нг/мл, а образцы сыворотки здоровых индивидуумов без злокачественной опухоли в анамнезе используются в качестве контроля. Изобретение обеспечивает прогнозирование рака мочевого пузыря. 5 з.п. ф-лы, 3 ил., 10 табл., 3 пр.
1. Способ прогнозирования рака мочевого пузыря у индивида, где рак мочевого пузыря является не нейроэндокринным раком мочевого пузыря, где способ включает
стадию определения уровня CgA в образце жидкости организма указанного индивида и, таким образом, осуществляя прогнозирование:
(i) если уровень CgA в образце физиологической жидкости пациента выше предопределенного порога для CgA, то это является показателем высокого риска связанной со злокачественной опухолью смерти после хирургического лечения, и/или лечения с использованием лекарственного средства, и/или радиотерапии, и
(ii) у пациента, подвергнутого трансуретральной резекции мочевого пузыря, показатель двадцатимесячной выживаемости после лечения составляет 87% у пациентов с низкой предоперационной концентрацией CgA и 70% у пациентов с высоким предоперационным уровнем CgA, или
(iii) у пациента, подвергнутого радикальной цистэктомии, показатель двадцатимесячной выживаемости после лечения составляет 76% у пациентов низкой предоперационной концентрацией CgA и с 33% у пациентов с высоким предоперационным уровнем CgA;
при этом уровень CgA в образце от пациента рассматривается по сравнению с контрольным уровнем или предопределенным порогом, где предопределенный порог для CgA составляет от 100 нг/мг до 147 нг/мл, а образцы сыворотки здоровых индивидуумов без злокачественной опухоли в анамнезе используются в качестве контроля.
2. Способ по п.1, где уровень CgA в образце индивида является показателем общей выживаемости индивида, или специфической для заболевания выживаемости индивида, или выживаемости без прогрессирования индивида.
3. Способ по п.1 или 2, где неблагоприятный прогноз представляет собой повышенный риск сокращения ожидаемой продолжительности жизни, повышенный риск прогрессирования, повышенный риск смерти от злокачественной опухоли и/или повышенный риск рецидива после хирургического лечения, и/или медикаментозного лечения, и/или радиотерапии.
4. Способ по п.3, где предопределенный порог уровня CgA выбран в диапазоне от 103 нг/мл до 191 нг/мл, более предпочтительно от 130 нг/мл до 160 нг/мл, и наиболее предпочтительно порог составляет 147 нг/мл.
5. Способ по любому из пп.1-4, в котором дополнительно определяют уровень матриксной металлопротеиназы 7 (MMP7) в указанном образце индивида, и где уровень MMP7 в образце индивида является показателем тяжести рака мочевого пузыря и/или исхода у индивида.
6. Способ по п.5, где уровень CgA и необязательно MMP7 определяют через регулярные интервалы времени в ходе последующего наблюдения и где контрольный уровень представляет собой соответствующий уровень, определенный до проведения указанного хирургического лечения, и/или медикаментозного лечения, и/или радиотерапии, и/или на начальной стадии последующего наблюдения.
| WO 2015158701 A1, 22.10.2015 | |||
| Bertaccini A.D | |||
| et al | |||
| Neuroendocrine carcinoma of the urinary bladder: case report and review of the literature // Anticancer Res, 28, 2008, р.1369-1372 | |||
| Reina J.J | |||
| Second Primary Malignancies in Patients With Neuroendocrine Tumors // Clin Transl Oncol, 16(10), 2014, р.921-926 | |||
| СПОСОБ ДИАГНОСТИКИ СТАДИИ ИНВАЗИИ РАКА МОЧЕВОГО ПУЗЫРЯ | 2010 |
|
RU2454181C1 |
| Способ консервирования свекловичного сока для сахарного производства | 1929 |
|
SU14301A1 |
Авторы
Даты
2022-12-12—Публикация
2017-03-07—Подача