Изобретение относится к медицине и может быть использовано для лечения мягкотканых опухолей, клетки которых экспрессируют HER2, путем доставки терапевтических средств к клеткам опухолевого узла.
Актуальность
В настоящее время известно о применении различных методов и средств иммунотерапии как для терапии опухолей, так и для профилактики рецидива онкологического заболевания у пациентов после условно-радикальных операций. В качестве средств иммунотерапии используют биомедицинские клеточные продукты, рекомбинантные цитокины, а также антитела к мембранно-связанным опухоль-специфическим молекулам или рецепторам, вовлеченным в реализацию противоопухолевого иммунного ответа.
Для снижения вводимой дозы препарата было предложено доставлять препараты in situ - локально в область опухолевого узла или высокого риска рецидива опухоли после резекции злокачественного новообразования, что призвано уменьшить риск развития побочных эффектов и снизить стоимость лечения.
Современные методы таргетной терапии показали свою достаточно высокую специфичность и эффективность по сравнению с химиотерапией. Вместе с тем они могут воздействовать на нормальные ткани, органы и нервную систему и вызывать серию иммуноопосредованных нежелательных явлений. Кроме того, при системном введении таргетных препаратов на основе больших молекул (моноклональных антител) биодоступность этих соединений обычно невысокая [Avramović N., Mandić В., Savić-Radojević A., Simić Т. Polymeric nanocarriers of drag delivery systems in cancer therapy. Pharmaceutics. 2020;12:298. doi: 10.3390/pharmaceutics12040298]. Учитывая вышеупомянутые проблемы и ограничения в использовании, в последние годы предпринимаются попытки снизить побочные эффекты и максимизировать эффективность лечения этими препаратами за счет их внутриопухолевого введения.
Уровень техники
Для целенаправленной доставки лекарственных препаратов в опухоль ранее предлагалось использовать наночастицы, нагруженные веществами с противоопухолевой активностью, однако, они могут накапливаться и в здоровых тканях или органах, вызывая побочные токсические эффекты. Кроме того, после введения наночастиц in vivo они могут временно или постоянно оставаться в нормальных тканях и органах и поэтому мало подходят для таргетной терапии [https://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/scenihr_o_003b.pd
В результате недавних исследований были разработаны технологии иммобилизации в гидрогелях лекарств для локальной внутриопухолевой доставки, чтобы свести к минимуму их системную токсичность для нормальных тканей и органов. После имплантации гидрогели, за счет формирования трехмерной сетчатой структуры, могут играть роль депо лекарственных средств, диффундирующих в опухолевый узел в контактной области гель/ткань против вектора градиента концентрации. Этот факт, наряду с хорошей биосовместимостью и низкой токсичностью, способствовал расширению области применения гидрогелей в различных биомедицинских областях [Sood N., Bhardwaj A., Mehta S., Mehta A. Stimuli-responsive hydrogels in drug delivery and tissue engineering. Drug Deliv. 2016;23:758-780. doi: 10.3109/10717544.2014.940091]. Таким образом, доставка препаратов с противоопухолевым действием в составе гидрогелей может рассматриваться как средство локальной терапии онкологических больных.
Для внутриопухолевых инъекций обычно используют инъекционные гидрогелевые составы, содержащие противоопухолевые препараты, которые вводят непосредственно в определенные участки опухоли или рядом с капсулой опухолевого узла, что оптимизирует биодоступность лекарственных средств относительно опухолевых клеток и, при этом сводит к минимуму накопление препарата в других органах, уменьшая его системную токсичность [Fakhari A., Subramony JA. Engineered in-situ depot-forming hydrogels for intratumoral drug delivery. J. Controlled Release. 2015;220:465-475. doi: 10.1016/j. jconrel. 2015.11.014]. Технология внутриопухолевых инъекций в последнее время претерпела огромный прогресс, включая разработку формирующихся in situ гидрогелей, оптимизированных для эффективной доставки и медленного поступления противоопухолевых препаратов в ткань опухолевого узла. Основной целью является проведение пациентам циторедуктивной терапии для уменьшения опухолевой массы, торможения, контроля, сдерживания или замедления роста и метастазирования опухоли, с последующими хирургическим удалением оставшейся опухолевой массы, что призвано обеспечить увеличение продолжительности жизни онкологического больного.
В частности, известна имплантируемая и герметизируемая система для однонаправленной доставки терапевтических препаратов в ткани (RU 2311892). Данная система предназначена для установки на поверхности ткани или органа (преимущественно, глаза) и не предполагает интратуморальной имплантации. Кроме того, корпус устройства выполнен из пластика, имеющего низкую рентгеноконтрастность, что затрудняет контроль локализации устройства после имплантации рентгенологическими методами, а также не обеспечивает жесткость скаффолда (система доставки веществ с регулируемыми свойствами), достаточную для его внедрения в ткань опухоли.
Известен имплантат для хирургического лечения воспалительных и опухолевых заболеваний позвоночника (RU 2611883). Однако каркас данного устройства содержит в своем составе такие опасные элементы как вольфрам, относящийся к тяжелым металлам, и молибден, способный оказать токсическое воздействие на организм пациента в целом, и на репродуктивную функцию и развитие плода, в частности [Vyskocil A, Viau Сюб 1999, doi: 10.1002/(sici)1099-1263(199905/06)19:3<185::aid-jat555>3.0.co;2-z.].
Известны способы, устройства и композиции для лечения пациентов с опухолями в различных органах путем внутрипросветной доставки онколитических агентов через кровеносный сосуд или проток, ведущий к опухолевой ткани. (TRANSLUMINAL DELIVERY OF ONCOLTYIC VIRUSES FOR CANCER THERAPY US 2010331815). Однако, в данном случае доставка лекарственного средства возможна только в хорошо васкуляризируемый или сообщающийся с протоком опухолевый узел. Кроме того, такой способ локорегионарной терапии не позволяет достичь длительного поддержания эффективной концентрации препарата в области опухоли. Также данное изобретение подразумевает использование вирусов, что, может приводить к системным воспалительным реакциям у пациентов.
Известны также составы для противораковых агентов, чья эффективность зависит от клеточного цикла (FORMULATIONS FOR CELL-SCHEDULE DEPENDENT ANTICANCER AGENTS WO 2004081196). Известное изобретение подразумевает использование пластиковой основы, имеющей низкую ренгеноконтрастность, что затрудняет контроль локализации устройства после имплантации рентгенологическими методами, а также не обеспечивает жесткость скаффолда, достаточную для его внедрения в ткань опухоли. Кроме того, биодоступность и механизм действия лекарственного средства зависит от стадии клеточного цикла, что вследствие гетерогенности клеток опухолевой массы, не позволит достичь существенной эффективности терапии.
Известен медицинский имплантат с пролонгированным высвобождением лекарственного средства, пригодный для многократного введения, который в основном состоит из тканевой оболочки с микропорами для высвобождения лекарственного средства и отверстиями для инъекции или постоянного введения лекарственного средства. Структурная форма, механические и биологические свойства, необходимые для реконструкции тканей, обеспечиваются тканевой оболочкой и микрокапсулами с противоопухолевыми свойствами (Medical implant with drag sustained-release effect, which can be repeatedly administrated CN 212140659). Однако, при данном способе введения противоопухолевое средство контактирует с окружающими тканями только в области микропор тканевой оболочки, значительно ограничивая контактную площадь, что может негативно повлиять на его биодоступность. Кроме того, из-за отсутствия жесткого каркаса, маловероятно, что данное устройство самостоятельно сможет обеспечить внутритуморальную доставку лекарственного препарата, что обусловило основное его применение на поверхности органов и тканей. Данное изделие не обладает рентгенконтрастностью, что делает невозможным ренгенологический контроль за его размещением внутри опухолевого узла.
Известен стент для переноса радиоактивных частиц и факторов подавления опухоли, содержащий опорный корпус, который представляет собой цилиндрическую сетчатую каркасную структуру, образованную переплетением никель-титанового сплава. Внутренняя и внешняя поверхности корпуса стента снабжены слоями пленочного покрытия, на слои пленочного покрытия напылены слои биоактивного средства с медленным высвобождением, множество из аксиально расположенных канавок равномерно покрывают наружную поверхность стента, контактируя с резервуарами для радиоактивных частиц (Stent for carrying radioactive particles and tumor suppression factors CN 209236465). Однако опасность для здоровья пациента, опосредованная внесением радиоактивных частиц в организм больного, значительно ограничивает область применения данного способа из-за риска развития целого спектра побочных негативных эффектов. Кроме того, данное устройство может быть использовано только для локальной терапии радиочувствительных опухолей и не позволяет применять таргетные препараты [Howell RW. Patient exposures and consequent risks from nuclear medicine procedures. Health Phys. 2011; 100(3):313-317. doi: 10.1097/HP. 0b013e31820ef10a].
В качестве прототипа заявляемого изобретения может быть рассмотрена система доставки rhuMAb-HER2 (Герцептина) - антитела, нацеленного на рецептор HER2, с использованием инъекционных и термочувствительных гидрогелей в качестве носителя для пролонгированного высвобождения терапевтического средства [Xiaobin Chen, Maoli Wang, Xiaowei Yang, Yaoben Wang, Lin Yu, Jian Sun, Jiandong Ding. Injectable hydrogels for the sustained delivery of a HER2-targeted antibody for preventing local relapse of HER2+ breast cancer after breast-conserving surgery. Theranostics. 2019 Aug 14;9(21):6080-6098. doi: 10.7150/thno.36514]. В описанной системе использована композиция на основе смеси гидрогелей и герцептина, которую инъекционно еженедельно вводили мышам на расстоянии 5 мм от опухолевого узла. Причинами, по которым использование способа-прототипа не позволяет достичь технического результата заявляемого способа являются:
• повышенный риск преждевременной полимеризации геля в просвете иглы из-за ее нагревания вследствие контакта с тканями тела;
• отсутствие возможности контролировать процесс биодеградации имплантата вследствие его низкой рентгеноконтрастности.
• использование гидрогелей на основе смеси полилактида, полиэтиленгликоля и полигликолида, находящихся на ранней стадии разработки и не разрешенных пока для медицинского применения.
Раскрытие сущности изобретения
Одним из широко известных средств для таргетной терапии HER2+ опухолей является препарат герцептин (трастузумаб), который представляет собой рекомбинантные гуманизированные моноклональные антитела, избирательно взаимодействующие с внеклеточным доменом рецепторов эпидермального фактора роста человека 2 типа (HER2). Эти антитела представляют собой IgG1, состоящие из человеческих регионов (константные участки тяжелых цепей) и определяющие комплементарность мышиных участков антитела pi 85 HER2 к HER2.
Человеческие рецепторы эпидермального фактора роста составляют семейство поверхностных рецепторов клеток, вовлеченных в передачу сигналов, управляющих нормальным ростом и дифференцированием клеток. HER2 - высокоспецифичная мишень для лечения рака молочной железы и ряда других солидных опухолей. Рекомбинантное моноклональное антитело к HER2 (rhuMAb-HER2) обеспечивает быстрое удаление HER2 с поверхности клеток и, таким образом, уменьшает доступность этого белка и его онкогенность. В частности, известно, что повышенная экспрессия HER2, характерная для 20-25% больных раком молочной железы, также была отмечена у больных саркомой, немелкоклеточным раком легких, раком желудка, глиобластомой. Было показано, что сверхэкспрессия клетками HER2 связана с резистентностью к терапии, низкодифференцированными опухолями и повышенной частотой метастазирования в головной мозг. В рутинной клинической практике основным способом введения rhuMAb-HER2 является еженедельное внутривенное введение, но при этом возможно развитие кардиотоксичности и плохая ретенция опухоли.
Задачей заявляемого изобретения является способ таргетной доставки рекомбинантных моноклональных антител к HER2 (rhuMAb-HER2) в толщу мягкотканной опухоли, клетки которой экспрессируют на своей поверхности молекулы HER2.
Особенность заявляемого способа заключается в том, что осуществляют таргетную доставку к опухолевым клеткам терапевтического препарата, размещенного внутри скаффолда, выполненного в форме трубки из титанового сплава ВТ6, снабженного продольным отверстием на боковой стороне, путем имплантации внутрь опухолевого узла. Терапевтический препарат представляет собой композицию из гетерогенного имплантируемого геля СФЕРО®гель для хирургии, разрешенного для клинического применения в медицине (производитель - АО «Биомир сервис», Россия) и рекомбинантных моноклональных антител к HER2 «Трастузумаб» (производитель - Биокад, Россия) в соотношении 1:1.
Техническими результатами заявляемого способа являются:
• минимизация механической травматизации окружающих тканей при имплантации пациенту за счет использования скаффолда, конфигурированного в форме трубки с отшлифованной внешней поверхностью, изготовленной из биосовместимого титанового сплава ВТ6, широко используемого в качестве основы медицинских имплантатов [Гуртовая Г.В., 2003, https://wvvw.dissercat.com/content/termovodorodnaya-obrabotka-fasonnykh-otlivok-iz-titanovogo-splava-vt201-dlya-meditsinskikh-i];
• гидрогель, заполняющий внутреннюю полость скаффолда, выполняет роль депо для иммунопрепарата;
• пролонгированное высвобождение иммунопрепарата - рекомбинантных моноклональных антител к HER2 в окружающие ткани после имплантации в ткань опухолевого узла происходит за счет его диффузии из гидрогеля на границе гель - ткань из области торцов и продольного отверстия на боковой стороне трубки;
• имплантат, выполненный в форме жесткого скаффолда, из титанового сплава, имеющий форму трубки с гладкой наружной поверхностью, обеспечивает функцию защиты внутреннего содержимого от контакта с окружающими тканями, а также обеспечивает проникновение имплантата вглубь опухолевой массы под давлением, создаваемым либо рукой хирурга, либо троакаром, доставляя терапевтический препарат в толщу опухоли;
• скаффолд из рентгеноконтрастного титанового сплава позволяет рентгенологически контролировать локализацию имплантата после введения пациенту, маркируя зону опухолевого узла для последующей резекции опухолевой массы, что позволяет уменьшить длину разреза и оптимизировать процесс хирургического вмешательства.
Предлагаемый способ заключается в подготовке композиции, состоящей из гидрогеля и действующего терапевтического иммунопрепарата в форме рекомбинантных моноклональных антител к HER2 в соотношении 1:1, заполнении подготовленной композицией внутренней полости скаффолда, изготовленного из титанового сплава ВТ6 в форме трубки длиной 5-10 мм с внутренним диаметром 2-4 мм (толщина стенок - 1±0,02 мм) и последующего размещения имплантата в глубине опухолевой массы. Физико-химические свойства гидрогеля: высокая влагоудерживающая способность, возникающая за счет большого количества гидроксильных групп и образования поперечных связей между линейными молекулами полимера, и способность к биодеградации обеспечивают доставку терапевтического агента непосредственно в ткань опухолевого узла за счет диффузии моноклональных антител по границе гель - ткань.
Моноклональные антитела опосредуют ингибирование HER2 рецепторов на поверхности опухолевых клеток, что индуцирует их апоптоз, уменьшение объема опухоли и реализацию противоопухолевой активности.
Способ осуществляют следующим образом.
В качестве основы имплантата используют скаффолд в виде трубки длиной 5-10 мм с продольным отверстием на боковой стороне шириной 1±0,05 мм. Трубка изготовлена из титанового сплава ВТ6, полученного методом электро-эрозионной резки, с внутренним диаметром 2-4 мм, и толщиной стенок 1±0,02 мм. Внешнюю сторону и края трубки шлифуют. Таким образом, формируют скаффолд в виде незамкнутой трубки с шлифованными краями.
Моноклональные антитела смешивают с гидрогелем в соотношении 1:1 и заполняют полученной композицией внутреннюю полость предварительно простерилизованного и охлажденного титанового скаффолда, при поддержании температуры не выше 6°С и соблюдении требований асептики и антисептики. Затем образец помещают в термостат, поддерживающий температуру 37°С в течение 30 минут, для полимеризации геля, что позволяет фиксировать моноклональные антитела в полости скаффолда до имплантации в ткань опухолевого узла.
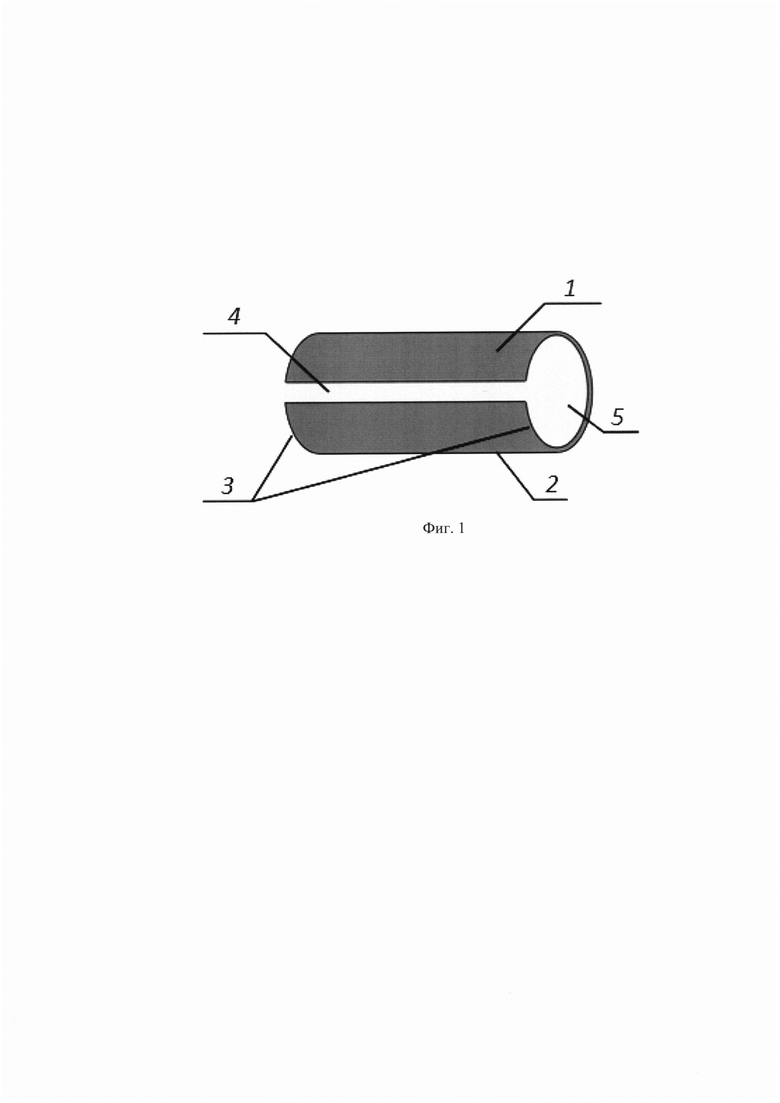
Краткое описание иллюстраций.
На Фиг. 1 представлена конструкция устройства готового имплантата для внутритуморальной доставки иммунопрепарата.
Обозначения:
1 - скаффолд;
2 - наружная поверхность скаффолда;
3 - края скаффолда;
4 - продольное отверстие на боковой стороне скаффолда;
5 - композиция из иммунопрепарата на основе моноклональных антител к HER2, смешанных с гидрогелем.
Пример. Исследование биоактивных свойств in vivo.
Изготавливали скаффолды из титанового сплава марки ВТ6 в виде незамкнутых трубок с внутренним диаметром 2,5 мм, длиной 6 мм методом электроэрозионной резки с последующей шлифовкой внешней поверхности и краев. Скаффолды промывали дистиллированной водой с использованием ультразвука, а затем стерилизовали и высушивали в стерильной атмосфере. Готовили композицию путем внесения в гидрогель раствора моноклональных антител (доза 0,125 мг/кг) в соотношении 1:1 при температуре +6°С. Заполняли полученной композицией внутреннюю полость скаффолдов и выдерживали в термостате при 37°С в течение 30 минут.
Эффективность противоопухолевой активности тестировали в эксперименте in vivo. Группа бестимусных мышей с привитой подкожно HER2+ опухолью молочной железы человека была разделена на две равные части. Первой имплантировали интратуморально подготовленные скаффолды под визуальным контролем, остальных использовали как контроль. Расположение и биодеструкцию изделия контролировали с использованием компьютерной томографии. Противоопухолевый эффект оценивали через 20 суток после введения имплантатов. Полученные результаты продемонстрировали, что введение заявляемых образцов имплантатов обеспечило 62% торможения роста опухоли в сравнении с контролем. Был сделан вывод о том, что под влиянием пролонгированного поступления иммунопрепарата из гидрогеля происходила блокировка HER2 на поверхности раковых клеток, что обеспечило антипролиферативный эффект и редукцию опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| Титановый имплантат с функцией локальной иммунотерапии для остеореконструктивной хирургии и профилактики местного рецидива онкологического заболевания и способ его изготовления | 2021 |
|
RU2779367C1 |
| Биодеградируемый металлический имплантат для локальной иммунотерапии пациентов с солидными опухолями | 2021 |
|
RU2780927C1 |
| Биодеградируемый имплантат для локальной иммунотерапии онкологических больных | 2021 |
|
RU2780932C1 |
| РЕКОМБИНАНТНЫЙ ТАРГЕТНЫЙ ТОКСИН, СПЕЦИФИЧНЫЙ К КЛЕТКАМ, ЭКСПРЕССИРУЮЩИМ РЕЦЕПТОР HER2 | 2016 |
|
RU2627215C1 |
| Подкожный биодеградируемый имплантат для отсроченной гемостимуляции онкологических больных | 2023 |
|
RU2809091C1 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ ОПУХОЛЕЙ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ АНТИТЕЛАМИ ПРОТИВ ErbB2 | 2003 |
|
RU2338751C2 |
| РЕЦЕПТОР-НАПРАВЛЕННЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2682335C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА С ПОМОЩЬЮ РЕКОМБИНАНТНОГО ПОКСВИРУСА, ЭКСПРЕССИРУЮЩЕГО ОПУХОЛЕВЫЙ АНТИГЕН, И АНТАГОНИСТА ИЛИ АГОНИСТА МОЛЕКУЛЫ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ | 2015 |
|
RU2724433C2 |
| СОЕДИНЕНИЕ И ЕГО КОМПЛЕКС С РАДИОНУКЛИДОМ Lu ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ НА HER2 РЕЦЕПТОРЫ | 2023 |
|
RU2826247C1 |
| КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ ПОКСВИРУСА, ЭКСПРЕССИРУЮЩЕГО ОПУХОЛЕВЫЙ АНТИГЕН, И АНТАГОНИСТА И/ИЛИ АГОНИСТА ИНГИБИТОРА ИМУННОЙ КОНТРОЛЬНОЙ ТОЧКИ | 2014 |
|
RU2714142C2 |
Изобретение относится к медицине и может быть использовано для лечения мягкотканных опухолей, клетки которых экспрессируют HER2, путем доставки терапевтических средств к клеткам опухолевого узла. Способ таргетной доставки терапевтических препаратов к опухолевым клеткам путем внутритуморального введения композиции из гидрогеля и рекомбинантных моноклональных антител к HER2, в котором указанную композицию вводят посредством внутритуморального введения имплантата в виде скаффолда, представляющего собой трубку, изготовленную из титанового сплава ВТ6, длиной 5-10 мм, с толщиной стенок 1±0,02 мм, с внутренним диаметром 2-4 мм, с шлифованной наружной поверхностью и краями, имеющую продольное отверстие на боковой стороне шириной 1±0,05 мм, внутренняя полость которого заполнена композицией из гидрогеля и рекомбинантных моноклональных антител к HER2 в соотношении 1:1. Изобретение обеспечивает минимизациию механической травматизации окружающих тканей при имплантации скаффолда, пролонгированное высвобождение иммунопрепарата. 1 пр., 1 ил.
Способ таргетной доставки терапевтических препаратов к опухолевым клеткам путем внутритуморального введения композиции из гидрогеля и рекомбинантных моноклональных антител к HER2, отличающийся тем, что указанную композицию вводят посредством внутритуморального введения имплантата в виде скаффолда, представляющего собой трубку, изготовленную из титанового сплава ВТ6, длиной 5-10 мм, с толщиной стенок 1±0,02 мм, с внутренним диаметром 2-4 мм, с шлифованной наружной поверхностью и краями, имеющую продольное отверстие на боковой стороне шириной 1±0,05 мм, внутренняя полость которого заполнена композицией из гидрогеля и рекомбинантных моноклональных антител к HER2 в соотношении 1:1.
| JP 2015134766 A, 27.07.2015 | |||
| ТЕРАПИЯ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА К СОСУДИСТОМУ ЭНДОТЕЛИАЛЬНОМУ ФАКТОРУ РОСТА И АНТИТЕЛА К РЕЦЕПТУРУ ТИПА 2 ЧЕЛОВЕЧЕСКОГО ЭПИТЕЛИАЛЬНОГО ФАКТОРА РОСТА | 2007 |
|
RU2538664C2 |
| СПОСОБ ИММУНОРЕАБИЛИТАЦИИ ОНКОЗАБОЛЕВАНИЙ | 2008 |
|
RU2377994C1 |
| СИСТЕМА И СПОСОБ МНОГОФАЗНОГО ВЫСВОБОЖДЕНИЯ ФАКТОРОВ РОСТА | 2012 |
|
RU2633057C2 |
| БИОСОВМЕСТИМЫЙ БИОРАЗЛАГАЕМЫЙ СКАФФОЛД НА ОСНОВЕ ПОЛИМЕРНОГО КОМПОЗИТА, СОДЕРЖАЩЕГО НАНОЧАСТИЦЫ ГИДРОКСИАПАТИТА | 2019 |
|
RU2756551C2 |
| RU 2019103382 A, 11.08.2020 | |||
| СПОСОБ СОЗДАНИЯ БИОРЕЗОРБИРУЕМОГО КЛЕТОЧНОГО СКАФФОЛДА НА ОСНОВЕ ФИБРИНА ПЛАЗМЫ КРОВИ | 2017 |
|
RU2653434C1 |
Авторы
Даты
2023-02-10—Публикация
2022-06-03—Подача