Перекрестная ссылка на родственную заявку
[0001] В настоящей заявке испрашивается преимущество предварительной заявки на патент США No. 62/514242, поданной 2 июня, 2017; и предварительной заявки на патент США No. 62/663082, поданной 26 апреля, 2018, которые в полном объеме включены в настоящее описание посредством ссылки.
Группа специалистов, участвующих в совместных исследованиях
[0002] Заявленное изобретение было осуществлено перечисленными ниже группами специалистов или с участием перечисленных ниже групп в соответствии с соглашением о проведении совместных исследований. Это соглашение о проведении совместных исследований вступает в силу во время или до даты осуществления заявленного изобретения, и заявленное изобретение было создано в результате проведенной работы в рамках соглашения о совместных исследованиях. Сторонами соглашения о проведении совместных исследований явояются BOSTON MEDICAL CENTER CORP. и PFIZER INC.
Список последовательностей
[0002.1] Настоящая заявка включает Список последовательностей, который был подан в электронном формате ASCII и включен в настоящее изобретение в полном объеме посредством ссылки. Указанная копия ASCII была создана 3 мая, 2018, под названием PCFC0043WO1_SL.txt, и ее размер составляет 54754 байта.
Предпосылки создания изобретения
[0003] Хроническая болезнь почек (ХБП) является проблемой здравоохранения во всем мире и часто приводит к почечной недостаточности в конечной стадии. По оценкам специалистов, ХБП страдает 13% населения или ~27 миллионов человек в США и более 500 миллионов человек во всем мире. По прогнозам специалистов, заболеваемость ХБП будет расти из-за продолжающейся эпидемии диабета и ожирения среди населения в целом. Приблизительно у полумиллиона пациентов с ХБП в США (~7 миллионов по всему миру) это заболевание будет прогрессировать и переходить в болезнь почек в конечной стадии (БПКС), и для сохранения жизни, эти пациенты нуждаются в диализе или трансплантации почек. Заболеваемость и смертность от БПКС является высокой и стоят бюджету США по меньшей мере 40 миллиардов долларов в год. Протеинурия (то есть, наличие избытка сывороточных белков в моче, обычно определяемое как уровень альбумина в моче >30 мг/день) является ранним биомаркером, фактором риска и суррогатной конечной точкой ХБП у пациентов с диабетом и без него. Лечение, направленное на снижение уровня протеинурии на ранних стадиях ХБП, может замедлять прогрессирование БПКС. Однако, в настоящее время для пациентов с ХБП и протеинурией какого-либо лечения протеинурии, специфичного к почечным подоцитам, не существует.
[0004] Подоциты представляют собой специализированные эпителиальные клетки, которые проходят первичные и вторичные стадии покрытия внешней поверхности гломерулярной базальной мембраны. Богатые актином переплетения вторичных отростков (например, отростков оснований) из соседних подоцитов создают фильтрационные щели, связанные мостиком с полупроницаемой щелевой диафрагмой, которая формирует окончательный барьер для проникновения белка. Протеинурия является клиническим признаком повреждения подоцитов при диабетической и недиабетической болезни почек. В настоящее время появляется все расширяющаяся группа опубликованных исследований, показывающая, что наследственные, врожденные или приобретенные аномалии в молекулярном компоненте подоцитов приводят к протеинурии. Поскольку генетические мутации белков подоцитов щелевой диафрагмы, таких как нефрин и подоцин, ассоциируются с наследственными формами протеинурической болезни почек, то становится все более очевидным, что белки, составляющие щелевую диафрагму и ассоциированные с ней, представляют собой нечто большее, чем просто структурный барьер. Таким образом, существует множество данных, которые позволяют предположить, что эти белки образуют сбалансированную сигнал-передающую сеть, которая может влиять на структуру отростков оснований подоцитов и на их функцию посредством взаимодействия с цитоскелетом актина.
Рецепторы окольного пути (ROBO)
[0005] Рецептор окольного пути 2 (ROBO2, также называемый здесь рецептором регуляции окольного пути 2 или гомологом окольного пути 2) представляет собой рецептор для лигандов белка-лиганда регуляции образования щели (SLIT). ROBO2 экспрессируются на базальной поверхности клубочковых подоцитов в почках, а лиганд регуляции образования щели 2 (SLIT2) присутствует в клубочках почек. После связывания SLIT2, ROBO2 образует комплекс с нефрином в фильтрационном барьере клубочков и действует как негативный регулятор ингибирования полимеризации актина, индуцированной нефрином. Потеря ROBO2 повышает уровень полимеризации актина в подоците и ослабляет аномальный структурный фенотип подоцита, обнаруженный у мышей с дефицитом нефрина. Потеря ROBO2 также повышает адгезию подоцитов к гломерулярной базальной мембране у мышей. Эти данные, наряду с наблюдением того, что у пациента с хромосомной транслокацией ROBO2 наблюдается отсутствие протеинурии, позволяют предположить, что блокирование пути передачи сигнала SLIT2-ROBO2 может повышать уровень полимеризации актина, индуцированной нефрином и снижать степень протеинурии. Блокирование передачи сигнала ROBO2 может также восстанавливать клубочковый фильтрационный барьер при протеинурической болезни посредством автивации полимеризации актина, индуцированной нефрином.
[0006] SLIT1, SLIT2 и SLIT3. SLIT представляют собой секретируемые белки, ассоциированные с внеклеточным матриксом. Последовательности белка всех SLIT обнаруживают высокую степень консервативности и имеют одинаковую структуру: N-концевой сигнальный пептид; четыре тандемных богатых лейцином повторяющихся домена (LRR), обозначаемых D1-D4; шесть доменов, подобных эпидермальному фактору роста (EGF); домен, подобный ламинину G; дополнительный один EGF-подобный домен (беспозвоночных) или три EGF-подобных домена (позвоночных) и С-концевой домен цистеинового узла. Лиганды SLIT могут расщепляться с образованием короткого С-концевого фрагмента с неизвестной функцией (продукта SLIT-С) и длинного N-концевого фрагмента (продукта SLIT-N), который является активным и опосредует связывание с ROBO. Лиганды SLIT, а также описанные здесь продукты их расщепления (например, SLIT-N, SLIT2-D2) могут быть использованы для оценки активности ROBO2.
[0007] У позвоночных были охарактеризованы четыре рецептора: ROBO ROBO1/Dutt1; ROBO2; ROBO3/Rig-1 и ROBO4/Magic Roundabout. ROBO1, ROBO2 и ROBO3 имеют общую структуру внеклеточного домена (ECD), которая напоминает структуру молекул клеточной адгезии. Эта область содержит пять иммуноглобулин-подобных (Ig-подобных) доменов (Ig1, Ig2, Ig3, Ig4 и Ig5), за которыми следуют три повтора типа фибронектина 3 (FN3) (фиг. 1А). Кроме того, ROBO2 имеет четыре цитоплазматических консервативных (CC) последовательности в своем внутриклеточном домене, как показано на фиг. 1А.
[0008] Последовательность полноразмерного человеческого предшественника ROBO2 показана как SEQ ID NO: 24. Лидерная последовательность ROBO2 из 21 аминокислоты (SEQ ID NO: 17; остатки 1-21 в соответствии с нумерацией, представленной в SEQ ID NO: 24) расщепляется в процессе продуцирования белка с образованием зрелого ROBO2 (фиг. 1A). Остатки 22-859 в соответствии с нумерацией, представленной в SEQ ID NO: 24, образуют внеклеточный домен, остатки 860-880, представленные в SEQ ID NO: 24, образуют трансмембранный домен, а остатки 881-1378, представленные в SEQ ID NO: 24, образуют цитоплазматический домен (фиг. 1A).
[0009] Репрезентативные последовательности пяти Ig-подобных доменов (Ig1, Ig2, Ig3, Ig4 и Ig5) ROBO2 показаны в Таблице 23. Последовательность пре-Ig1 ROBO2 (SEQ ID NO: 8), междоменный линкер Ig1-Ig2 (SEQ ID NO: 10) и междоменный линкер Ig2-Ig3 (SEQ ID NO: 12) также раскрыты в Таблице 23.
[0010] Домен LRR D2 SLIT и домены Ig1 и Ig2 ROBO являются эволюционно консервативными и участвуют в связывании. Домены Ig1 и Ig2 ROBO имеют также общее название SLIT-связывающий домен. Исследования показали, что хотя иммуноглобулин-подобные (Ig-подобные) домены 1 и 2 (Ig1 и Ig2) ROBO2 взаимодействуют со SLIT, однако, первый Ig-подобный домен (Ig1) является основным сайтом связывания со SLIT. Кроме того, проведенные ранее исследования показали, что удаление трех повторов фибронектина типа III (FNIII) оказывают более негативное влияние на связывание ROBO со SLIT, чем удаление третьего и четвертого иммуноглобулин-подобных доменов (Ig3 и Ig4) (см., например, Liu et al., 2004, Molecular Cellular Neuroanatomy 39:256261).
[0011] После связывания ROBO-SLIT, GTPазы Rho и их регуляторы (GAP и GEF) участвуют в последующем пути передачи сигнала. В присутствии SLIT, SLITROBO, белок активации GTPазы Rho SLITROBO 1 (srGAP1) связывается с доменом CC3 ROBO и инактивирует RhoA и Cdc42. Эти эффекторные белки способны опосредовать, среди прочих, отталкивание, регуляцию динамических импульсов цитоскелета и полярность клеток. В присутствии SLIT, Vilse/CrossGAP может также связываться с доменом CC2 ROBO и ингибировать Rac1 и Cdc42. Rac1 также активируется посредством рекрутинга белка GEF «Сын семерых» («Son of sevenless» (Sos)) под действием белка-адаптора Dreadlocks (Dock), который связывается с доменом CC23 ROBO. Это приводит к активации нижерасположенной мишени Rac1 и p21-активированной киназы (Pak), которая также связывается с доменами CC23 ROBO. Эти нижерасположенные партнеры по передаче сигнала ROBO регулируют оттлакивание заряда и динамический заряд цитоскелета. Тирозин-киназа Абельсона (Abl) может также связываться с доменом CC3 ROBO и блокировать передачу сигнала ROBO посредством фосфорилирования домена CC1, а также опосредовать клеточную адгезию. ENABLED (Ena), субстрат Abl, также связывается с доменами CC1 и CC2 ROBO. Все эти расположенные ниже молекулы ROBOSLIT могут быть использованы для оценки активности ROBO2, а также для оценки любого нейтрализующего действия нового рекомбинантного белка ROBO2, раскрытого в настоящей заявке.
[0012] В почках, ROBO2 образует комплекс с нефрином посредством белка-адаптера Nck. В отличие от роли нефрина, который стимулирует полимеризацию актина, сигнал-передающий комплекс SLIT-ROBO2 ингибирует полимеризацию актина, индуцируемую нефрином. Таким образом, связывание внутриклеточного домена ROBO2 и Nck может быть использовано для оценки активности ROBO2.
[0013] В настоящее время, для пациентов, страдающих многими клубочковыми заболеваниями (включая фокальный сегментарный гломерулярный склероз), не существует какой-либо доступной терапии для сохранения функции почек или какого-либо другого способа лечения заболевания. Кроме того, в настоящее время не существует какого-либо доступного лечения пациентов с ХБП и с протеинурией. В соответствии с этим, необходимо разработать терапевтический способ лечения, который позволял бы модулировать передачу сигнала ROBO2-SLIT, и тем самым сохранял бы или модулировал функции подоцитов и снижал степень протеинурии или как-либо иначе способствовал лечению или профилактике болезней почек, ассоциированных со связыванием и передачей сигнала ROBO2-SLIT или опосредуемых ими.
Сущность изобретения
[0014] Настоящее изобретение относится к рекомбинантным белкам ROBO2, которые связываются с лигандом SLIT, а также к их применению и к ассоциированным с ними способам. Специалистам в данной области будут очевидны, либо они могут самостоятельно определить, с использованием не более, чем рутинного экспериментирования, многие эквиваленты конкретных вариантов осуществления настоящего изобретения, описанных в настоящей заявке. Такие эквиваленты входят в объем нижеследующих вариантов осуществления изобретения (E).
[0015] Е1. Рекомбинантный белок рецептора окольного пути (Roundabout) 2 (ROBO2), содержащий аминокислотные остатки 1-203, в соответствии с нумерацией SEQ ID NO: 1, а также содержащий константный домен тяжелой цепи иммуноглобулина.
[0016] E2. Рекомбинантный белок рецептора Roundabout 2 (ROBO2), состоящий, по существу, из аминокислотных остатков 1-203 в соответствии с нумерацией SEQ ID NO: 1, и константного домена тяжелой цепи иммуноглобулина.
[0017] Е3. Рекомбинантный белок рецептора Roundabout 2 (ROBO2), содержащий (i) SLIT-связывающий фрагмент; и (ii) фрагмент, увеличивающий время полужизни, где указанный SLIT-связывающий фрагмент содержит часть внеклеточного домена ROBO2.
[0018] Е4. Рекомбинантный белок ROBO2 Е3, где указанная часть указанного внеклеточного домена ROBO2 содержит первые два иммуноглобулин-подобных (Ig1 и Ig2) домена ROBO2 и С-концевую последовательность, состоящую из последовательности SEQ ID NO: 12.
[0019] Е5. Рекомбинантный белок ROBO2 Е3, где указанная часть указанного внеклеточного домена ROBO2, по существу, состоит из пре-последовательности ROBO2, подобной иммуноглобулину 1 (Ig1) (SRLRQEDFP (SEQ ID NO: 8), первого иммуноглобулин-подобного домена (Ig1), междоменного линкера, расположенного между первым и вторым иммуноглобулин-подобными доменами (междоменного линкера Ig1-Ig2; VALLR (SEQ ID NO: 10)), второго иммуноглобулин-подобного домена (Ig2) и междоменного линкера, расположенного между вторым и третьим иммуноглобулин-подобными доменами (междоменного линкера Ig2-Ig3; VFER (SEQ ID NO: 12)).
[0020] Е6. Рекомбинантный белок ROBO2 любого из E3-E5, где указанная часть указанного внеклеточного домена ROBO2, по существу, состоит из аминокислотных остатков 1-203 в соответствии с нумерацией SEQ ID NO: 1.
[0021] Е7. Рекомбинантный белок ROBO2 любого из Е3-Е6, где указанный фрагмент, увеличивающий время полужизни, содержит домен иммуноглобулина.
[0022] Е8. Рекомбинантный белок ROBO2 любого из E1, E2 или E7, где указанный домен иммуноглобулина представляет собой Fc-домен IgA1 IgA2, IgD, IgE, IgM, IgG1, IgG2, IgG3 или IgG4.
[0023] Е9. Рекомбинантный белок ROBO2 E8, где указанный домен Fc-домен представляет собой Fc-домен человеческого IgG1.
[0024] Е10. Рекомбинантный белок ROBO2 Е9, где указанный Fc-домен был модифицирован для элиминации эффекторной функции.
[0025] Е11. Рекомбинантный белок ROBO2 E10, где указанным Fc-доменом является Fc-домен человеческого IgG1, и где указанный Fc-домен человеческого IgG1 содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из замены лейцина на аланин в аминокислотном остатке номер 234 (L234A), замены лейцина на аланин в аминокислотном остатке номер 235 (L235A) и замены глицина на аланин в аминокислотном остатке номер 237 (G237A), где все остатки пронумерованы в соответствии с Eu-нумерацией, предложенной Кэбатом.
[0026] Е12. Рекомбинантный белок ROBO2 Е9-E11, где указанный Fc-домен человеческого IgG1 не содержит лизин в остатке номер 447 в соответствии с Eu-нумерацией, предложенной Кэбатом.
[0027] E13. Рекомбинантный белок ROBO2 любого из E11-E12, где указанный Fc-домен содержит аминокислотные остатки 210-440 в соответствии с нумерацией SEQ ID NO: 1.
[0028] E14. Рекомбинантный белок ROBO2 любого из E11-E12, где указанный Fc-домен состоит из аминокислотных остатков 210-440 в соответствии с нумерацией SEQ ID NO: 1.
[0029] E15. Рекомбинантный белок ROBO2 любого из E1, E2 или E7, где указанные аминокислотные остатки 1-203 в соответствии с нумерацией SEQ ID NO: 1 являются смежными с указанным доменом иммуноглобулина.
[0030] E16. Рекомбинантный белок ROBO2 любого из E1, E2 или E7, где указанные аминокислотные остатки 1-203 в соответствии с нумерацией SEQ ID NO: 1 присоединены к указанному домену иммуноглобулина посредством линкера.
[0031] E17. Рекомбинантный белок ROBO2 E16, где указанным линкером является пептидильный линкер, содержащий приблизительно от 1 до 30 аминокислотных остатков.
[0032] E18. Рекомбинантный белок ROBO2 E17, где указанный пептидильный линкер выбран из группы, состоящей из:
a) богатого глицином пептида;
b) пептида, содержащего глицин и серин;
с) пептида, имеющего последовательность (Gly-Gly-Ser)n, где n равно 1, 2, 3, 4, 5 или 6 (SEQ ID NO: 22); и
d) пептида, имеющего последовательность (Gly-Gly-Gly-Gly-Ser)n, где n равно 1, 2, 3, 4, 5 или 6 (SEQ ID NO: 23).
[0033] E19. Рекомбинантный белок ROBO2 E18, где указанным пептидильным линкером является (Gly-Gly-Ser)2 (SEQ ID NO: 15).
[0034] E20. Рекомбинантный белок ROBO2-Fc, содержащий аминокислотную последовательность SEQ ID NO: 1.
[0035] E21. Рекомбинантный белок ROBO2-Fc, состоящий из аминокислотной последовательности SEQ ID NO: 1.
[0036] E22. Рекомбинантный белок ROBO2-Fc, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 1.
[0037] E23. Рекомбинантный белок ROBO2 любого из E1-E22, содержащий аминокислотную последовательность, кодируемую плазмидной вставкой, депонированной в ATCC и имеющей регистрационный номер ATCC No. PTA-124008.
[0038] E24. Рекомбинантный белок ROBO2-Fc любого из E4 или E5, где указанный Ig1 ROBO2 содержит по меньшей мере одну из следующих мутаций; S17T и R73Y, каждая из которых пронумерована в соответствии с SEQ ID NO: 1.
[0039] E25. Рекомбинантный ROBO2-Fc, содержащий аминокислотную последовательность SEQ ID NO: 19.
[0040] E26. Рекомбинантный ROBO2-Fc E25, где указанный белок не содержит С-концевой лизин в аминокислотном остатке номер 441 в соответствии с нумерацией SEQ ID NO: 19.
[0041] E27. Рекомбинантный белок ROBO2 любого из E1-E26, где указанным ROBO2 является человеческий ROBO2.
[0042] E28. Рекомбинантный белок ROBO2 любого из E1-E27, где указанный белок связывается с SLIT2 с аффинностью связывания (KD), равной или менее, чем: приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 2 нМ, приблизительно 1 нМ, приблизительно 900 пМ, приблизительно 800 пМ, приблизительно 700 пМ, приблизительно 600 пМ, приблизительно 500 пМ, приблизительно 400 пМ, приблизительно 300 пМ, приблизительно 250 пМ, приблизительно 200 пМ, приблизительно 150 пМ, приблизительно 100 пМ, приблизительно 50 пМ, приблизительно 40 пМ, приблизительно 30 пМ, приблизительно 25 пМ, приблизительно 20 пМ, приблизительно 15 пМ, приблизительно 10 пМ, приблизительно 5 пМ или приблизительно 1 пМ.
[0043] E29. Рекомбинантный белок ROBO2 любого из E1-E27, где указанный белок связывается с SLIT2 с KD, которая по меньшей мере приблизительно в 2 раза, приблизительно в 4 раза, приблизительно в 6 раз, приблизительно в 8 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 40 раз, приблизительно в 60 раз, приблизительно в 80 раз, приблизительно в 100 раз, приблизительно в 120 раз, приблизительно в 140 раз, приблизительно в 160 раз ниже, чем величина KD для связывания ROBO1 с SLIT2.
[0044] E30. Рекомбинантный белок ROBO2 любого из E1-E29, где указанный белок связывается с SLIT2 с величиной KD, которая по меньшей мере приблизительно в 2 раза, приблизительно в 4 раза, приблизительно в 6 раз, приблизительно в 8 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 40 раз, приблизительно в 60 раз, приблизительно в 80 раз, приблизительно в 100 раз, приблизительно в 120 раз, приблизительно в 140 раз, приблизительно в 160 раз ниже, чем величина KD для связывания белка ROBO1-Fc с SLIT2.
[0045] E31. Рекомбинантный белок ROBO2 любого из E1-E30, где указанную KD измеряют с помощью поверхностного плазмонного резонанаса (ППР).
[0046] E32. Рекомбинантный белок ROBO2 E31, где указанную KD измеряют на устройстве Biacore T200.
[0047] E33. Рекомбинантный белок ROBO2 любого из E28-E30, где указанную KD измеряют с помощью биослойной интерферометрии (БСИ).
[0048] E34. Рекомбинантный белок ROBO2 E33, где указанную KD измеряют на устройстве ForteBio Octet.
[0049] E35. Рекомбинантный белок ROBO2 любого из E1-E34, где указанный белок ингибирует связывание лиганда SLIT и ROBO2.
[0050] E36. Рекомбинантный белок ROBO2 любого из E1-E34, где указанный белок ингибирует ROBO2-зависимую активность SLITx-N.
[0051] E37. Рекомбинантный белок ROBO2 любого из E1-E36, где указанный белок ингибирует связывание лиганда SLIT и ROBO2 и ингибирует ROBO2-зависимую активность SLIT-N.
[0052] E38. Рекомбинантный белок ROBO2 любого из E1-E37, где указанная ROBO2-зависимая активность SLITx-N выбрана из группы, состоящей из полимеризации актина, адгезии подоцитов и ингибирования миграции нервных клеток.
[0053] E39. Рекомбинантный белок ROBO2 любого из E1-E38, где указанный белок имеет полумаксимальную ингибирующую концентрацию (IC50), составляющую не более, чем приблизительно 15 нМ, приблизительно 13 нМ, приблизительно 11 нМ, приблизительно 9 нМ, приблизительно 7 нМ, приблизительно 6 нМ, приблизительно 5 нМ, приблизительно 4 нМ, приблизительно 3 нМ, приблизительно 2 нМ, приблизительно 1 нМ.
[0054] E40. Рекомбинантный белок ROBO2 E39, где указанную IC50 измеряют с помощью анализа методом гомогенной флуоресценции с временным разрешением (HTRF) на ингибирование связывания ROBO2 с SLIT2.
[0055] E41. Рекомбинантный белок ROBO2 любого из E1-E40, где указанный белок имеет полумаксимальную IC50 не более, чем приблизительно 75 нМ, приблизительно 65 нМ, приблизительно 55 нМ, приблизительно 45 нМ, приблизительно 35 нМ, приблизительно 25 нМ, приблизительно 15 нМ, приблизительно 5 нМ.
[0056] E42. Рекомбинантный белок ROBO2 E41, где указанную IC50 измеряют путем оценки SLIT2-N-опосредуемого ингибирования миграции нервных клеток.
[0057] E43. Рекомбинантный белок ROBO2 любого из E28-E42, где указанным SLIT2 является человеческий SLIT2.
[0058] E44. Рекомбинантный белок ROBO2 любого из E1-E43, где два указанных рекомбинантных белка ROBO2 ассоциируются друг с другом с образованием гомодимера.
[0059] E45. Выделенная молекула нуклеиновой кислоты, кодирующая рекомбинантный белок ROBO2 любого из E1-E44.
[0060] E46. Выделенная молекула нуклеиновой кислоты E45, содержащая последовательность нуклеиновой кислоты SEQ ID NO: 21.
[0061] E47. Выделенная молекула нуклеиновой кислоты E45, состоящая из последовательности нуклеиновой кислоты SEQ ID NO: 21.
[0062] E48. Выделенная нуклеиновая кислота, содержащая последовательность нуклеиновой кислоты плазмидной вставки, депонированной в ATCC и имеющей регистрационный номер ATCC No. PTA-124008.
[0063] E49. Рекомбинантный белок ROBO2, содержащий аминокислотную последовательность, кодируемую последовательностью SEQ ID NO: 21.
[0064] E50. Рекомбинантный белок ROBO2, содержащий аминокислотную последовательность, кодируемую последовательностью, которая по меньшей мере на 85%, 90%, 95%, или 99% идентична последовательности SEQ ID NO: 21.
[0065] E51. Рекомбинантный белок ROBO2, содержащий аминокислотную последовательность, кодируемую последовательностью, способной гибридизоваться в условиях высокой жесткости с последовательностью SEQ ID NO: 21.
[0066] E52. Вектор, содержащий молекулу нуклеиновой кислоты любого из E45-E48.
[0067] E53. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты любого из E45-E48.
[0068] E54. Клетка-хозяин, содержащая вектор E52.
[0069] E55. Клетка-хозяин E53 или E54, где указанной клеткой является клетка млекопитающего.
[0070] E56. Клетка-хозяин E53 или E54, где указанной клеткой-хозяином является клетка CHO, клетка HEK-293 или клетка Sp2.0.
[0071] E57. Способ получения рекомбинантного белка ROBO2, включающий культивирование клетки-хозяина любого из E53-E56 в условиях, при которых наблюдается экспрессия указанного рекомбинантного белка ROBO2.
[0072] E58. Способ E57, также включающий выделение указанного рекомбинантного белка ROBO2.
[0073] E59. Фармацевтическая композиция, содержащая рекомбинантный белок ROBO2 любого из E1-E44A и фармацевтически приемлемый носитель или наполнитель.
[0074] E60. Способ снижения биологической активности ROBO2, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 любого из E1-E44, или фармацевтической композиции E59.
[0075] E61. Способ E60, где указанная биологическая активность ROBO2 выбрана из группы, состоящей из связывания по меньшей мере с одним лигандом SLIT, полимеризации актина, адгезии подоцитов, ингибирования SLIT2-N-опосредуемого ингибирования миграции нервных клеток, связывания ROBO2 с srGAP1 и связывания ROBO2 с Nck.
[0076] E62. Способ лечения болезни почек, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции E59.
[0077] E63. Способ сохранения функции подоцитов, включающий контактирование указанного подоцита с рекомбинантным белком ROBO2 любого из Е1-Е44 или с фармацевтической композицией Е59.
[0078] E64. Способ модуляции функции подоцитов, включающий контактирование указанного подоцита с рекомбинантным белком ROBO2 любого из Е1-Е44 или с фармацевтической композицией Е59.
[0079] E65. Способ лечения гломерулита, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции E59.
[0080] E66. Способ лечения фокального сегментарного гломерулярного склероза (ФСГС), включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции E59.
[0081] E67. Способ лечения нефропатии, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции E59.
[0082] E68. Способ E67, где указанная нефропатия представляет собой IgA-нефропатию.
[0083] E69. Способ любого из E60-E68, где указанным индивидуумом является человек.
[0084] E70. Способ любого из E60-E69, где указанный рекомбинантный белок ROBO2 или фармацевтическую композицию вводят внутривенно.
[0085] E71. Способ любого из E60-E69, где указанный рекомбинантный белок ROBO2 или фармацевтическую композицию вводят подкожно.
[0086] E72. Способ любого из E60-E71, где указанный рекомбинантный белок ROBO2 или фармацевтическую композицию вводят приблизительно два раза в неделю, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в десять недель, два раза в месяц, один раз в месяц, раз в два месяца, раз в три месяца или раз в четыре месяца.
[0087] E73. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция Е59 для применения в качестве лекарственного препарата.
[0088] E74. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция Е59 для применения в целях снижения активности ROBO2 в клетке.
[0089] E75. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция Е59 для применения в целях снижения активности ROBO2 у индивидуума.
[0090] E76. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция Е59 для применения в целях сохранения функции подоцитов у индивидуума.
[0091] E77. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция по Е59 для применения в целях модуляции функции подоцитов у индивидуума.
[0092] E78. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция Е59 для применения в целях лечения гломерулита у индивидуума.
[0093] E79. Рекомбинантный белок ROBO2 E78, где указанным гломерулитом является ФСГС.
[0094] E80. Рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическая композиция Е59 для применения в целях лечения нефропатии у индивидуума.
[0095] E81. Рекомбинантный белок ROBO2 E80, где указанной нефтопатией является IgA-нефропатия.
[0096] E82. Применение рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции Е59 в целях приготовления лекарственного препарата для снижения активности ROBO2 в клетке.
[0097] E83. Применение рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции Е59 в целях приготовления лекарственного препарата для снижения активности ROBO2 у индивидуума.
[0098] E84. Применение рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции Е59 в целях приготовления лекарственного препарата для сохранения функции подоцитов у индивидуума.
[0099] E85. Применение рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции Е59 в целях приготовления лекарственного препарата для модуляции функции подоцитов у индивидуума.
[0100] E86. Применение рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции Е59 в целях приготовления лекарственного препарата для лечения гломерулита у индивидуума.
[0101] E87. Применение рекомбинантного белка ROBO2 любого из E1-E44 или фармацевтической композиции Е59 в целях приготовления лекарственного препарата для лечения нефропатии у индивидуума.
[0102] E88. Набор, включающий контейнер, композицию в этом контейнере, содержащую рекомбинантный белок ROBO2 любого из E1-E44 или фармацевтическую композицию Е59 и вкладыш в упаковку, содержащий инструкции по введению терапевтически эффективного количества рекомбинантного белка ROBO2 или фармацевтической композиции для лечения пациента, нуждающегося в этом.
Краткое описание чертежей
[0103] На фиг. 1А представлен график, иллюстрирующий домены человеческого ROBO2. Лидерная последовательность ROBO2, состоящая из 21 аминокислоты (SEQ ID NO: 17; остатки 1-21 в соответствии с нумерацией, представленной в SEQ ID NO: 24), расщепляется в процессе продуцирования белка с образованием зрелого ROBO2. Остатки 22-859 в соответствии с нумерацией, представленной в SEQ ID NO: 24, образуют внеклеточный домен, остатки 860-880, в соответствии с нумерацией в SEQ ID NO: 24, образуют трансмембранный домен, а остатки 881-1378 в соответствии с нумерацией в SEQ ID NO: 24, образуют цитоплазматический домен. Также показаны пре-последовательность Ig1-ROBO2 (SEQ ID NO: 8), междоменный линкер Ig1-Ig2 (SEQ ID NO: 10)) и междоменный линкер Ig2-Ig3 (SEQ ID NO: 12).
[0104] На фиг. 1B представлен график, иллюстрирующий описанные здесь репрезентативные рекомбинантные гибридные белки ROBO2-Fc: ROBO2-Fc 1.0 (содержащий только домен Ig1, то есть, аминокислотные остатки 31-127 в соответствии с нумерацией SEQ ID NO: 24); ROBO2-Fc 1.1 (содержащий домен Ig1 и междоменный линкер Ig1-Ig2, то есть, аминокислотные остатки 31-132 в соответствии с нумерацией SEQ ID NO: 24); ROBO2-Fc 2.0 (содержащий домен Ig1, междоменный линкер Ig1-Ig2 и домен Ig2, то есть, аминокислотные остатки 31-220 в соответствии с нумерацией SEQ ID NO: 24); ROBO2-Fc 2.1 (содержащий домен Ig1, междоменный линкер Ig1-Ig2, домен Ig2 и междоменный линкер Ig2-Ig3, то есть, аминокислотные остатки 31-224 в соответствии с нумерацией SEQ ID NO: 24); ROBO2-Fc 2.2 (содержащий пре-последовательность Ig1, домен Ig1, междоменный линкер Ig1-Ig2, домен Ig2 и междоменный линкер Ig2-Ig3, то есть, аминокислотные остатки 22-224 в соответствии с нумерацией SEQ ID NO: 24); ROBO2-Fc 3.0 (содержащий домен Ig1, междоменный линкер Ig1-Ig2, домен Ig2, междоменный линкер Ig2-Ig3, домен Ig3, то есть, аминокислотные остатки 31-309 в соответствии с нумерацией SEQ ID NO: 24); и ROBO2-Fc 4.0 (содержащий домен Ig1, междоменный линкер Ig1-Ig2, домен Ig2, междоменный линкер Ig2-Ig3, домен Ig3, междоменный линкер Ig3-Ig4, и Ig4, то есть, аминокислотные остатки 31-409 в соответствии с нумерацией SEQ ID NO: 24).
[0105] На фиг.2 показана аминокислотная последовательность ROBO2-Fc 2.2 (SEQ ID NO: 1). Остатки пронумерованы последовательно, начиная с N-конца. Домены Ig1 и Ig2 показаны прописными буквами, а Fc-домен показан строчными буквами. Пре-последовательность Ig1 (SEQ ID NO: 8) и междоменный линкер Ig2-Ig3 (SEQ ID NO: 12) показаны жирным шрифтом и курсивом, а междоменный линкер Ig1-Ig2 (SEQ ID NO: 10) показан курсивом. Предсказанные внутрицепьевые и межцепьевые дисульфидные связи показаны соединительными линиями. Одна полипептидная цепь представлена вместе с дисульфидными связями в шарнирной области Fc, которая может димеризоваться со вторым Fc, содержащим полипептидную цепь. Сайты канонической консенсусной последовательности N-связанного гликозилирования показаны кружками (то есть, NXS/T, где гликан связан с аспарагиновым остатком, и где Х может представлять собой любую аминокислоту, кроме пролина, а третьей аминокислотой является либо серин, либо треонин), а точковые мутации, не имеющие Fc-эффекторной функции, и расположенные в A228, A229 и A231, показаны жирным шрифтом. Линкерная последовательность Gly-Ser из 6 аминокислот показана в рамке.
[0106] На фиг. 3 показано, что ROBO2-Fc 2.1 (SEQ ID NO: 2) связывается с SLIT2, а ROBO2-Fc 1.1 (SEQ ID NO: 4) и ROBO2-Fc 2.0 (SEQ ID NO: 3) не связываются с SLIT2. Используемые белки ROBO2-Fc Octet Red загружали на сенсоры, содержащие античеловеческий кристаллизованный фрагмент (AHFc) в концентрации 10 мкг/мл и инкубировали со 100 нМ SLIT2 в течение 7 минут, а затем сенсоры перемещали в отдельно взятый буфер на 640 секунд. ROBO2-Fc 4.0 (SEQ ID NO: 7) включали в качестве позитивного контроля для связывания. Присоединение последовательности VFER SEQ ID NO: 12) после домена Ig2 ROBO2 для получения ROBO2-Fc 2.1 (SEQ ID NO: 2) играет важную роль в получении гибридного белка ROBO2-Fc, который связывается с SLIT2.
[0107] На фиг. 4A-4C показано, что ROBO2-Fc 2.2 (SEQ ID NO: 1) связывается с SLIT2 с высокой аффинностью. Величины KD измеряли с помощью поверхностного плазмонного резонанаса (ППР). KD ROBO2-Fc для связывания с SLIT2-D2 человека/собакоподобных обезьян (ROBO2-связывающего домена, идентичного на 100%) составляла 0,293 нМ (фиг. 4А). KD ROBO2-Fc 2.2 для связывания с человеческим SLIT2-N (с N-концевым фрагментом) составляла 0,279 нМ (фиг. 4В), а KD ROBO2-Fc 2.2 для связывания с крысиным SLIT2-N составляла 0,543 нМ (фиг. 4С).
[0108] На фиг. 5 продемонстрировано, что ROBO2-Fc 2.2 (SEQ ID NO: 1) связывается с высокой аффинностью, составляющей EC50 9 нМ, с человеческим SLIT2-N, который сверхэкспрессируется на клетках почек человеческого эмбриона (HEK293). 12-точечные 2-кратные серийные разведения ROBO2-Fc 2.2, меченного Alexa Fluor 647 (AF647), инкубировали либо с SLIT2-N-экспрессирующими клетками HEK293, либо с контрольными клетками HEK293. Данные представлены как геометрически средняя интенсивность флуоресценции (Geo MFI) ROBO2-Fc 2.2 AF647 на SLIT2-N-клетках HEK293 минус геометрически средняя интенсивность флуоресценции ROBO2-FC 2.2 AF647 на контрольных клетках HEK293.
[0109] На фиг. 6A-6B продемонстировано дозозависимое ингибирование связывания SLIT2-N с ROBO2 на клеточной поверхности под действием ROBO2-Fc 2.2 (SEQ ID NO: 1), как было оценено по гомогенной флуоресценции с временным разрешением (HTRF). 11-точечную 4-кратную титруемую дозу ROBO2-FC 2.2 (черные квадраты) или антитела контрольного изотипа (черные кружки) добавляли к человеческому SLIT2-N (фиг. 6А) или крысиному SLIT2-N (фиг. 6В) в анализе на HTRF человеческого ROBO2. ROBO2-Fc представляет собой сильный нейтрализотор связывания человеческого SLIT2-N:человеческого ROBO2 (IC50= 7 нМ) и крысиного SLIT2-N:человеческого ROBO2 (IC50= 4 нМ).
[0110] На фиг. 7 показано дозозависимое ингибирование SLIT2-опосредуемого ингибирования миграции нервных клеток под действием ROBO2-Fc 2.2. Эксплантаты клеток нервных тканей субвентрикулярной зоны (SVZ) культивировали в течение ночи в присутствии 1 нМ SLIT2-N и ROBO2-Fc 2.2 в интервале доз. ROBO2-Fc 2.2 обладал способностью восстанавливать миграцию нервных клеток в зависимости от дозы при IC50=51 нМ.
[0111] На фиг. 8 продемонстировано ингибирование протеинурии путем введения ROBO2-Fc 2.2 с помощью крысиной модели пассивного нефрита Хеймана с использованием репрезентативной схемы профилактических доз. Двенадцать животных в каждой из указанных групп подкожно обрабатывали указанной дозой ROBO2-Fc 2.2 или нерелевантного моноклонального антитела контрольного изотипа (контроля) через каждые три дня, начиная со дня индуцирования модели на день 0. На оси Y отложено отношение альбумина к креатинину мочи (мг/мг) как показатель проникновения белка в мочу, на что указывает повреждение подоцитов. Крысам Льюиса инъецировали овечью антисывороку против щеточной каймы почек крыс (против Fx1a, базальной мембраны и подоцитов). У крыс развивался иммунный ответ против овечьей сыворотки, которая связывается с крысиными подоцитами. По мере повреждения и уничтожения подоцитов повышается уровень протеинурии. Обработка ROBO2-Fc 2.2, вводимого в количестве 25 мг/кг, приводила к снижению протеинурии максимум на 45%, а величина р составляла менее, чем 0,001, как было определено путем проведения повторных статистических анализов ANOVA по сравнению с обработкой контрольным антителом. Этот дозозависимый эффект также был статистически значимым с величиной р менее, чем 0,001.
[0112] На фиг. 9 продемонстировано ингибирование протеинурии путем обработки ROBO2-Fc 2.2 с помощью крысиной модели пассивного нефрита Хеймана с использованием репрезентативной схемы профилактических доз. Двенадцать животных в каждой из указанных групп подкожно обрабатывали указанной дозой ROBO2-Fc 2.2 или нерелевантного моноклонального антитела контрольного изотипа (контроля) через каждые три дня по соответствующей схеме введения доз: контрольное антитело вводили на день 0 (кружки), а ROBO2-Fc 2.2 вводили на день 0 (квадраты), на день 6 (треугольники) или на день 9 (перевернутые треугольники). На оси Y отложено отношение альбумина к креатинину мочи (мг/мг) как показатель проникновения белка в мочу, на что указывает повреждение подоцитов. Крысам Льюиса инъецировали овечью антисыворотку против щеточной каймы почек крыс (против Fx1a, базальной мембраны и подоцитов). У крыс развивался иммунный ответ против овечьей сыворотки, которая связывается с крысиными подоцитами. По мере повреждения и уничтожения подоцитов повышается уровень протеинурии. Обработка ROBO2-Fc 2.2, вводимого на дни 0, 6 и 9, приводила к снижению протеинурии в аналогичной степени, максимум на 40%, а величина р составляла менее, чем 0,001, как было определено путем проведения повторных статистических анализов ANOVA для каждой ROBO2-Fc 2.2-обработаннй группы по сравнению с обработкой контрольным антителом.
[0113] На фиг. 10A-10B показано, что обработка ROBO2-Fc 2.2 приводила к снижению уровня поражения субструктуры подоцитов у модели пассивного нефрита Хеймана. Двенадцать животных в каждой из указанных групп подкожно обрабатывали указанной дозой ROBO2-Fc 2.2 или нерелевантного моноклонального контрольного антитела через каждые три дня в дозе 25 мг/кг до достижения 100% охвата мишени, начиная со дня индуцирования модели на день 0. После умерщвления животных на день 16, отобранные образцы почек визуализировали в цифровом масштабе на просвечивающем электронном микроскопе. Три капллярных петли первых трех клубочков, обнаруженных при увеличении 200×, визуализировали при увеличении 5000× и 10000×, и эту процедуру не повторяли. Компьютерную программу ImageJ (версия 1.47v; National Institutes of Health, Bethesda, MD, USA) использовали для мануального мониторинга ширины смежных ветвистых отростков, а также плотности щелевых диафрагм на единицу длины гломерулярной базальной мембраны (GBM) на просвечивающем электронном микроскопе с большим увеличением. Образцы анализировали в 3 отдельных экспериментах. Отростки оснований подоцитов ROBO2-Fc 2.2-обработанного животного были значительно короче, чем у животного, обработанного контрольным антителом (фиг. 10А), а плотность щелевых диафрагм была значительно выше у ROBO2-Fc 2.2-обработанных животных (фиг. 10В; величина р составляла менее, чем 0,01, как было определено с помощью двустороннего Т-критерия), что указывает на то, что эти животные имели меньшую степень поражения и были защищены от повреждения клубочков.
[0114] На фиг. 11 продемонстировано, что ROBO2-Fc S17T/R73Y связывается с человеческим SLIT2-N, который сверхэкспрессируется на клетках почек человеческого эмбриона (HEK293) с высокой аффинностью, составляющей EC50 2,5 нМ. 12-точечные 2-кратные серийные разведения ROBO2-Fc S17T/R73Y, меченного Alexa Fluor 647 (AF647), инкубировали либо с SLIT2-N-экспрессирующими клетками HEK293, либо с контрольными клетками HEK293. Данные представлены как геометрически средняя интенсивность флуоресценции (Geo MFI) ROBO2-Fc S17T/R73Y AF647 на SLIT2-N-клетках HEK293 минус геометрически средняя интенсивность флуоресценции ROBO2-Fc S17T/R73Y AF647 на контрольных клетках HEK293.
[0115] На фиг. 12 продемонстировано дозозависимое ингибирование связывания SLIT2-N с ROBO2 на клеточной поверхности под действием ROBO2-Fc S17T/R73Y, как было оценено по гомогенной флуоресценции с временным разрешением (HTRF). 11-точечную 4-кратную титруемую дозу ROBO2-Fc S17T/R73Y (черные квадраты) или антитела контрольного изотипа (черные кружки) добавляли к человеческому SLIT2-N или крысиному SLIT2-N в анализе на HTRF человеческого ROBO2. ROBO2-Fc S17T/R73Y представляет собой сильный нейтрализатор связывания человеческого SLIT2-N:человеческого ROBO2 с IC50=1,4 нМ.
[0116] На фиг. 13 показано дозозависимое ингибирование SLIT2-опосредуемого ингибирования миграции нервных клеток под действием ROBO2-Fc S17T/R73Y. Эксплантаты клеток нервных тканей субвентрикулярной зоны (SVZ) культивировали в течение ночи в присутствии 1 нМ SLIT2-N и титруемых количеств ROBO2-Fc S17T/R73Y. ROBO2-Fc S17T/R73Y обладал способностью восстанавливать миграцию нервных клеток в зависимости от дозы при IC50 =11,5 нМ.
[0117] На фиг. 14 показано изображение, иллюстрирующее кристаллическую структуру конструкции ROBO2-His, которая состоит из пре-последовательности Ig1 ROBO2 (SRLRQEDFP; SEQ ID NO: 8), домена Ig1, домена Ig2 и междоменного линкера Ig2-3 ROBO2 (VFER; SEQ ID NO: 12) с гистидиновой 6×-меткой (His6)(SEQ ID NO: 25) у С-конца. Кристаллическая структура ROBO2-His показала, что Asp7, Phe8 и Pro9 играют важную роль во взаимодействиях, необходимых для достижения структурной целостности домена Ig1 ROBO2.
[0118] На фиг. 15 показано изображение, иллюстрирующее кристаллическую структуру конструкции ROBO2-His. Кристаллическая структура ROBO2-His6 («His6», представленного как SEQ ID NO: 25) показала, что междоменный линкер Ig2-3 ROBO2, валин200-фенилаланин201-глутаминовая кислота202-аргинин203 (SEQ ID NO: 12) эффективно стабилизирует структурную укладку в С-концевой области домена Ig2 ROBO2.
[0119] На фиг. 16 представлена кристаллическая структура первого иммуноглобулин-подобного домена (Ig1) ROBO2 S17T/R73Y в комплексе с SLIT2.
Подробное описание изобретения
1. Обзор
[0120] Настоящее изобретение охватывает новые рекомбинантные белки ROBO2, способные связываться с лигандами SLIT (например, с лигандом SLIT2), и тем самым, ингибировать взаимодействие SLIT с ROBO2, и кроме того, ингибировать путь передачи сигнала SLIT2-ROBO2. Проведенные ранее исследования показали, что хотя оба иммуноглобулин-подобных (Ig-подобных) домена 1 и 2 (Ig1 и Ig2) ROBO2 взаимодействуют с лигандами SLIT, однако, первым Ig-подобным доменом (Ig1) является первичный сайт связывания со SLIT. Кроме того, проведенные ранее исследования показали, что удаление трех повторов фибронектина типа III (FNIII) оказывают более негативное влияние на связывание ROBO с лигандами SLIT, чем удаление третьего и четвертого иммуноглобулин-подобных доменов (Ig3 и Ig4). То есть, делеция FNIII приводит к большему снижению уровня связывания ROBO с лигандами SLIT, чем делеция Ig3 и Ig4.
[0121] Впервые и неожиданно было показано, что конструкция ROBO2-Fc 2.1 (SEQ ID NO: 2; фиг. 1В) содержит только первые два иммуноглобулин-подобных домена (Ig1 и Ig2) вместе с междоменным линкером Ig2-3, VFER (SEQ ID NO: 12) и не содержит трех повторов фибронектина типа III (FNIII), связанных с SLIT2 (фиг. 3). В противоположность этому, рекомбинантные белки ROBO2 не содержат трех повторов фибронектина типа III (FNIII), но состоят из:
(i) домена Ig1 ROBO2 (ROBO2-Fc 1.1; SEQ ID NO: 4; фиг. 1В),
(ii) доменов Ig1 и Ig2 ROBO2 (ROBO2-Fc 2.0; SEQ ID NO: 3; фиг. 1В),
(iii) доменов Ig1, Ig2 и Ig3 ROBO2 (ROBO2-Fc 3.0; SEQ ID NO: 6; фиг. 1В), которые не связываются с SLIT2 (фиг. 3).
[0122] Таким образом, присоединение VFER (SEQ ID NO: 12) к С-концу доменов Ig1-Ig2 было необходимо для создания конструкции ROBO2-Fc (ROBO2-Fc 2.1; SEQ ID NO: 2), имеющей надежный профиль связывания с SLIT2 в отсутствии повторов FNIII. В этой конструкции ROBO2-Fc 2.1 отсутствуют не только третий, четвертый и пятый иммуноглобулин-подобные домены (Ig3, Ig4 и Ig5), но также и три повтора фибронектина типа III (FNIII). Неожиданно было обнаружено, что различия в связывании со SLIT2 и в отсутствии связывания со SLIT2 обусловлены присутствием последовательности VFER из четырех аминокислот (SEQ ID NO: 12).
[0123] Ни одна из вышеописанных конструкций рекомбинантных белков ROBO2 не содержит пре-последовательности Ig1 ROBO2 (SEQ ID NO: 8). Неожиданно было обнаружено, что уровень продуцирования этих рекомбинантных белков ROBO2, раскрытых и описанных в настоящей заявке, может резко увеличиваться благодаря включению пре-последовательности Ig1 ROBO2 (SEQ ID NO: 8). Присоединение этой последовательности приводит приблизительно к 25-кратному увеличению уровня продуцирования белка по сравнению с конструкциями, не содержащими этой последовательности, но сохраняющими высокую аффинность связывания с SLIT2 (фиг. 3-4А-С). Как показано на фиг. 14, эта пре-последовательность Ig1 ROBO2 образует мостиковую связь с двумя β-складками домена Ig1 ROBO2 и, вероятно, стабилизирует структурную укладку N-концевой области. Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что пре-последовательность Ig1, очевидно, участвует в повышении уровня экспрессии новых белков.
2. Определения
[0124] В некоторых своих аспектах, настоящее изобретение относится к рекомбинантным белкам ROBO2, способным связываться с SLIT и содержащим домен иммуноглобулина.
[0125] Термин «рекомбинантный белок» означает полипептид, который был продуцирован методами рекомбинантных ДНК, где, по существу, ДНК, кодирующую полипептид, встраивают в подходящий экспрессионный вектор, который, в свою очередь, будет встраиваться в клетку-хозяина с образованием рекомбинантного белка. Используемый здесь термин «белок» означает любую композицию, содержащую аминокислоты и известную специалистам как белок. Используемые здесь термины «белок», «пептид» и «полипептид» являются синонимами. Аминокислоты могут обозначаться полными названиями (например, аланин), либо они могут обозначаться общепринятыми однобуквенными кодами (например, А) или трехбуквенными кодами (например, Ala).
[0126] Используемый здесь термин «домен иммуноглобулина» означает полипептид, происходящий от иммуноглобулина. В некоторых вариантах осуществления изобретения, домен иммуноглобулина содержит тяжелую цепь иммуноглобулина или ее часть. В некоторых вариантах осуществления изобретения, часть тяжелой цепи представляет собой кристаллизующийся фрагмент (Fc) или его часть. Используемый здесь термин «Fc-фрагмент» включает шарнирную область тяжелой цепи и CH2- и CH3-домены тяжелой цепи иммуноглобулина. Тяжелая цепь (или ее часть) может происходить от тяжелой цепи любого известного изотипа: IgG (γ), IgM (μ), IgD (δ), IgE (ε) или IgA (α). Кроме того, тяжелая цепь (или ее часть) может происходить от тяжелой цепи любых известных изотипов или подтипов: IgG1 (γ1), IgG2 (γ2), IgG3 (γ3), IgG4 (γ4), IgA1 (α1), IgA2 (α2). В некоторых вариантах осуществления изобретения, домен иммуноглобулина содержит непрерывающуюся нативную последовательность (то есть, последовательность дикого типа) иммуноглобулина. В некоторых вариантах осуществления изобретения, Fc-домен иммуноглобулина содержит модифицированную Fc-область.
[0127] Для всех аминокислотных положений константной области тяжелой цепи, обсуждаемых в настоящей заявке, нумерация соответствует Eu-индексу, впервые описанному Edelman et al., 1969, Proc. Natl. Acad. Sci. USA 63(1):78-85, где представлена аминокислотная последовательность миеломного белка Eu, который был первым секвенированным человеческим IgG1. Eu-индекс, описанный Эдельманом и др., был также предложен Кэбатом и др. в публикации Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda. Таким образом, «EU-индекс, предложенный Кэбатом» или «EU-индекс по Кэбату» означает систему нумерации остатков, исходя из человеческого антитела IgG1 Eu, описанного Эдельманом и др., по Кэбату, 1991.
[0128] «Fc-область с нативной последовательностью» включает аминокислотную последовательность, идентичную аминокислотной последовательности природной Fc-области. «Модифицированная Fc-область» включает аминокислотную последовательность, которая отличается от нативной последовательности Fc-области по меньшей мере одной аминокислотной модификацией. Предпочтительно, модифицированная Fc-область имеет по меньшей мере одну аминокислотную замену по сравнению с Fc-областью с нативной последовательностью, например, приблизительно от одной и приблизительно до десяти аминокислотных замен, а предпочтительно, приблизительно от одной и приблизительно до пяти аминокислотных замен по сравнению с Fc-областью с нативной последовательностью. Модифицированная Fc-область, описанная в настоящей заявке, будет, предпочтительно, иметь аминокислотную последовательность, которая по меньшей мере приблизительно на 80%, более предпочтительно, по меньшей мере приблизительно на 90%, еще более предпочтительно, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98%, а наиболее предпочтительно, по меньшей мере приблизительно на 99%, идентична аминокислотной последовательности Fc-области с нативной последовательностью.
[0129] Используемый здесь термин «линкер» означает молекулу или группу молекул, которые связывают две отдельных молекулы (например, внеклеточного домена и домена иммуноглобулина рекомбинантного белка ROBO2-Fc) друг с другом и могут создавать пространство между этими двумя молекулами и обеспечивать их гибкость так, чтобы их конформация позволяла им специфически связываться, например, с их когнатным лигандом (например, лигандом SLIT). Особенно предпочтительными являются линкеры белков, и эти линкеры могут быть экспрессированы как компонент рекомбинантного белка стандартными методами рекомбинантных ДНК, хорошо известными специалистам.
[0130] Термин «IC50» или «полумаксимальная ингибирующая концентрация» означает концентрацию рекомбинантного белка ROBO2, которая необходима для 50% ингибирования пути передачи сигнала ROBO2-SLIT, например, пути передачи сигнала ROBO2-SLIT2. IC50 является показателем того, насколько рекомбинантный белок ROBO2 является необходимым для ингибирования биологического процесса ROBO2-SLIT на 50%, такого как связывание ROBO2 и лиганда SLIT; связывание внутриклеточных сигнал-передающих молекул (таких как srGAP1 или Nck) с внутриклеточным доменом ROBO2; и/или последующая активность передачи сигнала ROBO2-SLIT (такая как полимеризация актина, адгезия подоцитов и/или SLITx-N-опосредуемое ингибирование миграции нервных клеток). Более низкая IC50 указывает на более сильный эффект, поскольку уменьшение количества рекомбинантного белка ROBO2 опосредует более сильный ингибирующий эффект.
[0131] Используемый здесь термин «SLITx» означает, по существу, лиганд SLIT. Аналогичным образом, термины «SLITx-N» и «SLITx-С» означают, по существу, N-концевые и С-концевые фрагменты, соответственно, лигандов SLIT. Лигандом SLIT может быть лиганд SLIT млекопитающего, а предпочтительно, человеческий лиганд SLIT. В некоторых вариантах осуществления изобретения, лиганд SLIT выбран из группы, состоящей из лиганда SLIT1, лиганда SLIT2 и лиганда SLIT3. Лигандом SLIT может быть лиганд SLIT2, а предпочтительно, человеческий лиганд SLIT2.
[0132] Используемый здесь термин «индивидуум» относится к животному, предпочтительно, млекопитающему, более предпочтительно, примату, не являющемуся человеком, а наиболее предпочтительно, к человеку. Используемые здесь термины «субъект», «индивидуум» и «пациент» являются синонимами. Во всех вариантах осуществления изобретения, предпочтительными являются человеческие нуклеиновые кислоты и человеческие полипептиды. Считается, что результаты, полученные с использованием описанных здесь молекул человека, крыс и собакоподобных обезьян, могут быть прогностическими результатами, которые могут быть получены с использованием других гомологичных последовательностей.
[0133] Используемый здесь термин «лечение» означает способ достижения желаемых или нужных клинических результатов. В соответствии с целями настоящего изобретения, желаемыми или нужными клиническими результатами являются, но не ограничиваются ими, один или более из нижеследующих факторов, таких как снижение уровня протеинурии (то есть, снижение количества белка в моче по сравнению с количеством белка в моче без введения лекарственного средства), снижение отека и/или восстановление уровней альбумина в крови. Термин «лечение» включает профилактическое и/или терапевтическое лечение. Если лечение проводят до появления клинических признаков состояния, то такое лечение называется профилактическим. Терапевтическое лечение включает, например, ослабление или снижение тяжести заболевания или сокращение времени течения заболевания.
[0134] Термин «терапевтически эффективное количество» означает количество терапевтического агента согласно изобретению, эффективное для «лечения» заболевания или расстройства у индивидуума. Так, например, терапевтически эффективное количество может представлять собой количество, ослабляющее один или более симптомов заболевания или количество, необходимое для поддержания ремиссии заболевания. В случае фокального сегментарного гломерулосклероза (ФСГС), терапевтически эффективное количество означает количество, которое является подходящим для достижения по меньшей мере одного из нижеследующих эффектов: снижения уровня протеинурии (то есть, снижения количества белка в моче по сравнению с количеством белка в моче без введения лекарственного средства), снижения отека и/или восстановления уровней альбумина в крови.
[0135] Используемые здесь термины «около» или «приблизительно», если они употребляются вместе с измеримыми численными переменными, относятся к указанной величине переменной и ко всем величинам переменной, которые не выходят за пределы экспериментальной ошибки указанной величины (например, входят в 95% доверительный предел среднего) или составляют ±10% от указанной величины, которая может превышать эту величину. Численные пределы включают числа, определяющие границы интервала величин.
Аффинность связывания
[0136] «Аффинность связывания» обычно означает сумму сил всех нековалентных взаимодействий между контактирующим остатком одного партнера по связыванию (например, описанного здесь рекомбинантного белка ROBO2) и контактирующим остатком его партнера по связыванию (например, лиганда SLIT). Если это не оговорено особо, то используемый здесь термин «аффинность связывания» означает аффинность связывания, которая определяет взаимодействие 1:1 между членами связывающей пары или партнеров по связыванию (например, рекомбинантного белка ROBO2 и лиганда SLIT2).
[0137] При более детальном рассмотрении, аффинность связывания между ROBO2 и лигандом SLIT может быть определена по пространственным координатам, определяющим атомные контакты, участвующие во взаимодействии ROBO2/SLIT, а также по информации об их соответствующем участии в термодинамике связывания. На одном уровне, контактирующий остаток может быть охарактеризован по пространственным координатам, определяющим атомные контакты между ROBO2 и SLIT. В одном из аспектов изобретения, контактирующий остаток может быть определен по конкретному критерию, например, по расстоянию между атомами в аминокислотном остатке белка ROBO2 и атомами в аминокислотном остатке белка SLIT, например, по расстоянию, равному или составляющему менее, чем приблизительно 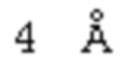 (например,
(например, 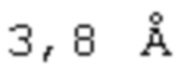 , используемый здесь в Примерах), от тяжелого атома аминокислотного остатка ROBO2 и тяжелого атома аминокислотного остатка SLIT. В другом аспекте, контактирующий остаток может быть охарактеризован как остаток, участвующий во взаимодействии водородной связи с когнатным партнером по связыванию или с молекулой воды, которая также представляет собой водород, связанный с партнером по связыванию (то есть, в образовании водородной связи, опосредуемой водой). В другом аспекте изобретения, контактирующий остаток может быть охарактеризован как остаток, образующий солевой мостик с остатком партнера по связыванию. В другом аспекте изобретения, контактирующий остаток может быть охарактеризован как остаток, имеющий ненулевое изменение площади скрытой поверхности (BSA) благодаря взаимодействию с контактирующим остатком партнера по связыванию. При менее детальном рассмотрении, аффинность связывания может быть охарактеризована по их функции, например, по конкурентному связыванию с другими белками.
, используемый здесь в Примерах), от тяжелого атома аминокислотного остатка ROBO2 и тяжелого атома аминокислотного остатка SLIT. В другом аспекте, контактирующий остаток может быть охарактеризован как остаток, участвующий во взаимодействии водородной связи с когнатным партнером по связыванию или с молекулой воды, которая также представляет собой водород, связанный с партнером по связыванию (то есть, в образовании водородной связи, опосредуемой водой). В другом аспекте изобретения, контактирующий остаток может быть охарактеризован как остаток, образующий солевой мостик с остатком партнера по связыванию. В другом аспекте изобретения, контактирующий остаток может быть охарактеризован как остаток, имеющий ненулевое изменение площади скрытой поверхности (BSA) благодаря взаимодействию с контактирующим остатком партнера по связыванию. При менее детальном рассмотрении, аффинность связывания может быть охарактеризована по их функции, например, по конкурентному связыванию с другими белками.
[0138] Низкоаффинные рекомбинантные белки обычно медленно связываются с лигандами и имеют тенденцию к быстрой диссоциации, тогда как высокоаффинные рекомбинантные белки обычно быстрее связываются с лигандами и имеют тенденцию к более длительному сохранению в связанном виде. Специалистам известен ряд методов измерения аффинности связывания, и любой из этих методов может быть применен в целях осуществления изобретения. Конкретные иллюстративные и репрезентативные варианты измерения аффинности связывания описаны ниже.
[0139] Аффинность связывания может быть выражена как величина KD, которая означает скорость диссоциации при конкретном взаимодействии рекомбинантного белка ROBO2-лиганда SLIT. KD представляет собой отношение скорости диссоциации, также называемой «диссоциацией (koff)», к скорости ассоциации или «ассоциации (kon)». Таким образом, KD равна koff/kon и выражена как молярная концентрация (M), причем, чем меньше KD, тем выше аффинность связывания. Величины KD могут быть определены методами, хорошо известными специалистам. Одним из репрезентативных методов измерения KD является метод поверхностного плазмонного резонанаса (ППР), то есть, метод, хорошо известный специалистам (например, Nguyen et al. Sensors (Basel), 2015 May 5; 15(5): 10481-510). Величина KD может быть измерена с помощью ППР с использованием биосенсорной системы, такой как BIACORE®. Кинетический анализ BIAcore включает анализ на связывание и диссоциацию антигена из чипов на поверхности которых присутствуют иммобилизованные молекулы (например, молекулы, содержащие эпитоп-связывающие домены). Другим хорошо известным методом определения KD белка является метод с использованием биослойной интерферометрии (например, Shah et al. J Vis Exp. 2014; (84): 51383). Величина KD может быть измерена с применением технологии OCTET® (Octet QKe system, ForteBio). Альтернативно или дополнительно, может быть также проведен анализ KinExA® (анализ на кинетическое исключение), разработанный Sapidyne Instruments (Boise, Id.). В объем настоящего изобретения входит любой известный метод оценки аффинности связывания между двумя партнерами по связыванию.
3. Рекомбинантные белки ROBO2
[0140] В некоторых своих аспектах, настоящее изобретение относится к рекомбинантным белкам ROBO2. В некоторых вариантах осуществления изобретения, описанные здесь рекомбинантные белки ROBO2 связываются с лигандами SLIT (а в частности, с лигандом SLIT2) и тем самым предотвращают связывание SLIT с клеточными рецепторами ROBO2, а поэтому они называются здесь белками SLIT, нейтрализующими захват лиганда. Как описано в Примерах, было неожиданно обнаружено, что конструкция ROBO2-Fc 2.1 (SEQ ID NO: 2; фиг. 1В) содержит первые два иммуноглобулин-подобных домена (Ig1 и Ig2), междоменный линкер Ig1-Ig2, вместе с междоменным линкером Ig2-3, VFER (SEQ ID NO: 12), и не содержит трех повторов фибронектина типа III (FNIII), связанных с SLIT2 (фиг. 3). Исследования кристаллической структуры также показали, что включение междоменного линкера Ig2-Ig3 ROBO2, VFER (SEQ ID NO: 12) (V200-F201-E202-R203; SEQ ID NO: 12) эффективно стабилизирует структурную укладку в С-концевой области второго домена Ig ROBO2 (фиг. 15) и заметно повышает уровень экспрессии рекомбинантного белка ROBO2.
[0141] В некоторых своих аспектах, настоящее изобретение относится к рекомбинантным полипептидам, содержащим SLIT-связывающую молекулу и молекулу, увеличивающую время полужизни. «SLIT-связывающая молекула» сообщает рекомбинантному белку ROBO2 способность связываться с SLIT. В некоторых вариантах осуществления изобретения, SLIT-связывающая молекула содержит часть внеклеточного домена ROBO2. В некоторых вариантах осуществления изобретения, часть внеклеточного домена ROBO2 содержит по меньшей мере два иммуноглобулин-подобных (Ig-подобных) домена и С-концевую последовательность, состоящую из VFER (SEQ ID NO: 12). В некоторых вариантах осуществления изобретения, по меньшей мере два Ig-подобных домена выбраны из группы, состоящей из Ig1, Ig2, Ig3, Ig4 и Ig5. В некоторых вариантах осуществления изобретения, по меньшей мере два Ig-подобных домена выбраны из группы, состоящей из последовательности SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13 и SEQ ID NO: 14. В некоторых вариантах осуществления изобретения, часть внеклеточного домена ROBO2 содержит первые два Ig-подобных домена (Ig1 и Ig2) ROBO2. В некоторых вариантах осуществления изобретения, часть внеклеточного домена ROBO2 содержит SEQ ID NO: 9 и/или SEQ ID NO: 11.
[0142] Исследования по продуцированию белка также показали, что продуцирование рекомбинантных белков ROBO2, раскрытое и описанное в настоящей заявке, может резко увеличиваться благодаря включению пре-последовательности Ig1 ROBO2 (SEQ ID NO: 8). Присоединение этой последовательности приводит к увеличению уровня продуцирования белка в транзиентно и/или стабильно трансфецированных клетках млекопитающих приблизительно в 25 раз и к сохранению высокой аффинности связывания с SLIT (фиг. 3-5).
[0143] В соответствии с этим, в некоторых вариантах осуществления изобретения, часть внеклеточного домена ROBO2 также содержит пре-последовательность Ig1 ROBO2. В некоторых вариантах осуществления изобретения, пре-последовательность Ig1 ROBO2 содержит SEQ ID NO: 8.
[0144] В некоторых вариантах осуществления изобретения, часть внеклеточного домена ROBO2 содержит пре-последовательность Ig1 ROBO2, Ig1, междоменный линкер Ig1-Ig2, Ig2 и междоменный линкер Ig2-Ig3. Репрезентативные последовательности пре-последовательности Ig1 ROBO2 (SEQ ID NO: 8), Ig1 (SEQ ID NO: 9), междоменного линкера Ig1-Ig2 (SEQ ID NO: 10), Ig2 (SEQ ID NO: 11) и междоменного линкера Ig2-Ig3 (SEQ ID NO: 12) представлены в Таблице 23 и также проиллюстрированы на фиг. 2. Настоящее изобретение не ограничивается раскрытыми здесь последовательностями. Соответствующие остатки других гомологов, изоформ, вариантов или фрагментов ROBO2 могут быть идентифицированы путем выравнивания последовательностей или выравнивания структур, известного специалистам. Так, например, выравнивание может быть осуществлено вручную или с использованием хорошо известных программ выравнивания последовательностей, таких как ClustalW2 или «BLAST 2 Sequences» с использованием параметров по умолчанию.
[0145] В некоторых вариантах осуществления изобретения, часть внеклеточного домена ROBO2 содержит аминокислотные остатки 1-203 в соответствии с нумерацией SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 содержит часть внеклеточного домена ROBO2, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотным остаткам 1-203 в соответствии с нумерацией SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 содержит внеклеточный домен, состоящий из аминокислотных остатков 1-203 в соответствии с нумерацией SEQ ID NO: 1.
[0146] В некоторых аспектах изобретения, ROBO2 представляет собой человеческий ROBO2. В некоторых аспектах изобретения, ROBO2 представляет собой крысиный ROBO2. В некоторых аспектах изобретения, ROBO2 представляет собой мышиный ROBO2. В некоторых аспектах изобретения, ROBO2 представляет собой ROBO2 приматов. В некоторых аспектах изобретения, ROBO2 представляет собой ROBO2 человекообразной обезьяны. В некоторых аспектах изобретения, ROBO2 представляет собой обезьяний ROBO2. В некоторых аспектах изобретения, ROBO2 представляет собой ROBO2 собакоподобных обезьян.
[0147] Новые рекомбинантные белки ROBO2 содержат, помимо SLIT-связывающей молекулы, молекулу, увеличивающую время полужизни. «Молекула, увеличивающая время полужизни» увеличивает время полужизни рекомбинантного белка ROBO2 in vivo в сыворотке по сравнению с тем же самым белком ROBO2, но в отсутствии молекулы, увеличивающей время полужизни. Примерами молекул, увеличивающих время полужизни, являются, но не ограничиваются ими, полигистидин, Glu-Glu, глутатион-S-трансфераза (GST), тиоредоксин, белок А, G-белок, домен иммуноглобулина, белок, связывающийся с мальтозой (MBP), альбумин человеческой сыворотки (HSA) или полиэтиленгликоль (ПЭГ). В некоторых вариантах осуществления изобретения, молекула, увеличивающая время полужизни, содержит домен иммуноглобулина. В некоторых вариантах осуществления изобретения, домен иммуноглобулина содержит Fc-домен. В некоторых вариантах осуществления изобретения, Fc-домен происходит от тяжелой цепи любого известного изотипа: IgG (γ), IgM (μ), IgD (δ), IgE (ε) или IgA (α). В некоторых вариантах осуществления изобретения, Fc-домен происходит от тяжелой цепи любого известного изотипа или подтипа: IgG1 (γ1), IgG2 (γ2), IgG3 (γ3), IgG4 (γ4), IgA1 (α1), IgA2 (α2). В некоторых вариантах осуществления изобретения, Fc-домен представляет собой Fc-домен человеческого IgG1.
[0148] В некоторых вариантах осуществления изобретения, Fc-домен содержит непрерывающуюся нативную последовательность (то есть, последовательность дикого типа) Fc-домена. В некоторых вариантах осуществления изобретения, Fc-домен иммуноглобулина содержит модифицированный Fc-домен, что приводит к изменению биологической активности. Так, например, в Fc-домен может быть включена по меньшей мере одна точковая мутация или делеция для снижения или элиминации эффекторной активности (например, WO 2005/063815) и/или для повышения гомогенности в процессе продуцирования рекомбинантного белка. В некоторых вариантах осуществления изобретения, Fc-домен представляет собой Fc-домен человеческого IgG1 и содержит одну или более из нижеследующих дефицитных по эффектору замен: L234A, L235A и G237A (Eu-нумерация) или L228A, L229A и G231A в соответствии с нумерацией SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, Fc-домен не содержит лизин в С-концевом положении человеческого IgG1 (то есть, K447 в соответствии с Eu-нумерацией). Отсутствие лизина может повышать гомогенность в процессе продуцирования рекомбинантного белка. В некоторых вариантах осуществления изобретения, Fc-домен содержит лизин в С-концевом положении (K447 в соответствии с Eu-нумерацией).
[0149] В некоторых вариантах осуществления изобретения, рекомбинантный полипептид ROBO2 содержит одну, две, три или четыре внутрицепьевых дисульфидных связи, которые могут присутствовать во внеклеточном домене ROBO2 или Fc-домене. В некоторых вариантах осуществления изобретения, рекомбинантный полипептид ROBO2 содержит четыре внутрицепьевых дисульфидных связи, две из которых присутствуют во внеклеточном домене ROBO2, а две в Fc-домене. В некоторых вариантах осуществления изобретения, внутрицепьевые дисульфидные связи, присутствующие во внеклеточном домене ROBO2, расположены между Cys31 и Cys89, и между Cys133 и Cys182, в соответствии с нумерацией SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, внутрицепьевые дисульфидные связи, присутствующие в Fc-домене, расположены между Cys255 и Cys315 и между Cys362 и Cys419, в соответствии с нумерацией SEQ ID NO: 1.
[0150] В некоторых вариантах осуществления изобретения, два рекомбинантных полипептида ROBO2 связаны либо ковалентно, например, посредством дисульфидных связи, полипептидной связи или перекрестно-сшивающего агента, либо нековалентно, с образованием гомодимерного белка. В некоторых вариантах осуществления изобретения, два рекомбинантных полипептида ROBO2 ковалентно связаны с образованием гомодимера посредством по меньшей мере одной, а более предпочтительно, двух внутрицепьевых дисульфидных связей цистеиновых остатков, предпочтительно, локализованных в Fc-области иммуноглобулина каждого полипептида. В некоторых вариантах осуществления изобретения, две внутрицепьевых дисульфидных связи расположены между Cys220 и Cys223. В некоторых вариантах осуществления изобретения, менее, чем 90%, менее, чем 80%, менее, чем 70%, менее, чем 60%, менее, чем 50%, менее, чем 40%, менее, чем 30%, менее, чем 20%, менее, чем 10%, менее, чем 6%, менее, чем 5%, менее, чем 4%, менее, чем 2%, менее, чем 1% рекомбинантных полипептидов ROBO2 ассоциируются друг с другом с образованием гомодимера.
[0151] В некоторых вариантах осуществления изобретения, два рекомбинантный полипептид ROBO2 связан с другим полипептидом либо ковалентно, например, посредством дисульфидной связи, полипептидной связи или перекрестно-сшивающего агента, либо нековалентно, с образованием гетеродимерного белка. В некоторых вариантах осуществления изобретения, гетеродимерный белок являются биспецифическим или мультиспецифическим. В некоторых вариантах осуществления изобретения, другой полипептид содержит домен иммуноглобулина. В некоторых вариантах осуществления изобретения, полипептиды ковалентно связаны с образованием гетеродимера посредством по меньшей мере одной, а более предпочтительно, двух внутрицепьевых дисульфидных связей цистеиновых остатков, предпочтительно, локализованных в Fc-области иммуноглобулина каждого полипептида. В некоторых вариантах осуществления изобретения, две внутрицепьевых дисульфидных связи расположены между Cys220 и Cys223 рекомбинантого полипептида ROBO2. В некоторых вариантах осуществления изобретения, гетеродимерный белок содержит два различных рекомбинантных полипептида ROBO2.
[0152] В некоторых вариантах осуществления изобретения, Fc-домен рекомбинантного белка ROBO2 содержит аминокислотные остатки 210-440 в соответствии с нумерацией SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 содержит Fc-домен, который по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен аминокислотным остаткам 210-440 в соответствии с нумерацией SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 содержит Fc-домен, состоящий из аминокислотных остатков 210-440 в соответствии с нумерацией SEQ ID NO: 1.
[0153] В некоторых вариантах осуществления изобретения, внеклеточный домен рекомбинантного белка ROBO2 является смежным с доменом иммуноглобулина. То есть, последний С-концевой аминокислотный остаток внеклеточного домена белка ROBO2 ковалентно связан пептидильной связью с первым N-концевым аминокислотным остатком домена иммуноглобулина. В некоторых вариантах осуществления изобретения, внеклеточный домен рекомбинантного белка ROBO2 связан с доменом иммуноглобулина посредством линкера. В некоторых вариантах осуществления изобретения, линкером является пептидильный линкер. В некоторых вариантах осуществления изобретения, пептидильный линкер содержит приблизительно от 1 до 30 аминокислотных остатков. В некоторых вариантах осуществления изобретения, пептидильный линкер выбран из группы, состоящей из богатого глицином пептида; пептида, содержащего глицин и серин; пептида, имеющего последовательность [Gly-Gly-Ser]n, где n равно 1, 2, 3, 4, 5 или 6 (SEQ ID NO: 22); и пептида, имеющего последовательность[Gly-Gly-GIy-Gly-Ser]n, где n равно 1, 2, 3, 4, 5 или 6 (SEQ ID NO: 23). В некоторых вариантах осуществления изобретения, пептидильным линкером является Gly-Gly-Ser-Gly-Gly-Ser (SEQ ID NO: 15). Богатый глицином пептидный линкер содержит пептидный линкер, где по меньшей мере 25% остатков составляют глицин. Богатые глицином пептидные линкеры хорошо известны специалистам (например, Chichili et al. Protein Sci. 2013 Feb; 22(2): 153-167).
[0154] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит последовательность SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc состоит из последовательности SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична последовательности SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична последовательности SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 96% идентична последовательности SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 97% идентична последовательности SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична последовательности SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 99% идентична последовательности SEQ ID NO: 1.
[0155] В некоторых вариантах осуществления изобретения, в последовательность SEQ ID NO: 1 было введено не более чем 10, не более, чем 9, не более, чем 8, не более, чем 7, не более, чем 6, не более, чем 5, не более, чем 4, не более, чем 3, не более, чем 2 или не более, чем 1 замена. В некоторых вариантах осуществления изобретения, в последовательность SEQ ID NO: 1 было введено не более, чем 5 замен. В некоторых вариантах осуществления изобретения, в последовательность SEQ ID NO: 1 было введено не более, чем 4 замены. В некоторых вариантах осуществления изобретения, в последовательность SEQ ID NO: 1 было введено не более, чем 3 замены. В некоторых вариантах осуществления изобретения, в последовательность SEQ ID NO: 1 было введено не более, чем 2 замены. В некоторых вариантах осуществления изобретения, в последовательность SEQ ID NO: 1 была введена не более, чем 1 замена. В некоторых вариантах осуществления изобретения, замена(ы) не изменяет(ют) KD более, чем в 1000 раз, более, чем в 100 раз или в 10 раз по сравнению с KD белка, содержащего последовательность SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, заменами являются консервативные замены, показанные в Таблице 1.
Таблица 1: Аминокислотные замены
[0156] В некоторых вариантах осуществления изобретения, один или более аминокислотных остатков ROBO2, перечисленных в Таблицах 4-15, не были заменены (например, E6, D7, F8, P9, V200, F201, E202, R203, каждый из которых пронумерован в соответствии с SEQ ID NO: 1). В некоторых вариантах осуществления изобретения, ни один из аминокислотных остатков, перечисленных в Таблицах 4-15 (например, E6, D7, F8, P9, V200, F201, E202, R203, пронумерованные в соответствии с SEQ ID NO: 1), не был заменен. Аминокислотные остатки ROBO2, перечисленные в Таблицах 4-15, представляют собой аминокислотные остатки, которык, очевидно, играют важную роль в сохранении структурной целостности SLIT-связывающего домена, как показало исследование кристаллической структуры (см. Пример 5). Аминокислотные замены в этих положениях могут влиять на связывание со SLIT. В соответствии с этим, может оказаться желательным, чтобы замена не присутствовала в этих положениях. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 содержит часть внеклеточного домена ROBO2, который по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен аминокислотным остаткам 1-203 последовательности, представленной в SEQ ID NO: 1, а также содержит один или более остатков E6, D7, F8, P9, V200, F201, E202 и R203 (пронумерованных в соответствии с SEQ ID NO: 1).
[0157] В некоторых аспектах изобретения, в последовательность SEQ ID NO: 1 могут быть введены одна или более точковых мутаций для повышения аффинности связывания рекомбинантного белка ROBO2 с лигандом SLIT, например, SLIT2. Как показано в Примерах, аффинность связывания с SLIT2 может быть повышена приблизительно в 10 раз путем введения точковых мутаций S17T и R73Y в последовательность SEQ ID NO: 1 (фиг. 11-13). В соответствии с этим, в некоторых своих аспектах, настоящее изобретение относится к рекомбинантному белку ROBO2, имеющему одну или более из следующих мутаций: S17T и R73Y по сравнению с последовательностью SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 содержит последовательность, представленную в SEQ ID NO: 19. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 состоит из последовательности, представленной в SEQ ID NO: 19. В некоторых вариантах осуществления изобретения, ретровирусный белок ROBO2 не содержит С-концевой лизин в аминокислотном остатке 441 в соответствии с нумерацией SEQ ID NO: 19. В некоторых вариантах осуществления изобретения, рекомбинантные белки ROBO2 согласно изобретению имеют KD не более, чем приблизительно 1×10–6 M, например, не более, чем приблизительно 1×10–7 M, не более, чем приблизительно 9×10–8 M, не более, чем приблизительно 8×10–8 M, не более, чем приблизительно 7×10–8 M, не более, чем приблизительно 6×10–8 M, не более, чем приблизительно 5×10–8 M, не более, чем приблизительно 4×10–8 M, не более, чем приблизительно 3×10–8 M, не более, чем приблизительно 2×10–8 M, не более, чем приблизительно 1×10–8 M, не более, чем приблизительно 9×10–9 M, не более, чем приблизительно 8×10–9 M, не более, чем приблизительно 7×10–9 M, не более, чем приблизительно 6×10–9 M, не более, чем приблизительно 5×10–9 M, не более, чем приблизительно 4×10–9 M, не более, чем приблизительно 3×10–9 M, не более, чем приблизительно 2×10–9 M, не более, чем приблизительно 1×10–9 M, не более, чем приблизительно 9×10–10 M, не более, чем приблизительно 8×10–10 M, не более, чем приблизительно 7×10–10 M, не более, чем приблизительно 6×10–10 M, не более, чем приблизительно 5×10–10 M, не более, чем приблизительно 4×10–10 M, не более, чем приблизительно 3×10–10 M, не более, чем приблизительно 2×10–10 M, не более, чем приблизительно 1×10–10 M, не более, чем приблизительно 9×10–11 M, не более, чем приблизительно 8×10–11 M, не более, чем приблизительно 7×10–11 M, не более, чем приблизительно 6×10–11 M, не более, чем приблизительно 5×10–11 M, не более, чем приблизительно 4×10–11 M, не более, чем приблизительно 3×10–11 M, не более, чем приблизительно 2×10–11 M, не более, чем приблизительно 1×10–11 M, не более, чем приблизительно 9×10–12 M, не более, чем приблизительно 8×10–12 M, не более, чем приблизительно 7×10–12 M, не более, чем приблизительно 6×10–12 M, не более, чем приблизительно 5×10–12 M, не более, чем приблизительно 4×10–12 M, не более, чем приблизительно 3×10–12 M, не более, чем приблизительно 2×10–12 M, не более, чем приблизительно 1×10–12 M, не более, чем приблизительно 9×10–13 M, не более, чем приблизительно 8×10–13 M, не более, чем приблизительно 7×10–13 M, не более, чем приблизительно 6×10–13 M, не более, чем приблизительно 5×10–13 M, не более, чем приблизительно 4×10–13 M, не более, чем приблизительно 3×10–13 M, не более, чем приблизительно 2×10–13 M, не более, чем приблизительно 1×10–13 M.
[0158] В некоторых вариантах осуществления изобретения, рекомбинантные белки ROBO2 согласно изобретению имеют KD в пределах приблизительно от 1×10–7 M до приблизительно 1×10–14 M, приблизительно от 9×10–8 M до приблизительно 1×10–14 M, приблизительно от 8×10–8 M до приблизительно 1×10–14 M, приблизительно от 7×10–8 M до приблизительно 1×10–14 M, приблизительно от 6×10–8 M до приблизительно 1×10–14 M, приблизительно от 5×10–8 M до приблизительно 1×10–14 M, приблизительно от 4×10–8 M до приблизительно 1×10–14 M, приблизительно от 3×10–8 M до приблизительно 1×10–14 M, приблизительно от 2×10–8 M до приблизительно 1×10–14 M, приблизительно от 1×10–8 M до приблизительно 1×10–14 M, приблизительно от 9×10–9 M до приблизительно 1×10–14 M, приблизительно от 8×10–9 M до приблизительно 1×10–14 M, приблизительно от 7×10–9 M до приблизительно 1×10–14 M, приблизительно от 6×10–9 M до приблизительно 1×10–14 M, приблизительно от 5×10–9 M до приблизительно 1×10–14 M, приблизительно от 4×10–9 M до приблизительно 1×10–14 M, приблизительно от 3×10–9 M до приблизительно 1×10–14 M, приблизительно от 2×10–9 M до приблизительно 1×10–14 M, приблизительно от 1×10–9 M до приблизительно 1×10–14 M, приблизительно от 1×10–7 M до приблизительно 1×10–13 M, приблизительно от 9×10–8 M до приблизительно 1×10–13 M, приблизительно от 8×10–8 M до приблизительно 1×10–13 M, приблизительно от 7×10–8 M до приблизительно 1×10–13 M, приблизительно от 6×10–8 M до приблизительно 1×10–13 M, приблизительно от 5×10–8 M до приблизительно 1×10–13 M, приблизительно от 4×10–8 M до приблизительно 1×10–13 M, приблизительно от 3×10–8 M до приблизительно 1×10–13 M, приблизительно от 2×10–8 M до приблизительно 1×10–13 M, приблизительно от 1×10–8 M до приблизительно 1×10–13 M, приблизительно от 9×10–9 M до приблизительно 1×10–13 M, приблизительно от 8×10–9 M до приблизительно 1×10–13 M, приблизительно от 7×10–9 M до приблизительно 1×10–13 M, приблизительно от 6×10–9 M до приблизительно 1×10–13 M, приблизительно от 5×10–9 M до приблизительно 1×10–13 M, приблизительно от 4×10–9 M до приблизительно 1×10–13 M, приблизительно от 3×10–9 M до приблизительно 1×10–13 M, приблизительно от 2×10–9 M до приблизительно 1×10–13 M или приблизительно от 1×10–9 M до приблизительно 1×10–13 M.
[0159] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD, равной или составляющей менее, чем: приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 2 нМ, приблизительно 1 нМ, приблизительно 900 пМ, приблизительно 800 пМ, приблизительно 700 пМ, приблизительно 600 пМ, приблизительно 500 пМ, приблизительно 400 пМ, приблизительно 300 пМ, приблизительно 250 пМ, приблизительно 200 пМ, приблизительно 150 пМ, приблизительно 100 пМ, приблизительно 50 пМ, приблизительно 40 пМ, приблизительно 30 пМ, приблизительно 25 пМ, приблизительно 20 пМ, приблизительно 15 пМ, приблизительно 10 пМ, приблизительно 5 пМ или приблизительно 1 пМ. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD приблизительно 600 пМ. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD приблизительно 500 пМ. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD приблизительно 400 пМ. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD приблизительно 300 пМ. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD приблизительно 250 пМ. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 связывается с SLIT2 с KD приблизительно 200 пМ.
[0160] Вообще говоря, рекомбинантный белок ROBO2-Fc должен связываться с лигандом SLIT (например, SLIT2) с высокой аффинностью для эффективного блокирования активности ROBO2. Желательно, чтобы рекомбинантный белок ROBO2-Fc имел аффинности связывания (KD) в низких наномолярных и пикомолярных пределах, например, приблизительно 1×10–8 M или менее.
[0161] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc связывается с SLIT2 с KD, которая по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 6 раз, по меньшей мере приблизительно в 8 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 40 раз, по меньшей мере приблизительно в 60 раз, по меньшей мере приблизительно в 80 раз, по меньшей мере приблизительно в 100 раз, по меньшей мере приблизительно в 120 раз, по меньшей мере приблизительно в 140 раз, по меньшей мере приблизительно в 160 раз ниже, чем величина KD для связывания ROBO1 со SLIT2. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc связывается с SLIT2 с KD, которая по меньшей мере приблизительно в 2 раза, по меньшей мере приблизительно в 4 раза, по меньшей мере приблизительно в 6 раз, по меньшей мере приблизительно в 8 раз, по меньшей мере приблизительно в 10 раз, по меньшей мере приблизительно в 20 раз, по меньшей мере приблизительно в 40 раз, по меньшей мере приблизительно в 60 раз, по меньшей мере приблизительно в 80 раз, по меньшей мере приблизительно в 100 раз, по меньшей мере приблизительно в 120 раз, по меньшей мере приблизительно в 140 раз, по меньшей мере приблизительно в 160 раз ниже, чем величина KD для связывания белка ROBO1-Fc со SLIT2.
Анализы на биологическую активность
[0162] В некоторых вариантах осуществления изобретения, раскрытый здесь рекомбинантный белок ROBO2-Fc снижает по меньшей мере одну биологическую активность передачи сигнала ROBO2-SLIT. Такими активностями являются, но не ограничиваются ими, связывание ROBO2 и лиганда SLIT; связывание внутриклеточных сигнал-передающих молекул (таких как srGAP1 или Nck) с внутриклеточным доменом ROBO2; и/или последующая активность передачи сигнала ROBO2-SLIT, такая как полимеризация актина, адгезия подоцитов и/или SLIT2-N-опосредуемое ингибирование миграции нервных клеток, а также другие активности ROBO2-SLIT, известные специалистам. Снижение активности ROBO2 под действием рекомбинантного белка ROBO2-Fc может быть оценено с помощью ряда анализов, хорошо известных специалистам. Так, например, анализы, известные специалистам, могут быть проведены для того, чтобы определить, может ли рекомбинантный белок ROBO2-Fc: (а) ингибировать связывание SLIT с ROBO2; (b) снижать уровень связывания srGAP1 с ROBO2; (с) снижать уровень связывания Nck с ROBO2; (d) ингибировать ROBO2-зависимую активность SLIT2-N; (e) ингибировать полимеризацию актина; (f) ингибировать адгезию подоцитов; и/или (g) ингибировать SLIT2-N-опосредуемое ингибирование миграции нервных клеток.
[0163] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc ингибирует связывание лиганда SLIT с ROBO2 (например, это может быть оценено в анализе на конкурентное связывание рекомбинантного белка ROBO2-Fc и ROBO2 с SLIT2). Так, например, в этом анализе может быть проведено сравнение (i) связывания ROBO2 и SLIT в присутствии рекомбинантного белка ROBO2-Fc и (ii) связывания ROBO2 и SLIT в отсутствии рекомбинантного белка ROBO2-Fc. Снижение уровня связывания ROBO2 и SLIT может составлять по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99%, в присутствии рекомбинантного белка ROBO2-Fc по сравнению со связыванием ROBO2 и SLIT в отсутствии тестируемого рекомбинантного белка ROBO2-Fc. Ожидаемое связывание SLIT с ROBO2 в отсутствии рекомбинантного белка ROBO2-Fc может быть принято за 100%.
[0164] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc ингибирует связывание SLIT с ROBO2 с полумаксимальной ингибирующей концентрацией (IC50), составляющей не более, чем приблизительно 1×10–7 M, не более, чем приблизительно 1×10–8 M, не более, чем приблизительно 1×10–9 M, не более, чем приблизительно 1×10–10 M, не более, чем приблизительно 1×10–11 M, не более, чем приблизительно 1×10–12 M, не более, чем приблизительно 1×10–13 M, не более, чем приблизительно 1×10–14 M, не более, чем приблизительно 1×10–15 M, приблизительно от 1×10–7 M до приблизительно 5×10–14 M, приблизительно от 1×10–7 M до приблизительно 1×10–14 M, приблизительно от 1×10–7 M до приблизительно 5×10–13 M, приблизительно от 1×10–7 M до приблизительно 1×10–13 M, приблизительно от 1×10–7 M до приблизительно 5×10–12 M или приблизительно от 1×10–7 M до приблизительно 1×10–12 M. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc имеет полумаксимальную ингибирующую концентрацию (IC50), составляющую не более, чем 15 нМ, приблизительно 13 нМ, приблизительно 11 нМ, приблизительно 9 нМ, приблизительно 7 нМ, приблизительно 6 нМ, приблизительно 5 нМ, приблизительно 4 нМ, приблизительно 3 нМ, приблизительно 2 нМ, приблизительно 1 нМ как было измерено с помощью анализа методом гомогенной флуоресценции с временным разрешением (HTRF) на ингибирование связывания ROBO2 с SLIT2. IC50 может быть оценена с использованием фрагмента SLIT или ROBO2, такого как SLIT-N, и домена Ig1 ROBO2 или доменов Ig 1 и 2 ROBO2.
[0165] Ингибирующая активность рекомбинантного белка ROBO2-Fc может быть также оценена путем измерения уровня ROBO2-зависимой активности SLIT-N, такой как полимеризация актина, адгезия подоцитов и/или SLIT2-N-опосредуемое ингибирование миграции нервных клеток. Так, например, в этом анализе может быть проведено сравнение (i) миграции нервных клеток в присутствии ROBO2, SLIT и рекомбинантного белка ROBO2-Fc и (ii) миграции нервных клеток в присутствии ROBO2, SLIT, но в отсутствии рекомбинантного белка ROBO2-Fc. Миграция нервных клеток может увеличиваться по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97%, по меньшей мере приблизительно на 98% или по меньшей мере приблизительно на 99%, в присутствии рекомбинантного белка ROBO2-Fc по сравнению с миграцией нервных клеток в отсутствии рекомбинантного белка ROBO2-Fc. Базовая миграция нервных клеток в отсутствии рекомбинантного белка ROBO2-Fc может быть принята за 0%.
[0166] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc ингибирует ROBO2-зависимую активность SLIT2-N, такую как полимеризация актина, адгезия подоцитов и/или SLIT2-N-опосредуемое ингибирование миграции нервных клеток с полумаксимальной ингибирующей концентрацией (IC50) не более, чем приблизительно 1×10–7 M, не более, чем приблизительно 1×10–8 M, не более, чем приблизительно 1×10–9 M, не более, чем приблизительно 1×10–10 M, не более, чем приблизительно 1×10–11 M, не более, чем приблизительно 1×10–12 M, не более, чем приблизительно 1×10–13 M, не более, чем приблизительно 1×10–14 M, не более, чем приблизительно 1×10–15 M, приблизительно от 1×10–7 M до приблизительно 5×10–14 M, приблизительно от 1×10–7 M до приблизительно 1×10–14 M, приблизительно от 1×10–7 M до приблизительно 5×10–13 M, приблизительно от 1×10–7 M до приблизительно 1×10–13 M, приблизительно от 1×10–7 M до приблизительно 5×10–12 M или приблизительно от 1×10–7 M до приблизительно 1×10–12 M. В некоторых вариантах осуществления изобретения, предпочтительная IC50 составляет приблизительно от 1×10–10 M до приблизительно 1×10–13 M. В некоторых вариантах осуществления изобретения, предпочтительная IC50 составляет приблизительно от 5×10–11 M до приблизительно 5×10–12 M. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2-Fc имеет полумаксимальную ингибирующую концентрацию (IC50) не более, чем приблизительно 75 нМ, приблизительно 65 нМ, приблизительно 55 нМ, приблизительно 45 нМ, приблизительно 35 нМ, приблизительно 25 нМ, приблизительно 15 нМ, приблизительно 5 нМ, как было оценено путем измерения уровня SLIT2-N-опосредуемого ингибирования миграции нервных клеток.
[0167] В некоторых вариантах осуществления изобретения, свойства рекомбинантного белка ROBO2-Fc согласно изобретению также оценивают с помощью других анализов на биологическую активность, например, анализов на его активность, фармакологическую активность и потенциальную эффективность как терапевтического средства. Такие анализы известны специалистам и зависят от цели применения рекомбинантного белка. Примерами являются, например, анализы на токсичность, анализы на иммуногенность, анализы на стабильность, анализы на антитело против лекарственного средства и/или определение ФК/ФД-профиля.
Нуклеиновые кислоты и способы продуцирования рекомбинантных белков ROBO2
[0168] Настоящее изобретение также относится к полинуклеотидам, кодирующим рекомбинантные белки ROBO2 согласно изобретению. Настоящее изобретение также относится к способу получения любых описанных здесь полинуклеотидов. Полинуклеотиды могут быть получены и экспрессированы методами, известными специалистам.
[0169] В одном из своих аспектов, настоящее изобретение относится к полинуклеотидам или композициям, содержащим полинуклеотиды, кодирующие рекомбинантный белок ROBO2, включающий часть внеклеточного домена ROBO2 (ECD), а также домен иммуноглобулина, где внеклеточный домен содержит по меньшей мере два иммуноглобулин-подобных (Ig-подобных) домена и С-концевую последовательность, состоящую из последовательности SEQ ID NO: 12.
[0170] В одном из своих аспектов, настоящее изобретение относится к полинуклеотидам или композициям, содержащим полинуклеотиды, кодирующие рекомбинантный белок ROBO2, включающий аминокислотные остатки 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1, а также домен иммуноглобулина.
[0171] В некоторых своих вариантах, настоящее изобретение относится к полинуклеотидам или композициям, содержащим полинуклеотиды, кодирующие любой из нижеследующих рекомбинантных белков ROBO2: ROBO2-Fc 2.2 (SEQ ID NO: 1), ROBO2-Fc 2.1 (SEQ ID NO: 2), ROBO2-Fc 2.0 (SEQ ID NO: 3), ROBO2-Fc 1.1 (SEQ ID NO: 4), ROBO2-Fc 1.0 (SEQ ID NO: 5), ROBO2-Fc 3.0 (SEQ ID NO: 6), ROBO2-Fc 4.0 (SEQ ID NO: 7) и ROBO2-Fc S17T R73Y (SEQ ID NO: 19). В некоторых своих вариантах, настоящее изобретение относится к полинуклеотидам или композициям, содержащим полинуклеотиды, кодирующие ROBO2-Fc 2.2 (SEQ ID NO: 1). В некоторых своих вариантах, настоящее изобретение относится к полинуклеотидам или композициям, содержащим полинуклеотиды, кодирующие ROBO2-Fc 2.1 (SEQ ID NO: 2). В некоторых своих вариантах, настоящее изобретение относится к полинуклеотидам или композициям, содержащим полинуклеотиды, кодирующие ROBO2-Fc 2.0 (SEQ ID NO: 3).
[0172] Настоящее изобретение также относится к полинуклеотидам или композициям, содержащим эти полинуклеотиды, где полинуклеотид содержит последовательность ДНК-вставки плазмиды, депонированной в ATCC и имеющей регистрационный номер ATCC No. PTA-124008.
[0173] В другом своем аспекте, настоящее изобретение относится к полинуклеотидам и их вариантам, кодирующим рекомбинантный белок ROBO2-Fc, где указанные варианты полинуклеотидов имеют последовательность, которая по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 87%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична последовательности любой нуклеиновой кислоты, раскрытой в настоящей заявке, такой как, но не ограничивающейся ими, нуклеиновая кислота, содержащая нуклеиновую кислоту SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 и 19, и последовательность нуклеиновой кислоты вставки плазмиды, депонированной в ATCC и имеющей регистрационный номер ATCC No. PTA-124008. В некоторых вариантах осуществления изобретения, такие варианты полинуклеотидов имеют последовательность, которая по меньшей мере на 95% идентична последовательности любой раскрытой здесь нуклеиновой кислоты, такой как, но не ограничивающейся ими, нуклеиновая кислота, содержащая нуклеиновую кислоту SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 и 19. В некоторых вариантах осуществления изобретения, такие варианты полинуклеотидов имеют последовательность, которая по меньшей мере на 96% идентична последовательности любой раскрытой здесь нуклеиновой кислоты, такой как, но не ограничивающейся ими, нуклеиновая кислота, содержащая нуклеиновую кислоту SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 и 19. В некоторых вариантах осуществления изобретения, такие варианты полинуклеотидов имеют последовательность, которая по меньшей мере на 97% идентична последовательности любой раскрытой здесь нуклеиновой кислоты, такой как, но не ограничивающейся ими, нуклеиновая кислота, содержащая нуклеиновую кислоту SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 и 19. В некоторых вариантах осуществления изобретения, такие варианты полинуклеотидов имеют последовательность, которая по меньшей мере на 98% идентична последовательности любой раскрытой здесь нуклеиновой кислоты, такой как, но не ограничивающейся ими, нуклеиновая кислота, содержащая нуклеиновую кислоту SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 и 19. В некоторых вариантах осуществления изобретения, такие варианты полинуклеотидов имеют последовательность, которая по меньшей мере на 99% идентична последовательности любой раскрытой здесь нуклеиновой кислоты, такой как, но не ограничивающейся ими, нуклеиновая кислота, содержащая нуклеиновую кислоту SEQ ID NO: 1, 2, 3, 4, 5, 6, 7 и 19.
[0174] В другом своем аспекте, настоящее изобретение включает полинуклеотиды и их варианты, содержащие последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 21. В некоторых вариантах осуществления изобретения, настоящее изобретение включает полинуклеотиды и их варианты, содержащие последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 21, а также последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 18. В некоторых вариантах осуществления изобретения, последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 18, находится у N-конца по отношению к последовательности нуклеиновой кислоты, представленной в SEQ ID NO: 21.
[0175] В одном варианте осуществления изобретения, внеклеточный домен ROBO2 и Fc-домен иммуноглобулина кодируются отдельными полинуклеотидами. Альтернативно, внеклеточный домен ROBO2 и Fc-домен иммуноглобулина кодируются одним полинуклеотидом.
[0176] Полинуклеотиды, комплементарные любым таким последовательностям, входят в объем настоящего изобретения. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными, и могут представлять собой молекулы ДНК (рекомбинантные ДНК, кДНК или синтетические ДНК) или молекулы РНК. Молекулы РНК включают гяРНК, которая содержит интроны и один к одному соответствует молекуле ДНК, и молекулы мРНК, которые не содержат интронов. Дополнительные кодирующие или не-кодирующие последовательности могут присутствовать, но необязательно, в полинуклеотиде согласно изобретению, и полинуклеотид, может быть, но необязательно, присоединен к другим молекулам и/или к материалам-носителям.
[0177] Полинуклеотиды могут содержать нативную последовательность (то есть, последовательность дикого типа) или могут содержать не-нативную последовательность (то есть, вариант). Полинуклеотидные варианты содержат одну или более замен, добавлений, делеций и/или инсерций, которые не снижают способность SLIT связываться с кодируемым полипептидом, как и в нативной молекуле. Влияние на SLIT-связывающую активность кодируемого полипептида может быть, по существу, оценено, как описано в настоящей заявке. В некоторых вариантах осуществления изобретения, варианты по меньшей мере приблизительно на 70%, в некоторых вариантах осуществления изобретения, по меньшей мере приблизительно на 80%, в некоторых вариантах осуществления изобретения, по меньшей мере приблизительно на 90%, а в некоторых вариантах осуществления изобретения, по меньшей мере приблизительно на 95%, идентичны полинуклеотидной последовательности, которая кодирует рекомбинантный белок ROBO2-Fc, содержащий нативные (дикого типа) последовательности ROBO2 и Fc-домена.
[0178] В некоторых вариантах осуществления изобретения, варианты кодируют рекомбинантный белок ROBO2, содержащий аминокислотные остатки, имеющие по меньшей мере 20, по меньшей мере 19, по меньшей мере 18, по меньшей мере 17, по меньшей мере 16, по меньшей мере 15, по меньшей мере 14, по меньшей мере 13, по меньшей мере 12, по меньшей мере 11, по меньшей мере 10, по меньшей мере 9, по меньшей мере 8, по меньшей мере 7, по меньшей мере 6, по меньшей мере 5, по меньшей мере 4, по меньшей мере 3, по меньшей мере 2 или по меньшей мере 1 аминокислотную замену в аминокислотных остатках 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, варианты кодируют рекомбинантный белок ROBO2, содержащий аминокислотные остатки, имеющие по меньшей мере 5 аминокислотных замен в аминокислотных остатках 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, варианты кодируют рекомбинантный белок ROBO2, содержащий аминокислотные остатки, имеющие по меньшей мере 4 аминокислотных замены в аминокислотных остатках 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, варианты кодируют рекомбинантный белок ROBO2, содержащий аминокислотные остатки, имеющие по меньшей мере 3 аминокислотных замены в аминокислотных остатках 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, варианты кодируют рекомбинантный белок ROBO2, содержащий аминокислотные остатки, имеющие по меньшей мере 2 аминокислотных замены в аминокислотных остатках 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1. В некоторых вариантах осуществления изобретения, варианты кодируют рекомбинантный белок ROBO2, содержащий аминокислотные остатки, имеющие по меньшей мере 1 аминокислотную замену в аминокислотных остатках 1-203 в соответствии с нумерацией, представленной в SEQ ID NO: 1. Эти количества не являются ограничивающими, и между указанными процентами могут наблюдаться приращения, которые входят в объем настоящего изобретения как часть его раскрытия.
[0179] Две полинуклеотидных или полипептидных последовательности считаются «идентичными», если последовательности нуклеотидов или аминокислот в двух последовательностях являются одинаковыми при выравнивании на максимальное соответствие, как описано ниже. Сравнение двух последовательностей обычно осуществляют путем сравнения последовательностей по всему окну сравнения для идентификации и сравнения сходства локальных областей последовательностей. Используемый здесь термин «окно сравнения» означает сегмент по меньшей мере из приблизительно 20 смежных положений, а обычно, от 50 до приблизительно 450 или от 100 до приблизительно 300, в которых последовательность можно сравнивать с эталонной последовательностью в том же самом ряду смежных положений после оптимального выравнивания двух последовательностей.
[0180] Оптимальное выравнивание последовательностей для сравнения может быть осуществлено с использованием программы MegAlign® в пакете биоинформационных компьютерных программ Lasergene® (DNASTAR®, Inc., Madison, Wl), с использованием параметров по умолчанию. Эта программа позволяет осуществлять выравнивание по нескольким схемам, описанным в следующих работах: Dayhoff, M.O., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5: 151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:1 1-17; Robinson, E.D., 1971 , Comb. Theor. 1 1 : 105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
[0181] В некоторых вариантах осуществления изобретения, «процент идентичности последовательностей» определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения по меньшей мере в 20 положениях, где часть полинуклеотидной или полипептидой последовательности в окне сравнения может содержать добавления или делеции (то есть, пробелы) в количестве 20 процентов или менее, а обычно от 5 до 15 процентов или от 10 до 12 процентов по сравнению с эталонными последовательностями (которые не содержат добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент вычисляют путем определения числа положений, в которых присутствуют идентичные основания нуклеиновых кислот или аминокислотные остатки в обеих последовательностях с получением числа соответствующих положений с последующим делением соответствующих положений на общее число положений в эталонной последовательности (то есть по размеру окна) и умножением результатов на 100 с получением процента идентичности последовательностей.
[0182] Варианты могут быть также или альтернативно, по существу, гомологичны нативному гену или его части или комплементу. Такие полинуклеотидные варианты способны гибридизоваться в условиях умеренной жесткости с природной последовательностью ДНК, кодирующей рекомбинантный белок ROBO2-Fc, содержащий нативные (дикого типа) последовательности ROBO2 и Fc-домен (или комплементарную последовательность).
[0183] Подходящие «условия умеренной жесткости» включают предварительную промывку в растворе 5× SSC, 0,5% ДСН, 1,0 мМ EDTA (pH 8,0); гибридизацию при 50-65°C, 5× SSC в течение ночи; с последующей двойной промывкой при 65°C в течение 20 минут каждым из 2×, 0,5× и 0,2× SSC, содержащим 0,1% ДСН.
[0184] Используемый здесь термин «в высокой степени жесткие условия» или «условия высокой жесткости» означают условия, при которых используются: (1) низкая ионная сила и высокая температура промывки, например, 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфата натрия при 50°C; (2) денатурирующий агент в процессе гибридизации, такой как формамид, например, 50% (об./об.) формамид с 0,1% альбумина бычьей сыворотки/0,1% фиколла/0,1% поливинилпирролидона/50 мМ фосфатно-нартиевого буфера при pH 6,5 вместе с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°C; или (3) 50% формамид, 5× SSC (0,75 M NaCl, 0,75 M цитрата натрия), 50 мМ фосфата натрия (pH 6,8), 0,1% прирофосфата натрия, 5× раствора Денхардта, обработанная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% ДСН и 10% сульфата декстрана при 42°C с последующей промывкой при 42°C в 0,2× SSC (хлорида натрия/цитрата натрия) и 50% формамида при 55°C и промывкой в условиях высокой жесткости, состоящей из промывки 0,1× SSC, содержащего EDTA при 55°C. Специалист в данной области может самостоятельно скорректировать температуру, ионную силу и т.п. в зависимости от таких факторов, как длина зонда и т.п.
[0185] Для специалиста в данной области очевидно, что в результате вырожденности генетического кода, множество нуклеотидных последовательностей будут кодировать полипептид ROBO2-Fc, содержащий описанную здесь аминокислотную последовательность. Некоторые из этих полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, которые варьируются из-за различий встречаемости кодонов, конкретно рассматриваются в настоящем изобретении. Кроме того, в объем настоящего изобретения входят аллели генов, содержащих описанные здесь полинуклеотидные последовательности. Аллели представляют собой эндогенные гены, которые были модифицированы в результате одной или более мутаций, таких как делеции, добавления и/или замены нуклеотидов. Полученная мРНК и белок могут иметь, но необязательно, измененную структуру или функцию. Аллели могут быть идентифицированы стандартными методами (такими как гибридизация, амплификация и/или сравнение последовательностей в базе данных).
[0186] Настоящее изобретение также включает оптимизированные по кодонам полинуклеотиды, где последовательность нуклеиновой кислоты была оптимизирована для максимизации ее экспрессии в конкретной клетке. Вообще говоря, оптимизация кодонов означает способ модификации последовательности нуклеиновой кислоты для повышения уровня экспрессии в представляющих интерес клетках-хозяевах путем замены по меньшей мере одного кодона (например, приблизительно или приблизительно более, чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 50 или более кодонов) нативной последовательности кодонами, которые чаще встречаются или очень часто встречаются в генах этой клетки-хозяина и сохраняют нативную аминокислотную последовательность. У различных видов наблюдается конкретное смещение некоторых кодонов конкретной аминокислоты. Смещение кодонов (различия во встречаемости кодонов у различных организмов) часто коррелируют с эффективностью трансляции матричной РНК (мРНК), что, в свою очередь, вероятно, зависит от свойств, транслируемых кодонов и доступности конкретных молекул транспортной РНК (тРНК), а также от других факторов. Преобладание выбранных тРНК в клетке, вероятно, обусловлено наиболее часто встречающимися кодонами, используемыми в пептидном синтезе. В соответствии с этим, гены могут быть специально сконструированы для их оптимальной экспрессии в данном организме на основе оптимизации кодонов. Таблицы встречаемости кодонов являются легко доступными, и эти таблицы могут быть адаптированы для ряда способов (например, Nakamura, Y., et al. «Codon usage tabulated from the international DNA sequence databases: status for the year 2000» Nucl. Acids Res. 28:292 (2000)). Компьютерные алгоритмы для оптимизации кодонов конкретной последовательности для ее экспрессии в конкретной клетке-хозяине также являются доступными, например, также существует программа Gene Forge (Aptagen; Jacobus, Pa.). В некоторых вариантах осуществления изобретения, один или более кодонов (например, 1, 2, 3, 4, 5, 10, 15, 20, 25, 50 или более, или все кодоны) в последовательности, кодирующей рекомбинантный белок ROBO2-Fc, соответствуют кодонам, наиболее часто встречающимся для конкретной аминокислоты.
[0187] Таким образом, в одном аспекте изобретения, модифицированная последовательность нуклеиновой кислоты обеспечивает детектируемо более высокий уровень экспрессии рекомбинантного белка ROBO2 в клетке по сравнению с экспрессией рекомбинантного белка ROBO2 из последовательности нуклеиновой кислоты дикого типа, например, нуклеиновой кислоты, кодирующей ROBO2-Fc 2.2 (SEQ ID NO: 21) в другой идентичной клетке. Эта нуклеиновая кислота может называться здесь нуклеиновой кислотой «с оптимизированной экспрессией» или «с повышенной экспрессией» или просто «модифицированной нуклеиновой кислотой».
[0188] Термины «оптимизированный» или «оптимизированный по кодонам» являются синонимами и относятся к кодирующей последовательности, которая была оптимизирована по сравнению с кодирующей последовательностью дикого типа (например, последовательностью, кодирующей человеческий ROBO2 и/или человеческий Fc-домен), для повышения уровня экспрессии кодирующей последовательности, например, путем минимизации присутствия редко встречающихся кодонов, снижения числа CpG-динуклеотидов, удаления скрытых донорных или акцепторных сайтов сплайсинга, удаления последовательностей Козака, удаления сайтов связывания с рибосомой и т.п.
[0189] Примерами модификаций являются элиминация одного или более цис-действующих мотивов и введение одной или более последовательностей Козака. В одном варианте осуществления изобретения удаляют один или более цис-действующих мотивов и вводят одну или более последовательностей Козака.
[0190] Примерами цис-действующих мотивов, которые могут быть удалены, являются внутренние TATA-боксы; chi-сайты; сайты связывания с рибосомой; элементы последовательности ARE, INS, и/или CRS; повторяющиеся последовательности и/или вторичные структуры РНК; (скрытые) донорные и/или акцепторные сайты сплайсинга; точки ветвления; и Sall.
[0191] В одном варианте осуществления изобретения, содержание GC (например, числа нуклеотидов G и C, присутствующих в последовательности нуклеиновой кислоты) было увеличено по сравнению с последовательностью гена ROBO2 дикого типа и/или человеческого Fc-домена IgG1 в новых белках ROBO2 согласно изобретению. Содержание GC, предпочтительно, по меньшей мере на 5%, более предпочтительно, по меньшей мере на 6%, еще более предпочтительно, по меньшей мере на 7%, еще более предпочтительно, по меньшей мере на 8%, еще более предпочтительно, по меньшей мере на 9%, еще более предпочтительно, по меньшей мере на 10%, еще более предпочтительно, по меньшей мере на 12%, еще более предпочтительно, по меньшей мере на 14%, еще более предпочтительно, по меньшей мере на 15%, еще более предпочтительно, по меньшей мере на 17%, еще более предпочтительно, по меньшей мере на 20%, еще более предпочтительно, по меньшей мере на 30%, еще более предпочтительно, по меньшей мере на 40%, еще более предпочтительно, по меньшей мере на 50%, еще более предпочтительно, по меньшей мере на 60%, а наиболее предпочтительно, по меньшей мере на 70% превышает содержание GC в гене дикого типа (например, SEQ ID NO: 21).
[0192] В другом варианте осуществления изобретения, содержание GC выражено как процент нуклеотидов G (гуанина) и С (цитозина) в последовательности. То есть, содержание GC в нуклеиновой кислоте дикого типа, кодирующей ROBO2-Fc 2.2 (SEQ ID NO: 21), ниже, чем содержание GC в оптимизированной по кодонам последовательности нуклеиновой кислоты, кодирующей ROBO2-Fc 2.2.
[0193] В одном варианте осуществления изобретения, содержание GC в модифицированной нуклеиновой кислоте согласно изобретению превышает содержание GC в нуклеиновой кислоте дикого типа, кодирующей ROBO2-Fc 2.2 и содержащей последовательность нуклеиновой кислоты SEQ ID NO: 21. Специалистам в данной области известно, что благодаря вырожденности кода нуклеиновой кислоты независимо от последовательности нуклеиновой кислоты, кодирующей белок, аминокислотная последовательность ROBO2-Fc 2.2 экспрессируется, предпочтительно, как аминокислотная последовательность SEQ ID NO: 1.
[0194] Известно, что метилирование CpG-динуклеотидов играет важную роль в регуляции экспрессии генов в эукариотах. В частности, метилирование CpG-динуклеотидов в эукариотах, в основном, служит для сайленсинга экспрессии генов посредством влияния на механизм транскрипции. Таким образом, поскольку сайленсинг генов вызывается метилированием мотивов CpG, то нуклеиновые кислоты и векторы согласно изобретению, имеющие пониженное число CpG-динуклеотидов, будут обеспечивать высокий и длительный уровень экспрессии трансгенов.
[0195] Потенциальные локальные области CpG могут быть идентифицированы с использованием общедоступной компьютерной программы, имеющейся, например, на сайте http://www.bioinformatics.org/sms2/cpg_islands.html. Программа для локальных областей CpG позволяет идентифицировать потенциальные локальные области CpG методом, описанным Gardiner-Garden and Frommer, 1987, J. Mol. Biol. 196(2):261-282, а также многими другими методами, хорошо известными специалистам в области идентификации потенциальных локальных областей CpG. Вычисление может быть осуществлено с использованием окна из 200 пар оснований (п.о.), двигающегося через всю последовательность с интервалами в 1 п.о. Локальные области CpG определены как интервалы последовательностей, где величина Obs/Exp превышает 0,6, а содержание GC превышает 50%. Ожидаемое число димеров CpG в окне может быть вычислено как число «С» в окне, умноженное на число «G» в окне и деленное на длину окна. Таким образом, потенциальные локальные области CpG, присутствующие в последовательности нуклеиновой кислоты, могут быть легко определены путем введения требуемой последовательности в данное окно, созданное с помощью компьютерной программы (осуществляемой по инструкциям для «встраивания исходной последовательности или одной или более последовательностей FASTA в текстовую область, указанную ниже. Предел ввода составляет 100000 знаков»). Локальные области CpG часто встречаются в 5'-областях генов позвоночных, а поэтому такая программа может быть использована для идентификации потенциальных генов в геномных последовательностях.
[0196] Полинуклеотиды согласно изобретению могут быть получены посредством химического синтеза, рекомбинантными методами или с помощью ПЦР. Методы химического синтеза полинуклеотидов хорошо известны специалистам, а поэтому подробно не описаны в настоящей заявке. Специалист в данной области может использовать описанные здесь последовательности и коммерчески доступный синтезатор ДНК для получения нужной последовательности ДНК.
[0197] Для получения полинуклеотидов рекомбинантными методами, полинуклеотид, содержащий нужную последовательность, может быть встроен в подходящий вектор, и этот вектор может быть, в свою очередь, введен в подходящую клетку-хозяина для репликации и амплификации, как подробно обсуждается в настоящей заявке. Полинуклеотиды могут быть встроены в клетки-хозяева любыми методами, известными специалистам. Клетки трансформируют путем введения эндогенного полинуклеотида посредством прямого поглощения, эндоцитоза, трансфекции, F-скрещивания или электропорации. После введения, экзогенный полинуклеотид может сохраняться в клетке как неинтегрированный вектор (такой как плазмида) или вектор, интегрированный в геном клетки-хозяина. Амплифицированный таким образом полинуклеотид может быть выделен из клетки-хозяина методами, хорошо известными специалистам. См., например, Sambrook et al., 1989.
[0198] Альтернативно, ПЦР позволяет репродуцировать последовательности ДНК. ПЦР-технология хорошо известна специалистам и описана в патентах США NN 4683195, 4800159, 4754065 и 4683202, а также в публикации PCR: The Polymerase Chain Reaction, Mullis et al., eds., Birkauswer Press, Boston, 1994.
[0199] РНК может быть получена с использованием выделенной ДНК в соответствующем векторе и ее встраивания в подходящую клетку-хозяина. Если клетка реплицируется, а ДНК транскрибируется в РНК, то РНК может быть затем выделена методами, хорошо известными специалистам, см., например, Sambrook et al., 1989.
[0200] Подходящие клонирующие векторы могут быть сконструированы стандартными методами, либо они могут быть отобраны из большого числа клонирующих векторов, доступных специалистам. Хотя отобранный клонирующий вектор может варьироваться в зависимости от используемой клетки-хозяина, однако, подходящими клонирующими векторами являются векторы, которые, по существу, будут способны к саморепликации, могут иметь одну мишень для конкретной рестриктирующей эндонуклеазы и/или могут иметь гены маркера, которые могут быть использованы для отбора клонов, содержащих вектор. Подходящими примерами являются плазмиды и бактериальные вирусы, например, pUC18, pUC19, Bluescript (например, pBS SK+) и их производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и pAT28. Эти и многие другие клонирующие векторы поставляются коммерческими поставщиками, такими как BioRad, Strategene и Invitrogen.
[0201] Настоящее изобретение также относится к экспрессионным векторам. Экспрессионные векторы обычно представляют собой реплицируемые полинуклеотидные конструкции, содержащие полинуклеотид согласно изобретению. При этом предусматривается, что экспрессионный вектор должен реплицироваться в клетках-хозяевах либо в виде эписом, либо в виде интегрированной части хромосомной ДНК. Подходящими экспрессионными векторами являются, но не ограничиваются ими, плазмиды, вирусные векторы, включая аденовирусы, аденоассоциированные вирусы, ретровирусы, космиды и экспрессионный(е) вектор(ы), раскрытый(е) в публикации РСТ WO 87/04462. Компонентами векторов могут быть, по существу, но не ограничиваются ими, один или более из нижеследующих компонентов: сигнальная последовательность; ориджин репликации; один или более маркерных генов; подходящие элементы регуляции транскрипции (такие как промоторы, энхансеры и терминатор). Для экспрессии (то есть, трансляции) также обычно необходимы один или более элементов регуляции трансляции, таких как сайты связывания с рибосомой, сайты инициации трансляции и стоп-кодоны.
[0202] В некоторых вариантах осуществления изобретения, вектор содержит молекулу нуклеиновой кислоты, представленную в SEQ ID NO: 21. В некоторых вариантах осуществления изобретения, вектор содержит молекулу нуклеиновой кислоты, представленную в SEQ ID NO: 21, и последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 18. В некоторых вариантах осуществления изобретения, последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность, представленную в SEQ ID NO: 17 или SEQ ID NO: 18, находится у N-конца по отношению к последовательности нуклеиновой кислоты, представленной в SEQ ID NO: 21.
[0203] Векторы, содержащие представляющие интерес полинуклеотиды, и/или сами полинуклеотиды могут быть введены в клетку-хозяина любыми различными подходящими методами, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микрочастицами; липофекцию и инфицирование (например, где вектором являются инфекционный агент, такой как вирус осповакцины). Выбор способа введения векторов или полинуклеотидов часто зависит от свойств клетки-хозяина.
[0204] Примерами клеток-хозяев являются клетки E. coli, дрожжевые клетки, клетки насекомых, обезьяньи клетки COS, клетки яичника китайского хомячка (CHO) или миеломные клетки. Предпочтительными клетками-хозяевами являются клетки CHO, клетки почек человеческого эмбриона (HEK) 293 или клетки Sp2.0, а также множество других клеток, хорошо известных специалистам.
[0205] Клетки-хозяева могут быть культивированы в условиях, способствующих экспрессии кодируемого рекомбинантного белка ROBO2. В некоторых вариантах осуществления изобретения, кодируемый рекомбинантный белок ROBO2-Fc содержит лидерную последовательность ROBO2, представленную в SEQ ID NO: 17, или лидерную последовательность Ig, представленную в SEQ ID NO: 18. В некоторых вариантах осуществления изобретения, лидерная последовательность ROBO2 (SEQ ID NO: 17) расщепляется в процессе продуцирования белка с образованием зрелого ROBO2-Fc. В некоторых вариантах осуществления изобретения, лидерная последовательность Ig (SEQ ID NO: 18) расщепляется в процессе продуцирования белка с образованием зрелого ROBO2-Fc, например, ROBO2-Fc 2.2.
4. Композиции и их применение
[0206] Рекомбинантные белки ROBO2 согласно изобретению могут быть получены в виде фармацевтической композиции. Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель, наполнитель и/или стабилизатор (Remington: The Science and practice of Pharmacy 20th Ed., 2000, Lippincott Williams and Wilkins, Ed. K. E. Hoover) в виде лиофилизованного препарата или водного раствора. Используемые здесь термины «фармацевтически приемлемый носитель» или «фармацевтически приемлемый наполнитель» включают любое вещество, которое в комбинации с активным ингредиентом, позволяет этому ингредиенту сохранять биологическую активность и неспособность реагировать с иммунной системой индивидуума. Примерами являются, но не ограничиваются ими, любые стандартные фармацевтические носители, такие как забуференный фосфатом физиологический раствор, вода, эмульсии, такие как эмульсия типа «масло в воде» и смачивающие агенты различных типов. Предпочтительными разбавителями для введения в виде аэрозоля или для парентерального введения являются забуференный фосфатом физиологический раствор (PBS) или нормальный (0,9%) физиологический раствор. Композиции, содержащие такие носители, получают хорошо известными стандартными методами (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; and Remington, The Science and Practice of Pharmacy, 20th Ed., Mack Publishing, 2000).
[0207] Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях, и могут содержать буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее, чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, манноз или декстраны; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ). Фармацевтически приемлемые наполнители дополнительно описаны в настоящей заявке.
Применение в диагностике
[0208] Рекомбинантные белки ROBO2 согласно изобретению могут быть использованы в различных терапевтических или диагностических целях. Так, например, рекомбинантные белки ROBO2 согласно изобретению могут быть использованы в качестве агента для аффинной очистки (например, для очистки in vitro лигандов SLIT, таких как SLIT2) и в качестве диагностического агента (например, для детектирования экспрессии лиганда SLIT (например, SLIT2 в конкретных клетках, тканях или в сыворотке)). Репрезентативные диагностические анализы на лиганд SLIT, такой как SLIT2, могут включать, например, контактирование образца, взятого у пациента, с рекомбинантным белком ROBO2 согласно изобретению, где рекомбинантный белок ROBO2 метят детектируемой меткой или репортерной молекулой.
[0209] Настоящее изобретение охватывает применение раскрытых здесь рекомбинантных белков ROBO2 в методах диагностической визуализации лиганда SLIT, такого как SLIT2, в образце, в клетке, в ткани или у пациента. Так, например, рекомбинантный белок ROBO2 может быть конъюгирован с визуализирующим агентом так, чтобы можно быть детектировать присутствие рекомбинантного белка ROBO2, а затем детектировать присутствие лиганда SLIT, такого как SLIT2.
Терапевтическое применение
[0210] Репрезентативным терапевтическим применением рекомбинантных белков ROBO2 согласно изобретению является лечение болезни почек, такой как гломерулит, фокальный сегментарный гломерулит (ФСГ). Рекомбинантные белки ROBO2 согласно изобретению могут быть также использованы для профилактики (например, для введения индивидууму, у которого отсутствует симптом заболевания, но который является восприимчивым к развитию болезни почек, такой как гломерулит, ФСГ).
[0211] В другом своем аспекте, настоящее изобретение включает лечение любого расстройства, заболевания или состояния, опосредуемого повышенным уровнем или ассоциированного с повышенным уровнем белка в моче по сравнению с уровнем белка в моче в отсутствии такого заболевания, расстройства или состояния. Такими заболеваниями, расстройствами или состояниями являются, но не ограничиваются ими, волчаночный нефрит, IgA-нефропатия, мембранозная нефропатия (МН), минимальная болезнь замещения (МБЗ), фиброз (например, фиброз печени), неалкогольный стеатогепатит (НАСГ), протеинурия, альбуминурия, гломерулонефрит, диабетическая нефропатия, нефротический синдром, фокальный гломерулосклероз, острая почечная недостаточность, острый тубулоинтерстициальный нефрит, пиелонефрит, отторжение трансплантата почек и рефлюкс-нефропатия.
[0212] Для терапевтического применения, рекомбинантные белки ROBO2 согласно изобретению могут быть введены млекопитающему, а в частности, человеку стандартными методами, например, внутривенно (в виде ударной дозы или путем непрерывного вливания в течение определенного периода времени), внутримышечно, внутрибрюшинно, в цереброспинальную жидкость, подкожно, внутрисуставно, в синовиальную жидкость, интретекально, перорально, местно или путем ингаляции. Рекомбинантные белки ROBO2 согласно изобретению могут быть также соответствующим образом введены вовнутрь опухоли, в околоопухолевые участки, в область поражения или вокруг этой области.
[0213] В соответствии с этим, в одном из своих аспектов, настоящее изобретение относится к способу снижения активности ROBO2, включающему введение индивидууму (например, человеку), нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 согласно изобретению.
[0214] В другом своем аспекте, настоящее изобретение относится к способу сохранения или модуляции функции подоцитов, включающему введение индивидууму (например, человеку), нуждающемуся в этом, терапевтически эффективного количества рекомбинантного белка ROBO2 согласно изобретению.
[0215] В некоторых вариантах осуществления изобретения, индивидуум страдает болезнью почек или является восприимчивым к болезни почек. В некоторых вариантах осуществления изобретения, болезнью почек является гломерулит. В некоторых вариантах осуществления изобретения, болезнью почек является ФСГС.
[0216] В некоторых вариантах осуществления изобретения, индивидуум страдает нефропатией или является восприимчивым к нефропатии.
[0217] В другом своем аспекте, настоящее изобретение относится к рекомбинантному белку ROBO2 согласно изобретению для его применения в раскрытом здесь способе лечения. Так, например, настоящее изобретение относится к рекомбинантному белку ROBO2 согласно изобретению для его применения в целях снижения активности ROBO2 в клетке, снижения активности ROBO2 у индивидуума, сохранения функции подоцитов у индивидуума, модуляции функции подоцитов у индивидуума, лечения гломерулита у индивидуума и лечения нефропатии у индивидуума.
[0218] В другом своем аспекте, настоящее изобретение относится к применению рекомбинантного белка ROBO2 согласно изобретению в целях приготовления лекарственного препарата для снижения активности ROBO2 в клетке, снижения активности ROBO2 у индивидуума, сохранения функции подоцитов у индивидуума, модуляции функции подоцитов у индивидуума, лечения гломерулита у индивидуума и лечения нефропатии у индивидуума.
Дозы и введение
[0219] В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 согласно изобретению вводят подкожно. В некоторых вариантах осуществления изобретения, рекомбинантный белок ROBO2 согласно изобретению вводят внутривенно.
[0220] Фармацевтические композиции могут быть введены индивидууму, нуждающемуся в этом, с частотой, которая может варьироваться в зависимости от тяжести болезни почек. В случае профилактической терапии, такая частота может варьироваться в зависимости от восприимчивости или предрасположенности индивидуума к болезни почек. В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят в однократной дозе, подкожно или внутривенно. В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят в виде дробных доз подкожно или внутривенно.
[0221] Композиции могут быть введены пациентам, нуждающимся в этом, в виде ударной дозы или путем непрерывного вливания. Так, например, введение рекомбинантного белка ROBO2 в ударной дозе может быть осуществлено в количестве от 0,0025 до 200 мг/кг массы тела, от 0,025 до 0,25 мг/кг, от 0,010 до 0,10 мг/кг или 0,10-0,50 мг/кг. Для непрерывного вливания, рекомбинантный белок ROBO2 может быть введен в дозе от 0,001 до 200 мг/кг массы тела/минуту, от 0,0125 до 1,25 мг/кг/минуту, от 0,010 до 0,75 мг/кг/минуту, от 0,010 до 1,0 мг/кг/минуту или 0,10-0,50 мг/кг/ минуту в течение 1-24 часов, 1-12 часов, 2-12 часов, 6-12 часов, 2-8 часов или 1-2 часов.
[0222] Для введения рекомбинантных белков ROBO2, дозы могут быть введены в количестве приблизительно от 1 мг/кг до приблизительно 10 мг/кг, приблизительно от 2 мг/кг до приблизительно 10 мг/кг, приблизительно от 3 мг/кг до приблизительно 10 мг/кг, приблизительно от 4 мг/кг до приблизительно 10 мг/кг, приблизительно от 5 мг/кг до приблизительно 10 мг/кг, приблизительно от 1 мг/кг до приблизительно 20 мг/кг, приблизительно от 2 мг/кг до приблизительно 20 мг/кг, приблизительно от 3 мг/кг до приблизительно 20 мг/кг, приблизительно от 4 мг/кг до приблизительно 20 мг/кг, приблизительно от 5 мг/кг до приблизительно 20 мг/кг, приблизительно 1 мг/кг или более, приблизительно 2 мг/кг или более, приблизительно 3 мг/кг или более, приблизительно 4 мг/кг или более, приблизительно 5 мг/кг или более, приблизительно 6 мг/кг или более, приблизительно 7 мг/кг или более, приблизительно 8 мг/кг или более, приблизительно 9 мг/кг или более, приблизительно 10 мг/кг или более, приблизительно 11 мг/кг или более, приблизительно 12 мг/кг или более, приблизительно 13 мг/кг или более, приблизительно 14 мг/кг или более, приблизительно 15 мг/кг или более, приблизительно 16 мг/кг или более, приблизительно 17 мг/кг или более, приблизительно 19 мг/кг или более, или приблизительно 20 мг/кг или более. Частота введения зависит от тяжести состояния. Введение может быть осуществлено с частотой от 3 раз в неделю до 1 раза в две или три недели.
[0223] Кроме того, композиции могут быть введены пациентам, путем подкожной инъекции. Так, например, доза от 1 до 200 мг рекомбинантного белка ROBO2 может быть введена пациентам путем подкожной или внутривенной инъекции два раза в неделю, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в десять недель, два раза в месяц, один раз в месяц, один раз в два месяца или один раз в три месяца.
[0224] В некоторых вариантах осуществления изобретения, время полужизни рекомбинантного белка ROBO2 у человека составляет приблизительно 24 часа, приблизительно 2 дня, приблизительно 4 дня, приблизительно 5 дней, приблизительно 6 дней, приблизительно 7 дней, приблизительно 8 дней, приблизительно 9 дней, приблизительно 10 дней, приблизительно 11 дней, приблизительно 12 дней, приблизительно 13 дней, приблизительно 14 дней, приблизительно 15 дней, приблизительно 16 дней, приблизительно 17 дней, приблизительно 18 дней, приблизительно 19 дней, приблизительно 20 дней, приблизительно 21 день, приблизительно 22 дня, приблизительно 23 дня, приблизительно 24 дня, приблизительно 25 дней, приблизительно 26 дней, приблизительно 27 дней, 28 дней, приблизительно 29 дней, приблизительно 30 дней, приблизительно от 5 дней до приблизительно 40 дней, приблизительно от 5 дней до приблизительно 35 дней, приблизительно от 5 дней до приблизительно 30 дней, приблизительно от 5 дней до приблизительно 25 дней, приблизительно от 10 дней до приблизительно 40 дней, приблизительно от 10 дней до приблизительно 35 дней, приблизительно от 10 дней до приблизительно 30 дней, приблизительно от 10 дней до приблизительно 25 дней, приблизительно от 15 дней до приблизительно 40 дней, приблизительно от 15 дней до приблизительно 35 дней, приблизительно от 15 дней до приблизительно 30 дней, или приблизительно от 15 дней до приблизительно 25 дней.
[0225] В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят подкожно или внутривенно через каждые 2-6 недель в дозе приблизительно от 0,1 мг/кг до приблизительно 10 мг/кг, приблизительно от 0,5 мг/кг до приблизительно 10 мг/кг, приблизительно от 1 мг/кг до приблизительно 10 мг/кг, приблизительно от 1,5 мг/кг до приблизительно 10 мг/кг, приблизительно от 2 мг/кг до приблизительно 10 мг/кг, приблизительно от 0,1 мг/кг до приблизительно 8 мг/кг, приблизительно от 0,5 мг/кг до приблизительно 8 мг/кг, приблизительно от 1 мг/кг до приблизительно 8 мг/кг, приблизительно от 1,5 мг/кг до приблизительно 8 мг/кг, приблизительно от 2 мг/кг до приблизительно 8 мг/кг, приблизительно от 0,1 мг/кг до приблизительно 5 мг/кг, приблизительно от 0,5 мг/кг до приблизительно 5 мг/кг, приблизительно от 1 мг/кг до приблизительно 5 мг/кг, приблизительно от 1,5 мг/кг до приблизительно 5 мг/кг, приблизительно от 2 мг/кг до приблизительно 5 мг/кг, приблизительно 0,5 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,5 мг/кг, приблизительно 2,0 мг/кг, приблизительно 2,5 мг/кг, приблизительно 3,0 мг/кг, приблизительно 3,5 мг/кг, приблизительно 4,0 мг/кг, приблизительно 4,5 мг/кг, приблизительно 5,0 мг/кг, приблизительно 5,5 мг/кг, приблизительно 6,0 мг/кг, приблизительно 6,5 мг/кг, приблизительно 7,0 мг/кг, 7,5 мг/кг, приблизительно 8,0 мг/кг, приблизительно 8,5 мг/кг, приблизительно 9,0 мг/кг, приблизительно 9,5 мг/кг, или приблизительно 10,0 мг/кг.
[0226] В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят подкожно или внутривенно через каждые 2-6 недель в дозе приблизительно 3,0 мг/кг. В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят подкожно или внутривенно через каждые 2-6 недель в дозе приблизительно от 2,0 мг/кг до приблизительно 10,0 мг/кг.
[0227] В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят подкожно или внутривенно еженедельно или через каждые 2 недели в дозе приблизительно 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 225 мг, 250 мг, 275 мг или 300 мг.
[0228] В одном репрезентативом варианте осуществления изобретения, фармацевтическую композицию вводят подкожно еженедельно или через каждые 2 недели. В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят подкожно раз в неделю в дозе приблизительно 2 мг/кг. В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят подкожно раз в неделю в дозе приблизительно 150 мг.
[0229] В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят внутривенно или подкожно через каждые 2-6 недель в дозе приблизительно 10,0 мг/кг. В некоторых вариантах осуществления изобретения, фармацевтическую композицию вводят внутривенно или подкожно через каждые 2-6 недель в дозе приблизительно от 1,0 мг/кг до приблизительно 10,0 мг/кг.
[0230] В одном репрезентативном варианте осуществления изобретения, фармацевтическую композицию вводят внутривенно каждый месяц.
[0231] Рекомбинантный белок ROBO2 согласно изобретению может быть использован в качестве монотерапии или в комбинации с другими видами терапии для лечения, например, болезни почек. Другие терапии для лечения болезни почек хорошо известны специалистам в данной области и не перечислены в настоящем описании.
5. Наборы
[0232] Настоящее изобретение также относится к наборам или к промышленному изделию, содержащим рекомбинантный белок ROBO2 согласно изобретению и к инструкциям по их применению. В соответствии с этим, в некотороых своих вариантах, настоящее изобретение относится к набору или к промышленному изделию, содержащим контейнер, к композиции, присутствующей в контейнере и содержащей рекомбинантный белок ROBO2, а также к вкладышу в упаковку, содержащему инструкции по введению терапевтически эффективного количества рекомбинантного белка ROBO2 для лечения пациента, нуждающегося в этом.
[0233] В некоторых вариантах осуществления изобретения, набор может содержать первый контейнер, имеющий осушенный белок, и второй контейнер, имеющий водный препарат. В некоторых вариантах осуществления изобретения включены наборы, содержащие однокамерные и многокамерные предварительно заполненные шприцы (например, шприцы для жидкостей и шприцы для лиофилизованного препарата).
[0234] Инструкции по использованию рекомбинантных белков ROBO2 согласно изобретению обычно включают информацию о дозах, схеме введения доз и о способе проведения соответствующего лечения. Контейнеры могут представлять собой унифицированные дозы, нерасфасованные упаковки (например, упаковки для дробных доз) или субунифицированные дозы. Инструкции, прилагаемые к наборам согласно изобретению, обычно представляют собой текстовые инструкции на этикетке или во вкладыше в упаковке (например, в виде бумажного информационного листка, включенного в набор), но могут также использоваться инструкции в электронном виде (например, инструкции на магнитном или оптическом диске для хранения информации).
[0235] Наборы согласно изобретению находятся в соответствующей упаковке. Подходящими упаковками являются, но не ограничиваются ими, флаконы, бутыли, кувшины, эластичные упаковки (например, герметичные пакеты Милара или пластиковые пакеты) и т.п. Также рассматриваются упаковки для их использования в комбинации с конкретным устройством, таким как ингалятор, устройство для интраназального введения (например, аэрозольный распылитель) или устройство для вливания, такое как мининасос. Набор может иметь стерильное отверстие для доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон, имеющий крышку, протыкаемую иглой для подкожных инъекций). Контейнер может также иметь стерильное отверстие для доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон, имеющий крышку, протыкаемую иглой для подкожных инъекций). Контейнер может также содержать второй фармацевтически активный агент.
[0236] Наборы могут содержать, но необязательно, дополнительные компоненты, такие как буферы и поясняющую информацию. Обычно, набор содержит контейнер и этикетку, наклеенную на контейнер, или вкладыш(и), вложенный(е) в контейнер.
6. Биологический депозит
[0237] Репрезентативные материалы согласно изобретению были депонированы в Американской коллекции типовых культур, 10801, University Boulevard, Manassas, Va. 201 10-2209, USA, 23 февраля, 2017. Вектор ROBO2-Fc 2.2 под регистрационным ATCC No. PTA-124008 содержит ДНК-вставку, кодирующую SEQ ID NO: 1. Депозиты были созданы в соответствии с Будапештским договором о Международном предоставлении депозита микроорганизмов в рамках проведения патентной процедуры и соответствующих норм (Будапештский договор). Это гарантирует сохранение жизнеспособной депозитарной культуры в течение 30 лет со дня создания депозита. Депозит может быть доступен под номером ATCC в рамках Будапештского договора и Соглашения между Pfizer Inc. и АТСС, которые гарантируют постоянную и неограниченную выдачу потомства депозитарной культуры конкретному лицу после соответствующего запроса владельца патента США или после открытого доступа владельцу любой патентной заявки США или иностранного патента, независимо от очередности запроса, и гарантируют доступность потомства лицу по решению Комиссии по патентам и торговым знакам США в соответствии со статьей 35 раздела 122 Кодекса законов США и в соответствии с правилами, утвержденными Комиссией (включая статью 37 раздела 1.14 Кодекса законов США с конкретной ссылкой на 886 OG 638).
[0238] Pfizer Inc., то есть, заявитель настоящего изобретения, дал свое согласие на то, что если культура материалов на депозите погибнет или потеряется или разрушится при культивировании в определенных условиях, то такие материалы будут незамедлительно заменены другими аналогичными материалами, о чем будет дано соответствующее уведомление. Доступность депонированного материала не должна рассматриваться как лицензия на практическое осуществление изобретения, поскольку в противном случае, это будет нарушением прав любого Правительственного органа, выдавшего грант в соответствии с патентным законодательством.
Примеры
[0239] В настоящей заявке описаны репрезентативные методы и материалы, хотя для практического осуществления настоящего изобретения или для проведения тестов согласно изобретению могут быть также применены методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалам. Такие материалы, методы и примеры приводятся лишь в иллюстративных целях и не рассматриваются как ограничение объема изобретения.
Пример 1. Получение ROBO2-Fc 2.2
Отбор ROBO2-Fc 2.2 посредством конструирования множества гибридных белков ROBO2-Fc
[0240] Для отбора оптимального лиганда-ловушки ROBO2-Fc было получено множество белков, состоящих из внеклеточного домена ROBO2 с различными длинами, присоединенного к Fc-домену IgG1 посредством линкера глицин-серин (GS). Исследования показали, что для рецепторов ROBO1 и ROBO2, их домен Ig1 является достаточным для связывания с богатым лейцином повторяющимся доменом D2 (LRR) лигандов SLIT. ROBO2 содержит 5 доменов Ig (Ig 1-5). Критерии отбора сначала были применены для получения гибридного белка ROBO2-Fc с минимальной последовательностью ROBO2, которая может связываться с SLIT2, а затем для оптимизации этой молекулы для экспрессии рекомбинантного белка в клетках HEK 293. Сначала было получено 4 конструкции ДНК для экспрессии полипептидных последовательностей, состоящих из домена Ig1 (ROBO2-Fc 1.0; SEQ ID NO: 5), доменов Ig1 и Ig2 (ROBO2-Fc 2.0; SEQ ID NO: 3), доменов Ig1, Ig2 и Ig3 (ROBO2-Fc 3.0; SEQ ID NO: 6) и доменов Ig1, Ig2, Ig3 и Ig4 (ROBO2-Fc 4.0; SEQ ID NO: 7), присоединенных к Fc-части человеческого IgG1 посредством линкера GS (Таблица 23). Экспрессия конструкций была индуцирована посредством лидерной последовательности Ig (SEQ ID NO: 18). Белки ROBO2-Fc 1.0, 2.0 и 3.0 не связывались с SLIT2. ROBO2-Fc 4.0 связывался с SLIT2. Для минимизации части Fc-гибрида ROBO2 было получено большее количество белков, включая вариант с доменом Ig1, содержащим междоменный линкер Ig1-Ig2 у С-конца (SEQ ID NO: 10) (ROBO2-Fc 1.1 (SEQ ID NO: 4). Другая полученная конструкция включала домены Ig1 и lg2 и междоменный линкер Ig2-lg3 (VFER (SEQ ID NO: 12)) (ROBO2-Fc 2.1; SEQ ID NO: 2). Присоединение VFER (SEQ ID NO: 12) у С-конца доменов Ig1-Ig2 для получения белка ROBO2-Fc 2.1 обеспечивало надежное связывание с SLIT2 (фиг. 3). ROBO2-Fc 1.1 не связывался с SLIT2. С использованием красителя Octet Red, белки ROBO2-Fc загружали на сенсоры, покрытые античеловеческим Fc (AHC) в количестве 10 мкг/мл и инкубировали со 100 нМ SLIT2 в течение 7 минут, а затем сенсоры перемещали в буфер на 640 секунд. ROBO2-Fc 4.0 был включен в качестве позитивного контроля для связывания.
[0241] Экспрессия рекомбинантного белка ROBO2-Fc 2.1 в клетках HEK 293 была очень низкой (3 мкг/мл). Для повышения уровня экспрессии присоединяли пре-последовательность Ig1 ROBO2 (SEQ ID NO: 8), и в экспрессионную конструкцию ROBO2-Fc 2.2 также включали лидерную последовательность ROBO2 (SEQ ID NO: 17) с получением экспрессионной конструкции ROBO2-Fc 2.2. Лидерная последовательность ROBO2 (SEQ ID NO: 17) расщеплялась в процессе продуцирования белка с образованием зрелого ROBO2-Fc 2.2. Присоединение пре-последовательности Ig1 ROBO2 (SEQ ID NO: 8) приводило к повышению уровня экспрессии белка более, чем в 25 раз по сравнению с уровнем экспрессии другой идентичной конструкции, которая не кодирует пре-последовательность Ig1 SRLRQEDFP (SEQ ID NO: 8) в другой идентичной клетке-хозяине. Повышение уровня экспрессии не влияло на биологическую активность ROBO2-Fc 2.2, который еще связывался с SLIT2 с высокой аффинностью (фиг. 3-4A-C).
Пример 2. Характеризация активности связывания и нейтрализации ROBO2-Fc 2.2
[0242] ROBO2-Fc 2.2 был скринирован во множестве анализов на связывание с SLIT2-N, на нейтрализацию связывания с SLIT2-N и на ингибирование функциональной активности SLITx-N. Связывание ROBO2-Fc 2.2 с SLIT2 было оценено двумя способами, сначала посредством поверхностного плазмонного резонанаса (ППР), а затем с помощью клеточного анализа методом проточной цитометрии для детектирования связывания ROBO2-Fc 2.2 с человеческим SLIT2-N, экспрессируемым клеткой.
Анализ с помощью ППР
[0243] Человеческий SLIT2 имеет высокую степень гомологии с SLIT2 собакоподобных обезьян, где общая гомология составляет 99%, а гомология в богатом лейцином повторяющемся домене 2 (D2) SLIT2, который содержит сайт связывания с ROBO2, составляет 100%. Аналогично SLIT2 собакоподобных обезьян, человеческий и крысиный SLIT2 имеют высокую степень гомологии с общей идентичностью последовательностей и в домене, связывающимся с D2, такая гомология составляет 97%. Связывание ROBO2-Fc 2.2 с N-концевым фрагментом человеческого и крысиного SLIT2, содержащего область D2 (SLIT2-N), и со специфическим доменом D2 SLIT2 человека и собакоподобных обезьян (100% идентичность), было оценено с помощью ППР. Для каждого цикла эксперимента по кинетическому титрованию (фиг. 4А-4С), молекула ROBO2-Fc 2.2 не была ковалентно связана с античеловеческим Fc (AHFc), присоединенным к чипу С1, который связывался с Fc-областью человеческого IgG1 ROBO2-Fc 2.2. Затем, захваченный ROBO2-Fc 2.2 обрабатывали различными концентрациями лигандов SLIT2 для мониторинга кинетики ассоциации и диссоциации. ROBO2-Fc 2.2 разводили до 2 нМ. HBS-EP использовали в качестве разбавителя. SLIT2-D2 человека/собакоподобных обезьян, человеческий SLIT2-N и крысиный SLIT2-N разводили до 2 нМ в HBS-EPB исходя из их начальных концентраций. 8-точечное 2-кратное серийное разведение осуществляли на лигандах SLIT2 в концентрации в пределах от 2 нМ до 15,6 пМ с использованием HBS-EPB в качестве разбавителя. ROBO2-Fc 2.2 захватывали до тех пор, пока не осуществлялось считывание ридов эквивалентов 10-15 О.Е., а затем обрабатывали титруемыми количествами специфического аналита SLIT2 (то есть, SLIT2-D2 человека/собакоподобных обезьян, человеческого SLIT2-N или крысиного SLIT2-N). Ассоциация указанного лиганда SLIT2, как показал мониторинг, составляла 120 секунд, а диссоциация составляла 180 секунд. Кажущуюся аффинность связывания определяли с использованием простой модели взаимодействия 1:1 для констант скорости кинетического связывания. KD связывания ROBO2-Fc 2.2 с SLIT2-D2 человека/собакоподобных обезьян (ROBO2-связывающего домена, идентичного на 100%), составляла, как было определено, 0,293 нМ (фиг. 4А). KD связывания ROBO2-Fc 2.2 с человеческим SLIT2-N (N-концевым фрагментом) составляла, как было определено, 0,279 нМ (фиг. 4В), и наконец, KD связывания ROBO2-Fc 2.2 с крысиным SLIT2-N составляла, как было определено, 0,543 нМ (фиг. 4С).
Анализ методом проточной цитометрии
[0244] ROBO2-Fc 2.2 конъюгировали с Alexa Fluor (AF) 647 в соответствии с инструкциями производителей. Клетки почек человеческого эмбриона (HEK293), сверхэкспрессирующие человеческий SLIT2-N, ресуспендировали в буфере, содержащем 5% фетальную бычью сыворотку, в препарате для окрашивания. Для окрашивания клеток ROBO2-Fc 2.2-AF647, 2× маточные растворы приготавливали и проводили 11-12-точечные 2-кратные серийные разведения в буфере для клеточного сортинга с активацией флуоресценции (FACS). Клетки и соответствующие разведения ROBO2-Fc 2.2-AF647 объединяли в 96-луночном планшете с U-образным дном и инкубировали при 4°C в течение 45 минут. После инкубирования добавляли 150 мкл буфера FACS на лунку для промывки клеток. После промывки, клетки ресуспендировали в буфере для получения информации на проточном цитометре Fortessa. Данные анализировали с помощью компьютерной программы FlowJo и представляли как геометрическое среднее интенсивности флуоресценции (Geo MFI) SLIT2-N-экспрессирующих клеток HEK293 минус Geo MFI для контрольных клеток HEK293. ROBO2-Fc 2.2 связывался с человеческим SLIT2-N, сверхэкспрессирующимся на клетках HEK293, в зависимости от дозы с высокой аффинностью с EC50 9 нМ (фиг. 5).
Анализ на гомогенную флуоресценцию с временным разрешением (HTRF)
[0245] ROBO2-Fc ингибирует связывание лиганда SLIT, такого как SLIT2, с клеточным рецептором ROBO2, вероятно, посредством его действия в качестве лиганда-ловушки. Анализ на мечение ROBO2-SLITx-N красителем HTRF был проведен для оценки способности ROBO2-Fc 2.2 нейтрализовать связывание лиганда SLIT с человеческим ROBO2. В этом анализе, клетки HEK293, экспрессирующие человеческий ROBO2, меченный тербием (Tb) (донором) и меченный SNAP (SNAP-tag® New England Biolabs; см., также, Keppler et al., 2003, Nat. Biotechnol. 21:86), инкубировали с 5 нМ d2-меченного (акцепторного) SLITx-N, происходящего от различных видов (полученного с использованием набора для мечения красителем Cisbio d2 в соответствии с инструкциями производителя) в присутствии титруемых количеств ROBO2-Fc 2.2 в течение 1 часа. После инкубирования измеряли флуоресценцию на 665 нм и 620 нм на планшет-ридере со множеством меток Envision. Отношение HTRF вычисляли по формуле: флуоресценция на 665 нм/флуоресценция на 620 нм × 10000. Максимальный сигнал определяли как отношение HTRF для Tb-меченных ROBO2-клеток с d2-меченным SLIT2-N в отсутствии ROBO2-Fc 2.2, а минимальный сигнал определяли как отношение HTRF только для клеток HEK293, экспрессирующих Tb-меченный ROBO2. В этом анализе оценивали нейтрализацию трех различных лигандов SLIT (SLIT1-N, SLIT2-N и SLIT3-N), происходящих от нескольких видов, включая человека, собакоподобных обезьян, кроликов, крыс и мышей. IC50 для каждого SLITx-N определяли с использованием 11-точечного 4-кратного серийного разведения с наивысшей концентрацией 4000 нМ. Геометрическое среднее IC50 для 3 независимых экспериментов вычисляли и систематизировали для всех оцениваемых лигандов (Таблица 2).
Таблица 2. Таблица систематизированных результатов анализа HTRF на ингибирование SLITx-N:человеческого ROBO2 посредством ROBO2-Fc 2.2
ДИ = доверительный интервал; Геом. среднее = геометрическое среднее; HTRF = Гомогенная флуоресценция с временным разрешением; IC50 = Ингибирующая концентрация при 50% активности; n = число определений; ROBO2 = рецептор регуляции окольного пути 2; SLIT = лиганд регуляции щели; x=1, 2 или 3.
Дозозависимое ингибирование связывания лиганда SLIT, происходящего от различных видов, с человеческим ROBO2 под действием ROBO2-Fc 2.2, оценивали с помощью HTRF. IC50 определяли с использованием 11-точечного 4-кратного титрования дозы ROBO2-Fc 2.2 в анализе HTRF для панели лигандов SLIT человека, собакоподобных обезьян, кроликов, крыс или мышей. ROBO2-Fc 2.2 представляет собой сильный нейтрализатор связывания SLIT1-N человека, собакоподобных обезьян, кроликов и крыс с человеческим ROBO2 с IC50 в пределах от низкого значения, составляющего 5,9 нМ (человек) до высокого значения, составляющего 9,8 нМ (кролик); ROBO2-Fc 2.2 также продемонстрировал дозозависимое ингибирование связывания SLIT2-N с человеческим ROBO2 с IC50 в пределах от 3,9 нМ (человек) до 5,7 нМ (кролик). ROBO2-Fc 2.2 представляет собой сильный нейтрализатор связывания SLIT3-N с человеческим ROBO2 с IC50 в пределах от 3,6 нМ (собакоподобная обезьяна) до 10,2 нМ (кролик). И наконец, ROBO2-Fc 2.2 представляет собой сильный нейтрализатор связывания человеческого SLIT2-N: человеческого ROBO2 (фиг. 6А) и крысиного SLIT2-N:человеческого ROBO2 (фиг. 6В) с IC50 7 нМ или 4 нМ, соответственно.
Анализ на миграцию нервных клеток
[0246] Конечный скрининг-отбор был проведен для оценки функциональной нейтрализации ROBO2-зависимой активности SLIT2-N. Взаимодействия SLIT2-ROBO2 представляют собой ключевые регуляторы миграции аксонов в процессе развития. Известно, что SLIT2 представляет собой химическое средство для отталкивания нейронов субвентрикулярной зоны, и что такая активность зависит от ROBO2. Затем, из субвентрикулярной зоны (SVZ) крыс выделяли эксплантаты нервной ткани и помещали в коллагеновую матрицу. В присутствии SLIT2-N наблюдалось ингибирование миграции нервных клеток (анализ SVZ), а поэтому эксплантаты ткани инкубировали в присутствии 1 нМ SLIT2-N и в присутствии или в отсутствии титруемых количеств ROBO2-Fc 2.2. После инкубирования, клетки фиксировали 4% параформальдегидом и окрашивали Hoechst 33342. Флуоресцентные изображения в широком поле получали на визуализаторе Operetta High Content Imager (Perkin Elmer) с объективом с высокой числовой апертурой (NA) и увеличением 10×. Девять полей на лунку с 5% перекрыванием было взято для захвата всей центральной площади лунки. Была получена информация по Z-стэкинг-взаимодействию для каждого поля, состоящего из 6 плоскостей с расстоянием 1 мкМ между каждой плоскостью для захвата всей глубины эксплантата ткани. Анализ проводили с помощью компьютерной программы Volocity (Perkin Elmer). Все поля в каждой лунке объединяли. Площадь эксплантата ткани в центре и в каждом ядре за пределами эксплантата ткани детектировали путем окрашивания красителем Hoechst 33342. Отдельные ядра подсчитывали, и расстояние от центра каждого ядра до ближайшего края эксплантата ткани измеряли в мкм. Среднее расстояние миграции ядер в лунке умножали на число ядер с получением общего расстояния миграции в каждой лунке. ROBO2-Fc 2.2 обладал способностью восстанавливать миграцию нервных клеток в зависимости от дозы с IC50 51 нМ (фиг. 7). Эти результаты показали, что ROBO2-Fc 2.2 может не только ингибировать связывание SLIT2 с ROBO2, но также оказывает сильное дозозависимое нейтрализующее действие на ROBO2-зависимую способность SLIT2 к химическому отталкиванию нейронов SVZ.
Пример 3. In vivo эффекты новых белков ROBO2
[0247] Пассивный нефрит Хеймана представляет собой крысиную модель нефротоксического поражения, влияющего на подоциты клубочков и приводящего к повышению уровня протеинурии. Эта модель была использована для оценки эффективности ROBO2-Fc 2.2 в снижении степени протеинурии. Обработка крыс ROBO2-Fc 2.2 приводила не только к снижению протеинурии, но также защищала архитектуру отростков оснований подоцитов. Как показано на фиг.8 и фиг. 9, введение крысам профилактических или терапевтических доз ROBO2-Fc 2.2 приводило к снижению уровня протеинурии. Крысам Льюиса вводили овечью антисыворотку против Fxla щеточной каймы почек крыс (Probetex Inc), базальной мембраны и подоцитов. У крыс вырабатывался иммунный ответ на овечью сыворотку. Активация комплемента приводила к уничтожению подоцитов и к повышению уровня протеинурии на день 3-12, а затем наблюдалось плато. Этот механизм очень напоминает механизм развития мембранозной нефропатии, при которой аутоантитела против белка подоцитов PLA2R (в 70% случаев) вызывают элиминацию подоцитов и нефротическую протеинурию после захвата комплемента. Крысы были предварительно обработаны за 24 часа до введения овечьей антисыворотки в интервалах доз, охватывающих приблизительно 50, 90 и 99% (1, 5 и 25 мг/кг) ROBO2 клубочков, а затем эти дозы вводили через каждые 72 часа (по профилактической схеме введения доз). Для введения доз по терапевтической схеме, ROBO2-Fc 2.2 вводили на день 6 или на день 9 (через 5 или 8 дней после введения овечьей антисыворотки), и перед введением овечьей антисыворотки, в данное исследование была включена доза, вводимая за 24 часа. Максимальное снижение протеинурии составляло 45%, если лечение начинали с профилактических доз (фиг. 8), а повторный анализ, проводимый с помощью статистического анализа ANOVA, подтвердил дозозависимый ответ с величиной р менее, чем 0,001. Обработка ROBO2-Fc 2.2, проводимая на дни 0, 6 и 9, приводила к аналогичному снижению протеинурии (фиг. 9) максимум на 40%, а величина р составляла менее, чем 0,001, на что указывал повторный анализ, проводимый с помощью статистического анализа ANOVA, для каждой ROBO2-Fc 2.2-обработанной группы по сравнению с группой, обработанной контрольным антителом. Какого-либо снижения осаждения иммунного комплекса в почках не наблюдалось, как было определено путем ИГХ-оценки комплемента, что указывало на то, что такой ответ был результатом протективного эффекта подоцитов.
[0248] Для дополнительной проверки достоверности модуляции функции и структуры подоцитов был проведен количественный анализ электронных микрографиков для субструктур подоцитов, как описано ниже.
Сбор, взятие образцов и получение срезов
[0249] Были получены полностью очищенные образцы почек (одной почки на животное), фиксированные путем погружения (в 4% формальдегид/1% глутаральдегид), а затем эти образцы обрезали так, чтобы они включали только корковое вещество, и пять образцов каждой почки заливали в эпоксидную смолу. Затем брали срез первого залитого образца каждой почки. Если этот образец содержал три клубочка, то получали его тонкие срезы и визуализировали. Если этот первый образец не содержал клубочков, то брали последовательные срезы других залитых образцов почек, и эти образцы аналогичным образом оценивали до тех пор, пока не был найден образец с тремя клубочками.
Обзор и визуализация
[0250] Отобранные образцы почек подвергали цифровой визуализации на просвечивающем электронном микроскопе (Hitachi H-7100) и на системе цифровых камер с зарядовой связью (Advanced Microscopy Techniques, Danvers, MA). Три капиллярных петли первых трех клубочков, обнаруженных при увеличении 200×, визуализировали при увеличении 5000× и 10000×, и эти процедуры не повторяли. В результате было получено 18 цифровых изображений на почку (то есть, три клубочка на образец почки × на три площади на клубочек при увеличении ×2). Для оценки слепым методом, каждое изображение идентифицировали только по числу исследований, числу животных, числу образцов и по увеличению.
Оценка ширины отростков окончаний подоцитов и плотности щелевой диафрагмы
[0251] Компьютерная программа ImageJ (version 1.47v; National Institutes of Health, Bethesda, MD, USA) была использована для мануального мониторинга и измерения ширины смежных отростков окончаний на единицу длины гломерулярной базальной мембраны (GBM) путем получения изображений на просвечивающем электронном микроскопе с большим увеличением. Вкратце, измерения проводили для шести крыс на группу и для каждой крысы получали девять 5000× TEM-изображений. Ширину отростков оснований подоцитов измеряли от одного конца щелевой диафрагмы до другого конца путем прочерчивания линии, параллельной GBM. Эту процедуру повторяли для всех отростков окончаний на изображении. Затем полученные результаты корректировали по масштабной шкале и вычисляли гармоническое среднее для каждого изображения.
[0252] Плотность щелевой диафрагмы: Плотность щелевой диафрагмы вычисляли путем подсчета числа щелевых диафрагм и деления результата на общую длину GBM, охватывающую площадь этих щелевых диафрагм. Вкратце, измерения проводили для шести крыс на группу и для каждой крысы получали девять 5000× TEM-изображений. Плотность вычисляли путем деления числа щелевых диафрагм на длину GBM. Если более, чем одна площадь GBM была видимой, или если GBM была отделена из-за отсутствия видимости отростков оснований, то вышеописанную процедуру повторяли, и среднее этих измерений использовали для вычисления плотности щелевой диафрагмы. Расстояние между щелевыми диафрагмами переплетенных отростков оснований вычисляли для всего множества капиллярных петель, что позволяло определить среднюю ширину отростков оснований. Ширина отростков оснований удаленных подоцитов превышала ширину нормальных неудаленных подоцитов.
[0253] Как показано на фиг. 10A, ширина отростков оснований у животных, обработанных ROBO2-Fc 2.2 в дозе 25 мг/кг, была значительно ниже, чем у животных, обработанных контрольным антителом. Эта данные показали, что снижение протеинурии обусловлено модификацией субструктуры подоцитов. Кроме того, как показано на фиг. 10В, ROBO2-Fc 2.2-обработка увеличивала плотность щелевых диафрагм (величина р составляла менее, чем 0,01, как было определено с помощью двустороннего Т-критерия), что указывает на то, что они в меньшей степени сморщены и защищены от поражения клубочков.
[0254] Эти результаты продемонстрировали, что ROBO2-Fc 2.2 эффективно ингибирует два признака гломерулита: протеинурию и диффузное сморщивание подоцитов. Таким образом, эти результаты подтвердили возможность применения ROBO2-Fc 2.2 как потенциального терапевтического средства для лечения гломерулита, такого как, но не ограничивающегося им, фокальный сегментарный гломерулосклероз (ФСГС).
[0255] Ключевые фармакологические свойства ROBO2-Fc 2.2 систематизированы в Таблице 3.
Таблица 3. Краткое описание ключевых фармакологических свойств ROBO2-Fc 2.2
[0256] Фармакологические исследования in vitro показали, что ROBO2-Fc 2.2 связывается с человеческим SLIT2-N с такой же высокой аффинностью, как и с идентичным доменом SLIT2-D2 человека и собакоподобных обезьян. ROBO2-Fc 2.2 связывается с крысиным SLIT2-N с такой же высокой аффинностью. ROBO2-Fc 2.2 связывается с клетками, экспрессирующими человеческий SLIT2-N в зависимости от дозы. Кроме того, ROBO2-Fc 2.2 может ингибировать связывание крысиного и человеческого SLIT2-N с человеческим ROBO2 в клеточном анализе HTRF на связывание. Механистические и фармакологические исследования и исследования на эффективность in vivo также проводили на крысиной модели гломерулита, ассоциированного с протеинурией. Введение ROBO2-Fc 2.2 по профилактической или терапевтической схеме введения доз приводило к статистически значимому снижению протеинурии у модели с ПНХ. Эти результаты подтвердили возможность применения ROBO2-Fc 2.2 для лечения гломерулита, такого как фокальный сегментарный гломерулосклероз (ФСГС).
Пример 4. Характеризация активности связывания и нейтрализации ROBO2-Fc S17T/R73Y
Анализ методом проточной цитометрии
[0257] ROBO2-Fc S17T/R73Y конъюгировали с Alexa Fluor (AF) 647 в соответствии с инструкциями производителей. Клетки, сверхэкспрессирующие человеческий SLIT2-N, ресуспендировали в буфере, содержащем 5% фетальную бычью сыворотку, в препарате для окрашивания. Для окрашивания клеток ROBO2-Fc S17T/R73Y-AF647, 2× маточные растворы приготавливали и проводили 11-12-точечные 2-кратные серийные разведения в буфере для FACS. Клетки и соответствующие разведения ROBO2-Fc S17T/R73Y-AF647 объединяли в 96-луночном планшете с U-образным дном и оставляли на 45 минут при 4°C. После инкубирования добавляли 150 мкл буфера для FACS на лунку для промывки клеток. После промывки, клетки ресуспендировали в буфере для получения информации на проточном цитометре Fortessa. Данные анализировали с помощью компьютерной программы FlowJo и представляли как геометрическое среднее интенсивности флуоресценции (Geo MFI) SLIT2-N-экспрессирующих клеток HEK293 минус Geo MFI для контрольных клеток HEK293. ROBO2-Fc S17T/R73Y связывался с человеческим SLIT2-N, сверхэкспрессирующимся на клетках почек человеческого эмбриона (HEK293) с высокой аффинностью с EC50 2,5 нМ (фиг. 11).
Анализ на гомогенную флуоресценцию с временным разрешением (HTRF)
[0258] Анализ на гомогенную флуоресценцию с временным разрешением для ROBO2-SLIT2-N (HTRF) проводили для оценки способности ROBO2-Fc S17T/R73Y блокировать взаимодействие SLIT2-N и ROBO2, экспрессируемого клетками. В этом анализе, клетки HEK293, экспрессирующие ROBO2, меченный тербием (Tb) (донором) и меченный SNAP, инкубировали с 5 нМ d2-меченного (акцепторного) человеческого SLITx-N в присутствии титруемых количеств ROBO2-Fc S17T/R73Y в течение 1 часа в соответствии с инструкциями производителя (набор для мечения d2 HTRF Cisbio 62D2DPEA и набор для мечения криптатом тербия 62TBSPEA). После инкубирования измеряли флуоресценцию на 665 нм и 620 нм на планшет-ридере со множеством меток Envision. Отношение HTRF вычисляли по формуле: флуоресценция на 665 нм/флуоресценция на 620 нм × 10000. Максимальный сигнал определяли как отношение HTRF для Tb-меченных ROBO2-клеток с d2-меченным SLIT2-N в отсутствии ROBO2-Fc S17T/R73Y, а минимальный сигнал определяли как отношение HTRF только для клеток HEK293, экспрессирующих Tb-меченный ROBO2. ROBO2-Fc S17T/R73Y представляет собой сильный нейтрализатор связывания человеческого SLIT2-N: человеческого ROBO2 с IC50 1,4 нМ (фиг. 12).
Анализ на миграцию нервных клеток
[0259] Как и в случае ROBO2-Fc 2.2, ROBO2-Fc S17T/R73Y оценивали на его способность отменять SLIT2-N-опосредуемое ингибирование миграции нервных клеток в зависимости от дозы. Из субвентрикулярной зоны (SVZ) крыс выделяли эксплантаты нервной ткани и заливали в коллагеновую матрицу. В присутствии SLIT2-N наблюдалось ингибирование миграции нервных клеток (анализ SVZ), а поэтому эксплантаты ткани инкубировали в присутствии 1 нМ SLIT2-N и в присутствии или в отсутствии титруемых количеств ROBO2-Fc S17T/R73Y. После инкубирования, клетки фиксировали 4% параформальдегидом и окрашивали Hoechst 33342. Флуоресцентные изображения в широком поле получали на визуализаторе Operetta High Content Imager (Perkin Elmer) с объективом с высокой числовой апертурой (NA) и увеличением 10×. Девять полей на лунку с 5% перекрыванием было взято для захвата всей центральной площади лунки. Была получена информация по Z-стэкинг-взаимодействию для каждого поля, состоящего из 6 плоскостей с расстоянием 1 мкМ между каждой плоскостью для захвата всей глубины эксплантата ткани. Анализ проводили с помощью компьютерной программы Volocity (Perkin Elmer). Все поля в каждой лунке объединяли. Площадь эксплантата ткани в центре и в каждом ядре за пределами эксплантата ткани детектировали путем окрашивания красителем Hoechst 33342. Отдельные ядра подсчитывали, и расстояние от центра каждого ядра до ближайшего края эксплантата ткани измеряли в мкм. Среднее расстояние миграции ядер в лунке умножали на число ядер с получением общего расстояния миграции в каждой лунке. ROBO2-Fc S17T/R73Y обладал способностью восстанавливать миграцию нервных клеток в зависимости от дозы с IC50 11,5 нМ (фиг. 13).
[0260] Эти результаты показали, что ROBO2-Fc S17T/R73Y, подобно ROBO2-Fc 2.2, может не только ингибировать связывание SLIT2 с ROBO2, но также оказывает сильное дозозависимое нейтрализующее действие на ROBO2-зависимую способность SLIT2 к химическому отталкиванию нейронов SVZ. Таким образом, эти данные позволяют предположить, что ROBO2-Fc S17T/R73Y, подобно ROBO2-Fc 2.2, может представлять собой потенциальное терапевтическое средство, которое может быть использовано для лечения гломерулита, ассоциированного с взаимодействием ROBO2-SLIT, такого как фокальный сегментарный гломерулосклероз (ФСГС).
Пример 5. Структурный анализ ROBO2-Fc 2.2
Получение материалов, кристаллизация, сбор данных и определение структуры
Экспрессии и очистка конструкции ROBO2-His
[0261] Конструкция ROBO2, состоящая из пре-последовательности Ig1 ROBO2 (SEQ ID NO: 8), домена Ig1, домена Ig2 и междоменного линкера Ig2-3 ROBO2 (SEQ ID NO: 12) с 6× гистидиновой меткой (SEQ ID NO: 25) у С-конца (ROBO2-His6 («His6», раскрытая как SEQ ID NO: 25)), экспрессировалась в клетках HEK293. Конструкцию очищали на Ni-колонке Excel путем элюирования в градиенте имидазола. Затем конструкцию очищали до гомогенности с помощью эксклюзионной хромотографии на HiLoad 26/200 Superdex 200 (GE Healthcare).
Кристаллизация
[0262] Кристаллы ROBO2-His6 получали в следующих условиях: 100 мМ цитрата натрия, рН 4,5, 12% ПЭГ 8000 с образованием кристаллов, имеющих дифракционную решетку до 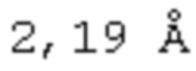 .
.
Сбор данных
[0263] Кристаллы подвергали временной криозащите, и сбор данных осуществляли дистанционно на синхротроне в присутствии активированного источника фотонов (APS). Кадрированные изображения обрабатывали с помощью компьютерной программы AutoPROC (Global Phasing Ltd). Эти данные принадлежат к пространственной группе P21, где элементарные ячейки имеют следующие параметры: 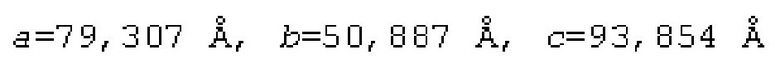 , α=γ=90°, β=114,92, с двумя копиями человеческого ROBO2 (Ig1 +Ig2) на асимметрическую ячейку.
, α=γ=90°, β=114,92, с двумя копиями человеческого ROBO2 (Ig1 +Ig2) на асимметрическую ячейку.
Определение и уточнение структуры
[0264] Поиск молекулярных замен с использованием гомологичной модели ROBO2 (Ig1+Ig2, код PDB: 2V9Q) позволяет определить каждый компонент раствора. Уточнение осуществляли с использованием компьютерной программы autoBUSTER (Global Phasing Ltd), где конечные факторы R/Rfree при 2,19  равны 0,2119 и 0,2425, соответственно, и где RMSD связи составляет 0,010
равны 0,2119 и 0,2425, соответственно, и где RMSD связи составляет 0,010  , а RMSD углов составляет 1,19°.
, а RMSD углов составляет 1,19°.
Результаты и анализ структуры
Повышение уровня экспрессии посредством пре-последовательности Ig1 ROBO2
[0265] В Примере 1 было продемонстрировано, что включение пре-последовательности Ig1 ROBO2 дикого типа SRLRQEDFP (SEQ ID NO: 8) приводит к резкому повышению уровня экспрессии ROBO2-Fc 2.2. Из кристаллической структуры ROBO2-His6 («His6», раскрытая как SEQ ID NO: 25) видно, что Asp7 (D7), Phe8 (F8) и Pro9 (P9), в основном, участвуют во взаимодействиях, играющих важную роль в структурной целостности первого домена Ig ROBO2 (фиг. 14). Asp7 образует водородную связь с Tyr94, а Phe8 образует двойную связь с Arg36 и Asn93 (Таблицы 4-5; расстояние между соседними остатками составляет 3,8  или менее). Кроме того, Asp7 (D7), Phe8 (F8) и Pro9 (P9) также активно участвуют в образовании ван-дер-ваальсовых связей с соседними остатками, что дает более, чем 50% площади скрытой поверхности (Таблицы 6-9). Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что полученные данные показали, что пре-последовательность Ig1 ROBO2 образует мостиковую связь с двумя β-складками первого домена Ig ROBO2 и, тем самым, значительно повышает стабильность структурной укладки N-концевой области. Эти данные, как было неожиданно обнаружено, позволяют предположить, что стабилизация структурной укладки опосредует повышение уровня экспрессии ROBO2-Fc 2.2 с правильной укладкой по сравнению с уровнем экспрессии конструкций ROBO2-Fc, не содержащих пре-последовательность Ig1.
или менее). Кроме того, Asp7 (D7), Phe8 (F8) и Pro9 (P9) также активно участвуют в образовании ван-дер-ваальсовых связей с соседними остатками, что дает более, чем 50% площади скрытой поверхности (Таблицы 6-9). Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что полученные данные показали, что пре-последовательность Ig1 ROBO2 образует мостиковую связь с двумя β-складками первого домена Ig ROBO2 и, тем самым, значительно повышает стабильность структурной укладки N-концевой области. Эти данные, как было неожиданно обнаружено, позволяют предположить, что стабилизация структурной укладки опосредует повышение уровня экспрессии ROBO2-Fc 2.2 с правильной укладкой по сравнению с уровнем экспрессии конструкций ROBO2-Fc, не содержащих пре-последовательность Ig1.
Таблица 4. Водородные связи, входящие в состав N-концевых остатков ROBO2 (копия 1)
 )
)
Таблица 5. Водородные связи, входящие в состав N-концевых остатков ROBO2 (копия 2)
 )
)
Таблица 6. Таблица взаимодействий на минимальном расстоянии от N-концевых остатков ROBO2 (копия 1)
 )
)
Таблица 7. Таблица взаимодействий на минимальном расстоянии от N-концевых остатков ROBO2 (копия 2)
 )
)
Таблица 8. Анализ на N-концевой остаток, скрытый на площади поверхности (BSA) (копия 1)
Таблица 9. Анализ на N-концевой остаток, скрытый на площади поверхности (BSA) (копия 2)
Повышение уровня экспрессии посредством междоменного линкера Ig2-3 ROBO2
[0266] Включение междоменного линкера Ig2-3 ROBO2 V200-F201-E202-R203 (VFER; SEQ ID NO: 12) приводит к заметному повышению уровня экспрессии ROBO2-Fc 2.2. Val200 представляет собой часть последней β-цепи в домене Ig2 ROBO2. V200 глубоко скрыт соседними остатками благодаря интенсивным ван-дер-ваальсовым связям (Таблицы 10-11); а поэтому 85% площади поверхности является скрытым (Таблицы 12-13). Phe201-Glu202-Arg203, помимо Val200, также в значительной степени участвуют в образовании водородных связей и ван-дер-ваальсовых взаимодействий в этой области (Таблицы 10-11, 14-15). В целом, эти данные позволяют предположить, что эти четыре аминокислотных остатка эффективно стабилизируют структурную укладку в С-концевой области домена Ig2 ROBO2 (фиг. 15). Не ограничиваясь какой-либо конкретной теорией, авторы на основе полученных данных лишь предполагают, что стабилизация структурной укладки повышает уровень экспрессии правильно уложенного ROBO2-Fc 2.2 по сравнению со снижением уровня экспрессии конструкций ROBO2-Fc, не содержащих междоменного линкера Ig2-3.
Таблица 10. Таблица взаимодействий на минимальном расстоянии от С-концевых остатков ROBO2 (копия 1)
 )
)
Таблица 11. Таблица взаимодействий на минимальном расстоянии от С-концевых остатков ROBO2 (копия 2)
 )
)
Таблица 12. Анализ на С-концевой остаток, скрытый на площади поверхности (BSA) (копия 1)
Таблица 13. Анализ на С-концевой остаток, скрытый на площади поверхности (BSA) (копия 2)
Таблица 14. Водородные связи, входящие в состав С-концевых остатков ROBO2 (копия 1)
 )
)
Таблица 15. Водородные связи, входящие в состав С-концевых остатков ROBO2 (копия 2)
 )
)
Пример 6. Структурный анализ ROBO2-Fc S17T/R73Y
Получение материалов, кристаллизация, сбор данных и определение структуры:
Экспрессия
[0267] Конструкция человеческого ROBO2 S17T/R73Y-His6 («His6», раскрытая как SEQ ID NO: 25) состоит из человеческого домена Ig1 ROBO2 с 2 точковыми мутациями (S17T и R73Y), за которыми следует С-концевая метка His ×6 (SEQ ID NO: 25). Конструкция человеческого SLIT2 состоит из домена D2 SLIT2 (271-479), за которым следует С-концевая метка His ×6 (SEQ ID NO: 25). Эти конструкции были экспрессированы в клетках HEK293 по отдельности и через 120 часов после трансфекции собирали кондиционированные среды.
Очистка человеческого ROBO2 S17T/R73Y-His6 («His6», раскрытая как SEQ ID NO: 25) и домена D2 SLIT2
[0268] Человеческий ROBO2 S17T/R73Y-His6 («His6», раскрытая как SEQ ID NO: 25) очищали из кондиционированных сред с использованием никеля-сефарозы HP (GE Healthcare) и градиента имидазола. Фракции пиков объединяли и разводили до 20 мМ NaCl, доводили до pH 6,0 и загружали на колонку HiTrap с Q-сефарозой Fast Flow (Q FF), находящуюся в тандеме с колонкой HiTrap, содержащей сильный сульфопропил (SP), то есть, с высокоэффективной колонкой (HP). После интенсивной промывки, колонку Q FF удаляли, и на колонку SP HP наносили градиент NaCl. Фракции собирали в зависимости от степени гликозилирования и диализовали против TBS.
[0269] Человеческий домен D2 SLIT2 захватывали из кондиционированных сред с использованием никеля-сефарозы HP (GE Healthcare) и очищали в градиенте имидазола. Фракции пиков объединяли и снова очищали с помощью эксклюзионной хромотографии на Superdex 200 в буфере, содержащем 50 мМ Трис-HCl pH 7.5, 1000 мМ NaCl. Фракции, содержащие D2 SLIT2, объединяли и доводили до 500 мМ NaCl.
Образование комплекса человеческого ROBO2 S17T/R73Y-His и домена D2 SLIT2
[0270] Из-за неожиданного взаимодействия между SLIT2 и смолой на гель-фильтрационной колонке, комплекс ROBO2 S17T/R73Y-His6 («His6», раскрытая как SEQ ID NO: 25) и SLIT2 не мог быть получен с помощью эксклюзионной хромотографии. Вместо этого, очищенный ROBO2 S17T/R73Y-His6 («His6», раскрытая как SEQ ID NO: 25) смешивали с доменом D2 SLIT2 в молярном отношении 1:1 и концентрировали в целях кристаллизации.
Кристаллизация
[0271] Кристаллы ROBO2 S17T/R73Y-His6 («His6», раскрытая как SEQ ID NO: 25) в комплексе с доменом D2 SLIT2 получали в следующих условиях: 100 мМ цитрата натрия, рН 5,5, 15% ПЭГ 6000. В результате были получены кристаллы, имеющие дифракционную решетку до  .
.
Сбор данных
[0272] Кристаллы подвергали временной криозащите, и сбор данных осуществляли дистанционно на синхротроне в присутствии активированного источника фотонов (APS). Кадрированные изображения обрабатывали с помощью компьютерной программы AutoPROC (Global Phasing Ltd). Эти данные принадлежат к пространственной группе P21, где элементарные ячейки имеют следующие параметры: 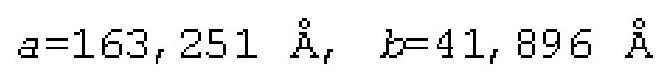 , α=β=γ=90°, с одной копией комплекса на асимметрическую ячейку.
, α=β=γ=90°, с одной копией комплекса на асимметрическую ячейку.
Определение и уточнение структуры
[0273] Поиск молекулярных замен с использованием гомологичной модели домена Ig1 ROBO1 и домена D2 SLIT2 (код PDB: 2V9T) позволил определить каждый компонент раствора. Уточнение осуществляли с использованием компьютерной программы autoBUSTER (Global Phasing Ltd), где конечные факторы R/Rfree при 1,78  равны 0,1848 и 0,2354, соответственно, и где RMSD связи составляет 0,010
равны 0,1848 и 0,2354, соответственно, и где RMSD связи составляет 0,010  , а RMSD углов составляет 1,10°.
, а RMSD углов составляет 1,10°.
Результаты и анализ структуры
[0274] Кристаллическая структура ROBO2 S17T/R73Y-His6-SLIT2 («His6», раскрытая как SEQ ID NO: 25) в значительной степени соответствует ROBO1-SLIT2, а пограничная область ROBO-SLIT является в высокой степени консервативной между ROBO2 и ROBO1. Следовательно, общедоступная структура ROBO1-SLIT2 может быть использована как заменитель ROBO2-SLIT2 для сравнения структур в целях зондирования влияния на S17T и R73Y.
[0275] Ser17 (S17) ROBO2 взаимодействует с Arg287 SLIT2 посредством водородной связи (фиг. 16). Водородная связь с аргинином является консервативной независимо от мутации, однако, Thr17 сообщает дополнительное ван-дер-ваальсово взаимодействие с Arg287, что дает некоторое энергетическое преимущество по сравнению с Ser17 дикого типа.
[0276] R73Y ROBO2 взаимодействует с Tyr404 SLIT2 (фиг. 16). Ван-дер-ваальсовы взаимодействия, вызываемые пи-пи-стэкниг-взаимодействиями двух остатков тирозина, являются гораздо более эффективными по сравнению с взаимодействиями между тирозином и гибкой боковой цепью аргинина. На это указывает процент скрытой площади поверхности (42% для Tyr73 и 22% для Arg73; Таблицы 16-19). Замена Arg на Tyr в ROBO2 S17T/R73Y, вероятно, является главным фактором, участвующим в повышении аффинности по сравнению с аффинностью ROBO2 дикого типа, содержащего S17 и R73.
[0277] Кроме того, S17 и R73 присутствуют на противоположных концах пограничной области ROBO2-SLIT2 (фиг. 16). Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что стабилизация взаимодействий в этих положениях, вероятно, сообщает ROBO2 большую способность связываться с SLIT2, и тем самым, повышает общую аффинность связывания двух белков.
Таблица 16. Таблица взаимодействий ключевых мутаций в ROBO2
 )
)
Таблица 17. Таблица взаимодействий соответствующих остатков дикого типа в ROBO1
 )
)
Таблица 18. Анализ площади скрытой поверхности для ключевых мутаций в ROBO2
Таблица 19. Анализ площади скрытой поверхности для соответствующих остатков дикого типа в ROBO10
Пример 7. Посттрансляционные модификации ROBO2-Fc 2.2
ЖХ/МС - Картирование пептидов
[0278] Анализ посттрансляционных модификаций ROBO2-Fc 2.2 осуществляли путем картирования пептидов. Вкратце, ROBO2-Fc 2.2 восстанавливали, алкилировали и расщепляли лизин-специфической протеазой, лизил-эндопептидазой (Lys-C). Протеолитические пептиды Lys-C анализировали с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с УФ-детектированием на 214 нм.
[0279] Все главные и вспомогательные пики в пептидной карте для ROBO2-Fc 2.2 идентифицировали с помощью масс-спектрометрии путем ионизации электронапылением в режиме онлайн (ОФ-ВЭЖХ/ИЭП-МС или ЖХ/МС). Наблюдаемые массы для каждого пика соответствовали ожидаемым протеолитическим пептидам Lys-C от ROBO2-Fc 2.2. Эти результаты ЖХ/МС-картирования пептидов показали, что ROBO2-Fc 2.2 содержит правильную аминокислотную последовательность, как было предсказано исходя из последовательности кДНК. ЖХ/МС-анализ указывал на присутствие N-связанных олигосахаридов в пептиде К6 (который был детектирован как K4K5K6), содержащем консенсусную последовательность N102AS для N-связанного гликозилирования. Главные олигосахаридные структуры, идентифицированные в гликопептиде K4K5K6, включают двухантенные структуры комплексного типа, содержащие два галактозных остатка с одним концевым остатком N-ацетилнейраминовой кислоты (G2F+1NeuAc) или с двумя концевыми остатками N-ацетилнейраминовой кислоты (G2F+2NeuAc). Также наблюдалось небольшое содержание гликопептидов K4K5K6, содержащих два концевых галактозных остатка (G2F). Кроме того наблюдалось небольшое содержание и других молекул, представляющих собой трехантенные и четырехантенные структуры комплексного типа с фукозой, имеющей замещение в сердцевине и содержащей до четырех концевых остатков N-ацетилнейраминовой кислоты.
[0280] ЖХ/МС-анализ также указывал на присутствие N-связанных олигосахаридов в пептиде К19 (который был детектирован как K18K19), содержащем консенсусную последовательность N291ST для N-связанного гликозилирования. Главные олигосахаридные структуры, идентифицированные в K18K19, включают асиало-двухантенные структуры комплексного типа, не содержащие галактозных остатков (G0F) или содержащие 1 (G1F) концевой галактозный остаток. Также наблюдалось небольшое содержание K18K19 с асиало-двухантенной структурой комплексного типа, содержащей два галактозных остатка (G2F). Было детектировано небольшое количество и следовые количества гликопептида K18K19, содержащего усеченные N-гликаны и комплексные N-гликаны, включающие до двух концевых остатков N-ацетилнейраминовой кислоты.
Таблица 20. ЖХ/МС-N-связанное гликозилирование
(Мажорный >40%, вспомогательный 540%, следовые количества<5%):
Детектированные Nгликаны (идентичные и соответствующие избыточные количества):
Мажорный: G0F, G1F
Вспомогательный: G0, G2F
Следовые количества: негликозилированный, G0 минус GlcNAc (усеченный), G0F минус GlcNAc (усеченный), Man5 (высокий уровень маннозы), G1, G1F+1NeuAc, G2F+1NeuAc, и G2F+2NeuAc
Занятие сайта Nсвязанного гликозилирования, подтвержденное в N102AT в пептидах K4K5K6 и K5K6 на пептидной карте
(Мажорный >40%, вспомогательный 540%, следовые количества <5%):
Детектированные Nгликаны (идентичные и соответствующие избыточные количества):
Мажорный: G2F+1NeuAc, G2F+2NeuAc
Вспомогательный: G2F, G3TriF+2NeuAc, G3TriF+3NeuAc, G4TetraF+3NeuAc и G2F+2NeuAc (пептид K5K6)
Следовые количества: G0 минус GlcNAc (усеченный), G1F+1NeuAc, G4TetraF+2NeuAc, G4 TetraF+4NeuAc, G2F+1NeuAc (пептид K5K6)
Пример 8. Исследования на безопасное фармакологическое действие
[0281] Самцам обезьян телеметрически вводили ROBO2-Fc 2.2 один раз в неделю путем внутривенной (IV) инъекции в течение 6 недель в дозе 50 мг/кг/дозу (всего 6 доз) для оценки конечных точек сердечно-сосудистого заболевания (CV). Наблюдались статистически значимые различия в частоте сердечных сокращений (ЧСС) и активности. Однако, эти различия были незначительными по величине, спорадическими по своей природе и не были продолжительными, а поэтому, они не рассматривались как ассоциированные с ROBO2-Fc 2.2. Внутривенное введение ROBO2-Fc 2.2 в дозе 50 мг/кг/дозу один раз в неделю в течение 6 недель не давало каких-либо ROBO2-Fc 2.2-ассоциированных изменений кровяного давления (КД), ЧСС или активности в любое время проведения исследования. Величины Cmax составляли 1060, 1030 и 1070 мкг/мл на дни 1, 22 и 36, соответственно.
[0282] Телеметрическое экспериментальное исследование на токсичность с повторением введения доз (ETS) самцам и самкам собакоподобных обезьян проводили для оценки влияния введения ROBO2-Fc 2.2 один раз в неделю путем внутривенной инъекции в дозе 50 мг/кг/дозу в течение 29 дней (всего 5 доз) на параметры электрокардиограммы (ЭКГ) и кровяного давления (КД), а также активности. Какого-либо ROBO2-Fc 2.2-ассоциированного влияния на параметры CV, взятые на день 9, не наблюдалось. На день 29, Cmax для животных обоих полов составляла 497 мкг/мл.
[0283] Измерения параметров ЭКГ и ЧСС включали в 3-месячное исследование на токсичность с повторяющимися дозами в соответствии со стандартной лабораторной практикой (GLP) для самцов и самок собакоподобных обезьян, которым вводили дозы 20, 100 или 300 мг/кг/дозу внутривенно или 300 мг/кг/дозу подкожно (SC). В этом исследовании, какого-либо ROBO2-Fc 2.2-ассоциированного влияния на ЭКГ или ЧСС не наблюдалось при среднем Cmax для животных обоих полов до 9210 мкг/мл. Кроме того, не проводилось каких-либо ROBO2-Fc 2.2-ассоциированных клинческих наблюдений, которые могли бы указывать на любые системные эффекты в области дыхательных путей или центральной нервной системы.
[0284] Кроме того, были оценены нейрофункциональные конечные точки в 3-месячном исследовании на токсичность у крыс. При этом не наблюдалось каких-либо ROBO2-Fc 2.2-ассоциированных эффектов в отношении двигательной активности или совокупности функциональных эффектов в дозах, вводимых внутривенно в количестве 425 мг/кг/дозу или подкожно в количестве 425 мг/кг/дозу (среднее Cmax для животных обоих полов составляло 7610 мкг/мл).
Пример 9. Фармакокинетика и метаболизм продуктов у животных
Методы анализа
I. Количественная оценка ROBO2-Fc 2.2 в сыворотке крыс и обезьян
[0285] Электрохемилюминесцентный (ЭХЛ) анализ проводили для определения количества ROBO2-Fc 2.2 в сыворотке крыс Wistar Han и собакоподобных обезьян на оборудовании для проведения анализа Meso Scale Discovery (MSD®) (15-1611, 15-1609). В этих анализах, образцы, содержащие ROBO2-Fc 2.2, инкубировали на покрытых стрептавидином планшетах MSD, сенсибилизированных биотинилированным реагентом для захвата анти-ROBO2-Fc антитела. Связанный ROBO2-Fc 2.2 детектировали с использованием рутенилированного мышиного антитела против Fc-фрагмента человеческого IgG. Конечное детектирование достигалось путем добавления буфера для считывания MSD для вырабатывания ЭХЛ-сигнала, который считывался на планшет-ридере MSD. Полученный ЭХЛ-сигнал был прямо пропорционален концентрации ROBO2-Fc 2.2. Концентрации образца определяли путем интерполяции исходя из стандартной кривой, которая была построена с использованием логарифмической модели 4PL (автоматически оцениваемой) с весовым коэффициентом 1/y. Интервал количественной оценки в 100% сыворотке составлял от 50 до 1280 нг/мл с минимально необходимым коэффициентом разведения (MRD) 20×.
II. Детектирование анти-ROBO2-Fc 2.2 антител в сыворотке крыс и обезьян
[0286] ЭХЛ-анализ проводили для детектирования присутствия антител против лекарственного средства (ADA) в сыворотке крыс Wistar Han и собакоподобных обезьян на оборудовании для проведения анализа MSD®. В этих анализах, ROBO2-Fc 2.2, меченный биотином и рутением, совместно инкубировали с экспериментальными образцами, позитивным контролем (с анти-ROBO2-Fc 2.2 антителами в сыворотке крыс Wistar Han или собакоподобных обезьян) или с негативным контролем (с объединенной нормальной сывороткой крыс Wistar Han или собакоподобных обезьян). Антитела против ROBO2-Fc 2.2, присутствующие в образцах, должны связываться с вариантами ROBO2-Fc 2.2, меченными биотином и рутением и детектируемыми в этих анализах. Связанные ADA захватывали на покрытых стрептавидином планшетах MSD. Конечное детектирование достигалось с использованием трипропиламина с продуцированием ЭХЛ-сигнала, который измеряли на планшет-ридере MSD и выражали в относительных световых единицах (RLU).
[0287] Экспериментальные образцы тестировали на ADA с применением ряда стратегий. Образцы сначала тестировали в скрининг-анализе при минимально необходимом разведении 1:50. Образцы, которые давали RLU ниже предельного значения анализа, были зарегистрированы как негативные (<1,70, log10 от минимально необходимого коэффициента разведения, 50). Образцы, которые давали RLU, равное предельному значению анализа или выше этого значения, снова анализировали в полной серии разведений для подтверждения позитивного результата и определения титра антитела. Титр антитела определяли как величину, обратную коэффициенту разведения образца, который давал RLU, эквивалентную RLU предельного значения анализа, и регистировали как log (по основанию 10) этого титра.
[0288] Выводы, относящиеся к индуцированию ADA, были сделаны исходя из сравнения результатов для образцов, взятых до введения дозы на день 1, и для образца, взятого после введения дозы. Если тестируемый образец, взятый до введения дозы, был негативным по ADA, а соответствующий тестируемый образец после введения дозы был позитивным по ADA, то такое животное рассматривалось как позитивное по индуцированию ADA-ответа на ROBO2-Fc 2.2. Если тестируемые образцы, взятые до введения дозы и после введения дозы, были позитивными по ADA, то такое животное рассматривалось как позитивное по индуцированию ADA-ответа только, если, титр образца после введения дозы также составлял по меньшей мере 0,48 (log 3, коэффициент серийного разведения) или выше титра образца до введения дозы.
Результаты
I. Фармакокинетика
А. Фармакокинетические анализы с одной дозой
[0289] Фармакокинетические свойства ROBO2-Fc 2.2 в сыворотке определяли у крыс Lewis (n=3) и у собакоподобных обезьян (n=2) после введения одной внутривенной дозы 10 мг/кг. ROBO2-Fc 2.2 обнаруживал клиренс (CL) у крыс при 1,5 мл/ч/кг и у обезьян при 0,89 мл/ч/кг и стационарный объем распределения (Vss) у крыс при 0,19 л/кг и у обезьян при 0,09 л/кг, и давал конечное время полужизни  приблизительно 5 и 8 дней у крыс и обезьян, соответственно. После введения крысам ROBO2-Fc 2.2 подкожно в дозе 10 мг/кг, оцененная биодоступность составляла 56%.
приблизительно 5 и 8 дней у крыс и обезьян, соответственно. После введения крысам ROBO2-Fc 2.2 подкожно в дозе 10 мг/кг, оцененная биодоступность составляла 56%.
В. Фармакокинетика с повторными дозами (Токсикокинетика; TK)
Токсикокинетика у крыс
[0290] Оценку TK и ADA проводили после внутривенного введения 25, 125 или 425 мг/кг/дозу, и после подкожного введения 425 мг/кг/дозу самцам и самкам крыс Wistar Han один раз через каждые 3 дня (n=6/пол/группу доз) в процессе 3-месячного экспериментального исследования токсичности в соответствии с GLP с 6-недельной фазой восстановления.
[0291] Концентрации ROBO2-Fc 2.2 в образцах, взятых и проанализированных до введения дозы на день 1 или в образцах, взятых и проанализированных у группы, которой вводили контроль-носитель, не определяли. Количественно оцениваемые концентрации ROBO2-Fc 2.2 наблюдались на день 88 (последний сбор образцов) и до последнего дня фазы восстановления (день 135) у группы, которой вводили дозу ROBO2-Fc 2.2.
[0292] При этом, не наблюдалось каких-либо явных ассоциированных с полом различий в системном ответе (оцениваемом по максимальной концентрации [Cmax] и площади под кривой концентрации (AUC) на время от 0 до 72 часов [AUC72]) у группы с любой дозой. Средний системный ответ увеличивался с увеличением дозы приблизительно пропорционально вводимой дозе со дня 1 до дня 88. Системная биодоступность ROBO2-Fc 2.2 составляла 24,4% и 25,4% после подкожного введения доз на дни 1 и 88, соответственно. Отношения аккумуляции (AUC, день 88/день 1) составляли < 2,0 для групп, которым вводили дозы внутривенно и подкожно (Таблица 21).
[0293] Частота индуцирования ADA в ответ на ROBO2-Fc 2.2 у групп, которым внутривенно вводили дозы 25, 125 и 425 мг/кг, составляла 0,0% (0/12 животных), 0,0% (0/12 животных), и 0,0% (0/12 животных), соответственно, и 41,7% у группы, которой подкожно вводили дозу 425 мг/кг (5/12 животных). Концентрации ROBO2-Fc 2.2 в сыворотке у ADA-позитивных животных были аналогичны концентрациям у ADA-негативных животных. Однако, следует отметить, что уровни ROBO2-Fc 2.2 в кровотоке, присутствующие в образцах, могут препятствовать детектированию ADA.
Токсикокинетика у собакоподобных обезьян
[0294] Оценку TK и ADA проводили после внутривенного введения 20, 100 или 300 мг/кг/дозу, и после подкожного введения 300 мг/кг/дозу самцам и самкам собакоподобных обезьян один раз в неделю (n=3 или 5/пол/группу доз) в процессе 3-месячного экспериментального исследования токсичности в соответствии с GLP с 6-недельной фазой восстановления.
[0295] Концентрации ROBO2-Fc 2.2 в образцах, взятых и проанализированных до введения дозы на день 1, или в образцах, взятых и проанализированных у группы, которой вводили контроль-носитель, не определяли. Количественно оцениваемые концентрации ROBO2-Fc 2.2 наблюдались на день 78 (последнего сбора образцов) и до последнего дня фазы восстановления (день 127 или 128) у группы, которой вводили дозу ROBO2-Fc 2.2.
[0296] При этом, не наблюдалось каких-либо явных ассоциированных с полом различий в системном ответе (оцениваемом по Cmax и AUC168) у группы с любой дозой. Средний системный ответ увеличивался с увеличением дозы приблизительно пропорционально вводимой дозе со дня 1 до дня 78. Системная биодоступность ROBO2-Fc 2.2 (в дозе 300 мг/кг, вводимой внутривенно и подкожно) составляла 53,7% и 77,0% после подкожного введения доз на день 1 и день 78, соответственно. Отношения аккумуляции (AUC, день 78/день 1) составляли <2,0 для групп, которым вводили дозы внутривенно, и 2,1 для группы, которой вводили дозы подкожно (Таблица 21).
[0297] Частота индуцирования ADA в ответ на ROBO2-Fc 2.2 у групп, которым внутривенно вводили дозы 20, 100 или 300 мг/кг, составляла 0% (0/6 животных), 0% (0/6 животных) и 20% (2/10 животных), соответственно, и 33% у группы, которой подкожно вводили дозу 300 мг/кг (2/6 животных). Концентрации ROBO2-Fc 2.2 в сыворотке у ADA-позитивных животных были аналогичны концентрациям у ADA-негативных животных. Однако, следует отметить, что уровни ROBO2-Fc 2.2 в кровотоке, присутствующие в образцах, могут препятствовать детектированию ADA.
II. Распределение
[0298] Стационарный объем распределения (Vss) ROBO2-Fc 2.2 у крыс (0,19 л/кг) и обезьян (0,09 л/кг) был низким после введения одной внутривенной дозы, что соответствовало ограниченному распределению Fc-содержащего белка во внеклеточных жидкостях.
III. Фармакокинетика-фармакодинамика и предсказание ФК у человека
[0299] Исходя из ФК/ФД-моделирования (включения предсказанных данных ФК у человека, измеренных данных ROBO2 и SLIT2 в сыворотке и измеренных концентраций в почках), было предсказано, что оцениваемая подкожная доза 2 мг/кг (150 мг), вводимая человеку еженедельно, сохраняла охват мишени Cmin >90% в почках. Предсказанная эффективная концентрация у человека в сыворотке (Ceff), составляющая ~11 мкг/мл, давала охват мишени >90% в почках. Предсказанные стационарные параметры Cmax и AUCtau у человека после еженедельного подкожного введения человеку дозы 2 мг/кг (150 мг) составляли 18,2 мкг/мл и 2610 мкг⋅ч/мл, соответственно.
[0300] Предсказание ФК для ROBO2-Fc 2.2 у человека было сделано путем масштабирования ФК–данных после внутривенного ввдения дозы собакоподобным обезьянам на основе аллометрических экспонент. Было предсказано, что у человека, клиренс ROBO2-Fc 2.2 составлял 0,5 мл/ч/кг, а стационарный объем распределения в дозе 90 мл/кг давал конечное время полужизни приблизительно 14 дней. Предсказанная биодоступность при подкожном введении человеку составляла 60%.
[0301] В начальных клинических исследованиях, предел экспозиции был установлен на Cmax 2930 мкг/мл, и AUC 74500 мкг⋅ч/мл была определена как ассоциированная с границами экспозиции 161× и 29×, то есть, предсказанной эффективной экспозиции у человека, соответственно, в экспериментальной эффективной дозе для человека (150 мг SC один раз в неделю). Этот предел экспозиции основан на отсутствии наблюдаемого уровня побочных эффектов (NOAEL) после 3-месячного исследования токсичности у крыс в соответствии с GLP.
[0302] Хотя ROBO2-Fc 2.2-ассоциированое влияние на уровни цитокинов в сыворотке не наблюдалось в течение 3-месячных исследований на токсичность в соответствии с GLP у крыс или собакоподобных обезьян в ETS после введения ROBO2-Fc 2.2 один раз в неделю подкожно в дозе 10 мг/кг/дозу или внутривенно в дозе 50 или 200 мг/кг/дозу, соответственно, однако, повышение уровня TNF-α и/или IL-6 наблюдалось у 1 из 8 людей-доноров и у 1 из 12 обезьян in vitro. Хотя данные in vitro пока еще не были точно интерпретированы, однако, были проведены такие процедуры, как медленное введение ROBO2-Fc 2.2 посредством внутривенного вливания (в небольшой фракции от общей дозы, вводимой в первый час, с последующим введением остальной дозы во второй час) в одной фазе исследования с увеличением доз для оценки перерыва/окончания введения доз, тщательного мониторинга жизненно важных функций, клинических симптомов и оценки уровней цитокинов.
Таблица 21. Средние общие (самки + самцы) токсикокинетические параметры ± стандартное отклонениеа у крыс и обезьян
Cmax = максимальная наблюдаемая концентрация; IV=внутривенно; SC=подкожно; Tmax = время до первого наблюдения Cmax.
а. Стандартное отклонение не регистрировали для 16GR156, поскольку используемая выборка является несерийной.
b. В исследовании на 16GR156, животным вводили дозу через каждые 3 дня.. В исследовании на 16GR143, животным вводили дозу один раз в неделю.
c. AUC72 использовали в исследовании на 16GR156, а AUC168 использовали в исследовании на 16GR143.
d. N=6/пол/группу, которой вводили дозу (3/пол/момент времени).
e. Общая биодоступность (F%) после введения SC-дозы, исходя из AUC72=24,4 на день 1 и 25,4 на день 88.
f. N=3 или 5/пол/группу, которой вводили дозу.
g. Общая биодоступность (F%) после введения SC-дозы, исходя из AUC168=53,7 на день 1 и 77,0 на день 78
Пример 10. Токсикология
[0303] ROBO2-Fc 2.2 вводили крысам и собакоподобным обезьянам путем внутривенной и подкожной инъекции в экспериментальных исследованиях на токсичность (которые проводили по схеме, не соответствующей стандартной лабораторной практике [GLP]) и в пилотных исследованиях на токсичность (проводимых в соответствии с GLP) в течение периода времени до 3 месяцев (13 недель). При этом не наблюдался какой-либо побочный эффект NOAEL после 3-месячного введения доз:
(i) 125 мг/кг/дозу, IV (Cmax 2930 мкг/мл и AUC72 74500 мкг⋅ч/мл) и 425 мг/кг/дозу, SC (Cmax 842 мкг/мл и AUC72 50500 мкг⋅ч/мл) у крыс, и
(ii) 300 мг/кг/дозу, IV (Cmax 9210 мкг/мл и AUC168 427000 мкг⋅ч/мл) и SC (Cmax 2340 мкг/мл и AUC168 328000 мкг⋅ч/мл) у обезьян.
I. Токсичность повторных доз
[0304] Экспериментальные и пилотные исследования на токсичность повторных доз проводили с использованием ROBO2-Fc 2.2 у крыс и собакоподобных обезьян.
А. Исследования на крысах
(i) Экспериментальное исследование на токсичность (ETS)
[0305] В экспериментальном исследовании на токсичность (ETS) у самцов крыс, ROBO2-Fc 2.2 вводили 1 раз в 3 дня в течение 14 дней (всего 5 доз) внутривенно в дозе 200 мг/кг/дозу или подкожно в дозе 10, 50 или 200 мг/кг/дозу, и все эти дозы были допустимыми. При этом не наблюдалось каких-либо ROBO2-Fc 2.2-ассоциированных клинических признаков и изменений параметров массы тела или усвояемости пищи.
[0306] ROBO2-Fc 2.2-ассоциированные эффекты включали минимильное-умеренное периваскулярное воспаление на участках подкожной инъекции в дозе ≥10 мг/кг/дозу SC; увеличение абсолютной массы тимуса (1,21×-1,44× по сравнению с контролем) и относительной массы тимуса (1,17×-1,39× по сравнению с контрольной массой тела и 1,22×-1,46× по сравнению с контрольной массой головного мозга) в дозе ≥10 мг/кг/дозу SC и IV, которые не ассоциируются с коррелятом, полученным под микроскопом; повышенный уровень креатинина в моче (1,70× и 1,83× по сравнению с контролем) и более низкий объем мочи (0,52× и 0,55× по сравнению с контролем) в дозе 200 мг/кг/дозу SC и IV; высокую среднюю удельную плотность мочи (1,011×-1,012× по сравнению с контролем) в дозе 200 мг/кг/дозу SC и IV; и более высокий средний уровень холестерина в сыворотке (1,38× по сравнению с контролем) в дозе 200 мг/кг/дозу IV. Данные клинического химического анализа и массы органов не ассоциировались с какими-либо данными, полученными под микроскопом.
(ii) Исследования на токсичность повторной дозы
[0307] В пилотном исследовании на токсичность повторных доз у крыс, ROBO2-Fc 2.2 вводили 1 раз в 3 дня в течение 3 месяцев (всего 31 доза) внутривенно в дозе 25, 125 или 425 мг/кг/дозу или подкожно в дозе 425 мг/кг/дозу, с последующей 6-недельной фазой восстановления (контроль и 425 мг/кг/дозу IV). Также оценивали нейрофункциональные эффекты ROBO2-Fc 2.2. ROBO2-Fc 2.2-ассоциированные клинические признаки включали поражение кожи (в дорсальной области, в грудной клетке, в области черепа или на участке инъекции), наблюдаемые у 4 из 10 самцов крыс при введении дозы 425 мг/кг/дозу SC на фазе введения доз. Эти изменения не рассматривались как побочные эффекты, поскольку их частота лишь слегка превышала частоту, наблюдаемую у контрольной группы (2/15 самцов), и такие изменения носили лишь спорадический характер на фазе введения доз и не наблюдались у животных, которым вводили ROBO2-Fc 2.2 в дозе до 425 мг/кг/дозу IV. Каких-либо данных относительно связи ROBO2-Fc 2.2 с массой тела, усвояемостью пищи, офтальмологическими параметрами, нейрофункциональными свойствами или макроскопическими параметрами не наблюдалось.
[0308] У самцов, почечные симптомы заключались в минимальной гломерулопатии при дозе ≥125 мг/кг/дозу IV. У самок, минимальная гломерулопатия также наблюдалась только при дозе 425 мг/кг/дозу IV и сопровождалась минимальной-слабой базофилией канальцев и отложениями гиалина в канальцах, а также повышенным содержанием белка в моче (100 мг/дл). Морфологические признаки гломерулопатии, базофилии канальцев и гиалиновых отложений в канальцах у самок рассматривались как побочные эффекты, поскольку их комбинация с не-побочным эффектом, таким как повышение уровня белка в моче, приводила к ухудшению функции почек. У самцов, гломерулопатия не являлась побочным эффектом, поскольку такой признак был гораздо менее интенсивным по его распределению, наблюдаемому в отсутствии базофилии и гиалиновых отложений в канальцах, и не ассоциировался с повышением уровня белка в моче. Гломерулопатия характеризовалась присутствием агрегатов гранулярного эозинофильного вещества в клубочках, присутствующих в корковом слое почек и наблюдаемых на оптическом микроскопе, а также слиянием отростков оснований подоцитов, окружающим гломерулярные капиллярные петли, наблюдаемые на просвечивающем электронном микроскопе. По окончании фазы восстановления, у самцов, гломерулопатия полностью исчезала и частично исчезала у самок и рассматривалась как не-побочный эффект. У самок также наблюдалось полное исчезновение базофилии канальцев, гиалиновых отложений в канальцах и белка в моче. Более высокое общее содержание белка в сыворотке ((1,09×-1,18×) и альбумина в сыворотке (1,10×-1,20×) наблюдалось у группы самцов, которым вводили дозу 425 мг/кг/дозу IV, и у группы самок, которым вводили дозу ≥25 мг/кг/дозу IV и 425 мг/кг/дозу SC. Такой эффект наблюдался у группы самок, которым вводили дозу 425 мг/кг/дозу IV, несмотря на повышение уровня белка в моче.
[0309] Дополнительные ROBO2-Fc 2.2-ассоциированные признаки, наблюдаемые под микроскопом, имелись у животных, которым вводили 425 мг/кг/дозу SC, и заключались в повышении частоты и/или тяжести (умеренной) кровоизлияния и воспаления на участке инъекции по сравнению с контролем (от минимальных до слабых) и в повышении частоты минимальной лимфоидной гиперплазии в дренирующем лимфоузле. Повышение частоты кровоизлияния и тяжести воспаления на участке SC-инъекции не рассматривалось как побочный эффект, поскольку такие эффекты лишь слегка превышали эффекты, наблюдаемые у параллельного контроля и не ассоциировались с поражением ткани, которые должны быть значительно выше, как это ожидалось при проведении процедуры инъекции. Повышение частоты минимальной лимфоидной гиперплазии в дренирующем лимфоузле не рассматривалось как побочный эффект, поскольку, по своей морфологии, такая гиперплазия аналогична гиперплазии у контроля и, вероятно, представляет собой небольшой иммунный ответ на ROBO2-Fc 2.2 и/или на процедуру введения доз. Ожидается, что эти признаки будут исчезать после прекращения введения инъекций.
[0310] ROBO2-Fc 2.2-ассоциированное повышение массы печени, наблюдаемое по окончании фазы введения доз, не рассматривалось как побочный эффект и заключалось в повышении средней абсолютной и относительной массы тела и головного мозга (1,11×-1,17× по сравнению с контролем) у групп самок, которым вводили дозу ≥25 мг/кг/дозу IV и 425 мг/кг/дозу SC. Это увеличение массы печени не рассматривалось как побочный эффект, поскольку отсутствовали коррелирующие макроскопические и микроскопические признаки и отсутствовали изменения в ферментах печени, указывающие на повреждение ткани. Наблюдалось полное восстановление массы печени.
[0311] Дополнительные изменения клинических патологических параметров свертывания крови и клинических химических параметров не рассматривались как побочные эффекты, и такие изменения заключались в повышении уровня фибриногена (1,21×-1,48×) у групп самок и самцов, которым вводили дозу ≥125 мг/кг/дозу IV, в повышении уровня холестерина (1,37×-2,52×) и триглицеридов (1,58×-3,11×) у группы самцов, которым вводили дозу ≥125 мг/кг/дозу IV, и у группы самок, которым вводили дозу ≥25 мг/кг/дозу IV и 425 мг/кг/дозу SC, и в повышении уровня глобулина (1,16×) и уровня кальция (1,09×) у группы самок, которым вводили дозу 425 мг/кг/дозу IV. У групп самцов и самок наблюдалось полное восстановление уровней фибриногена, холестерина, триглицеридов, общего белка, сывороточного альбумина и глобулина, но лишь частичное восстановление кальция (1,04× по сравнению с контрольной группой по окончании фазы восстановления) у группы самок, которым вводили дозу 425 мг/кг/дозу IV. Эти клинические патологические изменения не являлись побочными эффектами, если принять во внимание небольшие различия между параметрами для группы, которой вводили ROBO2-Fc 2.2, и контрольной группы, а также отсутствие коррелирующих макроскопических и микроскопических признаков.
[0312] Систематизированное описание токсикокиненических данных для крыс после 3-мечячного введения ROBO2-Fc 2.2 можно найти в Таблице 22. После IV-введения ROBO2-Fc 2.2 крысам в дозе 25, 125 или 425 мг/кг/дозу или после SC-введения дозы 425 мг/кг/дозу один раз в 3 дня в течение 3 месяцев (всего 31 доза), дозы 125 мг/кг/дозу IV и 425 мг/кг/дозу SC были идентифицированы как NOAEL.
В. Исследования на обезьянах
(i) Экспериментальное исследование на токсичность (ETS)
[0313] В ETS, самцам и самкам собакоподобных обезьян вводили ROBO2-Fc 2.2 один раз в неделю в течение 29 дней (всего 5 доз) в дозе 50 или 200 мг/кг/дозу IV или 10 мг/кг/дозу SC. Кардиоваскулярные эффекты оценивали у телеметрически имплантированных животных в группе, которой вводили 50 мг/кг/дозу IV. На день 30 после введения последней дозы, отобранных животных подвергали аутопсии. Двух обезьян в группе, которой вводили 50 мг/кг/дозу IV, оставляли до дня 71 для оценки переносимости и токсикокинетических свойств. Все введенные дозы ROBO2-Fc 2.2 переносились животными. При этом не наблюдалось каких-либо ROBO2-Fc 2.2-ассоциированных эффектов в отношении выживаемости, клинических признаков, массы тела, усвояемости пищи, сердечно-сосудистых параметров, оценки уровня цитокинов in vivo, гематологических параметров и параметров свертывания крови, а также макроскопических и микроскопических параметров. ROBO2-Fc 2.2-ассоциированные эффекты включали небольшое увеличение уровня аспартат-аминотрансферазы у обеих самок, которым вводили 50 мг/кг/дозу IV (1,26×-1,51× по сравнению с контролем), и у самцов и самок животных, которым вводили 200 мг/кг/дозу IV (1,59× и 1,55× по сравнению с контролем, соответственно), и небольшое повышение уровня аланин-аминотрансферазы у тех же самок, которым вводили 50 мг/кг/дозу IV (1,29×-2,05× по сравнению с контролем), и 200 мг/кг/дозу IV (1,29× по сравнению с контролем). Повышение уровня этих ферментов не ассоциировалось с микроскопическими изменениями, связанными с ROBO2-Fc 2.2, в печени этих животных.
(ii) Исследования на токсичность повторной дозы
[0314] В пилотном исследовании на токсичность повторных доз у собакоподобных обезьян, ROBO2-Fc 2.2 вводили один раз в неделю в течение 3 месяцев (всего 13 доз) внутривенно в дозе 20, 100 или 300 мг/кг/дозу или подкожно в дозе 300 мг/кг/дозу, с последующей 6-недельной фазой восстановления (контроль и 300 мг/кг/дозу IV). В этом исследовании, каких-либо побочных эффектов, вызываемых ROBO2-Fc 2.2, в любых конечных точках, не наблюдалось. При этом, не наблюдалось каких-либо клинических признаков, связанных с введением ROBO2-Fc 2.2, а именно, изменения массы тела, усвояемости пищи, электрокардиограммы/частоты сердечных сокращений, гематологических параметров, свертывания крови, анализа мочи, офтальмологических параметров, массы органов или макроскопических параметров. ROBO2-Fc 2.2-ассоциированные изменения клинических химических параметров включали повышение уровня холестерина (1,25×-1,61× по сравнению с контролем) при введении дозы 300 мг/кг/дозу IV или SC, повышение уровня триглицеридов (1,58×-4,59× по сравнению с контролем) при введении дозы ≥20 мг/кг/дозу IV, или 300 мг/кг/дозу SC, и снижение уровня глобулина (0,83×-0,87× по сравнению с контролем) при введении дозы ≥100 мг/кг/дозу IV или 300 мг/кг/дозу SC. Все клинические химические изменения не являлись побочными эффектами, на что указывала небольшая величина изменений и отсутствие ассоциированных изменений в ткани. Клинические химические изменения полностью исчезали, за исключением повышения уровня триглицеридов, которое сохранялось у самцов, которым вводили дозу 300 мг/кг/дозу IV после фазы восстановления (2,78×-6,79× по сравнению с контролем); при этом, количественно оцениваемые концентрации ROBO2-Fc 2.2 сохранялись вплоть до дня 128/127 фазы восстановления.
[0315] Повышенная концентрация клеток в лимфоидных фолликулах наблюдалась в дренирующих лимфоузлах (в левых подмышечных) и в подмышечных лимфоузлах (правых подмышечных) у животных, которым вводили дозу 300 мг/кг/дозу SC. Эти параметры были охарактеризованы по минимальному-слабому увеличению размера и числа лимфоидных фолликул с преобладающим образованием зародышевого центра и соответствовали ответу на антигенный стимулятор. Эти параметры не рассматривались как побочные эффекты из-за минимальной-умеренной тяжести. Ожидается, что эти признаки будут исчезать после прекращения введения инъекций. В противоположность этому, микроскопические признаки, связанные с ROBO2-Fc 2.2, не наблюдались у животных, которым вводили ROBO2-Fc 2.2 в дозах до 300 мг/кг/дозу IV.
[0316] Систематизированное описание токсикокинетических данных для собакоподобных обезьян после 3-месячного введения ROBO2-Fc 2.2 можно найти в Таблице 22. После IV-введения ROBO2-Fc 2.2 обезьянам в дозе 20, 100 или 300 мг/кг/дозу или после SC-введения дозы 300 мг/кг/дозу один раз в неделю в течение 3 месяцев (всего 13 доз), дозы 300 мг/кг/дозу IV и 300 мг/кг/дозу SC были идентифицированы как NOAEL.
II. Местная переносимость
[0317] Участки IV- и SC-инъекций оценивали под микроскопом в экспериментальных и пилотных исследованиях на токсичность повторных доз, вводимых крысам и собакоподобным обезьянам. Каких-либо ROBO2-Fc 2.2-ассоциированных изменений на участках IV-инъекций у крыс не наблюдалось. ROBO2-Fc 2.2-ассоциированные изменения наблюдались только на участках и SC-инъекций у крыс. В ETS у крыс, минимальное-умеренное подкожное периваскулярное воспаление при дозе ≥10 мг/кг/дозу SC ассоциировалось с физической травмой на участке инъекции и не рассматривалось как побочный эффект. В пилотном исследовании на крысах, повышение тяжести (умеренное) кровоизлияния не рассматривалось как побочный эффект, поскольку такой эффект лишь слегка превышал эффект, наблюдаемый у параллельного контроля и не ассоциировался с поражением ткани, которое должно быть значительно выше, как это ожидалось при проведении процедуры инъекции. Кроме того, в пилотном исследовании на крысах, ROBO2-Fc 2.2-ассоциированные поражения кожи (в дорсальной области, в грудной клетке, в области черепа или на участке инъекции) наблюдались у самцов при введении дозы 425 мг/кг/дозу SC на фазе введения доз. Эти изменения не рассматривались как побочные эффекты, поскольку частота их встречаемости лишь слегка превышала частоту у контрольной группы и спорадически наблюдалась на фазе введения доз.
[0318] У собакоподобных обезьян не наблюдалось каких-либо ROBO2-Fc 2.2-ассоциированных изменений на участках IV-инъекций. Кровоизлияние и/или нейтрофильное воспаление различной тяжести, наблюдаемое на участках IV-инъекций у большинства животных, включая контроль, при проведении ETS в дозах до 200 мг/кг/дозу IV, не рассматривалось как ассоциированное с ROBO2-Fc 2.2, и при этом не наблюдалось каких-либо ROBO2-Fc 2.2-ассоциированных изменений на участках IV-инъекций в пилотном исследовании на собакоподобных обезьянах в дозах до 300 мг/кг/дозу IV. Каких-либо ROBO2-Fc 2.2-ассоциированных изменений на участках SC-инъекций у обезьян не наблюдалось.
III. Анализы на высвобождение цитокинов
[0319] В анализе на высвобождение цитокинов in vitro (CRA), проводимом с использованием проб цельной крови, взятых у человека, ROBO2-Fc 2.2 способствовал продуцированию фактора некроза опухоли-альфа (TNF-α) и интерлейкина-6 (IL-6) в пробах цельной крови, взятых у 1 из 8 людей-доноров, участвующих в испытании. В пробах цельной крови человека, инкубированных с ROBO2-Fc 2.2, какого-либо ROBO2-Fc 2.2-ассоциированного высвобождения интерферона-гамма (IFN-γ) не наблюдалось.
[0320] В анализе CRA in vitro, проводимом с использованием проб цельной крови, взятых у собакоподобных обезьян до начала введения доз, ROBO2-Fc 2.2 стимулировал продуцирование IL-6 в пробах цельной крови, взятых у 1 из 12 тестируемых собакоподобных обезьян, и при этом, какого-либо ROBO2-Fc 2.2-ассоциированного высвобождения TNF-α или IFN-γ не наблюдалось.
[0321] Кроме того, пробы крови брали у собакоподобных обезьян в ETS после введения ROBO2-Fc 2.2 один раз в неделю в дозе 10 мг/кг/дозу SC или 50 или 200 мг/кг/дозу IV для характеризации изменений концентраций цитокинов. Каких-либо ROBO2-Fc 2.2-ассоциированных изменений концентраций TNF-α, IL-6 или IFN-γ в сыворотке не наблюдалось.
IV. Анализы на связывание с C1q и FcγR
[0322] ROBO2-Fc 2.2 оценивали in vitro в ELISA-анализе на связывание с белком комплемента 1q (C1q) для тестирования его способности вырабатывать комплемент-зависимую цитотоксичность (CDC) и в анализе на связывание с рецептором кристаллизуемого фрагмента гамма (FcγR) для тестирования его способности вырабатывать антитело-зависимую клеточно-опосредуемую цитотоксичность (ADCC). ROBO2-Fc 2.2 не связывался с C1q в тестируемых концентрациях, а поэтому он рассматривался как белок, имеющий низкую способность индуцировать CDC. Связывание ROBO2-Fc 2.2 со всеми тестируемыми FcγR было аналогично связыванию, наблюдаемому для анализируемого контрольного антитела, или ниже, и ниже, чем связывание с антителом позитивного контроля. Эти данные позволяют предположить, что ROBO2-Fc 2.2 обладает низкой способностью вырабатывать ADCC-активность.
V. Взаимосвязь изменений и фармакокинетики
[0323] Воздействие ROBO2-Fc 2.2 (оцениваемое по Cmax и AUC) увеличивалось по мере увеличения дозы приблизительно прямо пропорционально после повторного введения доз IV и SC крысам и собакоподобным обезьянам в интервале тестируемых доз. Каких-либо явных ассоциированных с полом различий наблюдаемых воздействий не обнаруживалось. Пороговые концентрации ROBO2-Fc 2.2, ассоциированные с ключевыми ответами, и вычисленные пределы экспозиции, по сравнению с этими ключевыми ответами, можно найти в Таблице 22.
Таблица 22. Концентрации ROBO2-Fc 2.2, ассоциированные с ключевыми ответами
Таблица 22. Концентрации ROBO2-Fc 2.2, ассоциированные с ключевыми ответами (продолжение)
M = самцы; NOAEL = отсутствие наблюдаемых побочных эффектов; SC=подкожно; SG = удельный вес; TP = общай белок; TRIG=триглицерид.
а. Величины AUC и Cmax означают средние концентрации в сыворотке. Зарегистрированные величины были получены почти по окончании эксперимента.
b. Пограничные экспозиции были вычислены в исследованиях на токсичность у животных путем деления величин Cmax и AUClast на экспериментальную Cmax у человека, равную 18,2 мкг/мл, и AUClast, = 1610 мкг*ч/мл в экспериментальной эффективной дозе для человека 2 мг/кг [150 мг], вводимой SC еженедельно.
[0324] В целом, эти данные позволяют предположить, что ROBO2–Fc 2.2 представляет собой терапевтическое средство, которое может быть использовано для лечения различных заболеваний, расстройств и состояний у человека.
[0325] Таким образом, настоящее изобретение было широко раскрыто и проиллюстрировано со ссылкой на описанные выше репрезентативные варианты осуществления изобретения. Специалисту в данной области очевидно, что в настоящее изобретение могут быть внесены различные модификации, не выходящие за рамки существа и объема изобретения. Все публикации, патентные заявки и выданные патенты вводятся в настоящее описание посредством ссылки, так, как если бы каждая отдельная публикация, патентная заявка или выданный патент были конкретно и отдельно включены в настоящще описание посредством ссылки в полном объеме. Определения, имеющиеся в тексте, включенном посредством ссылки, должны быть исключены, если они противоречат определениям, приведенным в настоящей заявке.
[0326] Следует отметить, что некоторые признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления изобретения, могут быть также представлены в комбинации в одном варианте осуществления изобретения. И наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления изобретения, могут быть также представлены отдельно или в любой подходящей субкомбинации.
[0327] В частности, предусматривается, что любое ограничение, обсуждаемое для одного варианта осуществления изобретения, может быть применимо и к любому другому варианту осуществления изобретения. Кроме того, любая композиция согласно изобретению может быть использована в любом способе согласно изобретению, и любой способ согласно изобретению может быть применен для получения или использования любой композиции согласно изобретению. В частности, любой аспект изобретения, описанный в формуле изобретения и взятый отдельно или в комбинации с одним или более дополнительными пунктами формулы изобретения и/или аспектами описания, следует рассматривать как аспекты, которые могут быть объединены с другими аспектами изобретения, представленными в формуле изобретения, и/или в описании изобретения, и/или в списках последовательностей, и/или в описании чертежей.
[0328] Если конкретно приведенные здесь примеры не входят в объем настоящего изобретения, то указанный конкретный пример может быть полностью исключен из притязаний.
[0329] Используемый здесь союз «или» означает «и/или», и если это не оговорено особо, имеет только разделительный смысл или взаимоисключающий смысл, хотя в настоящем описании имеются определения, которые имеют только разделительный смысл и «и/или». Используемые в данном описании артикли «а» или «an» могут означать один или более, если это не оговорено особо. Артикли «а» или «an», если они используются в формуле изобретения в сочетании со словом «содержащий», могут означать один или более, чем один. Используемое здесь слово «другой» может означать по меньшей мере второй или более. Если это конкретно не определено в настоящем изобретении, то научные и технические термины, используемые в настоящем изобретении, имеют свое общепринятое значение, понятное специалисту в данной области. Кроме того, если это не противоречит контексту изобретения, то термины, употребляемые в единственном числе, могут относиться и к существительным во множественном числе, а термины, употребляемые во множественном числе, могут относиться к существительным в единственном числе. Слова «содержит/содержащий» и слова «имеющий/включающий», если они используются в настоящем изобретении, указывают на конкретное присутствие заявленных признаков, целых чисел, стадий или компонентов, но не исключают присутствие или добавление одного или более других признаков, целых чисел, стадий, компонентов или групп.
[0330] Хотя раскрытое здесь описание приводится со ссылкой на различные применения, способы и композиции, однако, очевидно, что в настоящее изобретение могут быть внесены различные изменения и модификации, не выходящие за рамки описанного здесь изобретения и описанной ниже формулы изобретения. Примеры приводятся для лучшей иллюстрации раскрытого описания и не рассматриваются как ограничение объема представленного здесь изобретения. Хотя настоящее описание представлено на этих репрезентативных вариантах осуществления изобретения, однако, в него могут быть внесены различные изменения и модификации, которые могут быть осуществлены без излишнего экспериментирования. Все такие изменения и модификации входят в объем настоящего изобретения.
[0331] Если аспекты или варианты осуществления изобретения описаны на примере «группы Маркуша» или других альтернативных групп, то настоящее изобретение охватывает не только целую группу, представленную как единое целое, но также как каждый отдельный член этой группы и всех возможных подгрупп главной группы, и как главная группа, не содержащая одного или более членов этой группы. В настоящем изобретении также рассматривается полное исключение одного или более любых членов группы, имеющихся в заявленном изобретении.
[0332] Все цитируемые здесь документы, включая патенты, патентные заявки, статьи, руководства и т.п. и цитируемые в них ссылки, если они еще не были введены, вводятся в настоящее описание в полном объеме. В случае, если один или более включенных документов и аналогичных материалов отличаются от документов и материалов настоящей заявки или противоречат им, включая, но не ограничиваясь ими, определенные термины, употребление этих терминов, описанные методы или т.п., то следует отдать предпочтение терминам, используемым в настоящей заявке.
[0333] В описании и в примерах подробно представлены некоторые конкретные варианты осуществления изобретения и описан наилучший способ, рассматриваемый авторами изобретения. Однако, следует отметить, что в описании изобретения могут и не приводиться детали этих вариантов, а поэтому настоящее изобретение может быть осуществлено любыми способами и должно рассматриваться в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
Таблица 23. Последовательности
(Лидерная последовательность ROBO2 подчеркнута)
SRLRQEDFPPRIVEHPSDVIVSKGEPTTLNCKAEGRPTPTIEWYKDGERVETDKDDPRSHRMLLPSGSLFFLRIVHGRRSKPDEGSYVCVARNYLGEAVSRNASLEVALLRDDFRQNPTDVVVAAGEPAILECQPPRGHPEPTIYWKKDKVRIDDKEERISIRGGKLMISNTRKSDAGMYTCVGTNMVGERDSDPAELTVFERPTFLRRPINQVVLEEEAVEFRCQVQGDPQPTVRWKKDDADLPRGRYDIKDDYTLRIKKTMSTDEGTYMCIAENRVGKMEASATLTVRAPPQFVVRPRDQIVAQGRTVTFPCETKGNPQPAVFWQKEGSQNLLFPNQPQQPNSRCSVSPTGDLTITNIQRSDAGYYICQALTVAGSILAKAQLEVTDVLTDRPPPIILQGPANQTLAVDGTALLKCKATGDPLPVISWLKEGFTFPGRDPRATIQEQGTLQIKNLRISDTGTYTCVATSSSGETSWSAVLDVTESGATISKNYDLSDLPGPPSKPQVTDVTKNSVTLSWQPGTPGTLPASAYIIEAFSQSVSNSWQTVANHVKTTLYTVRGLRPNTIYLFMVRAINPQGLSDPSPMSDPVRTQDISPPAQGVDHRQVQKELGDVLVRLHNPVVLTPTTVQVTWTVDRQPQFIQGYRVMYRQTSGLQATSSWQNLDAKVPTERSAVLVNLKKGVTYEIKVRPYFNEFQGMDSESKTVRTTEEAPSAPPQSVTVLTVGSYNSTSISVSWDPPPPDHQNGIIQEYKIWCLGNETRFHINKTVDAAIRSVIIGGLFPGIQYRVEVAASTSAGVGVKSEPQPIIIGRRNEVVITENNNSITEQITDVVKQPAFIAGIGGACWVILMGFSIWLYWRRKKRKGLSNYAVTFQRGDGGLMSNGSRPGLLNAGDPSYPWLADSWPATSLPVNNSNSGPNEIGNFGRGDVLPPVPGQGDKTATMLSDGAIYSSIDFTTKTSYNSSSQITQATPYATTQILHSNSIHELAVDLPDPQWKSSIQQKTDLMGFGYSLPDQNKGNNGGKGGKKKKNKNSSKPQKNNGSTWANVPLPPPPVQPLPGTELEHYAVEQQENGYDSDSWCPPLPVQTYLHQGLEDELEEDDDRVPTPPVRGVASSPAISFGQQSTATLTPSPREEMQPMLQAHLDELTRAYQFDIAKQTWHIQSNNQPPQPPVPPLGYVSGALISDLETDVADDDADDEEEALEIPRPLRALDQTPGSSMDNLDSSVTGKAFTSSQRPRPTSPFSTDSNTSAALSQSQRPRPTKKHKGGRMDQQPALPHRREGMTDEEALVPYSKPSFPSPGGHSSSGTASSKGSTGPRKTEVLRAGHQRNASDLLDIGYMGSNSQGQFTGEL
Таблица 24. Объяснения к последовательностям ID
Х = Компонент, не являющийся частью конструкции.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PFIZER INC.
BOSTON MEDICAL CENTER CORPORATION
<120> РЕКОМБИНАНТНЫЕ БЕЛКИ ROBO2, КОМПОЗИЦИИ, СПОСОБЫ И ИХ
ПРИМЕНЕНИЕ
<130> PCFC-0043-WO1
<140>
<141>
<150> 62/663,082
<151> 2018-04-26
<150> 62/514,242
<151> 2017-06-02
<160> 25
<170> PatentIn version 3.5
<210> 1
<211> 440
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 1
Ser Arg Leu Arg Gln Glu Asp Phe Pro Pro Arg Ile Val Glu His Pro
1 5 10 15
Ser Asp Val Ile Val Ser Lys Gly Glu Pro Thr Thr Leu Asn Cys Lys
20 25 30
Ala Glu Gly Arg Pro Thr Pro Thr Ile Glu Trp Tyr Lys Asp Gly Glu
35 40 45
Arg Val Glu Thr Asp Lys Asp Asp Pro Arg Ser His Arg Met Leu Leu
50 55 60
Pro Ser Gly Ser Leu Phe Phe Leu Arg Ile Val His Gly Arg Arg Ser
65 70 75 80
Lys Pro Asp Glu Gly Ser Tyr Val Cys Val Ala Arg Asn Tyr Leu Gly
85 90 95
Glu Ala Val Ser Arg Asn Ala Ser Leu Glu Val Ala Leu Leu Arg Asp
100 105 110
Asp Phe Arg Gln Asn Pro Thr Asp Val Val Val Ala Ala Gly Glu Pro
115 120 125
Ala Ile Leu Glu Cys Gln Pro Pro Arg Gly His Pro Glu Pro Thr Ile
130 135 140
Tyr Trp Lys Lys Asp Lys Val Arg Ile Asp Asp Lys Glu Glu Arg Ile
145 150 155 160
Ser Ile Arg Gly Gly Lys Leu Met Ile Ser Asn Thr Arg Lys Ser Asp
165 170 175
Ala Gly Met Tyr Thr Cys Val Gly Thr Asn Met Val Gly Glu Arg Asp
180 185 190
Ser Asp Pro Ala Glu Leu Thr Val Phe Glu Arg Gly Gly Ser Gly Gly
195 200 205
Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
210 215 220
Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
340 345 350
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 2
<211> 432
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 2
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu Val Ala Leu Leu Arg Asp Asp Phe Arg Gln Asn Pro Thr Asp Val
100 105 110
Val Val Ala Ala Gly Glu Pro Ala Ile Leu Glu Cys Gln Pro Pro Arg
115 120 125
Gly His Pro Glu Pro Thr Ile Tyr Trp Lys Lys Asp Lys Val Arg Ile
130 135 140
Asp Asp Lys Glu Glu Arg Ile Ser Ile Arg Gly Gly Lys Leu Met Ile
145 150 155 160
Ser Asn Thr Arg Lys Ser Asp Ala Gly Met Tyr Thr Cys Val Gly Thr
165 170 175
Asn Met Val Gly Glu Arg Asp Ser Asp Pro Ala Glu Leu Thr Val Phe
180 185 190
Glu Arg Gly Gly Ser Gly Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser
210 215 220
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
225 230 235 240
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
245 250 255
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
260 265 270
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
275 280 285
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
290 295 300
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
305 310 315 320
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
325 330 335
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
340 345 350
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
355 360 365
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
370 375 380
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
385 390 395 400
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
405 410 415
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425 430
<210> 3
<211> 428
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 3
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu Val Ala Leu Leu Arg Asp Asp Phe Arg Gln Asn Pro Thr Asp Val
100 105 110
Val Val Ala Ala Gly Glu Pro Ala Ile Leu Glu Cys Gln Pro Pro Arg
115 120 125
Gly His Pro Glu Pro Thr Ile Tyr Trp Lys Lys Asp Lys Val Arg Ile
130 135 140
Asp Asp Lys Glu Glu Arg Ile Ser Ile Arg Gly Gly Lys Leu Met Ile
145 150 155 160
Ser Asn Thr Arg Lys Ser Asp Ala Gly Met Tyr Thr Cys Val Gly Thr
165 170 175
Asn Met Val Gly Glu Arg Asp Ser Asp Pro Ala Glu Leu Thr Gly Gly
180 185 190
Ser Gly Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro
195 200 205
Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe
210 215 220
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
225 230 235 240
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
245 250 255
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
260 265 270
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
275 280 285
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
290 295 300
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
305 310 315 320
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
325 330 335
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
340 345 350
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
355 360 365
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
370 375 380
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
385 390 395 400
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
405 410 415
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425
<210> 4
<211> 340
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 4
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu Val Ala Leu Leu Arg Gly Gly Ser Gly Gly Ser Glu Pro Lys Ser
100 105 110
Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
115 120 125
Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
130 135 140
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
145 150 155 160
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
165 170 175
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
180 185 190
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
195 200 205
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
210 215 220
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
225 230 235 240
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
245 250 255
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
260 265 270
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
275 280 285
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
290 295 300
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
305 310 315 320
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
325 330 335
Ser Pro Gly Lys
340
<210> 5
<211> 335
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 5
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu Gly Gly Ser Gly Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr His
100 105 110
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
115 120 125
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
130 135 140
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
145 150 155 160
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
165 170 175
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
180 185 190
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
195 200 205
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
210 215 220
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
225 230 235 240
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
245 250 255
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
260 265 270
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
275 280 285
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
290 295 300
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
305 310 315 320
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330 335
<210> 6
<211> 517
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 6
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu Val Ala Leu Leu Arg Asp Asp Phe Arg Gln Asn Pro Thr Asp Val
100 105 110
Val Val Ala Ala Gly Glu Pro Ala Ile Leu Glu Cys Gln Pro Pro Arg
115 120 125
Gly His Pro Glu Pro Thr Ile Tyr Trp Lys Lys Asp Lys Val Arg Ile
130 135 140
Asp Asp Lys Glu Glu Arg Ile Ser Ile Arg Gly Gly Lys Leu Met Ile
145 150 155 160
Ser Asn Thr Arg Lys Ser Asp Ala Gly Met Tyr Thr Cys Val Gly Thr
165 170 175
Asn Met Val Gly Glu Arg Asp Ser Asp Pro Ala Glu Leu Thr Val Phe
180 185 190
Glu Arg Pro Thr Phe Leu Arg Arg Pro Ile Asn Gln Val Val Leu Glu
195 200 205
Glu Glu Ala Val Glu Phe Arg Cys Gln Val Gln Gly Asp Pro Gln Pro
210 215 220
Thr Val Arg Trp Lys Lys Asp Asp Ala Asp Leu Pro Arg Gly Arg Tyr
225 230 235 240
Asp Ile Lys Asp Asp Tyr Thr Leu Arg Ile Lys Lys Thr Met Ser Thr
245 250 255
Asp Glu Gly Thr Tyr Met Cys Ile Ala Glu Asn Arg Val Gly Lys Met
260 265 270
Glu Ala Ser Ala Thr Leu Thr Gly Gly Ser Gly Gly Ser Glu Pro Lys
275 280 285
Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala
290 295 300
Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
305 310 315 320
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
325 330 335
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
340 345 350
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
355 360 365
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
370 375 380
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
385 390 395 400
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
405 410 415
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
420 425 430
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
435 440 445
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
450 455 460
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
465 470 475 480
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
485 490 495
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
500 505 510
Leu Ser Pro Gly Lys
515
<210> 7
<211> 617
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 7
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu Val Ala Leu Leu Arg Asp Asp Phe Arg Gln Asn Pro Thr Asp Val
100 105 110
Val Val Ala Ala Gly Glu Pro Ala Ile Leu Glu Cys Gln Pro Pro Arg
115 120 125
Gly His Pro Glu Pro Thr Ile Tyr Trp Lys Lys Asp Lys Val Arg Ile
130 135 140
Asp Asp Lys Glu Glu Arg Ile Ser Ile Arg Gly Gly Lys Leu Met Ile
145 150 155 160
Ser Asn Thr Arg Lys Ser Asp Ala Gly Met Tyr Thr Cys Val Gly Thr
165 170 175
Asn Met Val Gly Glu Arg Asp Ser Asp Pro Ala Glu Leu Thr Val Phe
180 185 190
Glu Arg Pro Thr Phe Leu Arg Arg Pro Ile Asn Gln Val Val Leu Glu
195 200 205
Glu Glu Ala Val Glu Phe Arg Cys Gln Val Gln Gly Asp Pro Gln Pro
210 215 220
Thr Val Arg Trp Lys Lys Asp Asp Ala Asp Leu Pro Arg Gly Arg Tyr
225 230 235 240
Asp Ile Lys Asp Asp Tyr Thr Leu Arg Ile Lys Lys Thr Met Ser Thr
245 250 255
Asp Glu Gly Thr Tyr Met Cys Ile Ala Glu Asn Arg Val Gly Lys Met
260 265 270
Glu Ala Ser Ala Thr Leu Thr Val Arg Ala Pro Pro Gln Phe Val Val
275 280 285
Arg Pro Arg Asp Gln Ile Val Ala Gln Gly Arg Thr Val Thr Phe Pro
290 295 300
Cys Glu Thr Lys Gly Asn Pro Gln Pro Ala Val Phe Trp Gln Lys Glu
305 310 315 320
Gly Ser Gln Asn Leu Leu Phe Pro Asn Gln Pro Gln Gln Pro Asn Ser
325 330 335
Arg Cys Ser Val Ser Pro Thr Gly Asp Leu Thr Ile Thr Asn Ile Gln
340 345 350
Arg Ser Asp Ala Gly Tyr Tyr Ile Cys Gln Ala Leu Thr Val Ala Gly
355 360 365
Ser Ile Leu Ala Lys Ala Gln Leu Glu Val Thr Gly Gly Ser Gly Gly
370 375 380
Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
385 390 395 400
Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys
405 410 415
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
420 425 430
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
435 440 445
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
450 455 460
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
465 470 475 480
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
485 490 495
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
500 505 510
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
515 520 525
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
530 535 540
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
545 550 555 560
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
565 570 575
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
580 585 590
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
595 600 605
Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615
<210> 8
<211> 9
<212> PRT
<213> Homo sapiens
<400> 8
Ser Arg Leu Arg Gln Glu Asp Phe Pro
1 5
<210> 9
<211> 97
<212> PRT
<213> Homo sapiens
<400> 9
Pro Arg Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu
<210> 10
<211> 5
<212> PRT
<213> Homo sapiens
<400> 10
Val Ala Leu Leu Arg
1 5
<210> 11
<211> 88
<212> PRT
<213> Homo sapiens
<400> 11
Asp Asp Phe Arg Gln Asn Pro Thr Asp Val Val Val Ala Ala Gly Glu
1 5 10 15
Pro Ala Ile Leu Glu Cys Gln Pro Pro Arg Gly His Pro Glu Pro Thr
20 25 30
Ile Tyr Trp Lys Lys Asp Lys Val Arg Ile Asp Asp Lys Glu Glu Arg
35 40 45
Ile Ser Ile Arg Gly Gly Lys Leu Met Ile Ser Asn Thr Arg Lys Ser
50 55 60
Asp Ala Gly Met Tyr Thr Cys Val Gly Thr Asn Met Val Gly Glu Arg
65 70 75 80
Asp Ser Asp Pro Ala Glu Leu Thr
85
<210> 12
<211> 4
<212> PRT
<213> Homo sapiens
<400> 12
Val Phe Glu Arg
1
<210> 13
<211> 85
<212> PRT
<213> Homo sapiens
<400> 13
Pro Thr Phe Leu Arg Arg Pro Ile Asn Gln Val Val Leu Glu Glu Glu
1 5 10 15
Ala Val Glu Phe Arg Cys Gln Val Gln Gly Asp Pro Gln Pro Thr Val
20 25 30
Arg Trp Lys Lys Asp Asp Ala Asp Leu Pro Arg Gly Arg Tyr Asp Ile
35 40 45
Lys Asp Asp Tyr Thr Leu Arg Ile Lys Lys Thr Met Ser Thr Asp Glu
50 55 60
Gly Thr Tyr Met Cys Ile Ala Glu Asn Arg Val Gly Lys Met Glu Ala
65 70 75 80
Ser Ala Thr Leu Thr
85
<210> 14
<211> 100
<212> PRT
<213> Homo sapiens
<400> 14
Val Arg Ala Pro Pro Gln Phe Val Val Arg Pro Arg Asp Gln Ile Val
1 5 10 15
Ala Gln Gly Arg Thr Val Thr Phe Pro Cys Glu Thr Lys Gly Asn Pro
20 25 30
Gln Pro Ala Val Phe Trp Gln Lys Glu Gly Ser Gln Asn Leu Leu Phe
35 40 45
Pro Asn Gln Pro Gln Gln Pro Asn Ser Arg Cys Ser Val Ser Pro Thr
50 55 60
Gly Asp Leu Thr Ile Thr Asn Ile Gln Arg Ser Asp Ala Gly Tyr Tyr
65 70 75 80
Ile Cys Gln Ala Leu Thr Val Ala Gly Ser Ile Leu Ala Lys Ala Gln
85 90 95
Leu Glu Val Thr
100
<210> 15
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 15
Gly Gly Ser Gly Gly Ser
1 5
<210> 16
<211> 232
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 16
Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 17
<211> 21
<212> PRT
<213> Homo sapiens
<400> 17
Met Ser Leu Leu Met Phe Thr Gln Leu Leu Leu Cys Gly Phe Leu Tyr
1 5 10 15
Val Arg Val Asp Gly
20
<210> 18
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 18
Met Gly Trp Ser Cys Ile Ile Phe Leu Val Ala Thr Ala Gly Ala His
1 5 10 15
Ser
<210> 19
<211> 441
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 19
Ser Arg Leu Arg Gln Glu Asp Phe Pro Pro Arg Ile Val Glu His Pro
1 5 10 15
Thr Asp Val Ile Val Ser Lys Gly Glu Pro Thr Thr Leu Asn Cys Lys
20 25 30
Ala Glu Gly Arg Pro Thr Pro Thr Ile Glu Trp Tyr Lys Asp Gly Glu
35 40 45
Arg Val Glu Thr Asp Lys Asp Asp Pro Arg Ser His Arg Met Leu Leu
50 55 60
Pro Ser Gly Ser Leu Phe Phe Leu Tyr Ile Val His Gly Arg Arg Ser
65 70 75 80
Lys Pro Asp Glu Gly Ser Tyr Val Cys Val Ala Arg Asn Tyr Leu Gly
85 90 95
Glu Ala Val Ser Arg Asn Ala Ser Leu Glu Val Ala Leu Leu Arg Asp
100 105 110
Asp Phe Arg Gln Asn Pro Thr Asp Val Val Val Ala Ala Gly Glu Pro
115 120 125
Ala Ile Leu Glu Cys Gln Pro Pro Arg Gly His Pro Glu Pro Thr Ile
130 135 140
Tyr Trp Lys Lys Asp Lys Val Arg Ile Asp Asp Lys Glu Glu Arg Ile
145 150 155 160
Ser Ile Arg Gly Gly Lys Leu Met Ile Ser Asn Thr Arg Lys Ser Asp
165 170 175
Ala Gly Met Tyr Thr Cys Val Gly Thr Asn Met Val Gly Glu Arg Asp
180 185 190
Ser Asp Pro Ala Glu Leu Thr Val Phe Glu Arg Gly Gly Ser Gly Gly
195 200 205
Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
210 215 220
Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
340 345 350
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 20
<211> 97
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 20
Pro Arg Ile Val Glu His Pro Thr Asp Val Ile Val Ser Lys Gly Glu
1 5 10 15
Pro Thr Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile
20 25 30
Glu Trp Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro
35 40 45
Arg Ser His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Tyr
50 55 60
Ile Val His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys
65 70 75 80
Val Ala Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu
85 90 95
Glu
<210> 21
<211> 1320
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 21
tcgcgtcttc gccaggagga ctttcccccg cggattgtgg agcatccttc cgatgtcatc 60
gtctctaagg gcgagcccac gactctgaac tgcaaggcgg agggccggcc aacgcccacc 120
attgagtggt acaaagatgg ggagcgagtg gagactgaca aggacgatcc ccggtcccac 180
aggatgcttc tgcccagcgg atccttattc ttcttgcgca tcgtgcacgg gcgcaggagt 240
aaacctgatg aaggaagcta cgtttgtgtt gcgaggaact atcttggtga agcagtgagt 300
cgaaatgcgt ctctggaagt ggcattgtta cgagatgact tccgacaaaa ccccacagat 360
gttgtagtgg cagctggaga gcctgcaatc ctggagtgcc agcctccccg gggacaccca 420
gaacccacca tctactggaa aaaagacaaa gttcgaattg atgacaagga agaaagaata 480
agtatccgtg gtggaaaact gatgatctcc aataccagga aaagtgatgc agggatgtat 540
acttgtgttg gtaccaatat ggtgggagaa agggacagtg acccagcaga gctgactgtc 600
tttgaacgag gcggcagcgg cggcagcgag cccaaatctt ctgacaaaac tcacacatgc 660
ccaccgtgcc cagcacctga agctgcaggg gcaccgtcag tcttcctctt ccccccaaaa 720
cccaaggaca ccctcatgat ctcccggacc cctgaggtca catgcgtggt ggtggacgtg 780
agccacgaag accctgaggt caagttcaac tggtacgtgg acggcgtgga ggtgcataat 840
gccaagacaa agccgcggga ggagcagtac aacagcacgt accgtgtggt cagcgtcctc 900
accgtcctgc accaggactg gctgaatggc aaggagtaca agtgcaaggt ctccaacaaa 960
gccctcccag cccccatcga gaaaaccatc tccaaagcca aagggcagcc ccgagaacca 1020
caggtgtaca ccctgccccc atcccgggag gagatgacca agaaccaggt cagcctgacc 1080
tgcctggtca aaggcttcta tcccagcgac atcgccgtgg agtgggagag caatgggcag 1140
ccggagaaca actacaagac cacgcctccc gtgctggact ccgacggctc cttcttcctc 1200
tatagcaagc tcaccgtgga caagagcagg tggcagcagg ggaacgtctt ctcatgctcc 1260
gtgatgcatg aggctctgca caaccactac acgcagaaga gcctctccct gtcccccgga 1320
<210> 22
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> /примечание="Эта последовательность может охватывать 1-6
повторяющихся звеньев 'Gly Gly Ser'"
<400> 22
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
1 5 10 15
Gly Ser
<210> 23
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<220>
<221> MISC_FEATURE
<222> (1)..(30)
<223> /примечание="Эта последовательность может охватывать 1-6
повторяющихся звеньев 'Gly Gly Gly Gly Ser"
<400> 23
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 24
<211> 1378
<212> PRT
<213> Homo sapiens
<400> 24
Met Ser Leu Leu Met Phe Thr Gln Leu Leu Leu Cys Gly Phe Leu Tyr
1 5 10 15
Val Arg Val Asp Gly Ser Arg Leu Arg Gln Glu Asp Phe Pro Pro Arg
20 25 30
Ile Val Glu His Pro Ser Asp Val Ile Val Ser Lys Gly Glu Pro Thr
35 40 45
Thr Leu Asn Cys Lys Ala Glu Gly Arg Pro Thr Pro Thr Ile Glu Trp
50 55 60
Tyr Lys Asp Gly Glu Arg Val Glu Thr Asp Lys Asp Asp Pro Arg Ser
65 70 75 80
His Arg Met Leu Leu Pro Ser Gly Ser Leu Phe Phe Leu Arg Ile Val
85 90 95
His Gly Arg Arg Ser Lys Pro Asp Glu Gly Ser Tyr Val Cys Val Ala
100 105 110
Arg Asn Tyr Leu Gly Glu Ala Val Ser Arg Asn Ala Ser Leu Glu Val
115 120 125
Ala Leu Leu Arg Asp Asp Phe Arg Gln Asn Pro Thr Asp Val Val Val
130 135 140
Ala Ala Gly Glu Pro Ala Ile Leu Glu Cys Gln Pro Pro Arg Gly His
145 150 155 160
Pro Glu Pro Thr Ile Tyr Trp Lys Lys Asp Lys Val Arg Ile Asp Asp
165 170 175
Lys Glu Glu Arg Ile Ser Ile Arg Gly Gly Lys Leu Met Ile Ser Asn
180 185 190
Thr Arg Lys Ser Asp Ala Gly Met Tyr Thr Cys Val Gly Thr Asn Met
195 200 205
Val Gly Glu Arg Asp Ser Asp Pro Ala Glu Leu Thr Val Phe Glu Arg
210 215 220
Pro Thr Phe Leu Arg Arg Pro Ile Asn Gln Val Val Leu Glu Glu Glu
225 230 235 240
Ala Val Glu Phe Arg Cys Gln Val Gln Gly Asp Pro Gln Pro Thr Val
245 250 255
Arg Trp Lys Lys Asp Asp Ala Asp Leu Pro Arg Gly Arg Tyr Asp Ile
260 265 270
Lys Asp Asp Tyr Thr Leu Arg Ile Lys Lys Thr Met Ser Thr Asp Glu
275 280 285
Gly Thr Tyr Met Cys Ile Ala Glu Asn Arg Val Gly Lys Met Glu Ala
290 295 300
Ser Ala Thr Leu Thr Val Arg Ala Pro Pro Gln Phe Val Val Arg Pro
305 310 315 320
Arg Asp Gln Ile Val Ala Gln Gly Arg Thr Val Thr Phe Pro Cys Glu
325 330 335
Thr Lys Gly Asn Pro Gln Pro Ala Val Phe Trp Gln Lys Glu Gly Ser
340 345 350
Gln Asn Leu Leu Phe Pro Asn Gln Pro Gln Gln Pro Asn Ser Arg Cys
355 360 365
Ser Val Ser Pro Thr Gly Asp Leu Thr Ile Thr Asn Ile Gln Arg Ser
370 375 380
Asp Ala Gly Tyr Tyr Ile Cys Gln Ala Leu Thr Val Ala Gly Ser Ile
385 390 395 400
Leu Ala Lys Ala Gln Leu Glu Val Thr Asp Val Leu Thr Asp Arg Pro
405 410 415
Pro Pro Ile Ile Leu Gln Gly Pro Ala Asn Gln Thr Leu Ala Val Asp
420 425 430
Gly Thr Ala Leu Leu Lys Cys Lys Ala Thr Gly Asp Pro Leu Pro Val
435 440 445
Ile Ser Trp Leu Lys Glu Gly Phe Thr Phe Pro Gly Arg Asp Pro Arg
450 455 460
Ala Thr Ile Gln Glu Gln Gly Thr Leu Gln Ile Lys Asn Leu Arg Ile
465 470 475 480
Ser Asp Thr Gly Thr Tyr Thr Cys Val Ala Thr Ser Ser Ser Gly Glu
485 490 495
Thr Ser Trp Ser Ala Val Leu Asp Val Thr Glu Ser Gly Ala Thr Ile
500 505 510
Ser Lys Asn Tyr Asp Leu Ser Asp Leu Pro Gly Pro Pro Ser Lys Pro
515 520 525
Gln Val Thr Asp Val Thr Lys Asn Ser Val Thr Leu Ser Trp Gln Pro
530 535 540
Gly Thr Pro Gly Thr Leu Pro Ala Ser Ala Tyr Ile Ile Glu Ala Phe
545 550 555 560
Ser Gln Ser Val Ser Asn Ser Trp Gln Thr Val Ala Asn His Val Lys
565 570 575
Thr Thr Leu Tyr Thr Val Arg Gly Leu Arg Pro Asn Thr Ile Tyr Leu
580 585 590
Phe Met Val Arg Ala Ile Asn Pro Gln Gly Leu Ser Asp Pro Ser Pro
595 600 605
Met Ser Asp Pro Val Arg Thr Gln Asp Ile Ser Pro Pro Ala Gln Gly
610 615 620
Val Asp His Arg Gln Val Gln Lys Glu Leu Gly Asp Val Leu Val Arg
625 630 635 640
Leu His Asn Pro Val Val Leu Thr Pro Thr Thr Val Gln Val Thr Trp
645 650 655
Thr Val Asp Arg Gln Pro Gln Phe Ile Gln Gly Tyr Arg Val Met Tyr
660 665 670
Arg Gln Thr Ser Gly Leu Gln Ala Thr Ser Ser Trp Gln Asn Leu Asp
675 680 685
Ala Lys Val Pro Thr Glu Arg Ser Ala Val Leu Val Asn Leu Lys Lys
690 695 700
Gly Val Thr Tyr Glu Ile Lys Val Arg Pro Tyr Phe Asn Glu Phe Gln
705 710 715 720
Gly Met Asp Ser Glu Ser Lys Thr Val Arg Thr Thr Glu Glu Ala Pro
725 730 735
Ser Ala Pro Pro Gln Ser Val Thr Val Leu Thr Val Gly Ser Tyr Asn
740 745 750
Ser Thr Ser Ile Ser Val Ser Trp Asp Pro Pro Pro Pro Asp His Gln
755 760 765
Asn Gly Ile Ile Gln Glu Tyr Lys Ile Trp Cys Leu Gly Asn Glu Thr
770 775 780
Arg Phe His Ile Asn Lys Thr Val Asp Ala Ala Ile Arg Ser Val Ile
785 790 795 800
Ile Gly Gly Leu Phe Pro Gly Ile Gln Tyr Arg Val Glu Val Ala Ala
805 810 815
Ser Thr Ser Ala Gly Val Gly Val Lys Ser Glu Pro Gln Pro Ile Ile
820 825 830
Ile Gly Arg Arg Asn Glu Val Val Ile Thr Glu Asn Asn Asn Ser Ile
835 840 845
Thr Glu Gln Ile Thr Asp Val Val Lys Gln Pro Ala Phe Ile Ala Gly
850 855 860
Ile Gly Gly Ala Cys Trp Val Ile Leu Met Gly Phe Ser Ile Trp Leu
865 870 875 880
Tyr Trp Arg Arg Lys Lys Arg Lys Gly Leu Ser Asn Tyr Ala Val Thr
885 890 895
Phe Gln Arg Gly Asp Gly Gly Leu Met Ser Asn Gly Ser Arg Pro Gly
900 905 910
Leu Leu Asn Ala Gly Asp Pro Ser Tyr Pro Trp Leu Ala Asp Ser Trp
915 920 925
Pro Ala Thr Ser Leu Pro Val Asn Asn Ser Asn Ser Gly Pro Asn Glu
930 935 940
Ile Gly Asn Phe Gly Arg Gly Asp Val Leu Pro Pro Val Pro Gly Gln
945 950 955 960
Gly Asp Lys Thr Ala Thr Met Leu Ser Asp Gly Ala Ile Tyr Ser Ser
965 970 975
Ile Asp Phe Thr Thr Lys Thr Ser Tyr Asn Ser Ser Ser Gln Ile Thr
980 985 990
Gln Ala Thr Pro Tyr Ala Thr Thr Gln Ile Leu His Ser Asn Ser Ile
995 1000 1005
His Glu Leu Ala Val Asp Leu Pro Asp Pro Gln Trp Lys Ser Ser
1010 1015 1020
Ile Gln Gln Lys Thr Asp Leu Met Gly Phe Gly Tyr Ser Leu Pro
1025 1030 1035
Asp Gln Asn Lys Gly Asn Asn Gly Gly Lys Gly Gly Lys Lys Lys
1040 1045 1050
Lys Asn Lys Asn Ser Ser Lys Pro Gln Lys Asn Asn Gly Ser Thr
1055 1060 1065
Trp Ala Asn Val Pro Leu Pro Pro Pro Pro Val Gln Pro Leu Pro
1070 1075 1080
Gly Thr Glu Leu Glu His Tyr Ala Val Glu Gln Gln Glu Asn Gly
1085 1090 1095
Tyr Asp Ser Asp Ser Trp Cys Pro Pro Leu Pro Val Gln Thr Tyr
1100 1105 1110
Leu His Gln Gly Leu Glu Asp Glu Leu Glu Glu Asp Asp Asp Arg
1115 1120 1125
Val Pro Thr Pro Pro Val Arg Gly Val Ala Ser Ser Pro Ala Ile
1130 1135 1140
Ser Phe Gly Gln Gln Ser Thr Ala Thr Leu Thr Pro Ser Pro Arg
1145 1150 1155
Glu Glu Met Gln Pro Met Leu Gln Ala His Leu Asp Glu Leu Thr
1160 1165 1170
Arg Ala Tyr Gln Phe Asp Ile Ala Lys Gln Thr Trp His Ile Gln
1175 1180 1185
Ser Asn Asn Gln Pro Pro Gln Pro Pro Val Pro Pro Leu Gly Tyr
1190 1195 1200
Val Ser Gly Ala Leu Ile Ser Asp Leu Glu Thr Asp Val Ala Asp
1205 1210 1215
Asp Asp Ala Asp Asp Glu Glu Glu Ala Leu Glu Ile Pro Arg Pro
1220 1225 1230
Leu Arg Ala Leu Asp Gln Thr Pro Gly Ser Ser Met Asp Asn Leu
1235 1240 1245
Asp Ser Ser Val Thr Gly Lys Ala Phe Thr Ser Ser Gln Arg Pro
1250 1255 1260
Arg Pro Thr Ser Pro Phe Ser Thr Asp Ser Asn Thr Ser Ala Ala
1265 1270 1275
Leu Ser Gln Ser Gln Arg Pro Arg Pro Thr Lys Lys His Lys Gly
1280 1285 1290
Gly Arg Met Asp Gln Gln Pro Ala Leu Pro His Arg Arg Glu Gly
1295 1300 1305
Met Thr Asp Glu Glu Ala Leu Val Pro Tyr Ser Lys Pro Ser Phe
1310 1315 1320
Pro Ser Pro Gly Gly His Ser Ser Ser Gly Thr Ala Ser Ser Lys
1325 1330 1335
Gly Ser Thr Gly Pro Arg Lys Thr Glu Val Leu Arg Ala Gly His
1340 1345 1350
Gln Arg Asn Ala Ser Asp Leu Leu Asp Ile Gly Tyr Met Gly Ser
1355 1360 1365
Asn Ser Gln Gly Gln Phe Thr Gly Glu Leu
1370 1375
<210> 25
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетическая метка
6xHis"
<400> 25
His His His His His His
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| РЕКОМБИНАНТНЫЕ БЕЛКИ С ДОМЕНАМИ CCN И СЛИТЫЕ БЕЛКИ | 2020 |
|
RU2825102C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ CD3E/BCMA И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800164C2 |
| Белки, связывающие NKG2D, CD16 и опухолеассоциированный антиген | 2018 |
|
RU2816716C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ CD33, NKG2D И CD16 | 2018 |
|
RU2820603C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| ХИМЕРНЫЕ БЕЛКИ НА ОСНОВЕ CSF1R | 2018 |
|
RU2792239C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ КАЛЬЦИФИКАЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2757417C2 |
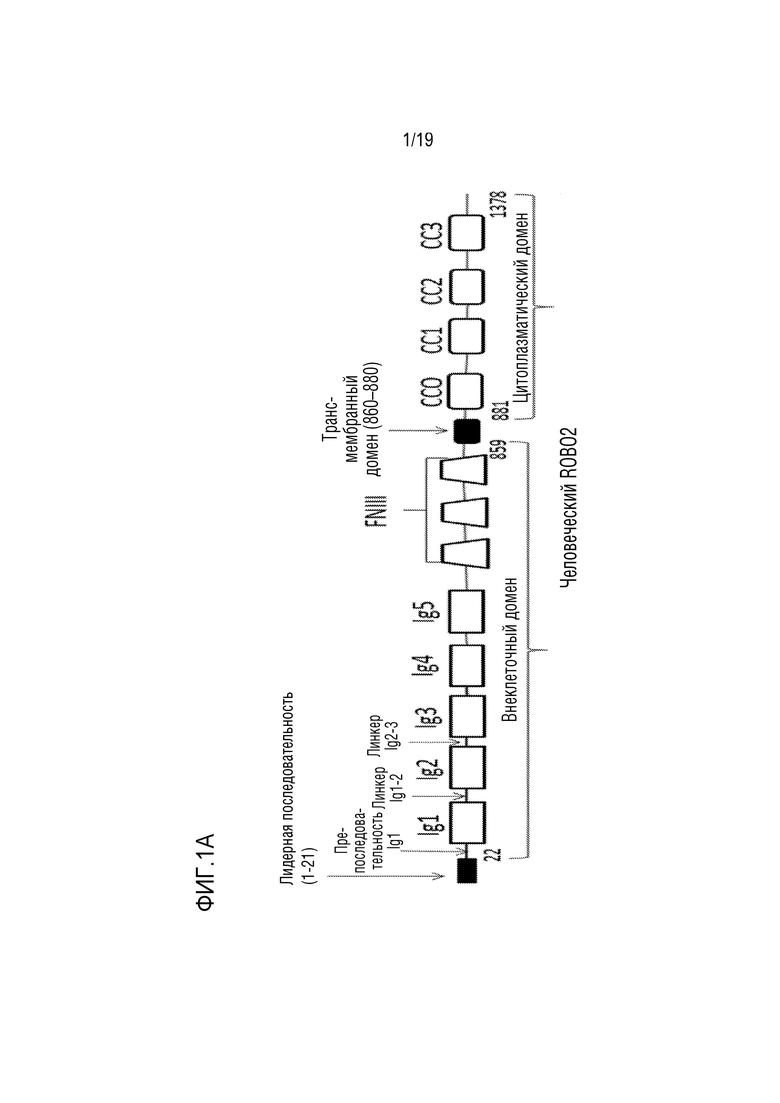
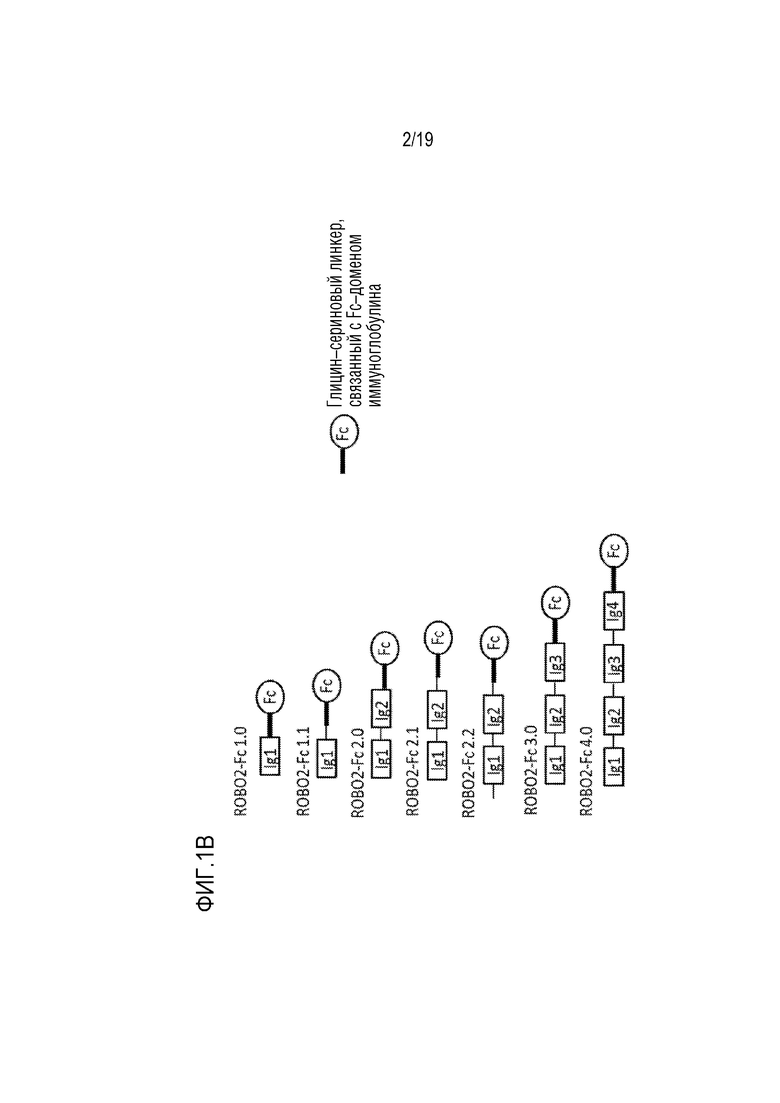

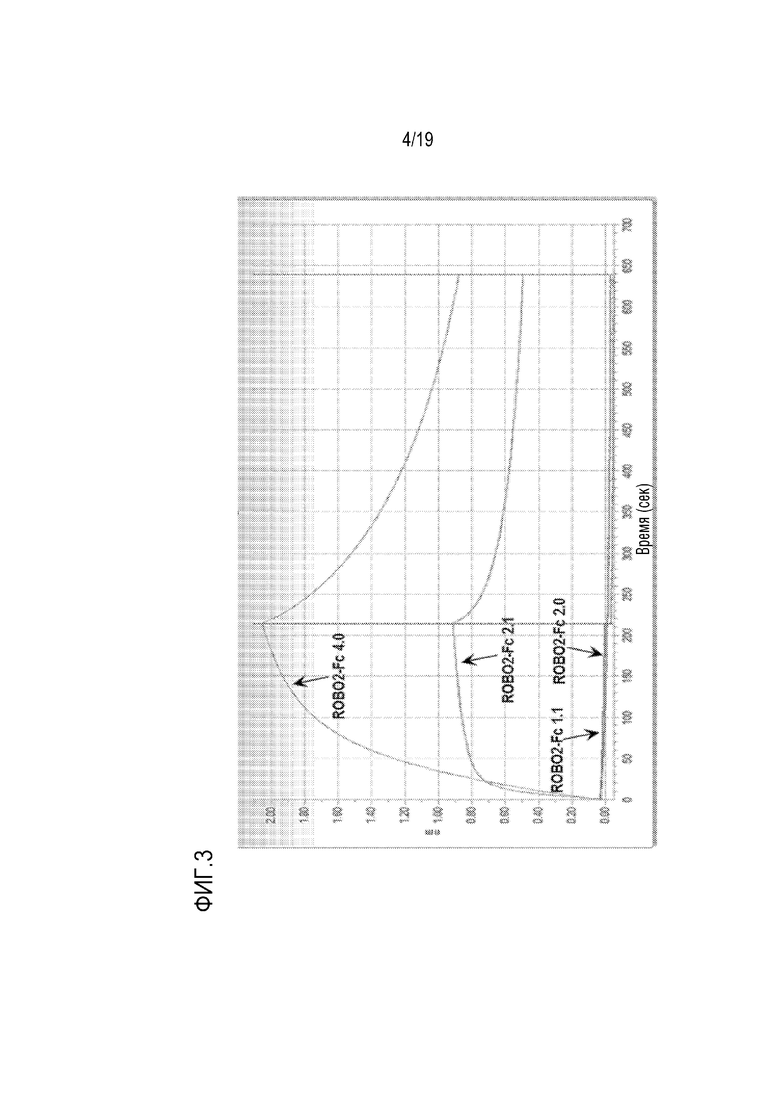
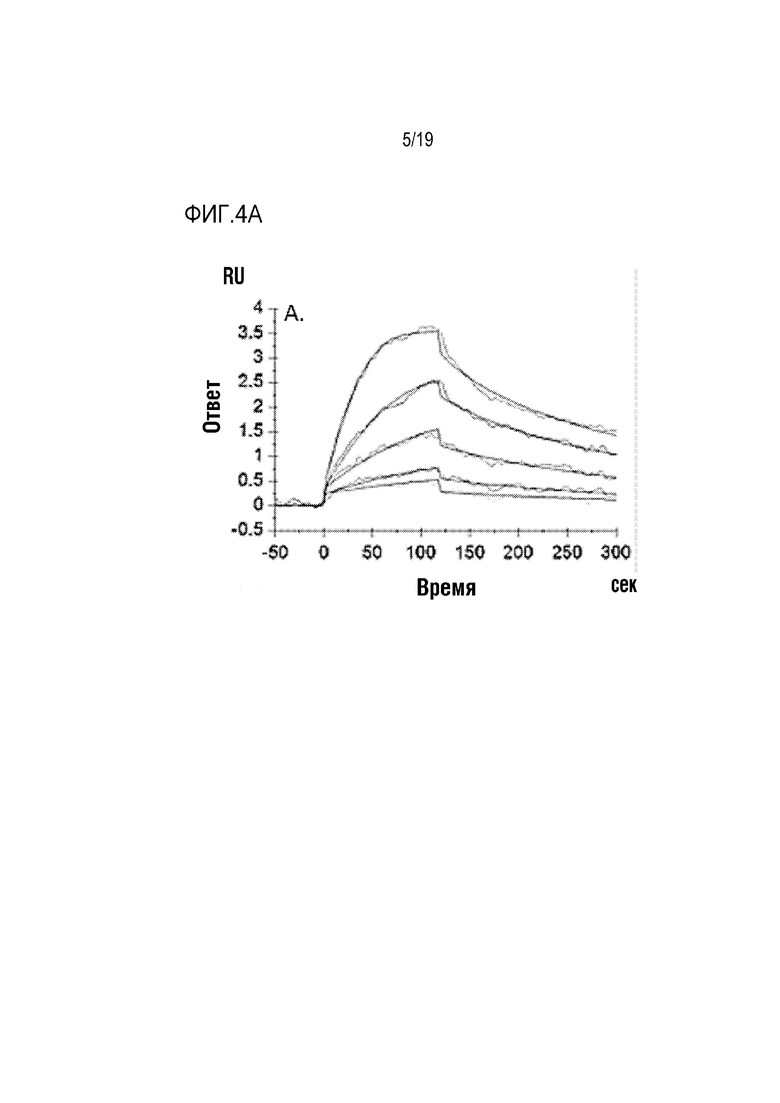
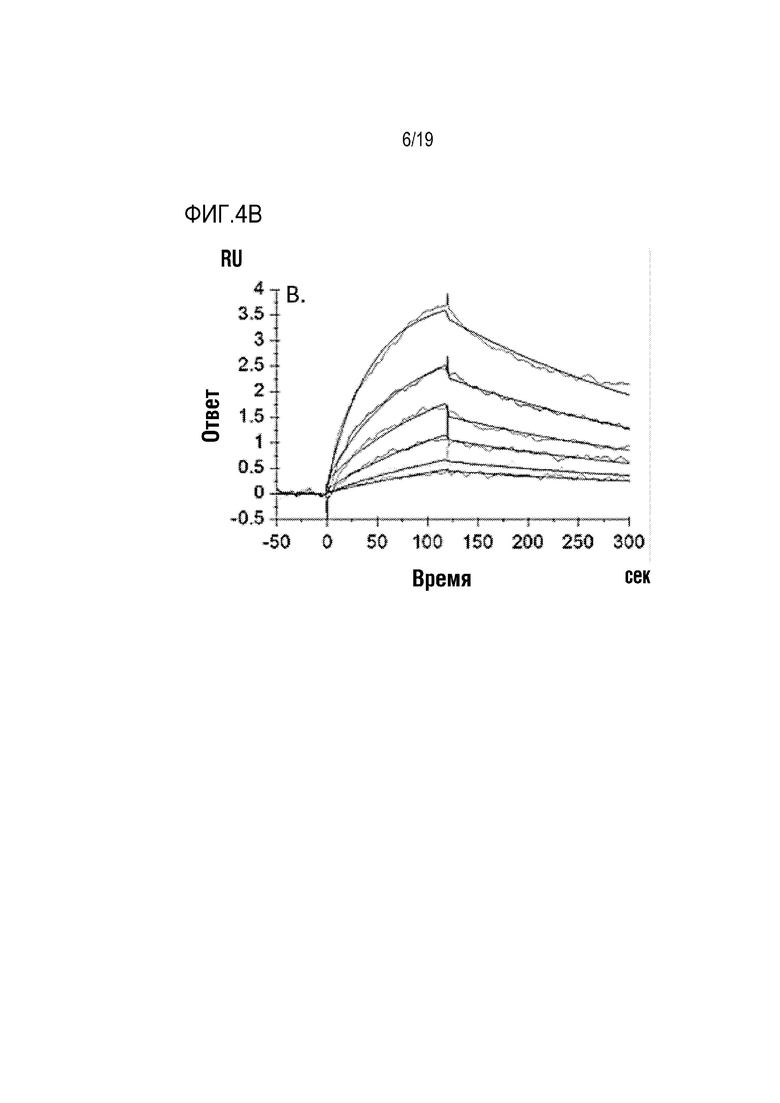
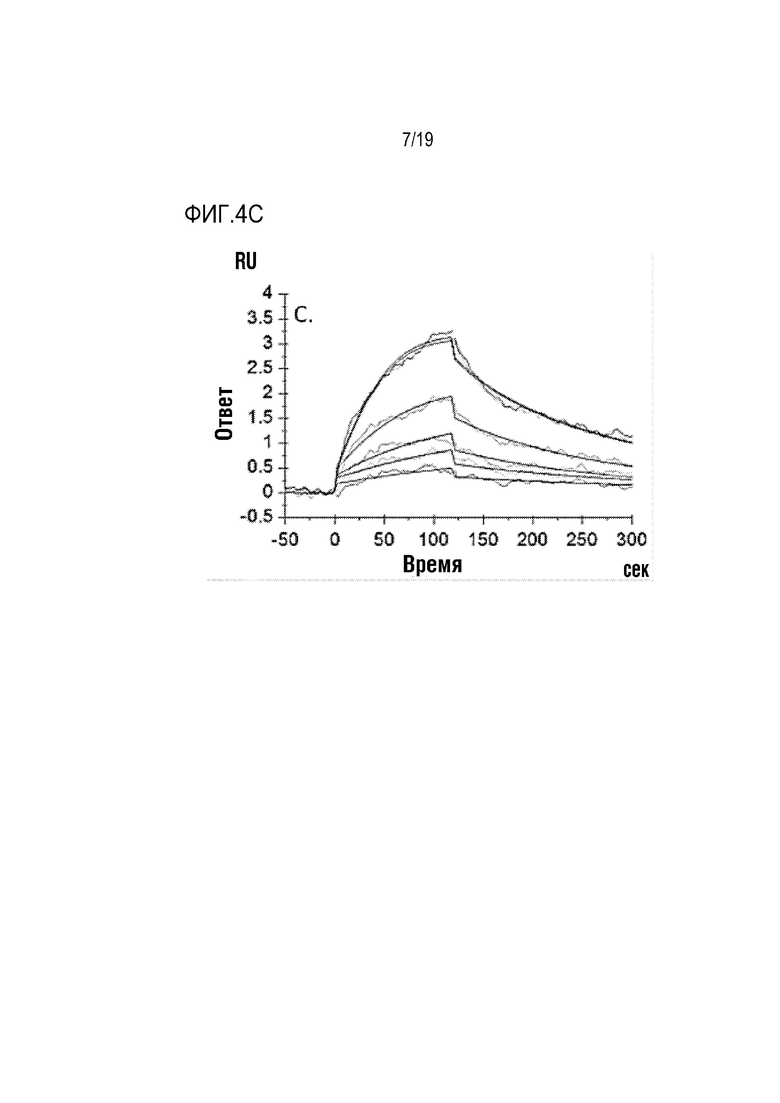
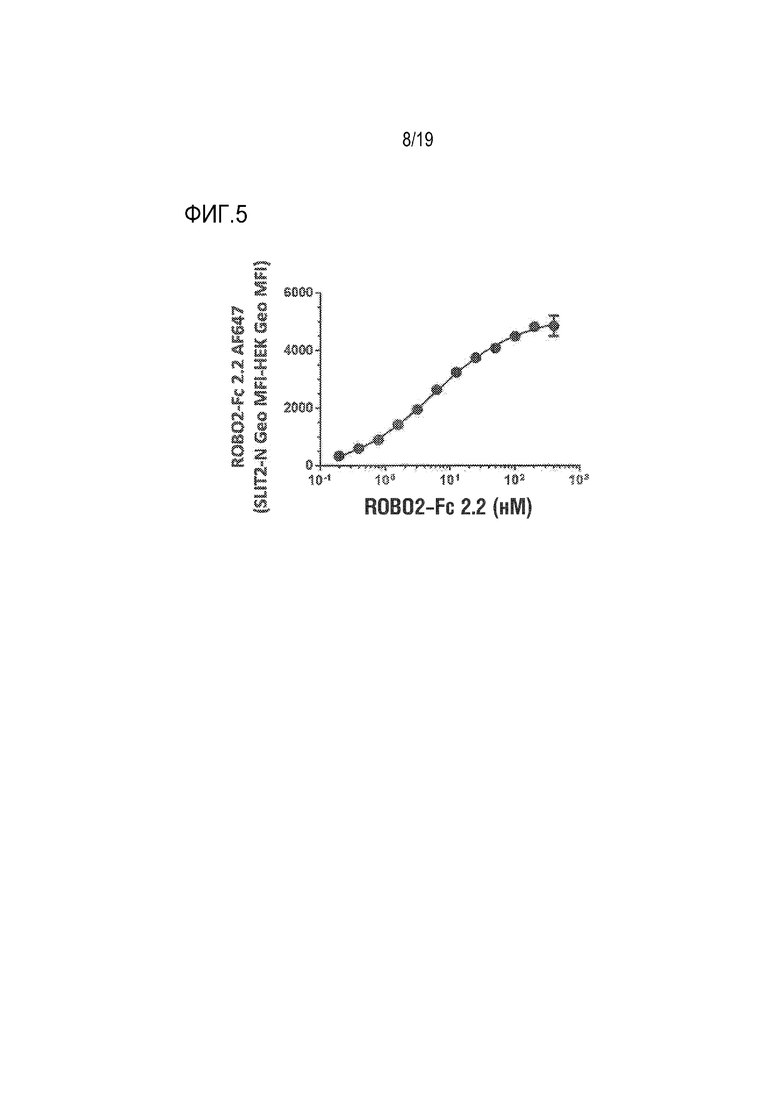
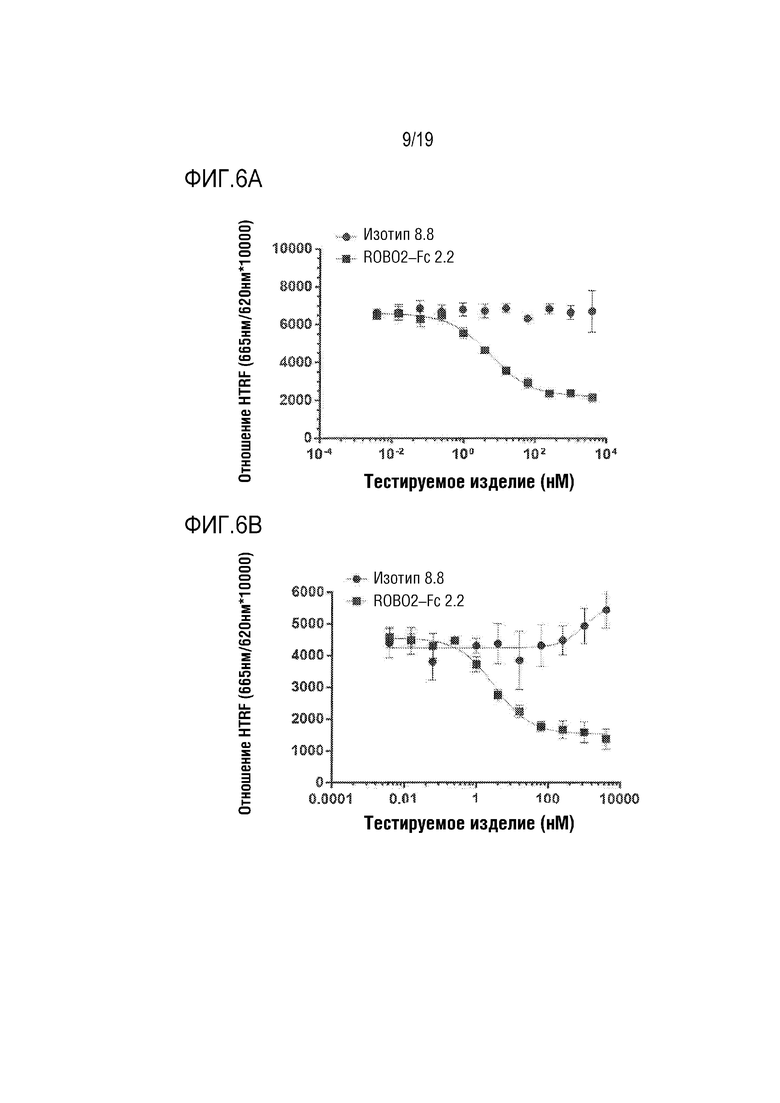
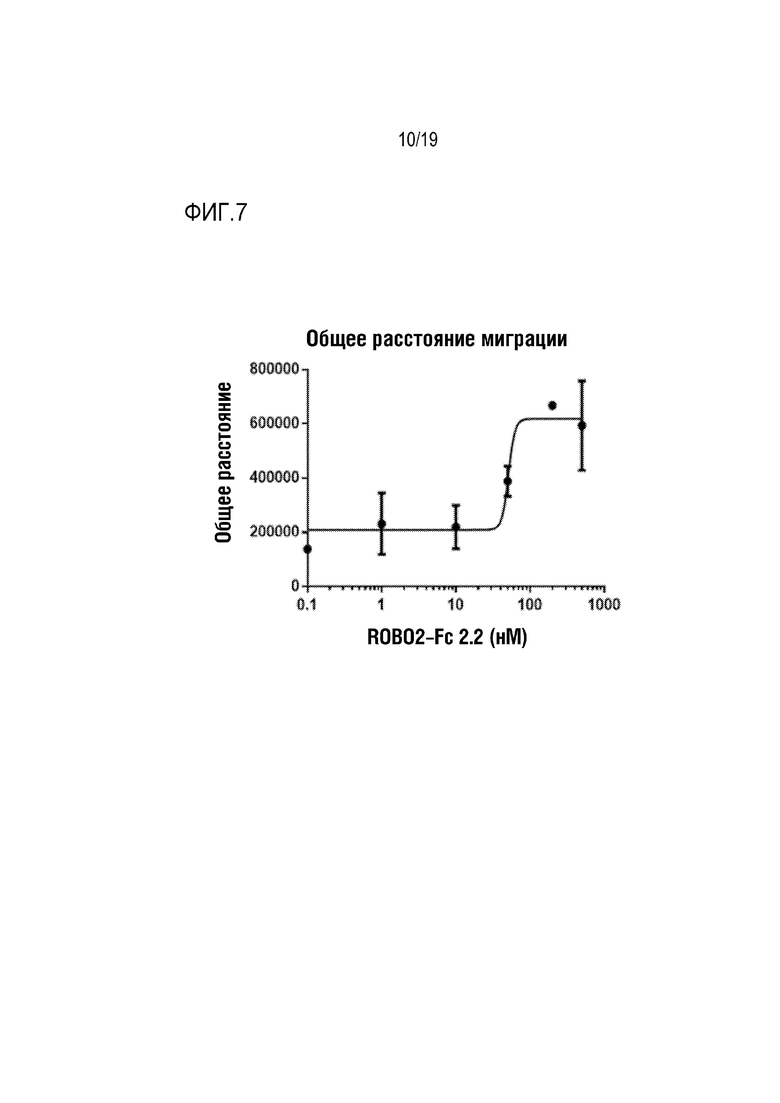
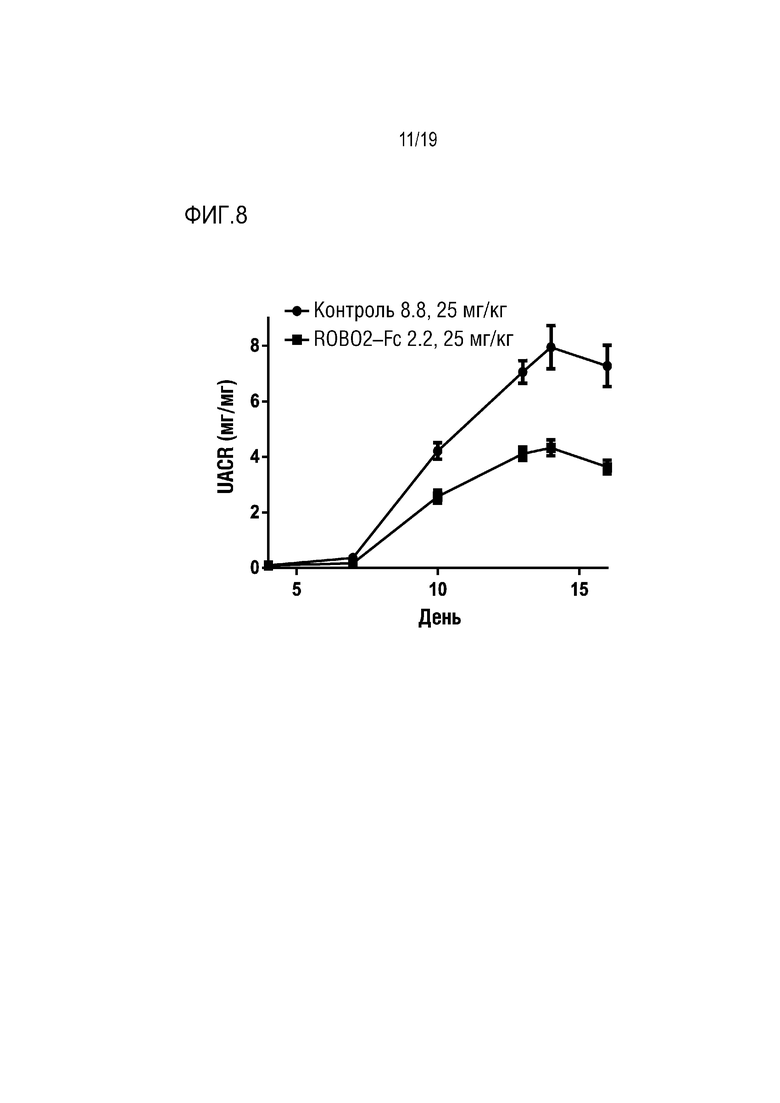
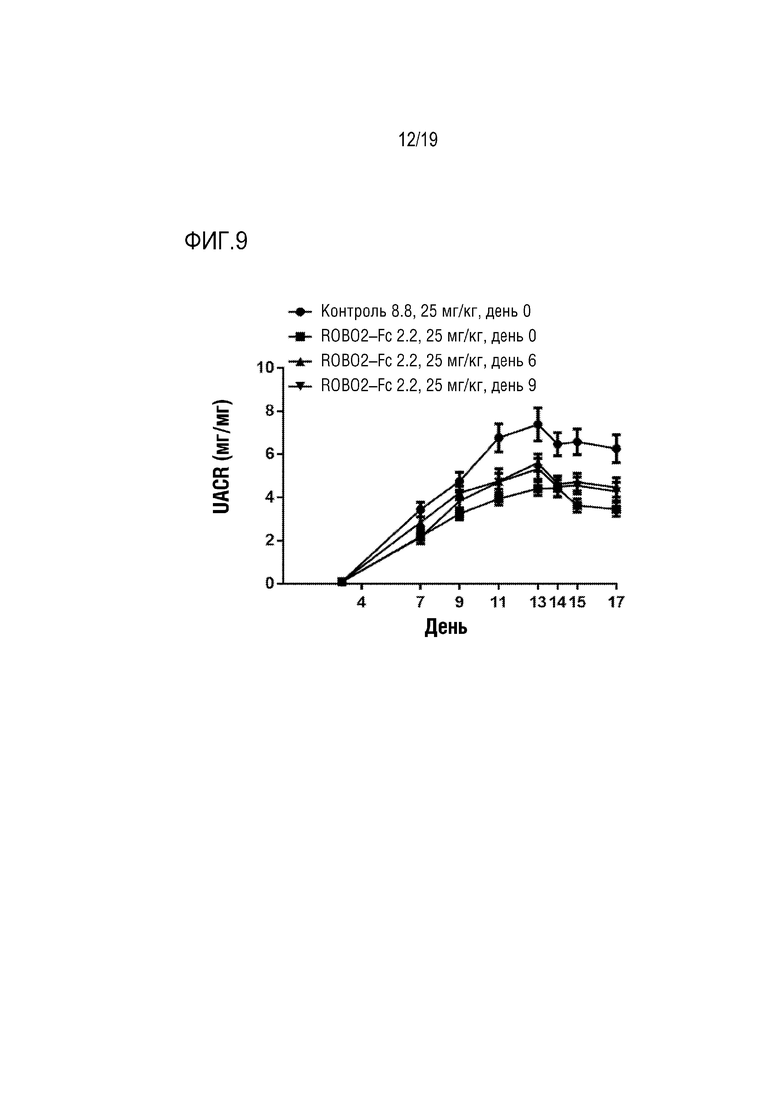
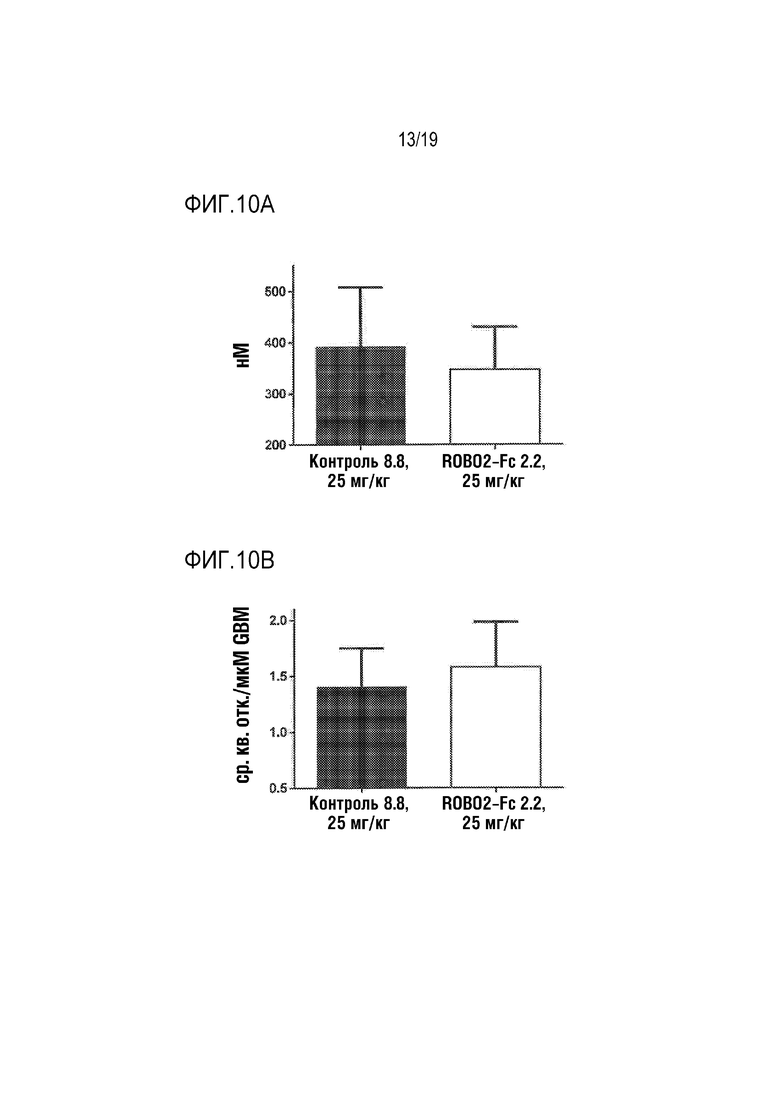
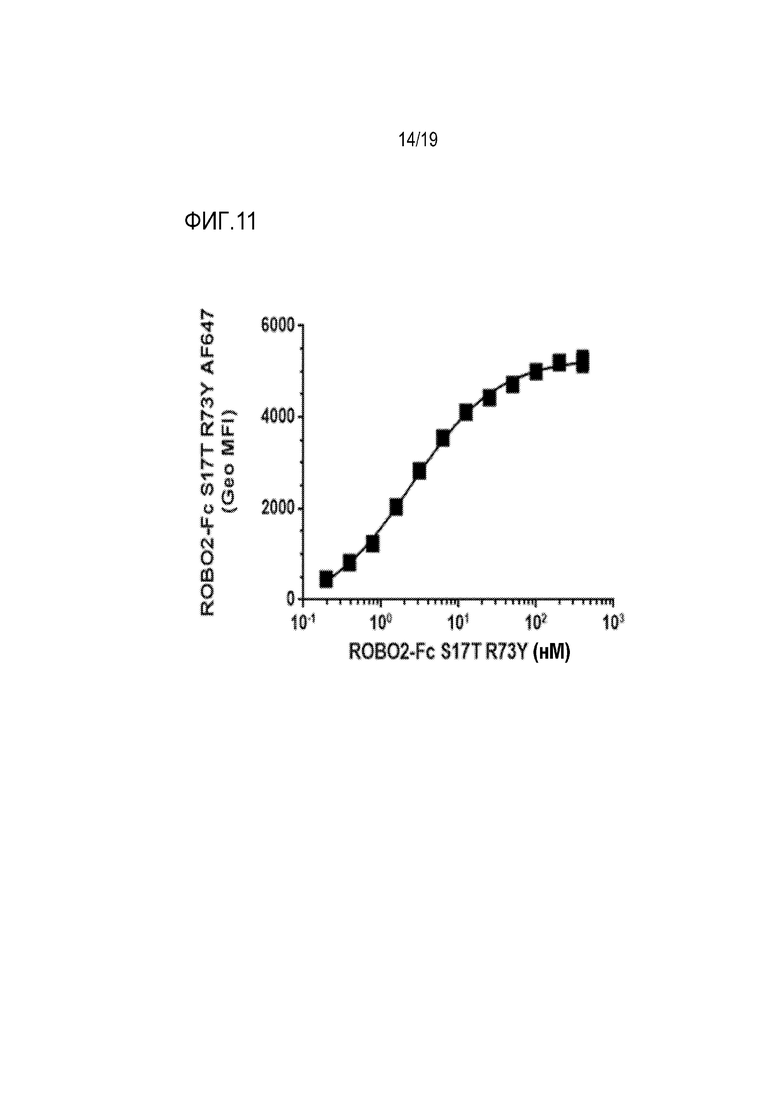
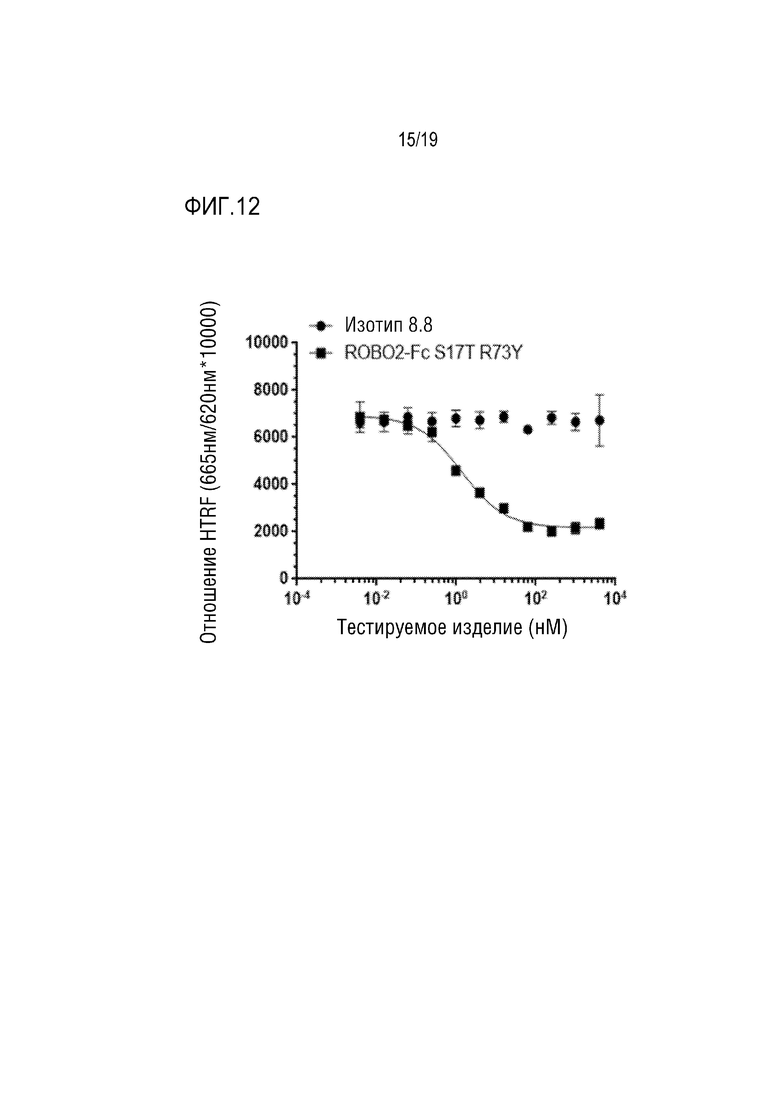
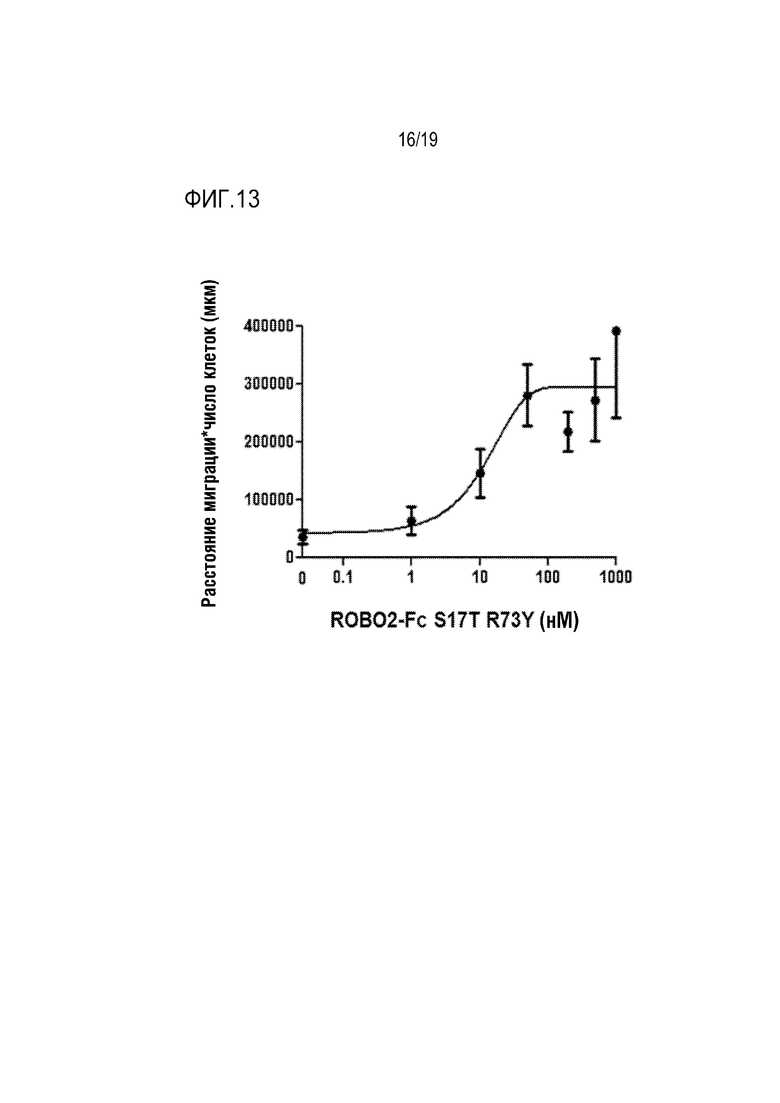
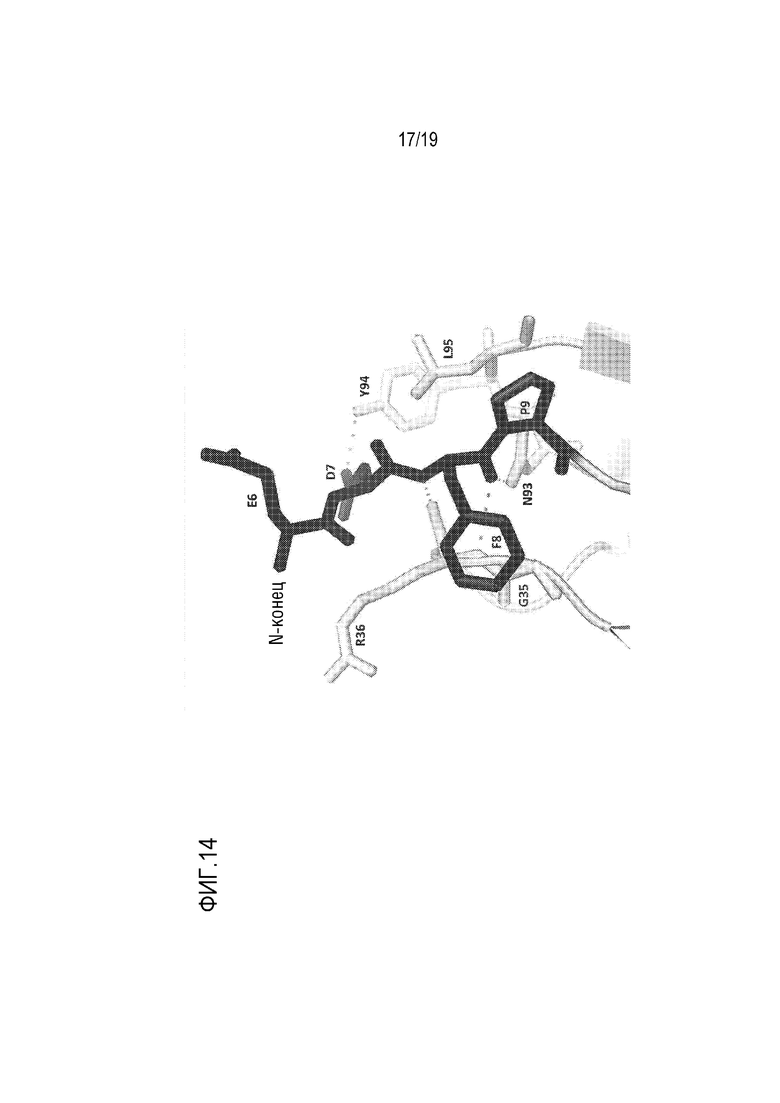
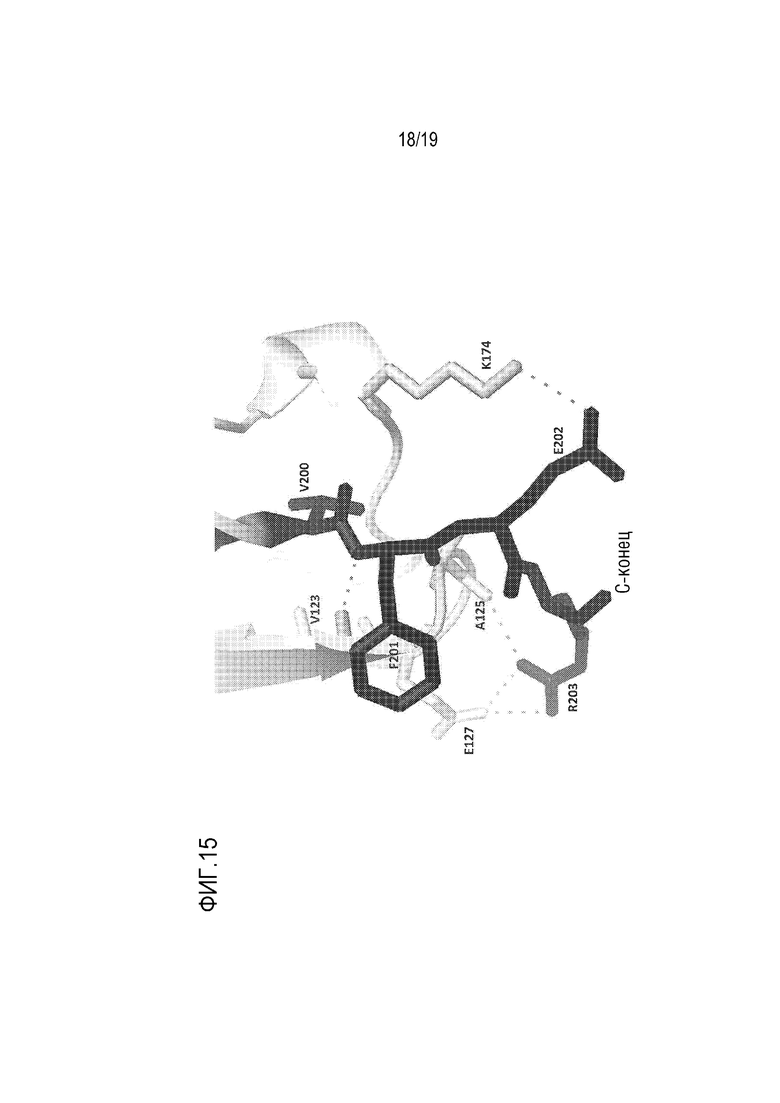
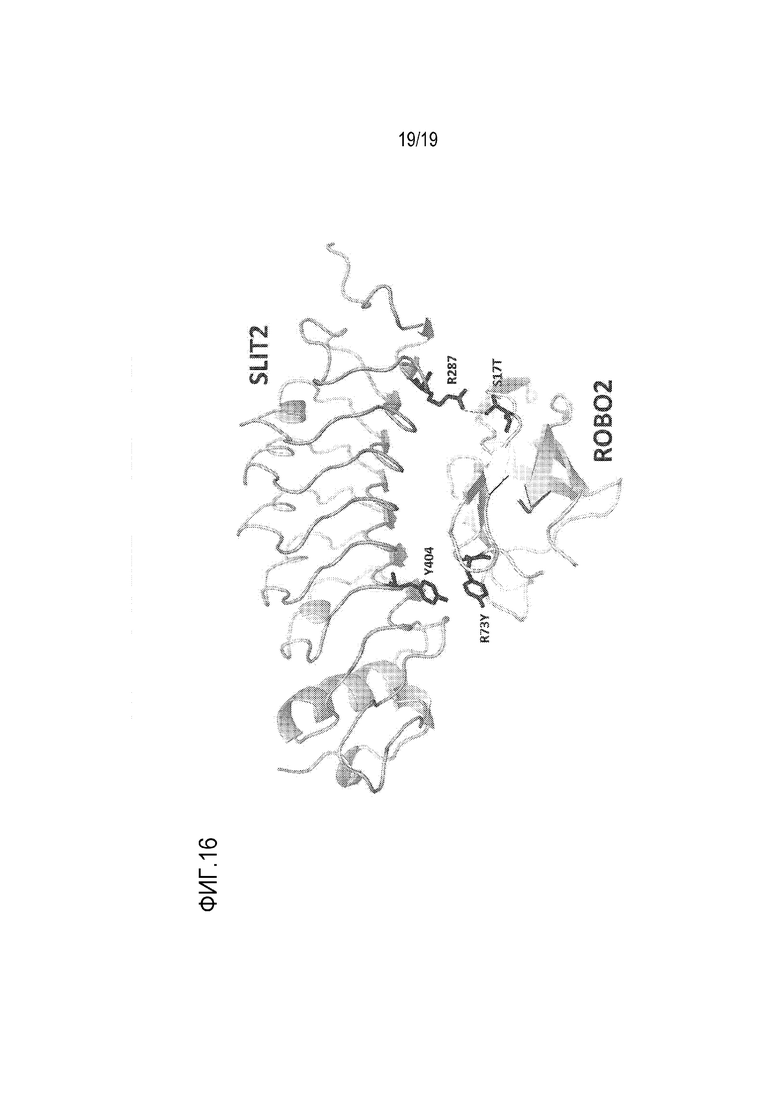
Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению слитых белков рецептора окольного пути Roundabout 2 (ROBO2), и может быть использовано в медицине для лечения болезни почек. Слитые белки ROBO2-Fc содержат Fc-домен и часть внеклеточного домена ROBO2, состоящего из двух иммуноглобулинподобных доменов (Ig1 и Ig2) и двух междоменных линкеров (линкер Ig1–Ig2 и линкер Ig2–Ig3), при этом указанный белок лишен трех повторов типа фибронектина III. Изобретение позволяет получить рекомбинантные белки ROBO2-Fc, которые способны связываться с лигандом регуляции образования щели подоцитов SLIT2 и ингибировать ROBO2-зависимую активность SLIT2. 10 н. и 27 з.п. ф-лы, 16 ил., 24 табл., 10 пр.
1. Рекомбинантный белок рецептора окольного пути Roundabout 2 (ROBO2), связывающийся с лигандом SLIT2, содержащий (i) часть внеклеточного домена ROBO2, и (ii) домен иммуноглобулина, который представляет собой Fc-домен IgA1, IgA2, IgD, IgE, IgM, IgG1, IgG2, IgG3 или IgG4, где указанная часть внеклеточного домена ROBO2 содержит последовательно первый иммуноглобулин–подобный домен (Ig1) с SEQ ID NO: 9 или SEQ ID NO: 20, междоменный линкер, расположенный между первым и вторым иммуноглобулин–подобными доменами (междоменный линкер Ig1–Ig2) с SEQ ID NO: 10; второй иммуноглобулин–подобный домен (Ig2) с SEQ ID NO: 11, и междоменный линкер, расположенныйй между вторым и третьим иммуноглобулин–подобными доменами (междоменный линкер Ig2–Ig3) с SEQ ID NO: 12, и лишен трех повторов типа фибронектина III (FNIII) внеклеточного домена ROBO2.
2. Рекомбинантный белок ROBO2 по п. 1, где указанный Ig1 ROBO2 содержит по меньшей мере одну из следующих мутаций: S17T и R73Y, каждая из которых пронумерована в соответствии с SEQ ID NO: 1.
3. Рекомбинантный белок ROBO2 по п. 1, где указанная часть внеклеточного домена ROBO2 содержит (i) аминокислотные остатки 31-224 в соответствии с нумерацией SEQ ID NO: 24 или (ii) аминокислотные остатки 31-409 в соответствии с нумерацией SEQ ID NO: 24.
4. Рекомбинантный белок ROBO2 по п. 1, где указанная часть внеклеточного домена ROBO2 дополнительно содержит пре-последовательность ROBO2, подобную иммуноглобулину 1 (Ig1), SEQ ID NO: 8.
5. Рекомбинантный белок ROBO2 по п. 1, где указанная часть внеклеточного домена ROBO2 содержит или состоит из аминокислотных остатков 1–203 в соответствии с нумерацией SEQ ID NO: 1.
6. Рекомбинантный белок ROBO2 по п. 1, где указанный Fc–домен представляет собой Fc–домен человеческого IgG1.
7. Рекомбинантный белок ROBO2 по п. 6, где указанный Fc–домен человеческого IgG1 содержит замены L234A, L235A и G237A (Eu–нумерация) и не содержит K447 (Eu–нумерация).
8. Рекомбинантный белок ROBO2 по п. 7, где указанный Fc–домен содержит аминокислотные остатки 210–440 в соответствии с нумерацией SEQ ID NO: 1.
9. Рекомбинантный белок ROBO2 по любому из пп. 1-8, где указанная часть внеклеточного домена ROBO2 является смежной с указанным доменом иммуноглобулина или связана с указанным доменом иммуноглобулина посредством линкера.
10. Рекомбинантный белок ROBO2 по п. 9, где указанным линкером является пептидильный линкер, содержащий приблизительно от 1 до 30 аминокислотных остатков.
11. Рекомбинантный белок ROBO2 по п. 10, где указанный пептидильный линкер выбран из группы, состоящей из:
a) богатого глицином пептида;
b) пептида, содержащего глицин и серин;
с) пептида, имеющего последовательность (Gly–Gly–Ser)n, где n равно 1, 2, 3, 4, 5 или 6 (SEQ ID NO: 22); и
d) пептида, имеющего последовательность (Gly–Gly–Gly–Gly–Ser)n, где n равно 1, 2, 3, 4, 5 или 6 (SEQ ID NO: 23).
12. Рекомбинантный белок ROBO2 по п. 11, где указанным пептидильным линкером является (Gly–Gly–Ser)2 (SEQ ID NO: 15).
13. Рекомбинантный белок рецептора окольного пути Roundabout 2 (ROBO2)–Fc, связывающийся с лигандом SLIT2, по существу состоящий из аминокислотной последовательности SEQ ID NО: 1.
14. Рекомбинантный белок рецептора окольного пути Roundabout 2 (ROBO2)–Fc, связывающийся с лигандом SLIT2, по существу состоящий из аминокислотной последовательности, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NО: 1 и сохраняет активность белка (ROBO2)–Fc.
15. Рекомбинантный белок ROBO2–Fc по п. 13, содержащий аминокислотную последовательность, кодируемую плазмидной вставкой, депонированной в ATCC и имеющей регистрационный номер ATCC No. PTA–124008.
16. Рекомбинантный белок ROBO2 по любому из предшествующих пунктов, где указанный белок связывается с SLIT2 с KD, равной или менее чем: приблизительно 10 нМ, приблизительно 5 нМ, приблизительно 2 нМ, приблизительно 1 нМ, приблизительно 900 пМ, приблизительно 800 пМ, приблизительно 700 пМ, приблизительно 600 пМ, приблизительно 500 пМ, приблизительно 400 пМ, приблизительно 300 пМ, приблизительно 250 пМ, приблизительно 200 пМ, приблизительно 150 пМ, приблизительно 100 пМ, приблизительно 50 пМ, приблизительно 40 пМ, приблизительно 30 пМ, приблизительно 25 пМ, приблизительно 20 пМ, приблизительно 15 пМ, приблизительно 10 пМ, приблизительно 5 по меньшей мере или приблизительно 1 пМ.
17. Рекомбинантный белок ROBO2 по любому из предшествующих пунктов, где указанный белок связывается с SLIT2 с KD, которая по меньшей мере приблизительно в 2 раза, приблизительно в 4 раза, приблизительно в 6 раз, приблизительно в 8 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 40 раз, приблизительно в 60 раз, приблизительно в 80 раз, приблизительно в 100 раз, приблизительно в 120 раз, приблизительно в 140 раз, приблизительно в 160 раз ниже, чем величина KD для связывания ROBO1 с SLIT2.
18. Рекомбинантный белок ROBO2 по любому из предшествующих пунктов, где указанный белок связывается с SLIT2 с KD, которая по меньшей мере приблизительно в 2 раза, приблизительно в 4 раза, приблизительно в 6 раз, приблизительно в 8 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 40 раз, приблизительно в 60 раз, приблизительно в 80 раз, приблизительно в 100 раз, приблизительно в 120 раз, приблизительно в 140 раз, приблизительно в 160 раз ниже, чем величина KD для связывания белка ROBO1–Fc с SLIT2.
19. Рекомбинантный белок ROBO2 по любому из пп 16-18, где указанную KD измеряют с помощью поверхностного плазмонного резонанаса (ППР).
20. Рекомбинантный белок ROBO2 по любому из пп 16-18, где указанную KD измеряют с помощью биослойной интерферометрии (БСИ).
21. Рекомбинантный белок ROBO2 по любому из предшествующих пунктов, где указанный белок ингибирует связывание SLIT и ROBO2 и/или ингибирует ROBO2–зависимую активность SLIT–N.
22. Рекомбинантный белок ROBO2 по любому из предшествующих пунктов, где указанный белок имеет полумаксимальную ингибирующую концентрацию (IC50), составляющую не более чем приблизительно 15 нМ, приблизительно 13 нМ, приблизительно 11 нМ, приблизительно 9 нМ, приблизительно 7 нМ, приблизительно 6 нМ, приблизительно 5 нМ, приблизительно 4 нМ, приблизительно 3 нМ, приблизительно 2 нМ, приблизительно 1 нМ, как было определено с помощью анализа методом гомогенной флуоресценции с временным разрешением (HTRF) на ингибирование связывания ROBO2 с SLIT2.
23. Рекомбинантный белок ROBO2 по любому из пп. 1–21, где указанный белок имеет полумаксимальную ингибирующую концентрацию (IC50) не более чем приблизительно 75 нМ, приблизительно 65 нМ, приблизительно 55 нM, приблизительно 45 нМ, приблизительно 35 нМ, приблизительно 25 нM, приблизительно 15 нМ, приблизительно 5 нМ, как было оценено путем определения SLIT2–N–опосредуемого ингибирования миграции нервных клеток.
24. Выделенная молекула нуклеиновой кислоты, кодирующая рекомбинантный белок ROBO2 по любому из пп. 1–23.
25. Выделенная молекула нуклеиновой кислоты по п. 24, где указанная молекула содержит последовательность нуклеиновой кислоты SEQ ID NO: 21.
26. Вектор экспрессии, содержащий выделенную молекулу нуклеиновой кислоты по п. 24 или 25.
27. Клетка–хозяин, экспрессирующая рекомбинантный белок ROBO2 по любому из пп. 1-23, содержащая вектор по п. 26.
28. Фармацевтическая композиция для лечения болезни почек, ассоциированной со связыванием и передачей сигнала ROBO2–SLIT или опосредуемой ими, содержащая рекомбинантный белок ROBO2 по любому из пп. 1–23 и фармацевтически приемлемый носитель или наполнитель.
29. Применение рекомбинантного белка ROBO2 по любому из пп. 1–23 для лечения болезни почек, ассоциированной со связыванием и передачей сигнала ROBO2–SLIT или опосредуемой ими.
30. Применение рекомбинантного белка ROBO2 по п. 29, где указанной болезнью почек является гломерулит, фокальный сегментарный гломерулярный склероз (ФСГС) или нефропатия.
31. Применение рекомбинантного белка ROBO2 по п. 30, где указанная болезнь почек представляет собой нефропатию, при этом указанная нефропатия представляет собой нефропатию IgA.
32. Способ получения рекомбинантного белка ROBO2, включающий культивирование клетки-хозяина по п. 27 в условиях, при которых экспрессируется рекомбинантный белок ROBO2.
33. Способ по п. 32, дополнительно включающий выделение рекомбинантного белка ROBO2.
34. Рекомбинантный белок ROBO2-Fc, связывающийся с лигандом SLIT2, по существу состоящий из аминокислотной последовательности SEQ ID NO: 2, 7 или 19, или аминокислотной последовательности, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 2, 7 или 19 и сохраняет активность белка (ROBO2)–Fc.
35. Рекомбинантный белок ROBO2-Fc по п. 34, где рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 2, 7 или 19.
36. Рекомбинантный белок ROBO2-Fc по п. 34, где рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 2, 7 или 19.
37. Рекомбинантный белок ROBO2-Fc по п. 34, где рекомбинантный белок ROBO2-Fc содержит аминокислотную последовательность SEQ ID NO: 2, 7 или 19.
| WO 2012085178 A1, 28.06.2012 | |||
| EA 201291044 A1, 30.04.2013 | |||
| FAN X | |||
| et al., Inhibitory effects of Robo2 on nephrin: a crosstalk between positive and negative signals regulating podocyte structure, Cell reports, 2012, v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| MORLOT C | |||
| et al., Structural insights into the Slit-Robo complex, Proceedings of the National Academy of | |||
Авторы
Даты
2023-03-09—Публикация
2018-05-31—Подача