Изобретение относится к области аналитической и фармацевтической химии и может быть использовано для оценки фармакокинетики и биораспределения дексаметазона в крови и тканях экспериментальных животных и человека.
Дексаметазон оказывает сильное противовоспалительное действие и является наиболее активным среди известных стероидов, он используется системно для лечения острых и тяжелых воспалительных, иммунологических, и аллергических расстройств (Pharmacokinetics and pharmacodynamics of dexamethasone sodium-m-sulfobenzoate (DS) after intravenous and intramuscular administration: a comparison with dexamethasone phosphate (DP) // Hochhaus G., Barth J., al-Fayoumi S., Suarez S., Derendorf H., Hochhaus R.,  / J Clin Pharmacol, 2001,41,425-34). Оценка фармакокинетики дексаметазона является особенно важной при разработке его новых лекарственных форм, а также при применении у пациентов с изменениями функциями почек. Эпидемия ковид-19, при котором дексаметазон оказался одним из немногих эффективных фармакологических средств, привел к скачкообразному увеличению потребления дексаметазона. Однако, противовоспалительное действие этого препарата было сопряжено с большим количеством побочных эффектов, таких как стероидный диабет, артериальная гипертензия, иммунодефицит и др. Кроме того, в настоящее время предлагается ряд новых лекарственных форм дексаметазона для местного и ингаляционного введения.
/ J Clin Pharmacol, 2001,41,425-34). Оценка фармакокинетики дексаметазона является особенно важной при разработке его новых лекарственных форм, а также при применении у пациентов с изменениями функциями почек. Эпидемия ковид-19, при котором дексаметазон оказался одним из немногих эффективных фармакологических средств, привел к скачкообразному увеличению потребления дексаметазона. Однако, противовоспалительное действие этого препарата было сопряжено с большим количеством побочных эффектов, таких как стероидный диабет, артериальная гипертензия, иммунодефицит и др. Кроме того, в настоящее время предлагается ряд новых лекарственных форм дексаметазона для местного и ингаляционного введения.
Метод определения дескаметазона в биообразцах с помощью высокоэффективной жидкостной хроматографии с ультрафиолетовым детектированием (ВЭЖХ-УФ) активно разрабатывается с конца 1990-х, и новые публикации продолжают появляться до сих пор. Преимущество ВЭЖХ перед другими методами (такими как иммуноэлектрофорез, спектрофотометрия, газовая хроматография и радиоиммунный анализ (РИА)) заключается в отсутствии перекрестной реакции или интерференции с экзогенными и/или эндогенными соединениями (кортизолом) (Pharmacoknetics of dexamethasone with pharmacokinetics/pharmacodynamic model of the effect of dexamethasone on endogenous hydrocortisone and cortisone in the horse // Soma L.R., Uboh C.E., Luo Y., Guan F., Moate P.J., Boston R.C. / J. Vet. Pharmacol. Therap., 2005, 28, 71-80).
Процесс пробоподготовки для ВЭЖХ анализа имеет массу модификаций, и оптимизация этого процесса отражается на валидационных характеристиках всего метода. (Simultaneous analysis of twenty-one glucocorticoids in equine plasma by liquid chromatography/tandem mass spectrometry // Luo Y., Uboh C.E., Soma L.R., Guan F.Y., Rudy J.A., Tsang D.S. / Rapid Commun Mass Spectrom, 2005, 19, 1245-1256).
В настоящее время достаточно много сообщений о применении для детекции дексаметазона ВЭЖХ с масс-спектрометрическим детектированием (ВЭЖХ-МС) (High throughput HPLC-ESI-MS method for the quantitation of dexamethasone in blood plasma Damonte G., Salis Α., Rossi L., Magnani M., Benatti U., J Pharm Biomed Anal, 2007, 43, 376-380). Обладая хорошей чувствительностью, этот метод отличается высокой стоимостью и ограниченной доступностью. В связи с этим разработка метода детектирования дексаметазона с помощью ВЭЖХ-УФ может стать приемлемой альтернативой масс-спектрометрическому анализу. Имеются публикации, в которых показана высокая чувствительность ВЭЖХ-УФ при определении дексаметазона в водных растворах (нижний предел количественного обнаружения составляет до 35 нг/мл) (Determination of Dexamethasone sodium phosphate and Dexamethasone base in one sample of horse plasma or/and synovial fluid using high resolution liquid chromatography. Technical note // Carballo R., Rosiles R., Bautista J., Octavio V. / Fuentes Revista Cientifica, 2012, 22, 410-417). Однако, главной проблемой при определении дексаметазона в биосредах является его экстракция. Большинство методов экстракции дексаметазона из биосред основаны на применении этилацетата. Следует отметить, что этилацетат хорошо экстрагирует гидрофобные соединения и поэтому является оптимальным для извлечения дексаметазона-основания. Такой тип экстракции может быть приемлемым для ВЭЖХ-МС, обладающей очень высокой чувствительностью, однако для ВЭЖХ-УФ чувствительность метода с этим типом экстракции недостаточна (НПКО составлет около 1 мкг/мл)
Прототип 1. Известен метод ВЭЖХ анализа дексаметазона фосфата, где образцы плазмы (обогащенной или тестируемой) объемом 10 мл после добавления внутреннего стандарта смешивались с 0,5 мл этилацетата и встряхивались в течение 30 с. После очистки и высушивания сухой остаток (экстракт) восстанавливали в подвижной фазе, которая состояла из ацетонитрила и дистиллированной воды (28:72% по объему, рН был доведен до 2,3 с помощью фосфорной кислоты). Пики дексаметазона определяли при 254 нм при скорости потока 1,2 мл/мин, при этом время удержания дексаметазона составило 10 минут (Kumar V., Mostafa S., Kayo M.W., Goldberg Ε.P., Derendorf Η. // HPLC determination of dexamethasone in human plasma and its application to an in vitro release study from endovascular stents / Pharmazie, 2006,61,908-911).
Недостатками прототипа является то, что без проведения соответствующих предварительных реакций степень экстракции будет незначительной, если присутствует дексаметазона фосфат динатриевая соль. Данный метод стабильно позволяет экстрагировать внутренний стандарт дезоксиметазон, который лучше растворяется в этилацетате, чем соль дексаметазона.
Прототип 2. Близким нашему изобретению методом, является метод предложенный Duarah S. et al., 2021. Метод проводится на подвижной фазе, состоящей из смеси ацетонитрила, воды и метанола. Схожая трехкомпонентная смесь используется и при экстракции дексаметазона фосфата динатриевой соли из образца плазмы. При этом метод достаточно чувствительный на длине волны 240 нм НПКО составило 60 нг/мл (Duarah S., Sharma Μ, Wen J. Rapid and simultaneous determination of dexamethasone and dexamethasone sodium phosphate using HPLC-UV: Application in microneedle-assisted skin permeation and deposition studies. J Chromatogr В Analyt Technol Biomed Life Sci. 2021 Apr 30;1170:122609. Основным недостатком метода является то, что для экстракции дексаметазона из биообразца используется трехкомпонентная смесь ацетонитрила, воды и метанола, которую необходимо готовить в соотношении 43:32:25. К тому же экстракция происходит 5 часов, что достаточно длительно. Время удержания дексаметазона при этом методе составляет 3,5 минуты, что достаточно мало для качественного отделения сопутствующих веществ плазмы, попавших в экстракт.
Прототип 3. Наиболее близким по своей сущности к предложенному методу являетмся метод, предложенный Carballo R. et al. 2012 для ВЭЖХ анализа дексаметазона фосфата из синовиальной жидкости сустава, как и при экстракции из плазмы применим этилацетат в соотношении с субстратом 1:1. Однако после центрифугирования синовиальный осадок не отбрасывали, а обрабатывали 0,6 мМ раствором серной кислоты в течение 30 секунд с последующей повторной экстракцией этилацетатом. (Determination of Dexamethasone sodium phosphate and Dexamethasone base in one sample of horse plasma or/and synovial fluid using high resolution liquid chromatography. Technical note // Carballo R., Rosiles R., Bautista J., Octavio V. / Fuentes Revista Cientifica, 2012, 22,410-417).
Недостатком наиболее близкого метода ВЭЖХ-УФ является неполная экстракции образца с первого раза и необходимости повторять извлечение из богатых белком образцов, таких как синовиальная жидкость.
Задачей настоящего изобретения является разработка высокочувствительного метода определения дексаметазона в биологических средах с помощью ВЭЖХ-УФ.
Эта задача решается тем, что предлагается метод количественного определения дексаметазона в биологических средах с помощью ВЭЖХ с ультрафиолетовым детектированием при длине волны 241 нм с использованием в качестве неподвижной фазы сорбента Kromasil 100 С18 (250×4,6 мм, 5 мкм).
Кроме того, эта задача решается тем, что экстракция осуществляется смесью соляной кислоты и ацетона.
Кроме того, эта задача решается тем, что в качестве внутреннего стандарта используется атенолол.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение описывается приведенными ниже примерами. В примере 1 описывается подготовка и идентификация проб для построения калибровочного графика зависимости площади хроматографического пика от концентрации дексаметазона в образце. В примере 2 описано извлечение и идентификация дексаметазона фосфата динатриевой соли в биологических пробах плазмы крови и гомогенатов легких мышей после однократного внутривенного введения.
Перечень фигур:
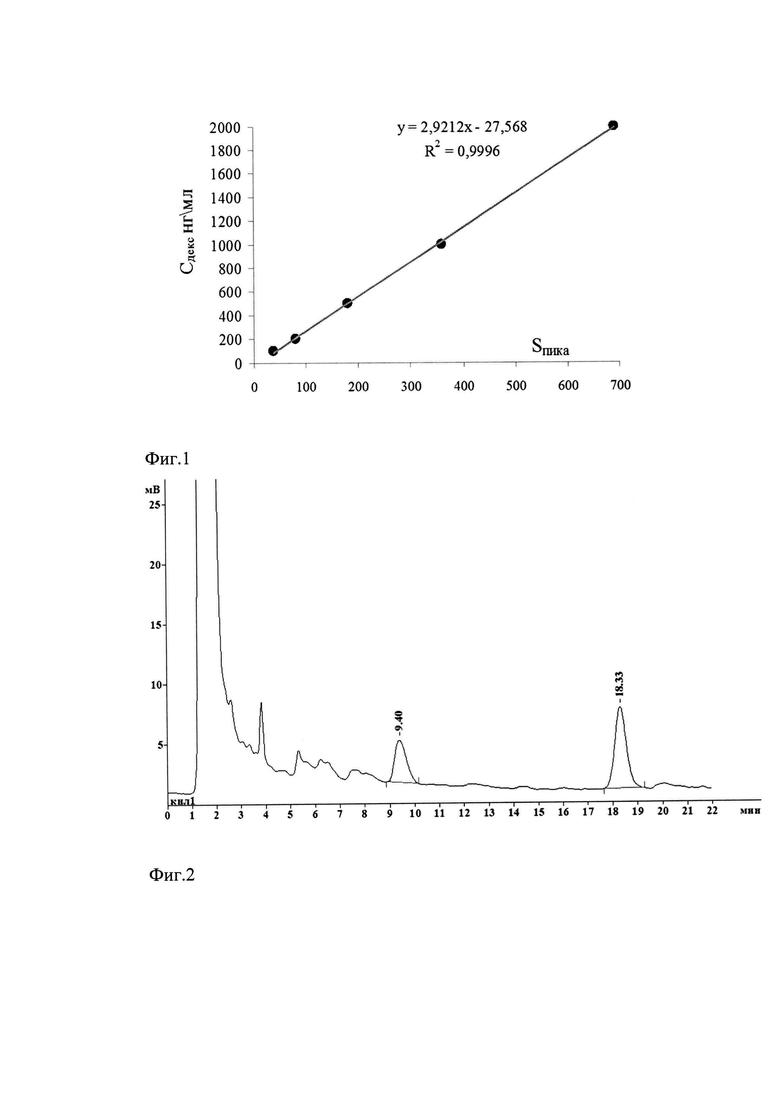
Фиг. 1. Калибровочный график зависимости концентрации дексаметазона в биообразце от площади хроматографического пика.
Фиг. 2. Хроматограмма дексаметазона (9,40 мин) и IS (атенолол) 18,33 мин. Легкие мыши через 10 минут после внутривенного введения липосом с дексаметазоном.
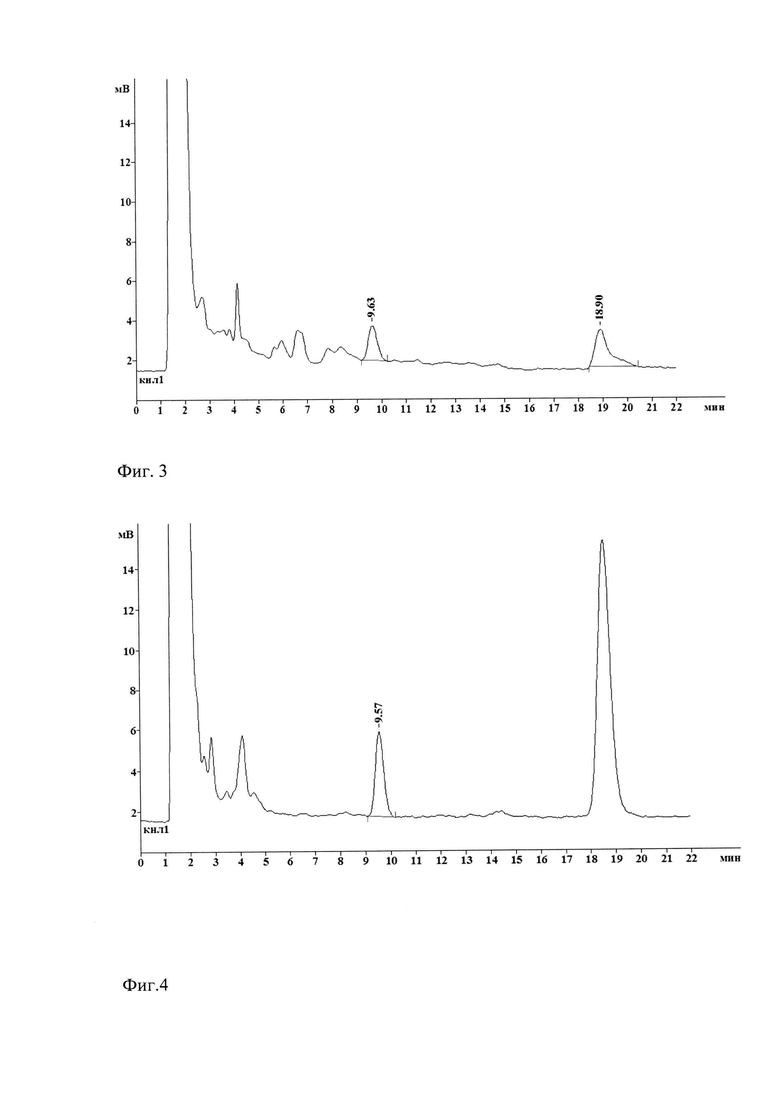
Фиг. 3. Хроматограмма дексаметазона (10,03 мин) и IS (атенолол) 19,10 мин. Легкие мыши через 60 минут после внутривенного введения липосом с дексаметазоном
Фиг. 4. Хроматограмма дексаметазона (9,90 мин) и IS (атенолол) 19,30 мин. Плазма мыши через 10 минут после внутривенного введения липосом с дексаметазоном
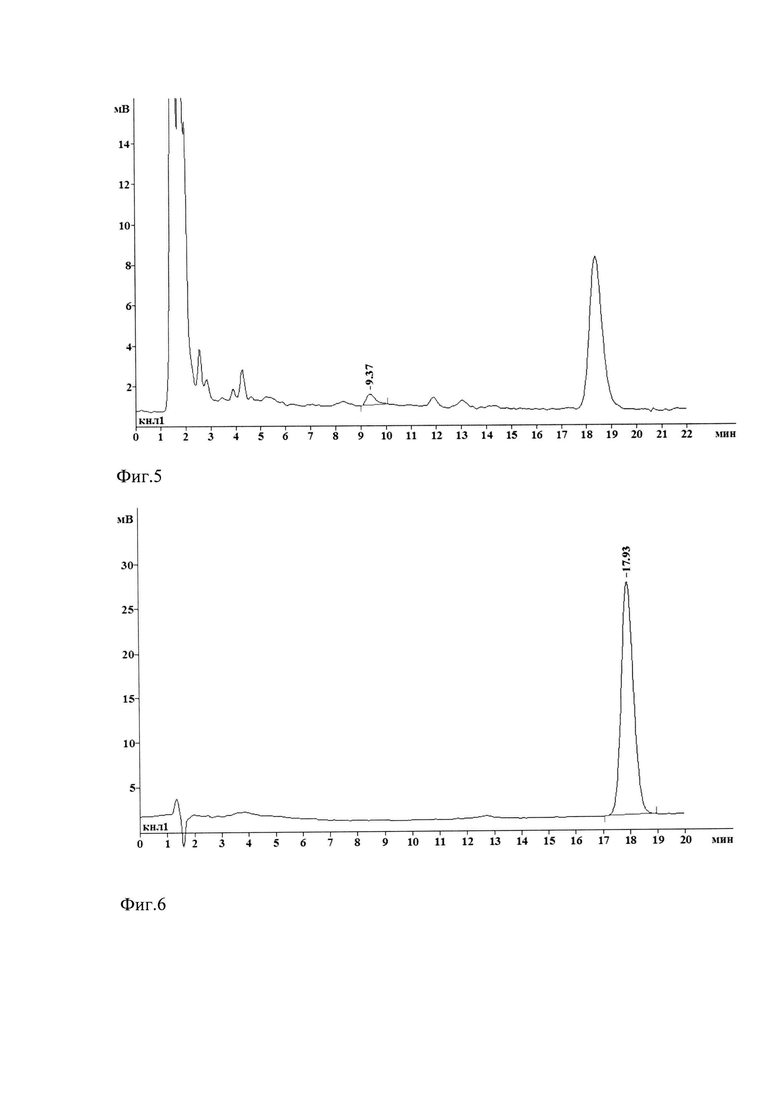
Фиг. 5. Хроматограмма дексаметазона (9,37 мин) и IS (атенолол) 18,60 мин. Плазма мыши через 60 минут после внутривенного введения липосом с дексаметазоном
Фиг. 6. Хроматограмма раствора дексаметазона динатриевой соли (17,93 мин) в подвижной фазе.
Фиг. 7. Динамика концентрации дексаметазона в ткани легких и плазме крови мышей, после однократного внутривенного введения раствора дексаметазона в дозе 10 мг/кг.
Пример 1. Описание метода ВЭЖХ дексаметазона фосфата динатриевой соли.
Для разработки метода использовалась хроматографическая система Gilson-Rainin - 307(Франция), состоящая из дегазатора, трехканального изократического насоса высокого давления Pump 306, Gilson, манометричекого блока Rainin Pressure Module, спектрофотометрического детектора 155 UV/VIS Detectors Gilson, и ручного инжектора Rheodyne 7725i. Программное обеспечение МультиХром™ (версия 3.0), ЗАО Амперсенд, Россия.
Вспомогательные устройства: весы лабораторные электронные аналитические (ГОСТ 24104-2001) OHAUS Pioneer РА-64С, США, с погрешностью взвешивания не более 0,001 мг.Портативный рН-метр АНИОН-4100, Россия; холодильник фармацевтический Pozis ХФ-250, Россия; дозаторы пипеточные одноканальные ДПОП-1 (объем 100-1000 мкл, 1000-5000 мкл) со сменными одноразовыми пластиковыми наконечниками «Экохим» (РФ); Пробирочный вортекс SIA «Biosan», Латвия; пробирки Эппендорфа «Экохим» (РФ); флаконы из нейтрального стекла на 10 мл; калиброванные мерные колбы вместимостью 50; 100 мл (ГОСТ 1770-74), стаканы лабораторные объемом 100 и 200 мл «Schott Duran» (Германия), центрифуги «ThermoScientific» (США) и Eva 21, Германия; Шкаф сушильный вакуумный, UT-4660V, Китай.
Извлечение дексаметазона из биообразцов (плазмы, органов) проводили путем жидкостно-жидкостной экстракции ацетоном в кислой среде с использованием в качестве внутреннего стандарта атенолола.
Детектирование производилось в изократическом режиме при длине волны 241 нм.
Концентрация дексаметазона рассчитывалась по калибровочной кривой зависимости отношения площади хроматографического пика аналита к площади хроматографического пика внутреннего стандарта от номинальной концентрации аналита. Концентрация внутреннего стандарта была постоянна для всех образцов. Калибровочная кривая представляла собой линейную функцию.
Подвижную фазу готовили путем смешения метанола (компонент I) и фосфатного буферного раствора (компонент II) в соотношении 50:50. Компонент II готовили путем растворения 0,375 г калия дигидрофосфата в 500 мл воды (рН=5,6). Готовую подвижную фазу дегазировали под действием ультразвука и хранили при +5°С в течение 72 часов.
Матричный раствор дексаметазона (0,04 мг/мл) готовили путем смешивания 1 мл препарата дексаметазон (4 мг/мл) с водой в мерной колбе вместимостью 50 мл.
Матричный раствор использовали для приготовления калибровочных стандартов. Растворы хранили при +5°С в течение 72 часов.
Стандартные растворы готовили путем последовательного разведения матричного раствора водой. Из матричного раствора готовили стандартные растворы со следующими концентрациями: 4000; 8000; 20000; 40000; 80000; нг/мл для приготовления калибровочных стандартов. Стандартные растворы добавлялись в плазму крови интактных мышей для получения соответствующей концентрации дексаметазона, следующим вносился стандартный раствор внутреннего стандарта.
Раствор внутреннего стандарта готовили растворением точной навески (0,01 г) субстанции атенолола в воде в мерной колбе объемом 100 мл. Получали раствор внутреннего стандарта (IS) с концентрацией 100000 нг/мл.
Калибровочные стандарты были приготовлены в плазме, полученной от интактных мышей со следующими концентрациями дексаметазона в плазме: 100; 200; 500; 1000; 2000 нг/мл.
Образцы готовились путем последовательного добавления к 450 мкл плазмы крови 50 мкл стандартного раствора дексаметазона и 5 мкл раствора IS (100000 нг/мл). Бланковые образцы готовились аналогичным образом, но вместо стандартного раствора аналита добавляли 50 мкл воды и 5 мкл раствора IS (100000 нг/мл).
Стандартные растворы хранили в холодильнике при температуре +2+8°С.
Концентрацию дексаметазона в плазме крови и органах находили по калибровочному графику (Фиг. 1). Учитывая разведение гомогената органа в 3 раза водой во время диспергирования концентрацию дексакметазона в органе рассчитывали по формуле С=3Сх; где 3 - степень разведения исходного образца, Сх - концентрация, найденная по калибровочному графику Фиг. 1.
Подготовка плазмы крови осуществлялась методом жидкостно-жидкостной экстракцией дексаметазона и IS ацетоном. В стеклянный флакон 10 мл отбирали 500 мкл плазмы, прибавляли 100 мкл 1%-ного раствора соляной кислоты, встряхивали на шейкере в течение 10 мин, затем добавляли 5 мл ацетона и встряхивали еще 10 мин, затем центрифугировали при 3500 об/мин в течение 10 мин. Далее отбирали 4 мл органического слоя и выпаривали до получения сухого остатка в вакуумном шкафу при температуре 40°С. Сухой остаток растворяли в 0,5 мл подвижной фазы, встряхивали на шейкере 10 минут, центрифугировали 10 минут, забирали 300 мкл супернатанта, который вводили в хроматографическую систему.
Параметры ВЭЖХ. Для хроматографического разделения использовали колонку Kmmasil 100 С18 (250×4,6 мм, 5 мкм). Режим работы насоса: изократический, скорость потока 1 мл/мин. Общее время анализа - 22 мин. Объем вводимой пробы - 20 мкл.
В качестве калибровочного стандарта использовали субстанцию дексаметазона фосфата динатриевой соли (Sigma Aldrich, США). Аналитический метод разработан для определения дексаметазона, обнаруживающегося в крови и внутренних органах (легкие, печень, почки) после внутривенного и внутрисуставного введения. В качестве биологической матрицы в настоящей методике использовалась плазма крови нелинейных лабораторных мышей. В качестве подвижной фазы использована смесь метанола и фосфатного буфера (рН=5,6).
Пример 2. Определение содержания дексаметазона методом ВЭЖХ в легких и крови мышей после внутривенного введения.
Для исследования использовали белых нелинейных мышей массой 20-25 г. Раствор дексаметазона использовали в концентрации (2,2 мг/мл) и вводили внутривенно в хвостовую вену в объеме 0,1 мл (10 мг/кг). После введения дексаметазона мышей забивали через 10, 15, 30 и 60 минут.Для каждой временной точки было взято по 5 животных. Эвтаназию животных осуществляли под общей анестезией Zoletil, Virbac (France) и Rometar, Bioveta, a. s. (Czech Republic). Для определения концетрации дексаметазона у животных забирали кровь для получения плазмы и легкие для получения гомогенатов. Кровь центрифугировали для отделения плазмы, а органы взвешивали и подвергали гомогенизации с помощью диспергатора IKA Τ 18 digital ULTRA-TURRAX (Германия) с добавлением дистиллированной воды (2 мл на 1 г органа). Гомогенаты центрифугировали и отделяли супернатант.
Производили экстракцию дексаметазона из супернатанта гомогенатов и плазмы крови по описанному в примере 1 методу. Органы и плазму крови хранили в морозильнике при температуре -20 -22°С.
Время удержания дексаметазона после экстракции из биопроб составило 9,3-9,6 мин, IS - 18,3-18,6 мин (Фиг. 2-6). При этом время удержания дексаметазона после экстракции было в 2 раза меньше, чем время удержания дексаметазона, растворенного в подвижной фазе, то есть препарата не прошедшего этапы экстракции.
При сравнении степени экстракции дексаметазона из биоматериала с концентрацией, вносимой в хроматографическую систему, не было выявлено различий в форме пика, отражающего концентрацию дексаметазона. Успешное повторение ВЭЖХ методик, основанных на экстракции дексаметазона с помощью этилацетата не всегда осуществимо. По этой причине мы предлагаем данную методику определения дексаметазона со стабильным аналитическим результатом. Причины уменьшения времени удержания препарата в два раза при сохранении всех прочих равных условий может быть связано с некоторыми химическими превращениями молекулы дексаметазона (ионизацией и др.). Для этого необходим дополнительный качественный анализ.
Из Фиг. 7 мы видим быстрое, в течение 15 минут накопление дексаметазона в легких до 184 нг/см3 с последующим быстрым снижением за 15 минут до 45 нг/см3. Дальнейшие 30 минут приводят значительному изменению концентрации дексаметазона в легких.
В плазме крови мы наблюдаем постепенное снижение концентрации дексаметазона за 1 час после в/в введения с 225 нг/см3 до 48 нг/см3.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения амиодарона и его основного метаболита дезэтиламиодарона в сыворотке крови человека | 2020 |
|
RU2749566C1 |
| Способ количественного определения антигипертензивных лекарственных веществ в плазме крови | 2022 |
|
RU2803887C1 |
| Способ количественного определения доксорубицина в биологических образцах | 2024 |
|
RU2839330C1 |
| Способ определения лекарственного препарата метформин в смешанной слюне пациента, страдающего сахарным диабетом | 2019 |
|
RU2705363C1 |
| Способ определения лозартана, его основного метаболита лозартан карбоновой кислоты и глибенкламида в сыворотке крови и моче человека | 2020 |
|
RU2749567C1 |
| Способ определения дабигатрана в сыворотке крови человека | 2018 |
|
RU2683032C1 |
| Способ количественного определения леводопы в плазме крови | 2017 |
|
RU2665164C1 |
| Способ количественного определения 2-изопропил-5-метилциклогексил 2-(1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил)ацетата и индометацина в плазме крови | 2021 |
|
RU2781342C1 |
| Способ количественного определения ликарбазепина в плазме крови | 2017 |
|
RU2660364C1 |
| СПОСОБ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ ПОЛИГЛУТАМАТОВ МЕТОТРЕКСАТА МЕТОДОМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТИРОВАНИЕМ (ВЭЖХ-МС-МС) | 2020 |
|
RU2752805C1 |

Изобретение относится к области аналитической и фармацевтической химии, а именно к способу количественного определения дексаметазона в биологических средах. Предлагается способ количественного определения дексаметазона в биологических средах с помощью ВЭЖХ с ультрафиолетовым детектированием, согласно которому извлечение дексаметазона из биообразцов проводят путем жидкостно-жидкостной экстракции ацетоном в кислой среде, в качестве подвижной фазы используется смесь метанола и фосфатного буфера в соотношении 50:50, неподвижная фаза представлена колонкой Kromasil 100 С18, 250×4,6 мм, 5 мкм, детектирование проводится при 241 нм, а в качестве внутреннего стандарта используется атенолол. Вышеописанный способ является высокочувствительным методом определения дексаметазона в биологических средах с помощью ВЭЖХ-УФ. 7 ил., 2 пр.
Способ количественного определения дексаметазона в биологических средах с помощью ВЭЖХ с ультрафиолетовым детектированием, отличающийся тем, что извлечение дексаметазона из биообразцов проводят путем жидкостно-жидкостной экстракции ацетоном в кислой среде, в качестве подвижной фазы используется смесь метанола и фосфатного буфера в соотношении 50:50, неподвижная фаза представлена колонкой Kromasil 100 С18, 250×4,6 мм, 5 мкм, детектирование проводится при 241 нм, а в качестве внутреннего стандарта используется атенолол.
| CARBALLO R | |||
| et al | |||
| Determination of Dexamethasone sodium phosphate and Dexamethasone base in one sample of horse plasma or/and synovial fluid using high resolution liquid chromatography | |||
| Technical note // Fuentes Revista Cientifica, 2012, 22, 410-417 | |||
| WORAPAN PORMSILA et al | |||
| A Modified quechers extraction for the determination of dexamethasone // |
Авторы
Даты
2023-03-21—Публикация
2022-12-23—Подача