Предлагаемое изобретение относится к области фармакологии, а именно к фармацевтическим препаратам, которые высвобождают терапевтическое средство в течение длительного периода времени, а также к биологически активным пептидам, способным ингибировать подвижность клеток, стимулированную моноцитарным хемотаксическим белком-1 (хемокином МСР-1). Известно, что при непосредственном участии хемотаксических цитокинов - хемокинов - в организме осуществляется привлечение лейкоцитов в участки воспаления, их активация и дифференцировка. Кроме того, известно, что воспаление является неотъемлемым компонентом в развитии онкологических, аутоиммунных и сердечно-сосудистых заболеваний. Так, в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка (СНСФВ) ключевую роль играет хронический низкоинтенсивный провоспалительный статус, который вызывает системную дисфункцию эндотелия коронарного микроциркуляторного русла с последующим снижением биодоступности оксида азота, развитием фиброза миокарда и прогрессированием диастолической дисфункции. Считается, что борьба с воспалением может стать новой лечебной стратегией при СНСФВ. Одним из ранних событий в развитии этого воспалительного процесса является увеличение выработки эндотелиальными клетками и макрофагами миокарда моноцитарного хемотаксического белка-1 (МСР-1), способствующего привлечению моноцитов из крови и поддерживающего воспалительный процесс в ткани. Как было показано в нескольких экспериментальных моделях с гипертрофией левого желудочка, подавление активности этого белка путем генных манипуляций или с использованием блокирующих антител предотвращало развитие фиброза миокарда и улучшало диастолическую функцию.
В настоящее время известны лекарственные формы пептидных препаратов с замедленным (пролонгированным) высвобождением, такие как октреотид-депо (Патент РФ №2541104 МПК: А61К 38/31, 47/32, 9/16; А61К 1/14, опубл. 10.02.2015 г.) или композиция, содержащая в качестве активного ингредиента один из аналогов LHRH, а именно трипторелин, деслорелин, нафарелин, гистрелин, бусерелин, госерелин, гонадорелин и лейпрорелин (Патент РФ №2690683 МПК A61K 38/09, опубл. 05.06.2019 г.)). Такие композиции могут обеспечить непрерывную доставку фармацевтически активного пептидного соединения пациенту в течение длительных периодов времени, например, в течение 2-4 недель.
Известен 12-членный пептидный фрагмент (65-76) МСР-1 человека, являющийся антагонистом этого белка (Патент РФ №2260598. МПК: С07К 7/08, А61К 38/10. Опубл. 20.09.2005). Он получил название Инграмон (Ингибитор гранулоцитов и моноцитов, №регистрации 425414 от 13.12.2010), разработанный в Институте экспериментальной кардиологии ФГБУ «НМИЦ Кардиологии» Минздрава России.
Способность Инграмона (при в/м или в/в введении) подавлять миграцию моноцитов и оказывать противовоспалительное действие доказана как в экспериментальных работах, выполненных на грызунах и приматах (Krasnikova 2004; Красникова 2005; Arefieva 2005; Сидорова 2006; Чазов 2006; Chazov 2007; Кухтина 2008), так и в клинических исследованиях у больных с ишемической болезнью сердца (Kukhtina 2005; Потехина 2010 и 2011; Arefieva 2011). Результаты доклинического токсикологического исследования показали, что препарат нетоксичен, не обладает мутагенными, тератогенными свойствами, не влияет на репродуктивную функцию, не проявляет аллергизирующих и иммунотоксических свойств. Безопасность ранее разработанной фармацевтической субстанции (ФС) была подтверждена у здоровых добровольцев (разрешение Министерства здравоохранения и социального развития Российской Федерации от 5 апреля 2007 г. №142) и в клинических исследованиях, в том числе у пациентов с сердечно-сосудистыми заболеваниями (разрешение Министерства здравоохранения и социального развития Российской Федерации на проведение клинических испытаний от 9 июля 2008 №№320, 321, 322 и от 16 февраля 2012, №720). Инграмон относится к группе противовоспалительных препаратов нестероидной природы при хронических воспалительных заболеваниях почек и ишемической болезни сердца (ИБС). Пептидные лекарственные средства привлекательны для длительного применения, т.к. обладают высокой эффективностью и низкой токсичностью. Однако пептиды, как правило, обладают низкой протеолитической устойчивостью, поэтому их вводят системно, например, внутривенно. Так, время полужизни Инграмона, введенного внутримышечно кроликам в концентрации 0,5 мг/кг, составляет 42 мин (определено в плазме крови с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с тандемным масс-селективным определением. Это ставит под сомнение возможность применения Инграмона для терапии заболеваний, обусловленных хроническим воспалительным процессом, в частности СНСФВ. Кроме того, парентеральное введение может быть болезненным и вызывать дискомфорт, прежде всего при повторных ежедневных введениях, показанных при хроническом воспалении. Для минимизации количества инъекций лекарственную субстанцию можно вводить с помощью пролонгированной лекарственной формы в виде депо. Кроме того, для лечения больных с хроническими воспалительными процессами, например СНСФВ требуется лекарственная форма препарата, приемлемая для амбулаторного приема (в виде формы для внутримышечного или подкожного введения с медленным высвобождением из депо).
Задачей настоящего изобретения является создание фармацевтической композиции с пролонгированным высвобождением (депо), содержащей в качестве действующего вещества додекапептид Инграмон, обладающей способностью ингибировать миграцию моноцитарных клеток, стимулированную хемокином МСР-1, и предназначенную для длительной поддерживающей терапии пациентов, страдающих хроническими воспалительными заболеваниями, в том числе СНСФВ.
Технический результат заключается в обеспечении пролонгированного высвобождения действующего вещества.
Технический результат достигается тем, что заявляемая фармацевтическая композиция с пролонгированным высвобождением додекапептида Инграмон содержит в качестве действующего вещества Инграмон или додекапептид Инграмон или его фармацевтически приемлемую соль, и биоразлагаемый линейный сополимер молочной и гликолевой кислот ПЛГА. Высвобождение действующего вещества происходит в течение 20 - 30 дней. Фармацевтическая композиция имеет форму микрочастиц диаметром от 10 до 90 мкм, которые могут дополнительно иметь кроющий слой или покрытие из препятствующего агломерации агента, при этом препятствующий агломерации агент присутствует в количестве менее 2% в пересчете на массу частиц. Фармацевтическую композицию применяют для пролонгированной поддерживающей терапии пациентов, страдающих хроническими воспалительными заболеваниями, в том числе сердечной недостаточностью с сохранной фракцией выброса левого желудочка (СНСФВ).
Заявляемая фармацевтическая композиция - депо содержит в качестве действующего вещества додекапептид Инграмон формулы H-Asp-His-Leu-Asp-Lys-Gln-Thr-Gln-Thr-Pro-Lys-Thr-OH (I) или его фармацевтически приемлемую соль, включенные в состав многокомпонентной композиции на основе биоразлагаемого линейного сополимера молочной и гликолевой кислот (ПЛГА) в форме микрочастиц. Концевые группы сополимеров ПЛГА, использованных для получения заявляемой фармацевтической композиции, могут представлять собой карбоксигруппу или сложный эфир. Фармацевтическая композиция, предлагаемая в настоящем изобретении, может содержать также один или несколько фармацевтических эксципиентов (вспомогательных веществ), модифицирующих, в частности, характеристики высвобождения пептида. Примерами таких агентов являются натриевая соль карбоксиметилцеллюлозы, приемлемые поверхностно-активные вещества, такие как полоксамеры, известные также как блок-сополимеры полиоксиэтилена и полиоксипропилена, эфиры жирных кислот и поли(оксиэтилен)сорбитана, которые известны под товарным знаком TWEEN® (например, Твин 80). Фармацевтическую композицию, предлагаемую в настоящем изобретении, можно получать в том числе в асептических условиях, что позволяет создать инъекционную форму, соответствующую требованиям действующей фармакопеи.
Неочевидность изобретения обусловлена тем, что любой дизайн пептидных молекул является чисто теоретическим подходом, так как каждый модифицированный пептид (в том числе включенный в состав другой лекарственной формы) является уникальным, его биологическая активность не является очевидной и требует экспериментального подтверждения.
Пептид Инграмон (I) (функциональный аналог, использованный в качестве прототипа) получали путем твердофазного синтеза, описанного в (Патент РФ №2340626 МПК: C07K 7/08, А61К 38/10. Опубл. 10.12.2008).
Получение микрочастиц Инграмон-депо выполняли методом двойного эмульгирования, включающим 3 основных этапа. Первый этап - получение первичной эмульсии (вода1/масло), где полимер растворен в органической фазе, а пептид Инграмон - во внутренней водной фазе. Внутренняя фаза (вода)) представляла собой раствор пептида в ацетатном буфере с рН 7,4 -8,0, при этом значение рН буферного раствора критично для стабильности пептида в микрочастицах. Органическая фаза первичной эмульсии представлена 15-30% раствором ПЛГА в одном из растворителей: хлористом метилене, хлороформе, этилацетате. Первое эмульгирование выполняли при высоких напряжениях сдвига (30000 об/мин), в течение 15-90 с. Второй этап - повторное эмульгирование во вторичной водной фазе с образованием двойной эмульсии (вода1/масло/вода2). Внешняя водная фаза (вода2) представляла собой раствор поверхностно-активного вещества (поливиниловый спирт, либо полоксамер 188, либо Твин -80) в воде или буферном растворе. Осмолярность и рН внешней водной фазы критичны для выхода процесса (процентного включения пептида). Второе эмульгирование выполняли при меньшем числе оборотов диспергатора (4000-15000 об/мин), при этом скорость диспергатора и время второго эмульгирования являются параметрами, определяющими размер получаемых микрочастиц. Третий этап - отверждение («созревание») микрочастиц путем выпаривания органического растворителя под вакуумом (0,4-0,8 атм) с медленным нагревом до 30°С. Сбор затвердевших частиц центрифугированием или фильтрацией, калибровка по размерам (просеивание через сито), смешивание со вспомогательными веществами (маннитол, карбоксиметилцеллюлоза) и лиофилизация. Описанный способ позволил получить фармацевтическую композицию с пролонгированным высвобождением пептида Инграмон, удовлетворяющую следующим требованиям:
• содержание пептида от 30 до 100 мг на 1 г ПЛГА ±5%
• период разрушения микрочастиц - от 10 до 60 дней
• биосовместимость;
• средний размер микрочастиц - от 10 до 100 мкм
• смачиваемость водой;
• инъецируемость (восстановленная суспензия свободно проходит через иглу шприца 0,8×40 мм
• стабильность формы микрочастиц;
• седиментационная устойчивость - время ресуспендирования не превышает 1 мин, осаждение суспензии наблюдается не ранее, чем через 2 мин.
Это обеспечивает высокое 92-97%-ное (от внесенного количества) включение пептида в состав микрочастиц.
Изобретение поясняется чертежами.
Фиг. 1. Морфология микрочастиц (микроскопическое исследование).
Фиг. 2. Распределение ФИТЦ-меченого пептида Инграмон внутри частиц ПЛГА в исходном состоянии (А) и через 14 суток при 37°С (Б).
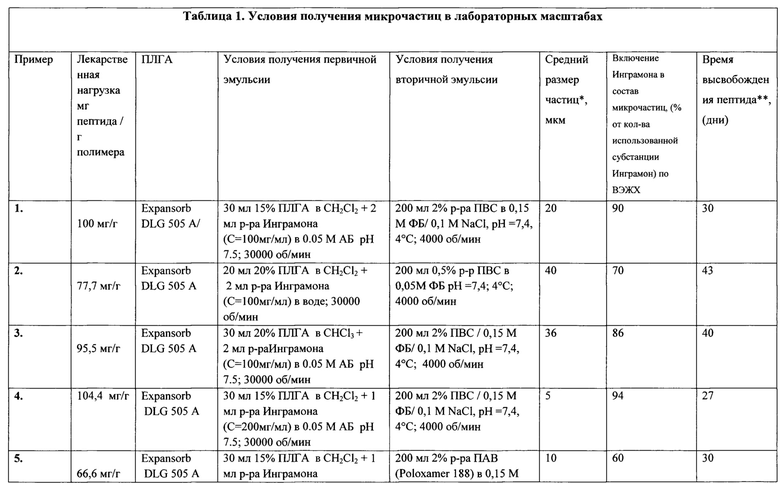
Фиг. 3. Распределение микрочастиц с инкапсулированным пептидом Инграмон по размерам (метод лазерного светорассеяния).
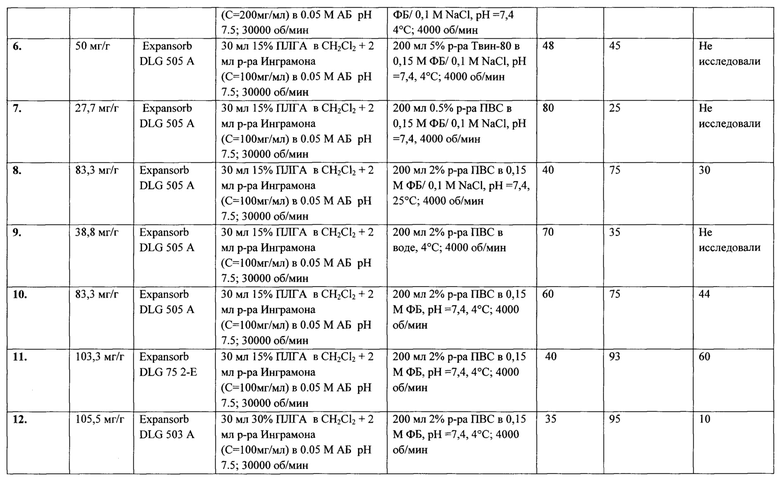
Фиг. 4. Кинетика высвобождения пептида Инграмон из микрочастиц в тесте «проточная ячейка»
Фиг. 5. Влияние препарата «Инграмон-депо» на JE/CCL2-индуцированную миграцию моноцитов в «воздушный мешок» у мышей.
Микроскопическое исследование микрочастиц (Фиг. 1) показало, что микрочастицы имеют сферическую форму. Для детального изучения морфологии в полученные описанным способом микрочастицы был инкапсулирован ФИТЦ-меченый пептид Инграмон. Частицы с меченым пептидом были исследованы методом конфокальной микроскопии с послойным получением изображений в проходящем свете и с регистрацией флуоресценции. При этом также было показано, что микрочастицы характеризуются правильной сферической формой и регулируемым диапазоном размеров, пептид Инграмон (зеленое свечение метки на фотографии) равномерно распределен внутри частиц ПЛГА, окружен тонкой капсулой ПЛГА и «ореолом» поливинилового спирта. Сорбции пептида снаружи полимерной частицы не обнаружено. (Фиг. 2А)
Высвобождение пептида Инграмон из микрочастиц анализировали с помощью конфокальной микроскопии с флуоресцентно меченым пептидом в интервале 7-14 дней (Фиг. 2Б). При этом на седьмой день в части микрочастиц еще сохранено выраженное наполненное пептидом ядро. К 14 дню микрочастиц с флуоресцирующим ядром уже не обнаруживается, зато визуализируются неравномерные скопления пептида на периферии микрочастицы.
Методом лазерного светорассеяния показано, что предлагаемый способ обеспечивает включение основной части пептида в микрочастицы размерного диапазона 40-60 мкм. Частиц с размером более 100 мкм не наблюдается (как предписано нормативными требованиями фармакопеи). (Фиг. 3)
Профиль высвобождения «Инграмона» из микрочастиц был изучен в условиях рекомендованного европейской фармакопеей (European Pharmacopoeia (Ph. Eur.) 10th Edition) теста растворения «Проточная ячейка» при 37°С. Количественный анализ содержания пептида выполнялся с помощью ВЭЖХ. Было показано, что высвобождение Инграмона из микрочастиц происходит в течение 28 дней с момента помещения препарата в среду растворения. При этом время окончания высвобождения пептида совпадает со временем деградации микрочастиц (падение оптической плотности, прозрачность раствора). В сутки высвобождается от 1 до 8% инкапсулированного пептида. Пик высвобождения приходится на 10-20 день с момента начала исследования, 50% икапсулированного Инграмона высвобождается на 16 день исследования. (Фиг. 4).
Действие фармацевтической композиции Инграмон-депо на миграцию моноцитов изучали в модели «воздушного мешка» у мышей, как описано в примере 16. (Фиг. 5). При этом было показано, что композиция с пролонгированным высвобождением пептида Инграмон на 30-35% ингибирует миграцию моноцитов, стимулированную введением рекомбинантного мышиного МСР-1 (JE/CCL2) в полость «воздушного мешка».
Изобретение описано 16 (шестнаднадцатью) примерами.
Список сокращений.
ВЭЖХ - высокоэффективная жидкостная хроматография;
ВЭЖХ-МС/МС - высокоэффективная жидкостная хроматография с тандемным масс-селективным определением;
МСР-1 - моноцитарный хемотаксический белок 1;
ПАВ - поверхностно активное вещество;
ПВС - спирт поливиниловый;
ПЛГА - линейный сополимер молочной и гликолевой кислот;
СНСФВ - сердечная недостаточность с сохраненной фракцией выброса левого желудочка;
ФИТЦ - флуоресцеин изотиоцианат
Примеры 1-14. Получение микрочастиц в лабораторных масштабах (выполнено по типовой методике, приведенной ниже)
Для получения микрочастиц применяли следующее оборудование: диспергатор IKA UltraTurrax Т10 basic (Швеция), роторный испаритель Hei-VAP Precision (Германия), лиофильная осушительная система FreeZone Triad (США), стерилизатор паровой (автоклав) ГК-10 (Россия), ламинар БМБ-II-"Ламинар-С (Россия), центрифуга СМ-6М с ротором на 6 пробирок на 50 мл (Россия), система вакуумной фильтрации Millipore (Гемрания), весы аналитические Ohaus (Швейцария), магнитная мешалка Heidolph с перемешивателем (Германия), рН-метр Ohaus (Швейцария), секундомер. Для определения размеров микрочастиц использовали лазерный дифрактометр LS13320 (Beckman Coulter, Inc., США), съемку частиц проводили на конфокальном микроскопе (Carl Zeiss, LSM 510), ВЭЖХ выполняли на хроматографе Shimadzu LC-20AD, оснащенном УФ-детектором.
В работе использовали линейные сополимеры (D,L)-молочной и гликолевой кислот (Seqense, Швейцария) марок Expansorb DLG 50-5А соотношение лактидтликолид 50:50, молекулярная масса - 42-65 kDa, кислота; Expansorb DLG 50-3А соотношение лактидтликолид 50:50, молекулярная масса - 15-40 kDa, кислота и Expansorb DLG 75-2Е соотношение лактидтликолид 75:25, молекулярная масса 10-25 kDa, сложный эфир; субстанцию Инграмон-ацетат (ФГБУ «НМИЦ кардиологии» Россия), хлористый метилен «хч», маннитол, фосфорную кислоту и натрия гидроксид (Химмед, Россия); спирт поливиниловый 72000 г/моль, натрия фосфат и натрия дигидрофосфат (Panreac, Испания), карбоксиметилцеллюлозы натриевую соль (Acros Organix, США).
К 30 мл 15% раствора ПЛГА в хлористом метилене добавляли 2 мл раствора субстанции Инграмон (100 мг/мл) в 0,05М ацетатном буфере рН 7,5 и выполняли диспергирование в течение 90 с при 30000 об/мин. Полученную первичную эмульсию выдерживали 20 мин без перемешивания, после чего ее плавно вводили (со скоростью не более 10 мл/мин) в 200 мл охлажденного до 4°С 2% раствора ПВС в 0,15 М фосфатном буфере, содержащем 0,1 М хлорид натрия (рН 7,4) и перемешивали 5 мин со скоростью 4000 об/мин. Полученную вторичную эмульсию выливали в 800 мл охлажденной до 4°С среды «созревания» (2% раствор ПВС в 0,15 М фосфатном буфере, содержащем 0,1 М хлорид натрия) и перемешивали в течение 12 ч с постепенным повышением температуры до 30°С. Затвердевшие микрочастицы собирали центрифугированием (800 об/мин), ресуспендировали в 50 мл раствора, содержащего 17 мг/мл маннита и 1 мг/мл карбоксиметилцеллюлозы и полученную суспензию разливали при постоянном перемешивании в пенициллиновые флаконы по 5 мл. Лиофилизацию проводили по программе: охлаждение до -40°С в течение 12 ч, сублимация при -40С - 48 ч, досушка остаточных растворителей при +10С - 48 ч. Получено 4,5 г микрочастиц со средним размером 20 мкм и содержанием Инграмона 100 мг/ г полимера (см. пример 1 в табл. 1).
В таблице 1 приведены условия получения микрочастиц в лабораторных масштабах, описанные примерами 1-14.
Пример 15. Получение микрочастиц Инграмон - депо в пилотном реакторе проводили в соответствии вышеописанной методикой. Для производства пилотной серии (150 флаконов Инграмон-депо) использовали 250 мл 15% раствора ПЛГА в хлористом метилене и 50 мл раствора Инграмон (100 мг/мл) в 0,05 М ацетатном буфере (рН 8,0) и 5000 мл 2% раствора ПВС в фосфатном буфере. Раствор ПЛГА и раствор пептида подвергались стерилизующей фильтрации, раствор ПВС-автоклавированию. После выполнения двух эмульгирований, вторичную эмульсию загружали в реактор с рубашкой термостатирования и подводом вакуума. «Созревание» микрочастиц протекало в течение 12 ч, с нагревом от +4 до 30°С, под вакуумом. Созревшие микрочастицы выгружали в центрифужные бутыли, сбор частиц проводили на центрифуге ЦЛУ 6-3 (Россия), при 3500 об/мин в течение 10 мин. После просеивания через сито (100 мкм), микрочастицы ресуспендировали в 300 мл раствора вспомогательных веществ (маннитол 42,5 мг/мл, КМЦ 5 мг/мл), разливали по 2 мл во флакон и лиофилизовали по программе, описанной выше. Получено 150 флаконов Инграмон -Депо (Состав на 1 флакон: Инграмон - 30 мг, ПЛГА - 300 мг, маннит - 85 мг, КМЦ - 10 мг).

Пример 16.
Действие препарата Инграмон-депо на миграцию моноцитов в модели «воздушного мешка» у мышей.
В работе использовали мышей линии C57Black/6. Под эфирным наркозом в асептических условиях в спинной области мышей создавали полость при помощи двукратного подкожного введения 5 мл (на 0 сутки) и 4 мл (на 4 сутки) стерильного воздуха. 100 мкл препарата Инграмон -депо в дозе 20 мг/кг (опыт) или 100 мкл раствора 0,5% маннита (контроль) вводили внутримышечно на 0 сутки эксперимента. На 7 сутки в сформировавшуюся полость вводили 100 нг хемоаттрактанта моноцитов JE/CCL2 (R&D Systems) - рекомбинантного мышиного аналога МСР-1 - в 1 мл стерильного физиологического раствора или 1 мл стерильного физиологического раствора. Через 5 ч полости промывали раствором Версена, в собранной лаважной жидкости подсчитывали под микроскопом количество клеток, используя камеру Горяева. Типирование моноцитов/макрофагов в лаважной жидкости проводили путем окрашивания клеток фикоэретрин-меченными моноклональными антителами крысы к антигену моноцитов/макрофагов мыши F4/80 (Abcam); связывание антител оценивали с помощью поточной цитофлуориметрии (BD Immunocytometry Systems). Для статистического анализа полученных данных использовали пакет программ Statistica 10,0. Для парных межгрупповых сравнений использовали критерий U Манна-Уитни. Различия считались статистически достоверными при р<0,05.
Результаты. При отсутствии хемоаттрактанта в лаважной жидкости количество клеток было невелико (223 (182; 339) тыс.; данные представлены как медиана (минимум; максимум)). Введение препарата Инграмон (пептид X) - депо не оказало влияния на количество клеток (данные не приведены). Введение рекомбинантного мышиного JE/CCL2 в воздушный мешок сопровождалось усилением миграции моноцитов (F4/80+клеток) в полость мешка. В группе с введением Инграмона (пептида X) - депо количество моноцитов, промигрировавших в полость «мешка» под действием JE/CCL2, было ниже (р=0,051,Фиг. 5).
Таким образом, заявляемое изобретение обеспечивает длительную поддерживающую терапию пациентов, страдающих хроническими воспалительными заболеваниями, в том числе СНСФВ, а так же расширение арсенала нетоксичных нестероидных препаратов с противовоспалительной активностью, недостаток которых очевиден в соответствующем сегменте фармацевтического рынка.
Список литературы
Paulus W., Tschöpe С.A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol 2013;62:263-71.
Glezeva N., Baugh J. Role of inflammation in the pathogenesis of heart failure with preserved ejection fraction and its potential as a therapeutic target. Heart Fail Rev 2014;19:681-94.
Kuwahara F., et al. Hypertensive myocardial fibrosis and diastolic dysfunction: another model of inflamma-tion? Hypertension 2004;43:739-745.
Haudek S., et al. Monocytic fibroblast precursors mediate fibrosis in angiotensin-II-induced cardiac hypertro-phy. J Mol Cell Cardiol 2010;49:499-507.
Krasnikova Т., Sidorova M., Arefieva Т., et al. The effects of synthetic peptides corresponding to MCP-1se-guences on monocytic cell migration. Abstracts of ESC Congress, Munich, 2004, p. 143.
Красникова Т.Л., Арефьева Т.И., Мелехов M. Г. и др. Пептид последовательности 66-77 моноцитарного хемотаксического белка-1 (МСР-1) - ингибитор воспаления у экспериментальных животных. Доклады Академии Наук, 2005, 404, 4,551-554.
Arefieva T.I., Kukhtina N.B., Antonova О.А., Krasnikova T.L. MCP-1 - stimulated chemotaxis of monocytic and endothelial cells is dependent on activation of different signaling cascades. Cytokine 2005, 31(6): 439-446.
Сидорова M.B., Молокоедов A.C., Азьмуко А.А. и др. Пептидный фрагмент (66-77) моноцитарного белка-1 и его ретро-энантио-аналог ингибируют миграцию клеток in vivo и in vitro. Биоорганическая химия, 2006, 32,2,161-168.
Чазов Е.И., Красникова Т.Л., Беспалова Ж.Д. и др. Ингибирование миграции моноцитов и гранулоцитов in vivo пептидом последовательности 65-76 моноцитарного хемотаксического белка-1 (МСР-1). Доклады Академии наук, 2006; 411: 270-272.
Chazov EI, Bespalova JD, Arefieva TI, Kukhtina NB, Sidorova MV, Provatorov SI, Krasnikova TL. The peptide analogue of MCP-1 65-76 sequence is an inhibitor of inflammation. Can J Physiol Pharmacol. 2007; 85(3-4): 332-40.
Кухтина Н.Б., Баштрыков П.П., Беспалова Ж.Д. и др. Влияние синтетического фрагмента 65-76 МСР-1 на формирование неоинтимы после баллонного повреждения у крыс. Российский физиологический журнал им. И.М.Сеченова 2008, 94, 1 27-36.
Arefieva T.I., Krasnikova T.L., Ruleva N.U., et al. Synthetic peptide fragment (65-76) of monocyte chemotactic protein-1 (MCP-1) inhibits MCP-1 binding to heparin and possesses antiinflammatory activity in stable angina patients after coronary stenting. Inflammation Research 2011;60:955-964.
Потехина A.B., Проваторов СИ., Арефьева Т.И. и др. Влияние противовоспалительного пептидного препарата инграмон на содержание белков острой фазы воспаления и хемокинов в крови больных после коронарного стентирования. Терапевтический архив 2010;82:58-63.
Потехина А.В. Содержание растворимых маркеров воспаления и субпопуляцион-ный состав лимфоцитов периферической крови после стентирования коронарных артерий. Диссертация на соискание ученой степени кандидата медицинских наук. Москва, 2011.
Карлина М.В., Косман В.М., Арефьева Т.И., Сидорова М.В., Дудкина У.С., Кискина А.Р., А Уколов. И., Макаров В.Г. Доклиническое исследование фармакокинетики инграмона. Экспериментальная и клиническая фармакология 2021 Том 84 №8 С. 40 - 44 DOI: 10.30906/0869-2092-2021 -84-8-40-44.
Чазов Е.И., Сидорова М.В., Молокоедов А.С., Арефьева Т.И., Кухтина Н.Б., Красникова Т.Л., Беспалова Ж.Д., Бушуев В.Н. Пептид, обладающий способностью ингибировать миграцию моноцитарных клеток, стимулированную белком МСР-1. Патент РФ №2260598. Опубликовано: 20.09.2005 Бюл. №26.
Чазов Е.И., Беспалова Ж.Д., Азьмуко А.А., Сидорова М.В., Молокоедов А.С., Красникова Т.Л., Арефьева Т.И., Кухтина Н.Б. Способ получения додекапептида и трипептид для его осуществления. Патент РФ 2340626. Опубликовано: 10.12.2008. Бюл. №34.
Петерзен X., Альхайм М. Патент РФ №2 541 104. Препаративная форма с замедленным высвобождением, содержащая октреотид и три линейных полимера поли(лактид-со-гликолида) WO 2009/095450 (06.08.2009) Дата публикации заявки: 10.03.2012 Бюл. №7 (45). Опубликовано: 10.02.2015. Бюл. №4.
Ришар Ж., Пети А., ХарнетТ Дж., Баронне М., Артзнер Ф., Кардус Малеспина М., Шериф-Шейкх Р., Монтес М., Патерностр М.-Т., Валери С. Водные композиции аналогов LHRH с замедленным высвобождением. Патент РФ №2690683. Опубликовано: 05.06.2019.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД ДЛЯ ИНГИБИРОВАНИЯ ФРАКТАЛКИН-СТИМУЛИРОВАННОЙ МИГРАЦИИ МОНОЦИТАРНЫХ КЛЕТОК | 2011 |
|
RU2461565C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ ИНГИБИРОВАТЬ МИГРАЦИЮ МОНОЦИТАРНЫХ КЛЕТОК, СТИМУЛИРОВАННУЮ БЕЛКОМ МСР-1 | 2003 |
|
RU2260598C2 |
| Пептидное лекарственное средство | 2022 |
|
RU2827765C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ ТЯЖЕСТИ ИШЕМИИ ТКАНЕЙ НИЖНИХ КОНЕЧНОСТЕЙ У БОЛЬНЫХ С ОБЛИТЕРИРУЮЩИМ АТЕРОСКЛЕРОЗОМ СОСУДОВ НИЖНИХ КОНЕЧНОСТЕЙ | 2012 |
|
RU2473082C1 |
| Антитела против эотаксина 2, которые распознают дополнительные связывающие CCR3 хемокины | 2015 |
|
RU2705255C2 |
| Применение пептида для лечения сердечно-сосудистых заболеваний | 2013 |
|
RU2672341C2 |
| ИСПОЛЬЗОВАНИЕ МСР-1 ДЛЯ ИНДУКЦИИ ГОТОВНОСТИ К РАСКРЫТИЮ ШЕЙКИ МАТКИ | 1995 |
|
RU2207873C2 |
| КЛЕТОЧНАЯ ТЕРАПИЯ ИШЕМИЧЕСКОЙ ТКАНИ | 2009 |
|
RU2535966C2 |
| АНТИТЕЛА ПРОТИВ МОНОЦИТАРНОГО ХЕМОАТТРАКТАНТНОГО БЕЛКА-1 (МСР-1) И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2339647C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ МИКРОСФЕРЫ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩИЕ АНАЛОГ ГПП-1 ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМУЮ СОЛЬ | 2021 |
|
RU2834992C1 |

Изобретение относится к области фармакологии. Сущность заключается в том, что создана фармацевтическая композиция для пролонгированного высвобождения обладающего противовоспалительным действием пептида Инграмон или его соли, где указанный пептид представлен следующей последовательностью: H-Asp-His-Leu-Asp-Lys-Gln-Thr-Gln-Thr-Pro-Lys-Thr-OH, причем композиция дополнительно содержит фармацевтически приемлемый биоразлагаемый полимер. Технический результат изобретения обеспечивает пролонгированное высвобождение действующего вещества. 4 з.п. ф-лы, 16 пр., 1 табл., 5 ил.
1. Фармацевтическая композиция с пролонгированным высвобождением додекапептида Инграмон для поддерживающей терапии заболеваний, связанных с хроническим воспалительным процессом, обусловленным увеличением выработки моноцитарного хемотаксического белка-1 (МСР-1), содержит в качестве действующего вещества додекапептид Инграмон или его фармацевтически приемлемую соль - ацетат и биоразлагаемый линейный сополимер молочной и гликолевой кислот ПЛГА в форме микрочастиц от 10 до 90 мкм, при этом композиции микрочастиц предназначены для инъекций.
2. Фармацевтическая композиция по п. 1, из которой высвобождение действующего вещества происходит в течение 20-30 дней.
3. Фармацевтическая композиция по п. 1, в которой микрочастицы дополнительно имеют кроющий слой или покрытие из препятствующего агломерации агента.
4. Фармацевтическая композиция по п. 3, в которой микрочастицы имеют покрытие из препятствующего агломерации агента и препятствующий агломерации агент присутствует в количестве менее 2% в пересчете на массу частиц.
5. Фармацевтическая композиция по одному из пп. 1-4 для пролонгированной поддерживающей терапии заболеваний, связанных с хроническим воспалительным процессом, в том числе сердечной недостаточности с сохранной фракцией выброса левого желудочка (СНСФВ).
| СПОСОБ ПОЛУЧЕНИЯ ДОДЕКАПЕПТИДА И ТРИПЕПТИД ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2007 |
|
RU2340626C1 |
| Кухтина, Надежда Борисовна, Моноцитарный хемотаксический белок-1 (МСР-1) как фактор воспаления при атерогенезе | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| АХМЕТШИНА МАРИНА РИНАТОВНА | |||
Авторы
Даты
2023-03-29—Публикация
2022-03-31—Подача