ПЕРЕКРЕСТНЫЕ ССЫЛКИ
Настоящая заявка испрашивает приоритет согласно заявке CN 01610536449.9, поданной 08 июля 2016 г., и международной РСТ-заявке PCT/CN2017/082024, поданной 26 апреля 2017 г., содержание которых полностью включено в настоящий документ посредством ссылки.
Область техники
Настоящее изобретение относится к области иммунологии и, в частности, настоящее изобретение относится к антителам против клаудина 18А2 и вариантам их применения.
Уровень техники
Химерный антигенный рецептор (CAR) представляет собой искусственный рекомбинантный рецептор, который обычно содержит домен распознавания антигена моноклонального антитела, локализованный во внеклеточной области, трансмембранную область и внутриклеточный сигнальный домен активации клетки иммунного ответа.
Рак желудка представляет собой один из видов рака, наиболее часто встречающийся в мире. В соответствии с данными статистики Программы по борьбе с раком ВОЗ, ежегодно от рака умирает 7 млн пациентов в мире; 700000 из них умирают от рака желудка. По сравнению со стандартными схемами лечения рака желудка, схемы лечения на основе антител отличаются многообещающими перспективами применения благодаря высокой специфичности и незначительным побочным эффектам.
Клаудин 18 (CLD18) представляет собой внутренний мембранный белок, локализованный в плотном контакте эпителия и эндотелия, имеющий молекулярную массу приблизительно 27,9 кДа. Номера доступа GenBank: вариант сплайсинга 1 (CLD18A1, CLD18.1): NP_057453, NM016369; вариант сплайсинга 2 (CLD18A2, CLD18.2): NM_001002026, NP_001002026. На фиг. 1А приведен сравненительный анализ идентичности клаудина 18А2 (SEQ ID NO: 55) и клаудина 18А1 (SEQ ID NO: 57). В нормальных клетках CLD18A1 селективно экспрессируется в эпителии легких и желудка, тогда как CLD18A2 на незначительном уровне экспрессируется в нормальных короткоживущих клетках желудочного эпителия. Однако в опухолевых клетках CLD18A2 на значительном уровне экспрессируется при различных типах рака. Например, у 75% пациентов с раком желудка наблюдаются высокие уровни экспрессии CLD18A2, у 50% пациентов с раком поджелудочной железы наблюдаются высокие уровни экспрессии CLD18A2; и у 30% пациентов с раком пищевода наблюдаются высокие уровни экспрессии CLD18A2, который на значительном уровне экспрессируется при раке легкого. Соответственно, для лечения и детекции рака очень важен поиск антител, связывающих с большей специфичностью CLD18A2, не связывая при этом CLD18A1.
Интерфероны I типа включают белок ИФН-α (класс идентичных белков, кодируемых 13 генами человека, от IFNA1 до IFNA13), ИФН-β (кодируемый одним геном IFNB1y человека и мыши) и другие, менее изученные интерфероны. Исследования показали, что интерфероны I типа оказывают противораковые эффекты на некоторые опухоли, возможно, за счет иммуностимулирующей функции. Однако системное введение интерферонов I типа может оказывать иммуносупрессивные эффекты (Lotrich, FE Major depression during interferon-α treatment: vulnerability and prevention. Dialogues Clin. Neurosci. 11, 417-425 (2009)) с выраженными нежелательными явлениями, наиболее распространенными из которых являются усталость, анорексия, гепатотоксичность, гриппоподобные симптомы и тяжелая депрессия (Kreutzer, K., Bonnekoh, В., Franke, I, Ulrich, J. & Gollnick, H. Sarcoidosis, myasthenia gravis And anterior ischaemic optic neuropathy: severe side effects of adjuvant interferon-a therapy in malignant melanoma?. J. Dtsch. Dermatol. Ges. 2, 689-694 (на немецком языке) (2004)), и такие тяжелые побочные эффекты серьезно ограничивают их применение.
Краткое описание изобретения
Настоящее изобретение позволяет преодолеть вышеупомянутые проблемы, а также обеспечивает дополнительные преимущества.
В соответствии с одним аспектом настоящего изобретения предложено антитело, которое специфически связывается с клаудином 18А2, отличающееся тем, что указанное антитело содержит CDR тяжелой цепи, содержащий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 31, 32, 33, 37, 38, 39, 43, 44, 45, 49, 50, 51, 83, 84, 85, или ее вариант, и/или CDR легкой цепи, содержащий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 34, 35, 36, 40, 41, 42, 46, 47, 48, 52, 53, 54, или ее вариант.
Согласно некоторым вариантам реализации антитело согласно настоящему изобретению выбрано из группы, состоящей из (а) антитела, содержащего вариабельную область тяжелой цепи, где указанная вариабельная область тяжелой цепи содержит CDR1, содержащий последовательность аминокислот, представленную в SEQ ID NO: 31, SEQ ID NO: 37, SEQ ID NO: 43 или SEQ ID NO: 49, CDR2, содержащий последовательность аминокислот, представленную в SEQ ID NO: 32, SEQ ID NO: 38, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 83, SEQ ID NO: 84 или SEQ ID NO: 85, CDR3, содержащий последовательность аминокислот, представленную в SEQ ID NO: 33, SEQ ID NO: 39, SEQ ID NO: 45 или SEQ ID NO: 51; (b) антитела, содержащего вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит CDR1, содержащий последовательность аминокислот, представленную в SEQ ID NO: 34, SEQ ID NO: 40, SEQ ID NO: 46 или SEQ ID NO: 52, CDR2, содержащий последовательность аминокислот, представленную в SEQ ID NO: 35, SEQ ID NO: 41, SEQ ID NO: 47 или SEQ ID NO: 53, CDR3, содержащий последовательность аминокислот, представленную в SEQ ID NO: 36, SEQ ID NO: 42, SEQ ID NO: 48 или SEQ ID NO: 54; (с) антитело, содержащее (а) вариабельную область тяжелой цепи указанного антитела и (b) вариабельную область легкой цепи указанного антитела; (d) антитело, распознающее тот же сайт антигенной детерминанты, что и антитело по любому из (а) - (с).
Согласно некоторым вариантам реализации указанные участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи указанного антитела представлены SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33; или SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39; или SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45; или SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51; или SEQ ID NO: 31, SEQ ID NO: 83, SEQ ID NO: 33; или SEQ ID NO: 31, SEQ ID NO: 84, SEQ ID NO: 33; или SEQ ID NO: 49, SEQ ID NO 85, SEQ ID NO: 51, соответственно; и/или участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи указанного антитела представлены SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36; или SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42; или SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48; или SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, соответственно.
Согласно некоторым вариантам реализации указанное антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, отличающиеся тем, что указанная вариабельная область тяжелой цепи имеет последовательность аминокислот, представленную в SEQ ID NO: 3, SEQ ID NO: 7, SEQ ID NO: 11, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 23, SEQ ID NO: 27 или SEQ ID NO: 29; а указанная вариабельная область легкой цепи имеет последовательность аминокислот, представленную в SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 9, SEQ ID NO: 13, SEQ ID NO: 21 или SEQ ID NO: 25. Согласно некоторым вариантам реализации указанное антитело представляет собой антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 3 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 7 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 5; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 11 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 9; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 15 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 13; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 17 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 19 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 23 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 21; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 27 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25; или антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 29 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25. Согласно некоторым вариантам реализации указанное антитело представляет собой антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 3 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 17 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 19 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 23 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 21; антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 27 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25; или антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 29 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25. Согласно некоторым вариантам реализации указанное антитело представляет собой гуманизированное антитело, химерное антитело или полностью гуманизированное антитело; или указанное антитело представляет собой моноклональное антитело; или указанное антитело представляет собой одноцепочечное антитело или доменное антитело. Согласно некоторым вариантам реализации указанное антитело представляет собой гуманизированное антитело, выбранное из группы, состоящей из антитела, содержащего вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 27 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25; антитела, содержащего вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 23 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 21; антитела, содержащего вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 29 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25. Согласно некоторым вариантам реализации указанное антитело выбрано из группы, состоящей из антитела, содержащего тяжелую цепь с последовательностью SEQ ID NO: 63 и легкую цепь с последовательностью SEQ ID NO: 65; антитела, содержащего легкую цепь с последовательностью SEQ ID NO: 61 и тяжелую цепь с последовательностью SEQ ID NO: 59; и антитела, содержащего тяжелую цепь с последовательностью SEQ ID NO: 67 и легкую цепь с последовательностью SEQ ID NO: 65.
В соответствии с одним аспектом настоящего изобретения предложена нуклеиновая кислота, кодирующая антитело, как упоминалось выше. В соответствии с другим аспектом настоящего изобретения предложен экспрессионный вектор, содержащий указанную нуклеиновую кислоту. В соответствии с другим аспектом настоящего изобретения предложен клетка-хозяин, содержащая экспрессионный вектор согласно настоящему изобретению или содержащая нуклеиновую кислоту согласно настоящему изобретению, интегрированные в ее геном.
В соответствии с одним аспектом настоящего изобретения предложено применение антитела в соответствии с настоящим изобретением для получения нацеленного лекарственного средства, конъюгата антитела с лекарственным средством или многофункционального антитела, специфически нацеленного на опухолевые клетки, экспрессирующие клаудин 18А2; или для получения реагента для диагностики опухоли, экспрессирующей клаудин 18А2; или для получения модифицированной химерным антигенным рецептором иммунной клетки. Согласно некоторым вариантам реализации указанная опухоль, экспрессирующая клаудин 18А2, включает: рак желудка, рак поджелудочной железы, рак пищевода, рак легкого.
В соответствии с одним аспектом настоящего изобретения предложен химерный антигенный рецептор, содержащий антитело согласно настоящему изобретению, отличающийся тем, что указанный химерный антигенный рецептор содержит следующие последовательно соединенные компоненты: антитело согласно настоящему изобретению, трансмембранную область и внутриклеточную сигнальную область. Согласно некоторым вариантам реализации указанная внутриклеточная сигнальная область выбрана из группы, состоящей из: последовательности внутриклеточной сигнальной области CD3ζ, FcεRIγ, CD27, CD28, CD137, CD134, MyD88, CD40 или их комбинации; или указанная трансмембранная область содержит трансмембранную область CD8 или CD28. Согласно некоторым вариантам реализации указанный химерный антигенный рецептор содержит последовательно соединенные антитело, трансмембранную область и внутриклеточную сигнальную область: антитело согласно настоящему изобретению, CD8 и CD3ζ; антитело согласно настоящему изобретению, CD8, CD137 и CD3ζ; или антитело согласно настоящему изобретению, трансмембранную область молекулы CD28, внутриклеточную сигнальную область молекулы CD28, и CD3ζ; или антитело согласно настоящему изобретению, трансмембранную область молекулы CD28, внутриклеточную сигнальную область молекулы CD28, CD 137 и CD3ζ.
В соответствии с другим аспектом настоящего изобретения предложена нуклеиновая кислота, кодирующая химерный антигенный рецептор. В соответствии с другим аспектом настоящего изобретения предложен экспрессионный вектор, содержащий нуклеиновую кислоту согласно настоящему изобретению. В соответствии с другим аспектом настоящего изобретения предложен вирус, содержащий вектор согласно настоящему изобретению.
В соответствии с одним аспектом настоящего изобретения в настоящем изобретении предложены варианты применения химерного антигенного рецептора, нуклеиновой кислоты, экспрессионного вектора или вируса согласно настоящему изобретению для получения модифицированных химерным антигенным рецептором иммунных клеток, нацеленных на опухолевые клетки, экспрессирующие клаудин 18А2. Согласно некоторым вариантам реализации опухоль, экспрессирующая клаудин 18А2, включает: рак желудка, рак поджелудочной железы, рак пищевода, рак легкого.
В соответствии с одним аспектом настоящего изобретения предложена модифицированная химерным антигенным рецептором иммунная клетка, трансдуцированная нуклеиновой кислотой, экспрессионным вектором или вирусом согласно настоящему изобретению; или содержащая химерный антигенный рецептор согласно настоящему изобретению, экспрессируемый на поверхности. Согласно некоторым вариантам реализации указанная иммунная клетка представляет собой: Т-лимфоцит, NK-клетку или NKT-лимфоцит. Согласно некоторым вариантам реализации указанная иммунная клетка дополнительно несет кодирующую последовательность экзогенного цитокина; или дополнительно экспрессирует другой химерный антигенный рецептор, который не содержит CD3ζ, однако содержит внутриклеточный сигнальный домен CD28, внутриклеточный сигнальный домен CD137, или комбинацию обоих доменов; или дополнительно экспрессирует хемокиновый рецептор (предпочтительно, указанный хемокиновый рецептор содержит: CCR); или дополнительно экспрессирует миРНК, которая может снижать экспрессию PD-1, или белок, который может блокировать PD-L1; или эндогенный PD-1 в указанной иммунной клетке нокаутирован с применением методик редактирования генов; или дополнительно экспрессирует «переключатель безопасности».
В соответствии с одним аспектом настоящего изобретения предложены варианты применения модифицированной химерным антигенным рецептором иммунной клетки для получения ингибирующего опухоли лекарственного средства, отличающиеся тем, что указанная опухоль представляет собой опухоль, экспрессирующую клаудин 18А2; предпочтительно, указанная опухоль включает: рак желудка, рак поджелудочной железы, рак пищевода, и рак легкого.
В соответствии с одним аспектом настоящего изобретения предложен многофункциональный иммуноконъюгат, содержащий антитело согласно настоящему изобретению; и присоединенную к нему функциональную молекулу; и указанная функциональная молекула выбрана из группы, состоящей из: молекулы, нацеленной на поверхностный маркер на опухоли, ингибирующей опухоли молекулы, молекулы, нацеленной на поверхностный маркер иммунной клетки, или детектируемой метки. Согласно некоторым вариантам реализации указанная молекула, нацеленная на поверхностный маркер иммунной клетки, представляет собой антитело, связывающееся с поверхностным маркером Т-клеток, которое образует бифункциональное антитело с антителом согласно настоящему изобретению с вовлечением Т-клетки. В соответствии с другим аспектом настоящего изобретения предложены нуклеиновая кислота, кодирующая указанный многофункциональный иммуноконъюгат, и варианты ее применения для получения противоопухолевых лекарственных средств. Согласно некоторым вариантам реализации указанную нуклеиновую кислоту, кодирующую многофункциональный иммуноконъюгат, применяют для получения реагента для диагностики опухоли, экспрессирующей клаудин 18А2. Согласно некоторым вариантам реализации указанную нуклеиновую кислоту, кодирующую многофункциональный иммуноконъюгат, применяют для получения модифицированных химерным антигенным рецептором иммунных клеток. Согласно некоторым вариантам реализации указанная иммунная клетка включает: Т-лимфоцит, NK-клетку или NKT-лимфоцит.
В соответствии с одним аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая антитело согласно настоящему изобретению или нуклеиновую кислоту, кодирующую указанное антитело. В соответствии с одним аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая иммуноконъюгат согласно настоящему изобретению или нуклеиновую кислоту, кодирующую указанный конъюгат. В соответствии с одним аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая химерный антигенный рецептор согласно настоящему изобретению или нуклеиновую кислоту, кодирующую указанный химерный антигенный рецептор. В соответствии с одним аспектом настоящего изобретения предложена фармацевтическая композиция, содержащая модифицированной химерным антигенным рецептором иммунной клетки согласно настоящему изобретению. Согласно некоторым вариантам реализации указанная фармацевтическая композиция содержит фармацевтически приемлемый носитель или вспомогательное вещество.
В соответствии с одним аспектом настоящего изобретения предложен набор, содержащий контейнер, и фармацевтическая композиция согласно настоящему изобретению в указанном контейнере; либо контейнер и антитело согласно настоящему изобретению или нуклеиновую кислоту, кодирующую указанное антитело в указанном контейнере; либо иммуноконъюгат согласно настоящему изобретению или нуклеиновую кислоту, кодирующую указанный конъюгат; либо химерный антигенный рецептор согласно настоящему изобретению или нуклеиновую кислоту, кодирующую указанный химерный антигенный рецептор; или модифицированную химерным антигенным рецептором иммунную клетку согласно настоящему изобретению.
В соответствии с одним аспектом настоящего изобретения предложена антигенсвязывающая единица, содержащая CDR легкой цепи и CDR тяжелой цепи, отличающаяся тем, что указанная антигенсвязывающая единица специфически связывается с пептидом клаудином 18А2; и тем, что указанная антигенсвязывающая единица в значимой степени не связывается с пептидом клаудином 18А1. В соответствии с другим аспектом настоящего изобретения предложена антигенсвязывающая единица, содержащая CDR легкой цепи и CDR тяжелой цепи, отличающаяся тем, что указанная антигенсвязывающая единица специфически связывается с пептидом клаудином 18А2; и тем, что указанная антигенсвязывающая единица, по сравнению с референсной антигенсвязывающей единицей, проявляет меньшую степень неспецифического связывания с пептидом клаудином 18А1. Согласно некоторым вариантам реализации указанная референсная антигенсвязывающая единица содержит последовательность аминокислот легкой цепи, представленную в SEQ ID NO: 86 или SEQ ID NO: 88; и/или последовательность аминокислот тяжелой цепи, представленную в SEQ ID NO: 87 или SEQ ID NO: 89. Согласно некоторым вариантам реализации указанный пептид клаудин 18А2 содержит последовательность аминокислот, представленную в SEQ ID NO: 55. Согласно некоторым вариантам реализации указанный пептид клаудин 18А1 содержит последовательность аминокислот, представленную в SEQ ID NO: 57. Согласно некоторым вариантам реализации неспецифическое связывание антигенсвязывающей единицы с пептидом клаудином 18А1 не превышает 20% от специфического связывания с пептидом клаудином 18А2. Согласно некоторым вариантам реализации указанную специфичность связывания определяют с применением проточной цитометрии. Согласно некоторым вариантам реализации указанную специфичность связывания определяют с применением FACS. Согласно некоторым вариантам реализации указанную специфичность связывания определяют с применением ИФА ELISA. Согласно некоторым вариантам реализации указанная антигенсвязывающая единица связывается с пептидом клаудином 18А2 с ЕС50, составляющей менее чем приблизительно 100 нМ. Согласно некоторым вариантам реализации указанная антигенсвязывающая единица представляет собой моноклональное антитело, гуманизированное антитело, химерное антитело, мультивалентное антитело или химерный антигенный рецептор. Согласно некоторым вариантам реализации указанный CDR легкой цепи содержит LCDR1, LCDR2 и LCDR3; а указанный CDR тяжелой цепи содержит HCDR1, HCDR2 и HCDR3; где указанные LCDR1, LCDR2 и LCDR3, соответственно, содержат последовательность аминокислот, выбранную из группы, состоящей из: SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; и указанные HCDR1, HCDR2 и HCDR3, соответственно, содержат последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Согласно некоторым вариантам реализации указанная LCDR1 содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 34, SEQ ID NO: 40, SEQ ID NO: 46 и SEQ ID NO: 52. Согласно некоторым вариантам реализации указанная LCDR2 содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 34, SEQ ID NO: 41, SEQ ID NO: 47 и SEQ ID NO: 53. Согласно некоторым вариантам реализации указанная LCDR3 содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 35, SEQ ID NO: 42, SEQ ID NO: 48 и SEQ ID NO: 54. Согласно некоторым вариантам реализации указанная HCDR1 содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 37, SEQ ID NO: 43 и SEQ ID NO: 49. Согласно некоторым вариантам реализации указанная HCDR2 содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 32, SEQ ID NO: 38, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Согласно некоторым вариантам реализации указанная HCDR3 содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 33, SEQ ID NO: 39, SEQ ID NO: 45 и SEQ ID NO: 51. Согласно некоторым вариантам реализации указанная антигенсвязывающая единица представляет собой scFv, Fv, Fab или (Fab)2.
В соответствии с одним аспектом настоящего изобретения предложена антигенсвязывающая единица, содержащая CDR легкой цепи и CDR тяжелой цепи, отличающаяся тем, что указанный CDR легкой цепи содержит LCDR1, LCDR2 и LCDR3; указанный CDR тяжелой цепи содержит HCDR1, HCDR2 и HCDR3; указанные LCDR1, LCDR2 и LCDR3, соответственно, содержат последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; и указанные HCDR1, HCDR2 и HCDR3, соответственно, содержат последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Согласно некоторым вариантам реализации указанный CDR легкой цепи содержит LCDR1, LCDR2 и LCDR3; указанный CDR тяжелой цепи содержит HCDR1, HCDR2 и HCDR3; указанные LCDR1, LCDR2 и LCDR3, соответственно, содержат последовательность аминокислот, выбранную из группы, состоящей из: SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48 SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; и указанные HCDR1, HCDR2 и HCDR3, соответственно, содержат последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Согласно некоторым вариантам реализации указанная LCDR1 содержит последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 34, SEQ ID NO: 40, SEQ ID NO: 46 и SEQ ID NO: 52. Согласно некоторым вариантам реализации указанная LCDR2 содержит последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 34, SEQ ID NO: 41, SEQ ID NO: 47 и SEQ ID NO: 53. Согласно некоторым вариантам реализации указанная LCDR3 содержит последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 35, SEQ ID NO: 42, SEQ ID NO: 48 и SEQ ID NO: 54. Согласно некоторым вариантам реализации указанная HCDR1 содержит последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 37, SEQ ID NO: 43 и SEQ ID NO: 49. Согласно некоторым вариантам реализации указанная HCDR2 содержит последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 32, SEQ ID NO: 38, SEQ ID NO: 44, SEQ ID NO: 50 SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Согласно некоторым вариантам реализации указанная HCDR3 содержит последовательность аминокислот, которая по меньшей мере на 80% идентична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 33, SEQ ID NO: 39, SEQ ID NO: 45 и SEQ ID NO: 51. Согласно некоторым вариантам реализации указанная антигенсвязывающая единица представляет собой моноклональное антитело, гуманизированное антитело, химерное антитело, мультивалентное антитело или химерный антигенный рецептор. Согласно некоторым вариантам реализации указанная антигенсвязывающая единица представляет собой scFv, Fv, Fab или (Fab)2.
В соответствии с одним аспектом настоящего изобретения предложен химерный антигенный рецептор, содержащий внеклеточную антигенсвязывающую единицу, трансмембранный домен и внутриклеточный домен, отличающийся тем, что указанная внеклеточная антигенсвязывающая единица содержит антигенсвязывающую единицу согласно настоящему изобретению. В соответствии с одним аспектом настоящего изобретения предложена композиция, содержащая антигенсвязывающую единицу или химерный антигенный рецептор согласно настоящему изобретению. Согласно некоторым вариантам реализации указанная композиция содержит интерферон I типа. В соответствии с одним аспектом настоящего изобретения предложена выделенная нуклеиновая кислота, кодирующая антигенсвязывающую единицу или химерный антигенный рецептор согласно настоящему изобретению; и, необязательно, интерферон I типа. В соответствии с одним аспектом настоящего изобретения предложен вектор, содержащий нуклеиновую кислоту согласно настоящему изобретению.
В соответствии с одним аспектом настоящего изобретения предложена клетка-хозяин, которая экспрессирует антигенсвязывающую единицу или химерный антигенный рецептор согласно настоящему изобретению; и, необязательно, интерферон I типа. В соответствии с одним аспектом настоящего изобретения предложена клетка-хозяин, содержащая нуклеиновую кислоту, кодирующую антигенсвязывающую единицу или химерный антигенный рецептор согласно настоящему изобретению; и, необязательно, интерферон I типа. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку иммунного ответа. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой Т-клетку, естественную киллерную клетку, цитотоксический Т-лимфоцит, естественную киллерную Т-клетку, DNT-клетку и/или регуляторную Т-клетку. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку NK92.
Согласно некоторым вариантам реализации указанная клетка-хозяин является цитотоксической для клетки, содержащей пептид клаудин 18А2, содержащий последовательность аминокислот, представленную в SEQ ID NO: 55. Согласно некоторым вариантам реализации указанная клетка-хозяин не обладает значимой цитотоксичностью для клетки, содержащей пептид клаудин 18А1, но не содержащей пептид клаудин 18А2, где пептид клаудин 18А1 содержит последовательность аминокислот, представленную в SEQ ID NO: 57, а пептид клаудин 18А2 содержит последовательность аминокислот, представленную в SEQ ID NO: 55.
В соответствии с одним аспектом настоящего изобретения предложен способ получения антигенсвязывающей единицы или химерного антигенного рецептора или композиции согласно настоящему изобретению, включающий: культивирование клетки-хозяина согласно настоящему изобретению в подходящих условиях и получение продукта, экспрессируемого указанной клеткой-хозяином.
В соответствии с одним аспектом настоящего изобретения предложен способ индукции смерти клетки, содержащей пептид клаудин 18А2, включающий приведение указанной клетки в контакт с антигенсвязывающей единицей, химерным антигенным рецептором, композицией или клеткой-хозяином согласно настоящему изобретению. Согласно некоторым вариантам реализации указанную клетку приводят в контакт с указанной антигенсвязывающей единицей, указанным химерным антигенным рецептором, указанной композицией или клеткой-хозяином in vitro. Согласно некоторым вариантам реализации указанную клетку приводят в контакт с указанной антигенсвязывающей единицей, указанным химерным антигенным рецептором, указанной композицией или клеткой-хозяином in vivo. Согласно некоторым вариантам реализации указанная клетка представляет собой раковую клетку. Согласно некоторым вариантам реализации указанная клетка представляет собой клетку солидной опухоли. Согласно некоторым вариантам реализации указанная клетка выбрана из группы, состоящей из: клетки рака желудка, клетки рака пищевода, клетки рака кишечника, клетки рака поджелудочной железы, клетки нефробластомы, клетки рака легкого, клетки рака яичников, клетки рака толстой кишки, клетки рака прямой кишки, клетки рака печени, клетки рака головы и шеи, клетки хронического миелоидного лейкоза и клетки рака желчного пузыря.
В соответствии с одним аспектом настоящего изобретения предложен способ лечения опухоли у нуждающегося в этом индивидуума, включающий введение указанному индивидууму эффективного количества антигенсвязывающей единицы, химерного антигенного рецептора, композиции или клетки-хозяина согласно настоящему изобретению. Согласно некоторым вариантам реализации указанная опухоль представляет собой солидную опухоль. Согласно некоторым вариантам реализации указанная опухоль представляет собой рак желудка, рак пищевода, рак кишечника, рак поджелудочной железы, нефробластома, рак легкого, рак яичников, рак толстой кишки, рак прямой кишки, рак печени, рак головы и шеи, хронический миелогенный лейкоз или рак желчного пузыря. Согласно некоторым вариантам реализации указанный способ дополнительно включает введение указанному индивидууму дополнительного терапевтического агента. Согласно некоторым вариантам реализации указанный дополнительный терапевтический агент представляет собой по меньшей мере что-либо одно из группы, состоящей из эпирубицина, оксалиплатина и 5-фторурацила.
Включение посредством ссылки
Все публикации, патенты и патентные заявки, упоминаемые в настоящем описании, включены в настоящий документ посредством ссылки в той же мере, как если бы каждая(ый) из указанных публикаций, патентов или патентных заявок был(а) включен(а) посредством ссылки.
Краткое описание чертежей
Чертежи дополнительно иллюстрируют новые признаки, раскрытые в настоящем описании. Признаки и преимущества, описанные в настоящем документе, будут более понятны после изучения описаний сопроводительных чертежей. Следует, однако, понимать, что чертежи предназначены исключительно для иллюстрации специфических вариантов реализации, задействующих принципы, описанные в настоящем документе, и не предполагают ограничений объема прилагаемой формулы изобретения.
На фиг. 1А приведено сравнение идентичности клаудина 18А2 (SEQ ID NO: 55) и клаудина 18А1 (SEQ ID NO: 57); на фиг. 1В показано связывание супернатантов гибридом 2В1, 3Е12, 4А11 и 8Е5 с клетками HEK293, стабильно трансфицированными CLD18A2 и CLD18A1 человека, по данным проточной цитометрии.
На фиг. 2 приведено выравнивание последовательностей антител против 2В1 (вариабельная область тяжелой цепи SEQ ID NO: 3, вариабельная область легкой цепи SEQ ID NO: 1), 3Е12 (вариабельная область тяжелой цепи SEQ ID NO: 7, вариабельная область легкой цепи SEQ ID NO: 5), 4А11 (вариабельная область тяжелой цепи SEQ ID NO: 11, вариабельная область легкой цепи SEQ ID NO: 9), 8Е5 (вариабельная область тяжелой цепи SEQ ID NO: 15, вариабельная область легкой цепи SEQ ID NO: 13) мыши.
На фиг. 3 показана относительная аффинность связывания антитела против 2В1 мыши, ScFv 8Е5, после слияния с Fc-частью IgG1 человека, с клетками HEK293, стабильно трансфицированными CLD18A2 человека.
На фиг. 4 показана относительная аффинность связывания сконструированного антитела мыши против 2В1 2B1-N52D и 2B1-S54A, после слияния с Fc-частью IgG1 человека, с клетками HEK293, стабильно трансфицированными CLD18A2 человека.
На фиг. 5 показана относительная аффинность связывания гуманизированного hu2B1-S54A, после слияния с Fc-частью IgG1 человека, с клетками HEK293, стабильно трансфицированными CLD18A2 человека.
На фиг. 6 показана относительная аффинность связывания гуманизированного hu8E5, после слияния с Fc-частью IgG1 человека, с клетками HEK293, стабильно трансфицированными CLD18A2 человека.
На фиг. 7 показана относительная аффинность связывания сконструированного гуманизированного hu8E5-2I с клетками HEK293, стабильно трансфицированными CLD18A2 человека.
На фиг. 8А приведено сравнение КЗЦ-эффектов гуманизированных антител hu2B1-S54A, hu8E5-2I и известного химерного антитела ch-163E12 (см. CN 103509110 А) на клетки HEK293, трансфицированные CLD18A2; на фиг. 8В приведено сравнение результатов КЗЦ гуманизированных антител hu2B1-S54A, hu8E5-2I и ch-163E12 на клетки HEK293, трансфицированные CLD18A1.
На фиг. 9 приведено сравнение АЗКЦ-эффектов гуманизированных антител hu2B1-S54A, hu8E5-2I и химерных антител ch-163E12, ch-175D10 (см. CN 103509110А).
На фиг. 10 приведено сравнение киллинговой активности hu8E5-2I и ch-175D10 у мышей.
На фиг. 11 приведено сравнение киллинговой активности in vitro Т-клеток hu8E5-28Z, hu8E5-BBZ и hu8E5-28BBZ в разных линиях клеток.
На фиг. 12 приведено сравнение киллинговой активности in vitro Т-клеток hu8E5-28Z, hu8E5-2I-28Z и hu2Bl-hs54A в разных линиях клеток.
На фиг. 13 приведены сравнительные графики эффекта CLDN18A2-CAR Т на объем опухоли на протяжении периода времени в модели рака желудка на мышах с подкожными ксенотрансплантатами, полученными от пациентов (PDX) (фиг. 13А) и сравнительные изображения с фотографиями опухолей (фиг. 13В).
На фиг. 14 представлены результаты анализа секреции цитокинов hu8E5-28Z и hu8E5-2I-28Z.
На фиг. 15 приведены сравнительные графики эффекта CLDN18A2-CAR Т на объем опухоли на протяжении периода времени в модели рака желудка на мышах с подкожным ксенотрансплантатом BGC-823-A2 (фиг. 15А), сравнительные графики массы опухолей (фиг. 15В) и сравнительные изображения с фотографиями опухолей (фиг. 15С).
На фиг. 16 показана инфильтрация опухоли CLDN18A2-CAR Т.
На фиг. 17А показана секреция клеточных молекул после коэкспрессии ИФН; на фиг. 17В приведены сравнительные графики противоопухолевой активности CAR-T-клеток, содержащих ИФН и не содержащих ИФН, в PDX-модели рака желудка с подкожными ксенотрансплантатами; на фиг. 17С приведены сравнительные графики числа жизнеспособных клеток в периферической крови мыши на 5, 7 и 10 дни реинфузированных CAR-T-клеток.
На фиг. 18А и фиг. 18В приведены плазмидные карты для конструирования CAR-NK-клеток.
На фиг. 19 показано определение коэффициента позитивности hu8E5-2I-28Z CAR-NK92 и hu8E5-28BBZ CAR-NK92.
На фиг. 20 приведены графики, отражающие цитотоксичность hu8E5-2I-28Z CAR-NK92.
На фиг. 21 приведены графики, отражающие цитотоксичность hu8E5-28BBZ CAR-NK92.
Способ реализации изобретения
В подробном описании ниже детально описаны варианты реализации настоящего изобретения. Следует понимать, что указанное описание не предназначено для ограничения конкретными вариантами реализации настоящего изобретения, которые могут быть разнообразными. Специалисту в данной области техники будет понятно, что настоящее изобретение может быть различным образом модифицировано или изменено, и все модификации входят в объем и сущность настоящего изобретения. Каждый вариант реализации может быть произвольно скомбинирован с любым другим вариантом реализации, если не указано иное.
Определенные варианты реализации настоящего изобретения предусматривают включение диапазона значений, и определенные аспекты настоящего изобретения могут быть описаны с указанием диапазона. Если не указано иное, следует понимать, что диапазон значений или описание объема значений приводятся для упрощения и удобства; и не должны рассматриваться как строго ограничивающие объем настоящего изобретения. Соответственно, описание объема должно толковаться как описание конкретным образом всех возможных субдиапазонов и всех возможных численных значений в пределах указанного диапазона, как если бы указанные субдиапазоны и численные значения были явным образом указаны в настоящем документе. Например, описание диапазона от 1 до 6 следует рассматривать как включающее конкретным образом субдиапазоны от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.п., а также конкретные численные значения в пределах указанного диапазона, такие как 1, 2, 3, 4, 5 и 6. Изложенные выше принципы применимы в равной степени независимо от широты диапазона указанных значений. Описываемый диапазон включает конечные точки указанного диапазона.
Подразумевается, что термин «приблизительно» в отношении измеряемых величин, таких как количество, временная продолжительность и т.п., включает изменения ±20%; или, в некоторых случаях, ±10%; или, в некоторых случаях, ±5%, или, в некоторых случаях, ±1%; или в некоторых случаях ±0,1% от указанной величины.
В настоящем документе термины «активировать» и «активация» могут использоваться взаимозаменяемо; указанные термины, а также другие их грамматические формы, могут относиться к процессу, за счет которого клетка переходит от состояния покоя к активному состоянию. Указанный процесс может включать ответ на антиген, миграцию и/или фенотипическое или генетическое изменение функционально активного состояния. Например, термин «активация» может относиться к процессу, за счет которого иммунные клетки постепенно активируются. Например, для полной активации Т-клеток может требоваться по меньшей мере два сигнала. Первый сигнал может возникать после связывания Т-клеточным рецептором (TCR) комплекса антиген-МНС, а второй сигнал может возникать при конъюгации костимулирующих молекул (см. перечень костимулирующих молекул в таблице 1). In vitro антитело к CD3 может симулировать первый сигнал, а антитело к CD28 может симулировать второй сигнал. Например, сконструированные Т-клетки могут быть активированы экспрессированным CAR. В настоящем документе активация иммунных клеток может относиться к состоянию стимуляции, достаточной для того, чтобы индуцировать детектируемую пролиферацию клеток, продуцирование цитокинов и/или детектируемую эффекторную функцию.
Термин «костимулирующая молекула» в настоящем документе относится к гомологичному партнеру для связывания на иммунной клетке, такой как Т-клетка, который специфически связывается с костимулирующим лигандом, опосредуя таким образом костимулирующий ответ, такой как пролиферация, но не ограничиваясь ей. Костимулирующая молекула представляет собой молекулу на поверхности клетки, отличную от антигенного рецептора или его лиганда, которая способствует эффективному иммунному ответу. Костимулирующие молекулы включают, не ограничиваясь перечисленными, молекулы МНС класса I, рецепторы BTLA и Toll лигандов, ОХ40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD1 la/CD18), ICOS (CD278) и 4-1ВВ (CD137). Примеры костимулирующих молекул включают, не ограничиваясь перечисленными, CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8α, CD8β, ИЛ-2Rβ, ИЛ-2Rγ, ИЛ-7Rα, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a; и лиганд, который специфически связывается с CD83.
В настоящем документе «костимулирующий сигнал» относится к сигналу, который, в комбинации с первым сигналом, таким как TCR/CD3, приводит к пролиферации Т-клеток и/или положительной либо отрицательной регуляции ключевых молекул.
Термин «антигенсвязывающая единица» в настоящем документе относится к молекуле иммуноглобулина и иммунологически активной части иммунной молекулы, т.е. молекуле, содержащей сайт связывания антигена, который специфически связывается с антигеном («иммунный ответ»). Термин «антигенсвязывающая единица» также включает молекулы иммуноглобулина различных видов, в том числе беспозвоночных и позвоночных. Простейшее встречающееся в природе антитело (например, IgG) структурно содержит четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями. Иммуноглобулины представляют собой большое семейство молекул, включающее несколько типов молекул, таких как IgD, IgG, IgA, IgM и IgE. Термин «молекула иммуноглобулина» включает, например, гибридное антитело или измененное антитело и его фрагменты. Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами встречающегося в природе антитела. Такие фрагменты в совокупности называют «антиген-комбинирующей единицей». Термин «антигенсвязывающая единица» также включает любую содержащую полипептидную цепь молекулярную структуру, имеющую специфическую форму, соответствующую эпитопу и распознающую эпитоп, при этом одно или более нековалентных связывающих взаимодействий стабилизируют комплекс между указанной молекулярной структурой и эпитопом. Примеры таких антигенсвязывающих единиц включают Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенные дисульфидным мостиком на шарнирной области (F(ab)2-фрагмент); Fd-фрагмент, состоящий из доменов VH и СН1, Fv-фрагмент, состоящий из доменов VL и VH антитела с одним плечом; dAb-фрагмент, состоящий из домена VH (Ward et al., Nature, 341: 544-546, 1989); и выделенные определяющие комплементарность участки (CDR) или любой слитый белок, содержащий такие антигенсвязывающие единицы.
Термин «антитело» в настоящем документе включает интактное антитело и любые антигенсвязывающие фрагменты (т.е. «антигенсвязывающие части») или его одиночные цепи. Встречающееся в природе «антитело» представляет собой гликопротеин, содержащий по меньшей мере две тяжелые (Н) цепей и две легкие (L) цепи, соединенные дисульфид ной связью. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в настоящем документе «VH») и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в настоящем документе «VL») и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть дополнительно подразделены на области высокой вариабельности, называемые определяющими комплементарность участками (CDR), разделенными более консервативными областями, называемыми каркасной областью (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, располагающихся в следующем порядке в направлении от аминоконца к карбоксильному концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой цепи и легкой цепи содержат связывающий домен, который взаимодействует с антигеном. Константная область антитела может опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классической системы комплемента.
Термин «scFv» относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, при этом указанные вариабельные области легкой цепи и тяжелой цепи являются непрерывными (например, за счет синтетического линкера, такого как короткий гибкий полипептидный линкер) и могут быть экспрессированы в виде одноцепочечного полипептида; и при этом указанный scFv сохраняет специфичность интактного антитела, из которого он происходит. Если не указано иное, в настоящем документе scFv может содержать вариабельные области VL и VH в любом порядке (например, относительно N-конца и С-конца полипептида), и указанный scFv может включать VL-линкер-VH или может быть включен VH-линкер-VL.
В настоящем документе термины «определяющий комплементарность участок» и «CDR» относятся к последовательности аминокислот в вариабельной области антитела, которая обеспечивает специфичность и аффинность в отношении связывания антигена. В общем случае, имеется три CDR (HCDR1, HCDR2, HCDR3) в каждой вариабельной области тяжелой цепи и три CDR (LCDR1, LCDR2, LCDR3) в вариабельной области легкой цепи.
Антигенсвязывающая единица «специфически связывается» с антигеном или является «иммунореактивной» относительно антигена, если указанная антигенсвязывающая единица связывается с указанным антигеном с большей аффинностью, чем с другими, референсными антигенами, в том числе полипептидами или другими веществами.
Термин «гуманизированное» в настоящем документе применяют для обозначения антитела, не являющегося антителом человека (например, антитела грызуна или примата), которое представляет собой гибридный иммуноглобулин, цепь иммуноглобулина или ее фрагмент, содержащий минимальную последовательность, происходящую из иммуноглобулина, не являющегося иммуноглобулином человека. В большинстве случаев гуманизированное антитело представляет собой иммуноглобулин человека (реципиентное антитело), остатки из определяющих комплементарность участков (CDR) которого заменены на остатки CDR видов, не являющихся человеком (донорное антитело), таких как мышь, крыса, кролик или приматы, с требуемыми специфичностью, аффинностью и производительностью. В некоторых случаях остатки в каркасной области (FR) Fv иммуноглобулина человека заменяют на соответствующие остатки иммуноглобулина, не являющегося иммуноглобулином человека. Кроме того, гуманизированное антитело может содержать остатки, которые присутствуют в реципиентном антителе, хотя отсутствуют в введенных последовательностях CDR или каркасных последовательностях. Указанные модификации осуществляют для дополнительного усовершенствования и оптимизации производительности антитела и минимизации иммуногенности при введении в организм человека. Согласно некоторым примерам гуманизированное антитело содержит по существу все, по меньшей мере один, как правило, два вариабельных домена, причем все или по существу все из участков CDR соответствуют областям CDR иммуноглобулина, не являющегося иммуноглобулином человека, и все или по существу все из областей FR представляют собой области последовательности иммуноглобулина человека. Гуманизированное антитело может также содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, константную область иммуноглобулина человека. Согласно некоторым вариантам реализации «гуманизированное антитело» может включать мутацию, такую как мутация, введенная посредством случайного или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo.
Термин «иммуноглобулин» или «Ig» в настоящем документе может относиться к классу белков, которые могут функционировать в качестве антител. Антитела, экспрессируемые В-клетками, иногда называют химерными антигенными рецепторами или антигенными рецепторами. Пять включенных в указанный класс членов представлены IgA, IgG, IgM, IgD и IgE, при этом IgG является наиболее распространенным циркулирующим антителом. Это наиболее мощный иммуноглобулин в отношении агглютинации, фиксации комплемента и других реакций антител, важный для защиты от бактерий и вирусов. Например, CAR может распознавать антигены опухолевых клеток (или «опухолевые антигены») или антигены патогенов.
В настоящем документе термин «выделенный» относится к отделению от клеточных компонентов или других компонентов, с которыми полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты обычно ассоциированы в естественном состоянии. Как будет понятно специалисту, нет необходимости «изолировать» не встречающиеся в природе полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты, чтобы отличить их от встречающихся в природе аналогов. Кроме того, «концентрированный», «выделенный» или «разведенный» полинуклеотид, пептид, полипептид, белок, антитело или его фрагмент можно отличить от встречающегося в природе аналога, поскольку концентрация или количество молекулы на единицу объема больше («концентрированная») или меньше («разведенная») концентрации встречающегося в природе аналога. Степень обогащения может быть измерена на абсолютном базисе, например, как масса на объем раствора, или может быть измерена относительно другого потенциального компонента, присутствующего в исходной смеси. Согласно некоторым вариантам реализации более высокая степень обогащения предпочтительна для технических решений согласно настоящему изобретению. Соответственно, например, 2-кратное обогащение является предпочтительным, 10-кратное обогащение является более предпочтительным, 100-кратное обогащение является более предпочтительным, 1000-кратное обогащение является еще более предпочтительным. «Выделенные» материалы могут также быть получены с применением способов искусственной сборки, например, химического синтеза или рекомбинантной экспрессии.
В настоящем документе «антиген» относится к веществу, которое распознает и специфически связывает антигенсвязывающая единица. Антигены могут включать пептиды, белки, гликопротеины, полисахариды, липиды, их части и их комбинации. Неограничивающие примеры антигенов включают опухолевые антигены или антигены патогенов. «Антиген» может также относиться к молекуле, вызывающей иммунный ответ. Указанный иммунный ответ может включать продуцирование антител или активацию специфических иммунологически компетентных клеток, или и то, и другое. Специалисту будет понятно, что любая макромолекула, в том числе практически все белки или пептиды, может служить в качестве антигена.
Термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо и относятся к полимеру аминокислот любой длины. Указанный полимер может быть линейным, циклическим или разветвленным, он может содержать модифицированные аминокислоты, в частности, консервативно модифицированные аминокислоты, и может прерываться неаминокислотными компонентами. Термин также включает модифицированные полимеры аминокислот, такие как полимер аминокислот, модифицированный путем сульфатирования, гликозилирования, липидизации, ацетилирования, фосфорилирования, иодирования, метилирования, окисления, протеолитического процессинга, пренилирования, рацемизации, селеноилирования, опосредованного транспортной РНК амино-присоединения (такого как аргинирование, убиквитинирование) или любой другой манипуляции, такой как конъюгация с меченым компонентом. В настоящем документе термин «аминокислота» относится к естественным и/или не встречающимся в природе или синтетическим аминокислотами, в том числе глицину и D- или L-оптическим изомерам, а также аналогам аминокислот и пептидомиметикам. Термин «происходящий(ая) из» заданного белка полипептид или последовательность аминокислот относится к источнику указанного полипептида. Указанный термин также охватывает полипептиды, экспрессируемые заданной последовательностью нуклеиновой кислоты.
Термин «модификация аминокислоты» (или «модифицированная аминокислота») включает замены аминокислот, инсерции и/или делеции в последовательности полипептида. В настоящем документе «замена аминокислоты» или «замена» означает замену аминокислоты в конкретном положении в исходной последовательности полипептида на другую аминокислоту. Например, замена R94K означает, что аргинин в положении 94 заменен на лизин. Та же замена в том же положении в исходной последовательности полипептида может также быть представлена как 94K, т.е. замена в положении 94 на лизин. В настоящем описании несколько замен, как правило, разделяют косой чертой. Например, R94K/L78V относится к двойному варианту, содержащему замены R94K и L78V. В настоящем документе «инсерция аминокислоты» или «инсерция» означает добавление аминокислоты в конкретном положении в исходной последовательности полипептида. Например, инсерция-94 указывает на инсерцию в положении 94. В настоящем документе «делеция аминокислоты» или «делеция» означает удаление аминокислоты в конкретном положении в исходной последовательности полипептида. Например, R94- указывает на делецию аргинина в положении 94.
Термин «консервативная модификация» или «консервативная модификация последовательности» в настоящем документе означает модификацию аминокислоты, которая значимо не влияет или не изменяет требуемые активность или свойства пептида, содержащего указанную последовательность аминокислот. Такие консервативные модификации включают замены, инсерции и делеции аминокислот. Модификации могут быть введены в антитело согласно настоящему изобретению с применением стандартных методик, известных в данной области техники, таких как сайт-специфический мутагенез и ПЦР-опосредованный мутагенез. Консервативные замены аминокислот представляют собой замены, при которых остатки аминокислот заменены на остатки аминокислот, содержащих аналогичные боковые цепи. Семейство остатков аминокислот, содержащих аналогичные боковые цепи, определено в данной области техники. Указанные семейства включают аминокислоты, содержащие основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, серии, треонин, тирозин, цистеин, триптофан), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), β-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Соответственно, один или более остатков аминокислот в областях CDR или каркасных областях антитела согласно настоящему изобретению могут быть заменены на другие остатки аминокислот с аналогичными боковыми цепями.
Термин «аутологичный» и другие его грамматические формы в настоящем документе может относиться к веществам из одного и того же источника. Например, образец (например, клетка) может быть взят у индивидуума, обработан и введен тому же индивидууму (например, пациенту) позднее. Аутологичный процесс отличается от аллогенного процесса, при котором донор и реципиент являются разными индивидуумами.
В настоящем документе «ксенотрансплантат» и другие его грамматические формы могут включать любую процедуру, при которой реципиент и донор относятся к разным видам, и клетки, тканей или органы трансплантируют, имплантируют или инфузируют указанному реципиенту. Трансплантаты клеток, органов и/или тканей согласно описанию в настоящем документе могут применяться в качестве ксенотрансплантатов у человека. Ксенотрансплантаты включают, не ограничиваясь перечисленными, васкуляризированные ксенотрансплантаты, частично васкуляризированные ксенотрансплантаты, неваскуляризированные ксенотрансплантаты, ксеногенные перевязочные материалы, ксеногенные повязки и ксеногенные структуры.
В настоящем документе «аллотрансплантат» и другие его грамматические формы (например, аллогенная трансплантация) могут включать любую процедуру, при которой реципиент и донор относятся к одному виду, но представляют собой разных индивидуумов, и клетки, ткани или органы трансплантируют, имплантируют или инфузируют указанному реципиенту. Трансплантаты клеток, органы и/или тканей согласно описанию в настоящем документе могут применяться в качестве аллотрансплантатов у человека. Аллотрансплантаты включают, не ограничиваясь перечисленными, васкуляризированные аллотрансплантаты, частично васкуляризированные аллотрансплантаты, неваскуляризированные аллотрансплантаты, аллогенные перевязочные материалы, аллогенные повязки и аллогенные структуры.
В настоящем документе термин «аутотрансплантация» и другие его грамматические формы (например, аутологичная трансплантация) могут включать любую процедуру, при которой реципиент и донор относятся к одному индивидууму, и клетки, ткани или органы трансплантируют, имплантируют или инфузируют указанному реципиенту. Трансплантаты клеток, органы и/или тканей согласно описанию в настоящем документе могут применяться в качестве аутотрансплантатов у человека. Аутотрансплантаты включают, не ограничиваясь перечисленными, васкуляризированные аутотрансплантаты, частично васкуляризированные аутотрансплантаты, неваскуляризированные аутотрансплантаты, аутологичные перевязочные материалы, аутологичные повязки и аутологичные структуры.
Термин «химерный антигенный рецептор» или «CAR» в настоящем документе относится к сконструированной молекуле, которая может быть экспрессирована иммунной клеткой в том числе, но не ограничиваясь перечисленными, Т-клеткой или NK-клеткой. CAR экспрессируется в Т-клетках и перенаправляет Т-клетки для индукции специфического киллинга целевых клеток со специфичностью, определяемой искусственным рецептором. Внеклеточный связывающий домен CAR может происходить из антитела мыши, гуманизированного или полностью гуманизированного моноклонального антитела.
Термин «эпитоп» и другие его грамматические формы в настоящем документе могут относиться к части антигена, которую может распознавать антитело, В-клетка, Т-клетка или сконструированная клетка. Например, эпитоп может представлять собой эпитоп опухоли или эпитоп патогена, распознаваемый TCR. Может также распознаваться несколько эпитопов в пределах антигена. Эпитопы могут также быть мутированными.
«Линия клеток» или «культура клеток» означает бактерию, растение, насекомое или клетку высших эукариот, культивируемую или поддерживаемую in vitro. Потомство клетки может не быть идентично (по морфологии, генотипу или фенотипу) материнской клетке.
Термин «сконструированный» и другие его грамматические формы в настоящем документе могут относиться к одному или более изменениям нуклеиновой кислоты, такой как нуклеиновая кислота в составе генома организма. Термин «сконструированный» могут относиться к изменениям, добавлениям и/или делециям генов. Сконструированные клетки могут также относится к клеткам с добавленными, делетированными и/или измененными генами. Сконструированные клетки могут также относится к клеткам, которые экспрессируют CAR.
Термин «трансфекция» в настоящем документе относится к введению экзогенной нуклеиновой кислоты в эукариотическую клетку. Трансфекция может быть осуществлена с применением различных способов, известных в данной области техники, в том числе коосаждения ДНК с фосфатом кальция, опосредованной ДЭАЭ-декстраном трансфекции, опосредованной полиамином трансфекции, электропорации, микроинъекции, слияния с липосомами, липофекции, слияния протопластов, ретровирусной инфекции и биолистики.
Термин «стабильная трансфекция» или «стабильно трансфицировать» относится к введению и интеграции экзогенных нуклеиновых кислот, ДНК или РНК, в геном трансфицированной клетки. Термин «стабильный трансфектант» относится к клетке, содержащей экзогенные нуклеиновые кислоты, стабильно интегрированные в геномную ДНК.
В настоящем документе термины «кодирующая молекула нуклеиновой кислоты», «кодирующая последовательность ДНК» и «кодирующая ДНК» относятся к порядку или последовательности дезоксирибонуклеотидов в дезоксирибонуклеотидной цепи. Порядок указанных дезоксирибонуклеотидов определяет порядок аминокислот в полипептидной (белковой) цепи. Соответственно, последовательность нуклеиновой кислоты кодирует последовательность аминокислот.
Термин «индивидуум» в настоящем документе относится к любому животному, такому как млекопитающее или сумчатое млекопитающее. Индивидуумы согласно настоящему изобретению включают, не ограничиваясь перечисленными, человека, не являющихся человеком приматов (например, макак-резусов или другие типы макак), мышей, свиней, лошадей, ослов, коров, овец, крыс и любых сельскохозяйственных птиц.
Термин «лимфоциты периферической крови» (ЛПК) и другие его грамматические формы в настоящем документе могут относиться к лимфоцитам, циркулирующим в крови (например, периферической крови). Лимфоциты периферической крови могут относиться к лимфоцитам, не ограниченным органами. Лимфоциты периферической крови могут содержать Т-клетки, NK-клетки, В-клетки или любые их комбинации.
Термин «клетка иммунного ответа» (или «иммунореактивная клетка», «иммунная эффекторная клетка» или «иммунная клетка») в настоящем документе может относиться к клетке, которая может вызывать иммунный ответ. Клетка иммунного ответа может также относиться к клетке лимфоидной или миелоидной линии. Примеры иммунных клеток включают, не ограничиваясь перечисленными, Т-клетки, такие как α/β Т-клетки и γ/δ Т-клетки, В-клетки, естественные киллерные (NK) клетки, естественные киллерные Т-клетки (NKT), тучные клетки и происходящие из костного мозга фагоцитарные клетки, соответствующие клетки-предшественники и их потомство.
Термин «Т-клетка» и другие его грамматические формы в настоящем документе могут относиться к Т-клеткам из любого источника. Например, Т-клетка может представлять собой первичную Т-клетку, такую как аутологичная Т-клетка или т.п. Т-клетка может также принадлежать человеку или не человеку.
Термин «активация Т-клеток» или «запуск Т-клеток» и другие его грамматические формы в настоящем документе могут относиться к статусу Т-клетки, в достаточной мере стимулированной для индукции детектируемой пролиферации клеток, продуцирования цитокинов и/или детектируемой эффекторной функции. Согласно некоторым вариантам реализации «полная активация Т-клеток» может быть аналогична запуску цитотоксичности Т-клеток. Активация Т-клеток может быть измерена с применением различных анализов, известных в данной области техники. Указанный анализ может представлять собой ИФА ELISA для измерения секреция цитокинов, ELISPOT, проточно-цитометрический анализ для измерения внутриклеточной экспрессии цитокинов (CD107), проточно-цитометрический анализ для измерения пролиферации; и анализ цитотоксичности для определения элиминации целевых клеток (анализ с высвобождением 51Cr). В указанном анализе, как правило, используют контроли (несконструированные клетки) для сравнения со сконструированными клетками (CART) с определением относительного уровня активации сконструированных клеток по сравнению с контрольными. Кроме того, может быть проведен анализ со сравнением со сконструированными клетками, которые инкубируют или приводят в контакт с целевыми клетками, не экспрессирующими целевой антиген. Например, указанное сравнение может представлять собой сравнение с клетками CD19-CART, инкубированными с целевыми клетками, не экспрессирующими CD19.
Термин «последовательность» и другие его грамматические формы в настоящем документе в отношении последовательности нуклеотидов может включать ДНК или РНК, которая может быть одноцепочечной или двуцепочечной. Последовательность нуклеиновой кислоты может быть мутирована. Последовательность нуклеиновой кислоты может иметь любую длину, например, содержать от 2 до 1000000 или более нуклеотидов (или любое целое число нуклеотидов в пределах указанного диапазона, или более), например, от приблизительно 100 до приблизительно 10000 нуклеотидов, или от приблизительно 200 до приблизительно 500 нуклеотидов.
Термин «эффективное количество» в настоящем документе относится к количеству, которое обеспечивает терапевтические или профилактические преимущества.
Термин «экспрессионный вектор» в настоящем документе относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий последовательность регуляции экспрессии, функционально связанную с последовательностью нуклеотидов, которую нужно экспрессировать. Экспрессионный вектор содержит достаточные для экспрессии цис-действующие элементы; другие элементы для экспрессии могут быть обеспечены клетками-хозяевами или экспрессионными системами in vitro. Экспрессионные векторы включают известные в данной области техники векторы, такие как космиды, плазмиды (например, без оболочки или заключенные в липосомы) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы).
Термин «лентивирус» в настоящем документе относится к роду семейства Retroviridae. Ретровирусы уникальны своей способностью инфицировать неделящиеся клетки; они могут доставлять значительные количества генетической информации в ДНК клеток-хозяев и, соответственно, представляют собой один наиболее эффективных способов векторной доставки генов. ВИЧ, SIV и FIV представляют собой примеры лентивирусов. Векторы, происходящие из лентивирусов, представляют собой способ обеспечения значительных уровней переноса генов in vivo.
Термин «функционально связанный» («оперативно связанный») в настоящем документе относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, которая приводит к экспрессии последней. Например, если первая последовательность нуклеиновой кислоты оперативно связана с второй последовательностью нуклеиновой кислоты, указанная первая последовательность нуклеиновой кислоты функционально связана с указанной второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если указанный промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Как правило, функционально связанные последовательности ДНК являются непрерывными, и, при необходимости, две кодирующих белок области лигированы в одной рамке считывания.
Термин «промотор» в настоящем документе определен как последовательность ДНК, распознаваемая синтетическим механизмом или введенным синтетическим механизмом, требуемая для инициации специфической транскрипции последовательности полинуклеотидов.
Термин «вектор» в настоящем документе относится к композиции, содержащей выделенную нуклеиновую кислоту и используемой для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области техники известен ряд векторов, в том числе, но не ограничиваясь перечисленными, линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Соответственно, термин «вектор» включает автономно реплицирующиеся плазмиды или вирусы. Также следует понимать, что указанный термин включает неплазмидные и невирусные соединения, облегчающие перенос нуклеиновых кислот в клетки, такие как соединения полилизина, липосомы и т.п. Примеры вирусных векторов включают, не ограничиваясь перечисленными, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы и т.п.
«Клетка-хозяин» включает индивидуальную клетку или культуру клеток, которая может быть или была акцептором нацеленного вектора. Клетки-хозяева включают потомство одной клетки-хозяина. Ввиду естественных, случайных или преднамеренных мутаций потомство не обязательно будет идентично исходной родительской клетке, например, в отношении морфологических свойств, или геномной ДНК, или тотальной ДНК. Клетки-хозяева включают клетки, трансфицированные in vivo векторами согласно настоящему изобретению. «Клетка-хозяин» может относиться к прокариотической клетке, эукариотической клетке или линии клеток, которые культивируют в виде одноклеточного объекта, который может быть или был использован в качестве реципиента рекомбинантных векторов или других полинуклеотидов для переноса, и включает потомство клеток, которые были трансфицированы.
Термин «идентичность последовательностей» в настоящем документе определяет процент идентичности путем сравнения двух максимально совпадающих последовательностей в пределах окна сравнения (например, по меньшей мере 20 положений), при этом части последовательности полинуклеотида или полипептида в окне сравнения могут содержать добавление или делецию (т.е. пропуск), например, 20% или менее пропусков (например, 5-15%, или 10-12%) относительно референсной последовательности (которая не содержит добавлений или делеций) для двух максимально совпадающих последовательностей. Указанный процент обычно вычисляют путем определения числа положений, где располагаются идентичные в обеих последовательностях нуклеотиды или остатки аминокислот, с получением числа корректно совпадающих положений. Процент идентичности последовательностей может быть получен путем деления числа корректно совпадающих положений на общее число положений в референсной последовательности (то есть на размер окна) и умножения результата на 100.
Термин «заболевание», или «состояние», или «расстройство» в настоящем документе относится к любому изменению или расстройству, нарушающему или вмешивающемуся в нормальную функцию клетки, ткани или органа. Например, термин «заболевание» включает, не ограничиваясь перечисленным, опухоль, инфекцию патогена, аутоиммунное заболевание, заболевание с дисфункцией Т-клеток или дефект иммунологической толерантности (например, отторжение трансплантата).
Термин «экзогенный» в настоящем документе относится к молекуле нуклеиновой кислоты или полипептида, эндогенно не экспрессируемой в клетке, или экспрессируемой на уровне, недостаточном для достижения функции избыточной экспрессии. Соответственно, «экзогенный» включает молекулы рекомбинантных нуклеиновых кислот или полипептидов, экспрессируемые в клетке, такие как экзогенные, гетерологичные и сверхэкспрессируемые молекулы нуклеиновых кислот и полипептиды.
Термин «регуляция» в настоящем документе относится к положительному или отрицательному изменению. Пример регуляции включает отклонение на 1%, 2%, 10%, 25%, 50%, 75% или 100%.
В настоящем документе термин «лечение» относится к клиническому вмешательству с целью изменения индивидуума или лечения заболевания, вызванного клеткой, как профилактически, так и при клиническом патологическом процессе. Терапевтические эффекты включают, не ограничиваясь перечисленными, предотвращение возникновения или рецидивирования заболевания, смягчение симптомов, уменьшение прямых или непрямых патологических последствий любого заболевания, предотвращение метастазирования, замедление прогрессирования заболевания, улучшение или облегчение состояния, смягчение или улучшение прогноза.
Термин «конститутивная экспрессия» в настоящем документе относится к экспрессии во всех физиологических условиях.
Термин «индуцируемая экспрессия» в настоящем документе относится к экспрессии в определенных условиях, например, при связывании Т-клетки с антигеном. Специалисту в данной области техники известно, как осуществить стандартную «индуцированную экспрессию».
Согласно некоторым вариантам реализации реализации настоящего изобретения предложена антигенсвязывающая единица, содержащая CDR легкой цепи и CDR тяжелой цепи, отличающаяся тем, что указанная антигенсвязывающая единица специфически связывается с пептидом клаудином 18А2; и тем, что указанная антигенсвязывающая единица в значимой степени не связывается с пептидом клаудином 18А1.
Согласно некоторым вариантам реализации настоящего изобретения предложены антигенсвязывающие единицы, содержащие CDR легкой цепи и CDR тяжелой цепи, отличающиеся тем, что указанная антигенсвязывающая единица специфически связывается с пептидом клаудином 18А2; и тем, что указанная антигенсвязывающая единица демонстрирует меньший уровень неспецифического связывания с пептидом клаудином 18А1 по сравнению с референсной антигенсвязывающей единицей.
Согласно некоторым вариантам реализации антигенсвязывающая единица, описанная в настоящем документе, содержит CDR легкой цепи. Указанный CDR легкой цепи может представлять собой определяющий комплементарность участок антигенсвязывающей единицы. CDR легкой цепи может содержать непрерывную последовательность остатков аминокислот, или две или более непрерывных последовательностей остатков аминокислот, разделенных областями, не определяющими комплементарность, такими как каркасные области. Согласно некоторым вариантам реализации CDR легкой цепи содержит две или более участков CDR легкой цепи, которые могут называться CDR-1 легкой цепи, CDR-2 легкой цепи и т.п. Согласно некоторым вариантам реализации CDR легкой цепи содержит три участка CDR легкой цепи, которые могут называться CDR-1 легкой цепи (LCDR1), CDR-2 легкой цепи (LCDR2) и CDR-3 легкой цепи (LCDR3), соответственно. Согласно некоторым вариантам реализации набор участков CDR, присутствующих на общей легкой цепи, может в совокупности называться CDR легкой цепи.
Согласно некоторым вариантам реализации антигенсвязывающая единица, описанная в настоящем документе, содержит CDR тяжелой цепи. Указанный CDR тяжелой цепи может представлять собой определяющий комплементарность участок антигенсвязывающей единицы. Указанный CDR тяжелой цепи может содержать непрерывную последовательность остатков аминокислот, или две или более непрерывных последовательности остатков аминокислот, разделенных областями, не определяющими комплементарность, такими как каркасные области. Согласно некоторым вариантам реализации CDR тяжелой цепи содержит две или более участков CDR тяжелой цепи, которые могут называться CDR-1 тяжелой цепи, CDR-2 тяжелой цепи, и т.п. Согласно некоторым вариантам реализации CDR тяжелой цепи содержит три участка CDR тяжелой цепи, которые могут называться CDR-1 тяжелой цепи (HCDR1), CDR-2 тяжелой цепи (HCDR2) и CDR-3 тяжелой цепи (HCDR3), соответственно. Согласно некоторым вариантам реализации набор участков CDR, присутствующих на общей тяжелой цепи, может в совокупности называться CDR тяжелой цепи.
Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, содержащая CDR легкой цепи и CDR тяжелой цепи, отличающаяся тем, что CDR легкой цепи содержит LCDR1, LCDR2 и LCDR3; a CDR тяжелой цепи содержит HCDR1, HCDR2 и HCDR3; последовательности аминокислот LCDR1, LCDR2 и LCDR3 по меньшей мере на 80% идентичны последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; и последовательностей аминокислот HCDR1, HCDR2 и HCDR3 по меньшей мере на 80% идентичны последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO 38, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 83 SEQ ID NO: 84 и SEQ ID NO: 85.
Согласно некоторым вариантам реализации реализации настоящего изобретения предложена антигенсвязывающая единица, содержащая CDR легкой цепи и CDR тяжелой цепи, отличающаяся тем, что указанный CDR легкой цепи содержит LCDR1, LCDR2 и LCDR3; и указанный CDR тяжелой цепи содержит HCDR1, HCDR2 и HCDR3; при этом последовательности аминокислот LCDR1, LCDR2 и LCDR3 по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичны последовательности аминокислот, выбранной из следующих последовательностей: SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; а последовательностей аминокислот HCDR1, HCDR2 и HCDR3 по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичны последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 37, S EQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85.
Согласно некоторым вариантам реализации настоящего изобретения CDR легкой цепи в антигенсвязывающей единице содержит LCDR1, LCDR2 и LCDR3; a CDR тяжелой цепи содержит HCDR1, HCDR2 и HCDR3; при этом указанные LCDR1, LCDR2 и LCDR3, соответственно, содержат последовательность аминокислот, выбранную из группы, состоящей из: SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO 47, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; и указанные HCDR1, HCDR2 и HCDR3, соответственно, содержат последовательность аминокислот, выбранную из группы, состоящей из: SEQ ID NO: 31 SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85.
Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, отличающаяся тем, что LCDR1 содержит последовательности аминокислот, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичные последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 34, SEQ ID NO: 40, SEQ ID NO: 46 и SEQ ID NO: 52. Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, отличающаяся тем, что LCDR2 содержит последовательности аминокислот, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичные последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 34, SEQ ID NO: 41, SEQ ID NO: 47 и SEQ ID NO: 53.
Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, отличающаяся тем, что LCDR3 содержит последовательности аминокислот, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичные последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 35, SEQ ID NO: 42, SEQ ID NO: 48 и SEQ ID NO: 54. Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, отличающаяся тем, что HCDR1 содержит последовательности аминокислот, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичные последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 31, SEQ ID NO: 37, SEQ ID NO: 43 и SEQ ID NO: 49. Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, отличающаяся тем, что HCDR2 содержит последовательности аминокислот, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичны последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 32, SEQ ID NO: 38, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Согласно некоторым вариантам реализации настоящего изобретения предложена антигенсвязывающая единица, отличающаяся тем, что HCDR3 содержит последовательности аминокислот, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 99,9% идентичные последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 33, SEQ ID NO: 39, SEQ ID NO: 45 и SEQ ID NO: 51.
Согласно некоторым вариантам реализации антигенсвязывающая единица согласно настоящему изобретению связывается с клаудином 18А2 или пептидом клаудином 18А2. Термин «клаудин 18А2» или «пептид клаудин 18А2» (CLD18.2, CLD18A2, CLDN18A2, CLDN18.2, Клаудин18.2 или Клаудин18А2) в настоящем документе может также относиться к гомологу, ортологу, межвидовому гомологу, кодон-оптимизированной форме, усеченной форме, фрагментированной форме, мутированной форме или любой другой известной производной форме известной последовательности клаудина 18А2, например, варианту посттрансляционной модификации. Согласно некоторым вариантам реализации указанный клаудин 18А2 или пептид клаудин 18А2 представляет собой пептид с номером доступа GenBank NP_001002026 (мРНК: NM_001002026). Согласно некоторым вариантам реализации указанный клаудин 18А2 или пептид клаудин 18А2 представляет собой пептид, содержащий последовательность аминокислот, представленную в SEQ ID NO: 55.
Согласно некоторым вариантам реализации антигенсвязывающая единица согласно настоящему изобретению в значимой степени не связывается с пептидом клаудином 18А1. Термин «клаудин 18А1» или «пептид клаудин 18А1» (CLD18A1, CLD18.1, CLDN18A1, CLDN18.1, Клаудин18.1 или Клаудин18А1) в настоящем документе может также относиться к гомологу, ортологу, межвидовому гомологу, кодон-оптимизированной форме, усеченной форме, фрагментированной форме, мутированной форме или любой другой известной производной форме известной последовательности клаудин 18А1, например, варианту посттрансляционной модификации. Согласно некоторым вариантам реализации указанный клаудин 18А1 или пептид клаудин 18А1 представляет собой пептид с номером доступа GenBank NP_057453 (мРНК: NM_016369). Согласно некоторым вариантам реализации указанный клаудин 18А1 или пептид клаудин 18А1 представляет собой пептид, содержащий последовательность аминокислот, представленную в SEQ ID NO: 57.
Специфичность связывания может быть определена определяющими комплементарность участками, или CDR, такими как участки CDR легкой цепи или участки CDR тяжелой цепи. Во многих случаях специфичность связывания определена областями CDR легкой цепи и областями CDR тяжелой цепи. По сравнению с другими референсными антигенами или референсными пептидами определенные CDR тяжелой цепи, CDR легкой цепи или их комбинация обеспечивают определенный связывающий карман, отличающийся большей аффинностью и/или специфичностью в отношении клаудина 18А2.
Связывание антигенсвязывающей единицы с пептидом клаудином 18А2 может быть охарактеризовано или описано любым известным в данной области техники способом. Например, связывание может характеризоваться аффинностью связывания, которая может представлять собой силу взаимодействия между антигенсвязывающей единицей и антигеном. Аффинность связывания может быть определена любым способом, известным в данной области техники, таким как анализы связывания in vitro. Например, аффинность связывания антигенсвязывающей единицы согласно описанию в настоящем документе может быть определена путем тестирования в анализе связывания in vitro с использованием клеток, экспрессирующих клаудин 18А2. Аффинность связывания тестируемой антигенсвязывающей единицы может быть выражена как Kd, которая представляет собой равновесную константу диссоциации антитела и соответствующего ему антигена. В некоторых случаях антигенсвязывающая единица согласно описанию в настоящем документе специфически связывается с клаудином 18А2 с Kd в диапазоне от приблизительно 10 мкМ до приблизительно 1 мМ. Например, указанная антигенсвязывающая единица может специфически связываться с клаудином 18А2 с Kd, составляющей менее чем приблизительно 10 мкМ, 1 мкМ, 0,1 мкМ, 10 нМ, 1 нМ, 0,1 нМ, 10 пМ, 1 пМ, 0,1 пМ, 10 фМ, 1 фМ или менее чем 0,1 фМ.
Согласно некоторым вариантам реализации указанная антигенсвязывающая единица не демонстрирует значимого связывания с референсным пептидом. Согласно некоторым примерам уровень связывания антигенсвязывающей единицы с референсным пептидом не превышает 20% от уровня связывания антигенсвязывающей единицы с клаудином 18А2. Например, уровень связывания может составлять 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее чем 1% от уровня связывания антигенсвязывающей единицы с клаудином 18А2. Согласно некоторым вариантам реализации антигенсвязывающая единица, описанная в настоящем документе, связывается с клаудином 18А2 на уровне, в 1 раз, 2 раза, 3 раза, 4 раза, 5 раза, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более чем в 10 раз превышающем уровень связывания с референсным пептидом. Согласно некоторым вариантам реализации указанный референсный пептид представляет собой пептид клаудин 18А1. Согласно некоторым вариантам реализации указанный референсный пептид представляет собой пептид, содержащий последовательность аминокислот, представленную в SEQ ID NO: 57. Согласно некоторым вариантам реализации указанный референсный пептид представляет собой пептид с последовательностью SEQ ID NO: 57.
Согласно некоторым вариантам реализации антигенсвязывающая единица, описанная в настоящем документе, проявляет меньшую степень неспецифического связывания с референсным пептидом по сравнению с референсной антигенсвязывающей единицей. Согласно некоторым вариантам реализации уровень неспецифического связывания антигенсвязывающей единицы, описанной в настоящем документе, с референсным пептидом на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% ниже уровня связывания референсной антигенсвязывающей единицы с референсным пептидом. Согласно некоторым вариантам реализации уровень неспецифического связывания антигенсвязывающей единицы, описанной в настоящем документе, с референсным пептидом в 1 раз, 2 раз, 3 раз, 4 раз, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более чем в 10 раз ниже уровня связывания референсной антигенсвязывающей единицы с референсным пептидом. Согласно некоторым вариантам реализации указанная референсная антигенсвязывающая единица содержит легкую цепь с последовательностью SEQ ID NO: 86 или SEQ ID NO: 88 и/или последовательность аминокислот тяжелой цепи, представленную в SEQ ID NO: 87 или SEQ ID NO: 89. Согласно некоторым вариантам реализации указанная референсная антигенсвязывающая единица содержит последовательность аминокислот, представленную в SEQ ID NO: 86. Согласно некоторым вариантам реализации указанная референсная антигенсвязывающая единица содержит последовательность аминокислот, представленную в SEQ ID NO: 87. Согласно некоторым вариантам реализации указанная референсная антигенсвязывающая единица содержит последовательность аминокислот, представленную в SEQ ID NO: 88. Согласно некоторым вариантам реализации указанная референсная антигенсвязывающая единица содержит последовательность аминокислот, представленную в SEQ ID NO: 89. Согласно некоторым вариантам реализации указанный референсный пептид представляет собой пептид клаудин 18А1. Согласно некоторым вариантам реализации указанный референсный пептид представляет собой пептид, содержащий последовательность аминокислот, представленную в SEQ ID NO: 57. Согласно некоторым вариантам реализации указанный референсный пептид представляет собой пептид с последовательностью SEQ ID NO: 57.
Согласно некоторым вариантам реализации указанная антигенсвязывающая единица является цитотоксической для клеток, содержащих пептид клаудин 18А2, содержащий последовательность аминокислот, представленную в SEQ ID NO: 55. Уровень указанной цитотоксичности составляет по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40% или 45% при соотношении антигенсвязывающей единицы к целевым клеткам, равном 20:1, 10:1, 5:1, 3:1, 2,5:1, 1:1 или 1:3.
Согласно некоторым вариантам реализации указанная антигенсвязывающая единица не обладает значимой цитотоксичностью в отношении клетки, содержащей пептид клаудин 18А1, но не содержащей пептид клаудин 18А2, при этом указанный пептид клаудин 18А1 содержит последовательность аминокислот, представленную в SEQ ID NO: 57, а пептид клаудин 18А2 содержит последовательность аминокислот, представленную в SEQ ID NO: 55. Согласно некоторым вариантам реализации уровень цитотоксичности не превышает 10%, 5%, 4%, 3%, 2% или 1%.
Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, специфически связывающееся с клаудином 18А2, отличающееся тем, что указанное антитело содержит CDR тяжелой цепи, содержащую последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 31, 32, 33, 37, 38, 39, 43, или 44, 45, 49, 50, 51, 83, 84, 85, или ее вариант, и/или CDR легкой цепи, содержащую последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 34, 35, 36, 40, 41, 42, 46, 47, 48, 52, 53, 54, или ее вариант.
Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, выбранное из группы, состоящей из (а) антитела, содержащего вариабельную область тяжелой цепи, где указанная вариабельная область тяжелой цепи содержит CDR1, содержащий последовательность аминокислот, представленную в SEQ ID NO: 31, SEQ ID NO: 37, SEQ ID NO: 43 или SEQ ID NO: 49, CDR2, содержащий последовательность аминокислот, представленную в SEQ ID NO: 32, SEQ ID NO: 38, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 83, SEQ ID NO: 84 или SEQ ID NO: 85, и CDR3, содержащий последовательность аминокислот, представленную в SEQ ID NO: 33, SEQ ID NO: 39, SEQ ID NO: 45 или SEQ ID NO: 51; (b) антитела, содержащего вариабельную область легкой цепи, где указанная вариабельная область легкой цепи содержит CDR1, содержащий последовательность аминокислот, представленную в SEQ ID NO: 34, SEQ ID NO: 40, SEQ ID NO: 46 или SEQ ID NO: 52, CDR2, содержащий последовательность аминокислот, представленную в SEQ ID NO: 35, SEQ ID NO: 41, SEQ ID NO: 47 или SEQ ID NO: 53, и CDR3, содержащий последовательность аминокислот, представленную в SEQ ID NO: 36, SEQ ID NO: 42, SEQ ID NO: 48 или SEQ ID NO: 54; (с) антитела, содержащего (а) вариабельную область тяжелой цепи указанного антитела и (b) вариабельную область легкой цепи указанного антитела; и (d) антитела, распознающего тот же сайт антигенной детерминанты, что и антитело по любому из (а) - (с). Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, отличающееся тем, что участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи указанного антитела представлены SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33; или SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39; или SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45; или SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51; или SEQ ID NO: 31, SEQ ID NO: 83, SEQ ID NO: 33; или SEQ ID NO: 31, SEQ ID NO: 84, SEQ ID NO: 33; или SEQ ID NO: 49, SEQ ID NO 85, SEQ ID NO: 51, соответственно; и/или участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи указанного антитела представлены SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36; или SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42; или SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48; или SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, соответственно.
Согласно некоторым вариантам реализации последовательности аминокислот CDR1, CDR2 и CDR3 тяжелой цепи антитела согласно настоящему изобретению выбраны из группы, состоящей из последовательностей аминокислот, представленных в таблице ниже, или их вариантов:
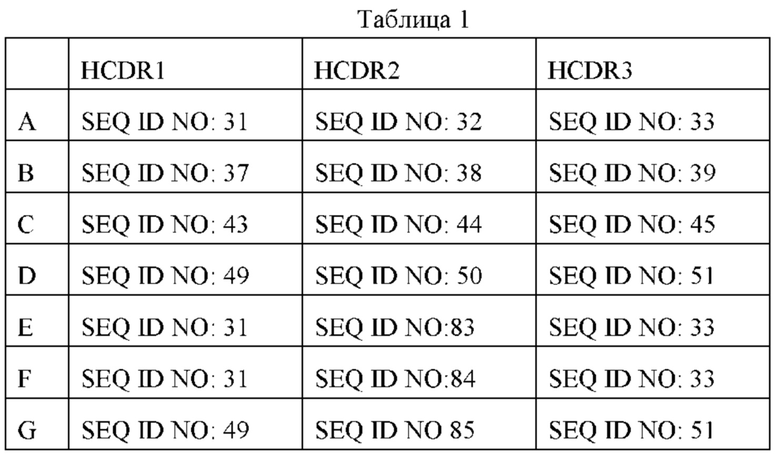
Согласно некоторым вариантам реализации настоящего изобретения предложено антитело, отличающееся тем, что последовательности аминокислот CDR1, CDR2 и CDR3 легкой цепи выбраны из группы, состоящей из последовательностей аминокислот, представленных в таблице ниже, или их вариантов:
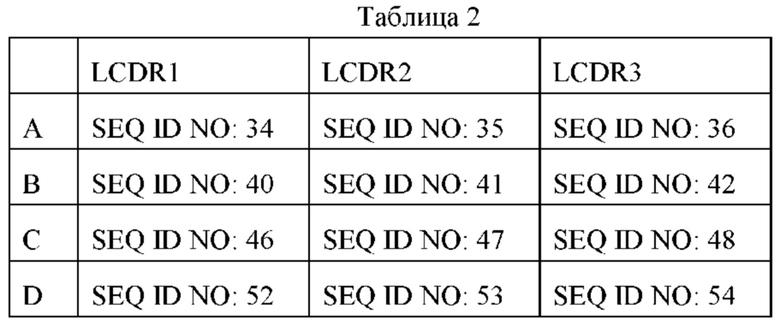
Согласно некоторым вариантам реализации настоящего изобретения антитело включает вариабельную область тяжелой цепи, содержащую последовательность аминокислот, выбранную из SEQ ID NO: 3, 7, 11, 15, 17, 19, 23, 27, 29 или их вариантов, и/или вариабельную область легкой цепи, содержащую последовательность аминокислот, выбранную из SEQ ID NO: 1, 5, 9, 13, 21, 25 или их варианта. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 3 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 1 или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 7 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 5 или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 11 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 9 или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 15 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 13 или ее вариант. Согласно некоторым предпочтительным вариантам реализации последовательности аминокислот CDR1, CDR2 и CDR3 тяжелой цепи выбирают из таблицы ниже.

Согласно некоторым вариантам реализации настоящего изобретения антитело включает вариабельную область тяжелой цепи, содержащую последовательность аминокислот, выбранную из SEQ ID NO: 17, 19, или ее варианты. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 17 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 1 или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 19 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 1 или ее вариант.
Согласно некоторым вариантам реализации антитело согласно настоящему изобретению или его функциональный фрагмент содержит вариабельную область тяжелой цепи, содержащую последовательность аминокислот, выбранную из SEQ ID NO: 23, 27, 29, или ее вариант, и/или вариабельную область легкой цепи, содержащую последовательность аминокислот, выбранную из SEQ ID NO: 21, 25, или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 23 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 21 или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 27 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 25 или ее вариант. Согласно некоторым вариантам реализации вариабельная область тяжелой цепи представляет собой последовательность SEQ ID NO: 29 или ее вариант, а вариабельная область легкой цепи представляет собой последовательность SEQ ID NO: 25, или ее вариант.
Согласно некоторым вариантам реализации антигенсвязывающую единицу или антитело согласно настоящему изобретению дополнительно соединяют или сливают с другой функциональной молекулой. Соответственно, настоящим изобретением также охвачено образование многофункциональных иммуноконъюгатов.
Термины «соединенный» или «слитый» используют в настоящем документе взаимозаменяемо. Указанные термины означают, что два или более химических элементов или компонентов соединены между собой любым способом, в том числе с применением химической конъюгации или рекомбинантных способов. «Слияние внутри рамки» означает, что две или более рамки считывания соединяют таким образом, чтобы сохранить корректную рамку считывания исходной открытой рамки считывания (ORF) с получением непрерывной более длинной ORF. Соответственно, итоговый рекомбинантный слитый белок представляет собой один белок, содержащий два или более фрагментов, соответствующих полипептиду, кодируемому исходной ORF (указанные фрагменты обычно не лигированы таким образом в естественном состоянии). Указанные рамки считывания являются непрерывными на протяжении слитого фрагмента, однако фрагменты могут быть физически или пространственно разделены, например, соединяющей последовательностью внутри рамки (например, «флексоном»).
Функциональную молекулу применяют, например, для диагностики или лечения опухоли.
Термин «опухоль» в настоящем документе относится к заболеванию, характеризующемуся патологической гиперплазией клеток или тканей, и последующей миграцией или инвазией в другие ткани или органы. Рост опухоли обычно является неконтролируемым и прогрессирующим, и не индуцирует или ингибирует пролиферацию нормальных клеток. Опухоли могут поражать разнообразные клетки, ткани или органы, в том числе, но не ограничиваясь перечисленными, мочевой пузырь, кости, головной мозг, молочные железы, хрящи, глиальные клетки, пищевод, фаллопиевы трубы, желчный пузырь, сердце, кишечник, почки, печень, легкие, лимфатические узлы, нервную ткань, яичники, поджелудочную железу, предстательную железу, скелетные мышцы, кожу, спинной мозг, селезенку, желудок, семенники, вилочковую железу, щитовидную железу, трахею, уретру, мочеточник, уретру, матку, органы влагалища, или ткани, или соответствующие клетки. Опухоли включают рак, такой как саркомы, карциномы или плазмоцитомы (злокачественные опухоли плазматических клеток). Опухоль согласно настоящему изобретению может включать, но не ограничиваясь перечисленным, лейкоз (такой как острый лейкоз, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, острый миелоидный лейкоз, острый промиелоцитарный лейкоз, острый гранулоцитарно-моноцитарный лейкоз, острый моноцитарный лейкоз, острый лейкоз, хронический лейкоз, хронический миелоидный лейкоз, хронический лимфоцитарный лейкоз, истинная полицитемия), лимфому (болезнь Ходжкина, неходжкинская болезнь), первичную макроглобулинемию, болезнь тяжелых цепей, солидные опухоли, такие как саркома и рак (например, фибросаркома, муцинозная саркома, липосаркома, хондросаркома, остеосаркома, хордома, эндотелиальная саркома, лимфангиосаркома, ангиосаркома, лимфатическая эндотелиальная саркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, рак толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточная карцинома, базально-клеточная карцинома, аденокарцинома, рак потовых желез, рак сальных желез, папиллярный рак, папиллярная аденокарцинома, карцинома, бронхиальная карцинома, медуллярная карцинома, почечноклеточный рак, рак печени, рак желчных путей, хориокарцинома, семинома, эмбриональная карцинома, нефробластома, рак шейки матки, рак матки, рак яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, опухоль шишковидной железы, гемангиобластома, акустическая невринома, олигодендроглиома, шванномы, менингиомы, меланома, нейробластома, ретинобластома), рак пищевода, карциному желчного пузыря, рак почки, множественную миелому. Предпочтительно, «опухоль» включает, но не ограничиваясь перечисленным, рак поджелудочной железы, рак печени, рак легкого, рак желудка, рак пищевода, плоскоклеточную карциному головы и шеи, рак предстательной железы, рак толстой кишки, рак молочной железы, лимфому, рак желчного пузыря, рак почки, лейкоз, множественную миелому, рак яичников, рак шейки матки и глиому.
Функциональная молекула включает, например, опухолевый антиген, такой как опухолеспецифический антиген (ОСА) или опухолеассоциированный антиген (ОАА). ОСА уникален для опухолевых клеток и не встречается на других клетках в организме. ТАА-ассоциированный антиген не уникален для опухолевых клеток, однако экспрессируется на нормальных клетках в условиях, в которых не может быть индуцировано состояние иммунологической толерантности к указанному антигену. Экспрессия антигена на опухоли может происходить в условиях, позволяющих иммунной системе отвечать на указанный антиген. При незрелости иммунной системы и ее неспособности к ответу ОАА может быть представлен антигеном, экспрессируемым на нормальных клетках при развитии плода, или ОАА могут быть представлены антигенами, в норме присутствующими на очень незначительных уровнях на нормальных клетках, но экспрессируемыми на более высоком уровне на опухолевых клетках.
Неограничивающие примеры антигенов ОСА или ОАА включают представленные ниже: антигены дифференцировки, такие как MART-1/MelanA (MART-I), gp100 (Pmel17), тирозиназа, TRP-1, TRP-2, и опухолеспецифические мультивалентные антигены, такие как MAGE-1, MAGE-3, BAGE, GAGE-1, GAGE-2, p15; сверхэкспрессируемые эмбриональные антигены, такие как КЭА; сверхэкспрессируемые онкогены и мутантные гены-супрессоры опухолевого роста, такие как р53, Ras, HER-2/neu; уникальные опухолевые антигены, являющиеся результатом хромосомных транслокаций, такие как BCR-ABL, E2A-PRL, Н4-RET, IGH-IGK и MYL-RAR; и вирусные антигены, такие как антиген вируса Эпштейна-Барр EBVA и антигены папилломавируса человека (HPV) Е6 и Е7; и т.п. Другие большие антигены на основе белков включают TSP-180, MAGE-4, MAGE-5, MAGE-6, RAGE, NY-ESO, p185erbB2, p180erbB-3, c-met, nm-23H1, ПСА, TAG-72, CA 19-9, CA 72-4, CAM 17,1, NuMa, K-ras, β-катенин, CDK4, Mum-1, p 15, p 16, 43-9F, 5T4, 791Tgp72, альфа-фетопротеин, бета-ХГЧ, BCA225, ВТАА, СА125, СА15-3\СА27,29\ВСАА, СА195, СА242, СА-50, САМ43, CD68\P1, СО-029, FGF-5, G250, Ga733\EpCAM, HTgp-175, М344, МА-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, ТА-90\Мас-2-связывающий белок\родственный циклофилину С белок, TAAL6, TAG72, TLP и TPS.
Согласно некоторым вариантам реализации указанный «опухолевый антиген» включает, но не ограничиваясь перечисленным, простатический специфический мембранный антиген (ПСМА), карциноэмбриональный антиген (КЭА), ИЛ-13R-альфа, HER-2, CD19, NY-ESO-1, HIV-1 Gag, Lewis Y, MART-1, gp100, тирозиназу, WT-I, hTERT, мезотелин, рЭФР, EGFRvIII (вариант III рЭФР), фосфатидилинозитол 3, EphA2, HER3, EpCAM, MUC1, MUC16, фолатный рецептор, CLDN6, CD30, CD138, ASGPR1, CDH16, GD2, 5T4, 8H9, интегрин αvβ6, антиген созревания В-клеток (ВСМА), В7-Н3, В7-Н6, CAIX, СА9, CD20, CD22, легкую цепь κ, CD33, CD38, CD44, CD44v6, CD44v7/8, CD70, CD123, CD171, CSPG4, EGP2, EGP40, ERBB3, ERBB4, ErbB3/4, FAP, FAR, FBP, эмбриональный AchR, GD2, GD3, HLA-AI MAGE A1, MAGE3, HLA-A2, ИЛ-11Ra, KDR, Lambda, MCSP, NCAM, лиганд NKG2D, PRAME, АСКП (антиген стволовых клеток предстательной железы), PSC1, ROR1, Sp17, сурвивин, TAG72, TEM1, TEM8, VEGRR2, HMW-MAA, рецептор ФРЭС; и/или фибронектин, тенасцин или карциноэмбриональные варианты факторов некроза опухолей.
Согласно некоторым вариантам реализации указанная функциональная молекула представляет собой интерферон. Согласно некоторым вариантам реализации указанный интерферон представляет собой интерферон I типа.
Термин «интерферон I типа» в настоящем документе включает ИФН-α, ИФН-β, ИФН-ε, ИФН-κ, ИФН-ω и т.п. Все интерфероны I типа связываются со специфическими рецепторами клеточной поверхности (так называемыми рецепторами ИФН-α/β) состоящими из двух цепей, IFNAR1 и IFNAR2. Согласно некоторым вариантам реализации термин «интерферон I типа» в настоящем документе представлен ИФН-α или ИФН-β. Согласно некоторым вариантам реализации термин «интерферон I типа» в настоящем документе представлен ИФН-β. Согласно некоторым вариантам реализации интерферон I типа в настоящем документе включает интерферон I типа человека, мыши или синтетический интерферон I типа. Согласно некоторым вариантам реализации термин «интерферон α» в настоящем документе может представлять собой полипептид с последовательностью NCBI ааа52724.1, или ааа52716.1, или ааа52725.1, или полипептид, последовательность которого по меньшей мере на 85% идентична указанным последовательностям. Согласно некоторым вариантам реализации термин «интерферон β» (ИФН-β) в настоящем документе может представлять собой белок, последовательность которого по меньшей мере на 85% идентична NCBI аас41702.1, или np_002167.1, или aah96152.1p41273, или NP 001552, или фрагмент, обладающий функцией лиганда фактора некроза опухоли (ФНО). Согласно некоторым вариантам реализации указанный интерферон β представляет собой интерферон β человека. Согласно некоторым вариантам реализации указанный интерферон β имеет последовательность аминокислот, представленную в SEQ ID NO: 92.
Согласно некоторым вариантам реализации интерферон I типа может представлять собой встречающийся в природе интерферон, например, выделенный или очищенный из организма млекопитающего; или может быть получен искусственным путем; например, рекомбинантные компоненты или интерферон I типа могут быть получены в соответствии со стандартными рекомбинантными методиками генетического конструирования. Рекомбинантные элементы или интерфероны I типа могут быть предпочтительным образом использованы для целей настоящего изобретения.
Последовательности аминокислот, полученные на основе последовательности полипептида интерферона I типа путем замены, делеции или добавления одного или более остатков аминокислот, также включены в настоящее изобретение. Замена аминокислот подходящим образом представляет собой методику, хорошо известную в данной области техники, которую легко использовать и которая обеспечивает неизменность биологической активности полученной молекулы. Специалисту будет понятно, что, в целом, изменение одной аминокислоты в не имеющей существенного значения области полипептида на основе указанных методик по существу не изменяет биологическую активность.
Согласно настоящему изобретению могут также применяться модифицированные полипептиды на основе последовательности полипептида интерферона I типа. Например, может применяться полипептид, модифицированный для повышения времени полужизни, эффективности, метаболизма и/или мощности. Таким образом, согласно настоящему изобретению может применяться любой вариант, не влияющий на биологическую активность полипептида.
Согласно настоящему изобретению могут применяться биологически активные фрагменты полипептида интерферона I типа. В настоящем документе термин «биологически активный фрагмент» относится к полипептиду, который, представляя собой часть полноразмерного полипептида, сохраняет, полностью или частично, функцию указанного полноразмерного полипептида. Как правило, указанный биологически активный фрагмент сохраняет по меньшей мере 50% активности указанного полноразмерного полипептида. В более предпочтительных условиях указанный активный фрагмент способен сохранять 60%, 70%, 80%, 90%, 95%, 99% или 100% активности указанного полноразмерного полипептида.
Согласно другому аспекту настоящего изобретения предложен химерный антигенный рецептор, содержащий внеклеточную антигенсвязывающую единицу согласно описанию в настоящем документе, трансмембранный домен и внутриклеточный домен. Термин «химерный антигенный рецептор (CAR)» в настоящем документе относится к связывающему опухолевый антиген домену, слитому с внутриклеточным доменом передачи сигнала, который активирует Т-клетки. Как правило, внеклеточный связывающий домен CAR происходит из моноклонального антитела мыши, гуманизированного моноклонального антитела или моноклонального антитела человека.
Химерный антигенный рецептор, как правило, содержит внеклеточную антигенсвязывающую область или антигенсвязывающую единицу. Согласно некоторым вариантам реализации указанная внеклеточная антигенсвязывающая единица представляет собой антигенсвязывающую единицу согласно описанию выше в настоящем документе.
Согласно некоторым вариантам реализации указанная внеклеточная антигенсвязывающая область может быть полностью человеческой. В других случаях указанная внеклеточная антигенсвязывающая область может быть гуманизированной. В других случаях указанная внеклеточная антигенсвязывающая область может представлять собой антигенсвязывающую область мыши, или представлять собой химеру и состоять из последовательностей аминокислот, происходящих от по меньшей мере двух разных животных. Согласно некоторым вариантам реализации указанная внеклеточная антигенсвязывающая область может происходить из вида, не являющегося человеком.
Могут быть сконструированы различные антигенсвязывающие области. Неограничивающие примеры включают одноцепочечные вариабельные фрагменты (scFv), происходящие из антител, фрагменты антигенсвязывающих участков (Fab), выбранные из библиотек, однодоменные фрагменты или естественные лиганды, которые связываются с соответствующими когнатными рецепторами. Согласно некоторым вариантам реализации внеклеточная антигенсвязывающая область может содержать scFv, Fab или естественный лиганд, а также любые их производные. Внеклеточная антигенсвязывающая область может относиться к молекуле, отличной от интактного антитела, которая может содержать часть интактного антитела и может связываться с антигеном, с которым связывается указанное интактное антитело. Примеры фрагментов антитело могут включать, не ограничиваясь перечисленными, Fv, Fab, Fab', Fab'-SH, F(ab')2; бифункциональные антитела, линейные антитела; одноцепочечные молекулы антител (например, scFv); и мультиспецифические антитела, образованные фрагментами антител.
Внеклеточная антигенсвязывающая область, такая как scFv, Fab или естественный лиганд, может представлять собой часть CAR, определяющую специфичность в отношении антигена. Указанная внеклеточная антигенсвязывающая область может связываться с любой комплементарной мишенью. Указанная внеклеточная антигенсвязывающая область может происходить из антитела с известной последовательностью вариабельной области. Указанная внеклеточная антигенсвязывающая область может быть получена из последовательностей антител доступных гибридом мыши. Как вариант, внеклеточные антигенсвязывающие области могут быть получены из опухолевых клеток или первичных клеток, таких как инфильтрующие опухоль лимфоциты (ИОЛ), путем тотального секвенирования.
Согласно некоторым вариантам реализации специфичность связывания указанной внеклеточной антигенсвязывающей области может определять определяющий комплементарность участок или CDR, такой как CDR легкой цепи или CDR тяжелой цепи. Во многих случаях специфичность связывания может быть определена участками CDR легкой цепи и участками CDR тяжелой цепи. По сравнению с другими референсными антигенами комбинация определенного CDR тяжелой цепи и CDR легкой цепи может обеспечивать определенный связывающий карман, отличающийся большей аффинностью и/или специфичностью в отношении антигена.
Согласно определенным аспектам любого варианта реализации настоящего изобретения внеклеточная антигенсвязывающая область, такая как scFv, может содержать CDR легкой цепи, специфический в отношении антигена. Указанный CDR легкой цепи может представлять собой определяющий комплементарность участок антигенсвязывающей единицы, такой как легкая цепь scFv CAR. Указанные участки CDR легкой цепи могут содержать непрерывную последовательность остатков аминокислот, или две или более непрерывных последовательностей остатков аминокислот, разделенных не определяющими комплементарность областями (например, каркасными областями). Согласно некоторым вариантам реализации CDR легкой цепи может содержать два или более участков CDR легкой цепи, которые могут называться CDR-1 легкой цепи, CDR-2 легкой цепи, и т.п. Согласно некоторым вариантам реализации указанные участки CDR легкой цепи могут содержать три участка CDR легкой цепи, которые могут называться CDR-1 легкой цепи, CDR-2 легкой цепи и CDR-3 легкой цепи, соответственно. Согласно некоторым примерам набор участков CDR, присутствующих на общей легкой цепи, может в совокупности называться CDR легкой цепи.
Согласно определенным аспектам любого варианта реализации настоящего изобретения внеклеточная антигенсвязывающая область, например, scFv, может содержать CDR тяжелой цепи, специфический в отношении антигена. Указанный CDR тяжелой цепи может представлять собой определяющий комплементарность участок антигенсвязывающей единицы, такой как тяжелая цепь scFv. Указанные участки CDR тяжелой цепи могут содержать непрерывную последовательность остатков аминокислот, или две или более непрерывных последовательностей остатков аминокислот, разделенных не определяющими комплементарность областями (например, каркасными областями). Согласно некоторым вариантам реализации CDR тяжелой цепи может содержать два или более участков CDR тяжелой цепи, которые могут называться CDR-1 тяжелой цепи, CDR-2 тяжелой цепи, и т.п. Согласно некоторым вариантам реализации указанные участки CDR тяжелой цепи могут содержать три участка CDR тяжелой цепи, которые могут называться CDR-1 тяжелой цепи, CDR-2 тяжелой цепи и CDR-3 тяжелой цепи, соответственно. Согласно некоторым примерам набор участков CDR, присутствующих на общей тяжелой цепи, может в совокупности называться CDR тяжелой цепи.
Указанная внеклеточная антигенсвязывающая область может быть модифицирована различными путями с применением генетического конструирования. Согласно некоторым вариантам реализации указанная внеклеточная антигенсвязывающая область может быть мутирована таким образом, чтобы выбрать внеклеточную антигенсвязывающую область, обладающую большей аффинностью в отношении мишени. Согласно некоторым вариантам реализации аффинность указанной внеклеточной антигенсвязывающей области в отношении ее мишени может быть оптимизирована для мишеней, экспрессируемых в нормальных тканях на незначительном уровне. Указанная оптимизация может быть проведена для минимизирования потенциальной токсичности. В других случаях клоны внеклеточной антигенсвязывающей области с более высокой аффинностью в отношении мембраносвязанной формы мишени могут быть предпочтительнее аналогов для растворимой формы. Такие модификации могут осуществляться, поскольку могут также быть детектированы различные уровни растворимых форм мишени, нацеливание на которые может вызывать нежелательную токсичность.
Согласно некоторым вариантам реализации внеклеточная антигенсвязывающая область содержит шарнир или спейсерную область. Термины «шарнир» и «спейсерная область» могут использоваться взаимозаменяемо. Шарнир может рассматриваться как часть CAR, придающая гибкость внеклеточной антигенсвязывающей области. Согласно некоторым вариантам реализации указанный шарнир может применяться для детекции CAR на поверхности клетки, в частности, в тех случаях, когда антитела, детектирующие внеклеточную антигенсвязывающую область, неэффективны или недоступны. Например, может быть необходима оптимизация длины шарнира, происходящего из иммуноглобулина, с учетом локализации эпитопа на мишени, на которую нацелена указанная внеклеточная антигенсвязывающая область.
Согласно некоторым вариантам реализации указанный шарнир может принадлежать не иммуноглобулину, а другой молекуле, например, представлять собой природный шарнир молекулы CD8α. Шарнир CD8α может содержать остатки цистеина и пролина, которые, как известно, играют роль во взаимодействии корецептора CD8 и молекулы МНС. Указанные остатки цистеина и пролина могут влиять на производительность CAR.
Размер шарнира CAR может быть адаптируемым. Морфология иммунологического синапса между клеткой иммунного ответа и целевой клеткой также определяет расстояние, на котором CAR не может обеспечить функциональную связь ввиду отдаленности от мембраны эпитопа на целевой молекуле на поверхности клетки, то есть применение CAR с коротким шарниром не позволяет достичь синаптического расстояния, обеспечивающего передачу сигнала. Аналогичным образом, в случае мембранопроксимального эпитопа целевого антигена CAR выходной сигнал может наблюдаться только в контексте CAR с длинным шарниром. Шарнир может быть адаптирован с учетом используемой внеклеточной антигенсвязывающей области. Длина указанного шарнира может быть любой.
Трансмембранный домен может обеспечивать заякоривание CAR в плазматической мембране клетки. Для CAR может быть использована естественная трансмембранная часть CD28. В других случаях в CAR может также быть использована естественная трансмембранная часть CD8α. «CD8» может представлять собой белок, отличающийся по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью белку под референсным номером NCBI: NP_001759, или его фрагмент, обладающий стимулирующей активностью. «Молекула нуклеиновой кислоты CD8» может представлять собой полинуклеотид, кодирующий полипептид CD8, и в некоторых случаях трансмембранная область может представлять собой естественную трансмембранную часть CD28. «CD28» может представлять собой белок, отличающийся по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью белку под референсным номером NCBI: NP_006130, или его фрагмент, обладающий стимулирующей активностью. «Молекула нуклеиновой кислоты CD28» может представлять собой полинуклеотид, кодирующий полипептид CD28. Согласно некоторым вариантам реализации указанная трансмембранная часть может содержать область CD8α.
Внутриклеточная сигнальная область CAR может отвечать за активацию по меньшей мере одной из эффекторных функций клетки иммунного ответа, в которую был помещен CAR. CAR может индуцировать эффекторные функции Т-клеток, например, указанная эффекторная функция может представлять собой цитолитическую активность или хелперную активность, в том числе секрецию цитокинов. Соответственно, термин «внутриклеточная сигнальная область» относится к части белка, передающей сигналы эффекторных функций и направляющей клетку для выполнения специфической функции. Как правило, может быть использована вся внутриклеточная сигнальная область, однако во многих случаях использование всей цепи сигнального домена не является необходимым. Согласно некоторым вариантам реализации используют усеченную часть внутриклеточной сигнальной области. Согласно некоторым вариантам реализации, соответственно, предполагается, что термин «внутриклеточная сигнальная область» включает любую усеченную часть внутриклеточной сигнальной области, достаточную для передачи сигналов эффекторных функций.
Предпочтительные примеры сигнальных доменов для применения в CAR могут включать цитоплазматические последовательностей Т-клеточных рецепторов (TCR) и корецепторов, действующих синергистически, инициируя передачу сигнала после связывания мишени с рецептором, а также любые производные или варианты их последовательностей, и любые синтетические последовательности, соответствующие указанным последовательностям, обладающие такой же функциональностью.
Согласно некоторым вариантам реализации внутриклеточная сигнальная область может содержать известный сигнальный мотив иммунорецепторного тирозинового активирующего мотива (ITAM). Примеры ITAM, содержащих цитоплазматические сигнальные последовательности, включают происходящие из TCRζ, FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD5, CD22, CD79a, CD79b и CD66d. Однако согласно предпочтительному варианту реализации указанный внутриклеточный сигнальный домен происходит из цепи CD3ζ.
Примером Т-клеточного сигнального домена, содержащего один или более мотивов ITAM, является домен CD3ζ, также известный как Т3ζ-цепь Т-клеточного рецептора, или CD247. Указанный домен представляет собой часть комплекса Т-клеточного рецептора-CD3 и играет важную роль, связывая распознавание антигена в нескольких внутриклеточных путях передачи сигнала с основным эффектом активации Т-клеток. В настоящем документе CD3ζ относится в первую очередь к CD3ζ человека и его изоформам, известным под номером Р20963 в базе Swissprot, в том числе к белкам, имеющим по существу идентичные последовательности. Повторим, что использование всей Т3ζ-цепи Т-клеточного рецептора что в качестве части химерного антигенного рецептора не требуется, и что для применения подходит любое производное сигнального домена, содержащего Т3ζ-цепь Т-клеточного рецептора, в том числе любой его функциональный эквивалент.
Внутриклеточный сигнальный домен может быть выбран из любых доменов, представленных в таблице 1. Согласно некоторым вариантам реализации указанный домен может быть модифицирован таким образом, что его идентичность референсному домену может варьировать от приблизительно 50% до приблизительно 100%. Любой домен в таблице 1 может быть модифицирован таким образом, чтобы модифицированная форма отличалась приблизительно 50, 60, 70, 80, 90, 95, 96, 97, 98, 99 или до приблизительно 100% идентичности.
Внутриклеточная сигнальная область CAR может дополнительно содержать один или более костимулирующих доменов. Внутриклеточная сигнальная область может содержать один костимулирующий домен, такой как ζ-цепь (первое поколение CAR) или как указанный домен, так и CD28 или 4-1ВВ (второе поколение CAR). Согласно другим примерам внутриклеточная сигнальная область может содержать два костимулирующих домена, таких как CD28/OX40 или CD28/4-1BB (третье поколение).
Совместно с внутриклеточными сигнальными доменами, такими как CD8, указанные костимулирующие домены могут вызывать последующую активацию киназного пути, поддерживая таким образом транскрипцию генов и функциональные клеточные ответы. Костимулирующий домен CAR может активировать путь CD28 (фосфатидилинозитол-4,5-дифосфат-3-киназы) или 4-1ВВ/ОХ40 (ассоциированного с рецептором ФНО фактора - адаптерного белка), а также MAPK и ассоциированный с активацией Akt проксимальный сигнальный белок.
В некоторых случаях сигналы, генерируемые CAR, могут сочетаться со вспомогательным или костимулирующим сигналом. В случае костимулирующих сигнальных доменов могут быть разработаны подобные химерным антигенным рецепторам комплексы, содержащие несколько возможных костимулирующих сигнальных доменов. Как хорошо известно в данной области техники, в необученных Т-клетках недостаточно задействовать Т-клеточные рецепторы, чтобы индуцировать полную активацию Т-клеток с образованием цитотоксических Т-клеток. Для полной продуктивной активации Т-клеток необходим второй костимулирующий сигнал. Сообщалось о нескольких рецепторах, обеспечивающих костимуляцию для активации Т-клеток, в том числе, но не ограничиваясь перечисленными, CD28, ОХ40, CD27, CD2, CD5, ICAM-1, LFA-1 (CD11a/CD18), 4-1BBL, MyD88 и 4-1ВВ. Пути передачи сигнала, используемые указанными костимулирующими молекулами, могут действовать синергистически в сочетании с первичным сигналом активации Т-клеточного рецептора. Сигналы, обеспечиваемые указанными костимулирующими сигнальными областями, могут действовать синергистически в сочетании с сигналами активации первичного эффекта, происходящими из одного или более мотивов ITAM (например, домена передачи сигнала CD3-зета) и могут отвечать требованиям для активации Т-клеток.
Согласно некоторым вариантам реализации добавление костимулирующего домена в подобный химерному антигенному рецептору комплекс может повышать эффективность и выносливость сконструированных клеток. Согласно другим вариантам реализации Т-клеточный сигнальный домен и костимулирующий домен слиты друг с другом с образованием сигнальной области.
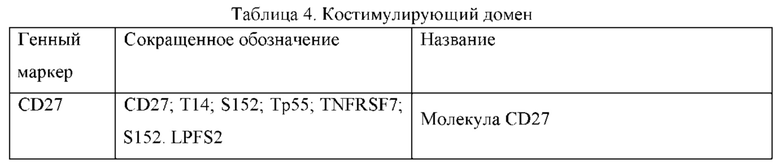
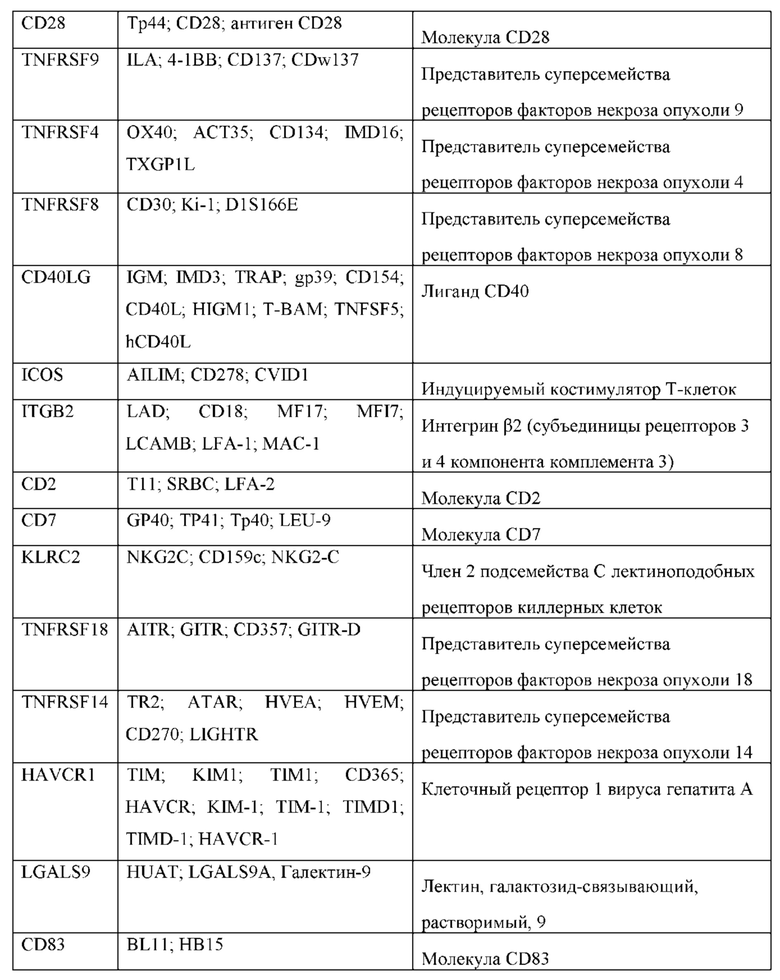
Химерный антигенный рецептор связывается с целевым антигеном. При измерении активации Т-клеток in vitro или ex vivo целевой антиген может быть получен или выделен из различных источников. Целевой антиген в настоящем документе представляет собой антиген или иммунологический эпитоп на антигене, критический важный у млекопитающих для иммунного распознавания и, в конечном итоге, элиминации или контроля патогенных факторов или болезненных состояний. Иммунное распознавание может быть клеточным и/или гуморальным. В случае внутриклеточных патогенов и рака иммунное распознавание может представлять собой, например, реакцию Т-лимфоцитов.
Согласно некоторым вариантам реализации указанный целевой антиген включает антиген, ассоциированный с предраковым или пролиферативным состоянием. Целевые антигены могут также быть ассоциированы с раком или возникать из-за рака. Например, согласно некоторым вариантам реализации химерный антигенный рецептор согласно настоящему изобретению распознает и связывается с опухолевым антигеном, содержащим ОСА и ОАА согласно описанию выше в настоящем документе.
Согласно некоторым вариантам реализации при наличии химерного антигенного рецептора в настоящем документе на плазматической мембране клетки, его связывании с мишенью и активации, клетка, экспрессирующая указанный химерный антигенный рецептор, может обладать цитотоксичностью для клетки, несущей мишень. Например, согласно некоторым вариантам реализации указанный химерный антигенный рецептор присутствует на цитотоксической клетке, такой как NK-клетка или цитотоксическая Т-клетка, и при активации мишенью токсичность указанной цитотоксической клетки в отношении целевой клетки может увеличиваться. Согласно некоторым вариантам реализации химерные антигенные рецепторы согласно описанию в настоящем документе могут увеличивать эффект иммунореактивных клеток на клетки, экспрессирующие клаудин 18А2, такие как опухолевые клетки. Согласно некоторым вариантам реализации по сравнению с клеткой, которая не экспрессирует химерный антигенный рецептор согласно описанию в настоящем документе, цитотоксический эффект клетки, экспрессирующей химерный антигенный рецептор, описанный в настоящем документе, в отношении клеток, экспрессирующих клаудин 18А2, увеличивается по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере в 1 раз, по меньшей мере в 1,5 раза, по меньшей мере в 2 раза, по меньшей мере в 2,5 раза, по меньшей мере в 3 раза, по меньшей мере в 3,5 раза, по меньшей мере в 4 раза, по меньшей мере в 4,5 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз или по меньшей мере в 10 раз.
Согласно некоторым вариантам реализации при наличии химерного антигенного рецептора в настоящем документе на плазматической мембране клетки, его связывании с мишенью и активации, химерный антигенный рецептор в настоящем документе не индуцирует значимой цитотоксичности в отношении клеток, содержащих пептид клаудин 18А1, но не пептид клаудин 18А2. Согласно некоторым вариантам реализации указанный уровень цитотоксичности составляет не более 10%, 5%, 4%, 3%, 2% или 1%.
В клетку может быть включен трансген, кодирующий рецептор или CAR, связывающийся с целевым антигеном. Например, трансген может быть включен в клетку иммунного ответа, такую как Т-клетка. При встраивании в клетку указанный трансген может представлять собой фрагмент комплементарной ДНК (кДНК), который представляет собой копию матричной РНК (мРНК); или собственно ген (с интронами или без интронов), локализованный в первоначальной области геномной ДНК.
Нуклеиновая кислота, кодирующая последовательность трансгена, такая как ДНК, может быть случайным образом встроена в хромосому клетки. Случайная интеграция может быть осуществлена любым способом, обеспечивающим введение нуклеиновой кислоты, такой как ДНК, в клетку. Например, указанный способ может включать, но не ограничиваясь перечисленным, электропорацию, ультразвук, применение генной пушки, липофекцию, трансфекцию с фосфатом кальция, применение дендримеров, микроинъекцию и применение вирусных векторов, в том числе аденовирусных, ААВ-векторов и ретровирусных векторов; и/или рибозима II типа.
Может также быть разработана кодирующая трансген ДНК, которая включает репортерный ген, так что присутствие трансгена или продукта его экспрессии может быть детектировано благодаря активации репортерного гена. Может быть использован любой репортерный ген, такой как описанные выше. Клетки, содержащие трансген, могут быть выбраны путем селекции (отбора) клеток в культуре клеток, где был активирован репортерный ген.
Экспрессия CAR может быть подтверждена с применением анализов экспрессии, такого как кПЦР, или путем измерения уровня РНК. Уровень экспрессии может также указывать на число копий. Например, если уровень экспрессии очень высок, это может указывать на интеграцию более чем одной копии CAR в геном. Как вариант, высокий уровень экспрессии может показывать, что трансген интегрирован в высокотранскрибируемую область, например, возле экспрессируемого на высоком уровне промотора. Экспрессия может также быть подтверждена путем измерения уровней белка, например, с применением вестерн-блоттинга.
Согласно некоторым вариантам реализации клетка иммунного ответа согласно настоящему изобретению может содержать один или более трансгенов. Указанный один или более трансгенов может экспрессировать белок CAR, который распознает и связывает по меньшей мере один эпитоп на антигене, или связывается с мутантным эпитопом на антигене. CAR может представлять собой функциональный CAR. Согласно некоторым вариантам реализации клетки иммунного ответа согласно настоящему изобретению могут содержать один или более CAR, или они могут содержать один CAR и вторичный сконструированный рецептор.
Согласно некоторым вариантам реализации указанный трансген может кодировать суицидный ген. Как свидетельствуют многие эффективные варианты лечения страдающих раком пациентов, клетки иммунного ответа с CAR могут вызывать регресс опухоли, однако могут быть также связаны с токсичностью. Согласно некоторым вариантам реализации, если целевой антиген присутствует как в нормальных тканях, так и в опухолевых клетках, клетки иммунного ответа с CAR может быть неспособны различать опухоли и нормальные ткани («целевая/нецелевая токсичность»). В других случаях может происходить системное нарушение работы иммунной системы, называемое синдромом высвобождения цитокинов (CRS). CRS может включать синдром системной воспалительной реакции или цитокиновый шторм, что может быть следствием быстрой экспансии клеток иммунного ответа с CAR in vivo. CRS представляет собой состояние, характеризующееся лихорадкой и гипотонией, которые могут приводить к мультиорганной недостаточности. В большинстве случаев токсичность ассоциирована с экспансией инфузированных клеток иммунного ответа с CAR in vivo, которая может вызывать общее нарушение работы иммунной системы, а также высвобождение высоких уровней провоспалительных цитокинов, таких как ФНО-α и ИЛ-6. Суицидные гены могут индуцировать элиминацию иммунореактивных клеток с CAR. Суицидный ген может быть представлен любым геном, который индуцирует апоптоз в иммунореактивных клетках с CAR. Суицидный ген может быть закодирован в вирусном векторе вместе с антигенсвязывающим рецептором. Кодирование суицидного гена позволяет облегчать или полностью устранять токсичность, вызванную экспансией in vivo инфузированных клеток иммунного ответа с CAR в специфических условиях.
Согласно некоторым вариантам реализации могут быть получены клетки с CAR, иммунореактивные в отношении антигена, который присутствует в нормальных тканях, транзиентно экспрессирующие CAR, например, после введения мРНК путем электропорации, кодирующей указанный рецептор. Кроме того, усилия, направленные на дополнительное усовершенствование иммунореактивных клеток с CAR путем включения «переключателя безопасности» могут по существу обеспечивать элиминацию иммунореактивных клеток с CAR в случае тяжелой целевой токсичности.
Согласно некоторым вариантам реализации кодирующий CAR вектор может быть скомбинирован, например, с индуцируемым геном каспазы-9 (активируемым димерным химическим индуктором), или усеченной формой рецептора рЭФР (активируемой моноклональным антителом цетуксимабом), или «переключателем безопасности» RQR8.
Один или более трансгенов, используемых в настоящем документе, могут происходить из разных видов. Например, один или более трансгенов могут содержать ген человека, ген мыши, ген крысы, ген свиней, ген бычьих, ген собаки, ген кошки, ген обезьяны, ген шимпанзе или любую их комбинацию. Например, трансген может происходить от человека и содержать генетическую последовательность человека. Один или более трансгенов может содержать ген человека. В некоторых случаях один или более трансгенов не являются аденовирусными генами.
Согласно описанию выше трансген может быть встроен в геном иммунореактивной клетки случайным или сайт-специфическим образом. Например, трансген может быть встроен в случайный сайт в геноме иммунной клетки. Указанные трансгены могут быть функциональными, например, полностью функциональными при встраивании в любую часть генома. Например, трансген может кодировать собственный промотор или может быть встроен в положении, контролируемом внутренним промотором. Как вариант, указанный трансген может быть встроен в ген, например, интрон гена или экзон, промотор или некодирующую область гена. Трансген может быть встроен таким образом, чтобы разрушить ген, например, эндогенную контрольную точку иммунного ответа.
Согласно некоторым вариантам реализации в несколько случайных сайтов в геноме может быть встроена более чем одна копия трансгена. Например, в случайные сайты в геноме может быть встроено несколько копий. Это может приводить к увеличению общего уровня экспрессии по сравнению с однократной случайной инсерцией трансгена. Как вариант, копия указанного трансгена может быть встроена в ген, а другая копия указанного трансгена может быть встроена в другой ген. Указанный трансген может быть нацелен таким образом, чтобы он мог быть встроен в специфический сайт в геноме иммунореактивной клетки.
Согласно некоторым вариантам реализации полинуклеиновая кислота, содержащая последовательность, кодирующую антигенсвязывающий рецептор, может принимать форму плазмидного вектора. Указанный плазмидный вектор может содержать промотор. В некоторых случаях указанный промотор может быть конститутивным. Согласно некоторым вариантам реализации указанный промотор представляет собой индуцируемый промотор. Указанный промотор может представлять собой или может происходить из CMV, U6, MND или EF1a. Согласно некоторым вариантам реализации указанный промотор может быть смежным последовательности CAR. Согласно некоторым вариантам реализации указанный плазмидный вектор дополнительно содержит акцептор сплайсинга. Согласно некоторым вариантам реализации указанный акцептор сплайсинга может быть смежным последовательности CAR. Последовательность промотора может представлять собой промотор PKG или MND. Промотор MND может представлять собой синтетический промотор, содержащий область U3 LTR MoMuLV, модифицированную энхансером миелопролиферативного вируса саркомы.
Согласно некоторым вариантам реализации может быть разработана полинуклеиновая кислота, кодирующая представляющий интерес рецептор, для доставки в клетку с применением методик, не задействующих вирусы. В некоторых случаях указанная полинуклеиновая кислота может представлять собой GMP-совместимый реагент.
Экспрессию полинуклеиновой кислоты, кодирующей рецептор, который связывается с антигеном, или CAR, может контролировать один или более промоторов. Промоторы могут быть общераспространенными, конститутивными (неограниченные промоторы, обеспечивающие непрерывную транскрипцию соответствующих генов), тканеспецифическими или индуцируемыми. Экспрессию трансгена, встроенного в смежном или близком к промотору положении, можно модулировать. Например, трансген может быть встроен вблизи или возле общераспространенного промотора. Некоторые примеры общераспространенных промоторов представлены промотором CAGGS, промотором hCMV, промотором PGK, промотором SV40 или промотором ROSA26.
Промоторы могут быть эндогенными или экзогенными. Например, один или более трансгенов могут быть встроены в положении, смежном или близком к эндогенному или экзогенному промотору ROSA26. Кроме того, промотор может быть специфическим в отношении иммунореактивных клеток. Например, один или более трансгенов могут быть встроены в положении, смежном или близком к промотору свиней ROSA26.
Тканеспецифические промоторы или клеточно-специфические промоторы могут применяться для контроля локализации экспрессии. Например, один или более трансгенов могут быть встроены в в положении, близком к тканеспецифическому промотору. Тканеспецифический промотор может представлять собой промотор FABP, промотор Lck, промотор CamKII, промотор CD19, промотор кератина, промотор альбумина, промотор аР2, промотор инсулина, промотор MCK, промотор MyHC, промотор WAP или промотор Col2A.
Индуцируемые промоторы могут также применяться. Указанные индуцируемые промоторы могут быть включены и выключены путем добавления или удаления индуктора, при необходимости. Предусмотрены, однако без ограничения перечисленным, следующие индуцируемые промоторы: Lac, tac, trc, trp, araBAD, phoA, recA, proU, cst-1, tetA, cadA, nar, PL, cspA, T7, VHB, Mx и/или Trex.
Термин «индуцируемый промотор» в настоящем документе означает контролируемый промотор, который не экспрессирует или экспрессирует на пониженном уровне функционально связанный с ним ген до достижения требуемых условий, и экспрессирует или экспрессирует на высоком уровне функционально связанный с ним ген при достижении требуемых условий. Например, согласно некоторым вариантам реализации в нормальных или гипероксических условиях в клетке индуцируемый промотор согласно настоящему изобретению не экспрессирует или экспрессирует на пониженном уровне функционально связанный с ним ген, а в ответ на пониженное содержание кислорода в клетке, в условиях гипоксии, функционально связанный с ним ген экспрессируется или сверхэкспрессируется. Согласно некоторым вариантам реализации используемый индуцируемый промотор согласно настоящему изобретению включает индуцируемый гипоксией транскрипционный фактор-1α (HIF-1α). Согласно некоторым вариантам реализации термин «индуцируемый промотор» в настоящем документе относится к «индуцируемому иммунной клеткой промотору», который не экспрессирует или экспрессирует на пониженном уровне функционально связанный с ним ген до контакта клетки иммунного ответа с антигеном, или в том случае, когда указанная клетка иммунного ответа не активирована, при этом только при контакте указанной клетки иммунного ответа с антигеном или при активации указанной клетки иммунного ответа указанный промотор запускает экспрессию или экспрессию на высоком уровне функционально связанного гена; или экспрессия происходит в таких условиях, как гипоксия. Согласно некоторым вариантам реализации указанный «индуцируемый иммунной клеткой промотор» включает промотор типа NFAT (ядерный фактор активированных Т-клеток).
В настоящем документе «промотор NFAT-типа» относится к классу промоторов, которые регулируют экспрессию функционально связанного с ними гена, задействуя связывающую активность NFAT.
NFAT представляет собой общий термин для обозначения семейства транскрипционных факторов, которые играют важную роль в иммунном ответе. Один или более представителей семейства NFAT экспрессируются в большинстве клеток иммунной системы. NFAT также вовлечен в развитие сердца, скелетных мышц и нервной системы.
Семейство транскрипционных факторов NFAT состоит из пяти представителей, NFAT1, NFAT2, NFAT3, NFAT4 и NFAT5. NFAT1-NFAT4 регулируются кальциевыми сигналами. Кальциевая сигнализация критически важна для активации NFAT, поскольку кальмодулин (СаМ) активирует серин/треониновую фосфатазу кальциневрин (CN). Активированная CN быстро дефосфорилирует богатую серином область (SRR) и SP-повторы на аминоконце белка NFAT; в результате происходит конформационное изменение, обеспечивающее экспонирование сигналов ядерной локализации, что приводит к входу NFAT в ядро.
Учитывая роль NFAT в транскрипционной экспрессии цитокинов при активации Т-клеток, он может применяться для модуляции индуцируемых иммунными клетками промоторов, описанных в настоящем документе, обеспечивая, соответственно, экспрессию или экспрессию на высоких уровнях функционально связанного с ним гена при контакте клеток иммунного ответа с антигеном и их активации.
Нуклеиновая кислота согласно настоящему изобретению может содержать любую подходящую последовательность нуклеотидов, кодирующую промотор NFAT-типа (или его функциональную часть или функциональный вариант). В настоящем документе «промотор NFAT-типа» относится к одному или более элементам ответа NFAT, соединенным с минимальным промотором любого гена, экспрессируемого Т-клеткой. Предпочтительно, минимальный промотор гена, экспрессируемого Т-клетками, представляет собой промотор ИЛ-2 человека минимального размера. Элемент ответа NFAT может включать, например, элементы ответа NFAT1, NFAT2, NFAT3 и/или NFAT4. Согласно некоторым вариантам реализации «промотор NFAT-типа» согласно описанию в настоящем документе включает более чем один связывающий мотив NFAT. Например, «промотор NFAT-типа» может включать 2, 3, 4, 5, 6, 7, 8, 9, 10 или более связывающих мотивов NFAT. Согласно некоторым вариантам реализации указанный «промотор NFAT-типа» включает до 12 связывающих мотивов NFAT. Согласно некоторым вариантам реализации указанный «промотор NFAT-типа» может представлять собой промотор, состоящий из совокупности связывающих мотивов NFAT в группах с промотором, таким как минимальный промотор ИЛ-2. Согласно некоторым вариантам реализации промотор NFAT-типа, описанный в настоящем документе, содержит шесть связывающих мотивов NFAT, обозначаемых (NFAT)6. Для удобства (NFAT)6 также называют NFAT6. Согласно некоторым вариантам реализации NFAT6 также соответствует 6 повторам связывающих мотивов NFAT (SEQ ID NO: 94) в промоторе NFAT-типа.
Кроме того, трансгенные последовательности могут также включать последовательности регуляции транскрипции или трансляции, такие как промоторы, энхансеры, инсуляторы, участки внутренней посадки рибосомы, последовательности, кодирующие пептиды 2А и/или сигналы полиаденилирования, хотя они и не являются обязательными для экспрессии.
Согласно некоторым вариантам реализации трансген кодирует рецептор или CAR, который связывается с антигеном, при этом указанный трансген встроен в «зону безопасности» таким образом, чтобы экспрессировать антигенсвязывающий рецептор. Согласно некоторым вариантам реализации указанный трансген встроен в локус PD1 и/или CTLA-4. В других случаях указанный трансген доставляют в клетки в виде лентивируса для случайной инсерции, тогда как PD1- или CTLA-4-специфическая нуклеаза может быть представлена в виде мРНК. Согласно некоторым вариантам реализации указанный трансген доставляют с применением вирусной векторной системы, например, ретровируса, ААВ или аденовируса, а мРНК кодирует специфическую нуклеазу для «зоны безопасности» (например, AAVS1, CCR5, альбумина или HPRT). Клетки могут также быть обработаны мРНК, кодирующей PD1- и/или CTLA-4-специфические нуклеазы. Согласно некоторым вариантам реализации полинуклеотид, кодирующий CAR, доставляют с применением вирусной системы наряду с мРНК, кодирующей HPRT-специфическую нуклеазу и PD1- или CTLA-4-специфическую нуклеазу. CAR, которые могут применяться в соответствии со способами и в композициях согласно описанию в настоящем документе, могут включать все типы указанных химерных белков.
Согласно некоторым вариантам реализации трансген может быть введен в иммунореактивную клетку с применением ретровирусного вектора (γ-ретровирусного или лентивирусного вектора). Например, трансген, кодирующий CAR или любой рецептор, который связывает антиген, или его вариант или фрагмент, может быть клонирован в ретровирусный вектор и им может управлять эндогенный промотор, ретровирусный длинный концевой повтор или специфический для целевых клеток промотор. Могут также применяться невирусные векторы. Невирусные векторные системы доставки могут включать ДНК-плазмиду, депротеинизированную нуклеиновую кислоту и нуклеиновую кислоту в комплексе с основой для доставки, такой как липосома или полоксамер.
Для переноса генов в клетки млекопитающих было разработано множество систем на основе вирусов. Например, ретровирусы представляют собой удобную платформу для систем доставки генов. Выбранный ген может быть встроен в вектор и упакован в ретровирусные частицы с применением методик, известных в данной области техники. Векторы, происходящие из ретровирусов, таких как лентивирусы, представляют собой подходящий инструмент для достижения долгосрочного переноса генов, поскольку они обеспечивают долгосрочную стабильную интеграцию трансгена и его размножение в дочерних клетках. Лентивирусные векторы обладают дополнительными преимуществами по сравнению с векторами, происходящими из ретровирусов, такими как вирус лейкоза мышей, поскольку они могут трансдуцировать не пролиферирующие клетки. Они также обладают дополнительными преимуществами, заключающимися в низкой иммуногенности. Преимуществом аденовирусных векторов является то, что они не сливаются с геномом целевой клетки, что позволяет обойти связанные с интеграцией негативные явления.
Клетки могут быть трансфицированы трансгеном, кодирующим антигенсвязывающий рецептор. Концентрация трансгена может варьировать от приблизительно 100 пикограммов до приблизительно 50 мкг. Согласно некоторым вариантам реализации количество нуклеиновой кислоты (например, оцДНК, дцДНК или РНК), вводимое в клетку, может быть изменено для оптимизации эффективности трансфекции и/или жизнеспособности клеток. Например, в каждый образец клеток для электропорации может быть добавлен 1 мкг дцДНК. Согласно некоторым вариантам реализации количество нуклеиновой кислоты (например, двуцепочечной ДНК), необходимое для обеспечения оптимальной эффективности трансфекции и/или жизнеспособности клеток, варьирует в зависимости от типа клеток. Согласно некоторым вариантам реализации количество нуклеиновой кислоты (например, дцДНК), используемое для каждого образца, может прямо соответствовать эффективности трансфекции и/или жизнеспособности клеток, например, диапазон концентраций для трансфекции. Трансген, кодируемый вектором, может быть интегрирован в геном клетки. Согласно некоторым вариантам реализации трансген, кодируемый указанным вектором, интегрирован в прямом направлении. В других случаях трансген, кодируемый указанным вектором, интегрирован в обратном направлении.
Вектор доставляют в организм индивидуального пациента, как правило, путем системного введения (например, внутривенного, внутрибрюшинного, внутримышечного, подкожного, или путем интракраниальной инфузии) или местного введения согласно приведенному ниже описанию. Как вариант, вектор может быть доставлен ex vivo в клетку, например, в клетку, извлеченную из организма индивидуального пациента (например, лимфоциты, Т-клетки, аспират костного мозга, биоптат ткани), после чего, как правило, отбирают клетки, в которые включен указанный вектор, и имплантируют пациенту. Клетки могут быть размножены до или после отбора.
Подходящие иммунореактивные клетки для экспрессии рецептора, который связывается с антигеном, могут представлять собой клетки, аутологичные или неаутологичные для нуждающегося в этом индивидуума.
Подходящий источник клеток иммунного ответа может быть получен от индивидуума. В некоторых случаях могут быть получены Т-клетки. Т-клетки могут быть получены из ряда источников, в том числе МКПК, костного мозга, ткани лимфатических узлов, пуповинной крови, ткани вилочковой железы и тканей из инфицированных сайтов, асцита, плеврального выпота, ткани селезенки и ткани опухоли. В некоторых случаях Т-клетки могут быть получены из крови, взятой у индивидуума с применением любых из ряда методик, известных специалисту в данной области техники, например, разделения в фиколле (Ficoll™). Согласно некоторым вариантам реализации клетки из циркулирующей крови индивидуума получают путем афереза. Продукты афереза, как правило, содержат лимфоциты, в том числе Т-клетки, моноциты, гранулоциты, В-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. Согласно некоторым вариантам реализации клетки, собранные путем афереза, могут быть промыты для удаления фракций плазмы и помещены в подходящий буфер или среду для последующих этапов обработки.
Как вариант, клетки могут происходить от здорового донора, от пациента с диагностированным раком или от пациента с диагностированной инфекцией. Согласно некоторым вариантам реализации указанные клетки могут представлять собой часть смешанной популяции клеток с разными фенотипическими характеристиками. Линии клеток могут также быть получены из трансформированных Т-клеток в соответствии с ранее описанными способами. Клетки могут также быть получены из библиотеки для клеточной терапии. Модифицированные клетки, устойчивые к иммуносупрессивной терапии, могут быть получены любым из способов, описанных в настоящем документе. Возможен также отбор подходящей популяции клеток до модификации. Популяция сконструированных клеток может также быть отобрана после модификации. Сконструированные клетки могут применяться для аутологичной трансплантации. Как вариант, указанные клетки могут применяться для аллогенной трансплантации. Согласно некоторым вариантам реализации указанные клетки вводят тому же пациенту, от которого получен образец для идентификации ассоциированной с раком целевой последовательности. В других случаях указанные клетки вводят пациенту, не являющемуся пациентом, образец от которого применяют для идентификации ассоциированной с раком целевой последовательности.
Согласно некоторым вариантам реализации подходящие первичные клетки включают мононуклеарные клетки периферической крови (МКПК), лимфоциты периферической крови (ЛПК) и другие субпопуляции клеток крови, такие как, но не ограничиваясь перечисленными, Т-клетки, естественные киллерные клетки, моноциты, естественные киллерные Т-клетки, клетки-предшественники моноцитов, гематопоэтические стволовые клетки или неплюрипотентные стволовые клетки. Согласно некоторым вариантам реализации указанная клетка может представлять собой любую иммунную клетку, в том числе любую Т-клетку, такую как инфильтрующая опухоль клетка (ИОЛ), такую как CD3+ Т-клетка, CD4+ Т-клетка, CD8+ Т-клетка или Т-клетка любого другого типа. Т-клетки могут также включать Т-клетки памяти, стволовые Т-клетки памяти или эффекторные Т-клетки. Возможен также отбор Т-клеток из большой популяции, например, отбор Т-клеток из цельной крови. Т-клетки могут также быть размножены из большой популяции. Может также наблюдаться тенденция принадлежности Т-клеток к специфическим популяциям и фенотипам. Например, может наблюдаться тенденция принадлежности Т-клетки к фенотипу, включающему CD45RO(-), CCR7(+), CD45RA(+), CD62L(+), CD27(+), CD28(+) и/или ИЛ-7Rα(+). Подходящие клетки могут содержать один или более из следующих маркеров: CD45RO(-), CCR7(+), CD45RA(+), CD62L(+), CD27(+), CD28(+) и/или ИЛ-7Rα(+). Подходящие клетки также включают стволовые клетки, такие как, например, эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки, гематопоэтические стволовые клетки, нейрональные стволовые клетки и мезенхимальные стволовые клетки. Подходящие клетки могут включать любое количество первичных клеток, таких как клетки человека, не принадлежащие человеку клетки и/или клетки мыши. Подходящие клетки могут представлять собой клетки-предшественники. Подходящие клетки могут происходить от подлежащего лечению субъекта (например, пациента).
Терапевтически эффективное количество клеток, необходимое для пациента, может варьировать в зависимости от жизнеспособности указанных клеток и эффективности генетической модификации указанных клеток (например, эффективности интеграции трансгена в одну или более клеток, или уровня экспрессии белка, кодируемого указанным трансгеном). Согласно некоторым вариантам реализации показатель жизнеспособности (например, пролиферативный потенциал) клеток после генетической модификации и эффективность интеграции трансгена могут соответствовать терапевтическому количеству клеток, которое может быть использовано для введения субъекту. Согласно некоторым вариантам реализации увеличение жизнеспособности клеток после генетической модификации может соответствовать снижению необходимого эффективного количества клеток для введения пациенту. Согласно некоторым вариантам реализации увеличение эффективности интеграции трансгена в одну или более клеток может соответствовать снижению числа клеток, которое необходимо ввести пациенту для эффективного лечения. Согласно некоторым вариантам реализации определение количества клеток, необходимого для эффективного лечения, может включать определение функций, ассоциированных с изменениями в клетках на протяжении периода времени. Согласно некоторым вариантам реализации определение количества клеток, необходимого для эффективного лечения, может включать определение функций, соответствующих изменениям эффективности интеграции трансгена в одну или более клеток в соответствии с зависимым от времени показателем (например, временем в культуре клеток, временем электропорации, временем стимуляции клеток). Согласно некоторым вариантам реализации терапевтически эффективные клетки могут представлять собой популяцию клеток, обеспечивающую приблизительно 30% - приблизительно 100% экспрессию антигенсвязывающего рецептора на поверхности клетки. Согласно некоторым вариантам реализации терапевтически эффективный клетки, по результатам проточной цитометрии, могут экспрессировать приблизительно 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или более чем приблизительно 99,9% антигенсвязывающего рецептора на поверхности клеток.
В соответствии с одним аспектом настоящего изобретения также предусмотрена нуклеиновая кислота, кодирующая антигенсвязывающий рецептор. Настоящее изобретение также относится к вариантам описанных выше полинуклеотидов, которые кодируют полипептид или фрагмент, аналог и производное полипептида с такой же последовательностью аминокислот, что и предусмотренная настоящим изобретением.
Согласно настоящему изобретению также предложен вектор, содержащий описанную выше нуклеиновую кислоту, кодирующую белок антигенсвязывающего рецептора, экспрессируемого на поверхности клетки иммунного ответа.
Настоящее изобретение также относится к вирусам, содержащим векторы, описанные выше. Вирус согласно настоящему изобретению включает инфекционный вирус после упаковки, а также включает подлежащий упаковке вирус, содержащий компоненты, необходимые для упаковки в инфекционный вирус. Другие известные в данной области техники вирусы, которые могут быть использованы для трансдукции экзогенных генов в клетки иммунного ответа, и соответствующие им плазмидные векторы могут также применяться согласно настоящему изобретению.
Согласно другому аспекту настоящего изобретения предложена клетка-хозяин, содержащая антигенсвязывающую единицу или химерный антигенный рецептор согласно описанию в настоящем документе; и, необязательно, интерферон I типа. Согласно другому аспекту настоящего изобретения предложена клетка-хозяин, содержащая нуклеиновую кислоту, кодирующую антигенсвязывающую единицу или химерный антигенный рецептор, описанные в настоящем документе; и, необязательно, интерферон I типа.
Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку иммунного ответа. Согласно некоторым вариантам реализации указанная клетка иммунного ответа представляет собой Т-клетку, естественную киллерную клетку, цитотоксический Т-лимфоцит, естественную киллерную Т-клетку, DNT-клетку и/или регуляторную Т-клетку. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку NK92.
Согласно некоторым вариантам реализации экспрессионная конструкция может быть включена в клетку иммунного ответа согласно настоящему изобретению, и элементы последовательно соединены следующим образом: антитело, костимулирующий сигнальный домен CD28, CD3ζ, а также NFAT6 и экспрессионная единица интерферона I типа, соединенные в обратном направлении с вышеупомянутыми элементами. Предпочтительно, антитело и CD28 костимулирующий сигнальный домен соединены трансмембранной областью CD8α и шарнирной областью CD8α.
Согласно некоторым вариантам реализации NFAT (ядерный фактор активированных Т-клеток) играет важную роль в транскрипционной экспрессии цитокинов при активации Т-клеток. С учетом указанного авторы настоящего изобретения поместили кодирующую последовательность ИФН-бета под контроль промотора NFAT6, так что экспрессия ИФН-бета на высоком уровне может происходить только при контакте CAR-Т-клеток с антигеном, индуцирующем активацию Т-клеток.
Промотор NFAT6 представляет собой промотор, полученный путем комбинирования шести связывающих положений NFAT и минимального промотора ИЛ-2 (Hooijberg Е, Bakker AQ, Ruizendaal JJ, Spits Н. NFAT-controlled expression of GFP permits visualization and Isolation of antigen-stimulated primary human Tcells. Blood. 2000 Jul 15; 96(2): 459-66), который может применяться для регуляции экспрессии цитокинов, таких как ИЛ-12 в Т-лимфоцитах, например, в TCR-T (Zhang L, Kerkar SP, Yu Z, Zheng Z, Yang S, Restifo NP, Rosenberg SA, Morgan RA. Improving adoptive T cell therapy by targeting and controlling IL-12 expression to the tumor environment. Mol Ther. 2011 Apr; 19(4):751-9).
Клетку иммунного ответа согласно настоящему изобретению трансдуцируют конструкцией, способной экспрессировать антигенсвязывающий рецептор и экзогенный интерферон I типа, или экспрессионный вектор или вирус, содержащий плазмиду. Согласно настоящему изобретению могут применяться стандартные для данной области техники способы трансдукции нуклеиновыми кислотами, в том числе невирусные и вирусные способы трансдукции.
Клетка иммунного ответа согласно настоящему изобретению может дополнительно нести кодирующую последовательность экзогенного цитокина, в том числе, но не ограничиваясь перечисленными, ИЛ-12, ИЛ-15 или ИЛ-21 и т.п. Указанные цитокины обладают дополнительной иммуномодулирующей или противоопухолевой активностью, усиливают функцию эффекторных Т-клеток и активированных NK-клеток, или непосредственно оказывают противоопухолевые эффекты. Соответственно, специалисту в данной области техники будет понятно, что применение указанных цитокинов помогает клеткам иммунного ответа лучше функционировать.
Клетка иммунного ответа согласно настоящему изобретению может также экспрессировать другой антигенсвязывающий рецептор, отличный от антигенсвязывающего рецептора, описанного выше.
Клетки иммунного ответа согласно настоящему изобретению могут также экспрессировать хемокиновый рецептор; указанные хемокиновые рецепторы включают, не ограничиваясь указанным, рецепторы CCR2. Специалисту будет понятно, что хемокиновый рецептор CCR2 может конкурировать за связывание CCR2 in vivo, что обеспечивает преимущества для блокирования метастазирования опухолей.
Клетки иммунного ответа согласно настоящему изобретению могут также экспрессировать миРНК, которая может снижать экспрессию PD-1, или белок, который может блокировать PD-L1. Специалисту будет понятно, что конкурентное блокирование взаимодействия PD-L1 с его рецептором PD-1 облегчает реализацию ответа противоопухолевых Т-клеток, ингибируя таким образом рост опухоли.
Клетки иммунного ответа согласно настоящему изобретению могут также экспрессировать «переключатель безопасности»; и, предпочтительно, указанный «переключатель безопасности» включает: iCaspase-9, усеченный рЭФР или RQR8.
Согласно некоторым вариантам реализации клетки иммунного ответа согласно настоящему изобретению не экспрессируют костимулирующий лиганд, такой как 4-1BBL.
Соответственно, согласно другому аспекту настоящего изобретения предложен способ получения антигенсвязывающей единицы или химерного антигенного рецептора, описанных в настоящем документе, или содержащей их композиции, включающий культивирование клетки-хозяина, описанной в настоящем документе, в подходящих условиях. Согласно некоторым вариантам реализации указанный способ включает изоляцию и получение продукта экспрессии из клетки-хозяина.
Согласно другому аспекту настоящего изобретения предложена композиция, содержащая антигенсвязывающую единицу, химерный антигенный рецептор или нуклеиновую кислоту, описанные в настоящем документе. Согласно некоторым вариантам реализации указанная композиция представляет собой фармацевтическую композицию, содержащую указанные антигенсвязывающую единицу, химерный антигенный рецептор или нуклеиновую кислоту. Согласно некоторым вариантам реализации указанная фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель.
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая клетку-хозяина, описанную в настоящем документе, и фармацевтически приемлемый носитель.
Термин «фармацевтически приемлемый» означает, что при введении подходящим образом молекул и композиций животному или человеку они не не вызывают нежелательных, аллергических или других неблагоприятных реакций.
Согласно некоторым вариантам реализации указанная композиция содержит дополнительный терапевтический агент. Согласно некоторым вариантам реализации указанный дополнительный терапевтический агент представляет собой химиотерапевтический агент, такой как описанные в US 20140271820, и/или его фармацевтически приемлемую соль или аналог. Согласно некоторым вариантам реализации указанный терапевтический агент включает, но не ограничиваясь перечисленными, ингибитор митоза (алкалоид барвинка), в том числе винкристин, винбластин, виндезин и навельбин (ТМ) (винорелбин, 5'-дегидросульфид водорода); ингибиторы топоизомеразы I, такие как соединения камптотецина, в том числе Камптосар™ (иринотекан HCL), Гикамтин™ (топотекан HCL) и другие соединения, происходящие из камптотецина, и т.п.; производное подофиллотоксина, такое как этопозид, тенипозид и мидостаурин; алкилирующий агент цисплатин, циклофосфамид, мустарген, триметилентиофосфорамид, кармустин, бусульфан, хлорамбуцил, белустин, урамустин, клопрофен и дакарбазин; антиметаболиты, в том числе цитарабин, 5-фторурацил, метотрексат, гуанидин, азатиоприн и прокарбазин; антибиотики, в том числе, но не ограничиваясь перечисленными, доксорубицин, блеомицин, дактиномицин, даунорубицин, эритромицин, митомицин, саркомицин С и даунорубицин; а также другие химиотерапевтические лекарственные средства, в том числе, но не ограничиваясь перечисленными, противоопухолевые антитела, дакарбазин, цитидин, амоксициллин, мелфалан, ифосфамид и митоксантрон. Согласно некоторым вариантам реализации указанный дополнительный терапевтический агент выбирают из одного или более следующих агентов: эпирубицина, оксалиплатина и 5-фторурацила. Согласно некоторым вариантам реализации указанный дополнительный терапевтический агент включает, но не ограничиваясь перечисленными, антиангиогенный агент, в том числе антитела против ФРЭС (в том числе гуманизированные и химерные антитела, направленные против ФРЭС аптамеры и антисмысловые олигонуклеотиды), и другие ингибиторы ангиогенеза, такие как ангиостатин, эндостатин, интерферон, интерлейкин 1 (в том числе α и β), интерлейкин 12, ретиноевая кислота и тканевые ингибиторы металлопротеиназ 1 и 2, и т.п.
Специфическими примерами некоторых веществ, которые могут применяться в качестве фармацевтически приемлемых носителей или их компонентов, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и метилцеллюлоза; порошок трагакантовой камеди; солод; желатин; тальк; твердые смазывающие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; полиолы, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как твин (Tween®); смачивающие агенты, такие как натрия лаурилсульфат; подкрашивающий агент; вкусоароматический агент; агент для прессования таблеток, стабилизаторы; антиоксиданты; консерванты; апирогенная вода; изотонический солевой раствор; и фосфатный буфер.
Фармацевтическая композиция, описанная в настоящем документе, может содержать одну или более фармацевтически приемлемых солей. «Фармацевтически приемлемая соль» относится к соли, которая сохраняет требуемую биологическую активность исходного соединения и не вызывает каких-либо нежелательных токсических эффектов (см., например, Berge, S.M., et al., 1977, J. Pharm. Sci. 66: 1-19). Примеры таких солей включают соли присоединения кислоты и соли присоединения основания.
Соли присоединения кислоты включают соли, происходящие из нетоксичных неорганических кислот, таких как соляная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, бромоводородная кислота, фосфористая кислота, и т.п., и происходящие из нетоксичных органических кислот, таких как алифатические монокарбоновые кислоты и дикарбоновая кислота, фенил-замещенная алкановая кислота, гидроксиалкановая кислота, ароматическая кислота, алифатическая или ароматическая сульфоновая кислота. Соли присоединения основания включают соли, происходящие из щелочно-земельных металлов (таких как натрий, калий, магний, кальций и т.п.), а также соли, происходящие из нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкозамин, глюкозамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и т.п.
Фармацевтическая композиция, описанная в настоящем документе, может также содержать антиоксидант. Примеры антиоксидантов включают, не ограничиваясь перечисленными, водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеина гидрохлорид, гидросульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и т.п.; и металлохелатирующие агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТК), сорбит, винная кислота, фосфорная кислота и т.п.
Композиция согласно настоящему изобретению при необходимости может входить в состав различных лекарственных форм, и может быть введена пациенту лечащим врачом в благоприятной дозе с учетом таких факторов, как тип пациента, возраст, масса тела, общий статус заболевания и способ введения, и т.п. Способ введения может представлять собой, например, парентеральное введение (например, инъекцию) или другой вариант лечения.
«Парентеральное» введение иммуногенной композиции включает, например, методики подкожной (п/к), внутривенной (в/в), внутримышечной (в/м) или интрастернальной инъекции или инфузии.
Составы, которые вводят индивидууму, содержащие популяцию иммунореактивных клеток, содержат совокупность иммунореактивных клеток, эффективных для лечения и/или предотвращения конкретного показателя или заболевания. Соответственно, индивидууму может быть введена терапевтически эффективная популяция иммунореактивных клеток. Как правило, вводят состав, содержащий от приблизительно 1×104 до приблизительно 1×1010 иммунореактивных клеток. В большинстве случаев состав содержит от приблизительно 1×105 до приблизительно 1×109 иммунореактивных клеток, от приблизительно 5×105 до приблизительно 5×108 иммунореактивных клеток, или от приблизительно 1×106 до приблизительно 1×107 иммунореактивных клеток. Однако в зависимости от локализации, источника, идентичности, степени и тяжести рака, возраста и физического состояния подлежащего лечению индивидуума, и т.п. число иммунореактивных клеток с CAR, которое вводят индивидууму, варьирует в широком диапазоне. Врач принимает окончательное решение о подходящей для использования дозе.
Согласно некоторым вариантам реализации химерный антигенный рецептор применяют для стимуляции опосредованного иммунными клетками иммунного ответа. Например, опосредованный Т-клетками иммунный ответ представляет собой иммунный ответ, задействующий активацию Т-клеток. Активированные антиген-специфические цитотоксические Т-клетки способны индуцировать апоптоз в целевых клетках, представляющих на поверхности экзогенный эпитоп, таких как раковые клетки, экспонирующие опухолевые антигены. Согласно другим вариантам реализации химерный антигенный рецептор применяют для обеспечения противоопухолевого иммунитета у млекопитающего. У субъектов развивается противоопухолевый иммунитет благодаря опосредованным Т-клетками иммунным ответам.
В некоторых случаях способ лечения субъекта, страдающего раком, может задействовать введение одной или более клеток иммунного ответа согласно настоящему изобретению нуждающемуся в лечении субъекту. Указанная клетка иммунного ответа может связываться с целевой молекулой опухоли и индуцировать смерть раковых клеток. Кроме того, как упоминалось выше, согласно настоящему изобретению также предложен способ лечения патогенных инфекций у индивидуума, включающий введение индивидууму терапевтически эффективного количества клеток иммунного ответа согласно настоящему изобретению.
Частота введения иммунореактивных клеток согласно настоящему изобретению зависит от факторов, включающих заболевание, лечение которого проводят, элементы конкретных иммунореактивных клеток и способ введения. Например, они могут вводиться 4 раза, 3 раза, 2 раза в сутки, один раз в сутки, один раз в два дня, каждые три дня, каждые четыре дней, каждые пять дней, каждые шесть дней, один раз в неделю, каждые восемь дней, каждые девять дней, каждые десять дней, один раз в неделю или два раза в месяц. Согласно описанию в настоящем документе клетки иммунного ответа согласно настоящему изобретению могут вводиться не только в терапевтически эффективном количестве, меньшем, чем такое количество для аналогичной клетки иммунного ответа, не экспрессирующей экзогенный интерферон I типа, но и с меньшей частотой, при достижении по меньшей мере аналогичных, а предпочтительно - более выраженных терапевтических эффектов, поскольку клетки иммунного ответа согласно настоящему изобретению обладают повышенной жизнеспособностью.
Согласно некоторым вариантам реализации указанные композиции могут быть изотоническими, т.е. осмотическое давление может быть таким же, как в крови и слезах. Требуемая изотоничность композиций согласно настоящему изобретению может быть достигнута с применением хлорида натрия или других фармацевтически приемлемых агентов, таких как глюкоза, борная кислота, тартрат натрия, пропиленгликоль или другие неорганические или органические растворенные вещества. При необходимости, вязкость композиции может поддерживаться на выбранном уровне с применением фармацевтически приемлемого загущающего агента. Подходящие загустители включают, например, метилцеллюлозу, ксантановую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбомер и т.п. Предпочтительная концентрация загустителя зависит от выбранного реагента. Очевидно, что выбор подходящего носителя и других добавок зависит от точного маршрута введения и свойств конкретной лекарственной формы, такой как жидкая лекарственная форма.
Согласно настоящему изобретению также предложены наборы, содержащие антигенсвязывающую единицу, химерный антигенный рецептор, нуклеиновую кислоту или клетку иммунного ответа согласно описанию в настоящем документе. Согласно некоторым вариантам реализации набор может включать терапевтическую или профилактическую композицию, содержащую эффективное количество антигенсвязывающей единицы, химерный антигенный рецептор, нуклеиновую кислоту или клетку иммунного ответа, описанные в настоящем документе, в одной или более единичных лекарственных формах. Согласно некоторым вариантам реализации указанный набор содержит стерильный контейнер, который может содержать терапевтическую или профилактическую композицию; и такой контейнер может представлять собой картридж, ампулу, бутылку, флакон, пробирку, мешок, блистерную упаковку или другую подходящую форму контейнера, известную в данной области техники. Такие контейнеры могут быть изготовлены из пластика, стекла, ламинированной бумаги, металлической фольги или других материалов, подходящих для хранения лекарственного средства. Согласно некоторым вариантам реализации указанный набор содержит антигенсвязывающую единицу, химерный антигенный рецептор, нуклеиновую кислоту или клетку иммунного ответа согласно описанию в настоящем документе, и инструкцию для введения индивидууму указанной антигенсвязывающей единицы, химерного антигенного рецептора, нуклеиновую кислоту или клетку иммунного ответа согласно описанию в настоящем документе. Указанная инструкция, как правило, включает описание способов лечения или предотвращения рака или опухолей с применением антигенсвязывающих единиц, химерных антигенных рецепторов, нуклеиновых кислот или клеток иммунного ответа согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный набор содержит клетки-хозяева согласно описанию в настоящем документе, и может содержать от приблизительно 1×104 клеток до приблизительно 1×106 клеток. Согласно некоторым вариантам реализации указанный набор может содержать по меньшей мере приблизительно 1×105 клеток, по меньшей мере приблизительно 1×106 клеток, по меньшей мере приблизительно 1×107 клеток, по меньшей мере приблизительно 4×107 клеток, по меньшей мере приблизительно 5×107 клеток, по меньшей мере приблизительно 6×107 клеток, по меньшей мере приблизительно 6×107 клеток, 8×107 клеток, по меньшей мере приблизительно 9×107 клеток, по меньшей мере приблизительно 1×108 клеток, по меньшей мере приблизительно 2×108 клеток, по меньшей мере приблизительно 3×108 клеток, по меньшей мере приблизительно 4×108 клеток, по меньшей мере приблизительно 5×108 клеток, по меньшей мере приблизительно 6×108 клеток, по меньшей мере приблизительно 6×108 клеток, по меньшей мере приблизительно 8×108 клеток, по меньшей мере приблизительно 9×108 клеток, по меньшей мере приблизительно 1×109 клеток, по меньшей мере приблизительно 2×109 клеток, по меньшей мере приблизительно 3×109 клеток, по меньшей мере приблизительно 4×109 клеток, по меньшей мере приблизительно 5×109 клеток, по меньшей мере приблизительно 6×109 клеток, по меньшей мере приблизительно 8×109 клеток, по меньшей мере приблизительно 9×109 клеток, по меньшей мере приблизительно 1×1010 клеток, по меньшей мере приблизительно 2×1010 клеток, по меньшей мере приблизительно 3×1010 клеток, по меньшей мере приблизительно 4×1010 клеток, по меньшей мере приблизительно 5×1010 клеток, по меньшей мере приблизительно 6×1010 клеток, по меньшей мере по меньшей мере приблизительно 9×1010 клеток, по меньшей мере приблизительно 9×1010 клеток, по меньшей мере приблизительно 1×1011 клеток, по меньшей мере приблизительно 2×1011 клеток, по меньшей мере приблизительно 3×1011 клеток, по меньшей мере приблизительно 4×1011 клеток, по меньшей мере приблизительно 5×1011 клеток, по меньшей мере приблизительно 8×1011 клеток, по меньшей мере приблизительно 9×1011 клеток или по меньшей мере приблизительно 1×1012 клеток. Например, в указанный набор может входить приблизительно 5×1010 клеток. Согласно другому примеру набор может включать 3×106 клеток; и указанные клетки могут быть размножены до количества, равного приблизительно 5×1010 клеток, и введены субъекту.
Согласно некоторым вариантам реализации указанный набор может включать аллогенные клетки. Согласно некоторым вариантам реализации указанный набор может включать клетки, которые могут содержать геномные модификации. Согласно некоторым вариантам реализации указанный набор может содержать «готовые» клетки. Согласно некоторым вариантам реализации указанный набор может включать клетки, которые могут быть размножены, для клинического применения. В некоторых случаях содержимое указанного набора может быть предназначено для исследовательских целей.
Согласно некоторым вариантам реализации указанная инструкция включает по меньшей мере что-либо одно из описания терапевтического агента; схемы дозирования и введения для лечения или предотвращения опухоли или ее симптома; профилактических мер, предупреждений, противопоказаний, дополнительной информации, нежелательных реакций, фармакологии у животных, клинических исследований и/или ссылок на источники. Инструкция может быть напечатана непосредственно на контейнере (при его наличии) или на этикетке, размещаемой на контейнере, или на отдельном листе бумаги, в буклете, на карточке или проспекте внутри контейнера. Согласно некоторым вариантам реализации указанная инструкция описывает способ введения клетки иммунного ответа согласно настоящему изобретению для лечения или предотвращения опухоли. В некоторых случаях указанная инструкция обеспечивает способ введения иммунореактивной клетки согласно настоящему изобретению до, после или одновременно с введением химиотерапевтического агента.
Согласно другому аспекту настоящего изобретения предложен способ индукции смерти клетки, содержащей пептид клаудин 18А2, при этом указанный способ включает: приведение указанной клетки в контакт с антигенсвязывающей единицей, описанных в настоящем документе, химерным антигенным рецептором, описанным в настоящем документе, композициями, описанными в настоящем документе, или клеткой-хозяином, описанной в настоящем документе. Согласно некоторым вариантам реализации приведение в контакт осуществляют in vitro. Согласно некоторым вариантам реализации приведение в контакт осуществляют in vivo.
Согласно некоторым вариантам реализации указанная клетка представляет собой опухолевую клетку. Согласно некоторым вариантам реализации указанная клетка представляет собой клетку солидной опухоли. Согласно некоторым вариантам реализации указанная клетка представляет собой раковую или опухолевую клетку согласно описанию в настоящем документе. Конкретные примеры таких клеток могут включать, не ограничиваясь перечисленными, клетки лейкоза (такого как острый лейкоз, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, острый миелоидный лейкоз, острый промиелоцитарный лейкоз, острый гранулоцитарно-моноцитарный лейкоз, острый моноцитарный лейкоз, острый лейкоз, хронический лейкоз, хронический миелоидный лейкоз, хронический лимфоцитарный лейкоз, истинная полицитемия), клетки лимфомы (болезнь Ходжкина, неходжкинская болезнь), клетки первичной макроглобулинемии, клетки болезни тяжелых цепей, клетки солидных опухолей, таких как саркома, и клетки рака (такого как фибросаркома, муцинозная саркома, липосаркома, хондросаркома, остеосаркома, хордома, эндотелиальная саркома, лимфангиосаркома, ангиосаркома, лимфатическая эндотелиальная саркома, синовиальная саркома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, рак толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточная карцинома, базально-клеточная карцинома, аденокарцинома, рак потовых желез, рак сальных желез, папиллярная карцинома, папиллярная аденокарцинома, рак, бронхиальная карцинома, медуллярная карцинома, почечноклеточный рак, рак печени, рак желчных путей, хориокарцинома, семинома, эмбриональная карцинома, нефробластома, рак шейки матки, рак матки, рак яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, опухоль шишковидной железы, гемангиобластома, акустическая невринома, олигодендроглиома, шванномы, менингиома, меланома, нейробластома, ретинобластома), клетки рака пищевода, клетки рака желчного пузыря раковые, клетки рака почки, клетки множественной миеломы и т.п. Согласно некоторым вариантам реализации указанная клетка представляет собой клетку рака желудка, клетку рака пищевода, клетку рака кишечника, клетку рака поджелудочной железы, клетку нефробластомы, клетку рака легкого, клетку рака яичников, клетку рака толстой кишки, клетку рака прямой кишки, клетку рака печени, клетки рака головы и шеи, клетку хронического миелоидного лейкоза и клетку рака желчного пузыря.
Согласно другому аспекту настоящего изобретения предложен способ лечения опухоли у нуждающегося в этом индивидуума, при этом указанный способ включает введение указанному индивидууму эффективного количества антигенсвязывающей единицы, химерного антигенного рецептора, композиции, вектора или клетки-хозяина согласно описанию в настоящем документе.
Согласно некоторым вариантам реализации указанная опухоль включает, не ограничиваясь перечисленными, опухоль мочевого пузыря, костей, головного мозга, молочной железы, хрящей, глиальных клеток, пищевода, фаллопиевых труб, желчного пузыря, сердца, кишечника, почек, печени, легких, лимфатических узлов, нервной ткани, яичников, поджелудочной железы, предстательной железы, скелетных мышц, кожи, спинного мозга, селезенки, желудка, семенников, вилочковой железы, щитовидной железы, трахеи, уретры, мочеточника, уретры, матки, органов влагалища. Согласно некоторым вариантам реализации указанная опухоль включает, но не ограничиваясь перечисленными, лейкоз (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, острый миелоидный лейкоз, острый промиелоцитарный лейкоз, острый гранулоцитарно-моноцитарный лейкоз, острый моноцитарный лейкоз, острый лейкоз, хронический лейкоз, хронический миелоидный лейкоз, хронический лимфоцитарный лейкоз, истинная полицитемия), лимфому (болезнь Ходжкина, неходжкинская болезнь), первичную макроглобулинемию, болезнь тяжелых цепей, солидные опухоли, такие как саркома, и рак (такой как фибросаркома, муцинозная саркома, липосаркома, хондросаркома, остеосаркома, хордома, эндотелиальная саркома, лимфангиосаркома, ангиосаркома, лимфатическая эндотелиальная саркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, рак толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточная карцинома, базально-клеточная карцинома, аденокарцинома, рак потовых желез, рак сальных желез, папиллярный рак, папиллярная аденокарцинома, рак, бронхиальная карцинома, медуллярная карцинома, почечноклеточный рак, рак печени, рак желчных путей, хориокарцинома, семинома, эмбриональная карцинома, нефробластома, рак шейки матки, рак матки, рак яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, опухоль шишковидной железы, гемангиобластома, акустическая невринома, олигодендроглиома, шванномы, менингиомы, меланома, нейробластома, ретинобластома), рак пищевода, рак желчного пузыря, рак почки, множественная миелома. Согласно некоторым вариантам реализации указанная опухоль представляет собой рак желудка, рак пищевода, рак кишечника, рак поджелудочной железы, нефробластому, рак легкого, рак яичников, рак толстой кишки, рак прямой кишки, рак печени, рак головы и шеи, хронический миелогенный лейкоз или рак желчного пузыря.
Согласно некоторым вариантам реализации иммунореактивные клетки могут быть введены субъекту, при этом возраст подходящих для введения иммунореактивных клеток может составлять от приблизительно 1 до приблизительно 35 дней. Например, возраст введенных клеток может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или до приблизительно 40 дней. Возраст иммунореактивных клеток с CAR может быть рассчитан исходя из времени стимуляции. Возраст иммунореактивных клеток может быть рассчитан исходя из времени взятия крови. Возраст иммунореактивных клеток может быть рассчитан исходя из времени трансдукции. Согласно некоторым вариантам реализации возраст иммунореактивных клеток, которые могут быть введены субъекту, составляет от приблизительно 10 до приблизительно 14 или приблизительно 20 дней. Согласно некоторым вариантам реализации «возраст» иммунореактивной клетки может быть определен по длине теломер. Например, «молодая» клетка иммунного ответа может иметь более длинные теломеры, чем «истощенные» или «старые» иммунореактивные клетки. Без связи с конкретной теорией считается, что расчетная длина теломер иммунореактивных клеток снижается приблизительно на 0,8 т.о. в неделю в культуре, и в молодой культуре иммунореактивная клетка может иметь приблизительно на 1,4 т.о. более длинные теломеры, чем иммунореактивная клетка возрастом приблизительно 44 дней. Без связи с конкретной теорией считается, что  длина теломер может быть ассоциирована с положительным объективным клиническим ответом у пациента и персистенцию клеток in vivo.
длина теломер может быть ассоциирована с положительным объективным клиническим ответом у пациента и персистенцию клеток in vivo.
Клетки (например, сконструированные клетки или сконструированные первичные Т-клетки) могут быть функциональными до, после и/или во время трансплантации. Например, трансплантированные клетки могут функционировать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 6, 27, 28, 29, 30, 40, 50, 60, 70, 80, 90 или 100 дней после трансплантации. Трансплантированные клетки могут функционировать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев после трансплантации. Трансплантированные клетки могут функционировать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или 30 лет после трансплантации. Согласно некоторым вариантам реализации трансплантированные клетки могут функционировать в течение жизни реципиента.
Кроме того, трансплантированные клетки могут функционировать на уровне 100% ожидаемой в норме функции. Указанные трансплантированные клетки могут также функционировать приблизительно на уровне 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или до уровня приблизительно 100% от их ожидаемой в норме функции.
Трансплантированные клетки могут также функционировать на уровне, превышающем 100% от их ожидаемой в норме функции. Например, трансплантированные клетки могут функционировать на уровне приблизительно 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000 или приблизительно до 5000% от их ожидаемой в норме функции.
Трансплантат может представлять собой любой тип трансплантата. Локализация может включать, не ограничиваясь перечисленным, подпеченочное пространство, подселезеночное пространство, субкапсулярное пространство, сальник, желудочный или кишечный подслизистый слой, сосудистый сегмент тонкого кишечника, венозный мешок, семенники, головной мозг, селезенка, или роговица. Например, указанный трансплантат может представлять собой субкапсулярный трансплантат. Указанный трансплантат может также представлять собой внутримышечный трансплантат. Указанный трансплантат может представлять собой трансплантат воротной вены.
Отторжение трансплантата может быть снижено после лечения клетками иммунного ответа согласно настоящему изобретению по сравнению с ситуацией, когда реципиенту трансплантируют одну или более клеток дикого типа. Например, отторжение трансплантата может представлять собой сверхострое отторжение. Отторжение трансплантата может также представлять собой острое отторжение. Другие типы отторжения могут включать хроническое отторжение. Отторжение трансплантата может также представлять собой клеточно-опосредованное отторжение или опосредованные Т-клетками отторжение. Отторжение трансплантата может также представлять собой опосредованное естественными киллерными клетками отторжение.
Улучшение при трансплантации может относиться к облегчению сверхострого отторжения, которое может включать снижение, облегчение или уменьшение нежелательных явлений или симптомов. Трансплантация может относиться к адоптивной трансплантации клеточных продуктов.
Другим признаком успешной трансплантации может быть количество дней, на протяжении которого реципиент не нуждается в иммуносупрессивной терапии. Например, после получения клеток иммунного ответа согласно настоящему изобретению реципиент может не нуждаться в иммуносупрессивной терапии на протяжении по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более дней. Это может указывать на успешную трансплантацию. Это может также показывать, что отторжения трансплантированных клеток, тканей и/или органов не происходит.
В некоторых случаях реципиенту не требуется иммуносупрессивная терапия на протяжении по меньшей мере 1 дня. Реципиенту может не требоваться иммуносупрессивная терапия на протяжении по меньшей мере 7 дней. Реципиенту не требуется иммуносупрессивная терапия на протяжении по меньшей мере 14 дней. Реципиенту не требуется иммуносупрессивная терапия на протяжении по меньшей мере 21 дней. Реципиенту не требуется иммуносупрессивная терапия на протяжении по меньшей мере 28 дней. Реципиенту не требуется иммуносупрессивная терапия на протяжении по меньшей мере 60 дней. Кроме того, реципиенту может не требоваться иммуносупрессивная терапия на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более лет.
Другим признаком успешности трансплантации может быть снижение количества дней, на протяжении которого реципиент нуждается в иммуносупрессивной терапии. Например, после лечения согласно настоящему изобретению реципиенту может требоваться сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более дней. Это может указывать на успешную трансплантацию. Это может также указывать на отсутствие отторжения или на минимальное отторжение трансплантированных клеток, тканей и/или органов.
Например, реципиенту может требоваться сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 1 дня. Реципиенту может также требоваться сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 7 дней. Реципиенту может требоваться сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 14 дней. Реципиенту требуется сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 21 дня. Реципиенту требуется сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 28 дней. Реципиенту требуется сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 60 дней. Кроме того, реципиенту может требоваться сокращенная иммуносупрессивная терапия на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более лет.
Сокращенная иммуносупрессивная терапия может относиться к меньшей потребности в иммуносупрессивной терапии по сравнению с ситуацией, когда реципиенту трансплантируют одну или более клеток дикого типа.
Иммуносупрессивная терапия может включать любое лечение, которое ингибирует иммунную систему. Иммуносупрессивная терапия может содействовать облегчению, снижению или элиминации отторжения трансплантата у пациентов. Например, до, во время и/или после трансплантации могут применяться иммунодепрессанты, в том числе MMF (микофенолата мофетил, Селлсепт), ATG (антитимоцитарный глобулин), анти-CD154 (CD4OL), анти-CD40 (2С10), иммуносупрессивные лекарственные средства, антитела против рИЛ-6 (тоцилизумаб, актемра), антитела против ИЛ-6 (сарилумаб, олокизумаб), CTLA4-Ig (Абатасепт/Оренсия), антитела против ИЛ-6 (ASKP1240, CCFZ533X2201)), амфетамин (кампат), анти-CD20 (ритуксимаб), бевацизумаб (LEA29Y), сиролимус (Рапамун), эверолимус, такролимус (Програф), Земегаб, Земилект, Ремикейд, циклоспорин, дигоксигенин, растворимый рецептор комплемента 1, яд кобры, антитело против С5 экулизумаб/солирис), метилпреднизолон, FTY720, эверолимус, лефлуномид, антитело против рИЛ-2, рапамицин, антитело против CXCR3, антитело против ICOS, антитело против ОХ40 и антитело против CD122. Кроме того, один или более иммуносупрессивных агентов/лекарственных средств могут применяться совместно или последовательно. Один или более иммуносупрессивных агентов/лекарственных средств могут применяться для индукции терапии или поддержания терапии. В фазах индукции и поддержания могут применяться одинаковые или разные лекарственные средства. В некоторых случаях даклизумаб (зенапакс) может применяться для индукции терапии, а такролимус (програф) и сиролимус (рапамун) могут применяться для поддержания терапии. Также для достижения иммуносупрессии могут применяться нефармакологические схемы, в том числе, но не ограничиваясь перечисленным, облучение всего тела, облучение вилочковой железы и тотальная и/или частичная спленэктомия. Указанные методики могут также применяться в комбинации с одним или более иммуносупрессивными лекарственными средствами.
Согласно некоторым вариантам реализации антигенсвязывающая единица, химерный антигенный рецептор, композиция, вектор или клетка-хозяин согласно описанию в настоящем документе может быть введен(а) в комбинации с другим терапевтическим агентом. Согласно некоторым вариантам реализации указанный дополнительный терапевтический агент представляет собой химиотерапевтический агент, такой как описанные в US 20140271820. Химиотерапевтические агенты, которые могут применяться в комбинации с клетками иммунного ответа согласно настоящему изобретению, включают, не ограничиваясь перечисленными, ингибиторы митоза (алкалоиды барвинка), в том числе винкристин, винбластин, виндезин и навельбин (ТМ) (винорелбин), 5'-дегидросульфид водорода); ингибиторы топоизомеразы I, такие как соединения камптотецина, в том числе Камптосар™ (иринотекан HCL), Гикамтин™ (топотекан HCL), и другие соединения, происходящие из камптотецина и его аналогов; производные подофиллотоксина такие как этопозид, тенипозид и мидостаурин; алкилирующие агенты цисплатин, циклофосфамид, мустарген, триметилен тиофосфорамид, мустарген, бусульфан, хлорамбуцил, белустин, урамустин, клопрофен и дакарбазин; антиметаболиты, в том числе цитарабин, 5-фторурацил, метотрексат, антрахинон, азатиоприн и прокарбазин; антибиотики, в том числе, но не ограничиваясь перечисленными, доксорубицин, блеомицин, дактиномицин, даунорубицин, эритромицин, митомицин, саркомицин С и даунорубицин; и другие химиотерапевтические лекарственные средства, в том числе, но не ограничиваясь перечисленными, противоопухолевые антитела, дакарбазин, цитидин, амоксициллин, мелфалан, ифосфамид и митоксантрон. Согласно некоторым вариантам реализации указанный дополнительный терапевтический агент выбирают из одного или более следующих агентов: эпирубицина, оксалиплатина и 5-фторурацила.
Согласно некоторым вариантам реализации химиотерапевтические агенты, которые могут применяться в комбинации с клетками иммунного ответа согласно настоящему изобретению, включают, не ограничиваясь перечисленными, антиангиогенный агент, в том числе антитела против ФРЭС (в том числе гуманизированные и химерные антитела, направленные против ФРЭС аптамеры и антисмысловые олигонуклеотиды), и другие ингибиторы ангиогенеза, такие как ангиостатин, эндостатин, интерферон, интерлейкин 1 (в том числе α и β), интерлейкин 12, ретиноевая кислота и тканевые ингибиторы металлопротеиназ 1 и 2, и т.п.
Пример
Настоящее изобретение дополнительно проиллюстрировано ниже с описанием специфических вариантов реализации. Следует понимать, что указанные примеры предназначены для демонстрации настоящего изобретения, а не для ограничения его объема. Экспериментальные способы, описанные в приведенных ниже примерах, специфические условия для которых не указаны, обычно используют в стандартных условиях, таких как описанные в руководстве: J. Sambrook et al., Molecular Cloning Experimental Guide, Third Edition, Science Press, 2002, или в условиях, рекомендуемых производителем.
В приведенных ниже примерах согласно настоящему изобретению при конструировании антигенсвязывающего рецептора или CAR костимулирующий сигнальный домен CD28 сокращенно обозначают как 28; CD3ζ сокращенно обозначают как Z; 4-1ВВ или CD137 сокращенно обозначают как ВВ. Например, сконструированный химерный антигенный рецептор, содержащий scFv с кодом 8E5-2I и костимулирующие сигнальные домены CD3ζ, а также CD28 в качестве внутриклеточного сигнального домена, может называться 8E5-2I-28Z. Таким образом конструируют CAR для разных антигенов.
Пример 1. Получение и характеризация антитела мыши к CLD18A2
Фрагменты антител получали с применением стандартных биологических протоколов. Вкратце, 8-недельных мышей Balb/c иммунизировали эукариотическим экспрессионным вектором, содержащим полноразмерную последовательность CLD18A2 человека (референсная последовательность NCBI: NM_001002026.2). Извлекали селезенку иммунизированной мыши и получали моноклональное антитело с применением стандартной для данной области техники биологической схемы.
Проводили скрининг индивидуальных клеток на моноклональное антитело против CLD18A2 с помощью проточной цитометрии; клетки HEK293 (HEK-CLD18A2), стабильно экспрессирующие CLD18A2 человека, использовали для первичного скрининга посредством проточной цитометрии с применением инструмента Guava easyCyte™ НТ System. Затем сравнивали связывание содержащих CLD18A1 и CLD18A2 человека трансформантов с антителами с помощью проточной цитометрии. Использовали инструмент Guava easyCyte™ НТ System.
После нескольких раундов получения и скрининга гибридом авторы настоящего изобретения обнаружили ряд антител, обладающих более или менее идеальными связывающими свойствами. На фиг. 1В приведен пример связывания супернатантов гибридома 2В1, 3Е12, 4А11, 8Е5 с клетками HEK293, стабильно трансфицированными CLD18A2 человека или CLD18A1, по оценкам результатов проточной цитометрии. Как показано на фиг. 1В, после двух раундов субклонирования большинство субклонов антител 2В1, 3Е12, 4А11 и 8Е5 специфически связывались с CLD18A2 человека, но не с CLD18A1 человека, и средняя интенсивность флуоресценции отличалась более чем в 5 раз.
Секретирующий моноклональное антитело гибридомный штамм клеток культивировали, и экстрагировали тотальную РНК из клеточного осадка в соответствии с инструкциями к набору для очищения РНК TRIzol® Plus RNA Purification kit (Invitrogen, 12183-555). Проводили обратную транскрипцию кДНК, используя тотальную РНК в качестве матрицы, в соответствии с инструкциями к набору High Capacity RNA-to-cDNA Kit (Invitrogen, 4387406). кДНК использовали в качестве матрицы; для амплификации использовали набор 5-Full RACE Kit (TAKARA, D315) и праймеры константной области антитела. Продукты ПЦР разделяли на 1,5% агарозном геле; фрагменты ДНК очищали и выделяли. Были получены следующие результаты секвенирования:
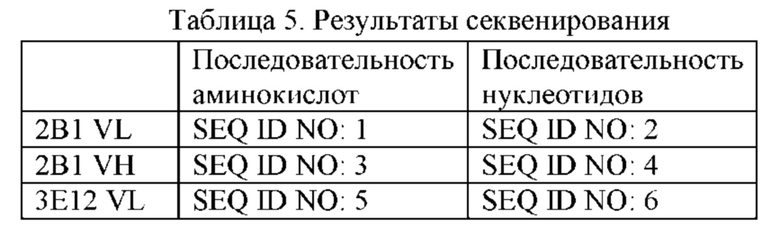
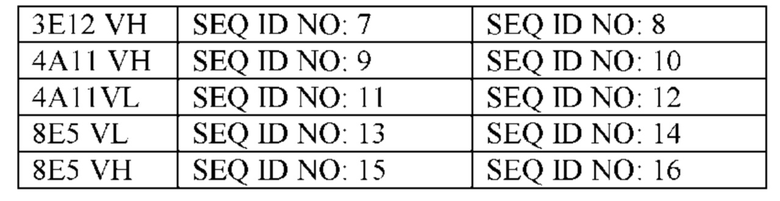
Последовательности антитела выравнивали; результаты представлены на фиг. 2.
Пример 2. Конструирование против слитого scFv_Fc-антитела против клаудина 18А2 и его транзиентная экспрессия в эукариотических клетках
Для фрагментов VH и VL 2В1, 8Е5 гибкий аминокислотный фрагмент GGGGSGGGGSGGGGS (SEQ ID NO: 93) вводили в качестве линкера для scFv; в 5'-направлении от VH вводили подходящий сайт рестрикции и защитные основания; в 3'-направлении от VL вводили подходящий сайт рестрикции и защитные основания; расщепляли и лигировали в эукариотический экспрессионный вектор (см. вектор рН или вектор pK согласно описанию в CN 101602808). Реагент для трансфекции 293fectin™ (Invitrogen, 12347-019) использовали для транзиентной трансфекции, собирали супернатант и проводили аффинное очищение; полученное антитело количественно и качественно анализировали с применением ДСН-ПААГ.
Связывание слитого scFv_Fc-антитела против клаудина 18А2 с клетками HEK293, стабильно трансфицированными CLD18A2, определяли с помощью проточной цитометрии. Экспериментальные данные анализировали с применением GraphPad Prism и инструмента Guava easyCyte™ НТ System согласно описанию в примере 1 для определения значения ЕС50. На фиг. 3 показана относительная аффинность связывания scFv моноклонального антитела 2В1, 8Е5, после слияния с Fc-частью IgG1 человека, с клетками HEK293, стабильно трансфицированными CLD18A2 человека. Можно видеть, что значение ЕС50 для 2В1 составляет 3,56 нМ; значение ЕС50 для 8Е5 составляет 49,19 нМ.
Пример 3. Получение вариантов антител против клаудина 18А2
Антитело 2В1 подвергали сайт-специфическому мутагенезу с применением мостиковой ПЦР. Мутации вводили в положении 52 или 54 (сайт N-гликозилирования) на тяжелой цепи антитела 2В1 с получением двух мутантов 2В1, 2B1-N52D (последовательность аминокислот VH: SEQ ID NO: 17; последовательность нуклеотидов: SEQ ID NO: 18) и 2B1-S54A (последовательность аминокислот VH: SEQ ID NO: 19; последовательность нуклеотидов: SEQ ID NO: 20).
Последовательности аминокислот и последовательности нуклеотидов легких цепей 2B1-N52D и 2B1-S54A идентичны соответствующим последовательностям 2В1.
Экспрессионные векторы ScFv_Fc-формы указанных двух мутантов конструировали согласно описанию в примере 2 и в соответствии с процедурой из примера 2, и анализировали экспериментальные данные с применением GraphPad Prism и инструмента Guava easyCyte™ НТ System для определения ЕС50.
На фиг. 4 приведена относительная аффинность связывания 2B1-N52D и 2B1-S54A после слияния с Fc-частью IgG1 человека с клетками HEK293, стабильно трансфицированными CLD18A2 человека. Можно видеть, что значение ЕС50 для 2В1-N52D составляет 6,11 нМ, и значение ЕС50 для 2B1-S54A составляет 3,85 нМ.
Пример 4. Получение гуманизированного антитела 2B1-S54A
Последовательности 6 CDR легкой и тяжелой цепи антитела определяли в соответствии со схемами нумерации Kabat, Chothia и IMGT. Используя выравнивание на основании сходства последовательностей, выбирали последовательность антитела, обладающую максимальным сходством с 2B1-S54A, в качестве антитела-матрицы. В указанном примере IGHV1-46*01 из базы данных IMGT выбирали в качестве антитела-матрицы для тяжелой цепи hu2B1-S54A. IGKV4-1*01 использовали в качестве антитела-матрицы для легкой цепи hu2B1-S54A. Участки CDR легких и тяжелых цепей 2B1-S54A заменяли на CDR областей антитела-матрицы.
Определение сайтов обратной мутации: (1) Выравнивание разработанного гуманизированного антитела со стартовым антителом и проверка наличия отличающихся аминокислот в каркасной области антитела. (2) Проверка того, являются ли указанные отличающиеся аминокислоты аминокислотами, поддерживающими петлевую структуру антитела, или аминокислотами, влияющими на связывание вариабельных областей легких и тяжелых цепей; в случае положительного результата указанные области представляют собой относительно консервативные области. (3) Проверка наличия каких-либо потенциальных сайтов посттрансляционной модификации в гуманизированных антителах, таких как сайты деамидирования (Asn-Gly), сайты изомеризации (Asp-Gly), экспонированный на поверхности метионин, сайт N-гликозилирования (Asn-X-Ser/Thr, где X не является пролином). (4) В тяжелой цепи гуманизированного антитела (hu2B1-S54A) расположены шесть потенциальных сайтов обратных мутаций, а именно, M48I, V68A, M70L, R72A, T74K, T91S, соответственно. Имеется потенциальный сайт обратной мутации в легкой цепи гуманизированного антитела (hu2B1-S54A), L84V.
Экспрессия и очищение гуманизированного антитела: (1) Разрабатывали и синтезировали последовательность нуклеотидов на основе последовательности аминокислот гуманизированного антитела (hu2B1-S54A). Синтезировали последовательность нуклеотидов легкой цепи (SEQ ID NO: 62); и последовательность нуклеотидов тяжелой цепи (SEQ ID NO: 60). (2) Последовательность нуклеотидов синтетического антитела, включающую сигнальный пептид, вариабельную область и константную область антитела, встраивают в экспрессионный вектор для клеток млекопитающих, конструируя экспрессионные векторы с антителом, содержащие тяжелую цепь и легкую цепь, соответственно, секвенировали и идентифицировали.
Последовательность аминокислот тяжелой цепи hu2B1-S54A представлена в последовательности SEQ ID NO: 59; последовательность нуклеотидов представлена в последовательности SEQ ID NO: 60. Последовательность аминокислот легкой цепи hu2B1-S54A представлена в последовательности SEQ ID NO: 61; последовательность нуклеотидов представлена в последовательности SEQ ID NO: 62. Последовательность аминокислот вариабельной области тяжелой цепи hu2B1-S54A представлена в последовательности SEQ ID NO: 23, последовательность нуклеотидов представлена в последовательности SEQ ID NO: 24; последовательность аминокислот вариабельной области легкой цепи представлена в последовательности SEQ ID NO: 21, нуклеозидная последовательность представлена в последовательности SEQ ID NO: 22.
Клетки 293F транзиентно трансфицировали реагентом 293Fectin и экспрессировали HCDR из hu2B1-S54A и такую же последовательность LCDR.
Выполняли анализ связывающей активности согласно описанию в примере 2, и анализировали экспериментальные данные, используя клетки HEK293 (HEK-CLD18A2), стабильно экспрессирующие CLD18A2 человека, GraphPad Prism и инструмент Guava easyCyte™ НТ System для определения ЕС50; результаты представлены на фиг. 5. Значение ЕС50 для scFv hu2B1-S54A после слияния с Fc-частью IgG1 человека, соответствующее относительной аффинности связывания с клеткой HEK293, стабильно трансфицированной CLD18A2 человека, составило 18,59 нМ, подтверждая, что hu2B1-S54A также демонстрирует выраженное связывание с HEK-CLD18A2.
Пример 5. Получение и оптимизация гуманизированного антитела из моноклонального антитела 8Е5
Используя процедуру из примера 4, 8Е5 гуманизировали, удаляя сайт N-гликозилирования в моноклональном антителе 8Е5 путем введения точечной мутации S62A, с получением гуманизированного антитела hu8E5 (или hu8E5-S62A). Ниже описан указанный специфический способ:
(1) IGHV4-30*03 выбирали в качестве антитела-матрицы тяжелой цепи 8Е5; IGKV4-1*01 выбирали в качестве антитела-матрицы легкой цепи 8Е5. Участки CDR легкой цепи или тяжелой цепи антитела 8Е5 заменяют на участки CDR антитела-матрицы.
(2) Определяют сайты обратной мутации; в тяжелой цепи гуманизированного антитела (hu8E5) имеется шесть потенциальных сайтов обратных мутаций, а именно, G27Y, G45K, L46M, I49M, V68I, V72R, А97Т, соответственно. В легкой цепи гуманизированного антитела (hu8E5) имеется потенциальный сайт обратной мутации L84V.
(3) Разрабатывали последовательности нуклеотидов, синтезировали последовательность нуклеотидов легкой цепи и последовательность нуклеотидов тяжелой цепи на основе последовательности аминокислот гуманизированного антитела hu8E5.
Последовательность аминокислот тяжелой цепи hu8E5-S62A представлена в последовательности SEQ ID NO: 67; последовательность нуклеотидов представлена в последовательности SEQ ID NO: 68. Последовательность аминокислот легкой цепи hu8E5-S62A представлена в последовательности SEQ ID NO: 65; последовательность нуклеотидов представлена в последовательности SEQ ID NO: 66. Последовательность аминокислот вариабельной области тяжелой цепи hu8E5-S62A представлена в последовательности SEQ ID NO: 27, последовательность нуклеотидов представлена в последовательности SEQ ID NO: 28; последовательность аминокислот вариабельной области легкой цепи hu8E5-S62A представлена в последовательности SEQ ID NO: 25, последовательность нуклеотидов представлена в последовательности SEQ ID NO: 26; HCDR2 в hu8E5-S62A отличается от соответствующей последовательности 8Е5, представленной в последовательности SEQ ID NO: 85; другие последовательности HCDR и последовательность LCDR идентичны соответствующим последовательностям 8Е5.
(4) Последовательность нуклеотидов синтетического антитела, включающую сигнальный пептид, вариабельную область и константную область антитела, встраивают в экспрессионный вектор для клеток млекопитающих конструируя экспрессионный вектор с антителом, содержащий тяжелую цепь и легкую цепь, соответственно, секвенировали и идентифицировали. Транзиентно трансфицировали клетки 293F с применением реагента 293Fectin и осуществляли экспрессию.
(5) Тестировали связывающую активность и анализировали экспериментальные данные, используя клетки HEK293 (HEK-CLD18A2), стабильно экспрессирующие CLD18A2 человека, GraphPad Prism и инструмент Guava easyCyte™ HT System; результаты представлены на фиг. 6. Было показано, что относительная аффинность связывания scFv hu8E5 после слияния с Fc-частью IgG1 человека с клеткой HEK293, стабильно трансфицированной CLD18A2 человека, соответствовала 107 нМ.
Создавали трехмерную модель hu8E5 с помощью программного обеспечения Discovery studio и анализировали потенциальные сайты агрегации. Было обнаружено, что 12-й и 93-й валин тяжелой цепи склонны вызывать агрегацию антител, что, в свою очередь, влияет на стабильность антитела. При анализе точечных мутаций было обнаружено, что при мутации с заменой на I в указанных двух сайтах антитело было более стабильным. Результаты использования молекулярного сита показали, что после мутации с заменой на I в указанных двух сайтах (hu8E5-2I) доля мономерной формы слитого scFv_Fc-антитела увеличивалась с исходных 74% (hu8E5) до 87% (hu8E5-2I).
Последовательность аминокислот тяжелой цепи hu8E5-2I представлена в последовательности SEQ ID NO: 63; последовательность нуклеотидов представлена в последовательности SEQ ID NO: 64. Последовательность аминокислот легкой цепи hu8E5-2I представлена в последовательности SEQ ID NO: 65; последовательность нуклеотидов представлена в последовательности SEQ ID NO: 66. HCDR2 в hu8E5-2I отличается от соответствующей последовательности 8Е5, однако идентична соответствующей последовательности hu8E5, и ее последовательность представлена в последовательности SEQ ID NO: 85; другие последовательности HCDR и последовательность LCDR идентичны соответствующим последовательностям 8Е5.
Мутант hu8E5-2I гуманизированного антитела hu8E5 конструировали согласно описанию в примере 3. Анализировали экспериментальные данные, используя клетки HEK293 (HEK-CLD18A2), стабильно экспрессирующие человека CLD18A2, GraphPad Prism и инструмент Guava easyCyte™ HT System; результаты представлены на фиг. 7. Значение ЕС50 scFv hu8E5-2I после слияния с Fc-частью IgG1 человека, соответствующее относительной аффинности связывания с клеткой HEK293, стабильно трансфицированной CLD18A2 человека, составляло 9,22 нМ. По сравнению с исходным антителом 8Е5 аффинность мутанта hu8E5-2I была в 5 раз выше.
Пример 6. Функциональный анализ гуманизированного антитела hu2B1-S54A и гуманизированного антитела hu8E5-2I in vitro и in vivo
Гуманизированное антитело hu2B1-S54A (последовательность легкой цепи: SEQ ID NO: 62, последовательность тяжелой цепи: SEQ ID NO: 60); гуманизированное антитело hu8E5-2I (Последовательность легкой цепи: SEQ ID NO: 66, последовательность тяжелой цепи: SEQ ID NO: 64) клонировали в эукариотический экспрессионный вектор с применением стандартных способов, известных специалисту. Клетки 293F в логарифмической фазе роста транзиентно трансфицировали реагентом для трансфекции 293fectin™ (Invitrogen, 12347-019), собирали культуральный супернатант и подвергали аффинному очищению. Полученные антитела количественно и качественно анализировали с применением ДСН-ПААГ. Для описанного выше эукариотического экспрессионного вектора используют вектор рН или вектор pK согласно описанию в CN101602808B.
1. Комплементзависимая цитотоксичность (КЗЦ)
У здоровых добровольцев брали кровь и получали сыворотку путем центрифугирования. Использовали набор CCK-8 для анализа пролиферации клеток и токсичности (Dojindo, #CK04). Клетки HEK293, стабильно трансфицированные CLD18A2 или CLD18A1, использовали в качестве целевых клеток. Указанные клетки двукратно промывали, ресуспендировали в полной среде до плотности, составляющей 1×105 клеток/мл, высевали в 96-луночный культуральный планшет в объеме 100 мкл на лунку и культивировали в течение ночи при 37°С. На следующий день в каждую лунку добавляли антитело до конечной концентрации 20 мкг/мл, и инкубировали в течение 30 минут при 37°С в инкубаторе. Затем добавляли сыворотку в конечной концентрации 10% и инкубировали при 37°С в течение 1,5 часов. Добавляли по 10 мкл раствора CCK-8 в каждую лунку, инкубировали при 37°С в течение 3,5 часов (по мере необходимости условия корректировали) и измеряли поглощение при 450 нм на ридере для микропланшетов. В эксперименте использовали шесть групп и дублирующие лунки, как видно из таблицы ниже.
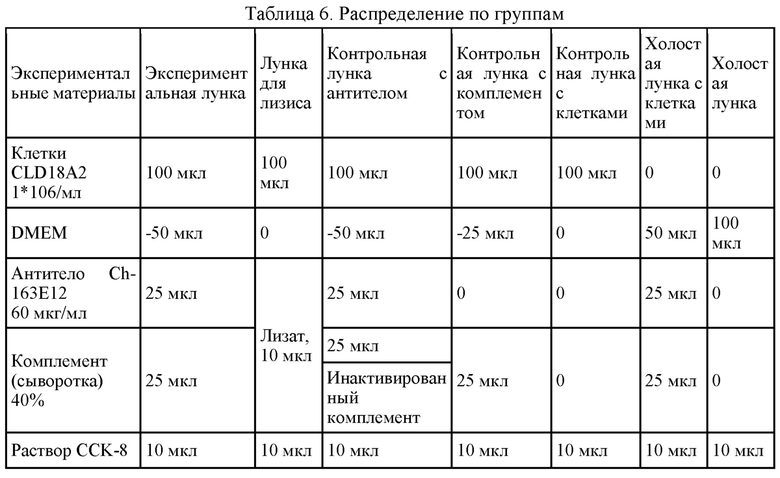
Процент лизиса вычисляют следующим образом:
Процент лизиса = (контрольная лунка с клетками - экспериментальная лунка) / контрольная лунка с клетками - (контрольная лунка с клетками - контрольная лунка с антителом) / контрольная лунка с клетками.
На фиг. 8А приведено сравнение КЗЦ-эффектов гуманизированных антител hu2B1-S54A, hu8E5-2I и химерного антитела ch-163E12 на клетки HEK293, трансфицированные CLD18A2. Результаты эксперимента показали, что при концентрации hu2B1-S54A и hu8E5-2I, равной 20 мкг/мл, КЗЦ-эффекты, направленные на HEK293-CLD18A2, составили 79,88% и 82,65%, соответственно, а КЗЦ-эффекты ch-163E12 при таких же условиях реакции были ниже 55%. На фиг. 8В приведено сравнение результатов для гуманизированных антител hu2B1-S54A, hu8E5-2I и химерного антитела ch-163E12 в отношении КЗЦ для клеток HEK293, трансфицированных CLD18A1. Эти результаты показали, что ch-163E12 также обеспечивало определенный уровень киллинга клеток, экспрессирующих 18А1, а под действием hu2B1-S54A и hu8E5-2I киллинг клеток, экспрессирующих 18А1, не происходил.
2. Антитело-зависимая цитотоксическая активность (АЗКЦ)
АЗКЦ-активность гуманизированного антитела к клаудину 18А2 измеряли с применением анализа высвобождения лактатдегидрогеназы (ЛДГ), используя набор для нерадиоактивного анализа цитотоксичности CytoTox 96 Non-Radioactive Cytotoxicity Assay (Promega, Мэдисон, США). Мононуклеарные клетки периферической крови (МКПК) человека очищали из цитрированной цельной крови, проводя стандартное разделение в градиенте фиколл-пак, и ресуспендировали в полной среде (культуральная среда RPMI-1640, Gibco) с добавлением 10% фетальной бычьей сыворотки (ФБС, Gibco) до плотности, составляющей 8×106 клеток/мл. Клетки HEK293, стабильно трансфицированные CLD18A2, использовали в качестве целевых клеток. Указанные клетки двукратно промывали и ресуспендировали в полной культуральной среде до плотности, составляющей 2×105 клеток/мл. МКПК инкубировали с антителом в конечной концентрации 20 мкг/мл в течение 30 минут при 37°С, а затем добавляли 50 мкл антитела и эффекторных клеток в 50 мкл целевых клеток, при отношении эффектор: мишень 50:1, 20:1, 10:1 (в общей сложности 1×104 целевых клеток). После инкубации в течение 4 часов при 37°С клетки центрифугировали, отбирали образец бесклеточного супернатанта объемом 50 мкл, переносили в плоскодонный 96-луночный планшет и анализировали. Процент лизиса рассчитывали следующим образом: (высвобождение из образца - спонтанное высвобождение из мишени - спонтанное высвобождение из эффекторных клеток) / (максимальное высвобождение - спонтанное высвобождение из мишени) * 100; где спонтанное высвобождение из мишени представлено флуоресценцией в лунках, содержащих только целевые клетки, спонтанное высвобождение из эффекторных клеток представлено флуоресценцией в лунках, содержащих только эффекторные клетки, и максимальное высвобождение представлено флуоресценцией в лунках, содержащих целевые клетки, которые были обработаны буфером для лизиса.
На фиг. 9 приведено сравнение АЗКЦ-эффектов гуманизированных антител hu2B1-S54A, hu8E5-2I и известных химерный антител ch-163E12, ch-175D10 (см. CN 103509110 А). Экспериментальные результаты показали, что гуманизированные антитела hu2B1-S54A и hu8E5-2I, при концентрации антител 20 мкг/мл и отношении эффектор: мишень 50:1, 20:1 и 10:1, демонстрировали значимо  АЗКЦ-эффекты по сравнению с ch-175D10 и ch-163E12; указанные АЗКЦ-эффекты, направленные против HEK293-CLD18A2, при отношении эффектор: мишень 50:1 составляли 62,84% и 72,88%, соответственно. При этом АЗКЦ-эффекты ch-163E12 и ch-175D10, направленные против HEK293-CLD18A2, при тех же условиях реакции составляли только 33,39% и 43,74%. Антитело согласно настоящему изобретению демонстрирует значимо лучшие киллинговые эффекты по сравнению с ch-163E12 и ch-175D10.
АЗКЦ-эффекты по сравнению с ch-175D10 и ch-163E12; указанные АЗКЦ-эффекты, направленные против HEK293-CLD18A2, при отношении эффектор: мишень 50:1 составляли 62,84% и 72,88%, соответственно. При этом АЗКЦ-эффекты ch-163E12 и ch-175D10, направленные против HEK293-CLD18A2, при тех же условиях реакции составляли только 33,39% и 43,74%. Антитело согласно настоящему изобретению демонстрирует значимо лучшие киллинговые эффекты по сравнению с ch-163E12 и ch-175D10.
3. Эксперимент in vivo на мышах
Получение PDX-модели рака желудка: Опухоли размером приблизительно 3 мм × 3 мм × 3 мм инокулировали подкожно в правую лодыжку мышей BALB/c nude. День инокуляции опухолевых клеток регистрировали как день DO, объем опухоли измеряли на день D27 от инокуляции опухоли, и мышей случайным образом разделяли на 5 групп. Формировали следующие специфические группы: (1) контрольная группа с ФСБ (фосфатный буфер) (2) группа лечения антителом hu8E5-2I (40 мг/кг); (3) группа лечения EOF (Е = эпирубицин: 1,25 мг/кг; О = оксалиплатин: 3,25 мг/кг; F = 5-фторурацил: 56,25 мг/кг) + ФСБ; (4) группа лечения антителом hu8E5-2I (40 мг/кг) + EOF (1,25 мг/кг эпирубицина + 3,25 мг/кг оксалиплатина + 56,25 мг/кг 5-фторурацила); (5) группа лечения антителом ch175D10 (40 мг/кг) + EOF (1,25 мг/кг эпирубицина + 3,25 мг/кг оксалиплатина + 56,25 мг/кг 5-фторурацила). Дозировка: EOF вводили один раз в неделю в течение 2 недель; антитела hu8E5-2I и ch175D10 вводили 3 раза в неделю в течение 2 недель.
Результаты представлены на фиг. 10. Опухоль инокулировали в течение D56 дней, EOF инъецировали дважды, антитело инъецировали 6 раз, мышей умерщвляли путем цервикальной дислокации. По сравнению с контрольной группой, получавшей ФСБ, показатели ингибирования опухоли составляли: 21,13% в группе моноклонального антитела hu8E5-2I, 47,89% в группе лечения EOF+ФСБ, 81,69% в группе лечения EOF+mAb hu8E5-2I, и 71,83% в группе лечения EOF+mAb 175D10, соответственно. По результатам взвешивания опухолей группа лечения EOF+mAb hu8E5-2I статистически отличалась от группы EOF+ФСБ, Р=0,033; тогда как группа лечения EOF+mAb 175D10 была статистически неотличима от группы EOF+ФСБ, Р=0,097.
Пример 7. Конструирование плазмиды с химерным антигенным рецептором для гуманизированного антитела (CAR-плазмиды)
1. Конструирование плазмиды с химерным антигенным рецептором для гуманизированного антитела hu8E5
С применением PRRLSIN-cPPT.EF-1α в качестве вектора конструировали лентивирусные плазмиды, кодирующие химерные антигенные рецепторы гуманизированного антитела hu8E5 второго и третьего поколения, в том числе PRRLSIN-cPPT.EF-1α-hu8E5-28Z, PRRLSIN-cPPT.EF-1α-hu8E5-BBZ и PRRLSIN-cPPT.EF-1α-hu8E5-28BBZ.
В основных чертах, Hu8E5-28Z включает (в направлении от 5'-конца к 3'-концу): кодирующую последовательность сигнального пептида CD8α (SEQ ID NO: 70), scFV hu8E5 (VH: SEQ ID NO: 27, VL: SEQ ID NO: 25, линкер: SEQ ID NO: 93), шарнир CD8 (SEQ ID NO: 72), трансмембранную область (SEQ ID NO: 74) и внутриклеточный сигнальный домен CD28 (SEQ ID NO: 76), а также внутриклеточный сегмент CD3ξ из CD3 (SEQ ID NO: 78).
В основных чертах, hu8E5-BBZ включает (в направлении от 5'-конца к 3'-концу): кодирующую последовательность сигнального пептида CD8α (SEQ ID NO: 70), scFV hu8E5 (VH: SEQ ID NO: 27, VL: SEQ ID NO: 25, линкер: SEQ ID NO: 93), шарнир CD8 (SEQ ID NO: 72), трансмембранную область CD8 (SEQ ID NO: 80), внутриклеточный сигнальный домен CD137 (SEQ ID NO: 82) и CD3ξ (SEQ ID NO: 78).
В основных чертах, hu8E5-28BBZ включает (в направлении от 5'-конца к 3'-концу): кодирующую последовательность сигнального пептида CD8α (SEQ ID NO: 70), hu8E5-scFV, CD8 шарнир (SEQ ID NO: 72), трансмембранную область (SEQ ID NO: 74) и внутриклеточный сегмент CD28 (SEQ ID NO: 76), внутриклеточный сигнальный домен CD137 (SEQ ID NO: 82) и CD3ξ (SEQ ID NO: 78).
2. Конструирование плазмиды с химерным антигенным рецептором для гуманизированного антитела hu8E5-2I
С применением PRRLSIN-cPPT.EF-1α в качестве вектора конструировали лентивирусную плазмида PRRLSIN-cPPT.EF-1α-hu8E5-2I-28Z, кодирующую химерные антигенные рецепторы второго поколения для гуманизированного антитела hu8E5.
В основных чертах, hu8E5-2I-28Z включает (в направлении от 5'-конца к 3'-концу): кодирующую последовательность сигнального пептида CD8α (SEQ ID NO: 70), hu8E5-2I scFV (VH: SEQ ID NO: 29, VL: SEQ ID NO: 25, линкер: SEQ ID NO: 93), шарнир CD8 (SEQ ID NO: 72), трансмембранную область (SEQ ID NO: 74) и внутриклеточный сигнальный домен CD28 (SEQ ID NO: 76); и внутриклеточный сигнальный домен CD3ξ из CD3 (SEQ ID NO: 78).
3. Конструирование плазмиды с химерным антигенным рецептором для гуманизированного антитела hu2B1-S54A
С применением PRRLSIN-cPPT.EF-1α в качестве вектора конструировали лентивирусную плазмиду PRRLSIN-cPPT.EF-1α-hu2B1-S54A-28Z, кодирующую химерные антигенные рецепторы второго поколения для гуманизированного антитела hu2B1-S54A.
В основных чертах, hu2B1-S54A-28Z включает (в направлении от 5'-конца к 3'-концу): кодирующую последовательность сигнального пептида CD8α (SEQ ID NO: 70), scFV hu2B1-S54A (VH: SEQ ID NO: 23; VL: SEQ ID NO: 21; линкер: SEQ ID NO: 93), шарнир CD8 (SEQ ID NO: 72), трансмембранную область (SEQ ID NO: 74) и внутриклеточный сегмент CD28 (SEQ ID NO: 76); и внутриклеточный домен CD3Z из CD3 (SEQ ID NO: 78).
Пример 8. Лентивирусная упаковка и определение титра
Клетки 293Т, культивированные до 6-10 пересева, инокулировали при плотности вируса 5×106 в культуральную чашку диаметром 10 см, и культивировали в течение ночи при 37°С, 5% CO2 для трансфекции; использовали среду DMEM с 10% фетальной бычьей сыворотки (Gibco).
Плазмиду с целевым геном PRRLSIN-cPPT.EF-1α-EGFP (проверочную) и другие CAR-плазмиды, полученные согласно примеру 9 (5,4 мкг), а также упаковочную плазмиду pRsv-REV (6,2 мкг), RRE-PMDLg (6,2 мкг) и Vsvg (2,4 мкг) растворяли в 800 мкл холостой среды DMEM; 60 мкг ПЭИ (1 мкг/мкл) растворяли в 800 мкл не содержащей сыворотки среды DMEM и перемешивали в течение 5 минут при комнатной температуре.
Смесь с плазмидами добавляли в смесь с ПЭИ и перемешивали в течение 20 минут при комнатной температуре с получением комплекса для трансфекции; 1,6 мл комплекса для трансфекции добавляли по каплям в культуральную чашку диаметром 10 см, содержащую 11 мл среды DMEM; через 4-5 часов среду для трансфицированных клеток 293Т заменяли на DMEM с 10% ФБС и инкубировали при 37°С в течение 72 ч. Супернатант с вирусами собирали, концентрировали и определяли титр. Число клеток с коэффициентом позитивности 5-20% было предпочтительным; титр (Ед/мл) рассчитывали по формуле: число клеток × коэффициент позитивности / объем вируса.
После концентрации титры вируса составляли:
hu8E5-28Z: 2,3×107 Ед/мл;
hu8E5-BBZ: 6,65×107 Ед/мл;
hu8E5-28BBZ: 6,67×107 Ед/мл;
hu8E5-2I-28Z: l,54×108 Ед/мл;
hu2B1-S54A-28Z: 1,14×108 Ед/мл.
Пример 9. Анализ цитотоксичности трансдуцированных лентивирусами Т-лимфоцитов и CAR-T-клеток
1. Инфицированные лентивирусом Т-лимфоциты
(1) Лимфоциты культивировали с плотностью, составляющей приблизительно 1×106/мл, добавляли покрытые антителами к CD3 и CD28 магнитные гранулы (Invitrogen) до соотношения магнитных гранул : клеток 1:1, и рекомбинантный ИЛ-2 человека в конечной концентрации 300 Ед/мл для стимуляции, и культивировали в течение 48 ч;
(2) Покрытые ретронектином 24-луночные планшеты: 380 мкл раствора 5 мкг/мл ретронектина (ФСБ) добавляли в каждую лунку; после инкубации при 4°С в течение ночи раствор ретронектина (ФСБ) в 24-луночном планшете утилизировали, и двукратно промывали 1 мл ФСБ;
(3) Клетки высевали в 24-луночный планшет, покрытый ретронектином. Число клеток на лунку составляло 3×105, объем культурального раствора - 600 мкл. Концентрированный лентивирус добавляли в клетки МКПК при множественности инфекции (MOI)=10, центрифугировали при 32°С в течение 40 минут и переносили в инкубатор для клеточных культур;
(4) Размножение в культуре: Инфицированные клетки пересевали один раз в два дня при плотности 5×105/мл; в раствор культуры лимфоцитов добавляли рекомбинантный ИЛ-2 человека в конечной концентрации 300 Ед/мл.
2. Экспрессия химерного антигенного рецептора Т-лимфоцитами
(1) На 7 день культивирования инфицированных лентивирусом Т-лимфоцитов отбирали 1×106 Т-клеток, помещали аликвоту в пробирку для центрифугирования объемом 2 мл, центрифугировали при 4°С, 5000 об/мин в течение 5 минут, утилизировали супернатант и двукратно промывали ФСБ.
(2) К контрольным клеткам добавляли 50 мкл ФЭ-СА (разведение 1:200) антитела и инкубировали в течение 45 минут на льду, двукратно промывали ФСБ (2% NBS), и ресуспендировали в качестве контроля; к клеткам в экспериментальной группе добавляли 50 мкл разведенного 1:50 биотинилированного F(ab')2 антитела козы против IgG человека, инкубировали на льду в течение 45 минут; двукратно промывали ФСБ (2% NBS).
(3) Добавляли 50 мкл ФЭ-СА (разведение 1:200) антитела и инкубировали в течение 45 минут на льду; к клеткам добавляли 2 мл ФСБ (2% NBS) для ресуспендирования и утилизировали супернатант после центрифугирования.
(4) Долю CAR-положительных Т-клеток детектировали с помощью проточной цитометрии. Коэффициенты позитивности инфекции для трех типов CAR Т-клеток, hu8E5-28Z, hu8E5-BBZ и hu8E5-28BBZ и проверочных контрольных клеток составили 52,1%, 47,8%, 44,6% и 71,7%, соответственно.
3. Анализ цитотоксичности нацеленных на CLD18A2 CAR-Т-клеток
(1) Целевые клетки: инокулировали, соответственно, по 75 мкл клеток 293Т-А1, 293Т-А2, клеток линии аденокарциномы желудка AGS, AGS-A2, клеток линий рака желудка BGC-823 и BGC-823-A2 с плотностью 2×105/мл. Линию клеток аденокарциномы желудка AGS, линию клеток рака желудка BGC-823 приобретали в банке клеток АТСС; клетки 293Т-А1, клетки 293Т-А2, клетки AGS-A2, BGC-823-A2 конструировали согласно описанию в CN101602808B, при этом клетки 293Т-А2, AGS-A2 и клетки BGC-823-A2 представляли собой CLD18A2-положительные клетки, а остальные представляли собой CLD 18А2-отрицательные клетки.
(2) Эффекторные клетки: Проверочные Т-клетки и CAR-T-клетки, экспрессирующие разные химерные антигенные рецепторы, добавляли в отношении эффектор: мишень 3:1, 1:1 или 1:3;
(3) Использовали 4 дублирующих лунки для каждой группы, и определяли среднее значение для 4 лунок-репликатов. Время детекции составляло 18 ч.
Каждая экспериментальная группа и каждая контрольная группа были составлены следующим образом:
Каждая экспериментальная группа: каждая целевая клетка + CAR-T-клетки, экспрессирующие разные химерные антигенные рецепторы;
Контрольная группа 1: максимальное высвобождение ЛДГ из целевых клеток;
Контрольная группа 2: спонтанное высвобождение ЛДГ из целевых клеток;
Контрольная группа 3: спонтанное высвобождение ЛДГ из эффекторных клеток;
(4) Способ детекции: использовали набор для нерадиоактивного тестирования цитотоксичности CytoTox 96 (Promega). Анализ CytoTox 96® позволяет проводить количественное определение лактатдегидрогеназы (ЛДГ), в частности, опираясь на инструкции к набору CytoTox 96 Non-Radioactive Cytotoxicity Assay Kit.
(5) Формула расчета цитотоксичности:
Цитотоксичность % = (Экспериментальная группа - контрольная группа 2 - контрольная группа 3) / (Контрольная группа 1 - контрольная группа 2) * 100%
Результаты киллинга клеток при разном отношении эффекторов к мишени представлены на фиг. 11 и фиг. 12. Результаты показали, что CAR-T-клеточные продукты демонстрируют хорошо выраженные киллинговые эффекты в отношении клеток 293Т-А2, AGS-A2 и BGC-823-A2, положительных по экспрессии CLD18A2. Среди них hu8E5-28Z и hu8E5-2I-28Z клетки могут обеспечивать киллинг более чем 60% клеток AGS-A2 клетки при отношении эффектор: мишень 3:1; в отношении клеток BGC-823-A2 киллинговые эффекты могут превышать 90%. В то же время, эти результаты также показали, что никакие из CAR-T-клеток (за исключением Hu2B1-S54A-28Z) не оказывали очевидных киллинговых эффектов на клетки, отрицательные по экспрессии CLD18A2.
Пример 10. Активность CLD18A2 CAR-T-клеток in vivo
Проводили эксперименты с противоопухолевым лечением нетрансфицированными Т-клетками (UTD) и Т-клетками hu8E5-2I-28Z подкожно трансплантированных опухолей в PDX-модели рака желудка.
1) Получение PDX-модели рака желудка: PDX-опухоль рака желудка размером приблизительно 2×2×2 мм инокулировали в правую подмышечную область самкам мышей NOD/SCID возрастом 6-8 недель; день инокуляции опухолевых клеток регистрировали как день D0.
2) Экспериментальная группа: Опухоли инокулировали в течение 15 дней, и мышей NOD-SCID случайным образом разделяли на 3 группы по 7 мышей в каждой, группу нетрансфицированных Т-клеток и группу Т-клеток hu8E5-2I-28Z.
3) Адоптивный перенос Т-клеток: когда объем опухоли достигал 30 мм3, внутрибрюшинно инъецировали 100 мг/кг циклофосфамида и инфузировали 1,0×107 CAR-Т-клеток через хвостовую вену через 24 часа после инъекции; в качестве контроля использовали группы, получавшие нетрансфицированные Т-клетки. Рост подкожных PDX-ксенотрансплантатов рака желудка наблюдали и измеряли. Результаты эксперимента показаны на фиг. 13А и 13В. На день D32 после инъекции CAR-T мышей умерщвляли путем цервикальной дислокации. По сравнению с группой UTD противоопухолевый эффект в группе лечения hu8E5-2I-28Z был значимым, и уровень ингибирования составлял 79,2%. По результатам взвешивания опухолей группа лечения hu8E5-2I-28Z статистически отличалась от группы UTD, P=0,01.
Пример 11. Анализ индуцированного высвобождения цитокинов CLD18A2 CAR-Т-клетками in vitro
Для верификации возможности эффективной активации сконструированных Т-клеток hu8E5-28Z и hu8E5-2I-28Z при стимуляции целевыми клетками авторы изобретения исследовали секрецию цитокинов Т-клетками hu8E5-28Z и hu8E5-2I-28Z после совместной инкубации с целевыми клетками.
Соответственно, детектировали цитокины, высвобождаемые трансфицированными Т-клетками (проверочными), Т-клетками hu8E5-28Z и hu8E5-2I-28Z. Описанные выше активно растущие Т-клетки двух типов собирали в пределах 1-2 недель после инфицирования лентивирусом и инокулировали 24-луночный планшет с плотностью 5×104/200 мкл (число положительных клеток); инокулировали 5×104/200 мкл/24 лунки целевых клеток с отношением эффектор: мишень, равным 1:1. Целевые клетки включают клетки 293Т-А1, 293Т-А2, AGS, AGS-A2, BGC-823 и BGC-823-A2. Супернатант собирали через 24 часа совместного культивирования. Метод сэндвич-анализа ELISA применяли для детекции в супернатанте ИЛ-2, ИФН-γ и ФНО-α, высвобождаемых при совместном культивировании CAR Т-лимфоцитов с целевыми клетками.
Результаты эксперимента показаны на фиг. 14. Результаты показали, что при инкубации hu8E5-28Z, hu8E5-2I-28Z с CLD18A2-положительными клетками 293Т-А2, AGS-A2 и BGC-823-A2 была активирована секреция цитокинов ИЛ-2, ИФН-γ и ФНО-α, тогда как в проверочной контрольной группе секреция указанных цитокинов может не активироваться и наблюдаются значимые отличия; при инкубации hu8E5-2I-28Z с клетками 293Т-А1, AGS и BGC-823, отрицательными по экспрессии CLD18A2, может не происходить активация секреции цитокинов ИЛ-2, ИФН-γ и ФНО-α; также активация секреции описанных выше цитокинов может не происходить и в проверочной контрольной группе. Описанные выше экспериментальные результаты показывают, что клетки, положительные по экспрессии CLD18A2, могут эффективно активировать CAR-T-клетки hu8E5-2I-28Z.
Пример 12. Киллинговая активность CLD18A2 CAR-T-клеток in vivo
Проводили эксперименты с противоопухолевым лечением нетрансфицированными Т-клетками (проверочными), Т-клетками hu8E5-28Z и hu8E5-2I-28Z подкожных ксенотрансплантатов клеток BGC-823-A2.
1) Инокуляция подкожных ксенотрансплантатов BGC-823-A2: плотность клеток BGC-823-A2, собранных в логарифмической фазе роста и хорошо растущих, доводили до 2,5×107/мл с применением физиологического солевого раствора, и объем суспензии клеток (200 мкл, 5×106/животное) инъецировали подкожно в правый бок мыши. День инокуляции опухолевых клеток регистрировали как день 0.
2) Экспериментальные группы: На 11-й день после инокуляции опухоли измеряли объем опухоли BGC-823-A2, и мышей NOD-SCID случайным образом разделяли на 3 группы по 6 мышей в каждой. Группы были представлены группой нетрансфицированных Т-клеток, Т-клеток hu8E5-28Z и Т-клеток hu8E5-2I-28Z, соответственно.
3) Адоптивный перенос Т-клеток: когда объем опухоли достигал 100-150 мм3 (день 11), внутрибрюшинно инъецировали 100 мг/кг циклофосфамида и инфузировали 1×107 CAR-T-клеток (проверочные клетки, Т-клетки hu8E5-28Z или Т-клетки hu8E5-2I-28Z) через хвостовую вену через 24 часа после инъекции; группу нетрансфицированных Т-клеток (проверочные группа) использовали в качестве контроля для наблюдения роста подкожных ксенотрансплантатов.
Результаты экспериментов на животных представлены на фиг. 15. Результаты показали, что на 17-й день лечения CAR-T-клетками hu8E5-28Z и hu8E5-2I-28Z показатели ингибирования ксенотрансплантированных опухолей BGC-823-A2 составили 81,3% и 89,2%, соответственно; и что имелись значимые различия терапевтических эффектов на ксенотрансплантаты BGC-823-A2 между группами лечения hu8E5-28Z, hu8E5-2I-28Z и проверочной контрольной группой. После 17 дня лечения мышей умерщвляли, опухоли извлекали и взвешивали. Средняя масса трансплантированных опухолей BGC-823-A2 в группах лечения hu8E5-28Z и hu8E5-2I-28Z составляла 0,1 и 0,06 г, соответственно, тогда как в проверочной контрольной группе средняя масса опухолей составляла 0,53 г, и имелись значимые различия между группой лечения CAR-T-клетками и проверочной контрольной группой, при Р-значениях 0,0013 и <0,0001, соответственно.
Пример 13. Эффект CLD18A2 CAR-T клеток на инфильтрацию опухоли in vivo
Используя модель с подкожным ксенотрансплантатом клеток BGC-823-A2 на животных согласно описанию в примере 12, через 17 дней после реинфузии проверочных клеток, hu8E5-28Z, и hu8E5-2I-28Z отбирали ткани опухоли и иммуногистохимически детектировали CD3+ клетки.
Результаты показаны на фиг. 16. Вокруг опухолевой ткани в проверочной группе Т-клеток практически не наблюдалось инфильтрации Т-клетками; в группах клеток hu8E5-28Z и hu8E5-2I-28Z можно наблюдать инфильтрацию CD3+ Т-клетками на границах опухолевой ткани; более выраженная инфильтрацию Т-клетками можно наблюдать на границах опухолевой ткани в группе лечения hu8E5-2I-28Z.
Пример 14. Получение CAR-T-клеток, коэкспрессирующих ИФН
В соответствии с процедурой из примеров 7-9 конструировали плазмиду с CAR hu8E5-28Z-IFNb, экспрессирующую цитокин ИФН-γ (IFNb), на основе hu8E5-28Z, и CAR-плазмиду hu8E5-2I-28Z-IFN, которая может экспрессировать цитокин ИФН-γ, на основе CAR hu8E5-2I-28Z; после упаковки и инфицирования клеток с помощью лентивируса получали CAR-T-клетки hu8E5-28Z-IFNb, коэкспрессирующие ИФН-γ (также обозначаемые hu8E5-28Z&IFNB) и CAR-T-клетки hu8E5-2I-28Z-IFN, коэкспрессирующие ИФН-γ (также обозначаемые hu8E5-2I-28Z&IFNB). CAR hu8E5-28Z-IFNb кодирует последовательность нуклеотидов SEQ ID NO: 90; CAR hu8E5-2I-28Z-IFN кодирует последовательность нуклеотидов SEQ ID NO: 91.
В соответствии с процедурой из примера 11 проводили in vitro анализ индукции высвобождения цитокинов. Результаты представлены на фиг. 17А; присутствие ИФН приводило к увеличению секреции цитокина ИФН-γ при совместной инкубации CAR-T-клеток hu8E5-28Z с целевыми клетками.
Проводили эксперименты с противоопухолевым лечением нетрансфицированными Т-клетками (UTD), Т-клетками hu8E5-28Z и Т-клетками hu8E5-2I-28Z-IFN подкожных ксенотрансплантатов в PDX-модели рака желудка. PDX-опухоль рака желудка размером приблизительно 2×2×2 мм инокулировали подкожно в правую подмышечную впадину 6-8 недельным самкам мышей NOD/SCID, и день инокуляции опухолевых клеток регистрировали как день D0. На день D15 после инокуляции опухоли мышей NOD-SCID случайным образом разделяли на 3 группы по 7 мышей в каждой, группу нетрансфицированных Т-клеток, группу Т-клеток hu8E5-28Z и группу Т-клеток hu8E5-2I-28Z-IFN. После достижения опухолью объема 30 мм3 внутрибрюшинно инъецировали 100 мг/кг циклофосфамида и инфузировали 1,0×107 CAR-T-клеток (Т-клетки hu8E5-28Z или Т-клетки hu8E5-2I-28Z-IFN) через хвостовую вену через 24 часа после инъекции. Одновременно в качестве контроля использовали группу, получавшую нетрансфицированные Т-клетки. Рост подкожных PDX-ксенотрансплантатов рака желудка наблюдали и измеряли. Результаты показаны на фиг. 17В; у одной из 7 мышей в получавшей лечение hu8E5-2I-28Z-IFN группе наблюдался полный регресс опухоли.
Выживание CAR-T-клеток in vivo оценивали с применением PDX-модели, описанной выше. Периферическую кровь собирали из подкожной вены мышей на дни D5, D7 и D10 после инфузии CAR-T, и детектировали выживание in vivo CAR-T-клеток (холостых Т-клеток (проверочных), Т-клеток hu8E5-28Z или Т-клеток hu8E5-2I-28Z-IFN). Результаты представлены на фиг. 17С; количество выживших Т-клеток в получавшей лечение Т-клетками hu8E5-2I-28Z-IFN группе было значимо выше, чем в группе лечения Т-клетками hu8E5-28Z-28Z.
Пример 15. Конструирование клетки CAR-NK
Как показано на плазмидных картах на фиг. 18А и 18В, с применением PRRLSIN-cPPT.EF-1α в качестве вектора конструировали лентивирусные плазмиды, кодирующие химерные антигенные рецепторы гуманизированного антитела hu8E5, в том числе PRRLSIN-cPPT.EF-1α-hu8E5-28BBZ и PRRLSIN-cPPT.EF-1α-hu8E5-2I-28Z. Последовательность hu8E5-28BBZ состоит из сигнального пептида CD8α (SEQ ID NO: 70), hu8E5-scFV, шарнира CD8 (SEQ ID NO: 72), трансмембранной области (SEQ ID NO: 74) и внутриклеточного сегмента CD28 (SEQ ID NO: 76).), сегмента внутриклеточного сигнального домена CD137 (SEQ ID NO: 82) и CD3ξ (SEQ ID NO: 78); и последовательность hu8E5-2I-28Z состоит из сигнального пептида CD8α (SEQ ID NO: 70), scFV hu8E5-2I, шарнира CD8 (SEQ ID NO: 72), трансмембранной области CD28 (SEQ ID NO: 74) и внутриклеточного сигнального домена CD28 (SEQ ID NO: 76) и внутриклеточного сегмента CD3ξ из CD3 (SEQ ID NO: 78).
1. Получение car-положительной линии клеток NK-92
1) Покрытые ретронектином 24-луночные планшеты: 380 мкл раствора ретронектина 5 мкг/мл (ФСБ) добавляли в каждую лунку и инкубировали при 4°С в течение ночи. Клетки высевали в 24-луночный планшет, покрытый ретронектином. Число клеток на лунку составляло 5×105, объем культурального раствора -500 мкл;
2) Концентрированный лентивирус добавляли в клетки NK92 при MOI=30, центрифугировали при 32°С в течение 90 минут и переносили в инкубатор для клеточных культур;
3) Размножение в культуре: Инфицированные клетки пересевали раз в два дня с плотностью, составляющей 5×105/мл; в раствор культуры лимфоцитов добавляли рекомбинантный ИЛ-2 человека в конечной концентрации 500 Ед/мл.
2. Экспрессия химерного антигенного рецептора клетками NK-92
(1) На 7 день культивирования инфицированных лентивирусом клеток NK92 отбирали 1×106 клеток, помещали аликвоту в пробирку для центрифугирования объемом 2 мл;
(2) К контрольным клеткам добавляли 50 мкл ФЭ-СА (разведение 1:200) антитела, инкубировали на льду и ресуспендировали в качестве контроля; к клеткам в экспериментальной группе добавляли 50 мкл разведенного 1:50 биотинилированного F(ab')2 антитела козы против IgG человека, инкубировали на льду в течение 45 минут; двукратно промывали ФСБ (2% NBS); добавляли 50 мкл ФЭ-СА (разведение 1:200) антитела и инкубировали на льду;
(3) добавляли 2 мл ФСБ (2% NBS) для ресуспендирования клеток; супернатант утилизировали после центрифугирования при 4°С; добавляли 500 мкл ФСБ (2% NBS) и переносили в пробирку для проточной цитометрии. С помощью проточной цитометрии детектировали канал ФЭ для определения доли CAR-положительных клеток NK92. Результаты представлены на фиг. 19.
Анализ цитотоксичности: Целевые клетки: 104 клеток AGS, AGS-A2, BGC-823, BGC-823-A2 инокулировали в 96-луночные планшеты, соответственно; Эффекторные клетки: добавляли клетки NK92 и CAR NK92 в отношении эффектор : мишень 6:1, 3:1 или 1,5:1; использовали 5 дублирующих лунок для каждой группы; определяли среднее значение для 5 лунок-репликатов. Время детекции составляло 4 ч. Каждая экспериментальная группа и каждая контрольная группа были составлены следующим образом:
Каждая экспериментальная группа: каждая целевая клетка + описанные выше Эффекторные клетки; контрольная группа 1: максимальное высвобождение ЛДГ из целевых клеток; контрольная группа 2: спонтанное высвобождение ЛДГ из целевых клеток; и контрольная группа 3: спонтанное высвобождение ЛДГ из эффекторных клеток.
Способ детекции: использовали набор для нерадиоактивного тестирования цитотоксичности CytoTox 96 (Promega), в частности, опираясь на инструкции к набору CytoTox 96 Non-Radioactive Cytotoxicity Assay Kit. Формула расчета цитотоксичности:
Цитотоксичность % = (Экспериментальная группа - контрольная группа 2 - контрольная группа 3) / (Контрольная группа 1 - контрольная группа 2) * 100%
Результаты представлены на фиг. 20 и 21, где hu8E5-21-28Z представляют собой клетки hu8E5-2I-28Z CAR-NK92 и hu8E5-28BBZ представляют собой клетки hu8E5-28BBZ CAR-NK92. Результаты показали, что клетки hu8E5 CAR-NK92 обладали значимой киллинговой активностью in vitro в отношении клеток, сверхэкспрессирующих CLDN18A2, и практически отсутствующей киллинговой токсичностью в отношении CLDN18A2-отрицательных клеток.















| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К IL-13RA2 И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2756623C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ К КАППА-АНТИГЕНУ МИЕЛОМЫ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2743188C2 |
| АНТИТЕЛО К CLDN18.2 И ЕГО ПРИМЕНЕНИЯ | 2018 |
|
RU2797709C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ НЕКТИНА-2 ЧЕЛОВЕКА | 2020 |
|
RU2820275C2 |
| АНТИГЕННЫЙ РЕЦЕПТОР | 2020 |
|
RU2832189C2 |
| GD2-СВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2020 |
|
RU2824670C2 |
| ОПУХОЛЕСПЕЦИФИЧНОЕ АНТИТЕЛО ПРОТИВ EGFR И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2730605C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ К CD22 | 2012 |
|
RU2644243C2 |
| КОНСТИТУТИВНО АКТИВНЫЕ ХИМЕРНЫЕ ЦИТОКИНОВЫЕ РЕЦЕПТОРЫ | 2020 |
|
RU2824672C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К НЕКТИНУ-4 ЧЕЛОВЕКА | 2019 |
|
RU2825839C2 |

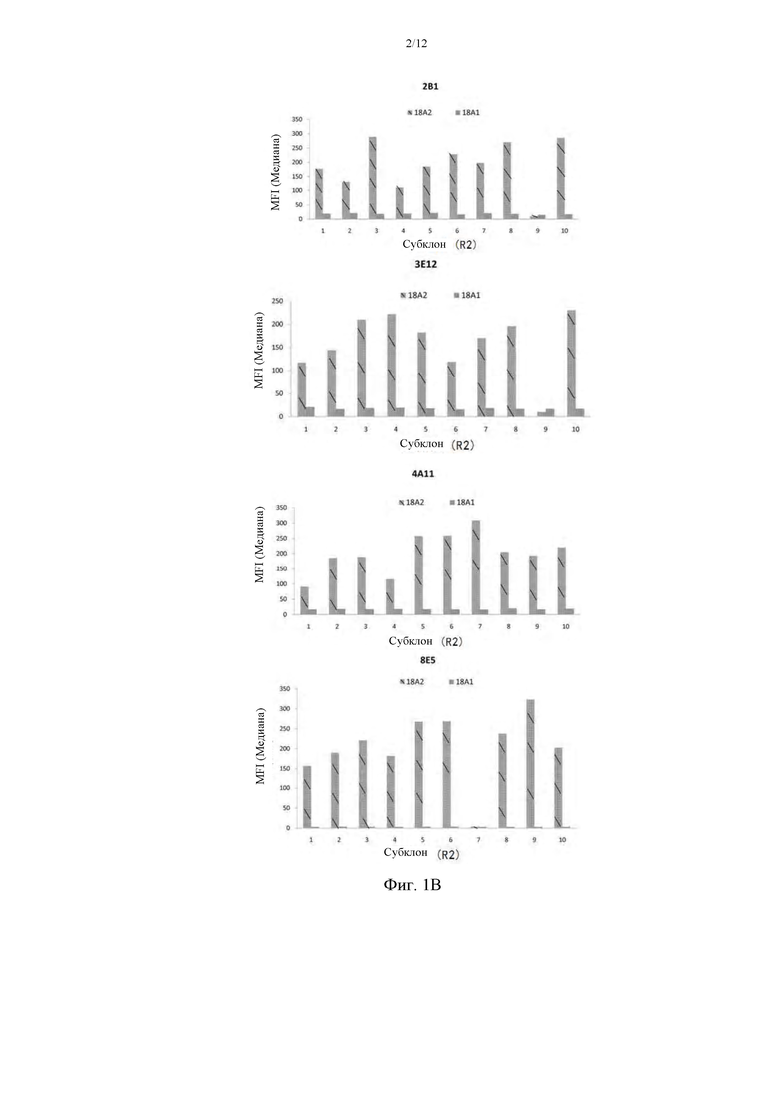
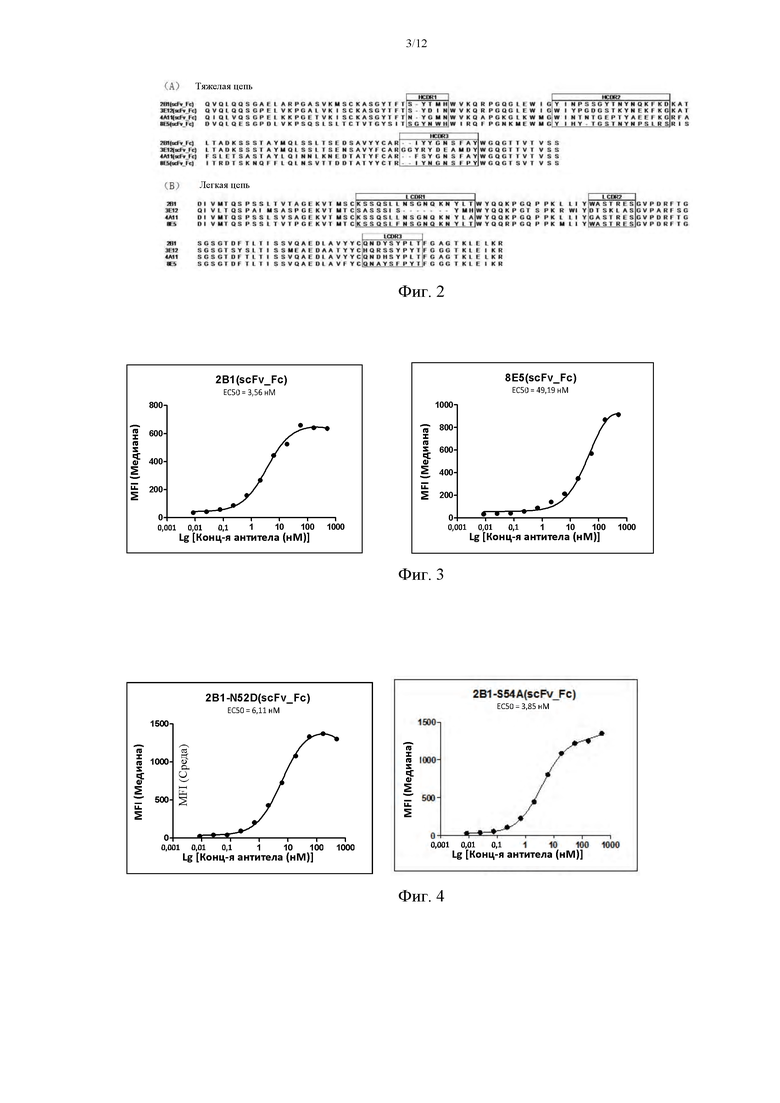
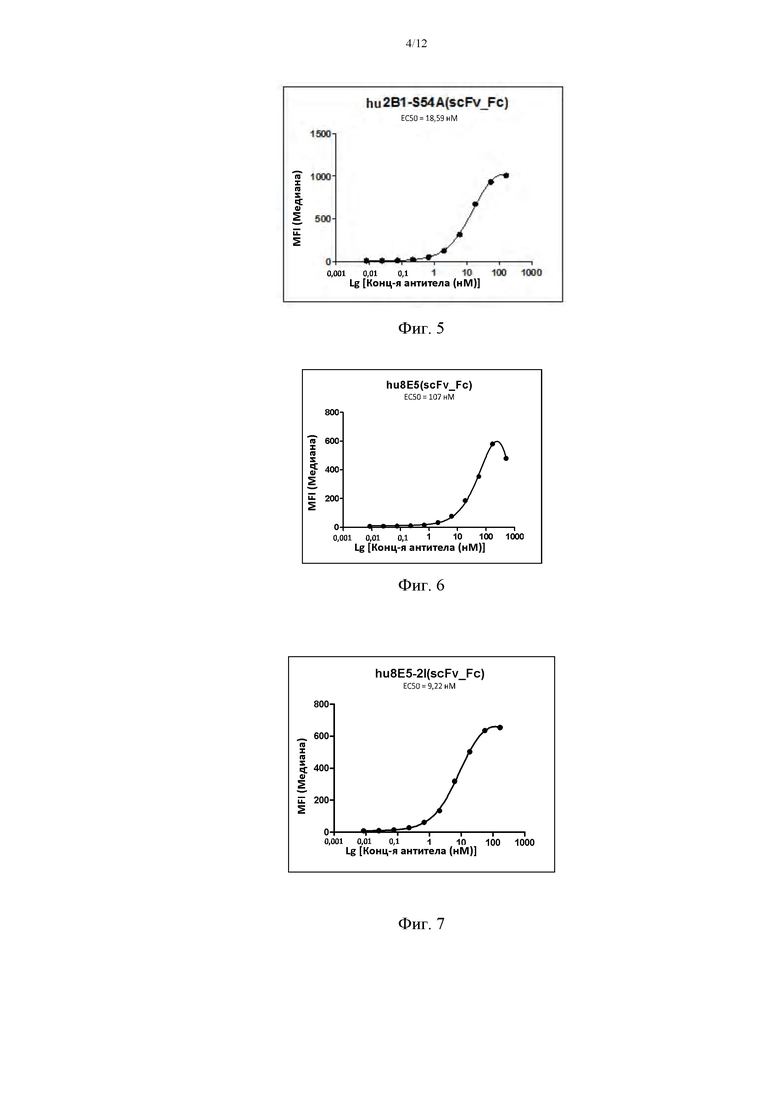
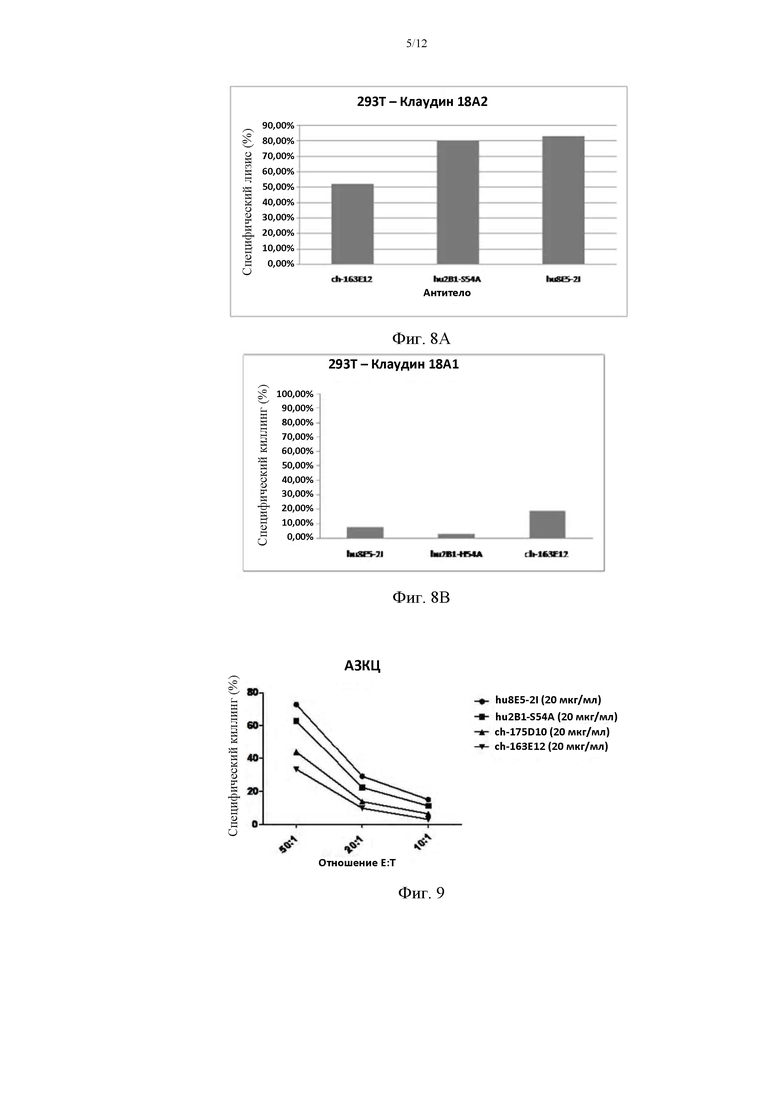
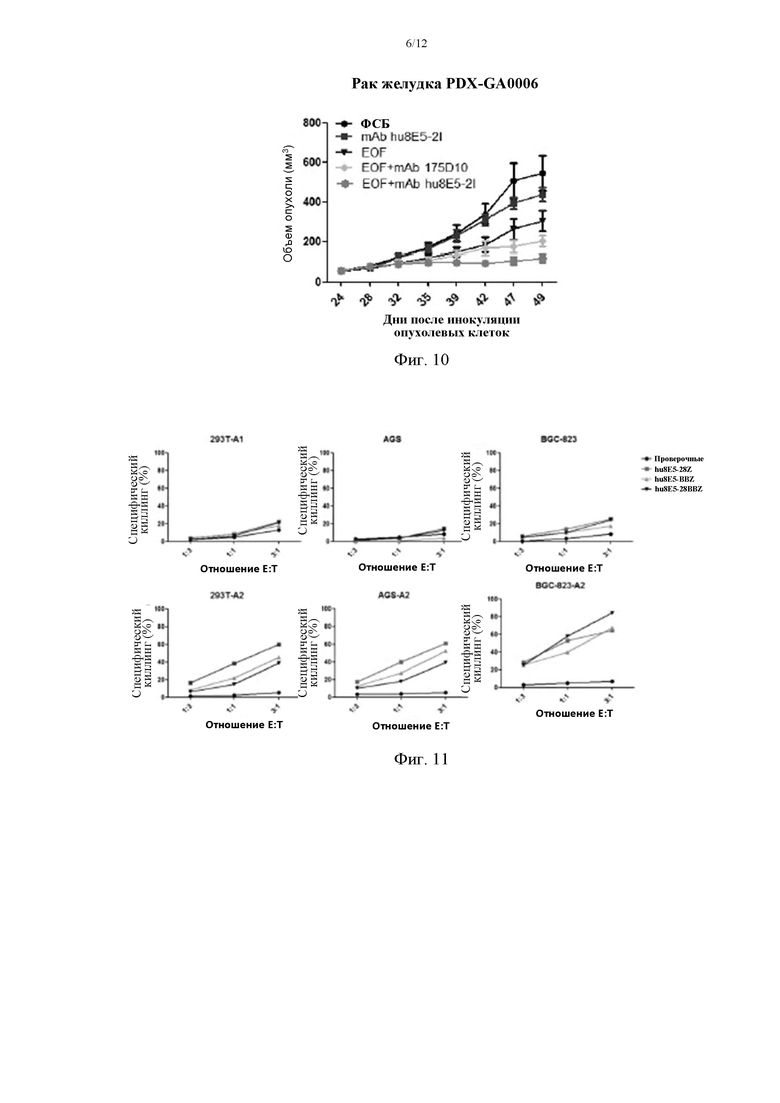
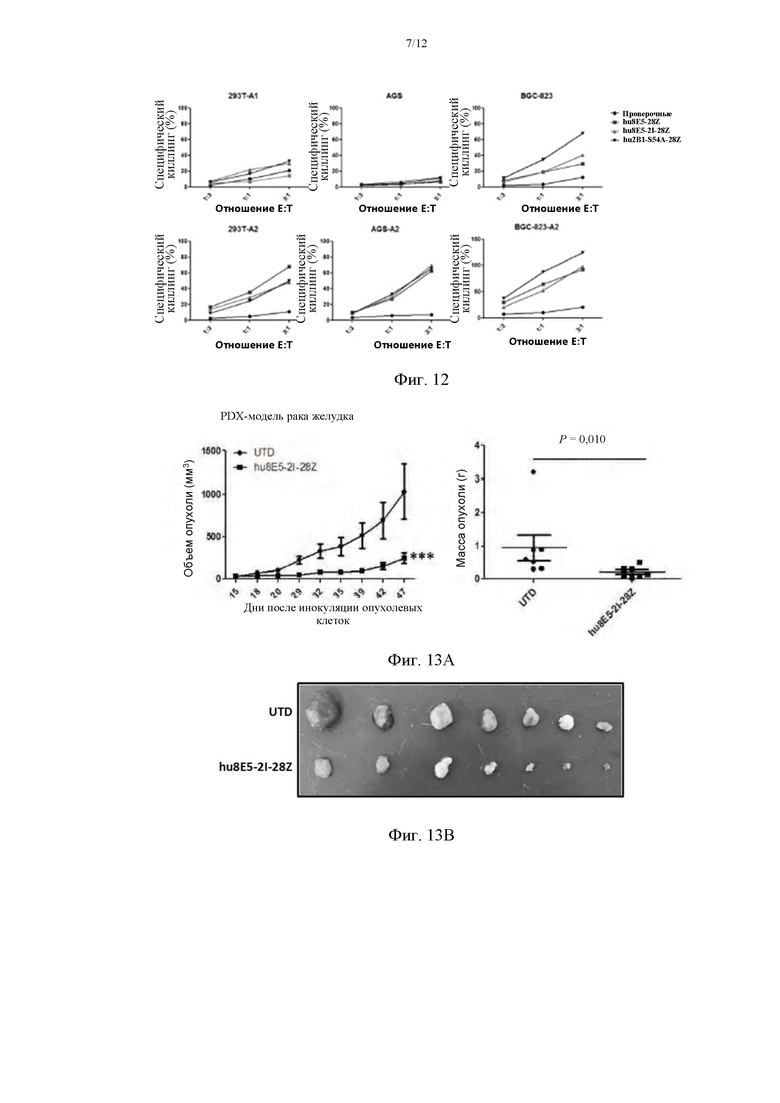
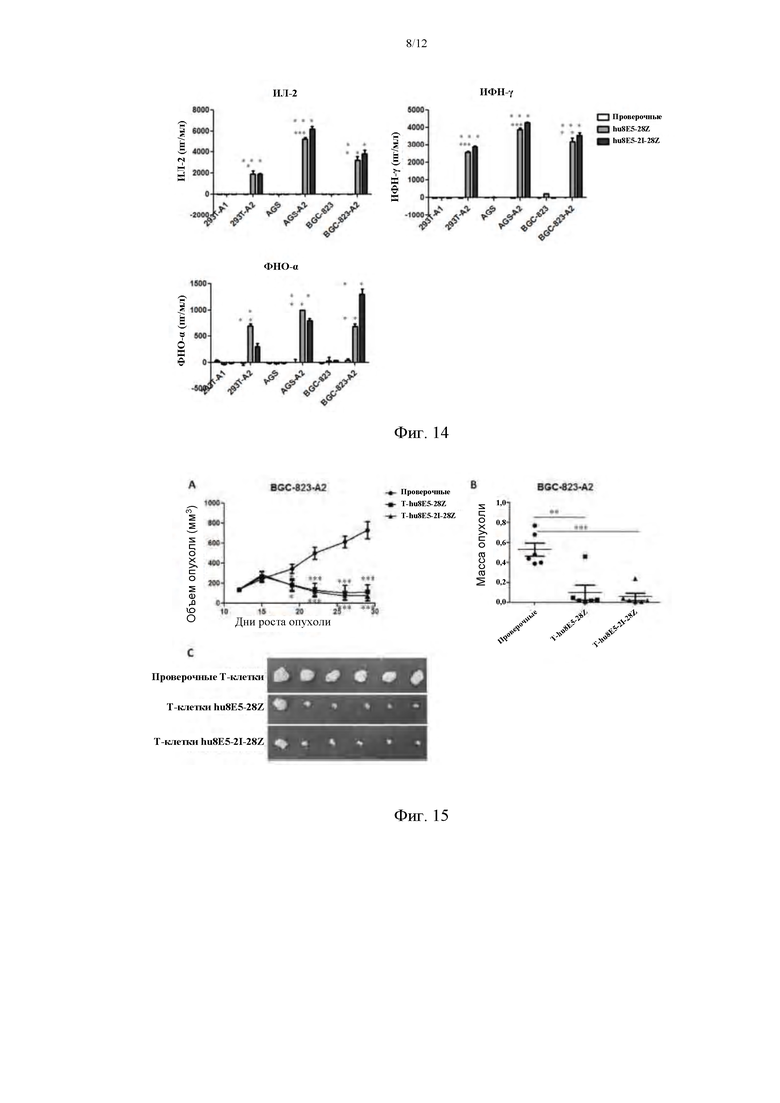
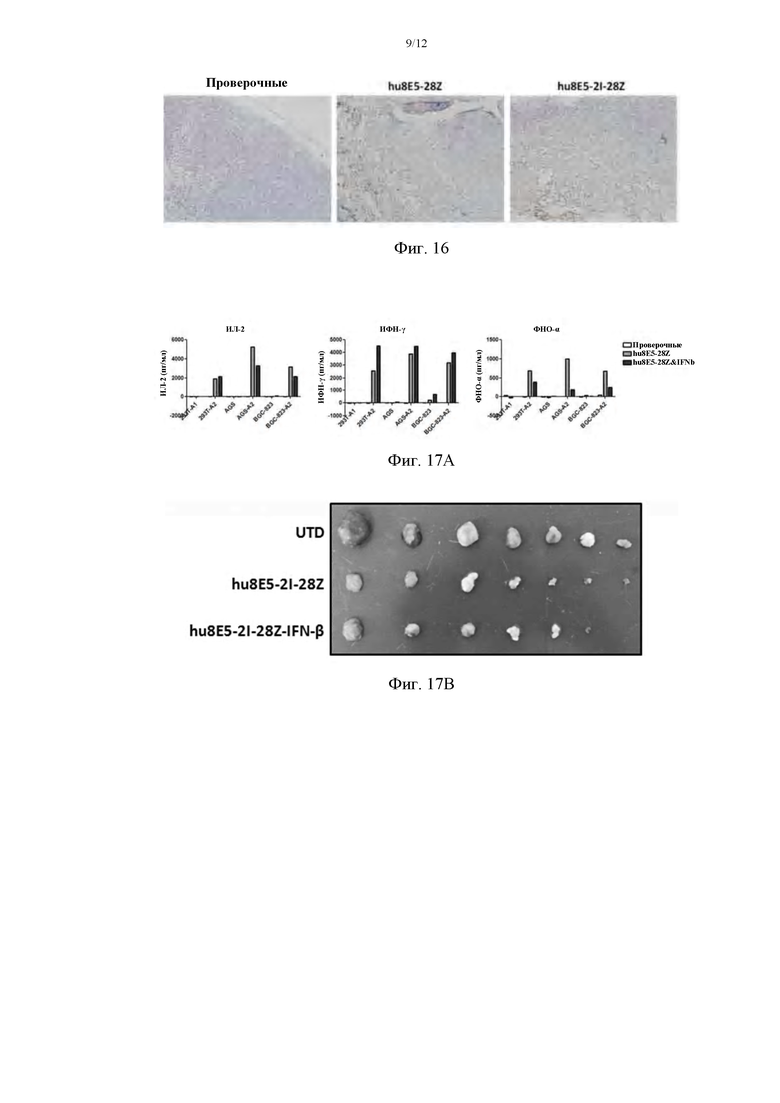
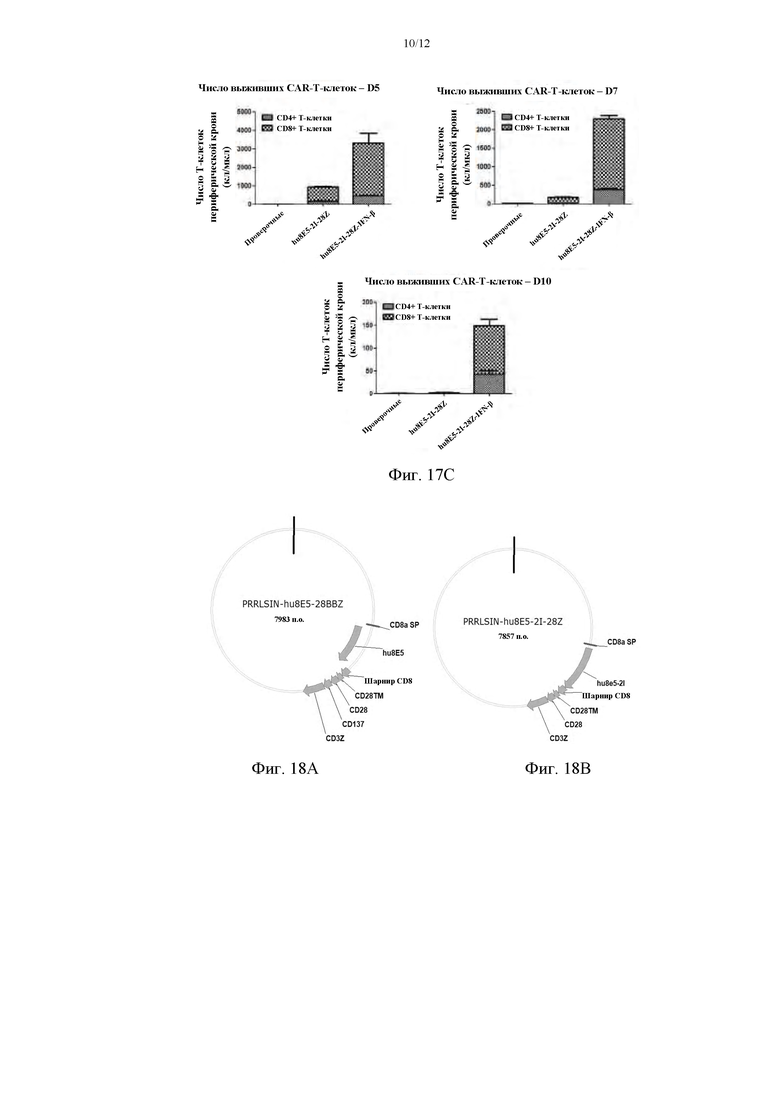
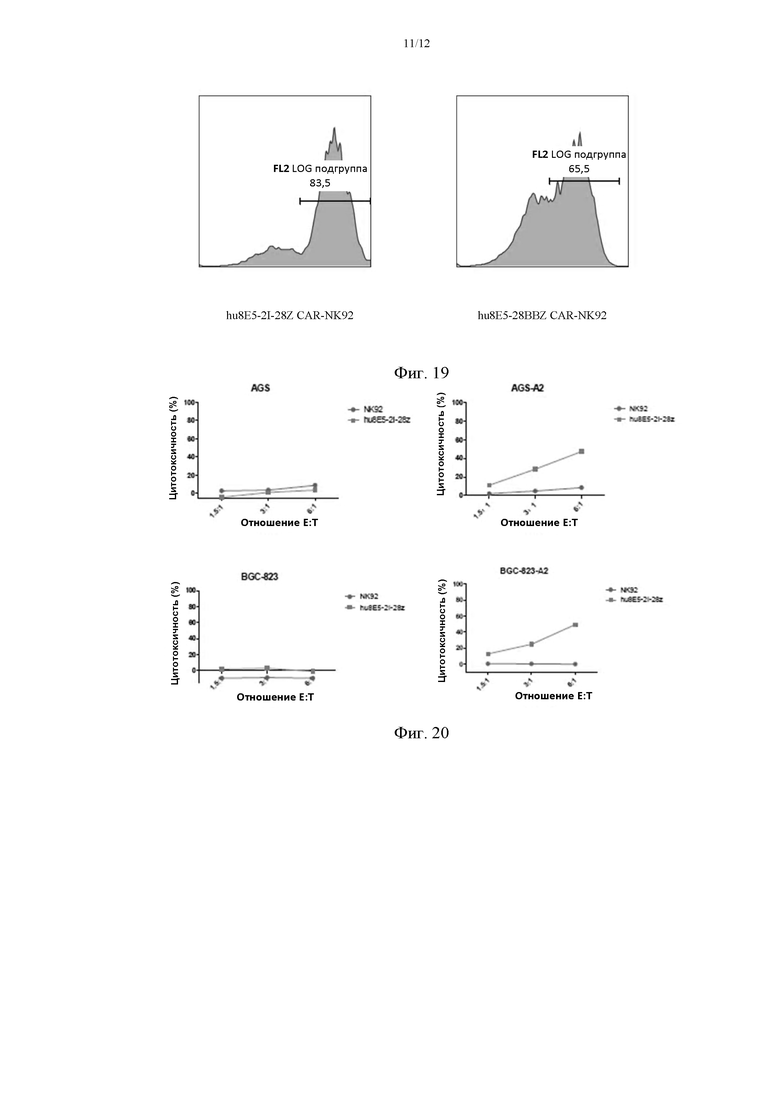

Изобретение относится к области биотехнологии. Предложено антитело, специфически связывающееся с клаудином 18A2. Также предложены включающие указанное антитело иммуноконъюгаты, химерный антигенный рецептор для распознавания клаудина 18A2, модифицированная химерным антигенным рецептором иммунная клетка, которые применяются для получения противоопухолевых лекарственных средств и реагентов для диагностики опухолей, экспрессирующих клаудин 18A2. Кроме того, раскрыты нуклеиновые кислоты для получения антител, иммуноконъюгатов и химерных антигенных рецепторов по изобретению. Изобретение обеспечивает повышенную цитотоксическую активность в отношении клеток, экспрессирующих клаудин 18A2. 24 н. и 11 з.п. ф-лы, 27 ил., 7 табл., 15 пр.
1. Антитело, специфически связывающееся с клаудином 18A2, причем указанное антитело содержит CDR тяжелой цепи и CDR легкой цепи, где:
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36; или
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 40, SEQ ID NO: 41 и SEQ ID NO: 42; или
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 43, SEQ ID NO: 44 и SEQ ID NO: 45, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48; или
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 49, SEQ ID NO: 50 и SEQ ID NO: 51, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54; или
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 31, SEQ ID NO: 83 и SEQ ID NO: 33, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36; или
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 31, SEQ ID NO: 84 и SEQ ID NO: 33, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36; или
участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела представляют собой SEQ ID NO: 49, SEQ ID NO 85 и SEQ ID NO: 51, а участки CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела представляют собой SEQ ID NO: 52, SEQ ID NO: 53 и SEQ ID NO: 54.
2. Антитело по п. 1, отличающееся тем, что указанное антитело представляет собой:
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 3 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 7 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 5;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 11 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 9;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 15 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 13;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 17 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 19 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 23 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 21;
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 27 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25; или
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 29 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25.
3. Антитело по п. 2, отличающееся тем, что указанное антитело представляет собой:
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 3 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; или
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 17 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; или
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 19 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 1; или
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 23 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 21; или
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 27 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25; или
антитело, содержащее вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 29 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25.
4. Антитело по любому из пп. 1–3, отличающееся тем, что указанное антитело представляет собой гуманизированное антитело, химерное антитело или полностью гуманизированное антитело; или указанное антитело представляет собой моноклональное антитело; или указанное антитело представляет собой одноцепочечное антитело или доменное антитело.
5. Антитело по п. 4, отличающееся тем, что указанное антитело представляет собой гуманизированное антитело, выбранное из группы, состоящей из:
антитела, содержащего вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 27 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25;
антитела, содержащего вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 23 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 21;
антитела, содержащего вариабельную область тяжелой цепи с последовательностью SEQ ID NO: 29 и вариабельную область легкой цепи с последовательностью SEQ ID NO: 25.
6. Антитело по п. 5, отличающееся тем, что указанное антитело выбрано из группы, состоящей из:
(a) антитела, содержащего тяжелую цепь с последовательностью SEQ ID NO: 63 и легкую цепь с последовательностью SEQ ID NO: 65;
(b) антитела, содержащего легкую цепь с последовательностью SEQ ID NO: 61 и тяжелую цепь с последовательностью SEQ ID NO: 59; и
(c) антитела, содержащего тяжелую цепь с последовательностью SEQ ID NO: 67 и легкую цепь с последовательностью SEQ ID NO: 65.
7. Нуклеиновая кислота, кодирующая антитело по любому из пп. 1–6.
8. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 7.
9. Клетка-хозяин для получения фармацевтический композиции, распознающей клаудин 18A2, содержащая экспрессионный вектор по п. 8 или содержащая нуклеиновую кислоту по п. 7, интегрированные в ее геном.
10. Применение антитела по любому из пп. 1–6 для получения нацеленного лекарственного средства, специфически нацеленного на опухолевые клетки, экспрессирующие клаудин 18A2.
11. Применение антитела по любому из пп. 1–6 для получения конъюгата антитела с лекарственным средством, специфически нацеленного на опухолевые клетки, экспрессирующие клаудин 18A2.
12. Применение антитела по любому из пп. 1–6 для получения многофункционального антитела, специфически нацеленного на опухолевые клетки, экспрессирующие клаудин 18A2.
13. Применение антитела по любому из пп. 1–6 для получения реагента для диагностики опухоли, экспрессирующей клаудин 18A2.
14. Применение антитела по любому из пп. 1–6 для получения модифицированной химерным антигенным рецептором иммунной клетки.
15. Применение по любому из пп. 10-14, отличающееся тем, что указанная опухоль, экспрессирующая клаудин 18A2, включает рак желудка, рак поджелудочной железы, рак пищевода, рак легкого.
16. Химерный антигенный рецептор для распознавания клаудина 18A2, содержащий антитело по любому из пп. 1–6, причем указанный химерный антигенный рецептор содержит следующие последовательно соединенные компоненты: антитело по любому из пп. 1–6, трансмембранную область и внутриклеточную сигнальную область.
17. Химерный антигенный рецептор по п. 16, отличающийся тем, что указанная внутриклеточная сигнальная область выбрана из группы, состоящей из: последовательности внутриклеточной сигнальной области CD3ζ, FcεRIγ, CD27, CD28, CD137, CD134, MyD88, CD40 или их комбинации; или указанная трансмембранная область содержит трансмембранную область CD8 или CD28.
18. Химерный антигенный рецептор по п. 17, отличающийся тем, что указанный химерный антигенный рецептор содержит последовательно соединенные антитело, трансмембранную область и внутриклеточную сигнальную область следующим образом:
антитело по любому из пп. 1–6, CD8 и CD3ζ;
антитело по любому из пп. 1–6, CD8, CD137 и CD3ζ; или
антитело по любому из пп. 1–6, трансмембранная область молекулы CD28, внутриклеточная сигнальная область молекулы CD28, и CD3ζ; или
антитело по любому из пп. 1–6, трансмембранная область молекулы CD28, внутриклеточная сигнальная область молекулы CD28, CD137 и CD3ζ.
19. Нуклеиновая кислота, кодирующая химерный антигенный рецептор по любому из пп. 16-18.
20. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 19.
21. Вирус для доставки генетической информации, содержащий вектор по п. 20.
22. Применение химерного антигенного рецептора по любому из пп. 16-18, нуклеиновой кислоты по п. 19, экспрессионного вектора по п. 20 или вируса по п. 21 для получения модифицированных химерным антигенным рецептором иммунных клеток, нацеленных на опухолевые клетки, экспрессирующие клаудин 18A2.
23. Применение по п. 22, отличающееся тем, что указанная опухоль, экспрессирующая клаудин 18A2, включает рак желудка, рак поджелудочной железы, рак пищевода, рак легкого.
24. Модифицированная химерным антигенным рецептором иммунная клетка, трансдуцированная нуклеиновой кислотой по п. 19, экспрессионным вектором по п. 20 или вирусом по п. 21; или
содержащая химерный антигенный рецептор по любому из пп. 16-18, экспрессируемый на поверхности;
предпочтительно указанная иммунная клетка представляет собой T-лимфоцит, NK-клетку или NKT-лимфоцит.
25. Иммунная клетка по п. 24, отличающаяся тем, что указанная иммунная клетка дополнительно несет кодирующую последовательность экзогенного цитокина; или
дополнительно экспрессирует другой химерный антигенный рецептор, который не содержит CD3ζ, однако содержит внутриклеточный сигнальный домен CD28, внутриклеточный сигнальный домен CD137 или комбинацию обоих доменов; или
дополнительно экспрессирует хемокиновый рецептор; предпочтительно указанный хемокиновый рецептор содержит CCR; или
дополнительно экспрессирует миРНК, которая может снижать экспрессию PD-1, или белок, который может блокировать PD-L1; или эндогенный PD-1 в указанной иммунной клетке нокаутирован с применением методик редактирования генов; или
дополнительно экспрессирует «переключатель безопасности».
26. Применение модифицированной химерным антигенным рецептором иммунной клетки по любому из пп. 24 или 25 для получения ингибирующего опухоли лекарственного средства, отличающееся тем, что указанная опухоль представляет собой опухоль, экспрессирующую клаудин 18A2; предпочтительно указанная опухоль включает рак желудка, рак поджелудочной железы, рак пищевода, рак легкого.
27. Иммуноконъюгат для распознавания клаудина 18A2, содержащий:
антитело по любому из пп. 1–6; и
присоединенную к нему функциональную молекулу; и указанная функциональная молекула представляет собой молекулу, нацеленную на поверхностный маркер на опухоли.
28. Иммуноконъюгат для распознавания клаудина 18A2, содержащий:
антитело по любому из пп. 1–6; и
присоединенную к нему функциональную молекулу; и указанная функциональная молекула представляет собой ингибирующую опухоль молекулу.
29. Иммуноконъюгат для распознавания клаудина 18A2, содержащий:
антитело по любому из пп. 1–6; и
присоединенную к нему функциональную молекулу; и указанная функциональная молекула представляет собой молекулу, нацеленную на поверхностный маркер иммунной клетки.
30. Иммуноконъюгат для распознавания клаудина 18A2, содержащий:
антитело по любому из пп. 1–6; и
присоединенную к нему функциональную молекулу; и указанная функциональная молекула представляет собой детектируемую метку.
31. Иммуноконъюгат по пп. 27-30, отличающийся тем, что указанная молекула, нацеленная на поверхностный маркер иммунной клетки, представляет собой антитело, связывающееся с поверхностным маркером T-клеток, которое образует бифункциональное антитело с антителом по любому из пп. 1–6 с вовлечением T-клетки.
32. Нуклеиновая кислота, кодирующая иммуноконъюгат по любому из пп. 27-31.
33. Применение иммуноконъюгата по любому из пп. 28-32 для получения противоопухолевых лекарственных средств для опухолей, экспрессирующих клаудин 18A2.
34. Применение иммуноконъюгата по любому из пп. 27-31 для получения реагента для диагностики опухоли, экспрессирующей клаудин 18A2.
35. Применение иммуноконъюгата по любому из пп. 27-31 для получения модифицированных химерным антигенным рецептором иммунных клеток; предпочтительно указанная иммунная клетка включает T-лимфоцит, NK-клетку или NKT-лимфоцит.
| US 2009169547 A1, 02.07.2009 | |||
| SAHIN UGUR et al | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| CARTELLIERI M | |||
| et al | |||
| Chimeric Antigen Receptor-Engineered T Cells for Immunotherapy of Cancer, Journal of Biomedicine and Biotechnology, 05 | |||
Авторы
Даты
2023-04-03—Публикация
2017-07-10—Подача