ОБЛАСТЬ ТЕХНИКИ
Представлен слитый полипептид, включающий GDF15 (фактор роста/дифференцировки 15) и Fc область иммуноглобулина, фармацевтическая композиция, включающая слитый полипептид, и способ увеличения длительности GDF15 in vivo, включающий слияние с Fc областью иммуноглобулина.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Большинство белковых или пептидных лекарственных средств имеют короткий период активности в организме и имеют низкую скорость абсорбции при введении способом, отличным от внутривенного, и, следовательно, они представляют неудобство, связанное с введением этих лекарственных средств повторно с короткими интервалами введения, когда требуется длительное лечение. Чтобы устранить это неудобство, требуется разработать методику непрерывного высвобождения лекарственных средств при разовой дозе. В ответ на такие потребности разрабатываются композиции с замедленным высвобождением для замедленного высвобождения.
Например, активно ведется исследование композиций с замедленным высвобождением, где получают микрочастицы в форме окружения белкового или пептидного лекарственного средства биоразлагаемой полимерной матрицей, и во время их введения материал матрицы медленно разлагается и удаляется в организме, а лекарственное средство медленно высвобождается.
С другой стороны, GDF15 (фактор роста/дифференцировки 15) является одним из семейства TGF-бета, и представляет собой 25 кДа гомодимер и является секреторным белком, циркулирующим в плазме. Уровень GDF15 в плазме связан с BMI (индексом массы тела), и GDF15 играет роль долгосрочного регулятора энергетического гомеостаза. GDF15 также защищает от патологических состояний, таких как сердечно-сосудистые заболевания, гипертрофия миокарда, ишемическое повреждение и т.п. Кроме того, GDF15 защищает от повреждения почечных канальцев и почечного интерстициального повреждения в моделях диабета 1 и 2 типа. Более того, GDF15 обладает защитным эффектом против связанной с возрастом потери сенсорных и двигательных нервов и может способствовать восстановлению повреждений периферических нервов. Помимо этого, GDF15 обладает эффектами снижения массы тела, уменьшения жировых отложений и устойчивости к глюкозе, а также повышения системного потребления энергии и окислительного метаболизма. GDF15 проявляет эффект гликемического контроля посредством зависимых и независимых от массы тела механизмов.
Существует необходимость в разработке методики повышения персистенции в организме белка GDF15, обладающего различными фармакологическими эффектами.
РАСКРЫТИЕ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
В настоящем раскрытии представлена технология конструирования слитого полипептида путем связывания GDF15 (фактор роста/дифференцировки 15) или его функционального варианта с Fc областью иммуноглобулина; тем самым увеличивая длительность in vivo за счет увеличения периода полужизни in vivo GDF15 по сравнению со случаем отсутствия Fc области, чтобы усилить фармакологический эффект GDF15 и/или увеличить интервал введения.
Вариант осуществления обеспечивает слитый полипептид, включающий GDF15 или его функциональный вариант и Fc область иммуноглобулина.
В слитом полипептиде Fc область иммуноглобулина может быть включена (связана) в N-конец GDF15 или его функциональный вариант. Например, слитый полипептид может включать (1) Fc область иммуноглобулина и (2) GDF15 или его функциональный вариант от N-конца к C-концу.
Fc область иммуноглобулина, включенная в слитый полипептид, играет роль повышения стабильности GDF15 или его варианта и, например, может иметь эффект продления периода полужизни (например, период полужизни in vivo). В одном варианте осуществления Fc область иммуноглобулина может быть выбрана из группы, состоящей из Fc области IgG1 и Fc области IgG4. Fc область IgG1 может включать CH2 домен, CH3 домен или CH2+CH3 домен IgG1, и включать или не включать шарнирную область IgG1 на N-конце. Fc область IgG4 может включать CH2 домен, CH3 домен, или CH2+CH3 домен IgG4, и включать или не включать шарнирную область IgG4 на N-конце.
Слитый полипептид может также включать пептидный линкер между Fc областью иммуноглобулина и GDF15 или его функциональным вариантом. В одном варианте осуществления пептидный линкер может быть гибким линкером, так что Fc область и GDF15, которые слиты с обоими концами линкера, могут независимо проявлять свою функцию. В конкретном варианте осуществления пептидный линкер может не быть жестким линкером. Например, пептидный линкер может быть GS линкером, который включает с повторами по меньшей мере один Gly (G) и по меньшей мере один Ser (S), и, например, может быть представлен как (GGGGS)n (n представляет собой число повторов GGGGS (SEQ ID NO: 13) и представляет собой целое число от 1 до 10 или целое число от 1 до 5 (1, 2, 3, 4 или 5)), но не ограничивается этим.
В слитом полипептиде GDF15 или его функциональный вариант, слитный с Fc областью иммуноглобулина, характеризуется повышенной стабильностью (период существования) in vivo (или в крови), по сравнению с GDF15 или его функциональным вариантом, не слитным с Fc областью иммуноглобулина (например, период полужизни in vivo или в крови увеличивается). Кроме того, GDF15 или его функциональный вариант, слитный с Fc областью иммуноглобулина, характеризуется улучшенным фармакологическим эффектом (например, эффектом снижения массы тела) по сравнению с GDF15 или его функциональным вариантом, не слитным с Fc областью иммуноглобулина.
Другой вариант осуществления обеспечивает димер слитого полипептида, включающий 2 из слитых полипептидов. Димер слитого полипептида может быть образован путем связывания (объединения) с GDF15 или его функциональным вариантом из двух слитых полипептидов.
Другой вариант осуществления обеспечивает молекулу нуклеиновой кислоты, кодирующую слитый полипептид.
Другой вариант осуществления обеспечивает рекомбинантный вектор, включающий молекулу нуклеиновой кислоты.
Другой вариант осуществления обеспечивает рекомбинантную клетку, включающую рекомбинантный вектор.
Другой вариант осуществления обеспечивает композицию (фармацевтическую композицию или композицию функциональной оздоровительной продукции) для снижения массы тела, контроля режима питания (уменьшения объема пищи) или профилактики, улучшения, облегчения, и/или лечения метаболического заболевания, включающую по меньшей мере один, выбранный из группы, состоящей из слитого полипептида, димера слитого полипептида, молекулы нуклеиновой кислоты, кодирующей слитый полипептид, рекомбинантного вектора, включающего молекулу нуклеиновой кислоты, и рекомбинантной клетки, включающей рекомбинантный вектор. Другой вариант осуществления обеспечивает способ снижения массы тела, способ контроля режима питания (уменьшения количества пищи) или способ профилактики, улучшения, облегчения, и/или лечения метаболического заболевания, включающий ведение фармацевтически эффективной дозы по меньшей мере одного, выбранного из группы, состоящей из слитого полипептида, димера слитого полипептида, молекулы нуклеиновой кислоты, кодирующей слитый полипептид, рекомбинантного вектора, включающего молекулу нуклеиновой кислоты, и рекомбинантной клетки, включающей рекомбинантный вектор, субъекту, нуждающегося в профилактике, улучшении, облегчении, и/или лечении метаболического заболевания. Метаболическое заболевание означает все заболевания, вызванные нарушением обмена веществ, и оно может быть выбрано из группы, состоящей из ожирения, диабета (например, диабета 2 типа), неалкогольной жировой болезни печени (например, неалкогольного стеатогепатита (NASH) и т.д.), и т.п.
Другой вариант осуществления обеспечивает способ получения GDF15 или его функционального варианта с увеличенным периодом полужизни in vivo (или в крови), включающий экспрессию рекомбинантного вектора в клетке, или способ получения слитого полипептида, включающего GDF15 или его функциональный вариант с увеличенным периодом полужизни in vivo (или в крови), или гомодимера, включающего слитый полипептид.
Другой вариант осуществления обеспечивает способ увеличения периода существования in vivo GDF15 или его функционального варианта, включающий слияние (или связывание или объединение) GDF15 или его функционального варианта с Fc областью иммуноглобулина. В одном конкретном варианте осуществления слияние может включать слияние (или связывание или объединения) Fc области иммуноглобулина с N-концом GDF15 или его функционального варианта, с линкером или без него. Другой вариант осуществления обеспечивает способ снижения иммуногенности GDF15, Fc области иммуноглобулина или включающего их слитого полипептида, включающий слияние (или связывание или объединение) Fc области иммуноглобулина с GDF15 или его функциональным вариантом с использованием гибкого линкера (например, GS линкера). Стадию слияния (или связывания или объединения) можно осуществить in vitro.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Далее настоящее изобретение будет описано более подробно:
GDF15
GDF15 состоит из аминокислот от 197-й (A) до 308-й (I), за исключением сигнального пептида и пропептида в 308 аминокислотах в целом (UniProt Q99988) (SEQ ID NO: 1; Фиг. 2; зрелая форма):
В настоящей заявке GDF15 означает полипептид, по существу включающий аминокислотную последовательность от 197 (A) до 308 (I) полноразмерного белка (UniProt Q99988) (SEQ ID NO: 1, см. Фиг. 2; ARNG DHCPLGPGRC CRLHTVRASL EDLGWADWVL SPREVQVTMC IGACPSQFRA ANMHAQIKTS LHRLKPDTVP APCCVPASYN PMVLIQKTDT GVSLQTYDDL LAKDCHCI), или аминокислотную последовательность, имеющую гомологию последовательности 80% или выше, 85% или выше, 90% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше или 99% или выше с аминокислотной последовательностью в диапазоне, который поддерживает уникальную активность и структуру GDF15, если не указано иное.
В настоящем изобретении функциональный вариант GDF15 может представлять собой вариант, модифицированный таким образом, чтобы GDF15 поддерживал уникальную активность и структуру и также был полезен для образования димерной структуры. В одном варианте осуществления функциональный вариант GDF15 может быть вариантом с делецией N-конца, в котором по меньшей мере один (1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14) из 14 аминокислотных остатков N-конца аминокислотной последовательности GDF15 SEQ ID NO: 1 (а именно, 14 аминокислотных остатков всего с 1-го по 14-й в SEQ ID NO: 1) (например, по меньшей мере один от N-конца по порядку), например, все 14 аминокислотных остатков делетированы (далее, может быть представлен как 'ΔN14GDF15' или 'GDF(CRL)'). В одном конкретном варианте осуществления функциональный вариант GDF15 может быть полипептидом, по существу включающим аминокислотную последовательность SEQ ID NO: 2 (CRLHTVRASL EDLGWADWVL SPREVQVTMC IGACPSQFRA ANMHAQIKTS LHRLKPDTVP APCCVPASYN PMVLIQKTDT GVSLQTYDDL LAKDCHCI) или аминокислотную последовательность, имеющую гомологию последовательности 80% или выше, 85% или выше, 90% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше или 99% или выше с аминокислотной последовательностью в диапазоне, который поддерживает уникальную активность и структуру GDF15.
Fc иммуноглобулина
Fc иммуноглобулина, подлежащий слиянию с GDF15 или его функциональным вариантом, играет роль повышения стабильности GDF15 или его функционального варианта, и например, может иметь эффект продления периода полужизни (например, периода полужизни in vivo) и/или снижения почечной фильтрации и т.д. В одном варианте осуществления Fc область иммуноглобулина может быть выбрана из Fc IgG1 и Fc IgG4. Fc область IgG1 может включать CH2 домен, CH3 домен или CH2+CH3 домен IgG1, и включать или не включать шарнирную область IgG1 на N-конце. Fc область IgG4 может включать CH2 домен, CH3 домен или CH2+CH3 домен IgG4, и включать или не включать шарнирную область IgG4 на N-конце.
IgG1 может происходить от приматов, таких как люди, или грызунов, таких как мыши, крысы и т.п., и, например, это может быть человеческий IgG1 (UniProtKB P01857). IgG4 может происходить от приматов, таких как люди, или грызунов, таких как мыши, крысы и т.п., и, например, это может быть человеческий IgG4 (UniProtKB P01861).
Fc область IgG1 может включать CH2 домен, CH3 домен или CH2+CH3 домен IgG1, и включать или не включать шарнирную область IgG1 на N-конце. Fc область IgG4 может включать CH2 домен, CH3 домен или CH2+CH3 домен IgG4, и включать или не включать шарнирную область IgG4 на N-конце.
В одном конкретном варианте осуществления Fc IgG1 может представлять собой полипептид, включающий CH2 домен и CH3 домен человеческого IgG1 (SEQ ID NO: 3), или полипептид, дополнительно включающий шарнирную область человеческого IgG1 (SEQ ID NO: 4) на N-конце аминокислотной последовательности SEQ ID NO: 3. Как описано в настоящей заявке, Fc область IgG1 может интерпретироваться как включающая аминокислотную последовательность, имеющую гомологию последовательности 80% или выше, 85% или выше, 90% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше или 99% или выше с аминокислотной последовательностью SEQ ID NO: 3, или ‘N-конец-(SEQ ID NO: 4)-(SEQ ID NO: 3)-C-конец’ в диапазоне, который поддерживает уникальную активность и структуру IgG1.
Fc IgG4 может представлять собой полипептид, включающий CH2 домен и CH3 домен человеческого IgG4 (SEQ ID NO: 5), или полипептид, дополнительно включающий шарнирную область человеческого IgG4 (SEQ ID NO: 10) на N-конце аминокислотной последовательности SEQ ID NO: 5. Как описано в настоящей заявке, Fc область IgG4 может интерпретироваться как включающая аминокислотную последовательность, имеющую гомологию последовательности 80% или выше, 85% или выше, 90% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше или 99% или выше с аминокислотной последовательностью SEQ ID NO: 5, или ‘N-конец-(SEQ ID NO: 10)-(SEQ ID NO: 5)-C-конец’ (или аминокислотную последовательность варианта Fc IgG4, описанную ниже) в диапазоне, который поддерживает уникальную активность и структуру IgG4.
Когда Fc область иммуноглобулина используют для продления (in vivo) периода полужизни белка, связанного с ее N-концом или C-концом, важно минимизировать любую эффекторную функцию Fc, чтобы уменьшить побочные эффекты за счет Fc области иммуноглобулина. В этом аспекте Fc область человеческого IgG4 имеет преимущество из-за низкой способности связывания с FcγR и факторами комплемента по сравнению с другими подтипами IgG. Кроме того, Fc область человеческого IgG4 может иметь пониженную эффекторную функцию путем включения аминокислотной замены. Аминокислотная замена Fc области человеческого IgG4 для снижения эффекторной функции может включать, по меньшей мере, одну из замены фенилаланина, который представляет собой 234-й остаток человеческого IgG4 (UniprotKB P01861), на аланин и замены 235-го остатка лейцина на аланин (содержащийся в сайте CH2-CH3 домена Fc IgG4; номер аминокислотного остатка соответствует нумерации ЕС [Kabat, E.A. et al. (1991) Sequences of Proteins of Immunological Interest, 5th edition, U.S. Dept. of Health and Human Services, Bethesda, MD, NIH Publication no. 91-3242]). Кроме того, Fc область IgG4 может включать аминокислотную замену, которая стабилизирует образование димера тяжелой цепи и предотвращает образование половины- IgG4 Fc цепи. Такая аминокислотная замена может включать замену 228-го аминокислотного остатка Fc области человеческого IgG4 (UniprotKB P01861) серина (согласно нумерации ЕС; находящегося в шарнирной области) на пролин.
В одном конкретном варианте осуществления для снижения иммуногенности Fc область может не включать мутации, отличные от мутаций, описанных выше, но не ограничиваясь этим.
В одном конкретном варианте осуществления Fc область иммуноглобулина может включать CH2-CH3 домен Fc человеческого IgG4 (SEQ ID NO: 5 (общий); SEQ ID NO: 6 (дикий тип) или SEQ ID NO: 7, 8 или 9 (вариант)) или дополнительно включать шарнирную область человеческого IgG4 на N-конце CH2-CH3 домена (SEQ ID NO: 10 (общий); SEQ ID NO: 11 (дикий тип) или SEQ ID NO: 12 (вариант)).
Fc области иммуноглобулинов, которые можно использовать в настоящем изобретении, представленные в следующей Таблице 1:
Слитый полипептид
Слитый полипептид, представленный в настоящей заявке, включает Fc область иммуноглобулина и GDF15 или его функциональный вариант, связанный с С-концом Fc области иммуноглобулина. Fc область иммуноглобулина и GDF15 или его функциональный вариант являются такими, как описано выше.
В слитом полипептиде Fc область иммуноглобулина и GDF15 или его функциональный вариант могут быть связаны ковалентно или нековалентно, или связаны при помощи подходящего линкера (например, пептидного линкера) или напрямую без линкера. В одном варианте осуществления пептидный линкер может представлять собой полипептид, состоящий из любого количества аминокислот от 1 до 20, от 1 до 15, от 1 до 10, от 2 до 20, от 2 до 15 или от 2 до 10, и виды содержащихся в нем аминокислот не ограничены. В настоящем раскрытии пептидный линкер может быть гибким линкером, чтобы, таким образом, Fc область и GDF15, которые слиты с обоими концами линкера, могли независимо проявлять свою функцию (например, для Fc области - стабилизирующую активность, такую как увеличение периода полужизни, снижение почечной фильтрации и т.п.). В конкретном варианте осуществления пептидный линкер может не быть жестким линкером. Например, пептидный линкер может включать по меньшей мере один аминокислотный остаток, выбранный из группы, состоящей из Gly, Asn, Ser, Glu и Lys, и также может включать нейтральные аминокислоты, такие как Thr и/или Ala, но не ограничивается этим, и аминокислотная последовательность, подходящая для пептидного линкера, известна в данной области техники.
В одном варианте осуществления пептидный линкер может быть GS линкером, многократно включающим один или несколько из Gly (G) и один или несколько из Ser (S), и, например, может представлять собой (GGGGS)n (n означает количество повторов GGGGS (SEQ ID NO: 13) и представляет собой целое число от 1 до 10 или целое число от 1 до 5 (1, 2, 3, 4 или 5)), но не ограничивается этим. В GS линкере Gly (глицин), который представляет собой аминокислоту, имеющую водород (-H) в качестве группы R, является неполярным и имеет высокую степень свободы (угол фи, пси) и превосходную подвижность; и Ser (Серин), который представляет собой аминокислоту, имеющую -CH2-OH в качестве группы R, имеет небольшой размер и полярность для образования водородной связи с водой, что полезно для поддержания стабильности, тем самым способствуя снижению неспецифического взаимодействия между GS линкером и GDF15 или Fc областью. Кроме того, GS линкер имеет гибкую структуру, что является выгодным для снижения иммуногенности. Кроме того, GS линкер может играть роль в пространственном разделении Fc области и GDF15, чтобы их функции не мешали друг другу. GS линкер может иметь длину от 15 до 25 аминокислот (n=от 3 до 5), от 15 до 20 аминокислот (n=3 или 4), от 15 до 25 аминокислот (n=4 или 5) или 20 аминокислот (n=4). В конкретном варианте осуществления пептидный линкер, который включен в слитый полипептид, представленный в настоящем описании, может не включать аминокислоты помимо GS линкера [(GGGGS)n (n представляет собой целое число от 1 до 10 или целое число от 1 до 5)], как описано выше.
В варианте осуществления слитый полипептид может дополнительно включать пептидный линкер между Fc областью иммуноглобулина и GDF15 или его функциональным вариантом. В одном варианте осуществления пептидный линкер может представлять собой GS линкер, включающий с повторами один или несколько Gly (G) и один или несколько Ser (S), и например, может представлять собой (GGGGS)n (n означает количество повторов GGGGS (SEQ ID NO: 13) и представляет собой целое число от 1 до 10 или целое число от 1 до 5 (1, 2, 3, 4 или 5)), но не ограничивается этим.
Слитый полипептид можно получить рекомбинантно или синтезировать химическим путем. При получении рекомбинантным способом слитый полипептид может кодироваться одной рамкой считывания, экспрессия которой контролируется одним регулирующим фактором инициации транскрипции (например, промотором и т.д.) (представлена «одной цепью»).
В слитом полипептиде GDF15 или его функциональный вариант, слитный с Fc областью иммуноглобулина, характеризуется повышенной стабильностью (период существования) in vivo (или в крови) (например, повышенным периодом полужизни in vivo или в крови) и/или пониженной иммуногенностью по сравнению со случаем, когда GDF15 или его функциональный вариант не слит с Fc областью иммуноглобулина, и/или Fc область иммуноглобулина и GDF15 или его функциональный вариант слиты через линкер, отличный от GS линкера, как описано выше. Кроме того, GDF15 или его функциональный вариант, слитный с Fc областью иммуноглобулина, характеризуется улучшенным фармакологическим эффектом (например, эффект снижения массы тела), по сравнению со случаем, когда GDF15 или его функциональный вариант не слит с Fc областью иммуноглобулина.
Димер слитого полипептида
Функционально активная форма GDF15 представляет собой гомодимерную форму.
Соответственно, другой вариант осуществления настоящего изобретения обеспечивает димер слитого полипептида, в котором объединены 2 слитых полипептида (первый слитый полипептид и второй слитый полипептид. Первый слитый полипептид включает Fc область первого иммуноглобулина и первый GDF15 или его функциональный вариант, а второй слитый полипептид включает Fc область второго иммуноглобулина и второй GDF15 или его функциональный вариант. В димере, в первом слитом полипептиде и втором слитом полипептиде, первый GDF15 или его функциональный вариант и второй GDF15 или его функциональный вариант могут быть связаны ковалентной связью (например, дисульфидной связью и т.д.). Кроме того, в димере, необязательно, Fc область первого иммуноглобулина и Fc область второго иммуноглобулина могут быть связаны ковалентной связью (например, дисульфидной связью и т.д.) или нековалентной связью (например, выступ & впадина, электростатическое взаимодействие, гидрофобное взаимодействие и т.д.) (см. Фиг. 1). Fc область иммуноглобулина и GDF15 или его функциональный вариант являются такими, как описано выше, и Fc область первого иммуноглобулина и Fc область второго иммуноглобулина, и первый GDF15 или его функциональный вариант и второй GDF15 или его функциональный вариант могут быть одинаковыми или разными.
В одном варианте осуществления Fc область первого иммуноглобулина и Fc область второго иммуноглобулина, и первый GDF15 или его функциональный вариант и второй GDF15 или его функциональный вариант, и первый слитый полипептид и второй слитый полипептид, образованные путем их связывания, включенные в димер слитого полипептида, является однонитевой формой (цепью; например, полипептидом, кодируемым одной рамкой считывания), соответственно, и структура, в которой по меньшей мере один из Fc области первого иммуноглобулина и Fc области второго иммуноглобулина, и первого GDF15 или его функционального варианта и второго GDF15 или его функционального варианта, и первого слитого полипептида и второго слитого полипептида, образованных путем их связывания, представляет собой димерную форму (например, Fc область первого или второго иммуноглобулина, включенная в первый или второй слитый полипептид, связана дисульфидной связью из двух нитей (2 молекул), и т.п., исключается.
N-конец мономера в димерной структуре GDF15 открыт для слияния с другим белком, а С-конец располагается там, где он не может сливаться с другим белком. Следовательно, для образования слитого полипептида при сохранении димерной формы GDF15 партнер для слияния (а именно, область Fc иммуноглобулина) предпочтительно должен быть связан с N-концом GDF15.
GDF15 образует комплексную структуру GDF15-GFRAL путем объединения со своим рецептором GFRAL (рецептор семейства GDNF альфа-подобный; например, номер доступа GenBank NP_997293.2). В комплексной структуре мономер GDF15 и мономер GFRAL объединены соответствующим образом, и N-конец GDF15 расположен в средней части димера GDF15. 4 аминокислотных остатка на N-конце, который может быть слит с GDF15, не наблюдаются в рентгеновской структуре, и поэтому предполагают, что он не имеет специфической структуры. 14 аминокислотных остатков на N-конце GDF15 фиксируются Cys7-Cys14 дисульфидной связью и не участвуют во взаимодействии между мономерами в димере GDF15. Кроме того, 14 аминокислотных остатков на N-конце GDF15 структурно расположены на расстоянии, которое не может взаимодействовать (связываться) с рецептором GFRAL, и, таким образом, ожидается, что никакого эффекта на связывание GDF15 с рецептором GFRAL нет, хотя 14 аминокислотных остатков на N-конце GDF15 делетированы.
Мономер GDF15 имеет 4 дисульфидные связи в молекуле и одну дисульфидную связь между молекулами димера. Предполагается, что дисульфидные связи в молекуле стабилизируют структуру, а дисульфидная связь, объединяющая Cys7-Cys14, расположена на краю мономерной структуры и действует для фиксации петлевой структуры N-конца. Поскольку 14 аминокислотных остатков на N-конце не играют непосредственной роли в связывании рецептора GFRAL, удаление одного или нескольких из них не повлияет на функцию и структуру GDF15, но Cys15 образует дисульфидную связь с Cys88, и поэтому, если Cys15 удален, это может повлиять на трехмерную структуру GDF15. Поэтому удаляемая область при сохранении функции и структуры GDF15 может представлять собой 14 аминокислот на N-конце (а именно, в SEQ ID NO: 1, по меньшей мере одна из 14 аминокислот от Ala1 до Cys14, например, по меньшей мере одна от N-конца по порядку (1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14)). В одном варианте осуществления мономер GDF15 может быть дикого типа (SEQ ID NO: 1) или формой, в которой 14 аминокислот на N-конце делетированы в диком типе (ΔN14GDF15; SEQ ID NO: 2).
В комплексной структуре, в которой wtGDF15 (SEQ ID NO: 1) или ΔN14GDF15 (форма, в которой 14 аминокислот на N-конце делетированы в SEQ ID NO: 1) объединен с его рецептором GFRAL, wt(дикий тип) GDF15 N-концевая (1-14 аминокислотных остатков) часть фиксируется Cys7-Cys14 дисульфидной связью, и N-конец открыт в нижнем левом и нижнем правом направлении, соответственно. Когда в wtGDF15 удалены 14 аминокислот на N-конце, N-конец открыт в левом верхнем и правом верхнем направлении, соответственно.
Благодаря такой структуре, когда слитый белок образуется путем слияния Fc белка иммуноглобулина с GDF15, ΔN14GDF15, в котором 14 аминокислотных остатков на N-конце удалены, и C-конец Fc белка могут быть морфологически естественным образом связаны (см. Фиг. 3a). С другой стороны, в случае wtGDF15, N-конец может быть расположен в направлении, которое немного трудно объединить с Fc белком (см. Фиг. 3b).
В комплексной структуре, в которой Fc-ΔN14GDF15 или Fc-wtGDF15 объединен с GFRAL, GDF15 и Fc представляют собой функционально димерную форму, а Fc-ΔN14GDF15 имеет структурное расположение, позволяющее легко образовывать димер Fc и димер ΔN14GDF15, соответственно. Поэтому Fc-ΔN14GDF15 может быть выгодным по сравнению с Fc-wtGDF15 в аспекте образования димера без прерывания образования комплекса с GFRAL.
Период полужизни in vivo (в крови) у млекопитающих GDF15 или его функционального варианта, включенного в слитый полипептид или димер слитого полипептида, представленный в настоящей заявке, может быть увеличен примерно в 1,5 раза или более, примерно в 2 раза или более, примерно в 2,5 раза или более, примерно в 3 раза или более, примерно в 3,5 раза или более, примерно в 4 раза или более, примерно в 4,5 раза или более, примерно в 5 раз или более, примерно в 5,5 раз или более, примерно в 6 раз или более, примерно в 7 раз или более, примерно в 8 раз или более, примерно в 9 раз или более или примерно в 10 раз, по сравнению с GDF15 или его функциональным вариантом, не слитным с Fc областью иммуноглобулина.
Как описано выше, GDF15 или его функциональный вариант в форме слитого полипептида, который слит с Fc областью иммуноглобулина, имеет такое преимущество, как большие интервалы между введениями, по сравнению с GDF15 или его функциональным вариантом, не слитым с Fc областью иммуноглобулина, за счет увеличения периода полужизни GDF15 или его функционального варианта.
Получение слитого полипептида
Слитый полипептид, включающий GDF15 или его функциональный вариант и Fc область иммуноглобулина, может быть получен обычными методами химического синтеза или рекомбинантными методами и может не встречаться в природе.
В настоящей заявке термин “вектор” означает экспрессирующее средство для экспрессии целевого гена в клетке-хозяине, и, например, может быть выбран из группы, состоящей из плазмидного вектора, космидного вектора и вирусного вектора, такого как вектор на основе бактериофага, вектор на основе аденовируса, вектор на основе ретровируса и вектор на основе аденоассоциированного вируса и т.п. В одном варианте осуществления вектор, используемый в рекомбинантном векторе, может быть получен на основе плазмиды (например, серии pcDNA, pSC101, pGV1106, pACYC177, ColE1, pKT230, pME290, pBR322, pUC8/9, pUC6, pBD9, pHC79, pIJ61, pLAFR1, pHV14, серии pGEX, серии pET, pUC19 и т.д.), фага (например, λgt4λB, λ-Charon, λΔz1, M13 и т.д.) или вируса (например, SV40 и т.д.), но не ограничивается этим.
В рекомбинантном векторе молекула нуклеиновой кислоты, кодирующая слитый полипептид, может быть функционально связана с промотором. Термин “функционально связанный” означает функциональное связывание последовательности, регулирующей экспрессию нуклеиновой кислоты (например, промоторной последовательности), и другой нуклеиновокислотной последовательности. Регулирующая последовательность может регулировать транскрипцию и/или трансляцию другой нуклеиновокислотной последовательности, будучи «функционально связанной».
Рекомбинантный вектор, как правило, может быть сконструирован как вектор для клонирования или экспрессирующий вектор для экспрессии. В качестве вектора экспрессии в данной области техники можно использовать обычный вектор, используемый для экспрессии чужеродного белка в растениях, животных или микроорганизмах. Рекомбинантный вектор может быть сконструирован различными способами, известными в данной области техники.
Рекомбинантный вектор можно использовать для экспрессии с использованием эукариота в качестве хозяина. При экспрессии с использованием эукариота в качестве хозяина рекомбинантный вектор может включать молекулу нуклеиновой кислоты, которая должна экспрессироваться, и вышеуказанный промотор, сайт связывания рибосомы, последовательность сигнала секреции (см. Публикацию патента Кореи № 2015-0125402) и/или, в дополнение к последовательности терминатора транскрипции/трансляции, точку начала репликации, действующую в эукариотах, такую как точка начала репликации f1, точка начала репликации SV40, точка начала репликации pMB1, точка начала репликации адено, точка начала репликации AAV и/или точка начала репликации BBV и т.п., но не ограничивается этим. Кроме того, промотор, происходящий из генома клетки млекопитающего (например, промотор металлотионеина), или промотор, происходящий из вируса млекопитающего (например, поздний промотор аденовируса, промотор вируса осповакцины 7.5K, промотор SV40, промотор цитомегаловируса, промотор слияния (KR 10-1038126 или KR 10-1868139), tk-промотор HSV), и можно использовать все последовательности сигнала секреции, обычно используемые в качестве последовательности сигнала секреции, и, например, можно использовать последовательность сигнала секреции, раскрытую в корейской патентной публикации № 2015-0125402, но не ограничиваясь этим, и она может включать полиаденилированную последовательность в качестве последовательности терминатора транскрипции.
Рекомбинантная клетка может быть получена путем введения (трансформации или трансфекции) рекомбинантного вектора в подходящую клетку-хозяин. Клетка-хозяин может быть выбрана из всех эукариот, которые могут стабильно и непрерывно клонировать или экспрессировать рекомбинантный вектор. Эукариот, используемый в качестве хозяина, включает дрожжи (Saccharomyces cerevisiae), клетки насекомых, клетки растений, клетки животных и т.п. и, например, включает мышей (например, COP, L, C127, Sp2/0, NS-0, NS-1, At20 или NIH3T3), крыс (например, PC12, PC12h, GH3 или MtT), хомяков (например, BHK, CHO, CHO с дефектом гена GS или CHO с дефектом гена DHFR), обезьян (например, COS (COS1, COS3, COS7 и т.д.), CV1 или Vero), людей (например, HeLa, HEK-293, полученные из сетчатки PER-C6, клетки, полученные из диплоидных фибробластов, миеломных клеток или HepG2), другие клетки животных (например, MDCK и т.д.), клетки насекомых (например, клетки Sf9, клетки Sf21, клетки Tn-368, клетки BTI-TN-5B1-4 и т.д.), гибридомы и т.п., но не ограничиваясь этим.
Путем экспрессии молекулы нуклеиновой кислоты, кодирующей слитый полипептид, представленный в настоящей заявке, в вышеуказанной соответствующей клетке-хозяине, по сравнению с неслитой формой, может быть получен GDF15 или его функциональный вариант, или слитый полипептид, или включающий их димер слитого полипептида с повышенной стабильностью in vivo. Способ получения слитого полипептида или димера слитого полипептида может включать культивирование рекомбинантной клетки, включающей молекулу нуклеиновой кислоты. Культивирование можно осуществить в обычных условиях культивирования. Кроме того, способ получения может дополнительно включать выделение и/или очистку слитого полипептида или димера слитого полипептида из культуры после культивирования.
Для доставки (введения) молекулы нуклеиновой кислоты или рекомбинантного вектора, включающего ее, в клетку-хозяин можно использовать способы доставки, широко известные в данной области. В способе доставки можно использовать, например, микроинъекцию, осаждение фосфатом кальция, электропорацию, липосомно-опосредованную трансфекцию и бомбардировку генов и т.п., когда клеткой-хозяином является эукариот, но не ограничиваясь этим.
Способ отбора трансформированной (введением рекомбинантного вектора) клетки-хозяина может быть легко осуществлен в соответствии с методами, широко известными в данной области, с использованием фенотипа, экспрессируемого селективным маркером. Например, когда селективный маркер представляет собой специфический антибиотик-резистентный ген, рекомбинантная клетка, в которую введен рекомбинантный вектор, может быть легко выбрана путем культивирования в среде, содержащей этот антибиотик.
Медицинские применения
Представлены композиция (фармацевтическая композиция или композиция функциональной оздоровительной продукции) для снижения массы тела, контроля режима питания (уменьшения объема пищи) или профилактики, улучшения, облегчения и/или лечения метаболического заболевания, включающая по меньшей мере одно, выбранное из группы, состоящей из слитого полипептида, димера слитого полипептида, молекулы нуклеиновой кислоты, кодирующей слитый полипептид, рекомбинантного вектора, включающего молекулу нуклеиновой кислоты, и рекомбинантной клетки, включающей рекомбинантный вектор; и/или способ снижения массы тела, способ контроля режима питания (уменьшения объема пищи) или способ профилактики, улучшения, облегчения и/или лечения метаболического заболевания, включающий введение фармацевтически эффективной дозы по меньшей мере одного, выбранного из группы, состоящей из слитого полипептида, димера слитого полипептида, молекулы нуклеиновой кислоты, кодирующей слитый полипептид, рекомбинантного вектора, включающего молекулу нуклеиновой кислоты, и рекомбинантной клетки, включающей рекомбинантный вектор, субъекту, нуждающемуся в профилактике, улучшении, облегчении и/или лечении метаболического заболевания.
Метаболическое заболевание означает все заболевания, вызванные метаболическими нарушениями, и может быть выбрано из группы, состоящей из ожирения, диабета (например, диабета II типа), неалкогольной жировой болезни печени (например, неалкогольного стеатогепатита (NASH) и т.д.) и т.п.
В контексте настоящей заявки фармацевтически эффективная доза означает содержание или дозу активного ингредиента, способную обеспечить желаемый эффект. Содержание или доза активного ингредиента (по меньшей мере одного, выбранного из группы, состоящей из слитого полипептида, включающего GDF15 или его функциональный вариант и Fc область иммуноглобулина, димера слитого полипептида, молекулы нуклеиновой кислоты, кодирующей слитый полипептид, рекомбинантного вектора, включающего молекулу нуклеиновой кислоты, и рекомбинантной клетки, включающей рекомбинантный вектор) в фармацевтической композиции могут по-разному назначаться в зависимости от таких факторов, как способ формулирования, способ введения, возраст пациента, масса тела, пол, заболеваемость, питание, время введения, интервал между введениями, путь введения, скорость экскреции и чувствительность реакции. Например, разовая доза активного ингредиента может находиться в диапазоне от 0,001 до 1000 мг/кг, от 0,01 до 100 мг/кг, от 0,01 до 50 мг/кг, от 0,01 до 20 мг/кг, от 0,01 до 10 мг/кг, от 0,01 до 5 мг/кг, от 0,1 до 100 мг/кг, от 0,1 до 50 мг/кг, от 0,1 до 20 мг/кг, от 0,1 до 10 мг/кг, от 0,1 до 5 мг/кг, 1 до 100 мг/кг, от 1 до 50 мг/кг, от 1 до 20 мг/кг, от 1 до 10 мг/кг или от 1 до 5 мг/кг, но не ограничивается этим. В другом варианте осуществления содержание активного ингредиента в фармацевтической композиции может составлять 0,01% масс. - 99,9% масс., 0,01% масс. - 90% масс., 0,01% масс. - 80% масс., 0,01% масс. - 70% масс., 0,01% масс. - 60% масс., 0,01% масс. - 50% масс., 0,01% масс. - 40% масс., 0,01% масс. - 30% масс., 1% масс. - 99,9% масс., 1% масс. - 90% масс., 1% масс. - 80% масс., 1% масс. - 70% масс., 1% масс. - 60% масс., 1% масс. - 50% масс., 1% масс. - 40% масс., 1% масс. - 30% масс., 5% масс. - 99,9% масс., 5% масс. - 90% масс., 5% масс. - 80% масс., 5% масс. - 70% масс., 5% масс. - 60% масс., 5% масс. - 50% масс., 5% масс. - 40% масс., 5% масс. - 30% масс., 10% масс. - 99,9% масс., 10% масс. - 90% масс., 10% масс. - 80% масс., 10% масс. - 70% масс., 10% масс. - 60% масс., 10% масс. - 50% масс., 10% масс. - 40% масс. или 10% масс. - 30% масс. в расчете на общую массу фармацевтической композиции.
Интервал между введениями (временной интервал между двумя последовательными дозами) активного ингредиента или включающей его фармацевтической композиции, представленной в настоящей заявке, может регулироваться в зависимости от концентрации или статуса (вариации и т.д.) активного ингредиента или состояния или симптомов пациентов, и, например, он может составлять 2 дня или более, 3 дня или более, 4 дня или более, 5 дней или более, 6 дней или более, 7 дней или более, 8 дней или более, 9 дней или более, 10 дней или более, 2 недели или более, 3 недели или более, 4 недели или более, 6 недель или более, 8 недель или более, 10 недель или более или 12 недель или более. Максимальный интервал между введениями может составлять около 2 недель, около 3 недель, около 4 недель, около 1 месяца, около 2 месяцев или около 3 месяцев, но не ограничивается этим, и он может быть увеличен или уменьшен в зависимости от концентрации или статуса (вариаций и т.д.) активного ингредиента или состояния или симптомов пациентов и т.п. В одном конкретном варианте осуществления интервал между введениями может быть соответствующим образом назначен в пределах от около 1 недели до около 3 месяцев.
Кроме того, фармацевтическая композиция может дополнительно включать фармацевтически приемлемый носитель в дополнение к активному ингредиенту. Носитель обычно используют для формулирования лекарственных средств, включающих белок, нуклеиновые кислоты или клетки, и он может представлять собой по меньшей мере одно, выбранное из группы, состоящей из лактозы, декстрозы, сахарозы, сорбита, маннита, крахмала, аравийской камеди, фосфата кальция, альгината, желатина, силиката кальция, микрокристаллической целлюлозы, поливинилпирролидона, целлюлозы, воды, сиропа, метилцеллюлозы, метилгидроксибензоата, пропилгидроксибензоата, талька, стеарата магния, минерального масла и т.п., но не ограничивается этим. Фармацевтическая композиция может дополнительно включать по меньшей мере одно, выбранное из группы, состоящей из разбавителя, эксципиента, смазывающего вещества, смачивающего вещества, подсластителя, ароматизатора, эмульгатора, суспендирующего агента, консерванта и т.п., обычно используемых для получения фармацевтической композиции.
Субъектом введения фармацевтической композиции могут быть млекопитающие, включая приматов, таких как люди, обезьяны и т.д., грызунов, таких как мыши, крысы и т.д. и т.п., или клетки, ткань, культура клеток или культура ткани, выделенные у них.
Фармацевтическую композицию можно вводить перорально или парентерально, или вводить путем контактирования с клеткой, тканью или жидкостью организма. В частности, в случае парентерального введения ее можно вводить путем подкожной инъекции, внутримышечной инъекции, внутривенной инъекции, интраперитонеальной инъекции, эндотелиального введения, местного введения, интраназального введения, внутрилегочного введения и ректального введения и т.п. В случае перорального введения пероральная композиция должна быть сформулирована так, чтобы обеспечить покрытие активного вещества или защитить его от разложения в желудке при переваривании белков или пептидов.
Кроме того, фармацевтическая композиция может быть получена в форме раствора, суспензии, сиропа или эмульсии в масле или водной среде, или в форме экстракта, порошка, гранул, таблеток или капсул или т.п., и может дополнительно включать диспергирующий агент или стабилизатор для формулирования композиции.
Еще один вариант осуществления обеспечивает способ увеличения периода существования GDF15 или его функционального варианта in vivo, включающий слияние (или связывание или объединение) GDF15 или его функционального варианта с Fc областью иммуноглобулина. В одном конкретном варианте осуществления слияние может включать слияние (или связывание или объединение) Fc области иммуноглобулина с N-концом GDF15 или его функционального варианта, с линкером или без него. Другой вариант осуществления обеспечивает способ снижения иммуногенности GDF15, Fc области иммуноглобулина или включающего их слитого полипептида, включающий слияние (или связывание или объединение) GDF15 или его функционального варианта с Fc областью иммуноглобулина с использованием гибкого линкера. Стадию слияния (или связывания или объединения) можно осуществить in vitro.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
GDF15, слитый с Fc областью иммуноглобулина, или его функциональный вариант, представленный в настоящем изобретении, имеет более длительное существование при введении в организм по сравнению со случаем, когда он не слит с Fc-областью иммуноглобулина, и, таким образом, интервал между введениями может быть увеличен, и, таким образом, доза может быть уменьшена, и, следовательно, это имеет благоприятный эффект с точки зрения удобства введения и/или экономического аспекта, а также имеет отличный фармакологический эффект, и, таким образом, его можно с успехом применять в областях, требующих лечения с использованием GDF15 или его функционального варианта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет миметическую диаграмму слитого полипептида в соответствии с одним примером.
Фиг. 2 показывает аминокислотную последовательность GDF15 (дикий тип; зрелая форма; SEQ ID NO: 1) (от N-конца к C-концу).
Фиг. 3a и Фиг. 3b показывают структуру комплекса, в котором Fc-ΔN14GDF15 (3a) или Fc-wtGDF15 (3b) связывается с GFRAL.
Фиг. 4 представляет миметическую диаграмму, схематически показывающую ген слитого полипептида в соответствии с примером.
Фиг. 5 представляет график, показывающий изменение массы тела в группе введения IgG1-GDF (CRL) и группе введения HIgG1-GDF (CRL).
Фиг. 6 представляет график, показывающий процент изменения массы тела через 7 дней после введения в группе введения IgG1-GDF (CRL) и группе введения HIgG1-GDF (CRL).
Фиг. 7 представляет график, показывающий изменение массы тела в группе введения IgG4-GDF15 и группе введения IgG4-GDF(CRL).
Фиг. 8 представляет график, показывающий процент изменения массы тела через 7 дней (синяя полоса) и 14 дней (красная полоса) после введения в группе введения IgG4-GDF15 и группе введения IgG4-GDF(CRL).
Фиг. 9 представляет график, показывающий суммарное потребление пищи через 7 дней после введения в группе введения IgG1-GDF (CRL) и группе введения HIgG1-GDF (CRL).
Фиг. 10 представляет график, показывающий суммарное потребление пищи через 7 дней, 14 дней и 19 дней после введения в группе введения IgG4-GDF15 и группе введения IgG4-GDF(CRL).
Фиг. 11 представляет график, показывающий изменение концентрации слитого полипептида в крови (в сыворотке) в зависимости от времени, прошедшего после введения слитого полипептида.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Далее настоящее изобретение будет описано более подробно при помощи следующих примеров. Однако эти примеры предназначены только для иллюстрации настоящего изобретения, но объем настоящего изобретения не ограничивается этими примерами.
Пример 1: Получение слитого полипептида
1.1. Клонирование и культивирование гена, кодирующего слитый полипептид
Получали IgG1-GDF(CRL), HIgG1-GDF(CRL), IgG4-GDF, HIgG4-GDF, IgG4-GDF(CRL) и HIgG4-GDF(CRL) (см. Фиг. 1), которые представляли собой слитые полипептиды, слитые со зрелым GDF15 (представлены GDF или GDF15; SEQ ID NO: 1), или вариантом GDF15 (представлен GDF(CRL); 14 аминокислот на N-конце были делетированы: SEQ ID NO: 2), который имел целевой полипептид иммуноглобулина Fc (IgG1-Fc (не включающий шарнирную область: SEQ ID NO: 3; HIgG1-Fc (включающий шарнирную область; [SEQ ID NO: 4]-[SEQ ID NO: 3]), мутированный IgG4-Fc (не включающий шарнирную область; SEQ ID NO: 7) или мутированный HIgG4-Fc (включающий шарнирную область: [SEQ ID NO: 12]-[SEQ ID NO: 7]), включающие или не включающие шарнирную область. Аминокислотные последовательности каждой части, включенной в слитый полипептид, представлены в Таблице 2, Таблице 3 и Таблице 4 ниже.
IgG1-GDF(CRL) (не включающий шарнирную область) и HIgG1-GDF(CRL) (включающий шарнирную область) (направление от N-конца к C-концу)
GVEVHNAKTK PREEQYNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKALPA
PIEKTISKAK GQPREPQVYT LPPSRDELTK NQVSLTCLVK GFYPSDIAVE
WESNGQPENN YKTTPPVLDS DGSFFLYSKL TVDKSRWQQG NVFSCSVMHE
ALHNHYTQKS LSLSPG
LHRLKPDTVP APCCVPASYN PMVLIQKTDT GVSLQTYDDL LAKDCHCI
IgG4-GDF15 (не включающий шарнирную область) и HIgG4-GDF15 (включающий шарнирную область) (направление от N-конца к C-концу)
GVEVHNAKTK PREEQFNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKGLPS
SIEKTISKAK GQPREPQVYT LPPSQEEMTK NQVSLTCLVK GFYPSDIAVE
WESNGQPENN YKTTPPVLDS DGSFFLYSRL TVDKSRWQEG NVFSCSVMHE
ALHNHYTQKS LSLSLG
QFRAANMHAQ IKTSLHRLKP DTVPAPCCVP ASYNPMVLIQ KTDTGVSLQT
YDDLLAKDCH CI
IgG4-GDF(CRL) (не включающий шарнирную область) и HIgG4-GDF(CRL) (включающий шарнирную область) (направление от N-конца к C-концу)
CKVSNKGLPS SIEKTISKAK GQPREPQVYT LPPSQEEMTK NQVSLTCLVK
GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSRL TVDKSRWQEG
NVFSCSVMHE ALHNHYTQKS LSLSLG
LHRLKPDTVP APCCVPASYN PMVLIQKTDT GVSLQTYDDL LAKDCHCI
1.1.1 Получение рекомбинантного вектора экспрессии
1.1.1.1. Зрелый GDF15
Для получения гена, кодирующего зрелый GDF15, ссылаясь на аминокислоту UniprotKB Q99968, ген, кодирующий зрелый GDF15 (SEQ ID NO: 14), синтезировали в Bioneer.
SEQ ID NO: 14 (339 пар оснований)
1 GCCCGGAACG GCGACCACTG CCCCCTGGGG CCCGGACGGT GCTGCCGGCT
51 GCACACCGTG CGGGCCTCCC TGGAGGACCT GGGCTGGGCC GACTGGGTGC
101 TGTCCCCAAG GGAGGTGCAA GTGACCATGT GCATCGGCGC CTGCCCATCT
151 CAGTTCCGGG CCGCCAACAT GCACGCTCAG ATCAAGACCA GCCTGCACCG
201 GCTGAAGCCC GACACCGTGC CCGCCCCCTG CTGCGTGCCC GCCTCCTACA
251 ACCCCATGGT GCTGATTCAG AAGACCGACA CCGGCGTGAG CCTGCAGACC
301 TACGACGACC TGCTGGCCAA GGACTGCCAC TGCATCTAA
(Подчеркнутая часть представляет собой GDF (CRL))
1.1.1.2. IgG1-Fc
Ген, кодирующий человеческий IgG1 Fc, включающий шарнирную область, или ген, кодирующий человеческий IgG1 Fc, не включающий шарнирную область, получали с использованием плазмиды, включающей ген, кодирующий коровую шарнирную область человеческого IgG1 и IgG1 Fc, посредством ПЦР.
SEQ ID NO: 15 (678 пар оснований)
1 GACAAAACTC ACACATGCCC ACCGTGCCCA GCACCTGAAC TCCTGGGGGG
51 ACCGTCAGTC TTCCTCTTCC CCCCAAAACC CAAGGACACC CTCATGATCT
101 CCCGGACCCC TGAGGTCACA TGCGTGGTGG TGGACGTGAG CCACGAAGAC
151 CCTGAGGTCA AGTTCAACTG GTACGTGGAC GGCGTGGAGG TGCATAATGC
201 CAAGACAAAG CCGCGGGAGG AGCAGTACAA CAGCACGTAC CGTGTGGTCA
251 GCGTCCTCAC CGTCCTGCAC CAGGACTGGC TGAATGGCAA GGAGTACAAG
301 TGCAAGGTCT CCAACAAAGC CCTCCCAGCC CCCATCGAGA AAACCATCTC
351 CAAAGCCAAA GGGCAGCCCC GAGAACCACA GGTGTATACC CTGCCCCCAT
401 CCCGGGATGA GCTGACCAAG AACCAGGTCA GCCTGACCTG CCTGGTCAAA
451 GGCTTCTATC CCAGCGACAT CGCCGTGGAG TGGGAGAGCA ATGGGCAGCC
501 GGAGAACAAC TACAAGACCA CGCCTCCCGT GCTGGACTCC GACGGCTCCT
551 TCTTCCTCTA CAGCAAGCTC ACCGTGGACA AGAGCAGGTG GCAGCAGGGG
601 AACGTCTTCT CATGCTCCGT GATGCATGAG GCTCTGCACA ACCACTACAC
651 GCAGAAGAGC CTCTCCCTGT CTCCGGGT
(Подчеркнутая часть представляет собой ген, кодирующий коровую шарнирную область IgG1)
1.1.1.3. IgG4-Fc
Ген, кодирующий человеческий IgG4 Fc, включающий шарнирную область, или ген, кодирующий человеческий IgG4 Fc, не включающий шарнирную область, получали с использованием плазмиды, включающей ген, кодирующий шарнирную область человеческого IgG4 и IgG4 Fc, посредством ПЦР.
SEQ ID NO: 16 (684 пар оснований)
1 GAGTCCAAAT ATGGTCCCCC ATGCCCACCC TGCCCAGCAC CTGAGGCCGC
51 CGGGGGACCG TCAGTCTTCC TCTTCCCCCC AAAACCCAAG GACACCCTCA
101 TGATCTCCCG GACCCCTGAG GTCACGTGCG TGGTGGTGGA CGTGTCCCAG
151 GAGGACCCCG AGGTGCAGTT CAACTGGTAC GTGGACGGCG TGGAGGTGCA
201 CAACGCCAAG ACCAAGCCCC GGGAGGAGCA GTTCAACTCC ACCTACCGGG
251 TGGTGTCCGT GCTGACCGTG CTGCACCAGG ACTGGCTGAA CGGCAAGGAG
301 TACAAGTGCA AGGTGTCCAA CAAGGGCCTG CCCTCCTCCA TCGAGAAGAC
351 CATCTCCAAG GCCAAGGGCC AGCCCCGGGA GCCCCAGGTG TACACCCTGC
401 CCCCCTCCCA GGAGGAGATG ACCAAGAACC AGGTGTCCCT GACCTGCCTG
451 GTGAAGGGCT TCTACCCCTC CGACATCGCC GTGGAGTGGG AGTCCAACGG
501 CCAGCCCGAG AACAACTACA AGACCACCCC CCCCGTGCTG GACTCCGACG
551 GCTCCTTCTT CCTGTACTCC CGGCTGACCG TGGACAAGTC CCGGTGGCAG
601 GAGGGCAACG TGTTCTCCTG CTCCGTGATG CACGAGGCCC TGCACAACCA
651 CTACACCCAG AAGTCCCTGT CCCTGTCCCT GGGC
(Подчеркнутая часть представляет собой ген, кодирующий шарнирную область IgG4)
1.1.1.4. Получение вектора экспрессии
pDHDD-D1G1 (включающий промотор KR10-1868139B1), который представлял собой вариант pcDNA3.1(+) (Invitrogen, Cat. No. V790-20), разрезали при помощи BamHI и NotI, и гены (зрелый GDF15, IgG1-Fc, IgG4-Fc) объединяли с ними для вставки гена, имеющего следующую структуру (см. Фиг. 4), тем самым получая каждый рекомбинантный вектор.
pHIgG1-GDF(CRL)
'(N-конец)-[BamHI сайт рестрикции-сигнальный пептид (SEQ ID NO: 17)-IgG1 Коровая шарнирная область (SEQ ID NO: 4)-IgG1 CH2-CH3 (SEQ ID NO: 3)-GS Линкер (SEQ ID NO: 18)-GDF (CRL) (SEQ ID NO: 2)- NotI сайт рестрикции]-(C-конец)'
pIgG1-GDF(CRL)
'(N-конец)-[BamHI сайт рестрикции-сигнальный пептид (SEQ ID NO: 17)-IgG1 CH2-CH3 (SEQ ID NO: 3)-GS Линкер (SEQ ID NO: 18)-GDF (CRL) (SEQ ID NO: 2)- NotI сайт рестрикции]-(C-конец)'
pHIgG4-GDF15
'(N-конец)-[BamHI сайт рестрикции-сигнальный пептид (SEQ ID NO: 17)-IgG4 Шарнирная область (SEQ ID NO: 12)-IgG4 CH2-CH3 (SEQ ID NO: 7)-GS Линкер (SEQ ID NO: 18)-GDF15 (SEQ ID NO: 1)- NotI сайт рестрикции]-(C-конец)'
pIgG4-GDF15
'(N-конец)-[BamHI сайт рестрикции-сигнальный пептид (SEQ ID NO: 17)-IgG4 CH2-CH3 (SEQ ID NO: 7)-GS Линкер (SEQ ID NO: 18)-GDF15 (SEQ ID NO: 1)- NotI сайт рестрикции]-(C-конец)'
pHIgG4-GDF(CRL)
'(N-конец)-[BamHI сайт рестрикции-сигнальный пептид (SEQ ID NO: 17)-IgG4 Шарнирная область (SEQ ID NO: 12)-IgG4 CH2-CH3 (SEQ ID NO: 7)-GS Линкер (SEQ ID NO: 18)-GDF(CRL) (SEQ ID NO: 2)- NotI сайт рестрикции]-(C-конец)'
pIgG4-GDF(CRL)
'(N-конец)-[BamHI сайт рестрикции-сигнальный пептид (SEQ ID NO: 17)- IgG4 CH2-CH3 (SEQ ID NO: 7)-GS Линкер (SEQ ID NO: 18)-GDF(CRL) (SEQ ID NO: 2)- NotI сайт рестрикции]-(C-конец)'
1.1.2. Культивирование гена, кодирующего слитый полипептид
Полученные рекомбинантные векторы экспрессии pHIgG1-GDF(CRL), pIgG1-GDF(CRL), pHIgG4-GDF(CRL), pIgG4-GDF(CRL), pHIgG4-GDF и pIgG4-GDF вводили в клетку ExpiCHO-S™ (Thermo Fisher Scientific) и культивировали в среде для экспрессии ExpiCHO (Thermo Fisher Scientific; 400 мл) в течение 12 дней (культура с подпиткой; подпитка в день 1 и день 5) для экспрессии слитых полипептидов HIgG1-GDF(CRL), IgG1-GDF(CRL), HIgG4-GDF(CRL), IgG4-GDF(CRL), HIgG4-GDF и IgG4-GDF.
1.2. Очистка слитого полипептида
Слитый полипептид очищали из культуры клеток, полученной в примере 1.1, с использованием аффинной хроматографии на белке А.
Сначала культуральный раствор слитого полипептида, выделенного из клеток, фильтровали через фильтр 0,22 мкм. Колонка со смолой MabSelect SuRe™ pcc (GE Healthcare Life Sciences) была снабжена AKTA™ Pure (GE Healthcare Life Sciences), и фосфатно-солевой буферный раствор (PBS, 10 мМ фосфата натрия, 150 мМ NaCl, pH 7,4) пропускали для уравновешивания колонки. После введения культурального раствора, отфильтрованного через фильтр 0,22 мкм, в уравновешенную колонку снова пропускали PBS для промывки колонки. После завершения промывки колонки в колонку вводили элюирующий буфер (0,1 М цитрата натрия, pH 3,5) для элюирования целевого слитого полипептида. К элюируемому раствору немедленно добавляли 1M Tris pH 8,5, чтобы получить нейтральный pH. Из элюированных фракций фракции с высокой концентрацией слитого полипептида и высокой чистотой собирали и хранили замороженными.
Для эксперимента на животных с использованием устройства Amicon Ultra Filter Device (MWCO 10K, Merck) и центрифуги образец элюированной фракции, включающей слитый полипептид, концентрировали с PBS или 20 мМ Tris pH 8,0, 150 мМ NaCl и осуществляли буферный обмен.
Количественный анализ слитого полипептида осуществляли путем измерения поглощения при 280 нм и 340 нм в УФ-спектрофотометре (G113A, Agilent Technologies) и расчета концентрации белка по следующему уравнению. В качестве коэффициента экстинкции каждого вещества использовали значение, теоретически рассчитанное с использованием аминокислотной последовательности (Таблица 5).

* Коэффициент экстинкции (0,1%): теоретическое поглощение при 280 нм, предполагая, что концентрация белка составляет 0,1% (1 г/л), и все цистеины в первичной последовательности окислены с образованием дисульфидной связи, который рассчитывают при помощи инструмента ProtParam tool (https://web.expasy.org/protparam/).
Коэффициент экстинкции слитого полипептида
Пример 2. Фармакологический эффект слитого полипептида (in vivo)
2.1. Метод испытания
Фармакологический эффект слитого полипептида, полученного и очищенного в Примере 1, испытывали на мышах (C57BL/6J, 6 недель, самцы, 100 мышей; RaonBio).
В этом примере использовали мышиную модель DI0 (Мышь, C57BL/6J-DIO, самцы, 100 мышей, 14 недель (8-недельное питание, способствующее ожирению), в которой мыши C57BL/6J получали корм с высоким содержанием жиров в течение 8 недель для индуцирования ожирения. Мышиная модель DIO демонстрирует клинические характеристики диабета 2 типа, такие как гиперлипидемия, инсулинорезистентность, гипергликемия и т.п., и поэтому она является животной моделью, широко используемой для оценки улучшения диабета и инсулинорезистентности, и исходные данные, сравнимые для исследований метаболических заболеваний, таких как ожирение, диабет, гиперлипидемия и т.п., накоплены в большом количестве, и поэтому она подходит для испытания фармакологического эффекта этого примера, и, таким образом, была выбрана эта модель.
Мышиная модель, которая получала питание, способствующее ожирению в течение 8 недель, подвергали 2-недельному периоду осмотра и очистки, и в течение этого периода общие симптомы наблюдали один раз в день, для проверки состояния здоровья и является ли она подходящей для эксперимента для отбора здоровых животных. Во время периода очистки индивидуума помечали, делая отметку красной масляной ручкой на хвосте животного, во время регистрации (метка на хвосте), и к боксу для разведения животных прикрепляли временную идентификационную карту индивидуума (название испытания, индивидуальный номер и время поступления) во время осмотра и очистки. При разделении группы на хвосте животного делали отметку черной масляной ручкой, и идентификационную карту индивидуума (название испытания, информация о группе, индивидуальный номер, пол, время поступления, период введения) прикрепляли к каждой клетке.
Чтобы свести к минимуму стресс экспериментального животного при подкожном введении испытываемого вещества (слитый полипептид), стерильный дистиллированный физиологический раствор вводили подкожно при 200 мкл/животное всем животным с использованием шприца объемом 1 мл за 3 дня до введения испытываемого вещества для преадаптационной подготовки к подкожному введению.
Что касается здоровых животных, у которых во время периода осмотра и очистки не было обнаружено никаких отклонений, массу тела и потребление пищи измеряли для всех индивидуумов после завершения периода очистки.
Измеряли массу тела и потребление пищи и осуществляли разделение групп таким образом, чтобы среднее значение двух измерений между группами было одинаковым в зависимости от массы тела. Введение испытываемого вещества начинали на следующий день после разделения групп. Оставшиеся животные, которые не были отобраны, были исключены из системы испытаний после окончания разделения групп.
Информация о диете с высоким содержанием жиров (питание, способствующее ожирению; Диета с высоким содержанием жиров (HFD)), которую получали C57BL/6J -DIO, была следующей:
5,24 ккал/г, жиры 60% масс., белки 20% масс., и получаемые из углеводов калории 20% масс.; Research Diet Inc., U.S.A.; Product No. High fat diet (Fat 60 kcal%, D12492).
Пищу давали в режиме свободного питания (питание в период очистки и испытания).
Что касается питьевой воды, водопроводную воду фильтровали с использованием проточного стерилизатора с фильтром, а затем облучали ультрафиолетовым светом, и ее беспрепятственно потребляли с использованием поликарбонатной бутылки для питьевой воды (250 мл).
2.1.1. HIgG1-GDF (CRL) и IgG1-GDF(CRL)
Введение испытываемых веществ (HIgG1-GDF(CRL) и IgG1-GDF(CRL)) и контрольного вещества GDF15 (R&D Systems) осуществляли на следующий день после разделения групп, с временем введения в 9 часов утра каждый день. И контрольное вещество, и испытываемые вещества вводили подкожно. Путь введения контрольного вещества и испытываемых веществ был выбран как подкожный путь в зависимости от предполагаемого клинического пути введения.
Доза как контрольного вещества, так и испытываемых веществ составляла 5 мл/кг, и индивидуальную дозу рассчитывали на основании недавно измеренной массы тела, и их вводили подкожно один раз в день начала испытания с использованием одноразового шприца (1 мл). Испытываемые вещества вводили только один раз в день начала испытания. Для сравнения, контрольную группу, в которой получали контрольное вещество GDF15, и для группы сравнения, в которой вводили GDF15, их вводили один раз в день в течение 5 дней, всего 5 раз, и все введения осуществляли с 9 часов утра.
Состав испытываемой группы, вводимая доза и т.п. представлены в следующей Таблице 6:
Состав группы введения слитого полипептида IgG1-GDF (CRL)
Был установлен график наблюдения, измерений и обследования для исследуемой группы: День 0 для начала введения, и 7 дней с начала введения были установлены как 1 неделя введения.
График исследования представлен в Таблице 7:
График исследования
Для всех животных общие клинические симптомы наблюдали один раз в день, и присутствие умирающих и мертвых животных подтверждали два раза в день, и это обследование осуществляли с 1 дня введения до конца введения. Во время обследования регистрировали только тот случай, когда имел место аномальный симптом.
Массу тела каждой мыши измеряли в день начала введения испытываемых веществ (перед введением), и затем массу тела измеряли каждый день (измеряли максимум 9 дней). Дозу испытываемых веществ определяли на основе самой последней измеренной массы тела.
Кроме того, после введения испытываемых веществ мышам потребление пищи измеряли каждый день, и количество пищи измеряли с использованием электронных весов в каждом боксе для разведения, и затем измеряли остаточное количество для расчета суточного потребления пищи. Индивидуумы, потреблявшие слишком большое количество пищи, были исключены из измерения.
Все экспериментальные результаты, полученные в этом примере, были представлены в виде среднего значения ± стандартное отклонение и были проверены при помощи Prism5 (версия 5.01). Для всех данных осуществляли односторонний дисперсионный анализ (ANOVA), и когда наблюдали значимость, применяли критерий Даннета, чтобы найти исследуемую группу со значимым отличием от контрольной группой (уровень значимости: обе стороны 5% и 1%, 0,1%).
2.1.2. IgG4-GDF и IgG4-GDF (CRL)
Испытываемые вещества (IgG4-GDF и IgG4-GDF(CRL)) и контрольное вещество Семаглутид (Bachem) вводили подкожно. Доза всех контрольного вещества и испытываемых веществ составляла 5 мл/кг, и индивидуальную дозу рассчитывали на основании недавно измеренной массы тела, и их вводили подкожно один раз в день начала испытания с использованием одноразового шприца. Испытываемые вещества вводили только один раз в день начала испытания, и для сравнения подготавливали контрольную группу, которой вводили контрольное вещество Семаглутид. Что касается группы сравнения, в которой вводили Семаглутид, Семаглутид вводили каждый день один раз в день. Все введения осуществляли с 9 часов утра.
Состав испытываемой группы, вводимая доза и т.п. представлены в следующей Таблице 8:
Состав группы введения слитого полипептида IgG4-GDF15
Обследование, измерение и график исследования для испытываемых групп были установлены День 0 для начала введения, и их выполняли так же, как в 2.1.1.
Массу тела каждой мыши измеряли в день начала введения испытываемых веществ (перед введением), и затем массу тела измеряли каждый день (измеряли максимум 19 дней). Дозу испытываемых веществ определяли на основании самой последней измеренной массы тела.
Кроме того, после введения испытываемых веществ мышам потребление пищи измеряли каждый день, и количество пищи измеряли с использованием электронных весов в каждом боксе для разведения, и затем измеряли остаточное количество для расчета суточного потребления пищи. Индивидуумы, потреблявшие слишком большое количество пищи, были исключены из измерения.
2.2. Результат испытания по снижению массы тела
2.2.1. HIgG1-GDF (CRL) и IgG1-GDF(CRL)
Изменение массы тела, измеренное в Примере 2.1.1, показано на Фиг. 5 и Фиг. 6, и в Таблице 9 (Масса тела (Группа, % от исходного уровня).
Фиг. 5 и Таблица 9 показывают изменение массы тела после однократного введения слитого белка IgG1-GDF по сравнению с группой отрицательного контроля (группа введения носителя) и группой положительного контроля (группа ежедневного введения GDF15). Кроме того, Фиг. 6 представляет график, извлекающий и показывающий результат через 7 дней из результатов на Фиг. 5.
Как показано в результатах, может быть подтверждено, что было небольшое изменение массы тела в группе отрицательного контроля (группа введения носителя), в то время как эффект потери массы тела исчезал с Дня 6, первого дня после прекращения введения в случае группы ежедневного введения GDF15 (прекращение введения с Дня 5). С другой стороны, может быть подтверждено, что эффект снижения массы тела проявлялся сразу после однократного введения в День 0 в случае слитого полипептида, в котором GDF15(CRL) был слит с IgG1 или Fc, включающим шарнирную область, и эффект снижения массы тела не снижался и постоянно проявлялся в течение всего периода испытания (9 дней), и с течением времени связанный с концентрацией эффект потери массы тела увеличивался, и эффект потери массы тела зависел от концентрации. Можно сказать, что этот эффект потери массы тела, демонстрируемый слитым полипептидом, сопоставим с GDF15 при введении один раз в день в течение всего периода испытания.
2.2.2. IgG4-GDF и IgG4-GDF(CRL)
Изменение массы тела, измеренное в Примере 2.1.2, показано на Фиг. 7 и в Таблице 10 (Масса тела (Группа, % от исходного уровня).
(Однократное введение)
(Ежедневное введение)
(Однократное введение)
(Однократное введение)
(Однократное введение)
(Однократное введение)
(Однократное введение)
(Ежедневное введение)
(Однократное введение)
(Однократное введение)
(Однократное введение)
(Однократное введение)
Фиг. 7 и Фиг. 8, а также Таблица 10 показывают изменение массы тела после однократного введения слитого белка IgG4-GDF15 IgG4-GDF (CRL) по сравнению с группой отрицательного контроля (группа введения носителя) и группой положительного контроля (группа ежедневного введения Семаглутида). Кроме того, Фиг. 8 представляет график, извлекающий и показывающий результат через 7 дней и 14 дней из результатов на Фиг. 7.
Как показано в результатах, может быть подтверждено, что масса тела немного увеличивалась в случае группы отрицательного контроля (группа введения носителя), в то время как потеря массы тела была постоянной в случае группы положительного контроля (группа ежедневного введения семаглутида). При однократном введении IgG4-GDF15 независимо от дозы эффект потери массы тела длился до 9 дней. С другой стороны, может быть подтверждено, что эффект снижения массы тела постоянно проявлялся до 10 дней при однократном введении 1 нмоль/кг IgG4-GDF(CRL) и до 15 дней при однократном введении 10 нмоль/кг, и с течением времени связанные с концентрацией эффект потери массы тела увеличивался, и эффект потери массы тела зависел от концентрации. Кроме того, было подтверждено, что слитый полипептид GDF (CRL) с Fc (мутантный) IgG4 без шарнирной области имел превосходный эффект потери массы тела при той же дозе по сравнению с GDF (CRL) слитым полипептидом с Fc (мутантный) IgG4, включающим шарнирную область. Можно сказать, что эффект снижения массы тела этого IgG4 Fc слитого полипептида был сопоставимым с тем, когда Семаглутид вводят один раз в день в течение всего периода испытания.
2.3. Результат испытания по оценке потребления пищи
2.3.1. HIgG1-GDF (CRL) и IgG1-GDF(CRL)
Изменение потребления пищи, измеренное в Примере 2.1.1, показано в Таблице 11 и на Фиг. 9 (кумулятивное потребление пищи за 6 дней), соответственно.
Как показано в результате, может быть подтверждено, что группа введения слитого полипептида, в котором GDF (CRL) слит с IgG1 Fc, включающим шарнирную область, или Fc IgG1, не включающим шарнирную область, продемонстрировала эффект снижения потребления пищи во время испытания (9 дней), по сравнению с группой введения отрицательного контроля (группа введения носителя), и эффект снижения потребления пищи зависел от концентрации. Этот эффект снижения потребления пищи слитого полипептида можно считать сопоставимым с тем, когда GDF15 вводят один раз в день в течение всего периода испытания.
2.3.2. IgG4-GDF и IgG4-GDF(CRL)
Изменение потребления пищи, измеренное в Примере 2.1.2, показано в Таблице 12 и на Фиг. 10 (кумулятивное потребление за 7 дней, 14 дней и 19 дней).
Как показано в результате, может быть подтверждено, что группа введения слитого полипептида, в котором GDF15 или GDF (CRL) слит с IgG4 (мутантный), не включающим шарнирную область, продемонстрировала эффект снижения потребления пищи во время испытания (19 дней), по сравнению с группой введения отрицательного контроля (группа введения носителя). Этот эффект снижения потребления пищи слитого полипептида можно считать сопоставимым с тем, когда Семаглутид вводят один раз в день в течение всего периода испытания. При сравнении групп введения 10 нмоль/кг слитого полипептида, в котором GDF15 или GDF (CRL) слит с IgG4 Fc (мутантный), не включающим шарнирную область, в случае группы введения полноразмерного слитого полипептида, GDF15-слитого, способность к подавлению приема пищи поддерживалась в течение примерно 10 дней, а в случае группы введения слитого полипептида, GDF(CRL)-слитого, способность к подавлению приема пищи поддерживалась в течение примерно 2 недель. Другими словами, было подтверждено, что GDF (CRL) слитый полипептид имел несколько более превосходный эффект потери массы тела при дозе 10 нмоль/кг по сравнению с полноразмерным GDF15 слитым полипептидом.
Пример 3. Фармакодинамическое испытание слитого полипептида (IgG4-GDF или IgG4-GDF(CRL))
3.1. Получение образцов сыворотки исследуемой группы и контрольной группы
Для оценки фармакодинамических характеристик, когда каждый полипептид вводили крысам подкожно, полипептид IgG4-GDF или IgG4-GDF (CRL) вводили подкожно в количестве 2 мг/кг, соответственно, крысам SD (Koatech, самцы, 7 недель, около 250 г; n=3 каждая; исследуемая группа), и в установленное время собирали кровь примерно 200 мл через хвостовую вену. Сбор крови осуществляли перед введением слитого полипептида и через 1, 2, 4, 8, 24, 48, 72, 96, 168, 240 и 336 часов после введения. В качестве контрольной группы для сравнения фармакодинамических характеристик, GDF15 (R&D Systems) вводили подкожно в количестве 2 мг/кг тем же способом, что и выше, для подготовки группы введения GDF15.
После введения крысам SD, как указано выше, кровь, собранную в определенный момент времени, центрифугировали для получения сыворотки и осуществляли ELISA с использованием иммуноанализа GDF15 человека (SGD150, R&D Systems) для измерения концентрации в сыворотке с течением времени для каждого полипептида. Используя эти данные, получали значения параметров, включая AUC (площадь под кривой), с использованием программного обеспечения для PK анализа (WinNonlin (Certara L.P.) et al.).
3.2 Результат фармакодинамического испытания
Полученные фармакодинамические параметры слитого полипептида показаны в таблице 13, а изменение концентрации слитого полипептида с течением времени показано на Фиг. 11:
Как показано в результате, может быть подтверждено, что по сравнению с GDF15 (период полужизни: 19 часов), в случае слитых белков IgG4-GDF15 (период полужизни: 101 час) и IgG4-GDF (CRL) (период полужизни: 114 часов), стабильность в крови (сыворотке) значительно повышалась (в 5 и более раз).
Из приведенного выше описания специалисты в области техники, к которой относится настоящее изобретение, поймут, что настоящее изобретение может быть реализовано в других конкретных формах без изменения его технической сущности или существенных характеристик. В этом отношении описанные выше варианты осуществления следует понимать как иллюстративные и не ограничивающие во всех аспектах. Объем настоящего изобретения следует рассматривать как включающий все измененные или модифицированные формы, вытекающие из смысла и объема формулы изобретения, которая будет описана ниже, и их эквивалентные концепции, а не приведенное выше подробное описание.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> LG CHEM, LTD.
<120> СЛИТЫЙ ПОЛИПЕПТИД, ВКЛЮЧАЮЩИЙ FC ОБЛАСТЬ ИММУНОГЛОБУЛИНА И
GDF15
<130> OPP20200894KR
<150> KR 10-2019-0047558
<151> 2019-04-23
<160> 18
<170> KopatentIn 3.0
<210> 1
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> зрелый GDF15 (дикий тип)
<400> 1
Ala Arg Asn Gly Asp His Cys Pro Leu Gly Pro Gly Arg Cys Cys Arg
1 5 10 15
Leu His Thr Val Arg Ala Ser Leu Glu Asp Leu Gly Trp Ala Asp Trp
20 25 30
Val Leu Ser Pro Arg Glu Val Gln Val Thr Met Cys Ile Gly Ala Cys
35 40 45
Pro Ser Gln Phe Arg Ala Ala Asn Met His Ala Gln Ile Lys Thr Ser
50 55 60
Leu His Arg Leu Lys Pro Asp Thr Val Pro Ala Pro Cys Cys Val Pro
65 70 75 80
Ala Ser Tyr Asn Pro Met Val Leu Ile Gln Lys Thr Asp Thr Gly Val
85 90 95
Ser Leu Gln Thr Tyr Asp Asp Leu Leu Ala Lys Asp Cys His Cys Ile
100 105 110
<210> 2
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> ДельтаN14GDF15
<400> 2
Cys Arg Leu His Thr Val Arg Ala Ser Leu Glu Asp Leu Gly Trp Ala
1 5 10 15
Asp Trp Val Leu Ser Pro Arg Glu Val Gln Val Thr Met Cys Ile Gly
20 25 30
Ala Cys Pro Ser Gln Phe Arg Ala Ala Asn Met His Ala Gln Ile Lys
35 40 45
Thr Ser Leu His Arg Leu Lys Pro Asp Thr Val Pro Ala Pro Cys Cys
50 55 60
Val Pro Ala Ser Tyr Asn Pro Met Val Leu Ile Gln Lys Thr Asp Thr
65 70 75 80
Gly Val Ser Leu Gln Thr Tyr Asp Asp Leu Leu Ala Lys Asp Cys His
85 90 95
Cys Ile
<210> 3
<211> 217
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG1-Fc (UniProtKB P01857) CH2-CH3
<400> 3
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG1-Fc (UniProtKB P01857) коровая шарнирная область
<400> 4
Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
<210> 5
<211> 217
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) CH2-CH3 (общий)
<220>
<221> MOD_RES
<222> (4)
<223> Xaa представляет собой Phe или Ala
<220>
<221> MOD_RES
<222> (5)
<223> Xaa представляет собой Leu или Ala
<220>
<221> MOD_RES
<222> (217)
<223> Xaa отсутствует или Lys
<400> 5
Ala Pro Glu Xaa Xaa Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Xaa
210 215
<210> 6
<211> 217
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) CH2-CH3 (дикий тип)
<400> 6
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 7
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) CH2-CH3 (мутантный)
<400> 7
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly
210 215
<210> 8
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) CH2-CH3 (мутантный)
<400> 8
Ala Pro Glu Ala Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly
210 215
<210> 9
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) CH2-CH3 (мутантный)
<400> 9
Ala Pro Glu Phe Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly
210 215
<210> 10
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) шарнирная область (общий)
<220>
<221> MOD_RES
<222> (10)
<223> Xaa представляет собой Ser или Pro
<400> 10
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Xaa Cys Pro
1 5 10
<210> 11
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) шарнирная область (дикий тип)
<400> 11
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 12
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> человеческий IgG4-Fc (UniProtKB P01861) шарнирная область (мутированный)
<400> 12
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 13
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> пептидный линкер
<400> 13
Gly Gly Gly Gly Ser
1 5
<210> 14
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> GDF15 кодирующий ген
<400> 14
gcccggaacg gcgaccactg ccccctgggg cccggacggt gctgccggct gcacaccgtg 60
cgggcctccc tggaggacct gggctgggcc gactgggtgc tgtccccaag ggaggtgcaa 120
gtgaccatgt gcatcggcgc ctgcccatct cagttccggg ccgccaacat gcacgctcag 180
atcaagacca gcctgcaccg gctgaagccc gacaccgtgc ccgccccctg ctgcgtgccc 240
gcctcctaca accccatggt gctgattcag aagaccgaca ccggcgtgag cctgcagacc 300
tacgacgacc tgctggccaa ggactgccac tgcatctaa 339
<210> 15
<211> 678
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1-Fc кодирующий ген
<400> 15
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 60
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 120
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 180
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 240
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 300
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 360
gggcagcccc gagaaccaca ggtgtatacc ctgcccccat cccgggatga gctgaccaag 420
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 480
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 540
gacggctcct tcttcctcta cagcaagctc accgtggaca agagcaggtg gcagcagggg 600
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 660
ctctccctgt ctccgggt 678
<210> 16
<211> 684
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG4-Fc кодирующий ген
<400> 16
gagtccaaat atggtccccc atgcccaccc tgcccagcac ctgaggccgc cgggggaccg 60
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 120
gtcacgtgcg tggtggtgga cgtgtcccag gaggaccccg aggtgcagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaactcc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggag 300
tacaagtgca aggtgtccaa caagggcctg ccctcctcca tcgagaagac catctccaag 360
gccaagggcc agccccggga gccccaggtg tacaccctgc ccccctccca ggaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctacccctc cgacatcgcc 480
gtggagtggg agtccaacgg ccagcccgag aacaactaca agaccacccc ccccgtgctg 540
gactccgacg gctccttctt cctgtactcc cggctgaccg tggacaagtc ccggtggcag 600
gagggcaacg tgttctcctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagtccctgt ccctgtccct gggc 684
<210> 17
<211> 22
<212> Белок
<213> Искусственная последовательность
<220>
<223> Сигнальный пептид
<400> 17
Met His Arg Pro Glu Ala Met Leu Leu Leu Leu Thr Leu Ala Leu Leu
1 5 10 15
Gly Gly Pro Thr Trp Ala
20
<210> 18
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> пептидный линкер
<400> 18
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| СЛИТЫЙ ПОЛИПЕПТИД, ВКЛЮЧАЮЩИЙ GDF15 И ПОЛИПЕПТИДНУЮ ОБЛАСТЬ, СПОСОБНУЮ К О-ГЛИКОЗИЛИРОВАНИЮ | 2020 |
|
RU2812049C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| АНТИТЕЛА К CD38 И КОМБИНАЦИИ С АНТИТЕЛАМИ К CD3 И CD28 | 2018 |
|
RU2812910C2 |
| НОВЫЙ МОДИФИЦИРОВАННЫЙ СЛИТЫЙ БЕЛОК FC-ФРАГМЕНТА ИММУНОГЛОБУЛИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800919C2 |
| СЛИТЫЕ БЕЛКИ IL-10/FC, ПРИГОДНЫЕ В КАЧЕСТВЕ ЭНХАНСЕРОВ ИММУНОТЕРАПИИ | 2020 |
|
RU2825306C1 |
| ТРИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, СВЯЗЫВАЮЩИЕ CD38, CD28 И CD3, А ТАКЖЕ СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНОЙ ИНФЕКЦИИ | 2019 |
|
RU2820351C2 |
| ПОЛИВАЛЕНТНЫЕ МОДУЛЯТОРЫ РЕГУЛЯТОРНЫХ T-КЛЕТОК | 2017 |
|
RU2769871C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
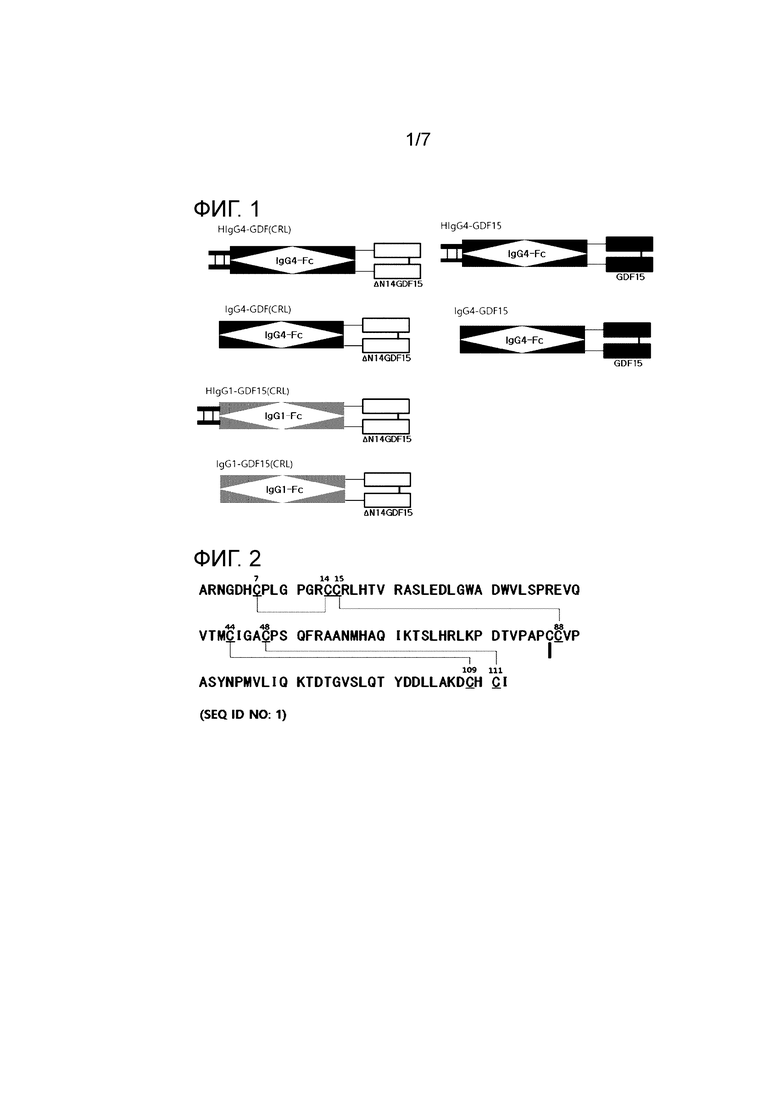
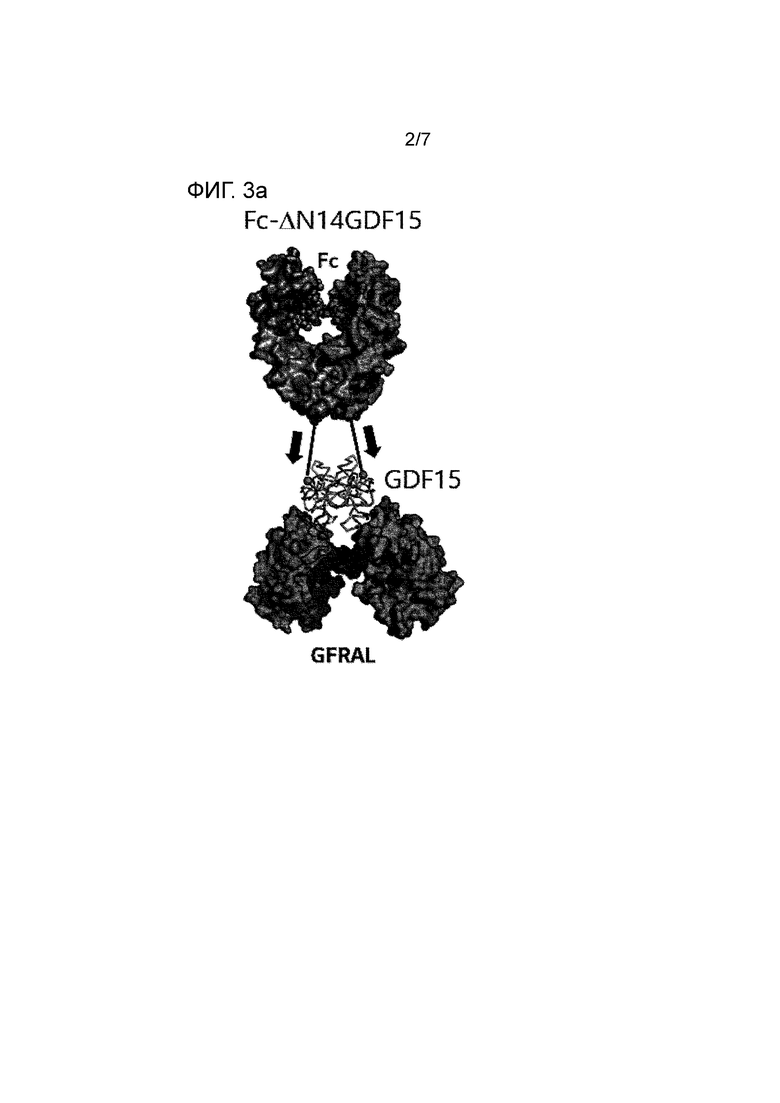
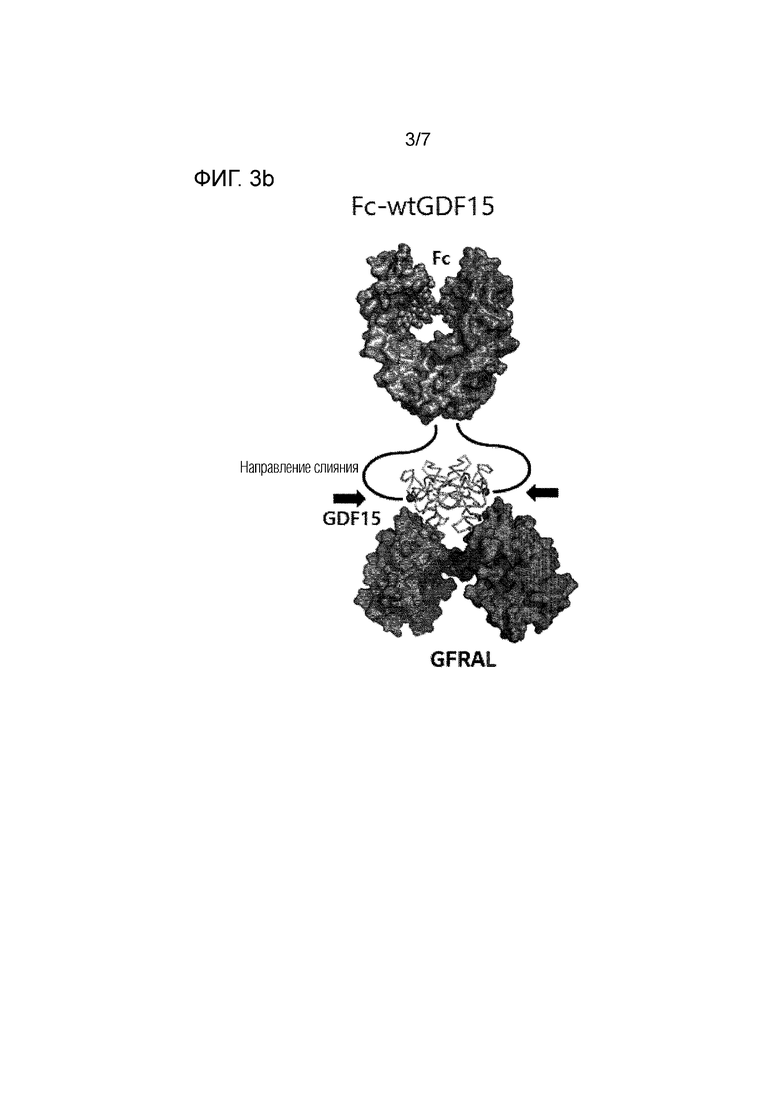
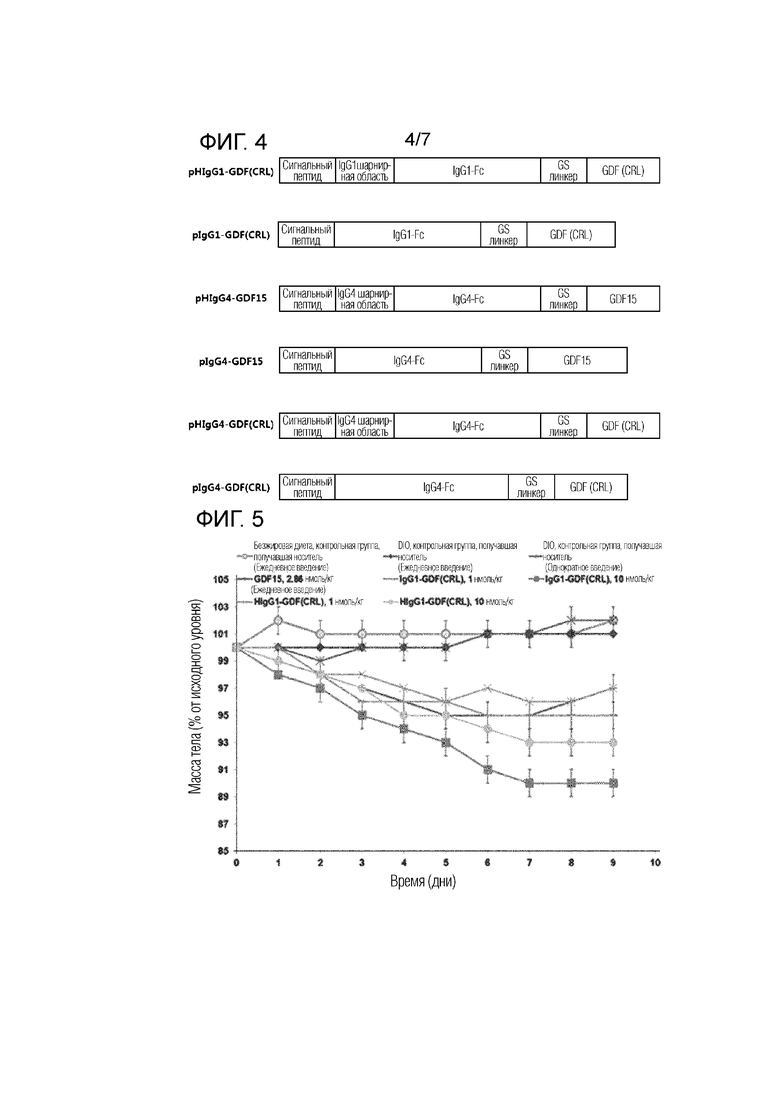
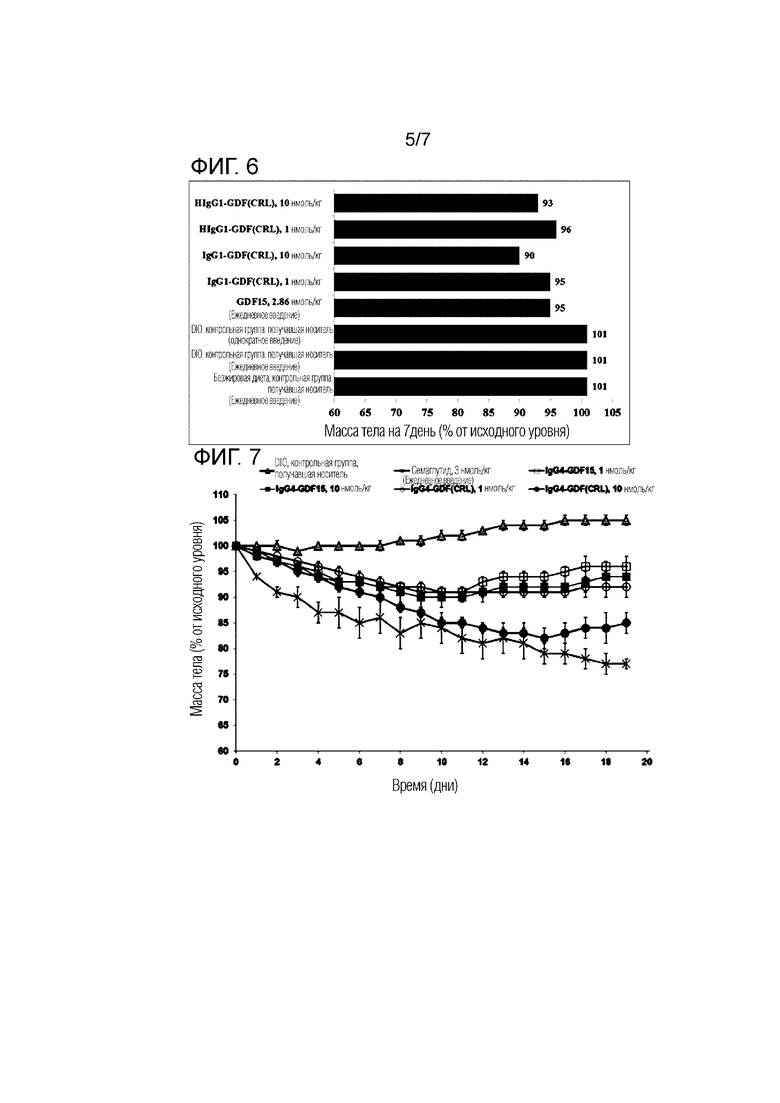
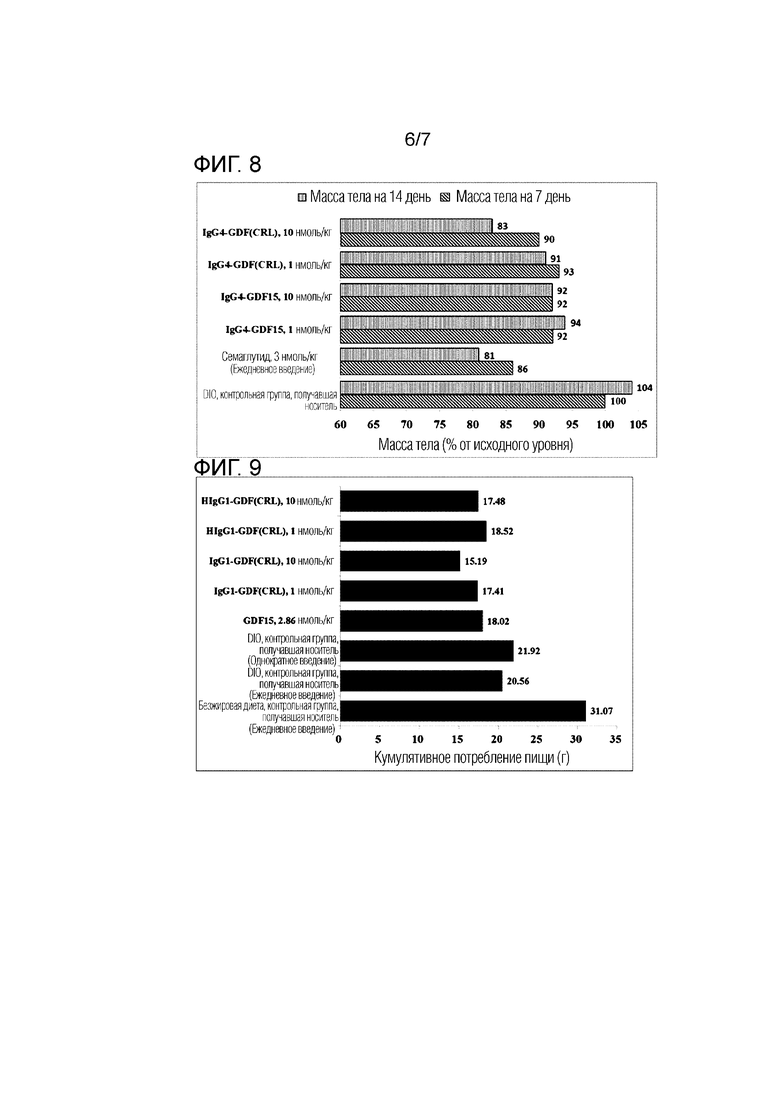
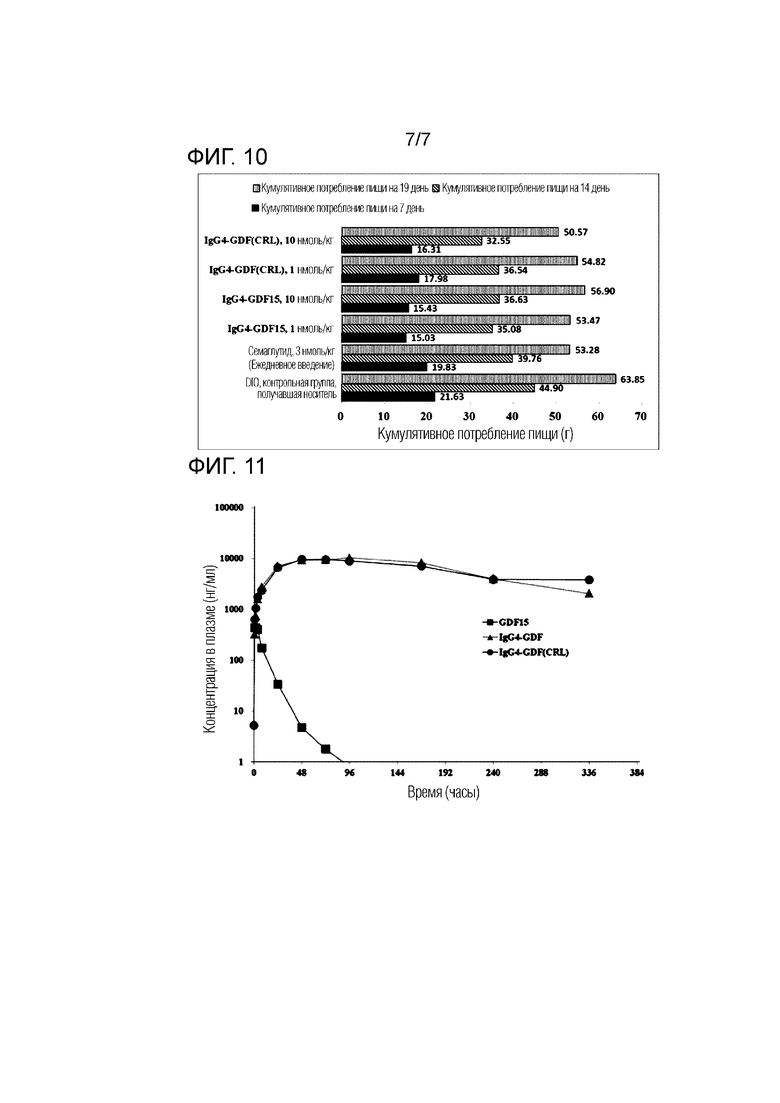
Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению слитых белков на основе Фактора роста/дифференцировки 15 (GDF15) и может быть использовано в медицине для снижения массы тела, контроля режима питания и профилактики или лечения метаболического заболевания. Сконструирован слитый полипептид, включающий GDF15 или его функциональный делетированный вариант, к N-концу которого присоединена одна цепь Fc области человеческого IgG4 через гибкий пептидный линкер. Изобретение позволяет получить слитый полипептид с увеличенным периодом существования GDF15 in vivo. 10 н. и 9 з.п. ф-лы, 11 ил., 13 табл., 3 пр.
1. Слитый полипептид, имеющий повышенный период существования GDF15 in vivo, включающий GDF15 (Фактор роста/дифференцировки 15) или его функциональный вариант и Fc область иммуноглобулина, где
Fc область иммуноглобулина представляет собой одну цепь Fc области человеческого IgG4 и связана с N-концом GDF15 или его функционального варианта через гибкий пептидный линкер,
функциональный вариант GDF15 представляет собой вариант с делецией, в котором по меньшей мере одна из 14 аминокислот в положениях с 1 по 14 аминокислотной последовательности SEQ ID NO: 1 делетирована, Fc область человеческого IgG4 содержит аминокислотную последовательность SEQ ID NO: 7, и
гибкий пептидный линкер представлен (GGGGS)n, где n имеет значение 1, 2, 3, 4 или 5.
2. Слитый полипептид по п. 1, где Fc область человеческого IgG4 дополнительно включает аминокислотную последовательность SEQ ID NO: 10 на N-конце аминокислотной последовательности SEQ ID NO: 7.
3. Слитый полипептид по п. 2, где Fc область человеческого IgG4 дополнительно включает аминокислотную последовательность SEQ ID NO: 11 или SEQ ID NO: 12 на N-конце аминокислотной последовательности SEQ ID NO: 7.
4. Слитый полипептид по п. 1, где функциональный вариант GDF15 включает аминокислотную последовательность SEQ ID NO: 2.
5. Слитый полипептид по любому из пп. 1-4, где GDF15 или его функциональный вариант, связанный с Fc областью иммуноглобулина в слитом полипептиде, имеет по меньшей мере 1,5-кратно увеличенный период полужизни in vivo по сравнению с GDF15 или его функциональным вариантом, который не связан с Fc областью иммуноглобулина.
6. Димер слитого полипептида, имеющий повышенный период существования GDF15 in vivo, включающий два слитых полипептида по любому из пп. 1-4.
7. Молекула нуклеиновой кислоты, кодирующая слитый полипептид по любому из пп. 1-4.
8. Рекомбинантный вектор экспрессии, включающий молекулу нуклеиновой кислоты по п. 7.
9. Рекомбинантная клетка для получения слитого полипептида по п. 1, включающая рекомбинантный вектор по п. 8, где клетка не является эмбриональной клеткой человека.
10. Способ получения слитого полипептида по п. 1, где слитый полипептид включает GDF15 или его функциональный вариант и Fc область иммуноглобулина IgG4, где способ включает культивирование рекомбинантной клетки по п. 9.
11. Способ получения слитого полипептида по п. 1, включающий связывание одной цепи Fc области человеческого IgG4 с N-концом GDF15 или его функционального варианта через гибкий пептидный линкер,
где функциональный вариант GDF15 представляет собой вариант с делецией, в котором по меньшей мере одна из 14 аминокислот положениях с 1 по 14 аминокислотной последовательности SEQ ID NO: 1 делетирована, Fc область человеческого IgG4 содержит аминокислотную последовательность SEQ ID NO: 7, и гибкий пептидный линкер представлен (GGGGS)n, где n имеет значение 1, 2, 3, 4 или 5.
12. Способ по п. 11, где Fc область человеческого IgG4 дополнительно включает аминокислотную последовательность SEQ ID NO: 10 на N-конце аминокислотной последовательности SEQ ID NO: 7.
13. Способ по п. 12, где Fc область человеческого IgG4 дополнительно включает аминокислотную последовательность SEQ ID NO: 11 или SEQ ID NO: 12 на N-конце аминокислотной последовательности SEQ ID NO: 7.
14. Способ по п. 11, где функциональный вариант GDF15 включает аминокислотную последовательность SEQ ID NO: 2.
15. Способ по любому из пп. 11-14, где GDF15 или его функциональный вариант, связанный с Fc областью иммуноглобулина в слитом полипептиде, имеет по меньшей мере 1,5-кратно увеличенный период полужизни in vivo по сравнению с GDF15 или его функциональным вариантом, который не связан с Fc областью иммуноглобулина.
16. Композиция для снижения массы тела, включающая эффективное количество по меньшей мере одного, выбранного из группы, состоящей из:
слитого полипептида по любому из пп. 1-4,
димера слитого полипептида по п. 6, включающего два из слитых полипептидов,
молекулы нуклеиновой кислоты по п. 7, кодирующей слитый полипептид,
рекомбинантного вектора по п. 8, включающего молекулу нуклеиновой кислоты, и
рекомбинантной клетки по п. 9, включающей рекомбинантный вектор; и
фармацевтически приемлемый носитель.
17. Композиция для контроля режима питания, включающая эффективное количество по меньшей мере одного, выбранного из группы, состоящей из:
слитого полипептида по любому из пп. 1-4,
димера слитого полипептида по п. 6, включающего два из слитых полипептидов,
молекулы нуклеиновой кислоты по п. 7, кодирующей слитый полипептид,
рекомбинантного вектора по п. 8, включающего молекулу нуклеиновой кислоты, и
рекомбинантной клетки по п. 9, включающей рекомбинантный вектор; и
фармацевтически приемлемый носитель.
18. Фармацевтическая композиция для профилактики или лечения метаболического заболевания, включающая эффективное количество по меньшей мере одного, выбранного из группы, состоящей из:
слитого полипептида по любому из пп. 1-4,
димера слитого полипептида по п. 6, включающего два из слитых полипептидов,
молекулы нуклеиновой кислоты по п. 7, кодирующей слитый полипептид,
рекомбинантного вектора по п. 8, включающего молекулу нуклеиновой кислоты, и
рекомбинантной клетки по п. 9, включающей рекомбинантный вектор; и
фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п. 18, где метаболическое заболевание представляет собой ожирение, диабет или неалкогольную жировую болезнь печени.
| US2014378665 A1, 25.12.2014, EA 201690297 A1, 30.06.2016, EA 201790405 A1, 29.09.2017, EP3144320 A1, 22.03.2017, WO 2015017710 A1, 05.02.2015, КУЗНЕЦОВА Е.А., СКОБКИ В ТЕКСТЕ ПРАВОВОГО ДОКУМЕНТА КАК ЛИНГВОКОГНИТИВНЫЙ ФЕНОМЕН, Вестник МГОУ | |||
| Серия: Русская филология, 2015, н.3, с.37-43. |
Авторы
Даты
2023-06-06—Публикация
2020-04-22—Подача