Изобретение относится к области биологии и медицины, а именно к химиотерапии злокачественных новообразований.
По данным Всемирной Организации Здравоохранения, заболеваемость онкологическими заболеваниями во всем мире постоянно возрастает, и, по оценкам ученых, к 2040 году число ежегодных новых случаев достигнет 28,4 млн человек. Основной прирост заболеваемости придется на развивающиеся страны, в том числе на Россию. По данным Минздрава РФ, в 2018 году было выявлено 425 случаев всех видов рака на 100 тысяч населения. В абсолютных цифрах это 624,7 тысяч человек. По оценке ведомства, сейчас в России живут 3,7 млн человек, больных каким-либо онкологическим заболеванием (около 2,6 тысяч человек на 100 тысяч населения).
Химиотерапия широко применяется в клинической практике для лечения больных со злокачественными заболеваниями, особенно распространенными, как в монорежиме, так и в сочетании с другими методами лечения (хирургическим, лучевым). Широкий спектр химиопрепаратов позволяет эффективно воздействовать на патологический очаг и добиваться регрессии опухоли, несмотря на стадию заболевания и гистологическую степень злокачественности.
Таксаны - современные препараты на основе паклитаксела - действующего вещества растительного происхождения, которое получают полусинтетическим путем из игл тиса европейского (Taxus baccata), широко применяются в схемах химотерапии. Механизм их действия связан со способностью стимулировать сборку микротрубочек из димерных молекул тубулина, стабилизировать их структуру и тормозить динамическую реорганизацию в интерфазе, что нарушает митотическую функцию клетки.
Ограничивающим фактором расширения применения таксанов является недостаточность химической базы для производства субстанции паклитаксел - основного действующего компонента. Источником паклитаксела является кора отдельных видов тиса. Однако поскольку содержание активных веществ в коре незначительно, для получения 1 кг паклитаксела необходимо 9-12 тонн коры, для получения которой, в свою очередь, необходимо срубить 2000-4000 деревьев. Из этого количества исходного сырья может быть произведено готового лекарства на 15 тыс. курсов лечения. Таким образом, низкое содержание активных веществ в исходном сырье определяет высокую стоимость субстанции паклитаксела. Другим следствием является то, что удовлетворение ежегодной потребности в производстве лекарственных форм из субстанции паклитаксела в перспективе может привести к уничтожению всей популяции тиса. Следовательно, производство паклитаксела из природных источников в нужном объеме нанесет существенный урон лесным экосистемам. Попытки получить паклитаксел с помощью химического синтеза для крупномасштабного коммерческого получения данного вещества успехом не увенчались из-за своей сложности и высокой стоимости.
Большинство производителей в настоящее время пользуется технологией экстракции из природного растительного сырья, поэтому, несмотря на значительные производственные мощности, субстанция остается чрезвычайно дорогой. Цена субстанции паклитаксела составляет 200-600 долларов США за 1 г в зависимости от качества и производителя.
Поскольку препараты на основе паклитаксела включены в схемы химиотерапии больных различными злокачественными заболеваниями, и являются чрезвычайно востребованными (необходимо около 10 млн доз ежегодно), поиск эффективного способа получения препарата сходного механизма действия и эффективности является актуальной задачей.
В настоящее время самым известным цитостатическим агентом из ряда стильбенов, влияющим на полимеризацию белка тубулина в клетке, является Комбретастатин СА4 (Фиг. 1), который был выделен в 1988 году из семян южного растения Combretumcaffrum. Несмотря на очень высокие показатели цитотоксичности (IC50 ≈ 5 × 10-9 моль/л), полученные in vitro, данное вещество не нашло применения в медицинской практике из-за своего физического строения. Наиболее активная форма - Комбретастатин СА4 (Фиг. 1) существует в цис-положении, которое в живом организме под действием ферментов легко переходит в мало токсичное для опухолевых клеток транс-положение. Многочисленные попытки затормозить обращение цис-формы Комбретастатина СА4 путем введения различных заместителей в ядра А и В к успеху не привели. Любое отклонение от канонической формы молекулы Комбретастатина СА4 приводило к резкому снижению цитотоксичности в отношении опухолевых клеток.
Одним из направлений исследований производных Комбретастатина СА4 был синтез производных с заместителями при двойной связи молекулы стильбена, которые тормозили бы переход цис-формы в транс-форму.
Было установлено, что торможение молекулы Комбретастатина СА4 в положении цис-формы с помощью нитрильной группы -CN позволяет получать высокоактивные соединения - ингибиторы молекулы белка тубулина опухолевых клеток с величиной активности IC50 ≈ 2,5 × 10-8 моль, что соответствовало активности Комбретастатина СА4.
Было также установлено, что для высокой цитотоксичности не обязательным условием является наличие трех метоксильных групп в ядре А.
Многочисленные попытки расположить между ароматическими ядрами А и В молекулы Комбретастатина СА4 различные гетероциклические структуры к успеху не привели. Цитотоксичность модифицированных молекул была ниже по сравнению с исходным Комбретастатином СА4 в 50 000 - 100 000 раз.
В ходе анализа биологически активных молекул - производных Комбретастатина СА4 было сделано предположение о перспективности получения гетероцикла с использованием двойной связи самого Комбретастатина СА4. Предполагалось, что синтезированные молекулы буду обладать определенной жесткостью в отношении конформационных изменений, и в результате более активно воздействовать на тубулин чем исходный Комбретастатин СА4. При таком расположении гетероцикла по отношению к ядрам Комбретастатина СА4цис-положение не только сохраняется, но и усиливается.
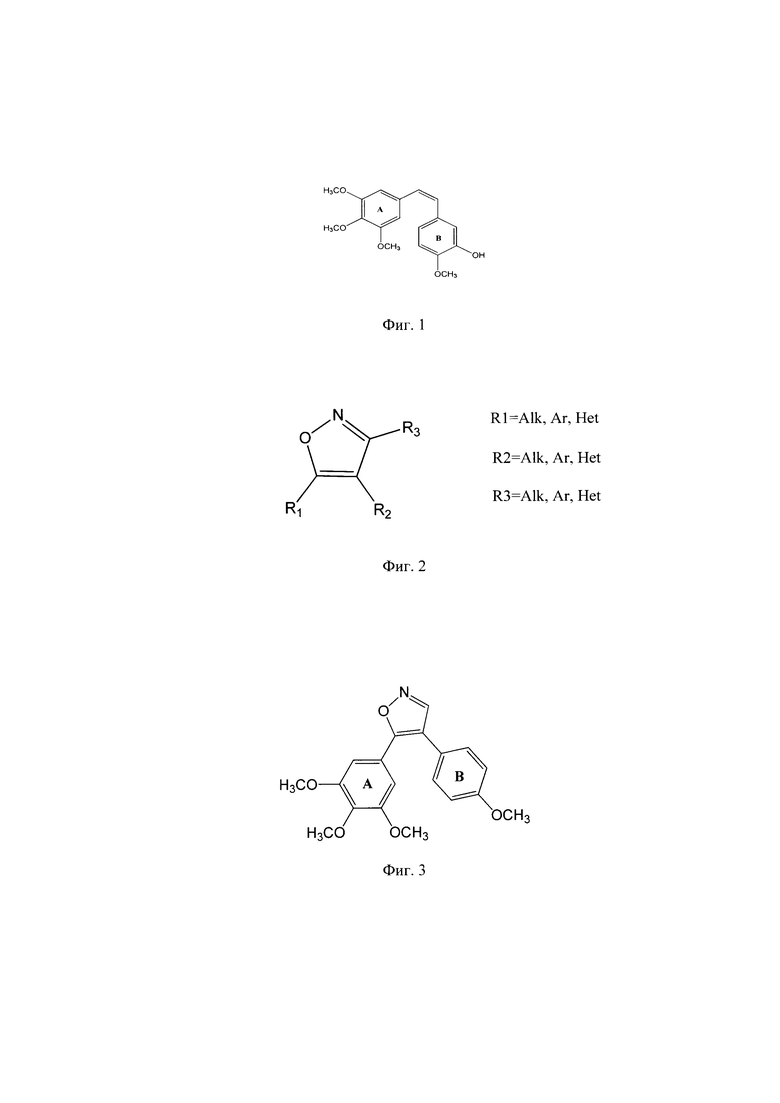
Наиболее близкие структуры, которые могут быть использованы как прототип, представлены в патенте US 9090603 (2015), в котором представлен синтез разнообразных 4,5-диарилоксазолов (Фиг. 2), где R1=замещенные арил, гетерил, ароил- и др.; R2=замещенные арил, гетерил, ароил- и др.; R3=алкил, арил, гетерил.
Из вышеназванного патента следовало описание изоксазола А (Фиг. 3), где R3=H, R1=-Ph(OCH3)3, R2=-Ph(OCH3), который проявляет цитотоксичность in vitro в отношении различных опухолевых клеток в интервале IC50 ≈ 2-7 × 10-9 моль/л.
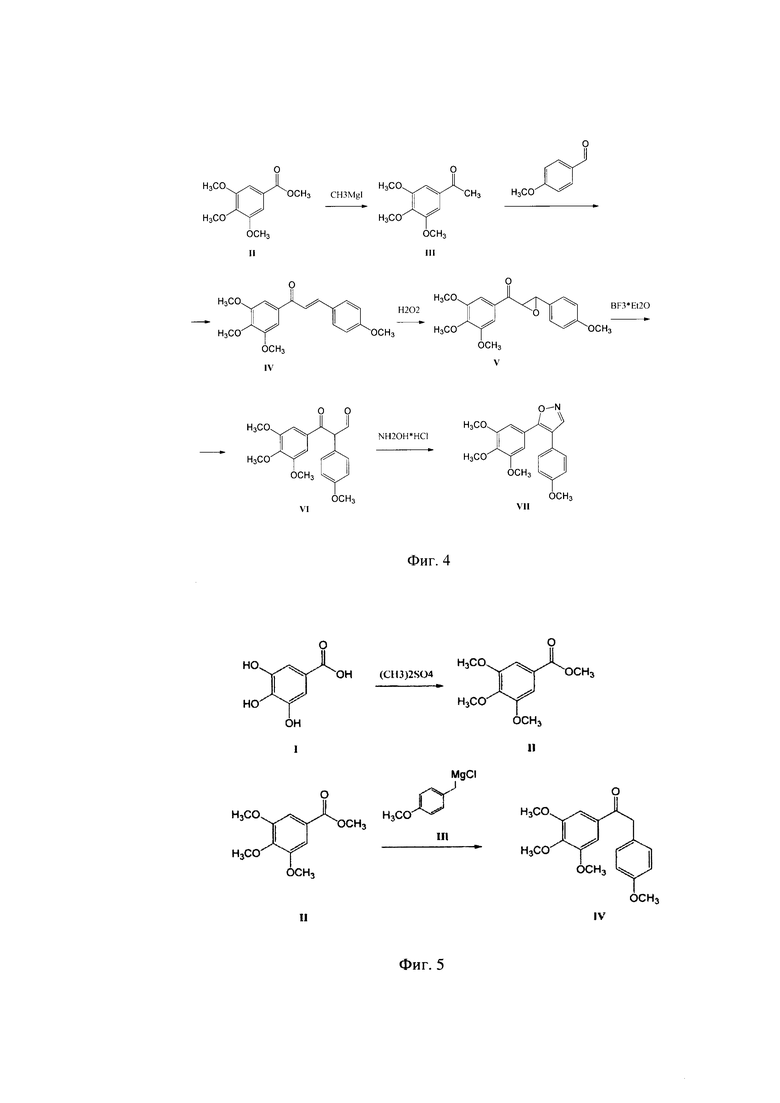
Согласно сведениям (US 9090603) 4,5-диарилизоксазолы получались в результате многостадийного синтеза, который заключался в конденсации замещенного арилкетона с производными бензальдегида с образованием соответствующего халкона, с последующим многочасовым воздействием перекиси водорода с образованием соответствующего оксирана. На следующей стадии раскрытие кислородного цикла происходит под действием эфирата трехфтористого бора, с образованием соответствующего кето-альдегида, который впоследствии взаимодействует с гидроксиламином, с образованием соответствующего 4,5-диарилизоксазола. Таким образом, были получены неизвестные ранее 4,5-диарилизоксазолы, цитостатическая активность которых была или на уровне или несколько ниже Комбретастатина СА-4. Общая схема получения 4,5-диарилизоксазолов на примере получения 4-(4-метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазола представлена на схеме 1 (Фиг. 4).
Согласно вышеописанной схеме 1 (Фиг. 4), были получены многочисленные замещенные 4,5-диарилизоксазолы. Однако авторами патента US 9090603 была упущена возможность получения еще более активных соединений, а именно 4,5-диарилпиразолов, которые могли быть получены при обработке кето-ацеталя (V) гидразин-гидратом или солями гидразина и минеральных кислот. Некоторые из полученных 4,5-диарилпиразолов показали очень высокую антипролиферативную активность, превышающую активность Комбретастатина СА-4 практически на 3 порядка.
При изучении вышеприведенной схемы 1 (Фиг. 4) получения 4,5-диарилизоксазолов оказалось, что один из наиболее активных изоксазолов - 4-(4-метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазол, описан в патенте некорректно. Так, в экспериментальной части патента US 9090603 (2015), наиболее активный 4-(4-метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазол описан как вещество светло-желтого цвета и с неопределенной температурой плавления, к тому же имеются неточности и в ПМР спектре вышеназванного соединения. В действительности, полученный нами 4-(3,4,5-триметоксифенил)-5(4-метоксифенил)-изоксазол является веществом белого цвета с температурой плавления 117-118°С. Также имеются расхождения в спектрах H1 ЯМР и масс-спектрах высокого разрешения. Из полученных данных был сделан однозначный вывод о том, что авторы патента US 9090603 (2015) не смогли получить чистое вещество - 4-(4-метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазол, активность которого, по нашим данным, превышала антипролиферативную активность описанных выше 4,5-диарилпиразолов.
С учетом высокой антипролиферативной активности 4,5-диарилизоксазолов и 4,5-диарилпиразолов была поставлена задача разработки нового способа получения вышеназванных соединений с использованием в качестве прототипа патента US 9090603.
Техническое решение достигается тем, что способ получения 4,5-диариалазолов общей формулы:
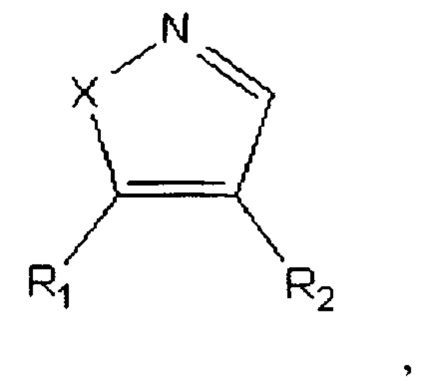
где Х=O, NH;
R1=-Ph(OCH3)3;
R2=-PhOCH3,
представители которых, в частности, 4-(3,4,5-триметоксифенил)-5-(4-метоксифенил)оксазол (соединение А-123124), и 4-(3,4,5-триметоксифенил)-5-(4-метоксифенил)пиразол (соединение А-124127), включающий следующие стадии:
Способ поясняется подробным описанием, экспериментальной частью, примерами выполнения и иллюстрациями, на которых изображено:
Фиг. 1 - формула комбретастатина СА4.
Фиг. 2 - Общая формула 4,5-диарилоксазолов (US 9090603).
Фиг. 3 - формула соединения A (US 9090603).
Фиг. 4 - Схема получения 4,5-диарилизоксазолов на примере 4-(4-метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазола.
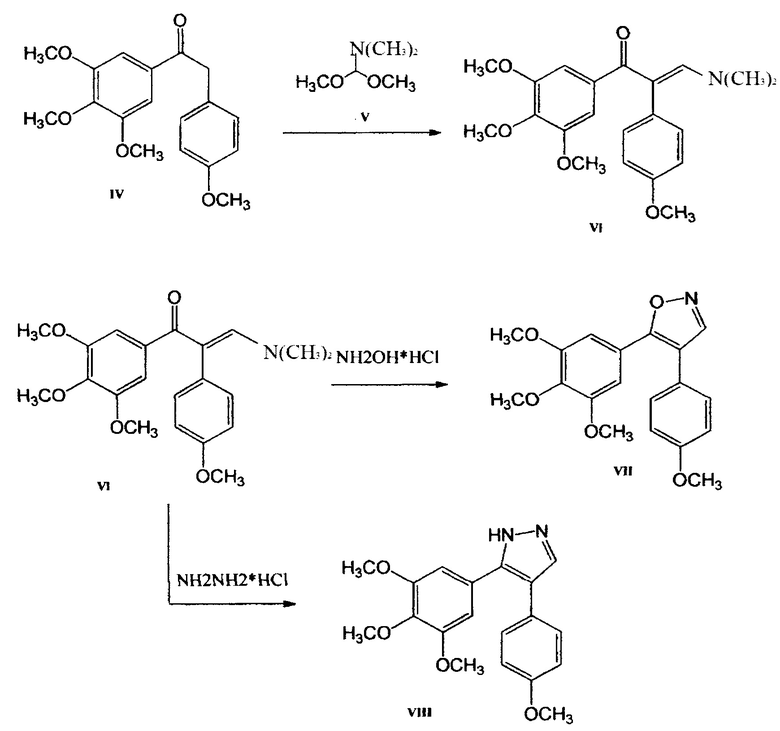
Фиг. 5 - Схема получения реакциям 1-(3,4,5-триметоксифенил)-2-метилен-(4-метоксифенил)-кетона (IV).
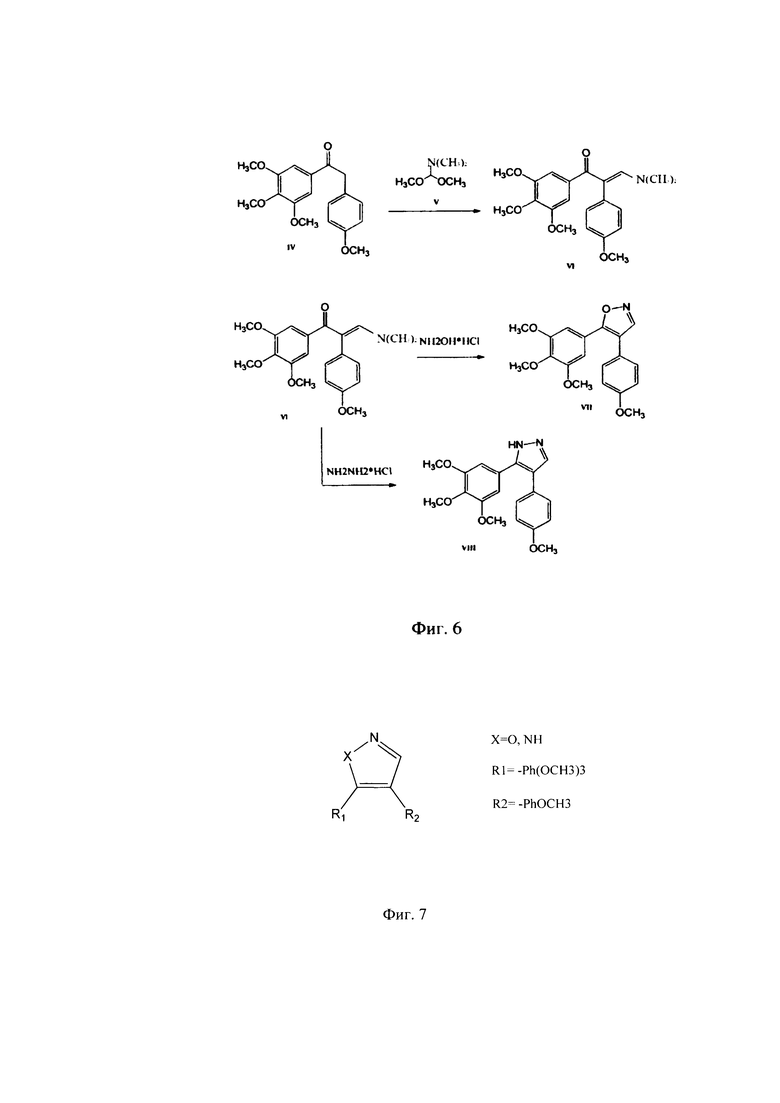
Фиг. 6 - Схема получения 4,5-диарил-изоксазола (VII) и пиразола (VIII) из метилового эфира галловой кислоты.
Фиг. 7 - Формула 4,5-диарилазолов.
Фиг. 8 - Цитотоксическая активность А-123124 (1) и Таксакад® (2) относительно опухолевых клеток аденокарциномы предстательной железы человека (РС-3).
Фиг. 9 - Цитотоксическая активность соединения А-123124 (1) и Таксакад® (2) относительно опухолевых клеток аденокарциномы легкого человека (А549).
Фиг. 10 - Цитотоксическая активность соединения А-123124 (1) и Таксакад® (2) относительно опухолевых клеток карциномы гортаноглотки человека (НЕр2).
Фиг. 11 - Цитотоксическая активность соединения А-123124 (1) и Таксакад® (2) относительно опухолевых клеток саркомы мыши (S-37).
Фиг. 12 - Цитотоксическая активность соединения А-123124 (1) и Таксакад® (2) относительно опухолевых клеток аденокарциномы толстой кишки мыши (С26).
Способ осуществляют следующим образом.
При разработке нового способа получения 4,5-диарилизоксазолов и 4,5-диарилпиразолов мы исходили из того, что в настоящее время целый ряд реактивов, используемых в прототипе US 9090603(2015), на территории РФ не производится.
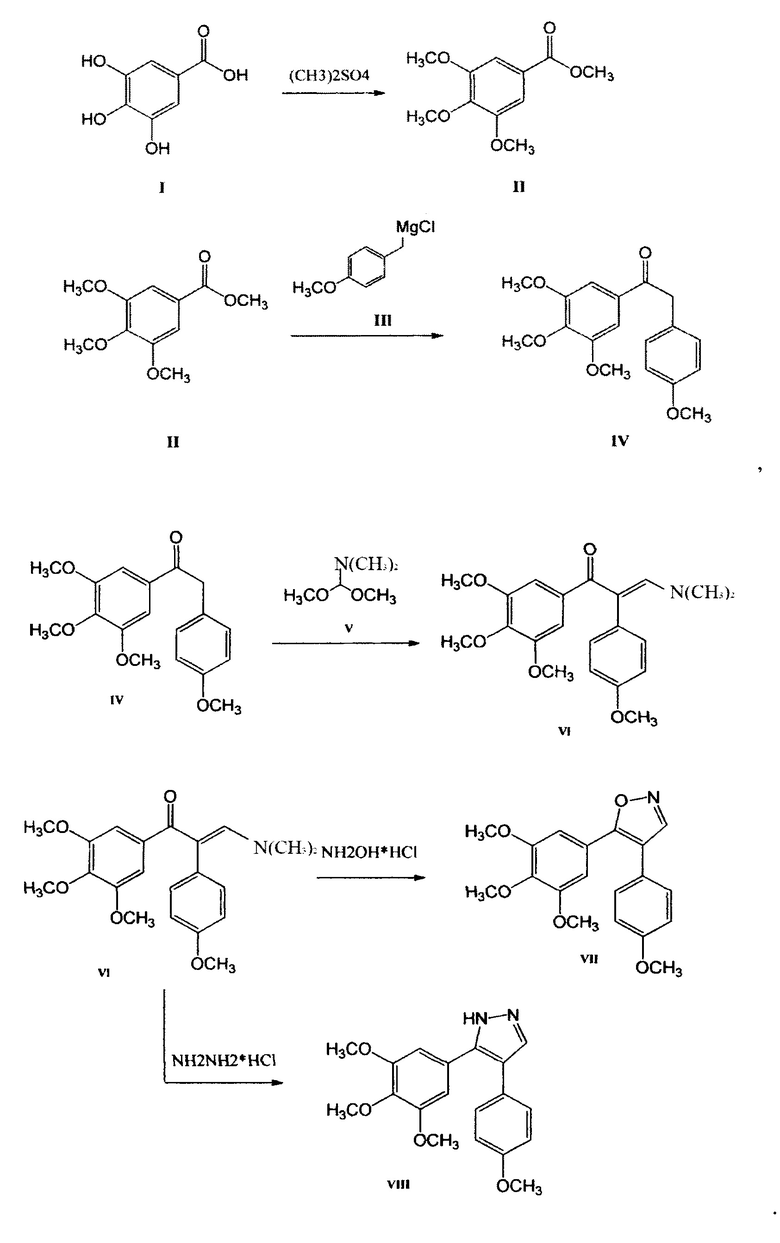
Следовательно, исходить нужно было из того, что производится на территории РФ, в частности галловой кислоты, получаемой из чернильных орешков. Из галловой кислоты (3,4,5-триметоксибензойной кислоты) с помощью реакции метилирования легко получить с практически количественным выходом метиловый эфир галловой кислоты, который с помощью реактива Гриньяра образует 1-(3,4,5-триметоксифенил)-2-метилен-(4-метокси-фенил) кетон. Описанные реакции приведены в схеме 2 (Фиг. 5).
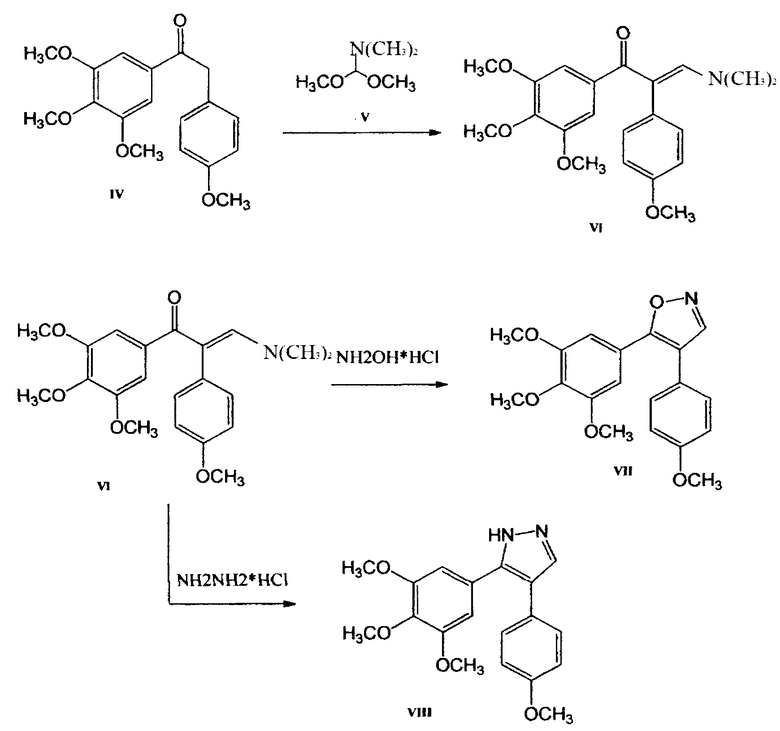
Таким образом, благодаря выше приведенным реакциям, 1-(3,4,5-триметоксифенил)-2-метилен-(4-метоксифенил)-кетон становится доступным реактивом, открывающим доступ к синтезу 4,5-диарилизоксазолов и 4,5-диарилпиразолов (Фиг. 6).
Согласно приведенной схеме (Фиг. 6) при взаимодействии метилового эфира галловой кислоты и 4-метоксибензилмагнийхлорида в тетрагидрофуране образуется с практически количественным выходом кетон VIII, который затем нагревали с диметилацеталем диметилформамида. После завершения реакции летучие вещества отгоняли в вакууме. Полученный енамин, без дополнительной очистки, был использован для синтеза 4,5-диарилизоксазола VII (А-123124) (в реакции с гидроксиламингидрохлоридом) и соответствующего 4,5-диарилпиразола VIII (А-124127) (в реакции с гидразином гидрохлоридом) (Фиг. 7), которые проявляют высокую цитотоксическую активность в отношении опухолевых клеток человека и мыши различного гистогенеза: ингибирование роста клеток на 50% происходит в диапазоне концентраций 10-12-10-9 моль/литр.
Способ синтеза соединений общей формулы (Фиг. 7) является оригинальным и доступным, не имеющим аналогов на территории Российской Федерации, при его получении используется только отечественное сырье.
Механизм действия соединений 4,5-диарилазолов связан с полимеризацией белка тубулина в опухолевых клетках, что приводит к нарушению фазы митоза, межфазных взаимодействий в клетках и индукции апоптоза. Этот механизм коррелирует с действием лекарственных средств таксанового ряда, самым известным из которых является Таксол. Препарат Таксол прочно занял ведущие позиции в лечении наиболее часто встречающихся злокачественных опухолей - рака молочной железы, легкого, головы и шеи, мочевого пузыря, пищевода, лейкемии. В зависимости от типа онкологического заболевания общая доля полной и частичной регрессии составляет не менее 50%, то есть терапия с использованием паклитаксела является весьма эффективной. Сходство механизмов действия 4,5-диарилазолов и таксанов позволяет надеяться, что эти соединения, полученные оригинальным способом, могут явиться эффективной основой лекарственных противоопухолевых препаратов.
Экспериментальная часть
Общие экспериментальные процедуры проводили в ФГБУН ИОХ им. Н.Д. Зелинского РАН. Спектры ЯМР получены на приборе Bruker DR-500: рабочие частоты -500,13 МГц (1Н) и 75,47 (13С). Масс-спектры получены на приборе Finnigan МАТ / INCOS 50 (70 эВ) с использованием прямого введения зонда. Элементный анализ выполнен с помощью автоматического микроанализатора Perkin-Elmer 2400 CHN.
Озонолиз проводили с использованием специально разработанного в ФГБУН ИОХ им. Н.Д. Зелинского РАН аппарата, оборудованного ИК-детектором концентрации О3 (Япония) и автоматической цепью отключения. Устройство допускает контролируемую генерацию озона из О2 с максимальной производительностью 10 г/ ч. Основные реактивы:
4-метокси-бензальдегид (анисовый альдегид): cas 123-11-5 3,4,5-тригидрокси-бензойная кислота (галловая кислота): cas149-91-7 3,4.5-триметоксиацетофенон: cas1136-86-3 Диметилсульфат: cas 77-78-1
1. Получение метилового эфира 3,4,5-триметоксибензойной кислоты.
К суспензии 25,0 г кристаллической галловой кислоты (23,4 г безводной) в 125 мл воды медленно добавляют 62,0 г диметилсульфата. При непрерывном перемешивании и охлаждении приливают по каплям охлажденный раствор 30,0 г NaOH в 125 мл воды. Колбу охлаждают в ванне с проточной водой. Когда весь диметилсульфат прореагирует, полученный метил 3,4,5-триметоксибензоат экстрагируют этилацетатом (3×100 мл), экстракт промывают водой, сушат над Na2SO4, упаривают растворитель в вакууме. Выход: 29,24 г конечного продукта, Т пл. 82-84°С (по данным литературы, Тпл. 82-84°С). 1Н NMR (400 MHz, CDCl3) δ 7.24 (s, 2Н), 3.85 (s, 12Н);
13С NMR (100 MHz, CDCl3) δ 166.8, 153.1, 142.2, 125.3, 106.9, 61.1, 56.4, 52.4; MS (m/z) вычислено для C11H15O5, мм 227,1, получено 227,1 (М+Н)
2. Получение 2-(4-метоксифенил)-1-(3,4,5-триметоксифенил)-этанона.
К кипящей реакционной смеси 4,5 г (0,185 моль) магниевого порошка в сухом тетрагидрофуране (ТГФ), в атмосфере азота, после прекращения нагревания, добавляют в течение 2-3 мин 14,5 г 4-метоксибензил хлорида, затем через 20 мин добавляют еще 14,5 г 4-метоксибензил хлорида, перемешивают 30 мин., охлаждают до -10°С и добавляют 29,0 г метилового эфира 3,4,5-триметокси-бензойной кислоты в 50 мл ТГФ. Реакционную массу перемешивают 1-1,5 часа. Поднимают температуру до 20°С и перемешивают еще 1 час, контролируя уменьшение количества метилового эфира 3,4,5-триметоксибензойной кислоты с помощью ТСХ. Добавляют 50 мл воды. Реакционную смесь перемешивают 30 мин., экстрагируют этилацетатом (3×100 мл), экстракт промывают водой, сушат над Na2SO4, упаривают растворитель в вакууме, получают 28,60 г конечного продукта. Очищают на хроматографической колонке с силикагелем; элюент - этилацетат/гексан.
Выход: 2(4-метоксифенил)-1(3,4,5-триметоксифенил)-этанона - 52,66 г (90%), Т пл. 85-87°С (по данным литературы, Т пл. 86-88°С).
1HNMR (CDCl3): δ 7.29 (2Н, s, Н-2',6'), 7.18 (2Н, d, J8.1 Hz, Н-2",6"), 6.87 (2Н, d, J 8.1 Hz, Н-3",5"), 4,19 (2Н, s, СН2), 3.9 (3Н, s, ОСН3), 3.89 (6Н, s, ОСН3-3',5'),3.79 (3Н, s, ОСН3); EIMSm/z 316 [М]+(8), 196 (16), 195 (100), 167 (5), 152 (11), 137 (12), 135 (8), 122 (11),121 (45), 109 (10), 98 (8), 81 (15), 78 (22), 77 (26); Анализ. Вычислено для C18H20O5: С, 68.34; Н, 6.37. Получено: С, 68.40;Н, 6.41.
3. Получение енаминона 2-(4-метоксифенил)-1-(3,4,5-триметоксифенил)-этанона. Смесь 2-(4-метоксифенил)-1-(3,4,5-триметоксифенил)-этанона-2 (10,0 г, 31,6 ммоль) и диметилформамида диметилацеталя (3,57 г, 31,6 ммоль) нагревают в атмосфере аргона 3 часа при 60°С. Смесь концентрируют в вакууме до образования кристаллического продукта. Выход енаминона 2-(4-метоксифенил)-1-(3,4,5-триметоксифенил)-этанона количественный (11,72 г, 31,6 ммоль).
4. Получение 4-(4-Метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазола (А-123124).
Гидроксиламин гидрохлорид (NH2OH⋅HCl) (0,27 г, 3,9 ммоль) добавляют к раствору енаминона 3(4-метоксифенил)-1(3,4,5-триметоксифенил)-пропанона-2 (1,34 г, 3,6 ммоль) в метаноле (20 мл). Полученную смесь кипятят с обратным холодильником в течение 2 ч, концентрируют в вакууме, остаток обрабатывают этилацетатом (50 мл) и органическую фазу промывают дистиллированной водой (2×25 мл), сушат над MgSO4 и концентрируют, получая неочищенный изоксазол, который очищают перекристаллизацией из МеОН. Выход: 4-(4-метоксифенил)-5-(3,4,5-триметоксифенил)-изоксазола (соединение А-123124), белое твердое вещество; 1,07 г (87%); Т пл. 117-118°. 1Н ЯМР (CDCl3) δ 8,30 (1H, с, Н-3), 7,35 (2Н, д, J=8,9 Гц, Н-2 ', 6 '), 6,95 (2Н, д, J=8,9 Гц, Н- 3 ', 5'), 6,89 (2Н, с, Н-2 ', 6'), 3,88 (3Н, с, ОСН3), 3,74 (3Н, с, ОСН3), 3,73 (6Н, с, ОСН3); 13С ЯМР (CDCl3) δ 163,2 (С-5), 159,5 (С-4 '), 153,3 (С-3), 152,0 (2С, С-3 ", 5 ' '), 139,3 (С-4 ' ')), 130,1 (2С, С-2 ', 6 '), 122,9 (С-1 '), 122,3 (С-1 ' '), 115,4 (С-4), 114,3 (2С, С-3 ', 5 '), 104,3 (2С, С-2 '', 6 ''), 60,9 (ОСН3), 56,0 (2С, 2OCH3), 55,3 (ОСН3); EIMS m / z 342 [М+1]+(21), 341 [М]+(100), 326 (27), 298 (20), 195 (56), 168 (32), 153 (24). Анализ. Вычислено для C19H19NO5: С 66,85; Н 5,61; N 4.10. Найдено: С 66,95; Н 5,67; N 3,95
5. Получение 5-(4-Метоксифенил)-4-(3,4,5-триметоксифенил)-1Н-пиразола (А-124127).
Гидразин гидрохлорид (N2H4HCI) (0,27 г, 3,9 ммоль) добавляют к раствору енаминона 3(4-метоксифенил)-1(3,4,5-триметоксифенил)-пропанона-2 (1,34 г, 3,6 ммоль) в метаноле (20 мл). Полученную смесь кипятят с обратным холодильником в течение 2 ч, концентрируют в вакууме, остаток обрабатывают этилацетатом (50 мл) и органическую фазу промывают дистиллированной водой (2x25 мл), сушат над MgSO4 и концентрируют, получая неочищенный пиразол, который очищают перекристаллизацией из МеОН. Выход: 5-(4-метоксифенил)-4-(3,4,5-триметоксифенил)-1Н-пиразола (соединение А-124127), белый кристаллический продукт, 0,86 г (70%); Т пл. 141-142°С;
1HNMR (CDCl3) δ 11.0 (1H, br, NH), 7.68 (1Н, s,H-3), 7.41 (2Н, d, J=8.2 Hz, Н-2'',6''), 6.89 (2Н, d, J=8.2Hz, H-3'',5), 6.52 (2H, s, Н-2',6'), 3.86 (3Н, s, ОСН3), 3.82(3Н, s, ОСН3), 3.72 (6Н, s, ОСН3-3',5'); 13CNMR (DMSOACSd6) δ 159.2, 158.6, 152.6, 147.1, 139.3, 135.9, 131.7, 130.9,129.3, 126.5, 113.8, 113.5, 105.4, 104.9, 103.8, 59.9, 55.5, 55.3; EIMSm/z 341 [М+1]+(22), 340 [М]+(100), 326 (17), 325(85), 265 (11), 250 (16), 211 (15), 168 (12), 154 (20), 140(11), 139(12), 119(12), 77 (12).
Анализ. Вычислено для C19H20N2O4: С 67.05; Н 5.92; N 8.23. Получено: С 67.12; H5.96;N8.17
Биологическая часть - Цитотоксическая активность наиболее активного соединения А-123124 в системе in vitro в отношении опухолевых клеток человека и мыши.
Исследование цитотоксической/цитостатической активности в системе in vitro проводили на 3-х клеточных линиях человека - аденокарциноме легкого (А 549), карциноме предстательной железы (РС-3), эпидермоидной карциноме гортаноглотки (НЕр2) и 2-х клеточных линиях мыши - саркоме (S-37) и карциноме толстой кишки (С26) с использованием сред Игла-MEM (А549, НЕр2), F-12K (РС-3), ДМЕМ (S-37, С26) с добавлением 2 mM L-глутамина и 10% эмбриональной телячьей сыворотки. Культивирование проводили при 37°С в увлажненной атмосфере с 5% содержанием CO2. Клетки рассевали в лунки плоскодонного 96-луночного микропланшета в концентрации 1×105 клеток в миллилитре. Через 24 часа вносили тестируемое соединение (А-123124) и препарат сравнения - Таксакад® (действующее вещество - паклитаксел) в серийных разведениях, варьируя концентрацию от 10-12 моль до 10-5 моль, и инкубировали в течение 72 часов при 37°С с 5% содержанием СО2. Выживаемость клеток определяли визуально, оценивая с помощью световой микроскопии морфологические изменения клеток, и колориметрическим методом с использованием МТТ-теста. Биологически значимым эффектом считали ингибирование роста клеток в культуре более чем на 50%.
Выявлено, что А-123124 проявлял высокую специфическую активность, величина IC50 варьировала от 70×10-12 моль до 10×10-9 в зависимости от культуры клеток, в то время как препарат Таксакад® проявлял значительно меньшую цитотоксическую активность в биологических тестах in vitro (величина IC50 составляла 10-12×10-8 моль).
Настоящее изобретение характеризуется следующими примерами.
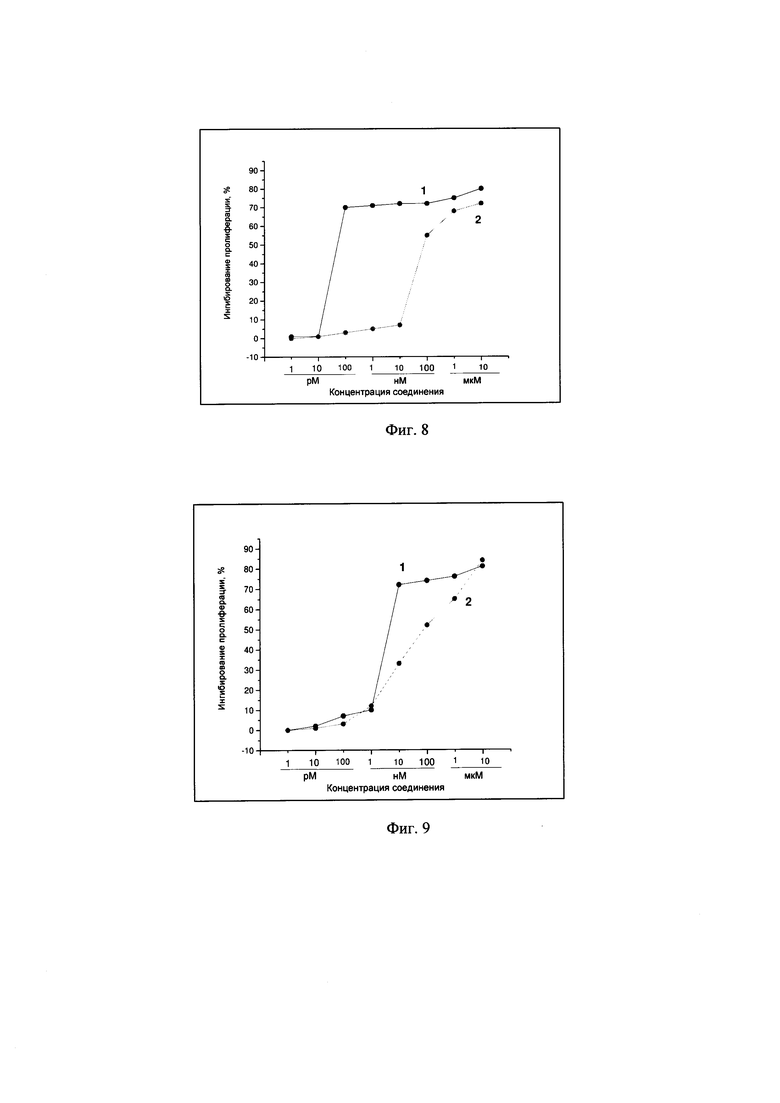
Пример 1 - Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток карциномы предстательной железы человека (культура РС-3)
Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток карциномы предстательной железы человека (РС-3) показало, что соединение проявляет высокую цитотоксическую активность относительно опухолевых клеток культуры РС-3 - IC50 7,0×10-11 моль, в то время как у препарата Таксакад® выявлена значительно меньшая специфическая активность в системе in vitro - IC50 1,0×10-7 моль (Фиг. 8).
Пример 2 - Изучение цитотоксической активности А-123124 относительно опухолевых клеток аденокарциномы легкого человека (культура А549)
Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток аденокарциномы легкого человека (А549) показало, что изученное соединение проявляет высокую цитотоксическую активность относительно опухолевых клеток культуры А549 - IC50 5×10-9 моль, в то время как у препарата Таксакад® выявлена значительно меньшая специфическая активность в системе in vitro IC50 1,0×10-7 моль (Фиг. 9).
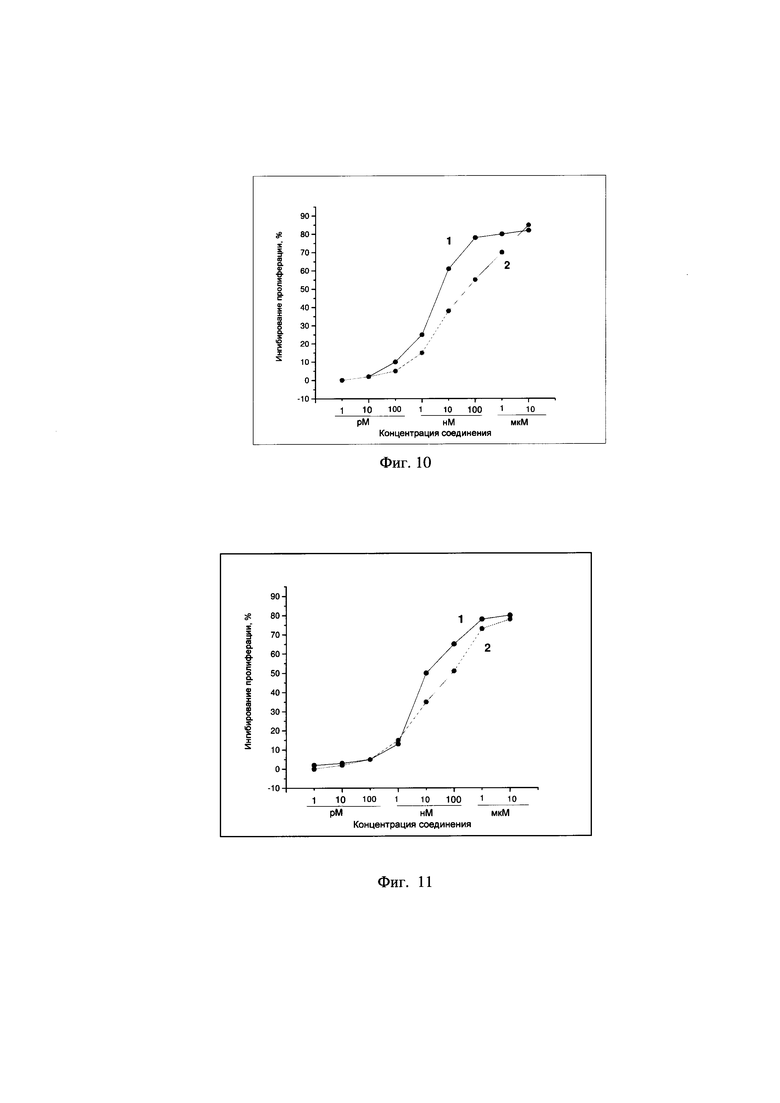
Пример 3 - Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток карциномы гортаноглотки человека (культура НЕр2)
Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток карциномы гортаноглотки человека (НЕр2) показало, что изученное соединение проявляет высокую цитотоксическую активность относительно опухолевых клеток культуры НЕр2 - IC50 9×10-9 моль, в то время как у препарата Таксакад® выявлена значительно меньшая специфическая активность в системе in vitro - IC50 1,0×10-7 моль (Фиг. 10).
Пример 4 - Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток саркомы мыши (культура S-37)
Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток саркомы мыши (S-37) показало, что изученное соединение проявляет высокую цитотоксическую активность относительно опухолевых клеток культуры S-37 -IC50 8,0×10-9 моль, в то время как у препарата Таксакад® выявлена значительно меньшая специфическая активность в системе in vitro IC50 1,1×10-7 моль (Фиг. 11).
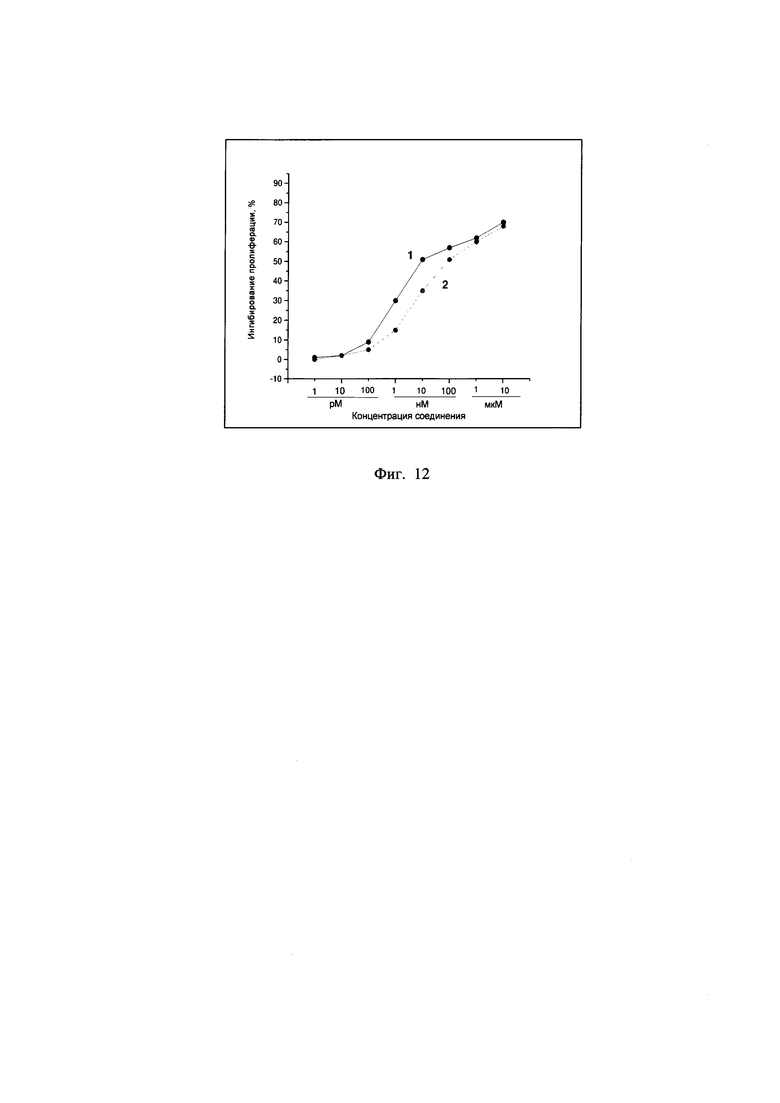
Пример 5 - Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток аденокарциномы толстой кишки мыши (культура С26)
Изучение цитотоксической активности соединения А-123124 относительно опухолевых клеток аденокарциномы толстой кишки мыши (С26) показало, что изученное соединение проявляет высокую цитотоксичекую активность относительно опухолевых клеток культуры С26 - IC50 1,0×10-8 моль, в то время как у препарата Таксакад® выявлена значительно меньшая специфическая активность в системе in vitro, IC50 1,2×10-7 моль (Фиг. 12).
Высокая цитотоксичность соединения А-123124 и А124127 в отношении культивируемых опухолевых клеток позволяет надеяться в дальнейшем получить лекарственную форму противоопухолевого препарата, вызывающую минимальные токсические реакции в организме больного благодаря тому, что вводимая доза будет существенно ниже (на два порядка), чем у препаратов таксанового ряда, применяемых в клинической практике в настоящее время.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НИТРИЛО-СТИЛЬБЕНА (СОЕДИНЕНИЯ А-104815) | 2021 |
|
RU2786432C2 |
| 3,5-ДИАРИЛИЗОКСАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2021 |
|
RU2801861C2 |
| Способ получения замещенных 3-арилпирролов | 2024 |
|
RU2831117C1 |
| Способ получения аминофуразанов | 2018 |
|
RU2671414C1 |
| 4-(2,4-ДИМЕТОКСИФЕНИЛ)-2-(2-ГИДРОКСИФЕНИЛ)-5,6-ДИГИДРО-4Н-БЕНЗО[H]ХРОМЕН-3-КАРБОНОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2707972C1 |
| 16α,17α-ЦИКЛОГЕКСА-17β-(2'-ГИДРОКСИЭТИЛ)-13β-МЕТИЛГОНА-1,3,5(10)-ТРИЕН-3-ОЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2601423C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| Фосфорил замещенные 3-кето-андрост-4-ен-[16,17-d]пиридазины и способ их получения | 2023 |
|
RU2807870C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ЛИМФОТРОПИНА ИЗ ПРОМЫШЛЕННОГО КРАСИТЕЛЯ "ДИСУЛЬФИНОВЫЙ ГОЛУБОЙ" | 2021 |
|
RU2782930C2 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
Изобретение относится к области органической химии, а именно к способу получения 4,5-диарилазолов, общей формулы 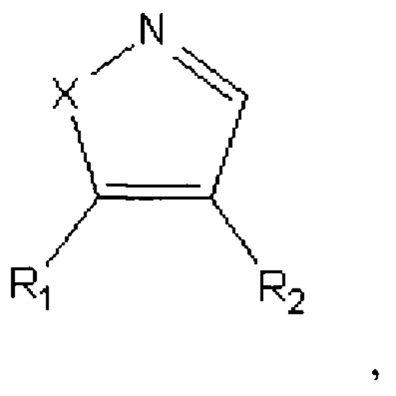 где Х=O, NH; R1=-Ph(OCH3)3; R2=-PhOCH3, представители которых, в частности, 4-(3,4,5-триметоксифенил)-5-(4-метоксифенил)оксазол (соединение А-123124), и 4-3,4,5-триметоксифенил)-5-(4-метоксифенил)пиразол (соединение А-123127), имеют высокую антипролиферативную активность IC50<10-12-10-10 моль в отношении опухолевых клеток человека и мыши различного гистогенеза. Способ получения включает следующие стадии
где Х=O, NH; R1=-Ph(OCH3)3; R2=-PhOCH3, представители которых, в частности, 4-(3,4,5-триметоксифенил)-5-(4-метоксифенил)оксазол (соединение А-123124), и 4-3,4,5-триметоксифенил)-5-(4-метоксифенил)пиразол (соединение А-123127), имеют высокую антипролиферативную активность IC50<10-12-10-10 моль в отношении опухолевых клеток человека и мыши различного гистогенеза. Способ получения включает следующие стадии 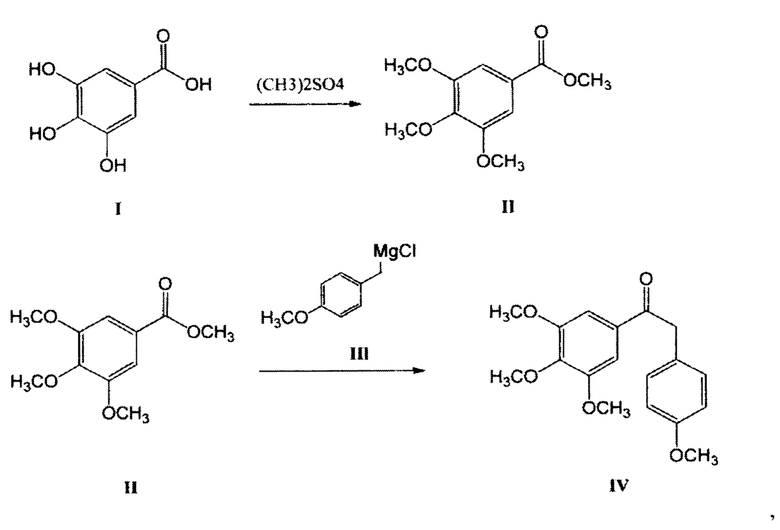
 Изобретение обеспечивает высокий выход целевых продуктов, при этом синтез осуществляется из доступного сырья. 12 ил., 5 пр.
Изобретение обеспечивает высокий выход целевых продуктов, при этом синтез осуществляется из доступного сырья. 12 ил., 5 пр.
Способ получения 4,5-диариалазолов общей формулы:
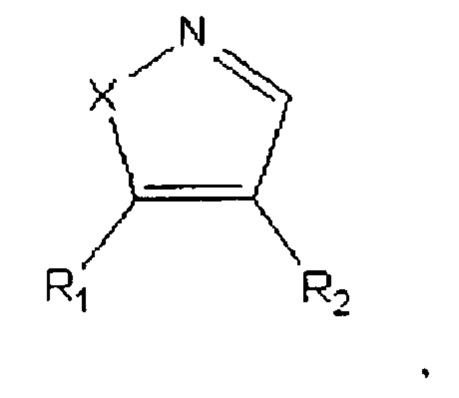
где Х=O, NH;
R1=-Ph(OCH3)3;
R2=-PhOCH3,
представители которых, в частности, 4-(3,4,5-триметоксифенил)-5-(4-метоксифенил)оксазол (соединение А-123124), и 4-(3,4,5-триметоксифенил)-5-(4-метоксифенил)пиразол (соединение А-124127), включающий следующие стадии:

| M | |||
| N | |||
| Semenova и др | |||
| "Sea Urchin Embryo Model As a Reliable in Vivo Phenotypic Screen to Characterize Selective Antimitotic Molecules | |||
| Comparative evaluation of Combretapyrazoles, -isoxazoles, -1,2,3-triazoles, and -pyrroles as Tubulin-Binding Agents" ACS Combinatorial Science, 2018, 20(12), с.700-721 | |||
| Sun CM | |||
| И др.: "Synthesis and cytotoxic |
Авторы
Даты
2023-07-04—Публикация
2022-01-28—Подача