Настоящее изобретение относится к бактериальным клеткам-хозяевам, способным продуцировать лактозу или интересующий олигосахарид, который содержит галактозо-β-1,4-глюкозную группировку на своем восстанавливающем конце, а также, к способу получения лактозы или интересующего олигосахарида, который содержит концевую галактозо-β-1,4-глюкозную группировку.
Предшествующий уровень техники
Человеческое грудное молоко содержит сложную смесь углеводов, жиров, белков, витаминов, минеральных веществ и микроэлементов. Наиболее преобладающая фракция человеческого грудного молока состоит из углеводов. Фракция углеводов в человеческом грудном молоке может быть дополнительно подразделена на (i) лактозу и (ii) олигосахариды (олигосахариды грудного молока ОГМ). В то время, как лактоза (галактозо-β-1,4-глюкоза) используется в качеств источника энергии, олигосахариды не метаболизируются младенцем. На долю фракции олигосахаридов приходится вплоть до 1/10 суммарной фракции углеводов, и она состоит, вероятно, из более, чем 150 разных олигосахаридов. Распространенность и концентрация данных сложных олигосахаридов являются характерными для человека, и, таким образом, они не могут быть обнаружены в больших количествах в молоке других млекопитающих, включая молочных сельскохозяйственных животных.
Наиболее распространенными олигосахаридами грудного молока являются 2'-фукозиллактоза и 3'-фукозиллактоза, которые вместе могут составлять вплоть до 1/3 суммарной фракции ОГМ. Дополнительные распространенные ОГМ, присутствующие в человеческом грудном молоке, представляют собой лакто-N-тетраозу, лакто-N-неотетраозу и лакто-N-фукопентаозу I. Помимо данных нейтральных олигосахаридов, также в человеческом грудном молоке могут быть обнаружены кислые ОГМ, такие как 3'-сиалиллактоза, 6'-сиалиллактоза и 3-фукозил-3'-сиалиллактоза, сиалил-лакто-N-тетраоза, дисиалил-лакто-N-тетраоза. Примечательно, что огромное большинство ОГМ содержат галактозо-β-1,4-глюкозную группировку на своем восстанавливающем конце. Структуры ОГМ являются близкородственными с эпитопами гликоконъюгатов поверхности эпителиальных клеток, антигенами группы крови Льюиса, такими как антиген Lex (LeX). Структурное сходство ОГМ с эпителиальными эпитопами обуславливает защитные свойства ОГМ против бактериальных патогенов.
О наличии олигосахаридов в человеческом грудном молоке известно в течение длительного времени, и физиологические функции данных олигосахаридов подвергали медицинскому исследованию на протяжении многих десятилетий. Для некоторых из более распространенных олигосахаридов грудного молока уже идентифицированы конкретные функции.
Помимо местного действия в кишечнике, как упоминалось в данном документе ранее, ОГМ, как также было показано, оказывают системное действие у младенцев в результате поступления их в системный кровоток. Кроме того, влияние ОГМ на белок-углеводные взаимодействия, например, связывание селектина и лейкоцита, может модулировать иммунные ответы и уменьшать воспалительные реакции. Кроме того, становится все более и более признанным, что ОГМ представляют ключевой субстрат для разработки микробиомов младенцев.
Вследствие хорошо изученных полезных свойств пребиотических олигосахаридов, в частности ОГМ, но их ограниченной доступности из природных источников, эффективное коммерческое, то есть крупномасштабное, получение ОГМ является весьма желательным.
Пытаясь добиться крупномасштабного производства отдельных олигосахаридов грудного молока, разработали химические пути для некоторых из данных олигосахаридов. Однако, такие способы включают применение нескольких вредных химических веществ, которые вызывают риск загрязнения конечного продукта. По меньшей мере крупномасштабные количества, а также количества, достаточные для применений в качестве пищевого продукта, не могли быть обеспечены до сегодняшнего дня с помощью химического синтеза.
Для того, чтобы обойти недостатки, связанные с химическим синтезом олигосахаридов грудного молока, разработали несколько ферментативных способов и подходов к ферментации для их продукции. Способы ферментативного получения разработаны для нескольких ОГМ, таких как 2'-фукозиллактоза, 3-фукозиллактоза, лакто-N-тетраоза, лакто-N-неотетраоза, 3'-сиалиллактоза и 6'-сиалиллактоза. В данных способах получения обычно используются генетически модифицированные бактериальные штаммы, такие как рекомбинантные Escherichia coli.
В настоящее время все способы ферментативного получения, а также биокаталитические реакции для получения ОГМ основаны исключительно на добавляемой извне лактозе в качестве исходного субстрата. В данных способах к лактозе добавляют один или более моносахаридов (США 7521212 В1; Albermann et al., (2001) Carbohydr. Res. 334(2) p 97-103). Добавление моносахаридов к лактозе может катализироваться или гликозилтрансферазами, или гликозидазами, с использованием подходящих активированных моносахаридных субстратов. Кроме того, дополнительные моносахариды могут быть добавлены к лактозе в результате реакций с трансглюкозидазой.
В частности, ферментативное получение ОГМ оказалось эффективным, поскольку моносахариды, активированные нуклеотидами, которые требуются, но которые сложно синтезировать, предоставлены за счет метаболизма микробных клеток, которые используются. Однако, применение цельных клеток для синтеза ОГМ также имеет, по сравнению с биокаталитическим подходом, несколько больших недостатков, которые связаны с процессами транспорта через мембрану клетки, с метаболическими побочными реакциями и с необходимостью того, что олигосахариды, синтезируемые микробными клетками, должны быть очищены от сложной смеси, содержащей, помимо прочего, разные полиолы (например, углеводы), нуклеиновые кислоты, полипептиды, неорганическое вещество и т.д.
Техническая проблема, связанная с применением лактозы в ферментативных процессах, которая должна быть решена, в частности, когда олигосахарид, подлежащий получению, будет использован в потреблении человеком, заключается в перестройке лактозы (бета-D-галакто-пиранозил-(1->4)-глюкозы) в лактулозу (бета-D-галактопиранозил-(1->4)-D-фруктофуранозу) при термической обработке лактозы. Данная перестройка может широко встречаться в результате тепловой стерилизации лактозы, приводящей к перестройке нескольких процентов лактозы, присутствующей в ферментационной среде, или лактозы ферментационной подпитки в лактулозу. Однако, лактулоза представляет собой неусваиваемый сахар для человека и широко используется в качестве слабительного в лечении хронического запора.
Превращение лактозы в лактулозу не только приводит к образованию нежелательной лактулозы, но также предоставляет нежелательный субстрат для реакций гликозилирования в микробных клетках. Вследствие этого, больше сложных олигосахаридов (например, 2'-фукозил-лактулоза) образуется в качестве побочных продуктов. Таким образом, образование лактулозы из лактозы приводит к загрязнению желательного продукта близкородственными олигосахаридами, которые сложно или даже невозможно отделить от желательного продукта.
Кроме того, лактоза может превращаться в аллолактозу (бета-D-галактопиранозил-(1→6)-D-глюкопиранозу), другое нежелательное загрязняющее вещество (Huber et al., «Efflux of beta-galactosidase products from Escherichia coli» (1980) J. Bacterid. 141, 528-533), при снабжении штамма Е. coli, позитивного в отношении бета-галактозидазы.
Кроме того, добавление лактозы может вызывать документально подтвержденный эффект, известный как «уничтожение клеток, вызываемое лактозой». Данный эффект наиболее вероятно обусловлен избыточным поглощением лактозы микробной клеткой и ассоциированным нарушением протонного градиента через бактериальную мембрану. В частности, сверхэкспрессия гена лактозопермеазы (например, lacY Е. coli) в сочетании с воздействием на рекомбинантную микробную клетку избытка лактозы может вызывать значительную задержку роста рекомбинантного штамма и повышенный уровень синтеза клеточных полисахаридов (Grube et al,, «Hydrogen-producing Escherichia coli strains overexpressing lactose permease: FT-IR analysis of the lactose-induced stress» (2013) Biotechnol. Appl. Biochem. 5, 31).
Кроме того, в настоящее время любая имеющаяся в продаже лактоза происходит из молочной сыворотки, отхода молочной промышленности. Молочную сыворотку получают в огромных количествах при изготовлении сыра и казеина. Таким образом, при получении из молочной промышленности все еще существуют опасения, связанные с возможным загрязнением лактозы белками - прионами, которые представляют собой причинный фактор губчатой энцефалопатии крупного рогатого скота (BSE - от англ. bovine spongiform encephalopathy), также широко известной как коровье бешенство. BSE представляет собой смертельное нейродегенеративное заболевание у крупного рогатого скота, вызывающее губчатую дегенерацию головного мозга и спинного мозга. BSE может предаваться человеку, и известна как вариант болезни Крейтцфельда-Якоба.
Кроме того, лактоза представляет собой еще один из наиболее дорогих компонентов ферментационной среды, и ее замена глюкозой, глицерином, сахарозой и т.д. будет приводить к более экономически эффективному получению ОГМ.
Для устранения упомянутых выше недостатков, были разработаны улучшенные средства и способы получения ОГМ. Например, в WO 2015/150328 А1 раскрыты бактериальные клетки-хозяева, способные продуцировать олигосахариды, содержащие концевой дисахарид галактозо-(1→4)-глюкоза, где указанная бактериальная клетка-хозяин экспрессирует по меньшей мере одну рекомбинантную последовательность нуклеиновой кислоты, кодирующую β-1,4-галактозилтрансферазу, которая способна осуществлять галактозилирование моносахарида - свободной глюкозы с образованием лактозы внутри клетки, и которая содержит и экспрессирует по меньшей мере одну рекомбинантную последовательность нуклеиновой кислоты, кодирующую фукозилтрансферазу, сиалилтрансферазу, глюкозамилтрансферазу или галактозилтрансферазу. Указанная бактериальная клетка-хозяин может образовывать олигосахарид без добавления извне лактозы, таким образом, что бактериальную клетку-хозяина можно культивировать в культуральной среде без добавления лактозы извне с получением указанного олигосахарида. Более конкретно, в WO 2015/150328 А1 раскрыт генетически модифицированный штамм Е, coli для продукции 2'-фукозиллактозы, который использует сахарозу или комбинацию глюкозы и сахарозы в качестве источника углерода. Для использования сахарозы указанный штамм Е. coli генетически модифицировали для экспрессии четырех генов кластера генов csc Е, coli W, а именно генов, кодирующих сахарозопермеазу (cscB), фруктокиназу (cscK), сахарозогидролазу (cscA) и транскрипционный репрессор (cscR).
Однако, продуцирование 2'-FL указанным генетически модифицированным штаммом Е, coli с использованием сахарозы в качестве единственного источника углерода и энергии имеет свои недостатки в том, что так же трудно осуществлять тепловую стерилизацию сахарозы без значительной степени гидролиза и образования нежелательных побочных продуктов. В качестве альтернативы может быть использована стерильная фильтрация раствора сахарозы, но стерильная фильтрация имеет высокий риск загрязнения ферментационной среды чужеродными агентами, в частности, при ферментации промышленного масштаба.
Кроме того, культивирование микробной клетки для продукции ОГМ в присутствии сахарозы в качестве источника углерода, где указанная микробная клетка была генетически модифицирована для того, чтобы она имела разделенный метаболизм, таким образом, что мономеры, составляющие сахарозу, используются в отличных метаболических путях, приводит к нежелательным характеристикам роста культуры бактериальных клеток, предположительно из-за стехиометрии мономеров, образованных в результате внутриклеточного гидролиза сахарозы, которая не соответствует количественным потребностям в разных мономерах в отличных путях.
Для устранения упомянутых выше недостатков предложена генетически модифицированная микробная клетка, которая способна продуцировать интересующий олигосахарид, содержащий галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце при культивировании на смешанном сырье на основе моносахаридов в качестве основного источника углерода и энергии, но в отсутствии добавляемой извне лактозы.
Краткое изложение сущности изобретения
В первом аспекте предложена генетически модифицированная микробная клетка для продукции лактозы или интересующего олигосахарида, содержащего галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце, где указанная микробная клетка может продуцировать указанную лактозу de novo или указанный интересующий олигосахарид при культивации в отсутствии лактозы, добавляемой извне.
Во втором аспекте предложено применение генетически модифицированной микробной клетки-хозяина для продукции лактозы или интересующего олигосахарида, содержащего галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце.
В третьем аспекте предложен способ получения лактозы или интересующего олигосахарида, содержащего галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце, посредством культивирования генетически модифицированной микробной клетки в присутствии смешанного сырья, содержащего глюкозу, и выделения данного интересующего олигосахарида.
Краткое описание графических материалов
На Фиг. 1 показано схематичное изображение типичного воплощения генетически модифицированной микробной клетки согласно изобретению для продукции 2'-фукозиллактозы.
На Фиг. 2 показано схематичное изображение еще одного типичного воплощения генетически модифицированной микробной клетки согласно изобретению для продукции 2'-фукозиллактозы.
На Фиг. 3 показано схематичное изображение еще одного типичного воплощения генетически модифицированной микробной клетки согласно изобретению для продукции 2'-фукозиллактозы.
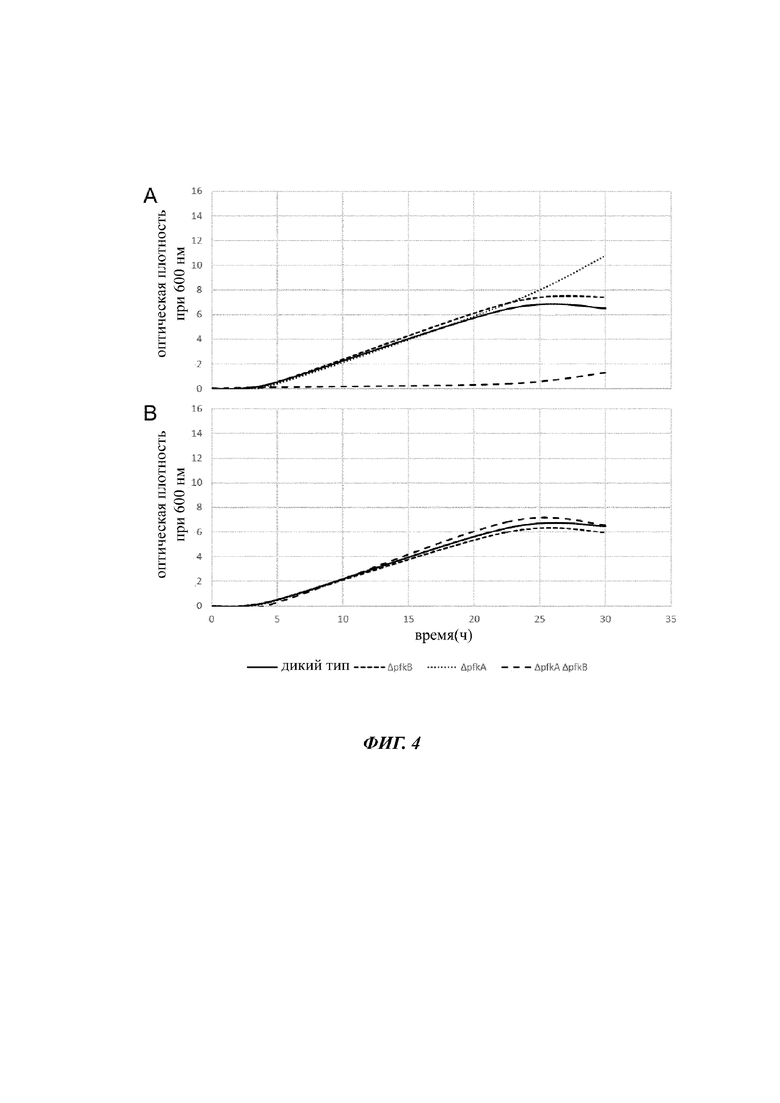
На Фиг. 4 показаны характеристики роста штаммов E.coli во время культивации глюкозе (А) или смешанном сырье на основе моносахаридов, состоящем из глюкозы и фруктозы (В) в качестве единственного источника углерода и энергии.
Подробное описание
Согласно первому аспекту предложена генетически модифицированная микробная клетка для продукции лактозы или интересующего олигосахарида, содержащего галактозо-β-1,4-глюкозную группировку на своем восстанавливающем конце, где указанная микробная клетка имеет по меньшей мере один глюкозный транспортер для переноса глюкозы из культуральной среды в цитоплазму микробной клетки, путь биосинтеза УДФ (уридиндифосфат)-галактозы для внутриклеточного биосинтеза УДФ-галактозы и по меньшей мере одну галактозилтрансферазу, которая может осуществлять галактозилирование свободной внутриклеточной глюкозы с внутриклеточной продукцией лактозы.
Генетически модифицированная микробная клетка может продуцировать лактозу. В некоторых воплощениях микробная клетка может использовать продуцируемую лактозу самостоятельно для продукции интересующего олигосахарида, который несет галактозо-β-1,4-глюкозную группировку на своем восстанавливающем конце. Для получения указанного интересующего олигосахарида не обязательно обеспечивать экзогенную подачу лактозы к микробной клетке.
Генетически модифицированная микробная клетка имеет по меньшей мере один глюкозный транспортер для переноса глюкозы из культуральной среды, в которой культивируется указанная микробная клетка, в цитоплазму микробной клетки, таким образом, что свободная глюкоза становится доступной для внутриклеточного биосинтеза лактозы.
Обычно, генетически модифицированная микробная клетка содержит по меньшей мере один функциональный ген, кодирующий указанный глюкозный транспортер, который может переносить глюкозу (Glu) из культуральной среды в цитоплазму клетки.
Термин «функциональный ген», в том виде, в котором он используется в данном документе, относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует белок или полипептид, и которая также содержит регуляторные последовательности, функционально связанные с указанной нуклеотидной последовательностью, кодирующей белок, таким образом, что нуклеотидная последовательность, которая кодирует данный белок или полипептид, может экспрессироваться в микробной клетке/микробной клеткой, несущей указанный функциональный ген. Таким образом, при культивации в условиях, которые являются пермиссивными в отношении экспрессии функционального гена, указанный функциональный ген экспрессируется, и микробная клетка, экспрессирующая указанный функциональный ген, обычно содержит белок или полипептид, который кодируется областью, кодирующей белок, функционального гена. В том виде, в котором они используются в данном документе, термины «нуклеиновая кислота» и «полинуклеотид» относятся к полимеру из дезоксирибонуклеотидов или рибонуклеотидов или в одно- или двухцепочечной форме и, если не ограничено иным образом, охватывают известные аналоги природных нуклеотидов, которые гибридизуются с нуклеиновыми кислотами таким же образом, как встречающиеся в природе нуклеотиды. Если не указано иначе, конкретная последовательность нуклеиновой кислоты включает ее комплементарную последовательность.
Термин «функционально связанный», в том виде, в котором он используется в данном документе, будет означать функциональную связь между нуклеотидной последовательностью контроля экспрессии (такой как промотор, сигнальная последовательность или ряд сайтов связывания транскрипционных факторов) и второй последовательностью нуклеиновой кислоты, где последовательность контроля экспрессии влияет на транскрипцию и/или трансляцию нуклеиновой кислоты, соответствующей второй последовательности. Соответственно, термин «промотор» обозначает последовательности ДНК, которые обычно «предшествуют» гену в ДНК-полимере и обеспечивают сайт инициации транскрипции в мРНК. «Регуляторные» последовательности ДНК, также обычно расположенные «выше» (то есть, предшествуя) гена в данном ДНК-полимере, связывают белки, которые определяют частоту (или скорость) инициации транскрипции. В совокупности называемые «промоторной/регуляторной» последовательностью ДНК или последовательностью ДНК «контроля», данные последовательности, которые предшествуют выбранному гену (или серии генов) в функциональном ДНК-полимере способствуют определению того, будет ли происходить транскрипция (и в конечном итоге экспрессия) гена. Последовательности ДНК, которые «следуют за» геном в ДНК-полимере и обеспечивают сигнал для терминации транскрипции в мРНК, называются последовательностями, «терминирующими» транскрипцию.
Термин «рекомбинантный», в том виде, в котором он используется в данном документе со ссылкой на бактериальную клетку-хозяина, указывает на то, что бактериальная клетка реплицирует гетерологичную нуклеиновую кислоту или экспрессирует пептид или белок, кодируемый гетерологичной нуклеиновой кислотой (а именно, последовательностью, «чужеродной в отношении указанной клетки»). Рекомбинантные клетки могут содержать гены, которые не обнаружены в нативной (нерекомбинантной) форме клетки. Рекомбинантные клетки могут также содержать гены, обнаруженные в нативной форме клетки, где гены модифицированы и повторно введены в клетку искусственными средствами. Термин также охватывает клетки, которые содержат нуклеиновую кислоту, эндогенную в отношении клетки, которая была модифицирована без удаления нуклеиновой кислоты из данной клетки; такие модификации включают модификации, полученные посредством замены генов, сайт-специфичной мутации и родственных методик. Соответственно, «рекомбинантный полипептид» представляет собой полипептид, который был получен посредством рекомбинантной клетки. Термин «гетерологичная последовательность» или «гетерологичная нуклеиновая кислота», в том виде, в котором он используется в данном документе, представляет собой последовательность или нуклеиновую кислоту, которая происходит из источника, чужеродного в отношении конкретной клетки-хозяина (например, из разных видов), или, если из одного и того же источника, модифицирована, по сравнению со своей исходной формой. Таким образом, гетерологичная нуклеиновая кислота, функционально связанная с промотором, происходит из источника, отличного от источника, из которого происходит промотор, или, если из одного и того же источника, модифицирована, по сравнению со своей исходной формой. Гетерологичная последовательность может быть стабильно введена, например, посредством трансфекции, трансформации, конъюгации или трансдукции, в геном клетки микроорганизма - хозяина, где могут применяться методики, которые будут зависеть от клетки-хозяина, в которую должна быть введена данная последовательность. Разные методики известны специалисту в данной области и раскрыты, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989).
Соответственно, под «генетически модифицированной микробной клеткой» понимают бактериальную клетку, которая трансформирована или трансфицирована, или способна к трансформации или трансфекции экзогенной полинуклеотидной последовательностью.
Таким образом, последовательности нуклеиновых кислот, как использовано в настоящем изобретении, могут, например, содержаться в векторе, которым нужно стабильно трансформировать/трансфицировать клетки-хозяева микроорганизма или который должен быть иным образом в них введен.
Огромное многообразие экспрессионных систем может использоваться для получения полипептидов по изобретению. Такие векторы включают, среди прочих, хромосомные, эписомальные векторы и векторы, происходящие из вирусов, например, векторы, происходящие из бактериальных плазмид, из бактериофага, из транспозонов, из эписом дрожжей, из инсерционных элементов, из хромосомных элементов дрожжей, из вирусов, и векторы, происходящие из их комбинаций, такие как векторы, происходящие из генетических элементов плазмиды и бактериофага, как например, космиды и фагмиды. Конструкции экспрессионных систем могут содержать регуляторные области, которые осуществляют регуляцию, а также вызывают экспрессию. Обычно, любую систему или вектор, подходящий для сохранения, размножения или экспрессии полинуклеотидов и для синтеза полипептида в хозяине, можно использовать для экспрессии в данном отношении. Соответствующая последовательность ДНК может быть вставлена в экспрессионную систему любой из множества хорошо известных и рутинных методик, таких как, например, методики, изложенные ранее в Sambrook et al.
Данная область богата патентными и литературными публикациями, относящимся к методам «генной инженерии» для выделения, синтеза, очистки и амплификации генетического материала для применения в трансформации выбранных организмов-хозяев. Таким образом, общеизвестна трансформация организмов-хозяев «гибридной» вирусной или кольцевой плазмидной ДНК, которая включает выбранные экзогенные (то есть, чужеродные или «гетерологичные») ДНК-последовательности. Способы, известные в данной области, прежде всего, включают образование вектора трансформации посредством ферментативного расщепления кольцевой вирусной или плазмидной ДНК с образованием линейных цепей ДНК. Выбранные чужеродные цепи ДНК, обычно включающие последовательности, кодирующие желательный белковый продукт, получают в линейной форме посредством использования одних и тех же/похожих ферментов. Линейную вирусную или плазмидную ДНК инкубируют с чужеродной ДНК в присутствии лигирующих ферментов, способных воздействовать на процесс восстановления, и образуются «гибридные» векторы, которые включают выбранный экзогенный сегмент ДНК, «сплайсированный» в вирусную или кольцевую ДНК-плазмиду.
Термин «нуклеотидная последовательность, кодирующая…» обычно относится к любому полирибонуклеотиду или полидезоксирибонуклеотиду, который может представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК, и обычно представляет часть гена, которая кодирует определенный полипептид или белок. Термин включает, без ограничения, одно- и двухцепочечную ДНК, ДНК, которая представляет собой смесь одно- и двухцепочечных участков или одно-, двух- и трехцепочечных участков, одно- и двухцепочечную РНК, и РНК, которая представляет собой смесь одно- и двухцепочечных участков, гибридные молекулы, содержащие ДНК и РНК, которые могут представлять собой одноцепочечные или более типично двухцепочечные или трехцепочечные участки, или смесь одно- и двухцепочечных участков. Термин также охватывает полинуклеотиды, которые включают один единственный непрерывный участок или прерывистые участки, кодирующие полипептид (например, прерывающиеся встроенным фагом или вставкой последовательности или редактированием), вместе с дополнительными участками, которые также могут содержать кодирующие и/или некодирующие последовательности.
В одном воплощении подходящий глюкозный транспортер представляет собой белок, облегчающий диффузию глюкозы. Подходящий белок, облегчающий диффузию глюкозы кодируется геном glf Zymomonas mobilis subsp, mobilis (штамм АТСС 31821 / ZM4 / CP4).
В дополнительном и/или альтернативном воплощении еще один подходящий глюкозный транспортер представляет собой пермеазу для переноса глюкозы. Подходящая пермеаза для переноса глюкозы кодируется геном galP K-12 Е, coli. Пермеаза для переноса глюкозы также известна как симпортер галактозы/протонов или галактозопермеаза, но также импортирует глюкозу через клеточную мембрану.
Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит и экспрессирует по меньшей мере один ген, содержащий область, кодирующую белок, гена glf Zymomonas mobilis subsp.mobilis (штамм АТСС 31821 / ZM4 / CP4), гена galP K-12 Е. coli или их функциональных вариантов.
Термин «вариант(ы)», в том виде, в котором он используется в данном документе, относится к полинуклеотиду или полипептиду, который отличается от референсного полинуклеотида или полипептида, соответственно, но сохраняет существенные (ферментативные) свойства референсного полинуклеотида или полипептида. Типичный вариант полинуклеотида отличается по нуклеотидной последовательности от другого, референсного полинуклеотида. Изменения в нуклеотидной последовательности варианта могут менять или могут не менять аминокислотную последовательность полипептида, кодируемого референсным полинуклеотидом. Изменения в нуклеотидах могут приводить к аминокислотным заменам, присоединениям, делециям и усечениям в полинуклеотиде, кодируемом референсной последовательностью, как обсуждается ниже. Типичный вариант полинуклеотида отличается по аминокислотной последовательности от другого, референсного полипептида. Обычно, различия ограничены таким образом, что последовательности референсного полипептида и варианта сильно похожи по всей длине и, во многих участках, идентичны. Вариант и референсный полипептид может отличаться в аминокислотной последовательности одной или более заменами, присоединениями, делециями в любой комбинации. Служащий заменой или вставленный остаток аминокислоты может представлять собой или может не представлять собой остаток аминокислоты, кодируемый генетическим кодом. Вариант полинуклеотида или полипептида может являться встречающимся в природе, таким как аллельный вариант, или он может представлять собой вариант, который не известно, чтобы встречался в природе. Варианты полинуклеотидов или полипептидов, не встречающиеся в природе, могут быть созданы методиками мутагенеза, посредством прямого синтеза и другими методами генной инженерии, известными специалистам в данной области.
В пределах объема настоящего изобретения, также нуклеиновая кислота/полинуклеотид и полипептидные полиморфные варианты, аллели, мутанты и межвидовые гомологи охвачены данными терминами, которые имеют аминокислотную последовательность, которая обладает более чем примерно 60%-ной идентичностью аминокислотных последовательностей, 65%-ной, 70%-ной, 75%-ной, 80%-ной, 85%-ной, 90%-ной, предпочтительно 91%-ной, 92%-ной, 93%-ной, 94%-ной, 95%-ной, 96%-ной, 97%-ной, 98%-ной или 99%-ной или большей идентичностью аминокислотных последовательностей, предпочтительно, на протяжении области из по меньшей мере примерно 25, 50, 100, 200, 500, 1000 или более аминокислот, с полипептидом, кодируемым белком дикого типа.
Соответственно, термин «функциональный вариант» любого из генов/белков, раскрытых в данном документе, предназначен для обозначения вариантов последовательностей генов/белков, все еще сохраняющих такую же или несколько меньшую активность гена или белка, из которого происходит соответствующий фрагмент.
В генетически модифицированной микробной клетке имеется путь биосинтеза УДФ-галактозы для внутриклеточного образования Гуанозиндифосфат-галактозы (ГДФ-Gal), поскольку для внутриклеточного биосинтеза лактозы требуется эффективная подача УДФ-галактозы.
В дополнительном и/или альтернативном воплощении УДФ-галактоза может быть получена за счет собственного метаболизма микробных клеток, а именно активности фосфоглюкомутазы, уридинтрифосфат-глюкозо-1-фосфат-уридилтрансферазы (УТФ-глюкозо-1-фосфат-уридилтрансферазы) и УДФ-глюкозо-4-эпимеразы.
Внутриклеточная подача ГДФ-галактозы может быть улучшена посредством генетических модификаций, таких как экспрессия или сверхэкспрессия одного или более генов, кодирующих полипептиды, демонстрирующие фосфоглюкомутазную активность, УДФ-глюкозо-1-фосфат-уридилтрансферазную активность и УДФ-глюкозо-4-эпимеразную активность, соответственно.
Термин «сверхэкспрессия» или «сверхэкспрессируемый», в том виде, в котором он используется в данном документе, относится к уровню экспрессии фермента или полипептида, который выше, чем уровень, который измеряют в клетке дикого типа того же вида, как и клетка-хозяин, которая не была генетически изменена.
Фосфоглюкомутаза представляет собой фермент, который облегчает взаимное превращение глюкозо-1-фосфата в глюкозо-6-фосфат в том смысле, что переносит фосфатную группу в мономере λ-D-глюкозы с положения 1' на 6' или с положения 6' на 1'. Типичный ген, кодирующий подходящую фосфоглюкомутазу, представляет собой ген рдт K-12 Е. coli (GenBank: U08369.1). Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит и экспрессирует/сверхэкспрессирует ген, кодирующий фосфоглюкомутазу, ген, предпочтительно содержащий область, кодирующую белок, гена рgm Е. coli или его варианта.
УТФ-глюкозо-1-фосфат-уридилтрансфераза, такая как GalU, или ее функциональный вариант катализирует превращение α-D-глюкозо-1-фасфата в УДФ-глюкозу с использованием УТФ. Типичным геном, кодирующим подходящую УТФ-глюкозо-1-фосфат-уридилтрансферазу, является ген galU K-12 Е, coli (GenBank: М98830.1). Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит и экспрессирует/сверхэкспрессирует ген, кодирующий УТФ-глюкозо-1-фосфат-уридилтрансферазу, ген, предпочтительно содержащий область, кодирующую белок, гена galU Е. coli или его варианта.
УДФ-глюкозо-4-эпимераза, такая как GalE или ее функциональный вариант, катализирует эпимеризацию УДФ-глюкозы в УДФ-галактозу. Типичный ген, кодирующий УДФ-глюкозо-4-эпимеразу, представляет собой ген galE K-12 Е. coli. Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит и экспрессирует/сверхэкспрессирует ген, кодирующий УДФ-глюкозо-4-эпимеразу, ген, предпочтительно содержащий область, кодирующую белок, гена galE Е, coli или его варианта.
В дополнительном и/или альтернативном воплощении путь биосинтеза УДФ-галактозы дополнительно содержит ферментативную активность глюкозо-6-фосфатизомеразы, которая превращает фруктозо-6-фосфат в глюкозо-6-фосфат и наоборот.Типичный ген, кодирующий глюкозо-6-фосфатизомеразу, представляет собой ген pgi K-12 Е. coli. Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит и экспрессирует/сверхэкспрессирует ген, кодирующий глюкозо-6-фосфатизомеразу, ген, предпочтительно содержащий область, кодирующую белок, гена pgi Е. coli или его варианта.
В качестве альтернативы, УДФ-галактоза может быть получена посредством подпитки микробных клеток галактозой через культуральную среду. Галактоза поглощается клеткой и фосфорилируется до галактозо-1 фосфата, который затем превращается в УДФ-галактозу. Гены, кодирующие ферменты, обладающие требуемой ферментативной активностью, известны в литературе (Groissoird et al., «Characterization, Expression, and Mutation of the Lactococcus lactis galPMKTE Genes, Involved in Galactose Utilization via the Leloir Pathway» (2003) J. Bacteriol. 185(3) 870-878).
Генетически модифицированная микробная клетка содержит β-1,4-галактозилтрансферазу, которая может осуществлять галактозилирование моносахарида - свободной глюкозы. В дополнительном и/или альтернативном воплощении подходящая β-1,4-галактозилтрансфераза происходит из Neisseria menningitidis, из Aggregatibacter aphrophilus или из Pasteureila multocida, предпочтительно β-1,4-галактозилтрансфераза, кодируемая геном IgtB Neisseria menningitidis, геном lex-1 Aggregatibacter aphrophilus или геном β-1,4-галактозилтрансферазы galTpm1141 из Pasteureila multocida (GenBank: AEC04686). Таким образом, в дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит и экспрессирует/сверхэкспрессирует ген, кодирующий β-1,4-галактозилтрансферазу, ген, предпочтительно содержащий область, кодирующую белок, гена IgtB Neisseria menningitidis, гена lex-1 Aggregatibacter aphrophilus, гена galTpm114 Pasteureila multocida 1 или их варианта.
β-1,4-Галактозилтрансфераза использует УДФ-галактозу в качестве субстрата для переноса галактозной группировки на моносахарид - свободную глюкозу, синтезируя, таким образом, дисахарид галактозо-β-1,4-глюкозу, то есть лактозу.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит по меньшей мере одну дополнительную гликозилтрансферазу, то есть помимо указанной β-1,4-галактозилтранcферазы.
Обычно, и по всему объему настоящего раскрытия, термин «гликозилтрансферазная активность» или «гликозилтрансфераза» обозначает и охватывает ферменты, которые отвечают за биосинтез дисахаридов, олигосахаридов и полисахаридов, и они катализируют перенос моносахаридных группировок от моносахарида/сахара, активированного нуклеотидом («донор гликозила»), к молекуле - акцептору гликозила.
В предпочтительном воплощении по меньшей мере одна дополнительная гликозилтрансфераза представляет собой фукозилтрансферазу, сиалилтрансферазу, глюкозаминилтрансферазу или галактозилтрансферазу, более предпочтительно по меньшей мере одна дополнительная гликозилтрансфераза выбрана из по меньшей мере одной из следующих: альфа-1,2-фукозилтрансфераза, альфа-1,3-фукозилтрансфераза, бета-1,3-N-ацетилглюкозамилтрансфераза, бета-1,3-галактозилтрансфераза, альфа-2,3-сиалилтрансфераза, альфа-2,6-сиалилтрансфераза, бета-1,4-галактозилтрансфераза или бета-1,6-галактозилтранcфераза.
Ферментативная активность по меньшей мере одной дополнительной гликозилтрансферазы обеспечивает продукцию интересующих олигосахаридов, которые содержат галактозо-β-1,4-глюкозную группировку на своем восстанавливающем конце, посредством использования лактозы в качестве акцептора в отношении активности дополнительной гликозилтрансферазы. В Таблице 1 идентифицированы наиболее распространенные ОГМ, которые могут продуцироваться микробными клетками и быть получены способами, раскрытыми в данном документе, в качестве интересующего олигосахарида.

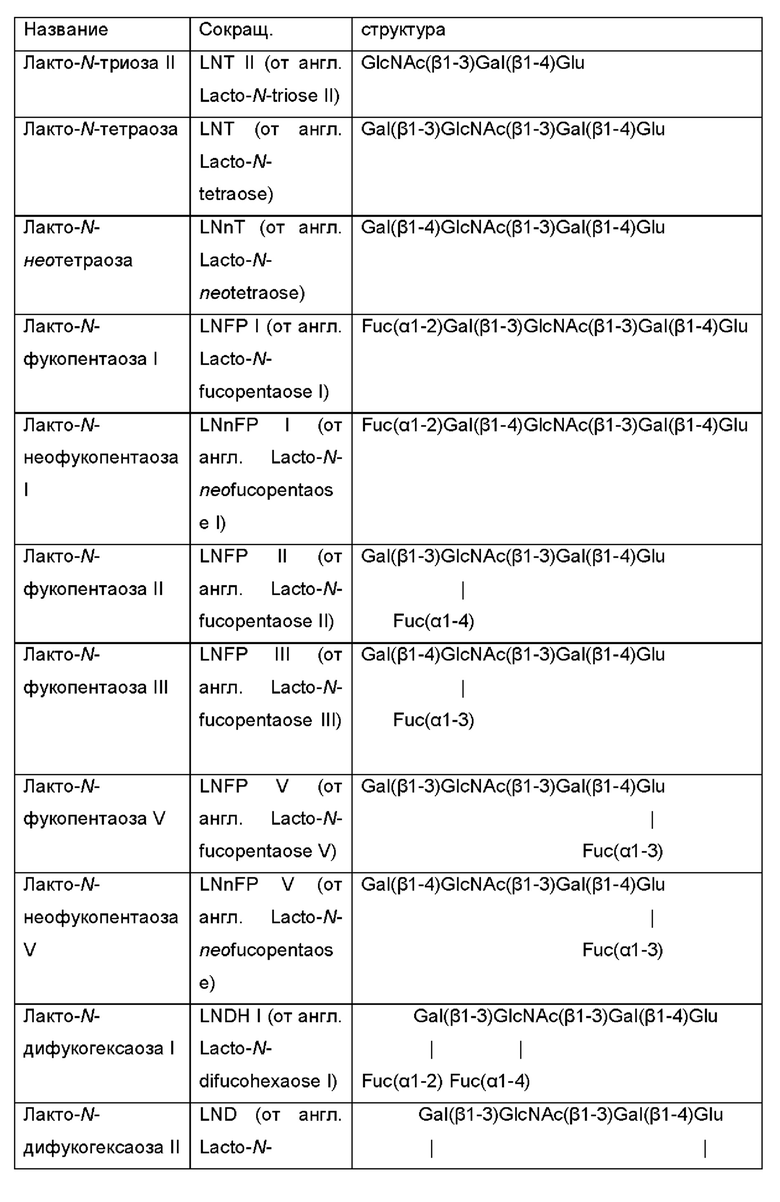
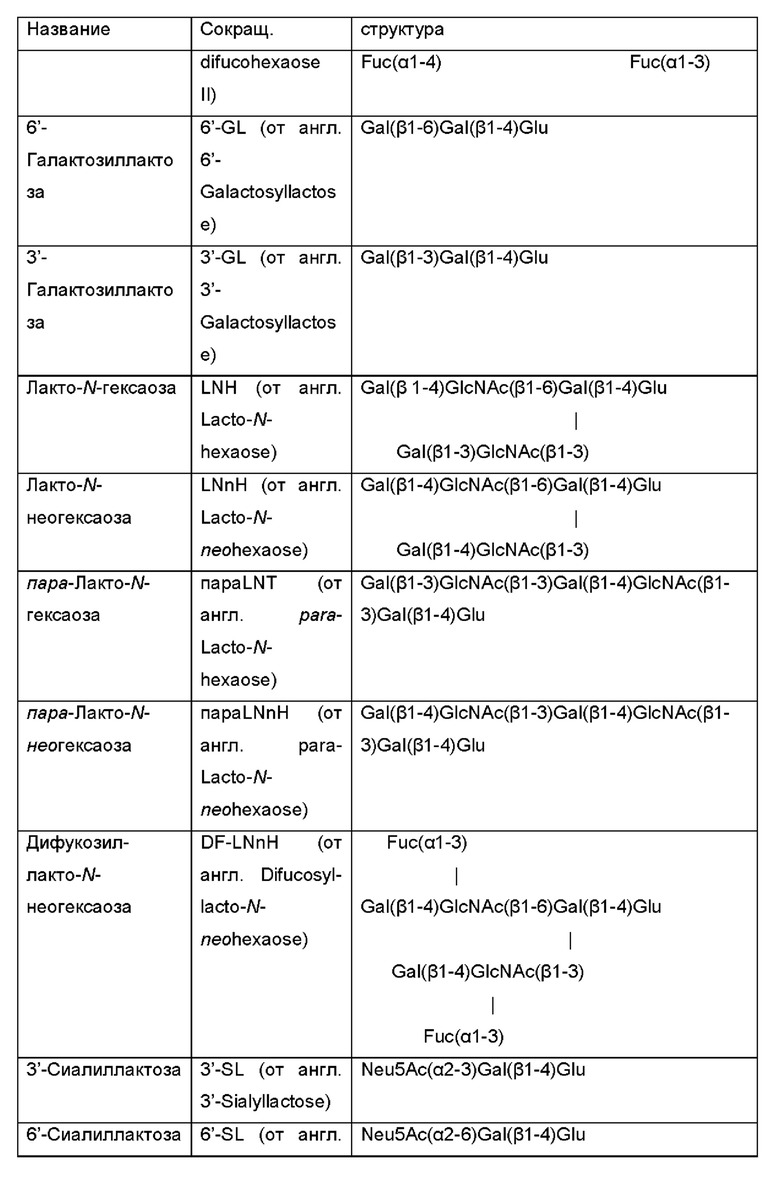
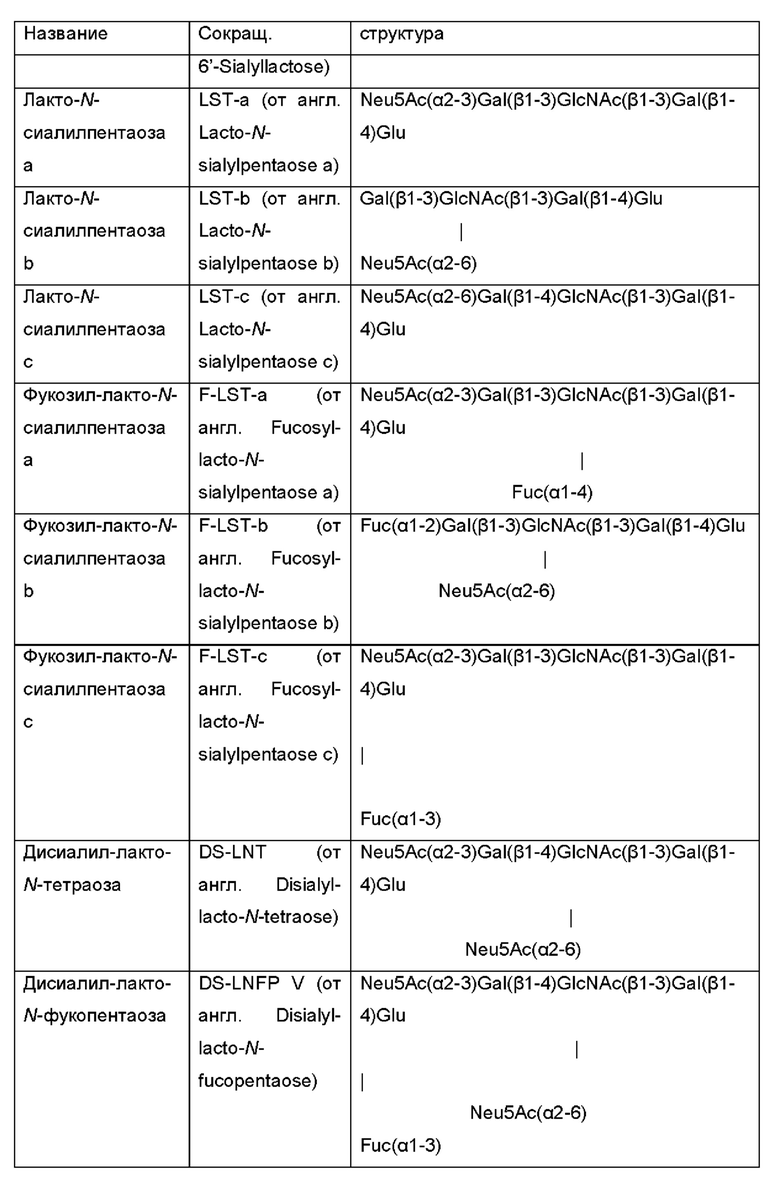
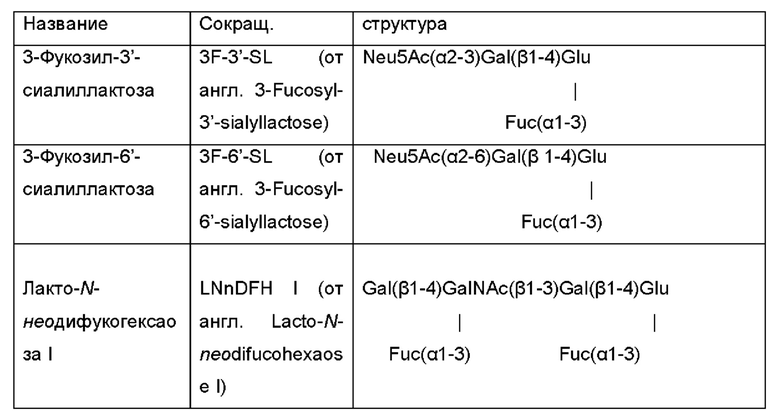
Таблица 1: Список интересующих олигосахаридов, которые могут быть получены посредством применения генетически модифицированной клетки и/или способом, как описано в данном документе.
В дополнительном и/или альтернативном воплощении микробная клетка содержит фосфотрансферазную систему переноса глюкозы (PtsG). Фосфотрансферазная система переноса глюкозы, катализирует фосфорилирование поступающей глюкозы, наряду с ее переносом через клеточную мембрану.
Общий механизм системы Pts заключается в следующем: фосфорильная группа от фосфоенолпирувата (PEP - от англ. phosphoenolpyruvate) переносится посредством пути передачи сигнала к ферменту I (EI - от англ. enzyme I), который, в свою очередь, переносит ее к носителю фосфорила, белку, богатому гистидином (НРr - от англ. histidine protein). Затем фосфо-HPr переносит фосфорильную группу к пермеазе, специфичной в отношении сахара, мембраносвязанному комплексу, известному как фермент 2 (ЕII - от англ. enzymes II), который транспортирует сахар в клетку. ЕII состоит по меньшей мере из трех структурно отличающихся доменов IIА, IIВ и IIC. Данные домены могут быть либо слиты вместе в одну единственную полипептидную цепь, либо существовать в виде двух или трех взаимосвязанных цепей, раньше называемых ферментами II (ЕII) и III (EIII).
Первый домен (IIА или ЕIIА) несет первый специфичный в отношении пермеазы сайт фосфорилирования, гистидин, который фосфорилируется фосфо-НРr. Второй домен (IIВ или ЕIIВ) фосфорилируется фосфо-IIА на остатке цистеинил или гистидил, в зависимости от транспортируемого сахара. Наконец, фосфорильная группа переносится от домена IIВ на субстрат-сахар, одновременно с поглощением сахара при участии домена IIC. Данный третий домен (IIС или ЕIIС) образует канал переноса и специфичный сайт связывания субстрата.
Таким образом, система PtsG приобретает экзогенную глюкозу и предоставляет глюкозо-6-фосфат в микробную клетку. Глюкозо-6-фосфат может или утилизироваться в пути биосинтеза УДФ-галактозы и/или превращаться во фруктозо-6-фосфат, который, в свою очередь, может быть использован для образования высокоэнергетических трифосфатов в центральном метаболизме и/или, например, в биосинтезе сахаридов, активированных нуклеотидом, таких как ГДФ-фукоза.
В дополнительном и/или альтернативном воплощении ген(ы) глюкокиназы микробной клетки удалены или функционально инактивированы, таким образом, что микробная клетка не имеет никакого полипептида, обладающего глюкокиназной активностью. Глюкокиназа (Glk)b фосфорилирует свободную глюкозу на ее атоме углерода 6 с образованием глюкозо-6-фосфата. В отсутствии глюкокиназной активности, свободная глюкоза, которая переносится в цитоплазму микробной клетки, становится доступной в качестве субстрата для β-1,4-галактозилтрансферазы с продукцией лактозы, тогда как глюкозо-6-фосфат, полученный за счет активности PtsG, может использоваться для образования УДФ-галактозы или в других метаболических путях.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит транспортер фруктозы для осуществления переноса фруктозы (Fru - от англ. fructose) из культуральной среды в цитоплазму микробной клетки. Подходящий транспортер фруктозы для поглощения свободной фруктозы представляет собой изоформу (PtsG-F), как описано Kornberg et al. PNAS 97: 1808-1812 (2000)).
Поглощенная фруктоза может затем быть фосфорилирована фруктокиназой (FrK - от англ. fructokinase), обеспечивая фруктозо-6-фосфат (Fru-6-P). Фруктозо-6-фосфат может быть утилизирован в пути биосинтеза УДФ-галактозы и/или в других метаболических путях, как например, образование высокоэнергетических трифосфатов в центральном метаболизме и/или, например, в биосинтезе сахаридов, активированных нуклеотидом, таких как ГДФ-фукоза.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит полипептиды, демонстрирующие активность фруктокиназы-6, и полипептиды, демонстрирующие активность 6-фосфофруктокиназы-1 (FruK или фосфофруктокиназа), с обеспечением метаболического пути от поглощенной фруктозы через фруктозо-6-фосфат до фруктозо-1,6-бисфосфата.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит фосфотрансферазную систему переноса фруктозы (PtsF). Фосфотрансферазная система переноса фруктозы, катализирует фосфорилирование поступающей фруктозы, одновременно с ее переносом через клеточную мембрану.
Таким образом, система PtsF приобретает экзогенную фруктозу и обеспечивает фруктозо-1-фосфат в микробной клетке. Система PtsF содержит трансмембранный белок FruA, 1-фосфофруктокиназу (FruK - от англ. phosphofructose kinase) и белок-переносчик дифосфорила FruB. Фруктоза переносится посредством FruA и FruB с обеспечением фруктозо-1-фосфата в цитоплазме. Фруктозо-1-фосфат может быть дополнительно фосфорилирован фосфофруктокиназой (FruK) с получением фруктозо-1,6-бифосфата, который, в свою очередь, может быть использован микробной клеткой для образования высокоэнергетических трифосфатов в центральном метаболизме.
Еще одна подходящая система PtsF содержит LevD, LevE, LevF и LevG. LevD представляет собой компонент фермента IIA- фосфотрансферазы, специфичной в отношении фруктозы. LevE представляет собой компонент фермента IIВ -фосфотрансферазы, специфичной в отношении фруктозы. LevF представляет собой компонент фруктозопермеазы IIС, LevG представляет собой компонент фруктозопермеазы IID. Соответствующие гены levD, levE, levF и levG, как известно, происходят, например, из Bacillus subtilis (штамм 168). Указанная система PtsF обеспечивает фруктозо-1-фосфат в клетке.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит по меньшей мере одну 1-фосфофруктокиназу (FruK).
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит фруктозо-1,6-бисфосфатазу (GIpX). Указанная фруктозо-1,6-бисфосфатаза дефосфорилирует фруктозо-1,6-бисфосфат, обеспечивая фруктозо-6-фосфат. Фруктозо-6-фосфат может использоваться микробной клеткой в пути биосинтеза ГДФ-галактозы или в другом метаболическом пути, например, в биосинтезе сахаридов, активированных нуклеотидом, таких как ГДФ-фукоза.
Предпочтительно, микробная клетка также содержит делецию или функциональную инактивацию своего (их) гена(ов) фосфофруктокиназы. Делеция или функциональная инактивация гена(ов) фосфофруктокиназы приводит к получению микробной клетки, которая не обладает фосфофруктокиназной активностью, таким образом, что предотвращается превращение Fru-6-P в Fru-1,6-бисР. В Е, coli присутствуют две изоформы фосфофруктокиназы, обозначаемые PfkA и PfkB. Соответствующие гены представляют собой pfkA и pfkB.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка имеет путь биосинтеза ГДФ-L-фукозы. В дополнительном и/или альтернативном воплощении путь биосинтеза ГДФ-фукозы содержит моннозо-6-фосфатизомеразу (МаnА), фосфоманномутазу (МаnВ), маннозо-1-фосфат-гуанилилтрансферазу (МаnС), ГДФ-маннозо-4,6-дегидратазу (Gmd), ГДФ-1_-фукозосинтазу (WcaG). Предпочтительно, микробная клетка, имеющая путь биосинтеза ГДФ-L-фукозы, также имеет фукозилтрансферазу.
В дополнительном и/или альтернативном воплощении микробная клетка содержит белок-экспортер или пермеазу, экспортирующую интересующий олигосахарид из клетки, предпочтительно эффлюксный транспортер сахаров.
В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка содержит делецию или функциональную инактивацию своего гена глюкозо-6-фосфатизомеразы, таким образом, что микробная клетка не обладает глюкозо-6-фосфатизомеразной активностью. Глюкозо-6-фосфатизомераза, в Е, coli обозначаемая Pgi, превращает глюкозо-6-фосфат во фруктозо-6-фосфат. Посредством удаления гена(ов) глюкозо-6-фосфата или посредством инактивации их экспрессии, любой глюкозо-6-фосфат, находящийся в цитоплазме микробной клетки, может быть направлен на продукцию лактозы.
В дополнительном и/или альтернативном воплощении микробная клетка представляет собой бактериальную клетку, выбранную из группы, состоящей из бактерий родов Escherichia, Lactobacillus, Corynebacterium, Bacillus, Streptococcus, Enterococcus, Lactococcus и Clostridium, предпочтительно бактериальную клетку, которая выбрана из группы видов бактерий, состоящей из Escherichia coli, Corynebacterium glutamicum, Clostridium cellulolyticum, Clostridium ljungdahlii, Clostridium autoethanogenum, Clostridium acetobutylicum, Bacillus subtilis, Bacillus megaterium, Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus heiveticus, Lactobacillus deibrueckii и Lactococcus lactis. В еще одном воплощении микробная клетка представляет собой Escherichia coli. Специалист в данной области будет иметь представление о дополнительных штаммах бактерий при чтении настоящего раскрытия.
Согласно второму аспекту предложено применение генетически модифицированной микробной клетки, как описано в данном документе, для получения лактозы или олигосахарида, который содержит галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце. В дополнительном и/или альтернативном воплощении генетически модифицированная микробная клетка используется в способе получения лактозы или олигосахарида, который содержит галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце, где микробную клетку культивируют в присутствии смешанного сырья, содержащего глюкозу и по меньшей мере один дополнительный источник углерода. Указанный дополнительный источник углерода может быть выбран из группы, состоящей из фруктозы, галактозы, маннозы, ксилозы, рамнозы, глицерина, сукцината, пирувата и малата. Предпочтительно, смешанное сырье представляет собой смесь глюкозы и фруктозы, более предпочтительно эквимолярную смесь глюкозы и фруктозы, наиболее предпочтительно содержащую или состоящую из гидролизованной сахарозы.
Согласно третьему аспекту предложен способ получения лактозы или интересующего олигосахарида, который содержит галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце, причем данный способ включает следующие стадии:
a) предоставление генетически модифицированной микробной клетки, как описано в данном документе;
b) культивирование микробной клетки в культуральной среде и в условиях, которые являются пермиссивными в отношении получения указанной лактозы или интересующего олигосахарида, где в культуральной среде содержится смесь глюкозы и по меньшей мере одного дополнительного соединения, выбранного из группы, состоящей из фруктозы, галактозы, маннозы, ксилозы, рамнозы, глицерина, сукцината, пирувата и малата, в качестве основного источника углерода; и
c) выделение лактозы или интересующего олигосахарида из культуральной среды и/или микробной клетки.
В дополнительном и/или альтернативном воплощении интересующий олигосахарид представляет собой олигосахарид грудного молока, выбранный из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3-фукозил-3'-сиалиллактозы, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-дифукозилгексозы I, лакто-N-дифукозилгексаозы II, лакто-N-сиалилпентаозы LSTa, LSTb, LSTc.
Предпочтительно, смесь глюкозы и по меньшей мере одного дополнительного моносахарида представляет собой смешанное сырье на основе глюкозы и фруктозы, предпочтительно полученное посредством гидролиза сахарозы.
В дополнительном и/или альтернативном воплощении микробная клетка культивируется без подачи лактозы извне, в частности, при культивации для продукции интересующего олигосахарида.
Настоящее изобретение будет описано в отношении конкретных воплощений и со ссылкой на графические материалы, но данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины первый, второй и тому подобное в описании и в формуле изобретения используются для проведения различия между похожими элементами и не обязательно для описания последовательности, во времени, в пространстве, по рангу или любым другим образом. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми в соответствующих обстоятельствах, и что воплощения изобретения, описанные в данном документе, способны работать в последовательностях, отличных от описанных или проиллюстрированных в данном документе.
Следует понимать, что термин «содержащий», используемый в формуле изобретения, не следует считать ограничивающимся средствами, перечисленными в дальнейшем; он не исключает других элементов или стадий. Таким образом, его следует считать определяющим наличие заявленных признаков, целых чисел, стадий или компонентов, на которые ссылаются, но он не исключает наличие или добавление одного или более других признаков, целых чисел, стадий или компонентов или их групп. Таким образом, объем выражения «устройство, содержащее средства А и В» не следует ограничивать устройствами, состоящими только из компонентов А и В. Оно означает, что в отношении настоящего изобретения, единственными релевантными компонентами устройства являются А и В.
Ссылка на всем протяжении данного описания изобретения на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанные в связи с данным воплощением, включены в по меньшей мере одно воплощение настоящего изобретения. Таким образом, появления фраз «в одном воплощении» или «в воплощении» в разных местах по всему объему данного описания изобретения не обязательно все относятся к одному и тому же воплощению, но могут. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом, как будет очевидно среднему специалисту в данной области из данного раскрытия, в одном или более воплощениях.
Аналогично следует понимать, что в описании иллюстративных воплощений изобретения разные признаки изобретения иногда сгруппированы вместе в одном единственном воплощении, фигуре или его описании в целях упрощения раскрытия и помощи в понимании одного или более разных аспектов изобретения. Данный способ раскрытия, однако, не нужно считать отражающим мысль, что заявленное изобретение требует больше признаков, чем явным образом перечислены в каждом пункте. Скорее, как отражено в приведенной ниже формуле изобретения, аспекты изобретения заключаются меньше чем во всех признаках одного вышеизложенного раскрытого воплощения. Таким образом, формула изобретения после подробного описания явным образом включена тем самым в данное подробное описание, причем каждый пункт отдельно стоит в виде отдельного воплощения данного изобретения.
Кроме того, в то время как некоторые воплощения, описанные в данном документе, включают некоторые, но не все признаки, включенные в другие воплощения, подразумевается, что комбинации признаков разных воплощений находятся в объеме изобретения и образуют разные воплощения, как будет понятно специалистам в данной области. Например, в приведенной ниже формуле изобретения любое из заявленных воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данном документе как способ или комбинация элементов способа, которые могут быть реализованы посредством процессора компьютерной системы или с помощью других средств выполнения функции. Таким образом, процессор с необходимыми инструкциями для осуществления такого способа или элемента способа образует средство осуществления способа или элемента способа. Кроме того, описанный в данном документе элемент воплощения аппарата представляет собой пример средства осуществления функции, выполняемой элементом, с целью осуществления изобретения.
В описании и графических материалах, предоставленных в данном документе, изложены многочисленные конкретные подробности. Однако, понятно, что воплощения изобретения можно осуществлять на практике без данных конкретных подробностей. В других примерах хорошо известные способы, структуры и методики не были показаны подробно для того, чтобы не затруднять понимание данного описания.
Теперь изобретение будет описано с помощью подробного описания нескольких воплощений изобретения. Ясно, что другие воплощения изобретения могут быть скомпонованы в соответствии со знаниями специалистов в данной области, не отклоняясь от истинной сущности или технической идеи изобретения, причем изобретение ограничено только условиями прилагаемой формулы изобретения.
В одном воплощении штамм Е, coli, имеющий генотип lacY-, lacZ-, fuclK-, wcaJ-, метаболически модифицирован для эффективной продукции 2'-фукозиллактозы посредством общей ферментации с использованием смешанного сырья на основе моносахаридов (например, гидролизированной сахарозы) в качестве основного источника углерода и энергии. Таким образом, уровень экспрессии гена глюкокиназы glk и/или гена глюкозодегидрогеназы gcd и/или гена глюкозо-PTS-пермеазы ptsG снижен и/или аннулирован. Кроме того, ген глюкозопермеазы экспрессируется или сверхэкспрессируется в указанном штамме Е. coli.
Кроме того, по меньшей мере один из генов Е. coli mаnА, mаnС, mаnВ, gmd, wcaG, рgm, galU и gale, а также экспрессия гетерологичной β-1,4-галактозилтрансферазы, способной переносить галактозу с УДФ-галактозы на глюкозу, таким образом, с образованием лактозы, и α-1,2-фукозилтрансферазы, способной переносить фукозу с ГДФ-фукозы на лактозу, таким образом, с образованием 2'-фукозиллактозы, экспрессируются/сверхэкспрессируются.
В предпочтительном воплощении данный продуцирующий штамм дополнительно модифицируют посредством снижения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf и/или гена глюкозо-6-фосфатизомеразы pgi. Данная дополнительная генетическая модификация делает возможной культивацию модифицированного таким образом продуцирующего штамма на смешанном сырье из моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, при одновременном предотвращении угнетения метаболизма штамма, но увеличении подачи предшественника (глюкозы и фруктозо-6-фосфата и глюкозо-6-фосфата) для продукции 2'-фукозиллактозы посредством общей ферментации.
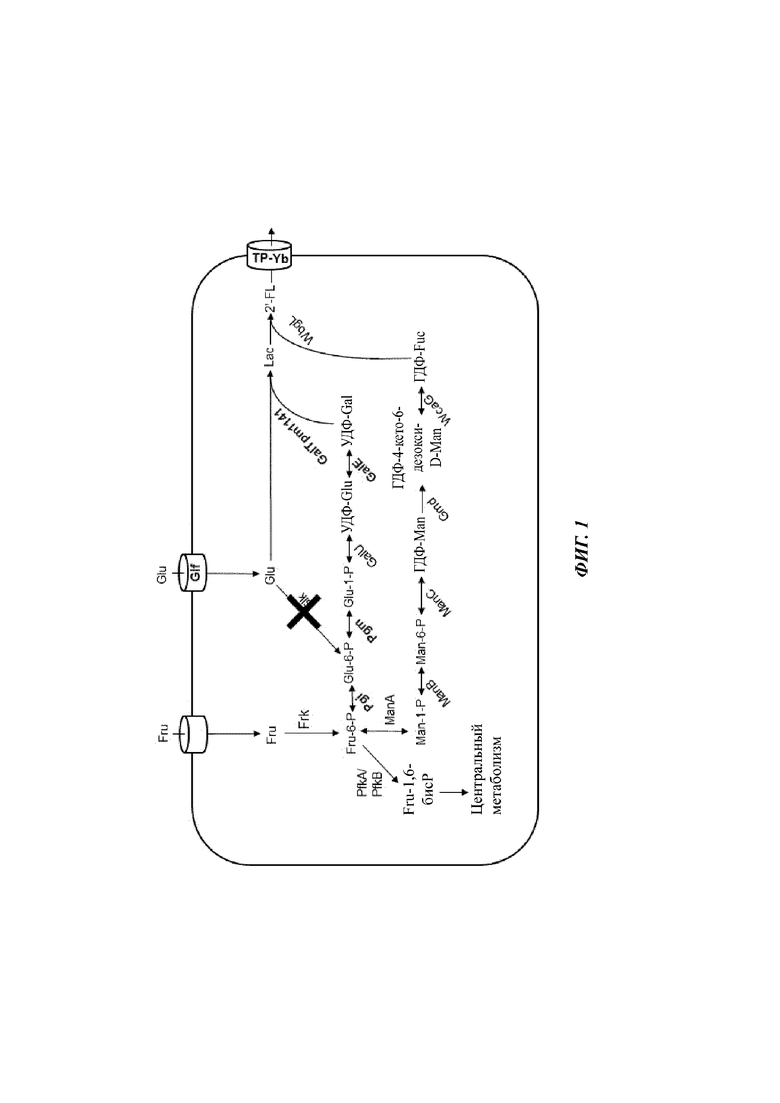
В отношении Фиг. 1, схематично показана типичная микробная клетка по изобретению. Указанная микробная клетка способна продуцировать 2'-FL при культивировании на смешанном сырье, состоящем из глюкозы (Glu - от англ. glucose) и фруктозы (Fru - от англ. fructose), но чье смешанное сырье не содержит лактозы (Lac - от англ. lactose). Микробная клетка экспрессирует полинуклеотиды, кодирующие транспортер глюкозы (Glf) и транспортер фруктозы для импорта глюкозы и фруктозы в клетку, соответственно. Поскольку экспрессия глюкозокиназы Glk была аннулирована в результате делеции или функциональной инактивации гена(ов) glk, любая глюкоза, которая импортируется клеткой, становится доступной в качестве субстрата для β1,4-галактозилтрансферазы GalTpm1141 с помощью пути биосинтеза УДФ-галактозы для внутриклеточного образования лактозы (Lac).
Импортируемая фруктоза фосфорилируется фруктозо-6-киназой клетки с образованием внутриклеточного пула Fru-6-P. Часть пула Fru-6-P используется в «пути биосинтеза УДФ-Gal» для внутриклеточного синтеза УДФ-Gal, которая служит донором Gal для галактозилтрансферазы GalTpm1141 с получением Lac. Еще одна часть пула fru-6-P используется в «пути биосинтеза ГДФ-L-Fuc» для продукции ГДФ-L-фукозы. Указанная ГДФ-L-фукоза служит донором фукозы для 2'-фукозилтрансферазы WbgL. Еще одну третью часть внутриклеточного пула Fru-6-P используют для продукции энергии и биомассы в том отношении, что ее fru-6-P превращается в Fru-1,6-бисP фосфофруктокиназами PfkA и/или PfkB клеток.
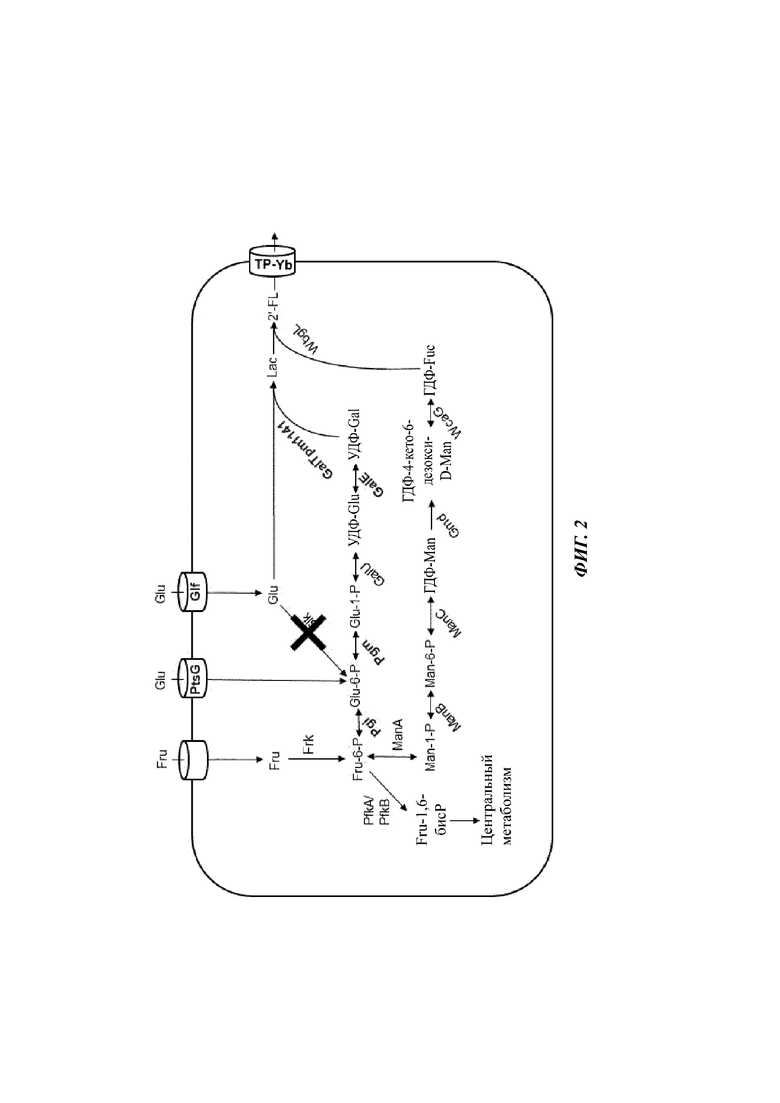
На Фиг. 2 схематично изображена еще одна типичная микробная клетка по изобретению, способная продуцировать 2'-FL при культивировании на смешанном сырье, состоящем из глюкозы (Glu) и фруктозы (Fru), но чье смешанное сырье не содержит лактозу (Lac). Помимо типичной микробной клетки, показанной на Фиг. 1, микробная клетка дополнительно содержит систему Pts, специфичную в отношении глюкозы (PtsG). Указанная система PtsG импортирует и фосфорилирует Glu с обеспечением Glu-6-P в цитоплазме клетки. Указанная Glu-6-P может использоваться микробной клеткой для образования УДФ-Gal или Fru-6-P. В варианте микробной клетки (не показано) ген(ы) клетки pgi, кодирующий(ие) глюкозо-6-фосфатизомеразу (Pgi), удален(ы). Наряду с удалением гена glk, микробная клетка генетически модифицирована таким образом, что мономер -свободная глюкоза - при приобретении Glf становится доступным в качестве субстрата для β1,4-галактозилтрансферазы, тогда как любая Glu-6-P, приобретенная посредством PtsG, становится доступной для биосинтеза УДФ-Gal.
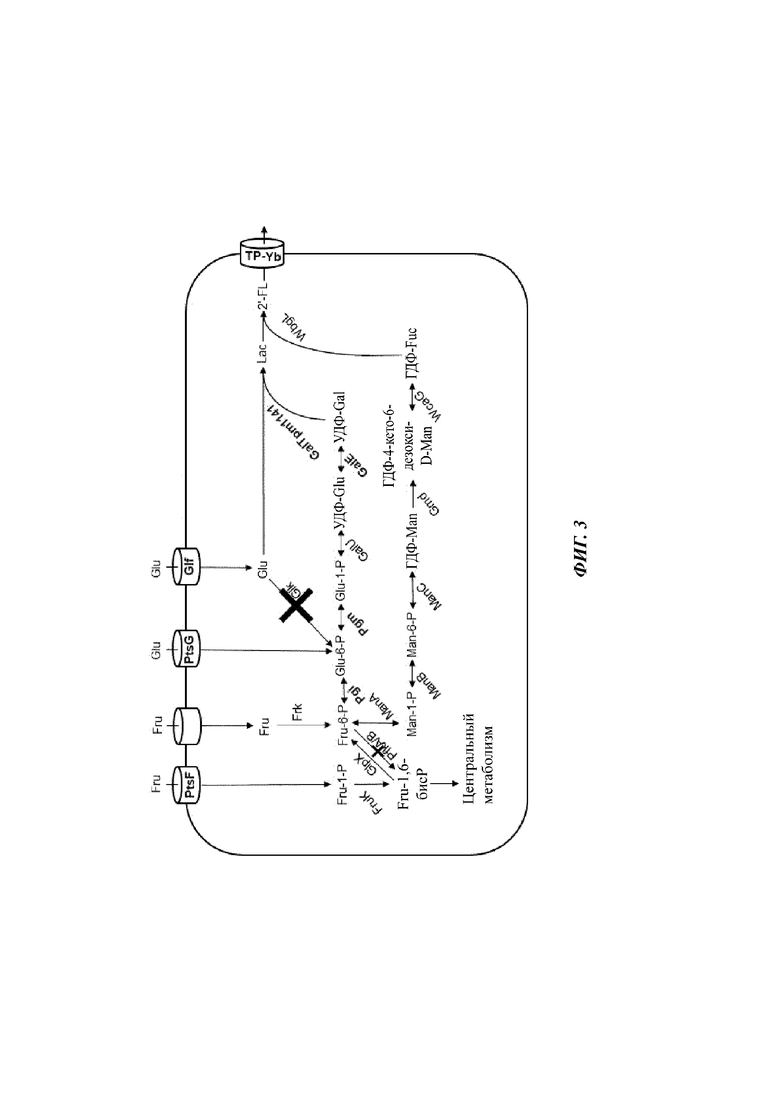
На Фиг. 3 схематично изображена еще одна типичная микробная клетка по изобретению, способная продуцировать 2'-FL при культивации на смешанном сырье, состоящем из глюкозы (Glu) и фруктозы (Fru), но чье смешанное сырье не содержит лактозы (Lac). Помимо типичной микробной клетки, показанной на Фиг. 2, микробная клетка дополнительно содержит систему Pts, специфичную в отношении фруктозы (PtsF). Указанная система PtsF импортирует и фосфорилирует Fru с обеспечением Fru-1-P. Fru-1-P фосфорилируется FruK с обеспечением Fru-1,6-бисP. Микробная клетка обладает фруктозо-1,6-бисфосфатазной (GIpX) активностью. Таким образом, генетически модифицированная микробная клетка метаболически модифицирована таким образом, что фруктоза и/или фруктозо-1-Р может использоваться клеткой для биосинтеза УДФ-Gal.
Кроме того, ген(ы) фосфофруктокиназы удален(ы) или функционально инактивирован(ы), таким образом, что клетка не обладает фосфофруктокиназной (PfkA/PfkB) активностью. Удаление или функциональная инактивация генов фосфофруктокиназы нарушает превращение Fru-6P в Fru-1,6-P, таким образом, что использование Fru-6-P для образования высокоэнергетических трифосфатов предотвращается, и продукция 2'-FL усиливается.
Примеры
Пример 1 - Получение смешанного сырья на основе моносахаридов 50%-ный (масс/об.) раствор сахарозы получали посредством растворения 500 г сахарозы в воде. Конечный объем раствора составлял 1 литр. При температуре 30°С-35°С рН регулировали посредством использования 96%-ной (об./об.) серной кислоты. Затем, раствор стерилизовали в вертикальном автоклаве (Systec VX-65, Linden, Германия) при 121°С в течение 45 минут. Образцы брали перед и после тепловой стерилизации и хранили в замороженном виде перед анализом посредством высокоэффективной жидкостной хроматографии (ВЭЖХ). ВЭЖХ проводили, используя рефрактометрический детектор RID-10A (Shimadzu, Германия) и колонку Waters XBridge Amide, 3,5 мкм (250 × 4,6 мм) (Eschborn, Германия), соединенную с системой ВЭЖХ Shimadzu. Изократическое элюирование проводили 30%-ным растворителем А (50% (об./об.) ацетонитрил в дважды дистиллированной воде, 0,1% (об./об.) NH4OH) и 70%-ным растворителем В (80% (об./об.) ацетонитрил в дважды дистиллированной воде, 0,1% (об./об.) NH4OH) при 35°С и при скорости потока 1,4 мл мин-1. Образцы очищали посредством твердофазной экстракции на ионообменной матрице (Strata ABW, Phenomenex). Десять микролитров образца (разведение 1:5) наносили на колонку. Наконец, определяли относительное количество выявленных сахаров. Как изображено в Таблице 1, превращение сахарозы в моносахариды глюкозу и фруктозу увеличивалось со снижением значений рН растворов до тепловой обработки. Полное расщепление сахарозы могло наблюдаться при значениях рН, равных или меньше 3,50, когда подкисление проводили серной кислотой.
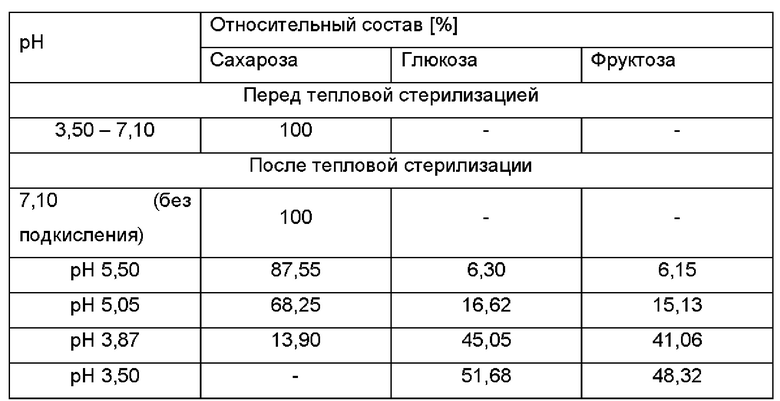
Таблица 1: Относительное количество cахаров, выявляемое в 50%-ном (масс/об.) растворе сахарозы с регулируемым рН перед и после тепловой стерилизации. Регуляцию рН проводили, используя 96%-ную (об./об.) серную кислоту. Изображено выраженное в процентах количество сахаров (площадь под кривой; AUC - от англ. area under curve), выявляемое посредством ВЭЖХ.
Пример 2 - Зависимый от сырья рост разных штаммов сделецией генов сравнивали характер роста штамма BL21 Е, coli (DE3) (дикий тип), а также мутантных штаммов Е. coli pfkA- (ΔpfkA), Е, coli pfkB- (ΔpfkB), E, coli pfkA- pfkB-(ΔpfkA ΔpfkA). Геномные делеции осуществляли в соответствии со способом Datsenko и Wanner (Proc. Natl. Acad. Sci. USA 97:6640-6645 (2000)). Все штаммы культивировали при 30°C в 100 мл-встряхиваемых колбах с 20 мл среды на основе минеральных солей, содержащей 7 г⋅л-1 NH4H2PO4, 7 г⋅л-1 K2НРO4, 2 г⋅л-1 KОН, 0,3 г⋅л-1 лимонной кислоты, 2 г⋅л-1 MgSO4 × 7⋅Н2O и 0,015 г⋅л-1 CaCI2 × 6⋅Н2O, с добавлением 1 мл⋅л-1 раствора микроэлементов (54.4 г⋅л-1 цитрата железа (III)-аммония, 9,8 г⋅л-1 MnCI2 × 4 Н2O, 1,6 г⋅л-1 CoCI2 × 6⋅Н2O, 1 г⋅л-1 CuCI2 × 2 Н2O, 1.9 г⋅л-1 Н3ВO3, 9 г⋅л-1 ZnSO4 × 7⋅Н2O, 1,1 г⋅л-1 Na2MoO4 × 2⋅Н2O, 1,5 г⋅L-1 Na2SeO3, 1,5 г⋅л-1 NiSO4 × 6⋅Н2O) и содержащей или 2% (масс./об.) глюкозы (А) или 1% (масс/об.) глюкозы/1% (масс./об.) фруктозы (В) в качестве источника углерода. Культуры инокулировали до оптической плотности (OD, от англ. - optical density) 0,1, и развитие роста отслеживали на протяжении 26 часов посредством измерения OD600. Как показано на Фиг. 2, Е. coli pfkA- pfkB- почти не демонстрировал роста, когда глюкоза была предоставлена в качестве одного единственного источника углерода и энергии, тогда как его рост был неотличим от штамма дикого типа, а также мутантов с единственной делецией, когда было доступно смешанное сырье на основе моносахаридов.
Пример 3 - Общая ферментация 2'-фукозиллактозы модифицированным штаммом Е, coli во время роста на смешанном сырье из моносахаридов
Штамм BL21 Е. coli (DE3), демонстрирующий генотип pfkA-, lacZ-, fuclK-, wcaJ-, glk-, gcd-, ptsG-, дополнительно генетически модифицировали посредством сверхэкспрессии ферментов для синтеза de novo ГДФ-фукозы (ManB, ManC, Gmd, WcaG), гена 2'-фукозилтрансферазы wbgL из Е, coli: 0126, гена эффлюксного транспортера сахара yberc0001_9420 из Yersinia bercovieri АТСС 43970, гена транспортера, облегчающего диффузию глюкозы glf из Zymomonas mobilis, гена β-1,4-галактотрансферазы gаlТрm1141 из Pasteureila multocida (GenBank: АЕС04686), а также генов galE и рgm Е. coli, кодирующих УДФ-глюкозо-4-эпимеразу и фосфоглюкомутазу, соответственно. Геномные делеции осуществляли в соответствии со способом Datsenko и Wanner (Proc. Natl. Acad. Sci. USA 97:6640-6645 (2000)). Интеграцию гетерологичных генов в геном проводили посредством транспозиции. Или транспозазу EZ-Tn5TM (Epicentre, США) использовали для интеграции линейных ДНК-фрагментов, или гиперактивный С9-мутант транспозазы mariner Himarl (Proc. Natl. Acad. Sci. 1999, USA 96:11428-11433) использовали для транспозиции. Гены подвергались оптимизации кодонов для экспрессии в Е, coli и их получали синтетически посредством кооперации с GenScript.
Полученный штамм Е, coli культивировали при 30°С в ферментере, объемом 3 л (New Brunswick, Edison, США), начиная с 1000 мл среды на основе минеральных солей, содержащей 7 г⋅л-1 NH4H2PO4, 7 г⋅л-1 K2НРO4, 2 г⋅л-1 KОН, 0,3 г⋅л-1 лимонной кислоты, 2 г⋅л-1 MgSO4 × 7⋅ Н2O и 0,015 г⋅л-1 CaCI2 × 6⋅Н2O, с добавлением 1 мл⋅л-1 раствора микроэлементов (54,4 г⋅л-1 цитрата железа (III)-аммония, 9,8 г⋅л-1 MnCI2 × 4⋅Н2O, 1,6 г⋅л-1 CoCI2 × 6⋅Н2O, 1 г⋅л-1 CuCI2 × 2Н2O, 1,9 г⋅л-1 Н3ВO3, 9 г⋅л-1 ZnSO4 × 7⋅Н2O, 1,1 г⋅ л-1 Na2MoO4 × 2⋅Н2O, 1,5 г⋅L-1 Na2SeO3, 1,5 г⋅л-1 NiSO4 × 6⋅Н2O) и содержащей 2% (масс/об.) гидролизованной сахарозы в качестве источника углерода. Культивацию начинали с добавления 2,5% (об./об.) инокулюма из предварительной культуры, выросшей в той же среде. Конец фазы периодического культивирования характеризовался повышением уровня растворенного кислорода. Углеродную подпитку, состоящую из полностью гидролизованной сахарозы, с добавлением 2 г⋅л-1 MgSO4 × 7⋅Н2O, 0,015 г⋅л-1 CaCI2 × 6⋅Н2O и 1 мл⋅л-1 раствора микроэлементов, применяли сразу же после окончания фазы периодического культивирования. Применяли скорость подачи 12,0-15,0 мл⋅л-1⋅ч-1 относительно исходного объема. Аэрацию поддерживали на уровне 3 л⋅мин-1. Уровень растворенного кислорода поддерживали на уровне насыщения 20-30% посредством осуществления контроля скорости перемешивания. рН поддерживали на уровне 6,7 посредством добавления 25%-ого раствора аммония. Культивирование продолжалось на протяжении 86 часов и давало существенные количества 2'-FL в супернатанте культуры.
Группа изобретений относится к биотехнологии. Раскрыты генетически модифицированные микробные клетки и их применение, где указанные микробные клетки могут продуцировать олигосахариды в отсутствие лактозы, добавляемой извне, а также способ получения олигосахаридов с использованием указанных микробных клеток. Изобретение позволяет использовать его для продукции олигосахаридов, содержащих галактозо-β1,4-глюкозную группировку на своем восстанавливающем конце. 3 н. и 13 з.п. ф-лы, 1 табл., 4 ил., 3 пр.
1. Генетически модифицированная клетка Escherichia coli для получения интересующего олигосахарида, который содержит галактозо-β1,4-глюкозную группировку на восстанавливающем конце, где указанная микробная клетка имеет:
- по меньшей мере один глюкозный транспортер для переноса глюкозы из культуральной среды в цитоплазму микробной клетки, в результате чего свободная глюкоза становится доступной для внутриклеточного биосинтеза лактозы, причем указанный по меньшей мере один глюкозный транспортер выбран из группы, состоящей из белков, облегчающих диффузию глюкозы, и пермеаз, переносящих глюкозу;
- путь биосинтеза уридиндифосфатгалактозы (УДФ-галактозы), включающий фосфоглюкомутазу, УТФ-глюкозо-1-фосфат-уридилтрансферазу и УДФ-глюкозо-4-эпимеразу;
- по меньшей мере одну β-1,4-галактозилтрансферазу, способную осуществлять галактозилирование свободной глюкозы с внутриклеточной продукцией лактозы;
- по меньшей мере одну дополнительную гликозилтрансферазу, выбранную из группы, состоящей из фукозилтрансфераз, сиалилтрансфераз, глюкозаминилтрансфераз и галактозилтрансфераз; и
- причем ген(ы) глюкокиназы удален(ы).
2. Генетически модифицированная микробная клетка по п. 1, где указанная микробная клетка экспрессирует или сверхэкспрессирует по меньшей мере один ген, кодирующий глюкозный транспортер, предпочтительно по меньшей мере один ген, выбранный из группы, состоящей из glf, galP и их функциональных вариантов.
3. Генетически модифицированная микробная клетка по п. 1 или 2, в которой указанная β-1,4-галактозилтрансфераза, способная осуществлять галактозилирование свободной глюкозы, кодируется геном, выбранным из группы, состоящей из IgtB Neisseria meningitidis, lex-1 Aggregatibacter aphrophilus, galTpm1141 Pasteurella multocida и их функциональных вариантов.
4. Генетически модифицированная микробная клетка по любому из пп. 1-3, где указанная микробная клетка содержит фосфотрансферазную систему переноса глюкозы.
5. Генетически модифицированная микробная клетка по любому из пп. 1-4, где указанная микробная клетка имеет транспортер фруктозы.
6. Генетически модифицированная микробная клетка по любому из пп. 1-5, где микробная клетка имеет фосфотрансферазную систему, специфичную в отношении фруктозы и где указанная клетка дополнительно содержит 1-фосфофруктокиназу.
7. Генетически модифицированная микробная клетка по п. 5, где указанная микробная клетка содержит активность фруктокиназы-6 и активность 6-фосфофруктокиназы-1.
8. Генетически модифицированная микробная клетка по п. 6, где микробная клетка содержит фруктозо-1,6-бисфосфатазу.
9. Генетически модифицированная микробная клетка по п. 6 или 8, где указанная микробная клетка содержит делецию или функциональную инактивацию своей глюкозо-6фосфатизомеразы.
10. Генетически модифицированная микробная клетка по любому из пп. 1-9, в которой дополнительная гликозилтрансфераза представляет собой фукозилтрансферазу и где в указанной микробной клетке имеются маннозо-6-фосфатизомераза, фосфоманномутаза, маннозо-1-фосфат-гуанил илтрансфераза, гуанозиндифосфат-маннозо-4,6-дегидратаза (ГДФ-маннозо-4,6-дегидратаза), ГДФ-L-фукозосинтаза.
11. Генетически модифицированная микробная клетка по любому из пп. 1-10, где указанная микробная клетка содержит белок-экспортер или пермеазу, экспортирующую интересующий олигосахарид из клетки, предпочтительно эффлюксный транспортер сахаров.
12. Применение генетически модифицированной клетки Escherichia coli по любому из пп. 1-11 для получения олигосахарида, представляющего интерес, который содержит галактозо-β1,4-глюкозную группировку на восстанавливающем конце.
13. Способ получения интересующего олигосахарида, который содержит галактозо-β1,4-глюкозную группировку на восстанавливающем конце, включающий следующие стадии:
a) предоставление генетически модифицированной клетки Escherichia coli по любому из пп. 1-11;
b) культивирование указанной клетки Escherichia coli в культуральной среде и в условиях, которые являются пермиссивными в отношении получения указанного интересующего олигосахарида, где в культуральной среде содержится смесь глюкозы и по меньшей мере одного дополнительного соединения, выбранного из группы, состоящей из фруктозы, галактозы, маннозы, ксилозы, рамнозы, глицерина, сукцината, пирувата и малата в качестве основного источника углерода; и
b) выделение интересующего олигосахарида из культуральной среды и/или указанной клетки Escherichia coli.
14. Способ по п. 13, в котором интересующий олигосахарид представляет собой олигосахарид грудного молока, выбранный из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3-фукозил-3'-сиалиллактозы, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-дифукозилгексозы I, лакто-N-дифукозилгексаозы II, лакто-N-сиалилпентаозы LSTa, LSTb, LSTc.
15. Способ по п. 13 или 14, в котором смесь глюкозы и по меньшей мере одного дополнительного моносахарида представляет собой смешанное сырье из глюкозы и фруктозы, предпочтительно полученное посредством гидролиза сахарозы.
16. Способ по любому из пп. 13-15, в котором указанная микробная клетка культивируется без подачи лактозы извне.
| WO 2015150328 A1, 08.10.2015 | |||
| US 7521212 B1, 21.04.2009 | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Способ искусственного получения акустического резонанса | 1922 |
|
SU334A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| RU 2016121174 A, 04.12.2017. | |||
Авторы
Даты
2023-08-03—Публикация
2019-09-02—Подача