Настоящее изобретение относится к области техники генной инженерии, в частности, к генной инженерии клеток Bacillus для получения сиалированных олигосахаридов в указанных клетках Bacillus, к ферментативной продукции сиалированных олигосахаридов с использованием указанных клеток Bacillus и к применению полученных таким образом сиалированных олигосахаридов.
Предшествующий уровень техники
Человеческое грудное молоко обеспечивает детей грудного возраста всеми питательными веществами, в которых они нуждаются для здорового роста и развития. Сахариды, которые присутствуют в человеческом грудном молоке, представляют собой его основной компонент, превосходя жиры и белки. Помимо лактозы, которая служит источником энергии, человеческое грудное молоко содержит молекулы более сложных сахаридов, а именно, олигосахаридов. На сегодняшний день в человеческом грудном молоке идентифицировано приблизительно 200 структурно отличающихся олигосахаридов. Данные олигосахариды обнаружены в значимых концентрациях только в человеческом молоке, и они суммарно известны как олигосахариды грудного молока (ОГМ). Указанные ОГМ основаны на дисахариде - лактозе (состоящей из группировки глюкозы (Glc) и группировки галактозы (Gal)) и несут дополнительные остатки моносахаридов, которые основаны на N-ацетил-глюкозамине (GlcNAc), фукозе (Fuc), сиаловой кислоте/N-ацетилнейраминовой кислоте (NeuNAc) и/или галактозе (Gal). Концентрация и состав ОГМ в человеческом грудном молоке варьирует среди индивидуумов и на протяжении периода лактации от вплоть до 20 г/л в молозиве до 5-10 г/л в зрелом молоке.
Значимое число ОГМ несет одну группировку NeuNAc. Среди данных сиалированных олигосахаридов грудного молока (СОГМ), 3'-сиалиллактоза, 6'-сиалиллактоза, сиалиллакто-N-тетраоза а, сиалиллакто-N-тетраоза b, сиалиллакто-N-тетраоза с и дисиалиллакто-N-тетраоза представляют собой наиболее распространенные члены в человеческом грудном молоке.
Сиаловые кислоты (Sia) представляют собой семейство отрицательно заряженных моносахаридов с каркасом из девяти атомов углерода. Более чем 50 форм данных α-кетокислот обнаружено в природе. Наиболее распространенной сиаловой кислотой, по-видимому, является N-ацетилнейраминовая кислота (NANA -от англ. N-acetylneuraminic acid, NeuNAc, Neu5Ac).
Сиаловые кислоты находятся в качестве концевых моносахаридных группировок гликанов, которые находятся в гликоконъюгатах (гликопротеины и гликолипиды) на поверхности клеток позвоночных и высших беспозвоночных. Сиаловые кислоты являются компонентами липополисахаридов и капсульных полисахаридов патогенных бактерий, включая Escherichia coli K1, Haemophilus influenzae, Haemophilus ducreyi, Pateurella multocida, Neisseria gonorrhoeae, Neisseria meningitidis, Campylobacter jejuni и Streptococcus agalactiae.
Наблюдали, что сиалированные ОГМ поддерживают устойчивость грудного ребенка к энтеропатогенным бактериям и вирусам. Что интересно, недавние исследования, кроме того, продемонстрировали защитное действие длинноцепочечных СОГМ в отношении некротического энтероколита, который является одним из наиболее распространенных и смертельных заболеваний у недоношенных новорожденных. Кроме того, показано, что сиалированные олигосахариды нейтрализуют энтеротоксины разных патогенных микробов, включая Escherichia coli, Vibrio cholerae и Salmonella. Кроме того, обнаружено, что сиалированные олигосахариды препятствуют колонизации кишечника Helicobacter pylori и, вследствие этого, предотвращают или ингибируют язвы желудка и двенадцатиперстной кишки. Кроме того, полагают, что сиалированные олигосахаирды поддерживают развитие головного мозга младенца и его когнитивные способности.
Благодаря известной пользе от ОГМ, главным образом сиалированных ОГМ, экономически целесообразный способ их получения является желательным, таким образом, чтобы данные сиалированные олигосахариды или по меньшей мере некоторые из данных сиалированных олигосахаридов стали доступными в качестве добавки к детским питательным смесям.
Ограниченная доступность грудного молока для целей, отличных от грудного вскармливания грудного ребенка, и сложности получения чистых фракций отдельных олигосахаридов грудного молока из природных источников привели к разработке химических путей их синтеза. Однако, и химический синтез, и биокаталитические подходы in-vitro оказались коммерчески нерациональными. Кроме того, в частности химический синтез олигосахаридов грудного молока включает применение нескольких вредных химических веществ, которые накладывают риск загрязнения конечного продукта.
В качестве альтернативы химическому и биокаталитическому синтезу in-vitro разработано ферментативное получение ОГМ. На сегодняшний день, рекомбинантные клетки Escherichia coli используют для микробной продукции некоторых ОГМ в промышленном масштабе.
Однако, род Escherichia coli включает патогенные члены, а также непатогенные члены. Несмотря на то, что для микробной продукции ОГМ используют непатогенные штаммы Е. coli, такие непатогенные Е. coli не считают безопасными для изготовления продуктов, которые предназначены для потребления человеком во множестве областей. Это мешает одобрению контролирующими органами ОГМ, изготавливаемых современными биотехнологическими способами, для потребления человеком в указанных областях. Таким образом, микробные клетки родов, которые расценивались бы как безопасные для потребления человеком или расценивались бы как безопасные при использовании в получении соединений для потребления человеком в таких областях, необходимы для изготовления сахаридов, которые предназначены для потребления человеком, например, олигосахаридов грудного молока, в частности, для потребления грудными детьми. Применение продуктивных штаммов, считающихся безопасными, уменьшает, по меньшей мере предположительно, проблемы в отношении вероятности рисков для здоровья человека, обусловленных сахаридом, и будет облегчать их одобрение контролирующими органами в большинстве областей.
Проблема решается посредством использования бактериальных клеток рода Bacillus для получения сиалированных олигосахаридов, в частности сиалированных ОГМ. Бактериальные клетки некоторых видов рода Bacillus уже расцениваются как безопасные для потребления человеком или для получения соединений/пищи для потребления человеком. Следовательно, предложены клетки Bacillus вида и/или штаммов, которые обычно расцениваются как безопасные для получения сиалированных олигосахаридов, в частности, для получения сиалированных олигосахаридов грудного молока.
Бактерии рода Bacillus являются грамположительными, палочковидными, образующими эндоспоры микробными клетками или аэробных, или факультативно анаэробных видов. Род Bacillus принадлежит к типу Фирмикуты. Геном членов рода Bacillus имеет тенденцию к парам оснований А-Т в своей частоте использования кодона. Виды Bacillus почти повсеместно распространены в природе. Например, они могут быть найдены в почве (В. subtilis), а также встречаются в экстремальных условиях окружающей среды, таких как высокий рН (В. alcalophilus), высокая температура (В. thermophilus) или высокое содержание солей (В, halodurans).
Род Bacillus включает 266 видов, имеющих название, которые включают свободноживущие виды, а также паразитарные патогенные виды. Два вида Bacillus считаются значимыми с медицинской точки зрения: В. anthracis, который вызывает сибирскую язву, и В. cereus, который вызывает пищевое отравление. Третий вид, В. thuringiensis, является важным патогеном насекомых, продуцирующим токсин, который может уничтожать насекомых. Таким образом, он используется в качестве инсектицида для борьбы с насекомыми-вредителями.
Из-за их статуса GRAS (от англ. generally recognized as safe - общепризнан безопасным), несколько видов Bacillus, например, В. amyloliquefaciens, В. licheniformis и B. subtilis, используются в биотехнологическом получении разных белков и соединений, используемых в пищевой и фармацевтической промышленности.
Bacillus amyloliquefaciens является источником рестриктазы BamHI и также синтезирует природный белок - антибиотик барназу. Кроме того, В. amyloliquefaciens продуцирует плантазолицин, антибиотик с селективной активностью в отношении В.anthracis. Альфа-амилаза из В. amyloliquefaciens часто используется в гидролизе крахмала. В. amyloliquefaciens также является источником субтилизина, который катализирует распад белков.
Bacillus amyloliquefaciens представляет собой бактерию-колонизатора корней, которая используется для того, чтобы бороться с некоторыми патогенами корней растений в сельском хозяйстве, водной культуре и гидропонике, поскольку она оказывает действие против бактериальных и грибковых патогенов и может предотвращать инфицирование в результате конкурентного исключения или вытеснения нежелательного патогена в конкурентной борьбе.
Ее высокая способность секретировать щелочную сериновую протеазу сделала B. licheniformis одной из наиболее важных бактерий в промышленном производстве фермента. Субтилизин Carlsberg, секретируемый В. licheniformis, используют в качестве протеазы для моющих средств, и он продается под торговым названием Alcalase®.
Bacillus subtilis представляет собой бактерию, позитивную в отношении каталазы, которая обнаружена в почве и желудочно-кишечном тракте жвачных животных и человека. В. subtilis и вещества, происходящие из данной бактерии, не содержащей эндотоксин, оценивались разными авторитетными органами в отношении их безопасности и пользы в применении в пищевой продукции. В Соединенных Штатах ферменты карбогидраза и протеаза из В. subtilis общепризнаны безопасными (GRAS) Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA - от англ. Food and Drug Administration). Bacillus subtilis также присвоен статус «квалифицированной презумпции безопасности» Европейским агентством по безопасности продуктов питания.
Кроме того, нетоксигенные и непатогенные штаммы В. subtilis обычно используются в пищевой промышленности. Например, ферментированные соевые бобы в виде натто часто потребляют в Японии, и они содержат вплоть до 108 жизнеспособных клеток В. subtilis на грамм. Натто признают за их вклад в здоровую флору кишечника и поглощение витамина K2. Продукт натто и В. subtilis var. natto в качестве его основного компонента представляют собой FOSHU (от англ. Foods for Specified Health Use - пищевые продукты, специально используемые для поддержания здоровья), одобренные министерством здравоохранения, труда и социальной защиты Японии как эффективные для сохранения здоровья.
С В. subtilis легко работать, она быстро растет, и условия культивирования являются простыми. Рекомбинантные штаммы В. subtilis используют в продукции полигидроксиалканолатов, гиалуроновой кислоты и разных ферментов, таких как амилаза и протеазы.
С природными изолятами В. subtilis дикого типа сложно работать, по сравнению с лабораторными штаммами, которые подвергались процессам одомашнивания на основе мутагенеза и селекции. Данные одомашненные штаммы часто обладают улучшенными способностями к развитию природной компетентности (поглощению и интеграции ДНК окружающей среды), улучшенными способностями к росту и потере способностей, необходимых «в дикой природе». В В. subtilis линейная ДНК, а также мультимерные формы плазмидной ДНК активно поглощаются природными компетентными клетками.
В определенных физиологических условиях маленькая субпопуляция клеток В. subtilis становится компетентной. В В. subtilis природная компетентность регулируется сложной регуляторной сетью. Ключевые регуляторы в данной сети представляют собой, среди прочих, мастер регулятор компетентности СоmK и транскрипционный мастер регулятор споруляции SpoOA. Эффективность трансформации клеток В. subtilis и возможно эффективность интеграции ДНК в их геном можно улучшать посредством генной инженерии. Это может быть достигнуто посредством эктопической интеграции экспрессионной кассеты, содержащей регулируемый промотор (например, промотор, индуцируемый маннитом  ) и гены comK и comS, в геном В. subtilis. Дополнительно, данная стратегия обеспечивает трансформацию В. subtilis за счет природной компетентности с использованием сложной среды (например, LB).
) и гены comK и comS, в геном В. subtilis. Дополнительно, данная стратегия обеспечивает трансформацию В. subtilis за счет природной компетентности с использованием сложной среды (например, LB).
Для продукции сиалированных олигосахаридов клетки Bacillus можно генетически конструировать разными способами.
Термин «генетически сконструированный», в том виде, в котором он используется в данном документе, относится к модификации генетического состава клетки Bacillus с использованием методов молекулярной биологии. Модификация генетического состава клетки Bacillus может включать перенос генов в пределах и/или через видовые связи, вставку, удаление, замену и/или модификацию нуклеотидов, триплетов, генов, открытых рамок считывания, промоторов, энхансеров, терминаторов и других нуклеотидных последовательностей, опосредуя и/или контролируя экспрессию генов. Модификация генетического состава клетки Bacillus нацелена на создание генетически сконструированной клетки, обладающей конкретными, желательными свойствами. Генетически сконструированные клетки Bacillus могут содержать один или более генов, которые отсутствуют в нативной (не генетически сконструированной) форме клетки. Методики введения экзогенных молекул нуклеиновой кислоты и/или осуществления вставки экзогенных молекул нуклеиновой кислоты (рекомбинантных, гетерологичных) в наследуемую информацию клетки Bacillus для вставки, удаления или изменения нуклеотидной последовательности генетической информации клетки известны квалифицированному специалисту. Генетически сконструированные клетки Bacillus могут содержать один или более генов, которые находятся в нативной форме клетки, где указанные гены модифицированы и повторно введены в клетку Bacillus искусственными средствами. Термин «генетически сконструированный» также охватывает клетки Bacillus, которые содержат молекулу нуклеиновой кислоты, являющуюся эндогенной в отношении клетки, и которая модифицирована без удаления молекулы нуклеиновой кислоты из клетки. Такие модификации включают модификации, полученные в результате замены генов, сайт-специфичных мутаций, и родственные методики.
Интеграция гена и/или (одновременная) инактивация гена посредством нарушения или удаления может быть достигнута посредством гомологичной рекомбинации. Для эффективной гомологичной рекомбинации по меньшей мере 400-500 п. н. гомологичных плечей необходимы в В. subtilis.
Еще одним способом направленного конструирования генома является система CRISPR-Cas9. Данный быстрый и безмаркерный инструмент редактирования генома может быть использован для крупномасштабных геномных делеций, маленьких и больших вставок ДНК, сайленсинга генов посредством введения стоп-кодона, а также введения точечных мутаций. Никаких предварительных модификаций генома не требуется для «бесшовного» редактирования генома посредством CRISPR-Cas9.
Случайную хромосомную интеграцию генов и инсерционный мутагенез можно проводить, используя модифицированный транспозон mariner. Данная система не проявляет тенденцию к горячим точкам в В. subtilis, одновременно демонстрируя высокую эффективность в случайной эктопической интеграции.
Несмотря на то, что виды Bacillus используют для промышленного производства ферментов, на сегодняшний день клетки Bacillus не внедрялись для промышленного производства олигосахаридов, в частности промышленного производства сиалированных олигосахаридов.
В китайской патентной заявке CN 108410787 А раскрыты рекомбинантные клетки Bacillus subtilis, которые синтезируют лактил-N-неотетраозу. Указанные рекомбинантные клетки В. subtilis имеют ген лактозопермеазы, который интегрируют в геном клетки. Кроме того, указанная клетка Bacillus, которая несет плазмиду, содержащую ген β-1,3-N-глюкозаминтрансферазы и ген β-1,4-галактозилтрансферазы. Клетки В. subtilis можно культивировать в присутствии экзогенной лактозы и они синтезируют лактил-N-неотетраозу при титрах вплоть до примерно 1 г/л, что слишком мало для экономически целесообразного промышленного производства.
В китайской патентной заявке CN 109735479 А раскрыты рекомбинантные клетки Bacillus subtilis для осуществления синтеза 2'-фукозиллактозы, где уровень экспрессии фермента-транспортера лактозы повышен, и где клетка экспрессирует фукозокиназу, фосфатгуанинтрансферазу и фукозилтрансферазу. Сообщалось, что выход 2'-фукозиллактозы в ферментационной среде составлял от 0,424 г/л до 1,042 г/л.
Несмотря на то, что во множестве патентных заявок упоминается Bacillus в качестве рода, который, как считается, подходит для продукции нейтральных олигосахаридов, таких как лакто-N-неотетраоза или 2'-фукозиллактоза, никакого применения Bacillus для продукций сиалированных олигосахаридов, в частности сиалированных олигосахаридов грудного молока, еще не было реализовано, предположительно из-за значительных усилий в модификации метаболизма, которые требуются для реализации необходимых путей биосинтеза для продукции ОГМ в Bacillus. Тогда как указанная выше В. subtilis для продукции LNnT зависит от субстратов-доноров, которые встречаются в природе в клетках В. subtilis, продукция сиалированного олигосахарида в Bacillus требует реализации гетерологичного метаболического пути в клетке для обеспечения субстрата-донора, а именно СМР (от англ. Cytidine Monophosphatase - цитидинмонофосфат)-NeuNAc, который является крайне важным для синтеза сиалированных олигосахаридов.
Цель была достигнута посредством предоставления клетки Bacillus, в которой имеется лактозопермеаза для импортирования экзогенной лактозы в клетку, путь биосинтеза CMP-NeuNAc для внутриклеточного образования нуклеотид-активируемой сиаловой кислоты, а именно, цитидинмонофосфат-N-ацетилнейраминовой кислоты (CMP-NeuNAc), в качестве субстрата-донора для группировки сиаловой кислоты, и сиалилтрансфераза для переноса группировки сиаловой кислоты с CMP-NeuNAc на субстрат-акцептор. Культивация таких клеток Bacillus в присутствии экзогенной лактозы делает возможной продукцию желательного сиалированного олигосахарида.
Краткое изложение сущности изобретения
Согласно первому аспекту предложена неспорообразующая бактериальная клетка рода Bacillus для получения сиалированного олигосахарида, где в клетке Bacillus имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза.
Согласно второму аспекту предложено применение неспорообразующей бактериальной клетки рода Bacillus согласно первому аспекту для получения сиалированного олигосахарида.
Согласно третьему аспекту предложен способ получения сиалированного олигосахарида, включающий:
- предоставление неспорообразующей бактериальной клетки рода Bacillus, где в указанной клетке Bacillus имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза;
- культивирование клетки Bacillus в культуральной среде, содержащей лактозу, и в условиях, которые являются пермиссивными в отношении клетки Bacillus, с продукцией сиалированного олигосахарида, и
- возможно, извлечение сиалированного олигосахарида из культуральной среды и/или клетки Bacillus.
Согласно четвертому аспекту предложены сиалированные олигосахариды, которые были продуцированы клеткой Bacillus, в которой имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза.
Согласно пятому аспекту предложено применение сиалированного олигосахарида, который был продуцирован клеткой Bacillus, в которой имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза, для изготовления питательной композиции.
Согласно шестому аспекту предложены питательные композиции, содержащие по меньшей мере один сиалированный олигосахарид, который продуцирован клеткой Bacillus, в которой имеется лактозопермеаза, путь биосинтеза CMP-NeuNAc и сиалилтрансфераза.
Описание графических материалов
На фиг. 1 проиллюстрированы разные воплощения пути биосинтеза CMP-NeuNAc, который осуществляется в клетке Bacillus для получения сиалированного олигосахарида.
Подробное описание
Согласно первому аспекту предложена неспорообразующая бактериальная клетка рода Bacillus для получения сиалированного олигосахарида. Для того, чтобы иметь способность продуцировать сиалированный олигосахарид, клетка Bacillus должна предоставлять сиалилтрансферазе субстрат-донор, содержащий группировку сиаловой кислоты, и субстрат-акцептор, представляющий собой дисахарид или олигосахарид, таким образом, чтобы сиалилтрансфераза могла переносить группировку сиаловой кислоты от субстрата-донора на указанный субстрат-акцептор, с образованием, вследствие этого, сиалированного олигосахарида.
Следует понимать, что сиалированный олигосахарид, который предназначена продуцировать указанная клетка Bacillus, представляет собой целевой сиалированный олигосахарид, тогда как другие сиалированные олигосахариды, которые могут быть образованы за счет разнородности сиалилтрансферазы во время продукции желательного сиалированного олигосахарида в клетке Bacillus, считаются нежелательными сиалированными олигосахаридами или побочными продуктами.
Клетка Bacillus для получения сиалированного олигосахарида представляет собой неспорообразующую клетку Bacillus. Клетки Bacillus дикого типа могут образовывать споры. Считают, что споруляция, а именно, процесс образования спор, у бактерий представляет собой реакцию бактериальной клетки, которая инициирует программу развития, приводящую к образованию дочерних клеток отличной морфологии и направления развития. Споруляцию Bacillus исследовали как основную модель дифференцировки клеток. Во время споруляции палочковидная клетка Bacillus делится ассиметрично, что приводит, вследствие этого, к получению двух генетически идентичных клеток с разной морфологией и направлениями развития.
Однако, при промышленном получении не желательно, если бактериальный штамм - продуцент образует споры во время ферментативной продукции целевого продукта. Таким образом, предпочтительно использовать клетки Bacillus для получения сиалированных олигосахаридов, которые не способны образовывать споры. Такие клетки Bacillus называются «неспорообразующими».
В одном воплощении неспорообразующая клетка Bacillus для получения сиалированного олигосахарида происходила из одного из штаммов В. subtilis, перечисленных в Таблице 1.

В некоторых воплощениях клетка Bacillus генетически сконструирована так, чтобы стать неспорообразующей, например, посредством делеции или функциональной инактивации SpoOA. SpoOA представляет собой ДНК-связывающий белок, который влияет, напрямую или опосредовано, на экспрессию более чем 500 генов на протяжении ранней стадии споруляции. Подходящая функциональная инактивация SpoOA включает делецию участка фосфорилирования, где фосфотрансферазы SpoOF и SpoOB фосфорилируют SpoOA. Делеция или функциональная инактивация участка фосфорилирования фосфотрансферазы SpoOF и SpoOB приводит к функциональной инактивации SpoOA и, вследствие этого, нарушает способность клетки Bacillus образовывать споры. В качестве альтернативы, ген или нуклеотидная последовательность, кодирующая SpoOA, или часть гена или нуклеотидной последовательности, кодирующей SpoOA, могут быть удалены из генома клетки Bacillus.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована посредством делеции или функциональной инактивации гена(ов), кодирующего(их) фактор сигма SigE (sigE) и/или фактор сигма SigF (sigF). Факторы сигма SigE и SigF представляют собой транскрипционные факторы, которые участвуют в экспрессии генов, которые кодируют белки, которые участвуют в ранней фазе споруляции.
Делеция или функциональная инактивация SpoOA, SigE и/или SigF нарушает способность клетки Bacillus образовывать споры. Такая неспорообразующая клетка Bacillus может быть использована в качестве предшественника для образования клетки Bacillus, которая способна продуцировать сиалированный олигосахарид.
Клетки Bacillus дикого типа как не синтезируют лактозу внутриклеточно, так и не поглощают экзогенную лактозу. Однако, лактоза представляет собой субстрат-акцептор для группировки сиаловой кислоты посредством сиалилтрансферазы, акцептирующей лактозу, в образовании некоторых сиалированных олигосахаридов, таких как 3'-сиалилактоза (3-SL) или 6'-сиалилактоза (3-SL). Следовательно, для того, чтобы иметь способность продуцировать такие сиалированные олигосахариды, клетка Bacillus должна обладать способностью предоставления лактозы сиалилтрансферазе, акцептирующей лактозу, или посредством образования лактозы внутриклеточно и/или посредством поглощения лактозы извне. Корме того, лактоза обычно представляет собой дисахаридную группировку, которую несет большая часть, если не все, сиалированных ОГМ. Следовательно, поглощение лактозы также требуется для биосинтеза сиалированных ОГМ, отличных от трисахаридов, а именно, когда субстрат-акцептор для группировки NeuNAc представляет собой олигосахарид, а не дисахарид лактозу.
В одном воплощении в клетке Bacillus для продуцирования сиалированного олигосахарида имеется лактозопермеаза для поглощения экзогенной лактозы. Следовательно, клетка Bacillus может поглощать экзогенную лактозу. В качестве альтернативы, клетка Bacillus может быть генетически сконструирована для внутриклеточного синтеза лактозы из глюкозы и галактозы, таким образом, что не будет необходимым экзогенное поступление лактозы для получения сиалированного олигосахарида.
Термин «экзогенный» в отношении лактозы, в том виде, в котором он используется в данном документе, относится к лактозе, которая не происходит из клетки Bacillus для получения сиалированного олигосахарида, а именно, являясь внутриклеточно синтезированной указанной клеткой Bacillus, а которая происходит вне указанной клетки Bacillus, и которую добавляют к культуральной среде, в которой выращивают клетку Bacillus для получения сиалированного олигосахарида.
В некоторых воплощениях клетка Bacillus генетически сконструирована для того, чтобы иметь способность поглощать экзогенную лактозу, а именно генетически сконструирована так, чтобы содержать лактозопермеазу. Таким образом, в клетке Bacillus для получения сиалированного олигосахарида имеется гетерологичная лактозопермеаза. Подходящая гетерологичная лактозопермеаза представляет собой LacY Е. coli или ее функциональный вариант.
Термин «гетерологичный», в том виде, в котором он используется в данном документе, в отношении белков, полипептидов, ферментов и транспортеров, а также в отношении молекул нуклеиновой кислоты, нуклеотидных последовательностей и/или генов, относится к молекуле, которая не является нативной в отношении вида клетки Bacillus, которая содержит указанную молекулу. Термин «ненативный» указывает на то, что указанная молекула отсутствует в клетке-предшественнике Bacillus, встречающейся в природе или дикого типа, а именно, в клетке Bacillus того же вида, который наиболее часто встречается в природе. Таким образом, «гетерологичная последовательность» или «гетерологичная нуклеиновая кислота» или «гетерологичный полипептид», в том виде, в котором он используется в данном документе, представляет собой последовательность или нуклеиновую кислоту или пептид, которые происходят из источника, являющегося чужеродным в отношении клетки Bacillus (например, из другого вида), или, если из того же источника, модифицированы по сравнению со своей исходной формой. Гетерологичная последовательность может быть стабильно введена, например, посредством трансфекции, трансформации, конъюгации или трансдукции, в геном микробной клетки-хозяина, таким образом, представляя генетически сконструированную клетку-хозяина. Можно применять методики, которые будут зависеть от клетки-хозяина, в которую должна быть введена последовательность. Разные методики известны специалисту в данной области, и например, раскрыты в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989). Соответственно, «гетерологичный полипептид» представляет собой полипептид, который в природе не встречается в клетке, и «гетерологичная сиалилтрансфераза» представляет собой сиалилтрансферазу, которая не встречается в природе в микробной клетке.
Термин «функциональный вариант», в том виде, в котором он используется в данном документе, в отношении ферментов и/или транспортных молекул, относится к белкам или полипептидам, обладающим такой же активностью (ферментативной, каталитической или транслоцирующей), что и референный фермент или молекула-транспортер, но который имеет аминокислотную последовательность, отличную от аминокислотной последовательности референсной молекулы фермента или транспортера. Таким образом, типичный вариант белка/полипептида отличается по аминокислотной последовательности от референсного белка/полипептида. Вариант и референсный белок/полипептид может отличаться по аминокислотной последовательности одной или более заменами, присоединениями и/или делециями в любой комбинации. Следовательно, термин «функциональный вариант» включает усеченные версии референсного белка/полипептида, которые обладают такой же активностью, как и референсный белок/полипептид. Замещенный или вставленный аминокислотный остаток может представлять собой или может не представлять собой аминокислотный остаток, кодируемый генетическим кодом. Вариант белка/полипептида может представлять собой встречающийся в природе, как например, аллельный вариант, или он может представлять собой вариант, который не известно, чтобы встречался в природе. Варианты белков/полипептидов, не встречающиеся в природе, могут быть созданы посредством методик мутагенеза, посредством прямого синтеза и посредством других методов генной инженерии, известных специалистам в данной области. В пределах объема настоящего раскрытия в термин «вариант» также включены белки и межвидовые гомологи, которые имеют аминокислотную последовательность, которая обладает более чем примерно 60%-ной идентичностью аминокислотных последовательностей, предпочтительно 65%-ной, 70%-ной, 75%-ной, 80%-ной, 85%-ной, 90%-ной, более предпочтительно 91%-ной, 92%-ной, 93%-ной, 94%-ной, 95%-ной, 96%-ной, 97%-ной, 98%-ной или 99%-ной или большей идентичностью аминокислотных последовательностей, предпочтительно, на протяжении области из по меньшей мере примерно 25, 50, 100, 200, 500, 1000 или более аминокислот, с референсным полипептидом.
Термин «такая же активность», в том виде, в котором он используется в данном документе, относится к ферментативной, каталитической активности или активности транспортировки белка/полипептида лишь с точки зрения качества. Следовательно, «функциональный вариант» также включает варианты, которые обладают повышенной или пониженной активностью, по сравнению с активностью референсного белка/полипептида.
В разных воплощениях клетка Bacillus генетически сконструирована так, что содержит и экспрессирует нуклеотидную последовательность, которая кодирует лактозопермеазу, предпочтительно нуклеотидную последовательность, которая кодирует лактозопермеазу LacY E.coli (UniProtKB- Р02920) или ее функциональный вариант.
Лактозопермеаза LacY Е. coli кодируется областью, кодирующей белок (а именно, открытая рамка считывания) гена lacY Е. coli (номер доступа Gen Bank: NP_414877.1).
Следовательно, в некоторых воплощениях клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, кодирующую область, кодирующую белок LacY Е. coli.
В некоторых воплощениях частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную лактозопермеазу, приспособлена к частоте использования кодона Bacillus. Частота использования кодона В. subtilis, например, необычна тем, что суммарное содержание GC ниже примерно 45%, содержание GC первой буквы данных кодонов выше примерно 51%, содержание CG второй буквы данных кодонов ниже примерно 36,1% и содержание CG третьей буквы данных кодонов ниже примерно 46%.
Для экспрессии лактозопермеазы клетка Bacillus содержит рекомбинантный ген лактозопермеазы, где нуклеотидная последовательность, которая кодирует лактозопермеазу, функционально связана с последовательностями контроля экспрессии, которые опосредуют экспрессию нуклеотидной последовательности, кодирующей лактозопермеазу.
Термин «функционально связанный», в том виде, в котором он используется в данном документе, будет означать функциональную связь между нуклеотидной последовательностью, которая кодирует полипептид или белок (обычно называемой «областью, кодирующей белок», «открытой рамкой считывания» и иногда даже «геном») и второй нуклеотидной последовательностью (последовательностью контроля экспрессии, такой как промотор, сигнальная последовательность или ряд сайтов связывания транскрипционных факторов), которая влияет на транскрипцию и/или трансляцию нуклеотидной последовательности, которая кодирует полипептид или белок. Соответственно, термин «промотор» обозначает последовательности дезоксирибонуклеиновой кислоты (ДНК), которые обычно «предшествуют» открытой рамке считывания в ДНК-полимере и обеспечивают сайт инициации транскрипции в мРНК. «Регуляторные» последовательности ДНК, также обычно расположенные «выше» (то есть, предшествуя) открытой рамки считывания в данном ДНК-полимере, связывают белки, которые определяют частоту (или скорость) инициации транскрипции. В совокупности называемые «промоторной/регуляторной» или «контрольной» ДНК-последовательностью, данные последовательности, которые предшествуют выбранной открытой рамке считывания (или серии открытых рамок считывания) в функциональном ДНК-полимере способствуют определению того, будет ли происходить транскрипция (и в конечном итоге экспрессия) открытой рамки считывания. Последовательности ДНК, которые «следуют за» геном в ДНК-полимере и обеспечивают сигнал для терминации транскрипции в мРНК, называются последовательностями, «терминирующими» транскрипцию.
Рекомбинантный ген лактозопермеазы может находиться, будучи интегрированным в хромосому Bacillus, или присутствовать в виде эписомальной версии на дополнительной плазмиде в клетке Bacillus.
Экспрессия гетерологичного гена лактозопермеазы в клетке Bacillus позволяет полученной клетке Bacillus поглощать извне поставляемую лактозу из культуральной среды. Поглощенная лактоза может затем служить субстратом-акцептором для группировки сиаловой кислоты, подлежащей переносу сиалилтрансферазой, акцептирующей лактозу (см. ниже в данном документе), например, в образовании 3'-SL или 6'-SL.
Для получения сиалированного олигосахарида Bacillus должна иметь способность предоставлять субстрат-донор для переноса группировки NeuNAc на субстрат-акцептор. Типичным субстратом-донором для группировки NeuNAc является CMP-NeuNAc. Следовательно, клетка Bacillus должна уметь внутриклеточно продуцировать CMP-NeuNAc для продукции сиалированных олигосахаридов. В случае внутриклеточного биосинтеза CMP-NeuNAc в клетке Bacillus имеется путь биосинтеза CMP-NeuNAc (Фиг. 1). Таким образом, клетка Bacillus генетически сконструирована так, чтобы иметь путь биосинтеза CMP-NeuNAc.
Путь биосинтеза CMP-NeuNAc включает путь утилизации NeuNAc или путь биосинтеза сиаловой кислоты для внутриклеточного биосинтеза de novo NeuNAc. Следовательно, в клетке Bacillus имеется путь биосинтеза CMP-NeuNAc, включающий путь утилизации NeuNAc и/или путь биосинтеза сиаловой кислоты.
Путь утилизации NeuNAc включает поглощение экзогенной сиаловой кислоты клеткой Bacillus и превращение поглощенной сиаловой кислоты в CMP-NeuNAc. Для поглощения экзогенной NeuNAc в клетке Bacillus имеется транспортер сиаловой кислоты. В некоторых воплощениях генетически сконструированная клетка Bacillus генетически сконструирована таким образом, чтобы имелся транспорт сиаловой кислоты для поглощения экзогенной NeuNAc. Подходящий транспортер сиаловой кислоты представляет собой NanT Е. coli (UniProtKB Р41036). NanT Е. coli катализирует протон-зависимый симпорт сиаловой кислоты. NanT может транспортировать NeuNAc, а также родственные сиаловые кислоты N-гликолилнейраминовую кислоту (NeuNGc) и 3-кето-3-дезокси-D-глицеро-D-галактононовую кислоту (KDN). В одном воплощении в генетически сконструированной клетке Bacillus имеется NanT Е. coli или его функциональный вариант.
В некоторых воплощениях клетка Bacillus генетически сконструирована таким образом, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует транспортер сиаловой кислоты для поглощения экзогенной NeuNAc, предпочтительно, нуклеотидную последовательность, которая кодирует NanT Е. coli или его функциональный вариант.
NanT Е. coli кодируется белок-кодирующей областью гена папТ Е. coli. Следовательно, в некоторых воплощениях клетка Bacillus генетически сконструирована таким образом, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует транспортер сиаловой кислоты NanT Е. coli или его функциональный вариант.
Для экспрессии транспортера сиаловой кислоты клетка Bacillus содержит рекомбинантный ген транспортера сиаловой кислоты, где нуклеотидная последовательность, которая кодирует транспортер сиаловой кислоты, функционально связана с последовательностями контроля экспрессии, которые опосредуют экспрессию нуклеотидной последовательности, кодирующей транспортер сиаловой кислоты.
Рекомбинантный ген транспортера сиаловой кислоты может присутствовать, будучи интегрированным в хромосому Bacillus, или присутствовать в виде эписомальной версии на дополнительной плазмиде в клетке Bacillus.
В одном из воплощений частота использования кодона нуклеотидной последовательности, кодирующей транспортер сиаловой кислоты, адаптирована к частоте использования кодона Bacillus.
В разных воплощениях путь биосинтеза CMP-NeuNAc включает путь биосинтеза сиаловой кислоты. Таким образом, в клетке Bacillus может иметься путь биосинтеза сиаловой кислоты для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты. Путь биосинтеза сиаловой кислоты включает ферментативные активности глутамин:фруктозо-6-фосфатаминотрансферазы (Фиг. 1:  ) и синтазы N-ацетилнейраминовой кислоты (тоже самое, что синтаза сиаловой кислоты) (Фиг. 1:
) и синтазы N-ацетилнейраминовой кислоты (тоже самое, что синтаза сиаловой кислоты) (Фиг. 1:  ). Следовательно, в клетке Bacillus для получения сиалированного олигосахарида есть глутамин:фруктозо-6-фосфатаминотрансфераза и синтаза N-ацетилнейраминовой кислоты.
). Следовательно, в клетке Bacillus для получения сиалированного олигосахарида есть глутамин:фруктозо-6-фосфатаминотрансфераза и синтаза N-ацетилнейраминовой кислоты.
Фермент глутамин:фруктозо-6-фосфатаминотрансфераза (ЕС 2.6.1.16) катализирует превращение фруктозо-6-фосфата (Frc-6P) в глюкозамин-6-фосфат (GlcN-6P) с использованием глутамина (Фиг. 1:  ). Обычно считается, что данная ферментативная реакция является первой стадией пути биосинтеза гексозамина. Альтернативными названиями глутамин:фруктозо-6-фосфатаминотрансферазы являются D-фруктозо-6-фосфатаминотрансфераза, GFAT, глюкозамин-6-фосфатсинтаза, гексозофосфатаминотрансфераза и L-глутамин-D-фруктозо-6-фосфатаминотрансфераза.
). Обычно считается, что данная ферментативная реакция является первой стадией пути биосинтеза гексозамина. Альтернативными названиями глутамин:фруктозо-6-фосфатаминотрансферазы являются D-фруктозо-6-фосфатаминотрансфераза, GFAT, глюкозамин-6-фосфатсинтаза, гексозофосфатаминотрансфераза и L-глутамин-D-фруктозо-6-фосфатаминотрансфераза.
В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется глутамин:фруктозо-6-фосфатаминотрансфераза, предпочтительно, гетерологичная глутамин:фруктозо-6-фосфатаминотрансфераза. Пример подходящей гетерологичной глутамин:фруктозо-6-фосфатаминотрансферазы происходит из Е. coli. Глутамин:фруктозо-6-фосфатаминотрансфераза Е. coli (UniProtKB - Р17169) обозначается GlmS. Следовательно, в клетке Bacillus имеется GlmS Е. coli или функциональный вариант GlmS Е. coli. Предпочтительно, функциональный вариант GlmS Е. coli представляет собой версию, которая демонстрирует значимо уменьшенную чувствительность к ингибированию глюкозамин-6-фосфата, по сравнению с ферментом дикого типа. Пример функционального варианта GlmS Е. coli, который демонстрирует значимо уменьшенную чувствительность к ингибированию глюкозамин-6-фосфата. Примеры функциональных вариантов GlmS Е. coli, которые демонстрируют значимо уменьшенную чувствительность к ингибированию глюкозамин-6-фосфата, представляют собой GlmS*54 и GlmS*, как описано в международной заявке №РСТ/ЕР2019/063669 (включена в данный документ посредством ссылки).
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует глутамин:фуктозо-6-фосфатаминотрансферазу, предпочтительно глутамин:фруктозо-6-фосфатаминотрансферазу GlmS Е. coli, или нуклеотидную последовательность, кодирующую функциональный вариант GlmS Е. coli, который демонстрировал значимо пониженную чувствительность в отношении ингибирования глюкозамин-6-фосфата, по сравнению с ферментом дикого типа.
Для экспрессии глутамин:фруктозо-6-фосфатаминотрансферазы клетка Bacillus содержит рекомбинантный ген глутамин:фруктозо-6-фосфатаминотрансферазы, где нуклеотидная последовательность, которая кодирует глутамин:фруктозо-6-фосфатаминотрансферазу, функционально связана с последовательностями контроля экспрессии, которые опосредуют экспрессию открытой рамки считывания глутамин:фруктозо-6-фосфатаминотрансферазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную глутамин:фруктозо-6-фосфатаминотрансферазу, адаптирована до частоты использования кодона Bacillus.
Рекомбинантный ген глутамин:фуктозо-6-фосфатаминотрансферазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит синтазу сиаловой кислоты. Синтаза сиаловой кислоты катализирует конденсацию N-ацетилманнозамина (ManNAc) и фосфоенолпирувата (ФЕП) с N-ацетилнейраминовой кислотой (NeuNAc) (Фиг. 1:  ). Ферментативное образование NeuNAc представляет собой последнюю стадию пути биосинтеза сиаловой кислоты.
). Ферментативное образование NeuNAc представляет собой последнюю стадию пути биосинтеза сиаловой кислоты.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит синтазу сиаловой кислоты или ее функциональный вариант, предпочтительно гетерологичную синтазу сиаловой кислоты. Примеры синтаз сиаловой кислоты известны из множества видов бактерий, таких как Campylobacter jejuni, Streptococcus agalactiae, Butyrivibrio proteoclasticus, Methanobrevibacter ruminatium, Acetobacterium woodii, Desulfobacula toluolica, Escherichia coli, Prevotella nigescens, Halorhabdus tiamatea, Desulfotignum phosphitoxidans или Candidatus Scalindua sp., Idomarina loihiensis, Fusobacterium nucleatum или Neisseria meningitidis. Примером подходящей синтазы сиаловой кислоты является синтаза N-ацетилнейраминовой кислоты NeuB С.jejuni, как кодируется геном пеиВ С.jejuni.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует синтазу N-ацетилнейраминовой кислоты. Следовательно, нуклеотидная последовательность, которая кодирует синтазу N-ацетилнейраминовой кислоты, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует синтазу N-ацетилнейраминовой кислоты в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности синтазы N-ацетилнейраминовой кислоты.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную синтазу N-ацетилнейраминовой кислоты, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген синтазы N-ацетилнейраминовой кислоты может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В одном воплощении путь биосинтеза сиаловой кислоты включает уридиндифосфат-N-ацетилглюкозамин (УДФ-GlcNAc) в качестве промежуточного соединения. В клетке Bacillus, имеющей путь биосинтеза сиаловой кислоты, который включает УДФ-GlcNAc в качестве промежуточного соединения, дополнительно имеется фосфоглюкозаминмутаза (Фиг. 1:  ), глюкозамин-1-фосфат N-ацетилтрансфераза (Фиг. 1:
), глюкозамин-1-фосфат N-ацетилтрансфераза (Фиг. 1:  ), N-ацетилглюкозамин-1-фосфатуридилтрансфераза (Фиг. 1
), N-ацетилглюкозамин-1-фосфатуридилтрансфераза (Фиг. 1  ) и УДФ-N-ацетилглюкозамин 2-эпимераза (Фиг. 1:
) и УДФ-N-ацетилглюкозамин 2-эпимераза (Фиг. 1:  ).
).
Фосфоглюкозаминмутаза превращает глюкозамин-6-фосфат (GlcN-6P) в глюкозамин-1-фосфат (GlcN-1 Р).
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована таким образом, чтобы содержать фосфоглюкозаминмутазу. Подходящая фосфоглюкозаминмутаза представляет собой фосфоглюкозаминмутазу GlmM Е. coli или ее функциональный вариант.Указанная GlmM Е. coli кодируется геном glmM Е. coli.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы в ней содержалась и экспрессировалась нуклеотидная последовательность, которая кодирует фосфоглюкозаминмутазу, предпочтительно, нуклеотидная последовательность, которая кодирует GlmM Е. coli или ее функциональный вариант.
Фосфоглюкозаминмутаза GlmM Е. coli кодируется белок-кодирующей областью гена glmM Е. coli. Следовательно, клетка Bacillus генетически сконструирована для содержания и экспрессии нуклеотидной последовательности, которая кодирует GlmM Е. coli.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует фосфоглюкозаминмутазу. Следовательно, нуклеотидная последовательность, которая кодирует фосфоглюкозаминмутазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует фосфоглюкозаминмутазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности фосфоглюкозаминмутазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную фосфоглюкозаминмутазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген фосфоглюкозаминмутазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
Глюкозамин-1-фосфат-N-ацетилтрансфераза катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P).
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать глюкозамин-1-фосфат-N-ацетилтрансферазу.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу. Следовательно, нуклеотидная последовательность, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует глюкозамин-1-фосфат-N-ацетилтрансферазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности глюкозамин-1-фосфат-N-ацетилтрансферазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную глюкозамин-1-фосфат-N-ацетилтрансферазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген глюкозамин-1-фосфат-N-ацетилтрансферазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
N-ацетилглюкозамин-1-фосфатуридилтрансфераза превращает N-ацетилглюкозамин-1-фосфат (GlcNAc-1-P) в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата).
В дополнительном и/или альтернативном воплощении клетка генетически сконструирована для того, чтобы иметь N-ацетилглюкозамин-1-фосфатуридилтрансферазу.
В дополнительном и/или альтернативном воплощении клетка генетически сконструирована для того, чтобы содержать или экспрессировать нуклеотидную последовательность, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу.
Следовательно, нуклеотидная последовательность, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует N-ацетилглюкозамин-1-фосфатуридилтрансферазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности N-ацетилглюкозамин-1-фосфатуридилтрансферазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-1-фосфатуридилтрансферазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген N-ацетилглюкозамин-1-фосфатуридилтрансферазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
В дополнительном и/или альтернативном воплощении глюкозамин-1-фосфат-N-ацетилтрансферазная активность и N-ацетилглюкозамин-1-фосфатуридилтрансферазная активность обеспечиваются бифункциональным ферментом. Примером таких бифункциональных ферментов является GlmU Е. coli. GlmU Е. coli катализирует по меньшей мере две последовательные реакции, которые превращают глюкозамин-1-фосфат в УДФ-GlcNAc (Фиг. 1:  ). С-концевой домен катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P), который превращается в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата), реакция, катализируемая N-концевым доменом.
). С-концевой домен катализирует перенос ацетильной группы с ацетил-коэнзима А на глюкозамин-1-фосфат (GlcN-1-P) с получением N-ацетилглюкозамин-1-фосфата (GlcNAc-1-P), который превращается в УДФ-GlcNAc посредством переноса уридин-5-монофосфата (с уридин 5-трифосфата), реакция, катализируемая N-концевым доменом.
Такой бифункциональный фермент также известен из Bacillus subtilis и Haemophilus influenzae.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы иметь гетерологичную бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу. Подходящим примером является GlmU Е. coli или ее функциональный вариант (включая GlmU Н. influenzae). Указанная GlmU Е. coli кодируется геном glmU Е. coli.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать или сверхэкспрессировать нуклеотидную последовательность, которая кодирует указанный бифункциональный фермент, предпочтительно нуклеотидную последовательность, которая кодирует GlmU Е. coli или ее функциональный вариант.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-осфатуридилтрансферазу. Следовательно, нуклеотидная последовательность, которая кодирует бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной глюкозамин-1-фосфат-N-ацетилтрансферазной активности и N-ацетилглюкозамин-1-фосфатуридилтрансферазной активности.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную бифункциональную глюкозамин-1-фосфат-N-ацетилтрансферазу/N-ацетилглюкозамин-1-фосфатуридилтрансферазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген бифункциональной глюкозамин-1-фосфат-N-ацетилтрансферазы/N-ацетилглюкозамин-1-фосфатуридилтрансферазы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
В дополнительном и/или альтернативном воплощении путь биосинтеза сиаловой кислоты включает превращение УДФ-GlcNAc в N-ацетилманнозамин (ManNAc). Данное превращение может быть катализировано УДФ-N-ацетилглюкозамин-2-эимеазой, которая не только превращает УДФ-N-ацетилглюкозамин в УДФ-N-ацетилманнозамин, но одновременно высвобождает УДФ (Фиг. 1:  ).
).
Следовательно, клетка Bacillus содержит УДФ-N-ацетилглюкозамин-2-эпимеразу, которая одновременно высвобождает УДФ.
Подходящая УДФ-N-ацетилглюкозамин-2-эпимераза с сопутствующим высвобождением УДФ представляет собой УДФ-N-ацетилглюкозамин-2-эпимеразу NeuC Campylobacter jejuni, кодируемую геном пеиС С.jejuni.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы иметь УДФ-N-ацетилглюкозамин-2-эпимеразу с сопутствующим высвобождением УДФ.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует УДФ-N-ацетилглюкозамин-2-эпимеразу, которая одновременно высвобождает УДФ, предпочтительно чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует NeuC С, jejuni или ее функциональный вариант.
УДФ-N-ацетилглюкозамин-2-эпимераза NeuC С.jejuni кодируется белок-кодирующей областью гена пеиС С.jejuni. Следовательно, клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, которая кодирует NeuC С.jejuni.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, которая кодирует УДФ-N-ацетилглюкозамин-2-эпимеразу с сопутствующим высвобождением УДФ во время ее ферментативной реакции с высвобождением ManNAc. Следовательно, нуклеотидная последовательность, которая кодирует УДФ-N-ацетилглюкозамин-2-эпимеразу, которая одновременно высвобождает УДФ, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует указанную УДФ-N-ацетилглюкозамин-2-эпимеразу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности УДФ-N-ацетилглюкозамин-2-эпимеразы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную УДФ-N-ацетилглюкозамин-2-эпимеразу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген УДФ-N-ацетилглюкозамин-2-эпимеразы может быть интегрирован в хромосому Bacillus или присутствовать в виде эписомальной версии на плазмиде в клетке Bacillus.
В альтернативном воплощении в пути биосинтеза сиаловой кислоты используется N-ацетилглюкозамин-6-фосфат (GlcNAc-6-P) в качестве промежуточного соединения, но не используется УДФ-GlcNAc. В генетически сконструированной клетке Bacillus имеется путь биосинтеза сиаловой кислоты для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, в котором используется GlcNAc-6-P в качестве промежуточного соединения, имеется глюкозамин-6-фосфат-N-ацетилтрансфераза (Фиг. 1:  ). В пути биосинтеза сиаловой кислоты, использующем глюкозамин-6-фосфат-N-ацетилтрансферазу для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, не используется УДФ-GlcNAc для биосинтеза сиаловой кислоты.
). В пути биосинтеза сиаловой кислоты, использующем глюкозамин-6-фосфат-N-ацетилтрансферазу для внутриклеточного биосинтеза N-ацетилнейраминовой кислоты, не используется УДФ-GlcNAc для биосинтеза сиаловой кислоты.
Путь биосинтеза сиаловой кислоты, использующий GlcNAc-6P, включает активности ферментов глутамин:фруктозо-6-фосфатаминотрансферазы (Фиг. 1:  ) и синтазы N-ацетилнейраминовой кислоты (Фиг. 1:
) и синтазы N-ацетилнейраминовой кислоты (Фиг. 1:  ). Указанный путь биосинтеза сиаловой кислоты дополнительно включает а) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:
). Указанный путь биосинтеза сиаловой кислоты дополнительно включает а) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:  ), N-ацетилглюкозамин-6-фосфатфосфатазы (Фиг. 1:
), N-ацетилглюкозамин-6-фосфатфосфатазы (Фиг. 1:  ) и N-ацетилглюкозамин-2-эпимеразы (Фиг. 1:
) и N-ацетилглюкозамин-2-эпимеразы (Фиг. 1:  ) или b) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:
) или b) активности ферментов глюкозамин-6-фосфат-N-ацетилтрансферазы (Фиг. 1:  ), N-ацетилглюкозамин-6-фосфатэпимеразы (Фиг. 1:
), N-ацетилглюкозамин-6-фосфатэпимеразы (Фиг. 1:  ) и N-ацетилманнозамин-6-фосфатфосфатазы (Фиг. 1:
) и N-ацетилманнозамин-6-фосфатфосфатазы (Фиг. 1:  ). Таким образом, необязательно, чтобы генетически сконструированная клетка Bacillus обладала ферментативными активностями фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ-N-ацетилглюкозамин 2-эпимеразы с сопутствующим высвобождением УДФ для внутриклеточного биосинтеза сиаловой кислоты. Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus, способная синтезировать сиаловую кислоту, не содержит одной или более активностей ферментов, выбранных из группы, состоящей из активностей ферментов фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ N-ацетилглюкозамин-2-эпимеразы с сопутствующим высвобождением УДФ.
). Таким образом, необязательно, чтобы генетически сконструированная клетка Bacillus обладала ферментативными активностями фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ-N-ацетилглюкозамин 2-эпимеразы с сопутствующим высвобождением УДФ для внутриклеточного биосинтеза сиаловой кислоты. Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus, способная синтезировать сиаловую кислоту, не содержит одной или более активностей ферментов, выбранных из группы, состоящей из активностей ферментов фосфоглюкозаминмутазы, N-ацетилглюкозамин-1-фосфатуридилтрансферазы и УДФ N-ацетилглюкозамин-2-эпимеразы с сопутствующим высвобождением УДФ.
В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется глюкозамин-6-фосфат-N-ацетилтрансферазная активность. Указанная глюкозамин-6-фосфат-N-ацетилтрансферазная активность превращает GlcN-6P в N-ацетилглюкозамин-6-фосфат (GlcNAc-6P). Примером глюкозамин-6-фосфат-N-ацетилтрансферазы является Gna1 Saccharomyces cerevisiae (UniProtKB - P43577).
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит глюкозамин-6-фосфат N-ацетилтрансферазу, предпочтительно, гетерологичную глюкозамин-6-фосфат-N-ацетилтрансферазу, более предпочтительно Gna1 из S. cerevisiae или ее функциональный вариант.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую глюкозамин-6-фосфат-N-ацетилтрансферазу, предпочтительно, Gna1 S. cerevisiae, где указанная нуклеотидная последовательность функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности глюкозамин-1-фосфат-N-ацетилтрансферазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную глюкозамин-6-фосфат-N-ацетилтрансферазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген глюкозамин-6-фосфат-N-ацетилтрансферазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется N-ацетилглюкозамин-6-фосфатфосфатазная активность. Указанная N-ацетилглюкозамин-6-фосфатфосфатазная активность превращает GlcNAc-6P в N-ацетилглюкозамин (GlcNAc). Примерами N-ацетилглюкозамин-6-фосфатфосфатазы являются сахарофосфатазы HAD-подобного суперсемейства, которые катализируют превращение GlcNAc6P в GlcNAc. HAD-подобное суперсемейство ферментов названо в честь бактериального фермента -дегидрогеназы галогенокислоты и включает фосфатазы. Подходящая фосфатаза HAD-подобного суперсемейства, катализирующего превращение GlcNAc6P в GlcNAc, может быть выбрана из группы, состоящей из фруктозо-1-фосфатфосфатазы (YqaB, UniProtKB - Р77475) и альфа-D-глюкозо-1-фосфатфосфатазы (YihX, UniProtKB - P0A8Y3). Считают, что ферменты YqaB Е. coli и YihX E.coli также действуют на GlcNAc6P (Lee, S.-W. and Oh, M.-K. (2015) Metabolic Engineering 28: 143-150).
В дополнительном и/или альтернативном воплощении сахарофосфатаза HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc, представляет собой гетерологичный фермент в генетически сконструированной клетке Bacillus. В дополнительном и/или альтернативном воплощении сахарофосфатаза HAD-подобного суперсемейства, катализирующего превращение GlcNAc6P в GlcNAc, выбрана из группы, состоящей из YqaB Е. coli, YihX Е. coli и их функциональных вариантов.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, которая содержит и экспрессирует нуклеотидную последовательность, кодирующую сахарофосфатазу HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc. В дополнительном и/или альтернативном воплощении нуклеотидная последовательность, кодирующая сахарофосфатазу HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc, представляет собой гетерологичную нуклеотидную последовательность. В дополнительном и/или альтернативном воплощении нуклеотидная последовательность, кодирующая сахарофосфатазу HAD-подобного суперсемейства, катализирующего превращение GlcNAc-6P в GlcNAc, кодирует YqaB Е. coli или YihX Е. coli или функциональный вариант одного или двух данных ферментов.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-6-фосфатфосфатазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген N-ацетилглюкозамин-6-фосфатфосфатазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus обладает N-ацетилглюкозамин-2-эпимеразной активностью. N-ацетилглюкозамин-2-эпимераза (ЕС 5.1.3.8) представляет собой фермент, который катализирует превращение N-ацетилглюкозамина (GlcNAc) в N-ацетилманнозамин (ManNAc). Фермент представляет собой рацемазу, оказывающую действие на углеводы и их производные. Систематическое название данного класса ферментов представляет собой N-ацил-D-глюкозамин 2-эпимеразу. Данный фермент участвует в метаболизме аминосахаров и метаболизме нуклеотидных Сахаров, предпочтительно гетерологичная N-ацетилглюкозамин 2-эпимераза.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит N-ацетилглюкозамин-2-эпимеразу, предпочтительно гетерологичную N-ацетилглюкозамин-2-эпимеразу. Примеры N-ацетилглюкозамин-2-эпимераз описаны у Anabena variabilis, Acaryochloris sp., Nostoc sp., Nostoc punctiforme, Bacteroides ovatus или Synechocystis sp.Пример подходящей N-ацетилглюкозамин 2-эпимеразы представляет собой N-цетилглюкозамин 2-эпимеразу В. ovatus АТСС 8483 (UniProtKB - A7LVG6), как кодируется геном BACOVA_01816. Еще одним примером является N-ацетилглюкозамин 2-эпимераза Synechocystis sp.(штамм РСС 6803) (UniProtKB - Р74124), которая также известна, как ренин-связывающий белок и кодируется геном slr1975.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует N-ацетилглюкозамин 2-эимеразу, предпочтительно, N-ацетилглюкозамин-2-эпимеразу В. ovatus АТСС 8483 или Synechocystis sp.(штамм РСС 6803) или ее функциональный вариант.
Следовательно, нуклеотидная последовательность, которая кодирует N-ацетилглюкозамин-2-эпимеразу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует N-ацетилглюкозамин-2-эпимеразу в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности N-ацетилглюкозамин-2-эпимеразы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-2-эпимеразу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген N-ацетилглюкозамин-2-эпимеразы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus имеется N-ацетилглюкозамин-6-фосфатэпимеразная активность и N-ацетилманнозамин-6-фосфатфосфатазная активность. N-ацетилглюкозамин-6-фосфатэпимераза превращает N-ацетилглюкозамин-6-фосфат (GlcNAc-6P) в N-ацетилмоннозамин-6-фосфат (ManNAc-6P), тогда как N-ацетилманнозамин-6-фосфатфосфатаза дефосфорилирует ManNAc-6P с получением N-ацетилмоннозамина (ManNAc). Обладание N-ацетилглюкозамин-6-фосфатэпимеразная активность и N-ацетилглюкозамин-6-фосфатфосфатазная активность обеспечивает дополнительный или альтернативный путь для обеспечения ManNAc для продукции Neu5Ac.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит N-ацетилглюкозамин-6-фосфатэпимеразу. Примером подходящей N-ацетилглюкозамин-6-фосфатэпимеразы является NanE Е. coli (UniprotKB Р0А761), как кодируется геном папЕ Е. coli.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую N-ацетилглюкозамин-6-фосфатэпимеразу, предпочтительно нуклеотидную последовательность, кодирующую NanE E.coli или ее функциональный вариант.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую N-ацетилглюкозамин-6-фосфатэпимеразу, где указанная нуклеотидная последовательность функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности в генетически сконструированной микробной клетке с обеспечением внутриклеточной активности N-ацетилглюкозамин-2-фосфатэпимеразы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-6-фосфатэпимеразу, адаптирована к частоте использования кодона Bacillus.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит N-ацетилглюкозамин-6-фосфатфосфатазу, которая превращает ManNAc-6P в ManNAc.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую N-ацетилманнозамин-6-фосфатфосфатазу. Следовательно, нуклеотидная последовательность, которая кодирует N-ацетилгманнозамин-6-фосфатфосфатазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, которая кодирует N-ацетилглюкозамин-6-фосфатфосфатазу, в генетически сконструированной клетке Bacillus с обеспечением внутриклеточной активности N-ацетилглюкозамин-6-фосфатфосфатазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную N-ацетилглюкозамин-6-фосфатфосфатазу, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген N-ацетилманнозамин-6-фосфатфосфатазы может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В генетически сконструированной клетке Bacillus имеется активность синтетазы цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты (Фиг. 1:  ) для переноса цитидин-5'-монофосфата на N-ацетилнейраминовую кислоту с образованием СМР-активированной N-ацетилнейраминовой кислоты (CMP-NeuNAc). Несколько синтетаз 5'-монофосфо-(СМР)-сиаловой кислоты известны в данной области и описаны, например, синтетазы 5'-монофосфо-(СМР)-сиаловой кислоты из Е. coli, Neisseria meningitidis, Campylobacter jejuni, Streptococcus sp.и т.д.
) для переноса цитидин-5'-монофосфата на N-ацетилнейраминовую кислоту с образованием СМР-активированной N-ацетилнейраминовой кислоты (CMP-NeuNAc). Несколько синтетаз 5'-монофосфо-(СМР)-сиаловой кислоты известны в данной области и описаны, например, синтетазы 5'-монофосфо-(СМР)-сиаловой кислоты из Е. coli, Neisseria meningitidis, Campylobacter jejuni, Streptococcus sp.и т.д.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, предпочтительно, гетерологичную синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, более предпочтительно N-ацетилнейраминатцитидилтрансферазу NeuA из С.jejuni. NeuA С.jejuni кодируется геном neuA С. jejuni.
Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую и экспрессирующую нуклеотидную последовательность, кодирующую синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, где указанная нуклеотидная последовательность функционально связана с по меньшей мере одной последовательностью контроля экспрессии нуклеиновой кислоты, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности в генетически сконструированной микробной клетке с обеспечением активности N-ацетилнейраминатцитидилтрансферазы.
В дополнительном и/или альтернативном воплощении частота использования кодона нуклеотидной последовательности, кодирующей гетерологичную синтетазу цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты, адаптирована к частоте использования кодона Bacillus.
Рекомбинантный ген синтетазы цитидин-5'-монофосфо-(СМР)-N-ацетилнейраминовой кислоты может быть интегрирован в хромосому Bacillus или находиться в виде эписомальной версии на плазмиде в клетке Bacillus.
В генетически сконструированной клетке Bacillus имеется сиалилтрансфераза, предпочтительно гетерологичная сиалилтрансфераза и более предпочтительно сиалилтрансферазная активность, выбранная из группы, состоящей из α-2,3-сиалилтрансферазной активности, α-2,6-сиалилтрансферазной активности и/или α-2,8-сиалилтрансферазной активности. Сиалилтрансферазная активность может переносить группировку N-ацетилнейраминовой кислоты с CMP-NeuNAc на акцепторную молекулу, где указанная акцепторная молекула представляет собой молекулу сахарида, с получением сиалированного сахарида.
В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка содержит по меньшей мере одну сиалилтрансферазу, предпочтительно по меньшей мере одну гетерологичную сиалилтрансферазу, где указанная сиалилтрансфераза может обладать α-2,3-сиалилтрансферазной активностью и/или α-2,6-сиалилтрансферазной активностью и/или α-2,8-сиалилтрансферазной активностью для переноса группировки NeuNAc с CMP-NeuNAc в качестве субстрата-донора на акцепторный сахарид. Иллюстративные сиалилтрансферазы и их гены идентифицированы в Таблице 2.
Термин «сиалилтрансфераза», в том виде, в котором он используется в данном документе, относится к полипептидам, способным обладать сиалилтрансферазной активностью. «Сиалилтрансферазная активность» относится к переносу остатка сиаловой кислоты, предпочтительно остатка N-ацетилнейраминовой кислоты (Neu5Ac), с субстрата-донора на акцепторную молекулу. Термин «сиалилтрансфераза» включает функциональные фрагменты сиалилтрансфераз, описанных в данном документе, функциональные варианты сиалилтрансфераз, описанных в данном документе, и функциональные фрагменты функциональных вариантов. «Функциональный» в данном отношении означает, что фрагменты и/или варианты могут обладать сиалилтрансферазной активностью. Функциональные фрагменты сиалилтрансферазы охватывают усеченные версии сиалилтрансферазы, как кодируется их геном, встречающимся в природе, усеченная версия которого может обладать сиалилтрансферазной активностью. Примерами усеченных версий являются сиалилтрансферазы, которые не содержат так называемой лидерной последовательности, которая обычно направляет полипептид к конкретной внутриклеточной локализации. Обычно такие лидерные последовательности удаляют из полипептида во время его внутриклеточного транспорта, и они также отсутствуют в зрелой сиалилтрансферазе, встречающейся в природе.
Гетерологичная сиалилтрансфераза может переносить остаток сиаловой кислоты с субстрата-донора на молекулу-акцептор. Термин «может» в отношении гетерологичной сиалилтрансферазы относится к сиалилтрансферазной активности гетерологичной сиалилтрансферазы и условию, что подходящие условия реакции требуются для гетерологичной сиалилтрансферазы для обладания ее ферментативной активностью. В отсутствии подходящих условий реакции гетерологичная сиалилтрансфераза не обладает своей ферментативной активностью, но сохраняет свою ферментативную активность и обладает своей ферментативной активностью, когда восстанавливают подходящие условия реакции. Подходящие условия реакции включают наличие подходящего субстрата-донора, наличие подходящих молекул-акцепторов, наличие существенных кофакторов, таких как, например, одновалентные или двухвалентные ионы, значение рН в соответствующем диапазоне, подходящую температуру и тому подобное. Не обязательно, чтобы оптимальные значения для каждого фактора, влияющего на ферментативную реакцию гетерологичной сиалилтрансферазы, были удовлетворены, но условия реакции должны быть такими, чтобы гетерологичная сиалилтрансфераза осуществляла свою ферментативную активность. Соответственно, термин «может» исключает любые условия, при которых ферментативная активность гетерологичной сиалилтрансферазы необратимо нарушена, и также исключено воздействие на гетерологичную сиалилтрансферазу любого такого условия. Напротив, термин «может» означает, что сиалилтрансфераза является ферментативно активной, а именно, обладает своей сиалилтрансферазной активностью, если пермиссивные условия реакции (где все требования, являющиеся необходимыми для того, чтобы сиалилтрансфераза реализовывала свою ферментативную активность) предоставлены сиалилтрансферазе.
Сиалилтрансферазы можно различить по типу связи с сахаром, которую они образуют. В том виде, в котором они используются в данном документе, термины «α-2,3-сиалилтрансфераза» и «α-2,3-сиалилтрансферазная активность» относятся к полипептидам и их ферментативной активности, которые добавляют остаток сиаловой кислоты с α-2,3-связью к галактозе, N-ацетилгалактозамину или галактозе или остатку N-ацетилгалактозамина акцепторной молекулы. Аналогично, термины «α-2,6-сиалилтрансфераза» и «α-2,6-сиалилтрансферазная активность» относятся к полипептидам и их ферментативной активности, которые добавляют остаток сиаловой кислоты с α-2,6-связью к галактозе, N-ацетилгалактозамину или галактозе или остатку N-ацетилгалактозамина акцепторной молекулы. Аналогично, термины «α-2,8-сиалилтрансфераза» и «α-2,8-сиалилтрансферазная активность» относятся к полипептидам и их ферментативной активности, которые добавляют остаток сиаловой кислоты с α-2,8-связью к галактозе, N-ацетилгалактозамину или галактозе или остатку N-ацетилгалактозамина акцепторной молекулы.
Кроме того, генетически сконструированная клетка Bacillus генетически сконструирована для того, чтобы содержать и экспрессировать нуклеотидную последовательность, кодирующую гетерологичную сиалилтрансферазу. С этой целью нуклеотидная последовательность, кодирующая гетерологичную сиалилтрансферазу, функционально связана с по меньшей мере одной последовательностью контроля экспрессии, влияющей на транскрипцию и/или трансляцию указанной нуклеотидной последовательности, кодирующей гетерологичную сиалилтрансферазу, в генетически сконструированной клетке Bacillus с получением внутриклеточной сиалилтрансферазной активности.
В еще одном воплощении гетерологичная сиалилтрансфераза может обладать α-2,6-сиалилтрансферазной активностью.
В дополнительном и/или альтернативном воплощении в генетически сконструированной клетке Bacillus содержится и экспрессируется молекула нуклеиновой кислоты, которая содержит по меньшей мере одну нуклеотидную последовательность, кодирующую указанную гетерологичную сиалилтрансферазу, способную обладать α-2,6-сиалилтрансферазной активностью.
В дополнительном и/или альтернативном воплощении гетерологичная сиалилтрансфераза может обладать α-2,8-сиалилтрансферазной активностью. Примером гетерологичной сиалилтрансферазы, которая способна обладать α-2,8-сиалилтрансферазной активностью, является сиалилтрансфераза Cstll OH4384Campylobacter jejuni.
Сиалилтрансфераза может переносить остаток сиаловой кислоты, например, остаток N-ацетилнейраминовой кислоты (Neu5Ac), от субстрата-донора, например, CMP-Neu5Ac, на акцепторную молекулу. Акцепторная молекула представляет собой молекулу сахарида, предпочтительно молекулу сахарида, изложенную в Таблице 3.
В дополнительном и/или альтернативном воплощении в генетически сконструированной микробной клетке Bacillus содержится молекула нуклеиновой кислоты, которая содержит и экспрессирует по меньшей мере одну нуклеотидную последовательность, кодирующую указанную гетерологичную сиалилтрансферазу, способную обладать α-2,3-сиалилтрансферазной активностью.
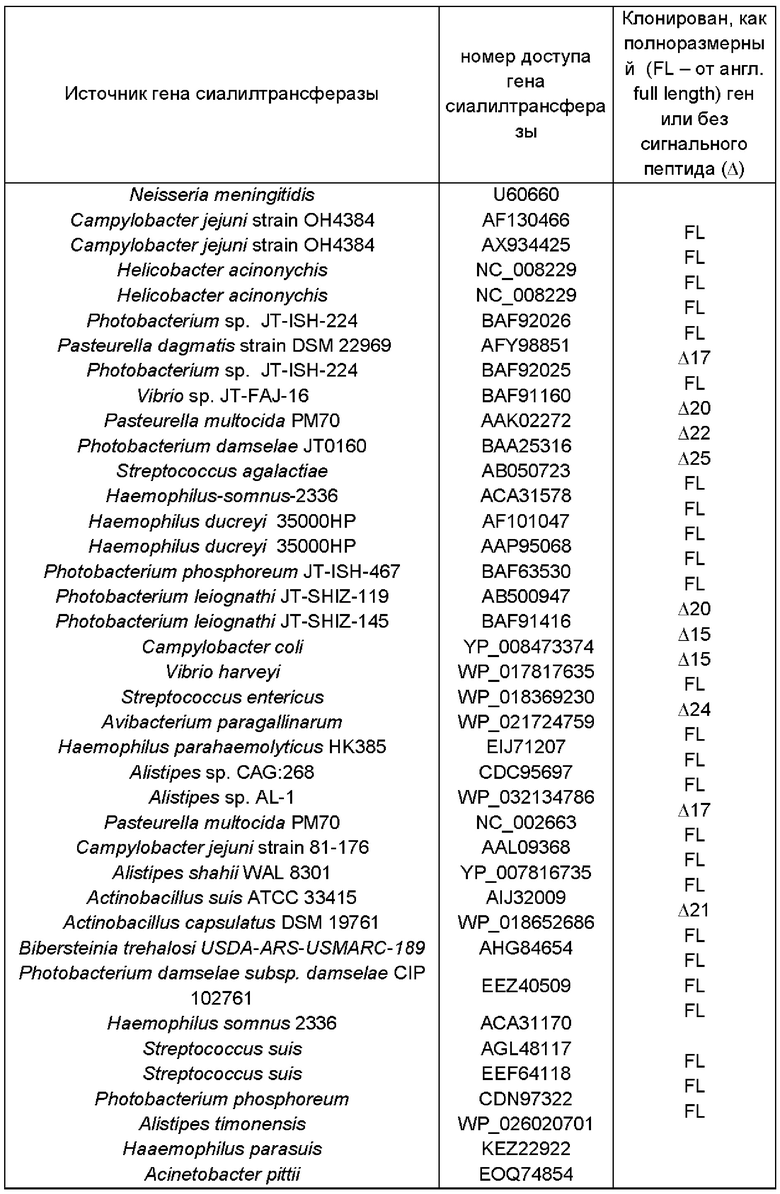
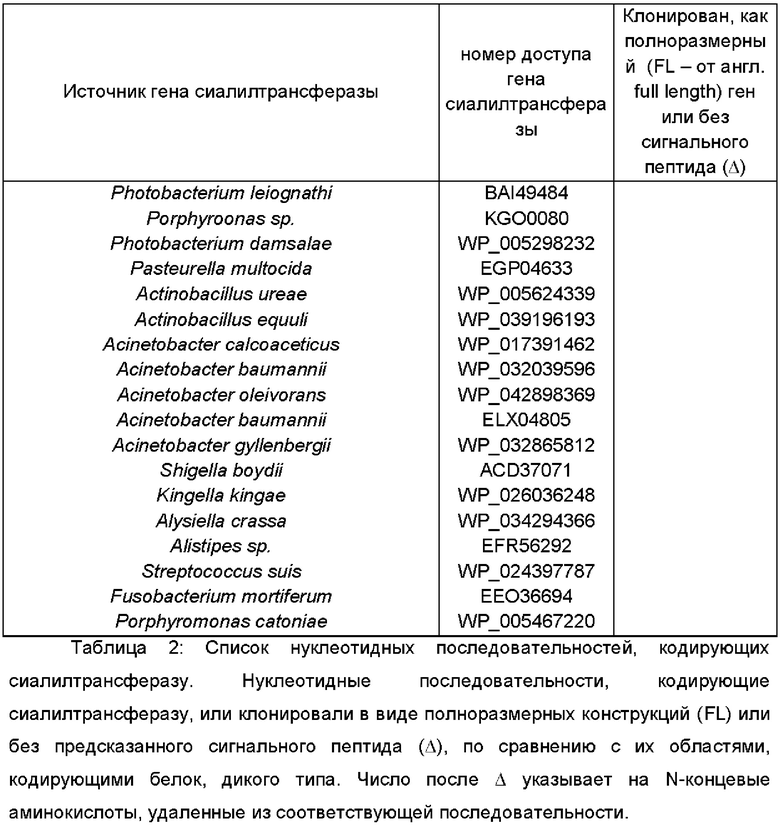
В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой моносахарид, предпочтительно моносахарид, выбранный из группы, состоящей из N-ацетилглюкозамина, галактозы и N-ацетилгалактозамина.
В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой дисахарид, предпочтительно дисахарид, выбранный из группы, состоящей из лактозы, лактулозы, N-ацетиллактозамина, лакто-N-биозы, лактулозы и мелибиозы.
В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой трисахарид, предпочтительно трисахарид, выбранный из группы, состоящей из рафинозы, лакто-N-триозы II, 2'-фукозиллактозы, 3-фукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3'-сиалил-N-
ацетиллактозамина, 6'-сиалил-N-ацетиллактозамина, 3'-галактозиллактозы и 6'-галактозиллактозы.
В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой тетрасахарид, предпочтительно тетрасахарид, выбранный из группы, состоящей из лакто-N-тетраозы, лакто-N-неотетраозы, 2'3-дифукозиллактозы, 3-фукозил-3'-сиалиллактозы и 3-фукозил-6'-сиалиллактозы.
В дополнительном и/или альтернативном воплощении акцепторная молекула представляет собой пентасахарид, предпочтительно пентасахарид, выбранный из группы, состоящей из сиалиллакто-N-тетраозы а, сиалиллакто-N-тетраозы b, сиалиллакто-N-тетраозы с, лакто-N-фукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы I и лакто-N-неофукопентаозы V.
Следует понимать, что клетка Bacillus, уже несущая один или более генов, кодирующих указанные ферменты образом, достаточным для продукции NeuNAc, CMP-NeuNAc и/или сиалированного сахарида, не нуждается в генетической модификации для совершения биосинтеза сиаловой кислоты и для переноса группировки сиаловой кислоты на акцептор-сахарид, но, тем не менее, может быть генетически сконструирована для изменения уровня экспрессии одного или более из указанных генов для повышения внутриклеточного уровня продуктов указанного одного или более генов, таких как, например, количество глутамин:фруктозо-6-фосфатаминотрансфеаза, глюкозамин-6-фосфат N-ацетилтрансфераза, N-ацетилглюкозамин-6-фосфатфосфатаза, N-ацетилглюкозамин 2-эпимераза и/или синтетаза N-ацетилнейраминовой кислоты, с повышением, таким образом, скорости биосинтеза Neu5Ac, и, как следствие, сиалированного сахарида, в генетически сконструированной клетке.
В некоторых воплощениях клетка Bacillus предназначена для применения в получении 3'-SL и генетически сконструирована для того, чтобы иметь лактозопермеазу, путь биосинтеза CMP-NeuNAc, в котором используется GlcN-1P в качестве промежуточного соединения, и α-2,3-сиалилтрансферазу.
В разных воплощениях клетка Bacillus предназначена для применения в получении 6'-SL и генетически сконструирована для того, чтобы иметь лактозопермеазу, путь биосинтеза CMP-NeuNAc, в котором используется GlcN-1P в качестве промежуточного соединения, и α-2,6-сиалилтрансферазу.
В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка Bacillus синтезирует больше ФЕП, чем клетка дикого типа. В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка генетически сконструирована для того, чтобы имелся усиленный путь биосинтеза ФЕП. Предпочтительно, генетически сконструированная микробная клетка генетически сконструирована для обладания повышенной активностью синтазы фосфоенолпирувата, например, в том, что ген ppsA, кодирующий фосфоенолпируватсинтазу, сверхэкспрессируется, и/или в том, что микроорганизмы, не встречающиеся в природе, содержат по меньшей мере одну дополнительную копию нуклеотидной последовательности, делающую возможной экспрессию фосфоенолпируватсинтазы или ее функционального варианта. Сверхэкспрессия ppsA усиливает внутриклеточный синтез ФЕП таким образом, что больше ФЕП доступно для продукции сиаловой кислоты. Например, подходящая фосфоенолпируватсинтаза представляет собой PpsA Е. coli.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus содержит молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую PpsA Е. coli или ее функциональный вариант.Указанная нуклеотидная последовательность, кодирующая PpsA Е. coli или ее функциональный вариант, обладает идентичностью последовательностей по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% с геном ppsA Е. coli.
В дополнительном и/или альтернативном воплощении генетически сконструированная клетка Bacillus дополнительно модифицирована для того, чтобы иметь способность переносить указанный один единственный источник углерода в клетку посредством механизма, при котором не потребляется ФЕП.
В дополнительном и/или альтернативном воплощении клетка Bacillus для получения сиалированного олигосахарида не обладает β-галактозидазной активностью или обладает пониженной β-галактозидазной активностью, по сравнению с клеткой Bacillus дикого типа того же вида.
Внутриклеточный биосинтез сиалированных олигосахаридов требует импортирования лактозы в качестве субстрата-акцептора для сиалилтрансферазы, акцептирующей лактозу. Любая внутриклеточная активность фермента, который гидролизует поглощенную лактозу, будет воздействовать на эффективность образования сиалиллактозы, поскольку пул внутриклеточной лактозы будет уменьшен. Таким образом, будет преимущественным, если клетка Bacillus для получения сиалированного олигосахарида не будет обладать или будет обладать по меньшей мере, по сравнению с клеткой Bacillus дикого типа, сниженной активностью бета-галактозидазы.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована для исключения или по меньшей мере уменьшения р-галактозидазной активности клетки.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована посредством делеции или функциональной инактивации гена ganA. В еще одном воплощении клетка Bacillus генетически сконструирована для уменьшения уровня экспрессии гена ganA, по сравнению с клеткой Bacillus дикого типа.
Ген ganA Bacillus также называется yvfN или lacA. Это ген регулона GanR, который содержит гены, кодирующие ферменты, участвующие в утилизации галактана. Ген ganA кодирует бета-галактозидазу, которая участвует в утилизации галактана Bacillus.
Делеция или функциональная инактивация гена ganA аннулирует GanA-опосредованную β-галактозидазную активность в клетке Bacillus, тогда как уменьшение уровня экспрессии ganA уменьшает количество GanA в клетке Bacillus и, следовательно, активность β-галактозидазы, которая могла бы мешать биосинтезу сиалированного олигосахарида.
В дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована посредством удаления или функциональной инактивации гена yesZ. Ген yesZ Bacillus кодирует бета-галактозидазу YesZ, которая играет роль в деградации рамногалактуронана, происходящего из клеточных стенок растений. Экспрессия гена yesZ Bacillus индуцируется рамногалактуронаном I. В еще одном воплощении клетка Bacillus генетически сконструирована для уменьшения уровня экспрессии гена yesZ, по сравнению с клеткой Bacillus дикого типа.
Удаление или функциональная инактивация гена yesZ аннулирует YesZ-опосредованную р-галактозидазную активность в клетке Bacillus, тогда как уменьшение уровня экспрессии yesZ уменьшает количество YesZ в клетке Bacillus и, следовательно, активность β-галактозидазы, которая могла бы мешать биосинтезу сиалированного олигосахарида.
Когда В. subtilis вступает в постэкспоненциальную фазу роста, они (начинают) продуцировать большие количества внеклеточных протеаз. Чужеродные белки часто являются чувствительными к протеазе. Таким образом, штамм, не содержащий экзопротеазу, является желательным для повышения стабильности гетерологичных белков и для обеспечения аккумуляции высоких уровней чужеродных белков. Геном Bacillus кодирует по меньшей мере восемь внеклеточных протеаз, а именно nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA. Таким образом, в дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована в том, что по меньшей мере один ген, кодирующий внеклеточную протеазу, был удален или функционально инактивирован, предпочтительно по меньшей мере один из генов, выбранных из группы, состоящей из nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA. Предпочтительно, два, три, четыре, пять, шесть, семь, или восемь из генов, выбранных из группы, состоящей из nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA, удалены или функционально инактивированы.
В, subtiiis синтезирует пульхерриминовую кислоту, когда растет в средах, содержащих углевод, такой как глюкоза или лактоза. Выделяемая пульхерриминовая кислота образует красный пигмент пульхерримин, соль пульхерриминовой кислоты (хелат железа (III)), когда железо находится в среде для выращивания. Образования данного нежелательного побочного продукта во время процессов ферментации можно избежать/аннулировать посредством удаления/нарушения генов yvmC и/или сурХ. Ген yvmC кодирует циклодипептидсинтазу, и ген сурХ кодирует цитохром Р450 цикло-I-лейцил-I-лейцилдипептидоксидазу.
Таким образом, в дополнительном и/или альтернативном воплощении клетка Bacillus генетически сконструирована таким образом, что по меньшей мере один из генов yvmC и сурХ удален или функционально инактивирован.
Ризобактерия В. subtilis имеет гены для синтеза более чем 20 антибиотиков. Среди них находятся антибиотики-пептиды, такие как лантибиотики и пептиды, подобные лактибиотикам Bacillus subtilis (субтилин, эрицин S, мерсацидин, субланцин 168, субтилозин А) и антибиотики, синтезируемые нерибосомально (пептид) (сурфактин, итуирн, бацилломицин, микосубтилин, коринебактин/бациллибактин, фенгицин, плипастатин, микобациллин, TL-119, бацилизин, бацилизоцин, амикоумацин, 3,3'-неотрегалозадиамин, диффицидин, ризоктицин).
Для получения сиалированного олигосахарида предпочтительно использовать клетку Bacillus, которая не продуцирует антибиотик. Таким образом, в дополнительном и/или альтернативном воплощении клетка Bacillus не синтезирует один или более антибиотиков, выбранных из группы, состоящей из лантибиотиков и пептидов, подобных лантибиотикам, таких как субтилин, эрицин S, мерзацидин, субланцин 168, субтилозин А; антибиотиков, синтезированных нерибосомально (пептид), таких как сурфактин, итурин, бацилломицин, микосубтилин, коринебактин/ бациллибактин, фенгицин, плипастатин, микобациллин, TL-119, бацилизин, бацилизоцин, амикоумацин, 3,3'-неотрегалозадиамин, диффицидин и ризоктицин. Клетка Bacillus могла быть генетически сконструирована для нарушения или аннулирования их своей способности синтезировать один или более из указанных антибиотиков.
Генетически сконструированная клетка Bacillus, которая может продуцировать сиалированный олигосахарид, может, возможно, включать дополнительные признаки и может быть генетически сконструирована для того, чтобы иметь данные дополнительные признаки. Считается, что данные дополнительные признаки улучают продуктивность микроорганизма, который не встречается в природе, приводя к более высоким выходам сиалированного олигосахарида.
Клетка Bacillus по изобретению может продуцировать сиалированный олигосахарид при культивации в присутствии лактозы в среде и в условиях, которые являются пермиссивными в отношении клетки Bacillus, для получения сиалированного олигосахарида. Таким образом, также предложено применение генетически сконструированной клетки Bacillus, как ранее описано в данном документе, для получения сиалированного олигосахарида.
В одном аспекте предложен способ получения сиалированного олигосахарида. Способ включает (i) предоставление клетки Bacillus, как описано ранее в данном документе, (ii) культивацию указанной клетки Bacillus в культуральной среде или ферментационном бульоне и в условиях, которые являются пермиссивными в отношении получения сиалированного олигосахарида. Способ может дополнительно включать извлечение сиалированного олигосахарида из культуральной среды/ферментационного бульона и/или из клетки Bacillus.
Ферментационный бульон содержит по меньшей мере один источник углерода для метаболизма клетки Bacillus. В некоторых воплощениях по меньшей мере один источник углерода выбран из группы, состоящей из глюкозы, фруктозы, сахарозы, глицерина и их комбинаций. Источник углерода может быть поглощен клеткой Bacillus и может быть привлечен метаболизмом клетки Bacillus с образованием биомассы и/или энергии в форме высокоэнергетических трифосфатов.
В некоторых воплощениях ферментационный бульон содержит лактозу, в частности, если клетка Bacillus не может синтезировать лактозу сама по себе. Лактоза может подаваться в ферментационный бульон извне. Лактоза может служить субстратом-акцептором для группировки NeuNAc в получении некоторых сиалированных олигосахаридов, в частности, в получении сиалиллактоз.
В разных воплощениях ферментационный бульон содержит сиаловую кислоту, в частности, если клетка Bacillus используется для получения сиалированного олигосахарида, в которой отсутствует путь биосинтеза сиаловой кислоты, но есть путь утилизации сиаловой кислоты.
В некоторых воплощениях получение сиалированного олигосахарида не требует добавления N-ацетилглюкозамина, N-ацетилманнозамина и/или N-ацетилнейраминовой кислоты в ферментационный бульон и/или культивации генетически сконструированной микробной клетки в присутствии N-ацетилглюкозамина, N-ацетилманнозамина и/или N-ацетилнейрамановой кислоты для внутриклеточного биосинтеза сиалированного олигосахарида, поскольку клетка Bacillus используется для получения сиалированного олигосахарида, в которой имеется путь биосинтеза сиаловой кислоты de novo для внутриклеточного биосинтеза NeuNAC.
В данном способе по меньшей мере одна генетически сконструированная клетка Bacillus культивируется в ферментационном бульоне и в условиях, которые являются пермиссивными в отношении получения сахарида, содержащего по меньшей мере одну группировку N-ацетилнейраминовой кислоты.
В то время как в процессе используется источник углерода в ферментационном бульоне для генетически сконструированной клетки Bacillus, нет необходимости в том, чтобы добавлять глюкозамин и/или N-ацетилнейраминовую кислоту и/или N-ацетилглюкозамин и/или N-ацетилманнозамин в ферментационный бульон, когда клетка Bacillus может внутриклеточно продуцировать N-ацетилнейраминовую кислоту. Таким образом, в разных воплощениях для получения сиалированного олигосахарида, генетически сконструированную клетку Bacillus культивируют в отсутствие и/или без добавления одного или более, выбранных из группы, состоящей из глюкозамина, N-ацетилглюкозамина, N-ацетилманнозамина и N-ацетилнейраминовой кислоты. Генетически сконструированную клетку Bacillus можно культивировать в отсутствии и/или без добавления галактозы, поскольку галактоза не доставляется в качестве субстрата-акцептора для реакции сиалилтрансферазы.
В дополнительных и/или альтернативных воплощениях генетически сконструированную клетку Bacillus культивируют в присутствии одного или более моносахаридов (например, галактозы), дисахаридов (например, лактозы), трисахаридов (например, лакто-N-триозы II), тетрасахаридов (например, лакто-N-тетраозы) и/или пентасахаридов (например, сиалиллакто-N-тетраозы а).
Согласно дополнительному и/или альтернативному воплощению генетически сконструированную клетку Bacillus культивируют в присутствии по меньшей мере одного субстрата-акцептора, выбранного из группы, состоящей из галактозы, N-ацетилгалактозамина, N-ацетилглюкозамина, лактозы, лактулозы, N-ацетиллактозамина, лакто-N-биозы, лакто-N-триозы, 2'-фукозиллактозы, 3-фукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3'-сиалил-N-ацетиллактозамина, 6'-сиалил-N-ацетиллактозамина, 3'-галактозиллактозы, 6'-галактозиллактозы, лакто-N-триозы II, лакто-N-тетраозы, лакто-N-неотетраозы, 2'3-дифукозиллактозы, 3-фукозил-3'-сиалиллактозы и 3-фукозил-6'-сиалиллактозы. Данные субстраты импортируются в клетку и используются в качестве молекул-акцепторов в клетке.
Способ включает возможную стадию выделения сиалированного олигосахарида, который продуцирован генетически сконструированной клеткой Bacillus во время ее культивирования и пролиферации в ферментационном бульоне. Сиалированный олигосахарид может быть выделен из ферментационного бульона после удаления генетически сконструированных клеток Bacillus, например, посредством центрифугирования или фильтрации и/или может быть выделен из клеток, например, в том отношении, что клетки собирают из ферментационного бульона посредством центрифугирования и подвергают стадии лизиса клеток. Затем, сиалированные олигосахариды могут быть дополнительно очищены из ферментационного бульона и/или клеточных лизатов подходящими методиками, известными специалисту в данной области. Подходящие методики включают микрофильтрацию, ультрафильтрацию, диафильтрацию, хроматографию с псевдодвижущимся слоем, электродиализ, обратный осмос, гель-фильтрацию, анионообменную хроматографию, катионообменную хроматографию и т.п.
Способ и генетически сконструированную микробную клетку, которую используют в способе, используют для получения сиалированного олигосахарида. Термин «сиалированный олигосахарид» относится к молекуле олигосахарида, содержащей по меньшей мере одну группировку N-ацетилнейраминовой кислоты.
В дополнительном и/или альтернативном воплощении сиалированный сахарид представляет собой олигосахарид. Термин «олигосахарид», в том виде, в котором он используется в данном документе, относится к полимерам моносахаридных остатков, где указанные полимеры содержат по меньшей мере два моносахаридных остатка, но не больше чем 10 моносахаридных остатков, предпочтительно не больше чем 7 моносахаридных остатков. Олигосахариды представляют собой или линейную цепь моносахаридов или являются разветвленными. Кроме того, моносахаридные остатки олигосахаридов могут характеризоваться целым рядом химических модификаций. Соответственно, олигосахариды могу содержать одну или более несахаридных группировок. Термин «сиалированный олигосахарид», в том виде, в котором он используется в данном документе, относится к олигосахаридам, содержащим один или более группировок N-ацетилнейраминовой кислоты.
Согласно дополнительному и/или альтернативному воплощению сиалированный олигосахарид выбран из группы, состоящей из 3'-сиалиллактозы, 6'-сиалиллактозы, сиалиллакто-N-тетраозы а, сиалиллакто-N-тетраозы b, сиалиллакто-N-тетраозы с, фукозил-сиалиллакто-N-тетраозы а, фукозил-сиалиллакто-N-тетраозы b, фукозил-сиалиллакто-N-тетраозы с, дисиалиллакто-N-тетраозы, фукозиллакто-N-тетраозы I, фукозиллакто-N-тетраозы II, 3'-сиалилгалактозы, 6'-сиалилгалактозы, 3'-сиалил-N-ацетиллактозамина и 6'-сиалил-N-ацетиллактозамина.
В еще одном аспекте изобретения предложено применение генетически сконструированной клетки Bacillus, как описано ранее в данном документе, для получения сиалированного олигосахарида в цельноклеточном ферментационном процессе, а именно, сиалированный олигосахарид синтезируется генетически сконструированной клеткой Bacillus и в генетически сконструированной клетке Bacillus.
В еще одном аспекте изобретения предложен сиалированный олигосахарид, который получен способом и/или посредством применения генетически сконструированной клетки Bacillus, как описано ранее в данном документе.
В еще одном аспекте изобретения предложено применение сиалированного олигосахарида, который получен способом, как описано ранее в данном документе, и/или посредством применения генетически сконструированной клетки Bacillus, как описано ранее в данном документе, для изготовления питательной композиции.
Таким образом, предложена питательная композиция, содержащая по меньшей мере один сиалированный олигосахарид, который получен способом и/или посредством генетически сконструированной клетки Bacillus, как ранее описано в данном документе.
В дополнительном и/или альтернативном воплощении сиалированный олигосахарид выбран из группы, состоящей из 3'-сиалиллактозы, 6'-сиалиллактозы, сиалиллакто-N-тетраозы а, сиалиллакто-N-тетраозы b, сиалиллакто-N-тетраозы с, фукозил-сиалиллакто-N-тетраозы а, фукозил-сиалиллакто-N-тетраозы b, фукозил-сиалиллакто-N-тетраозы с, дисиалиллакто-N-тетраозы, фукозилдисиалиллакто-N-тетраозы I, фукозилдисиаллакто-N-тетраозы II, 3'-сиалилгалактозы, 6'-сиалилгалактозы, 3'-сиалил-N-ацетиллактозамина и 6'-сиалил-N-ацетиллактозамина.
В некоторых воплощениях питательная композиция дополнительно содержит по меньшей мере один нейтральный ОГМ, предпочтительно по меньшей мере один нейтральный ОГМ, который продуцирован посредством использования генетически сконструированной клетки Bacillus. По меньшей мере один нейтральный ОГМ выделен из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, лакто-N-триозы II, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-неофукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-неофукопентаозы V, лакто-N-дифукогексаозы I, лакто-N-дифукогексаозы II, лакто-N-неодифукогексаозы I, лакто-N-гексаозы, лакто-N-неогексаозы, пара-лакто-N-гексаозы и пара-лакто-N-неогексаозы.
В дополнительном воплощении питательная композиция выбрана из группы, состоящей из медицинских композиций, фармацевтических композиций, нутрицевтических композиций, детских питательных смесей и биологически активных добавок.
Питательная композиция может быть представлена в жидкой форме или в твердой форме, включая порошки, гранулы, хлопья и пеллеты, но, не ограничиваясь ими.
Настоящее изобретение будет описано относительно конкретных воплощений, но данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины первый, второй и тому подобное в описании и в формуле изобретения используются для проведения различия между похожими элементами и не обязательно для описания последовательности, во времени, в пространстве, по рангу или любым другим образом. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми в соответствующих обстоятельствах, и что воплощения изобретения, описанные в данном документе, способны работать в последовательностях, отличных от описанных или проиллюстрированных в данном документе.
Следует отметить, что термин «содержащий», используемый в формуле изобретения, не следует считать ограничивающимся средствами, перечисленными в дальнейшем; он не исключает других элементов или стадий. Таким образом, его следует считать определяющим наличие заявленных признаков, целых чисел, стадий или компонентов, на которые ссылаются, но он не исключает наличие или добавление одного или более других признаков, целых чисел, стадий или компонентов или их групп. Таким образом, объем выражения «устройство, содержащее средства А и В» не следует ограничивать устройствами, состоящими только из компонентов А и В. Оно означает, что в отношении настоящего изобретения, единственными релевантными компонентами устройства являются А и В.
Ссылка на всем протяжении данного описания изобретения на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанные в связи с данным воплощением, включены в по меньшей мере одно воплощение настоящего изобретения. Таким образом, появления фраз «в одном воплощении» или «в воплощении» в разных местах по всему объему данного описания изобретения не обязательно все относятся к одному и тому же воплощению, но могут. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом, как будет очевидно среднему специалисту в данной области из данного раскрытия, в одном или более воплощениях.
Аналогично, следует понимать, что в описании иллюстративных воплощений изобретения разные признаки изобретения иногда сгруппированы вместе в одном единственном воплощении, фигуре или его описании в целях упрощения раскрытия и помощи в понимании одного или более из разных аспектов изобретения. Данный способ раскрытия, однако, не нужно считать отражающим мысль, что заявленное изобретение требует больше признаков, чем явным образом перечислены в каждом пункте. Скорее, как отражено в приведенной ниже формуле изобретения, аспекты изобретения заключаются меньше чем во всех признаках одного вышеизложенного раскрытого воплощения. Таким образом, формула изобретения после подробного описания явным образом включена тем самым в данное подробное описание, причем каждый пункт отдельно стоит в виде отдельного воплощения данного изобретения.
Кроме того, в то время как некоторые воплощения, описанные в данном документе, включают некоторые, но не все признаки, включенные в другие воплощения, подразумевается, что комбинации признаков разных воплощений находятся в объеме изобретения и образуют разные воплощения, как будет понятно специалистам в данной области. Например, в приведенной ниже формуле изобретения любое из заявленных воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данном документе как способ или комбинация элементов способа, которые могут быть реализованы посредством процессора компьютерной системы или с помощью других средств выполнения функции. Таким образом, процессор с необходимыми инструкциями для осуществления такого способа или элемента способа образует средство осуществления способа или элемента способа. Кроме того, описанный в данном документе элемент воплощения аппарата представляет собой пример средства осуществления функции, выполняемой элементом, с целью осуществления изобретения.
В описании и графических материалах, предоставленных в данном документе, изложены многочисленные конкретные подробности. Однако, понятно, что воплощения изобретения можно осуществлять на практике без данных конкретных подробностей. В других примерах хорошо известные способы, структуры и методики не были показаны подробно для того, чтобы не затруднять понимание. Теперь изобретение будет описано с помощью подробного описания нескольких воплощений изобретения. Ясно, что другие воплощения изобретения могут быть скомпонованы в соответствии со знаниями специалистов в данной области, не отклоняясь от истинной сущности или технической идеи изобретения, причем изобретение ограничено только условиями прилагаемой формулы изобретения.
Примеры
Пример 1: Трансформация Bacillus subtilis
Bacillus subtilis можно подвергать генетическим манипуляциям посредством разных методик. Для трансформации В. subtilis компетентные клетки готовили посредством модифицированного протокола двухстадийного способа (Anagnostopoulos, С.and Spizizen, J. (1961) J Bacteriol 81 (5): 741-746). Ночную культуру инокулировали в среде MG1 и встряхивали при 37°С. Среда MG1 представляет собой минимальную среду Спицайзена, которая дополнена 0,5% глюкозой, 5 мМ MgSO4 и 0,02% казаминовыми кислотами (возможно, дополнительно дополнена биотином и/или L-триптофаном). На следующее утро данную культуру разводили 1:20 в свежей среде MG1 и инкубировали при 37°С в течение приблизительно 6 ч. 1 мл культуры разводили в 8 мл среды MG2, которая отличается от среды MG1 по концентрации казаминовых кислот (0,01% вместо 0,02%). В укороченном протоколе ночную культуру непосредственно разводят в среде MG2. После инкубации в течение еще 90 мин порцию культуры, 1 мл, смешивали с 1-3 мкг мультимерной плазмидной ДНК или линейной ДНК и инкубировали при 37°С в течение 30-60 мин при встряхивании. Мультимерную плазмидную ДНК получали или посредством использования штамма Е. coli NM538 для размножения плазмидной ДНК или посредством линеаризации плазмиды в результате расщепления рестриктазой с одним разрезом, которая осуществляет расщепление в пределах каркаса с последующим повторным лигированием Т4 ДНК лигазой.
Затем, клетки распределяли по чашкам с 2xYT и агаром, содержащим соответствующий антибиотик. Антибиотики добавляли в следующих концентрациях: 5 мкг⋅мл-1 эритромицина, 5 мкг⋅мл-1 хлорамфеникола, 10 мкг⋅мл-1 канамицина. 100 мкг⋅мл-1 спектиномицина.
В качестве альтернативы, для трансформации протопластов (Romero, D. et al. (2006) Journal of Microbiological Methods 66:556-559) клетки выращивали в 20 мл бульона Penassay (РАВ) при 37°С до начала стационарной фазы роста (OD600 (от англ. optical density - оптическая фаза) равна 1,7-2). Затем клетки осаждали и ресуспендировали в 10 мл среды SMPP (0,3%-ный бычий сывороточный альбумин, 5%-ная 2 М сахароза, 25% 4× РАВ, 50% 2× SMM), состоящей из 2×SMM, представляющего собой 1 М сахарозу, 0,04 М гидрат двунатриевой соли малеиновой кислоты и 0,04 М MgCl2 (рН 6,5). После добавления лизоцима (10 мг мл-1) и мутанолизина (75 Ед мл-1) смесь инкубировали при 37°С при встряхивании с образованием протопластов. Образование протопластов проверяли посредством микроскопа. Затем протопласты аккуратно собирали посредством центрифугирования при 5200 ×g и 4°С в течение 5 мин, два раза промывали охлажденным льдом промывочным буфером для электротрансформации (1× SMM) и, в конечном итоге, суспендировали в данном растворе. Плазмидную ДНК (1-3 мкг) добавляли к 120 мкл суспензии протопластов, и смесь держали на льду в течение по меньшей мере 5 мин. Смесь для трансформации переносили в кювету, объемом 0,2 см, и один импульс для электропорации прикладывали на уровне 25 мкФ, 400 Ω⋅ и 0,7 кВ. Сразу после разряда электропорации 1 мл восстанавливающей среды (равные объемы 4х РАВ и 2х SMM, свежеприготовленные перед применением) добавляли в кювету. Затем реакционную смесь для трансформации переносили в 2 мл пробирку и инкубировали при 37°С при встряхивании в течение 12 ч. Для регенерации клеточную суспензию распределяли по чашкам с DM3 и агаром (Chang, S. and Cohen, S. (1979) MGG 168(1):111-115) и инкубировали при 37°C в течение 48 ч. Регенерирующая среда DM3 содержала следующие стерильные растворы на литр: 200 мл 4%-ого агара, 100 мл 5%-ных казаминовых кислот, 50 мл 10%-ого дрожжевого экстракта, 100 мл 3,5%-ого K2HPO4 и 1,5%-ого KH2PO4, 25 мл 20%-ной глюкозы, 20 мл 1 М MgCl2, 500 мл 0,5 М сорбита и 5 мл стерилизованного посредством фильтрации 2%-ого бычьего сывороточного альбумина (добавляемые к смеси, когда температура ниже 55°С), и ее дополняли соответствующим антибиотиком.
Электропорацию В. subtilis проводили в соответствии с модифицированным протоколом от Zhang et al. (2011), предоставленным MoBiTec GmbH (Zhang.G., Bao,P., Zhang,Y., Deng,A., Chen,N. и Wen,T. (2011) Anal. Biochem., 409:130-137). Ночную культуру 2x YT разводили в 100 раз свежей средой 2х YT, и культуру выращивали до OD600 0,2 при 37°С на ротационной качалке. Затем культуру дополняли 1%-ным DL-треонином, 2%-ным глицином, 0,1%-ным триптофаном и 0,03% Tween 80. После культивирования в течение еще 60 мин клеточную суспензию охлаждали на льду в течение 20 мин, центрифугировали при 5000 × g в течение 10 мин при 4°С и два раза промывали буфером для электропорации (0,5 М трегалоза, 0,5 М сорбит, 0,5 М маннит, 0,5 мМ MgCl2, 0,5 мМ K2HPO4, 0,5 мМ KH2PO4, рН 7,4, стерилизовали посредством фильтрации и хранили в замороженном виде). Наконец, клетки ресуспендировали в буфере для электропорации в соотношении 1/100 исходного объема культуры, и 100 мкл клеточной суспензии смешивали с ДНК. Смесь для трансформации переносили в 0,1-см кювету, и электропорацию проводили при 1,8 кВ с помощью одного импульса, доставляемого посредством прибора MicroPulser™ (Bio-Rad). Сразу после доставки импульса 1 мл бульона 2х YT, содержащего 0,5 М сорбит и 0,38 М маннит, добавляли в кювету. Суспензию для трансформации переносили в пробирку, объемом 2 мл, и инкубировали при 37°С в течение 3 ч на ротационной качалке. Клетки распределяли по чашке с 2х YT и агаром и инкубировали при 37°С в течение ночи.
Используя альтернативный протокол электропорации (Xue, G.P., J.S. Johnson and В.P. Dalrymple: 1999; Journal of Microbiological Methods 34:183-191), 5 мл седы LB, содержащей 0,5 M глюцит, инокулировали В. subtilis и инкубировали в течение ночи при 37°С.Далее, ночную культуру разводили (1:16) 75 мл LB, содержащей 0,5 М глюцит, и инкубировали до получения OD600 0,85-0,95. Затем клетки осаждали посредством центрифугирования в течение 10 мин при 4°С при 5,000хg и четыре раза промывали буфером для электропорации, охлажденным посредством льда (10% глицерин, 0,5 М глюцит, 0,5 М маннит). Наконец, клетки ресуспендировали в 1-2 мл буфера для электропорации. Электропорацию проводили, используя 60 мкл компетентных клеток с ДНК в охлажденной кювете для электропорации (расстояние между электродами 1 мм). Смесь клетки-ДНК подвергали воздействию одного электрического импульса на уровне 25 мкФ, 200 Ω и 21 кВ/см. Наконец, 1 мл бульона для восстановления (LB, содержащая 0,5 М глюцит и 0,38 М маннит) добавляли к электропермеабилизированным клеткам, и бактериальную культуру инкубировали в течение 3 ч при 37°С с последующим посевом на LB с агаром с добавлением антибиотика.
Использовали две разные обогащенные среды, а именно бульон Luria (LB) и 2х YT.
Среда бульон Luria (LB) состояла из 1%-ого триптона, 0,5%-ого дрожжевого экстракта и 0,5% NaCl (рН 7,2).
Среда 2х YT состояла из 1,6%-ого триптона, 1%-ого дрожжевого экстракта и 0,5% NaCl (рН 7,5).
Для получения чашек с обогащенной средой с агаром добавляли 15 г л-1 агара.
Для экспериментов со встряхиваемыми колбами использовали минимальную среду Спицайзена (Spizizen, J. 1958 Proc. Natl. Acad. Sci. U. S. A. 44(10):1072-1078).
Минимальная среда Спицайзена содержит следующие соли: 2 г/л (NH4)2SO4, 14 г/л K2HPO4, 6 г/л KH2PO4, 1 г/л цитрата Na3 × 2⋅H2O и 0,2 г/л MgSO4 × 7⋅H2O.
Предкультуральная среда, состоящая из минимальных солей Спицайзена, дополненная 2% D-глюкозой, 0,05% казаминовыми кислотами и MgSO4, до конечной концентрации 2 мМ (возможно дополнительно дополненная биотином и/или L-триптофаном).
Основная культуральная среда состояла из минимальных солей Спицайзена, дополненная 2%-ной D-глюкозой, 0,05%-ными казаминовыми кислотами, MgSO4 до конечной концентрации 2 мМ и 0,5 мл⋅л-1 1000х раствора микроэлементов (возможно дополнительно дополненная биотином и/или L-триптофаном).
Раствор микроэлементов (1000х) состоял из 100,6 г л-1 C6H9NO6, 56,4 г⋅л-1 цитрата железа (III)-аммония, 9,8 г⋅л-1 MnCl2 × 4⋅H2O, 1,6 г⋅л-1 CoCl2 × 6⋅H2O, 1 г⋅л-1 CuCl2 × 2⋅H2O, 1,9 г⋅л-1 Н3 BO3, 9 г⋅л-1 ZnSO4 × 7⋅H2O, 1,1 г⋅л-1 Na2MoO4 × 2⋅H2O, 1,5 г⋅л-1 Na2SeO3, 1,5 г⋅л-1 NiSO4 × 6⋅H2O.
При необходимости, соответствующий(ие) антибиотик(и) добавляли к среде для того, чтобы сделать ее селективной.
Штаммы В. subtilis исходно выращивали на чашках с обогащенными средами с агаром с получением одиночных колоний. Данные чашки выращивали в течение 1 суток при 30-37°С. В экспериментах со встряхиваемыми колбами 20 мл предварительной культуры инокулировали одиночной колонией и выращивали в течение ночи при 30-37°С на ротационной качалке. Следующие 20 мл основных культур инокулировали данной предварительной культурой до начальной OD600 примерно 0,1 и инкубировали при 30-37°С на ротационной качалке. Если требовалась индукция, 40-60 мл основной культуры разбивали на порции по 20 мл в момент времени индукции. Объем культуры не превышал 20% емкости встряхиваемой колбы.
Пример 2: Конструирование штамма-продуцента Bacillus subtilis для 3'-сиалиллактозы
Для синтеза 3'-сиалиллактозы из метаболического промежуточного соединения - УДФ-N-ацетилглюкозамина с использованием пути neuCBA, конструировали экспрессионную плазмиду В. subtilis (SEQ ID NO: 1). Сначала гены neuA, neuB, neuC, а также α-2,3-сиалилтрансферазу, подвергали оптимизации кодонов для экспрессии в В. subtilis и получали синтетически посредством GenScript Corp.Ген neuA Campylobacter jejuni (номер доступа UniProtKB: Q93MP7) кодирует синтетазу CMP-Neu5Ac. Ген neuB Campylobacter jejuni (номер доступа UniProtKB: Q93MP9) кодирует синтазу сиаловой кислоты. Ген neuC Campylobacter jejuni (номер доступа UniProtKB: Q93MP8) кодирует N-ацетилглюкозамин-6-фосфат 2-эпимеразу. Ген siaT Pasteurella multocida (номер доступа UniProtKB: Q9CLP3) кодирует α-2,3-сиалилтрансферазу. Открытую рамку считывания гена lacY Е. coli (номе доступа Gen Bank: NP_414877.1), кодирующую лактозопермеазу, амплифицировали посредством ПЦР (полимеразная цепная реакция) из хромосомной ДНК. Затем, конструировали экспрессионную кассету <Pgrac100-neuBCA-siaT-lacY-terminator>, которая содержит все необходимые гены под контролем индуцибельного промотора Pgrac100. С этой целью, экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса. Каждый ген в пределах экспрессионной кассеты связывали с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты. Полученную плазмиду <pHT253-Pgrac100-neuBCA-2,3siaT-lacY-terminator> (SEQ ID NO: 1) использовали для трансформации спорообразующего штамма В. subtilis (таблица 1) посредством использования его природной компетентности.
Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени.
Трансформанты культивировали в условиях, которые являются пермиссивными в отношении В. subtilis, с получением 3'-сиалиллактозы в присутствии экзогенной лактозы.
Пример 3: Конструирование штамма-продуцента Bacillus subtilis для 3'-сиалиллактозы
Для синтеза 3'-сиалиллактозы из метаболического промежуточного соединения - УДФ-N-ацетилглюкозамина с использованием пути neuCBA, конструировали конститутивную экспрессионную плазмиду В. subtilis (SEQ ID NO: 2). Сначала, гены neuA, neuB, neuC и siaT подвергали оптимизации кодонов для экспрессии в В. subtilis и получали синтетически посредством GenScript Corp.Ген neuA Campylobacter jejuni (номер доступа UniProtKB: Q93MP7) кодирует синтетазу CMP-Neu5Ac. Ген neuB Campylobacter jejuni (номер доступа UniProtKB: Q93MP9) кодирует синтазу сиаловой кислоты.
Ген neuC Campylobacter jejuni (номер доступа UniProtKB: Q93MP8) кодирует N-ацетилглюкозамин-6-фосфат 2-эпимеразу. Ген siaT Pasteurella multocida (номер доступа UniProtKB: Q9CLP3) кодирует α-2,3-сиалилтрансферазу. Открытую рамку считывания гена lacY Е. coli (номе доступа Gen Bank: NP_414877.1), кодирующую лактозопермеазу, амплифицировали посредством ПЦР из хромосомной ДНК. Затем, конструировали экспрессионную кассету <P43-neuBCA-PlepA-siaT-lacY-terminator>, которая содержит все необходимые гены, функционально связанные с двумя сильными конститутивными промоторами В. subtilis  и/или Р43. Экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса плазмиды. Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты.
и/или Р43. Экспрессионный вектор рНТ253 В. subtilis (MoBiTec GmbH, Göttingen, Германия) использовали в качестве каркаса плазмиды. Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Дополнительно, подходящую терминирующую последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) помещали ниже экспрессионной кассеты.
Полученную плазмиду <phT253-P43-neuBCA- -siaT-lacY-terminator> (SEQ ID NO: 2) использовали для трансформации спорообразующего и неспорообразующего штаммов В. subtilis (таблица 1) посредством использования их природной компетентности.
-siaT-lacY-terminator> (SEQ ID NO: 2) использовали для трансформации спорообразующего и неспорообразующего штаммов В. subtilis (таблица 1) посредством использования их природной компетентности.
Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени.
Трансформанты культивировали в условиях, которые являются пермиссивными в отношении В. subtilis, с получением 3'-сиалиллактозы в присутствии экзогенной лактозы.
Пример 4: Конструирование штамма-продуцента Bacillus subtilis для 6'-сиалиллактозы
Для продукции 6'-сиалиллактозы в В. subtilis использовали α-2,6-сиалилтрансферазу из Photobacterium leiognathi. Открытую рамку считывания гена siaT (номер доступа UniProtKB: D0VYB7) подвергали оптимизации кодонов для экспрессии в В. subtilis и получали синтетически посредством GenScript Corp.
Экспрессионную плазмиду <pHT253-Pgrac100-neuBCA-2,6siaT-lacY-terminator> (SEQ ID NO: 3) конструировали, как описано в примере 2. Полученную плазмиду (SEQ ID NO: 3) использовали для трансформации спорообразующего и неспорообразующего штаммов В. subtilis (Таблица 1) посредством использования их природной компетентности. Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени. Трансформанты культивировали в условиях, которые являются пермиссивными в отношении В. subtilis, с получением 6'-сиалиллактозы в присутствии экзогенной лактозы.
Пример 5: Конструирование штамма Bacillus subtilis для получения 3'-сиалиллактозы
Конструирование метаболизма В. subtilis (Таблица 1) достигалось посредством интеграции гетерологичных генов neuA Campylobacter jejuni, nanT Е. coli и siaT Haemophilus parahaemolyticus и одновременного удаления эндогенного гена ganA посредством гомологичной рекомбинации. Ген ganA В. subtilis (yvfN, lacA), который расположен в пределах галактозного оперона, кодирует бета-галактозидазу.
Для продукции 3'-сиалиллактозы из экзогенной сиаловой кислоты/N-ацетилнейраминовой кислоты и лактозы, открытые рамки считывания neuA, nanT и siaT были функционально связаны с конститутивным промотором Р43 В. subtilis (часть репозитория iGem: ID последовательности: ВВа_K143013) в виде оперона. С этой целью, во-первых, гены neuA, nanT и siaT подвергали оптимизации кодонов для экспрессиии в В. subtilis и получали синтетически посредством GenScript Corp.Ген neuA Campylobacter jejuni (номер доступа UniProtKB: Q93MP7) кодирует синтетазу CMP-Neu5Ac, ген nanT Е. coli (номер доступа GenBank: NP_417691.4) кодирует транспортер сиаловой кислоты и ген siaT Н. parahaemolyticus (номер доступа UniProtKB: I3DHL4) кодирует альфа-N-ацетилнейраминил-2,3-бета-галактозил-1,3-N-ацетилгалактозаминид 6-альфа-сиалилтрансферазу (альфа-2,3-сиалилтрансферазу).
Каждый ген в пределах экспрессионной кассеты был связан с последовательностью RBS В. subtilis. Кроме того, подходящая терминирующая последовательность В. subtilis из части репозитория iGem (ID последовательности: ВВа_В0015) была расположена ниже экспрессионной кассеты.
Клонирующий вектор pBR322 (New England Biolabs GmbH, Франкфурт, Германия) использовали в качестве каркаса плазмиды. Кассету полной интеграции собирали для создания суицидной плазмиды<pBR322 flank ganA up-Р43-siaT-neuA-nanT-terminator-erm-flank ganA down>(SEQ ID NO: 4). Затем, В. subtilis трансформировали данной плазмидой за счет ее природной компетентности. Клетки распределяли по чашкам с 2х YT и агаром, содержащей соответствующий антибиотик (5 мкг мл-1 эритромицина). Интеграцию экспрессионной кассеты <Р43-siaT-neuA-nanT-terminator> в локус ganA генома В. subtilis, с получением штамма А, проверяли посредством ПЦР на колониях. Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени.
Для импортирования экзогенной лактозы в клетку Bacillus ген lacY Е. coli интегрировали в эндогенный локус amyE (amyA) генома В. subtilis (кодирующий альфа-амилазу). С этой целью, открытую рамку считывания гена lacY Е. coli (номер доступа Gen Bank: NP_414877.1), кодирующую лактозопермеазу, амплифицировали посредством ПЦР из хромосомной ДНК. Кассету интеграции <flank amyE up-1ох71-aad9-lox66-P43-lacY-flank amyE down> (SEQ ID NO: 5) конструировали и клонировали в pBR322 (New England Biolabs GmbH, Фанкфурт, Германия). Штамм A трансформировали полученной суицидной плазмидой за счет природной компетентности. Интеграцию экспрессионной кассеты <Р43-lacY> в локус amyE штамма А, с получением конечного штамма В проверяли посредством ПЦР на колониях.
Экспрессию гена подтверждали посредством направленной протеомики и/или посредством ПЦР в реальном времени. Штамм В культивировали в условиях, которые являются пермиссивными в отношении В. subtilis с получением 3'-сиалиллактозы в присутствии экзогенной лактозы и сиаловой кислоты/N-ацетилнейраминовой кислоты.
Пример 6: Получение сиалиллактозы с использованием штаммов Bacillus subtilis с модифицированным метаболизмом
Предварительную культуру инокулировали штаммом Bacillus subtilis с модифицированным метаболизмом, подходящим для биосинтеза сиалиллактозы (как описано в примерах 2-5).
Предварительную культуру инкубировали при 30-37°С в течение ночи и затем разводили до исходной OD600 примерно 0,1 в свежей основной культуральной среде. Когда основная культура достигала OD600 приблизительно 0,5, 2 мМ лактозу добавляли к среде для выращивания. Когда для экспрессии гена использовали индуцибельный промотор Pgrac100, индукцию осуществляли посредством лактозы (2 мМ) или как лактозы (2 мМ), так и IPTG (от англ. isopropylthiogalactoside -изопропилтиогалактозид) (1 мМ). Для утилизирующего биосинтеза CMP-N-ацетилнейраминовой кислоты, дополнительно, добавляли 2 мМ сиаловой кислоты/N-ацетилнейраминовой кислоты. Культивирование прекращали после примерно 24 ч/48 ч после индукции, и внутриклеточную и внеклеточную сиалиллактозу анализировали посредством тонкослойной хроматографии и/или ВЭЖХ (высокоэффективной жидкостной хроматографии) и/или масс-спектрометрии (как описано в WO 2017/042382 А или WO 2019/008133 А). Выявляли биосинтез существенных количеств сиалиллактозы (3'-сиалиллактозы/6'-сиалиллактозы).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Jennewein Biotechnologie GmbH
<120> ПРОДУКЦИЯ СИАЛИРОВАННЫХ ОЛИГОСАХАРИДОВ В КЛЕТКАХ BACILLUS
<130> P 1906 WO
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 13121
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Экспрессионная плазмида
<400> 1
ttaagttatt ggtatgactg gttttaagcg caaaaaaagt tgctttttcg tacctattaa
60
tgtatcgttt tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa
120
gccagtcatt aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat
180
aaccatcaca aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt
240
tattaatgaa ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat
300
ttaagttaaa cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag
360
gtataggtgt tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt
420
ataaatcata aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt
480
tagatacacc atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc
540
cgtcgctatt gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga
600
aaataaatgc agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa
660
tatcaatttc tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct
720
cttttctctt ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa
780
tttttatcta aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc
840
ttttttaaaa gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat
900
ccaattttcg tttgttgaac taatgggtgc tttagttgaa gaataaagac cacattaaaa
960
aatgtggtct tttgtgtttt tttaaaggat ttgagcgtag cgaaaaatcc ttttctttct
1020
tatcttgata ataagggtaa ctattgccga tcgtccattc cgacagcatc gccagtcact
1080
atggcgtgct gctagcgcca ttcgccattc aggctgcgca actgttggga agggcgatcg
1140
gtgcgggcct cttcgctatt acgccagctg gcgaaagggg gatgtgctgc aaggcgatta
1200
agttgggtaa cgccagggtt ttcccagtca cgacgttgta aaacgacggc cagtgaattc
1260
gagctcaggc cttaactcac attaattgcg ttgcgctcac tgcccgcttt ccagtcggga
1320
aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg cggggagagg cggtttgcgt
1380
attgggcgcc agggtggttt ttcttttcac cagtgagacg ggcaacagct gattgccctt
1440
caccgcctgg ccctgagaga gttgcagcaa gcggtccacg ctggtttgcc ccagcaggcg
1500
aaaatcctgt ttgatggtgg ttgacggcgg gatataacat gagctgtctt cggtatcgtc
1560
gtatcccact accgagatat ccgcaccaac gcgcagcccg gactcggtaa tggcgcgcat
1620
tgcgcccagc gccatctgat cgttggcaac cagcatcgca gtgggaacga tgccctcatt
1680
cagcatttgc atggtttgtt gaaaaccgga catggcactc cagtcgcctt cccgttccgc
1740
tatcggctga atttgattgc gagtgagata tttatgccag ccagccagac gcagacgcgc
1800
cgagacagaa cttaatgggc ccgctaacag cgcgatttgc tggtgaccca atgcgaccag
1860
atgctccacg cccagtcgcg taccgtcttc atgggagaaa ataatactgt tgatgggtgt
1920
ctggtcagag acatcaagaa ataacgccgg aacattagtg caggcagctt ccacagcaat
1980
ggcatcctgg tcatccagcg gatagttaat gatcagccca ctgacgcgtt gcgcgagaag
2040
attgtgcacc gccgctttac aggcttcgac gccgcttcgt tctaccatcg acaccaccac
2100
gctggcaccc agttgatcgg cgcgagattt aatcgccgcg acaatttgcg acggcgcgtg
2160
cagggccaga ctggaggtgg caacgccaat cagcaacgac tgtttgcccg ccagttgttg
2220
tgccacgcgg ttgggaatgt aattcagctc cgccatcgcc gcttccactt tttcccgcgt
2280
tttcgcagaa acgtggctgg cctggttcac cacgcgggaa acggtctgat aagagacacc
2340
ggcatactct gcgacatcgt ataacgttac tggtttcatc aaaatcgtct ccctccgttt
2400
gaatatttga ttgatcgtaa ccagatgaag cactctttcc actatcccta cagtgttatg
2460
gcttgaacaa tcacgaaaca ataattggta cgtacgatct ttcagccgac tcaaacatca
2520
aatcttacaa atgtagtctt tgaaagtatt acatatgtaa gatttaaatg caaccgtttt
2580
ttcggaagga aatgatgacc tcgtttccac cggaattagc ttggtaccaa aggaggtaag
2640
gatcactaga aaatttttta aaaaatctct tgacattgga agggagatat gttattataa
2700
gaattgcgga attgtgagcg gataacaatt cccatataga ttaactaata aggaggacaa
2760
acatgaaaga aatcaaaatc caaaacatca tcatcagcga agaaaaagcg ccgctggttg
2820
tgccggaaat cggcattaat cataacggat ctttagaact ggctaaaatc atggttgatg
2880
cagcgttttc agctggagcc aaaatcatca aacatcaaac acatatcgtc gaagatgaaa
2940
tgagcaaagc tgcaaagaaa gttatcccgg gcaacgctaa aatctctatc tacgaaatca
3000
tgcagaaatg cgctttagat tacaaagatg aacttgccct gaaagaatac acagaaaaac
3060
tgggacttgt gtatcttagc acaccgtttt caagagcagg cgcgaatcgc ttagaagata
3120
tgggagtctc tgcatttaaa atcggctcag gagaatgtaa taactatccg ctgatcaaac
3180
atattgcagc gtttaaaaaa ccgatgattg tgtctacagg catgaactca atcgaaagca
3240
ttaaaccgac agtgaaaatc ctgcttgata acgaaatccc gtttgtcctg atgcatacaa
3300
caaacctgta tccgacaccg cataatcttg ttagattaaa cgccatgctg gaactgaaga
3360
aagaatttag ctgcatggtg ggactttctg atcatacaac agataatctg gcatgccttg
3420
gcgcggtcgt tcttggagcg tgtgtcttag aaagacattt tacagattca atgcatcgca
3480
gcggaccgga tattgtttgt tctatggata caaaagcctt aaaagaactg atcattcaat
3540
cagaacagat ggcaatcatt cgcggcaata acgaatcaaa gaaagcagcc aaacaagaac
3600
aggttacaat cgattttgct tttgcctctg tggtctcaat caaagatatt aagaaaggcg
3660
aagttctgtc aatggataat atttgggtga aaagaccggg acttggcgga atcagcgcag
3720
cggaatttga aaatattctg ggcaagaaag cactgcgcga tattgaaaac gatgcgcagt
3780
taagctatga agattttgct taagctctta aggaggattt tagaatgaag aaaattctgt
3840
ttatcacagg ctcaagagcg gattactcta aaatcaaatc acttatgtac cgcgtccaaa
3900
attcaagcga atttgaactt tacatctttg ctacaggcat gcatctgagc aaaaactttg
3960
gatacacagt taaagaatta tataaaaatg gctttaaaaa catctacgaa tttatcaact
4020
acgataaata ttatcagaca gataaagccc tggcaacaac aattgatgga ttttcaagat
4080
atgcgaacga attaaaaccg gatctgattg ttgtgcatgg cgatcgcatc gaaccgcttg
4140
cagcggctat tgtcggagcc cttaacaaca tcctggttgc acatatcgaa ggcggagaaa
4200
ttagcggaac aatcgatgat tctttaagac atgcgatttc aaaacttgct catatccatc
4260
tggtgaacga tgaatttgca aaaagacgcc ttatgcaatt aggcgaagat gaaaaatcaa
4320
tctttatcat cggatctccg gatctggaac tgcttaacga taacaaaatc tcacttagcg
4380
aagccaaaaa atactacgat attaactacg aaaactatgc attactgatg tttcatccgg
4440
tcacaacaga aatcacatct atcaaaaacc aagccgataa cctggtgaaa gcacttatcc
4500
agtcaaacaa aaactacatc gtcatctatc cgaataacga tctgggcttt gaactgatcc
4560
ttcagagcta tgaagaattt aaaaacaacc cgagatttaa actgtttccg tctctgcgct
4620
ttgaatactt tatcacactt ctgaaaaacg ccgattttat tatcggaaac tcttcatgca
4680
tcctgaaaga agcgttatac ctgaaaacag ctggcattct ggttggatca agacaaaatg
4740
gccgcttagg aaatgaaaac acactgaaag tgaatgcgaa cagcgatgaa atccttaaag
4800
ctatcaacac aatccataaa aaacaggatt tattttctgc taaactggaa attcttgata
4860
gctctaaact gtttttcgaa tatcttcaat caggcgattt ctttaaactt agcacacaga
4920
aagtttttaa agatattaaa taaaaaggag gaactactat gtcacttgca attatcccgg
4980
cgagaggcgg aagcaaaggc atcaaaaaca aaaacctggt tctgcttaac aacaaaccgc
5040
ttatctacta cacaatcaaa gcagcgctga atgctaaatc tatttcaaaa gttgtggtct
5100
caagcgatag cgatgaaatc cttaactacg ccaaatctca aaacgtggat attctgaaaa
5160
gaccgatctc tcttgcacag gatgatacaa catcagataa agtcttactg catgcgctga
5220
aattttacaa agattacgaa gatgttgtgt ttttacaacc gacatctccg ctgcgcacaa
5280
acattcatat caacgaagca tttaacctgt acaaaaattc aaacgctaat gccctgatta
5340
gcgtctctga atgcgataac aaaatcctta aagcatttgt ttgcaacgat tgtggcgatt
5400
tagccggaat ttgtaatgat gaatatccgt ttatgccgcg ccagaaactg ccgaaaacat
5460
atatgagcaa cggagcgatc tacatcctta aaatcaaaga atttctgaac aacccgtcat
5520
ttctgcaaag caaaacaaaa cattttctta tggatgaatc atcatcactg gatattgatt
5580
gcctggaaga tttaaagaaa gttgaacaaa tttggaaaaa ataaagatta actaataagg
5640
aggacaaaca tggataaatt tgctgaacat gaaattccga aagctgttat cgtggccggc
5700
aacggagaat ctctttcaca aatcgattac agactgcttc cgaaaaacta tgatgtcttt
5760
agatgcaacc agttttactt tgaagaacgc tattttcttg gcaacaaaat caaagcagtt
5820
ttctttacac cgggagtgtt tttagaacaa tactacacac tgtaccatct taaacgcaac
5880
aacgaatact ttgtcgataa cgttatcctg tcatcattta accatccgac agttgatctg
5940
gaaaaatcac aaaaaatcca ggctctgttt attgatgtga tcaacggcta cgaaaaatac
6000
ctgtctaaac tgacagcctt tgatgtttat ctgagataca aagaacttta cgaaaaccaa
6060
cgcattacat caggagtgta tatgtgcgcc gtcgcaatcg cgatgggcta tacagatatt
6120
taccttacag gaatcgattt ttatcaggca agcgaagaaa actacgcgtt tgataacaaa
6180
aaaccgaaca tcatcagatt actgccggat tttcgcaaag aaaaaacatt attttcatat
6240
catagcaaag atattgatct tgaagcatta tcttttctgc aacagcatta ccatgttaac
6300
ttttacagca tttctccgat gtctccgctg tcaaaacatt ttccgatccc gacagtggaa
6360
gatgattgtg aaacaacatt tgtcgcgccg ctgaaagaaa actacatcaa cgatattctt
6420
ttaccgccgc attttgtcta tgaaaaactt ggcgttgata aacttgcagc ggctttagaa
6480
catcatcatc atcatcatta aagtgatagc ggtaccatta taggtaagag aggaatgtac
6540
acatgtacta tttaaaaaac acaaactttt ggatgttcgg tttattcttt ttcttttact
6600
tttttatcat gggagcctac ttcccgtttt tcccgatttg gctacatgac atcaaccata
6660
tcagcaaaag tgatacgggt attatttttg ccgctatttc tctgttctcg ctattattcc
6720
aaccgctgtt tggtctgctt tctgacaaac tcgggctgcg caaatacctg ctgtggatta
6780
ttaccggcat gttagtgatg tttgcgccgt tctttatttt tatcttcggg ccactgttac
6840
aatacaacat tttagtagga tcgattgttg gtggtattta tctaggcttt tgttttaacg
6900
ccggtgcgcc agcagtagag gcatttattg agaaagtcag ccgtcgcagt aatttcgaat
6960
ttggtcgcgc gcggatgttt ggctgtgttg gctgggcgct gtgtgcctcg attgtcggca
7020
tcatgttcac catcaataat cagtttgttt tctggctggg ctctggctgt gcactcatcc
7080
tcgccgtttt actctttttc gccaaaacgg atgcgccctc ttctgccacg gttgccaatg
7140
cggtaggtgc caaccattcg gcatttagcc ttaagctggc actggaactg ttcagacagc
7200
caaaactgtg gtttttgtca ctgtatgtta ttggcgtttc ctgcacctac gatgtttttg
7260
accaacagtt tgctaatttc tttacttcgt tctttgctac cggtgaacag ggtacgcggg
7320
tatttggcta cgtaacgaca atgggcgaat tacttaacgc ctcgattatg ttctttgcgc
7380
cactgatcat taatcgcatc ggtgggaaaa acgccctgct gctggctggc actattatgt
7440
ctgtacgtat tattggctca tcgttcgcca cctcagcgct ggaagtggtt attctgaaaa
7500
cgctgcatat gtttgaagta ccgttcctgc tggtgggctg ctttaaatat attaccagcc
7560
agtttgaagt gcgtttttca gcgacgattt atctggtctg tttctgcttc tttaagcaac
7620
tggcgatgat ttttatgtct gtactggcgg gcaatatgta tgaaagcatc ggtttccagg
7680
gcgcttatct ggtgctgggt ctggtggcgc tgggcttcac cttaatttcc gtgttcacgc
7740
ttagcggccc cggcccgctt tccctgctgc gtcgtcaggt gaatgaagtc gcttaaggat
7800
ccatgtctag agtcgacgtc cccggggcag cccgcctaat gagcgggctt ttttcacgtc
7860
ccaggcatca aataaaacga aaggctcagt cgaaagactg ggcctttcgt tttatctgtt
7920
gtttgtcggt gaacgctctc tactagagtc acactggctc accttcgggt gggcctttct
7980
gcgtttatac ccggggcagc ccgcctaatg agcgggcttt tttcacgtca cgcgtccatg
8040
gagatctttg tctgcaactg aaaagtttat accttacctg gaacaaatgg ttgaaacata
8100
cgaggctaat atcggcttat taggaatagt ccctgtacta ataaaatcag gtggatcagt
8160
tgatcagtat attttggacg aagctcggaa agaatttgga gatgacttgc ttaattccac
8220
aattaaatta agggaaagaa taaagcgatt tgatgttcaa ggaatcacgg aagaagatac
8280
tcatgataaa gaagctctaa aactattcaa taaccttaca atggaattga tcgaaagggt
8340
ggaaggttaa tggtacgaaa attaggggat ctacctagaa agccacaagg cgataggtca
8400
agcttaaaga acccttacat ggatcttaca gattctgaaa gtaaagaaac aacagaggtt
8460
aaacaaacag aaccaaaaag aaaaaaagca ttgttgaaaa caatgaaagt tgatgtttca
8520
atccataata agattaaatc gctgcacgaa attctggcag catccgaagg gaattcatat
8580
tacttagagg atactattga gagagctatt gataagatgg ttgagacatt acctgagagc
8640
caaaaaactt tttatgaata tgaattaaaa aaaagaacca acaaaggctg agacagactc
8700
caaacgagtc tgttttttta aaaaaaatat taggagcatt gaatatatat tagagaatta
8760
agaaagacat gggaataaaa atattttaaa tccagtaaaa atatgataag attatttcag
8820
aatatgaaga actctgtttg tttttgatga aaaaacaaac aaaaaaaatc cacctaacgg
8880
aatctcaatt taactaacag cggccaaact gagaagttaa atttgagaag gggaaaaggc
8940
ggatttatac ttgtatttaa ctatctccat tttaacattt tattaaaccc catacaagtg
9000
aaaatcctct tttacactgt tcctttaggt gatcgcggag ggacattatg agtgaagtaa
9060
acctaaaagg aaatacagat gaattagtgt attatcgaca gcaaaccact ggaaataaaa
9120
tcgccaggaa gagaatcaaa aaagggaaag aagaagttta ttatgttgct gaaacggaag
9180
agaagatatg gacagaagag caaataaaaa acttttcttt agacaaattt ggtacgcata
9240
taccttacat agaaggtcat tatacaatct taaataatta cttctttgat ttttggggct
9300
attttttagg tgctgaagga attgcgctct atgctcacct aactcgttat gcatacggca
9360
gcaaagactt ttgctttcct agtctacaaa caatcgctaa aaaaatggac aagactcctg
9420
ttacagttag aggctacttg aaactgcttg aaaggtacgg ttttatttgg aaggtaaacg
9480
tccgtaataa aaccaaggat aacacagagg aatccccgat ttttaagatt agacgtaagg
9540
ttcctttgct ttcagaagaa cttttaaatg gaaaccctaa tattgaaatt ccagatgacg
9600
aggaagcaca tgtaaagaag gctttaaaaa aggaaaaaga gggtcttcca aaggttttga
9660
aaaaagagca cgatgaattt gttaaaaaaa tgatggatga gtcagaaaca attaatattc
9720
cagaggcctt acaatatgac acaatgtatg aagatatact cagtaaagga gaaattcgaa
9780
aagaaatcaa aaaacaaata cctaatccta caacatcttt tgagagtata tcaatgacaa
9840
ctgaagagga aaaagtcgac agtactttaa aaagcgaaat gcaaaatcgt gtctctaagc
9900
cttcttttga tacctggttt aaaaacacta agatcaaaat tgaaaataaa aattgtttat
9960
tacttgtacc gagtgaattt gcatttgaat ggattaagaa aagatattta gaaacaatta
10020
aaacagtcct tgaagaagct ggatatgttt tcgaaaaaat cgaactaaga aaagtgcaat
10080
aaactgctga agtatttcag cagttttttt tatttagaaa tagtgaaaaa aatataatca
10140
gggaggtatc aatatttaat gagtactgat ttaaatttat ttagactgga attaataatt
10200
aacacgtaga ctaattaaaa tttaatgagg gataaagagg atacaaaaat attaatttca
10260
atccctatta aattttaaca agggggggat taaaatttaa ttagaggttt atccacaaga
10320
aaagacccta ataaaatttt tactagggtt ataacactga ttaatttctt aatgggggag
10380
ggattaaaat ttaatgacaa agaaaacaat cttttaagaa aagcttttaa aagataataa
10440
taaaaagagc tttgcgatta agcaaaactc tttacttttt cattgacatt atcaaattca
10500
tcgatttcaa attgttgttg tatcataaag ttaattctgt tttgcacaac cttttcagga
10560
atataaaaca catctgaggc ttgttttata aactcagggt cgctaaagtc aatgtaacgt
10620
agcatatgat atggtatagc ttccacccaa gttagccttt ctgcttcttc tgaatgtttt
10680
tcatatactt ccatgggtat ctctaaatga ttttcctcat gtagcaaggt atgagcaaaa
10740
agtttatgga attgatagtt cctctctttt tcttcaactt ttttatctaa aacaaacact
10800
ttaacatctg agtcaatgta agcataagat gtttttccag tcataatttc aatcccaaat
10860
cttttagaca gaaattctgg acgtaaatct tttggtgaaa gaattttttt atgtagcaat
10920
atatccgata cagcaccttc taaaagcgtt ggtgaatagg gcattttacc tatctcctct
10980
cattttgtgg aataaaaata gtcatattcg tccatctacc tatcctatta tcgaacagtt
11040
gaacttttta atcaaggatc agtccttttt ttcattattc ttaaactgtg ctcttaactt
11100
taacaactcg atttgttttt ccagatctcg agggtaacta gcctcgccga tcccgcaaga
11160
ggcccggcag tcaggtggca cttttcgggg aaatgtgcgc ggaaccccta tttgtttatt
11220
tttctaaata cattcaaata tgtatccgct catgagacaa taaccctgat aaatgcttca
11280
ataatattga aaaaggaaga gtatgagtat tcaacatttc cgtgtcgccc ttattccctt
11340
ttttgcggca ttttgccttc ctgtttttgc tcacccagaa acgctggtga aagtaaaaga
11400
tgctgaagat cagttgggtg cacgagtggg ttacatcgaa ctggatctca acagcggtaa
11460
gatccttgag agttttcgcc ccgaagaacg ttttccaatg atgagcactt ttaaagttct
11520
gctatgtggc gcggtattat cccgtattga cgccgggcaa gagcaactcg gtcgccgcat
11580
acactattct cagaatgact tggttgagta ctcaccagtc acagaaaagc atcttacgga
11640
tggcatgaca gtaagagaat tatgcagtgc tgccataacc atgagtgata acactgcggc
11700
caacttactt ctgacaacga tcggaggacc gaaggagcta accgcttttt tgcacaacat
11760
gggggatcat gtaactcgcc ttgatcgttg ggaaccggag ctgaatgaag ccataccaaa
11820
cgacgagcgt gacaccacga tgcctgtagc aatggcaaca acgttgcgca aactattaac
11880
tggcgaacta cttactctag cttcccggca acaattaata gactggatgg aggcggataa
11940
agttgcagga ccacttctgc gctcggccct tccggctggc tggtttattg ctgataaatc
12000
tggagccggt gagcgtgggt ctcgcggtat cattgcagca ctggggccag atggtaagcc
12060
ctcccgtatc gtagttatct acacgacggg gagtcaggca actatggatg aacgaaatag
12120
acagatcgct gagataggtg cctcactgat taagcattgg taactgtcag accaagttta
12180
ctcatatata ctttagattg atttaaaact tcatttttaa tttaaaagga tctaggtgaa
12240
gatccttttt gataatctca tgaccaaaat cccttaacgt gagttttcgt tccactgagc
12300
gtcagacccc gtagaaaaga tcaaaggatc ttcttgagat cctttttttc tgcgcgtaat
12360
ctgctgcttg caaacaaaaa aaccaccgct accagcggtg gtttgtttgc cggatcaaga
12420
gctaccaact ctttttccga aggtaactgg cttcagcaga gcgcagatac caaatactgt
12480
ccttctagtg tagccgtagt taggccacca cttcaagaac tctgtagcac cgcctacata
12540
cctcgctctg ctaatcctgt taccagtggc tgctgccagt ggcgataagt cgtgtcttac
12600
cgggttggac tcaagacgat agttaccgga taaggcgcag cggtcgggct gaacgggggg
12660
ttcgtgcaca cagcccagct tggagcgaac gacctacacc gaactgagat acctacagcg
12720
tgagctatga gaaagcgcca cgcttcccga agggagaaag gcggacaggt atccggtaag
12780
cggcagggtc ggaacaggag agcgcacgag ggagcttcca gggggaaacg cctggtatct
12840
ttatagtcct gtcgggtttc gccacctctg acttgagcgt cgatttttgt gatgctcgtc
12900
aggggggcgg agcctatgga aaaacgccag caacgcggcc tttttacggt tcctggcctt
12960
ttgctggcct tttgctcaca tgttctttcc tgcgttatcc cctgattctg tggataaccg
13020
tattaccgcc tttgagtgag ctgataccgc tcgccgcagc cgaacgaccg agcgcagcga
13080
gtcagtgagc gaggaagcgg aagagcgccc aatacgcatg c
13121
<210> 2
<211> 11125
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Плазмида
<400> 2
ttaagttatt ggtatgactg gttttaagcg caaaaaaagt tgctttttcg tacctattaa
60
tgtatcgttt tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa
120
gccagtcatt aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat
180
aaccatcaca aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt
240
tattaatgaa ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat
300
ttaagttaaa cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag
360
gtataggtgt tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt
420
ataaatcata aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt
480
tagatacacc atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc
540
cgtcgctatt gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga
600
aaataaatgc agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa
660
tatcaatttc tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct
720
cttttctctt ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa
780
tttttatcta aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc
840
ttttttaaaa gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat
900
ccaattttcg tttgttgaac taatgggtgc tttagttgaa gaataaagac cacattaaaa
960
aatgtggtct tttgtgtttt tttaaaggat ttgagcgtag cgaaaaatcc ttttctttct
1020
tatcttgata ataagggtaa ctattgccga tcgtccattc cgacagcatc gccagtcact
1080
atggcgtgct gctagcattt tacattttta gaaatgggcg tgaaaaaaag cgcgcgatta
1140
tgtaaaatat aaagattaac taataaggag gacaaacatg aaagaaatca aaatccaaaa
1200
catcatcatc agcgaagaaa aagcgccgct ggttgtgccg gaaatcggca ttaatcataa
1260
cggatcttta gaactggcta aaatcatggt tgatgcagcg ttttcagctg gagccaaaat
1320
catcaaacat caaacacata tcgtcgaaga tgaaatgagc aaagctgcaa agaaagttat
1380
cccgggcaac gctaaaatct ctatctacga aatcatgcag aaatgcgctt tagattacaa
1440
agatgaactt gccctgaaag aatacacaga aaaactggga cttgtgtatc ttagcacacc
1500
gttttcaaga gcaggcgcga atcgcttaga agatatggga gtctctgcat ttaaaatcgg
1560
ctcaggagaa tgtaataact atccgctgat caaacatatt gcagcgttta aaaaaccgat
1620
gattgtgtct acaggcatga actcaatcga aagcattaaa ccgacagtga aaatcctgct
1680
tgataacgaa atcccgtttg tcctgatgca tacaacaaac ctgtatccga caccgcataa
1740
tcttgttaga ttaaacgcca tgctggaact gaagaaagaa tttagctgca tggtgggact
1800
ttctgatcat acaacagata atctggcatg ccttggcgcg gtcgttcttg gagcgtgtgt
1860
cttagaaaga cattttacag attcaatgca tcgcagcgga ccggatattg tttgttctat
1920
ggatacaaaa gccttaaaag aactgatcat tcaatcagaa cagatggcaa tcattcgcgg
1980
caataacgaa tcaaagaaag cagccaaaca agaacaggtt acaatcgatt ttgcttttgc
2040
ctctgtggtc tcaatcaaag atattaagaa aggcgaagtt ctgtcaatgg ataatatttg
2100
ggtgaaaaga ccgggacttg gcggaatcag cgcagcggaa tttgaaaata ttctgggcaa
2160
gaaagcactg cgcgatattg aaaacgatgc gcagttaagc tatgaagatt ttgcttaagc
2220
tcttaaggag gattttagaa tgaagaaaat tctgtttatc acaggctcaa gagcggatta
2280
ctctaaaatc aaatcactta tgtaccgcgt ccaaaattca agcgaatttg aactttacat
2340
ctttgctaca ggcatgcatc tgagcaaaaa ctttggatac acagttaaag aattatataa
2400
aaatggcttt aaaaacatct acgaatttat caactacgat aaatattatc agacagataa
2460
agccctggca acaacaattg atggattttc aagatatgcg aacgaattaa aaccggatct
2520
gattgttgtg catggcgatc gcatcgaacc gcttgcagcg gctattgtcg gagcccttaa
2580
caacatcctg gttgcacata tcgaaggcgg agaaattagc ggaacaatcg atgattcttt
2640
aagacatgcg atttcaaaac ttgctcatat ccatctggtg aacgatgaat ttgcaaaaag
2700
acgccttatg caattaggcg aagatgaaaa atcaatcttt atcatcggat ctccggatct
2760
ggaactgctt aacgataaca aaatctcact tagcgaagcc aaaaaatact acgatattaa
2820
ctacgaaaac tatgcattac tgatgtttca tccggtcaca acagaaatca catctatcaa
2880
aaaccaagcc gataacctgg tgaaagcact tatccagtca aacaaaaact acatcgtcat
2940
ctatccgaat aacgatctgg gctttgaact gatccttcag agctatgaag aatttaaaaa
3000
caacccgaga tttaaactgt ttccgtctct gcgctttgaa tactttatca cacttctgaa
3060
aaacgccgat tttattatcg gaaactcttc atgcatcctg aaagaagcgt tatacctgaa
3120
aacagctggc attctggttg gatcaagaca aaatggccgc ttaggaaatg aaaacacact
3180
gaaagtgaat gcgaacagcg atgaaatcct taaagctatc aacacaatcc ataaaaaaca
3240
ggatttattt tctgctaaac tggaaattct tgatagctct aaactgtttt tcgaatatct
3300
tcaatcaggc gatttcttta aacttagcac acagaaagtt tttaaagata ttaaataaaa
3360
aggaggaact actatgtcac ttgcaattat cccggcgaga ggcggaagca aaggcatcaa
3420
aaacaaaaac ctggttctgc ttaacaacaa accgcttatc tactacacaa tcaaagcagc
3480
gctgaatgct aaatctattt caaaagttgt ggtctcaagc gatagcgatg aaatccttaa
3540
ctacgccaaa tctcaaaacg tggatattct gaaaagaccg atctctcttg cacaggatga
3600
tacaacatca gataaagtct tactgcatgc gctgaaattt tacaaagatt acgaagatgt
3660
tgtgttttta caaccgacat ctccgctgcg cacaaacatt catatcaacg aagcatttaa
3720
cctgtacaaa aattcaaacg ctaatgccct gattagcgtc tctgaatgcg ataacaaaat
3780
ccttaaagca tttgtttgca acgattgtgg cgatttagcc ggaatttgta atgatgaata
3840
tccgtttatg ccgcgccaga aactgccgaa aacatatatg agcaacggag cgatctacat
3900
ccttaaaatc aaagaatttc tgaacaaccc gtcatttctg caaagcaaaa caaaacattt
3960
tcttatggat gaatcatcat cactggatat tgattgcctg gaagatttaa agaaagttga
4020
acaaatttgg aaaaaataaa gtcaatgtat gaatggatac gggatatgaa tcaataagta
4080
cgtgaaagag aaaagcaacc cagatatgat agggaacttt tctctttctt gttttacatt
4140
gaatctttac aatcctattg atataatcta agctagtgta ttttgcgttt aatagtggag
4200
aaaagctagc gattaactaa taaggaggac aaacatggat aaatttgctg aacatgaaat
4260
tccgaaagct gttatcgtgg ccggcaacgg agaatctctt tcacaaatcg attacagact
4320
gcttccgaaa aactatgatg tctttagatg caaccagttt tactttgaag aacgctattt
4380
tcttggcaac aaaatcaaag cagttttctt tacaccggga gtgtttttag aacaatacta
4440
cacactgtac catcttaaac gcaacaacga atactttgtc gataacgtta tcctgtcatc
4500
atttaaccat ccgacagttg atctggaaaa atcacaaaaa atccaggctc tgtttattga
4560
tgtgatcaac ggctacgaaa aatacctgtc taaactgaca gcctttgatg tttatctgag
4620
atacaaagaa ctttacgaaa accaacgcat tacatcagga gtgtatatgt gcgccgtcgc
4680
aatcgcgatg ggctatacag atatttacct tacaggaatc gatttttatc aggcaagcga
4740
agaaaactac gcgtttgata acaaaaaacc gaacatcatc agattactgc cggattttcg
4800
caaagaaaaa acattatttt catatcatag caaagatatt gatcttgaag cattatcttt
4860
tctgcaacag cattaccatg ttaactttta cagcatttct ccgatgtctc cgctgtcaaa
4920
acattttccg atcccgacag tggaagatga ttgtgaaaca acatttgtcg cgccgctgaa
4980
agaaaactac atcaacgata ttcttttacc gccgcatttt gtctatgaaa aacttggcgt
5040
tgataaactt gcagcggctt tagaacatca tcatcatcat cattaaagtg atagcggtac
5100
cattataggt aagagaggaa tgtacacatg tactatttaa aaaacacaaa cttttggatg
5160
ttcggtttat tctttttctt ttactttttt atcatgggag cctacttccc gtttttcccg
5220
atttggctac atgacatcaa ccatatcagc aaaagtgata cgggtattat ttttgccgct
5280
atttctctgt tctcgctatt attccaaccg ctgtttggtc tgctttctga caaactcggg
5340
ctgcgcaaat acctgctgtg gattattacc ggcatgttag tgatgtttgc gccgttcttt
5400
atttttatct tcgggccact gttacaatac aacattttag taggatcgat tgttggtggt
5460
atttatctag gcttttgttt taacgccggt gcgccagcag tagaggcatt tattgagaaa
5520
gtcagccgtc gcagtaattt cgaatttggt cgcgcgcgga tgtttggctg tgttggctgg
5580
gcgctgtgtg cctcgattgt cggcatcatg ttcaccatca ataatcagtt tgttttctgg
5640
ctgggctctg gctgtgcact catcctcgcc gttttactct ttttcgccaa aacggatgcg
5700
ccctcttctg ccacggttgc caatgcggta ggtgccaacc attcggcatt tagccttaag
5760
ctggcactgg aactgttcag acagccaaaa ctgtggtttt tgtcactgta tgttattggc
5820
gtttcctgca cctacgatgt ttttgaccaa cagtttgcta atttctttac ttcgttcttt
5880
gctaccggtg aacagggtac gcgggtattt ggctacgtaa cgacaatggg cgaattactt
5940
aacgcctcga ttatgttctt tgcgccactg atcattaatc gcatcggtgg gaaaaacgcc
6000
ctgctgctgg ctggcactat tatgtctgta cgtattattg gctcatcgtt cgccacctca
6060
gcgctggaag tggttattct gaaaacgctg catatgtttg aagtaccgtt cctgctggtg
6120
ggctgcttta aatatattac cagccagttt gaagtgcgtt tttcagcgac gatttatctg
6180
gtctgtttct gcttctttaa gcaactggcg atgattttta tgtctgtact ggcgggcaat
6240
atgtatgaaa gcatcggttt ccagggcgct tatctggtgc tgggtctggt ggcgctgggc
6300
ttcaccttaa tttccgtgtt cacgcttagc ggccccggcc cgctttccct gctgcgtcgt
6360
caggtgaatg aagtcgctta aggatccatg tctagagtcg acgtccccgg ggcagcccgc
6420
ctaatgagcg ggcttttttc acgtcccagg catcaaataa aacgaaaggc tcagtcgaaa
6480
gactgggcct ttcgttttat ctgttgtttg tcggtgaacg ctctctacta gagtcacact
6540
ggctcacctt cgggtgggcc tttctgcgtt tatagaattc atattactta gaggatacta
6600
ttgagagagc tattgataag atggttgaga cattacctga gagccaaaaa actttttatg
6660
aatatgaatt aaaaaaaaga accaacaaag gctgagacag actccaaacg agtctgtttt
6720
tttaaaaaaa atattaggag cattgaatat atattagaga attaagaaag acatgggaat
6780
aaaaatattt taaatccagt aaaaatatga taagattatt tcagaatatg aagaactctg
6840
tttgtttttg atgaaaaaac aaacaaaaaa aatccaccta acggaatctc aatttaacta
6900
acagcggcca aactgagaag ttaaatttga gaaggggaaa aggcggattt atacttgtat
6960
ttaactatct ccattttaac attttattaa accccataca agtgaaaatc ctcttttaca
7020
ctgttccttt aggtgatcgc ggagggacat tatgagtgaa gtaaacctaa aaggaaatac
7080
agatgaatta gtgtattatc gacagcaaac cactggaaat aaaatcgcca ggaagagaat
7140
caaaaaaggg aaagaagaag tttattatgt tgctgaaacg gaagagaaga tatggacaga
7200
agagcaaata aaaaactttt ctttagacaa atttggtacg catatacctt acatagaagg
7260
tcattataca atcttaaata attacttctt tgatttttgg ggctattttt taggtgctga
7320
aggaattgcg ctctatgctc acctaactcg ttatgcatac ggcagcaaag acttttgctt
7380
tcctagtcta caaacaatcg ctaaaaaaat ggacaagact cctgttacag ttagaggcta
7440
cttgaaactg cttgaaaggt acggttttat ttggaaggta aacgtccgta ataaaaccaa
7500
ggataacaca gaggaatccc cgatttttaa gattagacgt aaggttcctt tgctttcaga
7560
agaactttta aatggaaacc ctaatattga aattccagat gacgaggaag cacatgtaaa
7620
gaaggcttta aaaaaggaaa aagagggtct tccaaaggtt ttgaaaaaag agcacgatga
7680
atttgttaaa aaaatgatgg atgagtcaga aacaattaat attccagagg ccttacaata
7740
tgacacaatg tatgaagata tactcagtaa aggagaaatt cgaaaagaaa tcaaaaaaca
7800
aatacctaat cctacaacat cttttgagag tatatcaatg acaactgaag aggaaaaagt
7860
cgacagtact ttaaaaagcg aaatgcaaaa tcgtgtctct aagccttctt ttgatacctg
7920
gtttaaaaac actaagatca aaattgaaaa taaaaattgt ttattacttg taccgagtga
7980
atttgcattt gaatggatta agaaaagata tttagaaaca attaaaacag tccttgaaga
8040
agctggatat gttttcgaaa aaatcgaact aagaaaagtg caataaactg ctgaagtatt
8100
tcagcagttt tttttattta gaaatagtga aaaaaatata atcagggagg tatcaatatt
8160
taatgagtac tgatttaaat ttatttagac tggaattaat aattaacacg tagactaatt
8220
aaaatttaat gagggataaa gaggatacaa aaatattaat ttcaatccct attaaatttt
8280
aacaaggggg ggattaaaat ttaattagag gtttatccac aagaaaagac cctaataaaa
8340
tttttactag ggttataaca ctgattaatt tcttaatggg ggagggatta aaatttaatg
8400
acaaagaaaa caatctttta agaaaagctt ttaaaagata ataataaaaa gagctttgcg
8460
attaagcaaa actctttact ttttcattga cattatcaaa ttcatcgatt tcaaattgtt
8520
gttgtatcat aaagttaatt ctgttttgca caaccttttc aggaatataa aacacatctg
8580
aggcttgttt tataaactca gggtcgctaa agtcaatgta acgtagcata tgatatggta
8640
tagcttccac ccaagttagc ctttctgctt cttctgaatg tttttcatat acttccatgg
8700
gtatctctaa atgattttcc tcatgtagca aggtatgagc aaaaagttta tggaattgat
8760
agttcctctc tttttcttca acttttttat ctaaaacaaa cactttaaca tctgagtcaa
8820
tgtaagcata agatgttttt ccagtcataa tttcaatccc aaatctttta gacagaaatt
8880
ctggacgtaa atcttttggt gaaagaattt ttttatgtag caatatatcc gatacagcac
8940
cttctaaaag cgttggtgaa tagggcattt tacctatctc ctctcatttt gtggaataaa
9000
aatagtcata ttcgtccatc tacctatcct attatcgaac agttgaactt tttaatcaag
9060
gatcagtcct ttttttcatt attcttaaac tgtgctctta actttaacaa ctcgatttgt
9120
ttttccagat ctcgagggta actagcctcg ccgatcccgc aagaggcccg gcagtcaggt
9180
ggcacttttc ggggaaatgt gcgcggaacc cctatttgtt tatttttcta aatacattca
9240
aatatgtatc cgctcatgag acaataaccc tgataaatgc ttcaataata ttgaaaaagg
9300
aagagtatga gtattcaaca tttccgtgtc gcccttattc ccttttttgc ggcattttgc
9360
cttcctgttt ttgctcaccc agaaacgctg gtgaaagtaa aagatgctga agatcagttg
9420
ggtgcacgag tgggttacat cgaactggat ctcaacagcg gtaagatcct tgagagtttt
9480
cgccccgaag aacgttttcc aatgatgagc acttttaaag ttctgctatg tggcgcggta
9540
ttatcccgta ttgacgccgg gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat
9600
gacttggttg agtactcacc agtcacagaa aagcatctta cggatggcat gacagtaaga
9660
gaattatgca gtgctgccat aaccatgagt gataacactg cggccaactt acttctgaca
9720
acgatcggag gaccgaagga gctaaccgct tttttgcaca acatggggga tcatgtaact
9780
cgccttgatc gttgggaacc ggagctgaat gaagccatac caaacgacga gcgtgacacc
9840
acgatgcctg tagcaatggc aacaacgttg cgcaaactat taactggcga actacttact
9900
ctagcttccc ggcaacaatt aatagactgg atggaggcgg ataaagttgc aggaccactt
9960
ctgcgctcgg cccttccggc tggctggttt attgctgata aatctggagc cggtgagcgt
10020
gggtctcgcg gtatcattgc agcactgggg ccagatggta agccctcccg tatcgtagtt
10080
atctacacga cggggagtca ggcaactatg gatgaacgaa atagacagat cgctgagata
10140
ggtgcctcac tgattaagca ttggtaactg tcagaccaag tttactcata tatactttag
10200
attgatttaa aacttcattt ttaatttaaa aggatctagg tgaagatcct ttttgataat
10260
ctcatgacca aaatccctta acgtgagttt tcgttccact gagcgtcaga ccccgtagaa
10320
aagatcaaag gatcttcttg agatcctttt tttctgcgcg taatctgctg cttgcaaaca
10380
aaaaaaccac cgctaccagc ggtggtttgt ttgccggatc aagagctacc aactcttttt
10440
ccgaaggtaa ctggcttcag cagagcgcag ataccaaata ctgtccttct agtgtagccg
10500
tagttaggcc accacttcaa gaactctgta gcaccgccta catacctcgc tctgctaatc
10560
ctgttaccag tggctgctgc cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga
10620
cgatagttac cggataaggc gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc
10680
agcttggagc gaacgaccta caccgaactg agatacctac agcgtgagct atgagaaagc
10740
gccacgcttc ccgaagggag aaaggcggac aggtatccgg taagcggcag ggtcggaaca
10800
ggagagcgca cgagggagct tccaggggga aacgcctggt atctttatag tcctgtcggg
10860
tttcgccacc tctgacttga gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta
10920
tggaaaaacg ccagcaacgc ggccttttta cggttcctgg ccttttgctg gccttttgct
10980
cacatgttct ttcctgcgtt atcccctgat tctgtggata accgtattac cgcctttgag
11040
tgagctgata ccgctcgccg cagccgaacg accgagcgca gcgagtcagt gagcgaggaa
11100
gcggaagagc gcccaatacg catgc
11125
<210> 3
<211> 13805
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Экспрессионная плазмида
<400> 3
ttaagttatt ggtatgactg gttttaagcg caaaaaaagt tgctttttcg tacctattaa
60
tgtatcgttt tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa
120
gccagtcatt aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat
180
aaccatcaca aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt
240
tattaatgaa ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat
300
ttaagttaaa cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag
360
gtataggtgt tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt
420
ataaatcata aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt
480
tagatacacc atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc
540
cgtcgctatt gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga
600
aaataaatgc agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa
660
tatcaatttc tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct
720
cttttctctt ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa
780
tttttatcta aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc
840
ttttttaaaa gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat
900
ccaattttcg tttgttgaac taatgggtgc tttagttgaa gaataaagac cacattaaaa
960
aatgtggtct tttgtgtttt tttaaaggat ttgagcgtag cgaaaaatcc ttttctttct
1020
tatcttgata ataagggtaa ctattgccga tcgtccattc cgacagcatc gccagtcact
1080
atggcgtgct gctagcgcca ttcgccattc aggctgcgca actgttggga agggcgatcg
1140
gtgcgggcct cttcgctatt acgccagctg gcgaaagggg gatgtgctgc aaggcgatta
1200
agttgggtaa cgccagggtt ttcccagtca cgacgttgta aaacgacggc cagtgaattc
1260
gagctcaggc cttaactcac attaattgcg ttgcgctcac tgcccgcttt ccagtcggga
1320
aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg cggggagagg cggtttgcgt
1380
attgggcgcc agggtggttt ttcttttcac cagtgagacg ggcaacagct gattgccctt
1440
caccgcctgg ccctgagaga gttgcagcaa gcggtccacg ctggtttgcc ccagcaggcg
1500
aaaatcctgt ttgatggtgg ttgacggcgg gatataacat gagctgtctt cggtatcgtc
1560
gtatcccact accgagatat ccgcaccaac gcgcagcccg gactcggtaa tggcgcgcat
1620
tgcgcccagc gccatctgat cgttggcaac cagcatcgca gtgggaacga tgccctcatt
1680
cagcatttgc atggtttgtt gaaaaccgga catggcactc cagtcgcctt cccgttccgc
1740
tatcggctga atttgattgc gagtgagata tttatgccag ccagccagac gcagacgcgc
1800
cgagacagaa cttaatgggc ccgctaacag cgcgatttgc tggtgaccca atgcgaccag
1860
atgctccacg cccagtcgcg taccgtcttc atgggagaaa ataatactgt tgatgggtgt
1920
ctggtcagag acatcaagaa ataacgccgg aacattagtg caggcagctt ccacagcaat
1980
ggcatcctgg tcatccagcg gatagttaat gatcagccca ctgacgcgtt gcgcgagaag
2040
attgtgcacc gccgctttac aggcttcgac gccgcttcgt tctaccatcg acaccaccac
2100
gctggcaccc agttgatcgg cgcgagattt aatcgccgcg acaatttgcg acggcgcgtg
2160
cagggccaga ctggaggtgg caacgccaat cagcaacgac tgtttgcccg ccagttgttg
2220
tgccacgcgg ttgggaatgt aattcagctc cgccatcgcc gcttccactt tttcccgcgt
2280
tttcgcagaa acgtggctgg cctggttcac cacgcgggaa acggtctgat aagagacacc
2340
ggcatactct gcgacatcgt ataacgttac tggtttcatc aaaatcgtct ccctccgttt
2400
gaatatttga ttgatcgtaa ccagatgaag cactctttcc actatcccta cagtgttatg
2460
gcttgaacaa tcacgaaaca ataattggta cgtacgatct ttcagccgac tcaaacatca
2520
aatcttacaa atgtagtctt tgaaagtatt acatatgtaa gatttaaatg caaccgtttt
2580
ttcggaagga aatgatgacc tcgtttccac cggaattagc ttggtaccaa aggaggtaag
2640
gatcactaga aaatttttta aaaaatctct tgacattgga agggagatat gttattataa
2700
gaattgcgga attgtgagcg gataacaatt cccatataga ttaactaata aggaggacaa
2760
acatgaaaga aatcaaaatc caaaacatca tcatcagcga agaaaaagcg ccgctggttg
2820
tgccggaaat cggcattaat cataacggat ctttagaact ggctaaaatc atggttgatg
2880
cagcgttttc agctggagcc aaaatcatca aacatcaaac acatatcgtc gaagatgaaa
2940
tgagcaaagc tgcaaagaaa gttatcccgg gcaacgctaa aatctctatc tacgaaatca
3000
tgcagaaatg cgctttagat tacaaagatg aacttgccct gaaagaatac acagaaaaac
3060
tgggacttgt gtatcttagc acaccgtttt caagagcagg cgcgaatcgc ttagaagata
3120
tgggagtctc tgcatttaaa atcggctcag gagaatgtaa taactatccg ctgatcaaac
3180
atattgcagc gtttaaaaaa ccgatgattg tgtctacagg catgaactca atcgaaagca
3240
ttaaaccgac agtgaaaatc ctgcttgata acgaaatccc gtttgtcctg atgcatacaa
3300
caaacctgta tccgacaccg cataatcttg ttagattaaa cgccatgctg gaactgaaga
3360
aagaatttag ctgcatggtg ggactttctg atcatacaac agataatctg gcatgccttg
3420
gcgcggtcgt tcttggagcg tgtgtcttag aaagacattt tacagattca atgcatcgca
3480
gcggaccgga tattgtttgt tctatggata caaaagcctt aaaagaactg atcattcaat
3540
cagaacagat ggcaatcatt cgcggcaata acgaatcaaa gaaagcagcc aaacaagaac
3600
aggttacaat cgattttgct tttgcctctg tggtctcaat caaagatatt aagaaaggcg
3660
aagttctgtc aatggataat atttgggtga aaagaccggg acttggcgga atcagcgcag
3720
cggaatttga aaatattctg ggcaagaaag cactgcgcga tattgaaaac gatgcgcagt
3780
taagctatga agattttgct taagctctta aggaggattt tagaatgaag aaaattctgt
3840
ttatcacagg ctcaagagcg gattactcta aaatcaaatc acttatgtac cgcgtccaaa
3900
attcaagcga atttgaactt tacatctttg ctacaggcat gcatctgagc aaaaactttg
3960
gatacacagt taaagaatta tataaaaatg gctttaaaaa catctacgaa tttatcaact
4020
acgataaata ttatcagaca gataaagccc tggcaacaac aattgatgga ttttcaagat
4080
atgcgaacga attaaaaccg gatctgattg ttgtgcatgg cgatcgcatc gaaccgcttg
4140
cagcggctat tgtcggagcc cttaacaaca tcctggttgc acatatcgaa ggcggagaaa
4200
ttagcggaac aatcgatgat tctttaagac atgcgatttc aaaacttgct catatccatc
4260
tggtgaacga tgaatttgca aaaagacgcc ttatgcaatt aggcgaagat gaaaaatcaa
4320
tctttatcat cggatctccg gatctggaac tgcttaacga taacaaaatc tcacttagcg
4380
aagccaaaaa atactacgat attaactacg aaaactatgc attactgatg tttcatccgg
4440
tcacaacaga aatcacatct atcaaaaacc aagccgataa cctggtgaaa gcacttatcc
4500
agtcaaacaa aaactacatc gtcatctatc cgaataacga tctgggcttt gaactgatcc
4560
ttcagagcta tgaagaattt aaaaacaacc cgagatttaa actgtttccg tctctgcgct
4620
ttgaatactt tatcacactt ctgaaaaacg ccgattttat tatcggaaac tcttcatgca
4680
tcctgaaaga agcgttatac ctgaaaacag ctggcattct ggttggatca agacaaaatg
4740
gccgcttagg aaatgaaaac acactgaaag tgaatgcgaa cagcgatgaa atccttaaag
4800
ctatcaacac aatccataaa aaacaggatt tattttctgc taaactggaa attcttgata
4860
gctctaaact gtttttcgaa tatcttcaat caggcgattt ctttaaactt agcacacaga
4920
aagtttttaa agatattaaa taaaaaggag gaactactat gtcacttgca attatcccgg
4980
cgagaggcgg aagcaaaggc atcaaaaaca aaaacctggt tctgcttaac aacaaaccgc
5040
ttatctacta cacaatcaaa gcagcgctga atgctaaatc tatttcaaaa gttgtggtct
5100
caagcgatag cgatgaaatc cttaactacg ccaaatctca aaacgtggat attctgaaaa
5160
gaccgatctc tcttgcacag gatgatacaa catcagataa agtcttactg catgcgctga
5220
aattttacaa agattacgaa gatgttgtgt ttttacaacc gacatctccg ctgcgcacaa
5280
acattcatat caacgaagca tttaacctgt acaaaaattc aaacgctaat gccctgatta
5340
gcgtctctga atgcgataac aaaatcctta aagcatttgt ttgcaacgat tgtggcgatt
5400
tagccggaat ttgtaatgat gaatatccgt ttatgccgcg ccagaaactg ccgaaaacat
5460
atatgagcaa cggagcgatc tacatcctta aaatcaaaga atttctgaac aacccgtcat
5520
ttctgcaaag caaaacaaaa cattttctta tggatgaatc atcatcactg gatattgatt
5580
gcctggaaga tttaaagaaa gttgaacaaa tttggaaaaa ataaagatta actaataagg
5640
aggacaaaca tgaaaagaat cttttgcctt gtgtctgcaa tcctgctttc agcgtgtaat
5700
gataaccaga atacagtcga tgttgtggtc tcaacagtga acgataacgt catcgaaaac
5760
aacacatacc aggtcaaacc gatcgataca ccgacaacat ttgatagcta ttcttggatt
5820
caaacatgcg gcacaccgat ccttaaagat gatgaaaaat actcactgtc atttgatttt
5880
gttgctccgg aattagatca ggatgaaaaa ttttgttttg aatttacagg cgatgttgat
5940
ggaaaacgct atgtgacaca aacaaatctg acagttgtgg caccgacact tgaagtgtat
6000
gtcgatcatg cgagcctgcc gtctcttcaa cagctgatga aaatcatcca acagaaaaac
6060
gaatactctc agaacgaaag atttatctca tggggccgca tcggacttac agaagataac
6120
gctgaaaaac tgaatgccca tatttatccg ctggctggaa ataacacatc tcaagaatta
6180
gtcgatgcag ttatcgatta cgcggattca aaaaacagac tgaatctgga acttaacaca
6240
aacacagctc atagctttcc gaacttagcc ccgattctgc gcattatctc aagcaaaagc
6300
aacatcctga tctctaacat caacctttac gatgatggct cagccgaata cgtgaacctg
6360
tacaactgga aagatacaga agataaaagc gtcaaactgt ctgattcatt tttagttctg
6420
aaagattact ttaatggaat ttcttcagaa aaaccgagcg gcatctatgg aagatataac
6480
tggcatcagc tgtacaacac atcttactat tttctgagaa aagattatct gacagtcgaa
6540
ccgcaactgc atgatcttcg cgaatatctt ggcggatcat taaaacagat gagctgggat
6600
ggcttttcac aactgagcaa aggagataaa gaactgtttc tgaacattgt tggctttgat
6660
caagaaaaac tgcaacagga atatcaacag agcgaacttc cgaattttgt gtttacagga
6720
acaacaacat gggcaggcgg agaaacaaaa gaatattatg cgcaacagca agttaacgtc
6780
gttaacaacg caatcaacga aacatctccg tactacctgg gcagagaaca tgatcttttc
6840
tttaaaggac atccgcgcgg cggaattatc aatgatatta tcctgggctc atttaataac
6900
atgattgata ttccggcgaa agttagcttt gaagtgctta tgatgacagg aatgttaccg
6960
gatacagtgg gcggaattgc atcatcactg tattttagca tcccggccga aaaagtctct
7020
tttatcgttt ttacatcaag cgatacaatc acagatcgcg aagatgctct gaaatctccg
7080
cttgttcagg tgatgatgac actgggcatt gtgaaagaaa aagatgtcct gttttggtca
7140
gatttaccgg attgctcttc aggagtttgt attgcccaat attaaagtga tagcggtacc
7200
attataggta agagaggaat gtacacatgt actatttaaa aaacacaaac ttttggatgt
7260
tcggtttatt ctttttcttt tactttttta tcatgggagc ctacttcccg tttttcccga
7320
tttggctaca tgacatcaac catatcagca aaagtgatac gggtattatt tttgccgcta
7380
tttctctgtt ctcgctatta ttccaaccgc tgtttggtct gctttctgac aaactcgggc
7440
tgcgcaaata cctgctgtgg attattaccg gcatgttagt gatgtttgcg ccgttcttta
7500
tttttatctt cgggccactg ttacaataca acattttagt aggatcgatt gttggtggta
7560
tttatctagg cttttgtttt aacgccggtg cgccagcagt agaggcattt attgagaaag
7620
tcagccgtcg cagtaatttc gaatttggtc gcgcgcggat gtttggctgt gttggctggg
7680
cgctgtgtgc ctcgattgtc ggcatcatgt tcaccatcaa taatcagttt gttttctggc
7740
tgggctctgg ctgtgcactc atcctcgccg ttttactctt tttcgccaaa acggatgcgc
7800
cctcttctgc cacggttgcc aatgcggtag gtgccaacca ttcggcattt agccttaagc
7860
tggcactgga actgttcaga cagccaaaac tgtggttttt gtcactgtat gttattggcg
7920
tttcctgcac ctacgatgtt tttgaccaac agtttgctaa tttctttact tcgttctttg
7980
ctaccggtga acagggtacg cgggtatttg gctacgtaac gacaatgggc gaattactta
8040
acgcctcgat tatgttcttt gcgccactga tcattaatcg catcggtggg aaaaacgccc
8100
tgctgctggc tggcactatt atgtctgtac gtattattgg ctcatcgttc gccacctcag
8160
cgctggaagt ggttattctg aaaacgctgc atatgtttga agtaccgttc ctgctggtgg
8220
gctgctttaa atatattacc agccagtttg aagtgcgttt ttcagcgacg atttatctgg
8280
tctgtttctg cttctttaag caactggcga tgatttttat gtctgtactg gcgggcaata
8340
tgtatgaaag catcggtttc cagggcgctt atctggtgct gggtctggtg gcgctgggct
8400
tcaccttaat ttccgtgttc acgcttagcg gccccggccc gctttccctg ctgcgtcgtc
8460
aggtgaatga agtcgcttaa ggatccatgt ctagagtcga cgtccccggg gcagcccgcc
8520
taatgagcgg gcttttttca cgtcccaggc atcaaataaa acgaaaggct cagtcgaaag
8580
actgggcctt tcgttttatc tgttgtttgt cggtgaacgc tctctactag agtcacactg
8640
gctcaccttc gggtgggcct ttctgcgttt atacccgggg cagcccgcct aatgagcggg
8700
cttttttcac gtcacgcgtc catggagatc tttgtctgca actgaaaagt ttatacctta
8760
cctggaacaa atggttgaaa catacgaggc taatatcggc ttattaggaa tagtccctgt
8820
actaataaaa tcaggtggat cagttgatca gtatattttg gacgaagctc ggaaagaatt
8880
tggagatgac ttgcttaatt ccacaattaa attaagggaa agaataaagc gatttgatgt
8940
tcaaggaatc acggaagaag atactcatga taaagaagct ctaaaactat tcaataacct
9000
tacaatggaa ttgatcgaaa gggtggaagg ttaatggtac gaaaattagg ggatctacct
9060
agaaagccac aaggcgatag gtcaagctta aagaaccctt acatggatct tacagattct
9120
gaaagtaaag aaacaacaga ggttaaacaa acagaaccaa aaagaaaaaa agcattgttg
9180
aaaacaatga aagttgatgt ttcaatccat aataagatta aatcgctgca cgaaattctg
9240
gcagcatccg aagggaattc atattactta gaggatacta ttgagagagc tattgataag
9300
atggttgaga cattacctga gagccaaaaa actttttatg aatatgaatt aaaaaaaaga
9360
accaacaaag gctgagacag actccaaacg agtctgtttt tttaaaaaaa atattaggag
9420
cattgaatat atattagaga attaagaaag acatgggaat aaaaatattt taaatccagt
9480
aaaaatatga taagattatt tcagaatatg aagaactctg tttgtttttg atgaaaaaac
9540
aaacaaaaaa aatccaccta acggaatctc aatttaacta acagcggcca aactgagaag
9600
ttaaatttga gaaggggaaa aggcggattt atacttgtat ttaactatct ccattttaac
9660
attttattaa accccataca agtgaaaatc ctcttttaca ctgttccttt aggtgatcgc
9720
ggagggacat tatgagtgaa gtaaacctaa aaggaaatac agatgaatta gtgtattatc
9780
gacagcaaac cactggaaat aaaatcgcca ggaagagaat caaaaaaggg aaagaagaag
9840
tttattatgt tgctgaaacg gaagagaaga tatggacaga agagcaaata aaaaactttt
9900
ctttagacaa atttggtacg catatacctt acatagaagg tcattataca atcttaaata
9960
attacttctt tgatttttgg ggctattttt taggtgctga aggaattgcg ctctatgctc
10020
acctaactcg ttatgcatac ggcagcaaag acttttgctt tcctagtcta caaacaatcg
10080
ctaaaaaaat ggacaagact cctgttacag ttagaggcta cttgaaactg cttgaaaggt
10140
acggttttat ttggaaggta aacgtccgta ataaaaccaa ggataacaca gaggaatccc
10200
cgatttttaa gattagacgt aaggttcctt tgctttcaga agaactttta aatggaaacc
10260
ctaatattga aattccagat gacgaggaag cacatgtaaa gaaggcttta aaaaaggaaa
10320
aagagggtct tccaaaggtt ttgaaaaaag agcacgatga atttgttaaa aaaatgatgg
10380
atgagtcaga aacaattaat attccagagg ccttacaata tgacacaatg tatgaagata
10440
tactcagtaa aggagaaatt cgaaaagaaa tcaaaaaaca aatacctaat cctacaacat
10500
cttttgagag tatatcaatg acaactgaag aggaaaaagt cgacagtact ttaaaaagcg
10560
aaatgcaaaa tcgtgtctct aagccttctt ttgatacctg gtttaaaaac actaagatca
10620
aaattgaaaa taaaaattgt ttattacttg taccgagtga atttgcattt gaatggatta
10680
agaaaagata tttagaaaca attaaaacag tccttgaaga agctggatat gttttcgaaa
10740
aaatcgaact aagaaaagtg caataaactg ctgaagtatt tcagcagttt tttttattta
10800
gaaatagtga aaaaaatata atcagggagg tatcaatatt taatgagtac tgatttaaat
10860
ttatttagac tggaattaat aattaacacg tagactaatt aaaatttaat gagggataaa
10920
gaggatacaa aaatattaat ttcaatccct attaaatttt aacaaggggg ggattaaaat
10980
ttaattagag gtttatccac aagaaaagac cctaataaaa tttttactag ggttataaca
11040
ctgattaatt tcttaatggg ggagggatta aaatttaatg acaaagaaaa caatctttta
11100
agaaaagctt ttaaaagata ataataaaaa gagctttgcg attaagcaaa actctttact
11160
ttttcattga cattatcaaa ttcatcgatt tcaaattgtt gttgtatcat aaagttaatt
11220
ctgttttgca caaccttttc aggaatataa aacacatctg aggcttgttt tataaactca
11280
gggtcgctaa agtcaatgta acgtagcata tgatatggta tagcttccac ccaagttagc
11340
ctttctgctt cttctgaatg tttttcatat acttccatgg gtatctctaa atgattttcc
11400
tcatgtagca aggtatgagc aaaaagttta tggaattgat agttcctctc tttttcttca
11460
acttttttat ctaaaacaaa cactttaaca tctgagtcaa tgtaagcata agatgttttt
11520
ccagtcataa tttcaatccc aaatctttta gacagaaatt ctggacgtaa atcttttggt
11580
gaaagaattt ttttatgtag caatatatcc gatacagcac cttctaaaag cgttggtgaa
11640
tagggcattt tacctatctc ctctcatttt gtggaataaa aatagtcata ttcgtccatc
11700
tacctatcct attatcgaac agttgaactt tttaatcaag gatcagtcct ttttttcatt
11760
attcttaaac tgtgctctta actttaacaa ctcgatttgt ttttccagat ctcgagggta
11820
actagcctcg ccgatcccgc aagaggcccg gcagtcaggt ggcacttttc ggggaaatgt
11880
gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc cgctcatgag
11940
acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga gtattcaaca
12000
tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt ttgctcaccc
12060
agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag tgggttacat
12120
cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag aacgttttcc
12180
aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgta ttgacgccgg
12240
gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg agtactcacc
12300
agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca gtgctgccat
12360
aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag gaccgaagga
12420
gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc gttgggaacc
12480
ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg tagcaatggc
12540
aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc ggcaacaatt
12600
aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg cccttccggc
12660
tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg gtatcattgc
12720
agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga cggggagtca
12780
ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac tgattaagca
12840
ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa aacttcattt
12900
ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca aaatccctta
12960
acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag gatcttcttg
13020
agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac cgctaccagc
13080
ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa ctggcttcag
13140
cagagcgcag ataccaaata ctgtccttct agtgtagccg tagttaggcc accacttcaa
13200
gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag tggctgctgc
13260
cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc
13320
gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta
13380
caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag
13440
aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct
13500
tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga
13560
gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc
13620
ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt
13680
atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg
13740
cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcccaatacg
13800
catgc
13805
<210> 4
<211> 10838
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Суицидная плазмида
<400> 4
ttctcatgtt tgacagctta tcatcgataa gctttaatgc ggtagtttat cacagttaaa
60
ttgctaacgc agtcaggcac cgtgtatgaa atctaacaat gcgctcatcg tcatcctcgg
120
caccgtcacc ctggatgctg taggcatagg cttggttatg ccggtactgc cgggcctctt
180
gcgggatatc gtccattccg acagcatcgc cagtcactat ggcgtgctgc tagcgctata
240
tgcgttgatg caatttctat gcgcacccgt tctcggagca ctgtccgacc gctttggccg
300
ccgcccagtc ctgctcgctt cgctacttgg agccactatc gactacgcga tcatggcgac
360
cacacccgtc ctgtggatcc tctacgccgg acgcatcgtg gccggcatca ccggcgccac
420
aggtgcggtt gctggcgcct atatcgccga catcaccgat ggggaagatc gggctcgcca
480
cttcgggctc atgagcgctt gtttcggcgt gggtatggtg gcaggccccg tggccggggg
540
actgttgggc gccatctcct tgcatgcacc attccttgcg gcggcggtgc tcaacggcct
600
caacctacta ctgggctgct tcctaatgca ggagtcgcat aagggagagc gtcgaccgat
660
gcccttgaga gccttcaacc cagtcagctc cttccggtgg gcgcggggca tgactatcgt
720
cgccgcactt atgactgtct tctttatcat gcaactcgta ggacaggtgc cggcagcgct
780
ctgggtcatt ttcggcgagg accgctttcg ctggagcgcg acgatgatcg gcctgtcgct
840
tgcggtattc ggaatcttgc acgccctcgc tcaagccttc gtcactggtc ccgccaccaa
900
acgtttcggc gagaagcagg ccattatcgc cggcatggcg gccgacgcgc tgggctacgt
960
cttgctggcg ttcgcgacgc gaggctggat ggccttcccc attatgattc ttctcgcttc
1020
cggcggcatc gggatgcccg cgttgcaggc catgctgtcc aggcaggtag atgacgacca
1080
tcagggacag cttcaaggat cgctcgcggc tcttaccagc ctaacttcga tcactggacc
1140
gctgatcgtc acggcgattt atgccgcctc ggcgagcaca tggaacgggt tggcatggat
1200
tgtaggcgcc gccctatacc ttgtctgcct ccccgcgttg cgtcgcggtg catggagccg
1260
ggccacctcg acctgaatgg aagccggcgg cacctcgcta acggattcac cactccaaga
1320
attggagcca atcaattctt gcggagaact gtgaatgcgc aaaccaaccc ttggcagaac
1380
atatccatcg cgtccgccat ctccagcagc cgcacgcggc gcatctcggg cagcgttggg
1440
tcctggccac gggtgcgcat gatcgtgctc ctgtcgttga ggacccggct aggctggcgg
1500
ggttgcctta ctggttagca gaatgaatca ccgatacgcg agcgaacgtg aagcgactgc
1560
tgctgcaaaa cgtctgcgac ctgagcaaca acatgaatgg tcttcggttt ccgtgtttcg
1620
taaagtctgg aaacgcggaa gtcagcgccc tgcaccatta tgttccggat ctgcatcgca
1680
ggatgctgct ggctaccctg tggaacacct acatctgtat taacgaagcg ctggcattga
1740
ccctgagtga tttttctctg gtcccgccgc atccataccg ccagttgttt accctcacaa
1800
cgttccagta accgggcatg ttcatcatca gtaacccgta tcgtgagcat cctctctcgt
1860
ttcatcggta tcattacccc catgaacaga aatccccctt acacggaggc atcagtgacc
1920
aaacaggaaa aaaccgccct taacatggcc cgctttatca gaagccagac attaacgctt
1980
ctggagaaac tcaacgagct ggacgcggat gaacaggcag acatctgtga atcgcttcac
2040
gaccacgctg atgagcttta ccgcagctgc ctcgcgcgtt tcggtgatga cggtgaaaac
2100
ctctgacaca tgcagctccc ggagacggtc acagcttgtc tgtaagcgga tgccgggagc
2160
agacaagccc gtcagggcgc gtcagcgggt gttggcgggt gtcggggcgc agccatgacc
2220
cagtcacgta gcgatagcgg agtgtatact ggcttaacta tgcggcatca gagcagattg
2280
tactgagagt gcaccagcgg gcaaggaaag ccttcaatat gtgcagtggt atgtcaactc
2340
tatgaagatc agcctgttta caatggcagg gtctttgctc tgtgtgacgt ttacggccta
2400
tgcgttttcg cgctttcggt ttaaagggag gaaatacgct ttaacgctct ttttattgct
2460
gcagatgatt cctcagtttt cagctttaat tgccttgttt gtgctggcgc aaatcttggg
2520
aatgatcaat agccactggc tgctaatctt gctttatatc ggcggcctga tcccgatgaa
2580
tacgtatttg atgaaagggt acatggattc cattccgatg gatttagacg aaagcgccaa
2640
gattgacgga gccagcagca ccagaatctt cttccagatc attctgccat tatcaaaacc
2700
gatggcggca gtcgtggcca tgaacggctt taccggtccg ctcggagatt ttgtgctgtc
2760
ctcaaccata ttgagaacgc ctgaatcata tacattgccc gtcggtctat tcaatttagt
2820
gaatgatgtc atgggggcca gctatacgac atttgcggcc ggagccctgc ttatcagcat
2880
accggttgcc gtcatcttta ttatgctgca aaagaatttt gtgtccggat taaccgcagg
2940
cggaacgaag ggctaagaga acaaggagga gaatgtgatg tcaaagcttg aaaaaacgca
3000
cgtaacaaaa gcaaaattta tgctccatgg gggagactac aaccccgatc agtggctgga
3060
tcggcccgat attttagctg acgatatcaa actgatgaag ctttctcata cgaatacgtt
3120
ttctgtcggc aattttacat ttttagaaat gggcgtgaaa aaaagcgcgc gattatgtaa
3180
aatataaaga ttaactaata aggaggacaa acatgacaga acagtacatc aaaaacgttg
3240
aagtgtatct tgattatgca acaatcccga cactgaacta cttttaccat tttacagaaa
3300
acaaagatga tattgcgaca attagactgt ttggccttgg acgctttaac atctctaaat
3360
caatcatcga atcatatccg gaaggcatta tcagatattg cccgattatc tttgaagatc
3420
agacagcttt tcaacagctg tttatcacac tgcttacaga agattctttt tgtcaatacc
3480
gctttaactt tcatattaac ctgtttcatt catggaaaat gcttatcccg ctgctgcata
3540
ttatctggca atttaaacat aaagtcctgg atattaaact taacttttat gatgatggct
3600
ctgaaggact ggttacactg tcaaaaatcg aacaaaacta ttcaagcgaa attcttcaga
3660
aaatcatcga tattgatagc caatcttttt acgctgataa acttagcttt ttagatgaag
3720
atattgccag atatttatgg aatagcctgt ttgaatcaca ttactatctt ttaaacgatt
3780
ttctgcttaa aaacgaaaaa ctgagcttac tgaaaaactc tatcaaatac tgccatatca
3840
tggatcttga acgctattta caatttacac aggaagaaaa agatttcttt aacgaacttc
3900
tgggcattaa catccagagc cttgaagata aaatcaaaat ctttcaacaa aagaaaacat
3960
ttatttttac aggaacaaca atcttttctc tgccgaaaga agaagaagaa acactttaca
4020
gactgcatct gaacgctatc cttaactaca tccatccgaa cggcaaatac tttatcggcg
4080
atggatttac actggtgatc aaaggacatc cgcatcaaaa agaaatgaat agcagactgg
4140
aaaaatcatt tgaaaaagcc gtcatgctgc cggataacat cccgtttgaa attctttacc
4200
tgatcggctg caaaccggat aaaattggcg gatttgtttc aacaagctac ttttcatgtg
4260
ataagaaaaa tattgcggat ctgctgttta tcagcgcgag acaggaagaa gtgcgcaaaa
4320
acgattatct ttttaacatc caataccagc tgagagatat gatgatcaaa acaggattta
4380
tccaagaaga aaaaacacat ttttacagcg atattccgat ctttatttct taaaaaggag
4440
gaactactat gtcacttgca attatcccgg cgagaggcgg aagcaaaggc atcaaaaaca
4500
aaaacctggt tctgcttaac aacaaaccgc ttatctacta cacaatcaaa gcagcgctga
4560
atgctaaatc tatttcaaaa gttgtggtct caagcgatag cgatgaaatc cttaactacg
4620
ccaaatctca aaacgtggat attctgaaaa gaccgatctc tcttgcacag gatgatacaa
4680
catcagataa agtcttactg catgcgctga aattttacaa agattacgaa gatgttgtgt
4740
ttttacaacc gacatctccg ctgcgcacaa acattcatat caacgaagca tttaacctgt
4800
acaaaaattc aaacgctaat gccctgatta gcgtctctga atgcgataac aaaatcctta
4860
aagcatttgt ttgcaacgat tgtggcgatt tagccggaat ttgtaatgat gaatatccgt
4920
ttatgccgcg ccagaaactg ccgaaaacat atatgagcaa cggagcgatc tacatcctta
4980
aaatcaaaga atttctgaac aacccgtcat ttctgcaaag caaaacaaaa cattttctta
5040
tggatgaatc atcatcactg gatattgatt gcctggaaga tttaaagaaa gttgaacaaa
5100
tttggaaaaa ataagctctt aaggaggatt ttagaatgag cacaacaaca caaaatatcc
5160
cgtggtatcg ccatcttaac agagcccagt ggcgcgcatt ttctgcagcg tggttaggct
5220
atctgcttga tggatttgat tttgttctga ttgcactggt tcttacagaa gtgcaaggcg
5280
aatttggact tacaacagtg caggctgcct ctttaatttc agcagcgttt atcagcagat
5340
ggtttggcgg attaatgctg ggcgcaatgg gagatcgcta tggaagacgc ctggcgatgg
5400
tcacatctat tgttctgttt tcagcgggca cattagcttg cggctttgcc ccgggatata
5460
ttacaatgtt tatcgcgaga cttgtgattg gcatgggaat ggcaggcgaa tatggatcaa
5520
gcgcgacgta tgttatcgaa tcttggccga aacatctgcg caataaagca tcaggatttc
5580
ttattagcgg cttttctgtg ggagcggttg tggctgccca agtctattct cttgtcgttc
5640
cggtttgggg atggagagca ctgtttttca ttggcatcct tccgattatc tttgctcttt
5700
ggttacgcaa aaatatcccg gaagccgaag attggaaaga aaaacatgcc ggaaaagcac
5760
ctgtgagaac aatggtcgat attctgtata gaggcgaaca tcgcattgct aacatcgtta
5820
tgacattagc agcggctaca gctctgtggt tttgctttgc cggaaattta caaaacgccg
5880
caatcgttgc tgtgctgggc ttactgtgtg cggctatttt tatcagcttt atggttcagt
5940
ctgccggaaa acgctggccg acaggcgtga tgttaatggt ggtcgttctg tttgcttttc
6000
tttattcatg gccgattcaa gcccttttac cgacatacct gaaaacagat ttagcttaca
6060
atccgcatac agtggccaac gtcctgtttt tctcaggctt tggagccgca gttggctgct
6120
gtgtgggcgg atttcttggc gattggttag gaacaagaaa agcgtatgtt tgttcactgc
6180
ttgcgagcca gttactgatt atcccggttt ttgcaatcgg cggagcgaat gtctgggttc
6240
ttggactttt actgtttttc caacagatgt taggccaagg aattgctggc atcttaccga
6300
aactgattgg cggatatttt gatacagatc agagagcggc tggccttgga tttacatata
6360
atgttggagc actgggcgga gcccttgcac cgattatcgg agcgttaatt gctcaacgcc
6420
tggatcttgg cacagcgctt gcttctttat catttagcct gacatttgtg gtcattcttt
6480
taatcggcct tgatatgccg tcaagagttc agcgctggtt aagaccggaa gcactgagaa
6540
cacatgatgc gattgatggc aaaccgtttt caggagctgt gccgtttggc agcgccaaaa
6600
acgatctggt caaaacaaaa tcataaccag gcatcaaata aaacgaaagg ctcagtcgaa
6660
agactgggcc tttcgtttta tctgttgttt gtcggtgaac gctctctact agagtcacac
6720
tggctcacct tcgggtgggc ctttctgcgt ttatatacgc gttaacccgg gcccgcggat
6780
ggatatgatc agatccttta actctggcaa ccctcaaaat tgaatgagac atgctacacc
6840
tccggataat aaatatatat aaacgtatat agatttcata aagtctaaca cactagactt
6900
atttacttcg taattaagtc gttaaaccgt gtgctctacg accaaaacta taaaaccttt
6960
aagaactttc tttttttaca agaaaaaaga aattagataa atctctcata tcttttattc
7020
aataatcgca tccgattgca gtataaattt aacgatcact catcatgttc atatttatca
7080
gagctcgtgc tataattata ctaattttat aaggaggaaa aaatatgggc atttttagta
7140
tttttgtaat cagcacagtt cattatcaac caaacaaaaa ataagtggtt ataatgaatc
7200
gttaataagc aaaattcata taaccaaatt aaagagggtt ataatgaacg agaaaaatat
7260
aaaacacagt caaaacttta ttacttcaaa acataatata gataaaataa tgacaaatat
7320
aagattaaat gaacatgata atatctttga aatcggctca ggaaaaggcc attttaccct
7380
tgaattagta aagaggtgta atttcgtaac tgccattgaa atagaccata aattatgcaa
7440
aactacagaa aataaacttg ttgatcacga taatttccaa gttttaaaca aggatatatt
7500
gcagtttaaa tttcctaaaa accaatccta taaaatatat ggtaatatac cttataacat
7560
aagtacggat ataatacgca aaattgtttt tgatagtata gctaatgaga tttatttaat
7620
cgtggaatac gggtttgcta aaagattatt aaatacaaaa cgctcattgg cattactttt
7680
aatggcagaa gttgatattt ctatattaag tatggttcca agagaatatt ttcatcctaa
7740
acctaaagtg aatagctcac ttatcagatt aagtagaaaa aaatcaagaa tatcacacaa
7800
agataaacaa aagtataatt atttcgttat gaaatgggtt aacaaagaat acaagaaaat
7860
atttacaaaa aatcaattta acaattcctt aaaacatgca ggaattgacg atttaaacaa
7920
tattagcttt gaacaattct tatctctttt caatagctat aaattattta ataagtaagc
7980
gaggcaggat caggacaatg attatatttt tgtcatgaat ttcacggaag aaaaacagct
8040
ggtcacgttt gatcagagtg tgaaggacat aatgacagga gacatattgt caggcgacct
8100
gacgatggaa aagtatgaag tgagaattgt cgtaaacaca cattaggctg atgctccgct
8160
cgatatgggc ggattctttt ttctatagaa tgaaaacgct tgctaagtct tggggggatg
8220
aaatcatgaa aagcaaagtg aaaatgttct ttgcggctgc catcgtgtgg agtgcatgta
8280
gttcaacagg atatgccgct gccattgaga aggagaagca cgtgtcagag cttcgggcag
8340
aggatctttt tgttaaaaaa gtagagggga tgaacaagga ttttatcaaa ggggcagatg
8400
tatccagcgt tattgctttg gaaaacagcg gtgtcacctt ttacaataca aacggaaaac
8460
gccaggatat ctttacaact ttaaaacagg ctggggtcaa ctatgttcgc gtccgcatct
8520
ggaatcaccc gtatgattca aatggcaacg ggtatggcgg gggaaacaat gatgttcaaa
8580
aagccatcga aatcggaaaa agagcgacag cgaacggaat gaaggtgctg gccgactttc
8640
actactctga tttctgggcc gatccagcga aacaaaaggt gcccaaagcc tgggcgaatc
8700
tcagctttga agcaaaaaaa gcaaagctct atgagtatac gaaacaaagc ctgcaaaaga
8760
tgatcaagga aggcgtgcgg tgtgaaatac cgcacagatg cgtaaggaga aaataccgca
8820
tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt cggctgcggc
8880
gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca ggggataacg
8940
caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa aaggccgcgt
9000
tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat cgacgctcaa
9060
gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc cctggaagct
9120
ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc gcctttctcc
9180
cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt tcggtgtagg
9240
tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac cgctgcgcct
9300
tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg ccactggcag
9360
cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca gagttcttga
9420
agtggtggcc taactacggc tacactagaa ggacagtatt tggtatctgc gctctgctga
9480
agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa accaccgctg
9540
gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa ggatctcaag
9600
aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac tcacgttaag
9660
ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta aattaaaaat
9720
gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt taccaatgct
9780
taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata gttgcctgac
9840
tccccgtcgt gtagataact acgatacggg agggcttacc atctggcccc agtgctgcaa
9900
tgataccgcg agacccacgc tcaccggctc cagatttatc agcaataaac cagccagccg
9960
gaagggccga gcgcagaagt ggtcctgcaa ctttatccgc ctccatccag tctattaatt
10020
gttgccggga agctagagta agtagttcgc cagttaatag tttgcgcaac gttgttgcca
10080
ttgctgcagg catcgtggtg tcacgctcgt cgtttggtat ggcttcattc agctccggtt
10140
cccaacgatc aaggcgagtt acatgatccc ccatgttgtg caaaaaagcg gttagctcct
10200
tcggtcctcc gatcgttgtc agaagtaagt tggccgcagt gttatcactc atggttatgg
10260
cagcactgca taattctctt actgtcatgc catccgtaag atgcttttct gtgactggtg
10320
agtactcaac caagtcattc tgagaatagt gtatgcggcg accgagttgc tcttgcccgg
10380
cgtcaacacg ggataatacc gcgccacata gcagaacttt aaaagtgctc atcattggaa
10440
aacgttcttc ggggcgaaaa ctctcaagga tcttaccgct gttgagatcc agttcgatgt
10500
aacccactcg tgcacccaac tgatcttcag catcttttac tttcaccagc gtttctgggt
10560
gagcaaaaac aggaaggcaa aatgccgcaa aaaagggaat aagggcgaca cggaaatgtt
10620
gaatactcat actcttcctt tttcaatatt attgaagcat ttatcagggt tattgtctca
10680
tgagcggata catatttgaa tgtatttaga aaaataaaca aataggggtt ccgcgcacat
10740
ttccccgaaa agtgccacct gacgtctaag aaaccattat tatcatgaca ttaacctata
10800
aaaataggcg tatcacgagg ccctttcgtc ttcaagaa
10838
<210> 5
<211> 4254
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Интерграционная кассета
<400> 5
gcaggctgtt attgtaacat gtaagccata agccattcgt aaaagtgcgg gaggaaggtc
60
atgaataatc tgcgtaatag actttcaggc gtgaatggga aaaataagag agtaaaagaa
120
aaagaacaaa aaatctggtc ggagattggg atgatagcgg gagcatttgc gctgcttgat
180
gtgatcatcc gcggcattat gtttgaattt ccgtttaaag aatgggctgc aagccttgtg
240
tttttgttca tcattatctt atattactgc atcagggctg cggcatccgg aatgctcatg
300
ccgagaatag acaccaaaga agaactgcaa aaacgggtga agcagcagcg aatagaatca
360
attgcggtcg cctttgcggt agtggtgctt acgatgtacg acagggggat tccccataca
420
ttcttcgctt ggctgaaaat gattcttctt tttatcgtct gcggcggcgt tctgtttctg
480
cttcggtatg tgattgtgaa gctggcttac agaagagcgg taaaagaaga aataaaaaag
540
aaatcatctt ttttgtttgg aaagcgaggg aagcgttcac agtttcgggc agcttttttt
600
ataggaacat tgatttgtat tcactctgcc aagttgtttt gatagagtga ttgtgataat
660
tttaaatgta agcgttaaca aaattctcca gtcttcacat cggtttgaaa ggaggaagcg
720
gaagaatgaa gtaagaggga tttttgactc cgaagtaagt cttcaaaaaa tcaaataagg
780
agtgtcaaga atgtttgcaa aacgattcaa aacctcttta ctgccgttat tcgctggatt
840
tttattgctg tttcatttgg ttctggcagg accggcggct gcgagtgctg aaacggcgaa
900
caaatcgaat gagcttacag caccgtcgat caaaagcgga accattcttc atgcatggcc
960
agtgaattcg agctcggtac ctaccgttcg tataatgtat gctatacgaa gttatgataa
1020
aaaatttaga agccaatgaa atctataaat aaactaaatt aagtttattt aattaacaac
1080
tatggatata aaataggtac taatcaaaat agtgaggagg atatatttga atacatacga
1140
acaaattaat aaagtgaaaa aaatacttcg gaaacattta aaaaataacc ttattggtac
1200
ttacatgttt ggatcaggag ttgagagtgg actaaaacca aatagtgatc ttgacttttt
1260
agtcgtcgta tctgaaccat tgacagatca aagtaaagaa atacttatac aaaaaattag
1320
acctatttca aaaaaaatag gagataaaag caacttacga tatattgaat taacaattat
1380
tattcagcaa gaaatggtac cgtggaatca tcctcccaaa caagaattta tttatggaga
1440
atggttacaa gagctttatg aacaaggata cattcctcag aaggaattaa attcagattt
1500
aaccataatg ctttaccaag caaaacgaaa aaataaaaga atatacggaa attatgactt
1560
agaggaatta ctacctgata ttccattttc tgatgtgaga agagccatta tggattcgtc
1620
agaggaatta atagataatt atcaggatga tgaaaccaac tctatattaa ctttatgccg
1680
tatgatttta actatggaca cgggtaaaat cataccaaaa gatattgcgg gaaatgcagt
1740
ggctgaatct tctccattag aacataggga gagaattttg ttagcagttc gtagttatct
1800
tggagagaat attgaatgga ctaatgaaaa tgtaaattta actataaact atttaaataa
1860
cagattaaaa aaattataaa aaaattgaaa aaatggtgga aacacttttt tcaatttttt
1920
tgttttatta tttaatattt gggaaatatt cattctaata taacttcgta taatgtatgc
1980
tatacgaacg gtaggatcct ctagagtcga cctgcaggca ttttacattt ttagaaatgg
2040
gcgtgaaaaa aagcgcgcga ttatgtaaaa tataaagtga tagcggtacc attataggta
2100
agagaggaat gtacacatgt actatttaaa aaacacaaac ttttggatgt tcggtttatt
2160
ctttttcttt tactttttta tcatgggagc ctacttcccg tttttcccga tttggctaca
2220
tgacatcaac catatcagca aaagtgatac gggtattatt tttgccgcta tttctctgtt
2280
ctcgctatta ttccaaccgc tgtttggtct gctttctgac aaactcgggc tgcgcaaata
2340
cctgctgtgg attattaccg gcatgttagt gatgtttgcg ccgttcttta tttttatctt
2400
cgggccactg ttacaataca acattttagt aggatcgatt gttggtggta tttatctagg
2460
cttttgtttt aacgccggtg cgccagcagt agaggcattt attgagaaag tcagccgtcg
2520
cagtaatttc gaatttggtc gcgcgcggat gtttggctgt gttggctggg cgctgtgtgc
2580
ctcgattgtc ggcatcatgt tcaccatcaa taatcagttt gttttctggc tgggctctgg
2640
ctgtgcactc atcctcgccg ttttactctt tttcgccaaa acggatgcgc cctcttctgc
2700
cacggttgcc aatgcggtag gtgccaacca ttcggcattt agccttaagc tggcactgga
2760
actgttcaga cagccaaaac tgtggttttt gtcactgtat gttattggcg tttcctgcac
2820
ctacgatgtt tttgaccaac agtttgctaa tttctttact tcgttctttg ctaccggtga
2880
acagggtacg cgggtatttg gctacgtaac gacaatgggc gaattactta acgcctcgat
2940
tatgttcttt gcgccactga tcattaatcg catcggtggg aaaaacgccc tgctgctggc
3000
tggcactatt atgtctgtac gtattattgg ctcatcgttc gccacctcag cgctggaagt
3060
ggttattctg aaaacgctgc atatgtttga agtaccgttc ctgctggtgg gctgctttaa
3120
atatattacc agccagtttg aagtgcgttt ttcagcgacg atttatctgg tctgtttctg
3180
cttctttaag caactggcga tgatttttat gtctgtactg gcgggcaata tgtatgaaag
3240
catcggtttc cagggcgctt atctggtgct gggtctggtg gcgctgggct tcaccttaat
3300
ttccgtgttc acgcttagcg gccccggccc gctttccctg ctgcgtcgtc aggtgaatga
3360
agtcgcttaa gcaatcaatg tcggatgcca gcctggcttt gattacgtgc taaatggttt
3420
atataatgac tcgggcttaa gcggttctct tccccattga gggcaaggct agacgggact
3480
taccgaaaga aaccatcaat gatggtttct tttttgttca taaatcagac aaaacttttc
3540
tcttgcaaaa gtttgtgaag tgttgcacaa tataaatgtg aaatacttca caaacaaaaa
3600
gacatcaaag agaaacatac cctggaagga tgattaatga tgaacaaaca tgtaaataaa
3660
gtagctttaa tcggagcggg ttttgttgga agcagttatg catttgcgtt aattaaccaa
3720
ggaatcacag atgagcttgt ggtcattgat gtaaataaag aaaaagcaat gggcgatgtg
3780
atggatttaa accacggaaa ggcgtttgcg ccacaaccgg tcaaaacatc ttacggaaca
3840
tatgaagact gcaaggatgc tgatattgtc tgcatttgcg ccggagcaaa ccaaaaacct
3900
ggtgagacac gccttgaatt agtagaaaag aacttgaaga ttttcaaagg catcgttagt
3960
gaagtcatgg cgagcggatt tgacggcatt ttcttagtcg cgacaaatcc ggttgatatc
4020
ctgacttacg caacatggaa attcagcggc ctgccaaaag agcgggtgat tggaagcggc
4080
acaacacttg attctgcgag attccgtttc atgctgagcg aatactttgg cgcagcgcct
4140
caaaacgtac acgcgcatat tatcggagag cacggcgaca cagagcttcc tgtttggagc
4200
cacgcgaatg tcggcggtgt gccggtcagt gaactcgttg agaaaaacga tgcg
4254
<---
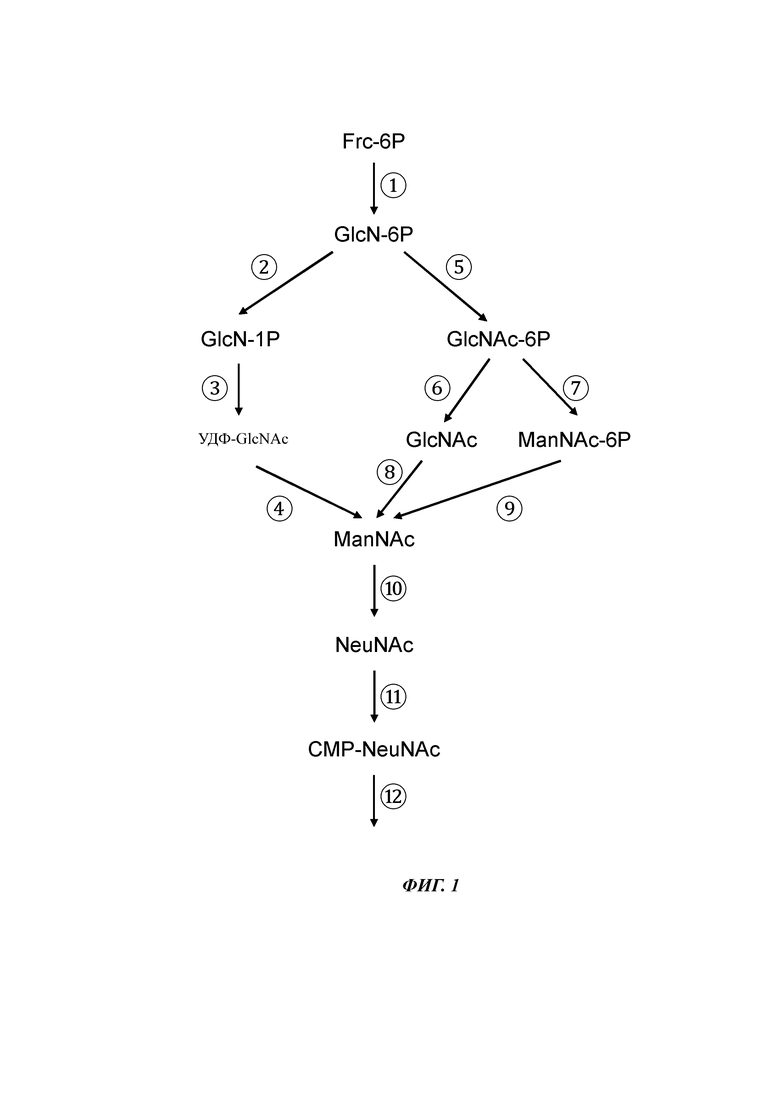
Изобретение относится к биотехнологии и представляет собой неспорообразующую клетку Bacillus для получения сиалированного олигосахарида, где указанная клетка Bacillus генетически сконструирована так, чтобы содержать лактозопермеазу, путь биосинтеза CMP-NeuNAc и сиалилтрансферазу, причем способность к споруляции клетки Bacillus нарушена в результате делеции или функциональной инактивации одного или более генов, кодирующих Spo0A, сигма E и сигма F. Изобретение относится также к способу получения сиалированного олигосахарида с использованием указанной клетки Bacillus. 3 н. и 10 з.п. ф-лы, 1 ил., 3 табл., 6 пр.
1. Неспорообразующая клетка Bacillus для получения сиалированного олигосахарида, где указанная клетка Bacillus генетически сконструирована так, чтобы содержать лактозопермеазу, путь биосинтеза CMP-NeuNAc и сиалилтрансферазу, причем способность к споруляции клетки Bacillus нарушена в результате делеции или функциональной инактивации одного или более генов, кодирующих Spo0A, сигма E и сигма F.
2. Клетка Bacillus по п. 1, в которой лактозопермеаза представляет собой LacY E. coli или ее функциональный вариант.
3. Клетка Bacillus по любому из пп. 1, 2, где в пути биосинтеза CMP-NeuNAc используется GlcN-1P или GlcNAc-6P в качестве промежуточного соединения.
4. Клетка Bacillus по любому из пп. 1-3, где в пути биосинтеза CMP-NeuNAc используется путь утилизации сиаловой кислоты.
5. Клетка Bacillus по любому из пп. 1-4, в которой сиалилтрансфераза представляет собой сиалилтрансферазу, акцептирующую лактозу, предпочтительно сиалилтрансферазу, выбранную из группы, состоящей из α-2,3-сиалилтрансфераз, α-2,6-сиалилтрансфераз и α-2,8-сиалилтрансфераз.
6. Клетка Bacillus по любому из пп. 1-5, где указанная клетка Bacillus не обладает какой-либо β-галактозидазной активностью или обладает пониженной β-галактозидазной активностью по сравнению с клеткой-предшественником Bacillus дикого типа того же вида.
7. Клетка Bacillus по п. 6, где указанная клетка Bacillus генетически сконструирована посредством делеции или функциональной инактивации по меньшей мере одного из генов, выбранных из группы, состоящей из yesZ и ganA.
8. Клетка Bacillus по любому из пп. 1-7, где указанная клетка Bacillus представляет собой клетку Bacillus subtilis.
9. Клетка Bacillus по любому из пп. 1-8, для применения в получении 3’-сиалиллактозы, где в пути биосинтеза CMP-NeuNAc используется GlcN-1P в качестве промежуточного соединения и где сиалилтрансфераза представляет собой α-2,3-сиалилтрансферазу.
10. Клетка Bacillus по любому из пп. 1-8, для применения в получении 6’-сиалиллактозы, где в пути биосинтеза CMP-NeuNAc используется GlcN-1P в качестве промежуточного соединения и где сиалилтрансфераза представляет собой α-2,6-сиалилтрансферазу.
11. Применение клетки Bacillus по любому из пп. 1-10 для получения сиалированного олигосахарида.
12. Способ получения сиалированного олигосахарида, включающий:
- предоставление неспорообразующей клетки Bacillus, как определено в любом из пп. 1-10;
- культивирование указанной клетки Bacillus в ферментационном бульоне и в условиях, которые являются пермиссивными в отношении получения сиалированного олигосахарида; и, возможно,
- извлечение сиалированного олигосахарида из среды и/или клетки Bacillus.
13. Способ по п. 12, в котором ферментационный бульон содержит лактозу.
| WO 2007101862 A1, 13.09.2007 | |||
| WO 2018122225 A1, 05.07.2018 | |||
| ОЛИГОСАХАРИДНАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ОСТРЫХ ИНФЕКЦИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2011 |
|
RU2593321C2 |
Авторы
Даты
2024-04-04—Публикация
2020-08-10—Подача