Настоящее изобретение относится к ферментативному получению целевого сахарида. Раскрыты микробные клетки, способные продуцировать целевой сахарид, где указанные микробные клетки используют сырье из смеси моносахаридов в качестве основного источника углерода и энергии во время ферментации. Также описаны способы получения целевого сахарида посредством использования указанных микробных клеток.
Предшествующий уровень техники
Человеческое грудное молоко содержит сложную смесь углеводов, жиров, белков, витаминов, минеральных веществ и микроэлементов. Наиболее преобладающая фракция человеческого грудного молока состоит из углеводов. Фракция углеводов в человеческом грудном молоке может быть дополнительно подразделена на (i) лактозу и (ii) олигосахариды (олигосахариды грудного молока, ОГМ). В то время, как дисахарид лактоза (галактозо-β1,4-глюкоза) используется грудным ребенком в качестве источника энергии, олигосахариды не метаболизируются младенцем.
На долю фракции олигосахаридов приходится вплоть до одной десятой суммарной фракции углеводов, и она, вероятно, состоит из более чем 150 структурно разных олигосахаридов. Распространенность и концентрация данных сложных олигосахаридов являются специфичными для человека, и, таким образом, они не могут быть обнаружены в больших количествах в молоке других млекопитающих, включая молочных сельскохозяйственных животных.
Наиболее распространенными олигосахаридами грудного молока являются 2'-фукозиллактоза (2-FL - от англ. 2-fucosyllactose) и 3'-фукозиллактоза (3-FL - от англ. 3-fucosyllactose), которые вместе могут составлять вплоть до 1/3 суммарной фракции ОГМ. Дополнительные распространенные ОГМ представляют собой лакто-N-тетраозу (LNT - от англ. lacto-N-tetraose), лакто-N-неотетраозу (LNnT - от англ. lacto-N-neotetraose) и лакто-N-фукопентаозу I (LNFP-I - от англ. lacto-N-fucopentaose I). Помимо данных нейтральных олигосахаридов, также в человеческом грудном молоке могут быть обнаружены кислые ОГМ, такие как 3'-сиалиллактоза (3'-SL - от англ. 3'-sialyllactose), 6'-сиалиллактоза (6'-SL - от англ. 6'-sialyllactose), 3-фукозил-3'-сиалиллактоза, сиалил-лакто-N-тетраоза и дисиалил-лакто-N-тетраоза.
Примечательно, что значительное большинство ОГМ содержат группировку галактозо-β1,4-глюкозы на своем восстанавливающем конце, которая удлиняется в результате добавления группировок моносахарида, как например, N-ацетилглюкозамин (GlcNAc) и/или фукоза и/или галактоза и/или N-ацетилнейраминовая кислота (NeuNAc). Структуры ОГМ являются близкородственными с эпитопами гликоконъюгатов поверхности эпителиальных клеток, антигенами группы крови Lewis, такими как антиген Lewis × (LeX). Структурное сходство ОГМ с эпителиальными эпитопами обуславливает защитные свойства ОГМ против бактериальных патогенов.
О наличии олигосахаридов в человеческом грудном молоке известно на протяжении длительного времени, и физиологические функции данных олигосахаридов подвергали медицинскому исследованию на протяжении многих десятилетий. Для некоторых из более распространенных олигосахаридов грудного молока уже идентифицированы конкретные функции.
Помимо оказания местного действия в кишечнике, как указано ранее в данном документе, ОГМ, как также было показано, оказывают системное действие у младенцев в результате поступления их в системный кровоток. Кроме того, влияние ОГМ на белок-углеводные взаимодействия, например, связывание селектина и лейкоцита может модулировать иммунные ответы и уменьшать воспалительные реакции. Кроме того, становится все более и более признанным, что ОГМ представляют ключевые субстраты для разработки микробиомов младенцев.
Ввиду хорошо изученных полезных свойств разных углеводов, в общем и в частности, пребиотических олигосахаридов, но из-за их ограниченной доступности из природных источников, эффективный и рентабельный способ получения моносахаридов (например, L-фукозы, N-ацетилнейраминовой кислоты), дисахаридов (например, лакто-N-биозы) и олигосахаридов (например, 2'-FL, LNnT) является весьма требуемым.
Пытаясь добиться крупномасштабного производства функциональных углеводов, разработали химические пути для некоторых из данных углеводов. Однако, такие способы включают применение нескольких вредных химических веществ, которые вызывают риск загрязнения конечного продукта. По меньшей мере крупномасштабные количества, а также качества функциональных углеводов, достаточные для их применения в качестве пищевого продукта, не могли быть обеспечены до сегодняшнего дня с помощью химического синтеза.
Для того, чтобы обойти недостатки, которые связаны с химическим синтезом олигосахаридов грудного молока, разработали несколько ферментативных способов и подходов к ферментации для их продукции. Способы ферментативного получения разработаны для нескольких углеводов, таких как L-фукоза, N-ацетилнейраминовая кислота, 2'-фукозиллактоза, 3-фукозиллактоза, лакто-N-тетраоза, лакто-N-неотетраоза, 3'-сиалил-лактоза и 6'-сиалиллактоза. В данных способах получения обычно используются генетически сконструированные бактериальные клетки, такие как рекомбинантные Escherichia coli.
Обычно, способы ферментативного получения, а также биокаталитические реакции для получения ОГМ основаны на добавляемой извне лактозе в качестве исходного акцепторного субстрата для получаемых ОГМ. В данных способах к лактозе добавляют один или более моносахаридов (США 7521212 В1; Albermann et al., (2001) Carbohydr. Res. 334(2) p 97-103). Добавление моносахаридов к лактозе может катализироваться или гликозилтрансферазами, или гликозидазами, с использованием подходящих активированных моносахаридных субстратов. Кроме того, к лактозе могут быть добавлены дополнительные моносахариды в результате реакций с трансгликозидазой.
В частности, ферментативное получение ОГМ оказалось эффективным, поскольку моносахариды, активированные нуклеотидами, которые требуются, но которые сложно синтезировать, предоставлены за счет метаболизма микробных клеток, которые используются. Путь биосинтеза моносахаридов, активированных нуклеотидами, обычно происходит от первичного метаболизма клетки-хозяина на уровне глюкозо-6-фосфата или фруктозо-6-фосфата. Путь биосинтеза в отношении УДФ (уридиндифосфат)-галактозы (УДФ-Gal) происходит от глюкозо-6-фосфата, в то время как биосинтез ГДФ (гуанозиндифосфат)-фукозы, УДФ-N-ацетилглюкозамина и СМР-N-ацетилнейраминовой кислоты происходит от фукозы-6-фосфата.
Эффективный биосинтез моносахаридов, активированных нуклеотидами в микробной клетке-хозяине и, следовательно, получение требуемых углеводов посредством ферментативных способов явно основаны на непрерывной подаче сахарофосфатов, таких как глюкозо-6-фосфат и/или фруктозо-6-фосфат.
Основной проблемой в указанных ферментативных способах, обычно основанных на потреблении простого и недорогого источника углерода и энергии (например, глицерина, глюкозы, сахарозы) микробной клеткой-хозяином, является ограниченная доступность таких фосфорилированных/активированных сахаридов в указанной клетке-хозяине (например, вследствие конкурирующих реакций), что сильно нарушает поток углевода пути биосинтеза продукта, таким образом, продуктивность данных процессов.
Для преодоления упомянутых выше недостатков разработали улучшенные средства и способы получения ОГМ. Например, в WO 2012/007481 А2 раскрыт сконструированный организм, способный продуцировать сахарид, активированный сахарид, нуклеозид, гликозид, гликолипид и гликопротеин, где указанный сконструированный организм экспрессирует: i) ген, кодирующий гидролазу углевода в комбинации с геном, кодирующим киназу углевода, ii) ген, кодирующий синтазу углевода, или iii) ген, кодирующий фосфорилазу углевода, таким образом, что указанный организм способен расщеплять дисахарид, олигосахарид, полисахарид или их смесь до активированного сахарида и сахарида, и где указанный организм дополнительно генетически модифицирован, таким образом, что по меньшей мере один ген, отличный от любого из вводимых генов указанного организма, сделан менее функциональным или нефункциональным, и где указанный другой ген кодирует фермент, который превращает указанный активированный сахарид в биомассу, и/или биокаталитические ферменты. Указанный сконструированный организм способен образовывать требуемые углеводы, одновременно используя дисахарид, такой как сахароза, олигосахарид, полисахарид или их смесь.
Однако, продукция требуемого соединения указанным сконструированным организмом с использованием сахарозы в качестве единственного источника углерода и энергии, имеет большой недостаток, заключающийся в том, что сложно стерилизовать сахарозу. Наиболее требуемым способом стерилизации является тепловая стерилизация. Однако, тепловая стерилизация сахарозы приводит к значительной степени гидролизации, препятствуя применимости способа, описанного в WO 2012/007481 А2.
В качестве альтернативы тепловой стерилизации может быть использована стерильная фильтрация раствора сахарозы, но стерильная фильтрация имеет высокий риск загрязнения, приводящего к росту нетребуемых бактериальных клеток, в частности, при ферментации промышленного масштаба.
Тем не менее, сахароза представляет наиболее привлекательный источник углерода для биотехнологических применений из-за своей доступности и низкой стоимости.
Следовательно, требуемо обеспечить микробные клетки для ферментативной продукции требуемого углевода, которые были бы способны продуцировать требуемый углевод при культивации в присутствии недорогого сырья в качестве основного источника углерода и энергии, где указанное сырье не должно быть гидролизовано микробной клеткой, используемого в метаболизме клетки, и способ получения целевого углевода посредством ферментации посредством культивирования указанной микробной клетки в присутствии указанного сырья в качестве главного источника углерода и энергии.
Цель достигается тем, что предложены генетически сконструированные микробные клетки, которые способны продуцировать требуемый углевод, при культивировании на сырье из смеси моносахаридов в качестве основного источника углерода и энергии, где указанное сырье из смеси моносахаридов состоит из глюкозы и по меньшей мере одного дополнительного моносахарида, выбранного из группы, состоящей из фруктозы и галактозы, и где микробные клетки обладают повышенной внутриклеточной доступностью по меньшей мере одного сахарофосфата, и посредством предложения способа ферментативной продукции целевого углевода, который включает культивирование указанных генетически сконструированных микробных клеток в присутствии указанного сырья из смеси моносахаридов в качестве основного источника углерода и энергии.
Краткое изложение сущности изобретения
Согласно первому аспекту предложена генетически сконструированная микробная клетка для продукции целевого углевода, где указанная микробная клетка обладает повышенной внутриклеточной доступностью по меньшей мере одного сахарофосфата и способна продуцировать целевой углевод при культивации в присутствии сырья из смеси моносахаридов в качестве основного источника углерода и энергии, где указанное сырье из смеси моносахаридов состоит из глюкозы и по меньшей мере одного дополнительного моносахарида, выбранного из группы, состоящей из фруктозы и галактозы.
Согласно второму аспекту предложено применение генетически сконструированной микробной клетки, как описано в данном документе, для продукции целевого углевода, где указанную микробную клетку культивируют в присутствии смеси моносахаридов, состоящей из глюкозы и по меньшей мере одного дополнительного моносахарида из группы фруктозы и галактозы.
Согласно третьему аспекту предложен способ ферментативного получения целевого углевода, включающий следующие стадии:
a) предоставление генетически сконструированной микробной клетки, которая способна продуцировать целевой углевод, где указанная микробная клетка обладает повышенной внутриклеточной доступностью по меньшей мере одного сахарофосфата;
b) культивирование указанной генетически сконструированной микробной клетки в культуральной среде, которая является пермиссивной в отношении продукции указанного целевого углевода, где культуральная среда содержит сырье из смеси моносахаридов в качестве главного источника углерода и энергии, где указанное сырье из смеси моносахаридов состоит из глюкозы и по меньшей мере одного дополнительного моносахарида, выбранного из группы, состоящей из фруктозы и галактозы; и
с) выделение указанного целевого углевода.
В четвертом аспекте предложено применение целевого углевода, который продуцирован генетически сконструированной микробной клеткой и/или способом, описанным в данном документе, для изготовления фармацевтической и/или пищевой композиции.
Краткое описание графических материалов
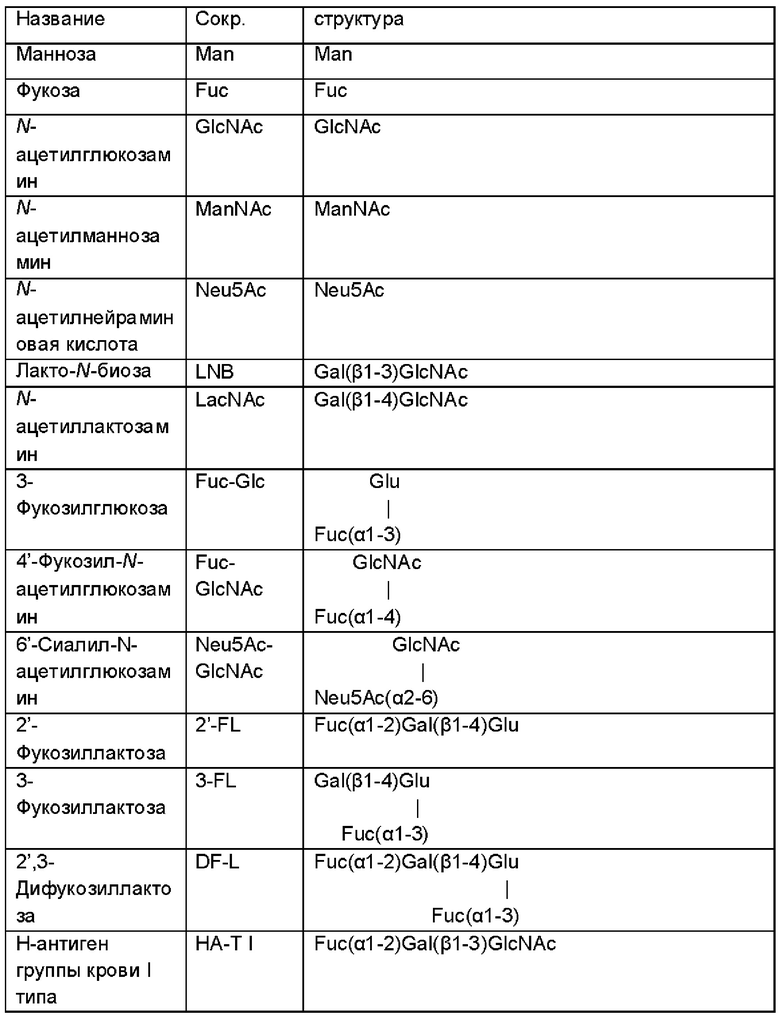
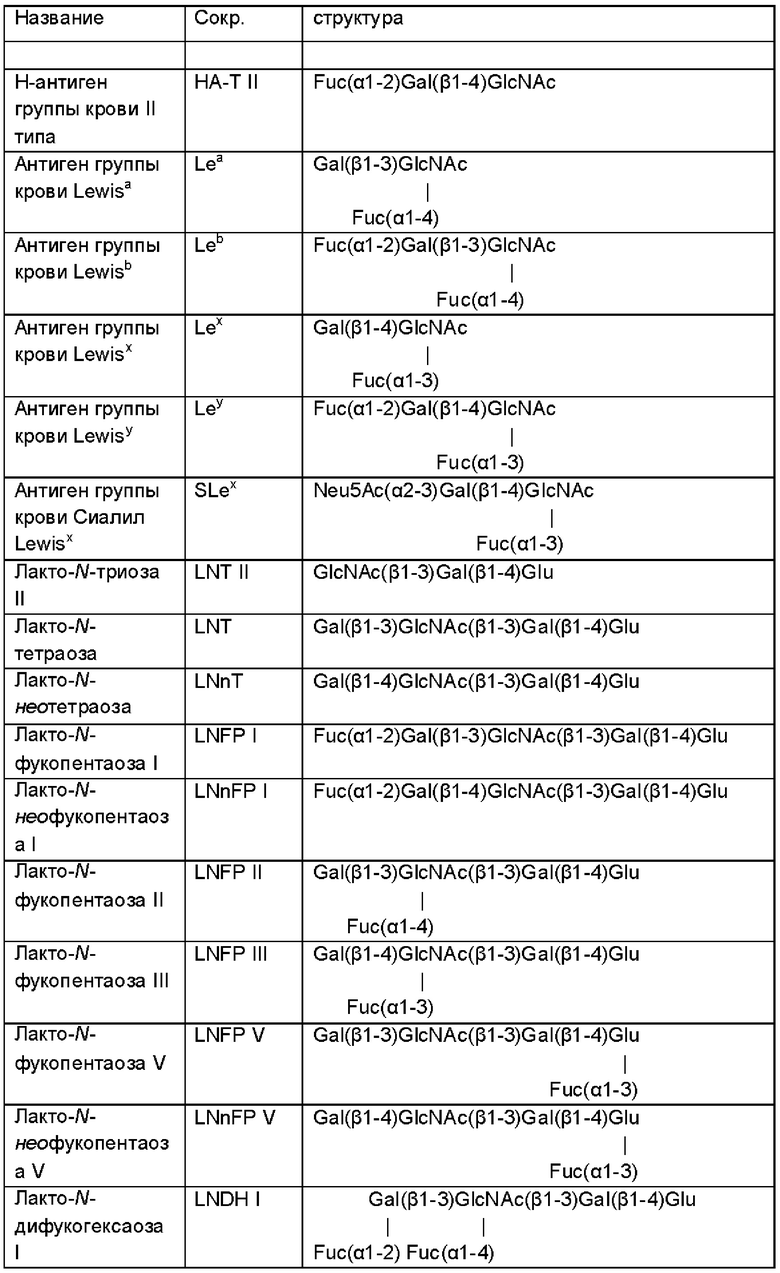
На Фиг. 1 показано схематическое представление иллюстративной микробной клетки дикого типа (например, Е. coli), иллюстрирующее встречающиеся в природе метаболические пути, приводящие к и происходящие от сахарофосфатов фруктозо-1-фосфат и глюкозо-6-фосфат.
На Фиг. 2 показано схематическое представление иллюстративной генетически модифицированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата.
На Фиг. 3 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата.
На Фиг. 4 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата.
На Фиг. 5 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата и повышенной доступности внутриклеточного фруктозо-6-фосфата.
На Фиг. 6 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата и повышенной доступности внутриклеточного фруктозо-6-фосфата.
На Фиг. 7 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата и повышенной доступности внутриклеточного фруктозо-6-фосфата.
На Фиг. 8 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата и повышенной доступности внутриклеточного фруктозо-6-фосфата.
На Фиг. 9 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточного глюкозо-6-фосфата и повышенной доступности внутриклеточного фруктозо-6-фосфата.
На Фиг. 10 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточной глюкозы, глюкозо-6-фосфата и фруктозо-6-фосфата.
На Фиг. 11 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности внутриклеточной маннозы и/или маннозо-6 фосфата.
На Фиг. 12 показано схематичное изображение еще одного иллюстративного воплощения генетически сконструированной микробной клетки по изобретению, где указаны генетические модификации, приводящие к повышенной доступности галактозо-1-фосфата и фруктозо-6-фосфата.
На Фиг. 13 изображены характеристики роста штаммов Е. coli во время культивирования на глюкозе (А) или на сырье из смеси моносахаридов, состоящем из глюкозы и фруктозы (В) в качестве единственного источника углерода и энергии.
Подробное описание
Согласно первому аспекту предложена генетически сконструированная микробная клетка, которая способна продуцировать целевой углевод. В дополнительном воплощении целевой углевод представляет собой углевод, который не встречается в природе в клетке-предшественнике дикого типа генетически сконструированной микробной клетки.
Микробная клетка обладает повышенной внутриклеточной доступностью по меньшей мере одного сахарофосфата, по сравнению с внутриклеточной доступностью указанного по меньшей мере одного сахарофосфата в соответствующей клетке дикого типа. Генетически сконструированная микробная клетка способна продуцировать указанный целевой углевод и продуцирует указанный целевой углевод при культивировании в культуральной среде, содержащей сырье из смеси моносахаридов в качестве основного источника углерода и энергии для микробной клетки, где сырье из смеси моносахаридов состоит из глюкозы и по меньшей мере одного дополнительного моносахарида, выбранного из группы, состоящей из фруктозы и галактозы.
Генетически сконструированная микробная клетка способна продуцировать целевой углевод благодаря генетическому конструированию. Следовательно, генетически сконструированная микробная клетка экспрессирует один или более гетерологичных генов, где активность полипептида(ов),кодируемого(ых) указанным(и) гетерологичным(и) геном(ами), дает возможность микробной клетке синтезировать целевой углевод.
Термин «функциональный ген», в том виде, в котором он используется в данном документе, относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует белок или полипептид, и которая также содержит регуляторные последовательности, функционально связанные с указанной нуклеотидной последовательностью, кодирующей белок, таким образом, что нуклеотидная последовательность, которая кодирует данный белок или полипептид, может экспрессироваться в микробной клетке/микробной клеткой, несущей указанный функциональный ген. Таким образом, при культивации в условиях, которые являются пермиссивными в отношении экспрессии функционального гена, указанный функциональный ген экспрессируется, и микробная клетка, экспрессирующая указанный функциональный ген, обычно содержит белок или полипептид, который кодируется областью, кодирующей белок, функционального гена. В том виде, в котором они используются в данном документе, термины «нуклеиновая кислота» и «полинуклеотид» относятся к полимеру из дезоксирибонуклеотидов или рибонуклеотидов или в одно- или двухцепочечной форме и, если не ограничено иным образом, охватывают известные аналоги природных нуклеотидов, которые гибридизуются с нуклеиновыми кислотами образом, похожим на нуклеотиды, встречающиеся в природе. Если не указано иное, конкретная последовательность нуклеиновой кислоты включает ее комплементарную последовательность.
Термин «функционально связанный», в том виде, в котором он используется в данном документе, будет означать функциональную связь между нуклеотидной последовательностью контроля экспрессии (такой как промотор, сигнальная последовательность или ряд сайтов связывания транскрипционных факторов) и второй последовательностью нуклеиновой кислоты, где последовательность контроля экспрессии влияет на транскрипцию и/или трансляцию нуклеиновой кислоты, соответствующей второй последовательности. Соответственно, термин «промотор» обозначает последовательности ДНК, которые обычно «предшествуют» гену в ДНК-полимере и обеспечивают сайт инициации транскрипции в мРНК. «Регуляторные» последовательности ДНК, также обычно расположенные «выше» (то есть, предшествуя) гена в данном ДНК-полимере, связывают белки, которые определяют частоту (или скорость) инициации транскрипции. В совокупности называемые «промоторной/регуляторной» ДНК-последовательностью или ДНК-последовательностью «контроля», данные последовательности, которые предшествуют выбранному гену (или серии генов) в функциональном ДНК-полимере способствуют определению того, будет ли происходить транскрипция (и в конечном итоге экспрессия) гена. Последовательности ДНК, которые «следуют за» геном в ДНК-полимере и обеспечивают сигнал для терминации транскрипции в мРНК, называются последовательностями, «терминирующими» транскрипцию.
Термин «рекомбинантный», в том виде, в котором он используется в данном документе со ссылкой на бактериальную клетку-хозяина, указывает на то, что бактериальная клетка реплицирует гетерологичную нуклеиновую кислоту или экспрессирует пептид или белок, кодируемый гетерологичной нуклеиновой кислотой (а именно, последовательностью, которая является «чужеродной в отношении указанной клетки»). Рекомбинантные клетки могут содержать гены, которые не обнаружены в нативной (нерекомбинантной) форме клетки. Рекомбинантные клетки могут также содержать гены, обнаруженные в нативной форме клетки, где гены модифицированы и повторно введены в клетку искусственными средствами. Термин также охватывает клетки, которые содержат нуклеиновую кислоту, эндогенную в отношении клетки, которая была модифицирована без удаления нуклеиновой кислоты изданной клетки; такие модификации включают модификации, полученные посредством замены генов, сайт-специфичной мутации и родственных методик. Соответственно, «рекомбинантный полипептид» представляет собой полипептид, который получен посредством рекомбинантной клетки. Термин «гетерологичная последовательность» или «гетерологичная нуклеиновая кислота», в том виде, в котором он используется в данном документе, представляет собой последовательность или нуклеиновую кислоту, которая происходит из источника, чужеродного в отношении конкретной клетки-хозяина (например, из отличного вида), или, если из одного и того же источника, модифицирована, по сравнению со своей исходной формой. Таким образом, гетерологичная нуклеиновая кислота, функционально связанная с промотором, происходит из источника, отличного от источника, из которого происходит промотор, или, если из одного и того же источника, модифицирована, по сравнению со своей исходной формой. Гетерологичная последовательность может быть стабильно введена, например, посредством трансфекции, трансформации, конъюгации или трансдукции, в геном клетки микроорганизма - хозяина, где могут применяться методики, которые будут зависеть от клетки-хозяина, в которую должна быть введена данная последовательность. Разные методики известны специалисту в данной области и раскрыты, например, в Sambrook et a/., Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989).
Соответственно, под «генетически сконструированной клеткой-хозяином» или «генетически сконструированной микробной клеткой» понимают бактериальную клетку или дрожжевую клетку, которая трансформирована или трансфицирована, или способна к трансформации или трансфекции экзогенной полинуклеотидной последовательностью.
Таким образом, последовательности нуклеиновых кислот, как использовано в настоящем изобретении, могут, например, содержаться в векторе, которым нужно стабильно трансформировать/трансфицировать клетки-хозяев а микроорганизма или который должен быть иным образом в них введен.
Огромное многообразие экспрессионных систем может использоваться для получения полипептидов по изобретению. Такие векторы включают, среди прочих, хромосомные, эписомальные векторы и векторы, происходящие из вирусов, например, векторы, происходящие из бактериальных плазмид, из бактериофага, из транспозонов, из эписом дрожжей, из инсерционных элементов, из хромосомных элементов дрожжей, из вирусов, и векторы, происходящие из их комбинаций, такие как векторы, происходящие из генетических элементов плазмид и бактериофагов, как например, космиды и фагмиды. Конструкции экспрессионных систем могут содержать регуляторные области, которые осуществляют регуляцию, а также вызывают экспрессию. Обычно, любую систему или вектор, подходящий для сохранения, размножения или экспрессии полинуклеотидов и для синтеза полипептида в хозяине, можно использовать для экспрессии в данном отношении. Соответствующая последовательность ДНК может быть вставлена в экспрессионную систему любой из множества хорошо известных и рутинных методик, таких как, например, методики, изложенные в Sambrook et al., см. выше.
Данная область богата патентными и литературными публикациями, относящимся к методам «генной инженерии» для выделения, синтеза, очистки и амплификации генетического материала для применения в трансформации выбранных организмов-хозяев. Таким образом, общеизвестна трансформация организмов-хозяев «гибридной» вирусной или кольцевой плазмидной ДНК, которая включает выбранные экзогенные (то есть, чужеродные или «гетерологичные») ДНК-последовательности. Способы, известные в данной области, прежде всего, включают создание вектора трансформации посредством ферментативного расщепления кольцевой вирусной или плазмидной ДНК с образованием цепей линейной ДНК. Выбранные чужеродные цепи ДНК, обычно включающие последовательности, кодирующие требуемый белковый продукт, получают в линейной форме посредством использования одних и тех же/похожих ферментов. Линейную вирусную или плазмидную ДНК инкубируют с чужеродной ДНК в присутствии лигирующих ферментов, способных воздействовать на процесс восстановления, и образуются «гибридные» векторы, которые включают выбранный экзогенный сегмент ДНК, «сплайсированный» в вирусную или кольцевую ДНК-плазмиду.
Термин «нуклеотидная последовательность, кодирующая...» обычно относится к любому полирибонуклеотиду или полидезоксирибонуклеотиду, который может представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК, и обычно представляет часть гена, которая кодирует определенный полипептид или белок. Термин включает, без ограничения, одно- и двухцепочечную ДНК, ДНК, которая представляет собой смесь одно- и двухцепочечных участков или одно-, двух- и трехцепочечных участков, одно- и двухцепочечную РНК, и РНК, которая представляет собой смесь одно- и двухцеп очечных участков, гибридные молекулы, содержащие ДНК и РНК, которые могут представлять собой одно цепочечные или более типично двухцепочечные или трехцепочечные участки, или смесь одно- и двухцепочечных участков. Термин также охватывает полинуклеотиды, которые включают один единственный непрерывный участок или прерывистые участки, кодирующие полипептид (например, прерывающиеся встроенным фагом или вставкой последовательности или редактированием), вместе с дополнительными участками, которые также могут содержать кодирующие и/или некодирующие последовательности.
Термин «вариант(ы)», в том виде, в котором он используется в данном документе, относится к полинуклеотиду или полипептиду, который отличается от референсного полинуклеотида или полипептида, соответственно, но сохраняет существенные (ферментативные) свойства референсного полинуклеотида или полипептида. Типичный вариант полинуклеотида отличается по нуклеотидной последовательности от другого, референсного полинуклеотида. Изменения в нуклеотидной последовательности варианта могут менять или могут не менять аминокислотную последовательность полипептида, кодируемого референсным полинуклеотидом. Изменения в нуклеотидах могут приводить к аминокислотным заменам, присоединениям, делециям, слияниям и усечениям в полипептиде, кодируемом референсной последовательностью, как обсуждается ниже. Типичный вариант полинуклеотида отличается по аминокислотной последовательности от другого, референсного полипептида. Обычно, различия ограничены таким образом, что последовательности референсного полипептида и варианта сильно похожи по всей длине и, во многих участках, идентичны. Вариант и референсный полипептид может отличаться в аминокислотной последовательности одной или более заменами, присоединениями, делециями в любой комбинации. Служащий заменой или вставленный остаток аминокислоты может представлять собой или может не представлять собой остаток аминокислоты, кодируемый генетическим кодом. Вариант полинуклеотида или полипептида может являться встречающимся в природе, таким как аллельный вариант, или он может представлять собой вариант, который не известно, чтобы встречался в природе. Варианты полинуклеотидов или полипептидов, не встречающиеся в природе, могут быть созданы методиками мутагенеза посредством прямого синтеза и другими методами генной инженерии, известными специалистам в данной области.
В пределах объема настоящего изобретения, данными терминами также охвачены нуклеотидные/полинуклеотидные и полипептидные полиморфные варианты, аллели, мутанты и межвидовые гомологи, которые имеют аминокислотную последовательность, которая обладает более чем примерно 60%-ной идентичностью аминокислотных последовательностей, 65%-ной, 70%-ной, 75%-ной, 80%-ной, 85%-ной, 90%-ной, предпочтительно 91%-ной, 92%-ной, 93%-ной, 94%-ной, 95%-ной, 96%-ной, 97%-ной, 98%-ной или 99%-ной или более высокой идентичностью аминокислотных последовательностей, предпочтительно, на протяжении участка из по меньшей мере примерно 25, 50, 100, 200, 500, 1000 или более аминокислот, с полипептидом, кодируемым белком дикого типа.
Соответственно, термин «функциональный вариант» любого из генов/белков, раскрытых в данном документе, предназначен для обозначения вариантов последовательностей генов/белков, все еще сохраняющих такую же или несколько меньшую активность гена или белка, из которого происходит соответствующий фрагмент.
Генетически сконструированная микробная клетка обладает по меньшей мере одним транспортером моносахарида для транслокации по меньшей мере одного моносахарида из культуральной среды, в которой указанная микробная клетка культивируется, в ее цитоплазму. Указанный по меньшей мере один транспортер моносахарида транслоцирует моносахарид, выбранный из группы, состоящей из глюкозы, фруктозы и галактозы.
Моносахарид, который транслоцирован через плазматическую мембрану, должен быть фосфорилирован для того, чтобы стать доступным для метаболизма клетки. В зависимости от транспортера моносахарида, который транслоцировал моносахарид через мембрану клетки, моносахарид(ы) или непосредственно фосфорилирован(ы), а именно, при переносе в клетку, или впоследствии фосфорилирован(ы) подходящей киназой. Транслокация моносахарида посредством транспорта, зависимого от фосфоенолпируват:сахарофосфотрансферазы (PEP-PTS - от англ. phosphoenolpyruvate:sugar phosphotransferase) приводит к прямому фосфорилированию, тогда как транслокация моносахарида посредством транспорта, независимого от фосфоенолпируват:сахарофосфотрансферазы (независимый от PEP-PTS) требует последующего фосфорилирования моносахарида внутриклеточной киназой.
В дополнительном и/или альтернативном воплощении микробная клетка содержит систему фосфотрансферазы, транслоцирующую глюкозу (PTsG - от англ. glucose-translocating phosphotransferase system). Система фосфотрансферазы, транслоцирующая глюкозу, катализирует фосфорилирование поступающей глюкозы одновременно с ее транслокацией через клеточную мембрану.
Общий механизм системы Pts заключается в следующем: фосфорильная группа от фосфоренолпирувата (PEP - от англ. phosphoenolpyruvate) переносится посредством пути передачи сигнала к ферменту I (EI - от англ. enzyme I), который, в свою очередь, переносит ее к переносчику фосфорила, белку, богатому гистидином (HPr от англ. histidine protein). Затем фосфо-HPr переносит фосфорильную группу к пермеазе, специфичной в отношении сахара, мембаносвязанному комплексу, известному как фермент 2 (EII - от англ. enzymes II), который транспортирует сахар к клетке. EII состоит по меньшей мере из трех структурно различных доменов IIA, IIB и IIC. Данные домены могут быть либо слиты вместе в одну единственную полипептидную цепь, либо существовать в виде двух или трех взаимосвязанных цепей, ранее называемых ферментами II (EII) и III (EIII).
Первый домен (IIA или EIIA) несет первый сайт фосфорилирования, специфичный в отношении пермеазы, гистидин, который фосфорилируется фосфо-HPr. Второй домен (IIB или EIIB) фосфорилируется фосфо-IIA на остатке цистеинила или гистидила, в зависимости от транспортируемого сахара. Наконец, фосфорильная группа переносится от домена IIB на субстрат-сахар, одновременно с поглощением сахара при участии домена IIC. Данный третий домен (IIC или EIIC) образует канал транслокации и специфичный сайт связывания субстрата.
Таким образом, система PtsG получает глюкозу извне и предоставляет глюкозо-6-фосфат в микробной клетке. Глюкозо-6-фосфат может утилизироваться в пути биосинтеза УДФ-галактозы и/или превращаться во фруктозо-6-фосфат, который, в свою очередь, может быть использован для образования высокоэнергетических трифосфатов в центральном метаболизме и/или, например, в биосинтезе сахаридов, активированных нуклеотидом, таких как ГДФ-фукоза.
В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка содержит транспортер фруктозы для осуществления транслокации фруктозы (Fru - от англ. fructose) из культуральной среды в цитоплазму микробной клетки. Подходящий транспортер фруктозы для поглощения свободной фруктозы представляет собой изоформу (PtsG-F), как описано Kornberg et al. PNAS 97: 1808-1812 (2000)).
Поглощенная фруктоза может быть затем фосфорилирован а фруктокиназой (FrK - от англ. fructokinase) с обеспечением фруктозо-6-фосфата (Fru-6-P). Фруктозо-6-фосфат может быть утилизирован в пути биосинтеза УДФ-галактозы и/или в других метаболических путях, как например, образование высокоэнергетических трифосфатов в центральном метаболизме и/или, например, в биосинтезе сахаридов, активированных нуклеотидом, таких как ГДФ-фукоза.
В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка содержит фосфотрансферазную систему, транслоцирующую фруктозу (PtsF). Фосфотрансферазная система, транслоцирующая фруктозу, катализирует фосфорилирование поступающей фруктозы, одновременно с ее транслокацией через клеточную мембрану.
Таким образом, система PtsF приобретает фруктозу извне и обеспечивает фруктозо-1-фосфат в микробной клетке. Система PtsF содержит трансмембранный белок FruA, 1-фосфофруктокиназу (FruK - от англ. phosphofructose kinase) и белок-переносчик дифосфорила FruB. Фруктоза транслоцируется посредством FruA и FruB с обеспечением фруктозо-1-фосфата в цитоплазме. Фруктозо-1-фосфат может быть дополнительно фосфорилирован фосфофруктокиназой (FruK) с получением фруктозо-1,6-бифосфата, который, в свою очередь, может быть использован микробной клеткой для образования высокоэнергетических трифосфатов в центральном метаболизме.
Еще одна подходящая система PtsF содержит LevD, LevE, LevF и LevG. LevD представляет собой компонент фермента IIA - фосфотрансферазы, специфичной в отношении фруктозы. LevE представляет собой компонент фермента IIB -фосфотрансферазы, специфичной в отношении фруктозы. LevF представляет собой компонент фруктозопермеазы IIC, LevG представляет собой компонент фруктозопермеазы IID. Соответствующие гены levD, levE, levF и levG, как известно, происходят, например, из Bacillus subtilis (штамм 168). Указанная система PtsF обеспечивает фруктозо-1-фосфат в клетке.
В дополнительном и/или альтернативном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза УДФ-галактозы для внутриклеточного образования УДФ-галактозы (УДФ-Gal). УДФ-галактоза требуется в качестве субстрата для галактозилтрансфераз, где активность указанных галактозилтрансфераз может приводить к образованию галактозилированных дисахаридов или галактозилированных олигосахаридов.
УДФ-галактоза может обеспечиваться встречающимся в природе метаболизмом микробных клеток, а именно, активностью фосфоглюкомутазы, катализирующей взаимопревращение глюкозо-1-фосфата и глюкозо-6-фосфата, УТФ (уридинтрифосфат)-глюкозо-1-фосфат-уридилтрансферазы, которая катализирует образование УДФ-глюкозы из глюкозо-1-фосфата и УТФ, и УДФ-глюкозо-4-эпимеразы, катализирующей обратимое превращение УДФ-глюкозы в УДФ-галактозу.
Внутриклеточная поставка УДФ-галактозы может быть улучшена посредством генной инженерии в том отношении, что один или более из генов, кодирующих фосфоглюкомутазу, УДФ-глюкозо-1-фосфат-уридилтрансферазу, УДФ-глюкозо-4-эпимеразу и их функциональные варианты, сверхэкспрессируются, и/или в том отношении, что одна или более дополнительных копий одного или более из генов, кодирующих фосфоглюкомутазу, УДФ-глюкозо-1-фосфат-уридилтранферазу, УДФ-глюкозо-4-эпимеразу и их функциональные варианты, экспрессируются в микробной клетке. Примером гена, кодирующего фосфоглюкомутазу, является ген pgm (№доступа NP_415214), обнаруженный в Е. coli K-12, примером гена, кодирующего УДФ-глюкозо-1-фосфат-уридилтранферазу, является ген Е, coli galU (№доступа NP_415752), обнаруженный в Е, coli K-12, и примером гена, кодирующего УДФ-глюкозо-4-эпимеразу, является ген Е, coli galE (NP_415280), обнаруженный в Е, coli K-12.
Термин «сверхэкспрессия» или «сверхэкспрессируемый», в том виде, в котором он используется в данном документе, относится к уровню экспрессии фермента или полипептида, который выше, чем уровень, который измеряют в клетке-предшественнике дикого типа, а именно клетке того же вида, как и генетически сконструированная микробная клетка и клетка, которая не была генетически изменена.
Дополнительно и/или в качестве альтернативы, внутриклеточная поставка УДФ-галактозы может быть достигнута или улучшена подачей галактозы в микробные клетки посредством культуральной среды, в которой культивируют указанную микробную клетку. Подаваемая извне галактоза поглощается микробной клеткой и впоследствии фосфорилируется до галактозо-1-фосфата, который затем превращается в УДФ-галактозу. В данном пути биосинтеза ГДФ-галактозы гены, кодирующие ферменты, обладающие требуемыми ферментативными активностями, известны в литературе (Groissoird et al., «Characterization, Expression, and Mutation of the Lactococcus lactis galPMKTE Genes, Involved in Galactose Utilization via the Leloir Pathway» (2003) J. Bacteriol. 185(3) 870-878). Ген galP (№доступа NP_417418) кодирует галактозный-протонный симпортер. Ген galM (№доступа NP_415277) кодирует альдозо-1-эпимеразу, ген galK (№доступа NP_415278) - галактокиназу, ген galT (№досптупа NP_415279) - галактозо-1-фосфат-уридилтрансферазу и ген galE -УДФ-галактозо-4-эпимеразу.
Следовательно, биосинтез УДФ-галактозы может быть также восполнен в результате экспрессии генов, кодирующих галактозный-протонный симпортер, галактокиназу и галактозо-1-фосфат-уридилтрансферазу в микробной клетке или улучшен в результате сверхэкспрессии генов, кодирующих галактозно-протонный симпортер, галактокиназу и галактозо-1-фосфат-уридилтрансферазу в микробной клетке.
В еще одном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза ГДФ-фукозы для внутриклеточного образования ГДФ-L-фукозы (ГДФ-Fuc). ГДФ-Fuc представляет собой субстрат фукозилтрансферазы, и ферментативная активность фукозилтранефераз может приводить к образованию фукозилированных дисахаридов или фукозилированных олигосахаридов.
В дополнительном и/или альтернативном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза ГДФ-L-фукозы, содержащий маннозо-6-фосфатизомеразу, фосфоманномутазу, манно-1-фосфат-гуанилилтрансферазу, ГДФ-маннозо-4,6-дегидратазу и ГДФ-L-фукозосинтазу.
Внутриклеточная поставка ГДФ-L-фукозы может быть улучшена посредством генной инженерии в том отношении, что один или более генов, кодирующих моннозо-6-фосфатизомеразу, фосфоманномутазу, маннозо-1-фосфат-гуанилилтрансферазу, ГДФ-маннозо-4,6-дегидратазу или ГДФ-1_-фукозосинтазу, сверхэкспрессируются и/или дополнительные копии одного или более генов, кодирующих маннозо-6-фосфатизомеразу, фосфоманномутазу, манно-1-фосфат-гуанилилтрансферазу, ГДФ-маннозо-4,6-дегидротазу и ГДФ-L-фукозосинтазу или их функциональные варианты, экспрессируются в микробной клетке. Примером гена, кодирующего маннозо-6-фосфатизомеразу, является ген Е. coli тапА (№доступа NP_416130), обнаруженный в Е. coli K-12, примером гена, кодирующего фосфоманномутазу, является ген Е. coli тапВ (№доступа NP_416552), обнаруженный в E.coli K-12, примером гена, кодирующего маннозо-1-фосфат-гуанилилтрансферазу, является ген E.coli тапС (№доступа NP_416553), обнаруженный в Е. coli K-12, примером гена, кодирующего ГДФ-маннозо-4,6-дегидратазу, является ген Е. coli gmd (№доступа NP_416557), обнаруженный в Е. coli K-12, и примером гена, кодирующего ГДФ-L-фукозосинтазу, является ген E.coli wcaG (№доступа NP_416556), обнаруженный в E.coli K-12.
Дополнительно и/или в качестве альтернативы, поставка ГДФ-L-фукозы может быть достигнута или улучшена посредством подачи L-фукозы в микробные клетки посредством культуральной среды, в которой культивируют указанную микробную клетку. Подаваемая извне L-фукоза поглощается микробной клеткой и сначала фосфорилируется до фукозо-1-фосфата под действием фермента фукозокиназа. Фукозо-1-фосфат впоследствии превращается в ГДФ-L-фукозу под действием ферментативной активности фермента фукозо-1-фосфатгуанилилтрансфераза. Гены, кодирующие ферменты, обладающие требуемыми ферментативными активностями, известны специалисту в данной области. Иллюстративно, ген fkp (№доступа WP_010993080), кодирующий бифункциональную L-фукокиназу/L-фукозо-1-фосфатгуанилилтрансферазу Bacteroides fragilis, может сверхэкспрессироваться в генетически сконструированной клетке-хозяине.
В еще одном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза УДФ-N-ацетилглюкозамина для внутриклеточного образования УДФ-N-ацетилглюкозамина (УДФ-GlcNAc), требуемого для реакций с N-ацетилглюкозаминилтрансферазой, приводящих к образованию N-ацетилглюкозаминилированных ди- или олигосахаридов.
В дополнительном и/или альтернативном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза УДФ-N-ацетилглюкозамина, например, включающий L-глутамин:D-фуктозо-6-фосфатаминотрансферазу, фосфоглюкозаминмутазу и N-ацетилглюкозамин-1-фосфатуридилтрансферазу/глюкозамин-1-фосфатацетилтрансферазу.
Внутриклеточная подача УДФ-N-ацетилглюкозамина может быть улучшена посредством генетических модификаций, таких как экспрессия или сверхэкспрессия одного или более генов, кодирующих полипептиды, демонстрирующие L-глутамин:D-фуктозо-6-фосфатаминотрансферазную активность (например, ген Е. coli K-12 glmS (№доступа NP_418185)), фосфоглюкозаминомутазную активность (например, ген Е. coli K-12 glmM (№доступа NP_417643)) и N-ацетилглюкозамин-1-фосфатуридилтрансферазную/глюкозамин-1-фосфатацетилтрансферазную активность (например, ген Е, coli K-12 glmU (номер доступа NP_418186)), или их варианты.
В еще одном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза СМР-N-ацетилнейраминовой кислоты/СМР-сиаловой кислоты для внутриклеточного образования СМР-N-ацетилнейраминовой кислоты (CMP-Neu5Ac), требуемой для реакций с сиалилтрансферазой, приводящих, например, к образованию сиалилированных ди- или олигосахаридов.
В дополнительном и/или альтернативном воплощении в генетически сконструированной микробной клетке имеется путь биосинтеза СМР-N-ацетилнейраминовой кислоты, например, включающий L-глутамин:D-фуктозо-6-фосфатаминотрансферазу, фосфоглюкозаминмутазу, N-ацетилглюкозамин-1-фосфатуридилтрансферазу/глюкозамин-1-фосфатацетилтрансферазу, УДФ-N-ацетилглюкозамин-2-эпимеразу, глюкозамин-6-фосфатацетилтрансферазу, N-ацетилглюкозамин-6-фосфатфосфатазу (предпочтительно, HAD-подобную сахарофосфатазу), N-ацетилглюкозамин-2-эпимеразу, синтазу сиаловой кислоты и синтетазу СМР-сиаловой кислоты.
Внутриклеточная подача СМР-N-ацетилнейраминовой кислоты может быть улучшена посредством генетических модификаций, таких как экспрессия или сверхэкспрессия одного или более генов, кодирующих полипептиды, демонстрирующие L-глутамин:D-фуктозо-6-фосфатаминотрансферазную активность (например, ген Е. coli K-12 glmS), фосфоглюкозаминмутазную активность (например, ген Е. coli K-12 glmM), N-ацетилглюкозамин-1-фосфатуридилтрансферазную/ глюкозамин-1-фосфатацетилтрансферазную активность (например, ген E.coli K-12 glmU), УДФ-N-ацетилглюкозамин-2-эпимеразную активность (например, ген Campylobacter jejuni neuC (№доступа AF305571)), глюкозамин-6-фосфатацетилтрансферазную активность (например, ген Saccharomyces cerevisiae дпа1 (№доступа NP_116637)), N-ацетилглюкозамин-6-фосфатфосфатазную активность (например, ген Е. coli K-12 yihX (№доступа NP_418321)), N-ацетилглюкозамин-2-эпимеразную активность (например, ген Synechocystis sp.РСС6803 slr1975 (№доступа BAL35720)), активность синтазы сиаловой кислоты (например, ген Campylobacter jejuni пеиВ (№доступа AF305571)) и активность синтетазы СМР-сиаловой кислоты (например, ген neuA Campylobacter jejuni (№доступа AF305571)), или их варианты.
Генетически сконструированная микробная клетка может дополнительно содержать гликозилтрансферазу. В предпочтительном воплощении по меньшей мере одна гликозилтрансфераза представляет собой фукозилтрансферазу, сиалилтрансферазу, глюкозаминилтрансферазу или галактозилтрансферазу, более предпочтительно, по меньшей мере одна гликозилтрансфераза демонстрирует (β-1,3-галактозилтрансферазную активность, (β-1,4-галактозилтрансферазную активность, β-1,6-галактозилтрансферазную активность, β-1,3-N-ацетилглюкозаминилтрансферазную активность, α-2,3-сиалилтрансферазную активность, α-2,6-сиалилтрансферазную активность, α-1,2-фукозилтрансферазную активность, α-1,3-фукозилтрансферазную активность, α-1,4-фукозилтрансферазную активность. Подходящие гликозилтрансферазы известны специалисту в данной области или могут быть найдены в литературе.
Обычно, и по всему объему настоящего раскрытия, термин «гликозилтрансферазная активность» или «гликозилтрансфераза» обозначает и охватывает ферменты, которые отвечают за биосинтез дисахаридов, олигосахаридов и полисахаридов, и они катализируют перенос группировок моносахарида от моносахарида/сахара, активированного нуклеотидом (например, УДФ-Glc, УДФ-Gal, ГДФ-Fuc, УДФ-GlcNAc, CMP-Neu5Ac), к молекуле - акцептору гликозила (например, моно-, ди- или олигосахаридам).
В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка синтезирует больше фосфоенолпирувата (PEP), чем клетка дикого типа. В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка генетически сконструирована таким образом, чтобы иметь путь усиленного биосинтеза PEP. Например, генетически сконструированная микробная клетка генетически сконструирована таким образом, чтобы обладать повышенной фосфоенолпируваткарбоксикиназной активностью, например, посредством сверхэкспрессии гена pckA Е. coli K-12 (№доступа NP_417862) или его функционального варианта. Предпочтительно, генетически сконструированная клетка-хозяин генетически сконструирована таким образом, чтобы иметь повышенную фосфоенолпируватсинтазную активность, например, в том отношении, что ген ppsA Е. coli K-12 (№доступа NP_416217), кодирующий фосфоенолпируватсинтазу, сверхэкспрессируется, и/или в том отношении, что не встречающиеся в природе микроорганизмы содержат по меньшей мере одну дополнительную копию нуклеотидной последовательности, делающую возможной экспрессию фосфоенолпируватсинтазы, или ее функциональный вариант. Сверхэкспрессия pckA или ppsA усиливает внутриклеточный синтез PEP таким образом, что доступно больше PEP, например, для продукции сиаловой кислоты
В дополнительном и/или альтернативном воплощении внутриклеточная РЕР-доступность генетически сконструированной клетки-хозяина может быть улучшена посредством уменьшения и/или ослабления активности импортера, зависимого от фосфоенолпируват:сахарофосфотрансферазы, требуемого для переноса определенного сахара (например, глюкозы), используемого в качестве источника углерода и энергии, из культуральной среды и клетку. Следовательно, для поддержания способности генетически сконструированной клетки-хозяина использовать указанный определенный сахар в качестве источника углерода и энергии, импортер, независимый от фосфоенолпируват:сахарофосфотрансферазы, нуждается в экспрессии или сверхэкспрессии. В дополнительном и/или альтернативном воплощении требуется экспрессия или сверхэкспрессия киназы, способной фосфорилировать указанный определенный сахар, или уменьшается и/или ослабляется для осуществления метаболизма указанного сахара или его накопления в нефосфорилированной форме в клетке, соответственно.
Импортер, зависимый от фосфоенолпируват:сахарофосфотрансферазы, или его компоненты, чья экспрессия и/или активность могли быть уменьшены и/или ослаблены в генетически сконструированной микробной клетке (например, Е. coli K-12), содержат по меньшей мере один, выбранный из группы, состоящей из генов глюкозо-PEP-PTS ptsG (№доступа NP_415619), malX (№доступа NP_416138), crr (№доступа NP_416912), bglF (№доступа NP_418178) и/или генов фруктозо-РЕР-PTS fruA (№доступа NP_416672), fruB (№доступа NP_416674), и/или генов маннозо-PEP-PTS тапХ (№доступа NP_416331), many (№доступа NP_416332), manZ (№доступа NP_416333) и/или гена N-ацетилглюкозамин-РЕР-PTS nagE (№доступа NP_415205).
Подходящий транспортер, независимый от PEP-PTS, или его варианты, способные переносить моносахариды (глюкозу и/или фруктозу и/или галактозу и/или N-ацетилглюкозамин и/или N-ацетилнейраминовую кислоту и/или фукозу) в микробную клетку, хорошо известны специалисту в данной области. Неограничивающими примерами генов, кодирующих указанный транспортер, независимый от PEP-PTS, являются galP Escherichia coli K-12 (SEQ ID NO. 1), glf Zymomonas mobilis (SEQ ID NO. 2), cscB Escherichia coli W (SEQ ID NO. 3), fupL Leuconostoc pseudomesenteroides (SEQ ID NO. 4), lacY Escherichia coli K-12 (SEQ ID NO. 5), fucP Escherichia coli K-12 (SEQ ID NO. 6), nanT Escherichia coli K-12 (SEQ ID NO. 7), nagP Xanthomonas campestris (SEQ ID NO. 8), glcP Bifidobacterium longum NCC2705 (SEQ ID NO. 9), glcP Bacillus subtilis (SEQ ID NO. 10), sgIS Vibrio parahaemolyticus (SEQ ID NO. 11), xylE Escherichia coli K-12 (SEQ ID NO. 12), araE Bacillus subtilis 168 (SEQ ID NO. 13). Таким образом, в дополнительном и/или альтернативном воплощении генетически сконструированная клетка-хозяин содержит и экспрессирует по меньшей мере один ген, содержащий белок-кодирующую область упомянутых выше генов или их функциональных вариантов.
В предпочтительном воплощении подходящий транспортер глюкозы, не зависимый от PEP-PTS, представляет собой белок облегченной диффузии ссахара и/или пермеазу транслокации глюкозы. Подходящий белок облегченой диффузии глюкозы кодируется геном glf Zymomonas mobilis. Подходящая пермеаза транслокации глюкозы кодируется геном galP Е. coli K-12. Пермеаза транслокации глюкозы также известна как симпортер галактозы-протонов или пермеаза галактозы, но также импортирует глюкозу через клеточную мембрану.
В еще одном предпочтительном воплощении подходящий транспортер фруктозы, независимый от PEP-PTS, представляет собой белок облегченной диффузии сахара и/или белок-переносчик фруктозы. Подходящий белок облегченной диффузии фруктозы кодируется геном glf Zymomonas mobilis. Подходящий белок-переносчик фруктозы кодируется геном fupL Leuconostoc pseudomesenteroides.
Обычно, и на протяжении всего настоящего раскрытия, термины «повышенная внутриклеточная доступность сахарофосфата» или «повышенная/улучшенная поставка сахарофосфата» относятся к повышенной способности генетически модифицированной микробной клетки образовывать повышенные внутриклеточные количества указанного сахарофосфата, по сравнению с немодифицированной микробной клеткой, обеспечивающей повышенный поток углерода через путь биосинтеза требуемого углевода. Вследствие этого, повышенная продукция указанного требуемого углевода указанной генетически модифицированной микробной клеткой представляет собой прямой показатель повышенного внутриклеточного количества указанного сахарофосфата. Кроме того, способы, нацеленные на количественную оценку внутриклеточных метаболитов, и/или потока углерода клеток, могут быть найдены в литературе, известной специалисту в данной области (например, Lammerhofer and Weckwerth, «Metabolomics in Practice: Successful Strategies to Generate and Analyze Metabolic Data», Wiley-VCH, Weinheim, Germany (2013)).
В дополнительном и/или альтернативном воплощении экспрессия и/или активность генов и/или белков, соответственно, конкурирующих с биосинтезом требуемого углевода, может быть снижена или ослаблена в генетически сконструированной клетке-хозяине. Неограничивающие примеры таких противодействующих белков/активностей белков включают по меньшей мере один, выбранный из группы, состоящей из нижеследующего: р-галактозидаза (например, LacZ Е. coli K-12 (№доступа NP_414878)), УДФ-глюкозо:ундекапренилфосфатглюкозо-1-фосфаттрансфераза (например, WcaJ E.coli K-12 (№доступа NP_416551)), L-фукозоизомераза (например, Fucl Е. coli K-12), фукулокиназа (например, FucK Е. coli K-12 (№доступа NP_417282)), N-ацетилглюкозамин-6-фосфатдеацетилаза (например, NagA Е. coli K-12 (№доступа NP_415203)), глюкозамин-6-фосфатдезаминаза (например, NagB E.coli K-12 (№доступа NP_415204)), N-ацетилманнозаминкиназа (например, NanK E.coli K-12 (№доступа NP_417689)), N-ацетилманнозамин-6-фосфатэпимераза (например, NanE Е. coli K-12 (№доступа NP_417690)), альдолаза N-ацетилнейраминовой кислоты (например, NanA Е. coli K-12 (№доступа NP_417692)), пермеаза сиаловой кислоты (например, NanT Е. coli K-12 (№доступа NP_417691)).
В дополнительном и/или альтернативном воплощении генетически сконструированная микробная клетка способна метаболизировать сахарозу, таким образом, содержа один или более генов, кодирующих: (i) гетерологичную PTS-зависимую транспортную систему утилизации сахарозы (например, гены Klebsiella pneumoniae scrYAB (SEQ ID NO. 14) или гены scrYAB Salmonella typhimurium (SEQ ID NO. 15), состоящие из порина сахарозы (scrY), субъединицы II PTS транспортера, специфичного в отношении сахарозы (scrA), и сахарозо-6-фосфатгидролазы (scrB), и/или (ii) гетерологичную PTS-зависимую систему транспорта сахарозы (например, гены scrYA Klebsiella pneumoniae или гены scrYA Salmonella typhimurium) в комбинации с геном сахарозофосфатсинтазы (например, ген spsA Anabaena sp.РСС7120 (№доступа AJ302071)) и/или (iii) гетерологичную PTS-независимую систему утилизации сахарозы (например, гены Е. coli W cscBKA (SEQ ID NO. 16), состоящую из фруктокиназы (cscK), сахарозогидролазы (cscA) и сахарозопермеазы (cscB), и/или (iv) гетерологичную систему утилизации сахарозы, состоящую из гена сахарозопермеазы (например, Е. coli W cscB) в комбинации с геном сахарозофосфорилазы (например, ген basP Bifidobacterium adolescentis (№доступа WP_011742626)) или геном сахарозосинтазы (например, ген susA Anabaena sp, (№доступа САА09297)).
В дополнительном и/или альтернативном воплощении микробная клетка содержит белок-экспортер или пермеазу, экспортирующую целевой углевод из клетки, предпочтительно, эффлюксный транспортер сахара.
В дополнительном и/или альтернативном воплощении клетка-хозяин представляет собой микробную клетку, предпочтительно, бактериальную клетку, выбранную из группы, состоящей из бактерий рода Escherichia, Lactobacillus, Corynebacterium, Bacillus, Streptococcus, Enterococcus, Lactococcus и Clostridium, предпочтительно, бактериальную клетку, которая выбрана из группы бактериальных видов, состоящих из Escherichia coli, Corynebacterium glutamicum, Clostridium cellulolyticum, Clostridium ljungdahlii, Clostridium autoethanogenum, Clostridium acetobutylicum, Bacillus subtilis, Bacillus megaterium, Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus helveticus, Lactobacillus delbrueckii и Lactococcus lactis. В еще одном воплощении микробная клетка представляет собой Escherichia coli. Специалисту в данной области будет известно о дополнительных бактериальных штаммах при чтении настоящего раскрытия.
Согласно второму аспекту предложено применение генетически сконструированной клетки-хозяина, как описано в данном документе, для продукции требуемого углевода, где указанную клетку-хозяина культивируют в присутствии смеси моносахаридов, состоящей из глюкозы и по меньшей мере второго моносахарида группы фруктозы и галактозы. Указанная клетка генетически сконструирована таким образом, чтобы демонстрировать повышенную внутриклеточную доступность по меньшей мере одного сахарофосфата, релевантного в отношении продукции требуемого углевода. Указанный сахарофосфат может быть выбран из группы, состоящей из фосфоенолпирувата (PEP), дигидроксиацетонфосфата, фруктозо-6-фосфата, фруктозо-1-фосфата, фруктозо-1,6-бисфосфата, глюкозо-6-фосфата, глюкозо-1-фосфата, галактозо-1-фосфата, маннозо-1-фосфата, маннозо-6-фофата, глюкозамин-6-фосфата, глюкозамин-1-фосфата, N-ацетилглюкозамин-6-фосфата, N-ацетилглюкозамин-1-фосфата, N-ацетилманнозамин-6-фосфата, УДФ-глюкозы, УДФ-галактозы, СМР-N-ацетилнейраминовой кислоты, ГДФ-маннозы, ГДФ-фукозы и УДФ-N-ацетилглюкозамина.
Согласно третьему аспекту предложен способ ферментативного получения требуемого углевода, включающий следующие стадии:
a) предоставление генетически сконструированного микроорганизма, способного продуцировать требуемый углевод, где указанный микроорганизм демонстрирует повышенную внутриклеточную доступность по меньшей мере одного сахарофосфата за счет сниженной и/или ослабленной экспрессии и/или активности по меньшей мере одного белка, что приводит к потреблению указанного внутриклеточного сахарофосфата в указанном сконструированном микроорганизме;
b) культивирование указанного генетически сконструированного микроорганизма в культуральной среде, пермиссивной в отношении продукции указанного требуемого углевода, где основной источник углерода представляет собой смесь моносахаридов, состоящую из глюкозы и по меньшей мере второго моносахарида группы из фруктозы и галактозы;
c) выделение указанного требуемого сахарида из культурального бульона.
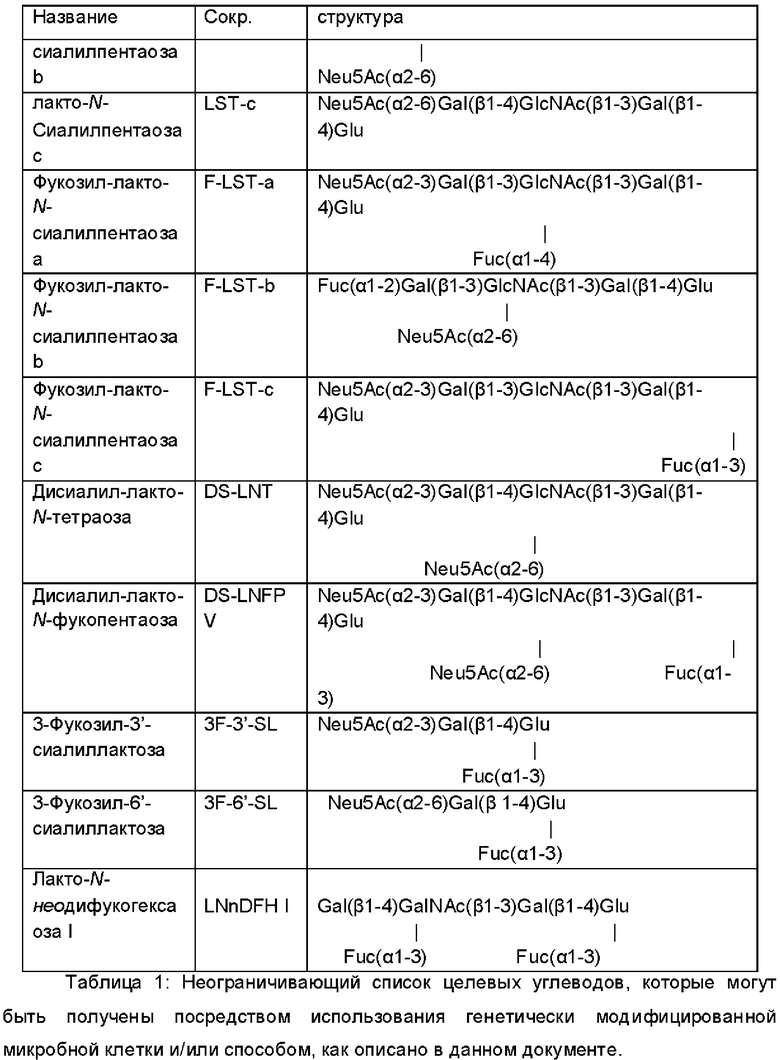
В дополнительном и/или альтернативном воплощении целевой углевод представляет собой олигосахарид грудного молока или его строительный блок. Список целевых углеводов, которые могут быть продуцированы посредством использования генетически модифицированной микробной клетки и/или способа, как описано в данном документе, раскрыт в таблице 1. Предпочтительно, требуемый углевод выбран из группы, состоящей из 2'-фукозиллактозы, 3-фукозиллактозы, 2',3-дифукозиллактозы, 3'-сиалиллактозы, 6'-сиалиллактозы, 3-фукозил-3'-сиалиллактозы, лакто-N-тетраозы, лакто-N-неотетраозы, лакто-N-фукопентаозы I, лакто-N-фукопентаозы II, лакто-N-фукопентаозы III, лакто-N-фукопентаозы V, лакто-N-дифукозилгексозы I, лакто-N-дифукозилгексаозы II, лакто-N-сиалилпентаозы LSTa, LSTb, LSTc.
Предпочтительно, смесь глюкозы и по меньшей мере одного дополнительного моносахарида представляет собой смешанное сырье из глюкозы и фруктозы, предпочтительно полученное в результате гидролиза сахарозы.
В дополнительном и/или альтернативном воплощении гидролиз сахарозы является неполным, таким образом, что существенные количества сахарозы остаются в сырье. Таким образом, количество сахарозы в гидролизованном и/или стерилизованном теплом сырье, больше чем 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или больше чем 80%.
В дополнительном и/или альтернативном воплощении микробная клетка культивируется без поставки извне акцепторного субстрата, например, N-ацетилглюкозамина или лактозы, в частности, при культивации для продукции целевого олигосахарида.
Настоящее изобретение будет описано относительно конкретных воплощений и со ссылкой на графические материалы, но данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины первый, второй и тому подобное в описании и в формуле изобретения используются для проведения различия между похожими элементами и не обязательно для описания последовательности, во времени, в пространстве, по рангу или любым другим образом. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми в соответствующих обстоятельствах, и что воплощения изобретения, описанные в данном документе, способны работать в последовательностях, отличных от описанных или проиллюстрированных в данном документе.
Следует отметить, что термин «содержащий», используемый в формуле изобретения, не следует считать ограничивающимся средствами, перечисленными в дальнейшем; он не исключает других элементов или стадий. Таким образом, его следует считать определяющим наличие заявленных признаков, целых чисел, стадий или компонентов, на которые ссылаются, но он не исключает наличие или добавление одного или более других признаков, целых чисел, стадий или компонентов или их групп. Таким образом, объем выражения «устройство, содержащее средства А и В» не следует ограничивать устройствами, состоящими только из компонентов А и В. Оно означает, что в отношении настоящего изобретения, единственными релевантными компонентами устройства являются А и В.
Ссылка на всем протяжении данного описания изобретения на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанные в связи с данным воплощением, включены в по меньшей мере одно воплощение настоящего изобретения. Таким образом, появления фраз «в одном воплощении» или «в воплощении» в разных местах по всему объему данного описания изобретения не обязательно все относятся к одному и тому же воплощению, но могут. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом, как будет очевидно среднему специалисту в данной области из данного раскрытия, в одном или более воплощениях.
Аналогично, следует понимать, что в описании иллюстративных воплощений изобретения разные признаки изобретения иногда сгруппированы вместе в одном единственном воплощении, фигуре или его описании в целях упрощения раскрытия и помощи в понимании одного или более из разных аспектов изобретения. Данный способ раскрытия, однако, не нужно считать отражающим мысль, что заявленное изобретение требует больше признаков, чем явным образом перечислены в каждом пункте. Скорее, как отражено в приведенной ниже формуле изобретения, аспекты изобретения заключаются меньше чем во всех признаках одного вышеизложенного раскрытого воплощения. Таким образом, формула изобретения после подробного описания явным образом включена тем самым в данное подробное описание, причем каждый пункт отдельно стоит в виде отдельного воплощения данного изобретения.
Кроме того, в то время как некоторые воплощения, описанные в данном документе, включают некоторые, но не все признаки, включенные в другие воплощения, подразумевается, что комбинации признаков разных воплощений находятся в объеме изобретения и образуют разные воплощения, как будет понятно специалистам в данной области. Например, в приведенной ниже формуле изобретения любое из заявленных воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данном документе как способ или комбинация элементов способа, которые могут быть реализованы посредством процессора компьютерной системы или с помощью других средств выполнения функции. Таким образом, процессор с необходимыми инструкциями для осуществления такого способа или элемента способа образует средство осуществления способа или элемента способа. Кроме того, описанный в данном документе элемент воплощения аппарата представляет собой пример средства осуществления функции, выполняемой элементом, с целью осуществления изобретения.
В описании и графических материалах, предоставленных в данном документе, изложены многочисленные конкретные подробности. Однако, понятно, что воплощения изобретения можно осуществлять на практике без данных конкретных подробностей. В других примерах хорошо известные способы, структуры и методики не были показаны подробно для того, чтобы не затруднять понимание данного описания.

Сейчас изобретение будет описано посредством подробного описания нескольких воплощений изобретения. Ясно, что другие воплощения изобретения могут быть сконфигурированы в соответствии со знанием специалистов в данной области без отступления от истинной сущности или технической идеи изобретения, причем изобретение ограничивается только прилагаемой формулой изобретения.
В одном воплощении штамм Е. coli, имеющий генотип nagABE-, manXYZ-метаболически сконструирован как эффективный продуцент N-ацетилглюкозамина (GlcNAc) с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии. Таким образом, гетерологичная экспрессия гена, кодирующего глюкозамин-6-фосфатацетилтрансферазу, способную переносить ацетат с ацетил-СоА на глкозамин-6-фосфат, таким образом, образуя N-ацетилглюкзамин-6-фосфат, является необходимой. В предпочтительном воплощении данный штамм-продуцент дополнительно генетически конструируют посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf. Данная дополнительная генетическая модификация делает возможной культивацию сконструированного штамма-продуцента на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но повышая поставку предшественника (фруктозо-6-фосфат) для продукции N-ацетилглюкозамина. В дополнительном воплощении ген, кодирующий глутамин-фруктозо-6-фосфатаминотрансферазу (например, GlmS Е. coli), и/или ген, кодирующий HAD-подобную сахарофосфатазу (например, YihX Е. coli, YqaB Е. coli), способную дефосфорилировать N-ацетилглюкозамин-6-фосфат до N-ацетилглюкозамина, экспрессируется/сверхэкспрессируется для содействия синтезу GlcNAc.
В еще одном воплощении штамм Е. coli, имеющий генотип lacY+, lacZ-, fucIK-, wcaJ-, метаболически сконструирован как эффективный продуцент L-фукозы с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, а также лактозы в качестве акцепторного субстрата. Таким образом, необходима сверхэкспрессия по меньшей мере одного из генов Е. coli manA, manC, manB, gmd и wcaG, а также экспрессия гетерологичной α-1,2-фукозилтрансферазы, способной переносить фукозу с ГДФ-фукозы на лактозу, с образованием, таким образом, 2'-фукозиллактозы, и α-1,2-фукозидазы, способной высвобождать свободную L-фукозу из 2'-фукозиллактозы. В одном воплощении данный штамм-продуцент дополнительно конструируют посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf. Данная дополнительная генетическая модификация делает возможной культивацию сконструированного штамма-продуцента на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но повышая поставку предшественника (фруктозо-6-фосфат) для продукции L-фукозы.
В еще одном воплощении штамм Е. coli, имеющий генотип nanKETA-, nagAB-, метаболически сконструирован как эффективный продуцент N-ацетилнейраминовой кислоты (Neu5Ac) с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии. Таким образом, необходима сверхэкспрессия по меньшей мере одного из генов, кодирующих или (i) глюкозамин-6-фосфатацетилтрансферазу и N-ацетилглюкозамин-2-эпимеразу и синтетазу N-ацетилнейраминовой кислоты или (ii) УДФ-N-ацетилглюкозамин-2-эпимеразу и синтетазу N-ацетилнейраминовой кислоты. Поскольку синтез N-ацетилнейраминовой кислоты представляет собой процесс, зависимый от фосфоенолпирувата (PEP), предпочтительно избегать конкурирующих реакций, приводящих к потреблению PEP. Таким образом, в предпочтительном воплощении данный штамм-продуцент дополнительно конструируют посредством уменьшения и/или ослабления импортирования указанного(ых) источника(ов) углерода и энергии за счет механизма, зависимого от фосфоенолпируват:сахарофосфотрансферазы, например, посредством уменьшения и/или ослабления экспрессии гена глюкозо-РЕР-пермеазы ptsG и/или гена фруктозо-РЕР-пермеазы fruA и/или генов маннозо-РЕР-пермеазы manXYZ. Наряду с экспрессией/сверхэкспрессией по меньшей мере одного гена, кодирующего транспортер, независимый от фосфоенолпируват:сахарофосфотрансферазы (независимый от PEP-PTS), обеспечивающий перенос моносахарида(ов) в сконструированную клетку, а также фруктокиназу (например, ген cscK Е. coli W) и глюкокиназу (например, ген glk Е, coli K-12), способную активировать фруктозу до фруктозо-6-фосфата и глюкозу до глюкозо-6-фосфата, соответственно, данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве главного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (фруктозо-6-фосфата, фосфоенолпирувата) для продукции N-ацетилнейраминовой кислоты.
В еще одном воплощении штамм Е. coli, имеющий генотип nagABE-, manXYZ-, lacZ-, метаболически сконструирован как эффективный продуцент N-ацетиллактозамина (LacNAc) с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, а также GlcNAc в качестве акцепторного субстрата. Таким образом, необходима экспрессия/сверхэкспрессия генов, кодирующих глюкозамин-6-фосфатацетилтрансферазу, транспортер, независимый от фосфоенолпируват:сахарофосфотрансферазы, способный переносить N-ацетил-глюкозамин в клетку, и β-1,4-галактозилтрансферазу, способную переносить галактозу из УДФ-Gal на свободный N-ацетилглюкозамин, с образованием, таким образом, N-ацетиллактозамина. В предпочтительном воплощении данный штамм-продуцент дополнительно генетически конструируют посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатизомеразы pgi и/или гена глюкозо-6-фосфатдегидрогеназы zwf. Данная дополнительная генетическая модификация обеспечивает культивирование сконструированного штамма-продуцента на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (глюкозо-6-фосфат) для продукции N-ацетиллактозамина. В дополнительном воплощении по меньшей мере один из генов Е. coli pgm, galU и galE сверхэкспрессируется для содействия синтезу УДФ-Gal.
В еще одном воплощении штамм Е. coli, имеющий генотип nagAB-, метаболически сконструирован как эффективный продуцент лакто-N-биозы (LNB) посредством общей ферментации с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии. Таким образом, необходима экспрессия/сверхэкспрессия генов, кодирующих глюкозамин-6-фосфатацетилтрансферазу, способную переносить ацетат с ацетил-КоА на глюкозамин-6-фосфат, таким образом, образуя N-ацетилглюкозамин-6-фосфат, HAD-подобную сахарофосфатазу, способную дефосфорилировать N-ацетилглюкозамин-6-фосфат, таким образом, образуя N-ацетилглюкозамин, и β-1,3-галактозилтрансферазу, способную переносить галактозу с УДФ-Gal на свободный N-ацетилглюкозамин, таким образом, образуя лакто-N-биозу. В одном предпочтительном воплощении данный штамм-продуцент дополнительно генетически сконструирован посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf. Данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на смешанном сырье из моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (фруктозо-6-фосфата и глюкозо-6-фосфата) для продукции лакто-N-биозы. В дополнительном воплощении по меньшей мере один из генов Е. coli glmS, pgm, galU, galE сверхэкспрессируется для содействия синтезу GlcNAc и/или УДФ-Gal.
В еще одном воплощении штамм Е. coli, имеющий генотип lacY+, lacZ-, nanKETA-, nagAB-, метаболически сконструирован как эффективный продуцент 3'-сиалиллактозы с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, а также лактозы в качестве акцепторного субстрата. Таким образом, штамм-продуцент N-ацетилнейраминовой кислоты, как описано, генетически сконструирован посредством экспрессии гетерологичной синтетазы CMP-N-ацетилнейраминовой кислоты, синтазы N-ацетилнейраминовой кислоты и α-2,3-сиалилтрансферазы, способной переносить N-ацетилнейраминовую кислоту с СМР-Neu5Ac на лактозу, образуя, таким образом, 3'-сиалиллактозу. Что касается синтеза N-ацетилнейраминовой кислоты, продукция 3'-SL представляет собой процесс, зависимый от фосфоенолпирувата (PEP). Таким образом, в предпочтительном воплощении указанный штамм-продуцент 3'-SL дополнительно сконструирован посредством уменьшения и/или ослабления импортирования указанного(ых) источника(ов) углерода и энергии за счет механизма, зависимого от фосфоенолпируват:сахарофосфотрансферазы, например, посредством уменьшения и/или ослабления экспрессии гена глюкозо-РЕР-пермеазы ptsG и/или гена фруктозо-РЕР-пермеазы fruA и/или генов маннозо-РЕР-пермеазы manXYZ. Наряду с экспрессией/сверхэкспрессией по меньшей мере одного гена, кодирующего транспортер, независимый от фосфоенолпируват:сахарофосфотрансферазы (независимый от PEP-PTS), обеспечивающий перенос моносахарида(ов) в сконструированную клетку, а также фруктокиназу (например, ген cscK Е. coli W) и глюкокиназу (например, ген glk Е. coli K-12), способную активировать фруктозу до фруктозо-6-фосфата и глюкозу до глюкозо-6-фосфата, соответственно, данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве главного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (фруктозо-6-фосфата, фосфоенолпирувата) для продукции 3'-сиалиллактозы.
В еще одном воплощении штамм Е. coli, имеющий генотип acY+, lacZ-, fuclK-, wcaJ-, метаболически сконструирован как эффективный продуцент 3'-фукозиллактозы с использованием сырья из смеси моносахаридов (например, гидролизованная сахароза) в качестве основного источника углерода и энергии, а также лактозы в качестве акцепторного субстрата. Таким образом, необходима сверхэкспрессия по меньшей мере одного из генов Е. coli manA, manC, manB, gmd и wcaG, а также экспрессия гетерологичной α-1,3-фукозилтрансферазы, способной переносить фукозу с ГДФ-фукозы на лактозу, таким образом, с образованием 3-фукозиллактозы. В одном предпочтительном воплощении данный штамм-продуцент дополнительно генетически сконструирован посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf. Данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (фруктозо-6-фосфат) для продукции 3-фукозиллактозы.
В еще одном воплощении штамм Е. coli, имеющий генотип acY+, lacZ-, nagB, wcaJ-, метаболически сконструирован для эффективной продукции лакто-N-триозы II (LNT-II) с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, а также лактозы в качестве акцепторного субстрата. Таким образом, необходима экспрессия гетерологичной β-1,3-N-ацетилглюкозаминилтрансферазы, способной переносить N-ацетилглюкозамин с УДФ-GlcNAc на лактозу, таким образом, с образованием лакто-N-триозы II. В одном предпочтительном воплощении данный штамм-продуцент дополнительно генетически сконструирован посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf. Данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (фруктозо-6-фосфат) для продукции лакто-N-триозы II. В дополнительном воплощении один из генов Е. coli glmS, glmU и glmM сверхэкспрессируется для содействия синтезу УДФ-GlcNAc.
В еще одном воплощении штамм Е. coli, имеющий генотип lacY+, lacZ-, nagB-, wcaJ-, метаболически сконструирован в качестве эффективного продуцента лакто-N-тетраозы (LNT) с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, а также лактозы в качестве акцепторного субстрата. Таким образом, необходима экспрессия гетерологичной β-1,3-N-ацетилглюкозаминилтрансферазы, способной переносить N-ацетилглюкозамин с УДФ-GlcNAc на лактозу, и β-1,3-галактозилтрансферазы, способной переносить галактозу с УДФ-галактозы на лакто-N-триозу II, с образованием, таким образом, лакто-N-тетраозы. В одном предпочтительном воплощении данный штамм-продуцент дополнительно генетически сконструирован посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf и/или гена глюкозо-6-фосфатизомеразы pgi. Данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (фруктозо-6-фосфат и глюкозо-6-фосфат) для продукции лакто-N-тетраозы. В дополнительном воплощении по меньшей мере один из генов Е. coli glmS, glmU, glmM, pgm, galU и galE сверхэкспрессируется для содействия синтезу УДФ-GlcNAc и/или УДФ-Gal.
В еще одном воплощении штамм Е. coli, имеющий генотип lacY+, lacZ-, nagB-, wcaJ-, метаболически сконструирован для эффективной продукции лакто-N-неотетраозы (LNnT) посредством общей ферментации с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии. Таким образом, штамм-продуцент LNnT генетически сконструирован посредством уменьшения и/или ослабления импортирования глюкозы за счет механизма, зависимого от фосфоенолпируват:сахарофосфотрансферазы, например, посредством уменьшения и/или ослабления экспрессии гена глюкозо-РЕР-пермеазы ptsG при одновременной экспрессии по меньшей мере одного гена, кодирующего транспортер, независимый от фосфоенолпируват:сахарофосфотрансферазы (независимый от PEP-PTS), обеспечивающий перенос глюкозы в сконструированную клетку. Кроме того, уровень экспрессии гена глюкокиназы glk и/или гена глюкозодегидрогеназы gcd снижен и/или аннулирован. По существу, необходима гетерологичная экспрессия (β-1,4-галктозилтрансферазы, способной переносить галактозу с УДФ-галактозы на глюкозу, с образованием, таким образом, лактозы, и β-1,3-N-ацетилглюкозаминилтрансферазы, способной переносить N-ацетилглюкозамин с УДФ-GlcNAc на лактозу, таким образом, с образованием лакто-N-триозы II, и β-1,4-галактозилтрансферазы, способной переносить галактозу с УДФ-галактозы на лакто-N-триозу II, с образованием, таким образом, лакто-N-неотетраозы. В одном предпочтительном воплощении данный штамм-продуцент дополнительно генетически сконструирован посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf и/или гена глюкозо-6-фосфатизомеразы pgi. Данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (глюкоза и фруктозо-6-фосфат и глюкозо-6-фосфат) для продукции лакто-N-неотетраозы посредством общей ферментации. В дополнительном воплощении по меньшей мере один из генов Е. coli glmS, glmU, glmM, pgm, galU и galE сверхэкспрессируется для содействия синтезу УДФ-GlcNAc и/или УДФ-Gal.
В еще одном воплощении штамм Е. coli, имеющий генотип lacY-, lacZ-, fuclK-, wcaJ-, метаболически сконструирован для эффективной продукции 2'-фукозиллактозы посредством общей ферментации с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии. Таким образом, уровень экспрессии гена глюкокиназы glk и/или гена глюкозодегидрогеназы gcd, а также активность механизма, зависимого от фосфоенолпируват:люкозофосфотрансферазы, снижен и/или аннулирован. Кроме того, ген транспортера, независимого от фосфоенолпируват:сахарофосфотрансферазы (независимый от PEP-PTS), экспрессируется или сверхэкспрессируется в указанном штамме Е. coli. Кроме того, по меньшей мере один из генов Е. coli manA, manC, manB, gmd, wcaG, pgm, galU и gale, а также гетерологичная β-1,4-галактозилтранфераза, способная переносить галактозу с УДФ-галактозы на глюкозу, с образованием, таким образом, лактозы, и α-1,2-фукозилтрансфераза, способная переносить фукозу с ГДФ-фукозы на лактозу, с образованием, таким образом, 2'-фукозиллактозы, экспрессируются/сверхэкспрессируются. В предпочтительном воплощении данный штамм-продуцент дополнительно сконструирован посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB и/или гена глюкозо-6-фосфатдегидрогеназы zwf и/или гена глюкозо-6-фосфатизомеразы pgi. Данная дополнительная генетическая модификация позволяет культивировать сконструированный штамм-продуцент на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (глюкоза и фруктозо-6-фосфат и глюкозо-6-фосфат) для продукции 2'-фукозиллактозы посредством общей ферментации.
В еще одном воплощении штамм Е. coli, имеющий генотип lacY+, lacZ-, fuclK-, wcaJ- manA-, метаболически сконструирован в качестве эффективного продуцента 2'3-дифукозиллактозы с использованием сырья из смеси моносахаридов (например, гидролизованной сахарозы) в качестве основного источника углерода и энергии, а также лактозы в качестве акцепторного субстрата. Таким образом, необходима экспрессия генов, демонстрирующих фруктокиназную активность (например, ген так Е. coli K-12) и активность механизма, зависимого от фосфоенолпируват:фруктозофосфотрансферазы, снижена и/или аннулирована. Данная клетка дополнительно генетически сконструирована посредством экспрессии/сверхэкспрессии по меньшей мере одного гена, кодирующего транспортер, независимый от фосфоенолпируват:фруктозофосфотрансферазы (независимый от PEP-PTS), обеспечивающий перенос фруктозы в сконструированную клетку, маннозоизомеразу, способную превращать фруктозу в маннозу (например, yihS Е. coli BL21, manl Agrobacterium radiobacter М-1), маннокиназу (например, manK Prevotella bryantii В14, manK Arthrobacter sp.штамм KM), способную активировать маннозу до маннозо-6-фосфата, а также по меньшей мере одну гетерологичную фукозилтрансферазу, демонстрирующую α-1,2- и/или α-1,3-фукозилтрансферазную активность, способную переносить фукозу с ГДФ-фукозы на лактозу и/или 2'-фукозиллактозу и/или 3-фукозиллактозу, таким образом, образуя 2'3-дифукозиллактозу. Данные дополнительные генетические модификации делают возможной культивацию сконструированного штамма-продуцента на сырье из смеси моносахаридов (например, гидролизованной сахарозе) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (маннозу/маннозо-6-фосфата) для продукции 2'3-дифукозиллактозы. В дополнительном воплощении сверхэкспрессия по меньшей мере одного из генов Е. coli manC, manB, gmd и wcaG сверхэкспрессируется для содействия синтезу ГДФ-Fuc.
Неограничивающие примеры для подходящих белков, демонстрирующих маннозоизомеразную активность (Manl) или маннокиназную активность (ManK), могут быть обнаружены в литературе (Hirose et al., Biosci Biotechnol Biochem. 2001 Mar;65(3):658-61; Hirose et al., Biotechnol Lett. 2003 Feb;25(4):349-52; Patel et al., Appl Environ Microbiol. 2011 May;77(10):3343-50; Hu et al., Int J Biol Macromol. 2016 Aug;89:328-35; Huang et al., Appl Microbiol Biotechnol. 2018 Mar;102(5):2051-2062; Mukai et al., Appl Environ Microbiol. 2003 Jul;69(7):3849-57; Fields and Russel, Microbiology. 2001 Apr;147(Pt 4):1035-43; Kroschewski et al., Mol Biochem Parasitol. 2000 Jan 5;105(1):71-80.).
В еще одном воплощении штамм Е. coli, имеющий генотип nagAB-, fuclK-, wcaJ, метаболически сконструирован в качестве эффективного продуцента Н-антигена I типа (НА-Т I) посредством общей ферментации с использованием сырья из смеси моносахаридов (например, смеси гидролизованной сахарозы и гидролизованной лактозы) в качестве основного источника углерода и энергии. Таким образом, штамм-продуцент генетически сконструирован посредством уменьшения и/или ослабления импортирования глюкозы за счет механизма, зависимого от фосфоенолпируват:сахарофосфотрансферазы, одновременно с экспрессией/сверхэкспрессией по меньшей мере одного гена, кодирующего транспортер, независимый от PEP-PTS, а также моносахаридкиназу, делающую возможным перенос глюкозы и/или галактозы в сконструированную клетку, а также активирующую данные моносахариды в фосфорилированную форму, соответственно. Кроме того, по меньшей мере экспрессируется/сверхэкспрессируется один ген, кодирующий глюкозамин-6-фосфатацетилтрансферазу, способную переносить ацетат с ацетил-КоА на глюкозамин-6-фосфат, с образованием, таким образом, N-ацетилглюкозамин-6-фосфата, HAD-подобную сахарофосфатазу, способную дефосфорилировать N-ацетилглюкозамин-6-фосфат, с образованием, таким образом, N-ацетилглюкозамина, гетерологичную β-1,3-галактозилтранферазу, способную переносить галактозу с УДФ-галактозы на N-ацетилглюкозамин, с образованием, таким образом, лакто-N-биозы, и α-1,2-фукозилтрансферазу, способную переносить фукозу с ГДФ-фукозы на лакто-N-биозу, с образованием Н-антигена I типа. В предпочтительном воплощении данный штамм-продуцент дополнительно генетически конструируют посредством уменьшения и/или ослабления экспрессии генов фосфофруктокиназы pfkA и/или pfkB. Данные генетические модификации обеспечивает культивирование сконструированного штамма-продуцента на сырье из смеси моносахаридов (например, смесь гидролизованной сахарозы и гидролизованной лактозы) в качестве основного источника углерода и энергии, одновременно предотвращая угнетение метаболизма штамма, но увеличивая поставку предшественника (N-ацетилглюкозамин, фруктозо-6-фосфат и галактозо-1-фосфат) для продукции Н-антигена I типа. В дополнительном воплощении по меньшей мере один из генов Е. coli glmS, galT, galE, manC, manB, gmd и wcaG сверхэкспрессируется для содействия синтезу GlcNAc и/или УДФ-Gal и/или ГДФ-Fuc.
В отношении Фиг. 1, схематично показана типичная природная микробная клетка. Указанная микробная клетка способна потреблять смешанное сырье, состоящее из глюкозы и фруктозы, что приводит к получению незначительного внутриклеточного пула глюкозо-6-фосфата и фруктозо-6-фосфата. Микробная клетка экспрессирует полинуклеотиды, кодирующие фосфоенолпируват:сахарофосфотрансферазные системы для импортирования глюкозы и фруктозы (PTS) в клетку. Продукты реакции главным образом поступают в гликолиз.
На Фиг. 2 схематично изображена типичная микробная клетка по изобретению, способная поставлять глюкозо-6-фосфат в высокой степени при культивировании на смешанном сырье, состоящем из глюкозы и фруктозы. Поскольку экспрессия глюкозо-6-фосфатизомеразы Pgi и/или глюкозо-6-фосфатдегидрогеназы Zwf уменьшалась или снизилась в результате делеции, функциональной инактивации или сайленсинга гена(ов) pgi и/или zwf, любой глюкозо-6-фосфат, образованный посредством импортирования глюкозы в клетку, может быть использован микробной клеткой для образования УДФ-Glc и/или УДФ-Gal. В одном варианте микробной клетки (Фиг. 3) фосфоенолпируват:сахарофосфотрансферазная(ые) система(ы) для фруктозы блокирована(ы), например, посредством делеции гена fruA. Вместо этого, фруктоза поступает в клетку посредством транспортера, независимого от фосфоенолпируват:сахарофосфотрансферазы (не зависимый от PEP-PTS), становясь активированной под действием фруктокиназы (например, CscK E.coli W) до фруктозо-6-фосфата. В одном варианте микробной клетки (Фиг. 4) фосфоенолпируват:сахарофосфотрансферазная(ые) система(ы) клетки для глюкозы также блокирована(ы), например, в результате делеции гена ptsG. Вместо этого, глюкоза поступает в клетку через транспортер, независимый от фосфоенолпируват:сахарофосфотрансферазы (независимый от PEP-PTS), активируясь под действием глюкокиназы (например, Glk Е. coli K-12) до глюкозо-6-фосфата.
На Фиг. 5 схематично изображена типичная микробная клетка по изобретению, способная поставлять глюкозо-6-фосфат и фруктозо-6-фосфат в более высокой степени, при культивировании на смешанном сырье, состоящем из глюкозы и фруктозы. Фосфоенолпируват:сахарофосфотрансферазная(ые) система(ы) клетки для фруктозы блокирована(ы), например, в результате делеции гена fruA. Вместо этого, фруктоза поступает в клетку через транспортер, независимый от фосфоенолпируват:сахарофосфотрансферазы (незавсимый от PEP-PTS), активируясь под действием фруктокиназы (например, CscK Е. coli W) до фруктозо-6-фосфата. В одном варианте микробной клетки (Фиг. 6), экспрессия фосфофруктокиназы(аз) Pfk и/или глюкозо-6-фосфатдегирогеназы Zwf уменьшена или ослаблена посредством делеции, функциональной инактивации или сайленсинга гена(ов) pfkA и/или pfkB и/или zwf, что приводит к повышенной доступности глюкозо-6-фосфата и фруктозо-6-фосфата, которые могут использоваться микробной клеткой для образования УДФ-Gal и/или ГДФ-Fuc и/или УДФ-GlcNAc и/или CMP-Neu5Ac. В одном варианте микробной клетки (Фиг. 7), клетка экспрессирует полинуклеотиды, кодирующие фосфоенолпируват:сахарофосфотрансферазные системы для имортирования глюкозы и фруктозы (PTS) в клетку. Экспрессия фосфофруктокиназы(аз) Pfk и/или глюкозо-6-фосфатдегидрогеназы Zwf уменьшена или ослаблена посредством делеции, функциональной инактивации или сайленсинга гена(ов) pfkA и/или pfkB и/или zwf, что приводит к повышенной доступности глюкозо-6-фосфата и фруктозо-6-фосфата.
На Фиг. 8 схематично изображена типичная микробная клетка по изобретению, способная поставлять глюкозо-6-фосфат и фруктозо-6-фосфат в более высокой степени при культивировании на смешанном сырье, состоящем из глюкозы и фруктозы. Клетка экспрессирует полинуклеотиды, кодирующие фосфоенолпируват:сахарофосфотрансферазные системы для импортирования глюкозы и фруктозы (PTS) в клетку. Экспрессия фосфофруктокиназы(аз) Pfk и/или глюкозо-6-фосфатизомеразы Pgi и/или глюкозо-6-фосфатдегидрогеназы Zwf уменьшена или ослаблена посредством делеции, функциональной инактивации или сайленсинга гена(ов) pfkA и/или pfkB и/или pgi и/или zwf. Вместе со сверхэкспрессией фруктозо-1,6-бисфосфатазы (например, glpX, fbp) образуется повышенная доступность глюкозо-6-фосфата и фруктозо-6-фосфата, и она может быть использована микробной клеткой для образования УДФ-Gal и/или ГДФ-Fuc и/или УДФ-GlcNAc и/или CMP-Neu5Ac.
На Фиг. 9 схематично изображена типичная микробная клетка по изобретению, способная генерировать высокую доступность глюкозо-6-фосфата и фруктозо-6-фосфата и фосфоенолпирувата при культивации на смешанном сырье, состоящем из глюкозы и фруктозы.
Фосфоенолпируват:сахарофосфотрансферазные системы клетки для глюкозы и фруктозы блокированы, например, посредством делеции генов ptsG и fruA, соответственно. Вместо этого, фруктоза и глюкоза поступают в клетку посредством транспортера, независимого от фосфоенолпируват:сахарофосфотрансферазы (не зависимого от PEP-PTS), активируемые под действием фруктокиназы (например, CscK Е. coli W) и глюкокиназы (например, Glk Е. coli K12), до фруктозо-6-фосфата и глюкозо-6-фосфата, соответственно. Кроме того, обходят потребление PEP фосфоенолпируват:сахарофосфотрансферазными системами. Наряду со сниженной и/или ослабленной экспрессией фосфофруктокиназы(аз) Pfk и/или глюкозо-6-фосфатдегидрогеназы Zwf, реализуемой посредством делеции, функциональной инактивации или сайленсинга гена(ов) pfkA и/или pfkB и/или zwf, достигается повышенная доступность глюкозо-6-фосфата и фруктозо-6-фосфата и фосфоенолпирувата. Это может быть использовано микробной клеткой для образования УДФ-Gal и/или ГДФ-Fuc и/или УДФ-GlcNAc и/или CMP-Neu5Ac.
На Фиг. 10 схематично изображена еще одна типичная микробная клетка по изобретению, способная образовывать повышенную доступность свободной глюкозы и глюкозо-6-фофата и фруктозо-6-фосфата при культивации на смешанном сырье, состоящем из глюкозы и фруктозы.
Фосфоенолпируват:сахарофосфотрансферазные системы клетки для глюкозы и фруктозы блокированы, например, посредством делеции генов ptsG и fruA, соответственно. Вместо этого, фруктоза и глюкоза поступают в клетку посредством транспортера, независимого от фосфоенолпируват:сахарофосфотрансферазы (не зависимого от PEP-PTS). Наряду с делецией гена glk, микробная клетка генетически сконструирована таким образом, что свободный мономер-глюкоза становится доступным в клетке. Вместо этого, фруктоза активируется фруктокиназой (например, CscK Е. coli W) до фруктозо-6-фосфата. Экспрессия фосфофруктокиназы(аз) Pfk и/или глюкозо-6-фософатдегидрогеназы Zwf уменьшена или снижена посредством делеции, функциональной инактивации или сайленсинга гена(ов) pfkA и/или pfkB и/или zwf. В итоге, это приводит к улучшенной внутриклеточной поставке свободной глюкозы и глюкозо-6-фосфата и фруктозо-6-фосфата. Глюкоза становится доступной в качестве субстрата для различных реакций гликозилирования, тогда как глюкозо-6-фосфат и фруктозо-6-фосфат могут быть использованы микробной клеткой для образования УДФ-Gal и/или ГДФ-Fuc и/или УДФ-GlcNAc и/или CMP-Neu5Ac. Кроме того, обходят потребление PEP фосфоенолпируват:сахарофосфотрансферазными системами.
На Фиг. 11 схематично изображена еще одна типичная микробная клетка по изобретению, способная достигать повышенную внутриклеточную доступность свободной маннозы и/или маннозо-6-фосфата при культивации на смешанном сырье, состоящем из глюкозы и фруктозы.
Фосфоенолпируват:сахарофосфотрансферазные системы клетки для фруктозы блокированы, например, в результате делеции гена fruA и/или генов manXYZ. Вместо этого, фруктоза поступает в клетку посредством сахаропермеазы и/или канала. Наряду с делецией генов, демонтсрирующих фруктокиназную активность (например, так) и/или маннозо-6-фосфатизомеразную активность (например, manA), а также экспрессией/сверхэкспрессией подходящей маннозоизомеразы (ManI) и маннокиназы (ManK), микробная клетка генетически сконструирована таким образом, что маннозо-6-фосфат становится доступным в клетке. Данный маннозо-6-фосфат может быть использован микробной клеткой для образования ГДФ-Мап и/или ГДФ-Fuc.
На Фиг. 12 схематично изображена еще одна типичная микробная клетка по изобретению, способная образовывать более высокую внутриклеточную доступность свободного фруктозо-6-фосфата и/или галактозо-1-фосфата при культивировании на смешанном сырье, состоящем из глюкозы и фруктозы и галактозы. Фосфоенолпируват:сахарофосфотрансферазные системы клетки для глюкозы блокированы, например, посредством делеции гена ptsG. Вместо этого, глюкоза поступает в клетку посредством транспортера, неависимого от фосфоенолпируват:сахарофосфотрансферазы (независимого от PEP-PTS). Экспрессия фосфофруктокиназы(аз) Pfk уменьшена или ослаблена посредством делеции, функциональной инактивации или сайленсинга гена(ов) pfkA и/или pfkB. Наряду с экспрессией/сверхэкспрессией подходящего транспортера, независимого от PEP-PTS, а также моносахаридкиназы, что обеспечивает перенос галактозы в сконструированную клетку, а также ее активацию до галактозо-1-фосфата, соответственно, микробная клетка генетически сконструирована таким образом, что фруктозо-6-фосфат и галактозо-1-фосфат становятся доступными в клетке. Данные фруктозо-6-фосфат и галактозо-1-фосфат могут быть использованы микробной клеткой для образования GlcNAc и/или ГДФ-Fuc и/или УДФ-Gal и/или CMP-Neu5Ac.
Согласно четвертому аспекту предложено применение требуемых углеводов в фармацетивческой и/или пищевой композиции, где целевой углевод предпочтительно получают способом или посредством генетически сконструированной клетки-хозяина согласно изобретению.
Примеры
Пример 1 - Получение сырья из смеси моносахаридов
50%-ный (масс./об.) раствор сахарозы готовили посредством растворения 500 г сахарозы в воде. Конечный объем раствора составлял 1 литр. При температуре 30°С-35°С рН регулировали посредством использования 96%-ной (об./об.) серной кислоты. Затем, раствор стерилизовали в вертикальном автоклаве (Systec VX-65, Linden, Германия) при 121°С в течение 45 минут. Образцы отбирали до и после тепловой стерилизации и хранили замороженными до анализа посредством высоко-эффективной жидкостной хроматографии (ВЭЖХ). ВЭЖХ осуществляли с использованием рефрактометрического детектора RID-10A (Shimadzu, Германия) и колонки Waters XBridge Amide 3,5 мкм (250×4,6 мм) (Eschborn, Германия), соединенной с системой ВЭЖХ Shimadzu. Изократическое элюирование проводили с помощью 30%-ого растворителя А (50% (об./об.) ацетонитрил в бидистиллированной воде, 0,1%-ого (об./об.) NH4OH) и 70%-ого растворителя В (80% (об./об.) ацетонитрил в бидистиллированной воде, 0,1% (об./об.) NH4OH) при 35°С и при скорости потока 1,4 мл мин-1. Образцы очищали посредством твердофазной экстракции на ионообменной матрице (Strata ABW, Phenomenex). Десять микролитров образца (разведение 1:5) наносили на колонку. Наконец, определяли относительное количество выявляемых сахаров. Как изображено в таблице 2, превращение сахарозы в моносахариды глюкозу и фруктозу увеличивалось со снижением значений рН растворов до тепловой обработки. Полное расщепление сахарозыкисление осуществ можно было наблюдать при значениях рН меньше или равных 3,50, когда подляли серной кислотой.
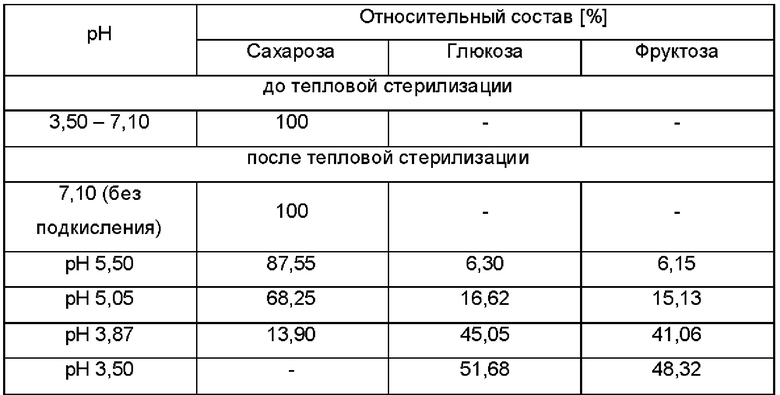

Пример 2 - Зависимый от сырья рост разных штаммов с делецией генов
Сравнивали поведение роста штамма Е. coli BL21(DE3) (дикий тип), а также мутированных штаммов Е. coli pfkA- (ApfkA), Е. coli pfkB- (ΔpfkB), E.coli pfkA- pfkB-(ΔpfkA ΔpfkA). Геномные делеции осуществляли в соответствии со способом Datsenko and Wanner (Proc. Natl. Acad. Sci. USA 97:6640-6645 (2000)). Все штаммы культивировали при 30°C в встряхиваемых колбах, объемом 100 мл, с 20 мл среды на основе минеральных солей, содержащей 7 г⋅л-1 NH4H2PO4, 7 г⋅л-1 K2HPO4, 2 г⋅л-1 KOH, 0,3 г⋅л-1 лимонной кислоты, 2 г⋅л-1 MgSO4 × 7⋅H2O и 0,015 г⋅л-1 CaCI2 × 6⋅H2O, с добавлением 1 мл⋅л-1 раствора микроэлементов (54,4 г⋅л-1 цитрат железа (III)-аммония, 9,8 г⋅л-1 MnCI2 × 4⋅H2O, 1,6 г⋅L-1 CoCI2 × 6⋅H2O, 1 г⋅л-1 CuCI2 × 2⋅H2O, 1,9 г⋅л-1 Н3 BO3, 9 г⋅л-1 ZnSO4 × 7⋅H2O, 1,1 г⋅л-1 Na2MoO4 × 2⋅H2O, 1,5 г⋅л-1 Na2SeO3, 1,5 г⋅л-1 NiSO4 × 6⋅H2O), и содержащей или 2% (масс./об.) глюкозы (А) или 1% (масс/об.) глюкозы/1% (масс/об.) фруктозы (В) в качестве источника углерода. Культуры инокулировали до OD (от англ. optical density - оптическая плотность) 0,1, и развитие роста отслеживали на протяжении 26 часов посредством измерения OD600. Как показано на Фиг. 2, E.coli pfkA- pfkB- лишь незначительно демонстрировали рост, когда глюкозу предоставляли в качестве единственного источника углерода и энергии, тогда как их рост был неотличим от штамма дикого типа, а также мутантов с одной единственной делецией, когда было доступно сырье из смеси моносахаридов.
Пример 3 - Продукция 2'-фукозиллактозы посредством сконструированного штамма E.coli
Штамм Е. coli BL21 (DE3), демонстрирующий генотип lacY+, lacZ-, fuclK-, wcaJ-, pfkA-, дополнительно генетически конструировали посредством сверхэкспрессии ферментов для синтеза de novo ГДФ-фукозы (ManB, ManC, Gmd, WcaG), гена 2'-фукозилтрансферазы wbgL из E.coli: O126, эффлюксного транспортера yberc0001_9420 из Yersinia bercovieri АТСС 43970 и кластера генов esc Е. coli W (№доступа СР002185.1), содержащего гены для сахаропермеазы, фруктокиназы, сахарогидролазы, а также транскрипционного репрессора (гены cscB, cscK, cscA, и cscR, соответственно), обеспечивающего рост штамма на сахарозе в качестве единственного источника углерода. Геномные делеции осуществляли в соответствии со способом Datsenko and Wanner (Proc. Natl. Acad. Sci. USA 97:6640-6645 (2000)). Геномную интеграцию гетерологичных генов проводили посредством транспозиции. Любую транспозазу EZ-Tn5TM (Epicentre, США) использовали для интеграции фрагментов линейной ДНК, или гиперактивный С9-мутант транспозазы mariner Himar1 (Proc. Natl. Acad. Sci. 1999, США 96:11428-11433) использовали для транспозиции. Гены подвергали оптимизации кодонов для экспрессии в Е. coli и получали синтетически посредством кооперации GenScript. Полученный в результате штамм культивировали при 30°С во встряхиваемых колбах, объемом 100 мл, с 20 мл среды на основе минеральных солей, содержащей 3 г/л KH2PO4, 12 г/л K2HPO4, 5 г/л (NH4)2SO4, 0,3 г/л лимонной кислоты, 2 г/л MgSO4 × 7H2O, 0,1 г/л NaCI и 0,015 г/л CaCI2 × 6H2O с 1 мл/л раствора микроэлементов (54,4 г/л цитрата железа (III)-аммония, 9,8 г/л MnCI2 × 4H2O, 1,6 г/л CoCI2 × 6H2O, 1 г/л CuCI2 × 2H2O, 1,9 г/л Н3 ВО3, 9 г/л ZnSO4 × 7H2O, 1,1 г/л Na2MoO4 2H2O, 1,5 г/л Na2SeO3, 1,5 г/л NiSO4 × 6H2O), и содержащей 2% (об./об.) глицерин, 2% (масс/об.) сахарозу, подвергающуюся стерильной фильтрации, или 2% гидролизат сахарозы в качестве источника углерода. Кроме того, добавляли 15 мМ лактозу, служащую в качестве акцепторного субстрата для продукции 2'-фукозиллактозы. Культуры инокулировали до OD 0,1, и культивацию останавливали, спустя 26 часов. Для количественной оценки 2'-FL в культуральном бульоне ВЭЖХ-анализ проводили, используя рефрактометрический детектор RID-10A (RID-10A) (Shimadzu, Германия) и колонку Waters XBridge Amide 3,5 мкм (250×4,6 мм) (Eschborn, Германия), соединенную с системой ВЭЖХ (Shimadzu, Германия). Элюирование проводили изократически с помощью 30%-ого А: 50% (об./об.) ACN в ddH2O, 0,1% (об./об.) NH4OH и 70%-ого В: 80% (об./об.) ACN в ddH2O, 0,1% (об./об.) NH4OH (об./об.) в качестве элюента при 35°С и при скорости потока 1,4 мл⋅мин-1. Культуральный супернатант подвергали стерильной фильтрации (размер пор 0,22 мкм) и чистили посредством твердофазной экстракции на ионообменной матрице (Strata ABW, Phenomenex). 10 мкл образцов наносили на колонку, и концентрацию 2'-фукозиллактозы рассчитывали в соответствии со стандартной кривой. Продуктивность сконструированного штамма во время роста на глицерине имело значение 100%. Как изображено в таблице 3, продукция 2'-FL была самая высокая, когда гидролизат сахарозы был предоставлен в качестве источника углерода и энергии.

Пример 4 - Общая ферментация 2'-фукозиллактозы сконструированным штаммом Е. coli во время роста на сырье из смеси моносахаридов
Штамм Е. coli BL21 (DE3), демонстрирующий генотип pfkA-, lacZ-, fuclK-, wcaJ-, glk-, gcd-, ptsG-, дополнительно генетически конструировали посредством сверхэкспрессии ферментов для синтеза de novo ГДФ-фукозы (ManB, ManC, Gmd, WcaG), гена 2'-фукозилтрансферазы wbgL из Е. coli: O126, гена эффлюксного транспортера сахара yberc0001_9420 из Yersinia bercovieri АТСС 43970, гена транспортера глюкозы glf из Zymomonas mobilis, гена β-1,4-галактозилтрансферазы ga1Tpm1141 из Pasteurella multocida (GenBank: АЕС04686), а также генов Е. coli galE и pgm, кодирующих УДФ-глюкозо-4-эпимеразу и фосфоглюкомутазу, соответственно. Геномные делеции осуществляли в соответствии со способом Datsenko and Wanner (Proc. Natl. Acad. Sci. USA 97:6640-6645 (2000)). Геномную интеграцию гетерологичных генов проводили посредством транспозиции. Любую транспозазу EZ-Tn5TM (Epicentre, США) использовали для интеграции фрагментов линейной ДНК, или гиперактивный С9-мутант транспозазы mariner Himar1 (Proc. Natl. Acad. Sci. 1999, USA 96:11428-11433) использовали для транспозиции. Гены подвергали оптимизации кодонов для экспрессии в E.coli и получали синтетически посредством кооперации GenScript.
Полученный штамм E.coli культивировали при 30°С в ферментере, объемом 3 л (New Brunswick, Edison, США), начиная с 1000 мл среды на основе минеральных солей, содержащей 7 г⋅л-1 NH4H2PO4, 7 г⋅л-1 KHPO4, 2 г⋅л-1 KOH, 0,3 г⋅л-1 лимонной кислоты, 2 г⋅л-1 MgSO4 × 7⋅H2O и 0,015 г⋅л-1 CaCI2 × 6⋅H2O с добавлением раствора микроэлементов 1 мл⋅л-1 (54,4 г⋅л-1 цитрата железа (III)-аммония, 9,8 г⋅л-1 MnCI2 × 4⋅H2O, 1,6 г⋅л-1 CoCI2 × 6⋅H2O, 1 г⋅л-1 CuCI2 × 2⋅H2O, 1,9 г⋅л-1 Н3 BO3, 9 г⋅л-1 ZnSO4 × 7⋅H2O, 1,1 г⋅л-1 Na2MoO4 × 2⋅H2O, 1,5 г⋅л-1 Na2SeO3, 1,5 г⋅л-1 NiSO4 × 6⋅H2O) и содержащей 2% (масс/об.) гидролизованной сахарозы в качестве источника углерода. Культивирование начинали с добавления 2,5% (об./об.) инокулюма из предварительной культуры, растущей на той же среде. Конец фазы периодического процесса характеризовался подъемом уровня растворенного кислорода. Добавку углерода, состоящую из полностью гидролизованной сахарозы с добавлением 2 г⋅л-1 MgSO4 × 7⋅H2O, 0,015 г⋅л-1 CaCI2 × 6-H2O и 1 мл⋅л-1 раствора микроэлементов, применяли сразу после окончания фазы периодического процесса. Применяли скорость подпитки 12,0-15,0 мл⋅л-1⋅ч-1, относительно исходного объема. Аэрацию поддерживали на уровне 3 л⋅мин-1. Растворенный кислород поддерживали на уровне 20-30% насыщения посредством осуществления контроля над скоростью перемешивания. рН поддерживали на уровне 6,7 посредством добавления 25%-го раствора аммония. Культивирование длилось на протяжении 86 часов и давало существенные количества 2'-FL в супернатанте культуры.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Jennewein Biotechnologie GmbH
<120> ФЕРМЕНТАТИВНАЯ ПРОДУКЦИЯ УГЛЕВОДОВ МИКРОБНЫМИ КЛЕТКАМИ С
ИСПОЛЬЗОВАНИЕМ СМЕШАННОГО СЫРЬЯ
<130> P 1901 WO
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 1395
<212> ДНК
<213> Escherichia coli
<400> 1
atgcctgacg ctaaaaaaca ggggcggtca aacaaggcaa tgacgttttt cgtctgcttc
60
cttgccgctc tggcgggatt actctttggc ctggatatcg gtgtaattgc tggcgcactg
120
ccgtttattg cagatgaatt ccagattact tcgcacacgc aagaatgggt cgtaagctcc
180
atgatgttcg gtgcggcagt cggtgcggtg ggcagcggct ggctctcctt taaactcggg
240
cgcaaaaaga gcctgatgat cggcgcaatt ttgtttgttg ccggttcgct gttctctgcg
300
gctgcgccaa acgttgaagt actgattctt tcccgcgttc tactggggct ggcggtgggt
360
gtggcctctt ataccgcacc gctgtacctc tctgaaattg cgccggaaaa aattcgtggc
420
agtatgatct cgatgtatca gttgatgatc actatcggga tcctcggtgc ttatctttct
480
gataccgcct tcagctacac cggtgcatgg cgctggatgc tgggtgtgat tatcatcccg
540
gcaattttgc tgctgattgg tgtcttcttc ctgccagaca gcccacgttg gtttgccgcc
600
aaacgccgtt ttgttgatgc cgaacgcgtg ctgctacgcc tgcgtgacac cagcgcggaa
660
gcgaaacgcg aactggatga aatccgtgaa agtttgcagg ttaaacagag tggctgggcg
720
ctgtttaaag agaacagcaa cttccgccgc gcggtgttcc ttggcgtact gttgcaggta
780
atgcagcaat tcaccgggat gaacgtcatc atgtattacg cgccgaaaat cttcgaactg
840
gcgggttata ccaacactac cgagcaaatg tgggggaccg tgattgtcgg cctgaccaac
900
gtacttgcca cctttatcgc aatcggcctt gttgaccgct ggggacgtaa accaacgcta
960
acgctgggct tcctggtgat ggctgctggc atgggcgtac tcggtacaat gatgcatatc
1020
ggtattcact ctccgtcggc gcagtatttc gccatcgcca tgctgctgat gtttattgtc
1080
ggttttgcca tgagtgccgg tccgctgatt tgggtactgt gctccgaaat tcagccgctg
1140
aaaggccgcg attttggcat cacctgctcc actgccacca actggattgc caacatgatc
1200
gttggcgcaa cgttcctgac catgctcaac acgctgggta acgccaacac cttctgggtg
1260
tatgcggctc tgaacgtact gtttatcctg ctgacattgt ggctggtacc ggaaaccaaa
1320
cacgtttcgc tggaacatat tgaacgtaat ctgatgaaag gtcgtaaact gcgcgaaata
1380
ggcgctcacg attaa
1395
<210> 2
<211> 1422
<212> ДНК
<213> Zymomonas mobilis
<400> 2
atgagttctg aaagtagtca gggtctagtc acgcgactag ccctaatcgc tgctataggc
60
ggcttgcttt tcggttacga ttcagcggtt atcgctgcaa tcggtacacc ggttgatatc
120
cattttattg cccctcgtca cctgtctgct acggctgcgg cttccctttc tgggatggtc
180
gttgttgctg ttttggtcgg ttgtgttacc ggttctttgc tgtctggctg gattggtatt
240
cgcttcggtc gtcgcggcgg attgttgatg agttccattt gtttcgtcgc cgccggtttt
300
ggtgctgcgt taaccgaaaa attatttgga accggtggtt cggctttaca aattttttgc
360
tttttccggt ttcttgccgg tttaggtatc ggtgtcgttt caaccttgac cccaacctat
420
attgctgaaa ttcgtccgcc agacaaacgt ggtcagatgg tttctggtca gcagatggcc
480
attgtgacgg gtgctttaac cggttatatc tttacctggt tactggctca tttcggttct
540
atcgattggg ttaatgccag tggttggtgc tggtctccgg cttcagaagg cctgatcggt
600
attgccttct tattgctgct gttaaccgca ccggatacgc cgcattggtt ggtgatgaag
660
ggacgtcatt ccgaggctag caaaatcctt gctcgtctgg aaccgcaagc cgatcctaat
720
ctgacgattc aaaagattaa agctggcttt gataaagcca tggacaaaag cagcgcaggt
780
ttgtttgctt ttggtatcac cgttgttttt gccggtgtat ccgttgctgc cttccagcag
840
ttagtcggta ttaacgccgt gctgtattat gcaccgcaga tgttccagaa tttaggtttt
900
ggagctgata cggcattatt gcagaccatc tctatcggtg ttgtgaactt catcttcacc
960
atgattgctt cccgtgttgt tgaccgcttc ggccgtaaac ctctgcttat ttggggtgct
1020
ctcggtatgg ctgcaatgat ggctgtttta ggctgctgtt tctggttcaa agtcggtggt
1080
gttttgcctt tggcttctgt gcttctttat attgcagtct ttggtatgtc atggggccct
1140
gtctgctggg ttgttctgtc agaaatgttc ccgagttcca tcaagggcgc agctatgcct
1200
atcgctgtta ccggacaatg gttagctaat atcttggtta acttcctgtt taaggttgcc
1260
gatggttctc cagcattgaa tcagactttc aaccacggtt tctcctatct cgttttcgca
1320
gcattaagta tcttaggtgg cttgattgtt gctcgcttcg tgccggaaac caaaggtcgg
1380
agcctggatg aaatcgagga gatgtggcgc tcccagaagt ag
1422
<210> 3
<211> 1248
<212> ДНК
<213> Escherichia coli
<400> 3
atggcactga atattccatt cagaaatgcg tactatcgtt ttgcatccag ttactcattt
60
ctctttttta tttcctggtc gctgtggtgg tcgttatacg ctatttggct gaaaggacat
120
ctagggttga cagggacgga attaggtaca ctttattcgg tcaaccagtt taccagcatt
180
ctatttatga tgttctacgg catcgttcag gataaactcg gtctgaagaa accgctcatc
240
tggtgtatga gtttcatcct ggtcttgacc ggaccgttta tgatttacgt ttatgaaccg
300
ttactgcaaa gcaatttttc tgtaggtcta attctggggg cgctattttt tggcttgggg
360
tatctggcgg gatgcggttt gcttgatagc ttcaccgaaa aaatggcgcg aaattttcat
420
ttcgaatatg gaacagcgcg cgcctgggga tcttttggct atgctattgg cgcgttcttt
480
gccggcatat tttttagtat cagtccccat atcaacttct ggttggtctc gctatttggc
540
gctgtattta tgatgatcaa catgcgtttt aaagataagg atcaccagtg cgtagcggca
600
gatgcgggag gggtaaaaaa agaggatttt atcgcagttt tcaaggatcg aaacttctgg
660
gttttcgtca tatttattgt ggggacgtgg tctttctata acatttttga tcaacaactt
720
tttcctgtct tttattcagg tttattcgaa tcacacgatg taggaacgcg cctgtatggt
780
tatctcaact cattccaggt ggtactcgaa gcgctgtgca tggcgattat tcctttcttt
840
gtgaatcggg tagggccaaa aaatgcatta cttatcggag ttgtgattat ggcgttgcgt
900
atcctttcct gcgcgctgtt cgttaacccc tggattattt cattagtgaa gttgttacat
960
gccattgagg ttccactttg tgtcatatcc gtcttcaaat acagcgtggc aaactttgat
1020
aagcgcctgt cgtcgacgat ctttctgatt ggttttcaaa ttgccagttc gcttgggatt
1080
gtgctgcttt caacgccgac tgggatactc tttgaccacg caggctacca gacagttttc
1140
ttcgcaattt cgggtattgt ctgcctgatg ttgctatttg gcattttctt cttgagtaaa
1200
aaacgcgagc aaatagttat ggaaacgcct gtaccttcag caatatag
1248
<210> 4
<211> 735
<212> ДНК
<213> Leuconostoc pseudomesenteroides
<400> 4
atggcacaaa acgcgcaaca tcataatccg cgaagcattt caatgagcaa atcacttatg
60
ttttttgcca tctcattgat tttaaatgcg atgggaaatg ttttgacgct cgtcacagct
120
tcacatataa aacccgcttt tttgggatca gcttattgga ctgctgcaga ggctaatcta
180
ggtcaagctt tattaggaaa taattcactt gtcttgtttt gggcattttt agttcttggc
240
atgcttattt cattcctgaa tgcgttatta atgaaaaagt tagattggca tcgtatcatt
300
ggtaatttct tgtttatgtt accattttca atttttattc aatggttttc aaatattttc
360
aatcaaatta tgccaaatgc taattcagtg gcagcaactg tgttatatac agtaattaat
420
tttattggtg ttggcttgat cgccgttgct atttcgattt atcaacgtgt gaatttagtg
480
ttacaccctg ccgatgattt gatgcaaatt ttacgtttca aatattttca cgggtcggct
540
ttcaaggcta tgtgggcgtc ctatattccg ccaacgattt ttgcaattat tgcctttgtg
600
atcactttcc ctaatttgta taatttcggg ttaggaatta tttttgcatt cttattccag
660
ggtggcatca caggaatcgc ggacaagtac gtctttaaga atttaaagca tcaggcaata
720
gatgttggta attaa
735
<210> 5
<211> 1254
<212> ДНК
<213> Escherichia coli
<400> 5
atgtactatt taaaaaacac aaacttttgg atgttcggtt tattcttttt cttttacttt
60
tttatcatgg gagcctactt cccgtttttc ccgatttggc tacatgacat caaccatatc
120
agcaaaagtg atacgggtat tatttttgcc gctatttctc tgttctcgct attattccaa
180
ccgctgtttg gtctgctttc tgacaaactc gggctgcgca aatacctgct gtggattatt
240
accggcatgt tagtgatgtt tgcgccgttc tttattttta tcttcgggcc actgttacaa
300
tacaacattt tagtaggatc gattgttggt ggtatttatc taggcttttg ttttaacgcc
360
ggtgcgccag cagtagaggc atttattgag aaagtcagcc gtcgcagtaa tttcgaattt
420
ggtcgcgcgc ggatgtttgg ctgtgttggc tgggcgctgt gtgcctcgat tgtcggcatc
480
atgttcacca tcaataatca gtttgttttc tggctgggct ctggctgtgc actcatcctc
540
gccgttttac tctttttcgc caaaacggat gcgccctctt ctgccacggt tgccaatgcg
600
gtaggtgcca accattcggc atttagcctt aagctggcac tggaactgtt cagacagcca
660
aaactgtggt ttttgtcact gtatgttatt ggcgtttcct gcacctacga tgtttttgac
720
caacagtttg ctaatttctt tacttcgttc tttgctaccg gtgaacaggg tacgcgggta
780
tttggctacg taacgacaat gggcgaatta cttaacgcct cgattatgtt ctttgcgcca
840
ctgatcatta atcgcatcgg tgggaaaaac gccctgctgc tggctggcac tattatgtct
900
gtacgtatta ttggctcatc gttcgccacc tcagcgctgg aagtggttat tctgaaaacg
960
ctgcatatgt ttgaagtacc gttcctgctg gtgggctgct ttaaatatat taccagccag
1020
tttgaagtgc gtttttcagc gacgatttat ctggtctgtt tctgcttctt taagcaactg
1080
gcgatgattt ttatgtctgt actggcgggc aatatgtatg aaagcatcgg tttccagggc
1140
gcttatctgg tgctgggtct ggtggcgctg ggcttcacct taatttccgt gttcacgctt
1200
agcggccccg gcccgctttc cctgctgcgt cgtcaggtga atgaagtcgc ttaa
1254
<210> 6
<211> 1317
<212> ДНК
<213> Escherichia coli
<400> 6
atgggaaaca catcaataca aacgcagagt taccgtgcgg tagataaaga tgcagggcaa
60
agcagaagtt acattattcc attcgcgctg ctgtgctcac tgttttttct ttgggcggta
120
gccaataacc ttaacgacat tttattacct caattccagc aggcttttac gctgacaaat
180
ttccaggctg gcctgatcca atcggccttt tactttggtt atttcattat cccaatccct
240
gctgggatat tgatgaaaaa actcagttat aaagcaggga ttattaccgg gttattttta
300
tatgccttgg gtgctgcatt attctggccc gccgcagaaa taatgaacta caccttgttt
360
ttagttggcc tatttattat tgcagccgga ttaggttgtc tggaaactgc cgcaaaccct
420
tttgttacgg tattagggcc ggaaagtagt ggtcacttcc gcttaaatct tgcgcaaaca
480
tttaactcgt ttggcgcaat tatcgcggtt gtctttgggc aaagtcttat tttgtctaac
540
gtgccacatc aatcgcaaga cgttctcgat aaaatgtctc cagagcaatt gagtgcgtat
600
aaacacagcc tggtattatc ggtacagaca ccttatatga tcatcgtggc tatcgtgtta
660
ctggtcgccc tgctgatcat gctgacgaaa ttcccggcat tgcagagtga taatcacagt
720
gacgccaaac aaggatcgtt ctccgcatcg ctttctcgcc tggcgcgtat tcgccactgg
780
cgctgggcgg tattagcgca attctgctat gtcggcgcac aaacggcctg ctggagctat
840
ttgattcgct acgctgtaga agaaattcca ggtatgactg caggctttgc cgctaactat
900
ttaaccggaa ccatggtgtg cttctttatt ggtcgtttca ccggtacctg gctcatcagt
960
cgcttcgcac cacacaaagt cctggccgcc tacgcattaa tcgctatggc actgtgcctg
1020
atctcagcct tcgctggcgg tcatgtgggc ttaatagccc tgactttatg cagcgccttt
1080
atgtcgattc agtacccaac aatcttctcg ctgggcatta agaatctcgg ccaggacacc
1140
aaatatggtt cgtccttcat cgttatgacc attattggcg gcggtattgt cactccggtc
1200
atgggttttg tcagtgacgc ggcgggcaac atccccactg ctgaactgat ccccgcactc
1260
tgcttcgcgg tcatctttat ctttgcccgt ttccgttctc aaacggcaac taactga
1317
<210> 7
<211> 1491
<212> ДНК
<213> Escherichia coli
<400> 7
atgagtacta caacccagaa tatcccgtgg tatcgccatc tcaaccgtgc acaatggcgc
60
gcattttccg ctgcctggtt gggatatctg cttgacggtt ttgatttcgt tttaatcgcc
120
ctggtactca ccgaagtaca aggtgaattc gggctgacga cggtgcaggc ggcaagtctg
180
atctctgcag cctttatctc tcgctggttc ggcggcctga tgctcggcgc tatgggtgac
240
cgctacgggc gtcgtctggc aatggtcacc agcatcgttc tcttctcggc cgggacgctg
300
gcctgcggct ttgcgccagg ctacatcacc atgtttatcg ctcgtctggt catcggcatg
360
gggatggcgg gtgaatacgg ttccagcgcc acctatgtca ttgaaagctg gccaaaacat
420
ctgcgtaaca aagccagtgg ttttttgatt tcaggcttct ctgtgggggc cgtcgttgcc
480
gctcaggtct atagcctggt ggttccggtc tggggctggc gtgcgctgtt ctttatcggc
540
attttgccaa tcatctttgc tctctggctg cgtaaaaaca tcccggaagc ggaagactgg
600
aaagagaaac acgcaggtaa agcaccagta cgcacaatgg tggatattct ctaccgtggt
660
gaacatcgca ttgccaatat cgtaatgaca ctggcggcgg ctactgcgct gtggttctgc
720
ttcgccggta acctgcaaaa tgccgcgatc gtcgctgttc ttgggctgtt atgcgccgca
780
atctttatca gctttatggt gcagagtgca ggcaaacgct ggccaacggg cgtaatgctg
840
atggtggtcg tgttgtttgc tttcctctac tcatggccga ttcaggcgct gctgccaacg
900
tatctgaaaa ccgatctggc ttataacccg catactgtag ccaatgtgct gttctttagt
960
ggctttggcg cggcggtggg atgctgcgta ggtggcttcc tcggtgactg gctgggaacc
1020
cgcaaagcgt acgtttgtag cctgctggcc tcgcagctgc tgattattcc ggtatttgcg
1080
attggcggcg caaacgtctg ggtgctcggt ctgttactgt tcttccagca aatgcttgga
1140
caagggatcg ccgggatctt accaaaactg attggcggtt atttcgatac cgaccagcgt
1200
gcagcgggcc tgggctttac ctacaacgtt ggcgcattgg gcggtgcact ggccccaatc
1260
atcggcgcgt tgatcgctca acgtctggat ctgggtactg cgctggcatc gctctcgttc
1320
agtctgacgt tcgtggtgat cctgctgatt gggctggata tgccttctcg cgttcagcgt
1380
tggttgcgcc cggaagcgtt gcgtactcat gacgctatcg acggtaaacc attcagcggt
1440
gccgtgccgt ttggcagcgc caaaaacgat ttagtcaaaa ccaaaagtta a
1491
<210> 8
<211> 1278
<212> ДНК
<213> Xanthomonas campestris
<400> 8
atgactaccg ccaggcccgc aaatcccgtt gtctcgatcg ccatcgtcgg cgtgctgttt
60
ttcatcatcg gctttttcac ctggatcaac gggccgctga tcaccttcgt gcggctggcg
120
ttcgacctca acgaggtcaa tgcgttcctg gtgctgatgg tgttctacct gtcgtacttc
180
ttcctggcgc tgccctcgtc atggatcctc aagcgcaccg gcatgaaaaa aggcctggcg
240
ctgagtctgg tggtgatggc gctgggcgcc gcagcattcg ggcaattcgc tacgcaacgc
300
tggtatccgg gcgcactggc cggcatgttc gtgatcggta gcggcctggc gttgttgcag
360
accgcgatca acccatacat cagtattctc gggccaatcg aaagtgcggc gcggcgcatc
420
gcgctgatgg gcatctgtaa caagattgcc ggcatcctgg cgccgatcct gatcggctcg
480
ctggtgctgc atggcatcgg cgatctctcc acgcaggtgg ccgcggccga tgcggcgacc
540
aagcagcaac tgctcaacgc gtttgccgcc aagatccatg caccatatct ggtgatgtcc
600
ggcgtgttgc tggtgctggc ggtgggcgtg ttgttctcgc cgctgcccga actcaaggcc
660
tccgaagcca atgccacgcc gggcagcggt ggcgcggcgc agaagtccag catcttccag
720
ttcccgcatc tgtggctggg cgtgttgtgc ctgttcgtgt atgtcggtgt ggaagtgatg
780
gccggcgatg ccatcggcac ttacggacac ggcttcaatt tgccgctgga cagcaccaag
840
ctgttcacct cctacacgct gggcgcaatg ttgctgggct atatcgccgg cctggtgctg
900
attccgcggg tgatttcgca ggcgcgctac ctgagcgtgt ctgcgctgct gggcgtgctg
960
ttctcgctgg gggcgctgtt cacccacggc tatgtgtcgg tggggttcgt ggccgcgctc
1020
ggttttgcca acgccatgat gtggccggcg atctttccgc tggccatccg cggcctgggc
1080
cggttcaccg agatcggttc ggcgttgctg gtgatgggca ttgccggcgg cgcgatcatt
1140
ccgcagctgt tcgccattct gaaacagcat tacgacttcc aggtggtgtt cgccgcgctg
1200
atggtgccgt gctacctgta catcctgttc tattcgctgc gcggccaccg tgtggggctg
1260
ccggctcaac cgaaatga
1278
<210> 9
<211> 1554
<212> ДНК
<213> Bifidobacterium longum
<400> 9
atgacgacga caacggcatc acccgtatcg aaacagacgg catccgcggc gcaggaaacc
60
agcgcaaccg gtgcggcggc caccgcaatc gaaaccatcg aaaccggcgt ggccggagtg
120
gcgggcgcgg ccacaaacgc ggcagccaac gcaatcgagg acctcgaagc cgccgaatcg
180
cacggcttct ccacgcgctt cccgctcaac agcgcattca tcttcacctt cggcgcgctc
240
ggcggcatgc tgttcggttt cgacaccggc atcatctccg gcgcctcccc gcttatcgaa
300
tcggacttcg gcctgagcgt ctctcagacc ggcttcatca cctcctcggt gctgatcggc
360
tcgtgcgcag gcgcgctgtc gatcggcgca ctgtctgacc ggttcggccg caagaagctg
420
ctcatcgtct ccgcgctgct gttcctgctc ggctcaggcc tgtgcgcctc ctccaccgga
480
ttcgcgatga tggtgtgcgc ccgcatcatc ctgggtctcg ccgtcggcgc ggcctccgcc
540
ctgaccccgg cgtacttggc cgaactggcg ccgaaggagc gtcgcggctc actgtccacg
600
ctgttccagc tcatggtcac cttcggcatt ctgctggcct acgcctccaa cctcggattc
660
ctgaaccaca acctcttcgg catccgcgac tggcgctgga tgctcggttc ggcgctggtg
720
ccggccgcct tgttgctgct cggcggcctg ttgctgcccg aatccccgcg ttatctggtg
780
aacaagggcg acacccgcaa cgccttcaaa gtgcttacgc tgattcgcaa ggacgtggat
840
cagacccagg tgcagattga gctggacgaa atcaaggccg tggccgcaca ggacaccaag
900
ggtggtgtgc gcgaactgtt ccgtatcgct cgtccggcgc tggtggccgc catcggtatc
960
atgctgttcc agcagctcgt gggcatcaac tcggtgatct acttcctgcc gcaggtgttc
1020
atcaagggct tcggcttccc tgaaggcgac gcgatctggg tgtcggtggg catcggcgtg
1080
gtgaacttcg tgagcaccat cgtggccacg cttatcatgg atcgtttccc gcgcaagggc
1140
atgctgatct tcggttccat cgtgatgacc gtttcgctcg cggtgctcgc cgtgatgaac
1200
ttcgtgggcg acgtggccgt gctggcagtg ccgacgatga ttctcatcgc tttctatatc
1260
ctcggctttg cggtctcgtg gggcccgatc gcctgggtgc ttatcggcga gatcttcccg
1320
ctgagcgtgc gcggcatcgg ctcatccttc ggctcggcgg cgaactggct gggcaacttc
1380
atcgtctccc agttcttcct cgtgctgctc gatgcgttcg gcaacaatgt gggcggcccg
1440
ttcgcgattt tcggcgtgtt ctcggccctg tccatcccgt tcgtgctgcg cttggtgccc
1500
gagaccaagg gcaagtcgct ggaggaaatc gagaaggaaa tgaccaagcg ctag
1554
<210> 10
<211> 1206
<212> ДНК
<213> Bacillus subtilis
<400> 10
atgttaagag ggacatattt atttggatat gctttctttt ttacagtagg tattatccat
60
atatcaacag ggagtttgac accattttta ttagaggctt ttaacaagac aacagatgat
120
atttcggtca taatcttctt ccagtttacc ggatttctaa gcggagtatt aatcgcacct
180
ttaatgatta agaaatacag tcattttagg acacttactt tagctttgac aataatgctt
240
gtagcgttaa gtatcttttt tctaaccaag gattggtatt atattattgt aatggctttt
300
ctcttaggat atggagcagg cacattagaa acgacagttg gttcatttgt tattgctaat
360
ttcgaaagta atgcagaaaa aatgagtaag ctggaagttc tctttggatt aggcgcttta
420
tctttcccat tattaattaa ttccttcata gatatcaata actggttttt accatattac
480
tgtatattca cctttttatt cgtcctattc gtagggtggt taattttctt gtctaagaac
540
cgagagtacg ctaagaatgc taaccaacaa gtgacctttc cagatggagg agcatttcaa
600
tactttatag gagatagaaa aaaatcaaag caattaggct tttttgtatt tttcgctttc
660
ctatatgctg gaattgaaac aaattttgcc aactttttac cttcaatcat gataaaccaa
720
gacaatgaac aaattagtct tataagtgtc tcctttttct gggtagggat catcatagga
780
agaatattga ttggtttcgt aagtagaagg cttgattttt ccaaatacct tctttttagc
840
tgtagttgtt taattgtttt gttgattgcc ttctcttata taagtaaccc aatacttcaa
900
ttgagtggta catttttgat tggcctaagt atagcgggga tatttcccat tgctttaaca
960
ctagcatcaa tcattattca gaagtacgtt gacgaagtta caagtttatt tattgcctcg
1020
gcaagtttcg gaggagcgat catctctttc ttaattggat ggagtttaaa ccaggatacg
1080
atcttattaa ccatgggaat atttacaact atggcggtca ttctagtagg tatttctgta
1140
aagattagga gaactaaaac agaagaccct atttcacttg aaaacaaagc atcaaaaaca
1200
cagtag
1206
<210> 11
<211> 1593
<212> ДНК
<213> Vibrio parahaemolyticus
<400> 11
atggtcttcg ccatttatgt cgcaattatc attggggtcg gactttgggt atctcgtgat
60
aaaaaaggca ctcagaaaag tacggaagat tatttcttgg cgggaaaatc tttgccttgg
120
tgggctgtcg gtgcttcgct aattgctgca aatatttctg cggaacaatt tataggaatg
180
tctggttcag gctattcaat tggcttggct atcgcatctt atgaatggat gtcggcaata
240
acattgatta ttgttggtaa gtactttcta cctattttca ttgaaaaagg aatctatacc
300
attcctgaat ttgttgaaaa acgcttcaat aaaaaactaa aaacaatttt ggccgttttt
360
tggatttcct tgtacatttt tgtaaaccta acttcagtac tgtatttagg tggtttggct
420
ctcgaaacca ttttgggtat tccgttgatg tactcaattc taggtcttgc gctgtttgcg
480
ttggtgtact caatttatgg tggtttatcg gcagtagtat ggaccgatgt catccaagtg
540
ttcttcttag ttttgggtgg ttttatgact acctacatgg cagtgagctt tattggtggt
600
acggacggtt ggttcgctgg ggtgtctaaa atggtcgatg cagctcctgg ccactttgag
660
atgatcttgg atcaaagtaa tccacaatac atgaaccttc ctggtattgc cgtattaatt
720
ggtggtcttt gggtagcaaa cttatattac tggggcttta accagtacat tattcaaaga
780
acgcttgctg caaaatcagt atcggaagct cagaaaggta ttgtttttgc agcgtttttg
840
aaacttatcg ttccgtttct cgtggtattg ccaggtattg ccgcttacgt tattacttcg
900
gacccacaac taatggcaag ccttggtgat attgcagcaa caaaccttcc aagtgctgct
960
aatgcggata aagcataccc ttggctaact cagttcttgc ctgttggtgt taaaggtgtt
1020
gtttttgcgg ctcttgctgc tgcaattgtt tcttcactag catcaatgct taactcaaca
1080
gccactatct tcactatgga tatttacaaa gagtatatct ctcctgactc aggtgaccac
1140
aagttggtga atgttgggcg tactgcagct gtggtggcac taattattgc ttgcctaatt
1200
gccccaatgt taggtggtat tggccaagca ttccaataca tccaagaata tacaggttta
1260
gttagccctg gtattttggc tgtattctta cttggcttat tctggaagaa aacaaccagt
1320
aaaggggcta ttattggtgt agtagcatca ataccatttg ccttgttctt gaaatttatg
1380
ccactttcca tgccatttat ggatcaaatg ctatacacat tattgtttac aatggttgtt
1440
atcgcattta caagtttgag cacatcaatt aatgatgatg atcctaaagg tattagtgtt
1500
acatcatcga tgtttgtaac agatcgaagc tttaatatcg ctgcttacgg cataatgatt
1560
gttttggcag tgttatatac attgttctgg taa
1593
<210> 12
<211> 1476
<212> ДНК
<213> Escherichia coli
<400> 12
atgaataccc agtataattc cagttatata ttttcgatta ccttagtcgc tacattaggt
60
ggtttattat ttggctacga caccgccgtt atttccggta ctgttgagtc actcaatacc
120
gtctttgttg ctccacaaaa cttaagtgaa tccgctgcca actccctgtt agggttttgc
180
gtggccagcg ctctgattgg ttgcatcatc ggcggtgccc tcggtggtta ttgcagtaac
240
cgcttcggtc gtcgtgattc acttaagatt gctgctgtcc tgttttttat ttctggtgta
300
ggttctgcct ggccagaact tggttttacc tctataaacc cggacaacac tgtgcctgtt
360
tatctggcag gttatgtccc ggaatttgtt atttatcgca ttattggcgg tattggcgtt
420
ggtttagcct caatgctctc gccaatgtat attgcggaac tggctccagc tcatattcgc
480
gggaaactgg tctcttttaa ccagtttgcg attattttcg ggcaactttt agtttactgc
540
gtaaactatt ttattgcccg ttccggtgat gccagctggc tgaatactga cggctggcgt
600
tatatgtttg cctcggaatg tatccctgca ctgctgttct taatgctgct gtataccgtg
660
ccagaaagtc ctcgctggct gatgtcgcgc ggcaagcaag aacaggcgga aggtatcctg
720
cgcaaaatta tgggcaacac gcttgcaact caggcagtac aggaaattaa acactccctg
780
gatcatggcc gcaaaaccgg tggtcgtctg ctgatgtttg gcgtgggcgt gattgtaatc
840
ggcgtaatgc tctccatctt ccagcaattt gtcggcatca atgtggtgct gtactacgcg
900
ccggaagtgt tcaaaacgct gggggccagc acggatatcg cgctgttgca gaccattatt
960
gtcggagtta tcaacctcac cttcaccgtt ctggcaatta tgacggtgga taaatttggt
1020
cgtaagccac tgcaaattat cggcgcactc ggaatggcaa tcggtatgtt tagcctcggt
1080
accgcgtttt acactcaggc accgggtatt gtggcgctac tgtcgatgct gttctatgtt
1140
gccgcctttg ccatgtcctg gggtccggta tgctgggtac tgctgtcgga aatcttcccg
1200
aatgctattc gtggtaaagc gctggcaatc gcggtggcgg cccagtggct ggcgaactac
1260
ttcgtctcct ggaccttccc gatgatggac aaaaactcct ggctggtggc ccatttccac
1320
aacggtttct cctactggat ttacggttgt atgggcgttc tggcagcact gtttatgtgg
1380
aaatttgtcc cggaaaccaa aggtaaaacc cttgaggagc tggaagcgct ctgggaaccg
1440
gaaacgaaga aaacacaaca aactgctacg ctgtaa
1476
<210> 13
<211> 1395
<212> ДНК
<213> Bacillus subtilis
<400> 13
atgaagaata ctccaactca attagaacca aatgttcctg taacaagaag ccattcaatg
60
ggatttgtca ttttgatctc atgtgcggcg gggcttggcg gcttattgta tggctatgac
120
acggcagtga tttctggcgc catcggtttt ctgaaagatt tatacagcct gagtccgttt
180
atggagggac ttgtcatttc aagcattatg attggaggag ttgtgggcgt cgggatatcc
240
ggatttttaa gtgacagatt cggccggaga aaaattttaa tgacagccgc tttgttattt
300
gcgatatcag caatcgtttc agcgctttct caagacgtgt ccaccttaat cattgcaagg
360
attatcgggg ggctgggaat cgggatgggc tcatcgctct ctgttacgta tattacagaa
420
gcggcaccgc ccgctatacg cggaagttta tcttcgttat atcagctctt tacgatactg
480
ggtatttccg caacatactt tattaatcta gctgtgcagc ggtccggaac atacgaatgg
540
ggcgtgcaca ccggctggag atggatgctt gcttatggaa tggtgccatc cgtcattttt
600
ttccttgtcc tgctcgtcgt cccggaaagt ccgagatggc tggcgaaagc gggcaaaaca
660
aatgaagctt taaagatcct gacacgtatt aatggagaaa ctgttgcaaa agaagaatta
720
aagaacattg agaactcttt aaaaatagaa caaatggggt cgctctccca gctgtttaag
780
ccgggtctca gaaaggcgct tgtcattgga atcctgctgg cgctgtttaa ccaagtcatc
840
ggcatgaacg cgattactta ctacgggccg gaaatcttta aaatgatggg attcgggcaa
900
aacgccggat ttgtgacgac ttgtatcgtc ggggttgtag aagttatttt taccgttatt
960
gcggtgttgc tgattgataa agtcggacga aaaaaactga tgtccatcgg ttctgctttt
1020
atggctattt ttatgatttt aatcgggacg tcgttttatt ttgagttaac aagcgggatc
1080
atgatgatcg tccttatatt aggttttgtc gctgctttct gtgtctcggt cggaccgatc
1140
acatggatta tgatttctga aatcttcccg aaccatctgc gtgcgcgggc cgcgggcatt
1200
gcgaccatct ttttatgggg agcaaactgg gcgatcggac agtttgtgcc aatgatgatc
1260
gattctttcg ggctcgccta tacattttgg atctttgcgg tgattaacat cctttgtttc
1320
ctgtttgtcg ttacgatctg tccagaaacg aagaacaaat cgctcgagga aattgaaaag
1380
ctttggataa aatga
1395
<210> 14
<211> 4393
<212> ДНК
<213> Klebsiella pneumoniae
<400> 14
atgtataaaa aacggaagtt agccattctt attgctttgc taaccggcac cgccgccgcc
60
catgggcaga cagacctgaa cagcattgaa gcgcgtctcg ccgccctgga aaaacgcctg
120
caggacgccg agacccgcgc cagcactgcc gaaagccgcg ccgcctcagc ggagcagaaa
180
gttcagcagt taacccagca gcagcagcaa acccaggcca ccacccagca ggtggccagg
240
cgcaccactc aactggaaga aaaagccgaa cggcccggcg gctttgagtt ccatggctat
300
gcgcgttccg gggtgatcat gaacgactcg gccgccagta ccaaatccgg cgcttatatg
360
acccccgccg gggagaccgg cggcgccatt ggtcgcctgg gcaaccaggc cgacacctat
420
gtggaaatga acctcgaaca taaacagacc ctggacaacg gggcgaccac ccgtttcaaa
480
gtgatggtgg ccgacggaca gaccacctat aacgactgga cggcaagcag cagcgacctg
540
aacgtacgcc aggcgttcgt cgagctgggc aatctgccga ccttcgaagg cccgttcaaa
600
ggctcgaccc tgtgggccgg gaaacgcttt gaccgcgaca acttcgacat ccactggatt
660
gactcggatg tggtgttcct cgccgggacc ggcggcggga tctacgacgt gaaatggaac
720
gacagcctgc gcagcaactt ctcgttatac ggccgcaact ttggcgatat cgccgacagc
780
agcaacagcg tgcagaacta tatcgtcagc atgaataact ttgccggccc ggtgcagatg
840
atggtcagcg ggatgcgggc gaaagataat gacgaccgcc aggacgcgaa cggcaatctg
900
gtgaaaggcg atgccgctaa caccggggtt catgccctgc tgggcctgca caatgagagc
960
ttctatggcc tgcgcgacgg gaccagcaaa acggccctgc tgtacggcca cgggctgggc
1020
gccgaggtta aaggcatcgg ctccgacggc gcgctgcgcc cgggggccaa tacctggcgc
1080
ttcgccagct atggcactac gccgctgagc gatcgctggt ttattgcccc ggccgtgctg
1140
gcgcagagca gtaaagatcg ttatgtcgat ggcgacagct atcagtgggc caccctcaac
1200
ctgcgtctga ttcaggaagt gacgcagaac ttcgccctcg cctgggaggg cagctatcag
1260
tacatggatc tgcagcctga aggctacaac gatcgccatg cggtcaatgg cagcttctac
1320
aagctgacct tcgccccgac cttcaaggtg ggcagcatcg gcgacttctt ctcgcggccg
1380
gagatccgct tctatacatc gtggatggac tggagcaaaa aactggacaa ctacgccaac
1440
gatgacgcgt taggcagcaa cggattcaaa tcgggcggcg aatggtcgtt cggtatgcaa
1500
atggagacct ggttctgacg gccaccgggg cgacagggta aataacacat aaatataagg
1560
ttcgcggcgc ctgccacggc tggcgccgcc cacgccatat catcatgcat ttagagggta
1620
ctatggattt tgaacagatt tcccgctcac tgcttcccct gctgggcggc aaggaaaata
1680
tcgccagcgc cgcgcactgc gccacccgcc tgcggctggt gctggtcgac gacgcgctcg
1740
ccgatcagca ggcgattggc aaaatcgacg gggtgaaagg ctgctttcgc aatgccggac
1800
agatgcagat catcttcggc accggggtgg tcaataaagt ctatgccgcc tttatccagg
1860
ccgcaggcat cagcgaatcg agcaaatccg aagccgccga cctggcggcg aaaaagctga
1920
acccgttcca gcgcatcgcc cgcctgctgt ccaacatctt cgtgccgatt attccggcca
1980
tcgtcgcctc cggcctgctg atgggcctgc tggggatggt gaaaacctac ggttgggtcg
2040
acccgagcaa cgctctctat atcatgctgg atatgtgcag ttcggcggcg tttatcattc
2100
tgccgatcct gatcggcttt accgccgccc gcgaatttgg cggtaacccc tatctgggcg
2160
cgaccctcgg cgggatcctc acccacccgg cgctgaccaa cgcctggggc gtcgccgccg
2220
gcttccacac catgaatttc ttcggcatcg aagtggcgat gatcggctac cagggcaccg
2280
tcttcccggt gctgctggcg gtgtggttta tgagcatggt cgagaagcgg ctgcgccgcg
2340
tgatccctga cgcgctggac ctgatcctca ctccgttcct gacggtgatt atctccggct
2400
ttatcgccct gctgctgatc ggcccggccg gtcgcgcgct cggcgacggc atttcgttta
2460
tcctcagcac gcttatcagc catgccggct ggctggcggg cctgctgttc ggcggcctct
2520
attcggtgat cgtcattacc ggtatccatc acagcttcca tgccatcgag gccggactgc
2580
tgggcaaccc atcgattggc gtcaacttcc tgctgccgat ctgggcgatg gccaacgtcg
2640
cccagggcgg cgcctgcttt gcggtgtggt ttaaaaccaa agatgccaaa ataaaagcca
2700
tcaccctgcc gtcggcgttt tcggcgatgc tggggatcac cgaggcggca atcttcggga
2760
ttaacctgcg ctttgtgaaa ccgtttatcg ccgcgctggt gggcggtgcc gccggcggcg
2820
cctgggtggt gtcgatgcac gtctacatga ccgcggtggg cctgacggcg atcccgggaa
2880
tggctatcgt gcaggccagc tcgctgctga actacattat cggaatggcg atcgccttcg
2940
ccgtggcctt cgcgctctct ctgacgctga aatacaaaac ggacgctgaa taatgtcatt
3000
accgtcacgt ctgcctgcga tcctgcaggc cgttatgcag ggccagccgc aggcgctggc
3060
cgacagccat tatccgcaat ggcatctggc gccggtcaac ggactgctga acgatcctaa
3120
cggcttttgc caggtcgccg ggcgttacca cctgttttat cagtggaacc cgctcgcctg
3180
cgaccatacc tataagtgct ggggacactg gagctctgcc gatctgctgc actggcggca
3240
cgaacctatc gccctgatgc cggatgaaga gtatgaccgc aacggctgct actctggcag
3300
cgcggtcgag ttcgagggtg ccctgactct gtgctacacc ggcaacgtga aattccccga
3360
cggcgggcgc accgcctggc aatgtctggc gaccgagaat gccgatggca ccttccgcaa
3420
gctggggccg gtgctgccgc tgccagaagg ctataccggc catgtgcgcg accctaaagt
3480
gtggcggcag gacgggcgct ggtacatggt tcttggggcg caggatgtgc aacagcgcgg
3540
caaagtgctg ctgtttaccg ccagcgacct gcgggagtgg cgcctggtgg gcgagatcgc
3600
cgggcacgac gtgaacggcc tggcgaacgc cggctacatg tgggagtgcc cggatctctt
3660
tccgctggcg gacacccacc tgctgatctg ctgcccgcag gggctggccc gcgaagcgca
3720
gcgctttctc aatacctatc cggcggtgtg gatggcaggc cgcttcgacg ccgaacgcgg
3780
gatcttcgac cacggcccgc tgcacgagct ggacagcgga tttgagttct acgcgccgca
3840
gaccatgcag gccgacgatg gccgccgcct gctggtcggc tggatgggcg tccccgacgg
3900
ggacgagatg catcagccca cccgcgcgca gggctggatc catcagatga cctgcgtgcg
3960
tgagctggag tggcaggctg gcactctgta tcagcgtccg ctgcgcgagc tggtcgccct
4020
gcgcggggaa gcccagggct ggtgcggaca gaccctgccc ctcgccccga tggagctggc
4080
ctttgacctt tcccccgaca gcacgctggg gctggacttt gccggcgccc tgcagctcac
4140
cgtcaatcgc gacggcctac gtctgtcgcg ccgcggcctg cagacggcag agatgcatca
4200
ccgctactgg cgcggcgagg cgcgacgcct gcggatcttt atcgaccgct ccagcgtgga
4260
gattttcatc aacgatggcg agggggtgat gagcagccgc ttctttccgg gctatccggg
4320
gcagctcatc ttcagcggtg cgacgccggt ggcattctgc cgctggctgc tgcggccatg
4380
catggtagaa taa
4393
<210> 15
<211> 4423
<212> ДНК
<213> Salmonella typhimurium
<400> 15
atgtacagaa aaagcacact tgcgatgctt atcgctttgc taaccagcgc tgcctcagcc
60
catgcgcaaa cggatataag caccattgaa gcccgactca acgcgctgga aaaacgcctg
120
caggaggcag aaaacagggc gcaaacggcg gaaaaccgcg ccggggcggc ggagaaaaaa
180
gttcagcaac tcaccgcgca gcagcaaaaa aaccagaact cgactcagga agtggctcag
240
cgtaccgcca gacttgagaa aaaagccgat gacaaaagcg gatttgagtt tcacggttac
300
gcccgctccg gcgtgataat gaatgattcc ggcgccagca ccaaatccgg agcctacata
360
acgccggcag gtgaaaccgg cggagctatc ggccgtctgg gaaaccaggc cgatacctat
420
gttgaaatga atcttgaaca taagcagacc ctggataatg gggccacgac ccgctttaag
480
gtgatggtcg ccgacgggca aacctcttat aacgactgga ctgcaagcac cagcgatctg
540
aacgttcgtc aggcctttgt cgaattgggt aacctgccga cgttcgctgg gccatttaag
600
ggctccaccc tgtgggccgg gaaacgtttc gaccgcgaca atttcgatat tcactggatt
660
gactctgatg tcgtgttcct cgccggtacc ggtggtggta tctatgacgt gaagtggaac
720
gacggcctgc ggagtaattt ctccctgtac gggcgtaact tcggcgacat tgatgattcc
780
agcaacagcg tgcagaacta tatcctcacc atgaatcact tcgcaggtcc gctgcagatg
840
atggtcagcg gtctgcgggc gaaggataac gacgagcgta aagatagcaa cggcaatctg
900
gcaaaaggcg atgcggcaaa caccggcgtg catgcgctgc tcggcctgca taacgacagt
960
ttctacggcc tgcgcgacgg tagcagtaaa accgctctgc tttatggtca tggtctgggc
1020
gcagaggtta aaggtatcgg atctgatggc gcacttcgtc cgggagccga cacatggcgc
1080
attgccagtt acggcaccac gccgctcagc gaaaactggt ctgttgcccc ggcaatgctg
1140
gcgcaacgca gtaaagaccg ctatgccgat ggcgacagct atcagtgggc aacattcaac
1200
ctgcgtctga ttcaggcaat caatcagaat ttcgctctcg cctacgaagg cagctaccag
1260
tacatggatc ttaaacccga aggttataac gatcgtcagg cggtgaacgg tagcttctac
1320
aagctcacct tcgccccgac atttaaggtc ggcagtatcg gtgatttctt cagtcgcccg
1380
gagattcgtt tctatacctc ctggatggac tggagcaaaa aactgaataa ttacgccagc
1440
gacgacgccc tgggcagtga cggttttaac tcgggcggcg aatggtcttt cggtgtgcag
1500
atggaaacct ggttctgacg cttacgcctg atgacaggaa tagccggggg tcagagcatc
1560
tttgtcaccc cggactcaac taagacgcag aaaaagcgct cccgtgaacg cgggacgaca
1620
acataaaaat gtttaagcct taagagggta ctatggattt tgaacagatt tcctgctcgc
1680
tgcttccgct tcttggaggc aaagaaaata tcgccagcgc cgcgcactgc gccacgcgcc
1740
tgcgcctggt gctggtcgat gattcgctgg ccgaccagca ggccatcggc aaagttgaag
1800
gggtgaaggg ctgttttcgt aatgccggac agatgcagat tattttcggc accggggtgg
1860
taaataaggt ctacgctgcc tttactcagg cggcgggtat tagcgaatcc agcaaatcgg
1920
aagccgccga catcgcggca aaaaagctca atccgttcca gcgcatcgcc cgcctgctat
1980
caaacatctt cgtgccgata atccctgcca tcgtcgcctc tggtctgctg atgggcctgc
2040
tgggaatggt caaaacatac ggctgggttg acccgggcaa cgccatctac atcatgctgg
2100
atatgtgcag ctcggcggca tttatcattc tgccgattct gattggcttt accgccgccc
2160
gcgaattcgg cggtaatcct tatctcggcg cgacgcttgg cggcattctg actcatccag
2220
cgctgactaa cgcctggggc gtggccgcgg gtttccacac catgaacttt ttcggcttcg
2280
aaattgccat gatcggctat cagggtacgg tgttcccggt actgctggca gtatggttta
2340
tgagcatcgt tgagaagcag ttgcgtcgcg caatccccga tgccctggat ttgatcctga
2400
cgccgttcct gacggtgatt atatccggtt ttatcgccct gttgattatc ggcccggccg
2460
gtcgcgcact gggcgacggt atctcgtttg tcctcagcac cctgattagc cacgccggct
2520
ggctcgccgg gttactgttt ggcggtctct attcagttat cgtcattacc ggtattcatc
2580
acagcttcca tgcggttgaa gccgggttgc tgggcaatcc ctccatcggc gtcaacttcc
2640
tgctgccgat ttgggcgatg gccaacgtcg ctcagggcgg agcctgtctg gcggtgtggt
2700
tcaaaaccaa agatgcaaaa attaaagcca ttactctgcc ctcggcgttt tccgccatgc
2760
tgggcatcac cgaggcggcg atttttggta ttaacctgcg ctttgtgaag ccatttattg
2820
cggcgctgat tggtggtgcg gcgggcggcg catgggtggt atctgtacac gtctacatga
2880
ccgcggtcgg cttgacagcg atccccggca tggccatcgt gcaggccagt tcgctgttga
2940
actacattat cgggatggtt atcgcctttg gcgtcgcctt tacggtctcc ctggttttga
3000
aatacaaaac ggacgctgaa taatgtctct tccatcacga ctgcctgcga ttttgcaggc
3060
cgtaatgcag ggccagccgc gcgcgctggc cgatagccac tatccgcgct ggcaccatgc
3120
gccggtcacc gggctgatga acgaccccaa cggctttatc gaatttgccg gacgctatca
3180
tctgttttat cagtggaacc cgctcgcctg cgatcatacg tttaagtgct gggcgcactg
3240
gagttccatc gatctgctgc actggcagca tgagcccatt gcgctgatgc cggacgaaga
3300
gtatgaccgt aacggctgct actccggcag cgcggtggat aacaacggta cgcttaccct
3360
gtgctatacc ggcaacgtga agtttgccga gggagggcga accgcctggc aatgcctggc
3420
aacggaaaac gctgacggca ccttccgcaa aatcggtccg gtcctgccgc tgccggaggg
3480
ctacaccggc cacgtgcgcg acccaaaagt ctggcgacac gaagacctgt ggtacatggt
3540
gctgggcgcg caggatcggc aaaagcgcgg caaggtgctg ctgttcagct ctgcggatct
3600
ccatcagtgg acgagtatgg gtgaaatcgc cggccacggc atcaatggcc tcgacgacgt
3660
cggctatatg tgggagtgcc cggatctttt tccactcggc gaccagcata ttctaatctg
3720
ctgtccgcag gggattgccc gtgaggaaga gtgctacctg aacacctacc cggcagtatg
3780
gatggcgggc gagtttgatt acgctgctgg cgctttcaga cacggcgaac tgcacgaact
3840
ggacgccggg tttgagttct acgccccgca aaccatgctt accagtgatg gccgtcgtct
3900
gctggtcggc tggatgggcg tgccggaggg cgaagagatg cttcagccga ccctgaacaa
3960
cggctggatc catcagatga cctgcctgcg tgagctggag tttatcaacg gtcagctcta
4020
tcagcgtccg ctacgggaac tgagcgccct gcgcggtgaa gcgaacggct ggtcggggaa
4080
cgccctgccg ctggcaccga tggaaatcga tttgcaaacc cgcgggggcg atatgttgag
4140
cctcgatttt ggcggcgtat taacccttga gtgcgatgcc agcggactcc gcctggcccg
4200
acgcagtctc gccagtgacg agatgcatta tcgttactgg cgcggaaacg tccgctcgct
4260
gcgtgttttc atcgaccagt cgagcgtgga gattttcata aacggcggtg aaggggtgat
4320
gagcagccgc tacttcccgg cctgctccgg tcagctaaca ttctccggca tcacgccgga
4380
cgcattctgc tactggccgc tgcgaacttg catggtagaa taa
4423
<210> 16
<211> 3883
<212> ДНК
<213> Eastern equine encephalomyelitis virus
<400> 16
ctatattgct gaaggtacag gcgtttccat aactatttgc tcgcgttttt tactcaagaa
60
gaaaatgcca aatagcaaca tcaggcagac aatacccgaa attgcgaaga aaactgtctg
120
gtagcctgcg tggtcaaaga gtatcccagt cggcgttgaa agcagcacaa tcccaagcga
180
actggcaatt tgaaaaccaa tcagaaagat cgtcgacgac aggcgcttat caaagtttgc
240
cacgctgtat ttgaagacgg atatgacaca aagtggaacc tcaatggcat gtaacaactt
300
cactaatgaa ataatccagg ggttaacgaa cagcgcgcag gaaaggatac gcaacgccat
360
aatcacaact ccgataagta atgcattttt tggccctacc cgattcacaa agaaaggaat
420
aatcgccatg cacagcgctt cgagtaccac ctggaatgag ttgagataac catacaggcg
480
cgttcctaca tcgtgtgatt cgaataaacc tgaataaaag acaggaaaaa gttgttgatc
540
aaaaatgtta tagaaagacc acgtccccac aataaatatg acgaaaaccc agaagtttcg
600
atccttgaaa actgcgataa aatcctcttt ttttacccct cccgcatctg ccgctacgca
660
ctggtgatcc ttatctttaa aacgcatgtt gatcatcata aatacagcgc caaatagcga
720
gaccaaccag aagttgatat ggggactgat actaaaaaat atgccggcaa agaacgcgcc
780
aatagcatag ccaaaagatc cccaggcgcg cgctgttcca tattcgaaat gaaaatttcg
840
cgccattttt tcggtgaagc tatcaagcaa accgcatccc gccagatacc ccaagccaaa
900
aaatagcgcc cccagaatta gacctacaga aaaattgctt tgcagtaacg gttcataaac
960
gtaaatcata aacggtccgg tcaagaccag gatgaaactc atacaccaga tgagcggttt
1020
cttcagaccg agtttatcct gaacgatgcc gtagaacatc ataaatagaa tgctggtaaa
1080
ctggttgacc gaataaagtg tacctaattc cgtccctgtc aaccctagat gtcctttcag
1140
ccaaatagcg tataacgacc accacagcga ccaggaaata aaaaagagaa atgagtaact
1200
ggatgcaaaa cgatagtacg catttctgaa tggaatattc agtgccataa ttacctgcct
1260
gtcgttaaaa aattcacgtc ctatttagag ataagagcga cttcgccgtt tacttctcac
1320
tattccagtt cttgtcgaca tggcagcgct gtcattgccc ctttcgccgt tactgcaagc
1380
gctccgcaac gttgagcgag atcgataatt cgtcgcattt ctctctcatc tgtagataat
1440
cccgtagagg acagacctgt gagtaacccg gcaacgaacg catctcccgc ccccgtgcta
1500
tcgacacaat tcacagacat tccagcaaaa tggtgaactt gtcctcgata acagaccacc
1560
accccttctg cacctttagt caccaacagc atggcgatct catactcttt tgccagggcg
1620
catatatcct gatcgttctg tgtttttcca ctgataagtc gccattcttc ttccgagagc
1680
ttgacgacat ccgccagttg tagcgcctgc cgcaaacaca agcggagcaa atgctcgtct
1740
tgccatagat cttcacgaat attaggatcg aagctgacaa aacctccggc atgccggatc
1800
gccgtcatcg cagtaaatgc gctggtacgc gaaggctcgg cagacaacgc aattgaacag
1860
agatgtaacc attcgccatg tcgccagcag ggcaagtctg tcgtctctaa aaaaagatcg
1920
gcactggggc ggaccataaa cgtaaatgaa cgttcccctt gatcgttcag atcgacaagc
1980
accgtggatg tccggtgcca ttcatcttgc ttcagatacg tgatatcgac tccctcagtt
2040
agcagcgttc tttgcattaa cgcaccaaaa ggatcatccc ccacccgacc tataaaccca
2100
cttgttccgc ctaatctggc gattcccacc gcaacgttag ctggcgcgcc gccaggacaa
2160
ggcagtaggc gcccgtctga ttctggcaag agatctacga ccgcatcccc taaaacccat
2220
actttggctg acattttttt cccttaaatt catctgagtt acgcatagtg ataaacctct
2280
ttttcgcaaa atcgtcatgg atttactaaa acatgcatat tcgatcacaa aacgtcatag
2340
ttaacgttaa catttgtgat attcatcgca tttatgaaag taagggactt tatttttata
2400
aaagttaacg ttaacaattc accaaatttg cttaaccagg atgattaaaa tgacgcaatc
2460
tcgattgcat gcggcgcaaa acgccctagc aaaacttcat gagcaccggg gtaacacttt
2520
ctatccccat tttcacctcg cgcctcctgc cgggtggatg aacgatccaa acggcctgat
2580
ctggtttaac gatcgttatc acgcgtttta tcaacatcat ccgatgagcg aacactgggg
2640
gccaatgcac tggggacatg ccaccagcga cgatatgatc cactggcagc atgagcctat
2700
tgcgctagcg ccaggagacg ataatgacaa agacgggtgt ttttcaggta gtgctgtcga
2760
tgacaatggt gtcctctcac ttatctacac cggacacgtc tggctcgatg gtgcaggtaa
2820
tgacgatgca attcgcgaag tacaatgtct ggctaccagt cgggatggta ttcatttcga
2880
gaaacagggt gtgatcctca ctccaccaga aggaatcatg cacttccgcg atcctaaagt
2940
gtggcgtgaa gccgacacat ggtggatggt agtcggggcg aaagatccag gcaacacggg
3000
gcagatcctg ctttatcgcg gcagttcgtt gcgtgaatgg accttcgatc gcgtactggc
3060
ccacgctgat gcgggtgaaa gctatatgtg ggaatgtccg gactttttca gccttggcga
3120
tcagcattat ctgatgtttt ccccgcaggg aatgaatgcc gagggataca gttaccgaaa
3180
tcgctttcaa agtggcgtaa tacccggaat gtggtcgcca ggacgacttt ttgcacaatc
3240
cgggcatttt actgaacttg ataacgggca tgacttttat gcaccacaaa gctttttagc
3300
gaaggatggt cggcgtattg ttatcggctg gatggatatg tgggaatcgc caatgccctc
3360
aaaacgtgaa ggatgggcag gctgcatgac gctggcgcgc gagctatcag agagcaatgg
3420
caaacttcta caacgcccgg tacacgaagc tgagtcgtta cgccagcagc atcaatctgt
3480
ctctccccgc acaatcagca ataaatatgt tttgcaggaa aacgcgcaag cagttgagat
3540
tcagttgcag tgggcgctga agaacagtga tgccgaacat tacggattac agctcggcac
3600
tggaatgcgg ctgtatattg ataaccaatc tgagcgactt gttttgtggc ggtattaccc
3660
acacgagaat ttagacggct accgtagtat tcccctcccg cagcgtgaca cgctcgccct
3720
aaggatattt atcgatacat catccgtgga agtatttatt aacgacgggg aagcggtgat
3780
gagtagtcga atctatccgc agccagaaga acgggaactg tcgctttatg cctcccacgg
3840
agtggctgtg ctgcaacatg gagcactctg gctactgggt taa
3883
<---
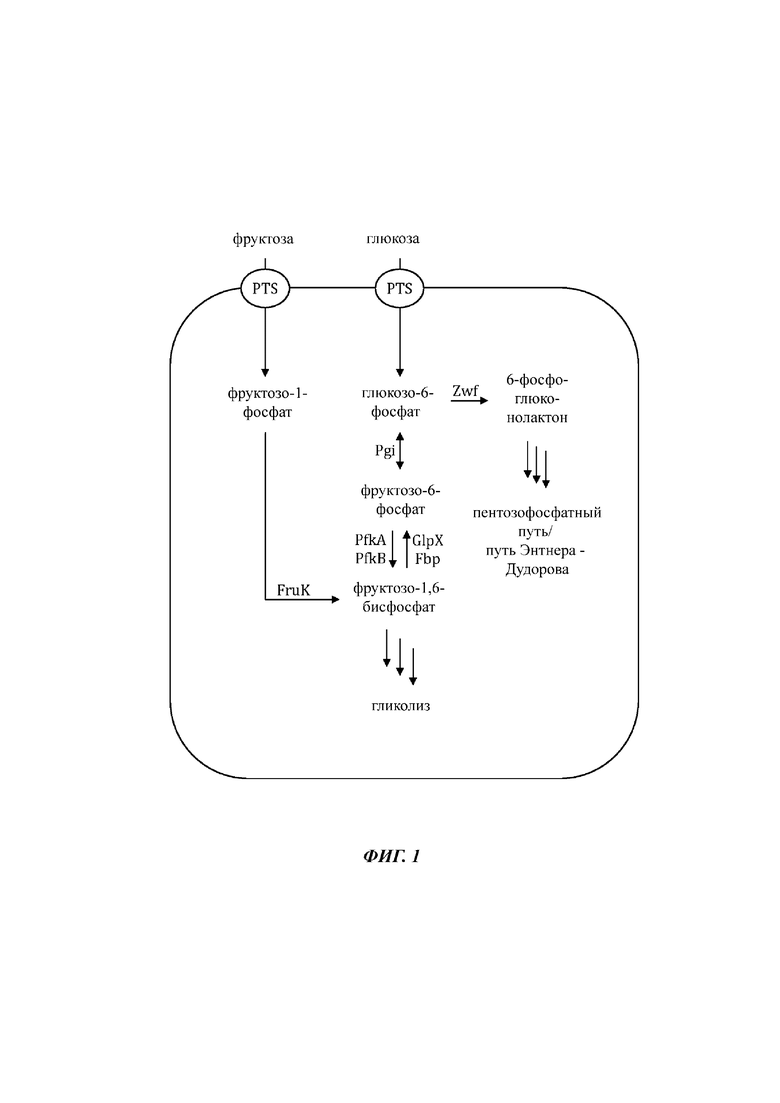
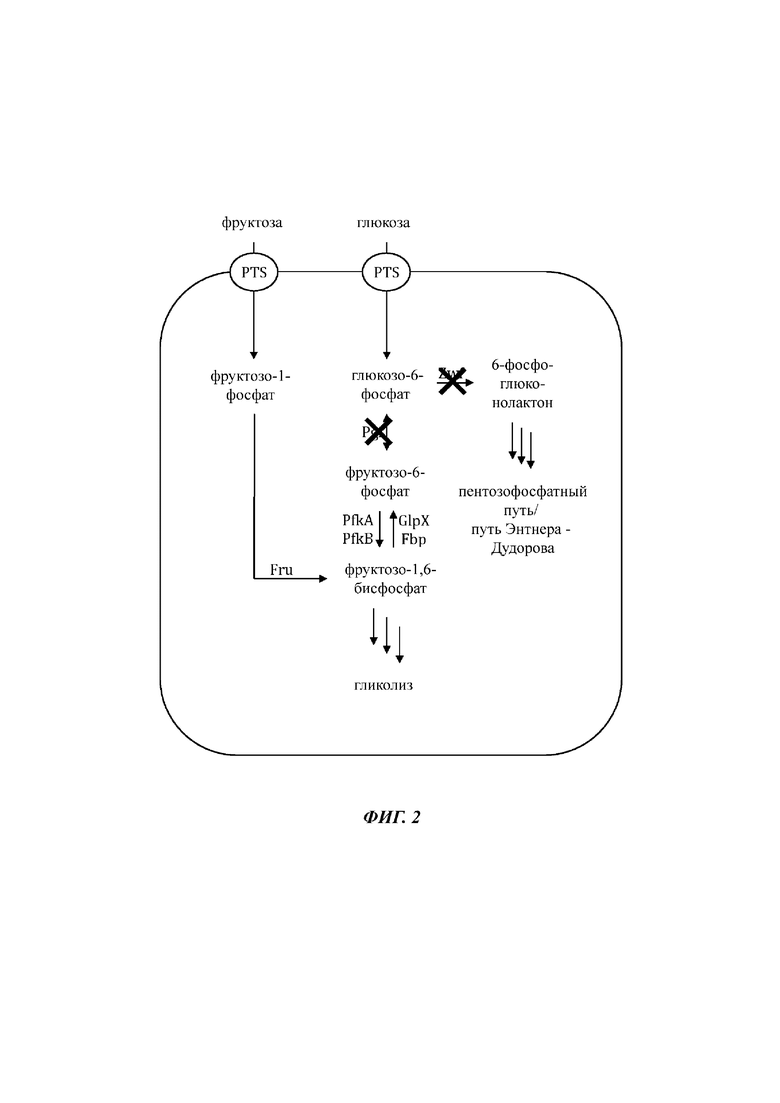
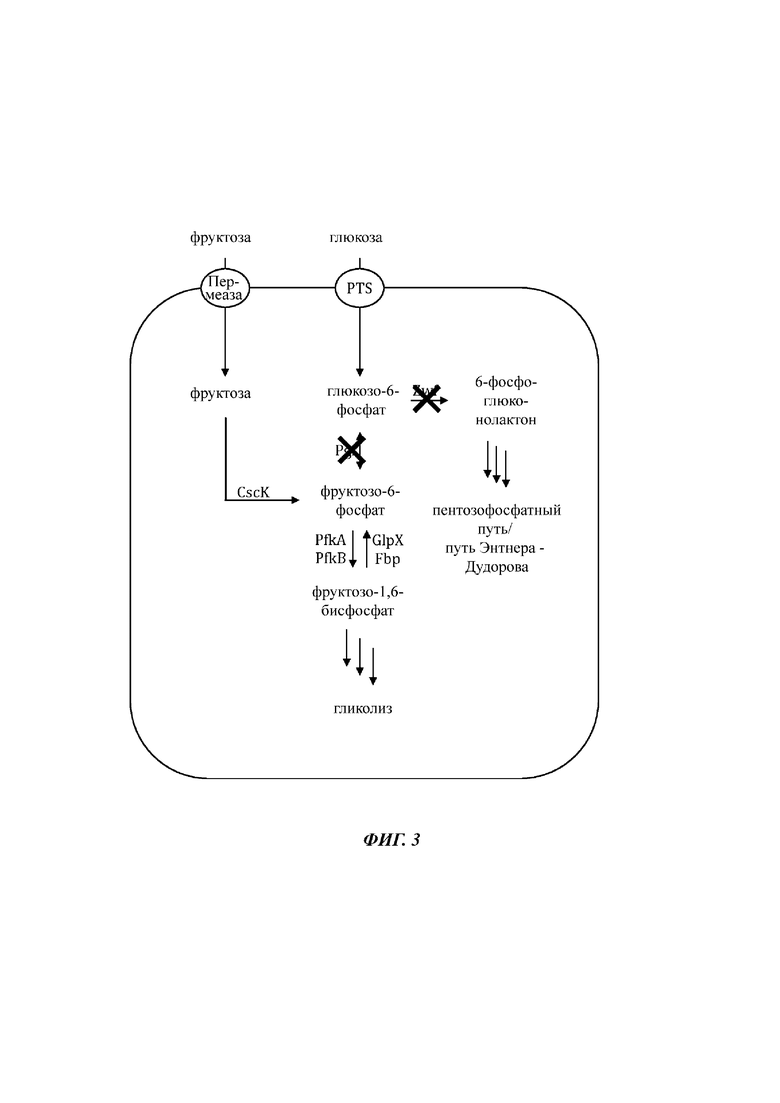
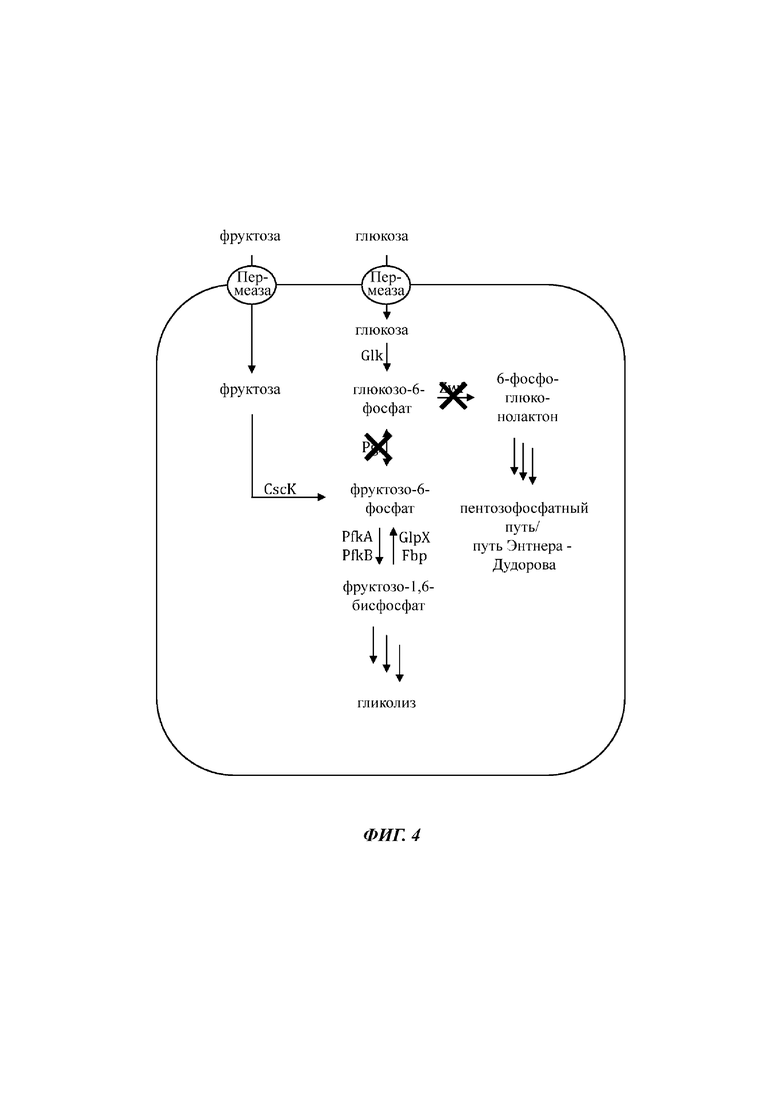
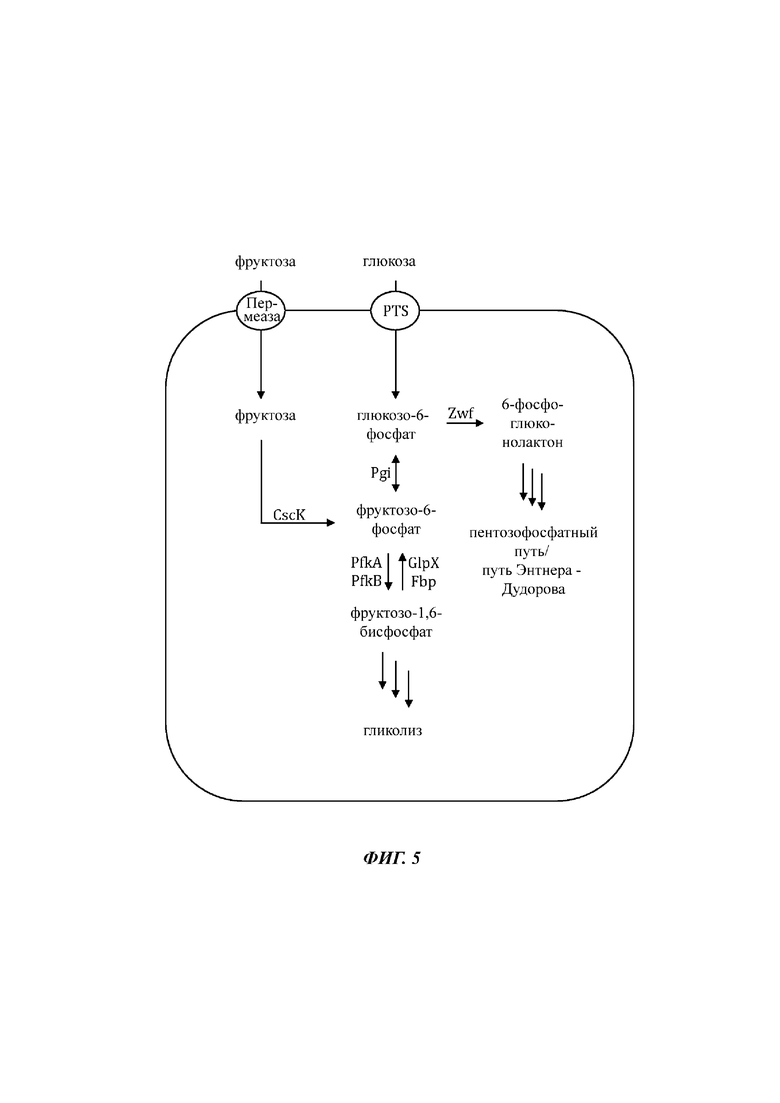
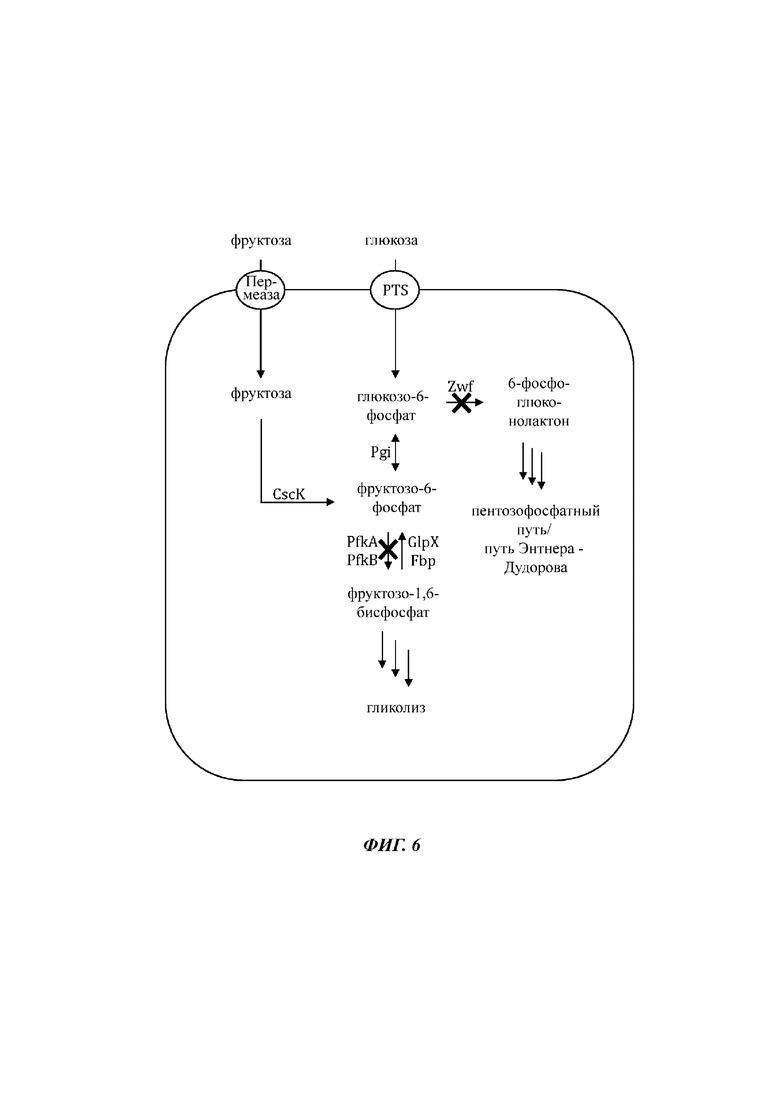
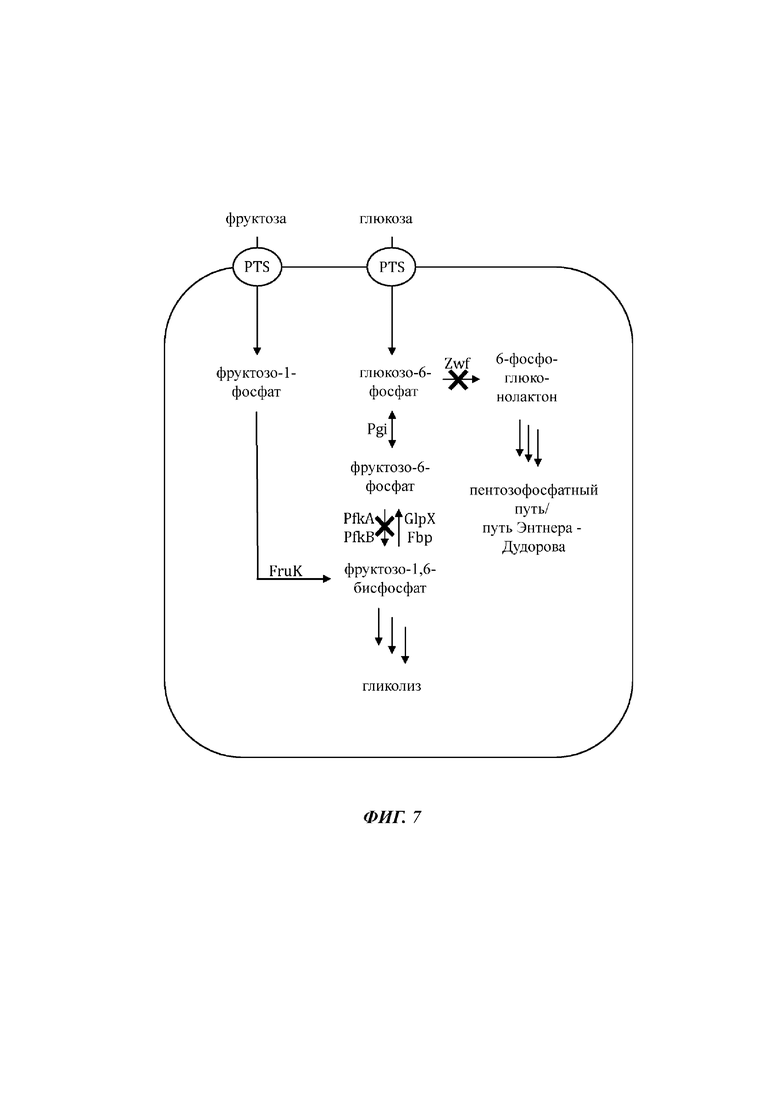

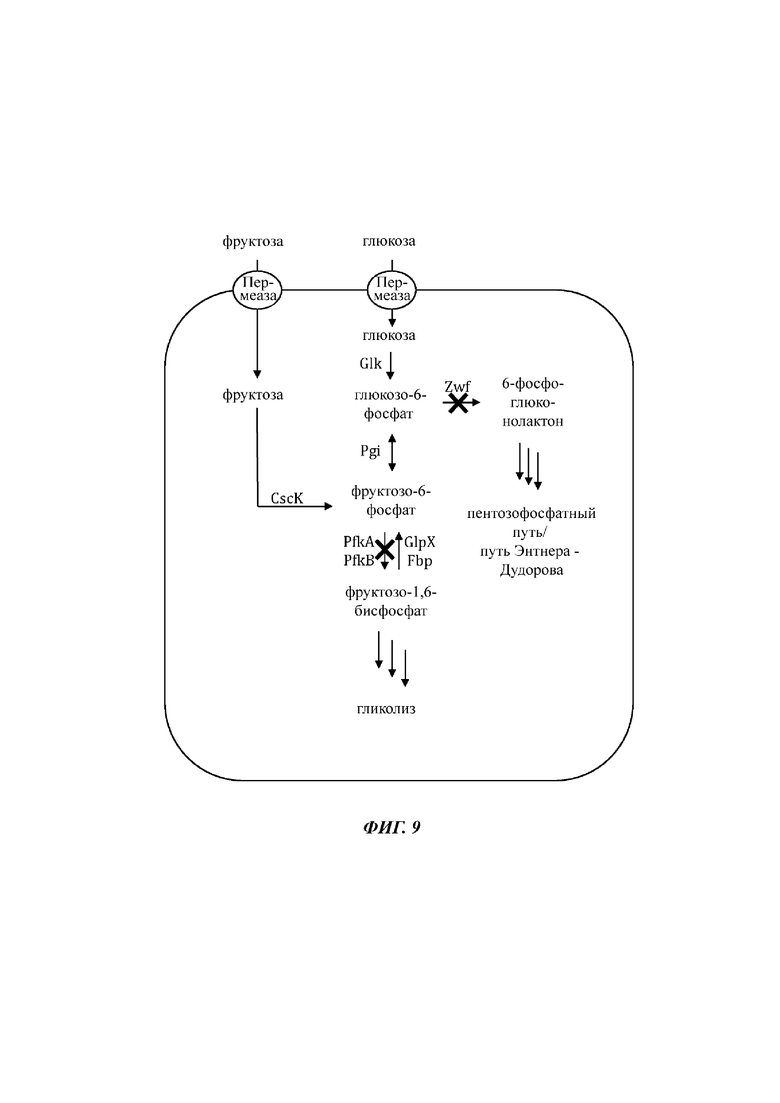
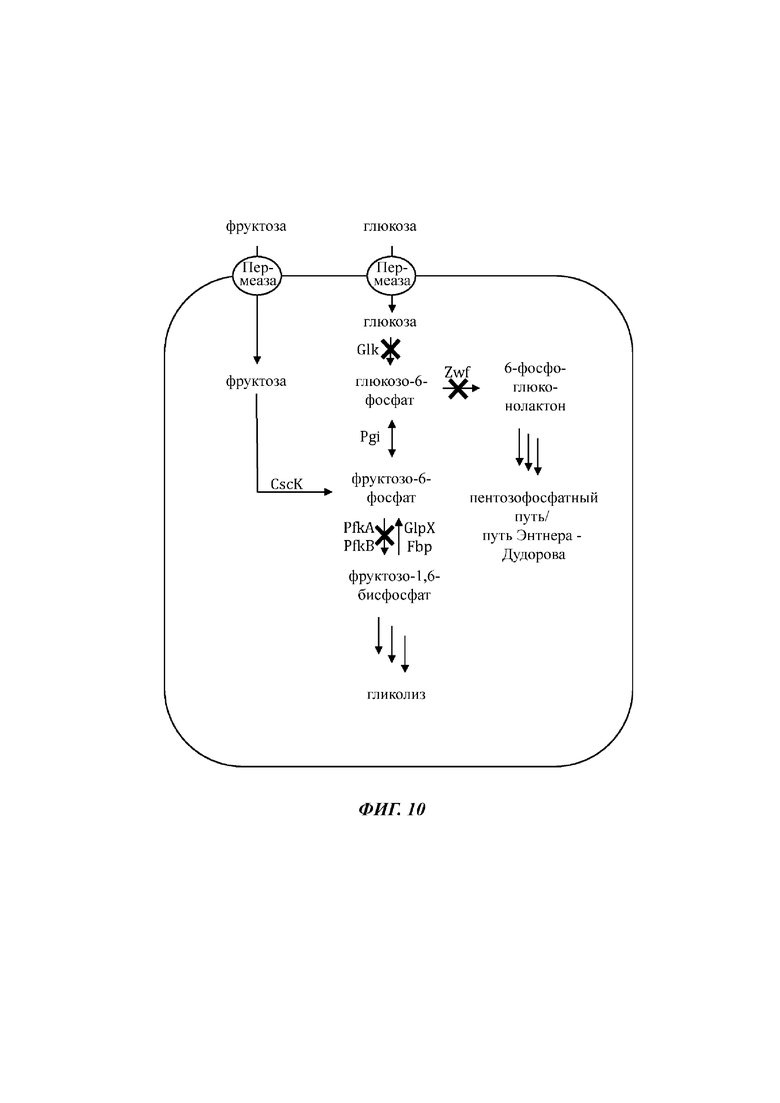
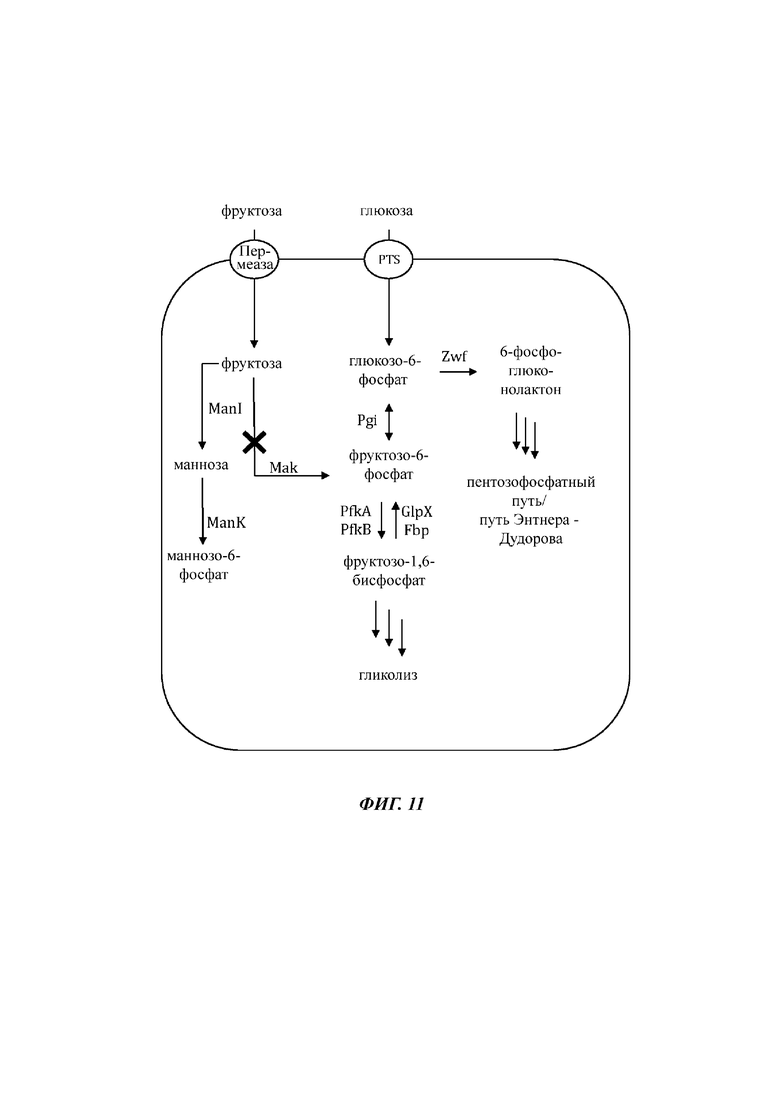
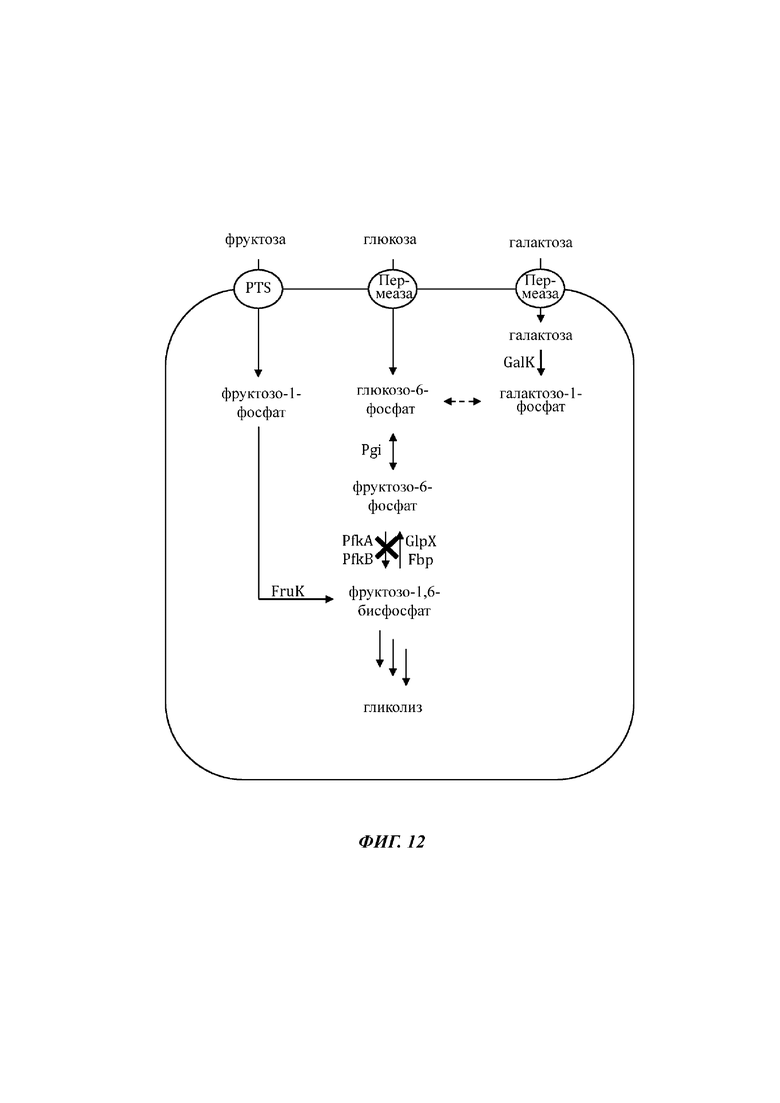
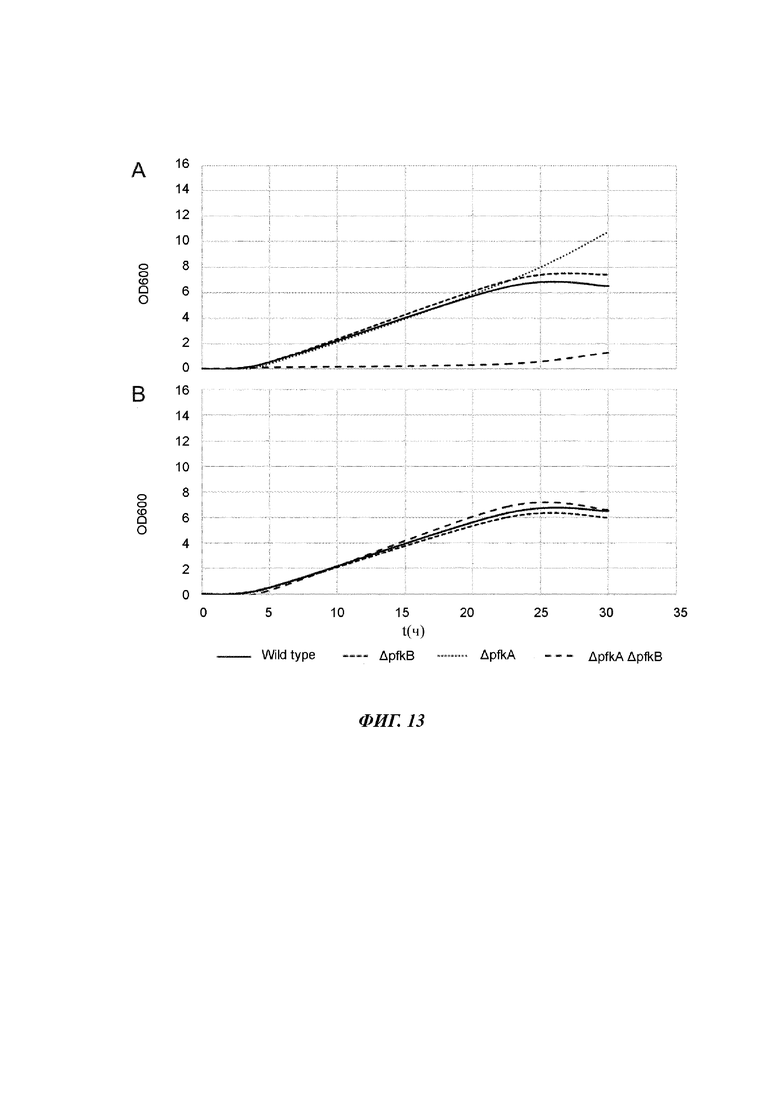
Изобретение относится к биотехнологии. Предложен способ ферментативного получения 2’-фукозиллактозы, включающий предоставление клетки E. coli, генетически сконструированной для выработки 2’-фукозиллактозы, культивирование указанной генетически сконструированной клетки E. coli в культуральной среде, пермиссивной в отношении продукции 2’-фукозиллактозы, где основной источник углерода представляет собой смесь моносахаридов, состоящую из глюкозы и фруктозы, полученную гидролизом сахарозы; и выделение 2’-фукозиллактозы. При этом клетка E. coli демонстрирует генотип pfkA–, lacZ–, fuclK–, wcaJ–, осуществляет сверхэкспрессию ферментов ManB, ManC, Gmd и WcaG для синтеза de novo ГДФ-фукозы, гена α-1,2-фукозилтрансферазы и гена эффлюксного транспортера сахара yberc0001_9420 из Yersinia bercovieri ATCC 43970. Изобретение обеспечивает увеличение продуктивности 2’-фукозиллактозы. 5 з.п. ф-лы, 13 ил., 3 табл., 4 пр.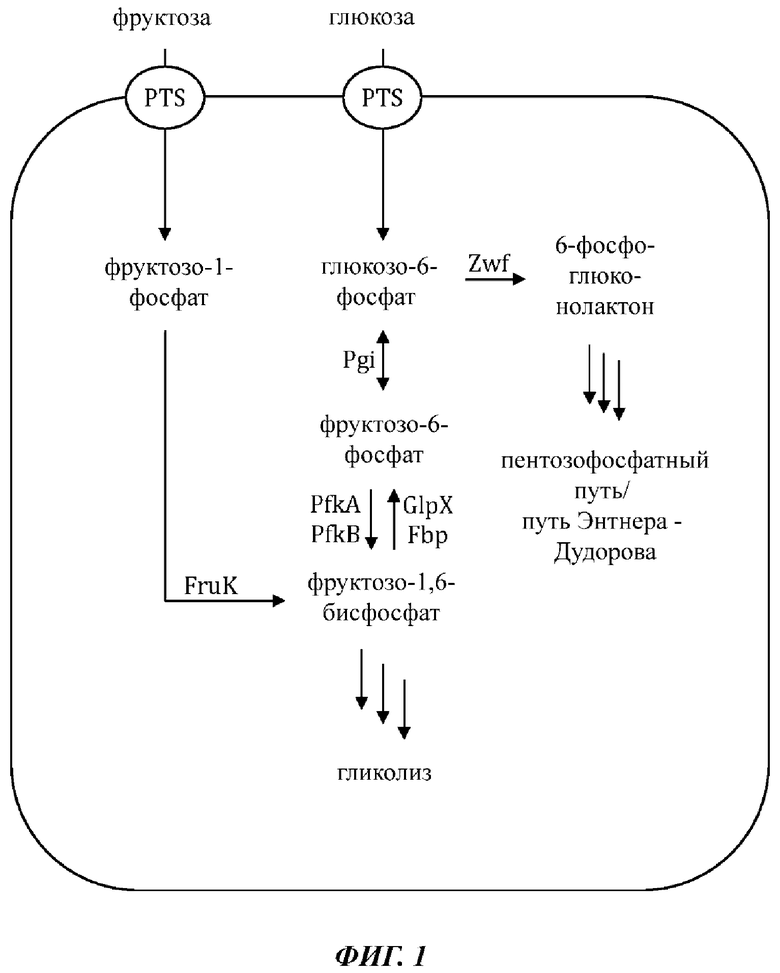
1. Способ ферментативного получения 2’-фукозиллактозы, включающий следующие стадии:
а) предоставление клетки E. coli, генетически сконструированной для выработки 2’-фукозиллактозы, где клетка E. coli демонстрирует генотип pfkA–, lacZ–, fuclK–, wcaJ–, осуществляет сверхэкспрессию ферментов ManB, ManC, Gmd и WcaG для синтеза de novo ГДФ-фукозы, гена α-1,2-фукозилтрансферазы и гена эффлюксного транспортера сахара yberc0001_9420 из Yersinia bercovieri ATCC 43970;
b) культивирование указанной генетически сконструированной клетки E. coli в культуральной среде, пермиссивной в отношении продукции 2’-фукозиллактозы, где основной источник углерода представляет собой смесь моносахаридов, состоящую из глюкозы и фруктозы, полученную гидролизом сахарозы; и
c) выделение 2’-фукозиллактозы.
2. Способ по п. 1, где в указанной генетически сконструированной клетке E. coli дополнительно содержится путь биосинтеза УДФ-галактозы для внутриклеточного образования УДФ-галактозы, причем путь биосинтеза УДФ-галактозы включает в себя сверхэкспрессию гена galE E. coli, гена pgm E. coli и гена β-1,4-галактозилтрансферазы galTpm1141 из Pasteurella multocida.
3. Способ по п. 1 или 2, где указанная генетически сконструированная клетка E. coli дополнительно содержит по меньшей мере один транспортер моносахарида для транслокации моносахарида из среды в цитоплазму клетки E. coli, предпочтительно, кодируемый геном белка облегченной диффузии глюкозы glf из Zymomonas mobilis.
4. Способ по любому из пп. 1-3, где ген α-1,2-фукозилтрансферазы представляет собой ген 2'-фукозилтрансферазы wbgL из E. coli:O126.
5. Способ по п. 1, где генетически сконструированная E. coli содержит кластер генов csc E. coli W.
6. Способ по п. 1, где генетически сконструированная клетка E. coli дополнительно содержит генотип glk–, gcd–, ptsG–.
| WO 2012007481 A3, 19.01.2012 | |||
| ANNE R | |||
| et al., Metabolic engineering of microbes for oligosaccharide and polysaccharide synthesis, Microbial Cell Factories, 2006, vol | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| WO 2018077892 A1, 03.05.2018 | |||
| WO 2015150328 A1, 08.10.2015 | |||
| WO 2015032413 A1, 12.03.2015 | |||
| СПОСОБ ПОЛУЧЕНИЯ СИАЛИЛИРОВАННЫХ ОЛИГОСАХАРИДОВ | 2007 |
|
RU2473695C2 |
Авторы
Даты
2023-12-07—Публикация
2020-02-28—Подача