ПЕРЕКРЕСТНАЯ ССЫЛКА
[0001] Данная заявка испрашивает приоритет на основании предварительной заявки на патент США № 62/577149, поданной 25 октября 2017 г., полностью включенной в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Растения связаны с микробиомом посредством общего метаболома. Многоплановая связь между определенным качеством сельскохозяйственной культуры и соответствующим метаболомом характеризуется ландшафтом с множеством локальных максимумов. Оптимизация от более низкого локального максимума до другого, представляющего собой лучшее качество, путем изменения влияния микробиома на метаболом может быть желательна по ряду причин, например, для оптимизации сельскохозяйственной культуры. Для удовлетворения потребностей растущего мирового населения необходимы экономически, экологически и социально рациональные подходы к сельскому хозяйству и производству продуктов питания. Продовольственная и сельскохозяйственная организация ООН прогнозирует, что к 2050 году совокупное производство продуктов питания должно возрасти на 70% для удовлетворения потребностей растущего населения - задача, сложность которой усугубляется множеством факторов, в том числе сокращением ресурсов пресной воды, усилением конкуренции за пахотные земли, ростом цен на энергоносители, растущими затратами на сырье и вероятной потребностью к адаптации сельскохозяйственных культур к воздействиям более сухого, жаркого и экстремального глобального климата.
[0003] Одной из областей, представляющих интерес, является улучшение азотфиксации. Газообразный азот (N2) является основным компонентом атмосферы Земли. Кроме того, элементарный азот (N) является важным компонентом многих химических соединений, из которых состоят живые организмы. Однако многие организмы не могут непосредственно использовать N2 для синтеза химических веществ, используемых в физиологических процессах, таких как рост и размножение. Для использования N2 должен быть объединен с водородом. Объединение водорода с N2 называют азотфиксацией. Азотфиксация, независимо от того, осуществляется она химически или биологически, требует больших затрат энергии. В биологических системах фермент, известный как нитрогеназа, катализирует реакцию, которая приводит к азотфиксации. Важной целью исследования азотфиксации является распространение этого фенотипа на небобовые растения, особенно на такие важные в сельском хозяйстве злаковые, как пшеница, рис и кукуруза. Несмотря на огромный прогресс в понимании развития азотфиксирующего симбиоза между клубеньковыми бактериями и бобовыми, путь к использованию этих знаний для индукции азотфиксирующих клубеньков на небобовых сельскохозяйственных культурах остается неясным. Между тем проблема обеспечения достаточного объема дополнительных источников азота, таких как удобрения, будет по-прежнему расти с ростом потребности в увеличении производства продуктов питания.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Настоящее изобретение относится к генетически сконструированной бактерии, содержащей модификацию в glnD, где указанная модификация выбрана из группы, состоящей из делеции всего гена, делеции по существу всего гена, делеции домена ACT, делеции более 50% домена ACT, инактивации домена ACT и инактивации домена UTase. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в glnA, приводящую к изменению экспрессии или активности glnA. В некоторых вариантах осуществления указанная модификация приводит к снижению экспрессии glnA. В некоторых вариантах осуществления указанная модификация включает замену нативного промотора glnA промотором с более низкой активностью. В некоторых вариантах осуществления указанная модификация включает замену нативного промотора glnA промотором, выбранным из группы, состоящей из промотора glnB, промотора glnD и промотора glnE. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в glnA, приводящую к снижению экспрессии или активности glnA.
[0005] Настоящее изобретение относится к генетически сконструированной бактерии, обладающей измененной экспрессией rpoN. В некоторых вариантах осуществления генетически сконструированная бактерия обладает повышенной экспрессией rpoN. В некоторых вариантах осуществления генетически сконструированная бактерия обладает повышенной экспрессией rpoN. В некоторых вариантах осуществления предложена генетически сконструированная бактерия по любому из пп. 1-7 формулы изобретения, где указанная генетически сконструированная бактерия представляет собой генетически сконструированную диазотрофную бактерию. В некоторых вариантах осуществления экспрессию rpoN повышают путем делеции нативного промотора rpoN и замены сильным конститутивным промотором. В некоторых вариантах осуществления генетически сконструированная бактерия является межродовой. В некоторых вариантах осуществления генетически сконструированная бактерия способна фиксировать атмосферный азот в присутствии экзогенного азота. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в генетической сети азотфиксации. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в NifA. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию, которая приводит к повышению экспрессии NifA. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в NifL. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию, которая приводит к снижению экспрессии NifL. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в NifH. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию, которая приводит к повышению экспрессии NifH. В некоторых вариантах осуществления указанная генетически сконструированная бактерия содержит модификацию, которая приводит к повышению экспрессии генов кластера Nif. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в генетической сети ассимиляции азота. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию в GlnE. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию, которая приводит к снижению активности GlnE. В некоторых вариантах осуществления генетически сконструированная бактерия содержит модификацию, которая приводит к снижению активности amtB.
[0006] Настоящее изобретение относится к способу увеличения количества получаемого из атмосферы азота в растении, включающему приведение указанного растения в контакт с множеством указанных генетически сконструированных бактерий, описанных в настоящем документе. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к семени указанного растения. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к проростку указанного растения. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению в составе жидкого препарата. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению после посадки, но до сбора урожая указанного растения. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению в качестве подкормки. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению в период от одного месяца до восьми месяцев после прорастания. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению в период от двух месяцев до восьми месяцев после прорастания. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению в период от одного месяца до трех месяцев после прорастания. В некоторых вариантах осуществления генетически сконструированную бактерию применяют к указанному растению в период от трех месяцев до шести месяцев после прорастания. В некоторых вариантах осуществления растение представляет собой растение зерновой культуры. В некоторых вариантах осуществления растение представляет собой растение кукурузы. В некоторых вариантах осуществления растение представляет собой растение риса. В некоторых вариантах осуществления растение представляет собой растение пшеницы. В некоторых вариантах осуществления растение представляет собой растение сои.
[0007] Настоящее изобретение относится к композиции, содержащей семя и семени; причем указанное покрытие семени содержит множество указанных генетически сконструированных бактерий, как описано в настоящем документе. В некоторых вариантах осуществления семя представляет собой семя зерновой культуры. В некоторых вариантах осуществления семя выбрано из группы, состоящей из семени кукурузы, семени пшеницы, семени риса, семени сои, семени ржи и семени сорго. Настоящее изобретение относится к композиции, содержащей растение и множество указанных генетически сконструированных бактерий, описанных в настоящем документе. В некоторых вариантах осуществления растение представляет собой проросток. В некоторых вариантах осуществления семя представляет собой семя зерновой культуры. В некоторых вариантах осуществления семя выбрано из группы, состоящей из кукурузы, риса, пшеницы, сои, ржи и сорго.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[0008] Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка были специально и по отдельности указаны как включенные посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0009] Новые признаки изобретения подробно изложены в прилагаемой формуле изобретения. Более полное понимание признаков и преимуществ настоящего изобретения будет получено со ссылкой на следующее подробное описание, в котором изложены иллюстративные варианты осуществления, в которых используются принципы изобретения, и прилагаемые графические материалы, где:
[0010] На фигуре 1A-B изображено обогащение и выделение азотфиксирующих бактерий. (A) Чашку со средой Nfb, содержащей агар, использовали для выделения одиночных колоний азотфиксирующих бактерий. (B) Полутвердая среда Nfb с агаром, отлитая в пробирку Балча. Стрелкой обозначена пленка обогащенных азотфиксирующих бактерий.
[0011] На фигуре 2 изображен иллюстративный ПЦР-скрининг nifH. В этом скрининге позитивные полосы наблюдались при ~350 п.н. для двух колоний. Нижние полосы представляют собой праймер-димеры.
[0012] На фигуре 3 изображен пример ПЦР-скрининга колоний из отобранного по CRISPR-Cas мутагенеза. Колонии CI006 подвергали скринингу с использованием праймеров, специфичных для локуса nifL. Продукт ПЦР дикого типа ожидается при ~2,2 тыс. п.н., тогда как мутант ожидается при ~1,1 тыс. п.н. Семь из десяти подвергшихся скринингу колоний однозначно демонстрируют желаемую делецию.
[0013] На фигурах 4A-D изображены in vitro фенотипы различных штаммов. Активности мутантов штамма CI010 (фигура 4A) и мутантов штамма CI006 (фигура 4B), выращенных в азотфиксирующей среде с добавкой от 0 до 10 мМ глутамина, в анализе восстановления ацетилена (ARA). Активности в ARA дополнительных штаммов показаны на фигуре 4C, а профиль экскреции аммония во времени для двух штаммов показан на фигуре 4D.
[0014] На фигуре 5 показан профиль экспрессии в культуре 9 различных генов в штаммах CI006, участвующих в диазотрофной азотфиксации. Числа представляют собой число каждого транскрипта. Указаны различные условия (0, 1, 10 мМ глутамина и 0%, 10%, 20% N2 в атмосферном воздухе).
[0015] На фигуре 6 изображена колонизация CI006 корней кукурузы. Проростки кукурузы инокулировали CI006, несущим плазмиду экспрессии RFP. Спустя две недели роста и поддержания плазмиды путем полива подходящим антибиотиком корни собирали и визуализировали с помощью флуоресцентной микроскопии. Наблюдается колонизации межклеточного пространства корня.
[0016] На фигуре 7 изображен азот, полученный на уровне микроорганизмов в штамме дикого типа (CI050) и оптимизированном (CM002) штамме.
[0017] На фигуре 8 показаны условия эксперимента для анализа массы плодов Micro-Tom.
[0018] На фигуре 9 показан скрининг 10 штаммов на предмет увеличения массы плодов растения Micro-Tom. Представлены результаты шести параллельных анализов. Для столбца 3 р=0,07. Для столбца 7 р=0,05.
[0019] На фигурах 10A-C показаны дополнительные результаты для активности в ARA микроорганизмов-кандидатов и соответствующих мутантов-кандидатов, выращенных в азотфиксирующих средах с добавкой от 0 до 10 мМ глутамина.
[0020] На фигуре 11 изображен двойной мутант, который демонстрирует более высокую экскрецию аммиака, чем одиночный мутант, из которого он был получен.
[0021] На фигуре 12 показано значение NDFA, полученное в эксперименте по поглощению газообразного 15N (экстраполированный назад на основании дней воздействия) для измерения NDFA у растений кукурузы в удобренном состоянии.
[0022] На фигуре 13 показано значение NDFA, полученное в эксперименте по поглощению газообразного 15N (экстраполированный назад на основании дней воздействия) для измерения NDFA у растений сетарии в удобренном состоянии.
[0023] На фигуре 14А показана степень включения газообразного 15N. Растения, инокулированные эволюционировавшим штаммом, показали увеличение включения газообразного 15N по сравнению с неинокулированными растениями.
[0024] На фигуре 14В показано, что через 4 недели после посадки до 7% азота в растениях, инокулированных эволюционировавшим штаммом, происходит из фиксируемого микроорганизмами азота.
[0025] На фигуре 14C показано, что площадь листа (и другие измерения биомассы, данные не показаны) увеличена у растений, инокулированных эволюционировавшим штаммом, по сравнению с ненокулированными или инокулированными диким типом растениями.
[0026] На фигуре 15А изображены эволюционировавшие штаммы, демонстрирующие значительно более высокую продукцию nifH в ткани корня, согласно результатам транскриптомного исследования in planta.
[0027] На фигуре 15В показано, что уровень фиксированного азота, обнаруженного в растительной ткани, коррелирует со степенью, в которой это конкретное растение колонизировано штаммом, оптимизированным посредством HoME.
[0028] На фигуре 16А изображена карта структуры почвы для различных полевых почв, испытанных на колонизацию. Почвы, из которых изначально были получены некоторые микроорганизмы, обозначены звездочками.
[0029] На фигуре 16B показана степень колонизации штамма 1 и штамма 5, которые были протестированы на четырех разных типах почв (кружки). Оба штамма показали относительно устойчивый профиль колонизации на разных типах почв.
[0030] На фигуре 16C показана колонизация штамма 1, протестированная в полевых испытаниях в течение периода вегетации. Штамм 1 сохраняется в ткани кукурузы вплоть до 12 недели после посадки и по прошествии этого времени начинает демонстрировать снижение колонизации.
[0031] На фигуре 17 изображена схема селекции микроорганизмов в соответствии с вариантами осуществления.
[0032] На фигуре 18 изображен развернутый вид измерения состава микробиома, как показано на фигуре 17.
[0033] На фигурах 19А и 19В показано повышение нитрогеназной активности и экскреции аммония у мутантов штамма К. sacchari CI006 с модификациями в гене синтеза гликогена glgA.
[0034] На фигурах 20А и 20В показано повышение нитрогеназной активности и экскреции аммония у мутантов штамма К. variicola CI137 с модификациями в гене синтеза гликогена glgA по сравнению с родительскими штаммами с идентичными генотипами, но без модификации glgA.
[0035] На фигуре 21 проиллюстрирована схема гена glnE, на которой показаны области, соответствующие функциональным доменам белка GlnE.
[0036] На фигуре 22 показано повышение экскреции аммония в минимальных средах, не содержащих азота, у мутантов штамма K. variicola CI137 с модификациями в гене glnD.
[0037] На фигуре 23 показано повышение экскреции аммония у мутантов штамма K. sacchari CI006 с модификациями в гене glnD.
[0038] На фигуре 24A показано повышение экскреции аммония в минимальных средах, не содержащих азота, у мутантов штамма K. variicola CI137 с модификациями в гене glnK.
[0039] На фигуре 24B показано повышение экскреции аммония у мутантов штамма K. variicola CI137 с модификациями в гене glnA, созданными путем вставки промотора из гена, конститутивно экспрессируемого на низком уровне (glnE, glnD или glnB), в направлении против хода транскрипции, и мутирования старт-кодона ATG в GTG в штамме с мутацией glnE_KO2 в минимальной среде с добавкой 5 мМ глутамина.
[0040] На фигуре 25 показано повышение экскреции аммония у мутантов штамма K. variicola CI137 с модификациями в гене glnA, созданными путем вставки промотора из гена, конститутивно экспрессируемого на низком уровне (glnE, glnD или glnB), в направлении против хода транскрипции, и мутирования старт-кодона ATG в GTG в штамме с мутацией glnE_KO2 и ΔnifL::Prm1.2 в минимальной среде с добавкой 5 мМ глутамина.
[0041] На фигуре 26 показано повышение экскреции аммония у мутантов штамма K. sacchari CI006 с модификациями в гене glnA, созданными путем вставки промотора из гена, конститутивно экспрессируемого на низком уровне (glnE, glnD или glnB), в направлении против хода транскрипции, и мутирования старт-кодона ATG в GTG в штамме с мутацией glnE_KO2 и ΔnifL::Prm1.2 в минимальной среде, не содержащей азота.
[0042] На фигуре 27 показано повышение экскреции аммония у мутантов штамма K. variicola CI137 с модификациями оперона, кодирующего GOGAT (glnBD), созданными путем вставки промотора glnD против хода транскрипции от оперона в родительском штамме 137-2084.
[0043] На фигуре 28 показано повышение нитрогеназной активности, измеренное с помощью ARA, у мутантов штамма K. variicola CI137 с модификациями в опероне, кодирующем GOGAT (glnBD), созданными путем вставки промотора glnD против хода транскрипции от оперона, по сравнению с родительским штаммом 137-2084.
[0044] На фигуре 29 показано повышение экскреции аммония у мутантов штамма K. sacchari CI006 с модификациями в экспрессии фермента глутаминазы glsA2, созданными путем вставки сильного промотора против хода транскрипции от гена glsA2, по сравнению с родительским контролем.
[0045] На фигуре 30 показано повышение экскреции аммония у мутантов штамма K. variicola CI137 с модификациями в экспрессии фермента глутаминазы glsA2, созданными путем вставки сильного промотора против хода транскрипции от гена glsA2, по сравнению с родительским контролем.
[0046] На фигуре 31 показано повышение экскреции аммония у мутантов штамма К. variicola CI137 с модификациями в гене asnB по сравнению с родительским контрольным штаммом.
[0047] На фигуре 32 показано повышение нитрогеназной активности у мутантов штамма K. variicola CI137 с модификациями rpoN по сравнению с родительским контролем.
[0048] На фигуре 33 показано повышение экскреция азота у мутантов штамма K. variicola CI137 с модификациями rpoN по сравнению с родительским контролем.
[0049] На фигуре 34 показано повышение нитрогеназной активности у мутантов штамма K. sacchari CI006 с измененной экспрессией гена otsB по сравнению с родительским контролем.
[0050] На фигуре 35 показано повышение экскреции азота у мутантов штамма K. sacchari CI006 с измененной экспрессией гена otsB по сравнению с родительским контролем.
[0051] На фигурах 36А и 36В показана не подвергшаяся изменениям экскреция азота и повышенная колонизация у мутантов штамма K. variicola CI137 с модификациями в phoB по сравнению с родительским контролем.
[0052] На фигуре 37 показано повышение колонизации у мутантов штамма K. sacchari CI006 с модификациями в yjbE по сравнению с родительским контролем.
[0053] На фигурах 38A и B показано повышение нитрогеназной активности и экскреции азота у мутантов штамма K. sacchari CI006 с модификациями экспрессии гена транспорта сульфатов otsB, созданными путем вставки промотора непосредственно против хода транскрипции от указанного гена, по сравнению с родительским штаммом.
[0054] На фигурах 39А и 39В показано повышение нитрогеназной активности у мутантов штамма K. sacchari CI006 с модификациями экспрессии гена транспорта сульфатов cysZ, созданными путем вставки промотора непосредственно против хода транскрипции от указанного гена, по сравнению с родительским штаммом.
[0055] На фигурах 40А и 40В показано повышение экскреции аммония у мутантов штамма К. variicola CI137 с модификациями в dctA1 и dctA2.
На фигурах 41А и 41В проиллюстрировано отношение транскрипта nifH к транскрипту nifA в нескольких штаммах с различными промоторами и последовательностями RBS, вставленными против хода транскрипции от nifA.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0056] Термины «полинуклеотид», «нуклеотид», «нуклеотидная последовательность», «нуклеиновая кислота» и «олигонуклеотид» используются взаимозаменяемо. Они относятся к полимерной форме нуклеотидов любой длины, либо дезоксирибонуклеотидов, либо рибонуклеотидов, либо их аналогов. Полинуклеотиды могут иметь любую трехмерную структуру и могут выполнять любую функцию, известную или неизвестную. Ниже приведены неограничивающие примеры полинуклеотидов: кодирующие или некодирующие области гена или фрагмента гена, локусы (локус), определенные из анализа сцепления, экзоны, интроны, матричная РНК (мРНК), транспортная РНК (тРНК), рибосомная РНК (рРНК), короткая интерферирующая РНК (киРНК), короткая шпилечная РНК (кшРНК), микроРНК (мкРНК), рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, зонды нуклеиновых кислот и праймеры. Полинуклеотид может содержать один или более модифицированных нуклеотидов, таких как метилированные нуклеотиды и нуклеотидные аналоги. Модификация структуры нуклеотида, если она имеет место, может быть внесена до или после сборки полинуклеотида. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгации с метящим компонентом.
[0057] «Гибридизация» относится к реакции, в которой один или более полинуклеотидов реагируют с образованием комплекса, который стабилизируется посредством водородных связей между основаниями нуклеотидных остатков. Водородная связь может происходить путем спаривания оснований по Уотсону-Крику, связывания по Хугстину или любым другим специфичным для последовательности образом в соответствии с комплементарностью оснований. Комплекс может содержать две цепи, образующие дуплексную структуру, три или более цепей, образующих многоцепочечный комплекс, одну самогибридизирующуюся цепь или любую их комбинацию. Реакция гибридизации может представлять собой стадию в более широкомасштабном процессе, таком как инициация ПЦР или ферментативное расщепление полинуклеотида эндонуклеазой. Вторая последовательность, которая является комплементарной первой последовательности, называется «комплементом» первой последовательности. Термин «гибридизуемый» применительно к полинуклеотиду относится к способности полинуклеотида образовывать комплекс, который стабилизируется посредством водородных связей между основаниями нуклеотидных остатков в реакции гибридизации.
[0058] «Комплементарность» относится к способности нуклеиновой кислоты образовывать водородную связь (связи) с другой последовательностью нуклеиновой кислоты либо традиционного типа по Уотсону-Крику, либо других нетрадиционных типов. Процент комплементарности обозначает процент остатков в молекуле нуклеиновой кислоты, которые могут образовывать водородные связи (например, спаривание оснований по Уотсону-Крику) со второй последовательностью нуклеиновой кислоты (например, 5, 6, 7, 8, 9, 10 из 10 составляет 50%, 60%, 70%, 80%, 90% и 100%, соответственно). «Совершенно комплементарный» означает, что все смежные остатки последовательности нуклеиновой кислоты будут иметь водородную связь с таким же количеством смежных остатков во второй последовательности нуклеиновой кислоты. «По существу комплементарный» в контексте настоящего документа относится к степени комплементарности, составляющей по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% в пределах области из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более нуклеотидов, или относится к двум нуклеиновым кислотам, которые гибридизуются в жестких условиях. Идентичность последовательностей, например, для оценки процента комплементарности, может быть измерена с помощью любого подходящего алгоритма выравнивания, включая, не ограничиваясь перечисленным, алгоритм Нидлмана-Вунша (см., например, средство для выравнивания EMBOSS Needle, доступное по адресу www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html, необязательно с настройками по умолчанию), алгоритм BLAST (см., например, инструмент для выравнивания BLAST, доступный по адресу blast.ncbi.nlm.nih.gov/Blast.cgi, необязательно с настройками по умолчанию) или алгоритм Смита-Уотермана (см., например, средство для выравнивания EMBOSS Water, доступное по адресу www.ebi.ac.uk/Tools/psa/emboss_water/nucleotide.html, необязательно с настройками по умолчанию). Оптимальное выравнивание может быть оценено с использованием любых подходящих параметров выбранного алгоритма, включая параметры по умолчанию.
[0059] В целом «жесткие условия» гибридизации относятся к условиям, при которых нуклеиновая кислота, обладающая комплементарностью целевой последовательности, преимущественно гибридизуется с целевой последовательностью и по существу не гибридизуется с нецелевыми последовательностями. Жесткие условия, как правило, зависят от последовательности и варьируются в зависимости от ряда факторов. Как правило, чем длиннее последовательность, тем выше температура, при которой последовательность специфично гибридизуется с ее целевой последовательностью. Неограничивающие примеры жестких условий подробно описаны в Tijssen (1993), Laboratory Techniques In Biochemistry And Molecular Biology-Hybridization With Nucleic Acid Probes, часть I, вторая глава “Overview of principles of hybridization and the strategy of nucleic acid probe assay”, Elsevier, N.Y.
[0060] В целом «идентичность последовательностей» относится к точному соответствию нуклеотидов или аминокислот двух полинуклеотидных или полипептидных последовательностей, соответственно. Как правило, способы определения идентичности последовательностей включают определение нуклеотидной последовательности полинуклеотида и/или определение кодируемой ими аминокислотной последовательности и сравнение этих последовательностей со второй нуклеотидной или аминокислотной последовательностью. Две или более последовательностей (полинуклеотидные или аминокислотные) можно сравнивать, определяя их «процент идентичности». Процент идентичности двух последовательностей, будь то последовательности нуклеиновых кислот или аминокислотные последовательности, может быть рассчитан как количество точных совпадений между двумя выровненными последовательностями, разделенное на длину более коротких последовательностей и умноженное на 100. В некоторых случаях процент идентичности исследуемой последовательности и референсной последовательности, последовательности нуклеиновых кислот или аминокислотные последовательности, может быть рассчитан как число точных совпадений между двумя выровненными последовательностями, разделенное на длину референсной последовательности и умноженное на 100. Процент идентичности также может быть определен, например, путем сравнения информации о последовательности с использованием усовершенствованной компьютерной программы BLAST, включая версию 2.2.9, доступную от National Institutes of Health. Программа BLAST основана на алгоритме выравнивания Karlin и Altschul, Proc. Natl. Acad. Sci. USA 87:2264-2268 (1990) и как обсуждается в Altschul, et al., J. Mol. Biol. 215:403-410 (1990); Karlin And Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877 (1993); и Altschul et al., Nucleic Acids Res. 25:3389-3402 (1997). Вкратце, в программе BLAST идентичность определена как количество идентичных выровненных символов (обычно нуклеотидов или аминокислот), деленное на общее количество символов в более короткой из двух последовательностей. Данная программа может быть использована для определения процента идентичности по всей длине сравниваемых белков. Параметры по умолчанию предоставляются для оптимизации поиска с короткими искомыми последовательностями, например, в программе blastp. Программа также позволяет использовать фильтр SEG для маскировки сегментов искомых последовательностей, как определено в программе SEG, описанной Wootton and Federhen, Computers and Chemistry 17: 149-163 (1993). Диапазоны желаемых степеней идентичности последовательностей составляют примерно от 80% до 100%, включая целочисленные значения между ними. Как правило, процент идентичности между раскрытой последовательностью и заявленной последовательностью составляет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99%.
[0061] В контексте настоящего документа термин «экспрессия» относится к процессу, посредством которого полинуклеотид транскрибируется с ДНК-матрицы (например, в мРНК или другой РНК-транскрипт) и/или процессу, посредством которого транскрибированная мРНК впоследствии транслируется в пептиды, полипептиды или белки. Транскрипты и кодируемые полипептиды могут в совокупности называться «продуктом гена». Если полинуклеотид получен из геномной ДНК, экспрессия может включать сплайсинг мРНК в эукариотической клетке.
[0062] Термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и может прерываться сегментами, отличными от аминокислот. Данные термины также включают полимер аминокислот, который был модифицирован; например, образованием дисульфидной связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или любыми другими манипуляциями, такими как конъюгация с метящим компонентом. В контексте настоящего документа термин «аминокислота» относится к природным и/или неприродным или синтетическим аминокислотам, включая глицин и как оптические D- или L-изомеры, так и аналоги аминокислот и пептидомиметики.
[0063] В контексте настоящего документа термин «приблизительно» используется в качестве синонима термину «примерно». В качестве иллюстрации, использование термина «приблизительно» применительно к количеству означает, что значения немного выходят за пределы приведенных значений, например, плюс или минус 0,1-10%.
[0064] Термин «биологически чистая культура» или «по существу чистая культура» относится к культуре видов бактерий, описанных в настоящем документе, не содержащей других видов бактерий в количествах, достаточных для того, чтобы препятствовать репликации культуры или быть обнаруженными обычными бактериологическими методами.
[0065] «Продуктивность растения» в общем относится к любому аспекту роста или развития растения, который является причиной, по которой растение выращивают. Для пищевых сельскохозяйственных культур, таких как зерновые или овощи, «продуктивность растения» может относиться к урожайности зерна или плодов, собираемых с определенной сельскохозяйственной культуры. В контексте настоящего документа улучшение продуктивности растения в целом относится к улучшению урожайности зерна, плодов, цветов или других частей растения, собираемых для различных целей, улучшению роста частей растения, включая стебли, листья и корни, стимулированию роста растений, поддержанию высокого содержания хлорофилла в листьях, увеличению количества плодов или семян, увеличению массы единицы плода или семени, сокращению выбросов NO2 из-за сокращения использования азотных удобрений и аналогичным улучшениям в части роста и развития растений.
[0066] Микроорганизмы внутри и вокруг пищевых сельскохозяйственных культур могут влиять на качества этих культур. Качества растений, на которые могут влиять микроорганизмы, включают: урожайность (например, производство зерна, продукция биомассы, развитие плодов, цветение); питание (например, усвоение азота, фосфора, калия, железа, микроэлементов); контроль абиотического стресса (например, засухоустойчивость, солеустойчивость, жароустойчивость); и контроль биотического стресса (например, сельскохозяйственных вредителей, сорных растений, насекомых, грибов и бактерий). Стратегии изменения качеств сельскохозяйственных культур включают: повышение концентрации ключевых метаболитов; изменение временной динамики влияния микроорганизмов на ключевые метаболиты; связывание продукции/разложения метаболитов микроорганизмов с новыми факторами окружающей среды; снижение нежелательных метаболитов; и улучшение баланса метаболитов или исходных белков.
[0067] В контексте настоящего документа термин «контрольная последовательность» относится к оператору, промотору, сайленсеру или терминатору.
[0068] В некоторых вариантах осуществления нативные или эндогенные контрольные последовательности генов согласно настоящему изобретению заменены одной или более внутриродовыми контрольными последовательностями.
[0069] В контексте настоящего документа термин «введенный» относится к введению посредством современной биотехнологии, а не к введению, произошедшему естественным путем.
[0070] В некоторых вариантах осуществления бактерии согласно настоящему изобретению были модифицированы таким образом, что они не являются встречающимися в природе бактериями.
[0071] В некоторых вариантах осуществления бактерии согласно настоящему изобретению присутствуют в растении в количестве по меньшей мере 103 КОЕ, 104 КОЕ, 105 КОЕ, 106 КОЕ, 107 КОЕ, 108 КОЕ, 109 КОЕ, 1010 КОЕ, 1011 КОЕ или 1012 КОЕ на грамм сырой или сухой массы растения. В некоторых вариантах осуществления бактерии согласно настоящему изобретению присутствуют в растении в количестве по меньшей мере приблизительно 103 КОЕ, приблизительно 104 КОЕ, приблизительно 105 КОЕ, приблизительно 106 КОЕ, приблизительно 107 КОЕ, приблизительно 108 КОЕ, приблизительно 109 КОЕ, приблизительно 1010 КОЕ, приблизительно 1011 КОЕ или приблизительно 1012 КОЕ на грамм сырой или сухой массы растения. В некоторых вариантах осуществления бактерии согласно настоящему изобретению присутствуют в растении в количестве по меньшей мере от 103 до 109, от 103 до 107, от 103 до 105, от 105 до 109, от 105 до 107, от 106 до 1010, от 106 до 107 КОЕ на грамм сырой или сухой массы растения.
[0072] Удобрения и экзогенный азот согласно настоящему изобретению могут содержать следующие азотсодержащие молекулы: аммоний, нитрат, нитрит, аммиак, глутамин и т.д. Источники азота согласно настоящему изобретению могут включать безводный аммиак, сульфат аммония, мочевину, диаммонийфосфат, формальдегидмочевину, моноаммонийфосфат, нитрат аммония, аммиачную воду, нитрат кальция, нитрат калия, нитрат натрия и т.д.
[0073] В контексте настоящего документа термин «экзогенный азот» относится к неатмосферному азоту, легко доступному в почве, поле или питательной среде, который присутствует в нелимитирующих условиях по азоту, включая аммиак, аммоний, нитрат, нитрит, мочевину, мочевую кислоту, кислый аммоний и т.д.
[0074] В контексте настоящего документа термин «нелимитирующие условия по азоту» относится к доступности неатмосферного азота в почве, поле, среде в концентрациях, превышающих приблизительно 4 мМ азота, как описано в источнике Kant et al. (2010). J. Exp. Biol. 62(4):1499-1509), включенном в настоящий документ посредством сслыки.
[0075] В контексте настоящего документа термин «введенный генетический материал» означает генетический материал, который был добавлен в геном реципиента и остается его компонентом.
[0076] В некоторых вариантах осуществления генетическая регуляторная сеть фиксации и ассимиляции азота включает полинуклеотиды, кодирующие гены, и некодирующие последовательности, которые направляют, модулируют и/или регулируют фиксацию и/или ассимиляцию азота микроорганизмом и могут содержать полинуклеотидные последовательности кластера nif (например, nifA, nifB, nifC,…….nifZ), полинуклеотиды, кодирующие регуляторный белок C азота, полинуклеотиды, кодирующие регуляторный белок B азота, полинуклеотидные последовательности кластера gln (например, glnA и glnD), draT и транспортеры/пермеазы аммиака. В некоторых случаях кластер Nif может включать NifB, NifH, NifD, NifK, NifE, NifN, NifX, hesa и NifV. В некоторых случаях кластер Nif может содержать часть из NifB, NifH, NifD, NifK, NifE, NifN, NifX, hesa и NifV.
[0077] В некоторых вариантах осуществления удобрение согласно настоящему изобретению содержит по меньшей мере 5 масс. %, 6 масс. %, 7 масс. %, 8 масс. %, 9 масс. %, 10 масс. %, 11 масс. %, 12 масс. %, 13 масс. %, 14 масс. %, 15 масс. %, 16 масс. %, 17 масс. %, 18 масс. %, 19 масс. %, 20 масс. %, 21 масс. %, 22 масс. %, 23 масс. %, 24 масс. %, 25 масс. %, 26 масс. %, 27 масс. %, 28 масс. %, 29 масс. %, 30 масс. %, 31 масс. %, 32 масс. %, 33 масс. %, 34 масс. %, 35 масс. %, 36 масс. %, 37 масс. %, 38 масс. %, 39 масс. %, 40 масс. %, 41 масс. %, 42 масс. %, 43 масс. %, 44 масс. %, 45 масс. %, 46 масс. %, 47 масс. %, 48 масс. %, 49 масс. %, 50 масс. %, 51 масс. %, 52 масс. %, 53 масс. %, 54 масс. %, 55 масс. %, 56 масс. %, 57 масс. %, 58 масс. %, 59 масс. %, 60 масс. %, 61 масс. %, 62 масс. %, 63 масс. %, 64 масс. %, 65 масс. %, 66 масс. %, 67 масс. %, 68 масс. %, 69 масс. %, 70 масс. %, 71 масс. %, 72 масс. %, 73 масс. %, 74 масс. %, 75 масс. %, 76 масс. %, 77 масс. %, 78 масс. %, 79 масс. %, 80 масс. %, 81 масс. %, 82 масс. %, 83 масс. %, 84 масс. %, 85 масс. %, 86 масс. %, 87 масс. %, 88 масс. %, 89 масс. %, 90 масс. %, 91 масс. %, 92 масс. %, 93 масс. %, 94 масс. %, 95 масс. %, 96 масс. %, 97 масс. %, 98 масс. %, 99 масс. % азота.
[0078] В некоторых вариантах осуществления удобрение согласно настоящему изобретению содержит по меньшей мере приблизительно 5 масс. %, приблизительно 6 масс. %, приблизительно 7 масс. %, приблизительно 8 масс. %, приблизительно 9 масс. %, приблизительно 10 масс. %, приблизительно 11 масс. %, приблизительно 12 масс. %, приблизительно 13 масс. %, приблизительно 14 масс. %, приблизительно 15 масс. %, приблизительно 16 масс. %, приблизительно 17 масс. %, приблизительно 18 масс. %, приблизительно 19 масс. %, приблизительно 20 масс. %, приблизительно 21 масс. %, приблизительно 22 масс. %, приблизительно 23 масс. %, приблизительно 24 масс. %, приблизительно 25 масс. %, приблизительно 26 масс. %, приблизительно 27 масс. %, приблизительно 28 масс. %, приблизительно 29 масс. %, приблизительно 30 масс. %, приблизительно 31 масс. %, приблизительно 32 масс. %, приблизительно 33 масс. %, приблизительно 34 масс. %, приблизительно 35 масс. %, приблизительно 36 масс. %, приблизительно 37 масс. %, приблизительно 38 масс. %, приблизительно 39 масс. %, приблизительно 40 масс. %, приблизительно 41 масс. %, приблизительно 42 масс. %, приблизительно 43 масс. %, приблизительно 44 масс. %, приблизительно 45 масс. %, приблизительно 46 масс. %, приблизительно 47 масс. %, приблизительно 48 масс. %, приблизительно 49 масс. %, приблизительно 50 масс. %, приблизительно 51 масс. %, приблизительно 52 масс. %, приблизительно 53 масс. %, приблизительно 54 масс. %, приблизительно 55 масс. %, приблизительно 56 масс. %, приблизительно 57 масс. %, приблизительно 58 масс. %, приблизительно 59 масс. %, приблизительно 60 масс. %, приблизительно 61 масс. %, приблизительно 62 масс. %, приблизительно 63 масс. %, приблизительно 64 масс. %, приблизительно 65 масс. %, приблизительно 66 масс. %, приблизительно 67 масс. %, приблизительно 68 масс. %, приблизительно 69 масс. %, приблизительно 70 масс. %, приблизительно 71 масс. %, приблизительно 72 масс. %, приблизительно 73 масс. %, приблизительно 74 масс. %, приблизительно 75 масс. %, приблизительно 76 масс. %, приблизительно 77 масс. %, приблизительно 78 масс. %, приблизительно 79 масс. %, приблизительно 80 масс. %, приблизительно 81 масс. %, приблизительно 82 масс. %, приблизительно 83 масс. %, приблизительно 84 масс. %, приблизительно 85 масс. %, приблизительно 86 масс. %, приблизительно 87 масс. %, приблизительно 88 масс. %, приблизительно 89 масс. %, приблизительно 90 масс. %, приблизительно 91 масс. %, приблизительно 92 масс. %, приблизительно 93 масс. %, приблизительно 94 масс. %, приблизительно 95 масс. %, приблизительно 96 масс. %, приблизительно 97 масс. %, приблизительно 98 масс. % или приблизительно 99 масс. % азота.
[0079] В некоторых вариантах осуществления удобрение согласно настоящему изобретению содержит приблизительно от 5 масс. % до 50 масс. %, приблизительно от 5 масс. % до 75 масс. %, приблизительно от 10 масс. % до 50 масс. %, приблизительно от 10 масс. % до 75 масс. %, приблизительно от 15 масс. % до 50 масс. %, приблизительно от 15 масс. % до 75 масс. %, приблизительно от 20 масс. % до 50 масс. %, приблизительно от 20 масс. % до 75 масс. %, приблизительно от 25 масс. % до 50 масс. %, приблизительно от 25 масс. % до 75 масс. %, приблизительно от 30 масс. % до 50 масс. %, приблизительно от 30 масс. % до 75 масс. %, приблизительно от 35 масс. % до 50 масс. %, приблизительно от 35 масс. % до 75 масс. %, приблизительно от 40 масс. % до 50 масс. %, приблизительно от 40 масс. % до 75 масс. %, приблизительно от 45 масс. % до 50 масс. %, приблизительно от 45 масс. % до 75 масс. % или приблизительно от 50 масс. % до 75 масс. % азота.
[0080] В некоторых вариантах осуществления повышение азотфиксации и/или продукции 1% или более азота в растении измеряют относительно контрольных растений, которые не подвергались воздействию бактерий согласно настоящему изобретению. Все повышения или снижения у бактерий измеряют относительно контрольных бактерий. Все повышения или снижения у растений измеряют относительно контрольных растений.
[0081] В контексте настоящего документа «конститутивный промотор» представляет собой промотор, активный при большинстве условий и/или на большинстве стадий развития. Существует несколько преимуществ, связанных с использованием конститутивных промоторов в векторах экспрессии, используемых в биотехнологии, таких как: высокий уровень продукции белков, используемых для отбора трансгенных клеток или организмов; высокий уровень экспрессии репортерных белков или селективных маркеров, что обеспечивает простоту обнаружения и количественного определения; высокий уровень продукции транскрипционного фактора, который является частью регуляторной системы транскрипции; продуцирование соединений, требующее универсальной активности в организме; и продуцирование соединений, требуемых на всех стадиях развития. Неограничивающие примеры конститутивных промоторов включают промотор CaMV 35S, опиновые промоторы, промотор убиквитина, промотор алкогольдегидрогеназы и т.д.
[0082] В контексте настоящего документа «неконститутивный промотор» представляет собой промотор, активный в определенных условиях, в определенных типах клеток и/или на определенных стадиях развития. Например, тканеспецифические, тканепредпочтительные, клеточноспецифические, клеточнопредпочтительные, индуцибельные промоторы и промоторы, контролируемые стадией развития, являются неконститутивными промоторами. Примеры промоторов, контролируемых стадией развития, включают промоторы, которые избирательно инициируют транскрипцию в определенных тканях.
[0083] В контексте настоящего документа «индуцибельный» или «репрессируемый» промотор представляет собой промотор, который находится под контролем химических факторов или факторов окружающей среды. Примеры условий окружающей среды, которые могут влиять на транскрипцию индуцибельными промоторами, включают анаэробные условия, определенные химические вещества, присутствие света, кислотные или основные условия и т.д.
[0084] В контексте настоящего документа «тканеспецифический» промотор представляет собой промотор, который инициирует транскрипцию только в определенных тканях. В отличие от конститутивной экспрессии генов, тканеспецифическая экспрессия представляет собой результат взаимодействия нескольких уровней генной регуляции. Соответственно, в данной области техники иногда предпочтительно применение промоторов из гомологичного или близкородственного вида для достижения эффективной и надежной экспрессии трансгенов в определенных тканях. Это одна из основных причин значительного количества тканеспецифических промоторов, выделенных из определенных тканей, описанных как в научной, так и в патентной литературе.
[0085] В контексте настоящего документа термин «функционально связанный» относится к связи последовательностей нуклеиновых кислот на одном фрагменте нуклеиновой кислоты таким образом, что функцию одной регулирует другая. Например, промотор функционально связан с кодирующей последовательностью, если он способен регулировать экспрессию указанной кодирующей последовательности (т.е. кодирующая последовательность находится под транскрипционным контролем указанного промотора). Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации. Согласно еще одному примеру комплементарные области РНК согласно описанию могут быть функционально связаны, прямо или опосредованно, с 5'-концом целевой мРНК, или с 3'-концом целевой мРНК, или внутри целевой мРНК, или первая комплементарная область является 5'-концевой, а ее комплемент является 3'-концевым относительно целевой мРНК.
Регуляция азотфиксации
[0086] Одним из качеств, на которое может быть направлена регуляция описанными в настоящем документе способами, является азотфиксация. Азотные удобрения являются крупнейшим операционным расходом на ферме и основным стимулятором более высоких урожайностей таких пропашных сельскохозяйственных культур, как кукуруза и пшеница. В настоящем документе описаны продукты на основе микроорганизмов, которые могут доставлять возобновляемые формы азота в небобовые культуры. Хотя некоторые эндофиты обладают генетикой, необходимой для азотфиксации в чистой культуре, фундаментальная техническая проблема заключается в том, что эндофиты дикого типа зерновых и злаковых перестают фиксировать азот в удобренных полях. Применение химических удобрений и остаточные уровни азота в полевых почвах сигнализирует микроорганизму о необходимости остановить биохимический путь азотфиксации.
[0087] Для разработки микроорганизма, способного фиксировать и переносить азот в кукурузу в присутствии удобрения, необходимы изменения в транскрипционном и посттрансляционном уровнях регуляторной сети азотфиксации. С этой целью в настоящем документе описана технология Эволюции Хозяин-Микроорганизм (Host-Microbe Evolution, HoME) для точного развития регуляторных сетей и выявления новых фенотипов. В настоящем документе также описаны уникальные, запатентованные библиотеки азотфиксирующих эндофитов, выделенных из кукурузы, в сочетании с обширными данными омики, касающимися взаимодействия микроорганизмов и растения-хозяина при различных условиях окружающей среды, таких как недостаток и избыток азота. Эта технология обеспечивает точное развитие генетической регуляторной сети эндофитов для получения микроорганизмов, которые активно фиксируют азот даже в присутствии удобрений в поле. В настоящем документе также описаны оценки технического потенциала разрабатываемых микроорганизмов, которые колонизируют ткани корня кукурузы и продуцируют азот, для удобренных растений, а также оценки совместимости эндофитов со стандартными методами приготовления препаратов и разнообразными почвами, чтобы определить возможность интеграции микроорганизмов в современные стратегии контроля азота.
[0088] Чтобы использовать элементарный азот (N) для химического синтеза, формы жизни объединяют газообразный азот (N2), доступный из атмосферы, с водородом в процессе, известном как азотфиксация. Из-за энергоемкой природы биологической азотфиксации у диазотрофов (бактерий и архей, которые фиксируют атмосферный газообразный азот) развилась сложная и жесткая регуляция кластера генов nif в ответ на кислород окружающей среды и доступный азот. Гены nif кодируют ферменты, участвующие в азотфиксации (такие как комплекс нитрогеназы), и белки, регулирующие азотфиксацию. В источнике Shamseldin (2013. Global J. Biotechnol. Biochem. 8(4):84-94) приведены подробные описания генов nif и их продуктов, и он включен в настоящий документ посредством ссылки. В настоящем документе описаны способы получения растения с улучшенным качеством, включающие выделение бактерий из первого растения, введение генетического изменения в ген nif выделенных бактерий, подвергание второго растения воздействию вариантных бактерий, выделение бактерий из второго растения, обладающего улучшенным качеством относительно первого растения, и повторение стадий с бактериями, выделенными из второго растения.
[0089] У Proteobacteria регуляция азотфиксации сосредоточена вокруг σ54-зависимого энхансер-связывающего белка NifA, положительного регулятора транскрипции кластера nif. Внутриклеточные уровни активного NifA контролируются двумя ключевыми факторами: транскрипцией оперона nifLA и ингибированием активности NifA межбелковым взаимодействием с NifL. Оба этих процесса восприимчивы к внутриклеточным уровням глутамина посредством сигнального каскада белка PII. Этот каскад опосредован GlnD, который непосредственно распознает глутамин и катализирует уридилирование или деуридилирование двух регуляторных белков PII - GlnB и GlnK - в ответ на отсутствие или присутствие, соответственно, связанного глутамина. В условиях избытка азота немодифицированный GlnB сигнализирует об инактивации промотора nifLA. Однако в лимитированных по азоту условиях GlnB является посттрансляционно модифицированным, что ингибирует его активность и приводит к транскрипции оперона nifLA. Таким образом, транскрипция nifLA строго контролируется в ответ на азот в окружающей среде посредством сигнального каскада белка PII. На посттрансляционном уровне регуляции NifA GlnK ингибирует взаимодействие NifL/NifA в зависимости от общего уровня свободного GlnK в клетке.
[0090] NifA транскрибируется с оперона nifLA, промотор которого активируется фосфорилированным NtrC, еще одним σ54-зависимым регулятором. Состояние фосфорилирования NtrC опосредовано гистидинкиназой NtrB, которая взаимодействует с деуридилированным GlnB, но не уридилированным GlnB. В условиях избытка азота высокий внутриклеточный уровень глутамина приводит к деуридилированию GlnB, который затем взаимодействует с NtrB, инактивируя его фосфорилирующую активность и активируя его фосфатазную активность, что приводит к дефосфорилированию NtrC и инактивации промотора nifLA. Однако в лимитированных по азоту условиях низкий уровень внутриклеточного глутамина приводит к уридилированию GlnB, что ингибирует его взаимодействие с NtrB и позволяет осуществлять фосфорилирование NtrC и транскрипцию оперона nifLA. Таким образом, экспрессия nifLA строго контролируется в ответ на азот в окружающей среде посредством сигнального каскада белка PII. Все из nifA, ntrB, ntrC и glnB представляют собой гены, которые могут быть мутированы в описанных в настоящем документе способах. Эти процессы могут также быть восприимчивыми к внутриклеточным уровням аммиака, мочевины или нитратов.
[0091] Активность NifA также регулируется посттрансляционно в ответ на азот окружающей среды, чаще всего посредством опосредованного NifL ингибирования активности NifA. Как правило, на взаимодействие NifL и NifA влияет сигнальный каскад белка PII посредством GlnK, хотя характер взаимодействий между GlnK и NifL/NifA значительно варьируется между диазотрофами. У Klebsiella pneumoniae обе формы GlnK ингибируют взаимодействие NifL/NifA, а взаимодействие между GlnK и NifL/NifA определяется общим уровнем свободного GlnK в клетке. В условиях избытка азота деуридилированный GlnK взаимодействует с транспортером аммония AmtB, который служит как для блокирования поглощения аммония AmtB, так и для секвестрации GlnK в мембрану, что позволяет ингибировать NifA посредством NifL. С другой стороны, у Azotobacter vinelandii взаимодействие с деурилилированным GlnK необходимо для взаимодействия NifL/NifA и ингибирования NifA, тогда как уридилирование GlnK ингибирует его взаимодействие с NifL. Существуют свидетельства того, что у диазотрофов, не имеющих гена nifL, активность NifA ингибируется непосредственно при взаимодействии с деуридилированными формами как GlnK, так и GlnB в условиях избытка азота. У некоторых бактерий кластер Nif может регулироваться посредством glnR, и, кроме того, в некоторых случаях это может включать отрицательную регуляцию. Независимо от механизма посттрансляционное ингибирование NifA является важным регулятором кластера nif у большинства известных диазотрофов. Кроме того, nifL, amtB, glnK и glnR являются генами, которые могут быть мутированы в описанных в настоящем документе способах.
[0092] Помимо регуляции транскрипции генов кластера nif у многих диазотрофов развился механизм для прямой посттрансляционной модификации и ингибирования самого фермента нитрогеназы, известный как выключение нитрогеназы. Этот процесс опосредуется АДФ-рибозилированием Fe-белка (NifH) в условиях избытка азота, что нарушает его взаимодействие с белковым комплексом MoFe (NifDK) и ликвидирует нитрогеназную активность. DraT катализирует АДФ-рибозилирование Fe-белка и выключение нитрогеназы, тогда как DraG катализирует удаление АДФ-рибозы и повторную активацию нитрогеназы. Как и в случае транскрипции nifLA и ингибирования NifA, выключение нитрогеназы также регулируется посредством сигнального каскада белка PII. В условиях избытка азота деуридилированный GlnB взаимодействует с DraT и активирует его, а деуридилированный GlnK взаимодействует как с DraG, так и с AmtB с образованием комплекса, секвестрируя DraG в мембрану. В лимитированных по азоту условиях уридилированные формы GlnB и GlnK не взаимодействуют с DraT и DraG, соответственно, что приводит к инактивации DraT и диффузии DraG к Fe-белку, где он удаляет АДФ-рибозу и активирует нитрогеназу. Способы, описанные в настоящем документе, также предусматривают введение генетического изменения в гены nifH, nifD, nifK и draT.
[0093] Хотя некоторые эндофиты обладают способностью фиксировать азот in vitro, часто генетика подавляется в полевых условиях высокими уровнями экзогенных химических удобрений. Можно отделить восприятие экзогенного азота от экспрессии фермента нитрогеназы, чтобы способствовать азотфиксации в полевых условиях. Улучшение интегральной нитрогеназной активности во времени дополнительно способствует повышению продукции азота для использования сельскохозяйственной культурой. Конкретные мишени для генетического изменения для способствования азотфиксации в полевых условиях с использованием описанных в настоящем документе способов включают один или более генов, выбранных из группы, состоящей из nifA, nifL, ntrB, ntrC, glnA, glnB, glnK, draT, amtB, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ.
[0094] Дополнительной мишенью для генетического изменения для способствования азотфиксации в полевых условиях с использованием описанных в настоящем документе способов является белок NifA. Белок NifA обычно является активатором для экспрессии генов азотфиксации. Повышение продукции NifA (либо конститутивно, либо в условиях высокого содержания аммиака) позволяет обойти природный путь восприятия аммиака. Кроме того, снижение продукции белков NifL, известного ингибитора NifA, также приводит к повышению уровня свободно активного NifA. Кроме того, повышение уровня транскрипции оперона nifAL (либо конститутивно, либо в условиях высокого содержания аммиака) также приводит к общему повышению уровня белков NifA. Повышенный уровень экспрессии nifAL достигается путем изменения самого промотора или путем снижения экспрессии NtrB (часть сигнального каскада ntrB и ntrC, которая первоначально приводила к выключению оперона nifAL в условиях высокого содержания азота). Высокий уровень NifA, достигнутый этими или любыми другими способами, описанными в настоящем документе, повышает азотфиксирующую активность эндофитов.
[0095] Другой мишенью для генетического изменения для способствования азотфиксации в полевых условиях с использованием описанных в настоящем документе способов является сигнальный каскад GlnD/GlnB/GlnK PII. Внутриклеточный уровень глутамина воспринимается через сигнальный каскад GlnD/GlnB/GlnK PII. Мутации активного сайта в GlnD, которые ликвидируют уридилил-удаляющую активность GlnD, нарушают каскад восприятия азота. Кроме того, снижение концентрации GlnB вызывает сбой в каскаде восприятия глутамина. Эти мутации «обманывают» клетки, создавая видимость лимитированного по азоту состояния, тем самым повышая уровень азотфиксирующей активности. Эти процессы могут также быть восприимчивыми к внутриклеточным, или внеклеточным, уровням аммиака, мочевины или нитратов.
[0096] Белок amtB также является мишенью для генетического изменения для способствования азотфиксации в полевых условиях с использованием описанных в настоящем документе способов. Поглощение аммиака из окружающей среды может быть уменьшено путем снижения уровня экспрессии белка amtB. Без внутриклеточного аммиака эндофит неспособен воспринимать высокий уровень аммиака, что предотвращает подавление генов азотфиксации. Любой аммиак, попадающий во внутриклеточный компартмент, превращается в глутамин. Внутриклеточный уровень глутамина является основным источником восприятия азота. Снижение внутриклеточного уровня глутамина предотвращает восприятие клетками высоких уровней аммония в окружающей среде. Этот эффект может быть достигнут путем повышения уровня экспрессии глутаминазы - фермента, превращающего глутамин в глутамат. Кроме того, внутриклеточный уровень глутамина также может быть снижен путем уменьшения глутаминсинтазы (фермента, превращающего аммиак в глутамин). У диазотрофов фиксированный аммиак быстро ассимилируется в глутамин и глутамат для использования в клеточных процессах. Нарушение ассимиляции аммиака может позволить перенаправить фиксированный азот, который будет экспортироваться из клетки в виде аммиака. Фиксированный аммиак преимущественно ассимилируется в глутамин глутаминсинтетазой (GS), кодируемой glnA, а затем в глутамин глутамин-оксоглутарат-аминотрансферазой (GOGAT). В некоторых примерах glnS кодирует глутаминсинтетазу. GS регулируется посттрансляционно GS-аденилилтрансферазой (GlnE) - бифункциональным ферментом, кодируемым glnE, который катализирует как аденилирование, так и деаденилирование GS посредством активности его аденилилтрансферазного (AT) и аденилил-удаляющего (AR) доменов, соответственно. В лимитированных по азоту условиях glnA экспрессируется, а AR-домен GlnE деаденилирует GS, обеспечивая ее активность. В условиях избытка азота экспрессия glnA выключается, и AT-домен GlnE аллостерически активируется глутамином, вызывая аденилирование и инактивацию GS.
[0097] Кроме того, ген draT также может быть мишенью для генетического изменения для способствования азотфиксации в полевых условиях с использованием описанных в настоящем документе способов. После продуцирования клеткой азотфиксирующих ферментов выключение нитрогеназы представляет собой еще один уровень, на котором клетка подавляет азотфиксирующую активность в условиях высокого содержания азота. Это выключение можно убрать, снизив уровень экспрессии DraT.
[0098] Способы придания микроорганизмам новых фенотипов могут быть осуществлены на транскрипционном, трансляционном и посттрансляционном уровнях. Транскрипционный уровень включает изменения в промоторе (такие как изменение аффинности сигма-фактора или сайтов связывания для транскрипционных факторов, включая делецию всего или части промотора) или изменение терминаторов и аттенюаторов транскрипции. Трансляционный уровень включает изменения в сайтах связывания рибосомы и изменения сигналов деградации мРНК. Посттрансляционный уровень включает мутирование активного сайта фермента и изменение межбелковых взаимодействий. Эти изменения могут быть достигнуты множеством способов. Снижение уровня экспрессии (или ее полная ликвидация) может быть достигнуто путем замены нативного сайта связывания рибосомы (RBS) или промотора на другой с более низкой силой/эффективностью. Стартовые сайты ATG могут быть заменены старт-кодоном GTG, TTG или CTG, что приводит к снижению трансляционной активности кодирующей области. Полная ликвидация экспрессии может быть осуществлена путем нокаута (делеции) кодирующей области гена. Сдвиг открытой рамки считывания (ORF), вероятно, приведет к преждевременному стоп-кодону вдоль ORF, обеспечивая таким образом нефункциональный усеченный продукт. Вставка стоп-кодонов внутрь рамки считывания также обеспечит нефункциональный усеченный продукт. Для снижения эффективной концентрации определенного гена также может быть осуществлено добавление метки деградации на N- или C-конце.
[0099] И наоборот, уровень экспрессии генов, описанных в настоящем документе, может быть достигнут с использованием более сильного промотора. Для обеспечения высокой активности промотора в условиях высокого уровня азота (или в любых других условиях) можно получить профиль транскрипции всего генома в условиях высокого уровня азота, и из этого набора данных могут быть выбраны активные промоторы с желаемым уровнем транскрипции для замены слабого промотора. Слабые старт-кодоны могут быть заменены старт-кодоном ATG для лучшей эффективности инициации трансляции. Слабые сайты связывания рибосомы (RBS) также могут быть заменены другими RBS с более высокой эффективностью инициации трансляции. Кроме того, для изменения активности фермента также может быть проведен сайт-специфический мутагенез.
[00100] Повышение уровня азотфиксации, которое происходит в растении, может привести к уменьшению количества химических удобрений, необходимых для производства сельскохозяйственных культур, и снижению выбросов парниковых газов (например, окислов азота).
Повышение азотфиксирующей активности
[00101] Нитрогеназы представляют собой ферменты, ответственные за катализ азотфиксации. Существует три типа нитрогеназы, обнаруженных в различных азотфиксирующих бактериях: молибден-содержащая (Мо) нитрогеназа, ванадий-содержащая (V) нитрогеназа и содержащая только железо (Fe) нитрогеназа. Нитрогеназы представляют собой двухкомпонентные системы, состоящие из компонента I (также известного как динитрогеназа) и компонента II (также известного как редуктаза динитрогеназы). Компонент I представляет собой белок MoFe в молибден-содержащей нитрогеназе, белок VFe в ванадий-содержащей нитрогеназе и белок Fe в содержащей только железо нитрогеназе. Компонент II представляет собой Fe-белок, содержащий железосерный кластер (Fe-S).
[00102] В некоторых случаях изменение количества поступающих кофакторов может привести к повышению азотфиксации. Например, увеличение поглощения серы может обеспечить больший пул кофакторов для ферментов нитрогеназ, таким образом повышая количество функциональных комплексов нитрогеназы. В некоторых случаях поглощение серы может быть увеличено путем активации генов транспорта сульфатов. В качестве примеров генов транспорта сульфатов можно привести, не ограничиваясь перечисленным, cysPTWA, sbp, sbp, cysZK.
[00103] В некоторых случаях изменение количества поступающих кофакторов может привести к повышению азотфиксации. Например, увеличение поглощения молибдена (Мо) может обеспечить повышение количества функциональных комплексов нитрогеназы. В некоторых случаях поглощение Mo может быть увеличено путем активации генов транспорта Mo. В качестве примеров генов транспорта Mo можно привести, не ограничиваясь перечисленным, modEBA, modEB и modA.
[00104] В некоторых случаях на поступление кофактора может оказывать влияние поглощение железа. На поглощение железа может оказывать влияние система транспорта tonB. В некоторых случаях влияние на поглощение железа может быть оказано путем активации генов системы транспорта tonB. В качестве примеров генов транспорта tonB можно привести, не ограничиваясь перечисленным, tonB и exbAB. В некоторых случаях на поглощение железа могут влиять сидерофоры, которые увеличивают поглощение железа микроорганизмами и растениями. В некоторых случаях влияние на поглощение железа может быть оказано путем активации генов биосинтеза сидерофоров. В качестве примеров генов биосинтеза сидерофоров можно привести, не ограничиваясь перечисленным, yhfA, yusV, sbnA, fiu, yfiZ и fur.
[00105] Изменение метаболического потока в АТФ может привести к повышению азотфиксации. Например, метаболический поток в АТФ может быть увеличен посредством направленного воздействия на биосинтез гликогена. На биосинтез гликогена может оказывать влияние перенаправление углерода на гликолиз, цикл ТСА (трикарбоновых кислот) и/или окислительное фосфорилирование, а не синтез гликогена. В некоторых случаях на биосинтез гликогена можно влиять, удаляя или подавляя соответствующий ген для гликогенсинтазы. В качестве примера гена гликогенсинтазы можно привести, не ограничиваясь перечисленным, glgA.
[00106] К повышению азотфиксации может привести изменение количества ферментов нитрогеназ на клетку. Например, на количество ферментов нитрогеназ на клетку может оказывать влияние дерепрессия nif. Дерепрессия nif может быть достигнута путем конститутивной передачи сигналов о нехватке азота. В некоторых случаях дерепрессия nif может быть достигнута путем делеции UR-домена соответствующих генов. В качестве примера гена, который может выступать в качестве мишени для дерепрессии генов nif, можно привести, не ограничиваясь перечисленным, glnD. В некоторых случаях транскрипция кластера(ов) nif может быть повышена путем введения сильных промоторов против хода транскрипции от оперона nifHDK или nifDK.
[00107] Еще одним способом повышения азотфиксации может быть повышение количества ферментов нитрогеназ на клетку путем повышения транскрипции кластера nif. Транскрипция кластера nif может быть повышена путем повышения транскрипции NIFA. В некоторых случаях на транскрипцию кластера nif может оказывать влияние повышение числа копий гена nifA в геноме.
[00108] Транскрипция кластера nif также может быть повышена путем повышения трансляции NifA. В некоторых случаях трансляция NifA может быть повышена путем повышения силы сайта связывания рибосомы в гене nifA.
[00109] К повышению азотфиксации может привести изменение чувствительности нитрогеназы к кислороду. На чувствительность к кислороду может повлиять снижение восприятия кислорода. В некоторых случаях снижение восприятия кислорода может быть обеспечено нарушением генов восприятия кислорода. В качестве примеров генов восприятия кислорода можно привести, не ограничиваясь перечисленным, nifT/fixU, fixJ и fixL.
[00110] В некоторых случаях на чувствительность к кислороду может оказывать влияние поддержание низкого уровня цитозольного кислорода посредством стимуляции цитохром-bd-опосредованного дыхания. В некоторых случаях на чувствительность к кислороду может оказывать влияние активация генов, кодирующих цитохром-bd-оксидазу, и/или нокаутирование альтернативных систем цитохрома. В качестве примеров генов, кодирующих гены цитохром-bd, можно привести, не ограничиваясь перечисленным, cydABX, cydAB и cydX. В некоторых случаях нитрогеназа может быть защищена от окисления путем изменения окислительно-восстановительного равновесия в клетке. Окислительно-восстановительное равновесие может быть изменено посредством поглощения АФК (активных форм кислорода). Одной из стратегий для осуществления поглощения АФК является активация соответствующих генов. В качестве примеров генов поглощения АФК можно привести, не ограничиваясь перечисленным, grxABCD, trxA, trxC и tpx.
[00111] В некоторых случаях на чувствительность к кислороду может оказывать влияние поглощение свободного кислорода. В некоторых случаях поглощение свободного кислорода может быть достигнуто путем активации генов бактериального гемоглобина. В качестве примера гена гемоглобина можно привести, не ограничиваясь перечисленным, glbN. В некоторых случаях поглощение свободного кислорода может быть достигнуто путем активации генов fixNOPQ, кодирующих высокоаффинную гем-медную оксидазу типа cbb3.
[00112] К повышению экспрессии нитрогеназы может привести модификация IHFa. В некоторых случаях экспрессия нитрогеназы может быть повышена путем облегчения взаимодействия между nifA и σ54 в последовательности активации, расположенной против хода транскрипции от определенных генов. В частности, активация IHF может повысить транскрипцию нитрогеназы. В некоторых случаях активация IHF в сочетании с nifA и σ54 может усиливать транскрипцию оперона нитрогеназы. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экспрессии азота, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и/или Klebsiella variicola. В некоторых случаях активация оперона нитрогеназы может быть более эффективной, если она сочетается с мутацией в гене, кодирующем σ54.
[00113] К повышению экспрессии нитрогеназы может привести модификация гена, кодирующего σ54. В некоторых случаях активация гена, кодирующего σ54, может привести к повышению транскрипции нитрогеназы. В качестве примера гена, кодирующего σ54, можно привести, не ограничиваясь перечисленным, rpoN. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экспрессии азота, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и/или Klebsiella variicola. В некоторых случаях активация σ54 в сочетании с nifA и IHF может усиливать транскрипцию оперона нитрогеназы. В некоторых случаях транскрипция оперона нитрогеназы может быть дополнительно улучшена путем сочетания активации σ54 с мутацией IHF.
[00114] В некоторых случаях удаление белка, такого как DraT, из штамма, такого как штамм kosakonia, может повысить нитрогеназную активность. В некоторых случаях DraT может посттрансляционно модифицировать фермент нитрогеназу, ингибируя его активность. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения нитрогеназной активности, могут включать, не ограничиваясь перечисленным, штаммы kosakonia.
[00115] В некоторых случаях модификация гена asnB может повысить экскрецию аммония. В частности, усечение и активация гена asnB могут превращать глутамин обратно в аммоний. Ферменты AsnB содержат два домена; один может дезаминировать глутамин с высвобождением аммония, а другой использует аммоний для выработки аспарагина. Усечение AsnB для делеции домена аспарагинсинтазы и/или активация домена глутаминдезаминазы может способствовать обратному превращению клеточного глутамина в аммоний, тем самым повышая экскрецию аммония. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00116] В некоторых случаях модификация гена asnB может повысить экскрецию аммония. В частности, делеция гена asnB может уменьшить поглощение аммония в клетке. asnB может использовать цитозольный аммоний вместо глутамина в качестве донора азота. В некоторых случаях делеция, усечение или активация asnB может повысить количество аммония, выделяемого из клетки. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
В некоторых случаях модификация glnD может быть полезна для изменения регуляции ассимиляции азота. В частности, модификации glnD могут быть использованы для оптимизации регуляции путей ассимиляции азота через сигнальный путь белка PII. Фермент, кодируемый glnD, модифицирует белки PII GlnK и GlnB. Фермент GlnD обратимо уридилирует и деуридилирует белки PII в условиях лимитирования и избытка азота, соответственно. Белки PII сообщают сигнальные каскады путям азотного метаболизма. Примеры генов метаболизма азота, на которые оказывает влияние передача сигналов белком PII, включают, не ограничиваясь перечисленным, glnA, кодирующий глутаминсинтетазу, ntrB/glnL, кодирующий сенсорную гистидинкиназу/фосфатазу ntrB, glnG/ntrC ДНК-связывающий регулятор транскрипции ntrC и оперон nifLA. В некоторых случаях glnD может быть подвергнут делеции, чтобы снизить транскрипцию генов ассимиляции азота и количество азота, ассимилируемого в клетке. В некоторых случаях glnD может быть модифицирован путем делеции области ACT12, делеции области UR и/или путем инактивации области UR путем мутирования определенных аминокислотных остатков (например, остатков 90, 91 и/или 104). В некоторых случаях штаммы, которые могут быть использованы в этом процессе снижения ассимиляции азота, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00117] В некоторых случаях модификация glnD может быть полезна для повышения нитрогеназной активности, экскреции аммония и/или роста растения. В частности, удаление восприимчивой к азоту области может повысить нитрогеназную активность и/или рост растения. В некоторых случаях домен ACT glnD может быть подвергнут делеции. В некоторых случаях домен ACT участвует в определении азотного статуса посредством аллостерической регуляции глутамином. Удаление домена ACT может снизить активность уридилилтрансферазы, тем самым сигнализируя об избытке азота и подавляя гены ассимиляции азота, что приводит к повышению экскреции аммония. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения нитрогеназной активности, экскреции аммония и/или роста растения, могут включать, не ограничиваясь перечисленным, штаммы Kosakonia sacchari и Klebsiella variicola.
[00118] В некоторых случаях модификация glnD может быть полезна для повышения нитрогеназной активности, экскреции аммония и/или роста растения. В частности, удаление или инактивация области уридилилтрансферазы (UT) в домене glnD может повысить нитрогеназную активность, экскрецию аммония и/или рост растения. Удаление или инактивация домена UT может снизить активность уридилилтрансферазы, тем самым сигнализируя об избытке азота и подавляя гены ассимиляции азота, что приводит к повышению экскреции аммония. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения нитрогеназной активности, экскреции аммония и/или роста растения, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00119] В некоторых случаях модификация GlnB может быть полезна для повышения экскреции соединений азота. В некоторых случаях домен уридилилтрансферазы (UTase) GlnD модифицирует GlnB по тирозину-51. В некоторых случаях путем модификации домена UTase GlnD продукция GlnB-UMP может быть снижена. В некоторых случаях путем удаления домена UTase GlnD продукция GlnB-UMP может быть снижена. В некоторых случаях путем изменения домена UTase GlnD продукция GlnB-UMP может быть предотвращена. В некоторых случаях путем удаления домена UTase GlnD продукция GlnB-UMP может быть предотвращена. В некоторых случаях GlnB может быть модифицирован путем делеции тирозина-51. В некоторых случаях GlnB может быть модифицирован путем модификации GlnB по тирозину-51. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00120] В некоторых случаях модификация GlnK может быть полезна для повышения экскреции аммония. В некоторых случаях GlnK в штамме может функционировать как аналог GlnB из-за сходства структур GlnK и GlnB. В некоторых случаях модификация GlnK может повысить экскрецию аммония путем устранения ингибирующих действий, которые могут быть обусловлены GlnK. В некоторых случаях путем изменения GlnK ингибирующие действия на экскрецию аммония могут быть снижены. В некоторых случаях путем удаления GlnK ингибирующие действия на экскрецию аммония могут быть снижены. В некоторых случаях путем изменения GlnK ингибирующие действия на экскрецию аммония, обусловленные GlnK, могут быть предотвращены. В некоторых случаях путем удаления гена glnK ингибирующие действия на экскрецию аммония, обсуловленные GlnK, могут быть предотвращены. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00121] В некоторых случаях модификация glnK может быть полезна для повышения экскреции аммония. В некоторых случаях домен UTase GlnD модифицирует glnK по тирозину-51. В некоторых случаях путем модификации домена UTase GlnD продукция glnK-UMP может быть снижена. В некоторых случаях путем удаления домена UTase GlnD продукция glnK-UMP может быть снижена. В некоторых случаях путем изменения домена UTase GlnD продукция glnK-UMP может быть предотвращена. В некоторых случаях путем удаления домена UTase GlnD продукция glnK-UMP может быть предотвращена. В некоторых случаях GlnK может быть модифицирован путем делеции тирозина-51. В некоторых случаях GlnK может быть модифицирован путем модификации GlnK по тирозину-51. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00122] В некоторых случаях модификация glnL, кодирующего белок NtrB, может быть полезна для повышения экскреции аммония. В частности, модификация NtrB может быть полезна для контроля транскрипции glnA независимо от азотного статуса. В некоторых случаях модификация ntrB может быть достигнута путем делеции определенных остатков для дозирования активности. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00123] В некоторых случаях модификация glnA может быть полезна для повышения экскреции аммония. В некоторых случаях модификация NtrC может быть полезна для модификации уровня белка GlnA в клетке. В частности, модификация NtrC может быть полезна вследствие предотвращения фосфорилизации NtrC. Фосфорилированный NtrC может привести к транскрипционной активации glnA. Как таковая, модификация ntrC для предотвращения фосфорилизации ntrC может быть полезной для снижения транскрипции glnA. В некоторых случаях модификация NtrC может быть достигнута путем замены аспарата 54. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00124] В некоторых случаях модификация глутаминазы B может быть полезна для повышения экскреции аммония. В частности, в некоторых случаях превращение глутамина обратно в глутамат и аммиак посредством глутаминазы B может активироваться с повышением экскреции аммония. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции азота, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00125] В некоторых случаях модификация nifA может быть полезна для повышения экспрессии нитрогеназы. В некоторых случаях может быть полезно модифицировать nifA, чтобы увеличить количество копий гена nifA в клетке. Количество копий гена nifA может быть увеличено путем вставки нескольких копий гена nifA перед конститутивно экспрессирующими промоторами. В некоторых случаях прикрепление копии гена nifA к одному или более оперонам «домашнего хозяйства» может увеличить общее количество генов nifA в клетке. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экспрессии нитрогеназы, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis и Klebsiella variicola.
[00126] В некоторых случаях модификация оперона нитрогеназы может быть полезна для повышения экспрессии нитрогеназы. В некоторых случаях может быть полезным активировать опероны нитрогеназы для повышения транскрипции нитрогеназы. В некоторых случаях промоторы из бактерии, активные при колонизации бактерией ризосферы, могут быть вставлены перед оперонами нитрогеназы для активации оперонов нитрогеназы. В некоторых случаях nifL из оперонов нитрогеназы может быть подвергунт делеции для активации оперонов нитрогеназы. В некоторых случаях nifA из оперонов нитрогеназы может быть подвергнут делеции для активации оперонов нитрогеназы. В некоторых случаях nifA и nifL из оперонов нитрогеназы могут быть подвергнуты делеции для активации оперонов нитрогеназы. В некоторых случаях несколько промоторов могут быть размещены непосредственно перед генами nifHDK, чтобы обойти контроль транскрипции nifA. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экспрессии нитрогеназы, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis и Klebsiella variicola.
[00127] В некоторых случаях модификация glnE может быть полезна для повышения экскреции аммония. В некоторых случаях консервативный мотив аспартат-аминокислота-аспартат (DXD) на AR-домене glnE может быть изменен. В некоторых случаях изменение консервативного остатка DXD в AR-домене glnE может быть использовано для лишения glnE деаденилирующей активности. В некоторых случаях в DXD-мотиве в AR-области glnE может быть заменен остаток D. В некоторых случаях замена остатка D в мотиве DXD в AR-области glnE может не затрагивать сайт связывания GlnB, что позволяет регулировать активность аденилирования при снижении или предотвращении AR-активности. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00128] В некоторых случаях модификация glnA может быть полезна для повышения экскреции AMM. В некоторых случаях glnA может быть подавлен путем вставки промоторов glnB, glnD и/или glnE против хода транскрипции от гена glnA. В некоторых случаях модификация glnA может позволить отделить экспрессию glnA от сигнального каскада N-статуса и снизить экспрессию до базального уровня, так что большее количество фиксированного азота остается неассимилированным. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00129] В некоторых случаях модификация GOGAT может быть полезна для повышения экскреции аммония. В некоторых случаях GOGAT может быть подавлен путем вставки против хода транскрипции от генов GOGAT промотора, контролирующего glnB, glnD и/или glnE. Подавление GOGAT может, в свою очередь, привести к снижению экспрессии глутамин-оксиглутарат-аминотрансферазы. В некоторых случаях модификация GOGAT может позволить отделить экспрессию GOGAT от сигнального каскада N-статуса и снизить экспрессию до базального уровня, так что большее количество фиксированного азота остается неассимилированным. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00130] В некоторых случаях модификация GDH может быть полезна для повышения экскреции аммония. В некоторых случаях GDH может быть подавлен путем вставки против хода транскрипции от гена GDH промотора, контролирующего glnB, glnD и/или glnE. Подавление GDH может, в свою очередь, привести к снижению экспрессии НАД-специфической глутаматдегидрогеназы. В некоторых случаях модификация GDH может позволить отделить экспрессию GDH от сигнального каскада N-статуса и снизить экспрессию до базального уровня, так что большее количество фиксированного азота остается неассимилированным. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения экскреции аммония, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
Повышение азотфиксации за счет ассимиляции
[00131] Количество азота, предоставляемого растению, связанному с микроорганизмами, может быть увеличено путем снижения ассимиляции азота в микроорганизме. В этом случае на ассимиляцию может оказывать влияние скорость экскреции аммиака. Посредством направленного воздействия на ассимиляцию аммиака возможно увеличить доступность азота. В некоторых случаях влияние на ассимиляцию аммиака может быть оказано путем снижения степени обратного поглощения аммиака после экскреции. Для снижения степени обратного поглощения аммиака после экскреции может быть осуществлен нокаут любого соответствующего гена. В качестве примера генов обратного поглощения аммиака можно привести, не ограничиваясь перечисленным, amtB.
[00132] В некоторых случаях на ассимиляцию может оказывать влияние интенсивность поглощения растением. Посредством направленного воздействия на гены и пути, ответственные за ассимиляцию азота в растениях, доступность азота может быть увеличена. В некоторых случаях ассимиляция аммиака растением может быть изменена путем инокуляции микроорганизмами, способствующими росту N-фиксирующих растений. Может быть проведен скрининг для идентификации микроорганизмов, вызывающих ассимиляцию аммиака в растениях.
Повышение азотфиксации за счет колонизации
[00133] Повышение колонизационной способности микроорганизмов может позволить увеличить количество фиксированного азота, предоставляемого растению. На колонизацию может оказывать влияние изменение переносимого объема (распространенности микроорганизмов на поверхности корня) и/или приспособляемости микроорганизмов. В некоторых случаях влияние на переносимый объем и приспособляемость микроорганизмов может быть оказано путем изменения транспорта органических кислот. Транспорт органических кислот может быть улучшен путем активации соответствующих генов. В качестве примера гена транспорта органических кислот можно привести, не ограничиваясь перечисленным, dctA.
[00134] Например, на колонизационную способность может оказывать влияние экспрессия агглютининов. Повышенная экспрессия агглютининов может способствовать прилипанию микроорганизмов к корням растений. Примеры генов агглютининов могут включать, не ограничиваясь перечисленным, fhaB и fhaC.
[00135] На колонизационную способность может оказывать влияние увеличение проникновения эндофитов. Например, на проникновение эндофитов могут оказывать влияние ферменты, разрушающие клеточные стенки растений (CDWE). Повышение экспрессии и/или секреции CDWE может увеличивать колонизацию и проникновение эндофитных микроорганизмов. В качестве примеров CDWE можно привести, не ограничиваясь перечисленным, полигалактуроназы и целлюлазы. Примером гена полигалактуроназ является pehA. В некоторых случаях экспорт полигалактуроназ и целлюлаз может быть увеличен путем обеспечения сигнала экспорта вместе с ферментами.
[00136] Изменение переносимого объема может привести к увеличению количества азота, предоставляемого соответствующему растению. На переносимый объем может оказывать влияние образование биопленки. В некоторых случаях на переносимый объем может оказывать влияние малая РНК rsmZ. Малая РНК rsmZ является отрицательным регулятором образования биопленки. В некоторых случаях образованию биопленки может способствовать делеция или подавление rsmZ, что приводит к повышению трансляции rsmA (положительного регулятора вторичного метаболизма) и образованию биопленки.
[00137] В некоторых случаях на образование биопленки может оказывать влияние усиление способности штаммов прилипать к поверхности корня. В некоторых случаях образованию биопленки может способствовать активация крупных адгезивных белков. В качестве примера крупного адгезивного белка можно привести, не ограничиваясь перечисленным, lapA.
[00138] В некоторых случаях на переносимый объем может оказывать влияние чувство кворума. В некоторых случаях чувство кворума может быть усилено путем увеличения числа копий генов биосинтеза АГЛ.
[00139] В некоторых случаях на колонизацию ризосферы может оказывать влияние масса корня. Например, на массу корня может оказывать влияние биосинтез ИУК (индол-3-уксусной кислоты) микроорганизмами. Повышение биосинтеза ИУК микроорганизмом может стимулировать образование корневой биомассы. В некоторых случаях влияние на биосинтеза ИУК может быть оказано путем активации (на разных уровнях) генов биосинтеза ИУК. В качестве примера гена биосинтеза ИУК можно привести, не ограничиваясь перечисленным, ipdC.
[00140] В некоторых случаях этиленовая сигнализация может вызывать системную резистентность растения и влиять на колонизационную способность микроорганизма. Этилен является сигнальной молекулой растения, которая вызывает широкий спектр реакций в зависимости от растительной ткани и уровня этилена. Преобладающая модель реакции на этилен в корне состоит в том, что растения, подвергшиеся стрессу, быстро реагируют, вырабатывая небольшой пик этилена, который инициирует защитную реакцию растения, например, транскрипцию генов, кодирующих защитные белки. Если стресс сохраняется или является интенсивным, возникает второй, гораздо больший пик этилена, часто через несколько дней. Этот второй пик этилена вызывает такие процессы, как старение, хлороз и опадание, которые могут привести к значительному угнетению роста и выживания растения. В некоторых случаях бактерии, способствующие росту растений, могут стимулировать рост корней, продуцируя ауксин ИУК, который стимулирует небольшой этиленовый ответ в корнях. В то же время бактерии могут предотвращать второй большой пик этилена, вырабатывая фермент (АЦК-деаминазу), замедляющий выработку этилена в растении, тем самым поддерживая уровень этилена, способствующий стимулированию роста корней. На индукцию системной резистентности у растения могут влиять бактериальные ИУК. В некоторых случаях стимуляция биосинтеза ИУК может быть достигнута путем активации (на разных уровнях) генов биосинтеза ИУК. В качестве примера гена биосинтеза можно привести, не ограничиваясь перечисленным, ipdC.
[00141] В некоторых случаях на колонизацию может оказывать влияние АЦК-деаминаза. АЦК-дезаминаза может снижать выработку этилена в корне путем перенаправления АЦК в побочный продукт. В некоторых случаях влияние на АЦК-деаминазу может быть оказано путем активации генов АЦК-деаминазы. В качестве примеров генов АЦК-деаминазы можно привести, не ограничиваясь перечисленным, dcyD.
[00142] В некоторых случаях на колонизацию могут влиять переносимый объем и/или приспособляемость микроорганизмов. Например, на переносимый объем и/или приспособляемость микроорганизмов может оказывать влияние избыточная продукция трегалозы. Избыточная продукция трегалозы может повысить засухоустойчивость. В некоторых случаях влияние на избыточную продукцию трегалозы может быть оказано путем активации (на разных уровнях) генов биосинтеза трегалозы. В качестве примеров генов биосинтеза трегалозы можно привести, не ограничиваясь перечисленным, otsA, otsB, treZ и treY. В некоторых случаях активация otsB также может повышать азотфиксирующую активность.
[00143] В некоторых случаях на переносимый объем может оказывать влияние прикрепление к корням. На прикрепление к корням может оказывать влияние секреция экзополисахаридов. В некоторых случаях влияние на секрецию экзополисахаридов может быть оказано путем повышения экспрессии белков, продуцирующих экзополисахариды. В качестве примеров белков, продуцирующих экзополисахариды, можно привести, не ограничиваясь перечисленным, yjbE и pssM. В некоторых случаях влияние на секрецию экзополисахаридов может быть оказано путем активации биосинтеза целлюлозы. В качестве примеров генов биосинтеза целлюлозы можно привести, не ограничиваясь перечисленным, гены acs и кластеры генов bcs.
[00144] В некоторых случаях на переносимый объем и/или приспособляемость микроорганизмов может оказывать влияние ингибирование грибов. На ингибирование грибов могут влиять хитиназы, которые могут разрушать клеточные стенки грибов и могут приводить к биоконтролю ризосферных грибов. В некоторых случаях влияние на ингибирование грибов может быть оказано путем активации генов хитиназы. В качестве примеров генов хитиназы можно привести, не ограничиваясь перечисленным, хитиназу класса 1 и chiA.
[00145] В некоторых случаях эффективное поглощение железа может способствовать выживанию микроорганизмов в ризосфере, где им приходится конкурировать с другими почвенными микроорганизмами и растением за поглощение железа. В некоторых случаях высокоаффинное хелатирование (сидерофоры) и системы транспорта могут способствовать компетентности в ризосфере путем: 1) обеспечения получения микроорганизмами достаточного количества железа, и 2) уменьшения доступного железа для конкурирующих видов. Увеличение способности микроорганизма осуществлять эти действия может повысить его конкурентоспособность в ризосфере. В некоторых случаях влияние на поглощение железа может быть оказано путем активации генов сидерофоров. В качестве примеров генов сидерофоров можно привести, не ограничиваясь перечисленным, yhfA, yusV, sbnA, fiu, yfiZ и fur. В некоторых случаях на поглощение железа может оказывать влияние система транспорта tonB. В некоторых случаях влияние на поглощение железа может быть оказано путем активации генов системы транспорта tonB. В качестве примеров генов транспорта tonB можно привести, не ограничиваясь перечисленным, tonB и exbAB.
[00146] В некоторых случаях на переносимый объем и/или приспособляемость микроорганизмов может оказывать влияние окислительно-восстановительное равновесие и/или поглощение АФК. На окислительно-восстановительное равновесие и/или поглощение АФК может оказывать влияние биосинтез бактериального глутатиона (GSH). В некоторых случаях влияние на биосинтез бактериального глутатиона (GSH) может быть оказано путем активации генов биосинтеза бактериального глутатиона. В качестве примеров генов биосинтеза бактериального глутатиона можно привести, не ограничиваясь перечисленным, gshA, gshAB и gshB.
[00147] В некоторых случаях на окислительно-восстановительное равновесие может оказывать влияние поглощение АФК. В некоторых случаях влияние на поглощение АФК может быть оказано путем активации каталаз. В качестве примеров генов каталаз можно привести, не ограничиваясь перечисленным, katEG и Mn-каталазу.
[00148] В некоторых случаях на образование биопленки может оказывать влияние фосфорная сигнализация. В некоторых случаях влияние на фосфорную сигнализацию может быть оказано путем изменения экспрессии генов, ответственных за фосфорную сигнализацию. В качестве примеров генов, ответственных за фосфорную сигнализацию, можно привести, не ограничиваясь перечисленным, phoR и phoB.
[00149] В некоторых случаях на переносимый объем может оказывать влияние прикрепление к корням. На прикрепление к корням может оказывать влияние биосинтез сурфактина. В некоторых случаях влияние на биосинтез сурфактина может быть оказано путем активации биосинтеза сурфактина для улучшения образования биопленки. В качестве примера гена биосинтеза сурфактина можно привести, не ограничиваясь перечисленным, srfAA.
[00150] В некоторых случаях на колонизацию и/или приспособляемость микроорганизмов может оказывать переносимый объем, конкуренция с другими микроорганизмами и/или защита сельскохозяйственной культуры от других микроорганизмов. В некоторых случаях на конкуренцию с другими микроорганизмами и/или защиту сельскохозяйственной культуры от других микроорганизмов может оказывать влияние чувство кворума и/или гашение кворума. Гашение кворума может оказывать влияние на колонизацию путем подавления чувства кворума потенциальных патогенных/конкурирующих бактерий. В некоторых случаях влияние на гашение кворума может быть оказано путем вставки и/или активации генов, кодирующих ферменты гашения кворума. В качестве примеров генов, ответственных за гашение кворума, можно привести, не ограничиваясь перечисленным, ahlD, Y2-aiiA, aiiA, ytnP и attM. В некоторых случаях модификация ферментов, участвующих в гашении кворума, таких как Y2-aiiA и/или ytnP, может быть полезной для колонизации. В некоторых случаях активация Y2-aiiA и/или ytnP может привести к гидролизу внеклеточного ацил-гомосеринлактона (АГЛ). aiiA представляет собой N-ацил-гомосерин-лактоназу, которая является ферментом, расщепляющим лактон гомосерина. Расщепление АГЛ может остановить или замедлить способность сигнализировать о кворуме конкурирующих грамотрицательных бактерий. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения колонизации, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00151] В некоторых случаях на переносимый объем и/или приспособляемость микроорганизмов может оказывать влияние биосинтез ризобитоксина. Биосинтез ризобитоксина может снижать продукцию этилена в корне путем ингибирования АЦК-синтазы. В некоторых случаях влияние на биосинтез ризобитоксина может быть оказано путем активации генов биосинтеза ризобитоксина.
[00152] В некоторых случаях на переносимый объем может оказывать влияние прикрепление к корням. На прикрепление к корням может оказывать влияние секреция экзополисахаридов. В некоторых случаях влияние на секрецию экзополисахарида может быть оказано путем создания гипермукоидных мутантов путем удаления mucA.
[00153] В некоторых случаях на прикрепление к корням может оказывать влияние биосинтез феназина. В некоторых случаях влияние на биосинтез феназина может быть оказано путем активации генов биосинтеза феназина для улучшения образования биопленки.
[00154] В некоторых случаях на прикрепление к корням может оказывать влияние биосинтез циклических липопептидов (CLP). В некоторых случаях влияние на биосинтез циклических липопептидов (CLP) может быть оказано путем активации биосинтеза CLP для улучшения образования биопленки.
В некоторых случаях на переносимый объем и/или конкуренцию может оказывать влияние синтез антибиотиков. Синтез антибиотиков может повышать продукцию антибиотиков для уничтожения конкурирующих микроорганизмов. В некоторых случаях повышение продукции антибиотиков может быть достигнуто путем исследования геномов на предмет путей биосинтеза антибиотиков и активации.
[00155] В некоторых случаях на колонизацию может оказывать влияние устойчивость к высушиванию. В некоторых случаях модификация rpoE может быть полезна для колонизации. В некоторых случаях активация rpoE может приводить к повышению экспрессии генов и путей, ответственных за устойчивость к стрессу. В некоторых случаях rpoE может быть активирован с помощью уникального переключаемого промотора. В некоторых случаях rpoE может быть активирован с использованием промотора арабинозы. rpoE является сигма-фактором, схожим с phyR. При экспрессии rpoE может вызывать активацию множества генов, ответственных за устойчивость к стрессу. Поскольку ферменты, ответственные за устойчивость к стрессу, могут быть бесполезны во время цикла колонизации, может быть использован переключаемый промотор. В некоторых случаях промотор может быть активным во время роста биомассы и/или во время нанесения покрытия на семена. В некоторых случаях может быть использован переключаемый промотор, где в течение логарифмической фазы роста биомассы может быть внесена добавка сахара или химического вещества, но где также во время одного или нескольких других применений микроорганизма промотор может быть не включен. В некоторых случаях rpoE может быть активирован при одновременном подавлении rseA. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения колонизации, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
[00156] В некоторых случаях на колонизацию может оказывать влияние устойчивость к высушиванию. В некоторых случаях модификация rseA может быть полезна для колонизации. В некоторых случаях rseA может быть подавлен с помощью уникального переключаемого промотора. В некоторых случаях rseA может быть подавлен с использованием промотора арабинозы. rseA является анти-сигма-фактором, экспрессируемым совместно с rpoE. В некоторых случаях ферменты остаются связанными друг с другом, что может снизить способность rpoE действовать в качестве транскрипционного фактора или лишить его этой способности. Однако в условиях стресса resA может отщепляться и rpoE может свободно активировать/подавлять гены, ответственные за устойчивость к стрессу. Путем нарушения ко-транскрипции с rpoE уровни rpoE и resA могут быть дозированы независимо, что может быть полезным для оптимизации колонизации сконструированных штаммов. В некоторых случаях штаммы, которые могут быть использованы в этом процессе повышения колонизации, могут включать, не ограничиваясь перечисленным, штаммы Rahnella aquatilis, Kosakonia sacchari и Klebsiella variicola.
Получение бактериальных популяций
Выделение бактерий
[00157] Микроорганизмы, пригодны для способов и композиций, раскрытых в настоящем документе, могут быть получены путем извлечения микроорганизмов с поверхностей или тканей нативных растений. Микроорганизмы могут быть получены путем измельчения семян для выделения микроорганизмов. Микроорганизмы могут быть получены путем посадки семян в различные образцы почвы и извлечения микроорганизмов из тканей. Кроме того, микроорганизмы могут быть получены путем инокуляции растений экзогенными микроорганизмами и определения того, какие микроорганизмы появляются в растительных тканях. Неограничивающие примеры растительных тканей могут включать семя, проросток, лист, срез, растение, луковицу или клубень.
[00158] Способ получения микроорганизмов может быть осуществлен посредством выделения бактерий из почв. Бактерии могут быть собраны из различных типов почв. В некоторых примерах почва может характеризоваться такими качествами, как высокое или низкое плодородие, уровень влажности, уровень минералов и различные методы земледелия. Например, почва может быть вовлечена в севооборот, когда различные сельскохозяйственные культуры высаживают в одну и ту же почву в ходе поочередных сезонов посадки. Последовательное выращивание разных сельскохозяйственных культур в одной и той же почве может предотвратить непропорциональное истощение запасов определенных минералов. Бактерии могут быть выделены из растений, произрастающих в выбранных почвах. Проростки растений могут быть собраны через 2-6 недель роста. Например, за один цикл уборки урожая могут быть собраны по меньшей мере 400 изолятов. Типы почв и растений свидетельствуют как о фенотипе растения, так и об условиях, которые впоследствии обеспечивают обогащение определенных фенотипов.
[00159] Микроорганизмы могут быть выделены из растительных тканей для оценки качеств микроорганизмов. Параметры для обработки образцов тканей могут варьировать для выделения различных типов ассоциированных микроорганизмов, таких как ризосферные бактерии, эпифиты или эндофиты. Изоляты могут быть культивированы в не содержащей азота среде для обогащения бактериями, осуществляющими азотфиксацию. В качестве альтернативы, микроорганизмы могут быть получены из мировых банков штаммов.
[00160] Для оценки качеств микроорганизмов проводят аналитику in planta. В некоторых вариантах осуществления растительная ткань может быть обработана для скрининга путем высокопроизводительной обработки ДНК и РНК. Кроме того, могут быть использованы неинвазивные измерения для оценки характеристик растений, таких как колонизация. Измерения диких микроорганизмах могут быть получены на каждом отдельном растении поочередно. Измерения диких микроорганизмов также могут быть сделаны в полевых условиях с помощью методов средней производительности. Измерения могут быть выполнены последовательно с течением времени. Может быть использована модельная растительная система, включая, но не ограничиваясь этим, сетарию (Setaria).
[00161] Микроорганизмы в растительной системе могут быть подвергнуты скринингу с помощью транскрипционного профилирования микроорганизма в растительной системе. Примерами скрининга с помощью транскрипционного профилирования являются методы количественной полимеразной цепной реакции (кПЦР), молекулярные штрих-коды для выявления транскриптов, секвенирование нового поколения и мечение микроорганизмов флуоресцентными маркерами. Для оценки колонизации в теплице могут быть измерены влияющие факторы, включая, не ограничиваясь перечисленным, микробиом, абиотические факторы, состояние почвы, кислород, влажность, температуру, условия инокулята и локализацию корней. Азотфиксация может быть оценена у бактерий путем измерения газообразного 15N/в составе удобрения (разбавления) с помощью IRMS (изотопной масс-спектрометрии) или NanoSIMS, как описано в настоящем документе. NanoSIMS представляет собой масс-спектрометрию вторичных ионов высокого разрешения. Метод NanoSIMS представляет собой способ исследования химической активности биологических образцов. Катализ реакций восстановления и окисления, которые управляют метаболизмом микроорганизмов, может быть исследован на клеточном, субклеточном, молекулярном и элементном уровнях. NanoSIMS может обеспечить высокое пространственное разрешение, превышающее 0,1 мкм. NanoSIMS способен обнаруживать использование изотопных индикаторов, таких как 13C, 15N и 18O. Поэтому NanoSIMS может быть использован для анализа химической активности азота в клетке.
[00162] Автоматизированные теплицы могут быть использованы для аналитики растений. Измеряемые контрольные показатели растений в ответ на воздействие микроорганизмов включают, не ограничиваясь перечисленным, биомассу, анализ хлоропластов, ПЗС ((прибор с зарядовой связью)-камеру, измерения объемной томографии.
[00163] Одним из способов обогащения популяции микроорганизмов является обогащение в соответствии с генотипом. Например, анализ методом полимеразной цепной реакции (ПЦР) с целевым праймером или специфичным праймером. Праймеры, разработанные для гена nifH, могут быть использованы для идентификации диазотрофов, поскольку диазотрофы экспрессируют ген nifH в процессе азотфиксации. Популяция микроорганизмов также может быть обогащена с помощью подходов, не зависящих от культуры из одной клетки, и подходов к выделению, основанных на хемотаксисе. В качестве альтернативы, целевое выделение микроорганизмов может быть осуществлено путем культивирования микроорганизмов на селективных средах. Спланированные подходы к обогащению популяций микроорганизмов желаемыми качествами могут основываться на данных биоинформатики и описаны в настоящем документе.
Обогащение микроорганизмами со способностью к азотфиксации с использованием биоинформатики
[00164] Биоинформационные инструменты могут быть использованы для идентификации и выделения ризобактерий, способствующих росту растений (PGPR), которые выбирают на основе их способности осуществлять азотфиксацию. Микроорганизмы с высокой азотфиксирующей способностью могут способствовать появлению у растений благоприятных качеств. Биоинформационные способы анализа для идентификации PGPR включают, не ограничиваясь перечисленным, геномику, метагеномику, целевое выделение, секвенирование генов, секвенирование транскриптома и моделирование.
[00165] Геномный анализ может быть использован для идентификации PGPR и подтверждения наличия мутаций с помощью методов секвенирования нового поколения, как описано в настоящем документе, и контроля версий микроорганизмов.
[00166] Метагеномика может быть использована для идентификации и выделения PGPR с использованием алгоритма прогнозирования для колонизации. Метаданные также могут быть использованы для выявления присутствия сконструированного штамма в пробах из окружающей среды и теплицы.
[00167] Секвенирование транскриптома может быть использовано для прогнозирования генотипов, приводящих к фенотипам PGPR. Кроме того, транскриптомные данные используются для идентификации промоторов для изменения экспрессии генов. Транскриптомные данные могут быть проанализированы в сочетании с последовательностью всего генома (WGS) для создания моделей метаболизма и регуляторных сетей генов.
Одомашнивание микроорганизмов
[00168] Микроорганизмы, выделенные из природы, могут подвергаться процессу одомашнивания, при котором микроорганизмы преобразуют в форму, которая является генетически отслеживаемой и идентифицируемой. Одним из способов одомашнивания микроорганизма является придание ему устойчивости к антибиотикам. Процесс придания устойчивости к антибиотикам может быть начат с определения чувствительности к антибиотикам в штамме микроорганизма дикого типа. Если бактерии чувствительны к антибиотику, то антибиотик может быть хорошим кандидатом для придания устойчивости к антибиотикам. Затем ген устойчивости к антибиотикам или суицидный вектор отрицательного отбора может быть включен в геном микроорганизма с использованием методов рекомбинационной инженерии. Суицидный вектор отрицательного отбора может состоять из делеции представляющего интерес гена, селектируемого маркера и маркера отрицательного отбора sacB. Отрицательный отбор может быть использован для обмена нативных последовательностей ДНК микроорганизма на гены, устойчивые к антибиотикам. Метод средней пропускной способности может использоваться для оценки нескольких микроорганизмов одновременно, что позволяет проводить параллельное одомашнивание. Альтернативные способы одомашнивания включают использование хоминг-нуклеаз для предотвращения петлеобразования последовательностей суицидного вектора или получения промежуточных векторных последовательностей.
[00169] ДНК-векторы могут быть введены в бактерии несколькими способами, включая электропорацию и химические трансформации. Для трансформаций может быть использована стандартная библиотека векторов. Примером способа редактирования генов является CRISPR, которому предшествует тестирование на Cas9, чтобы удостовериться в активности Cas9 в микроорганизмах.
Нетрансгенное конструирование микроорганизмов
[00170] Популяция микроорганизмов с благоприятными качествами может быть получена путем направленной эволюции. Направленная эволюция - это подход, при котором имитируется процесс естественного отбора для эволюции белков или нуклеиновых кислот в направлении определенной пользователем цели. Примером направленной эволюции является введение случайных мутаций в популяцию микроорганизмов, отбор микроорганизмов с наиболее благоприятными качествами и продолжение выращивания выбранных микроорганизмов. Наиболее благоприятные качества у способствующих росту ризобактерий (PGPR) могут состоять в азотфиксации. Метод направленной эволюции может быть итеративным и адаптивным, основанным на процессе выбора после каждой итерации.
[00171] Могут быть получены ризобактерии, способствующие росту растений (PGPR), с высокой способностью к азотфиксации. Эволюция PGPR может быть осуществлена путем введения генетического изменения. Генетическое изменение может быть введено посредством мутагенеза с помощью полимеразной цепной реакции, олигонуклеотид-направленного мутагенеза, насыщающего мутагенеза, мутагенеза с перестановкой фрагментов, гомологичной рекомбинации, систем CRISPR/Cas9, химического мутагенеза и их комбинаций. Эти подходы позволяют вводить случайные мутации в популяцию микроорганизмов. Например, мутанты могут быть получены с использованием синтетической ДНК или РНК посредством олигонуклеотид-направленного мутагенеза. Мутанты могут быть получены с использованием инструментов, содержащихся в плазмидах, которые впоследствии устраняются. Представляющие интерес гены могут быть идентифицированы с использованием библиотек, полученных от других видов с улучшенными качествами, включающими, не ограничиваясь перечисленным, улучшенные свойства PGPR, улучшенную колонизацию зерновых, повышенную чувствительность к кислороду, повышенную азотфиксацию и повышенную экскрецию аммиака. Внутриродовые гены могут быть разработаны на основе этих библиотек с использованием такого программного обеспечения, как программное обеспечение для разработки Genious или Platypus. Мутации могут быть разработаны с помощью машинного обучения. Мутации могут быть разработаны с помощью метаболической модели. Автоматическая разработка мутации может быть выполнена по образцу Platypus и будет направлять РНК для Cas-направленного мутагенеза.
[00172] Внутриродовые гены могут быть перенесены в микроорганизм-хозяин. Кроме того, в микроорганизм также могут быть перенесены репортерные системы. Репортерные системы характеризуют промоторы, определяют успешность трансформации, осуществляют скрининг мутантов и выступают в качестве инструментов отрицательного скрининга.
[00173] Микроорганизмы, несущие мутацию, могут быть культивированы посредством последовательного пассирования. Колония микроорганизма содержит один вариант микроорганизма. Колонии микроорганизмов проверяют с помощью автоматического сборщика колоний и жидкостного манипулятора. Мутанты с дупликацией генов и увеличенным числом копий экспрессируют более высокий генотип желаемого качества.
Отбор микроорганизмов, способствующих росту растений, на основе азотфиксации
[00174] Колонии микроорганизмов могут быть подвергнуты скринингу с использованием различных анализов для оценки азотфиксации. Одним из способов измерения азотфиксации является проведение одного ферментативного анализа, в котором измеряется экскреция азота. Альтернативным способом является анализ восстановления ацетилена (ARA) со встроенным отбором проб с течением времени. ARA может быть проведен в высокопроизводительных планшетах из массивов микропробирок. ARA может быть проведен с живыми растениями и растительными тканями. Состав сред и концентрация кислорода в средах в анализах ARA могут варьироваться. Еще один способ скрининга вариантов микроорганизмов состоит в использовании биосенсоров. Использование NanoSIMS и Рамановской микроспектроскопии может быть использовано для исследования активности микроорганизмов. В некоторых случаях бактерии также могут быть культивированы и размножены с использованием методов ферментации в биореакторах. Биореакторы предназначены для повышения стойкости роста бактерий и снижения чувствительности бактерий к кислороду. Микроферментеры на основе планшетов с производительностью от средней до высокой используют для оценки чувствительности к кислороду, потребностей в питании, азотфиксации и экскреции азота. Бактерии могут также быть совместно культивированы с конкурентными или полезными микроорганизмами для исследования скрытых путей. Проточная цитометрия может быть использована для скрининга бактерий, продуцирующих высокие уровни азота, с использованием химических, колориметрических или флуоресцентных индикаторов. Бактерии могут быть культивированы в присутствии или в отсутствие источника азота. Например, бактерии могут быть культивированы с глутамином, аммиаком, мочевиной или нитратами.
Селекция микроорганизмов
[00175] Селекция микроорганизмов представляет собой метод систематической идентификации и улучшения роли видов в микробиоме сельскохозяйственной культуры. Метод состоит из трех стадий: 1) отбор видов-кандидатов путем картирования взаимодействий растений и микроорганизмов и прогнозирования регуляторных сетей, связанных с конкретным фенотипом, 2) прагматическое и прогнозируемое улучшение фенотипов микроорганизмов посредством внутривидового скрещивания регуляторных сетей и кластеров генов, и 3) скрининг и отбор новых генотипов микроорганизмов, обеспечивающих желаемые фенотипы сельскохозяйственных культур. Для систематической оценки улучшения штаммов создана модель, которая связывает динамику колонизации сообщества микроорганизмов с генетической активностью посредством ключевых видов. Эта модель используется для прогнозирования селекции генетических мишеней и повышения частоты отбора улучшений в кодируемых микробиомами качествах, имеющих агрономическую значимость.
[00176] Получение бактерий для улучшения качеств растений (например, азотфиксации) может быть достигнуто посредством последовательного пассирования. Получение этих бактерий может быть осуществлено путем отбора растений, обладающих определенным улучшенным качеством, на которое влияет микробиологическая флора, а также идентификации бактерий и/или композиций, способных придать одно или более улучшенных качеств одному или более растениям. Один из способов получения бактерий для улучшения качества растения включает следующие стадии: (a) выделение бактерий из ткани или почвы первого растения; (b) внесение генетического изменения в одну или несколько бактерий для получения одной или более вариантных бактерий; (c) воздействие на множество растений вариантными бактериями; (d) выделение бактерий из ткани или почвы одного из множества растений, где растение, из которого выделены бактерии, имеет улучшенное качество по сравнению с другими растениями во множестве растений; и (e) повторение стадий (b)-(d) с бактериями, выделенными из растения с улучшенным качеством (стадия (d)). Стадии (b)-(d) могут повторяться любое количество раз (например, один, два, три раза, четыре раза, пять раз, десять раз или более), пока улучшенное качество в растении не достигнет желаемого уровня. Кроме того, множество растений может представлять собой более двух растений, например, 10-20 растений или 20 или более, 50 или более, 100 или более, 300 или более, 500 или более или 1000 или более растений.
[00177] Помимо получения растения с улучшенным качеством получают бактериальную популяцию, содержащую бактерии, содержащие одно или более генетических изменений, введенных в один или более генов (например, генов, регулирующих азотфиксацию). Повторяя стадии, описанные выше, можно получить популяцию бактерий, включающую наиболее подходящих представителей этой популяции, которые соотносятся с представляющим интерес качеством растения. Бактерии в этой популяции могут быть идентифицированы и могут быть определены их полезные свойства, например, с помощью генетического и/или фенотипического анализа. Генетический анализ может быть проведен на выделенных бактериях на стадии (a). Фенотипическая и/или генотипическая информация может быть получена с использованием таких методов, как: высокопроизводительный скрининг химических компонентов растительного происхождения, методы секвенирования, включая высокопроизводительное секвенирование генетического материала, методы дифференциального дисплея (включая DDRT-PCR и DD-PCR), методы микрочипов нуклеиновых кислот, РНК-секвенирование (шотган-секвенирование всего транскриптома) и qRT-ПЦР (количественная ПЦР в реальном времени). Полученная информация может быть использована для профилирования сообщества в отношении идентификации и активности присутствующих бактерий, такого как филогенетический анализ или скрининг на основе микрочипов нуклеиновых кислот, кодирующих компоненты оперонов рРНК или других содержащих таксономические сведения локусов. Примеры содержащих таксономические сведения локусов включают ген 16S рРНК, ген 23S рРНК, ген 5S рРНК, ген 5.8S рРНК, ген 12S рРНК, ген 18S рРНК, ген 28S рРНК, ген gyrB, ген rpoB, ген fusA, ген recA, ген coxl, ген nifD. Примеры процессов таксономического профилирования для определения таксонов, присутствующих в популяции, описаны в US 20140155283. Идентификация бактерий может включать характеристику активности одного или более генов или одного или более сигнальных путей, таких как гены, связанные с путем азотфиксации. В бактериальных популяциях также могут присутствовать синергетические взаимодействия (когда два компонента благодаря своей комбинации увеличивают желаемый эффект более чем на аддитивную величину) между различными видами бактерий.
[00178] Генетическое изменение может представлять собой ген, выбранный из группы, состоящей из: nifA, nifL, ntrB, ntrC, glnA, glnB, glnK, draT, amtB, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическое изменение может представлять собой изменение в гене, кодирующем белок с функциональностью, выбранной из группы, состоящей из: глутаминсинтетазы, глутаминазы, глутаминсинтетазы-аденилилтрансферазы, транскрипционного активатора, анти-транскрипционного активатора, пируват:флаводоксин-оксидоредуктазы, флаводоксина или АДФ-D-рибозилтрансферазы НАД+:динитрогеназоредуктазы. Генетическое изменение может представлять собой мутацию, приводящую к одному или более из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной аденилат-удаляющей активности GlnE; или сниженной уридилил-удаляющей активности GlnD. Введение генетического изменения может включать вставку и/или делецию одного или более нуклеотидов в сайте-мишени, например, 1, 2, 3, 4, 5, 10, 25, 50, 100, 250, 500 или более нуклеотидов. Генетическое изменение, введенное в одну или более бактерий в способах, раскрытых в настоящем документе, может представлять собой нокаутирующую мутацию (например, делецию промотора, вставку или делецию для получения преждевременного стоп-кодона, делецию целого гена), или оно может представлять собой устранение или ликвидацию активности белкового домена (например, точечную мутацию, затрагивающую активный сайт, или делецию части гена, кодирующего соответствующую часть белкового продукта), или оно может изменить или ликвидировать регуляторную последовательность гена-мишени. Также может быть вставлена одна или более регуляторных последовательностей, включая гетерологичные регуляторные последовательности и регуляторные последовательности, содержащиеся в геноме вида или рода бактерий, соответствующего бактериям, в которые вводится генетическое изменение. Кроме того, регуляторные последовательности могут быть выбраны на основе уровня экспрессии гена в бактериальной культуре или в растительной ткани. Генетическое изменение может представлять собой предопределенное генетическое изменение, намеренно вводимое в сайт-мишень. Генетическое изменение может представлять собой случайную мутацию в пределах сайта-мишени. Генетическое изменение может представлять собой вставку или делецию одного или более нуклеотидов. В некоторых случаях множество различных генетических изменений (например, 2, 3, 4, 5, 10 или более) вводят в одну или более выделенных бактерий перед тем, как подвергнуть растения воздействию бактерий для оценки улучшения качеств. Множество генетических изменений может иметь любой из вышеуказанных типов, одинаковых или разных типов и в любой комбинации. В некоторых случаях множество различных генетических изменений вводят последовательно, вводя первое генетическое изменение после первой стадии выделения, второе генетическое изменение после второй стадии выделения и так далее, чтобы накопить в бактериях множество генетических изменений, придающих связанным растениям последовательно улучшающиеся качества.
[00179] В целом термин «генетическое изменение» относится к любому изменению, введенному в полинуклеотидную последовательность относительно референсного полинуклеотида, такого как референсный геном или его часть, или референсный ген или его часть. Генетическое изменение может называться «мутацией», а последовательность или организм, содержащий генетическое изменение, может называться «генетическим вариантом» или «мутантом». Генетические изменения могут оказывать любое количество эффектов, таких как повышение или снижение некоторой биологической активности, включая экспрессию генов, метаболизм и клеточную сигнализацию. Генетические изменения могут быть намеренно введены в сайт-мишень или введены случайным образом. Для введения генетического изменения доступен целый ряд молекулярных инструментов и методов. Например, генетическое изменение может быть введено посредством мутагенеза с помощью полимеразной цепной реакции, олигонуклеотид-направленного мутагенеза, насыщающего мутагенеза, мутагенеза с перестановкой фрагментов, гомологичной рекомбинации, рекомбинационной инженерии, лямбда Red-зависимой рекомбинации, систем CRISPR/Cas9, химического мутагенеза и их комбинаций. Химические методы введения генетического изменения включают воздействие на ДНК химического мутагена, например, этилметансульфоната (EMS), метилметансульфоната (MMS), N-нитрозомочевины (EN U), N-метил-N-нитро-N'-нитрозогуанидина, 4-нитрохинолин-N-оксида, диэтилсульфата, бензопирена, циклофосфамида, блеомицина, триэтилмеламина, акриламидного мономера, азотистого иприта, винкристина, диэпоксиалканов (например, диэпоксибутана), ICR-170, формальдегида, прокарбазина гидрохлорида, этиленоксида, диметилнитрозамина, 7,12-диметилбенз(а)антрацена, хлорамбуцила, гексаметилфосфорамида, бисульфана и тому подобного. Агенты, вызывающие радиационные мутации, включают ультрафиолетовое излучение, γ-облучение, рентгеновское излучение и бомбардировку быстрыми нейтронами. Генетическое изменение также может быть введено в нуклеиновую кислоту с использованием, например, триметилпсоралена с ультрафиолетовым излучением. Случайная или направленная вставка мобильного элемента ДНК, например, транспозируемого элемента, является еще одним подходящим способом получения генетического изменения. Генетические изменения могут быть введены в нуклеиновую кислоту во время амплификации в бесклеточной системе in vitro, например, с использованием метода полимеразной цепной реакции (ПЦР), такого как подверженная ошибкам ПЦР. Генетические изменения могут быть введены в нуклеиновую кислоту in vitro с использованием методов перестановки в ДНК (например, перестановки экзонов, обмена доменами и тому подобного). Генетические изменения также могут быть введены в нуклеиновую кислоту в результате дефицита фермента репарации ДНК в клетке, например, ожидается, что присутствие в клетке мутантного гена, кодирующего мутантный фермент репарации ДНК, будет генерировать мутации с высокой частотой (т. е. приблизительно 1 мутацию/100 генов-1 мутацию/10000 генов) в геноме клетки. Примеры генов, кодирующих ферменты репарации ДНК, включают, не ограничиваясь перечисленным, Mut H, Mut S, Mut L и Mut U и их гомологи у других видов (например, MSH 1 6, PMS 1 2, MLH 1, GTBP, ERCC-1 и тому подобное). Иллюстративные описания различных способов введения генетических изменений содержатся, например, в Stemple (2004) Nature 5:1-7; Chiang et al. (1993) PCR Methods Appl 2(3): 210-217; Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751; и патентах США №№ 6,033,861 и 6,773,900.
[00180] Генетические изменения, введенные в микроорганизмы, могут быть классифицированы как трансгенные, цисгенные, внутригеномные, внутриродовые, межродовые, синтетические, сформировавшиеся в процессе эволюции, перегруппированные или SNP (однонуклеотидные полиморфизмы).
[00181] Генетическое изменение может быть введено во множество метаболических путей в микроорганизмах для выявления улучшений в качествах, описанных выше. Иллюстративные пути включают пути поглощения серы, биосинтез гликогена, путь регуляции глутамина, путь поглощения молибдена, путь азотфиксации, ассимиляцию аммиака, экскрецию или секрецию аммиака, поглощение азота, биосинтез глутамина, аннамокс, солюбилизацию фосфатов, транспорт органических кислот, продуцирование органических кислот, продуцирование агглютининов, гены, поглощающие активные кислородные радикалы, биосинтез индолилуксусной кислоты, биосинтез трегалозы, ферменты или пути, ответственные за разрушение клеточной стенки растений, гены, ответственные за прикрепление к корням, секрецию экзополисахаридов, путь глутаматсинтазы, пути поглощения железа, путь сидерофоров, путь хитиназы, АЦК-дезаминазу, биосинтез глутатиона, гены, ответственные за фосфорную сигнализацию, путь гашения кворума, пути цитохрома, путь гемоглобина, бактериальный гемоглобиноподобный путь, малая РНК rsmZ, биосинтез ризобитоксина, адгезионный белок lapA, путь чувства кворума АГЛ, биосинтез феназина, биосинтез циклических липопептидов и продуцирование антибиотиков.
[00182] Для введения желаемых мутаций могут быть использованы системы CRISPR/Cas9 (короткие палиндромные повторы, регулярно расположенные группами)/CRISPR-ассоциированные (Cas). CRISPR/Cas9 обеспечивают бактерии и археи адаптивным иммунитетом против вирусов и плазмид, используя РНК CRISPR (крРНК) для управления сайленсингом инвазивных нуклеиновых кислот. Белок Cas9 (или его функциональный эквивалент и/или вариант, т. е. Cas9-подобный белок) по своей природе обладает активностью ДНК-эндонуклеазы, зависящей от ассоциации белка с двумя природными или синтетическими молекулами РНК, называемыми крРНК и тракрРНК (также называемыми гидовыми РНК). В некоторых случаях указанные две молекулы ковалентно связаны, образуя единую молекулу (также называемую одногидовой РНК («огРНК»). Таким образом, Cas9 или Cas9-подобный белок связывается с ДНК-нацеливающей РНК (этот термин включает в себя как двухмолекулярную конфигурацию гидовой РНК, так и одномолекулярную конфигурацию гидовой РНК), которая активирует Cas9 или Cas9-подобный белок и направляет белок к последовательности нуклеиновой кислоты-мишени. Если Cas9 или Cas9-подобный белок сохраняет свою естественную ферментативную функцию, он расщепит ДНК-мишень, создавая двухцепочечный разрыв, который может привести к изменению генома (т. е. редактированию: делеции, вставке (когда присутствует донорный полинуклеотид), замене и т.д.), тем самым изменяя экспрессию генов. Некоторые варианты Cas9 (которые охватываются термином Cas9-подобный) были изменены таким образом, что они обладают сниженной активностью расщепления ДНК (в некоторых случаях они расщепляют одну цепь вместо обеих цепей ДНК-мишени, тогда как в других случаях они имеют активность расщепления ДНК в диапазоне от значительно сниженной до отсутствующей). Дополнительные иллюстративные описания систем CRISPR для введения генетического изменения содержатся, например, в US8795965.
[00183] В качестве метода циклической амплификации в мутагенезе с помощью полимеразной цепной реакции (ПЦР) для введения желаемых мутаций используются мутагенные праймеры. ПЦР включает циклы денатурации, отжига и удлинения. После амплификации с помощью ПЦР отбор мутантной ДНК и удаление родительской плазмидной ДНК может быть осуществлен путем: 1) замены dCTP гидроксиметилированным-dCTP в ходе ПЦР с последующим расщеплением рестриктазами для удаления только негидроксиметилированной родительской ДНК; 2) одновременного мутагенеза как гена устойчивости к антибиотику, так и изучаемого гена, изменяющего плазмиду на другую устойчивость к антибиотику, причем новая устойчивость к антибиотику затем облегчает отбор желаемой мутации; 3) после введения желаемой мутации, расщепления родительской метилированной матричной ДНК рестриктазой Dpnl, которая расщепляет только метилированную ДНК, с помощью которой обнаруживают подвергнутые мутагенезу неметилированные цепи; или 4) циркуляризации мутированных продуктов ПЦР в дополнительной реакции лигирования для повышения эффективности трансформации мутированной ДНК. Дополнительное описание иллюстративных способов содержится, например, в US 7132265, US 6713285, US 6673610, US 6391548, US 5789166, US 5780270, US 5354670, US 5071743 и US 20100267147.
[00184] В олигонуклеотид-направленном мутагенезе, также называемом сайт-направленным мутагенезом, обычно используется синтетический ДНК-праймер. Этот синтетический праймер содержит желаемую мутацию и комплементарен матричной ДНК вокруг сайта мутации, так что он может гибридизоваться с ДНК в представляющем интерес гене. Мутация может представлять собой изменение одного основания (точечная мутация), изменения множества оснований, делецию или вставку, или их комбинацию. Затем одноцепочечный праймер удлиняют с использованием ДНК-полимеразы, которая копирует остальную часть гена. Скопированный таким образом ген содержит мутированный сайт и затем может быть введен в клетку-хозяина в качестве вектора и клонирован. Наконец, мутанты могут быть отобраны путем секвенирования ДНК, чтобы проверить, что они содержат желаемую мутацию.
[00185] Генетические изменения могут быть введены с использованием подверженной ошибкам ПЦР. В этой методике представляющий интерес ген амплифицируют с использованием ДНК-полимеразы в условиях, которые являются недостаточными для точности репликации последовательности. В результате продукты амплификации содержат по меньшей мере одну ошибку в последовательности. Когда ген амплифицируется и полученный(ые) продукт(ы) реакции содержат одно или более изменений в последовательности по сравнению с матричной молекулой, полученные продукты являются мутированными по сравнению с матрицей. Еще одним средством введения случайных мутаций является воздействие на клетки химического мутагена, такого как нитрозогуанидин или этилметансульфонат (Nestmann, Mutat Res 1975 June; 28(3):323-30), и вектор, содержащий ген, затем выделяют из хозяина.
[00186] Насыщающий мутагенез является еще одной формой случайного мутагенеза, при котором пытаются генерировать все или почти все возможные мутации в конкретном сайте или узкой области гена. В общем смысле насыщающий мутагенез заключается в подвергании мутагенезу полного набора мутагенных кассет (где каждая кассета имеет длину, например, 1-500 оснований) в определенной полинуклеотидной последовательности, подлежащей мутированию (где последовательность, подлежащая мутированию, имеет длину, например, от 15 до 100 000 оснований). Следовательно, в каждую кассету, подлежащую мутированию, вводится группа мутаций (например, в диапазоне от 1 до 100 мутаций). Группировка мутаций, подлежащих введению в одну кассету, может отличаться или совпадать со второй группой мутаций, подлежащих введению во вторую кассету во время применения одного цикла насыщающего мутагенеза. Примерами таких группировок являются делеции, добавления, группировки определенных кодонов и группировки определенных нуклеотидных кассет.
[00187] Мутагенез перестановки фрагментов, также называемый перестановкой в ДНК, является способом быстрого распространения полезных мутаций. В примере процесса перестановки используют ДНКазу для фрагментации набора родительских генов на участки длиной, например, приблизительно 50-100 п.н. Затем проводят полимеразную цепную реакцию (ПЦР) без праймеров - фрагменты ДНК с достаточной перекрывающейся гомологичной последовательностью будут отжигаться друг с другом и затем удлиняться ДНК-полимеразой. Допускается несколько циклов этого удлинения методом ПЦР после того, как некоторые молекулы ДНК достигнут размера родительских генов. Эти гены могут быть затем амплифицированы с помощью другой ПЦР, на этот раз с добавлением праймеров, сконструированных таким образом, чтобы они были комплементарны концам цепей. Праймеры могут иметь дополнительные последовательности, добавленные к их 5'-концам, такие как последовательности сайтов распознавания рестриктаз, необходимые для лигирования в клонирующий вектор. Дополнительные примеры методик перестановки приведены в US 20050266541.
[00188] Гомологичный рекомбинационный мутагенез включает рекомбинацию между экзогенным фрагментом ДНК и полинуклеотидной последовательностью-мишенью. После того, как происходит двухцепочечный разрыв, участки ДНК вокруг 5'-концов разрыва обрезаются в ходе процесса, называемого резекцией. На следующей стадии инвазии цепей выступающий 3'-конец сломанной молекулы ДНК затем «внедряется» в схожую или идентичную молекулу ДНК, не являющуюся сломанной. Этот метод может быть использован для делеции гена, удаления экзонов, добавления гена и введения точечных мутаций. Гомологичный рекомбинационный мутагенез может быть постоянным или зависящим от определенных условий. Как правило, также предоставляется матрица рекомбинации. Матрица рекомбинации может представлять собой компонент другого вектора, содержаться в отдельном векторе или предоставляться в виде отдельного полинуклеотида. В некоторых вариантах осуществления матрица рекомбинации предназначена для использования в качестве матрицы в гомологичной рекомбинации, например, внутри или вблизи последовательности-мишени, никованной или расщепленной сайт-специфической нуклеазой. Матричный полинуклеотид может иметь любую подходящую длину, например, приблизительно 10, 15, 20, 25, 50, 75, 100, 150, 200, 500, 1000 нуклеотидов или более. В некоторых вариантах осуществления матричный полинуклеотид является комплементарным части полинуклеотида, содержащего последовательность-мишень. При оптимальном выравнивании матричный полинуклеотид может перекрываться с одним или более нуклеотидами последовательностей-мишеней (например, приблизительно с 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100 нуклеотидами или более). В некоторых вариантах осуществления, когда матричная последовательность и полинуклеотид, содержащий последовательность-мишень, оптимально выровнены, ближайший нуклеотид матричного полинуклеотида находится в пределах примерно 1, 5, 10, 15, 20, 25, 50, 75, 100, 200, 300, 400, 500, 1000, 5000, 10000 или более нуклеотидов от последовательности-мишени. Неограничивающие примеры сайт-направленных нуклеаз, применимых в способах гомологичной рекомбинации, включают нуклеазы «цинковые пальцы», нуклеазы CRISPR, нуклеазы TALE и мегануклеазу. Более подробное описание применения таких нуклеаз см., например, в US 8795965 и US 20140301990.
[00189] Для создания генетических изменений могут быть использованы мутагены, создающие в основном точечные мутации и короткие делеции, вставки, трансверсии и/или транзиции, включая химические мутагены или излучение. Мутагены включают, не ограничиваясь перечисленным, этилметансульфонат, метилметансульфонат, N-этил-N-нитрозомочевину, триэтилмеламин, N-метил-N-нитрозомочевину, прокарбазин, хлорамбуцил, циклофосфамид, диэтилсульфат, акриламидный мономер, мелфалан, азотистый иприт, винкристин, диметилнитрозамин, N-метил-N'-нитро-нитрозогуанидин, нитрозогуанидин, 2-аминопурин, 7,12-диметилбенз(а)антрацен, этиленоксид, гексаметилфосфорамид, бисульфан, диэпоксиалканы (диэпоксиоктан, диэпоксибутан и тому подобное), 2-метокси-6-хлор-9[3-(этил-2-хлорэтил)аминопропиламино]акридина дигидрохлорид и формальдегид.
[00190] Введение генетического изменения может представлять собой незавершенный процесс, так что некоторые бактерии в популяции обработанных бактерий несут желаемую мутацию, а другие - нет. В некоторых случаях желательно применять давление отбора для обогащения бактериями, несущими желаемое генетическое изменение. Традиционно отбор успешных генетических вариантов включал отбор по или против определенной функциональности, придаваемой или ликвидируемой генетическим изменением, например, в случае вставки гена устойчивости к антибиотику или ликвиации метаболической активности, способной превращать нелетальное соединение в летальный метаболит. Также возможно применять давление отбора на основе самой полинуклеотидной последовательности, так что необходимо введение только желаемого генетического изменения (например, без одновременной необходимости в селектируемом маркере). В этом случае давление отбора может включать расщепление геномов, лишенных генетического изменения, введенного в сайт-мишень, так что отбор эффективно направлен против референсной последовательности, в которую необходимо ввести генетическое изменение. Как правило, расщепление происходит в пределах 100 нуклеотидов от сайта-мишени (например, в пределах 75, 50, 25, 10 или менее нуклеотидов от сайта-мишени, включая расщепление рядом с сайтом-мишенью или внутри него). Расщепление может быть направлено сайт-специфической нуклеазой, выбранной из группы, состоящей из нуклеазы «цинкового пальца», нуклеазы CRISPR, нуклеазы TALE (TALEN) или мегануклеазы. Такой процесс аналогичен процессам усиления гомологичной рекомбинации в сайте-мишени, за исключением того, что не предоставляется матрица для гомологичной рекомбинации. В результате бактерии, лишенные желаемого генетического изменения, с большей вероятностью подвергаются расщеплению, которое, если его не восстанавливать, приводит к гибели клеток. Затем выжившие после отбора бактерии могут быть выделены для использования для воздействия на растения для оценки придания улучшенного качества.
[00191] Нуклеаза CRISPR может быть использована в качестве сайт-специфической нуклеазы для направления расщепления на сайт-мишень. Улучшенный отбор мутантных микроорганизмов может быть достигнут при использовании Cas9 для уничтожения немутированных клеток. Затем растения инокулируют мутированными микроорганизмами, чтобы повторно подтвердить симбиоз и создать давление эволюционного отбора для отбора эффективных симбионтов. Затем микроорганизмы могут быть повторно выделены из растительных тканей. В системах нуклеаз CRISPR, используемых для отбора против невариантных организмов, могут использоваться элементы, аналогичные описанным выше в отношении введения генетического изменения, за исключением того, что не предоставляется матрица для гомологичной рекомбинации. Расщепление, направленное на сайт-мишень, таким образом, усиливает гибель пораженных клеток.
[00192] Доступны другие варианты специфичного индуцирования расщепления в сайте-мишени, такие как нуклеазы «цинковые пальцы», системы нуклеаз TALE (TALEN) и мегануклеаза. Нуклеазы «цинковые пальцы» (ZFN) представляют собой искусственные ДНК-эндонуклеазы, полученные путем слияния ДНК-связывающего домена цинкового пальца с ДНК-расщепляющим доменом. ZFN могут быть сконструированы для нацеливания на желаемые последовательности ДНК, и это позволяет нуклеазам «цинковые пальцы» расщеплять уникальные последовательности-мишени. При введении в клетку ZFN могут быть использованы для редактирования ДНК-мишени в указанной клетке (например, генома клетки) путем индукции двухцепочечных разрывов. Эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), представляют собой искусственные ДНК-эндонуклеазы, полученные путем слияния эффекторного ДНК-связывающего домена TAL (подобного активатору транскрипции) с доменом расщепления ДНК. TALEN могут быть быстро сконструированы так, чтобы связывать практически любую желаемую последовательность ДНК, и при введении в клетку TALEN могут быть использованы для редактирования ДНК-мишени в указанной клетке (например, генома клетки) путем индукции двухцепочечных разрывов. Мегануклеазы (хоминг-эндонуклеаза) представляют собой эндодезоксирибонуклеазы, характеризующиеся большим сайтом распознавания (двухцепочечные последовательности ДНК из 12-40 пар нуклеотидов). Мегануклеазы могут быть использованы для замены, устранения или модификации последовательностей с высокой направленностью. Модифицируя их последовательность распознавания посредством белковой инженерии, можно изменять последовательность-мишень. Мегануклеазы могут быть использованы для модификации всех типов генома, будь то бактериальный, растительный или животный, и обычно они группируются в четыре семейства: семейство LAGLIDADG, семейство GIY-YIG, семейство His-Cyst box и семейство HNH. Иллюстративные хоминг-эндонуклеазы включают I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII.
[00193] Способы согласно настоящему изобретению могут быть использованы для введения или улучшения одного или более из множества желательных качеств. Примеры качеств, которые могут быть введены или улучшены, включают: биомассу корня, длину корня, высоту, длину побега, число листьев, эффективность водопотребления, общую биомассу, урожайность, размер плодов, размер зерна, интенсивность фотосинтеза, засухоустойчивость, жароустойчивость, солеустойчивость, устойчивость к стрессу, вызванному нематодами, устойчивость к грибковому патогену, устойчивость к бактериальному патогену, устойчивость к вирусному патогену, уровень метаболита и экспрессию протеома. Желательные качества, включая высоту, общую биомассу, биомассу корня и/или побегов, всхожесть семян, выживаемость проростков, эффективность фотосинтеза, интенсивность транспирации, количество или массу семян/плодов, урожайность зерна или плодов растения, содержание хлорофилла в листьях, интенсивность фотосинтеза, длину корня или любую их комбинацию, могут быть использованы для измерения роста и сравнены со скоростью роста контрольных сельскохозяйственных растений (например, растений без улучшенных качеств), выращиваемых в идентичных условиях.
[00194] Предпочтительным качеством, подлежащим введению или улучшению, является азотфиксация, как описано в настоящем документе. В некоторых случаях растение, полученное способами, описанными в настоящем документе, демонстрирует разницу в качестве, которая по меньшей мере приблизительно на 5%, например, по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 8%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%, или по меньшей мере на 100%, по меньшей мере приблизительно на 200%, по меньшей мере приблизительно на 300%, по меньшей мере приблизительно на 400% или более, превышает контрольное сельскохозяйственное растение, выращенное в тех же условиях почвы. В дополнительных примерах растение, полученное способами, описанными в настоящем документе, демонстрирует разницу в качестве, которая по меньшей мере приблизительно на 5% превышает, например, по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 8%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%, или по меньшей мере на 100%, по меньшей мере приблизительно на 200%, по меньшей мере приблизительно на 300%, по меньшей мере приблизительно на 400% или более, превышает контрольное сельскохозяйственное растение, выращенное в схожих условиях почвы.
[00195] Качество, подлежащее улучшению, может быть оценено в условиях, включающих применение одного или более биотических или абиотических факторов, вызывающих стресс. Примеры факторов, вызывающих стресс, включают абиотические стрессы (такие как тепловой стресс, солевой стресс, стресс, вызванный засухой, стресс, вызванный холодом, и стресс, вызванный низким содержанием питательных веществ) и биотические стрессы (такие как стресс, вызванный нематодами, стресс, вызванный насекомым-вредителем, стресс, вызванный грибковым патогеном, стресс, вызванный бактериальным патогеном, и стресс, вызванный вирусным патогеном).
Качество, улучшаемое способами и композициями согласно настоящему изобретению, может заключаться в азотфиксации, в том числе у растения, ранее не способного к азотфиксации. В некоторых случаях бактерии, выделенные в соответствии с описанным в настоящем документе способом, продуцируют 1% или более (например, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или более) азота растения, что может представлять собой повышение способности к азотфиксации по меньшей мере в 2 раза (например, в 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 20 раз, 50 раз, 100 раз, 1000 раз или более) по сравнению с бактериями, выделенными из первого растения до введения каких-либо генетических изменений. В некоторых случаях бактерии продуцируют 5% или более азота растения. Желаемый уровень азотфиксации может быть достигнут после повторения стадий введения генетического изменения, оказания воздействия на множество растений и выделения бактерий из растений с улучшенным качеством один или более раз (например, 1, 2, 3, 4, 5, 10, 15, 25 или более раз). В некоторых случаях повышенные уровни азотфиксации достигаются в присутствии удобрения с добавкой глутамина, аммиака или другого химического источника азота. Известны способы оценки степени азотфиксации, примеры которых описаны в настоящем документе.
[00196] Селекция микроорганизмов представляет собой метод систематической идентификации и улучшения роли видов в микробиоме сельскохозяйственной культуры. Метод состоит из трех стадий: 1) отбор видов-кандидатов путем картирования взаимодействий растений и микроорганизмов и прогнозирования регуляторных сетей, связанных с конкретным фенотипом, 2) прагматическое и прогнозируемое улучшение фенотипов микроорганизмов посредством внутривидового скрещивания регуляторных сетей и кластеров генов, и 3) скрининг и отбор новых генотипов микроорганизмов, обеспечивающих желаемые фенотипы сельскохозяйственных культур. Для систематической оценки улучшения штаммов создана модель, которая связывает динамику колонизации сообщества микроорганизмов с генетической активностью посредством ключевых видов. Эта модель используется для прогнозирования селекции генетических мишеней и повышения частоты отбора улучшений в кодируемых микробиомами качествах, имеющих агрономическую значимость.
Азотфиксация
[00197] В настоящем документе описаны способы повышения азотфиксации у растения, включающие воздействие на растение бактерий, содержащих одно или более генетических изменений, введенных в один или более генов, регулирующих азотфиксацию, где бактерии продуцируют 1% или более азота в растении (например, 2%, 5%, 10% или более), что может представлять собой повышение способности к азотфиксации по меньшей мере в 2 раза по сравнению с растением в отсутствие бактерий. Бактерии могут продуцировать азот в присутствии удобрения с добавкой глутамина, мочевины, нитратов или аммиака. Генетические изменения могут представлять собой любые генетические изменения, описанные в настоящем документе, включая примеры, представленные выше, в любом количестве и любой комбинации. Генетическое изменение может быть введено в собой ген, выбранный из группы, состоящей из nifA, nifL, ntrB, ntrC, глутаминсинтетазы, glnA, glnB, glnK, draT, amtB, глутаминазы, glnD, glnE, nifJ, nifH, nifD, nifK , nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическое изменение может представлять собой мутацию, приводящую к одному или более из: повышенной экспрессии или активности nifA или глутаминазы; сниженной экспрессии или активности nifL, ntrB, глутаминсинтетазы, glnB, glnK, draT, amtB; сниженной аденилат-удаляющей активности GlnE; или сниженной уридилил-удаляющей активности GlnD. Генетическое изменение, введенное в одну или более бактерий в способах, описанных в настоящем документе, может представлять собой нокаутирующую мутацию, или она может ликвидировать регуляторную последовательность гена-мишени, или она может включать вставку гетерологичной регуляторной последовательности, например, вставку регуляторной последовательности, содержащейся в геноме того же вида или рода бактерий. Регуляторная последовательность может быть выбрана на основе уровня экспрессии гена в бактериальной культуре или в растительной ткани. Генетическое изменение может быть вызвано химическим мутагенезом. Растения, выращенные на стадии (c), могут быть подвергнуты воздействию биотических или абиотических факторов, вызывающих стресс.
[00198] Величина азотфиксации, происходящей в растениях, описанных в настоящем документе, может быть измерена несколькими способами, например, с помощью анализа восстановления ацетилена (AR). Анализ восстановления ацетилена может быть проведен in vitro или in vivo. Свидетельства того, что определенная бактерия обеспечивает растение фиксированным азотом, могут включать: 1) общее количество N растения значительно увеличивается при инокуляции, предпочтительно с сопутствующим увеличением концентрации N в растении; 2) симптомы дефицита азота снижаются в условиях лимитирования N при инокуляции (что должно включать увеличение сухой массы); 3) фиксация N2 документируется с использованием подхода 15N (который может представлять собой эксперименты по изотопному разведению, анализы восстановления 15N2 или анализы распространенности 15N в природе); 4) фиксированный N включен в растительный белок или метаболит; и 5) все эти эффекты не наблюдаются у неинокулированных растений или у растений, инокулированных мутантом штамма инокулята.
[00199] Каскад регуляции азотфиксации дикого типа может быть представлен в виде цифровой логической цепи, где поступающие O2 и NH4+ проходят через вентиль NOR, выходящий поток из которого поступает в вентиль AND в дополнение к АТФ. В некоторых вариантах осуществления способы, раскрытые в настоящем документе, нарушают влияние NH4+ на эту цепь в нескольких точках регуляторного каскада, так что микроорганизмы могут продуцировать азот даже на удобренных полях. Однако способы, раскрытые в настоящем документе, также предусматривают изменение влияния АТФ или O2 на цепь или замену цепи другими регуляторными каскадами в клетке, или изменение генетических цепей, отличных от азотфиксации. Кластеры генов могут быть перестроены для создания функциональных продуктов под контролем гетерологичной регуляторной системы. Путем устранения нативных регуляторных элементов вне и внутри кодирующих последовательностей кластеров генов и замены их альтернативными регуляторными системами можно контролировать и/или перемещать в гетерологичные клетки функциональные продукты сложных генетических оперонов и других кластеров генов, включая клетки различных видов, кроме видов, из которых были получены нативные гены. После перестройки синтетические кластеры генов могут контролироваться генетическими цепями или другими индуцибельными регуляторными системами, тем самым контролируя экспрессию продуктов желаемым образом. Кассеты экспрессии могут быть спроектированы для работы в качестве логических вентилей, генераторов импульсов, генераторов колебаний, переключателей или запоминающих устройств. Управляющая кассета экспрессии может быть связана с промотором, так что кассета экспрессии выполняет функцию датчика окружающей среды, такого как датчик кислорода, температуры, тактильный сенсор, сенсор осмотического стресса, мембранного стресса или окислительно-восстановительный датчик.
[00200] Например, гены nifL, nifA, nifT и nifX могут быть удалены из кластера генов nif. Синтетические гены могут быть сконструированы путем рандомизации кодонов ДНК, кодирующей каждую аминокислотную последовательность. Выполняют отбор кодонов так, чтобы использование кодонов было максимально отличным от использования кодонов в нативном гене. Предложенные последовательности сканируют на наличие любых нежелательных признаков, таких как сайты распознавания рестриктаз, сайты распознавания транспозонов, повторяющиеся последовательности, промоторы сигма-54 и сигма-70, криптические сайты связывания рибосомы и rho-независимые терминаторы. Синтетические сайты связывания рибосомы выбирают так, чтобы они соответствовали силе каждого соответствующего нативного сайта связывания рибосомы, например, путем конструирования флуоресцентной репортерной плазмиды, в которой 150 п.н., окружающие старт-кодон гена (от -60 до +90), слиты с флуоресцентным геном. Эта химера может быть экспрессирована под контролем промотора Ptac, и флуоресценция может быть измерена с помощью проточной цитометрии. Для создания синтетических сайтов связывания рибосомы генерируют библиотеку репортерных плазмид с использованием 150 п.н. (от -60 до +90) синтетической кассеты экспрессии. Вкратце, синтетическая кассета экспрессии может состоять из случайного ДНК спейсера, вырожденной последовательности, кодирующей библиотеку RBS, и кодирующей последовательности для каждого синтетического гена. Несколько клонов подвергают скринингу для идентификации синтетического сайта связывания рибосомы, который наилучшим образом соответствует нативному сайту связывания рибосомы. Таким образом конструируют синтетические опероны, состоящие из тех же генов, что и нативные опероны, и тестируют их на функциональную комплементацию. Более подробное иллюстративное описание синтетических оперонов приведено в US 20140329326.
Виды бактерий
[00201] Микроорганизмы, пригодные для способов и композиций, раскрытых в настоящем документе, могут быть получены из любого источника. В некоторых случаях микроорганизмы могут представлять собой бактерии, археи, простейших или грибы. Микроорганизмы согласно настоящему изобретению могут представлять собой азотфиксирующие микроорганизмы, например, азотфиксирующие бактерии, азотфиксирующие археи, азотфиксирующие грибы, азотфиксирующие дрожжи или азотфиксирующих простейших. Микроорганизмы, используемые в способах и композициях, раскрытых в настоящем документе, могут представлять собой спорообразующие микроорганизмы, например, спорообразующие бактерии. В некоторых случаях бактерии, пригодные для способов и композиций, раскрытых в настоящем документе, могут представлять собой грамположительные бактерии или грамотрицательные бактерии. В некоторых случаях бактерии могут представлять собой бактерии, образующие эндоспоры, принадлежащие к типу Firmicute. В некоторых случаях бактерии могут представлять собой диазотрофа. В некоторых случаях бактерии могут не представлять собой диазотрофа.
[00202] Способы и композиции согласно данному изобретению могут быть использованы с археями, такими как, например, Methanothermobacter thermoautotrophicus.
[00203] В некоторых случаях бактерии, которые могут быть пригодными, включают, но не ограничиваясь перечисленным, Agrobacterium radiobacter, Bacillus acidocaldarius, Bacillus acidoterrestris, Bacillus agri, Bacillus aizawai, Bacillus albolactis, Bacillus alcalophilus, Bacillus alvei, Bacillus aminoglucosidicus, Bacillus aminovorans, Bacillus amylolyticus (также известная как Paenibacillus amylolyticus) Bacillus amyloliquefaciens, Bacillus aneurinolyticus, Bacillus atrophaeus, Bacillus azotoformans, Bacillus badius, Bacillus cereus (синонимы: Bacillus endorhythmos, Bacillus medusa), Bacillus chitinosporus, Bacillus circulans, Bacillus coagulans, Bacillus endoparasiticus Bacillus fastidiosus, Bacillus firmus, Bacillus kurstaki, Bacillus lacticola, Bacillus lactimorbus, Bacillus lactis, Bacillus laterosporus (также известная как Brevibacillus laterosporus), Bacillus lautus, Bacillus lentimorbus, Bacillus lentus, Bacillus licheniformis, Bacillus maroccanus, Bacillus megaterium, Bacillus metiens, Bacillus mycoides, Bacillus natto, Bacillus nematocida, Bacillus nigrificans, Bacillus nigrum, Bacillus pantothenticus, Bacillus popillae, Bacillus psychrosaccharolyticus, Bacillus pumilus, Bacillus siamensis, Bacillus smithii, Bacillus sphaericus, Bacillus subtilis, Bacillus thuringiensis, Bacillus uniflagellatus, Bradyrhizobium japonicum, Brevibacillus brevis Brevibacillus laterosporus (ранее - Bacillus laterosporus), Chromobacterium subtsugae, Delftia acidovorans, Lactobacillus acidophilus, Lysobacter antibioticus, Lysobacter enzymogenes, Paenibacillus alvei, Paenibacillus polymyxa, Paenibacillus popilliae (ранее - Bacillus popilliae), Pantoea agglomerans, Pasteuria penetrans (ранее - Bacillus penetrans), Pasteuria usgae, Pectobacterium carotovorum (ранее - Erwinia carotovora), Pseudomonas aeruginosa, Pseudomonas aureofaciens, Pseudomonas cepacia (ранее известная как Burkholderia cepacia), Pseudomonas chlororaphis, Pseudomonas fluorescens, Pseudomonas proradix, Pseudomonas putida, Pseudomonas syringae, Serratia entomophila, Serratia marcescens, Streptomyces colombiensis, Streptomyces galbus, Streptomyces goshikiensis, Streptomyces griseoviridis, Streptomyces lavendulae, Streptomyces prasinus, Streptomyces saraceticus, Streptomyces venezuelae, Xanthomonas campestris, Xenorhabdus luminescens, Xenorhabdus nematophila, Rhodococcus globerulus AQ719 (регистрационный номер NRRL B-21663), Bacillus sp. AQ175 (регистрационный номер ATCC 55608), Bacillus sp. AQ 177 (регистрационный номер ATCC 55609), Bacillus sp. AQ178 (регистрационный номер ATCC 53522) и штамм Streptomyces sp., регистрационный номер NRRL B-30145. В некоторых случаях бактерия может представлять собой Azotobacter chroococcum, Methanosarcina barkeri, Klesiella pneumoniae, Azotobacter vinelandii, Rhodobacter spharoides, Rhodobacter capsulatus, Rhodobcter palustris, Rhodosporillum rubrum, Rhizobium leguminosarum или Rhizobium etli.
[00204] В некоторых случаях бактерия может представлять собой вид Clostridium, например, Clostridium pasteurianum, Clostridium beijerinckii, Clostridium perfringens, Clostridium tetani, Clostridium acetobutylicum.
[00205] В некоторых случаях бактерии, используемые в способах и композициях согласно настоящему изобретению, могут представлять собой цианобактерии. Примеры родов цианобактерий включают Anabaena (например, Anagaena sp. PCC7120), Nostoc (например, Nostoc punctiforme) или Synechocystis (например, Synechocystis sp. PCC6803).
[00206] В некоторых случаях бактерии, используемые в способах и композициях согласно настоящему изобретению, могут принадлежать к типу Chlorobi, например, Chlorobium tepidum.
[00207] В некоторых случаях микроорганизмы, используемые в способах и композициях согласно настоящему изобретению, могут содержать ген, гомологичный известному гену NifH. Последовательности известных генов NifH можно найти, например, в базе данных NifH лаборатории Zehr (https://wwwzehr.pmc.ucsc.edu/nifH_Database_Public/, 4 апреля 2014 г.) или в базе данных NifH лаборатории Бакли (http://www.css.cornell.edu/faculty/buckley/nifh.htm, а также в Gaby, John Christian, and Daniel H. Buckley. "A comprehensive aligned nifH gene database: a multipurpose tool for studies of nitrogen-fixing bacteria." Database 2014 (2014): bau001.). В некоторых случаях микроорганизмы, используемые в способах и композициях согласно настоящему изобретению, могут содержать последовательность, кодирующую полипептид, обладающий по меньшей мере 60%, 70%, 80%, 85%, 90%, 95%, 96%, 96%, 98%, 99% или более чем 99% идентичностью последовательностью из базы данных NifH лаборатории Zehr (https://wwwzehr.pmc.ucsc.edu/nifH_Database_Public/, 4 апреля 2014 г.). В некоторых случаях микроорганизмы, используемые в способах и композициях согласно настоящему изобретению, могут содержать последовательность, кодирующую полипептид, обладающий по меньшей мере 60%, 70%, 80%, 85%, 90%, 95%, 96%, 96%, 98%, 99% или более чем 99% идентичностью последовательности из базы данных NifH лаборатории Buckley (Gaby, John Christian, and Daniel H. Buckley. "A comprehensive aligned nifH gene database: a multipurpose tool for studies of nitrogen-fixing bacteria." Database 2014 (2014): bau001.).
[00208] Микроорганизмы, пригодны для описанных в настоящем документе способов и композиций, могут быть получены путем извлечения микроорганизмов с поверхностей или тканей нативных растений; измельчения семян для выделения микроорганизмов; посадки семян в различных образцах почвы и выделения микроорганизмов из тканей; или инокулирования растений экзогенными микроорганизмами и определения того, какие микроорганизмы появляются в растительных тканях. Неограничивающие примеры растительных тканей включают семя, проросток, лист, срез, растение, луковицу или клубень. В некоторых случаях бактерии выделяют из семени. Параметры для обработки образцов могут варьировать для выделения различных типов ассоциированных микроорганизмов, таких как ризосферные микроорганизмы, эпифиты или эндофиты. Бактерии также могут быть получены из хранилища, такого как коллекции штаммов из окружающей среды, вместо первоначального выделения из первого растения. Микроорганизмы могут быть генотипированы и фенотипированы путем секвенирования геномов выделенных микроорганизмов; профилирования сообществ in planta; определения характеристик транскриптомной функциональности сообществ или выделенных микроорганизмов; или скрининга признаков микроорганизмов с использованием селективных или фенотипических сред (например, фенотипов азотфиксации или солюбилизации фосфатов). Отобранные штаммы- или популяции-кандидаты могут быть получены с помощью данных о последовательности; данные о фенотипе; данных о растениях (например, данных о геноме, фенотипе и/или урожайности); данных о почве (например, pH, содержании N/P/K и/или основных биотических сообществах почвы); или любой их комбинации.
[00209] Бактерии и способы получения бактерий, описанные в настоящем документе, могут применяться к бактериям, способным эффективно самостоятельно размножаться на поверхности листьев, поверхности корней или внутри растительных тканей, не вызывая разрушительной защитной реакции растений, или к бактериям, устойчивых к защитным реакциям растений. Описанные в настоящем документе бактерии могут быть выделены путем культивирования экстракта растительной ткани или смыва с поверхности листа в среде без добавления азота. Однако бактерии могут быть некультивируемыми, то есть, может быть неизвестно, являются ли они культивируемыми или трудными для культивирования с использованием стандартных способов, известных в данной области техники. Описанные в настоящем документе бактерии могут представлять собой эндофита, эпифита или бактерию, населяющую ризосферу растения (ризосферные бактерии). Бактерии, полученные после повторения стадий введения генетического изменения, оказания воздействия на множество растений и выделения бактерий из растений с улучшенным качеством один или более раз (например, 1, 2, 3, 4, 5, 10, 15, 25 или более раз), могут быть эндофитными, эпифитными или ризосферными. Эндофиты представляют собой организмы, которые попадают внутрь растений, не вызывая симптомов заболевания и не вызывая образования симбиотических структур, и представляют агрономический интерес, поскольку они могут усиливать рост растений и улучшать питание растений (например, путем азотфиксации). Бактерии могут представлять собой эндофита, переносимого семенами. К переносимым семенами эндофитам относятся бактерии, связанные с семенами травы или растения или полученные из них, такие как переносимый семенами бактериальный эндофит, встречающихся в зрелых, сухих, неповрежденных (например, без трещин, видимых грибковых инфекций или преждевременно прорастания) семенах. Переносимый семенами бактериальный эндофит может быть связан с поверхностью семени или получен из нее; в качестве альтернативы или в дополнение, он может быть связан с внутренней частью семени или получен из нее (например, из семени со стерилизованной поверхностью). В некоторых случаях переносимый семенами бактериальный эндофит способен размножаться в растительной ткани, например, внутри семени. Кроме того, в некоторых случаях переносимый семенами бактериальный эндофит способен выживать после высушивания.
[00210] Бактерия, выделенная в соответствии со способами согласно изобретению, или используемая в способах или композициях согласно изобретению, может содержать множество различных бактериальных таксонов в комбинации. В качестве примера, бактерии могут включать Proteobacteria (такие как Pseudomonas, Enterobacter, Stenotrophomonas, Burkholderia, Rhizobium, Herbaspirillum, Pantoea, Serratia, Rahnella, Azospirillum, Azorhizobium, Azotobacter, Duganella, Delftia, Bradyrhizobiun, Sinorhizobium и Halomonas), Firmicutes (такие как Bacillus, Paenibacillus, Lactobacillus, Mycoplasma и Acetabacterium) и Actinobacteria (такие как Streptomyces, Rhodacoccus, Microbacterium и Curtobacterium). Бактерии, используемые в способах и композициях согласно изобретению, могут включать азотфиксирующие бактериальные консорциумы двух или более видов бактерий. В некоторых случаях один или более видов бактерий в составе бактериальных консорциумов могут быть способны фиксировать азот. В некоторых случаях один или более видов в составе бактериальных консорциумов могут способствовать способности других бактерий фиксировать азот или усиливать ее. Бактерии, фиксирующие азот, и бактерии, усиливающие способность других бактерий фиксировать азот, могут быть одинаковыми или разными. В некоторых примерах бактериальный штамм может быть способен фиксировать азот в сочетании с другим бактериальным штаммом или в определенных бактериальных консорциумах, но может быть неспособен фиксировать азот в монокультуре. Примеры родов бактерий, которые могут встречаться в азотфиксирующих бактериальных консорциумах, включают, не ограничиваясь перечисленным, Herbaspirillum , Azospirillum, Enterobacter и Bacillus.
Бактерии, которые могут быть получены способами, раскрытыми в настоящем документе, включают Azotobacter sp., Bradyrhizobium sp., Klebsiella sp. и Sinorhizobium sp. В некоторых случаях бактерии могут быть выбраны из группы, состоящей из: Azotobacter vinelandii, Bradyrhizobium japonicum, Klebsiella pneumoniae и Sinorhizobium meliloti. В некоторых случаях бактерии могут принадлежать к роду Enterobacter или Rahnella. В некоторых случаях бактерии могут принадлежать к роду Frankia или Clostridium. Примеры бактерий рода Clostridium включают, не ограничиваясь перечисленным, Clostridium acetobutilicum, Clostridium pasteurianum, Clostridium beijerinckii, Clostridium perfringens и Clostridium tetani. В некоторых случаях бактерии могут принадлежать к роду Paenibacillus, например, Paenibacillus azotofixans, Paenibacillus borealis, Paenibacillus durus, Paenibacillus macerans, Paenibacillus polymyxa, Paenibacillus alvei, Paenibacillus amylolyticus, Paenibacillus campinasensis, Paenibacillus chibensis, Paenibacillus glucanolyticus, Paenibacillus illinoisensis, Paenibacillus larvae, подвид Larvae, Paenibacillus larvae, подвид Pulvifaciens, Paenibacillus lautus, Paenibacillus macerans, Paenibacillus macquariensis, Paenibacillus macquariensis, Paenibacillus pabuli, Paenibacillus peoriae или Paenibacillus polymyxa.
[00211] В некоторых примерах бактерии, выделенные в соответствии со способами согласно изобретению, могут принадлежать к одному или более из следующих таксонов: Achromobacter, Acidithiobacillus, Acidovorax, Acidovoraz, Acinetobacter, Actinoplanes, Adlercreutzia, Aerococcus, Aeromonas, Afipia, Agromyces, Ancylobacter, Arthrobacter, Atopostipes, Azospirillum, Bacillus, Bdellovibrio, Beijerinckia, Bosea, Bradyrhizobium, Brevibacillus, Brevundimonas, Burkholderia, Candidatus Haloredivivus, Caulobacter, Cellulomonas, Cellvibrio, Chryseobacterium, Citrobacter, Clostridium, Coraliomargarita, Corynebacterium, Cupriavidus, Curtobacterium, Curvibacter, Deinococcus, Delftia, Desemzia, Devosia, Dokdonella, Dyella, Enhydrobacter, Enterobacter, Enterococcus, Erwinia, Escherichia, Escherichia/Shigella, Exiguobacterium, Ferroglobus, Filimonas, Finegoldia, Flavisolibacter, Flavobacterium, Frigoribacterium, Gluconacetobacter, Hafnia, Halobaculum, Halomonas, Halosimplex, Herbaspirillum, Hymenobacter, Klebsiella, Kocuria, Kosakonia, Lactobacillus, Leclercia, Lentzea, Luteibacter, Luteimonas, Massilia, Mesorhizobium, Methylobacterium, Microbacterium, Micrococcus, Microvirga, Mycobacterium, Neisseria, Nocardia, Oceanibaculum, Ochrobactrum, Okibacterium, Oligotropha, Oryzihumus, Oxalophagus, Paenibacillus, Panteoa, Pantoea, Pelomonas, Perlucidibaca, Plantibacter, Polynucleobacter, Propionibacterium, Propioniciclava, Pseudoclavibacter, Pseudomonas, Pseudonocardia, Pseudoxanthomonas, Psychrobacter, Ralstonia, Rheinheimera, Rhizobium, Rhodococcus, Rhodopseudomonas, Roseateles, Ruminococcus, Sebaldella, Sediminibacillus, Sediminibacterium, Serratia, Shigella, Shinella, Sinorhizobium, Sinosporangium, Sphingobacterium, Sphingomonas, Sphingopyxis, Sphingosinicella, Staphylococcus, 25 Stenotrophomonas, Strenotrophomonas, Streptococcus, Streptomyces, Stygiolobus, Sulfurisphaera, Tatumella, Tepidimonas, Thermomonas, Thiobacillus, Variovorax, род WPS-2 incertae sedis, Xanthomonas и Zimmermannella.
[00212] Бактерия может быть получена из любой общей среды суши, включая ее почвы, растения, грибы, животных (включая беспозвоночных) и другую биоту, включая донные отложения, воду и биоту озер и рек; из морской среды, ее биоты и донных отложений (например, морской воды, морских грязей, морских растений, морских беспозвоночных (например, губок), морских позвоночных (например, рыб)); геосферы суши и морей (реголита и камня, например, измельченных подземных пород, песков и глин); криосферы и ее талых вод; атмосферы (например, отфильтрованной взвешенной пыли, облаков и дождевых капель); городских, промышленных и других искусственных сред (например, накопленных органических и минеральных веществ на бетоне, придорожных канавах, поверхностях крыш и дорожных покрытиях).
[00213] Растения, из которых получены бактерии, могут представлять собой растение, имеющее одно или более желательных качеств, например, растение, которое естественным образом произрастает в определенной среде или при определенных условиях, представляющих интерес. Например, определенное растение может естественным образом произрастать в песчаной почве или песке с высоким содержанием солей, или при экстремальных температурах, или с небольшим количеством воды, или оно может быть устойчивым к определенным сельскохозяйственным вредителям или болезням, присутствующим в окружающей среде, и это может быть желательно для выращивания промышленной сельскохозяйственной культуры в таких условиях, особенно если они являются, например, единственными условиями, доступными в определенном географическом местоположении. В качестве еще одного примера, бактерии могут быть собраны из промышленных сельскохозяйственных культур, выращиваемых в таких условиях окружающей среды, или, более конкретно, из отдельных растений сельскохозяйственной культуры, лучше всего демонстрирующих представляющее интерес качество среди сельскохозяйственной культуры, выращиваемой в любой конкретной среде: например, наиболее быстро растущих растений среди сельскохозяйственной культуры, выращиваемой в лимитированных по солям почвах, или наименее поврежденных растений в сельскохозяйственных культурах, подверженных серьезному повреждению насекомыми или эпидемическому заболеванию, или растений, имеющие желаемые количества определенных метаболитов и других соединений, включая содержание клетчатки, содержание масла и тому подобное, или растений, демонстрирующих желательные цвета, вкус или запах. Бактерии могут быть собраны из представляющего интерес растения или любого материала, встречающегося в представляющей интерес окружающей среде, включая грибы и другую животную и растительную биоту, почву, воду, донные отложения и другие элементы окружающей среды, как упоминалось ранее.
[00214] Бактерии могут быть выделены из растительной ткани. Это выделение может происходить из любой подходящей ткани растения, включая, например, корень, стебель и листья, а также репродуктивные ткани растения. Например, традиционные способы выделения из растений обычно включают стерильное отделение представляющего интерес растительного материала (например, длины корня или стебля, листьев), стерилизацию поверхности подходящим раствором (например, 2% гипохлоритом натрия), после чего растительный материал помещают на питательную среду для выращивания микроорганизмов. В качестве альтернативы, растительный материал, поверхность которого была стерилизована, может быть измельчен в стерильной жидкости (обычно в воде), и жидкая суспензия, включающая небольшие кусочки измельченного растительного материала, может быть распределена по поверхности подходящей твердой агаровой среды или сред, которые могут быть или не быть селективными (например, содержать только фитиновую кислоту в качестве источника фосфора). Этот подход особенно подходит для бактерий, которые образуют изолированные колонии, и они могут быть собраны по отдельности на отдельные чашки с питательной средой и дополнительно очищены до одного вида хорошо известными способами. В качестве альтернативы, образцы корней или листвы растений могут не быть подвергнуты стерилизации поверхности, а лишь тщательно промыты, что позволяет включать в процесс выделения живущие на поверхности эпифитные микроорганизмы, или же эпифитные микроорганизмы могут быть выделены отдельно путем отпечатывания кусочков корней, стебля или листьев растения на поверхности агаровой среды и их снятия, после чего выделяют отдельные колонии, как указано выше. Этот подход особенно подходит, например, для бактерий. В качестве альтернативы, корни могут быть обработаны без смывания небольших количеств почвы, прилипшей к корням, что позволяет включать микроорганизмы, колонизирующие ризосферу растения. В противном случае почва, прилипшая к корням, может быть удалена, разбавлена и распределена на подходящих селективных и неселективных агаровых средах для выделения отдельных колоний ризосферных бактерий.
[00215] Биологически чистые культуры Rahnella aquatilis и Enterobacter sacchari были депонированы 14 июля 2015 г. в Американской коллекции типовых культур (ATCC; международный орган по депонированию), Манассас, Виргиния, США, и им были присвоены номера для целей патентного депонирования PTA-122293 и PTA-122294, соответственно. Эти депонирования были осуществлены в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и Инструкции к нему (Будапештский договор).
Композиции
[00216] Композиции, содержащие бактерии или бактериальные популяции, полученные в соответствии со способами, описанными в настоящем документе, и/или имеющие характеристики, описанные в настоящем документе, могут быть в форме жидкости, пены или сухого продукта. В некоторых примерах композиция, содержащая бактериальные популяции, может быть в форме сухого порошка, суспензии порошка и воды, или текучего состава для обработки семян.
[00217] Композиция может быть изготовлена в биореакторах, таких как реакторы непрерывного действия с перемешиванием, реакторы периодического действия, а также на ферме. В некоторых примерах композиции могут храниться в контейнере, таком как бутыль, или небольшим нефасованными партиями. В некоторых примерах композиции могут храниться в объекте, выбранном из группы, состоящей из бутылки, банки, ампулы, упаковочной тары, сосуда, пакета, коробки, бункера, конверта, картонной тары, контейнера, силоса, транспортировочного контейнера, платформы грузовика и/или упаковки.
[00218] Композиции также могут быть использованы для улучшения качеств растений. В некоторых примерах одна или более композиций могут быть нанесены в качестве покрытия на семя. В некоторых примерах одна или более композиций могут быть нанесены в качестве покрытия на проросток. В некоторых примерах одна или более композиций могут быть нанесены в качестве покрытия на поверхность семени. В некоторых примерах одна или несколько более могут быть нанесены в качестве слоя над поверхностью семени. В некоторых примерах композиция, нанесенная в качестве покрытия на семя, может быть в жидкой форме, в форме сухого продукта, в форме пены, в форме суспензии порошка и воды или текучего состава для обработки семян. В некоторых примерах одна или более композиций могут быть нанесены на семя и/или проросток путем распыления, погружения, нанесения покрытия, инкапсулирования и/или обсыпки семени и/или проростка одной или более композициями. В некоторых примерах множество бактерий или бактериальных популяций могут быть нанесены в качестве покрытия на семя и/или проросток растения. В некоторых примерах по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять или более десяти бактерий в составе комбинации бактерий могут быть выбраны из одного из следующих родов: Acidovorax, Agrobacterium, Bacillus, Burkholderia, Chryseobacterium, Curtobacterium, Enterobacter, Escherichia, Methylobacterium, Paenibacillus, Pantoea, Pseudomonas, Ralstonia, Saccharibacillus, Sphingomonas и Stenotrophomonas.
[00219] В некоторых примерах по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять или более десяти бактерий и бактериальных популяций в составе комбинации эндофитов выбраны из одного из следующих семейств: Bacillaceae, Burkholderiaceae, Comamonadaceae, Enterobacteriaceae, Flavobacteriaceae, Methylobacteriaceae, Microbacteriaceae, Paenibacillileae, Pseudomonnaceae, Rhizobiaceae, Sphingomonadaceae, Xanthomonadaceae, Cladosporiaceae, Gnomoniaceae, Incertae sedis, Lasiosphaeriaceae, Netriaceae и Pleosporaceae.
[00220] В некоторых примерах по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять или более десяти бактерий и бактериальных популяций в составе комбинации эндофитов выбраны из одного из следующих семейств: Bacillaceae, Burkholderiaceae, Comamonadaceae, Enterobacteriaceae, Flavobacteriaceae, Methylobacteriaceae, Microbacteriaceae, Paenibacillileae, Pseudomonnaceae, Rhizobiaceae, Sphingomonadaceae, Xanthomonadaceae, Cladosporiaceae, Gnomoniaceae, Incertae sedis, Lasiosphaeriaceae, Netriaceae, Pleosporaceae.
[00221] Примеры композиций могут включать покрытия семян для коммерчески важных сельскохозяйственных культур, например, сорго, канолы, томатов, клубники, ячменя, риса, маиса и пшеницы. Примеры композиций также могут включать покрытия семян для кукурузы, сои, канолы, сорго, картофеля, риса, овощей, зерновых и масличных культур. Семена, предложенные в настоящем документе, могут быть генетически модифицированными организмами (ГМО), не ГМО, органическими или обычными. В некоторых примерах композиции могут быть распылены на надземные части растения или нанесены на корни путем введения в борозды, в которые посеяны семена растений, полива почвы или погружения корней в суспензию композиции. В некоторых примерах композиции могут быть обезвожены подходящим способом, сохраняющим жизнеспособность клеток и способность искусственно инокулировать и колонизировать растения-хозяева. Виды бактерий могут присутствовать в композициях в концентрации от 108 до 1010 КОЕ/мл. В некоторых примерах композиции могут быть дополнены ионами микроэлементов, такими как ионы молибдена, ионы железа, ионы марганца или комбинации этих ионов. Концентрация ионов в примерах композиций, как описано в настоящем документе, может составлять от приблизительно 0,1 до приблизительно 50 мМ. Некоторые примеры композиций также могут включать носитель, такой как бета-глюкан, карбоксиметилцеллюлоза (КМЦ), бактериальное внеклеточное полимерное вещество (EPS), сахар, молоко животного происхождения или другие подходящие носители. В некоторых примерах в качестве носителя могут быть использованы торф или посадочные материалы, или в качестве носителя могут быть использованы биополимеры, в которых заключена композиция.
[00222] Композиции, содержащие бактериальные популяции, описанные в настоящем документе, могут быть нанесены в качестве покрытия на поверхность семени. Как таковые также рассматриваются композиции, содержащие семена, покрытые одной или более бактериями, описанными в настоящем документе. Покрытие семян может быть сформировано путем смешивания бактериальной популяции с пористым, химически инертным гранулированным носителем. В качестве альтернативы, композиции могут быть вставлены непосредственно в борозды, в которые посеяны семена, или распылены на листья растений, или нанесены путем погружения корней в суспензию композиции. Эффективное количество композиции может быть использовано для заселения подпочвенного слоя, прилегающего к корням растения, жизнеспособными размножающимися бактериями, или для заселения листьев растения жизнеспособными размножающимися бактериями. Как правило, эффективное количество представляет собой количество, достаточное для получения растений с улучшенными качествами (например, желаемым уровнем азотфиксации).
[00223] Описанные в настоящем документе бактериальные композиции могут быть приготовлены с использованием приемлемого в сельском хозяйстве носителя. Препарат, пригодный для этих вариантов осуществления, может включать по меньшей мере один компонент, выбранный из группы, состоящей из вещества, повышающего клейкость, микробиологического стабилизатора, фунгицида, антибактериального агента, консерванта, стабилизатора, поверхностно-активного вещества, агента против комкования, гербицида, нематоцида, инсектицида, регулятора роста растений, удобрения, родентицида, осушителя, бактерицида, питательного вещества или любой их комбинации. В некоторых примерах композиции могут быть пригодны для длительного хранения. Например, любая из описанных в настоящем документе композиций может включать приемлемый в сельском хозяйстве носитель (например, одно или более из удобрения, такого как удобрение неприродного происхождения, связывающего вещества, такого как связывающее вещество неприродного происхождения, и пестицида, такого как пестицид неприродного происхождения). Связывающее вещество неприродного происхождения может представлять собой, например, полимер, сополимер или синтетический воск. Например, любой из семян, проростков или растений с покрытием, описанных в настоящем документе, может содержать такой приемлемый в сельском хозяйстве носитель в покрытии семян. В любой из композиций или способов, описанных в настоящем документе, приемлемый в сельском хозяйстве носитель может представлять собой или может включать соединение неприродного происхождения (например, удобрение неприродного происхождения, связывающее вещество неприродного происхождения, такое как полимер, сополимер или синтетический воск, пестицид неприродного происхождения). Неограничивающие примеры приемлемых в сельском хозяйстве носителей описаны ниже. Дополнительные примеры приемлемых в сельском хозяйстве носителей известны в данной области техники.
[00224] В некоторых случаях бактерии смешивают с приемлемым в сельском хозяйстве носителем. Носитель может представлять собой твердый носитель или жидкий носитель и присутствовать в различных формах, включая микросферы, порошки, эмульсии и тому подобное. Носитель может представлять собой любой один или более носителей, придающих различные свойства, такие как повышенная стабильность, смачиваемость или диспергируемость. В композицию могут быть включены смачивающие агенты, такие как природные или синтетические поверхностно-активные вещества, которые могут представлять собой неионогенные или ионогенные поверхностно-активные вещества, или их комбинация. Эмульсии вода-в-масле также могут быть использованы для приготовления композиции, включающей выделенные бактерии (см., например, патент США № 7,485,451). Подходящие препараты, которые могут быть приготовлены, включают смачивающиеся порошки, гранулы, гели, агаровые пластинки или пеллеты, загустители и тому подобное, микроинкапсулированные частицы и тому подобное, жидкости, такие как водные текучие среды, водные суспензии, эмульсии вода-в-масле и т.д. Препарат может включать зерновые или бобовые продукты, например, измельченное зерно или бобы, бульон или муку, полученную из зерна или бобов, крахмал, сахар или масло.
[00225] В некоторых вариантах осуществления сельскохозяйственный носитель может представлять собой почву или питательную среду для роста растений. Другие сельскохозяйственные носители, которые могут быть использованы, включают воду, удобрения, масла растительного происхождения, увлажняющие вещества или их комбинации. В качестве альтернативы, сельскохозяйственный носитель может представлять собой твердое вещество, такое как диатомовая земля, суглинок, диоксид кремния, альгинат, глина, бентонит, вермикулит, семенные коробочки, другие продукты растительного и животного происхождения или их комбинации, включая гранулы, пеллеты или суспензии. Смеси любых из вышеупомянутых ингредиентов также рассматриваются в качестве носителей, таких как, не ограничиваясь перечисленным, pesta (мука и каолиновая глина), агар или гранулы на основе муки в суглинке, песке или глине, и т.д. Препараты могут включать источники питания для бактерий, такие как ячмень, рис или другие биологические материалы, такие как семена, части растений, жом сахарного тростника, шелуха или стебли от переработки зерна, измельченный растительный материал или древесина от строительного мусора, древесные опилки или мелкие волокна от переработки бумаги, ткани или дерева.
[00226] Например, удобрение может быть использовано для способствования росту или обеспечения питательными веществами семени, проростка или растения. Неограничивающие примеры удобрений включают азот, фосфор, калий, кальций, серу, магний, бор, хлорид, марганец, железо, цинк, медь, молибден и селен (или их соли). Дополнительные примеры удобрений включают одну или более аминокислот, соли, углеводы, витамины, глюкозу, NaCl, дрожжевой экстракт, NH4H2PO4, (NH4)2SO4, глицерин, валин, L-лейцин, молочную кислоту, пропионовую кислоту, янтарную кислоту, яблочную кислоту, лимонную кислоту, гидротартрат калия, ксилозу, ликсозу и лецитин. В одном из вариантов осуществления препарат может включать вещество, повышающее клейкость, или клейкое вещество (называемое связывающим веществом), чтобы помочь связать другие активные агенты с веществом (например, с поверхностью семени). Такие агенты используют для объединения бактерий с носителями, которые могут содержать другие соединения (например, средства для контроля, которые не являются биологическими), с получением композиции покрытия. Такие композиции помогают создавать покрытия вокруг растения или семени для поддержания контакта микроорганизма и других агентов с растением или частью растения. В одном из вариантов осуществления связывающие вещества выбраны из группы, состоящей из: альгината, камедей, крахмалов, лецитинов, формононетина, поливинилового спирта, формононетината щелочного металла, гесперетина, поливинилацетата, цефалинов, гуммиарабика, ксантановой камеди, минерального масла, полиэтиленгликоля (ПЭГ), поливинилпирролидона (PVP), арабиногалактана, метилцеллюлозы, ПЭГ-400, хитозана, полиакриламида, полиакрилата, полиакрилонитрила, глицерина, триэтиленгликоля, винилацетата, геллановой камеди, полистирола, поливинила, карбоксиметилцеллюлозы, камеди гхатти и блок-сополимеров полиоксиэтилена и полиоксибутилена.
[00227] В некоторых вариантах осуществления связывающие вещества могут представлять собой, например, воск, такой как карнаубский воск, пчелиный воск, китайский воск, шеллачный воск, спермацетовый воск, канделильский воск, касторовый воск, воск оурикури и воск из рисовых отрубей, полисахарид (например, крахмал, декстрины, мальтодекстрины, альгинат и хитозаны), жир, масло, белок (например, желатин и зеины), аравийские камеди и шеллаки. Связывающие вещества могут представлять собой соединения неприродного происхождения, например, полимеры, сополимеры и воски. Например, неограничивающие примеры полимеров, которые могут быть использованы в качестве связывающего вещества, включают: поливинилацетаты, поливинилацетатные сополимеры, этиленвинилацетатные (EVA) сополимеры, поливиниловые спирты, сополимеры поливиниловых спиртов, целлюлозы (например, этилцеллюлозы, метилцеллюлозы, гидроксиметилцеллюлозы, гидроксипропилцеллюлозы и карбоксиметилцеллюлозы), поливинилпирролидоны, винилхлорид, сополимеры винилиденхлорида, лигносульфонаты кальция, акриловые сополимеры, поливинилакрилаты, полиэтиленоксид, ациламидные полимеры и сополимеры, полигидроксиэтилакрилат, метилакриламидные мономеры и полихлоропрен.
[00228] В некоторых примерах один или более из связывающих веществ, противогрибковых агентов, агентов, регулирующих рост, и пестицидов (например, инсектицид) представляют собой соединения неприродного происхождения (например, в любой комбинации). Дополнительные примеры приемлемых в сельском хозяйстве носителей включают диспергаторы (например, поливинилпирролидон/винилацетат PVPIVA S-630), поверхностно-активные вещества, вяжущие и наполнители.
[00229] Препарат также может содержать поверхностно-активное вещество. Неограничивающие примеры поверхностно-активных веществ включают смеси азота и поверхностно-активного вещества, такие как Prefer 28 (Cenex), Surf-N(US), Inhance (Brandt), P-28 (Wilfarm) и Patrol (Helena); этерифицированные растительные масла включают Sun-It II (AmCy), MSO (UAP), Scoil (Agsco), Hasten (Wilfarm) и Mes-100 (Drexel); и органосиликоновые поверхностно-активные вещества включают Silwet L77 (UAP), Silikin (Terra), Dyne-Amic (Helena), Kinetic (Helena), Sylgard 309 (Wilbur-Ellis) и Century (Precision). В одном из вариантов осуществления поверхностно-активное вещество присутствует в концентрации от 0,01 об. % до 10 об. %. В еще одном варианте осуществления поверхностно-активное вещество присутствует в концентрации от 0,1 об. % до 1 об. %.
[00230] В отдельных случаях препарат включает микробиологический стабилизатор. Такой агент может включать осушитель, который может включать любое соединение или смесь соединений, которые могут быть классифицированы как осушитель, независимо от того, используются ли соединение или соединения в таких концентрациях, что они фактически оказывают осушающее действие на жидкий инокулянт. Такие осушители идеально совместимы с используемой бактериальной популяцией и должны способствовать способности популяции микроорганизмов выживать при нанесении на семена и выживать после высушивания. Примеры подходящих осушителей включают одно или более из трегалозы, сахарозы, глицерина и метиленгликоля. Другие подходящие осушители включают, не ограничиваясь перечисленным, невосстанавливающие сахара и сахарные спирты (например, маннит или сорбит). Количество осушителя, вводимого в препарат, может составлять от приблизительно 5% до приблизительно 50% (масс./об.), например, от приблизительно 10% до приблизительно 40%, от приблизительно 15% до приблизительно 35% или от приблизительно 20% до приблизительно 30%. В некоторых случаях предпочтительно, чтобы препарат содержал такие агенты, как фунгицид, антибактериальный агент, гербицид, нематицид, инсектицид, регулятор роста растений, родентицид, бактерицид или питательное вещество. В некоторых примерах агенты могут включать защитные средства, обеспечивающие защиту от патогенов на поверхности семян. В некоторых примерах защитные средства могут обеспечивать определенный уровень контроля над почвенными патогенами. В некоторых примерах защитные средства могут быть эффективными преимущественно на поверхности семян.
[00231] В некоторых примерах фунгицид может включать соединение или агент, химический или биологический, который может ингибировать рост гриба или уничтожать гриб. В некоторых примерах фунгицид может включать соединения, которые могут быть фунгистатическими или фунгицидными. В некоторых примерах фунгицид может представлять собой защитное средство, или агенты, эффективные преимущественно на поверхности семян, обеспечивая защиту от патогенов на поверхности семян и обеспечивая некоторый уровень контроля над почвенными патогенами. Неограничивающие примеры защитных фунгицидов включают каптан, манеб, тирам или флудиоксонил.
[00232] В некоторых примерах фунгицид может представлять собой системный фунгицид, который может всасываться появляющимся проростком и ингибировать или уничтожать гриб внутри тканей растения-хозяина. Системные фунгициды, используемые для обработки семян, включают, не ограничиваясь перечисленным, следующие: азоксистробин, карбоксин, мефеноксам, металаксил, тиабендазол, трифлоксистробин и различные триазольные фунгициды, включая дифеноконазол, ипконазол, тебуконазол и тритиконазол. Мефеноксам и металаксил в основном используются для борьбы с водными плесневыми грибами Pythium и Phytophthora. Некоторые фунгициды являются более предпочтительными, в зависимости от вида растения, либо из-за незначительных различий в чувствительности патогенных видов грибов, либо из-за различий в распределении фунгицидов или чувствительности растений. В некоторых примерах фунгицид может представлять собой средство биологической борьбы, такое как бактерия или грибок. Такие организмы могут паразитировать на патогенных грибах или секретировать токсины или другие вещества, которые могут уничтожать или иным образом препятствовать росту грибов. Любой тип фунгицидов, особенно фунгициды, обычно используемые на растениях, могут быть использованы в качестве средства для контроля в составе для семян.
[00233] В некоторых примерах композиция для покрытия семян содержит средство для контроля, обладающее антибактериальными свойствами. В одном из вариантов осуществления средство для контроля с антибактериальными свойствами выбрано из соединений, описанных в других местах настоящего документа. В еще одном варианте осуществления соединение представляет собой стрептомицин, окситетрациклин, оксолиновую кислоту или гентамицин. Другие примеры антибактериальных соединений, которые могут быть использованы в составе композиции для покрытия семян, включают соединения, основанные на дихлорфене и полуформале бензилового спирта (Proxel® от ICI или Acticide® RS от Thor Chemie и Kathon® MK 25 от Rohm & Haas), и производные изотиазолинона такие как алкилизотиазолиноны и бензизотиазолиноны (Acticide® MBS от Thor Chemie).
[00234] В некоторых примерах регулятор роста выбран из группы, состоящей из: абсцизовой кислоты, амидохлора, анцимидола, 6-бензиламинопурина, брассинолида, бутралина, хлормеквата (хлормекватхлорида), холинхлорида, цикланилида, даминозида, дикегулака, диметипина, 2,6-диметилпуридина, этефона, флуметралина, флурпримидола, флутиацета, форхлорфенурона, гибберелловой кислоты, инабенфида, индол-3-уксусной кислоты, гидразида малеиновой кислоты, мефлуидида, мепиквата (мепикватхлорида), нафтилуксусной кислоты, N-6-бензиладенина, паклобутразола, прогексадион тритиофосфата, 2,3,5-три-иодбензойной кислоты, тринексапак-этила и униконазола. Дополнительные неограничивающие примеры регуляторов роста включают брассиностероиды, цитокинины (например, кинетин и зеатин), ауксины (например, индолилуксусную кислоту и индолилацетиласпартат), флавоноиды и изофлаваноиды (например, формононетин и диосметин), фитоалексины (например, глицеоллин) и фитоалексин-индуцирующие олигосахариды (например, пектин, хитин, хитозан, полигалакуроновая кислота и олигогалактуроновая кислота), и гибеллерины. Такие агенты идеально совместимы с сельскохозяйственными семенами или проростками, на которые наносят препарат (например, они не должны оказывать пагубного действия на рост или здоровье растения). Кроме того, агент, в идеале не вызывает угроз безопасности при применении у человека, животных или в промышленности (например, отсутствуют угрозы безопасности, или соединение является достаточно неустойчивым, чтобы товарный растительный продукт, полученный из растения, содержал незначительные количества соединения).
[00235] Некоторые примеры средств биологической борьбы-антагонистов нематод включают ARF18; 30 Arthrobotrys spp.; Chaetomium spp.; Cylindrocarpon spp.; Exophilia spp.; Fusarium spp.; Gliocladium spp.; Hirsutella spp.; Lecanicillium spp.; Monacrosporium spp.; Myrothecium spp.; Neocosmospora spp.; Paecilomyces spp.; Pochonia spp.; Stagonospora spp.; везикулярно-арбускулярные микоризные грибы, Burkholderia spp.; Pasteuria spp., Brevibacillus spp.; Pseudomonas spp.; и Rhizobacteria. Особенно предпочтительные средства биологической борьбы-антагонисты нематод включают ARF18, Arthrobotrys oligospora, Arthrobotrys dactyloides, Chaetomium globosum, Cylindrocarpon heteronema, Exophilia jeanselmei, Exophilia pisciphila, Fusarium aspergilus, Fusarium solani, Gliocladium catenulatum, Gliocladium roseum, Gliocladium vixens, Hirsutella rhossiliensis, Hirsutella minnesotensis, Lecanicillium lecanii, Monacrosporium drechsleri, Monacrosporium gephyropagum, Myrotehcium verrucaria, Neocosmospora vasinfecta, Paecilomyces lilacinus, Pochonia chlamydosporia, Stagonospora heteroderae, Stagonospora phaseoli, везикулярно-арбускулярные микоризные грибы, Burkholderia cepacia, Pasteuria penetrans, Pasteuria thornei, Pasteuria nishizawae, Pasteuria ramosa, Pastrueia usage, Brevibacillus laterosporus strain G4, Pseudomonas fluorescens и Rhizobacteria.
[00236] В качестве примера, питательные вещества могут быть выбраны из группы, состоящей из азотного удобрения, включая, не ограничиваясь перечисленным, мочевину, нитрат аммония, сульфат аммония, растворы азота, полученные не под давлением, аммиачную воду, безводный аммиак, тиосульфат аммония, покрытую серой мочевин, формальдегидмочевину, IBDU (изобутилидендимочевину), мочевину с полимерным покрытием, нитрат кальция, формальдегидмочевину и метиленмочевину, фосфорные удобрения, такие как диаммонийфосфат, моноаммонийфосфат, полифосфат аммония, концентрированный суперфосфат и тройной суперфосфат, и калийные удобрения, такие как хлорид калия, сульфат калия, сульфат калия-магния, нитрат калия. Такие композиции могут существовать в виде свободных солей или ионов в композиции покрытия семян. В качестве альтернативы, питательные вещества/удобрения могут быть связанными в комплекс или хелат, чтобы обеспечить длительное высвобождение с течением времени.
[00237] Некоторые примеры родентицидов могут включать вещества, выбранные из группы, состоящей из 2-изовалерилиндан-1,3-диона, 4-(хиноксалин-2-иламино)бензолсульфонамида, альфа-хлоргидрина, фосфата алюминия, aльфа-нафтилтиомочевины, триоксида мышьяка, карбоната бария, бистиосеми, бродифакума, бромадиолона, брометалина, цианида кальция, хлоралозы, хлорофацинона, холекальциферола, кумахлора, кумафурила, куматетралила, кримидина, дифенакума, дифетиалона, дифацинона, эргокальциферола, флокумафена, фторацетамида, флупропадина, флупропадина гидрохлорида, цианида водорода, иодметана, линдана, фосфида магния, метилбромида, норбормида, фосацетима, фосфина, фосфора, пиндона, арсенита калия, пиринурона, сциллирозида, арсенита натрия, цианида натрия, фторацетата натрия, стрихнина, сульфата таллия, варфарина и фосфида цинка.
[00238] В жидкой форме, например, растворов или суспензий, бактериальные популяции могут быть смешаны или суспендированы в воде или в водных растворах. Подходящие жидкие разбавители или носители включают воду, водные растворы, нефтяные дистилляты или другие жидкие носители.
[00239] Твердые композиции могут быть получены путем диспергирования бактериальных популяций в и на подходящим образом разделенном твердом носителе, таком как торф, пшеница, отруби, вермикулит, глина, тальк, бентонит, диатомовая земля, фуллерова земля, пастеризованная почва и тому подобное. Когда такие препараты используются в виде смачиваемых порошков, могут быть использованы биологически совместимые диспергирующие агенты, такие как неионные, анионные, амфотерные или катионные диспергирующие и эмульгирующие агенты.
[00240] Твердые носители, используемые при приготовлении препаратов, включают, например, минеральные носители, такие как каолиновая глина, пирофиллит, бентонит, монтмориллонит, диатомовая земля, кислая светлая почва, вермикулит и перлит, и неорганические соли, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевина, хлорид аммония и карбонат кальция. Также могут быть использованы органические мелкие порошки, такие как пшеничная мука, пшеничные отруби и рисовые отруби. Жидкие носители включают растительные масла, такие как соевое масло и хлопковое масло, глицерин, этиленгликоль, полиэтиленгликоль, пропиленгликоль, полипропиленгликоль и т.д.
Применение бактериальных популяций на сельскохозяйственных культурах
[00241] Композиция бактерий или бактериальной популяции, описанная в настоящем документе, может применяться в борозде, в тальке или в виде состава для обработки семян. Композиция может применяться к массе семян в виде нефасованной партии, в виде небольшой нефасованной партии, в пакете или в тальке.
[00242] Сеятель может посеять обработанные семена и выращивать сельскохозяйственную культуру в соответствии с традиционными способами, двухстрочным посевом или способами, не требующими обработки почвы. Семена могут быть распределены с использованием контрольного высевающего аппарата или отдельного высевающего аппарата. Семена также могут быть распределены с помощью сжатого воздуха или вручную. Посев семян может быть выполнен с использованием технологий переменного нормирования. Кроме того, применение бактерий или бактериальных популяций, описанных в настоящем документе, может быть осуществлено с использованием технологий переменного нормирования. В некоторых примерах бактерии могут быть применены к семенам кукурузы, сои, канолы, сорго, картофеля, риса, овощей, зерновых, псевдозерновых и масличных культур. Примеры зерновых могут включать ячмень, фонио, овес, щетинник, рожь, африканское просо, сорго, полбу, теф, тритикале и пшеницу. Примеры псевдозерновых могут включать бросимум напитковый, гречиху обыкновенную, рогоз, чиа, лен, амарантовую крупу, босцию сенегальскую, киноа и кунжут. В некоторых примерах семена могут быть генетически модифицированными организмами (ГМО), не ГМО, органическими или обычными.
[00243] Для обработки сельскохозяйственных культур могут быть дополнительно использованы добавки, такие как микроудобрение, PGR (регулятор роста растений), гербицид, инсектицид и фунгицид. Примеры добавок включают средства защиты растений, такие как инсектициды, нематициды, фунгициды, усилители, такие как красители, полимеры, агенты для гранулирования, прайминг и дезинфицирующие средства, и другие агенты, такие как инокулянт, PGR, смягчитель и микроэлементы. PGR могут представлять собой природные или синтетические растительные гормоны, влияющие на рост корней, цветение или удлинение стебля. PGR могут включать ауксины, гиббереллины, цитокинины, этилен и абсцизовую кислоту (АБК).
[00244] Композиция может быть применена в борозде в сочетании с жидким удобрением. В некоторых примерах жидкое удобрение может храниться в резервуарах. NPK удобрения содержат макроэлементы натрий, фосфор и калий.
[00245] Композиция может улучшать качества растений, например, стимулировать рост растений, поддерживать высокое содержание хлорофилла в листьях, увеличивать количество плодов или семян и увеличивать массу плодов или семян. Способы согласно настоящему изобретению могут быть использованы для введения или улучшения одного или более из множества желательных качеств. Примеры качеств, которые могут быть введены или улучшены, включают: биомассу корня, длину корня, высоту, длину побега, число листьев, эффективность водопотребления, общую биомассу, урожайность, размер плодов, размер зерна, интенсивность фотосинтеза, засухоустойчивость, жароустойчивость, солеустойчивость, устойчивость к стрессу, вызванному низким уровнем азота, эффективность использования азота, устойчивость к стрессу, вызванному нематодами, устойчивость к грибковому патогену, устойчивость к бактериальному патогену, устойчивость к вирусному патогену, уровень метаболита, модуляцию уровня метаболита и экспрессию протеома. Желательные качества, включая высоту, общую биомассу, биомассу корня и/или побегов, всхожесть семян, выживаемость проростков, эффективность фотосинтеза, интенсивность транспирации, количество или массу семян/плодов, урожайность зерна или плодов растения, содержание хлорофилла в листьях, интенсивность фотосинтеза, длину корня или любую их комбинацию, могут быть использованы для измерения роста и сравнены со скоростью роста контрольных сельскохозяйственных растений (например, растений без введенных и/или улучшенных качеств), выращиваемых в идентичных условиях. В некоторых примерах желательные качества, включая высоту, общую биомассу, биомассу корня и/или побегов, всхожесть семян, выживаемость проростков, эффективность фотосинтеза, интенсивность транспирации, количество или массу семян/плодов, урожайность зерна или плодов растения, содержание хлорофилла в листьях, интенсивность фотосинтеза, длину корня или любую их комбинацию, могут быть использованы для измерения роста и сравнены со скоростью роста контрольных сельскохозяйственных растений (например, растений без улучшенных и/или введенных качеств), выращиваемых в схожих условиях.
[00246] Агрономическое качество растения-хозяина может включать, не ограничиваясь перечисленным, следующие: измененное содержание масла, измененное содержание белка, измененная композиция углеводов в семенах, измененная композиция масла семян и измененная композиция белков семян, химическая устойчивость, устойчивость к холоду, задержка старения, устойчивость к болезням, засухоустойчивость, масса колоса, улучшение роста, улучшение здоровья, жароустойчивость, устойчивость к гербицидам, устойчивость к травоядным животным, улучшенная азотфиксация, улучшенное использование азота, улучшенная архитектура корня, улучшенная эффективность использования воды, увеличение биомассы, увеличение длины корня, увеличение массы семян, увеличение длины побега, повышенная урожайность, повышенная урожайность в условиях нехватки воды, масса зерна, содержание влаги в зерне, металлоустойчивость, количество колосьев, количество зерен на колос, количество стручков, улучшение питания, устойчивость к патогенам, устойчивость к сельскохозяйственным вредителям, улучшение фотосинтезирующей способности, солеустойчивость, задержка старения листьев, улучшение мощности, увеличение сухой массы зрелых семян, увеличение сырой массы зрелых семян, увеличение количества зрелых семян на растение, увеличение содержания хлорофилла, увеличение количества стручков на растение, увеличение длины стручков на растение, уменьшение количества увядших листьев на растение, уменьшение количества значительно увядших листьев на растение и увеличение количества неувядших листьев на растение, обнаружимая модуляция уровня метаболита, обнаружимая модуляция уровня транскрипта и обнаружимая модуляция протеома, по сравнению с растением той же линии, выращенным из семян без использования указанного препарата для обработки семян.
[00247] В некоторых случаях растения инокулируют бактериями или бактериальными популяциями, которые выделены из того же вида растений, что и растительный элемент инокулируемого растения. Например, бактерия или бактериальная популяция, которая обычно встречается у одного сорта маиса (кукурузы), связана с растительным элементом растения другого сорта маиса, который в своем естественном состоянии лишен указанных бактерий и бактериальных популяций. В одном из вариантов осуществления бактерии и бактериальные популяции получают из растения родственного вида в качестве растительного элемента инокулируемого растения. Например, бактерии и популяции бактерий, которые обычно встречаются у Zea diploperennis (Iltis et al.), (Diploperennial teosinte), применяют к маису (кукурузе), или наоборот. В некоторых случаях растения инокулируют бактериями и бактериальными популяциями, гетерологичными растительному элементу инокулируемого растения. В одном из вариантов осуществления бактерии и бактериальные популяции получают из растения другого вида. Например, бактерии и бактериальные популяции, которые обычно встречаются у двудольных растений, применяют к однодольному растению (например, для инокуляции кукурузы бактериями и бактериальными популяциями, полученными из соевых бобов), или наоборот. В других случаях бактерии и бактериальные популяции, которые должны быть инокулированы на растение, получают из видов, родственных инокулируемому растению. В одном из вариантов осуществления бактерии и бактериальные популяции получены из родственного таксона, например, из родственных видов. Растение другого вида может представлять собой сельскохозяйственное растение. В еще одном варианте осуществления бактерии и бактериальные популяции являются частью разработанной композиции, инокулированной в любой элемент растения-хозяина.
[00248] В некоторых примерах бактерия или бактериальная популяция является экзогенной, где бактерии и бактериальная популяция выделены из растения, отличного от инокулиуемого растения. Например, в одном из вариантов осуществления бактерии или бактериальная популяция могут быть выделены из другого растения того же вида, что и инокулируемое растение. В некоторых случаях бактерии или бактериальная популяция могут быть выделены из вида, родственного инокулируемому растению.
[00249] В некоторых примерах бактерии и бактериальные популяции, описанные в настоящем документе, способны перемещаться из одного типа ткани в другой. Например, обнаружение и выделение бактерий и бактериальных популяций в зрелых тканях растений согласно настоящему изобретению после нанесения покрытия на внешнюю поверхность семян демонстрирует их способность перемещаться с внешней поверхности семени в вегетативные ткани созревающего растения. Следовательно, в одном из вариантов осуществления популяция бактерий и бактериальных популяций способна перемещаться с внешней поверхности семени в вегетативные ткани растения. В одном из вариантов осуществления бактерии и бактериальные популяции, нанесенные в качестве покрытия на семя растения, способны при прорастании семени в состояние вегетации сосредотачиваться в другой ткани растения. Например, бактерии и бактериальные популяции могут быть способны сосредотачиваться в любой из тканей растения, включая корень, придаточный корень, зародышевый корень, корневой волосок, побег, лист, цветок, почку, метелку, меристему, пыльцу, пестик, завязь, тычинку, плод, ползучий побег, корневище, узелок, клубень, трихом, устьичные клетки, гидатоду, лепесток, чашелистик, чешую, ость, сосудистый камбий, флоэму и ксилему. В одном из вариантов осуществления бактерии и бактериальные популяции способны сосредотачиваться в корне и/или корневых волосках растения. В еще одном варианте осуществления бактерии и бактериальные популяции способны сосредотачиваться в фотосинтезирующих тканях, например, листьях и побегах растения. В других случаях бактерии и бактериальные популяции сосредотачиваются в проводящих тканях растения, например, в ксилеме и флоэме. В еще одном варианте осуществления бактерии и бактериальные популяции способны сосредотачиваться в репродуктивных тканях (цветке, пыльце, пестике, завязи, тычинке, плоде) растения. В еще одном варианте осуществления бактерии и бактериальные популяции способны сосредотачиваться в корне, побегах, листьях и репродуктивных тканях растения. В еще одном варианте осуществления бактерии и бактериальные популяции колонизируют плод или ткань семени растения. В еще одном варианте осуществления бактерии и бактериальные популяции способны колонизировать растение таким образом, что они присутствуют на поверхности растения (т. е. их присутствие может быть обнаружено на внешней поверхности растения или в эписфере растения). В других вариантах осуществления бактерии и бактериальные популяции способны сосредотачиваться практически во всех или во всех тканях растения. В отдельных вариантах осуществления бактерии и бактериальные популяции не сосредотачиваются в корне растения. В других случаях бактерии и бактериальные популяции не сосредотачиваются в фотосинтезирующих тканях растения.
[00250] Эффективность композиций также может быть оценена путем измерения относительной зрелости сельскохозяйственной культуры или единиц накопления тепла (CHU). Например, бактериальная популяция может быть применена к кукурузе, и рост кукурузы может быть оценен согласно относительной зрелости зерна кукурузы или времени, когда зерно кукурузы достигает максимальной массы. Единицы накопления тепла (CHU) также могут быть использованы для прогнозирования созревания урожая кукурузы. CHU определяют количество накопленного тепла путем измерения максимальных суточных температур в ходе роста растений.
[00251] Например, бактерии могут сосредотачиваться в любой из тканей растения, включая корень, придаточный корень, зародышевый корень, корневой волосок, побег, лист, цветок, почку, метелку, меристему, пыльцу, пестик, завязь, тычинку, плод, ползучий побег, корневище, узелок, клубень, трихом, устьичные клетки, гидатоду, лепесток, чашелистик, чешую, ость, сосудистый камбий, флоэму и ксилему. В еще одном варианте осуществления бактерии или бактериальная популяция способны сосредотачиваться в фотосинтезирующих тканях, например, листьях и побегах растения. В других случаях бактерии и бактериальные популяции сосредотачиваются в проводящих тканях растения, например, в ксилеме и флоэме. В еще одном варианте осуществления бактерии или бактериальная популяция способны сосредотачиваться в репродуктивных тканях (цветке, пыльце, пестике, завязи, тычинке или плоде) растения. В еще одном варианте осуществления бактерии и бактериальные популяции способны сосредотачиваться в корне, побегах, листьях и репродуктивных тканях растения. В еще одном варианте осуществления бактерии или бактериальная популяция колонизируют плод или ткань семени растения. В еще одном варианте осуществления бактерии или бактериальная популяция способны колонизировать растение так, что они присутствуют на поверхности растения. В еще одном варианте осуществления бактерии или бактериальная популяция способны сосредотачиваться практически во всех или во всех тканях растения. В отдельных вариантах осуществления бактерии или бактериальная популяция не сосредотачиваются в корне растения. В других случаях бактерии и бактериальные популяции не сосредотачиваются в фотосинтезирующих тканях растения.
[00252] Эффективность бактериальных композиций, применяемых к сельскохозяйственным культурам, может быть оценена путем измерения различных характеристик роста сельскохозяйственных культур, включая, не ограничиваясь перечисленным, норму посадки, мощность всходов, силу корней, засухоустойчивость, высоту растения, высушивание и натурную массу.
Виды растений
[00253] Способы и бактерии, описанные в настоящем документе, подходят для любого из множества растений, таких как растения родов Hordeum, Oryza, Zea и Triticeae. Другие неограничивающие примеры подходящих растений включают мхи, лишайники и водоросли. В некоторых случаях растения имеют экономическую, социальную и/или экологическую ценность, такие как продовольственные культуры, текстильные культуры, масличные культуры, растения в лесной или целлюлозно-бумажной промышленности, сырье для производства биотоплива и/или декоративные растения. В некоторых примерах растения могут использоваться для производства экономически ценных продуктов, таких как зерно, кормовая мука, крахмал, сироп, мука, масло, пленка, упаковка, нутрицевтический продукт, мякоть, корм для животных, корм для рыб, основной материал для промышленных химикатов, зерновой продукт, обработанный продукт питания для человека, сахар, спирт и/или белок. Неограничивающие примеры сельскохозяйственных культур включают маис, рис, пшеницу, ячмень, сорго, просо, овес, тритикале, гречиху обыкновенную, сахарную кукурузу, сахарный тростник, лук, томаты, клубнику и спаржу.
[00254] В некоторых примерах растения, которые могут быть получены или улучшены с использованием способов и композиции, раскрытых в настоящем документе, могут включать растения, которые являются важными или представляют интерес для сельского хозяйства, садоводства, биомассы для производства молекул биотоплива и других химических веществ и/или лесного хозяйства. Некоторые примеры этих растений могут включать ананас, банан, кокос, лилию, чину посевную, люцерну, томатильо, дыню, нут, цикорий, клевер, кудрявую капусту, чечевицу, сою, табак, картофель, сладкий картофель, редьку, капусту, рапс, яблони, виноград, хлопок, подсолнечник, арабидопсис, канолу, цитрусовые (включая апельсин, мандарин, кумкват, лимон, лайм, грейпфрут, танжерин, танжело, цитрон и помело), перец, фасоль, латук, Panicum virgatum (просо прутьевидное), Sorghum bicolor (сорго суданское), Miscanthus giganteus (мискантус), Saccharum sp. (энергетический тростник), Populus balsamifera (тополь), Zea mays (кукуруза), Glycine max (соя), Brassica napus (канола), Triticum aestivum (пшеница), Gossypium hirsutum (хлопок), Oryza sativa (рис), Helianthus annuus (подсолнечник), Medicago sativa (люцерна), Beta vulgaris (сахарная свекла), Pennisetum glaucum (африканское просо), Panicum spp. Sorghum spp., Miscanthus spp., Saccharum spp., Erianthus spp., Populus spp., Secale cereale (рожь), Salix spp. (ива), Eucalyptus spp. (эвкалипт), Triticosecale spp. (гибрид triticum - пшеницы и ржи), бамбук, Carthamus tinctorius (сафлор), Jatropha curcas (ятрофа), Ricinus communis (клещевина), Elaeis guineensis (масличная пальма), Phoenix dactylifera (финиковая пальма), Archontophoenix cunninghamiana (королевская пальма), Syagrus romanzoffiana (сиагрус Румянцева), Linum usitatissimum (лен), Brassica juncea, Manihot esculenta (кассава), Lycopersicon esculentum (томат), Lactuca saliva (латук), Musa paradisiaca (банан), Solanum tuberosum (картофель), Brassica oleracea (брокколи, цветная капуста, брюссельская капуста), Camellia sinensis (чай), Fragaria ananassa (клубника), Theobroma cacao (какао), Coffea arabica (кофе), Vitis vinifera (виноград), Ananas comosus (ананас), Capsicum annum (острый и сладкий перец), Allium cepa (лук), Cucumis melo (дыня), Cucumis sativus (огурец), Cucurbita maxima (тыква), Cucurbita moschata (тыква), Spinacea oleracea (шпинат), Citrullus lanatus (арбуз), Abelmoschus esculentus (окра), Solanum melongena (баклажан), Papaver somniferum (опийный мак), Papaver orientale, Taxus baccata, Taxus brevifolia, Artemisia annua, Cannabis saliva, Camptotheca acuminate, Catharanthus roseus, Vinca rosea, Cinchona officinalis, Coichicum autumnale, Veratrum californica, Digitalis lanata, Digitalis purpurea, Dioscorea spp., Andrographis paniculata, Atropa belladonna, Datura stomonium, Berberis spp., Cephalotaxus spp., Ephedra sinica, Ephedra spp., Erythroxylum coca, Galanthus wornorii, Scopolia spp., Lycopodium serratum (Huperzia serrata), Lycopodium spp., Rauwolfia serpentina, Rauwolfia spp., Sanguinaria canadensis, Hyoscyamus spp., Calendula officinalis, Chrysanthemum parthenium, Coleus forskohlii, Tanacetum parthenium, Parthenium argentatum (гваюла), Hevea spp. (гевея), Mentha spicata (мята), Mentha piperita (мята), Bixa orellana, Alstroemeria spp., Rosa spp. (роза), Dianthus caryophyllus (carnation), Petunia spp. (петуния), Poinsettia pulcherrima (пуансеттия), Nicotiana tabacum (табак), Lupinus albus (люпин), Uniola paniculata (овес), Hordeum vulgare (ячмень) и Lolium spp. (рожь).
[00255] В некоторых примерах может быть использовано однодольное растение. Однодольные растения принадлежат к порядкам Alismatales, Arales, Arecales, Bromeliales, Commelinales, Cyclanthales, Cyperales, Eriocaulales, Hydrocharitales, Juncales, Lilliales, Najadales, Orchidales, Pandanales, Poales, Restionales, Triuridales, Typhales и Zingiberales. Растения, принадлежащие к классу Gymnospermae, представляют собой Cycadales, Ginkgoales, Gnetales и Pinales. В некоторых примерах однодольное растение может быть выбрано из группы, состоящей из маиса, риса, пшеницы, ячменя и сахарного тростника.
[00256] В некоторых примерах может быть использовано двудольное растение, в том числе растения, принадлежащие к отрядам Aristochiales, Asterales, Batales, Campanulales, Capparales, Caryophyllales, Casuarinales, Celastrales, Cornales, Diapensales, Dilleniales, Dipsacales, Ebenales, Ericales, Eucomiales, Euphorbiales, Fabales, Fagales, Gentianales, Geraniales, Haloragales, Hamamelidales, Middles, Juglandales, Lamiales, Laurales, Lecythidales, Leitneriales, Magniolales, Malvales, Myricales, Myrtales, Nymphaeales, Papeverales, Piperales, Plantaginales, Plumb aginales, Podostemales, Polemoniales, Polygalales, Polygonales, Primulales, Proteales, Rafflesiales, Ranunculales, Rhamnales, Rosales, Rubiales, Salicales, Santales, Sapindales, Sarraceniaceae, Scrophulariales, Theales, Trochodendrales, Umbellales, Urticales и Violates. В некоторых примерах двудольное растение может быть выбрано из группы, состоящей из хлопка, сои, перца и томата.
[00257] В некоторых случаях подлежащее улучшению растение не всегда с легкостью поддается экспериментальным условиям. Например, выращивание сельскохозяйственного растения в достаточной степени, чтобы была возможна оценка улучшенного качества последовательно в течение нескольких итераций, может занять слишком много времени. Соответственно, первое растение, из которого первоначально выделены бактерии, и/или множество растений, к которым применяют генетически модифицированные бактерии, может представлять собой модельное растение, такое как растение, лучше поддающееся оценке в желаемых условиях. Неограничивающие примеры модельных растений включают Setaria, Brachypodium и Arabidopsis. Способность бактерий, выделенных в соответствии со способом согласно изобретению с использованием модельного растения, затем может быть применена к растению другого типа (например, к сельскохозяйственному растению), чтобы подтвердить придание улучшенного качества.
[00258] Качества, которые могут быть улучшены способами, раскрытыми в настоящем документе, включают любую наблюдаемую характеристику растения, включая, например, скорость роста, высоту, массу, цвет, вкус, запах, изменения в продукции растением одного или более соединений (включая, например, метаболиты, белки, лекарственные вещества, углеводы, масла и любые другие соединения). Предусматривается также отбор растений на основе генотипической информации (например, включая профиль экспрессии растительных генов в ответ на бактерии или идентификацию наличия генетических маркеров, таких как маркеры, связанные с повышенной азотфиксацией). Растения также могут быть отобраны на основе отсутствия, подавления или ингибирования определенного признака или качества (такого как нежелательный признак или качество), а не на основе наличия определенного признака или качество (такого как желательный признак или качество).
ПРИМЕРЫ
[00259] В приведенных в настоящем документе примерах описаны способы выделения бактерий, анализа бактерий и растений и улучшения качеств растений. Примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие изобретение каким-либо образом.
Пример 1. Выделение микроорганизмов из растительной ткани
[00260] Плодородный слой почвы был получен из различных сельскохозяйственных районов Центральной Калифорнии. Было собрано двадцать видов почв с различными структурными характеристиками, в том числе тяжелая глина, торфянистый глинистый суглинок, пылеватая глина и песчаный суглинок. В каждый вид почвы были посеяны семена различной полевой кукурузы, сладкой кукурузы, негибридной кукурузы и томатов, как показано в таблице 1.
Таблица 1. Тип сельскохозяйственной культуры и сорта, посаженные в почву с различными характеристиками
[00261] Растения выкапывали через 2-4 недели выращивания, и избыток почвы удаляли с поверхности корней деионизированной водой. После удаления почвы поверхность растений стерилизовали дезинфицирующим раствором и энергично промывали в стерильной воде. Очищенный отрезок корня размером 1 см отрезали от растения и помещали в забуференный фосфатом физиологический раствор, содержащий стальные шарики размером 3 мм. Получали суспензию путем энергичного встряхивания раствора с помощью TissueLyser II от Qiagen.
[00262] Суспензию корня и физиологического раствора разводили и инокулировали на различные типы питательных сред для выделения ризосферных, эндофитных, эпифитных и других связанных с растением микроорганизмов. Агаровые среды R2A и Nfb использовали для получения одиночных колоний, а полутвердые скошенные среды Nfb использовали для получения популяций азотфиксирующих бактерий. Через 2-4 недели инкубации в полутвердых скошенных средах Nfb популяции микроорганизмов собирали и делали посевы штрихами для получения одиночных колоний на агаре R2A, как показано на фигурах 1A-B. Одиночные колонии повторно суспендировали в смеси R2A и глицерина, подвергали анализу методом ПЦР и замораживали при -80°C для последующего анализа. Было получено примерно 1000 отдельных колоний, которые были обозначены как «выделенные микроорганизмы».
[00263] Затем изоляты подвергали ПЦР-скринингу колоний для выявления присутствия гена nifH с целью идентификации диазотрофов. Для исследования присутствия кластера nif в каждом изоляте использовали ранее описанный набор праймеров Ueda 19F/388R, который, как было показано, позволяет обнаруживать более 90% диазотрофов в ходе скрининга (Ueda et al. 1995; J. Bacteriol. 177: 1414-1417). Одиночные колонии очищенных изолятов отбирали, повторно суспендировали в PBS и использовали в качестве матрицы для ПЦР колоний, как показано на фигуре 2. Колонии изолятов, которые давали позитивные полосы в ПЦР, подвергали повторному посеву штрихами, и процесс ПЦР и повторного посева штрихами колонии повторяли дважды, чтобы предотвратить ложноположительную идентификацию диазотрофов. Очищенные изоляты затем были названы «микроорганизмами-кандидатами».
Пример 2. Определение характеристик выделенных микроорганизмов
Секвенирование, анализ и филогенетическая характеристика
[00264] Для создания предварительных филогенетических идентификаторов для выделенных и кандидатных микроорганизмов использовали секвенирование 16S рДНК с набором праймеров 515f-806r (см., например, Vernon et al.; BMC Microbiol. 23 декабря 2002 г.;2:39.). Микроорганизмы включают различные роды, в том числе: Enterobacter, Burkholderia, Klebsiella, Bradyrhizobium, Rahnella, Xanthomonas, Raoultella, Pantoea, Pseudomonas, Brevundimonas, Agrobacterium и Paenibacillus, как показано в таблице 2.
Таблица 2. Разнообразие микроорганизмов, выделенных из растений томата, по данным глубокого секвенирования 16S рДНК.
[00265] Затем геномы 39 микроорганизмов-кандидатов были секвенированы с использованием платформы Illumina Miseq. Геномную ДНК из чистых культур экстрагировали с использованием мини-набора QIAmp DNA (QIAGEN), а библиотеки тотальной ДНК для секвенирования готовили через стороннего поставщика (SeqMatic, Hayward). Затем осуществляли сборку генома с помощью конвейера A5 (Tritt et al. 2012; PLoS One 7(9):e42304). Гены были идентифицированы и аннотированы, и гены, связанные с регуляцией и экспрессией азотфиксации, были отмечены в качестве мишеней для мутагенеза.
Транскриптомное профилирование микроорганизмов-кандидатов
[00266] Было проведено транскриптомное профилирование штамма CI010 для идентификации промоторов, активных в присутствии азота окружающей среды. Штамм CI010 культивировали в среде определенного состава, не содержащей азота, с добавкой 10 мМ глутамина. Из этих культур экстрагировали тотальную РНК (набор QIAGEN RNeasy) и подвергали секвенированию RNASeq с помощью Illumina HiSeq (SeqMatic, Фримонт, Калифорния). Чтения секвенирования картировали с данными генома CI010 с использованием Geneious, и были идентифицированы высокоэкспрессируемые гены под контролем проксимальных транскрипционных промоторов. В таблицах 3A-C перечислены гены и их относительный уровень экспрессии, измеренный с помощью секвенирования RNASeq тотальной РНК. Последовательности проксимальных промоторов записывали для использования в мутагенезе путей nif, путей, связанных с использованием азота, или других генов с желаемым уровнем экспрессии.
Оценка удобства генетического манипулирования
[00267] Микроорганизмы-кандидаты были охарактеризованы на основе трансформируемости и удобства генетического манипулирования. Во-первых, определяли оптимальное использование источника углерода по росту на небольшой панели соответствующих сред, а также по кривой роста как в среде без азота, так и в обогащенной среде. Во-вторых, определяли естественную устойчивость к антибиотикам каждого штамма путем точечного посева и выращивания в жидкой культуре, содержащей панель антибиотиков, используемых в качестве селективных маркеров мутагенеза. В-третьих, проверяли каждый штамм на его трансформируемость путем электропорации набора плазмид. Набор плазмид включает комбинированную экспансию семи точек начала репликации, т. е. p15a, pSC101, CloDF, colA, RK2, pBBR1 и pRO1600, и четырех маркеров устойчивости к антибиотикам, т. е. CmR, KmR, SpecR и TetR. Эта систематическая оценка совместимости точек начала репликации и маркеров устойчивости была использована для идентификации векторов для плазмидного мутагенеза у микроорганизмов-кандидатов.
Пример 3. Мутагенез микроорганизмов-кандидатов
Лямбда Red-зависимые нокауты
[00268] Было получено несколько мутантов микроорганизмов-кандидатов с использованием плазмиды pKD46 или производного, содержащего маркер устойчивости к канамицину (Datsenko et al. 2000; PNAS 97(12): 6640-6645). Нокаутные кассеты были сконструированы с гомологией 250 п.н., фланкирующей ген-мишень, и получены с помощью ПЦР с перекрывающимися праймерами. Микроорганизмы-кандидаты были трансформированы pKD46, культивированы в присутствии арабинозы для индукции экспрессии механизма лямбда Red, подготовлены для электропорации и трансформированы нокаутными кассетами с получением мутантных штаммов-кандидатов. Четыре микроорганизма-кандидата и один лабораторный штамм, Klebsiella oxytoca M5A1, были использованы для создания тринадцати мутантов-кандидатов регуляторных генов азотфиксации nifL, glnB и amtB, как показано в таблице 4.
Таблица 4. Список мутантов с одним нокаутом, созданных с помощью лямбда Red-зависимого мутагенеза
Олиго-направленный мутагенез с отбором с помощью Cas9
[00269] Олиго-направленный мутагенез использовали для нацеливания геномных изменений на ген rpoB в E.coli DH10B, и отбирали мутантов с помощью системы CRISPR-Cas. Был сконструирован мутагенный олигонуклеотид (ss1283: “G*T*T*G*ATCAGACCGATGTTCGGACCTTCcaagGTTTCGATCGGACATACGCGACCGTAGTGGGTCGGGTGTACGTCTCGAACTTCAAAGCC”, где * означает тиофосфатную связь) для придания устойчивости к рифампицину посредством мутации величиной 4 п.н. в гене rpoB. Клетки, содержащие плазмиду, кодирующую Cas9, индуцировали для экспрессии Cas9, подготавливали для электропорации и затем электропорировали как мутагенным олигонуклеотидом, так и плазмидой, кодирующей конститутивную экспрессию гидовой РНК (гРНК), нацеливающей Cas9 на расщепление последовательности rpoB дикого типа. Электропорированные клетки извлекали в неселективной среде в течение ночи, чтобы обеспечить достаточную сегрегацию полученных мутантных хромосом. После посева для отбора плазмиды, кодирующей гРНК, было показано, что две из десяти прошедших скрининг колоний содержали желаемую мутацию, в то время как остальные, как было показано, являлись «ускользнувшими» мутантами, сгенерированными посредством мутации протоспейсера в плазмиде гРНК или потери плазмиды Cas9.
Лямбда Red-зависимый мутагенез с селекцией с помощью Cas9
[00270] Мутанты микроорганизмов-кандидатов CI006 и CI010 были получены с помощью лямбда Red-зависимого мутагенеза с селекцией с помощью CRISPR-Cas. Нокаутные кассеты содержали эндогенный промотор, идентифицированный посредством транскрипционного профилирования (как описано в примере 2 и показано в таблице 3), и области гомологии величиной ~250 п.н., фланкирующие мишень для делеции. CI006 и CI010 трансформировали плазмидами, кодирующими систему лямбда Red-зависимой рекомбинации (гены exo, beta, gam) под контролем индуцибельного промотора арабинозы и Cas9 под контролем индуцибельного промотора IPTG. В полученных трансформантах индуцировали системы Red-зависимой рекомбинации и Cas9, и штаммы подготавливали для электропорации. Затем нокаутные кассеты и кодируемую плазмидой выбранную гРНК трансформировали в компетентные клетки. После посева на антибиотики, селективные как для плазмиды Cas9, так и для плазмиды гРНК, в 7 из 10 прошедших скрининг колоний была обнаружена предполагаемая нокаутирующая мутация, как показано на фигуре 3.
Пример 4. Фенотипирование молекул-кандидатов in vitro
[00271] Было оценено влияние экзогенного азота на биосинтез и активность нитрогеназы у различных мутантов. Для измерения нитрогеназной активности в условиях чистой культуры использовали анализ восстановления ацетилена (ARA) (Temme et al. 2012; 109(18): 7085-7090). Штаммы выращивали в герметичных пробирках и количественно оценивали восстановление ацетилена до этилена с помощью газового хроматографа Agilent 6890. Активность микроорганизмов-кандидатов и соответствующих мутантов-кандидатов, выращенных в азотфиксирующих средах с добавкой от 0 до 10 мМ глутамина, в анализе ARA показана на фигурах 4A-B и фигурах 10A-C.
[00272] В анаэробных условиях культивирования тестировали диапазон концентраций глутамина и аммиака, чтобы количественно оценить влияние на азотфиксирующую активность. В клетках дикого типа активность быстро снижалась по мере увеличения концентрации глутамина. Однако в серии первоначальных нокаутирующих мутаций был подтвержден класс мутаций, позволяющий экспрессировать гены, ответственные за азотфиксацию, при концентрациях глутамина, которые в противном случае выключали бы активность у дикого типа. Этот профиль был создан у четырех различных видов диазотрофов, как можно видеть на фигуре 4C. Кроме того, перенастройка регуляторной сети с использованием идентифицированных генетических частей позволила прогнозируемо настроить уровень азотфиксирующей активности. Это можно видеть на фигуре 4B, где проиллюстрированы штаммы CM023, CM021, CM015 и CI006. Штамм CM023 представляет собой эволюционировавший штамм низкого уровня; штамм CM021 представляет собой эволюционировавший штамм высокого уровня; штамм CM015 представляет собой эволюционировавший штамм среднего уровня; штамм CI006 представляет собой дикий тип (штамм 2). Аммиак, экскретируемый в культуральные супернатанты, анализировали с использованием анализа на основе ферментов (MEGAZYME). В анализе было измерено количество НАДФH, потребляемое при поглощении 340 нм. Анализ проводили на бактериальных культурах, выращенных в не содержащей азот анаэробной среде с начальной плотностью 1E9 КОЕ/мл. На панели из шести эволюционировавших штаммов один штамм экскретировал до 100 мкМ аммиака в течение 48 часов, как можно видеть на фигуре 4D. Кроме того, двойной мутант показал более высокую экскрецию аммиака, чем одиночный мутант, из которого он был получен, как показано на фигуре 11. Это демонстрирует способность микроорганизмов продуцировать аммиак сверх их физиологических потребностей.
Транскрипционное профилирование чистых культур
[00273] Транскрипционную активность CI006 измеряли с использованием платформы Nanostring Elements. Клетки выращивали в среде, не содержащей азот, и 10E8 клеток собирали после 4-часовой инкубации. Тотальную РНК экстрагировали с использованием набора Qiagen RNeasy. Очищенная РНК была отправлена в Core Diagnostics в Пало-Альто, Калифорния, для гибридизации зондов и анализа с помощью цифрового анализатора, как показано на фигуре 5.
Пример 5. Фенотипирование микроорганизмов-кандидатов in planta
Колонизация растений микроорганизмами-кандидатами
[00274] Колонизацию желаемых растений-хозяев микроорганизмом-кандидатом количественно оценивали с помощью краткосрочных экспериментов по выращиванию растений. Растения кукурузы инокулировали штаммами, экспрессирующими RFP (красный флуоресцентный белок), либо из плазмиды, либо из Tn5-интегрированной кассеты экспрессии RFP. Растения выращивали как в стерилизованном песке, так и в нестерильной торфяной среде, и инокуляцию проводили путем капания из пипетки 1 мл клеточной культуры непосредственно над формирующимся колеоптилем растения через три дня после прорастания. Плазмиды поддерживали путем полива растений раствором, содержащим подходящий антибиотик. Через три недели корни растений собирали, трижды промывали стерильной водой для удаления видимой почвы и разделяли на два образца. Один образец корня проанализировали с помощью флуоресцентной микроскопии, чтобы определить закономерности локализации микроорганизмов-кандидатов. Микроскопию проводили на самых тонких интактных корнях растения длиной 10 мм, как показано на фигуре 6.
[00275] Был разработан второй количественный метод оценки колонизации. Количественный анализ методом ПЦР проводили на препаратах цельной ДНК из корней растений, инокулированных эндофитами. Семена кукурузы (Dekalb DKC-66-40) проращивали в предварительно стерилизованном в автоклаве песке в горшке размером 2,5 на 2,5 дюйма на 10 дюймов. Через один день после посадки 1 мл культивированной в течение ночи культуры эндофита (среда SOB) выливали прямо в то место, где располагалось семя. 1 мл этой культивированной в течение ночи культуры примерно эквивалентно приблизительно 109 КОЕ, различаясь в пределах 3 раз в зависимости от используемого штамма. Каждый проросток удобряли 3 раза в неделю 50 мл модифицированного раствора Хогланда с добавкой либо 2,5 мМ, либо 0,25 мМ нитрата аммония. Через четыре недели после посадки собирали образцы корней для экстракции ДНК. Остатки почвы смывали струей воды под давлением. Затем эти образцы тканей гомогенизировали с использованием QIAGEN Tissuelyzer, после чего экстрагировали ДНК с использованием мини-набора QIAmp DNA (QIAGEN) в соответствии с рекомендованным протоколом. На этих экстрактах ДНК проводили анализ методом кПЦР с использованием RT-PCR Stratagene Mx3005P с праймерами, сконструированными так (с использованием Primer BLAST от NCBI), чтобы они были специфичными к локусам в геноме каждого эндофита. Наличие геномных копий эндофитов количественно оценивали. Для дальнейшего подтверждения идентичности эндофитов продукты ПЦР-амплификации секвенировали, было и подтверждено, что они имели правильную последовательность. Краткое описание профиля колонизации штаммов CI006 и CI008 из микроорганизмов-кандидатов представлено в таблице 5. У штамма CI008 была продемонстрирована степень колонизации вплоть до 107 КОЕ/г сырой массы корня.
Таблица 5. Колонизация кукурузы, измеренная с помощью кПЦР
Профилирование РНК in planta
[00276] Биосинтез компонентов пути nif in planta оценивали путем измерения транскрипции генов nif. Тотальная РНК была получена из ткани корня растения, инокулированного CI006 (способы посадки, как описано ранее). Экстракцию РНК проводили с использованием мини-набора RNEasy в соответствии с рекомендуемым протоколом (QIAGEN). Затем тотальную РНК из этих растительных тканей анализировали с использованием наборов Nanostring Elements (NanoString Technologies, Inc.) с использованием зондов, которые специфичных для генов nif в геноме штамма CI006. Сводные данные по экспрессии гена nif in planta приведены в таблице 6. Экспрессия генов nifH была обнаружена у растений, инокулированных штаммами CM013, тогда как экспрессия nifH не была обнаружена у растений, инокулированных CI006. Штамм CM013 является производным штамма CI006, в котором ген nifL был нокаутирован.
[00277] Высокоэкспрессируемые гены CM011, ранжированные по транскриптам на т. п.н. на миллион (ТРМ), были измерены in planta в условиях внесения удобрения. Промоторы, контролирующие экспрессию некоторых из этих высокоэкспрессируемых генов, использовали в качестве матриц для гомологичной рекомбинации в локусы-мишени фиксации и ассимиляции азота. Образцы РНК из инокулированного CM011 растения, выращенного в теплице, экстрагировали, рРНК удаляли с использованием набора Ribo-Zero, секвенировали с использованием платформы Truseq от Illumina и картировали обратно на геном CM011. Высокоэкспрессируемые гены из CM011 перечислены в таблице 7.
Таблица 6. Экспрессия nifH in planta
Таблица 7. Высокоэкспрессируемые гены из CM011
Анализ 15N
[00278] В основном способе демонстрации фиксации используется изотоп азота 15N, который содержится в атмосфере в фиксированном соотношении относительно 14N. Внося в удобрение либо в атмосферу повышенные уровни 15N, можно наблюдать фиксацию в растительных тканях либо непосредственно, в виде повышенных количеств 15N, фиксированных из атмосферы с добавкой газообразного 15N2 (Yoshida 1980), либо в обратной зависимости посредством разбавления обогащенного удобрения газообразным N2 из атмосферы (Iniguez 2004). Метод разбавления позволяет наблюдать кумулятивный фиксированный азот в течение роста растения, в то время как метод с использованием газообразного 15N2 ограничен измерением фиксации, которая происходит в течение короткого интервала, в течение которого растение можно выращивать в изолированной атмосфере (измерение интенсивности). Следовательно, метод с использованием газа обладает большей специфичностью (поскольку любые повышенные уровни 15N2 в растении выше атмосферного уровня могут быть однозначно отнесены к фиксации), но он не может показать кумулятивную активность.
[00279] Были проведены оба вида анализа для измерения активности фиксации улучшенных штаммов относительно растений кукурузы дикого типа и не подвергшихся инокуляции, и наблюдались повышенные степени фиксации in planta для нескольких из улучшенных штаммов (фигура 12, фигура 14A и фигура 14B). Эти анализы позволяют продемонстрировать, что активность штаммов, наблюдаемая in vitro, транслируется в результаты in vivo. Кроме того, эти анализы позволяют измерять влияние удобрений на активность штамма и дали основания полагать о подходящей функциональности штамма для сельскохозяйственных условий. Аналогичные результаты наблюдались при инокуляции растений сетарии дикими типами и улучшенными штаммами (фигура 13). Фиксирующая активность in planta, показанная на фигурах 14A-14C, дополнительно подтверждаются транскриптомными данными. Эволюционировавшие штаммы демонстрируют повышенный уровень транскрипта nifH по сравнению с аналогами дикого типа. Кроме того, уровень азота, полученного из микроорганизмов, in planta, также коррелирует с уровнем колонизации для каждого отдельного растения. Эти результаты (фигура 12, фигура 13, фигуры 14A-14C, фигура 15A и фигура 15B) подтверждают гипотезу о том, что микроорганизм благодаря улучшенной регуляции кластера генов nif является вероятной причиной увеличения уровня атмосферного азота, наблюдаемого в растительной ткани. Помимо непосредственного измерения фиксации было измерено влияние инокуляции растений улучшенными штаммами в анализе биомассы растений, подвергнутых воздействию стресса, вызванному недостатком азота. Хотя биомасса растения может быть связана со многими возможными взаимодействиями микроорганизма с растением, можно ожидать, что добавление фиксированного азота повлияет на фенотип растения, когда содержание азота лимитировано. Инокулированные растения выращивали при полном отсутствии азота, и у инокулированных растений наблюдалось значительное увеличение площади листьев, сырой и сухой массы побегов, а также сырой и сухой массы корней по сравнению с необработанными контролями (фигура 14C). Хотя эти различия не могут быть отнесены исключительно к азотфиксации, они подтверждают вывод о том, что улучшенные штаммы активно обеспечивают растение азотом. Растения кукурузы и сетарии выращивали и инокулировали, как описано выше. Растения регулярно снабжали удобрением, содержащим 1,2% 15N, посредством полива. Фиксацию азота микроорганизмами определяли путем измерения уровня 15N в растительной ткани. Ткань четвертого листа собирали и высушивали через 4 недели после посадки. Образцы высушенных листьев гомогенизировали с использованием шариков (QIAGEN Tissuelyzer) и отбирали аликвоты в оловянные капсулы для проведения IRMS (Лаборатория стабильных изотопов MBL в The Ecosystems Center, Вудс-Хол, Массачусетс). Рассчитывали азот, полученный из атмосферы (NDFA),и продукция азота CI050 и CM002 показана на фигуре 7.
Анализ продукции фитогормонов
[00280] Сорт карликовых томатов (Solanum lycopersicum) 'Micro-Tom' ранее использовался для изучения влияния индол-3-уксусной кислоты на созревание плодов в in vitro анализе (Cohen 1996; J Am Soc Hortic Sci 121: 520-524). Для оценки продукции и секреции фитогормонов микроорганизмами-кандидатами был разработан скрининговый анализ на основе планшетов с использованием незрелых плодов Micro-Tom. Планшеты для тканевых культур с двенадцатью лунками подготавливали, заполняя лунки агаровой средой, позволяя ей затвердеть, и точечно высевая 10 мкл культур микроорганизмов, культивированных в течение ночи, на поверхность агара, как показано на фигуре 8. Лунки с агаром, содержащие возрастающие количества гибберелловой кислоты (GA), но без бактериальной культуры, использовали в качестве положительного контроля и стандартов. Цветы на следующий день после расцветания, срезанные с растущих растений Micro-Tom, вставляли стеблем в агар в точке бактериальной точечной культуры. За этими цветами наблюдали в течение 2-3 недель, после чего собирали и взвешивали плоды. Увеличение массы плодов в нескольких параллельных анализах свидетельствует о выработке растительного гормона инокулирующим микроорганизмом, как показано на фигуре 9.
Пример 6. Циклическая эволюция хозяин-микроорганизм
[00281] Растения кукурузы инокулировали CM013 и выращивали в течение 4 недель приблизительно до стадии роста V5. Растения, демонстрирующие улучшенное накопление азота из микробиологических источников в анализе 15N, выкапывали и корни промывали водой под давлением для удаления основной массы почвы. Отрезок корня массой 0,25 г разрезали и промывали в растворе PBS для удаления мелких частиц почвы и неприлипших микроорганизмов. Образцы тканей гомогенизировали с использованием стальных шариков размером 3 мм в QIAGEN TissueLyser II. Гомогенат разбавляли и высевали на агаровую среду SOB. Одиночные колонии повторно суспендировали в жидких средах и подвергали анализу методом ПЦР 16s рДНК и мутаций, уникальных для инокулирующего штамма. Процесс выделения, мутагенеза, инокуляции и повторного выделения микроорганизмов может быть повторен многократно для улучшения качеств микроорганизмов, качеств растений и колонизационной способности микроорганизма.
Пример 7. Совместимость с различной географией
[00282] Способность улучшенных микроорганизмов колонизировать инокулированное растение имеет решающее значение для успеха растения в полевых условиях. Хотя описанные способы выделения предназначены для отбора из почвенных микроорганизмов, которые могут иметь тесную связь с сельскохозяйственными растениями, такими как кукуруза, многие штаммы могут неэффективно осуществлять колонизацию в случае различных генотипов растений, сред, типов почв или условий инокуляции. Поскольку колонизация представляет собой сложный процесс, требующий ряда взаимодействий между штаммом микроорганизма и растением-хозяином, скрининг на компетентность к колонизации стал центральным способом отбора приоритетных штаммов для дальнейшей разработки. В ранних попытках оценить колонизацию использовалось флуоресцентное мечение штаммов, которое было эффективным, но занимало много времени и не масштабировалось для каждого штамма. Поскольку колонизационная активность не поддается прямому улучшению, крайне важно, чтобы потенциальные продукты-кандидаты были выбраны из штаммов, которые являются естественными колонизаторами.
[00283] Был разработан анализ для тестирования на устойчивую колонизацию штаммов дикого типа в любом отдельно взятом растении-хозяине с использованием кПЦР и праймеров, сконструированных таким образом, чтобы они были специфичными для штамма в образце сообщества. Этот анализ предназначен для быстрого измерения степени колонизации микроорганизмов в образцах ткани кукурузы. Первоначальные тесты с использованием штаммов, оцененных как вероятные колонизаторы, с использованием флуоресцентной микроскопии и методик на основе планшетов, показали, что подход с использованием кПЦР был бы как количественным, так и масштабируемым.
[00284] Типичный анализ проводится следующим образом: растения, в основном сорта кукурузы и пшеницы, выращивают в торфяной почевнной смеси для выращивания в теплице в шести параллельных анализах на штамм. Через четыре или пять дней после посадки пипеткой на формирующийся колеоптиль из пипетки капают дозу 1 мл культур бактерий в ранней стационарной фазе, разбавленных до оптической плотности при 590 нм, равной 0,6-1,0 (примерно 5E+08 КОЕ/мл). Растения поливают только водопроводной водой и позволяют им расти в течение четырех недель перед отбором проб, после чего растения выкапывают и корни тщательно промывают для удаления большинства остатков торфа. Образцы чистых корней отрезают и гомогенизируют, чтобы создать суспензию детрита растительных клеток и связанных бактериальных клеток. Авторы разработали протокол высокопроизводительной экстракции ДНК, эффективно обеспечивавший смесь растительной и бактериальной ДНК для использования в качестве матрицы для кПЦР. Основанный на экспериментах с добавками бактериальных клеток, этот процесс экстракции ДНК обеспечивает количественный образец бактериальной ДНК относительно сырой массы корней. Каждый штамм оценивают с использованием штамм-специфичных праймеров, сконструированных с использованием Primer BLAST (Ye 2012), и сравнивают с фоновой амплификацией из неинокулированных растений. Поскольку некоторые праймеры демонстрируют нецелевую амплификацию у неинокулированных растений, колонизацию определяют либо по наличию амплификации либо повышенной амплификации правильного продукта по сравнению с фоновым уровнем.
[00285] Этот анализ использовали для измерения совместимости микробиологического продукта с различной географией почвы. Качества полевой почвы и полевые условия могут оказать огромное влияние на воздействие микробиологического продукта. pH почвы, водоудерживающая способность и конкурентоспособные микроорганизмы представляют собой лишь несколько примеров факторов в почве, которые могут влиять на выживаемость инокулята и колонизационную способность. Анализ колонизации был проведен с использованием трех различных типов почв, отобранных с сельскохозяйственных полей в Калифорнии, в качестве среды для выращивания растений (фигура 16А). Для имитации реалистичных сельскохозяйственных условий использовали промежуточную плотность инокуляции. В течение 3 недель штамм 5 колонизировал все растения при от 1E+06 до 1E+07 КОЕ/г сырой массы. Через 7 недель выращивания растений эволюционировавшая версия штамма 1 показывала высокую степень колонизации (1E+06 КОЕ/г сырой массы) во всех типах почв. (фигура 16B).
[00286] Кроме того, для оценки колонизации при сложности полевых условий было начато полевое испытание на площади 1 акр в Сан-Луис-Обиспо в июне 2015 года для оценки воздействия и колонизации семи штаммов дикого типа на две разновидности полевой кукурузы. Агротехническое планирование и выполнение испытания были выполнены подрядной полевой исследовательской организацией Pacific Ag Research. Для инокуляции использовалась та же технология нанесения покрытия на семена торфяных культур, которая была испытана в эксперименте с методами инокуляции. В течение вегетационного периода собирали образцы растений для оценки колонизации внутри корня и стебля. Образцы собирали с трех параллельных анализов каждой обработки через четыре и восемь недель после посадки и со всех шести параллельных анализов каждой обработки незадолго до сбора урожая через 16 недель. Дополнительные образцы собирали со всех шести параллельных анализов обработки, инокулированных штаммом 1 и штаммом 2, а также необработанными контролями, через 12 недель. Количество клеток на грамм сырой массы отмытых корней оценивали как при других анализах колонизации с использованием кПЦР и штамм-специфичных праймеров. Два штамма, штамм 1 и штамм 2, показали согласованную и широко распространенную колонизацию корней, которая достигла пика через 12 недель, а затем резко снизилась (фигура 16C). Хотя штамм 2, по-видимому, присутствовал в количестве на порядок ниже, чем штамм 1, он был обнаружен в более согласующихся количествах у разных растений. По-видимому, ни один из штаммов не осуществлял эффективную колонизацию внутренней части стебля. В подтверждение данных о колонизации, полученных методом кПЦР, оба штамма были успешно повторно выделены из образцов корней с использованием посева и секвенирования 16S для идентификации изолятов, имеющих совпадающие последовательности.
[00287] Примеры селекции микроорганизмов можно обобщить на схеме, приведенной на фигуре 17 и фигуре 18. На фигуре 17 изображена селекция микроорганизмов, где сначала может быть измерен состав микробиома и идентифицированы интересующие виды. Метаболизм микробиома может быть картирован и связан с генетикой. После этого можно ввести целевое генетическое изменение, используя методы, включающие, не ограничиваясь перечисленным, конъюгацию и рекомбинацию, химический мутагенез, адаптивную эволюцию и редактирование генов. Производные микроорганизмы используют для инокуляции сельскохозяйственных культур. В некоторых примерах отбирают сельскохозяйственные культуры с лучшими фенотипами.
[00288] Как показано на фигуре 17, сначала может быть измерен состав микробиома и идентифицированы интересующие виды. Метаболизм микробиома может быть картирован и связан с генетикой. Метаболизм азота может включать в себя поступление аммиака (NH4+) из ризосферы в цитозоль бактерий посредством транспортера AmtB. Аммиак и L-глутамат (L-Glu) катализируются глутаминсинтетазой и АТФ в глутамин. Глутамин может привести к образованию биомассы (росту растений), а также может ингибировать экспрессию оперона nif. После этого можно ввести целевое генетическое изменение, используя методы, включающие, не ограничиваясь перечисленным, конъюгацию и рекомбинацию, химический мутагенез, адаптивную эволюцию и редактирование генов. Производные микроорганизмы используют для инокуляции сельскохозяйственных культур. Отбирают сельскохозяйственные культуры с лучшими фенотипами.
[00289] В контексте описания изобретения (особенно в контексте нижеследующей формулы изобретения) термины в единственном числе относятся как к единственному, так и множественному числу, если иное не указано, указано в настоящем документе или это явно противоречит контексту. Термины «содержащий», «имеющий» и «включающий» следует толковать как неограничивающие (т.е. означающие «включающий, не ограничиваясь перечисленным»), если не указано иное. Приведение диапазонов значений в настоящем документе предназначено исключительно с целью упростить ссылку по отдельности на каждое значение внутри диапазона, если в настоящем документе не указано иное, и каждое отдельное значение включено в описание, как если бы оно было упомянуто отдельно. Например, если раскрыт диапазон 10-15, то также раскрыты 11, 12, 13 и 14. Все описанные в настоящем документе способы могут быть осуществлены в любом подходящем порядке, если не указано иное или это явно не противоречит контексту. Любые возможные примеры или приведение в качестве примера (например, «такой как») в настоящем документе предназначено исключительно для лучшего раскрытия изобретения и не накладывает ограничений на объем настоящего изобретения, если в формуле изобретения не заявлено иное. Никакую формулировку в описании не следует толковать как указывающую на какой-либо отсутствующий в формуле изобретения элемент как на элемент, существенный для практического осуществления изобретения.
[00290] Хотя в настоящем документе были показаны и описаны предпочтительные варианты осуществления настоящего изобретения, для специалистов в данной области техники будет очевидно, что такие варианты осуществления предоставлены только в качестве примера. Множество вариаций, изменений и замен без выхода за рамки изобретения будут понятны специалистам в данной области техники. Следует понимать, что при практическом осуществлении изобретения могут быть использованы различные альтернативы вариантам осуществления изобретения, описанным в настоящем документе. Предполагается, что нижеследующая формула изобретения определяет объем изобретения и, таким образом, охватывает способы и структуры в пределах объема этой формулы изобретения и их эквиваленты.
[00291] Таблица 3А
[00292] Таблица 3В
Пример 8. Делеция glgA повышает экскрецию азота
[00293] Синтез гликогена перенаправляет углерод от гликолиза и цикла TCA. Снижение или ликвидация синтеза гликогена может привести к увеличению потока углерода в направлении гликолиза и цикла TCA, что приводит к большей доступности АТФ в клетке. Это может привести к повышению нитрогеназной активности, так как в азотфиксации требуется 16 АТФ для восстановления одной молекулы N2, и она может быть ограничена доступностью АТФ. Гликогенсинтаза кодируется геном glgA. Подавление или делеция glgA может привести к повышению азотфиксирующей активности.
[00294] Для этого были сконструированы штаммы Kosakonia sacchari CI006 и Klebsiella variicola, в которых glgA был подвергнут делеции. Штаммы 6-1694, 6-1744 и 137-1893 подвергали анализу экскреции аммония (AMM), в котором измеряли экскрецию аммиака с течением времени в условиях азотфиксации путем культивирования клеток в среде, не содержащей азот, осаждения клеток центрифугированием и измерения свободного аммония в бесклеточном бульоне; более высокие уровни экскреции аммония свидетельствуют о более высокой фиксации и экскреции азота. Штаммы 6-1681 и 137-1893 подвергали анализу ARA, как описано ранее, в среде с добавкой 5 мМ фосфата аммония. Штамм 6-1694 соответствует родительскому штамму 6-342. Штамм 6-1744 соответствует родительскому штамму 6-923. Штамм 6-1681 соответствует родительскому штамму 6-346. Штамм 137-1893 соответствует родительскому штамму 137-1586.
[00295] Данные анализа AMM показаны на фигурах 19А-20В. Штаммы 6-1694 и 6-1744 демонстрируют повышенную способность экскреции азота по сравнению с их родительскими штаммами (фигура 19А). Штамм 6-1681 показал повышенную активность в ARA по сравнению с его родительским штаммом (фигура 19B). Штамм 137-1893 показал как повышенную экскрецию аммония (фигура 20А), так и повышенную нитрогеназную активность по результатам ARA (фигура 20В). Таким образом, уменьшая или исключая синтез гликогена у бактерий, можно увеличить количество экскретируемого азота. Подробные сведения о штаммах, описанных в настоящем документе, содержатся в таблицах 8 и 9.
Пример 9. Мутации glnD повышают экскрецию азота
[00296] GlnD является бифункциональным уридилилтрансфераза/уридилил-удаляющим ферментом, который служит центральным «переключателем» для восприятия азота в клетке. Он содержит три отдельных домена: домен UTase, который уридилирует белки PII GlnB и GlnK; уридилил-удаляющий домен (UR), также известный как домен HD, который удаляет уридильную группу из белков PII; и два домена ACT, которые регулируют активность двух других доменов в ответ на связывание глутамина (фигура 21). При избытке азота глутамин связывает домен ACT, а UR-домен активируется; при азотном голодании ACT не связан, а домен UTase активен. Последующая передача сигналов белком PII влияет на транскрипцию нескольких кластеров генов, включая гены нитрогеназы и ассимиляции азота.
[00297] Были выполнены различные усечения и делеции, чтобы увидеть, как они влияют на фиксацию и экскрецию азота. Несколько мутаций glnD, модифицирующих домены UTase, UR и ACT1/2 (восприимчивые к глутамину), привели к повышению активности согласно результатам анализов ARA и экскреции аммония. На фигуре 22 продемонстрировано несколько модификаций glnD, приводящих к повышению экскреции аммония у K. variicola CI137; на фигуре 23 продемонстрировано несколько модификаций glnD, приводящих к повышению экскреции аммония у K. sacchari.
Пример 10. Делеция glnK повышает экскрецию азота
[00298] GlnK является белком PII, который может выступать в качестве посттрансляционного регулятора и может участвовать в синтезе глутамина, что может представлять собой конкурирующий путь экскреции аммония. Более высокие уровни GlnK могут снизить количество экскретируемого NH4. Удаление glnK может снизить или устранить ингибирующее действие на экскрецию NH4.
[00299] GlnK был подвергнут делеции в штамме, который уже содержал делецию nifL::1.2 и делецию glnE. Таким образом, делеция glnK была введена в штамм, который уже обладал повышенной способностью фиксировать азот. Штамм с делецией glnK обозначен как 137-2225, а родительский штамм обозначен как 137-2084 на фигуре 24А. На этих клетках был проведен анализ AMM, в котором было измерено количество NH4+, экскретируемого на оптическую плотность в час (в мМ). В этом анализе большая экскреция NH4+ может свидетельствовать о более высокой азотфиксирующей активности. В частности, штамм 137-2225 проявлял азотфиксирующую активность, которая была в 1,32 раза выше, чем у родительского штамма, согласно результатам анализа AMM.
Пример 11. Подавление гена glnA повышает экскрецию аммония
[00300] Глутаминсинтетаза (GS) кодируется геном glnA. Снижение активности GS может приводить к снижению степени ассимиляции азота. В условиях азотфиксации это может привести к накоплению внутриклеточного аммония и экскреции аммония.
[00301] Было сконструировано несколько штаммов, в которых нативный промотор для glnA был заменен промотором, о котором известно, что он конститутивно экспрессируется на низком уровне: промотором из генов glnB, glnD либо glnE. Ожидается, что это приведет к снижению транскрипции glnA. В некоторых случаях старт-кодон ATG гена glnA был также мутирован в GTG, чтобы снизить степень инициации трансляции белка GS. На фигуре 24B, фигуре 25 и фигуре 26 описано несколько мутантов CI137 и CI006, у которых подавление гена glnA привело к повышению экскреции аммония.
Пример 12. Подавление глутаматсинтазы приводит к повышению экскреции аммония
[00302] Глутамат служит основным источником азота в клетке, а путь GS-GOGAT является основным путем ассимиляции азота. Оперон gltBD кодирует GOGAT. Был сконструирован штамм (137-2215), в котором нативный промотор для оперона gltBD был подвергнут делеции и заменен сильным конститутивным промотором. На фигуре 27 продемонстрировано, как 137-2215 проявляет повышенную экскрецию аммония по сравнению с родительским контролем; на фигуре 28 продемонстрировано, что 137-2215 проявили повышенную азотфиксирующую активность согласно результатам анализа ARA.
Пример 13. Активация гена глутаминазы glsA2 приводит к повышению экскреции аммония
[00303] Ферменты глутаминазы расщепляют связь C-N в глутамине, высвобождая аммоний и глутамат. Повышение глутаминазной активности в клетке может привести к повышению высвобождения аммония из глутамина и экскреции аммония. Ген glsA2 кодирует глутаминазу. Были сконструированы штаммы, в которых нативный промотор гена glsA2 был подвергнут делеции и заменен последовательностью сильного промотора. На фигуре 29 и фигуре 30 продемонстрирована повышенная экскреция аммония этими штаммами по сравнению с контрольными родительскими штаммами.
Пример 14. Активация глутаминазного домена asnB приводит к повышению экскреции аммония
[00304] Ген asnB кодирует фермент трансаминазу, который имеет два домена: домен глутаминазы и домен аспарагинсинтазы. На фигуре 31 показано, как делеция домена аспарагинсинтазы или активация гена asnB могут привести к повышению экскреции аммония.
Пример 15. Активация rpoN повышает азотфиксацию
[00305] rpoN (сигма-54) представляет собой фактор инициации, используемый для стимулирования прикрепления РНК-полимеразы к определенным сайтам инициации. Наряду с nifA и ihfA/B он транскрибирует nifH. Активация rpoN может привести к повышению уровней nifH, что может привести к повышению азотфиксации.
[00306] Были сконструированы два штамма K. variicola CI137, в которых rpoN был активирован путем делеции его нативного промотора и замены сильным конститутивным промотором. Данные показаны на фигуре 32 и фигуре 33. Штаммы с модификацией rpoN обозначены как 137-2251 и 137-2285, а родительский штамм обозначен как 137-2084.
[00307] На фигуре 32 данные представлены в виде десятичного логарифма количества этилена, образовавшегося на колониеобразующую единицу в час, так что более высокое количество образовавшегося этилена свидетельствует о большей азотфиксации. Анализ проводили с 5 мМ фосфата аммония, предоставляемого в качестве источника азота. Штамм 137-2251 фиксировал азот в 1,23 раза лучше, чем родительский штамм (р=0,028), тогда как штамм 137-2285 фиксировал азот в 1,95 раз лучше, чем родительский штамм (р=0,031).
[00308] Эти результаты позволяют предположить, что азотфиксация может быть усилена путем увеличения количества полимеразы, ответственной за транскрипцию РНК, кодирующей фермент nifH.
[00309]
Пример 16. Активация otsB приводит к повышению азотфиксирующей активности
[00310] otsB участвует в биосинтезе трегалозы в клетке, и модификации otsB могут улучшать устойчивость штамма. В данном примере были созданы и протестированы модификации otsB, чтобы определить, оказывали ли эти модификации отрицательное влияние на азотфиксацию в клетках.
[00311] Три штамма азотфиксирующих бактерий были модифицированы для повышения экспрессии гена otsB. Нативный промотор гена otsB был подвергнут делеции и заменен сильным конститутивным промотором. Модифицированные штаммы представляли собой 6-921 и 6-922 (родительский штамм 6-435) и 6-1697 (родительский штамм 6-923). Анализ ARA проводили на модифицированных штаммах 6-921 и 6-922 (фигура 34). Данные представлены в виде десятичного логарифма количества этилена, образовавшегося на колониеобразующую единицу в час, так что более высокое количество образовавшегося этилена свидетельствует о большей азотфиксации. Анализ проводили с 5 мМ фосфата аммония, предоставляемого в качестве источника азота. CI006 использовали в качестве отрицательного контроля. Неожиданно, азотфиксирующая активность модифицированного штамма была повышена по сравнению с родительским.
[00312] Анализ экскреции аммония проводили на штамме 6-1697. Данные представлены в виде количества экскретированного NH4+ (мМ/оптическую плотность) в час, так что более высокое значение свидетельствует о большей экскреции азота. Данные относятся к экспериментам, проведенным в разные дни. Данные показаны на фигуре 35. Активность экскреции азота была выше по сравнению с родительской. Неожиданно, активность экскреции аммония модифицированного штамма была повышена по сравнению с родительским.
Пример 17. phoB может быть модифицирован для увеличения колонизации ризосферы
[00313] Колонизация некоторых штаммов может быть связана с образованием биопленки, на которое может влиять фосфорная сигнализация, на которую в некоторых случаях может влиять изменение экспрессии генов, ответственных за фосфорную сигнализацию, таких как phoB. Таким образом, изменения в phoB могут повлиять на колонизацию некоторых штаммов бактерий.
[00314] Модификация phoB (штамм 137-1901) была создана в бактериальном штамме с высокой экскрецией азота согласно результатам анализа AMM. Родительский штамм был обозначен как 137-1586.
[00315] На клетках проводили анализ AMM, чтобы определить, оказывали ли модификации отрицательное влияние на активность экскреции азота клетками. Модификации не снижали активность экскреции азота клетками (фигура 36А). Таким образом, phoB может быть модифицирован без снижения экскреции азота.
[00316] Был проведен анализ колонизации корней кукурузы, чтобы определить, влияли ли модификации на способность штамма колонизировать корни растений. Вкратце, растения после проращивания инокулировали приблизительно 109 клеток и давали им расти в течение 4 недель, после чего их собирали. Образцы объединенного зародышевого корня и первого узла были взяты примерно на 1-2 дюйма ниже кроны растения. После сбора образцы лизировали и проводили кПЦР для определения количества клеток, присутствующих на грамм ткани корня (КОЕ/г сырой массы). Штамм 137-1901 показал повышенную колонизацию по сравнению с родительским штаммом 137-1586, как можно видеть на фигуре 36B. Таким образом, модификации phoB могут повышать колонизацию клеток, поскольку колонизация корня мутантным штаммом в этом случае была выше, чем у родительского штамма.
Пример 18. yjbE2 может быть модифицирован для увеличения колонизации ризосферы
[00317] Гены yjbE могут стимулировать секрецию экзополисахаридов, что может усиливать прикрепление к корням определенных штаммов.
[00318] Был проведен анализ колонизации корней кукурузы, чтобы определить, влияли ли модификации yjbE на способность штамма колонизировать корни растений. Вкратце, растения после проращивания инокулировали приблизительно 109 клеток и давали им расти в течение 4 недель, после чего их собирали. Образцы объединенного зародышевого корня и первого узла были взяты примерно на 1-2 дюйма ниже кроны растения. После сбора образцы лизировали и проводили кПЦР для определения количества клеток, присутствующих на грамм ткани корня (КОЕ/г сырой массы). Штамм 6-1779 показал повышенную колонизацию по сравнению с родительским штаммом 6-848, как можно видеть на фигуре 37.
Пример 19. otsB
otsB участвует в биосинтезе трегалозы в клетке, и модификации otsB могут улучшать устойчивость штамма. В данном примере были созданы и протестированы модификации otsB, чтобы определить, оказывали ли эти модификации отрицательное влияние на азотфиксацию в клетках.
[00319] Штамм азотфиксирующих бактерий был модифицирован для повышения экспрессии гена otsB. На модифицированных клетках проводили анализ ARA. Данные представлены в виде десятичного логарифма количества этилена, образовавшегося на колониеобразующую единицу в час, так что более высокое количество образовавшегося этилена свидетельствует о большей азотфиксации. Анализ проводили с 0 мМ (верхняя секция) или 5 мМ (нижняя секция) фосфата аммония, предоставляемого в качестве источника азота. Модифицированные штаммы 6-1697 и 6-1698 (родительский штамм 6-923). CI006 использовали в качестве отрицательного контроля. Данные показаны на фигуре 38A. Азотфиксирующая активность модифицированного штамма была повышена по сравнению с родительским. Таким образом, модификации otsB могут быть выполнены без отрицательного воздействия на азотфиксирующую активность клеток.
[00320] На модифицированных клетках проводили анализ экскреции аммония. Данные представлены в виде количества экскретированного NH4+ (мМ/оптическую плотность) в час, так что более высокое значение свидетельствует о большей экскреции азота. Данные относятся к экспериментам, проведенным в разные дни. Данные показаны на фигуре 38B. Активность экскреции азота была выше по сравнению с родительской. Таким образом, модификации otsB могут быть выполнены без отрицательного воздействия на азотфиксирующую активность клеток.
Пример 20. Мутация cysZ повышает азотфиксацию
[00321] CysZ опосредует поглощение сульфатов, обеспечивая серу, которая затем используется для синтеза серосодержащих соединений в бактериальных клетках, включая кофакторы, необходимые для нитрогеназной активности. Повышение экспрессии гена транспорта серы, такого как cysZ, может увеличить количество функциональных комплексов нитрогеназы. Для этого были созданы два штамма Kosakonia sacchari с модификациями cysZ, которые обозначены как 6-1691 и 6-916. Были проведены анализы восстановления ацетилена (ARA), и данные были сравнены с родительским штаммом без мутаций в cysZ (штаммы 6-346 и 6-435 были родителями для 6-1691 и 6-916, соответственно). Штамм CI006 использовали в качестве отрицательного контроля, и анализы ARA были проведены одинаковым образом для обоих штаммов, за исключением того, что 6-1691 и его родитель были проанализированы в 5 мМ фосфата аммония (фигура 39А), в то время как 6-916 и его родитель были проанализированы в 5 мМ глутамина (фигура 39B). Оба штамма проявляют повышенную нитрогеназную активность по сравнению со штаммом дикого типа и родительскими штаммами. Увеличение, продемонстрированное 6-1691, было приблизительно 14-кратным, в то время как штамм 6-916 имел азотфиксирующую активность приблизительно в 6 раз выше, чем у его родителя.
Пример 21. Образование биопленки
[00322] Образование биопленки может влиять на количество азота, предоставляемого связанному растению. Увеличение образования биопленки на корне растения может увеличить количество азота, предоставляемого растению.
[00323] Некоторые гены могут регулировать образование биопленки. Например, smZ может выступать отрицательным регулятором регуляции биопленки. Мутация smZ, приводящая к уменьшению или устранению функции smZ, может увеличить образование биопленки в бактериях. Может быть осуществлен мутагенез для мутации smZ в штаммах с повышенной активностью экскреции и фиксации азота для создания библиотеки бактерий, мутантных по smZ.
[00324] Некоторые белки могут способствовать образованию биопленки. Например, большие адгезивные белки, включая lapA, могут способствовать образованию биопленки. Один или более промоторов, регулирующих экспрессию lapA, могут быть активированы, так что вырабатывается больше lapA, согласно результатам вестерн-блоттинга.
[00325] Могут быть генерированы штаммы с мутациями smZ и активацией lapA для создания библиотеки штаммов smZ/lapA для тестирования. Штаммы smZ/LapA могут характеризоваться повышенным образованием биопленки и могут обладать способностью образования биопленки, превышающей штаммы только с мутацией smZ или мутацией lapA.
[00326] Штаммы могут быть выращены в лизогенном буфере (LB) и инокулированы в почву с проростком. Проросток, почва и бактериальный штамм могут находиться в горшке, в поле, в помещении или на улице. Проросток может быть посажен весной, летом, осенью или зимой. Воздух может иметь влажность приблизительно 0%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. Погода может быть дождливой, туманной, облачной или солнечной. Температура может составлять приблизительно 4°C, 10°C, 15°C, 20°C, 25°C, 30°C, 35°C, 40°C или 45°C. Проросток может быть посажен на рассвете, утром, в полдень, во второй половине дня, в сумерках, вечером или ночью. Проросток может выращиваться в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20 или 30 дней. По прошествии времени можно выкопать растение и измерить количество биопленки на корнях.
Пример 22. Чувствительность к кислороду
[00327] Чувствительность к кислороду ферментов нитрогеназ может влиять на азотфиксацию, экскрецию азота, или на то и другое. Снижение чувствительности к кислороду фермента нитрогеназы может повысить азотфиксирующую активность, повысить активность экскреции азота, или и то, и другое. Может быть создан штамм бактерий, содержащий один или более ферментов нитрогеназ с пониженным содержанием кислорода, таким образом, чтобы штамм проявлял повышенную азотфиксирующую активность или повышенную активность экскреции азота.
[00328] В бактериальных клетках с диким типом или генетически улучшенной азотфиксирующей активностью, азотсодержащей активностью, или обоими, могут быть проведены генетические модификации. Генетические модификации могут быть введены в клетки таким образом, что один или более генов фермента нитрогеназ были мутированы по протоколу мутагенеза, и может быть создана библиотека таких штаммов.
[00329] Каждый штамм в библиотеке может быть подвергнут анализу чувствительности к кислороду. Для этого могут быть проведены анализы AMM и ARA в условиях с различными концентрациями кислорода. Концентрация кислорода может варьироваться от 1 мкМ до 6 мкМ. Данные могут быть проанализированы, чтобы определить, проявляют ли штаммы пониженную экскрецию азота или азотфиксирующую активность в зависимости от концентрации кислорода. Некоторые штаммы с модифицированными ферментами нитрогеназами могут демонстрировать незначительное снижение или вообще не снижать экскрецию азота или азотфиксирующую активность при увеличении концентрации кислорода.
Пример 23. Изменение modA, modB, modE
[00330] Путь поглощения молибдена может относиться к метаболическому пути у бактерий, который обеспечивает поглощение молибдена в клетку. Молибден может выступать в качестве кофактора при азотфиксации. Увеличение поглощения молибдена клетками может повысить азотфиксацию, экскрецию азота, или и то, и другое.
[00331] Ключевые ферменты в пути транспорта молибдена могут включать modA, modB и modE. Модификация или активация любого одного, двух или трех из этих генов в бактериальном штамме может увеличить поглощение молибдена в клетках и может повысить азотфиксацию, экскрецию азота, или то, и другое, в клетках.
[00332] В отношении этих генов в бактериальных клетках могут быть выполнены генетические модификации, приводящие к увеличению транспорта молибдена. Чтобы идентифицировать такие модификации, мутагенез может быть проведен внутри и вокруг активных сайтов генов, кодирующих modA, modB или modC. Для каждого гена может быть сконструирована библиотека мутантов. Затем эти библиотеки могут быть подвергнуты скринингу на повышенную активность поглощения молибдена. Эти библиотеки могут быть созданы из клеток дикого типа или из клеток, которые уже были модифицированы для проявления повышенной азотфиксации, повышенной экскреции азота, или и того, и другого.
[00333] Генетические модификации могут быть выполнены в этих клетках так, что активируются один или более генов в пути поглощения молибдена. Библиотека вариантов также может быть сконструирована так, что повышается активность промотора для одного или более генов в пути поглощения молибдена. Например, промотор modABC можно генетически настроить для повышения транскрипции. Вестерн-блоттинг может быть использован для определения того, какие штаммы имеют повышенную экспрессию одного или более генов поглощения молибдена, и эти штаммы могут представлять интерес в качестве вариантов.
[00334] Для скрининга на повышенную активность поглощения молибдена каждый представляющий интерес мутант или вариант, а также немутированный родительский штамм для каждого штамма может быть инокулирован и выращен в трех лунках 96-луночного планшета в среде LB. Как только клетки достигают оптической плотности, равной 0,8, может быть собран материал из одной из лунок для каждого мутанта, при этом клетки осаждают центрифугированием, избыток LB смывают и клетки повторно суспендируют, лизируют и готовят для спектроскопии в 96-луночном планшете. Содержание молибдена может быть измерено с помощью спектроскопии для определения исходного содержания молибдена в образцах. В остальные образцы могут быть введены добавки молибдена в виде тетраоксианиона молибдата только в LB или LB, так что добавляемое количество составляет 10% или менее от общего объема в каждой лунке. Конечная концентрация молибдена в каждой лунке в анализе может быть представлять собой одну из 10 пМ, 100 пМ, 1 нМ, 10 нМ или 100 нМ, и может быть проанализировано более одной концентрации. Анализ может проводиться в течение одной или более из 1 секунд, 10 секунд, 30 секунд, 1 минуты, 2 минут, 3 минут, 4 минут, 5 минут, 10 минут, 20 минут, 30 минут и 60 минут.
[00335] Во-первых, для каждой концентрации может быть построен график зависимости количества молибдена, транспортируемого в каждую клетку, от времени для определения оптимальной продолжительности анализа. Оптимальной продолжительностью может быть временной интервал, в котором установившееся состояние не было достигнуто, а скорость реакции остается линейной. Затем для оптимальной продолжительности может быть построен график зависимости количества молибдена, транспортируемого в каждую клетку, от концентрации, и может быть выполнен анализ Михаэлиса-Ментен. Представляющие интерес мутантные штаммы или варианты, демонстрирующие значительное увеличение (р<0,05) транспорта молибдена по сравнению с немутированным и немодифицированным родительским штаммом, как определено сравнением Km, могут быть выбраны для дальнейших анализов.
[00336] Затем каждый штамм, выбранный для дальнейших анализов, может быть подвергнут анализу AMM, а также анализу ARA, как описано в настоящем документе, для измерения экскреции и фиксации азота, соответственно. Одна или более из этих мутаций или вариантов могут увеличивать AMM, ARA или оба, одного или более из этих бактериальных штаммов.
Пример 24. Увеличение транспорта железа может повысить азотфиксацию
[00337] Путь поглощения железа может относиться к метаболическому пути у бактерий, который обеспечивает поглощение железа в клетку. Железо может выступать в качестве кофактора для стимуляции азотфиксации. Увеличение поглощения железа клетками может повысить азотфиксацию, экскрецию азота, или и то, и другое.
[00338] Ключевые ферменты в пути транспорта железа могут включать exbA, exbB и tonB. Модификация или активация любого одного, двух или трех из этих генов в бактериальном штамме может увеличить поглощение железа в клетках и может повысить азотфиксацию, экскрецию азота, или то, и другое, в клетках.
[00339] В отношении этих генов в бактериальных клетках могут быть выполнены генетические модификации, приводящие к увеличению транспорта железа. Чтобы идентифицировать такие модификации, мутагенез может быть проведен внутри и вокруг активных сайтов генов, кодирующих exbA, exbB или tonB. Для каждого гена может быть сконструирована библиотека мутантов. Затем эти библиотеки могут быть подвергнуты скринингу на повышенную активность поглощения железа. Эти библиотеки могут быть созданы из клеток дикого типа или из клеток, которые уже были модифицированы для проявления повышенной азотфиксации, повышенной экскреции азота, или и того, и другого.
[00340] Генетические модификации могут быть выполнены в этих клетках так, что активируются один или более генов в пути поглощения железа. Библиотека вариантов также может быть сконструирована так, что повышается активность промотора для одного или более генов в пути поглощения железа. Вестерн-блоттинг может быть использован для определения того, какие штаммы имеют повышенную экспрессию одного или более генов поглощения железа, и эти штаммы могут представлять интерес в качестве вариантов.
[00341] Для скрининга на повышенную активность поглощения железа каждый представляющий интерес мутант или вариант, а также немутированный родительский штамм для каждого штамма может быть инокулирован и выращен в трех лунках 96-луночного планшета в среде LB. Как только клетки достигают оптической плотности, равной 0,8, может быть собран материал из одной из лунок для каждого мутанта, при этом клетки осаждают центрифугированием, избыток LB смывают и клетки повторно суспендируют, лизируют и готовят для спектроскопии в 96-луночном планшете. Содержание железа может быть измерено с помощью спектроскопии для определения исходного содержания железа в образцах. В остальные образцы могут быть введены добавки железа в виде FeSO4 только в LB или LB, так что добавляемое количество составляет 10% или менее от общего объема в каждой лунке. Может быть добавлено 0,1 мМ уксусной кислоты (конечная концентрация), чтобы улучшить растворимость железа. Конечная концентрация железа в каждой лунке в анализе может быть представлять собой одну из 10 пМ, 100 пМ, 1 нМ, 10 нМ, 100 нМ, 1 мкМ, 10 мкМ или 100 мкМ, и может быть проанализировано более одной концентрации. Анализ может проводиться в течение одной или более из 1 секунд, 10 секунд, 30 секунд, 1 минуты, 2 минут, 3 минут, 4 минут, 5 минут, 10 минут, 20 минут, 30 минут и 60 минут.
[00342] Сначала для каждой концентрации может быть построен график зависимости количества железа, транспортируемого в каждую клетку, от времени для определения оптимальной продолжительности анализа. Оптимальной продолжительностью может быть временной интервал, в котором установившееся состояние не было достигнуто, а скорость реакции остается линейной. Затем для оптимальной продолжительности может быть построен график зависимости количества железа, транспортируемого в каждую клетку, от концентрации, и может быть выполнен анализ Михаэлиса-Ментен. Представляющие интерес мутантные штаммы или варианты, демонстрирующие значительное увеличение (р<0,05) транспорта железа по сравнению с немутированным и немодифицированным родительским штаммом, как определено сравнением Km, могут быть выбраны для дальнейших анализов.
[00343] Затем каждый штамм, выбранный для дальнейших анализов, может быть подвергнут анализу AMM, а также анализу ARA, как описано в настоящем документе, для измерения экскреции и фиксации азота, соответственно. Одна или более из этих мутаций или вариантов могут увеличивать AMM, ARA или оба, одного или более из этих бактериальных штаммов.
Пример 25. Увеличение количества генов биосинтеза сидерофоров может повысить азотфиксацию
[00344] Сидрофоры yhf, или молекулы, образующие хелаты с железом, могут влиять на поглощение железа бактериями. Повышение продукции сидерофоров yhf может повышать поглощение железа бактериями. Модификации генов сидерофоров, в том числе yhfA, yusV, sbnA, yfiZ, fiu и fur, могут повысить продукцию сидерофоров yhf, что, в свою очередь, может повысить поглощение железа клетками. Эти модификации могут привести к повышению фиксации или экскреции азота.
[00345] В отношении этих генов в бактериальных клетках могут быть выполнены генетические модификации, приводящие к повышению продукции сидерофоров. Чтобы идентифицировать такие модификации, мутагенез может быть проведен внутри и вокруг активных сайтов генов, кодирующих yhfA, yusV, sbnA, yfiZ, fiu или fur. Для каждого гена может быть сконструирована библиотека мутантов. Затем эти библиотеки могут быть подвергнуты скринингу на предмет повышения продукции сидерофоров. Эти библиотеки могут быть созданы из клеток дикого типа или из клеток, которые уже были модифицированы для проявления повышенной азотфиксации, повышенной экскреции азота, или и того, и другого. Для скрининга на предмет повышения продукции сидерофоров каждый мутант может быть выращен до оптической плотности, равное 0,8, а затем может быть добавлен избыток, но не токсичное количество предшественников сидерофоров, и осуществлена инкубация в течение 30 минут или 60 минут. Количество сидерофоров, продуцированных после назначенного периода времени, может быть нормировано, и штаммы, демонстрирующие повышенную продукцию сидерофоров, могут быть подвергнуты скринингу на предмет увеличения транспорта железа.
[00346] Для скрининга на повышенную активность поглощения железа каждый представляющий интерес мутант или вариант, а также немутированный родительский штамм для каждого штамма может быть инокулирован и выращен в трех лунках 96-луночного планшета в среде LB. Как только клетки достигают оптической плотности, равной 0,8, может быть собран материал из одной из лунок для каждого мутанта, при этом клетки осаждают центрифугированием, избыток LB смывают и клетки повторно суспендируют, лизируют и готовят для спектроскопии в 96-луночном планшете. Содержание железа может быть измерено с помощью спектроскопии для определения исходного содержания железа в образцах. В остальные образцы могут быть введены добавки железа в виде FeSO4 только в LB или LB, так что добавляемое количество составляет 10% или менее от общего объема в каждой лунке. Может быть добавлено 0,1 мМ уксусной кислоты (конечная концентрация), чтобы улучшить растворимость железа. Конечная концентрация железа в каждой лунке в анализе может быть представлять собой одну из 10 пМ, 100 пМ, 1 нМ, 10 нМ, 100 нМ, 1 мкМ, 10 мкМ или 100 мкМ, и может быть проанализировано более одной концентрации. Анализ может проводиться в течение одной или более из 1 секунд, 10 секунд, 30 секунд, 1 минуты, 2 минут, 3 минут, 4 минут, 5 минут, 10 минут, 20 минут, 30 минут и 60 минут.
[00347] Сначала для каждой концентрации может быть построен график зависимости количества железа, транспортируемого в каждую клетку, от времени для определения оптимальной продолжительности анализа. Оптимальной продолжительностью может быть временной интервал, в котором установившееся состояние не было достигнуто, а скорость реакции остается линейной. Затем для оптимальной продолжительности может быть построен график зависимости количества железа, транспортируемого в каждую клетку, от концентрации, и может быть выполнен анализ Михаэлиса-Ментен. Представляющие интерес мутантные штаммы или варианты, демонстрирующие значительное увеличение (р<0,05) транспорта железа по сравнению с немутированным и немодифицированным родительским штаммом, как определено сравнением Km, могут быть выбраны для дальнейших анализов.
[00348] Затем каждый штамм, выбранный для дальнейших анализов, может быть подвергнут анализу AMM, а также анализу ARA, как описано в настоящем документе, для измерения экскреции и фиксации азота, соответственно. Одна или более из этих мутаций или вариантов могут увеличивать AMM, ARA или оба, одного или более из этих бактериальных штаммов.
Пример 26. dctA1 и dctA2
[00349] dctA1 и dctA2 ответственны за аэробный транспорт дикарбоксилатов фумарата, L- и D-малата и, в меньшей степени, сукцината, из периплазмы через внутреннюю мембрану. Модификации этих генов могут влиять на колонизацию микроорганизмов.
Модификации в dctA1 (штамм 137-1861) и dctA2 (штамм 137-1905) были созданы в штамме с высокой экскрецией азота согласно результатам анализа AMM. Родительский штамм был обозначен как 137-1905.
[00350] На клетках проводили анализ AMM, чтобы определить, оказывали ли модификации отрицательное влияние на активность экскреции азота клетками. Модификации не снижали активность экскреции азота клетками (фигура 40А). Таким образом, dctA1 и dctA2 могут быть модифицированы без снижения экскреции азота.
[00351] Анализ образования колоний проводили на клетках с использованием кПЦР, чтобы определить, оказывали ли модификации влияние на колониеобразующие свойства клеток. Вкратце, растения после проращивания инокулировали приблизительно 109 клеток и давали им расти в течение 4 недель, после чего их собирали. Образцы объединенного зародышевого корня и первого узла были взяты примерно на 1-2 дюйма ниже кроны растения. После сбора образцы лизировали и проводили кПЦР для определения КОЕ/г сырой массы. Данные показаны на фигуре 40B. Оба штамма показали повышенную колонизацию. Таким образом, модификации dctA1 и dctA2 могут повышать колонизацию в клетках.
Пример 27. Повышение устойчивости к высушиванию
[00352] Улучшение устойчивости к высушиванию может повысить колонизацию штамма, используемого для покрытия семян, или другого применения в сухом виде для растения или поля. Будет создан генетически сконструированный микроорганизм, содержащий промотор арабинозы, функционально связанный с геном rpoE. Указанный генетически сконструированный микроорганизм и несконструированный родительский контроль будут культивированы в среде с добавкой арабинозы в течение 48 часов, а затем высушены. После высушивания часть каждого из сконструированного и несконструированного штаммов будет регенерирована в среде, не содержащей арабинозы, и будет проанализировано количество микроорганизмов в среде через 24 часа. Среда, содержащая сконструированный штамм, будет содержать больше микроорганизмов, чем среда, содержащий несконструированный родительский штамм.
[00353] Высушенные микроорганизмы будут нанесены на семена кукурузы и посажены в почву, лишенную арабинозы, в теплице в условиях, подходящих для прорастания семян кукурузы. Через 4 недели проростки будут собраны, и будет оценено количество колониеобразующих единиц как сконструированных, так и несконструированных микроорганизмов на корнях растений. Растения, подвергшиеся воздействию сконструированных микроорганизмов, будут связаны с большим количеством микроорганизмов, чем растения, подвергшиеся воздействию несконструированного родительского штамма.
Пример 28. Изменение RBS nifA повышает транскрипцию nifH
[00354] Последовательности промотор-RBS, вставленные против хода транскрипции от nifA, приводят к повышению соотношений транскрипции nifH: nifA, что свидетельствует об увеличении количества активного белка NifA из-за повышенной силы вставленного RBS, что приводит к более высокой скорости инициации трансляции NifA.
[00355]
Таблица 8. Штаммы, описанные в настоящем документе
Таблица 9. Другие штаммы, описанные в настоящем документе
Безотносительно прилагаемой формулы изобретения изобретение, изложенное в настоящем документе, также определяется следующими пунктами:
1. Штамм микроорганизма с улучшенной устойчивостью к высушиванию.
2. Штамм микроорганизма, где экспрессия rpoE регулируется переключаемым промотором.
3. Штамм микроорганизма согласно пункту 2, где указанный переключаемый промотор представляет собой промотор арабинозы.
4. Штамм микроорганизма согласно пункту 2, где ген rseA является подавленным.
5. Штамм микроорганизма согласно пункту 2, где указанный переключаемый промотор представляет собой промотор, который может быть активирован химическим веществом.
6. Штамм микроорганизма согласно пункту 2, где указанный переключаемый промотор представляет собой промотор, который может быть активирован сахаром.
7. Штамм микроорганизма согласно пункту 2, где указанный переключаемый промотор представляет собой промотор, который может быть активирован арабинозой.
8. Способ повышения устойчивости микроорганизма к высушиванию, включающий конструирование указанного микроорганизма таким образом, чтобы он содержал ген rpoE, функционально связанный с переключаемым промотором, активацию указанного переключаемого промотора во время логарифмической фазы роста биомассы, повышая таким образом устойчивость указанного микроорганизма к высушиванию.
9. Способ повышения устойчивости микроорганизма к высушиванию во время нанесения покрытия на семена, включающий конструирование указанного микроорганизма таким образом, чтобы он содержал ген rpoE, функционально связанный с переключаемым промотором, активацию указанного переключаемого промотора перед высушиванием, повышая таким образом устойчивость указанного микроорганизма к высушиванию.
10. Способ согласно пункту 9, где указанный переключаемый промотор представляет собой промотор, который может быть активирован химическим веществом.
11. Способ согласно пункту 9, где указанный переключаемый промотор представляет собой промотор, который может быть активирован сахаром.
12. Способ согласно пункту 9, где указанный переключаемый промотор представляет собой промотор, который может быть активирован арабинозой.
13. Способ согласно пункту 9, где указанный переключаемый промотор активируют во время логарифмической фазы роста биомассы.
14. Способ согласно пункту 9, где указанный переключаемый промотор активируют во время нанесения покрытия на семена.
15. Способ согласно пункту 9, где указанный микроорганизм также сконструирован для снижения экспрессии rseA.
16. Генетически сконструированная бактерия, содержащая гетерологичный регуляторный элемент, функционально связанный с cysP.
17. Генетически сконструированная бактерия согласно пункту 16, где указанный гетерологичный регуляторный элемент представляет собой промотор.
18. Генетически сконструированная бактерия согласно пункту 16, где указанный гетерологичный регуляторный элемент является нативным для указанной генетически сконструированной бактерии.
19. Генетически сконструированная бактерия, содержащая генетическое изменение, которое приводит к повышению экспрессии белка, катализирующего транспорт компонентов кофакторов нитрогеназы в клетку.
20. Генетически сконструированная бактерия согласно пункту 19, где указанный белок, катализирующий транспорт компонентов кофакторов нитрогеназы в клетку, представляет собой ген транспортера серы.
21. Генетически сконструированная бактерия согласно пункту 20, где указанный ген транспортера серы представляет собой cysZ.
22. Генетически сконструированная бактерия согласно пункту 20, где указанный ген транспортера серы представляет собой cysK.
23. Генетически сконструированная бактерия согласно пункту 20, где указанный ген транспортера серы представляет собой cysT.
24. Генетически сконструированная бактерия согласно пункту 20, где указанный ген транспортера серы представляет собой cysW.
25. Генетически сконструированная бактерия согласно пункту 20, где указанный ген транспортера серы представляет собой cysA.
26. Генетически сконструированная бактерия согласно пункту 20, где указанный ген транспортера серы представляет собой sbp.
27. Генетически сконструированная бактерия согласно пункту 19, где указанное генетическое изменение приводит к повышению экспрессии оперона cysZK.
28. Генетически сконструированная бактерия согласно пункту 19, где указанное генетическое изменение приводит к повышению экспрессии оперона cysPTWA.
29. Генетически сконструированная бактерия согласно пункту 19, где указанный белок, катализирующий транспорт компонентов кофакторов нитрогеназы в клетку, представляет собой ген транспортера молибдена.
30. Генетически сконструированная бактерия согласно пункту 29, где указанный ген транспортера молибдена представляет собой modE.
31. Генетически сконструированная бактерия согласно пункту 29, где указанный ген транспортера молибдена представляет собой modB.
32. Генетически сконструированная бактерия согласно пункту 29, где указанный ген транспортера молибдена представляет собой modA.
33. Генетически сконструированная бактерия согласно пункту 19, где указанное генетическое изменение приводит к повышению экспрессии оперона modEB.
34. Генетически сконструированная бактерия согласно пункту 19, где указанное генетическое изменение приводит к повышению экспрессии оперона modEBA.
35. Генетически сконструированная бактерия согласно пункту 19, где указанный белок, катализирующий транспорт компонентов кофакторов нитрогеназы в клетку, представляет собой ген транспортера железа.
36. Генетически сконструированная бактерия согласно пункту 35, где указанный ген транспортера железа представляет собой exbA.
37. Генетически сконструированная бактерия согласно пункту 35, где указанный ген транспортера железа представляет собой exbB.
38. Генетически сконструированная бактерия согласно пункту 35, где указанный ген транспортера железа представляет собой tonB.
39. Генетически сконструированная бактерия согласно пункту 19, где указанное генетическое изменение приводит к повышению экспрессии оперона exbAB.
40. Генетически сконструированная бактерия согласно любому из положений 19-39, где указанное генетическое изменение включает вставку промотора.
41. Генетически сконструированная бактерия, обладающая измененной экспрессией гена биосинтеза сидерофора.
42. Генетически сконструированная бактерия согласно пункту 41, где указанный ген биосинтеза сидерофора представляет собой yhfA.
43. Генетически сконструированная бактерия согласно пункту 41, где указанный ген биосинтеза сидерофора представляет собой yusV.
44. Генетически сконструированная бактерия согласно пункту 41, где указанный ген биосинтеза сидерофора представляет собой sbnA.
45. Генетически сконструированная бактерия согласно пункту 41, где указанный ген биосинтеза сидерофора представляет собой yfiZ.
46. Генетически сконструированная бактерия согласно пункту 41, где указанный ген биосинтеза сидерофора представляет собой fiu.
47. Генетически сконструированная бактерия согласно пункту 41, где указанный ген биосинтеза сидерофора представляет собой fur.
48. Генетически сконструированная бактерия, содержащая генетическое изменение в glgA; где указанная генетически сконструированная бактерия обладает повышенной азотфиксирующей активностью по сравнению с бактерией того же вида без указанного генетического изменения в glgA.
49. Генетически сконструированная бактерия согласно пункту 47, где указанное генетическое изменение приводит к снижению экспрессии glgA.
50. Генетически сконструированная бактерия, содержащая ненативный сайт связывания рибосомы, приводящий к повышению трансляции NifA.
51. Генетически сконструированная бактерия, содержащая по меньшей мере две копии гена NifA.
52. Генетически сконструированная бактерия согласно пункту 51, содержащая по меньшей мере три копии гена NifA.
53. Генетически сконструированная бактерия согласно пункту 51, содержащая по меньшей мере четыре копии гена NifA.
54. Генетически сконструированная бактерия согласно пункту 51, содержащая по меньшей мере пять копий гена NifA.
55. Генетически сконструированная бактерия согласно пункту 51, содержащая по меньшей мере шесть копий гена NifA.
56. Генетически сконструированная бактерия согласно пункту 51, содержащая по меньшей мере семь копий гена NifA.
57. Генетически сконструированная бактерия согласно пункту 51, содержащая более десяти копий гена NifA.
58. Генетически сконструированная бактерия, содержащая гетерологичный промотор, функционально связанный с по меньшей мере одним геном, выбранным из группы, состоящей из nifH, nifD и nifK; где указанный гетерологичный промотор получен из генетического материала микроорганизма-хозяина.
59. Генетически сконструированная бактерия, содержащая генетический вариант в гене, ответственном за поглощение активных форм кислорода.
60. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой grxA.
61. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой grxB.
62. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой grxC.
63. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой grxD.
64. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой trxA.
65. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой trxC.
66. Генетически сконструированная бактерия согласно пункту 59, где указанный ген, ответственный за поглощение активных форм кислорода, представляет собой tpx.
67. Генетически сконструированная бактерия, содержащая генетическую структуру, приводящую к изменению экспрессии оперона grxABCD.
68. Генетически сконструированная бактерия, содержащая генетический вариант, приводящий к повышению уровня нитрогеназной активности в условиях по меньшей мере 0,05% кислорода по сравнению с несконструированной диазотрофной бактерией того же вида.
69. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к повышению уровня нитрогеназной активности в условиях по меньшей мере 0,1% кислорода по сравнению с несконструированной диазотрофной бактерией того же вида.
70. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к повышению уровня нитрогеназной активности в условиях по меньшей мере 0,5% кислорода по сравнению с несконструированной диазотрофной бактерией того же вида.
71. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к повышению уровня нитрогеназной активности в условиях по меньшей мере 1% кислорода по сравнению с несконструированной диазотрофной бактерией того же вида.
72. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии оперона cydABX.
73. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии оперона cydAB.
74. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена cydX.
75. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена cydA.
76. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена cydB.
77. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена glbN.
78. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии оперона fixNOPQ.
79. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена fixN.
80. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена fixO.
81. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена fixP.
82. Генетически сконструированная бактерия согласно пункту 68, где указанный генетический вариант приводит к изменению экспрессии гена fixQ.
83. Генетически сконструированная бактерия, содержащая модификацию в asnB.
84. Генетически сконструированная бактерия, содержащая модификацию в гене, выбранном из группы, состоящей из asnB, asnA, glnL, уридилилтрансферазы, amtB и GDH.
85. Генетически сконструированная бактерия согласно пункту 84, где указанный генетический вариант приводит к изменению экспрессии гена asnB.
86. Генетически сконструированная бактерия согласно пункту 84, где указанный генетический вариант приводит к изменению экспрессии гена asnA.
87. Генетически сконструированная бактерия согласно пункту 84, где указанный генетический вариант приводит к изменению экспрессии гена glnL.
88. Генетически сконструированная бактерия согласно пункту 84, где указанный генетический вариант приводит к изменению экспрессии гена уридилилтрансферазы.
89. Генетически сконструированная бактерия согласно пункту 84, где указанный генетический вариант приводит к изменению экспрессии гена GDH.
90. Генетически сконструированная бактерия, содержащая модификацию в glnK, где указанная модификация выбрана из группы, состоящей из делеции всего гена, делеции по существу всего гена, делеции домена ACT, делеции более 50% домена ACT, инактивации домена ACT и инактивации домена UTase.
91. Генетически сконструированная бактерия, содержащая модификацию в glnD, где указанная модификация выбрана из группы, состоящей из делеции всего гена, делеции по существу всего гена, делеции домена ACT, делеции более 50% домена ACT, инактивации домена ACT и инактивации домена UTase.
92. Генетически сконструированная бактерия с улучшенной выживаемостью в ризосфере по сравнению с несконструированной бактерией того же вида, где указанная бактерия содержит генетическое изменение, приводящее к повышению экспрессии транспортера сахара.
93. Генетически сконструированная бактерия согласно пункту 92, где указанный транспортер сахара представляет собой dctA.
94. Генетически сконструированная бактерия, содержащая генетическое изменение, приводящее к повышению экспрессии транспортера сахара.
95. Генетически сконструированная бактерия согласно пункту 94, где указанный транспортера сахара представляет собой dctA.
96. Генетически сконструированная бактерия с улучшенной выживаемостью в ризосфере по сравнению с несконструированной бактерией того же вида, где указанная бактерия содержит генетическое изменение, приводящее к изменению сигнализации о кворуме.
97. Генетически сконструированная бактерия согласно пункту 96, где указанное генетическое изменение, приводящее к изменению сигнализации о кворуме, приводит к изменению гашения кворума.
98. Генетически сконструированная бактерия согласно пункту 96, где указанное генетическое изменение, приводящее к изменению сигнализации о кворуме, приводит к изменению экспрессии Y2-aiiA.
99. Генетически сконструированная бактерия согласно пункту 96, где указанное генетическое изменение, приводящее к изменению сигнализации о кворуме, приводит к изменению экспрессии ytnP.
100. Генетически сконструированная бактерия с улучшенной выживаемостью в ризосфере по сравнению с несконструированной бактерией того же вида, где указанная бактерия содержит генетическое изменение, приводящее к повышению прикрепления к корням.
101. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящая к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению биосинтеза феназина.
102. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению биосинтеза циклических липопептидов.
103. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии агглютининов.
104. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии fhaB.
105. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии fhaC.
106. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии yjbE.
107. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии pssM.
108. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии генов acs.
109. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии otsA.
110. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии оперона, содержащего otsA.
111. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии treY.
112. Генетически сконструированная бактерия согласно пункту 100, где указанное генетическое изменение, приводящее к повышению прикрепления к корням, включает генетическое изменение, приводящее к изменению экспрессии оперона, содержащего treY.
113. Генетически сконструированная бактерия, содержащая генетическое изменение, приводящее к повышению образования биопленки.
114. Генетически сконструированная бактерия согласно пункту 113, где указанное генетическое изменение, приводящее к повышению образования биопленки, включает генетическое изменение, приводящее к изменению экспрессии smZ.
115. Генетически сконструированная бактерия согласно пункту 113, где указанное генетическое изменение, приводящее к повышению образования биопленки, включает генетическое изменение, приводящее к изменению экспрессии lapA.
116. Генетически сконструированная бактерия согласно пункту 113, где указанное генетическое изменение, приводящее к повышению образования биопленки, включает генетическое изменение, приводящее к изменению экспрессии генов биосинтеза АГЛ.
117. Генетически сконструированная бактерия согласно пункту 113, где указанное генетическое изменение, приводящее к повышению образования биопленки, включает генетическое изменение, приводящее к изменению экспрессии phoB.
118. Генетически сконструированная бактерия согласно пункту 113, где указанное генетическое изменение, приводящее к повышению образования биопленки, включает генетическое изменение, приводящее к изменению экспрессии phoR.
119. Генетически сконструированная бактерия согласно пункту 113, где указанное генетическое изменение, приводящее к повышению образования биопленки, включает генетическое изменение, приводящее к изменению экспрессии MucA.
120. Генетически сконструированная бактерия с улучшенной выживаемостью в ризосфере по сравнению с несконструированной бактерией того же вида, где указанная бактерия содержит генетическое изменение, приводящее к повышению экспрессии фермента, разрушающего клеточную стенку.
121. Генетически сконструированная бактерия согласно пункту 120, где указанный фермент, разрушающий клеточную стенку, включает полигалактуроназу.
122. Генетически сконструированная бактерия согласно пункту 120, где указанный фермент, разрушающий клеточную стенку, включает целлюлазу.
123. Генетически сконструированная бактерия согласно пункту 120, где указанный фермент, разрушающий клеточную стенку, включает pehA.
124. Генетически сконструированная бактерия согласно любому из положений 19-123, представляющая собой генетически сконструированную диазотрофную бактерию.
125. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия не является межродовой.
126. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия является межродовой.
127. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия способна фиксировать атмосферный азот в присутствии экзогенного азота.
128. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию в генетической сети азотфиксации.
129. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию в NifA.
130. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию, приводящую к повышению экспрессии NifA.
131. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию в NifL.
132. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию, приводящую к снижению экспрессии NifL.
133. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию в NifH.
134. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию, приводящую к повышению экспрессии NifH.
135. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию, приводящую к повышению экспрессии кластера генов Nif.
136. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию в генетической сети ассимиляции азота.
137. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию в GlnE.
138. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию, приводящую к снижению активности GlnE.
139. Генетически сконструированная бактерия согласно любому из положений 19-123, где указанная генетически сконструированная бактерия содержит модификацию, приводящую к снижению активности amtB.
140. Способ увеличения количества получаемого из атмосферы азота в растении, включающий приведение указанного растения в контакт с множеством указанных генетически сконструированных бактерий согласно любому из положений 19-139.
141. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к семени указанного растения.
142. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к проростку указанного растения.
143. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению в составе жидкого препарата.
144. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению после посадки, но до сбора урожая указанного растения.
145. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению в качестве подкормки.
146. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению в период от одного месяца до восьми месяцев после прорастания.
147. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению в период от двух месяцев до восьми месяцев после прорастания.
148. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению в период от одного месяца до трех месяцев после прорастания.
149. Способ согласно пункту 140, где указанную генетически сконструированную бактерию применяют к указанному растению в период от трех месяцев до шести месяцев после прорастания.
150. Способ согласно пункту 140, где указанное растение представляет собой растение зерновой культуры.
151. Способ согласно пункту 140, где указанное растение представляет собой растение кукурузы.
152. Способ согласно пункту 140, где указанное растение представляет собой растение риса.
153. Способ согласно пункту 140, где указанное растение представляет собой растение пшеницы.
154. Способ согласно пункту 140, где указанное растение представляет собой растение сои.
155. Композиция, содержащая семя и покрытие семени, где указанное покрытие семени содержит множество указанных генетически сконструированных бактерий согласно любому из положений 19-39.
156. Композиция согласно пункту 155, где указанное семя представляет собой семя зерновой культуры.
157. Композиция согласно пункту 155, где указанное семя выбрано из группы, состоящей из семени кукурузы, семени пшеницы, семени риса, семени сои, семени ржи и семени сорго.
158. Композиция, содержащая растение и множество указанных генетически сконструированных бактерий согласно любому из положений 19-39.
159. Композиция согласно пункту 158, где указанное растение представляет собой проросток.
160. Композиция согласно пункту 158, где указанное семя представляет собой семя зерновой культуры.
161. Композиция согласно пункту 158, где указанное семя выбрано из группы, состоящей из кукурузы, риса, пшеницы, сои, ржи и сорго.
162. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности транспортера серы.
163. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта серы.
164. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности транспортера молибдена.
165. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта молибдена.
166. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности транспортера железа.
167. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта железа.
168. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению биосинтеза сидерофоров.
169. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена, контролирующего биосинтез сидерофоров.
170. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности поглотителя активных форм кислорода.
171. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за поглощение активных форм кислорода.
172. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в сигнализации о кворуме.
173. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за сигнализацию о кворуме.
174. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности агглютининов.
175. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии агглютининов.
176. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в образовании биопленки.
177. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за образование биопленки.
178. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности белка биосинтеза АГЛ.
179. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена биосинтеза АГЛ.
180. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению активности фермента, разрушающего клеточную стенку.
181. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению экспрессии гена фермента, разрушающего клеточную стенку.
182. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению генетической сети азотфиксации.
183. Способ повышения азотфиксации у микроорганизма, включающий введение генетической модификации, приводящей к изменению генетической сети ассимиляции азота.
184. Способ повышения азотфиксации микроорганизмом, включающий введение генетической модификации в ген из группы, состоящей из rpoE, rseA, cysP, cysZ, cysK, cysT, cysW, cysA, sbp, оперона cysZK, оперона cysPTWA, modE, modB, modA, оперона modEB, оперона modEBA, exbA, exbB, tonB, оперона exbAB, isyhfA, yusV, sbnA, yfiZ, fiu, fur, glgA, NifA, nifH, nifD, nifK, grxA, grxB, grxC, grxD, trxA, trxC, tpx, оперона grxABCD, оперона cydABX, cydX из оперона cydAB, cydA, cyddB, glbN, fixNOPQ, fixN, fixO, foxP, fixQ, asnB, asnA, glnL, уридилилтрансферазы, amtB, glnK, GDH и glnD.
186. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности транспортера серы.
187. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта серы.
188. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности транспортера молибдена.
189. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта молибдена.
190. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности транспортера железа.
191. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта железа.
192. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению биосинтеза сидерофоров.
193. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена, контролирующего биосинтез сидерофоров.
194. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности поглотителя активных форм кислорода.
195. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за поглощение активных форм кислорода.
196. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в сигнализации о кворуме.
197. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за сигнализацию о кворуме.
198. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности агглютининов.
199. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии агглютининов.
200. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в образовании биопленки.
201. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за образование биопленки.
202. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности белка биосинтеза АГЛ.
203. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена биосинтеза АГЛ.
204. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению активности фермента, разрушающего клеточную стенку.
205. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению экспрессии гена фермента, разрушающего клеточную стенку.
206. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению генетической сети азотфиксации.
207. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации, приводящей к изменению генетической сети ассимиляции азота.
208. Способ повышения экскреции аммония микроорганизмом, включающий введение генетической модификации в ген из группы, состоящей из rpoE, rseA, cysP, cysZ, cysK, cysT, cysW, cysA, sbp, оперона cysZK, оперона cysPTWA, modE, modB, modA, оперона modEB, оперона modEBA, exbA, exbB, tonB, оперона exbAB, isyhfA, yusV, sbnA, yfiZ, fiu, fur, glgA, NifA, nifH, nifD, nifK, grxA, grxB, grxC, grxD, trxA, trxC, tpx, оперона grxABCD, оперона cydABX, cydX из оперона cydAB, cydA, cyddB, glbN, fixNOPQ, fixN, fixO, foxP, fixQ, asnB, asnA, glnL, уридилилтрансферазы, amtB, glnK, GDH и glnD.
209. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в прикреплении к корням.
210. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена белка, участвующего в прикреплении к корням.
211. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности транспортера молибдена.
212. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта молибдена.
213. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности транспортера железа.
214. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена транспорта железа.
215. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению биосинтеза сидерофоров.
216. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена, контролирующего биосинтез сидерофоров.
217. Способ повышения выживаемости микроорганизма в рихосфере, включающий введение генетической модификации, приводящей к изменению активности поглотителя активных форм кислорода.
218. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за поглощение активных форм кислорода.
219. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в сигнализации о кворуме.
220. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за сигнализацию о кворуме.
221. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности агглютининов.
222. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии агглютининов.
223. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности белка, участвующего в образовании биопленки.
224. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена, ответственного за образование биопленки.
225. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности белка биосинтеза АГЛ.
226. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена биосинтеза АГЛ.
227. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению активности фермента, разрушающего клеточную стенку.
228. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению экспрессии гена фермента, разрушающего клеточную стенку.
229. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению генетической сети азотфиксации.
230. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации, приводящей к изменению генетической сети ассимиляции азота.
231. Способ повышения выживаемости микроорганизма в ризосфере, включающий введение генетической модификации в ген из группы, состоящей из fhaB, fhaC, yjbE, pssM, otsA, treY, smZ, lapA, phoB, phoR, MucA и pehA.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PIVOT BIO, INC.
<120> ГЕНЫ-МИШЕНИ ДЛЯ НАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА АЗОТФИКСАЦИЮ
ДЛЯ УЛУЧШЕНИЯ КАЧЕСТВ РАСТЕНИЙ
<130> 47736-715.601
<140> PCT/US18/57613
<141> 2018-10-25
<150> 62/577,149
<151> 2017-10-25
<160> 2
<170> PatentIn версии 3.5
<210> 1
<211> 9
<212> PRT
<213> Неизвестное
<220>
<223> Описание неизвестного:
Последовательность мотива белка семейства "LAGLIDADG"
<400> 1
Leu Ala Gly Leu Ile Asp Ala Asp Gly
1. 5
<210> 2
<211> 90
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
олигонуклеотид
<400> 2
gttgatcaga ccgatgttcg gaccttccaa ggtttcgatc ggacatacgc gaccgtagtg 60
ggtcgggtgt acgtctcgaa cttcaaagcc 90
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ ПРИЗНАКОВ РАСТЕНИЙ | 2016 |
|
RU2775712C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ ПРИЗНАКОВ РАСТЕНИЙ | 2016 |
|
RU2769873C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ ПРИЗНАКОВ РАСТЕНИЙ | 2018 |
|
RU2797537C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ СЕМЕЙСТВА ГЛУТАМАТА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA | 2009 |
|
RU2420586C2 |
| Микроорганизм, обладающий усиленной способностью продуцировать L-глутамин, и способ получения L-глутамина с его применением | 2021 |
|
RU2835802C1 |
| МУТАНТНАЯ ГЛУТАМИНСИНТЕТАЗА, ФРАГМЕНТ ДНК, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ L-ГЛУТАМИНА И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ | 2001 |
|
RU2230114C2 |
| БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ ESCHERICHIA, - ПРОДУЦЕНТ L-ЦИСТЕИНА И СПОСОБ ПОЛУЧЕНИЯ L-ЦИСТЕИНА | 2003 |
|
RU2275425C2 |
| РЕКОМБИНАНТНЫЕ МИКРООРГАНИЗМЫ, ПРОДУЦИРУЮЩИЕ МЕТИОНИН | 2006 |
|
RU2447146C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2009 |
|
RU2518677C2 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ПУРИНОВОГО НУКЛЕОЗИДА 5'-АМИНОИМИДАЗОЛ-4-КАРБОКСАМИДРИБОЗИДА (АИКАР) И ШТАММ БАКТЕРИЙ BACILLUS SUBTILIS - ПРОДУЦЕНТ АИКАР | 2008 |
|
RU2405833C2 |

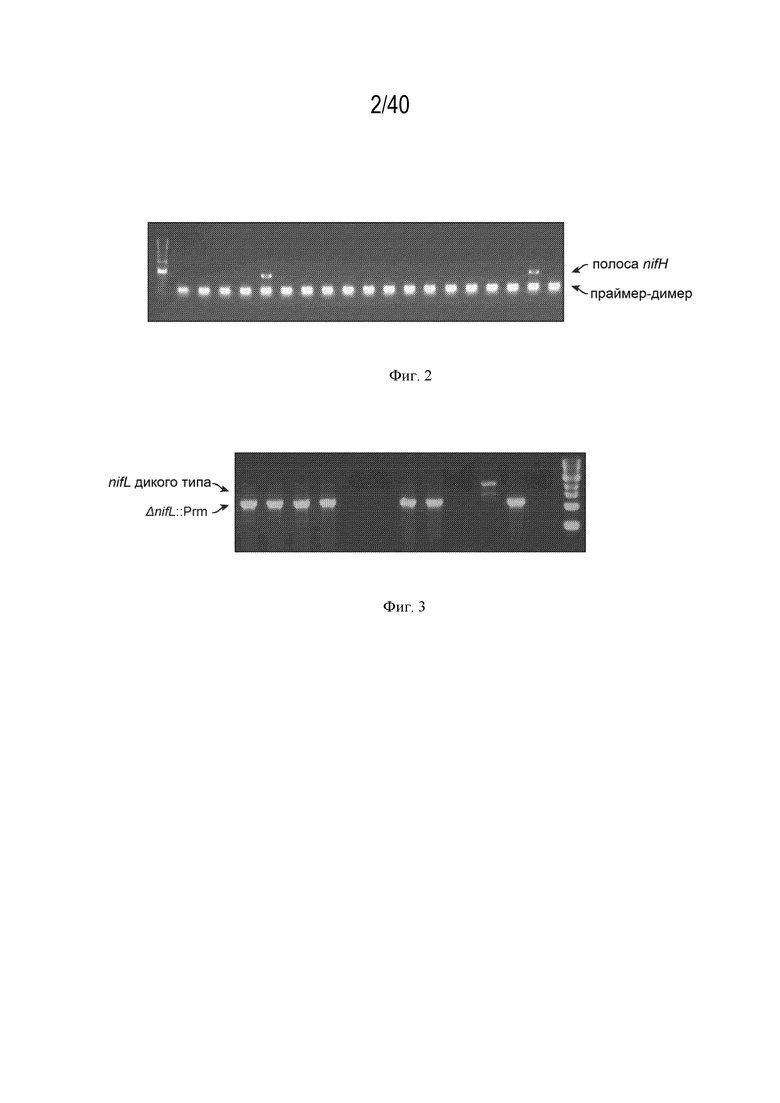
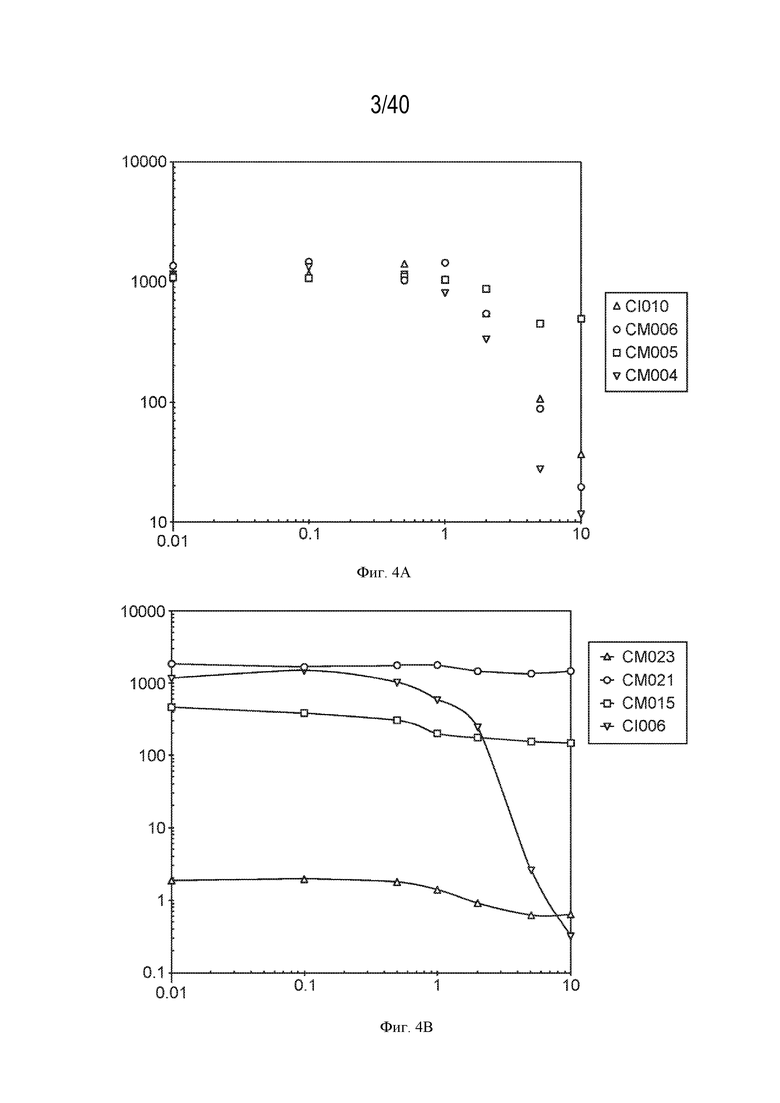
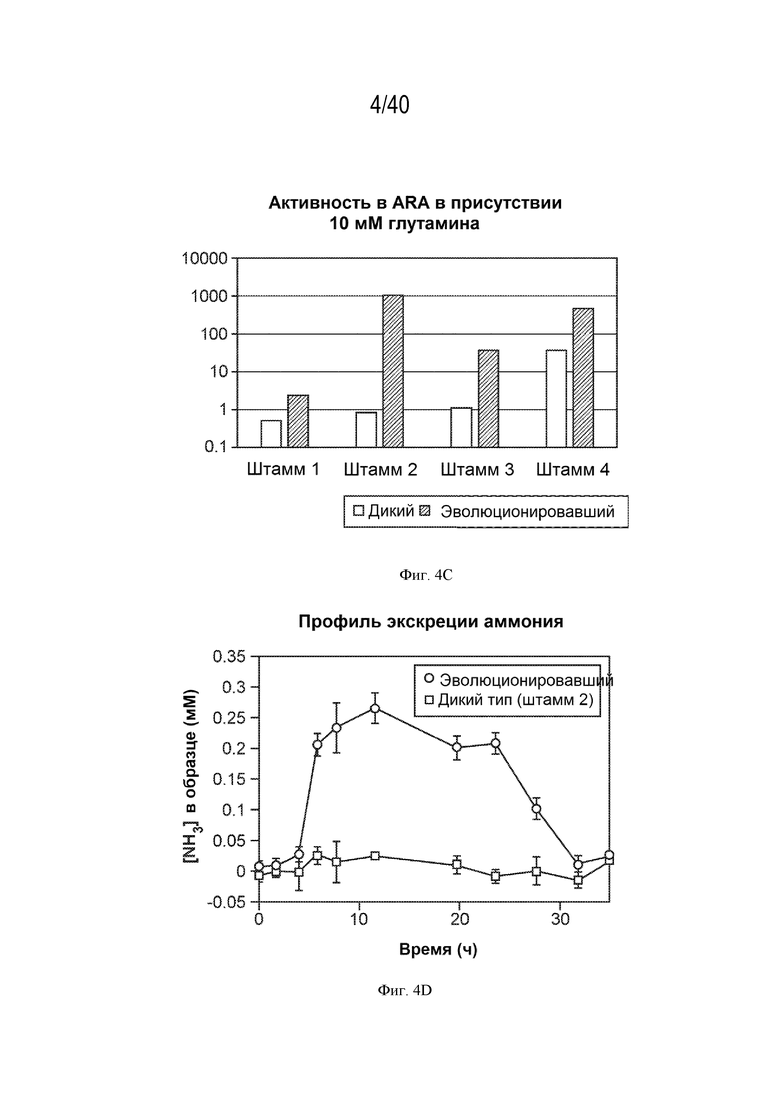
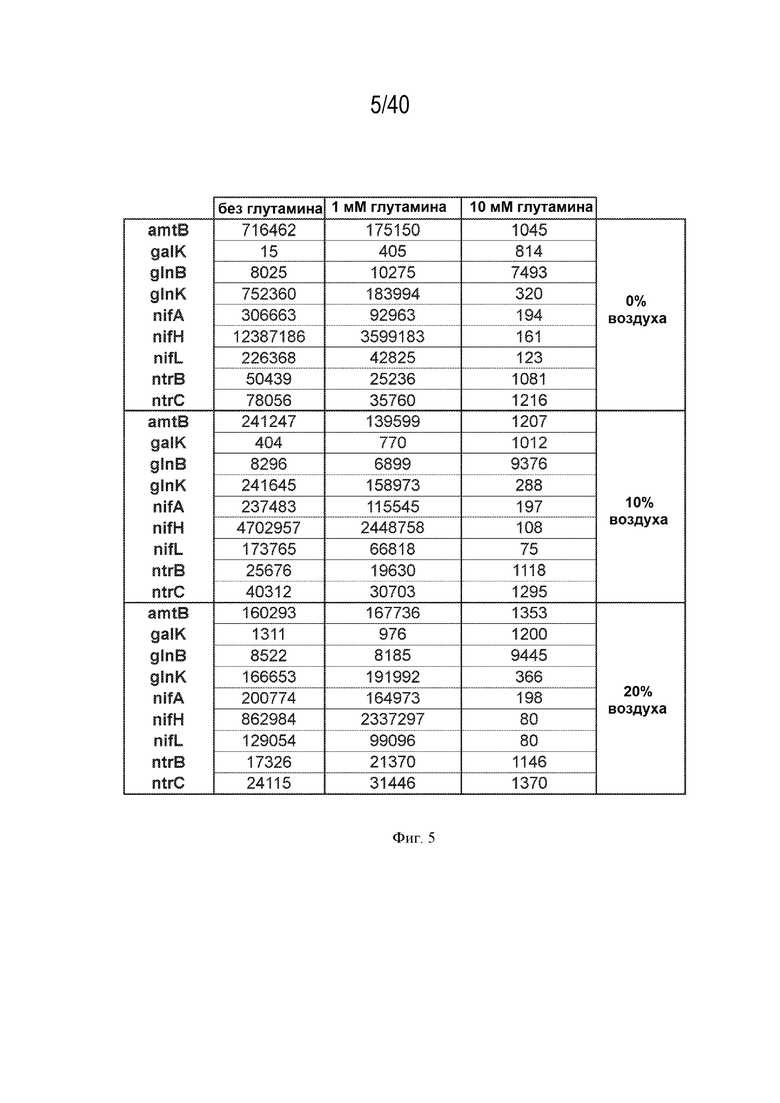
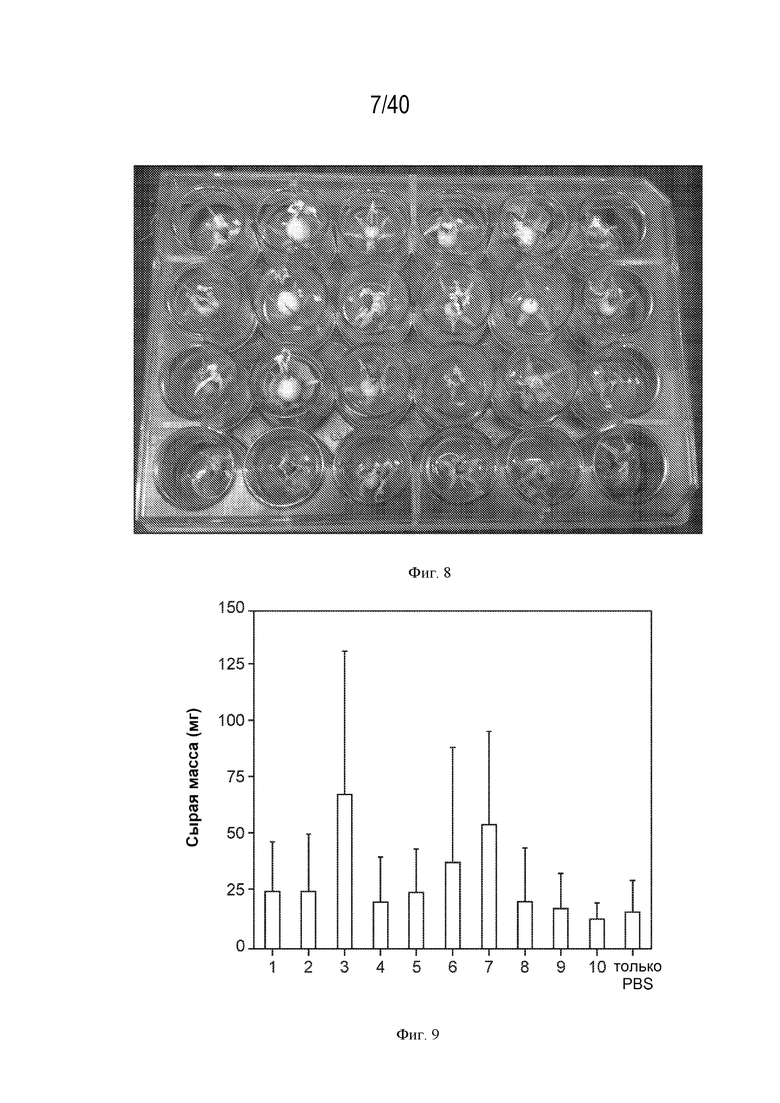
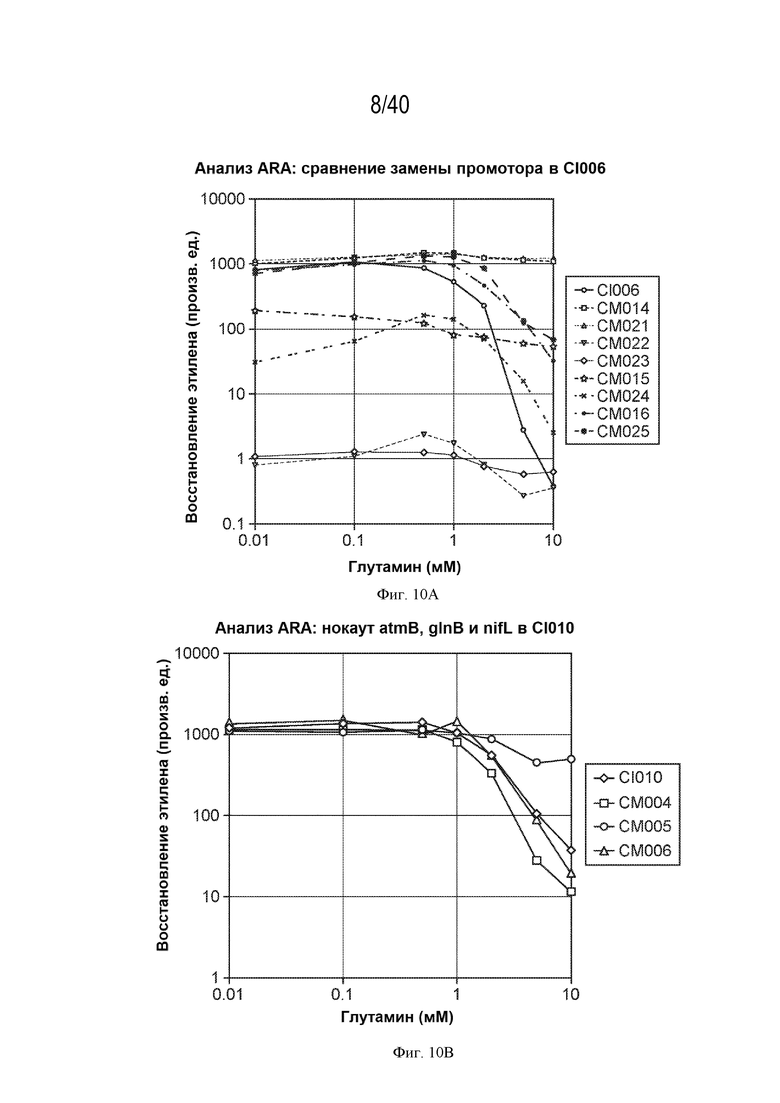
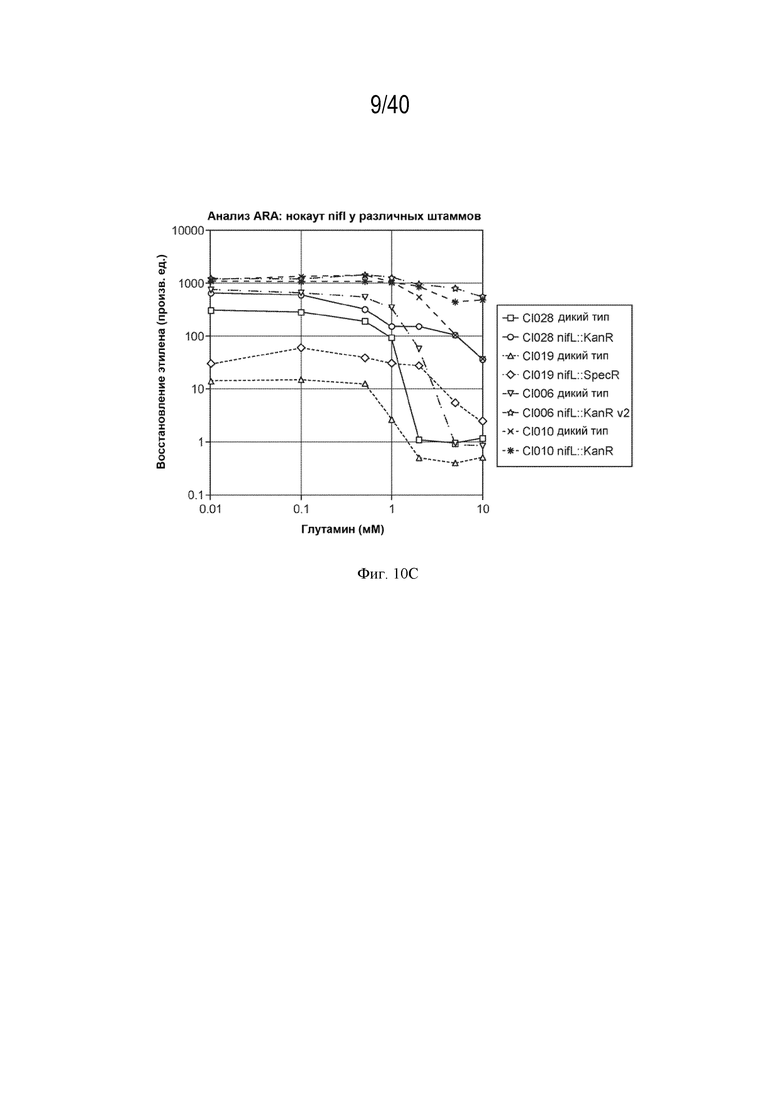
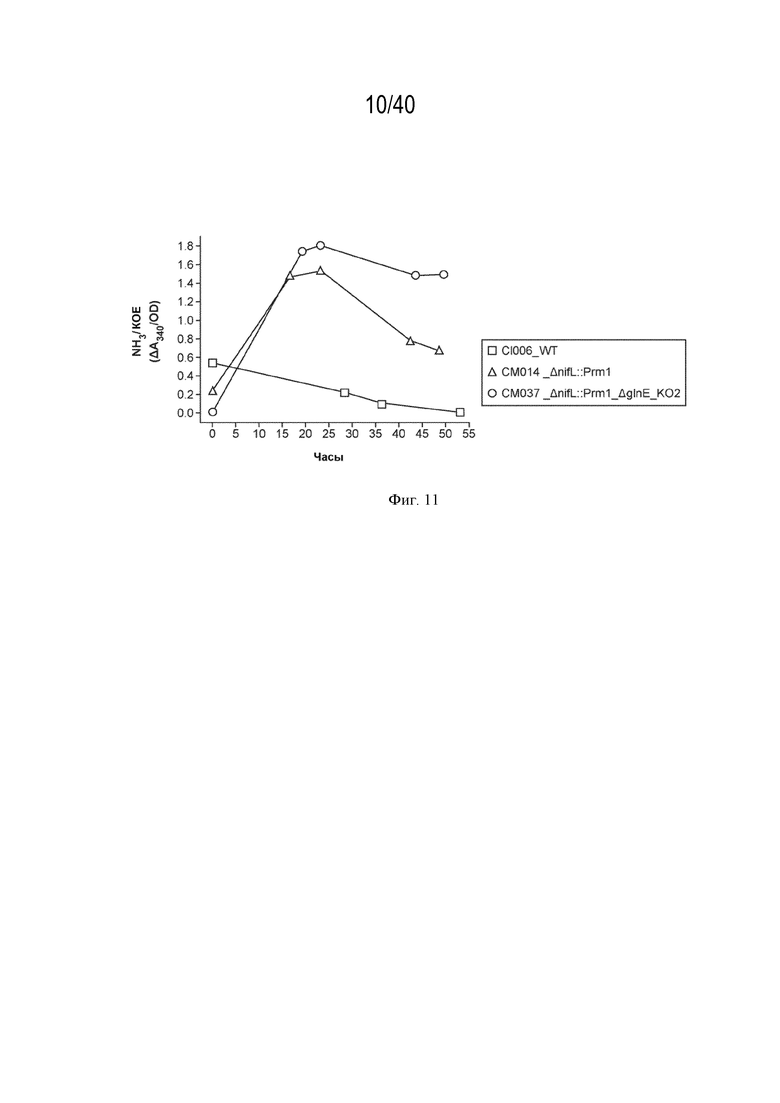


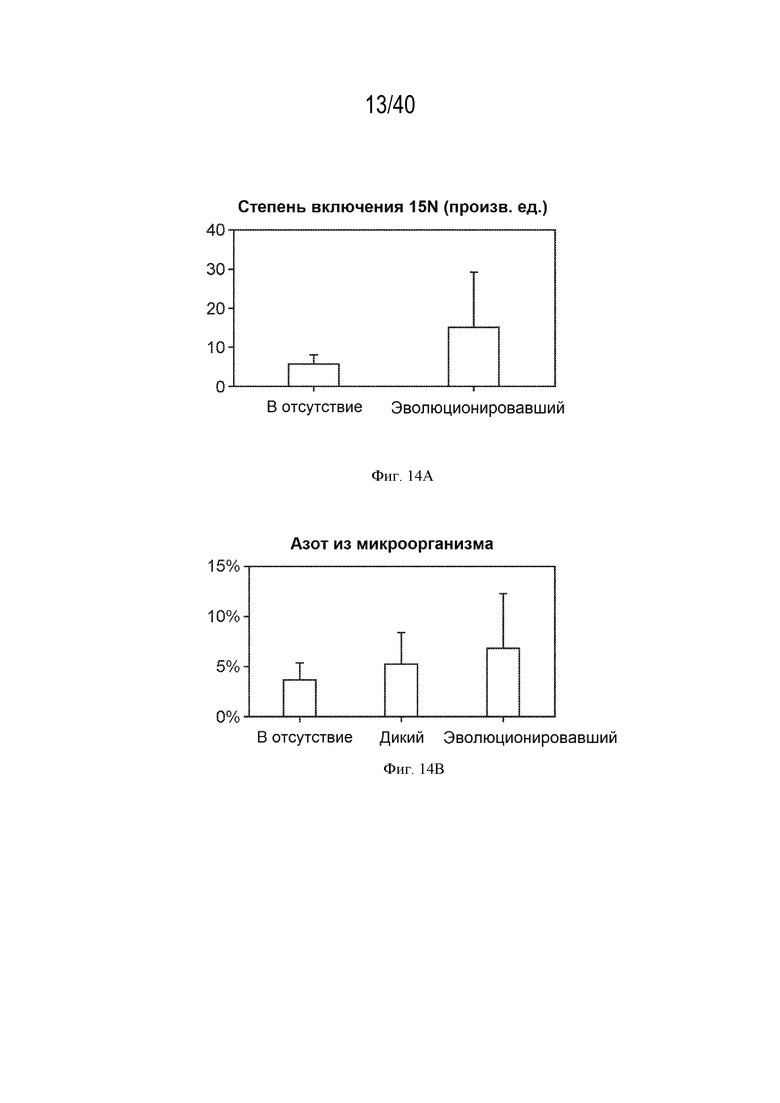
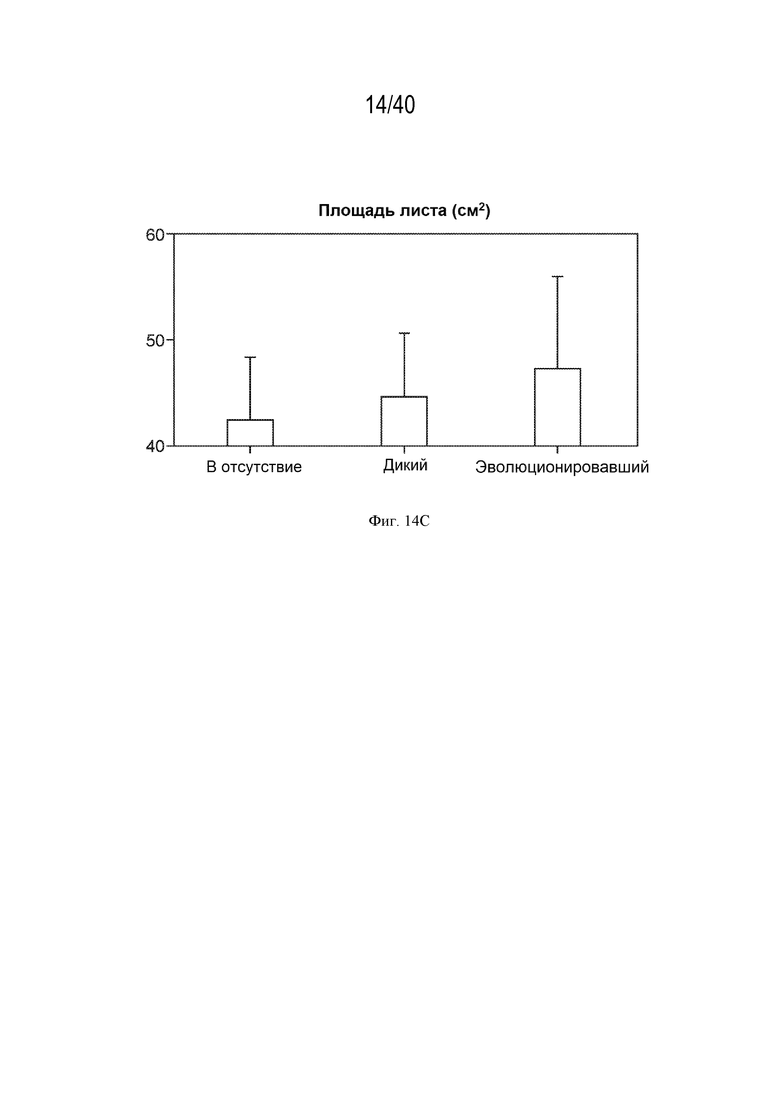
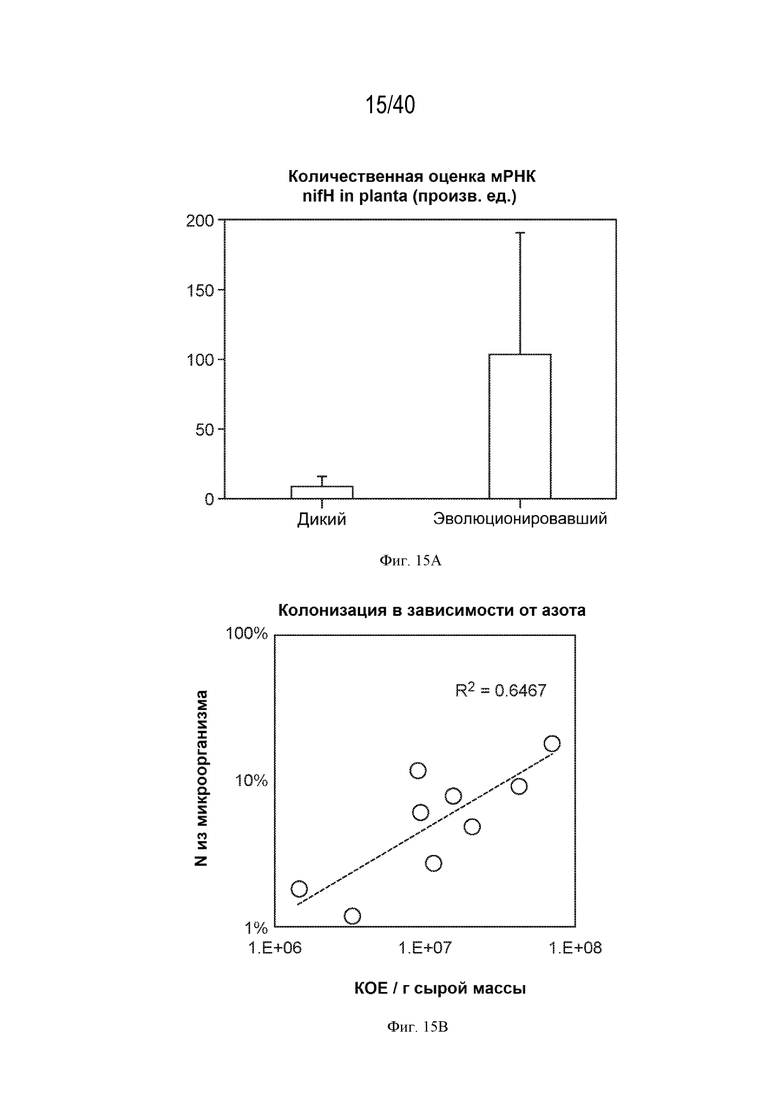

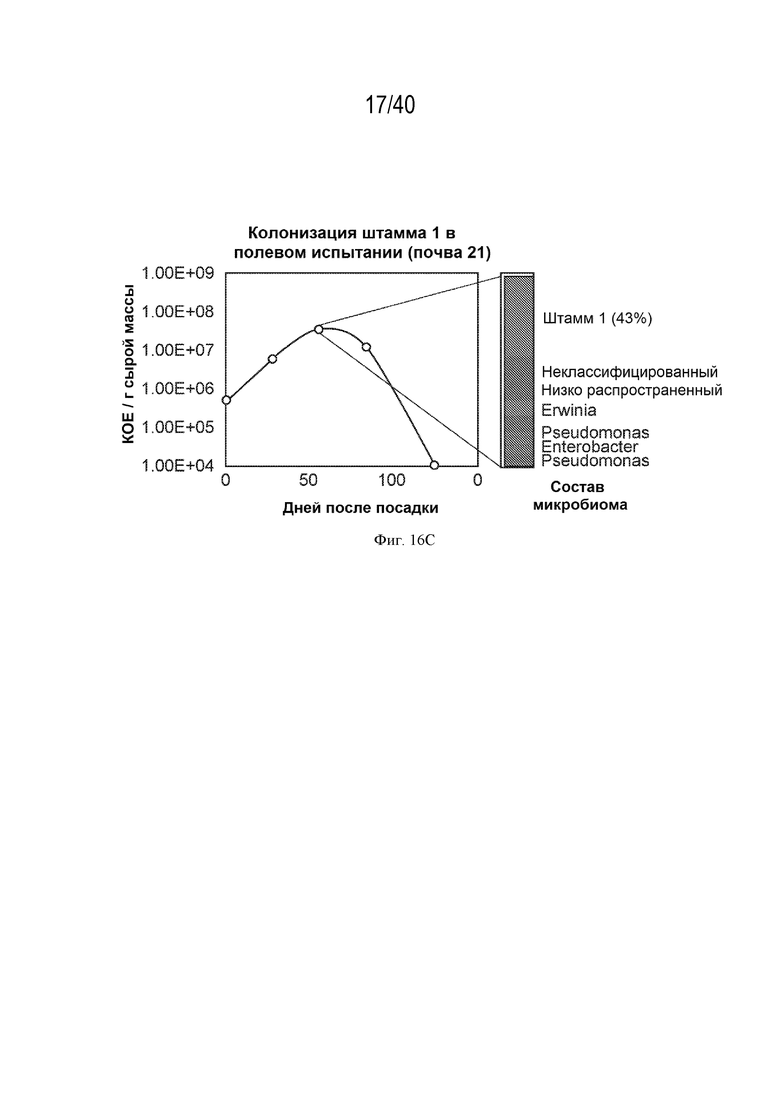
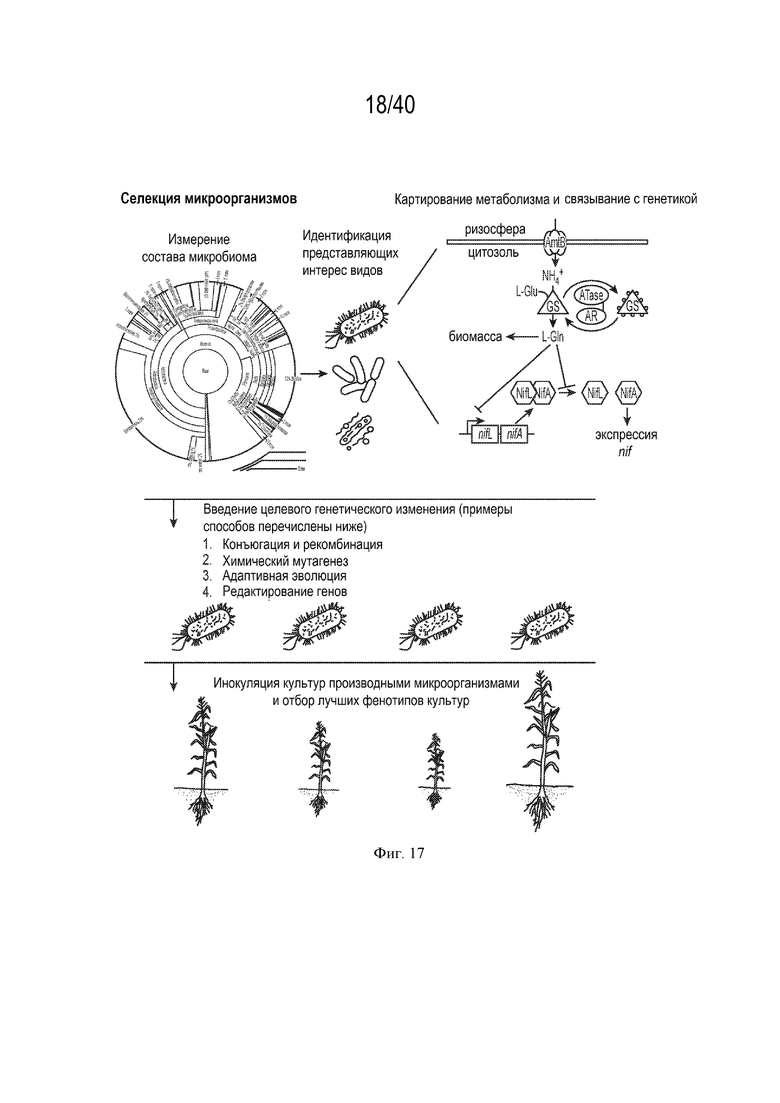
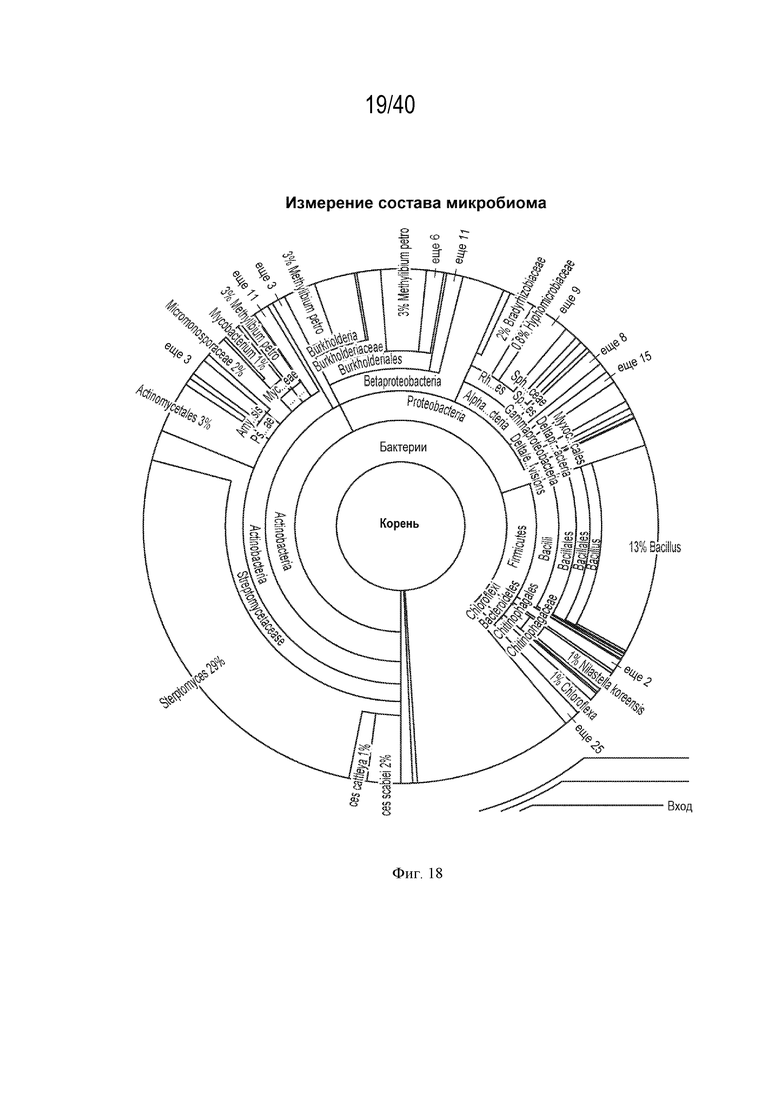

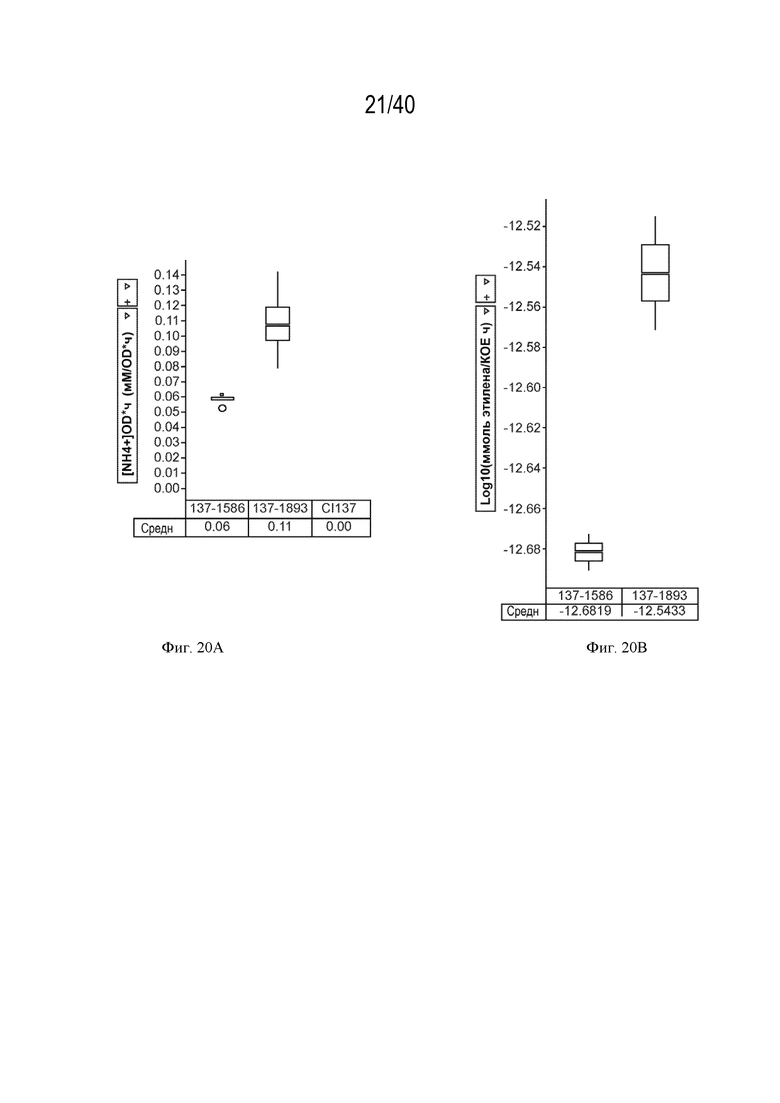
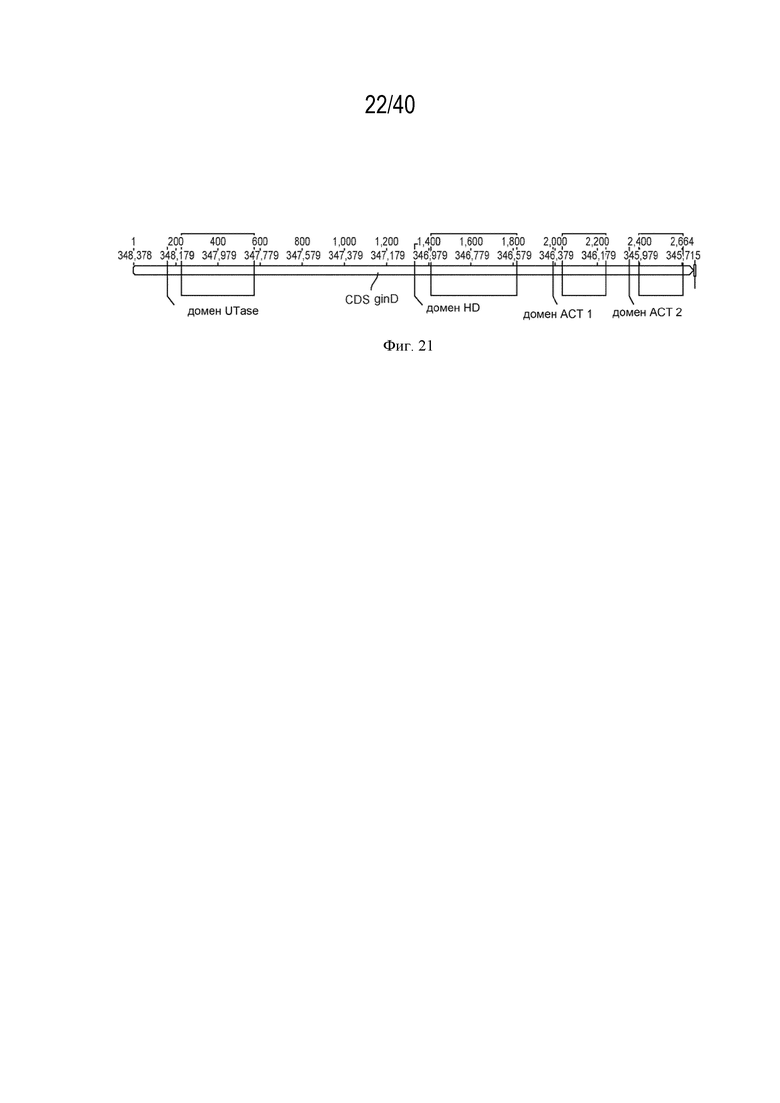

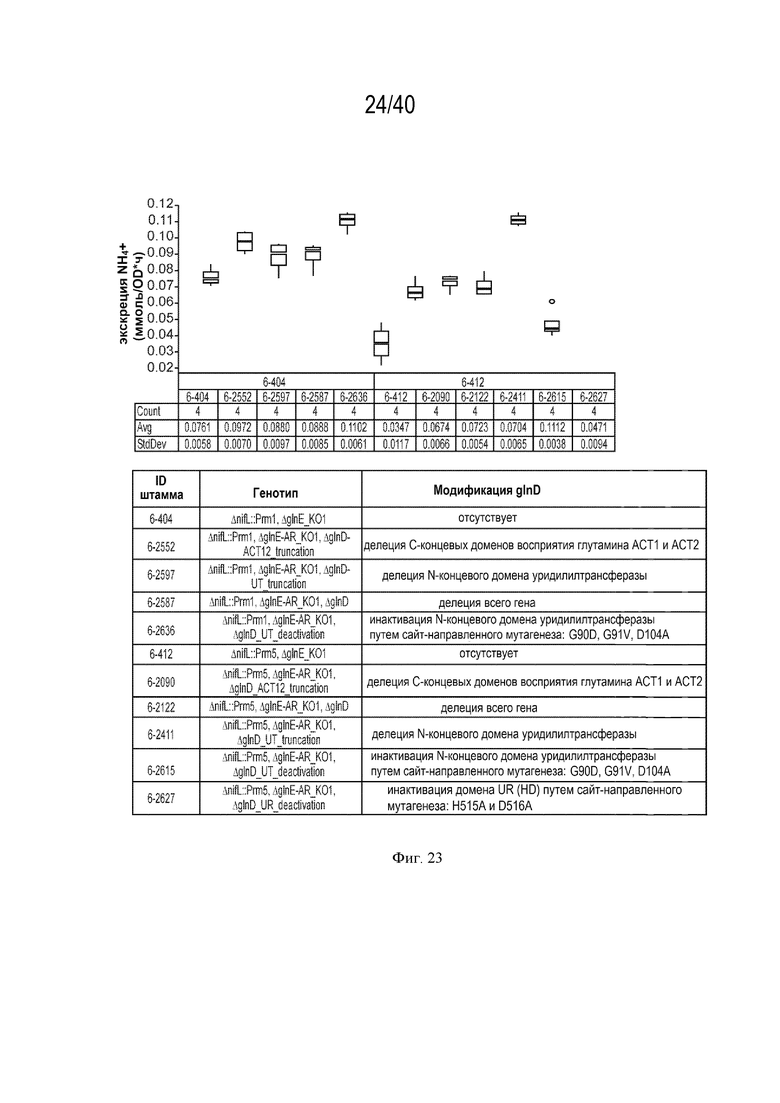
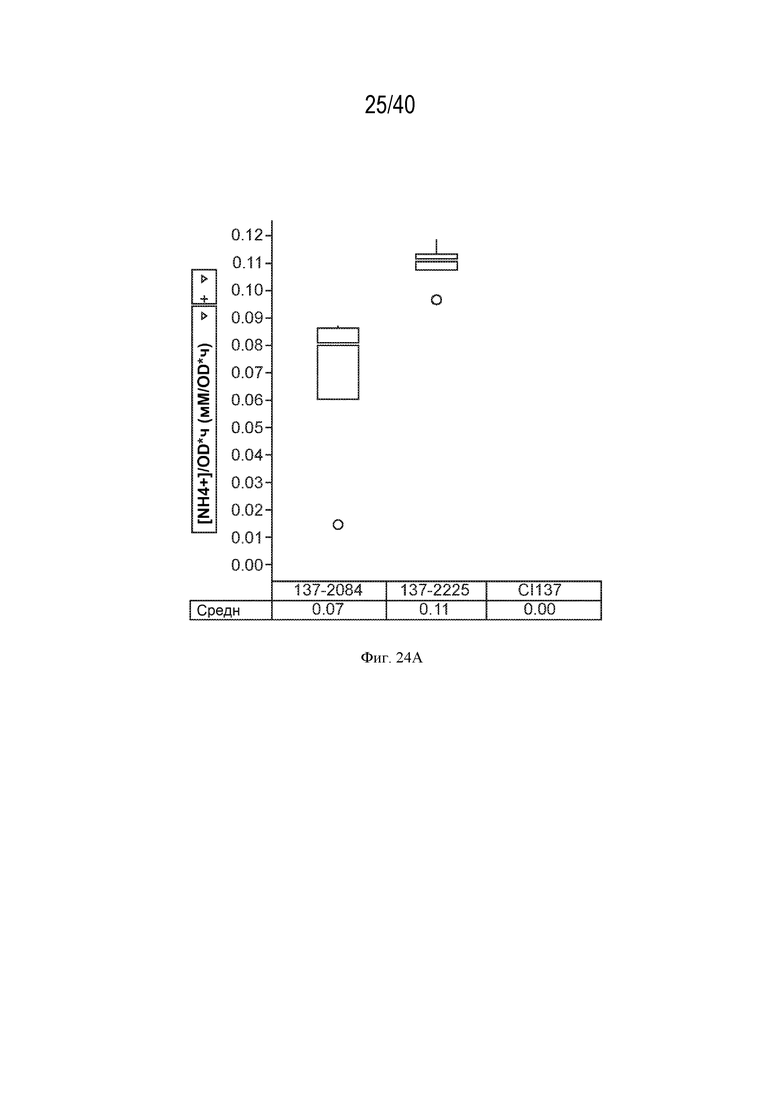


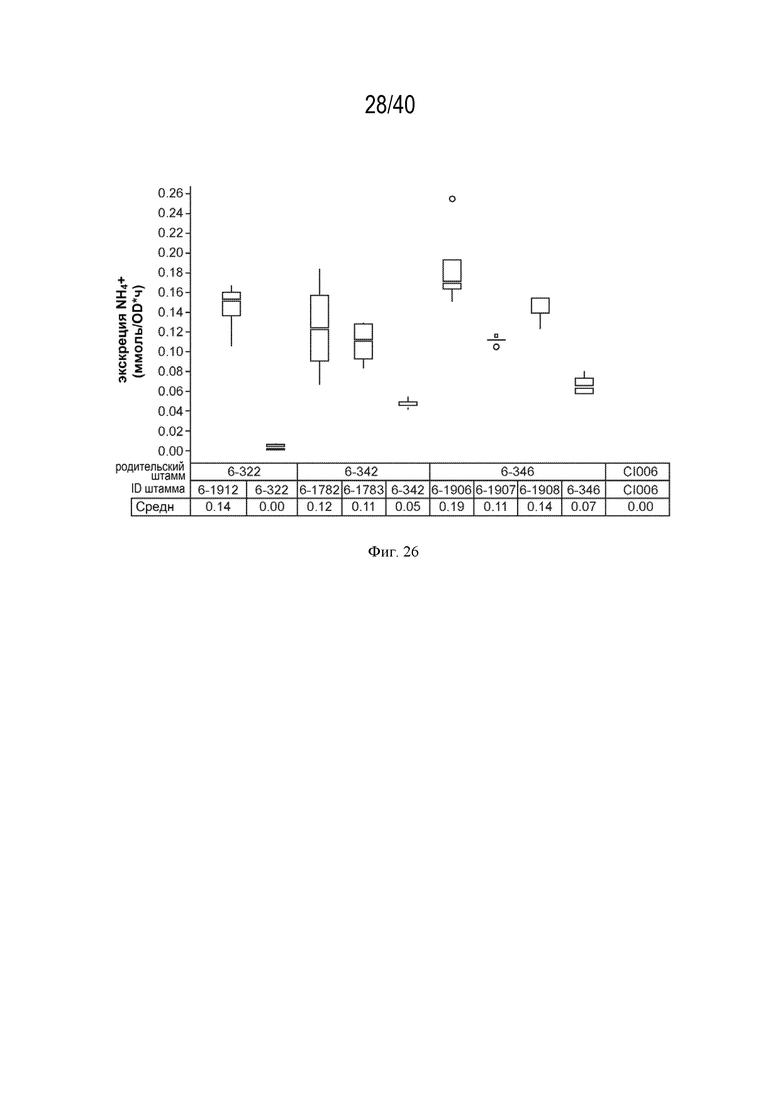


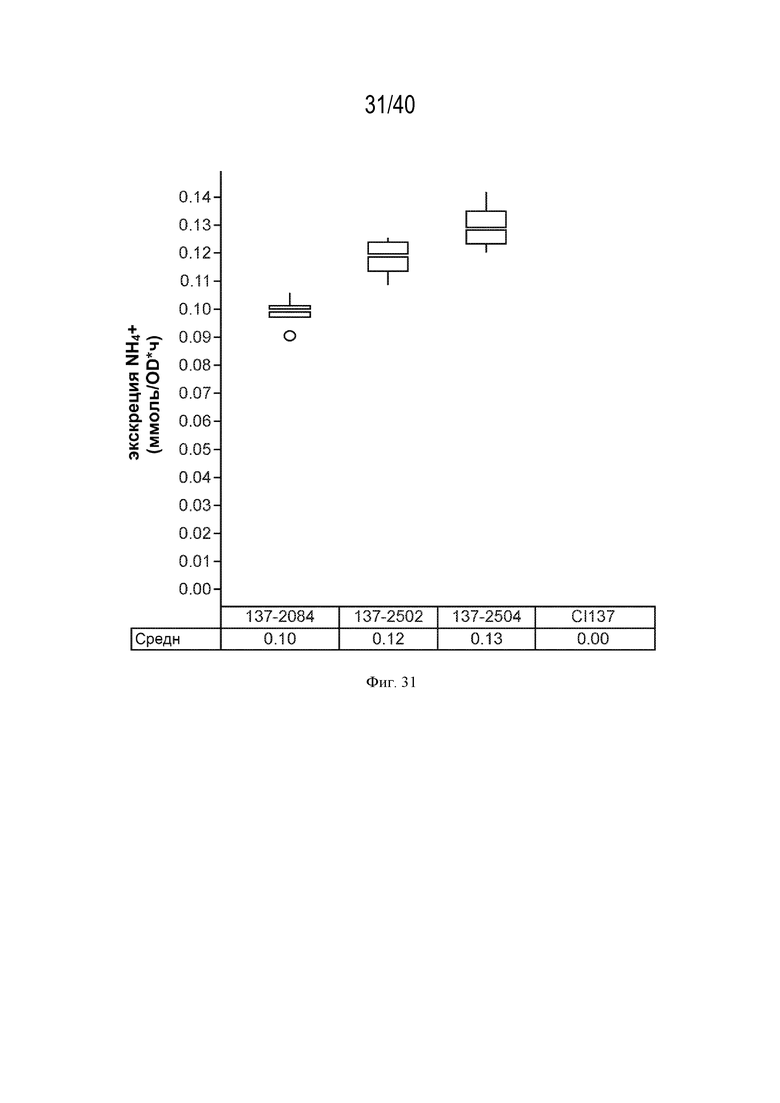
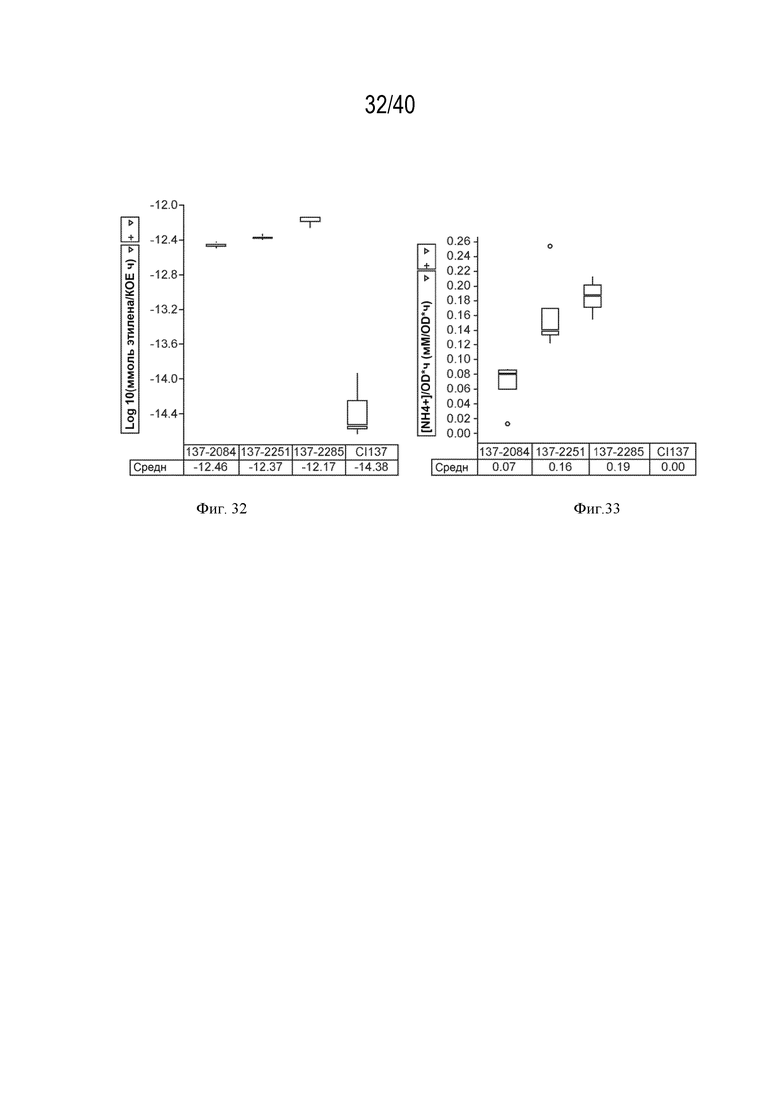

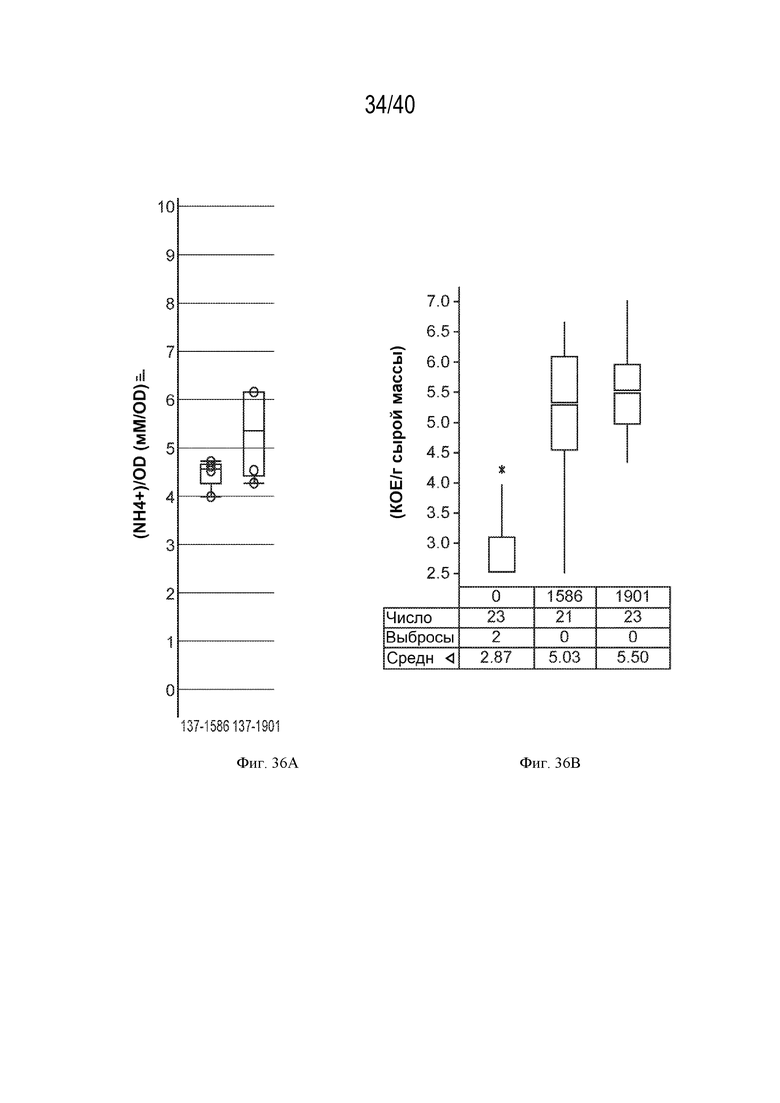
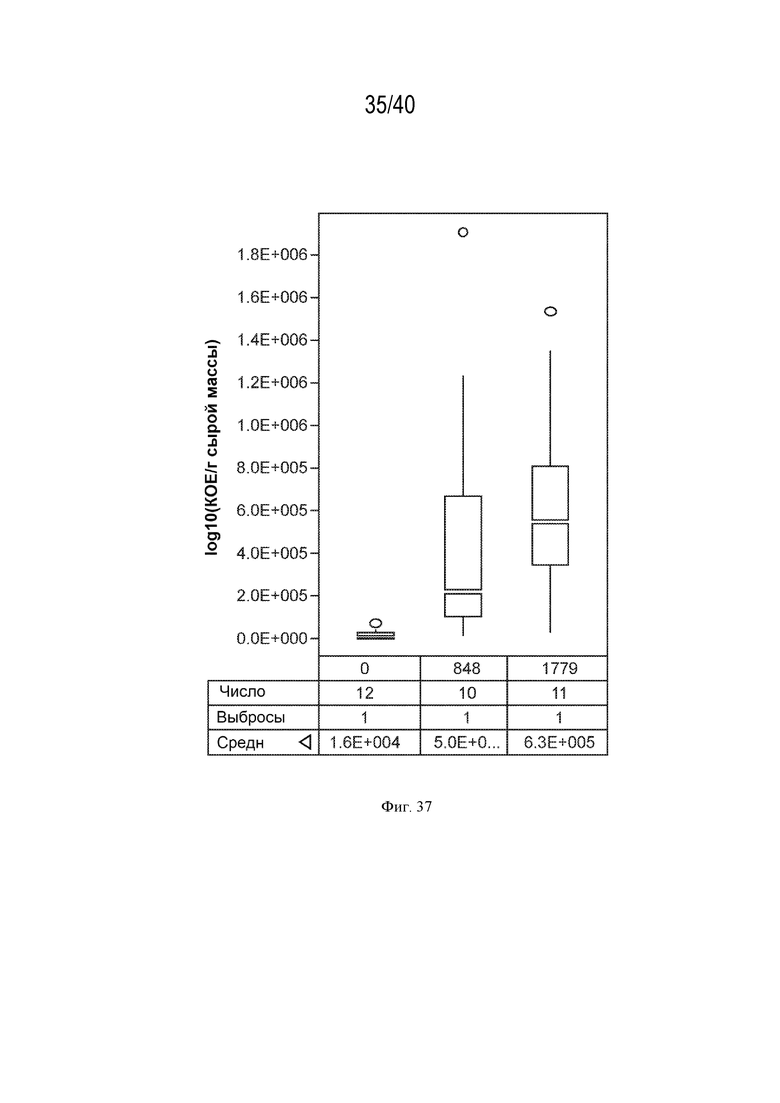
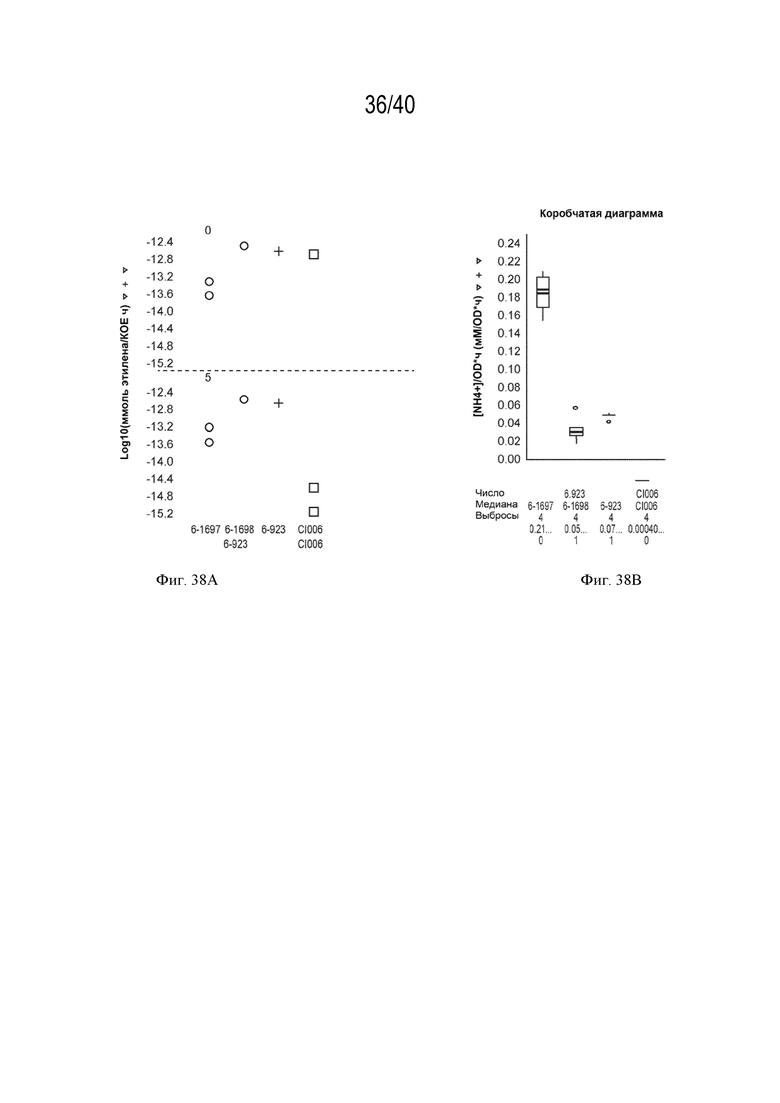

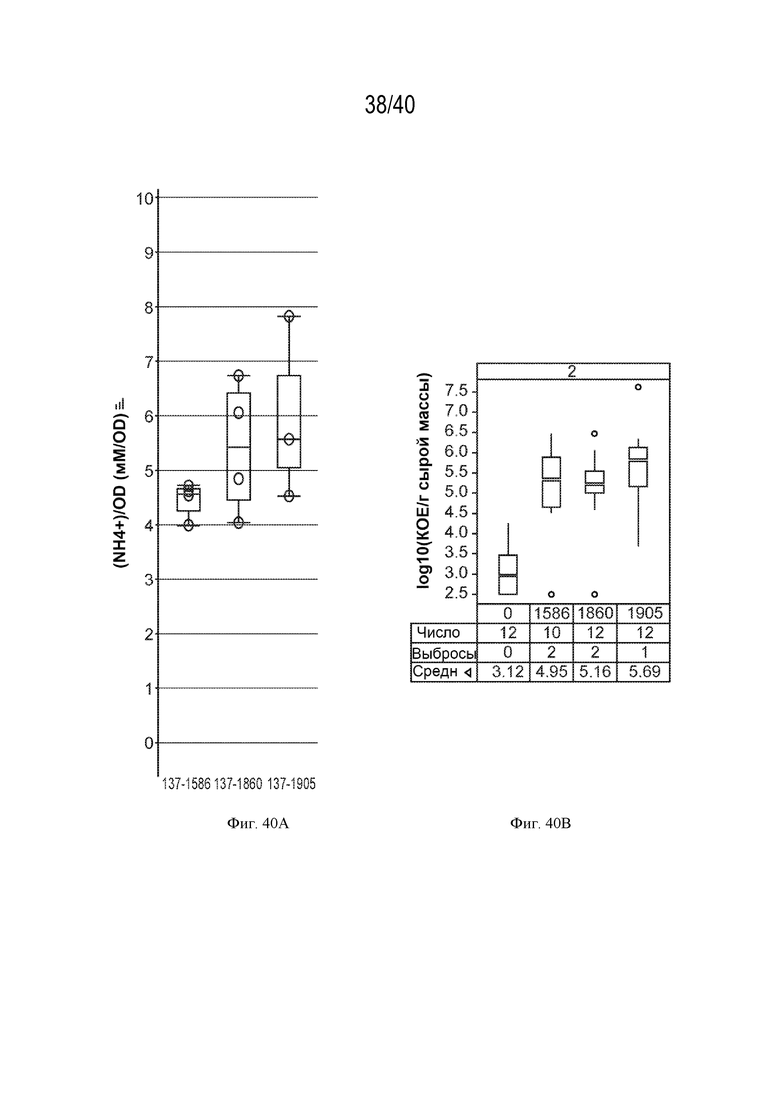
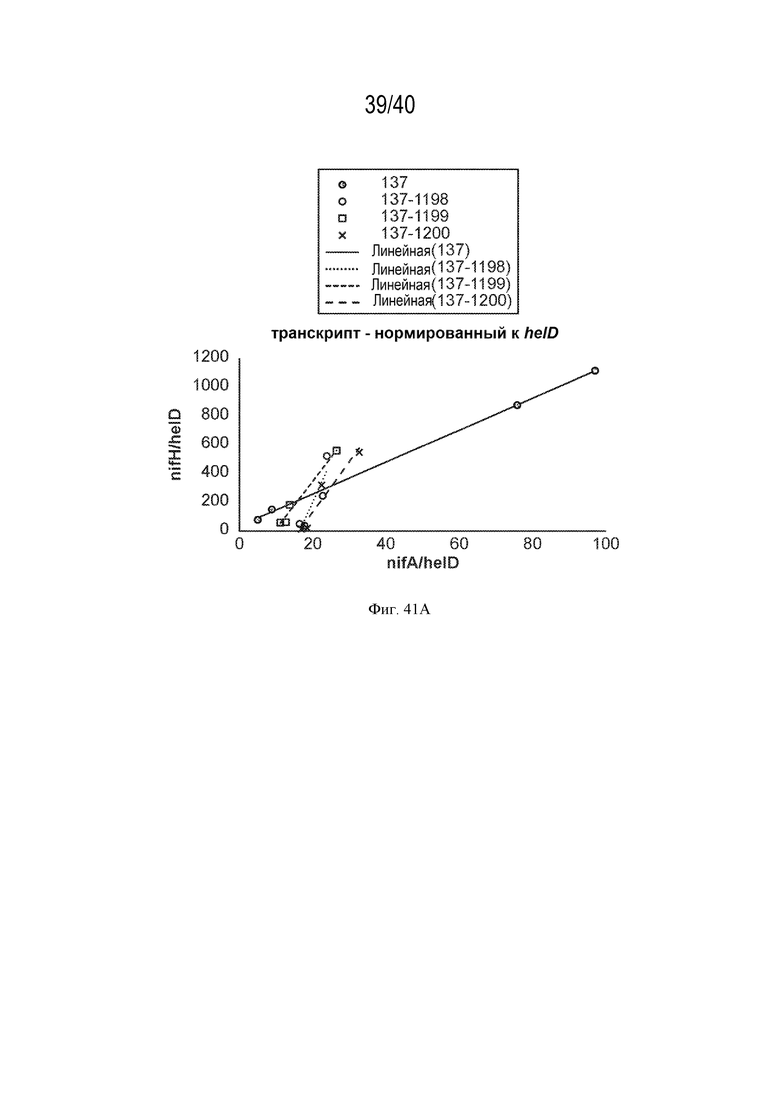
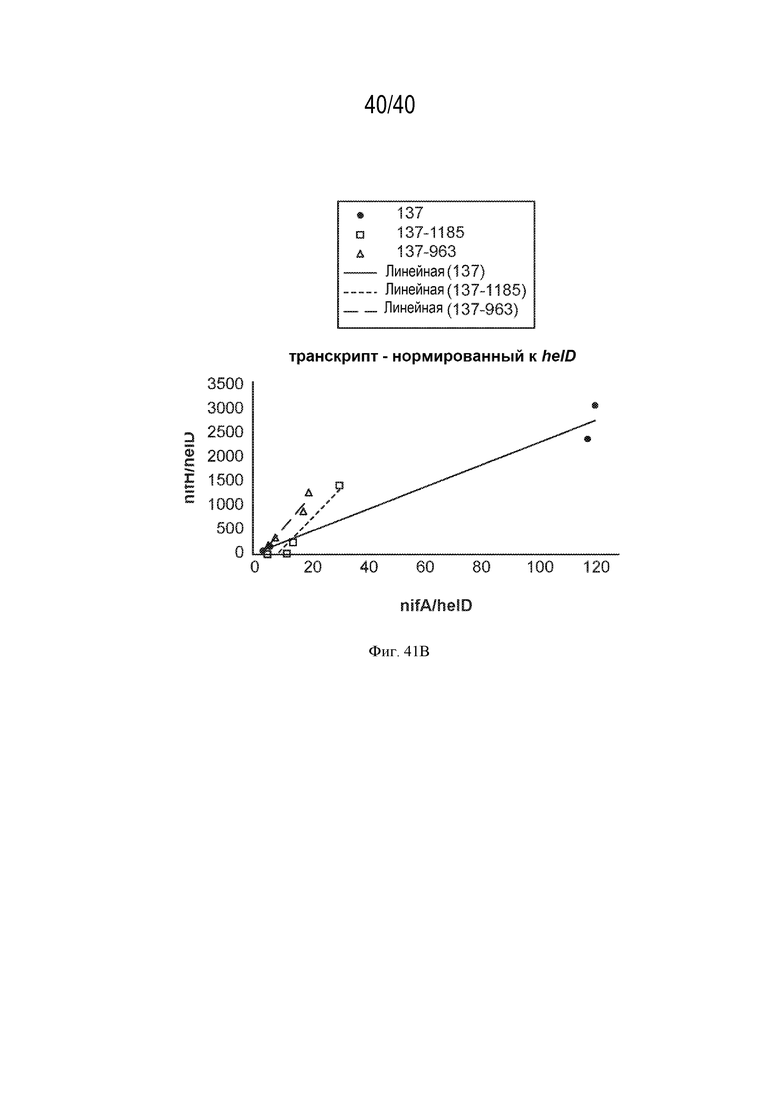
Изобретение относится к биотехнологии и сельскому хозяйству и представляет собой генетически сконструированную диазотрофную бактерию, способную увеличивать количество атмосферного азота в растении, имеющую повышенную экспрессию rpoN, причем экспрессия rpoN повышена путем делеции нативного промотора rpoN и замены конститутивным промотором. Изобретение позволяет увеличить количество получаемого из атмосферы азота в растении путем приведения растения в контакт с множеством указанных генетически сконструированных диазотрофных бактерий. 6 н. и 15 з.п. ф-лы, 41 ил., 8 табл., 28 пр.
1. Генетически сконструированная диазотрофная бактерия, способная увеличивать количество атмосферного азота в растении, имеющая повышенную экспрессию rpoN, причем экспрессия rpoN повышена путем делеции нативного промотора rpoN и замены конститутивным промотором.
2. Генетически сконструированная диазотрофная бактерия по п.1, где указанная генетически сконструированная диазотрофная бактерия дополнительно содержит генетическую модификацию в glnD, где указанная генетическая модификация выбрана из группы, состоящей из: делеции всего гена, делеции по существу всего гена, делеции домена ACT, делеции более 50% домена ACT, инактивации домена ACT, снижения уридил-удаляющей активности glnD по сравнению с бактерией дикого типа, удаления уридил-удаляющей активности glnD и инактивации домена Utase.
3. Генетически сконструированная диазотрофная бактерия по п.2, где указанная генетическая модификация в glnD включает делецию домена ACT, делецию более 50% домена ACT или инактивацию домена ACT.
4. Генетически сконструированная диазотрофная бактерия по любому из пп. 1-3, где указанная генетически сконструированная диазотрофная бактерия является межродовой.
5. Генетически сконструированная диазотрофная бактерия по любому из пп. 1-3, где указанная генетически сконструированная диазотрофная бактерия дополнительно содержит модификацию в генетической сети азотфиксации или модификацию в генетической сети ассимиляции азота.
6. Генетически сконструированная диазотрофная бактерия по любому из пп. 1-3, где указанная генетически сконструированная диазотрофная бактерия дополнительно содержит генетическую модификацию, приводящую к повышенной экспрессии NifA, генетическую модификацию, которая приводит к сниженной экспрессии NifL, генетическую модификацию, которая приводит к повышенной экспрессии NifH, генетическую модификацию, которая приводит к сниженной активности GlnE или генетическую модификацию, приводящую к сниженной активности AmtB.
7. Генетически сконструированная диазотрофная бактерия по любому из пп. 1-3, где указанная генетически сконструированная диазотрофная бактерия дополнительно содержит:
генетическая модификация, которая приводит к повышенной экспрессии NifA; и
генетическую модификацию, которая приводит к сниженной экспрессии NifL.
8. Способ увеличения количества получаемого из атмосферы азота в растении, включающий приведение указанного растения в контакт с множеством указанных генетически сконструированных диазотрофных бактерий по любому из пп. 1-7.
9. Способ по п.8, где указанную генетически сконструированную диазотрофную бактерию применяют к семени указанного растения, проростку указанного растения, растению после посадки, но до сбора урожая указанного растения или растению в качестве подкормки.
10. Способ по п.8, где указанную генетически сконструированную диазотрофную бактерию применяют к указанному растению в качестве жидкого препарата или применяют в период от одного месяца до восьми месяцев, в период от двух месяцев до восьми месяцев, в период от одного месяца до трех месяцев, или в период от трех месяцев до шести месяцев после прорастания.
11. Способ по п.8, где указанное растение выбрано из группы, состоящей из: растения зерновой культуры, растения кукурузы, растения риса, растения пшеницы или растения сои.
12. Композиция для нанесения на семя, где композиция содержит множество указанных генетически сконструированных диазотрофных бактерий по любому из пп. 1-7.
13. Композиция по п.12, где указанное семя представляет собой семя зерновой культуры, семя кукурузы, семя пшеницы, семя риса, семя сои, семя ржи или семя сорго.
14. Композиция для нанесения на растение, где композиция содержит множество указанных генетически сконструированных диазотрофных бактерий по любому из пп. 1-7, необязательно, где указанное растение представляет собой растение зерновой культуры, растение кукурузы, растение риса, растения пшеницы, растения сои, растения ржи или растения сорго.
15. Композиция по п.14, где указанное растение представляет собой проросток.
16. Семя для получения растения, имеющего увеличенное количество атмосферного азота, где указанное семя покрыто композицией по п.12.
17. Семя по п.16, отличающееся тем, что указанное семя представляет собой семя зерновой культуры, кукурузы, пшеницы, риса, сои, ржи или сорго.
18. Растение с увеличенным количеством атмосферного азота, содержащее множество генетически сконструированных диазотрофных бактерий по любому из пп.1-7.
19. Растение, имеющее увеличенное количество атмосферного азота, где указанное растение покрыто композицией по п.14.
20. Растение по п.18 или 19, где указанное растение представляет собой всход.
21. Растение по любому из пп.18-20, где указанное растение представляет собой растение зерновой культуры, растение кукурузы, растение риса, растение пшеницы, растение сои, растение ржи или растение сорго.
| WO 2017011602 A1, 19.01.2017 | |||
| WO 2010080184 A1, 15.07.2010 | |||
| RU 94045882 A1, 10.09.1996. |
Авторы
Даты
2023-10-11—Публикация
2018-10-25—Подача