ПЕРЕКРЕСТНАЯ ССЫЛКА
[0001] По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 62/192009, зарегистрированной 13 июля 2015 года, и предварительной патентной заявки США № 62/213567, зарегистрированной 2 сентября 2015 года, каждая из которых полностью включена в настоящий документ в качестве ссылки.
ЗАЯВЛЕНИЕ О ФИНАНСИРУЕМОМ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИИ
[0002] Настоящее изобретение осуществлено с поддержкой правительства Соединенных Штатов Америки в виде грана SBIR 1520545, выделенного национальным научным фондом (National Science Foundation). Правительство США обладает определенными правами на описываемый объект изобретения.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0003] Растения связаны с микробиомом общим метаболомом. Многомерная зависимость между конкретным признаком сельскохозяйственной культуры и лежащим в его основе метаболоме характеризуется рельефом с множеством локальных максимумов. Оптимизация от меньшего локального максимума к другому, представляющему улучшенный признак, посредством изменения влияния микробиома на метаболом может являться желательным по целому ряду причин, например, для оптимизации сельскохозяйственных культур. Для удовлетворения потребностей растущего мирового населения необходимы экономически, экологически и социально устойчивые подходы к сельскому хозяйству и производству пищевых продуктов. Продовольственная и сельскохозяйственная организация ООН прогнозирует, что для удовлетворения потребностей растущего населения к 2050 году общее производство пищевых продуктов должно увеличиться на 70%, задача, которая осложняется многочисленными факторами, включая уменьшение ресурсов пресной воды, увеличивающуюся конкуренцию за пахотные земли, растущие цены на энергоносители, растущие затраты на производство и подобные требования для адаптации культур к давлению более засушливого, жаркого и более экстремального глобального климата.
[0004] Одной из представляющих интерес областей является улучшение фиксации азота. Газообразный азот (N2) является основным компонентом атмосферы Земли. Кроме того, элементарный азот (N) является важным компонентом множества химических соединений, составляющих живые организмы. Однако многие организмы не могут непосредственно использовать N2 для синтеза химических соединений, используемых в физиологических процессах, таких как рост и воспроизводство. Для использования N2 необходимо, чтобы N2 был комбинирован с водородом. Комбинирование водорода с N2 обозначают как фиксация азота. Фиксация азота, проводимая химически или биологически, требует затрат большого количества энергии. В биологических системах реакцию, которая приводит к фиксации азота, катализирует фермент, известный как нитрогеназа. Важной целью исследований фиксации азота является расширение этого фенотипа на небобовые растения, конкретно на важные агротехнические травы, такие как пшеница, рис и кукуруза. Несмотря на большой прогресс в понимании развития азотфиксирующего симбиоза между клубеньковыми бактериями и бобовыми, путь для использования этого знания для индукции азотфиксирующих клубеньков у небобовых культур все еще не ясен. Между тем, проблема обеспечения достаточных дополнительных источников азота, такого как в удобрениях, будет продолжать расти вместе с растущей необходимостью в увеличении производства пищевых продуктов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] В свете указанного выше существует необходимость в улучшении признаков растений, придаваемых ассоциированным микробиомом. Настоящее изобретение решает эту задачу, а также обеспечивает дополнительные преимущества. В определенных случаях мишенями для модуляции влияния микроорганизмов на метаболом являются виды, составляющие микробиом, и определяющая их генетика.
[0006] В одном из аспектов настоящее изобретение относится к способу увеличения фиксации азота небобовыми растениями, где способ включает воздействие на растение множеством бактерий, где каждый представитель множества несет одну или несколько генетических вариаций, вносимых в один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота бактерий так, что бактерии становятся способны к фиксации атмосферного азота в присутствии экзогенного азота; где бактерии не являются межродовыми микроорганизмами; и где бактерии in planta продуцируют в растении 1% или более фиксированного азота.
[0007] В определенных вариантах осуществления бактерии in planta продуцируют в растении 5% или более фиксированного азота. В определенных вариантах осуществления бактерии in planta продуцируют в растении 10% или более фиксированного азота.
[0008] В определенных вариантах осуществления одна или несколько генетических вариаций включают вводимую регуляторную последовательность, функционально связанную с указанными одним или несколькими генами генетической регуляторной сети фиксации или ассимиляции азота. В дополнительных вариантах осуществления регуляторная последовательность представляет собой промотор. В дополнительных вариантах осуществления промотор представляет собой индуцибельный промотор. В определенных вариантах осуществления бактерии не содержат конститутивного промотора, функционально связанного с геном генетической регуляторной сети фиксации или ассимиляции азота. В определенных вариантах осуществления бактерии не содержат конститутивного промотора, функционально связанного с геном из кластера генов nif.
[0009] В определенных вариантах осуществления бактерии in planta выделяют азотсодержащие продукты фиксации азота. В определенных вариантах осуществления множество бактерий, воздействующих на растение, не стимулирует увеличения захвата экзогенного неатмосферного азота.
[0010] В определенных вариантах осуществления растение выращивают в почве с поля, в которую внесено приблизительно 22,7 кг азотсодержащего удобрения на акр, и где азотсодержащее удобрение содержит по меньшей мере 5% азота по массе. В дополнительных вариантах осуществления азотсодержащее удобрение содержит аммоний или содержащие аммоний молекулы. В определенных вариантах осуществления экзогенный азот выбран из удобрения, содержащего одно или несколько из глутамина, аммиака, аммония, мочевины, нитрата, нитрита, содержащих аммоний молекул, содержащих нитраты молекул и содержащих нитриты молекул.
[0011] В определенных вариантах осуществления множество бактерий включает по меньшей мере два различных вида бактерий. В определенных вариантах осуществления множество бактерий включает по меньшей мере два различных штамма одного вида бактерий. В определенных вариантах осуществления множество бактерий представляет собой бактерии рода Enterobacter. В определенных вариантах осуществления множество бактерий является эндофитным, эпифитным или ризосферным. В определенных вариантах осуществления множество бактерий колонизирует растение так, что бактерии присутствуют в растении в количестве по меньшей мере 105 КОЕ на грамм свежей массы растения.
[0012] В определенных вариантах осуществления один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота бактерий выбраны из группы, состоящей из: nifA, nifL, ntrB, ntrC, полинуклеотида, кодирующего глутаминсинтетазу, glnA, glnB, glnK, drat, amtB, полинуклеотида, кодирующего глутаминазу, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. В определенных вариантах осуществления одна или несколько генетических вариаций представляют собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. В определенных вариантах осуществления одна или несколько генетических вариаций (A) представляют собой нокаут-мутацию; (B) изменяют или удаляют регуляторную последовательность гена-мишени или (C) включают вставку гетерологичной регуляторной последовательности.
[0013] В определенных вариантах осуществления растение представляет собой сельскохозяйственную культуру. В дополнительных вариантах осуществления сельскохозяйственная культура выбрана из сорго, канола, томата, клубники, ячменя, риса, кукурузы и пшеницы. В дополнительных вариантах осуществления растение представляет собой генетически модифицированный организм. В дополнительных вариантах осуществления растение не является генетически модифицированным организмом. В определенных вариантах осуществления растение генетически сконструировано или выведено для эффективного использования азота.
[0014] В одном из аспектов настоящее изобретение относится к популяции бактерий, включающих бактерии, несущие одну или несколько генетических вариаций, вводимых в один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота бактерий так, что бактерии становятся способными к фиксации атмосферного азота в присутствии экзогенного азота; где бактерии не являются межродовыми микроорганизмами; и где бактерии in planta продуцируют в растении, выращиваемом в присутствии популяции бактерий, 1% или более фиксированного азота.
[0015] В определенных вариантах осуществления бактерии in planta продуцируют в растении 5% или более фиксированного азота. В определенных вариантах осуществления бактерии in planta продуцируют в растении 10% или более фиксированного азота.
[0016] В определенных вариантах осуществления одна или несколько генетических вариаций включают вводимую регуляторную последовательность, функционально связанную с указанными одним или несколькими генами генетической регуляторной сети фиксации или ассимиляции азота. В дополнительных вариантах осуществления регуляторная последовательность представляет собой промотор. В дополнительных вариантах осуществления промотор представляет собой индуцибельный промотор. В определенных вариантах осуществления бактерии не содержат конститутивного промотора, функционально связанного с геном генетической регуляторной сети фиксации или ассимиляции азота. В определенных вариантах осуществления бактерии не содержат конститутивного промотора, функционально связанного с геном в кластере генов nif.
[0017] В определенных вариантах осуществления бактерии in planta выделяют азотсодержащие продукты фиксации азота. В определенных вариантах осуществления множество бактерий, воздействующих на растение, не стимулирует увеличения захвата экзогенного неатмосферного азота. В определенных вариантах осуществления экзогенный азот выбран из удобрения, содержащего одно или несколько из глутамина, аммиака, аммония, мочевины, нитрата, нитрита, содержащих аммоний молекул, содержащих нитраты молекул и содержащих нитриты молекул.
[0018] В определенных вариантах осуществления популяция бактерий включает по меньшей мере два различных вида бактерий. В определенных вариантах осуществления популяция бактерий включает по меньшей мере два различных штамма одного вида бактерий. В определенных вариантах осуществления множество бактерий представляет собой бактерии рода Enterobacter. В определенных вариантах осуществления множество бактерий является эндофитным, эпифитным или ризосферным. В определенных вариантах осуществления множество бактерий колонизирует растение так, что бактерии присутствуют в растении в количестве по меньшей мере 105 КОЕ на грамм свежей массы растения.
[0019] В определенных вариантах осуществления один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота бактерий выбраны из группы, состоящей из: nifA, nifL, ntrB, ntrC, полинуклеотида, кодирующего глутаминсинтетазу, glnA, glnB, glnK, drat, amtB, полинуклеотида, кодирующего глутаминазу, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. В определенных вариантах осуществления одна или несколько генетических вариаций представляют собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. В определенных вариантах осуществления одна или несколько генетических вариаций (A) представляют собой нокаут-мутацию; (B) изменяют или удаляют регуляторную последовательность гена-мишени или (C) включают вставку гетерологичной регуляторной последовательности.
[0020] В определенных вариантах осуществления растение представляет собой сельскохозяйственную культуру. В дополнительных вариантах осуществления сельскохозяйственная культура выбрана из сорго, канола, томата, клубники, ячменя, риса, кукурузы и пшеницы. В дополнительных вариантах осуществления растение представляет собой генетически модифицированный организм. В дополнительных вариантах осуществления растение не является генетически модифицированным организмом. В определенных вариантах осуществления растение генетически сконструировано или выведено для эффективного использования азота.
[0021] В одном из аспектов настоящее изобретение относится к композиции, содержащей популяцию бактерий по настоящему изобретению. В определенных вариантах осуществления композиция содержит популяцию бактерий, наносимых на поверхность семян. В определенных вариантах осуществления композицию формулируют в виде жидкости или порошка.
[0022] В одном из аспектов настоящее изобретение относится к выделенной бактерии, депонированной в виде № доступа к депозиту ATCC PTA-122293 или PTA-122294.
[0023] В одном из аспектов настоящее изобретение относится к не являющейся межродовой бактерии, несущей одну или несколько генетических вариаций, вводимых в один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота бактерий так, что бактерия становится способной к фиксации атмосферного азота в присутствии экзогенного азота.
[0024] В определенных вариантах осуществления одна или несколько генетических вариаций включают вводимую регуляторную последовательность, функционально связанную с указанными одним или несколькими генами генетической регуляторной сети фиксации или ассимиляции азота. В дополнительных вариантах осуществления регуляторная последовательность представляет собой промотор. В дополнительных вариантах осуществления промотор представляет собой индуцибельный промотор. В определенных вариантах осуществления бактерии не содержат конститутивного промотора, функционально связанного с геном генетической регуляторной сети фиксации или ассимиляции азота. В определенных вариантах осуществления бактерии не содержат конститутивного промотора, функционально связанного с геном в кластере генов nif.
[0025] В определенных вариантах осуществления один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота бактерий выбраны из группы, состоящей из: nifA, nifL, ntrB, ntrC, полинуклеотида, кодирующего глутаминсинтетазу, glnA, glnB, glnK, drat, amtB, полинуклеотида, кодирующего глутаминазу, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. В определенных вариантах осуществления одна или несколько генетических вариаций представляют собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. В определенных вариантах осуществления одна или несколько генетических вариаций (A) представляют собой нокаут-мутацию; (B) изменяют или удаляют регуляторную последовательность гена-мишени или (C) включают вставку гетерологичной регуляторной последовательности.
[0026] В определенных вариантах осуществления бактерия представляет собой бактерию из рода Enterobacter. В определенных вариантах осуществления бактерия является эндофитной, эпифитной или ризосферной.
[0027] В одном из аспектов настоящее изобретение относится к способу получения одной или нескольких бактерий. В одном из вариантов осуществления способ включает (a) выделение бактерий из ткани или почвы первого растения; (b) внесение в одну или несколько бактерий генетической вариации (например, одной или нескольких генетических вариаций) с получением одного или нескольких вариантов бактерий; (c) воздействие вариантами бактерий на множество растений; (d) выделение бактерий из ткани или почвы одного из множества растений, где растение, из которого выделяют бактерии, обладает улучшенным признаком относительно других растений в множестве растений; и (e) повторение этапов (b)-(d) с бактериями, выделенными на этапе (d). Улучшенный признак может представлять собой улучшенную фиксацию азота в растении, из которого выделяют бактерии, и/или в растениях, подвергаемых воздействию бактерий. Генетическая вариация может представлять собой вариацию в гене, выбранном из группы, состоящей из: nifA, nifL, ntrB, ntrC, glnA, glnB, glnK, draT, amtB, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическая вариация может представлять собой вариацию в гене, кодирующем белок с функциональностью, выбранной из группы, состоящей из: глутаминсинтетазы, глутаминазы, аденилаттрансферазы глутаминсинтетазы, активатора транскрипции, антиактиватора транскрипции, пируват:флаводоксин-оксидоредуктазы, флаводоксина или АДФ-D-рибозилтрансферазы НАД+:динитрогеназоредуктазы. В определенных вариантах осуществления генетическая вариация представляет собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. Генетическая вариация может представлять собой нокаут-мутацию, приводить к устранению или отмене активности белкового домена, изменять или устранять регуляторную последовательность гена-мишени и/или включает вставку гетерологичной регуляторной последовательности. В определенных вариантах осуществления генетическая вариация включает вставку регуляторной последовательности, выявленной в геноме вида или рода бактерий соответствующих бактериям, у которых проводят генетическую вариацию. Регуляторную последовательность необязательно можно выбирать на основе уровня экспрессии гена в культуре бактерий или в ткани растения. Генетическая вариация может представлять собой случайную мутацию в случайном положении, случайную мутация в намеченном участке или предопределенную генетическую вариацию, специфически вносимую в намеченный участок. Генетическая вариация может включать вставку, делецию или замену одного или нескольких нуклеотидов или любую комбинацию из них. Генетическую вариацию можно получать посредством химического мутагенеза. В определенных вариантах осуществления способ дополнительно включает подвергание растений биотическим или абиотическим стрессогенным факторам. В определенных вариантах осуществления бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), продуцируют 1% или более (например, по меньшей мере 2%, 5%) 10% или более) азота во второе растение того же типа, что и первое растение, или в растение, подвергаемое действию бактерий. Такой продукции также можно добиваться, когда второе растение выращивают в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником азота. В определенных вариантах осуществления бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), демонстрируют по меньшей мере 2-кратное увеличение (например, по меньшей мере 5-кратное увеличение) фиксации азота по сравнению с бактериями, выделяемыми из первого растения. Первое растение или растения во множестве растений могут представлять собой сельскохозяйственную культуру, например, растение, выбранное из ячменя, риса, кукурузы, пшеницы, сорго, сахарной кукурузы, сахарного тростника, репчатого лука, томатов, клубники или спаржи. Первое растение или растения во множестве растений могут представлять собой модельное растение, такое как растение, выбранное из Setaria, Brachypodium или Arabidopsis. В определенных вариантах осуществления этап (a) дополнительно включает проведение генетического анализа выделенных бактерий. В определенных вариантах осуществления этап (b) дополнительно включает применение селекционного давления для обогащения бактериями, несущими генетическую вариацию, и необязательно выделение бактерий, перенесших селекционное давление. Селекционное давление может включать расщепление геномов с отсутствием генетической вариации, вводимой в намеченный участок, где расщепление происходит в пределах 100 нуклеотидов от намеченного участка. Расщепление можно проводить посредством сайт-специфической нуклеазы, такой как нуклеаза, выбранная из группы, состоящей из нуклеаза с цинковыми пальцами, нуклеаза CRISPR, нуклеаза TALE или мегануклеаза. В некоторых случаях предпочтительной может являться нуклеаза CRISPR. Бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), являются эндофитными, эпифитными или ризосферными. Бактерии можно выделять из ткани растения (например, семян). Бактерии могут включать бактерии множества различных таксонов. В определенных вариантах осуществления выделение бактерий на этапе (a) включает выделение бактерий из семян первого растения.
[0028] В одном из аспектов настоящее изобретение относится к способу увеличения фиксации азота в растении. В одном из вариантов осуществления способ включает воздействие на растение бактериями, несущими одну или несколько генетических вариаций, вводимых в один или несколько генов, регулирующих фиксацию азота, где бактерии продуцируют в растении 1% или более (например, по меньшей мере 2%, 5%, 10% или более) азота. Бактерии могут продуцировать азот в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником дополнительного азота. В определенных вариантах осуществления генетическая вариация представляет собой вариацию в гене, выбранном из группы, состоящей из: nifA, nifL, ntrB, ntrC, глутаминсинтетазы, glnA, glnB, glnK, draT, amtB, глутаминазы, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическая вариация может представлять собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. В определенных вариантах осуществления генетическая вариация (a) представляет собой нокаут-мутацию; (b) изменяет или удаляет регуляторную последовательность гена-мишени или (c) включает вставку гетерологичной регуляторной последовательности. Бактерии могут являться эндофитными, эпифитными или ризосферными. В некоторых случаях бактерии представляют собой бактерии рода Enterobacter или Rahnella. Бактерии могут включать бактерии множества различных таксонов. В определенных вариантах осуществления растение представляет собой сельскохозяйственную культуру, например, растение, выбранное из сорго, канола, томата, клубники, ячменя, риса, кукурузы и пшеницы. Растение может представлять собой небобовое растение. Растение может представлять собой генетически модифицированный организм (ГМО; например, растение с геномом измененным так, чтобы нести гетерологичный ген), генетически немодифицированный организм (не ГМО) или генетически сконструировано или выведено для эффективного использования азота.
[0029] В одном из аспектов настоящее изобретение относится к популяции бактерий. В одном из вариантов осуществления популяция бактерий включает бактерии, несущие одну или несколько генетических вариаций, вводимых в один или несколько генов, регулирующих фиксацию азота, где бактерии продуцируют в растении, выращиваемом в присутствии популяции бактерий, 1% или более (например, по меньшей мере 2%, 5%, 10% или более) азота. Бактерии могут продуцировать азот в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником дополнительного азота. В определенных вариантах осуществления генетическая вариация представляет собой вариацию в гене, выбранном из группы, состоящей из: nifA, nifL, ntrB, ntrC, глутаминсинтетазы, glnA, glnB, glnK, draT, amtB, глутаминазы, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическая вариация может представлять собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии nifA или глутаминазы; сниженной экспрессии nifL, ntrB, глутаминсинтетазы, glnB, glnK, draT, amtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. В определенных вариантах осуществления генетическая вариация (a) представляет собой нокаут-мутацию; (b) изменяет или удаляет регуляторную последовательность гена-мишени или (c) включает вставку гетерологичной регуляторной последовательности. Бактерии могут являться эндофитными, эпифитными или ризосферными. В некоторых случаях бактерии представляют собой бактерии рода Enterobacter или Rahnella. Бактерии могут включать бактерии множества различных таксонов.
[0030] В одном из аспектов настоящее изобретение относится к композиции, содержащей популяцию бактерий, такую как популяция бактерий, как описано в настоящем документе. Композиция может содержать популяцию бактерий, наносимых на поверхность семян. В определенных вариантах осуществления композицию формулируют в виде жидкости или порошка.
[0031] В одном из аспектов настоящее изобретение относится к бактерии с номером доступа к депозиту ATCC PTA-122293. В одном из аспектов настоящее изобретение относится к бактерии с номером доступа к депозиту ATCC PTA-122294.
ВКЛЮЧЕНИЕ В КАЧЕСТВЕ ССЫЛКИ
[0032] Все публикации, патенты и патентные заявки, указываемые в настоящем описании, включены в настоящий документ в качестве ссылки в той же степени, как если бы каждые конкретные публикация, патент или патентная заявка были конкретно и отдельно указаны для включения в качестве ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0033] Новые признаки изобретения подробно описаны в прилагаемой формуле изобретения. Лучшее понимание признаков и преимуществ настоящего изобретения можно получить при обращении к приводимому ниже подробному описанию, в котором приведены иллюстративные варианты осуществления, в которых использованы основы изобретения, и к сопровождающим фигурам, в которых:
[0034] На фигуре 1A-B представлено обогащение и выделение азотфиксирующих бактерий. (A) Для выделения единичных колоний азотфиксирующих бактерий использовали планшеты с агаром Nfb. (B) Полутвердый агар Nfb залитый в пробирку Balch. Стрелка указывает на пелликулу обогащенных азотфиксирующих бактерий.
[0035] На фигуре 2 представлен иллюстративный скрининг nifH посредством ПЦР. В этом скрининге положительные полосы наблюдали при ≈350 п.н. для двух колоний. Более низко расположенные полосы представляют собой 7димеры праймеров.
[0036] На фигуре 3 приведен пример скрининга посредством ПЦР колоний после мутагенеза с отбором CRISPR-Cas. Колонии CI006 подвергали скринингу с праймерами, специфичными для локуса nifL. Ожидаемый продукт ПЦР дикого типа составляет ≈2,2 т.п.н., тогда как ожидаемый мутант составляет ≈1,1 т.п.н. Семь из десяти подвергнутых скринингу колоний однозначно продемонстрировали требуемую делецию.
[0037] На фигурах 4A-D приведены фенотипы различных штаммов in vitro. Анализ восстановления ацетилена (ARA) активность мутантов штамма CI010 (фигура 4A) и мутантов штамма CI006 (фигура 4B), выращиваемых в среде для фиксации азота, дополненной глутамином в концентрации от 0 до 10 мМ. Активность дополнительных штаммов в ARA приведена на фигуре 4C, а профиль выделения двумя штаммами аммония с течением времени представлен на фигуре 4D.
[0038] На фигуре 5 приведен профиль экспрессии в культуре 9 различных генов у штаммов CI006, вовлеченных в диазатрофную фиксацию азота. Цифры представляют количества каждого транскрипта. Приведены различные условия (0, 1, 10 мМ глутамин и 0%, 10%, 20% атмосферный воздух в N2).
[0039] На фигуре 6 приведена колонизация CI006 корней кукурузы. Всходы кукурузы инокулировали CI006, несущими экспрессирующую RFP плазмиду. После двух недель роста и сохранения плазмиды при поливе соответствующим антибиотиком, корни собирали и проводили визуализацию посредством флуоресцентной микроскопии. Можно наблюдать колонизацию межклеточного пространства корней.
[0040] На фигуре 7 приведен азот, получаемый на уровне микроорганизмов у штамма WT (CI050) и оптимизированного штамма (CM002).
[0041] На фигурах 8 представлена экспериментальная установка для анализа массы плодов Micro-Tom.
[0042] На фигуре 9 представлен скрининг 10 штаммов на увеличение массы плода растения в Micro-Tom. Представлены результаты шести повторений. Для столбца 3, p=0,07. Для столбца 7, p=0,05.
[0043] На фигурах 10A-C приведены дополнительные результаты для активности микроорганизмов-кандидатов и других мутантов-кандидатов, выращиваемых в средах для фиксации азота, дополненной глутамином в концентрации от 0 до 10 мМ, в ARA.
[0044] На фигуре 11 приведен двойной мутант, который демонстрирует более высокое выделение аммиака, чем одиночный мутант, из которого он получен.
[0045] На фигуре 12 приведен NDFA, получаемый в эксперименте по захвату газообразного 15N (с обратной экстраполяцией с использованием суток воздействия) для определения NDFA в растениях кукурузы в условиях добавления удобрения.
[0046] На фигуре 13 приведено значение NDFA, получаемое в эксперименте по захвату газообразного 15N (с обратной экстраполяцией с использованием суток воздействия) для определения NDFA в растениях Setaria в условиях добавления удобрения.
[0047] На фигуре 14A приведена степень включения газообразного 15N. Растения, инокулированные эволюционировавшим штаммом, по сравнению с неинокулированными растениями демонстрировали увеличение включения газообразного 15N.
[0048] На фигуре 14B приведены 4 недели после посадки, до 7% азота в растениях, инокулированных эволюционировавшим штаммом, происходит из фиксированного микроорганизмами азота.
[0049] На фигуре 14C показано увеличение площади листа (и других измерений биомассы, данные не показаны) у растений, инокулированных эволюционировавшим штаммом по сравнению с неинокулированными растениями или инокулированными растениями дикого типа.
[0050] На фигуре 15A приведены эволюционировавшие штаммы, которые демонстрируют значимо более высокую продукцию nifH в ткани корня, как определяют посредством транскриптомного исследования in planta.
[0051] На фигуре 15B показано, что уровень фиксированного азота, выявляемый в ткани растения, коррелирует с уровнем колонизации данного конкретного растения оптимизированным по HoME штаммом.
[0052] На фигуре 16A приведена карта структур почв различных полевых почв, тестируемых для колонизации. Почвы, которые исходно являлись источником незначительного количества микроорганизмов, указаны звездами.
[0053] На фигуре 16B приведена уровень колонизации штамма 1 и штамма 5, которые тестируют в четырех различных типах почв (окружности). Оба штамма продемонстрировали относительно устойчивый профиль колонизации в различных типах почв.
[0054] На фигуре 16C приведена колонизация штамма 1, протестированная в полевых испытаниях в течение вегетационного периода. Штамм 1 сохранялся в ткани кукурузы до 12 недели после посадки и начинал демонстрировать снижение колонизации после этого времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0055] Термины "полинуклеотид", "нуклеотид", "нуклеотидная последовательность", "нуклеиновая кислота" и "олигонуклеотид" используют взаимозаменяемо. Они относятся к полимерной форме нуклеотидов любой длины, представляющих собой дезоксирибонуклеотиды, или рибонуклеотиды, или их аналоги. Полинуклеотиды могут обладать любой трехмерной структурой и могут выполнять любую функцию, известную или неизвестную. Неограничивающими примерами полинуклеотидов является следующее: кодирующие или некодирующие области гена или фрагмента гена, локусы (локус), определяемые на основе анализа сцепления, экзоны, интроны, информационная РНК (иРНК), транспортная РНК (тРНК), рибосомальная РНК (рРНК), малая интерферирующая РНК (миРНК), короткошпилечная РНК (кшРНК), микро-РНК (мкРНК), рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, зонды и праймеры нуклеиновой кислоты. Полинуклеотид может содержать один или несколько модифицированных нуклеотидов, таких как метилированные нуклеотиды и аналоги нуклеотидов. Если они присутствуют, модификации структуры нуклеотида можно обеспечивать до или после сборки полимера. Последовательности нуклеотидов могут прерываться ненуклеотидными компонентами. Полинуклеотид можно дополнительно модифицировать после полимеризации, например, посредством конъюгации с меченым компонентом.
[0056] "Гибридизация" относится к реакции, в которой реагируют один или несколько полинуклеотидов с формированием комплекса, который стабилизирован вследствие образования водородных связей между основаниями нуклеотидных остатков. Образование водородных связей может происходить при спаривании оснований по Уотсону-Крику, связывании по Хугстину или любым другим специфичным для последовательностей способом. Комплекс может содержать две цепи, формирующие дуплексную структуру, три или более цепи, формирующие мультицепочечный комплекс, одну самогибридизующуюся цепь или любую комбинацию из них. Реакция гибридизации может представлять собой этап в более сложном процессе, таком как инициация ПЦР или ферментативное расщепление полинуклеотида эндонуклеазой. Вторая последовательность, которая комплементарна первой последовательности обозначают как последовательность, "комплементарную" первой последовательности. Термин "гибридизующийся" в применении к полинуклеотиду относится к способности полинуклеотида к формированию комплекса, который стабилизирован вследствие образование водородных связей между основаниями нуклеотидных остатков в реакции гибридизации.
[0057] "Комплементарность" относится к способности нуклеиновой кислоты к формированию водородной связи(ей) с другой последовательностью нуклеиновой кислоты посредством традиционного спаривания по Уотсону-Крику или других нетрадиционных типов спаривания. Процент комплементарности означает процент остатков в молекуле нуклеиновой кислоты, которые могут формировать водородные связи (например, посредством спаривания оснований по Уотсону-Крику) со второй последовательностью нуклеиновой кислоты (например, 5, 6, 7, 8, 9, 10 из 10 представляют собой комплементарность 50%, 60%, 70%, 80%, 90% и 100%, соответственно). "Идеальная комплементарность" означает, что се последовательные остатки последовательности нуклеиновой кислоты формируют водородные связи с таким же количеством последовательных остатков во второй последовательности нуклеиновой кислоты. Как используют в настоящем документе, "в значительной степени комплементарные" относится к степени комплементарности, которая составляет по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% на области 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более нуклеотидов, или относится к двум нуклеиновым кислотам, которые гибридизуются в жестких условиях. Идентичность последовательностей, например, для целей оценки процента комплементарности, можно определять любым подходящим алгоритмом выравнивания, включая в качестве неограничивающих примеров алгоритм Нидлмана-Вунша (см. например, средство выравнивания EMBOSS Needle, доступное на www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html, необязательно с установками по умолчанию), алгоритм BLAST (см. например, средство выравнивания BLAST, доступное на blast.ncbi.nlm.nih.gov/Blast.cgi, необязательно с настройками по умолчанию) или алгоритм Смита-Уотермана (см. например, средство выравнивания EMBOSS Water, доступное на www.ebi.ac.uk/Tools/psa/emboss_water/nucleotide.html, необязательно с настройками по умолчанию). Оптимальное выравнивание можно оценивать с использованием любых подходящих параметров выбранного алгоритма, включая параметры по умолчанию.
[0058] Как правило, "жесткие условия" гибридизации относятся к условиям, в которых нуклеиновая кислота, комплементарная последовательности-мишени, преимущественно гибридизуется с последовательностью-мишенью, и по существу не гибридизуется с не являющимися мишенями последовательностями. Как правило, жесткие условия зависят от последовательности и варьируют в зависимости от ряда факторов. Как правило, чем длиннее является последовательность, тем выше является температура при которой последовательность специфически гибридизуется с ее последовательностью-мишенью. Неограничивающие примеры жестких условий подробно описаны в Tijssen (1993), Laboratory Technniques In Biochemistry And Molecular Biology-Hybridization With Nucleic Acid Probes Part I, Second Chapter "Overview of principles of hybridization and the strategy of nucleic acid probe assay", Elsevier, N.Y.
[0059] Как используют в настоящем документе, "экспрессия" относится к процессу, посредством которого полинуклеотид транскрибируется с матрицы ДНК (например в иРНК или другой транскрипт РНК), и/или к процессу, посредством которого затем происходит трансляция транскрибируемой иРНК в пептиды, полипептиды или белки. Транскрипты и кодируемые полипептиды в совокупности можно обозначить как "продукт гена". Если полинуклеотид получен с геномной ДНК, экспрессия может включать сплайсинг иРНК в эукариотической клетке.
[0060] Термины "полипептид", "пептид" и "белок" в настоящем документе используют взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может прерываться не являющимися аминокислотами участками. Термины также включает модифицированный полимер из аминокислот; например, посредством формирования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции, такой как конъюгация с меченым компонентом. Как используют в настоящем документе термин "аминокислота" включает природные и/или неприродные или синтетические аминокислоты, включая глицин и D или L оптические изомеры, и аналоги аминокислот и пептидомиметики.
[0061] Как используют в настоящем документе, термин "приблизительно" используют как синоним термина "примерно". Для иллюстрации, использование термина "приблизительно" в отношении количества означает, что значения немного выходят за указанные значения, например, плюс или минус от 0,1% до 10%.
[0062] Термин "биологически чистая культура" или "по существу чистая культура" относится к культуре вида бактерий, описываемого в настоящем документе, не содержащей других видов бактерий в количествах, достаточных для препятствия репликации культуры, или детектируемых стандартными бактериологическими методами.
[0063] "Продуктивность растений" в основном относится к любому показателю роста или развития растения, который является причиной, по которой это растение выращивают. Для продовольственных культур, таких как зерновые или овощи, "продуктивность растений" может относиться к урожаю зерновых или плодов, собираемых у конкретной сельскохозяйственной культуры. Как используют в настоящем документе, улучшенная продуктивность растений в широком смысле относится к улучшению урожая зерна, плодов, цветов или других частей растений, собираемых с различными целями, улучшению роста частей растений, включая стебли, листья и корни, к стимуляции роста растений, подержанию высокого содержания хлорофилла в листьях, увеличению количества плодов или семян, увеличению массы единичного плода или семени, уменьшению выброса NO2 вследствие сниженного использования азотных удобрений и подобным улучшениям роста и развития растений.
[0064] Микроорганизмы в продовольственных культурах и около них могут влиять на признаки этих культур. Признаки растений, на которые могут влиять микроорганизмы включают: урожайность (например, продукция зерна, производство биомассы, развитие плодов, строение цветов); питание (например, потребление азота, фосфора, калия, железа, питательных микроэлементов); способность к контролю абиотического стресса (например, засухоустойчивость, солеустойчивость, жароустойчивость) и способность к контролю биотического стресса (например, сельскохозяйственных вредителей, сорняков, насекомых, грибов и бактерий). Стратегии изменения признаков сельскохозяйственных культур включают: увеличение концентраций ключевых метаболитов; изменение временной динамики воздействия микроорганизмов на ключевые метаболиты; связывание продукции/разрушения метаболитов микроорганизмами с новыми параметрами окружающей среды; сокращение нежелательных метаболитов и улучшение баланса метаболитов или обуславливающих белков.
[0065] Как используют в настоящем документе, "регуляторная последовательность" относится к оператору, промотору, сайленсеру или терминатору.
[0066] Как используют в настоящем документе, "in planta" означает в растении, где растение дополнительно включает листья, корни, стебли, семена, семязачатки, пыльцу, цветы, плоды и т.д.
[0067] В определенных вариантах осуществления природные или эндогенные регуляторные последовательности генов по настоящему изобретению заменяют одной или несколькими внутриродовыми регуляторными последовательностями.
[0068] Как используют в настоящем документе, "вводимый" относится к введению посредством современной биотехнологии, а не к природному введению.
[0069] В определенных вариантах осуществления бактерии по настоящему изобретению модифицированы так, что они не являются природными бактериями.
[0070] В определенных вариантах осуществления бактерии по настоящему изобретению присутствуют в растении в количестве по меньшей мере 103 КОЕ, 104 КОЕ, 105 КОЕ, 106 КОЕ, 107 КОЕ, 108 КОЕ, 109 КОЕ, 1010 КОЕ, 1011 КОЕ или 1012 КОЕ на грамм сырой или сухой массы растения. В определенных вариантах осуществления бактерии по настоящему изобретению присутствуют в растении в количестве по меньшей мере приблизительно 103 КОЕ, приблизительно 104 КОЕ, приблизительно 105 КОЕ, приблизительно 106 КОЕ, приблизительно 107 КОЕ, приблизительно 108 КОЕ, приблизительно 109 КОЕ, приблизительно 1010 КОЕ, приблизительно 1011 КОЕ или приблизительно 1012 КОЕ на грамм сырой или сухой массы растения. В определенных вариантах осуществления бактерии по настоящему изобретению присутствуют в растении в количестве по меньшей мере от 103 до 109, от 103 до 107, от 103 до 105, от 105 до 109, от 105 до 107, от 106 до 1010, от 106 до 107 КОЕ на грамм сырой или сухой массы растения.
[0071] Удобрения и экзогенный азот по настоящему изобретению могут включать следующие азотсодержащие молекулы: аммоний, нитрат, нитрит, аммиак, глутамин и т.д. Источники азота по настоящему изобретению могут включать безводный аммиак, сульфат аммония, мочевину, фосфат диаммония, формальдегидмочевину, фосфат моноаммония, нитрат аммония, жидкие азотные удобрения, нитрат кальция, нитрат калия, нитрат натрия и т.д.
[0072] Как используют в настоящем документе, "экзогенный азот" относится к неатмосферному азоту, легкодоступному в почве, поле или среде для выращивания, который присутствует в условиях без ограничения азота, включая аммиак, аммоний, нитрат, нитрит, мочевина, мочевая кислота, аммонийные кислоты и т.д.
[0073] Как используют в настоящем документе, "условия без ограничения азота" относится к неатмосферному азоту, доступному в почве, поле, средах в концентрациях, больших чем приблизительно 4 мМ азот, как описано в Kant et al. (2010. J. Exp. Biol. 62(4):1499-1509), включенной в настоящий документ в качестве ссылки.
[0074] Как используют в настоящем документе, "межродовой микроорганизм" представляет собой микроорганизм, который сформирован посредством преднамеренной комбинации генетического материала, исходно выделенного из организмов различных таксономических родов. Взаимозаменяемо с "межродовым микроорганизмом" можно использовать "межродовой мутант". Иллюстративный "межродовой микроорганизм" включает микроорганизм, содержащий мобильный генетический элемент, который впервые идентифицирован в микроорганизме, принадлежащем роду, отличного от микроорганизма-реципиента. Дополнительное объяснение в числе прочего можно найти в 40 C.F.R. 725.3.
[0075] Как используют в настоящем документе, "внутриродовой микроорганизм" представляет собой микроорганизм, который сформирован посредством преднамеренной комбинации генетического материала, исходно выделенного из организмов одного и того же таксономического рода. Взаимозаменяемо с "внутриродовым микроорганизмом" можно использовать "внутриродовой мутант".
[0076] Как используют в настоящем документе, "вводимый генетический материал" означает генетический материал, который добавляют в геном реципиента и который остается в геноме реципиента в качестве компонента.
[0077] В определенных вариантах осуществления генетическая регуляторная сеть фиксации и ассимиляции азота содержит полинуклеотиды, кодирующие гены, и некодирующие последовательности, которые направляют, модулируют и/или регулируют фиксацию и/или ассимиляцию азота микроорганизмами и может содержать полинуклеотидные последовательности кластера nif (например, nifA, nifB, nifC,.......nifZ), полинуклеотиды, кодирующие регулирующий метаболизм азота белок C, полинуклеотиды, кодирующие регулирующий метаболизм азота белок B, полинуклеотидные последовательности кластера gln (например, glnA и glnD), draT и переносчики/пермеазы аммония.
[0078] В определенных вариантах осуществления удобрение по настоящему изобретению содержит по меньшей мере 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% азота по массе.
[0079] В определенных вариантах осуществления удобрение по настоящему изобретению содержит по меньшей мере приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9%, приблизительно 10%, приблизительно 11%, приблизительно 12%, приблизительно 13%, приблизительно 14%, приблизительно 15%, приблизительно 16%, приблизительно 17%, приблизительно 18%, приблизительно 19%, приблизительно 20%, приблизительно 21%, приблизительно 22%, приблизительно 23%, приблизительно 24%, приблизительно 25%, приблизительно 26%, приблизительно 27%, приблизительно 28%, приблизительно 29%, приблизительно 30%, приблизительно 31%, приблизительно 32%, приблизительно 33%, приблизительно 34%, приблизительно 35%, приблизительно 36%, приблизительно 37%, приблизительно 38%, приблизительно 39%, приблизительно 40%, приблизительно 41%, приблизительно 42%, приблизительно 43%, приблизительно 44%, приблизительно 45%, приблизительно 46%, приблизительно 47%, приблизительно 48%, приблизительно 49%, приблизительно 50%, приблизительно 51%, приблизительно 52%, приблизительно 53%, приблизительно 54%, приблизительно 55%, приблизительно 56%, приблизительно 57%, приблизительно 58%, приблизительно 59%, приблизительно 60%, приблизительно 61%, приблизительно 62%, приблизительно 63%, приблизительно 64%, приблизительно 65%, приблизительно 66%, приблизительно 67%, приблизительно 68%, приблизительно 69%, приблизительно 70%, приблизительно 71%, приблизительно 72%, приблизительно 73%, приблизительно 74%, приблизительно 75%, приблизительно 76%, приблизительно 77%, приблизительно 78%, приблизительно 79%, приблизительно 80%, приблизительно 81%, приблизительно 82%, приблизительно 83%, приблизительно 84%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% азота по массе.
[0080] В определенных вариантах осуществления удобрение по настоящему изобретению содержит приблизительно от 5% до 50%, приблизительно от 5% до 75%, приблизительно от 10% до 50%, приблизительно от 10% до 75%, приблизительно от 15% до 50%, приблизительно от 15% до 75%, приблизительно от 20% до 50%, приблизительно от 20% до 75%, приблизительно от 25% до 50%, приблизительно от 25% до 75%, приблизительно от 30% до 50%, приблизительно от 30% до 75%, приблизительно от 35% до 50%, приблизительно от 35% до 75%, приблизительно от 40% до 50%, приблизительно от 40% до 75%, приблизительно от 45% до 50%, приблизительно от 45% до 75% или приблизительно от 50% до 75% азота по массе.
[0081] В определенных вариантах осуществления увеличение фиксации азота и/или продукцию 1% или более азота в растении определяют относительно контрольных растений, которые не подвергали действию бактерий по настоящему изобретению. Все увеличения или уменьшения количеств бактерий определяют относительно контрольных растений. Все увеличения или уменьшения в растениях измеряют относительно контрольных растений.
[0082] Как используют в настоящем документе, "конститутивный промотор" представляет собой промотор, который является активным в большинстве условий и/или в течение большинства стадий развития. Существует несколько преимуществ использования в экспрессирующих векторах, используемых в биотехнологии, конститутивных промоторов, например: высокий уровень продукции белков, используемых для отбора трансгенных клеток или организмов; высокий уровень экспрессии репортерных белков или селективных маркеров, обеспечивая простые детекцию и количественный анализ; высокий уровень продукции фактора транскрипции, который является частью системы регуляции транскрипции; продукция соединений, у которых необходима повсеместная активность в организме; и продукция соединений, которые необходимы на всех стадиях развития. Неограничивающие иллюстративные конститутивные промоторы включают промотор 35S CaMV, промоторы опинов, промотор убиквитина, промотор алкогольдегидрогеназы и т.д.
[0083] Как используют в настоящем документе, "неконститутивный промотор" представляет собой промотор, который активен в определенных условиях, в определенных типах клеток и/или в течение определенных стадиях развития. Например, тканеспецифичные, тканепредпочтительные, специфичные для типов клеток, предпочтительные для типов клеток, индуцибельные промоторы и промоторы под контролем развития являются неконститутивными промоторы. Примеры промоторов под контролем развития включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях.
[0084] Как используют в настоящем документе, "индуцибельный" или "реперссируемый" промотор представляет собой промотор, который находится под контролем химических веществ или факторов окружающей среды. Примеры условий окружающей среды, который могут влиять на транскрипцию под действием индуцибельных промоторов, включают анаэробные условия, определенные химические вещества, наличие света, кислые или основные условия и т.д.
[0085] Как используют в настоящем документе, "тканеспецифический" промотор представляет собой промотор, который инициирует транскрипцию только в определенных тканях. В отличие от конститутивной экспрессии генов, тканеспецифическая экспрессия является результатом нескольких взаимодействующих уровне регуляции генов. Таким образом, в данной области для достижения эффективной и надежной экспрессии трансгенов в конкретных тканях иногда предпочтительно использовать промоторы гомологичных или близкородственных видов. Это является одной из основных причин находимого как в научной, так и в патентной литературе большого количества тканеспецифичных промоторов, выделенных из конкретных тканей.
[0086] Как используют в настоящем документе, термин "функционально связанные" относится к ассоциации последовательностей нуклеиновых кислот в одном фрагменте нуклеиновой кислоты так, что функцию одной регулирует другая. Например, промотор функционально связан с кодирующей последовательностью, когда он может регулировать экспрессию этой кодирующей последовательности (т.е., эта кодирующая последовательность находится под транскрипционным контролем промотора). Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации. В другом примере комплементарные области РНК по изобретению могут быть функционально связаны, непосредственно или опосредовано, со стороны 5'-конца от иРНК-мишени, или со стороны 3'-конца от иРНК-мишени, или с иРНК-мишенью, или первая комплементарная область находится со стороны 5'-конца, а ее комплементарная область находится со стороны 3'-конца от иРНК-мишени
[0087] Одним из признаков, которые могут являться мишенью для регуляции способами, описываемыми в настоящем документе, является фиксация азота. Азотные удобрения являются наибольшими эксплуатационными расходами на фермах и основным движущим фактором более высоких урожаев пропашных культур, таких как кукуруза и пшеница. В настоящем документе описаны продукты жизнедеятельности микроорганизмов, которые могут доставлять возобновляемые формы азота в небобовые сельскохозяйственные культуры. Хотя у некоторых эндофитов присутствуют генетические факторы, необходимые для фиксации азота в чистой культуре, основной технической проблемой является то, что эндофиты злаков и трав дикого типа прекращают фиксацию азота на удобряемых полях. Применение химических удобрений и остаточные уровни азота в полевых почвах подают микроорганизму сигнал выключения биохимического пути фиксации азота.
[0088] Для разработки микроорганизма, способного к фиксации и переноса азота в кукурузу в присутствии удобрения необходимы изменения на транскрипционном и посттрансляционном уровнях регуляторной сети фиксации азота. С этой целью в настоящем документе описана технология эволюции хозяина-микроорганизма (HoME), позволяющая обеспечить направленную эволюцию регуляторных сетей и получать новые фенотипы. Также в настоящем документе описаны уникальные, проприетарные библиотеки азотфиксирующих эндофитов, выделенных из кукурузы, совместно с обширными "омиксными" данными о взаимодействии микроорганизмов и растения-хозяина в различных условиях окружающей среды, таких как недостаток и избыток азота. Это обеспечивает направленную эволюцию генетической регуляторной сети эндофитов в направлении получения микроорганизмов, которые активно фиксируют азот даже в присутствии удобрения в полевых условиях. Также в настоящем документе описана оценка промышленного потенциала получаемых микроорганизмов, которые колонизирует ткани корня кукурузы и продуцируют азот у удобряемых растений, и оценка совместимости эндофитов со стандартными технологиями составления и различными почвами для определения возможности интеграции микроорганизмов в современные стратегии контроля азота
[0089] Для использования элементарного азота (N) для химического синтеза живые формы комбинируют газообразный азот (N2), доступный в атмосфере, с водородом в процессе, известном как фиксация азота. Вследствие энергоемкого характера биологической фиксации азота диазотрофы (бактерии и археи, которые фиксируют атмосферный газообразный азот) в процессе эволюции сформировали развитую и жесткую регуляцию кластера генов nif в ответ на кислород окружающей среды и доступный азот. Гены Nif кодируют ферменты, вовлеченные в фиксацию азота (такие как нитрогеназный комплекс), и белки, которые регулируют фиксацию азота. В Shamseldin (2013. Global J. Biotechnol. Biochem. 8(4):84-94) приведено подробное описание генов nif и их продуктов, и она включена в настоящий документ в качестве ссылки. В настоящем документе описаны способы получения растения с улучшенным признаком, включающие выделение бактерий из первого растения, внесение генетической вариации в ген nif выделенных бактерий, воздействие вариантов бактерий на второе растение, выделение бактерий из второго растения с улучшенным признаком относительно первого растения и повторение этапов с бактериями, выделенными из второго растения.
[0090] У Proteobacteria регуляция фиксации азота сконцентрирована вокруг зависимого от фактора σ54 связывающего энхансеры белка NifA, положительного регулятора транскрипции кластера nif. Внутриклеточные уровни активного NifA контролируют два ключевых фактора: транскрипция оперона nifLA и ингибирование активности NifA белок-белковым взаимодействием с NifL. Оба эти процесса реагируют на внутриклеточные уровни глутамина посредством сигнального каскада белков PII. Этот каскад опосредован GlnD, который непосредственно определяет уровень глутамина и катализирует уридилирование или деуридилирование двух регуляторных белков PII, GlnB и GlnK, в ответ на отсутствие или наличие связанного глутамина, соответственно. В условиях избытка азота немодифицированный GlnB передает сигнал к деактивации промотора nifLA. Однако в условиях ограничения азота происходит посттрансляционная модификация GlnB, что ингибирует его активность и приводит к транскрипции оперона nifLA. Таким образом, существует жесткий контроль транскрипции nifLA в ответ на азот окружающей среды посредством сигнального каскада белков PII. На посттрансляционном уровне регуляции NifA GlnK ингибирует взаимодействие NifL/NifA в зависимости от общего уровня свободного GlnK в клетке.
[0091] Транскрипция NifA происходит с оперона nifLA, промотор которого активирует фосфорилированный NtrC, другой зависимый от фактора σ54 регулятор. Состояние фосфорилирования NtrC опосредовано гистидинкиназой NtrB, которая взаимодействует с деуридилированным GlnB, но не с уридилированным GlnB. В условиях избытка азота высокий внутриклеточный уровень глутамина приводит к деуридилированию GlnB, который затем взаимодействует с NtrB с деактивацией ее фосфорилазной активности и активацией ее фосфатазной активности, что приводит к дефосфорилированию NtrC и деактивации промотора nifLA. Однако в условиях ограничения азота низкий уровень внутриклеточного глутамина приводит к уридилированию GlnB, что ингибирует его взаимодействие с NtrB и обеспечивает фосфорилирование NtrC и транскрипцию оперона nifLA. Таким образом, существует жесткий контроль экспрессии nifLA в ответ на азот окружающей среды посредством сигнального каскада белков PII. Все из nifA, ntrB, ntrC и glnB представляют собой гены, которые можно подвергать мутированию в способах, описываемых в настоящем документе.
[0092] Также существует посттрансляционная регуляция активности NifA в ответ на азот окружающей среды, как правило, посредством опосредованного NifL ингибирования активности NifA. Как правило, взаимодействие на взаимодействие NifL и NifA влияет сигнальный каскад белков PII посредством GlnK, хотя характер взаимодействий между GlnK и NifL/NifA у диазотрофов значительно варьирует. У Klebsiella pneumoniae обе формы GlnK ингибируют взаимодействие NifL/NifA, и взаимодействие между GlnK и NifL/NifA определяют по общему уровню свободного GlnK в клетке. В условиях избытка азота деуридилированный GlnK взаимодействует с переносчиком аммиака AmtB, который служит для блокировки захвата аммиака посредством AmtB и изоляции GlnK на мембране, обеспечивая ингибирование NifA посредством NifL. С другой стороны, у Azotobacter vinelandii, для взаимодействия NifL/NifA и ингибирования NifA необходимо взаимодействие с деуридилированным GlnK, тогда как уридилирование GlnK ингибирует это взаимодействие с NifL. У диазотрофов с отсутствием гена nifL существуют данные о том, что ингибирование активности NifA происходит непосредственно при взаимодействии с деуридилированными формами GlnK и GlnB в условиях избытка азота. Независимо от механизма посттрансляционное ингибирование NifA является важным регулятором кластера nif у большинства известных диазотрофов. Дополнительно, гены, которые можно подвергать мутированию в способах, описываемых в настоящем документе, представляют собой nifL, amtB и glnK.
[0093] В дополнение к регуляции транскрипции кластера генов nif многие диазотрофы в процессе эволюции сформировали механизм прямой посттрансляционной модификации и ингибирования самого фермента нитрогеназы, известный как выключение нитрогеназы. Он опосредован АДФ-рибозилированием белка Fe (NifH) в условиях избытка азота, что нарушает его взаимодействие с белковым комплексом MoFe (NifDK) и устраняет нитрогеназную активность. DraT катализирует АДФ-рибозилирование белка Fe и выключение нитрогеназы, тогда как DraG катализирует удаление АДФ-рибозы и реактивацию нитрогеназы. Как и в случае транскрипции nifLA и ингибирования NifA, выключение нитрогеназы также регулирует сигнальный каскад белков PII. В условиях избытка азота деуридилированный GlnB взаимодействует с DraT и активирует его, тогда как деуридилированный GlnK взаимодействует с DraG и AmtB с формированием комплекса, изолируя DraG на мембране. В условиях ограничения азота уридилированные формы GlnB и GlnK не взаимодействуют с DraT и DraG, соответственно, что приводит к инактивации DraT и диффузии DraG к белку Fe, где он удаляет АДФ-рибозу и активирует нитрогеназу. В способах, описываемых в настоящем документе, также предусмотрено внесение генетических вариаций в гены nifH, nifD, nifK и draT.
[0094] Хотя некоторые эндофиты обладают способностью к фиксации азота in vitro, часто эти генетические факторы в полевых условиях подавлены высокими уровнями экзогенных химических удобрений. Для облегчения фиксации азота в полевых условиях можно разделить определение уровня экзогенного азота и экспрессию фермента нитрогеназы. Улучшение суммарной нитрогеназной активности по времени дополнительно способствует увеличению продукции азота для использования сельскохозяйственной культурой. Конкретные мишени генетической вариации для облегчения фиксации азота в полевых условиях способами, описываемыми в настоящем документе, включают один или несколько генов, выбранных из группы, состоящей из nifA, nifL, ntrB, ntrC, glnA, glnB, glnK, draT, amtB, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ.
[0095] Дополнительной мишенью генетической вариации для облегчения фиксации азота в полевых условиях способами, описываемыми в настоящем документе, является белок NifA. Как правило, белок NifA является активатором экспрессии генов фиксации азота. Увеличение продукции NifA (конститутивно или в условиях высокого содержания аммиака) преодолевает природный путь определения уровня аммиака. Кроме того, снижение продукции белков NifL, известного ингибитора NifA, также приводит к увеличению уровня свободного активного NifA. Кроме того, к повышению общего уровня белков NifA также приводит увеличение уровня транскрипции оперона nifAL (конститутивно или в условиях высокого содержания аммиака). Повышенного уровня экспрессии nifAL достигают, изменяя сам промотор или снижая экспрессию NtrB (часть сигнального каскада ntrB и ntrC, который исходно может приводить к выключению оперона nifAL в условиях высокого содержания азота). Высокий уровень NifA, достигаемый этими или любыми другими способами, описываемыми в настоящем документе, увеличивает активность фиксации азота эндофитами.
[0096] Другой мишенью генетической вариации для облегчения фиксации азота в полевых условиях способами, описываемыми в настоящем документе, является сигнальный каскад PII GlnD/GlnB/GlnK. Внутриклеточный уровень глутамина определяет сигнальный каскад PII GlnD/GlnB/GlnK. Мутации активного центра GlnD, устраняющие активность удаления уридилата GlnD, разрывают каскад определения уровня азота. Кроме того, уменьшение концентрации GlnB замыкает каскад определения уровня глутамина. Эти мутации "обманом" приводят клетки к определению условий ограничения азота, таким образом, увеличивая уровень активности фиксации азота.
[0097] Также мишенью генетической вариации для облегчения фиксации азота в полевых условиях способами, описываемыми в настоящем документе, является белок amtB. Захват аммиака из окружающей среды можно уменьшать, снижая уровень экспрессии белка amtB. Без внутриклеточного аммиака эндофит неспособен к определению высокого уровня аммиака, что предотвращает отрицательную регуляцию генов фиксации азота. Любой аммиак, попадающий во внутриклеточный компартмент, преобразуется в глутамин. Внутриклеточный уровень глутамина является основным средством определения уровня азота. Снижение внутриклеточного уровня глутамина предотвращает определение клетками высоких уровней аммиака в окружающей среде. Это можно осуществлять, увеличивая уровень экспрессии глутаминазы, фермента, который преобразует глутамин в глутаминат. Кроме того, уровень внутриклеточного глутамина также можно уменьшать, снижая уровень глутаминсинтетазы (фермента, преобразующего аммиак в глутамин). Диазотрофы быстро ассимилируют фиксированный аммиак в глутамин и глутаминат для использования в клеточных процессах. Нарушение ассимиляции аммиака может обеспечить выведение фиксированного азота на экспорт из клетки в виде аммиака. Фиксированный аммиак преимущественно ассимилируется в глутамин глутаминсинтетазой (GS), кодируемой glnA, а затем в глутаминат глутаминоксоглутаратаминотрансферазой (GOGAT). В определенных примерах, glnS кодирует глутаминсинтетазу. GS посттрансляционно регулирует аденилилтрансфераза GS (GlnE), бифункциональный фермент, кодируемый glnE, который катализирует аденилирование и деаденилирование GS вследствие активности его аденилилтрансферазного (AT) и аденилилудаляющего (AR) доменов, соответственно. В условиях ограничения азота экспрессирован glnA и AR домен GlnE деаденилирует GS, обеспечивая ее активность. В условиях избытка азота экспрессия glnA выключена и глутамин аллостерически активирует AT домен GlnE, что вызывает аденилирование и деактивацию GS.
[0098] Кроме того, мишенью генетической вариации для облегчения фиксации азота в полевых условиях способами, описываемыми в настоящем документе, также может являться ген draT. После продукции клеткой ферментов фиксации азота другим уровнем, на котором клетка отрицательно регулирует активность фиксации в условиях высокого содержания азота, является выключение нитрогеназы. Это выключение можно устранить снижая уровень экспрессии DraT.
[0099] Способы придания микроорганизмам новых фенотипов можно проводить на транскрипционном, трансляционном и посттрансляционном уровнях. Транскрипционный уровень включает изменения в промоторе (такие как изменение аффинности к фактору сигма или участков связывания факторов транскрипции, включая делецию всего или части промотора) или изменение терминаторов и аттенюаторов транскрипции. Трансляционный уровень включает изменение в участках связывания рибосом и изменение сигналов деградации иРНК. Посттрансляционный уровень включает мутации активных центров ферментов и изменения белок-белковых взаимодействий. Эти изменения можно осуществлять множеством способов. Снижение уровня экспрессии (или полное устранение) можно осуществлять посредством замены природного участка связывания рибосомы (RBS) или промотора другими с меньшей силой/эффективностью. Участки старта ATG можно заменять на старт-кодоны GTG, TTG или CTG, что приводит к снижению трансляционной активности кодирующей области. Полного устранения экспрессии можно добиваться посредством нокаута (делеции) кодирующей области гена. Сдвиг открытой рамки считывания (ORF) с большой вероятностью приводит к преждевременному стоп-кодону в ORF, таким образом, приводя к получению нефункционального укороченного продукта. Подобным образом, вставка в рамку стоп-кодонов также приводит к получению нефункционального укороченного продукта. Для снижения эффективной концентрации конкретного гена также можно проводить добавление метки разрушения на N- или C-конец.
[0100] И наоборот, определенного уровня экспрессии генов, описываемых в настоящем документе, можно достигать с использованием более сильных промоторов. Для обеспечения высокой активности промотора в условиях высокого уровня азота (или в любых других условиях) можно получать профиль транскрипции всего генома в условиях высокого уровня азота, и из этого массива данных можно выбирать активные промоторы с желаемым уровнем транскрипции для замены слабого промотора. Для улучшения эффективности инициации трансляции слабые старт-кодоны можно заменять старт-кодоном ATG. Также можно заменять слабые участки связывания рибосом (RBS) другими RBS с улучшенной эффективностью инициации трансляции. Кроме того, для изменения активности фермента также можно проводить сайт-специфический мутагенез.
[0101] Увеличение уровня фиксации азота, которое происходит в растении, может приводить к уменьшению количества необходимых химических удобрений для получения сельскохозяйственных культур и уменьшению эмиссии парниковых газов (например, оксида одновалентного азота).
Серийный пересев
[0102] Получения бактерий для улучшения признаков растений (например, фиксации азота) можно достигать посредством серийного пересева. Его в дополнение к идентификации бактерий и/или композиций, способных к обеспечению одного или нескольких улучшенных признаков в одном или нескольких растениях, можно проводить посредством отбора растений с конкретным улучшенным признаком, на который влияет микробная флора. Один из способов получения бактерий для улучшения признака растения включает этапы: (a) выделения бактерий из ткани или почвы первого растения; (b) внесение генетической вариации в одну или несколько бактерий с получением одного или нескольких вариантов бактерий; (c) воздействие вариантами бактерий на множество растений; (d) выделение бактерий из ткани или почвы одного из множества растений, где растение, из которого выделяют бактерии, обладает улучшенным признаком относительно других растений в множестве растений; и (e) повторение этапов (b)-(d) с бактериями, выделяемыми из растения с улучшенным признаком (этап (d)). Этапы (b)-(d) можно повторять любое количество раз (например, однократно, дважды, три раза, четыре раза, пять раз, десять раз или более) до достижения улучшенным признаком растения желаемого уровня. Кроме того, множество растений может представлять собой более двух растений, например, от 10 до 20 растений или 20 или более, 50 или более, 100 или более, 300 или более, 500 или более или 1000 или более растений.
[0103] В дополнение к получению растения с улучшенным признаком, получают популяцию бактерий, содержащую бактерии, несущие одну или несколько генетических вариаций, вносимых в один или несколько генов (например, генов, регулирующих фиксацию азота). Повторяя описанные выше этапы, можно получать популяцию бактерий, которая содержит наиболее подходящих представителей популяции, которая коррелирует с представляющим интерес признаком растения. Бактерии в этой популяции можно идентифицировать и определить их благоприятные свойства, например, посредством генетического и/или фенотипического анализа. Генетический анализ можно проводить у выделенных на этапе (a) бактерий. Фенотипическую и/или генотипическую информацию можно получать с использованием способов, включающих: высокопроизводительный скрининг химических компонентов растительного происхождения, способы секвенирования, включающие высокопроизводительное секвенирование генетического материала, способы дифференциального дисплея (включая ДДОТ-ПЦР и ДД-ПЦР), способы с микропанелями нуклеиновых кислот, РНК-сек (секвенирование методом дробовика всего генома) и кПЦР-РВ (количественную ПЦР с детекцией в реальном времени). Полученную информацию можно использовать для получения профилирующей популяцию информации об идентификационных характеристиках и активности присутствующих бактерий, например, филогенетического анализа или основанного на микропанелях скрининга нуклеиновых кислот, кодирующих компоненты оперонов рРНК или других таксономически информативных локусов. Примеры таксономически информативных локусов включают ген 16S рРНК, ген 23S рРНК, ген 5S рРНК, ген 5.8S рРНК, ген 12S рРНК, ген 18S рРНК, ген 28S рРНК, ген gyrB, ген rpoB, ген fusA, ген recA, ген coxl, ген nifD. Примеры способов таксономического профилирования для определения таксонов, присутствующих в популяции описаны в US20140155283. Идентификация бактерий может включать характеризующую активность одного или нескольких генов или оного или нескольких путей передачи сигнала, например, генов, ассоциированных с путем фиксации азота. также в бактериальных популяциях могут присутствовать синергические взаимодействия (когда два компонента при их комбинации увеличивают требуемое действие более чем аддитивно) между различными видами бактерий.
[0104] Генетическая вариация может представлять собой ген, выбранный из группы, состоящей из: nifA, nifL, ntrB, ntrC, glnA, glnB, glnK, draT, amtB, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическая вариация может представлять собой вариацию в гене, кодирующем белок с функциональностью, выбранной из группы, состоящей из: глутаминсинтетазы, глутаминазы, аденилаттрансферазы глутаминсинтетазы, активатора транскрипции, антиактиватора транскрипции, пируват:флаводоксин-оксидоредуктазы, флаводоксина или АДФ-D-рибозилтрансферазы НАД+:динитрогеназоредуктазы. Генетическая вариация может представлять собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. Внесение генетической вариации может включать вставку и/или делецию одного или нескольких нуклеотидов в намеченном участке, например, 1, 2, 3, 4, 5, 10, 25, 50, 100, 250, 500 или более нуклеотидов. Генетическая вариация, вносимая в одну или несколько бактерий способами, описываемыми в настоящем документе, может представлять собой нокаут-мутацию (например, делецию промотора, вставку или делецию с получением преждевременного стоп-кодона, делецию всего гена), или она может представлять собой удаление или устранение активности белкового домена (например, точечную мутацию влияющую на активный центр, или делецию части гена, кодирующей значимую часть белкового продукта), или она может представлять собой изменение или удаление регуляторной последовательности гена-мишени. Также можно вставлять одну или несколько регуляторных последовательностей, включая гетерологичные регуляторные последовательности и регуляторные последовательности, выявленные в геноме вида или рода бактерий, соответствующих бактериям, у которых проводят генетическую вариацию. Кроме того, регуляторные последовательности можно выбирать на основе уровня экспрессии гена в культуре бактерий или в ткани растения. Генетическая вариация может представлять собой предопределенную генетическую вариацию, которую конкретно вводят в намеченный участок. Генетическая вариация может представлять собой случайную мутацию в намеченном участке. Генетическая вариация может представлять собой вставку или делецию одного или нескольких нуклеотидов. В некоторых случаях в одну или несколько выделенных бактерий перед воздействием бактерий на растения для оценки улучшения признака вносят множество различных генетических вариаций (например, 2, 3, 4, 5, 10 или более). Множество генетических вариаций может являться любым из описанных выше типов, одним и тем же или различными типами и любой их комбинацией. В некоторых случаях последовательно проводят множество различных генетических вариаций, проводя первую генетическую вариацию после первого этапа выделения, вторую генетическую вариацию после второго этапа выделения, и т.д. так, чтобы накопить множество генетических вариаций в бактериях постепенно обеспечивая улучшенные признаки у ассоциированных растений.
[0105] В основном термин "генетическая вариация" относится к любому изменению, вносимому в полинуклеотидную последовательность относительно эталонного полинуклеотида, такого как эталонный геном или его часть, или эталонный ген или его часть. Генетическую вариацию можно обозначать как "мутацию", а последовательность или организм, содержащие генетическую вариацию можно обозначать как "генетический вариант" или "мутант". Генетические вариации могут обладать рядом эффектов, таким как повышение или снижение определенного вида биологической активности, включение экспрессии гена, метаболизма и клеточной сигнализации. Генетические вариации можно конкретно вносить в намеченный участок или вносить случайным образом. Для внесения генетических вариаций доступен ряд средств и способов молекулярной биологии. Например, генетическую вариацию можно вносить посредством мутагенеза при полимеразной цепной реакции, сайт-специфического мутагенеза, насыщающего мутагенеза, мутагенез с перестановкой фрагментов, гомологичной рекомбинации, систем CRISPR/Cas9, химического мутагенеза и их сочетаний. Химические способы внесения генетических вариаций включают воздействие на ДНК химическим мутагеном, например, этилметансульфонатом (EMS), метилметансульфонатом (MMS), N-нитрозомочевиной (EN U), N-метил-N-нитро-N'-нитрозогуанидином, 4-нитрохинолин-N-оксидом, диэтилсульфатом, бензопиреном, циклофосфамидом, блеомицином, триэтилмеламином, мономерным акриламидом, азотистым ипритом, винкристином, диэпоксиалканами (например, диэпоксибутаном), ICR-170, формальдегидом, гидрохлоридом прокарбазина, этиленоксидом, диметилнитрозамином, 7,12 диметилбенз(a)антраценом, хлорамбуцилом, гексаметилфосфамидом, бисульфаном и т.п. Индуцирующие мутации посредством облучения средства включают ультрафиолетовое облучение, γ-облучение, рентгеновские лучи и бомбардировку быстрыми нейтронами. Также генетические вариации можно вносить в нуклеиновые кислоты, например, с использованием триметилпсоралена с ультрафиолетовым облучением. Другим подходящим способом получения генетической вариации является случайная или направленная вставка мобильного элемента ДНК, например, транспозона. Генетические вариации можно вносить в нуклеиновую кислоту при амплификации в бесклеточной системе in vitro, например, с использованием способа полимеразной цепной реакции (ПЦР), такого как ПЦР со сниженной точностью. Генетические вариации можно вносить в нуклеиновые кислоты in vitro с использованием способы перестановки ДНК (например, перестановки экзонов, обмены доменов и т.п.). Генетические вариации также можно вносить в нуклеиновые кислоты как результат недостаточности в клетке ферментов репарации ДНК, например, полагают, что присутствие в клетке мутантного гена, кодирующего мутантный фермент репарации ДНК, приведет к получению высокой частоты мутаций (т.е., приблизительно от 1 мутации/100 генов до 1 мутации/10000 генов) в геноме клетки. Примеры генов, кодирующих ферменты репарации ДНК в качестве неограничивающих примеров включают Mut H, Mut S, Mut L, и Mut U и их гомологи у других видов (например, от MSH1 до MSH6, от PMS1 до PMS2, MLH1, GTBP, ERCC-1 и т.п.). Примеры описаний различных способов внесения генетических вариации приведены, например, в Stemple (2004) Nature 5:1-7; Chiang et al. (1993) PCR Methods Appl 2(3): 210-217; Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751 и в патентах США №№ 6033861 и 6773900.
[0106] В качестве способа циклической амплификации в мутагенезе при полимеразной цепной реакции (ПЦР) для внесения желаемых мутаций используют мутагенные праймеры. ПЦР проводят в виде циклов денатурации, отжига и достройки. После амплификации посредством ПЦР отбор мутантной ДНК и удаление исходной плазмидной ДНК можно проводить посредством: 1) замены dCTP в течение ПЦР гидроксиметилированным dCTP, с последующим расщепление рестрикционными ферментами с удалением только негидроксиметилированной исходной ДНК; 2) одновременного мутагенеза гена устойчивости к антибиотикам и исследуемого гена, изменяя у плазмиды устойчивость к антибиотикам на устойчивость к другим антибиотикам, где устойчивость к новым антибиотикам затем облегчает отбор требуемой мутации; 3) расщепление исходной метилированной матричной ДНК после внесения требуемой мутации рестрикционным ферментом DpnI, который расщепляет только метилированную ДНК, посредством чего происходит выделение мутантных неметилированных цепей; или 4) получения кольцевых молекул мутантных продуктов ПЦР в дополнительной реакции лигирования с увеличением эффективности трансформации мутантной ДНК. Дополнительное описание иллюстративных способов можно найти, например, в US7132265, US6713285, US6673610, US6391548, US5789166, US5780270, US5354670, US5071743 и US20100267147.
[0107] В олигонуклеотид-специфическом мутагенезе, также называемом сайт-специфическим мутагенезом, как правило, используют синтетический праймер ДНК. Этот синтетический праймер содержит требуемую мутацию и комплементарен матричной ДНК вокруг участка мутации так, что он может гибридизоваться с ДНК в представляющем интерес гене. Мутация может представлять собой однонуклеотидную замену (точечную мутацию), замену нескольких нуклеотидов, делецию или вставку или их комбинацию. Затем одноцепочечный праймер достраивают с использованием ДНК-полимеразы, которая копирует остальную часть гена. Копированный таким образом ген содержит мутантный участок, и его затем можно вносить в клетку-хозяина в виде вектора и клонировать. В заключение мутантов можно отбирать посредством секвенирования ДНК для проверки того, что они содержат требуемую мутацию.
[0108] Генетические вариации можно вносить с использованием ПЦР со сниженной точностью. В этом способе представляющий интерес ген амплифицируют с использованием ДНК-полимеразы в условиях недостаточности точности репликации последовательности. Результатом является то, что продукты амплификации содержат по меньшей мере одну ошибку в последовательности. Когда ген амплифицируют и полученный продукт(ы) реакции содержит одно или несколько изменений последовательности по сравнению с матричной молекулой, полученные продукты являются мутантными по сравнению с матрицей. Другим способом внесения случайных мутаций является воздействие на клетки химическим мутагеном, таким как нитрозогуанидин или этилметансульфонат (Nestmann, Mutat Res 1975 June; 28(3):323-30), а затем у хозяина выделяют вектор, содержащий ген.
[0109] Другим способом случайного мутагенеза является насыщающий мутагенез, в котором стараются получить все или почти все возможные мутации в конкретном участке или небольшой области гена. В широком смысле насыщающий мутагенез состоит из мутагенеза полного набора мутагенных кассет (где длина каждой кассеты составляет, например, 1-500 оснований) в определенной полинуклеотидной последовательности для мутагенеза (где длина последовательности для мутагенеза составляет, например, от 15 до 100000 оснований). Таким образом, в каждую подвергаемую мутагенезу кассету вносят группу мутаций (например, в диапазоне от 1 до 100 мутаций). Группа мутаций, вносимых в одну кассету, может отличаться от второй группы мутаций, вносимых во вторую кассету в течение одного раунда насыщающего мутагенеза, или являться такой же. Примерами таких групп являются делеции, добавления, группы конкретных кодонов и группы конкретных нуклеотидных кассет.
[0110] Мутагенез с перестановкой фрагментов, также называемый перестановкой ДНК, является способом быстрой репродукции благоприятных мутаций. В примере способ перестановки, используют ДНКазу для фрагментации набора исходных генов на части длиной, например, приблизительно 50-100 п.н. После этого проводят полимеразную цепную реакцию (ПЦР) без праймеры - фрагменты ДНК с достаточным перекрыванием гомологичных последовательностей отжигаются друг с другом и затем их достраивает ДНК-полимераза. После достижения некоторыми молекулами ДНК размера исходных генов, проводят несколько циклов этой достройки посредством ПЦР. Затем эти гены можно амплифицировать посредством другой ПЦР, в этот раз с добавлением праймеров, которые сконструированы так, чтобы они были комплементарны концам цепей. Праймеры могут содержать дополнительные последовательности, добавляемые на их 5'-концы, такие как последовательности участков распознавания рестрикционных ферментов, необходимые для лигирования в клонирующий вектор. Дополнительные примеры способов перестановок приведены в US20050266541.
[0111] Мутагенез посредством гомологичной рекомбинации включает рекомбинацию экзогенного фрагмента ДНК и полинуклеотидной последовательности-мишени. После образования двухцепочечных разрывов происходит удаление участков ДНК на 5'-концах разрывов в процессе, называемом резекцией. На последующем этапе внедрения цепи выступающий 3'-конец разорванной молекулы ДНК затем "внедряется" в сходную или идентичную молекулу ДНК, которая не подвергалась разрыву. Способ можно использовать для удаления генов, удаления экзонов, добавления генов и внесения точечных мутаций. Мутагенез посредством гомологичной рекомбинации может являться постоянным или условным. Как правило, также предоставляют матрицу рекомбинации. Матрица рекомбинации может представлять собой компонент другого вектора, содержащийся в отдельном векторе, или ее предоставляют в виде отдельного полинуклеотида. В определенных вариантах осуществления матрицу рекомбинации конструируют так, чтобы она служила в качестве матрицы в гомологичной рекомбинации, например, в пределах или рядом с последовательностью-мишенью, разрезаемой или расщепляемой сайт-специфической нуклеазой. Длина матричного полинуклеотида может являться любой подходящей длиной, например, длина может составлять приблизительно или более чем приблизительно 10, 15, 20, 25, 50, 75, 100, 150, 200, 500, 1000 или более нуклеотидов. В определенных вариантах осуществления матричный полинуклеотид комплементарен части полинуклеотида, содержащего последовательность-мишень. При оптимальном выравнивании матричныый полинуклеотид может перекрываться с одним или несколькими нуклеотидами последовательности-мишени (например, приблизительно или более чем приблизительно с 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100 или более нуклеотидами). В определенных вариантах осуществления, когда матричная последовательность и полинуклеотид, содержащий последовательность-мишень, оптимально выровнены, ближайший нуклеотид матричного полинуклеотида находится в пределах приблизительно 1, 5, 10, 15, 20, 25, 50, 75, 100, 200, 300, 400, 500, 1000, 5000, 10000 или более нуклеотидов от последовательности-мишени. Неограничивающие примеры сайт-специфических нуклеаз, пригодных в способах гомологичной рекомбинации, включают нуклеазы с цинковыми пальцами, нуклеазы CRISPR, нуклеазы TALE и мегануклеазу. Для дополнительного описания использования таких нуклеаз, см. например, US8795965 и US20140301990.
[0112] CRISPR/Cas9 (короткие палиндромные повторы, регулярно расположенные группами)/ассоциированные с CRISPR (Cas) системы обеспечивают бактериям и археям приобретенный иммунитет против вирусов и плазмид посредством использования CRISPR РНК (кпРНК), направляя сайленсинг внедряющихся нуклеиновых кислот. Белок Cas9 (или его функциональный эквивалент и/или вариант, т.е., подобный Cas9 белок) в природных условиях обладает ДНК-эндонуклеазной активностью, которая зависит от ассоциации белка с двумя природными или синтетическими молекулами РНК, называемыми кпРНК и транскпРНК (также называемыми направляющими РНК). В некоторых случаях, две молекулы ковалентно связаны с формированием одной молекулы (также называемой одиночной направляющей РНК ("онРНК"). Таким образом, белок Cas9 или подобный Cas9 белок ассоциируют с направленной к ДНК РНК (где этот термин включает конфигурацию с двумя направляющими молекулами РНК и конфигурацию с одиночной направляющей молекулой РНК), которая активирует Cas9 или подобный Cas9 белок и направляет белок к последовательности нуклеиновой кислоты-мишени. Если Cas9 или подобный Cas9 белок сохраняют свою ферментативную функцию, они расщепляют ДНК-мишень с образованием двухцепочечного разрыва, что может приводить к изменению генома (т.е., редактированию: делеции, вставке (когда присутствует полинуклеотид-донор), замене и т.д.), таким образом, изменяя экспрессию генов. Определенные варианты Cas9 (которые включены в термин подобные Cas9) изменяют так, чтобы они обладали сниженной активностью расщепления ДНК (в некоторых случаях они расщепляют одну цепь вместо обеих цепей ДНК-мишени, тогда как в других случаях их активность сильно снижают до отсутствия активности расщепления ДНК). Дополнительные иллюстративные описания систем CRISPR для внесения генетических вариаций можно найти, например, в US8795965.
[0113] Для получения генетических вариаций можно использовать мутагены, посредством которых преимущественно получают точечные мутации и короткие делеции, вставки, трансверсии и/или транзиции, включая химические мутагены или облучение. В качестве неограничивающих примеров мутагены включают этилметансульфонат, метилметансульфонат, N-этил-N-нитрозомочевину, триэтилмеламин, N-метил-N-нитрозомочевину, прокарбазин, хлорамбуцил, циклофосфамид, диэтилсульфат, мономерный акриламид, мелфалан, азотистый иприт, винкристин, диметилнитрозамин, N-метил-N'-нитронитрозогуанидин, нитрозогуанидин, 2-аминопурин, 7,12-диметилбенз(a)антрацен, этиленоксид, гексаметилфосфамид, бисульфан, диэпоксиалканы (диэпоксиоктан, диэпоксибутан и т.п.), дигидрохлорид 2-метокси-6-хлор-9[3-(этил-2-хлорэтил)аминопропиламино]акридина и формальдегид.
[0114] Внесение генетической вариации может представлять собой незавершенный процесс так, что определенные бактерии в обрабатываемой популяции бактерий несут требуемую мутацию, тогда как другие нет. В определенных случаях для обогащения бактериями, несущими требуемую генетическую вариацию необходимо применять селекционное давление. Как правило, отбор успешных генетических вариантов включает отбор по или против определенной функциональности, придаваемой или устраняемой генетической вариацией, так как в случае вставки гена устойчивости к антибиотикам или устранения метаболической активности, обеспечивающей возможность преобразования нелетального соединения в летальный метаболит. Также селекционное давление можно применять на основе самой полинуклеотидной последовательности так, что необходимо внести только требуемую генетическую вариацию (например, также без необходимости селективного маркера). В этом случае, селекционное давление может включать расщепление геномов без генетической вариации, вносимой в участок-мишень так, что отбор эффективно направлен против эталонной последовательности в которую необходимо внести генетическую вариацию. Как правило, расщепление происходит в пределах 100 нуклеотидов от участка-мишени (например, в пределах 75, 50, 25, 10 или менее нуклеотидов от участка-мишени, включая расщепление в участке-мишени или в его пределах). Расщепление может направлять сайт-специфическая нуклеаза, выбранная из группы, состоящей из нуклеазы с цинковыми пальцами, нуклеазы CRISPR, нуклеазы TALE (TALEN) или мегануклеазы. Такой процесс аналогичен процессам увеличения гомологичной рекомбинации в участке-мишени, за исключением того, что не предоставлена матрица для гомологичной рекомбинации. В результате в бактериях без требуемой генетической вариации с большей вероятностью проходит расщепление, которое в отсутствии восстановления приводит к гибели клеток. Затем бактерии, выжившие в отборе, можно выделять для применения в воздействии на растения для оценки придаваемого улучшенного признака.
[0115] Для направления расщепления в участке-мишени можно использовать нуклеазу CRISPR. Используя Cas9 для уничтожения немутантных клеток, можно обеспечивать улучшенный отбор мутантных микроорганизмов. Затем растениям инокулируют мутантные микроорганизмы для подтверждения симбиоза и обеспечения эволюционного давления с отбором эффективных симбионтов. Затем микроорганизмы можно повторно выделять из тканей растений. В системах с нуклеазами CRISPR, применяемых для отбора относительно отсутствия вариантов, можно использовать элементы, сходные с описанными выше в отношении внесения генетических вариаций элементами, за исключением того, что не предоставляют матрицу для гомологичной рекомбинации. Таким образом, расщепление, направленное на участок-мишень увеличивает гибель подвергшихся ему клеток.
[0116] Доступны другие варианты специфически индуцируемого расщепления в участке-мишени, такие как нуклеазы с цинковыми пальцами, системы нуклеазы TALE (TALEN) и мегануклеаза. Нуклеазы с цинковыми пальцами (ZFN) представляют собой искусственные эндонуклеазы ДНК, получаемые посредством слияния связывающего ДНК домена цинковых пальцев с доменом расщепления ДНК. ZFN можно конструировать для расщепления требуемых последовательностей ДНК и это позволяет нуклеазам с цинковыми пальцами расщеплять уникальные последовательности-мишени. При введении в клетку ZFN можно использовать для редактирования ДНК-мишени в клетке (например, генома клетки) посредством индукции двухцепочечных разрывов. Подобные активаторам транскрипции эффекторные нуклеазы (TALEN) представляют собой искусственные эндонуклеазы ДНК, получаемые посредством слияния эффекторного ДНК-связывающего домена TAL (подобного активаторам транскрипции) с доменом расщепления ДНК. TALEN можно быстро конструировать для связывания практически любой требуемой последовательности ДНК и при введении в клетку, TALEN можно использовать для редактирования ДНК-мишени в клетке (например, генома клетки) посредством внесения двухцепочечных разрывов. Мегануклеазы (хоминг-эндонуклеаза) представляют собой эндодезоксирибонуклеазы, характеризууемые большим участком распознавания (двухцепочечных последовательностей ДНК длиной от 12 до 40 пар оснований). Мегануклеазы можно использовать для замещения, удаления или модификации последовательностей узконаправленным способом. Модифицируя узнаваемые ими последовательности посредством белковой инженерии, можно изменять последовательность-мишень. Мегануклеазы можно использовать для модификации всех типов геномов, бактерий, растений или животных и, как правило, их группируют в четыре семейства: семейство LAGLIDADG, семейство GIY-YIG, семейство His-Cyst box и семейство HNH. Иллюстративные хоминг-эндонуклеазы включают I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII.
[0117] Способы по настоящему изобретению можно использовать для придания или улучшения одного или нескольких из ряда требуемых признаков. Примеры признаков, которые можно придавать или улучшать, включают: биомассу корня, длину корня, рост, высоту побега, количество листьев, эффективность использования воды, общую биомассу, урожайность, размер плодов, размер семян, уровень фотосинтеза, засухостойкость, жароустойчивость, солеустойчивость, устойчивость к стрессу, вызванному нематодами, устойчивость к грибковому патогену, устойчивость к бактериальному патогену, устойчивость к вирусному патогену, уровень метаболита и экспрессия протеома. Требуемые признаки, включая рост, общую биомассу, биомассу корня и/или побега, пророст семян, жизнеспособность всходов, эффективность фотосинтеза, интенсивность транскрипции, количество или массу семян/плодов, урожай семян или плодов растения, содержание хлорофилла в листьях, скорость фотосинтеза, длина корня или любое их сочетание, можно использовать для определения роста и сравнения со скоростью роста эталонных сельскохозяйственных растений (например, растения без улучшенных признаков), выращиваемых в идентичных условиях. Предпочтительный придаваемый или улучшаемый признак, как описано в настоящем документе, представляет собой фиксацию азота. В некоторых случаях, растения, получаемые способами, описываемыми в настоящем документе, демонстрируют отличия по признаку, которые представляют собой превышение по меньшей мере приблизительно на 5%, например, по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 8%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%, или по меньшей мере на 100%, по меньшей мере приблизительно на 200%, по меньшей мере приблизительно на 300%, по меньшей мере приблизительно на 400% или более по сравнению с эталонным сельскохозяйственным растением, выращиваемым в почве в тех же условиях.
[0118] Улучшаемый признак можно оценивать в условиях, включающих воздействие одного или нескольких биотических или абиотических стрессовых факторов. Примеры стрессовых факторов включают абиотические стрессовые воздействия (такие как тепловой стресс, солевой стресс, вызываемый засухой стресс, холодовой стресс и стресс, вызванный недостаточностью питательных веществ) и биотические стрессовые воздействия (такие как стресс, вызываемый нематодами, стресс, вызываемый растительноядными насекомыми, стресс, вызываемый грибковыми патогенами, стресс, вызываемый бактериальными патогенами и стресс, вызываемый вирусными патогенами).
[0119] Признак, улучшаемый способами и композициями по настоящему изобретению, может представлять собой фиксацию азота, в том числе и в растении, ранее не способном к фиксации азота. В некоторых случаях бактерии, выделяемые способом, описываемым в настоящем документе, продуцируют 1% или более (например, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или более) азота растения, что может представлять собой увеличение способности к фиксации азота по меньшей мере в 2 раза (например, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз, в 10 раз, в 20 раз, в 50 раз, в 100 раз, в 1000 раз или более) по сравнению с бактериями, выделяемыми из первого растения до внесения какой-либо генетической вариации. В некоторых случаях бактерии продуцируют 5% или более азота растения. Желаемого уровня фиксации азота можно достигать после однократного или многократного повторения этапов внесения генетических вариаций, воздействия на множество растений и выделение бактерий из растений с улучшенным признаком (например, 1, 2, 3, 4, 5, 10, 15, 25 или более раз). В некоторых случаях, увеличенных уровней фиксации азота достигают в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником азота. Известны способы оценки степени фиксации азота, примеры которых описаны в настоящем документе.
Фиксация азота
[0120] В настоящем документе описаны способы увеличения фиксации азота в растении, включающие воздействие на растение бактериями, несущими одну или несколько генетических вариаций, вводимых в один или несколько генов, регулирующих фиксацию азота, где бактерии продуцируют в растении 1% или более азота (например, 2%, 5%, 10% или более), что может представлять собой по меньшей мере в 2 раза большую способность к фиксации азота по сравнению с растением в отсутствие бактерий. Бактерии могут продуцировать азот в присутствии удобрения, дополненного глутамином или аммиаком. Генетические вариации могут представлять собой любые генетические вариации, описываемые в настоящем документе, включая примеры, приводимые выше, в любом количестве и в любой комбинации. Генетическую вариацию можно вносить в ген, выбранный из группы, состоящей из nifA, nifL, ntrB, ntrC, глутаминсинтетазы, glnA, glnB, glnK, draT, amtB, глутаминазу, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ. Генетическая вариация может представлять собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD. Генетическая вариация, вносимая в одну или несколько бактерий способами, описываемыми в настоящем документе, может представлять собой нокаут-мутацию, или она может удалять регуляторную последовательность гена-мишени, или она может включать вставку гетерологичной регуляторной последовательности, например, вставку регуляторной последовательности, выявленной в геноме бактерий того же вида или рода. Регуляторную последовательность можно выбирать на основе уровня экспрессии гена в культуре бактерий или в ткани растения. Генетическую вариацию можно получать посредством химического мутагенеза. Растения, выращиваемые на этапе (c), можно подвергать воздействию биотических или абиотических стрессовых факторов.
[0121] Количественно фиксацию азота, происходящую в растениях, описываемых в настоящем документе, можно измерять различными способами, например, посредством анализа восстановления ацетилена (AR). Анализ восстановления ацетилена можно проводить in vitro или in vivo. Доказательство того, что конкретная бактерия предоставляет растению фиксированный азот, может включать: 1) общий N растения после инокуляции значимо увеличивается, предпочтительно с сопутствующим возрастанием концентрации N в растении; 2) симптомы недостаточности азота в условиях ограничения в N после инокуляции ослабляются (что должно включать возрастание сухой массы); 3) документацию фиксации N2 с использованием подхода с 15N (который может представлять собой эксперименты с разведением изотопа, анализы восстановления 15N2 или анализы распространенности 15N в природе); 4) встраивание фиксированного N в растение белок или метаболит и 5) отсутствие всех этих эффектов у растений без проведенной инокуляции или у растений, инокулированных мутантом инокулируемого штамма.
[0122] Регуляторный каскад фиксации азота дикого типа можно представить как цифровую логическую схему, где входящие O2 и NH4+ проходят через логический вентиль ИЛИ-НЕ, выход которого в дополнение к АТФ поступает в логический вентиль И. В определенных вариантах осуществления способы, описываемые в настоящем документе, нарушают действие NH4+ на эту схему в нескольких точках регуляторного каскада так, что микроорганизмы могут продуцировать азота даже на удобряемых полях. Однако способы, описываемые в настоящем документе, также предусматривают изменение влияния АТФ или O2 на схему или изменение схемы с использованием других регуляторных каскадов в клетке или изменение генетических схем, отличных от фиксации азота. Можно перестраивать генные кластеры с получением функциональных продуктов под контролем гетерологичной системы регуляции. Удаляя природные регуляторные элементы вне и в кодирующих последовательностях кластеров генов и заменяя их альтернативными системами регуляции, функциональные продукты сложных генетических оперонов и других кластеров генов можно контролировать и/или помещать в гетерологичные клетки, включая клетки других видов, отличных от видов, из которых получены природные гены. После перестройки синтетические кластеры генов можно контролировать посредством генетических схем или других индуцибельных систем регуляции, таким образом, контролируя экспрессию продуктов необходимым образом. Экспрессирующие кассеты можно конструировать так, чтобы они действовали в качестве логических вентилей, генераторов импульсов, осцилляторов, переключателей или устройств памяти. Контролирующую экспрессирующую кассету можно лигировать с промотором так, чтобы экспрессирующая кассета функционировала в качестве датчика состояний окружающей среды, такого как датчик кислорода, температуры, прикосновения, осмотического стресса, поверхностного напряжения или окислительно-восстановительного потенциала.
[0123] В качестве примера из кластера генов nif можно удалять гены nifL, nifA, nifT и nifX. Синтетические гены можно конструировать посредством рандомизации кодонов ДНК, кодирующей каждую аминокислотную последовательность. Отбор кодонов проводят, устанавливая, чтобы частота использования кодонов как можно больше отличалась от частоты использования кодонов в природном гене. Предлагаемые последовательности сканируют на наличие любых нежелательных свойств, таких как участки распознавания рестрикционных ферментов, участки распознавания транспозонов, повторяющиеся последовательности, промоторы сигма 54 и сигма 70, скрытые участки связывания рибосом и ро-независимые терминаторы. Синтетические участки связывания рибосом выбирают так, чтобы они соответствовали силе каждого соответствующего природного участка связывания рибосомы, например, конструируя плазмиду с флуоресцентным репортером, в которой 150 п.н., окружающих старт-кодон гена (от -60 до +90) слиты с геном флуоресцентного маркера. Этот химерный ген можно экспрессировать под контролем промотора Ptac, а флуоресценцию измерять посредством проточной цитометрии. Для получения синтетических участков связывания рибосом получают библиотеку репортерных плазмид с использованием 150 п.н. (от -60 до +90) синтетической экспрессирующей кассеты. В кратком изложении синтетическая экспрессирующая кассета может состоять из случайного ДНК-спейсера, вырожденной последовательности, кодирующей библиотеку RBS и кодирующей последовательности каждого синтетического гена. Подвергают скринингу множество клонов для идентификации синтетического участка связывания рибосомы, который наилучшим образом соответствует природному участку связывания рибосомы. Таким образом, конструируют синтетические опероны, которые состоят из таких же генов, что природные опероны, и тестируют на функциональную комплементацию. Дополнительное иллюстративное описание синтетических оперонов приведено в US20140329326.
Виды бактерий
[0124] Микроорганизмы, пригодные в способах и композициях, описываемых в настоящем документе, можно получать посредством выделения микроорганизмов с поверхностей или из тканей природных растений; измельчения семян с выделением микроорганизмов; высаживания семян в различные образцы почв и выделения микроорганизмов из тканей; или инокуляции растений экзогенными микроорганизмами и определения того, какие микроорганизмы обнаруживаются в тканях растений. Неограничивающие примеры тканей растений включают семена, всходы, листья, срезы, растения, луковицы или клубни. В некоторых случаях бактерии выделяют из семян. Параметры обработки образцов могут варьировать для выделения различных типов ассоциированных микроорганизмов, таких как ризосферные микроорганизмы, эпифиты или эндофиты. Вместо начального выделения из первого растения бактерии также можно получать из хранилищ, таких как коллекции природных штаммов. Микроорганизмы можно генотипировать и фенотипировать посредством секвенирование геномов выделенных микроорганизмов; профилирования составов сообществ in planta; характеристики функциональности транскриптомов сообществ или выделенных микроорганизмов; или скрининга свойств микроорганизмов с использованием селективных или фенотипических сред (например, фенотипы с фиксацией азота или растворением фосфатов). Выбранные штаммы или популяции кандидатов можно получать из данных секвенирования; данных фенотипирования; данных о растении (например, данных о геноме, фенотипе и/или урожае); данных о почве (например, pH, содержание N/P/K и/или биотическое сообщество основной почвы) или любой комбинации из них.
[0125] Бактерии и способы получения бактерий, описываемые в настоящем документе, можно применять для бактерий, способных к эффективному самостоятельному размножению на поверхностях листьев, поверхностях корней или внутри тканей растений, не вызывая разрушительной защитной реакции растений, или для бактерий, которые устойчивы к защитным реакциям растений. Бактерии, описываемые в настоящем документе, можно выделять посредством культивирования экстракта ткани растения или смыва поверхности листа в среде без добавления азота. Однако бактерии могут являться некультивируемыми, т.е. об их культивируемости может быть неизвестно, или их может быть трудно культивировать известными в данной области стандартными способами. Бактерии, описываемые в настоящем документе, могут являться эндофитными или эпифитными или бактериями, обитающими в ризосфере растения (ризосферные бактерии). Бактерии, получаемые после однократного или многократного повторения этапов внесения генетической вариации, воздействия на множество растений и выделения бактерий из растений с улучшенным признаком (например, 1, 2, 3, 4, 5, 10, 15, 25 или более раз) могут являться эндофитными, эпифитными или ризосферными. Эндофиты представляют собой организмы, которые проникают внутрь растений, не вызывая симптомов заболеваний или не вызывая формирования симбиотических структур, и представляют собой агротехнический интерес, так как они могут усиливать рост растений и улучшать питание растений (например, посредством фиксации азота). Бактерии могут представлять собой передающиеся с семенами эндофиты. Передающиеся с семенами эндофиты включают бактерии, ассоциированные с семенами трав или других растений или получаемые из них, такие как передающиеся с семенами бактериальные эндофиты, выявляемые в созревших, сухих, неповрежденных (например, без трещин, без видимой грибковой инфекции или без преждевременного пророста) семян. Передающиеся с семенами бактериальные эндофиты могут быть ассоциированы или их можно получать с поверхности семян; альтернативно или кроме того, они могут быть ассоциированы или их можно получать из внутреннего компартмента семян (например, семян со стерилизованной поверхностью). В определенных случаях передающиеся с семенами бактериальные эндофиты способны к репликации в тканях растений, например, внутри семян. В определенных случаях передающиеся с семенами бактериальные эндофиты также способны переживать обезвоживание.
[0126] Бактерии, выделяемые способами по изобретению, могут включать множество бактерий различных таксонов в комбинации. В качестве примера бактерии могут включать Proteobacteria (такие как Pseudomonas, Enterobacter, Stenotrophomonas, Burkholderia, Rhizobium, Herbaspirillum, Pantoea, Serratia, Rahnella, Azospirillum, Azorhizobium, Azotobacter, Duganella, Delftia, Bradyrhizobiun, Sinorhizobium и Halomonas), Firmicutes (такие как Bacillus, Paenibacillus, Lactobacillus, Mycoplasma и Acetabacterium) и Actinobacteria (такие как Streptomyces, Rhodacoccus, Microbacterium и Curtobacterium). Бактерии, которые можно получать способами, описываемыми в настоящем документе, включают вид Azotobacter, вид Bradyrhizobium, вид Klebsiella и вид Sinorhizobium. Бактерии можно выбирать из группы, состоящей из: Azotobacter vinelandii, Bradyrhizobium japonicum, Klebsiella pneumoniae и Sinorhizobium meliloti. Бактерии могут представлять собой бактерии родов Enterobacter и Rahnella.
[0127] Бактерии можно получать из любой обычной наземной окружающей среды, включая ее почвы, растения, грибы, животные (включая беспозвоночных) и другую биоту, включая осадки, воду и биоту озер и рек; из морской окружающей среды, ее биоты и осадков (например, морской воды, морского ила, морских растений, морских беспозвоночных (например, губок), морских позвоночных (например, рыб)); земной и морской геосферы (рыхлые поверхностные отложения и камни, например, раздробленные подпочвенные камни, песок и глины); криосферы и ее талых вод; атмосферы (например, отфильтрованной взвешенной пыли, облачных и дождевых капель); городской, промышленной и других техногенных окружающих сред (например, накопленные органический и минеральный материал на бетоне, желобах обочин, поверхностях крыш и дорожных покрытиях).
[0128] Растения, из которых получают бактерии, могут представлять собой растение с одним или несколькими требуемыми признаками, например, растения, которые в природе растут в конкретной окружающей среде или в определенных представляющих интерес условиях. В качестве примера, определенное растение может в природе расти в песчаном грунте или песке с высокой минерализацией, или при экстремальных температурах, или с малым количеством воды, или оно может быть устойчивым к определенным вредителям или заболеваниям, присутствующим в окружающей среда, и желательным может являться выращивание коммерческой сельскохозяйственной культуры в таких условиях, в частности, например, если они представляют собой единственные доступные в конкретном географическом положении условия. В качестве дополнительного примера бактерии можно выделять из коммерческой сельскохозяйственной культуры, выращиваемой в таких средах или более конкретно, из конкретной сельскохозяйственной культуры, в которой среди сельскохозяйственных культур, выращиваемых в любой конкретной окружающей среде, наилучшим образом представлен представляющий интерес признак: например, наиболее быстрорастущие растения среди сельскохозяйственных культур, выращиваемых в почвах с ограниченным уровнем солей, или наименее повреждаемые растения среди сельскохозяйственных культур, подвергшихся сильному повреждению насекомыми или эпидемическим заболеванием, или растения с требуемыми количествами определенных метаболитов и других соединений, включая содержание волокон, содержание масел и т.п., или растения, демонстрирующие требуемые цвета, вкус или запах. Бактерии можно выделять из представляющего интерес растения или любого материала, находящегося в исследуемой окружающей среде, включая грибы и другую животную и растительную биоту, почву, воду, осадки и друг составляющие окружающей среды, как указано ранее.
[0129] Бактерии можно выделять из ткани растения. Это выделение можно проводить из любой подходящий ткани растения, включая например, корень, стебель и листья и репродуктивные ткани растения. В качестве примера, общепринятые способы выделения из растений, как правило, включают вырезание в стерильных условиях материала исследуемого растения (например, участки корня или стебля, листья), стерилизация поверхности подходящим раствором (например, 2% гипохлоритом натрия) с последующим помещением материала растения на питательную среду для роста микроорганизмов. Альтернативно, материал растения со стерилизованной поверхностью можно измельчать в стерильную жидкость (как правило, воду) и жидкую суспензию, содержащую небольшие части измельченного материала растения наносить на поверхность подходящей твердой агарозной среды или сред, которые могут являться селективными или нет (например, содержать только фитиновую кислоту в качестве источника фосфора). Этот подход особенно пригоден для бактерий, которые формируют изолированные колонии и которые можно индивидуально перенести на отдельные планшеты с питательной средой, и дополнительно очищать до одного вида хорошо известными способами. Альтернативно, образцы корней или листьев растение можно не подвергать поверхностной стерилизации, а только аккуратно промыть, таким образом, включая в процесс выделения обитающие на поверхности эпифитные микроорганизмы, или эпифитные микроорганизмы можно выделять отдельно, прикладывая и убирая части корней, стеблей или листьев растений на поверхности агарозной среда, а затем выделяя отдельные колонии, как описано выше. Этот подход особенно пригоден, например, для бактерий. Альтернативно, корни можно обрабатывать без отмывания небольших количеств почвы, налипших на корни, таким образом, включая микроорганизмы, которые колонизирует ризосферу растения. В других случаях можно отбирать почву, налипшую на корни, разбавлять и наносить на агар с подходящими селективными и неселективными средами с получением отдельных колоний ризосферных бактерий.
[0130] Биологически чистые культуры Rahnella aquatilis и Enterobacter sacchari депонированы 14 июля 2015 года в American Type Culture Collection (ATCC; International Depositary Authority), Manassas, VA, USA, и с присвоенными номерами указания патентного депонирования ATTC PTA-122293 и PTA-122294, соответственно. Эти депозиты сделаны в соответствии с положениями Budapest Treaty on the International Recognition of the Deposit of Microorganisms for the Purpose of Patent Procedure and the Regulations (Budapest Treaty).
Композиции
[0131] Для улучшения признаков растений также можно использовать композиции, содержащие бактерии или бактериальные популяции, получаемые способами, описываемыми в настоящем документе, и/или с характеристиками, как описано в настоящем документе. Композиции, содержащие бактериальные популяции можно наносить на поверхность семян, и они могут находиться в жидкой форме. Композиции включают покрытия семян для коммерчески важных сельскохозяйственных культур, например, сорго, канолы, томата, клубники, ячменя, риса, кукурузы и пшеницы. Композиции также можно распылять на надземные части растений или наносить на корни, внося их в борозды, в которые сажают семена растений, поливая почву или опуская корни в суспензию композиции. Композиции можно обезвоживать подходящим способом, который сохраняет жизнеспособность клеток и способность к искусственному заселению и колонизации растений-хозяев. Виды бактерий могут присутствовать в композициях в концентрации от 108 до 1010 КОЕ/мл. Композиции можно дополнять ионами металлов-микроэлементов, такими как ионы молибдена, ионы железа, ионы марганца или комбинации этих ионов. Концентрации ионов в композициях, описываемых в настоящем документе, могут составлять приблизительно от 0,1 мМ до приблизительно 50 мМ. Композиции также можно формулировать c носителем, таким как бета-глюкан, карбоксилметилцеллюлоза (CMC), бактериальное внеклеточное полимерное вещество (EPS), сахар, молоко животного или другие подходящие носители. Альтернативно, в качестве носителя можно использовать торф или посадочные материалы или биополимеры, в которых композицию помещают в биополимер. Композиции, содержащие бактериальные популяции, описываемые в настоящем документе, могут улучшать признаки растений, например, стимулировать рост растений, поддерживать высокое содержание хлорофилла в листьях, увеличивать количества плодов или семян и увеличивать массу единичного плода или семени.
[0132] Композиции, содержащие бактериальные популяции, описываемые в настоящем документе, можно наносить на поверхность семян. Таким образом, предусмотрены композиции, содержащие семена, покрытые одним или несколькими видами бактерий, описанных в настоящем документе. Покрытие семян можно формулировать, смешивая популяцию бактерий с пористым, химически инертным гранулярным носителем. Альтернативно, композиции можно вносить непосредственно в борозды, в которые высаживают семена или распылять на листья растений или наносить посредством погружения корней в суспензию композиции. Можно использовать эффективное количество композиции для заполнения области грунта рядом с корнями растения с ростом жизнеспособных бактерий или заселения листьев растения с ростом жизнеспособных бактерий. Как правило, эффективное количество представляет собой количество, достаточное для получения растений с улучшенными признаками (например, с желаемым уровнем фиксации азота).
[0133] Бактериальные композиции, описываемые в настоящем документе, можно формулировать с использованием приемлемого в сельском хозяйстве носителя. Состав, пригодный для этих вариантов осуществления, может содержать по меньшей мере одного представителя, выбранного из группы, состоящей из придающего клейкость средства, стабилизатора микроорганизмов, фунгицида, антибактериального средства, гербицида, нематоцида, инсектицида, регулятора роста растения, удобрения, родентицида, поглотителя влаги и питательного вещества. Например, любая из композиций, описываемых в настоящем документе, может содержать приемлемый в сельском хозяйстве носитель (например, один или несколько из удобрений, таких как неприродное удобрение, обеспечивающих прилипание средств, таких как неприродное обеспечивающее прилипание средство, и пестицидов, таких как неприродный пестицид). Неприродное обеспечивающее прилипание средство может представлять собой, например, полимер, сополимер или синтетический воск. Например, любой из покрытых семян, всходов или растений, описываемых в настоящем документе, может содержать в покрытии семян такой приемлемый в сельском хозяйстве носитель. В любых из композиций или способов, описываемых в настоящем документе, приемлемый в сельском хозяйстве носитель может представлять собой или может содержать неприродное соединение (например, неприродное удобрение, неприродное обеспечивающее прилипание средство, такое как полимер, сополимер или синтетический воск, или неприродный пестицид). Неограничивающие примеры приемлемых в сельском хозяйстве носителей описаны ниже. В данной области известны дополнительные примеры приемлемых в сельском хозяйстве носителей.
[0134] В некоторых случаях бактерии смешивают с приемлемым в сельском хозяйстве носителем. Носитель может представлять собой твердый носитель или жидкий носитель, и находиться в различных формах, включая микросферы, порошки, эмульсии и т.п. Носитель может представлять собой любой один или несколько из ряда носителей, которые обеспечивают ряд таких свойств, как увеличенная стабильность, смачиваемость или диспергируемость. В композиции можно включать средства для смачивания, такие как природные или синтетические поверхностно-активные вещества, которые могут быть неионными или ионными поверхностно-активными вещества, или их сочетание. Также для формулирования композиций, которые содержат выделенные бактерии, можно использовать эмульсии вода-в-масле (см., например, патент США № 7485451). Подходящие составы, которые можно получать, включают смачиваемые порошки, гранулы, гели, агарозные пластинки или шарики, загустители и т.п., микроинкапсулированные частицы и т.п., жидкости, такие как водные жидкости, водные суспензии, эмульсии вода-в-масле и т.д. Состав может содержать зерновые или бобовые продукты, например, молотые зерна или бобы, бульон или муку тонкого помола, получаемые из зерен или бобов, крахмал, сахар или масло.
[0135] В определенных вариантах осуществления сельскохозяйственный носитель может представлять собой почву или среду для выращивания растений. Другие сельскохозяйственные носители, которые можно использовать, включают воду, удобрения, растительные масла, увлажнители или их сочетания. Альтернативно, сельскохозяйственный носитель может быть твердым, таким как диатомовая земля, глина, диоксид кремния, альгинат, глинистый грунт, бентонит, вермикулит, семенные коробочки, другое растительные и животные продукты или их комбинации, включая гранулы, осадки или суспензии. В качестве носителей также предусмотрены смеси любых указанных выше ингредиентов, в качестве неограничивающих примеров такие как песта (мука тонкого помола и каолиновая глина), шарики на основе агара или муки тонкого помола в глине, песке или глинистый грунт и т.д. Составы могут содержать источники пищи для бактерий, такие как ячмень, рис или другие биологические материалы, такие как семена, части растений, выжимки сахарного тростника, шелуха или плодоножки после обработки зерна, измельченный растительный материал или древесину из отходов строительных участков, опилки или мелкие волокна после переработки бумаги, ткани или дерева.
[0136] Для помощи в стимуляции роста или обеспечения питательных веществ для семян, всходов или растений можно использовать, например, удобрение. Неограничивающие примеры удобрений включают азот, фосфор, калий, кальций, серу, магний, бор, хлорид, марганец, железо, цинк, медь, молибден и селен (или их соли). Дополнительные примеры удобрений, включают одну или несколько аминокислот, соли, углеводы, витамины, глюкозу, NaCl, дрожжевой экстракт, NH4H2PO4, (NH4)2SO4, глицерин, валин, L-лейцин, молочную кислоту, пропионовую кислоту, янтарную кислоту, яблочную кислоту, лимонную кислоту, тартрат KH, ксилозу, ликсозу и лецитин. В одном из вариантов осуществления состав может содержать придающее клейкость средство или клеящее средство (обозначаемое как адгезивное средство), помогающее связывать другие активные средства с веществом (например, с поверхностью семян). Такие средства пригодны для комбинации бактерий с носителями, которые могут содержать другие соединения (например, контрольные средства, которые являются небиологическими), с получением покрывающей композиции. Такие композиции помогают получать покрытия вокруг растения или семян с поддержанием контакта микроорганизмов и других средств с растением или частью растения. В одном из вариантов осуществления адгезивы выбраны из группы, состоящей из: альгината, камедей, различных видов крахмала, лецитинов, формононетина, поливинилового спирта, щелочного формононетината, гесперетина, поливинилацетата, цефалинов, гуммиарабика, ксантановой камеди, минерального масла, полиэтиленгликоля (ПЭГ), поливинилпирролидона (ПВП), арабино-галактана, метилцеллюлозы, ПЭГ 400, хитозана, полиакриламида, полиакрилата, аолиакрилонитрила, глицерина, триэтиленгликоля, винилацетата, геллановой камеди, полистирола, поливинила, карбоксиметилцеллюлозы, камеди гхатти и полиоксиэтилен-полиоксибутиленовых блок-сополимеров.
[0137] В определенных вариантах осуществления адгезивы могут представлять собой, например, воск, такой как карнаубский воск, пчелиный воск, китайский воск, шеллачный воск, спермацетовый воск, канделильский воск, гидрированное касторовое масло, орикурийский воск и воск рисовых отрубей, полисахарид (например, крахмал, декстрины, мальтодекстрины, альгинат и хитозаны), жир, масло, белок (например, желатин и зеины), гуммиарабик и шеллаки. Адгезивные средства могут представлять собой неприродные соединения, например, полимеры, сополимеры и воска. Например, неограничивающие примеры полимеров, которые можно использовать в качестве адгезивного средства, включают: поливинилацетаты, сополимеры поливинилацетатов, сополимеры этилена и винилацетата (EVA), поливиниловые спирты, сополимеры поливиниловых спиртов, соединения целлюлозы (например, различные виды этилцеллюлозы, метилцеллюлозы, гидроксиметилцеллюлозы, гидроксипропилцеллюлозы и карбоксиметилцеллюлозы), поливинилпирролидоны, винилхлорид, сополимеры винилиденхлорида, лигносульфонаты кальция, акриловые сополимеры, поливинилакрилаты, полиэтиленоксид, ациламидные полимеры и сополимеры, полигидроксиэтилакрилат, мономерные метилакриламиды и полихлоропрен.
[0138] В определенных примерах одно или несколько из адгезивных средств, противогрибковых средств, средств регуляции роста и пестицидов (например, инсектицидов) представляют собой неприродные соединения (например, в любой комбинации). Дополнительные примеры приемлемых в сельском хозяйстве носителей включают дисперсанты (например, поливинилпирролидон/винилацетат PVPIVA S-630), поверхностно-активные вещества, связывающие средства и наполнители.
[0139] Состав также может содержать поверхностно-активное вещество. Неограничивающие примеры поверхностно-активных веществ включают смеси азотных удобрений и поверхностно-активных веществ, такие как Prefer 28 (Cenex), Surf-N (US), Inhance (Brandt), P-28 (Wilfarm) и Patrol (Helena); этерифицированные масла семян включают Sun-It II (AmCy), MSO (UAP), Scoil (Agsco), Hasten (Wilfarm) и Mes-100 (Drexel); и органо-силиконовые поверхностно-активные вещества включают Silwet L77 (UAP), Silikin (Terra), Dyne-Amic (Helena), Kinetic (Helena), Sylgard 309 (Wilbur-Ellis) и Century (Precision). В одном из вариантов осуществления поверхностно-активное вещество присутствует в концентрации от 0,01% об./об. до 10% об./об. В другом варианте осуществления поверхностно-активное вещество присутствует в концентрации от 0,1% об./об. до 1% об./об.
[0140] В определенных случаях состав содержит стабилизатор микроорганизмов. Такое средство может включать поглотитель влаги, который может включать любое соединение или смесь соединений, которые можно классифицировать как поглотитель влаги вне зависимости от того используют ли соединение или соединения в таких концентрациях, что они фактически проявляют высушивающее действие на жидкое инокулируемое средство. Такие поглотители влаги в идеале совместимы с используемыми популяциями бактерий и должны поддерживать способность популяции микроорганизмов переживать нанесение на семена и переживать обезвоживание. Примеры подходящих поглотителей влаги включают одно или несколько из трегалозы, сахарозы, глицерина и метиленгликоля. Другие подходящие поглотители влаги в качестве неограничивающих примеров включают невосстанавливающие сахара и сахарные спирты (например, маннит или сорбит). Количество поглотителя влаги, вводимое в состав, может находиться в диапазоне приблизительно от 5% до приблизительно 50% по массе/объему, например, приблизительно от 10% до приблизительно 40%, приблизительно от 15% до приблизительно 35% или приблизительно от 20% до приблизительно 30%. В некоторых случаях предпочтительно, чтобы состав содержал такие средства, как фунгицид, антибактериальное средство, гербицид, нематоцид, инсектицид, регулятор роста растения, родентицид или питательное вещество. Неограничивающие примеры регуляторов роста включают брассиностероиды, цитокинины (например, кинетин и зеатин), ауксины (например, индолилуксусную кислоту и индолилацетиласпартат), флавоноиды и изофлавоноиды (например, формононетин и диосметин), фитоауксины (например, глицеоллин) и индуцируемые фитоалексинами олигосахариды (например, пектин, хитин, хитозан, полигалактуроновая кислота и олигогалактуроновая кислота) и гибеллерины. Такие средства в идеале совместимы с сельскохозяйственными семенами или всходами, на которые наносят состав (например, он не должен быть вреден для роста или здоровья растений). Кроме того, в идеале средство представляет собой средство, которое не представляет угрозу безопасности применения для человека, животного или промышленного (например, отсутствие угроз безопасности или соединение является в достаточной степени нестабильным так, что потребляемый растительный продукт, получаемый из растения, содержит незначительные количества этого соединения).
[0141] В жидкой форме, например, в растворе или суспензии, бактериальные популяции можно смешивать или суспендировать в воде или в водных растворах. Подходящие жидкие разбавители или носители включают воду, водные растворы, нефтяные дистилляты или другие жидкие носители.
[0142] Твердые композиции можно получать посредство диспергирования бактериальных популяций в соответствующим образом измельченном твердом носителе и на нем, таком как торф, пшеница, отруби, вермикулит, глина, тальк, бентонит, диатомовая земля, фуллерова глина, пастеризованная почва и т.п. Когда такие составы используют в качестве смачиваемых порошков, можно использовать биологически совместимые диспергирующие средства, такие как неионные, анионные, амфотерные или катионные диспергирующие средства и эмульгаторы.
[0143] Твердые носители, используемые в составе включают, например, минеральные носители, такие как каолиновая глина, пирофиллит, бентонит, монтмориллонит, диатомовая земля, кислая белая земля, вермикулит и перлит, и неорганические соли, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевина, хлорид аммония и карбонат кальция. Также можно использовать органические тонкодисперсные порошки, такие как пшеничная мука, пшеничные отруби и рисов отруби. Жидкие носители включают растительные масла, такие как соевое масло и хлопковое масло, глицерин, этиленгликоль, полиэтиленгликоль, пропиленгликоль, полипропиленгликоль и т.д.
Виды растений
[0144] Способы и бактерии, описываемые в настоящем документе подходят для любого из множества растений, таких как растения родов Hordeum, Oryza, Zea и Triticeae. Другие неограничивающие примеры подходящих растений включают мхи, лишайники и водоросли. В некоторых случаях растения имеют экономическое, социальное и/или природоохранное значение, являясь продовольственными культурами, волокнистыми сельскохозяйственными культурами, масличными культурами, растениями, используемыми в лесной или целлюлозно-бумажной промышленности, сырьем для получения биотоплива и/или декоративными растениями. Неограничивающие примеры сельскохозяйственных культур включают кукурузу, рис, пшеницу, ячмень, сорго, просо, овес, рожь тритикале, гречиху, сахарную кукурузу, сахарный тростник, репчатый лук, томаты, клубнику и спаржу.
[0145] Растения, которые можно получать или улучшать с использованием способов и композиций, описываемых в настоящем документе, также включают ананас, банан, кокос, лилии и травы; и двудольные растения, такие как, например, горох, люцерна, физалис, дыню, нут, цикорий, клевер, кочанную капусту, чечевицу, сою, табак, картофель, батат, редис, огородную капусту, рапс, яблоневые деревья, виноград, хлопок, подсолнечник, арабидопсис, канолу, цитрусовые (включая апельсин, мандарин, кумкват, лимон, лайм, грейпфрут, тангерин, танжело, цитрон и помело), перец, фасоль и латук.
[0146] В некоторых случаях улучшаемое растение трудно поддается экспериментальным условиям. Например, может пройти слишком много времени для достаточного роста сельскохозяйственной культуры, чтобы практически последовательно оценить улучшенный признак в нескольких повторениях. Таким образом, первое растение, из которого исходно выделяют бактерии, и/или множество растений, для которых применяют генетически модифицированные бактерии, могут представлять собой модельные растения, такие как растение, более поддающиеся анализу в требуемых условиях. Неограничивающие примеры модельных растений включают Setaria, Brachypodium и Arabidopsis. Способность бактерий, выделяемых способом по настоящему изобретению с использованием модельного растения, затем для подтверждения приобретения улучшенного признака можно применять для растений другого типа (например, сельскохозяйственной культуры).
[0147] Признаки, которые можно улучшать способами, описываемыми в настоящем документе, включают любые наблюдаемые характеристики растения, включая, например, скорость роста, рост, массу, цвет, вкус, запах, изменения продукции растением одного или нескольких соединений (включая например, метаболиты, белки, лекарственные средства, углеводы, масла и любые другие соединения). Также предусмотрен отбор растений на основе генотипической информации (например, включая профиль экспрессии генов растения в ответ на бактерии или идентификацию присутствия генетических маркеров, таких как генетические маркеры, ассоциированные с увеличенной фиксацией азота). Растения в противоположность присутствию определенного свойства или признака (таких как требуемые свойство или признак) также можно выбирать на основе отсутствия, подавления или ингибирования определенного свойства или признака (таких как нежелательные свойство или признак).
ПРИМЕРЫ
[0148] В примерах, предоставляемых в настоящем документе, описаны способы выделения бактерий, анализа бактерий и растений и улучшения признаков растений. Примеры приведены исключительно с иллюстративными целями, и их не следует рассматривать, как каким-либо образом ограничивающие.
Пример 1: Выделение микроорганизмов из ткани растения
[0149] В различных сельскохозяйственных районах центральной Калифорнии получали верхние слои почвы. Получали двадцать почв с различными структурными характеристиками, включая плотную глину, торфяной суглинок, илистую глину и суглинок. Семена различных полевых кукурузы, сахарной кукурузы, старой негибридной кукурузу и томата высаживали в каждую почву, как представлено в таблице 1.
Таблица 1: Типы и сорта сельскохозяйственных культур, высаживаемых в почвы с различными характеристиками
[0150] Растения выкорчевывали через 2-4 недели роста и избыток почвы на поверхностях корней удаляли деионизированной водой. После удаления почвы у растений стерилизовали поверхность побелкой и интенсивно промывали в стерильной воде. Из растения вырезали 1 см участка очищенного корня и помещали в фосфатно-солевой буфер, содержащий 3 мм стальные гранулы. Посредством интенсивного перемешивания раствора на Qiagen TissueLyser II получали взвесь.
[0151] Взвесь корня и солевого раствора разбавляли и инокулировали на различные типы сред для выращивания для выделения ризосферных, эндофитных, эпифитных и других ассоциированных с растениями микроорганизмов. Для получения единичных колоний использовали агарозные среды R2A и Nfb, а для получения популяций фиксирующих азот бактерий использовали полутвердые скошенные среды Nfb. Через 2-4 недели инкубации в полутвердых скошенных средах Nfb популяции микроорганизмов собирали и штрихами наносили на агар R2A для получения единичных колоний, как показано на фигуре 1A-B. Единичные колонии ресуспендировали в смеси R2A и глицерина, подвергали анализу ПЦР и замораживали при -80°C для дальнейшего анализа. Получали приблизительно 1000 единичных колоний и обозначали как "выделенные микроорганизмы".
[0152] Затем изоляты подвергали скринингу колоний посредством ПЦР с детекцией присутствия генов nifH для идентификации диазотрофов. Для анализа присутствия кластера nif в каждом изоляте использовали ранее описанный набор праймеров Ueda 19F/388R, для которого показано, что посредством него при скринингах детектируют более 90% диазотрофов (Ueda et al. 1995; J. Bacteriol. 177: 1414-1417). Накалывали единичные колонии выделенных изолятов, ресуспендировали в PBS и использовали в качестве матрицы для ПЦР колоний, как представлено на фигуре 2. Колонии изолятов, для которых получали положительные полосы при ПЦР повторно высевали штрихом, и дважды повторяли ПЦР колоний и повторное высевание штрихом для предотвращения ложно-положительной идентификации диазотрофов. Затем выделенные изоляты обозначали как "микроорганизмы-кандидаты".
Пример 2: Характеристика выделенных микроорганизмов
Секвенирование, анализ и филогенетическая характеристика
[0153] Для получения предварительных филогенетических идентификационных характеристик выделенных микроорганизмов и микроорганизмов-кандидатов использовали секвенирование 16S рДНК с набором праймеров 515f-806r (см. например, Vernon et al.; BMC Microbiol. 2002 Dec 23;2:39.). Микроорганизмы содержали различные рода, включая: Enterobacter, Burkholderia, Klebsiella, Bradyrhizobium, Rahnella, Xanthomonas, Raoultella, Pantoea, Pseudomonas, Brevundimonas, Agrobacterium и Paenibacillus, как представлено в таблице 2.
Таблица 2: Разнообразие микроорганизмов, выделяемых из растений томата, как определено посредством глубокого секвенирования 16S рДНК.
[0154] Затем, геномы 39 микроорганизмов-кандидатов секвенировали с использованием платформы Illumina Miseq. Геномную ДНК из чистых культур выделяли с использованием мини-набора для ДНК QIAmp (QIAGEN), а библиотеки тотальной ДНК для секвенирования получали у независимого поставщика (SeqMatic, Hayward). Затем проводили сборку генома посредством конвейера A5 (Tritt et al. 2012; PLoS One 7(9):e42304). Проводили идентификацию и аннотацию генов, и гены, связанные с регуляцией и проявлением фиксации азота отмечали в качестве мишеней мутагенеза.
Транскриптомное профилирование микроорганизмов-кандидатов
[0155] Для идентификации промоторов, которые активны в присутствии азота окружающей среды проводили транскриптомное профилирование штамма CI010. Штамм CI010 культивировали в определенной среде без азота, дополненной 10 мМ глутамином. Из этих культур выделяли тотальную РНК (набор QIAGEN RNeasy) и подвергали секвенированию RNAseq посредством HiSeq Illumina (SeqMatic, Fremont CA). Прочтения секвенирования картировали на данные генома CI010 с использованием Geneious и идентифицировали высокоэкспрессированные гены под контролем проксимальных промоторов транскрипции. В таблицах 3A-C перечислены гены и их относительные уровни экспрессии, определяемые посредством секвенирования RNAseq тотальной РНК. Последовательности проксимальных промоторов регистрировали для применения в мутагенезе метаболических путей nif, метаболических путей, связанных с утилизацией азота, или других генов с требуемым уровнем экспрессии.
Оценка удобства манипуляций с генами
[0156] Микроорганизмы-кандидаты характеризовали на основе способности к трансформации и удобства манипуляций с генами. Во-первых, определяли оптимальное использование источника углерода посредством выращивания на небольшой панели соответствующей среды, а также кривую роста в средах без азота и в богатых средах. Во-вторых, определяли природную устойчивость к антибиотикам каждого штамма посредством метода реплик и выращивания в жидкой культуре, содержащей панель антибиотиков, используемых в качестве селективных маркеров мутагенеза. В-третьих, каждый штамм тестировали на его способность к трансформации посредством электропорации коллекции плазмид. Коллекция плазмид содержит комбинаторное расширение семи участки начала репликации, т.е., p15a, pSC101, CloDF, colA, RK2, pBBR1 и pRO1600 и четыре маркера устойчивости к антибиотикам, т.е., CmR, KmR, SpecR и TetR. Эту системную оценку совместимости участков начала репликации и маркеров устойчивости использовали для идентификации векторов для основанного на плазмидах мутагенеза микроорганизмов-кандидатов.
Пример 3: Мутагенез микроорганизмов-кандидатов
Опосредованный Red лямбда нокаут
[0157] Получали несколько мутантных микроорганизмов-кандидатов с использованием плазмиды pKD46 или ее производное, содержащие маркер устойчивости к канамицину (Datsenko et al. 2000; PNAS 97(12): 6640-6645). Нокаут-кассеты конструировали с гомологией 250 п.н., фланкирующей ген-мишень, и получали посредством ПЦР с достройкой перекрывающихся участков. Микроорганизмы-кандидаты трансформировали pKD46, культивировали в присутствии арабинозы для индукции механизм экспрессии Red лямбда, подготавливали для электропорация и трансформировали нокаут-кассетами с получением мутантных штаммов-кандидатов. Для получения тринадцати кандидатов, мутантных по регуляторным генам фиксации азота nifL, glnB и amtB, использовали четыре микроорганизма-кандидата и один лабораторный штамм, Klebsiella oxytoca M5A1, как представлено в таблице 4.
Таблица 4: Список одиночных нокаут-мутантов, полученных с использованием опосредованного Red лямбда мутагенеза
Олигонуклеотид-специфический мутагенез с отбором Cas9
[0158] Для локализации изменений генома в гене rpoB DH10B E. coli использовали олигонуклеотид-специфический мутагенез, а мутантов отбирали с использованием системы CRISPR-Cas. Проведено конструирование мутагенного олигонуклеотида (ss1283: "G*T*T*G*ATCAGACCGATGTTCGGACCTTCcaagGTTTCGATCGGACATACGCGACCGTAGTGGGTCGGGTGTACGTCTCGAACTTCAAAGCC", где * означает тиофосфатную связь) для придания устойчивости к рифампицину посредством мутации 4 п.н. в гене rpoB. В клетках, содержащих плазмиду, кодирующую Cas9, проводили индукцию экспрессии Cas9, подготавливали их для электропорации, а затем проводили электропорацию мутагенным олигонуклеотидом и плазмидой, кодирующей конститутивную экспрессию направляющей РНК (нРНК), которая направляет расщепление Cas9 последовательности rpoB WT. Подвергнутые электропорации клетки восстанавливали в неселективных средах в течение ночи для обеспечения достаточной сегрегации полученных мутантных хромосом. После высевания на селекционную среду для отбора кодирующей нРНК плазмиды, показано, что две из десяти подвергаемых скринингу колоний содержат требуемую мутацию, тогда как остальные, как показано, являются "ускользнувшими" мутантами, полученными вследствие протоспейсерной мутации в плазмиде с нРНК или потери плазмиды с Cas9.
Опосредованный Red лямбда мутагенез с отбором посредством Cas9
[0159] Получали мутанты микроорганизмов-кандидатов CI006 и CI010 с использованием опосредованного Red лямбда мутагенеза с отбором посредством CRISPR-Cas. Нокаут-кассеты содержали эндогенный промотор, идентифицированный посредством транскриптомного профилирования (как описано в примере 2 и приведено в таблице 3) и области гомологии ≈250 п.н., фланкирующие мишень делеции. CI006 и CI010 трансформировали плазмидами, кодирующими систему рекомбинации Red лямбда (гены exo, beta, gam) под контролем промотора, индуцируемого арабинозой, и Cas9 под контролем промотора, индуцируемого IPTG. У полученных трансформантов индуцировали системы рекомбинации Red и Cas9 и получали штаммы для электропорации. Затем в компетентные клетки трансформировали нокаут-кассеты и плазмиду с кодируемой селектирующей нРНК. После высевания на селективные среды с антибиотиками для плазмиды Cas9 и плазмиды с нРНК, 7 из 10 подвергнутых скринингу колоний продемонстрировали требуемую нокаут-мутация, как представлено на фигуре 3.
Пример 4: Фенотипирование молекул-кандидатов in vitro
[0160] У различных мутантов определяли влияние экзогенного азота на биосинтез и активность нитрогеназы. Для определения нитрогеназной активности в условиях чистой культуры использовали анализ восстановления ацетилена (ARA) (Temme et. al. 2012; 109(18): 7085-7090). Штаммы выращивали в герметически закрытых тестовых пробирках и восстановление ацетилена в этилен количественно определяли с использованием газового хроматографа Agilent 6890. Активность микроорганизмов-кандидатов и других мутантов-кандидатов, выращиваемых в средах для фиксации азота, дополненных глутамином в концентрации от 0 до 10 мМ, в ARA представлена на фигурах 4A-B и фигурах 10A-C.
[0161] В анаэробных условиях культивирования определяли диапазон концентраций глутамина и аммиака с количественным определением влияния на активность фиксации азота. В клетках дикого типа по мере роста концентрации глутамина активность быстро снижалась. Однако в ряду исходных нокаут-мутаций был подтвержден класс мутаций, обеспечивающих экспрессию генов фиксации азота в условиях концентрации глутамина, которые в ином случае подавляют эту активность у дикого типа. Как видно на фигуре 4C, этот профиль получали у четырех разных видов диазотрофов. Кроме того, перенастраивая регуляторную сеть с использованием идентифицированных генетических компонентов, уровень активности фиксации азота регулировали предсказуемым образом. Это можно наблюдать на фигуре 4B, на который проиллюстрированы штаммы CM023, CM021, CM015 и CI006. Штамм CM023 представляет собой слабо эволюционировавший штамм; штамм CM021 представляет собой сильно эволюционировавший штамм; штамм CM015 представляет собой средне эволюционировавший штамм; штамм CI006 представляет собой штамм дикого типа (штамм 2). Аммиак, выделяемый в супернатанты культур, тестировали с использованием ферментативного анализа (MEGAZYME). В анализе определяли количество расходуемого NADPH при оптической плотности 340 нм. Анализ проводили в бактериальных культурах, выращиваемых в не содержащей азот, анаэробной среде с исходной плотностью 109 КОЕ/мл. Как видно на фигуре 4D, в панели из шести эволюционировавших штаммов, один из штаммов выделял до 100 мкМ аммиака в течение периода 48 часов. Кроме того, как видно на фигуре 11 двойной мутант демонстрировал большее выделение аммиака, чем одиночный мутант, из которого он получен. Это демонстрирует способность микроорганизмов продуцировать аммиак в количествах, превышающих их физиологические потребности.
Транскриптомное профилирование чистых культур
[0162] Транскрипционная активность CI006 определяли с использованием платформы Nanostring Elements. Клетки выращивали в не содержащей азот среде и через 4 часа инкубации собирали 108 клеток. Выделяли тотальную РНК с использованием набора Qiagen RNeasy. Очищенную РНК отправляли в Core Diagnostics в Palo Alto, CA, для гибридизации с зондами и анализа Digital Analyzer, как представлено на фигуре 5.
Пример 5: Фенотипирование микроорганизмов-кандидатов in planta
Колонизация растений микроорганизмами-кандидатами
[0163] Колонизацию желательных растения-хозяев микроорганизмами-кандидатами количественно определяли посредством экспериментов с кратковременным ростом растений. Растения кукурузы инокулировали штаммами, экспрессирующими RFP с плазмиды или с интегрированной посредством Tn5 экспрессирующей RFP кассеты. Растения выращивали в стерилизованном песке и нестерильной торфяной среде, а инокуляцию проводили посредством нанесения 1 мл культуры клеток пипеткой непосредственно на появившийся колеоптиль растения через трое суток после пророста. Плазмиды сохраняли посредством полива растений раствором, содержащим соответствующий антибиотик. Через три недели, собирали корни растений, три раза промывали в стерильной воде для удаления видимой почвы и разделяли на два образца. Один образец корней анализировали посредством флуоресцентной микроскопии для определения профилей локализации микроорганизмов-кандидатов. Микроскопию проводили на 10 мм частях лучших интактных корней растений, как представлено на фигуре 6.
[0164] Разработан второй количественный способ оценки колонизации. Проводили количественной анализ ПЦР на препаратах тотальной ДНК из корней растений, инокулированных эндофитами. Семена кукурузы (Dekalb DKC-66-40) проращивали в предварительно автоклавированном песке в горшке 6,35 см на 6,35 см на 25,4 см. Через сутки после посадки проводили пропитку 1 мл ночной культуры эндофитов (среда SOB) непосредственно в участке расположения семян. 1 мл этой ночной культуры приблизительно эквивалентен приблизительно 109 КОЕ, с разбросом в пределах 3 раз друг от друга в зависимости от используемого штамма. Каждый проросток удобряли 3 раза в неделю 50 мл модифицированного раствора Хогланда, дополненного 2,5 мМ или 0,25 мМ нитратом аммония. Через четыре недели после посадки собирали образцы корней для выделения ДНК. Остатки почвы смывали с использованием распыления воды под давлением. Затем эти образцы ткани гомогенизировали с использованием QIAGEN Tissuelyzer, и затем выделяли ДНК с использованием мини-набор для выделения ДНК QIAmp (QIAGEN) по рекомендованному протоколу. С этими выделенными образцами ДНК проводили анализ кПЦР с использованием устройства для ОТ-ПЦР Stratagene Mx3005P с использованием праймеров, которые сконструированы (с использованием Primer BLAST NCBI) специфичными к локусам, в каждом геноме эндофитов. Количественно определяли присутствие копий геномов эндофитов. Для дальнейшего подтверждения идентификации эндофитов проводили секвенирование продуктов амплификации ПЦР и подтверждали наличие правильной последовательности. Обобщенная информация о профилях колонизации штаммов CI006 и CI008 из числа микроорганизмов-кандидатов представлена в таблице 5. У штамма CI008 продемонстрирован уровень колонизации до 107x КОЕ/г сырой массы корня.
Таблица 5: Колонизация кукурузы, определяемая посредством кПЦР
Профилирование РНК in planta
[0165] Биосинтез компонентов пути nif in planta оценивали, определяя транскрипцию генов nif. Тотальную РНК получали из тканей корней растений, инокулированных CI006 (способы посадки описаны ранее). Выделение РНК проводили с использованием мини-набора RNEasy по рекомендуемому протоколу (QIAGEN). Затем тотальную РНК этих тканей растений анализировали с использованием наборов Nanostring Elements (NanoString Technologies, Inc.) с использованием зондов, специфичных к генам nif в геноме штамма CI006. Данные по экспрессии генов nif in planta обобщены в таблице 6. Экспрессию генов nifH детектировали в инокулированных штаммом CM013 растениях, в то время как у инокулированных CI006 растений экспрессию nifH не детектировали. Штамм CM013 представляет собой производное штамма CI006, у которого ген nifL подвергнут нокауту.
[0166] Высокоэкспрессированные гены CM011, ранжированные транскриптов в т.н. на миллион (TPM), измеряли in planta в условиях добавления удобрений. Промоторы, контролирующие экспрессию некоторых из этих высокоэкспрессированных генов использовали в качестве матриц для гомологичной рекомбинации в являющихся мишенями локусах фиксации и ассимиляции азота. Проводили выделение образцов РНК выращиваемых в теплице инокулированных CM011 растений, удаляли рРНК с использованием набора Ribo-Zero, секвенировали с использованием платформы Truseq Illumina и обратно картировали на геном CM011. Высокоэкспрессированные гены CM011 приведены в таблице 7.
Таблица 6: Экспрессия nifH in planta
Таблица 7
Анализ 15N
[0167] В основном способе демонстрации фиксации используют изотоп азота 15N, который находится в атмосфере с установленным уровнем относительно 14N. Добавляя в каждое удобрение или атмосферу повышенные уровни 15N, можно наблюдать фиксацию или непосредственно в увеличенных количествах 15N, фиксируемого из атмосферы, дополненной газообразным 15N2 (Yoshida 1980), или опосредовано посредством разбавления обогащенного удобрения атмосферным газообразным N2 в тканях растений (Iniguez 2004). Способ разбавления позволяет наблюдать накопление фиксированного азота в течение роста растения, тогда как способ с газообразным 15N2 ограничен определением фиксации, которая происходит в течение короткого интервала, в течение которого растение можно выращивать в ограниченной атмосфере (измерения скорости). Таким образом, способ с использованием газа лучше подходит для определения специфичности (так как любые повышенные уровни 15N2 в растении, превышающие атмосферный уровень, можно однозначно соотнести с фиксацией), но им нельзя демонстрировать суммарную активность.
[0168] Для определения активности фиксация улучшенных штаммов относительно штаммов дикого типа и не подвергаемых инокуляции растений кукурузы проводили оба типа анализа, и у нескольких из улучшенных штаммов in planta наблюдали увеличенные уровни фиксация (фигура 12, фигура 14A и фигура 14B). Эти анализы являются важными для демонстрации того, что активность исследуемых штаммов in vitro соответствует результатам in vivo. Кроме того, эти анализы позволяют определять влияние удобрения на активность штамма, позволяя предполагать соответствующую функциональность в сельскохозяйственных условиях. Подобные результаты наблюдали, когда штаммами дикого типа и улучшенными штаммами инокулировали растения Setaria (фигура 13). Активность фиксации in planta, приведенная на фигурах 14A-14C, дополнительно подтверждена транскриптомными данными. Эволюционировавшие штаммы демонстрируют увеличенный уровень транскриптов nifH относительно вариантов дикого типа. Кроме того, обеспечиваемый микроорганизмами уровень азота in planta также коррелировал с уровнем колонизации растения в расчете на растение. Эти результаты (фигура 12, фигура 13, фигуры 14A-14C, фигура 15A и фигура 15B) поддерживают гипотезу о том, что вероятной причиной увеличения получаемого из атмосферы азота, наблюдаемого в тканях растений, является микроорганизм, вследствие улучшенной регуляции кластера генов nif. В дополнение к прямому определению фиксация определяли эффект инокуляции растений улучшенными штаммами в анализе биомассы растений в условиях недостатка азота. Хотя биомасса растения может быть связана со множеством возможных взаимодействий микроорганизмов с растением, можно ожидать, что добавление фиксированного азота может влиять на фенотип растения в условиях недостатка азота. Инокулированные растения выращивали в условиях полного отсутствия азота наблюдали и значимое увеличение площади листьев, сырой и сухой массы побегов и сырой и сухой массы корней у инокулированных растений относительно необработанных контрольных растений (фигура 14C). Хотя эти различия нельзя приписать исключительно фиксации азота, они поддерживают вывод, что улучшенные штаммы активно предоставляют азот растениям. Выращивали растения кукурузы и Setaria и инокулировали как описано выше. Растениям посредством полива регулярно добавляли удобрение, содержавшее 1,2% 15N. Фиксацию азота микроорганизмами количественно определяли, определяя уровень 15N в ткани растения. На 4 неделе после посадки получали ткань четвертого листа и высушивали. Высушенные образцы листьев гомогенизировали с использованием гранул (QIAGEN Tissuelyzer) и разделяли на аликвоты в жестяные капсулы для IRMS (MBL Stable Isotope Laboratory at The Ecosystems Center, Woods Hole, MA). Рассчитывали азот, получаемый из атмосферы (NDFA), и продукция азота CI050 и CM002 приведена на фигуре 7.
Анализ продукции фитогормонов
[0169] Ранее для исследования влияния индол-3-уксусной кислоты на созревание плодов посредством анализа in vitro использовали сорт карликовых томатов (Solanum lycopersicum) "Micro-Tom" (Cohen 1996; J Am Soc Hortic Sci 121: 520-524). Для оценки продукции и секреции фитогормонов микроорганизмами-кандидатами разработан анализ планшетного скрининга с использованием незрелых плодов Micro-Tom. Получали двенадцатилуночные тестовые планшеты для тканевых культур, заполняя лунки агарозной средой, позволяя ей отвердевать и нанося на поверхность агара 10 мкл ночной культуры микроорганизмов, как представлено на фигуре 8. Лунки с агаром содержат увеличенные количества гибберелловой кислоты (GA), но в качестве положительного контроля и стандартнов не использовали ни одной культуры бактерий. В агар в участок нанесения бактериальной культуры стеблем вперед помещали цветы, срезанные с растущих растений Micro-Tom через сутки после начала цветения. За этими цветами наблюдали в течение 2-3 недель, после чего собирали и взвешивали плоды. Увеличение массы плода растения в нескольких повторениях свидетельствовал о продукции гормонов растений инокулируемыми микроорганизмами, как представлено на фигуре 9.
Пример 6: Циклическaя эволюция хозяин-микроорганизм
[0170] Растения кукурузы инокулировали CM013 и выращивали 4 недели приблизительно до стадии роста V5. Растения, демонстрирующие улучшенное накопление азота из микробных источников по результатам анализа 15N, выкорчевывали и корни отмывали с использованием воды под давлением для удаления основной почвы. Производили срез корня массой 0,25 г и промывали в растворе PBS для удаления мелких частичек почвы и неприкрепившихся микроорганизмов. Образцы ткани гомогенизировали с использованием 3 мм стальных гранул в QIAGEN TissueLyser II. Гомогенат разбавляли и наносили в планшеты на агарозные среды SOB. Единичные колонии ресуспендировали в жидких средах и подвергали анализу ПЦР 16s рДНК и мутаций, уникальных для инокулируемого штамма. Процесс выделения микроорганизма, мутагенеза, инокуляции и повторного выделения можно повторять несколько раз с улучшением признаков микроорганизма, признаков растений и способности микроорганизмов к колонизации.
Пример 7: Совместимость в различных географических условиях
[0171] Способность улучшенных микроорганизмов к колонизации инокулированного растения является критичной для успешного существования растения в полевых условиях. Хотя описанные способы выделения разработаны для выбора из почвенных микроорганизмов, которые могут иметь тесную связь с сельскохозяйственными культурами, такими как кукуруза, многие штаммы не могут эффективно колонизировать в целому ряду генотипов растений, типов окружающей среды, типов почв или условий инокуляции. Так как колонизация представляет собой сложный процесс, требующий целого ряда взаимодействий между штаммом микроорганизмов и растением-хозяином, основным способом для выбора приоритетных штаммов для дальнейшей разработки стал скрининг на способность к колонизации. В ранних попытках оценки колонизации использовали флуоресцентно меченые штаммы, которая являлась эффективной, но отнимала много времени и не являлась масштабируемой относительно штаммов. Так как активность колонизации не поддается непосредственному улучшению, крайне важно отбирать потенциальных продуцирующих кандидатов из штаммов, которые являются природными колонизаторами.
[0172] Разработан анализ для тестирования на стабильную колонизацию штаммами дикого типа любого данного растения-хозяина с использованием кПЦР и праймеров, сконструированных так, чтобы они являлись специфичными для штамма в образце сообщества. Этот анализ предназначен для быстрого определения скорости колонизации микроорганизмов из образцов ткани кукурузы. Исходные тесты с использованием штаммов, оцениваемых как вероятные колонизаторы, с использованием флуоресцентной микроскопии и планшетных способов, продемонстрировали, что подход кПЦР может являться количественным и масштабируемым.
[0173] Типичный анализ проводят следующим образом: растения, в основном сорта кукурузы и пшеницы, выращивают в торфяной горшковой смеси в теплице в шести повторениях на штамм. Через четыре или пять суток после посадки 1 мл пропитки культур бактерий в ранней стационарной фазе, разбавленной до OD590 0,6-1,0 (приблизительно 5×108 КОЕ/мл), пипетируют на восходящий колеоптиль. Растения поливают только водопроводной водой и оставляют рати в течение четырех недели с последующим забором образцов, во время которого растения выкорчевывают и корни тщательно промывают с удалением большинства остатков торфа. Вырезают образцы чистых корней и гомогенизируют с получением взвеси клеток дебриса растения и ассоциированных бактериальных клеток. Авторы разработали протокол высокопроизводительного выделения ДНК, который позволяет эффективно получать смесь ДНК растения и бактерий для использования в качестве матрицы для кПЦР. На основе экспериментом во резкому возрастанию количества бактериальных клеток, этим способом выделения ДНК получают количественный образец бактериальной ДНК относительно сырой массы корней. Каждый штамм оценивают с использованием штаммоспецифичных праймеров, сконструированных с использованием Primer BLAST (Ye 2012) и сравнивают с фоновой амплификацией у не подвергаемых инокуляции растений. Так как у некоторых праймеров у не подвергаемых инокуляции растений выявлена побочная амплификация, колонизацию определяют по наличию амплификации или повышенной амплификации соответствующего продукта по сравнению с фоновым уровнем.
[0174] Этот анализ использовали для определения совместимости продукта микроорганизмов в различных почвенных географических условиях. Качества полевых почв и полевые условия могут оказывать очень большое влияние на действие продукта микроорганизмов. pH почвы, способность к удержанию воды и конкурирующие микроорганизмы являются только малым количеством примеров факторов почвы, которые могут влиять на жизнеспособность инокулята и его способность к колонизации. Анализ колонизации проводили с использованием трех различных типов почв, образцы которых в качестве среды для выращивания растений получены с сельскохозяйственных полей в Калифорнии (фигура 16A). Для аппроксимации реальных сельскохозяйственных условий использовали промежуточную плотность инокуляции. В течение 3 недель штамм 5 колонизировал все растения на уровне от 106 до 107 КОЕ/г сырой массы. Через 7 недель роста растений, эволюционировавшая версия штамма 1 демонстрировала высокие уровни колонизации (106 КОЕ/г сырой массы) во всех типах почв. (фигура 16B).
[0175] Кроме того, для оценки колонизации в сложных полевых условиях на поле площадью 1 акр в Сан-Луис-Обиспо в июне 2015 года начато испытание с оценкой влияния и колонизации семи штаммов дикого типа на два сорта полевой кукурузы. Агротехническое проектирование и проведение испытания выполняла по контракту полевая исследовательская организация, Pacific Ag Research. Для инокуляции, использовали тот же способ покрытия семян торфяной культуры, который был испытан в экспериментах по способам инокуляции. В течение вегетационного периода собирали образцы растений для оценки колонизации корня и внутренности стебля. Образцы собирали из трех повторных участков после каждой обработки через четыре и восемь недель после посадки, и из всех шести повторений после каждой обработки незадолго перед сбором через 16 недель. Дополнительные образцы собирали из всех шести повторных участков после обработок путем инокуляции штамма 1 и штамма 2, а также необработанных контролей, через 12 недель. Число клеток на грамм сырой масса отмытых корней оценивали также, как и в других анализах колонизации с использованием кПЦР и штаммоспецифичных праймеров. Два штамма, штамм 1 и штамм 2, продемонстрировали стабильную и повсеместную колонизацию корней, которая достигала максимума через 12 недель, а затем резко снижалась (фигура 16C). Хотя штамм 2, по видимому, присутствовал в количествах, на порядок меньших, чем штамм 1, выявлено, что он его количества от растению к растению являются более постоянными. По видимому, ни один из штаммов внутренность стебля эффективно не колонизирует. В поддержку данных кПЦР о колонизации, оба штамма успешно повторно выделяли из образцов корней с использованием планшетов и секвенирование 16S для идентификации изолятов соответствующей последовательности.
[0176] Использование терминов в единственном числе в рамках описания изобретения (особенно в рамках приводимой ниже формулы изобретения) следует рассматривать как относящиеся к единственному и множественному числу, если в настоящем документе не указано иначе или явно не продиктовано контекстом. Если не указано иначе, термины "содержащий", "обладающий", "включающий" и "вмещающий" следует рассматривать как открытые термины (т.е., означающие "включающие в качестве неограничивающих примеров"). Если в настоящем документе не указано иначе указание диапазонов значений в настоящем документе служит исключительно в качестве способа сокращения индивидуального указания каждого отдельного значения, находящегося в указанном диапазоне и каждое отдельное значение включено в описание также, как если бы оно было индивидуально указано в настоящем документе. Например, если указан диапазон 10-15, то также включены 11, 12, 13 и 14. Если в настоящем документе не указано иначе или иначе явно не продиктовано контекстом, все способы, описываемые в настоящем документе, можно проводить в любом подходящем порядке. Если не указано иначе, использование любого и всех примеров или иллюстративных формулировок (например, "такой как"), приводимое в настоящем документе, предназначено исключительно для лучшего описания изобретения и не предназначено для ограничения объема изобретения. Ни одну из формулировок в описании не следует рассматривать как указание того, что какой-либо незаявляемый элемент существенен для практического осуществления изобретения.
[0177] Хотя в настоящем документы приведены и описаны предпочтительные варианты осуществления настоящего изобретения, специалистам в данной области очевидно, что такие варианты осуществления приведены исключительно в качестве примера. Специалисты в даннойм области могут проводить множество вариаций, изменений и изменений без отклонения от изобретения. Следует понимать, что в практическом осуществлении изобретения можно использовать различные альтернативы вариантам осуществления изобретения, описываемым в настоящем документе. Следует понимать, что объем изобретения определен приводимой ниже формулой изобретения и что таким образом охвачены способы и структуры в объеме этой формулы изобретения и их эквиваленты.
[0178] Таблица 3A
[0179] Таблица 3B
[0180] Таблица 3C


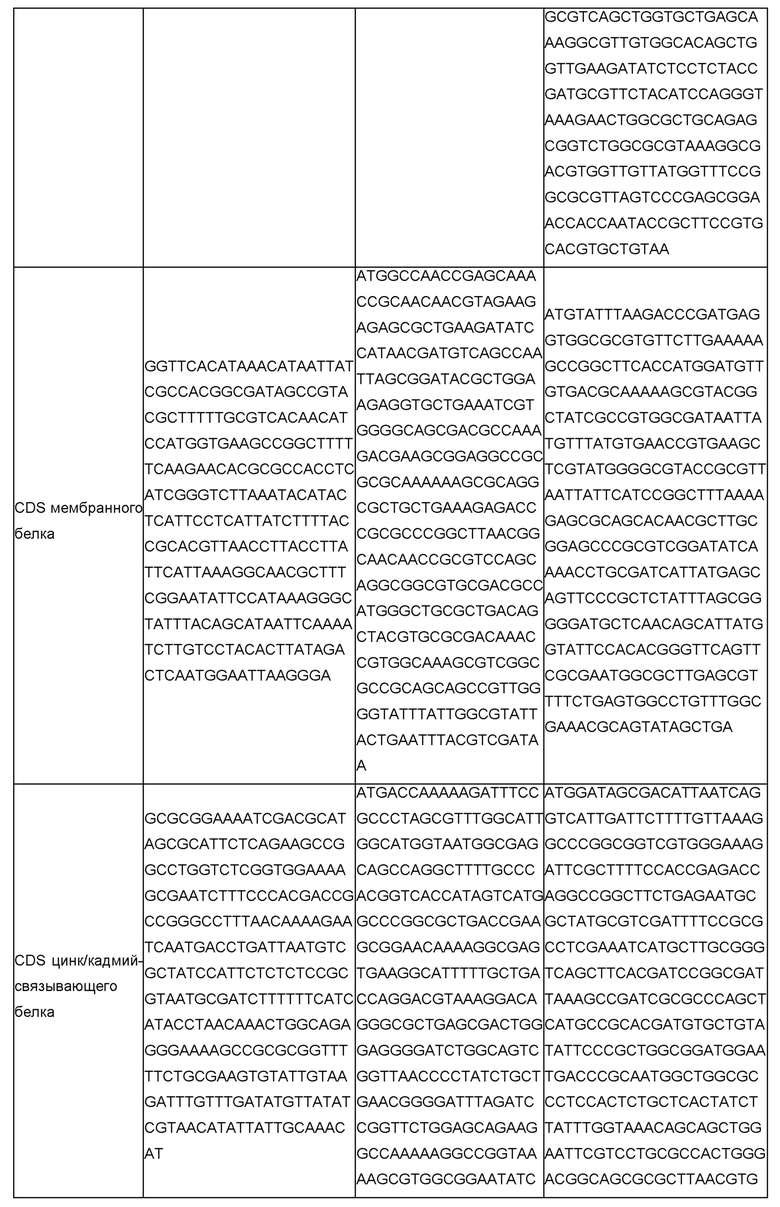
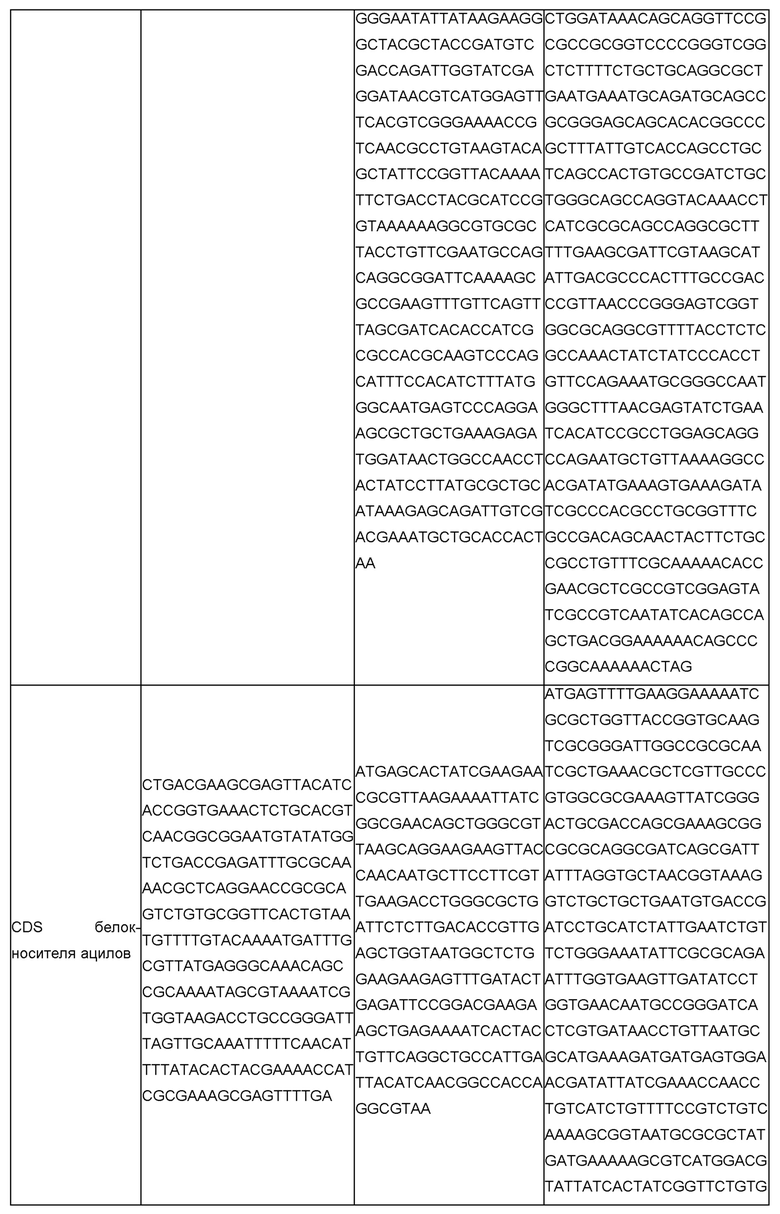
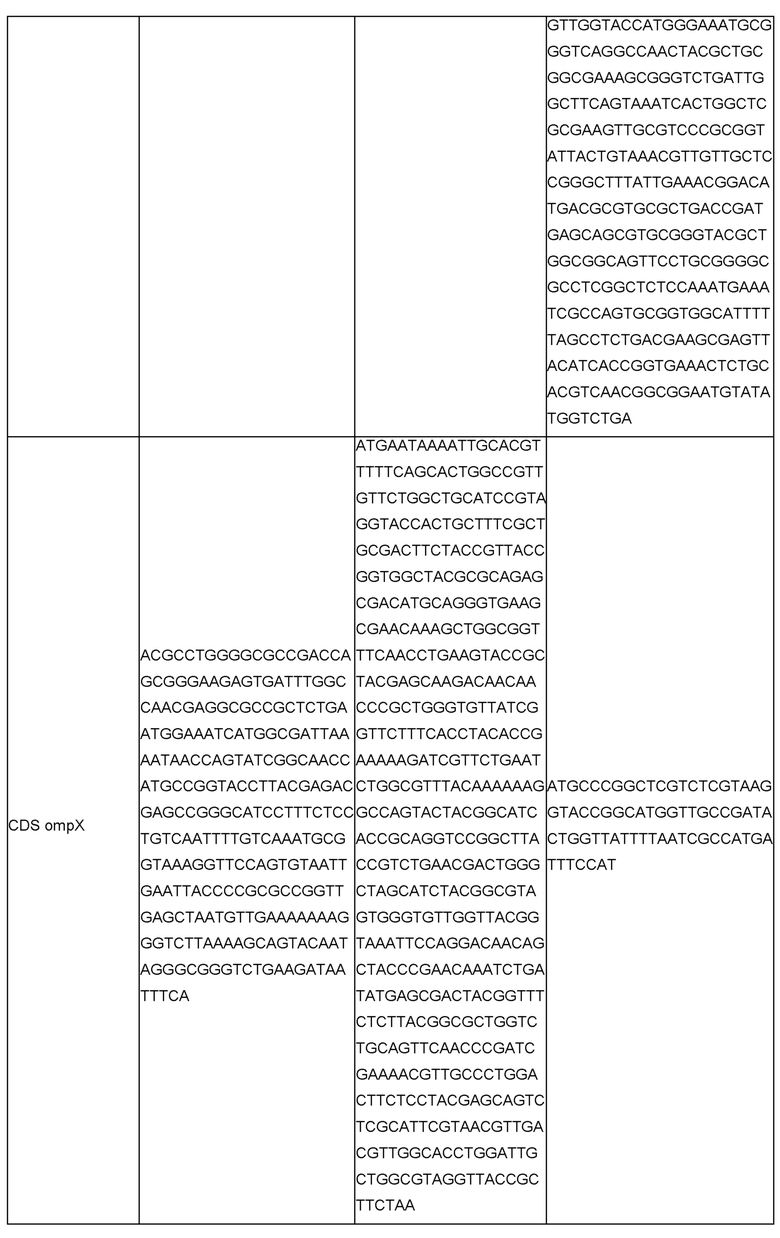


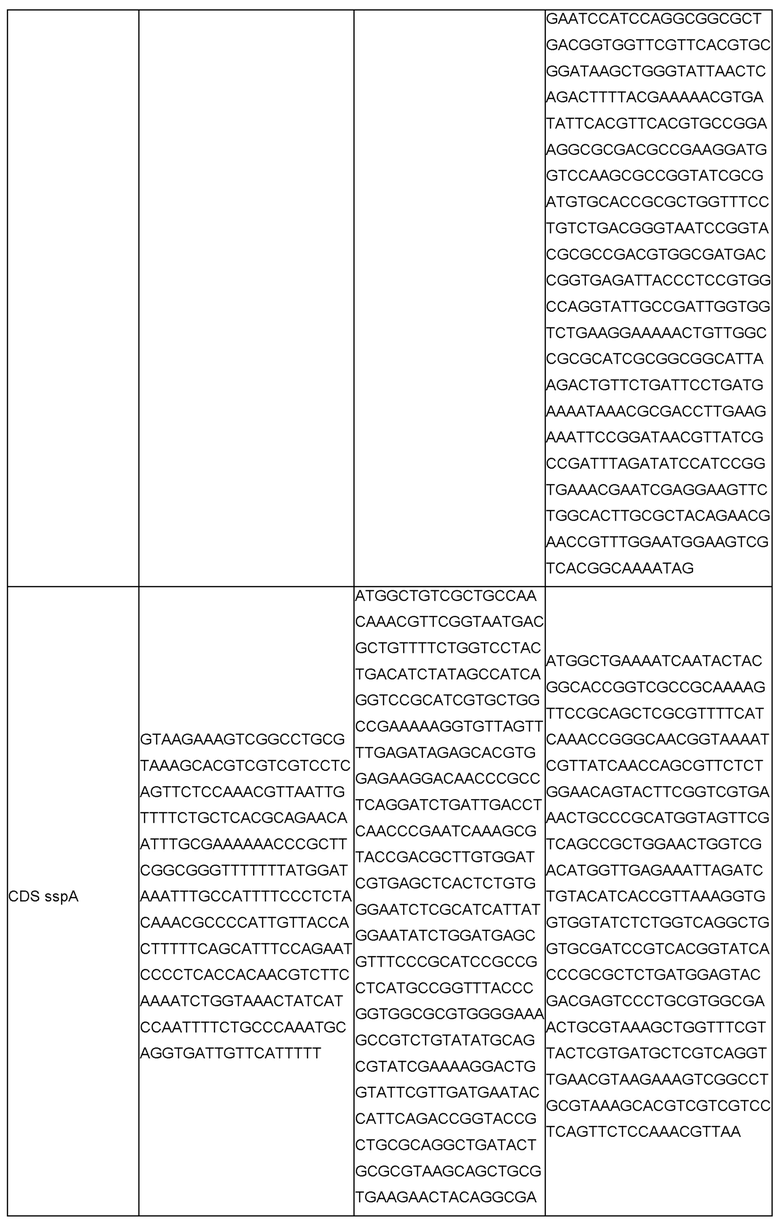



[0181] Таблица штаммов
Несмотря на прилагаемую формулу изобретения, описание, приводимое в настоящем документе, также определено следующими пунктами:
1. Способ получения одной или нескольких бактерий, включающий:
(a) выделение бактерий из ткани или почвы первого растения;
(b) внесение генетической вариации в одну или несколько бактерий с получением одного или нескольких вариантов бактерий;
(c) воздействие вариантами бактерий на множество растений;
(d) выделение бактерий из ткани или почвы одного из множества растений, где растение, из которого выделяют бактерии, обладает улучшенным признаком относительно других растений в множестве растений; и
(e) повторение этапов (b)-(d) с бактериями, выделенными на этапе (d).
2. Способ по п. 1, где улучшенный признак представляет собой улучшенную фиксацию азота в растении, из которого выделяют бактерии.
3. Способ по п. 1, где генетическая вариация представляет собой вариацию в гене, выбранном из группы, состоящей из: nifA, nifL, ntrB, ntrC, glnA, glnB, glnK, draT, amtB, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ.
4. Способ по п. 1, где генетическая вариация представляет собой вариацию в гене, кодирующем белок с функциональностью, выбранной из группы, состоящей из: глутаминсинтетазы, глутаминазы, аденилаттрансферазы глутаминсинтетазы, активатора транскрипции, антиактиватора транскрипции, пируват:флаводоксин-оксидоредуктазы, флаводоксина или АДФ-D-рибозилтрансферазы НАД+:динитрогеназоредуктазы.
5. Способ по п. 1, где генетическая вариация представляет собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD.
6. Способ по п. 1, где генетическая вариация представляет собой нокаут-мутацию.
7. Способ по п. 1, где генетическая вариация приводит к устранению или отмене активности белкового домена.
8. Способ по п. 1, где генетическая вариация включает изменение или удаление регуляторной последовательности гена-мишени.
9. Способ по п. 1, где генетическая вариация включает вставку гетерологичной регуляторной последовательности.
10. Способ по п. 1, где генетическая вариация включает вставку регуляторной последовательности, выявленной в геноме вида или рода бактерий соответствующих бактериям, у которых проводят генетическую вариацию.
11. Способ по п. 10, где регуляторная последовательность выбрана на основе уровня экспрессии гена в культуре бактерий или в ткани растения.
12. Способ по п. 1, где генетическую вариацию получают посредством химического мутагенеза.
13. Способ по п. 1, где этап (c) дополнительно включает воздействие на растения биотическими или абиотическими стрессовыми факторами.
14. Способ по п. 2, где бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), продуцируют 1% или более азота у второго растения того же типа, что и первое растение.
15. Способ по п. 2, где бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), демонстрируют по меньшей мере 2-кратное увеличение фиксации азота по сравнению с бактериями, выделяемыми из первого растения.
16. Способ по п. 14, где второе растение выращивают в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником азота.
17. Способ по п. 1, где первое растение представляет собой сельскохозяйственную культуру.
18. Способ по п. 17, где сельскохозяйственная культура выбрана из ячменя, риса, кукурузы, пшеницы, сорго, сахарной кукурузы, сахарного тростника, репчатого лука, томатов, клубники или спаржи.
19. Способ по п. 1, где первое или растения в множестве растений являются модельными растениями.
20. Способ по п. 19, где модельное растение выбрано из Setaria, Brachypodium или Arabidopsis.
21. Способ по п. 1, где генетическая вариация представляет собой предопределенную генетическую вариацию, которую специфически, проводят в намеченном участке.
22. Способ по п. 1, где генетическая вариация представляет собой случайную мутацию в участке-мишени.
23. Способ по п. 1, где этап (a) дополнительно включает проведение генетического анализа выделенных бактерий.
24. Способ по п. 1, где этап (b) дополнительно включает применение селекционного давления для обогащения бактериями, несущими генетическую вариацию.
25. Способ по п. 24, где селекционное давление включает расщепление геномов с отсутствием генетической вариации, вводимой в намеченный участок, где расщепление происходит в пределах 100 нуклеотидов от намеченного участка.
26. Способ по п. 24, дополнительно включающий выделение бактерий, перенесших селекционное давление.
27. Способ по п. 25, где расщепление проводят посредством сайт-специфической нуклеазы, выбранной из группы, состоящей из нуклеазы с цинковыми пальцами, нуклеазы CRISPR, нуклеазы TALE или мегануклеазы.
28. Способ по п. 27, где сайт-специфическая нуклеаза представляет собой нуклеазу CRISPR.
29. Способ по п. 1, где генетическая вариация представляет собой вставку или делецию одного или нескольких нуклеотидов.
30. Способ по п. 1, где бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), являются эндофитными, эпифитными или ризосферными.
31. Способ по п. 1, где бактерии, выделенные после однократного или многократного повторения этапов (b)-(d), включают множество бактерий различных таксонов.
32. Способ по п. 1, где бактерии выделяют из ткани растения.
33. Способ по п. 1, где выделение бактерий на этапе (a) включает выделение бактерий из семян первого растения.
34. Способ увеличения фиксации азота в растении, включающий воздействие на растение бактериями, несущими одну или несколько генетических вариаций, вводимых в один или несколько генов, регулирующих фиксацию азота, где бактерии продуцируют в растении 1% или более азота.
35. Способ по п. 34, где бактерии продуцируют в растении 5% или более азота.
36. Способ по п. 34, где бактерии продуцируют в растении 10% или более азота.
37. Способ по п. 34, где бактерии продуцируют азот в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником дополнительного азота.
38. Способ по п. 34, где генетическая вариация представляет собой вариацию в гене, выбранном из группы, состоящей из: nifA, nifL, ntrB, ntrC, глутаминсинтетазы, glnA, glnB, glnK, draT, amtB, глутаминазы, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ.
39. Способ по п. 34, где генетическая вариация представляет собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии или активности NifA или глутаминазы; сниженной экспрессии или активности NifL, NtrB, глутаминсинтетазы, GlnB, GlnK, DraT, AmtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD.
40. Способ по п. 34, где генетическая вариация (a) представляет собой нокаут-мутацию; (b) изменяет или удаляет регуляторную последовательность гена-мишени или (c) включает вставку гетерологичной регуляторной последовательности.
41. Способ по п. 34, где бактерии представляют собой бактерии рода Enterobacter.
42. Способ по п. 34, где бактерии представляют собой бактерии рода Rahnella.
43. Способ по п. 34, где бактерии являются эндофитными, эпифитными или ризосферными.
44. Способ по п. 34, где бактерии включают множество бактерий различных таксонов.
45. Способ по п. 34, где растение представляет собой сельскохозяйственную культуру.
46. Способ по любому из пп. 34-45, где растение представляет собой небобовое растение.
47. Способ по п. 45, где сельскохозяйственная культура выбрана из сорго, канола, томата, клубники, ячменя, риса, кукурузы и пшеницы.
48. Способ по п. 45, где растение представляет собой генетически модифицированный организм (ГМО).
49. Способ по п. 45, где растение не является генетически модифицированным организмом (ГМО).
50. Способ по п. 45, где растение генетически сконструировано или выведено для эффективного использования азота.
51. Популяция бактерий, содержащая бактерии, несущие одну или несколько генетических вариаций, вводимых в один или несколько генов, регулирующих фиксацию азота, где бактерии продуцируют в растении, выращиваемом в присутствии популяции бактерий, 1% или более азота.
52. Популяция бактерий по п. 51, где бактерии продуцируют азот в присутствии удобрения, дополненного глутамином, аммиаком или другим химическим источником дополнительного азота.
53. Популяция бактерий по п. 51, где генетическая вариация представляет собой вариацию в гене, выбранном из группы, состоящей из: nifA, nifL, ntrB, ntrC, глутаминсинтетазы, glnA, glnB, glnK, draT, amtB, глутаминазы, glnD, glnE, nifJ, nifH, nifD, nifK, nifY, nifE, nifN, nifU, nifS, nifV, nifW, nifZ, nifM, nifF, nifB и nifQ.
54. Популяция бактерий по п. 51, где генетическая вариация представляет собой мутацию, которая приводит к одному или нескольким из: повышенной экспрессии nifA или глутаминазы; сниженной экспрессии nifL, ntrB, глутаминсинтетазы, glnB, glnK, draT, amtB; сниженной активности удаления аденилата GlnE или сниженной активности удаления уридилата GlnD.
55. Популяция бактерий по п. 51, где генетическая вариация (a) представляет собой нокаут-мутацию; (b) изменяет или удаляет регуляторную последовательность гена-мишени или (c) включает вставку гетерологичной регуляторной последовательности.
56. Популяция бактерий по п. 51, где бактерии are Enterobacter.
57. Популяция бактерий по п. 51, где бактерии are Rahnella.
58. Популяция бактерий по п. 51, где бактерии являются эндофитными, эпифитными или ризосферными.
59. Популяция бактерий по п. 51, где бактерии включают множество бактерий различных таксонов.
60. Композиция, содержащая популяцию бактерий по любому из пп. 51-59.
61. Композиция по п. 60, где композиция содержит популяцию бактерий, наносимых на поверхность семян.
62. Композиция по п. 60, где композицию формулируют в виде жидкости или порошка.
63. Бактерия с номером доступа к депозиту ATCC of PTA-122293 или PTA-122294.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ ПРИЗНАКОВ РАСТЕНИЙ | 2016 |
|
RU2775712C2 |
| ГЕНЫ-МИШЕНИ ДЛЯ НАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА АЗОТФИКСАЦИЮ ДЛЯ УЛУЧШЕНИЯ КАЧЕСТВ РАСТЕНИЙ | 2018 |
|
RU2805085C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ ПРИЗНАКОВ РАСТЕНИЙ | 2018 |
|
RU2797537C2 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ АМИНОКИСЛОТ ПУТЕМ ПОВЫШЕННОЙ АКТИВНОСТИ ЭКСПОРТ-НОСИТЕЛЕЙ | 1996 |
|
RU2225883C2 |
| МУТАНТНАЯ ГЛУТАМИНСИНТЕТАЗА, ФРАГМЕНТ ДНК, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ L-ГЛУТАМИНА И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ | 2001 |
|
RU2230114C2 |
| СПОСОБ КОНСТРУИРОВАНИЯ РЕКОМБИНАНТНЫХ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ PANTOEA, И СПОСОБ ПРОДУКЦИИ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ PANTOEA | 2006 |
|
RU2418069C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ С МОДИФИЦИРОВАННЫМ ГЕНОМ BBD29_09525 ДЛЯ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ, А ТАКЖЕ СПОСОБ ЕГО КОНСТРУИРОВАНИЯ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2838163C1 |
| САМОИНДУЦИРУЕМАЯ ЭКСПРЕССИОННАЯ СИСТЕМА И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ПОЛЕЗНЫХ МЕТАБОЛИТОВ С ПОМОЩЬЮ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae | 2013 |
|
RU2549708C2 |
| СПОСОБ ПРОДУЦИРОВАНИЯ АМИНОКИСЛОТ СЕМЕЙСТВА АСПАРТАТА С ИСПОЛЬЗОВАНИЕМ МИКРООРГАНИЗМОВ | 2010 |
|
RU2535973C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ С МОДИФИЦИРОВАННЫМ ГЕНОМ BBD29_11265 ДЛЯ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ, А ТАКЖЕ СПОСОБ ЕГО КОНСТРУИРОВАНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2841248C1 |
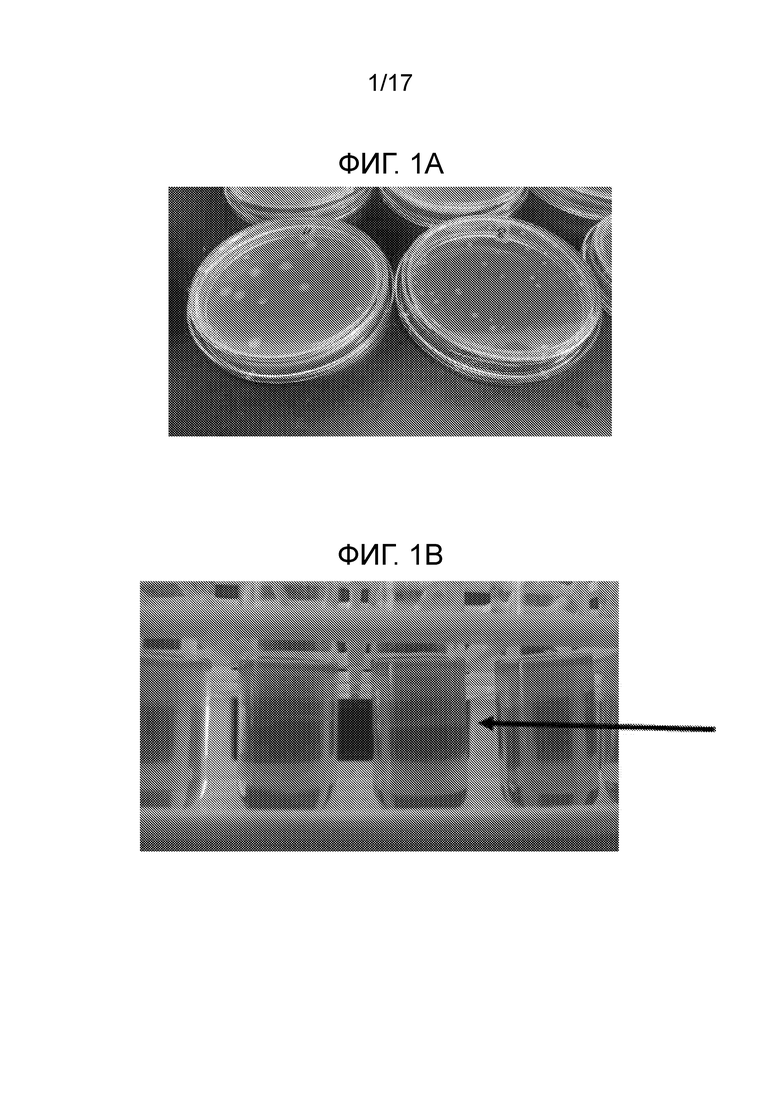
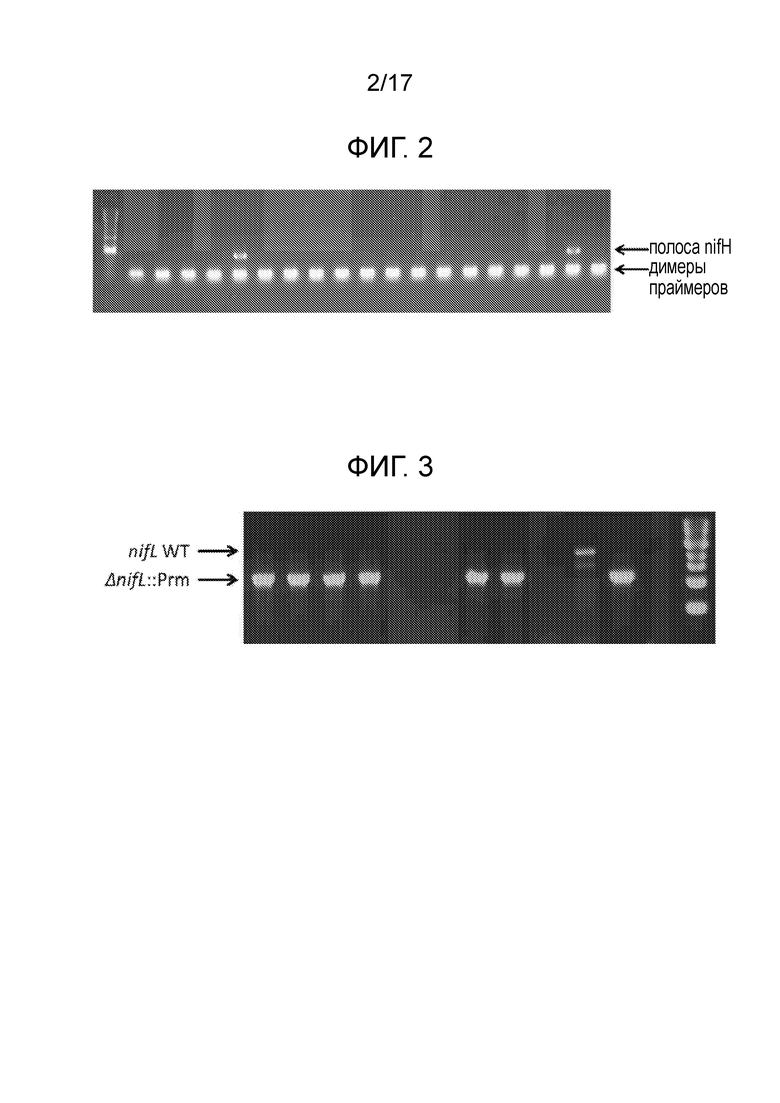
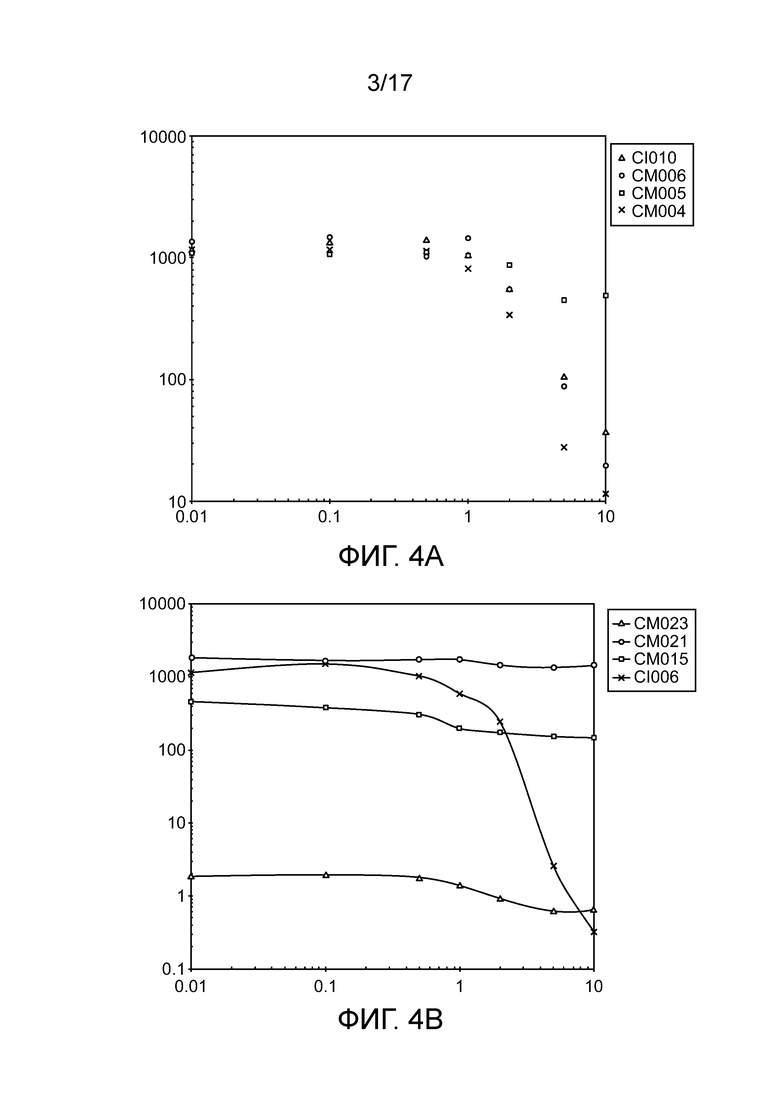
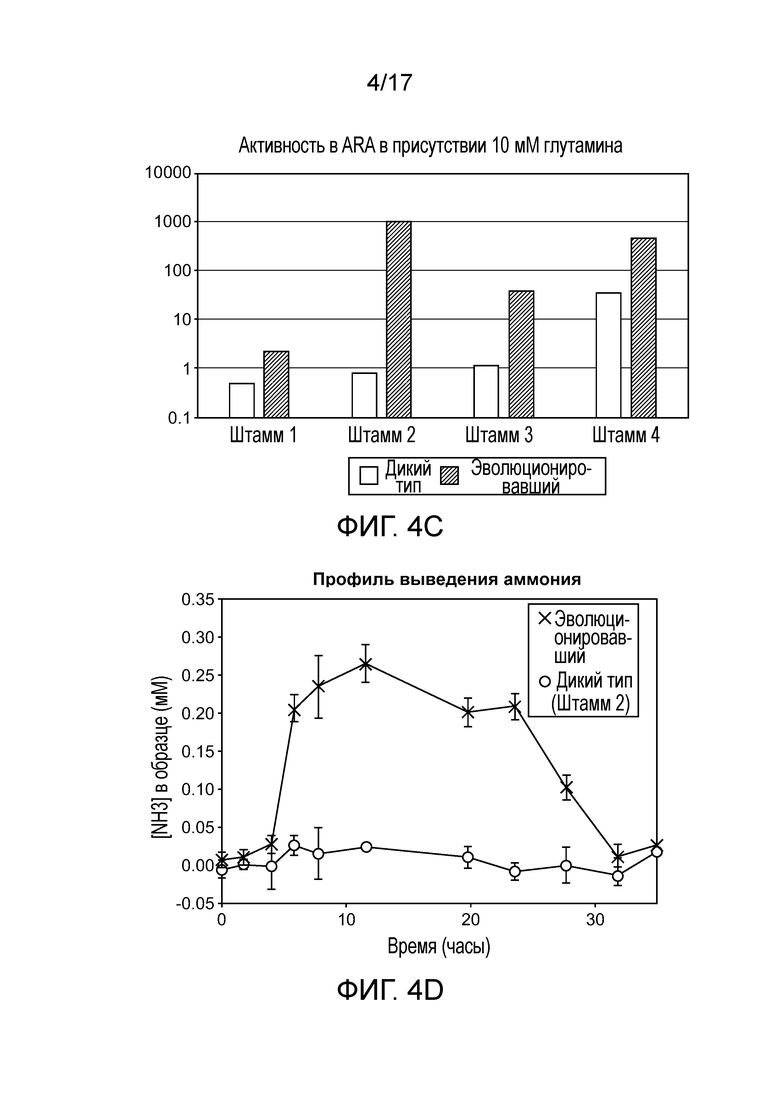
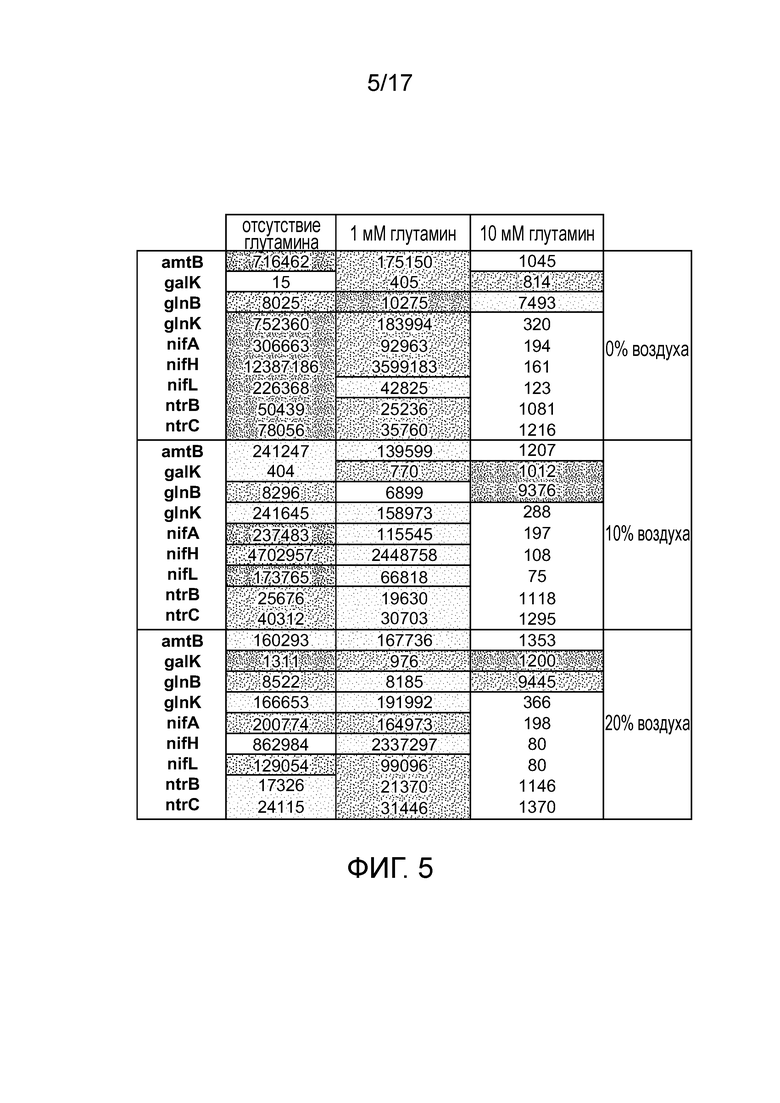
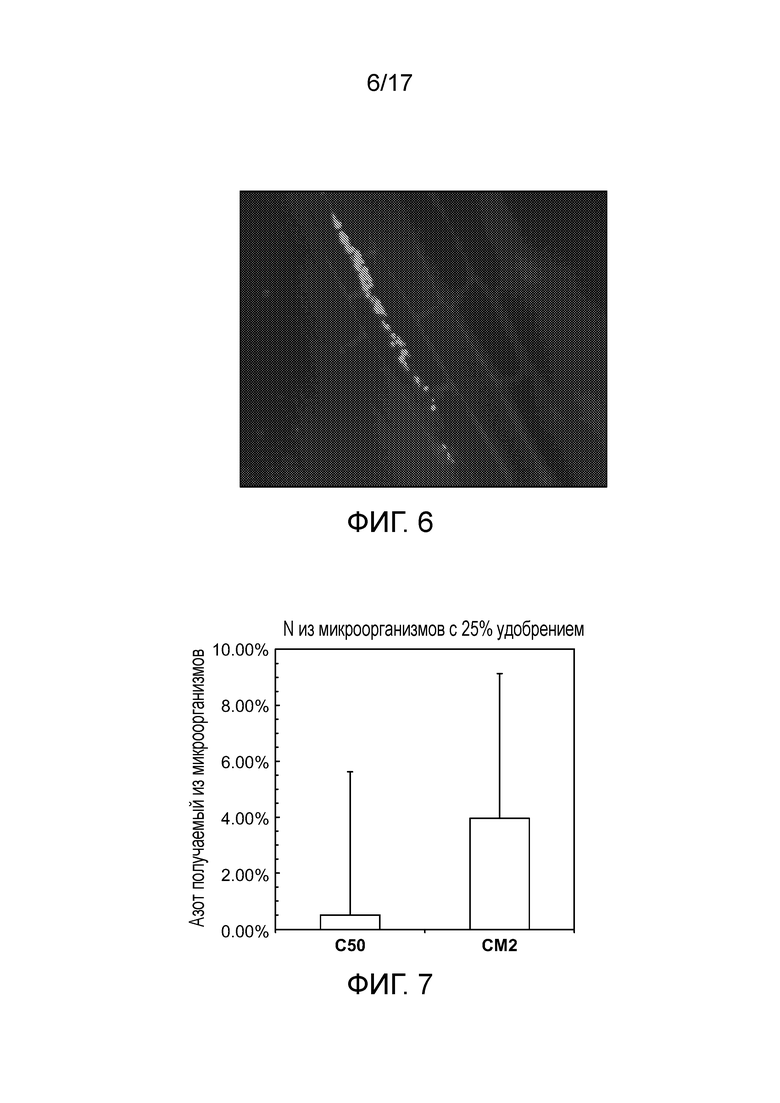
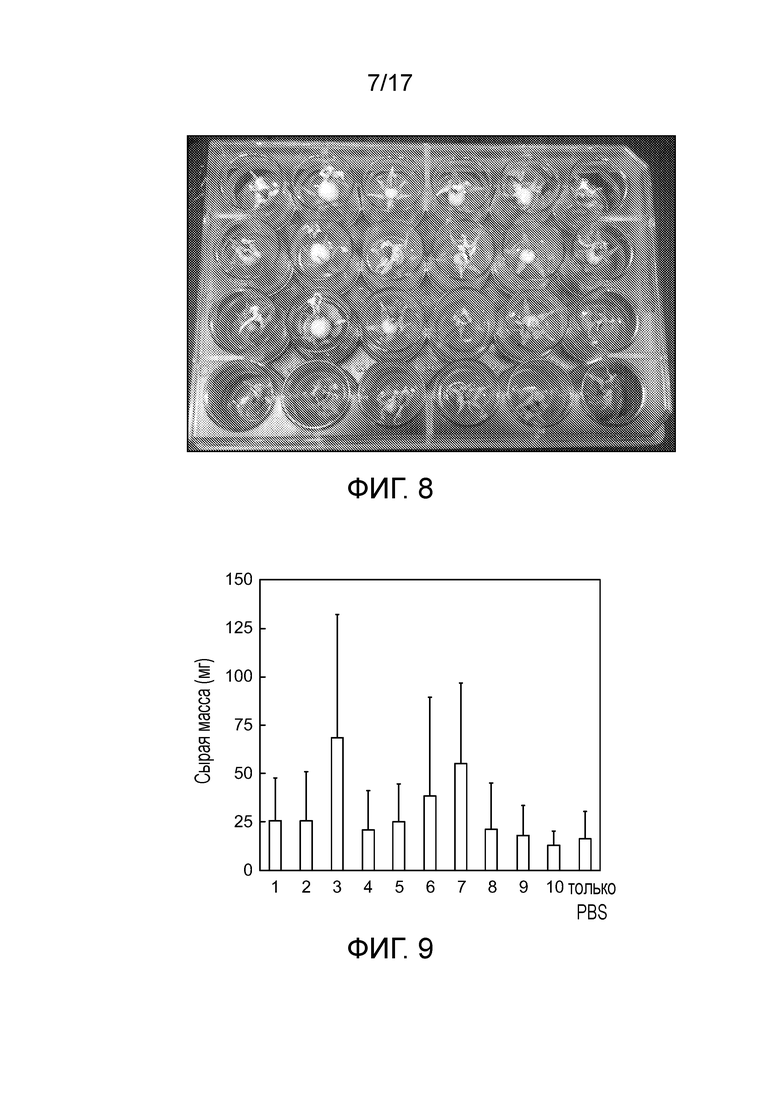
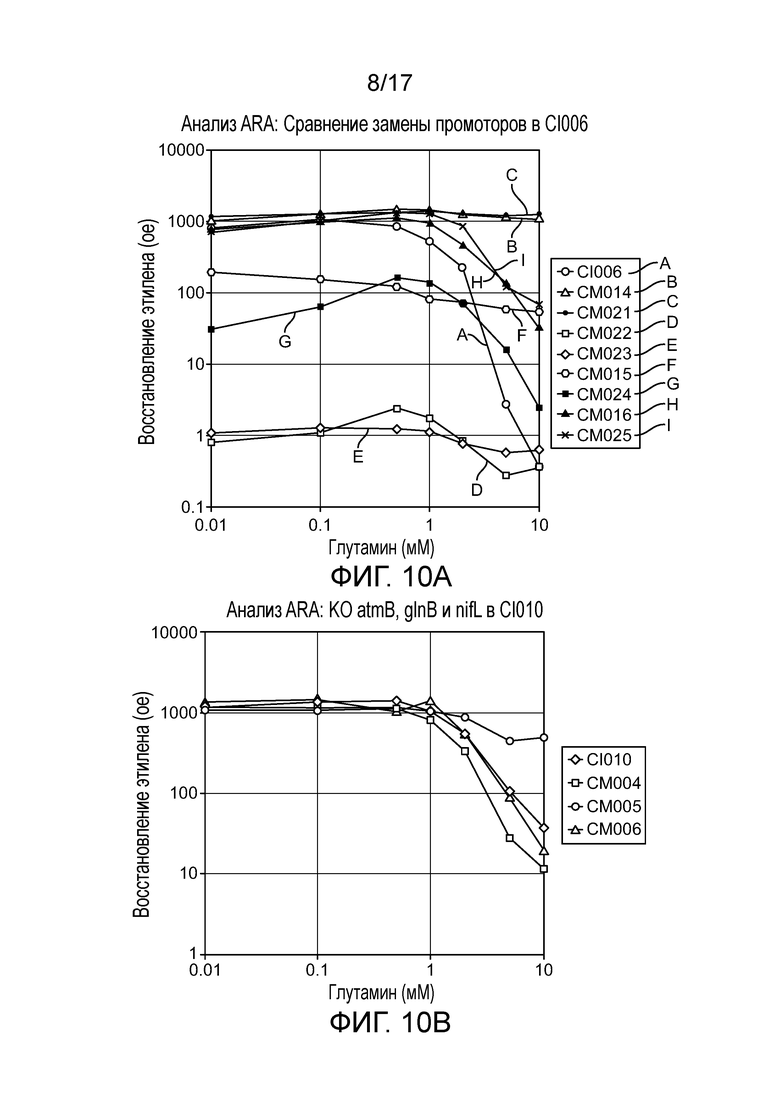
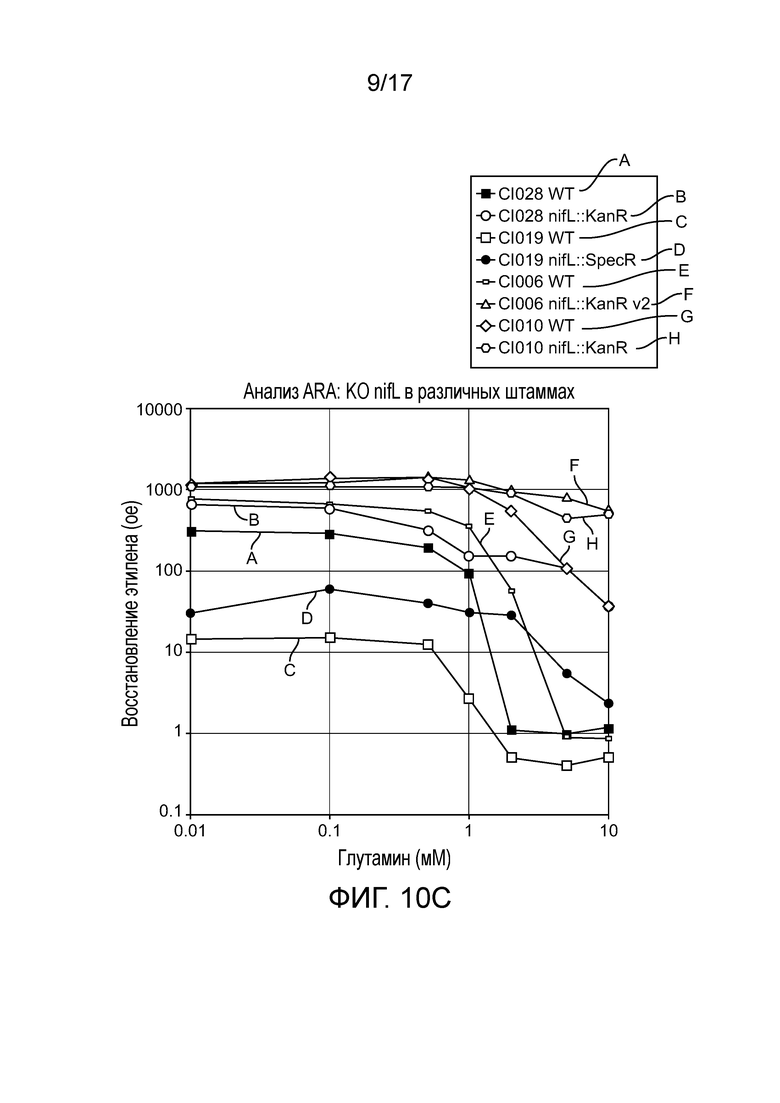
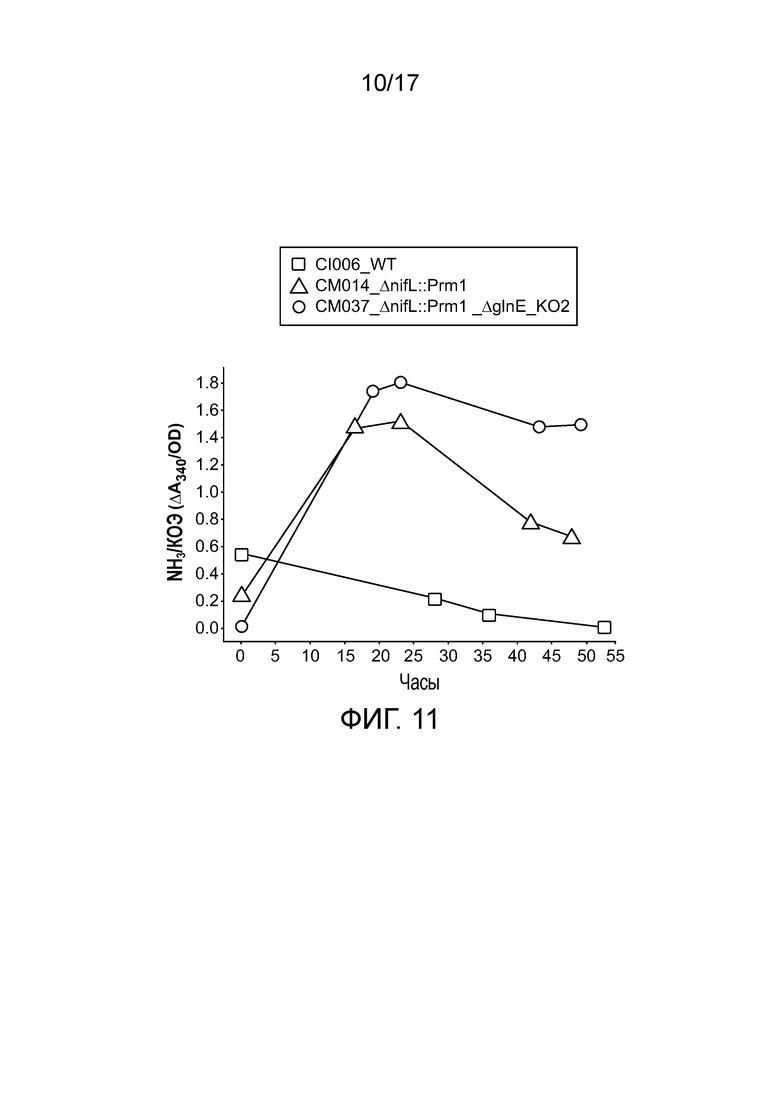
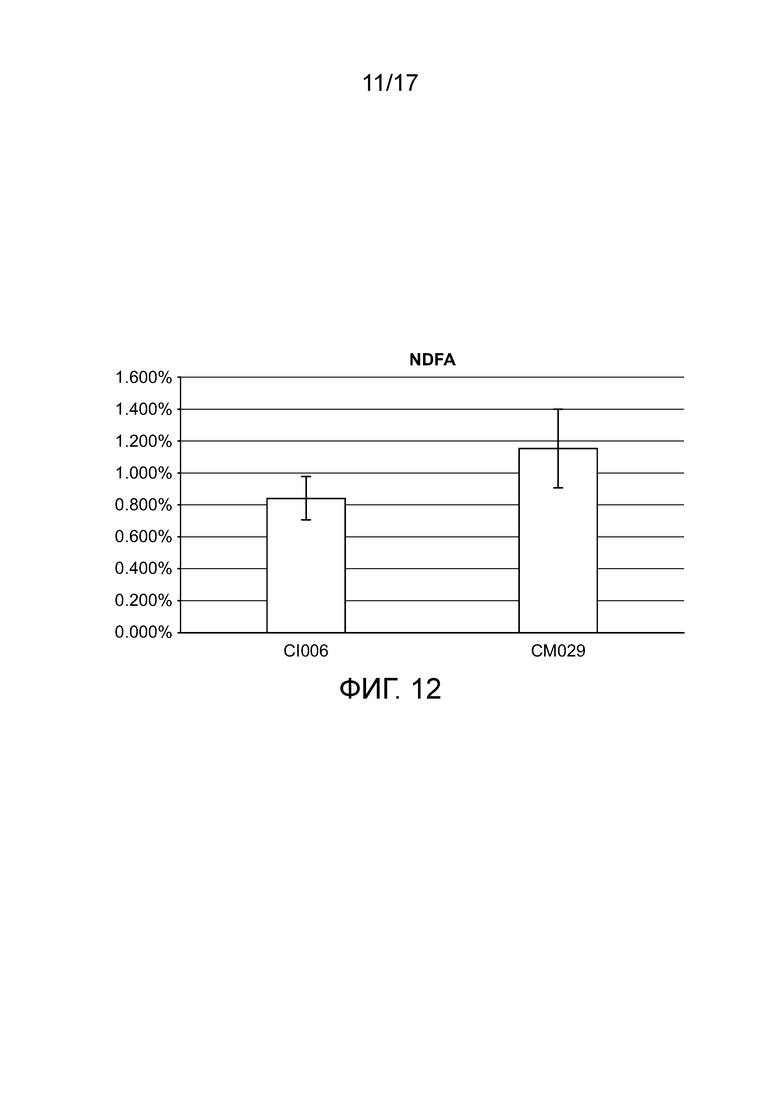
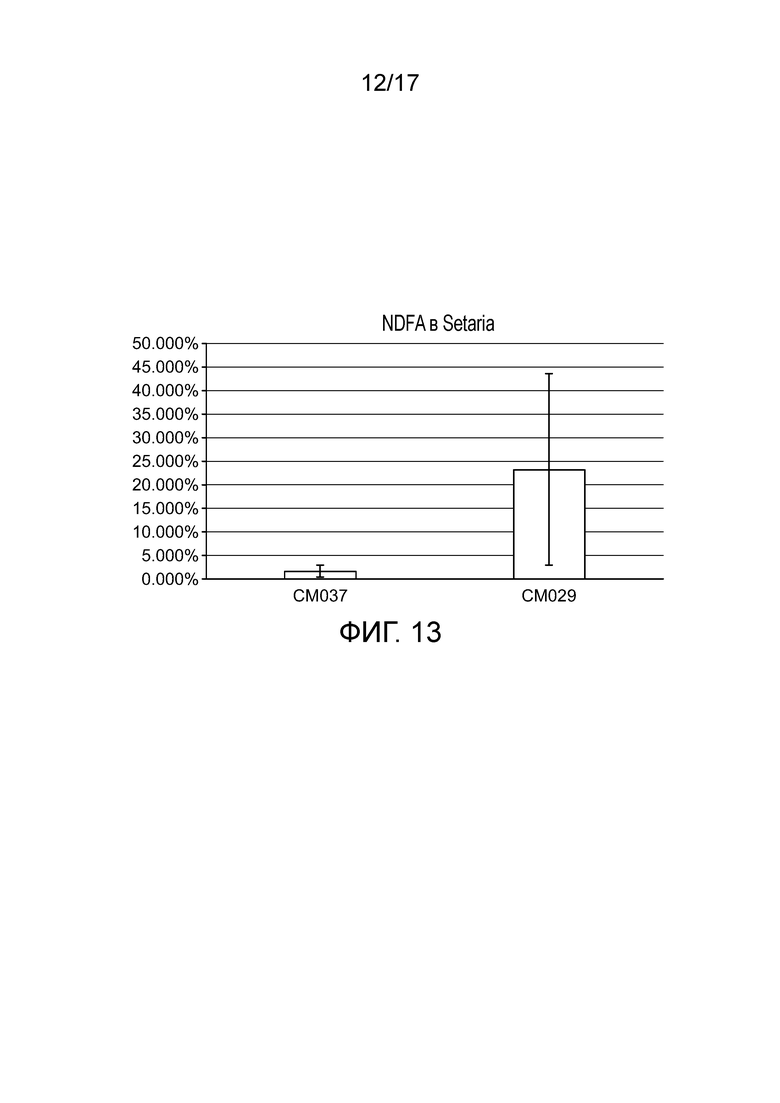
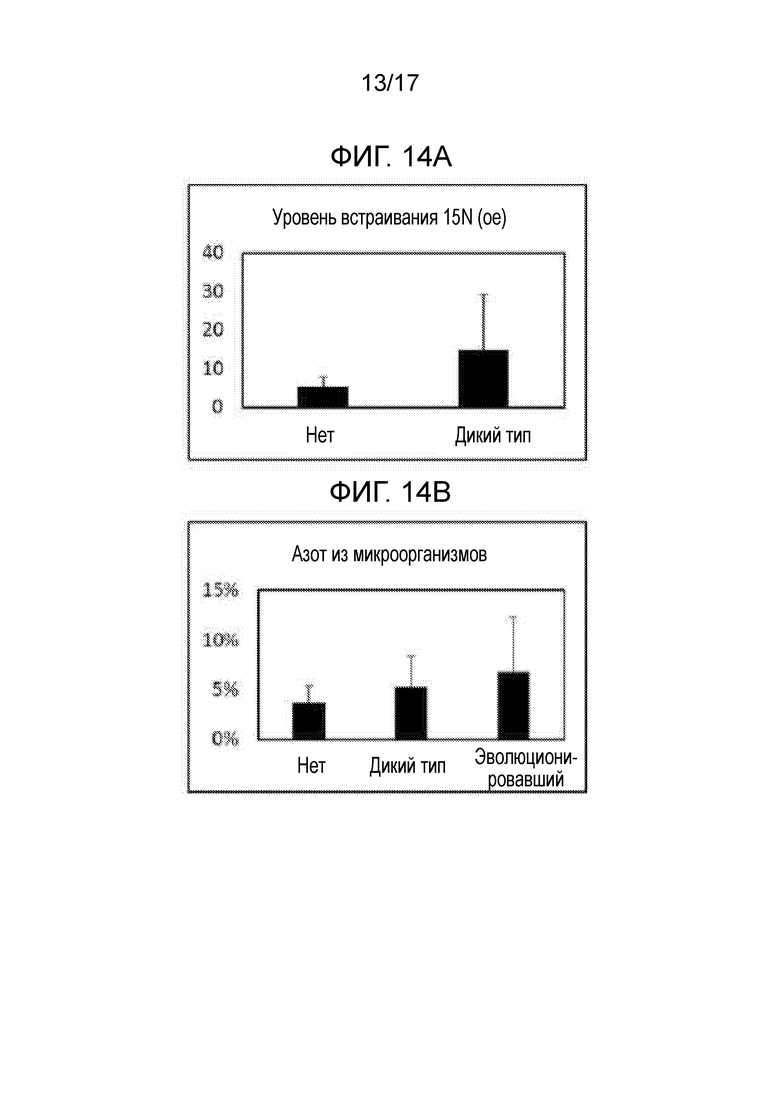
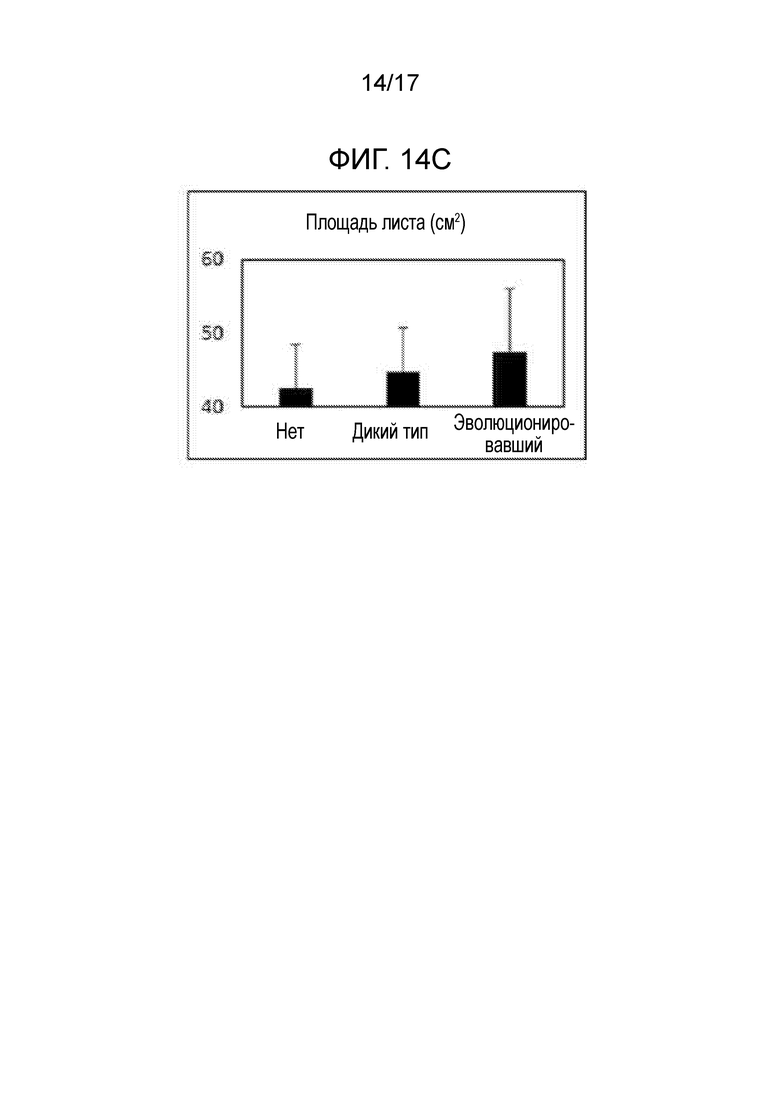
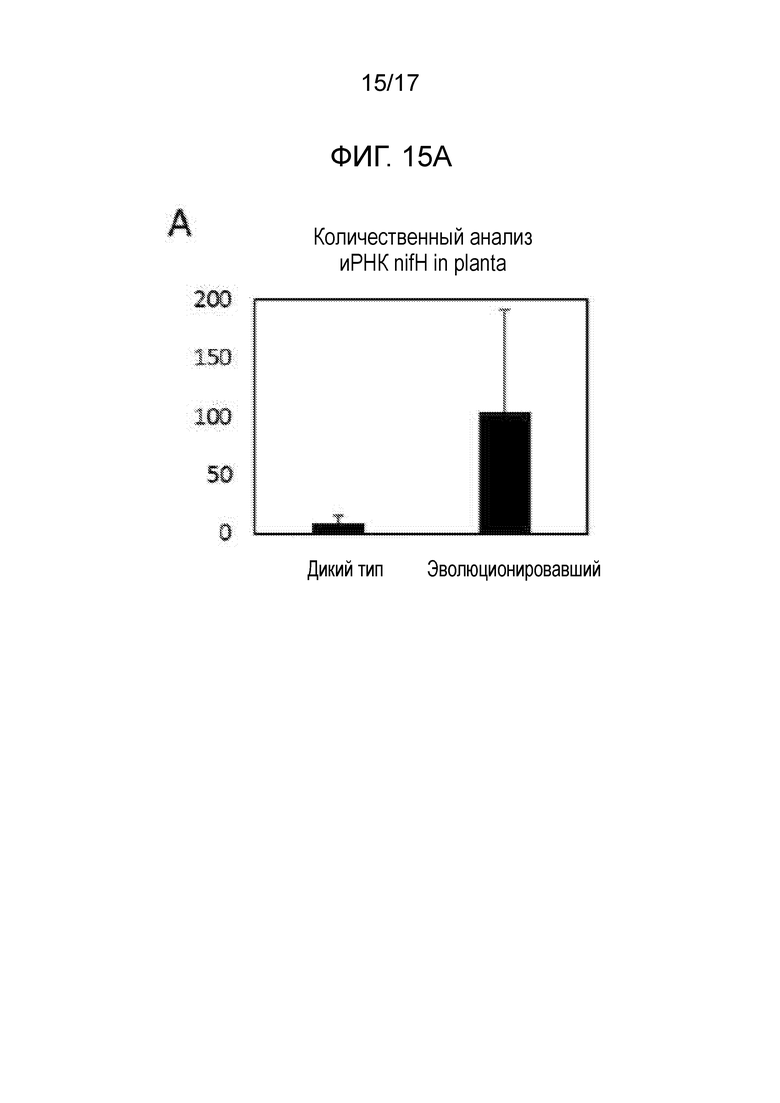
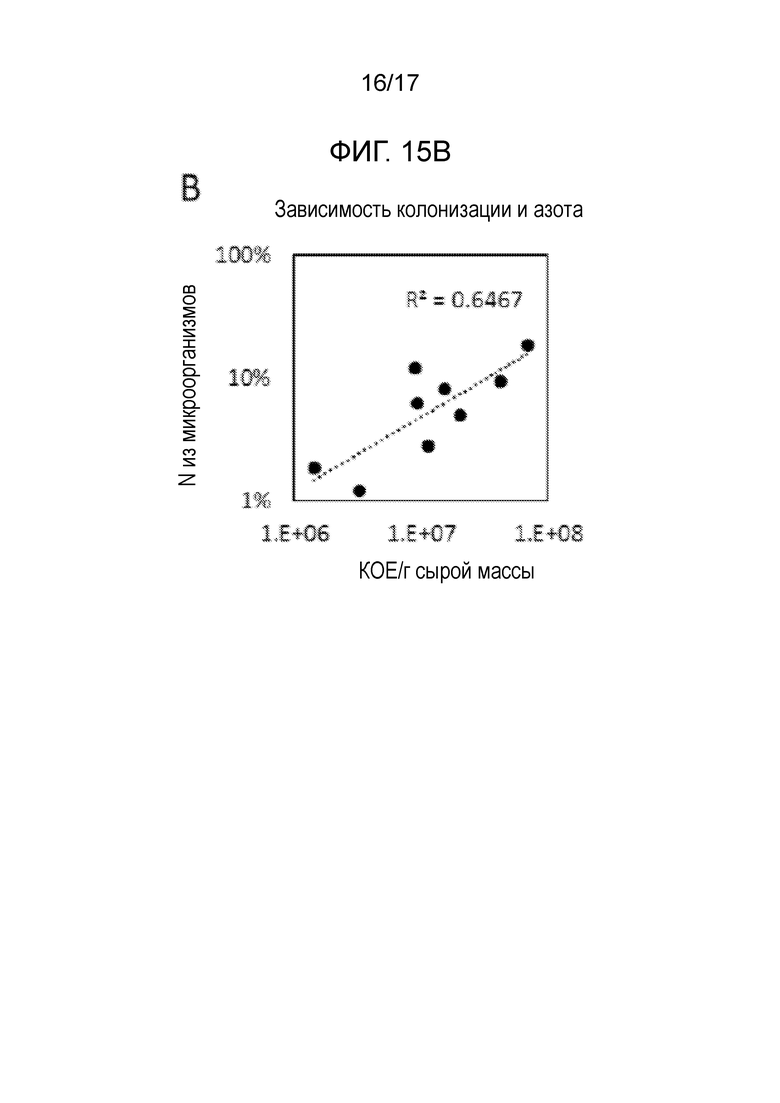
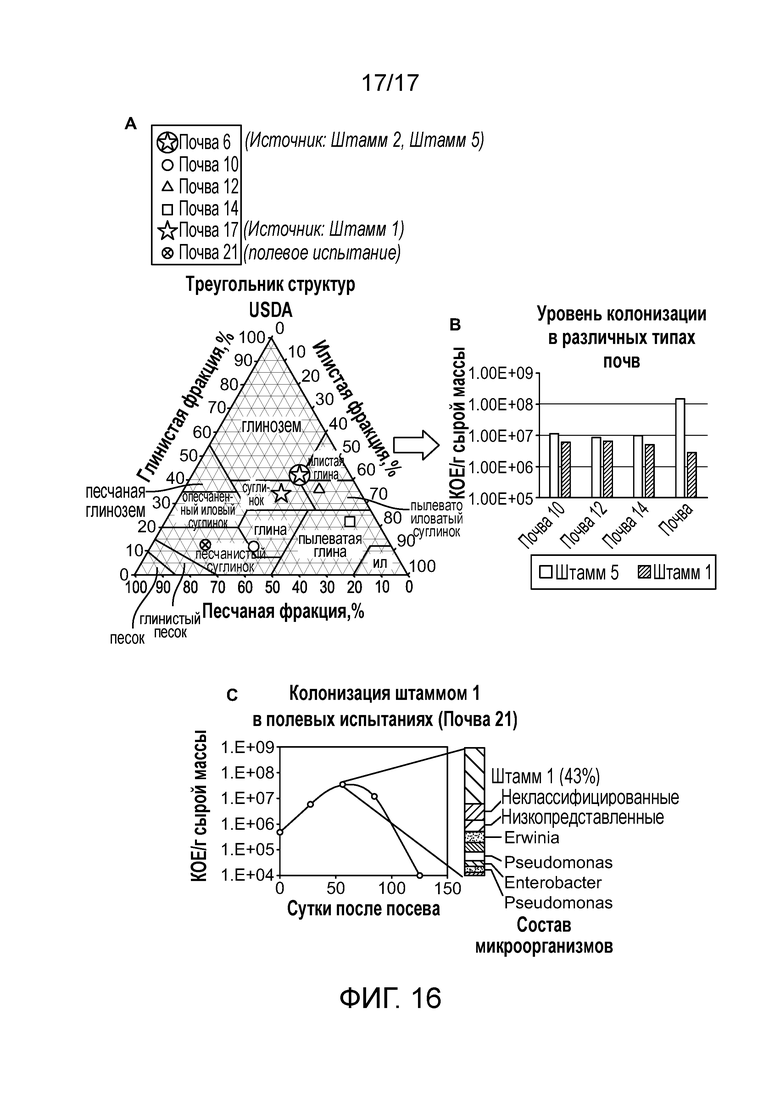
Изобретение относится к способу увеличения фиксации азота у небобового растения. Способ включает воздействие на растение множеством не являющихся межродовыми диазотрофных бактерий. Каждый представитель множества указанных бактерий несет одну или несколько генетических вариаций, вводимых в один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота не являющихся межродовыми диазотрофных бактерий так, что не являющиеся межродовыми диазотрофные бактерии становятся способными к фиксации атмосферного азота в присутствии экзогенного азота. При этом одна или несколько генетических вариаций включают генетический материал, происходящий от организма, имеющего тот же таксономический род, что и не являющиеся межродовыми диазотрофные бактерии. При этом указанные одна или несколько генетических вариаций представляют собой нокаут-мутацию или изменяют или удаляют регуляторную последовательность гена-мишени или включают вставку гетерологичной регуляторной последовательности. При этом указанные одна или несколько генетических вариаций приводят к повышенной активности или экспрессии nifH или nifA, пониженной экспрессии или активности nifL или пониженной экспрессии или активности аденилилтрансферазы или активности удаления аденилата бифункциональной глутаминсинтетазы. Указанные не являющиеся межродовыми диазотрофные бактерии in planta продуцируют в растении 1% или более фиксированного азота. 22 з.п. ф-лы, 16 ил., 10 табл., 7 пр.
1. Способ увеличения фиксации азота у небобового растения, включающий: воздействие на растение множеством не являющихся межродовыми диазотрофных бактерий, где каждый представитель множества несет одну или несколько генетических вариаций, вводимых в один или несколько генов или некодирующих полинуклеотидов генетической регуляторной сети фиксации или ассимиляции азота не являющихся межродовыми диазотрофных бактерий так, что не являющиеся межродовыми диазотрофные бактерии становятся способными к фиксации атмосферного азота в присутствии экзогенного азота;
где одна или несколько генетических вариаций включают генетический материал, происходящий от организма, имеющего тот же таксономический род, что и не являющиеся межродовыми диазотрофные бактерии;
где одна или несколько генетических вариаций (A) представляют собой нокаут-мутацию; (B) изменяют или удаляют регуляторную последовательность гена-мишени или (C) включают вставку гетерологичной регуляторной последовательности;
где одна или несколько генетических вариаций приводят к одному или нескольким из: повышенной активности или экспрессии nifH, повышенной экспрессии или активности nifA, пониженной экспрессии или активности nifL, или пониженной экспрессии или активности аденилилтрансферазы, или активности удаления аденилата бифункциональной глутаминсинтетазы; и
где не являющиеся межродовыми диазотрофные бактерии in planta продуцируют в растении 1% или более фиксированного азота.
2. Способ по п. 1, в котором одна или несколько генетических вариаций включают вводимую регуляторную последовательность, функционально связанную с указанными одним или несколькими генами генетической регуляторной сети фиксации или ассимиляции азота.
3. Способ по п. 2, в котором регуляторная последовательность представляет собой промотор.
4. Способ по п. 3, в котором промотор представляет собой индуцибельный промотор.
5. Способ по п. 1, в котором бактерии не содержат конститутивного промотора, функционально связанного с геном генетической регуляторной сети фиксации или ассимиляции азота.
6. Способ по п. 1, в котором не являющиеся межродовыми диазотрофные бактерии не содержат конститутивного промотора, функционально связанного с геном в кластере генов nif.
7. Способ по п. 1, в котором не являющиеся межродовыми диазотрофные бактерии in planta выделяют азотсодержащие продукты фиксации азота.
8. Способ по п. 1, в котором множество не являющихся межродовыми диазотрофных бактерий, воздействующих на растение, не стимулируют увеличения захвата экзогенного неатмосферного азота.
9. Способ по п. 1, в котором растение выращивают в почве с поля, в которое вводили по меньшей мере 22,68 кг азотсодержащего удобрения на акр, и где азотсодержащее удобрение содержит по меньшей мере 5% азота по массе.
10. Способ по п. 9, в котором азотсодержащее удобрение содержит аммоний или содержащую аммоний молекулу.
11. Способ по п. 1, в котором множество не являющихся межродовыми диазотрофных бактерий включает по меньшей мере два различных вида бактерий.
12. Способ по п. 1, в котором множество не являющихся межродовыми диазотрофных бактерий включает по меньшей мере два различных штамма одного вида бактерий.
13. Способ по п. 1, в котором экзогенный азот выбран из удобрения, содержащего одно или несколько из глутамина, аммиака, аммония, мочевины, нитрата, нитрита, содержащих аммоний молекул, содержащих нитраты молекул и содержащих нитриты молекул.
14. Способ по п. 1, в котором не являющиеся межродовыми диазотрофные бактерии in planta продуцируют в растении 5% или более фиксированного азота.
15. Способ по п. 1, в котором не являющиеся межродовыми диазотрофные бактерии in planta продуцируют в растении 10% или более фиксированного азота.
16. Способ по п. 1, в котором множество не являющихся межродовыми диазотрофных бактерий представляют собой бактерии родов, включающих Enterobacter, Rahnella, Kosakonia, Burkholderia или Klebsiella.
17. Способ по п. 1, в котором множество не являющихся межродовыми диазотрофных бактерий является эндофитным, эпифитным или ризосферным.
18. Способ по п. 1, в котором множество не являющихся межродовыми диазотрофных бактерий колонизирует по меньшей мере корни растений так, что бактерии присутствуют в растении в количестве по меньшей мере приблизительно 105 КОЕ на грамм сырой массы ткани.
19. Способ по п. 1, в котором растение представляет собой сельскохозяйственную культуру.
20. Способ по п. 19, в котором сельскохозяйственная культура выбрана из сорго, канола, томата, клубники, ячменя, риса, кукурузы и пшеницы.
21. Способ по п. 19, в котором растение представляет собой генетически модифицированный организм.
22. Способ по п. 19, в котором растение не является генетически модифицированным организмом.
23. Способ по п. 19, в котором растение генетически сконструировано или выведено для эффективного использования азота.
| Q | |||
| AN ET AL | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| J Appl Microbiol | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| US 20090137390 A1, 28.05.2009 | |||
| WO 2013132518 A1, 12.09.2013 | |||
| ИВАНОВА Е.С | |||
| И ДР | |||
| Искусственная регуляция генов, кодирующих белки нитрогеназного | |||
Авторы
Даты
2022-04-07—Публикация
2016-07-13—Подача