Ссылка на родственные заявки
[01] Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №62/965688, поданной 24 января 2020 года, предварительной заявкой на выдачу патента США №63/104213, поданной 22 октября 2020 года и предварительной заявкой на выдачу патента США №63/121467, поданной 4 декабря 2020 года, содержание каждой из которых полностью включено в данный документ посредством ссылки.
Перечень последовательностей
[02] Настоящая заявка содержит перечень последовательностей, который был представлен в электронном виде в формате ASCII и полностью включен в настоящий документ посредством ссылки. Указанная копия ASCII, созданная 6 января 2021 года, называется PC072498A_Sequence_Listing_ST25.txt и имеет размер 1048576 байт.
Область техники, к, которой относится настоящее изобретение
[03] Настоящее изобретение относится к антителам и их антигенсвязывающим фрагментам, которые специфически связывают E-селектин, и к композициям, способам и вариантам их применения, включая применение антител согласно раскрытию для лечения серповидноклеточной анемии (SCD), включая лечение и профилактику вазоокклюзивного криза (VOC), связанного с SCD.
Предшествующий уровень техники настоящего изобретения
[04] Серповидноклеточная анемия (SCD) представляет собой тяжелое, редкое генетическое нарушение, которым только в США (US) болеет свыше 100000 человек (Центр Регулирования и Профилактики Заболеваний). Это хроническое заболевание со значительной заболеваемостью и смертностью среди населения с сильно неудовлетворенными медицинскими потребностями. Люди с SCD страдают от прогрессирующего повреждения органов и заметного сокращения ожидаемой продолжительности жизни, при этом медиана выживаемости составляет примерно 56 лет (Gardner et al. Blood 2016; 128(10) 1436-38).
[05] SCD характеризуется наличием аномальной формы гемоглобина (Hb) - серповидного гемоглобина (HbS). Единственная нуклеотидная замена в гене β-глобина (HBB) приводит к одной аминокислотной замене (валин на глутаминовую кислоту) в остатке 6 (аллель HBS). Люди, гомозиготные по HBS, имеют наиболее распространенную и наиболее тяжелую форму серповидноклеточной анемии (SCD-SS). Вариантные формы SCD возникают, когда у человека есть одна копия HBS и одна мутантная копия в другом гене HBB. Люди с 1 копией аллеля HBS и 1 копией аллеля гемоглобина C (HBC) имеют заболевание SC (SCD-SC). Когда у человека есть 1 копия HBS и одна копия аллеля β-талассемии, тяжесть SCD зависит от тяжести аллеля β-талассемии с делецией Hbβ-талассемии (SCD-Sβ-thal), часто более тяжелого, чем аллель Hbβ+-талассемии (SCD-Sβ+-thal) или другой взаимодействующий вариант HB (SCD-SVariant) (Frenett & Atweh J. Clin. Invest. 2007; 117:850-858).
[06] Первичным событием молекулярного патогенеза SCD является склонность HbS к полимеризации в условиях низкого напряжения кислорода, в результате чего красные кровяные тельца (эритроциты) становятся ригидными и приобретают серповидную форму (Fabry & Nagel Blood 1982; 60(6)1370-77). Гипоксия в микрокапиллярном венозном русле приводит к воспалению эндотелия и адгезии нейтрофилов, уменьшению движения нейтрофилов и скорости кровотока. Эти клеточные агрегаты попадают в сосудистую сеть посредством взаимодействия с эндотелиальными клетками. Адгезивные взаимодействия серповидных RBC, лейкоцитов и эндотелиальных клеток закупоривают сосудистую сеть, что приводит к окклюзии сосудов (Zhang et al., Blood 2016:127:801-809; Okpala, 2006; Frenette & Atweh, J. Clin. Invest. 2007; 117:850-858). Нарушение регуляции гомеостаза оксида азота способствует сосудистой дисфункции при SCD (Aslan & Freeman, 2007). Скопления клеток крови приводят к эпизодам сосудистой обструкции, инфаркту органов и ишемии, которые клинически проявляются эпизодами сильной боли. Анемия является следствием укороченной продолжительности жизни эритроцитов из-за гемолиза и окклюзии сосудов, которые провоцируются взаимодействиями между сосудистым эндотелием и серповидными RBC, лейкоцитами и тромбоцитами (Rees et al., Lancet 2010; 376:2018-31).
[07] Вазоокклюзивный криз (VOC) является наиболее распространенным клиническим проявлением SCD и основной причиной заболеваемости при SCD с нарушением повседневного функционирования (Ballas & Lusardi, Am. J. Hematol. 2005; 79:17-25; Piel et al. New Engl. J. Med. 2017; 376:1561-1573; Darbari et al. PloS One 2013; 8(11):e79923). VOC инициируется взаимодействием между серповидными RBC и эндотелия сосудов в посткапиллярных венулах, где напряжение кислорода самое низкое (Manwani & Frenette, Blood 2013; 122(24):3892-8). Это приводит к повреждению эндотелия, которое запускает воспалительную реакцию и вызывает рекрутирование лейкоцитов, тромбоцитов и дополнительных RBC в очаг воспаления (Zhang et al. Blood 2016; 127(7):801). Эти клеточные агрегаты приводят к окклюзии сосудов (Turhan et al. Proc. Natl. Acad. Sci. 2002; 99(5):3047-51) и замедлению кровотока в посткапиллярных венулах, что вызывает локальную тканевую гипоксию и дополнительное воспаление тканей. Эта приводит к большей дезоксигенации и серповидности RBC и к распространению окклюзии, иногда называемому вторичным рекрутингом серповидных клеток и закупоренных сосудов (Stuart & Nagel, Lancet 2004; 364(9942):1343-60).
[08] VOC может проявляться у пациентов с SCD уже в возрасте 6 месяцев, хотя у младенцев они встречаются значительно реже, чем у детей старшего возраста или взрослых (Benjamin et al. Amer. Pain Soc. 1994; vol. 1, 94 pp). Примерно 60% пациентов с гомозиготной SCD имеют по меньшей мере 1 тяжелый эпизод VOC в год, но у части пациентов эпизодов значительно больше (Platt et al. N. Engl. J. Med. 1991; 325(1); 11-6). В этом же исследовании у 5,2% пациентов с генотипом SCD было 3-10 тяжелых эпизодов VOC в год, а у небольшой части (> 1%) пациентов было 10 и более эпизодов в год.
[09] Боль является клиническим проявлением начальной и продолжающейся окклюзии сосудов и ишемии (Ballas, Hematol. Oncol. Clin. North Am. 2005; 19(5):785-802), которые могут быть особенно тяжелыми у пациентов с генотипом SCD-SS, у которых также наблюдается более высокая смертность, чем при других генотипах (Platt et al. N. Engl. J. Med. 1994; 330(23); 1639-44).
[010] Рекрутинг лейкоцитов в области повреждения эндотелия сосудов включает молекулы адгезии семейства селектинов: Е-селектин (также известный как CD62E); Р-селектин (также известный как CD62P); и L-селектин (также известный как CD62L), которые все регулируются как часть воспалительной реакции (Ernst & Magnani Nat. Rev. Drug Discov. 2009; 8(8):661-77; Morikis et al., Blood 2017; 130(19):2101-10). Несмотря на сходство структуры, каждый селектин демонстрирует различное распределение, кинетику связывания лиганда и разнообразие как патологических, так и физиологических функций.
[011] Молекулы адгезии семейства селектинов и их лиганды являются частью провоспалительного ответа при SCD, которому способствуют изменения в серповидных эритроцитах и активированных эндотелиальных клетках. Селектины также играют критическую роль в регуляции начального контакта межклеточной адгезии, движения лейкоцитов по эндотелию и активации интегрина и трансмиграции клеток. Адгезия лейкоцитов к воспаленному эндотелию и циркулирующим клеточным агрегатам является характерным признаком SCD.
[012] Связывающие углеводы белки семейства селектинов имеет схожую структуру, причем каждый из них имеет N-концевой домен распознавания углеводов, характерный для Са2+-зависимых лектинов (типа С), за которым следует домен, подобный эпидермальному фактору роста (EGF), серия коротких консенсусных повторов с гомологией, дополняющей регуляторные домены, трансмембранный домен и короткий цитоплазматический хвост (McEver & Zhu, 2010). Селектины и их лиганды опосредуют рекрутинг тромбоцитов и лейкоцитов из крови в эндотелий сосудов, способствуя созданию хронической провоспалительной среды.
[013] Патофизиология SCD является сложной и гетерогенной. Симптомы включают болевые кризы, хроническую анемию, острый грудной синдром, инсульт, секвестрацию селезенки, вазоокклюзивные острые боли или кризы, почечную дисфункцию и восприимчивость к бактериальным инфекциям (Ashley-Koch et al., Am. J. Epidemiol. 2000; 151:839-845; Steinberg, New Engl. J. Med., 1999; 340:1021-1030; Piel et al., New Engl. J. Med., 2017; 376:1561-1573). Острые органные осложнения, связанные с SCD, могут включать острый грудной синдром, острый приапизм при инсульте, гепатобилиарные осложнения, секвестрацию селезенки и острую почечную недостаточность. Хронические осложнения кумулятивного инсульта SCD включают аваскулярный некроз, легочную гипертензию, почечные осложнения, офтальмологические осложнения, язвы на ногах и рецидивирующий приапизм (Yawn et al., JAMA 2014; 312:1033-48).
[014] Гидроксимочевина одобрена для профилактической терапии SCD. Механически гидроксимочевина повышает концентрацию эмбрионального гемоглобина (HbF) и снижает количество болевых кризов (Charache et al., New Engl. J. Med. 1995; 332:1317-1322). Несмотря на то, что гидроксимочевина считается стандартом лечения VOC, частота неудач составляет ~30-35%, и она неэффективна при лечении симптомов острого VOC. ENDARI (L-глютамин) недавно был одобрен для профилактического лечения SCD, однако механизм действия неясен, а клиническая польза является умеренной (Quinn, Blood 2018; 132:689-693). Текущие методы лечения острых эпизодов VOC в значительной степени поддерживаются опиоидными анальгетиками, гидратацией, кислородом и переливанием крови. Кроме того, большинство пациентов лечат VOC дома и не обращаются за прямым медицинским вмешательством (Smith et al., Ann. Intern. Med. 2008; 148:94-101; Callaghan et al., Blood 2017; 130:973).
[015] Сохраняется значительная потребность в профилактике и лечении SCD и, в частности, в устранении лежащей в основе патофизиологии (например, в уменьшении воспаления и клеточной агрегации) рецидивирующих и изнурительных VOC у пациентов. Настоящее изобретение относится к новым терапевтическим антителам, которые специфически связываются с Е-селектином и способны нейтрализовать функциональную активность Е-селектина. Эти антитела могут быть успешно использованы для предотвращения или уменьшения возникновения VOC при использовании в качестве профилактического лечения SCD, а также для лечения острого VOC у пациентов с SCD путем уменьшения продолжительности (например, сокращения времени, необходимого для устранения VOC), интенсивности и/или тяжести VOC.
Сущность настоящего изобретения
[016] В изобретении представлены антитела и их антигенсвязывающие фрагменты, которые специфически связываются с E-селектином, а также варианты применения и связанные с ними способы. Специалисты в данной области узнают или смогут установить с использованием не более чем рутинных экспериментов многие эквиваленты конкретных вариантов осуществления изобретения, описанных в настоящем документе. Предполагается, что такие эквиваленты охватываются следующими вариантами осуществления (E).
E1. Выделенные антитела или их антигенсвязывающие фрагменты, которые специфически связываются с E-селектином, (например, E-селектином человека и/или яванского макака).
E2. Антитела или их антигенсвязывающие фрагменты согласно E1, содержащие последовательности HCDR-1, HCDR-2 и HCDR-3, выбранные из группы, состоящей из SEQ ID NO: 8, 23, 52, 63, 77, 92, 111, 125, 9, 24, 29, 38, 41, 44, 53, 64, 78, 93, 112, 126, 10, 54, 65, 79, 94, 113 и 127.
E3. Антитела или их антигенсвязывающие фрагменты по любому из E1-E2, содержащие последовательности LCDR-1, LCDR-2 и LCDR-3, выбранные из группы, состоящей из SEQ ID NO: 2, 18, 47, 68, 82, 97, 106, 9, 24, 29, 38, 41, 44, 53, 64, 78, 93, 112, 126 10, 54, 65, 79, 94, 113 и 127.
E4. Антитела или их антигенсвязывающие фрагменты по любому из E1-E3, содержащие один или более элементов из (a)-(f)
(a) аминокислотную последовательность LCDR-1, выбранную из группы, состоящей из последовательности SEQ ID NO: 2, 18, 47, 68, 82, 97 и 106;
(b) аминокислотную последовательность LCDR-2, выбранную из группы, состоящей из последовательности SEQ ID NO: 3, 19, 48, 69, 83, 98, 107 и 120;
(c) аминокислотную последовательность LCDR-3, выбранную из группы, состоящей из последовательности SEQ ID NO: 4, 20, 49, 70, 84, 99, 108 и 121;
(d) аминокислотную последовательность HCDR-1, выбранную из группы, состоящей из последовательности SEQ ID NO: 8, 23, 52, 63, 77, 92, 111 и 125;
(e) аминокислотную последовательность, HCDR-2, выбранную из группы, состоящей из последовательности SEQ ID NO: 9, 24, 29, 38, 41, 44, 53, 64, 78, 93, 112 и 126; и
(f) аминокислотную последовательность, HCDR-3, выбранную из группы, состоящей из последовательности SEQ ID NO: 10, 54, 65, 79, 94, 113 и 127.
E5. Антитела или их антигенсвязывающие фрагменты по любому из E1-E4, содержащие один или более элементов из следующих:
LCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 2,
LCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 3,
LCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 4,
HCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 8,
HCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 9, и
HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10.
E6. Антитела или их антигенсвязывающие фрагменты по любому из E1-E5, содержащие последовательности HCDR-1, HCDR-2 и HCDR-3 из по меньшей мере одной последовательности, выбранной из группы, состоящей из SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128.
E7. Антитела или их антигенсвязывающие фрагменты по любому из E1-E6, содержащие последовательности LCDR-1, LCDR-2 и LCDR-3 из по меньшей мере одной последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116 и 122.
E8. Антитела или их антигенсвязывающие фрагменты по любому из E1-E7, содержащие последовательности HCDR-1, HCDR-2 и HCDR-3 из по меньшей мере одной последовательности, выбранной из группы, состоящей из SEQ ID NO: 7, 13, 22, 28, 34, 37, 40, 43, 51, 59, 62, 74, 76, 89, 91, 103, 110, 117 и 124.
E9. Антитела или их антигенсвязывающие фрагменты по любому из E1-E8, содержащие последовательности LCDR-1, LCDR-2 и LCDR-3 из по меньшей мере одной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 17, 26, 31, 46, 56, 67, 72, 81, 86, 96, 101, 105, 115 и 119.
E10. Антитела или их антигенсвязывающие фрагменты по любому из E1-E9, содержащие последовательности HCDR-1, HCDR-2 и HCDR-3 SEQ ID NO: 11.
E11. Антитела или их антигенсвязывающие фрагменты по любому из E1-E10, содержащие последовательности LCDR-1, LCDR-2 и LCDR-3 SEQ ID NO: 5.
E12. Антитела или их антигенсвязывающие фрагменты по любому из E1-E11, содержащие последовательности HCDR-1, HCDR-2 и HCDR-3 SEQ ID NO: 7 или 13.
E13. Антитела или их антигенсвязывающие фрагменты по любому из E1-E12, содержащие последовательности LCDR-1, LCDR-2 и LCDR-3 SEQ ID NO: 1.
E14. Антитела или их антигенсвязывающие фрагменты по любому из E1-E13, содержащие LCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 2, LCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 3, LCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 4, HCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 8, HCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 9, и HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10.
E15. Антитела или их антигенсвязывающие фрагменты по любому из E1-E4, содержащие LCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 2, LCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 3, LCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 4.
E16. Антитела или их антигенсвязывающие фрагменты по любому из E1-E15, содержащие HCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 8, HCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 9, и HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10.
E17. Антитела или их антигенсвязывающие фрагменты по любому из E1-E16, содержащие каркасную последовательность VL, полученную из последовательности VL зародышевой линии человека, выбранной из группы, состоящей из IGKV1-12*01, IGKV1-13*02, IGKV1-33*01, IGKV1-39*01, IGKV1-5*01, IGKV3-11*01, IGKV3-15*01, IGKV3-20*01, IGKV3D-20*02 и IGKV4-1*01.
E18. Антитела или их антигенсвязывающие фрагменты по любому из E1-E17, содержащие каркасную последовательность VH, полученную из последовательности VH зародышевой линии человека, выбранной из группы, состоящей из IGHV1-2*02, IGHV1-3*01, IGHV1-46*01, IGHV1-69*01, IGHV1-69*02, IGHV1-8*01, IGHV3-7*01, IGHV3-13*01, IGHV3-23*01, IGHV3-23*04, IGHV3-30*01, IGHV3-30*18, IGHV5-10-1*01, IGHV5-10-1*04 и IGHV5-51*01.
E19. Антитела или их антигенсвязывающие фрагменты по любому из E1-E18, содержащие каркасную последовательность VL IGHV1-39*01.
E20. Антитела или их антигенсвязывающие фрагменты по любому из E1-E19, содержащие каркасная последовательность VH IGHV3-07*01.
E21. Антитела или их антигенсвязывающие фрагменты по любому из E1-E20, содержащие каркасную последовательность VL и каркасная последовательность VH, и при этом каркасная последовательность VL по меньшей мере на 72% идентична последовательности зародышевой линии человека, из которой она получена.
E22. Антитела или их антигенсвязывающие фрагменты по любому из E1-E21, содержащие каркасную последовательность VL и каркасную последовательность VH, и при этом каркасная последовательность VL по меньшей мере на 72%, 74%, 75%, 77%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности зародышевой линии человека, из которой она получена.
E23. Антитела или их антигенсвязывающие фрагменты по любому из E1-E22, содержащие каркасную последовательность VL и каркасную последовательность VH, и при этом каркасная последовательность VH по меньшей мере на 53% идентична последовательности зародышевой линии человека, из которой она получена.
E24. Антитела или их антигенсвязывающие фрагменты по любому из E1-E23, содержащие каркасную последовательность VL и каркасную последовательность VH, и при этом каркасная последовательность VH по меньшей мере на 53%, 58%, 60%, 63%, 71%, 72%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности зародышевой линии человека, из которой она получена.
E25. Антитела или их антигенсвязывающие фрагменты по любому из E1-E24, содержащие домен VH, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 11.
E26. Антитела или их антигенсвязывающие фрагменты по любому из E1-E25, содержащие домен VH, содержащий аминокислотную последовательность, по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 11.
E27. Антитела или их антигенсвязывающие фрагменты по любому из E1-E26, содержащие домен VH, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 11.
E28. Антитела или их антигенсвязывающие фрагменты по любому из E1-E27, содержащие домен VL, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 5.
E29. Антитела или их антигенсвязывающие фрагменты по любому из E1-E28, содержащие домен VL, содержащий аминокислотную последовательность по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 5.
E30. Антитела или их антигенсвязывающие фрагменты по любому из E1-E29, содержащие или состоящие из домена VL, содержащего аминокислотную последовательность SEQ ID NO: 5.
E31. Антитела или их антигенсвязывающие фрагменты по любому из E1-E30, содержащие домен VH, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 11, и домен VL, содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 5.
E32. Антитела или их антигенсвязывающие фрагменты по любому из E1-E31, содержащие Fc-домен.
E33. Антитела или их антигенсвязывающие фрагменты согласно E32, в которых Fc-домен представляет собой Fc-домен IgA (например, IgA1 или IgA2), IgD, IgE, IgM или IgG (например IgG1, IgG2, IgG3 или IgG4).
E34. Антитела или их антигенсвязывающие фрагменты согласно E33, в которых Fc-домен представляет собой Fc-домен IgG.
E35. Антитела или их антигенсвязывающие фрагменты согласно E34, в которых IgG выбирают из группы, состоящей из IgG1, IgG2, IgG3 и IgG4.
E36. Антитела или их антигенсвязывающие фрагменты согласно E35, в которых IgG представляет собой IgG1.
E37. Антитела или их антигенсвязывающие фрагменты по любому из E1-E36, содержащие тяжелую цепь, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 7 или SEQ ID NO: 13.
E38. Антитела или их антигенсвязывающие фрагменты по любому из E1-E37, содержащие тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 7 или SEQ ID NO: 13.
E39. Антитела или их антигенсвязывающие фрагменты по любому из E1-E38, содержащие тяжелую цепь, содержащую или состоящую из аминокислотной последовательности SEQ ID NO: 7 или SEQ ID NO: 13.
E40. Антитела или их антигенсвязывающие фрагменты по любому из E1-E39, содержащие тяжелую цепь, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную любой из SEQ ID NO: 22, 28, 34, 37, 40, 43, 51, 59, 62, 74, 76, 89, 91, 103, 110, 117 и 124.
E41. Антитела или их антигенсвязывающие фрагменты по любому из E1-E40, содержащие LC, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 1.
E42. Антитела или их антигенсвязывающие фрагменты по любому из E1-E41, содержащие LC, содержащую аминокислотную последовательность по меньшей мере на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 1
E43. Антитела или их антигенсвязывающие фрагменты по любому из E1-E42, содержащие LC, содержащую или состоящую из аминокислотной последовательности SEQ ID NO: 1.
E44. Антитела или их антигенсвязывающие фрагменты по любому из E1-E43, содержащие тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 13, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 1.
E45. Антитела или их антигенсвязывающие фрагменты по любому из E1-E45, содержащие легкую цепь, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную любой из SEQ ID NO: 17, 26, 31, 1, 46, 56, 67, 72, 81, 86, 96, 101, 105, 115 и 119.
E46. Антитела или их антигенсвязывающие фрагменты по любому из E1-E45, содержащие HCDR-1, HCDR-2 и HCDR-3, закодированные вставкой плазмиды, депонированной в ATCC и имеющей в ATCC учетный № PTA-126529.
E47. Антитела или их антигенсвязывающие фрагменты по любому из E1-E46, содержащие LCDR-1, LCDR-2 и LCDR-3, закодированные вставкой плазмиды, депонированной в ATCC и имеющей в ATCC учетный № PTA-126530.
E48. Антитела или их антигенсвязывающие фрагменты по любому из E1-E47, содержащие домен VH, закодированный вставкой в плазмиду, депонированную в ATCC и имеющую в ATCC учетный № PTA-126529.
E49. Антитела или их антигенсвязывающие фрагменты по любому из E1-E48, содержащие домен VL, закодированный вставкой в плазмиду, депонированную в ATCC и имеющую в ATCC учетный № PTA-126530.
E50. Антитела или их антигенсвязывающие фрагменты по любому из E1-E49, содержащие аминокислотную последовательность HC, закодированную вставкой в плазмиду, депонированную в ATCC и имеющую в ATCC учетный № PTA-126529, и аминокислотную последовательность LC, закодированную вставкой в плазмиду, депонированную в ATCC и имеющую в ATCC учетный № PTA-126530.
E51. Антитела или их антигенсвязывающие фрагменты по любому из E1-E50, причем антитела или антиген-связывание фрагменты представляют собой белок слияния Fc, монотела, макситела, бифункциональные антитела, scFab, scFv, пептитела.
E52. Антитела или их антигенсвязывающие фрагменты по любому из E1-E52, причем антитела или их антигенсвязывающие фрагменты связывают E-селектин человека с KD, примерно равным или меньше значения, выбранного из группы, состоящей из примерно 800 нМ, 700 нМ, 600 нМ, 500 нМ, 400 нМ, 300 нМ, 200 нМ, 175 нМ, 150 нМ, 125 нМ, 100 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ, 1 нМ, 900 пМ, 800 пМ, 700 пМ, 600 пМ и 500 пМ.
E53. Антитела или их антигенсвязывающие фрагменты по любому из E1-E52, причем антитела или их антигенсвязывающие фрагменты связывают E-селектин яванского макака с KD, примерно равным или меньше значения, выбранного из группы, состоящей из примерно 800 нМ, 700 нМ, 600 нМ, 500 нМ, 400 нМ, 300 нМ, 200 нМ, 175 нМ, 150 нМ, 125 нМ, 100 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ, 1 нМ, 900 пМ, 800 пМ, 700 пМ, 600 пМ и 500 пМ.
E54. Антитела или их антигенсвязывающие фрагменты по любому из E1-E53, причем антитела или их антигенсвязывающие фрагменты связывают E-селектин человека с KD от примерно 10 нМ до примерно 200 нМ.
E55. Антитела или их антигенсвязывающие фрагменты по любому из E1-E54, причем антитела или их антигенсвязывающие фрагменты связывают E-селектин человека с KD примерно 68,4 +/- 3,18 нМ.
E56. Антитела или их антигенсвязывающие фрагменты по любому из E1-E55, причем антитела или их антигенсвязывающие фрагменты связывают E-селектин яванского макака с KD от примерно 10 нМ до примерно 200 нМ.
E57. Антитела или их антигенсвязывающие фрагменты по любому из E1-E56, причем антитела или их антигенсвязывающие фрагменты связывают E-селектин яванского макака с KD примерно 64,9 +/- 1,13 нМ.
E58. Антитела или их антигенсвязывающие фрагменты по любому из E1-E57, причем антитела против E-селектина связывают E-селектин человека с KD, выбранным из группы, состоящей из примерно 92,85 нМ, примерно 70,3 нМ, примерно 65,2 нМ, примерно 61,8 нМ, примерно 60,5 нМ, примерно 68,0 нМ, примерно 21,6 нМ, примерно 324 нМ, примерно 54,4 нМ, примерно 628,5 нМ и 2940 нМ.
E59. Антитела или их антигенсвязывающие фрагменты по любому из E1-E58, причем антитела против E-селектина связывают E-селектин яванского макака с KD, выбранным из группы примерно 138,5 нМ, примерно 78,3 нМ, примерно 76,5 нМ, примерно 81,5 нМ, примерно 67,8 нМ, примерно 45,8 нМ, примерно 243,5 нМ, примерно 45,4 нМ, примерно 492 нМ и 3145 нМ.
E60. Антитела или их антигенсвязывающие фрагменты по любому из E1-E59, причем средний период полужизни у яванского макака составляет по меньшей мере примерно 14,4 дней (345 часов) после IV введения в дозе 10 мг/кг.
E61. Антитела или их антигенсвязывающие фрагменты по любому из E1-E60, причем средний период полужизни у яванского макака составляет по меньшей мере примерно 12 дней (287 часов) после IV введения в дозе 3 мг/кг.
E62. Антитела или их антигенсвязывающие фрагменты по любому из E1-E61, причем средний период полужизни у яванского макака составляет примерно 21,5 дней (518 часов) после SC введения в дозе 3 мг/кг.
E63. Антитела или их антигенсвязывающие фрагменты по любому из E1-E62, причем антитела или их антигенсвязывающие фрагменты не индуцируют антитела против лекарственного средства.
E64. Антитела или их антигенсвязывающие фрагменты по любому из E1-E63, причем прогнозируемый иммуногенный потенциал антител, указанный скорректированной оценкой t-regitope (T-Reg), составляет менее примерно -30.
E65. Антитела или их антигенсвязывающие фрагменты по любому из E1-E64, причем прогнозируемый иммуногенный потенциал антител, указанный скорректированной оценкой t-regitope (T-Reg), составляет менее примерно -45, и имеется 0 эпитопов T-клеток не зародышевой линии.
E66. Антитела или их антигенсвязывающие фрагменты по любому из E1-E65, причем прогнозируемый иммуногенный потенциал антител, указанный скорректированной оценкой T-Reg, меньше скорректированной оценки T-Reg, выбранной из группы, состоящей из примерно -24, -26, -27, -30, -32, -33, -34, -35, -36, -37, -38, -39, -40, -41, -42, -43, -44, -45, -46, -47 и -48.
E67. Антитела или их антигенсвязывающие фрагменты по любому из E1-E66, причем прогнозируемый иммуногенный потенциал антител, указанный скорректированной оценкой T-Reg, составляет примерно -45 или -46.
E68. Антитела против E-селектина или их антигенсвязывающие фрагменты по любому из E1-E67, причем антитела или их антигенсвязывающие фрагменты имеют низкий риск полиреактивности при измерении, например, с помощью анализа AC-SINS, анализа связывания ДНК и/или анализа связывания инсулина.
E69. Антитела или их антигенсвязывающие фрагменты по любому из E1-E68, причем антитела или их антигенсвязывающие фрагменты имеют вязкость, выбранную из группы, состоящей из примерно 7,97 +/- 1,83 сП при концентрации примерно 23 мг/мл, примерно 12,38 +/- 5,28 сП при концентрации примерно 48 мг/мл, примерно 4,26 +/- 0,6 сП при концентрации примерно 90 мг/мл, примерно 5,58 +/- 0,99 сП при концентрации примерно 102 мг/мл, примерно 8,44 +/- 1,54 сП при концентрации примерно 121 мг/мл, примерно 9,78 +/- 2,32 сП при концентрации примерно 140 мг/мл, примерно 17,47 +/- 3,24 сП при концентрации примерно 158 мг/мл и примерно 37,99 +/- 7,03 сП при концентрации примерно 188 мг/мл при измерении при 25°C, например, с помощью динамического рассеяния света (DLS).
E70. Антитела или их антигенсвязывающие фрагменты по любому из E1-E69, причем антитела или их антигенсвязывающие фрагменты имеют вязкость примерно от 15 сП до 40 сП при концентрации от примерно 150 мг/мл до примерно 190 мг/мл при измерении при 25°C, например, с помощью DLS.
E71. Антитела или их антигенсвязывающие фрагменты по любому из E1-E70, причем антитела или их антигенсвязывающие фрагменты имеют вязкость 33,4 сП при 185,7 мг/мл при измерении при 25°C, например, по методу Anton Parr.
E72. Антитела или их антигенсвязывающие фрагменты по любому из E1-E71, причем антитела или их антигенсвязывающие фрагменты связываются по меньшей мере с одним из трех эпитопов E-селектина человека при определении, например, с помощью конкурентного анализа с использованием, например, биосенсора Octet.
E73. Антитела или их антигенсвязывающие фрагменты согласно E72, причем по меньшей мере 2 эпитопа перекрываются.
E74. Антитела или их антигенсвязывающие фрагменты по любому из E1-E73, причем антитела или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним аминокислотным остатком E-селектина человека, выбранным из группы, состоящей из T7, E8, A9, M10, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, N105, E107, R108, S110, K111, K112, K113 и их комбинации.
E75. Антитела или их антигенсвязывающие фрагменты по любому из E1-E74, причем антитела или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним аминокислотным остатком E-селектина человека в пределах 3,8 Å, выбранным из группы, состоящей из T7, E8, A9, T11, P46, S47, Y48, N82, N83, Q85, E92, Y94, N105, E107, R108, S110, K111, K112 и их комбинации.
E76. Антитела или их антигенсвязывающие фрагменты по любому из E1-E75, причем антитела или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним аминокислотным остатком E-селектина человека со скрытой площадью поверхности (Å2) >5 Å2, выбранным из группы, состоящей из T7, E8, A9, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, E107, R108, S110, K111, K112, K113 и их комбинации.
E77. Антитела или их антигенсвязывающие фрагменты по любому из E1-E76, причем антитела или их антигенсвязывающие фрагменты взаимодействуют посредством водородной связи по меньшей мере с одним аминокислотным остатком E-селектина человека, выбранным из группы, состоящей из E8, S47, N82, N83, E88, E92, Y94, N105, E107, R108, S110, K112 и их комбинации.
E78. Антитела или их антигенсвязывающие фрагменты по любому из E1-E77, причем антитела или их антигенсвязывающие фрагменты взаимодействуют посредством солевого мостика по меньшей мере с одним аминокислотным остатком E-селектина человека, выбранным из группы, состоящей из K111, K112 и их комбинации.
E79. Антитела или их антигенсвязывающие фрагменты по любому из E1-E78, причем антитела или их антигенсвязывающие фрагменты взаимодействуют посредством опосредованной водой водородной связи по меньшей мере с одним аминокислотным остатком E-селектина человека, выбранным из группы, состоящей из R97, K112 и их комбинации.
E80. Антитела или их антигенсвязывающие фрагменты по любому из E1-E79, причем антитела или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним аминокислотным остатком E-селектина человека, который также взаимодействует в пределах 3,8A аминокислотного остатка sLex, выбранным из группы, состоящей из Y48, N82, N83, E92, Y94, R97, N105, E107 и их комбинации.
E81. Антитела или их антигенсвязывающие фрагменты по любому из E1-E80, причем процентная доля HMMS и/или процентная доля LMMS составляет менее 5% после хранения при 40°C в течение 4 недель в растворе, выбранном из группы, состоящей из 20 мМ Tris при pH 7,5, 20 мМ гистидина при pH 5,8 и 20 мМ глутаминовой кислоты при pH 4,5, и при этом необязательно проводят анализ с помощью aSEC.
E82. Антитела или их антигенсвязывающие фрагменты по любому из E1-E81, причем процентная доля HMMS составляет менее 5% после хранения при 4°C или 25°C в течение до 6 недель в растворе, выбранном из группы, состоящей из 20 мМ Tris, 8,5% сахарозы при pH 7,5, 20 мМ гистидина, 8,5% сахарозы, 0,005% EDTA при pH 5,8 и 20 мМ глутаминовой кислоты, 8,5% трегалозы при pH 4,5; причем антитела имеют концентрацию примерно 150 мг/мл; и при этом необязательно проводят анализ с помощью aSEC.
E83. Антитела или их антигенсвязывающие фрагменты по любому из E1-E82, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm1) или температурой, при которой CH2 антитела развернут на 50%, примерно 65°C или более при измерении с помощью дифференциальной сканирующей калориметрии.
E84. Антитела или их антигенсвязывающие фрагменты по любому из E1-E83, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm1) или температурой, при которой CH2 антитела развернут на 50%, от 65°C до 72°C при измерении с помощью дифференциальной сканирующей калориметрии.
E85. Антитела или их антигенсвязывающие фрагменты по любому из E1-E84, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm1) или температурой, при которой CH2 антитела развернут на 50%, примерно 71,7°C при измерении с помощью дифференциальной сканирующей калориметрии.
E86. Антитела или их антигенсвязывающие фрагменты по любому из E1-E85, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm2) или температурой, при которой Fab антитела развернут на 50%, примерно 74°C или более при измерении с помощью дифференциальной сканирующей калориметрии.
E87. Антитела или их антигенсвязывающие фрагменты по любому из E1-E86, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm2) или температурой, при которой Fab антитела развернут на 50%, от 74°C до 78°C при измерении с помощью дифференциальной сканирующей калориметрии.
E88. Антитела или их антигенсвязывающие фрагменты по любому из E1-E87, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm2) или температурой, при которой Fab антитела развернут на 50%, примерно 78,2°C при измерении с помощью дифференциальной сканирующей калориметрии.
E89. Антитела или их антигенсвязывающие фрагменты по любому из E1-E88, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm3) или температурой, при которой CH3 антитела развернут на 50%, примерно 82°C или более при измерении с помощью дифференциальной сканирующей калориметрии.
E90. Антитела или их антигенсвязывающие фрагменты по любому из E1-E89, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm3) или температурой, при которой CH3 антитела развернут на 50%, от 82°C до 86°C при измерении с помощью дифференциальной сканирующей калориметрии.
E91. Антитела или их антигенсвязывающие фрагменты по любому из E1-E90, причем антитела или их антигенсвязывающие фрагменты обладают термической стабильностью с температурой плавления (Tm3) или температурой, при которой CH3 антитела развернут на 50%, примерно 84,3°C при измерении с помощью дифференциальной сканирующей калориметрии.
E92. Антитела или их антигенсвязывающие фрагменты по любому из E1-E91, причем антитела или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином человека, выражаемой в виде EC50, равной 50 нМ или менее, например, равной 48 нМ, 45 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,1 нМ или менее, при измерении, например, с помощью FACS.
E93. Антитела или их антигенсвязывающие фрагменты по любому из E1-E92, причем антитела или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином человека, выражаемой в виде EC50, составляющей примерно 0,66 нМ при измерении, например, с помощью FACS.
E94. Антитела или их антигенсвязывающие фрагменты по любому из E1-E93, причем антитела или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином яванского макака, выражаемой в виде EC50, равной 50 нМ или менее, например, равной 48 нМ, 45 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,1 нМ или менее, при измерении, например, с помощью FACS.
E95. Антитела или их антигенсвязывающие фрагменты по любому из E1-E94, причем антитела или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином человека, выражаемой в виде EC50, равной 350 нМ или более, например, равной 400 нМ, 450 нМ, 500 нМ, 550 нМ, 600 нМ, 650 нМ или более при измерении, например, с помощью FACS.
E96. Антитела или их антигенсвязывающие фрагменты по любому из E1-E95, причем антитела или их антигенсвязывающие фрагменты слабо связываются или не связываются с растворимым E-селектином крысы, мыши или кролика, или с растворимым L- или P-селектином человека.
E97. Антитела или их антигенсвязывающие фрагменты по любому из E1-E96, причем антитела или их антигенсвязывающие фрагменты слабо связываются или не связываются с экспрессируемым на клеточной поверхности P-селектином человека.
E98. Антитела или их антигенсвязывающие фрагменты по любому из E1-E97, причем антитела или их антигенсвязывающие фрагменты не связываются с E-селектином крысы, мыши или кролика, или с растворимым L- или P-селектином человека до 405 нМ при измерении, например, с помощью SPR.
E99. Антитела или их антигенсвязывающие фрагменты по любому из E1-E98, причем антитела или их антигенсвязывающие фрагменты демонстрируют слабое ненасыщаемое связывание с растворимым E-селектином мыши или крысы примерно в >100 раз ниже связывания с E-селектином крысы или человека при измерении, например, с помощью прямого связывания ELISA.
E100. Антитела или их антигенсвязывающие фрагменты по любому из E1-E99, причем антитела или их антигенсвязывающие фрагменты демонстрируют слабое ненасыщаемое связывание с растворимым E-селектином мыши или крысы до 133,3 нМ при измерении, например, с помощью прямого связывания ELISA.
E101. Антитела или их антигенсвязывающие фрагменты по любому из E1-E100, причем антитела или их антигенсвязывающие фрагменты связываются с растворимым E-селектином человека с EC50, равной 2 нМ или менее, например, равной 0,010 нМ, 0,015 нМ, 0,020 нМ, 0,025 нМ, 0,030 нМ, 0,035 нМ, 0,040 нМ, 0,045 нМ, 0,05 нМ, 0,055 нМ, 0,06 нМ, 0,065 нМ, 0,070 нМ, 0,075 нМ, 0,080 нМ, 0,085 нМ, 0,090 нМ, 0,10 нМ, 0,12 нМ, 0,15 нМ, 0,2 нМ, 0,5 нМ, 0,9 нМ, 0,95 нМ, 1,0 нМ 1,5 нМ, 18 нМ или 1,9 нМ или менее.
E102. Антитела или их антигенсвязывающие фрагменты по любому из E1-E101, причем антитела или их антигенсвязывающие фрагменты связываются с растворимым E-селектином человека с EC50 от примерно 0,085 нМ до примерно 0,12 нМ при измерении, например, с помощью прямого связывания ELISA.
E103. Антитела или их антигенсвязывающие фрагменты по любому из E1-E102, причем антитела или их антигенсвязывающие фрагменты связываются с растворимым E-селектином яванского макака с EC50, равной 1 нМ или менее, например, равной 0,010 нМ, 0,015 нМ, 0,020 нМ, 0,025 нМ, 0,030 нМ, 0,035 нМ, 0,040 нМ, 0,045 нМ, 0,05нМ, 0,055 нМ, 0,06 нМ, 0,065 нМ, 0,070 нМ, 0,075 нМ, 0,080 нМ, 0,085 нМ, 0,090 нМ, 0,10 нМ, 0,12 нМ, 0,15 нМ, 0,2 нМ, 0,5 нМ, 0,9 нМ или 0,95 нМ или менее.
E104. Антитела или их антигенсвязывающие фрагменты по любому из E1-E103, причем антитела или их антигенсвязывающие фрагменты связываются с растворимым E-селектином яванского макака с EC50 от 0,071 нМ до 0,093 нМ при измерении, например, с помощью прямого связывания ELISA.
E105. Антитела или их антигенсвязывающие фрагменты по любому из E1-E104, причем антитела или их антигенсвязывающие фрагменты связывают свободный растворимый E-селектин человека в сыворотке человека с IC50 от примерно 1 нМ до примерно 3 нМ и предпочтительно с IC50 примерно 1,2 нМ.
E106. Антитела или их антигенсвязывающие фрагменты по любому из E1-E105, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с IC50, равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, с помощью конкурентного ELISA в статических условиях.
E107. Антитела или их антигенсвязывающие фрагменты по любому из E1-E106, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с IC50 от примерно 2,87 нМ до примерно 3,01 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
E108. Антитела или их антигенсвязывающие фрагменты по любому из E1-107, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином яванского макака с IC50, равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, с помощью конкурентного ELISA в статических условиях.
E109. Антитела или их антигенсвязывающие фрагменты по любому из E1-E108, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином яванского макака с IC50 от примерно 2,39 нМ до примерно 2,91 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
E110. Антитела или их антигенсвязывающие фрагменты по любому из E1-E109, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином человека с IC50, равной 100 нМ или менее, например, равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, с помощью конкурентного ELISA в статических условиях.
E111. Антитела или их антигенсвязывающие фрагменты по любому из E1-E110, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 1,88 нМ до примерно 2,89 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
E112. Антитела или их антигенсвязывающие фрагменты по любому из E1-E111, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50, равной 100 нМ или менее, например, равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, с помощью конкурентного ELISA в статических условиях.
E113. Антитела или их антигенсвязывающие фрагменты по любому из E1-E112, причем антитела или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 от примерно 1,47 нМ до примерно 2,65 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
E114. Антитела или их антигенсвязывающие фрагменты по любому из E1-E113, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 , равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, в статических условиях.
E115. Антитела или их антигенсвязывающие фрагменты по любому из E1-E114, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 3,36 нМ до примерно 4,7 нМ при измерении, например, в статических условиях.
E116. Антитела или их антигенсвязывающие фрагменты согласно E1-E115, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 примерно 3,84 нМ при измерении, например, в статических условиях.
E117. Антитела или их антигенсвязывающие фрагменты по любому из E1-E116, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 , равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ или 2 нМ, или менее, при измерении, например, в условиях физиологического потока.
E118. Антитела или их антигенсвязывающие фрагменты по любому из E1-E117, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 4,25 нМ до примерно 4,56 нМ при измерении, например, в условиях физиологического потока.
E119. Антитела или их антигенсвязывающие фрагменты по любому из E1-E118, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 от примерно 4,32 нМ до примерно 4,35 нМ при измерении, например, в условиях физиологического потока.
E120. Антитела или их антигенсвязывающие фрагменты по любому из E1-E119, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с растворимым E-селектином человека с IC50 , равной 300 нМ или менее, например, равной 290 нМ, 280 нМ, 270 нМ, 260 нМ, 250 нМ, 150 нМ, 100 нМ, 90 нМ, 100 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 20 нМ, 5 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, в условиях физиологического потока.
E121. Антитела или их антигенсвязывающие фрагменты по любому из E1-E120, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с растворимым E-селектином человека с IC50 от примерно 13,28 нМ до примерно 15,94 нМ при измерении, например, в условиях физиологического потока.
E122. Антитела или их антигенсвязывающие фрагменты по любому из E1-E121, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию активированных нейтрофилов человека (например, активированных TNF-α) с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 от примерно 9,45 нМ до примерно 16,33 нМ при измерении, например, в условиях физиологического потока.
E123. Антитела или их антигенсвязывающие фрагменты по любому из E1-E122, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию активированных нейтрофилов человека (например, активированных TNF-α) с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 2,87 нМ до примерно 4,65 нМ при измерении, например, в условиях физиологического потока.
E124. Антитела или их антигенсвязывающие фрагменты по любому из E1-E123, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток крови пациентов с SCD с растворимым E-селектином человека с IC50 от примерно 6,17 нМ до примерно 18,66 нМ при измерении, например, в условиях физиологического потока.
E125. Антитела или их антигенсвязывающие фрагменты по любому из E1-E124, причем антитела или их антигенсвязывающие фрагменты ингибируют адгезию клеток крови пациентов с SCD с растворимым E-селектином человека с IC50 примерно 12,4 нМ при измерении, например, в условиях физиологического потока.
E126. Выделенные молекулы нуклеиновой кислоты, содержащие последовательность нуклеиновой кислоты, кодирующую антитело или его антигенсвязывающий фрагмент по любому из E1-E125.
E127. Выделенные молекулы нуклеиновой кислоты, содержащие по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую антитело или его антигенсвязывающий фрагмент по любому из E1-E125.
E128. Выделенные молекулы нуклеиновой кислоты, кодирующие VL, VH или обе, антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин человека, причем указанная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты SEQ ID NO: 136, последовательность нуклеиновой кислоты SEQ ID NO: 137 или обе.
E129. Выделенные молекулы нуклеиновой кислоты, содержащие или состоящие из последовательности нуклеиновой кислоты SEQ ID NO: 136, последовательности нуклеиновой кислоты SEQ ID NO: 137 или обеих.
E130. Выделенные молекулы нуклеиновой кислоты, содержащие или состоящие из последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 136.
E131. Выделенные молекулы нуклеиновой кислоты, содержащие или состоящие из последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 137.
E132. Выделенные молекулы нуклеиновой кислоты, кодирующие VH антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин человека, содержащие по меньшей мере одну последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 136, 144, 146, 148, 150, 151, 152, 153, 155, 157, 159, 161, 163, 165, 167, 169, 171 и 173.
E133. Выделенные молекулы нуклеиновой кислоты, кодирующие VH антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин человека, содержащие нуклеиновую кислоту, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 136, 144, 146, 148, 150, 151, 152, 153, 155, 157, 159, 161, 163, 165, 167, 169, 171 и 173.
E134. Выделенные молекулы нуклеиновой кислоты, кодирующие VL антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин человека, содержащие по меньшей мере одну последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 137, 145, 147, 149, 154, 156, 158, 160, 162, 164, 166, 168, 170, 172 и 174.
E135. Выделенные молекулы нуклеиновой кислоты, кодирующие VL антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин человека, содержащие нуклеиновую кислоту, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 137, 145, 147, 149, 154, 156, 158, 160, 162, 164, 166, 168, 170, 172 и 174.
E136. Выделенные молекулы нуклеиновой кислоты, кодирующие легкую цепь, тяжелую цепь или обе цепи антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин человека, причем указанная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты SEQ ID NO: 206 или 138; последовательность нуклеиновой кислоты SEQ ID NO: 139; или обе.
E137. Выделенные молекулы нуклеиновой кислоты, содержащие последовательность нуклеиновой кислоты SEQ ID NO: 206 или 138; последовательность нуклеиновой кислоты SEQ ID NO: 139; или обе, или состоящие из них.
E138. Выделенные молекулы нуклеиновой кислоты, содержащие или состоящие из последовательности нуклеиновой кислоты SEQ ID NO: 206 или 138.
E139. Выделенные молекулы нуклеиновой кислоты, содержащие или состоящие из последовательности нуклеиновой кислоты SEQ ID NO: 139.
E140. Выделенные молекулы нуклеиновой кислоты, кодирующие антитела или их антигенсвязывающие фрагменты, которые специфически связывают E-селектин человека, причем указанная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529.
E141. Выделенные молекулы нуклеиновой кислоты, кодирующие антитела или их антигенсвязывающие фрагменты, которые специфически связывают E-селектин человека, причем указанная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
E142. Выделенные молекулы нуклеиновой кислоты, кодирующие антитела или их антигенсвязывающие фрагменты, которые специфически связывают E-селектин человека, причем указанная нуклеиновая кислота содержит последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529, и последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
E143. Выделенные молекулы нуклеиновой кислоты, содержащие последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529.
E144. Выделенные молекулы нуклеиновой кислоты, содержащие последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
E145. Выделенные молекулы нуклеиновой кислоты, содержащие последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529, и последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
E146. Вектор, содержащий молекулу нуклеиновой кислоты по любому из E126-E145.
E147. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по любому из E126-E145 или вектор согласно E146.
E148. Клетка-хозяин согласно E147, причем указанная клетка представляет собой клетку млекопитающего.
E149. Клетка-хозяин согласно E147 или E148, причем указанная клетка-хозяин представляет собой клетку CHO, клетку HEK-293, клетку NS0, клетку PER.C6® или клетку Sp2,0.
E150. Способ получения антител или их антигенсвязывающих фрагментов, предусматривающий культивирование клетки-хозяина по любому из E147-E149 в условиях, в которых указанные антитела или их антигенсвязывающие фрагменты экспрессируются указанной клеткой-хозяином.
E151. Способ согласно E150, кроме того, предусматривающий выделение указанных антител или их антигенсвязывающих фрагментов.
E152. Фармацевтическая композиция, содержащая антитела или их антигенсвязывающие фрагменты по любому из E1-E125 и E221 и фармацевтически приемлемый носитель или вспомогательное средство.
E153. Фармацевтическая композиция согласно E152, причем композиция содержит 1,12 мг/мл L-гистидина, 2,67 мг/мл гидрохлорида моногидрата L-гистидина, 85 мг/мл сахарозы, 0,05 мг/мл дигидрата динатрия эдетата, 0,2 мг/мл полисорбата 80 при pH 5,8.
E154. Фармацевтическая композиция согласно E152 или E153, причем композиция содержит 20 мМ гистидина, 8,5% сахарозу и 0,02% полисорбат 80, 0,005% EDTA при pH 5,8.
E155. Фармацевтическая композиция по любому из E152-E154, причем композиция содержит примерно 25 мг/мл, 50 мг/мл, 75 мг/мл, 100 мг/мл, 125 мг/мл, 150 мг/мл антител или их антигенсвязывающих фрагментов.
E156. Фармацевтическая композиция согласно E155, причем композиция содержит примерно 100 мг/мл антител или их антигенсвязывающих фрагментов.
E157. Фармацевтическая композиция по любому из E152-E156, причем доза представляет собой дозу 1 мл.
E158. Фармацевтическая композиция согласно E152-E157, причем композиция подходит для SC и/или IV введения.
E159. Фармацевтическая композиция по любому из E152-E158, содержащая антитела или их антигенсвязывающие фрагменты, содержащие i) последовательности HCDR-1, HCDR-2 и HCDR-3 SEQ ID NO: 11 и последовательности LCDR-1, LCDR-2 и LCDR-3 SEQ ID NO: 5; ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 5; или iii) HC, содержащую аминокислотную последовательность SEQ ID NO: 7 или 13, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1.
E160. Фармацевтическая композиция по любому из E152-E159, содержащая дополнительное терапевтически активное соединение, выбранное из группы, состоящей из L-глутамина (например ENDARI), антител против P-селектина (например кризанлизумаба (ADAKVEO)), соединения, которое модулирует HbS, так чтобы сохранять его в R-состоянии (то есть окисленным), например 2-аминохинолина и соединений, описанных в WO 2020/109994 (включенной в настоящий документ посредством ссылки), соединения, которое модулирует аффинность HbS к кислороду (например вокселотора (OXBRYTA)), соединения, воздействующего на полимеризацию HbS путем модулирования образования 2,3-дисфосфоглицериновой кислоты, соединения, воздействующего на полимеризацию HbS, индуцируя экспрессию эмбрионального гемоглобина (например гидроксимочевины, например, DROXIA, HYDREA), соединения, воздействующего на дисфункциональную клеточную адгезию, сосудистую дисфункцию и/или воспаление (например ингибитора фосфодиэстеразы-9), соединения, повышающего уровни оксида азота в крови (например стимулятора растворимой гуанилатциклазы, например IW-1701, риоцигуата (ADEMPAS)), внутривенного IG, соединения, воздействующего на гиперкоагуляцию (например риоцигуата (ADEMPAS), апиксабана (ELIQUIS), ривароксабана (XARELTO)), соединения, которое блокирует связывание рецептора NMDA, (например мемантина (NAMENDA)) и их комбинации.
E161. Фармацевтическая композиция по любому из E152-E159, содержащая дополнительное терапевтически активное соединение, выбранное из группы, состоящей из пенициллина для профилактики для предотвращения пневмококковой инфекции, гидроксимочевины (например DROXIA, HYDREA), L-глутамина (например ENDARI), кризанлизумаба (ADAKVEO), вокселотора (OXBRYTA), апиксабана (ELIQUIS), ривароксабана (XARELTO), нестероидных противовоспалительных препаратов, анальгетика в целом, опиоидного анальгетика, IW-1701, риоцигуата (ADEMPAS), тикагрелора (BRILINTA), мемантина (NAMENDA) и их комбинации.
E162. Способ снижения или ингибирования активности E-селектина, предусматривающий введение нуждающемуся в этом субъекту терапевтически эффективного количества антител или их антигенсвязывающих фрагментов по любому из E1-E125, E221 или фармацевтической композиции по любому из E152-E161, и сравнение активности E-селектина перед введением с уровнем активности E-селектина после введения антител, снижая за счет этого активность E-селектина.
E163. Способ согласно E162, в котором снижение или ингибирование активности E-селектина лечит заболевание, нарушение или состояние, которое улучшают, купируют, ингибируют или предотвращают за счет удаления, ингибирования или уменьшения активности E-селектина.
E164. Способ по любому из E162-E163, причем активность E-селектина выбирают из группы, состоящей из:
(a) связывания лейкоцитов с эндотелиальными клетками;
(b) активации стабильной адгезии с эндотелиальными клетками;
(c) медленного движения лейкоцитов до блокировки;
(d) эффективной трансэндотелиальной миграции лейкоцитов;
(e) аффинности и авидности интегринов CD18;
(f) переноса лейкоцитов в очаги острого воспаления;
(g) повышения цитозольного кальция;
(h) повышения фосфорилирования тирозина, которое активирует киназу p38 MAP и киназу Syk;
(i) рекрутирования тромбоцитов и лейкоцитов из крови в эндотелий сосудов; и
(j) создания провоспалительной среды.
E165. Способ снижения уровня свободного E-селектина у нуждающегося в этом субъекта, причем способ предусматривает введение субъекту терапевтически эффективного количества антител или их антигенсвязывающих фрагментов по любому из E1-E125 или фармацевтической композиции по любому из E152-E161.
E166. Способ лечения и/или профилактики заболевания, нарушения и/или состояния, связанного или опосредованного экспрессией E-селектина и/или связыванием E-селектина с лигандом, предусматривающий введение нуждающемуся в этом субъекту терапевтически эффективного количества антител или их антигенсвязывающих фрагментов по любому из E1-E125 или фармацевтической композиции по любому из E152-E161.
E167. Способ согласно E166, в котором по меньшей мере одно заболевание, нарушение и/или состояние выбирают из группы, состоящей из SCD, вазоокклюзивного криза (VOC), боли, инфаркта органа, ишемии, инсульта, дисфункции органа-мишени, острого грудного синдрома и окклюзии сосудов, кожных заболеваний (например, псориаза), воспалительных заболеваний (например ревматоидного артрита) и осложнений диабета.
E168. Способ по любому из E167, в котором VOC связан с SCD.
E169. Способ по любому из E166-E168, предусматривающий профилактическое лечение SCD путем профилактики или снижения частоты VOC.
E170. Способ по любому из E167-E169, предусматривающий интенсивное лечение SCD путем уменьшения продолжительности (например, уменьшения времени устранения VOC) и интенсивности VOC.
E171. Способ по любому из E166-E170, в котором лечение представляет собой профилактическое лечение.
E172. Способ по любому из E166-E171, который лечит, предотвращает и/или улучшает по меньшей мере один признак и/или симптом SCD, например признаки и/или симптомы, влияющие на кардиоторакальную систему (такие как хроническое рестриктивное заболевание легких, диастолическое заболевание левого желудочка, легочная гипертензия, острый грудной синдром, аритмия, внезапная смерть, вазоокклюзивный криз), на нервную систему (такие как геморрагический инсульт, тромбоз венозных синусов, бессимптомный церебральный инфаркт головного мозга, хроническая боль, острый ишемический инсульт головного мозга, пролиферативная ретинопатия, орбитальный инфаркт, когнитивные нарушения), на ретикулоэндотелиальную систему (такие как секвестрация селезенки, функциональный гипоспленизм, анемия, гемолиз), на костно-мышечную систему (такие как аваскулярный некроз, изъязвления кожи), на мочеполовую систему (такие как папиллярный некроз, протеинурия, почечная недостаточность, гематурия, ночной энурез, приапизм) и на желудочно-кишечный тракт (такие как желчнокаменная болезнь, холангиопатия, гепатопатия, окклюзия мезентериальных сосудов).
E173. Способ по любому из E166-E172, в котором субъектом является человек.
E174. Способ по любому из E166-E173, в котором субъектом является пациент с SCD.
E175. Способ по любому из E166-E174, в котором субъект имеет вариант генотипа HBSS, HBSC, HBS/βthal, HBS/β+thal или HBS.
E176. Способ по любому из E166-E175, в котором антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят подкожно.
E177. Способ по любому из E166-E176, в котором антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят внутривенно.
E178. Способ по любому из E166-E177, в котором антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят примерно два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель, один раз каждые восемь недель, один раз каждые девять недель, один раз каждые десять недель, два раза в месяц, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз каждые семь месяцев, один раз каждые восемь месяцев, один раз каждые девять месяцев, один раз каждые десять месяцев, один раз каждые одиннадцать месяцев или один раз каждые двенадцать месяцев.
E179. Способ по любому из E166-E177, в котором антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят один раз в месяц.
E180. Способ по любому из E166-E179, в котором антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят один раз в неделю.
E181. Способ по любому из E66-E180, в котором терапевтически эффективное количество включает в себя дозу от примерно 1 мг до примерно 800 мг антител против E-селектина или их антигенсвязывающих фрагментов.
E182. Способ согласно E181, в котором дозой является начальная фиксированная доза.
E183. Способ по любому из E181-E182, в котором доза составляет от примерно 1 мг до примерно 10 мг, от примерно 10 мг до примерно 20 мг, от примерно 20 мг до примерно 30 мг, от примерно 30 мг до примерно 40 мг, от примерно 40 мг до примерно 50 мг, от примерно 50 мг до примерно 60 мг, от примерно 60 мг до примерно 70 мг, от примерно 70 мг до примерно 80 мг, от примерно 80 мг до примерно 90 мг, от примерно 90 мг до примерно 100 мг, от примерно 100 мг до примерно 150 мг, от примерно 150 мг до примерно 200 мг, от примерно 200 мг до примерно 300 мг, от примерно 300 мг до примерно 400 мг, от примерно 400 мг до примерно 500 мг, от примерно 500 мг до примерно 600 мг, от примерно 600 мг до примерно 700 мг или примерно 700 мг до примерно 800 мг антител против E-селектина или их антигенсвязывающих фрагментов.
E184. Способ по любому из E181-E183, в котором доза составляет примерно 15 мг, 40 мг, 100 мг, 150 мг, 300 мг, 500 мг или 600 мг антител против E-селектина или их антигенсвязывающих фрагментов.
E185. Способ по любому из E181-E184, в котором доза составляет примерно 150 мг антител против E-селектина или их антигенсвязывающих фрагментов.
E186. Способ по любому из E81-E185, предусматривающий введение дозы один раз в неделю, один раз каждые 2 недели, один раз в месяц, один раз каждые два месяца или в виде комбинации этого.
E187. Способ по любому из E162-E186, в котором антитела представляют собой антитела 1444, а антигенсвязывающий фрагмент представляет собой фрагмент антитела 1444.
E188. Способ по любому из E162-E187, в котором введение представляет собой подкожное или внутривенное введение.
E189. Способ по любому из E162-E188, предусматривающий введение антител или их антигенсвязывающих фрагментов, содержащих i) последовательности HCDR-1, HCDR-2 и HCDR-3 SEQ ID NO: 11 и последовательности LCDR-1, LCDR-2 и LCDR-3 SEQ ID NO: 5; ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 5; или iii) HC, содержащую аминокислотную последовательность SEQ ID NO: 7 или 13, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1.
E190. Способ по любому из E162-E188, предусматривающий введение фармацевтической композиции, содержащей антитела или их антигенсвязывающие фрагменты, содержащие i) последовательности HCDR-1, HCDR-2 и HCDR-3 SEQ ID NO: 11 и последовательности LCDR-1, LCDR-2 и LCDR-3 SEQ ID NO: 5; ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 5; или iii) HC, содержащую аминокислотную последовательность SEQ ID NO: 7 или 13, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1.
E191. Способ по любому из E162-E190, в котором субъектом является пациент с SCD.
E192. Способ лечения SCD, предусматривающий введение нуждающемуся в этом субъекту терапевтически эффективного количества антител против E-селектина или их антигенсвязывающих фрагментов, содержащих i) последовательности HCDR-1, HCDR-2 и HCDR-3 SEQ ID NO: 11 и последовательности LCDR-1, LCDR-2 и LCDR-3 SEQ ID NO: 5; ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 11, и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 5; или iii) HC, содержащую аминокислотную последовательность SEQ ID NO: 7 или 13, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1, и фармацевтически приемлемый носитель или вспомогательное средство.
E193. Способ согласно E192, в котором лечение SCD включает в себя лечение по меньшей мере одного симптома SCD, включая VOC.
E194. Способ по любому из E192-E193, в котором субъектом является пациент с SCD.
E195. Способ по любому из E192-E194, предусматривающий введение антител или их антигенсвязывающих фрагментов подкожно и/или внутривенно.
E196. Способ по любому из E192-E195, в котором указанные антитела или их антигенсвязывающие фрагменты вводят примерно два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель, один раз каждые восемь недель, один раз каждые девять недель, один раз каждые десять недель, два раза в месяц, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз каждые семь месяцев, один раз каждые восемь месяцев, один раз каждые девять месяцев, один раз каждые десять месяцев, один раз каждые одиннадцать месяцев или один раз каждые двенадцать месяцев.
E197. Способ по любому из E192-E196, в котором антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят один раз в неделю, один раз каждые 2 недели, один раз каждые 3 недели, один раз в месяц или в виде комбинации этого.
E198. Способ по любому из E192-E197, в котором антитела или их антигенсвязывающие фрагменты вводят в дозе от от примерно 1 мг до примерно 800 мг.
E199. Способ по любому из E192-198, в котором указанные антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию вводят в дозе, выбранной из группы, состоящей из примерно 15 мг, примерно 40 мг, примерно 100 мг, примерно 150 мг, примерно 300 мг, примерно 500 мг и примерно 600 мг.
E200. Способ по любому из E192-E199, в котором антитела или их антигенсвязывающие фрагменты вводят в комбинации с терапевтически эффективным количеством одного или нескольких дополнительных терапевтически активных соединений или средств лечения, эффективных при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD.
E201. Способ по любому из E192-E200, в котором количество антител против E-селектина или их антигенсвязывающих фрагментов и количество терапевтически активного соединения или средства лечения, эффективного при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, вводят в количествах, которые вместе обеспечивают синергетический эффект при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD.
E202. Способ по любому из E192-E201, в котором количество антител против E-селектина или их антигенсвязывающих фрагментов и/или количество терапевтически активного соединения или средства лечения, эффективного при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, каждое вводят в дозе ниже, чем была бы при введении не в комбинации.
E203. Способ по любому из E192-E202, в котором дополнительное терапевтически активное соединение выбирают из группы, состоящей из пенициллина для профилактики для предотвращения пневмококковой инфекции, гидроксимочевины (например DROXIA, HYDREA), L-глутамина (например ENDARI), кризанлизумаба (ADAKVEO), вокселотора (OXBRYTA), апиксабана (ELIQUIS), ривароксабана (XARELTO), нестероидных противовоспалительных препаратов, анальгетика в целом, опиоидного анальгетика, IW-1701, риоцигуата (ADEMPAS), тикагрелора (BRILINTA), мемантина (NAMENDA) и их комбинации.
E204. Способ по любому из E192-E203, в котором дополнительное терапевтически активное соединение выбирают из группы, состоящей из L-глутамина (например ENDARI), антител против P-селектина (например кризанлизумаба (ADAKVEO)), соединения, которое модулирует HbS, так чтобы сохранять его в R-состоянии (то есть окисленным), например 2-аминохинолина и соединений, описанных в WO 2020/109994 (включенной в настоящий документ посредством ссылки), соединения, которое модулирует аффинность HbS к кислороду (например вокселотора (OXBRYTA)), соединения, воздействующего на полимеризацию HbS путем модулирования образования 2,3-дисфосфоглицериновой кислоты, соединения, воздействующего на полимеризацию HbS, индуцируя экспрессию эмбрионального гемоглобина (HbF) (например гидроксимочевины, например, DROXIA, HYDREA), соединения, воздействующего на дисфункциональную клеточную адгезию, сосудистую дисфункцию и/или воспаление (например ингибиторов фосфодиэстеразы-9), соединения, повышающего уровни оксида азота в крови (например стимуляторов растворимой гуанилатциклазы, например IW-1701, риоцигуата (ADEMPAS)), внутривенного IG, соединения, воздействующего на гиперкоагуляцию (например риоцигуата (ADEMPAS), апиксабана (ELIQUIS), ривароксабана (XARELTO)), соединения, которое блокирует связывание рецептора NMDA, (например мемантина (NAMENDA)) и их комбинации.
E205. Способ по любому из E192-204, в котором терапевтически активное средство лечения, используемое для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, выбирают из группы, состоящей из кислородной терапии, переливания крови необязательно с хелатированием железа, трансплантации костного мозга, генной терапии (например LentiGlobin®), терапии путем редактирования генов с помощью CRISPR (например CTX001) или метода цинковых пальцев и их комбинации.
E206. Способ по любому из E200-E205, в котором антитела против E-селектина или их антигенсвязывающие фрагменты и терапевтически активное соединение или средство лечения, эффективное при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, вводят совместно.
E207. Способ по любому из E200-E206, в котором комбинированные препараты вводят по одинаковой схеме введения препарата (например, оба препарата вводят ежесуточно) или по разным схемам введения препаратов (например, один препарат вводят ежесуточно, другой препарат вводят еженедельно).
E208. Способ по любому из E200-E207, в котором комбинированные препараты вводят субъекту одним и тем же или разными путями введения.
E209. Применение фармацевтической композиции по любому из E152-E161 для изготовления лекарственного средства для лечения заболевания, нарушения или состояния, опосредованного E-селектином (например, SCD).
E210. Применение антител или их антигенсвязывающих фрагментов по любому из E1-E125 или E221 для изготовления лекарственного средства для лечения и/или профилактики заболевания, нарушения или состояния, связанного или опосредованного экспрессией E-селектина и/или связыванием E-селектина с лигандом.
E211. Применение фармацевтической композиции по любому из E152-E161 для изготовления лекарственного средства для лечения и/или профилактики заболевания, нарушения или состояния, связанного или опосредованного экспрессией E-селектина и/или связыванием E-селектина с лигандом.
E212. Антитела или их антигенсвязывающие фрагменты по любому из E1-E125 или E221 или фармацевтическая композиция согласно E152-E161 для применения в качестве лекарственного средства.
E213. Антитела или их антигенсвязывающие фрагменты по любому из E1-E125 или E221 или фармацевтическая композиция по любому из E152-E161 для применения при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD.
E214. Антитела или их антигенсвязывающие фрагменты, или фармацевтическая композиция для применения согласно E213, причем симптом SCD является VOC.
E215. Антитела или их антигенсвязывающие фрагменты, или фармацевтическая композиция для применения по любому из E213-214, причем лечение и/или профилактика дополнительно предусматривает дополнительное терапевтическое средство, например, без ограничения по меньшей мере еще одно терапевтически активное соединение или средство лечения, эффективное при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD.
E216. Антитела или их антигенсвязывающие фрагменты, или фармацевтическая композиция для применения согласно E215, причем дополнительное терапевтическое средство представляет собой средство, являющееся стандартным средством для профилактики и/или лечения по меньшей мере одного признака и/или симптома SCD (например, L-глутамин, гидроксимочевину, переливание крови и любой другой препарат, известный в данной области).
E217. Антитела или их антигенсвязывающие фрагменты, или фармацевтическая композиция для применения согласно E215-216, причем лечение и/или профилактика включает в себя i) синергетическое, терапевтически эффективное количество антител против E-селектина или их антигенсвязывающих фрагментов и ii) синергетическое, терапевтически эффективное количество дополнительного терапевтического средства.
E218. Антитела или их антигенсвязывающие фрагменты, или фармацевтическая композиция для применения согласно E215 или E216, причем лечение и/или профилактика включает в себя i) синергетическое, терапевтически эффективное количество антител против E-селектина или их антигенсвязывающих фрагментов и ii) синергетическое, терапевтически эффективное количество средства лечения.
E219. Фармацевтическая композиция по любому из E152-E161, причем подходящее количество каждого соединения, используемого в комбинации для введения пациенту с SCD, определяют с учетом по меньшей мере одного фактора, выбранного из группы, состоящей из возраста, веса, общего состояния здоровья, вводимого соединения, пути введения, характера и успеха лечения SCD и наличия других препаратов.
E220. Фармацевтическая композиция по любому из E152-E161, составленная для применения в качестве лекарственного средства для лечения заболевания, нарушения или состояния, опосредованного E-селектином (например, SCD).
E221. Выделенные моноклональные антитела, которые специфически связывают E-селектин, причем антитела представляют собой антитела 0039, 0164, 0158, 0159, 0170, 0180, 0841, 1282 1284, 1444 или 1448.
Краткое описание чертежей
[017] На фиг. 1 представлена иллюстративная кристаллическая структура Fab-антител 0164 против E-селектина, сокристаллизованных с усеченным E-селектином человека. E-селектин показан в виде серой поверхности (молекула справа Fab). 0164 (молекула слева) показан в виде лент со светло серыми VL и темно серыми VH.
[018] На фиг. 2 представлены иллюстративные данные трехчастного масс-спектроскопического анализа оптимизированного антитела 0841 против E-селектина в 0 момент времени (T0) и после хранения при 40°C в течение 4 недель в Tris буфере (TrisT4), гистидиновом буфере (HisT4) или буфере глутаминовой кислоты (Glu4).
[019] На фиг. 3 представлен иллюстративный конкурентный анализ ELISA антитела 841 (также известного как 0841) после принудительного разложения. Антитела 841 анализировали в 0 момент времени (0wk) и после инкубации в Tris, His или Glu буфере в течение 2 недель (2wk) или 4 недель (4wk) при 40°C.
[020] На фиг. 4 представлены прогнозируемые T-клеточные эпитопы не зародышевой линии для областей VH и VL гуманизированных антител 0841. Аминокислотные остатки, прогнозируемые Epivax/ISPRI или IEDB, охватывающие Т-клеточные эпитопы, не обнаруженные в зародышевых линиях человека, подчеркнуты.
[021] На фиг. 5 представлена иллюстративная нейтрализация адгезии лиганда сиалил-Льюис A с клетками яичника китайского хомячка (СНО), экспрессирующими E-селектин человека. Тестируемые антитела включали антитела 164, 1282,1284, 1444 и 1448 против E-селектина (также известные как 0164) и изотипический контроль IgG.
[022] На фиг. 6 представлена иллюстративная нейтрализация адгезии лиганда сиалил-Льюис X с клетками CHO, экспрессирующими E-селектин яванского макака. Тестируемые антитела включали антитела 164, 1282, 1284, 1444, 1448 против E-селектина (также известные как 0164) и изотипический контроль IgG.
[023] На фиг. 7 представлена иллюстративная нейтрализация адгезии клеток HL-60 с клетками CHO, экспрессирующими E-селектин человека, антителами 1282, 1284, 1444, 1448 и 164 (также известными как 0164).
[024] На фиг. 8 представлены иллюстративные данные трехкомпонентного масс-спектроскопического анализа оптимизированного антитела 1444 против E-селектина в 0 момент времени (верхняя панель) и после хранения при 40°C в течение 4 недель в Tris, His или Glu буфере.
[025] На фиг. 9A-9D представлен иллюстративный конкурентный анализ ELISA антител 1282 (фиг. 9A), 1284 (фиг. 9B), 1444 (фиг. 9C) и 1448 (фиг. 9D) после принудительного разложения. Антитела были анализировали на момент 1 (T0) и после инкубации в Tris, His или Glu буфере в течение 2 недель (T2) или 4 недели (T4) при 40°C.
[026] На фиг. 10A-10D представлен анализ aSEC образцов оптимизированных антител против E-селектина высокой концентрации. Антитела при концентрации 150 мг/мл анализировали в 0 момент времени (0) и после хранения при 4°C или 25°C в буфере Tris/Suc, His/Suc или Glu/Tre в течение 1, 2, 4, 6 и 7 недель. Количественно определяли процентную долю высокомолекулярных соединений (% HMMS). На фиг. 10A представлены результаты для антитела 1282; на фиг. 10B представлены результаты для антитела 1284; на фиг. 10C представлены результаты для антитела 1444; на фиг. 10D представлены результаты для антитела 1448.
[027] На фиг. 11 представлены иллюстративные кривые вязкости оптимизированных антител против E-селектина. Вязкость оптимизированных антител 1282, 1284, 1444 и 1448 измеряли с применением способа на основе шариков DLS. Для каждой из них предусмотрены дополнительные отдельные точки данных с использованием метода конуса и пластины Anton Paa.
[028] На фиг. 12 представлен иллюстративный анализ SPR связывания оптимизированных антител 1444 с E-селектином человека (rhE-Селектином), гомологами P-селектина и L-селектина и видовыми гомологами кролика, крысы, мыши (muE-Селектин) и яванского макака (rcyE-Селектин).
[029] На фиг. 13 представлено иллюстративное связывание антител против E-селектина (0841, 1282, 1284, 1444 и 1448) с иммобилизованным L-селектином человека и P-селектином человека. Контрольные антитела против L-селектина и контрольные антитела против P-селектина связывали L-селектин человека и P-селектин человека, соответственно.
[030] На фиг. 14 представлена иллюстративная нейтрализация адгезии клеток пациента с SCD (донор 11253 и донор 22358) с рекомбинантным E-селектином в физиологическом потоке.
Подробное описание
[031] В настоящем раскрытии представлены антитела и их антигенсвязывающие фрагменты, которые специфически связываются с E-селектином и уменьшают или ингибируют активность E-селектина, включая без ограничения способность E-селектина взаимодействовать (например связываться) с лигандами, содержащими углеводные структуры с детерминантой сиалил-Льюис (sLex) на гликопротеинах или гликолипидах. В раскрытии также представлены способы создания, получения или выработки антител против E-селектина. Антитела согласно раскрытию используют для диагностики, профилактики и/или лечения заболеваний или состояний, опосредованных или связанных с активностью E-селектина (например связыванием), включая без ограничения SCD, вазоокклюзивный криз, боль, инфаркт органа, ишемию, инсульт и окклюзию сосудов. Раскрытие дополнительно охватывает экспрессию антител и получение и изготовление композиций, содержащих антитела согласно раскрытию или их антигенсвязывающие фрагменты, например лекарственные средства для применения антител.
[032] Представлены полинуклеотиды, кодирующие антитела, которые связывают E-селектин, или их антигенсвязывающие фрагменты. Также представлены полинуклеотиды, кодирующие тяжелые цепи или легкие цепи антител, или и те и другие. Представлены клетки-хозяева, которые экспрессируют антитела против E-селектина. Представлены способы лечения с использованием антител против E-селектина. Такие способы включают без ограничения способы лечения и/или профилактики заболеваний, связанных или опосредованных экспрессией E-селектина и/или связыванием E-селектина с лигандами sLex, включая без ограничения SCD, вазоокклюзивный криз, боль, инфаркт органа, ишемию, инсульт, дисфункцию органа-мишени, острый грудной синдром и окклюзию сосудов.
[033] Не желая связывать себя никакой конкретной теорией, семейство селектинов из молекул адгезии (например, E-селектин) и их лиганды играют критическую роль в регуляции первоначального контакта межклеточной адгезии, движения лейкоцитов по эндотелию, активации интегрина и трансмиграции клеток, все это часть провоспалительного ответа при SCD, который клинически проявляется в виде эпизодов сильной боли или вазоокклюзивного криза (включая, например, окклюзию сосудов, инфаркт органа и ишемию). Таким образом, антитела и их антигенсвязывающие фрагменты согласно раскрытию обеспечивают избирательный антагонизм в отношении активности и связывания Е-селектина в сосудистой системе, снижая за счет этого окклюзию сосудов у субъекта. В некоторых вариантах осуществления, раскрытых в примерах в настоящем документе, было показано, что антитела и их антигенсвязывающие фрагменты против E-селектина ингибируют, нейтрализуют или уменьшают связывание E-селектина с его лигандами, когда E-селектин находится в растворе или экспрессируется на клетках (например клетках яичника китайского хомячка (СНО), нейтрофилах и/или клетках крови пациентов с SCD), а его лиганд (лиганды) находятся в растворе или экспрессируются на клетках (например клетках HL-60, эндотелиальных клетках пупочной вены человека (HUVEC), эндотелиальные клетки микрососудов легких яванского макака (CLMEC)).
[034] Антитела против E-селектина или их антигенсвязывающие фрагменты, включая гуманизированные антитела, можно использовать отдельно или в сочетании со второй терапией для профилактики, лечения и/или улучшения по меньшей мере одного признака и/или симптома SCD, включая вазоокклюзивный криз, боль, инфаркт органа, ишемию, инсульт и окклюзию сосудов.
[035] Используемые в данном документе заголовки разделов предназначены только для организационных целей и не должны толковаться как ограничивающие описываемый предмет.
[036] Все ссылки, указанные в настоящем документе, включая патентные заявки, патентные публикации, регистрационные номера UniProtKB, включены в настоящий документ посредством ссылки, как если бы было конкретно и отдельно указано, что каждая ссылка полностью включена посредством ссылки.
[037] Методов и процедуры, описанные или упомянутые в настоящем документе, как правило, хорошо понятны и широко используются специалистами в данной области с использованием традиционной методологии, например, широко используемые методы, описанные в Sambrook et al, Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F.M. Ausubel, et al. eds., (2003)); the series METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH (M.J. MacPherson, B.D. Hames and G.R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL, and ANIMAL CELL CULTURE (R.I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al, eds., 1994); Current Protocols in Immunology (J.E. Coligan et al, eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999)); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995); и в их обновленных версиях.
[038] Настоящее раскрытие можно более легко понять посредством ссылки на следующее подробное описание иллюстративных вариантов осуществления изобретения и включенные в него примеры.
[039] Когда аспекты или варианты осуществления изобретения описаны в терминах группы Маркуша или другой группы альтернатив, настоящее изобретение охватывает не только всю группу, перечисленную целиком, но каждый член группы в отдельности и все возможные подгруппы основной группы, но также основную группу с отсутствующими одним или несколькими членами группы. Настоящее изобретение также предусматривает явное исключение в заявленном изобретении одного или нескольких любых членов группы.
Определения
[040] Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то значение, которое в целом понятно рядовому специалисту в области, к которой относится это изобретение. В случае конфликта, настоящее описание, включая определения, будет иметь преимущественную силу.
[041] Кроме того, если иное не требуется по контексту или прямо не указано, термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число.
[042] Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объем изобретения, являются приблизительными, числовые значения, указанные в конкретных примерах, представлены максимально точно. Однако любое числовое значение по своей сути содержит определенные ошибки, обязательно возникающие из-за стандартного отклонения, обнаруженного в соответствующих тестовых измерениях. Кроме того, следует понимать, что все раскрытые в настоящем документе диапазоны охватывают любые и все включенные в него поддиапазоны. Например, заявленный диапазон «от 1 до 10» следует рассматривать как включающий любые и все поддиапазоны между (и включительно) минимальным значением 1 и максимальным значением 10; то есть все поддиапазоны, начинающиеся с минимального значения 1 или более, например, от 1 до 6,1 и заканчивая максимальным значением 10 или менее, например, от 5,5 до 10.
[043] В рамках настоящего изобретения, если не указано иное, форма единственного числа включает ссылки во множественном числе.
[044] В рамках настоящего изобретения термин «и/или» относятся и охватывает любые и все возможные комбинации одного или нескольких связанных перечисленных элементов, а также отсутствие комбинаций при интерпретации в альтернативе «или».
[045] В рамках настоящего изобретения термин «примерно» или «приблизительно» относится к измеряемому значению, такому как величина биологической активности, длина последовательности полинуклеотида или полипептида, содержание нуклеотидов G и C, индекс адаптации кодонов, количество динуклеотидов CpG, доза, время, температура и тому подобное, и означает охват отклонений 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% 1%, 0,5% или даже 0,1% в любом направлении (больше или меньше) от указанного количества, если не утверждается иное, иное не очевидно из контекста или за исключением случаев, когда такие количество будет превышать 100% возможного значения.
[046] В рамках настоящего изобретения термин «улучшать» означает поддающееся обнаружению или измеримое улучшение у субъекта заболевания, нарушения или состояния (например SCD), или его симптома (например вазоокклюзивного криза) или лежащего в его основе клеточного ответа. Поддающееся обнаружению или измеримое улучшение включает в себя субъективное или объективное снижение, уменьшение, ингибирование, подавление, ограничение или контроль возникновения, частоты, тяжести, прогрессирования или продолжительности осложнения, вызванного или связанного с улучшением симптома или купирования заболевания, нарушения или состояния.
[047] В рамках настоящего изобретения «еще один» может означать по меньшей мере второй или более. Если в настоящем документе не указано иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые в общем понятны рядовым специалистам в данной области. Кроме того, если из контекста не требуется иное, термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число.
[048] В рамках настоящего изобретения термин «связанный с» относится к связи элементов друг с другом, если наличие, уровень и/или форма одного коррелирует с наличием, уровнем и/или формой другого. Например, конкретный объект (например, полипептид, генетический признак, метаболит, микроорганизм и так далее) считается связанным с конкретным заболеванием, нарушением или состоянием, если его наличие, уровень и/или форма коррелирует с частотой и/или предрасположенностью к заболеванию, нарушению или состоянию (например в соответствующей популяции). В некоторых вариантах осуществления два или более объекта физически «связаны» друг с другом, если они прямо или косвенно взаимодействуют таким образом, что они находятся и/или остаются в физической близости друг с другом. В некоторых вариантах осуществления два или более объекта, физически связанных друг с другом, связаны друг с другом ковалентно; в некоторых вариантах осуществления два или более объекта, физически связанных друг с другом, не связаны друг с другом ковалентно, но связаны нековалентно, например, посредством водородных связей, взаимодействия Ван-дер-Вальса, гидрофобных взаимодействий, магнетизма и за счет их комбинации.
[049] В рамках настоящего изобретения термин «кодирующая последовательность» относится к последовательности, которая кодирует конкретный белок, или «кодирующая нуклеиновая кислота» обозначает последовательность нуклеиновой кислоты, которая транскрибируется (в случае ДНК) и транслируется (в случае мРНК) в полипептид in vitro или in vivo, при нахождении под управлением (функционально связанных) подходящих регуляторных последовательностей. границы кодирующей последовательности определяет стартовый кодон на 5' (амино) конце и терминирующий трансляцию кодон на 3' (карбокси) конце. Кодирующая последовательность может содержать без ограничения кДНК от прокариотической или эукариотической мРНК, последовательности геномной ДНК от прокариотической или эукариотической ДНК и даже последовательности синтетической ДНК.
[050] Во всем этом описании и формуле изобретения слово «содержат» или такие варианты, как «содержит» или «содержащий», и слова «имеющий/включающий» следует понимать как подразумевающие включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если из контекста не требуется иное, термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число. Любой пример (примеры) после термина «напр.» или «например» не является исчерпывающим или ограничивающим. Нужно понимать, что везде, где варианты осуществления в настоящем документе описаны с формулировкой «содержащий», также представлены иные аналогичные варианты осуществления, описанные в терминах «состоящий из» и/или «состоящий по существу из».
[051] В рамках настоящего изобретения термин «консервативная замена» относится к замене одной аминокислоты биологически, химически или структурно похожим остатком. Биологически похожий означает, что замена не нарушает биологическую активность. Структурно похожий означает, что аминокислоты имеют боковые цепи с аналогичной длиной, например аланин, глицин и серин, или с аналогичным размером. Химическое сходство означает, что остатки имеют одинаковый заряд или являются гидрофильными или гидрофобными. Конкретные примеры включают замену гидрофобного остатка, например изолейцина, валина, лейцина или метионина другим или замену одного полярного остатка другим, например замену аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин, серина на треонин и тому подобное. Конкретный примеры консервативных замен включают замену гидрофобного остатка, например изолейцина, валина, лейцина или метионина друг на друга, замену полярного остатка на другой, например замену аргинина на лизин, глутаминовой кислоты на аспарагиновую кислота или глутамина на аспарагин и тому подобное. Консервативные аминокислотные замены обычно включают, например, замены в пределах следующей группы: глицин, аланин, валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. «Консервативная замена» также включает в себя использование замещенной аминокислоты вместо незамещенной исходной аминокислоты.
[052] В рамках настоящего изобретения термин «последовательность контроля экспрессии» означает последовательность нуклеиновой кислоты, которая направляет транскрипцию нуклеиновой кислоты. Последовательностью контроля экспрессии может быть промотор, например конститутивный или индуцируемый промотор или энхансер. Последовательность контроля экспрессии функционально связана с транскрибируемой последовательностью нуклеиновой кислоты.
[053] В рамках настоящего изобретения термин «эффективная дозировка» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для воздействия на любой или несколько полезных или нужных результатов. В более конкретных аспектах эффективное количество предотвращает, облегчает и/или улучшает по меньшей мере один признак и/или симптом заболевания, например, SCD. Для профилактического применения полезные или нужные результаты включают устранение или снижение риска, уменьшение тяжести или отсрочку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, имеющиеся в процессе развитие заболевания. Для терапевтического применения полезные или нужные результаты включают клинические результаты, например, уменьшение по меньшей мере одного признака и/или симптома опосредованного E-селектином заболевания, нарушения или состояния, уменьшение дозы других препаратов, необходимых для лечения заболевания, усиление эффекта другого препарата и/или задержка прогрессирования заболевания пациентов. Эффективную дозу можно вводить за одно или несколько введений. Для целей этого изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения либо прямо, либо косвенно. Как понятно в клиническом контексте, эффективная доза лекарственного средства, соединения или фармацевтической композиции может быть достигнута или не достигнута в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективную дозу» можно рассматривать в контексте введения одного или нескольких терапевтических средств, и можно считать, что одно средство введено в эффективном количестве, если в сочетании с одним или более другими средствами может быть достигнут или достигнут нужный результат.
[054] В рамках настоящего изобретения термин «функциональный» относится к биологической молекуле в такой форме, в которой она проявляет свойство и/или активность, которая ее характеризует. Биологическая молекула может иметь две функции (то есть является бифункциональной) или множество функций (то есть является мультифункциональной).
[055] В рамках настоящего изобретения термин «характер гликозолирования» означает характер углеводных единиц, которые ковалентно присоединены к белку (например гликоформе), а также к участку (участкам), в котором гликоформа (гликоформы) ковалентно присоединены к пептидному каркасу белка, более конкретно к белку иммуноглобулина.
[056] В рамках настоящего изобретения термин «гомологичный» или «гомология» относится к двум или более эталонным объектам (например к нуклеотидным или полипептидным последовательностям), которые обладают по меньшей мере частичной идентичностью в заданной области или фрагменте. Например, когда положение аминокислоты в двух пептидах занято идентичными аминокислотами, пептиды являются гомологичными в этом положении. Примечательно, что гомологичный пептид будет сохранять активность или функцию, связанную с немодифицированным или эталонным пептидом, а модифицированный пептид будет в целом иметь аминокислотную последовательность, «по существу гомологичную» последовательности аминокислот из немодифицированной последовательность. Когда речь идет о полипептиде, нуклеиновой кислоте или фрагменте, «существенная гомология» или «существенное сходство» означает, что при оптимальном выравнивании соответствующих вставок или делеций с другим полипептидом, нуклеиновой кислотой (или ее комплементарной цепью) или ее фрагментом, идентичность последовательности составляет по меньшей мере примерно от 95% до 99% последовательности. Степень гомологии (идентичности) между двумя последовательностями можно установить с использованием компьютерной программы или математического алгоритма. Такие алгоритмы, которые рассчитывают процентную гомологию (или идентичность) последовательности, обычно учитывают пропуски в последовательностях и несоответствия в сравниваемой области или зоны. Иллюстративные программы и алгоритмы представлены ниже.
[057] В рамках настоящего изобретения термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» использованы взаимозаменяемо и означают отдельную клетку или культуру клеток, которые могут быть или были реципиентом вектора (векторов) для включения вставок полинуклеотидов. Клетки-хозяева включают «трансформанты», «трансформированные клетки» и «трансдуцированные клетки», которые включают первичную трансформированную или трансдуцированную клетку и полученное из нее потомство независимо от количества пассажей. Потомство клетки-хозяина не обязательно может быть полностью идентичным (по морфологии или комплементарности геномной ДНК) с исходной родительской клеткой из-за естественной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные и/или трансформированные in vivo полинуклеотидом согласно этому изобретению (например, полинуклеотидом, кодирующим аминокислотную последовательность антител против E-селектина).
[058] В рамках настоящего изобретения термин «идентичность» или «идентичный» относится к общему родству между полимерными молекулами, например, между молекулами нуклеиновой кислоты (например молекулами ДНК и/или молекулами РНК) и/или между молекулами полипептидов. «Идентичность» измеряет процентное значение идентичных совпадений между двумя или более последовательностями с выравниванием пропусков, учитываемых конкретной математической моделью компьютерных программ (то есть «алгоритмов»).
[059] В некоторых вариантах осуществления полимерные молекулы считаются «по существу идентичными» друг другу, если их последовательности идентичны по меньшей мере на 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%.
[060] Вычисление процентной идентичности, например, последовательностей двух нуклеиновых кислот или полипептидов можно проводить путем выравнивания двух последовательностей для целей оптимального сравнения (например, для оптимального выравнивания можно ввести пропуски в одну или обе из первой и второй последовательности, и неидентичные последовательности для целей сравнения можно не учитывать). В определенных вариантах осуществления длина последовательности, выровненный для целей сравнения, составляет по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или 100% длины эталонной последовательности. Затем сравнивают нуклеотиды в соответствующих положениях. Когда положение в первой последовательности занято тем же остатком (например, нуклеотидом или аминокислотой), что и соответствующее положение во второй последовательности, то молекулы в этом положении являются идентичными. Процентная идентичность между двумя последовательностями зависит от количества идентичных положений, общих для последовательностей, с учетом количества пропусков и длины каждого пропуска, который нужно ввести для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процентной идентичности между двумя последовательностями можно выполнять с применением математического алгоритма.
[061] Для определения процентной идентичности последовательности можно выравнивать с использованием способов и компьютерных программ, включая BLAST, доступных во всемирной сети по адресу ncbi.nlm.nih.gov/BLAST/. Другие программы выравнивания включают программу MegAlign® в пакете программного обеспечения для биоинформатики Lasergene® (DNASTAR®, world wide web). Другим алгоритмом выравнивания является программа FASTA, доступная в пакете Genetics Computing Group (GCG) из Madison, Wis., USA. Другие способы выравнивания описаны в Methods in Enzymology, vol. 266: Computer Methods for Macromolecular Sequence Analysis (1996), ed. Doolittle, Academic Press, Inc. Особый интерес представляют программы выравнивания, допускающие пропуски в последовательности. Алгоритм Смита-Уотермана - это один из типов алгоритмов, который допускает пропуски в выравнивании последовательностей. См. Meth. Mol. Biol. 70: 173-187 (1997). Кроме того, для выравнивания последовательностей можно использовать программу GAP, использующую метод выравнивания Нидлмана-Вунша. См. J. Mol. Biol. 48: 443-453 (1970).
[062] Также представляет интерес программа BestFit, использующая алгоритм локальной гомологии Смита-Уотермана (1981, Advances in Applied Mathematics 2: 482-489) для определения идентичности последовательностей. Штраф за создание пропуска обычно находится в диапазоне от 1 до 5, обычно от 2 до 4, а в некоторых вариантах осуществления будет равен 3. Штраф за удлинение пропуска обычно находится в диапазоне примерно от 0,01 до 0,20, а в некоторых случаях будет равен 0,10. Программа имеет параметры по умолчанию, определяемые последовательностями, введенными для сравнения. Предпочтительно идентичность последовательности определяют с использованием параметров по умолчанию, определенных программой. Эта программа также доступна в пакете Genetics Computing Group (GCG) из Madison, WI, USA.
[063] Другой представляющей интерес программой является алгоритм FastDB. FastDB описан в Current Methods in Sequence Comparison and Analysis, Macromolecule Sequence and Synthesis, Selected Methods and Applications, pp. 127-149, 1988, Alan R. Liss, Inc. Процентную идентичность последовательности рассчитывают в FastDB на основе следующих параметров: штраф за несоответствие: 1,00; штраф за пропуск: 1,00; штраф за размер пропуска: 0,33; и штраф за присоединение: 30.0.
[064] В рамках настоящего изобретения термины «увеличение», «улучшение», «снижение» или «уменьшение» обозначают значения относительно исходного измерения, например измерения у одного и того же человека перед началом лечения, описанного в настоящем документе, или измерения у контрольного человека (или множества контрольных людей) в отсутствие лечения, описанного в настоящем документе. В некоторых вариантах осуществления «контрольным человеком» является человек, болеющий такой же формой заболевания или поражения, что и человек, получающий лечение. В некоторых вариантах осуществления «контрольным человеком» является человек, который не болеет такой же формой заболевания или поражения, что и человек, получающий лечение.
[065] В рамках настоящего изобретения термин «выделенная молекула» (когда молекула представляет собой, например, полипептид, полинуклеотид или антитело или его антигенсвязывающий фрагмент) означает молекулу, которая в силу своего происхождения или источника образования (1) не связана со связанными в естественных условиях компонентами, которые находятся рядом в ее нативном состоянии, (2) по существу не содержит другие молекулы того же вида (3) экспрессируются клеткой другого вида или (4) не встречается в природе. Таким образом, молекула, химически синтезированная или экспрессированная в клеточной системе, отличной из клетки, из которой она происходит в естественных условиях, будет «выделенной» из связанных с ней в естественных условиях компонентов. Молекула также может быть по существу освобождена от связанных в естественных условиях компонентов путем выделения с использованием методов очистки, хорошо известных в данной области. чистоту или гомогенность молекул можно анализировать с помощью ряда способов, хорошо известных в данной области. Например, чистоту образца полипептида можно анализировать с использованием электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида с использованием методов, хорошо известных в данной области. Для определенных целей более высокое разрешение можно обеспечить с использованием HPLC или других способов очистки, хорошо известных в данной области.
[066] В рамках настоящего изобретения термины «лидерный пептид» или «лидерная последовательность», или «лидерная сигнальная последовательность», или «сигнальная последовательность» (используемые взаимозаменяемо в настоящем документе) означают любую последовательность нуклеиновой кислоты или закодированную ей аминокислотную последовательность, которая может иметься на 5'-конце молекулы нуклеиновой кислоты и/или на N-конце полипептида или около него, которая, при наличии может опосредовать транспортировку полипептида в органеллу назначения, включая без ограничения секрецию полипептида из клетки. Такие лидерные последовательности включают без ограничения последовательности нуклеиновых кислот, содержащие, например,
ATGGAATGGAGCTGGGTCTTTCTCTTCTTCCTGTCAGTAACTACAGGTGTCCACTCC (SEQ ID NO: 140) и
ATGGGATGGAGCTGTATCATCCTCTTCTTGGTGGCAACAGCTACAGGCGTGCACTCC (SEQ ID NO: 141), и закодированные ими аминокислотные последовательности, например, без ограничения MGWSCIILFLVATATGVHS (SEQ ID NO: 129) и MEWSWVFLFFLSVTTGVHS (SEQ ID NO: 130) или другие лидерные последовательности, например, MGWSCIILFLVATATGAHS (SEQ ID NO: 131). Изобретение охватывает эти и любые другие лидерные сигналы (нуклеиновые и аминокислотные последовательности), известные в данной области или подлежащие идентификации, которые могут приводить к транспортировке полипептида в нужную органеллу, например, эндоплазматический ретикулум, и/или к секреции из клетки. Обычно сигнальный пептид выводится из зрелого полипептида и/или не имеется в нем.
[067] В рамках настоящего изобретения термин «остаток» означает положение в белке и связанную с ним идентичность аминокислоты. Например, аспарагин 297 (также называемый Asn297, также называемый N297) представляет собой остаток в человеческом антителе IgG1.
[068] Термин «сходство» является родственным понятием, но в отличие от «идентичности» относится к мере сходства, которая включает в себя как идентичные совпадения, так и совпадения с консервативной заменой. Поскольку консервативные замены применимы к полипептидам, а не к молекулам нуклеиновой кислоты, сходство применимо только к сравнениям полипептидных последовательностей. Если две полипептидные последовательности имеют, например, 10 из 20 идентичных аминокислот, а все остальные являются неконсервативными заменами, то процент идентичности и сходства будет 50%. Если в том же примере имеется еще 5 положений, где имеются консервативные замены, то процент идентичности останется 50%, но процент сходства будет 75% (15 из 20). Следовательно, в случаях, где есть консервативные замены, степень сходства между двумя полипептидными последовательностями будет выше, чем процент идентичности этих двух последовательностей.
[069] В рамках настоящего изобретения термин «субъект» означает млекопитающее, более предпочтительно человека. Млекопитающие также включают без ограничения сельскохозяйственных животных (например, коров, свиней, лошадей, кур и так далее), домашних животных, приматов, лошадей, собак, кошек, мышей и крыс. В некоторых вариантах осуществления субъект является пациентом. В некоторых вариантах осуществления у субъекта имеется риск заболевания, нарушения или состояния, опосредованного или связанного со связыванием E-селектина с его лигандом. В некоторых вариантах осуществления субъектом является пациент, который имеет заболевание, нарушение или состояние, описанное в настоящем документе, например, SCD. В некоторых вариантах осуществления субъект (например, пациент) имеет SCD, вариант SCD или заболевание SC. В некоторых вариантах осуществления субъект (например, пациент) имеет генотип HBSS, HBSC, HBS/βthal, HBS/β+thal, HBS/HPHP, HBSE или HBS-вариант.
[070] В рамках настоящего изобретения термин «по существу чистый» означает, что основными соединениями являются преобладающие имеющиеся соединения (то есть на молярной основе они более распространены, чем любые другие отдельные соединения в композиции), а предпочтительно по существу очищенная фракция представляет собой композицию, в которой основные соединения (например гликопротеины, включая антитело или рецептор) составляют по меньшей мере примерно 50 процентов (на молярной основе) всех имеющихся макромолекулярных соединений. В целом, по существу чистая композиция будет содержать примерно более 80 процентов всех макромолекулярных соединений, имеющихся в композиции, более предпочтительно примерно более 85%, 90%, 95% и 99%. Наиболее предпочтительно, целевые соединения очищают по существу до гомогенности (загрязняющие соединения в композиции нельзя обнаружить обычными способами обнаружения), причем композиция по существу состоит из одних макромолекулярных соединений. В определенных вариантах осуществления по существу чистый материал является чистым (то есть не содержит загрязнений) по меньшей мере на 50%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 98% и наиболее предпочтительно, по меньшей мере на 99%.
[071] «Фрагменты» или «части» полипептида или антитела согласно изобретению можно получать путем усечения, например с помощью удаления одного или нескольких аминокислот на N и/или C-концах полипептида. Таким образом, на N и/или C-концах можно удалить 1, 2, 3, 4, 5, до 10, до 20, до 30, до 40 или более аминокислот. Фрагменты также можно создавать с помощью одной или нескольких внутренних делеций.
[072] В рамках настоящего изобретения термины «последовательность нуклеиновой кислоты» и «нуклеотидная последовательность» взаимозаменяемо относятся к любой молекуле, состоящей или содержащей мономерные нуклеотиды. Нуклеиновая кислота может представлять собой олигонуклеотид или полинуклеотид. Нуклеотидная последовательность может быть ДНК или РНК (например, геномная ДНК, кДНК, антисмысловая ДНК, мРНК, тРНК, рРНК и так далее). Нуклеотидная последовательность может быть химически модифицированной или искусственной. Нуклеотидные последовательности включают пептидные нуклеиновые кислоты (PNA), морфолино и закрытые нуклеиновые кислоты (LNA), а также гликолиевые нуклеиновые кислоты (GNA) и треозные нуклеиновые кислоты (TNA). Каждая из этих последовательностей отличается от природной ДНК или РНК изменениями каркаса молекулы. Также можно использовать фосфоротиоатные нуклеотиды. Другие аналоги дезоксинуклеотидов включают метилфосфонаты, фосфорамидаты, фосфородитиоаты, N3'-P5'-фосфорамидаты и олигорибонуклеотидные фосфоротиоаты и их 2'-0-аллильные аналоги и 2'-0-метилрибонуклеотидные метилфосфонаты, которые можно использовать в нуклеотидной последовательности согласно раскрытию.
[073] В рамках настоящего изобретения термин «конструкция нуклеиновой кислоты» относятся к неприродной молекуле нуклеиновой кислоты, полученной в результате применения технологии рекомбинантной ДНК (например рекомбинантной нуклеиновой кислоты). Конструкция нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, одноцепочечную или двухцепочечную, которая была модифицирована так, чтобы она содержала сегменты последовательностей нуклеиновой кислоты, которые объединены и расположены способом, не встречающимся в природе. Конструкция нуклеиновой кислоты может представлять собой «вектор» (например, плазмиду), то есть молекулу нуклеиновой кислоты, предназначенную для доставки экзогенно созданной ДНК в клетку-хозяин.
[074] В рамках настоящего изобретения термин «функционально связанный» относится к соединению элементов полинуклеотида (или полипептида) с функциональной взаимосвязью. Нуклеиновых кислот функционально связана, когда она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, промотор или другая регуляторная последовательность транскрипции (например, энхансер) функционально связана с кодирующей последовательностью, если она влияет на транскрипцию кодирующей последовательности. В некоторых вариантах осуществления функционально связанный означает, что связываемые последовательности нуклеиновых кислот являются смежными. В некоторых вариантах осуществления функционально связанный не значит, что последовательности нуклеиновых кислот связаны непрерывно, точнее между этими связанными последовательностями нуклеиновых кислот находятся промежуточные последовательности.
[075] В рамках настоящего изобретения термин «полинуклеотид» (также называемый в настоящем документе «молекулой нуклеиновой кислоты») относится к последовательности нуклеотидов, соединенных фосфодиэфирными связями. Полинуклеотиды представлены в настоящем документе в направлении 5'-3'. Полинуклеотид согласно настоящему раскрытию может представлять собой молекулу дезоксирибонуклеиновой кислоты (ДНК) или молекулу рибонуклеиновой кислоты (РНК) и относится ко всем формам нуклеиновой кислоты, таким как двухцепочечные молекулы, одноцепочечные молекулы, малая или короткая шпилечная РНК (shRNA), микро РНК, малые или короткая интерферирующая РНК (siRNA), транс-сплайсинговая РНК, антисмысловая РНК. Когда полинуклеотид представляет собой молекулу ДНК, эта молекула может представлять собой ген, кДНК, антисмысловую молекулу или фрагмент любой из указанных выше молекулы. Нуклеотидные основания обозначены в настоящем документе однобуквенным кодом: аденин (A), гуанин (G), тимин (T), цитозин (C), инозин (I) и урацил (U). Полинуклеотид согласно настоящему раскрытию можно получить с использованием стандартных методов, хорошо известных специалисту в данной области.
[076] В рамках настоящего изобретения термины «полипептид», «белок» и «пептид», закодированные полинуклеотидом (последовательностью нуклеиновой кислоты или нуклеотидной последовательностью), относятся к полноразмерным нативным последовательностям, как и в случае природных белков, а также к функциональным субпоследовательностям, модифицированным формам или вариантам последовательностей при условии, что субпоследовательность, модифицированная форма или вариант сохраняет определенную степень функциональности нативного полноразмерного белка. В способах и вариантах применения согласно раскрытию такие полипептиды, белки и пептиды, закодированные полинуклеотидными последовательностями, могут быть, но не обязательно идентичны эндогенному белку, который является дефектным или экспрессия которого недостаточна или дефицитная у субъекта, получающего генную терапию.
[077] В рамках настоящего изобретения термин «предотвращать» или «профилактика» относится к задержке начала и/или уменьшения частоты и/или тяжести по меньшей мере одного признака и/или симптома (например вазоокклюзивного криза, боли) конкретного заболевания, нарушения или состояния (например SCD). В некоторых вариантах осуществления профилактику оценивают на основе популяции, и считается, что средство «предотвращает» конкретное заболевание, нарушение или состояние, если в популяции, восприимчивой к заболеванию, нарушению или состоянию, наблюдается статистически значимое уменьшение развития, частоты и/или интенсивности одного или нескольких симптомов заболевания, нарушения или состояния. Профилактику можно считать завершенной, когда начало заболевания, нарушения или состояния было отсрочено на заданный период времени.
[078] В рамках настоящего изобретения термин «рекомбинантный» относится к вектору, полинуклеотиду, полипептиду или клетке, являющейся продуктом различных комбинаций стадий клонирования, рестрикции или лигирования (например в отношении содержащегося в них полинуклеотида или полипептида) и/или других процедур, в результате которых создается конструкция, отличная от продукта, встречающегося в природе.
[079] В рамках настоящего изобретения термины «лечить» или «лечение» означают введение препарата, который частично или полностью облегчает, улучшает, ослабляет, ингибирует, задерживает начало, уменьшает тяжесть и/или снижает частоту одного или нескольких симптомов, признаков и причин конкретного заболевания, нарушения и/или состояния (например SCD). Для целей этого изобретения полезные или нужные клинические результаты включают без ограничения один или несколько результатов из следующих: увеличение выживаемости (уменьшение смертности), снижение количества фиброзов ткани, уменьшение степени повреждения заболевания, уменьшение продолжительности заболевания и/или снижение количества, степени или продолжительности симптома, связанного с заболеванием. Термин предусматривает введение соединения или средства согласно настоящему изобретению для предотвращения или задержки начала симптома, осложнения или биохимических признаков заболевания, облегчения симптома или задержки или ингибирования дальнейшего развития заболевания, состояния или нарушения. Лечение может быть профилактическим (для предотвращения или задержки начала заболевания или предотвращения проявления его клинических или субклинических симптомов) или терапевтическим подавлением или ослаблением симптома после проявления заболевания. В некоторых вариантах осуществления заболеванием, состоянием или нарушением является SCD.
Антитела
[080] «Антитело» или «Ab» представляет собой молекулу иммуноглобулина, способную распознавать и связываться с конкретной мишенью или антигеном (Ag), например, углеводом, полинуклеотидом, липидом, полипептидом и так далее, посредством по меньшей мере одного участка распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. В рамках настоящего изобретения, термин «антитело» может включать в себя любой тип антитела, включая без ограничения моноклональные антитела, поликлональные антитела, антигенсвязывающие фрагменты (или части) интактных антител, которые сохраняют способность специфически связываться с данным антигеном (например, E-селектином), и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит участок распознавания антигена.
[081] Антитела включают антитела любого класса, например, IgG, IgA или IgM (или их подклассы), и антитела не обязательно должны относиться к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области тяжелой цепи (HC) антитела, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. В некоторых вариантах осуществления антителом против E-селектина согласно настоящему раскрытию является IgG1 антитело. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Хорошо известны структуры субъединицы и трехмерные конфигурации разных классов иммуноглобулинов.
[082] Антитела можно получать у любых млекопитающих, включая без ограничения людей, обезьян, свиней, лошадей, кроликов, собак, кошек, мышей, крыс (например, крыс Sprague Dawley) и так далее, или у других животных, таких как птицы (например, курицы), рыбы (например акулы) и верблюжьи (например ламы).
[083] Термин «антиген» относится к молекулярному объекту, используемому для иммунизации иммунокомпетентного позвоночного для получения антитела, которое распознает антиген или для скрининга библиотеки экспрессии (среди прочего, например, фаговой, дрожжевой или рибосомной дисплейной библиотеки). В настоящем документе антиген использован в более широком смысле и в целом предполагает включение молекул-мишеней, которые специфически распознаются антителами, включая таким образом фрагменты или миметики молекул, используемых в процессе иммунизации для получения антител или при скрининге библиотеки для выбора антител. Таким образом, в настоящем документе для антител согласно изобретению, связывающихся с E-селектином, полноразмерный E-селектин видов млекопитающих (например, человека, обезьяны (включая яванского макака), мыши, кролика и крысы), включая мономеры и мультимеры, например димеры, тримеры и так далее, их усеченные и другие варианты E-селектина (например внеклеточный домен), а также растворимый E-селектин и E-селектин, экспрессируемый на клеточной поверхности, называются антигеном.
[084] Термин «антигенсвязывающий фрагмент» антител относится к одному или нескольким фрагментам полноразмерного антитела, который сохраняет способность специфически связываться с антигеном (предпочтительно по существу с одинаковой аффинностью связывания). Было показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, включенных в термин «антигенсвязывающий фрагмент» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одной группы антител, (v) фрагмент dAb (Ward et al. Nature 1989; 341:544-546), который состоит из домена VH; и (vi) выделенную определяющую комплементарность область (CDR), связанный дисульфидом Fv (dsFv) и антиидиотипические (против Id) антитела и интратела. Кроме того, хотя два домена Fv-фрагмента, VL и VH, закодированы отдельными генами, они могут быть соединены с использованием рекомбинантных способов синтетическим линкером, который обеспечивает их конструирование в виде одной белковой цепи, в которой области VL и VH соединены с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv)); см., например, Bird et al. Science 1988; 242:423-426 и Huston et al. Proc. Natl. Acad. Sci. 1988 USA 85:5879-5883. Также включены другие формы одноцепочечных антител, таких как диатела. Предполагается, что такие одноцепочечные антитела также будут включены в термин «антигенсвязывающий фрагмент» антител. Диатела представляют собой двухвалентные, биспецифические антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечить соединение между двумя доменами на одной и той цепи, обеспечивая за счет этого соединение доменов с комплементарными доменами другой цепи и создавая два антигенсвязывающих участка (см., например, Holliger et al, Proc. Natl. Acad. Sci. USA 1993; 90:6444-6448; Poljak et al. Structure 1994; 2:1121-1123).
[085] «Вариабельный домен» антител относится к вариабельной области легкой цепи (VL) антитела или к вариабельной области тяжелой цепи (VH) антитела либо отдельно, либо в сочетании. Как известно в данной области, каждая вариабельная область тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя «определяющими комплементарность областями» (CDR), и участвует в образовании антигенсвязывающего участка антител. Если нужны варианты рассматриваемой вариабельной области, особенно с заменой аминокислотных остатков за пределами области CDR (то есть в каркасной области), подходящую аминокислотную замену, предпочтительно консервативную аминокислотную замену, можно идентифицировать путем сравнения рассматриваемой вариабельной области с вариабельными областями других антител, которые содержат последовательности CDR1 и CDR2 того же канонического класса, что и рассматриваемая вариабельная область (Chothia и Lesk, J. Mol. Biol. 1987; 196(4): 901-917).
[086] Остатки в вариабельном домене обычно нумеруют по Kabat, что обеспечивает систему нумерации, используемую для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи при компиляции антител. См. Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. При использовании этой системы нумерации реальная линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может содержать вставку одной аминокислоты (остаток 52а по Kabat) после остатка 52 H2 и вставленные остатки (например, остатки 82a, 82b и 82c по Kabat) после остатка FR тяжелой цепи 82. Нумерация остатков по Kabat может быть определена для данного антитела путем выравнивания областей гомологии последовательности антитела со «стандартной» нумерованной последовательностью по Kabat. Доступны различные алгоритмы присвоения нумерации по Kabat. Например, алгоритм, реализованный в выпуске версии 2.3.3 Abysis (www.abysis.org), можно использовать для присвоения нумерации Kabat вариабельным областям LCDR-1, LCDR-2, LCDR-3, HCDR-2 и HCDR-3, а затем определение AbM можно использовать для HCDR-1.
[087] В некоторых вариантах осуществления окончательное разграничение CDR и идентификацию остатков, содержащих участок связывания антитела, осуществляют путем определения структуры антитела и/или определения структуры комплекса антитело-лиганд. В некоторых вариантах осуществления это может быть выполнено любым из множества методов, известных специалистам в данной области, таких как рентгеновская кристаллография. В некоторых вариантах осуществления можно использовать различные способы анализа для идентификации или аппроксимации областей CDR. Примеры таких способов включают без ограничения определение по Kabat, определение по Chothia, определение по AbM, контактное определение и конформационное определение.
[088] «Определяющие комплементарность области» (CDR) могут быть идентифицированы в соответствии с определениями Kabat, Chothia, аккумуляции как Kabat, так и Chothia, AbM, контактным, North и/или конформационным определениями или любым хорошо известным в данной области методом определения CDR. См., например, Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5 изд. (гипервариабельные области); Chothia и др., Nature 1989; 342:877-883 (конструкции структурных петель). Идентичность аминокислотных остатков в конкретном антителе, составляющих CDR, можно определить с помощью методов, хорошо известных в данной области. Определение CDR по AbM является компромиссом между Kabat и Chothia и использует программное обеспечение для моделирования антител Oxford Molecular AbM (Accelrys®).
[089] «Контактное» определение CDR основано на наблюдаемых контактах антигена, изложенных в MacCallum et al., J. Mol. Biol. 1996; 262:732-745. «Конформационное» определение CDR основано на остатках, которые принимают энтальпийное участие в связывании антигена (см., например, Makabe et al., J. Biol. Chem., 2008; 283:1156-1166). North идентифицировал канонические конформации CDR, используя другой предпочтительный набор определений CDR (North et al., J. Mol. Biol. 2011; 406: 228-256). В другом подходе, называемом в настоящем документе «конформационным определением» CDR, положения CDR могут быть идентифицированы как остатки, которые принимают энтальпийное участие в связывании антигена (Makabe et al., J. Biol. Chem. 2008, 283: 1156-1166). Другие определения границ CDR могут не строго следовать одному из вышеперечисленных подходов, но, тем не менее, будут перекрываться, по крайней мере, с частью CDR по Kabat, хотя они могут быть укорочены или удлинены в свете прогноза или экспериментальных данных о том, что определенные остатки или группы остатков или даже целые CDR не оказывают существенного влияния на связывание антигена. В рамках настоящего изобретения CDR может относиться к CDR, определенным с помощью любого известного в данной области подхода, включая комбинации подходов. В способах, используемых в настоящем документе, можно использовать CDR, определенные в соответствии с любым из этих подходов. Для любого данного варианта осуществления, содержащего более одной CDR, CDR (или другой остаток антитела) могут быть определены в соответствии с любым из определений по Kabat, Chothia, North, расширенного, AbM, контактного и/или конформационного.
[090] «Контактный остаток» в рамках настоящего изобретения в отношении антитела или антигена, специфически им связываемого, относится к аминокислотному остатку, имеющемуся на антителе/антигене, содержащему по меньшей мере один тяжелый атом (то есть не водород), который находится в пределах 4 Å или менее от тяжелого атома аминокислотного остатка, имеющегося на родственном антителе/антигене.
[091] «Каркасные» (FR) остатки представляют собой остатки вариабельного домена антитела, отличные от остатков CDR. Каркас домена VH или VL содержит четыре каркасные субобласти, FR1, FR2, FR3 и FR4, чередующиеся с CDR в следующей структуре: FR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4.
[092] Как известно в данной области, «константная область» антитела относятся к константной области легкой цепи антитела или константной области тяжелой цепи антитела, либо отдельно, либо в комбинации.
[093] Термины «Fc-область IgG», «Fc-область», «Fc-домен» и «Fc», которые взаимозаменяемо использованы в настоящем документе, относятся к части молекулы иммуноглобулина (Ig), которая коррелирует с кристаллизируемым фрагментом, полученным за счет расщепления папаина молекулы Ig. В рамках настоящего изобретения термины относятся к константной области антитела за исключением первой константной области домена иммуноглобулина и дополнительно относятся к частям этой области. Таким образом, Fc относится к последним двум доменам иммуноглобулина константной области IgA, IgD и IgG и к последним трем доменам иммуноглобулина константной области IgE и IgM и к гибкому шарниру на N-конце этих доменов или их частей. Для IgA и IgM Fc может содержать цепь J.
[094] Для IgG Fc содержит домены Cγ2 и Cγ3 иммуноглобулина (C гамма 2 и C гамма 3) и шарнир между Cγ1 (C гамма 1) и Cγ2 (C гамма 2). Хотя границы Fc-области могут меняться, Fc-область тяжелой цепи IgG человека обычно определяют так, чтобы она содержала остатки C226 или P230 на его карбоксильном конце, причем нумерация соответствует индексу ЕС согласно Edelman et al. Proc. Natl. Acad. Sci. USA 1969; 63(1) :78-85 и Kabat et al. 1991. Обычно Fc-домен содержит от примерно 236 до примерно 447 аминокислотных остатков константного домена IgG1 человека. Иллюстративная аминокислотная последовательность Fc-домена IgG1 дикого типа человека приведена в SEQ ID NO: 16 и SEQ ID NO: 15 (включая необязательный концевой остаток лизин (K)). Fc-полипептид может относиться к этой области в отдельности или к этой области в контексте антитела или его антигенсвязывающего фрагмента или белка слияния Fc.
[095] Константный домен тяжелой цепи содержит Fc-область и дополнительно содержит домен CH1 и шарнир, а также домены CH2 и CH3 (и необязательно CH4 IgA и IgE) тяжелой цепи IgG.
[096] «Функциональная Fc-область» обладает по меньшей мере одной эффекторной функцией нативной последовательности Fc-области. Иллюстративные «эффекторные функции» включают связывание C1q; комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, рецепторов B-клеток), активацию B-клеток и так далее. Такие эффекторные функции в целом требуют объединения Fc-области со связывающим доменом (например, с вариабельным доменом антитела или его антигенсвязывающим фрагментом), и их можно оценивать с использованием различных анализов, известных в данной области, для оценки таких эффекторных функций антитела.
[097] В рамках настоящего изобретения «Fc-рецептор» или «FcR» описывает рецептор, который связывается с Fc-областью антител. В некоторых вариантах осуществления FcγR представляет собой нативный FcR человека. В некоторых вариантах осуществления FcR представляет собой рецептор, который связывает IgG антитело (гамма рецептор) и содержит рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют похожие аминокислотные последовательности, которые отличаются главным образом их цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецептор тирозин на основе активация мотив (ITAM) в его цитоплазматическими домен. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в его цитоплазматическом домене, (см., например, Daeron, Annu. Rev. Immunol. 1997; 15:203-234). Обзор FcRs показан, например, в Ravetch и Kinet, Annu. Rev. Immunol 1991; 9:457-92; Capel et al. Immunomethods 1994; 4:25-34; и de Haas et al. J. Lab. Clin. Med. 1995; 126:330-41. Термин «FcR» в настоящем документе охватывает другие FcR, включая те, что будут идентифицированы в будущем.
[098] Термин «Fc-рецептор» или «FcR» также содержит неонатальный рецептор, FcRn, который отвечает за перенос материнского IgG в плод (Guyer et al. J. Immunol. 1976; 117:587 и Kim et al. J. Immunol. 1994; 24:249) и регуляцию гомеостаза иммуноглобулинов. Способы измерения связывания с FcRn известны (см., например, Ghetie and Ward., Immunol. Today 1997; 18(12):592-598; Ghetie et al., Nature Biotechnology, 1997; 15(7):637-640; Hinton et al., J. Biol. Chem. 2004; 279(8):6213-6216; WO 2004/92219).
[099] «Человеческие эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. В определенных вариантах осуществления клетки экспрессируют по меньшей мере FcγRIII и выполняют эффекторную функцию (функции) ADCC. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), клетки естественные киллеры (NK), моноциты, макрофаги, цитотоксические T-клетки и нейтрофилы. Эффекторные клетки можно выделять из нативного источника, например, из крови.
[0100] В рамках настоящего изобретения термин «антителозависимая клеточно-опосредованная цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретируемый Ig, связанный с Fc-рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), позволяет этим цитотоксическим эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью и впоследствии уничтожать клетку-мишень цитотоксинами. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Чтобы оценить активность ADCC интересующей молекулы, можно проводить анализ ADCC in vitro, такой как описан в патенте США №5500362, 5821337 или 6737056. Полезные эффекторные клетки для таких анализов включают РВМС и NK-клетки. Альтернативно или дополнительно активность ADCC интересующей молекулы может быть оценена in vivo, например, на животной модели, такой как модель, описанная в Clynes et al., Proc. Natl. Acad. Sci. (USA) 1998; 95:652-656. Дополнительные антитела с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной активностью ADCC описаны, например, в патенте США №7923538 и в патенте США №7994290.
[0101] Антитело, обладающее «повышенной активностью ADCC», относится к антителу, которое более эффективно опосредует ADCC in vitro или in vivo по сравнению с исходным антителом, при этом антитело и исходное антитело отличаются по меньшей мере в одном структурном аспекте, и количества такого антитела и исходного антитела, используемые в анализе, по существу одинаковы. В некоторых вариантах осуществления антитело и исходное антитело имеют одинаковую аминокислотную последовательность, но антитело афукозилировано, в то время как исходное антитело фукозилировано. В некоторых вариантах осуществления активность ADCC будет определяться с использованием анализа ADCC in vitro, как описано в настоящем документе, но предполагаются другие анализы или способы определения активности ADCC, например, в животной модели и так далее. В некоторых вариантах осуществления антитело с повышенной активностью ADCC обладает повышенной аффинностью к Fc гамма RIIIA.
[0102] Антитело с «измененной» аффинностью связывания FcR или активностью ADCC представляет собой антитело, которое имеет либо повышенную, либо пониженную активность связывания FcR и/или активность ADCC по сравнению с исходным антителом, причем антитело и исходное антитело отличаются по меньшей мере одним структурным аспектом. Антитело, которое «проявляет повышенное связывание» с FcR, связывает по меньшей мере один FcR с большей аффинностью, чем исходное антитело. Антитело, которое «демонстрирует пониженное связывание» с FcR, связывает по меньшей мере один FcR с более низкой аффинностью, чем исходное антитело. Такие антитела, которые демонстрируют пониженное связывание с FcR, могут обладать незначительным связыванием или вообще не связываться с FcR, например, связыванием с FcR 0-20% по сравнению с Fc-областью IgG с нативной последовательностью.
[0103] «Повышенная аффинность к FcγRIIIA» относится к антителу, которое обладает большей аффинностью к FcγRIIIA, чем исходное антитело, при этом антитело и исходное антитело отличаются по меньшей мере в одном структурном аспекте.
[0104] «Комплементзависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (Clq) с антителами (соответствующего подкласса), которые связаны с родственным им антигеном. Для оценки активации комплемента можно выполнить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 1996; 202: 163. Антитела с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной способностью связывания Clq описаны, например, в патентах США №6194551, 7923538, 7994290 и WO 1999/51642.
[0105] Константный домен тяжелой цепи содержит Fc-область и дополнительно содержит домен CH1 и шарнир, а также домены CH2 и CH3 тяжелой цепи IgG (и, необязательно, CH4 IgA и IgE).
[0106] В некоторых вариантах осуществления, где антитело против Е-селектина содержит С-концевой аминокислотный остаток лизина (К) на полипептиде тяжелой цепи (например, тяжелая цепь IgG1 человека содержит концевой лизин), специалисту в данной области будет понятно, что остаток лизина может быть усечен, что приведет к получению антитела с тяжелой цепью, лишенной С-концевого остатка лизина. Кроме того, тяжелая цепь антитела может быть получена с использованием нуклеиновой кислоты, не кодирующей лизин. Таким образом, в некоторых вариантах осуществления антитело против Е-селектина содержит тяжелую цепь, в которой концевой лизин отсутствует.
[0107] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент, описанные в настоящем документе, содержат домен Fc. Домен Fc может быть получен из IgA (например, IgA1 или IgA2), IgD, IgE, IgM или IgG (например, IgG1, IgG2, IgG3 или IgG4). В некоторых вариантах осуществления антитело против Е-селектина представляет собой антитело IgG. В некоторых вариантах осуществления антитело против Е-селектина (например, антитело 1444) представляет собой антитело IgG1.
[0108] Белок «слияния Fc» представляет собой белок, в котором один или несколько полипептидов функционально связаны с полипептидом Fc. Fc-слияние объединяет Fc-область иммуноглобулина с партнером по слиянию.
[0109] «Fc-область с нативной последовательностью» содержит аминокислотную последовательность, идентичную природной аминокислотной последовательности Fc-области. «Вариант Fc-области» содержит аминокислотную последовательность, которая отличается от Fc-области с нативной последовательностью по меньшей мере одной модификацией аминокислоты, но сохраняет по меньшей мере одну эффекторную функцию Fc-области с нативной последовательностью. Предпочтительно вариант Fc-области имеет по меньшей мере одну аминокислотную замену по сравнению с Fc-областью с нативной последовательностью или Fc-областью исходного полипептида, например, от примерно одной до примерно десяти аминокислотных замен и предпочтительно от примерно одной до примерно пяти аминокислотных замен в Fc-области с нативной последовательностью или в Fc-области исходного полипептида. Вариант Fc-области в настоящем описании будет предпочтительно обладать по меньшей мере примерно 80% идентичностью последовательности с Fc-областью с нативной последовательностью и/или с Fc-областью исходного полипептида и, наиболее предпочтительно, по меньшей мере примерно 90% идентичностью последовательности с ней, более предпочтительно по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98%, по меньшей мере примерно 99% идентичностью последовательности с ней.
[0110] «Эпитоп» относится к участку или области антигена, с которой антитело специфически связывается, например, к участку или области, содержащей остатки, которые взаимодействуют с антителом, что определяют с помощью любого способа, хорошо известного в данной области, например, с помощью обычных иммуноанализов или как описано в примерах 9 и 10 настоящего изобретения. В данной области известно много способов картирования и определения местоположения эпитопов на белках, включая определение кристаллической структуры комплекса антитело-антиген, конкурентные анализы, анализы экспрессии фрагментов генов и анализы на основе синтетических пептидов, как описано, например, в главе 11 Harlow and Lane, Using Antibodies, a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999. В дополнительном примере можно использовать картирование эпитопов для определения последовательности, с которой связывается антитело против Е-селектина. Картирование эпитопов коммерчески доступно из различных источников, например, Pepscan Systems (Edelhertweg 15, 8219 PH Lelystad, The Netherlands). Альтернативно, в процессе исследования на информацию о нужных эпитопах могут пролить свет образование и характеристика антител. Затем на основе этой информации можно провести конкурентный скрининг антител на связывание с одним и тем же эпитопом. Подход для достижения этого заключается в проведении исследований конкуренции и перекрестной конкуренции для поиска антител, которые конкурируют или перекрестно конкурируют друг с другом за связывание с Е-селектином, например, антител, которые конкурируют за связывание с антигеном.
[0111] Кроме того, эпитоп, с которым связывается антитело против Е-селектина, можно определить при систематическом скрининге с использованием перекрывающихся пептидов, полученных из Е-селектина (например, последовательности Е-селектина человека), и определения связывания антителом. В соответствии с анализами экспрессии фрагментов гена открытая рамка считывания, кодирующая E-селектин, может быть фрагментирована либо случайным образом, либо с помощью конкретных генетических конструкций, и определяют реактивность экспрессированных фрагментов E-селектина с тестируемым антителом. Фрагменты гена можно, например, получить с помощью ПЦР, а затем транскрибировать и транслировать в белок in vitro в присутствии радиоактивных аминокислот. Затем связывание антитела с радиоактивно мечеными фрагментами Е-селектина определяют с помощью иммунопреципитации и гель-электрофореза.
[0112] Определенные эпитопы также можно идентифицировать с помощью больших библиотек случайных пептидных последовательностей, представленных на поверхности фаговых частиц (фаговые библиотеки) или дрожжей (дрожжевой дисплей). В качестве альтернативы определенная библиотека перекрывающихся пептидных фрагментов может быть протестирована на связывание с тестируемым антителом в простых анализах связывания. В дополнительном примере для идентификации остатков, нужных, достаточных и/или необходимых для связывания эпитопа, можно проводить мутагенез антигена, эксперименты по замене доменов и аланин-сканирующий мутагенез.
[0113] На самом детальном уровне эпитоп для взаимодействия между антигеном и антителом может быть определен с помощью пространственных координат, определяющих атомные контакты, присутствующие при взаимодействии антиген-антитело, а также информации об их относительном вкладе в термодинамику связывания. На менее детальном уровне эпитоп может быть охарактеризован пространственными координатами, определяющими атомные контакты между антигеном и антителом. На еще менее подробном уровне эпитоп может быть охарактеризован аминокислотными остатками, которые он содержит, что определяют по конкретному критерию, например, по расстоянию между атомами в антителе и антигене (например, тяжелыми, то есть неводородными атомами). На еще менее подробном уровне эпитоп можно охарактеризовать по функции, например, по конкурентному связыванию с другими антителами. В более общем смысле эпитоп также может быть определен по содержанию аминокислотных остатков, замена которых другой аминокислотой изменит характеристики взаимодействия между антителом и антигеном (например, с помощью аланинового сканирования).
[0114] Из того факта, что описания и определения эпитопов, в зависимости от используемого метода картирования эпитопов, получаются на разных уровнях детализации, следует, что сравнение эпитопов для разных антител на одном и том же антигене можно аналогичным образом проводить на разных уровнях детализации.
[0115] Эпитопы, описанные на уровне аминокислот, например, определенные с помощью рентгеновской кристаллографии, спектроскопии ядерного магнитного резонанса (ЯМР), масс-спектрометрии с обменом водорода/дейтерия (H/D-MS), считаются идентичными, если они содержат одинаковый набор аминокислотных остатков. Говорят, что эпитопы перекрываются, если по меньшей мере одна аминокислота является общей для эпитопов. Эпитопы называются отдельными (уникальными), если ни один аминокислотный остаток не является общим для эпитопов.
[0116] Еще один способ, который можно использовать для характеристики антитела против Е-селектина, заключается в использовании конкурентных анализов (например, как описано в примере 9 настоящего изобретения) с другими антителами, о которых известно, что они связываются с одним и тем же антигеном, для определения, связывается ли антитело против Е-селектина с тем же эпитопом, что и другие антитела. Анализы конкуренции хорошо известны специалистам в данной области. Эпитопы, характеризующиеся конкурентным связыванием, называются перекрывающимися, если связывание соответствующих антител является взаимоисключающим, то есть связывание одного антитела исключает одновременное или последовательное связывание другого антитела. Эпитопы называются отдельными (уникальными), если антиген способен обеспечивать одновременное связывание обоих соответствующих антител.
[0117] Эпитопы могут быть линейными или конформационными. В линейном эпитопе все точки взаимодействия между белком и взаимодействующей молекулой (такой как антитело) располагаются линейно вдоль первичной аминокислотной последовательности белка. «Нелинейный эпитоп» или «конформационный эпитоп» содержит несмежные полипептиды (или аминокислоты) внутри антигенного белка, с которыми связывается антитело, специфичное к эпитопу.
[0118] Аффинность связывания антитела может быть выражена как значение KD, которое относится к скорости диссоциации при конкретном взаимодействии антиген-антитело. KD представляет собой отношение скорости диссоциации, также называемой «koff» или «KD», к скорости ассоциации, также называемой «kon» или «ka». Таким образом, KD равно koff/kon (или KD/ka) и выражается в виде молярной концентрации (M), причем чем меньше KD, тем сильнее аффинность связывания. Значения KD для антител можно определить с использованием методов, хорошо известных в данной области. Одним типичным методом измерения KD является поверхностный плазмонный резонанс (SPR), обычно с использованием биосенсорной системы, такой как система BIACORE®. Кинетический анализ BIAcore включает анализ связывания и диссоциации антигена с чипов с иммобилизованными на их поверхности молекулами (например, молекулами, содержащими связывающие эпитопы домены). Другой метод определения KD антитела заключается в использовании интерферометрии биослоев, обычно с использованием технологии OCTET (система Octet QKe, ForteBio). В качестве альтернативы или в дополнение также можно использовать анализ KinExA (анализ кинетического исключения), доступный от Sapidyne Instruments (Boise, ID).
[0119] Термин «антитело, которое «предпочтительно связывается» или «специфически связывается» (использовано в данном документе взаимозаменяемо) с эпитопом, хорошо известен в данной области, и способы определения такого специфического или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула (например, белок, нуклеиновая кислота, антитело и тому подобное) демонстрирует «специфическое связывание» или «предпочтительное связывание», если она реагирует или связывается чаще, быстрее, с большей продолжительностью и/или с большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело «специфически связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфически или преимущественно связывается с эпитопом Е-селектина, представляет собой антитело, которое связывается с конкретным эпитопом с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими эпитопами Е-селектина или эпитопами не Е-селектина, включая эпитопы P-селектина и/или L-селектина. Таким образом, в определенных условиях анализа конкретный связывающий фрагмент (например, антитело или его антигенсвязывающий фрагмент, или рецептор, или его лигандсвязывающий фрагмент) связывается преимущественно с конкретной молекулой-мишенью и не связывается в значительном количестве с другими компонентами, присутствующими в тестовом образце. Как правило, но не обязательно, ссылка на связывание означает предпочтительное связывание.
[0120] Для выбора антитела или пептида, которые специфически связываются с интересующей молекулой, можно использовать различные форматы анализа. Например, твердофазный иммуноанализ ELISA (включая конкурентное связывание ELIA), иммуноанализ AlphaLISA® (Perkin-Elmer), иммунопреципитация, BIAcore™ (GE Healthcare, Piscataway, NJ), сортировка клеток, активируемых флуоресценцией (FACS), Octet™ (FortéBio, Inc., Menlo Park, CA) и вестерн-блоттинг входят в число многих анализов, которые можно использовать для идентификации антитела, которое специфически реагирует с антигеном или рецептором, или его связывающего лиганд фрагмента, который специфически связывается с родственным лигандом или партнером по связыванию. Как правило, специфическая или избирательная реакция будет по меньшей мере в два раза выше фонового сигнала или шума и, что более типично, больше чем в 10 раз выше фона, больше чем в 50 раз выше фона, больше чем в 1000 раз выше фона или более. Говорят, что антитело «специфически связывает» антиген, когда равновесная константа диссоциации (KD) составляет ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤100 пМ. В некоторых вариантах осуществления антитело против Е-селектина связывает Е-селектин (например, Е-селектин человека) с KD <70 нМ (например, 68,4 +/- 3,18 нМ). В некоторых вариантах осуществления антитело против Е-селектина связывает Е-селектин (например, Е-селектин яванского макака) с KD <68 нМ (например, 64,9 +/- 1,13 нМ).
[0121] В некоторых вариантах осуществления антитело против Е-селектина связывает Е-селектин человека с KD, выбранным из группы, состоящей из примерно 92,85 нМ, примерно 70,3 нМ, примерно 65,2 нМ, примерно 61,8 нМ, примерно 60,5 нМ, примерно 68,0 нМ. нМ, примерно 21,6 нМ, примерно 324 нМ, примерно 54,4 нМ, примерно 628,5 нМ и 2940 нМ. В некоторых вариантах осуществления антитело против Е-селектина связывает Е-селектин яванского макака с KD, выбранным из группы примерно 138,5 нМ, примерно 78,3 нМ, примерно 76,5 нМ, примерно 81,5 нМ, примерно 67,8 нМ, примерно 45,8 нМ, примерно 243,5 нМ, примерно 45,4 нМ, примерно 492 нМ и 3145 нМ.
[0122] В рамках настоящего изобретения термин «конкурировать» в отношении антитела, означает, что связывание первого антитела или его антигенсвязывающего фрагмента с антигеном снижает последующее связывание того же антигена вторым антителом или его антигенсвязывающим фрагментом. Необязательно, но может иметься альтернатива, когда связывание второго антитела с антигеном также заметно снижается в присутствии первого антитела. То есть первое антитело может ингибировать связывание второго антитела с антигеном без того, чтобы это второе антитело ингибировало связывание первого антитела с его соответствующим эпитопом. Однако, если каждое антитело заметно ингибирует связывание другого антитела с родственным ему эпитопом или лигандом в той же, большей или меньшей степени, говорят, что антитела «перекрестно конкурируют» друг с другом за связывание своего соответствующего эпитопа (эпитопов). Настоящее изобретение охватывает как конкурирующие, так и перекрестно конкурирующие антитела. Независимо от механизма, с помощью которого происходит такая конкуренция или перекрестная конкуренция (например, стерические затруднения, конформационные изменения или связывание с общим эпитопом, или его фрагментом), специалист в данной области должен понимать, основываясь на идеях, представленных в настоящем документе, что такие конкурирующие и/или перекрестно-конкурирующие антитела включены и могут быть применимы для описанных в данном документе способов.
[0123] Стандартные конкурентные анализы можно использовать для определения того, конкурируют ли два антитела друг с другом. Один подходящий анализ конкуренции антител включает использование технологии Biacore, которая может измерять степень взаимодействия с использованием технологии поверхностного плазмонного резонанса (SPR), обычно с использованием биосенсорной системы (такой как система BIACORE). Например, SPR можно использовать в анализе конкурентного ингибирования связывания in vitro для определения способности одного антитела ингибировать связывание второго антитела. В другом анализе для измерения конкуренции антител используют подход, основанный на ELISA.
[0124] Кроме того, в международной патентной заявке № WO2003/48731 описан высокопроизводительный процесс «биннинга» антител, основанный на их конкуренции. Конкуренция присутствует, если одно антитело (или его фрагмент) уменьшает связывание другого антитела (или его фрагмента) с Е-селектином. Например, можно использовать последовательный конкурентный анализ связывания с последовательным добавлением различных антител. Первое антитело может быть добавлено для достижения связывания, близкого к насыщению. Затем добавляют второе антитело. Если связывание второго антитела с Е-селектином не обнаружено или значительно снижено (например по меньшей мере примерно на 10%, по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50% снижение по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80% или по меньшей мере примерно на 90%) по сравнению с параллельным анализом в отсутствие первого антитела (значение которого может быть установлено как 100%), два антитела считаются конкурирующими друг с другом.
[0125] Определение термина «паратоп» получено из приведенного выше определения «эпитоп» путем обращения перспективы. Таким образом, термин «паратоп» относится к участку или области антитела, которая специфически связывается с антигеном, то есть к аминокислотным остаткам антитела, которые вступают в контакт с антигеном (Е-селектином или его фрагментом), так как «контакт» определен в другом месте настоящего документа. Паратоп для данной пары антитело/антиген может быть идентифицирован обычными методами. Например, антитело и молекула-мишень могут быть объединены, а комплекс антитело/антиген может быть кристаллизован. Кристаллическую структуру комплекса можно определить и использовать для идентификации специфических участков взаимодействия между антителом и его мишенью.
[0126] В некоторых вариантах осуществления антитело представляет собой «вариант антитела». Вариант антитела может содержать 1, 2, 3, 4, 5, до 10, до 20, до 30 или более аминокислотных замен и/или делеций и/или вставок из определенных последовательностей и фрагментов, раскрытых в настоящем документе, и в частности, в Таблице 2. Варианты «делеции» могут включать удаление отдельных аминокислот, удаление небольших групп аминокислот, например 1, 2, 3, 4 или 5 аминокислот, или удаление более крупных аминокислотных областей, например удаление определенных аминокислотных доменов или других элементов. Варианты «вставки» могут включать вставку отдельных аминокислот, вставку небольших групп аминокислот, например, 1, 2, 3, 4 или 5 аминокислот, или вставку более крупных участков аминокислот, например вставку определенных аминокислотных доменов или других элементов. Варианты «замещения» предпочтительно включают замену одной или нескольких аминокислот таким же количеством аминокислот и выполнение консервативных замен аминокислот. Например, аминокислота может быть заменена альтернативной аминокислотой, имеющей аналогичные свойства, например, другой основной аминокислотой, другой кислой аминокислотой, другой нейтральной аминокислотой, другой заряженной аминокислотой, другой гидрофильной аминокислотой, другой гидрофобной аминокислотой, другой полярной аминокислотой, другой ароматической аминокислотой или другой алифатической аминокислотой.
[0127] Варианты замены имеют по меньшей мере один удаленный аминокислотный остаток в молекуле антитела и вставленный на его место другой остаток. Участки, представляющие наибольший интерес для заместительного мутагенеза, включают гипервариабельные области, но также предполагаются изменения каркаса. Консервативные замены показаны в таблице 1. Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные изменения, называемые «иллюстративными заменами», показанные ниже или описанные ниже в отношении классов аминокислот и продуктов скрининга.
ТАБЛИЦА 1
Аминокислоты и Замены
[0128] Существенные модификации биологических свойств антитела осуществляют путем выбора замен, которые существенно различаются по своему влиянию на сохранение (а) структуры полипептидного остова в области замены, например, в виде бета-листа или спиральной конформации, (b) заряда или гидрофобности молекулы на участке-мишени или (c) объема боковой цепи. Природные остатки делятся на группы на основе общих свойств боковой цепи:
i. Неполярные: Норлейцин, Met, Ala, Val, Leu, Ile;
ii. Полярные без заряда: Cys, Ser, Thr, Asn, Gln;
iii. Кислотные (отрицательно заряженные): Asp, Glu;
iv. Основные (положительно заряженные): Lys, Arg;
v. Остатки, влияющие на ориентацию цепи: Gly, Pro; и
vi. Ароматические: Trp, Tyr, Phe, His.
[0129] Неконсервативные замены производят путем замены члена одного из этих классов на другой класс.
[0130] Например, один тип замещения, который может быть осуществлен, заключается в замене одного или нескольких цистеинов в антителе, которые могут быть химически реактивными, на другой остаток, такой как без ограничения аланин или серин. Например, может быть замена неканонического цистеина. Замена может быть произведена в CDR или каркасной области вариабельного домена или в константной области антитела. В некоторых вариантах осуществления цистеин является каноническим. Любой остаток цистеина, не участвующий в поддержании надлежащей конформации антитела, также может быть заменен, как правило, серином, для улучшения окислительной стабильности молекулы и предотвращения аберрантного перекрестного связывания. И наоборот, цистеиновая связь (связи) могут быть добавлены к антителу для повышения его стабильности, особенно если антитело представляет собой фрагмент антитела, такой как Fv-фрагмент.
[0131] В процессе, известном как «модифицирование на уровне генов зародышевой линии», некоторые аминокислоты в последовательностях VH и VL могут быть подвергнуты мутагенезу, чтобы соответствовать аминокислотам, которые естественным образом находятся в последовательностях VH и VL зародышевой линии. В частности, аминокислотные последовательности каркасных областей в последовательностях VH и VL могут быть подвергнуты мутагенезу для соответствия последовательностям зародышевой линии, чтобы снизить риск иммуногенности при введении антитела. В рамках настоящего изобретения термин «зародышевая линия» относится к нуклеотидным последовательностям и аминокислотным последовательностям генов и сегментов генов антител, которые передаются от родителей потомству через зародышевые клетки. Эта последовательность зародышевой линии отличается от нуклеотидных последовательностей, кодирующих антитела в зрелых В-клетках, которые были изменены в результате событий рекомбинации и гипермутации в ходе созревания В-клеток. Антитело, которое «использует» конкретную зародышевую линию, имеет нуклеотидную или аминокислотную последовательность, которая наиболее близко соответствует этой нуклеотидной последовательности зародышевой линии или аминокислотной последовательности, которую оно определяет. Такие антитела часто мутируют по сравнению с последовательностью зародышевой линии. Последовательности ДНК зародышевой линии для генов VH и VL человека известны в данной области (см., например, базу данных последовательностей зародышевой линии человека «Vbase»; см. также Kabat, E.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson et al., J. Mol. Biol. 1992; 227:776-798; and Cox et al., Eur. J. Immunol. 1994; 24:827-836).
Антитела против E-селектина
[0132] В раскрытии представлены антитела и их антигенсвязывающие фрагменты, которые связываются с E-селектином. E-селектин также известен как член E антигеноподобного семейства CD62 (CD62E), молекула 1 адгезии лейкоцитов в эндотелии (ELAM-1) или молекула 2 адгезии лейкоцитов на эндотелиальных клетках (LECAM2).
[0133] В рамках настоящего изобретения термин «Е-селектин» включает варианты, изоформы, гомологи, ортологи и паралоги Е-селектина человека. В некоторых вариантах реализации изобретения антитело или его антигенсвязывающий фрагмент, раскрытые в настоящем документе, перекрестно реагируют с Е-селектином видов, отличных от человека, таким как Е-селектин яванского макака, а также с различными формами Е-селектина. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент могут быть полностью специфичными в отношении Е-селектина человека и могут не проявлять перекрестной реактивности между видами (например не связывать Е-селектин мыши) или других типов перекрестной реактивности (например не связывать P-селектин и/или L-селектин). В рамках настоящего изобретения, если в контексте не указано иное, термин Е-селектин относится к природному Е-селектину человека. Следовательно, «антитело к Е-селектину или его антигенсвязывающий фрагмент», «антитело против Е-селектина или его антигенсвязывающий фрагмент» или другое подобное обозначение означает любое антитело или его антигенсвязывающий фрагмент (согласно определению в настоящем документе), который специфически и/или предпочтительно входит в ассоциацию, связывается или реагирует с Е-селектином, его изоформой, фрагментом или производным. Полноразмерная зрелая форма E-селектина человека, представленная в UniProtKB/Swiss-Prot под регистрационным номером P16581 (аминокислоты 22-610), представлена в настоящем документе как SEQ ID NO: 132. Полноразмерная зрелая форма E-селектина мыши, представленная в UniProtKB/Swiss-Prot под регистрационным номером Q00690 (аминокислоты 22-612), представлена в настоящем документе как SEQ ID NO: 134. Полноразмерная зрелая форма E-селектина яванского макака, представленная в UniProtKB/Swiss-Prot под регистрационным номером G8F370 (аминокислоты 22-610), представлена в настоящем документе как SEQ ID NO: 201.
[0134] E-селектин экспрессируется на эндотелиальных клетках, L-селектин конститутивно экспрессируется на микроворсинках лейкоцитов, а P-селектин хранится в α-гранулах тромбоцитов и тельцах Вейбеля-Паладе эндотелиальных клеток (Tedder et al., FASEB J. 1995; 9:866-873; Kanas et al., Blood 1996; 88:3259-3287). Все они связываются с углеводными структурами с детерминантой сиалил-Льюис (sLex) на гликопротеинах или гликолипидах (Chase et al., Ann. Biomed. Eng. 2012; 40(4):849-885). P- и L-селектины также требуют сульфатирования лиганда для оптимального связывания, в то время как связывание E-селектина с лигандами является более пермиссивным, требуя только детерминант сиалил-Льюис. Лиганд-1 гликопротеина P-селектина (PSGL-1) экспрессируется на лейкоцитах и связывается со всеми селектинами. E-селектин также взаимодействует с лигандами, включая лиганд L-селектина, CD44 и лиганд E-селектина-1 (ESL-1) (Chase et al., Ann. Biomed. Eng. 2012; 40(4):849-885; Hidalgo et al., Immunity 2007; 26(4):477-489).
[0135] Экспрессия Е-селектина эндотелиальными клетками требует синтеза нового белка в ответ на гипоксию или воспалительный стимул. E-селектин имеет решающее значение для прикрепления нейтрофилов к эндотелию и генерации волн активирующих сигналов на эндотелии, которые вызывают поляризованную экспрессию активированного интегрина αMβ2 (Hidalgo et al., Nat. Med. 2009; 15:384-391; Pruenster et al., Nat. Commun. 2015; 6:6915; Manwani, & Frenette, Blood 2014; 122:3892-3898). Мыши с дефицитом Е-селектина не проявляют явного фенотипа, отличимого от мышей дикого типа (Labow et al., Immunity 1994; 1:709-720).
[0136] В дополнение к Е-селектину эндотелиальных клеток в кровотоке обнаружен растворимый Е-селектин (sE-селектин). Механизм высвобождения sE-селектина в кровоток может представлять собой ферментативное расщепление или результат выделения поврежденных или активированных эндотелиальных клеток; однако точный механизм неизвестен (Roldan et al., Thromb. Haemost. 2003; 90:1007-1020). Похоже концентрация sE-селектина коррелирует с его экспрессией на поверхности эндотелиальных клеток, поэтому концентрация sE-селектина в плазме может быть маркером повреждения или активации эндотелиальных клеток (Leeuwenberg et al., Immunology 1992; 77(4):543-549; Roldán et al., Thromb. Haemost. 2003; 90:1007-1020). Повышенные уровни циркулирующего растворимого Е-селектина были обнаружены при ряде болезненных состояний, включая гипертензию, диабет и гиперлипидемию (Roldan et al., Thromb. Haemost. 2003; 90:1007-1020). Kato с соавторами изучили 160 пациентов с SCD и 41 контрольного субъекта и обнаружили, что растворимый Е-селектин был значительно повышен в плазме пациентов с SCD по сравнению с контролем (медиана 74,6±41,5 нг/мл, p<0,001) (British J. Haem. 2005; 130:943-953). Низкие и умеренные уровни легочной гипертензии были в значительной степени связаны с линейной концентрацией sE-селектина и имели повышенный относительный риск ранней смертности у пациентов с SCD (RR 4,2; 95% CI 2,0, 8,9) (Kato et al.).
[0137] Предпочтительно антитела и их антигенсвязывающие фрагменты согласно настоящему изобретению связываются с Е-селектином, но не связываются или связываются с меньшей аффинностью с другими селектинами (например, Р-селектином, L-селектином). В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты согласно настоящему изобретению специфически связывают Е-селектин и, более предпочтительно, специфически связывают Е-селектин человека и/или Е-селектин яванского макака. В описании также представлены композиции, содержащие такие антитела и их антигенсвязывающие фрагменты, а также применение таких антител, включая терапевтическое и фармацевтическое применение.
[0138] Антитело против Е-селектина, предпочтительно, высокоаффинное антитело (например, специфическое антитело), может быть эффективным в сосудистой системе и множестве тканевых компартментов, где Е-селектин экспрессируется на поверхности эндотелиальных клеток, или находится в растворимой форме и, как полагают, взаимодействует с клетками-мишенями (например, нейтрофилами, моноцитами, эозинофилами, эффекторными Т-подобными лимфоцитами памяти, натуральными клетками-киллерами, миелоидными клетками), экспрессирующими лиганды Е-селектина. Антитела и их антигенсвязывающие фрагменты согласно настоящему изобретению обладают способностью ингибировать связывание Е-селектина с лигандами, включая, например, гликопротеины или гликолипиды с детерминантой сиалил-Льюис (sLex) (например, α2,3-сиалилированный и α1,3 или α1,4 фукозилированный тетрасахарид сиалил-Льюис х), детерминанта сиалил-Льюис А, лиганд-1 E-селектина (ESL-1), L-селектин, CD44, гликопротеиновый лиганд-1 P-селектина (PSGL-1), ассоциированный с лизосомами мембранный белок 1 (LAMP1), ассоциированный с лизосомами мембранный белок 2 (LAMP2), рецептор смерти-3 (DR3) и интегрин αMβ2 (CD11b/CD18; Mac-1) (Chase et al., Annals Biomed. Engin. 2012; 40(4): 849-859). Не желая связывать себя какой-либо конкретной теорией, блокада взаимодействия E-селектина с клеточным лигандом ингибирует прилипание лейкоцитов (например, нейтрофилов) к эндотелию, предотвращая блокирование кровотока клеточными агрегатами и приводя к VOC.
[0139] Нейтрализующее или «блокирующее» антитело относится к антителу, связывание которого с Е-селектином (i) препятствует, ограничивает или ингибирует взаимодействие между Е-селектином или фрагментом Е-селектина и лигандом Е-селектина, таким как детерминанта sLex; и/или (ii) приводит к ингибированию по меньшей мере одной биологической функции связывания Е-селектина. Анализы для определения нейтрализации антителом согласно настоящему изобретению описаны в других разделах настоящего документа и хорошо известны в данной области.
[0140] «Биологическая функция» или «биологическая активность» Е-селектина включает связывание лейкоцитов, медленное движение и активацию стабильной адгезии лейкоцитов к эндотелиальным клеткам, селективную и эффективную передачу сигналов экстравазации в местах воспаления. «Биологическая функция» или «биологическая активность» E-селектина включает опосредование увеличения: аффинности и авидности интегринов CD18 для поддержки замедления PMN и доставки к местам острого воспаления, цитозольный кальций, фосфорилирование тирозина для активации киназы p38 MAP и киназы Syk, среди прочего, что известно в данной области или будет идентифицировано позже. Биологическая функция или биологическая активность Е-селектина может быть, но не обязательно опосредована взаимодействием между Е-селектином и его лигандами.
[0141] Настоящее изобретение включает антитело или его антигенсвязывающий фрагмент, которые могут модулировать биологическую активность Е-селектина. То есть изобретение включает выделенное антитело или его антигенсвязывающий фрагмент, которое специфически связывает Е-селектин и модулирует по меньшей мере одну обнаруживаемую активность Е-селектина, так что антитело: (а) снижает прикрепление лейкоцитов к эндотелиальным клеткам; b) снижает активацию стабильной адгезии к эндотелиальным клеткам; (c) уменьшает медленное движение лейкоцитов до остановки; (d) снижает эффективную трансэндотелиальную миграцию лейкоцитов; (e) снижает аффинность и авидность интегринов CD18; (f) снижает перенос лейкоцитов в места острого воспаления; (g) уменьшает цитозольный кальций; (h) уменьшает фосфорилирование тирозина, которое активирует киназу p38 MAP и киназу Syk; (i) уменьшает рекрутирование тромбоцитов и лейкоцитов из крови в эндотелий сосудов; и/или (j) не создает провоспалительную среду.
[0142] Биологическую активность Е-селектина можно оценить в анализах связывания со статической нейтрализацией in vitro с использованием Е-селектина (например, растворимого Е-селектина или клеток СНО, экспрессирующих Е-селектин) и лиганда (например, растворимого лиганда сиалил-Льюис или лиганда, экспрессируемого на клеточной поверхности (например, на клетках HL-60)). Связывание Е-селектина можно также оценить с использованием растворимых или экспрессируемых на клеточной поверхности белков в физиологических проточных анализах, известных в данной области и изложенных в разделе настоящего описания «Примеры». Способность нейтрализующих антител предотвращать связывание Е-селектина можно также оценить путем инкубации клеток, экспрессирующих Е-селектин (например, человека, яванского макака), с растворимым антигеном сиалил-Льюис или лигандом Е-селектина экспрессирующимся на клеточной поверхности (например, на клетках HL-60, HUVEC, CLMEC) в отсутствие или в присутствии возрастающих концентраций антитела против Е-селектина или его антигенсвязывающего фрагмента.
[0143] В некоторых вариантах осуществления антитело против Е-селектина согласно настоящему изобретению включает антитело, которое конкурирует за связывание с Е-селектином человека и/или связывает тот же эпитоп, что и антитело, или его антигенсвязывающий фрагмент, имеющий аминокислотную последовательность вариабельной области тяжелой цепи, приведенную в SEQ ID NO: 11, и аминокислотную последовательность вариабельной области легкой цепи, приведенную в SEQ ID NO: 5.
[0144] В некоторых вариантах осуществления антитело против Е-селектина или его антигенсвязывающий фрагмент согласно настоящему изобретению включает антитело или его антигенсвязывающий фрагмент, которое ингибирует или снижает связывание Е-селектина по меньшей мере с одним лигандом Е-селектина (например гликопротеинов или гликолипидов с детерминантой сиалил-Льюис (sLex) (например α2,3 сиалилированным и α1,3 или α1,4 фукозилированным тетрасахаридом сиалил-Льюис X), детерминантой сиалил-Льюис А, ESL-1, L-селектином, CD44, PSGL-1, LAMP1, LAMP2, DR3 и интегрином αMβ2 (CD11b/CD18; Mac-1)).
[0145] В некоторых вариантах осуществления настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые конкурируют с антителом или его антигенсвязывающим фрагментом, имеющим аминокислотную последовательность вариабельной области тяжелой цепи, приведенную в SEQ ID NO.:11, и аминокислотную последовательность вариабельной области легкой цепи, приведенную в SEQ ID NO: 5, при ингибировании связывания Е-селектина с лигандом.
[0146] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению включает константную область тяжелой цепи IgG1, например, тяжелую цепь антитела против Е-селектина, приведенную в SEQ ID NO: 7 или SEQ ID NO: 13 (без С-концевого лизина). В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент включает константную область легкой цепи каппа, например, легкую цепь антитела против Е-селектина, приведенную в SEQ ID NO: 1.
[0147] Антитела против Е-селектина согласно настоящему изобретению могут включать моноклональные антитела, поликлональные антитела, фрагменты антител (например Fab, Fab', F(ab')2, Fv, Fc и так далее), химерные антитела, биспецифические антитела, гетероконъюгированные антитела, одноцепочечные (ScFv), их мутанты, слитые белки, содержащие фрагмент антитела (например, доменное антитело), гуманизированные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит участок распознавания антигена требуемой специфичности, включая варианты гликозилирования антител, варианты аминокислотной последовательности антител и ковалентно модифицированные антитела. Антитела могут быть мышиного, крысиного, человеческого или любого другого происхождения (включая химерные или гуманизированные антитела). В некоторых вариантах осуществления антитело против Е-селектина представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело против Е-селектина представляет собой человеческое или гуманизированное антитело. В некоторых вариантах осуществления антитело против Е-селектина представляет собой химерное антитело.
[0148] В Таблице 2 представлены аминокислотные и нуклеотидные последовательности для химерных и гуманизированных антител против Е-селектина, как описано в настоящем документе. Как правило, если не указано иное, антитела против Е-селектина согласно настоящему изобретению могут включать любую комбинацию одного или нескольких CDR. В некоторых вариантах осуществления антитела против Е-селектина согласно настоящему изобретению могут включать любую комбинацию одной или нескольких последовательностей VH и/или VL, как указано в Таблице 2, с конкретными антителами, определенными SEQ ID NO: в Таблице 3. CDR VH и VL антител против Е-селектина были определены с использованием определения Kabat с расширенным H1. Для HCDR-1 последний остаток включает любую вставку перед положением H36 (то есть H35a, H35b, H35c и так далее). CDR были определены следующим образом: HCDR-1 (от H26 до H35c), HCDR-2 (от H50 до H65), HCDR-3 (от H95 до H102), LCDR-1 (от L24 до L34), LCDR-2 (от L50 до L56) и LCDR-3 (от L89 до L87).
[0149] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат HC, LC, домен VL и/или домен VH, содержащий аминокислотную последовательность, по меньшей мере на 80%, 85%, 90%, 91%, 92, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности Таблицы 2. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат HC, LC, домен VL и/или домен VH, закодированный последовательностью нуклеиновой кислоты, по меньшей мере на 80%, 85%, 90%, 91%, 925, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную последовательности нуклеиновой кислоты Таблицы 2.
[0150]
[0151]
оптимизированное
гуманизированные
гуманизированные
химера
оптимизированное
оптимизированное
оптимизированное
гуманизированные
химера
гуманизированные
химера
гуманизированные
химера
гуманизированные
химера
гуманизированные
химера
химера
[0152] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VH, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 11. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VH, содержащий или состоящий из аминокислоты SEQ ID NO: 11.
[0153] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VH, который может содержать аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности любой из SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VH, который может содержать или состоять из аминокислотной последовательности любой из SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128.
[0154] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 5. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий или состоящий из аминокислотной последовательности, по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 5.
[0155] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, который может содержать аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности любой из SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116 и 122. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, который может содержать или состоять из аминокислотной последовательности любой из SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116 и 122.
[0156] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 5, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 11. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 5, и домен VH, содержащий аминокислотную последовательность любой из SEQ ID NO: 39, 42 или 45. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 21, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 25. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 27, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 30. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 32, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 35. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 50, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 55. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 57, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 60. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 71, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 66. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 73, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 75. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 85, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 80. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 87, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 90. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 100, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 95. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 102, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 104. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 109, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 114. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 116, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 118. Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность SEQ ID NO: 122, и домен VH, содержащий аминокислотную последовательность SEQ ID NO: 128.
[0157] Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать домен VL, содержащий аминокислотную последовательность любой из SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116 и 122, и домен VH, содержащий аминокислотную последовательность любой из SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128.
[0158] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат LCDR-1, LCDR-2 и LCDR-3, приведенные по меньшей мере в одной из аминокислотных последовательностей SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116 и 122.
[0159] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты дополнительно содержат HCDR-1, HCDR-2 и HCDR-3, приведенные по меньшей мере в одной из аминокислотных последовательностей SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128.
[0160] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат LCDR-1, LCDR-2, LCDR-3, приведенные в аминокислотной последовательности SEQ ID NO: 5, и HCDR-1, HCDR-2 и HCDR-3, приведенные в аминокислотной последовательности SEQ ID NO: 11.
[0161] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат LCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 2, LCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 3, и LCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат HCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 8, HCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 9, и HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат HCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 8, HCDR-2, содержащую аминокислотную последовательность любой из SEQ ID NO: 38, 41 или 44, и HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10.
[0162] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат LCDR-1, содержащую аминокислотную последовательность любой из SEQ ID NO: 2, 18, 47, 68, 82, 97 или 106, LCDR-2, содержащую аминокислотную последовательность любой из SEQ ID NO: 3, 19, 48, 69, 83, 98, 107 или 120, и LCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 4, 20, 49, 70, 84, 99, 108 или 121. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат HCDR-1, содержащую аминокислотную последовательность SEQ ID NO: 8, 23, 52, 63, 77, 92, 111 или 125, HCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 9, 24, 29, 38, 41, 44, 53, 64, 78, 93, 112 или 126, и HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10, 54, 65, 79, 94, 113 или 127.
[0163] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат LCDR-1, LCDR-2 и LCDR-3, приведенные в аминокислотной последовательности, закодированной вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
[0164] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат HCDR-1, HCDR-2 и HCDR-3, приведенные в аминокислотной последовательности, закодированной вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529.
[0165] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат аминокислотные последовательности LCDR-1, LCDR-2 и LCDR-3, закодированные вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530, и аминокислотные последовательности HCDR-1, HCDR-2 и HCDR-3, закодированные вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529.
[0166] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат вариабельную область легкой цепи, содержащую аминокислотную последовательность, закодированную вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
[0167] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, закодированную вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529.
[0168] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат легкую цепь, содержащую аминокислотную последовательность, закодированную вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126530.
[0169] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат тяжелую цепь, содержащую аминокислотную последовательность, закодированную вставкой плазмиды, депонированной в ATCC и имеющей учетный номер PTA-126529.
[0170] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать LC, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат или состоят из аминокислотной последовательности SEQ ID NO: 1
[0171] LC может содержать аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности любой из SEQ ID NO: 1, 17, 26, 31, 46, 56, 67, 72, 81, 86, 96, 101, 105, 115 или 119. В некоторых вариантах осуществления LC антитела может содержать аминокислотную последовательность, содержащую или состоящую из любой SEQ ID NO: 1, 17, 26, 31, 46, 56, 67, 72, 81, 86, 96, 101, 105, 115 или 119.
[0172] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать HC, содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности SEQ ID NO: 7 или 13. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать HC, содержащую или состоящую из аминокислотной последовательности, по меньшей мере на 90% идентичной аминокислотной последовательности SEQ ID NO: 7 или 13.
[0173] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать тяжелую цепь, содержащую аминокислотную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности любой из SEQ ID NO: 7, 13, 22, 28, 34, 37, 40, 43, 51, 59, 62, 74, 76, 89, 91, 103, 110, 117 или 124. В некоторых вариантах осуществления HC антитела может содержать аминокислотную последовательность, содержащую или состоящую из любой SEQ ID NO: 7, 13, 22, 28, 34, 37, 40, 43, 51, 59, 62, 74, 76, 89, 91, 103, 110, 117 или 124.
[0174] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат LC, содержащую или состоящую из аминокислотной последовательности SEQ ID NO: 1, и HC, содержащую или состоящую из аминокислотной последовательности SEQ ID NO: 7 или SEQ ID NO: 13. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты не имеют эффекторной функции (то есть являются нулевым эффектором).
[0175] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать тяжелую цепь, содержащую домен VH, содержащий аминокислотную последовательность любой из SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128 (например SEQ ID NO: 11), и дополнительно содержат константный домен IgG1 (например константный домен IgG1, содержащий аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 16).
[0176] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат тяжелую цепь, содержащую домен VH, содержащий аминокислотную последовательность SEQ ID NO: 11, и дополнительно содержат константный домен IgG1, содержащий аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 16. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты содержат домен VH, состоящий из аминокислотной последовательности SEQ ID NO: 11, и дополнительно содержат константный домен IgG1, состоящей из аминокислотной последовательности SEQ ID NO: 15 или SEQ ID NO: 16. В некоторых вариантах осуществления антитела против E-селектина не имеют эффекторной функции (функций).
[0177] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют константную область легкой цепи, выбранную, например, из константной области легкой цепи каппа (например человека) (например, закодированной аминокислотной последовательностью SEQ ID NO: 14) или константную область легкой цепи лямбда.
[0178] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат легкую цепь, содержащую домен VL, содержащий аминокислотную последовательность любой из SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116 и 122 (например SEQ ID NO: 5) и дополнительно содержат константный домен каппа, содержащий аминокислотную последовательность SEQ ID NO: 14. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат легкую цепь, содержащую домен VL, состоящий из аминокислотной последовательности SEQ ID NO: 5, и дополнительно содержат константный домен каппа, состоящий из аминокислотной последовательности SEQ ID NO: 14.
[0179] В некоторых вариантах осуществления константную область антител против E-селектина или их антигенсвязывающих фрагментов можно изменять, например подвергать мутагенезу, для модификации свойств антител (например для увеличения или уменьшения одного или нескольких свойств из: связывания Fc-рецептора, гликозолирования антитела, количества остатков цистеина, функции эффекторных клеток и/или функции комплемента).
[0180] В некоторых аспектах вариант антител или их антигенсвязывающих фрагментов содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных или неконсервативных замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 добавлений и/или делеций полноразмерной тяжелой цепи (например HC с аминокислотной последовательностью SEQ ID NO: 7 или 13) и/или полноразмерной легкой цепи. В дополнительном аспекте вариантные антитела обладают по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с полноразмерной тяжелой цепью, и при этом указанные антитела или их антигенсвязывающие фрагменты специфически связывают E-селектин. В дополнительном аспекте вариантные антитела обладают по меньшей мере 65%, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с полноразмерной легкой цепью (например, LC с аминокислотной последовательностью SEQ ID NO: 1), и при этом указанные антитела или их антигенсвязывающие фрагменты специфически связывают E-селектин.
Замены зародышевой линии
[0181] Доступно большое множество акцепторных последовательностей зародышевой линии человека, и процесс «гуманизации» антител нечеловеческих видов для применения у людей хорошо известен в данной области и также обсуждается в других разделах настоящего документа. Таким образом, специалисту в данной области будет понятно, что в контексте аминокислотных последовательностей вариабельного домена человека можно разместить указанные выше последовательности CDR мыши, крысы и так далее. При этом для сохранения связывания антител и других желательных характеристик исходного родительского (то есть донорного) антитела обычно вносят изменения в акцепторных последовательностях зародышевой линии человека. Как CDR, так и каркасные области (FW) могут быть сконструированы следующим образом.
[0182] В определенных вариантах осуществления замена представляет собой замену зародышевой линии человека, в которой для увеличения содержания аминокислот человека и потенциального снижения иммуногенности антител (донорский) остаток CDR заменен соответствующим (акцепторным) остатком зародышевой линии человека, как описано, например, в публикации заявки на патент США №2017/0073395 и Townsend et al. Proc. Nat. Acad. Sci. USA 2015; 112(50):15354-15359, которые обе полностью включены в настоящий документ посредством ссылки.
[0183] Антитела или их антигенсвязывающие фрагменты могут содержать каркас VH, содержащий каркасную последовательность VH зародышевой линии человека. В некоторых аспектах можно использовать каркас VH из следующих зародышевых линий: IGHV1-2*02, IGHV1-3*01, IGHV1-46*01, IGHV1-69*01, IGHV1-69*02, IGHV1-8*01, IGHV3-7*01, IGHV3-13*01, IGHV3-23*01, IGHV3-23*04, IGHV3-30*01, IGHV3-30*18, IGHV5-10-1*01, IGHV5-10-1*04 или IGHV5-51*01 (названия зародышевых линий основаны на определении зародышевой линии IMGT). В некоторых вариантах осуществления в антителах против E-селектина или их антигенсвязывающих фрагментах использован каркас VH из зародышевой линии IGHV3-7*01 (SEQ ID NO: 202). В некоторых вариантах осуществления в антителах против E-селектина или их антигенсвязывающих фрагментах использован каркас VH из зародышевой линии IGHV3-7*01 (SEQ ID NO: 202) для областей CDR и IGHJ4*01 (SEQ ID NO: 203) для каркасной области.
[0184] Предпочтительными каркасами легкой цепи зародышевой линии человека являются каркасы, полученные из зародышевых линий VK или Vλ. В некоторых аспектах можно использовать каркас VL из следующих зародышевых линий: IGKV1-12*01, IGKV1-13*02, IGKV1-33*01, IGKV1-39*01, IGKV1-5*01, IGKV3-11*01, IGKV3-15*01, IGKV3-20*01, IGKV3D-20*02 и IGKV4-1*01 (названия зародышевых линий основаны на определении зародышевой линии IMGT). В некоторых вариантах осуществления в антителах против E-селектина или их антигенсвязывающих фрагментах использован каркас VL из зародышевой линии IGHV1-39*01 (SEQ ID NO: 204). В некоторых вариантах осуществления в антителах против E-селектина или их антигенсвязывающих фрагментах использован каркас VL из зародышевой линии IGHV1-39*01 (SEQ ID NO: 204) для областей CDR и IGKJ1*01 (SEQ ID NO: 205) для каркасной области.
[0185] Альтернативно или в дополнение, каркасной последовательностью может быть консенсусная каркасная последовательность зародышевой линии человека, например каркас консенсусной последовательности Vλ1, консенсусной последовательности VK1, консенсусной последовательности VK2, консенсусной последовательности VK3, консенсусной последовательности зародышевой линии VH3, консенсусной последовательности зародышевой линии VH1, консенсусной последовательности зародышевой линии VH5 или консенсусной последовательности зародышевой линии VH4 человека. Последовательности каркасов зародышевой линии человека доступны в различных общедоступных базах данных, таких как V-base, IMGT, NCBI или Abysis.
[0186] Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать каркас VL, содержащий каркасную последовательность VL зародышевой линии человека. Каркас VL может содержать одну или несколько аминокислотных замен, добавлений или делеций, сохраняя при этом функциональное и структурное сходство с зародышевой линией, из которой он получен. В некоторых аспектах каркас VL по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичен каркасной последовательности VL зародышевой линии человека. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты содержат каркас VL, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 аминокислотных замен, добавлений или делеций по сравнению с каркасной последовательностью VL зародышевой линии человека. В некоторых вариантах осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен, добавлений или делеций находятся только в каркасных областях. В некоторых вариантах осуществления процентная идентичность основана на сходстве с доменом VL за исключением тех частей, которые в настоящем документе определены как CDR.
[0187] Каркасом VL зародышевой линии человека может быть, например, каркас IGKV1-39*01. Каркасом VL зародышевой линии человека может быть, например, каркас IGKV1-33*01. Каркасом VL зародышевой линии человека может быть каркас любой консенсусной последовательности человека, включая: Vλ, Vλ1, Vλ3, VK, VK1, VK2 или VK3.
[0188] В некоторых вариантах осуществления каркасом VL является IGK-39*01_IGKJ1*01. Также предполагается, что другие аналогичные каркасные области будут доставлять предпочтительные антитела согласно изобретению, содержащие CDR SEQ ID NO: 2-4, 18-20, 47-49, 68-70, 82-84, 97-99, 106-108, 120 и 121; и CDR, обозначенные следующими аминокислотными последовательностями VL: SEQ ID NO: 5, 21, 27, 32, 50, 57, 71, 73, 85, 87, 100, 102, 109, 116, 122, которые могут обладать 99%, 97%, 97%, 96%, 80%, 76%, 74% и 66% идентичностью, соответственно, с каркасной областью любого из IGKV1-12*01, IGKV1-13*02, IGKV1-33*01, IGKV1-39*01, IGKV1-5*01, IGKV3-11*01, IGKV3-15*01, IGKV3-20*01, IGKV3D-20*02 и IGKV4-1*01. В некоторых вариантах осуществления процентная идентичность основана на сходстве с VL за исключением тех частей, которые в настоящем документе определены как CDR.
[0189] Антитела против E-селектина или их антигенсвязывающие фрагменты могут содержать каркас VH, содержащий каркасную последовательность VH зародышевой линии человека. Каркас VH может содержать одну или несколько аминокислотных замен, добавлений или делеций, сохраняя при этом функциональное и структурное сходство с зародышевой линией, из которой он получен. В некоторых аспектах каркас VH по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичен каркасной последовательности VH зародышевой линии человека. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты содержат каркас VH, содержащий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 аминокислотных замен, добавлений или делеций по сравнению с каркасной последовательностью VH зародышевой линии человека. В некоторых вариантах осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен, добавлений или делеций находятся только в каркасных областях. В некоторых вариантах осуществления процентная идентичность основана на сходстве с доменом VH за исключением тех частей, которые в настоящем документе определены как CDR.
[0190] каркасом VH зародышевой линии человека может быть, например, каркас IGHV3-7*01. Каркасом VH зародышевой линии человека может быть, например, каркас IGHV1-46*01. Каркасом VH зародышевой линии человека может быть, например, IGHV1-69*01. Каркасом VH зародышевой линии человека может быть каркас консенсусной последовательности зародышевой линии VH человека. Каркасом VH зародышевой линии человека может быть каркас консенсусной последовательности зародышевой линии человека, включая: VH3, VH5, VH1 или VH4.
[0191] В некоторых вариантах осуществления каркасом VH является IGHV3-7*01 Также предполагается, что другие аналогичные каркасные области будут доставлять предпочтительные антитела согласно изобретению, содержащие CDR SEQ ID NO: 8-10, 23, 24, 29, 38, 41, 44, 52-54, 63-65, 77-79, 92-94, 111-113, 125-127, и CDR, обозначенные любыми следующими аминокислотными последовательностями VH: SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118, 128, включая IGHV1-2*02, IGHV1-3*01, IGHV1-46*01, IGHV1-69*01, IGHV1-69*02, IGHV1-8*01, IGHV3-7*01, IGHV3-13*01, IGHV3-23*01, IGHV3-23*04, IGHV3-30*01, IGHV3-30*18, IGHV5-10-1*01, IGHV5-10-1*04 или IGHV5-51*01, которые могут иметь 92, 93, 94, 95, 96, 97, 98, 99% идентичность, соответственно, с областью FW DP-54 и одно или менее аминокислотных отличий общих структурных признаков (нумерация Kabat) В некоторых аспектах процентная идентичность основана на сходстве с доменом VH за исключением тех частей, которые в настоящем документе определены как CDR.
[0192] В определенных вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, содержат (i) домен VH, содержащий аминокислотную последовательность, которая по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична аминокислотной последовательности SEQ ID NO: 11 и/или (ii) домен VL, содержащий аминокислотную последовательность, которая по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 66%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 76%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична аминокислотной последовательности SEQ ID NO: 5. Изобретение также охватывает любую комбинацию этих последовательностей VL и VH.
[0193] В определенных вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, содержат (i) HC, содержащую аминокислотную последовательность, которая по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична аминокислотной последовательности SEQ ID NO: 7 или SEQ ID NO: 13; и/или (ii) LC, содержащую аминокислотную последовательность, которая по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична аминокислотной последовательности SEQ ID NO: 1. Изобретение также охватывает любую комбинацию этих последовательностей HC и LC.
[0194] В определенных вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, содержат Fc-домен. Fc-домен может быть получен из IgA (например, IgA1 или IgA2), IgG, IgE или IgG (например IgG1, IgG2, IgG3 или IgG4). В некоторых вариантах осуществления антитела против E-селектина представляют собой и IgG1 антитела.
Биологическую активность антител против E-селектина
[0195] В дополнение к связыванию эпитопа на E-селектине антитела или их антигенсвязывающие фрагменты согласно раскрытию могут опосредовать биологическую активность. То есть раскрытие включает в себя выделенные антитела или их антигенсвязывающие фрагменты, которые специфически связывают E-селектин и опосредуют по меньшей мере одну поддающуюся обнаружению активность, выбранную из следующего:
(i) специфически связываются с E-селектином человека
(ii) специфически связываются с E-селектином яванского макака;
(iii) уменьшают, ингибируют и/или нейтрализуют взаимодействие (например, связывание) между растворимым E-селектином (например, человека, яванского макака) и лигандом E-селектина (например, лигандом сиалил-Льюис А и/или сиалил-Льюис X);
(iv) уменьшают, ингибируют и/или нейтрализуют взаимодействие (например, связывание) между экспрессируемым на клеточной поверхности E-селектином (например, человека, яванского макака) и лигандом E-селектина (например, лигандом сиалил-Льюис А и/или сиалил-Льюис X);
(v) уменьшают, ингибируют и/или нейтрализуют взаимодействие (например, адгезию) между экспрессируемым на клеточной поверхности E-селектином (например, человека, яванского макака) и экспрессируемыми на клеточной поверхности лигандами E-селектина (например, лигандом сиалил-Льюис А и/или сиалил-Льюис X, например, на клетках HL-60);
(vi) уменьшают, ингибируют и/или нейтрализуют взаимодействие (например, адгезию) растворимого E-селектина с клетками, экспрессирующими лиганд E-селектина (например, HL-60);
(vii) уменьшают, ингибируют и/или нейтрализуют адгезию клеток, экспрессирующих лиганд E-селектина (например, HL-60) с клетками, экспрессирующими E-селектин в статических условиях и условиях физиологического потока;
(viii) уменьшают, ингибируют и/или нейтрализуют адгезию активированных нейтрофилов человека с клетками, экспрессирующими E-селектин (например, человека и яванского макака) в условиях физиологического потока;
(ix) связываются по меньшей мере с одним аминокислотным остатком, выбранным из: T7, E8, A9, M10, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, N105, E107, R108, S110, K111, K112 и K113 E-селектина человека;
(x) имеют вязкость примерно 38 +/- 7 сП при концентрации примерно 187 мг/мл при 25°C;
(xi) имеют период полужизни примерно 21,5 дней (518 часов) при введении SC в дозе 3 мг/кг;
(xii) проявляют подходящие свойства готовых форм, включая высокую степень термической стабильности и минимальную агрегацию при высокой концентрации; и
(xiii) могут проявлять воспроизводимую экспрессию и чистоту в условиях крупномасштабного производства.
[0196] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты обладают аффинностью связывания, выражаемой как KD для растворимого E-селектина человека, равного или меньшего 200 нМ, например равного или меньшего 195 нМ, 190 нМ, 180 нМ, 160 нМ, 140 нМ, 120 нМ, 110 нМ, 100 нМ, 90 нМ, 80 нМ, 75 нМ, 50 нМ. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты обладают аффинностью связывания, выражаемой как KD для растворимого E-селектина человека, равного или меньшего 200 нМ при измерении с помощью SPR. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты обладают аффинностью связывания, выражаемой как KD для растворимого E-селектина человека, составляющего от примерно 61,8 до примерно 68,4 +/- 3,18 нМ при измерении, например, с помощью SPR.
[0197] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты обладают аффинностью связывания, выражаемой как KD, для растворимого E-селектина яванского макака, равного или меньшего 200 нМ, например равного или меньшего 195 нМ, 190 нМ, 180 нМ, 160 нМ, 140 нМ, 120 нМ, 110 нМ, 100 нМ, 90 нМ, 80 нМ, 75 нМ, 50 нМ. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты обладают аффинностью связывания, выражаемой как KD, для растворимого E-селектина яванского макака, составляющий от примерно 64,9 +/- 1,13 нМ до примерно 81,5 нМ при измерении, например, с помощью SPR.
[0198] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином человека, выражаемой в виде EC50, равной 50 нМ или менее, например равной 48 нМ, 45 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,1 нМ или менее, при измерении, например, с помощью FACS. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином человека, выражаемой в виде EC50, составляющей примерно 0,66 нМ при измерении, например, с помощью FACS.
[0199] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином яванского макака, выражаемой в виде EC50, равной 50 нМ или менее, например равной 48 нМ, 45 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,1 нМ или менее, при измерении, например, с помощью FACS. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином яванского макака, выражаемой в виде EC50, составляющей примерно 0,75 нМ при измерении, например, с помощью FACS.
[0200] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты обладают аффинностью связывания с экспрессируемым на клеточной поверхности E-селектином человека, выражаемой в виде EC50, равной 350 нМ или более, например равной 400 нМ, 450 нМ, 500 нМ, 550 нМ, 600 нМ, 650 нМ или более при измерении, например, с помощью FACS.
[0201] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты слабо связываются или не связываются с растворимым E-селектином крысы, мыши или кролика или растворимым L- или P-селектином человека. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты не связываются с растворимым E-селектином крысы, мыши или кролика или растворимым L- или P-селектином человека до 405 нМ при измерении, например, с помощью SPR. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты демонстрируют слабое связывание без насыщения (например >100 раз ниже) с растворимым E-селектином мыши или крысы до 133,3 нМ при измерении, например, с помощью прямого связывания ELISA.
[0202] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты связываются с растворимым E-селектином человека с EC50, равной 2 нМ или менее, например равной 0,010 нМ, 0,015 нМ, 0,020 нМ, 0,025 нМ, 0,030 нМ, 0,035 нМ, 0,040 нМ, 0,045 нМ, 0,05нМ, 0,055 нМ, 0,06 нМ, 0,065 нМ, 0,070 нМ, 0,075 нМ, 0,080 нМ, 0,085 нМ, 0,090 нМ, 0,10 нМ, 0,12 нМ, 0,15 нМ, 0,2 нМ, 0,5 нМ, 0,9 нМ, 0,95 нМ, 1 нМ, 1,5 нМ, 1,8 нМ или 1,9 нМ или менее. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты связываются с растворимым E-селектином человека с EC50 от примерно 0,085 нМ до примерно 0,12 при измерении, например, с помощью прямого связывания ELISA.
[0203] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с EC50, равной 2 нМ, например равной или менее 0,010 нМ, 0,015 нМ, 0,020 нМ, 0,025 нМ, 0,030 нМ, 0,035 нМ, 0,040 нМ, 0,045 нМ, 0,05нМ, 0,055 нМ, 0,06 нМ, 0,065 нМ, 0,070 нМ, 0,075 нМ, 0,080 нМ, 0,085 нМ, 0,090 нМ, 0,10 нМ, 0,12 нМ, 0,15 нМ, 0,2 нМ, 0,5 нМ, 0,9 нМ, 0,95 нМ, 1 нМ, 1,5 нМ, 1,8 нМ или 1,9 нМ или менее, при измерении, например, с помощью гомогенного конкурентного анализа AlphaLisa.
[0204] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты связываются с растворимым E-селектином яванского макака с EC50, равной 1 нМ или менее, например равной 0,010 нМ, 0,015 нМ, 0,020 нМ, 0,025 нМ, 0,030 нМ, 0,035 нМ, 0,040 нМ, 0,045 нМ, 0,05нМ, 0,055 нМ, 0,06 нМ, 0,065 нМ, 0,070 нМ, 0,075 нМ, 0,080 нМ, 0,085 нМ, 0,090 нМ, 0,10 нМ, 0,12 нМ, 0,15 нМ, 0,2 нМ, 0,5 нМ, 0,9 нМ или 0,95 нМ, или менее. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты связываются с растворимым E-селектином яванского макака с EC50 от 0,071 нМ до 0,093 нМ при измерении, например, с помощью прямого связывания ELISA.
[0205] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты связывают свободный растворимый E-селектин человека в сыворотке человека с IC50 от примерно 1 нМ до примерно 3 нМ и предпочтительно с IC50 примерно 1,2 нМ.
[0206] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с IC50, равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или 1 нМ, или менее при измерении, например, с помощью конкурентного ELISA в статических условиях. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с IC50 от примерно 2,87 нМ до примерно 3,01 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
[0207] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином яванского макака с IC50, равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или 1 нМ, или менее при измерении, например, с помощью конкурентного ELISA в статических условиях. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином яванского макака с IC50 от примерно 2,39 нМ до примерно 2,91 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
[0208] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином человека с IC50, равной 50 нМ или менее, например, равной 48 нМ, 45 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ, или менее при измерении, например, с помощью конкурентного ELISA в статических условиях. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 1,88 нМ до примерно 2,89 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
[0209] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50, равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или 1 нМ, или менее при измерении, например, с помощью конкурентного ELISA в статических условиях. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 от примерно 1,47 нМ до примерно 2,65 нМ при измерении, например, с помощью конкурентного ELISA в статических условиях.
[0210] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50, равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или 1 нМ, или менее при измерении, например, в статических условиях. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 3,36 нМ до примерно 4,7 нМ при измерении, например, в статических условиях.
[0211] В некоторых вариантах осуществления антитела против E-селектина (например антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 примерно 3,84 нМ при измерении, например, в статических условиях.
[0212] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 , равной 100 нМ или менее, например равной 95 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или 1 нМ, или менее при измерении, например, в условиях физиологического потока. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 от примерно 4,25 нМ до примерно 4,56 нМ при измерении, например, в условиях физиологического потока.
[0213] В некоторых вариантах осуществления антитела против E-селектина (например антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 от примерно 4,32 нМ до примерно 4,35 нМ при измерении, например, в условиях физиологического потока.
[0214] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с растворимым E-селектином человека с IC50 , равной 300 нМ или менее, например, равной 290 нМ, 280 нМ, 270 нМ, 260 нМ, 250 нМ, 150 нМ, 100 нМ, 90 нМ, 100 нМ, 90 нМ, 80 нМ, 70 нМ, 60 нМ, 50 нМ, 40 нМ, 20 нМ, 20 нМ, 5 нМ, 2 нМ или 1 нМ, или менее, при измерении, например, в условиях физиологического потока. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с растворимым E-селектином человека с IC50 от примерно 13,28 нМ до примерно 15,94 нМ при измерении, например, в условиях физиологического потока.
[0215] В некоторых вариантах осуществления антитела против E-селектина (например антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию активированных нейтрофилов человека с экспрессируемым на клеточной поверхности E-селектином человека или экспрессируемым на клеточной поверхности E-селектином яванского макака с IC50 от примерно 2,87 нМ до примерно 4,65 нМ или от 9,45 нМ до примерно 16,33 нМ при измерении, например, в условиях физиологического потока. В некоторых вариантах осуществления нейтрофилы активирует TNF-α.
[0216] В некоторых вариантах осуществления антитела против E-селектина (например антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток крови пациентов с SCD с растворимым E-селектином человека с IC50 от примерно 6,17 нМ до примерно 18,66 нМ при измерении, например, в условиях физиологического потока. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты ингибируют адгезию клеток крови пациентов с SCD с растворимым E-селектином человека с IC50 примерно 12,4 нМ при измерении, например, в условиях физиологического потока.
[0217] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты связываются по меньшей мере с одним из трех эпитопов E-селектина человека при определении, например, с помощью конкурентного анализа с использованием, например, биосенсора Octet.
[0218] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты связываются по меньшей мере с одним, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 или более аминокислотными остатками E-селектина человека, выбранным из группы, состоящей из T7, E8, A9, M10, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, N105, E107, R108, S110, K111, K112, K113 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0219] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками T7, E8, A9, M10, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, N105, E107, R108, S110, K111, K112 и K113 E-селектина человека, необязательно в соответствии с кристаллической структурой.
[0220] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 или более аминокислотными остатками E-селектина человека в пределах 3,8 Å, выбранными из группы, состоящей из T7, E8, A9, T11, P46, S47, Y48, N82, N83, Q85, E92, Y94, N105, E107, R108, S110, K111, K112 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0221] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками T7, E8, A9, T11, P46, S47, Y48, N82, N83, Q85, E92, Y94, N105, E107, R108, S110, K111 и K112 E-селектина человека в пределах 3,8 Å, необязательно в соответствии с кристаллической структурой.
[0222] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 или более аминокислотными остатками E-селектина человека со скрытой площадью поверхности (Å2) >5 Å2, выбранными из группы, состоящей из T7, E8, A9, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, E107, R108, S110, K111, K112, K113 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0223] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками T7, E8, A9, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, E107, R108, S110, K111, K112 и K113 E-селектина человека со скрытой площадью поверхности (Å2) >5 Å2, необязательно в соответствии с кристаллической структурой.
[0224] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10 или более аминокислотными остатками E-селектина человека посредством водородной связи, выбранными из группы, состоящей из E8, S47, N82, N83, E88, E92, Y94, N105, E107, R108, S110, K112 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0225] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками E8, S47, N82, N83, E88, E92, Y94, N105, E107, R108, S110 и K112 E-селектина человека посредством водородной связи, необязательно в соответствии с кристаллической структурой.
[0226] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним аминокислотным остатком E-селектина человека посредством солевого мостика, выбранным из группы, состоящей из K111, K112 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0227] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками K111 и K112 E-селектина человека посредством солевого мостика, необязательно в соответствии с кристаллической структурой.
[0228] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним аминокислотным остатком E-селектина человека посредством опосредованной водой водородной связи, выбранным из группы, состоящей из R97, K112 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0229] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками R97 и K112 E-селектина человека посредством опосредованной водой водородной связи, необязательно в соответствии с кристаллической структурой.
[0230] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют по меньшей мере с одним, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, более аминокислотными остатками E-селектина человека, который также взаимодействует в пределах 3,8Å контакта аминокислотного остатка sLex, выбранными из группы, состоящей из Y48, N82, N83, E92, Y94, R97, N105, E107 и их комбинации, необязательно в соответствии с кристаллической структурой.
[0231] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты взаимодействуют с аминокислотными остатками Y48, N82, N83, E92, Y94, R97, N105 и E107 E-селектина человека, которые также взаимодействуют в пределах 3,8Å контакта аминокислотного остатка sLex, необязательно в соответствии с кристаллической структурой.
[0232] Связывание или взаимодействие антител против E-селектина или их антигенсвязывающих фрагментов по меньшей мере с одним или более аминокислотными остатками E-селектина человека можно определить согласно способам, известным в данной области, включая анализ кристаллической структуры связанных молекул, как описано в примерах в настоящем документе.
[0233] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют низкий риск полиреактивности при измерении, например, с помощью анализа AC-SINS, анализа связывания ДНК и/или анализа связывания инсулина. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют риск низкой иммуногенности, например, имеют скорректированный балл T-reg примерно -44, -45, -46 или -47.
[0234] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты демонстрировали по меньшей мере один прогнозируемый фармакокинетический (PK) параметр человека при введении IV, выбранный из: (i) системного клиренса от примерно 0,15 мл/ч/кг до примерно 0,39 мл/ч/кг; (ii) явного объема распределения в равновесном состоянии от 22 мл/кг до 36 мл/кг; (iii) среднего периода полужизни от примерно 102 часов до примерно 345 часов. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты, вводимые SC, демонстрируют период полужизни от примерно 243 до примерно 518 часов.
[0235] В некоторых вариантах осуществления средний период полужизни антител против E-селектина или их антигенсвязывающих фрагментов составляет по меньшей мере примерно 102 часа (примерно 4,25 дня) после IV введения в дозе 0,3 мг/кг. В некоторых вариантах осуществления средний период полужизни антител против E-селектина или их антигенсвязывающих фрагментов составляет по меньшей мере примерно 264 часа (примерно 11 дней) после IV введения в дозе 0,6 мг/кг. В некоторых вариантах осуществления средний период полужизни антител против E-селектина или их антигенсвязывающих фрагментов составляет по меньшей мере примерно 188 часов (примерно 7,8 дней) после IV введения в дозе 1,0 мг/кг. В некоторых вариантах осуществления средний период полужизни антител против E-селектина или их антигенсвязывающих фрагментов составляет по меньшей мере примерно 345 часов (примерно 14,4 дней) после IV введения в дозе 10 мг/кг.
[0236] В некоторых вариантах осуществления средний период полужизни антител против E-селектина или их антигенсвязывающих фрагментов составляет по меньшей мере примерно 243 часа (примерно 10 дней) после SC введения в дозе 1,0 мг/кг. В некоторых вариантах осуществления средний период полужизни антител против E-селектина или их антигенсвязывающих фрагментов составляет по меньшей мере примерно 518 часов (примерно 21,5 дней) после SC введения в дозе 3,0 мг/кг.
[0237] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют вязкость, выбранную из группы, состоящей из примерно 7,97 +/- 1,83 сП при концентрации примерно 23 мг/мл, примерно 12,38 +/- 5,28 сП при концентрации примерно 48 мг/мл, примерно 4,26 +/- 0,6 сП при концентрации примерно 90 мг/мл, примерно 5,58 +/- 0,99 сП при концентрации примерно 102 мг/мл, примерно 8,44 +/- 1,54 сП при концентрации примерно 121 мг/мл, примерно 9,78 +/- 2,32 сП при концентрации примерно 140 мг/мл, примерно 17,47 +/- 3,24 сП при концентрации примерно 158 мг/мл и примерно 37,99 +/- 7,03 сП при концентрации примерно 188 мг/мл при измерении при 25°C, например, с помощью динамического рассеяния света (DLS).
[0238] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют вязкость примерно от 15 сП до 40 сП при концентрации от примерно 150 мг/мл до примерно 190 мг/мл при измерении при 25°C, например, с помощью DLS.
[0239] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют вязкость 33,4 сП при 185,7 мг/мл при измерении при 25°C, например, по методу Anton Parr.
Иммуногенность
[0240] Иммуногенность является основным препятствием для разработки и использования белковых терапевтических средств, включая антитела и Fc-слитые белки. Несколько факторов могут способствовать иммуногенности белка, включая без ограничения последовательность белка, способ и частоту введения, а также популяцию пациентов. Хотя иммунные ответы, как правило, наиболее серьезны для нечеловеческих белков, таких как мышиные антитела, иммуногенными могут быть даже терапевтические средства, в основном или полностью содержащие человеческие последовательности. Иммуногенность представляет собой сложную серию реакций на вещество, которое воспринимается как чужеродное, и может включать выработку нейтрализующих и ненейтрализующих антител, образование иммунных комплексов, активацию комплемента, активацию тучных клеток, воспаление и анафилаксию. Нежелательные иммунные реакции могут снижать эффективность терапевтических средств на основе антител и Fc-слитых белков путем прямого вмешательства в распознавание антигена, изменения взаимодействия с эффекторными молекулами или нарушения периода полужизни в сыворотке или распределения терапевтического средства в тканях.
[0241] Белковые терапевтические препараты можно анализировать для прогнозирования присутствия потенциальных иммуногенных эпитопов с использованием коммерчески доступных услуг, таких как предоставляемые Epivax, Inc. of Providence, R.I. Потенциальные иммуногенные эпитопы также можно прогнозировать с использованием таких методов, как консенсусный метод IEDB. В некоторых вариантах осуществления алгоритмы in silico могут прогнозировать эпитопы, которые связываются с молекулами MHC класса II. Анализ набора данных полипептида с помощью таких алгоритмов дает прогнозируемые эпитопы. Прогнозируемые эпитопы используют для получения пептидов стандартными методами автоматизированного синтеза пептидов или методами рекомбинантной ДНК. Информация о подсчете баллов, предоставленная Epivax, может дать представление о том, насколько широко в популяции распознается спрогнозированный эпитоп. Более низкий балл прогнозирует более низкий иммуногенный потенциал.
[0242] В рамках настоящего изобретения «T-регитопы» представляют собой аминокислотные последовательности в каркасной области моноклонального антитела, которые потенциально могут активировать естественные регуляторные T-клетки и уменьшать нежелательные иммунные ответы. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты содержат 8, 7, 6, 5, 4, 3, 2, 1 или 0 эпитопов T-клеток не зародышевой линии. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты имеют риск низкой иммуногенности, например, имеют скорректированный балл T-reg примерно -45,11, -45,32, -46,16 или -46,26. В некоторых вариантах осуществления антитела против E-селектина (например, антитела 1444) или их антигенсвязывающие фрагменты имеют скорректированный балл T-reg примерно -45,11 и 0 эпитопов T-клеток не зародышевой линии.
Нуклеиновые кислоты, кодирующие Антитела против E-селектина
[0243] В раскрытии также представлены полинуклеотиды, кодирующие любые антитела согласно изобретению, включая части антител и модифицированные антитела, описанные в настоящем документе. В изобретении также представлен способ получения любых полинуклеотидов, описанных в настоящем документе. Можно получать полинуклеотиды и экспрессировать белки с помощью методов, известных в данной области.
[0244] Последовательность нужного антитела или его антигенсвязывающего фрагмента и нуклеиновую кислоту, кодирующую такое антитело или его антигенсвязывающий фрагмент, можно определить с использованием стандартных методов секвенирования. Молекулы нуклеиновой кислоты, кодирующие нужные антитела или их антигенсвязывающие фрагменты, можно вводить в различные векторы (например, векторы клонирования и экспрессии) для рекомбинантной выработки и получения характеристики. Молекулы нуклеиновой кислоты, кодирующие тяжелую цепь или антигенсвязывающий фрагмент тяжелой цепи и молекулы нуклеиновой кислоты, кодирующие легкую цепь или антигенсвязывающие фрагмент легкой цепи, можно клонировать в один и тот же вектор или разные векторы.
[0245] В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие аминокислотные последовательности любого из следующих антител против E-селектина и их антигенсвязывающих фрагментов: антитела 1444, 0841, 0978, 0164, 1448, 1284, 1282, 0525, 0039, 0265_0254, 0158, 0929_548, 0159, 0955_0300, 0170, 0564, 0180 и 0027. В одном варианте осуществления в изобретении представлены полинуклеотиды, кодирующие аминокислотную последовательность антител 1444 против E-селектина и их антигенсвязывающих фрагментов.
[0246] В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие один или несколько полипептидов HC антитела против E-селектина, содержащих аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 7, 13, 22, 28, 34, 37, 40, 43, 51, 59, 62, 74, 76, 89, 91, 103, 110, 117 и 124. В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие полипептиды HC антител против E-селектина, содержащие или состоящие из аминокислотной последовательности SEQ ID NO: 7 или SEQ ID NO: 13.
[0247] В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие один или несколько полипептидов LC антител против E-селектина, содержащих аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 1, 17, 26, 31, 46, 56, 67, 72, 81, 86, 96, 101, 105, 115 и 119. В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие полипептиды LC антител против E-селектина, содержащие или состоящие из аминокислотной последовательности SEQ ID NO: 1.
[0248] В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие один или несколько полипептидов домена VH антитела против E-селектина, содержащих аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 11, 25, 30, 35, 39, 42, 45, 55, 60, 66, 75, 80, 90, 95, 104, 114, 118 и 128. В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие полипептид домена VH антитела против E-селектина, содержащие или состоящие из аминокислотной последовательности SEQ ID NO: 11.
[0249] В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие один или несколько полипептидов домена VL антитела против E-селектина, содержащих аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 5, 21, 27, 32, 50, 57, 7, 73, 85, 87, 100, 102, 109, 116 и 122. В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды, кодирующие полипептид домена VL антитела против E-селектина, содержащие или состоящие из аминокислотной последовательности SEQ ID NO: 5.
[0250] В изобретении представлен полинуклеотид, содержащий последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126529, кодирующую домен HC антитела 1444. В изобретении также представлен полинуклеотид, содержащий последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126530, кодирующий LC антитела 1444. Кроме того, в изобретении представлен полипептид, содержащий аминокислотную последовательность, закодированную вставкой ДНК плазмиды, депонированной в ATCC и имеющей учетный № PTA-126529, кодирующую домен VH антитела 1444. Кроме того, в изобретении представлен полипептид, содержащий аминокислотную последовательность, закодированную вставкой плазмиды, депонированной в ATCC и имеющей учетный № PTA-126530, кодирующую домен VL антитела 1444.
[0251] В изобретении также представлен полинуклеотид, содержащий последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126529, кодирующий HCDR-1, HCDR-2 и HCDR-3 антитела 1444, и последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126530, кодирующих LCDR-1, LCDR-2 и LCDR-3 антитела 1444.
[0252] В изобретении также представлен полинуклеотид, содержащий последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126529, кодирующую домен VH антитела 1444, и последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126530, кодирующую домен VL антитела 1444.
[0253] В изобретении также представлен полинуклеотид, содержащий последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126529, кодирующую тяжелую цепь антитела 1444, и последовательность нуклеиновой кислоты из вставки плазмиды, депонированной в ATCC и имеющей учетный № PTA-126530, кодирующую легкую цепь антитела 1444.
[0254] В некоторых вариантах осуществления в раскрытии представлены полинуклеотиды и их варианты, кодирующие антитела против E-селектина, причем такие вариантные полинуклеотиды обладают по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере на 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности нуклеиновой кислоты с любой из последовательностей нуклеиновой кислоты, раскрытых в таблице 2. Это не значит, что эти количества являются ограничивающими, и между приведенными процентными значениями специально предусмотрены увеличения значения в качестве части раскрытия.
[0255] В одном варианте осуществления домены VH и VL или их антигенсвязывающие фрагменты, или полноразмерные HC или LC закодированы отдельными полинуклеотидами. Альтернативно, и VH и VL или их антигенсвязывающие фрагменты, или HC и LC закодированы одним полинуклеотидом.
[0256] Также настоящее раскрытие охватывает полинуклеотиды, комплементарные любой из таких последовательностей. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой молекулы ДНК (геномной, кДНК или синтетической) или РНК. Молекулы РНК включают молекулы HnRNA, которые содержат интроны и один к одному соответствуют молекуле ДНК и молекулам мРНК, которые не содержат интронов. необязательно в полинуклеотиде согласно настоящему раскрытию могут иметься дополнительные кодирующие или некодирующие последовательности, и необязательно полинуклеотид может быть связан с другими молекулами и/или материалами подложки.
[0257] Полинуклеотиды могут содержать последовательность нуклеиновой кислоты, которая кодирует антитела или их фрагменты или могут содержать вариант такой последовательности. Варианты полинуклеотида содержат одну или несколько таких замен, добавлений, делеций и/или вставок, чтобы характеристики связывания закодированного полипептида не ухудшались по сравнению с нативной молекулой антитела. Влияние характеристик связывания полипептида, закодированного вариантом последовательности нуклеиновой кислоты, можно оценить в общем так, как описано в настоящем документе. В некоторых вариантах осуществления варианты полинуклеотида демонстрируют по меньшей мере примерно 70% идентичность, по меньшей мере примерно 80% идентичность, по меньшей мере примерно 90% идентичность, по меньшей мере примерно 95% идентичность, по меньшей мере 98% идентичность или по меньшей мере 99% идентичность полинуклеотидной последовательности, которая кодирует исходное (родительское) антитело, не содержащее никаких замен, добавлений, делеций и/или вставок или их фрагментов. Это не значит, что эта процентная идентичность является ограничивающей, и увеличения значения между приведенными процентными значениями специально предусмотрены в качестве части раскрытия.
[0258] Говорят, что две полинуклеотидные или полипептидные последовательности являются «идентичными», если последовательность нуклеотидов или аминокислот в двух последовательностях является одинаковой при выравнивании для максимального соответствия, как описано в настоящем документе. Сравнения между двумя последовательностями обычно проводят путем сравнения последовательностей в окне сравнения для идентификации и сравнения локальных областей сходства последовательностей. «Окно сравнения» в рамках настоящего изобретения относится к сегменту по меньшей мере примерно 20 смежными положений, обычно от 30 до примерно 75 или от 40 до примерно 50, в котором последовательность можно сравнивать с эталонной последовательностью такого же количества смежных положений после оптимального выравнивания двух последовательностей. В некоторых вариантах осуществления полинуклеотид по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 98%, 99% идентичен полинуклеотиду, раскрытому в настоящем документе.
[0259] В некоторых вариантах осуществления домен VL антитела против E-селектина закодирован полинуклеотидом, содержащим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 137, 145, 147, 149, 154, 165, 158, 160, 162, 164, 166, 168, 170, 172 и 174. В некоторых вариантах осуществления домен VL антитела против E-селектина закодирован полинуклеотидом, содержащим последовательность нуклеиновой кислоты по меньшей мере на 80%, 85%, 90%, 95%, 98% или 99% идентичную нуклеиновой кислоте, выбранной из группы, состоящей из SEQ ID NO: 137, 145, 147, 149, 154, 165, 158, 160, 162, 164, 166, 168, 170, 172 и 174.
[0260] В некоторых вариантах осуществления домен VL антитела против E-селектина закодирован полинуклеотидом, содержащим последовательность нуклеиновой кислоты, по меньшей мере на 90% идентичную последовательности нуклеиновой кислоты SEQ ID NO: 137. В некоторых вариантах осуществления домен VL антитела против E-селектина закодирован полинуклеотидом, содержащим или состоящим из последовательности нуклеиновой кислоты SEQ ID NO: 137.
[0261] В некоторых вариантах осуществления домен VH антитела против E-селектина закодирован полинуклеотидом, содержащим последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 136, 144, 146, 148, 150, 151, 152, 153, 155, 157, 159, 161, 163, 165, 167, 169, 171 и 173. В некоторых вариантах осуществления домен VH антитела против E-селектина закодирован полинуклеотидом, содержащим последовательность нуклеиновой кислоты по меньшей мере на 80%, 85%, 90%, 95%, 98% или 99% идентичную нуклеиновой кислоте, выбранной из группы, состоящей из SEQ ID NO: 136, 144, 146, 148, 150, 151, 152, 153, 155, 157, 159, 161, 163, 165, 167, 169, 171 и 173.
[0262] В некоторых вариантах осуществления домен VH антитела против E-селектина закодирован полинуклеотидом, содержащим последовательность нуклеиновой кислоты, по меньшей мере на 90% идентичную SEQ ID NO: 136. В некоторых вариантах осуществления домен VH антитела против E-селектина закодирован полинуклеотидом, содержащим или состоящим из последовательности нуклеиновой кислоты SEQ ID NO: 136.
[0263] В некоторых вариантах осуществления HC антитела против E-селектина закодирована полинуклеотидом, содержащим последовательность нуклеиновой кислоты, по меньшей мере на 90% идентичную SEQ ID NO: 206 или 207. В некоторых вариантах осуществления HC антитела против E-селектина закодирована полинуклеотидом, содержащим или состоящим из последовательности нуклеиновой кислоты SEQ ID NO: 206 или 138.
[0264] В некоторых вариантах осуществления LC антитела против E-селектина закодирована полинуклеотидом, содержащим последовательность нуклеиновой кислоты, по меньшей мере на 90% идентичную SEQ ID NO: 139. В некоторых вариантах осуществления LC антитела против E-селектина закодирована полинуклеотидом, содержащим последовательность нуклеиновой кислоты SEQ ID NO: 139.
[0265] Также или альтернативно варианты полинуклеотида могут быть по существу гомологичными гену или его фрагменту, или комплементу. Такие варианты полинуклеотида способны гибридизироваться в умеренно жестких условиях с природной последовательностью ДНК, кодирующей антитело (или комплементарной последовательностью).
[0266] Подходящие «умеренно жесткие условия» включают предварительную мойку в растворе 5X SSC, 0,5% SDS, 1,0 мМ EDTA (pH 8,0); гибридизацию при температуре примерно от 50°C до 65°C, 5X SSC (0,75 M NaCl, 0,075 M цитрата натрия), в течение ночи; с последующей мойкой два раза при 65°C в течение 20 минут с каждым из растворов SSC 2X, 0,5X и 0,2X, содержащих 0,1% SDS.
[0267] В рамках настоящего изобретения термины «очень жесткие условия» или «условия высокой жесткости» означают условия, при которых: (1) используют низкую ионную силу и высокую температуру для промывки, например, 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфат натрия при 50°С; (2) во время гибридизации используют денатурирующее средство, такое как формамид, например, 50% (о/о) формамида с 0,1% бычьего сывороточного альбумина/0,1% фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) используют 50% формамид, 5X SSC, 50 мМ фосфата натрия (pH 6,8), 0,1% пирофосфата натрия, 5X раствор Денхардта, ДНК спермы лосося, обработанную ультразвуком (50 мкг/мл), 0,1% SDS и 10% сульфат декстрана при 42°C, с промывками при 42°C в 0,2X SSC (хлорид натрия/цитрат натрия) и 50% формамид при 55°C, с последующей промывкой в очень жестких условиях, состоящей из 0,1X SSC, содержащего EDTA, при 55°C. Квалифицированный специалист поймет, как при необходимости отрегулировать температуру, ионную силу и так далее, чтобы приспособиться к таким факторам, как длина зонда и тому подобное.
[0268] Рядовому специалисту в данной области будет понятно, что в результате вырождения генетического кода имеется множество нуклеотидных последовательностей, которые кодируют аминокислотную последовательность полипептида, как описано в настоящем документе. Некоторые эти полинуклеотиды имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. То есть для кодирования 20 природных аминокислот существует 64 разных кодонов, причем некоторые аминокислоты имеют множество кодонов, которые их кодируют (например, лейцин кодируют 6 разных кодонов). Следовательно, большое количество последовательностей нуклеиновой кислоты могут кодировать одну и ту же белковую последовательность, так что две нуклеиновые кислоты, кодирующие одну и ту же аминокислотную последовательность полипептида, могут иметь очень низкую идентичность последовательности нуклеиновой кислоты. Следовательно, в настоящем раскрытии специально предусмотрены полинуклеотиды, которые отличаются из-за различий использования кодонов.
[0269] Кроме того, в объем настоящего изобретения входят аллели генов, содержащих полинуклеотидные последовательности, представленные в настоящем документе. Аллели представляют собой эндогенные гены, измененные в результате одной или нескольких мутаций, таких как делеции, добавления и/или замены нуклеотидов. Полученные мРНК и белок не обязательно могут иметь измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных методов (таких как гибридизация, амплификация и/или сравнение последовательности базы данных).
[0270] Полинуклеотиды согласно настоящему изобретению могут быть получены с использованием химического синтеза, рекомбинантных методов или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не нуждаются в подробном описании в данном документе. Для получения желаемой последовательности ДНК специалист в данной области может использовать представленные в данном документе последовательности и коммерческий синтезатор ДНК.
[0271] Для получения полинуклеотидов с использованием рекомбинантных способов полинуклеотид, содержащий нужную последовательность, может быть встроен в подходящий вектор, а вектор, в свою очередь, может быть введен в подходящую клетку-хозяин для репликации и амплификации, как обсуждается дальше в настоящем документе. Полинуклеотиды могут быть встроены в клетки-хозяева любыми способами, известными в данной области. Клетки трансформируют путем введения экзогенного полинуклеотида путем прямого захвата, эндоцитоза, трансфекции, F-скрещивания или электропорации. После введения экзогенный полинуклеотид можно сохранять в клетке в виде неинтегрированного вектора (такого как плазмида) или интегрировать в геном клетки-хозяина. Амплифицированный таким образом полинуклеотид может быть выделен из клетки-хозяина способами, хорошо известными в данной области. См., например, Sambrook et al., 1989.
[0272] Альтернативно, ПЦР позволяет воспроизводить последовательности ДНК. Технология ПЦР хорошо известна в данной области и описана в патентах США №4683195, 4800159, 4754065 и 4683202, а также в PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
[0273] РНК можно получить, используя выделенную ДНК в соответствующем векторе и встраивая ее в подходящую клетку-хозяин. Когда клетку реплицируют, и ДНК транскрибируют в РНК, РНК затем может быть выделена с использованием способов, хорошо известных специалистам в данной области, как изложено, например, в Sambrook et al., 1989.
[0274] В рамках настоящего изобретения термин «вектор» означает конструкцию, которая способна доставлять и, предпочтительно, экспрессировать в клетке-хозяине один или несколько представляющих интерес генов или последовательностей (например, нуклеиновую кислоту, кодирующую HC, LC, VH, VL антитела против E-селектина и/или их фрагмент). Примеры векторов включают без ограничения вирусные векторы (например, AAV), векторы экспрессии «голой» ДНК или РНК, плазмидные, космидные или фаговые векторы, векторы экспрессии ДНК или РНК, связанные с катионными конденсирующими средствами, векторы экспрессии ДНК или РНК, инкапсулированные в липосомы и некоторые эукариотические клетки, такие как клетки-продуценты.
[0275] Подходящие векторы клонирования и экспрессии могут включать множество компонентов, таких как промотор, энхансер и другие регуляторные последовательности транскрипции. Вектор также может быть сконструирован так, чтобы сделать возможным последующее клонирование вариабельного домена антитела в разные векторы. Подходящие клонирующие векторы могут быть сконструированы в соответствии со стандартными методами или могут быть выбраны из большого количества клонирующих векторов, доступных в данной области. Хотя выбранный клонирующий вектор может варьироваться в зависимости от клетки-хозяина, которую предполагается использовать, полезные клонирующие векторы обычно обладают способностью к саморепликации, могут иметь единственную мишень для конкретной эндонуклеазы рестрикции и/или могут нести гены для маркера которые можно использовать при отборе клонов, содержащих вектор. Подходящие примеры включают плазмиды и бактериальные вирусы, например, pUC18, pUC19, Bluescript (например, pBS SK+) и их производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и pAT28. Эти и многие другие векторы клонирования доступны у коммерческих поставщиков, таких как BioRad, Stratagene и Invitrogen.
[0276] Кроме того, предоставлены векторы экспрессии. Векторы экспрессии, как правило, представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклеотид в соответствии с изобретением. Подразумевается, что вектор экспрессии должен реплицироваться в клетках-хозяевах либо в виде эписом, либо как неотъемлемая часть хромосомной ДНК. Подходящие векторы экспрессии включают без ограничения плазмиды, вирусные векторы, включая аденовирусы, аденоассоциированные вирусы, ретровирусы, космиды и вектор (векторы) экспрессии, раскрытые в публикации РСТ № WO 87/04462. Компоненты вектора обычно могут включать в себя без ограничения один или несколько из следующих элементов: сигнальную последовательность; начало репликации; один или несколько маркерных генов; подходящие элементы, контролирующие транскрипцию (такие как промоторы, энхансеры и терминаторы). Для экспрессии (то есть трансляции) также обычно требуется один или несколько элементов, контролирующих трансляцию, таких как сайты связывания рибосом, сайты инициации трансляции и стоп-кодоны.
[0277] В некоторых вариантах осуществления клетку (например, выделенную или находящуюся внутри организма) трансдуцируют рекомбинантным AAV (rAAV), содержащим рекомбинантную нуклеиновую кислоту, кодирующую гетерологичный полинуклеотид (например, HC, LC, домен VH, домен VL антитела против E-селектина или его антигенсвязывающий фрагмент) и капсид AAV. Рекомбинантная нуклеиновая кислота может дополнительно содержать регуляторные элементы (например, промотор, энхансер, интрон, экзон, полиА) для экспрессии гетерологичного полинуклеотида в трансдуцированной клетке. Рекомбинантная нуклеиновая кислота может дополнительно содержать последовательности вирусных инвертированных тандемных повторов (ITR). В некоторых вариантах осуществления капсид AAV представляет собой капсид AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10 или любой другой капсид AAV дикого типа или рекомбинантный, известный в данной области. Последовательности ITR могут представлять собой AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10 или любые другие последовательности ITR дикого типа или рекомбинантные (например, AAV2), известные в данной области. В некоторых вариантах осуществления rAAV содержит рекомбинантную нуклеиновую кислоту, кодирующую HC, LC, домен VH, домен VL антитела против E-селектина или их антигенсвязывающий фрагмент, промотор, ITR AAV и вирусный капсид. Такой rAAV подходит для экспрессии антитела против Е-селектина или его антигенсвязывающего фрагмента в клетке для лечения или профилактики заболевания, расстройства или состояния (например, SCD), опосредованного Е-селектином, у субъекта (например, пациента).
[0278] Векторы, содержащие представляющие интерес полинуклеотиды и/или сами полинуклеотиды, могут быть введены в клетку-хозяин любым из ряда подходящих способов, включая электропорацию, трансфекцию с использованием хлорида кальция или полиэтиленимина (PEI), хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микроснарядами; липофекцию; и инфекцию (например, когда вектор представляет собой инфекционное средство, такое как вирус коровьей оспы). Выбор векторов для введения или полинуклеотидов часто будет зависеть от особенностей клетки-хозяина.
[0279] В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 137, 145, 147, 149, 154, 165, 158, 160, 162, 164, 166, 168, 170, 172 и 174. В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий последовательность нуклеиновой кислоты по меньшей мере на 70%, 80%, 85%, 90%, 95%, 98% или 99% идентичную последовательности нуклеиновой кислоты SEQ ID NO: 137. В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий или состоящий из последовательности нуклеиновой кислоты SEQ ID NO: 137.
[0280] В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 136, 144, 146, 148, 150, 151, 152, 153, 155, 157, 159, 161, 163, 165, 167, 169, 171 и 173. В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий последовательность нуклеиновой кислоты, по меньшей мере на 70% 80%, 85%, 90%, 95%, 98% или 99% идентичную SEQ ID NO: 136. В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий или состоящий из последовательности нуклеиновой кислоты SEQ ID NO: 136.
[0281] В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий i) последовательность нуклеиновой кислоты SEQ ID NO: 136; ii) нуклеиновую кислоту SEQ ID NO: 137; или iii) и то, и другое.
[0282] В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий последовательность нуклеиновой кислоты, по меньшей мере на 70% 80%, 85%, 90%, 95%, 98% или 99% идентичную SEQ ID NO: 206 или 138. В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий или состоящий из последовательности нуклеиновой кислоты SEQ ID NO: 206 или 138.
[0283] В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий последовательность нуклеиновой кислоты, по меньшей мере на 70% 80%, 85%, 90%, 95%, 98% или 99% идентичную SEQ ID NO: 139. В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий или состоящий из последовательности нуклеиновой кислоты SEQ ID NO: 139.
[0284] В некоторых вариантах осуществления вектор содержит полинуклеотид, содержащий i) последовательность нуклеиновой кислоты SEQ ID NO: 206 или 138; ii) нуклеиновую кислоту SEQ ID NO: 139; или iii) и то, и другое.
[0285] В рамках настоящего изобретения термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» использованы взаимозаменяемо и означают отдельную клетку или культуру клеток, которые могут быть или были реципиентом полинуклеотида и/или вектора (векторов) для включения полинуклеотидных вставок. Клетки-хозяева включают «трансформанты», «трансформированные клетки» и «трансдуцированные клетки», которые включают первичные трансформированные или трансдуцированные клетки и полученное от них потомство независимо от количества пассажей. Потомство клетки-хозяина не обязательно может быть полностью идентичным (по морфологии или комплементарности геномной ДНК) с исходной родительской клеткой из-за естественной, случайной или преднамеренной мутации. Клетка-хозяин включает в себя клетки, трансфицированные и/или трансформированные in vivo полинуклеотидом согласно этому изобретению (например, полинуклеотидом, кодирующим аминокислотную последовательность антител против E-селектина) или содержащим его вектором.
[0286] Клетки-хозяева могут представлять собой прокариотические клетки или эукариотические клетки. Иллюстративные эукариотические клетки включают клетки млекопитающих, например, клетки приматов или не являющихся приматами животных; клетки грибов, например дрожжей; клетки; растений и клетки насекомых.
[0287] Антитело или его антигенсвязывающий фрагмент можно получить рекомбинантно с использованием подходящей клетки-хозяина. Нуклеиновая кислота, кодирующая антитело против Е-селектина или его антигенсвязывающий фрагмент согласно настоящему изобретению, может быть клонирована в вектор экспрессии, который затем может быть введен в клетку-хозяин, причем клетка иначе не продуцирует белок иммуноглобулина, чтобы получить синтез антитела в рекомбинантной клетке-хозяине. Любая клетка-хозяин, чувствительная к клеточной культуре и к экспрессии белка или полипептидов, может быть использована в соответствии с настоящим изобретением. В некоторых вариантах осуществления клетка-хозяин представляет собой клетку млекопитающего. Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии, хорошо известны в данной области и включают множество иммортализованных клеточных линий, доступных из Американской коллекции типовых культур (ATCC). Неограничивающие примеры клеток млекопитающих включают без ограничения клетки NS0, НЕК 293 и клетки яичника китайского хомячка (СНО), а также их производные, такие как клетки 293-6E и CHO DG44, клетки CHO DXB11 и Potelligent® CHOK1SV (BioWa/Lonza, Allendale, NJ). Клетки-хозяева млекопитающих также включают без ограничения клетки карциномы шейки матки человека (HeLa, ATCC CCL 2), клетки почки детеныша хомячка (BHK, ATCC CCL 10), клетки почки обезьяны (COS) и клетки гепатоцеллюлярной карциномы человека (например, Hep G2). Другие неограничивающие примеры клеток млекопитающих, которые можно использовать в соответствии с настоящим изобретением, включают ретинобласты человека (PER.C6®; CruCell, Leiden, The Netherlands); линия почки обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); эмбриональная линии 293 почки человека (НЕК 293) или клетки 293, субклонированные для выращивания в суспензионной культуре (Graham et al., J. Gen Virol. 1997; 36:59); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 1980; 23:243-251); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1 587); клетки почек собак (MDCK, ATCC CCL 34); клетки печени крысы buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TR1 (Mather et al., Annals NY Acad. Sci. 1982; 383:44-68); клетки MRC 5; клетки FS4; линия гепатомы человека (Hep G2); и многочисленные клеточные линии миеломы, включая без ограничения линию миеломы мыши BALB/c (NS0/1, ECACC NO: 85110503), клетки NS0 и клетки Sp2/0.
[0288] Кроме того, в соответствии с настоящим изобретением можно использовать любое количество коммерчески и некоммерчески доступных клеточных линий, которые экспрессируют полипептиды или белки. Специалисту в данной области будет понятно, что разные клеточные линии могут иметь разные требования к питанию и/или могут нуждаться в разных условиях культивирования для оптимального роста и экспрессии полипептида или белка, и при необходимости он сможет модифицировать условия.
Варианты применения
Способы лечения
[0289] В некоторых вариантах осуществления в раскрытии представлены терапевтические способы снижения или ингибирования активности E-селектина с применением антител против E-селектина или их антигенсвязывающих фрагментов, причем терапевтический способ предусматривает введение терапевтически эффективного количества фармацевтической композиции, содержащей антитела или их антигенсвязывающие фрагменты. Подлежащим лечению заболеванием является любое заболевание или состояние, которое улучшают, купируют, ингибируют или предотвращают за счет удаления, ингибирования или уменьшения активности E-селектина (например, SCD).
[0290] Способы лечения с использованием антител против E-селектина или их антигенсвязывающих фрагментов, включают без ограничения способы лечения и/или профилактики заболеваний, нарушений и состояний, связанных или опосредованных экспрессией E-селектина и/или связыванием E-селектина с лигандом (например, с детерминантами sLex A и/или X), включая без ограничения SCD, вазоокклюзивный криз, боль, инфаркт органа, ишемию, инсульт, дисфункцию органа-мишени, острый грудной синдром и окклюзию сосудов. Антитела против E-селектина или их антигенсвязывающие фрагменты согласно настоящему раскрытию также можно использовать для лечения и/или профилактики других заболеваний, нарушений и состояний, например, кожных заболеваний (например, псориаза), воспалительных заболеваний (например ревматоидного артрита) и осложнений диабета.
[0291] В настоящем раскрытии представлены новые терапевтические антитела, которые специфически связываются с E-селектином и способны нейтрализовать функциональную активность E-селектина. Эти антитела можно предпочтительно использовать для предотвращения или снижения частоты VOC при использовании в виде профилактического лечения SCD. В некоторых вариантах осуществления частота VOC у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, снижается примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с частотой VOC у субъекта или группы субъектов (например, пациента (пациентов) с SCD), которые не получали антитела против E-селектина или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления частота VOC у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, снижается примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с частотой VOC у того же субъект перед лечением антителами против E-селектина или их антигенсвязывающими фрагментами. В некоторых вариантах осуществления частота VOC у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, незначительно отличается от частоты VOC у субъекта или популяции субъектов, у которых нет SCD. В некоторых вариантах осуществления частоту VOC (например, количество явлений VOC) измеряют в течение некоторого периода времени. В некоторых вариантах осуществления частоту VOC (например, количество явлений VOC) измеряют на протяжении дней, недель, месяцев или лет.
[0292] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты согласно раскрытию могут уменьшать годовую частоту болевого криза, связанного с серповидно-клеточной анемией. Болевые кризы, связанные с серповидно-клеточной анемией, называются в настоящем документе острыми эпизодами боли без какой-либо медицинской причины кроме вазоокклюзивного явления, которые могут привести к посещению медицинского учреждения и/или могут приводить к лечению пероральными или парентеральными наркотическими средствами или парентеральным нестероидным противовоспалительным средством. В некоторых вариантах осуществления острый грудной синдром, секвестрация печени, секвестрация селезенки и приапизм считаются болевыми кризами, связанными с серповидно-клеточной анемией.
[0293] В некоторых вариантах осуществления годовая частота болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% ниже годовой частоты болевого криза, связанного с серповидно-клеточной анемией, у субъекта или группы субъектов (например пациента (пациентов) с SCD), которые не получали антитела против E-селектина или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления годовая частота болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% ниже годовой частоты болевого криза, связанного с серповидно-клеточной анемией, у того же субъекта перед лечением антителами против E-селектина или их антигенсвязывающими фрагментами. В некоторых вариантах осуществления годовая частота болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, незначительно отличается от годовой частоты болевого криза, связанного с серповидно-клеточной анемией, у субъекта или популяции субъектов, у которых нет SCD.
[0294] В некоторых вариантах осуществления медианное время до первого болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% дольше медианного времени до первого болевого криза, связанного с серповидно-клеточной анемией, у субъекта или группы субъектов (например пациента (пациентов) с SCD), которые не получали антитела против E-селектина или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления медианное время до первого болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% дольше медианного времени до первого болевого криза, связанного с серповидно-клеточной анемией, у того же субъекта перед лечением антителами против E-селектина или их антигенсвязывающими фрагментами. В некоторых вариантах осуществления медианное время до первого болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, незначительно отличается от медианного времени до первого болевого криза, связанного с серповидно-клеточной анемией, у субъекта или популяции субъектов, у которых нет SCD.
[0295] В некоторых вариантах осуществления медианное время до второго болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% дольше медианного времени до второго болевого криза, связанного с серповидно-клеточной анемией, у субъекта или группы субъектов (например пациента (пациентов) с SCD), которые не получали антитела против E-селектина или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления медианное время до второго болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% дольше медианного времени до второго болевого криза, связанного с серповидно-клеточной анемией, у того же субъекта перед лечением антителами против E-селектина или их антигенсвязывающими фрагментами. В некоторых вариантах осуществления медианное время до второго болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, незначительно отличается от медианного времени до второго болевого криза, связанного с серповидно-клеточной анемией, у субъекта или популяции субъектов, у которых нет SCD.
[0296] В некоторых вариантах осуществления медианная частота неосложненного болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% ниже медианной частоты неосложненного болевого криза, связанного с серповидно-клеточной анемией, у субъекта или группы субъектов (например пациента (пациентов) с SCD), которые не получали антитела против E-селектина или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления неосложненным кризом был криз, отличный от острого грудного синдрома, секвестрации печени, секвестрации селезенки и/или приапизма. В некоторых вариантах осуществления медианная частота неосложненного болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% дольше медианной частоты неосложненного болевого криза, связанного с серповидно-клеточной анемией, у того же субъекта перед лечением антителами против E-селектина или их антигенсвязывающими фрагментами. В некоторых вариантах осуществления медианная частота неосложненного болевого криза, связанного с серповидно-клеточной анемией, у субъекта (например, пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, незначительно отличается от медианной частоты неосложненного болевого криза, связанного с серповидно-клеточной анемией, у субъекта или популяции субъектов, у которых нет SCD.
[0297] Антитела согласно раскрытию также можно использовать предпочтительно для лечения острого VOC у пациента с SCD путем уменьшения продолжительности (например уменьшения времени устранения VOC), тяжести и/или интенсивности VOC. В некоторых вариантах осуществления продолжительность, тяжесть и/или интенсивность VOC у субъекта (например пациента с SCD), получающего антитела против E-селектина или их антигенсвязывающие фрагменты, снижается примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с продолжительностью, тяжестью и/или интенсивностью VOC у субъекта или группы субъектов (например пациента (пациентов) с SCD), которые не получали антитела против E-селектина или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления продолжительность, тяжесть и/или интенсивность VOC у субъекта (например, пациента с SCD), получающего антитела против E-селектина, снижены примерно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с продолжительностью, тяжестью и/или интенсивностью VOC у того же субъекта перед лечением антителами против E-селектина или их антигенсвязывающими фрагментами. В некоторых вариантах осуществления продолжительность, тяжесть и/или интенсивность VOC у субъекта (например, пациента с SCD), получающего антитела против E-селектина, или их антигенсвязывающие фрагменты, незначительно отличается от продолжительности, тяжести и/или интенсивности VOC у субъекта или популяции субъектов, у которых нет SCD.
[0298] Антитела против E-селектина или их антигенсвязывающие фрагменты также можно использовать, для лечения, профилактики и/или улучшения по меньшей мере одного признака и/или симптома SCD, например признаков и/или симптомов, влияющих на кардиоторакальную систему (таких как хроническое рестриктивное заболевание легких, диастолическое заболевание левого желудочка, легочная гипертензия, острый грудной синдром, аритмия, внезапная смерть, вазоокклюзивный криз), на нервную систему (таких как геморрагический инсульт, тромбоз венозных синусов, бессимптомный церебральный инфаркт головного мозга, хроническая боль, острый ишемический инсульт головного мозга, пролиферативная ретинопатия, орбитальный инфаркт, когнитивные нарушения), на ретикулоэндотелиальную систему (таких как секвестрация селезенки, функциональный гипоспленизм, анемия, гемолиз), на костно-мышечную систему (таких как аваскулярный некроз, изъязвления кожи), на мочеполовую систему (например папиллярный некроз, протеинурия, почечная недостаточность, гематурия, ночной энурез, приапизм) и на желудочно-кишечный тракт (например желчнокаменная болезнь, холангиопатия, гепатопатия, окклюзия мезентериальных сосудов).
[0299] В некоторых вариантах осуществления настоящее раскрытие включает в себя выделенные антитела или их антигенсвязывающие фрагменты, которые специфически связывают E-селектин и модулируют по меньшей мере одну поддающуюся обнаружению биологическую активность E-селектина, так что антитела: (a) уменьшают связывания лейкоцитов с эндотелиальными клетками; (b) уменьшают активацию стабильной адгезии с эндотелиальными клетками; (c) уменьшают медленное движение лейкоцитов до блокировки; (d) уменьшают эффективную трансэндотелиальную миграцию лейкоцитов; (e) уменьшают аффинность и авидность интегринов CD18; (f) уменьшают перенос лейкоцитов в очаги острого воспаления; (g) снижают цитозольный кальций; (h) уменьшают фосфорилирование тирозина, которое активирует киназу p38 MAP и киназу Syk; (i) уменьшают рекрутирование тромбоцитов и лейкоцитов из крови в эндотелий сосудов; и/или (j) не создают провоспалительную микросреду.
[0300] Способы лечения с применением антител против E-селектина или их антигенсвязывающих фрагментов согласно настоящему раскрытию предусматривают профилактическое и/или терапевтическое лечение. Если препарат вводят перед клиническим проявлением заболевания, лечение считается профилактическим. Например, введение антител против E-селектина или их антигенсвязывающих фрагментов можно использовать для предотвращения VOC (например, для уменьшения частоты явлений VOC) при использовании в виде профилактического лечения (например одна или несколько доз в течение некоторого периода времени) при SCD. Терапевтическое лечение предусматривает, например, ослабление или снижение тяжести заболевания или сокращение продолжительности заболевания. Например, введение антител против E-селектина или их антигенсвязывающих фрагментов можно использовать для лечения острого VOC у пациентов с SCD путем уменьшения продолжительности, интенсивности и/или тяжести VOC.
[0301] В некоторых вариантах осуществления получающим лечение субъектом может быть млекопитающее и, в частности, пациент-человек, например, пациент с SCD. Субъекту может быть нужно лечение, поскольку в результате одной или нескольких мутаций в кодирующей последовательности гена HBB, белок β-глобин экспрессируются неправильно, например, имеет неправильную аминокислотную последовательность. Введение антител против E-селектина или их антигенсвязывающих фрагментов можно использовать для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD (например, VOC), варианта SCD или заболевания SC. Введение антител против E-селектина или их антигенсвязывающих фрагментов можно использовать для лечения и/или профилактики по меньшей мере одного признака и/или симптома заболевания у субъекта, который имеет генотип HBSS, HBSC, HBSE, HBS/βthal, HBS/β+thal или HBS-вариант.
[0302] Раскрытие дополнительно включает в себя антитела против E-селектина или их антигенсвязывающие фрагменты, или фармацевтическую композицию согласно определению в настоящем документе для применения in определенных способах лечения и/или профилактики. В вариантах осуществления, которые относятся к способу лечения и/или профилактики, как описано в настоящем документе, такие варианты осуществления также включают дополнительные варианты осуществления, касающиеся антител против E-селектина или их антигенсвязывающих фрагментов, или фармацевтической композиции для применения для такого лечения и/или профилактики, или альтернативно для применения для изготовления лекарственного средства для лечения и/или профилактики симптома SCD.
Комбинированные препараты
[0303] Антитела или их антигенсвязывающие фрагменты согласно настоящему раскрытию, можно вводить в комбинации с одним или более дополнительными терапевтически активными соединениями или средствами лечения, которые являются эффективными при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD. Раскрытие включает в себя способ лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, предусматривающий введение нуждающемуся в этом пациенту количества антител против E-селектина или их антигенсвязывающих фрагментов, в комбинации с количеством терапевтически активного соединения или средства лечения, эффективных при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD. В некоторых вариантах осуществления лечение симптома SCD предусматривает уменьшение продолжительности и интенсивности острого VOC. В некоторых вариантах осуществления профилактика симптом SCD предусматривает снижение частоты явлений VOC.
[0304] Изобретение также включает в себя способ лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, предусматривающий введение нуждающемуся в этом пациенту количества антител против E-селектина или их антигенсвязывающих фрагментов и количества терапевтически активного соединения или средства лечения, эффективного при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, причем количества вместе являются эффективными при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD.
[0305] В другом варианте осуществления изобретение связано со способом лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, предусматривающим введение нуждающемуся в этом пациенту количества антител против E-селектина или их антигенсвязывающих фрагментов и количества терапевтически активного соединения или средства лечения, эффективных при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, причем количества вместе обеспечивают синергетический эффект при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, то есть комбинация является «синергетической», (то есть комбинация обеспечивает эффект больше, чем только добавочный эффект двух или более отдельных препаратов). С такими синергетическими комбинированными препаратами можно предпочтительно использовать более низкие дозы вводимых терапевтических средств, избегая таким образом возможной токсичности или осложнений, связанных с различными видами монотерапии.
[0306] Дополнительные терапевтически активные соединения, используемые для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, включают, например, пенициллин для профилактики для предотвращения пневмококковой инфекции, гидроксимочевину (например DROXIA, HYDREA), L-глутамин (например ENDARI), кризанлизумаб (ADAKVEO), вокселотор (OXBRYTA), апиксабан (ELIQUIS), ривароксабан (XARELTO), нестероидные противовоспалительные препараты, анальгетики в целом, опиоидные анальгетики, IW-1701, риоцигуат (ADEMPAS), тикагрелор (BRILINTA), мемантин (NAMENDA) и их комбинации.
[0307] Дополнительные терапевтически активные соединения, используемые для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, включают соединения, например антитела против P-селектина (например кризанлизумаб (ADAKVEO)), соединение, которое модулирует HbS, соединение, которое модулирует аффинность HbS к кислороду (например вокселотор (OXBRYTA)), соединение, воздействующее на полимеризацию HbS путем модулирования образования 2,3-дисфосфоглицериновой кислоты, соединение, воздействующее на полимеризацию HbS, индуцируя экспрессию эмбрионального гемоглобина (HbF) (например гидроксимочевины), соединение, воздействующее на дисфункциональную клеточную адгезию, сосудистую дисфункцию и/или воспаление (например ингибитор фосфодиэстеразы-9), соединение, повышающее на уровни оксида азота в крови (например стимуляторы растворимой гуанилатциклазы, например IW-1701, риоцигуат (ADEMPAS)), внутривенного IG, соединения, воздействующего на гиперкоагуляцию (например риоцигуат (ADEMPAS), апиксабан (ELIQUIS), ривароксабан (XARELTO)), соединение, которое блокирует связывание рецептора NMDA, (например мемантин (NAMENDA)).
[0308] Дополнительное терапевтически активное соединение, используемые для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, (например, VOC) представляет собой соединение, которое модулирует HbS, так чтобы сохранять его в R-состоянии (то есть окисленном состоянии), например соединения, описанные в WO 2020/109994, включенной в настоящий документ посредством ссылки. В некоторых вариантах осуществления соединение, которое модулирует HbS, так чтобы сохранять его в R-состоянии, включает соединение 2-аминохинолин. В некоторых вариантах осуществления соединение, которое модулирует HbS, так чтобы сохранять его в R-состоянии, представляет собой 6-{(1S)-1-[(2-амино-6-фторхинолин-3-ил)окси]этил}-5-(1H-пиразол-1-ил)пиридин-2-ол, необязательно полученный в твердой форме в виде его амида таутомера (c)-6-(1-((2-амино-6-фторхинолин-3-ил)окси)этил)-5-(1 H-пиразол-1-ил)пиридин-2(1H)-она,
 .
.
[0309] Терапевтически активное средство лечения, используемое для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD, включает в себя кислородную терапию, переливание крови необязательно с хелатированием железа, трансплантацию костного мозга, генную терапию (например, LentiGlobin®), терапию путем редактирования генов с помощью CRISPR (например, CTX001), метод цинковых пальцев и их комбинации.
[0310] Настоящее раскрытие включает в себя фармацевтическую композицию, содержащую антитела против E-селектина или их антигенсвязывающие фрагменты, терапевтически активное соединение или средство лечения, эффективное при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, и фармацевтически приемлемый носитель для применения при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD (например, VOC). Раскрытие включает в себя фармацевтическую композицию, содержащую синергетическое, терапевтически эффективное количество антител против E-селектина, синергетическое, терапевтически эффективное количество терапевтически активного соединения или средства лечения, эффективные при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, и фармацевтически приемлемый носитель для применения при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD (например VOC). Композиция может дополнительно содержать дополнительное терапевтическое средство, например, без ограничения по меньшей мере еще одно терапевтически активное соединение или средство лечения, эффективное при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD (например VOC).
[0311] На основе представленного раскрытия специалисту в данной области будет понятно, что способ лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD включает в себя введение синергетического, терапевтически эффективного количества антител против E-селектина и синергетического, терапевтически эффективного количества терапевтически активного соединения или средства лечения, эффективных при лечении и/или профилактике по меньшей мере одного признака и/или симптома SCD, пациенту, который либо ранее получал, либо сейчас получает, по меньшей мере одно дополнительное терапевтическое средство для лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD (например VOC).
[0312] Такое дополнительное терапевтическое средство включает в себя средство, являющееся стандартом лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD. То есть комбинированные препараты согласно изобретению можно добавлять к терапевтической схеме пациента с SCD, уже получающего какую-либо терапию, включая без ограничения L-глутамин, гидроксимочевину, переливание крови (необязательно с хелатированием железа) и любую другую терапию, известную в данной области.
[0313] Специалисты в данной области будут способны определить с помощью известных способов подходящее количество, дозу или дозировку каждого соединения, используемого в комбинации согласно настоящему раскрытию, для введения пациенту с SCD, с учетом таких факторов, как возраст, вес, общее состояние здоровья, вводимое соединение, путь введения, характер и успех лечения SCD, и наличие других препаратов.
[0314] Профилактическое или терапевтическое средство при комбинированной терапии, включая антитела против E-селектина или их антигенсвязывающие фрагменты, можно вводить субъекту в одной и той же фармацевтической композиции (например, совместно составленные препараты). Альтернативно, профилактическое или терапевтическое средство при комбинированной терапии можно вводить субъекту одновременно в виде отдельных фармацевтических композиций (например, препараты вводят совместно). Профилактическое или терапевтическое средство при комбинированной терапии можно вводить по одинаковой схеме введения препарата (например, оба препарата вводят ежесуточно) или по разным схемам введения препаратов (например один препарат вводят ежесуточно, другой препарат вводят еженедельно). Профилактические или терапевтические средства можно вводить субъекту одним и тем же или разными путями введения.
[0315] Профилактическое или терапевтическое средство при комбинированной терапии, включая антитела против E-селектина или их антигенсвязывающие фрагменты, и 6-{(1S)-1-[(2-амино-6-фторхинолин-3-ил)окси]этил}-5-(1H-пиразол-1-ил)пиридин-2-ол, необязательно полученный в твердой форме в виде его амида таутомера (c)-6-(1-((2-амино-6-фторхинолин-3-ил)окси)этил)-5-(1H-пиразол-1-ил)пиридин-2(1H)-она, можно вводить субъекту одновременно в виде отдельных фармацевтических композиций (например препараты вводят совместно). Такое профилактическое или терапевтическое средство при комбинированной терапии можно вводить по одинаковой схеме введения препарата (например, оба препарата вводят ежесуточно) или по разным схемам введения препаратов (например один препарат вводят ежесуточно, другой препарат вводят еженедельно). Кроме того, такие профилактические или терапевтические средства можно вводить субъекту одним и тем же или разными путями введения.
[0316] Профилактические или терапевтические средства, включая антитела против E-селектина или их антигенсвязывающие фрагменты и 6-{(1S)-1-[(2-амино-6-фторхинолин-3-ил)окси]этил}-5-(1H-пиразол-1-ил)пиридин-2-ол, необязательно полученный в твердой форме в виде его амида таутомера (c)-6-(1-((2-амино-6-фторхинолин-3-ил)окси)этил)-5-(1H-пиразол-1-ил)пиридин-2(1H)-она, можно вводить в комбинации для уменьшения продолжительности (например уменьшения времени устранения VOC), тяжести и/или интенсивности VOC, для уменьшения годовой частоты болевого криза, связанного с серповидно-клеточной анемией, для увеличения медианного времени до первого болевого криза, связанного с серповидно-клеточной анемией, для увеличения медианного времени до второго болевого криза, связанного с серповидно-клеточной анемией, и/или для уменьшения медианной частоты неосложненного болевого криза, связанного с серповидно-клеточной анемией, у субъекта.
[0317] Раскрытие дополнительно включает в себя профилактическое или терапевтическое средство при комбинированной терапии, включая антитела против E-селектина или их антигенсвязывающие фрагменты, определенное в настоящем документе для применения в определенных способах лечения и/или профилактики. В вариантах осуществления, которые относятся к способу лечения и/или профилактики, как описано в настоящем документе, такие варианты осуществления также включают дополнительные варианты осуществления, касающиеся комбинированных препаратов, включая антитела против E-селектина или их антигенсвязывающие фрагменты, или фармацевтическую композицию для применения для такого лечения и/или профилактики, или альтернативно для изготовления лекарственного средства для применения для такого лечения и/или профилактики по меньшей мере одного признака и/или симптома SCD.
[0318] В раскрытии представлены протоколы введения нуждающемуся в этом субъекту фармацевтической композиции, содержащей антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию, отдельно или в комбинации с другой терапией. Препараты (например, профилактические или терапевтические средства) при комбинированной терапии согласно настоящему раскрытию можно вводить субъекту одновременно или последовательно. Препараты (например, профилактические или терапевтические средства) при комбинированной терапии согласно настоящему раскрытию также можно вводить циклически. Циклическая терапия предусматривает введение первого препарата (например первого профилактического или терапевтического средства) в течение некоторого периода времени с последующим введением второго препарата (например второго профилактического или терапевтического средства) в течение некоторого периода времени и повторение этого последовательного введения, то есть циклически, для уменьшения развития резистентности к одному из препаратов (например средств), чтобы избежать или уменьшить побочные эффекты одного из препаратов (например средств), и/или для повышения эффективности терапии.
[0319] Препараты (например, профилактические или терапевтические средства) при комбинированной терапии согласно раскрытию можно вводить субъекту одновременно. Термин «одновременно» не ограничен введением препаратов (например профилактических или терапевтических средств) точно в одно, а затем же время, но точнее означает, что фармацевтическую композицию, содержащую антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию, вводят субъекту последовательно и в пределах временного интервала, так что антитела согласно раскрытию или их конъюгаты могут действовать вместе с другим препаратом (препаратами), чтобы обеспечить повышенную пользу, чем, если их вводить иным образом. Например, каждый препарат можно вводить субъекту в одно, а затем же время или последовательно в любом порядке в разные моменты времени; однако, если вводить не в одно, а затем же время, их следует вводить по времени достаточно близко, чтобы обеспечить нужный терапевтический или профилактический эффект. Каждый препарат можно вводить субъекту отдельно в любой подходящей форме и любым подходящим путем. В разных вариантах осуществления препараты (например профилактические или терапевтические средства) вводят субъекту с интервалом менее 15 минут, менее 30 минут, менее 1 час, с интервалом примерно 1 час, с интервалом от примерно 1 час до примерно 2 часа, с интервалом от примерно 2 часа до примерно 3 часа, с интервалом от примерно 3 часа до примерно 4 часа, с интервалом от примерно 4 часа до примерно 5 часов, с интервалом от примерно 5 часов до примерно 6 часов, с интервалом от примерно 6 часов до примерно 7 часов, с интервалом от примерно 7 часов до примерно 8 часов, с интервалом от примерно 8 часов до примерно 9 часов, с интервалом от примерно 9 часов до примерно 10 часов, с интервалом от примерно 10 часов до примерно 11 часов, с интервалом от примерно 11 часов до примерно 12 часов, с интервалом 24 часа, с интервалом 48 часов, с интервалом 72 часа или с интервалом 1 неделя. В других вариантах осуществления два или более препарата (например, профилактические или терапевтические средства) вводят во время одного и того же приема пациента врачом.
[0320] Профилактические или терапевтические средства при комбинированной терапии можно вводить субъекту в одной и той же фармацевтической композиции. Альтернативно, профилактическое или терапевтическое средство при комбинированной терапии можно вводить субъекту одновременно в виде отдельных фармацевтических композиций. Профилактические или терапевтические средства можно вводить субъекту одним и тем же или разными путями введения.
Диагностические варианты применения
[0321] Антитела против E-селектина, композиции на основе антител и способы согласно настоящему изобретению можно применять in vitro и in vivo, включая иммуноанализы и применение для диагностики и оценки лечения опосредованных E-селектином заболеваний. Способы особенно подходят для диагностики, оценки и лечения пациентов-людей с нарушением, связанным с наличием E-селектина. Это нарушение, связанное с наличием E-селектина, включает без ограничения SCD, кожные заболевания (например, псориаз), воспалительные заболевания (например ревматоидный артрит) и осложнения диабета.
[0322] В изобретении представлен способ определения наличия E-селектина в образце, причем способ включает введение в контакт образца с подозрением на содержание E-селектина с антителами, специфическими к E-селектину, и определение наличия E-селектина, связанного с антителами, определяя за счет этого E-селектин в образце. Способы определения E-селектина, связанного с антителами, хорошо известны в данной области, включая без ограничения анализ, когда E-селектин связывают с твердой подложкой, и к нему добавляют образец, обеспечивая связывание антител против E-селектина в образце. Добавляют вторые антитела против E-селектина, либо такие же, либо отличные от антител, связанных с твердой подложкой, которые можно обнаружить либо за счет прямого мечения (то есть вторые антитела конъюгированы с поддающейся обнаружению меткой), либо за счет добавления третьих антител, например, из другого вида, которые реагируют с константным доменом вторых антител и которые содержат поддающуюся обнаружению метку. Таким образом, анализ можно использовать для выявления наличия или отсутствия E-селектина в образце.
[0323] В изобретении также представлен способ определения концентрации E-селектина в образце, причем указанный способ включает предоставление меченого конкурента, содержащего E-селектин, связанный с поддающейся обнаружению меткой; предоставление антител или их антигенсвязывающих фрагментов, которые специфически связывают E-селектин; объединение образца, антител и меченого конкурента, причем E-селектин в образце конкурирует с меченым конкурентом за связывание с антителами; и определение концентрации E-селектина в указанном образце путем измерения количества меченого конкурента, не связанного с антителами, с помощью обнаружения метки. Количество меченого конкурента, связанного с антителами, в отсутствии образца сравнивают с количеством меченого конкурента, связанного с антителами, при добавлении образца. Величина уменьшения связанного меченого конкурента в присутствии образца является показателем количества немеченого E-селектина, имеющегося в образце, так что анализ можно использовать для оценки наличия и уровня E-селектина в образце. В некоторых вариантах осуществления E-селектин представляет собой растворимый E-селектин. В некоторых вариантах осуществления E-селектин представляет собой связанный с мембраной E-селектин.
[0324] В одном варианте осуществления в изобретении представлен способ оценки эффективности лечения заболевания или нарушения, связанного с повышенным уровнем E-селектина у субъекта, причем способ предусматривает введение препарата субъекту и сравнение уровня E-селектина в образце, полученном у субъекта перед лечением, с уровнем E-селектина в другом идентичном образце, полученном у субъекта после лечения, причем уровень E-селектина в образце оценивают с применением специфических антител против E-селектина, и более низкий уровень E-селектина в образце, взятом у субъекта после лечения, по сравнению с уровнем E-селектина в образце, взятом у субъекта перед лечением, является показателем эффективности курса лечения.
[0325] Термин «меченый» в отношении специфических антител против E-селектина или меченого конкурента включает прямое мечение путем связывания (то есть физического связывания) поддающегося обнаружению вещества с антителами или меченым конкурентом, а также непрямое мечение антител или меченого конкурента путем его связывания с другим реагентом, меченым напрямую. Пример непрямого мечения включает обнаружение первичных антител с применением флюоресцентно меченых вторичных антител. Методы In vitro обнаружения полипептидов согласно изобретению включают твердофазные иммуноферментные анализы (ELISA), Вестерн блоттинг, иммунопреципитацию и иммунофлуоресценцию.
[0326] Термин «образец» предназначен для включения в себя тканей, клеток и биологических текучих сред (например, крови, CSF, мочи и так далее), выделенных у субъекта, а также тканей, клеток и текучих сред, имеющихся у субъекта.
[0327] Антитела, меченые конкуренты и потенциальные терапевтические соединения, описанные в настоящем документе, также подходят для применения с любым числом других гомогенных и гетерогенных иммуноанализов с рядом систем обнаружения.
Композиции
[0328] Антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию можно составлять в виде фармацевтической композиции. Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель, вспомогательное средство и/или стабилизатор (Remington: The Science and practice of Pharmacy 21st Ed., 2005, Lippincott Williams and Wilkins, Ed. K.E. Hoover) в виде лиофилизированной готовой формы или водного раствора. В рамках настоящего изобретения термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемое вспомогательное средство» включает в себя любой материал, который при комбинировании с активным ингредиентом обеспечивает сохранение ингредиентом биологической активности и нереактивность для иммунной системы субъекта.
[0329] Примеры включают без ограничения любые стандартные фармацевтические носители, такие как фосфатно-солевой буфер (PBS), вода, физиологический раствор (0,9%), эмульсии (например, эмульсии масло/вода) и различные типы смачивающих средств. Предпочтительными разбавителями для аэрозольного или парентерального введения являются PBS и физиологический раствор.
[0330] Приемлемые носители, вспомогательные средства или стабилизаторы нетоксичны для реципиентов в определенных дозах и концентрациях и могут включать в себя такие буферы, как фосфат, цитрат и другие органические кислоты; антиоксиданты включая аскорбиновую кислоту и метионин; консерванты (например хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенолоспирт, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пентанол и м-крезол); низкомолекулярные (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстраны; хелатирующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™, полисорбат (например полисорбат 80 (PS80), полисорбат 60 (PS60), полисорбат 20 (PS20)) или полиэтиленгликоль (PEG). Фармацевтически приемлемые вспомогательные средства дальше описаны в данном документе.
[0331] Фармацевтическая соединения согласно раскрытию могут включать одну или несколько фармацевтически приемлемых солей. Примеры таких солей включают соли присоединения кислот и соли присоединения оснований. Соли присоединения кислот включают соли, полученные из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромистоводородная, йодистоводородная, фосфористая и тому подобное, а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и тому подобное. Соли присоединения оснований включают соли, полученные из щелочноземельных металлов, таких как натрий, калий, магний, кальций и тому подобное, а также из нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и тому подобное.
[0332] Фармацевтическая композиция согласно раскрытию также может содержать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и тому подобное; (2) маслорастворимые антиоксиданты, например аскорбил пальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и тому подобное; и (3) хелатирующие металлы средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобное.
[0333] Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях согласно раскрытию, включают воду этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное) и их подходящие смеси, растительные масла, например оливковое масло и органические сложные эфиры для инъекций, например этилолеат. Надлежащую текучесть можно сохранять, например, за счет применения покрывающих материалов, таких как лецитин, за счет поддержания необходимого размера частиц в случае дисперсий и за счет применения поверхностно-активных веществ.
[0334] Эти композиции могут также содержать вспомогательные средства, такие как консерванты, смачивающие средства, эмульгирующие средства и дисперсионные средства. Предотвращение наличия микроорганизмов можно обеспечивать как за счет стерилизирующих процедур, так и за счет включения различных антибактериальных и противогрибковых средств, таких как, парабен, хлорбутанол, фенол, сорбиновая кислота и тому подобное. также может быть нужно включать в композиции изотонические средства, такие как сахара, хлорид натрия и тому подобное. Кроме того, длительная абсорбция фармацевтической формы для инъекций может быть обусловлена включением средств, которые задерживают абсорбцию, таких как моностеарат алюминия и желатин.
[0335] Фармацевтические композиции обычно должны быть стерильными и стабильными в условиях изготовления и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для лекарственного средства с высокой концентрацией. носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное) и их подходящие смеси. надлежащую текучесть можно сохранять, например, за счет применения покрытия, такого как лецитин, за счет поддержания необходимого размера частиц в случае дисперсии и за счет применения поверхностно-активных веществ. во многих случаях целесообразно включать в композиции изотонические средства, такие как сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Длительная абсорбция композиций для инъекций может быть обусловлена включением в композицию средства, которое задерживает абсорбцию, таки как соли-моностеараты и желатин.
[0336] Стерильные растворы для инъекций могут быть получены за счет включения активного соединения в необходимом количестве в подходящем растворителе при необходимости с одним или комбинацией перечисленных выше ингредиентов с последующей стерилизацией микрофильтрацией.
[0337] Обычно дисперсии получают путем включения активного соединения в стерильную несущую среду, которая содержит основную дисперсионную среду и необходимые другие ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и сушка вымораживанием (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный нужный ингредиент из их предварительно отфильтрованного стерильного раствора.
[0338] Фармацевтическую композицию согласно настоящему раскрытию можно получать, упаковывать или продавать в виде готовой формы, подходящей для офтальмологического введения. Такие готовые формы могут быть, например, в форме глазных капель, включая, например, 0,1%-1,0% (м/м) раствор или суспензию активного ингредиента в водном или масляном жидком носителе. Такие капли могут дополнительно содержать буферные средства, соли или один или несколько других дополнительных ингредиентов, описанных в настоящем документе. Другие используемые вводимые офтальмологическим путем готовые формы включают формы, которые содержат активный ингредиент в микрокристаллической форме или в липосомном препарате.
[0339] В рамках настоящего изобретения «дополнительные ингредиенты» включают без ограничения одно или несколько следующих компонентов: вспомогательные средства; поверхностно-активные средства; дисперсионные средства; инертные разбавители; гранулирующие средства и средства улучшения распадаемости; связывающие средства; смазывающие средства; подсластители; ароматизирующие средства; окрашивающие средства; консерванты; физиологически разлагаемые композиции, такие как желатин; водные несущие среды и растворители; масляные несущие среды и растворители; суспендирующие средства; дисперсионные или смачивающие средства; эмульгирующие средства, смягчающие средства; буферы; соли; загущающие средства; наполнители; эмульгирующие средства; антиоксиданты; антибиотики; антигрибковые средства; стабилизирующие средства; и фармацевтически приемлемые полимерные или гидрофобные материалы. Другие «дополнительные ингредиенты», которые можно включить в фармацевтические композиции согласно раскрытию, известны в данной области и описаны, например, в Remington's Pharmaceutical Sciences, Genaro, ed., Mack Publishing Co., Easton, PA (1985), который включен в настоящий документ посредством ссылки.
[0340] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты находятся в ампуле, содержащей 100 мг антител против E-селектина (например антител 1444) или их антигенсвязывающих фрагментов в 1 мл водного буферного раствора. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты находятся в ампуле, содержащей 150 мг антител против E-селектина (например, антител 1444) или их антигенсвязывающих фрагментов в 1 мл водного буферного раствора. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты находятся в ампуле, содержащей 15 мг, 40 мг, 100 мг, 300 мг или 600 мг антител против E-селектина (например, антител 1444) или их антигенсвязывающих фрагментов в 1 мл водного буферного раствора, необязательно для подкожного введения. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты находятся в ампуле, содержащей 500 мг антител против E-селектина (например, антител 1444) или их антигенсвязывающих фрагментов в 1 мл водного буферного раствора, необязательно для внутривенного введения.
[0341] В некоторых вариантах осуществления фармацевтическая композиция содержит примерно 25 мг/мл, 50 мг/мл, 75 мг/мл, 100 мг/мл, 125 мг/мл, 150 мг/мл антител или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления фармацевтическая композиция содержит примерно 100 мг/мл антител или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления фармацевтическая композиция, подходящая для SC и/или IV введения, содержит примерно 100 мг/мл антител против E-селектина (например, антител 1444) или их антигенсвязывающих фрагментов.
[0342] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты вводят в виде готовой формы для внутривенного или подкожного введения в виде стерильного водного раствора, содержащего полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 13. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты вводят в виде готовой формы для внутривенного или подкожного введения в виде стерильного водного раствора, содержащего полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты вводят в виде готовой формы для внутривенного или подкожного введения в виде стерильного водного раствора, содержащего полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 13, и полипептид, содержащий аминокислотную последовательность SEQ ID NO: 1.
[0343] В некоторых вариантах осуществления антитела против E-селектина (например антитела 1444) или их антигенсвязывающие фрагменты вводят в виде готовой формы для внутривенного или подкожного введения, которая представляет собой стерильный водный раствор, содержащий примерно 5 мг/мл, примерно 10 мг/мл, примерно 15 мг/мл, примерно 20 мг/мл антител, примерно 25 мг/мл, примерно 50 мг/мл, примерно 75 мг/мл, примерно 100 мг/мл, примерно 125 мг/мл или примерно 150 мг/мл антител или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления готовая форма для внутривенного или подкожного введения представляет собой стерильный водный раствор, содержащий ацетат натрия, полисорбат 80 и хлорид натрия при pH в диапазоне от примерно 5 до 6. В некоторых вариантах осуществления внутривенная готовая форма представляет собой стерильный водный раствор, содержащий 5 или 10 мг/мл антител, 20 мМ ацетата натрия, 0,2 мг/мл полисорбата 80 и 140 мМ хлорида натрия при pH 5,5. Кроме того, раствор, содержащий антитела или их антигенсвязывающие фрагменты, среди многих других соединений может содержать глутаминовую кислоту, гистидин, маннит, сахарозу, трегалозу, глицин, поли(этилен)гликоль, EDTA, метионин, полисорбат 80 и любые их комбинации, и многие другие соединения, известные в соответствующей области.
[0344] В одном варианте осуществления фармацевтическая композиция согласно настоящему раскрытию содержит следующие компоненты: 50 мг/мл или 100 мг/мл антител против E-селектина (например антител 1444) или антигенсвязывающих фрагментов согласно настоящему раскрытию, 20 мМ гистидина, 8,5% сахарозы и 0,02% полисорбата 80, 0,005% EDTA при pH 5,8. В одном варианте осуществления фармацевтическая композиция согласно настоящему изобретению содержит следующие компоненты: 100 мг/мл антител против E-селектина (например, антител 1444) или антигенсвязывающих фрагментов согласно настоящему раскрытию, 10 мМ гистидина, 5% сахарозы и 0,01% полисорбата 80 при pH 5,8.
[0345] В некоторых вариантах осуществления фармацевтическая композиция содержит антитела против E-селектина или их антигенсвязывающие фрагменты (например антитела 1444) в концентрации 100 мг/мл, 1,12 мг/мл L-гистидина, 2,67 мг/мл гидрохлорида моногидрата L-гистидина, 85 мг/мл сахарозы, 0,05 мг/мл дигидрата динатрия эдетата и 0,2 мг/мл полисорбата 80 при pH 5,8 в номинальном объеме заполнения 1,0 мл. Такая фармацевтическая композиция подходит для SC или IV введения.
[0346] Такие фармацевтические композиции можно предоставлять в виде жидкого состава или в виде лиофилизированного порошка. Когда порошок восстанавливают в полном объеме, композиция сохраняет такой состав. Альтернативно, порошок можно восстанавливать в половине объема, в этом случае композиция содержит те же компоненты, но в двойной концентрации.
[0347] Что касается терапевтического средства, как хорошо известно в данной области, когда в комбинированной терапии нужно использовать средство, например, малую молекулу, оно может иметься в фармацевтической композиции в форме физиологически приемлемого сложного эфира или соли, например, в комбинации с физиологически приемлемым катионом или анионом.
[0348] Готовые формы фармацевтических композиций, описанных в настоящем документе, можно получить любым способом, известным или впоследствии разработанным в области фармакологии. Обычно такие способы получения имеют стадию связывания активного ингредиента с носителем или одним или несколькими другими вспомогательными ингредиентами, а затем, если это необходимо или нужно, формование или упаковку продукта в нужную однодозовую или многодозовую лекарственную форму.
[0349] В некоторых вариантах осуществления композиция согласно раскрытию представляет собой апирогенную готовую форму, которая по существу не содержит эндотоксинов и/или родственных пирогенных веществ. Эндотоксины включают токсины, которые заключены внутри микроорганизма и высвобождаются, когда микроорганизмы разрушаются или умирают. К пирогенным веществам относятся также вызывающие лихорадку, термостабильные вещества (гликопротеины) из наружной мембраны бактерий и других микроорганизмов. Эти вещества могут вызывать лихорадку, гипотензию и шок при введении людям. Из-за возможных вредных эффектов целесообразно удалять даже небольшие количества эндотоксинов из растворов фармацевтических препаратов, вводимых внутривенно. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов («FDA») установило верхний предел в 5 единиц эндотоксинов (ЕЕ) на дозу на килограмм массы тела в течение одного часа для внутривенного введения лекарственного средства (The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1):223 (2000)). Когда терапевтические белки вводят в количестве нескольких сотен или тысяч миллиграммов на килограмм массы тела целесообразно удалять даже следовые количества эндотоксина. В одном варианте осуществления уровни эндотоксина и пирогена в композиции составляют менее 10 ЕЕ/мг или менее 5 ЕЕ/мг, или менее 1 ЕЕ/мг, или менее 0,1 ЕЕ/мг, или менее 0,01 ЕЕ/мг, или менее 0,001 ЕЕ/мг. В другом варианте осуществления уровни эндотоксина и пирогена в композиции составляют менее примерно 10 ЕЕ/мг или менее примерно 5 ЕЕ/мг, или менее примерно 1 ЕЕ/мг, или менее примерно 0,1 ЕЕ/мг, или менее примерно 0,01 ЕЕ/мг, или менее примерно 0,001 ЕЕ/мг.
Расчет дозы и введение
[0350] Для получения фармацевтической или стерильной композиции, содержащей антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию, антитела смешивают с фармацевтически приемлемым носителем или вспомогательным средством (см. выше). Готовые формы терапевтических и диагностических средств можно получать путем смешивания с физиологически приемлемыми носителями, вспомогательными средствами или стабилизаторами, например, в виде лиофилизированных порошков, взвесей, водных растворов, лосьонов или суспензий (см., например, Hardman, et al. (2001) Goodman and Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, N.Y.; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, N.Y.; Avis, et al. (eds.) (1993) Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, NY; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, N.Y.).
[0351] Выбор схемы введения терапевтического средства зависит от нескольких факторов, включая скорость циркуляции вещества в сыворотке или ткани, уровень симптома, иммуногенность вещества и доступность клеток-мишеней в биологической матрице. В определенных вариантах осуществления схема введения максимизирует количество терапевтического средства, доставляемого пациенту, в соответствии с приемлемым уровнем побочных эффектов. Соответственно, количество доставляемого биологического препарата частично зависит от конкретного вещества и тяжестя заболевания, подлежащего лечению. Имеются рекомендации по выбору соответствующих доз антител, цитокинов и малых молекул (см., например, Wawrzynczak, 1996, Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK; Kresina (ed.), 1991, Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, N.Y.; Bach (ed.),1993, Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, N. Y.; Baert, et al., New Engl. J. Med. 2003; 348:601-608; Milgrom, et al., New Engl. J. Med. 1999; 341:1966-1973; Slamon, et al., New Engl. J. Med. 2001; 344:783-792; Beniaminovitz, et al., New Engl. J. Med. 2000; 342:613-619; Ghosh, et al., New Engl. J. Med. 2003; 348:24-32; Lipsky, et al., New Engl. J. Med. 2000; 343:1594-1602).
[0352] Определение подходящей дозы проводит врач, например, с использованием параметров или факторов, которые, как в данной области известно или предполагается, влияют на лечение, или предполагается, что они влияют на лечение. Обычно дозу начинают с количества, несколько меньшего, чем оптимальная доза, а затем увеличивают с небольшими увеличениями значения до тех пор, пока не будет достигнут нужный или оптимальный эффект по сравнению с любыми отрицательными побочными эффектами. Конкретный протокол дозы может предусматривать максимальную дозу или частоту введения дозы, которые предотвращают существенные нежелательные побочные эффекты.
[0353] «Снижение, уменьшение, нейтрализация или ингибирование взаимодействия с E-селектином», использованные в качестве терминов в настоящем документе, означает уменьшение, снижение, нейтрализация или ингибирование взаимодействия E-селектина с лигандом по сравнению с уровнем взаимодействия перед любыми терапевтическими вмешательствами. В рамках настоящего изобретения «свободный E-селектин» означает не связанный E-селектин или без иного комплекса с другой молекулой (например, со свободным или экспрессируемым на клеточной поверхности лигандом E-селектина).
[0354] Уровень E-селектина означает уровень свободного E-селектина у субъекта, когда уровень оценивают с использованием способов, раскрытых в настоящем документе, или любого другого способа оценки уровня свободного E-селектина, известного в данной области.
[0355] В одном варианте осуществления уровень свободного E-селектина снижается по сравнению с уровнем E-селектина у субъекта перед введением антител против E-селектина согласно раскрытию. В одном варианте осуществления уровень свободного E-селектина снижается по сравнению со стандартным уровнем свободного E-селектина, который связан или указывает на то, что у субъекта имеется заболевание, нарушение или состояние, связанное или опосредованное свободным E-селектином.
[0356] В некоторых вариантах осуществления раскрытие охватывает снижение уровня свободного E-селектина до уровня, при котором наблюдается снижение или полное отсутствие поддающегося обнаружению вредного эффекта (эффектов), опосредованных или связанных со свободным E-селектином. В некоторых вариантах осуществления эффективную дозу антител против E-селектина вводят, чтобы нейтрализовать функциональную активность E-селектин, например (a) связывание лейкоцитов с эндотелиальными клетками; (b) активацию стабильной адгезии с эндотелиальными клетками; (c) медленное движение лейкоцитов до блокировки; (d) трансэндотелиальную миграцию лейкоцитов; (e) аффинность и авидность интегринов CD18; (f) перенос лейкоцитов в очаги острого воспаления; (g) повышение цитозольного кальция; (h) повышение фосфорилирования тирозина, которое активирует киназу p38 MAP и киназу Syk; (i) рекрутирование тромбоцитов и лейкоцитов из крови в эндотелий сосудов; и/или (j) не создание провоспалительной микросреды.
[0357] В рамках настоящего изобретения «эффективная дозировка», «эффективная доза», «эффективное количество», или «терапевтически эффективное количество» лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для получения любого или нескольких полезных или нужных результатов. Для профилактического применения полезные или нужные результаты включают устранение или снижение риска, снижение частоты возникновения (например, в течение некоторого периода времени, например еженедельно, ежемесячно, ежегодно), уменьшение тяжести и/или задержка начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, имеющиеся в процессе развития заболевания. Для терапевтического применения полезные или нужные результаты включают поддающиеся обнаружению клинические результаты, например, снижение или уменьшение частоты VOC или снижение одного или нескольких симптомов, полученных в результате экспрессии E-селектина, уменьшение дозы других препаратов, необходимых для лечения заболевания, усиление эффекта другого препарата и/или задержка прогрессирования заболевания пациентов. Эффективную дозу можно вводить за одно или несколько введений. Для целей этого изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения, прямо или косвенно. Как понятно в клиническом контексте, эффективная доза лекарственного средства, соединения или фармацевтической композиции может быть достигнута или не достигнута в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективную дозу» можно рассматривать в контексте введения одного или нескольких терапевтических средств, и можно считать, что одно средство введено в эффективном количестве, если в сочетании с одним или более другими средствами может быть достигнут или достигнут нужный результат.
[0358] В некоторых вариантах осуществления эффективную дозу антител против E-селектина пациенту вводят с SCD, кожными заболеваниями (например псориазом), воспалительными заболеваниями (например ревматоидным артритом) и осложнениями диабета.
[0359] В некоторых вариантах осуществления эффективную дозу антител против E-селектина (например антител 1444) вводят для лечения и/или профилактики заболевания, нарушения и состояния, связанного или опосредованного экспрессией E-селектина и/или связыванием E-селектина с лигандом (например с детерминантами sLex A и/или X), включая без ограничения SCD, вазоокклюзивный криз, боль, инфаркт органа, ишемию, инсульт, дисфункцию органа-мишени, острый грудной синдром и окклюзию сосудов.
[0360] В некоторых вариантах осуществления эффективную дозу антител против E-селектина (например антител 1444) вводят для предотвращения или снижения частоты VOC при использовании в виде профилактического лечения SCD. В некоторых вариантах осуществления профилактическое введение антител против E-селектина (например, антител 1444) вводят один раз. В некоторых вариантах осуществления профилактическое введение антител против E-селектина (например, антител 1444) вводят на постоянной основе (например одну или более одной дозы, в течение некоторого периода времени).
[0361] В некоторых вариантах осуществления эффективную дозу антител против E-селектина (например антител 1444) вводят для лечения острого VOC у пациентов с SCD путем уменьшения продолжительности, интенсивности и/или тяжести VOC.
[0362] В некоторых вариантах осуществления эффективную дозу антител против E-селектина (например антител 1444) вводят для лечения, профилактики и/или улучшения по меньшей мере одного признака и/или симптома SCD, например признаков и/или симптомов, влияющих на кардиоторакальную систему (таких как хроническое рестриктивное заболевание легких, диастолическое заболевание левого желудочка, легочная гипертензия, острый грудной синдром, аритмия, внезапная смерть, вазоокклюзивный криз), на нервную систему (таких как геморрагический инсульт, тромбоз венозных синусов, бессимптомный церебральный инфаркт головного мозга, хроническая боль, острый ишемический инсульт головного мозга, пролиферативная ретинопатия, орбитальный инфаркт, когнитивные нарушения), на ретикулоэндотелиальную систему (таких как секвестрация селезенки, функциональный гипоспленизм, анемия, гемолиз), на костно-мышечную систему (таких как аваскулярный некроз, изъязвления кожи), на мочеполовую систему (таких как папиллярный некроз, протеинурия, почечная недостаточность, гематурия, ночной энурез, приапизм) и на желудочно-кишечный тракт (таких как желчнокаменная болезнь, холангиопатия, гепатопатия, окклюзия мезентериальных сосудов).
[0363] В некоторых вариантах осуществления способ или применение предусматривает введение дозы от примерно 1 мг до примерно 800 мг. В некоторых вариантах осуществления способ или применение предусматривает введение дозы примерно от 1 мг до 800 мг в качестве начальной фиксированной дозы. В некоторых вариантах осуществления способ или применение предусматривает введение дозы от примерно 1 мг до примерно 2 мг, от примерно 2 мг до примерно 5 мг, от примерно 5 мг до примерно 10 мг, от примерно 10 мг до примерно 20 мг, от примерно 20 мг до примерно 30 мг, от примерно 30 мг до примерно 40 мг, от примерно 40 мг до примерно 50 мг, от примерно 50 мг до примерно 60 мг, от примерно 60 мг до примерно 70 мг, от примерно 70 мг до примерно 80 мг, от примерно 80 мг до примерно 90 мг, от примерно 90 мг до примерно 100 мг, от примерно 100 мг до примерно 150 мг, от примерно 150 мг до примерно 200 мг, от примерно 200 мг до примерно 300 мг, от примерно 300 мг до примерно 400 мг, от примерно 400 мг до примерно 500 мг, от примерно 500 мг до примерно 600 мг, от примерно 600 мг до примерно 700 мг или от примерно 700 мг до примерно 800 мг, необязательно в качестве начальной фиксированной дозы. В некоторых вариантах осуществления способ или применение предусматривает введение дозы примерно 15 мг, 40 мг, 100 мг, 150 мг, 300 мг, 500 мг или 600 мг антител против E-селектина или их антигенсвязывающих фрагментов или фармацевтической композиции согласно изобретению. В некоторых вариантах осуществления дозой является начальная фиксированная доза.
[0364] В некоторых вариантах осуществления способ или применение предусматривает введение дозы примерно 150 мг антител против E-селектина или их антигенсвязывающих фрагментов или фармацевтической композиции согласно изобретению. В некоторых вариантах осуществления способ или применение предусматривает введение дозы примерно 150 мг антител против E-селектина или их антигенсвязывающих фрагментов или фармацевтической композиции согласно изобретению на еженедельной основе. В некоторых вариантах осуществления способ или применение предусматривает введение дозы примерно 150 мг антител против E-селектина (например, антител 1444) или их антигенсвязывающих фрагментов или фармацевтической композиции согласно изобретению подкожно на еженедельной основе.
[0365] В некоторых вариантах осуществления способ или применение предусматривает введение дозы от примерно 0,01 мг/кг до примерно 30 мг/кг антител или их антигенсвязывающих фрагментов, или фармацевтической композиции согласно изобретению необязательно в виде начальной дозы. За начальной дозой может следовать одна или несколько последующих доз. В некоторых вариантах осуществления одну или несколько последующих доз можно вводить по меньшей мере еженедельно, каждые две недели, каждые три недели, каждые четыре недели, каждые пять недель, каждые шесть недель, каждые семь недель, каждые восемь недель, каждые девять недель, каждые десять недель, каждые одиннадцать недель или каждые двенадцать недель.
[0366] За начальной дозой может следовать одна или несколько последующих доз. В некоторых вариантах осуществления последующая доза является такой же дозой, более низкой дозой или более высокой доза антител против E-селектина по сравнению с начальной дозы. В некоторых вариантах осуществления одну или несколько последующих доз можно вводить по меньшей мере еженедельно, каждые две недели, каждые три недели, каждые четыре недели, каждые пять недель, каждые шесть недель, каждые семь недель, каждые восемь недель, каждые девять недель, каждые десять недель, каждые одиннадцать недель или каждые двенадцать недель. Конкретный протокол дозирования включает в себя максимальную дозу или частоту приема, которые позволяют избежать значительных нежелательных побочных эффектов.
[0367] Фармацевтическую композицию согласно настоящему раскрытию также можно вводить посредством одного или нескольких путей введения с использованием одного или нескольких из множества способов, известных в данной области. Как будет ясно специалисту, путь и/или режим введения будет меняться в зависимости от нужных результатов. Выбранные пути введения антител согласно раскрытию включают внутривенный, внутримышечный, внутрикожный, внутрибрюшинный, подкожный, спинальный или другие парентеральные пути введения, например с помощью инъекции или инфузии. Парентеральное введение может представлять собой способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включает без ограничения внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсульную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию. Альтернативно, композицию согласно раскрытию можно вводить непарентеральным путем, например местным, эпидермальным путем введения или через слизистую оболочку, например интраназально, перорально, вагинально, ректально, подъязычно или местно.
[0368] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию вводят внутривенно. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию вводят подкожно.
[0369] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию вводят внутривенно или подкожно на еженедельной основе. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию вводят в разовой дозе примерно 15 мг, примерно 40 мг, примерно 100 мг, примерно 150 мг, примерно 300 мг или примерно 600 мг подкожно на еженедельной основе. В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию вводят в разовой дозе примерно 150 мг или примерно 500 мг внутривенно на еженедельной основе.
[0370] В некоторых вариантах осуществления субъекту вводят антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию на еженедельной основе и терапевтически активное соединение или средство лечения, эффективное при лечении и/или профилактике по меньшей мере одного признака и/или симптома заболевания (например SCD), на в сутки, еженедельно, раз в две недели, ежемесячно или по мере необходимости. В раскрытии представлены протоколы введения нуждающемуся в этом субъекту фармацевтической композиции, содержащей антитела против E-селектина или их антигенсвязывающие фрагменты согласно раскрытию, отдельно или в комбинации с другой терапией. Препараты (например, профилактические или терапевтические средства) при комбинированной терапии согласно настоящему раскрытию можно вводить субъекту одновременно или последовательно. Препараты (например, профилактические или терапевтические средства) при комбинированной терапии согласно настоящему раскрытию также можно вводить циклически.
[0371] В некоторых вариантах осуществления антитела против E-селектина или их антигенсвязывающие фрагменты, или содержащую их фармацевтическую композицию вводят примерно два раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель, один раз каждые восемь недель, один раз каждые девять недель, один раз каждые десять недель, два раза в месяц, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев, один раз каждые семь месяцев, один раз каждые восемь месяцев, один раз каждые девять месяцев, один раз каждые десять месяцев, один раз каждые одиннадцать месяцев или один раз каждые двенадцать месяцев.
[0372] В некоторых вариантах осуществления часть дозы вводят в виде внутривенного болюса, а оставшуюся часть дозы вводят путем инфузии готовой формы антител. Например, 0,01 мг/кг внутривенной инъекции антител против E-селектина или их антигенсвязывающих фрагментов можно давать в виде болюса, а оставшуюся часть дозы антител можно вводить путем внутривенной инъекции. Заданную дозу антител против E-селектина или их антигенсвязывающих фрагментов можно вводить, например, в течение от полутора часов до двух часов и до пяти часов.
[0373] Когда нужно, композиция может также содержать солюбилизирующее средство и местный анестетик, например, лидокаин, для облегчения боли в месте инъекции. Кроме того, также можно использовать ингаляционное введение, например, с помощью применения ингалятора и небулайзера и готовой формы с аэрозольным средством. См., например, патенты США №№6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и PCT публикации №№ WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждая из который полностью включена в настоящий документ посредством ссылки.
Наборы
[0374] В раскрытии также представлены набор, содержащий любые или все антитела против E-селектина или их антигенсвязывающие фрагменты, описанные в настоящем документе. Набор согласно раскрытию содержит один или несколько контейнеров, содержащих антитела против E-селектина или их антигенсвязывающие фрагменты, описанные в настоящем документе, и инструкции по применению в соответствии с любым из способов согласно раскрытию, описанных в настоящем документе. Обычно эти инструкции содержат описание введения антител для описанного выше терапевтического лечения. В некоторых вариантах осуществления набор представлен для приготовления однодозовой единицы введения. В определенных вариантах осуществления набор может содержать как первый контейнер с сухим белком, так и второй контейнер с водной готовой формой. В определенных вариантах осуществления имеется набор, содержащий устройство введения, например, однокамерный и многокамерный заранее наполненный шприц или устройство (например, шприцы для жидкости и лиошприцы).
[0375] В некоторых вариантах осуществления набор содержит устройство введения, содержащее антитела против E-селектина или их антигенсвязывающие фрагменты, причем устройство введения сконструировано или подходит для самостоятельного введения пациентом (например пациентом с SCD). В некоторых вариантах осуществления самостоятельное введение представляет собой подкожное введение.
[0376] Инструкции в отношении применения антител против E-селектина или их антигенсвязывающих фрагментов обычно содержат информацию о дозировке, графике введения препарата и пути введения (например, SC или IV) для предполагаемого лечения. Контейнер может содержать стандартную дозу, представлять собой объемную упаковку (например, многодозовую упаковку) или содержать субстандартную дозу. Инструкции, поставляемые в наборе согласно раскрытию, обычно представляют собой письменные инструкции на этикетке или вкладыше в упаковку (например, лист бумаги, включенный в комплект), но машиночитаемые инструкции (например инструкции на магнитном или оптическом диске) также являются приемлемыми.
[0377] Набор согласно данному раскрытию находится в подходящей упаковке. Подходящая упаковка включает в себя без ограничения флакон, бутылку, банку, гибкую упаковку (например, запечатанный майларовый или пластиковый пакет) и тому подобное. Также рассматриваются упаковки для использования в сочетании с конкретным устройством, таким как ингалятор, устройство для назального введения (например, распылитель) или устройство для инфузии, такое как мининасос. Набор может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). Контейнер также может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). По меньшей мере одним активным средством в композиции являются антитела против Е-селектина согласно настоящему изобретению. Контейнер может дополнительно содержать дополнительное терапевтическое средство.
[0378] В одном варианте осуществления изобретение включает набор, дополнительно содержащий второе терапевтически активное соединение или средство лечения, эффективное при лечении или профилактике симптомов SCD, причем количество антитела против E-селектина и второго соединения или средства вместе обеспечивают синергетический эффект при лечении или профилактике симптомов SCD, то есть комбинация является «синергической» (то есть комбинация обеспечивает эффект, больший, чем просто аддитивный эффект двух или более отдельных препаратов). В таком наборе, содержащем синергетические комбинированные препараты, можно выгодно использовать более низкие дозы вводимых терапевтических средств, что позволяет избежать возможной токсичности или осложнений, связанных с различными видами монотерапии.
[0379] В некоторых вариантах осуществления набор может дополнительно содержать по меньшей мере одно дополнительное терапевтически активное соединение, используемое для лечения или профилактики признака и/или симптома SCD включая, например, пенициллин, гидроксимочевину (например DROXIA, HYDREA), L-глутамин (например ENDARI), кризанлизумаб (ADAKVEO), вокселотор (OXBRYTA), апиксабан (ELIQUIS), ривароксабан (XARELTO), нестероидный противовоспалительный препарат, анальгетик в целом, опиоидный анальгетик, IW-1701, риоцигуат (ADEMPAS), тикагрелор (BRILINTA) или мемантин (NAMENDA).
[0380] В наборе необязательно могут быть предоставлены дополнительные компоненты, такие как буфер и пояснительная информация. Обычно набор содержит контейнер и этикетку или лист-вкладыш (вкладыши) на контейнере или прикрепленные к нему.
[0381] В раскрытии также представлен диагностический набор, содержащий любые или все антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе. Диагностический набор используют, например, для определения наличия E-селектина в образце. В некоторых вариантах осуществления диагностический набор можно использовать для идентификации индивидуума с латентным заболеванием, нарушением или состоянием, которое может подвергнуть его риску развития заболевания, нарушения или состояния, опосредованного Е-селектином. В некоторых вариантах осуществления диагностический набор можно использовать для выявления наличия и/или уровня E-селектина у индивидуума с подозрением на заболевание, расстройство или состояние, опосредованное Е-селектином.
[0382] Диагностические наборы согласно раскрытию содержат один или несколько контейнеров, содержащих антитела против E-селектина или их антигенсвязывающие фрагменты, описанные в настоящем документе, и инструкции по применению в соответствии с любым из способов согласно раскрытию, описанных в настоящем документе. Обычно инструкции содержат описание применения E-селектина антитела или их антигенсвязывающие фрагменты для выявления наличия E-селектина у людей с риском или с подозрением на заболевание, расстройство или состояние, опосредованное Е-селектином, например VOC, у пациента, у которого подозревают или имеется SCD и или любое другое состояние, связанное или опосредованное аномальной формой β-глобина, включая: HbS, HbC, Hbβ+-талассемия, Hbβ-талассемия или другой вариант Hb. В некоторых вариантах осуществления иллюстративный диагностический набор может иметь такие реагенты, как, например, антитела против E-селектина или их антигенсвязывающие фрагменты отрицательный контрольный образец, положительный контрольный образец и руководство по использованию набора.
Биологические депозиты
[0383] Тяжелые и легкие цепи антител 1444 против E-селектина были депонированы в соответствии с Будапештским договором в Американской коллекции типовых культур (АТСС), 10801 University Boulevard, Manassas, VA. 20110-2209, США, 6 декабря 2019 года.
[0384] Депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов в целях патентной процедуры и положений к нему (Будапештский договор). Это обеспечивает сохранение жизнеспособной культуры депозита в течение 30 лет с момента депонирования. Депозит будет предоставлен ATCC в соответствии с условиями Будапештского договора и в соответствии с соглашением между Pfizer Inc. и ATCC, которое гарантирует постоянную и неограниченную доступность потомства культуры депозита для общественности при выдаче соответствующего патента США или при обнародовании любой заявки на патент США или иностранного государства, в зависимости от того, что наступит раньше, и гарантирует доступность потомства тому, кто, как определен Комиссаром США по патентам и товарным знакам, имеет право на это в соответствии с 35 параграфом Раздела 122 Свода законов США и соответствующими ему правилами Комиссара (включая 37 параграф Раздел 1.14 федеральных правил США с особой ссылкой на 886 OG 638).
[0385] Правопреемник настоящей заявки согласился с тем, что если культура депонированных материалов погибнет, будет утеряна или уничтожена при культивировании в подходящих условиях, материалы будут незамедлительно заменены по уведомлению другой такой же культурой. Доступность депонированного материала не должна рассматриваться как лицензия на использование изобретения в нарушение прав, предоставленных любым правительством в соответствии с его патентным законодательством.
Общие Методов
[0386] Должно быть понятно, что это изобретение не ограничено конкретными синтетическими способами получения, которые могут меняться. Если в настоящем документе не указано иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые в общем понятны рядовым специалистам в данной области. Кроме того, если из контекста не требуется иное, термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число. Как правило, номенклатуры, используемые в связи с культурами клеток и тканей, молекулярной биологией, иммунологией, микробиологией, генетикой, химией белков и нуклеиновых кислот и гибридизацией, и способы их применения, описанные в настоящем документе, хорошо известны и обычно используются в данной области.
[0387] Если не указано иное, при практическом применении настоящего изобретения следует использовать традиционные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах компетенции специалистов в данной области. Такие методики полностью описаны в литературе, например, Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd. ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, NY (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1998); Coligan et al., Short Protocols in Protein Science, John Wiley & Sons, NY (2003); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
[0388] Ферментативные реакции и методики очистки осуществляют в соответствии со спецификациями производителя, как это обычно делается в данной области или как описано в настоящем документе. Номенклатура, используемая в связи с аналитической химией, биохимией, иммунологией, молекулярной биологией, синтетической органической химией и медицинской и фармацевтической химией, а также лабораторные процедуры и методы, описанные в настоящем документе, хорошо известны и широко используются в данной области. Стандартные методы используются для химического синтеза, химического анализа, фармацевтической подготовки, составления и доставки, а также лечения пациентов.
Эквиваленты
[0389] Предшествующее описание и следующие примеры подробно описывают некоторые конкретные варианты осуществления раскрытия и описывают наилучший вариант, предусмотренный изобретателями. Следует, однако, понимать, что независимо от того, насколько подробно вышеизложенное может выглядеть в тексте, раскрытие может быть реализовано многими способами, и раскрытие должно быть истолковано в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
[0390] Хотя раскрытые идеи были описаны со ссылкой на различные варианты применения, способы, наборы и композиции, следует понимать, что различные изменения и модификации могут быть сделаны без отклонения от идей, изложенных в настоящем документе, и заявленного ниже раскрытия. Следующие примеры предоставлены для лучшей иллюстрации раскрытых идей и не предназначены для ограничения объема представленных в данном документе идей. Хотя настоящие идеи были описаны в терминах этих иллюстративных вариантов осуществления, специалист в данной области техники легко поймет, что многочисленные варианты и модификации этих иллюстративных вариантов осуществления возможны без обширных экспериментов. Все такие варианты и модификации находятся в рамках текущих идей.
[0391] Все ссылки, приведенные в настоящем документе, включая патенты, патентные заявки, статьи, учебники и тому подобное, а также приведенные в них ссылки в той мере, в какой они еще не включены, настоящим полностью включены посредством ссылки. В случае, если один или несколько из включенных документов и аналогичных материалов отличаются или противоречат настоящей заявке, включая без ограничения определенные термины, использование терминов, описанные методы и тому подобное, настоящая заявка имеет приоритет.
ПРИМЕРЫ
[0392] Чтобы это изобретение можно было лучше понять, приведены следующие примеры. Эти примеры предназначены только для цели пояснения и никоим образом не подлежат трактовке в качестве ограничения объема изобретения.
Пример 1: Выделение крысиных моноклональных антител, которые связываются с E-селектином человека.
[0393] Крыс Spraque Dawley иммунизировали растворимым внеклеточным доменом E-селектина человека (Uniprot P16581 остатки 22-556; SEQ ID NO: 133) с использованием метода иммунизации Rappid IP. Супернатанты гибридом проверяли на связывание с растворимым внеклеточным доменом E-селектина человека (ID NO: 133) и мыши (SEQ ID NO: 135) и усеченным E-селектином человека (UniProtKB P16581 остатки 22-178; SEQ ID NO: 197) и усеченным E-селектином мыши (UniProtKB Q00690 остатки 22-178; SEQ ID NO: 199) с использованием HRP-ELISA прямого связывания. Из набора связывающих веществ было отобрано 6 антител (0039, 0158, 0159, 0164, 0170 и 0180), которые связывались с растворимым и усеченным E-селектином человека, и одно антитело (0027), которое связывалось с растворимым и усеченным E-селектином мыши. Эти семь антител были выбраны для молекулярного клонирования и последующего анализа.
Пример 2: Клонирование вариабельных областей тяжелой и легкой цепи крысиных антител против E-селектина.
[0394] Вариабельные области тяжелой цепи (HC) и легкой цепи (LC) антител против E-селектина, которые связаны с E-селектином человека (антитела 0039, 0158, 0159, 0164, 0170 и 0180) или E-селектином мыши (антитела 0027), клонировали с использованием системы синтеза кДНК SMART® (Clontech Laboratories Inc. of Mountain View, California) с последующей ПЦР-амплификацией. КДНК синтезировали из 1 мкг общей РНК, выделенной примерно из 500000 клеток гибридомы (для каждого клона 0027, 0039, 0158, 0159, 0164, 0170 и 0180) с использованием набора RNEasy (Qiagen) и олигонуклеотидов SMART® IIA (Clontech Laboratories Inc.) с обратной транскриптазой Superscript™ III (Invitrogen). Затем кДНК амплифицировали с помощью ПЦР с использованием праймера, гибридизированного с олигопоследовательностью SMART® IIA, и праймера, специфичного для константной области крысы (каппа крысы для легкой цепи и IgG1 крысы для тяжелой цепи) с Q5® High-Fidelity 2X Master Mix (New England Biolabs Inc.). Продукты ПЦР тяжелой и легкой цепи субклонировали в вектор pCR4-TOPO (Invitrogen) и определяли последовательность нуклеиновой кислоты. Этот метод удобен тем, что не требует предварительных знаний о последовательности ДНК. Кроме того, полученная последовательность ДНК не изменяется при использовании вырожденных праймеров для ПЦР.
[0395] Вариабельные области тяжелой цепи (VH для антитела 0039 (аминокислотная последовательность SEQ ID NO: 60), VH для антитела 0158 (аминокислотная последовательность SEQ ID NO: 75), VH для антитела 0159 (аминокислотная последовательность SEQ ID NO: 90), VH для антитела 0164 (аминокислотная последовательность SEQ ID NO: 35), VH для антитела 0170 (аминокислотная последовательность SEQ ID NO: 104), VH для антитела 0180 (аминокислотная последовательность SEQ ID NO: 118) и VH для антитела 0027 (аминокислотная последовательность SEQ ID NO: 128)) клонировали в вектор экспрессии pTT5 млекопитающих, содержащий константную область IgG1 человека, подвергнутую мутагенезу для отмены эффекторной функции (Leu234Ala, Leu235Ala и Gly237Ala, нумерация ЕС; патенте США №5624821) (аминокислотная последовательность SEQ ID NO: 15) с продуцированием химерных тяжелых цепей. Вариабельные области легкой цепи (VL для антитела 0039 (аминокислотная последовательность SEQ ID NO: 57), VL для антитела 0158 (аминокислотная последовательность SEQ ID NO: 73), VL для антитела 0159 (аминокислотная последовательность SEQ ID NO: 87), VL для антитела 0164 (аминокислотная последовательность SEQ ID NO: 32), VL для антитела 0170 (аминокислотная последовательность SEQ ID NO: 102), VL для антитела 0180 (аминокислотная последовательность SEQ ID NO: 116) и VL для антитела 0027 (аминокислотная последовательность SEQ ID NO: 122)) клонировали в векторы экспрессии pTT5 млекопитающих, содержащие константную область каппа человека (аминокислотная последовательность SEQ ID NO: 14) для получения химерных легких цепей.
Пример 3: Связывание и нейтрализация антител против E-селектина.
[0396] Связывание антител против E-селектина с внеклеточными доменами E-селектина человека (аминокислотная последовательность SEQ ID NO: 133 плюс хвост для очистки 10 His) и мыши (аминокислотная последовательность SEQ ID NO: 135 плюс хвост для очистки 10 His) измеряли с применением рекомбинантной антигенсвязывающего ELISA с обнаружением HPR. Для захвата рекомбинантных полипептидов E-селектина человека и мыши, меченных His, использовали 384-луночные планшеты Maxisorp. Полипептиды инкубировали с химерными антителами различной концентрации и обнаруживали с помощью меченных HRP антител против IgG1 человека. Антитела 0039, 0158, 0159, 0164, 0170 и 0180 связывались с E-селектином человека с EC50s 0,02 нМ, 0,03 нМ, 0,02 нМ, 0,02 нМ, 0,01 нМ и 0,01 нМ, соответственно. Ни одно из этих антител не связывалось с E-селектином мыши с EC50 >133 нМ. Антитела 0027 связывались с E-селектином мыши с EC50 0,02 нМ, но не связывались с E-селектином человека с EC50 >133 нМ.
[0397] Нейтрализующую способность антител против Е-селектина измеряли в гомогенном конкурентном анализе AlphaLISA. В данном случае антитела конкурировали за взаимодействие внеклеточного домена Е-селектина человека (аминокислотная последовательность SEQ ID NO: 133 плюс хвост для очистки 10 His), внеклеточного домена Е-селектина мыши (аминокислотная последовательность SEQ ID NO: 135 плюс хвост для очистки 10 His) или внеклеточного домена E-селектина яванского макака (аминокислотная последовательность SEQ ID NO: 175 плюс хвост для очистки 10 His) с лигандом сиалил-Льюис А. Для этого эксперимента 1 мкл антител добавляли в лунку 384-луночного планшета, а затем 1 мкл сиалил-Льюис A-PAA-биотина до конечной концентрации 1,75 нМ. Инкубировали при комнатной температуре в течение 15 минут с последующим добавлением 1,4 мкл Е-селектина человека, мыши или яванского макака до конечной концентрации 7 нМ. Снова инкубировали при комнатной температуре в течение 15 минут. Добавляли 1,4 мкл шариков AlphaLISA (Ni-донор/SA-акцептор) до конечной концентрации анализа 10 мкг/мл. Инкубировали в темноте при комнатной температуре по меньшей мере 10 часов. Затем планшеты считывали с использованием протокола AlphaLISA (Envision).
[0398] EC50 нейтрализации Е-селектина человека, мыши и яванского макака измеряли для химерных антител против Е-селектина 0027, 0158, 0159, 0164, 0170 и 0180. Антитела 0039, 0158, 0159, 0164, 0170 и 0180 имели значения EC50 по отношению к E-селектину человека <1 нМ, в то время как антитела 0027 не нейтрализовали E-селектин человека и имело EC50 >133 нМ. Антитела 0158, 0159, 0164, 0170 и 0180 имели значения ЕС50 к Е-селектину яванского макака <1 нМ, антитела 0039 имели ЕС50 к Е-селектину яванского макака >63 нМ, а антитела 0027 не нейтрализовали Е-селектин яванского макака и имели EC50 >133 нМ. Антитела 0027 имели значение ЕС50 1 нМ по отношению к Е-селектину мыши, в то время как антитела 0039, 0158, 0159, 0164, 0170 и 0180 не нейтрализовали Е-селектин мыши и имели ЕС50 >133 нМ (таблица 4).
[0399]
Пример 4: Кинетическая оценка антител против E-селектина с использованием поверхностного плазмонного резонанса (SPR).
[0400] Получали белки внеклеточного домена E-селектина человека (аминокислотная последовательность SEQ ID NO: 133), мыши (аминокислотная последовательность SEQ ID NO: 135) и яванского макака (аминокислотная последовательность SEQ ID NO: 175). Каждый белок содержал С-концевую гистидиновую метку из 10 остатков, которую использовали для очистки. Сенсорный чип против человеческого Fc получали путем аминосоединения антител против человеческого IgG (номер по каталогу BR-1008-39, GE Healthcare) со всеми четырьмя проточными кюветами сенсорного чипа, покрытого карбоксиметилированным декстраном (CM5) (номер по каталогу BR100530, GE Healthcare) в соответствии с протоколами производителя. Проточные кюветы активировали путем введения смеси 1:1 400 мМ гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и 100 мМ N-гидроксисукцинимида (NHS) в течение 7 минут при скорости потока 10 мкл/минуту. Антитела против IgG человека разбавляли до 25 мкг/мл в 10 мМ ацетате натрия, рН 5,0, и вводили во все проточные кюветы в течение 7 минут со скоростью 10 мкл/минуту. Все проточные кюветы блокировали 1М раствором этаноламина-HCl (ETH) в течение 7 минут со скоростью 10 мкл/мин. Конечный уровень иммобилизации захватывающих антител составлял примерно 10000 резонансных единиц (RU). Текущим буфером для иммобилизации и кинетики был HBS-EP+ (10 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфокислоты (HEPES), pH 7,4, 150 мМ хлорида натрия, 3 мМ этилендиаминтетрауксусной кислоты (EDTA), 0,05% (о/о) Tween-20).
[0401] Чтобы охарактеризовать связывание антител с E-селектином человека, яванского макака и мыши, антитело разводили до 0,5 мкг/мл в HBS EP+ и захватывали антителами против IgG человека, иммобилизованными на проточных кюветах 2, 3 и 4 в течение от 30 секунд до 1 минуты при скорости потока 10 мкл/мин до достижения уровня захвата от 70 до 300 RU. Проточную кювету 1 использовали в качестве эталонной поверхности. После захвата антителами скорость потока увеличивали до 50 мкл/мин, и во все проточные кюветы вводили буфер или белки Е-селектина в концентрации от 15 нМ до 405 нМ в HBS-EP+ в течение 1,0-минутного периода ассоциации, а затем обеспечивали диссоциирование от 6 до 15 минут. Циклы буфера HBS-EP+, собранные для каждого захваченного антитела, использовали для двойного сравнения (Myszka DG. J. Mol. Recognition 1999; 12(5):279-84). В конце каждого цикла всю поверхность с антителами против IgG регенерировали 30-секундным вытеснением 3 М MgCl2 и 30-секундным вытеснением ионного буфера (1,83 М MgCl2, 0,92 М мочевины, 1,83 М гуанидина HCl, рН 7,4) (Andersson). К. Analy.Chem., 1999, 71(13): 2475-81). Кинетические анализы проводили при 25°C при частоте сбора 10 герц (Гц) на приборе BIAcore™ T200 (GE Healthcare). Константы скорости и аффинности определяли путем подгонки данных к модели связывания 1:1 в программном обеспечении для оценки BIAcore™ T200 версии 3.0 (GE Healthcare).
[0402] Аффинность связывания Е-селектина человека и яванского макака определяли для антител 0039, 0158, 0159, 0164, 0170 и 0180, а Е-селектина мыши для антител 0027 путем первого связывания антител с иммобилизованными антителами против IgG человека. После захвата антител перфузировали растворы белков E-селектина и определяли константу скорости ассоциации (ka), константу скорости диссоциации (kd), t½ и значения KD для связывания с E-селектином человека, яванского макака и мыши (таблицы 5-7). В этом анализе SPR аффинность (KD) антител 0039, 0158, 0159, 0164, 0170 и 0180 против Е-селектина человека составляла 68,0 нМ, 21,6 нМ, 324 нМ, 54,4 нМ, 628 нМ и 2940 нМ, соответственно. Аффинность KD химерных антител 0039, 0159, 0164, 0170 и 0180 к Е-селектину яванского макака составляла 45,8 нМ, 243,5 нМ, 45,4 нМ, 492 нМ и 3145 нМ, соответственно. Антитела 0158 не связывались с Е-селектином яванского макака. Аффинность KD химерных антител 0027 против Е-селектина мыши составляла 1,2 нМ.
[0403]
[0404]
ND: не обнаружено
[0405]
Пример 5: Нейтрализация лиганда связывания антител против E-селектина в статическом анализе связывания.
[0406] Способность антител против E-селектина нейтрализовать связывание лиганда оценивали в статическом анализе нейтрализации с использованием конкурентного твердофазного иммуноферментного анализа (ELISA) для оценки нейтрализации антигена сиалил-Льюис клетками яичника китайского хомячка (CHO), сконструированными для экспрессии E-селектина.
[0407] Вкратце, клетки CHO, экспрессирующие E-селектин человека, выращивали в культуральной среде (MEM (минимальная необходимая среда) Alpha Medium, дополненной 10% диализированной эмбриональной бычьей сывороткой, 100 нМ метотрексата и 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина) и высевали по 12500 клеток на лунку в 96-луночный планшет для тканевых культур и инкубировали при 37°C, 5% CO2 в течение 48 часов с образованием конфлюэнтного монослоя. Затем планшеты дважды промывали 200 мкл фосфатно-солевого буфера, не содержащего кальция и магния (PBS). Антитела против Е-селектина 0039, 0158, 0159, 0164, 0170 и 0180 или изотипический контроль IgG1 добавляли к анализу в присутствии небольшого синтетического конъюгата биотинилированного полиакриламида сиалил-Льюис А (Carbosynth LLC; OS45446) со стрептавидином/пероксидазой хрена (всего 100 мкл) и инкубировали при 37°C, 5% CO2 в течение 2 часов. Затем планшеты дважды промывали 200 мкл PBS, не содержащего кальция и магния. После инкубации клетки дважды промывали 200 мкл промывочного буфера, содержащего 2 мМ хлорида кальция (50 мМ TRIS [тризаминометана], 150 мМ хлорида натрия, 0,05% полисорбата 20, рН 7,4, 2 мМ хлорида кальция). Сигнал стимулировали путем добавления 100 мкл субстрата 1-Step Ultra TMB (Thermo Scientific, 34028) и инкубации в течение 30 минут при комнатной температуре. Реакции останавливали с помощью 2 М серной кислоты и измеряли оптическую плотность при 450 нм (Spectramax M5e). Данные анализировали и представляли в виде графиков с использованием программного обеспечения GraphPad Prism (версия 8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50) (таблица 8).
[0408] Тестируемые антитела дозозависимо нейтрализовали связывание лиганда с экспрессируемым на клеточной поверхности E-селектином человека. Расчетные значения IC50 в анализе нейтрализации для химерных антител 0039, 0164, 0158, 0159, 0170 и 0180 составляли 3,76 нМ, 2,77 нМ, 2,87 нМ, 3,24 нМ, 2,3 нМ и 3,83 нМ, соответственно. Антитела 0027 не нейтрализовали связывание лиганда полиакриламид сиалил-Льюис A с экспрессируемым на клеточной поверхности E-селектином человека. Контрольные антитела против IgG человека не продемонстрировало эффекта в этих анализах.
Пример 6: Ингибирования клеточного связывания в статическом анализе адгезии антител против E-селектина.
[0409] Оценивали способность химерных антител против E-селектина 0039, 0164, 0158, 0159, 0170 и 0180 ингибировать адгезию клеток, экспрессирующих лиганд E-селектина, в статических условиях, к клеткам CHO, экспрессирующим E-селектин человека.
[0410] Клетки CHO, экспрессирующие E-селектин человека, культивировали в среде Alpha (MEM [минимальная необходимая среда]) Alpha Medium, Corning)/10% диализированной эмбриональной телячьей сыворотки (GIBCO)/100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Gibco)/100 нМ метотрексата и содержали при 37°C с 5% CO2 и 95% влажности. Клетки HL-60 (клеточная линия промиелоцитов человека, которая экспрессирует лиганд E-селектина, PSGL-1 и другие лиганды сиалил-Льюис) содержали при 37°C с 5% CO2 и 95% влажности в ростовой среде RPMI/глютамин (Gibco)/10% эмбриональной телячьей сыворотки (Gibco)/ 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Gibco). Клетки CHO, экспрессирующие E-селектин человека, высевали в 96-луночные черные планшеты с плоским дном с плотностью 11500 клеток/лунку и инкубировали с образованием конфлюэнтного монослоя в течение 48 часов при 37°C, 5% CO2 и 95% воздуха во влажном инкубаторе.
[0411] Для статического анализа нейтрализации адгезии клетки HL-60 в фазе логарифмического роста три раза промывали в PBS и ресуспендировали в 500 мкл PBS и равном объеме 2 мкМ карбоксифлуоресцеиндиацетат сукцинимидилового сложного эфира флуоресцентного красителя [(CFSE) (ThemoFisher)]. Клетки инкубировали в течение 10 минут при комнатной температуре в темноте. Мечение останавливали путем добавления 4 мл холодной ростовой среды HL-60 на льду в течение 5 минут. Меченые клетки HL-60 три раза промывали в сбалансированном солевом растворе Хэнкса (HBSS)/1% бычьего сывороточного альбумина (BSA)/0,1% азида натрия, ресуспендировали с плотностью 400000 клеток/мл для применения в статическом анализе адгезии.
[0412] Химерные антитела против E-селектина 0039, 0164, 0158, 0159, 0154, 0170 и 0180, отрицательные контрольные антитела против P-селектина и контрольный IgG человека были серийно разводили (концентрации в диапазоне от 1333 нМ до 1,83 нМ) в HBSS/1%BSA/0,1% азида натрия. Для каждого антитела готовили контроль без антител. Монослой клеток CHO с E-селектином осторожно три раза промывали HBSS/1%BSA/0,1% азида натрия, в лунки добавляли 100 мкл клеточной суспензии и инкубировали в течение одного часа на льду. Добавляли 50 мкл (20000) меченных CFSE клеток HL-60 на лунку без удаления антител. Меченые клетки HL-60 инкубировали с монослоем клеток CHO в течение 1 часа при 37°C при 5% CO2 и 95% воздуха во влажном инкубаторе. Планшет три раза промывали HBSS/1%BSA/0,1% азида натрия, добавляли 100 мкл HBSS/1% Triton-X100 и инкубировали в течение 10 минут в темноте. Флуоресценцию связанных клеток HL-60 измеряли при длинах волн возбуждения/испускания 494/521 нм с использованием Spectramax i3X (Molecular Devices) для определения количества прилипших клеток HL-60. Фоновое связывание вычитали с использованием сигнала от контрольных лунок без клеток, и определяли % адгезии с использованием контроля IgG человека за 100%. Расчетные значения EC50 определяли в пакете GraphPad Prism.
[0413] В статических условиях адгезии антитела 0158 и 0164 ингибировали адгезию клеток HL-60 с клетками CHO, экспрессирующими E-селектин человека, с ингибированием >50% при 16,5 нМ. Антитела 0159 ингибировали адгезию клеток HL-60 с клетками CHO, экспрессирующими E-селектин человека, с ингибированием >50% при 49,4 нМ. Антитела 0170 и 0180 ингибировали адгезию HL-60 с клетками CHO, экспрессирующими E-селектин человека, с ингибированием >50% при 444 нМ. Антитела 0039 при концентрации до 1333 нМ не ингибировали адгезию клеток HL-60 с клетками CHO, экспрессирующими E-селектин человека. Отрицательные контрольные антитела не ингибировали адгезию клеток HL-60 (Таблица 8).
Пример 7: Связывание с клеточной поверхностью (FACS) антител против E-селектина.
[0414] С использованием сортировки клеток с активированной флуоресценцией (FACS) оценивали связывание антител с клетками, сконструированными для экспрессии E-селектина или P-селектина. Также оценивали перекрестную реактивность видов и яванского макака.
[0415] Клетки CHO, экспрессирующие E-селектин или P-селектин человека, культивировали в среде Alpha (MEM [минимальная необходимая среда]) Alpha Medium, Corning), дополненной 10% диализированной эмбриональной телячьей сыворотки (GIBCO), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Gibco). Для клеток CHO, экспрессирующих E-селектин человека, ростовую среду также дополняли 100 нМ метотрексата. Клетки CHO, экспрессирующие E-селектин яванского макака, культивировали в среде R1 (модифицированная по способу Дульбекко среда Игла R1/модифицированная среда Хэма F12), дополненной 10% инактивированной нагреванием эмбриональной телячьей сыворотки (GIBCO), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, и 125 мкг/мл зеоцина (GIBCO). Клетки содержали в ростовой среде при 37°C, 5% CO2 и 95% воздуха во влажном инкубаторе. Метотрексат или зеоцин удаляли из среды перед культивированием для экспериментов. Клетки CHO-E-селектин или клетки P-селектин отделяли от колб T-150 с использованием лимонного солевого раствора (135 мМ KCl, 15 мМ цитрата натрия) и немедленно рекальцинировали путем добавления CaCl2 к отделенным клеткам до итоговой концентрации 1 мМ. К отделенным клеткам немедленно добавляли ростовую среду, затем центрифугировали при 300×g в течение 5 минут при комнатной температуре для осаждения клеток. Клетки высевали в 96-луночные планшеты с V-образным дном в холодном буфере CHO, состоящем из фосфатно-солевого буфера (PBS), pH 7,4, содержащего бычий сывороточный альбумин (BSA; Sigma-Aldrich) в итоговой концентрации 1%, хлорид кальция в итоговой концентрации 1 мМ и азид натрия в итоговой концентрации 0,1%, в течение 5 минут на влажном льду. После инкубации клетки центрифугировали при 300 x g в течение 2 минут при 4°C для удаления буфера.
[0416] Растворы тестируемых антител получали путем серийного разведения (в диапазоне от 1333,3 нМ до 0,0022 нМ) с использованием буфера CHO в качестве разбавителя, добавляли 100 мкл и инкубировали в указанном объеме серийно разведенных антител и инкубировали в течение 45 минут на льду. После инкубации антитела удаляли, и клетки три раза промывали путем центрифугирования при 300×g в течение 1 минуты при 4°C и ресуспендировали в холодном буфере CHO. Промытые клетки инкубировали в течение 30 минут на влажном льду со 100 мкл при разведении 1:1000 конъюгированных с APC фрагментов козьих антител против IgG человека AffiniPure F(ab')2, Fcγ (Jackson Immunoresearch). Клетки промывали три или четыре раза перед ресуспендированием в буфере CHO для анализа методом проточной цитометрии. Для получения данных флуоресценции клеток использовали прибор Becton Dickinson LSRFortessa, использующий лазерную линию 640 нм. Среднее геометрическое значение флуоресценции клеток анализировали с помощью программного пакета FlowJo (FlowJo, LLC) и строили график зависимости от концентрации антител. Расчетные значения EC50 получали с использованием нелинейного регрессионного анализа в пакете Prism (GraphPad, version 8) (Таблица 8).
[0417] Химерные антитела 0039, 0164, 0158, 0159, 0154, 0170 и 0180 продемонстрировали связывание с экспрессируемым на клеточной поверхности E-селектином человека на клетках CHO с расчетными значениями EC50 в диапазоне от 1,99 нМ до 4,99 нМ (Таблица 8). Антитела 0039, 0164, 0158, 0159, 0170 и 0180 также связывались с клетками CHO, экспрессирующие E-селектин яванского макака, с расчетными значениями EC50 в диапазоне от 3,37 до 13,98. Антитела 0164, 0158,0159, 0154, 0170 и 0180 не связывались с экспрессируемым CHO P-селектином человека, что указывает на селективность к E-селектину. Антитела 0039 продемонстрировали минимальное связывание с экспрессируемым CHO P-селектином человека с расчетным значением EC50 > 354 нМ.
[0418]
EC50 (нМ)
EC50 (нМ)
Пример 8: Нейтрализация Ex vivo антител против E-селектина с применением анализа физиологического потока
[0419] Клеточную адгезию анализировали Ex vivo в условиях физиологического потока с применением системы BioFlux™ (Fluxion, San Francisco, CA, USA) с использованием планшетов/камер BioFlux™ (Fluxion Biosciences, 48-луночный планшет с низким сдвигом, 0-20 дин/см2; 910-0004). Анализы адгезии проводили с использованием рекомбинантных очищенных растворимых белков E- или P-селектина и клеток HL-60 человека (ATCC CCL-240). Клетки HL-60 экспрессируют лиганд E-селектина, PSGL-1 и другие лиганды сиалил-Льюис. Клетки HL-60 содержали при 37°C с 5% CO2 и 95% влажности в ростовой среде RPMI/глютамин (Gibco) с 10% эмбриональной телячьей сыворотки (Gibco); 1X пенициллина/стрептомицина (Gibco). Клетки содержали при 37°C перед перфузией, и анализы BioFlux™ проводили при комнатной температуре. Во-первых, чтобы имитировать поверхность активированной эндотелиальной клетки, проточные камеры покрывали равными количествами растворимых рекомбинантных белков E- и P-селектина человека. Проточные микроканалы BioFlux™ покрывали 10 мкг/мл растворимого рекомбинантного P-селектина человека (R & D Systems, ADP3) и E-селектина (R & D Systems, ADP1), приготовленных в PBS, перфузировали по 1 дин/см2 в течение 5 минут, инкубировали при комнатной температуре в течение 1 часа и промывали PBS в течение 3-5 минут по 1 дин/см2. Химерные антитела против E-селектина, 0039, 0158, 0159, 0164, 0170 и 0180 разводили в PBS, и планшеты обрабатывали тестируемыми образцами (концентрации от 1,6 до 1000 нМ) или контролем в виде несущей среды в течение 1 часа по 1 дин/см2. Клетки HL-60 центрифугировали при 1000 об/мин в течение 5 минут, окрашивали Calcein AM (Calcein; Life Technologies™; C3099) в течение 30 минут, промывали два раза фосфатно-солевым буфером (PBS; Gibco) и ресуспендировали до концентрации ~3×106 клеток/мл в PBS. Разведенные маточные растворы антител также добавляли в клеточную суспензию перед перфузией в проточных камерах. Аликвоту 100 мкл клеток HL-60 перфузировали в каждый канал в течение 10 минут в физиологическом потоке со сдвигом 1 дин/см2. Для удаления неприлипших клеток перфузировали PBS в течение 2-3 минут по 1 дин/см2. Прилипшие клетки визуализировали и подсчитывали с применением фазово-контрастного флуоресцентного микроскопа Nikon Eclipse Ti-S (NIS-Elements BR 3.2 64-bit) с перевернутым столиком и 40-кратным увеличением. Количество клеток нормализовали по отношению к контролю в виде несущей среды с фосфатным буфером. Каждый эксперимент имеет две лунки на условие. Данные представили в виде графиков и анализировали с использованием GraphPad Prism (8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50).
[0420] В этих исследованиях, которые были разработаны, чтобы имитировать кровоток через сосудистую сеть ex vivo, антитела против E-селектина 0039, 0164, 0158, 0159, 0170 и 0180 нейтрализовали адгезию клеток HL-60 к растворимому рекомбинантному белку Е-селектину с расчетными значениями IC50 of 264,7 нМ, 1,7 нМ, 17,9 нМ, 21 нМ, 74,2 нМ и 224,7 нМ, соответственно, (Таблица 9).
[0421]
Пример 9: Группировка эпитопов антител против E-селектина
[0422] Шесть нейтрализующих химерных антител (0039, 0158, 0159, 0164, 0170 и 0180) были сгруппированы в группы эпитопов на основе конкурентного анализа с использованием биосенсора Octet. Наконечники, покрытые антителами против FC человека (AHC), переносили в лунку, содержащую 20 мкг/мл одного из семи антител, на 600 секунд, чтобы обеспечить связывание первых антител с антителами против FC человека. Наконечники переносили во вторую лунку с 300 нМ внеклеточного домена E-селектина человека (SEQ ID NO: 133 плюс хвост для очистки 10 His), и обеспечивали возможность ассоциации в течение 100 секунд. Наконец, наконечники на 100 секунд переносили в третью лунку, содержащую вторые антитела. Антитела считали неконкурирующими, если второе антитело демонстрировало увеличение сигнала биосенсора выше, чем сигнал, продуцируемый первым антителом, и их оценивали как конкурирующие, если второе антитело не вызывало дополнительного увеличения сигнала (таблица 10).
[0423] На основе этих данных о конкуренции антитела 0159, 0164, 0170 и 0180 определяли одну группа эпитопов, 0158 определяли вторую группу эпитопов, а 0039 определяли третью группу эпитопов. Первая группа и вторая группа частично перекрываются, вторая и третья группы частично перекрываются, а первая и третья группа не перекрываются. В таблице 10 «+» указывает, что вторые антитела (указаны в заголовках столбцов) связывались в присутствии первых антител (указано в заголовках строк). «-» указывает, что при добавлении вторых антител не наблюдалось усиление сигнала.
[0424]
Пример 10: Кристаллическая структура и эпитоп
[0425] Fab-фрагменты химерных антител против E-селектина 0164 получали путем расщепления полноразмерного IgG папаином и удаления Fc с использованием смолы с белком А. Fab смешивали с усеченным E-селектином человека (описанным в примере 1) с молярным отношением 1:1, и полученный комплекс очищали с помощью эксклюзионной хроматографии (SEC). Кристаллы комплекса образовались в 200 мМ ацетата кальция, рН 7,5, 20% PEG 3350. Данные собирали до 2,68 Å на линии луча 17-ID в усовершенствованной установке синхротронного излучения. Структуру определяли методом молекулярной замены и очистки до соотношения R/Rfree 0,243/0,252 (фиг. 1). Кристаллическая структура имеет единственную копию E-селектина, связанную с одним фрагментом 0164 Fab в асимметричной единице в пространственной группе P3121
[0426] На основе кристаллической структуры остатки E-селектина, которые взаимодействовали с антителами 0164, определяли на основе: i) остатков, которые были в пределах 3,8 Å, ii) нормализованной площади поверхности (Å2) скрытой из-за взаимодействий между парами остатков антител 0164 и остатков E-селектин >5Å 2, iii) образования солевого мостика, iv) образования водородной связи или v) образования опосредованной водой водородной связи. Список остатков, нумерация которых основана на последовательности зрелого E-селектина человека (SEQ ID NO: 132), содержит T7, E8, A9, M10, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, N105, E107, R108, S110, K111, K112 и K113 (Таблица 11).
[0427] Взаимодействие Е-селектина с его природным лигандом Сиалил-Льюис X (sLeX) с помощью рентгеновской кристаллографии показано в структуре PDB (1g1t) (см. www.rcsb.org/structure/1g1t). В этой структуре остатки Е-селектина, которые находятся в пределах 3,8 Å от sLeX и аналогичны взаимодействию с антителом 0164, представляют собой Y48, N82, N83, E92, Y94, R97, N105 и E107, исходя из нумерации SEQ ID NO: 132. Дополнительные остатки, которые также находятся в пределах 3,8 ангстрем от sLex, представляют собой E80, E98 и D106 (на основе нумерации SEQ ID NO: 132). Учитывая значительное перекрытие эпитопов sLex и антитела 0164, вполне вероятно, что нейтрализующая активность, проявляемая этим антителом, является результатом прямого блокирования взаимодействия с Е-селектином sLeX и других подобных лигандов, таких как сиалил-Льюис А (sLeA).
[0428]

Пример 11: Гуманизация крысиных антител против E-селектина
[0429] Гуманизированные варианты нейтрализующих крысиных химерных антител 0039, 0158, 0159, 0164, 0170 и 0180 конструировали путем прививки определяющей комплементарность области (CDR) (называемой далее «с привитой CDR»). Для антител 0039, 0158, 0164 и 0180, CDR тяжелой цепи прививали на каркасную область DP-54 человека (подгруппа VH3). Гуманизированные антитела 0039 содержали аминокислотные остатки крысы, включая метионин в положении 48, глицин в положении 49 и валин в положении 78. Гуманизированные антитела 0158 содержали аминокислотные остатки крысы, включая валин в положении 24, метионин в положении 48, глицин в положении 49, треонин в положении 73 и валин в положении 78. Гуманизированные антитела 0164 содержали аминокислотные остатки крысы, включая аланин в положении 71, аланин в положении 78 и метионин в положении 94. Гуманизированные антитела 0180 содержали аминокислотные остатки крысы, включая изолейцин в положении 48, глицин в положении 49, лейцин в положении 69, серин в положении 71 треонин в положении 73, аланин в положении 78 и изолейцин в положении 94.
[0430] Для антител 0159 CDR тяжелой цепи прививали на каркасную область DP-7 (подгруппа VH1). Гуманизированные антитела 0159 содержали аминокислотные остатки крысы, включая валин в положении 24, лейцин в положении 69, аланин в положении 78 и метионин в положении 94.
[0431] Для антител 0170 CDR тяжелой цепи прививали на каркасную область DP-10 (подгруппа VH1). Гуманизированные антитела 0170 содержали аминокислотные остатки крысы, включая валин в положении 24, изолейцин в положении 69, треонин в положении 73 и валин в положении 94.
[0432] На все 6 гуманизированных антител прививали JH4 J-сегмент (аминокислотная последовательность SEQ ID NO: 6).
[0433] Для антител 0039, 0158, 0164, 0170 и 0180 CDR легкой цепи прививали на каркасную область DPK9 человека (подгруппа VKI). Гуманизированные антитела 0039 содержали аминокислотный остаток цистеин крысы в L87. Гуманизированные антитела 0158 содержали аминокислотный остаток метионин крысы в положении 4. Гуманизированные антитела 0164 и 180 содержали аминокислотный остаток фенилаланин крысы в положении 87. Гуманизированные антитела 0170 содержали аминокислотные остатки крысы, включая метионин в положении 48 и фенилаланин в положении 87.
[0434] Для антител 0159 CDR легкой цепи прививали на каркасную область DPK1 человек (подгруппа VKI).
[0435] Гуманизированные области VH присоединяли к константной области IgG1 человека с мутацией эффекторной функции (аминокислотная последовательность SEQ ID NO: 16) и затем субклонировали в запатентованный вектор экспрессии для получения тяжелых цепей SEQ ID NO: 51 с привитой CDR (трансплантат CDR 0039; тяжелая цепь антитела 0525), SEQ ID NO: 62 (трансплантат CDR 0158; тяжелая цепь антитела 265_254), SEQ ID NO: 76 (трансплантат CDR 0159; тяжелая цепь антитела 0929_0548), SEQ ID NO: 22 (трансплантат CDR 0164; тяжелая цепь антитела 0841), SEQ ID NO: 91 (трансплантат CDR 0170; тяжелая цепь антитела 0955_0300) и SEQ ID NO: 110 (трансплантат CDR 0180; тяжелая цепь антитела 0564).
[0436] Гуманизированные VL области сливали с константной областью каппа человека (аминокислотная последовательность SEQ ID NO: 14), а затем субклонировали в запатентованный вектор экспрессии для получения легких цепей SEQ ID NO: 46 с привитой CDR (трансплантат CDR 0039; легкая цепь антитела 0525), SEQ ID NO: 67 (трансплантат CDR 0158; легкая цепь антитела 0265_0254), SEQ ID NO: 81 (трансплантат CDR 0159; легкая цепь антитела 0929_0548), SEQ ID NO: 17 (трансплантат CDR 0164; легкая цепь антитела 0841), SEQ ID NO: 96 (трансплантат CDR 0170; легкая цепь антитела 0955_0300) и SEQ ID NO: 105 (трансплантат CDR 0180; легкая цепь антитела 0564).
[0437]
1448
1282
1284
Пример 12: Кинетическая оценка гуманизированных антител против E-селектина с использованием поверхностного плазмонного резонанса.
[0438] Аффинность связывания определяли для Е-селектина человека и яванского макака для гуманизированных антител 0841 (HC SEQ ID NO: 22, LC SEQ ID NO: 17) с использованием SPR в методе, аналогичном методу, описанному в примере 4. Сперва связывали антитела с иммобилизованными антителами против IgG человека. После захвата антител перфузировали растворы белков E-селектина, и определяли константу скорости ассоциации (ka), константу скорости диссоциации (kd), t½ и значения KD для связывания с Е-селектином человека и яванского макака (Таблица 13). В этом анализе SPR аффинность гуманизированных антител 0841 против E-селектина к E-селектину человека и E-селектину яванского макака составляла 92,85 нМ и 138,5 нМ, соответственно.
[0439]
Пример 13: Связывание с клеточной поверхностью (FACS) гуманизированных антител против E-селектина (0841)
[0440] Оценивали связывание антител с использованием проточной цитометрии (FACS) клеток, сконструированных для экспрессии E-селектина. Также оценивали перекрестную реактивность видов и яванского макака.
[0441] Клетки CHO, экспрессирующие E-селектин человека, культивировали в среде Alpha (MEM [минимальная необходимая среда]) Alpha Medium, Corning), дополненной 10% диализированной эмбриональной телячьей сыворотки (GIBCO) и 100 ед/мл пенициллина и 100 мкг/мл стрептомицина в культуральной среде (Gibco). Для клеток CHO, экспрессирующих E-селектин человека, ростовую среду также дополняли 100 нМ метотрексата. Клетки CHO, экспрессирующие E-селектин яванского макака, культивировали в среде R1 (модифицированная по способу Дульбекко среда Игла R1/модифицированная среда Хэма F12), дополненной 10% инактивированной нагреванием эмбриональной телячьей сыворотки (GIBCO), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, и 125 мкг/мл зеоцина (GIBCO). Клетки содержали в ростовой среде при 37°C, 5% CO2 и 95% воздуха во влажном инкубаторе. Метотрексат или зеоцин удаляли из среды перед культивированием для экспериментов. Клетки CHO-E-селектин отделяли от колб T-150 с использованием лимонного солевого раствора (135 мМ KCl, 15 мМ цитрата натрия) и немедленно рекальцинировали путем добавления CaCl2 к отделенным клеткам до итоговой концентрации 1 мМ. К отделенным клеткам немедленно добавляли ростовую среду, затем центрифугировали при 300 x g в течение 5 минут при комнатной температуре для осаждения клеток. Клетки высевали в 96-луночные планшеты с круглым дном в холодном буфере CHO, состоящем из фосфатно-солевого буфера (PBS), pH 7,4, содержащего бычий сывороточный альбумин (BSA; Sigma-Aldrich) в итоговой концентрации 1%, хлорид кальция в итоговой концентрации 1 мМ и азид натрия в итоговой концентрации 0,1%, в течение 5 минут на влажном льду. После инкубации клетки центрифугировали при 300 x g в течение 2 минут при 4°C для удаления буфера.
[0442] Растворы тестируемых антител получали путем серийного разведения (в диапазоне от 1333,3 нМ до 0,0022 нМ) с использованием буфера CHO в качестве разбавителя, 100 мкл добавляли в указанный объем серийно разведенных антител и инкубировали в течение 45 минут на льду. После инкубации антитела удаляли, и клетки три раза промывали путем центрифугирования при 300 x g в течение 1 минуты при 4°C и ресуспендировали в холодном буфере CHO. Промытые клетки ресуспендировали и инкубировали в течение 30 минут на влажном льду со 100 мкл при разведении 1:1000 конъюгированных с APC фрагментов козьих антител против IgG человека AffiniPure F(ab')2, Fcγ (Jackson Immunoresearch). Клетки промывали три или четыре раза перед ресуспендированием в буфере CHO для анализа методом проточной цитометрии. Для получения данных флуоресценции клеток использовали прибор Becton Dickinson LSRFortessa, использующий лазерную линию 640 нм. Среднее геометрическое значение флуоресценции клеток анализировали с помощью программного пакета FlowJo (FlowJo, LLC) и строили график зависимости от концентрации антител. Расчетные значения EC50 получали с использованием нелинейного регрессионного анализа в пакете GraphPad Prism.
[0443] Связывание гуманизированных антител 0841 с Е-селектином человека и яванского макака, экспрессируемым на поверхности клеток CHO, было аналогично расчетным значениям EC50 1,62 и 1,54 нМ, соответственно, (Таблица 14). Расчетные значения EC50 для антител 0164 в том же анализе были аналогичны расчетным значениям EC50 1,39 и 1,73 нМ для экспрессируемого CHO Е-селектина человека и яванского макака, соответственно, (Таблица 14).
Пример 14: Нейтрализация гуманизированными антителами против E-селектина связывания лиганда с клетками CHO, экспрессирующими E-селектин человека или яванского макака
[0444] В статическом анализе клеточной адгезии лиганда конъюгированный с пероксидазой хрена (HRP) лиганд E-селектина и антитела против E-селектина конкурируют за связывания с E-селектином человека или яванского макака, экспрессируемым на клетках яичника китайского хомячка (СНО). Способность антител против E-селектина нейтрализовать связывание лиганда оценивали в статическом анализе нейтрализации с использованием конкурентного твердофазного иммуноферментного анализа (ELISA) для оценки нейтрализации антигена сиалил-Льюис клетками яичника китайского хомячка (CHO), сконструированными для экспрессии E-селектина человека или яванского макака.
[0445] Клетки CHO, экспрессирующие E-селектин человека, выращивали в культуральной среде (MEM (минимальная необходимая среда) Alpha Medium, дополненной 10% диализированной эмбриональной телячьей сыворотки, 100 нМ метотрексата и 100 ед/мл пенициллина и 100 мкг/мл стрептомицина), а клетки CHO, экспрессирующие E-селектин яванского макака, культивировали в среде R1 (модифицированная по способу Дульбекко среда Игла R1/модифицированная среда Хэма F12), дополненной 10% инактивированной нагреванием эмбриональной телячьей сыворотки (GIBCO), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина и 125 мкг/мл зеоцина (GIBCO). Клетки CHO, экспрессирующие E-селектин, высевали по 12500 клеток на лунку в 96-луночные планшеты для культуры ткани и инкубировали при 37°C, 5% CO2 в течение 48 часов с образованием конфлюэнтного монослоя. Затем планшеты промывали два раза 200 мкл не содержащего кальция и магния PBS. Антитела против E-селектина или изотипический контроль IgG1 добавляли в анализ в присутствии небольшого синтетического конъюгата биотинилированного полиакриламида сиалил-Льюис A (Carbosynth LLC, OS45446) или полиакриламида сиалил-Льюис X (Glycotech, 01-045) со стрептавидином/пероксидазой хрена (всего 100 мкл) и инкубировали при 37°C, 5% CO2 в течение 2 часов. Затем планшеты промывали два раза 200 мкл не содержащего кальция и магния PBS. После инкубации клетки промывали два раза 200 мкл буфера для промывки, содержащего 2 мМ хлорида кальция (50 мМ TRIS [трисаминометан], 150 мМ хлорида натрия; 0,05% полисорбата 20, pH 7,4; 2 мМ хлорида кальция). Сигнал стимулировали путем добавления 100 мкл субстрата 1-Step Ultra TMB (Thermo Scientific, 34028) и инкубации в течение 30 минут при комнатной температуре. Реакции останавливали путем использования 2 M серной кислоты, и поглощение считывали при 450 нМ (Spectramax M5e). Данные анализировали, и строили график с использованием программного обеспечения GraphPad Prism (Версия 8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50).
[0446] Нейтрализация гуманизированными антителами 0841 связывания лиганда сиалил-Льюис с Е-селектином человека и яванского макака, экспрессируемым на поверхности клеток CHO, была аналогична расчетным значениям IC50 3,81 и 1,74 нМ, соответственно (Таблица 14). Расчетные значения IC50 для 0164 в том же анализе были аналогичны расчетным значениям IC50 5,17 и 2,00 нМ для экспрессируемого CHO Е-селектина человека и яванского макака, соответственно.
Пример 15: Нейтрализация гуманизированными антителами против E-селектина клеточной адгезии в физиологическом потоке
[0447] Проводили исследования движения/адгезии клеток ex vivo для оценки эффективности и активности нейтрализации антител 0841 и 0164 для ингибирования адгезии клеток HL-60 с клетками CHO-E-селектина человека с применением системы физиологического потока.
[0448] Клетки CHO-E-селектин человека содержали в среде Alpha/10% диализированной эмбриональной Ртелячьей сыворотки (GIBCO)/ пенициллин/стрептомицина (1X) и 100 нМ метотрексата при 37°C с 5% CO2 и 95% влажности. Планшеты BioFlux™ покрывали 50 мкг/мл фибронектина в PBS при скорости потока 1 дин/см2 и инкубировали в течение 1 часа при комнатной температуре. Клетки яичников китайского хомяка, экспрессирующие E-селектин человека (клетки CHO-E-селектин человека), получали для анализа путем обработки в отношении 1:1 0,05% трипсин-этилендиаминтетрауксусной кислоты (EDTA) и аккутазы StemPro (Gibco; A1110501) в течение 5 минут при 37°C, нейтрализовали равным объемом ростовой среды, собирали, центрифугировали при 1000 об/мин в течение 5 минут и ресуспендировали до итоговой концентрации ~30×106 клеток/мл в ростовой среде. Планшеты перфузировали два раза ростовой средой CHO-E-селектин человека по 1 дин/см2 в течение 2-3 минут при комнатной температуре. Всю среду удаляли и 30 мкл клеток CHO-E-селектин человека (~30×106 клеток/мл) перфузировали в течение 25 секунд по 3-4 дин/см2. Планшеты удаляли с прибора и инкубировали в инкубаторе при 37°C в 5% CO2 в течение 1 часа. Среду удаляли, добавляли 500 мкл свежей ростовой среды, и клетки инкубировали в инкубаторе при 37°C в 5% CO2 в течение ночи. После инкубации монослои CHO-E промывали (3-4 дин/см2) на приборе BioFlux свежей ростовой средой. Антитела 0841 (серийные разведения), изотипический контрольные антитела и контрольные антитела IgG1 (200 нМ) в PBS и контроль в виде несущей среды перфузировали по 1 дин/см2 в течение 1 часа.
[0449] Клетки HL-60 содержали при 37°C с 5% CO2 и 95% влажности в ростовой среде RPMI/глютамин (Gibco) с 10% эмбриональной телячьей сыворотки (Gibco); и 1X пенициллина/стрептомицина (Gibco). Клетки содержали при 37°C перед перфузией. Клетки HL-60 центрифугировали при 1000 об/мин в течение 5 минут, окрашивали Calcein AM (Life Technologies™; C3099) в течение 30 минут, промывали два раза фосфатно-солевым буфером (PBS; Gibco) и ресуспендировали до концентрации ~3×106 клеток/мл в PBS. Разведенные маточные растворы антител также добавляли в клеточную суспензию перед перфузией в проточных камерах. Аликвоту 100 мкл клеток HL-60 плюс ингибитор перфузировали в каждый канал в течение 10 минут в физиологическом потоке со сдвигом 1 дин/см2. Для удаления неприлипших клеток PBS перфузировали в течение 2-3 минут по 1 дин/см2, и планшеты визуализировали и анализировали. Анализы проводили при комнатной температуре.
[0450] Антитела 0841 и 0164 ингибировали нейтрализацию адгезии клеток HL-60 с клетками CHO, экспрессирующими E-селектин человека в условиях физиологического потока с расчетными значениями IC50 4,17 и 3,73 нМ, соответственно, (Таблица 14).
[0451]
EC50 (нМ)
Пример 16: Получение биофизических характеристик гуманизированных антител против E-селектина
Термическая стабильность
[0452] Для определения стабильности гуманизированных антител 0841 (содержащих аминокислотную последовательность HC SEQ ID NO: 22 и LC аминокислотную последовательность SEQ ID NO: 17) использовали дифференциальную сканирующую калориметрию. Для этого анализа образцы с концентрацией 0,3 мг/мл дозировали в лоток для образцов MicroCal VP-Capillary DSC автодозатором (Malvern Instruments, Inc.), уравновешивали в течение 5 минут при 10°C, а затем сканировали до 110°C со скоростью 100°C в час. Был выбран период фильтрации 16 секунд. Необработанные данные были скорректированы по исходному уровню, а концентрация белка была нормализована. Для подгонки данных к модели состояния MN2 с соответствующим количеством переходов использовали программное обеспечение Origin 7.0 (OriginLab Corporation, Northampton, MA). В таблице 15 ниже показаны температуры плавления (Tm1 - Tm4 и FAB) молекул в буфере Tris/Suc (20 мМ Tris, 8,5% сахарозы, при pH 7,5), буфере His/Suc (20 мМ гистидина, 8,5% сахарозы, 0,005% EDTA, при pH 5,8) и буфере Glu/Tre (20 мМ глутаминовой кислоты, 8,5% трегалозы, при pH 4,5). Эти молекулы показали хорошую стабильность, с первым переходом в домене CH2 (Tm1) более 65°C в буферах Tris/Suc и Glu/Tre и чуть ниже 65°C в буфере Glu/Tre.
[0453]
Принудительное разложение
[0454] Гуманизированные антитела 0841 подвергли экстенсивному диализу в трех буферах: Tris (20 мМ Tris при pH 7,5), His (20 мМ гистидина при pH 5,8) и Glu (20 мМ глутаминовой кислоты при pH 4,5) для 4-недельного исследования принудительного разложения при 40°C. После диализа концентрации образцов доводили до 5 мг/мл. На T0, T2 и T4 неделе образцы брали для аналитической эксклюзионной хроматографии (aSEC), капиллярного электрофореза с визуализацией (iCE) и тестирования биопроб.
[0455] Агрегированное состояние нагретых образцов определяли с помощью aSEC. Образцы вводили в колонку YMC-Pack Diol-200 (300×8,0 мМ, размер пор 200 Å), соединенную с системой Agilent 1260 HPLC (Agilent Technologies, Santa Clara, CA) с 20 мМ фосфатом натрия, 400 мМ аргинина при pH 7,2 в качестве подвижной фазы. для элюирования образца к колонке aSEC применяли изократическую программу при скорости потока 0,75 мл/минуту в течение 20 минут, и данные анализировали с применением программного обеспечения Agilent OpenLAB Data Analysis для интегрирования и количественного определения площади пиков агрегата, представляющего интерес белка и низкомолекулярных соединений. Все образцы показали минимальное изменение % HMMS (высокомолекулярных соединений) и % LMMS (низкомолекулярных соединений), то есть процентное значение было менее 5% (Таблица 16).
[0456]
(HC SEQ ID NO: 22; LC ID SEQ NO: 17)
(мг/мл)
[0457] iCE использовали для выявления основанной на заряде неоднородности принудительно разложенных образцов. iCE разделяет заряженные белковые соединения при высоком напряжении и обнаружении при поглощении 280 нМ. Амфолиты-носители создают градиент pH, и белки мигрируют до тех пор, пока их суммарный заряд не станет равным нулю. Электрофореграммы анализировали для определения значений pI и площадей пиков для кислотных, основных и щелочных соединений. Для анализа образцов использовался прибор Protein Simple iCE3 с автодозатором PrinCE. Белки разбавляли водой до концентрации 2 мг/мл. Разбавитель образца содержал 0,01 мг/мл маркера pI 4,65, 0,01 мг/мл маркера pI 9,5, 4,0% Pharmalyte pH 3-10, 0,25% метилцеллюлозы и 2,0 М мочевины. Образцы содержали 15 мкл белка в концентрации 2 мг/мл и 85 мкл разбавителя образца. Образцы фокусировали в течение 1 минуты при 1500 вольт, а затем 6 минут при 3000 вольт. Для анализа данных использовалось программное обеспечение Empower.
[0458] Для образцов с высоким процентным содержанием кислотных/щелочных соединений в анализе iCE требовался дополнительный анализ масс-спектроскопии для выявления сайтов ответственности последовательностей в областях CDR. Анализ образцов в буферах с гистидином и глутаминовой кислотой показал типичное увеличение кислотных и щелочных соединений. Однако для стабильного антитела в трис-буфере наблюдалось более значительное увеличение щелочных соединений, чем ожидалось, что предполагает возможную химическую модификацию (таблица 17). Образцы во всех трех буферах дополнительно анализировали с использованием трехкомпонентного анализа масс-спектроскопии и картирования пептидов.
[0459]
Масс-спектроскопический анализ
[0460] Для 3-компонентного масс-спектроскопического анализа антитела расщепляли с использованием FabALACTICA. 50 мкг антител mAb добавляли в 100-150 мМ NaPO4, pH 7,0 для объема 25 мкл. Добавляли 1,5 мкл фермента FabALACTICA (40 Ед/мкл) и инкубировали в течение ночи (16-18 часов) при 37°C, плавно встряхивая. После этого добавляли 50 мкл 8M Guan-HCl, 12,5 мкл 1 M DTT и 12,5 мкл 150 мМ натрий-фосфатного буфера pH 7,0. Инкубировали в течение 1 часа при 37°C, плавно встряхивая. 7-8 мкг (примерно 15 мкл) использовали для 3-компонентного анализа жидкостной хроматографии и масс-спектрометрии (LC-MS).
[0461] LC-MS анализ проводили с применением масс-спектрометра Bruker maXis II (Bruker, Billerica, MA), соединенного с UPLC Waters H-класса (Waters, Milford, MA). расщепленные FabALACTICA и восстановленные образцы разделяли на колонке Waters BEH C4 (1,7Å, 2,1×150 мМ), при 65°C со скоростью потока 300 мкл/мин. Подвижной фазой A была вода с 5% ацетонитрилом и 0,05% TFA, подвижной фазой B был 50:50 ацетонитрил:2-пропанол и 0,05%TFA. Масс-спектрометр работал только в положительном режиме MS, и данные были получены с помощью управляющего программного обеспечения oTOF. Сигнал TOF-MS подвергали деконволюции с использованием максимальной энтропии в Compass DataAnalysis v 4.2 (Bruker). Анализ образцов 0841 с принудительным разложением в глутаминовой кислоте, гистидине и трис-буфере в течение четырех недель (T4W) показал аналогичные профили по сравнению с образцами в момент времени 0 (T0) (фиг. 2). PyroE-Fd (фрагмент Fd тяжелой цепи IgG с пироглутаминовой кислотой (PyroE) на N-конце) показал небольшое увеличение в образцах T4W, особенно в Трис-буфере (~3,5%). Кроме того, в образцах T0 и T4W было обнаружено около 5% усеченного фрагмента Fd D/P (фрагмент Fd с расщепленным участком аспарагиновой кислоты/пролина (D/P)).
Пептидное картирование с помощью LC-MS
[0462] Для дальнейшего исследования стабильности образцов использовали пептидное картирование LC-MS. Для пептидного картирования денатурацию и восстановление антител 0841 проводили в 5 М Guan: HCl NaAc, pH 5,0, 10 мМ TCEP при 37°C в течение 1 часа. Реакционную смесь разбавляли в 10 раз 100 мМ MES, pH 6,0, 0,5 мМ буфера TCEP. Затем добавляли смесь LysC/трипсин в соотношении 1:10 с последующим расщеплением при 37°C в течение ночи. Реакцию гасили 0,5% TFA/H2O (конечная концентрация). Затем эту смесь для переваривания вводили в систему Thermo Scientific Orbitrap Fusion Lumos для анализа методом LC-MS.
[0463] Анализ пептидного картирования LC-MS проводили с использованием масс-спектрометра Orbitrap Fusion Lumos (Thermo Scientific, Waltham, MA), соединенного с UPLC Waters H-Class (Waters, Milford, MA). Расщепленные образцы разделяли на колонке Waters BEH C18 (300Å, 1,7 мкм, 2,1×150 мМ) при 60°C со скоростью потока 200 мкл/мин. Подвижная фаза А представляла собой 0,05% TFA в воде, а подвижная фаза В представляла собой 0,05% TFA в ацетонитриле. Пептиды элюировали из колонки с использованием градиента: от 0,5% до 35% B за 135 минут. Масс-спектрометр работал только в положительном режиме MS, сканируя от 300 до 1600 м/z, и данные собирали с помощью программного обеспечения Xcalibur. Анализ данных и поиск в базе данных проводили с использованием программного обеспечения Xcalibur (Thermo Fisher Scientific, Waltham MA) and Peaks AB (Bioinformatics Solutions Inc, Toronto, Canada).
[0464] Высокоточный анализ пептидного картирования образцов T4W на Tris, гистидин и буфер с глутаминовой кислотой выявил следовые количества дезамидирования (<1%) в пептиде CDR2 HC с последовательностью IDPAN*GNTIYAEK (сайт дезамидирования NG подчеркнут; SEQ ID NO: 176). NG является обычным сайтом дезамидирования, но в данном случае в основном стабильным. Потенциальное дезамидирование (в форме сукцинимида-N) обнаружено в пептиде CDR1 LC с последовательностью TSQNIN*RYLNWYQQKPGK (сайт дезамидирования NR подчеркнут; SEQ ID N:177), в образце Tris T4W дезамидирование увеличилось примерно до 5,1%. (Спектр MS2 показал, что сайт N(30)R был наиболее вероятным сайтом дезамидирования, однако N28 и N34 также потенциально могли иметь следовые количества дезамидирования) (таблица 18).
[0465]
Конкурентное связывание ELISA
[0466] Для дополнительной оценки стабильности принудительно разложенных образцов активность подвергнутых стрессу образцов оценивали в конкурентном связывании ELISA. В данном случае стабильность образцов T0, T2W и T4W сравнивали по их способности конкурировать с биотинилированными химерными антителами 0164 (содержащими HC SEQ ID NO: 34 и LC SEQ ID NO: 31) за связывание с Е-селектином человека. Е-селектин человека хранили в PBS с Ca/Mg при концентрации 500 мкг/мл и разбавляли PBS с Ca/Mg до концентрации 1 мкг/мл. Его добавляли в 384-луночный планшет MaxiSorp, запечатывали и инкубировали при 4°C при осторожном встряхивании в течение ночи. На следующий день реагенты из каждой лунки удаляли с последующим добавлением в каждую лунку по 50 мкл блокирующего буфера (1% BSA в PBS с Ca/Mg). Лунки запечатывали и инкубировали при комнатной температуре в течение примерно 1 часа при осторожном встряхивании. При начальной концентрации 0,2 мг/мл антитела 0841 серийно поэтапно разбавляли, по 1/3 разбавления PBS с Ca/Mg, всего 12 концентраций.
[0467] Биотинилированные антитела 0164 разводили до концентрации 0,04 мкг/мл в 2% BSA/PBS с Ca/Mg. Равные объемы разбавленных антител 0841 смешивали с биотинилированными антителами 0164. Затем планшет для промывки блокировали 1% BSA с PBST (0,05% Tween) на TITERTEK в течение 3 циклов, используя 80 мкл для каждой промывки. Планшет постукивали по бумажному полотенцу для стекания жидкости. Двадцать пять мкл смеси антител 0841 и меченых биотином антител 0164 добавляли в каждую лунку 384-луночного планшета с двойным повтором лунок и инкубировали при комнатной температуре при осторожном встряхивании в течение 2-4 часов. Стадию промывки повторяли с 3 циклами по 2 промывки. Затем в каждую лунку добавляли разбавленный Streptavidin-HRP (~ 1/7500, разбавленный блокирующим буфером), и планшет инкубировали при комнатной температуре при осторожном встряхивании в течение от ~40 минут до 1 часа. Стадию промывки снова повторяли с 3 циклами по 2 промывки, высушивали встряхиванием и затем добавляли 25 мкл субстрата TMB (однокомпонентный субстрат HRP для микролунок). После этого добавляли 25 мкл 0,18 М серной кислоты, чтобы остановить реакцию, когда цвет достигал насыщения (определялось по наблюдению за изменением цвета). Измерение OD450 планшета затем считывали с помощью планшетного ридера Envision, и данные анализировали с помощью GraphPad, Prism7.
[0468] Результаты конкурентного связывания показаны на фиг. 3, и не было видно различий между образцами T0, T2W и T4W ни в одном из трех буферов. Эти данные демонстрируют, что антитела 0841 сохраняли способность связываться с Е-селектином после хранения в условиях высокой температуры (то есть при 40°С).
Стабильность высокой концентрации
[0469] Гуманизированные антитела 0841 подвергали экстенсивному диализу в трех буферах: Tris/Suc (20 мМ Tris, 8,5% сахарозы, pH 7,5), His/Suc (20 мМ гистидина, 8,5% сахарозы, 0,005% EDTA, pH 5,8) и Glu/Tre (20 мМ глутаминовой кислоты, 8,5% трегалозы, рН 4,5). После диализа образцы концентрировали до концентрации 150 мг/мл с помощью концентратора со спиновым фильтром и хранили при 4°C и 25°C. На T0, T1, T2, T4 и T6 неделе образцы брали для анализа aSEC в режиме реального времени.
[0470] Агрегированное состояние образцов с высокой концентрацией определяли с помощью aSEC, как описано выше для анализа принудительного разложения. Образцы, хранившиеся при 4°C и 25°C, были стабильны при высокой концентрации в течение T6 недель (T6W) с небольшим увеличением процентного содержания HMMS (<5%) в условиях всех трех буферов (таблица 19).
[0471]
T0
[0472] В недели T0, T3 (T3W) и T6 образцы анализировали с помощью iCE и капиллярного гель-электрофореза (CGE). iCE использовали для обнаружения гетерогенности на основе заряда образцов с высокой концентрацией с использованием метода, аналогичного методу, использованному в исследовании принудительного разложения. Минимальные изменения % кислотных соединений и % щелочных соединений наблюдали в течение 6 недель хранения при 25°C в буферах His/Suc и Glu/Tre с большими изменениями, связанными с буфером Tris/Suc, у кислотных и щелочных соединений (таблица). 20).
[0473]
Время отбора образцов
[0474] CGE выполняли для определения фрагментации образцов с высокой концентрацией антител 0841. Образцы анализировали с использованием экспресс-анализа белка LabChip Touch HT от Perkin Elmer. Анализ проводили в соответствии с инструкциями производителя, и образцы готовили с использованием модифицированного метода. Вкратце, 5 мкл образца с концентрацией 1 мг/мл смешивали с 35 мкл буфера для образцов, содержащего либо йодацетамид для невосстановления (nrCGE), либо дитиотреитол для снижения CGE, и инкубировали при 70°C в течение 10 минут. После нагревания к каждому образцу добавляли 70 мкл деионизированной воды перед анализом на системе Touch. Размер и уровень фрагментации для каждого образца количественно определяли с использованием программного обеспечения LabChip GX.
[0475] Количественное определение % фрагментации и % HMMS показало, что антитела 0841 при высокой концентрации было стабильным во всех трех буферах (таблица 21).
[0476]
pH 7,5
pH 5,8
pH 4,5
pH 7,5
pH 5,8
pH 4,5
Пример 17: Риск иммуногенности In Silico и прогноз Т-клеточного эпитопа гуманизированного антитела против Е-селектина.
[0477] Риск иммуногенности гуманизированных антител против Е-селектина 0841 прогнозировали с использованием инструментов in silico для прогноза связывания пептида MHCII. Эти инструменты использовали: (1) для идентификации эпитопов потенциального связывания MHCII для каждого отдельного пептида в последовательности, (2) для классификации эпитопов, чтобы оценить риск потенциальных средств связывания пептидов MHCII, и (3) для общей оценки последовательности, чтобы спрогнозировать общий риск иммуногенности связывания всей последовательности, ассоциированной со связыванием MHCII. Методы описаны ниже.
Идентификация эпитопа
[0478] Последовательности анализировали с использованием двух протоколов (описанных ниже) для идентификации эпитопов. Любая последовательность, меченная согласно правилам, описанным в данном документе для любого из протоколов, считалась эпитопом. Эти методы исследуют последовательности, прежде всего, на уровне 9-меров аминокислот.
Протокол 1: ISPRI/EpiMatrix
[0479] Последовательности были представлены для анализа EpiMatrix в пакете программного обеспечения ISPRI (ISPRI v 1.8.0, EpiVax Inc., Providence, RI (2017); Schafer JRA et al. (1998) Vaccine 16(19): 1880-84). Необработанные результаты предоставили ранжирование вероятности связывания каждого 9-мерного аминокислотного фрагмента с 8 различными типами HLA. Таким образом, для каждого 9-мера было 8 прогнозов («наблюдений»). 9-меры создавали, начиная с каждой отдельной позиции линейной нумерации последовательности (таким образом, один и тот же 9-мер мог встречаться более одного раза в одной и той же последовательности). Если какие-либо 4 наблюдения указывали на то, что 9-мер находился в первых 5% связывающих веществ (это означает, что он должен был находиться в первых 5% связывающих веществ по меньшей мере для 4 типов HLA), 9-мер считался предполагаемым эпитопом («эпитоп»). В качестве альтернативы, если любой 1 из 8 прогнозов указывал на то, что 9-мер находился в верхнем 1% связывающих веществ, 9-мер также считался спрогнозированным эпитопом.
Протокол 2: Консенсусный метод IEDB
[0480] Последовательности были представлены для анализа с использованием консенсусного метода связывания MHC-II (Wang P. et al. (2010) BMC Bioinformatics 11: 568; Wang P. et al. (2008) PLoS Comput. Biol. 4(4),e1000048) in IEDB (Vita R. et al., Nucleic Acids Res. 2015; 28 (43): D405-12; IEDB MHC-II Binding Pregictions, www.iedb.org). Результат программного обеспечения упорядочил результаты по 15-мерам. Для каждой комбинации 15-мера и типа HLA были предоставлены консенсусная оценка и процентильное ранжирование. Индивидуальные оценки, из которых был получен консенсус каждого 15-мера, представляли собой ранжирование определенных 9-меров, обнаруженных в 15-мере: каждый метод, использованный для консенсуса, сообщал о процентильном ранге для 9-мера в 15-мере. Консенсус, принятый в качестве значения для всего 15-мера, был прогнозом 9-мера, имеющего средний балл. 9-мер классифицировали как эпитоп, если (а) он был выбран в качестве консенсусного представителя для 15-мера И (б) имел процентильный ранг среди 10% лучших связующих веществ для рассматриваемого типа HLA, И если критерии (a) и (b) совпали для трех или более различных типов HLA для одного и того же 9-мера (то есть три наблюдения). Рассмотренными типами HLA были DRB1*01, 1*03, 1*04, 1*07, 1*08, 1*11, 1*13 и 1*15, которые были одинаковыми типами HLA в стандартном отчете ISPRI/EpiMatrix. Таким образом, хотя первичным результатом метода было ранжирование 15-меров, мы переинтерпретировали данные, чтобы получить список предсказанных 9-мерных эпитопов для простоты сравнения с Протоколом 1.
Классификация эпитопов
[0481] Каждый эпитоп классифицировали как эпитоп зародышевой линии или эпитоп не зародышевой линии. Для антител авторы дополнительно классифицировали каждый эпитоп на основе его расположения в антителе (CDR или не-CDR). авторы отфильтровали последовательности V-доменов человека, полученные из IMGT (www.imgt.org), чтобы удалить зародышевые линии, аннотированные как псевдогены или открытые рамки считывания (ORF). Любые спрогнозированные 9-мерные эпитопы, обнаруженные в остальных последовательностях, считались эпитопами зародышевой линии. Эпитопы, обнаруженные в областях J или C (включая IgG1, IgG2, IgG3 и IgG4), или соединения между этими областями, также были классифицированы как эпитопы зародышевой линии. В противном случае эпитоп классифицировали как эпитоп не зародышевой линии. Остатки вариабельного домена нумеровали на основе системы нумерации Kabat (Kabat EA, et al. (1991) US Department of Health and Human Services, NIH Publication No. 91-3242). После нумерации CDR определяли как включающие следующие остатки: CDR-H1 (H26-H35, включая вставки, такие как H35A, вплоть до H36, но не включая их), CDR-H2 (H50-H65 включительно), CDR-H3 (H95-H102 включительно) CDR-L1 (L24-L34 включительно), CDR-L2 (L50-L56 включительно), CDR-L3 (L89-L97 включительно). Спрогнозированный 9-мерный эпитоп был эпитопом CDR, если любая из его аминокислот была частью области CDR. Следует отметить, что выбранная авторами начальная позиция (H26) для CDR-H1 отличается от некоторых других публикаций, использующих аннотацию Kabat.
Общая оценка последовательности (скорректированная оценка T-reg)
[0482] Для отдельной цепи или для пары VH- и VL-доменов антител общий балл рассчитывали путем суммирования каждого из составляющих 9-меров следующим образом. Были исследованы все отдельные комбинации 9-мера и типа HLA («наблюдения»), независимо от того, был ли 9-мер эпитопом. Если конкретное наблюдение указывало на то, что пептид находится в верхних 5% связывающих веществ для данного типа HLA, Z-оценка EpiMatrix для этого наблюдения добавлялась к промежуточному итогу, связанному со всей последовательностью белка. Также фиксировалось общее количество просмотренных наблюдений. Единственным исключением было то, что предполагалось, что все наблюдения 9-меров, идентифицированных ISPRI как «T-регитопы» имеют нулевые оценки EpiMatrix. В промежуточной сумме исходный балл 0,05 * 2,2248 вычитали из каждого наблюдения (включая Т-регитопы). Окончательную оценку рассчитывали следующим образом:
[0483] Скорректированная оценка T-reg=(Промежуточная сумма) * 1000/(Количество наблюдений)
[0484] Более низкие баллы указывали на более низкий прогнозируемый иммуногенный потенциал. Нужно учесть, что оценка включала только прогнозы из ISPRI/EpiMatrix и не включала информацию из IEDB. Следовательно, любые сильные HLA-связывающие вещества, спрогнозированные IEDB, но не ISPRI, не влияли на оценку. Теоретически последовательности могут содержать много спрогнозированных IEDB связывающих веществ HLA и по-прежнему иметь благоприятный скорректированный показатель T-reg, если EpiMatrix также не прогнозирует, что те же последовательности являются вероятными связывающими веществами.
[0485] Эти инструменты использовали для прогнозирования числа эпитопов Т-клеток, не относящихся к зародышевой линии, и общей оценки последовательности в гуманизированном антителе 0841 (содержащем аминокислотную последовательность VH SEQ ID NO: 25 и аминокислотную последовательность VL SEQ ID NO: 21). Используя два протокола, в последовательностях VH и VL идентифицировали 8 эпитопов не зародышевой линии (H27: YNIRSSYMH (SEQ ID NO: 178), H63: FKIRFTISA (SEQ ID NO: 179), H65: IRFTISADN (SEQ ID NO: 180), L29: INRYLNWYQ (SEQ ID NO: 181), L46: LLIYNANSL (SEQ ID NO: 182), L47: LIYNANSLQ (SEQ ID NO: 183), L48: IYNANSLQT (SEQ ID NO: 184) и L49: YNANSLQTG (SEQ ID NO: 185) (фиг. 4).Кроме того, общая оценка последовательности составила -30,34. Предполагается, что уменьшение количества эпитопов и общей оценки последовательности снижает общий риск иммуногенности последовательности.
Пример 18: Оптимизация гуманизированных антител против Е-селектина.
Основанный на структуре рациональный мутагенез антител 0841
[0486] Антитела к Е-селектину 0841 содержали несколько спрогнозированных Т-клеточных эпитопов, которые могут повышать риск иммуногенности при введении субъекту. К ним относятся 8 эпитопов не зародышевой линии, содержащихся в последовательностях VH и VL (H27: YNIRSSYMH, H63: FKIRFTISA, H65: IRFTISADN, L29: INRYLNWYQ, L46: LLIYNANSL, L47: LIYNANSLQ, L48: IYNANSLQT и L49: YNANSLQTG). Кроме того, пептидное картирование антител после индуцированного термического разложения выявило сайт ответственности за дезамидирование NR в положении L30. В дополнение к сайту ответственности за дезамидирование NR в L30 были идентифицированы другие сайты потенциальной ответственности, включая сайт NG в положении тяжелой цепи H54, сайт NS в положении L52 и сайт NS в положении L92. Для удаления спрогнозированных Т-клеточных эпитопов и сайтов ответственности последовательности, использовали методы оптимизации на основе структуры.
[0487] Однако первоначально было получено еще одно гуманизированное антитело 0978 (содержащее аминокислотную последовательность HC SEQ ID NO: 28 и аминокислотную последовательность LC SEQ ID NO: 26), в котором произведена модификация на уровне зародышевой линии CDR-L2 с DPK9 CDR-L2 (AASSLQS (SEQ ID NO: 3) и конец CDR-H2 с последовательностью DP-54 (H59-H65 YVDSVKG (SEQ ID NO: 186)). Было показано, что антитело 0978 сохраняет связывание, сходное с антителами 0841 с использованием анализа конкурентного связывания, описанного в примере 16. Модификация на уровне зародышевой линии этих двух сайтов удалила 5 спрогнозированных Т-клеточных эпитопов (H63: FKIRFTISA (SEQ ID NO: 179), L46: LLIYNANSL (SEQ ID NO: 182), L47: LIYNANSLQ (SEQ ID NO: 183), L48: IYNANSLQT (SEQ ID NO: 184) и L49: YNANSLQTG (SEQ ID NO: 185), но ввела новый спрогнозированный Т-клеточный эпитоп (H63: VKGRFTISA (SEQ ID NO: 187)). Кроме того, мутация L2 удалила потенциальный сайт ответственности NS в положении L52, но мутация конца H2 добавила участок DS в положении H61, который был еще одним потенциальным сайтом ответственности. Оптимизацию на основе структуры проводили для антител 0978 с использованием рентгеноструктурного анализа кристаллической структуры антител 0164, связанных с лектиновым доменом с-типа Е-селектина (остатки 22-178), чтобы удалить оставшиеся 3 спрогнозированных Т-клеточных эпитопа и сайтов ответственности последовательности.
[0488] Чтобы определить подходящие положения для мутагенеза, компьютерное прогнозирование мутаций как для изменений аффинности, так и для изменений стабильности проводили с использованием Discovery Studio 4.5 (Dassault Systems Biovia Corp.) и FoldX. Допустимые мутации - это мутации, для которых не прогнозируется ΔΔG >1 ккал/моль как для методов Discovery Studio, так и для методов FoldX. На основании этих прогнозов был идентифицирован набор остатков, которые, как предполагается, будут оказывать минимальное влияние на связывание и стабильность при удалении спрогнозированных Т-клеточных эпитопов и сайтов ответственности последовательностей, которые показаны в Таблице 22.
[0489]
(SEQ ID NO: 188)
(SEQ ID NO: 187)
(SEQ ID NO: 189)
(SEQ ID NO: 187)
(SEQ ID NO: 190)
(SEQ ID NO: 187)
(SEQ ID NO: 191)
(SEQ ID NO: 181)
(SEQ ID NO: 192)
[0490] С использованием этого набора мутаций сконструировали 4 оптимизированные конструкции, которые удаляли 3 сайта ответственности последовательности и 3 Т-клеточных эпитопа, идентифицированных в таблице 22. Эти конструкции представляют собой антитела 1282 (содержащие аминокислотную последовательность HC SEQ ID NO: 43 и аминокислотную последовательность LC SEQ ID NO: 1), антитела 1284 (содержащие аминокислотную последовательность HC SEQ ID NO: 40 и аминокислотную последовательность LC SEQ ID NO: 1), антитела 1444 (содержащие аминокислотную последовательность HC SEQ ID NO: 13 и аминокислотную последовательность LC SEQ ID NO: 1) и антитела 1448 (содержащие аминокислотную последовательность HC SEQ ID NO: 37 и аминокислотную последовательность LC SEQ ID NO: 1). Мутации относительно антитела 0978 показаны в таблице 23. То, что аффинность связывания этих мутантов похожа на антитела 0978, подтверждено с использованием анализа конкурентного связывания, описанного в примере 16.
[0491]
Пример 19: Нейтрализация оптимизированных антител против E-селектина. (0164, 0841, 1282, 1284, 1444, 1448)
Нейтрализация связывания лиганда с экспрессируемым на клеточной поверхности CHO E-селектином
[0492] В статическом анализе клеточной адгезии лиганда конъюгированный с пероксидазой хрена (HRP) лиганд E-селектина (антиген сиалил-Льюис) и антитела против E-селектина конкурируют за связывания с E-селектином человека или яванского макака, экспрессируемым на клетках яичника китайского хомячка (СНО). Способность антител против E-селектина нейтрализовать связывание лиганда оценивали в статическом анализе нейтрализации с использованием конкурентного твердофазного иммуноферментного анализа (ELISA) для оценки нейтрализации антигена сиалил-Льюис клетками яичника китайского хомячка (CHO), сконструированными для экспрессии E-селектина человека или яванского макака.
[0493] Клетки CHO, экспрессирующие E-селектин человека, выращивали в культуральной среде (MEM (минимальная необходимая среда) Alpha Medium, дополненной 10% (о/о) диализированной эмбриональной телячьей сыворотки, 100 нМ метотрексата и 100 ед/мл пенициллина и 100 мкг/мл стрептомицина). Клетки CHO, экспрессирующие E-селектин яванского макака, культивировали в среде R1 (модифицированная по способу Дульбекко среда Игла R1/модифицированная среда Хэма F12), дополненной 10% инактивированной нагреванием эмбриональной телячьей сыворотки (GIBCO), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина и 125 мкг/мл зеоцина (GIBCO).
[0494] Клетки CHO, экспрессирующие E-селектин, высевали по 12500 клеток на лунку в 96-луночный планшет для культуры ткани и инкубировали при 37°C, 5% CO2 в течение 48 часов с образованием конфлюэнтного монослоя. Затем планшеты промывали два раза 200 мкл не содержащего кальция и магния PBS. Антитела против E-селектина или изотипический контроль IgG1 (IgG контроль) добавляли в анализ в присутствии небольшого синтетического конъюгата биотинилированного полиакриламида сиалил-Льюис A (Carbosynth LLC, OS45446) или полиакриламида сиалил-Льюис X (Glycotech, 01-045) со стрептавидином/пероксидазой хрена (всего 100 мкл) и инкубировали при 37°C, 5% CO2 в течение 2 часов. Затем планшеты промывали два раза 200 мкл не содержащего кальция и магния PBS. После инкубации клетки промывали два раза 200 мкл буфера для промывки, содержащего 2 мМ хлорида кальция (50 мМ TRIS [трисаминометан], 150 мМ хлорида натрия; 0,05% полисорбата 20, pH 7,4; 2 мМ хлорида кальция). Сигнал стимулировали путем добавления 100 мкл субстрата 1-Step Ultra TMB (Thermo Scientific, 34028) и инкубации в течение 30 минут при комнатной температуре. Реакции останавливали путем использования 2 M серной кислоты, и поглощение считывали при 450 нМ (Spectramax M5e). Данные анализировали, и строили график с использованием программного обеспечения GraphPad Prism (Версия 8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50) в диапазоне от 1,38 до 2,89 нМ для E-селектина человека и от 1,85 до 2,65 нМ для E-селектина яванского макака (фиг. 5 и на фиг. 6) (Таблица 24).
[0495]
[0496] В дополнительных статических анализах нейтрализации с использованием способов, аналогичных тем, что описаны выше, антитела 1444 нейтрализовали связывание лиганда с белком E-селектина человека или яванского макака, экспрессируемым клетками CHO с прогнозируемым значением IC50 1,88 нМ - 2,33 нМ и 1,47 нМ - 1,49 нМ, соответственно.
Нейтрализация связывания лиганда с Растворимыми Рекомбинантными Белками
[0497] Получали маточные растворы рекомбинантного меченого гистидином E-селектина; E-селектина яванского макака (Sino Biologicals; 190169-C08H) и E-селектина человека (Sino Biologicals; 13025-H08H) в итоговой концентрации 3 мкг/мл в фосфатно-солевом буфере (PBS) без кальция и магния. В 96-луночный планшет Ni-NTA HisSorb (Qiagen, 35061) добавляли сто мкл на лунку разведенного рекомбинантного белка E-селектина, и планшеты инкубировали на орбитальном шейкере при комнатной температуре в течение 2 часов. Полиакриламид сиалил-Льюис A биотин, синтетический лиганд E-селектина (корпорация GlycoTech 01-044) конъюгировали со стрептавидином HRP (пероксидаза хрена) (Ultra Streptavidin HRP, Thermo Scientific N504) и разводили в растворителе для анализа, содержащем 2 мМ хлорида кальция (буфер BD OptEIA; BD Biosciences, 555213).
[0498] Двукратно концентрированные маточные растворы антител (контроль IgG1, 0160, 1282, 1284, 1444 и 1448) также готовили в разбавителе для анализа, содержащем 2 мМ хлорида кальция. После инкубации планшеты 5 раз промывали 200 мкл промывочного буфера, содержащего 2 мМ хлорида кальция (50 мМ TRIS [тризаминометан]; 150 мМ хлорида натрия, 0,05% полисорбата 20, рН 7,4; 2 мМ хлорида кальция). После этого добавляли 100 мкл смеси антител (контроль IgG1, 0160, 1282, 1284, 1444 и 1448) и сиалила Льюиса А, конъюгированного с пероксидазой хрена, и планшеты инкубировали на орбитальном шейкере при комнатной температуре в течение 2 часов. Конечная концентрация антител колебалась от 200 нМ до 0,09 нМ, а конечная концентрация сиалила Льюиса А, конъюгированного с пероксидазой хрена, составляла 5 мкг/мл. Планшеты промывали, как указано выше, добавляли по 100 мкл на лунку субстрата 1-Step Ultra TMB (Thermo Scientific, 34028) и инкубировали в течение 5 минут при комнатной температуре. Реакции останавливали 100 мкл 2М серной кислоты, и измеряли оптическую плотность при 450 нм (Spectramax M5e). Данные анализировали и представляли в виде графиков с использованием программного обеспечения GraphPad Prism (версия 8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50) (Таблица 25.
[0499] В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50) в диапазоне от 2,96 нМ до 3,59 нМ для нейтрализации антителами связывания лиганда с растворимым рекомбинантным E-селектином человека и от 2,74 нМ до 3,29 нМ для нейтрализации антителами связывания лиганда с растворимым рекомбинантным E-селектином яванского макака.
[0500]
[0501] В дополнительных статических анализах нейтрализации с использованием способов, аналогичных тем, что описаны выше, антитела 1444 нейтрализовали связывание лиганда с белком E-селектина человека или яванского макака с прогнозируемым значением IC50 of 2,87 нМ - 2,91 нМ и 2,39 нМ - 2,45 нМ, соответственно.
Пример 20: Кинетическая оценка оптимизированных антител против E-селектина с использованием поверхностного плазмонного резонанса.
[0502] Аффинность связывания определяли для Е-селектина человека и яванского макака для оптимизированных антител 1282, 1284, 1444 и 1448 с использованием SPR с помощью способа, аналогичного пример 4. Сперва связывали антитела с иммобилизованными антителами против IgG человека. После захвата антител перфузировали растворы белков E-селектина человека и яванского макака, и определяли константу скорости ассоциации (ka), константу скорости диссоциации (kd), t½ и значения KD для связывания (Таблица 26). В этом анализе SPR аффинность 1282, 1284, 1444 и 1448 с E-селектином человека составляла 70,3 нМ, 65,2 нМ, 61,8 нМ и 60,5 нМ, соответственно. Аффинности 1282, 1284, 1444 и 1448 с E-селектином яванского макака составляла 78,3 нМ, 76,5 нМ, 81,5 нМ и 67,8 нМ, соответственно.
[0503]
Пример 21: Связывание с клеточной поверхностью (FACS) и нейтрализация оптимизированных антител против E-селектина (0164, 0841, 1282, 1284, 1444 и 1448).
Связывание с клеточной поверхностью согласно FACS
[0504] Связывание антител 0841, 0164, 1282, 1284, 1444 и 1448 с E-селектином, связанным с мембраной, анализировали согласно FACS. Клетки CHO, экспрессирующие E-селектин человека, культивировали в среде Alpha (MEM [минимальная необходимая среда]) Alpha Medium, 50-012-PC, Corning;), дополненной диализированной эмбриональной телячьей сыворотки (GIBCO) в итоговой концентрации 10%, пенициллином/стрептомицином (1X) и дополненной метотрексатом. Кратко, оттаявшие клетки сначала выращивали в присутствии 100 нМ метотрексата. Для последующего культивирования метотрексат удалили из ростовой среды.
[0505] Эндотелиальные клетки оттаивали из замороженных маточных растворов и первоначально помещали в T-25 колбы (Corning, 353108), повторно покрытые стерильным 0,1% раствором желатина (Sigma, ES-006-B). Эндотелиальные клетки пупочной вены человека (HUVEC) выращивали на ростовой среде для эндотелиальных клеток (Sigma Aldrich, 211-500), тогда как эндотелиальные клетки микрососудов легких яванского макака (CLMEC) выращивали на полной среде для эндотелиальных клеток обезьяны (Cell Biologics, MK1168). Клетки разделяли по достижении конфлюентности 90% и высевали в три колбы Т-175, предварительно покрытые 0,1% желатином
[0506] Клеточные линии CHO, экспрессирующие E-селектин человека, отделяли от конфлюэнтных колб с использованием не содержащего ферментов буфера для диссоциации клеток (GIBCO, 13151014). К отделенным клеткам немедленно добавляли ростовую среду, затем центрифугировали при 300 x g в течение 5 минут при комнатной температуре для осаждения клеток. Затем клетки ресуспендировали в холодном буфере CHO, состоящем из фосфатно-солевого буфера (PBS), pH 7,4, содержащего бычий сывороточный альбумин (BSA; Sigma-Aldrich, A3059) в итоговой концентрации 1%, хлорид кальция в итоговой концентрации 1 мМ и азид натрия в итоговой концентрации 0,1%.
[0507] Для первичных клеток, HUVEC или CLMEC, культуры при 90% конфлюэнтности лишали сыворотки путем замены ростовой среды на базальную среду для эндотелиальных клеток (Sigma-Aldrich, 210-500). Клетки инкубировали при 37°С, 5% СО2 и 95% воздуха во влажном инкубаторе в течение 2 часов. Сразу после лишения сыворотки к клеткам добавляли базальную среду для эндотелиальных клеток, содержащую 10 нг/мл фактора некроза тканей человека-альфа (TNF-α; GIBCO), для индуцирования экспрессии E-селектина. После 4 часов стимуляции TNF-α клетки отделяли с помощью лимонного солевого раствора (135 мМ хлорида калия, 15 мМ цитрата натрия) и немедленно рекальцинировали путем добавления хлорида кальция до конечной концентрации 1 мМ. Клетки центрифугировали при 300×g при 4°C и фиксировали путем ресуспендирования в PBS, содержащем 4% параформальдегид (PFA; Electron Microscopy Sciences, 15710), на влажном льду в течение 15 минут. PFA удаляли путем центрифугирования, и клетки ресуспендировали в буфере CHO в течение ночи.
[0508] Исследования связывания с клетками CHO проводили в двух повторениях с использованием двух рядов 96-луночного планшета с круглым дном, тогда как исследования связывания с первичными эндотелиальными клетками проводили в одном ряду 96-луночного планшета с V-образным дном. Планшеты центрифугировали при 300×g в течение 2 минут при 4°С, клетки ресуспендировали и блокировали путем инкубации в буфере СНО в течение 10 минут на влажном льду. После инкубации клетки центрифугировали при 300×g в течение 2 минут при 4°C для удаления буфера. Осадок клеток в каждой лунке затем ресуспендировали и инкубировали в указанном объеме серийно разбавленного антитела (контроль IgG1 человека, 0841, 1282, 1284, 1444 и 1448) и инкубировали в течение 30 минут на влажном льду. Растворы тестируемых антител готовили путем серийного трехкратного разведения (от 1333 нМ до 0,0226 нМ) с использованием буфера CHO в качестве разбавителя. После инкубации с антителом клетки трижды промывали путем центрифугирования при 300×g в течение 1 минуты при 4°С и ресуспендировали в холодном буфере CHO. Промытые клетки ресуспендировали и инкубировали с 100 мкл AlexaFluor647, конъюгированного с козьими фрагментами F(ab')2 (специфическими антителами к фрагментам Fcγ, [Jackson Immunoresearch, 109-606-170]), при разведении 1:1000 в течение 45 минут (клетки СНО) или 30 минут (эндотелиальные клетки) на влажном льду. Клетки промывали три или четыре раза перед ресуспендированием в буфере СНО для проточного цитометрического анализа. Для получения данных флуоресценции клеток использовали прибор Becton Dickinson LSRFortessa с использованием лазерной линии 640 нм. Среднее геометрическое значение флуоресценции клеток анализировали с помощью программного пакета FlowJo (FlowJo, LLC) и строили график зависимости от концентрации антител. Расчетные значения EC50 рассчитывали с использованием нелинейного регрессионного анализа в пакете Prism (GraphPad, версия 8).
[0509] Антитела 0841, 1282, 1284, 1444 и 1448 связывались с клетками CHO, сконструированными для экспрессии E-селектина человека, с похожими расчетными значениями EC50 в диапазоне нМ от субнизких до низких значений (Таблица 27). Контрольный IgG человека не показал никакого связывания с клетками CHO, экспрессирующими E-селектин человека.
[0510] Антитела 0164, 1282, 1284, 1444 и 1448 связывались с Е-селектином клеточной поверхности человека и яванского макака на HUVEC и CLMEC, которые обрабатывали в течение 4 часов TNF-α, чтобы индуцировать экспрессию E-селектина. По сравнению с изотипическим контролем IgG1, в котором связывание не наблюдалось, наблюдалось связывание с эндогенно экспрессируемым E-селектином на клеточной поверхности HUVEC или CLMEC, активированных TNF-α. наблюдался высокая фоновая флуоресценция, и значения EC50 не рассчитывали (Таблица 27).
[0511]
Пример 22: Статическая нейтрализация клеточной адгезии посредством оптимизированных антитела против E-селектина
[0512] E-селектин связывается с сиалированными модифицированными лигандами Lewis, экспрессируемыми на поверхности клеток крови. В этом исследовании клеточную линию промиелоцитов человека (HL-60) использовали в виде клеточного источника для лигандов E-селектина. Активность нейтрализации антителами 0164, 1282, 1284, 1444 и 1448 адгезии клеток HL-60 с клеточной поверхностью E-селектина (на клетках CHO) оценивали в статическом анализе нейтрализации адгезии.
[0513] Клетки CHO, экспрессирующие E-селектин человека, выращивали в свежей ростовой среде, дополненной 100 нМ метотрексата. После этого первоначального пассажа клеток метотрексат удалили из ростовой среды для последующего культивирования. Клетки CHO, экспрессирующие E-селектин яванского макака, культивировали в среде R1. После этого первоначального пассажа клеток зеоцин удалили из ростовой среды для последующего культивирования.
[0514] Клетки HL-60 в фазе логарифмического роста метили с использованием набора для мечения флуоресцентным красителем сукцинимидиловый сложный эфир карбоксифлуоресцеиндиацетата (CFSE) (ThemoFisher, 65-0850-84). Меченые клетки HL-60 ресуспендировали в буфере CHO (PBS, pH 7,4/1% бычьего сывороточного альбумина (BSA)/1 мМ хлорида кальция (CaCl2)/0,1% азида натрия (NaN3)) с плотностью 400000 клеток/мл для применения в статическом анализе адгезии.
[0515] Оценивали способность антител 0164, 1282, 1284, 1444 и 1448 ингибировать адгезию клеток HL-60 с экспрессирующим E-селектин клетками CHO в статических условиях. Кратко, клетки CHO высевали в двух рядах 96-луночных (технические повторы) черных планшетах с плоским дном с плотностью 100000 клеток/лунку и обеспечивали образование конфлюэнтного монослоя (обычно через 24 часа) при 37°C, 5% CO2 и 95% воздуха во влажном инкубаторе. Монослой клеток осторожно промывали с использованием буфера CHO, затем указанные лунки инкубировали с раствором антител (0164, 1282, 1284, 1444 и 1448) сериями с трехкратным разведением (в диапазоне от 200 мкг/мл или от 1333 нМ до 0,003 мкг/мл, или 0,022 нМ). В лунки немедленно добавляли подходящий объем суспензии меченых CFSE клеток HL-60 (400000 клеток/мл) таким образом, чтобы сохранить итоговую концентрацию антител (в диапазоне от 200 мкг/мл или 1333 нМ до 0,003 мкг/мл или 0,022 нМ). Меченые клетки HL-60 инкубировали с монослоем клеток CHO в течение 45 минут при 37°C при 5% CO2 и 95% воздуха во влажном инкубаторе. После инкубации планшет три раза промывали буфером CHO, и измеряли флуоресценцию связанных клеток HL-60 при длинах волн возбуждения/испускания 494/521 нм с использованием Spectramax i3X (Molecular Devices). единицы флуоресценции наносили на график в зависимости от концентрации антител, и IC50 оценивали с использованием нелинейного регрессионного анализа с использованием программного обеспечения GraphPad Prism (Версия 8.0.2).
[0516] Расчетные значения IC50 для антител были схожими в диапазоне от 3,4 нМ до 6,2 нМ (фиг. 7) (Таблица 28).
[0517]
[0518] В дополнительном статическом анализе нейтрализации с использованием способов, аналогичных тем, что описаны выше, антитела 1444 нейтрализовали адгезию HL-60 с клеточной поверхностью Е-селектина человека и яванского макака с расчетными значениями IC50 3,36 нМ и 3,84 нМ, соответственно (Таблица 38).
Пример 23: Связывание эндогенного E-селектина человека оптимизированными антителами против E-селектина.
[0519] Анализ ингибирования связывания Е-селектина в плазме человека с помощью оптимизированных антител 1282, 1284, 1444 и 1448 против Е-селектина проводили с использованием метода IP-LC/MS/MS. Этот метод количественно определял свободный растворимый Е-селектин человека в сыворотке человека или свободный растворимый Е-селектин обезьяны в сыворотке яванского макака. В методе использовали 50 мкл сыворотки в 250 мкл PBS, которую инкубировали в течение ночи при 4°C (в холодной комнате, встряхивая при 500 об/мин) с 1,0 мкг биотинилированных антител 0164 против Е-селектина. После инкубации к каждому образцу добавляли 30 мкл магнитных шариков стрептавидина Т1 Invitrogen с последующей инкубацией в течение 40 минут при комнатной температуре (встряхивая при 1000 об/мин). Используя Hamilton Microlabstar, магнитные шарики затем дважды промывали PBS/0,05% Tween-20, а затем один раз PBS. Затем растворимый E-селектин элюировали из шариков с помощью 145 мкл 30 мМ соляной кислоты (HCl) и нейтрализовали с помощью 32 мкл 1 М Tris-HCl, pH 8. Затем добавляли 50 фмоль внутреннего стандарта, меченного стабильным изотопом (SIL), с последующим добавлением дитиотреитола (DTT, 10 мкл × 50 мМ). После инкубации в течение 35 минут при 60°C образцам давали остыть до комнатной температуры перед добавлением йодацетамида (IAA, 10 мкл × 100 мМ). Затем образцы помещали в темноту на 30 минут, и добавляли 1 мкг Promega LysC/трипсина (10 мкл x 100 мкг/мл), а затем расщепляли в течение ночи при 37°C.
[0520] После инкубации в течение ночи 50 мкл полученного образца вводили на нано ESILC-MS/MS. Количественное определение осуществляли путем отслеживания триптических пептидов для растворимого E-селектина (CSSLAVLEK (SEQ ID NO: 193)). Это количественное определение показало, что антитела 1282, 1284, 1444 и 1448 имели похожее ингибирование E-селектина человека с IC50 2,4 нМ, 1,1 нМ, 1,2 нМ и 1,8 нМ, соответственно, и IC90 4,9 нМ, 4,8 нМ, 6,5 нМ и 8,6 нМ, соответственно.
Пример 24: Получение биофизических характеристик гуманизированных антител против E-селектина.
Термическая стабильность
[0521] Дифференциальную сканирующую калориметрию использовали для определения стабильности четырех оптимизированных антител 1282, 1284, 1444 и 1448 против E-селектина. Использовали способ DSC, похожий на способ, описанный в примере 16. В таблице 29 ниже показана температура плавления (Tm1 - Tm3 и FAB) этих молекул в буфере Tris/Сахароза («Tris/Suc») (20 мМ Tris, 8,5% сахарозы, при pH 7,5), буфере Гистидин/Сахароза («His/Suc») (20 мМ гистидина, 8,5% сахарозы, 0,005% EDTA, при pH 5,8) и буфере Глутаминовая кислота/Трегалоза («Glu/Tre») (20 мМ глутаминовой кислоты, 8,5% трегалозы, при pH 4,5). Все четыре молекулы демонстрировали хорошую стабильность с первым переходом в домене CH2 (Tm1) более 65°C в буферах Tris/Suc, His/Suc и Glu/Tre. Эти молекулы показали небольшое увеличение стабильности в буферах His/Suc и Glu/Tre и небольшое снижение стабильности в буфере Tris/Suc.
[0522]
Принудительное разложение
[0523] Оптимизированные антитела 1282, 1284, 1444 и 1448 против E-селектина получали в 4-недельном исследовании принудительного разложения при 40°C путем интенсивного диализа в трех буферах: Tris (20 мМ Tris при pH 7,5), His (20 мМ гистидина при pH 5,8) и Glu (20 мМ глутаминовой кислоты при pH 4,5). После диализа концентрации образцов доводили до 5 мг/мл. На T0, T2 и T4 неделе брали аликвоты образцов для aSEC, iCE и тестирования биопроб.
[0524] Агрегированное состояние принудительно разложенных образцов определяли путем aSEC, как описано в примере 16. Все образцы показали минимальное изменение менее 5% LMMS и менее 1% HMMS соединений на T4 неделе (Таблица 30).
[0525]
[0526] Визуализируемое капиллярное изоэлектрическое фокусирование (iCE) использовали для обнаружения основанной на заряде неоднородности принудительно разложенных образцов. Это было сделано с использованием метода, аналогичного методу, использованному в примере 16. Для образцов с высоким % кислотных/щелочных соединений в анализе iCE требовался дополнительный анализ масс-спектроскопии для выявления потенциальных последовательностей в областях CDR. Анализ образцов в буферах Tris, His и Glu показал типичное увеличение кислотных и щелочных соединений (таблица 31). Антитела 1444 дополнительно анализировали с использованием трехкомпонентного анализа масс-спектроскопии и пептидного картирования для сравнения с гуманизированными антителами 0841.
[0527]
Масс-спектроскопический анализ
[0528] На оптимизированных антителах 1444 проводили 3-компонентный масс-спектроскопический анализ. Анализ принудительного разложения антител 1444 на T4W в буфере Glu, His и Tris показал похожие профили по сравнению с T0. Были низкие уровни окисления scFc (одноцепочечного Fc) и наблюдаемого усеченного фрагмента D/P, низкие уровни обнаруженного oxi_Fd (окисленного Fd), обнаруженного следового Fd+ HexNAc (гликированногой Fd), обнаруженных следовых количеств усеченного фрагмента Fd D/P (Fd-фрагмента с расщепленным сайтом D/P) и низкий уровень PyroE Fd (Fd-фрагмента с пироглутаминовой кислотой на N-конце), наблюдаемый у подвергаемых стрессовому воздействию образцов (фиг. 8).
[0529] Пептидное картирование проводили для антител 1444 с применением способа, похожего на способ, используемый в примере 16. Высокоточный анализ пептидного картирования на T0 и T4 неделе принудительного разложения образцов в буфере Tris, His или Glu показал, что следовый уровень изомеризации и дезамидирования был обнаружен только в пептиде IDPANGNTIYVDSVTGR (SEQ ID NO: 194) HC CDR 2 антитела 1444 против E-селектина (Таблица 32). Все образцы имели > 96% обычных пептидов, причем менее 1% находилось в виде деамидированных пептидов и менее 2% находилось в виде пептидов, содержащих изомеризации (IsoD). Этот оптимизированный вариант более не содержит химически лабильного мотива в положении 30 легкой цепи, который был заменен на Glu в результате мутагенеза. Для пептида TSQNIERYLNWYQQKPGK CDR1 LC (SEQ ID NO: 195) модификация не обнаружена.
[0530]
[0531] Для дополнительной оценки стабильности принудительно разложенных образцов активность подвергаемых стрессовому воздействию образцов (антител 1282, 1284, 1444, 1448) оценивали в ELISA конкурентного связывания. В данном случае T0, T2W и T4W образцы сравнивали по их способности конкурировать с биотинилированными химерными антителами 0164 за связывание с E-селектином человека. Этот способ был похож на способ, описанный в примере 16. Результаты конкурентного связывания показаны на фиг. 9A-9D, и между образцами T0, T2W и T4W разница была не видна, что указывает на то, что способность антител связываться с E-селектином была стабильной после инкубации при высокой температуре.
Стабильность Высокой Концентрации
[0532] Оптимизированные антитела 1282, 1284, 1444 и 1448 против E-селектина интенсивно диализировали в трех буферах, Tris/Suc (20 мМ Tris, 8,5% сахарозы при pH 7,5), His/Suc (20 мМ гистидина, 8,5% сахарозы, 0,005% EDTA при pH 5,8) и Glu/Tre (20 мМ глутаминовой кислоты, 8,5% трегалозы при pH 4,5). После диализа образцы концентрировали до 150 мг/мл с использованием концентратора в виде спинового фильтра и хранили при 4°C и 25°C. На момент ноль (T0), одна неделя (T1W), две недели (T2W), четыре недели (T4W), шесть недель (T6W) и семь недель (T7W) брали аликвоты образцов для анализа aSEC в реальном времени, а анализ iCE и CGE проводили в конце исследования на неделе T0, T3 и T7.
[0533] Агрегированное состояние образцов высокой концентрации определяли путем aSEC, как описано в примере 16. Образцы при 4°C и 25°C показали хорошую стабильность высокой концентрации во все моменты времени с небольшим повышением HMMS (<5% от общего числа) в условия всех трех буферов (фиг. 10A-10D).
[0534] iCE использовали для выявления основанной на заряде неоднородности образцов высокой концентрации с применением способа, аналогичного способу, описанному в примере 16. Минимальное изменение % кислотных и % щелочных соединений было видно у антител, хранящихся при 25°C в буферах Tris/Suc, His/Suc и Glu/Tre на протяжении 7 недель исследования (Таблица 33).
[0535]
[0536] Анализ CGE проводили для определения фрагментации образцов высокой концентрации оптимизированных антител 1282, 1284, 1444 и 1448. Анализ проводили с применением способа, аналогичного способу, описанному в примере 16. Количественное определение % фрагментации и % HMMS продемонстрировало хорошую стабильность высокой концентрации для антител 1282, 1284, 1444 и 1448 во всех трех буферах при 25°C (Таблица 34).
[0537]
буфер/время
буфер/время
Вязкость
[0538] Вязкость оптимизированных антител 1282, 1284, 1444 и 1448 измеряли с использованием следующего метода DLS (динамического светорассеяния) на основе шариков. Белки в PBS подвергали интенсивному диализу с 20 мМ гистидина, 85 мг/мл сахарозы, 0,05 мг/мл EDTA, pH 6,0 с использованием мембранных кассетных устройств 10K MWCO (Thermo Scientific). Белки собирали после диализа и фильтровали с использованием шприцевого фильтра 0,2 мкМ. Белки концентрировали с использованием центробежных концентраторов Vivaspin 10K MWCO (GE Healthcare). Аликвоты образцов (12 мкл) удаляли из ретентата концентратора по мере уменьшения объема белка и увеличения концентрации белка. К образцам белка и пустому буферу добавляли шарики размером 300 нм (Nanosphere, Thermo Scientific). Шарики разводили 1:10 в 20 мМ гистидина, 85 мг/мл сахарозы, 0,05 мг/мл EDTA, рН 6,0, и 0,75 мкл разбавленных шариков добавляли в образец белка. Образцы белок/шарики и буфер/шарики смешивали путем осторожного встряхивания. Восемь мкл образца переносили в 1536-луночный планшет (SensoPlate, стеклянное дно, Greiner Bio-One) для анализа методом DLS. Планшет запечатывали оптически прозрачной лентой и центрифугировали при 2000 об/мин в течение 2 минут для удаления пузырьков.
[0539] Измерения DLS проводили с использованием планшетного ридера DynaPro (Wyatt Technology, Santa Barbara, Calif). Образцы инкубировали при 25°C и измеряли с помощью 15 последовательных измерений по 25 секунд. Радиус шарика был усреднен для сбора данных, которые имели приемлемые кривые затухания. Вязкость рассчитывали на основе уравнения Стокса-Эйнштейна. Вязкость образца рассчитывали путем деления измеренного видимого радиуса на номинальный радиус шарика и умножения на 0,893 сантипуаз (сП), что соответствует вязкости воды при 25°С.
[0540] Готовая форма с высокой концентрацией является желательным свойством антител, позволяющим вводить более высокие и менее частые дозы. Все оптимизированные антитела продемонстрировали хорошие профили вязкости, при этом их вязкость не достигала 20 сП до примерно 160 мг/мл. Для подтверждения этого измерения было проведено дополнительное измерение вязкости при одной концентрации для каждого оптимизированного антитела с использованием метода Антона Паара, описанного ниже.
[0541] Образцы белка концентрировали до целевого значения 170-180 мг/мл с использованием центробежных фильтров Amicon с отсечкой по молекулярной массе 50 кДа (EMD Millipore, Billerica, MA). Концентрации белка определяли с помощью анализа 280 нм на системе SoloVPE Variable Pathlength (C Technologies, Inc, Bridgewater, NJ). Измерения вязкости выполняли с использованием конуса и пластины CP25-1 на реометре MCR-302 (Anton Paar USA Inc., Ashland, VA) при постоянной скорости вращения 150 об/мин при 25°C. Для каждого образца провели в общей сложности 10 измерений по 10 секунд каждое, и данные были проанализированы с использованием программного обеспечения Rheoplus (Anton Paar USA Inc.) V 3.62. Измеренная вязкость 1282 составила 36,29 сП при 179,5 мг/мл. Измеренная вязкость 1284 составила 27,38 сП при 171,9 мг/мл. Измеренная вязкость 1444 составила 33,43 сП при 185,7 мг/мл. Измеренная вязкость 1448 составила 33,35 сП при 186,8 мг/мл. Все эти измерения хорошо согласуются с аппроксимацией кривой измерений вязкости методом DLS, что повышает их точность (фиг. 11).
Пример 25: Риск иммуногенности In silico и прогноз T-клеточных эпитопов оптимизированных антител против E-селектина.
[0542] Риск иммуногенности оптимизированных антител против E-селектина 1282, 1284, 1444 и 1448 прогнозировали с использованием инструментов in silico для прогноза связывания пептидов MHCII. Используемый способ был похожа на способ, описанный в примере 17. Оптимизированные антитела показали улучшенный общий показатель последовательности с уменьшением от -30,34 для гуманизированных антител 0841 до показателей -46,26 для антител 1282, -46,16 для антител 1284, -45,11 для антител 1444 и -45,32 для антител 1448. Кроме того, в оптимизированных антителах удаляли 8 спрогнозированных T-клеточных эпитопов не зародышевой линии (Таблица 35).
[0543]
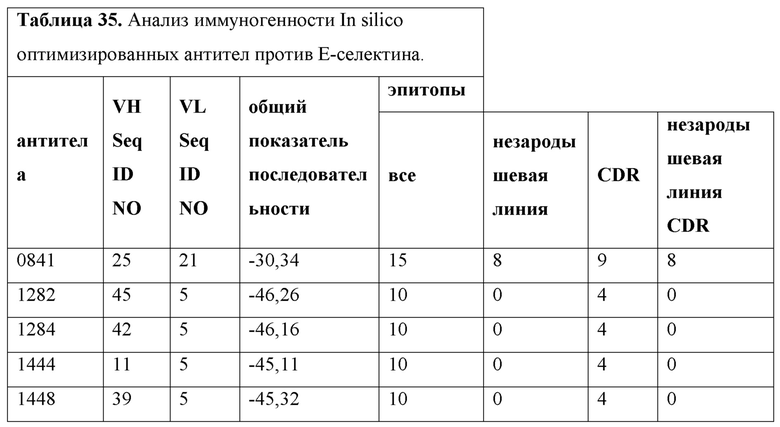
Пример 26: Самовзаимодействие и полиреактивность оптимизированных антител против E-селектина.
[0544] оптимизированные антитела 1444 (содержащие аминокислотную последовательность HC SEQ ID NO: 13 и аминокислотную последовательность LC SEQ ID NO: 1), 1282 (содержащие аминокислотную последовательность HC SEQ ID не 43 и аминокислотную последовательность LC SEQ ID NO: 1), 1284 (содержащие аминокислотную последовательность HC SEQ ID NO: 40 и аминокислотную последовательность LC SEQ ID NO: 1) и 1448 (содержащие аминокислотную последовательность HC SEQ ID NO: 37 и аминокислотную последовательность LC SEQ ID NO: 1) тестировали на связывание с ДНК и инсулином, и кроме того тестировали на самовзаимодействие в анализе AC-SINS (спектроскопия с аффинным захватом и самовзаимодействием наночастиц; Liu et al. (2014) mAb 6:483-92). В анализе AC-SINS mAb, захваченные золотыми наносферами, вызывают сдвиг максимума поглощения, если они связываются друг с другом и тем самым вызывают кластеризацию шариков. Предполагается, что высокие оценки в этом анализе коррелируют с низкой или плохой растворимостью и неспецифическим взаимодействием с мембраной (Liu et al., mAbs 2014; 6:483-92). Антитела 1282, 1284, 1444 и 1448 имели очень низкие оценки AC-SINS и оценки ДНК/инсулина, сравнимые с оценками у отрицательного контроля (таблица 36). Эти данные показывают, что эти антитела, как и отрицательный контроль, имеют низкий риск полиреактивности.
[0545]
(длина волны максимального поглощения относительно контроля, нМ)
Пример 27: Оценка перекрестной реактивности оптимизированных антител против E-селектина с использованием поверхностного плазмонного резонанса.
[0546] Аффинность связывания определяли для Е-селектина человека и яванского макака для оптимизированных антител 1444 (содержащих аминокислотную последовательность HC SEQID NO: 13 и аминокислотную последовательность LC SEQ ID NO: 1) с использованием SPR, как описано в примере 20. Используя похожий способ с высокой концентрацией аналита 405 нМ, авторы также оценили аффинность связывания этих антител с гомологами E-селектина крысы, E-селектина мыши, E-селектина кролика, L-селектина человека и P-селектина человека с применением способа, аналогичного способу, описанному в примере 5. При 25°C наблюдалось отсутствие связывания антител 1444 с E-селектином крысы, E-селектином мыши, E-селектином кролика, L-селектином человека и P-селектином человека до 405 нМ (фиг. 12). Антитела 1444 связывались с E-селектином человека с KD 68,35 +/- 3,18 нМ и связывались с E-селектином яванского макака с KD 64,9 +/- 1,13 нМ.
Пример 28: Планшетный анализ ELISA прямого связывания антител 1282, 1284, 1444 и 1448.
[0547] ELISA прямого связывания использовали для получения характеристики связывание антител 0841, 1282, 1284, 1444 и 1448 с разными иммобилизованными растворимыми рекомбинантными селектинами. маточные растворы рекомбинантного меченого гистидином P-, E- или L-селектина человека (Sino Biologicals), E-селектина мыши (Sino Biologicals), E-селектина крысы (Sino Biologicals) и E-селектина яванского макака (Sino Biologicals) получали с итоговой концентрацией 1 мкг/мл в фосфатно-солевом буфере без кальция и магния. Контроль включал направленные на L-селектин антитела (BioLegend; 304811) или направленные на P-селектин антитела или отрицательный контрольный IgG. Сто мкл на лунку разведенных рекомбинантных белков селектина добавляли в 96-луночный планшет Ni-NTA HisSorb (Qiagen; 35061). Планшеты инкубировали на орбитальном шейкере при комнатной температуре в течение 2 часов. После инкубации планшеты промывали 3 раза 200 мкл промывочного буфера (50 мМ TRIS [трисаминометан]; 150 мМ хлорида натрия; 0,05% полисорбата 20, pH 7,4). Для снижения неспецифического связывания планшеты обрабатывали 200 мкл блокировочного буфера (буфер BD OptEIA; 555213; BD Biosciences), инкубировали на орбитальном шейкере в течение 1 часа при комнатной температуре и промывали, как описано выше. Антитела (контрольные антитела IgG1, антитела против E-селектина, антитела против P-селектина или антитела против L-селектина) добавляли в реакцию по 100 мкл на лунку в двух повторениях с сериями четырехкратных разведений (в диапазоне от 133,33 нМ до 0,004 нМ, проводимых в буфере BD OptEIA), инкубировали в течение 1 часа на орбитальном шейкере и промывали, как описано выше. Добавляли сто мкл специфических антител для обнаружения (описанных ниже) и инкубировали в течение 1 часа:
IgG1 контроль, антитела 0841, 1282, 1284, 1444, 1448 против E-селектина и против P-селектина мыши обнаружили с использованием разведения 1-25000 или 1-50000 конъюгированных с пероксидазой козьих антител против Fc гамма IgG человека (Jackson ImmunoResearch Lab; 109-035-008);
антитела против L-селектина и против E-селектина крысы обнаружили с использованием разведения 1-25000 конъюгированных с пероксидазой козьих антител против IgG (H+L) мыши; (Jackson ImmunoResearch Lab;).
[0548] Планшеты промывали, добавляли 100 мкл на лунку субстрата 1-Step Ultra TMB (Thermo Scientific) и инкубировали в течение 5 минут при комнатной температуре. Реакции останавливали с помощью 100 мкл 2 M серной кислоты, и считывали поглощение при 450 нМ (Spectramax M5e). Данные анализировали, и строили график с использованием программного обеспечения GraphPad Prism (8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50).
[0549] Дозозависимое связывание с иммобилизованным L-селектином человека или P-селектином человека наблюдалось при направленных на L- или P-селектин антителах, с расчетными значениями EC50 0,362 нМ и 0,081 нМ, соответственно. В отличие от этого не наблюдалось перекрестной реактивности 0841, 1282, 1284, 1444 или 1448 с растворимым белком L- или P-селектином человека (фиг. 13). Эти исследования демонстрируют, что антитела (например 1444) избирательно связываются с E-селектином без наблюдаемого связывания с L- или P-селектином человека.
[0550] Дозозависимое связывание с E-селектином мыши и E-селектином крысы наблюдалось при контрольных антителах против E-селектина крысы или мыши с низким и субнаномолярным связыванием (0,153 нМ и 0,0139 нМ, соответственно). В отличие от этого наблюдалось слабое связывание 0841, 1282, 1284, 1444 или 1448 с E-селектином мыши и крысы, и кривые связывания были сдвинуты вправо по сравнению с положительными контрольными антителами. Кривые связывания показывали более слабое, ненасыщенное или вариабельное связывание по сравнению с контрольными антителами, направленными на E-селектин крысы или мыши (Таблица 37).
[0551]
EC50 (нМ)
ненасыщенное
ненасыщенное
ненасыщенное
[0552] В дополнительном ELISA прямого связывания с использованием способов, аналогичных тем, что описаны выше, антитела 1444 связывались с иммобилизованным растворимым рекомбинантным E-селектином человека с EC50 0,085 и с иммобилизованным растворимым рекомбинантным E-селектином яванского макака с EC50 0,07через 1-0,075 нМ (Таблица 38).
Пример 29: Фармакокинетика оптимизированных антител 1444 у обезьян после внутривенного или подкожного введения.
[0553] Исследование фармакокинетики оптимизированных антител 1444 проводили у яванского макака с использованием внутривенного и подкожного введения. Количественное определение концентрации антител 1444 в сыворотке (содержащих аминокислотную последовательность HC SEQ ID NO: 7 (которая содержит концевой лизин) и аминокислотную последовательность LC SEQ ID NO: 1) проводили с использованием иммуноанализа на платформе для анализа Meso-Scale Discovery® (MSD). В анализе для количественного определения антител 1444 против E-селектина биотинилированные козьи антитела против человеческого иммуноглобулина G (IgG) связывали с блокированным, покрытым небольшими пятнами стрептавидина планшетом. Антитела 1444 против E-селектина захватывались лигандом, рекомбинантным растворимым E-селектином человека. Связанные антитела 1444 против E-селектина обнаруживали с помощью рутенилированных козьих антител против IgG человека. Планшеты считывали на MSD SECTOR Imager 6000, и итоговое обнаружение проводили с использованием меченых рутением козьих против IgG человека антитела и трипропиламина (TPA) для получения на приборе MSD электрохимиолюминисцентного сигнала, отражающего количество связанных антител 1444 против E-селектина. Концентрации образцов определяли путем интерполяции стандартной кривой, которую подгоняли с применением логистического уравнения по 5 параметрам (весовой формулой для стандартной кривой является 1/y^2). Диапазон количественного определения в 100% сыворотке составлял от 40,0 нг/мл до 2560 нг/мл.
[0554] После внутривенного (IV) введения с концентрацией 0,3, 0,6, 1, 3 или 10 мг/кг двум животным антитела 1444 продемонстрировали средний системный клиренс, рассчитанный от времени 0 до последней измеримой концентрации (CL0-tlast) 0,39, 0,31, 0,15, 0,18 и 0,18 мл/ч/кг, соответственно, и явный объем распределения в равновесном состоянии (Vss(0-tlast)) 25, 22, 27, 35 и 36 мл/кг, соответственно. Антитела 1444 проявляли зависимую от дозы фармакокинетику, клиренс снижался с повышением дозы, что указывает на опосредованное мишеню распределение лекарственного средства. Средний период полужизни (t1/2) для IV введения с концентрацией 0,3, 0,6, 1, 3 или 10 мг/кг составлял 102, 264, 188, 287 и 345 часов соответственно.
[0555] После подкожного (SC) введения по 1 или 3 мг/кг двум животным средняя биодоступность (%F) антител 1444 составляла 50% после SC введения по 1 мг/кг по сравнению с IV введением антител по 1 мг/кг. После SC введения антител 1444 по 3 мг/кг средняя %F антител 1444 составляла 65% по сравнению с IV введением антител 1444 по 3 мг/кг. Средний период полужизни (t1/2) для SC введения антител 1444 по 1 и 3 мг/кг составлял 243 и 518 часов, соответственно.
[0556] Анализ связывания лиганда был утвержден для выявления наличия антител против лекарственного средства (ADA) в сыворотке яванского макака на платформе Meso Scale Discovery. В этом способе положительный контроль при 2 разных концентрациях, состоящий из мышиных моноклональных антител против антител 1444, введенных в сыворотку яванского макака, и отрицательный контроль, состоящий из объединенной нормальной сыворотки яванского макака, распределяли на каждый планшет для мониторинга эффективности анализа. Общая частота индукции ADA антителами 1444 составила 0% (0/18 животных) во всех группах доз.
Пример 30: Нейтрализация Ex vivo клеточной адгезии с помощью оптимизированных антител 1444 в анализе физиологического потока
[0557] Эксперименты по клеточной адгезии Ex vivo проводили внутри микрожидкостных каналов, покрытых рекомбинантными белками или клеточными монослоями, для оценки эффективности и активности нейтрализации антител 1444 в отношении ингибирования адгезии клеток, которые экспрессируют лиганды E-селектина. Клеточную адгезию анализировали в условиях физиологического потока с применением системы BioFlux™ (S/N-008-0180-08) (Fluxion, San Francisco, CA, USA). Анализы адгезии проводили с использованием рекомбинантных очищенных растворимых белков E- или P-селектина или клеток яичника китайского хомячка (СНО), сконструированных для экспрессии E-селектина (человека или яванского макака), на клеточной поверхности. Для тестирования адгезии с рекомбинантными белками E- и P-селектина и клетками CHO, которые экспрессируют E-селектин, использовали клетки HL-60 человека, которые экспрессируют лиганд E-селектина, PSGL-1 и другие лиганды сиалил-Льюис X, очищенные нейтрофилы человека, которые экспрессируют лиганды E-селектина, или цельную кровь, взятую у пациентов с серповидноклеточной анемией.
[0558] В этих исследованиях использовали планшеты/камеры BioFlux™ (Fluxion Biosciences, 48-луночный планшет с низким сдвигом, 0-20 дин/см2; 910-0004). Клетки CHO, экспрессирующие E-селектин человека, (CHO-E человека, Pfizer) или E-селектин яванского макака (CHO-E яванского макака, Pfizer), и клетки HL-60 содержали при 37°C с 5% CO2 и 95% влажности в их соответствующей ростовой среде. В исследовании с использованием клеток HL-60 или очищенных нейтрофилов человека, клетки центрифугировали при 1000 об/мин в течение 5 минут, окрашивали Calcein AM (Calcein; Life Technologies™; C3099) в течение 30 минут, промывали два раза фосфатно-солевым буфером (PBS) с кальцием и магнием (Gibco; номер по каталогу 14040-133) и ресуспендировали до концентрации 3×106 клеток/мл в PBS перед перфузией в проточных камерах. Леред перфузией клетки содержали при 37°C, а анализы BioFlux™ проводили при комнатной температуре. Прилипшие клетки визуализировали и подсчитывали с применением фазово-контрастного флуоресцентного микроскопа Nikon Eclipse Ti-S (NIS-Elements BR 3.2 64-bit) с перевернутым столиком и 40-кратным увеличением. Количество клеток нормализовали по отношению к контролю в виде несущей среды с фосфатным буфером. Каждый эксперимент имели две лунки на условие. Данные наносили на график и анализировали с использованием GraphPad Prism (8.0.2). В результате анализа получали расчетные значения полумаксимальной ингибирующей концентрации (IC50), которые округляли до двух знаков после точки. Расчетные значения IC50 были рассчитаны путем нормализации данных контроля в виде несущей среды (=100%, с не ингибирования).
Нейтрализация клеточной адгезии с рекомбинантным E-селектином
[0559] Во-первых, чтобы имитировать поверхность активированной эндотелиальной клетки, проточные камеры покрывали равными количествами растворимых рекомбинантных белков E- и P-селектина человека. Проточные микроканалы BioFlux™ покрывали 20 мкг/мл растворимого рекомбинантного P-селектина человека и E-селектин (Sino Biologicals), приготовленными в PBS, перфузировали по 1 дин/см2 в течение 5 минут, инкубировали при комнатной температуре в течение 1 часа и промывали 0,1% бычьего сывороточного альбумина (BSA)/PBS в течение 3-5 минут по 1 дин/см2. Планшеты обрабатывали тестируемыми образцами, включая антитела 1444 (концентрации от 0,78 до 200 нМ), изотипические отрицательные контрольные антитела (200 нМ), положительные контрольные антитела против E-селектина (200 нМ) в PBS и контроль в виде несущей среды, в течение 1 часа по 1 дин/см2. Аликвоту 100 мкл клеток HL-60 перфузировали в каждый канал в течение 10 минут в физиологическом потоке со сдвигом 1 дин/см2. Для удаления неприлипших клеток PBS перфузировали в течение 2-3 минут по 1 дин/см2 и анализировали, как описано.
[0560] Антитела 1444 (от 0,78 до 200 нМ), изотипические отрицательные контрольные антитела или несущую среду перфузировали в камеры для ингибирования связывания E-селектина. В этих исследованиях клетки HL-60, которые экспрессируют лиганд E-селектина, PSGL-1 и другие лиганды сиалил-Льюис X, протекали по 1 дин/ см2. Антитела 1444 снижали адгезию клеток HL-60 с очищенным растворимым белком E-селектина человека, с прогнозируемым значением IC50 15,26 нМ. Изотипический отрицательный контроль не влиял на анализ. Положительные контрольные антитела против E-селектина снижали адгезию HL-60 примерно на 43%.
[0561] В дополнительном проточном анализе нейтрализации адгезии с использованием способов, аналогичных тем, что описаны выше, антитела 1444 нейтрализовали адгезию HL-60 с рекомбинантным белком E-селектином человека с прогнозируемым значением IC50 13,28 нМ - 15,94 нМ (Таблица 38).
Нейтрализация клеточной адгезии с Клетками яичников китайского хомяка, Экспрессирующими E-селектин
[0562] Планшеты BioFlux™ покрывали 100 мкг/мл фибронектина (Advanced BioMatrix, номер по каталогу 5050-1МГ) в PBS при скорости потока 1 дин/см2 и инкубировали в течение 1 часа при комнатной температуре. Клетки яичников китайского хомяка, экспрессирующие E-селектин (CHO-E человека или яванского макака) получали для анализа путем обработки 0,05% трипсин-этилендиаминтетрауксусная кислота (EDTA) в отношении 1:1 (Gibco, 25300054) и аккутазой StemPro (Gibco; A1110501) в течение 5 минут при 37°C, нейтрализовали равным объемом ростовой среды, собирали, центрифугировали при 1000 об/мин в течение 5 минут и ресуспендировали до итоговой концентрации 60×106 клеток/мл в их соответствующей ростовой среде. Планшеты перфузировали два раза 250 мкл ростовой среды CHO по 1 дин/см2 в течение 2-3 минут при комнатной температуре, всю среду удаляли и 10-20 мкл клеток CHO-E (по 60×106 клеток/мл) перфузировали в течение 15 секунд по 2-3 дин/см2. Планшеты удаляли с прибора и инкубировали в инкубаторе при 37°C в 5% CO2 в течение 1 часа. Среду удаляли, добавляли 500 мкл свежей ростовой среды, и клетки инкубировали в инкубаторе при 37°C в 5% CO2 в течение ночи. После инкубации монослои CHO-E промывали (3-4 дин/см2) на приборе BioFlux свежей ростовой средой. Планшеты обрабатывали тестируемыми образцами, включая антитела 1444 (концентрации от 0,78 до 200 нМ), изотипические отрицательные контрольные антитела (200 нМ), положительные контрольные коммерческие антитела против E-селектина (200 нМ) в PBS и контроль в виде несущей среды путем перфузии по 1 дин/см2 в течение 1 часа. Аликвоту 100 мкл клеток HL-60 перфузировали в каждый канал в течение 10 минут в физиологическом потоке со сдвигом 1 дин/см2. Для удаления неприлипших клеток перфузировали PBS в течение 2-3 минут по 1 дин/см2, и планшеты визуализировали и анализировали, как описано.
[0563] E-селектин экспрессируется на поверхности эндотелиальных клеток. Клетки CHO, которые экспрессируют E-селектин (человека или яванского макака) прилипали к поверхности проточных камер с образованием клеточного монослоя. Антитела 1444 перфузировали в камеры (от 0,78 до 200 нМ), и клетки HL-60 перфузировали в физиологическом потоке по 1 дин/см2. Отрицательный контроль включал изотипические отрицательные контрольные антитела и несущую среду. Антитела 1444 против E-селектина нейтрализовали клеточную адгезию клеток HL-60 с клетками CHO-E-селектина человека с прогнозируемым значением IC50 4,41 нМ. Кроме того, расчетное значение IC50 для нейтрализация HL-60 с клетками, экспрессирующими E-селектин яванского макака, составляло 4,34 нМ. Изотипические отрицательные контрольные антитела не нейтрализовали связывание HL-60 с клетками CHO, экспрессирующими E-селектин человека или яванского макака. Тестируемые положительные контрольные антитела при 200 нМ снижали адгезию HL-60 с клетками, экспрессирующими E-селектин человека, примерно на 44%
[0564] В дополнительном проточном анализе нейтрализации адгезии с использованием способов, аналогичных тем, что описаны выше, антитела 1444 нейтрализовали адгезию HL-60 с клетками CHO, экспрессирующими E-селектин человека или яванского макака, с прогнозируемым значением IC50 4,25 нМ - 4,56 нМ и 4,32 нМ - 4,35 нМ, соответственно, (Таблица 38).
Нейтрализация Адгезии Очищенных Нейтрофилов с Клетками яичников китайского хомяка, экспрессирующими E-селектин
[0565] Монослои клеток CHO человека и яванского макака получали на планшетах BioFlux, как описано. Цельную кровь получали у четырех здоровых доноров добровольцев (Pfizer), у каждого объединяли 3 мл, и нейтрофилы очищали с использованием набора Miltenyi (набор для выделения нейтрофилов из цельной крови человека MACSxpress, 130-104-434) согласно протоколу производителя.
[0566] Тестируемые образцы, включая антитела 1444 (концентрация от 0,78 до 200 нМ), изотипические отрицательные контрольные антитела (200 нМ), положительные контрольные антитела против E-селектина (200 нМ) в PBS и контроль в виде несущей среды перфузировали по 1 дин/см2 в течение 1 часа. Очищенные нейтрофилы окрашивали кальцеином и обрабатывали фактором некроза опухоли-альфа (TNF-α) (Biotang Inc, 50-751-5681) в течение 10 минут при 37°C перед анализом. Собирали нейтрофилы, 300 x g в течение 10 минут при комнатной температуре, и ресуспендировали в PBS (с кальцием и магнием). Нейтрофилы перфузировали по 1 дин/см2 в течение 10 минут. Для удаления неприлипших клеток PBS перфузировали в течение 2-3 минут по 1 дин/см2, и планшеты визуализировали и анализировали.
[0567] Нейтрофилы экспрессируют лиганды E-селектина, и E-селектин опосредует адгезию нейтрофилов с эндотелием. Оценивали нейтрализацию антителами против E-селектина адгезии нейтрофилов человека с монослоями CHO, которые экспрессируют E-селектин (человека или яванского макака) в физиологическом потоке ex vivo. Антитела 1444, изотипические отрицательные контрольные антитела или несущую среду перфузировали в камеры. В анализе у 4 здоровых доноров очищали человеческие нейтрофилы, объединяли, и оценивали нейтрофилы, активированные TNF-α (10 нг/мл). Антитела 1444 нейтрализовали адгезию активированных нейтрофилов человека с клетками CHO-E-селектин человека с расчетными значениями IC50 2,87 нМ. Расчетная IC50 для нейтрализации адгезии активированных нейтрофилов человека с клетками CHO-E-селектин яванского макака составляла 16,33 нМ.
[0568] В дополнительном проточном анализе нейтрализации адгезии с использованием способов, аналогичных тем, что описаны выше, антитела 1444 нейтрализовали адгезию активированных нейтрофилов человека с клетками CHO, экспрессирующими E-селектин человека или яванского макака, с прогнозируемым значением IC50 4,65 нМ и 9,45 нМ, соответственно, (Таблица 38).
Нейтрализация Адгезии Клеток Крови SCD
[0569] Провоспалительной реакции при SCD способствуют изменения в серповидных эритроцитах и активированных эндотелиальных клетках (Manwani D and Frenette PS Blood 2013; 122(24):3892-98). Серповидность эритроцитов, гемолиз и дисфункция эндотелиальных клеток приводят к воспалению и клеточной активации и способствуют патогенезу SCD. Цельную кровь от 2 доноров с SCD метили кальцеином и хехст для визуализации перемещения и адгезии. Вкратце, кровь анализировали через 24 часа после прибытия и разбавляли до гематокрита 15% буфером HBSS (сбалансированный солевой раствор Хэнка), содержащим 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ N 2 гидроксиэтилпиперазин-N-2-этансульфоновой кислоты, 0,25% BSA, 0,1% глюкозу, рН 7,4. Перед анализом клетки крови окрашивали красителем кальцеином и хехст (Thermo Scientific, номер по каталогу 33342) (1:1000) в течение 30 минут при 37°C. Проточные камеры покрывали 20 мкг/мл каждого из растворимых рекомбинантных белков E- и P-селектина человека (Sino Biologicals), приготовленных в PBS по 1 дин/см2 в течение 5 минут, инкубировали при комнатной температуре в течение 1-2 часов и промывали 0,1% BSA/PBS в течение 3,5 минут по 1 дин/см2.
[0570] Кровь от обоих доноров оценивали на адгезию к рекомбинантным белкам Е- и Р-селектина человека. Тестируемые образцы, включая антитела 1444, контрольные антитела против P-селектина в PBS (0,78-200 нМ), изотипические отрицательные контрольные антитела (200 нМ), контрольные антитела против E-селектина (200 нМ) или несущую среду, пропускали по 1 дин/см2 в течение 1 часа. Разбавленную кровь SCD пропускали в течение 10 минут по 0,6 дин/см2. PBS пропускали в течение 2-3 минут по 1 дин/см2 для удаления неприлипших клеток, после чего планшеты визуализировали и анализировали. Оценочные значения IC50 рассчитывали, как описано выше. Оценочные IC20, IC80 и IC90 рассчитывали по формуле: (IC50* эффект)/(100-эффект). Расчет основан на модели Emax T [E=(Emax+C)/(C+EC50)].
[0571] Изотипические отрицательные контрольные антитела не нейтрализовали связывание. Тестируемые Положительные контрольные антитела при 200 мМ снижали адгезию клеточного связывания между 10-35%. Антитела 1444 нейтрализовали связывание клеток SCD человека с рекомбинантным E-селектином с прогнозируемым значением IC50 6,17 нМ и 18,66 нМ, в среднем 12,4 нМ (фиг. 14). Оцененные значения IC20, IC80 и IC90 составили 3,1 нМ, 49,6 нМ и 111,6 нМ, соответственно. Большую нейтрализацию клеточной адгезии наблюдали при ингибировании Е-селектина по сравнению с ингибированием Р-селектина при сходных физиологических условиях потока с использованием камер, покрытых растворимым белком Е- и Р-селектина.
[0572]
Пример 31: Связывание с клеточной поверхностью (FACS) и нейтрализация оптимизированных антител 1444 против E-селектина.
[0573] Е-селектин экспрессируется на поверхности эндотелиальных клеток, и в условиях дисфункции эндотелиальных клеток, таких как воспалительная реакция, циркулирующие клетки крови прикрепляются к эндотелию сосудов за счет взаимодействий лиганд-молекула адгезии. Оценивали способность антител 1444 связывать экспрессируемый на клеточной поверхности Е-селектин. В этих исследованиях клеточные линии СНО, экспрессирующие связанный с мембраной Е-селектин человека или яванского макака, использовали для характеристики связывания антител 1444 с экспрессируемым на клеточной поверхности Е-селектином.
[0574] Клетки CHO, которые экспрессируют E-селектин (человека или яванского макака) или P-селектин человека на клеточной поверхности, и контрольные нетрансфицированные клетки CHO (CHO-DUKX) оценивали с помощью анализа FACS с использованием антител 1444, контрольного изотипа IgG1 и двух контрольных антител к Р-селектину. Антитела 1444 связывались с Е-селектином человека с расчетной ЕС50 от 0,66 до 2,33 нМ (на основе 6 экспериментов). Антитела 1444 связывались с E-селектином яванского макака с расчетной EC50 от 0,75 до 1,37 нМ (на основе 6 экспериментов). Антитела 1444 не связывались с контрольным CHO-DUKX, что указывает на отсутствие обнаруживаемого связывания с клеточной поверхностью. Кроме того, антитела 1444 не связывали Р-селектин клеточной поверхности. Наблюдали дозозависимое связывание контрольных антител против P-селектина с клетками CHO-P-селектина, что указывает на экспрессию P-селектина. Не наблюдали связывания с контрольным изотипом IgG1 (таблица 38).
Пример 32. Исследование переносимости и токсикокинетики у яванских макак.
[0575] Яванские макаки были единственным фармакологически значимым неклиническим видом, основанным в фармакологических исследованиях in vitro, предназначенных для оценки способности антител 1444 ингибировать связывание и/или биологическую активность E-селектина. Аффинность связывания с селектином E человека и яванского макака была одинаковой во всех оцениваемых анализах, в отличие от отсутствия сильного связывания с селектином E мыши, кролика или крысы. В функциональных анализах in vitro антитела 1444 в зависимости от дозы нейтрализовали клеточную адгезию промиелоцитов человека к растворимому рекомбинантному белку Е-селектина человека и экспрессируемому клетками рекомбинантному селектину Е человека или яванского макака. Кроме того, антитела 1444 нейтрализовали адгезию очищенных нейтрофилов к клеточному селектину Е как человека, так и яванского макака, с расчетными значениями 50% ингибирующей концентрации (IC50) в низком диапазоне нМ. Доза SC 30 мг/кг была связана с общей максимальной наблюдаемой концентрацией (Cmax) 353 мкг/мл и площадью под кривой зависимости концентрации от времени от 0 до 336 часов (AUC336) 92500 мкг•ч/мл; в то время как доза IV 100 мг/кг была связана с общей Cmax 693 мкг/мл и AUC336108000 мкг•ч/мл. Антитела 1444 вводили самцам и самкам яванских макаков в дозах до 200 мг/кг/неделю IV один раз в неделю в течение 1 месяца, и они также хорошо переносились. Анализы In vitro связывания компонента 1q комплемента человека (C1q) и фрагмента кристаллизуемого гамма-Fc-рецептора (FcγR) и оценка перекрестной реактивности тканей не выявили опасений по поводу безопасности.
Пример 33: Фармакокинетика и метаболизм продукта у животных
[0576] PK однократного введения и ТК повторной дозы оценивали у яванских макаков после IV и/или SC введения антител 1444. После однократного IV введения яванским макакам наблюдался дозозависимый клиренс (CL), который соответствовал насыщаемому опосредованному мишенью распределению лекарственного средства (TMDD). После однократного IV введения в диапазоне доз от 0,3 до 10 мг/кг антитела 1444 демонстрировали средний CL и средний VSS приблизительно от 0,39 до 0,15 мл/ч/кг и от 22 до 36 мл/кг, соответственно. После однократного SC введения антител 1444 в дозе 1 мг/кг или 3 мг/кг Tmax наблюдали через 72 и 96 часов соответственно, а биодоступность SC составляла >50%. Расчетное T1/2 антитела 1444 при IV дозе 3 мг/кг составляло примерно 12 дней.
[0577] В 1-месячном исследовании токсичности повторных доз согласно GLP не было выявлено явных половых различий в системном воздействии (по оценке максимальной наблюдаемой концентрации [Cmax] площади под кривой концентрация-время [AUC]) после повторного SC и IV введения. Системное воздействие увеличивалось с увеличением дозы (SC) и было выше после повторного SC и IV введения. Антитела 1444 вводили самцам и самкам яванских макаков в дозах 15 или 50 мг/кг/неделю SC или 200 мг/кг/неделю IV один раз в неделю в течение 1 месяца (всего 5 доз). После повторного введения один раз в неделю в дозах 15 и 50 мг/кг/неделю среднее значение Tmax составляло от 72 до 112 часов после введения дозы в 1 и 22 дни. Системное воздействие было выше после повторного введения со средними коэффициентами накопления (AUC168, 22 день/1 день) 5,5, 3,2 и 1,9 для 15 (п/к), 50 (SC) и 200 (IV) мг/кг/неделю, соответственно.
[0578] Прогнозируемая эффективная доза для человека представляет собой однократное SC введение антител 1444 в дозе 150 мг. Прогнозируемая минимальная эффективная концентрация и воздействие при SC введении 150 мг составляют 14 мкг/мл для средней концентрации (Cav [от 1 до 168 часов]) и 2400 мкг·ч/мл для AUC168, соответственно.
Пример 34: Уровни Е-селектина, агрегаты и экспрессия ICAM-1 у животных
[0579] Получали характеристику растворимого Е-селектина в сыворотке яванских макак после введения доз антител 1444 в диапазоне от 0,3 до 10 мг/кг с помощью жидкостной хроматографии-масс-спектрометрии (LC-MS). Антител 1444 продемонстрировали эффективное связывание Е-селектина в зависимости от концентрации, и ингибирующее действие растворимого Е-селектина >90% наблюдалось во всех группах доз, что указывает на активность связывания Е-селектина in vivo антителами 1444.
[0580] После введения дозы антитела 1444 у яванских макак собирали кровь и анализировали с использованием сортировки клеток, активируемых флуоресценцией (FACS) для обнаружения клеточных агрегатов и маркеров адгезии. Исследовали моноцитарно-тромбоцитарные агрегаты и нейтрофильно-тромбоцитарные агрегаты. В этом анализе FACS CD14 использовали для дифференциации моноцитов и нейтрофилов с помощью сканирования размера, а CD41 использовали для обнаружения агрегатов моноцитов-тромбоцитов и агрегатов нейтрофилов-тромбоцитов. Антитела 1444 продемонстрировали влияние на уменьшение агрегатов моноцитов-тромбоцитов и нейтрофилов-тромбоцитов у яванских макак после лечения.
[0581] Экспрессию молекул межклеточной адгезии 1 лейкоцитов (ICAM-1) исследовали в лейкоцитах яванских макак после введения дозы антител 1444 с использованием анализа FACS. После введения дозы наблюдалось снижение ICAM-1.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПФАЙЗЕР ИНК.
<120> АНТИТЕЛА ПРОТИВ E-СЕЛЕКТИНА, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ
<130> PC072498A
<150> US 62/965,688
<151> 2020-01-24
<150> US 63/104,213
<151> 2020-10-22
<150> US 63/121,467
<151> 2020-12-04
<160> 206
<170> PatentIn version 3.5
<210> 1
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Thr Ser Gln Asn Ile Glu Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ala Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 2
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 2
Lys Thr Ser Gln Asn Ile Glu Arg Tyr Leu Asn
1 5 10
<210> 3
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 3
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 4
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 4
Leu Gln Asp Asn Ala Trp Pro Leu Thr
1 5
<210> 5
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Thr Ser Gln Asn Ile Glu Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ala Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 6
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 6
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 7
<211> 447
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 8
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 8
Gly Tyr Ala Ile Arg Ser Ala Tyr Met His
1 5 10
<210> 9
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 9
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val Thr
1 5 10 15
Gly
<210> 10
<211> 8
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 10
Asp Leu Tyr Ser Thr Ser Glu Tyr
1 5
<210> 11
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 12
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 13
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 14
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 14
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 15
<211> 330
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 15
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 16
<211> 329
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 16
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 17
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 18
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 18
Lys Thr Ser Gln Asn Ile Asn Arg Tyr Leu Asn
1 5 10
<210> 19
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 19
Asn Ala Asn Ser Leu Gln Thr
1 5
<210> 20
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 20
Leu Gln Asp Asn Ser Trp Pro Leu Thr
1 5
<210> 21
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 22
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asn Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Ile Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 23
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 23
Gly Tyr Asn Ile Arg Ser Ser Tyr Met His
1 5 10
<210> 24
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 24
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe Lys
1 5 10 15
Ile
<210> 25
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asn Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Ile Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 27
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 28
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asn Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 29
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 29
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val Lys
1 5 10 15
Gly
<210> 30
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asn Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 31
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 31
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Leu Gly Glu Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Gln Thr Gly Ile Pro Ser Arg Phe Ser Ala
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 32
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Leu Gly Glu Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Gln Thr Gly Ile Pro Ser Arg Phe Ser Ala
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln Asp Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 33
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 33
Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 34
<211> 447
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 34
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Phe Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Asn Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Ile Lys Ala Ile Leu Thr Ala Asp Ser Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 35
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 35
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Phe Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Asn Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Ile Lys Ala Ile Leu Thr Ala Asp Ser Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 36
Trp Gly Gln Gly Val Met Val Thr Val Ser Ser
1 5 10
<210> 37
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 37
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Lys Glu Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 38
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 38
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val Lys
1 5 10 15
Glu
<210> 39
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 39
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Lys Glu Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 40
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 40
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Glu Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 41
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 41
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Glu Ser Val Glu
1 5 10 15
Gly
<210> 42
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 42
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Glu Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 43
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 43
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 44
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 44
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val Glu
1 5 10 15
Gly
<210> 45
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 45
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ala Ile Arg Ser Ala
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Ala Asp Asn Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Asp Leu Tyr Ser Thr Ser Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 46
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Thr Val Gly Ile Asn
20 25 30
Val Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Cys Cys Leu Gln Tyr Gly Ser Ile Pro His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 47
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 47
Lys Ala Ser Gln Thr Val Gly Ile Asn Val Asp
1 5 10
<210> 48
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 48
Gly Ala Ser Asn Arg His Thr
1 5
<210> 49
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 49
Leu Gln Tyr Gly Ser Ile Pro His Thr
1 5
<210> 50
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Thr Val Gly Ile Asn
20 25 30
Val Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Cys Cys Leu Gln Tyr Gly Ser Ile Pro His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 51
<211> 453
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 51
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Tyr Met Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Phe Ile Arg Ser Ser Gly Ser Thr Glu Tyr Asn Ser Glu Phe Lys
50 55 60
Ser Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Cys Pro Tyr Lys Tyr Ser Ser Phe Val Tyr Val Gly Val Met Asp
100 105 110
Ala Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly
450
<210> 52
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 52
Gly Phe Ser Leu Thr Gly Tyr Tyr Met Gln
1 5 10
<210> 53
<211> 16
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 53
Phe Ile Arg Ser Ser Gly Ser Thr Glu Tyr Asn Ser Glu Phe Lys Ser
1 5 10 15
<210> 54
<211> 16
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 54
Cys Pro Tyr Lys Tyr Ser Ser Phe Val Tyr Val Gly Val Met Asp Ala
1 5 10 15
<210> 55
<211> 124
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Tyr Met Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Phe Ile Arg Ser Ser Gly Ser Thr Glu Tyr Asn Ser Glu Phe Lys
50 55 60
Ser Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Cys Pro Tyr Lys Tyr Ser Ser Phe Val Tyr Val Gly Val Met Asp
100 105 110
Ala Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 56
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 56
Glu Ile Val Met Thr Gln Ser Pro Thr Ser Met Ser Thr Ser Ile Gly
1 5 10 15
Glu Arg Val Thr Leu Asn Cys Lys Ala Ser Gln Thr Val Gly Ile Asn
20 25 30
Val Asp Trp Tyr Gln Gln Thr Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Phe Gly Arg Asp Phe Thr Leu Thr Ile Ser Asn Val Glu Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Cys Cys Leu Gln Tyr Gly Ser Ile Pro His
85 90 95
Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 57
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 57
Glu Ile Val Met Thr Gln Ser Pro Thr Ser Met Ser Thr Ser Ile Gly
1 5 10 15
Glu Arg Val Thr Leu Asn Cys Lys Ala Ser Gln Thr Val Gly Ile Asn
20 25 30
Val Asp Trp Tyr Gln Gln Thr Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Phe Gly Arg Asp Phe Thr Leu Thr Ile Ser Asn Val Glu Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Cys Cys Leu Gln Tyr Gly Ser Ile Pro His
85 90 95
Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 58
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 58
Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys
1 5 10
<210> 59
<211> 454
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 59
Gln Val Gln Leu Lys Glu Thr Gly Pro Gly Leu Val Gln Pro Thr Gln
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Tyr Met Gln Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Phe Ile Arg Ser Ser Gly Ser Thr Glu Tyr Asn Ser Glu Phe Lys
50 55 60
Ser Arg Leu Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Lys Thr Glu Asp Thr Gly Val Tyr Tyr Cys Ala
85 90 95
Arg Cys Pro Tyr Lys Tyr Ser Ser Phe Val Tyr Val Gly Val Met Asp
100 105 110
Ala Trp Gly Gln Gly Ala Pro Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 60
<211> 124
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 60
Gln Val Gln Leu Lys Glu Thr Gly Pro Gly Leu Val Gln Pro Thr Gln
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Tyr Met Gln Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Phe Ile Arg Ser Ser Gly Ser Thr Glu Tyr Asn Ser Glu Phe Lys
50 55 60
Ser Arg Leu Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Lys Thr Glu Asp Thr Gly Val Tyr Tyr Cys Ala
85 90 95
Arg Cys Pro Tyr Lys Tyr Ser Ser Phe Val Tyr Val Gly Val Met Asp
100 105 110
Ala Trp Gly Gln Gly Ala Pro Val Thr Val Ser Ser
115 120
<210> 61
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 61
Trp Gly Gln Gly Ala Pro Val Thr Val Ser Ser
1 5 10
<210> 62
<211> 444
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 62
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ser Ile Ser Thr Tyr
20 25 30
Asn Val His Trp Leu Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Met Trp Ser Gly Gly Ser Pro Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Phe Thr Ile Ser Arg Asp Thr Ala Lys Asn Ser Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Trp Gly Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 63
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 63
Gly Phe Ser Ile Ser Thr Tyr Asn Val His
1 5 10
<210> 64
<211> 16
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 64
Met Met Trp Ser Gly Gly Ser Pro Asp Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 65
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 65
Trp Gly Gly Gly Phe Asp Tyr
1 5
<210> 66
<211> 115
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Ser Ile Ser Thr Tyr
20 25 30
Asn Val His Trp Leu Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Met Trp Ser Gly Gly Ser Pro Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Phe Thr Ile Ser Arg Asp Thr Ala Lys Asn Ser Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Trp Gly Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 67
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 67
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser His Ser Ile Gly Thr Asn
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Phe Thr Ser Gln Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Gln Ser Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 68
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 68
Arg Ala Ser His Ser Ile Gly Thr Asn Leu His
1 5 10
<210> 69
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 69
Phe Thr Ser Gln Ser Ile Ser
1 5
<210> 70
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 70
Gln Gln Thr Gln Ser Trp Pro Leu Thr
1 5
<210> 71
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 71
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser His Ser Ile Gly Thr Asn
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Phe Thr Ser Gln Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Gln Ser Trp Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 72
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 72
Asp Ile Val Leu Thr Gln Ser Pro Thr Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Thr Val Ser Leu Ser Cys Arg Ala Ser His Ser Ile Gly Thr Asn
20 25 30
Leu His Trp Tyr Gln Gln Lys Thr Asn Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Phe Thr Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Ala
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile Asn Asn Val Glu Phe
65 70 75 80
Asp Asp Val Ser Ser Tyr Phe Cys Gln Gln Thr Gln Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 73
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 73
Asp Ile Val Leu Thr Gln Ser Pro Thr Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Thr Val Ser Leu Ser Cys Arg Ala Ser His Ser Ile Gly Thr Asn
20 25 30
Leu His Trp Tyr Gln Gln Lys Thr Asn Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Phe Thr Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Ala
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile Asn Asn Val Glu Phe
65 70 75 80
Asp Asp Val Ser Ser Tyr Phe Cys Gln Gln Thr Gln Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 74
<211> 445
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 74
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Gln Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Ile Ser Thr Tyr
20 25 30
Asn Val His Trp Leu Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Met Trp Ser Gly Gly Ser Pro Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Ser Glu Asp Thr Thr Thr Tyr Tyr Cys Ala
85 90 95
Arg Trp Gly Gly Gly Phe Asp Tyr Trp Gly Gln Gly Val Met Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 75
<211> 115
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 75
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Gln Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Ile Ser Thr Tyr
20 25 30
Asn Val His Trp Leu Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Met Met Trp Ser Gly Gly Ser Pro Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Ser Glu Asp Thr Thr Thr Tyr Tyr Cys Ala
85 90 95
Arg Trp Gly Gly Gly Phe Asp Tyr Trp Gly Gln Gly Val Met Val Thr
100 105 110
Val Ser Ser
115
<210> 76
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 76
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Asn Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Arg Arg Val Thr Leu Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Glu Val Arg Val Ser Phe Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 77
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 77
Gly Tyr Asn Ile Arg Ser Thr Tyr Met His
1 5 10
<210> 78
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 78
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe Lys
1 5 10 15
Arg
<210> 79
<211> 8
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 79
Glu Val Arg Val Ser Phe Glu Tyr
1 5
<210> 80
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 80
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Asn Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Arg Arg Val Thr Leu Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Glu Val Arg Val Ser Phe Glu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 81
<211> 213
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Ile Asn Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Asn Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln His Asp Ser Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 82
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 82
Lys Ala Ser Gln Asn Ile Asn Lys Tyr Leu Asp
1 5 10
<210> 83
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 83
Tyr Thr Asn Asn Leu His Thr
1 5
<210> 84
<211> 8
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 84
Leu Gln His Asp Ser Gly Tyr Thr
1 5
<210> 85
<211> 106
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 85
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Ile Asn Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Asn Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln His Asp Ser Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 86
<211> 213
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 86
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ala Ser Gln Asn Ile Asn Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Leu Gly Glu Gly Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Asn Asn Leu His Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asp Ser Gly Tyr Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 87
<211> 106
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 87
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ala Ser Gln Asn Ile Asn Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Leu Gly Glu Gly Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Asn Asn Leu His Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asp Ser Gly Tyr Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 88
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 88
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
1 5 10
<210> 89
<211> 447
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 89
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Asn Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Ser Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Arg Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Arg Ala Ile Tyr Phe Cys
85 90 95
Ala Met Glu Val Arg Val Ser Phe Glu Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 90
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 90
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Asn Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Ser Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys Phe
50 55 60
Lys Arg Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Arg Ala Ile Tyr Phe Cys
85 90 95
Ala Met Glu Val Arg Val Ser Phe Glu Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser
115
<210> 91
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 91
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Ser Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Arg Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Val Glu Ile Leu Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 92
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 92
Gly Tyr Ser Ile Arg Ser Thr Tyr Met His
1 5 10
<210> 93
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 93
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Arg Phe Lys
1 5 10 15
Asn
<210> 94
<211> 8
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 94
Glu Ile Leu Gly Ile Phe Asp Tyr
1 5
<210> 95
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 95
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Ser Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Arg Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Val Glu Ile Leu Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 96
<211> 213
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 96
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Ile Asp Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Met
35 40 45
Tyr Asn Thr Asn Ser Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 97
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 97
Lys Ala Ser Gln Asn Ile Asp Lys Tyr Leu Asp
1 5 10
<210> 98
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 98
Asn Thr Asn Ser Leu His Thr
1 5
<210> 99
<211> 8
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 99
Leu Gln His Asn Ser Gly Tyr Thr
1 5
<210> 100
<211> 106
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 100
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Ile Asp Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Met
35 40 45
Tyr Asn Thr Asn Ser Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 101
<211> 213
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 101
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ala Ser Gln Asn Ile Asp Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Leu Gly Glu Ala Pro Lys Leu Leu Met
35 40 45
Tyr Asn Thr Asn Ser Leu His Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Gly Tyr Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 102
<211> 106
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 102
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ala Ser Gln Asn Ile Asp Lys Tyr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Leu Gly Glu Ala Pro Lys Leu Leu Met
35 40 45
Tyr Asn Thr Asn Ser Leu His Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Gly Tyr Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 103
<211> 447
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 103
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Ser Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Arg Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Val Glu Ile Leu Gly Ile Phe Asp Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 104
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 104
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Ser Ile Arg Ser Thr
20 25 30
Tyr Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Arg Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Val Glu Ile Leu Gly Ile Phe Asp Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser
115
<210> 105
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 105
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln His Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Asn Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Trp Pro Asn
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 106
<211> 11
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 106
Lys Ala Ser Gln His Ile Asn Arg Tyr Leu Asn
1 5 10
<210> 107
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 107
Asp Ala Asn Asn Leu Gln Thr
1 5
<210> 108
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 108
Leu Gln His Asn Ser Trp Pro Asn Thr
1 5
<210> 109
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 109
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln His Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Asn Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Trp Pro Asn
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 110
<211> 446
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 110
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Tyr Lys Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Gly Asp Lys Phe
50 55 60
Lys Ser Arg Phe Thr Leu Ser Ser Asp Thr Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Asp Ile Gly Thr Thr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 111
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 111
Gly Tyr Lys Ile Arg Ser Ser Tyr Met His
1 5 10
<210> 112
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 112
Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Gly Asp Lys Phe Lys
1 5 10 15
Ser
<210> 113
<211> 8
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 113
Asp Ile Gly Thr Thr Phe Asp Tyr
1 5
<210> 114
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 114
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Tyr Lys Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Gly Asp Lys Phe
50 55 60
Lys Ser Arg Phe Thr Leu Ser Ser Asp Thr Ala Lys Asn Ser Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Asp Ile Gly Thr Thr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 115
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 115
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ala Ser Gln His Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Leu Gly Glu Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Asn Leu Gln Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Trp Pro Asn
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 116
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 116
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ala Ser Gln His Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Leu Gly Glu Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Asn Leu Gln Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Trp Pro Asn
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 117
<211> 447
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 117
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Lys Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Gly Asp Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Ser Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Ile Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Ile Asp Ile Gly Thr Thr Phe Asp Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 118
<211> 117
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 118
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Val Ser Gly Tyr Lys Ile Arg Ser Ser
20 25 30
Tyr Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Gly Asp Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Ser Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Ile Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
85 90 95
Ala Ile Asp Ile Gly Thr Thr Phe Asp Tyr Trp Gly Gln Gly Val Met
100 105 110
Val Thr Val Ser Ser
115
<210> 119
<211> 214
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 119
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Ile Thr Ile Asn Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Phe Gln Gln Lys Leu Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Gln Ala Asp Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His His Phe Trp Pro Tyr
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 120
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 120
Asn Ala Asn Ser Leu Gln Ala
1 5
<210> 121
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 121
Leu Gln His His Phe Trp Pro Tyr Thr
1 5
<210> 122
<211> 107
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 122
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Ile Thr Ile Asn Cys Lys Thr Ser Gln Asn Ile Asn Arg Tyr
20 25 30
Leu Asn Trp Phe Gln Gln Lys Leu Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Gln Ala Asp Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His His Phe Trp Pro Tyr
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg
100 105
<210> 123
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 123
Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg
1 5 10
<210> 124
<211> 449
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 124
Glu Val His Leu His Gln Ser Gly Pro Glu Leu Gly Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Val Met Asn Trp Val Arg Gln Ser Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asn Pro Glu Asp Tyr Ser Phe Asp Ser Gly Glu Lys Phe
50 55 60
Leu Glu Arg Ala Thr Leu Thr Ala Ala Thr Ser Ser Asn Thr Val Tyr
65 70 75 80
Ile Gln Leu Ser Gly Leu Thr Ser Asp Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Val Arg Gly Gly Leu Pro Gly Asp Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 125
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 125
Gly Tyr Thr Phe Thr Asp Tyr Val Met Asn
1 5 10
<210> 126
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 126
Trp Ile Asn Pro Glu Asp Tyr Ser Phe Asp Ser Gly Glu Lys Phe Leu
1 5 10 15
Glu
<210> 127
<211> 10
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 127
Gly Gly Leu Pro Gly Asp Trp Phe Ala Tyr
1 5 10
<210> 128
<211> 119
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 128
Glu Val His Leu His Gln Ser Gly Pro Glu Leu Gly Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Val Met Asn Trp Val Arg Gln Ser Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asn Pro Glu Asp Tyr Ser Phe Asp Ser Gly Glu Lys Phe
50 55 60
Leu Glu Arg Ala Thr Leu Thr Ala Ala Thr Ser Ser Asn Thr Val Tyr
65 70 75 80
Ile Gln Leu Ser Gly Leu Thr Ser Asp Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Val Arg Gly Gly Leu Pro Gly Asp Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 129
<211> 19
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 129
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser
<210> 130
<211> 19
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 130
Met Glu Trp Ser Trp Val Phe Leu Phe Phe Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser
<210> 131
<211> 19
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 131
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Ala His Ser
<210> 132
<211> 589
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 132
Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser Tyr Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Val Trp Val Gly
50 55 60
Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val Glu Ile Tyr Ile Lys
85 90 95
Arg Glu Lys Asp Val Gly Met Trp Asn Asp Glu Arg Cys Ser Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr Asn Thr Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn Tyr Thr Cys Lys Cys
130 135 140
Asp Pro Gly Phe Ser Gly Leu Lys Cys Glu Gln Ile Val Asn Cys Thr
145 150 155 160
Ala Leu Glu Ser Pro Glu His Gly Ser Leu Val Cys Ser His Pro Leu
165 170 175
Gly Asn Phe Ser Tyr Asn Ser Ser Cys Ser Ile Ser Cys Asp Arg Gly
180 185 190
Tyr Leu Pro Ser Ser Met Glu Thr Met Gln Cys Met Ser Ser Gly Glu
195 200 205
Trp Ser Ala Pro Ile Pro Ala Cys Asn Val Val Glu Cys Asp Ala Val
210 215 220
Thr Asn Pro Ala Asn Gly Phe Val Glu Cys Phe Gln Asn Pro Gly Ser
225 230 235 240
Phe Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys Glu Glu Gly Phe Glu
245 250 255
Leu Met Gly Ala Gln Ser Leu Gln Cys Thr Ser Ser Gly Asn Trp Asp
260 265 270
Asn Glu Lys Pro Thr Cys Lys Ala Val Thr Cys Arg Ala Val Arg Gln
275 280 285
Pro Gln Asn Gly Ser Val Arg Cys Ser His Ser Pro Ala Gly Glu Phe
290 295 300
Thr Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu Glu Gly Phe Met Leu
305 310 315 320
Gln Gly Pro Ala Gln Val Glu Cys Thr Thr Gln Gly Gln Trp Thr Gln
325 330 335
Gln Ile Pro Val Cys Glu Ala Phe Gln Cys Thr Ala Leu Ser Asn Pro
340 345 350
Glu Arg Gly Tyr Met Asn Cys Leu Pro Ser Ala Ser Gly Ser Phe Arg
355 360 365
Tyr Gly Ser Ser Cys Glu Phe Ser Cys Glu Gln Gly Phe Val Leu Lys
370 375 380
Gly Ser Lys Arg Leu Gln Cys Gly Pro Thr Gly Glu Trp Asp Asn Glu
385 390 395 400
Lys Pro Thr Cys Glu Ala Val Arg Cys Asp Ala Val His Gln Pro Pro
405 410 415
Lys Gly Leu Val Arg Cys Ala His Ser Pro Ile Gly Glu Phe Thr Tyr
420 425 430
Lys Ser Ser Cys Ala Phe Ser Cys Glu Glu Gly Phe Glu Leu His Gly
435 440 445
Ser Thr Gln Leu Glu Cys Thr Ser Gln Gly Gln Trp Thr Glu Glu Val
450 455 460
Pro Ser Cys Gln Val Val Lys Cys Ser Ser Leu Ala Val Pro Gly Lys
465 470 475 480
Ile Asn Met Ser Cys Ser Gly Glu Pro Val Phe Gly Thr Val Cys Lys
485 490 495
Phe Ala Cys Pro Glu Gly Trp Thr Leu Asn Gly Ser Ala Ala Arg Thr
500 505 510
Cys Gly Ala Thr Gly His Trp Ser Gly Leu Leu Pro Thr Cys Glu Ala
515 520 525
Pro Thr Glu Ser Asn Ile Pro Leu Val Ala Gly Leu Ser Ala Ala Gly
530 535 540
Leu Ser Leu Leu Thr Leu Ala Pro Phe Leu Leu Trp Leu Arg Lys Cys
545 550 555 560
Leu Arg Lys Ala Lys Lys Phe Val Pro Ala Ser Ser Cys Gln Ser Leu
565 570 575
Glu Ser Asp Gly Ser Tyr Gln Lys Pro Ser Tyr Ile Leu
580 585
<210> 133
<211> 535
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 133
Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser Tyr Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Val Trp Val Gly
50 55 60
Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val Glu Ile Tyr Ile Lys
85 90 95
Arg Glu Lys Asp Val Gly Met Trp Asn Asp Glu Arg Cys Ser Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr Asn Thr Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn Tyr Thr Cys Lys Cys
130 135 140
Asp Pro Gly Phe Ser Gly Leu Lys Cys Glu Gln Ile Val Asn Cys Thr
145 150 155 160
Ala Leu Glu Ser Pro Glu His Gly Ser Leu Val Cys Ser His Pro Leu
165 170 175
Gly Asn Phe Ser Tyr Asn Ser Ser Cys Ser Ile Ser Cys Asp Arg Gly
180 185 190
Tyr Leu Pro Ser Ser Met Glu Thr Met Gln Cys Met Ser Ser Gly Glu
195 200 205
Trp Ser Ala Pro Ile Pro Ala Cys Asn Val Val Glu Cys Asp Ala Val
210 215 220
Thr Asn Pro Ala Asn Gly Phe Val Glu Cys Phe Gln Asn Pro Gly Ser
225 230 235 240
Phe Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys Glu Glu Gly Phe Glu
245 250 255
Leu Met Gly Ala Gln Ser Leu Gln Cys Thr Ser Ser Gly Asn Trp Asp
260 265 270
Asn Glu Lys Pro Thr Cys Lys Ala Val Thr Cys Arg Ala Val Arg Gln
275 280 285
Pro Gln Asn Gly Ser Val Arg Cys Ser His Ser Pro Ala Gly Glu Phe
290 295 300
Thr Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu Glu Gly Phe Met Leu
305 310 315 320
Gln Gly Pro Ala Gln Val Glu Cys Thr Thr Gln Gly Gln Trp Thr Gln
325 330 335
Gln Ile Pro Val Cys Glu Ala Phe Gln Cys Thr Ala Leu Ser Asn Pro
340 345 350
Glu Arg Gly Tyr Met Asn Cys Leu Pro Ser Ala Ser Gly Ser Phe Arg
355 360 365
Tyr Gly Ser Ser Cys Glu Phe Ser Cys Glu Gln Gly Phe Val Leu Lys
370 375 380
Gly Ser Lys Arg Leu Gln Cys Gly Pro Thr Gly Glu Trp Asp Asn Glu
385 390 395 400
Lys Pro Thr Cys Glu Ala Val Arg Cys Asp Ala Val His Gln Pro Pro
405 410 415
Lys Gly Leu Val Arg Cys Ala His Ser Pro Ile Gly Glu Phe Thr Tyr
420 425 430
Lys Ser Ser Cys Ala Phe Ser Cys Glu Glu Gly Phe Glu Leu His Gly
435 440 445
Ser Thr Gln Leu Glu Cys Thr Ser Gln Gly Gln Trp Thr Glu Glu Val
450 455 460
Pro Ser Cys Gln Val Val Lys Cys Ser Ser Leu Ala Val Pro Gly Lys
465 470 475 480
Ile Asn Met Ser Cys Ser Gly Glu Pro Val Phe Gly Thr Val Cys Lys
485 490 495
Phe Ala Cys Pro Glu Gly Trp Thr Leu Asn Gly Ser Ala Ala Arg Thr
500 505 510
Cys Gly Ala Thr Gly His Trp Ser Gly Leu Leu Pro Thr Cys Glu Ala
515 520 525
Pro Thr Glu Ser Asn Ile Pro
530 535
<210> 134
<211> 591
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 134
Trp Tyr Tyr Asn Ala Ser Ser Glu Leu Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Arg Asp Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Asn Tyr Leu Asn Ser Asn Leu Lys His Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Ile Trp Val Gly
50 55 60
Thr Gly Lys Pro Leu Thr Glu Glu Ala Gln Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Lys Gln Arg Asn Glu Asp Cys Val Glu Ile Tyr Ile Gln
85 90 95
Arg Thr Lys Asp Ser Gly Met Trp Asn Asp Glu Arg Cys Asn Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ser Cys Thr Asn Ala Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Ile Glu Thr Ile Asn Ser Tyr Thr Cys Lys Cys
130 135 140
His Pro Gly Phe Leu Gly Pro Asn Cys Glu Gln Ala Val Thr Cys Lys
145 150 155 160
Pro Gln Glu His Pro Asp Tyr Gly Ser Leu Asn Cys Ser His Pro Phe
165 170 175
Gly Pro Phe Ser Tyr Asn Ser Ser Cys Ser Phe Gly Cys Lys Arg Gly
180 185 190
Tyr Leu Pro Ser Ser Met Glu Thr Thr Val Arg Cys Thr Ser Ser Gly
195 200 205
Glu Trp Ser Ala Pro Ala Pro Ala Cys His Val Val Glu Cys Glu Ala
210 215 220
Leu Thr His Pro Ala His Gly Ile Arg Lys Cys Ser Ser Asn Pro Gly
225 230 235 240
Ser Tyr Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys Val Glu Gly Tyr
245 250 255
Arg Arg Val Gly Ala Gln Asn Leu Gln Cys Thr Ser Ser Gly Ile Trp
260 265 270
Asp Asn Glu Thr Pro Ser Cys Lys Ala Val Thr Cys Asp Ala Ile Pro
275 280 285
Gln Pro Gln Asn Gly Phe Val Ser Cys Ser His Ser Thr Ala Gly Glu
290 295 300
Leu Ala Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu Gln Ser Phe Thr
305 310 315 320
Leu Gln Gly Pro Ala Gln Val Glu Cys Ser Ala Gln Gly Gln Trp Thr
325 330 335
Pro Gln Ile Pro Val Cys Lys Ala Val Gln Cys Glu Ala Leu Ser Ala
340 345 350
Pro Gln Gln Gly Asn Met Lys Cys Leu Pro Ser Ala Ser Gly Pro Phe
355 360 365
Gln Asn Gly Ser Ser Cys Glu Phe Ser Cys Glu Glu Gly Phe Glu Leu
370 375 380
Lys Gly Ser Arg Arg Leu Gln Cys Gly Pro Arg Gly Glu Trp Asp Ser
385 390 395 400
Lys Lys Pro Thr Cys Ser Ala Val Lys Cys Asp Asp Val Pro Arg Pro
405 410 415
Gln Asn Gly Val Met Glu Cys Ala His Ala Thr Thr Gly Glu Phe Thr
420 425 430
Tyr Lys Ser Ser Cys Ala Phe Gln Cys Asn Glu Gly Phe Ser Leu His
435 440 445
Gly Ser Ala Gln Leu Glu Cys Thr Ser Gln Gly Lys Trp Thr Gln Glu
450 455 460
Val Pro Ser Cys Gln Val Val Gln Cys Pro Ser Leu Asp Val Pro Gly
465 470 475 480
Lys Met Asn Met Ser Cys Ser Gly Thr Ala Val Phe Gly Thr Val Cys
485 490 495
Glu Phe Thr Cys Pro Asp Asp Trp Thr Leu Asn Gly Ser Ala Val Leu
500 505 510
Thr Cys Gly Ala Thr Gly Arg Trp Ser Gly Met Pro Pro Thr Cys Glu
515 520 525
Ala Pro Val Ser Pro Thr Arg Pro Leu Val Val Ala Leu Ser Ala Ala
530 535 540
Gly Thr Ser Leu Leu Thr Ser Ser Ser Leu Leu Tyr Leu Leu Met Arg
545 550 555 560
Tyr Phe Arg Lys Lys Ala Lys Lys Phe Val Pro Ala Ser Ser Cys Gln
565 570 575
Ser Leu Gln Ser Phe Glu Asn Tyr His Val Pro Ser Tyr Asn Val
580 585 590
<210> 135
<211> 536
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 135
Trp Tyr Tyr Asn Ala Ser Ser Glu Leu Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Arg Asp Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Asn Tyr Leu Asn Ser Asn Leu Lys His Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Ile Trp Val Gly
50 55 60
Thr Gly Lys Pro Leu Thr Glu Glu Ala Gln Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Lys Gln Arg Asn Glu Asp Cys Val Glu Ile Tyr Ile Gln
85 90 95
Arg Thr Lys Asp Ser Gly Met Trp Asn Asp Glu Arg Cys Asn Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ser Cys Thr Asn Ala Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Ile Glu Thr Ile Asn Ser Tyr Thr Cys Lys Cys
130 135 140
His Pro Gly Phe Leu Gly Pro Asn Cys Glu Gln Ala Val Thr Cys Lys
145 150 155 160
Pro Gln Glu His Pro Asp Tyr Gly Ser Leu Asn Cys Ser His Pro Phe
165 170 175
Gly Pro Phe Ser Tyr Asn Ser Ser Cys Ser Phe Gly Cys Lys Arg Gly
180 185 190
Tyr Leu Pro Ser Ser Met Glu Thr Thr Val Arg Cys Thr Ser Ser Gly
195 200 205
Glu Trp Ser Ala Pro Ala Pro Ala Cys His Val Val Glu Cys Glu Ala
210 215 220
Leu Thr His Pro Ala His Gly Ile Arg Lys Cys Ser Ser Asn Pro Gly
225 230 235 240
Ser Tyr Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys Val Glu Gly Tyr
245 250 255
Arg Arg Val Gly Ala Gln Asn Leu Gln Cys Thr Ser Ser Gly Ile Trp
260 265 270
Asp Asn Glu Thr Pro Ser Cys Lys Ala Val Thr Cys Asp Ala Ile Pro
275 280 285
Gln Pro Gln Asn Gly Phe Val Ser Cys Ser His Ser Thr Ala Gly Glu
290 295 300
Leu Ala Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu Gln Ser Phe Thr
305 310 315 320
Leu Gln Gly Pro Ala Gln Val Glu Cys Ser Ala Gln Gly Gln Trp Thr
325 330 335
Pro Gln Ile Pro Val Cys Lys Ala Val Gln Cys Glu Ala Leu Ser Ala
340 345 350
Pro Gln Gln Gly Asn Met Lys Cys Leu Pro Ser Ala Ser Gly Pro Phe
355 360 365
Gln Asn Gly Ser Ser Cys Glu Phe Ser Cys Glu Glu Gly Phe Glu Leu
370 375 380
Lys Gly Ser Arg Arg Leu Gln Cys Gly Pro Arg Gly Glu Trp Asp Ser
385 390 395 400
Lys Lys Pro Thr Cys Ser Ala Val Lys Cys Asp Asp Val Pro Arg Pro
405 410 415
Gln Asn Gly Val Met Glu Cys Ala His Ala Thr Thr Gly Glu Phe Thr
420 425 430
Tyr Lys Ser Ser Cys Ala Phe Gln Cys Asn Glu Gly Phe Ser Leu His
435 440 445
Gly Ser Ala Gln Leu Glu Cys Thr Ser Gln Gly Lys Trp Thr Gln Glu
450 455 460
Val Pro Ser Cys Gln Val Val Gln Cys Pro Ser Leu Asp Val Pro Gly
465 470 475 480
Lys Met Asn Met Ser Cys Ser Gly Thr Ala Val Phe Gly Thr Val Cys
485 490 495
Glu Phe Thr Cys Pro Asp Asp Trp Thr Leu Asn Gly Ser Ala Val Leu
500 505 510
Thr Cys Gly Ala Thr Gly Arg Trp Ser Gly Met Pro Pro Thr Cys Glu
515 520 525
Ala Pro Val Ser Pro Thr Arg Pro
530 535
<210> 136
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 136
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta tgccatccgt tctgcctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggactccg tgaccggccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc g 351
<210> 137
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 137
gatattcaga tgacgcagtc cccatcttcc ctttcagcat ctgtgggtga ccgggttaca
60
atcacttgta aaacatccca gaacattgag cgttatttaa attggtatca gcagaaaccg
120
ggtaaagccc cgaaactatt gatttatgcc gcgtcctcgc tgcaatccgg cgtgccgagt
180
cgttttagcg gctccgggag cggcaccgat tttactctta ccatttcgag tctgcagccg
240
gaagactttg ccacttattt ctgtctccag gataacgcct ggccattaac cttcggtcag
300
ggtaccaaag ttgaaattaa a 321
<210> 138
<211> 1341
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 138
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta tgccatccgt tctgcctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggactccg tgaccggccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc ggcgtcgacc
360
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggcacagcg
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc
600
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt
660
gacaaaactc acacatgccc accgtgccca gcacctgaag ccgctggggc accgtcagtc
720
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca
780
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac
840
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac
900
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag
960
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa
1020
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggagga gatgaccaag
1080
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag
1140
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc
1200
gacggctcct tcttcctcta tagcaagctc accgtggaca agagcaggtg gcagcagggg
1260
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc
1320
ctctccctgt ccccgggaaa a 1341
<210> 139
<211> 642
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 139
gatattcaga tgacgcagtc cccatcttcc ctttcagcat ctgtgggtga ccgggttaca
60
atcacttgta aaacatccca gaacattgag cgttatttaa attggtatca gcagaaaccg
120
ggtaaagccc cgaaactatt gatttatgcc gcgtcctcgc tgcaatccgg cgtgccgagt
180
cgttttagcg gctccgggag cggcaccgat tttactctta ccatttcgag tctgcagccg
240
gaagactttg ccacttattt ctgtctccag gataacgcct ggccattaac cttcggtcag
300
ggtaccaaag ttgaaattaa acgtacggtg gctgcaccat ctgtcttcat cttcccgcca
360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat
420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag
480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg
540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc
600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt 642
<210> 140
<211> 57
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 140
atggaatgga gctgggtctt tctcttcttc ctgtcagtaa ctacaggtgt ccactcc 57
<210> 141
<211> 57
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 141
atgggatgga gctgtatcat cctcttcttg gtggcaacag ctacaggcgt gcactcc 57
<210> 142
<211> 990
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 142
gcgtcgacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg
60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg
120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca
180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc
240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc
300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaagc cgctggggca
360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct
420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg
480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac
540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag
600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc
660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggaggag
720
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc
780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg
840
ctggactccg acggctcctt cttcctctat agcaagctca ccgtggacaa gagcaggtgg
900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg
960
cagaagagcc tctccctgtc cccgggaaaa 990
<210> 143
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 143
cgtacggtgg ctgcaccatc tgtcttcatc ttcccgccat ctgatgagca gttgaaatct
60
ggaactgcct ctgttgtgtg cctgctgaat aacttctatc ccagagaggc caaagtacag
120
tggaaggtgg ataacgccct ccaatcgggt aactcccagg agagtgtcac agagcaggac
180
agcaaggaca gcacctacag cctcagcagc accctgacgc tgagcaaagc agactacgag
240
aaacacaaag tctacgcctg cgaagtcacc catcagggcc tgagctcgcc cgtcacaaag
300
agcttcaaca ggggagagtg t 321
<210> 144
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 144
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta taacatccgt tctagctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gctgagaagt tcaaaatccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc g 351
<210> 145
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 145
gatattcaga tgacgcagtc cccatcttcc ctttcagcat ctgtgggtga ccgggttaca
60
atcacttgta aaacatccca gaacattaac cgttatttaa attggtatca gcagaaaccg
120
ggtaaagccc cgaaactatt gatttataac gcgaactcgc tgcaaactgg cgtgccgagt
180
cgttttagcg gctccgggag cggcaccgat tttactctta ccatttcgag tctgcagccg
240
gaagactttg ccacttattt ctgtctccag gataactcct ggccattaac cttcggtcag
300
ggtaccaaag ttgaaattaa a 321
<210> 146
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 146
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta taacatccgt tctagctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggactccg tgaaaggccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc g 351
<210> 147
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 147
gatattcaga tgacgcagtc cccatcttcc ctttcagcat ctgtgggtga ccgggttaca
60
atcacttgta aaacatccca gaacattaac cgttatttaa attggtatca gcagaaaccg
120
ggtaaagccc cgaaactatt gatttatgcc gcgtcctcgc tgcaatccgg cgtgccgagt
180
cgttttagcg gctccgggag cggcaccgat tttactctta ccatttcgag tctgcagccg
240
gaagactttg ccacttattt ctgtctccag gataactcct ggccattaac cttcggtcag
300
ggtaccaaag ttgaaattaa a 321
<210> 148
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 148
gaagtccagc tgcagcagtc tggggctgag tttgggaaac ctgggacctc agtcaagttg
60
tcttgcaagg tttctgggta taacattagg agttcataca tgcactgggt gaatcagagg
120
cctggaaagg gcctggaatg gataggaagg attgatcctg caaacggaaa tactatatat
180
gctgagaagt tcaaaatcaa ggccattctg actgcagatt catcgtccaa cacagcctac
240
atgcaactca gccaactgaa atctgacgac acagcaatct atttttgtgc tatggacctc
300
tacagtacct ctgaatactg gggccaagga gtcatggtca cagtctcctc a 351
<210> 149
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 149
gacatccaga tgacccagtc tccttcattc ctgtctgcat ctgtgggaga cagagtcact
60
atcaactgca aaacgagtca gaatattaac aggtacttaa actggtacca gcaaaagctt
120
ggagaagctc ccaaactcct gatatataat gcaaacagtt tgcaaacggg catcccatca
180
cggttcagtg ccagtggatc cggtactgat ttcacactca ccatcaacag cctgcagcct
240
gaagatgttg ccacatattt ttgcttgcag gataatagtt ggccgctcac gttcggttct
300
gggaccaagc tggagatcaa a 321
<210> 150
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 150
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta tgccatccgt tctgcctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggactccg tgaaagagcg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc g 351
<210> 151
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 151
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta tgccatccgt tctgcctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggagtccg tggagggccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc g 351
<210> 152
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 152
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta tgccatccgt tctgcctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggactccg tggagggccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc g 351
<210> 153
<211> 372
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 153
gaggtacagt tggtggaatc tggcggcggc ctggtccagc cgggcgggtc tttgcgcctg
60
agttgtgcag cgagtgggtt tagcctgacg ggctactaca tgcaatgggt ccgtcaggcg
120
ccgggcaaag gtctggaatg gatgggtttt atacggagta gtggaagcac agagtataat
180
tcagagttca aatcccgttt taccatctct cgcgataacg cgaaaaacag cgtgtatctg
240
cagatgaata gcctgcgcgc cgaagatacc gccgtgtact actgcgcgcg ttgcccgtat
300
aaatatagtt catttgtata tgtgggtgtc atggatgcgt ggggccaggg tacactggtt
360
accgtgagct cg 372
<210> 154
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 154
gatatccaaa tgacgcaatc gcctagcagc ttatccgcgt cagttggcga tcgcgtgacc
60
atcacttgca aagcgtcgca aaccgtcgga atcaacgtgg attggtacca acagaaaccg
120
ggcaaggcgc cgaaactgct gatctatgga gccagcaatc gccacacagg agtgccgtcc
180
cgttttagcg gcagcgggag cggtacggat tttaccctga cgatttcttc actccaaccc
240
gaagactttg caacctattg ctgcttgcaa tatggttcaa tcccgcatac tttcggccag
300
ggtacaaaag tggaaattaa a 321
<210> 155
<211> 372
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 155
caggtgcagc tgaaggagac aggacctggc ctggtgcaac caacacagac cctgtccatc
60
acatgtactg tttctgggtt ctcattaacc ggctattata tgcagtgggt tcgccagact
120
ccaggaaagg ggctagaatg gatgggattt atacggagta gtggaagcac agagtataat
180
tcagagttca aatcccgact tagcatcagc agggacacct ccaagaacca agttttctta
240
aaaatgaaca gtctgaaaac agaagataca ggcgtgtatt actgtgccag atgcccttat
300
aagtatagca gctttgtcta cgtaggggtt atggatgcct ggggtcaagg agctccagtc
360
actgtctcct ca 372
<210> 156
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 156
gaaattgtga tgacccagtc tcccacatcc atgtccacat caataggaga gagggtcacc
60
ctgaactgca aggccagtca gactgtgggt attaatgttg actggtacca acagacacca
120
gggcagcctc ctaaactact gatatatggg gcatccaacc gacacactgg ggtccctgat
180
cgcttcacag gcagtggatt tgggagagat ttcactctca ccatcagcaa cgtggaggct
240
gaagacctag ctgtttattg ctgtctgcaa tatggctcca ttcctcacac gtttggacct
300
gggaccaagc tggagctgaa a 321
<210> 157
<211> 345
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 157
gaagtgcagt tagtggaaag tggcggtggc ctggtgcaac cgggaggatc cttacgttta
60
agctgcgccg tgtccgggtt tagtatcagc acctataatg tacactggct gcgtcaagcc
120
ccgggcaaag ggttagaatg gatgggaatg atgtggagtg gtggaagccc agattataat
180
tcagctctca aatcccgatt cactattagt cgcgataccg caaaaaactc cgtgtacctt
240
cagatgaact ctcttcgcgc agaggatacg gcggtttact actgtgctcg ctggggcggc
300
gggtttgatt actggggcca gggaacgctg gtaacggttt ccagt 345
<210> 158
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 158
gacattcaac tgacccagag cccgtccagc ttatctgcga gtgttgggga ccgggtcacg
60
attacctgcc gggctagtca cagcattggg acgaacttgc attggtacca gcagaaacct
120
ggcaaagctc cgaaactgct gatttatttt acatcccaaa gcatcagcgg tgtcccctcc
180
cgattttccg ggtccggatc cggtaccgat tttactttaa cgatcagcag tctgcagcca
240
gaggatttcg ccacctacta ttgtcagcaa actcagtctt ggcccctgac ctttggccaa
300
gggaccaagg tagaaatcaa g 321
<210> 159
<211> 345
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 159
caggtgcagc tgaaggagtc aggacctggc ctggtgcagc cctcagagac cctgtccctc
60
acctgcactg tctctgggtt ctcaataagc acctataacg tacactggct tcgacagcct
120
ccaggaaaag gtctggagtg gatgggaatg atgtggagtg gtggaagccc agattataat
180
tcagctctca aatcccgact gagcatcagc agggacacct ccaagaacca agttttctta
240
aaaatgaaca gtctgcaaag tgaagacaca accacttact actgtgccag atgggggggg
300
ggctttgatt actggggcca aggagtcatg gtcacagtct cctca 345
<210> 160
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 160
gacatcgtgc tgactcagtc tccaaccacc ctgtctgtga ctccaggaga gacagtcagt
60
ctctcctgca gggctagcca tagtattggc acaaatctac actggtatca acaaaaaaca
120
aatgagtctc caaggcttct catcaagttt acttcccagt ccatctctgg gatcccctcc
180
aggttcagtg ccagtggatc agggacagat tttactctca acatcaacaa tgtggagttt
240
gatgatgtct caagttattt ttgtcaacag actcaaagct ggcccctcac gttcggttct
300
gggaccaagc tggagatcaa a 321
<210> 161
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 161
caagtacaac tggtgcagag tggggccgaa gtgaaaaaac ccggcgctag cgtgaaagtc
60
agctgtaaag tgtccggtta taatattaga agcacctata tgcattgggt gcgtcaagcg
120
ccgggccagg gcttagagtg gatgggtagg attgatcctg caaatggaaa tactatttat
180
gctgagaagt tcaaaaggag agttacgctg acccgcgaca cgtccacctc gacggcctat
240
atggagctgt cttctttacg ctcagaggac actgcagttt actattgtgc catggaagtt
300
agagttagct tcgaatattg gggtcaaggc acattggtca cggtcagcag t 351
<210> 162
<211> 318
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 162
gatatccaga tgactcaatc tccatcgagc ctttcggcgt cagtgggtga tcgtgttacc
60
atcacttgta aggcctccca aaacattaat aaatatctgg actggtacca gcagaaaccg
120
ggcaaagccc caaagttact gatctactat acaaataacc tacacacagg tgttccatca
180
cgcttttcag gtagcggaag cgggaccgac tttacgttta cgatctccag cttgcaacca
240
gaagacattg ccacttatta ttgtctccag catgacagtg gctatacctt tggacagggt
300
actaaggtgg aaatcaag 318
<210> 163
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 163
gaagtccagc tgcagcagtc tggggctgag ctagggaaac ctgggacctc agtcaagttg
60
tcttgcaagg tttctggcta taacattagg agtacctaca tgcactgggt gagtcagagg
120
cctggaaagg gcctggaatg gataggaagg attgatcctg caaatggaaa tactatttat
180
gctgagaagt tcaaaaggaa ggccacactg actgcagata catcgtccaa cacagcctac
240
atgcaactca gccaactgaa atctgacgac agagcaatct atttttgtgc tatggaagta
300
cgggtgtcct ttgagtactg gggccaggga gtcatggtca ccgtctcctc a 351
<210> 164
<211> 318
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 164
gacatccaga tgacccagtc tccttcattc ctgtctgcat ctgtgggaga cagagtcact
60
atcaactgca aagcaagtca gaatattaac aagtacttag actggtatca gcaaaagctt
120
ggtgaaggtc ccaaactcct gatatattat acaaacaatt tacatacagg aatcccatca
180
aggttcagtg gcagtgggtc tggtactgat ttcacactta ccatcagcag cctgcagcct
240
gaagatgttg ccacatattt ctgccttcag catgacagtg ggtacacgtt tggagctggg
300
accaagctgg aactgaaa 318
<210> 165
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 165
caagtgcagc tggtacagtc tggtgccgag gttaaaaagc cgggtagtag cgtgaaagta
60
agctgcaaag tgagtggtta tagcattcgt tcaacctata tgcactgggt tcgtcaggcg
120
ccaggccaag gtctcgagtg gatgggaagg attgatcctg caaatggaaa tacaatatat
180
gctgagaggt tcaaaaaccg cgtgacgctg accgcagata ccagcacttc cacggcgtac
240
atggaactgt cctccctgcg gtccgaagat accgcagtat attattgcgc cgtagaaatc
300
ctaggcattt ttgattattg ggggcagggc acactggtca ccgtatcgag c 351
<210> 166
<211> 318
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 166
gatatacaaa tgacacagag tccgagttcc ctatcagcga gcgtgggaga cagggttacc
60
ataacgtgta aagcatcgca gaatattgac aaatatctcg actggtatca acagaagccg
120
ggcaaagcac caaaactcct tatgtataac accaactctt tacatactgg cgtcccaagt
180
cgtttttcgg ggtctggcag cggcacagat tttacgctca ccattagttc gctgcagcca
240
gaagactttg ctacctactt ctgtctgcaa cataatagcg gctacacctt cggtcagggg
300
actaaagttg aaataaaa 318
<210> 167
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 167
gaagtccagc tgcagcagtc cggggctgag cttgggaaac ctgggacctc agtcaagttg
60
tcttgcaagg tttctggcta tagtattagg agtacctaca tgcactgggt gaatcagagg
120
cctggaaagg gcctggaatg ggtaggaagg attgatcctg caaatggaaa tacaatatat
180
gctgagaggt tcaaaaacaa ggccacactg actgcagata catcgtccaa cacagcctac
240
atgcaactca gccaactgaa atctgacgac acagcaatct atttttgtgc tgtggagatc
300
cttgggatct ttgattactg gggccaagga gtcatggtca cagtctcctc a 351
<210> 168
<211> 318
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 168
gacatccaga tgacccagtc tccttcattc ctgtctgcat ctgtgggaga cagagtcact
60
atcaactgca aagcaagtca gaatattgac aagtacttag actggtatca gcaaaagctt
120
ggtgaagctc ccaaactcct gatgtataat acaaacagtt tgcatacagg aattccatca
180
aggttcagtg gcagtggatc tggtactgat ttcacactta ccatcagcag cctgcagcct
240
gaagatgttg ccacatattt ctgccttcag cataacagtg ggtacacgtt tggagctggg
300
accaagctgg aactgaaa 318
<210> 169
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 169
gaggtacagc tggttgaatc gggtggtggt ctggttcagc cgggtggctc attaagactg
60
tcatgcgccg tgtctggtta taaaatccgc agcagttata tgcattgggt tcgtcaagct
120
ccgggtaaag gtttagaatg gatcgggagg attgatcctg caaatggaaa tactatatac
180
ggtgacaagt tcaaaagtcg gtttactctg tcatccgata ccgcgaaaaa ctcagcctat
240
ctgcaaatga attccctgcg cgcggaagac actgctgtct attattgcgc aattgatatc
300
ggtaccacgt ttgattattg gggccagggt acgttggtga cggttagctc c 351
<210> 170
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 170
gacatccaaa tgacccaatc tccgagttct ctgtctgctt ccgtgggcga ccgagtcacc
60
ataacctgta aggcttcgca acacatcaac cgttatttga actggtatca acagaaaccg
120
gggaaagcgc cgaaattgct gatttatgat gctaacaacc tgcagacagg cgtaccatcg
180
cgatttagcg gctccggaag cgggacggat tttactctca ccatcagctc tctgcagccg
240
gaagactttg caacctattt ctgtttacag cataattcct ggccgaatac ctttggccag
300
gggacaaagg tggaaatcaa a 321
<210> 171
<211> 351
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 171
gaggtccagc tgcagcagtc tggggctgag cttgggaaac ctgggacctc agtcaagttg
60
tcttgcaagg tttctggcta taagattagg agttcctaca tgcactgggt gaatcagagg
120
cctggaaagg gcctggaatg gataggaagg attgatcctg caaatggaaa tactatatac
180
ggtgacaagt tcaaaagtaa ggccacactg acttcagata catcgtccaa cacagcctac
240
atccaactca gccaactgaa atctgacgac acagcaatct atttttgtgc tatagatata
300
ggtacaacct ttgattattg gggccaagga gtcatggtca cagtctcctc a 351
<210> 172
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 172
gacatccaga tgacccagtc tccttcattc ctgtctgcat ctgtgggaga cagagtcact
60
atcaactgca aagcaagtca gcatattaat aggtacttaa actggtacca gcaaaagctt
120
ggagaagctc ccaaactcct gatatatgat gcaaacaatt tgcaaacggg catcccatca
180
cggttcagtg gcagtggatc tggtactgat ttcacactca ccatcagcag cctgcagcct
240
gaagatgttg ccacatattt ctgcttgcag cataatagtt ggccgaacac gtttggggct
300
gggaccaagc tggaattgaa a 321
<210> 173
<211> 357
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 173
gaagtccacc tgcaccagtc tgggcctgag cttgggaggc ctgggtcctc agtcaagatt
60
tcttgcaagg cttctggcta cacctttaca gattacgtta tgaactgggt gaggcagagt
120
cctggacagg ggctggaatg gataggatgg atcaatcctg aagattatag ttttgattct
180
ggtgagaagt tcctagagag ggccacactg actgcagcta cgtcctccaa cacagtctac
240
atccagctta gcggcctgac atctgacgac acagccacct atttttgtgt tagaggggga
300
ctacccgggg attggtttgc ttactggggc caaggcactc tggtcactgt ctcttca
357
<210> 174
<211> 321
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 174
gacatccaga tgacccagtc tccttcattc ctgtctgcat ctgtgggaga cagaatcact
60
atcaactgca agacaagtca gaatattaac aggtacttaa actggttcca gcaaaagctt
120
ggagaacctc ccaaactcct gatatataat gcaaacagtt tgcaagcgga cattccatca
180
cggttcagtg gcagtggatc tggtactgat ttcacactca ccatcaccag cctgcagcct
240
gaagatgttg ccacatattt ctgcttgcag catcatttct ggccgtacac gtttggagct
300
gggaccaagc tggaactgag a 321
<210> 175
<211> 535
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 175
Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser Tyr Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Val Trp Val Gly
50 55 60
Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val Glu Ile Tyr Ile Lys
85 90 95
Arg Asp Lys Asp Val Gly Met Trp Asn Asp Glu Arg Cys Ser Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr Asn Thr Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn Tyr Thr Cys Lys Cys
130 135 140
Asp Pro Gly Phe Ser Gly Leu Glu Cys Glu Gln Ile Val Asn Cys Thr
145 150 155 160
Ala Leu Glu Ser Pro Glu His Gly Ser Leu Val Cys Ser His Pro Leu
165 170 175
Gly Asn Phe Ser Tyr Ser Ser Ser Cys Ser Val Ser Cys Asp Arg Gly
180 185 190
Tyr Leu Pro Ser Ser Val Glu Thr Thr Gln Cys Met Ser Ser Gly Glu
195 200 205
Trp Ser Val Pro Ile Pro Ala Cys Lys Val Val Glu Cys Asp Ala Val
210 215 220
Thr Asn Pro Ala Asn Gly Phe Val Glu Cys Phe Gln Asn Pro Gly Ser
225 230 235 240
Phe Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys Glu Glu Gly Phe Glu
245 250 255
Leu Met Gly Ala Gln Ser Leu Gln Cys Thr Ser Ser Gly Asn Trp Asp
260 265 270
Asn Glu Lys Pro Thr Cys Lys Ala Val Thr Cys Arg Ala Ile Arg Gln
275 280 285
Pro Gln Asn Gly Ser Val Arg Cys Ser His Ser Pro Ala Gly Glu Phe
290 295 300
Thr Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu Glu Gly Phe Met Leu
305 310 315 320
Gln Gly Ala Ala Gln Val Glu Cys Thr Thr Gln Gly Gln Trp Thr Gln
325 330 335
Gln Val Pro Val Cys Glu Ala Phe Gln Cys Thr Ala Leu Ser Asn Pro
340 345 350
Glu Arg Gly Tyr Met Asn Cys Leu Pro Ser Ala Ser Gly Ser Phe Arg
355 360 365
Asn Gly Ser Ser Cys Glu Phe Ser Cys Glu Gln Gly Phe Val Leu Lys
370 375 380
Gly Ser Lys Arg Leu Gln Cys Gly Pro Thr Gly Glu Trp Asp Asn Glu
385 390 395 400
Lys Pro Thr Cys Glu Ala Val Arg Cys Asp Ala Val His Gln Pro Gln
405 410 415
Arg Gly Leu Val Arg Cys Ala His Ser Pro Ile Gly Glu Phe Thr Tyr
420 425 430
Lys Ser Ser Cys Ala Phe Ser Cys Glu Glu Gly Phe Glu Leu His Gly
435 440 445
Ser Thr Gln Leu Glu Cys Thr Ser Gln Gly Gln Trp Thr Glu Glu Val
450 455 460
Pro Ser Cys Gln Val Val Lys Cys Ser Ser Leu Ala Val Leu Glu Lys
465 470 475 480
Ile Asn Met Ser Cys Ser Gly Glu Pro Val Phe Gly Thr Val Cys Asn
485 490 495
Phe Ala Cys Pro Glu Gly Trp Arg Leu Asn Gly Ser Ala Ala Met Thr
500 505 510
Cys Gly Ala Thr Gly His Trp Ser Gly Met Leu Pro Thr Cys Glu Ala
515 520 525
Pro Thr Glu Ser Asn Thr Pro
530 535
<210> 176
<211> 13
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 176
Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Ala Glu Lys
1 5 10
<210> 177
<211> 18
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 177
Thr Ser Gln Asn Ile Asn Arg Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
1 5 10 15
Gly Lys
<210> 178
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 178
Tyr Asn Ile Arg Ser Ser Tyr Met His
1 5
<210> 179
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 179
Phe Lys Ile Arg Phe Thr Ile Ser Ala
1 5
<210> 180
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 180
Ile Arg Phe Thr Ile Ser Ala Asp Asn
1 5
<210> 181
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 181
Ile Asn Arg Tyr Leu Asn Trp Tyr Gln
1 5
<210> 182
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 182
Leu Leu Ile Tyr Asn Ala Asn Ser Leu
1 5
<210> 183
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 183
Leu Ile Tyr Asn Ala Asn Ser Leu Gln
1 5
<210> 184
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 184
Ile Tyr Asn Ala Asn Ser Leu Gln Thr
1 5
<210> 185
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 185
Tyr Asn Ala Asn Ser Leu Gln Thr Gly
1 5
<210> 186
<211> 7
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 186
Tyr Val Asp Ser Val Lys Gly
1 5
<210> 187
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 187
Val Lys Gly Arg Phe Thr Ile Ser Ala
1 5
<210> 188
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 188
Tyr Ala Ile Arg Ser Ala Tyr Met His
1 5
<210> 189
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 189
Val Glu Gly Arg Phe Thr Ile Ser Ala
1 5
<210> 190
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 190
Val Thr Gly Arg Phe Thr Ile Ser Ala
1 5
<210> 191
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 191
Val Lys Glu Arg Phe Thr Ile Ser Ala
1 5
<210> 192
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 192
Ile Glu Arg Tyr Leu Asn Trp Tyr Gln
1 5
<210> 193
<211> 9
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 193
Cys Ser Ser Leu Ala Val Leu Glu Lys
1 5
<210> 194
<211> 17
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 194
Ile Asp Pro Ala Asn Gly Asn Thr Ile Tyr Val Asp Ser Val Thr Gly
1 5 10 15
Arg
<210> 195
<211> 18
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 195
Thr Ser Gln Asn Ile Glu Arg Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
1 5 10 15
Gly Lys
<210> 196
<211> 610
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 196
Met Ile Ala Ser Gln Phe Leu Ser Ala Leu Thr Leu Val Leu Leu Ile
1 5 10 15
Lys Glu Ser Gly Ala Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr
20 25 30
Tyr Asp Glu Ala Ser Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val
35 40 45
Ala Ile Gln Asn Lys Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser
50 55 60
Tyr Ser Pro Ser Tyr Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val
65 70 75 80
Trp Val Trp Val Gly Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn
85 90 95
Trp Ala Pro Gly Glu Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val
100 105 110
Glu Ile Tyr Ile Lys Arg Glu Lys Asp Val Gly Met Trp Asn Asp Glu
115 120 125
Arg Cys Ser Lys Lys Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr
130 135 140
Asn Thr Ser Cys Ser Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn
145 150 155 160
Tyr Thr Cys Lys Cys Asp Pro Gly Phe Ser Gly Leu Lys Cys Glu Gln
165 170 175
Ile Val Asn Cys Thr Ala Leu Glu Ser Pro Glu His Gly Ser Leu Val
180 185 190
Cys Ser His Pro Leu Gly Asn Phe Ser Tyr Asn Ser Ser Cys Ser Ile
195 200 205
Ser Cys Asp Arg Gly Tyr Leu Pro Ser Ser Met Glu Thr Met Gln Cys
210 215 220
Met Ser Ser Gly Glu Trp Ser Ala Pro Ile Pro Ala Cys Asn Val Val
225 230 235 240
Glu Cys Asp Ala Val Thr Asn Pro Ala Asn Gly Phe Val Glu Cys Phe
245 250 255
Gln Asn Pro Gly Ser Phe Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys
260 265 270
Glu Glu Gly Phe Glu Leu Met Gly Ala Gln Ser Leu Gln Cys Thr Ser
275 280 285
Ser Gly Asn Trp Asp Asn Glu Lys Pro Thr Cys Lys Ala Val Thr Cys
290 295 300
Arg Ala Val Arg Gln Pro Gln Asn Gly Ser Val Arg Cys Ser His Ser
305 310 315 320
Pro Ala Gly Glu Phe Thr Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu
325 330 335
Glu Gly Phe Met Leu Gln Gly Pro Ala Gln Val Glu Cys Thr Thr Gln
340 345 350
Gly Gln Trp Thr Gln Gln Ile Pro Val Cys Glu Ala Phe Gln Cys Thr
355 360 365
Ala Leu Ser Asn Pro Glu Arg Gly Tyr Met Asn Cys Leu Pro Ser Ala
370 375 380
Ser Gly Ser Phe Arg Tyr Gly Ser Ser Cys Glu Phe Ser Cys Glu Gln
385 390 395 400
Gly Phe Val Leu Lys Gly Ser Lys Arg Leu Gln Cys Gly Pro Thr Gly
405 410 415
Glu Trp Asp Asn Glu Lys Pro Thr Cys Glu Ala Val Arg Cys Asp Ala
420 425 430
Val His Gln Pro Pro Lys Gly Leu Val Arg Cys Ala His Ser Pro Ile
435 440 445
Gly Glu Phe Thr Tyr Lys Ser Ser Cys Ala Phe Ser Cys Glu Glu Gly
450 455 460
Phe Glu Leu His Gly Ser Thr Gln Leu Glu Cys Thr Ser Gln Gly Gln
465 470 475 480
Trp Thr Glu Glu Val Pro Ser Cys Gln Val Val Lys Cys Ser Ser Leu
485 490 495
Ala Val Pro Gly Lys Ile Asn Met Ser Cys Ser Gly Glu Pro Val Phe
500 505 510
Gly Thr Val Cys Lys Phe Ala Cys Pro Glu Gly Trp Thr Leu Asn Gly
515 520 525
Ser Ala Ala Arg Thr Cys Gly Ala Thr Gly His Trp Ser Gly Leu Leu
530 535 540
Pro Thr Cys Glu Ala Pro Thr Glu Ser Asn Ile Pro Leu Val Ala Gly
545 550 555 560
Leu Ser Ala Ala Gly Leu Ser Leu Leu Thr Leu Ala Pro Phe Leu Leu
565 570 575
Trp Leu Arg Lys Cys Leu Arg Lys Ala Lys Lys Phe Val Pro Ala Ser
580 585 590
Ser Cys Gln Ser Leu Glu Ser Asp Gly Ser Tyr Gln Lys Pro Ser Tyr
595 600 605
Ile Leu
610
<210> 197
<211> 157
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 197
Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser Tyr Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Val Trp Val Gly
50 55 60
Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val Glu Ile Tyr Ile Lys
85 90 95
Arg Glu Lys Asp Val Gly Met Trp Asn Asp Glu Arg Cys Ser Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr Asn Thr Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn Tyr Thr Cys Lys Cys
130 135 140
Asp Pro Gly Phe Ser Gly Leu Lys Cys Glu Gln Ile Val
145 150 155
<210> 198
<211> 612
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 198
Met Asn Ala Ser Arg Phe Leu Ser Ala Leu Val Phe Val Leu Leu Ala
1 5 10 15
Gly Glu Ser Thr Ala Trp Tyr Tyr Asn Ala Ser Ser Glu Leu Met Thr
20 25 30
Tyr Asp Glu Ala Ser Ala Tyr Cys Gln Arg Asp Tyr Thr His Leu Val
35 40 45
Ala Ile Gln Asn Lys Glu Glu Ile Asn Tyr Leu Asn Ser Asn Leu Lys
50 55 60
His Ser Pro Ser Tyr Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val
65 70 75 80
Trp Ile Trp Val Gly Thr Gly Lys Pro Leu Thr Glu Glu Ala Gln Asn
85 90 95
Trp Ala Pro Gly Glu Pro Asn Asn Lys Gln Arg Asn Glu Asp Cys Val
100 105 110
Glu Ile Tyr Ile Gln Arg Thr Lys Asp Ser Gly Met Trp Asn Asp Glu
115 120 125
Arg Cys Asn Lys Lys Lys Leu Ala Leu Cys Tyr Thr Ala Ser Cys Thr
130 135 140
Asn Ala Ser Cys Ser Gly His Gly Glu Cys Ile Glu Thr Ile Asn Ser
145 150 155 160
Tyr Thr Cys Lys Cys His Pro Gly Phe Leu Gly Pro Asn Cys Glu Gln
165 170 175
Ala Val Thr Cys Lys Pro Gln Glu His Pro Asp Tyr Gly Ser Leu Asn
180 185 190
Cys Ser His Pro Phe Gly Pro Phe Ser Tyr Asn Ser Ser Cys Ser Phe
195 200 205
Gly Cys Lys Arg Gly Tyr Leu Pro Ser Ser Met Glu Thr Thr Val Arg
210 215 220
Cys Thr Ser Ser Gly Glu Trp Ser Ala Pro Ala Pro Ala Cys His Val
225 230 235 240
Val Glu Cys Glu Ala Leu Thr His Pro Ala His Gly Ile Arg Lys Cys
245 250 255
Ser Ser Asn Pro Gly Ser Tyr Pro Trp Asn Thr Thr Cys Thr Phe Asp
260 265 270
Cys Val Glu Gly Tyr Arg Arg Val Gly Ala Gln Asn Leu Gln Cys Thr
275 280 285
Ser Ser Gly Ile Trp Asp Asn Glu Thr Pro Ser Cys Lys Ala Val Thr
290 295 300
Cys Asp Ala Ile Pro Gln Pro Gln Asn Gly Phe Val Ser Cys Ser His
305 310 315 320
Ser Thr Ala Gly Glu Leu Ala Phe Lys Ser Ser Cys Asn Phe Thr Cys
325 330 335
Glu Gln Ser Phe Thr Leu Gln Gly Pro Ala Gln Val Glu Cys Ser Ala
340 345 350
Gln Gly Gln Trp Thr Pro Gln Ile Pro Val Cys Lys Ala Val Gln Cys
355 360 365
Glu Ala Leu Ser Ala Pro Gln Gln Gly Asn Met Lys Cys Leu Pro Ser
370 375 380
Ala Ser Gly Pro Phe Gln Asn Gly Ser Ser Cys Glu Phe Ser Cys Glu
385 390 395 400
Glu Gly Phe Glu Leu Lys Gly Ser Arg Arg Leu Gln Cys Gly Pro Arg
405 410 415
Gly Glu Trp Asp Ser Lys Lys Pro Thr Cys Ser Ala Val Lys Cys Asp
420 425 430
Asp Val Pro Arg Pro Gln Asn Gly Val Met Glu Cys Ala His Ala Thr
435 440 445
Thr Gly Glu Phe Thr Tyr Lys Ser Ser Cys Ala Phe Gln Cys Asn Glu
450 455 460
Gly Phe Ser Leu His Gly Ser Ala Gln Leu Glu Cys Thr Ser Gln Gly
465 470 475 480
Lys Trp Thr Gln Glu Val Pro Ser Cys Gln Val Val Gln Cys Pro Ser
485 490 495
Leu Asp Val Pro Gly Lys Met Asn Met Ser Cys Ser Gly Thr Ala Val
500 505 510
Phe Gly Thr Val Cys Glu Phe Thr Cys Pro Asp Asp Trp Thr Leu Asn
515 520 525
Gly Ser Ala Val Leu Thr Cys Gly Ala Thr Gly Arg Trp Ser Gly Met
530 535 540
Pro Pro Thr Cys Glu Ala Pro Val Ser Pro Thr Arg Pro Leu Val Val
545 550 555 560
Ala Leu Ser Ala Ala Gly Thr Ser Leu Leu Thr Ser Ser Ser Leu Leu
565 570 575
Tyr Leu Leu Met Arg Tyr Phe Arg Lys Lys Ala Lys Lys Phe Val Pro
580 585 590
Ala Ser Ser Cys Gln Ser Leu Gln Ser Phe Glu Asn Tyr His Val Pro
595 600 605
Ser Tyr Asn Val
610
<210> 199
<211> 157
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 199
Trp Tyr Tyr Asn Ala Ser Ser Glu Leu Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Arg Asp Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Asn Tyr Leu Asn Ser Asn Leu Lys His Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Ile Trp Val Gly
50 55 60
Thr Gly Lys Pro Leu Thr Glu Glu Ala Gln Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Lys Gln Arg Asn Glu Asp Cys Val Glu Ile Tyr Ile Gln
85 90 95
Arg Thr Lys Asp Ser Gly Met Trp Asn Asp Glu Arg Cys Asn Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ser Cys Thr Asn Ala Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Ile Glu Thr Ile Asn Ser Tyr Thr Cys Lys Cys
130 135 140
His Pro Gly Phe Leu Gly Pro Asn Cys Glu Gln Ala Val
145 150 155
<210> 200
<211> 610
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 200
Met Ile Ala Ser Gln Phe Leu Ser Ala Leu Thr Leu Val Leu Leu Ile
1 5 10 15
Lys Glu Ser Gly Ala Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr
20 25 30
Tyr Asp Glu Ala Ser Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val
35 40 45
Ala Ile Gln Asn Lys Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser
50 55 60
Tyr Ser Pro Ser Tyr Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val
65 70 75 80
Trp Val Trp Val Gly Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn
85 90 95
Trp Ala Pro Gly Glu Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val
100 105 110
Glu Ile Tyr Ile Lys Arg Asp Lys Asp Val Gly Met Trp Asn Asp Glu
115 120 125
Arg Cys Ser Lys Lys Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr
130 135 140
Asn Thr Ser Cys Ser Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn
145 150 155 160
Tyr Thr Cys Lys Cys Asp Pro Gly Phe Ser Gly Leu Glu Cys Glu Gln
165 170 175
Ile Val Asn Cys Thr Ala Leu Glu Ser Pro Glu His Gly Ser Leu Val
180 185 190
Cys Ser His Pro Leu Gly Asn Phe Ser Tyr Ser Ser Ser Cys Ser Val
195 200 205
Ser Cys Asp Arg Gly Tyr Leu Pro Ser Ser Val Glu Thr Thr Gln Cys
210 215 220
Met Ser Ser Gly Glu Trp Ser Val Pro Ile Pro Ala Cys Lys Val Val
225 230 235 240
Glu Cys Asp Ala Val Thr Asn Pro Ala Asn Gly Phe Val Glu Cys Phe
245 250 255
Gln Asn Pro Gly Ser Phe Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys
260 265 270
Glu Glu Gly Phe Glu Leu Met Gly Ala Gln Ser Leu Gln Cys Thr Ser
275 280 285
Ser Gly Asn Trp Asp Asn Glu Lys Pro Thr Cys Lys Ala Val Thr Cys
290 295 300
Arg Ala Ile Arg Gln Pro Gln Asn Gly Ser Val Arg Cys Ser His Ser
305 310 315 320
Pro Ala Gly Glu Phe Thr Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu
325 330 335
Glu Gly Phe Met Leu Gln Gly Ala Ala Gln Val Glu Cys Thr Thr Gln
340 345 350
Gly Gln Trp Thr Gln Gln Val Pro Val Cys Glu Ala Phe Gln Cys Thr
355 360 365
Ala Leu Ser Asn Pro Glu Arg Gly Tyr Met Asn Cys Leu Pro Ser Ala
370 375 380
Ser Gly Ser Phe Arg Asn Gly Ser Ser Cys Glu Phe Ser Cys Glu Gln
385 390 395 400
Gly Phe Val Leu Lys Gly Ser Lys Arg Leu Gln Cys Gly Pro Thr Gly
405 410 415
Glu Trp Asp Asn Glu Lys Pro Thr Cys Glu Ala Val Arg Cys Asp Ala
420 425 430
Val His Gln Pro Gln Arg Gly Leu Val Arg Cys Ala His Ser Pro Ile
435 440 445
Gly Glu Phe Thr Tyr Lys Ser Ser Cys Ala Phe Ser Cys Glu Glu Gly
450 455 460
Phe Glu Leu His Gly Ser Thr Gln Leu Glu Cys Thr Ser Gln Gly Gln
465 470 475 480
Trp Thr Glu Glu Val Pro Ser Cys Gln Val Val Lys Cys Ser Ser Leu
485 490 495
Ala Val Leu Glu Lys Ile Asn Met Ser Cys Ser Gly Glu Pro Val Phe
500 505 510
Gly Thr Val Cys Asn Phe Ala Cys Pro Glu Gly Trp Arg Leu Asn Gly
515 520 525
Ser Ala Ala Met Thr Cys Gly Ala Thr Gly His Trp Ser Gly Met Leu
530 535 540
Pro Thr Cys Glu Ala Pro Thr Glu Ser Asn Thr Pro Leu Val Ala Gly
545 550 555 560
Leu Ser Ala Ala Gly Leu Ser Leu Leu Thr Leu Ala Pro Phe Leu Leu
565 570 575
Trp Leu Arg Lys Cys Phe Arg Lys Ala Lys Lys Phe Val Pro Ala Ser
580 585 590
Ser Cys Gln Ser Leu Glu Ser Asp Gly Ser Tyr Gln Lys Pro Ser Tyr
595 600 605
Ile Leu
610
<210> 201
<211> 589
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 201
Trp Ser Tyr Asn Thr Ser Thr Glu Ala Met Thr Tyr Asp Glu Ala Ser
1 5 10 15
Ala Tyr Cys Gln Gln Arg Tyr Thr His Leu Val Ala Ile Gln Asn Lys
20 25 30
Glu Glu Ile Glu Tyr Leu Asn Ser Ile Leu Ser Tyr Ser Pro Ser Tyr
35 40 45
Tyr Trp Ile Gly Ile Arg Lys Val Asn Asn Val Trp Val Trp Val Gly
50 55 60
Thr Gln Lys Pro Leu Thr Glu Glu Ala Lys Asn Trp Ala Pro Gly Glu
65 70 75 80
Pro Asn Asn Arg Gln Lys Asp Glu Asp Cys Val Glu Ile Tyr Ile Lys
85 90 95
Arg Asp Lys Asp Val Gly Met Trp Asn Asp Glu Arg Cys Ser Lys Lys
100 105 110
Lys Leu Ala Leu Cys Tyr Thr Ala Ala Cys Thr Asn Thr Ser Cys Ser
115 120 125
Gly His Gly Glu Cys Val Glu Thr Ile Asn Asn Tyr Thr Cys Lys Cys
130 135 140
Asp Pro Gly Phe Ser Gly Leu Glu Cys Glu Gln Ile Val Asn Cys Thr
145 150 155 160
Ala Leu Glu Ser Pro Glu His Gly Ser Leu Val Cys Ser His Pro Leu
165 170 175
Gly Asn Phe Ser Tyr Ser Ser Ser Cys Ser Val Ser Cys Asp Arg Gly
180 185 190
Tyr Leu Pro Ser Ser Val Glu Thr Thr Gln Cys Met Ser Ser Gly Glu
195 200 205
Trp Ser Val Pro Ile Pro Ala Cys Lys Val Val Glu Cys Asp Ala Val
210 215 220
Thr Asn Pro Ala Asn Gly Phe Val Glu Cys Phe Gln Asn Pro Gly Ser
225 230 235 240
Phe Pro Trp Asn Thr Thr Cys Thr Phe Asp Cys Glu Glu Gly Phe Glu
245 250 255
Leu Met Gly Ala Gln Ser Leu Gln Cys Thr Ser Ser Gly Asn Trp Asp
260 265 270
Asn Glu Lys Pro Thr Cys Lys Ala Val Thr Cys Arg Ala Ile Arg Gln
275 280 285
Pro Gln Asn Gly Ser Val Arg Cys Ser His Ser Pro Ala Gly Glu Phe
290 295 300
Thr Phe Lys Ser Ser Cys Asn Phe Thr Cys Glu Glu Gly Phe Met Leu
305 310 315 320
Gln Gly Ala Ala Gln Val Glu Cys Thr Thr Gln Gly Gln Trp Thr Gln
325 330 335
Gln Val Pro Val Cys Glu Ala Phe Gln Cys Thr Ala Leu Ser Asn Pro
340 345 350
Glu Arg Gly Tyr Met Asn Cys Leu Pro Ser Ala Ser Gly Ser Phe Arg
355 360 365
Asn Gly Ser Ser Cys Glu Phe Ser Cys Glu Gln Gly Phe Val Leu Lys
370 375 380
Gly Ser Lys Arg Leu Gln Cys Gly Pro Thr Gly Glu Trp Asp Asn Glu
385 390 395 400
Lys Pro Thr Cys Glu Ala Val Arg Cys Asp Ala Val His Gln Pro Gln
405 410 415
Arg Gly Leu Val Arg Cys Ala His Ser Pro Ile Gly Glu Phe Thr Tyr
420 425 430
Lys Ser Ser Cys Ala Phe Ser Cys Glu Glu Gly Phe Glu Leu His Gly
435 440 445
Ser Thr Gln Leu Glu Cys Thr Ser Gln Gly Gln Trp Thr Glu Glu Val
450 455 460
Pro Ser Cys Gln Val Val Lys Cys Ser Ser Leu Ala Val Leu Glu Lys
465 470 475 480
Ile Asn Met Ser Cys Ser Gly Glu Pro Val Phe Gly Thr Val Cys Asn
485 490 495
Phe Ala Cys Pro Glu Gly Trp Arg Leu Asn Gly Ser Ala Ala Met Thr
500 505 510
Cys Gly Ala Thr Gly His Trp Ser Gly Met Leu Pro Thr Cys Glu Ala
515 520 525
Pro Thr Glu Ser Asn Thr Pro Leu Val Ala Gly Leu Ser Ala Ala Gly
530 535 540
Leu Ser Leu Leu Thr Leu Ala Pro Phe Leu Leu Trp Leu Arg Lys Cys
545 550 555 560
Phe Arg Lys Ala Lys Lys Phe Val Pro Ala Ser Ser Cys Gln Ser Leu
565 570 575
Glu Ser Asp Gly Ser Tyr Gln Lys Pro Ser Tyr Ile Leu
580 585
<210> 202
<211> 98
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 202
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 203
<211> 15
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 203
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10 15
<210> 204
<211> 95
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 204
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro
85 90 95
<210> 205
<211> 12
<212> PRT
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 205
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 206
<211> 1338
<212> ДНК
<213> Искусственная Последовательность
<220>
<223> Синтетическая Конструкция
<400> 206
gaagtgcagc ttgtggaatc cgggggcggc ttggtccaac cgggtggcag cctccgtctg
60
tcgtgcgcgg cttcgggcta tgccatccgt tctgcctaca tgcactgggt tcgccaggcg
120
cctgggaagg gcctggaatg ggtggccagg attgatcctg caaacggaaa tactatatat
180
gtggactccg tgaccggccg ctttacaatc agcgccgaca acgctaagaa ttccgcctac
240
ctgcaaatga atagcctgcg ggcagaggat accgcggtgt actattgtgc catggattta
300
tattccacgt ctgaatattg gggccaagga accctggtaa cggtgtcgtc ggcgtcgacc
360
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggcacagcg
420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca
480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac
540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc
600
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt
660
gacaaaactc acacatgccc accgtgccca gcacctgaag ccgctggggc accgtcagtc
720
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca
780
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac
840
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac
900
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag
960
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa
1020
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggagga gatgaccaag
1080
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag
1140
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc
1200
gacggctcct tcttcctcta tagcaagctc accgtggaca agagcaggtg gcagcagggg
1260
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc
1320
ctctccctgt ccccggga 1338
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С СОРТИЛИНОМ И ПОДАВЛЯЮТ СВЯЗЫВАНИЕ ПРОГРАНУЛИНА | 2016 |
|
RU2735639C2 |
| CD47-АНТИГЕНСВЯЗЫВАЮЩАЯ ЕДИНИЦА И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2780859C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| УЛУЧШЕННЫЕ АНТИ-FLT3 АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2830982C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙ АНТИГЕН ST2 | 2021 |
|
RU2841164C2 |
| АНТИ-ROR1/АНТИ-CD3 БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2831608C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| НОВОЕ АНТИ-С-МЕТ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2751720C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К Vβ17/CD123 | 2020 |
|
RU2831786C2 |



















Изобретение относится к области биотехнологии, в частности к выделенному антителу или его антигенсвязывающему фрагменту, которые специфически связываются с E-селектином, а также к композиции и набору, их содержащим. Также раскрыты выделенная молекула нуклеиновой кислоты, кодирующая вышеуказанное антитело или его фрагмент, а также вектор и клетка, ее содержащие. Изобретение также относится к способу получения антитела или его антигенсвязывающего фрагмента, предусматривающему культивирование вышеуказанной клетки. Изобретение эффективно для лечения медицинского состояния, заболевания или нарушения, опосредованного или связанного с экспрессией E-селектина, связыванием E-селектина с лигандом, или и тем, и другим. 19 н. и 21 з.п. ф-лы, 14 ил., 38 табл., 34 пр.
1. Выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с E-селектином, человека, содержащие по меньшей мере одно из следующего:
(a) определяющую комплементарность область 1 легкой цепи (LCDR-1), содержащую аминокислотную последовательность SEQ ID NO: 2, LCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 3, LCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 4, определяющую комплементарность область 1 тяжелой цепи (HCDR-1), содержащую аминокислотную последовательность SEQ ID NO: 8, HCDR-2, содержащую аминокислотную последовательность SEQ ID NO: 9, и HCDR-3, содержащую аминокислотную последовательность SEQ ID NO: 10;
(b) аминокислотные последовательности HCDR-1, HCDR-2 и HCDR-3, приведенные в аминокислотной последовательности SEQ ID NO: 11, и аминокислотные последовательности LCDR-1, LCDR-2 и LCDR-3, приведенные в аминокислотной последовательности SEQ ID NO: 5;
(c) вариабельный домен тяжелой цепи (VH), содержащий аминокислотную последовательность, по меньшей мере на 99% идентичную последовательности SEQ ID NO: 11, и содержащий HCDR-1, состоящий из аминокислотной последовательности SEQ ID NO: 8, HCDR-2, состоящий из аминокислотной последовательности SEQ ID NO: 9, и HCDR-3, состоящий из аминокислотной последовательности SEQ ID NO: 10; и вариабельный домен легкой цепи (VL), содержащий аминокислотную последовательность, по меньшей мере на 99% идентичную последовательности SEQ ID NO: 5, и содержащий LCDR-1, состоящий из аминокислотной последовательности SEQ ID NO: 2, LCDR-2, состоящий из аминокислотной последовательности SEQ ID NO: 3, и LCDR-3, состоящий из аминокислотной последовательности SEQ ID NO: 4;
(d) VH, содержащий аминокислотную последовательность SEQ ID NO: 11, и VL, содержащий аминокислотную последовательность SEQ ID NO: 5;
(e) тяжелую цепь (HC), содержащую аминокислотную последовательность, по меньшей мере на 98% идентичную аминокислотной последовательности SEQ ID NO: 7 или SEQ ID NO: 13, и содержащий HCDR-1, состоящий из аминокислотной последовательности SEQ ID NO: 8, HCDR-2, состоящий из аминокислотной последовательности SEQ ID NO: 9, и HCDR-3, состоящий из аминокислотной последовательности SEQ ID NO: 10; и легкую цепь (LC), содержащую аминокислотную последовательность, по меньшей мере на 98% идентичную аминокислотной последовательности SEQ ID NO: 1, и содержащий LCDR-1, состоящий из аминокислотной последовательности SEQ ID NO: 2, LCDR-2, состоящий из аминокислотной последовательности SEQ ID NO: 3, и LCDR-3, состоящий из аминокислотной последовательности SEQ ID NO: 4; и
(f) HC, содержащую аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 13, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1.
2. Выделенное антитело, которое специфически связывается с E-селектином, человека, содержащее:
аминокислотную последовательность VL, содержащую LCDR-1, LCDR-2 и LCDR-3 аминокислотной последовательности SEQ ID NO: 5; и
аминокислотную последовательность VH, содержащую HCDR-1, HCDR-2 и HCDR-3 аминокислотной последовательности SEQ ID NO: 11.
3. Выделенное антитело по п. 2, содержащее константную область тяжелой цепи (CH) антитела, содержащую аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 16, и константную область легкой цепи (CL) антитела, содержащую аминокислотную последовательность SEQ ID NO: 14.
4. Выделенное антитело, которое специфически связывается с E-селектином, человека, содержащее LC, содержащую аминокислотную последовательность SEQ ID NO: 1, и HC, содержащую аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 13.
5. Выделенное антитело, которое специфически связывает E-селектин человека, содержащее:
a) VL антитела, содержащую LCDR1, LCDR2 и LCDR3 VL, содержащей аминокислотную последовательность SEQ ID NO: 5;
VH антитела, содержащую HCDR1, HCDR2 и HCDR3 VH, содержащей аминокислотную последовательность SEQ ID NO: 11;
CL антитела, содержащую аминокислотную последовательность SEQ ID NO: 14; и
CH антитела, содержащую аминокислотную последовательность SEQ ID NO: 15 или SEQ ID NO: 16;
b) VL антитела, содержащую аминокислотную последовательность, по меньшей мере на 99% идентичную аминокислотной последовательности SEQ ID NO: 5, и содержащую LCDR-1, состоящую из аминокислотной последовательности SEQ ID NO: 2, LCDR-2, состоящую из аминокислотной последовательности SEQ ID NO: 3, и LCDR-3, состоящую из аминокислотной последовательности SEQ ID NO: 4; и VH антитела, содержащую аминокислотную последовательность, по меньшей мере на 99% идентичную аминокислотной последовательности SEQ ID NO: 11, и содержащую HCDR-1, состоящую из аминокислотной последовательности SEQ ID NO: 8, HCDR-2, состоящую из аминокислотной последовательности SEQ ID NO: 9, и HCDR-3, состоящую из аминокислотной последовательности SEQ ID NO: 10.
6. Выделенное антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5, содержащие Fc-домен человека, выбранный из группы, состоящей из Fc-домена IgA1 IgA2, IgD, IgE, IgM, IgG1, IgG2, IgG3 или IgG4; константную область легкой цепи, выбранную из каппа или лямбда, и их комбинацию.
7. Выделенное антитело или его антигенсвязывающий фрагмент по любому из пп. 1-6, причем i) изотипом тяжелой цепи антитела является IgG1, ii) константной областью легкой цепи является легкая цепь каппа или iii) обе.
8. Выделенное антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, причем антитело или его антигенсвязывающий фрагмент связывает E-селектин человека или яванского макака с KD примерно от 200 нМ до примерно 2 нМ.
9. Выделенное антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, которые специфически связывают E-селектин человека и демонстрируют по меньшей мере одну поддающуюся обнаружению характеристику, выбранную из следующего:
(i) связываются с E-селектином человека с KD 200 нМ или менее, при измерении необязательно с помощью SPR;
(ii) связываются с E-селектином яванского макака с KD 200 нМ или менее, при измерении необязательно с помощью SPR;
(iii) связываются с E-селектином, экспрессируемым на клеточной поверхности, с EC50 50 нМ или менее, при измерении необязательно с помощью FAC;
(iv) связываются с растворимым E-селектином человека с EC50 2 нМ или менее, при измерении необязательно с помощью ELISA;
(v) нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с EC50 2 нМ или менее, при измерении необязательно с помощью конкурентного анализа AlphaLisa;
(vi) связываются со свободным растворимым E-селектином человека в сыворотке человека с IC50 от примерно 1 нМ до примерно 3 нМ;
(vii) нейтрализуют связывание лиганда сиалил-Льюис А с растворимым E-селектином человека с IC50 100 нМ или менее при измерении необязательно с помощью конкурентного ELISA в статических условиях;
(viii) нейтрализуют связывание лиганда сиалил-Льюис А с экспрессируемым на клеточной поверхности E-селектином человека с IC50 50 нМ или менее при измерении необязательно с помощью конкурентного ELISA в статических условиях;
(ix) ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 100 нМ или менее при измерении необязательно в статических условиях;
(x) ингибируют адгезию клеток, экспрессирующих лиганд E-селектина (например, лиганд E-селектина PSGL-1 и другие лиганды сиалил-Льюис), с экспрессируемым на клеточной поверхности E-селектином человека с IC50 100 нМ или менее при измерении необязательно в условиях физиологического потока;
(xi) ингибируют адгезию клеток крови пациентов с серповидноклеточной анемией (SCD) с растворимым E-селектином человека с IC50 от примерно 6,17 нМ до примерно 18,66 нМ при измерении необязательно в условиях физиологического потока;
(xii) связываются по меньшей мере с одним аминокислотным остатком E-селектина человека, выбранным из T7, E8, A9, M10, T11, P46, S47, Y48, N82, N83, Q85, E88, E92, Y94, R97, N105, E107, R108, S110, K111, K112 и K113;
(xiii) имеют средний период полужизни примерно 14,4 дней (345 часов) после IV введения в дозе 10 мг/кг;
(xiv) имеют средний период полужизни примерно 21,5 дней (518 часов) после SC введения в дозе примерно 3 мг/кг;
(xv) имеют вязкость 33,4 сП при 185,7 мг/мл при измерении при 25°C необязательно по методу Anton Parr;
(xvi) проявляют свойства для коммерчески подходящих готовых форм, включая высокую степень термической стабильности и минимальную агрегацию при высокой концентрации; и
(xvii) демонстрируют воспроизводимую экспрессию и чистоту в условиях крупномасштабного производства.
10. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9.
11. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9, содержащая по меньшей мере одно из следующего:
a) нуклеиновая кислота, кодирующая VH и VL области антитела, которое специфически связывает Е-селектин человека, где указанная нуклеиновая кислота содержит последовательность нуклеиновой кислоты SEQ ID NO: 136 и последовательность нуклеиновой кислоты SEQ ID NO: 137; и
b) нуклеиновая кислота, кодирующая HC и LC антитела, которое специфически связывается с E-селектином человека, где указанная нуклеиновая кислота содержит последовательность нуклеиновой кислоты SEQ ID NO: 138 или 206 и последовательность нуклеиновой кислоты SEQ ID NO: 139.
12. Выделенная молекула нуклеиновой кислоты, кодирующая VH антитела или его антигенсвязывающий фрагмент по любому из пп. 1-9, содержащая последовательность нуклеиновой кислоты SEQ ID NO: 136.
13. Выделенная молекула нуклеиновой кислоты, кодирующая VL антитела или его антигенсвязывающий фрагмент по любому из пп. 1-9, содержащая последовательность нуклеиновой кислоты SEQ ID NO: 137.
14. Выделенная молекула нуклеиновой кислоты, кодирующая HC антитела или его антигенсвязывающий фрагмент по любому из пп. 1-9, содержащая последовательность нуклеиновой кислоты SEQ ID NO: 138 или SEQ ID NO: 206.
15. Выделенная молекула нуклеиновой кислоты, кодирующая LC антитела или его антигенсвязывающий фрагмент по любому из пп. 1-9, содержащая последовательность нуклеиновой кислоты SEQ ID NO: 139.
16. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 10 или 11, или нуклеиновые кислоты по пп. 12 и 13, или нуклеиновые кислоты по пп. 14 и 15.
17. Клетка-хозяин, экспрессирующая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9 и содержащая вектор по п. 16.
18. Клетка-хозяин по п. 17, причем указанная клетка-хозяин представляет собой клетку млекопитающего, выбранную из группы, состоящей из клетки CHO, клетки COS, клетки HEK-293, клетки NS0, клетки PER.C6 или клетки Sp2,0.
19. Способ получения антитела или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина по п. 17 или 18 в условиях, в которых указанное антитело или его антигенсвязывающий фрагмент экспрессируется указанной клеткой-хозяином.
20. Фармацевтическая композиция для лечения заболевания, расстройства и/или состояния, связанного или опосредованного i) экспрессией E-селектина, ii) связыванием E-селектина с лигандом или iii) тем и другим, содержащая эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп. 1-9 и фармацевтически приемлемый носитель или вспомогательное средство.
21. Фармацевтическая композиция по п. 20, содержащая i) антитело или его антигенсвязывающий фрагмент, содержащие HC, содержащую аминокислотную последовательность SEQ ID NO: 7, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1, ii) антитело или его антигенсвязывающий фрагмент, содержащие HC, содержащую аминокислотную последовательность SEQ ID NO: 13, и LC, содержащую аминокислотную последовательность SEQ ID NO: 1, или iii) и то, и другое.
22. Способ лечения медицинского состояния, заболевания или нарушения, опосредованного или связанного с i) экспрессией E-селектина, ii) связыванием E-селектина с лигандом или iii) и тем, и другим у нуждающегося в этом субъекта, причем способ предусматривает введение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-9, которые специфически связываются с E-селектином человека.
23. Способ по п. 22, в котором медицинским состоянием, заболеванием или нарушением является SCD, кожное заболевание, воспалительное заболевание и/или осложнения диабета.
24. Способ лечения SCD у нуждающегося в этом субъекта, причем способ предусматривает введение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-9, которые специфически связываются с E-селектином, и лечит по меньшей мере один признак и/или симптом SCD, выбранный из группы, состоящей из признаков и/или симптомов, влияющих на кардиоторакальную систему, на нервную систему, на ретикулоэндотелиальную систему, на костно-мышечную систему, на мочеполовую систему и на желудочно-кишечный тракт, и их комбинации.
25. Способ лечения SCD по п.24, где по меньшей мере один признак или симптом SCD, поражающий кардиоторакальную систему, выбран из группы, состоящей из хронического рестриктивного заболевания легких, диастолического заболевания левого желудочка, легочной гипертензии, острого грудного синдрома, аритмии, внезапной смерти, вазоокклюзионного криза (VOC) и их комбинации.
26. Способ лечения SCD по п. 25, причем лечение VOC включает i) лечение острого VOC путем уменьшения продолжительности VOC, интенсивности VOC или и того, и другого, ii) профилактику или снижение частоты VOC или iii) и то, и другое.
27. Способ уменьшения биологической активности E-селектина у нуждающегося в этом субъекта, причем способ предусматривает введение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-9, которые специфически связываются с E-селектином человека.
28. Способ по п. 27, в котором антитело или его антигенсвязывающий фрагмент снижают по меньшей мере одну поддающуюся обнаружению биологическую активность E-селектина, причем сниженную активность выбирают из группы, состоящей из (a) связывания лейкоцитов с эндотелиальными клетками; (b) активации стабильной адгезии с эндотелиальными клетками; (c) медленного движения лейкоцитов до блокировки; (d) эффективной трансэндотелиальной миграции лейкоцитов; (e) аффинности и авидности Е-селектина к интегринам CD18; (f) переноса лейкоцитов в очаги острого воспаления; (g) цитозольного кальция; (h) фосфорилирования тирозина, которое активирует киназу p38 MAP и киназу Syk; (i) рекрутирования тромбоцитов и лейкоцитов из крови в эндотелий сосудов; (j) создания провоспалительной среды; и (k) их комбинации.
29. Способ по любому из пп. 22-28, предусматривающий введение терапевтически эффективного количества по меньшей мере одного дополнительного терапевтически активного соединения или средства лечения, причем дополнительное соединение и средство является эффективным при лечении по меньшей мере одного признака и/или симптома SCD.
30. Способ по п. 29, в котором по меньшей мере одно дополнительное терапевтически активное соединение выбирают из группы, состоящей из пенициллина для профилактики, гидроксимочевины, L-глутамина, кризанлизумаба, вокселотора, апиксабана, ривароксабана, нестероидных противовоспалительных препаратов, анальгетика, IW-1701, риоцигуата, тикагрелора, мемантина и их комбинации.
31. Способ по п. 29, в котором по меньшей мере одно дополнительное терапевтически активное соединение выбирают из группы, состоящей из антител против P-селектина, соединение, которое модулирует HbS, так чтобы сохранять его в R-состоянии, соединение, которое модулирует аффинность HbS к кислороду, соединения, воздействующего на полимеризацию HbS путем модулирования образования 2,3-дисфосфоглицериновой кислоты, соединения, воздействующего на полимеризацию HbS, индуцируя экспрессию эмбрионального гемоглобина (HbF), соединения, воздействующего на дисфункциональную клеточную адгезию, сосудистую дисфункцию и/или воспаление, соединения, повышающего уровни оксида азота (NO) в крови по сравнению с уровнем NO перед введением соединения, внутривенного IG, соединения, воздействующего на гиперкоагуляцию, соединение, которое блокирует связывание рецептора NMDA, и их комбинации.
32. Способ по п. 29, в котором по меньшей мере одно дополнительное терапевтически активное средство лечения выбирают из группы, состоящей из средства для кислородной терапии, переливания крови, хелатирования железа, трансплантации костного мозга, генной терапии, терапии путем редактирования генов с помощью CRISPR или метода цинковых пальцев и их комбинации.
33. Способ по любому из пп. 29-32, в котором введение по меньшей мере одного дополнительного терапевтически активного соединения или средства лечения, эффективного при лечении и/или профилактике по меньшей мере одного признака или симптома SCD, проводят одновременно, последовательно или отдельно от введения терапевтически эффективного количества антитела против E-селектина или его антигенсвязывающего фрагмента.
34. Набор для лечения SCD, содержащий терапевтически эффективное количество антитела против E-селектина по любому из пп. 1-9, контейнер и этикетку.
35. Набор по п. 34, дополнительно содержащий терапевтически эффективное количество по меньшей мере одного дополнительного терапевтически активного соединения или средства лечения, эффективного при лечении и/или профилактике по меньшей мере одного признака или симптома SCD.
36. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9 или фармацевтическая композиция по п. 20 или 21 для применения при лечении и/или профилактике заболевания, нарушения или состояния, связанного или опосредованного i) экспрессией E-селектина, ii) связыванием E-селектина с лигандом или iii) и тем, и другим.
37. Антитело или его антигенсвязывающий фрагмент или фармацевтическая композиция для применения по п. 36, причем заболеванием, нарушением или состоянием является SCD.
38. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-9 для изготовления лекарственного средства для лечения заболевания, нарушения или состояния, связанного или опосредованного i) экспрессией E-селектина, ii) связыванием E-селектина с лигандом или iii) и тем, и другим.
39. Применение по п. 38, причем заболеванием, нарушением или состоянием является SCD.
40. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-9 или фармацевтическая композиция по п. 20 или 21 для применения с целью снижения активности E-селектина у нуждающегося в этом субъекта для лечения SCD.
| OWENS R | |||
| et al., The in vivo and in vitro characterisation of an engineered human antibody to E-selectin, Immunotechnology, 1997, 3, pp.107-116 | |||
| US 5632991 A, 27.05.1997 | |||
| WO 9640942 A1, 19.12.1996 | |||
| ГУМАНИЗИРОВАННЫЙ ИММУНОГЛОБУЛИН, СПЕЦИФИЧНЫЙ ДЛЯ БЕЛКА L-СЕЛЕКТИНА ЧЕЛОВЕКА | 1993 |
|
RU2151612C1 |
Авторы
Даты
2023-10-11—Публикация
2021-01-21—Подача