Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности, разработке ассоциированной вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак.
Важнейшим условием, обеспечивающим использование собак в различных областях народного хозяйства и быту, является сокращение заболеваемости и падежа этих животных от инфекционных болезней, которые в экономическом, эпизоотологическом и клиническом направлениях нуждаются в проведении профилактической вакцинации. Специалисты во всем мире давно уже убедились в правильности аксиомы, что болезнь лучше и легче предупредить, чем потом заниматься ее трудоемким лечением. Среди инфекционных болезней собак особое значение представляют чума плотоядных, парвовирусный и коронавирусный энтериты, аденовирусные инфекции и др. В последние годы в России разработано и повсеместно применяется значительное количество отечественных и импортных биопрепаратов для собак. На основе всесторонне изученных штаммов возбудителей этих болезней в отечественной практике были созданы моно- и ассоциированные вакцины, которые в настоящее время выпускают 6 предприятий.
По данным Росстата на 2021 год в России числится порядка 20 млн собак, кошек около 60 млн, что почти вдвое превышает численность собак. В России существует 412 приютов для бездомных животных и 219 пунктов передержки, расположенных в 69 регионах.
По данным Центра Ветеринарии за 2017-2021 гг. эпизоотическая ситуация по вирусным заболеваниям собак на территории РФ выглядит так, лидирующее место занимает парвовирусный энтерит - его регистрировали в 37% случаях, на втором месте аденовирусная инфекция - она составляет 24%, на третьем месте коронавирусный энтерит - 21%, бешенство - 16% и чума плотоядных - 2%.
Данные заболевания встречаются повсеместно у собак разных пород и возрастов. Чума плотоядных и парвовирусный энтерит являются высококонтагиозными заболеваниями, смертность от которых для щенков может достигать 100%. Инфекционный гепатит и инфекционный ларинготрахеит, вызываемые соответственно аденовирусами 1-го и 2-го типов, поражают собак любого возраста и могут вызывать тяжелые поражения печени и респираторного тракта, приводящие к гибели животного. Коронавирусный энтерит наиболее опасен для щенков в первые месяцы жизни [1, 2, 3, 4].
Широкое распространение вышеуказанных болезней среди собак, изменением некоторых показателей эпизоотического процесса, обусловленное большим разнообразием штаммов возбудителей на территории РФ, их высокой мутагенностью, появлением в стране новых породных групп, частым проведением выставок, бесконтрольным перемещением животных и целым рядом других факторов. Не всегда эффективная действенность традиционных методов лечения указывают на необходимость дальнейшего совершенствования мер борьбы и профилактики, поиска и разработки новых более эффективных препаратов, что является актуальным, несмотря на обилие выпускаемых отечественной и зарубежной биопромышленностью вакцинных препаратов [5, 6, 7].
Создание ассоциированных вакцин это оптимальное решение не только для щенков, содержащихся индивидуально, но особенно для использования в питомниках, приютах, где скученное содержание животных способствует возникновению и распространению инфекции. В целом применение ассоциированных вакцин, включающих несколько иммуногенов, позволяет снизить стрессовые ситуации у прививаемых животных, создать напряженный иммунитет в сжатые сроки и уменьшить трудозатраты [7].
Чума плотоядных - высококонтагиозная вирусная болезнь плотоядных животных, характеризуется лихорадкой, острым катаральным воспалением слизистых оболочек дыхательного, пищеварительного и мочевыделительного трактов, кожной экзантемой, пневмонией и тяжелым поражением нервной системы. Возбудителем является РНК-содержащий вирус из семейства Paramyxoviridae, род Morbillivirus, вид Canine morbillivirus. Форма вирионов полиморфная, преобладает сферическая. Внутренняя часть вириона представляет собой закрученную спиралью нить рибонуклеопротеида, который окружен оболочкой с радиально расположенными отростками. Вирус однороден в иммунобиологическом отношении. Размер вириона колеблется от 115 до 160 нм [8].
Возбудитель устойчив к действию внешних факторов: на солнечном свете сохраняет активность до 10-14 ч, при температуре минус 20°С сохраняется в органах павших животных до 6 месяцев, в крови - до 3. В выделениях больных животных (кал, слизь) во внешней среде при температуре 4°С вирус сохраняет вирулентность длительное время 7-11 дней, а при 100°С погибает мгновенно [1].
На сегодняшний день в иммунологических реакциях нельзя показать неоднородность штаммов. Между тем все известные штаммы вируса обладают неодинаковой видовой патогенностью (существует несколько клинических форм течения болезни) и различным тропизмом. Многообразие различных форм течения чумы плотоядных затрудняет своевременную постановку диагноза [5].
Профилактика - это самый реальный и эффективный метод - иммунизация собак с использованием различных типов вакцин. За 100 прошедших лет после открытия возбудителя во многих странах мира проведены исследования биологических свойств вируса чумы плотоядных, эпизоотологии, патогенеза, клинических признаков и других аспектов болезни. Значительное внимание уделено диагностике и профилактике [9]. Создано большое количество моно- и поливалентных вакцин. Одна из первых вакцин, разработанная в 1924 году Пунтоли - тканевая инактивированная из головного мозга; она создавала слабый иммунитет при поздних сроках его формирования. В 1939 г. Грин предложил тканевую вакцину. Но после проведения 53…64 пассажей вирус терял вирулентность для лисиц. Широкое применение данной вакцины показало, что она обладала высокой остаточной вирулентностью. Новым этапом в разработке вакцин - аттенуирование штаммов. В результате проведения серийных пассажей вирус потерял вирулентные свойства, но приобретал иммуногенную активность [25].
Первый аттенуированный штамм Ондестепорт был получен после 123 пассажа вируса чумы плотоядных на эмбрионах кур и 5 в культуре клеток. Данный вирус широко используется в настоящее время при изготовлении вакцин против чумы плотоядных.
В нашей стране до 1970 года применяли эмбрион-вакцину из аттенуированного на эмбрионах кур штамма Ш-2 и культуральную из штамма У. В начале 1970 г. была предложена культуральная вакцина из штамма 668-КФ [10], в 1974 - создана вакцина Вакчум [11]. В 1976-1977 гг. была усовершенствована технология производства ранее выпускаемой вакцины из штамма У, заменив культуру клеток почки щенка на культуру клеток эмбриона перепела [12]. Адаптированный штамм был назван ЭПМ.
В настоящее время в стране зарегистрировано 17 моно- и ассоциированных вакцин для собак, содержащих в своем составе тот или иной штамм вируса чумы плотоядных. В дальнейшем стали использовать перевиваемые культуры клеток, что значительно удешевило вакцины.
Парвовирусный энтерит - высококонтагиозная вирусная болезнь собак, характеризующаяся в основном острым геморрагическим энтеритом, обезвоживанием организма, лейкопенией и миокардитом. Возбудитель - ДНК-содержащий вирус, относится к семейству Parvoviridae роду Protoparvovirus. Существует две разновидности парвовируса собак (CPV): CPV-1 и CPV-2. Наиболее опасен патогенный CPV-2, который обусловливает острые парвовирусные энтериты у собак. По иммуногенным свойствам CPV-2 близок к возбудителям панлейкопении кошек и энтериту норок. Возбудитель CPV-2 очень устойчив в окружающей среде и при комнатной температуре может сохраняться в инфицированных объектах в течение 6 месяцев [13, 14].
Как самостоятельная болезнь парвовирусный энтерит собак впервые был зарегистрирован в 1976 г. в Бельгии, в 1978 г. - в США, а затем в 1978-1981 гг. - в Австралии, Канаде, Англии, Италии, Франции и др. В России впервые болезнь зарегистрирована примерно в 1983 г. В настоящее время парвовирусный энтерит собак входит в группу 5 наиболее распространенных в России инфекционных болезней собак [14].
Важно отметить, что вирусные энтериты (гастроэнтериты) у собак может вызывать не только возбудитель CPV-2, но и другие вирусы: коронавирус, вирус чумы плотоядных, инфекционного гепатита, смешанные инфекции и др. Так, например, в Австралии при патологоанатомическом вскрытии собак, болевших энтеритами, были обнаружены: в 30% случаев - парвовирус собак, в 2,6% - вирус чумы плотоядных и в 2% - коронавирус собак [15, 16, 19].
Изучением антигенного родства CPV-1 и CPV-2 вирусов установлено наличие у них общих специфических антигенов. Различия в нуклеотидной последовательности их ДНК составляют менее 1%. Обнаружена разной степени антигенная общность всех парвовирусов - собак, кошек, свиней, крыс, мышей, норок и человека. Из-за наличия такого родства для человека небезопасно заболевание животных парвовирусами [17,19].
У возбудителя CPV антигенные свойства проявляется индуцированием синтеза комплементсвязывающих, вируснейтрализующих и антигемагглютинирующих антител, которые обнаруживаются на 5-7-й день после заражения и сохраняются в организме в течение двух лет [17]. Парвовирус собак гемагглютинирует эритроциты свиньи и кошки при 4°С и рН 5,8-8,2. Однако не все штаммы вируса обладают этим свойством.
Парвовирус собак культивируется в первично-трипсинизированных и перевиваемых культурах клеток собак и кошек, а также в перевиваемой линии VERO. Однако размножение вируса не сопровождается проявлением ЦПД. Для выявления антигена парвовируса собак могут быть использованы РИФ с флуоресцирующей сывороткой против лейкопении кошек, ИФА. Возможно обнаружение и титрование накопившегося в культуре клеток вируса в РГА с эритроцитами свиньи [20].
Первой в нашей стране была разработана инактивированная вакцина против парвовирусных инфекций плотоядных - Парвовак карниворум. Позже Уласовым в 1984 году был выделен от собак аденовирус тип 2. Что послужило появлением ассоциированной вакцины Тривак - для профилактики аденовирусных инфекций и парвовирусного энтерита собак. Далее к этой вакцине добавили вирус чумы плотоядных, инфекционного гепатита - была разработана вакцина Тетравак [21].
Коронавирусный энтерит - широко распространен и встречается во всех уголках нашей планеты. Впервые коронавирусные энтериты собак были зарегистрированы в Германии в 1971 г., затем были выявлены во многих других странах Европы, Азии и Америки. В России CCoV был впервые выделен и идентифицирован в 1997 г. А.А. Ольшанской и др [22, 23]. Данный возбудитель заболевания видоспецифичен, т.е. опасным является именно для всего семейства собачьих. К болезни восприимчивы собаки всех возрастов и пород, но наиболее чувствительны к CCoV молодые щенки до 5-месячного возраста при групповом методе содержания животных.
Коронавирус у собак протекает со схожими симптомами, которые мы можем наблюдать при заболевании парвовирусным энтеритом. В большинстве случаев коронавирусный энтерит не характеризуется столь тяжелым течением и протекает без видимых клинических признаков. Однако случается, что собака одновременно заражается и парвовирусным, и коронавирусным энтеритом, что осложняет течение заболевания. В таком случае ярко проявляются клинические симптомы, животному требуется врачебная помощь, зачастую стационарное лечение. В некоторых случаях, при запоздалом обращении или наличии сопутствующих заболеваний, в том числе и паразитарных, может произойти гибель собаки. По результатам исследований британских ученых летальность достигает 89% случаев при одновременном заражении собаки корона- и парвовирусным энтеритом.
Возбудителем является РНК-содержащий вирус, семейства Coronaviridae. Коронавирус собак (CCoV) имеет антигенное родство с коронавирусом кошек, свиней и может их инфицировать. CCoV не устойчив во внешней среде и сохраняется в каловых массах при комнатной температуре не более 2 суток [13].
Поскольку собачий коронавирус является весьма заразной инфекцией, лучшей профилактикой является своевременная вакцинация. Коронавирусный антиген «входит» не во все распространяемые вакцины.
Аденовирусные инфекции собак - проявляются в виде двух самостоятельных болезней: инфекционного гепатита, вызываемого аденовирусом собак тип 1 (CAV-1), и аденовироза, вызываемого аденовирусом собак тип 2 (CAV-2). Инфекционный гепатит (CAV-1) (заразное воспаление печени собак, болезнь Рубарта, вирусный гепатит) - это остроконтагиозное заболевание, протекающее с явлениями лихорадки, воспалительных процессов слизистых оболочек глаз, носовой полости, желудочно-кишечного тракта, печени и желчного пузыря, сопровождающегося иногда нарушением деятельности центральной нервной системы. ДНК-со держащий вирус относится к семейству Adenoviridae, роду Mastadenovirus, виду Canine mactadenovirus А серотипа I (CAV-1).
Антигенного родства вируса CAV-1 с аденовирусом человека не обнаружено. Штаммы вируса CAV-1, выделенные в разных регионах страны, антигенно-родственны. Штаммы вируса, выделенные от песцов и лисиц, идентичны штаммам вируса CAV-1 по антигенным свойствам. Вирус содержит преципитирующий, гемагтлютинирующий и комплементсвязывающий антигены и индуцирует образование соответствующих антител. Успешно культивируется в культуре клеток почки щенков собак, песцов, лисиц. Из перевиваемых культур к этому вирусу оказалась чувствительной MDCK (почка собаки) - цитопатогенное действие достигает максимума через 48 ч и характеризуется округлением клеток и образованием конгломератов, напоминающих гроздья винограда. В клетках обнаруживаются внутриядерные тельца-включения. Большинство эпизоотических штаммов вируса CAV-1 обладают гемагглютинирующей активностью в отношении эритроцитов морской свинки и человека.
Первым детально описал этиологию и симптомы CAV-1 шведский ученый Рубарт (1947), именем которого иногда и называют болезнь [24].
Сохранение инфекционной активности вируса максимально выражено при рН 6,0-9,0. Вирус весьма термолабилен - 56°С быстро инактивирует его. При 22°С вирус сохраняется во внешней среде до 4 мес; на шерсти переболевшего животного при 17°С - до 1; при 0-2°С - до 6 мес. При замораживании, высушивании и хранении в 50%-ном растворе глицерина не теряет инфекционной активности в течение 3-5 лет.
К настоящему времени известно несколько комбинированных вакцин различной валентности против данных инфекций.
Известна вакцина против чумы плотоядных, инфекционного гепатита и парвовирусного энтерита плотоядных, содержащая лиофилизированную смесь суспензии вакцинного штамма «ВНИИВВмМ-88» чумы плотоядных, суспензии вакцинного штамма «Корнелл-2» инфекционного гепатита собак, суспензии вакцинного штамма «А» панлейкопении кошек и среду высушивания на основе лактозы, сахарозы, сорбита и желатина (патент RU №2154496, опубл. 20.08.2000) [26]. Недостатком известной ассоциированной вакцины является ограниченность спектра действия, так как она направлена против узкой группы возбудителей заболеваний и не обеспечивает иммунологическую защиту собак от коронавирусного энтерита. Кроме того, входящий в ее состав вакцинный штамм «А» панлейкопении кошек обладает недостаточной иммуногенностью и не обеспечивает нужную степень защиты собак против вирулентных штаммов вируса парвовирусного энтерита собак.
Известна вакцина «Гексаканивак» для специфической профилактики чумы плотоядных, инфекционного гепатита, аденовироза, парвовирусного энтерита и лептоспироза собак, содержащая культуральную вирусную суспензию штамма Distemper canine «ЭПМ», инактивированную культуральную вирусную суспензию штамма Mammaliadenovirus Adenovirus canis 2 «Ада», инактивированную культуральную вирусную суспензию штамма Virus panleucopenia Felline «Ганнибал», лептоспиры серогруппы Canicola штамм ВГНКИ-3 и серогруппы Icterohaemorrhagiae штамм ВГНКИ-2 в равном соотношении при концентрации 300-500 млн. клеток/0,2 см3, адъювант - гидроокись алюминия и белок сыворотки крови, стабилизатор - растворы желатозы и сорбита (патент RU №2045960, опубл. 20.10.1995) [27].
Известна вакцина «Тетравак» для профилактики чумы плотоядных, инфекционного гепатита, аденовирусных инфекций и парвовирусного энтерита у собак, включающая инактивированную суспензию штамма Mammaliadenovirus Adenovirus canis-2 «Ада», инактивированную суспензию штамма Virus panleucopenia felline «Ганнибал», суспензию штамма Distem50/0,5 см3, гидроокись алюминия, 25%-ный раствор желатозы, 50%-ный раствор сорбита, воду дистиллированную и раствор Хенкса (патент RU №2030917, опубл. 20.03.1995) [21].
Наиболее близкой по форме фармацевтической субстанции известна ассоциированная вакцина «Биовак» против чумы плотоядных, парвовирусного энтерита, инфекционного гепатита, аденовироза и лептоспироза собак, содержащая в одной прививочной дозе (2 мл) лиофилизированную вируссодержащую жидкость штамма вируса чумы плотоядных, суспензию адсорбированной инактивированной культуры штамма парвовируса плотоядных «Геркулес», инактивированную вирусную суспензию штамма Mammaliadenovirus Adenovirus canis - 2 «Ада» и смешанную суспензию лептоспир серогрупп Canicola-3 и Icterohaemorrhagiae, взятых в равном соотношении микробных клеток, при общей концентрации 200-400 млн. м. кл. Сухой компонент вакцины - лиофилизированную вируссодержащую жидкость штамма вируса чумы плотоядных, смешивают с остальными жидкими компонентами вакцины непосредственно перед использованием (патент RU №2150296, опубл. 10.06.2000) [28].
Существенным недостатком данных вакцин является, что они не создают иммунитета против коронавирусного энтерита собак, ввиду отсутствия в составе данного антигена, что требует дополнительного применения моновакцин.
Известна вакцина против чумы плотоядных, аденовирусных инфекций, парвовирусного и коронавирусного энтеритов, лептоспироза и бешенства собак [патент RU №2546247, опубл. 10.04.2015] [29]. В одной дозе вакцина содержится в качестве активного вещества смесь: суспензии аттенуированного штамма вируса чумы плотоядных ГКВ №2313, семейства Paramyxoviridae, рода Morbillivirus; суспензии аттенуированного штамма аденовируса собак 2-го типа ГКВ №2311, семейства Adenoviridae, рода Mastadenovirus; суспензии аттенуированного штамма парвовируса собак 2-го типа ГКВ №2312, семейства Parvoviridae, рода Parvovirus; суспензии аттенуированного штамма коронавируса собак ГКВ №2314, семейства Coronaviridae, рода Coronavirus; инактивированной суспензии штамма вируса бешенства Ера - СВ-М20, семейства Rhabdoviridae, рода Lyssavirus, инактивированных суспензий лептоспир серогрупп Icterohaemorrhagiae и Canicola, взятых в смеси в равном соотношении с конечной концентрацией каждого штамма не менее 3×108 инактивированных микробных клеток.
Известны поливалентные вакцины для собак против Leptospira Bratislava и других патогенов [патент RU №2400248, опубл. 27.09.2010] [30]. В данном изобретении описаны комбинированные вакцины против лептоспироза собак, которые содержат препарат клеток Leptospira из Leptospira bratislava, Leptospira canicola, Leptospira grippotyphosa, Leptospira icterohaemorrhagiae и Leptospira pomona и носитель. Комбинированная вакцина для иммунизации собак включает ослабленный штамм Snyder Hill вируса чумы собак (CDV), ослабленный штамм Manhattan аденовируса собак 2 типа (CAV-2), ослабленный штамм вируса NL-CPI-5 парагриппа собак (CPI), ослабленный штамм NL-35-D парвовируса собак (CPV), инактивированный препарат штамма коронавируса собак (CCV) и антиген р68 Bordetella bronchiseptica.
Из российских моно-, или поливалентных вакцин на рынке предлагается: «Биовак». Эта вакцина выпускается в различных сочетаниях ее компонентов: «Биовак D» - компонент против чумы собак;
«Биовак РА» - комплекс компонентов против парвовирусного энтерита, гепатита, аденовирусной инфекции;
«Биовак DPA» - содержит комплекс компонентов против чумы, парвовирусного энтерита, гепатита, аденовирусной инфекции;
«Биовак DPAL» - комплекс против чумы, парвовирусного энтерита, гепатита, аденовирусной инфекции и лептоспироза;
«Биовак L" - содержит комплекс компонентов против лептоспироза.
Также выпускается серия «Мультикан»:
«Мультикан-1» - против чумы плотоядных;
«Мультикан-2» - против парвовирусного энтерита и аденовирусных инфекций собак;
«Мультикан-6» - против чумы, аденовирусной инфекции, парвовирусного и коронавирусного энтеритов и лептоспироза;
"Мультикан-7" - против чумы, аденовирусной инфекции, парвовирусного и коронавирусного энтеритов, лептоспироза и дерматофитозов (лишая);
«Мультикан-8» - содержащая живые аттенуированные штаммы вируса чумы плотоядных, аденовируса 2-го типа, парво- и коронавируса собак и инактивированные производственные штаммы вируса бешенства и лептоспир серогрупп Icterohaemorrhagiae, Canicola и Gryppotyphosa, а также гидроокись алюминия в качестве адъюванта. Препарат обладает выраженной антигенной и иммуногенной активностями, безопасен для собак. Недостатком этой вакцины является отсутствии возможности подкожного применения - при попадании под кожу входящая в ее состав гидроокись алюминия индуцирует образование местной безболезненной припухлости, которая рассасывается от нескольких дней до 1 - 2 недель. В некоторых случаях на месте введения возможно образование стерильного абсцесса;
Наиболее близкой по составу антигенов вирусов инфекционных заболеваний является вакцина «Мультикан-4» - против чумы, аденовируса, парвовирусного и коронавирусного энтеритов. В инструкции по применению данной вакцины не прописаны, какие именно штаммы использовались при изготовлении данной вакцины [31]. Вакцина состоит из сухого и жидкого компонентов: - сухой компонент (живая вакцина) изготовлен из аттенуированных производственных штаммов вируса чумы собак, аденовируса собак типа 2, парвовируса и коронавируса собак; - жидкий компонент - вода для инъекций. Жидкий компонент является растворителем сухого компонента вакцины.
«Вакчум» - вакцина против чумы плотоядных.
«Владивак» - вакцина против чумы (Ч), парвовирусного энтерита (П), аденовирусной инфекции и инфекционного гепатита (АГ).
«Триовак» - против аденовирусной инфекции и парвовирусного энтерита собак.
«Тривирокан» - против парвовирусного энтерита, инфекционного гепатита и аденовирусной инфекции собак.
Из импортных вакцин на рынке предлагаются:
Серия «Duramoon-Дюрамун» (Дания, Сев. Ирландия). Вакцина против чумы, аденовирусной и коронавирусной инфекций, парвовирусного энтерита, парагриппа и лептоспироза;
- «Duramoone Мах 5/4b»/«Дюрамун Макс 5/4Л» - против чумы, аденовирусной инфекции, парагриппа, парвовирусного энтерита и лептоспироза;
- «Duramoone Мах 5 Cvc/4L» - против чумы, аденовирусной инфекции, коронавирусной инфекции, парагриппа, парвовирусного энтерита и лептоспироза;
- «Duramoone KF-11» - против парвовирусного энтерита.
Серия «Nobivac - Нобивак» (Голландия). Комплексная вакцина против чумы, инфекционного гепатита и парвовирусного энтерита (сочетание «Nobivac DHP»);
- «Nobivac DHPPi» - против чумы, инфекционного гепатита, парвовирусного энтерита и парагриппа;
- «Nobivac Parvo-С» - против парвовирусного энтерита или «Nobivac Puppy DP»
- против чумы и парвовирусного энтерита, щенков начинают вакцинировать с 4-6-недельного возраста.
Серия «Vanguard 5/L - Вангард 5/Л» (США, Ирландия). Вакцина против чумы плотоядных, инфекционного гепатита, парвовирусного энтерита, аденовирусной инфекции, парагриппа и лептоспироза;
- «Vanguard 7» - против чумы плотоядных, инфекционного гепатита, аденовирусной инфекции, парагриппа, парвовирусного энтерита; лептоспироза;
- «Vanguard CPV» - против парвовирусного энтерита: рекомендуется для ранней вакцинации щенков.
Серия «Еипсап - Эурикан» (Франция). Вакцина против аденовирусной инфекции, бешенства, лептоспироза, парагриппа, парвовирусного энтерита, чумы плотоядных. Первая инъекция (DHPPI2-L) выполняется в возрасте 7 недель, вторая (DHPPI2-LR), уже с компонентом бешенства, - через 3-5 недель. Ревакцинацию проводят через год.
Серия «Hexadog - Гексадог» (Франция, США) - против чумы (Ч), инфекционного гепатита (Г), парвовирусного энтерита (П), лептоспироза (Л) и бешенства (Б). Выпускается в сочетании «Гексадог ЧГП» и «Гексадог ЛБ».
Серия «Canivac - Канивак» (Польша) - против чумы и инфекционного гепатита («Canivac CH»);
- «Canivac CHL» - против чумы, инфекционного гепатита и лептоспироза;
- «Canivac Р» против парвовирусного энтерита.
Серия «Tetradog - Тетрадог» (Франция) - против чумы, инфекционного гепатита, парвовирусного энтерита и лептоспироза.
Серия «Trivirovax - Тривировакс» (Франция) - против чумы, инфекционного гепатита и парвовирусного энтерита.
Серия «Vaccidog L - Вакцидог Л» - против лептоспироза собак. «Vaccidog combi DHPPi» - против чумы, инфекционного гепатита, парвовирусного энтерита и парагриппа.
Для профилактики чумы плотоядных, инфекционного гепатита (аденовирусной инфекции), парвовирусного и коронавирусного энтеритов используют как живые, так и инактивированные моно- и ассоциированные вакцины, полученные как на основе первичных, так и перевиваемых клеточных культур.
Для иммунизации плотоядных, в том числе собак, против чумы плотоядных применяют культуральные вакцины из штаммов Ondersteport, ЭПМ, ВНИИВВиМ-88, 668-КФ, Рокборн, модифицированного Snyder-Hill и других (Автор, св-ва СССР №527072, 1977. Патенты US №4224412, 1980; №5000951, 1991; RU 2067002, 1996; RU №2005490, 1994; RU 2080125, 1997; RU №2108385, 1998).
Для защиты от инфекционного гепатита используют преимущественно препараты из штамма «Корнелл», а также аденовирусы собак типа 1 и 2 (Патент RU №2030917, 1995) [21].
Вакцины против парвовирусного энтерита в своем составе содержат живые аттенуированные и инактивированные вирулентные штаммы парвовирусов собак: «Риэль», «Геркулес», NL-35-D, №1-404 (Патенты US №4810494, 1989, RU №2150296,2000; RU №2045960,1995; RU №2400248, 2008; RU 2147609, 2000; СССР №1568520).
Однако известные моновалентные вакцины требуют проведения профилактических обработок против каждой инфекции в отдельности, недостаточно эффективны и не обеспечивают максимального профилактического эффекта, т.к. все чаще встречается смешанное течение данных инфекционных заболеваний.
Для формирования иммунитета против перечисленных инфекций в наиболее короткие сроки при меньших затратах труда и снижении риска осложнений, возникающих из-за стрессовых явлений при проведении прививок против каждой болезни, успешно применяют ассоциированные вакцины (Патенты US 5000951, 1991; RU №2030917, 1995; ТУ 08064-019-004-94 на вакцину жидкую инактивированную против парвовирусного энтерита и гепатита плотоядных; ТУ 10-09-98-91 на вакцину сухую культуральную против чумы, гепатита и парвовируса плотоядных) [26, 31].
Все известные комбинированные поливалентные ассоциированные вакцины содержат в своем составе живые аттенуированные вирусы и (или) инактивированный антиген. Они характеризуются недостаточной противоэпизоотической эффективностью, обусловленной тем, что используемые для изготовления поливалентной вакцины штаммы обладают антигенными и иммунобиологическими отличиями по сравнению с аналогичными характеристиками эпизоотических возбудителей, циркулирующих на территории России и стран СНГ. В связи с этим задачей изобретения является создание безопасной и высокоиммуногенной вакцины против основных инфекционных болезней собак, содержащей сбалансированные в антигенном и иммуногенном отношении вирусные антигены, обеспечивающих формирование устойчивого иммунитета по отношению к вирусу чумы плотоядных, аденовирусу - инфекционному гепатиту, парвовирусному и коронавирусному энтеритам собак.
Ассоциированной вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» в РФ не зарегистрировано, несмотря на то, что данные болезни являются для собак высококонтагиозными инфекциями, приводящими к гибели.
По данным патентной и научно-технической литературы не обнаружена аналогичная совокупность признаков, в части компонентов, что позволяет судить об изобретательском уровне заявленного технического решения.
Общим существенным недостатком известных ассоциированных вакцин, является их недостаточно высокая эффективность вследствие несоответствия антигенного профиля используемых в составе вакцины специфических антигенов эпизоотической обстановке.
Поэтому проблема получения высокоэффективной ассоциированной вакцины против основных возбудителей заболеваний собак остается актуальной и является основным направлением исследований по созданию искомого препарата.
Технический результат изобретения заключается в расширении арсенала ассоциированных вакцин против основных возбудителей инфекционных болезней собак, в повышении стабильности, антигенной и иммуногенной активности вакцины, а так же в усилении напряженности иммунитета у привитых животных за счет получения вирионов с полным спектром антигенов.
Технический результат изобретения достигается путем использования в составе вакцины нового производственного штамма вируса коронавирусной инфекции собак и известных штаммов аденовируса (инфекционного гепатита), парвовируса собак, вируса чумы плотоядных с высокой антигенной и иммуногенной активностью, и образования синергетической композиции поливалентной ассоциированной вакцины при объединении антигенов вирусов нового производственного штамма с известными вакцинными штаммами.
Указанный технический результат достигнут созданием ассоциированной вакцины против чумы плотоядных, парвовирусного энтерита собак гена VP2, коронавирусного энтерита, аденовирусной инфекции 1 серотипа собак «Карникан-4», охарактеризованной следующей совокупностью признаков.
Сущность изобретения заключается в следующем: предлагаемая ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4», содержит в качестве активного вещества смесь из аттенуированного антигенного материала из штамма «Рокборн» вируса чумы плотоядных; из инактивированного очищенного антигенного материала из штамма «Грей» парвовирусного энтерита собак; из инактивированного очищенного антигенного материала из штамма «Рич» коронавирусного энтерита собак; из инактивированного очищенного антигенного материала из штамма «ВГНКИ» аденовирусной инфекции (инфекционного гепатита) собак, взятых в эффективных количествах, обеспечивающих протективную иммунную активность в организме собаки после введения ей целевого препарата. В качестве целевой добавки предлагаемая вакцина содержит в качестве адьюванта гидроокись алюминия (производство «ВНИИЗЖ») и стабилизирующую среду.
В предлагаемой вакцине активное вещество и целевая добавка объединены в соотношении: для жидкого компонента, об. %: 90,0÷10,0; для сухого компонента - активное вещество и целевая добавка объединены в соотношении, об. %: 80,0÷20,0; жидкий компонент и сухой компонент смешиваются в соотношении 1:1.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые спрашивается правовая охрана:
1. Вакцина ассоциированная против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4»;
2. Активное вещество в виде смеси из лиофильно высушенного живого аттенуированного антигенного материала из штамма «Рокборн» вируса чумы плотоядных, сем. Paramyxoviridae, рода Morbillivirus, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №28 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «Грей» вируса парвовирусного энтерита собак, сем. Parvoviridae, рода Protoparvovirus, вид Carnivore protoparvovirus 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №27 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «Рич» вируса коронавирусного энтерита собак, сем. Coronaviridae, рода Alphacoronavirus, вид Alphacoronavirus 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №376 - деп / 22-10 ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа сем. Adenoviridae, рода Mastadenovirus, вид Canine mastadenovirus А, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №29 - ГКШМ ФГБУ «ВНИИЗЖ»;
3. Целевые добавки.
Существенные отличительные признаки предлагаемой вакцины заключаются в том, что в качестве активного вещества она содержит смесь из инактивированных очищенных антигенных материалов из штаммов «Грей» вируса парвовирусного энтерита, «Рич» вируса коронавирусного энтерита и штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа, и аттенуированного лиофилизированного вирусного материала из штамма «Рокборн» вируса чумы плотоядных, в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Антигенный материал из штамма «Рокборн» вируса чумы плотоядных (CVD), полученный предпочтительно в перевиваемой культуре клеток VERO, в эффективном количестве.
2. Антигенный материал из штамма «Рокборн» вируса чумы плотоядных (CVD), полученный предпочтительно в перевиваемой культуре клеток VERO, представляющий собой аттенуированную лиофилизированную вирусную суспензию с инфекционной активностью не менее 3,58±0,14 lg ТЦД50/см3 в количестве 80,0 об. %.
3. Инактивированный и очищенный антигенный материал из штамма «Грей» вируса парвовирусного энтерита собак (CPV-2), полученный предпочтительно в перевиваемой культуре клеток FS, в эффективном количестве.
4. Инактивированный и очищенный антигенный материал из штамма «Грей» вируса парвовирусного энтерита собак (CPV-2), полученный предпочтительно в перевиваемой культуре клеток FS, представляющий собой вирусную суспензию с гемагглютинирующей активностью не менее 8,33±0,57 log2, в количестве 30,0 об. %.
5. Инактивированный и очищенный антигенный материал из штамма «Рич» вируса коронавирусного энтерита собак (CCoV), полученный предпочтительно в перевиваемой культуре клеток CrFk, представляющий собой суспензию в эффективном количестве.
6. Инактивированный и очищенный антигенный материал из штамма «Рич» вируса коронавирусного энтерита собак (CCoV), полученный предпочтительно в перевиваемой культуре клеток CrFk, представляющий собой вирусную суспензию с инфекционной активностью не менее 3,33±0,14 lg ТЦД50/см3, в количестве 30,0 об. %.
7. Инактивированный и очищенный антигенный материал из штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа (CAV-1), полученный предпочтительно в перевиваемой культуре клеток MDCK, в эффективном количестве.
8. Инактивированный и очищенный антигенный материал из штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го типа (CAV-1), предпочтительно в перевиваемой культуре клеток MDCK, представляющий собой вирусную суспензию с инфекционной активностью не менее 3,41±0,14 lg ТЦД50/см3, в количестве 30,0 об. %.
9. Из целевых добавок вакцина содержит гидроокись алюминия.
10. 3%-ный гель гидроокиси алюминия.
11. Вакцина содержит 3%-ный гель гидроокиси алюминия в количестве не менее 10,0 об. %.
12. Дополнительно из целевых добавок вакцина содержит стабилизирующую среду.
13. Стабилизирующая среда состоит из: гидролизат лактальбумина (ГЛА) - 9,0%, сахарозы - 9,0%, желатозы - 2,0%.
14. Вакцина содержит стабилизирующую среду: гидролизат лактальбумина (ГЛА) - 9,0%, сахарозы - 9,0%, желатозы - 2,0%, в количестве 20,0 об. %.
15. Смесь из инактивированных и очищенных антигенных материалов из штамма «Грей» вируса парвовирусного энтерита собак, из штамма «Рич» вируса коронавирусного энтерита собак, из штамма «ВГНКИ» вируса аденовирусной инфекции 1-го серотипа (инфекционного гепатита); лиофилизированного аттенуированного антигенного материала из штамма «Рокборн» вируса чумы плотоядных и целевые добавки: стабилизирующую среду и адъювант гидроокись алюминия в количестве, об. %:
Сухой компонент:
Жидкий компонент:
Адъювант в составе вакцины усиливает воздействие фармацевтической субстанции (антигенов) на иммунную систему прививаемых животных, инициируя каскад иммунных реакций, и обеспечивая выработку напряженного иммунитета.
Активным веществом в сухом компоненте вакцины является аттенуированный штамм «Рокборн» вируса чумы плотоядных. Для сохранения поддержания жизнеспособности и сохранения иммунобиологических свойств штамма в сухой компонент включена стабилизирующая среда, состоящая из гидролизата лактальбумина, сахарозы и желатозы, которая обеспечивает стабильность препарата в продолжении срока годности.
В результате проведенных исследований авторы определили важнейшие технологические показатели, позволившие создать препарат, в котором отсутствует конкуренция между антигенами, входящими в состав предлагаемой вакцины, а его иммуногенные свойства были сравнимы с таковыми после применения монопрепаратов. Высокий иммунологический эффект в отношении специфических антигенов, входящих в состав вакцины, был достигнут путем получения вирусных компонентов в составе вакцины, обладающих безвредностью, иммуногенностью и антигенной активностью, а так же вариант оптимального их соотношения в составе вакцины, обеспечивающих выработку защитного уровня антител, т.е. создание напряженного иммунитета к заболеваниям у собак.
Предлагаемая вакцина обладает высокой иммуногенной активностью и обеспечивает надежную защиту против вирусов чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции 1-го серотипа, циркулирующих на территории Российской Федерации.
Дополнительный технический результат от использования предлагаемого изобретения достигается за счет того, что для инактивации вируссодержащих материалов используют аминоэтилэтиленимин (АЭЭИ), что позволяет значительно снизить трудо- и энергозатраты на изготовление вакцины и повысить качество антигенных материалов.
Дополнительный технический результат предлагаемого изобретения достигается за счет того, что в состав ассоциированной вакцины входит новый производственный штамм «Рич» вируса коронавирусной инфекции собак.
Сущность изобретения отражена на графических материалах:
Фиг. 1 - Дендрограмма, отражает филогенетическое взаимоотношения штаммов вируса «Рокборн» чумы плотоядных с эпизоотическими и вакцинными штаммами вируса чумы. Дендрограмма основана на сравнении полных нуклеотидных последовательностях Н-гена.
Фиг. 2 - Дендрограмма, отражает филогенетическое взаимоотношения штаммов вируса «Грей» парвовирусного энтерита собак с эпизоотическими и вакцинными штаммами вируса парвовирусного энтерита. Дендрограмма основана на сравнении полных нуклеотидных последовательностях гена, кодирующего белок VP2.
Фиг. 3 - Филогенетическое древо для вируса коронавирусного энтерита собак штамма «Рич». Дендрограмма основана на сравнении полных нуклеотидных последовательностях М-гена кДНК вируса коронавирусного энтерита собак.
Фиг. 4 - Дендрограмма, отражает филогенетическое взаимоотношения штаммов вируса «ВГНКИ» аденовирусной инфекции собак 1-го серотипа с эпизоотическими и вакцинными штаммами вируса аденовирусной инфекции 1-го серотипа (инфекционного гепатита). Дендрограмма основана на сравнительном анализе нуклеотидных последовательностях fiber gene аденовируса собак, в том числе I и II серотипов.
Сущность изобретения пояснена следующими перечнями последовательностей:
SEQ ID NO:1 - Последовательность нуклеотидов Н-гена штамма «Рокборн» вируса чумы плотоядных (Canine morbillivirus) генотипа Rockborn-like. SEQ ID NO:2 - Последовательность аминокислот белка, который кодируется Н-геном, штамма «Рокборн» генотипа Rockborn-like вируса чумы плотоядных (Canine morbillivirus).
SEQ ID NO:3 - Последовательность нуклеотидов VP2-гена штамма «Грей» вируса парвовирусного энтерита собак генотипа CPV-2b.
SEQ ID NO:4 - Последовательность аминокислот белка, который кодируется VP2-геном, штамма Грей генотипа CPV-2b вируса парвовирусного энтерита собак.
SEQ ID NO:5 - Последовательность нуклеотидов М-гена кДНК вируса коронавирусного энтерита собак штамма «РИЧ»;
SEQ ID NO:6 - Последовательность аминокислот М-гена к ДНК вируса коронавирусного энтерита собак штамма «РИЧ».
SEQ ID NO:7 - Последовательность нуклеотидов fiber gene аденовируса собак штамма «ВГНКИ» генотипа CAV-1 аденовируса собак.
SEQ ID NO:8 - Последовательность аминокислот белка, который кодируется fiber gene, штамма «ВГНКИ» генотипа CAV-1 аденовируса собак.
Исходный вирус для получения штамма «Рокборн» вируса чумы плотоядных получен из ФГБУ «ВГНКИ» в 1995 г. Методом предельных разведений был адаптирован к репродукции в перевиваемой культуре клеток почки африканской зеленой мартышки (КК VERO).
Штамм «Рокборн» вируса чумы плотоядных депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №28 - ГКШМ ФГБУ «ВНИИЗЖ».
Штамм «Рокборн» вируса чумы плотоядных характеризуется следующими признаками и свойствами.
Морфологические признаки
Вирионы имеют разнообразную форму - от сферической до нитевидной с диаметром от 100 до 700 нм. Внутри он содержит нуклеокапсид со спиральной структурой.
Антигенные свойства
Антигенная структура вируса изучена слабо. Морфологическое сходство с вирусом кори человека дало возможность предположить аналогичность их антигенного состава.
Вирус чумы в иммунобиологическом отношении однороден, в то же время по происхождению и некоторым биологическим особенностям его штаммы разделяют на две подгруппы: классические и вариантные. Классические штаммы высокопатогенны и проявляют строгую видовую специфичность.
Гено- и хемотаксономические характеристики
Вирион имеет разнообразную форму - от сферической до нитевидной с диаметром от 100 до 700 нм. Внутри он содержит нуклеокапсид со спиральной структурой. В его состав входит РНК и 3 вирусных белка из 6 структурных: NP с молекулярной массой 58 кД, Р - с молекулярной массой 66 кД и L-200 кД, причем два последних обладают полимеразной активностью. В состав геномной РНК входит 10-15 тыс. нуклеотидов, организованных в шесть транскрипционных единиц. Геномная однонитевая РНК не является информационной для синтеза белка. Эту функцию выполняет РНК, комплементарная геномной, которая образуется в инфицированной клетке. Нуклеокапсид окружен липопротеидной оболочкой с М-белком с внутренней стороны и Н- и F-белками с наружной. М-мембранный белок гликазилирован. Н- и F-белки вируса чумы плотоядных, как поверхностные, наиболее интересны в патогенетическом и иммуногенном отношениях. Белок Н (hemagglutinin) - молекулярная масса 76 кД, имеет в своем составе 607 аминокислоты. Функционально ответствен за прикрепление (адсорбцию) вируса к клетке-мишени. В его структуре отмечают значительную вариабельность. С этим фактом некоторые авторы связывают тропизм вируса к различным тканям, что впоследствии определяет клинические проявления в виде кожных, респираторных или кишечных патологий. Белок F (fusion-слияние) - мол. м. 62 кД, состоит из двух компонентов, связанных между собой дисульфидной связью.
Методом нуклеотидного секвенирования методом Сенгера определена первичная структура Н-гена (1824 н.о.) (гемагглютинин) штамма «Рокборн» вируса чумы плотоядных {Canine morbillivirus) и определено положение данного штамма на филогенетическом древе вируса.
Представлен сравнительный анализ нуклеотидных последовательностей Н-гена штамма «Рокборн» вируса чумы плотоядных с другими штаммами, в том числе генетических линий Europe-1 /South America-1, South America-2, South America-3, European wildlike, Rockborn-like (RL), America-1, America-2, Asia-1, Asia-2, Asia-3, Asia-4, Arctic, Africa-1, Africa-2 (Фиг. 1).
Филогенетическое дерево выведено с использованием программы MEGA6 и алгоритма Neighbor-Joining. Процент повторяющихся ветвей, в которых связанные таксоны сгруппированы вместе в тесте начальной загрузки (100 повторов), показан рядом с ветвями. Эволюционные расстояния были рассчитаны с использованием метода Maximum Composite Likelihood и выражены в единицах количества замен оснований на сайт. Этот анализ включал 24 нуклеотидных последовательностей, в том числе последовательность Н-гена штамма «Рокборн» вируса чумы плотоядных. Все позиции, содержащие пробелы и отсутствующие данные, были удалены (вариант полного удаления). В окончательном наборе данных было всего 1824 позиции нуклеотидов и 607 аминокислотных остатков. Эволюционный анализ проводился в MEGA 6.
В результате проведенной работы по сравнению полных нуклеотидных последовательностей Н-гена штамма «Рокборн» и других штаммов вируса чумы плотоядных определено положение исследуемого штамма на филогенетическом древе (фиг. 1).
По результатам всего анализа делаем вывод, что исследуемый штамм «Рокборн» относится к генотипу Rockborn-like (RL), что подтверждают данные нуклеотидного и аминокислотного анализа.
Штамм «Рокборн» проявляет генетическую стабильность.
Биотехнологические характеристики
Штамм «Рокборн» вируса чумы плотоядных репродуцируется в перевиваемой культуре почки зеленой мартышки (VERO). Репродукция вируса в культуре клеток VERO сопровождается специфическим цитопатическим действием, вызывающим два типа клеточной дегенерации. Первый тип дегенерации проявляется появлением зернистых клеток, увеличением их рефрактильности и округлением, с последующим отделением от монослоя. Второй тип дегенерации характеризуется образованием многоядерных клеток и симпластов.
При адаптации вируса к перевиваемым клеточным культурам его патогенность утрачивается, а при пассажах в первичных культурах клеток она восстанавливается.
Устойчивость к внешним факторам
Во внешней среде в выделениях больных животных (кал, слизь) вирус сохраняется 7-11 дней, в крови при 4°С до 14 дней, в селезенке до 2 месяцев, в органах павших животных при минус 20°С до 6 месяцев, в носовой слизи до 1-2 месяцев. При минус 10°С вирус сохраняется в течение нескольких месяцев, при минус 76°С - неограниченное время, в лиофилизированном состоянии - более года. При 60°С вирус чумы плотоядных инактивируется за 30 минут, при 100°С - мгновенно. Он чувствителен к эфиру, хлороформу, инактивируется 0,05%-ным раствором формалина при 37°С в течение 4 ч. Сравнительно устойчив при рН 4,5 и выше, частично инактивируется при рН 9,0, оптимальным является рН 7,0.
Дополнительные признаки и свойства
Реактогенность - реактогенными свойствами не обладает.
Патогенность - не патогенен для собак любой породы и возраста.
Вирулентность - авирулентен для естественно-восприимчивых животных при контактном заражении, механическим путем через контаминированные вирусом чумы плотоядных предметы ухода, кормушки, инвентарь, помещения и подстилка, где содержались больные животные, а также при помощи человека и транспортных средств.
Стабильность - сохраняет исходные биологические свойства при пассировании в течение 5 пассажей (срок наблюдения) в перевиваемых культурах клеток почки африканской зеленой мартышки (KK VERO).
Свободен от контаминации бактериями, микоплазмами и посторонними вирусами.
Для получения антигенного материала их штамма «Рокборн» вируса чумы плотоядных в качестве чувствительной биологической системы используют преимущественно перевиваемую культуру клеток почки африканской зеленой мартышки (КК VERO), выращенную в виде монослоя в 1,5 дм3 клинских матрасах. Из клинских матрасов с клеточным монослоем удаляют ростовую среду, далее в разные точки монослоя вносят рабочее разведение вирусного материала и покачивающими движениями, распределяют по монослою клеток, после чего матрасы переносят в СО2 - термостат (или термальную комнату) с температурой (37,0±0,5)°С. После экспозиции в матрасы с инфицированной культурой вносят поддерживающую среду в объеме 300 см3 и вновь их помещают в СО2 - термостат (или термальную комнату) для культивирования вируса.
Инфицированную КК VERO ежедневно просматривают под микроскопом. Через 24-48 ч в инфицированной культуре клеток наблюдают признаки цитопатического эффекта, обусловленного CDV. При охвате инфекционным процессом 70-80% площади клеточного монослоя культивирование прекращают, после чего инфицированную КК VERO замораживают в низкотемпературном холодильнике при температуре минус (45,0±5,0)°С.
Стерильный инфицированный монослой дезагрегируют с рабочей поверхности матрасов, путем его разморозки при комнатной температуре и периодического встряхивания. По окончании интенсивным встряхиванием остатки монослоя удаляют с рабочей поверхности, затем соблюдая условия асептики инфицированную суспензию собирают в общую емкость. Из собранного материала отбирают пробу для контроля контаминации бактериями (в т.ч. микоплазмами) и грибами в соответствии с ГОСТ 28085.
Суспензию клеточного детрита вируса CDV достают из низкотемпературного холодильника в количестве необходимом для получения серии вакцины и размораживают. Таяние материала должно происходить при температуре не выше 25°С. В жидком состоянии антиген должен храниться при температуре не выше 8°С и не более 12 ч. Полученный вируссодержащий материал освобождают от клеточного детрита и других балластных примесей низкоскоростным центрифугированием или любым другим известным способом.
Объем вируссодержащего материала в полуфабрикате должен составлять 80%. От вирусного сырья перед смешиванием отбирают пробу для контроля стерильности, которую высевают на МПА и агар Сабуро.
Далее в бутыль, соблюдая условия стерильности, добавляют компоненты протектора (стабилизирующая среда) в следующей пропорции (от конечного объема):
- 20%-ный раствор гидролизата лактальбумина - 9%;
- 50%-ный раствор сахарозы - 9%;
- 10%-ный раствор желатозы - 2%.
Также полученный полуфабрикат для лиофилизированного компонента вакцины проверяют на стерильность. Фасовку антигена производят с помощью шприца автомат «Socorex» в стерильные флаконы по 1,0 см3.
Перед постановкой лотков с флаконами вакцины в холодильную камеру, устанавливают температурные датчики, для контроля температуры в процессе замораживания и сушки. Началом замораживания считают момент установки лотков в холодильную камеру. Процесс замораживания считают завершенным при достижении температуры в полуфабрикате вакцины не выше минус 50°С, что соответствует длительности замораживания в 24 ч при температуре в холодильной камере не выше минус 50°С.
Далее быстро, в течение 3 мин, лотки перегружают из холодильной камеры в камеру лиофилизатора (установка «USIFROID», Франция). Подключают датчики контроля температуры полуфабриката вирусвакцины, камеру герметизируют и вакуумируют до остаточного давления не более 80-100 мкм рт.ст. и выдерживают в течение 3÷4 ч без подогрева полок.
По истечении указанного времени включают подогрев полок и устанавливают стартовую температуру минус 40°С. В продолжение 26 ч температуру полок постепенно увеличивают до 0°С, далее в течение 11 ч, перейдя на положительный диапазон, температуру полок доводят до (25-27)°С, после чего процесс сушки завершают.
В завершении проводится вторичная сушка (досушивание) в течение 8 ч при давлении в камере не более 100 мкм рт.ст., после чего процесс сушки считают законченным.
Лотки с флаконами высушенного антигена выгружают из камеры сублимационной установки, на флакон надевается алюминиевый колпачок, который затем обкатывается полуавтоматической ручной закаточной машинкой. После завершения процесса обкатки, определяют соответствие внешнего вида флаконов с вакциной, а именно отсутствие трещин и сколов, качество закатки колпачков. На флаконы с сухим компонентом вакцины, наклеивают этикетку.
Для изготовления предлагаемой вакцины используют лиофильно высушенный живой аттенуированный материал из штамма «Рокборн» вируса чумы плотоядных, полученный в культуру клеток VERO с инфекционной активностью не менее 3,58±0,14 lg ТЦД50/см3, в количестве не менее 80,0 об. %.
Исходный вирус для получения штамма «Грей» вируса парвовирусного энтерита собак (CPV-2) получен в ФГБУ «ВНИИЗЖ» в 2005 г. из патологического материала от собаки. Методом предельных разведений был адаптирован к репродукции в перевиваемой культуре клеток почки кошки (КК CrFk) и селезенки кошки (КК FS).
Штамм «Грей» вируса парвовирусного энтерита собак депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №27 - ГКШМ ФГБУ «ВНИИЗЖ».
Штамм «Грей» вируса парвовирусного энтерита собак (CPV-2) характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «Грей» вируса парвовирусного энтерита собак относится к семейству Parvoviridae, роду Protoparvovirus, виду Carnivore protoparvovirus 1. Вирионы безоболочечные кубического типа симметрии, лишены внешней липидной оболочки.
Антигенные свойства
Возбудитель по свойствам близок вирусу панлейкопении кошек и возможно является его мутантной формой. Между ними нет физико-химических различий, однако они отличаются по чувствительности к ним клеточных систем и по гемагглютинирующей активности.
Антигенная активность возбудителя CPV-2 проявляется индуцированием синтеза комплементсвязывающих, вируснейтрализующих и антигемагглютинирующих антител, которые обнаруживаются на 5-7-й день после заражения и сохраняются в организме в течение двух лет.
Штамм «Грей» вируса парвовируса собак гемагглютинирует эритроциты свиньи и кошки при 4°С и рН 5,8-8,2. Однако не все штаммы вируса обладают этим свойством.
Гено- и хемотаксономические характеристики
Диаметр вирионов 18-26 нм. Молекулярная масса колеблется в пределах 5,5*106÷6,2*106 Кд. Икосаэдрический белковый капсид окружает геномную одноцепочечную ДНК, состоящую приблизительно из 5000 оснований, кодирующих 3 или 4 вирусных белка. Зрелые вирионы CPV-2 образованы тремя капсидными белками VP1, VP2, VP3. Капсид состоит из 32 капсомеров диаметром 3-4 нм. Геном представлен односпиральной линейной молекулой ДНК. На концах такая ДНК имеет двуспиральные участки («шпильки»). Значительная часть вирионов содержит минус- и плюс-нить ДНК. Репликация вирусной ДНК и сборка вирионов происходят в ядре клетки с участием полимераз клетки. В вирионах содержатся четыре белка (А, В, С, D). Дополнительно к структурным белками геном вируса кодирует неструктурные белки: NS-1 и, вероятно, NS-2.
При изучении первичной структуры вариабельного фрагмента гена, кодирующего белок VP2 (414 н.о.) штамма «Грей» вируса парвовирусного энтерита собак (CPV-2) методом нуклеотидного секвенирования методом Сенгера определено положение данного штамма на филогенетическом древе вируса (Фиг. 2). Метод основан на определении наиболее вариабельной первичной структуры гена, кодирующего белок VP2, испытуемого штамма с последующим анализом филогенетического родства с другими штаммами вируса парвовирусного энтерита.
На фиг. 2 представлен сравнительный анализ нуклеотидных последовательностей гена, кодирующего белок VP2, штамма «Грей» вируса парвовирусного энтерита (CPV) с другими штаммами, в том числе генотипов CPV-1, CPV-2a, CPV-2b, CPV-2c.
Филогенетическое дерево выведено с использованием программы MEGA6 и алгоритма Neighbor-Joining. Процент повторяющихся ветвей, в которых связанные таксоны сгруппированы вместе в тесте начальной загрузки (100 повторов), показан рядом с ветвями. Эволюционные расстояния были рассчитаны с использованием метода Maximum Composite Likelihood и выражены в единицах количества замен оснований на сайт. Этот анализ включал 13 нуклеотидных последовательностей, в том числе последовательность VP2-гена штамма «Грей» вируса парвовирусного энтерита. Все позиции, содержащие пробелы и отсутствующие данные, были удалены (вариант полного удаления). В окончательном наборе данных было всего 414 позиции нуклеотидов и 138 аминокислотных остатков. Эволюционный анализ проводился в MEGA 6.
По результатам всего анализа делаем вывод, что исследуемый штамм «Грей» относится к генотипу CPV-2b, что подтверждают данные нуклеотидного и аминокислотного анализа.
Штамм «Грей» проявляет генетическую стабильность.
Биотехнологические характеристики
Штамм «Грей» вируса CPV-2 адаптирован к репродукции в перевиваемой культуре клеток «FS», также к перевиваемой культуре клеток «CtFk». Установлено, что CPV-2 размножается во всех культурах клеток кошек, активно репродуцируются в линиях клеток собак. Вирус не вызывает цитопатогенного действия. Обладает гемагглютинирующим действием по отношению к эритроцитам свиньи.
Устойчивость к внешним факторам
Возбудитель устойчив к физико-химическому воздействию. Хорошо переносит высушивание, выдерживает прогревание при 60°С в течение 60 минут и при 80°С - 30 минут, не разрушается при воздействии эфира, хлороформа, спирта и желчи, устойчив в средах с рН 3,0-9,0. Возбудитель CPV-2 инактивируется ультрафиолетовыми лучами, формалином, йодоформом, едким натрием и калием, хлорной известью, гидрохлоридом и хлоридом натрия, производными этеленимина, β-пропиолактоном.
Дополнительные признаки и свойства
Реактогенность - реактогенными свойствами не обладает.
Патогенность - патогенен.
Вирулентность - вирулентен для естественно-восприимчивых животных при контактном заражении, механическим путем через контаминированные вирусом парвовирусного энтерита предметы ухода, кормушки, инвентарь, помещения и подстилка, где содержались больные животные, а также при помощи человека и транспортных средств.
Стабильность - сохраняет исходные биологические свойства при пассировании в течение 5 пассажей (срок наблюдения) в перевиваемых культурах клеток селезенки кошки (КК FS).
Свободен от контаминации бактериями, микоплазмами и посторонними вирусами.
Для получения антигенного материала их штамма «Грей» вируса парвовирусного энтерита собак в качестве чувствительной биологической системы используют перевиваемую культуру клеток селезенки кошки (КК FS), выращенную в виде монослоя в 1,5 дм3 клинских матрасах.
Замороженный рабочий посевной материал размораживают, разбавляют физиологическим раствором, получая рабочего разведения антигена с гемагглютинирующим титром не ниже 8,0±1,0 log2. Перед заражением проводят микроскопию клеточного монослоя, оценивая его состояние и выбраковывая культуру с признаками дегенерации.
Все операции по заражению проводят в асептических условиях. Из клинских матрасов с клеточным монослоем удаляют ростовую среду. Соблюдая условия асептики, при помощи стерильной пипетки в разные точки монослоя вносят рабочее разведение вирусного материала и покачивающими движениями, распределяют по монослою клеток, после чего матрасы переносят в СО2 - термостат (или термальную комнату) с температурой (37,0±0,5)°С. После экспозиции в матрасы с инфицированной КК Fs вносят поддерживающую среду в объеме 300 см3 и вновь их помещают в термостат (или термальную комнату), инкубируют при температуре (37,5±0,5)°С в течение 5 сут.
По истечении 5 сут матрасы замораживают в низкотемпературном холодильнике при температуре минус (45,0±5,0)°С.
Стерильный инфицированный монослой дезагрегируют с рабочей поверхности флаконов путем его разморозки при температуре (20,0±2,0)°С и периодического встряхивания. По окончании разморозки интенсивным встряхиванием остатки монослоя удаляют с рабочей поверхности, затем соблюдая условия асептики инфицированную суспензию собирают в общую емкость. Из собранного материала отбирают пробу в объеме 1,0 см3 с соблюдением условий асептики и антисептики для контроля стерильности и определения гемагглютинирующего титра. Полученный вируссодержащий материал освобождают от клеточного детрита и других балластных примесей низкоскоростным центрифугированием или любым другим известным способом.
Для инактивации штамма «Грей» вируса парвовирусного энтерита собак используют аминоэтилэтиленимин (АЭЭИ), который добавляют в очищенную вируссодержащую суспензию до концентрации 0,1%. Инактивацию вируса проводят при температуре (37,5±0,5)°С в течение 24 ч. В процессе инактивации вируссодержащий материал периодически перемешивают. По окончании инактивации полученный материал помещают в холодильник при температуре (2-8)°С.
Полноту инактивации определяют методом трехкратных последовательных пассажей полученного антигена в перевиваемых культурах клеток. Отсутствие гемагглютинирующего титра свидетельствует об утрате инфекционных свойств вируса парвовирусного энтерита.
Для изготовления сорбированной - жидкой части ассоциированной вакцины «Карникан-4» используют инактивированный очищенный антигенный материал из штамма «Грей» вируса парвовирусного энтерита собак (CPV-2), полученного в перевиваемой культуре клеток селезенки кошки (КК Fs), с гемагглютинирующей активностью не менее 8,33±0,57 log2 в количестве 30,0 об. %
Изолят вируса коронавирусного энтерита собак, послуживший источником для получения штамма «Рич» был выделен из патологического материала, полученного от погибшего беспородного щенка, содержащегося в ВООО Центра животных «Валента» на территории г. Владимир, в 2021 г., путем пассирования выделенного вируса в перевиваемой культуре клеток почки кошки (КК CrFk) методом предельных разведений.
Штамм «Рич» вируса коронавирусного энтерита собак депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ», под регистрационным номером: №376 - деп/22-10 - ГКШМ ФГБУ «ВНИИЗЖ».
Штамм «Рич» вируса коронавирусного энтерита собак (CCoV) характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «Рич» вируса коронавирусного энтерита собак относится к семейству Coronaviridae, роду Alphacoronavirus, виду Alphacoronavirus 1 и обладает морфологическими признаками, характерными для представителей коронавирусов: вирионы сферической формы, нуклеокапсид окружен белковой мембраной и липосодержащей внешней оболочкой, от которой отходят шиловидные отростки.
Антигенные свойства
В антигеном отношении вирус коронавирусного энтерита собак родственен вирусам трансмиссивного гастроэнтерита свиней и коронавирусу кошек [3]. У переболевших животных в сыворотках крови образуются антитела, выявляемые в реакции нейтрализации (РН). Вирус стабильно нейтрализуется гомологичной антисывороткой в РН в культуре клеток CrFk. Инокуляция в организм животного штамма «Рич» вируса коронавирусного энтерита собак сопровождается образованием вируснейтрализующих антител в крови в титре от 2,8 log2 SN50 до 5,1 log2 SN50 у хорьков.
Гено- и хемотаксономическая характеристики
Штамм «Рич» вируса коронавирусного энтерита является РНК-содержащим вирусом и размером около 29,4 kb. Около 2/3 геномной РНК вируса занимают две большие, частично перекрывающиеся открытые рамки считывания (ORF), ORF1a и ORF1b, которые кодируют два полипротеина (репликазные белки), приводящих к образованию вирусной репликазы. ORF 1а и 1ab, кодирующими 16 неструктурных белков, которые генерируют репликазный комплекс. С 3'-конца 1/3 генома (примерно 9000 н.о.) состоит из других ORF, кодирующих структурные и неструктурные белки. Структурные белки включают белки S, Е, М и N, кодируемые ORF2, ORF4, ORF5 и ORF6 соответственно.
Пять основных генов кодируют следующие белки: шипообразный белок (S-белок), мембранный гликопротеин (М-белок), нуклеокапсид (N-белок), белок оболочки (Е-белок) и ORF1ab (большой полипротеин, известный как репликаза / протеаза). М-белок - мембранный белок с тройным охватом, который является наиболее распространенным белком в вирионе. Он играет центральную роль в сборке и морфогенезе вирионов, а также определяет форму вирусной оболочки. Данный белок рассматривается как центральный организатор сборки вирусной частицы, взаимодействующий со всеми другими основными структурными белками коронавируса. Взаимодействия между М-белками являются основной движущей силой формирования оболочки вириона. Кроме того, для полного формирования вириона ему необходимо взаимодействовать с другими структурными белками коронавируса. Взаимодействие спайкового S-белка с М-белком не требуется для процесса сборки. Однако связывание М-протеина с N-белком стабилизирует нуклеокапсид (комплекс N-белок-РНК), а также внутреннее ядро вирионов и, таким образом, способствует завершению сборки вируса.
При генетической идентификации полученного вируса и сравнительного анализа последовательности кДНК использовали обратную транскрипцию и полимеразную цепную реакцию (ОТ-ПЦР). Для идентификации и филогенетического анализа осуществляли секвенирование.
Редактор выравнивания последовательностей BioEdit использовался для анализа необработанных последовательностей. Выравнивания, содержащие полногеномные последовательности, были построены с использованием программы Clustal W. Эволюционная история была выведена с использованием критерия максимального правдоподобия, основанного на 3-параметрической классической модели Tamura. Дерево было нарисовано в масштабе, с длиной ветвей, измеренной в количестве замен на сайт. Эволюционный анализ был проведен в MEGA7. Выравнивание аминокислотных последовательностей проводили с использованием Clustal X. Дендрограмма основана на сравнении полных нуклеотидных последовательностей М-гена кДНК вируса коронавирусного энтерита собак. Штамм «Рич» имеет близкое родство со штаммами «Карат» и №49 (Фиг. 3)
Биотехнологические характеристики.
Штамм «Рич» вируса коронавирусного энтерита собак репродуцируется в перевиваемой культуре клеток почки кошки (CrFk) и в перевиваемой культуре клеток селезенки кошки (Fs), а также в первично-трипсинизированной культуре клеток селезенки котенка (СК). Репродукция вируса в культуре клеток Fs и СК не сопровождается специфическим цитопатическим действием. Репродукция вируса в культуре клеток CrFk сопровождается специфическим цитопатическим действием, приводящим к образованию симпластов и деструкции монослоя через 48-72 ч культивирования. Биологические свойства характеризовали путем определения инфекционной активности вируса каждого пассажа в перевиваемой культуре клеток CrFk. При культивировании вируса штамма «Рич» накапливается в титре не менее 3,0 lg ТЦД50/см3 и сохраняет исходные характеристики при пассировании в чувствительных биологических системах в течение не менее 5 пассажей (срок наблюдения).
Устойчивость к внешним факторам
Вирус не устойчив во внешней среде. На поверхностях при температуре (24±2)°С погибает в течение 48 ч. В кале собак сохраняется не более 2 суток. Относительно стабилен в кислой среде при рН 6,0-6,5. Чувствителен к формальдегиду, глутаровому альдегиду, 70% раствору этилового спирта, четвертичным аммонийным соединениям. Переносит двукратное размораживание и оттаивание.
Дополнительные признаки и свойства:
Реактогенность - реактогенными свойствами не обладает.
Патогенность - низкопатогенен для естественно-восприимчивых животных.
Вирулентность - слабо вирулентен для естественно-восприимчивых животных при внутрибрюшинном заражении. Безвреден для кроликов и белых мышей при внутримышечном и подкожном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения) на перевиваемой культуре клеток CrFk.
Контаминация бактериями, грибами, микоплазмами и посторонними вирусами - штамм «Рич» не контаминирован бактериями, грибами, микоплазмами и посторонними вирусами.
Условия хранения
При хранении штамма в нативном состоянии при температуре минус 70-50°С допустимая длительность хранения без освежения составляет 12 мес, а при хранении в лиофилизированном состоянии при той же температуре - 10 лет.
Для получения антигенного материала из штамма «Рич» вируса коронавирусного энтерита собак используют преимущественно перевиваемую культуру клеток почки кошки (КК CrFk).
Первое проявление ЦПД вируса в культуре клеток CrFk наблюдается через 48 ч культивирования. Через 72 ч культивирования большая часть клеток отслаивалась от субстрата, собиралась в агрегаты разного размера, часть клеток деградировала до детрита. Полученный вируссодержащий материал освобождают от клеточного детрита и других баластных примесей низкоскоростным центрифугированием или любым другим известным способом.
Для инактивации штамма «Рич» вируса коронавирусного энтерита собак используют аминоэтилэтиленимин (АЭЭИ), который добавляют в очищенную вируссодержащую суспензию до концентрации 0,1%. Инактивацию вируса проводят при температуре (37,0±0,5)°С в течение 24 часов при значении рН 7,6-7,8 с периодическим перемешиванием суспензии (каждые 5-6 часов по 3-5 минут). По окончании инактивации полученный материал помещают в холодильник при температуре (4÷8)°С. Полноту инактивации определяют методом трехкратных последовательных пассажей антигена в перевиваемых культурах клеток. Отсутствие ЦПД свидетельствует об утрате инфекционных свойств вируса коронавирусного энтерита.
Для изготовления сорбированной - жидкой части ассоциированной вакцины используют инактивированный очищенный антигенный материал из штамма «Рич» вируса коронавирусного энтерита собак (CCoV), репродуцируемого в перевиваемой культуре клеток почки кошки (КК CrFk), с инфекционной активностью не менее 3,33±0,14 lg ТЦД50/см3, в количестве 30,0 об. %
Вирусный изолят, послуживший источником для получения производственного штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа выделен от собаки и получен из Всероссийской государственной коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве, ФГБУ «ВГНКИ».
Штамм «ВГНКИ» вируса аденовирусной инфекции собак 1-го типа депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ», под регистрационным номером: №29 - ГКШМ ФГБУ «ВНИИЗЖ.
Штамм «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа (CAV-1) относится к семейству Adenoviridae, роду Mastadenovirus, виду Canine mastadenovirus А, 1 серотипа. Данный штамм вызывает инфекционный гепатит у собак. Вирионы имеют кубическую симметрию, округлую или овальную форму. Лишены наружной липопротеидной оболочки и не содержат липидов и гликопротеидов.
Антигенная структура
С помощью хроматографии и электрофореза выделены три различных растворимых антигена, отличающихся по иммунологическим свойствам и связанных с различными морфологическими субъединицами вируса.
1. А-антиген, гексон - групповой, общий для всех серотипов вируса антиген, локализованный в 240 капсомерах капсида, каждый из которых граничит с шестью соседними капсомерами, что определило название антигена (hexon). Антитела против очищенного гексонного антигена нейтрализуют инфекционные свойства только гомологичного серотипа. В то же время эта сыворотка реагирует в реакции связывания комплемента с любыми гетерологичными серотипами, так как в составе гексонного антигена имеются две реактивные группы, одна из которых стимулирует образование группоспецифических, а другая - типоспецифических антител.
2. В-антиген, пентон - токсический антиген, вызывающий округление и скучивание (агрегация) чувствительных клеток однослойной культуры и отделение клеток с поверхности стекла. Локализован в капсомерах, расположенных на вершине двенадцати угловых участков вириона, каждый из которых граничит с пятью соседними капсомерами (pepton). Чувствителен к действию трипсина. Ингибирует активность интерферона и повышает тяжесть ассоциированных респираторных инфекций.
3. С-антиген - нитевой (fiber) антиген, имеет морфологически форму нити с узловым утолщением, прикрепленной к пентонному антигену. Представляет собой типоспецифический антиген, устойчив к действию трипсина, способствует адсорбции аденовирусов на эритроцитах обезьяны или крысы и их агглютинации.
Выделенные в разных странах штаммы вируса инфекционного гепатита собак идентичны по антигенному составу. Штаммы возбудителя могут значительно различаться по степени вирулентности.
Гено- и хемотаксономические характеристики
Вирионы CAV-1, как и все аденовирусы, представляют собой изометрические частицы кубического типа симметрии с диаметром вириона 70-90 нм. На вершинах икосаэдра имеются отростки (фиберы). Капсид содержит 12 структурных белков. Имеется также белок сердцевины, связанный с вирионной ДНК. Нуклеиновая кислота вириона представлена двуспиральной линейной ДНК.
Полный капсид содержит 252 капсомера без суперкапсидной оболочки, каждый из которых составляют 5 - 6 и более мелких субъединиц. Геном представляет собой одну молекулу двухцепочечной ДНК. Вирус имеет 10 структурных белков. Размеры его варьируют от 60 до 120 нм. Структура вириона включает преципитирующий, гемагглютинирующий и комплемент-связывающий антигены. Преципитирующий антиген состоит из двух компонентов. Один связан с инфекционной вирусной частицей, а другой не связан с инфекционностью вируса. Преципитирующий антиген не устойчив к нагреванию: при температуре 56°С разрушается за 30 минут, при 70°С - за 3 - 5 минут.
Гемагглютинирующий антиген обнаружен у всех выделенных эпизоотических штаммов. Он связан с инфекционным компонентом вируса, его удаление методом адсорбции ведет к снижению инфекционности вируса. Формалин, щелочь, фенол, лизол быстро разрушают вирусный гемагглютинин.
Методом нуклеотидного секвенирования методом Сенгера изучена первичная структура fiber gene (421 н.о.) штамма «ВГНКИ» аденовируса собак 1-го серотипа и определено положение данного штамма на филогенетическом древе вируса (Фиг. 4). Метод основан на определении первичной структуры fiber gene испытуемого штамма с последующим анализом филогенетического родства с другими штаммами аденовируса собак.
Филогенетическое дерево выведено с использованием программы MEGA6 и алгоритма Neighbor-Joining. Процент повторяющихся ветвей, в которых связанные таксоны сгруппированы вместе в тесте начальной загрузки (100 повторов), показан рядом с ветвями. Эволюционные расстояния были рассчитаны с использованием метода Maximum Composite Likelihood и выражены в единицах количества замен оснований на сайт. Этот анализ включал 11 нуклеотидных последовательностей, в том числе последовательность fiber gene штамма «ВГНКИ» аденовируса собак 1-го серотипа. Все позиции, содержащие пробелы и отсутствующие данные, были удалены (вариант полного удаления). В окончательном наборе данных было всего 423 позиции нуклеотидов и 141 аминокислотных остатков. Эволюционный анализ проводился в MEGA 6.
При сравнении полных нуклеотидных последовательностей fiber gene штамма «ВГНКИ» и других штаммов аденовируса собак 1-го серотипа определено положение исследуемого штамма на филогенетическом древе (Фиг. 4).
По результатам всего анализа делаем вывод, что исследуемый штамм «ВГНКИ» аденовируса собак относится к генотипу CAV-1, что подтверждают данные нуклеотидного и аминокислотного анализа.
Биотехнологические характеристики.
Штамм адаптирован к репродукции в перевиваемой КК почки собаки MDCK.
Штамм «ВГНКИ» вируса аденовируса собак 1-го серотипа успешно репродуцируется в культуре клеток почки щенков собак, песцов и лисиц, но не размножается в клетках человеческого, обезьяньего и бычьего происхождения.
В культуре клеток цитопатогенное действие CAV-1 характеризуется появлением отдельных округлившихся, рефрактильных клеток, которые постепенно отторгаются от стекла. По мере развития инфекции число клеток, подвергшихся дегенерации, увеличивается и образуются большие пустоты в монослое. По краям сохранившихся островков пораженные клетки концентрируются, образуя большие конгломераты, напоминающие грозди винограда. В культуре клеток через 20-30 часов после заражения образуются характерные внутриядерные включения, которые хорошо обнаруживаются при окраске препаратов или методом иммунофлуоресценции. Число их увеличивается и достигает максимума через 36-40 часов, когда развиваются четко выраженные цитопатические изменения.
Устойчивость к внешним факторам
Возбудитель инфекционного гепатита собак устойчив к физико-химическим факторам. При выделении из секретов, органов и тканей больных животных он сохраняет активность в течение нескольких месяцев. В выделениях больных собак (фекалии, моча, слизь) вирус может сохранять свою жизнеспособность во внешней среде до 1,5 лет. На волосяном покрове собак жизнеспособность возбудителя колеблется в широких пределах в зависимости от температуры окружающего воздуха. При температуре 17°С он инактивируется за 27 дней, при температуре 0-2°С - за 178 дней и при температуре 1-8°С - за 250 дней.
Условия хранения
При хранении штамма в нативном состоянии при температуре минус 70-50°С допустимая длительность хранения без освежения составляет 12 мес, а при хранении в лиофилизированном состоянии при той же температуре - 10 лет.
Для получения антигенного материала из штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа в качестве чувствительной биологической системы используют преимущественно перевиваемую культуру клеток почки собаки (КК MDCK), выращенную в виде монослоя в 1,5 дм3 клинских матрасах.
Из клинских матрасов с клеточным монослоем удаляют ростовую среду. В разные точки монослоя вносят рабочее разведение вирусного материала и покачивающими движениями, распределяют по монослою клеток, после чего матрасы переносят в СО2 - термостат (или термальную комнату) с температурой (37,0±0,5)°С. После экспозиции в матрасы с инфицированной культурой КК MDCK вносят поддерживающую среду (ПСС (питательная среда синтетическая) +2% фетальной сыворотка крови КРС) в объеме 300 см3 и вновь их помещают в СО2 - термостат для культивирования вируса. Инфицированную КК MDCK инкубируют при температуре (37,5±0,5)°С в течение трех суток, ежедневно просматривая ее под микроскопом. Через 36-48 ч в инфицированной культуре клеток наблюдают признаки цитопатического действия (округление клеток и формирование гроздевидных скоплений разной величины), обусловленного вирусом CAV-1. При охвате инфекционным процессом 70-80% площади клеточного монослоя культивирование прекращают, флаконы замораживают в низкотемпературном холодильнике при минус (45±5)°С.
Стерильный инфицированный монослой дезагрегируют с рабочей поверхности матрасов, путем его разморозки при температуре (20±2)°С и периодического встряхивания. По окончании разморозки интенсивным встряхиванием остатки монослоя удаляют с рабочей поверхности, затем соблюдая условия асептики инфицированную суспензию собирают в общую емкость. Из собранного материала отбирают пробу для контроля стерильности и инфекционной активности.
Вируссодержащий материал размораживают, освобождают от клеточного детрита и других балластных примесей низкоскоростным центрифугированием или любым другим известным способом, затем добавляют инактивант АЭЭИ до конечной концентрации 0,1%, и помещают в термостат, где материал инактивируется при температуре (37,5±0,5)°С в течение 24 ч. В процессе инактивации вируссодержащий материал периодически перемешивают. По окончании инактивации полученный материал помещают в холодильник при температуре (4÷8)°С. Полноту инактивации антигена CAV-1 определяют методом трехкратных последовательных пассажей в перевиваемой культуре клеток. Отсутствие ЦПД свидетельствует об утрате инфекционных свойств вируса аденовирусной инфекции.
Для изготовления сорбированной - жидкой части ассоциированной вакцины «Карникан-4» используют инактивированный очищенный антигенный материал из штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа (CAV-1), репродуцируемого в перевиваемой культуре клеток почки собаки (КК MDCK), с инфекционной активностью не менее 3,41±0,14 lg ТЦД50/см3, в количестве 30,0 об. %
Получена ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак - «Карникан-4».
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Приготовление предлагаемой вакцины
Для приготовления ассоциированной вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» использовали штаммы вирусов: штамм «Рокборн», штамм «Грей», штамм «Рич» и штамм «ВГНКИ».
Технологический процесс состоит из следующих технологических этапов:
получение вирусных суспензий из штамма «Рокборн», штамма «Грей», штамма «Рич» и штамма «ВГНКИ»;
определение активности каждой суспензии;
лиофилизация вирусного материала из аттенуированного штамма «Рокборн» отдельно;
инактивация вируссодержащих жидкостей штаммов «Грей», «Рич» и «ВГНКИ» отдельно;
объединение полученных инактивированных суспензий вирусов;
добавления адьюванта к смеси инактивированных вирусов;
расфасовка готового продукта - лиофилизированный аттенуированный антиген штамма «Рокборн» отдельно от смешанных объединенных инактивированных сорбированных компонентов.
Посевной материал, используемый для изготовления вакцины, получали в перевиваемых культурах клеток.
Для изготовления вакцины «Карникан-4» ассоциированной против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак использовали культуральный аттенуированный вирус штамма «Рокборн»; культуральный вирус штамма «Грей»; культуральный вирус штамма «Рич» и культуральный вирус штамма «ВГНКИ», выращенные в 1,5 дм3 матрасах.
Предлагаемая вакцина «Карникан-4» имеет оптимальный компонентный состав, об. %:
- Сухой компонент:
1. Антигенный материал из штамма «Рокборн» вируса чумы плотоядных (CDV), репродуцированный в перевиваемой культуре клеток КК VERO, с инфекционной активностью не менее 3,58±0,14 lg ТЦД50/см3 в количестве 80,0 об. %.
2. Стабилизирующая среда, в количестве 20,0 об. %.
- Жидкий компонент:
3. Антигенный материал из штамма «Грей» вируса парвовирусного энтерита собак (CPV-2), репродуцированный в перевиваемой культуре клеток почки кошки КК Fs, с гемагглютинирующей активностью не менее 8,33±0,57 log2, в количестве 30,0 об. %.
4. Антигенный материал из штамма «Рич» вируса коронавирусного энтерита собак (CCoV), репродуцированный в перевиваемой культуре клеток почки кошки КК CrFk, с инфекционной активностью не менее 3,33±0,14 lg ТЦД50/см3, в количестве 30,0 об. %.
5. Антигенный материал из штамма «ВГНКИ» аденовирусной инфекции собак 1-го серотипа (CAV-1), репродуцированный в перевиваемой культуре клеток почки кошки КК MDCK, с инфекционной активностью не менее 3,41±0,14 lg ТЦД50/см3, в количестве 30,0 об. %.
6. Адьювант 3%-ный гель гидроокиси алюминия в количестве не менее 10,0 об. %.
Содержимое антигенных материалов в предлагаемой вакцине «Карникан-4» в указанных выше концентрациях является их эффективным количеством в препарате, обеспечивающим достижение технического результата от использования изобретения.
Полученная вакцина «Карникан-4» представляет собой:
- лиофилизированная сухая однородная пористая масса светло-бежевого цвета;
- жидкость розового или светло-розового цвета с осадком. При встряхивании легко разбивается в гомогенную взвесь.
Сосуды, в которых отмечали ЦПД вируса чумы плотоядных с поражением 70-80% клеточного монослоя исследовали на стерильность. Отобранные сосуды (V=1,5 дм3) с культурой клеток VERO содержащей вирус штамма «Рокборн», прошедшие контроль на отсутствие контаминации, однократно замораживали и оттаивали при комнатной температуре, при этом клетки вируссодержащей суспензии дезагрегировали, и далее встряхивали суспензию подтаявшего монослоя. По окончании интенсивным встряхиванием остатки монослоя удаляли с рабочей поверхности, затем соблюдая условия асептики инфицированную суспензию собирали в общую емкость. Из собранного материала пробу высевали на бактериальные среды для исключения контаминации микробами, грибами и микоплазмами по ГОСТ 28085 и ГФ XIV, том II, с. 2997-3008 (ОФС.1.7.2.0031.15), после чего отбирали пробы для определения инфекционной активности.
Суспензию клеточного детрита вируса CDV доставали из низкотемпературного холодильника в количестве необходимом для получения серии вакцины и размораживали. Таяние материала проходило при температуре не выше 25°С. В жидком состоянии антиген может храниться при температуре не выше 8°С и не более 12 ч.
Объем вируссодержащего материала в полуфабрикате должен составлять 80%. От вирусного сырья перед смешиванием отбирали пробу для контроля стерильности, которую высевали на МПА и агар Сабуро.
Далее в бутыль, соблюдая условия стерильности, добавляли компоненты стабилизирующей среды в следующей пропорции (от конечного объема):
- 20%-ный раствор гидролизата лактальбумина - 9%;
- 50%-ный раствор сахарозы - 9%;
- 10%-ный раствор желатозы - 2%.
Смешивание компонентов осуществляли, соблюдая условия асептики. От полученного полуфабриката лиофилизированного компонента вакцины производили отбор проб на стерильность. Фасовку антигена со стабилизирующей средой проводили с помощью шпица автомата «Socorex» по 1 см3 во флакон. Кассеты с наполненными флаконами устанавливали на металлические лотки и размещали в холодильную камеру. Перед установкой лотков с вакцинным компонентом в 2 флакона, расположенных в центральной части лотка, установили температурные датчики, для контроля температуры в процессе замораживания и сушки.
Началом замораживания считали установку кассет в холодильную камеру. Процесс замораживания завершили при достижении температуры в полуфабрикате минус 43°С, что соответствовало 11,5 ч замораживания.
Лотки с флаконами установили на полки в камеру лиофилизатора «USIFROID», подключили датчики контроля температуры, камеру герметизировали и вакуумировали до остаточного давления не более 80-100 мкм рт.ст. и выдерживали в течение 3-4 ч без подогрева полок. Далее включили подогрев полок и установили стартовую температуру минус 35°С. В течение 67 ч температуру подняли до 0°С, далее в течение 29 ч - до 25°С. Процесс сушки завершили. На флаконы надели алюминиевым колпачки и закатали ручной закаточной машиной. Наклеили этикетку.
Содержимое сосудов, с инактивированным очищенным антигенным материал из штамма «Грей» вируса парвовирусного энтерита собак (CPV-2), из штамма «Рич» вируса коронавирусного энтерита собак (CCoV) и штамма «ВГНКИ» вируса аденовирусной инфекции собак 1 серотипа (CAV-1) сливали в отдельные емкости и охлаждали при температуре 2-8°С, освобождаясь от клеточного детрита известным способом (низкоскоростное центрифугирование - как описано выше). Освобожденная от детрита суспензия должна иметь вид полупрозрачной жидкости от розового до светло-розового цвета.
Затем из емкостей отбирали пробы для контроля вирусного сырья.
Серия вируса штамма «Рокборн» чумы плотоядных (CDV) должна иметь инфекционную активность не менее 3,0 lg ТЦД50/см3.
Серия вируса штамма «Грей» парвовирусного энтерита собак (CPV-2) должна иметь гемагглютинирующую активность не менее 7,0 log2;
Серия вируса штамма «Рич» коронавирусного энтерита собак (CCoV) должна иметь инфекционную активность не менее 3,0 lg ТЦД50/см3
Серия вируса штамма «ВГНКИ» аденовирусной инфекции собак 1 серотипа (CAV-1) должна иметь инфекционную активность не менее 3,0 lg ТЦД50/см3.
Инактивацию вирусного сырья осуществляли добавлением аминоэтилэтиленимином (АЭЭИ): вносимого в вирусную суспензию штаммов «Грей», «Рич» и «ВГНКИ» 0,1% до конечной концентрации. Затем выдерживали в термостате при температуре (37,5±0,5)°С и экспозиции 24 ч Инактивацию проводили с периодическим перемешиванием (каждые 5-6 часов по 3-5 мин.)
По окончании инактивации антигенный материал каждого штамма охлаждали до температуры 4-8°С и отбирали пробы для определения рН, стерильности и полноты инактивации.
Для нейтрализации АЭЭИ в вирусную суспензию антигенного материала добавляли тиосульфат натрия из расчета 10% к объему использованного АЭЭИ.
Полученный антигенный материал штамма «Грей», штамма «Рич», штамма «ВГНКИ» использовали для изготовления сорбированной формы вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4». Для этого инактивированный антигенный материал тщательно смешивали с 3%-ным гелем гидроокиси алюминия в количественном соотношении 30,0:30,0:30,0:10,0, соответственно.
Вакцину контролировали на стабильность, стерильность и антигенную активность.
Стерильность вакцины определяли в соответствии с ГОСТ 28085-89 «Препараты биологические. Методы биологического контроля стерильности». Сущность метода заключается в определении отсутствия роста бактериальной и грибной микрофлоры в посевах из образцов вакцины на питательные среды.
Контроль лиофилизированной части проводили на остаточную влажность после лиофилизации, контроль биологической активности в культуре клеток, отсутствие контаминации штамма другими вирусами общепринятыми методами. Содержимое флаконов в виде восстановленной суспензии высевали на следующие среды: МПА (мясо-пептонный агар), МПБ (мясо-пептонный бульон), МГШБ (мясо-пептонный печеночный бульон), агар Сабуро (жидкий) и тиогликолевую среду. Для исключения контаминации микоплазмами делали высевы на среду Каган жидкую с 0,3% агара и среду Каган полутвердую с 1,3% агара, проводили 3 пересева с интервалом 4-7 дней. В посевах не наблюдали роста бактериальной, грибной микрофлоры и микоплазм в установленные периоды наблюдений.
Для определения остаточной влажности проводили в соответствии с ГОСТ 24061-89 «Препараты биологические сухие. Метод определения влажности». Для проведения испытания использовали 3 флакона со штаммом «Рокборн» вируса чумы плотоядных. Пробу биопрепарата, растолченную до порошкообразного состояния, ровным слоем вносили в предварительно взвешенную бюксу. Бюксы с пробами и крышками взвешивали и помещали в открытом состоянии в сушильный шкаф. Началом досушивания считали время достижения температуры 105°С, которое продолжается 1 ч. После окончания досушивания бюксы накрывали крышками и переносили в эксикатор для достижения комнатной температуры, после чего взвешивали с точностью до четвертого знака после запятой. Вычисление влажности каждой из проб проводили с точностью до второго десятичного знака. За окончательный результат принимали значение среднего арифметического трех параллельных определений. Массовая доля влаги во флаконе с лиофилизированной вирусной суспензией штамма «Рокборн» чумы плотоядных составила 2,3%, что соответствует требованиям НД (табл. 1).
Контроль инфекционной активности штамма «Рокборн» CDV проводили согласно «Методическим рекомендациям по титрованию вируса чумы плотоядных микрометодом» [33]. Контроль инфекционной активности проводили в перевиваемой культуре клеток VERO путем определения титра биологической активности штамма «Рокборн». Сущность титрования основана на определении цитопатогенного действия (ЦПД) вируса, которое проявлялось в культуре клеток VERO через 96-120 ч. Титром вируса считают последнее его разведение, вызывающее 50% эффект, который рассчитывают по формуле Кербера.
Титр биологической/инфекционной активности штамма «Рокборн» CDV, после лиофилизации составил 3,58±0,14 lg ТЦД50/см3.
Лиофильно высушенную часть вакцины (сухой компонент), содержащей аттенуированный вирус штамма «Рокборн» CDV, контролировали на безвредность и авирулентность на естественно восприимчивых животных (хорьках, белых мышах и щенках) по ГОСТ 31926, которым вводили в повышенной дозе образец штамма.
Для этого использовали хорьков 6-7 месячного возраста в количестве 9 годов, белых мышей массой 18-20 гр в количестве 9 голов, беспородных щенков 2-3 месячного возраста в количестве 6 голов. Каждый вид животных разделили на 3 группы.
Группа №3 - контрольная.
Группе №1 вводили сухой компонент вакцины в 10-кратной дозе - лиофильно высушенный штамм «Рокборн». Содержимое 10 флаконов растворяли в физиологическом растворе до первоначального объема перед лиофилизацией и объединяли. Препарат вводили внутримышечно в область бедра: хорькам и щенкам 10 кратную дозу в прививном объеме 1,0 см3, мышам в прививном объеме 0,2 см3. Период наблюдения за животными составил 21 день. У хорьков, щенков и мышей группы №1 какого-либо угнетенного состояния, а также снижения аппетита или отказа от корма не отмечено. Лиофилизированный препарат из штамма «Рокборн» CDV является безвредным, т.к. в течение срока наблюдения все животные остались живыми и клинически здоровыми.
Контроль гемагглютинирующей активности штамма «Грей» CPV-2 проводили согласно «Методическим рекомендациям по титрованию возбудителя парвовирусного энтерита собак микрометодом» [34]. Сущность метода заключается в способности CPV-2 гемагглютинировать эритроциты свиньи. За титр вируса принимали его наибольшее разведение, вызывающее полную агглютинацию эритроцитов. Гемагглютинирующая активность вируса до инактивации составила 8,33±0,57 log2 в РГА.
Контроль инфекционной активности штамма «Рич» CCoV проводили согласно «Методическим рекомендациям по титрованию вируса коронавирусного энтерита собак микрометодом» [35]. Контроль инфекционной активности проводили в перевиваемой культуре клеток CrFk путем определения титра биологической активности штамма «Рич». Сущность титрования основана на определении цитопатогенного действия (ЦПД) вируса, которое проявлялось в культуре клеток CrFk через 48-72 ч. Титром вируса считают последнее его разведение, вызывающее 50% эффект, который рассчитывают по формуле Кербера. Инфекционная активность вируса до инактивации составила 3,33±0,141g ТЦД50/см3.
Контроль инфекционной активности штамма «ВГНКИ» CAV-1 проводили согласно «Методическим рекомендациям по титрованию вируса аденовироза собак микрометодом» [36]. Контроль инфекционной активности проводили в перевиваемой культуре клеток MDCK путем определения титра биологической активности штамма «ВГНКИ». Сущность титрования основана на определении цитопатогенного действия (ЦПД) вируса, которое проявлялось в культуре клеток MDCK через 96-120 ч. Титром вируса считают последнее его разведение, вызывающее 50% эффект, который рассчитывают по формуле Кербера. Инфекционная активность вируса до инактивации составила 3,41±0,14 lg ТЦД50/см3.
Жидкую часть вакцины контролировали на полноту инактивации (авирулентность), безвредность и фасовали в стерильные флаконы.
Полноту инактивации препарата определяли общеизвестным способом, аналогично определению безвредности.
Безвредность и реактогенность сорбированной жидкой части вакцины изучали на группе №2 хорьков, щенков и мышей, которым вводили двукратный прививной объем. Период наблюдения за животными составил 21 день. В группе №2 угнетенного состояния, снижения аппетита или отказа от корма не наблюдалось. Лишь у одной мыши на 3 день наблюдалось образование незначительной припухлости диаметром до 0,2 см на месте инъекции, которое исчезло на 7 сутки.
По результатам проверки безвредности животные оставались живыми в течение всего срока наблюдения. Известно, что местные и общие реакции, зависящие от токсического действия вакцины, наиболее выражены после первого введения препарата, в то время как аллергические свойства проявляются при повторной вакцинации. Реактогенность на аллергические свойства сорбированной жидкой части вакцины изучали на группе №2, методом введения второй дозы вакцины, через 21 день после первой иммунизации. Наблюдение за животными в течение 10 дней не выявило каких-либо отклонений со стороны общего состояния организма животных, что говорит о безвредности и ареактогенности жидкой части вакцины.
Жидкий компонент вакцины должен быть стерильным, авирулентным и безвредным.
Безвредность и ареактогенность ассоциированной вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» проверяли на 20 белых мышах массой 18-20 гр. Содержимое пяти флаконов с сухим компонентом объединяли с содержимым пяти флаконов с жидким компонентом вакцины, перемешивали, получали среднюю пробу и вводили 6 белым мышам внутримышечно по 0,6 см3 (3-кратная прививная доза) в область бедра. В область бедра внутримышечно по 0,6 см3 вводили 2 белым мышам жидкий компонент и 2 белым мышам сухой компонент (растворенный раствором для инъекций, до первоначального объема). Оставшиеся 10 белых мышей были контрольными. За животными наблюдали в течение 10 суток. В течение всего срока наблюдения все животные остались живы, отклонений от физиологической нормы не наблюдали. В месте введения вакцины изменений некротического характера зарегистрировано не было. Отсутствие падежа после вакцинации дополнительно свидетельствовало об отсутствии остаточной вирулентности компонентов вакцины.
В течение всего времени наблюдения за животными, не было зарегистрировано признаков ответной местной тканевой реакции на введение как сухого, так и жидкого компонентов вакцины, заболевания или гибели животных. Температура тела животных оставалась в пределах физиологической нормы.
Пример 2. Антигенная активность и стабильность ассоциированной вакцины «Карникан-4»
Антигенную активность вакцины оценивали по результатам вакцинации кроликов образцами, полученными после определенного интервала хранения препарата (3 мес, 6 мес, 9 мес и 12 мес). Для этого использовали кроликов 45-дневного возраста с массой тела 1,0-1,5 кг в количестве 42 головы (по 6 голов на каждое установленное на заданных интервалах времени хранения вакцины). Не вакцинированные 2 кролика составляли группу контроля.
Каждые 3 месяца вновь создаваемой группе кроликов состоявшей из 6 голов вводили вакцину в объеме 1,0 см3, внутримышечно однократно, которая хранилась 3 мес, 6 мес, 9 мес и 12 мес. У всех кроликов отбирали пробы крови до иммунизации и через 21 день после иммунизации для выявления в РТГА антител к вирусу CPV-2, в РМН антител к вирусам CDV, CCoV, CAV-1 (табл. 3). Вакцина введенная однократно внутримышечно должна вызывать у животных не менее чем 2-кратный прирост антител к вирусу чумы плотоядных, аденовирусу, парвовирусу и коронавирусу собак по отношению к титрам антител до вакцинации. У контрольной группы антител не должно быть.
Стабильность вакцины исследовали на протяжении 12 месяцев хранения при температуре от 2°С до 8°С с периодичностью осмотра и проведения исследований каждые 3 месяца (табл. 2). Наличие вакуума во флаконах с вакциной проводили по ГОСТ 28083 при помощи аппарата Д'Арсонваль. Все подготовленные пробы обоих компонентов вакцины исследовали на стерильность по ГОСТ 28085-89. Проверку на отсутствие контаминации микоплазмами проводили в соответствии с требованиями ГФ XIV том 2, ОФС 1.7.2.0031.15.
Как представлено в таблице 1, 2 и 3 на всех зачетных интервалах времени при хранении вакцины при температуре от 2°С до 8°С не обнаружили изменений показателей качества препарата: внешний вид, наличие посторонних примеси, наличие вакуума, массовой доли влаги, растворимость, биологическая активность вируса чумы плотоядных для сухого компонента; стерильность; полнота инактивации; безвредность и реактогенность; антигенная активность для жидкого компонента.
Инфекционная активность вируса чумы плотоядных в сухом компоненте вакцины не ниже 10,03,0 ТЦД50/см3. Все кролики, вакцинированные образцами вакцины как на момент закладки на хранение, так и образцами после 3, 6, 9 и 12 месяцев хранения при температуре от 2°С до 8°С, через указанный период были иммунны. Титр антител у животных превышал 2-х кратный прирост антител к вирусам чумы, парвовирусному и коронавирусному энтериту, аденовирусной инфекции собак, что указывает на стабильность вакцины в течение 12 месяцев.
Пример 3. Применение предлагаемой ассоциированной вакцины «Карникан-4» для иммунизации собак.
Предлагаемая вакцина состоит из 2 компонентов:
- сухой компонент - лиофилизат для приготовления суспензии для инъекций (изготовлена из перевиваемой культуры клеток почки африканской зеленой мартышки VERO, инфицированной аттенуированным вирусом «Рокборн» чумы плотоядных (80%), с добавлением стабилизирующих компонентов (% по сухому веществу): гидролизата лактальбумина (9%), сахарозы (9%) и желатозы (2%));
- жидкий компонент - смесь антигенов, полученных в перевиваемых культурах клеток CrFk, Fs и MDCK, инфицированных вирусом парвовирусного энтерита собак штамма «Грей», коронавирусного энтерита собак штамма «Рич», аденовирусной инфекции штамма «ВГНКИ» 1 серотипа (90%), и инактивированных аминоэтилэтиленимином (АЭЭИ), с добавлением в качестве адьюванта 3%-ного геля гидроокиси алюминия (10%).
По внешнему виду сухой компонент представляет собой однородную пористую массу бежевого цвета, полностью растворяющуюся в жидком компоненте вакцины в течение 1 минуты без образования хлопьев. Жидкий компонент представляет собой однородную суспензию розового или светло-розового цвета с осадком, легко разбивающегося в равномерную взвесь при взбалтывании (табл. 1).
Во флакон с сухим компонентом вакцины, содержащий 1 прививную дозу вакцины, соблюдая правила асептики, при помощи шприца вносили 1,0 см3 жидкого компонента и тщательно встряхивали.
Вакцину вводили щенкам двукратно с интервалом в 21 сутки внутримышечно в дозе 1,0 см3 в область средней трети бедра с соблюдением правил асептики.
Вакцина вызывает формирование иммунного ответа у собак к чуме плотоядных, парвовирусному и коронавирусному энтеритам, аденовирусной инфекции 1 серотипа через 14 сутки после двукратного введения, продолжительностью иммунитета против чумы, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции 1 серотипа не менее 12 месяцев.
Пример 3. Эффективность вакцинации предлагаемой вакциной
Эффективность вакцины ассоциированной против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4», изготовленной так, как описано в примере 1, представлена в таблицах 4-6.
Испытание иммуногенной активности полученного препарата проводили на 15 щенках 2-3 месячного возраста не вакцинированных от чумы плотоядных (CDV), парвовирусного (CPV-2) и коронавирусного энтеритов (CCoV), аденовирусной инфекции (CAV-1), а 3 щенков оставили не вакцинированными в качестве контроля.
Всех 15 щенков разделили на 3 группы по 5 голов в каждой. На каждой группе испытывали различные схемы применения предлагаемого изобретения.
Щенков группы №1 вакцинировали дважды. Вакцину (предлагаемое изобретение) вводили внутримышечно двукратно с интервалом в 21 сутки в объеме 1,0 см3.
Щенков группы №2 вакцинировали дважды с интервалом в 21 сутки. В 12 месячном возрасте щенкам провели ревакцинацию. Каждый раз вакцину (предлагаемое изобретение) вводили внутримышечно в объеме 1,0 см3.
Щенкам группы №3 вакцину вводили внутримышечно однократно в объеме 1,0 см3.
Схемы отбора проб крови от животных для серологических исследований и результаты исследований титров антител по каждому компоненту вакцины представлены в таблицах 4-6. Сыворотки крови животных исследовали в РТГА на присутствие антител к вирусу CPV-2 и в РМН на присутствие антител к вирусам CDV, CCoV и CAV-1. Величину титра антител считали оценкой напряженности поствакцинального иммунитета против данных вирусов. РМН и РТГА ставили по общепринятым методикам.
После вакцинации вакциной против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» на антигены, входящие в состав препарата, иммунная система животных активно реагировала. У животных всех групп наблюдали напряженный иммунный ответ на CDV, CCoV, CPV-2 и CAV-1 на протяжении всего срока наблюдения. Однако у щенков группы №3 через 6 месяцев наблюдалось снижения уровня антител к вирусам CDV, CPV-2, CCoV и CAV-1.
При этом пробы сыворотки отобранные до вакцинации показали, что специфические антитела в отношении CDV, CCoV и CAV-1 были <1,0 log2 в РМН, а в отношении CPV-2 не превышали в среднем 4,40 log2 в РТГА.
Уже первое введение вакцины позволило защитить щенков от CDV, все животные имели уровень вируснейтрализующих антител к вирусу CDV от 4-7 log2 (1:16-1:128) средний геометрический 7,5 log2, с увеличением до 8-10 log2 (1:256-1:1024) средний геометрический 9,15 log2 после второй вакцинации. Титр вируснейтрализующих антител к вирусу CAV-1 после первого введения вакцины был 3-5 log2 (1:8-1:32) средний геометрический 4,40 log2, после второй вакцинации увеличился до 5-7 log2 (1:32-1:128) средний геометрический 6,10 log2. Средний геометрический титр вируснейтрализующих антител к вирусу CCoV составил 3,20 log2 и 6,10 log2 после первой и второй вакцинации соответственно (1:8-1:128). После первой вакцинации уровень специфических антител к CPV-2, выявляемый в РТГА повысился до 7,20-10,20 log2 (1:640-1:5120), после второй вакцинации привело к дальнейшему увеличению у части животных до 11,0 log2 (>1:5120).
После ревакцинации животных вакциной «Карникан-4» группы №2 в возрасте 12 месяцев был установлен прирост антител к вирусам CDV, CPV-2, CCoV и CAV-1. При тестировании образцов сывороток крови, отобранных от вакцинированных щенков, все пробы были положительными, данные величины статистически тождественны (р=0,05).
Данные таблицы 5 свидетельствуют о том, что титры антител против CDV, CPV-2, CCoV и CAV-1 собак после ревакцинации значительно увеличились по сравнению с исходными показателями, превышали требуемые минимальные титры ко всем антигенным компонентам вакцины, и сохранялись на высоком уровне к 21 дню наблюдения. Титры антител ко всем антигенным компонентам в контрольной группе оставались примерно на одном уровне в течение всего срока наблюдения.
Величина защитного титра антител в работах различных авторов в связи с использованием разных методов оценки отличается и колеблется в пределах: 1:4-1:16 для вируса CDV (РМН), 1:2-1:8 для вируса CAV-1 (РМН), 1:80 для вируса CPV-2 (РТГА). При защите от возбудителя CCoV ведущая роль принадлежит секреторным иммуноглобулинам слизистых. Наличие гуморальных антител к вирусу не всегда коррелирует с защитой при контрольном заражении, однако, сероконверсия после вакцинации свидетельствует о системном иммунном ответе на вакцинацию, что в свою очередь позволит избежать клинических признаков заболевания коронавирусным энтеритом собак и значительно сократит время выделения вируса CCoV с фекалиями у таких животных.
Как представлено в таблицах 4-6, даже при однократном введении вакцины в прививной дозе уровень антител находится в пределах 2 кратного прироста антител по сравнению с не иммунными животными.
Таким образом, ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» (предлагаемое изобретение) формирует у иммунизированных животных стойкий иммунный ответ против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак 1 серотипа продолжительностью не менее 12 месяцев при введении препарата двукратно с интервалом 21 день и ревакцинацией животных в 12 месячном возрасте.
Данные свидетельствует о том, что полученная вакцина обладает высокой антигенной активностью и вызывает у щенков формирование высоких титров антител к вирусу чумы плотоядных штамма «Рокборн», причем прирост титров антител был постоянным в течение всего срока наблюдений и достигал максимального значения 9,45±0,44 log2 через 21 день после ревакцинации.
Данные свидетельствует о том, что ассоциированная вакцина индуцирует у привитых щенков образование высоких уровней антител к вирусу парвовирусного энтерита штамма «Грей». Максимальный уровень титров антител наблюдали через 21 день после ревакцинации составил 11,20±0,84 log2.
Данные свидетельствует о том, что ассоциированная вакцина индуцирует у привитых щенков образование высоких уровней антител к вирусу коронавирусного энтерита штамма «Рич». Максимальный уровень титров антител наблюдали через 21 день после ревакцинации составил 6,20±0,37 log2.
Данные свидетельствует о том, что ассоциированная вакцина индуцирует у привитых щенков образование высоких уровней антител к вирусу аденовирусной инфекции (инфекционному гепатиту) штамма «ВГНКИ». Максимальный уровень титров антител наблюдали через 21 день после ревакцинации составил 6,90±0,45 log2.
Ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» (предлагаемое изобретение) обладает высокой иммуногенной и антигенной активностью в отношении всех 4 антигенных компонентов и безвредна для собак.
Пример 4. Определение антигенной активности вируса чумы плотоядных CDV.
Готовили вакцину против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак путем смешивания лиофилизированного и жидкого компонентов, в соотношении 1:1. Вводили трем хорькам по 1,0 см3 (одна прививная доза) внутримышечно в область бедра. Контрольную группу из трех хорьков оставляли не привитыми и содержали отдельно. За животными вели клиническое наблюдение в течение 21 суток, после чего отбирали индивидуальные пробы крови для определения титров сывороточных антител в РМН к вирусу CDV. Пробы сывороток от вакцинированных и не иммунных (контрольная) групп хорьков исследовали методом РМН. Реакцию микронейтрализации ставили по общепринятой методики на микроплашках в культуре клеток VERO.
Вакцину считаются антигенно активной, если через 21 день после вакцинации титр антител к вирусу CDV составляет не ниже 4-7 log2 (1:16-1:128), средний геометрический 7,5 log2 в РМН.
Пример 5. Определение антигенной активности вируса парвовирусного энтерита собак.
Готовили вакцину против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак путем смешивания лиофилизированного и жидкого компонентов, в соотношении 1:1. Вводили трем хорькам по 1,0 см3 (одна прививная доза) внутримышечно в область бедра. Контрольную группу из трех хорьков оставляли не привитыми и содержали отдельно. За животными вели клиническое наблюдение в течение 21 суток, после чего отбирали индивидуальные пробы крови для определения титров сывороточных антител в РТГА к вирусу CPV-2. Пробы сывороток от вакцинированных и не иммунных (контрольная) групп хорьков исследовали методом РТГА. Реакцию гемагглютинации ставили по общепринятой методики на микроплашках с 0,8% суспензией эритроцитов свиньи.
Вакцину считаются антигенно активной, если через 21 день после вакцинации уровень специфических антител к вирусу CPV-2, выявляемый в РТГА повышался до 7,20-10,20 log2 (1:640-1:5120).
Пример 6. Определение антигенной активности вируса коронавирусного энтерита собак
Готовили вакцину против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак путем смешивания лиофилизированного и жидкого компонентов, в соотношении 1:1. Вводили трем хорькам по 1,0 см3 (одна прививная доза) внутримышечно в область бедра. Контрольную группу из трех хорьков оставляли не привитыми и содержали отдельно. За животными вели клиническое наблюдение в течение 21 суток, после чего отбирали индивидуальные пробы крови для определения титров сывороточных антител в РМН к вирусу CCoV. Пробы сывороток от вакцинированных и не иммунных (контрольная) групп хорьков исследовали методом РМН. Реакцию микронейтрализации ставили по общепринятой методики на микроплашках в культуре клеток CrFk.
Вакцину считаются антигенно активной, если через 21 день после вакцинации титр антител к вирусу CCoV составляет не ниже 3-5 log2 (1:8-1:32), средний геометрический 4,20 log2 в РМН.
Пример 7. Определение антигенной активности вируса аденовирусной инфекции (инфекционного гепатита) 1 серотипа собак
Готовили вакцину против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак путем смешивания лиофилизированного и жидкого компонентов, в соотношении 1:1. Вводили трем хорькам по 1,0 см3 (одна прививная доза) внутримышечно в область бедра. Контрольную группу из трех хорьков оставляли не привитыми и содержали отдельно. За животными вели клиническое наблюдение в течение 21 суток, после чего отбирали индивидуальные пробы крови для определения титров сывороточных антител в РМН к вирусу CAV-1. Пробы сывороток от вакцинированных и не иммунных (контрольная) групп хорьков исследовали методом РМН. Реакцию микронейтрализации ставили по общепринятой методики на микроплашках в культуре клеток MDCK.
Вакцину считаются антигенно активной, если через 21 день после вакцинации титр антител к вирусу CAV-1 составляет не ниже 3-5 log2 (1:8-1:32), средний геометрический 4,40 log2 в РМН.
Пример 8. Контроль иммуногенности предлагаемой вакцины по компоненту CAV-1.
Проводили на беспородных щенках 2-3 месячного возраста в количестве 8 голов не иммунных к вирусам чумы плотоядных CDV, парвовирусного CPV-2 и коронавирусного энтеритов CCoV, аденовирусной инфекции собак CAV-1.
Щенков содержали в отдельных изоляторах. Животные псевдослучайным образом были разделены на 2 группы по 4 головы. Группе №1 препарат вводили внутримышечно однократно в область бедра в прививной дозе (1 см3). Для этого, непосредственно перед инъекцией, сухой компонент вакцины смешивали с жидким компонентом, в соотношении 1:1. Контрольная группа состоящая из 4 голов, содержалась изолированно и оставалась интактной.
Перед вакцинацией и после 21 суток от всех животных производили отбор проб крови для получения сывороток для исследования в РМН и РТГА по общим принятым методикам на наличие специфических антител к вирусам чумы плотоядных CDV, парвовирусного CPV-2 и коронавирусного энтеритов CCoV, аденовирусной инфекции собак CAV-1. Результаты исследований представлены в таблице 7.
Вакцинированных и контрольных животных заражали в дозе 2,0 lg LD50/см3 в переднюю камеру глаза через 21 день после однократной вакцинации. Для количественной характеристики иммунитета у животных, вакцинированных вакциной, были исследованы сыворотки крови до вакцинации, через 21 день после вакцинации и через 21 день после заражения (табл. 7).
Вакцину считали иммуногенно активной в случае, если у всех животных из контрольной группы наблюдался аваскулезный кератит, в то время как заболевания животных в вакцинированной группе не наблюдалось.
Как представлено в таблице 7, после иммунизации предлагаемой вакциной на антигены, входящие в состав препарата, иммунная система животных активно реагировала. Через 21 сутки после введения вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Кариникан-4» у животных опытной группы №1 наблюдали напряженный гуморальный иммунный ответ на CDV, CCoV, CPV-2 и CAV-1. Среднегрупповые оценки титров антител по данным РМН: к CDV были 7,16±0,52 log2, к CCoV 4,43±0,12 log2, к CAV-1 4,56±0,12 log2, по данным РТГА к CPV-2 7,50±0,57 log2. При этом пробы сыворотки отобранные до вакцинации показали, что специфические антитела в отношении CDV, CCoV и CAV-1 были <1,0 log2 в РМН, а в отношении CPV-2 не превышали 3,25+0,5 log2 в РТГА.
Показано, что после заражения вирулентным штаммом «ВГНКИ» вируса CAV-1 вакцинированные животные были защищены. У всех животных из контрольной группы наблюдался аваскулезный кератит, в то время как заболевания в опытной вакцинированной группе отмечено не было. Сделали вывод, что вакцина Карникан-4 (предлагаемое изобретение) в отношении вируса CAV-1 является иммуногенной.
По результатам можно сделать вывод, что сухой и жидкий компоненты вакцины не препятствуют формированию иммунного ответа на возбудителей чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак. После введения вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4» вырабатывается напряженный иммунитет, способный обеспечить надежную защиту против указанных возбудителей. На этом основании считаем, что компоненты вакцины против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак совместимы между собой.
Таким образом, ассоциированная вакцина против CDV, CPV-2, CCoV и CAV-1 собак обладает высокой иммуногенной и антигенной активностью в отношении всех 4 антигенных компонентов и безвредна для собак.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак «Карникан-4»:
1. Вирусные болезни животных / В.Н. Сюрин, А.Я. Самуйленко, Б.В. Соловьев, Н.В. Фомина // Вирусные болезни животных. - М.: ВНИТИБП, 1998. - 928 с.
2. Decaro N. et al. Fecal immunoglobulin A antibodies in dogs infected or vaccinated with canine coronavirus. Clin. Diagn. Lab. Immunol. 2004; 11:102-105.
3. Greene C.E. et al. Canine viral enteritis // In: Infectious diseases of the dog and cat, 4th ed., Elsevier, 2012; p. 67-80.
4. Pratelli A. et al. Safety and efficacy of a modified-live canine coronavirus vaccine in dogs. Vet. Microbiol. 2004; 99, 43-49.
5. Сулимов, A.A. Вирусные болезни собак / A.A. Сулимов, В.И. Уласов. М.: КолосС, 2006. - 110 с.
6. Abdelmagid O.Y. et al. Evaluation of the efficacy and duration of immunity of a canine combination vaccine against virulent parvovirus, infectious canine hepatitis virus and distemper virus experimental challenges. Veterinary Therapeutics. 2004; 5, 173-186.
7. Мороз, H.B. Разработка и усовершенствование контроля ассоциированных вакцин против болезней плотоядных / Н.В. Мороз // Актуальные проблемы науки в АПК: Мат.научно-практ.конф. - Кострома, 2003. С. 102-103.
8. Белоусова Р.В., Троценко Н.И., Преображенская Э.А. Практикум по ветеринарной вирусологии. Москва, 2006
9. Инфекционные болезни мелких домашних животных // А.А. Шевченко, Д.Ю. Зеркалев, Л.В. Шевченко, О.Ю. Черных, Е.А. Горпинченко // Учебное пособие: Краснодарский ЦНТИ-филиал ФГБУ "РЭА" Минэнерго России (Краснодар), 2018.
10. Сафонов Г.А. и др. Групповой способ вакцинации пушных зверей против чумы плотоядных. В кн.: Актуальные вопросы ветеринарной вирусологии. - Владимир, 1976, Ч. 2. С. 82-83.
11. М.П. Чумаков и др. - Свидетельство на изобретение СССР №527072, 28.10.1977 г.
12. В.М. Дорофеев и др. - патент РФ №2067002, от 06.09.1994 г.
13. Справочник по инфекционным болезням собак и кошек / Гаскелл Розалинд М., Беннет Малькольм // Практика ветеринарного врача - М.: Аквариум-Принт. - 2009.
14. Болезни собак / Практич. руководство для ветеринарных врачей // Ниманд Х.Г., Сутер П.Ф. - М.: Аквариум. - 1998.
15. Диагностика и профилактика инфекционных болезней кошек и собак: Руководство для практикующих ветеринарных врачей под редакцией Т.И. Алипера. - Москва, 2017; 207-212.
16. Schultz R. D. et al. Age and Long-term Protective Immunity in Dogs and Cats. J. Сотр. Path. 2010; 142:102-108.
17. Иммунобиологические свойства возбудителей парвовирусного энтерита и чумы плотоядных, используемых для изготовления биопрепаратов. Автореферат диссертации, Галкина Т.С., 2008 г.
18. New approaches for the molecular characterization of canine parvovirus type 2 strains / N. Decaro, G. Elia, M. Campolo et al. // J. Vet. Med. B. - 2005. Vol. 52. - P. 316-319.
19. Сюрин, B.H. Частная ветеринарная вирусология / B.H. Сюрин, Н.В. Фомина, Р.В. Белоусова. М.: Колос, 1984. - 472 с.
20. Львов Д.К. Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. Медицинское информационное агентство. Москва, 2013.
21. Патент RU №2030917, от 20.03.1995 г.
22. Диагностика и профилактика коронавирусного энтерита собак / Ольшанская А.А. // Ветеринарная патология. - 1997 г.
23. Биологические свойства и диагностика коронавирусного энтерита собак / Ольшанская А.А. // Автореферат диссертации. - 1997.
24. Rubarth, S (1947). An acute virus disease with liver lesions in dogs (heptatitis contagiosa canis). // Acta Path Microbiol Scand, Supplement 67.
25. Gillespie, A Study of Inactivated Distemper Virus in the Dog // Veterinary Virus Research Institute, 1964, pp. 3-8.
26. Патент RU №2154496, от 20.08.2000.
27. Патент RU №2045960, от 20.10.1995 г.
28. Патент RU №2150296, от 10.06.2000 г.
29. Патент RU №2546247, от 10.04.2015 г.
30. Патент RU №2400248, от 27.09.2010 г.
31. ТУ - 10-09-98-91 - https://www.tenderguru.ru/standart/tu-10-09-98-91?ysclid=18x0pokhe8385403360
32. Инструкция по применению вакцины Мультикан-4 против чумы, аденовирусных инфекций, парвовирусного и коронавирусного энтеритов собак - https://veterinarka.ru/vetmedicaments/multikan-4.html?ysclid=lakrvfkntt726926820
33. Методические рекомендации по титрованию вируса чумы плотоядных микрометодом / А.М. Киселев, А.А. Комарова, Т.С. Галкина, А.А. Климова; ФГБУ «ВНИИЗЖ». - Владимир: 2022 - 10 с.
34. «Методическим рекомендациям по титрованию возбудителя парвовирусного энтерита собак микрометодом» / А.А. Климова, А.А. Комарова, A.M. Киселев, Т.С. Галкина; ФГБУ «ВНИИЗЖ». - Владимир: 2022 - 9 с.
35. «Методическим рекомендациям по титрованию вируса аденовироза собак микрометодом» / А.А. Климова, А.А. Комарова, A.M. Киселев, Т.С. Галкина; ФГБУ «ВНИИЗЖ». - Владимир: 2022 - 10 с.
36. Методическим рекомендациям по титрованию вируса коронавирусного энтерита собак микрометодом» / А.А. Комарова, Т.С. Галкина, A.M. Киселев, А.А. Климова; ФГБУ «ВНИИЗЖ». - Владимир: 2022 - 10 с.
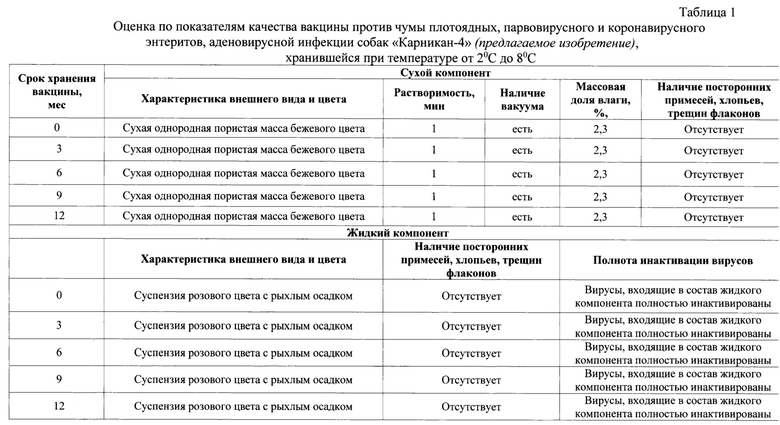
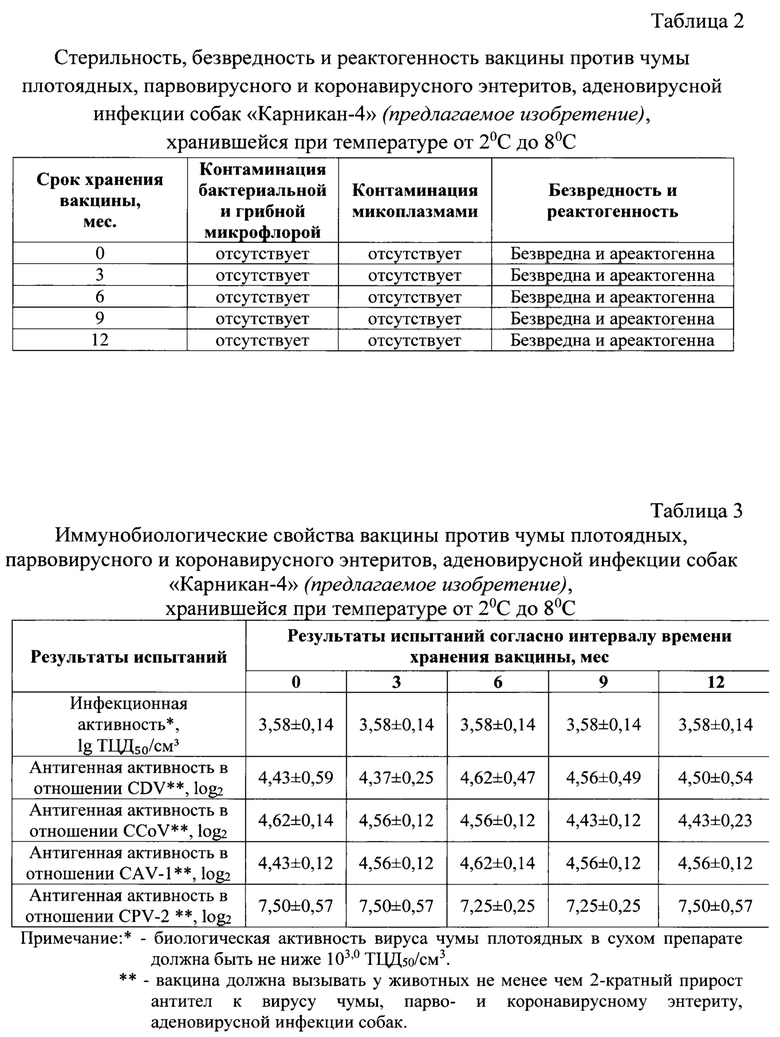
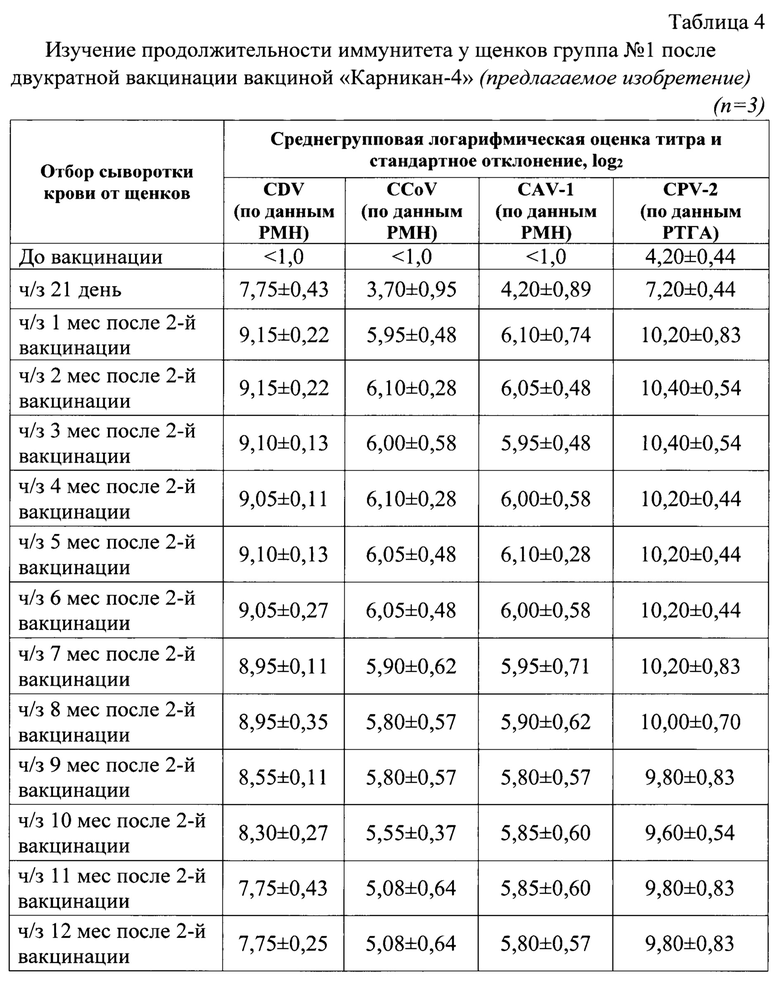
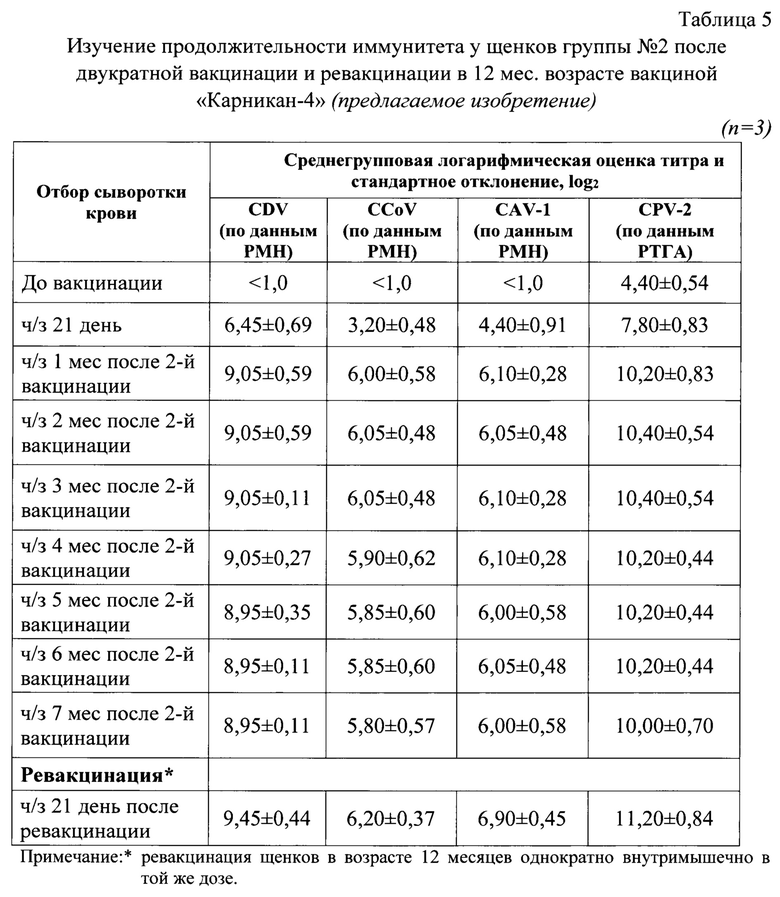
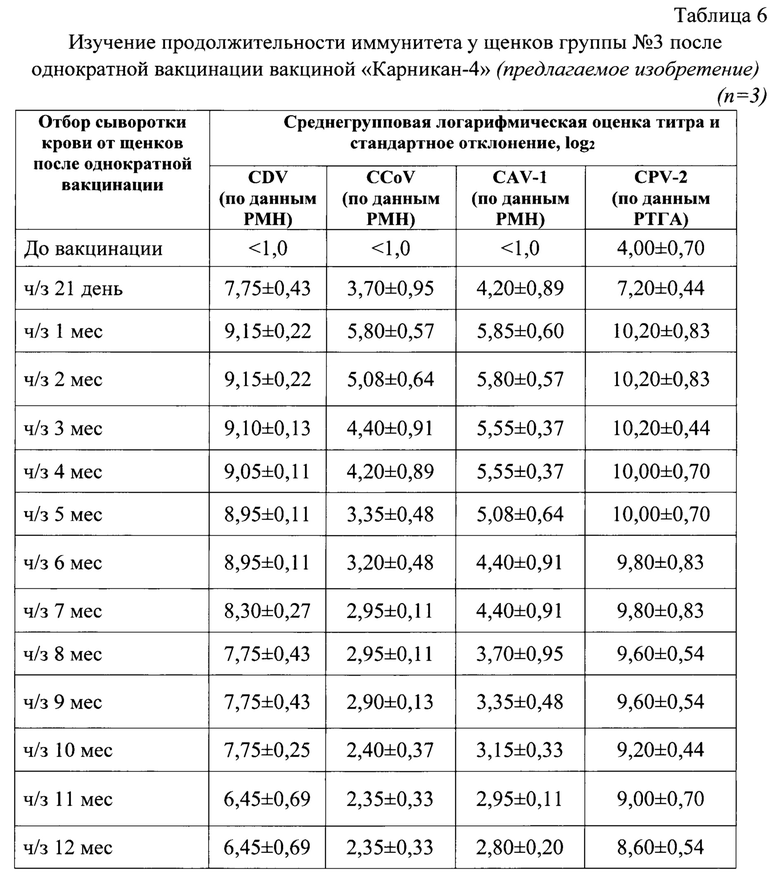
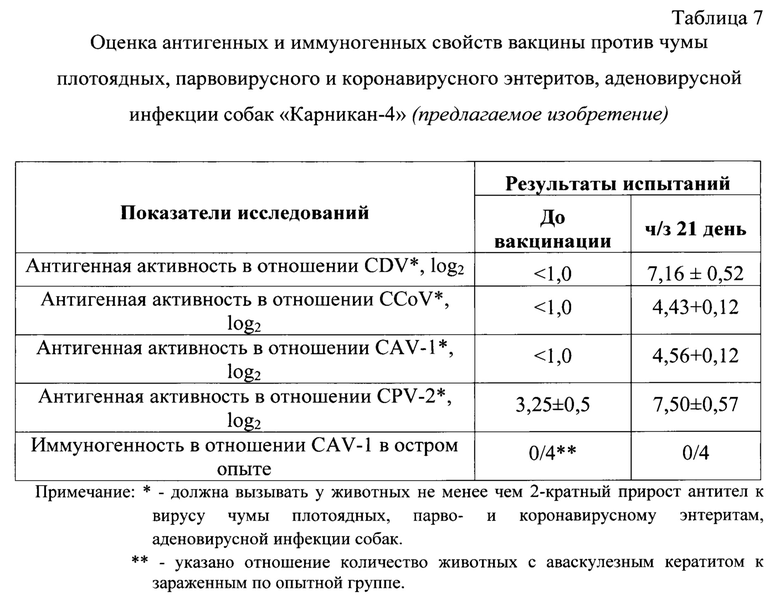
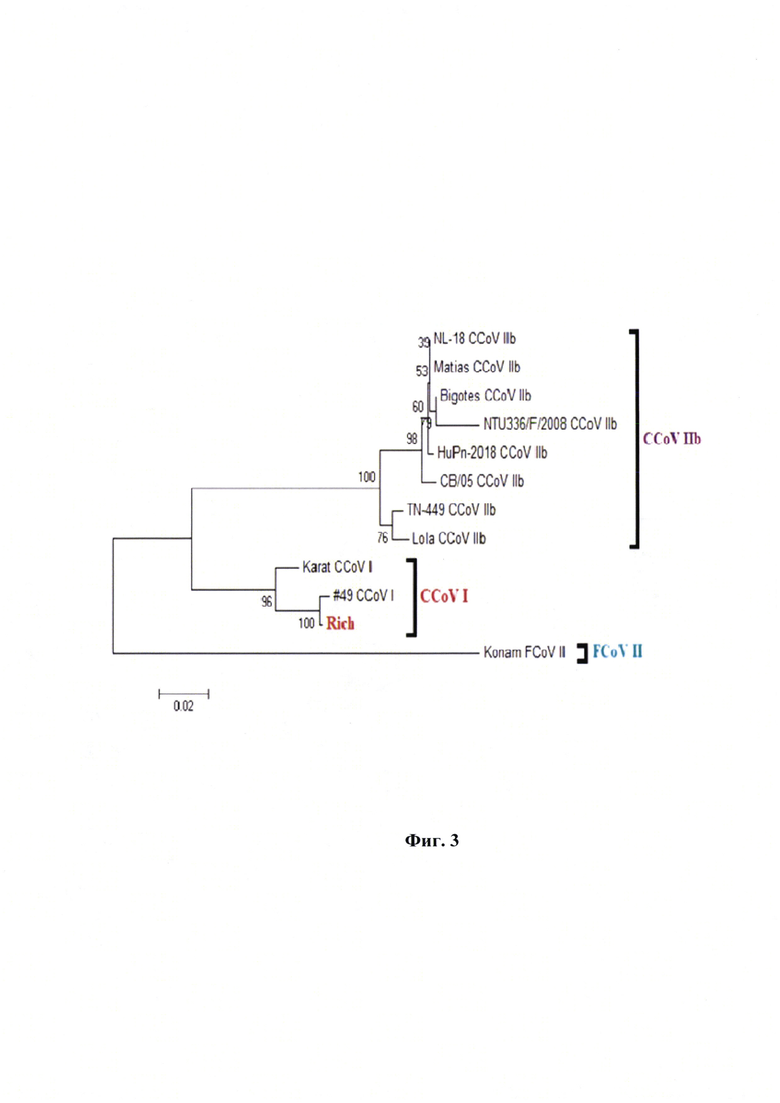
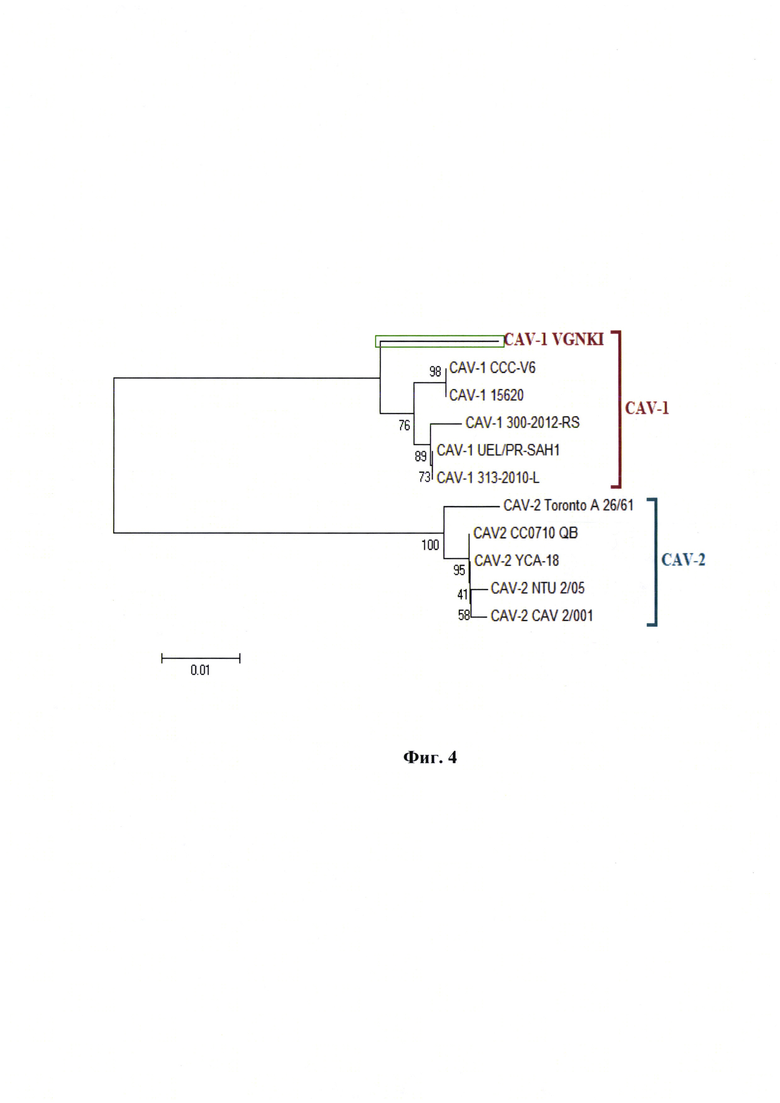
Изобретение относится к биотехнологии и ветеринарии. Предложена вакцина. Вакцина содержит активное вещество и целевую добавку. В качестве активного вещества вакцина содержит два компонента: жидкий компонент - смесь из инактивированного очищенного антигенного материала из штамма «Грей» парвовирусного энтерита собак, сем. Parvoviridae, рода Protoparvovirus, вид Carnivore protoparvovirus 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №27 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «Рич» коронавирусного энтерита собак, сем. Coronaviridae, рода Alphacoronavirus, вид Alphacoronavirus 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №376 - деп / 22-10 ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «ВГНКИ» аденовирусной инфекции собак сем. Adenoviridae, рода Mastadenovirus, вид Canine mastadenovirus А, серотипа 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №29 - ГКШМ ФГБУ «ВНИИЗЖ»; и сухой компонент - лиофилизированный аттенуированный очищенный антигенный материала из штамма «Рокборн» вируса чумы плотоядных, сем. Paramyxoviridae, рода Morbillivirus, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №28 - ГКШМ ФГБУ «ВНИИЗЖ»; и целевые добавки: 3%-ный гель гидроокиси алюминия и стабилизирующая среда, взятых в объемном соотношении 30,0:30,0:30,0:80,0:10,0:20,0, соответственно и в количествах, обеспечивающих протективную иммунногенную активность каждого антигена в организме собак после введения им целевого препарата. Заявленная вакцина имеет повышенную стабильность, антигенную и иммуногенную активность, позволяет усилить напряженность иммунитета у привитых животных за счет получения вирионов с полным спектром антигенов. 7 з.п. ф-лы, 4 ил., 7 табл., 8 пр.
1. Вакцина ассоциированная против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак, содержащая активное вещество и целевую добавку, отличающаяся тем, что в качестве активного вещества она содержит два компонента: жидкий компонент - смесь из инактивированного очищенного антигенного материала из штамма «Грей» парвовирусного энтерита собак, сем. Parvoviridae, рода Protoparvovirus, вид Carnivore protoparvovirus 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №27 - ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «Рич» коронавирусного энтерита собак, сем. Coronaviridae, рода Alphacoronavirus, вид Alphacoronavirus 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №376 - деп/22-10 ГКШМ ФГБУ «ВНИИЗЖ»; из инактивированного очищенного антигенного материала из штамма «ВГНКИ» аденовирусной инфекции собак сем. Adenoviridae, рода Mastadenovirus, вид Canine mastadenovirus А, серотипа 1, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №29 - ГКШМ ФГБУ «ВНИИЗЖ»; и сухой компонент - лиофилизированный аттенуированный очищенный антигенный материала из штамма «Рокборн» вируса чумы плотоядных, сем. Paramyxoviridae, рода Morbillivirus, коллекция ФГБУ «ВНИИЗЖ» под регистрационным номером: №28 - ГКШМ ФГБУ «ВНИИЗЖ»; и целевые добавки: 3%-ный гель гидроокиси алюминия и стабилизирующая среда, взятых в объемном соотношении 30,0:30,0:30,0:80,0:10,0:20,0, соответственно и в количествах, обеспечивающих протективную иммунногенную активность каждого антигена в организме собак после введения им целевого препарата.
2. Вакцина по п. 1, отличающаяся тем, что она содержит инактивированный и очищенный антигенный материал «Грей» парвовирусного энтерита собак (CPV-2), сем. Parvoviridae, рода Protoparvovirus, вид Carnivore protoparvovirus 1, полученный предпочтительно в перевиваемой культуре клеток Fs, представляющий собой вирусную суспензию в количестве 30,0 об. %.
3. Вакцина по п. 1, отличающаяся тем, что она содержит инактивированный и очищенный антигенный материал из штамма «Рич» вируса коронавирусного энтерита собак (CCoV), сем. Coronaviridae, рода Alphacoronavirus, вид Alphacoronavirus 1, полученный предпочтительно в перевиваемой культуре клеток CrFk, представляющий собой суспензию в количестве 30,0 об. %.
4. Вакцина по п. 1, отличающаяся тем, что она содержит инактивированный и очищенный антигенный материал из штамма «ВГНКИ» аденовирусной инфекции (инфекционного гепатита) собак 1-го серотипа (CAV-1), сем. Adenoviridae, рода Mastadenovirus, вид Canine mastadenovirus А, полученный предпочтительно в перевиваемой культуре клеток MDCK, представляющий собой суспензию в количестве 30,0 об. %.
5. Вакцина по п. 1, отличающаяся тем, что в качестве адъюванта она содержит 3%-ный гель гидроокиси алюминия в количестве не менее 10,0 об. %.
6. Вакцина по п. 1, отличающаяся тем, что она содержит сухой аттенуированный антигенный материал из штамма «Рокборн» вируса чумы плотоядных (CVD), сем. Paramyxoviridae, рода Morbillivirus, полученный предпочтительно в перевиваемой культуре клеток VERO, представляющий собой аттенуированную лиофилизированную вирусную суспензию, в количестве 80,0 об. %.
7. Вакцина по п. 1, отличающаяся тем, что она содержит стабилизирующую среду из: гидролизат лактальбумина (ГЛА) - 9,0%, сахароза - 9,0%, желатоза - 2,0%, в количестве 20,0 об. %.
8. Вакцина по любому из пп. 1-7, отличающаяся тем, что она содержит смесь из инактивированных и очищенных антигенных материалов из штамма «Грей» парвовирусного энтерита собак (CPV-2), полученный предпочтительно в перевиваемой культуре клеток Fs, с инфекционной активностью не менее 8,33±0,57 log2; из штамма «Рич» вируса коронавирусного энтерита собак (CCoV), полученный предпочтительно в перевиваемой культуре клеток CrFk, с инфекционной активностью не менее 3,33±0,14 lg ТЦД50/см3; из штамма «ВГНКИ» вируса аденовирусной инфекции собак 1-го серотипа (CAV-1), полученный предпочтительно в перевиваемой культуре клеток MDCK, с инфекционной активностью не менее 3,41±0,14 lg ТЦД50/см3; лиофилизированного антигенного материала из аттенуированного штамма «Рокборн» вируса чумы плотоядных (CVD), полученный предпочтительно в перевиваемой культуре клеток VERO, с инфекционной активностью не менее 3,58±0,14 lg ТЦД50/см3 и целевые добавки: стабилизирующую среду и адъювант в количестве, об. %:

| US 5000951, А,19.03.1991 | |||
| ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ЧУМЫ, ИНФЕКЦИОННОГО ГЕПАТИТА, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ И ПАРВОВИРУСНОГО ЭНТЕРИТА У СОБАК И СПОСОБ ПРОФИЛАКТИКИ ЧУМЫ, ИНФЕКЦИОННОГО ГЕПАТИТА, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ И ПАРВОВИРУСНОГО ЭНТЕРИТА У СОБАК | 1991 |
|
RU2030917C1 |
| ВАКЦИНА ПРОТИВ ЧУМЫ, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ, ПАРВОВИРУСНОГО И КОРОНАВИРУСНОГО ЭНТЕРИТОВ, ЛЕПТОСПИРОЗА И БЕШЕНСТВА СОБАК | 2013 |
|
RU2546247C2 |
| ГАЛКИНА Т.С., Иммунобиологические свойства возбудителей парвовирусного энтерита и чумы плотоядных, используемых для изготовления биопрепаратов, автореферат диссертации, Владимир, 2008, 27 с. | |||
Авторы
Даты
2023-10-26—Публикация
2022-11-29—Подача