Область техники
Известно, что путь c участием PD-1 играет жизненно важную роль в регулировании баланса между ингибирующими и стимулирующими сигналами в иммунной системе. Активация пути PD-1 отрицательно регулирует активность иммунной системы, повышая периферическую иммунную толерантность и предотвращая аутоиммуннитет (Keir et al., Annu Rev Immunol, 26:677-704, 2008; Okazaki et al., Int Immunol 19:813-824, 2007). PD-1 представляет собой трансмембранный рецепторный белок, экспрессируемый на поверхности активированных иммунных клеток, в том числе Т-клеток, B-клеток, NK-клеток и моноцитов (Agata et al., Int Immunol 8:765-772, 1996). Цитоплазматическая концевая часть PD-1 содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM). PD-L1 и PD-L2 являются природными лигандами PD-1 и экспрессируются на поверхности антигенпрезентирующих клеток (Dong et al., Nat Med., 5:1365-1369, 1999; Freeman et al., J Exp Med 192:1027-1034, 2000; Latchman et al., Nat Immunol 2:261-268, 2001). При задействовании лиганда в область ITIM PD-1 рекрутируются фосфатазы, что приводит к ингибированию TCR-опосредованного сигналинга и последующему снижению пролиферации лимфоцитов, секреции цитокинов и цитотоксической активности. PD-1 также может индуцировать апоптоз в Т-клетках посредством способности ингибировать сигналы выживания при костимуляции (Keir et al., Annu Rev Immunol, 26:677-704, 2008).
Наблюдение, что у мышей с нокаутом PD-1 развиваются поздний прогрессирующий артрит, волчаночноподобный гломерулонефрит и аутоиммунная кардиомиопатия, первоначально указало на центральную роль пути PD-1 в контроле аутоиммуннитета (Nishimura et al., Immunity 11:141-151, 1999; Nishimura et al., Science 291: 319-322, 2001). Кроме того, введение дефицита PD-1 мышам с диабетом без ожирения (NOD) значительно ускорило заболеваемость диабетом, в результате чего у всех мышей диабет развился к 10-недельному возрасту (Wang et al., PNAS 102:11823-11828, 2005). У людей PD-1, по-видимому, также проявляет сходные модуляторные функции. Однонуклеотидные полиморфизмы в гене PD-1 были связаны с различными аутоиммунными заболеваниями, включая красную волчанку, рассеянный склероз, диабет I типа, ревматоидный артрит и болезнь Грейвса (Prokunina et al., Arthritis Rheum 50:1770, 2004; Neilson et al., Tissue Antigens 62:492, 2003; Kroner et al., Ann Neurol 58:50, 2005; Okazaki et al., Int Immunol 19:813-824, 2007); сообщалось также о нарушениях пути PD-1 при других аутоиммунных заболеваниях (Kobayashi et al., J rheumatol 32:215, 2005; mataki et al., Am J Gastroenterol 102:302, 2007). Наконец, блокада пути PD-1 антагонистическими антителами была связана с аутоиммунными побочными эффектами у онкологических больных (Michot et al., Eur J Cancer 54:139-148, 2016).
Терапевтические стратегии, ведущие к активации пути PD-1, обеспечивают перспективный подход к лечению аутоиммунных состояний. Например, было показано, что искусственные дендритные клетки, которые чрезмерно экспрессируют PD-L1, уменьшают воспаление спинного мозга и клиническую тяжесть экспериментального аутоиммунного энцефаломиелита в модели на мышах (Hirata et al., J Immunol 174:1888-1897, 2005). Кроме того, было показано, что рекомбинантный аденовирус, экспрессирующий PD-L1, сопровождающийся блокадой ко-стимуляторных молекул, предотвращает волчаночный нефрит у мышей BXSB (Ding et al., Clin Immunol 118:258-267, 2006). Ряд антител-агонистов PD-1 был разработан для лечения различных аутоиммунных заболеваний у человека (например, см. WO2013022091, WO2004056875, WO2010029435, WO2011110621, WO2015112800). Однако, несмотря на разработку таких веществ, было мало доказательств того, что растворимые агенты эффективны для запуска сигналинга PD-1, и, насколько известно, только одна такая молекула прошла клинические испытания для лечения псориаза (см. NCT03337022). Введение агонистов PD-1 также потенциально может вызвать системные иммунные эффекты вдали от очага заболевания, что ведет к клинической токсичности. Поэтому существует необходимость в более безопасных и эффективных видах терапии на основе агонистов PD-1 для лечения аутоиммунного заболевания.
Авторы настоящего изобретения неожиданно обнаружили, что молекулы, содержащие агонист PD-1, слитый со связывающим пептид-MHC фрагментом, приводят к эффективному ингибированию сигналинга PD-1.
Без связи с какой-либо теорией, авторы настоящего изобретения выдвигают гипотезу, согласно которой эффективное ингибирование активации Т-клеток требует локализации агониста PD-1 в иммунном синапсе. Прикрепление агониста PD-1 к фрагменту, который связывается со специфичным для заболевания пептидом-MHC, таким как TCR или TCR-подобное антитело, направляет агонист к иммунному синапсу, обеспечивая более безопасную и мощную стратегию модуляции пути PD-1.
Т-клеточные рецепторы (TCR, TCRs) в природе экспрессируются CD4+ и CD8+ Т-клетками. TCR предназначены для распознавания коротких пептидных антигенов, которые отображаются на поверхности антигенпрезентирующих клеток в комплексе с молекулами главного комплекса гистосовместимости (MHC) (у человека молекулы MHC также известны как антигены лейкоцитов человека, или HLA) (Davis, et al., (1998), Annu Rev Immunol 16: 523-544.). CD8+ Т-клетки, которые также называют цитотоксическими Т-клетками, специфически распознают пептиды, связанные с MHC класса I, и обычно отвечают за обнаружение и опосредованное разрушение инфицированных или раковых клеток.
Желательно, чтобы TCR для иммунотерапевтического применения были способны точно распознавать целевой антиген, то есть TCR должен обладать высокой афинностью и/или длительным периодом полужизни в отношении связывания целевого антигена, чтобы вызывать мощный ответ. TCR в том виде, в котором они существуют в природе, обычно имеют низкую афинность к целевому антигену (в низком микромолярном диапазоне), поэтому часто необходимо идентифицировать мутации, включая, но не ограничиваясь ими, замены, вставки и/или делеции, которые могут быть сделаны в данной последовательности TCR, чтобы улучшить связывание антигена. Для применения в качестве растворимых агентов для нацеливания предпочтительны афинности связывания TCR антигена в наномолярном и пикомолярном диапазоне и с периодом полужизни в отношении связывания, составляющим несколько часов. Также желательно, чтобы терапевтические TCR демонстрировали высокий уровень специфичности к целевому антигену для снижения риска токсичности при клиническом применении в результате нецелевого связывания. Получение столь высокой специфичности может быть особенно сложной задачей, учитывая естественную вырожденность распознавания TCR антигена (Wooldridge, et al., (2012), J Biol Chem 287 (2): 1168-1177; Wilson, et al., (2004), Mol Immunol 40 (14-15): 1047-1055). Наконец, предпочтительно, чтобы терапевтические TCR было возможно экспрессировать и очищать в высокостабильной форме.
Краткое описание изобретения
Согласно первому аспекту, в настоящем изобретении предложен бифункциональный связывающий полипептид, содержащий связывающий pMHC фрагмент и агонист PD-1. Связывающий pMHC фрагмент может содержать вариабельные домены TCR и/или вариабельные домены антитела. Связывающий pMHC фрагмент может быть Т-клеточным рецептором (TCR) или TCR-подобным антителом. Связывающий pMHC фрагмент может быть гетеродимерной парой полипептидов альфа/бета TCR или одноцепочечным полипептидом альфа/бета TCR. Агонист PD-1 может быть растворимой внеклеточной формой PD-L1 или его функциональным фрагментом, PD-L1 может содержать или состоять из последовательности: FTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSYRQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPY. Агонист PD-1 может представлять собой полноразмерное антитело или его фрагмент, такой как scFv-антитело.
Агонист PD-1 может быть слит с C или N концом связывающего pMHC фрагмента и может быть слит со связывающим pMHC фрагментом через линкер. Длина линкера может достигать 25 аминокислот. Предпочтительно длина линкера составляет 2, 3, 4, 5, 6, 7 или 8 аминокислот.
Если связывающий pMHC фрагмент представляет собой TCR, TCR может содержать неприродную дисульфидную связь между константной областью альфа-цепи и константной областью бета-цепи и может специфически связываться с пептидным антигеном.
В дополнительном аспекте настоящего изобретения предложен бифункциональный связывающий полипептид в соответствии с первым аспектом изобретения для применения при лечении аутоиммунного заболевания, такого как очаговая алопеция, анкилозирующий спондилит, атопический дерматит, болезнь Грейвса, рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, диабет 1 типа и витилиго, и воспалительная болезнь кишечника.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая бифункциональный связывающий полипептид в соответствии с первым аспектом.
Предложена нуклеиновая кислота, кодирующая бифункциональный связывающий полипептид в соответствии с первым аспектом, а также вектор экспрессии, содержащий такую нуклеиновую кислоту.
Также предложена клетка-хозяин, содержащая такую нуклеиновую кислоту или такой вектор, при этом нуклеиновая кислота, кодирующая бифункциональный связывающий полипептид, может присутствовать в виде одной открытой рамки считывания или двух отдельных открытых рамок считывания, кодирующих альфа-цепь и бета-цепь TCR, соответственно.
Предложен также способ получения бифункционального связывающего полипептида в соответствии с первым аспектом, при этом способ включает поддержание клетки-хозяина согласно настоящему изобретению в необязательных условиях для экспрессии нуклеиновой кислоты и выделение бифункционального связывающего пептида по первому аспекту.
Способ лечения аутоиммунного нарушения, включающий введение бифункционального связывающего полипептида в соответствии с первым аспектом нуждающемуся в нем пациенту также входит в объем настоящего изобретения.
Подробное описание изобретения
В соответствии с первым аспектом, в настоящем изобретении предложен бифункциональный связывающий полипептид, содержащий связывающий pMHC фрагмент и агонист PD-1. Связывающий pMHC фрагмент может содержать вариабельные домены TCR. В качестве альтернативы, связывающий pMHC фрагмент может содержать вариабельные домены антитела. Связывающий pMHC фрагмент может быть Т-клеточным рецептором (TCR) или TCR-подобным антителом.
Последовательности TCR чаще всего описывают со ссылкой на номенклатуру IMGT, которая широко известна и доступна специалистам в области TCR. Например, см.: LeFranc and LeFranc, (2001). “T cell Receptor Factsbook”, Academic Press; Lefranc, (2011), Cold Spring Harb Protoc 2011(6): 595-603; Lefranc, (2001), Curr Protoc Immunol Appendix 1: Appendix 10; and Lefranc, (2003), Leukemia 17(1): 260-266. Кратко, αβ TCR состоят из двух дисульфидно связанных цепей. Каждая цепь (альфа и бета) обычно рассматривается как имеющая два домена, а именно вариабельный и константный домен. Короткий J-сегмент связывает вариабельный и константный домены и обычно считается частью вариабельной области альфа. Кроме того, бета-цепь обычно содержит короткий D-сегмент рядом с J-сегментом, который также обычно считается частью вариабельной области бета.
Вариабельный домен каждой цепи расположен N-терминально и включает в себя три участка, определяющих комплементарность (CDR), встроенные в каркасную последовательность (FR). Эти CDR содержат сайты распознавания для пептида-МНС. Существует несколько генов, кодирующих вариабельные области альфа-цепи (Vα), и несколько генов, кодирующих вариабельные области бета-цепи (Vβ), которые различаются своим каркасом, последовательностями CDR1 и CDR2 и частично определенной последовательностью CDR3. Гены Vα и Vβ, согласно номенклатуре IMGT, обозначают префиксом TRAV и TRBV, соответственно (Folch and Lefranc, (2000), Exp Clin Immunogenet 17(1): 42-54; Scaviner and Lefranc, (2000), Exp Clin Immunogenet 17(2): 83-96; LeFranc and LeFranc, (2001), “T cell Receptor Factsbook”, Academic Press). Также существует несколько “соединяющих» (joining) генов или J генов, обозначаемых TRAJ или TRBJ, для альфа и бета-цепей соответственно, и в случае бета-цепи, существует «вариабельный» (diversity) ген или D-ген, обозначаемый TRBD (Folch and Lefranc, (2000), Exp Clin Immunogenet 17(2): 107-114; Scaviner and Lefranc, (2000), Exp Clin Immunogenet 17(2): 97-106; LeFranc and LeFranc, (2001), “T cell Receptor Factsbook”, Academic Press). Огромное разнообразие цепей рецепторов Т-клеток является результатом комбинаторных перестроек между различными V, J и D генами, которые включают аллельные варианты, а также множественности J-сегментов (Arstila, et al., (1999), Science 286(5441): 958-961; Robins et al., (2009), Blood 114(19): 4099-4107.) Константные, или С-области, альфа и бета-цепей TCR обозначают TRAC и TRBC соответственно (Lefranc, (2001), Curr Protocol Immunol Appendix 1: Appendix 10).
Если связывающий pMHC фрагмент представляет собой TCR, TCR может быть не природного происхождения и/или очищенным и/или сконструированным. Более одной мутации может присутствовать в вариабельном домене альфа-цепи и/или вариабельном домене бета-цепи относительно природного TCR. Мутации предпочтительно производят в пределах участков CDR. Такие мутации обычно вводят для того, чтобы улучшить афинность связывающего фрагмента (например, TCR) к специфическому пептидному антигену HLA-комплекса.
Связывающий pMHC фрагмент может быть TCR-подобным антителом. TCR-подобное антитело представляет собой термин, применяемый в данной области техники для молекул антител, наделенных TCR-подобной специфичностью по отношению к пептидным антигенам, презентированным MHC, и обычно имеющих более высокую афинность к антигену, чем природные TCR. (Dahan et al., Expert Rev Mol Med 14:e6, 2012). Такие антитела могут содержать тяжелую цепь и легкую цепь, каждая из которых содержит вариабельную область и константную область. Функциональные фрагменты таких антител входят в объем настоящего изобретения, такие как scFvs, Fab-фрагменты и другие, хорошо известные в данной области техники.
Бифункциональные связывающие полипептиды согласно настоящему изобретению обладают свойством связывать специфический пептидный комплекс антиген-MHC. Специфичность в контексте полипептидов согласно настоящему изобретению относится к их способности распознавать клетки-мишени, которые презентируют пептидный комплекс антиген-MHC, при этом имея минимальную способность распознавать клетки-мишени, которые не презентируют пептидный комплекс антиген-MHC.
Бифункциональные связывающие полипептиды согласно настоящему изобретению могут иметь идеальный профиль безопасности для применения в качестве терапевтических реагентов. Идеальный профиль безопасности означает, что в дополнение к демонстрации хорошей специфичности, полипептиды согласно настоящему изобретению могут пройти дальнейшие доклинические испытания на предмет безопасности. Примеры таких тестов включают тесты на аллореактивность, подтверждающие низкий потенциал распознавания альтернативных типов HLA.
Бифункциональные связывающие полипептиды согласно настоящему изобретению могут поддаваться очистке с высоким выходом. Выход может быть определен на основе количества материала, удерживаемого в процессе очистки (т.е. количества материала с правильным фолдингом, полученного в конце процесса очистки, относительно количества солюбилизированного материала, полученного до рефолдинга), и или выход может быть определен на основе количества материала с правильным фолдингом, полученного в конце процесса очистки, относительно исходного объема культуры. Высокий выход означает более 1%, или более предпочтительно более 5%, или более высокий выход. Высокий выход означает более 1 мг/мл, или более предпочтительно более 3 мг/мл, или более 5 мг/мл, или более высокий выход.
Бифункциональные связывающие полипептиды согласно настоящему изобретению будут иметь подходящую афинность связывания пептидного антигена и PD-1. Способы определения аффинности связывания (обратно пропорциональной константе равновесия KD) и периода полужизни в отношении связывания (выраженного как T½) известны специалистам в данной области. В предпочтительном варианте реализации аффинность связывания и период полужизни в отношении связывания определяют при помощи поверхностного плазмонного резонанса (SPR) или био-слоевой интерферометрии (BLI), например, при помощи прибора BIAcore или прибора Octet, соответственно. Следует отметить, что удвоение связывающей афинности полипептида приводит к уменьшению KD вдвое. T½ рассчитывают как значение ln2, разделенное на коэффициент отклонения (koff). Таким образом, удвоение T½ приводит к уменьшению koff вдвое. Значения KD и koff обычно измеряют для растворимых форм полипептидов. Для учета различий между независимыми измерениями и, в частности, для взаимодействий со временем диссоциации, превышающим 20 часов, аффинность связывания и/или период полужизни в отношении связывания данного полипептида могут быть измерены несколько раз, например 3 или более раз, с применением одного и того же протокола анализа и среднего значения полученных результатов. Для сравнения данных связывания между двумя образцами (т.е. двумя различными полипептидами и или двумя препаратами одного и того же полипептида) предпочтительно проводить измерения при одних и тех же условиях анализа (например, температуре).
Для бифункциональных связывающих полипептидов согласно настоящему изобретению, в которых связывающий pMHC фрагмент содержит вариабельные домены TCR, домены могут быть α и β-вариабельными доменами. Если связывающий pMHC фрагмент представляет собой TCR, то такие TCR могут быть гетеродимерами αβ. В некоторых случаях связывающий pMHC фрагмент содержит вариабельные домены γ и δ TCR. Если связывающий pMHC фрагмент представляет собой TCR, то такие TCR могут быть гетеродимерами γδ.
Связывающий pMHC фрагмент согласно настоящему изобретению может содержать последовательность константного домена внеклеточной альфа-цепи TRAC и/или последовательность константного домена внеклеточной бета-цепи TRBC1 или TRBC2. Константные домены могут быть укорочены таким образом, что трансмембранные и цитоплазматические домены отсутствуют. Один или оба константных домена могут содержать мутации, замены или делеции относительно природных последовательностей TRAC и/или TRBC1/2. Термин TRAC и TRBC1/2 также охватывает естественные полиморфные варианты, например N-K в положении 4 TRAC (Bragado et al International immunology. 1994 Feb;6(2):223-30).
В качестве альтернативы вместо полноразмерных или укороченных константных доменов могут отсутствовать константные домены TCR. Соответственно, связывающий pMHC фрагмент согласно настоящему изобретению может состоять из вариабельных доменов альфа-и бета-цепей TCR.
Если связывающий pMHC фрагмент содержит вариабельные домены TCR, такие вариабельные домены TCR могут быть представлены одной цепью, как например одноцепочечный TCR. Формат одной цепи включает, но не ограничиваются ими: αβ TCR, полипептиды типов Vα-L-Vβ, Vβ-L-Vα, Vα-Cα-L-Vβ, Vα-L-Vβ-Cβ, or Vα-Cα-L-Vβ-Cβ, где Vα и Vβ являются вариабельными областями TCR α и β, соответственно, Сα и Cβ являются внеклеточными константными областями TCR α и β, соответственно, и L представляет собой линкерную последовательности (Weidanz et al., (1998) J Immunol Methods. Dec 1;221(1-2):59-76; Epel et al., (2002), Cancer Immunol Immunother. Nov;51(10):565-73; WO 2004/033685; WO9918129). Там, где они присутствуют, один или оба внеклеточных константных домена могут быть полной длины, или они могут быть укорочены и/или содержать мутации, как описано выше. В некоторых вариантах реализации одноцепочечные вариабельные домены TCR и/или одноцепочечные TCR согласно настоящему изобретению могут иметь введенную дисульфидную связь между остатками соответствующих константных доменов, как описано в WO 2004/033685. Одиночная цепь TCR более подробно описана в WO2004/033685; WO98/39482; WO01/62908; Weidanz et al. (1998) J Immunol Methods 221(1-2): 59-76; Hoo et al. (1992) Proc Natl Acad Sci U S A 89(10): 4759-4763; Schodin (1996) Mol Immunol 33(9): 819-829).
Для бифункциональных связывающих полипептидов согласно настоящему изобретению, в которых связывающий pMHC фрагмент представляет собой TCR, последовательности константных доменов альфа-и бета-цепей такого TCR могут быть модифицированы укорочением или заменой для удаления природной дисульфидной связи между Cys4 экзона 2 TRAC и Cys2 экзона 2 TRBC1 или TRBC2. Последовательность(и) константных доменов альфа-и/или бета-цепей может иметь введенную дисульфидную связь между остатками соответствующих константных доменов, как описано, например, в WO 03/020763. В предпочтительном варианте реализации альфа и бета-константные домены могут быть модифицированы замещением остатков цистеина в положении Thr 48 TRAC и положении Ser 57 TRBC1 или TRBC2, причем указанные остатки цистеина образуют дисульфидную связь между альфа и бета константными доменами TCR. TRBC1 или TRBC2 могут дополнительно содержать мутацию цистеина на аланин в положении 75 константного домена и мутацию аспарагина на аспарагиновую кислоту в положении 89 константного домена. Один или оба внеклеточных константных домена, присутствующих в гетеродимере αβ согласно настоящему изобретению, могут быть укорочены на С-конце или С-концах, например, до 15, или до 10, или до 8 или менее аминокислот. Один или оба внеклеточных константных домена, присутствующих в гетеродимере αβ согласно настоящему изобретению, могут быть укорочены на С-конце или С-концах, например, до 15, или до 10, или до 8 аминокислот. С-конец внеклеточного константного домена альфа-цепи может быть укорочен на 8 аминокислот.
Между внеклеточными константными доменами может присутствовать неприродная дисульфидная связь. Указанные неприродные дисульфидные связи более подробно описаны в WO03020763 и WO06000830. Неприродная дисульфидная связь может находиться между положением Thr 48 TRAC и положением Ser 57 TRBC1 или TRBC2. Один или оба константных домена могут содержать одну или несколько мутационных замен или делеций относительно природных последовательностей TRAC и/или TRBC1/2.
В другом предпочтительном формате бифункциональных связывающих полипептидов, где связывающий pMHC фрагмент содержит вариабельные домены TCR, вариабельные домены TCR и домен(ы) агониста PD-1 могут чередоваться на отдельных полипептидных цепях, что приводит к димеризации. Такие форматы описаны в WO2019012138. Коротко, первая полипептидная цепь может содержать (от N до C-конца) первый вариабельный домен антитела, за которым следует вариабельный домен TCR, а затем необязательно Fc-домен. Вторая цепь может содержать (от N до C-конца) вариабельный домен TCR, за которым следует второй вариабельный домен антитела, за которым необязательно следует FC-домен. Учитывая линкеры соответствующей длины, цепи димеризуются в мультиспецифичную молекулу, необязательно содержащую Fc-домен. Молекулы, в которых домены расположены на различных цепях таким образом, также могут быть названы диателами, которые также рассматриваются в данном изобретении. Дополнительные цепи и домены могут быть добавлены для формирования, например, триател.
Соответственно, в настоящей заявке также предложена полипептидная молекула с двойной специфичностью, выбранная из группы молекул, содержащих первую полипептидную цепь и вторую полипептидную цепь, в которой:
первая полипептидная цепь содержит первую связывающую область вариабельного домена (VD1) антитела-агониста PD-1 и первую связывающую область вариабельного домена (VR1) TCR, специфически связывающегося с MHC-ассоциированным пептидным эпитопом, и первый линкер (LINK1), соединяющий указанные домены;
вторая полипептидная цепь содержит вторую область связывания вариабельного домена (VR2) TCR, специфически связывающегося с MHC-ассоциированным пептидным эпитопом, и вторую область связывания вариабельного домена (VD2) антитела-агониста PD-1 и второй линкер (LINK2), соединяющий указанные домены;
где указанная первая связывающая область (VD1) и указанная вторая связывающая область (VD2) ассоциируют с образованием первого сайта связывания (VD1) (VD2);
указанная первая связывающая область (VR1) и указанная вторая связывающая область (VR2) ассоциируют с образованием второго сайта связывания (VR1) (VR2), который связывает указанный MHC-ассоциированный пептидный эпитоп;
где указанные две полипептидные цепи слиты с шарнирными доменами IgG человека и/или Fc-доменами IgG человека или их димеризующими частями; и
где указанные две полипептидные цепи соединены ковалентными и/или нековалентными связями между указанными шарнирными доменами и/или Fc-доменами; и
где указанная молекула полипептида с двойной специфичностью способна одновременно быть агонистом PD-1 и связывать MHC-ассоциированный пептидный эпитоп, а также молекулы полипептида с двойной специфичностью, причем порядок областей связывания в двух полипептидных цепях выбран из VD1-VR1 и VR2- VD2 или VD1-VR2 и VR1-VD2, или VD2-VR1 и VR2-VD1 или VD2-VR2 и VR1-VD1, и где домены связаны либо посредством LINK1, либо LINK2.
Агонист PD-1 может соответствовать растворимой внеклеточной области PD-L1 (Uniprot ref: Q9NZQ7) или PD-L2 (Q9BQ51) или ее функциональному фрагменту. PD-L1 может содержать или состоять из последовательности, указанной ниже.
Полноразмерный PD-L1 имеет последовательность, указанную ниже:
FTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSY
RQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPYNKINQRILVV
DPVTSEHELTCQAEGYPKAEVIWTSSDHQVLSGKTTTTNSKREEKLFNVTSTLRINTTTNEIF
YCTFRRLDPEENHTAELVIPELPLAHPPNER
Укороченная форма PD-L1 может быть слита со связывающим pMHC фрагментом, при условии, что он сохраняет связывающую способность и является агонистом PD-1. Такой укороченный фрагмент может быть представлен следующей последовательностью:
FTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSY
RQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPY
В качестве альтернативы более короткие или более длинные укорочения также могут быть слиты со связывающим pMHC фрагментом.
Агонист PD-1 может представлять собой полноразмерное антитело или его фрагмент, такой как scFv антитело или Fab фрагмент, или наночастицу. Примеры таких антител приведены в WO2011110621, и WO2010029434, и WO2018024237. Молекулы антител согласно настоящему изобретению могут содержать целую молекулу антитела, имеющую полноразмерную длину тяжелой и легкой цепей или их фрагмент, и могут представлять собой, но не ограничиваются ими, Fab, модифицированными Fab, Fab', модифицированными Fab', F(ab')2, Fv, однодоменными антителами (например, VH или VL или VHH), scFv, ди-, три- или тетравалентными антителами, Bis-scFv, дителами, трителами, тетрателами, нанотелами и эпитопсвязывающими фрагментами любого из вышеперечисленных.
Агонист PD-1 может быть слит с C или N концом связывающего pMHC фрагмента и может быть слит со связывающим pMHC фрагментом через линкер, который может быть 2, 3, 4, 5, 6, 7 или 8 аминокислот в длину. Линкеры могут быть 10, 12, 15, 16, 18, 20 или 25 аминокислот в длину. Последовательность линкера может повторяться, формируя более длинный линкер. Каждый линкер может быть сформирован одним, двумя, тремя или четырьмя повторами более короткой последовательности линкеров. Линкерные последовательности обычно являются гибкими, поскольку они состоят в основном из аминокислот, таких как глицин, аланин и серин, которые не имеют громоздких боковых цепей, способных ограничить гибкость. В качестве альтернативы могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Длина линкера может достигать 25 аминокислот. Часто линкерная последовательность будет меньше, например, 12, например менее 10, или от 2-8 аминокислот в длину. Примеры подходящих линкеров, которые могут быть задействованы в TCR согласно настоящему изобретению, включают, но не ограничиваются ими: GGGGS, GGGSG, GGSGG, GSGGG, GSGGGP, GGEPS, GGEGGGP и GGEGGGSEGGGS (как описано в WO2010/133828).
Бифункциональный связывающий полипептид согласно настоящему изобретению может дополнительно содержать фрагмент, модифицирующий pK. Там, где применяют Fc домен иммуноглобулина, это может быть любая Fc область антитела. Fc область - это хвостовая область антитела, которая взаимодействует с Fc-рецепторами клеточной поверхности и некоторыми белками системы комплемента. Область Fc обычно содержит две полипептидные цепи, имеющие два или три константных домена тяжелой цепи (называемых CH2, CH3 и CH4), и шарнирную область. Две цепи связаны дисульфидными связями в шарнирной области. Fc-домены из подклассов иммуноглобулинов IgG1, IgG2 и IgG4 связываются с и подвергаются FcRn-опосредованной рециркуляции, обеспечивая длительный период полужизни в кровотоке (3-4 недели). Взаимодействие IgG с FcRn локализовано в области Fc, охватывающей части доменов CH2 и CH3. Предпочтительно, иммуноглобулин Fc для применения в настоящем изобретении включает, но не ограничивается ими, домены Fc из IgG1 или IgG4. Предпочтительно домен Fc является производным от последовательностей человека. Область Fc может также предпочтительно включать мутации KiH, которые облегчают димеризацию, а также мутации для предотвращения взаимодействия с активирующими рецепторами, то есть функционально молчащими молекулами. Домен Fc иммуноглобулина может быть слит с C или N концом других доменов (т.е. с вариабельными доменами TCR или иммунным эффектором). Иммуноглобулин Fc может быть слит с другими доменами (например, вариабельными доменами TCR или иммунным эффектором) через линкер. Линкерные последовательности обычно являются гибкими, поскольку они состоят в основном из аминокислот, таких как глицин, аланин и серин, которые не имеют громоздких боковых цепей, способных ограничить гибкость. В качестве альтернативы могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Часто последовательность линкера будет, например, меньше 12, например менее 10, или от 2-10 аминокислот в длину, линкер может быть 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот в длину. Примеры подходящих линкеров, которые могут быть задействованы мультидоменными связывающими молекулами согласно настоящему изобретению, включают, но не ограничиваются ими: GGGSGGGG, GGGGS, GGGSG, GGGGG, GSGGG, GSGGGP, GGEPS, GGEGGGP и GGEGGGSEGGGS (как описано в WO2010/133828). Если иммуноглобулин Fc слит с TCR, он может быть слит либо с альфа -, либо с бета-цепями, с линкером или без него. Кроме того, отдельные цепи Fc могут быть слиты с отдельными цепями TCR.
Предпочтительно область Fc может быть производной подкласса IgG1 или IgG4. Эти две цепи могут содержать константные домены СН2 и СН3 и всю шарнирную область или ее часть. Шарнирная область может значительно или частично соответствовать шарнирной области из IgG1, IgG2, IgG3 или IgG4. Шарнир может содержать всю или часть основной шарнирной области и всю или часть нижней шарнирной области. Предпочтительно, чтобы шарнирная область содержала по меньшей мере одну дисульфидную связь, связывающую две цепи.
Область Fc может содержать мутации относительно последовательности дикого типа. Мутации включают в себя замены, вставки и делеции. Такие мутации могут быть введены с целью введения желательных терапевтических свойств. Например, чтобы облегчить гетеродимеризацию, мутации выступы-во-впадины (knobs into holes, KiH) могут быть встроены в домен CH3. В этом случае одна цепь спроектирована так, чтобы содержать громоздкий выступающий остаток (то есть выступ), такой как Y, а другая цепь спроектирована так, чтобы содержать дополнительный карман (то есть впадину). Подходящие положения для мутаций KiH известны в данной области. Дополнительно или альтернативно могут быть введены мутации, которые отменяют или уменьшают связывание с рецепторами Fcy и или увеличивают связывание с FcRn, и/или предотвращают обмен Fab плечами, или удаляют сайты протеаз.
Фрагмент, модифицирующий PK, также может представлять собой альбумин-связывающий домен, который также может увеличивать период полужизни. Как известно в данной области техники, альбумин имеет длительный период полужизни в кровотоке, составляющий 19 дней, отчасти из-за его размера, превышающего почечный порог, а также из-за его специфического взаимодействия и рециркуляции через FcRn. Связывание с альбумином - это известная стратегия для улучшения полужизни терапевтической молекулы в кровотоке в живом организме. Альбумин может быть связан нековалентно, с помощью специфического домена связывания альбумина, или ковалентно, путем конъюгации или прямого генетического слияния. Примеры терапевтических молекул, в которых применяли связывание альбумина для улучшения периода полужизни, приведены в Sleep et al., Biochim Biophys Acta. 2013 Dec;1830(12):5526-34.
Альбумин-связывающий домен может быть любым фрагментом, способным связываться с альбумином, включая любой известный альбумин-связывающий фрагмент. Домены связывания альбумина могут быть выбраны из эндогенных или экзогенных лигандов, небольших органических молекул, жирных кислот, пептидов и белков, которые специфически связывают альбумин. Примеры предпочтительных доменов связывания альбумина включают короткие пептиды, такие как описано в Dennis et al., J Biol Chem. 2002 Sep 20;277(38):35035-43 (например, пептид QRLMEDICLPRWGCLWEDDF); белки, сконструированные для связывания альбумина, такие как антитела, фрагменты антител и антитело-подобные скаффолды, например Albudab® (O'Connor-Semmes et al., Clin Pharmacol Ther. 2014 Dec;96(6):704-12), предоставляемые на коммерческой основе GSK и Nanobody® (Van Roy et al., Arthritis Res Ther. 2015 May 20;17:135), предоставляемые на коммерческой основе Ablynx; и белки на основе доменов связывания альбумина, встречающиеся в природе, таких как стрептококковый G-белок (Streptococcal protein G Protein) (Stork et al., Eng Des Sel. 2007 Nov;20(11):569-76), например Albumod® предоставляемые на коммерческой основе Affibody.
Предпочтительно альбумин представляет собой сывороточный альбумин человека (HSA). Афинность домена связывания альбумина к альбумину человека может находиться в диапазоне от пикомолярной до микромолярной. Учитывая чрезвычайно высокую концентрацию альбумина в сыворотке крови человека (35-50 мг/мл, приблизительно 0,6 мМ), подсчитано, что практически все связывающие альбумин домены будут связывать альбумин in vivo.
Связывающий альбумин фрагмент может быть связан с C или N концом других доменов (т.е. с вариабельными доменами TCR или иммунным эффектором). Связывающий альбумин фрагмент может быть связан с другими доменами (например, вариабельными доменами TCR или иммунным эффектором) через линкер. Линкерные последовательности обычно являются гибкими, поскольку они состоят в основном из аминокислот, таких как глицин, аланин и серин, которые не имеют громоздких боковых цепей, способных ограничить гибкость. В качестве альтернативы могут быть предпочтительными линкеры с большей жесткостью. Пригодные для применения или оптимальные длины линкерных последовательностей могут быть легко определены. Часто линкерная последовательность будет меньше, например, 12, например менее 10, или от 2-10 аминокислот в длину. Линкер может быть 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот в длину. Примеры подходящих линкеров, которые могут быть задействованы в мультидоменных связывающих молекулах согласно настоящему изобретению, включают, но не ограничиваются ими: GGGSGGGG, GGGGS, GGGSG, GGGGG, GSGGG, GGEPS, GGEGGGP и GGEGGGSEGGGS (как описано в WO2010/133828). Если альбумин-связывающий фрагмент связан с TCR, он может быть связана либо с альфа -, либо с бета-цепями, с линкером или без него.
В еще одном аспекте настоящего изобретения предложено бифункциональное связывание полипептида в соответствии с первым аспектом настоящего изобретения для применения при лечении аутоиммунного заболевания, такого как очаговая алопеция, анкилозирующий спондилит, атопический дерматит, болезнь Грейвса, рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, диабет 1 типа, витилиго, воспалительные заболевания кишечника, болезнь Крона, язвенный колит, целиакия, заболевания глаз (например, увеит), кожная волчанка и волчаночный нефрит, а также аутоиммунные заболевания у онкологических больных, вызванные антагонистами PD-1/PD-L1.
В настоящем изобретении также предложен бифункциональный связывающий полипептид в соответствии с первым аспектом настоящего изобретения для применения при лечении или профилактике боли, в частности боли, связанной с воспалением.
Необязательно, бифункциональный полипептид согласно настоящему изобретению предназначен для применения при лечении диабета 1 типа, воспалительного заболевания кишечника и ревматоидного артрита. В рамках настоящего изобретения также предложена фармацевтическая композиция, содержащая бифункциональный связывающий полипептид в соответствии с первым аспектом. В другом аспекте в рамках настоящего изобретения предложена нуклеиновая кислота, кодирующая бифункциональный связывающий полипептид согласно настоящему изобретению. В некоторых вариантах реализации нуклеиновой кислотой является кДНК. В некоторых вариантах реализации нуклеиновой кислотой может быть мРНК. В некоторых вариантах реализации в рамках настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую вариабельный домен α-цепи TCR согласно настоящему изобретению. В некоторых вариантах реализации в рамках настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую вариабельный домен β-цепи TCR согласно настоящему изобретению. В некоторых вариантах реализации в рамках настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую легкую цепь TCR-подобного антитела. В некоторых вариантах реализации в рамках настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую тяжелую цепь TCR-подобного антитела. В некоторых вариантах реализации в рамках настоящего изобретения предложена нуклеиновая кислота, содержащая последовательность, кодирующую весь или часть агониста PD-1, например PD-L1 или укороченную его часть, или все или часть агонистического антитела к PD-1, например легкую цепь и/или тяжелую цепь такого антитела. Нуклеиновая кислота может иметь неприродное происхождение и/или быть очищенной и/или сконструированной. Последовательность нуклеиновых кислот может быть оптимизирована кодоном в соответствии с применяемой системой экспрессии. Как известно специалистам в данной области, экспрессионные системы могут включать бактериальные клетки, такие как E. coli, или дрожжевые клетки, или клетки млекопитающих, или клетки насекомых, или они могут быть бесклеточными системами экспрессии.
В другом аспекте в рамках настоящего изобретения предложен вектор, который содержит нуклеиновую кислоту согласно настоящему изобретению. Предпочтительно вектор является подходящим вектором экспрессии.
В рамках настоящего изобретения предложена также клетка, содержащая вектор согласно настоящему изобретению. Подходящие клетки включают бактериальные клетки, такие как E. coli, или дрожжевые клетки, или клетки млекопитающих, или клетки насекомых. Вектор может содержать нуклеиновую кислоту согласно настоящему изобретению, кодирующую одну открытую рамку считывания, или две отдельные открытые рамки считывания, кодирующие альфа-цепь и бета-цепь TCR, соответственно, или легкую цепь или тяжелую цепь TCR-подобного антитела, соответственно. Согласно другому аспекту, предложена клетка, содержащая первый вектор экспрессии, который содержит нуклеиновую кислоту, кодирующую альфа-цепь/легкую цепь TCR/TCR-подобного антитела полипептида согласно настоящему изобретению, и второй вектор экспрессии, который содержит нуклеиновую кислоту, кодирующую бета-цепь/тяжелую цепь TCR/TCR-подобного антитела согласно настоящему изобретению. Клетки согласно настоящему изобретению могут быть выделенными и/или рекомбинантными и/или иметь неприродное происхождения и/или быть сконструированными.
Как хорошо известно в данной области, полипептиды могут подвергаться посттрансляционным модификациям. Гликозилирование является одной из таких модификаций, которая включает ковалентное присоединение олигосахаридных фрагментов к определенным аминокислотам в TCR/TCR-подобном антителе/ антителе к PD-L1 или PD-1 или другом агонисте PD-1. Например, остатки аспарагина или остатки серина/треонина являются хорошо известными сайтами прикрепления олигосахаридов. Статус гликозилирования конкретного белка зависит от ряда факторов, включая последовательность белка, конформацию белка и доступность определенных ферментов. Кроме того, статус гликозилирования (т.е. тип олигосахарида, ковалентная связь и общее количество прикреплений) может влиять на функцию белка. Поэтому при производстве рекомбинантных белков часто желательно контролировать гликозилирование. Контролируемое гликозилирование было применено для улучшения терапии на основе антител (Jefferis et al., (2009) Nat Rev Drug Discov Mar;8(3):226-34.). Для растворимых TCR согласно настоящему изобретению гликозилирование можно контролировать, например, с помощью применения конкретных клеточных линий, например (включая, но не ограничиваясь ими), клеточных линий млекопитающих, таких как клетки яичника китайского хомяка (CHO) или эмбриональные клетки почки человека (HEK)), или путем химической модификации. Такие модификации могут быть предпочтительными, поскольку гликозилирование может улучшать фармакокинетику, снижать иммуногенность и более точно имитировать природный белок человека (Sinclair and Elliott, (2005) Pharm Sci.Aug; 94(8):1626-35).
Для введения пациентам бифункциональные связывающие полипептиды согласно настоящему изобретению могут быть предоставлены в составе стерильной фармацевтической композиции вместе с одним или несколькими фармацевтически приемлемыми носителями или наполнителями. Эта фармацевтическая композиция может быть в любой подходящей форме (в зависимости от желаемого способа введения ее пациенту). Она может быть предоставлена в единичной лекарственной форме, как правило, предоставляется в герметичном контейнере и может быть предоставлена как часть набора. Такой набор обычно (хотя и не обязательно) включает инструкции по применению. Он может включать в себя множество указанных единичных лекарственных форм.
Фармацевтическая композиция может быть адаптирована для введения любым подходящим путем, таким как парентеральный (включая подкожный, внутримышечный, интратекальный или внутривенный), энтеральный (включая пероральный или ректальный), ингаляционный или интраназальный. Такие композиции могут быть получены любым способом, известным в области фармации, например путем смешивания активного ингредиента с носителем (носителями) или наполнителем (наполнителями) в стерильных условиях.
Дозировки веществ согласно настоящему изобретению могут варьировать в широких пределах в зависимости от заболевания или нарушения, подлежащего лечению, возраста и состояния индивидуума, подлежащего лечению, и т.д. Подходящий диапазон доз для бифункционального связывающего полипептида может находиться в диапазоне от 25 нг/кг до 50 мкг/кг или от 1 мкг до 1 г. Врач в конечном счете определит соответствующие дозы для применения.
Бифункциональные связывающие полипептиды, фармацевтические композиции, векторы, нуклеиновые кислоты и клетки согласно настоящему изобретению могут быть предоставлены в по существу очищенном виде, например, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% очищенном.
Также предложена клетка-хозяин, содержащая такую нуклеиновую кислоту или такой вектор, в котором нуклеиновая кислота, кодирующая бифункциональный связывающий полипептид, может присутствовать в виде одной открытой рамки считывания или двух отдельных открытых рамок считывания, кодирующих альфа-цепь и бета-цепь TCR, соответственно.
Также предложен способ получения бифункционального связывающего полипептида согласно первому аспекту, где способ включает поддержание клетки-хозяина согласно настоящему изобретению в необязательных условиях для экспрессии нуклеиновой кислоты согласно настоящему изобретению и выделение бифункционального связывающего пептида согласно первому аспекту.
Предпочтительными признаками каждого аспекта изобретения являются те же, что и для каждого из других аспектов с соответствующими поправками. Упомянутые в настоящей заявке документы предшествующего уровня техники включены в настоящую заявку в максимально возможной степени, разрешенной законом.
Изобретение описано со ссылкой на следующие неограничивающие примеры и фигуры, в которых:
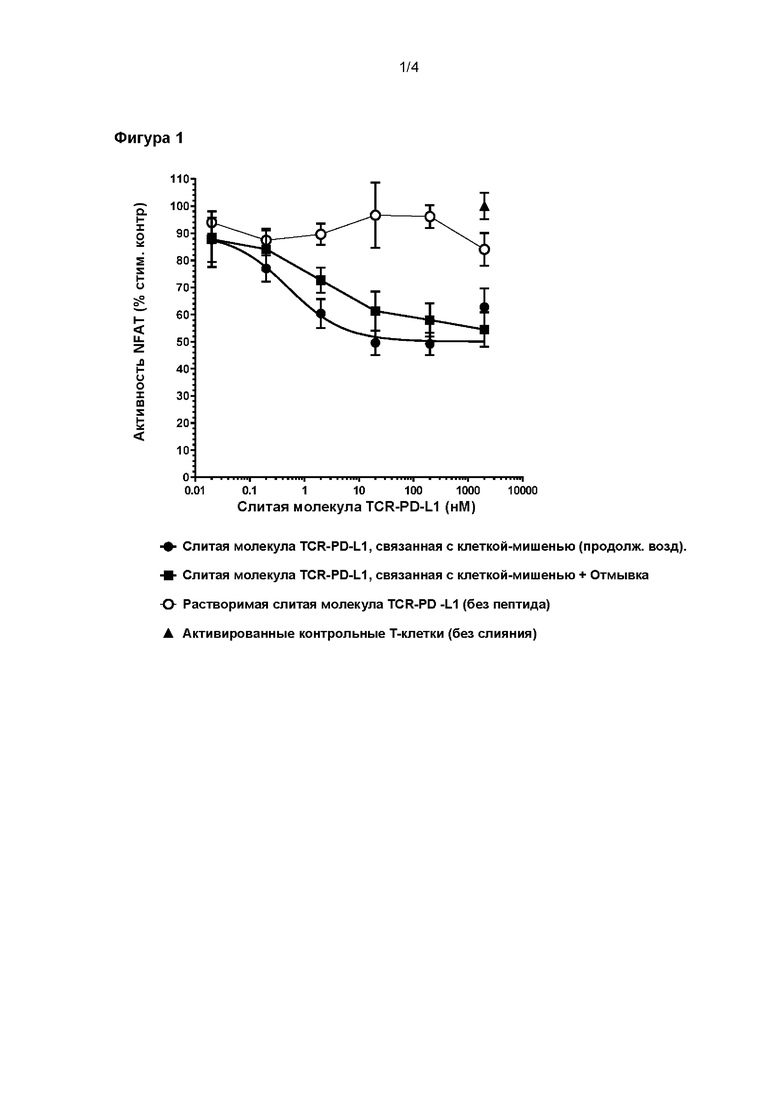
На Фигуре 1 показано дозозависимое ингибирование репортерной активности NFAT бифункциональным полипептидом согласно настоящему изобретению, содержащим растворимый TCR и укороченную форму PD-L1, в присутствии обработанных пептидом клеток-мишеней.
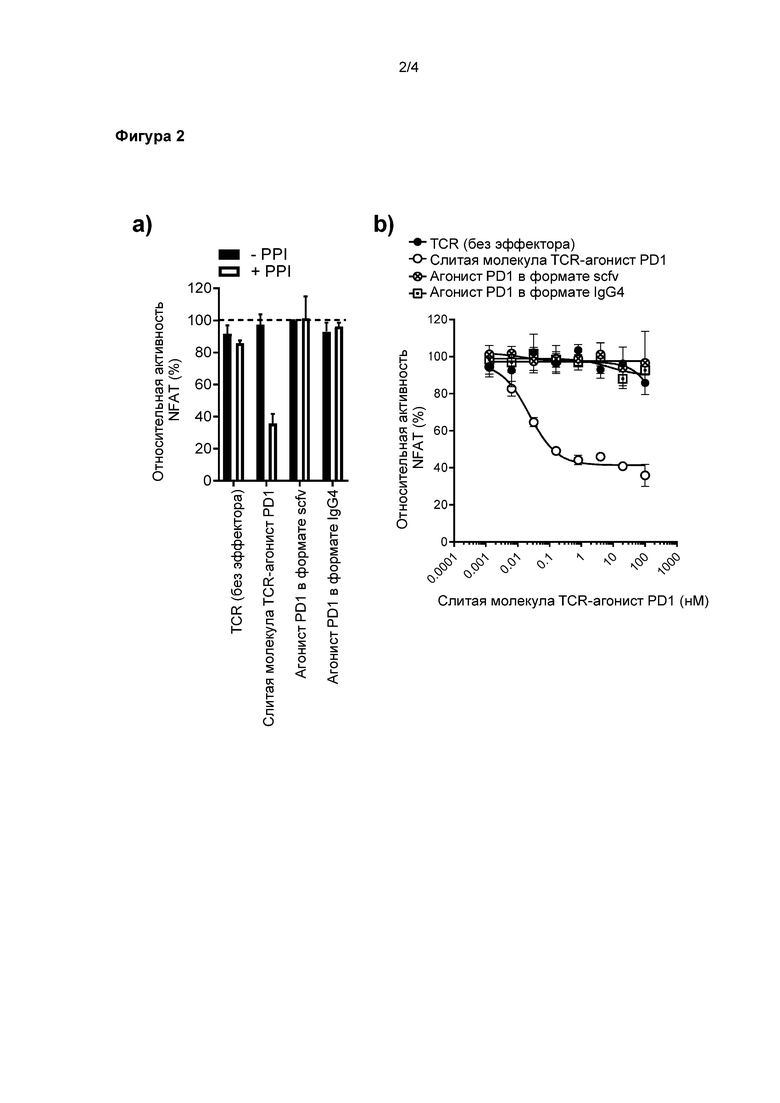
На Фигуре 2 показано ингибирование репортерной активности NFAT бифункциональным полипептидом согласно настоящему изобретению, содержащим растворимый TCR и scFv фрагмент антитела-агониста PD-1, в присутствии обработанных пептидом клеток-мишеней.
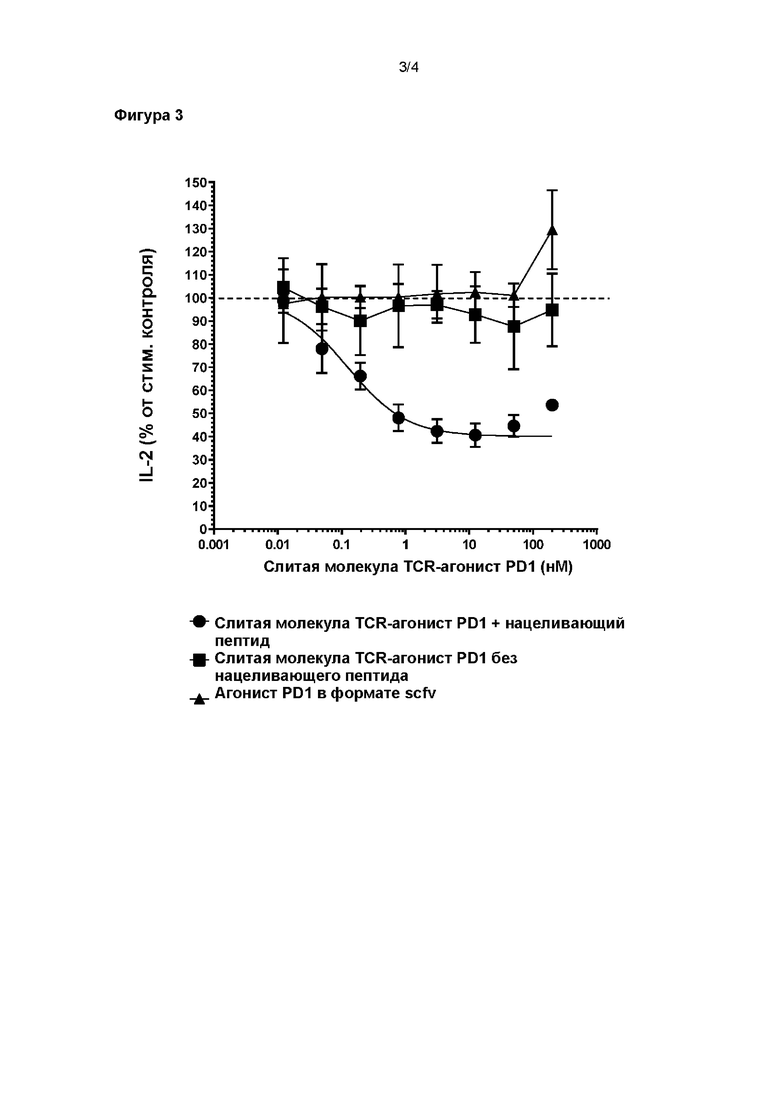
На Фигуре 3 показано ингибирование первичной активации Т-клеток человека бифункциональным полипептидом согласно настоящему изобретению, содержащим растворимый TCR и scFv фрагмент антитела-агониста PD-1, в присутствии обработанных пептидом клеток-мишеней.
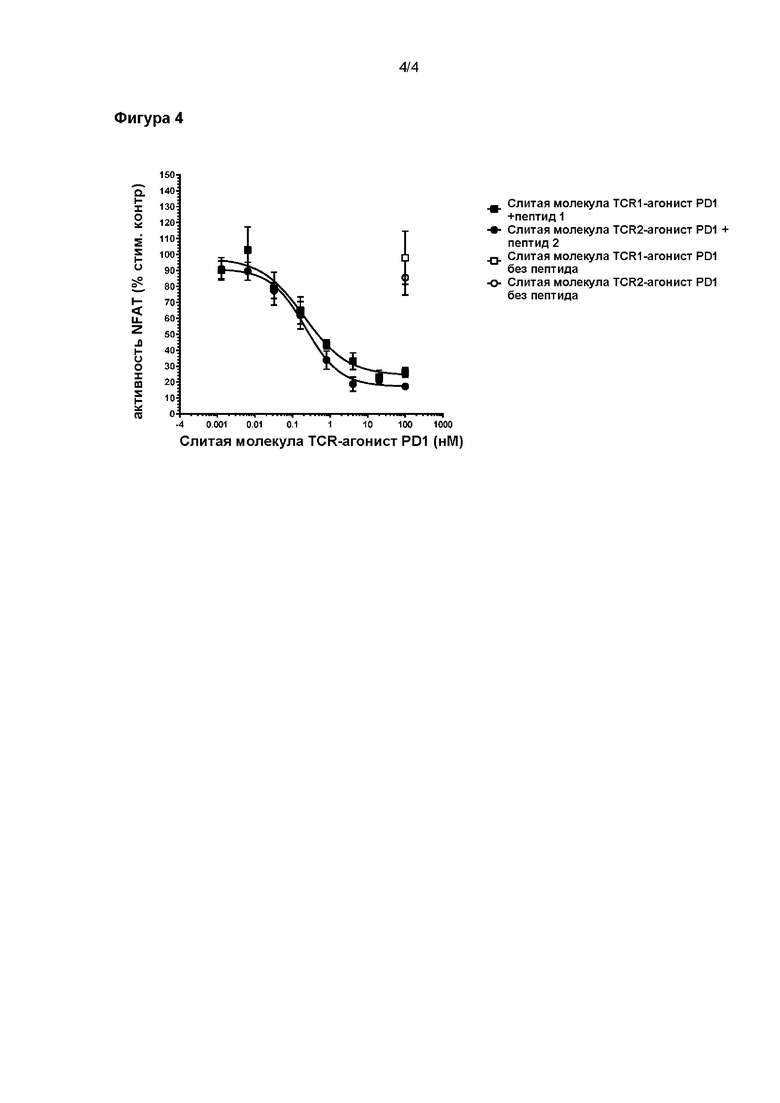
На Фигуре 4 показано ингибирование репортерной активности NFAT бифункциональным полипептидом согласно настоящему изобретению, содержащим один из двух растворимых TCR с различной специфичностью и scFv фрагмент антитела-агониста PD-1, в присутствии обработанных пептидом клеток-мишеней.
Примеры
Пример 1
Следующий пример демонстрирует, что агонист PD-1, слитый с растворимым TCR, может эффективно ингибировать активацию Т-клеток, когда он нацелен на иммунный синапс.
Растворимый TCR, примененный в этом бифункциональном связывающем полипептиде, представляет собой версию природного TCR с усиленной аффинностью, который специфически распознает пептид, рестриктированный HLA-A*02, полученный из пре-про-инсулина человека (такие молекулы описаны в WO2015092362). Агонист PD-1 представлял собой укороченную версию внеклеточной области PD-L1, содержащую сайт взаимодействия PD-1 (Zak et al., Structure 23:2341-2348, 2015). PD-L1 сливали с N-концом альфа-цепи TCR через стандартный линкер из 5 аминокислот.
Анализ по репортерной NFAT люциферазе на Jurkat PD-1 применяли для измерения опосредованного слитой молекулой TCR-агонист PD1 ингибирования активности NFAT в Т-клетках в присутствии антигенпрезентирующих клеток-мишеней HEK293T
Спосбы
Экспрессия, рефолдинг и очистка слитых молекул TCR - агонист PD1
Экспрессию слитых молекул TCR-агонист PD1 проводили с применением высокопроизводительной системы временной экспрессии на основе адаптированных к суспензии клеток яичника китайского хомяка (CHO) (ExpiCHO Expression system, Thermo Fisher). Клетки подвергали котрансфекции в соответствии с инструкциями производителя с применением экспрессионных плазмид млекопитающих, содержащих цепи TCR, слитые с агонистом PD-1. После сбора материала осветление супернатантов клеточных культур проводили центрифугированием супернатанта при 4000-5000 х g в течение 30 минут в охлаждаемой центрифуге. Супернатанты фильтровали через фильтр 0,22 мкм и отбирали для дальнейшей очистки.
В качестве альтернативы экспрессию слитых молекул TCR-агонист PD1 проводили с применением E. coli в качестве организма-хозяина. Экспрессионные плазмиды, содержащие альфа и бета-цепи, отдельно трансформировали в штамм BL21pLysS E-coli и высевали на чашку с LB-агаром, содержащую 100 мкг/мл ампициллина. Колонии на петлях для посева из каждой трансформации отбирали и выращивали в среде LB (со 100 мкг/мл ампициллина и 1% глюкозы) при 37°C до тех пор, пока OD600 не достигало ~0,5 - 1,0. Затем стартовую культуру LB добавляли в среду для аутоиндукции (Foremedium), и клетки выращивали при 37°C в течение ~3 часов, а затем при 30°C в течение ночи. Клетки отбирали центрифугированием и лизировали в Bugbuster (Novagen). Тельца включения (IBs) извлекали путем выполнения двух промывок Тритоном (50 мМ Трис рН 8,1, 100 мМ, NaCl, 10 мМ ЭДТА, 0,5% Тритон) для удаления клеточного дебриса и мембраны. Каждый раз IBs отбирали центрифугированием при 10000 g в течение 5 минут. Для удаления детергента IBs промывали 50 мМ Трис pH8.1, 100 мМ NaCl и 10 мМ ЭДТА. Наконец, IBs повторно суспендировали в буфере с 50мМ Трис-рн8.1, 100мМ NaCl и 10мМ ЭДТА. Для измерения выхода белка, IBs солюбилизировали в буфере c 8М мочевиной и определяли концентрацию по поглощению при 280 нм.
Для рефолдинга альфа и бета-цепи смешивали в молярном соотношении 1:1 и денатурировали в течение 30 минут при 37°С в 6 М гуанидин-HCl, 50 мМ Трис рн8.1, 100 мМ NaCl, 10 мМ ЭДТА, 20 мМ ДТТ. Затем денатурированные цепи добавляли в буфер для рефолдинга, состоящий из 4 М мочевины, 100 мМ Трис рН 8.1, 0,4 М L-аргинина, 2 мМ ЭДТА, 1 мМ цистамина и 10 мМ цистеамина, и инкубировали в течение 10 минут при постоянном перемешивании. Буфер для рефолдинга, содержащий денатурированные цепи, диализировали на мембране Spectra/Por 1 против 10-кратного объема H2O в течение ~16 часов, 10-кратного объема 10 мМ Трис pH 8.1 в течение ~7 часов и 10-кратного объема 10 мМ Трис pH8.1 в течение ~16 часов.
Растворимые белки, полученные из экспрессионных систем млекопитающих или E. coli, очищали на AKTA pure (GE healthcare) с применением анионообменной колонки POROS 50 HQ (Thermo Fisher Scientific) с применением 20 мМ Трис pH 8.1 в качестве загрузочного буфера и 20 мМ Трис pH 8.1 с 1М NaCl в качестве связующего и элюирующего буфера. Белок загружали на колонку и элюировали с градиентом 0-50% элюирующего буфера. Фракции, содержащие белок, объединяли и разбавляли 20-кратно (об./об.) в 20 мМ МЭС (MES) pH6.0 для второй ступени катионообменной хроматографии на колонке POROS 50 HS (Thermos Fisher Scientific) с применением 20 мМ МЭС (MES) pH 6.0 и 20 мМ МЭС (MES) pH 6.0, 1M NaCl в качестве связующего и элюирующего буфера, соответственно. Связанный белок из катионообменной колонки элюировали с применением 0-100% градиента элюирующего буфера. Катионообменные фракции, содержащие белок, объединяли и дополнительно очищали на гелевой фильтрующей колонке Superdex 200 HR (GE healthcare) с применением ФСБ (PBS) в качестве подвижного буфера. Положительные фракции от гель-фильтрации объединяли, концентрировали и хранили при температуре -80°C до востребования.
Анализ на Jurkat c NFAT Luc-PD-1 по гену-репортеру
HLA-А*02-положительные клетки-мишени HEK293T временно трансфицировали активаторной плазмидой с TCR (BPS Bioscience, Cat no: 60610) и обрабатывали соответствующим пептидом, распознаваемым слитой молекулой TCR-агонист PD1. Затем клетки-мишени инкубировали с различными концентрациями слитой молекулы TCR-агонист PD1, чтобы обеспечить связывание с когнатным пептидным комплексом HLA-A2. Эффекторные клетки Jurkat NFAT Luc PD-1, конститутивно экспрессирующие PD-1, добавляли к клеткам-мишеням и определяли активность NFAT через 18-20 ч. Эксперименты проводили с отмывкой или без нее (после связывания слитой молекулы TCR-агонист PD1). Дальнейший контроль проводили с применением необработанных клеток-мишеней. Клетки-мишени HEK293T A2B2M, трансфицированные активатором TCR/PD-L1 включали в качестве положительного контроля.
Результаты
Данные, представленные на Фигуре 1, демонстрируют, что дозозависимое ингибирование репортерной активности NFAT наблюдали со слитой молекулой TCR-агонист PD1 в присутствии обработанных пептидом клеток-мишеней с отмывкой или без нее. Важно отметить, что минимальное ингибирование наблюдали у необработанных клеток-мишеней, что указывает на то, что нацеливание на иммунный синапс имеет решающее значение для активности агониста PD-1.
Пример 2
Следующий пример обеспечивает дополнительные доказательства того, что агонист PD-1, слитый с растворимым TCR, может эффективно ингибировать активацию Т-клетки при нацеливании на иммунный синапс.
Экспериментальная система и способы, применяемые в этом примере, были такими же, как и описанные в Примере 1, за исключением того, что в этом случае агонистическая часть слитой молекулы TCR-агонист PD1 представляла собой фрагмент антитела scFv, такой, как описано в WO 2011110621.
Анализ по репортерной NFAT люциферазе на Jurkat PD-1, описанный в Примере 1, применяли для измерения опосредованного слитой молекулой TCR - агонист PD1 ингибирования активности NFAT в Т-клетке в присутствии антигенпрезентирующих клеток-мишеней HEK293T.
Результаты
Как показано на Фигуре 2a, значительное ингибирование активности NFAT (> 60%) наблюдали в обработанных пептидом клетках (обозначены +PPI), обработанных 100 нМ слитой молекулы TCR - агонист PD1; в то время как минимальное ингибирование наблюдали в необработанных клетках-мишенях (обозначены -PPI), обработанных слитой молекулой TCR - агонист PD1. Контрольные эксперименты с применением либо только растворимого TCR, либо только агониста PD-1 (как в формате scFv, так и в формате IgG4) не показали ингибирования репортерной активности, что указывает на то, что для активности агониста PD-1 требуется нацеливание агониста PD-1 на иммунный синапс. На Фигуре 2b дополнительно показано дозозависимое ингибирование активности NFAT. Опять же, только молекула TCR-агонист PD1, в слитом формате, способна ингибировать активность NFAT. Ненацеленное антитело-агонист PD-1 оказалось не способно ингибировать активность.
В совокупности, эти результаты демонстрируют, что нацеливание агониста PD-1 на иммунный синапс имеет решающее значение для активности агониста PD-1.
Пример 3
Следующий пример обеспечивает дополнительные доказательства того, что агонист PD-1, слитый с растворимым TCR, может эффективно ингибировать активацию Т-клетки при нацеливании на иммунный синапс.
Слитая молекула TCR-агонист PD1, применяемая в этом примере, была такой же, как описано в Примере 2, в котором агонист PD1 является фрагментом антитела в формате scFv.
В этом случае применяли альтернативный анализ для оценки влияния слитых молекул TCR- агонист PD1 на функцию первичных Т-клеток человека.
Способ
Анализ первичных Т-клеток человека
Первичные Т-клетки человека выделяли из свежеприготовленных МКПК (РВМС) с применением набора для выделения пан-Т-клеток. (Miltenyi, cat no: 130-096-535). HLA-A*02-положительные клетки Raji B (Raji A2B2M) предварительно загружали стафилококковым энтеротоксином B (SEB, 100 нг/мл, Sigma S4881) в течение 1 ч, а затем облучали 33Gy. Для предварительной активации первичные Т-клетки человека инкубировали с SEB-нагруженными клетками-мишенями Raji A2B2M в соотношении 1:1, используя 1x10e6 клеток/мл каждого типа клеток в 24-луночных культуральных планшетах. Первичные Т-клетки человека инкубировали в течение 10 дней с SEB-нагруженными клетками Raji A2B2M с добавлением IL-2 (50 ед/мл) на 3 и 7 день. На 10-й день предварительно активированные Т-клетки промывали и повторно суспендировали в свежей среде. Свежие клетки Raji A2B2M обрабатывали 20 мкМ соответствующего пептида, распознаваемого слитой молекулой TCR-агонист PD1, или оставляли без обработки на 2 ч. Клетки Raji A2B2M загружали SEB (10 нг/мл) в течение последнего 1 ч обработки пептидом, а затем облучали 33Gy. Клетки Raji A2B2M высевали в 96-луночные планшеты для культивирования клеток из расчета 1 × 10E5 клеток/лунку, а затем предварительно инкубировали с титрами слитых молекул TCR-агонист PD1 в течение 1 часа. Предварительно активированные Т-клетки добавляли к клеткам-мишеням Raji A2B2M в количестве 1 × 10E5 клеток/лунку и инкубировали в течение 48 часов. Супернатанты собирали и определяли уровень IL-2 с помощью MSD ИФА (MSD ELISA).
Результаты
Данные, показанные на Фигуре 3, демонстрируют, что слитые молекулы TCR-агониста PD1 дозозависимо ингибируют продукцию IL-2 первичными Т-клетками человека в присутствии обработанных пептидом клеток-мишеней, тогда как ненацеленные слитые молекулы TCR-агониста PD1 (т.е. с необработанными клетками-мишенями) или только агонист PD-1 в формате scFv - нет. Эти данные демонстрируют, что нацеливание агониста PD-1 на иммунный синапс приводит к активности агониста PD-1 в первичных клетках.
Пример 4:
Следующий пример демонстрирует тот же технический результат, который наблюдали при применении TCR, распознающих альтернативные антигены.
Экспериментальная система и способы, примененные в этом примере, были такими же, как и в Примере 2. В этом случае агонистическое антитело к PD-1 сливали с двумя различными растворимыми TCR.
Анализ по репортерной NFAT люциферазе на Jurkat PD-1, описанный в Примере 1, был применен для измерения опосредованного слитой молекулой TCR-агонист PD1 ингибирования активности NFAT Т-клетки в присутствии антигенпрезентирующих клеток-мишеней HEK293T.
Результаты
Как показано на Фигуре 4, сильное и дозозависимое ингибирование наблюдали при введении двух слитых молекул TCR-агонист PD1 (содержащих фрагмент scFv антитела-агониста к PD-1, слитый либо с TCR 1, либо с TCR 2) в присутствии клеток-мишеней, обработанных соответствующими пептидами (пептиды 1 или 2). Для обеих слитых молекул TCR-агонист PD1 наблюдали минимальную активность, когда исследование проводили без присутствия нацеливающего пептида.
Эти результаты демонстрируют, что слитые молекулы TCR-агонист PD1 могут быть направлены на различные ткани с применением растворимых TCR со специфичностью для различных pMHC и способствовать целенаправленному ингибированию активности Т-клеток.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQUENCE LISTING
<110> IMMUNOCORE LIMITED
<120> Бифункциональные связывающие полипептиды
<130> P117978WO
<150> GB 1807767.7
<151> 2018-05-14
<150> GB 1819584.2
<151> 2018-11-30
<160> 2
<170> PatentIn версии 3.5
<210> 1
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Укороченный фрагмент PD-L1
<400> 1
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr
115
<210> 2
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерный PD-L1
<400> 2
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ IMMTAC, СВЯЗЫВАЮЩИЕ РЕСТРИКТИРОВАННЫЙ ПО HLA-A*02 ПЕПТИД, С УВЕЛИЧЕННЫМ ПЕРИОДОМ ПОЛУВЫВЕДЕНИЯ | 2020 |
|
RU2833530C2 |
| CD3-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2826453C2 |
| ИММУНОТЕРАПИЯ С ПРИМЕНЕНИЕМ АНТИТЕЛ, СВЯЗЫВАЮЩИХ БЕЛОК 1 ПРОГРАММИРУЕМОЙ СМЕРТИ КЛЕТОК (PD-1) | 2017 |
|
RU2768404C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811120C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ДЛЯ ВЫРАБОТКИ ТЕРАПЕВТИЧЕСКИХ АНТИТЕЛ ПРОТИВ КОМПЛЕКСОВ ПЕПТИД-MHC, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ВАРИАНТЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2819525C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С PD1 И LAG3 | 2018 |
|
RU2778805C2 |
| РЕАГЕНТЫ ДЛЯ РАЗМНОЖЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЕ РЕЦЕПТОРЫ | 2018 |
|
RU2783956C2 |
| СПЕЦИФИЧНЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2825837C2 |
| НОВЫЕ БИСПЕЦИФИЧНЫЕ ПОЛИПЕПТИДНЫЕ КОМПЛЕКСЫ ПРОТИВ CD3/CD19 | 2018 |
|
RU2788127C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ BCMA И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2785658C2 |
Настоящее изобретение относится к области биотехнологии и может быть применимо в медицине. Предложена бифункциональная полипептидная конструкция, содержащая фрагмент, связывающий пептид, ассоциированный с главным комплексом гистосовместимости (pMHC), а также фрагмент агониста PD-1. Изобретение обеспечивает эффективное ингибирование сигнального пути PD-1 и может быть использовано в медицине, в частности при профилактике или лечении различных аутоиммунных заболеваний. 9 н. и 10 з.п. ф-лы, 4 пр., 4 ил.
1. Бифункциональный связывающий полипептид, способный связываться с пептидом, ассоциированным с главным комплексом гистосовместимости (pMHC), и PD-1, где:
(а) указанный бифункциональный связывающий полипептид по существу состоит из связывающего pMHC фрагмента и агониста PD-1;
(b) указанный агонист PD-1 слит с указанным связывающим pMHC фрагментом посредством пептидного линкера;
(c) указанный связывающий pMHC фрагмент содержит вариабельные домены Т-клеточного рецептора (TCR) и/или вариабельные домены антитела, которые связывают pMHC; и
(d) указанный агонист PD-1 представляет собой PD-L1 или его функциональный фрагмент, или полноразмерное антитело, которое является агонистом PD-1, или его функциональный фрагмент.
2. Бифункциональный связывающий полипептид по п. 1, отличающийся тем, что указанный связывающий pMHC фрагмент представляет собой TCR или TCR-подобное антитело.
3. Бифункциональный связывающий полипептид по любому из предыдущих пунктов, отличающийся тем, что указанный связывающий pMHC фрагмент представляет собой гетеродимерную пару полипептидов альфа/бета TCR.
4. Бифункциональный связывающий полипептид по любому из предыдущих пунктов, отличающийся тем, что указанный связывающий pMHC фрагмент представляет собой одноцепочечный полипептид альфа/бета TCR.
5. Бифункциональный связывающий полипептид по любому из пп. 3, 4, отличающийся тем, что указанный TCR содержит неприродную дисульфидную связь между константной областью альфа-цепи и константной областью бета-цепи.
6. Бифункциональный связывающий полипептид по любому из пп. 3-5, отличающийся тем, что указанный TCR специфически связывается с пептидным антигеном.
7. Бифункциональный связывающий полипептид по п. 6, отличающийся тем, что PD-L1 содержит или состоит из следующей последовательности:
FTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSYRQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPY.
8. Бифункциональный связывающий полипептид по п. 7, отличающийся тем, что указанный агонист PD-1 представляет собой антитело scFv.
9. Бифункциональный связывающий полипептид по любому из предыдущих пунктов, отличающийся тем, что указанный агонист PD-1 слит с C- или N-концом указанного связывающего pMHC фрагмента.
10. Бифункциональный связывающий полипептид по любому из пп. 1–9, отличающийся тем, что указанный линкер составляет 2, 3, 4, 5, 6, 7 или 8 аминокислот в длину.
11. Фармацевтическая композиция для ингибирования PD-1 сигналинга, содержащая в эффективном количестве бифункциональный связывающий полипептид по любому из пп. 1-10 и один или более фармацевтически приемлемый носитель или наполнитель.
12. Нуклеиновая кислота, кодирующая бифункциональный связывающий полипептид по любому из пп. 1-11.
13. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 12.
14. Клетка-хозяин, способная экспрессировать бифункциональный связывающий полипептид, содержащая нуклеиновую кислоту по п. 12 или вектор по п. 13, при этом необязательно нуклеиновая кислота, кодирующая указанный бифункциональный связывающий полипептид, присутствует в виде одной открытой рамки считывания или двух отдельных открытых рамок считывания, кодирующих альфа-цепь и бета-цепь соответственно.
15. Способ получения бифункционального связывающего полипептида по любому из пп. 1-10, включающий поддержание клетки-хозяина по п. 14 в условиях для обеспечения экспрессии нуклеиновой кислоты и выделение указанного бифункционального связывающего пептида.
16. Применение бифункционального связывающего полипептида по любому из пп. 1-10, фармацевтической композиции по п. 11, нуклеиновой кислоты по п. 12 и/или вектора по п. 13 в медицине, в частности для лечения аутоиммунного заболевания.
17. Применение по п. 16, отличающееся тем, что указанное аутоиммунное заболевание представляет собой одно из следующих: очаговая алопеция, анкилозирующий спондилит, атопический дерматит, болезнь Грейвса, рассеянный склероз, псориаз, ревматоидный артрит, системная красная волчанка, диабет 1 типа и витилиго, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, целиакия, заболевания глаз (например, увеит), кожная волчанка и волчаночный нефрит, и аутоиммунное заболевание у онкологических больных, вызванное антагонистами PD-1/PD-L1.
18. Применение бифункционального связывающего полипептида по любому из пп. 1-10, фармацевтической композиции по п. 11, нуклеиновой кислоты по п. 12 и/или вектора по п. 13 при лечении или профилактике боли, в частности боли, связанной с воспалением.
19. Способ лечения аутоиммунного нарушения, включающий введение в эффективном количестве бифункционального связывающего полипептида по любому из пп. 1-10, фармацевтической композиции по п. 11, нуклеиновой кислоты по п. 12 и/или вектора по п. 13 пациенту, нуждающемуся в этом.
| OATES J | |||
| et al.: "ImmTACs: Novel bi-specific agents for targeted cancer therapy ", ONCOIMMUNOLOGY, 01.02.2013, v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| LI Y | |||
| et al.: "Directed evolution of human T-cell receptors with picomolar affinities by phage display", NATURE BIOTECH., 2005, v | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| LIDDY N | |||
| et al.: "Monoclonal TCR-redirected tumor cell killing", NATURE | |||
Авторы
Даты
2023-11-07—Публикация
2019-05-14—Подача