Область техники.
Изобретение относится к микробиологической промышленности, а именно к штамму метилотрофных (метанолокисляющих) бактерий Methylobacillus methanolivorans GSA, который может быть использован для получения белковой биомассы для балансирования кормов для сельскохозяйственных животных.
Уровень техники.
Численность народонаселения планеты Земля перешагнула рубеж в 8 млрд. человек. Для обеспечения населения продуктами питания необходимо интенсифицировать сельское хозяйство, для чего необходимо создать стабильную кормовую базу на основе сбалансированного включения в корма белковых веществ, незаменимых аминокислот, витаминов и микроэлементов.
Проблема дефицита кормового белка является основной причиной низкой эффективности животноводческих комплексов, птицефабрик и рыборазведения, т.к. в себестоимости их продукции 70-80% составляют затраты на корм, от сбалансированности которого зависит экономика этих отраслей сельского хозяйства. Этот дефицит можно ликвидировать путем производства белка одноклеточных (SCP), в том числе и на основе метанола, полученная при этом биомасса по составу и количеству незаменимых аминокислот сопоставима с рыбной и соевой мукой.
К продуцентам кормовой белковой биомассы относятся микроорганизмы различных таксономических групп, способные расти на различных субстратах: грибы, дрожжи, бактерии. Использование каждого типа микробного продуцента белка подбирается исходя из технических условий и экономической эффективности их применения. При этом учитывается потенциал и стабильность свойств продуцента белка.
В патенте РФ №2042713 описан способ получения биомассы, в котором в качестве продуцента используют дрожжеподобные несовершенные грибы рода Candida, в частности штамм Candida tropicalis ВСБ-928К [1]. Недостатком известных штаммов микроорганизмов является отсутствие способности к активному росту в условиях длительного нестерильного процесса культивирования, а также их условная патогенность, что требует выполнения дополнительного процесса термолиза и наличия специального оборудования, сложной системы обезвреживания стоков и воздушных выбросов при значительных объемах используемого воздуха. Кроме того, дрожжевая биомасса проигрывает бактериальной по уровню сырого протеина, составу и количеству аминокислот, включая незаменимые.
В качестве продуцентов белковой биомассы широко используются штаммы бактерий. В качестве продуцента белкового компонента корма, бактерии более эффективны. В частности, они образуют до 79% белка по массе, в то время как дрожжи - не более 60%.
В качестве примера, включающего, но не ограничивающего применения бактерий в качестве продуцента белкового корма можно привести бактериальные штаммы Lactobacillus plantarum. Известен штамм Lactobacillus plantarum 578/26 - продуцент белкового корма, депонированный в ГНУ ВНИИПБТ Россельхозакадемии (патент РФ 2390554) [2]. Общим недостатком бактериальных штаммов является нестабильный выход биомассы, а также их недостаточно высокая продуктивность.
Известно применение смешанных культур микроорганизмов. В патенте РФ №2601122 описано применение смешанной культуры содержащей бактерии Cellulosimicrobium funkei ВКПМ АС-1948, дрожжеподобный гриб Trichosporon mycotoxinivorans ВКПМ Y-3975, и дрожжи Saccharomyces cerevisiae ВКПМ Y-3585 для получения кормового белка из древесных опилок с содержанием белка 20-45% в готовом продукте [3].
Известны штаммы бактерий, продуцирующие кормовой белок, с использованием различных видов метанокисляющих бактерий. В патенте РФ №2763052 описан штамм метанокисляющих бактерий Methylococcus capsulatus ЛБТИ-029, регистрационный номер ВКПМ В-13554 [4]. Штамм относится к облигатным метанокисляющим бактериям. В качестве единственного источника углерода усваивает метан, в том числе и в составе природного газа. Однако скорость роста культуры в непрерывном режиме культивирования недостаточно высока (0,30 ч-1).
Для биосинтеза микробной белковой массы широко применяются и метилотрофные микроорганизмы, использующие в качестве источника углерода и энергии метанол. Применение метанола имеет очевидные преимущества поскольку метанол превосходно растворим в воде, обладает высокой химической чистотой, доступен по сравнительно низкой цене, требует меньше кислорода и образует меньше тепла в процессе культивирования, чем н-парафины и метан, что снижает затраты на перемешивание и охлаждение. В отличие от взрывоопасного метана, метанол не требует баростойких емкостей для хранения и транспортировки.
Известен штамм Methylophilus methylotrophus AS1, промышленное производство белково-витаминного концентрата на основе этого облигатного метилотрофного продуцента из метанола было впервые реализовано фирмой ICI в Великобритании в 1980-х гг. [5]. Непрерывный, полностью автоматизированный процесс ферментации проводили под давлением в асептическом биореакторе с рабочим объемом 1500 м3 и производительностью 50000-70000 т белка «Pruteen» в год. К недостаткам штамма можно отнести одновременное образование 2-х видов полисахаридов, что снижало выход основного целевого белкового продукта.
Известно применение штамма метанолокисляющих бактерий Acidomonas methanolica BF 21-05М ВКПМ В-14051 для получения белково-витаминных комплексов (Патент РФ №2773502) [6]. К недостатку можно отнести необходимость отбора культуральной жидкости на выходе из ферментера, отделения от клеток в нестерильном режиме и возвращения в ферментационный процесс вместо воды.
В 1985 году было выдано авторское свидетельство № SU 989867, в котором описан штамм облигатно-метилотрофной бактерии Methylobacillus methylophilus БСБ-792, которая представляла собой первую в СССР культуру облигатно-метилотрофных бактерий. Этот штамм использовался в качестве продуцента белково-витаминной биомассы на основе метанола [7]. Штамм, депонирован в коллекция Всесоюзного научно-исследовательского института генетики и селекции промышленных микроорганизмов под номером ЦМПМ В-1946.
Штамм хорошо растет на минеральных средах с метанолом с достаточно высокой скоростью роста, скорость протока при непрерывной культуре до 0,5 ч-1. Однако при этом снижается выход биомассы на 15%. Выход биомассы на тонну метанола составлял 54%. при высоком содержании сырого протеина (80 - 85%) к сухому весу. Дополнительно штамм характеризуется высоким содержанием витамина В2, до 100 мкг/г., а также более 1000 мкг/г НАД-кофермента. Штамм стабилен при непрерывном выращивании, сохраняется в нестерильных условиях, легко поддерживается в лабораторных условиях, нелизогенен. Недостатком штамма является выделение в среду при определенных условиях большого количества полисахарида, что может препятствовать непрерывному способу ведения процесса ферментации и снижает целевую ассимиляцию питательных веществ. Данный штамм принят в качестве наиболее близкого аналога заявляемого изобретения.
Задачи, на решение которых направлено заявляемое изобретение, относятся к получению нового штамма-продуцента, обладающего более высоким технологическим потенциалом для промышленного биосинтеза микробного белка на метаноле, а также к расширению арсенала метилотрофных штаммов для биосинтеза белковой биомассы.
Поставленные задачи решаются за счет достижения таких технических результатов, как обнаружение нового метилотрофного штамма Methylobacillus methanolivorans GSA, депонированного под номером ВКМ B-3694D и использование нового штамма в качестве штамма-продуцента кормового белка на основе использования метанола.
Описание изобретения
При совершенствовании промышленной технологии получения белковой биомассы решались задачи повышения эффективности способа продленного периодического культивирования на основе нового штамма-продуцента.
Заявленный штамм Methylobacillus methanolivorans GSA депонирован во Всероссийской Коллекции Микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина, обособленного подразделения Федерального исследовательского центра «Пущинский научный центр биологических исследований Российской Академии наук» под регистрационным номером ВКМ В-3694D.
Штамм Methylobacillus methanolivorans GSA ВКМ B-3694D был получен из активного ила очистных сооружений Кехраского целлюлозо-бумажного завода г. Кехра, Эстония.
Штамм Methylobacillus methanolivorans GSA ВКМ B-3694D имеет следующие характеристики:
Культурально-морфологические характеристики
На среде с метанолом заявленный штамм представлен грамотрицательными, аспорогенными палочками, размером 0,4-0,5 × 1,5-2,5 мкм. Клетки штамма GSA размножаются бинарным делением, подвижны за счет одного полярного жгутика. На агаре с минеральными солями и метанолом формируются колонии от белого до светло-кремового цвета, круглые, диаметром 1-2 мм, с блестящей поверхностью, выпуклые, блестящие, вязкой однородной консистенции.
Физиологические и биохимические характеристики
Клетки штамма Methylobacillus methanolivorans GSA ВКМ B-3694D Строго аэробные, каталазо-, оксидазо- и уреазоположительные. Растут в диапазоне рН 6,0-8,0 и температур 10-40°С.Оптимально растут при 29-35°С и рН 6,5-7,5 и с 0,05% (масса/объем) NaCl. В присутствии 1% (мас./об.) NaCl не растут. Нитраты восстанавливаются до нитритов. Образует индол-3-уксусную кислоту из триптофана на среде с нитратом в качестве источника азота. Ацетоин и H2S не образуют, желатин не разжижают. Никаких витаминов или других факторов для роста не требуется. Облигатные метилотрофы, утилизирующие только метанол. Окисляет метанол метанолдегидрогеназой, связанной с PQQ, до формальдегида и ассимилирует его по пути RuMP (вариант Энтнера-Дудорова). Трикарбоновый цикл является незавершенным из-за отсутствия активности α-кетоглутаратдегидрогеназы. Ферменты глиоксилатного шунта и рибулозобисфосфаткарбоксилаза отсутствуют. Аммиак усваивается глутаматдегидрогеназой. Источниками азота служат нитраты, соли аммония и мочевина. Не растут на богатых средах с триптоном или LB среде.
В качестве источника углерода и энергии клетки используют только метанол, достигая высокой удельной скорости роста μ=0,4 - 0,5 ч-1.
Хемотаксономические характеристики
Преобладающими клеточными жирными кислотами являются С16:0 и С16:1ω7с. Основным убихиноном является Q-8. Преобладающими фосфолипидами являются фосфатидилэтаноламин, фосфатидилглицерин и дифосфатидилглицерин (кардиолипин). Штамм устойчив к стрептомицину, эритромицину, ампициллину, линкомицину, олеандомицину и неомицину, но чувствителен к канамицину, налидиксовой кислоте, гентамицину и новобиоцину в концентрациях, указанных на дисках. Содержание ДНК G+C составляет 51,0 моль% (Tm).
Условия хранения: штамм может храниться путем замораживания в культуральной среде с 10% диметилсульфоксида, а также на стерильной стекловолокнистой бумаге при -20 или -80°С, с периодом обновления 1 раз в год. Исследуемый штамм GSA хорошо выживает в лиофилизованном состоянии в ампулах.
Генотипические характеристики
Выделение геномной ДНК проводили по методу Мармура [8] с последующим анализом. Ген, кодирующий 16S рРНК амплифицировали с использованием опубликованных праймерных систем [9]. Продукты реакции разделяли методом электрофореза в 1%-ном агарозном геле. Ампликоны очищали с помощью ZR Fungal/Bacterial DNA MiniPrep ("Zymo Research", США), секвенировали на автоматическом секвенаторе CEQ2000 XL ("Beckman Coulter", США).
Для установления точной видовой принадлежности нового изолята в данной работе провели секвенирование гена 16S рРНК. Филогенетический анализ проводили с помощью пакетов программ BLAST [http://ncbi.nlm.nih.gov] [10], CLUSTAL W [11], MEGA версия 5 [12] методом "neighbor-joining" [13].
Филогенетический анализ нуклеотидных последовательностей гена 16S рРНК показал, что штамм GSA имеет наибольшее сходство с представителями рода Methylobacillus: 100% с Methylobacillus methanolivorans VKM В-3037Т и 96,72 - 98,89% с другими видами этого рода. Таким образом, на основании секвенирования гена 16S рРНК штамм GSA относится к известному виду Methylobacillus methanolivorans [14].
Изобретение подтверждено следующими примерами
Пример 1. Для культивирования Methylobacillus methanolivorans GSA ВКМ B-3694D применяют питательные среды следующего состава, г/л: Среда «К» содержит (г/л): КН2РO4 - 2,0; (NH4)2SO4 - 2,0; MgSO4⋅7H2O - 0,025; NaCl - 0,5; FeSO4⋅7H2O - 0,002, рН 7,2 и 0,5% (об./об.) СН3ОН. Значение рН доводили до 7,4 добавлением 5 М NaOH. Агаризованную среду «К» готовят путем добавления 2,0% (масса/объем) агара (Difco).
В качестве источника микроэлементов для культивирования вносят 1 мл/л раствора микроэлементов SL10 (г/л): FeCl2⋅4 H2O/FeSO4⋅7H2O - 1.500; ZnCl2 - 0.070; MnCl2⋅4Н2О - 0.200; Н3ВО3 - 0.006; CoCl2⋅6Н2О - 0.190; CuCl2⋅2H2O - 0.002; NiCl2⋅6 H2O - 0.024; Na2MoO4 × 2 H2O - 0.036, HCl (конц.) - 5.000 мл. Метилобактерии выращивали в колбах Эрленмейера объемом 750 мл, содержащих 200 мл среды «К» с 0.5% (по объему) метанола, на качалке (180 об/мин) при 29°С. Для проверки чистоты культур использовали агаризованную среду 5/5, следующего состава (г/л): бакто-триптон (Pronadisa, Испания) - 5,0; соевый пептон (Difco, США) - 5,0; дрожжевой экстракт - 1,0; аминопептид (Самсон-Мед, Россия) - 60 мл, агар - 15,0.
Полученную культуру используют в качестве посевного материала для последующего выращивания бактерий в автоматизированном ферментационном комплексе объемом 30 л (рабочий объем 22 л).
Пример 2. Периодическое культивирование метилотрофного штамма Methylobacillus methanolivorans GSA ВКМ B-3694D проводили в аппаратах управляемого культивирования АНКУМ-2М с объемом в 10 л, рабочий объем среды 6 л) со стерильной средой (5 л) доводили рН до 7.0 с помощью раствора 10% NaOH до стерилизации. Затем рН среды поддерживали на уровне 7.0 с помощью 10% раствора аммиака. В случае повышения рН выше нормы, рН доводят до 7.0 с помощью 10% раствора H2SO4.
Инокулятом служила суточная культура метилотрофных бактерий, выращенная в колбах объемом 750 мл с 200 мл согласно примеру 1. Инокулят стерильно сливали в колбу с отростком и засевали ферментер после его охлаждения до 35°С, в которой содержалась среда следующего состава (г/л): (NH4)2SO4 - 4.0; NaH2PO4 ⋅ 2H2O - 0.8; K2HPO4 ⋅ 3H2O - 0.8; MgSO4 ⋅ 7H2O - 0.2; CaCl2 - 0.02; Трилон Б - 5⋅10-3; FeSO4 ⋅ 7H2O - 2⋅10-3; ZnSO4 ⋅ 7H2O - 10-4; MnCl2 ⋅ 4 H2O - 3⋅10-5; CoCl2 ⋅ 6 H2O - 2⋅10-4; CuSO4 ⋅ 2 H2O - 10-4; NiCl2 ⋅ 6 H2O - 2⋅10-5; Na2MoO4 - 3⋅10-5; Н3ВО3 - 3⋅10-4; дистиллированная вода - остальное.
В ферментер вносили метанол из расчета 1 мл на 1 л среды. По мере роста культуры в ферментер подавали дозы метанола в размере от 1 мл/л до 10 мл/л На первом этапе оптимальная концентрация метанола в среде 1-2 мл/л, но при высокой оптической плотности культуры концентрацию увеличивают. Температуру жидкости в ферментере поддерживают автоматически на уровне 35°С.
Значение рО2 поддерживали на уровне 30%-ного от насыщения воздухом и числе оборотов мешалки 1000 об./мин. В случае вспенивания культуральной жидкости в ферментер подавали пеногаситель очень маленькими порциями. Измерение оптической плотности культуры сначала проводили через каждые 4 часа, после достижения ОП=10 замер проводили каждые 2 часа. При достижении оптической плотности ОП600=10 вносили концентрат среды.
В ходе ферментации достигнуты показатели роста культуры: μmax - 0,495; YX/CH3OH - 0,113 /г метанола. Биомассу, полученную в этом эксперименте, отцентрифугировали и лиофилизовали.
Пример 3. Характеристики аминокислотного состава клеток штамма GSA
Для определения аминокислотного состава, клетки отбирают из экспоненциальной фазы роста, центрифугируют (10000g, 20 мин) при 2-4°С и 5 раз отмывают 100 кратным объемом дистиллированной воды. Полученную биомассу лиофилизировали, досушивали до постоянного веса при 80°С под вакуумом.
Образцы биомассы (6 мг) гидролизовали в запаянных ампулах с 5 мл 6н HCl в течение 48 ч при 105°С. Гидролизаты упаривали в роторном испарителе при 40°С. Следы соляной кислоты удаляли из гидролизатов путем выдерживания их в эксикаторе над твердым KOH. Упаренные гидролизаты растворяли в 3 мл 0.2 н цитратного буфера рН 2.2 и анализировали на автоматическом анализаторе аминокислот LC000E «Биотроник» (Германия).
В лиофилизованной и доведенной до постоянного веса биомассе определяли суммарное количество нуклеиновых кислот [15]. Содержание нуклеиновых кислот у штамма GSA составляло 11.5%.
Данные по сравнению содержания аминокислот и белка в биомассе метилотрофного штамма GSA по отношению к метилотрофным референтным штаммам Methylobacillus viscogenes V (ВКМ В-1836Д) [16], Methylophilus glucosoxydans В (ВКМ В-1607 Т) [17] и Methylophilus methylotrophus ASIT (ВКМ В-1623 Т=NCIMB 10515Т) [18] приведены в Таблице 1.
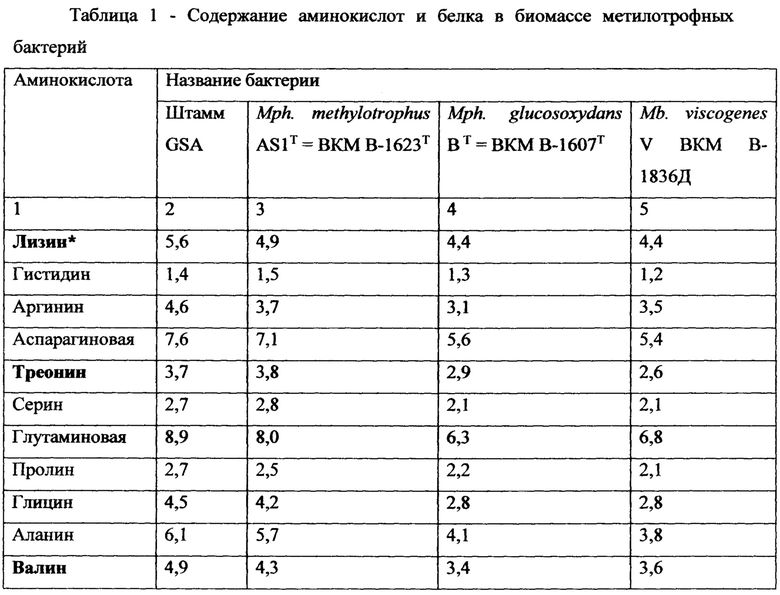

Содержание белка в биомассе определяли по сумме аминокислот. По составу и количеству аминокислот биомасса исследуемых бактерий сопоставима с рыбной и соевой мукой [19], что свидетельствует о ее высокой питательной ценности.
Пример 4. Жирнокислотный состав клеток штамма GSA определяли в системе Шерлок. Пробу сухой биомассы клеток (5 мг) обрабатывали кислым метанолизом. Образовавшиеся метиловые эфиры жирных кислот и диметилацетали экстрагировали гексаном. Для анализа 2 мкл смеси вводили в автоматическом режиме с помощью автосэмплера Hewlett-Packard 7673А в инжектор газового хроматографа системы Шерлок для идентификации микроорганизмов по профилю жирных кислот (Microbial identification System, Microbial ID Inc. Newark, Del. US), используя параметры хроматографирования, рекомендованные инструкцией к прибору (Microbial ID Inc.).
По современным представлениям, жирные кислоты с нечетным числом углеродных атомов, не обладая значительной токсичностью, тем не менее, изменяют благоприятный химический состав продуктов или оказывают отрицательное влияние на процессы трансформации обычных пищевых веществ. По этой причине присутствие таких кислот в биомассе одноклеточных нежелательно. В составе жирных кислот штамма GSA преобладают C16:0 и С16:1 (Таблица 2).

Таким образом, новый изолят является представителем непатогенного рода метилобактерий Methylobacillus и может быть использован в биотехнологии. Биомасса изучаемого метилотрофа содержит высокий уровень жирных кислот характерных для обычных пищевых продуктов.
Пример 5. Определение степени перевариваемости биомассы штамма GSA протеолитическими ферментами
Перевариваемость клеток из экспоненциальной фазы роста рассчитывали как отношение растворенного азота к общему азоту биомассы после ее обработки протеолитическими ферментами (пепсином и трипсином) и выражали в процентах [20].
Для определения растворенного азота 1 г отмытых дистиллированной водой клеток помещали в 100 мл колбу Эрленмейера и смешивали с 20 мл 0,1 н. HCl, добавляли 1 мл раствора пепсина (50 ед.) и инкубировали при 38С в течение 24 ч на качалке (140 об/мин). Далее суспензию клеток нейтрализовали раствором бикарбоната натрия, добавляли 10 мл 0,1 М К-фосфатного буфера, рН 8,0, 5 мл трипсина (2,5 ед.) и инкубировали в тех же условиях 24 часа. По окончании инкубации суспензию центрифугировали (10000g, 10 мин), осадок трижды отмывали 15 мл 5% ТХУ и отбрасывали. Супернатанты объединяли и доводили до 100 мл. В полученном растворе определяли азот по Кьельдалю [21].
Для определения общего азота клеток 100 мг отмытой биомассы помещали в пробирку, заливали 4 мл конц. H2SO4 и нагревали в течение 3 мин в кипящей водяной бане. 1 мл пробы сжигали в 2 мл конц. H2SO4 в присутствии 200 мг селенового катализатора, приготовленного путем растирания и смешивания 100 г K2SO4, 10 г CuSO4 и 2 г селена. Далее азот определяли по Кьельдалю. Степень перевариваемости биомассы в контрольных опытах (инкубация клеток в указанных условиях без добавления экзогенных протеиназ) составляла 3-4%.
Определение степени перевариваемости биомассы штамма GSA показало, что она достаточно полно расщепляется под действием протеолитических ферментов и составляет 97.1%.
Предлагаемый штамм Methylobacillus methanolivorans GSA ВКМ B-3694D отличается от наиболее близкого прототипа Methylobacillus methylophilus БСБ-792 ЦМПМ В-1946 [7] по следующим признакам: поддерживает высокую скорость роста 0,5 ч-1 без снижения выхода биомассы на 15%, имеет более высокий выход биомассы, составляющий 60 - 65% на тонну метанола, имеет высокое значение общей суммы аминокислот, составляющей 70,9%, в число которых входят 7 незаменимых аминокислот, имеет в своем составе жирные кислоты с преобладанием C16:0 и C16:1, имеет высокую величину в 97,1% перевариваемости биомассы.
Таким образом, с учетом характеристик штамма ВКМ B-3536D, его применение дает возможность проводить балансирование состава белковой биомассы кормов для сельскохозяйственных животных.
Из приведенного изложения ясно, что изобретение не ограничивается приведенной реализацией. Многочисленные возможные модификации, изменения, вариации и замены, сохраняющие суть и форму настоящего изобретения, очевидны для квалифицированных в предметной области специалистов.
Приведенные примеры подтверждают промышленную применимость данного изобретения. Важным показателем биологической ценности микробной биомассы являются аминокислотный состав и содержание белка. Биомасса исследуемых бактерий характеризуется достаточно высоким содержанием белка и незаменимых аминокислот (Таблица 1). Сравнение аминокислотного состава исследуемых штаммов с составом обычных продуктов питания [22] показывает, что первые менее сбалансированы, чем полноценные продукты животного происхождения (казеин), но имеют определенные преимущества относительно некоторых продуктов растительного происхождения, например, хлеба из пшеничной муки. Штамм GSA, имеет среди других исследуемых штаммов наиболее высокое содержание лизина и белка в биомассе. Наряду с лизином в аминокислотном составе штамма GSA доминировали лейцин (незаменимые), а также аланин, аспарагиновая и глутаминовая аминокислоты.
Создание отечественного фонда культур, активно растущих за счет метанола и обладающих ценными признаками, является необходимым условием развития отечественного кормопроизводства, животноводства, способствует повышению уровня продовольственной безопасности, формирует технологический суверенитет нашей страны.
Поставщиками метанола могут быть предприятия системы «Азот», поставляя не только метанол, но и метанол-сырец. Метанол можно получить и из попутного нефтяного газа (ПНГ) непосредственно на нефтяных месторождениях по одностадийному плазмо-химическому методу с низкой себестоимостью, при этом его доставка на производство белка может производится в спиртовых танк-контейнерах по железной дороге или автоцистернах.
Таким образом, создан новый штамма микроорганизма, который можно использовать в качестве продуцента микробного белка, что обеспечило расширение арсенала технических средств данного назначения.
Источники информации
1. Коваленко Ю.Ф., и др. СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ. Патент РФ №2042713 (27.08.1995).
2. Честнов С.Н. ШТАММ Lactobacillus plantarum - ПРОДУЦЕНТ КОРМОВОГО БЕЛКА. Патент РФ №2390554 (27.05.2010).
3. Воробьева Г.И. СМЕШАННАЯ КУЛЬТУРА Cellulosimicrobium funkei, Trichosporon mycotoxinivorans, Saccharomyces cerevisiae - ПРОДУЦЕНТ КОРМОВОГО БЕЛКОВОГО ПРОДУКТА НА ДРЕВЕСНЫХ ОПИЛКАХ. Патент РФ №2601122 (27.10.2016).
4. Заборская Т.М. Небойша Я. Штамм бактерий Methylococcus capsulatus ВКПМ В-13554 - источник кормового белка. Патент РФ №2763052 (27.12.2021).
5. Muffler K. et al. 2.09 - Bio-Feedstocks in Comprehensive Biotechnology (Second Edition), Volume 2, 2011, Pages 93-101.
6. Сафонов А.И. и др. Штамм метанолокисляющих бактерий Acidomonas methanolica BF 21-05М - продуцент для получения микробной белковой массы. Патент РФ №2773502 (07.06.2022).
7. Диканская Э.М. и др. Штамм облигатно-метилотрофной бактерии Methylobacillus methylophilus БСБ-792/ Авт.Св. № SU 989867 (15/10/85).
8. Marmur, J. A procedure for the isolation of deoxyribonucleic acid from micro-organisms. Journal of Molecular Biology - 1961. - V. 3. - P.208-218.
9. Lane, D.J. 16S/23S rRNA sequencing. In Nucleic acid techniques in bacterial systematics. Eds.: Stackebrandt E., Goodfellow M. Chichester: John Wiley and Sons. 1991. P. 115-175.
10. NCBI Blast [Электронный ресурс]: URL: https://blast.ncbi.nlm.mh.gov/Blast.cgi?PROGRAM=blastn&PAGE_TWE=BlastSear ch&LINK_LOC=blasthome (дата обращения: 12.04.2023).
11. Thompson J.D. et al. The ClustalX windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res. - 1997. - V. 25. - P. 4876-4882.
12. Tamura K. et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony. Mol. Biol. Evol. - 2011. - V. 28. - P. 2731-2739.
13. Saitou, N., Nei, M. The neighbour-joining method: a new method for reconstructing phylogenetic trees. Mol. Biol. Evol. - 1987. - V. 4. - P. 405-425.
14. Kaparullina EN, Trotsenko YA, Doronina NV. Methylobacillus methanolivorans sp. nov., a novel non-pigmented obligately methylotrophic bacterium. Int J Syst Evol Microbiol - 2017. - V. 67 - P. 425-431.
15. Спирин А.С. Спектрофотометрическое определение суммарного количества нуклеиновых кислот. Биохимия, 1958, Т. 23, №5, С. 656.
16. Доронина, Н.В., Троценко, Ю.А. Methylobacillus viscogenes - новый вид облигатно-метилотрофных бактерий, образующих экзополисахарид. Микробиология. - 1991. - Т. 60. - №5. - С. 908-914.
17. Doronina, NV, Gogleva, АА, Trotsenko, YA. Methylophilus glucosoxydans sp. nov., a restricted facultative methylotroph from rice rhizosphere. Int J Syst Evol Microbiol. - 2012 - V. 62. P. - 196-201.
18. Jenkins, O, Byrom, D, Jones, D. Methylophilus: a new genus of methanol-utilizing bacteria. Int. J. Syst. Bacteriol - 1987. - V. 37. - P. 446-448.
19. Klass DL., Lanaulo JJ, Knabel SJ. Key process factors in the microbial conversion of methane to protein. Chem. Eng. Progr. Symp. Series. 1969. V. 65. P. 72.
20. Альбицкая O.H. и др. Характеристика белкового продукта из биомассы Spirulina platensis. Прикладная биохимия и микробиология, 1979, 5:751.
21. Ермаков А. И. и др. Методы биохимического исследования растений. Под ред. А.И. Ермакова. - 2-е изд., перераб. и доп. - Ленинград: Колос, 1972. - 456 с.
22. Микробиологические исследования углеводородных дрожжей (1964 - 1970 гг.), М: Наука 1972, С. 468.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Methylobacterium extorquens ВКПМ В-14231 - продуцент микробной белковой массы | 2022 |
|
RU2796376C1 |
| Штамм облигатно-метилотрофной бактерии @ @ ВСБ-792 | 1980 |
|
SU989867A1 |
| Штамм Methylobacterium populi ВКПМ В-14346 - продуцент микробной белковой массы | 2024 |
|
RU2835677C1 |
| Штамм дрожжей Ogataea parapolymorpha ВКПМ Y-5081 - продуцент белковой биомассы | 2023 |
|
RU2796923C1 |
| Ассоциация штаммов бактерий для получения микробной белковой биомассы (варианты) | 2022 |
|
RU2793472C1 |
| Штамм метанокисляющих бактерий Methylococcus capsulatus BF19-07 - продуцент для получения микробной белковой массы | 2020 |
|
RU2745093C1 |
| Штамм Methylococcus capsulatus - продуцент высокобелковой биомассы | 2022 |
|
RU2787202C1 |
| Штамм гетеротрофных бактерий Cupriavidus gilardii - ассоциант для получения микробной белковой массы | 2018 |
|
RU2687135C1 |
| Штамм гетеротрофных бактерий Stenotrophomonas acidaminiphila GBS-15-2 - ассоциант для получения микробной белковой массы | 2018 |
|
RU2687136C1 |
| Штамм бактерий Methylococcus capsulatus CONCEPT-8 - продуцент белковой биомассы | 2018 |
|
RU2706074C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой штамм Methylobacillus methanolivorans GSA, депонированный во Всероссийской Коллекции Микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина, обособленного подразделения Федерального исследовательского центра «Путинский научный центр биологических исследований Российской Академии наук» (ВКМ ИБФМ ФИЦ ПНЦБИ РАН) под регистрационным номером ВКМ B-3694D. Заявленный штамм используется в качестве продуцента микробной белковой массы. Это обеспечивает возможность применения биомассы бактерий заявленного штамма для балансирования кормов сельскохозяйственных животных. 2 н.п. ф-лы, 2 табл.
1. Штамм Methylobacillus methanolivorans GSA, депонированный во Всероссийской Коллекции Микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина, обособленного подразделения Федерального исследовательского центра «Пущинский научный центр биологических исследований Российской Академии наук» под регистрационным номером ВКМ B-3694D, в качестве продуцента микробной белковой массы.
2. Применение штамма Methylobacillus methanolivorans GSA ВКМ B-3694D для балансирования кормов сельскохозяйственных животных.
| Штамм облигатно-метилотрофной бактерии @ @ ВСБ-792 | 1980 |
|
SU989867A1 |
| KAPARULLINA EN, Methylobacillus methanolivorans sp | |||
| nov., a novel non-pigmented obligately methylotrophic bacterium | |||
| Int J Syst Evol Microbiol, 2017, v | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ СКОРОСТИ ТЕЧЕНИЯ ВОДЫ И ОДНОВРЕМЕННОГО ПОЛУЧЕНИЯ ПРОБ ЕЕ | 1925 |
|
SU425A1 |
| ШТАММ Lactobacillus plantarum - ПРОДУЦЕНТ КОРМОВОГО БЕЛКА | 2007 |
|
RU2390554C2 |
Авторы
Даты
2023-11-23—Публикация
2023-06-07—Подача