Список последовательностей
Настоящая заявка содержит список последовательностей, который был представлен в электронном виде в формате ASCII и включен в настоящую заявку посредством ссылки во всей полноте. Указанная копия ASCII, созданная ______________, имеет название __________________________ и имеет размер _______ байт.
Предпосылки создания изобретения
Белки RAS являются важными компонентами клеточных сигнальных путей. Онкогенная активация белков RAS путем мутации часто обнаруживается при нескольких типах рака, включая рак поджелудочной железы. По-прежнему существует потребность в новых и более эффективных методах лечения рака.
Сущность изобретения
Настоящее изобретение обеспечивает соединения, которые можно использовать в методах терапии.
Соответственно, в первом аспекте изобретение обеспечивает соединение, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS включает или состоит из аминокислотной последовательности, выбранной из группы, состоящей из YKLVVVGADGVGKSALTI (SEQ ID NO:23), YKLVVVGAVGVGKSALTI (SEQ ID NO:24), YKLVVVGARGVGKSALTI (SEQ ID NO:25), YKLVVVGAAGVGKSALTI (SEQ ID NO:26), YKLVVVGASGVGKSALTI (SEQ ID NO:27), YKLVVVGACGVGKSALTI (SEQ ID NO:28), YKLVVVGATGVGKSALTI (SEQ ID NO:29) и YKLVVVGAGDVGKSALTI (SEQ ID NO:30).
Во втором аспекте изобретение обеспечивает соединение, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS включает или состоит из аминокислотной последовательности, выбранной из группы, состоящей из CYKLVVVGADGVGKSALTI (SEQ ID NO:1), CYKLVVVGAVGVGKSALTI (SEQ ID NO:2), CYKLVVVGARGVGKSALTI (SEQ ID NO:3), CYKLVVVGAAGVGKSALTI (SEQ ID NO:4), CYKLVVVGASGVGKSALTI (SEQ ID NO:5), CYKLVVVGACGVGKSALTI (SEQ ID NO:6), CYKLVVVGATGVGKSALTI (SEQ ID NO:22) и CYKLVVVGAGDVGKSALTI (SEQ ID NO:7).
В одном варианте осуществления первого и второго аспектов настоящего изобретения мутантная последовательность KRAS, на ее N-конце, конъюгирована с линкером через цистеин-малеимидную связь.
В другом варианте осуществления первого и второго аспектов настоящего изобретения линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
В дополнительном варианте осуществления первого и второго аспектов настоящего изобретения мутантная последовательность KRAS, на ее N-конце, конъюгирована со следующей структурой:
 .
.
В третьем аспекте изобретение обеспечивает композицию, включающую одно или несколько соединений первого и второго аспектов настоящего изобретения и фармацевтически приемлемый носитель.
В одном варианте осуществления третьего аспекта настоящего изобретения композиция включает (1) соединение, включающее аминокислотную последовательность YKLVVVGADGVGKSALTI (SEQ ID NO:23), (2) соединение, включающее аминокислотную последовательность YKLVVVGAVGVGKSALTI (SEQ ID NO:24), (3) соединение, включающее аминокислотную последовательность YKLVVVGARGVGKSALTI (SEQ ID NO:25), (4) соединение, включающее аминокислотную последовательность YKLVVVGAAGVGKSALTI (SEQ ID NO:26), (5) соединение, включающее аминокислотную последовательность YKLVVVGASGVGKSALTI (SEQ ID NO:27), (6) соединение, включающее аминокислотную последовательность YKLVVVGACGVGKSALTI (SEQ ID NO:28), или соединение, включающее аминокислотную последовательность YKLVVVGATGVGKSALTI (SEQ ID NO:29), и (7) соединение, включающее аминокислотную последовательность YKLVVVGAGDVGKSALTI (SEQ ID NO:30).
В одном варианте осуществления третьего аспекта настоящего изобретения композиция включает (1) соединение, включающее аминокислотную последовательность YKLVVVGADGVGKSALTI (SEQ ID NO:23), (2) соединение, включающее аминокислотную последовательность YKLVVVGAVGVGKSALTI (SEQ ID NO:24), (3) соединение, включающее аминокислотную последовательность YKLVVVGARGVGKSALTI (SEQ ID NO:25), (4) соединение, включающее аминокислотную последовательность YKLVVVGAAGVGKSALTI (SEQ ID NO:26), (5) соединение, включающее аминокислотную последовательность YKLVVVGASGVGKSALTI (SEQ ID NO:27), (6) соединение, включающее аминокислотную последовательность YKLVVVGACGVGKSALTI (SEQ ID NO:28), и (7) соединение, включающее аминокислотную последовательность YKLVVVGAGDVGKSALTI (SEQ ID NO:30).
В другом варианте осуществления третьего аспекта настоящего изобретения композиция включает (1) соединение, включающее аминокислотную последовательность CYKLVVVGADGVGKSALTI (SEQ ID NO:1), (2) соединение, включающее аминокислотную последовательность CYKLVVVGAVGVGKSALTI (SEQ ID NO:2), (3) соединение, включающее аминокислотную последовательность CYKLVVVGARGVGKSALTI (SEQ ID NO:3), (4) соединение, включающее аминокислотную последовательность CYKLVVVGAAGVGKSALTI (SEQ ID NO:4), (5) соединение, включающее аминокислотную последовательность CYKLVVVGASGVGKSALTI (SEQ ID NO:5), (6) соединение, включающее аминокислотную последовательность CYKLVVVGACGVGKSALTI (SEQ ID NO:6), или соединение, включающее аминокислотную последовательность CYKLVVVGATGVGKSALTI (SEQ ID NO:22), и (7) соединение, включающее аминокислотную последовательность CYKLVVVGAGDVGKSALTI (SEQ ID NO:7).
В другом варианте осуществления третьего аспекта настоящего изобретения композиция включает (1) соединение, включающее аминокислотную последовательность CYKLVVVGADGVGKSALTI (SEQ ID NO:1), (2) соединение, включающее аминокислотную последовательность CYKLVVVGAVGVGKSALTI (SEQ ID NO:2), (3) соединение, включающее аминокислотную последовательность CYKLVVVGARGVGKSALTI (SEQ ID NO:3), (4) соединение, включающее аминокислотную последовательность CYKLVVVGAAGVGKSALTI (SEQ ID NO:4), (5) соединение, включающее аминокислотную последовательность CYKLVVVGASGVGKSALTI (SEQ ID NO:5), (6) соединение, включающее аминокислотную последовательность CYKLVVVGACGVGKSALTI (SEQ ID NO:6), и (7) соединение, включающее аминокислотную последовательность CYKLVVVGAGDVGKSALTI (SEQ ID NO:7).
В некоторых вариантах осуществления в композицию включено 700 мкг каждого соединения.
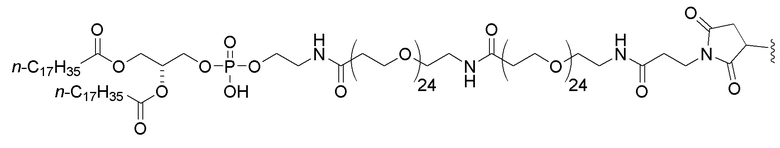
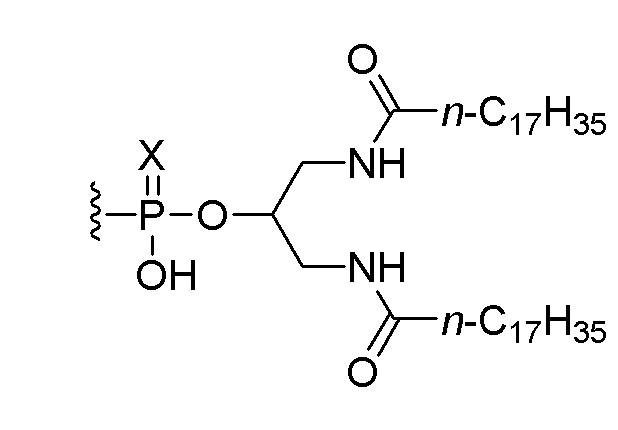
В дополнительном варианте осуществления третьего аспекта настоящего изобретения композиция дополнительно включает соединение, состоящее из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
 ,
,
или его солью, где Х представляет собой О или S. В одном варианте осуществления нуклеотидная последовательность связана с липидом. В другом варианте осуществления все межнуклеозидные группы, соединяющие нуклеозиды в 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), представляют собой фосфоротиоаты.
В четвертом аспекте изобретение обеспечивает способ лечения рака у пациента, при этом способ включает введение пациенту композиции согласно третьему аспекту настоящего изобретения.
В одном варианте осуществления четвертого аспекта настоящего изобретения способ дополнительно включает введение адъюванта, такого как адъювант, включающий CpG нуклеотидную последовательность (например, 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’; SEQ ID NO:8).
В некоторых вариантах осуществления вводят 0,1 мг, 0,5 мг или 2,5 мг адъюванта.
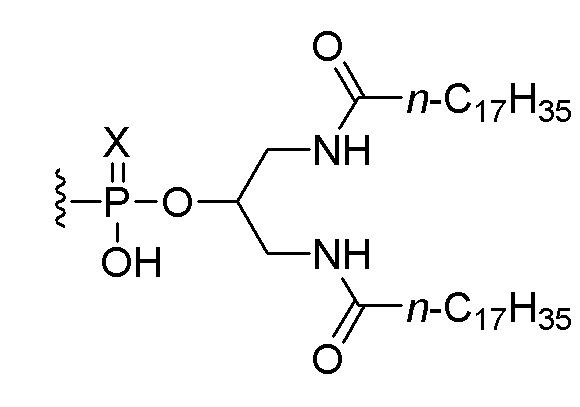
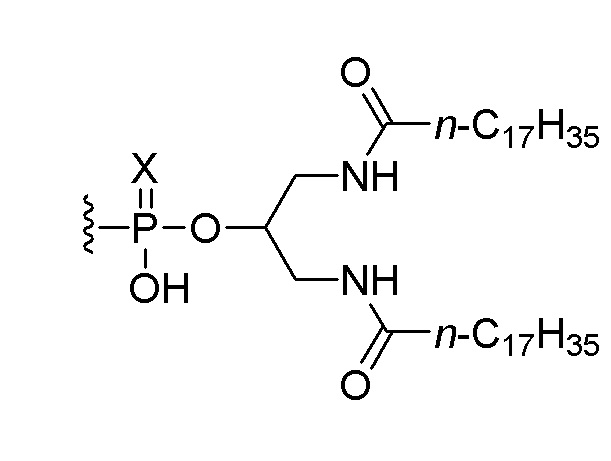
В одном варианте осуществления четвертого аспекта настоящего изобретения способ дополнительно включает введение пациенту соединения, состоящего из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
 ,
,
или его солью, где Х представляет собой О или S. В одном варианте осуществления нуклеотидная последовательность связана с липидом. В одном варианте осуществления вводят 0,1 мг, 0,5 мг или 2,5 мг соединения.
В другом варианте осуществления все межнуклеозидные группы, соединяющие нуклеозиды в 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), представляют собой фосфоротиоаты.
В одном варианте осуществления четвертого аспекта настоящего изобретения рак представляет собой рак поджелудочной железы, рак легкого или рак толстой кишки.
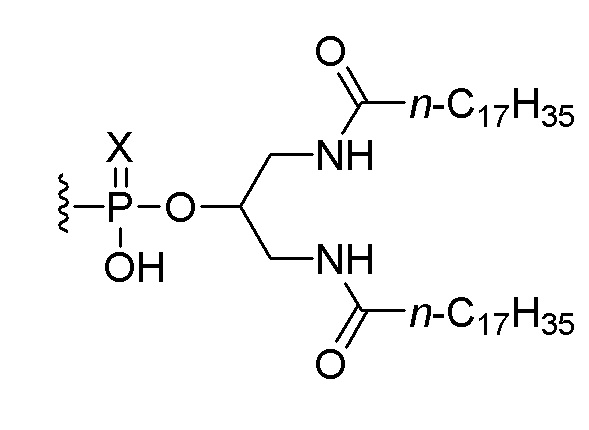
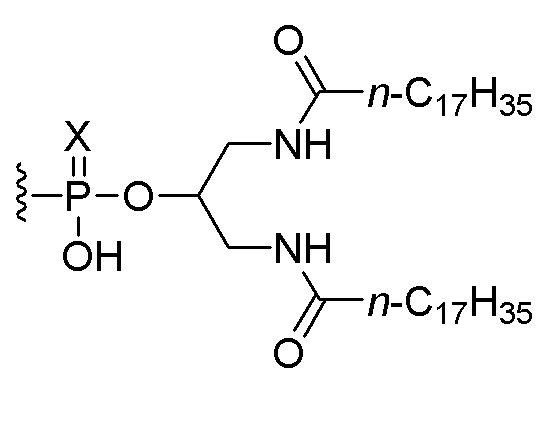
В пятом аспекте изобретение обеспечивает набор, включающий (i) соединение по любому из пунктов 1-5 или композицию по любому из пунктов 6-8 и (ii) соединение, состоящее из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
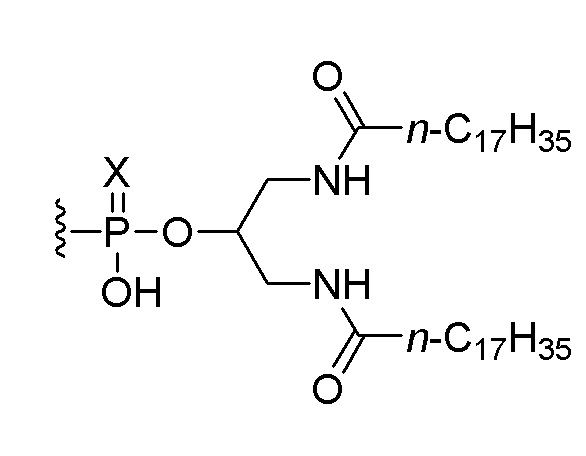 ,
,
или его солью, где Х представляет собой О или S. В одном варианте осуществления нуклеотидная последовательность связана с липидом. В другом варианте осуществления все межнуклеозидные группы, соединяющие нуклеозиды в 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), представляют собой фосфоротиоаты.
Определения
“Карбонил” в контексте настоящей заявки относится к группе -C(O)-.
“Карбоксилат” в контексте настоящей заявки относится к группе -C(O)-OH или ее соли.
В контексте настоящей заявки “конъюгированный” относится к ковалентному связыванию мутантной последовательности KRAS с линкером и, необязательно, дополнительному ковалентному связыванию линкера с липидом. В различных примерах ковалентные связи, соединяющие линкер с мутантной последовательностью KRAS или с липидом, могут быть ковалентной связью между атомом серы и sp3-гибридизированным атомом углерода в сукцинимиде, между атомом азота и атомом углерода карбонила, или между атомом кислорода и атомом фосфора тиофосфорила или фосфорила. В различных примерах каждый из последовательности KRAS и липида может содержать группу для связывания с комплементарной группой в линкере. Например, полипептид KRAS может включать атом серы (например, атом серы в цистеиновом остатке), связанный с комплементарной группой, например сукцинимидом, в линкере. Связь между атомом серы в полипептиде KRAS и сукцинимидом в линкере может быть образована реакцией тиола (например, тиола в цистеиновом остатке) в полипептиде KRAS и малеимида в линкере. Альтернативно, полипептид KRAS может включать атом азота или карбонильную группу, связанные с карбонильной группой или атомом азота, соответственно, в линкере. Связь между карбонильной группой и атомом азота может быть образована реакцией между амином или карбоксилатом в полипептиде KRAS и карбоксилатом или амином, соответственно, в линкере.
“Липид” представляет собой любое из группы органических соединений, жирных на ощупь, нерастворимых в воде и растворимых в органических растворителях, и обычно включает жирные кислоты и их производные. Одним из примеров липида, используемого в изобретении, является 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE).
“Линкер” в контексте настоящей заявки относится к одновалентной или двухвалентной группе, в которой одна валентность ковалентно связана с одной биологически функциональной группой, а другая валентность ковалентно связана с другой биологически функциональной группой. В одном примере линкер соединяет последовательность KRAS с липидом, как указано выше. Необязательно, такой линкер может включать один или несколько полиэтиленгликолевых блоков. В другом примере линкер соединяет нуклеотидную последовательность, например, CpG олигонуклеотида, с липидом (например, -P(X)(OH)-O-CH(CH2NHCO-(CH2)16-CH3)2 или его солью, где Х представляет собой О или S, как описано в настоящей заявке). Такие линкеры могут необязательно включать один или несколько нуклеотидов, например динуклеотид (например, GG).
“Фармацевтически приемлемый носитель” в контексте настоящей заявки относится к носителю, способному суспендировать или растворять активное соединение и который является нетоксичным и не вызывает воспаление у субъекта (например, пациента), которому его вводят. Кроме того, фармацевтически приемлемый носитель может включать фармацевтически приемлемую добавку, такую как консервант, антиоксидант, ароматизатор, эмульгатор, краситель или эксципиент, известную или используемую в области формулирования лекарственных препаратов, которая не оказывает значительного влияния на терапевтическую эффективность биологической активности активного вещества и которая нетоксична для субъекта.
“Фосфорил” в контексте настоящей заявки относится к группе -P(O)(ORA)(ORB), где RA представляет собой H и RB представляет собой валентность.
“Полиэтиленгликоль” в контексте настоящей заявки относится к блоку -(OCH2CH2)n-, где n представляет собой количество повторяющихся звеньев и является целым числом от 2 до 50 (например, 24 или 48).
“Тиол” в контексте настоящей заявки относится к группе -SH.
“Тиофосфорил” в контексте настоящей заявки относится к группе -P(S)(ORA)(ORB), где RA представляет собой H и RB представляет собой валентность.
Термины “лечить”, “лечение” и “лечащий” относятся к терапевтическим подходам, цель которых устранить, облегчить, нормализовать, подавить, замедлить или остановить прогрессирование или тяжесть состояния, связанного с заболеванием или расстройством, например раком. Эти термины включают уменьшение или облегчение по меньшей мере одного неблагоприятного эффекта или симптома состояния, заболевания или расстройства. Лечение обычно является “эффективным”, если один или несколько симптомов или клинических маркеров уменьшаются, или если индуцируется желаемый ответ (например, специфический иммунный ответ). Альтернативно, лечение является “эффективным”, если прогрессирование заболевания замедляется или останавливается.
Настоящее изобретение обеспечивает несколько преимуществ. Например, при включении групп DSPE, некоторые соединения по настоящему изобретению связываются с эндогенным альбумином у субъектов, которым их вводят, что усиливает доставку соединений в лимфатические узлы субъектов. Это облегчает индукцию терапевтического иммунного ответа против последовательностей KRAS соединений, что приводит к эффективному лечению рака.
Другие особенности и преимущества изобретения будут очевидны из следующего подробного описания, чертежей и формулы изобретения.
Описание чертежей
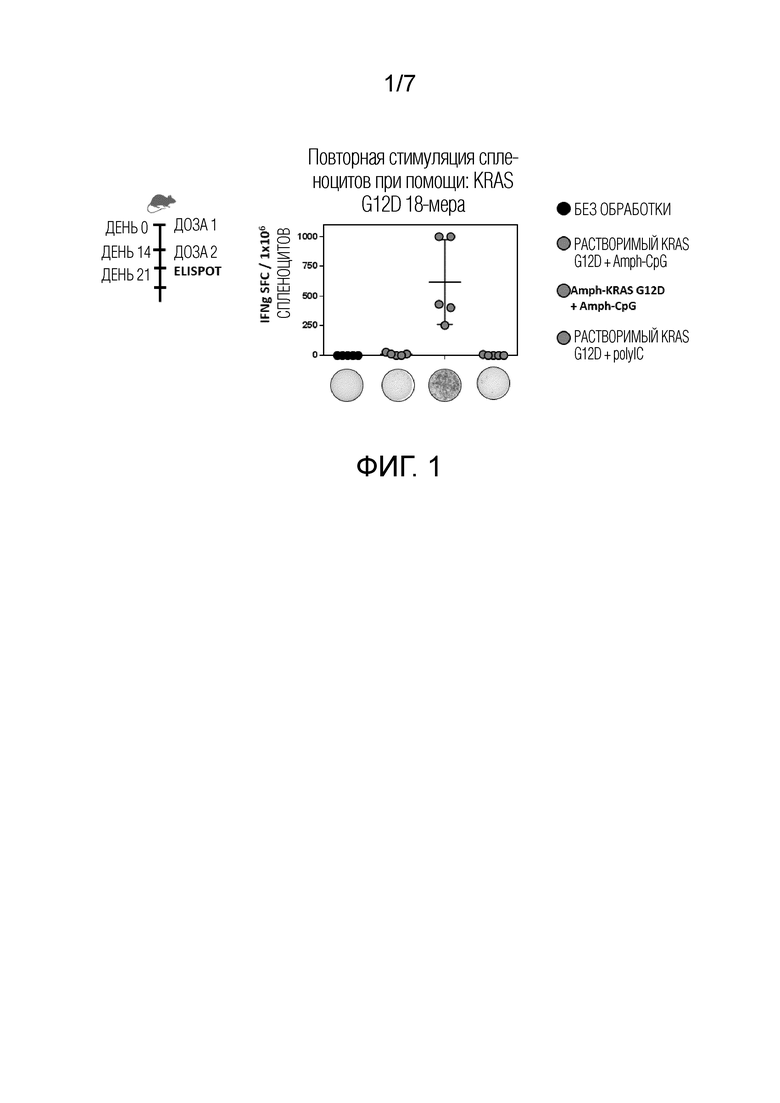
Фиг. 1 показывает, что амфифильный KRas (aKRas) в комбинации с амфифильным CpG (aCpG) активировал спленоциты, в то время как растворимый KRas в комбинации с aCpG и контрольные группы, включающие необработанные и растворимые KRas и polyIC (pIC), не активировали.
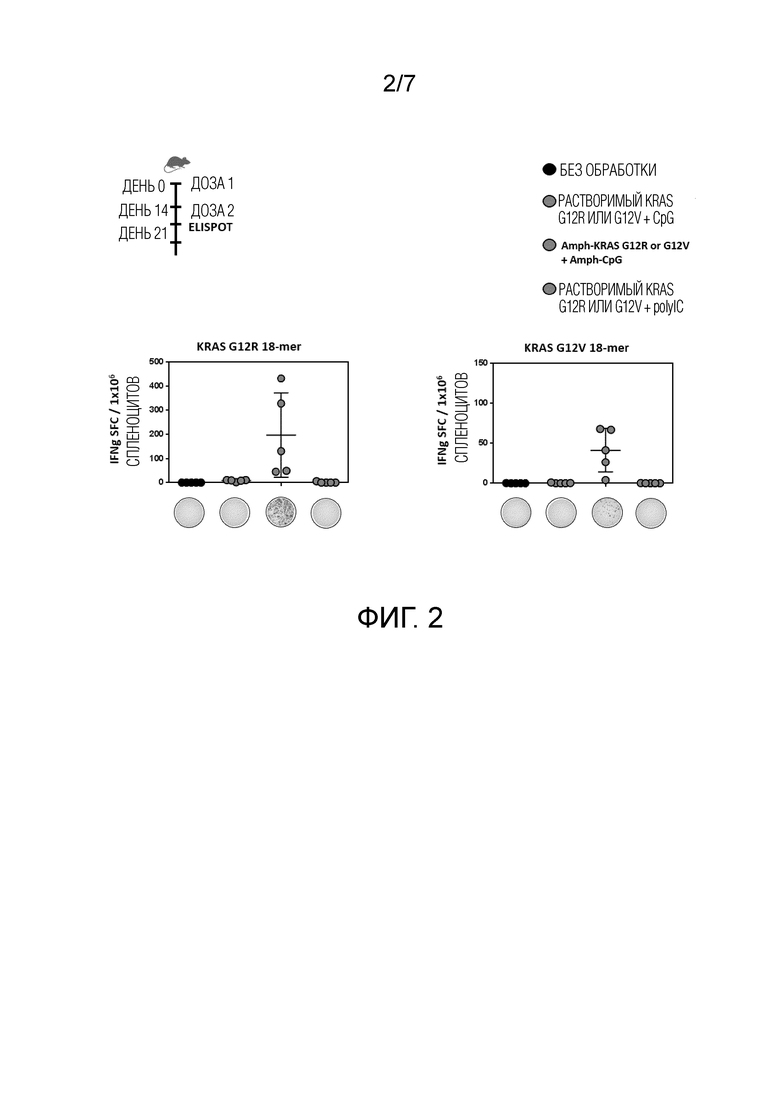
Фиг. 2 показывает, что как aKRas G12R, так и G12V в комбинации с aCpG активировали спленоциты, в то время как ни растворимый KRas ни G12R в комбинации с aCpG и контрольные группы, включающие необработанные и растворимые KRas G12V и pIC, не активировали.
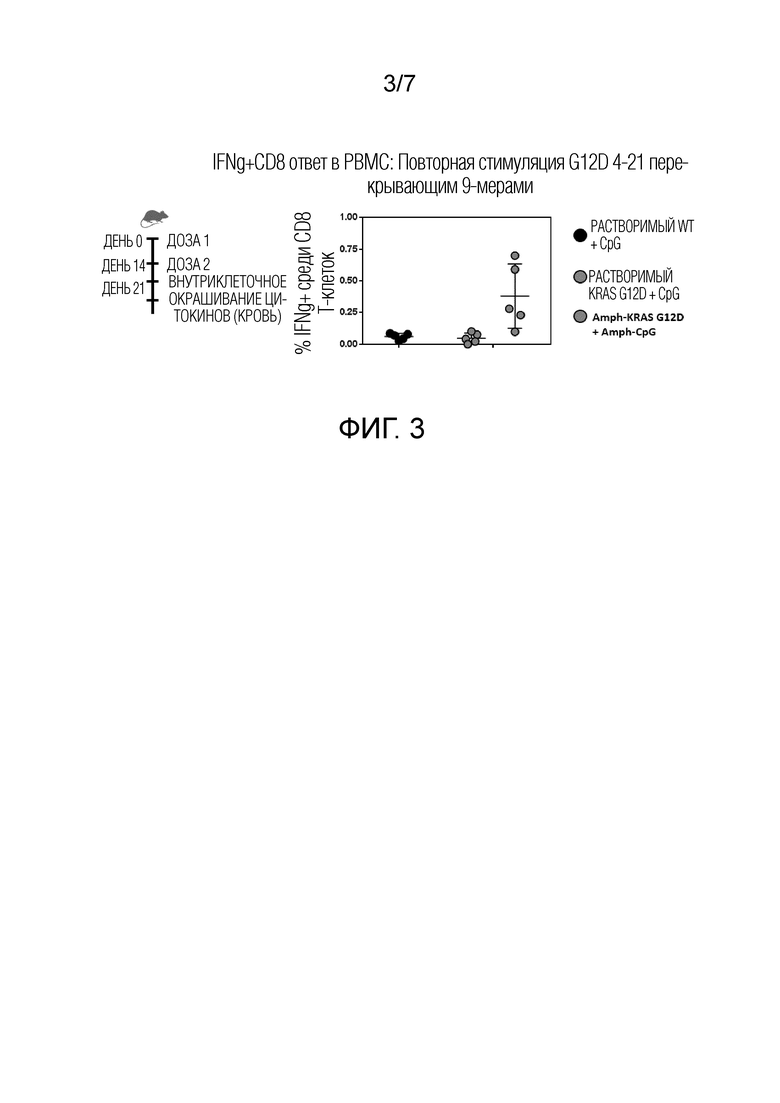
Фиг. 3 показывает KRas-специфический CD8+ T-клеточный ответ для мышей, иммунизированных комбинацией aKRas G12D и aCpG, но не для растворимого KRas G12D в комбинации с CpG или растворимого KRas дикого типа в комбинации с CpG.
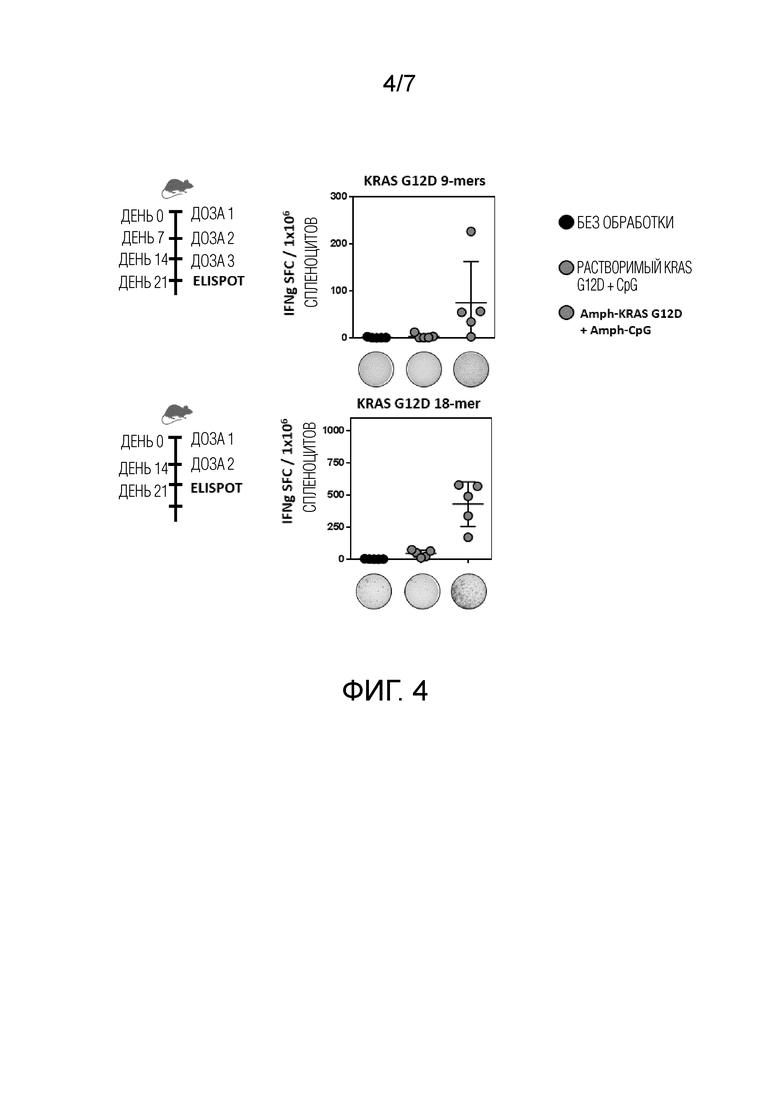
Фиг. 4 показывает KRas-специфический CD8+ T-клеточный ответ (9-меры) и CD8+ или CD4+T-клеточный ответ (18-мер) для мышей, иммунизированных комбинацией aKRas G12D и aCpG, но не для растворимого KRas G12D в комбинации с CpG или необработанной контрольной группы.
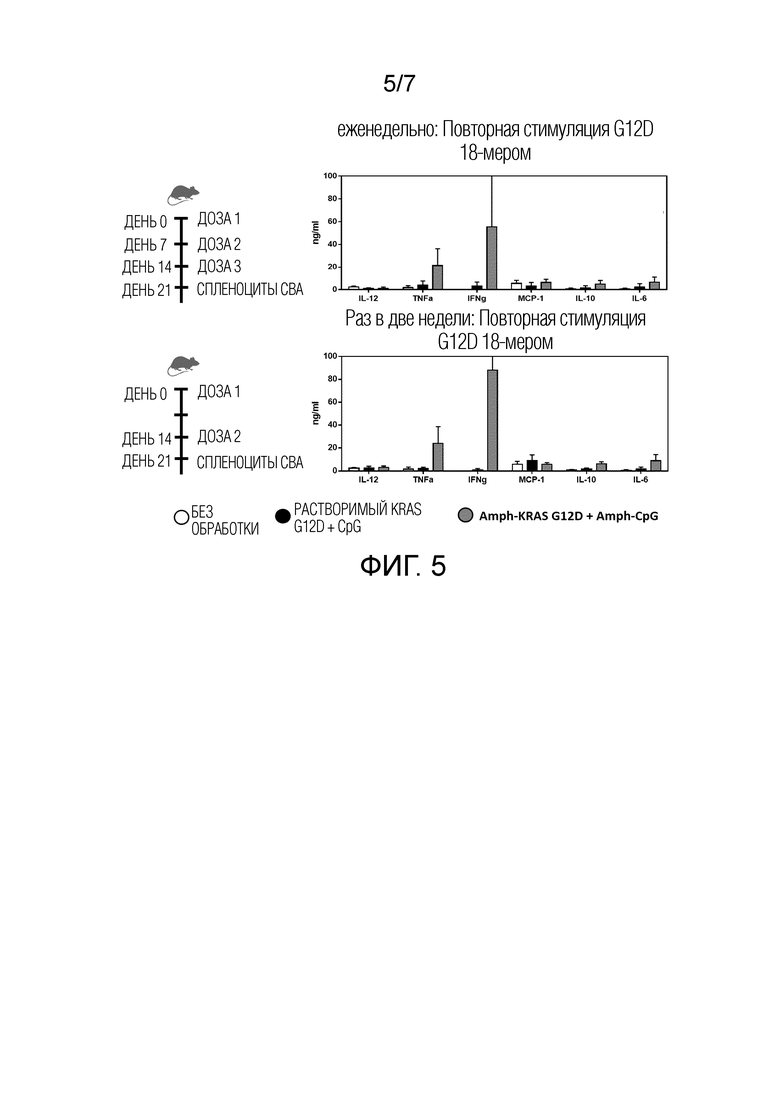
Фиг. 5 показывает, что вакцины на основе амфифильного KRas (Amph-KRAS) и амфифильного CpG (Amph-CpG) вызывают превосходные эндогенные T-клеточные ответы по сравнению с вакцинами на основе растворимого KRas, на что указывает повышенное продуцирование цитокинов спленоцитами в анализе определения концентрации цитокинов на основе микросфер. Растворимый KRAS G12D=YKLVVVGADGVGKSALTI (SEQ ID NO: 23); Amph-KRAS G12D=DSPE-амидо-dPEG24-амидо-dPEG24-CYKLVVVGADGVGKSALTI (SEQ ID NO: 1); KRAS G12D 18-мер=YKLVVVGADGVGKSALTI (SEQ ID NO:23); CBA=анализ для определения концентрации цитокинов на основе микросфер; IFN=интерферон; IL=интерлейкин; KRAS=саркома крыс Кирстена.
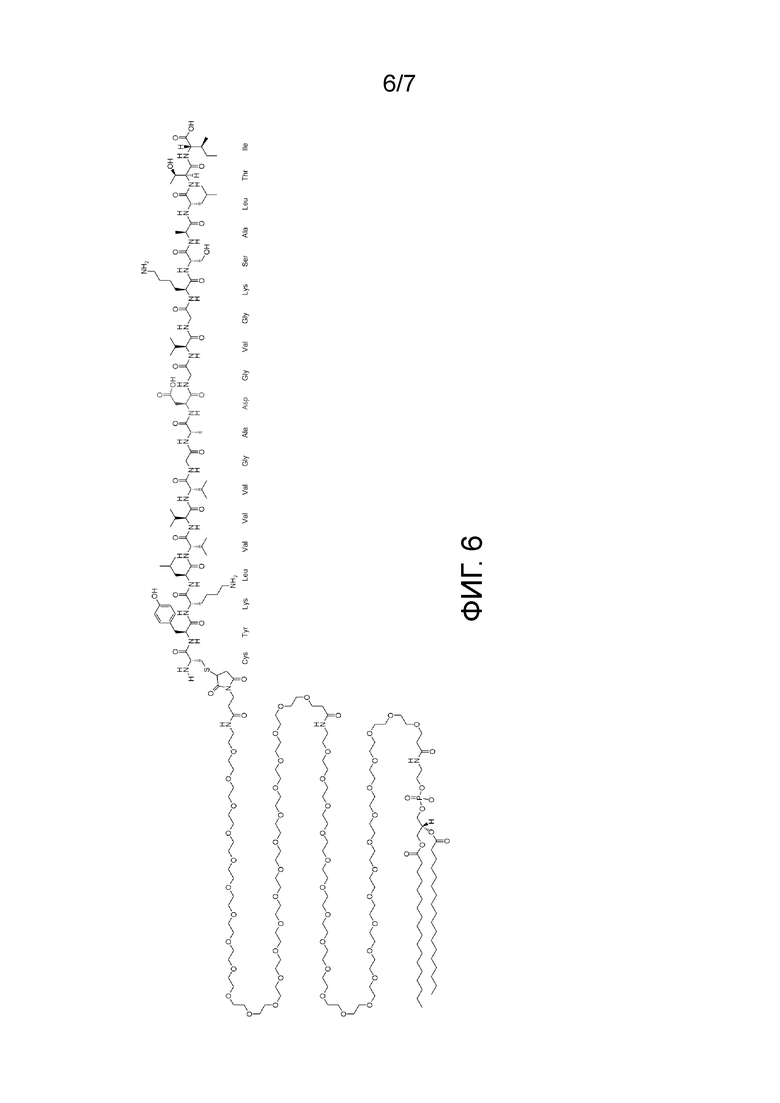
Фиг. 6 показывает структуру амфифильного пептида G12D 4-21 (SEQ ID NO:1).
Фиг. 7 показывает структуру амфифильного CpG-7909. Все сахара представляют собой дезоксирибозу. Все межнуклеозидные связи представляют собой фосфоротиоаты. Структура представлена в виде натриевой соли.
Подробное описание изобретения
Настоящее изобретение обеспечивает соединения, которые можно использовать в методах терапии. Каждое из соединений настоящего изобретения включает мутантную последовательность KRAS (например, например, любую из SEQ ID NO:1-7 и 22; см. Таблицу 1 ниже, или, например, любую из SEQ ID NO:23-30, см. Таблицу 2 ниже) и липид (например, 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE)). Эти фрагменты (мутантная последовательность KRAS и липид) связаны друг с другом при помощи линкера, например, линкера, включающего один или несколько полиэтиленгликолевых блоков. В одном примере линкер представляет собой:
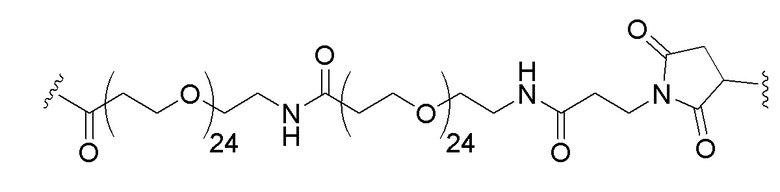 .
.
В конкретном примере мутантная последовательность KRAS (например, любая из SEQ ID NO:1-7 или 22 или, например, любая из SEQ ID NO:23-30) связана на N-конце через Cys остаток с линкером, а линкер связан с липидом, где линкер представляет собой:
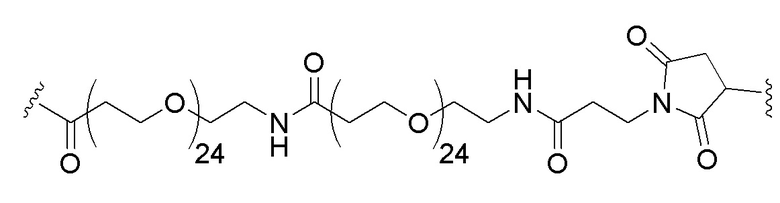 ,
,
и липид представляет собой:
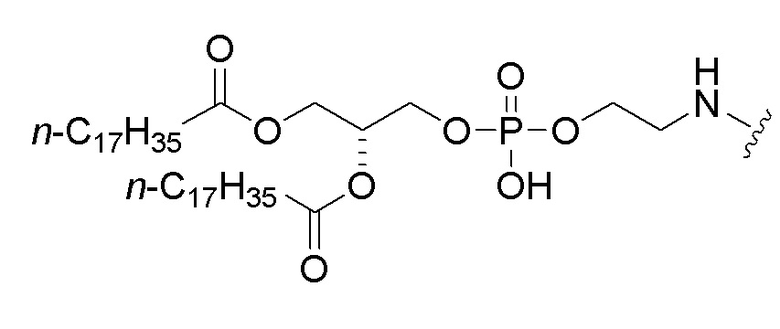 ,
,
или его соль.
Настоящее изобретение также обеспечивает композиции, которые включают одно или несколько соединений по настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Необязательно, композиции могут включать семь различных соединений, как описано выше, где каждое из семи различных соединений включает разную последовательность, выбранную из SEQ ID NO:1-7 и 23 или SEQ ID NO:23-30. Композиции, включающие подгруппы (например, 2, 3, 4, 5 или 6) этих соединений, также включены в изобретение. Различные соединения, включенные в композиции по настоящему изобретению, могут необязательно включать одинаковые или отличные друг от друга последовательности KRAS, линкеры и/или липиды.
Композиции по настоящему изобретению можно использовать в способах индукции иммунных ответов на KRAS последовательности соединений. Соответственно, композиции могут быть указаны как иммуногенные или вакцинные композиции. Таким образом, композиции, необязательно, могут включать один или несколько адъювантов, или их можно вводить с одним или несколькими адъювантами. В одном примере используемый адъювант может включать CpG олигонуклеотид (например, 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’; SEQ ID NO:8; CpG-7909), который на 5’-конце связан или соединен при помощи линкера с липидом, таким, как следующий:
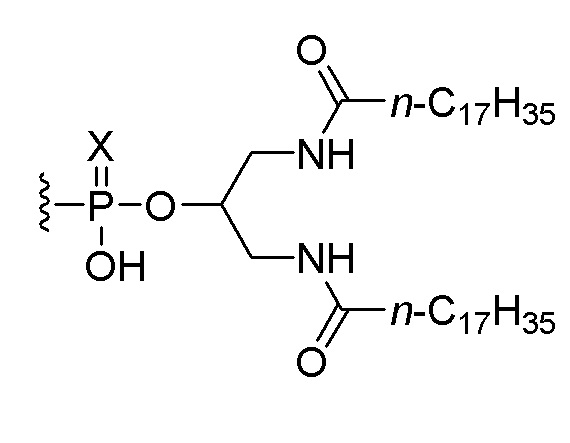 ,
,
или его соль, где Х представляет собой О или S. Предпочтительно, X представляет собой S.
CpG олигонуклеотид может быть непосредственно связан с липидом. Альтернативно, линкер, связанный с CpG олигонуклеотидом и с липидом, может представлять собой GG. В CpG олигонуклеотиде все межнуклеозидные группы представляют собой фосфоротиоаты (например, все межнуклеозидные группы в соединении могут быть фосфоротиоатами).
Соединения и композиции по изобретению можно использовать в методах терапии. В частности, KRAS последовательности соединений могут вызывать иммунный ответ на KRAS, который экспрессируется в некоторых раковых клетках. Соответственно, настоящее изобретение обеспечивает способы лечения рака у субъекта (например, пациента-человека) путем введения субъекту одного или нескольких соединений или композиций по изобретению. Настоящее изобретение также включает способы индуцирования иммунного ответа против KRAS у субъекта (например, пациента-человека) путем введения субъекту одного или нескольких соединений или композиций по изобретению. В различных примерах рак выбран из группы, состоящей из рака поджелудочной железы, рака легкого и рака толстой кишки. Необязательно, способы по изобретению могут также включать введение соединения или композиции по настоящему изобретению в комбинации со вторым (или дополнительным) другим подходом к лечению.
Настоящее изобретение также обеспечивает наборы, каждый из которых содержит, например, первый сосуд, который включает одно или несколько соединений по изобретению, необязательно вместе со вторым сосудом, который включает адъювант, такой как адъювант, описанный в настоящей заявке.
(SEQ ID NO:1-7 и 22)
масса (Да)
или
G12T 4-21
или
CYKLVVVGATGVGKSALTI
19
Для каждого из “Amph-Пептидов” указанных в Таблице 1, липид поли(этиленгликоль) фрагмент был конъюгирован через малеимид (MAL) - цистеин связывание с пептидом с использованием следующего синтона:
DSPE-амидо-dPEG24-амидо-dPEG24-MAL
(SEQ ID NO:23-30)
G12T 4-21
или
YKLVVVGATGVGKSALTI
18
Соединение по настоящему изобретению можно получить из мутантного полипептида KRAS, предшественника линкера и липида с использованием способов, известных в данной области. В некоторых вариантах предшественник линкера сначала связывают с липидом, например, следующим образом:
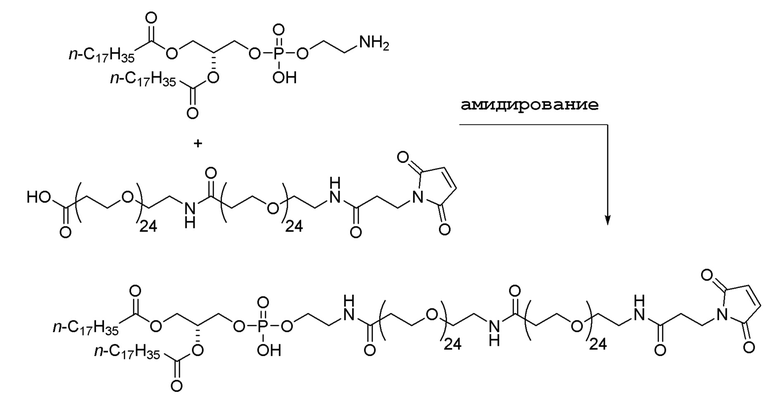
Условия реакции амидирования известны в данной области, например, типичные условия амидирования включают использование реагентов, таких как EDC/DMAP, HATU/HOAt или HBTU/HOAt. Альтернативно, карбоксилат можно заменить O-сукцинимидным сложным эфиром, сложным пентрафторфениловым эфиром или сложным тетрафторфениловым эфиром. Затем можно осуществить взаимодействие продукта этой реакции с мутантным полипептидом KRAS, например, следующим образом:
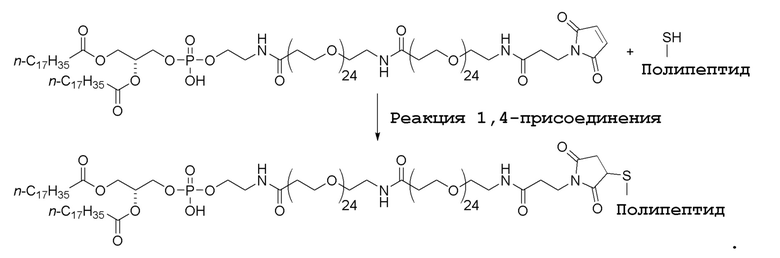
Реакцию 1,4-присоединения можно осуществить в подходящем растворителе, например полярном органическом растворителе или воде.
Альтернативно, соединение по изобретению можно получить следующим образом. Предшественник линкера сначала можно связать с липидом, например, следующим образом:
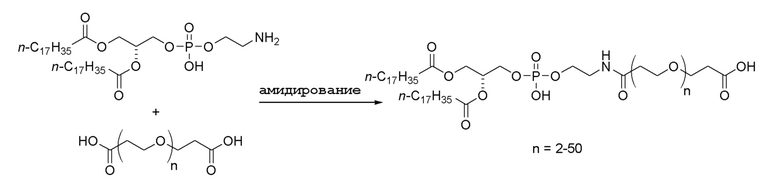
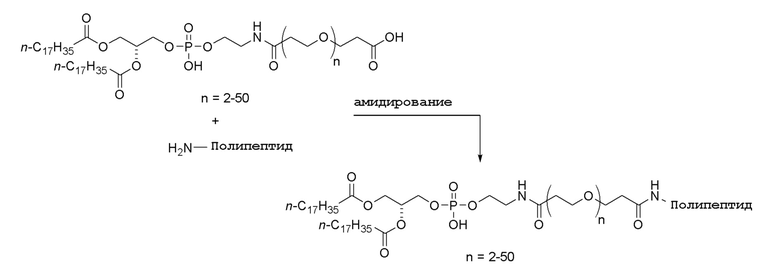
Затем можно осуществить взаимодействие продукта с аминогруппой (например, N-концевым амином) в мутантном полипептиде KRAS с образованием соединения по настоящему изобретению:
CpG олигонуклеотид может быть связан непосредственно или при помощи линкера с липидом. Эти соединения могут быть получены с использованием обычной фосфорамидитной химии, известной в данной области. В некоторых примерах CpG олигонуклеотид или CpG олигонуклеотид, который на своем 5’-конце связан с GG, можно подвергнуть взаимодействию со следующим соединением:
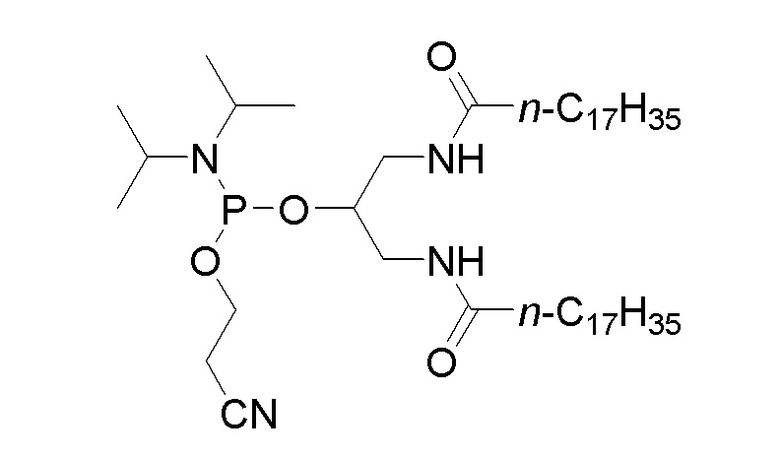
с получением промежуточного соединения, которое после окисления (например, методами фосфитного окисления, известными в данной области, например, с использованием сульфирующего агента, такого как 3-((N, N-диметиламинометилиден)амино)-3H-1,2,4-дитиазол-5-тиона) и гидролиза цианоэтильной группы может дать соединение, состоящее из CpG олигонуклеотида, который на 5’-конце связан или соединен при помощи линкера с липидом:
 ,
,
или его солью,
где Х представляет собой О или S.
Дозирование
Доза каждого вводимого KRAS пептида может находиться в диапазоне от 100 до 5000 мкг на пептид (например, 700 мкг/пептид, что дало бы дозу пептида 4900 мкг для группы из 7 пептидов).
Если адъювант вводят с KRAS пептидом, доза адъюванта может достигать, в расчете на массу тела, 0,48 мг/кг. Примеры схем дозирования показаны ниже в Таблице 3.
Следующие примеры представлены для более полного понимания настоящего изобретения. Эти примеры предназначены только для иллюстрации и не должны рассматриваться как ограничивающие каким-либо образом объем изобретения.
ПРИМЕРЫ
Пример 1: Амфифильный KRas G12D вызывает иммунный ответ
Определяли эффективность мутантных последовательностей растворимого KRas (KRas) или амфифильного KRas (aKRas) (Фиг. 6) и амфифильного CpG адъюванта (aCpG) для получения иммунного ответа. В этих экспериментах использовали в пять раз больше aCpG, чем амфифильного KRas, поскольку эксперименты с увеличением дозы CpG показали, что эта доза может быть более эффективной.
План эксперимента включал следующие 4 группы мышей C57BL/6, иммунизированных перечисленными соединениями (n=5 для каждой группы):
1. KRas G12D+aCpG
2. aKRas G12D+aCpG
3. KRas G12D+pIC
4. Без иммунизации
PolyIC (pIC) использовали как эталонный адъювант в качестве контроля.
Адъювант, а также исходные растворы пептидов растворяли в H2O. Конечные инъекции разбавляли 1X PBS (фосфатно-солевой буферный раствор).
Используемые aKRas пептиды представляли собой последовательности 18-меров мутантных последовательностей с заменой G12D (аминокислоты 4-21 дикого типа → YKLVVVGAGGVGKSALTI (SEQ ID NO:9)). Для каждой инъекции использовали 20 мкг в 100 мкл.
Используемая aCpG последовательность представляла собой последовательность CpG1826 (5’-tccatgacgttcctgacgtt-3’; SEQ ID NO:10) с двумя гуанинами, добавленными на 5’-конце (5’-gg tccatgacgttcctgacgtt-3’; SEQ ID NO:11), при концентрации 5 нмоль на каждую 100 мкл инъекцию. CpG1826 является оптимальной мышиной последовательностью, в то время как CpG7909 оптимальна для людей и малоактивна у мышей. CpG1826 и CpG7909 относятся к одному и тому же классу CpG (класс B) и обычно имеют сходные профили активности у своих соответствующих видов.
Использовали 50 мкг pIC на каждую 100 мкл инъекцию.
Примирующую иммунизацию осуществляли подкожно (п/к) в основание хвоста (день 0), с одной бустерной дозой через 2 недели (день 14). Осуществляли ELISpot анализ на секретирующие IFNγ спленоциты, используя стандартные протоколы, через 8 дней после введения бустерной дозы (день 21). Спленоциты (106 клеток/лунка) активировали при помощи 5мкг/лунка последовательности G12D 1 18-мер (aa4-21) → YKLVVVGADGVGKSALTI (SEQ ID NO:1). Как показано на Фиг. 1, aKRas в комбинации с aCpG активировал спленоциты, в то время как при использовании растворимого KRas в комбинации с aCpG, а также в необработанных и обработанных растворимым KRas и pIC контрольных группах активация отсутствовала.
Пример 2: Амфифильный KRas G12R и G12V вызывают иммунный ответ
Определяли эффективность дополнительных мутантных последовательностей растворимого KRas (KRas) или амфифильного KRas (aKRas) и амфифильного CpG адъюванта (aCpG) или растворимого CpG (CpG) для получения иммунного ответа.
План эксперимента включал следующие 7 групп мышей C57BL/6, иммунизированных перечисленными соединениями (n=5 для каждой группы):
1. KRas G12R+CpG
2. KRas G12V+CpG
3. KRas G12R+pIC
4. KRas G12V+pIC
5. aKRas G12R+aCpG
6. aKRas G12V+aCpG
7. Без иммунизации
Адъювант, а также исходные растворы пептидов растворяли в H2O. Конечные инъекции разбавляли 1X PBS.
Используемые пептиды aKRas представляли собой последовательности 18-меров мутантных последовательностей с заменами G12R/V (SEQ аминокислоты 4-21 дикого типа → YKLVVVGAGGVGKSALTI (SEQ ID NO:9)). Использовали 20 мкг в 100 мкл для каждой инъекции.
Используемая aCpG последовательность представляла собой последовательность CpG1826 (5’-tccatgacgttcctgacgtt-3’; SEQ ID NO:10) с двумя гуанинами, добавленными на 5’-конце (5’-gg tccatgacgttcctgacgtt-3’; SEQ ID NO:11), при концентрации 5 нмоль для каждой 100 мкл инъекции.
Использовали 50 мкг pIC для каждой 100 мкл инъекции.
Примирующую иммунизацию осуществляли подкожно (п/к) в основание хвоста, с одной бустерной дозой через 2 недели (день 14).
Осуществляли анализ ELISpot на секретирующие IFNγ спленоциты, используя стандартные протоколы, через 7 дней после введения бустерной дозы (день 21). Спленоциты (106 клеток/лунка) активировали при помощи 5 мкг/лунка либо: последовательности G12V 18-мера (aa4-21) → YKLVVVGAVGVGKSALTI (SEQ ID NO:2) или последовательности G12R 18-мера (aa4-21) → YKLVVVGARGVGKSALTI (SEQ ID NO:3).
Как показано на Фиг. 2, и aKRas G12R и G12V в комбинации с aCpG активировали спленоциты, в то время как при использовании растворимого KRasG12R или G12V в комбинации с aCpG, а также в необработанных и обработанных растворимым KRas и pIC контрольных группах активация отсутствовала.
Пример 3: Амфифильный KRas G12D вызывает CD8+ T-клеточные иммунные ответы
У мышей B6 дикого типа трудно вызвать Kras-специфический CD8+ T-клеточный ответ. Мышей B6, трансгенных по гену HLA человека, A2.1, иммунизировали либо растворимыми, либо амфифил-конъюгированными формами антигена KRas G12D, а также адъювантом (CpG или aCpG). Известно, что аллель A2.1 усиливает у людей ответы на KRas пептиды.
План эксперимента включал следующие 4 группы B6 HLA-A2.1 Tg мышей, иммунизированных перечисленными соединениями (n=5 для каждой группы):
1. KRas дикого типа+CpG
2. KRas 12D+CpG
3. aKRas 12D+aCpG
4. Без иммунизации
Адъювант, а также исходные растворы пептидов растворяли в H2O. Конечные инъекции разбавляли 1X PBS.
Используемые пептиды aKRas представляли собой последовательности 18-меров мутантных последовательностей с заменой G12D (аминокислоты 4-21 дикого типа → YKLVVVGAGGVGKSALTI (SEQ ID NO:9)). Использовали 20 мкг в 100 мкл для каждой инъекции.
Используемая aCpG последовательность представляла собой последовательность CpG1826 (5’-tccatgacgttcctgacgtt-3’; SEQ ID NO:10) с двумя гуанинами, добавленными на 5’-конце (5’-gg tccatgacgttcctgacgtt-3’; SEQ ID NO:11), при концентрации 5 нмоль для каждой 100 мкл инъекции.
Вакцину вводили самкам мышей подкожно с двух сторон в основание хвоста, по 50 мкл на каждую сторону. Две бустерные дозы вводили с двухнедельными интервалами.
Осуществляли анализ внутриклеточного окрашивания цитокинов (ICS) мононуклеарных клеток периферической крови (PBMCs) на IFNγ и анализ ELISpot на секретирующие IFNγ спленоциты, используя стандартные протоколы, через 7 дней после второй и третьей бустерной дозы, соответственно.
PBMC/Спленоциты (106 клеток/лунка и 2×106 клеток/лунка) активировали при помощи 5мкг/лунка либо SEQ ID NO:1, либо одной из SEQ ID NO:12-20, как показано ниже:
Специфические мутантные пептиды вводят только мышам, иммунизированным соответствующим 18-мером.
Фиг. 3 показывает KRas-специфический CD8+ T-клеточный ответ для мышей, иммунизированных комбинацией aKRas G12D и aCpG, но не для растворимого KRas G12D в комбинации с CpG или растворимого KRas дикого типа в комбинации с CpG.
Пример 4: Анализ для определения более высокой концентрации антигена и различных интервалов дозирования
Концентрацию антигена увеличивали с 20 мкг до 50 мкг, и испытывали двухнедельные (bw) или недельные (w) интервалы между введением доз.
План эксперимента включал следующие 5 группы мышей C57BL/6, иммунизированных перечисленными соединениями (n=5 для каждой группы):
1. KRas 12D+CpG1826 (bw)
2. KRas 12D+CpG1826 (w)
3. aKRas 12D+aCpG1826 (bw)
4. aKRas 12D+aCpG1826 (w)
5. Без иммунизации
Адъювант, а также исходные растворы пептидов растворяли в H2O. Конечные инъекции разбавляли 1X PBS.
Используемые пептиды aKRas представляли собой последовательности 18-меров мутантных последовательностей с заменой G12D (аминокислоты 4-21 дикого типа → YKLVVVGAGGVGKSALTI (SEQ ID NO:9)). Использовали 50 мкг в 100 мкл для каждой инъекции.
Используемая aCpG последовательность представляла собой последовательность CpG1826 (5’-tccatgacgttcctgacgtt-3’; SEQ ID NO:10) с двумя гуанинами, добавленными на 5’-конце (5’-gg tccatgacgttcctgacgtt-3’; SEQ ID NO:11), при концентрации 5 нмоль для каждой 100 мкл инъекции.
Примирующую иммунизацию осуществляли подкожно (п/к) в основание хвоста, с одной бустерной дозой через 2 недели.
ELISpot анализ на IFNγ и CBA анализ (цитометрическое определение концентрации цитокинов на основе микросфер) на IL6, IL10, IL12, TNFα, IFNγ и MCP1 осуществляли на спленоцитах, используя стандартные протоколы, через 7 дней после введения бустерной дозы. Спленоциты (106 клеток/лунка) активировали при помощи 5мкг/лунка либо SEQ ID NO:1, либо одной из SEQ ID NO:12-21, как показано ниже:
Специфические мутантные пептиды вводили только мышам, иммунизированным соответствующим 18-мером.
Отдельные планшеты готовили для стимуляций либо короткими (9-мер и 10-мер), либо длинными (17-мер и 18-мер) пептидами. Клетки от контрольных мышей “Без иммунизации” стимулировали всеми стимулами.
Фиг. 4 показывает KRas-специфический CD8+ T-клеточный ответ (9-меры) и CD8+ или CD4+T-клеточный ответ (18-мер) для мышей, иммунизированных комбинацией aKRas G12D и aCpG, но не для растворимого KRas G12D в комбинации с CpG или необработанного контроля.
Пример 5: Дальнейший анализ амфифилов KRAS
Как описано в приведенных выше примерах, потенциальная иммуногенность вакцины на основе мутантного KRAS пептида - амфифила с aCpG адъювантом была продемонстрирована на мышиной модели C57BL/6. Эти и дальнейшие исследования кратко описаны в Таблице 4, и они демонстрируют, что, хотя исторически у мышей были более слабые иммунологические ответы, чем у людей, на мутантные KRAS пептиды из-за видовых различий в связывании MHC,
● подкожное введение мутированных KRAS Amph-Пептидов (G12D (Фиг. 6), G12R и G12V) эффективно для индукции KRAS-специфических Т-клеток селезенки у мышей, как определено при помощи ELISPOT и анализа для определения концентрации цитокинов на основе микросфер (Фиг. 1, Фиг. 2, Фиг. 4 и Фиг. 5)
● мутированные KRAS Amph-Пептиды (G12D, G12R и G12V) в сочетании с aCpG в качестве адъюванта более эффективны для индукции KRAS-специфических T-клеток селезенки, чем мутированные KRAS пептиды в сочетании либо с растворимым CpG, либо с полиинозиновой:полицитидиловой кислотой (poly IC) в качестве адъюванта (Фиг. 1, Фиг. 2 и Фиг. 5) и
мутированные KRAS Amph-Пептиды (G12D) в сочетании с aCpG более эффективны, чем растворимые KRAS пептиды в сочетании с растворимым CpG, для индукции как CD4-, так и CD8-клеточных ответов, что продемонстрировано посредством ответа эффекторных цитокинов при повторной стимуляции либо длинными (18-мер), либо минимальными (9-мер) пептидными эпитопами (Фиг. 4).
1) KRAS G12D+CpG;
2) Amph-KRAS G12D+aCpG;
3) KRAS G12D+Poly IC;
4) Без лечения
KRAS пептиды (амфифильные или растворимые) дозировали при 20 мкг; aCpG-1826 при 5 нмоль; и Poly IC при 50 мкг; исходные растворы растворяли в воде, а растворы конечной дозы - в фосфатно-солевом буферном растворе (PBS).
Объем дозы: 100 мкл, разделенные для введения в виде подкожной инъекции (п/к) с обеих сторон основания хвоста (по 50 мкл на место инъекции)
Прайм: День 0
Буст: День 14
Amph-пептид G12D+aCpG вызывал превосходные ответы Т-клеток селезенки по сравнению с растворимым G12D+растворимый CpG или Poly IC
1) KRAS G12R+CpG;
2) KRAS G12V+CpG
3) KRAS G12R+Poly IC;
4) KRAS G12V+Poly IC;
5) Amph-KRAS G12R+aCpG;
6) Amph-KRAS G12V+aCpG;
7) Без лечения
KRAS пептиды (амфифильные или растворимые) дозировали при 20 мкг; aCpG-1826 при 5 нмоль; и Poly IC при 50 мкг; исходные растворы растворяли в воде, а растворы конечной дозы в PBS.
Объем дозы: 100 мкл, разделенные для введения в виде подкожной инъекции (п/к) с обеих сторон основания хвоста (по 50 мкл на место инъекции)
Прайм: День 0
Буст: День 14
Последовательности KRAS пептидов более иммуногенны при конъюгировании с липидным фрагментом, чем растворимые пептиды
1) KRAS G12D+CpG (bw);
2) KRAS G12D+CpG (w);
3) Amph-KRAS G12D+aCpG (bw);
4) Amph-KRAS G12D+aCpG (w);
5) Без лечения
KRAS пептиды (амфифильные или растворимые) дозировали при 20 мкг; aCpG-1826 при 5 нмоль; и Poly IC при 50 мкг; исходные растворы растворяли в воде, а растворы конечной дозы в PBS.
Объем дозы: 100 мкл, разделенные для введения в виде подкожной инъекции (п/к) с обеих сторон основания хвоста (по 50 мкл на место инъекции)
2 дозы (прайм+буст) вводили животным, обрабатываемым раз в две недели (bw), и 3 дозы (прайм+2 буст-дозы) вводили животным, обрабатываемым еженедельно (w):
Прайм: День 0 (w и bw)
Буст: День 7 (w)
Буст: День 14 (w и bw)
Амфифилы вызывали эндогенные CD8 и CD4 T-клеточные ответы против мутантного KRAS у мышей C57BL/6, как определено методом ELISPOT (IFNγ) и/или в анализе определения концентрации цитокинов на основе микросфер (IFNγ, TNFα и IL-6)
Другие варианты осуществления
Хотя изобретение было описано в связи с его конкретными вариантами осуществления, следует понимать, что оно допускает дальнейшие модификации, и настоящая заявка предназначена для охвата любых вариаций, применений или адаптаций изобретения, следуя, в целом, принципам изобретения, и включение таких отступлений от настоящего раскрытия входит в известную или обычную практику в области техники, к которой относится изобретение, и может применяться к существенным признакам, описанным выше.
Все публикации, патенты и патентные заявки включены в настоящую заявку посредством ссылки во всей своей полноте в той степени, как если бы каждая отдельная публикация, патент или патентная заявка были специально и индивидуально указаны для включения посредством ссылки во всей полноте.
Некоторые варианты осуществления изобретения представлены в виде следующих отдельных пронумерованных параграфов.
1. Соединение, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS включает или состоит из аминокислотной последовательности, выбранной из группы, состоящей из YKLVVVGADGVGKSALTI (SEQ ID NO:23), YKLVVVGAVGVGKSALTI (SEQ ID NO:24), YKLVVVGARGVGKSALTI (SEQ ID NO:25), YKLVVVGAAGVGKSALTI (SEQ ID NO:26), YKLVVVGASGVGKSALTI (SEQ ID NO:27), YKLVVVGACGVGKSALTI (SEQ ID NO:28), YKLVVVGATGVGKSALTI (SEQ ID NO:29) и YKLVVVGAGDVGKSALTI (SEQ ID NO:30).
2. Соединение, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS включает или состоит из аминокислотной последовательности, выбранной из группы, состоящей из CYKLVVVGADGVGKSALTI (SEQ ID NO:1), CYKLVVVGAVGVGKSALTI (SEQ ID NO:2), CYKLVVVGARGVGKSALTI (SEQ ID NO:3), CYKLVVVGAAGVGKSALTI (SEQ ID NO:4), CYKLVVVGASGVGKSALTI (SEQ ID NO:5), CYKLVVVGACGVGKSALTI (SEQ ID NO:6), CYKLVVVGATGVGKSALTI (SEQ ID NO:22) и CYKLVVVGAGDVGKSALTI (SEQ ID NO:7).
3. Соединение по пункту 1 или 2, где мутантная последовательность KRAS, на ее N-конце, конъюгирована с линкером через цистеин-малеимидную связь.
4. Соединение по любому из пунктов 1-3, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
5. Соединение по пункту 1 или 2, где мутантная последовательность KRAS, на ее N-конце, конъюгирована со следующей структурой:
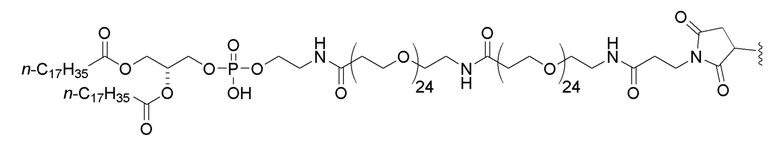
6. Композиция, включающая одно или несколько соединений по любому из пунктов 1-5 и фармацевтически приемлемый носитель.
7. Композиция по пункту 6, где композиция включает (1) соединение, включающее аминокислотную последовательность YKLVVVGADGVGKSALTI (SEQ ID NO:23), (2) соединение, включающее аминокислотную последовательность YKLVVVGAVGVGKSALTI (SEQ ID NO:24), (3) соединение, включающее аминокислотную последовательность YKLVVVGARGVGKSALTI (SEQ ID NO:25), (4) соединение, включающее аминокислотную последовательность YKLVVVGAAGVGKSALTI (SEQ ID NO:26), (5) соединение, включающее аминокислотную последовательность YKLVVVGASGVGKSALTI (SEQ ID NO:27), (6) соединение, включающее аминокислотную последовательность YKLVVVGACGVGKSALTI (SEQ ID NO:28), или соединение, включающее аминокислотную последовательность YKLVVVGATGVGKSALTI (SEQ ID NO:29), и (7) соединение, включающее аминокислотную последовательность YKLVVVGAGDVGKSALTI (SEQ ID NO:30).
8. Композиция по пункту 6, где композиция включает (1) соединение, включающее аминокислотную последовательность CYKLVVVGADGVGKSALTI (SEQ ID NO:1), (2) соединение, включающее аминокислотную последовательность CYKLVVVGAVGVGKSALTI (SEQ ID NO:2), (3) соединение, включающее аминокислотную последовательность CYKLVVVGARGVGKSALTI (SEQ ID NO:3), (4) соединение, включающее аминокислотную последовательность CYKLVVVGAAGVGKSALTI (SEQ ID NO:4), (5) соединение, включающее аминокислотную последовательность CYKLVVVGASGVGKSALTI (SEQ ID NO:5), (6) соединение, включающее аминокислотную последовательность CYKLVVVGACGVGKSALTI (SEQ ID NO:6), или соединение, включающее аминокислотную последовательность CYKLVVVGATGVGKSALTI (SEQ ID NO:22), и (7) соединение, включающее аминокислотную последовательность CYKLVVVGAGDVGKSALTI (SEQ ID NO:7).
9. Композиция по любому из пунктов 6-8, где композиция дополнительно включает соединение, состоящее из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
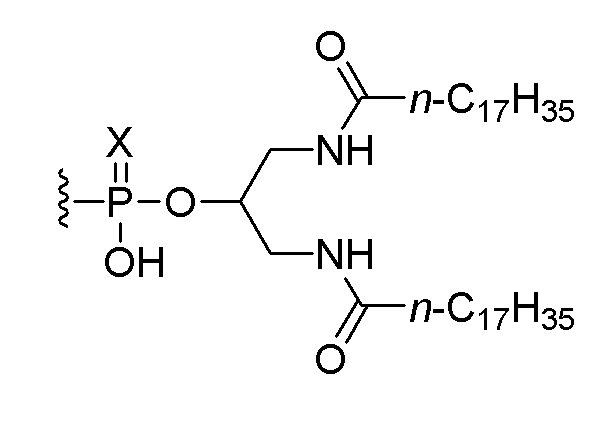 ,
,
или его солью,
где Х представляет собой О или S.
10. Композиция по пункту 6, где композиция включает 700 мкг каждого соединения.
11. Способ лечения рака у пациента, при этом способ включает введение пациенту композиции по любому из пунктов 6-10.
12. Способ по пункту 11, где способ дополнительно включает введение адъюванта.
13. Способ по пункту 12, где адъювант включает CpG нуклеотидную последовательность.
14. Способ по пункту 13, где CpG нуклеотидная последовательность включает 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8).
15. Способ по любому из пунктов 12-14, где вводят 0,1 мг, 0,5 мг или 2,5 мг адъюванта.
16. Способ по пункту 10, где способ дополнительно включает введение пациенту соединения, состоящего из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
 ,
,
или его солью,
где Х представляет собой О или S.
17. Композиция по пункту 9 или способ по пункту 16, где нуклеотидная последовательность связана с липидом.
18. Способ по пункту 16 или 17, где вводят 0,1 мг, 0,5 мг или 2,5 мг соединения, состоящего из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
 ,
,
или его солью,
где Х представляет собой О или S.
19. Способ по любому из пунктов 11-16 или 18, где рак представляет собой рак поджелудочной железы, рак легкого или рак толстой кишки.
20. Способ по любому из пунктов 11-16 или 18, где все межнуклеозидные группы, соединяющие нуклеозиды в 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), представляют собой фосфоротиоаты.
21. Набор, включающий (i) соединение по любому из пунктов 1-5 или композицию по любому из пунктов 6-8 и (ii) соединение, состоящее из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO:8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
 ,
,
или его солью,
где Х представляет собой О или S.
Другие варианты осуществления находятся в пределах следующей формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> VEDANTRA PHARMACEUTICALS, INC.
<120> СОЕДИНЕНИЯ, ВКЛЮЧАЮЩИЕ МУТАНТНУЮ ПОСЛЕДОВАТЕЛЬНОСТЬ KRAS И
ЛИПИД,
И ИХ ПРИМЕНЕНИЯ
<130> 51026-026WO2
<140> PCT/US19/020404
<141> 2019-03-01
<150> US 62/637,879
<151> 2018-03-02
<160> 31
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 1
Cys Tyr Lys Leu Val Val Val Gly Ala Asp Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 2
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Cys Tyr Lys Leu Val Val Val Gly Ala Val Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 3
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Cys Tyr Lys Leu Val Val Val Gly Ala Arg Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 4
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Cys Tyr Lys Leu Val Val Val Gly Ala Ala Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 5
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Cys Tyr Lys Leu Val Val Val Gly Ala Ser Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 6
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Cys Tyr Lys Leu Val Val Val Gly Ala Cys Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 7
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Cys Tyr Lys Leu Val Val Val Gly Ala Gly Asp Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 8
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
tcgtcgtttt gtcgttttgt cgtt
24
<210> 9
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Tyr Lys Leu Val Val Val Gly Ala Gly Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
tccatgacgt tcctgacgtt
20
<210> 11
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
ggtccatgac gttcctgacg tt
22
<210> 12
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Tyr Lys Leu Val Val Val Gly Ala Asp Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 13
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 13
Lys Leu Val Val Val Gly Ala Asp Gly Val Gly Lys Ser Ala Leu Thr
1 5 10 15
Ile
<210> 14
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
Lys Leu Val Val Val Gly Ala Asp Gly Val
1 5 10
<210> 15
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 15
Leu Val Val Val Gly Ala Asp Gly Val
1 5
<210> 16
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
Val Val Val Gly Ala Asp Gly Val Gly
1 5
<210> 17
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Val Val Gly Ala Asp Gly Val Gly Lys
1 5
<210> 18
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Val Gly Ala Asp Gly Val Gly Lys Ser
1 5
<210> 19
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 19
Gly Ala Asp Gly Val Gly Lys Ser Ala
1 5
<210> 20
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 20
Ala Asp Gly Val Gly Lys Ser Ala Leu
1 5
<210> 21
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
Asp Gly Val Gly Lys Ser Ala Leu Thr
1 5
<210> 22
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Cys Tyr Lys Leu Val Val Val Gly Ala Thr Gly Val Gly Lys Ser Ala
1 5 10 15
Leu Thr Ile
<210> 23
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
Tyr Lys Leu Val Val Val Gly Ala Asp Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 24
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Tyr Lys Leu Val Val Val Gly Ala Val Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 25
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 25
Tyr Lys Leu Val Val Val Gly Ala Arg Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 26
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 26
Tyr Lys Leu Val Val Val Gly Ala Ala Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 27
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 27
Tyr Lys Leu Val Val Val Gly Ala Ser Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 28
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 28
Tyr Lys Leu Val Val Val Gly Ala Cys Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 29
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 29
Tyr Lys Leu Val Val Val Gly Ala Thr Gly Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 30
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 30
Tyr Lys Leu Val Val Val Gly Ala Gly Asp Val Gly Lys Ser Ala Leu
1 5 10 15
Thr Ile
<210> 31
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 31
Lys Leu Val Val Val Gly Ala Asp Gly
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| CPG АМФИФИЛЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2823677C2 |
| НЕОАНТИГЕННЫЕ КОМПОЗИЦИИ И ИХ ИСПОЛЬЗОВАНИЕ | 2020 |
|
RU2832574C2 |
| КОНСТРУКТЫ Т-КЛЕТОЧНОГО РЕЦЕПТОРА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2785954C2 |
| СЛИТАЯ КОНСТРУКЦИЯ, СОДЕРЖАЩАЯ ПРОНИКАЮЩИЙ В КЛЕТКУ ПЕПТИД, ПОЛИЭПИТОП И ПЕПТИДНЫЙ АГОНИСТ TLR, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2807135C2 |
| НЕОАНТИГЕНЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2805196C2 |
| КОНЪЮГИРОВАННЫЕ ЧЕРЕЗ CYS80 ИММУНОГЛОБУЛИНЫ | 2016 |
|
RU2756101C2 |
| НАПРАВЛЕННАЯ РЕГЕНЕРАЦИЯ ПЕРЕЛОМАННОЙ КОСТИ ПОСРЕДСТВОМ СТИМУЛЯЦИИ РЕЦЕПТОРА ПАРАТИРЕОИДНОГО ГОРМОНА | 2017 |
|
RU2785401C2 |
| АНТИГЕННЫЕ ПОЛИПЕПТИДЫ НА ОСНОВЕ ПОСЛЕДОВАТЕЛЬНОСТИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2019 |
|
RU2807992C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ T-КЛЕТОК И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2835034C2 |
| МУТАНТЫ FIMH E. COLI И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2831010C1 |

Изобретение относится к соединению, включающему мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-7 и 22-30. Также предложена композиция, включающая одно или несколько указанных соединений, способ лечения рака и набор для лечения рака, экспрессирующего мутантный KRAS. 4 н. и 39 з.п. ф-лы, 7 ил., 4 табл., 5 пр.
1. Соединение, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности, выбранной из группы, состоящей из CYKLVVVGADGVGKSALTI (SEQ ID NO: 1), CYKLVVVGAVGVGKSALTI (SEQ ID NO: 2), CYKLVVVGARGVGKSALTI (SEQ ID NO: 3), CYKLVVVGAAGVGKSALTI (SEQ ID NO: 4), CYKLVVVGASGVGKSALTI (SEQ ID NO: 5), CYKLVVVGACGVGKSALTI (SEQ ID NO: 6), CYKLVVVGATGVGKSALTI (SEQ ID NO: 22), CYKLVVVGAGDVGKSALTI (SEQ ID NO: 7), YKLVVVGADGVGKSALTI (SEQ ID NO: 23), YKLVVVGAVGVGKSALTI (SEQ ID NO: 24), YKLVVVGARGVGKSALTI (SEQ ID NO: 25), YKLVVVGAAGVGKSALTI (SEQ ID NO: 26), YKLVVVGASGVGKSALTI (SEQ ID NO: 27), YKLVVVGACGVGKSALTI (SEQ ID NO: 28), YKLVVVGATGVGKSALTI (SEQ ID NO: 29) и YKLVVVGAGDVGKSALTI (SEQ ID NO: 30).
2. Соединение по п. 1, где мутантная последовательность KRAS, представленная SEQ ID NO: 1, 2, 3, 4, 5, 6, 22 или 7, на ее N-конце, конъюгирована с линкером через цистеин-малеимидную связь.
3. Соединение по п. 1, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
4. Соединение по п. 1, где мутантная последовательность KRAS, на ее N-конце, конъюгирована со следующей структурой:
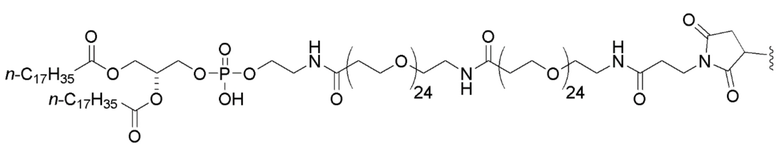 .
.
5. Композиция для лечения рака, экспрессирующего мутантный KRAS, включающая терапевтически эффективное количество одного или нескольких соединений по п. 1 и фармацевтически приемлемый носитель.
6. Композиция по п. 5, отличающаяся тем, что композиция включает (1) соединение, включающее аминокислотную последовательность YKLVVVGADGVGKSALTI (SEQ ID NO: 23), (2) соединение, включающее аминокислотную последовательность YKLVVVGAVGVGKSALTI (SEQ ID NO: 24), (3) соединение, включающее аминокислотную последовательность YKLVVVGARGVGKSALTI (SEQ ID NO: 25), (4) соединение, включающее аминокислотную последовательность YKLVVVGAAGVGKSALTI (SEQ ID NO: 26), (5) соединение, включающее аминокислотную последовательность YKLVVVGASGVGKSALTI (SEQ ID NO: 27), (6) соединение, включающее аминокислотную последовательность YKLVVVGACGVGKSALTI (SEQ ID NO: 28), или соединение, включающее аминокислотную последовательность YKLVVVGATGVGKSALTI (SEQ ID NO: 29), и (7) соединение, включающее аминокислотную последовательность YKLVVVGAGDVGKSALTI (SEQ ID NO: 30).
7. Композиция по п. 5, отличающаяся тем, что композиция включает (1) соединение, включающее аминокислотную последовательность CYKLVVVGADGVGKSALTI (SEQ ID NO: 1), (2) соединение, включающее аминокислотную последовательность CYKLVVVGAVGVGKSALTI (SEQ ID NO: 2), (3) соединение, включающее аминокислотную последовательность CYKLVVVGARGVGKSALTI (SEQ ID NO: 3), (4) соединение, включающее аминокислотную последовательность CYKLVVVGAAGVGKSALTI (SEQ ID NO: 4), (5) соединение, включающее аминокислотную последовательность CYKLVVVGASGVGKSALTI (SEQ ID NO: 5), (6) соединение, включающее аминокислотную последовательность CYKLVVVGACGVGKSALTI (SEQ ID NO: 6), или соединение, включающее аминокислотную последовательность CYKLVVVGATGVGKSALTI (SEQ ID NO: 22), и (7) соединение, включающее аминокислотную последовательность CYKLVVVGAGDVGKSALTI (SEQ ID NO: 7).
8. Композиция по п. 5, отличающаяся тем, что композиция дополнительно включает соединение, состоящее из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
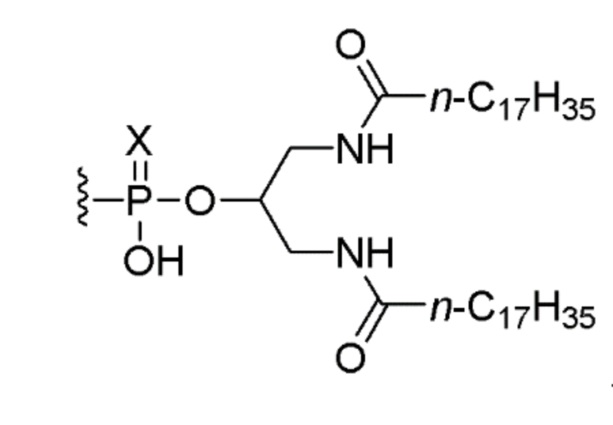 ,
,
или его солью,
где Х представляет собой О или S.
9. Композиция по п. 5, отличающаяся тем, что композиция включает 700 мкг каждого соединения.
10. Композиция по п. 8, в которой нуклеотидная последовательность связана с липидом.
11. Способ лечения рака, экспрессирующего мутантный KRAS, у пациента, являющегося человеком, при этом способ включает введение пациенту терапевтически эффективного количества композиции по п. 5.
12. Способ по п. 11, отличающийся тем, что способ дополнительно включает введение адъюванта.
13. Способ по п. 12, в котором адъювант включает CpG нуклеотидную последовательность.
14. Способ по п. 13, в котором CpG нуклеотидная последовательность включает 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8).
15. Способ по п. 11, в котором вводят 0,1 мг, 0,5 мг или 2,5 мг адъюванта.
16. Способ по п. 11, отличающийся тем, что способ дополнительно включает введение пациенту соединения, состоящего из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
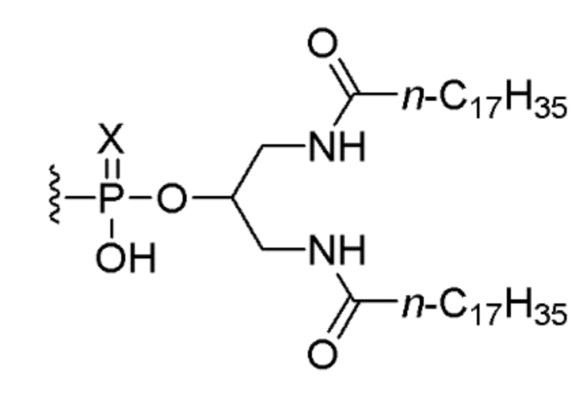 ,
,
или его солью,
где Х представляет собой О или S.
17. Способ по п. 16, где нуклеотидная последовательность связана с липидом.
18. Способ по п. 16, в котором вводят 0,1 мг, 0,5 мг или 2,5 мг соединения, состоящего из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
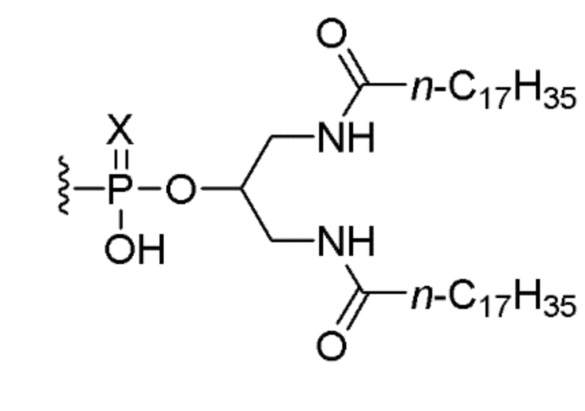 ,
,
или его солью,
где Х представляет собой О или S.
19. Способ по п. 11, в котором рак представляет собой рак поджелудочной железы, рак легкого или рак толстой кишки.
20. Способ по п. 11, в котором все межнуклеозидные группы, соединяющие нуклеозиды в 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8), представляют собой фосфоротиоаты.
21. Набор для лечения рака, экспрессирующего мутантный KRAS, включающий (i) соединение по п. 1 или 2 и (ii) соединение, состоящее из нуклеотидной последовательности 5’-TCGTCGTTTTGTCGTTTTGTCGTT-3’ (SEQ ID NO: 8), которая, на ее 5’-конце, связана или соединена при помощи линкера со следующим липидом:
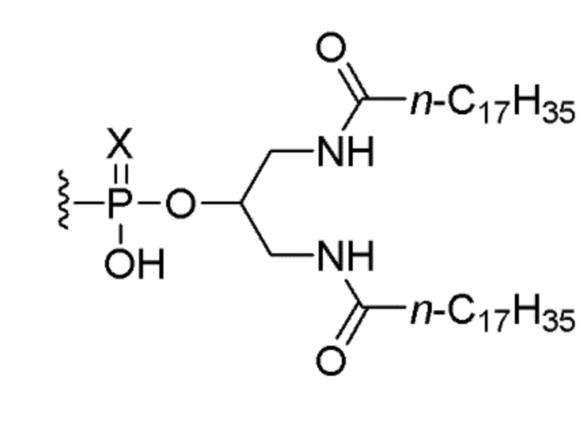 ,
,
или его солью,
где Х представляет собой О или S.
22. Соединение по п. 1, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
23. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности CYKLVVVGADGVGKSALTI (SEQ ID NO: 1), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
24. Соединение по п. 23, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
25. Соединение по п. 24, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
26. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности CYKLVVVGAVGVGKSALTI (SEQ ID NO: 2), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
27. Соединение по п. 26, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
28. Соединение по п. 27, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
29. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности CYKLVVVGARGVGKSALTI (SEQ ID NO: 3), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
30. Соединение по п. 29, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
31. Соединение по п. 30, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
32. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности CYKLVVVGAAGVGKSALTI (SEQ ID NO: 4), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
33. Соединение по п. 32, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
34. Соединение по п. 33, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
35. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности CYKLVVVGASGVGKSALTI (SEQ ID NO: 5), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
36. Соединение по п. 35, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
37. Соединение по п. 36, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
38. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности CYKLVVVGAGDVGKSALTI (SEQ ID NO: 7), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
39. Соединение по п. 38, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
40. Соединение по п. 39, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
41. Соединение по п. 1, включающее мутантную последовательность KRAS и липид, где мутантная последовательность KRAS конъюгирована с липидом при помощи линкера, и (i) линкер включает один или несколько полиэтиленгликолевых блоков, (ii) липид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), и (iii) мутантная последовательность KRAS состоит из аминокислотной последовательности YKLVVVGACGVGKSALTI (SEQ ID NO: 28), где мутантная последовательность KRAS конъюгирована с линкером через цистеин-малеимидную связь.
42. Соединение по п. 41, где линкер содержит 2-50 повторяющихся звеньев полиэтиленгликоля.
43. Соединение по п. 42, где линкер включает 48 повторяющихся звеньев полиэтиленгликоля.
| US 20100074945 A1, 25.03.2010 | |||
| US 7709002 B1, 04.05.2010 | |||
| US 20140044755 A1, 13.02.2014 | |||
| US 6168778 B1, 02.01.2001 | |||
| US 20120328701 A1, 27.12.2012. |
Авторы
Даты
2023-12-07—Публикация
2019-03-01—Подача