ОБЛАСТЬ ТЕХНИКИ
[0001] Данное изобретение относится к новому варианту глутамат-цистеинлигазы и к способу получения глутатиона с его применением.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Глутатион (GSH), органическое серосодержащее соединение, обычно встречающееся в большинстве клеток, представляет собой трипептид, состоящий из трех аминокислот: глицина, глутамата и цистеина.
[0003] Глутатион присутствует в живом организме в восстановленной форме глутатиона (GSH) и в окисленной форме глутатиона (GSSG). Восстановленная форма глутатиона (GSH), присутствующая в относительно высокой пропорции в нормальных обстоятельствах, в основном распределена в клетках печени и кожи человеческого организма и играет важную роль, выполняя антиоксидантную функцию путем разложения и удаления активных форм кислорода, детоксикационную функцию путем удаления ксенобиотических соединений, таких как токсичные вещества, и осветляющую функцию путем ингибирования образования меланина.
[0004] Поскольку продуцирование глутатиона постепенно снижается по мере старения, а понижение продуцирования глутатиона, играющего важную роль в антиоксидантной и детоксикационной функции, способствует накоплению активных форм кислорода, что является основной причиной старения, необходимо поступление глутатиона извне (Sipes IG et at., «The role of glutathione in the toxicity of xenobiotic compounds: metabolic activation of 1,2-dibromoethane by glutathione», Adv Exp Med Biol. 1986; 197:457-67).
[0005] Глутатион, обладающий разнообразными функциями, как описано выше, привлек внимание как вещество в различных областях, таких как фармацевтика, функциональные оздоровительные продукты и косметика, а также применяется в изготовлении вкусовых добавок и пищевых и кормовых добавок. Известно, что глутатион оказывает большое влияние на обогащение вкуса исходного ингредиента и поддержание богатых вкусовых оттенков и может быть использован сам по себе или в комбинации с другими веществами, как усилитель вкусоароматических свойств kokumi. В целом, известно, что вещества kokumi обладают более богатыми вкусоароматическими свойствами, чем вещества umami, такие как известные нуклеиновые кислоты и глутамат натрия (MSG), и образуются при распаде белков в ходе созревания.
[0006] Несмотря на наличие растущей потребности в глутатионе для применения в различных областях, его рынок не активизирован из-за высоких затрат на промышленное производство глутатиона, поскольку процессы синтеза ферментов для него не коммерциализованы по причине высоких производственных затрат и выходы в способах культивирования микроорганизмов и выделения из них глутатиона являются низкими.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
[0007] В результате напряженных усилий в решении вышеописанных проблем авторы данного изобретения разработали новый вариант глутамат-цистеинлигазы и обнаружили существенное увеличение способности продуцировать глутатион у штаммов, в которые введена новая глутамат-цистеинлигаза, тем самым завершив данное изобретение.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
[0008] В данном изобретении предложен вариант глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту.
[0009] В данном изобретении предложен полинуклеотид, кодирующий этот вариант, и вектор, включающий его.
[0010] В данном изобретении предложен микроорганизм, продуцирующий глутатион благодаря включению по меньшей мере одного из: указанный варианта; полинуклеотид а, кодирующего указанный вариант, и вектора, включающего такой полинуклеотид.
[0011] В данном изобретении предложен способ получения глутатиона, включающий культивирование микроорганизма.
ПОЛЕЗНЫЕ ЭФФЕКТЫ
[0012] Новый вариант глутамат-цистеинлигазы по данному изобретению существенно повышает продуцирование глутатиона и таким образом, может применяться в продуцировании глутатиона с высоким выходом. Поскольку дрожжи, продуцирующие глутатион с высокими выходами, высушенные продукты, экстракты, их культуры и лизаты, а также произведенный глутатион обладают антиоксидантным, детоксикационным и усиливающим иммунитет действием, они могут эффективно применяться в косметических композициях, пищевых композициях, кормовых композициях и фармацевтических композициях, и их получении.
Лучший вариант осуществления изобретения
[0013] Далее данное изобретение будет описано более подробно. При этом, каждое описание и воплощение, раскрытое в данном документе, также может быть применено к другим описаниям и воплощениям. Иными словами, все комбинации различных элементов, раскрытых в данном документе, входят в объем данного изобретения. Более того, объем данного изобретения не ограничивается описаниями, приведенными ниже.
[0014] Специалисты в данной области поймут или смогут обнаружить, проведя не более чем рутинные эксперименты, множество эквивалентов конкретных воплощений данного изобретения. Предполагается, что такие эквиваленты входят в объем прилагаемой формулы изобретения.
[0015] В одном аспекте данного изобретения предложен вариант глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту.
[0016] Данный вариант может представлять собой вариант глутамат-цистеинлигазы, включающий по меньшей мере одну аминокислотную замену в аминокислотной последовательности SEQ ID NO: 1, где замена включает замену аминокислоты, соответствующей положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, на другую аминокислоту.
[0017] В частности, вариант может представлять собой вариант белка, в котором аминокислота в положении 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту.
[0018] «Глутамат-цистеинлигаза (GCL)» по данному изобретению представляет собой фермент, также упоминаемый как «глутамат-цистеин-связывающий фермент» или «гамма-глутамилцистеин-синтетаза (GCS)». Известно, что глутамат-цистеинлигаза катализирует следующую реакцию:
[0019] L-глутамат + L-цистеин + АТФ ↔ гамма-глутамилцистеин + АДФ+Фн
[0020] Кроме того, известно, что реакция, катализируемая глутамат-цистеинлигазой, является первой стадией синтеза глутатиона.
[0021] Глутамат-цистеинлигаза, как последовательность дрожжевого происхождения, может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1, без ограничения им.
[0022] В данном изобретении аминокислотная последовательность SEQ ID NO: 1, представляет собой аминокислотную последовательность, кодируемую геном gsh1, и может также обозначаться как «белок GSH1» или «глутамат-цистеинлигаза». Аминокислотная последовательность, составляющая глутамат-цистеинлигазу по данному изобретению, может быть получена из известной базы данных GenBank NCBI. Например, аминокислотная последовательность иметь происхождение из Saccharomyces cerevisiae, но не ограничена таким происхождением, и может включать любую последовательность, обладающую такой же активностью, как указанная выше аминокислотная последовательность, без ограничения.
[0023] Кроме того, хотя глутамат-цистеинлигаза определяется как белок, включающий аминокислотную последовательность SEQ ID NO: 1, в данном изобретении, она не исключает мутацию, которая может возникнуть естественным образом, или в результате добавления нонсенс-последовательности в 5-' или 3'-направлении относительно аминокислотной последовательности SEQ ID NO: 1, или мутации естественного происхождения, или молчащей мутации, и для специалиста в данной области техники очевидно, что любые белки, обладающие активностью, идентичной или эквивалентной активности белка, включающего аминокислотную последовательность SEQ ID NO: 1, принадлежат глутамат-цистеинлигазе по данному изобретению.
[0024] Например, глутамат-цистеинлигаза по данному изобретению может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, гомологичную или идентичную ей по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%. Также очевидно, что любой белок, имеющий аминокислотную последовательность, включающую делецию, модификацию, замену или добавление одной или более аминокислот, входит в объем данного изобретения при условии, что аминокислотная последовательность сохраняет вышеупомянутую гомологию или идентичность, эффект, эквивалентный эффекту этого белка.
[0025] Иными словами, хотя в данном изобретении используются выражения «белок или полипептид, имеющий аминокислотную последовательность с заданной SEQ ID NO:» и «белок или полипептид, включающий аминокислотную последовательность с заданной SEQ ID NO:», очевидно, что в данном изобретении может применяться любой белок, имеющий аминокислотную последовательность, включающую делецию, модификацию замену или добавление одной или более аминокислот, при условии, что белок обладает активностью, идентичной или эквивалентной полипептиду, состоящему из заданной аминокислотной последовательности. Например, очевидно, что «полипептид, включающий аминокислотную последовательность SEQ ID NO: 1» принадлежит «полипептиду, состоящему из аминокислотной последовательности SEQ ID NO: 1» при условии, что первый обладает такой же или эквивалентной активностью, как второй.
[0026] В данном описании термин «вариант» относится к белку, полученному в результате консервативной замены и/или модификации по меньшей мере одной аминокислоты, отличной от аминокислоты приведенной последовательности, при этом сохраняющему функции или свойства белков, и может быть вариантом глутамат-цистеинлигазы, в котором аминокислота, соответствующая 86 положению от N-конца в аминокислотной последовательности SEQ ID NO: 1, замещена аминокислотным остатком, отличным от цистеина, в свете задач данного изобретения. Вариант отличается от указанной последовательности заменой, делецией или добавлением нескольких аминокислот. Такие варианты, как правило, можно идентифицировать посредством модификации одной из вышеупомянутых аминокислотных последовательностей белка и оценки свойств модифицированного белка. Таким образом, активность варианта может быть усилена по сравнению с нативным белком. Кроме того, некоторые варианты могут включать варианты, из которых удалена по меньшей мере одна часть, такая как N-концевая лидерная последовательность или трансмембранный домен. Другие варианты могут включать варианты, в которых удалена часть с N- и/или С-конца зрелого белка. Термин «вариант» может также использоваться взаимозаменяемо с другими терминами, такими как модификация, модифицированный белок, модифицированный полипептид, мутант, мутеин и дивергент, а также могут использоваться любые термины, обозначающие вариацию, без ограничения. В свете задач данного изобретения вариант может обладать усиленной активностью по сравнению с белками дикого типа или немодифицированными белками, без ограничения этим.
[0027] В данном описании термин «консервативная замена» относится к замене одной аминокислоты на другую аминокислоту, имеющую схожую структуру и/или химические свойства. Вариант может иметь по меньшей мере одну консервативную замену, при этом сохраняя по меньшей мере одну биологическую активность. Такие аминокислотные замены, как правило, могут происходить на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатка.
[0028] Варианты могут также включать делецию или добавление аминокислот, которые оказывают минимальное влияние на свойства и вторичную структуру полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью на N-конце белка, которая контролирует перенос белка одновременно с трансляцией или после ее завершения. Полипептид может также быть конъюгирован с другой последовательностью или линкером для обнаружения, очистки или синтеза полипептида.
[0029] В данном изобретении «замена на другую аминокислоту» не ограничена конкретными заменами, при условии, что замещающая аминокислота отличается от замещаемой аминокислоты. Это означает, что замена цистеина, представляющего собой 86-ю аминокислоту от N-конца аминокислотной последовательности SEQ ID NO: 1, на другую аминокислоту может также выражаться как «замена 86-й аминокислоты на аминокислоту, отличную от цистеина». При этом, в данном изобретении очевидно, что выражение «замена на заданную аминокислоту» означает, что замещающая аминокислота отличается от замещаемой аминокислоты, за исключением случаев, когда указано выражение «замещена другой аминокислотой».
[0030] «Вариант глутамат-цистеинлигазы» по данному изобретению может также упоминаться как «(вариант) полипептида, обладающего активностью глутамат-цистеинлигазы» или «вариант GSH1», который может увеличивать продуцирование глутатиона по сравнению с белком до модификации, полипептидом дикого типа или немодифицированным полипептидом, без ограничения этим.
[0031] В таком варианте по меньшей мере одна аминокислота в аминокислотной последовательности SEQ ID NO: 1 может быть замещена на другую аминокислоту. В частности, вариант может включать замену аминокислоты, соответствующей положению 86 в аминокислотной последовательности SEQ ID NO: 1 на аминокислоту, отличную от цистеина. Другая аминокислота может быть выбрана из глицина, аланина, валина, лейцина, изолейцина, метионина, фенилаланина, триптофана, пролина, серина, треонина, тирозина, аспарагина, глутамата, глутамина, аспартата, лизина, аргинина и гистидина.
[0032] В данном изобретении очевидно, что «вариант, в котором 86-я аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1 замещена другой аминокислотой» включает вариант, в котором аминокислота, соответствующая 86-му положению в аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту, несмотря на то, что аминокислота находится в положении, отличном от положения 86 вследствие делеции/добавления/в ставки или тому подобного аминокислоты на N- или С-конце или в середине аминокислотной последовательности SEQ ID NO: 1.
[0033] Также, хотя вариант, в котором 86-я аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1 замещена другой аминокислотой, в данном описании раскрыт в качестве примера варианта глутамат-цистеинлигазы, вариант глутамат-цистеинлигазы по данному изобретению не ограничен вариантом аминокислотной последовательности SEQ ID NO: 1, и очевидно, что вариант, в котором «аминокислота, соответствующая 86-му положению в аминокислотной последовательности SEQ ID NO: 1» замещена другой аминокислотой в любой аминокислотной последовательности, обладающей активностью глутамат-цистеинлигазы, также входит в объем варианта глутамат-цистеинлигазы по данному изобретению.
[0034] В любой аминокислотной последовательности «аминокислота, соответствующая положению 86 в аминокислотной последовательности SEQ ID NO: 1» может быть идентифицирована при помощи различных способов выравнивания последовательностей, хорошо известных в данной области техники.
[0035] Вариант глутамат-цистеинлигазы по данному изобретению, в котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту, может быть белком, включающим аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, гомологичную или идентичную ей по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, где аминокислота, соответствующая 86-му положению в SEQ ID NO: 1, замещена на другую аминокислоту.
[0036] Вариант глутамат-цистеинлигазы, в котором 86-я аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 1 заменена на аминокислоту, отличную от цистеина по данному изобретению, может включать одну из аминокислотных последовательностей SEQ ID NO: 3 - 21. В частности, вариант может по существу состоять из одной из аминокислотных последовательностей SEQ ID NO: 3 - 21, и более конкретно, он может состоять из одной из аминокислотных последовательностей SEQ ID NO: 3 - 21, без ограничения ими.
[0037] Также, вариант может включать одну из аминокислотных последовательностей SEQ ID NO: 3 - 21 или аминокислотную последовательность, включающую фиксированную 86-ю аминокислоту (то есть в аминокислотной последовательности варианта аминокислота, соответствующая 86-му положению SEQ ID NO: 3 - 21 идентична аминокислоте в 86-м положении SEQ ID NO: 3 - 21) и гомологична или идентична им по меньшей мере на 80%, без ограничения этим.
[0038] В частности, вариант по данному изобретению может включать полипептид, имеющий одну из аминокислотных последовательностей SEQ ID NO: 3 - 21, и полипептид, по меньшей мере на 80%, 90%, 95%, 96%, 97%, 98% или 99% гомологичный или идентичный одной из аминокислотных последовательностей SEQ ID NO: 3 - 21. Также очевидно, что любой белок, имеющий аминокислотную последовательность, включающую делецию, модификацию, замену или добавление одной или более аминокислот в положении, отличном от положения 86, входит в объем данного изобретения при условии, что белок сохраняет вышеупомянутую гомологию или идентичность, а также эффект, эквивалентный эффекту варианта.
[0039] В данном описании термин «гомология» или «идентичность» относится к степени соответствия двух заданных аминокислотных последовательностей или последовательностей оснований и может выражаться в процентах. Термины «гомология» и «идентичность» часто могут использоваться взаимозаменяемо.
[0040] Гомология или идентичность последовательностей консервативных полинуклеотидов или полипептидов может быть установлена при помощи стандартного алгоритма выравнивания, при этом можно использовать значения штрафов за открытие гэпа, установленные в программе по умолчанию. По существу, гомологичные или идентичные последовательности могут гибридизоваться друг с другом в условиях умеренной или высокой жесткости на протяжение по меньшей мере приблизительно 50%, 60%, 70%, 80% или 90% от всей последовательности или по всей длине последовательности. В гибридизованных полинуклеотидах также можно учитывать полинуклеотиды, включающие вместо кодона вырожденный кодон.
[0041] Гомологию, сходство или идентичность между двумя заданными полипептидами или полинуклеотидами можно устанавливать с использованием любого известного компьютерного алгоритма, такого как программа FASTA с использованием параметров по умолчанию, как предложено, например, в Pearson et al. (1988) Proc. Natl. Acad. Sci. USA 85:2444. В альтернативном варианте для этого можно использовать алгоритм Нидлмана-Вунша (1970, J. Mol. Biol. 48:443-453), выполняемый в программе Needleman пакета программ EMBOSS (The European Molecular Biology Open Software Suite) (Rice et al., 2000, Trends Genet. 16:276-277) (версия 5.0.0 или более поздняя) (включая пакет программ GCG (Devereux, J., et al, Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S.F., et al, JMOLEC BIOL 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994, and CARILLO et al. (1988) SIAM J Applied Math 48:1073). Например, гомологию, сходство или идентичность можно определять с использованием BLAST, базы данных Национального Центра Биотехнологической Информации (the National Center for Biotechnology Information), или ClustalW.
[0042] Гомологию, сходство или идентичность полинуклеотидов или полипептидов можно определять путем сравнения информации о последовательности с использованием компьютерной программы GAP, такой как программа, разработанная Needleman et al. (1970), J Mol Biol. 48:443, как описано в Smith and Waterman, Adv. Appl. Math (1981) 2:482. В кратком изложении, программа GAP определяет сходство как количество выровненных символов (то есть нуклеотидов или аминокислот), которые являются одинаковыми, поделенное на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) бинарную матрицу сравнения (содержащую значение 1 для идентичных и значение 0 для неидентичных символов) и взвешенную матрицу сравнения, предложенную в Gribskov et al. (1986) Nucl. Acids Res. 14:6745, описанную в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979) (или подстановочную матрицу EDNAFULL (EMBOSS версия NCBI NUC4.4)); (2) штраф 3,0 за каждый гэп и дополнительный штраф 0,10 за каждый символ в каждом гэпе (или штраф за открытие гэпа 10 и штраф за продолжение гэпа 0,5); и (3) отсутствие штрафа за концевые гэпы.
[0043] Кроме того, гомологию, сходство или идентичность последовательностей двух заданных полинуклеотидов или полипептидов можно устанавливать путем сравнения их последовательностей при помощи гибридизации по Саузерну в условиях определенной жесткости, и установленные жесткие условия гибридизации известны в уровне техники и могут быть установлены способом, хорошо известным специалисту в данной области техники (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et at., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York).
[0044] В еще одном аспекте данного изобретения предложен полинуклеотид, кодирующий такой вариант.
[0045] В данном описании термин «полинуклеотид» относится к полимеру из нуклеотидов, в котором нуклеотидные мономеры соединены друг с другом в длинную цепь ковалентными связями и обычно обозначает цепь ДНК или РНК, имеющую определенную минимальную длину, более конкретно, полинуклеотидный фрагмент, кодирующий указанный вариант.
[0046] Полинуклеотид, кодирующий вариант белка по данному изобретению, может включать любую нуклеотидную последовательность, кодирующую вариант глутамат-цистеинлигазы, обладающий усиленной активностью, без ограничения.
[0047] Ген, кодирующий глутамат-цистеинлигазу по данному изобретению, может представлять собой ген gsh1. Ген может происходить из дрожжей. В частности, ген может происходить из микроорганизма, относящегося к роду Saccharomyces, более конкретно Saccharomyces cerevisiae. В частности, ген может представлять собой ген, кодирующий аминокислотную последовательность SEQ ID NO: 1, более конкретно, последовательность, включающую последовательность оснований SEQ ID NO: 2, без ограничения ими.
[0048] Полинуклеотид по данному изобретению может включать различные модификации, сделанные в кодирующей области, при условии, что они не изменяют аминокислотную последовательность полипептида, экспрессирующегося с кодирующей области вследствие вырожденности кодонов или с учетом предпочтения кодонов у живого организма, в котором экспрессируется полипептид. В частности, в изобретение может быть включена любая полинуклеотидная последовательность, кодирующая вариант белка, в котором аминокислота в положении, соответствующем 86-му положению в SEQ ID NO: 1, замещена на другую аминокислоту, без ограничения. Например, полинуклеотид по настоящему изобретению может иметь полинуклеотидную последовательность, кодирующую вариант белка по настоящему изобретению, в частности белок, включающий одну из аминокислотных последовательностей с SEQ ID NO: 3-21, или полипептид, обладающий гомологией или идентичностью с ним, без ограничения. Гомология или идентичность являются такими, как описано выше.
[0049] Кроме того, полинуклеотид может включать нуклеотидную последовательность, которая гибридизуется с зондом, сконструированным с использованием известной последовательности гена, например нуклеотидную последовательность, полностью или частично комплементарную нуклеотидной последовательности в условиях высокой жесткости, чтобы кодировать вариант белка, в котором аминокислота, соответствующая 86-му положению в аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту, без ограничения.
[0050] Термин «жесткие условия» относится к условиям, позволяющим полинуклеотидам специфически гибридизоваться. Такие условия подробно раскрыты в известных документах (например J. Sambrook et at). Например, эти условия могут включать проведение гибридизации между генами, обладающими высокой гомологией, например 80% или более, в частности 90% или более, более конкретно 95% или более, еще более конкретно 97% или более, особенно 99% или более, при отсутствии гибридизации между генами, обладающими гомологией меньше указанных выше, или осуществление гибридизации однократно, в частности два или более раз, в условиях со стандартной отмывкой при гибридизации по Саузерну с концентрацией соли и температурой 60°С, 1X SSC (хлорида натрия/цитрата натрия) и 0,1% SDS (додецилсульфат натрия), в частности 60°С, 0,1Х SSC и 0,1% SDS, и более конкретно 68°С, 0,1X SSC и 0,1% SDS. Однако жесткие условия гибридизации не ограничиваются указанными и могут быть подходящим образом скорректированы специалистом в данной области техники в зависимости от намеченных целей.
[0051] Для гибридизации необходимо, чтобы два полинуклеотид а имели комплементарные последовательности, хотя возможны несовпадения между основаниями, в зависимости от степени строгости гибридизации. Термин «комплементарный» используется для описания взаимоотношения между нуклеотидными основаниями, способными гибридизоваться друг с другом. Например, в случае ДНК, аденозин комплементарен тимину, а цитозин комплементарен гуанину. Соответственно, данное изобретение может охватывать не только по существу аналогичные нуклеиновокислотные последовательности, но и выделенный фрагмент нуклеиновой кислоты, комплементарный полной последовательности.
[0052] В частности, полинуклеотиды, обладающие гомологией или идентичностью, можно обнаруживать с использованием вышеописанных условий гибридизации, включая процесс гибридизации при значении Tm 55°С. Также, значение Tm может составлять 60°С, 63°С или 65°С, без ограничения ими, и может быть соответствующим образом скорректировано специалистом в данной области техники в зависимости от задач.
[0053] Надлежащая степень строгости для гибридизации полинуклеотидов может зависеть от длин полинуклеотидов и степени комплементарности, и эти параметры хорошо известны в данной области техники.
[0054] В еще одном аспекте настоящего изобретения предложен вектор, включающий в себя полинуклеотид, кодирующий вариант белка.
[0055] В данном описании термин «вектор» относится к ДНК-конструкции, включающей в себя последовательность оснований полинуклеотида, кодирующего целевой белок, функционально связанную с подходящей регуляторной последовательностью для экспрессии целевого белка в подходящей клетке-хозяине. Регуляторная последовательность может включать промотор, обеспечивающий инициацию транскрипции, последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания рибосомы в составе мРНК, и последовательность, регулирующую терминацию транскрипции и трансляции. После введения вектора в подходящую клетку-хозяина он может реплицироваться или функционировать независимо от генома хозяина и может интегрироваться в сам геном.
[0056] Вектор, использованный в данном изобретении, не ограничен каким-либо конкретным вектором, и можно использовать любой известный в данной области техники вектор. В качестве вектора, экспрессируемого дрожжами, можно использовать как интегративную плазмиду дрожжей (YIp), так и внехромосомные плазмидные векторы. Внехромосомный плазмидный вектор может включать эписомные плазмиды дрожжей (YEp), репликативные плазмиды дрожжей (YRp) и центромерные плазмиды дрожжей (YCp). Также, в качестве вектора по данному изобретению можно использовать искусственные хромосомы дрожжей (YAC). В качестве конкретного примера, доступные векторы могут включать pESCHIS, pESC-LEU, pESC-TRP, pESC-URA, Gateway pYES-DEST52, pAO815, pGAPZ A, pGAPZ B, pGAPZ C, pGAPα A, pGAPα B, pGAPα С, pPIC3.5K, pPIC6 A, pPIC6 В, pPIC6 C, pPIC6α A, pPIC6α B, pPIC6α C, pPIC9K, pYC2/CT, вектор pYD1 для дрожжевого дисплея, pYES2, pYES2/CT, pYES2/NT A, pYES2/NT B, pYES2/NT C, pYES2/CT, pYES2.1, pYES-DEST52, pTEF1/Zeo, pFLD1, PichiaPinkTM, p427-TEF, p417-CYC, pGAL-MF, p427-TEF, p417-CYC, PTEF-MF, pBY011, pSGP47, pSGP46, pSGP36, pSGP40, ZM552, pAG303GAL-ccdB, pAG414GAL-ccdB, pAS404, pBridge, pGAD-GH, pGAD T7, pGBK T7, pHIS-2, pOBD2, pRS408, pRS410, pRS418, pRS420, pRS428, микронную форму A дрожжей, pRS403, pRS404, pRS405, pRS406, pYJ403, pYJ404, pYJ405 и pYJ406, без ограничения ими.
[0057] Например, полинуклеотид, кодирующий целевой белок в хромосоме, может быть замещен мутантным полинуклеотидом с использованием вектора для встраивания в хромосому клеток. Встраивание полинуклеотид а в хромосому можно осуществлять любым известным в данной области техники методом, например посредством гомологичной рекомбинации, без ограничения ею. Для подтверждения встраивания в хромосому может быть дополнительно включен селективный маркер. Селективный маркер применяют для отбора клеток, трансформированных вектором, т.е. для подтверждения встраивания нужного полинуклеотида, и примеры селективного маркера могут включать маркеры, обеспечивающие селектируемый фенотип, такой как устойчивость к лекарственным средствам, потребность в питательных веществах, резистентность к цитотоксическим агентам или поверхностная экспрессия варианта полипептида. Только клетки, экспрессирующие селективный маркер, могут выживать или демонстрировать отличающиеся фенотипы в среде, обработанной селективным агентом, и таким образом можно осуществлять отбор трансформированных клеток.
[0058] В данном описании термин «трансформация» относится к процессу введения вектора, включающего в себя полинуклеотид, кодирующий вариант глутамат-цистеинлигазы, в клетку-хозяина, так чтобы белок, кодируемый полинуклеотидом, экспрессировался в клетке-хозяине. Трансформированный полинуклеотид может быть либо в форме, встроенной он в хромосому клетки-хозяина, либо во внехромосомной форме, при условии, что белок экспрессируется в клетке-хозяине. Кроме того, полинуклеотид включает ДНК и РНК, которые кодируют вариант глутамат-цистеинлигазы. Полинуклеотид может быть введен в клетку-хозяина в любой форме, при условии, что полинуклеотид введен в клетку-хозяина и в ней экспрессируется белок. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, включающую все существенные элементы, необходимые для саморепликации. Как правило, экспрессионная кассета может включать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции. Экспрессионная кассета может быть в форме самореплицирующегося экспрессирующего вектора. Кроме того, полинуклеотид может быть введен в клетку-хозяина в его исходной форме и быть функционально связанным с последовательностью, необходимой для экспрессии в клетке-хозяине, без ограничения этим.
[0059] В данном описании термин «функционально связан» означает функциональную связь между полинуклеотидной последовательностью, кодирующей полипептид по данному изобретению, и последовательностью промотора, которая инициирует и опосредует транскрипцию полинуклеотидной последовательности. Способы трансформации по настоящему изобретению включают любые способы, позволяющие вводить вектор в клетку-хозяина и могут быть осуществлены подходящими стандартными методами, хорошо известными в данной области техники, выбранными в соответствии с клеткой-хозяином. Например, можно использовать электропорацию, преципитацию фосфатом кальция (CaPO4), преципитацию хлоридом кальция (CaCl2), микроинъекцию, метод с полиэтиленгликолем (PEG), метод с DEAE-декстраном, метод с катионными липосомами, метод с ацетатом лития-DMSO, однако данное изобретение не ограничивается ими.
[0060] В данном изобретении может быть предложен микроорганизм, продуцирующий глутатион благодаря включению по меньшей мере одного из: варианта; полинуклеотида, кодирующего вариант; и вектора, включающего полинуклеотид.
[0061] Микроорганизм может представлять собой микроорганизм, экспрессирующий вариант, или микроорганизм, в который введен вариант.
[0062] В данном описании термин «микроорганизм, включающий вариант», «микроорганизм, в который введен вариант» или «микроорганизм, экспрессирующий вариант» может относиться к микроорганизму, полученному путем усиления способности продуцировать глутатион в микроорганизме, от природы обладающему слабой способностью продуцировать глутатион, или путем придания способности продуцировать глутатион родительскому штамму, не способному продуцировать глутатион. В частности, микроорганизм может представлять собой микроорганизм, экспрессирующий вариант глутамат-цистеинлигазы, включающий по меньшей мере одну аминокислотную мутацию в аминокислотной последовательности SEQ ID NO: 1, и аминокислотная мутация может включать замену аминокислоты, соответствующей положению 86 от N-конца на другую аминокислоту. Кроме того, микроорганизм может представлять собой микроорганизм, экспрессирующий вариант глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 86 в аминокислотной последовательности SEQ ID NO: 1, замещена на другую аминокислоту, без ограничения этим.
[0063] Глутамат-цистеинлигаза и ее варианты являются такими, как описано выше.
[0064] В данном документе «экспрессируемый/экспрессирующийся» белок означает состояние, в котором целевой белок введен в микроорганизм или экспрессируется в микроорганизме. В случае, когда целевой белок присутствует в микроорганизме, активность белка усилена по сравнению с активностью эндогенного белка или белка до модификации. В свете задач данного изобретения «целевой белок» может представлять собой вышеупомянутый вариант глутамат-цистеинлигазы.
[0065] В частности, термин «введение белка» относится к обеспечению активности конкретного белка в микроорганизме, который не обладает этим белком, или усиление активности белка по сравнению с собственной активностью белка или активностью до модификации. Например, введение белка может относиться к введению полинуклеотида, кодирующего конкретный белок, в хромосому или к введению фрагмента или вектора, включающего полинуклеотид, кодирующий конкретный белок, в микроорганизм, тем самым обеспечивая проявление активности белка. Кроме того, «усиление активности» может означать, что активность конкретного белка микроорганизма усиливается по сравнению с собственной активностью или активностью до модификации. Термин «собственная активность» относится к активности конкретного белка, которой обладал родительский штамм до трансформации, когда микроорганизм трансформирован вследствие естественной или искусственной генетической вариации.
[0066] В частности, усиление активности по данному изобретению может осуществляться по меньшей мере одним из способов, включающим увеличение числа копий гена, кодирующего вариант белка, введение мутации в последовательность, регулирующую экспрессию гена, кодирующего вариант белка, замену последовательности, регулирующей экспрессию гена, кодирующего вариант белка, на последовательность, обладающую более сильной активностью, замену хромосомного гена, кодирующего белок дикого типа, геном, кодирующим вариант белка, дополнительное введение мутации в ген, кодирующий вариант белка, для усиления активности варианта белка и введение варианта белка в микроорганизм, без ограничения этим.
[0067] Увеличение числа копий гена осуществляют в форме функциональной связи с вектором или в форме встраивания в хромосому клетки-хозяина, без конкретного ограничения этим. В частности, данный способ можно осуществлять путем введения в клетку-хозяина вектора, который реплицируется и функционирует независимо от хозяина и функционально связан с полинуклеотидом, кодирующим белок по данному изобретению. В качестве альтернативы, число копий гена может быть увеличено путем введения в клетку-хозяина вектора, который встраивает полинуклеотид в хромосому клетки-хозяина и который функционально связан с полинуклеотидом. Встраивание полинуклеотид а в хромосому можно осуществлять любым известным в данной области техники способом, например посредством гомологичной рекомбинации.
[0068] Кроме того, модификация последовательности, регулирующей экспрессию полинуклеотида, может осуществляться путем индукции вариации в нуклеиновокислотной последовательности путем делеции, вставки, неконсервативной замены, консервативной замены или любой их комбинации для дальнейшего усиления активности последовательности, регулирующей экспрессию, или путем замены нуклеотидной последовательности нуклеотидной последовательностью, обладающей более сильной активностью, без ограничения этим. Выражение "последовательность, регулирующая экспрессию", может включать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность регуляции транскрипции и трансляции, без ограничения ими.
[0069] Более сильный промотор по сравнению с собственным промотором может быть присоединен в направлении против хода транскрипции от экспрессируемой полинуклеотидной единицы, без ограничения этим. Например, когда клетка-хозяин представляет собой дрожжи, доступный промотор может включать промотор TEF1, промотор TEF2, промотор GAL10, промотор GAL1, промотор ADH1, промотор ADH2, промотор РН05, промотор GAL1-10, промотор TDH3 (промотор GPD), промотор TDH2, промотор TDH1, промотор PGK1, промотор PYK2, промотор ENO1, промотор ENO2 и промотор ТРИ, без ограничения ими. Кроме того, описанная модификация полинуклеотидной последовательности на хромосоме может осуществляться путем индукции вариации в последовательности, регулирующей экспрессию, путем делеции, вставки, неконсервативной замены, консервативной замены или любой их комбинации для дальнейшего усиления активности полинуклеотидной последовательности или путем замены нуклеотидной последовательности нуклеотидной последовательностью, модифицированной так, чтобы обладать более сильной активностью, без ограничения этим.
[0070] В целом, введение и усиление активности белка может увеличивать активность или концентрацию соответствующего белка на от 1%, 10%, 25%, 50%, 75%, 100%, 150%, 200%, 300%, 400% или 500%, до максимально 1000% или 2000%, относительно активности или концентрации штамма микроорганизма дикого типа или немодифицированного микроорганизма, без ограничения этим.
[0071] В данном описании термин «немодифицированный микроорганизм» не исключает штаммов, имеющих мутацию, которая может возникнуть в микроорганизмах естественным образом, и может представлять собой штамм дикого типа, микроорганизм, не включающий вариант белка, или микроорганизм, не трансформированный вектором, включающим полинуклеотид, кодирующий вариант белка.
[0072] В данном изобретении микроорганизм, включающий в себя вариант глутамат-цистеинлигазы или кодирующий ее полинуклеотид, может представлять собой, например, рекомбинантный микроорганизм, полученный путем трансформации микроорганизма вектором, содержащим полинуклеотид, без ограничения им. Рекомбинантный микроорганизм может представлять собой дрожжи, например микроорганизм, относящийся к роду Saccharomyces, в частности Saccharomyces cerevisiae. Например, микроорганизм может представлять собой штамм Saccharomyces cerevisiae с регистрационным номером KCCM12659P, без ограничения им.
[0073] В данном описании термин «глутатион» может использоваться взаимозаменяемо с «GSH» и относится к трипептидному соединению, состоящему из трех аминокислот: глутамата, цистеина и глицина. Глутатион может быть использован в качестве исходного материала для фармацевтических средств, функциональной оздоровительной продукции, вкусовых добавок, пищевых и кормовых добавок, косметических средств и тому подобного, без ограничения ими.
[0074] В данном описании термин «глутатион-продуцирующий микроорганизм» включает микроорганизмы, модифицированные посредством естественной или искусственной генетической модификации, и может относиться к микроорганизму, обладающему конкретным механизмом, который ослаблен или усилен в результате введения экзогенного гена или усиления или инактивации эндогенного гена посредством генетической модификации для продуцирования глутатиона. В свете задач настоящего изобретения микроорганизм, продуцирующий глутатион, может относиться к микроорганизму, содержащему глутамат-цистеинлигазу и способному продуцировать большое количество целевого глутатиона по сравнению с микроорганизмами дикого типа или немодифицированными микроорганизмами. «Глутатион-продуцирующий микроорганизм» может использоваться взаимозаменяемо с терминами «микроорганизм, продуцирующий глутатион», «микроорганизм, обладающий способностью продуцировать глутатион», «глутатион-продуцирующий штамм», «штамм, обладающий способностью продуцировать глутатион» или тому подобным.
[0075] Глутатион-продуцирующий микроорганизм может представлять собой рекомбинантный микроорганизм. Рекомбинантный микроорганизм является таким, как описано выше.
[0076] Глутатион-продуцирующий микроорганизм не ограничен каким-либо конкретным типом, при условии, что он продуцирует глутатион, но может представлять собой микроорганизм, относящийся к роду Saccharomyces, в частности Saccharomyces cerevisiae, без ограничения им.
[0077] Родительский штамм глутатион-продуцирующего микроорганизма, включающего вариант, конкретно не ограничен, при условии, что этот штамм обладает способностью продуцировать глутатион. Микроорганизм может включать модификацию для усиления биосинтетического пути для увеличения способности продуцировать глутатион, снятия ингибирования по принципу обратной связи и инактивации генов, которые ослабляют путь деградации или путь биосинтеза, и такая модификация не исключает модификацию, возникающую естественным образом. Однако, данное изобретение не ограничивается указанным.
[0078] В другом аспекте настоящего изобретения предложен способ получения глутатиона, включающий культивирование микроорганизма. Микроорганизм и глутатион являются такими, как описано выше. Глутатион может накапливаться в штамме при культивировании штаммов.
[0079] Применительно к культуральной среде или другим условиям культивирования для культивирования штамма по данному изобретению можно использовать любую среду для культивирования, обычно используемую для культивирования микроорганизмов, принадлежащих к роду Saccharomyces, без ограничения. В частности, штамм по данному изобретению можно культивировать в обычной среде, содержащей надлежащие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины, в аэробных или анаэробных условиях при поддержании температуры, рН и тому подобного.
[0080] В данном изобретении в качестве источников углерода можно использовать такие углеводы, как глюкоза, фруктоза, сахароза и мальтоза; такие сахароспирты, как маннит и сорбит; такие органические кислоты, как пировиноградная кислота, молочная кислота и лимонная кислота, и такие аминокислоты, как глутамат, метионин и лизин, без ограничения ими. Кроме того, можно использовать такие органические питательные вещества, как гидролизаты крахмала, меласса, сырая меласса, рисовые отруби, маниок, тростниково-сахарная багасса и кукурузный экстракт, и такие углеводы, как глюкоза и стерилизованная обработанная меласса (т.е. меласса, в которой сахара конвертированы в восстанавливающие сахара) и, кроме того, можно использовать подходящие количества любых других источников углерода, без ограничения ими. Такие источники углерода можно использовать по отдельности или в виде комбинации по меньшей мере двух из них.
[0081] В качестве источников азота можно использовать источники неорганического азота, такие как аммоний, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония, и источники органического азота, такие как аминокислоты, пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, мальтозный экстракт, кукурузный экстракт, гидролизат казеина, рыба или продукты ее деструкции, и обезжиренный соевый жмых или продукты его деструкции. Такие источники углерода можно использовать по отдельности или в виде комбинации по меньшей мере двух из них.
[0082] В качестве источников фосфора можно использовать дигидрофосфат калия, гидрофосфат калия или соответствующие натрий-содержащие соли. В качестве неорганических соединений можно использовать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и тому подобные.
[0083] Культуральная среда может дополнительно включать аминокислоты, витамины и/или подходящие предшественники. В частности, в среду для культивирования штамма можно добавлять L-аминокислоты или тому подобное. В частности, при необходимости, в культуральную среду можно добавлять глицин, глутамат и/или цистеин и дополнительно добавлять такие L-аминокислоты, как лизин, однако данное изобретение не ограничивается перечисленным.
[0084] Культуральную среду и предшественники можно добавлять к культурам периодически или непрерывно, без ограничения этим.
[0085] В данном изобретении для корректировки рН культуры в процессе культивирования штамма к культурам можно надлежащим образом добавлять такие соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Кроме того, для предупреждения образования пены в процессе культивирования можно добавлять пеногаситель, такой как сложный полигликолевый эфир жирной кислоты. Дополнительно, для поддержания культур в аэробных условиях можно инжектировать в культуры кислород или кислород-содержащий газ, и газообразный азот, водород или диоксид углерода можно инжектировать в культуры для поддержания культуры в анаэробных и микроаэробных условиях, без инжектирования каких-либо других газов.
[0086] Температуру культивирования можно поддерживать от 25°С до 40°С, и в частности от 28°С до 37°С, без ограничения этим. Культивирование можно продолжать до достижения нужного количества нужного вещества, в частности от 1 до 100 часов, без ограничения этим.
[0087] Способ получения глутатиона может дополнительно включать дополнительный процесс после стадии культивирования. Дополнительный процесс может быть надлежащим образом выбран в соответствии с целью применения глутатиона.
[0088] В частности, способ получения глутатиона может включать выделение глутатиона из по меньшей мере одного, выбранного из штамма, высушенного продукта, экстракта, культурального продукта и его лизата, после культивирования микроорганизма.
[0089] Способ может дополнительно включать лизирование штамма до или одновременно со стадией выделения. Лизирование штамма может осуществляться любым способом, обычно используемым в области техники, к которой относится данное изобретение, например путем обработки нагревом или путем использования лизирующего буферного раствора, ультразвукового гомогенизатора и френч-пресса. Также, стадия лизирования может включать ферментативную реакцию посредством литического фермента клеточной стенки, нуклеазы, транснуклеотидазы, протеазы или тому подобного, без ограничения ими.
[0090] В свете задач данного изобретения посредством способа получения глутатиона можно получать сухие дрожжи, экстракт дрожжей, порошкообразную смесь дрожжевого экстракта и чистый глутатион, каждый из которых имеет высокое содержание глутатиона. Однако данное изобретение не ограничивается перечисленным, и указанные продукты могут быть приготовлены соответствующим образом в соответствии с нужными продуктами.
[0091] В данном изобретении "сухие дрожжи" могут использоваться взаимозаменяемо с «высушенным продуктом штамма». Сухие дрожжи могут быть получены путем сушки штамма дрожжей, в котором накоплен глутатион и, в частности, они могут входить в кормовую композицию, пищевую композицию и тому подобное, без ограничения ими.
[0092] В данном изобретении "дрожжевой экстракт» может использоваться взаимозаменяемо с таким термином как «экстракт штамма». Экстракт штамма может относиться к веществам, остающимся после отделения клеточных стенок от штаммов. В частности, экстракт штамма может относиться к остающимся компонентам, за исключением клеточных стенок, среди компонентов, полученных путем лизиса клеток. Экстракт штамма включает глутатион и один или более других компонентов, выбранных из белков, углеводов, нуклеиновых кислот и волокон, в дополнение к глутатиону, без ограничения ими.
[0093] Стадия выделения может осуществляться любым подходящим способом, известным в данной области техники, и глутатион может быть выделен как целевое вещество.
[0094] Стадия выделения может включать процесс очистки. Процесс очистки можно осуществлять путем выделения из штамма только глутатиона. При помощи процесса очистки можно получать глутатион.
[0095] При необходимости, способ получения глутатиона может дополнительно включать смешивание эксципиента с одним, выбранным из: штамма, его высушенного продукта, экстракта, культуры и лизата и выделенного из них глутатиона. Благодаря стадии смешивания можно получать порошкообразную смесь дрожжевого экстракта.
[0096] Эксципиент может быть надлежащим образом выбран и использован согласно целевому назначению или форме и, например, может быть выбран из крахмала, глюкозы, целлюлозы, лактозы, гликогена, D-маннита, сорбита, лактита, мальтодекстрина, карбоната кальция, искусственного силиката алюминия, моногидрофосфата кальция, сульфата кальция, хлорида натрия, гидрокарбоната натрия, очищенного ланолина, декстрина, альгината натрия, метилцеллюлозы, коллоидного диоксида кремния, гидроксипропилкрахмала, гидроксипропилметил целлюлозы, пропиленгликоля, казеина, лактата кальция, примойела и гуммиарабика, и, в частности, он может включать по меньшей мере один компонент, выбранный из крахмала, глюкозы, целлюлозы, лактозы, декстрина, гликогена, D-маннита и мальтодекстрина, без ограничения ими.
[0097] Эксципиент может включать, например, консервант, увлажняющее вещество, диспергирующее вещество, суспендирующее вещество, буфер, стабилизатор или изотоническое вещество, без ограничения ими.
[0098] В другом аспекте данного изобретения предложено применение варианта глутамат-цистеинлигазы для получения глутатиона. В другом аспекте данного изобретения предложено применение микроорганизма для получения глутатиона. Вариант глутамат-цистеинлигазы, микроорганизм и глутатион являются такими, как описано выше.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0099] Далее данное изобретение будет описано более подробно со ссылкой на приведенные ниже примеры и экспериментальные примеры. Однако приведенные ниже примеры и экспериментальные примеры предназначены исключительно для иллюстрации данного изобретения и не ограничивают объем данного изобретения.
[00100] Пример 1. Выбор глутатион-продуцирующего штамма и подтверждение способности продуцировать глутатион
[00101] Штаммы получали из прессованных дрожжей, содержащих различные штаммы, и улучшали их характеристики для отбора штаммов, обладающих способностью продуцировать глутатион.
[00102] В частности, отбирали образцы зерен, таких как рис, ячмень, бобы мунг и овес из 20 областей, таких как Hwaseong, Pyeongtaek, Yongin и им подобные из провинции Gyeonggi-do, Республика Корея, измельчали, растирали, помещали в ткань, плотно спрессовывали для придания им формы, оборачивали соломой для ферментации в течение 10 суток и медленно сушили с получением прессованных дрожжей.
[00103] Проводили следующий эксперимент для выделения различных штаммов из полученных прессованных дрожжей. К 5 г прессованных дрожжей добавляли 45 мл солевого раствора и измельчали при помощи миксера. Для выделения чистых штаммов дрожжей полученное разводили путем последовательных разведений, наносили на агар YPD (10 г/л дрожжевого экстракта, 20 г/л бактопептона и 20 г/л глюкозы на 1 л дистиллированной воды) и культивировали при 30°С в течение 48 часов. Затем, руководствуясь морфологией колоний и верификацией под микроскопом, осуществляли посев штрихом колоний дрожжей на агар YPD. 25 мл среды YPD в конических колбах объемом 250 мл инокулировали выделенным чистым штаммом и культивировали в инкубаторе со встряхиванием в течение 48 часов при 30°С и 220 об/мин. Проводили скрининг штаммов, определяя продуцирование глутатиона.
[00104] Для улучшения первично выделенных штаммов, в выделенных штаммах индуцировали случайный мутагенез. В частности, из прессованных дрожжей выделяли штамм с подтвержденной способностью продуцировать глутатион и обозначали его как штамм CJ-37. Штамм CJ-37 культивировали на твердой среде и инокулировали в бульон с получением раствора его культуры и подвергали раствор культуры УФ-облучению с использованием УФ-лампы. После посева раствора культуры, подвергнутой воздействию УФ лучей, на среду в чашке выделяли только мутантный штамм, образовывавший колонии, и определяли продуцирование им глутатиона.
[00105] В результате среди мутантных штаммов отбирали штамм с наиболее высоким продуцированием глутатиона, в качестве глутатион-продуцирующего штамма, обозначали его как штамм CJ-5, депонировали 31 июля 2019 в Корейском Центре культур микроорганизмов (KCCM) в соответствии с Будапештским договором с присвоением регистрационного номера KCCM12568P.
[00106] Пример 2. Эксперимент для дальнейшего улучшения глутатион-продуцирующей способности
[00107] Для дальнейшего улучшения способности штамма CJ-5 продуцировать глутатион индуцировали мутацию следующим образом.
[00108] Штамм CJ-5 культивировали на твердой среде и инокулировали в бульон с получением раствора его культуры и подвергали раствор культуры УФ-облучению с использованием УФ-лампы. После посева раствора культуры, подверженной воздействию УФ-лучей, на среду в чашке выделяли только мутантный штамм, образовавший колонии. Выделяли штамм, демонстрирующий наибольшую продуцирование глутатиона, обозначали его как штамм СС02-2490, депонировали 17 января 2020 в Корейском Центре культур микроорганизмов (KCCM) в соответствии с Будапештским договором с присвоением регистрационного номера КССМ 12659Р. В результате анализа последовательности оснований gsh1, представляющего собой ген биосинтеза глутатиона, в отношении усиления глутатион-продуцирующей способности штамма, было подтверждено, что цистеин, который является 86й аминокислотой белка GSH1, кодируемого геном gsh1, заменен на аргинин.
[00109] Пример 3. Эксперимент с мутацией остатка С86 GSH1
[00110] Учитывая на основании результатов Примера 2, что аминокислота в положении 86 белка GSH1 важна для продуцирования глутатиона, получали мутантные штаммы Saccharomyces cerevisiae (S. cerevisiae) CEN.PK2-1D и Saccharomyces cerevisiae (S. cerevisiae) CJ-5, экспрессирующие варианты белка, в которых цистеин в положении 86 белка GSH1 был заменен на другую аминокислоту, и определяли увеличение продуцирования глутатиона.
[00111] Для получения штаммов, в которых цистеин в положении 86 белка GSH1 Saccharomyces cerevisiae был заменен на аргинин, использовали плазмиды pWAL100 и pWBR100 согласно публикации Lee ТН et al. (J. Microbiol. Biotechnol. (2006), 16(6), 979 982). В частности, проводили полимеразную цепную реакцию (ПЦР) с использованием в качестве матрицы геномной ДНК штамма CJ-5 следующим образом. Получали частичную последовательность N-конца белка GSH1, включающую N-концевую фланкирующую последовательность BamHI, инициирующий кодон ORF (открытой рамки считывания) GSH1 и последовательность, кодирующую мутацию C86R, осуществляя ПЦР с использованием праймеров с SEQ ID NO: 22 и 23, и частичную последовательность С-конца белка GSH1, включающую С-концевую фланкирующую последовательность XhoI, терминирующий кодон ORF GSH1 и последовательность, кодирующую мутацию C86R, осуществляя ПЦР с использованием праймеров с SEQ ID NO: 24 и 25. Затем, в результате осуществления перекрывающейся ПЦР с использованием в качестве матрицы двух последовательностей с праймерами SEQ ID NO: 22 и 25, получали фрагмент ORF GSH1, включающий последовательность, кодирующую модифицированный белок GSH1, в котором цистеин в положении 86 был заменен на аргинин, с N-концевой последовательностью, распознаваемой рестрикционным ферментом BamHI, и С-концевой последовательностью, распознаваемой рестрикционным ферментом XhoI. Фрагмент ORF обрабатывали BamHI и XhoI и затем клонировали в вектор pWALlOO, обработанный теми же ферментами, с получением вектора pWAL100-GSHl(C86R).
[00112] Также, получали 500 п. н. в направлении по ходу транскрипции относительно терминирующего кодона ORF GSH1, включающие N-концевую последовательность, распознаваемую рестрикционным ферментом SpeI, и С-концевую последовательность, распознаваемую рестрикционным ферментом NcoI, выполняя ПЦР с использованием геномной ДНК штамма CJ-5 в качестве матрицы и праймеров с SEQ ID NO: 26 и 27 и обрабатывали рестрикционными ферментами SpeI и NcoI. Затем полученное клонировали в pWBR100, обработанный теми же ферментами с получением вектора pWBR100-GSH1.
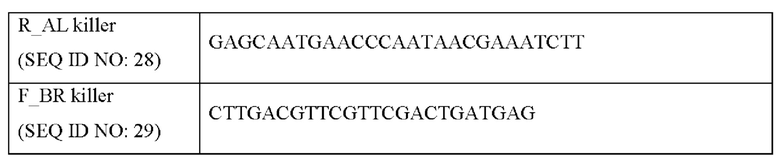
[00113] Для получения итогового фрагмента ДНК для введения в дрожжи получали ПЦР-продукты, включающие последовательность, кодирующую аргининовую мутацию и часть KlURA3, с использованием в качестве матрицы вектора pWAL100-GSH1(C86R), полученного как описано выше, и праймеров с SEQ ID NO: 22 и 28, и получали ПЦР-продукты, включающие часть KlURA3 и 500 п. н. в направлении по ходу транскрипции относительно терминирующего кодона GSH1, с использованием в качестве матрицы вектора pWBR100-GSH1 и праймеров с SEQ ID NO: 29 и 27. Трансформировали S. cerevisiae CEN.PK2-1D и S. cerevisiae CJ-5 ПЦР-продуктами в одинаковом молярном отношении. Выполняли ПЦР посредством денатурации при 95°С в течение 5 минут, отжига при 53°С в течение 1 минуты и полимеризации в течение 1 минуты на т.о. при 72°С, и осуществляли трансформацию дрожжей согласно способу с ацетатом лития, модифицированному на основе способа, изложенного в публикации Geitz (Nucleic Acid Research, 20(6), 1425). В частности, клетки дрожжей с ОП (оптическая плотность) от 0,7 до 1,2 двукратно промывали ацетатом лития/буфером ТЕ (трис-ЭДТА) и смешивали с ПЦР-продуктами и одноцепочечной ДНК (Sigma D-7656). Культивировали клетки в условиях статической культуры в буфере ацетат лития/ТЕ/40% ПЭГ при 30°С в течение 30 минут и при 42°С в течение 15 минут. Затем клетки культивировали на чашке с агаром SC (2% глюкоза), не содержащим урацил, до появления видимых колоний с получением штамма, в который были введены последовательность, кодирующая GSH1 с мутацией C86R и ген KlURA3. Затем для удаления KlURA3 штаммы культивировали в 2 мл YPD в течение ночи, разбавляли в соотношении 1/100, высевали на чашку с агаром SC (с 2% глюкозой), содержащим 0,1% 5-FOA (5-фтороротовая кислота), с получением мутантного штамма S. cerevisiae CEN.PK2-1D GSH1 C86R и мутантного штамма S. cerevisiae CJ-5 GSH1 C86R, лишенных урацильного маркера. Также, штаммы, способные экспрессировать белки с модифицированным GSH1, в которых цистеин был замещен 18 типами аминокислот, отличных от аргинина, получали аналогичным образом, за исключением того, что использовали пару праймеров с SEQ ID NOS: 23 и 24, в которых последовательность, кодирующая 86й аргинин, была заменена последовательностью, кодирующей другую аминокислоту.

[00115] После культивирования штаммов, полученных, как описано выше, в течение 26 часов измеряли концентрацию полученного глутатиона (GSH), которая приведена в Таблицах 2 и 3.
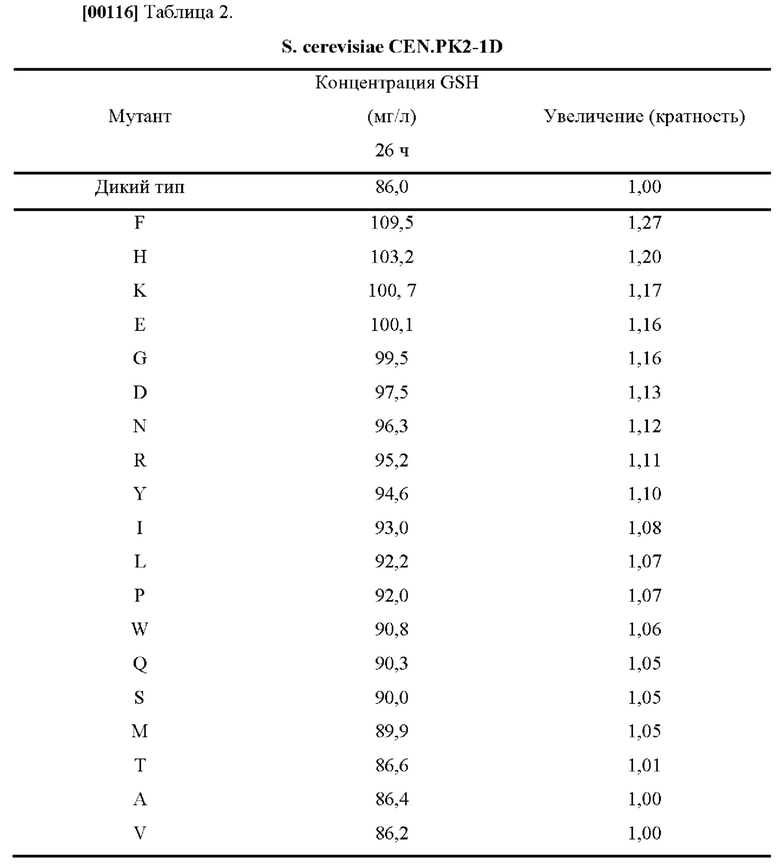

[00118] На основании результатов эксперимента было подтверждено, что способность продуцировать глутатион, полученная в результате замены цистеина в положении 86 белка GSH1 на другую аминокислоту, повышалась вплоть до 27% по сравнению со способностью продуцировать глутатион, полученной у белка GSH1 дикого типа.
[00119] На этом основании было подтверждено, что вариант GSH1, полученный путем замены цистеина в положении 86 белка GSH1 на другую аминокислоту, обладал значительно улучшенной способностью продуцировать глутатион.
[00120] Пример 4. Подтверждение влияния другого остатка Cys на продуцирование глутатиона
[00121] В качестве сравнительного примера модифицировали другой остаток Cys белка GSH1 и исследовали глутатион-продуцирующую способность, полученную в результате модификации. Результаты приведены в Таблице 4 ниже.
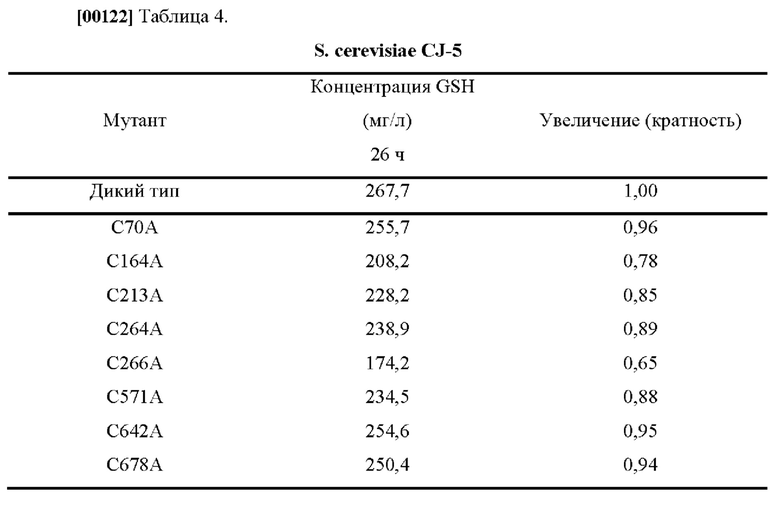
[00123] На основании результатов эксперимента, остаток цистеина, отличный от цистеина в положении 86, не оказывал повышающего влияния на продуцирование глутатиона, а наоборот, снижал продуцирование глутатиона.
[00124] На этом основании было подтверждено, что не все остатки цистеина, присутствующие в белке, обладают повышающим эффектом на продуцирование глутатиона. Также было подтверждено, что новый вариант GSH1, разработанный в данном изобретении, повышал продуцирование глутатиона.
[00125] Поскольку дрожжи, продуцирующие глутатион с высоким выходом, их высушенный продукт, экстракт, культура и лизат и произведенный глутатион обладают антиоксидантным, детоксикационным и усиливающим иммунитет влиянием, их можно эффективно применять для получения косметической композиции, пищевой композиции, кормовой композиции и фармацевтической композиции.
[00126] Приведенное выше описание данного изобретения представлен для иллюстрации, и специалистам в данной области техники понятно, что возможны различные изменения и модификации, не изменяющие технической концепции и существенных признаков данного изобретения. Таким образом, очевидно, что описанные выше воплощения являются иллюстративными во всех аспектах и не ограничивают данное изобретение. Не следует считать исчерпывающими различные воплощения, изложенные в данном документе, истинный объем изобретения определяется формулой изобретения, приведенной ниже. Данное изобретение ограничивается исключительно признаками формулы изобретения, охватывая и весь объем эквивалентов, на которые распространяется такая формула изобретения.
Изобретение относится к биотехнологии и представляет собой вариант глутамат-цистеинлигазы, обладающий активностью глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена на другую аминокислоту. Изобретение также относится к способу получения глутатиона, включающий культивирование в культуральной среде микроорганизма, содержащего вариант глутамат-цистеинлигазы согласно изобретению; полинуклеотида, кодирующего этот вариант, и вектора, содержащего этот полинуклеотид. Изобретение позволяет получать глутатион с высокой степенью эффективности. 6 н. и 6 з.п. ф-лы, 4 табл., 4 пр.
1. Вариант глутамат-цистеинлигазы, обладающий активностью глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена на другую аминокислоту.
2. Вариант глутамат-цистеинлигазы по п. 1, в котором аминокислота, соответствующая положению 86, заменена на глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, серин, треонин, тирозин, аспарагин, глутамат, глутамин, аспартат, лизин, аргинин или гистидин.
3. Вариант глутамат-цистеинлигазы, обладающий активностью глутамат-цистеинлигазы, и имеющий гомологию последовательности, равную или более 80% и менее 100%, с аминокислотной последовательностью SEQ ID NO: 1, в котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена на другую аминокислоту.
4. Вариант глутамат-цистеинлигазы по п. 1, который состоит из одной аминокислотной последовательности, выбранной из SEQ ID NO: 3 - 21.
5. Полинуклеотид, кодирующий вариант глутамат-цистеинлигазы по любому из пп. 1 - 4.
6. Экспрессионный вектор, содержащий полинуклеотид по п. 5.
7. Микроорганизм, продуцирующий глутатион, содержащий по меньшей мере один из: варианта глутамат-цистеинлигазы по любому из пп. 1 - 4; полинуклеотида, кодирующего этот вариант, и вектора, содержащего этот полинуклеотид.
8. Микроорганизм по п. 7, который представляет собой микроорганизм, принадлежащий к роду Saccharomyces.
9. Микроорганизм по п. 7, который представляет собой Saccharomyces cerevisiae.
10. Микроорганизм по п. 7, который представляет собой штамм Saccharomyces cerevisiae, депонированный под регистрационным номером KCCM12659P.
11. Способ получения глутатиона, включающий культивирование в культуральной среде микроорганизма, содержащего по меньшей мере один из: варианта глутамат-цистеинлигазы по любому из пп. 1 - 4; полинуклеотида, кодирующего этот вариант, и вектора, содержащего этот полинуклеотид.
12. Способ по п. 11, дополнительно включающий выделение глутатиона из по меньшей мере одного, выбранного из культивируемого микроорганизма, высушенного продукта этого микроорганизма, экстракта этого микроорганизма, культуры этого микроорганизма и лизата этого микроорганизма.
| EP 3101130 A1, 07.12.2016 | |||
| CN 102911960 B, 08.10.2014 | |||
| WO 2010075243 A2, 01.07.2010 | |||
| Компаратор напряжения | 1988 |
|
SU1539982A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2023-12-11—Публикация
2021-03-24—Подача