Область изобретения
Настоящее изобретение относится к варианту изопропилмалатсинтазы и способу получения L-лейцина с его использованием.
Предшествующий уровень техники
L-Лейцин представляет собой незаменимую аминокислоту, и является дорогостоящей аминокислотой, широко используемой в лекарственных средствах, пищевых продуктах, кормовых добавках, промышленных химикатах и т.п. В основном его полуют с использованием микроорганизмов. Получение аминокислот с разветвленной цепью, включая L-лейцин, путем ферментации в основном осуществляют при помощи микроорганизмов рода Escherichia или микроорганизмов рода Corynebacterium, и аминокислоты с разветвленной цепью, как известно, биосинтезируются из пировиноградной кислоты за несколько стадий с использованием 2-кетоизокапроата в качестве предшественника (Корейский патент №10-0220018, Корейский патент №10-0438146).
Изопропилмалатсинтаза, которая представляет собой фермент, вовлеченный в биосинтез L-лейцина, представляет собой фермент первой стадии в биосинтезе лейцина, который превращает 2-кетоизовалериат, продуцируемый в пути биосинтеза валина, в изопропилмалат, который необходим в биосинтезе лейцина вместо валина, и изопропилмалатсинтаза представляет собой важный фермент в процессе биосинтеза лейцина. Однако изопропилмалатсинтаза подвергается ингибированию по типу обратной связи L-лейцином, который является конечным продуктом, или его производными. Соответственно, хотя существует множество документов предшествующего уровня техники, относящихся к вариантам изопропилмалатсинтазы, которые ослабляют ингибирование по типу обратной связи, до сих пор продолжаются исследования для обнаружения более хороших вариантов с целью получения высокой концентрации лейцина (патентная публикация США №2015-0079641 и патент США №6403342).
Описание изобретения
Техническая проблема
Авторы настоящего изобретения постарались разработать вариант изопропилмалатсинтазы, который может быть использован для получения L-лейцина в высокой концентрации, и в результате они разработали новый вариант изопропилмалатсинтазы и подтвердили, что L-лейцин может быть получен с высоким выходом из микроорганизма, включающего его, тем самым завершив настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить вариант полипептида, обладающий активностью изопропилмалатсинтазы.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить полинуклеотид, кодирующий вариант полипептида по настоящему изобретению.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить вектор, содержащий полинуклеотид по настоящему изобретению.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Corynebacterium, продуцирующий L-лейцин, где микроорганизм содержит вариант полипептида по настоящему изобретению; кодирующий его полинуклеотид; или включающий его вектор.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения L-лейцина, включающий стадию культивирования в среде микроорганизма рода Corynebacterium, продуцирующего L-лейцин, где микроорганизм содержит вариант полипептида по настоящему изобретению; кодирующий его полинуклеотид; или включающий его вектор.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить композицию для получения L-лейцина, где композиция содержит штамм Corynebacterium glutamicum, включающий вариант полипептида по настоящему изобретению или полинуклеотид по настоящему изобретению; или среду, в которой культивируют штамм.
Полезные эффекты
В настоящем изобретении вариант полипептида, обладающий активностью изопропилмалатсинтазы, обладает повышенной активностью по сравнению с изопропилмалатсинтазой дикого типа, и он его можно применять для крупномасштабного получения L-лейцина с высоким выходом.
Подробное описание предпочтительных воплощений
Настоящее изобретение будет подробно описано ниже. Между тем, каждое описание и воплощение, раскрытые в данном описании изобретения, также может применяться к другим описаниям и воплощениям. То есть все комбинации различных элементов, раскрытых в данном описании изобретения, входят в объем настоящего изобретения. Кроме того, объем настоящего изобретения не ограничен конкретным описанием, представленным ниже. Кроме того, специалистам в данной области техники понятно или они могут определить, с использованием не более чем стандартных экспериментов, множество эквивалентов конкретных воплощений описанного здесь изобретения. Кроме того, эти эквиваленты следует интерпретировать как входящие в объем настоящего изобретения.
Для достижения этих задач в одном из аспектов настоящего изобретения предложен вариант полипептида, обладающий активностью изопропилмалатсинтазы.
В частности, вариант полипептида может включать одну или более чем одну замену, выбранную из группы, состоящей из 1) замены аминокислотного остатка, соответствующего положению 138, другим аминокислотным остатком, 2) замены аминокислотного остатка, соответствующего положению 162, другим аминокислотным остатком, 3) замены аминокислотного остатка, соответствующего положению 211, другим аминокислотным остатком, 4) замены аминокислотного остатка, соответствующего положению 245, другим аминокислотным остатком, и 5) замены аминокислотного остатка, соответствующего положению 588, другим аминокислотным остатком, в аминокислотной последовательности SEQ ID NO: 1.
Используемый здесь термин "изопропилмалатсинтаза (IPMS)" относится к ферменту, который превращает 2-кетоизовалериат в изопропилмалат, являющийся предшественником L-лейцина, путем взаимодействия с ацетил-СоА. В настоящем изобретении термин изопропилмалатсинтаза может быть использован взаимозаменяемо с терминами фермент, синтезирующий изопропилмалат, IPMS, белок LeuA или LeuA.
В настоящем изобретении последовательность LeuA может быть получена из GenBank в NCBI (Национальный центр биотехнологической информации), который представляет собой известную базу данных, и в частности, LeuA может представлять собой белок, обладающий активностью изопропилмалатсинтазы, который кодируется геном leuA, но не ограничен этим.
LeuA может представлять собой фермент, полученный из микроорганизма рода Corynebacterium. В частности, LeuA может представлять собой изопропилмалатсинтазу, полученную из Corynebacterium glutamicum.
LeuA по настоящему изобретению может включать аминокислотную последовательность SEQ ID NO: 1, но не ограничивается этим. Кроме того, LeuA может включать полипептид, обладающий по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99% гомологией с аминокислотной последовательностью SEQ ID NO: 1. Кроме того, очевидно, что аминокислотная последовательность, обладающая такой гомологией или идентичностью и демонстрирующая активность, соответствующую активности изопропилмалатсинтазы, может быть включена в объем настоящего изобретения, даже хотя она имеет аминокислотную последовательность, в которой некоторые последовательности удалены, модифицированы, заменены или добавлены.
Например, LeuA может включать последовательности, имеющие вставку или делецию последовательности, не изменяющие функцию белка по настоящему изобретению, по N-концу, С-концу и/или внутри аминокислотной последовательности, или природную мутацию, молчащую мутацию или консервативную замену.
"Консервативная замена" означает замену одной аминокислоты на другую аминокислоту, имеющую похожие структурные и/или химические свойства. Такая аминокислотная замена обычно может осуществляться на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Обычно консервативная замена может незначительно влиять или не влиять на активность белков или полипептидов.
LeuA по настоящему изобретению может иметь аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, обладающую 90% или более идентичностью с ней, или может состоять из этой аминокислотной последовательности или может по существу состоять из этой аминокислотной последовательности.
Используемый здесь термин "вариант полипептида" относится к полипептиду, имеющему аминокислотную последовательность, отличающуюся от аминокислотной последовательности варианта полипептида перед модификацией консервативной заменой и/или модификацией одной или более аминокислот, но с сохранением функций или свойств. Такие варианты полипептида как правило могут быть идентифицированы путем модификации одной или более аминокислот в аминокислотной последовательности полипептида и оценки свойств модифицированного полипептида. Иначе говоря, способность варианта полипептида может быть увеличена, не изменена или уменьшена по сравнению с нативным полипептидом до изменения. Кроме того, некоторые варианты полипептида могут включать варианты полипептида, в которых один или более чем один фрагмент, такой как N-концевая лидерная последовательность или трансмембранный домен, удален. Другие варианты полипептида могут включать варианты полипептида, в которых удалена часть N- и/или С-конца зрелого белка. Термин "вариант полипептида" может быть использован взаимозаменяемо с такими терминами, как модификация, модифицированный полипептид, модифицированный белок, мутант, мутеин и дивергент, но не ограничен ими при условии, что этот термин используют в значении вариации.
Кроме того, вариант полипептида также может включать делеции или вставки аминокислот, которые обладают минимальным эффектом на свойства и вторичную структуру полипептида. Например, сигнальная (или лидерная) последовательность, которая котрансляционно или посттрансляционно вовлечена в транслокацию белков, может быть конъюгирована с N-концом варианта полипептида. Кроме того, вариант полипептида может быть конъюгирован с другими последовательностями или линкерами для идентификации, очистки или синтеза.
Вариант полипептида по настоящему изобретению может обладать активностью изопропилмалатсинтазы. Кроме того, вариант полипептида по настоящему изобретению может обладать усиленной активностью изопропилмалатсинтазы по сравнению с полипептидом дикого типа, обладающим активностью изопропилмалатсинтазы.
Вариант полипептида по настоящему изобретению может включать одну или более замен, выбранных из группы, состоящей из 1) замены аминокислотного остатка, соответствующего положению 138, другим аминокислотным остатком, 2) замену аминокислотного остатка, соответствующего положению 162, другим аминокислотным остатком, 3) замену аминокислотного остатка, соответствующего положению 211, другим аминокислотным остатком, 4) замену аминокислотного остатка, соответствующего положению 245, другим аминокислотным остатком, и 5) замену аминокислотного остатка, соответствующего положению 588, другим аминокислотным остатком в аминокислотной последовательности SEQ ID NO: 1, в частности одну или более замен, выбранных из группы, состоящей из 1) замены лейцина, который представляет собой аминокислотный остаток, соответствующий положению 138, другим аминокислотным остатком, отличным от лейцина, 2) замены гистидина, который представляет собой аминокислотный остаток, соответствующий положению 162, другим аминокислотным остатком, отличным от гистидина, 3) замену серина, который представляет собой аминокислотный остаток, соответствующий положению 211, другим аминокислотным остатком, отличным от серина, 4) замену аспарагина, который представляет собой аминокислотный остаток, соответствующий положению 245, другим аминокислотным остатком, отличным от аспарагина, и 5) замену изолейцина, который представляет собой аминокислотный остаток, соответствующий положению 588, другим аминокислотным остатком, отличным от изолейцина, в аминокислотной последовательности SEQ ID NO: 1, и более конкретно, одну или более замен, выбранных из группы, состоящей из 1) замены лейцина, который представляет собой аминокислотный остаток, соответствующий положению 138, на глицин, 2) замены гистидина, который представляет собой аминокислотный остаток, соответствующий положению 162, на глутамат, 3) замену серина, который представляет собой аминокислотный остаток, соответствующий положению 211, на лейцин, 4) замену аспарагина, который представляет собой аминокислотный остаток, соответствующий положению 245, на серии, и 5) замену изолейцина, который представляет собой аминокислотный остаток, соответствующий положению 588, на пролин в аминокислотной последовательности SEQ ID NO: 1, и еще более конкретно, одну или более чем одну, две или более чем две, три или более чем три, четыре или более чем четыре и пять замен. Две или более замены могут представлять собой комбинацию (1) и (5); комбинацию (2) и (5); комбинацию (3) и (5); или комбинацию (4) и (5), но не ограничиваются ими. Четыре или более замены могут представлять собой комбинацию (1), (2), (3) и (4), но не ограничиваются ими. Пять или более замен могут представлять собой комбинацию (1), (2), (3), (4) и (5).
Вариант полипептида по настоящему изобретению может иметь/включать аминокислотную последовательность SEQ ID NO: 6, или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, или может состоять из/может по существу состоять из аминокислотной последовательности SEQ ID NO: 6, или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14. Вариант полипептида по настоящему изобретению может включать полипептид, обладающий по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99%, или более чем 99%, и менее чем 100% идентичностью или гомологией с аминокислотной последовательностью SEQ ID NO: 6, или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, где 1) аминокислотный остаток, соответствующий положению 138, представляет собой глицин, 2) аминокислотный остаток, соответствующий положению 162, представляет собой глутамат, 3) аминокислотный остаток, соответствующий положению 211, представляет собой лейцин, 4) аминокислотный остаток, соответствующий положению 245, представляет собой серии, или 5) аминокислотный остаток, соответствующий положению 588, представляет собой пролин, в аминокислотной последовательности SEQ ID NO: 6, или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14. В частности, SEQ ID NO: 6 может представлять собой аминокислотную последовательность, в которой лейцин, который представляет собой аминокислотный остаток, соответствующий положению 138 в аминокислотной последовательности SEQ ID NO: 1, заменен на глицин, SEQ ID NO: 8 может представлять собой аминокислотную последовательность, в которой гистидин, который представляет собой аминокислотный остаток, соответствующий положению 162, заменен на глутамат, SEQ ID NO: 10 может представлять собой аминокислотную последовательность, в которой серии, который представляет собой аминокислотный остаток, соответствующий положению 211, заменен на лейцин, SEQ ID NO: 12 может представлять собой аминокислотную последовательность, в которой изолейцин который представляет собой аминокислотный остаток, соответствующий положению 588, заменен на пролин, и SEQ ID NO: 14 может представлять собой аминокислотную последовательность, в которой аспарагин, который представляет собой аминокислотный остаток, соответствующий положению 245, заменен на серии.
Кроме того, очевидно то, что вариант полипептида, имеющий аминокислотную последовательность, в которой некоторые последовательности удалены, модифицированы, заменены, консервативно заменены или добавлены, дополнительно к 1) положению 138, 2) положению 162, 3) положению 211, 4) положению 245 или 5) положению 588 в аминокислотной последовательности SEQ ID NO: 6, или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, также включен в объем настоящего изобретения при условии, что аминокислотная последовательность обладает такой идентичностью или гомологией и демонстрирует эффективность, соответствующую эффективности варианта полипептида по настоящему изобретению. В частности, замена может включать любой один или более из (1) варианта (R558H) замены гистидина на аргинин, который представляет собой аминокислоту, соответствующую положению 558 в белке LeuA, путем замены А на G, который представляет собой нуклеотид в положении 1673 гена leuA, кодирующего изопропилмалатсинтазу, (2) варианта (G561D) замены аспарагиновой кислоты на глицин, который представляет собой аминокислоту, соответствующую положению 561, путем замены AT на GC, которые представляют собой нуклеотиды в положениях 1682 и 1683 гена leuA, или (3) варианта (Р247С) замены цистеина на пролин, который представляет собой аминокислоту в положении 247, путем замены TG на СС, которые представляют собой нуклеотиды в положениях 739 и 740 гена leuA, и их описания, представленные выше.
Более конкретно, вариант полипептида может включать полипептид, включающий варианты (SEQ ID NO: 38) в положениях 247, 558 и 561 дополнительно к 1) варианту в положении 138; или варианты (SEQ ID NO: 40) в положениях 247, 558 и 561 дополнительно к 2) варианту в положении 162; или варианты (SEQ ID NO: 42) в положениях 247, 558 и 561 дополнительно к 3) варианту в положении 211; варианты (SEQ ID NO: 44) в положениях 247, 558 и 561 дополнительно к 4) варианту в положении 245; варианты (SEQ ID NO: 46) в положениях 247, 558 и 561 дополнительно к 5) варианту в положении 588; варианты (SEQ ID NO: 48) в положениях 247, 558 и 561 дополнительно к 3) варианту в положении 211 и 5) варианту в положении 588; варианты (SEQ ID NO: 50) в положениях 247, 558 и 561 дополнительно к 1) варианту в положении 138, 2) варианту в положении 162, 3) варианту в положении 211 и 4) варианту в положении 245; или варианты (SEQ ID NO: 52) в положениях 247, 558 и 561 дополнительно к 1) варианту в положении 138, 2) варианту в положении 162, 3) варианту в положении 211, 4) варианту в положении 245 и 5) варианту в положении 588, но не ограничен этим.
Используемый здесь термин "соответствующий" относится к аминокислотным остаткам в положениях, перечисленных в полипептиде, или к аминокислотным остаткам, которые аналогичны, идентичны или гомологичны перечисленным в полипептиде. Идентификация аминокислоты в соответствующем положении может представлять собой определение конкретной аминокислоты в последовательности, которая относится к конкретной последовательности. Используемый здесь термин "соответствующая область" в общем случае относится к аналогичному или соответствующему положению в родственном белке или референсном белке.
Например, произвольная аминокислотная последовательность выравнивают с SEQ ID NO: 1 и на основании этого каждый аминокислотный остаток аминокислотной последовательности может быть пронумерован со ссылкой на аминокислотный остаток, соответствующий аминокислотному остатку в SEQ ID NO: 1. Например, алгоритм выравнивания последовательности, описанный в описании настоящего изобретения, может определять положению аминокислоты или положение, в котором осуществляется модификация, такая как замена, вставка или делеция, путем сравнения с интересующей последовательностью (также называемой "референсная последовательность").
Для таких выравниваний может быть использован, например, алгоритм Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), программа Needleman в пакете EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000), Trends Genet. 16: 276-277) и подобные, без ограничения ими, и подходящим образом может быть использована программа выравнивания последовательностей, алгоритм попарного сравнения последовательностей и т.п., известные в данной области техники.
Используемый здесь термин "гомология" или "идентичность" означает степень сходства между двумя данными аминокислотными последовательностями или нуклеотидными последовательностями, и она может быть выражена в процентах. Часто термины "гомология" и "идентичность" могут быть использованы взаимозаменяемо.
Гомологию или идентичность последовательности консервативного полинуклеотида или полипептида определяют посредством стандартных алгоритмов выравнивания, и при этом можно использовать штраф за пропуск в последовательности, установленный в используемой программе. По существу, гомологичные или идентичные последовательности, как правило, способны гибридизоваться с полной последовательностью или частью последовательности в умеренно строгих или очень строгих условиях. Понятно то, что гибридизация также включает гибридизацию полинуклеотида с полинуклеотидом, содержащим общий кодон или кодон с учетом вырожденности ко до нов.
Имеют ли любые две полинуклеотидные или полипептидные последовательности гомологию, сходство или идентичность можно определить с использованием известных компьютерных алгоритмов, таких как программа "FASTA", например, с использованием параметров по умолчанию, таких как в Pearson et al., (1988) [Proc. Natl. Acad. Sci. USA 85]: 2444. Альтернативно, гомология, сходство или идентичность можно определить с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), который осуществляют с использованием программы Needleman пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277) (версия 5.0.0 или более поздняя) (включающий программный пакет GCG (Devereux, J., et al, Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.,] [ET AL, J MOLEC BIOL 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego, 1994, и [CARILLO ET AL/.](1988) SIAM J Applied Math 48: 1073). Например, для определения гомологии, сходства или идентичности могут быть использованы BLAST от Национального Центра Биотехнологической Информации или ClustalW.
Гомологию, сходство или идентичность полинуклеотидов или полипептидов можно определить путем сравнения информации о последовательностях с использованием, например, компьютерной программы GAP, такой как Needleman et al. (1970), J Mol Biol. 48:443, как раскрыто, например, в Smith and Waterman, Adv. Appl. Math (1981) 2:482. В общем, программа GAP может быть определена как величина, получаемая путем деления количества выровненных одинаковых символов (а именно нуклеотидов или аминокислот) на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) матрицу двоичного сравнения (содержащую значения 1 в случае идентичности и 0 в случае не идентичности) и взвешенную матрицу сравнения в соответствии с Gribskov et al (1986) Nucl. Acids Res. 14: 6745 (или матрицу замен EDNAFULL (версия EMBOSS в NCBI NUC4.4)), как раскрыто в Schwartz and Dayhoff, eds., Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, pp.353 358 (1979); (2) штраф 3,0 за каждый гэп и дополнительный штраф 0,10 за каждый символ в каждом гэпе (или штраф за открытие гэпа 10 и штраф за продление гэпа 0,5) и (3) отсутствие штрафа за концевые гэпы.
В еще одном аспекте настоящего изобретения предложен полинуклеотид, кодирующий вариант полипептида по настоящему изобретению.
Используемый здесь термин "полинуклеотид" представляет собой цепь ДНК или РНК, имеющую определенную длину или более в виде полимера из нуклеотидов, в котором нуклеотидные мономеры связаны в длинную цепь при помощи ковалентных связей, и, более конкретно, он означает полинуклеотидный фрагмент, кодирующий вариант белка.
Полинуклеотид, кодирующий вариант полипептида по настоящему изобретению, может включать нуклеотидную последовательность, кодирующую аминокислотную последовательность, описанную в SEQ ID NO: 6 или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, или SEQ ID NO: 38, или SEQ ID NO: 40, или SEQ ID NO: 42, или SEQ ID NO: 44, или SEQ ID NO: 46, или SEQ ID NO: 48, или SEQ ID NO: 50, или SEQ ID NO: 52, но не ограничивается этим. В частности, полинуклеотид по настоящему изобретению может иметь или включать нуклеотидную последовательность SEQ ID NO: 7, или SEQ ID NO: 9, или SEQ ID NO: 11, или SEQ ID NO: 13, или SEQ ID NO: 15, или SEQ ID NO: 39, или SEQ ID NO: 41, или SEQ ID NO: 43, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49, или SEQ ID NO: 51, или SEQ ID NO: 53.
В полинуклеотиде различные модификации могут быть осуществлены в кодирующей области до тех пор, пока аминокислотная последовательность полипептида не меняется, с учетом вырожденности кодонов или кодонов, предпочтительных в организмах, в которых предполагается экспрессия полипептида. В частности, полинуклеотид может состоять из нуклеотидной последовательности, имеющей гомологию или идентичность 80% или более, 90% или более, 95% или более, 96% или более, 97% или более, 98% или более, и менее чем 100% с SEQ ID NO: 7, или SEQ ID NO: 9, или SEQ ID NO: 11, или SEQ ID NO: 13, или SEQ ID NO: 15, или SEQ ID NO: 39, или SEQ ID NO: 41, или SEQ ID NO: 43, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49, или SEQ ID NO: 51, или SEQ ID NO: 53, но не ограничивается этим.
Кроме того, полинуклеотид по настоящему изобретению может включать зонд, который может быть получен из известной генной последовательности, например последовательности без ограничения, пока она представляет собой последовательность, которая может гибридизоваться с комплементарной последовательностью до полноразмерной или части полинуклеотидной последовательности по настоящему изобретению в строгих условиях. "Строгие условия" означают условия, которые обеспечивают специфическую гибридизацию полинуклеотидов. Эти условия в частности описаны в документах (смотри J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York, 9.50-9.51, 11.7-11.8). Примеры включают условия, в которых полинуклеотиды, обладающие более высокой гомологией или идентичностью, а именно полинуклеотиды, обладающие 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более гомологией или идентичностью гибридизуются друг с другом, тогда как полинуклеотиды, обладающие меньшей гомологией или идентичностью, не гибридизуются друг с другом, или условия отмывки для обычной гибридизации по Саузерну, когда отмывку осуществляют однократно, в частности два или три раза при концентрации соли и температуре, эквивалентных 60°С, 1 × SSC (раствор цитрата и хлорида натрия), 0,1% SDS (додецилсульфат натрия), в частности 60°С, 0,1× SSC, 0,1% SDS, более конкретно 68°С, 0,1 × SSC, 0,1% SDS.
Для гибридизации требуется, чтобы две нуклеиновые кислоты имели комплементарные последовательности, хотя ошибки спаривания оснований допустимы в зависимости от строгости гибридизации. Термин "комплементарный" используют для описания взаимодействия между нуклеотидными основаниями, способными гибридизоваться друг с другом. Например, в случае ДНК аденин комплементарен тимину и цитозин комплементарен гуанину. Таким образом, полинуклеотид по настоящему изобретению также может включать по существу похожие последовательности нуклеиновых кислот, а также выделенные фрагменты нуклеиновых кислот, комплементарные полноразмерной последовательности.
В частности, полинуклеотид, обладающий гомологией или идентичностью с полинуклеотидом по настоящему изобретению, может быть обнаружен с использованием условий гибридизации, включающих стадию гибридизации при величине Tm 55°С в вышеописанных условиях. Величина Tm может составлять 60°С, 63°С или 65°С, но не ограничивается ими, и может быть подходящим образом скорректирована специалистом в данной области техники в зависимости от задачи.
Подходящая строгость условий для гибридизации полинуклеотид о в зависит от длины и степени комплементарности полинуклеотидов, и эти переменные хорошо известны в области техники (например, J. Sambrook et al., выше).
Например, полинуклеотид по настоящему изобретению может включать любую последовательность без ограничения до тех пор, пока она кодирует аминокислотную последовательность SEQ ID NO: 6, или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, или SEQ ID NO: 38, или SEQ ID NO: 40, или SEQ ID NO: 42, или SEQ ID NO: 44, или SEQ ID NO: 46, или SEQ ID NO: 48, или SEQ ID NO: 50, или SEQ ID NO: 52.
В полинуклеотиде по настоящему изобретению вариант полипептида является таким, как описано в других аспектах.
В еще одном аспекте настоящего изобретения предложен вектор, содержащий полинуклеотид по настоящему изобретению.
Вектор по настоящему изобретению относится к ДНК-конструкции, включающей полинуклеотидную последовательность, кодирующую интересующий полипептид, функционально связанную с подходящей областью, регулирующей экспрессию (последовательностью, регулирующей экспрессию), таким образом, что интересующий полипептид может экспрессироваться в подходящем хозяине. Область, регулирующая экспрессию, может включать промотор, способный инициировать транскрипцию, любую операторную последовательность для регулирования транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и последовательность, регулирующую прекращение транскрипции и трансляции. Вектор может быть трансформирован в подходящую клетку-хозяин и затем реплицироваться или функционировать независимо от генома хозяина или может быть встроен в ее геном.
Вектор, используемый в настоящего изобретения, конкретно не ограничен, и может быть использован любой вектор, известный в данной области техники. Примеры обычно используемых векторов могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A и Charon21A и т.п. В качестве плазмидного вектора может быть использована система pBR, система pUC, система pBluescript II, система pGEM, система pTZ, система pCL, система рЕТ и т.п. В частности, может быть использован вектор pDCM2 (WO 2021-187781 A1), pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC и т.п.
Например, полинуклеотид, кодирующий интересующий полипептид, может быть встроен в хромосому с использованием вектора для внутриклеточного встраивания в хромосому. Встраивание полинуклеотида в хромосому может быть осуществлено при помощи любого способа, известного в данной области техники, например, при помощи гомологичной рекомбинации, без ограничения ею. Вектор может дополнительно включать селективный маркер для идентификации встраивания в хромосому. Селективный маркер предназначен для отбора клеток, трансформированных векторами, то есть для идентификации встраивания интересующей молекулы нуклеиновой кислоты, и могут быть использованы маркеры, придающие селектируемые фенотипы, такие как резистентность к лекарственным средствам, ауксотрофия, резистентность к цитотоксическим агентам или экспрессия поверхностных полипептидов. В среде, обработанной селективным агентом только клетки, экспрессирующие селективные маркеры, выживают или демонстрируют другие фенотипические черты, и таким образом трансформированные клетки могут быть отобраны.
Использованный здесь термин "трансформация" означает то, что в клетку-хозяина или микроорганизм введен вектор, содержащий полинуклеотид, кодирующий целевой полипептид, так, что белок, кодируемый этим полинуклеотидом, может экспрессироваться в клетке-хозяине. Трансформированный полинуклеотид может быть локализован путем встраивания в хромосому клетки-хозяина или локализован вне хромосомы, при условии, что он может экспрессироваться в клетке-хозяине. Кроме того, полинуклеотид включает ДНК и РНК, кодирующие интересующий белок. Полинуклеотид может быть введен в любой форме при условии, что он может быть введен в клетку-хозяина и затем экспрессироваться. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессирующейся кассеты, которая представляет собой генетическую конструкцию, включающую все элементы, необходимые для ее самоэкспрессии. Как правило, экспрессирующаяся кассета может включать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания с рибосомой и сигнал терминации трансляции. Экспрессирующаяся кассета может находиться в форме экспрессионного вектора, способного к саморепликации. Кроме того, полинуклеотид может быть введен в клетку-хозяина в своей собственной форме и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине, без ограничения этим.
Кроме того, использованный здесь термин "функционально связанный" означает, что полинуклеотидная последовательность функционально связана с промоторной последовательностью, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего интересующий вариант белка по настоящему изобретению.
В векторе по настоящему изобретению полинуклеотид является таким, как описано в других аспектах.
В еще одном аспекте описания настоящего изобретения предложен микроорганизм рода Corynebacterium, продуцирующий L-лейцин, где микроорганизм содержит вариант полипептида по настоящему изобретению; кодирующий его полинуклеотид; или включающий его вектор.
Используемый здесь термин "микроорганизм" включает все из микроорганизмов дикого типа или естественных образом или искусственно генетически модифицированных микроорганизмов, и он может представлять собой микроорганизм, в котором специфический механизм ослаблен или усилен вследствие встраивания чужеродного гена, или усиления активности или инактивации эндогенного гена, и может представлять собой микроорганизм, содержащий генетическую модификацию для получения интересующего полипептида, белка или продукта.
Микроорганизм по настоящему изобретению может представлять собой микроорганизм, включающий любой один или более вариантов по настоящему изобретению, полинуклеотид по настоящему изобретению и вектор, включающий полинуклеотид по настоящему изобретению; микроорганизм, модифицированный таким образом, чтобы экспрессировать вариант по настоящему изобретению или полинуклеотид по настоящему изобретению; микроорганизм (например рекомбинантный штамм), экспрессирующий вариант по настоящему изобретению или полинуклеотид по настоящему изобретению; или микроорганизм (например рекомбинантный штамм), обладающий активностью варианта по настоящему изобретению, но не ограничивается этим.
Микроорганизм по настоящему изобретению может представлять собой микроорганизм, в природе обладающий активностью изопропилмалатсинтазы или способностью продуцировать L-лейцин, или микроорганизм, полученный путем экспрессии варианта полипептида по настоящему изобретению в родительском штамме, не обладающим активностью изопропилмалатсинтазы или способностью продуцировать L-лейцин, или путем придания способности продуцировать L-лейцин родительскому штамму, но не ограничивается этим.
В частности, микроорганизм по настоящему изобретению может представлять собой клетку или микроорганизм, экспрессирующий вариант полипептида по настоящему изобретению посредством трансформации полинуклеотидом по настоящему изобретению или вектором, включающим ген, кодирующий вариант полипептида по настоящему изобретению, и, в отношении задач настоящего изобретения, микроорганизм по настоящему изобретению может включать все микроорганизмы, способные продуцировать L-лейцин, путем включения варианта полипептида по настоящему изобретению. Например, микроорганизм по настоящему изобретению может представлять собой рекомбинантный микроорганизм, обладающий усиленной способностью продуцировать L-лейцин, в котором вариант полипептида по настоящему изобретению экспрессируется путем введения полинуклеотида, кодирующего вариант полипептида по настоящему изобретению, в природный микроорганизм дикого типа или в микроорганизм, продуцирующий L-лейцин. Рекомбинантный микроорганизм, обладающий усиленной способностью продуцировать L-лейцин, может представлять собой микроорганизм, обладающий усиленной способностью продуцировать L-лейцин, по сравнению с природным микроорганизмом дикого типа или с немодифицированным микроорганизмом, но не ограничивается этим.
Используемый здесь термин "немодифицированный микроорганизм" не исключает штаммы, включающие мутации, которые могут возникать естественным образом у микроорганизмов, и может представлять собой штамм дикого типа или сам природный штамм, или может представлять собой штамм до того, как характеристики меняются путем генетической вариации вследствие природных или искусственных факторов. Например, немодифицированный микроорганизм может представлять собой штамм, в который вариант белка, описанный в описании настоящего изобретения, не введен или еще не введен. Термин "немодифицированный микроорганизм" может быть использован взаимозаменяемо с "штаммом перед модификацией", "микроорганизмом перед модификацией", "неизмененным штаммом", "немодифицированным штаммом", "неизмененным микроорганизмом" или "референсным микроорганизмом".
В частности, микроорганизм по настоящему изобретению может представлять собой Corynebacterium glutamicum, Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris или Corynebacterium flavescens.
Микроорганизм по настоящему изобретению может представлять собой микроорганизм, включающий нуклеотидную последовательность, кодирующую изопропилмалатсинтазу, в которой один или более чем один аминокислотный остаток за исключением аминокислотного остатка 1) в положении 138, 2) в положении 162, 3) в положении 211, 4) в положении 245 или 5) в положении 588 в аминокислотной последовательности SEQ ID NO: 1, составляющей изопропилмалатсинтазу по настоящему изобретению, заменены на другую аминокислоту. В частности, замена может включать любой один или более чем один из (1) варианта (R558H) замены гистидина на аргинин, который представляет собой аминокислоту в положении 558 белка LeuA, путем замены А на G, который представляет собой нуклеотид в положении 1673 гена leuA, кодирующего изопропилмалатсинтазу, (2) варианта (G561D) замены аспарагиновой кислоты на глицин, который представляет собой аминокислоту в положении 561, путем замены AT на GC, которые представляют собой нуклеотиды в положениях 1682 и 1683 гена leuA, или (3) варианта (Р247С) замены цистеина на пролин, который представляет собой аминокислоту в положении 247 путем замены TG на СС, которые представляют собой нуклеотиды в положениях 739 и 740 гена leuA, и их описания являются такими, как описано выше.
В частности, микроорганизм, продуцирующий L-лейцин по настоящему изобретению, может представлять собой микроорганизм, обладающий усиленной активностью изопропилмалатсинтазы, путем экспрессии изопропилмалатсинтазы, включающей такую вариацию.
Используемый здесь термин "усиление" полипептидной активности означает, что активность полипептида увеличивается по сравнению с собственной активностью. Усиление может быть использовано взаимозаменяемо с терминами, такими как повышающая регуляция, сверхэкспрессия, увеличение и т.п. Следовательно, увеличение может включать как демонстрацию активности, которой полипептид исходно не обладал, так и демонстрацию улучшенной активности по сравнению с собственной активностью или активностью до модификации. "Собственная активность" означает активность конкретного полипептида, исходно демонстрируемая родительским штаммом до изменения характеристик или немодифицированным микроорганизмом, когда характеристики изменяются путем генетической вариации вследствие природных или искусственных факторов. Этот термин может быть использован взаимозаменяемо с "активностью до модификации". Тот факт, что активность полипептида "усилена" или "увеличена" по сравнению с собственной активностью, означает то, что активность полипептида улучшена по сравнению с активностью конкретного полипептида, которой исходно обладал родительский штамм перед изменением характеристик или немодифицированный микроорганизм.
Усиление может быть достигнуто путем введения чужеродного полипептида или усиления собственной активности полипептида. Усиление активности полипептида может быть подтверждено по увеличению степени активности и уровня экспрессии соответствующего полипептида или количества продукта, продуцируемого из соответствующего полипептида.
Для усиления активности полипептида могут применяться различные способы, хорошо известные в области техники, и способ не ограничен, пока активность интересующего полипептида может быть усилена по сравнению с активностью микроорганизма перед модификацией. В частности, может быть использована генетическая инженерия и/или белковая инженерия, хорошо известные специалистам в данной области техники, которые представляют собой обычные для молекулярной биологии способы, но способ не ограничен ими (например, Sitnicka et al. Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol. 2. 1-16, Sambrook et al. Molecular Cloning 2012 и т.п).
В частности, усиление активности полипептида по настоящему изобретению может быть осуществлено путем:
1) увеличения числа копий полинуклеотида, кодирующего полипептид, в клетках;
2) замены области, регулирующей экспрессию гена, в хромосоме, кодирующей полипептид, на последовательность, обладающую сильной активностью;
3) модификации стартового кодона гена, кодирующего полипептид, или последовательности оснований области 5'-UTR;
4) модификации аминокислотной последовательности полипептида для усиления активности полипептида;
5) модификации полинуклеотидной последовательности, кодирующей полипептид, для усиления активности полипептида;
6) введения чужеродного полинуклеотида, демонстрирующего активность полипептида;
7) оптимизации кодонов полинуклеотида, кодирующего полипептид;
8) анализа третичной структуры полипептида для выбора экспонируемого сайта и для осуществления модификации или химической модификации экспонируемого сайта; или
9) комбинации (1)-(8), но не конкретно ими не ограничено.
Более конкретно, (1) увеличение в клетке числа копий полинуклеотида, кодирующего полипептид, может быть осуществлено путем введения вектора, который реплицируется и функционирует независимо от клетки-хозяина и функционально связан с полинуклеотидом, кодирующим соответствующий полипептид в клетке-хозяине. Альтернативно, это увеличение может быть достигнуто путем введения одной копии, или двух или более чем двух копий полинуклеотида, кодирующего соответствующий полипептид, в хромосому клетки-хозяина. Введение в хромосому может быть осуществлено путем введения вектора, способного встраивать полинуклеотид в хромосому клетки-хозяина, в клетку-хозяина, но не ограничивается этим. Вектор является таким, как описано выше.
2) Замена области, контролирующей экспрессию гена (или последовательности, контролирующей экспрессию), в хромосоме, кодирующей полипептид, на последовательность, демонстрирующую сильную активность, может представлять собой, например, возникновение варианта в последовательности из-за делеции, вставки, неконсервативной или консервативной замены, или их комбинации, или замену на последовательность, демонстрирующую более сильную активность, так, что активность области, контролирующей экспрессию, дополнительно усиливается. Область, контролирующая экспрессию, не ограничена конкретно этим, но может включать промотор, операторную последовательность, последовательность, кодирующую сайт связывания с рибосомой, последовательность, контролирующую прекращение транскрипции и трансляции и т.п. Например, замена может представлять собой замену исходного промотора на сильный промотор, но не ограничивается этим.
Примеры известных сильных промоторов включают промоторы cj1-cj7 (патент США №7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL, промотор tet, промотор gapA, промотор SPL7, промотор SPL13(sm3) (патент США №10584338 В2), промотор O2 (патент США №10273491 В2), промотор tkt, промотор уссА и т.п., но не ограничиваются ими.
3) Модификация стартового кодона гена, кодирующего полипептид, или последовательности оснований области 5'-UTR может представлять собой, например, замену на другой стартовый кодон, обладающий более высоким уровнем экспрессии полипептида по сравнению с эндогенным стартовым кодоном, но не ограничивается этим.
4) и 5) Модификация аминокислотной последовательности или полинуклеотидной последовательности может представлять собой возникновение вариации в последовательности вследствие делеции, вставки, неконсерватиной или консервативной замены аминокислотной последовательности полипептида или полинуклеотидной последовательности, кодирующей полипептид, или их комбинации, или замены на аминокислотную последовательность или полинуклеотидную последовательность, модифицированную таким образом, чтобы обладать более сильной активностью, или аминокислотную последовательность или полинуклеотидную последовательность, модифицированную таким образом, чтобы быть более активной, так, чтобы активность полипептида была усилена, но не ограничивается этим. Замена может быть, в частности, осуществлена путем встраивания полинуклеотида в хромосому путем гомологичной рекомбинации, но не ограничиваться этим. Используемый здесь вектор может дополнительно включать селектируемый маркер для подтверждения встраивания в хромосому. Селектируемый маркер является таким, как описано выше.
6) Введение чужеродного полинуклеотида, демонстрирующего активность полипептида, может представлять собой введение в клетку-хозяина чужеродного полинуклеотида, кодирующего полипептид, демонстрирующий активность, идентичную/аналогичную активности полипептида. Чужеродный полинуклеотид не ограничен по своему происхождению или последовательности до тех пор, пока он демонстрирует активность, идентичную/похожую на активность полипептида. Введение может быть осуществлено путем подходящего выбора способа трансформации, известного специалистам в данной области техники. Поскольку введенный полинуклеотид экспрессируется в клетке-хозяине, может быть получен полипептид, и его активность может быть увеличена.
7) Оптимизация кодонов полинуклеотида, кодирующего полипептид, может представлять собой оптимизацию кодонов эндогенного полинуклеотида таким образом, чтобы увеличить транскрипцию или трансляцию в клетке-хозяине, или оптимизацию кодонов чужеродного полинуклеотида таким образом, чтобы осуществлять оптимизированную транскрипцию и трансляцию в клетке-хозяине.
8) Анализ третичной структуры полипептида для выбора экспонируемого сайта и для осуществления модификации или химической модификации экспонируемого сайта может быть осуществлен, например, для определения кандидата белка-матрицы в соответствии со степенью сходства последовательности путем сравнения информации о последовательности анализируемого полипептида с базой данных, в которой хранится информация о последовательностях известных белков, для идентификации структуры на этой основе и для выбора и модификации или химической модификации экспонированного фрагмента, который предполагается модифицировать или химически модифицировать.
Такое улучшение полипептидной активности может представлять собой увеличение активности или концентрации соответствующего полипептида на основе активности или концентрации полипептида, экспрессирующегося в штамме дикого типа или в микробном штамме перед модификацией, или увеличение количества продукта, продуцируемого из соответствующего полипептида, но не ограничивается этим.
В микроорганизме по настоящему изобретению частичная или полная модификация полинуклеотида (например модификация для кодирования вышеописанного варианта белка) может быть вызвана (а) гомологичной рекомбинацией с использованием вектора для встраивания в хромосому в микроорганизме или редактирования генома с использованием сконструированной нуклеазы (например CRTSPR-Cas9) и/или (б) обработкой светом, таким как ультрафиолетовые лучи и излучение, и/или химическими веществами, но не ограничивается этим. Способ модификации части или всего гена может включать способ с использованием технологии рекомбинантной ДНК. Например, путем введения нуклеотидной последовательности или вектора, содержащего нуклеотидную последовательность, гомологичную интересующему гену, в микроорганизм для того, чтобы вызвать гомологичную рекомбинацию, часть или весь ген может быть удален. Введенная нуклеотидная последовательность или вектор может включать доминантный селективный маркер, но не ограничивается этим.
Более конкретно, микроорганизм, продуцирующий L-лейцин, по настоящему изобретению может представлять собой микроорганизм, дополнительно включающий полипептид, включающий SEQ ID NO: 6 или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, или SEQ ID NO: 38, или SEQ ID NO: 40, или SEQ ID NO: 42, или SEQ ID NO: 44, или SEQ ID NO: 46, или SEQ ID NO: 48, или SEQ ID NO: 50, или SEQ ID NO: 52, полинуклеотид, кодирующий полипептид, включающий SEQ ID NO: 6 или SEQ ID NO: 8, или SEQ ID NO: 10, или SEQ ID NO: 12, или SEQ ID NO: 14, или SEQ ID NO: 38, или SEQ ID NO: 40, или SEQ ID NO: 42, или SEQ ID NO: 44, или SEQ ID NO: 46, или SEQ ID NO: 48, или SEQ ID NO: 50, или SEQ ID NO: 52, или полинуклеотид, включающий SEQ ID NO: 7 или SEQ ID NO: 9, или SEQ ID NO: 11, или SEQ ID NO: 13, или SEQ ID NO: 15, или SEQ ID NO: 39, или SEQ ID NO: 41, или SEQ ID NO: 43, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49, или SEQ ID NO: 51, или SEQ ID NO: 53.
В микроорганизме по настоящему изобретению вариант полипептида, полинуклеотид, вектор, L-лейцин и т.п.являются такими, как описано в других аспектах.
В еще одном аспекте настоящего изобретения предложен способ получения L-лейцина, включающий стадию культивирования в среде микроорганизма рода Corynebacterium, продуцирующего L-лейцин, где микроорганизм содержит вариант полипептида по настоящему изобретению; кодирующий его полинуклеотид; или включающий его вектор.
Использованный здесь термин "культивирование" означает культивирование рода Corynebacterium по настоящему изобретению в надлежащим образом контролируемых условиях окружающей среды. Процесс культивирования по настоящему изобретению может быть осуществлен с использованием подходящей среды и условий культивирования, известных в данной области техники. Такой процесс культивирования может быть легко скорректирован и использован специалистами в данной области техники в соответствии с выбранным штаммом. В частности, культивирование может представлять собой периодическое культивирование, непрерывное культивирование и культивирование с подпиткой, но не ограничивается этим.
Использованный здесь термин "среда" обозначает смешанное вещество, содержащее питательные вещества, необходимые для культивирования микроорганизма рода Corynebacterium по настоящему изобретению в качестве основного компонента, и среда обеспечивает питательные вещества и факторы роста, включая воду, которые необходимы для выживания и развития. В частности, в качестве среды и других условий культивирования, используемых для культивирования микроорганизма рода Corynebacterium по настоящему изобретению, может быть использована любая среда без конкретного ограничения до тех пор, пока она представляет собой среду, используемую для обычного культивирования микроорганизмов. Штамм Corynebacterium glutamicum по настоящему изобретению можно культивировать в обычной среде, содержащей надлежащие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины и т.п., в то же самое время контролируя температуру, рН и т.п.в аэробных условиях. В частности, культуральную среду для штамма рода Corynebacterium можно найти в документе ["Manual of Methods for General Bacteriology" by the American Society for Bacteriology (Washington D.C., USA, 1981)].
В настоящем изобретении источники углерода включают углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, сахароза, мальтоза и т.п.; сахарные спирты, такие как маннит, сорбит и т.п.; органические кислоты, такие как пировиноградная кислота, молочная кислота, лимонная кислота и т.п.; аминокислоты, такие как глутаминовая кислота, метионин, лизин и т.п. Могут быть использованы природные органические питательные вещества, такие как гидролизат крахмала, меласса, черная меласса, рисовые отруби, маниок, выжимка сахарного тростника и жидкий кукурузный экстракт. В частности, могут быть использованы углеводы, такие как глюкоза и стерильная предварительно обработанная меласса (т.е. меласса, преобразованные в восстановленный сахар), и подходящие количества других источников углерода могут быть использованы различным образом без ограничения. Эти источники углерода могут быть использованы сами по себе или в комбинации двух или более чем двух из них, но не ограничиваются этим.
В качестве источников азота могут быть использованы неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и т.п.; и органические источники азота, такие как аминокислоты, такие как глутаминовая кислота, метионин, глютамин и т.п., пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или продукты ее деградации, и обезжиренный соевый жмых или продукты его деградации. Эти источники азота могут быть использованы сами по себе или в комбинации по меньшей мере двух или более из них, но не ограничиваются этим.
Источники фосфора могут включать однозамещенный фосфат калия, двузамещенный фосфат калия или соответствующие натрий-содержащие соли. В качестве неорганических соединений могут быть использованы хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и т.п. Дополнительно к этим соединениям могут быть включены аминокислоты, витамины и/или подходящие предшественники. Эти компоненты или предшественники могут быть добавлены к среде партиями или непрерывно, но не ограничены этим.
Кроме того, во время культивирования штамма Corynebacterium glutamicum по настоящему изобретению рН среды может быть скорректирован путем добавления подходящим образом в среду соединений, таких как гидроксид аммония, гидроксид калия, аммиак, ортофосфорная кислота и серная кислота. Во время культивирования образование пены может быть подавлено путем использования пеногасителя, такого как полигликоле вый эфир жирной кислоты. Кислород или содержащий кислород газ могут быть введены в среду для поддержания аэробного состояния среды, или газ может не вводиться, или азот, водород или углекислый газ могут быть введены для поддержания анаэробных и микроаэробных состояний, без ограничения этим.
В культуре по настоящему изобретению температура культивирования может поддерживаться на уровне от 20°С до 45°С, в частности от 25°С до 40°С, и штамм можно культивировать в течение приблизительно от 10 до 160 часов, но не ограничивается этим.
L-лейцин, продуцируемый путем культивирования по настоящему изобретению, может быть секретирован в среду или может сохраняться в клетках.
Способ получения L-лейцина по настоящему изобретению дополнительно может включать стадию приготовления штамма Corynebacterium glutamicum по настоящему изобретению, или стадию приготовления среды для культивирования штамма.
Способ получения L-лейцина по настоящему изобретению может дополнительно включать стадию выделения L-лейцина из среды в соответствии с культурой или из штамма Corynebacterium glutamicum по настоящему изобретению.
Выделение может быть осуществлено для сбора интересующего L-лейцина при помощи подходящего способа, известного в данной области техники, в соответствии со способом культивирования микроорганизма по настоящему изобретению, например посредством периодического способа культивирования, непрерывного способа культивирования или культивирования с подпиткой. Например, могут быть использованы центрифугирование, фильтрование, обработка агентом, осаждающим кристаллизованный белок (высаливание), экстракция, ультразвуковое разрушение, ультрафильтрация, диализ, различные формы хроматографии, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и аффинная хроматография, HPLC (высокоэффективная жидкостная хроматография) или их комбинация. Интересующий L-лейцин может быть выделен из среды или микроорганизма при помощи подходящего способа, известного в данной области техники.
Кроме того, способ получения L-лейцина по настоящему изобретению дополнительно может включать стадию очистки. Очистка может быть осуществлена с использованием подходящего способа, известного в данной области техники. В качестве примера, когда способ получения L-лейцина по настоящему изобретению включает и стадию выделения и стадию очистки, тогда стадия выделения и стадия очистки могут быть осуществлены непрерывно или с перерывами независимо от последовательности, или могут быть осуществлены одновременно или путем объединения в одну стадию, но не ограничивается этим.
В способе по настоящему изобретению вариант полипептида, полинуклеотид, L-лейцин и т.п. являются такими, как описано в других аспектах.
В еще одном аспекте настоящего изобретения предложена композиция для получения L-лейцина, где композиция содержит штамм Corynebacterium glutamicum, включающий вариант полипептида по настоящему изобретению или полинуклеотид по настоящему изобретению; или среда, в которой культивируют штамм.
Композиция по настоящему изобретению может дополнительно включать произвольные подходящие эксципиенты, обычно используемые в композициях для получения аминокислот. Такие эксципиенты могут представлять собой, например, консервант, увлажнитель, диспергирующий агент, суспендирующий агент, буферный агент, стабилизатор или изотонический агент, но не ограничены ими.
В композиции по настоящему изобретению вариант полипептида, полинуклеотид, L-лейцин и т.п. являются такими, как описано в других аспектах.
Способ осуществления изобретения
Далее настоящее описание будет описано более подробно со ссылкой на примеры воплощений. Однако следующие примеры воплощений являются только предпочтительными воплощениями для иллюстрации описания настоящего изобретения, и, следовательно, не предназначены для ограничения объема настоящего изобретения. Между тем, технические вопросы, не описанные в описании настоящего изобретения, могут быть достаточно поняты и легко осуществлены специалистами в области техники настоящего изобретения или похожих технических областях.
Пример 1. Конструирование библиотеки ДНК, кодирующей мутантную из опр опилма латсинтазу
1-1. Конструирование вектора, включающего leuA
Для конструирования библиотеки мутантов leuA, обладающих активностью изопропилмалатсинтазы, сначала конструировали рекомбинантный вектор, включающий leuA. Для амплификации гена leuA (SEQ ID NO: 2), кодирующего белок LeuA (SEQ ID NO: 1, код доступа Uniprot: P42455), происходящий из дикого типа Corynebacterium glutamicum, осуществляли ПЦР с использованием хромосомы штамма дикого типа Corynebacterium glutamicum АТСС13032 в качестве матрицы и праймеров SEQ ID NO: 3 и 4, путем повторения 25 циклов, состоящих из денатурации при 94°С в течение 1 минуты, отжига при 58°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты с использованием ДНК-полимеразы Pfu. Последовательности используемых праймеров являются такими, как представлено в таблице 1 ниже.
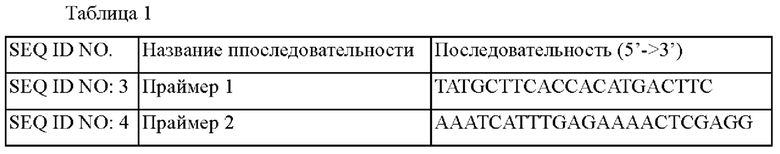
Продукт ПЦР клонировали в вектор pCR2.1 E.coli с использованием набора для клонирования ТОРО cloning kit (Invitrogen) с получением 'pCR-leuA'.
1-2. Конструирование библиотеки мутантов leuA
На основе вектора, полученного в примере 1-1, получали библиотеку мутантов leuA с использованием набора для ПЦР сниженной точности (clontech Diversify® PCR Random Mutagenesis Kit). Реакцию ПЦР осуществляли с использованием праймеров SEQ ID NO: 3 и SEQ ID NO: 4, описанных в таблице 1, в условиях, в которых от 0 до 3 мутаций возникают на 1000 п. о.
Более конкретно, ПЦР осуществляли путем предварительного нагрева при 94°С в течение 30 секунд с последующими 25 циклами денатурации при 94°С в течение 30 секунд и полимеризации при 68°С в течение 1 минуты 30 секунд. Продукт ПЦР, полученный в этот момент времени, подвергали 25 циклам денатурации при 95°С в течение 50 секунд, отжига при 60°С в течение 50 секунд и полимеризации при 68°С в течение 12 минут с использованием мегапраймера (от 50 нг до 125 нг), с последующей обработкой DpnI, и затем трансформировали в Е. coli DH5α при помощи способа теплового шока, и высевали на твердую среду LB (Луриа-Бертани), содержащую 25 мг/л канамицина. После отбора 20 типов трансформированных колоний получали и секвенировали плазмиды. В результате было подтверждено, что мутации были введены в разные положения с частотой 2 мутации/кб. Отбирали приблизительно 20000 трансформированных колоний Е. coli, и экстрагировали плазмиды, которые были названы 'pTOPO-leuA-library' ('pTOPO-leuA-библиотека').
Пример 2. Оценка сконструированной библиотеки и отбор мутантов
2-1. Отбор мутантных штаммов с увеличенной продукцией L-лейцина
pTOPO-leuA-library, полученную в примере 1-2, трансформировали в Corynebacterium glutamicum АТСС13032 дикого типа путем электропорации, и затем распределяли по питательной среде (таблица 2), содержащей 25 мг/л канамицина для отбора 10000 колоний штамма, в который были встроены мутантные гены. Каждая отобранная колония была названа ATCC13032/pTOPO_leuA(mt)1 - АТСС 13032/pTOPO_leuA(mt) 10000.
Для идентификации колоний, в которых продукция L-лейцина увеличилась и продукция L-фенилаланина среди ароматических аминокислот увеличилась или уменьшалась, среди полученных 10000 колоний, оценивали титр ферментации для каждой колонии при помощи следующего способа.

Каждую колонию инокулировали с использованием платиновой петли в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мкг/мл канамицина в 25 мл среды для продуцирования в соответствии с таблицей 2, и затем культивировали при 30°С в течение 60 часов при встряхивании при 200 об./мин. После завершения культивирования продукцию L-лейцина измеряли при помощи способа с использованием высокоэффективной жидкостной хроматографии (HPLC, SHIMAZDU LC20A).
В качестве результата из 10000 колоний отобрали 5 видов штаммов (АТСС13032/рТОРО_leuA(mt)3847, АТСС13032/рТОРО_leuA(mt)4708, АТСС13032/рТОРО_leuA(mt)5109, АТСС13032/рТОРО_leuA(mt)7563, АТСС13032/pTOPO_leuA(mt)8459), демонстрирующих наиболее улучшенную способность продуцировать L-лейцин, по сравнению с Corynebacterium glutamicum АТСС13032 дикого типа. Концентрации L-лейцина, полученные в выбранных штаммах, представлены в таблице 3 ниже.
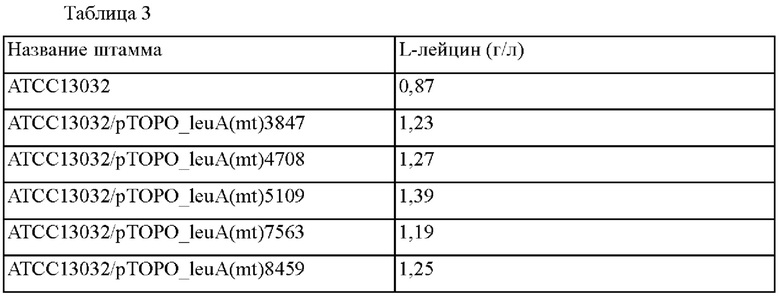
Как показано в таблице 3, было подтверждено, что Corynebacterium glutamicum АТСС13032/рТОРО_leuA(mt)3847, имеющий мутацию в гене leuA, демонстрировал приблизительно 1,41-кратное улучшение в продуцировании L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032. Также было подтверждено, что АТСС13032/pTOPO_leuA(mt)4708, ATCC13032/pTOPO_leuA(mt)5109, АТСС13032/рТОРО_leuA(mt)7563 и ATCC13032/pTOPO_leuA(mt)8459 демонстрировали приблизительно 1,45-, 1,59-, 1,36- и 1,38-кратное улучшение, соответственно, в продуцировании L-лейцина по сравнению с родительским штаммом.
2-2. Идентификация мутаций в мутантных штаммах с повышенным продуцированием L-лейцина
Для идентификации мутации гена leuA в выбранных 5 мутантных штаммах осуществляли ПЦР с использованием ДНК каждого мутантного штамма в качестве матрицы и праймеров с SEQ ID NO: 3 и SEQ ID NO: 4, описанных в таблице 1, в условиях денатурации при 94°С в течение 5 минут с последующими 30 циклами денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты и 30 секунд, и затем полимеризации при 72°С в течение 5 минут, и осуществляли секвенирование ДНК.
По результатам секвенирования, в штамме АТСС13032/рТОРО_leuA(mt)3847, как С, так и Т в положениях 412 и 413 гена leuA с SEQ ID NO: 2 был заменен на G, свидетельствуя о том, что он кодирует вариант (ниже названный как L138G), имеющий замену глицина на лейцин, который представляет собой аминокислоту в положении 138 (в положении 103 на основе литературных данных, в которой стартовый кодон трансляции читается на 35 в обратном направлении и белок LeuA состоит из 581 аминокислоты (SEQ ID NO: 5); ниже упоминаемая только как в положении 138) белка LeuA. Аминокислотная последовательность варианта LeuA (L138G) и нуклеотидная последовательность варианта leuA, кодирующая его, являются такими, как в SEQ ID NO: 6 и SEQ ID NO: 7.
Было подтверждено, что штамм АТСС 13032/pTOPO_leuA(mt)4708 имеет замену G на С, которые представляют собой нуклеотиды в положениях 484 и 486 гена leuA, свидетельствуя о том, что он кодирует вариант (ниже названный как Н162Е), имеющий замену глутамата на гистидин, который представляет собой аминокислоту в положении 162 (в положении 127 на основе литературных данных, в которой стартовый кодон трансляции читается на 35 в обратном направлении и белок LeuA состоит из 581 аминокислот (SEQ ID NO: 5); ниже упоминаемый только как в положении 162) белка LeuA. Аминокислотная последовательность варианта LeuA (Н162Е) и последовательность оснований варианта leuA, кодирующая его, являются такими, как в SEQ ID NO: 8 и SEQ ID NO: 9.
Было подтверждено, что штамм АТСС13032/pTOPO_leuA(mt)5109 имел замену СТТ на ТСС, которые представляют собой нуклеотиды в положениях 631-633 гена leuA, свидетельствуя о том, что он кодирует вариант (ниже названный как S211L), имеющий замену лейцина на серии, который представляет собой аминокислоту в положении 211 (в положении 176 на основе литературных данных, в которой стартовый кодон трансляции читается на 35 в обратном направлении и белок LeuA состоит из 581 аминокислоты (SEQ ID NO: 5); ниже упоминаемый только как в положении 211) белка LeuA. Аминокислотная последовательность варианта LeuA (S211L) и нуклеотидная последовательность варианта leuA, кодирующий его, являются такими, как в SEQ ID NO: 10 и SEQ ID NO: 11.
Было подтверждено, что штамм АТСС13032/pTOPO_leuA(mt)7563 имеет замену СС на AT, которые представляют собой нуклеотиды в положениях 1762-1763 гена leuA, свидетельствуя о том, что он кодирует вариант (ниже названный как I588P), имеющий замену пролина на изолейцин, который представляет собой аминокислоту в положении 588 (в положении 553 на основе литературных данных, в которой стартовый кодон трансляции читается на 35 в обратном направлении и белок LeuA состоит из 581 аминокислоты (SEQ ID NO: 5); ниже упоминаемый только как в положении 553) белка LeuA. Аминокислотная последовательность варианта LeuA (I588P) и нуклеотидная последовательность варианта leuA, кодирующая его, являются такими, как в SEQ ID NO: 12 и SEQ ID NO: 13.
Также было подтверждено, что штамм АТСС13032/pTOPO_leuA(mt)8459 имеет замену ТС на АА, которые представляют собой нуклеотиды в положениях 733-734 гена leuA, свидетельствуя о том, что он кодирует вариант (ниже названный как N245S), имеющий замену серина на аспарагин, который представляет собой аминокислоту в положении 245 (в положении 210 на основе литературных данных, в которой стартовый кодон трансляции читается на 35 в обратном направлении и белок LeuA состоит из 581 аминокислоты (SEQ ID NO: 5); ниже упоминаемый только как в положении 245) белка LeuA. Аминокислотная последовательность варианта LeuA (N245 S) и нуклеотидная последовательность варианта leuA, кодирующая его, являются такими, как в SEQ ID NO: 14 и SEQ ID NO: 15.
В следующих ниже примерах было проверено, влияют ли варианты (L138G, Н162Е, S211L, N245S, I588P) на продуцирование L-лейцина микроорганизмами рода Corynebacterium.
Пример 3. Проверка способности продуцировать L-лейцин выбранных мутантных штаммов
3-1. Конструирование вектора для встраивания, включающего вариант leuA
Для введения вариантов, выбранных в примере 2, в штамм предполагалось сконструировать вектора для встраивания. Сайт-направленный мутагенез использовали для конструирования вектора для введения вариантов leuA (L138G, Н162Е, S211L, N245S, I588P). Более конкретно, осуществляли ПЦР с использованием хромосомы штамма Corynebacterium glutamicum АТСС13032 дикого типа в качестве матрицы, и с использованием пары праймеров с SEQ ID NO: 16 и SEQ ID NO: 17, пары с SEQ ID NO: 18 и SEQ ID NO: 19 для создания варианта L138G, и с использованием пары праймеров с SEQ ID NO: 16 и SEQ ID NO: 20 и пары праймеров с SEQ ID NO: 19 и SEQ ID NO: 21 для создания варианта Н162Е. Осуществляли ПЦР с использованием пары праймеров с SEQ ID NO: 16 и SEQ ID NO: 22, пары праймеров с SEQ ID NO: 19 и SEQ ID NO: 23 для создания варианта S211L, и с использованием пары праймеров с SEQ ID NO: 16 и SEQ ID NO: 24, пары праймеров с SEQ ID NO: 19 и SEQ ID NO: 25 для создания варианта N245S. Осуществляли ПЦР с использованием пары праймеров с SEQ ID NO: 16 и SEQ ID NO: 26, пары праймеров с SEQ ID NO: 19 и SEQ ID NO: 27 для создания варианта I588P. Более конкретно, ПЦР осуществляли путем денатурации при 94°С в течение 5 минут с последующими 30 циклами, состоящими из денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты и 30 секунд, и затем полимеризации при 72°С в течение 5 минут. Конкретные последовательности используемых праймеров представлены в таблице 4 ниже.
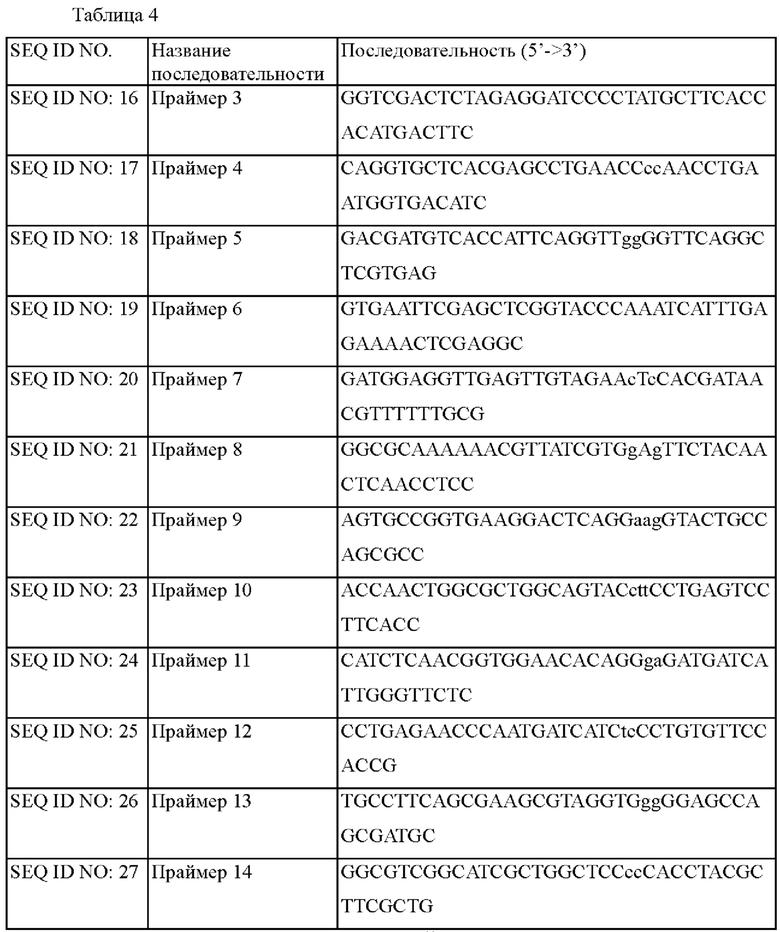
Клонирование осуществляли путем слияния продукта ПЦР с линейным вектором pDCM2, расщепленным ферментом рестрикции SmaI, с использованием фермента In-Fusion посредством гомологичной последовательности концевых 15 оснований фрагментов ДНК, таким образом конструируя 'pDCM2-leuA(L138G)', 'pDCM2-leuA(H162E)', 'pDCM2-leuA(S211L)', 'pDCM2-leuA(N245S)' и 'pDCM2-leuA(I588P)', которые представляют собой векторы для замены аминокислот в LeuA. Кроме того, 'pDCM2-leuA(S211L, I588P), pDCM2-leuA(L138G, Н162Е, S211L, N245S)', 'pDCM2-leuA(L138G, H162E, S211L, N245S, I588P)', которые представляют собой векторы для замены аминокислот в LeuA, конструировали в соответствии с комбинацией вариантов.
3-2. Введение варианта в штамм Corynebacterium glutamicum АТСС13032 и оценка
Векторы pDCM2-leuA(L138G), pDCM2-leuA(H162E), pDCM2-leuA(S211L), pDCM2-leuA(N245S), pDCM2-leuA(I588P), pDCM2-leuA(S211L, I588P), pDCM2-leuA(L138G, H162E, S211L, N245S), PDCM2-leuA(L138G, H162E, S211L, N245S, I588P), полученные в примере 3-1, соответственно трансформировали в штамм Corynebacterium glutamicum АТСС 13032 путем электропорации, и штаммы, в которых каждый вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы вновь подвергали вторичному кроссинговеру, и отбирали штаммы, в которые был введен вариант целевого гена. Наконец, подтверждали, введен или нет вариант гена leuA в трансформированный штамм, путем осуществления ПЦР с использованием праймеров с SEQ ID NO: 3 и SEQ ID NO: 4, и затем анализируя нуклеотидную последовательность, таким образом идентифицируя, что вариант был введен в штамм. В общей сложности готовили 8 штаммов, и они были названы 'ATCC13032_leuA_L138G', 'АТСС13032_leuA_Н162Е', 'АТСС13032_leuA_S211L', 'АТСС13032_leuA_N245S', 'ATCC13032_leuA_I588P', 'ATCC13032_leuA_(S211L, I588P)' 'ATCC13032_leuA_(L138G, H162E, S211L, N245S)', 'ATCC13032_leuA_(L138G, H162E, S211L, N245S, I588P)', соответственно.
Для оценки способности продуцировать L-лейцин в общей сложности 8 штаммов, полученных таким образом, оценивали титр ферментации в колбе. Каждую одну платиновую петлю родительского штамма Corynebacterium glutamicum АТСС13032 и полученных ATCC13032_leuA_L138G, ATCC13032_leuA_H162E, АТСС13032_leuA_S211L, АТСС13032_leuA_N245S, ATCC13032_leuA_I588P, ATCC13032_leuA_(S211L, I588P), ATCC13032_leuA_(L138G, H162E, S211L, N245S), ATCC13032 leuA (L138G, H162E, S211L, N245S, I588P) инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл среды для продуцирования, и затем культивировали при 30°С в течение 60 часов при встряхивании при 200 об./мин с получением L-лейцина. После завершения культивирования продукцию L-лейцина измеряли при помощи HPLC. Концентрация лейцина в кулыуральной среде каждого тестируемого штамма представлена в таблице 5 ниже.
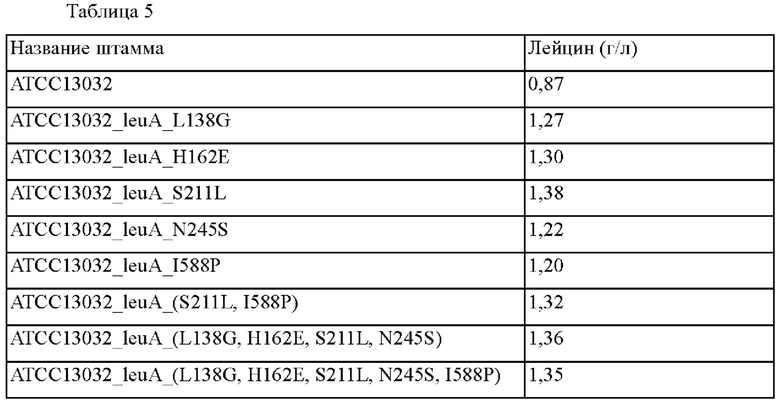
Как показано в таблице 5, ATCC13032_leuA_L138G с вариантом L138G в гене leuA продемонстрировал приблизительно 1,45-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032, ATCC13032_leuA_H162E с вариантом Н162Е продемонстрировал приблизительно 1,49-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032, ATCC13032_leuA_S211L с вариантом S211L продемонстрировал приблизительно 1,58-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032, АТСС13032_leuA_N245S с вариантом N245S продемонстрировал приблизительно 1,40-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032, АТСС 13032_leuA_I588P с вариантом I588P продемонстрировал приблизительно 1,37-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032, и ATCC13032_leuA_(S211L, I588P) продемонстрировал приблизительно 1,51-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом. АТСС13032_leuA_(L138G, Н162Е, S211L, N245S) и АТСС13032_leuA_(L138G, Н162Е, S211L, N245S, I588P) продемонстрировали приблизительно 1,56-кратное улучшение выхода L-лейцина по сравнению с родительским штаммом Corynebacterium glutamicum.
Пример 4. Проверка способности продуцировать лейцина выбранными вариантами leuA в лейцин-продуцирующих штаммах
Штамм дикого типа рода Corynebacterium продуцирует только следовые количества лейцина, несмотря на то, что он продуцирует лейцин. Соответственно, получали лейцин-продуцирующий штамм, происходящий от дикого типа Corynebacterium glutamicum АТСС 13032, и выбранные варианты вводили для осуществления эксперимента по проверке способности продуцировать лейцин. Подробный экспериментальный способ и результаты являются следующими.
4-1. Получение L-лейцин-продуцирующего штамма CJL-8109
В качестве штаммов для получения высоких концентраций L-лейцина получали штаммы, являющиеся производным Corynebacterium glutamicum АТСС 13032 дикого типа, где каждый включает (1) вариант (R558H), в котором гистидин заменен на аргинин, который представляет собой аминокислоту в положении 558 белка LeuA, путем замены А на G, который представляет собой нуклеотид в положении 1673 гена leuA, (2) вариант (G561D), в котором аспарагиновая кислота заменена на глицин, который представляет собой аминокислоту в положении 561 белка LeuA, путем замены AT на GC, которые представляют собой нуклеотиды в положениях 1682 и 1683 гена leuA, или (3) вариант (Р247С), в котором цистеин заменен на пролин, который представляет собой аминокислоту в положении 247 белка LeuA, путем замены TG на СС, которые представляют собой нуклеотиды в положениях 739 и 740 гена leuA.
Более конкретно, вектор pDCM2-leuA(R558H, G561D) (патентная публикация США №2021-0254111), включающий варианты гена leuA (R558H, G561D), трансформировали в Corynebacterium glutamicum АТСС13032 путем электропорации, и штаммы, в которых вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы вновь подвергали вторичному кроссинговеру, и отбирали штаммы, в которые был введен вариант гена leuA. Наконец, введен или нет вариант в трансформированный штамм, подтверждали путем осуществления ПЦР (94°С в течение 5 минут, с последующими 30 циклами при 94°С в течение 30 секунд/55°С в течение 30 секунд/72°С в течение 90 секунд и 72°С в течение 5 минут) с использованием праймеров SEQ ID NO: 28 и 55, и затем анализируя нуклеотидную последовательность, таким образом идентифицируя введение вариантов R558H, G561D. Конкретные последовательности используемых праймеров представлены в таблице 6 ниже. Штамм АТСС13032_leuA_(R558H, G561D), трансформированный вектором pDCM2-leuA(R558H, G561D), был назван 'CJL-8100'.

Для встраивания варианта (Р247С) в штамм, продуцирующий L-лейцин, конструировали вектор для встраивания CJL-8100.
Более конкретно, осуществляли ПЦР с использованием хромосомы штамма CJL-8100 в качестве матрицы и пар праймеров с SEQ ID NO: 28 и 29 и SEQ ID NO: 54 и 55. ПЦР осуществляли следующим образом: денатурация при 94°С в течение 5 минут, 30 циклов при 94°С в течение 30 секунд, при 55°С в течение 30 секунд, и при 72°С в течение 1 минуты 30 секунд, с последующей полимеризацией при 72°С в течение 5 минут. Полученный в результате продукт ПЦР клонировали в линейный вектор pDCM2, расщепленный ферментом рестрикции SmaI, с использованием фермента In-Fusion путем слияния гомологичной последовательности концевых 15 оснований фрагментов ДНК, таким образом конструируя вектор pDCM2-leuA(P247C, R558H, G561D), включающий вариант leuA, кодирующий вариант LeuA, в котором гистидин заменен на аргинин, который представляет собой аминокислоту в положении 558 аминокислотной последовательности LeuA штамма дикого типа, и аспарагиновая кислота заменена на глицин, который представляет собой аминокислоту в положении 561, и цистеин (Cys) заменен на пролин(Pro), который представляет собой аминокислоту в положении 247 LeuA.
Вектор pDCM2-leuA(P247C, R558H, G561D) трансформировали в Corynebacterium glutamicum АТСС 13032 дикого типа путем электропорации, и штаммы, в которых вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы вновь подвергали вторичному кроссинговеру, и отбирали штаммы, в которые вводили варианты гена leuA. Наконец, введены ли или нет варианты в трансформированный штамм, подтверждали путем осуществления ПЦР (94°С в течение 5 минут, 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 90 секунд, с последующей полимеризацией при 72°С в течение 5 минут) с использованием праймеров SEQ ID NO: 3 и 4, и затем анализируя нуклеотидную последовательность, таким образом идентифицируя введение вариантов Р247С, R558H и G561D. Штамм АТСС13032_leuA_(Р247С, R558H, G561D), трансформированный вектором pDCM2-leuA(P247C, R558H, G561D), был назван 'СА13-8105'.
СА13-8105 был депонирован в Корейском центре культур микроорганизмов, представляющем собой международную депонирующую организацию в соответствии с Будапештским договором, 29 апреля 2020 года, и ему присвоили № КССМ12709Р.
Для повышения продуцирования L-лейцина в полученном штамме СА13-8105 получали штамм, в который был введен вариант ilvE (V156A), кодирующий аминотрансферазу аминокислоты с разветвленной цепью (WO 2021-112469 А1). Более конкретно, вектор pDCM2-ilvE(V156A), включающий вариант гена ilvE, трансформировали в Corynebacterium glutamicum CJL-8100 путем электропорации, и штаммы, в которых вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы вновь подвергали вторичному кроссинговеру, и отбирали штаммы, в которые был введен вариант гена ilvE. Наконец, введен ли или нет вариант в трансформированный штамм, подтверждали путем осуществления ПЦР (94°С в течение 5 минут, 30 циклов при 94°С в течение 30 секунд/55°С в течение 30 секунд/72°С в течение 90 секунд, затем 72°С в течение 5 минут) с использованием праймеров SEQ ID NO: 30 и 31 в соответствии с таблицей 7 ниже, и затем анализируя нуклеотидную последовательность, таким образом идентифицируя введение варианта V156A. Штамм, трансформированный вектором pDCM2-ilvE(V156A), был назван 'CJL-8108'.

Для повышения продуцирования L-лейцина в полученном штамме CJL-8108 получали штамм, в который был введен вариант gltA (М3121) с ослабленной активностью цитратсинтазы.
Более конкретно, сайт-направленный мутагенез использовали при конструировании вектора для введения варианта gltA(M3121). Осуществляли ПЦР с использованием хромосомы Corynebacterium glutamicum АТСС13032 дикого типа в качестве матрицы и праймеров в соответствии с таблицей 8 ниже. Осуществляли ПЦР в условиях денатурации при 94°С в течение 5 минут, 30 циклов при 94°С в течение 30 секунд, при 55°С в течение 30 секунд и при 72°С в течение 1 минуты и 30 секунд, с последующей полимеризацией при 72°С в течение 5 минут. Полученный в результате фрагмент гена клонировали в линейный вектор pDCM2, расщепленный ферментом рестрикции Smal, с использованием фермента In-Fusion путем слияния гомологичной последовательности концевых 15 оснований фрагментов ДНК, таким образом конструируя вектор pDCM2-gltA(M3121) для замены метионина в положении 312 на изолейцин.
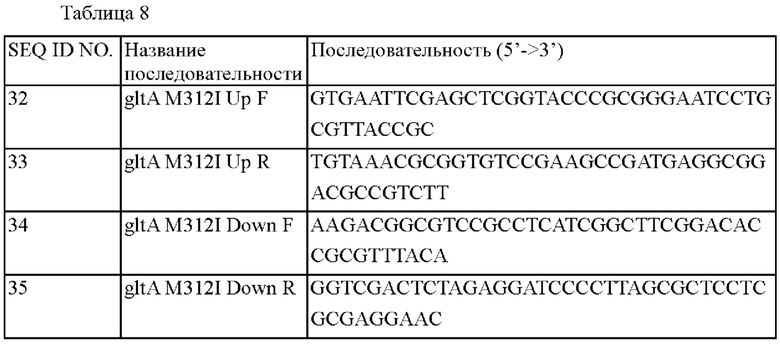
Вектор pDCM2-gltA(M3121), включающий вариант гена gltA, трансформировали в Corynebacterium glutamicum CJL-8108 путем электропорации, и отбирали штаммы, в которых вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы вновь подвергали вторичному кроссинговеру, и отбирали штаммы, в которые был введен вариант гена gltA. Наконец, введен или нет вариант в трансформированный штамм подтверждали путем осуществления ПЦР (94°С в течение 5 минут, 30 циклов при 94°С в течение 30 секунд/55°С в течение 30 секунд/72°С в течение 90 секунд, с последующими 72°С в течение 5 минут) с использованием праймеров SEQ ID NO: 36 и 37 в соответствии с таблицей 9 ниже, и затем анализируя нуклеотидную последовательность, таким образом идентифицируя введение варианта M312I. Штамм, трансформированный вектором pDCM2-gltA(M3121), был назван 'CJL-8109'.

4-2. Конструирование вектора для встраивания, включающего вариант leuA
Для введения вариантов (L138G, Н162Е, S211L, N245S, I588P), выбранных в примере 2, в штамм, продуцирующий L-лейцин, CJL-8109, полученный в примере 4-1, предполагалось сконструировать вектор для встраивания.
Осуществляли ПЦР с использованием хромосомы штамма CJL-8109 в качестве матрицы, и пары праймеров в соответствии с таблицей 4. ПЦР осуществляли в условиях денатурации при 94°С в течение 5 минут, 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты и 30 секунд с последующей полимеризацией при 72°С в течение 5 минут. Полученный продукт ПЦР клонировали в линейный вектор pDCM2, расщепленный ферментом рестрикции Smal, с использованием фермента In-Fusion путем слияния гомологичной последовательности концевых 15 оснований фрагментов ДНК, таким образом конструируя в общей сложности 8 векторов 'pDCM2-leuA(L138G, Р247С, R558H, G561D)', 'pDCM2-leuA(H162E, Р247С, R558H, G561D)', 'pDCM2-leuA(S211L, P247C, R558H, G561D)', 'pDCM2-leuA(N245S, P247C, R558H, G561D)', 'pDCM2-leuA(P247C, R558H, G561D, I588P)', 'pDCM2-leuA(S211L, P247C, I588P)', 'pDCM2-leuA(L138G, H162E, S211L, N245S, P247C, R558H, G561D)' и 'pDCM2-leuA(L138G, H162E, S211L, N245S, P247C, R558H, G561D, I588P)'.
4-3. Введение варианта leuA в штамм CJL-8109 и оценка
L-лейцин-продуцирующий штамм CJL-8109 трансформировали каждым из векторов, полученных в примере 4-2, и штаммы, в которых каждый вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы вновь подвергали вторичному кроссинговеру, и отбирали штаммы, в которые был введен вариант целевого гена. Наконец, введен или нет вариант гена leuA в трансформированный штамм подтверждали путем осуществления ПЦР с использованием праймеров с SEQ ID NO: 3 и SEQ ID NO: 4, и затем анализируя нуклеотидную последовательность, таким образом идентифицируя, что вариант leuA введен в штамм. В общей сложности 8 полученных таким образом штаммов были названы как в таблице 11 ниже, и аминокислотная последовательность варианта, включающая вариацию, и нуклеотидная последовательность кодирующего его варианта leuA, представлены в таблице 10 ниже.
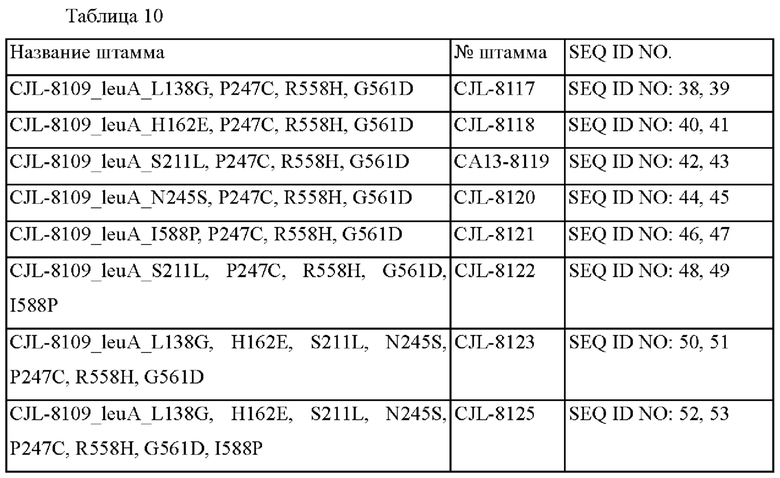
Затем оценивали L-лейцин-продуцирующую способность Corynebacterium glutamicum АТСС13032 дикого типа и полученных штаммов CJL-8109, CJL-8117, CJL-8118, СА13-8119, CJL-8120, CJL-8121, CJL-8122, CJL-8123 и CJL-8125. Более конкретно, культивирование культуры в колбе осуществляли при помощи способа в соответствии с примером 2-1. После завершения культивирования продуцирование L-лейцина родительским штаммом и вариантами штаммов измеряли при помощи HPLC, и результаты представлены в таблице 11 ниже.
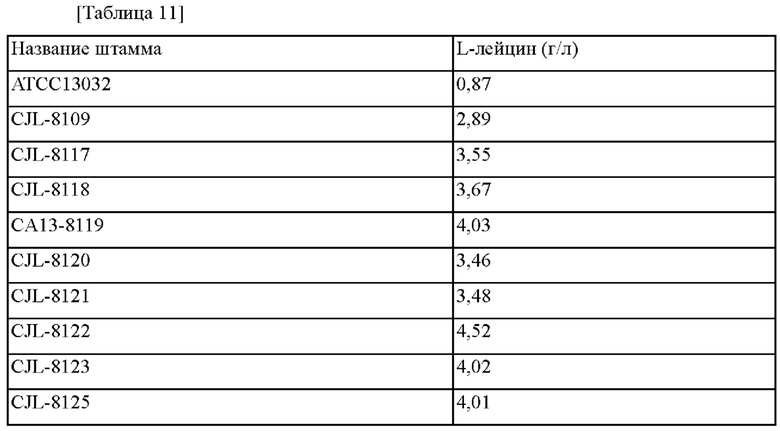
В соответствии с таблицей 11, CJL-8117, CJL-8118, СА13-8119, CJL-8120, CJL-8121, CJL-8122, CJL-8124 и CJL-8125, которые представляют собой L-лейцин-продуцирующие штаммы, имеющие дополнительный вариант L138G, Н162Е, S211L, N245S, I588P, S211L/I588P, L138G/H162E/S211L/N245S или L138G/H162E/S211L/N245S/I588P в гене leuA, продемонстрировали приблизительно 4-5-кратное улучшение продуктивности по L-лейцину по сравнению с родительским штаммом Corynebacterium glutamicum АТСС 13032 дикого типа. Также было подтверждено, что продуцирующие L-лейцин штаммы Corynebacterium glutamicum CJL-8117, CJL-8118, CA13-8119, CJL-8120, CJL-8121, CJL-8122, CJL-8123 и CJL-8125 продемонстрировал приблизительно 1,2-1,6-кратное улучшение продуктивности по L-лейцину по сравнению с родительским штаммом Corynebacterium glutamicum CJL-8109.
Эти результаты указывают на то, что аминокислоты в положениях 138, 162, 211, 245 и 588 аминокислотной последовательности белка LeuA представляют собой важные сайты для продуцирования L-лейцина.
4-4. Измерение активности изопропилмалатсинтазы в штамме с введенным вариантом LeuA
Для измерения активности изопропилмалатсинтазы в CJL-8109 и CJL-8117, CJL-8118, СА13-8119, CJL-8120, CJL-8121, CJL-8122, CJL-8123 и CJL-8125, которые представляют собой продуцирующие L-лейцин штаммы, полученные в примере 4-3, эксперимент осуществляли следующим образом.
Каждую одну платиновую петлю штаммов (CJL-8109, CJL-8117, CJL-8118, СА13-8119, CJL-8120, CJL-8121, CJL-8122, CJL-8123, CJL-8125) и Corynebacterium glutamicum ATCC13032 дикого типа инокулировали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл среды для продуцирования в соответствии с таблицей 2, и затем культивировали при 30°С в течение 16 часов при встряхивании при 200 об./мин. После завершения культивирования каждую культуральную среду центрифугировали, и супернатант удаляли. Осадок промывали и суспендировали с лизирующим буфером, и разрушали. Количественное определение белка в лизате осуществляли в соответствии с анализом Брэдфорда, и использовали лизат, содержащий 100 мкг/мл белка. В этот момент времени изменение поглощения при 412 нм из-за тионитробензоата (TNB), образующегося из DTNB (5,5'-дитиобис-(2-нитробензойной кислоты), реактив Эллмана) путем восстановления с использованием продуцируемого СоА, измеряли для определения активности фермента изопропилмалатсинтазы. Результаты измерения активности изопропилмалатсинтазы в каждом штамме представлены в таблице 12 ниже.

Затем для проверки степени ослабления ингибирования по типу обратной связи фермента лейцином определяли активность изопропилмалатсинтазы путем измерения Со А, образующегося, когда использовали лизат, содержащий 100 мкг/мл белка, в условиях, в которых добавляли 2 г/л лейцина. Результаты измерения активности изопропилмалатсинтазы в каждом штамме представлены в таблице 13 ниже.

В соответствии с представленным в таблицах 12 и 13, CJL-8109 и CJL-8117, CJL-8118, СА13-8119, CJL-8120, CJL-8121, CJL-8122, CJL-8123 и CJL-8125, которые представляют собой продуцирующие L-лейцин штаммы, трансформированные вектором, экспрессирующим вариант LeuA, демонстрировали приблизительно 1,18-1,38-кратное улучшение активности изопропилмалатсинтазы по сравнению с контрольным Corynebacterium glutamicum АТСС 13032 дикого типа. Также было подтверждено, что штаммы, продуцирующие L-лейцин, сохраняли от 83% до 93% активности изопропилмалатсинтазы даже в условиях, в которых добавляли 2 г/л лейцина, свидетельствуя об ослаблении ингибирования по типу обратной связи лейцином.
СА13-8119 был депонирован в Корейском центре культур микроорганизмов (Korean Culture Center of Microorganisms), представляющем собой международную депонирующую организацию в соответствии с Будапештским договором, 8 февраля 2021 года, и ему присвоили № КССМ12949Р.
На основании приведенного выше описания изобретения специалистам в данной области техники должно быть понятно, что настоящее изобретение может быть реализовано в другой конкретной форме без изменения его технической сущности или существенных характеристик. При этом следует понимать, что вышеупомянутое воплощение является не ограничивающим, а иллюстративным во всех аспектах. Объем изобретения определен прилагаемой формулой изобретения, а не предшествующим описанием изобретения, и поэтому предполагается, что все изменения и модификации, которые находятся в рамках формулы изобретения или эквивалентов таких рамок, охвачены формулой изобретения.
Изобретение относится к биотехнологии и представляет собой вариант полипептида, обладающий активностью изопропилмалатсинтазы, содержащий одну или более чем одну замену, выбранную из группы, состоящей из 1) замены аминокислотного остатка, соответствующего положению 138, на другой аминокислотный остаток, 2) замены аминокислотного остатка, соответствующего положению 162, на другой аминокислотный остаток, 3) замены аминокислотного остатка, соответствующего положению 211, на другой аминокислотный остаток, 4) замены аминокислотного остатка, соответствующего положению 245, на другой аминокислотный остаток и 5) замены аминокислотного остатка, соответствующего положению 588, на другой аминокислотный остаток, в аминокислотной последовательности SEQ ID NO: 1. Изобретение касается также способа получения L-лейцина, включающего стадию культивирования в среде микроорганизма рода Corynebacterium, продуцирующего L-лейцин, причем микроорганизм содержит указанный вариант полипептида, кодирующий его полинуклеотид или включающий его вектор. Изобретение позволяет получать L-изолейцин с высокой степенью эффективности. 6 н. и 8 з.п. ф-лы, 13 табл., 4 пр.
1. Вариант полипептида, обладающий активностью изопропилмалатсинтазы, содержащий одну или более чем одну замену, выбранную из группы, состоящей из 1) замены аминокислотного остатка, соответствующего положению 138, на другой аминокислотный остаток, 2) замены аминокислотного остатка, соответствующего положению 162, на другой аминокислотный остаток, 3) замены аминокислотного остатка, соответствующего положению 211, на другой аминокислотный остаток, 4) замены аминокислотного остатка, соответствующего положению 245, на другой аминокислотный остаток и 5) замены аминокислотного остатка, соответствующего положению 588, на другой аминокислотный остаток, в аминокислотной последовательности SEQ ID NO: 1.
2. Вариант полипептида по п. 1, где 1) лейцин, который представляет собой аминокислотный остаток, соответствующий положению 138, заменен на глицин.
3. Вариант полипептида по п. 1, где 2) гистидин, который представляет собой аминокислотный остаток, соответствующий положению 162, заменен на глутамат.
4. Вариант полипептида по п. 1, где 3) серин, который представляет собой аминокислотный остаток, соответствующий положению 211, заменен на лейцин.
5. Вариант полипептида по п. 1, где 4) аспарагин, который представляет собой аминокислотный остаток, соответствующий положению 245, заменен на серин.
6. Вариант полипептида по п. 1, где 5) изолейцин, который представляет собой аминокислотный остаток, соответствующий положению 588, заменен на пролин.
7. Вариант полипептида по п. 1, содержащий одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 и SEQ ID NO: 14.
8. Полинуклеотид, кодирующий вариант полипептида по любому из пп. 1-7.
9. Экспрессионный вектор, содержащий полинуклеотид по п. 8.
10. Микроорганизм рода Corynebacterium, продуцирующий L-лейцин, где микроорганизм содержит вариант полипептида по п. 1, кодирующий его полинуклеотид, или включающий его вектор.
11. Микроорганизм рода Corynebacterium по п. 10, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
12. Способ получения L-лейцина, включающий стадию культивирования в среде микроорганизма рода Corynebacterium, продуцирующего L-лейцин, где микроорганизм содержит вариант полипептида по п. 1, кодирующий его полинуклеотид или включающий его вектор.
13. Способ по п. 12, дополнительно включающий стадию выделения L-лейцина из среды или из микроорганизма после стадии культивирования.
14. Композиция для получения L-лейцина, содержащая (i) микроорганизм рода Corynebacterium, продуцирующий L-лейцин, содержащий вариант полипептида по п. 1, кодирующий его полинуклеотид или включающий его вектор; или среду, в которой культивируют указанный микроорганизм, и (ii) эксципиент.
| EP 3578645 A1, 11.12.2019 | |||
| US 20200032305 A1, 30.01.2020 | |||
| EP 1568776 B1, 03.09.2008 | |||
| СПОСОБ ПОЛУЧЕНИЯ L-ЛЕЙЦИНА (ВАРИАНТЫ), ШТАММ ESCHERICHIA COLI 505/PACYC-TYR B - ПРОДУЦЕНТ L-ЛЕЙЦИНА | 2002 |
|
RU2243260C2 |
| МУТАНТНАЯ АЛЬФА-ИЗОПРОПИЛМАЛАТ СИНТАЗА (IPMS), ДНК, КОДИРУЮЩАЯ МУТАНТНУЮ IPMS, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ESCHERICHIA COLI, СПОСОБ ПОЛУЧЕНИЯ L-ЛЕЙЦИНА | 1999 |
|
RU2201454C2 |
Авторы
Даты
2024-08-09—Публикация
2022-01-28—Подача