Настоящее изобретение относится к области органической химии, к гетероциклическим соединениям, содержащим пятичленные кольца, содержащие три атома азота в качестве гетероатома, а именно к триазолам, не конденсированные с другими кольцами, только с атомами водорода или радикалами, содержащими только атомы водорода и углерода и касается производных (S)-4-оксо-N-(1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)пентанамида и его применения в качестве пролекарственной формы противоопухолевого лекарственного средства для лечения онкологических заболеваний.
В настоящее время онкологические заболевания являются одной из основных причин смерти во всем мире. В 2020 году зарегистрировано 19,3 миллиона новых случаев онкозаболеваний и более 10 миллионов случаев смерти от этой группы заболеваний. По прогнозам, число случаев онкологических заболеваний в мире будет продолжать расти и в 2030 году достигнет 22,2 миллионов. В связи с этим, синтез новых соединений и создание на их основе противоопухолевых препаратов, обладающих улучшенными фармакокинетическими свойствами, является актуальной задачей здравоохранения.
Один из классов противоопухолевых препаратов представляет собой ингибиторы митоза клеток. Активность таких соединений обусловлена воздействием на клеточный белок тубулин, связывание с которым нарушает образование митотического веретена деления, что приводит к остановке клеточного цикла (J. Med. Chem. 2020, 63, 10618-10651).
Установлены основные классы соединений, связывающиеся с колхициновым сайтом тубулина и вызывающим остановку митоза клеток. К таким соединениям относятся алкалоиды ряда колхицина, комбретастатин А-4 и его производные, 4-арилкумарины, а также гетероциклические производные аллоколхицина. Однако, каждый из них имеет недостатки.
Недостатком комбретастатина А-4 (US 4996237 A, кл. C07C 43/23, C07D 317/64, A61K 31/075, опубл. 1991.02.26) и его производных (US 2009186857 A, кл. A61K 31/66, опубл. 2009.07.23, EP 1045853 B1, кл. C07F 9/12, опубл. 2010.08.04.) является низкая эффективность за счет нежелательных побочных эффектов при применении in vivo вследствие их самопроизвольного превращения из активной цис-формы в неактивную транс-форму (Curr. Opin. Pharmacol., 2001, 1, 370). 4 - арилкумарины проявляют низкую антипролиферацинную и апоптозиндуцирующую активность по сравнению с производными комбретастатина и колхицина (J. Med. Chem. 2003, 46, 5437; J. Med. Chem. 2011, 54, 3153).
Известны, например, колхицин и его производные из патентных документов: WO 2011022805 (A1), кл. A61K 31/165, A61P 35/00, C07C 233/32, опубл. 2011.03.03 г.; WO 2010105172 (A1), кл. A01N 37/18, A61K 31/16, опубл. 2010.09.16 г.; EP 2056812 A1, кл. A61K 31/165, A61P 35/04, опубл. 2009.05.13 г.; US 2004204370 A1, кл. C07C 323/41, C07C 323/42, C07C 323/60, опубл. 2004.10.14 г.; US 7964647 B2, кл. C07C 205/00, C07C 207/00, опубл. 2011.07.21.; EP 0784613 B1, кл. C07C 323/41, C07C 323/60, опубл. 09.06.1999.
Известны соединения с колхициновым скелетом для получения лекарственных препаратов с противоопухолевой активностью (RU 99100326 A, кл. C07C 49/755, C07C 323/22, C07D 265/34, A61K 31/12, A61P 35/00, опубл. 20.11.2000 г.).
Известны производные колхицина, которые проявляют противоопухолевую и антипролиферативную активность (RU 2181354 C2, кл. C07C 49/755, C07D 265/36, A61K 31/1222, A61K 31/165, A61P 35/00, опубл. 20.04.02 г.).
Известны производные N-деацитилтиоколхицина, которые обладают антипролиферативной активностью (RU 2257379 C2, кл. C07C 323/41, C07C 323/44, A61K 31/165, A61K 31/17, A61P35/00, A61P 19/02, опубл. 27.07.05 г.).
Недостатком колхицина и его производных является возникновение побочных эффектов при их применении, в частности, значительная неспецифическая токсичность (Med. Res. Rev. 2008, 28, 155-183; Semin Arthritis Rheum. 2015, 45, 341-350), что делает невозможным их использование в качестве противоопухолевых препаратов.
Известно индольные (N.S. Sitnikjov et al., Chem. Eur. J. 2012, 18, 12096, Eur. J. Org. Chem., 2016, 5620-5623; Eur. J. Med. Chem., 2017, 141, 51-60, RU 2630303 C1, RU 2593998 C1) и фурановые (RU 2538982 С1, опубл. 10.01.2015 г., кл. C07D 307/78, C07D 405/06, A61K 31/343, A61K 35/00, J. Med. Chem. 2015, 58, 692, RU 2678440 C1, кл. C07D 0307/78; A61K 0031/343; A61P 0035/00, опубл. 29.01.2019 г.) производные аллоколхицина, обладающие значительной антипролиферативной активностью и апоптоз-индуцирующей активностью.
Недостатком указанных соединений является высокая системная токсичность для организма, неселективное воздействие на ткани организма, быстрая биотрансформация производных и их утилизация печенью.
В задачу изобретения положено создание нового производного колхицина, создание на его основе липидного производного для последующего включения его в липосомальные системы доставки.
Технический результат от использования изобретения заключается в снижении неспецифической токсичности активного соединения за счет создания рН-чувствительной пролекарственной формы и включения ее в состав липосомальных частиц, которые могут избирательно накапливаться в опухолевых тканях за счет механизма пассивного нацеливания.
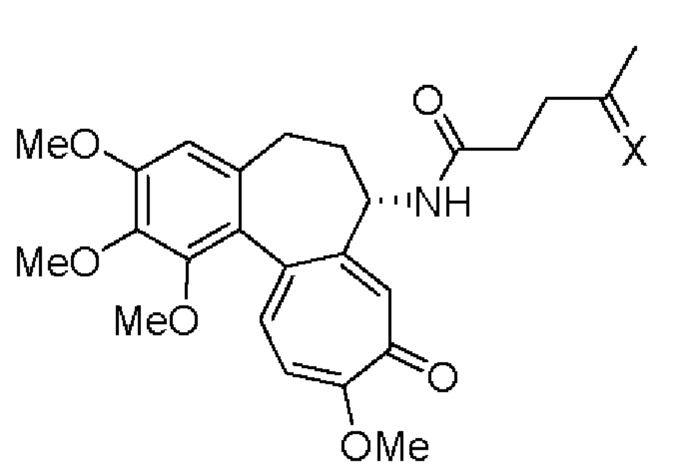
Это достигается тем, что производное (S)-4-oксо-N-(1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)пентанамида формулы:
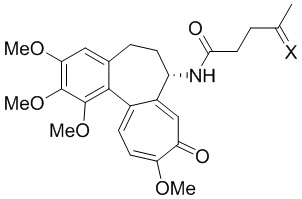 ,
,
где X - заместитель,
X= 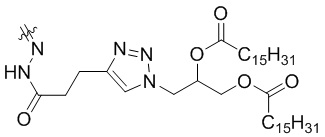
применяют в качестве кислотно-чувствительной пролекарственной формы противоопухолевого лекарственного средства для лечения онкологических заболеваний.
При X =  это 3-(4-(3-оксо-3-(2-((Z)-5-oксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1H-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитат.
это 3-(4-(3-оксо-3-(2-((Z)-5-oксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1H-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитат.
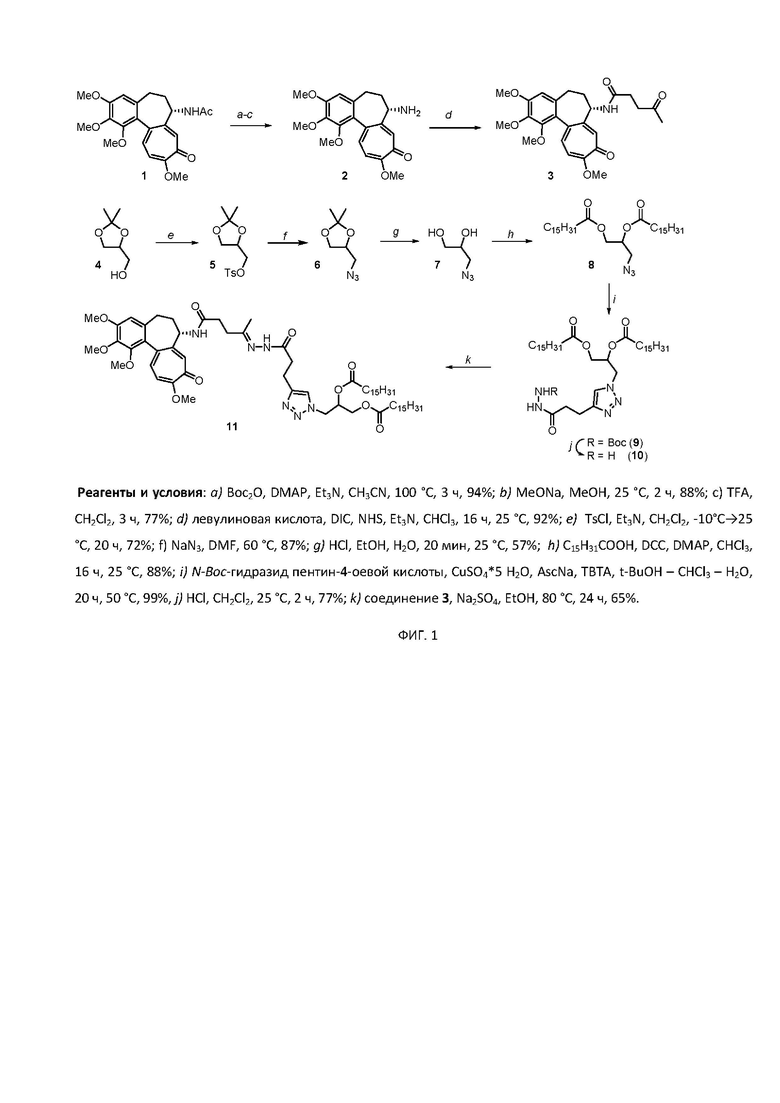
На фиг. 1 представлена схема получения производного 3-(4-(3-оксо-3-(2-((Z)-5-oксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1H-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитата.
В Таблице 1 представлены результаты биологических испытаний, отражающие активность при ингибировании пролиферации опухолевых клеток производными (S)-4-oксо-N-(1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)пентанамидом и 3-(4-(3-оксо-3-(2-((Z)-5-oксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1H-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитатом к клеткам EL-4, Colo-357 и MCF7.
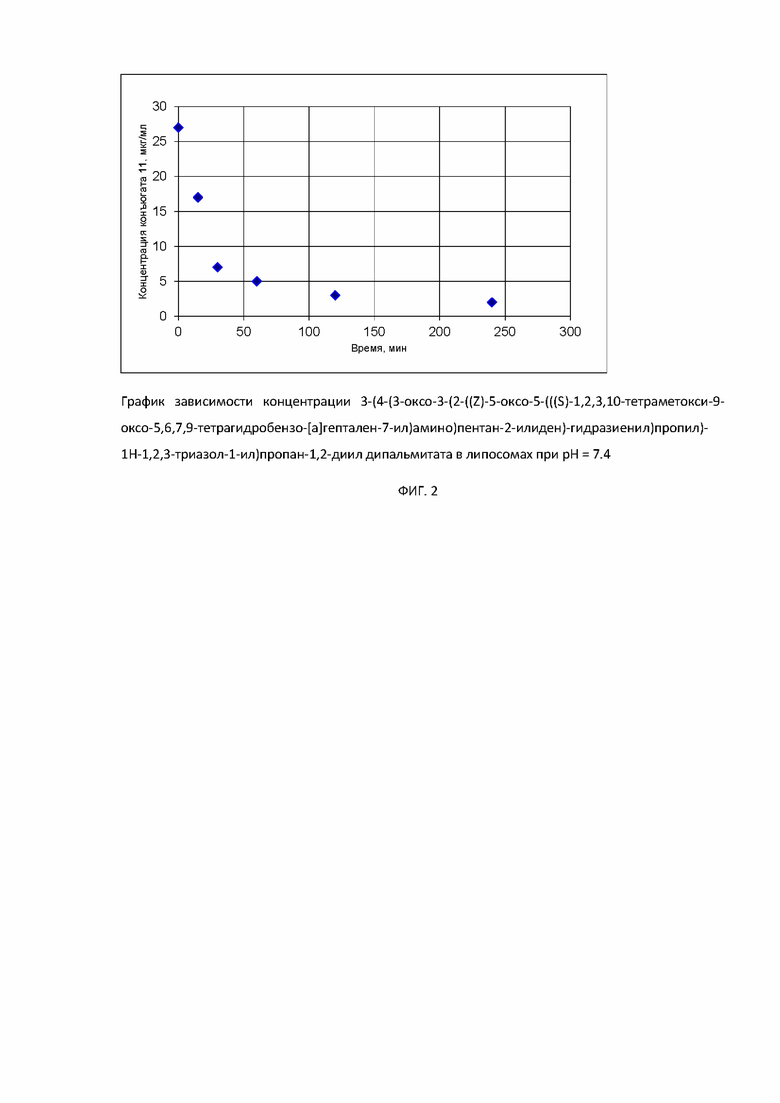
На фиг.2 показана динамика распада соединения в составе липосом при физиологическом рН.
Получение 3-(4-(3-оксо-3-(2-((Z)-5-oксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1H-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитата осуществляют следующим образом.
На первом этапе из колхицина синтезируют деацетилколхицин. Для этого к смеси, содержащей колхицин 1 (3.00 г, 7.51 ммоль) и DMAP (915 мг, 7.50 ммоль) в ацетонитриле (30.0 мл) в атмосфере аргона добавляют ½ раствора Boc2O (7.52 г, 34.5 ммоль) в ацетонитриле (8.00 мл) и 2.10 мл Et3N. Полученный раствор перемешивался при 100°С в течение часа. Через 1 час добавляют остаток раствора Boc2O в ацетонитриле и перемешивание проводят в течение двух часов при 100°С, затем смесь охлаждают до комнатной температуры. После упаривания растворителя N-Boc-колхицин (2.29 г, 94%) в выделяют методом колоночной хроматографии на силикагеле, элюент 4:1 (этилацетат : ацетон).
1H ЯМР: (400 MГц, ДМСО-d6) δ 7.26 (с, 1H), 7.11 (д, J = 10.7 Гц, 1H), 7.02 (д, J = 10.7 Гц, 1H), 6.78 (с, 1H), 4.90 (дд, J = 12.3, 5.8 Гц, 1H), 3.87 (с, 3H), 3.83 (с, 3H), 3.77 (с, 3H), 3.54 (с, 3H), 2.69 (дд, J = 13.5, 6.0 Гц, 2H), 2.33 - 2.26 (м, 1H), 2.23 (с, 3H), 1.96 - 1.85 (м, 1H), 1.49 (с, 9H).
13С ЯМР: (400 MГц, ДМСО-d6) δ 177.84, 163.50, 153.10, 152.97, 150.47, 150.01, 148.20, 140.82, 134.73, 134.48, 133.83, 131.72, 125.60, 112.12, 107.72, 84.34, 60.83, 60.64, 56.04, 55.83, 31.79, 29.24, 27.28.
В колбе Шленка N-Boc-колхицин (2.29 г, 4.60 ммоль) смешивают с MeONa (0.99 г, 18.4 ммоль), в атмосфере аргона растворяют смесь в MeOH (34.0 мл). Полученный раствор перемешивают в течение 2 часов при 25°С. После завершения реакции раствор нейтрализуют насыщенным раствором хлорида аммония, проводят экстракцию EtOAc, объединенный органический слой высушивают над Na2SO4. После упаривания растворителя получают N-Boc-деацетилколхицин (1.85 г, 88 %).
1H ЯМР: (400 MГц, ДМСО-d6) δ 7.69 (д, J = 7.8 Гц, 1H), 7.21 (с, 1H), 7.10 (д, J = 10.6 Гц, 1H), 7.02 (д, J = 10.8 Гц, 1H), 6.76 (с, 1H), 4.11 - 4.04 (м, 1H), 3.87 (с, 3H), 3.83 (с, 3H), 3.79 (с, 3H), 3.54 (с, 3H), 2.55 (дд, J = 13.2, 5.9 Гц, 1H), 2.17 (тд, J = 13.0, 6.9 Гц, 1H), 2.04 - 1.95 (м, 1H), 1.86 - 1.77 (м, 1H), 1.32 (с, 9H).
13С ЯМР: (400 MГц, ДМСО-d6) δ 177.99, 163.49, 154.49, 152.93, 151.01, 150.34, 140.68, 135.08, 134.37, 134.25, 130.50, 125.30, 112.11, 107.65, 78.13, 60.82, 60.63, 56.00, 55.84, 52.86, 35.79, 29.26, 28.13.
В колбу Шленка поместили N-Boc-деацетилколхицин (1.85 г, 4.00 ммоль), в атмосфере аргона добавили 30.0 мл СН2Сl2. К полученному раствору добавили TFA (7.00 мл) и оставили перемешиваться при комнатной температуре на 1 час. По окончании реакции раствор нейтрализовали NaHCO3, экстрагировали СН2Сl2, органический слой сушили над Na2SO4. После упаривания растворителя был выделен продукт 2 в виде желтого порошка (1,09 г, 77 %).
1H ЯМР: (400 MГц, ДМСО-d6) δ 7.64 (с, 1H), 7.05 (д, J = 10.6 Гц, 1H), 6.99 (д, J = 10.8 Гц, 1H), 6.74 (с, 1H), 3.86 (с, 3H), 3.83 (с, 3H), 3.76 (с, 3H), 3.55 (с, 3H), 3.45 (дд, J = 10.4, 5.9 Гц, 1H), 2.14 (м, 3H), 1.49 (тд, J = 10.0, 4.8 Гц, 1H).
13С ЯМР: (400 MГц, ДМСО-d6) δ 178.16, 163.29, 153.25, 152.76, 150.16, 140.49, 135.59, 134.79, 133.86, 131.76, 125.35, 111.87, 107.37, 60.67, 60.53, 55.92, 55.85, 53.08, 29.79.
Синтез соединения 3.
В колбу Шленка поместили соединение 2 (500 мг, 1,42 ммоль), левулиновую кислоту (0,17 мл, 1,71 ммоль), N-гидроксисукцинимид (124 мг, 1,07 ммоль), Et3N (0,59 мл, 4,26 ммоль). В атмосфере аргона добавили 20,0 мл CHCl3 и DIC (0,25 мл, 1,84 ммоль), оставили перемешиваться на 16 часов при комнатной температуре. После окончания реакции растворитель упарили, продукт 3 был выделен в виде желтого порошка (700 мг, 92%) методом колоночной хроматографии на силикагеле, элюент 10:1 (CHCl3 : MeOH).
1H ЯМР: (400 МГц, ДМСО-d6) δ 8.55 (д, J = 7.4 Гц, 1H), 7.12 (д, J = 7.7 Гц, 1H), 7.08 (с, 1H), 7.01 (д, J = 10.9 Гц, 1H), 6.76 (с, 1H), 4.35 - 4.27 (м, 1H), 3.87 (с, 3H), 3.83 (с, 3H), 3.78 (с, 3H), 3.51 (с, 3H), 2.58 (дд, J = 13.1, 6.5 Гц, 3H), 2.42 - 2.31 (м, 2H), 2.21 (дд, J = 13.1, 6.1 Гц, 1H), 2.08 (с, 3H), 1.82 (дд, J = 11.6, 4.8 Гц, 1H).
13C ЯМР: (101 МГц, ДМСО-d6) δ 207.59, 178.42, 171.00, 163.93, 157.21, 153.36, 151.14, 150.86, 141.16, 135.57, 134.76, 134.64, 130.83, 125.87, 112.49, 108.18, 61.28, 61.12, 56.47, 56.30, 51.65, 38.14, 29.99, 29.65, 29.28.
Синтез липидной части пролекарства начинали с модификации диоксолана 4.
В колбу Шленка поместили (2,2-диметил-1,3-диоксолан-4-ил)метанол 4 (3,73 мл, 40,5 ммоль), в атмосфере аргона добавили 40,0 мл CH2Cl2, тозилхлорид (8,47 г, 44,6 ммоль) и Et3N (6,21 мл, 44,6 ммоль). Реакцию проводили при -10°С с постепенным повышением температуры до комнатной. После окончания реакции растворитель удалили при пониженном давлении, соединение 5 было выделено (8.34 г, 72%) методом колоночной хроматографии на силикагеле, элюент 10:1 (циклогексан : этилацетат).
1H ЯМР: (400 МГц, CDCl3) δ 7.78 (д, J = 8.3 Гц, 2H), 7.34 (д, J = 8.1 Гц, 2H), 4.30 - 4.22 (м, 1H), 4.05 - 3.94 (м, 3H), 3.75 (дд, J = 8.8, 5.1 Гц, 1H), 2.44 (с, 3H), 1.33 (с, 3H), 1.30 (с, 3H).
13С ЯМР: (101 МГц, CDCl3) δ 145.03, 129.88, 127.96, 110.02, 77.33, 77.02, 76.70, 72.89, 69.46, 66.16, 26.61, 25.12, 21.62.
Далее производное 5 (1,50 г, 5,47 ммоль) взаимодействовало с NaN3 (534 мг, 8,21 ммоль). В атмосфере аргона к указанной смеси добавили 30,0 мл DMF и оставили перемешиваться 20 часов при 65°С. После окончания реакции растворитель удалили при пониженном давлении, продукт 6 был выделен в виде белого порошка (750 мг, 87%) методом колоночной хроматографии на силикагеле, элюент 10:1 (циклогексан : этилацетат).
1H ЯМР: (400 МГц, CDCl3) δ 4.30 - 4.23 (м, 2H), 3.76 (дд, J = 8.5, 5.9 Гц, 1H), 3.34 (ддд, J = 18.3, 12.8, 5.1 Гц, 2H), 1.46 (с, 3H), 1.35 (с, 3H).
13С ЯМР: (101 МГц, CDCl3) δ 109.92, 74.55, 66.58, 52.82, 26.88, 26.59.
На следующем этапе проводили удаление защитной группы. Для этого к соединению 6 (750 мг, 4,78 ммоль) прилили 5,70 мл EtOH и 0,97 мл 36% раствора соляной кислоты. Смесь перемешивали в течение 20 минут при комнатной температуре. По окончании реакции соляную кислоту нейтрализовали водным раствором NaOH. Затем проводили экстракцию диэтиловым эфиром, объединенный органический слой сушили над Na2SO4. Растворитель удалили при пониженном давлении, продукт 7 был выделен в виде твердого кристаллического вещества (316 мг, 57%).
1H ЯМР: (400 МГц, CDCl3) δ 3.88 (тдд, J = 6.3, 4.7, 3.7 Гц, 1H), 3.66 (ддд, J = 17.4, 11.3, 4.9 Гц, 2H), 3.46 - 3.36 (м, 2H), 2.52 (с, 2H).
13С ЯМР: (101 МГц, CDCl3) δ 70.80, 63.95, 53.52.
Для получения диэфира 8 в колбу Шленка поместили соединение 7 (316 мг, 2,70 ммоль), пальмитиновую кислоту (1,52 г, 5,94 ммоль), DMAP (65,8 мг, 0,54 ммоль), в атмосфере аргона добавили 30,0 мл CH2Cl2 и диизопропилкарбодиимид (DIC) (1,15 мл, 8,10 ммоль), перемешивали 20 часов при комнатной температуре. После окончания реакции продукт 8 был выделен в виде прозрачной маслянистой жидкости (1,41 г, 88%) методом колоночной хроматографии на силикагеле, элюент 20:1 (циклогексан : этилацетат).
1H ЯМР: (400 МГц, CDCl3) δ 5.21 - 5.14 (м, 1H), 4.31 - 4.12 (м, 2H), 3.46 (дд, J = 5.2, 3.4 Гц, 2H), 2.34 (дд, J = 13.6, 7.4 Гц, 4H), 1.62 (дд, J = 14.9, 7.4 Гц, 4H), 1.29 - 1.20 (м, 48H), 0.88 (т, J = 6.9 Гц, 6H).
13С ЯМР: (101 МГц, CDCl3) δ 173.17, 172.81, 77.30, 77.19, 76.98, 76.67, 69.84, 62.26, 50.87, 48.95, 34.22, 34.17, 34.02, 31.90, 29.67, 29.66, 29.63, 29.59, 29.45, 29.34, 29.24, 29.23, 29.09, 29.05, 26.89, 24.97, 24.84, 24.79, 24.59, 22.83, 22.67, 22.49, 20.17, 14.25, 14.23.
Методика синтеза трет-бутил-2-(3-(1-(2,3- бис(пентадецилокси) пропил)-1H-1,2,3-триазол-4-ил)пропаноил)гидразин-1-карбоксилата 9.
В колбу Шленка поместили соединение 8 (107 мг, 0,50 ммоль) и N-Boc-гидразид пентиноевой кислоты (300 мг, 0,50 ммоль). В атмосфере аргона добавили 10,0 мл t-BuOH. В отдельной колбе смешали CuSO4*5H2O (25,3 мг, 0,10 ммоль), AsсNa (19,4 мг, 0,10 ммоль) и TBTA (108 мг, 0,20 ммоль), добавили 3,00 мл t-BuOН, 1,00 мл CHCl3, 1,00 мл H2O. Затем добавили эту смесь в колбу с субстратами. Реакцию проводили 20 часов при 60°С. После окончания реакции растворитель удалили, продукт 9 выделили (402 мг, 99%) методом колоночной хроматографии на силикагеле, элюент 50:1 (CH2Cl2 : MeOH).
1H ЯМР: (400 МГц, CDCl3) δ 5.21 - 5.14 (м, 1H), 4.31 - 4.12 (м, 2H), 3.49 - 3.43 (м, 2H), 2.34 (дд, J = 13.6, 7.4 Гц, 4H), 1.62 (дд, J = 14.9, 7.4 Гц, 4H), 1.42 (с, 9H), 1.29 - 1.20 (м, 48H), 0.88 (т, J = 6.8 Гц, 6H).
13С ЯМР: (101 МГц, CDCl3) δ 173.19, 173.13, 172.77, 171.65, 162.52, 155.35, 81.49, 77.31, 77.20, 76.99, 76.68, 69.38, 62.12, 60.36, 50.12, 36.45, 34.02, 33.97, 33.53, 31.90, 31.41, 29.67, 29.63, 29.61, 29.47, 29.33, 29.25, 29.24, 29.11, 29.04, 28.11, 24.80, 24.73, 23.40, 22.82, 22.66, 21.11, 21.01, 20.29, 20.25, 14.25, 14.20, 14.17, 14.09, 0.99.
Для удаления защитной Boc-группы соединение 9 (794 мг, 0,98 ммоль), растворили в 14,0 мл CH2Cl2 и добавили к раствору 3,00 мл 35% соляной кислоты. Реакцию проводили 1 час при комнатной температуре. По окончании реакции избыток кислоты нейтрализовали карбонатом натрия. Продукт экстрагировали CH2Cl2, органический слой сушили над Na2SO4. Продукт 10 был выделен в виде белого кристаллического вещества (533 мг, 77%).
1H ЯМР: (400 МГц, CDCl3) δ 8.41 (с, 1H), 7.42 (с, 2H), 5.36 (дд, J = 10.4, 5.2 Гц, 1H), 4.53 (дд, J = 11.4, 6.1 Гц, 2H), 4.28 - 4.03 (м,2H), 2.60 (д, J = 4.3 Гц,1H), 2.29 (дд, J = 15.2, 7.6 Гц, 4H), 1.62 - 1.51 (м, 4H), 1.29 - 1.20 (м, 48H), 0.87 (т, J = 6.8 Гц, 6H).
13С ЯМР: (101 МГц, CDCl3) δ 173.23, 173.12, 172.79, 172.61, 172.56, 122.29, 122.20, 77.32, 77.21, 77.00, 76.69, 69.35, 62.04, 50.03, 49.83, 34.03, 33.98, 32.16, 31.89, 29.67, 29.63, 29.61, 29.46, 29.33, 29.25, 29.24, 29.16, 29.11, 29.03, 25.32, 24.88, 24.82, 24.74, 23.43, 22.66, 21.17, 20.30, 15.91, 14.08, 0.98.
Синтез производного 11 был проведен при взаимодействии полученных ранее веществ 3 (27,0 мг, 0,06 ммоль) и 10 (40,0 мг, 0,05 ммоль). К смеси указанных соединений добавили 5 мл абсолютного этилового спирта, избыток Na2SO4, реакцию проводили в течение 20 часов при 80°С. Продукт был выделен в виде твердого бежевого порошка (43,0 мг, 65%) методом колоночной хроматографии на силикагеле, элюент 3:1:1 (циклогексан : этилацетат : этанол).
1H ЯМР: (400 МГц, CD3OD) δ 8.19 (с, 1H), 7.63 (с, 1H), 7.23 (с, 1H), 7.02 (с, 1H), 6.96 (д, J = 10.9 Гц, 1H), 6.59 (с, 1H), 4.45 (дд, J = 10.7, 5.2 Гц, 1H), 4.35 (с, 3H), 4.00 - 3.95 (м, 3H), 3.89 (с, 3H), 3.87 (с, 3H), 3.63 - 3.57 (м, 3H), 3.07 (т, J = 7.4 Гц, 2H), 3.02 (д, J = 4.0 Гц, 1H), 2.76 (дд, J = 16.0, 8.9 Гц, 2H), 2.57 (дд, J = 15.4, 8.4 Гц, 3H), 2.25 - 2.16 (м, 2H), 2.11 (с, 1H), 1.87 (с, 4H), 1.57 (дд, J = 18.4, 11.2 Гц, 4H), 1.29 - 1.20 (м, 48H), 0.85 (т, J = 6.8 Гц, 6H).
13С ЯМР: (101 МГц, CDCl3) δ 173.55, 173.48, 172.96, 172.93, 172.78, 172.58, 163.98, 163.92, 163.82, 153.63, 150.79, 141.22, 134.58, 130.08, 125.28, 123.06, 107.41, 77.86, 77.73, 77.54, 77.21, 69.50, 69.45, 62.19, 60.98, 60.85, 60.84, 56.03, 55.64, 52.74, 52.24, 49.94, 48.88, 48.81, 48.67, 48.60, 48.45, 48.38, 48.24, 48.17, 47.96, 47.74, 47.53, 36.11, 33.79, 33.76, 33.74, 31.74, 30.02, 29.49, 29.46, 29.44, 29.30, 29.16, 29.11, 29.09, 28.92, 28.83, 28.76, 24.67, 24.60, 22.45, 20.92, 20.25, 13.52.
Результаты биологических испытаний, отражающие активность при ингибировании пролиферации опухолевых клеток, (IC50а, нM).
aIC50 (нМ) - концентрация полумаксимального ингибирования. МТТ-тест повторяли 3 раза, ошибка составляет менее 10% и не приведена для наглядности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2326864C2 |
| НОВОЕ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2470934C1 |
| ОБЩИЙ СИНТЕЗ МИРИАПОРОНОВ | 2003 |
|
RU2328492C2 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТЫ | 1994 |
|
RU2127261C1 |
| БИАРИЛЬНОЕ ПРОИЗВОДНОЕ И СОДЕРЖАЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2016 |
|
RU2760373C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2528393C9 |
| ПРОИЗВОДНЫЕ 5,6-ДИГИДРОПИРОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2140917C1 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2489429C2 |
| ПОЛУСИНТЕТИЧЕСКИЙ СПОСОБ И НОВЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2237063C9 |
Настоящее изобретение относится к области органической химии, к гетероциклическим соединениям, содержащим пятичленные кольца с тремя атомами азота в качестве гетероатома, а именно к 3-(4-(3-оксо-3-(2-((Z)-5-оксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[a]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1H-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитату формулы 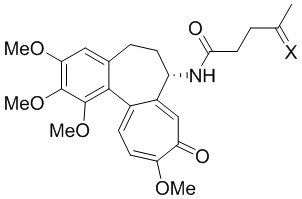 , где
, где
X= 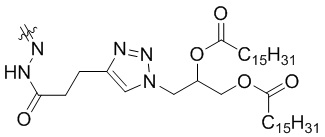 . Изобретение может применяться в качестве пролекарственной формы противоопухолевого лекарственного средства для лечения онкологических заболеваний. Технический результат изобретения заключается в снижении неспецифических токсических эффектов от применения активного вещества и усиленном его накоплении в опухоли за счет эффекта повышенной проницаемости и удержания, характерного для сосудов солидных опухолей. 2 ил., 1 табл.
. Изобретение может применяться в качестве пролекарственной формы противоопухолевого лекарственного средства для лечения онкологических заболеваний. Технический результат изобретения заключается в снижении неспецифических токсических эффектов от применения активного вещества и усиленном его накоплении в опухоли за счет эффекта повышенной проницаемости и удержания, характерного для сосудов солидных опухолей. 2 ил., 1 табл.
Производное (S)-4-оксо-N-(1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[а]гептален-7-ил)пентанамида формулы
 ,
,
где X = 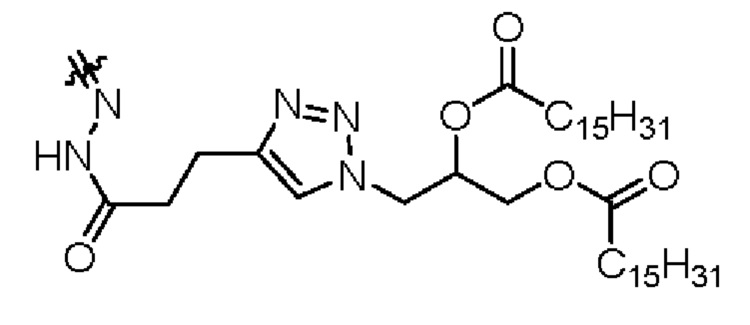 ,
,
представляющее собой 3-(4-(3-oкco-3-(2-((Z)-5-оксо-5-(((S)-1,2,3,10-тетраметокси-9-оксо-5,6,7,9-тетрагидробензо[а]гептален-7-ил)амино)пентан-2-илиден)гидразиенил)пропил)-1Н-1,2,3-триазол-1-ил)пропан-1,2-диил дипальмитат.
| Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение | 2016 |
|
RU2630303C1 |
| ПРОИЗВОДНОЕ 1', 2', 3'-ТРИМЕТОКСИБЕНЗО[5', 6:5, 4]-1H-6, 7-ДИГИДРОЦИКЛОГЕПТА[3, 2-f]БЕНЗОФУРАНА И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2593998C1 |
| ПРОИЗВОДНОЕ N-(1S)-1',2',3'-ТРИМЕТОКСИ-6,7-ДИГИДРО-1Н-БЕНЗО[5',6':5,4]ЦИКЛОГЕПТА-[3,2-F]БЕНЗОФУРАН-1-ИЛ)АЦЕТАМИДА И ЕГО ПРИМЕНЕНИЕ | 2013 |
|
RU2538982C1 |
| ПРОИЗВОДНОЕ 1",2",3"-ТРИМЕТОКСИБЕНЗО[5",6":5',4']1H-(aR,1S)-1-АЦЕТАМИДО-6',7'-ДИГИДРОЦИКЛОГЕПТА[2',3'-f]-2,3-ДИГИДРОФУРАНА И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2678440C1 |
| ПРОИЗВОДНЫЕ N-ДЕАЦЕТИЛТИОКОЛХИЦИНА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2001 |
|
RU2257379C2 |
| GRACHEVA I.A | |||
| et al., Colchicine Alkaloids, and Synthetic Analogues: Current Progress and Perspectives, J | |||
| Med | |||
| Chem., 2020, vol.63, no.19, p.10618-10651 | |||
| WO 2011022805 A1, 03.03.2011. | |||
Авторы
Даты
2023-12-12—Публикация
2022-11-23—Подача