Изобретение относится к области медицины, а именно к репродуктологии и методам ЭКО, и может быть использовано для лечения пациенток с бесплодием, вызванным фиброзно-склеротической или гипопластической трансформацией эндометрия при повторных неудачах имплантации в циклах ВРТ в анамнезе.
В настоящее время репродуктологи всего мира уделяют большое внимание проблеме «тонкого эндометрия», ассоциированого с гипопластичным эндометрием. Распространенность синдрома «тонкого эндометрия» в протоколах ВРТ составляет не менее 2,4% (1). Под тонким эндометрием понимается эхографически определяемая толщина эндометрия менее 7 мм. Снижение толщины эндометрия менее 7 мм уменьшает частоту имплантации в 2 раза (2). Независимо от природы повреждающего фактора реакция эндометрия имеет универсальный характер, альтерация структурных компонентов эндометрия сопровождается фиброзом стромы, дефицитом специализированных клеток и развитием функциональной недостаточности эндометрия. Существующие в настоящее время терапевтические подходы, включая комплексные хирургические и консервативные, комбинированные гормональные методы, часто не обеспечивают полноценного восстановления функциональной активности эндометрия. Для таких пациенток единственной возможностью преодоления бесплодия является программа суррогатного материнства, которая хоть и позволяет решить возникшую проблему у части больных, но вряд ли может рассматриваться в качестве полноценного лечебного подхода при наличии маточного фактора бесплодия, поскольку не восстанавливает утраченную функцию поврежденного органа.
Мезенхимные стромальные (стволовые) клетки (МСК) - один из наиболее перспективных объектов в регенеративной медицине и клеточной терапии заболеваний человека. Установлено, что трансплантация МСК стимулирует регенерацию тканей, включая костную ткань, кожу, миокард, периферичекую нервную систему, скелетную мускулатуру, ткани печени, а также служат источником факторов роста и цитокинов (3).
Исследования трансплантации стволовых клеток из костного мозга и жировой ткани на экспериментальных моделях повреждения эндометрия показали, что введенные клетки мигрировали к поврежденной матке в сравнении с отсутствием эффекта у группы плацебо, вне зависимости от пути введения клеточного продукта (внутриматочно или в хвостовую вену) [4, 5]. Концепция эффективности внутривенного введения стволовых клеток основана на эффекте хоуминга на примере модели введения клеток-предшественниц кардиомиоцитов для улучшения кровоснабжения и сократимости миокарда у больных с ишемической болезнью сердца. Эффект хоуминга основан на усилении миграции МСК и дифференцированных в направлении кардиомиоцитов клеток-предшественниц вместо поврежденного миокарда. Внутривенный (системный) способ введения является наиболее простым и наименее инвазивным методом, не требующим хирургических и/или эндоскопических вмешательств.
Положительные предварительные результаты проводимых в различных странах клинических и экспериментальных исследований обосновывают актуальность, перспективность и достаточную безопасность метода трансплантации аутологичных МСК при лечении пациенток с синдромом тонкого эндометрия при повторных неудачах имплантации в программах вспомогательных репродуктивных технологий (ВРТ).
Известен способ трансплантации клеточного продукта на основе МСК костномозгового (КМ) происхождения путем введения в маточные артерии с использованием доступа, аналогичного применяемому при эмболизации маточных артерий. Применение такого подхода апробировано у 16 пациенток с синдромом Ашермана. У 15 из них в результате проведенного лечения произошло восстановление менстраульного цикла. У 7 пациенток наступила беременность. У троих спонтанно, у четверых после проведения криопротоколов.
К недостаткам описываемого способа следует отнести необходимость применения ангиографического оборудования, сложный доступ с пунктированием маточных артерий, что препятствует широкой воспроизводимости данного способа и является дорогостоящей методикой (6).
Известен способ введения стволовых клеток, описанный Tan и соавт (7). Он основан на выделении стволовых клеток из менструальной крови, их культивировании с последующим переносом клеточного продукта в полость матки. Способ был апробирован у 7 пациенток с синдромом Ашермана. После выделения стволовых клеток и культивирования суспензия с полученным клеточным продуктом вводилась в полость матки пациенток после скретчинга, далее проводился мониторинг толщины эндометрия. По результатам из 7 пациенток у 1-й наступила спонтанная беременность, у двоих после переноса криоконсервированных эмбрионов. Сообщается, что в одном случае была биохимическая беременность, во втором трубная беременность, спонтанная беременность на момент публикации статьи развивалась.
К недостаткам описанного способа относятся его невысокая эффективность, апробация на малом числе пациенток.
Техническим результатом изобретения является повышение эффективности способа: положительная динамика роста эндометрия и его структуры, повышение результатов наступления клинической беременности пациенток.
Указанный технический результат достигается в способе лечения пациенток с бесплодием, вызванным фиброзно-склеротической или гипопластической трансформацией эндометрия при повторных неудачах имплантации в циклах ВРТ в анамнезе путем трансплантации в полость матки клеточного продукта на основе аутологичных мезенхимальных стволовых клеток (МСК) на фоне гормональной терапии, отличающийся тем, что трансплантацию клеточного продукта на основе МСК костного мозга (МСК КМ), полученных при биопсии гребня подвздошной кости, осуществляют комплексно на 5-6 день менструального цикла, при этом внутривенно в течение 30-40 мин. вводят клеточный продукт объемом 100 мл, содержащий МСК КМ, иммобилизованные в транспортном растворе на основе желатина из расчета 1 млн клеток на кг массы тела пациентки в 100 мл раствора, после чего проводят внутриматочное введение клеточного продукта под контролем УЗИ путем орошения, объемом 1 мл, содержащей 10 млн МСК КМ в аналогичном растворе.
Исследование, на котором основано изобретение, включало три этапа и было выполнено в соответствии с принципами Хельсинской декларации Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека», действующими Порядками и Стандартами оказания медицинской помощи и другими применимыми регуляторными требованиями к проведению клинических исследований и наблюдательных программ в Российской Федерации. Протокол наблюдения за пациентами и программа обследования были одобрены локальным этическим комитетом.
На подготовительном этапе проводилась подготовка клеточного продукта. Получение образца костного мозга осуществлялось врачом-трансфузиологом по общепринятой методике при биопсии гребня подвздошной кости под местной анестезией.
Критериями включения в исследование на подготовительном этапе являлись:
- Возраст от 20 до 45 лет включительно в момент включения в исследование;
- Пациентки с повторными безрезультатными попытками ЭКО и криопротоколами при наличии эмбрионов высокого качества;
- Толщина эндометрия по данным УЗИ на фоне применения заместительной гормональной терапии в протоколе подготовки к переносу эмбрионов не более 6 мм не менее чем в двух попытках;
- Наличие фиброзно-склеротического процесса в полости матки по данным гистероскопического исследования и отсутствия положительной динамики в результате проводимой заместительной терапии в течение 3 месяцев после оперативного лечения;
- Отсутствие бесплодия или нарушения фертильности любого другого генеза.
Критериями исключения являлись:
- Наличие бесплодия или нарушения фертильности другой этиологии, включая трубно-перитонеальное бесплодие, ановуляторное бесплодие, мужское бесплодие, в том числе при субфертильных результатах спермограммы;
- Противопоказания к вынашиванию беременности;
- Отсутствие криоконсервированных эмбрионов высокого качества на хранении в криобанке ОВРТ;
- Сахарный диабет и другие нарушения углеводного обмена;
- Некомпенсированное нарушение функции щитовидной железы и других желез внутренней секреции (гипофиз, надпочечники, паращитовидные железы, яичники) в том числе требующее назначения заместительной гормональной терапии;
- Психиатрические заболевания, алкоголизм, наркомания;
- Злокачественные новообразования, включая интраэпителиальной дисплазии любой локализации, и/или лимфопролиферативные заболевания в анамнезе или выявленные в период проведения исследования;
- Индекс массы тела по Броку более 29,9 кг/м2, менее 19,0 кг/м2;
- ВИЧ-позитивные пациентки или пациенты с высоким риском инфицирования, профилактически получающие антиретровирусную терапию, вирусный гепатит В, С, в том числе в анамнезе;
- Анамнестические данные о тромбоэмболических нарушениях и/или наличие доказанной наследственной тромбофилии;
- Наличие миоматозных узлов в размере более 4 см или 2-х и более миоматозных узлов в диаметре более 2,5 см;
- Наличие узловой формы аденомиоза;
- Наличие кист яичников в диаметре более 4 см;
- Нежелание пациентки участвовать в исследовании и/или низкая комплаентность.
Обследование пациентки включало рутинное серологическое и ПНР тестирование на предмет наличия возбудителей инфекционных заболеваний: HCV, HBV, HIV 1/2, сифилиса, CMV, вируса Эпштейн-Барра, токсоплазмоза. Образец КМ был помещен в стерильную транспортную упаковку и маркирован. Затем проводились посев, экспансия, криоконсервирование, реинициация культуры. Данные шаги проводились согласно стандартным операционным процедурам ООО «Транс-Технологии» (Санкт-Петербург).
Экспансия МСК КМ (культивирование). Клетки инкубировали при 37°С в атмосфере 5% СO2 в инкубаторе. Среду для культивирования меняли на 100% каждые 4 дня. Производили ежедневный визуальный контроль роста клеток. По достижению 80% конфлюэнтности выполняли пересев клеток (плотность пересева 10 000 кл/см2).
Криоконсервирование. После первого пассажа МСК ресуспензировали в среде для культивирования в концентрации 2×10(6)/мл. Клеточную суспензию расфасовывали по криовиалам в количестве 10 млн клеток/виала (2 мл). Суспензию смешивали с предварительно охлажденной криозащитной смесью, состоящей из среды для культивирования (80% по объему) и диметилсульфоксида (20% по объему). Охлаждали в программном замораживателе при скорости снижения температуры 1°С/мин до -80°С. После этого криовиалы помещали в морозильную камеру на -80°С. При необходимости длительного хранения, помещали в жидкий азот.
Реинициация культуры МСК КМ. Криовиалы размораживали в предварительно подогретой до 37°С воде. Клетки ресуспензировали в среде для культивирования и помещали в СO2- инкубатор. Производили ежедневный визуальный контроль за ростом клеток. По достижении 80% конфлюэнтности производили сбор клеток.
Подготовка конечного продукта МСК. Полученные клетки 3-кратно отмывали физиологическим раствором путем центрифугирования и удаления супернатанта. Производили забор проб для контроля качества. МСК в концентрации 10 млн/мл асептически расфасовывали в виалы емкостью 1,8 мл. Транспортировали в перевозных контейнерах в клинику для последующего введения пациенту.
Перед дальнейшим использованием конечный продукт оценивался в соответствии со следующими критериями: 1. Технические характеристики Экспрессия поверхностных маркеров (клетки 2 пассажа):
- CD90+>90%;
- CD44+>90%;
- CD105+>90%;
- CD73+>90%.
Присутствие контаминирующих гемопоэтических клеток (клетки 2 пассажа):
- CD45+<1%;
- CD34+<0,5%;
Оценка микробной контаминации:
- Рост бактериальных колоний отсутствует при посеве на стандартные среды;
- ДНК микоплазмы: не выявляется Количество клеток: 10 млн;
- Жизнеспособность клеток (по 7ADD):<10% нежизнеспособных клеток;
2. Характеристика примесей:
В конечном продукте МСК КМ не могло быть исключено наличие следов среды для культивирования и других, используемых в производстве реагентов. Минимальный фактор разведения вспомогательных реагентов составил 8×106.
3. Стабильность, условия хранения и транспортировки:
Конечный продукт (МСК КМ в растворе хранения) стабилен до 6-ти часов от момента выпуска и должен сохраняться в темном месте при температуре 18°- 22°.
На следующем этапе проводилась процедура трансплантации пациентам МСК КМ. Одновременно пациентки получали стандартную терапию препаратами эстрогенов и гестагенов, модулирующими гормональные изменения, происходящие в естественном менструальном цикле (эстраднола валерат 4 мг/сутки со 2-го по 25 день цикла, дидрогестерон 20 мг/сутки с 15 по 25 день цикла). Лечение продолжалось в течении 3-х циклов. На 3-м цикле гормональной терапии на 20-й день проводилась пайпель-биопсия эндометрия с последующим гистологическим и иммуногистохимическим исследованием на определение уровней экспрессии рецепторов к эстрогенам и прогестерону. На 9-10 и 19-21 день каждого цикла проводилось УЗИ органов малого таза с определением состояния эндометрия. При получении морфологических и эхографических показателей эндометрия, приемлемых для проведения подготовки эндометрия в протоколе переноса размороженных эмбрионов, пациентка включалась в протокол подготовки эндометрия для переноса эмбриона в полость матки. При отсутствии показателей, удовлетворяющих критериям приемлемости для проведения переноса размороженных эмбрионов, пациентке была предложена повторная процедура применения клеточного продукта (не более 3-х раз) - с интервалом в 3 месяца.
Процедура трансплантации проводилась в чистой перевязочной клиники на 5-6 день менструального цикла. После обработки наружных половых органов зеркалах в асептических условиях в цервикальный канал пациентки до области внутреннего зева вводился проводник от катетера для переноса эмбрионов. Затем катетер с заблаговременно набранной суспензией, объемом 1 мл, содержащей 10 млн аутологичных МСК КМ в транспортном растворе на основе желатина, вводился по проводнику в полость матки под контролем УЗИ, после чего шприцом проводилось введение суспензии в полость матки.
В группу пациенток на промежуточном этапе исследования вошли 30 пациенток которым было проведено внутриматочное введение клеточного продукта на основе аутологичных МСК КМ.
На финальном этапе исследования пациентки получали внутриматочное и внутривенное введение клеточного продукта на основе аутологичных мезенхимальных клеток костного мозга. Клеточный продукт, содержащий МСК КМ, иммобилизованные в транспортном растворе на основе желатина водили внутривенно капельно в течение 30-40 мин. из расчета 1 млн клеток на кг массы тела пациентки в 100 мл раствора, внутриматочное введение клеточного продукта осуществлялось по описанной выше методике непосредственно после окончания внутривенного введения.
В группу пациенток на финальном этапе исследования были включены: 32 пациентки, которым было проведено внутриматочное и внутривенное введение клеточного продукта на основе аутологичных мезенхимальных клеток костного мозга. В эту группу перешли пациентки, у которых в результате внутриматочного введения не удалось достичь М-эхо больше 6 мм во вторую фазу менструального цикла.
Средний возраст женщин составил 37,3±0,5 года. У 28% пациенток был анамнез первичного бесплодия, у 50% в анамнезе имело место невынашивание беременности, у 31% пациенток беременность закончилась артифициальным абортом. Хронический сальпингоофорит был в анамнезе у 31%, хронический эндометрит - у 87,5% пациенток. В момент обращения в отделение ВРТ каждая пациентка имела в анамнезе несколько внутриматочных вмешательств, которые производились с диагностической или лечебной целью, так выскабливание полости матки было у 24 пациенток. Длительность бесплодия включенных в исследование пациенток на момент обращения в клинику в среднем составила 7,02±0,5 года. Каждая пациентка в момент включения в исследование уже имела опыт лечения бесплодия и чаще - с использованием нескольких методов.
Всем пациенткам перед началом протокола проводилось морфологическое исследование эндометрия. По данным гистологического исследования у всех женщин с повторными неудачами имплантации включенных в исследование были диагностированы гипопластические изменения эндометрия, у 81% женщин имелось сочетание гипопластических изменений и хронического эндометрита. У всех обследованных пациенток наблюдалось несоответствие морфологических характеристик эндометрия дню менструального цикла. Фибропластические изменения в строме эндометрия у женщин обследуемой группы проявлялись в виде как очагового, так и диффузного фиброза стромы (табл. 1).
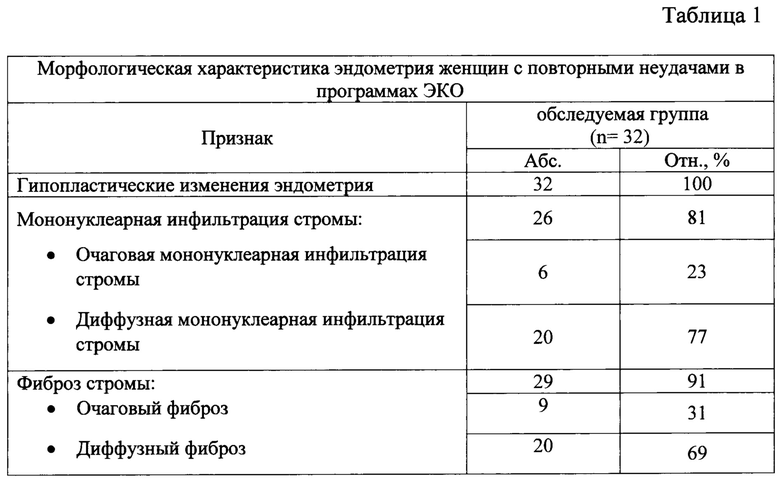
Дополнительно к гистологическому анализу эндометрия у всех пациенток иммуногистохимическим методом определялся субпопуляционный состав мононуклеаров эндометрия (табл. 2).
По совокупности данных гистологического и иммуногистохимического исследований хронический эндометрит был диагностирован у 68,8% женщин с повторными неудачами имплантации в протоколах ВРТ, включенных в исследование.
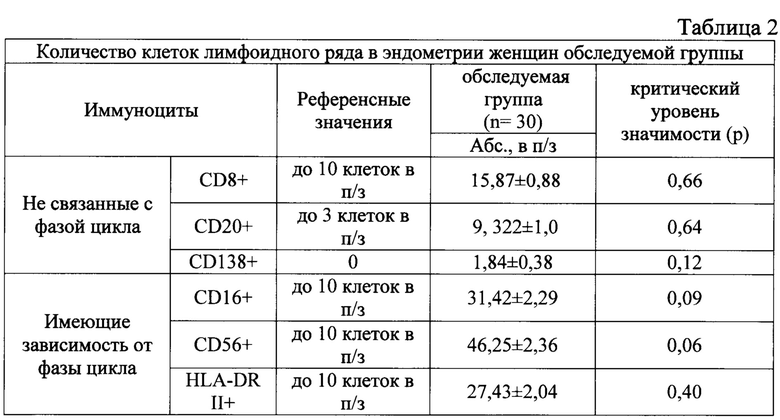
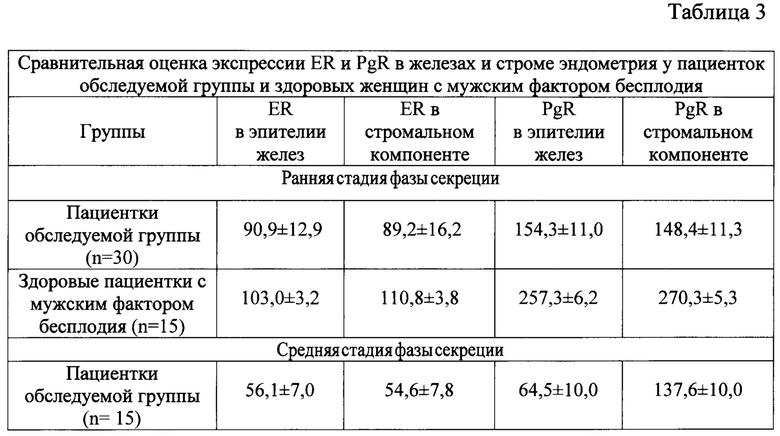
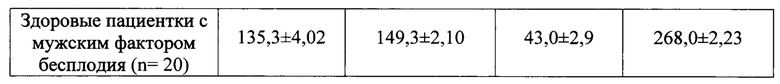
Кроме того, в рамках иммуногистохимического исследования проводился анализ рецепторного статуса с учетом соответствия исследуемых биоптатов эндометрия различным стадиям фазы секреции: ранней стадии (n=30 для женщин обследуемой группы и средней стадии фазы секреции Для проведения сравнительного анализа рецепторного статуса эндометрия данные иммуногистохимического исследования пациенток с повторными неудачами в программах ЭКО сопоставлялись с аналогичными показателями здоровых женщин с мужским фактором бесплодия (табл.3).
У преимущественного большинства пациенток основной группы в программах ЭКО было выявлено снижение экспрессии PgR в железах и строме в раннюю стадию секреции (р<0,001) и резкое (<100 баллов по HS) снижение PgR в стромальном компоненте в среднюю стадию фазы секреции (р<0,001)(табл. 4).
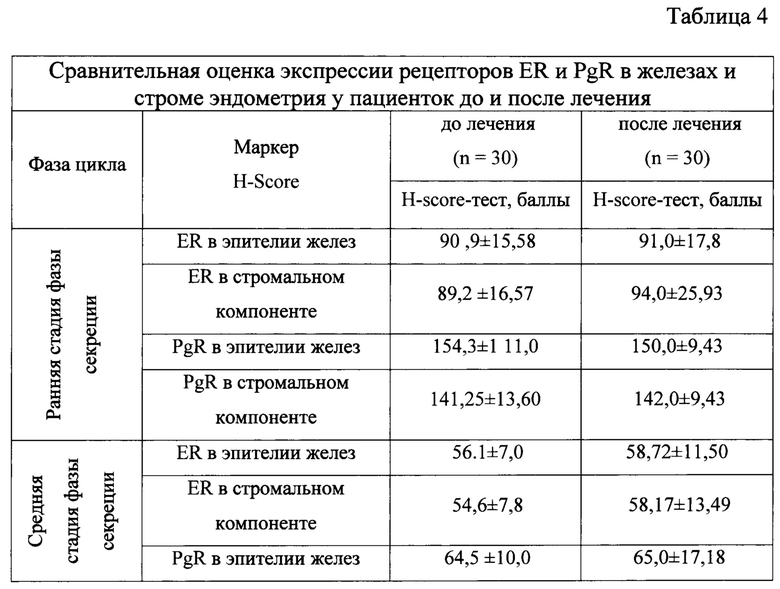
При сравнении экспрессии ER и PgR в железистом и стромальном компонентах эндометрия до и после лечения статистически достоверных различий выявлено не было. В процессе лечения не было зарегистрировано каких-либо нежелательных явлений, связанных с забором костного мозга, и внутриматочным введением клеточного продукта.
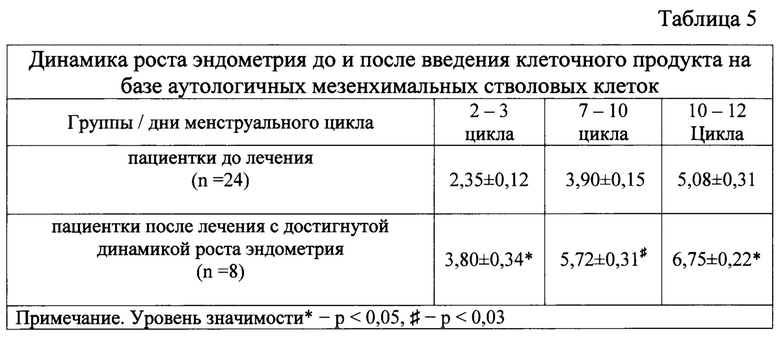
В процессе клинического исследования было установлено, что в результате лечения у 8 (25%) имело место не только увеличение толщины, но и изменение структуры эндометрия (табл. 5). Визуализация при УЗИ трехслойного эндометрия в соответствующую фазу менструального цикла у пациенток обследуемой группы дает основание полагать, что с помощью нового метода лечения возможно создать условия, необходимые для переноса размороженных эмбрионов.
У 11 пациенток в обследуемой группе наступила клиническая беременность (34%), среди которых: 2 внематочные беременности, 1 анэмбриония, 1 неразвивающаяся беременность, 3 прогрессирующие беременности, 4 живорождения в срок. При этом у 1 пациентки за родами в срок наступила следующая беременность, закончившаяся родами в срок. 4 беременности наступили после протоколов ВРТ, 7 беременностей самостоятельно в естественном цикле. Среднее время до наступления беременности - 9 месяцев.
Способ подтверждается следующими клиническими примерами.
Пример 1. Пациентка Д, 1981 г. р., обратилась в отделение ВРТ в 2019 году с жалобами на бесплодие маточного происхождения. Из анамнеза привычное невынашивание беременности, удаление обеих маточных труб при лапароскопии по поводу внематочных беременностей, повторные гистероскопии по удалению внутриматочных синехий. С 2017 по 2019 гг было проведено 3 безрезультатных программы ЭКО и 4 переноса криоконсервированных эмбрионов. В 2020 году проведена программа ЭКО с криоконсервацией эмбрионов и отказом от переноса эмбрионов из-за недостаточной толщины эндометрия - 4 мм. В ходе проведения подготовки эндометрия в дальнейшем отсутствовал эффект на стимуляцию препаратами эстрогенов. Толщина эндометрия не превышала 4 мм, независимо от длительности и дозы применяемых препаратов эстрогенов.
По описанному протоколу в июне 2020 года была проведена биопсия гребня подвздошной кости с подготовкой клеточного продукта. В июле 2020 года была проведена первая процедура введения клеточного продукта в полость матки. Через 3 месяца в течение которых проводилась гормональная терапия, в соответствии с представленным протоколом, была проведена биопсия эндометрия. По данным УЗИ толщина эндометрия за все время лечения не превышала 5 мм, по данным гистологического и ИГХ исследования улучшения морфологических показателей также не произошло. От переноса криоконсервированных эмбрионов было решено воздержаться.
В октябре 2020 года было проведено повторное введение клеточного продукта уже сочетанным методом: на 5 день менструального цикла внутривенно ввели клеточный продукт, содержащий МСК КМ иммобилизованных в транспортном растворе на основе желатина в течение 30-40 мин. из расчета 1 млн клеток на кг массы тела пациентки в 100 мл раствора, а затем - внутриматочное введение клеточного продукта под контролем УЗИ путем орошения, объемом 1 мл, содержащей 10 млн МСК КМ в аналогичном растворе.
Параллельно проводилось продолжение циклической гормональной терапии. По результатам УЗИ удалось достичь толщины эндометрия в 8 мм. Был проведен перенос криоконсервированного эмбриона, в результате чего наступила беременность, которая прогрессировала без осложнений и завершилась родами живым доношенным плодом 3450/52? С оценкой по Апгар 8 баллов.
Пример 2. Пациентка Р, 1991 г. р., обратилась с жалобами на вторичное бесплодие маточного происхождения. В анамнезе неразвивающаяся беременность раннего срока, выскабливание полости матки, после чего отмечает скудные менструации- проведено повторным выскабливанием полости матки и цервикального канала, в этом же году гистерорезектоскопия с рассечением синехий в полости матки. В 2019 году проведен протокол ЭКО с криоконсервацией всех эмбрионов, перенос эмбрионов не проводился из-за малой толщины эндометрия (5 мм). Далее проводилась попытка достичь приемлемых показателей толщины эндометрия путем проведения циклической гормональной терапии препаратами эстрогенов и гестагенов. Эффект от проводимой терапии отсутствовал.
В 2019 г была проведена биопсия гребня подвздошной кости-получены МСК, согласно представленному протоколу, после подготовки клеточного продукта было проведено его внутриматочное введение. Последующее применение циклической гормональной терапии в течение полугода не дало клинического эффекта, который был подтвержден и морфологическим исследованием биоптата эндометрия на 3-м месяце терапии.
В 2020 году было проведено повторное введение клеточного продукта уже сочетанное (внутривенное и внутриматочное): на 6 день менструального цикла внутривенно ввели клеточный продукт, содержащий МСК КМ иммобилизованных в транспортном растворе на основе желатина в течение 30-40 мин. из расчета 1 млн клеток на кг массы тела пациентки в 100 мл раствора, а затем - внутриматочное введение клеточного продукта под контролем УЗИ путем орошения, объемом 1 мл, содержащей 10 млн МСК КМ в аналогичном растворе, после которого была продолжена гормональная терапия. Через 6 месяцев терапии гормональная терапия была отменена и толщина эндометрия в спонтанном цикле достигла 7 мм. Пациентка готовилась к проведению криопротокола, однако через 1 месяц наступила спонтанная беременность, которая нормально протекала и завершилась родами здоровым плодом на сроке 39 недель 3300/51- 8 баллов по шкале Апгар
Таким образом, заявляемый способ лечения пациенток с повторными неудачами в программах ВРТ, обусловленными гипопластическими и/или фиброзно-склеротическими изменениями эндометрия, является безопасным и эффективным. Эффективность данной методики подтверждается положительной динамикой роста эндометрия у 25% и наступлением клинической беременности у 34% пациенток.
Заявляемый способ повышает эффективность лечения, способствует положительной динамике роста эндометрия и его структуры, повышает результаты наступления клинической беременности пациенток.
Источники информации:
1. Kasius A, Smit JG, Torrance HL, Eijkemans MJ, Mol BW, Opmeer ВС, et al. Endometrial thickness and pregnancy rates after IVF: A systematic review and meta-analysis. Hum Reprod Update. 2014;20:530-41.
2. Mahajan N, Sharma S. The endometrium in assisted reproductive technology: How thin is thin? J Hum Reprod Sci. 2016 Jan-Mar;9(1):3-8. doi: 10.4103/0974-1208.178632. PMID: 27110071; PMCID: PMC4817285.
3. Askari A.T., Unzek S., Popovic Z.B., Goldman C.K., Forudi F., Kie-drowski M., Rovner A., Ellis S.G., Thomas J.D., DiCorleto P.E., Topol E.J., Perm M.S. Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy // The Lancet. 2003 T. 362 No9385. - C. 697-703.
4. Alawadhi F, Du H, Cakmak H, Taylor HS. Bone Marrow-Derived Stem Cell (BMDSC) transplantation improves fertility in a murine model of Asherman's syndrome. PLoS One 2014;9:e96662.
5. Cervello'I, Gil-Sanchis C, Santamar'ia X. Human CD133(p) bone marrow-derived stem cells promote endometrial proliferation in a murine model of Asherman syndrome. Fertil Steril. 2015; 104(6): 1552-1560.e3
6. Santamaria X, Cabanillas S, Cervelló I, Arbona C, Raga F, Ferro J, Palmero J, Remohl J, Pellicer A, Simon C. Autologous cell therapy with CD133+ bone marrow-derived stem cells for refractory Asherman's syndrome and endometrial atrophy: a pilot cohort study. Hum Reprod. 2016 May;31(5): 1087-96. doi: 10.1093/humrep/dew042. Epub 2016 Mar 22. PMID: 27005892.
7. Tan J, Li P, Wang Q, Li Y, Li X, Zhao D, Xu X, Kong L. Autologous menstrual blood-derived stromal cells transplantation for severe Asherman's syndrome. Hum Reprod. 2016 Dec;31(12):2723-2729. doi: 10.1093/humrep/dew235. Epub 2016 Sep 22. PMID: 27664218.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения повторяющихся неудач имплантации эмбриона при вспомогательных репродуктивных технологиях | 2024 |
|
RU2838873C1 |
| Способ увеличения толщины эндометрия для повышения репродуктивных исходов у пациентов с "тонким" гипопластическим эндометрием | 2024 |
|
RU2835449C1 |
| СПОСОБ ПОВЫШЕНИЯ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ У ПАЦИЕНТОК С МАТОЧНОЙ ФОРМОЙ БЕСПЛОДИЯ, ОБУСЛОВЛЕННОЙ ЭНДОМЕТРИАЛЬНОЙ ДИСФУНКЦИЕЙ, ПРИ ПОДГОТОВКЕ К ПРОВЕДЕНИЮ ПРОЦЕДУРЫ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ (ЭКО) ПО КРИОПРОТОКОЛУ | 2021 |
|
RU2746643C1 |
| Способ восстановления фертильности у женщин с эндометриальным бесплодием в анамнезе на фоне "тонкого эндометрия" | 2023 |
|
RU2800236C1 |
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ РЕЦИДИВОВ ВНУТРИМАТОЧНЫХ СИНЕХИЙ | 2015 |
|
RU2582226C1 |
| Способ внутриматочной инфузии аутологичной плазмы женщины для повышения эффективности программ вспомогательных репродуктивных технологий | 2021 |
|
RU2762159C1 |
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ РЕЦИДИВОВ ВНУТРИМАТОЧНЫХ СИНЕХИЙ | 2013 |
|
RU2525533C1 |
| Способ реабилитации пациенток с "тонким" эндометрием после неудач ЭКО | 2022 |
|
RU2792572C1 |
| Способ лечения хронического эндометрита | 2017 |
|
RU2692999C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ У ЖЕНЩИН С МАТОЧНОЙ ФОРМОЙ БЕСПЛОДИЯ С ИСПОЛЬЗОВАНИЕМ КАВИТИРОВАННОГО РАСТВОРА ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА РОСТА | 2017 |
|
RU2667611C1 |
Изобретение относится к области медицины, а именно к репродуктологии и методам ЭКО, и может быть использовано для лечения пациенток с бесплодием, вызванным фиброзно-склеротической или гипопластической трансформацией эндометрия при повторных неудачах имплантации в циклах ВРТ в анамнезе. На фоне гормональной терапии на 5-6 день менструального цикла осуществляют комплексную трансплантацию клеточного продукта на основе аутологичных мезенхимальных стволовых клеток костного мозга (МСК КМ), полученных при биопсии гребня подвздошной кости. При этом внутривенно в течение 30-40 мин вводят клеточный продукт объемом 100 мл, содержащий МСК КМ, иммобилизованные в транспортном растворе на основе желатина из расчета 1 млн клеток на кг массы тела пациентки в 100 мл раствора. После чего проводят внутриматочное введение клеточного продукта под контролем УЗИ путем орошения, объемом 1 мл, содержащего 10 млн МСК КМ в аналогичном растворе. Способ обеспечивает повышение эффективности лечения, способствует положительной динамике роста эндометрия и его структуры, повышение результатов наступления клинической беременности пациенток. 2 пр., 5 табл.
Способ лечения пациенток с бесплодием, вызванным фиброзно-склеротической или гипопластической трансформацией эндометрия при повторных неудачах имплантации в циклах ВРТ в анамнезе путем трансплантации в полость матки клеточного продукта на основе аутологичных мезенхимальных стволовых клеток (МСК) на фоне гормональной терапии, отличающийся тем, что трансплантацию клеточного продукта на основе МСК костного мозга (МСК КМ), полученных при биопсии гребня подвздошной кости, осуществляют комплексно на 5-6 день менструального цикла, при этом внутривенно в течение 30-40 мин вводят клеточный продукт объемом 100 мл, содержащий МСК КМ, иммобилизованные в транспортном растворе на основе желатина из расчета 1 млн клеток на кг массы тела пациентки в 100 мл раствора, после чего проводят внутриматочное введение клеточного продукта под контролем УЗИ путем орошения, объемом 1 мл, содержащего 10 млн МСК КМ в аналогичном растворе.
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2652902C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ У ЖЕНЩИН С МАТОЧНОЙ ФОРМОЙ БЕСПЛОДИЯ С ИСПОЛЬЗОВАНИЕМ КАВИТИРОВАННОГО РАСТВОРА ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА РОСТА | 2017 |
|
RU2667611C1 |
| WO 2015193737 A1, 23.12.2015 | |||
| Насадюк К.М | |||
| КЛЕТОЧНЫЕ ТЕХНОЛОГИИ В РЕПРОДУКТОЛОГИИ, АКУШЕРСТВЕ И ГИНЕКОЛОГИИ | |||
| КЛIТИННА ТА ОРГАННА ТРАНСПЛАНТОЛОГIЯ, ТОМ 1, N 1, 2013, с | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Сизоненко М.Л., Брюхин Г.В., Шереметьева М.А | |||
| Проблема мужского бесплодия: возможные пути решения (обзор литературы) | |||
Авторы
Даты
2023-12-14—Публикация
2022-11-24—Подача