Изобретение относится к области биохимии и касается способа определения активности ферментов рестрикции (эндонуклеазы рестрикции) в клеточном экстракте, полученном из разнообразных микроорганизмов.
Эндонуклеазы рестрикции (рестриктазы), которые расщепляют обе нити ДНК сайт-специфическим образом, являются фундаментальным инструментом молекулярной биологии. Открытие эндонуклеаз началось в 1960-х годах и привело к их коммерческой доступности в начале 1970-х годов. Хотя в основном эндонуклеазы рестрикции обнаружены в бактериальных геномах и плазмидах, они также существуют у архей, вирусов и эукариот. По оценкам, каждая четвертая исследованная бактерия может содержать одну или несколько рестриктаз (Roberts, R. J. and Halford, S. E. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. 1993). Neisseria и Helicobacter pylori представляют собой наиболее богатые источники ферментов рестрикции. В отдельных штаммах этих микроорганизмов было обнаружено от 7 до 14 генов эндонуклеаз, хотя некоторые гены активно не экспрессируются (Stein, D.C., Gunn, J.S., Radlinska, М., Piekarowicz, A. Gene. 1995, Lin, L-F. Posfai, J., Roberts, R. J., and Kong, H. Nuc. Acids Res. 2001).
В настоящее время известно 3500 ферментов рестрикции (всех возможных типов), которые распознают 259 различных последовательностей ДНК. Подавляющее большинство из них, около 3460 ферментов, распознающих 234 последовательности ДНК, классифицируются как эндонуклеазы рестрикции типа II. Как правило, распространенные эндонуклеазы рестрикции типа II являются гомодимерами (в большинстве случаев с массой мономерной субъединицы между 25 и 35 кДа), нуждаются в двухвалентном металле (Mg2+) для катализа и расщепляют ДНК внутри палиндромов, частичных палиндромов или прерванных палиндромов. Несмотря на разную первичную последовательность, эндонуклеазы рестрикции типа II имеют схожую трехмерную структуру: U-образный димерный холофермент, в котором каждая из идентичных субъединиц располагается таким образом, что по бокам находятся домены, вносящие свой вклад в распознавание и катализ, а внизу мостиковые (соединительные) домены. Мономеры эндонуклеаз рестрикции типа II сами по себе не обладают активностью.
В настоящее время известно лишь 16 сайт-специфических ДНК-никаз, расщепляющих одну из цепей ДНК в специфическом сайте. Всего на сегодняшний день клонировано 297 ферментов рестрикции. Эндонуклеазы рестрикции все еще остаются областью активных исследований, включающих в себя такие аспекты, как механизм расщепления, функции in vivo, эволюционное происхождение и как объект модели сайт-специфического распознавания ДНК. Но даже несмотря на то, что количество охарактеризованных ферментов, которые являются основным продуктом молекулярной биологии, продолжает расти, количество поставщиков и разнообразие их продуктовых линеек увеличивается, до сих пор нет универсального подхода для скрининга рестриктазной активности в клеточных экстрактах различного происхождения.
В связи с этим, разработка способа скрининга для определения активности эндонуклеаз рестрикции в клеточных экстрактах является актуальной задачей и чрезвычайно важна для развития биотехнологических и генетических технологий.
Активность фермента характеризуют величиной каталитической константы kcat, равной числу оборотов фермента в единицу времени. За удельную активность (А) фермента принимают, как широко распространено в энзимологии, количество мкмоль продукта, образующегося в минуту, в расчете на 1 мг фермента (мкмоль × мин-1 × мг-1), (Биохимия, 2004, Т. 69, Вып. 1, С. 134-144).
Известен способ тестирования бактериальных штаммов на наличие активности эндонуклеаз рестрикции, заключающийся в том, что собранные клетки обрабатывают лизоцимом и тритоном Х-100 и после центрифугирования супернатант анализируют на наличие специфической эндонуклеазной активности с помощью электрофореза в агарозном геле. Способ позволяет за 3-4 часа провести анализ до 100 колоний (Белавин П.А., Дедков B.C., Дегтярев С.Х. Прикладная биохимия и микробиология. 1988).
Несколькими годами позже этот способ был немного дополнен. Клетки бактериальных штаммов, обработанные лизоцимом и тритоном Х-100, инкубировали в течении 3 часов с ДНК фага λ или плазмидой. Результат анализировали с помощью электрофореза в агарозном геле (Дедков B.C., Дегтярев С.Х. Прикладная биохимия и микробиология. 1992).
Основными недостатками известных способов являются многостадийность и многокомпонентность используемых подходов.
Наиболее ближайшим к заявленному способу - прототипом, является способ определения активности рестриктазы PspXI в клетках культуры, заключающийся в следующем. Реакцию запускают путем смешивания раствора субстрата и клеточного лизата и инкубируют смесь при 37°С в течении часа. Продукты реакции разделяют в агарозном геле и, после окрашивания бромистым этидием, гель визуализируют в УФ-свете. В качестве субстрата используют ДНК фага λ, гидролизованную эндонуклеазой рестрикции HindIII или плазмиды pBluescriptSK(+) (pBS). Взаимодействие эндонуклеазы рестрикции с ДНК-субстратом приводит к расщеплению 2'-дезоксирибозофосфатного остова по специфическому сайту. В результате чего в геле видны продукты реакции, образующиеся при действии эндонуклеазы рестрикции HindIII и дополнительные продукты реакции, характерные для новой эндонуклеазы рестрикции (Гончар Д.А., Абдурашитов М.А., Беличенко О.А., Дедков B.C., Мезенцева Н.В., Томилова Ю.Э., Дегтярев С.Х. Вестник биотехнологии. 2005).
Недостатками прототипа являются трудоемкость способа, связанная с разделением продуктов реакции в геле, а также низкая чувствительность способа, вследствие того, что достоверная визуализация продуктов реакции после окрашивания бромистым этидием достигается при концентрации продукта не менее 50 нг.
Задачей изобретения является упрощение способа и повышение производительности определения активности эндонуклеаз рестрикции в клеточном экстракте за счет использования флуоресцентных ДНК-зондов.
Технический результат: упрощение способа и повышение производительности определения активности эндонуклеаз рестрикции в клеточных экстрактах микроорганизмов.
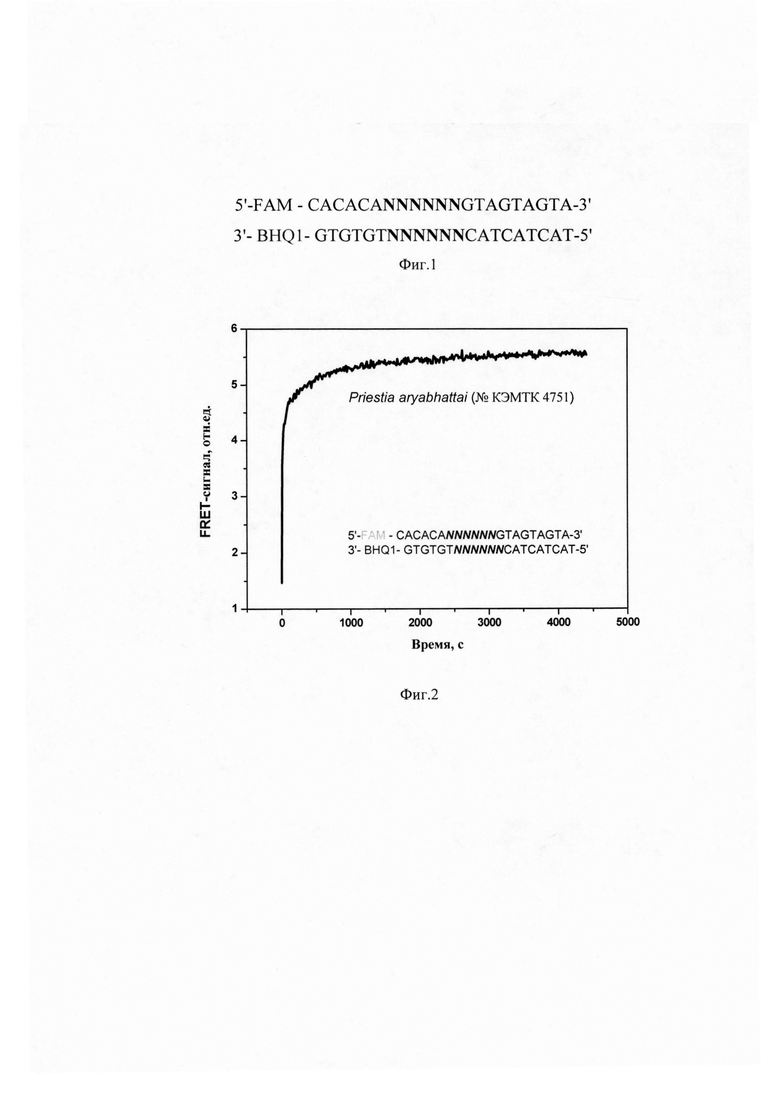
Поставленная задача достигается предлагаемым способом, заключающимся в регистрации во времени изменения интенсивности флуоресценции субстрата в реакционной смеси при взаимодействии с клеточным экстрактом, полученным из микроорганизмов различного происхождения. Для анализа активности ферментов рестрикции используют ДНК-зонд, представляющий собой дуплекс:
5'-FAM - CACACANNNNNNGTAGTAGTA-3'
3'-BHQ1 - GTGTGTNNNNNNCATCATCAT-5'
где FAM - остаток флуоресцеина, BHQ1 - остаток тушителя black hole quencher 1, NNNNNN - 6-звенный фрагмент вырожденной последовательности (фиг.1).
На первом этапе готовят клеточный экстракт.В стерильных условиях колонию переносят в 1.5 мл пробирку, содержащую 200 мкл лизис-буфера (20 мМ HEPES-KOH рН 7.5, 40 мМ NaCl). Для количественного лизиса клеток полученную суспензию обрабатывают ультразвуком (10 импульсов по 30 с, 22 ГГц). После каждого импульса суспензию клеток охлаждают в ванне со льдом в течение 90 с. Полученный клеточный экстракт центрифугируют 20 мин при 14500 об/мин, 4°С.
Общую концентрацию белка в экстракте определяют исходя из оптической плотности растворов на длине волны 280 нм в электронных спектрах поглощения. В каждом отдельном эксперименте общее количество белка в растворе клеточного экстракта было равно 20 мкг. Клеточный экстракт готовят каждый раз непосредственно перед работой.
Реакцию запускают путем смешивания раствора субстрата в рабочем буфере и клеточного экстракта в соотношении 1:1. Возбуждение флуоресценции проводят на длине волны 494 нм, регистрацию проводят в спектральном диапазоне 500-550 нм. Изменение интенсивности флуоресценции субстрата регистрируют в интервале времени 15-3600 с. Каждую кинетическую кривую усредняют минимум по трем экспериментальным кривым.
Кинетические кривые обрабатывают, используя уравнение (1) с помощью программы OriginPro 8.1 (OriginLab Corp., США). Полученное в результате обработки значение константы скорости каталитической реакции kobs, характеризует активность фермента.

где F0 - амплитуда, kobs - константа скорости каталитической реакции.
В качестве субстрата используют ДНК-зонд, представляющий собой комплементарный олигонуклеотид, содержащий 6-звенный участок вырожденной последовательности. На 5'- и 3'-концах этого олигодезоксирибонуклеотида находятся флуоресцентные красители, которые подобранны таким образом, что спектр испускания флуоресценции одного красителя (флуоресцеин, FAM) перекрывается со спектром поглощения второго красителя (тушитель флуоресценции, BHQ1). Образование дуплекса приводит к пространственному сближению флуорофора FAM и тушителя флуоресценции BHQ1, в результате чего происходит эффективное тушение интенсивности флуоресценции (резонансный перенос энергии флуоресценции, FRET).
Взаимодействие субстрата и фермента приводит к расщеплению 2'-дезоксирибозофосфатного остова ДНК по специфическому сайту (определенная последовательность для каждой эндонуклеазы рестрикции). В результате чего в продукте реакции цепи олигонуклеотидов расходятся, что приводит к пространственному разделению флуорофора и тушителя. Интенсивность флуоресценции увеличивается по мере накопления продукта реакции.
Отличиями заявленного способа от прототипа являются:
- использование в качестве ДНК-зонда дуплекса олигонуклеотидов, несущего 6-звенный участок вырожденной последовательности, что позволяет в одной пробе реализовать сразу 4096 варианта сайтов узнавания эндонуклеаз рестрикции;
- регистрацию интенсивности флуоресценции субстрата проводят в планшетном флуориметре (а не разделение продуктов реакции в агарозном геле), что позволяет значительно сократить объем биологического материала для проведения анализа и увеличить производительность способа за счет сокращения времени проведения анализа в 3-4 раза.
- кинетические кривые обрабатывают с помощью программы OriginPro8.1 (OriginLab Corp., США), которая позволяет минимизировать время обработки кинетических кривых и достоверно рассчитать V0 - начальную скорость накопления продукта.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1
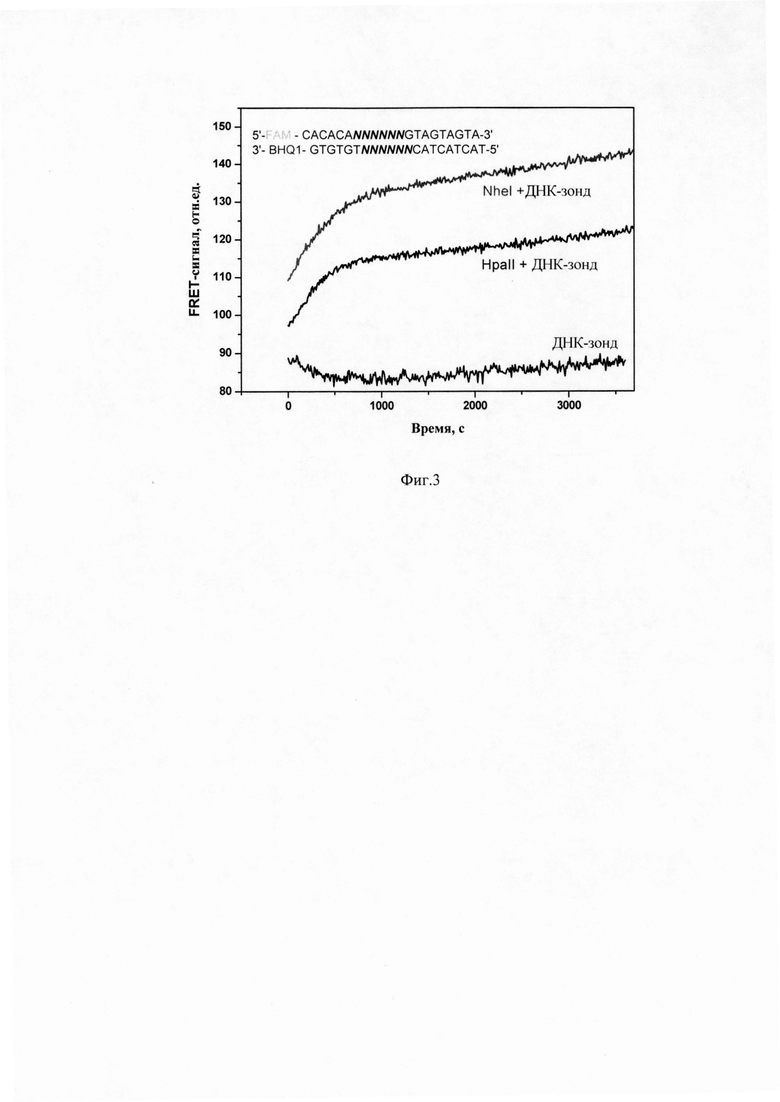
Определение активности эндонуклеаз рестрикции в клеточном экстракте, полученном из клеток микроорганизма Priestia aryabhattai.
Для определения активности эндонуклеаз рестрикции готовят буфер следующего состава: 50 мМ Tris-HCl рН 7.5, 50 мМ KCl, 1 мМ ЭДТА, 5 мМ MgCl2, 1 мМ ДТТ, 7% глицерин. Приготавливают в буфере 20 мкМ раствор субстрата, представляющий собой дуплекс олигонуклеотидов, несущий 6-звенный участок вырожденной последовательности (фиг.1).
Лизис клеток Priestia aryabhattai проводят в буфере состава 10 мМ Tris-HCl, рН 7.5, 1 мМ MgCl2, 1 мМ EDTA, 0,5% CHAPS, 10% глицерин, 0,1 мМ PMSF, 0,5 мМ β-меркаптоэтанол. К клеточному осадку добавляют 150 мкл лизис-буфера, выдерживают на льду в течение 30 минут, затем центрифугируют (14500 об/мин, 10 мин). Общую концентрацию белка в полученном супернатанте определяют по методу Бредфорда (для анализа в каждую пробу берут по 20 мкг общего белка).
Запускают реакцию путем смешивания растворов субстрата и экстракта в соотношении 1:1 и регистрируют изменение интенсивности флуоресценции субстрата в интервале времени 15-3600 с при температуре 37°С. Возбуждение флуоресценции проводят на длине волны 485 нм, регистрацию флуоресценции проводят на длине волны 520 нм.
На фиг.2 представлены результаты регистрации FRET-сигнала для клеточного экстракта из Priestia aryabhattai.
Кинетическую кривую анализируют с помощью программы OriginPro8.1 (OriginLab Corp., США), которая позволяет рассчитать параметры ур. 1. В результате обработки получают значение kobs = 0,0003±0,00002 с-1, характеризующую активность эндонуклеаз рестрикции в клеточном экстракте.
Пример 2
Определение активности рекомбинантных препаратов эндонуклеаз рестрикции на примере коммерчески доступных эндонуклеаз рестрикции NheI и HpaII с использованием заявленного способа.
Для определения активности рекомбинантных препаратов эндонуклеаз рестрикции NheI и HpaII готовят буфер следующего состава: 50 мМ Tris-HCl рН 7.5, 50 мМ KCl, 1 мМ ЭДТА, 5 мМ MgCl2, 1 мМ ДТТ, 7% глицерин. Приготавливают в буфере 20 мкМ раствор субстрата, представляющий собой дуплекс олигонуклеотидов, несущий 6-звенный участок вырожденной последовательности (фиг.1).
Используют концентрацию рекомбинантного фермента равную 20 мкМ. Запускают реакцию путем смешивания растворов субстрата и экстракта в соотношении 1:1 и регистрируют изменение интенсивности флуоресценции субстрата в интервале времени 15-3600 с при температуре 37°С. Возбуждение флуоресценции проводят на длине волны 485 нм, регистрацию флуоресценции проводят на длине волны 520 нм.
На фиг.3 представлены результаты регистрации FRET-сигнала, полученного при взаимодействии эндонуклеаз рестрикции NheI и HpaII с ДНК-зондом, содержащим вырожденную 6-звенную последовательность.
Кинетические кривые анализируют с помощью программы OriginPro8.1 (OriginLab Corp., США), которая позволяет рассчитать параметры ур. 1. В результате обработки получают значения kobs = 0,0009±0,0002 с-1 и kobs = 0,0012±0,0004 с-1 для NheI и HpaII, соответственно, которые характеризуют активность рекомбинантных эндонуклеаз рестрикции.
Использование способа позволяет упростить определение активности ферментов рестрикции в клеточном экстракте, и, наряду с этим, ускорить проведение анализа, что необходимо для повышения производительности поиска новых ферментов рестрикции.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения активности ферментов эксцизионной репарации оснований ДНК в клетках человека | 2022 |
|
RU2789867C1 |
| МОЛЕКУЛА СУБСТРАТА | 2016 |
|
RU2755495C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ АПУРИН/АПИРИМИДИН-ЭНДОНУКЛЕАЗЫ ЧЕЛОВЕКА | 2009 |
|
RU2389026C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ Pu(5mC)GPy В ЗАДАННОМ ПОЛОЖЕНИИ ПРОТЯЖЕННОЙ ДНК | 2013 |
|
RU2525710C1 |
| СПОСОБ ОДНОВРЕМЕННОГО ДНК-ТЕСТИРОВАНИЯ НА НАЛИЧИЕ ПОЛИМОРФИЗМОВ Н63D И C282Y В ГЕНЕ HFE, СВЯЗАННЫХ С НАСЛЕДСТВЕННЫМ ГЕМОХРОМАТОЗОМ | 2006 |
|
RU2304170C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pVar15-HIV-LTR, НЕСУЩАЯ КЛОНИРОВАННЫЙ ФРАГМЕНТ ГЕНОМА ВИЧ-1 ТИПА ИЗ КОНСЕРВАТИВНОГО УЧАСТКА 5'-LTR ПОСЛЕДОВАТЕЛЬНОСТИ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBluKSM-HIV-LTR mod, НЕСУЩАЯ КЛОНИРОВАННЫЙ МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ЭТОГО ЖЕ УЧАСТКА ГЕНОМА ВИЧ-1 ТИПА, ТЕСТ-НАБОР ДЛЯ КОЛИЧЕСТВЕННОЙ ЭКСПРЕСС-ИДЕНТИФИКАЦИИ ГЕНОМА ВИЧ-1 ЛЮБОГО ТИПА В ПРОБЕ И СПОСОБ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2006 |
|
RU2350650C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPHOFus, КОДИРУЮЩАЯ СУБСТРАТ ЛЕТАЛЬНОГО ФАКТОРА СИБИРСКОЙ ЯЗВЫ, СЛИТЫЙ СО ЩЕЛОЧНОЙ ФОСФАТАЗОЙ Escherichia coli, И ШТАММ Escherichia coli BL-PHOFus, ПРОДУЦИРУЮЩИЙ БЕЛОК - СУБСТРАТ ЛЕТАЛЬНОГО ФАКТОРА СИБИРСКОЙ ЯЗВЫ В СОСТАВЕ ЩЕЛОЧНОЙ ФОСФАТАЗЫ Escherichia coli | 2009 |
|
RU2416637C1 |
| ШТАММ БАКТЕРИЙ Arthrobacter luteus B-ПРОДУЦЕНТ САЙТ-СПЕЦИФИЧЕСКОЙ ЭНДОНУКЛЕАЗЫ Alu BI | 2007 |
|
RU2340670C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МЕТИЛИРОВАНИЯ САЙТОВ PuCGPy РЕГУЛЯТОРНЫХ ОБЛАСТЕЙ ГЕНОВ-ОНКОМАРКЕРОВ КОЛОРЕКТАЛЬНОГО РАКА МЕТОДОМ GLAD-ПЦР-АНАЛИЗА И ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И ФЛУОРЕСЦЕНТНО-МЕЧЕНЫЕ ЗОНДЫ ДЛЯ ОСУЩЕСТВЛЕНИЯ УКАЗАННОГО СПОСОБА | 2015 |
|
RU2596404C1 |
| Способ определения метилирования сайтов PuCGPy регуляторных областей генов-онкомаркеров колоректального рака методом GLAD-ПЦР-анализа и набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для осуществления указанного способа | 2016 |
|
RU2630669C1 |
Изобретение относится к области биохимии. Запускают реакцию путем смешивания растворов ДНК-зонда и клеточного экстракта в соотношении 1:1 и регистрируют изменение интенсивности флуоресценции FRET-пары в интервале времени 15-3600 сек. Для этого, в 96-луночном планшете для флуориметра смешивают растворы субстрата (20 мкМ), буфера (50 мМ Tris-HCl рН 7.5, 50 мМ KCl, 1 мМ ЭДТА, 5 мМ MgCl2, 1 мМ ДТТ, 7% глицерин) и образца клеточного экстракта микроорганизма (20 мкг общего белка). В качестве ДНК-зонда используют комплементарный олигодезоксирибонуклеотид, несущий FRET-пару FAM/BHQ1 на концах цепи, а также содержащий в своем составе 6-звенную вырожденную последовательность. Технический результат: упрощение способа и повышение производительности определения активности эндонуклеаз рестрикции в клеточных экстрактах микроорганизмов. 3 з.п. ф-лы, 3 ил., 2 пр.
1. Способ определения активности эндонуклеаз рестрикции в клеточных экстрактах микроорганизмов, включающий смешивание субстрата в рабочем буфере и клеточного экстракта в соотношении 1:1 и регистрацию изменения интенсивности флуоресценции субстрата с помощью флуориметра с последующей обработкой полученных кинетических кривых с помощью программы, отличающийся тем, что в качестве субстрата используют ДНК-зонд, представляющий собой дуплекс:
5’-FAM-CACACANNNNNNGTAGTAGTA-3’
3’-BHQ1-GTGTGTNNNNNNCATCATCAT-5’
Где FAM – остаток флуоресцеина, BHQ1- остаток тушителя black hole quencher 1, NNNNNN – 6-звенный фрагмент вырожденной последовательности.
2. Способ по п. 1, отличающийся тем, что буфер содержит 50 мМ Tris-HCl рН 7.5, 50 мМ KCl, 1 мМ ЭДТА, 5 мМ MgCl2, 1 мМ ДТТ, 7% глицерин.
3. Способ по п. 1, отличающийся тем, что регистрацию интенсивности флуоресценции субстрата проводят в планшетном флуориметре.
4. Способ по п. 1, отличающийся тем, что кинетические кривые обрабатывают с помощью программы OriginPro8.1.
| Д.А | |||
| Гончар, М.А | |||
| Абдурашитов и др., Новая эндонуклеаза рестрикции PspXI узнает необычную последовательность днк 5’-VC^TCGAGB-3’, Вестник биотехнологии, 2005, 1, N 1, с | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| SU 980433 A1, 27.07.2000 | |||
| Способ тестирования рестриктаз S @ и S @ из микроорганизмов рода SтRертомYсеS | 1988 |
|
SU1634714A1 |
Авторы
Даты
2023-12-28—Публикация
2023-04-28—Подача