Изобретение относится к области медицины, а именно к области биотехнологии, генетической инженерии и медицины, в частности, к способу получения рекомбинантного глиального фибрилярного кислого белка (GFAP) человека для применения в диагностических целях.
Глиальный фибриллярный кислый белок (GFAP - от англ. Glial Fibrillary Acid Protein) является важным диагностическим биомаркером черепно-мозговых травм [1-3] и основным цитоскелетным белком нейроглиальных клеток центральной нервной системы (ЦНС), который выполняет множество функций. GFAP участвует в поддержании формы астроглии, в пролиферации клеток, синаптогенезе, играет важную роль в межклеточной коммуникации (нейрон-астроглия), вовлечен в процессы восстановления ЦНС после травм (формирование глиальных рубцов) и поддержания гематоэнцефалического барьера [4].
В норме GFAP является внутриклеточным белком, а его появление во внеклеточном пространстве свидетельствует о повреждении глиальных клеток, что может быть вызвано повреждением ЦНС. Примечательно, что GFAP обладает высокой специфичностью в отношении повреждения именно клеток астроглии, что позволяет использовать его в качестве специфического биохимического маркера повреждений головного мозга (детектируемого в плазме крови), возникающих при черепно-мозговых травмах (ЧМТ) [5]. При этом, GFAP может быть обнаружен в образцах крови вскоре после ЧМТ [6]. Известно, что в случае легкой и умеренной ЧМТ уровни GFAP демонстрируют заметное повышение через восемь часов после травмы [7,8]. Кроме того, оценка концентрации GFAP в крови больного позволяет оценить тяжесть ЧМТ и ее исход [9,10]. Показано, что GFAP может быть важным биомаркером для дифференциации между геморрагическим и ишемическим инсультом, которые имеют разные механизмы возникновения и требуют противоположных стратегий лечения. Известно, что при геморрагическом инсульте концентрация GFAP в крови увеличивается стремительно, GFAP появляется в крови в течение первых двух часов, а максимальный его уровень наблюдается между 6 и 12 часами после начала геморрагического инсульта. В то же время, при ишемическом инсульте уровень GFAP в крови повышается существенно позднее (24 - 48 ч) [6,11]. Кроме того, описаны случаи менингоэнцефалита, связанного с аутоиммунной реакцией на GFAP [12].
Таким образом, GFAP (α изоформа) является важным прогностическим белком, который может найти применение в диагностике (в составе тест-систем) патологических состояний ЦНС [13-17]. Серьезным препятствием для широкого применения GFAP в клинике в качестве биохимического маркера является сложность в получении этого белка в качестве контроля / антигена для проведения иммуноферментного анализа (ИФА) [18].
По своей структуре GFAP относится к нейрофиламентам (промежуточные филаменты III типа). GFAP подразделяется на 10 изоформ, среди которых клиническое значение имеет альфа или 1-изоформа (GFAP-α) [4]. Мономерная форма GFAP состоит из 432 аминокислотных остатков, имеет молекулярную массу 50-52 кДа. GFAP состоит из 3-х доменов: головного, стержневого и хвостового. Головной и хвостовой домены не имеют определенной структуры, в то время как стержневой домен содержит четыре основных альфа-спиральных сегмента [19]. Полимеризация GFAP начинается с димеризации мономеров, которые в свою очередь полимеризуются по типу «голова к хвосту», образуя протяженные (сотни нм) филаменты [20]. В связи с склонность белка GFAP к полимеризации, получение его полноразмерной водорастворимой формы, включающей все 3 домена, представляется сложной задачей. Известны рекомбинантные фрагменты GFAP человека, включающие преимущественно стрежневую часть белка, с редуцированным хвостовым или головным доменом. Например, был получен ряд дериватов GFAP, включающий 292-432 аминокислотные остатки белка [21], 60-383 аминокислотные остатки [22], 256-357 аминокислотные остатки [23]. Получение редуцированной формы GFAP упрощает процесс очистки этого белка из-за меньшей склонности дериватов к полимеризации, однако недостатком этого подхода является ограничение числа эпитопов, способных распознаваться антителами тест-систем. В клетках зародыша пшеницы синтезирован полноразмерный GFAP человека, при этом в виде химерной конструкции, содержащей GST-tag на N-конце белка [24,25]. Недостатком этого способа экспрессии белков является высокая стоимость и малые объемы синтеза целевого белка. Для создания необходимых количеств тест-систем на GFAP, необходимо получение доступного рекомбинантного GFAP человека в достаточном количестве. В настоящее время наработка рекомбинантного GFAP человека возможна в прокариотических и эукариотических клетках. При этом, синтез GFAP в бактериальной системе экспрессии имеет несколько важных преимуществ: экономичность и широкая возможность оптимизации экспрессии целевого белка.
Известен способ визуализации астроглиального вала в диагностике низкодифференцированных глиом [26], в ходе которого получают иммуногенный рекомбинантный GFAP человека, иммунизируют им мышь линии Balb/C, выделяют В-лимфоциты селезенки этой мыши и сливают с клетками миеломы мыши линии Sp 2/0-Ag14, получают гибридомы. Тестируют супернатанты полученных гибридом иммунохимически на наличие анти-GFAP антител, из них отбирают клон гибридных клеток, продуцирующий анти-GFAP антитела, способные распознавать GFAP in vivo. Очищают анти-GFAP антитела из супернатанта отобранного клона и ковалентно связывают с липосомальными наноконтейнерами, содержащими диагностическую метку. Антитела отобранного клона гибридных клеток модифицируют по ε-аминогруппам остатков лизина и инкубируют с раствором stelths-липосом. Полученную наносистему вводят в сосудистое русло пациента и визуализируют астроглиальный вал по расположению диагностической метки в тканях головного мозга.
Наиболее близким к заявляемому способу является способ рекомбинантного глиофибриллярного кислого протеина [27], в ходе которого клонируют кДНК hGFAP в вектор рЕТ28а с последующей экспрессия в штамме Е. coli (DE3 BL21), что позволяет выделять рекомбинантный GFAP иммунохимически идентичный нативному антигену. Получаемые к рекомбинантному GFAP поликлональные и моноклональные антитела идентичны антителам, получаемым к нативному антигену. На основе рекомбинантного GFAP и антител полученных к нему может быть разработан твердофазный сэндвич вариант ИФА для количественного определения концентрации GFAP в биологических жидкостях человека.
Технической проблемой является необходимость расширения арсенала средств получения рекомбинантного человеческого глиального фибриллярного кислого белка.
Технический результат состоит в обеспечении возможности рекомбинантного человеческого глиального фибриллярного кислого белка.
Технический результат достигается за счет штамма E. сoli Origami 2 (DE3) pET28a-hGFAP, депонированного во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина под № ВКМ B-3635D и являющегося продуцентом рекомбинантного глиального фибрилярного кислого белка (GFAP) человека для применения в диагностических целях.
Технический результат также достигается тем, что в способе получения рекомбинантного человеческого глиального фибриллярного кислого белка, в ходе которого клонируют ген GFAP человека в вектор в вектор рЕТ28а с последующей экспрессией в штамме Е. coli, согласно изобретению используют штамм-продуцент E. сoli Origami 2 (DE3) pET28a-hGFAP, депонированный во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина под № ВКМ B-3635D, причем осадок бактериальных клеток штамм-продуцента E.сoli Origami 2 (DE3) pET28a-hGFAP ресуспендируют в фосфатном буфере и разрушают с помощью ультразвукового дезинтегратора на льду, клеточный дебрис, содержащий тельца включений E. сoli с рекомбинантным GFAP человека, собирают центрифугированием, а полученный осадок растворяют в денатурирующим буферном растворе, содержащем мочевину, Tris-HCl и имидазол, после чего полученный раствор фильтруют и наносят на хроматографическую колонку, предварительно уравновешенную фосфатным буфером, затем осуществляют адсорбцию рекомбинантного GFAP человека на Ni-NTA-агарозе, после чего хроматографическую колонку промывают буферным раствором, содержащем мочевину, Tris-HCl и имидазол, далее полученный раствор белка подвергают ступенчатому диализу, в результате чего происходит разбавление мочевины и ренатурация белка GFAP.
Создана генно-инженерная конструкция и бактериальный продуцент полноразмерного рекомбинантного GFAP человека, который практически полностью идентичен натуральному белку.
Разработана методика получения и очистки рекомбинантного GFAP человека из бактериального продуцента, включающая в себя несколько стадий хроматографий, диализа, ферментативной обработки и концентрирования.
Полученный рекомбинантный GFAP человека пригоден в качестве антигена для иммунизации животных (для получения поликлональных и моноклональных антител) и в качестве антигена для проведения иммуноферментного анализа.
Заявляемое изобретение поясняется фигурами.
Фигура 1. Получение кДНК гена GFAP человека из клеток глиобластомы человека U-257. M - маркер молекулярных весов (п.н.).
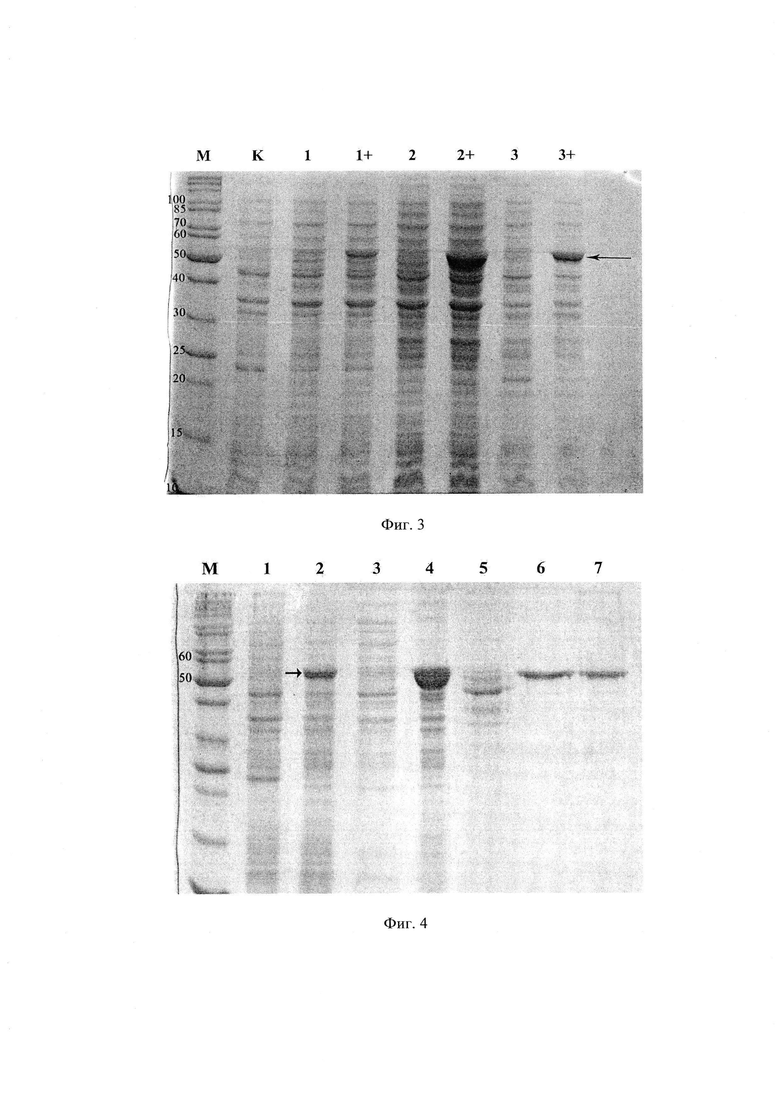
Фигура 2. Схема клонирования гена GFAP человека в вектор pET28a по сайтам рестрикции NdeI и EcoRI. ATG - старт транскрипции, RBS - последовательность связывания рибосом, KanR - устойчивость к канамицину, ori - точка начала репликации плазмидной ДНК ColE1, f1 ori - начало репликации ДНК бактериофага f1, rop - регуляторный белок Rop (модулятор РНК).
Фигура 3. Индукция экспрессии GFAP в различных штаммах E.coli: 1 - BL21(DE3), 2 - C41(DE3), 3 - Origami 2 при внесении в культуральную среду индуктора ИПТГ (+). M - маркер молекулярных весов (кДа). К - контроль, нетрансформированные плазмидой pET28a-hGFAP клетки BL21(DE3).
Фигура 4. Очистка рекомбинантного GFAP человека. 1 - клетки E.coli Origami 2 (DE3), 2 - E.coli Origami 2 (DE3) pET28a-hGFAP индукция экспрессии ИПТГ, 3 - водорастворимая фракция белков продуцента GFAP, 4 - водонерастворимая фракция белков продуцента GFAP, 5 несвязавшаяся с Ni-NTA агарозой фракция белков продуцента GFAP, 6 - элюат GFAP, 7 - диализованный GFAP. M - маркер молекулярных весов (кДа).
Заявляемое изобретение поясняется примерами.
Пример 1. Получение бактериального продуцента GFAP человека
Ген GFAP человека (SEQ ID NO:1) был получен с помощью ПЦР, ген-специфических праймеров (прямой: 5’-TTTTCATATGGAGAGGAGACGCATCACCTCCGC-3’ (NdeI), обратный: 5’-TTTTGAATTCTTACATCACATCCTTGTGCTCCTGCTTG-3’ (EcoRI)) и кДНК, полученной путем обратной транскрипции (с помощью набора MMLV-RT, «Евроген», Россия) из тотальной РНК клеток (U-251) глиобластомы человека (Фиг.1).
Полученный ген GFAP человека был клонирован в экспрессирующий вектор pET28а по сайтам рестрикции NdeI и EcoRI. Таким образом, в экспрессирующем векторе pET28a перед 5’-концом гена GFAP человека расположена последовательность, кодирующая His-tag и протеолитический сайт, узнаваемый тромбином, что позволяет после обработки тромбином чистого белка GFAP получить белок практически полностью идентичный человеческому (Фиг.2). Корректность генетической конструкции проверялась с помощью секвенирования («Евроген», Россия). Для трансформации бактериальных клеток использовали конструкцию, в которой последовательность клонированного фрагмента ДНК полностью совпадает с кодирующей последовательностью гена GFAP человека в GenBank (NM_001131019).
Плазмидой pET28a-hGFAP (SEQ ID NO:2) была проведена трансформация (стандартным Ca2+ методом) нескольких штаммов E. coli: BL21(DE3), C41(DE3) и Origami 2 (DE3) («Novagen», США), для оценки уровня экспрессии целевого белка. Показано, что наиболее высокий уровень синтеза GFAP наблюдается в клетках C41(DE3) и Origami 2 (DE3), в которых до 20% от тотального белка бактерий приходится на целевой белок (Фиг.3). Для дальнейших работ был использован продуцент на основе штамма Origami 2 (DE3).
В ходе экспрессии синтезирована химерная форма белка GFAP человека (SEQ ID NO:3), содержащая на N-конце His-tag (HHHHHH положение 5-10), сайт узнавания протеазой - тромбином (LVPRGS положение 14-19). После обработки тромбином на N-конце белка GFAP человека остаются гетерологичные аминокислоты GSH.
Пример 2. Условия культивирования продуцента рекомбинантного белка GFAP
При разработке методов культивирования продуцента GFAP человека, основное внимание было уделено получению условий, при которых происходит максимальная экспрессия целевого белка.
Штамм E.coli Origami 2 (DE3) является производной формой штамма K-12, который имеет мутации в генах тиоредоксин-редуктазы (trxB) и глутатион-редуктазы (gor), что в значительной степени усиливает образование дисульфидных связей в цитоплазме E. coli. Origami 2 (DE3) несет хромосомную копию гена РНК-полимеразы T7 фага λ под контролем промотора lacUV5. Этот штамм используют для улучшения синтеза белков эукариот, имеющих критически важные для стабильности структуры дисульфидные связи, а также при синтезе токсичных для бактерий белков, для которых в других штаммах не удается добиться приемлемого уровня синтеза. Генотип: Δ(ara-leu)7697 ΔlacX74 ΔphoA PvuII phoR araD139 ahpC galE galK rpsL F′[lac+ lacIq pro] (DE3) gor522::Tn10 trxB (StrR, TetR).
Проводили трансформацию штамма E.coli Origami 2 (DE3) плазмидой pET28a-hGFAP с помощью стандартного Ca2+ метода [28]. Полученные трансформанты использовали для приготовления затравочной культуры. Одной колонией E.coli Origami 2 (DE3) pET28a-hGFAP заражали 200 мл питательной среды LB, содержащей канамицин (Km) в концентрации 25 мкг/мл, и растили на качалке (120 об/мин) в течении 16 часов при +37°С. Полученной затравочной культурой заражали 2 л питательной среды LB, содержащей канамицин (Km) в концентрации 25 мкг/мл, в ферментере Ф-301 (ИБП РАН, Россия) при +37°С и интенсивной аэрации. Экспрессию GFAP индуцировали добавлением в среду культивирования изопропил-β-D-1-тиогалактопиранозида (ИПТГ) до конечной концентрации 1 мМ, при оптической плотности культуры 0.6 о.е. (λ=600 нм). После индукции температуру снижали до +30°С и культивировали еще в течение 4 ч, после чего бактерии собирали центрифугированием (4000 об/мин, 20 мин), полученный осадок продуцента замораживали при -20°С и хранили до выделения белка.
Пример 3. Оценка генетической стабильности продуцента рекомбинантного белка GFAP
Для проверки генетической стабильности ночную культуру E.coli Origami 2 (DE3) pET28a-hGFAP высевали на агаризованную среду LB с канамицином (устойчивость к которому несет плазмида pET28a-hGFAP) и без него и подсчитывали число колоний, выросших на чашках при высеве из одного и того же разведения.
Одну из колоний трансформированных клеток E.coli Origami 2 (DE3) pET28a-hGFAP, выросших на чашке с LB-агаром и Km, засевали в 50 мл жидкую питательную среду LB с Km (25 мкг/мл). Культуру выращивали в термостатируемой качалке («Biosan», Финляндия) при +37°С, при 200 об/мин в течении 16 ч, затем отбирали 50 мкл культуры, проводили серию разведений (до 10000 кратного) в стерильном LB и высевали по 50 мкл на чашку с LB-агаром и Km (25 мкг/мл) и без него. Спустя 16 ч роста клеток при +37°С проводили подсчет количества колоний на чашках в присутствии или отcутствии антибиотика. Приблизительно равное количество колоний на чашках Петри с антибиотиком и без него свидетельствует о генетической стабильности культуры-продуцента. Напротив, снижение количества колоний на чашке Петри с антибиотиком, по сравнению с чашкой без антибиотика, свидетельствует о снижении количества клеток содержащих плазмиду, обеспечивающую устойчивость к соответствующему антибиотику. Всего таким образом было проведено 10 пассажей исходной трансформированной колонии E.coli Origami 2 (DE3) pET28a-hGFAP, результаты которых представлены в таблице 1. Полученные данные свидетельствуют о генетической стабильности продуцента Origami 2 (DE3) pET28a-hGFAP.
Пример 4. Получение полноразмерного рекомбинантного GFAP человека
Присутствие His-tag в структуре белка GFAP упрощает процедуру очистки рекомбинантного белка благодаря тому, что этот домен специфически связывается с Ni-NTA-агарозой. Осадок (~ 5 г) бактериальных клеток продуцента GFAP (E. сoli Origami 2 (DE3) pET28a-hGFAP) ресуспендировали в 50 мл фосфатного буфера (1xPBS) и разрушали с помощью ультразвукового дезинтегратора УЗДН-2Т (Россия) на льду. Клеточный дебрис, содержащий тельца включений E. сoli с рекомбинантным GFAP человека, собирали центрифугированием при 10000g в течение 30 мин. Полученный осадок растворяли в 50 мл денатурирующего буфера: 8 М мочевина, 15 мМ Tris-HCl (pH 8.0), 10 мМ имидазола. Полученный раствор фильтровали через шприцевой фильтр 0.2 мкм («Teknokroma», Испания) и с помощью перистальтического насоса наносили на хроматографическую колонку («BioRad», США) с 10 мл Ni-NTA-агарозы («Invitrogen», США), которая предварительно была уравновешена тем же буфером. Адсорбцию рекомбинантного GFAP на Ni-NTA-агарозе проводили при комнатной температуре. Затем колонку промывали 100 мл раствора: 8 М мочевина, 15 мМ Tris-HCl (pH 8.5), 20 мM имидазол. Элюцию белка проводили 20 мл буфера: 8М мочевина, 15 мМ Tris-HCl (pH 8.5), 250 мM имидазол. Полученный раствор белка подвергали ступенчатому диализу (в диализном мешке с отсечение 3.5 кДа) по схеме указанной в Табл.2, в результате чего происходит разбавление мочевины и ренатурация белка GFAP.
Ренатурированный препарат (7 стадия диализа) белка GFAP концентрировали с помощью мембранного концентратора SPIN-X («Corning», США), обрабатывали тромбином (~ 2 ед.) для отщепления пептида с карбоксильного конца белка (SEQ ID NO:4). Затем, реакционную смесь пропускали через колонку с Ni-NTA агарозой (уравновешенной буфером 15 мМ Tris-HCl (pH 8.0), 0.05% CHAPS, 0.05% Твин20), для связывания пептидов с His-tag (отщепленного и непроцессированного GFAP).
Затем обработанный тромбином белок GFAP пропускали через гель-фильтрационную колонку с носителем Superdex 200 («GE Healthcare», США), уравновешенную буфером 15 мМ Tris-HCl (pH 8.0), 0.1 мМ ЭДТА, 0.1 мМ ДTT, 0.05% CHAPS, 0.05% Твин20, для удаления примесей тромбина (мол. вес. ~ 36 кДа). После гельфильтрационной колонки белок концентрировали с помощью мембранного концентратора SPIN-X («Corning», США) с отсечением по молекулярному весу 30 кДа, до концентрации 0.5 мг/мл. Чистоту конечного препарата GFAP оценивали с помощью электрофореза в 12.5% полиакриламидном геле (в присутствии додецилсульфата Na), которая составила ≥ 95%, а молекулярный вес ~ 52 кДа (Фиг.4). Таким образом, с 2 л бактериальной культуры E. coli Origami 2 (DE3) pET28a-hGFAP (оптической плотностью 1.5 о.е., λ = 600 нм) удается получить до 4 мг чистого рекомбинантного GFAP человека.
Полученный рекомбинантный GFAP человека подходит для использования в качестве стандарта или калибратора при иммуноферментном анализе (ИФА). Антиген состоит из полноразмерного GFAP человека (SEQ ID NO:5). Следует заметить, что GFAP, будучи фибриллярным белком, при длительном хранении в водных растворах склонен к олигомеризации, образуя водонерастворимые агрегаты. При многократном (более 3 раз) замораживании/размораживании раствор GFAP также способен необратимо агрегировать. В связи с этим, необходима стабилизация рекомбинантного белка для его длительного хранения.
Наиболее оптимальным способом хранения рекомбинантного GFAP является лиофильно-высушенная форма. Лиофилизированный препарат GFAP получают по технологии, включающей как минимум 4 стадии: 1) очистка белка с помощью аффинной хромотографии на Ni-NTA-агарозе и гельфильтрации; 2) концентрирование фракций белка GFAP до концентрации 0.5 мг/мл и диализ (по вышеописанной схеме); 3) введение, по крайней мере, одного стабилизатора; 4) белок в комплексе со стабилизатором/ стабилизаторами замораживают в жидком азоте, 5) процесс лиофилизации проводят при - 20°С до образования сухого порошка GFAP.
Стабилизаторы используют для повышения стабильности рекомбинантного GFAP на длительный срок хранения (не менее одного года), при температуре от +4 до -20°С, в зависимости от срока хранения. Известно, что манноза выполняет функцию сохранения вторичной структуры пептидов и белков [29]. Применение маннозы, в качестве стабилизатора включает, но не ограничивает использование других стабилизаторов. Стабилизаторы могут быть выбраны из группы, состоящей из: 1) одного или более моно- или полисахаридов, или сахарных спиртов (мальтоза, глюкоза, лактоза, трегалоза, сахароза, маннит, инозит, галактоза, рибоза, ксилоза, манноза, сахароза, целлобиоза, рафиноза и мальтотриоза), 2) аминокислот (аланин, глицин и др.), 3) нейтральных белков (бычий сывороточный альбумин и т.п.). В связи с тем, что GFAP является олигомерным белком, для предотвращения его агрегации используют растворы неионных детергентов: 0.05% CHAPS и 0.05% Tween 20. Наличие восстановителя 0.1 мМ дитиотреитола (ДTT) в растворе GFAP препятствует окислению консервативного остатка цистеина (С294), который играет важную роль в полимеризации этого белка.
Лиофилизированный препарат GFAP (в комплексе со стабилизаторами) расфасовывают в стерильные стеклянные флаконы (в зависимости от применения по дозам от 100 до 1000 мкг), герметично закупоривают и хранят при температуре от +4 до -20°С.
Непосредственно перед использованием сухой порошок лиофилизированного GFAP растворяют в деионизованной воде в требуемой концентрации (менее 1 мг/мл, для предотвращения агрегации). Приготовленный раствор белка используют сразу для иммунизации или нанесения на планшет (в качестве стандарта) для проведения ИФА.
Пример 5. Применение рекомбинантного GFAP в качестве стандарта для ИФА
Полученные рекомбинантный GFAP человека может быть использован в качестве антигена (положительного стандарта) при проведении ИФА. Растворы рекомбинантного GFAP человека (в различных разведениях, с концентрацией от 0.25 до 25 нг/мл) вносят в соответствующие лунки микропланшета для ИФА (в объеме 100 - 300 мкл). В качестве отрицательного контроля используется буфер для разведения, который вносится в соответствующие лунки (в таких же объемах, что и положительный контроль GFAP). Затем проводится инкубация микропланшета при комнатной температуре 25°С в течение 2 часов, на орбитальном шейкере, установленном на 300 оборотов/мин, в ходе которого происходит связывание антигена со стенками планшета. Возможно нанесение стандартов GFAP на микропланшеты с антителами на GFAP (в случае проведения «сэндвич» - ИФА). Далее производят промывку лунок микропланшета 3 раза буфером для промывок (по 350 мкл на лунку). Затем вносят по 100-200 мкл антител против GFАР в каждую лунку и проводят инкубацию при комнатной температуре (22-25°С) в течение 1 часа, на орбитальном шейкере, установленном на 300 оборотов/мин. Промывают лунки микропланшета 3 раза буфером для промывок (по 350 мкл на лунку). Затем во все лунки добавляют по 100-200 мкл раствора вторичных антител, конъюгированных с пероксидазой. Затем проводят инкубацию в течение 1 часа при комнатной температуре, на орбитальном шейкере со скоростью 300 оборотов/мин. После промывают лунки микропланшета 3 раза буфером для промывок (по 350 мкл на лунку). Затем добавляют по 100 мкл раствора субстрата в каждую лунку, при этом избегают попадания прямых солнечных лучей на микропланшет. Проводят инкубацию в течение 10 минут при комнатной температуре. Реакцию останавливают добавлением 100 мкл стоп-раствора в каждую лунку. В течение 5 - 15 минут после остановки реакции проводят оценку оптической плотности образцов при длине волны 450 нм осуществляют на микропланшетном ридере. По результатам полученных данных для стандартов GFAP строится калибровочная кривая, которая используется для количественной оценки содержания антигена в исследуемых биологических образцах.
Пример 6. Применение рекомбинантного GFAP в качестве антигена при иммунизации животных
Полученный полноразмерный GFAP человека (в чистом виде или в комплексе с полным/неполным адъювантом Фрейнда) может быть использован для иммунизации животных. Для кроликов оптимален внутрикожный (область загривка) способ введения GFAP (по 50 - 100 мкг белка в комплексе с адъювантом на животного), в 2 этапа (1-й, 14-й или 17-й день иммунизации) с целью последующего получения поликлональных антител из сыворотки крови. Для мышей оптимален внутримышечный (область бедра) способ введения GFAP (5 - 20 мкг белка в комплексе с адъювантом на животного), в 2 этапа (1-й, 14-й или 21-й день иммунизации), с целью последующего создания гибридом и получения моноклональных антител.
Источники литературы:
1. Methods for aiding in diagnosing and evaluating a traumatic brain injury in a human subject using a combination of GFAP and UCH-L1, CA3067055A1, publ. 13.06.2019.
2. Method for diagnosing traumatic brain injury, US2019302127, publ. 03.10.2019.
3. Diagnostic technique of craniocerebral injury using protein biomarkers, RU2741227C1, publ. 21.01.2021.
4. Middeldorp, J., & Hol, E. M. (2011). GFAP in health and disease. Progress in neurobiology, 93(3), 421-443. https://doi.org/10.1016/j.pneurobio.2011.01.005
5. Pelinka, L. E., Kroepfl, A., Schmidhammer, R., Krenn, M., Buchinger, W., Redl, H., & Raabe, A. (2004). Glial fibrillary acidic protein in serum after traumatic brain injury and multiple trauma. The Journal of trauma, 57(5), 1006-1012.
6. Foerch, C., Niessner, M., Back, T., Bauerle, M., De Marchis, G. M., Ferbert, A., Grehl, H., Hamann, G. F., Jacobs, A., Kastrup, A., Klimpe, S., Palm, F., Thomalla, G., Worthmann, H., Sitzer, M., & BE FAST Study Group (2012). Diagnostic accuracy of plasma glial fibrillary acidic protein for differentiating intracerebral hemorrhage and cerebral ischemia in patients with symptoms of acute stroke. Clinical chemistry, 58(1), 237-245. https://doi.org/10.1373/clinchem.2011.172676.
7. Papa, L., Brophy, G. M., Welch, R. D., Lewis, L. M., Braga, C. F., Tan, C. N., Ameli, N. J., Lopez, M. A., Haeussler, C. A., Mendez Giordano, D. I., Silvestri, S., Giordano, P., Weber, K. D., Hill-Pryor, C., & Hack, D. C. (2016). Time Course and Diagnostic Accuracy of Glial and Neuronal Blood Biomarkers GFAP and UCH-L1 in a Large Cohort of Trauma Patients With and Without Mild Traumatic Brain Injury. JAMA neurology, 73(5), 551-560. https://doi.org/10.1001/jamaneurol.2016.0039
8. Vos, P. E., Jacobs, B., Andriessen, T. M., Lamers, K. J., Borm, G. F., Beems, T., Edwards, M., Rosmalen, C. F., & Vissers, J. L. (2010). GFAP and S100B are biomarkers of traumatic brain injury: an observational cohort study. Neurology, 75(20), 1786-1793. https://doi.org/10.1212/WNL.0b013e3181fd62d2
9. Herrmann, M., Vos, P., Wunderlich, M. T., de Bruijn, C. H., & Lamers, K. J. (2000). Release of glial tissue-specific proteins after acute stroke: A comparative analysis of serum concentrations of protein S-100B and glial fibrillary acidic protein. Stroke, 31(11), 2670-2677. https://doi.org/10.1161/01.str.31.11.2670
10. Сосновский Е.А., Пурас Ю.В., Талыпов А.Э. Биохимические маркеры черепно-мозговой травмы. Нейрохирургия. 2014;(2):83-91. https://doi.org/10.17650/1683-3295-2014-0-2-83-91
11. Yang, Z., & Wang, K. K. (2015). Glial fibrillary acidic protein: from intermediate filament assembly and gliosis to neurobiomarker. Trends in neurosciences, 38(6), 364-374. https://doi.org/10.1016/j.tins.2015.04.003
12. Allen, A., Gulhar, S., Haidari, R., Martinez, J., Bekenstein, J., DeLorenzo, R., Tang, Y., & Oh, U. (2020). Autoimmune glial fibrillary acidic protein astrocytopathy resulting in treatment-refractory flaccid paralysis. Multiple sclerosis and related disorders, 39, 101924. Advance online publication. https://doi.org/10.1016/j.msard.2019.101924
13. Micro-rna, autoantibody and protein markers for diagnosis of neuronal injury, US20130022982, publ. 24.01.2013.
14. Methods for aiding in diagnosing and evaluating a traumatic brain injury in a human subject using a combination of GFAP and UCH-L1, CA3067055A1, publ. 13.06.2019.
15.Method for diagnosing traumatic brain injury, US2019302127, publ. 03.10.2019.
16. Diagnostic technique of craniocerebral injury using protein biomarkers, RU2741227C1, publ. 21.01.2021
17. Methods for aiding in diagnosing and evaluating a traumatic brain injury in a human subject using a combination of GFAP and UCH-L1, US11016105B2, publ. 25.05.2021.
18. Eng, L. F., Ghirnikar, R. S., & Lee, Y. L. (2000). Glial fibrillary acidic protein: GFAP-thirty-one years (1969-2000). Neurochemical research, 25(9-10), 1439-1451. https://doi.org/10.1023/a:1007677003387
19. Viedma-Poyatos, Á., de Pablo, Y., Pekny, M., & Pérez-Sala, D. (2018). The cysteine residue of glial fibrillary acidic protein is a critical target for lipoxidation and required for efficient network organization. Free radical biology & medicine, 120, 380-394. https://doi.org/10.1016/j.freeradbiomed.2018.04.007
20. Perng, M. D., Wen, S. F., Gibbon, T., Middeldorp, J., Sluijs, J., Hol, E. M., & Quinlan, R. A. (2008). Glial fibrillary acidic protein filaments can tolerate the incorporation of assembly-compromised GFAP-delta, but with consequences for filament organization and alphaB-crystallin association. Molecular biology of the cell, 19(10), 4521-4533. https://doi.org/10.1091/mbc.e08-03-0284
21. Recombinant Human GFAP protein (ab151370) https://www.abcam.com/recombinant-human-gfap-protein-ab151370.html
22. Glial fibrillary acidic protein (GFAP), human, recombinant https://shop.hytest.fi/product/glial-fibrillary-acidic-protein-gfap-human-recombinant
23. Recombinant Glial Fibrillary Acidic Protein (GFAP) http://www.cloud-clone.com/products/RPA068Hu01.html
24. Recombinant Human GFAP protein (ab114149) https://www.abcam.com/recombinant-human-gfap-protein-ab114149.html
25. Recombinant Human GFAP GST (N-Term) Protein https://www.novusbio.com/products/gfap-full-length-recombinant-protein_h00002670-p01.
26. Method of imaging of astroglial bank in diagnosing of high-grade gliomaS RU2437159C1, publ. 20.12.2011.
27. Pavlov Konstantin Alexandrovich. Obtaining and immunochemical analysis of recombinant gliofibrillar acidic protein: dissertation... PhD: 03.00.04 / Pavlov Konstantin Aleksandrovich; [Place of protection: State. scientific center of social and fate. psychiatry them. V.P. Serbian Ministry of Health of the Russian Federation].- Moscow, 2009.- 120 p.: ill. RSL OD, 61 09-3/903.
28. Green M. R., Sambrook J. Molecular cloning: a laboratory manual. - 4th ed., Cold Spring Harbor Laboratory Press, New York, 2012.
29. Rahim A., Peters G.H.J., Jalkanen K.J., Westh, P. (2013) Effects of mannose, fructose, and fucose on the structure, stability, and hydration of lysozyme in aqueous solution. Current Physical Chemistry. 3(1), 113-125.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3"
fileName="/Users/fedorivanov/Downloads/ Seq List St26.xml"
softwareName="WIPO Sequence" softwareVersion="2.2.0"
productionDate="2023-04-17">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022123601</ApplicationNumberText>
<FilingDate>2022-09-05</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>GFAP</ApplicantFileReference>
<ApplicantName languageCode="ru">Федеральное государственное
автономное образовательное учреждение высшего образования
"Московский физико-технический институт (национальный
исследовательский университет)"</ApplicantName>
<ApplicantNameLatin>Federal State Autonomous Educational Institution
of Higher Education "Moscow Institute of Physics and Technology
(National Research University)"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Способ получения рекомбинантного
человеческого глиального фибриллярного кислого белка и используемая в
нём генетическая конструкция</InventionTitle>
<SequenceTotalQuantity>5</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1333</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1333</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cagcggcctggtgccgcgcggcagccatatggagaggagacgcatcacc
tccgctgctcgccgctcctacgtctcctcaggggagatgatggtggggggcctggctcctggccgccgtc
tgggtcctggcacccgcctctccctggctcgaatgccccctccactcccaacccgggtggatttctccct
ggctggggcactcaatgctggcttcaaggagacccgggccagtgagcgggcagagatgatggagctcaat
gaccgctttgccagctacatcgagaaggttcgcttcctggaacagcaaaacaaggcgctggctgctgagc
tgaaccagctgcgggccaaggagcccaccaagctggcagacgtctaccaggctgagctgcgagagctgcg
gctgcggctcgatcaactcaccgccaacagcgcccggctggaggttgagagggacaatctggcacaggac
ctggccactgtgaggcagaagctccaggatgaaaccaacctgaggctggaagccgagaacaacctggctg
cctatagacaggaagcagatgaagccaccctggcccgtctggatctggagaggaagattgagtcgctgga
ggaggagatccggttcttgaggaagatccacgaggaggaggttcgggaactccaggagcagctggcccga
cagcaggtccatgtggagcttgacgtggccaagccagacctcaccgcagccctgaaagagatccgcacgc
agtatgaggcaatggcgtccagcaacatgcatgaagccgaagagtggtaccgctccaagtttgcagacct
gacagacgctgctgcccgcaacgcggagctgctccgccaggccaagcacgaagccaacgactaccggcgc
cagttgcagtccttgacctgcgacctggagtctctgcgcggcacgaacgagtccctggagaggcagatgc
gcgagcaggaggagcggcacgtgcgggaggcggccagttatcaggaggcgctggcgcggctggaggaaga
ggggcagagcctcaaggacgagatggcccgccacttgcaggagtaccaggacctgctcaatgtcaagctg
gccctggacatcgagatcgccacctacaggaagctgctagagggcgaggagaaccggatcaccattcccg
tgcagaccttctccaacctgcagattcgagaaaccagcctggacaccaagtctgtgtcagaaggccacct
caagaggaacatcgtggtgaagaccgtggagatgcgggatggagaggtcattaaggagtccaagcaggag
cacaaggatgtgatgtaagaattc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>6626</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..6626</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atccggatatagttcctcctttcagcaaaaaacccctcaagacccgttt
agaggccccaaggggttatgctagttattgctcagcggtggcagcagccaactcagcttcctttcgggct
ttgttagcagccggatctcagtggtggtggtggtggtgctcgagtgcggccgcaagcttgtcgacggagc
tcgaattcttacatcacatccttgtgctcctgcttggactccttaatgacctctccatcccgcatctcca
cggtcttcaccacgatgttcctcttgaggtggccttctgacacagacttggtgtccaggctggtttctcg
aatctgcaggttggagaaggtctgcacgggaatggtgatccggttctcctcgccctctagcagcttcctg
taggtggcgatctcgatgtccagggccagcttgacattgagcaggtcctggtactcctgcaagtggcggg
ccatctcgtccttgaggctctgcccctcttcctccagccgcgccagcgcctcctgataactggccgcctc
ccgcacgtgccgctcctcctgctcgcgcatctgcctctccagggactcgttcgtgccgcgcagagactcc
aggtcgcaggtcaaggactgcaactggcgccggtagtcgttggcttcgtgcttggcctggcggagcagct
ccgcgttgcgggcagcagcgtctgtcaggtctgcaaacttggagcggtaccactcttcggcttcatgcat
gttgctggacgccattgcctcatactgcgtgcggatctctttcagggctgcggtgaggtctggcttggcc
acgtcaagctccacatggacctgctgtcgggccagctgctcctggagttcccgaacctcctcctcgtgga
tcttcctcaagaaccggatctcctcctccagcgactcaatcttcctctccagatccagacgggccagggt
ggcttcatctgcttcctgtctataggcagccaggttgttctcggcttccagcctcaggttggtttcatcc
tggagcttctgcctcacagtggccaggtcctgtgccagattgtccctctcaacctccagccgggcgctgt
tggcggtgagttgatcgagccgcagccgcagctctcgcagctcagcctggtagacgtctgccagcttggt
gggctccttggcccgcagctggttcagctcagcagccagcgccttgttttgctgttccaggaagcgaacc
ttctcgatgtagctggcaaagcggtcattgagctccatcatctctgcccgctcactggcccgggtctcct
tgaagccagcattgagtgccccagccagggagaaatccacccgggttgggagtggagggggcattcgagc
cagggagaggcgggtgccaggacccagacggcggccaggagccaggccccccaccatcatctcccctgag
gagacgtaggagcggcgagcagcggaggtgatgcgtctcctctccatatggctgccgcgcggcaccaggc
cgctgctgtgatgatgatgatgatggctgctgcccatggtatatctccttcttaaagttaaacaaaatta
tttctagaggggaattgttatccgctcacaattcccctatagtgagtcgtattaatttcgcgggatcgag
atctcgatcctctacgccggacgcatcgtggccggcatcaccggcgccacaggtgcggttgctggcgcct
atatcgccgacatcaccgatggggaagatcgggctcgccacttcgggctcatgagcgcttgtttcggcgt
gggtatggtggcaggccccgtggccgggggactgttgggcgccatctccttgcatgcaccattccttgcg
gcggcggtgctcaacggcctcaacctactactgggctgcttcctaatgcaggagtcgcataagggagagc
gtcgagatcccggacaccatcgaatggcgcaaaacctttcgcggtatggcatgatagcgcccggaagaga
gtcaattcagggtggtgaatgtgaaaccagtaacgttatacgatgtcgcagagtatgccggtgtctctta
tcagaccgtttcccgcgtggtgaaccaggccagccacgtttctgcgaaaacgcgggaaaaagtggaagcg
gcgatggcggagctgaattacattcccaaccgcgtggcacaacaactggcgggcaaacagtcgttgctga
ttggcgttgccacctccagtctggccctgcacgcgccgtcgcaaattgtcgcggcgattaaatctcgcgc
cgatcaactgggtgccagcgtggtggtgtcgatggtagaacgaagcggcgtcgaagcctgtaaagcggcg
gtgcacaatcttctcgcgcaacgcgtcagtgggctgatcattaactatccgctggatgaccaggatgcca
ttgctgtggaagctgcctgcactaatgttccggcgttatttcttgatgtctctgaccagacacccatcaa
cagtattattttctcccatgaagacggtacgcgactgggcgtggagcatctggtcgcattgggtcaccag
caaatcgcgctgttagcgggcccattaagttctgtctcggcgcgtctgcgtctggctggctggcataaat
atctcactcgcaatcaaattcagccgatagcggaacgggaaggcgactggagtgccatgtccggttttca
acaaaccatgcaaatgctgaatgagggcatcgttcccactgcgatgctggttgccaacgatcagatggcg
ctgggcgcaatgcgcgccattaccgagtccgggctgcgcgttggtgcggatatctcggtagtgggatacg
acgataccgaagacagctcatgttatatcccgccgttaaccaccatcaaacaggattttcgcctgctggg
gcaaaccagcgtggaccgcttgctgcaactctctcagggccaggcggtgaagggcaatcagctgttgccc
gtctcactggtgaaaagaaaaaccaccctggcgcccaatacgcaaaccgcctctccccgcgcgttggccg
attcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatg
taagttagctcactcattaggcaccgggatctcgaccgatgcccttgagagccttcaacccagtcagctc
cttccggtgggcgcggggcatgactatcgtcgccgcacttatgactgtcttctttatcatgcaactcgta
ggacaggtgccggcagcgctctgggtcattttcggcgaggaccgctttcgctggagcgcgacgatgatcg
gcctgtcgcttgcggtattcggaatcttgcacgccctcgctcaagccttcgtcactggtcccgccaccaa
acgtttcggcgagaagcaggccattatcgccggcatggcggccccacgggtgcgcatgatcgtgctcctg
tcgttgaggacccggctaggctggcggggttgccttactggttagcagaatgaatcaccgatacgcgagc
gaacgtgaagcgactgctgctgcaaaacgtctgcgacctgagcaacaacatgaatggtcttcggtttccg
tgtttcgtaaagtctggaaacgcggaagtcagcgccctgcaccattatgttccggatctgcatcgcagga
tgctgctggctaccctgtggaacacctacatctgtattaacgaagcgctggcattgaccctgagtgattt
ttctctggtcccgccgcatccataccgccagttgtttaccctcacaacgttccagtaaccgggcatgttc
atcatcagtaacccgtatcgtgagcatcctctctcgtttcatcggtatcattacccccatgaacagaaat
cccccttacacggaggcatcagtgaccaaacaggaaaaaaccgcccttaacatggcccgctttatcagaa
gccagacattaacgcttctggagaaactcaacgagctggacgcggatgaacaggcagacatctgtgaatc
gcttcacgaccacgctgatgagctttaccgcagctgcctcgcgcgtttcggtgatgacggtgaaaacctc
tgacacatgcagctcccggagacggtcacagcttgtctgtaagcggatgccgggagcagacaagcccgtc
agggcgcgtcagcgggtgttggcgggtgtcggggcgcagccatgacccagtcacgtagcgatagcggagt
gtatactggcttaactatgcggcatcagagcagattgtactgagagtgcaccatatatgcggtgtgaaat
accgcacagatgcgtaaggagaaaataccgcatcaggcgctcttccgcttcctcgctcactgactcgctg
cgctcggtcgttcggctgcggcgagcggtatcagctcactcaaaggcggtaatacggttatccacagaat
caggggataacgcaggaaagaacatgtgagcaaaaggccagcaaaaggccaggaaccgtaaaaaggccgc
gttgctggcgtttttccataggctccgcccccctgacgagcatcacaaaaatcgacgctcaagtcagagg
tggcgaaacccgacaggactataaagataccaggcgtttccccctggaagctccctcgtgcgctctcctg
ttccgaccctgccgcttaccggatacctgtccgcctttctcccttcgggaagcgtggcgctttctcatag
ctcacgctgtaggtatctcagttcggtgtaggtcgttcgctccaagctgggctgtgtgcacgaacccccc
gttcagcccgaccgctgcgccttatccggtaactatcgtcttgagtccaacccggtaagacacgacttat
cgccactggcagcagccactggtaacaggattagcagagcgaggtatgtaggcggtgctacagagttctt
gaagtggtggcctaactacggctacactagaaggacagtatttggtatctgcgctctgctgaagccagtt
accttcggaaaaagagttggtagctcttgatccggcaaacaaaccaccgctggtagcggtggtttttttg
tttgcaagcagcagattacgcgcagaaaaaaaggatctcaagaagatcctttgatcttttctacggggtc
tgacgctcagtggaacgaaaactcacgttaagggattttggtcatgaacaataaaactgtctgcttacat
aaacagtaatacaaggggtgttatgagccatattcaacgggaaacgtcttgctctaggccgcgattaaat
tccaacatggatgctgatttatatgggtataaatgggctcgcgataatgtcgggcaatcaggtgcgacaa
tctatcgattgtatgggaagcccgatgcgccagagttgtttctgaaacatggcaaaggtagcgttgccaa
tgatgttacagatgagatggtcagactaaactggctgacggaatttatgcctcttccgaccatcaagcat
tttatccgtactcctgatgatgcatggttactcaccactgcgatccccgggaaaacagcattccaggtat
tagaagaatatcctgattcaggtgaaaatattgttgatgcgctggcagtgttcctgcgccggttgcattc
gattcctgtttgtaattgtccttttaacagcgatcgcgtatttcgtctcgctcaggcgcaatcacgaatg
aataacggtttggttgatgcgagtgattttgatgacgagcgtaatggctggcctgttgaacaagtctgga
aagaaatgcataaacttttgccattctcaccggattcagtcgtcactcatggtgatttctcacttgataa
ccttatttttgacgaggggaaattaataggttgtattgatgttggacgagtcggaatcgcagaccgatac
caggatcttgccatcctatggaactgcctcggtgagttttctccttcattacagaaacggctttttcaaa
aatatggtattgataatcctgatatgaataaattgcagtttcatttgatgctcgatgagtttttctaaga
attaattcatgagcggatacatatttgaatgtatttagaaaaataaacaaataggggttccgcgcacatt
tccccgaaaagtgccacctgaaattgtaaacgttaatattttgttaaaattcgcgttaaatttttgttaa
atcagctcattttttaaccaataggccgaaatcggcaaaatcccttataaatcaaaagaatagaccgaga
tagggttgagtgttgttccagtttggaacaagagtccactattaaagaacgtggactccaacgtcaaagg
gcgaaaaaccgtctatcagggcgatggcccactacgtgaaccatcaccctaatcaagttttttggggtcg
aggtgccgtaaagcactaaatcggaaccctaaagggagcccccgatttagagcttgacggggaaagccgg
cgaacgtggcgagaaaggaagggaagaaagcgaaaggagcgggcgctagggcgctggcaagtgtagcggt
cacgctgcgcgtaaccaccacacccgccgcgcttaatgcgccgctacagggcgcgtcccattcgcca</I
NSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>451</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..451</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MGSSHHHHHHSSGLVPRGSHMERRRITSAARRSYVSSGEMMVGGLAPGR
RLGPGTRLSLARMPPPLPTRVDFSLAGALNAGFKETRASERAEMMELNDRFASYIEKVRFLEQQNKALAA
LNQLRAKEPTKLADVYQAELRELRLRLDQLTANSARLEVERDNLAQDLATVRQKLQDETNLRLEAENNLA
AYRQEADEATLARLDLERKIESLEEEIRFLRKIHEEEVRELQEQLARQQVHVELDVAKPDLTAALKEIRT
QYEAMASSNMHEAEEWYRSKFADLTDAAARNAELLRQAKHEANDYRRQLQSLTCDLESLRGTNESLERQM
REQEERHVREAASYQEALARLEEEGQSLKDEMARHLQEYQDLLNVKLALDIEIATYRKLLEGEENRITIP
VQTFSNLQIRETSLDTKSVSEGHLKRNIVVKTVEMRDGEVIKESKQEHKDVM</INSDSeq_sequence
>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MGSSHHHHHHSSGLVPRGSH</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>432</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..432</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q11">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MERRRITSAARRSYVSSGEMMVGGLAPGRRLGPGTRLSLARMPPPLPTR
VDFSLAGALNAGFKETRASERAEMMELNDRFASYIEKVRFLEQQNKALAAELNQLRAKEPTKLADVYQAE
LRELRLRLDQLTANSARLEVERDNLAQDLATVRQKLQDETNLRLEAENNLAAYRQEADEATLARLDLERK
IESLEEEIRFLRKIHEEEVRELQEQLARQQVHVELDVAKPDLTAALKEIRTQYEAMASSNMHEAEEWYRS
KFADLTDAAARNAELLRQAKHEANDYRRQLQSLTCDLESLRGTNESLERQMREQEERHVREAASYQEALA
RLEEEGQSLKDEMARHLQEYQDLLNVKLALDIEIATYRKLLEGEENRITIPVQTFSNLQIRETSLDTKSV
SEGHLKRNIVVKTVEMRDGEVIKESKQEHKDVM</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ТЯЖЕСТИ АНТИ-NMDA-РЕЦЕПТОРНОГО ЭНЦЕФАЛИТА С ВЫРАЖЕННОЙ ПСИХОПАТОЛОГИЧЕСКОЙ СИМПТОМАТИКОЙ | 2024 |
|
RU2840435C1 |
| СПОСОБ ДИАГНОСТИКИ ТЕЛЭНЦЕФАЛЬНОГО ГЛИОЗА У ДЕТЕЙ С ВРОЖДЕННЫМИ ИНФЕКЦИЯМИ | 2012 |
|
RU2488831C1 |
| ПЛАЗМИДА, СПОСОБ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА, РЕКОМБИНАНТНЫЙ АНТИМИКРОБНЫЙ ПЕПТИД | 2024 |
|
RU2831834C1 |
| Штамм-продуцент фермента поли(А)-полимеразы E. coli | 2022 |
|
RU2825470C2 |
| СПОСОБ СТИМУЛИРОВАНИЯ РЕГЕНЕРАЦИИ СПИННОГО МОЗГА С ПОМОЩЬЮ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ КЛЕТОК КРОВИ ПУПОВИНЫ ЧЕЛОВЕКА | 2013 |
|
RU2521225C2 |
| ШТАММ-ПРОДУЦЕНТ БЕЗМЕТИОНИНОВОГО CRM197 НА ОСНОВЕ КЛЕТОК E. coli BL21 (DE3) | 2015 |
|
RU2575621C1 |
| Способ получения рекомбинантного антимикробного пептида UBI18-35, рекомбинантная плазмидная ДНК pET31b-2хUBI18-35 и штамм-продуцент Escherichia coli BL21 Rosetta DE3 pLysS/ pET31b-2хUBI18-35 антимикробного пептида UBI18-35 | 2018 |
|
RU2698037C1 |
| Способ получения рекомбинантного белка OMP25d-OMP19-OMP10His | 2024 |
|
RU2825400C1 |
| Способ получения препарата рекомбинантной нуклеазы CAS, по существу, свободного от бактериальных эндотоксинов, полученный данным способом препарат и содержащий его набор для использования в системе CRISPR/Cas | 2019 |
|
RU2707542C1 |
| ШТАММ E.coli BL21(DE3)/pET-hHSP70 - ПРОДУЦЕНТ БЕЛКА ТЕПЛОВОГО ШОКА ЧЕЛОВЕКА HSP70 | 2006 |
|
RU2333956C1 |
Изобретение относится к биотехнологии. Предложен рекомбинантный штамм E. сoli Origami 2 (DE3) pET28ahGFAP для получения рекомбинантного глиального фибрилярного кислого белка (GFAP) человека для применения в диагностических целях, полученный путем трансформации штамма E. сoli Origami 2 (DE3) плазмидой pET28a-hGFAP, представленной на фиг.2. Также предложен способ получения рекомбинантного человеческого глиального фибриллярного кислого белка с использованием указанного штамма. Изобретение обеспечивает возможность получения рекомбинантного человеческого глиального фибриллярного кислого белка. 2 н.п. ф-лы, 4 ил., 2 табл., 6 пр.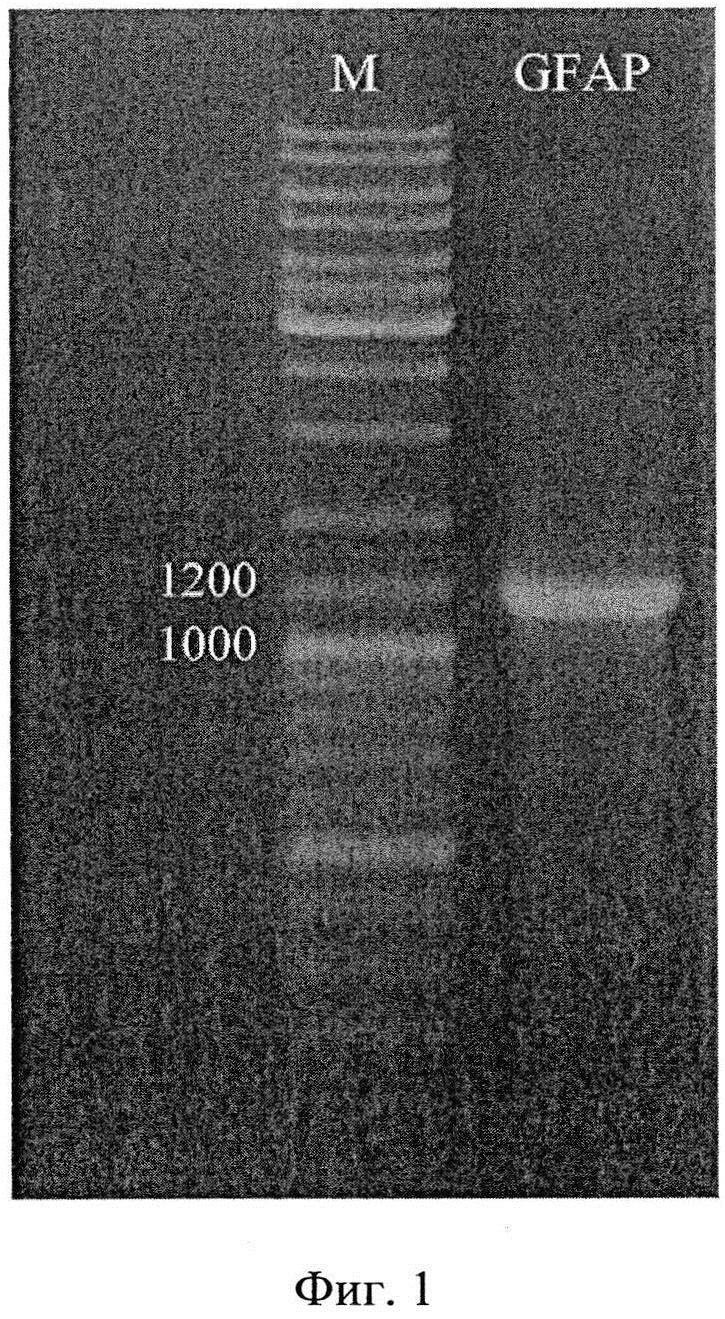
1. Рекомбинантный штамм E. сoli Origami 2 (DE3) pET28ahGFAP для получения рекомбинантного глиального фибрилярного кислого белка (GFAP) человека для применения в диагностических целях, полученный путем трансформации штамма E. сoli Origami 2 (DE3) плазмидой pET28a-hGFAP, представленной на фиг.2.
2. Способ получения рекомбинантного человеческого глиального фибриллярного кислого белка, в ходе которого клонируют ген GFAP человека в вектор рЕТ28а с последующей экспрессией в штамме Е. coli, отличающийся тем, что используют штамм по п.1, причем осадок бактериальных клеток штамм-продуцента E. сoli Origami 2 (DE3) pET28a-hGFAP ресуспендируют в фосфатном буфере и разрушают с помощью ультразвукового дезинтегратора на льду, клеточный дебрис, содержащий тельца включений E. сoli с рекомбинантным GFAP человека, собирают центрифугированием, а полученный осадок растворяют в денатурирующим буферном растворе, содержащем мочевину, Tris-HCl и имидазол, после чего полученный раствор фильтруют и наносят на хроматографическую колонку, предварительно уравновешенную фосфатным буфером, затем осуществляют адсорбцию рекомбинантного GFAP человека на Ni-NTA-агарозе, после чего хроматографическую колонку промывают буферным раствором, содержащем мочевину, Tris-HCl и имидазол, далее полученный раствор белка подвергают ступенчатому диализу, в результате чего происходит разбавление мочевины и ренатурация белка GFAP, после чего ренатурированный белок GFAP концентрируют, обрабатывают тромбином, пропускают через колонку с Ni-NTA агарозой, затем пропускают через гель-фильтрационную колонку, после чего белок концентрируют.
| ПАВЛОВ К | |||
| А | |||
| Получение и иммунохимическии анализ рекомбинантного глиофибриллярного кислого протеина | |||
| Автореферат диссертации на соискание ученой степени кандидата биологических наук | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| CHEKHONIN, V.P | |||
| et al | |||
| Cloning and expression of rat GFAP cDNA in Escherichia coli | |||
| Крутильная машина для веревок и проч. | 1922 |
|
SU143A1 |
Авторы
Даты
2024-01-11—Публикация
2022-09-05—Подача