Область техники
Настоящее изобретение относится к области генной инженерии, а именно к штамму-продуценту фермента поли(А)-полимеразы E. сoli. В частности настоящее изобретение относится к рекомбинантному штамму E. сoli BL21-РAP, предназначенному для экспрессии фермента поли(А)-полимеразы, необходимого для полиаденирования при in vitro синтезе РНК, обеспечивающему индуцируемую высокую экспрессию целевого белка и возможность его хроматографической очистки для дальнейшего промышленного и лабораторного применения. В другом варианте осуществления изобретение относится к вектору polyA-pET28-N6His для трансформации рекомбинантного штамма-продуцента. В еще одном варианте осуществления изобретение относится к применению рекомбинантного штамма-продуцента для in vitro синтеза РНК.
Уровень техники
Функциональная активность фермента поли(А)-полимеразы в клетках служит для присоединения аденозин-монофосфата к 3’-концу мРНК вне зависимости от нуклеотидной последовательности матрицы, что приводит к «созреванию» мРНК и началу трансляции её последовательности в белковую на рибосомах. Молекула «зрелой» мРНК транспортируется из ядрышка в цитоплазму к рибосомам, где происходит трансляция. Поли(А)-хвост обеспечивает стабильность мРНК в клетке [1-2]. Нуклеотидные и аминокислотные последовательности поли(А)-полимеразы имеют очень высокую степень гомологии у эукариотических и прокариотических организмов [3-4]. Фермент может быть использован в биотехнологических производствах в качестве индуктора запуска экспрессии белков в эукариотических системах-продуцентах. Его практическое применение в качестве индуктора повышения выхода продукции возможно для гибридом-продуцентов терапевтических гуманизированных антител, при наработке рекомбинантных белков в клетках дрожжей, китайского хомяка, зеленой мартышки, насекомых на биотехнологических фармацевтических производствах. В то же время поли(А)-полимераза приводит к деградации несмысловой РНК в эукариотических клетках [7]. В бактериальных клетках поли(А)-полимераза может, напротив, приводить к деградации мРНК.
В молекулярной генетике фермент поли(А)-полимераза широко используется для стабилизации линейной РНК (поли(А)-кэпирование) при хранении, манипуляциях и для дальнейшего ее клонирования [2]. Фермент и способы его выделения и очистки стали привлекать к себе внимание в период развития молекулярных методов в генетике, поскольку оказалось, что поли(А)-концевой фрагмент способен очень хорошо защищать чувствительные и крайне нестабильные молекулы мРНК при её выделении и любых манипуляциях с ней, например, при выделении РНК и подготовке ее к количественной ПЦР в реальном времени, которая является основным количественным методом в диагностике патогенных микроорганизмов и вызываемых ими заболеваний [8-9].
Но если в большинстве наборов для выделения РНК в диагностических целях используется ГИТЦ (гуанидин-изотиоцианат), блокирующий РНКазы, то при создании рекомбинантных РНК-вакцин разработчики вынуждены искать нетоксичные компоненты, пригодные для введения в организм [2, 10-12]. Поли(А)-полимераза также может быть использована при радиоактивном мечении РНК аденозином с изотопом фосфора 34Р для изучения биохимических и генетических процессов в радио-медицине и биологии. Добавление поли(A)-хвоста придает стабильность мРНК, способствует экспорту мРНК в цитозоль и участвует в образовании трансляционно-компетентного рибонуклеопротеина (РНП) вместе со структурой 5’-кэпа. Зрелая мРНК образует кольцевую структуру (замкнутую петлю), соединяя кэп с поли(А) хвостом через кэп-связывающий белок eIF4E (эукариотический фактор инициации 4E) и поли(А)-связывающий белок, оба из которых взаимодействуют с eIF4G (фактор инициации эукариот 4G).
Известно, что поли(А)-полимераза, выделенная из разных микроорганизмов (E. coli, Xenopus, Saccaromises, etc.), обладает очень высокой степенью идентичности последовательности ДНК и конформации самого белка [1-4]. Методики её выделения с применением методов молекулярного клонирования из разных организмов известны с начала 90-х годов [1, 3, 4]. Однако в то время не существовало технических возможностей получения высокопроизводительных рекомбинантных штаммов-продуцентов, и современные методики промышленного выделения и очистки фермента также не существовали. Например, существует большое количество публикаций [1, 3-4] и патентов [5-6] первой половины 90-х годов о способах амплификации из природных источников гена поли(А)-полимеразы, создании кДНК-библиотек (плазмидных векторов), трансформации микроорганизмов геном поли(А)-полимеразы. Все эти разработки являются близкими аналогами изобретения. Однако, во-первых, с 90-х годов такие способы давно устарели с точки зрения использования оборудования и реагентов и практически неприменимы в современных лабораториях. Во-вторых, они не позволяют получить высокопроизводительные штаммы и нарабатываемый ими фермент, который можно относительно дешево и эффективно выделять, и очищать методами тангенциальной фильтрации и аффинной хроматографии (6His, другие современные таг-фрагменты).
Современные патенты в основном дают описание и правовую защиту методам применения поли(А)-полимеразы для разных лабораторных исследований и промышленных задач по использованию мРНК и миРНК в сохранённом виде. Так, в европейском патенте 2005 года EP 1512743 раскрывается применение штамма-продуцента поли(А)-полимеразы и использование метода поли(А)-аденилирования (кэпирования) в получении, наработке и регуляции функционирования малых интреферирующих РНК (миRNA) в цитоплазме эукариотических клеточных культур [7].
В патентной заявке KR 2019010635 А описывается методика синтезирования поли(А)-конца у фрагментов мРНК с целью её защиты от деградации при помощи применения фермента поли(А)-полимеразы [9]. Кевин Аллан с коллегами в китайском патентной заявке CN 113614228 А описывают условия и метод применения поли(А)-полимеразы для разделения смеси полноразмерных и коротких фрагментов выделяемой мРНК, защиты стабильности длинных смысловых мРНК и повышения качества получаемых с них библиотек [10].
В патенте CN 114032285 А приводятся системы для стандартизованного тестирования активности поли(А)-полимеразы разных производителей (NEB, собственной РАР от Beijing Full Gold Biotechnology Co. LTD) на способность присоединять к РНК до 15 остатков аденозин-монофосфата методом ОТ-ПЦР-РВ и формула для расчёта активности фермента [8].
Из патентной заявки CN 114736951 A известна способ применения поли(А)-полимеразы для защиты выделяемых транскриптов мРНК в реверс-транскрипции с анализом качества получаемых библиотек к ДНК [11]. В патентной заявке CN 110218753 A описан способ стабилизации синтетической РНК добавлением поли(А)-фрагмента на ее конец при помощи фермента поли(А)-полимеразы при манипуляциях с выделяемой РНК в диагностических исследованиях методом ПЦР обратной транскрипции в реальном времени [12].
Ближайшим аналогом настоящего изобретения является рекомбинантная плазмида для прокариотической экспрессии белка в штамме E.coli BL21 и рекомбинантный штамм-продуцент E.coli BL21-FCoV-S, разарботанная учеными из университета Лонгъян и описанная ими в китайской патентной заявке CN 113072626 A. В документе раскрывается способ получения рекомбинантного S-белка кошачьего коронавируса, который включает следующие стадии: (а) проведение ПЦР амплификация путем взятия гена S-белка коронавируса кошек в качестве матрицы и клонирования фрагмента рекомбинантного S-белка; (b) проведение электрофоретического разделения фрагмента рекомбинантного S-белка, выделение и очистка, соединение с вектором и трансформация в компетентные клетки; (c) лигирование плазмиды с прокариотическим вектором экспрессии для получения рекомбинантной плазмиды pET28a-FCoV-S и (d) трансформацию рекомбинантной плазмиды в BL21 для прокариотической экспрессии с получением рекомбинантного S-белка кошачьего коронавируса.
Настоящее изобретение отличается тем, что коммерчески доступный экспрессионный вектор pET28 в составе рекомбинантной плазмиды polyA-pET28-N6His трансформируется в штамм E.coli BL21 с получением рекомбинантного штамма-продуцента BL21-РAP, обеспечивающего индуцируемую высокую экспрессию целевого белка и возможность его хроматографической очистки для дальнейшего промышленного и лабораторного применения.
Создание отечественного высокоэффективного штамма-продуцента поли(А)-полимеразы и её получение в диагностических и производственных лабораториях и промышленности продолжает оставаться актуальной задачей.
Краткое описание изобретения
Настоящее изобретение в общем смысле относится к области генной инженерии, и в частности к штамму-продуценту фермента поли(А)-полимеразы E. coli. Описанные в настоящем изобретении генетические конструкции могут быть использованы для in vitro синтеза РНК.
В частности в настоящем изобретении описан рекомбинантный штамм-продуцент фермента поли(А)-полимеразы E. coli BL21-РAP, предназначенный для экспрессии фермента поли(А)-полимеразы, необходимого для полиаденирования при in vitro синтезе РНК, обеспечивающий индуцируемую высокую экспрессию целевого белка и возможность его хроматографической очистки для дальнейшего промышленного и лабораторного применения.
Предложенный рекомбинантный штамм может применяться для осуществления работ по разработке мРНК-вакцины против бактериальных инфекций для воспроизведения одного из основных ферментов для in vitro синтеза РНК - поли(А)-полимеразы.
Также описана рекомбинантная плазмида polyA-pET28-N6His для трансформации рекомбинантного штамма-продуцента, необходимого для получения раскрываемого рекомбинантного штамма-продуцента E. сoli BL21-РAP.
Также описано применение рекомбинантного штамма-продуцента E. сoli BL21-РAP для in vitro синтеза РНК.
Краткое описание графических материалов
На фиг. 1 показаны результаты анализа кэпированной и полиаденилированной синтетической мРНК, полученной in vitro.
A. Большая длина поли(А)-хвоста достигается увеличенным количеством фермента в реакции.
B. Влияние ферментативного полиаденилирования мРНК на эффективность трансляции в клеточном тесте по измерению люциферазной активности.
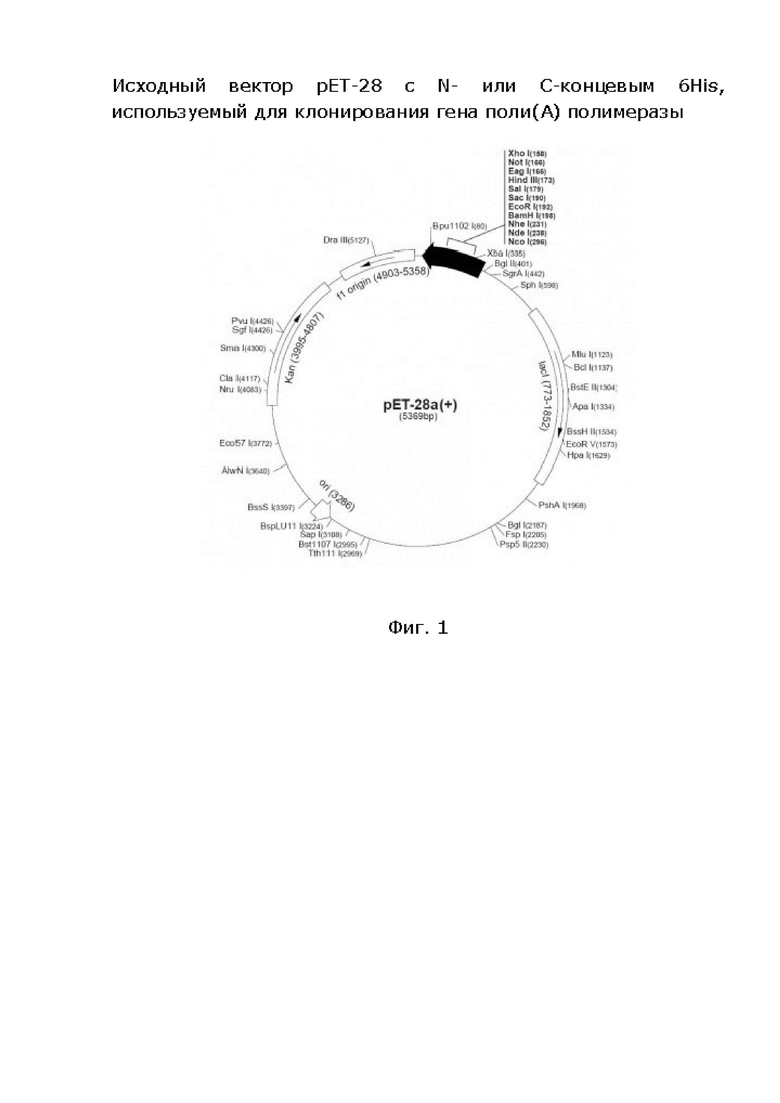
На фиг. 2 показан исходный вектор pET-28 с N- или С-концевым 6His, используемый для клонирования гена поли(А)-полимеразы.
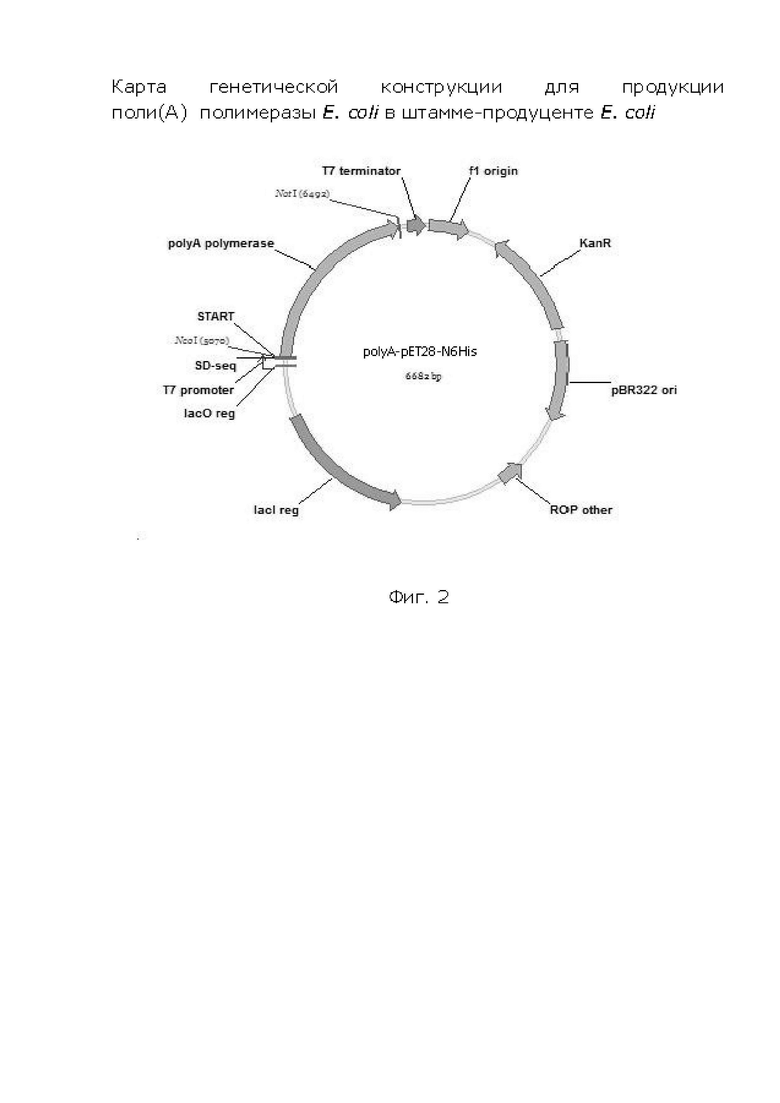
На фиг. 3 показана карта генетической конструкции для продукции поли(А)-полимеразы E. coli в штамме-продуценте E. coli.
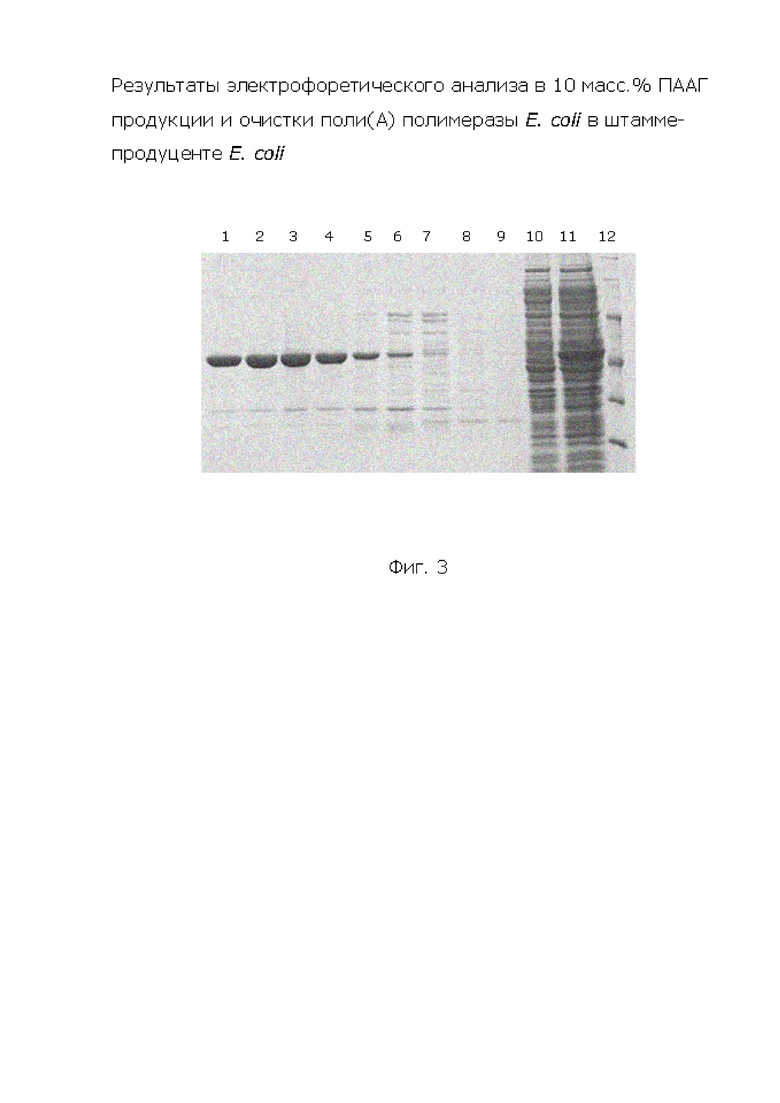
На рис. 4 показаны результаты электрофоретического анализа в 10 масс.% ПААГ продукции и очистки поли(А)-полимеразы E. coli в штамме-продуценте E. coli. 1) 250 мМ имидазола; 2) 200 мМ имидазола; 3) 150 мМ имидазола; 4) 100 мМ имидазола; 5) 30 мМ имидазола; 6) 10 мМ имидазола; 7) 5 мМ имидазола; 8) промывка; 9) проскок; 10) тельца включения, осадок растворен в 8 М мочевине; 11) супернатант, наносимый на колонку; 12) маркеры.
Описание изобретения
Определения:
Под «вектором» в настоящем изобретении понимается кольцевая молекула ДНК, построенная на основе типичного для бактерий внехромосомного репликона - плазмиде, которая кодирует целевой фермент, используемая в генетической инженерии для передачи генетического материала внутрь клетки.
Под «полиаденилированием» в настоящем изобретении понимается процесс присоединения большого количества остатков аденозинмонофосфата (поли(А)-хвоста) к 3'-концу первичной мРНК (пре-мРНК). У эукариот полиаденилирование является частью процессинга мРНК — процесса созревания первичного транскрипта в зрелую мРНК, готовую для трансляции.
Под «поли(А)-хвостом» в настоящем изобретении понимается фрагмент молекулы мРНК, азотистые основания которого представлены только аденином.
Под «рекомбинантным штаммом» в настоящем изобретении понимается штамм-продуцент, полученный в результате объединения in vitro чужеродных фрагментов и содержащий новое сочетания последовательностей нуклеотидов.
Под «РНК-вакциной» в настоящем изобретении понимается вакцина на основе матричной рибонуклеиновой кислоты – вакцина, действующая часть которой – рибонуклеиновая кислота, кодирующая белок, характерный для патогена. Помимо собственно РНК в вакцине присутствует липидная оболочка, защищающая РНК от разрушения и обеспечивающая проникновение РНК в клетку.
Под «штаммом-продуцентом» в настоящем изобретении понимается искусственно полученный штамм микроорганизма, который продуцирует определенное биологически активное соединение и может быть использован в биотехнологической промышленности.
Используемые сокращения:
ГИТЦ – гуанидин-изотиоцианат,
кДНК – комплементарная ДНК,
ИПТГ – изопропил-β-D1-тиогалактопиранозид,
мРНК – матричная РНК,
миRNA – малые интреферирующие РНК,
РНП – рибонуклеопротеин,
ПААГ – поли-акриламидный гель,
ПЦР – полимеразная цепная реакция,
E. coli - Escherichia coli,
РАР – поли(А)-полимераза.
Раскрытие сущности изобретения
Настоящее изобретение относится к штамму-продуценту фермента поли(А)-полимеразы E. сoli, предназначенному для экспрессии фермента поли(А)-полимеразы, необходимого для полиаденирования при in vitro синтезе РНК, обеспечивающему экспрессию фермента поли(А)-полимеразы, необходимого для полиаденирования при in vitro синтезе РНК, отличающееся тем, что штамм обеспечивает индуцируемую высокую экспрессию целевого белка и возможность его хроматографической очистки для дальнейшего промышленного и лабораторного применения.
Таким образом, целью настоящего изобретения является получение рекомбинантного штамма-продуцента фермента поли(А)-полимеразы E. сoli BL21-РAP.
Еще одной целью настоящего изобретения является получение плазмидного вектора polyA-pET28-N6His для трансформации рекомбинантного штамма-продуцента фермента поли(А) полимеразы E. сoli BL21-РAP.
Другой целью настоящего изобретения является обеспечение применения рекомбинантного штамма-продуцента фермента поли(А) полимеразы E. сoli BL21-РAP для in vitro синтеза РНК.
Предложенное в настоящей заявке изобретение может быть применено для синтеза одноцепочечных молекул РНК in vitro - широко используемой лабораторной процедуры, которая активно используется как для научных задач по исследованию РНК, так и для получения терапевтических препаратов на основе РНК. Этот метод универсален и позволяет исследователю или разработчику адаптировать синтез РНК и вносить модификации в кодируемые последовательности для решения разных задач. Так, этот способ применим для биохимического и молекулярного анализа РНК и взаимодействия РНК-белок, а также структурного анализа комплексов, создания РНК-аптамеров, синтеза функциональных мРНК для экспрессии и создания малых РНК для изменения экспрессии генов (например, направляющие РНК). Кроме того, использование синтезированной in vitro РНК сыграло важную роль в разработке РНК-вакцин и инструментов редактирования генома CRISPR / Cas9, создании плюрипотентных стволовых клеток, а также в разработке диагностики, основанной на амплификации РНК.
В частности полученная при использовании раскрываемого в настоящем изобретении штамма-продуцента E. сoli BL21-РAP поли(А)-полимераза может применяться в пост-транскрипционном синтезе поли(A)-хвоста. Поли(А)-хвост придает стабильность мРНК и повышает эффективность трансляции в клетке. Поли(A)-хвост может быть закодирован в матрице ДНК с использованием праймера для ПЦР с соответствующим хвостом, или он может быть добавлен к уже синтезированной РНК на стадии ферментативной обработки поли(A)-полимеразой из E. coli. Длину добавленного хвоста можно регулировать титрованием поли(А)-полимеразы в реакции (Фиг. 1). Важность поли(А)-хвоста легко демонстрируется разницей в трансляции при трансфекции клеток двумя типами мРНК – полиаденилированной и с отсутствием поли(А)-хвоста. При сравнении активности люциферазы в клетках, трансфицированных эквимолярными количествами полиаденилированными и мРНК без поли(А)-хвоста, наблюдается значительное повышение эффективности трансляции (Фиг. 1).
Способы осуществления данного изобретения
Пример 1. Получение штамма-продуцента фермента поли(А)-полимеразы
Нуклеотидную последовательность, кодирующую поли(А)-полимеразу E. Coli, нарабатывают ПЦР со специфических праймеров, содержащих уникальные сайты рестрикции (SEQ ID NO: 1-2), а также последовательность, кодирующую поли гистидиновую аминокислотную, последовательность для аффинной хроматографической очистки. В качестве матрицы ПЦР используют препарат геномной ДНК E. coli MG1655, выделенной набором для выделения геномной ДНК (Transgene). Фрагмент ДНК, соответствующий требуемому гену, нарабатывают с использованием высокоточной ДНК-полимеразы Q5 (NEB). Далее этот фрагмент очищают через электрофорез в агарозном геле.
Для амплификации гена поли(А)-полимеразы используют следующие олигонуклеотиды-1:
polyA_Nco_forward
gatataccatgggacatcatcaccaccatcactttacccgagtcgctaatttttgc (SEQ ID NO: 1)
polyA_Not_reverse
ctcgagtgcggccgctcatgcggtaccctcacgacgtggtg (SEQ ID NO: 2)
Для клонирования гена поли(А)-полимеразы используют коммерчески доступный ДНК-плазмидный вектор pET-28 с N- или С-концевым 6His (шесть остатков гистидина на концевом участке целевого белка для возможности его выделения и хроматографической очистки), разработанный фирмами EMD Biosciences pET-28 a (+) или Novagen pET-28a-c(+) размером 5369 п.н. с геном канамицина для отбора трансформированных вариантов компетентных клеток штамма ВL21 (Рис.2), 5'концевой праймер Т7 5'd[TAATACGACTCACTATAGGG]3' (SEQ ID NO: 3).
Очищенный препарат ДНК-фрагмента гена поли(А)-полимеразы подвергают реакции рестрикции по двум уникальным эндонуклеазам рестрикции NcoI и NotI (NEB) при 37°С в течение 1 часа, после чего следует стадия переосаждения ДНК этанолом. Аналогично по сайтам рестрикции подготавливается плазмидная ДНК экспрессионного вектора pET28 (Фиг.2). Выделенную плазмидную ДНК гидролизуют двумя эндонуклеазами рестрикции NcoI и NotI (NEB) при 37°С в течение 1 часа. После этого гидролизованную плазмиду очищают через электрофорез в агарозном геле. Далее ставят реакцию лигирования с использованием Т4 ДНК лигазы (220°С, 1 час), реакцию лигирования останавливают прогревом при 65°С в течение 10 минут. Полученной лигазной смесью трансформируют компетентные клетки E. coli 10G, после чего инкубируют чашки с агаризованной средой LB и антибиотиком канамицином в течение ночи при 37°С до появления отдельных колоний. На следующий день проводят ПЦР анализ отдельных колоний на содержание вектора со вставкой (Фиг. 3). Из положительных колоний выделяют плазмидную ДНК и проводят реакцию секвенирования (SEQ ID NO: 4).
Для секвенирования (подтверждения получения плазмидного вектора polyA-pET28-N6His) используют следующие олигонуклеотиды-2:
pet28_seq forward: cacgatgcgtccggcgtagagg (SEQ ID NO: 5)
pet28_seq reverse: gctttgttagcagccggatctc (SEQ ID NO: 6)
polyA_seq1 forward: cactatcaacagcctgtattacag (SEQ ID NO: 7)
После анализа результатов сиквенса отбирают корректные образцы плазмидной ДНК. Далее отобранные генетические конструкции используют для трансформации штамма для продукции рекомбинантных белков в культуре E. coli. Штамм E. coli BL21 (DE3), предназначенный для продукции рекомбинантных белков, трансформируют (химически либо с использованием электропорации) полученной генетической конструкцией, кодирующей фермент поли(А)-полимеразу E. coli. Получают штамм-продуцент BL21-РAP, производящий поли(А)-полимеразу.
Пример 2. Осаждение биомассы штамма-продуцента BL21-РAP, выделение и очистка поли(А)-полимеразы.
Трансформационную смесь высевают на чашки Петри с агаризованной средой LB c соответствующим антибиотиком для селекции (канамицин) и инкубируют ночь при 37°С до появления единичных колоний. Далее единичные колонии инокулируют в 5 мл жидкой среды LB с антибиотиком (канамицин) и инкубируют ночь при 37°С на шейкере (180 об/мин). Через 12 часов после достижения указанного параметра OD = 0,4-0,6 в реактор вносят ИПТГ до конечной концентрации 2мМ. После достижении оптической плотности культуры 1-1,2 через 7-8 часов осаждают биомассу центрифугированием до 5000g в течение 30 мин при 4°С. Лизис бактериальных клеток осуществляют в буфере (Трис 50 мМ, рН 8, NaCl, 500 mM) на льду, разрушение клеток осуществляют ультразвуком в течение 30-40 секунд с охлаждением при 4°С. Полученный лизат центрифугируют (10 000g, 40 мин, при 4°С) для избавления от клеточного дебриса. Далее супернатант наносят на колонку с сорбентом Ni-NTA, предварительно промытую буфером (Трис 50 мМ, рН 8, NaCl 500 mM). Фермент элюируют линейным либо ступенчатым градиентом концентрации имидазола (20 мМ-500 мМ) в том же буфере. Собранные хроматографические фракции, содержащие максимальный уровень белка, объединяют, подвергают диализу против буфера для хранения с глицерином и хранят при -20°С. Электрофорез в ПААГ проводят по стандартной методике Лэммли. Для белкового электрофореза в денатурирующих условиях используется 8-12 масс.% ПААГ. К белковому препарату добавляют двукратный объем Sample буфера (250 мМ Трис-HCl (pH 6.8), 6 масс.% SDS, 2% меркаптоэтанол, 16 масс.% глицерин, 0.05% бромфеноловый синий), раствор тщательно перемешивают и выдерживают в кипящей водяной бане в течение 5 мин. Окраску геля проводят с использованием Кумасси (бриллиантового синего R-250). Электрофорез проводится в трис-глициновом буфере (10х 1 масс.% SDS 0.25М Трис- OH - 30 г/л, 1.86 М глицин - 140г/л) на приборе фирмы ”Bio-Rad” (CША).
Результаты получения очищенного хроматографически на никель-агарозе и элюированного в градиенте концентрации имидазола белка поли(А)-полимеразы (SEQ ID NO: 8) представлены на Фиг. 4.
Список литературы:
1. Cao G. J., Sarkar N. Identification of the gene for an Escherichia coli poly (A) polymerase //Proceedings of the National Academy of Sciences. – 1992. – Т. 89. – №. 21. – С. 10380-10384;
2. Paschal B. M. et al. RNA polymerases // Current Protocols in Molecular Biology. – 2008. – Т. 84. – №. 1. – С. 3.8. 1-3.8. 8;
3. Lingner J., Kellermann J., Keller W. Cloning and expression of the essential gene for poly (A) polymerase from S. cerevisiae // Nature. – 1991. – Т. 354. – №. 6353. – С. 496-498;
4. Gebauer F., Richter J. D. Cloning and characterization of a Xenopus poly (A) polymerase // Molecular and Cellular Biology. – 1995. – Т. 15. – №. 3. – С. 1422-1430;
5. RU 2001101147 А, (БАСФ АКЦИЕНГЕЗЕЛЬШАФТ), 27.12.2002;
6. US 5262311 A, (DANA FARBER CANCER INST INC), 16.11.2993;
7. EP 1512743 A1, (ODENTHAL MARGARETE; BREUHAHN KAI DR; FRIES JOCHEN W U DR), 09.03.2005;
8. CN 114032285 A, (BEIJING TSINGKE BIOTECHNOLOGY CO., LTD.; BEIJING ZIXI BIOTECHNOLOGY CO., LTD.), 11.02.2022;
9. KR 20190106354 A, (ENZYNOMICS CO., LTD.), 18.09.2019;
10. CN 113614228 A, (BIOO SCIENTIFIC CORPORATION), 05.11.2021;
11. CN 114736951 A, (SHENZHEN UNIVERSITY), 12.07.2022;
12. CN 110218753 A, (HUBEI AIJI LAISI BIOTECHNOLOGY CO., LTD.), 10.09.2019.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Перечень
последовательностей в машиночитаемом виде.xml" softwareName="WIPO
Sequence" softwareVersion="2.2.0" productionDate="2023-01-13">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022133433</ApplicationNumberText>
<FilingDate>2022-12-20</FilingDate>
</ApplicationIdentification>
<ApplicantName languageCode="ru">Автономная некоммерческая
образовательная организация высшего образования
"Научно-технологический университет
"Сириус"</ApplicantName>
<ApplicantNameLatin>Sirius University of Science and
Technology</ApplicantNameLatin>
<InventionTitle languageCode="ru">Штамм-продуцент фермента поли(А)
полимеразы E. coli</InventionTitle>
<SequenceTotalQuantity>8</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>56</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..56</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gatataccatgggacatcatcaccaccatcactttacccgagtcgctaa
tttttgc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>41</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..41</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ctcgagtgcggccgctcatgcggtaccctcacgacgtggtg</INSDSe
q_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>taatacgactcactataggg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>1398</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1398</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgtttacccgagtcgctaatttttgccgcaaggtgctaagccgcgagg
aaagcgaggctgaacaggcagtcgcccgtccacaggtgacggtgatcccgcgtgagcagcatgctatttc
ccgcaaagatatcagtgaaaatgccctgaaggtaatgtacaggctcaataaagcgggatacgaagcctgg
ctggttggcggcggcgtgcgcgacctgttacttggcaaaaagccgaaagattttgacgtaaccactaacg
ccacgcctgagcaggtgcgcaaactgttccgtaactgccgcctggtgggtcgccgtttccgtctggctca
tgtaatgtttggcccggagattatcgaagttgcgaccttccgtggacaccacgaaggtaacgtcagcgac
cgcacgacctcccaacgcgggcaaaacggcatgttgctgcgcgacaacattttcggctccatcgaagaag
acgcccagcgccgcgatttcactatcaacagcctgtattacagcgtagcggattttaccgtccgtgatta
cgttggcggcatgaaggatctgaaggacggcgttatccgtctgattggtaacccggaaacgcgctaccgt
gaagatccggtacgtatgctgcgcgcggtacgttttgccgccaaattgggtatgcgcatcagcccggaaa
ccgcagaaccgatccctcgcctcgctaccctgctgaacgatatcccaccggcacgcctgtttgaagaatc
gcttaaactgctacaagcgggctacggttacgaaacctataagctgttgtgtgaatatcatctgttccag
ccgctgttcccgaccattacccgctacttcacggaaaatggcgacagcccgatggagcggatcattgaac
aggtgctgaagaataccgatacgcgtatccataacgatatgcgcgtgaacccggcgttcctgtttgccgc
catgttctggtacccactgctggagacggcacagaagatcgcccaggaaagcggcctgacctatcacgac
gctttcgcgctggcgatgaacgacgtgctggacgaagcctgccgttcactggcaatcccgaaacgtctga
cgacattaacccgcgatatctggcagttgcagttgcgtatgtcccgtcgtcagggtaaacgcgcatggaa
actgctggagcatcctaagttccgtgcggcttatgacctgttggccttgcgagctgaagttgagcgtaac
gctgaactgcagcgtctggtgaaatggtggggtgagttccaggtttccgcgccaccagaccaaaaaggga
tgctcaacgagctggatgaagaaccgtcaccgcgtcgtcgtactcgtcgtccacgcaaacgcgcaccacg
tcgtgagggtaccgcatga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cacgatgcgtccggcgtagagg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>22</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..22</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q12">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gctttgttagcagccggatctc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>24</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..24</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q14">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cactatcaacagcctgtattacag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="8">
<INSDSeq>
<INSDSeq_length>465</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..465</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q16">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Escherichia coli</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MFTRVANFCRKVLSREESEAEQAVARPQVTVIPREQHAISRKDISENAL
KVMYRLNKAGYEAWLVGGGVRDLLLGKKPKDFDVTTNATPEQVRKLFRNCRLVGRRFRLAHVMFGPEIIE
VATFRGHHEGNVSDRTTSQRGQNGMLLRDNIFGSIEEDAQRRDFTINSLYYSVADFTVRDYVGGMKDLKD
GVIRLIGNPETRYREDPVRMLRAVRFAAKLGMRISPETAEPIPRLATLLNDIPPARLFEESLKLLQAGYG
YETYKLLCEYHLFQPLFPTITRYFTENGDSPMERIIEQVLKNTDTRIHNDMRVNPAFLFAAMFWYPLLET
AQKIAQESGLTYHDAFALAMNDVLDEACRSLAIPKRLTTLTRDIWQLQLRMSRRQGKRAWKLLEHPKFRA
AYDLLALRAEVERNAELQRLVKWWGEFQVSAPPDQKGMLNELDEEPSPRRRTRRPRKRAPRREGTA</IN
SDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к биотехнологии. Предложены рекомбинантная плазмида, кодирующая поли(А)-полимеразу, и рекомбинантная бактерия Escherichia coli, продуцирующая фермент поли(А)-полимеразу, кодируемый SEQ ID NO: 4, и трансформированная указанной рекомбинантной плазмидой. Также предложено применение указанной рекомбинантной бактерии в in vitro синтезе поли(А)-полимеразы. Изобретение обеспечивает высокую экспрессию целевого белка. 3 н.п. ф-лы, 3 ил., 2 пр.
1. Рекомбинантная плазмида, кодирующая поли(А)-полимеразу, содержащая элементы:
- участок начала репликации вектора pBR322 origin;
- ген маркера антибиотикоустойчивости KanR;
- регулятор копийности вектора ROP;
- репрессор экспрессии гена PAP lacl;
- последовательность промотора T7 (T7promoter);
- последовательность, кодирующую полигистидиновый хвост N6His.
- последовательность SEQ ID NO:4, кодирующую поли(А)-полимеразу (PAP);
- терминаторную последовательность транскрипции T7 terminator.
2. Рекомбинантная бактерия Escherichia coli, продуцирующая фермент поли(А)-полимеразу, кодируемый SEQ ID NO:4, и трансформированная рекомбинантной плазмидой по п. 1.
3. Применение рекомбинантной бактерии по п. 2 в in vitro синтезе поли(А)-полимеразы.
| CAO G.-J | |||
| et al | |||
| Identification of the coding region for a second poly(A) polymerase in Escherichia coli | |||
| Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Пружинный матрац | 1928 |
|
SU11580A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| LINGNER J | |||
| et al | |||
| Cloning and expression of the essential gene for poly(A) polymerase from S | |||
| cerevisiae | |||
| Nature, 1991, 354(6353), | |||
Авторы
Даты
2024-08-26—Публикация
2022-12-20—Подача