Введение
Рак представляет собой многофакторное заболевание, при котором группа клеток демонстрирует неконтролируемый рост, инвазию, при которой происходит проникновение и разрушение соседних тканей, и иногда метастаз или распространение на другие участки в организме через лимфу и кровь. Данные три свойства злокачественности раковых заболеваний отличают их от доброкачественных опухолей, которые не осуществляют инвазии или не дают метастазы.
Существует целый ряд способов, используемых в настоящее время для лечения каждого типа рака, включая оперативное вмешательство, лучевую терапию, химиотерапию, таргетную терапию и иммунотерапию. Успешная терапия рака направлена на первичную опухоль и на любые метастазы, будь то клинически выраженные или видимые только в микроскоп.
Для пациента крайне важно как можно раньше идентифицировать тип рака, подлежащего лечению. Рак, который диагностирован на ранней стадии, более вероятно будет успешно вылечен. Если рак распространится, эффективное лечение становится сложнее, и обычно шансы выжить гораздо ниже. Таким образом, крайне необходимо знать, когда незамедлительно использовать протокол тяжелого и интенсивного лечения для предотвращения распространения агрессивного рака.
В настоящее время, выбор лечения в случае солидных опухолей зависит от стадирования опухоли, которое обычно проводят, используя анализ Опухоли/Узла/Метастаза (TNM - от англ. Tumour/Node/Metastasis) от Американского объединенного комитета по изучению рака (AJCC - от англ. American Joint Committee on Cancer). Обычно считается, что хотя данный анализ и система стадирования обеспечивает ценную информацию, касающуюся стадии, на которой солидная опухоль была диагностирована у пациента, она является неточной и недостаточной. В частности, она ограничивается солидными опухолями.
Самым главным является то, что анализ TNM не может идентифицировать самые ранние стадии прогрессирования опухолей. Данные ранние стадии предлагают наиболее обнадеживающее окно для терапии. Выявление рака в самом начале его развития делает возможной таргетную, эффективную терапию с уменьшенными побочными эффектами. Таким образом, важно идентифицировать пациентов по возможности на самой ранней стадии в рамках осуществления скрининга целой популяции. Таким образом, рак может быть идентифицирован у сообщества рано, что делает возможным более раннее вмешательство и лечение с уменьшением смертности и страдания от указанного заболевания.
Заявителем недавно разработан диагностический анализ на основе выявления прогастрина. Отобранные антитела использовали для проведения анализа ELISA (от англ. enzyme-linked immunosorbent assay - твердофазный иммуноферментный анализ) для выявления прогастрина в крови пациентов с разными типами рака и на разных стадиях. Данный анализ, коммерциализированный под названием CancerRead, особенно эффективен для выявления разных типов рака, включая ранние стадии (WO 2017/114973). Примечательно, анализ CancerRead демонстрирует высокую чувствительность и специфичность в отношении опухолей ранней стадии.
Однако, даже при том что уровень прогастрина в крови является надежным биомаркером для осуществления скрининга начальной стадии рака, он не дает информации относительно первичного очага рака.
Таким образом, существует реальная необходимость в реагентах, делающих возможной in vivo идентификацию рака, таким образом, чтобы соответствующая терапия могла быть предоставлена по возможности на самой ранней стадии.
Описание
Настоящее изобретение относится к производному прогастрина для визуализации рака у пациента.
В первом аспекте настоящее изобретение относится к соединению или его фармацевтически приемлемой соли, причем указанное соединение содержит:
- группировку прогастрина, и
- хелатирующую группировку,
где указанная хелатирующая группировка возможно ассоциирована с радиоактивным изотопом.
В предпочтительном воплощении группировка прогастрина и хелатирующая группировка ковалентно связаны. Согласно данному воплощению настоящее соединение представляет собой конъюгат.
Соединения по изобретению особенно полезны, поскольку они способны связываться с раковыми клетками in vivo, таким образом, обеспечивая визуализацию указанного рака. Это особенно полезно для идентификации локализации рака. Примечательно, радиоактивно меченный прогастрин используют для визуализации потока посредством разных технологий, таких как однофотонная эмиссионная компьютерная томография (SPECT - от англ. Single Photon Emission Computed Tomography) и позитронно-эмиссионная томография (PET - от англ. Positron Emission Tomography).
Термин «прогастрин» в данном документе относится к пептиду млекопитающего прогастрин. Прогастрин образуется посредством отщепления первых 21 аминокислоты (сигнальный пептид) от препрогастрина, пептида из 101 аминокислоты (референс аминокислотной последовательности: ААВ19304.1), который представляет собой первичный продукт трансляции гена гастрина. Цепь прогастрина из 80 аминокислот дополнительно обрабатывают ферментами расщепления и модифицирующими ферментами до нескольких биологически следующих активных форм гормона гастрин: гастрин 34 (G34) и глицин-удлиненный гастрин 34 (G34-Gly), содержащие аминокислоты 38-71 прогастрина, гастрин 17 (G17) и глицин-удлиненный гастрин 17 (G17-Gly), содержащие аминокислоты 55-71 прогастрина.
В предпочтительном воплощении производное прогастрина представляет собой производное человеческого прогастрина. Более конкретно, выражение «человеческий прогастрин» относится к человеческому прогастрину последовательности SEQ ID No. 1. Человеческий прогастрин содержит в частности N-концевой и С-концевой домен, оба из которых не присутствуют в биологически активных формах гормона гастрин, упомянутых выше. Предпочтительно, последовательность указанного N-концевого домена представлена SEQ ID NO. 2. В другом предпочтительном воплощении последовательность указанного С-концевого домена представлена SEQ ID NO. 3.
Клетки, продуцирующие гастрин, в природе продуцируют прогастрин, который созревает до гастрина. Во время расщепления 95% прогастрина высвобождается из клетки в виде гастрина. Очень маленькое количество прогастрина высвобождается в виде прогастрина. Следовательно, за исключением периода расщепления, здоровый человек не имеет прогастрина в своей крови.
С другой стороны, при патологических состояниях прогастрин становится маркером ранней стадии. В опухолевых клетках прогастрин не созревает до гастрина и, как следствие, высвобождается из опухолевой клетки. Прогастрин может стимулировать онкогенез (например, рак желудка [Burkitt et al., World J Gastroenterol. 15(1): 1-16, 2009, WO 2017/114975], толстой кишки [Watson et al., J Cancer. 87(5): 567-573, 2002], поджелудочной железы [Harris et al., Cancer Res. 64(16): 5624-5631, 2004, WO 2011/083091], яичника [WO 2017/114972], предстательной железы [WO 2018/178352], пищевода [WO 2017/114976] и легкого [WO 2018/178354]) аутокринным, паракринным или эндокринным образом (Dimaline & Varro, J Physiol 592(Pt.14): 2951-2958, 2014), что также служит основанием считать прогастрин предпочтительной противоопухолевой мишенью при раковых заболеваниях с экспрессией данных факторов стимуляции (см., например, WO 2011/045080, WO 2011/083088, WO 2011/116954, WO 2012/013609, WO 2011/083090, WO 2011/083091, WO 2017/114975, WO 2017/114976, WO 2017/114972, WO 2018/178364). Данный процесс не зависит от расщепления.
Термины «хелатирующая группировка» или «хелатирующий агент» или «хелатор», в том виде, в котором они используются в данном документе, относятся к соединению, которое способно хелатировать любой из данных радиоактивных изотопов. Хелатирующая группировка секвестрирует соответствующие свободные радиоактивные изотопы из водных растворов, таким образом, делая возможным применение указанных изотопов для конкретных биологических применений. Предпочтительно, указанная хелатирующая группировка представляет собой бифункциональный хелатор. Термин «бифункциональный хелатор» или «бифункциональный хелатирующий агент», в том виде, в котором он используется в данном документе, относится к соединению, обладающему функцией металл-связывающей группировки и химически реакционноспособной функциональной группой.
В данной области известно множество бифункциональных хелаторов. Большое число из них на самом деле имеются в продаже и широко используются в качестве средств РЕТ-визуализации. Структура и физические свойства варьируют среди бифункциональных хелаторов. Специалист в данной области выберет наиболее подходящий бифункциональный хелатор для использования с группировкой прогастрина, при этом, принимая во внимание используемый радиоактивный изотоп (см., например, Cutler et al., Chem Rev. 113(2): 858-883, 2013; Price & Orvig, Chem. Soc. Rev. 43(1): 260-290, 2013; Tornesello et al., Molecules 22: E1282, 2017; Brandt et al., J Nucl Med 59(10): 1500-1506, 2018; Morais & Ma, Drug Discovery Today: Technologies, 2018, DOI: 10.1016/j.ddtec.2018.10.002).
Примеры бифункциональных хелатирующих агентов представлены в Таблице 1.

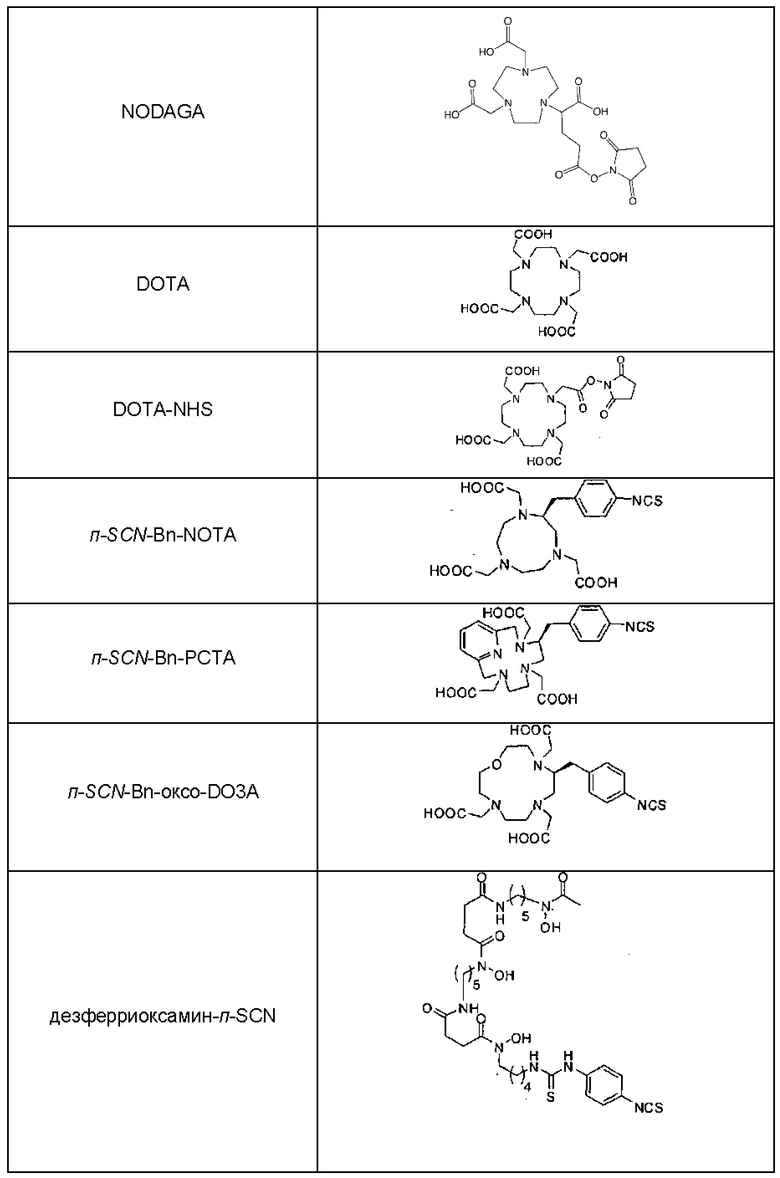
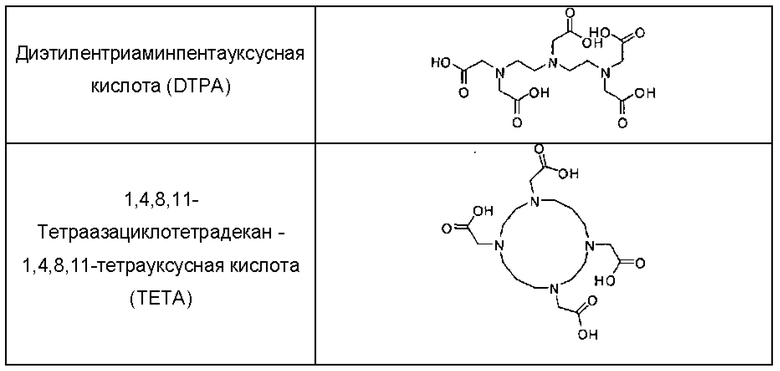
Таким образом, бифункциональный хелатор предпочтительно выбран из списка NODAGA, NOTA, DOTA, DOTA-NHS, п-SCN-Bn-NOTA, п-SCN-Bn-PCTA, п-SCN-Bn-оксо-D03A, дезферриоксамин-п-SCN, DTPA и ТЕТА.
DOTA, NOTA и NOGADA представляют собой широко используемые бифункциональные хелаторы, в особенности для 68Ga-мечения. Таким образом, быстрое и количественное 68Ga-радиоактивное мечение биомолекул может быть достигнуто посредством использования хорошо-известных хелаторов, таких как DOTA, NOTA и NOGADA.
В частности, показали, что хелатирующий агент DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота) (или его модифицированные производные) является превосходным лигандом для связывания галлия; и DOTA-пептиды могут быть быстро и эффективно мечены 68Ga при высоких удельных активностях (Velikyan, Molecules, 20: 12913-12943, 2015). Аналогично, широко используют диэтилентриаминпентауксусную кислоту (DTPA) и ее производное. Например, 1B4M-DTPA, также известный как MX-DTPA или тиуксетан, разработан в качестве компонента хелатирующего агента Зевалина для радиоактивного мечения либо 1111п, либо 90Y (Brechbiel, Q J Nucl Med Mol imaging. 52(2): 166-173, 2008).
Обычно считают, что NOTA (1,4,7-триазациклононан-1,4,7-триуксусная кислота) представляет собой «золотой стандарт» для Ga3+ хелатирования, обладающий благоприятными условиями для радиоактивного мечения (КТ (комнатная температура), 30-60 минут) и превосходной стабильностью in vivo. В действительности, хорошо известно, что NOTA и производные образуют очень стабильные комплексы с 68Ga и с 64Cu.
Производные NOTA, особенно NODAGA (1,4,7-триазациклононан-1-глутаровая кислота-4,7-диуксусная кислота), как оказалось, являются более подходящими для хелатирования иона 68Ga, чем производные DOTA. NODAGA особенно полезна для 68Ga- и 64Cu-мечения ввиду высокой гидрофильности и стабильности in vivo ее 68Ga- и 64Cu-хелатов. Клинические исследования продемонстрировали, что радиоактивные индикаторы, содержащие [68Ga]NODAGA, хорошо переносятся без неблагоприятных воздействий у пациентов, связанных с лекарственным средством (см., например, Haubner et al., EurJNucI Med Moi imaging 43:2005-2013, 2016; Kumar et al., J Nucl Med 57(suppl. 2): 1171,2016; Ben Azzouna et al., Endocrine Abstracts 47: OC4, 2016). В действительности, [68Ga]NODAGA, по-видимому, особенно подходит для визуализации опухоли in vivo (см., например, Oxboel et al., Nucl Med Biol. 41(3):259-267, 2014; Kumar et al., J Nucl Med 57(suppl. 2): 675, 2016; Kumar et al., J Nucl Med 57(suppl. 2): 1171, 2016; Kumar et al., J Nucl Med 57(suppl. 2): 1298, 2016;Tornesello et al., Molecules 22: E1282, 2017). NODAGA имеется в продаже от разных поставщиков в виде сложных эфиров NODAGA-NHS, делающих возможной простую биоконъюгацию с амином группировки прогастрина.
Предпочтительно, хелатирующий агент выбран из DOPA, NOTA и NODAGA. Наиболее предпочтительно, хелатирующий агент представляет собой NODAGA.
Термин «радиоактивный изотоп», в том виде, в котором он используется в данном документе, представляет собой версию химического элемента, которая имеет неустойчивое ядро и испускает излучение во время своего превращения в стабильную форму. Радиоактивные изотопы имеют важные применения в медицинской диагностике, лечении и исследовании. Радиоактивный изотоп настоящих соединений предпочтительно выбран из списка, состоящего из 68Ga, 64Cu, 89Zr, 186/188Re, 90Y, 177Lu, 153Sm, 213Bi, 225Ac, 111ln, 99mTc, 123I или 223Ra. Данные радиоактивные изотопы являются особенно преимущественными, благодаря своему большому периоду полураспада и маленькому размеру, что делает их особенно подходящими для PET/SPECT-визуализации. Более предпочтительно, радиоактивный изотоп представляет собой 68Ga или 64Cu. Даже более предпочтительно, указанный радиоактивный изотоп представляет собой 68Ga.
Преимущества 68Ga в сравнении с другими радионуклидами PET включают главным образом его доступность из внутреннего генератора, независимо от местного циклотрона (Shukla & Mittal, J Postgrad Med Edu Res 47(1): 74-76, 2013). Таким образом, он может быть экономически эффективным и его можно непрерывно получать посредством имеющегося в продаже 68Ge/68Ga генератора, удовлетворяя потребность в близости PET центров с циклотронами, необходимой для продукции, например, 18F. Способ распада радионуклида приводит к получению изображений позитронно-эмиссионной томографии (PET) высокого качества и обеспечивает точную количественную оценку. Кроме того, короткий физический период полураспада 68Ga (t1/2 составляет 68 мин) обеспечивает улучшенную дозиметрию и повторную визуализацию, что делает данные агенты идеальными для клинического применения. Примечательно, данный период полураспада облегчает визуализацию вскоре после введения при уменьшенном воздействии на пациента. Маленькие соединения, биологические макромолекулы, а также нано- и микрочастицы, были успешно мечены 68Ga, и полученные агенты демонстрировали многообещающую способность визуализации доклинически и клинически (см., например, Beylergil et al., Nucl Med Commun. 34(12): 1157-1165,2013).
Другие воплощения раскрытия включают фармацевтически приемлемые соли соединений, описанных в любом из ранее приведенных воплощений. В том виде, в котором он используется в данном документе, термин «фармацевтически приемлемые соли» относится к производным раскрытых соединений, где исходное соединение модифицировано в результате получения его нетоксичных кислых или основных солей. Примеры фармацевтически приемлемых солей включают соли неорганической или органической кислоты основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты и т.п., но не ограничиваются ими. Фармацевтически приемлемые соли включают традиционные нетоксичные соли или четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот.Например, традиционные нетоксичные кислые соли включают соли, полученные из неорганических кислот, таких как соляная, бромоводородная, серная, сульфаминовая, ортофосфорная, азотная и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памоевая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, метансульфоновая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтионовая, НООС-(СН2)n-СООН, где n представляет собой 0-4, и т.п. Фармацевтически приемлемые соли по настоящему раскрытию можно синтезировать из исходного соединения, которое содержит основную или кислотную группировку, посредством традиционных химических способов. Обычно, такие соли могут быть получены в результате взаимодействия форм свободной кислоты данных соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид Na, Са, Mg или K, карбонат, бикарбонат или т.п.) или в результате взаимодействия форм свободного основания данных соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводят в воде или в органическом растворителе или в их смеси. Обычно используют неводные среды, подобно простому эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу, при наличии возможности. Списки дополнительных подходящих солей могут быть найдены, например, в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, p.1418 (1985).
В другом аспекте согласно настоящему изобретению предложен способ получения соединения по изобретению. Указанный способ включает следующие стадии:
а) осуществление конъюгации амин-реактивной хелатирующей группировки с группировкой прогастрина; и
б) выделение конъюгата прогастрина и хелатора.
Амин-реактивные хелатные структуры для радиоактивного изотопа, описанного в данном документе, имеются в продаже, такие как, например, сложные эфиры DOTA-NHS, NOTA-NHS и NODAGA-NHS. Предпочтительно, указанная амин-реактивная хелатирующая группировка представляет собой сложный эфир NODAGA-NHS. Специалисту в данной области хорошо известно, что сложные NHS-эфиры (сложные N-гидроксисукцинимидные эфиры) будут взаимодействовать с первичными аминами на N-конце и в боковой цепи аминокислотных остатках лизина (Lys, К) остатков прогастрина, и, таким образом, не требуется подробного описания в данном документе.
Предпочтительно, способ получения соединения по изобретению дополнительно включает стадию:
в) инкубирования конъюгата прогастрина и хелатора с комплементарным радиоактивным изотопом;
что, таким образом, приводит к образованию соединения по изобретению.
В другом аспекте согласно настоящему изобретению предложен способ визуализации одной или более клеток, органов или тканей посредством подвергания клетки воздействию или введения в организм эффективного количества соединения, где соединение включает изотоп-металл, подходящий для визуализации. Визуализацию можно проводить посредством любой подходящей методики, известной специалисту в данной области, в особенности PET или SPECT.
SPECT и PET представляют собой функциональные методики визуализации, используемые для локализации метаболических процессов. Радионуклид, продуцируемый или из циклотрона, или генератора, присоединен к биологически активной молекуле, образуя радиоактивный индикатор PET. Изотопы, которые в настоящее время используются в исследованиях SPECT/PET-визуализации, являются привлекательными и возможно лучшими альтернативными вариантами 18F. 68Ga, 64Cu, 89Zr, 186/188Re, 90Y, 177Lu, 153Sm, 213Bi, 225Ac или 223Ra являются доступными изотопами, которые оцениваются в отношении РЕТ-визуализации из-за их свойств легких металлов и способности связываться с хелатирующими агентами.
Позитронно-эмиссионная томография (PET) представляет собой ядерную медицину, функциональную методику визуализации, которая дает трехмерное изображение функциональных процессов в организме. PET используют для локализации метаболических процессов. Позитронно-активный радионуклид, полученный либо из циклотрона, либо из генератора, присоединен к биологически активной молекуле, образуя радиоактивный индикатор PET, такой как, например, соединения, описанные в данном документе. Радиоактивный индикатор PET затем вводят пациенту посредством инъекции, перорального введения или ингаляции. Система выявляет пары гамма-лучей, непрямо испускаемых радионуклидом (индикатором), который вводят в организм на радиоактивном индикаторе. Трехмерные изображения концентрации индикатора в организме затем конструируют посредством компьютерного анализа. В современных сканерах РЕТ-СТ (от англ. computer tomography - компьютерная томография) трехмерную визуализацию часто выполняют с помощью СТ-сканирования рентгеновскими лучами, проводимого на пациенте за один и тот же сеанс, на одном и том же приборе. Сразу после введения радиоактивного индикатора PET, пациента размещают таким образом, чтобы детекторы могли регистрировать падающие гамма-лучи, фотоны 2 511 кэВ, движущиеся в противоположных направлениях, продуцируемые, когда радионуклид распадается, приводя к событию аннигиляции из позитрона, в сочетании с электроном после прохождения короткого расстояния. Электроника детектора синхронизирована таким образом, что 2 испускаемых фотона выявляют на противоположных сторонах и называют совпадающими, и, таким образом, должно быть происходят из одного и того же события аннигиляции. Данные совпадающие проекции относят к линии ответа и затем реконструируют, используя стандартные методики томографии для идентификации положения события аннигиляции. Используя современную информацию о «времени пролета» при реконструкции изображения PET с очень быстрыми сцинтилляторами, источник события аннигиляции вдоль линии ответа выявляют с улучшенной точностью.
Радионуклиды, используемые в РЕТ-сканировании, обычно представляют собой изотопы с короткими периодами полураспада, такие как 11С (примерно 20 мин), 13N (примерно 10 мин), 150 (примерно 2 мин), 18F (примерно 110 мин) или 82Rb (примерно 1,27 мин). Радиоактивные изотопы, описанные выше, а именно список, состоящий из 68Ga, 64Cu, 89Zr, 186/188Re, 90Y, 177Lu, 153Sm, 213Bi, 225Ас или 223Ra, также широко используются в PET. В связи с этим, как указано выше, 68Ga является особенно преимущественным за счет его периода полураспада 68 минут. Данные радионуклиды включают либо в соединения, обычно используемые организмом, такие как глюкоза (или аналоги глюкозы), вода или аммоний, или в молекулы, которые связываются с рецепторами или другими сайтами, включая прогастрин. Такие меченые соединения известны как радиоактивные индикаторы. РЕТ-технология может быть использована для отслеживания биологического пути любого соединения в живом человеке (и также многих других видах), при условии, что оно может быть радиоактивно мечено изотопом PET. В частности, как описано ниже, РЕТ-технологию можно использовать для выявления рака у живого человека посредством визуализации радиоактивно меченного зонда, который специфично связывается с раковыми клетками, такого как соединение, описанное в данном документе.
Благодаря коротким периодам полураспада большинства позитронно-активных радиоактивных изотопов, радиоактивные индикаторы традиционно получали, используя циклотрон в непосредственной близости с оборудованием для РЕТ-визуализации. Период полураспада фтора-18 является достаточно продолжительным, чтобы радиоактивные индикаторы, меченные фтором-18, могли быть изготовлены в промышленном масштабе за пределами площадки и отправлены в центры визуализации. С другой стороны, 68Ga можно получать в генераторе, таким образом, освобождаясь от необходимости в циклотроне (Velikyan, Molecules 20: 12913-12943, 2015). Кроме того, период полураспада галлия-68 близок к периоду полураспада 18F, что делает данный радионуклид особенно полезным для РЕТ-визуализации.
Однофотонная эмиссионная компьютерная томография (SPECT) представляет собой методику визуализации ядерной медицины, похожую на PET. В ней также используется радиоактивно меченный индикатор, и она основана на выявлении гамма-лучей. В отличие от PET, радиоактивная метка, используемая в SPECT, испускает гамма-излучение, которое непосредственно измеряется.
Воплощения изобретения включают соединение по настоящему изобретению для применения в способах визуализации одной или более клеток, органов или тканей, включающих подвергание клеток воздействию или введение субъекту эффективного количества соединения с изотопной меткой, подходящей для визуализации. В некоторых воплощениях один или более органов или тканей включают ткань предстательной железы, ткань почки, ткань мозга, сосудистую ткань или опухолевую ткань. Клетки, органы или ткани могут быть визуализированы в пределах организма, или посредством визуализации всего тела, или посредством визуализации, проводимой во время операции, или могут быть удалены из организма для визуализации.
В другом воплощении способ визуализации подходит для визуализации рака, опухоли или новообразования. В том виде, в котором он используется в данном документе, термин «рак» относится к или описывает физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемой пролиферацией клеток. Подразумевается, что термины «рак» и «раковый», в том виде, в котором они используются в данном документе, охватывают все стадии данного заболевания. Термин «рак», в том виде, в котором он используется в данном документе, представляет собой любое злокачественное новообразование, являющееся результатом нежелательного роста, инвазии и в определенных условиях метастазирования поврежденных клеток в организме. Клетки, порождающие рак, генетически нарушены и обычно утеряли свою способность контролировать клеточное деление, поведение миграции клеток, статус дифференцировки и/или механизм гибели клеток. При большинстве раковых заболеваний образуется опухоль, но при некоторых видах рака гемопоэтических тканей, таких как лейкоз, - не образуется. Рак обычно образуется в первичном очаге, порождая первичный рак. Рак, который распространяется локально, или до удаленных частей тела, называют метастазом.
Таким образом, «рак», в том виде, в котором он используется в данном документе, может включать как доброкачественные, так и злокачественные опухоли. Термин «рак», в том виде, в котором он используется в данном документе, может также включать как первичные, так и метастатические раковые заболевания. Примеры рака включают карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные образования, но не ограничиваются ими. Более конкретно, рак согласно настоящему изобретению выбран из группы, включающей следующие виды рака: плоскоклеточный рак (например, плоскоклеточный рак эпителия), рак легкого, включая мелкоклеточный рак легкого, не мелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, рак ротоглотки, рак носоглотки, рак гортани, рак брюшной полости, рак пищевода, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта и гастроинтестинальную стромальную опухоль, рак поджелудочной железы, глиобластома, рак головного мозга, рак нервной системы, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочевыводящих путей, гепатома, рак молочной железы, рак толстой кишки, рак прямой кишки, рак толстой и прямой кишки, карцинома эндометрия или матки, карцинома слюнной железы, рак почки или ренальный рак, рак предстательной железы, рак желчного пузыря, рак вульвы, рак яичка, рак щитовидной железы, саркома Капоши, карцинома печени, карцинома анального канала, карцинома полового члена, немеланомный рак кожи, меланома, меланома кожи, поверхностная распространяющаяся меланома, лентиго-меланома, акральные лентигинозные меланомы, узелковые меланомы, множественная миелома и В-клеточная лимфома (включая лимфому Ходжкина; неходжкинскую лимфому, такую как, например, низкодифференцированная фолликулярная неходжкинская лимфома (NHL - от англ. non-Hodgkin's lymphoma); мелкоклеточная лимфоцитарная (SL - от англ. small lymphocytic) NHL; среднедифференцированная фолликулярная NHL; среднедифференцированная диффузная NHL; высокодифференцированная иммунобластная NHL; высокодифференцированная лимфобластная NHL; высокодифференцированная мелкоклеточная NHL с нерасщепленным ядром; NHL с массивным поражением; мантийноклеточная лимфома; СПИД-ассоциированная лимфома; и макро глобул и немия Вальденстрема); хронический лимфоцитарный лейкоз (CLL - от англ. chronic lymphocytic leukaemia); острый лимфобластный лейкоз (ALL - от англ. acute lymphoblastic leukaemia); волосатоклеточный лейкоз; хронический миелобластный лейкоз (CML - от англ. chronic myeloblasts leukaemia); острый миелобластный лейкоз (AML - от англ. acute myeloblasts leukaemia); и посттрансплантационное лимфопролиферативное расстройство (PTLD - от англ. post-transplant lymphoproliferative disorder), а также аномальная пролиферация сосудов, ассоциированная с факоматозом, отечностью (как например, пролиферация, ассоциированная с опухолями головного мозга), синдромом Мейгса, а также рак головы и шеи, включая рак губы и полости рта, и ассоциированные метастазы.
В предпочтительном воплощении указанный рак представляет собой рак легкого, рак губы и полости рта, рак ротоглотки, рак носоглотки, рак гортани, предстательной железы, рак пищевода, рак желчного пузыря, рак печени, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта и гастроинтестинальную стромальную опухоль, рак поджелудочной железы, лимфому Ходжкина, неходжкинскую лимфому, лейкоз, множественную миелому, саркому Капоши, рак почки, рак мочевого пузыря, рак толстой кишки, рак прямой кишки, рак толстой и прямой кишки, гепатому, карциному печени, карциному анального канала, рак щитовидной железы, немеланомный рак кожи, меланому кожи, рак головного мозга, рак нервной системы, рак яичка, рак шейки матки, рак матки, рак эндометрия, рак яичника или рак молочной железы.
В более предпочтительном воплощении указанный рак представляет собой рак пищевода, рак печени, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта и гастроинтестинальную стромальную опухоль, рак поджелудочной железы, лимфому Ходжкина, рак толстой кишки, рак прямой кишки, рак толстой и прямой кишки, гепатому, карциному печени, карциному анального канала, немеланомный рак кожи, меланому кожи, рак шейки матки, рак матки, рак эндометрия, рак яичника или рак молочной железы.
Авторы настоящего изобретения обнаружили, что радиоактивно меченные соединения, описанные в данном документе, можно использовать для исследования рака in vitro и in vivo, используя методики авторадиографии и способы молекулярной визуализации, такие как PET или SPECT. Группировка прогастрина специфично связывается с раковыми клетками, таким образом, что сигнал, испускаемый радиоактивным изотопом, указывает на локализацию раковых клеток.
Согласно другому аспекту предложен способ визуализации одной или более раковых клеток, органов или тканей у субъекта, признанного нуждающимся в этом, включающий:
а) введение соединения, как описано в данном документе, или его фармцевтически приемлемой соли указанному субъекту; и
б) выявление указанного соединения посредством in vivo PET- или SPECT-визуализации.
Соединения по изобретению также полезны для диагностирования рака у пациента. Согласно данному аспекту изобретения предложен способ диагностики рака у пациента, причем указанный способ включает следующие стадии:
а) введение соединения, как описано в данном документе, или его фармацевтически приемлемой соли указанному субъекту;
б) выявление указанного соединения посредством in vivo PET- или SPECT-визуализации; и
в) диагностирование рака на основе выявления стадии б).
Производные прогастрина по настоящему изобретению связываются только с раковыми клетками. Любой сигнал, выявленный при PET или SPECT-визуализации, таким образом, является показателем того, что раковые клетки присутствуют.Благодаря чувствительности настоящих радиоактивно меченных соединений, возможно идентифицировать раковые клетки в организме пациента и, таким образом, диагностировать рак. Кроме того, можно легко сделать вывод о типе рака по локализации первичного рака.
В другом аспекте настоящее изобретение относится к способу прогнозирования рака у пациента, причем указанный способ включает следующие стадии:
а) введение соединения, как описано в данном документе, или его фармацевтически приемлемой соли указанному субъекту;
б) выявление указанного соединения посредством in vivo PET- или SPECT-визуализации; и
в) прогнозирование рака на основе выявления стадии в).
Термин «прогноз», в том виде, в котором он используется в данном документе, означает вероятность восстановления после заболевания или предсказание вероятного развития или исхода заболевания. Например, чем больше сигнал, выявляемый на стадии б), чем больше опухолевая масса в организме пациента, тем хуже прогноз.
В еще одном аспекте согласно настоящему изобретению предложен способ определения локализации рака у субъекта, нуждающегося в этом, включающий:
а) введение соединения, как описано в данном документе, или его фармацевтически приемлемой соли указанному субъекту; и
б) выявление указанного соединения посредством in vivo PET- или SPECT-визуализации.
Специалисту в данной области будет сразу понятно, что изобретение также может идентифицировать локализацию рака на самых ранних стадиях. Примечательно, что настоящее изобретение особенно полезно для идентификации очага рака, который слишком мал для выявления иным образом. Это особенно преимущественно, когда единственный признак того, что у пациента рак, вытекает из анализа биомаркера. Например, анализ, включающий антитела против прогастрина и основанный на его выявлении, делает возможной идентификацию возможности появления рака, даже в отсутствии какого-либо симптома (см., например, WO 2017/114973).
Согласно конкретному воплощению способ выявления локализации рака у субъекта, нуждающегося в этом, включает следующие стадии:
а) выявление уровня прогастрина в образце указанного субъекта;
б) введение соединения, как описано в данном документе, или его фармацевтически приемлемой соли указанному субъекту; и
в) выявление указанного соединения посредством in vivo PET- или SPECT-визуализации.
Определение концентрации прогастрина, в настоящем способе, проводят посредством любой методики, известной специалисту в области биохимии.
Предпочтительно, определение уровней прогастрина в образце включает приведение указанного образца в контакт с прогастрин-связывающей молекулой и измерение связывания указанной прогастрин-связывающей молекулы с прогастрином.
Когда уровни экспрессии измеряют на уровне белка, это можно главным образом осуществлять, используя специфичные прогастрин-связывающие молекулы, такие как, например, антитела, в частности, используя хорошо известные технологии, такие как окрашивание клеточной мембраны, используя биотинилирование или другие эквивалентные методики с последующей иммунопреципитацией с помощью специфичных антител, вестерн-блоттинг, ELISA или ELISPOT (от англ. enzyme-linked immunospot - метод иммуноферментных пятен), твердофазные иммуноферментные анализы (ELISA), радиоиммунологические анализы (RIA - от англ. radioimmunoassay), иммуногистохимия (IHC - от англ. immunohistochemistry), иммунофлуоресценция (IF - от англ. immunofluorescence), микрочипы на основе антител или микрочипы на основе тканей в сочетании с им муно гистохимией. Другие подходящие методики включают FRET или BRET, способы микроскопии на одиночных клетках или способы гистохимии с использованием длины волны однократного или многократного возбуждения и применение любого из адаптированных оптических методов, таких как электрохимические методы (методики вольтаметрии и амперометрии), атомно-силовая микроскопия и радиочастотные методы, например, многополярная резонансная спектроскопия, конфокальная и не конфокальная, выявление флуоресценции, люминесценции, хемилюминесценции, поглощения, отражения, пропускающей способности и двупреломления или показателя преломления (например, поверхностный плазмонный резонанс, эллипсометрия, резонансный зеркальный метод, волноводный метод на основе решеточного устройства связи или интерферометрия), ELISA на клетках, проточная цитометрия, визуализация на основе радиоактивных изотопов, магнитно-резонансная визуализация, анализ посредством электрофореза в полиакриламидном геле (SDS-PAGE - от англ. sodium dodecyl sulphate-polyacrylamide gel electrophoresis - электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия); ВЭЖХ (Высокоэффективная жидкостная хроматография)-Масс-спектрометрия; Жидкостная хроматография/Масс-спектрометрия (ЖХ-МС/МС)). Все данные методики хорошо известны в данной области и не требуют дополнительного подробного изложения в данном документе. Эти разные методики можно использовать для измерения уровней прогастрина.
Указанный способ может, в частности, быть выбран среди следующих способов: способ на основе иммунологического выявления, способ на основе вестерн-блоттинга, способ на основе масс-спектрометрии, способ на основе хроматографии и способ на основе проточной цитометрии. Несмотря на то, что любые подходящие средства проведения данных анализов включены в изобретение, способы, такие как FACS (от англ. fluorescence-activated cell sorting -сортировка клеток с активированной флуоресценцией), ELISA, RIA, вестерн-блоттинг и IHC, особенно полезны для осуществления способа по изобретению.
Ранее показали, что у субъекта рак, если уровень прогастрина выше 0 пМ (см., например, WO 2017/114973). Согласно предпочтительному воплощению способ включает следующие стадии:
а) измерение уровня прогастрина в образце указанного субъекта;
б) определение того, что уровень стадии а) выше, чем 0 пМ;
в) введение соединения, как описано в данном документе, или его фармацевтически приемлемой соли указанному субъекту; и
г) выявление указанного соединения посредством in vivo PET- или SPECT-визуализации.
Термин «прогастрин-связывающая молекула» в данном документе относится к любой молекуле, которая связывает прогастрин, но не связывает гастрин-17 (G17), гастрин-34 (G34), глицин-удлиненный гастрин-17 (G17-Gly) или глицин-удлиненный гастрин-34 (G34-Gly). Прогастрин-связывающая молекула по настоящему изобретению может представлять собой любую прогастрин-связывающую молекулу, такую как, например, молекула антитела или рецепторная молекула. Предпочтительно, прогастрин-связывающая молекула представляет собой антитело против прогастрина или его антигенсвязывающий фрагмент. Согласно конкретному воплощению способа уровень прогастрина определяют посредством использования одного или более антител против прогастрина. Согласно данному воплощению уровень прогастрина определяют посредством приведения одного или более антител против прогастрина в контакт с образцом указанного субъекта.
Указанное антитело может представлять собой поликлональное или моноклональное антитело. Предпочтительно, моноклональное антитело против прогастрина по настоящему способу представляет собой любое из моноклональных антител против hPG, раскрытых в WO 2017/114973.
Термин «биологический образец», в том виде, в котором он используется в данном документе, также включает образец солидной опухоли пациента, подлежащий анализу, когда рак представляет собой солидную опухоль. Такой образец солидной опухоли позволяет специалисту выполнять любой тип измерений уровня биомаркера по изобретению. В некоторых случаях способы по изобретению могут дополнительно включать предварительную стадию отбора образца солидной опухоли у пациента. Термин «образец солидной опухоли» относится к образцу опухолевой ткани. Даже у пациента с раком ткань, которая представляет собой очаг опухоли, еще содержит неопухолевую здоровую ткань. «Образец опухоли», таким образом, должен ограничиваться опухолевой тканью, отобранной у пациента. Указанный «образец опухоли» может представлять собой образец биопсии или образец, отобранный в результате терапии на основе хирургической резекции.
Биологический образец обычно получают из эукариотического организма, наиболее предпочтительно млекопитающего, или птицы, рептилии или рыбы. В действительности, «субъект», который может подвергаться способу, описанному в данном документе, может представлять собой любое из животных-млекопитающих, включая человека, собаку, кошку, крупный рогатый скот, козу, кабана, свинью, овцу и обезьяну; или птицу; рептилию; или рыбу. Предпочтительно, субъект представляет собой человека; субъект, являющийся человеком, может быть известен, как «пациент».
Под фразой «получение биологического образца» в данном документе подразумевается получение биологического образца для применения в способах, описанных в данном изобретении. Чаще всего, это будут осуществлять посредством удаления образца клеток из животного, но также могут выполнять, используя ранее выделенные клетки (например, выделенные другим лицом, в другое время и/или с другой целью), или посредством проведения способов по изобретению in vivo. Архивные образцы, имеющие историю лечения или результата лечения, будут особенно полезны.
Данный образец может быть получен и, при необходимости, приготовлен в соответствии со способами, известными специалисту в данной области. В частности, в данной области хорошо известно, что образец следует отбирать у субъекта натощак.
Определение концентрации прогастрина относится к определению количества прогастрина в известном объеме образца. Концентрация прогастрина может быть выражена относительно референсного образца, например, в виде доли или процента. Концентрация может быть также выражена в виде интенсивности или локализации сигнала, в зависимости от способа, используемого для определения указанной концентрации. Предпочтительно, концентрация соединения в образце выражена после нормализации общей концентрации родственных соединений в указанном образце, например, уровень или концентрация белка выражены после нормализации общей концентрации белков в образце.
Лечение, прописываемое пациенту с раком, будет зависеть от типа рака. Настоящее изобретение является особенно преимущественным в данном отношении, поскольку тип рака можно идентифицировать на основе локализации указанного рака у пациента. Соответствующую терапию можно вводить пациенту, таким образом, улучшая его/ее прогноз. Соединения, описанные в данном документе, особенно полезны, поскольку они делают возможной визуализацию и идентификацию рака на самых ранних стадиях. Примечательно, что когда их применение сочетают с измерением уровней прогастрина, как описано выше, настоящие соединения обеспечивают визуализацию и идентификацию рака даже при отсутствии какого-либо симптома. Это особенно полезно для идентификации первичного очага рака, поскольку указанный рак может быть визуализирован перед тем, как он дал метастазы в отдаленных частях организма пациента.
Согласно аспекту изобретения предложен способ идентификации первичного очага рака у субъекта, нуждающегося в этом. Данный способ включает стадии определения локализации рака способами, описанными в данном документе, и идентификации органа, который затронут раком. В одном воплощении способ дополнительно включает in vitro гистологическое исследование образца указанного органа указанного пациента.
Другой аспект настоящего изобретения относится к композиции, главным образом фармацевтической композиции, содержащей соединение, как описано в данном документе.
Соединения, обсуждаемые в данном документе, могут входить в состав разных композиций, для применения в способах лечения на основе диагностики или визуализации. Данные композиции (например, фармацевтические композиции) могут быть собраны в виде набора.
Обычно фармацевтическая композиция содержит эффективное количество (например, фармацевтически эффективное количество или поддающееся выявлению эффективное количество) соединения, описанного выше.
Композиция по раскрытию может быть приготовлена в виде фармацевтической композиции, которая содержит соединение по изобретению и фармацевтически приемлемый носитель. Под «фармацевтически приемлемым носителем» подразумевается вещество, которое не является биологически или иным образом нежелательным, а именно вещество можно вводить субъекту, не оказывая какого-либо нежелательного биологического действия или без взаимодействия губительным образом с какими-либо другими компонентами фармацевтической композиции, в которой он содержится. Носитель в природных условиях будет выбран для минимизации какой-либо деградации активного ингредиента и для минимизации любых вредных побочных эффектов у субъекта, как будет хорошо известно специалисту в данной области. Для обсуждения фармацевтически приемлемых носителей и других компонентов фармацевтических композиций см., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, 1990. Некоторые подходящие фармацевтические носители будут очевидны квалифицированному работнику и включают, например, воду (включая стерильную и/или деионизированную воду), подходящие буферы (такие как PBS (от англ. phosphate buffered saline - фосфатно-солевой буферный раствор)), физиологический раствор, среду клеточной культуры (такую как DMEM (от англ. Dulbecco modified Eagle's medium - среда Иглу, модифицированная по Дульбекко)), искусственную спинномозговую жидкость и т.п.
Фармацевтическая композиция или набор по раскрытию могут содержать другие фармацевтические средства, помимо соединения. Другой(ие) агент(ы) можно вводить в любое подходящее время на протяжении лечения пациента, или одновременно или последовательно.
Специалисту в данной области будет понятно, что конкретная композиция будет, в частности, зависеть от конкретного агента, который используется, и выбранного пути введения. Соответственно, существует широкий круг подходящих композиций по настоящему раскрытию.
Специалисту в данной области будет понятно, что подходящую или соответствующую композицию можно выбрать, адаптировать или разработать в зависимости от конкретного предстоящего применения. Дозировки для композиций по раскрытию могут быть представлены в единичной лекарственной форме. Термин «единичная лекарственная форма», в том виде, в котором он используется в данном документе, относится к физически дискретным единицам, подходящим для однократных дозировок для субъектов, являющихся животным (например, человеком), причем каждая единица содержит предварительно установленное количество агента по изобретению, отдельно или в комбинации с другими терапевтическими агентами, рассчитанное в количестве, достаточном для получения желаемого эффекта, совместно с фармацевтически приемлемым разбавителем, носителем или наполнителем.
Специалист в данной области может легко определить соответствующую дозу, режим и способ введения для точного состава используемой композиции для достижения желательного эффективного количества или эффективной концентрации агента у отдельно взятого пациента. Доза композиции, описанной в данном документе, вводимая животному, в частности человеку, в контексте настоящего изобретения должна быть достаточной для получения по меньшей мере поддающегося выявлению количества диагностического ответа у индивида на протяжении разумного периода времени. Дозу, используемую для достижения желательного эффекта, будут определять по множеству факторов, включая активность конкретного агента, подлежащего введению, фармакодинамику, ассоциированную с агентом в хозяине, тяжесть состояния заболевания инфицированных индивидов, другие лекарственные средства, вводимые субъекту, и т.п.Размер дозы также будет определяться наличием каких-либо неблагоприятных побочных эффектов, которые могут сопровождать конкретный используемый агент или его композицию. Обычно желательно, по возможности, сводить неблагоприятные побочные эффекты к минимуму. Доза биологически активного вещества будет варьировать; подходящие количества для каждого конкретного агента будут очевидны квалифицированному работнику.
Фармацевтическую или радиофармацевтическую композицию можно вводить парентерально, а именно, посредством инъекции, и наиболее предпочтительно она представляет собой водный раствор. Такая композиция может, возможно, содержать дополнительные ингредиенты, такие как буферы; фармацевтически приемлемые солюбилизаторы (например, циклодекстрины или поверхностно-активные вещества, такие как Плюроник, Твин или фосфолипиды); фармацевтически приемлемые стабилизаторы или антиоксидантны (такие как аскорбиновая кислота, гентизиновая кислота или парааминобензойная кислота). Когда соединение, описанное в данном документе, предложено в виде радиофармацевтической композиции, способ получения указанного соединения может дополнительно включать стадии, требуемые для получения радиофармацевтической композиции, например, удаление органического растворителя, добавление биосовместимого буфера и каких-либо возможных дополнительных ингредиентов. Для парентерального введения необходимо включать стадии, обеспечивающие, чтобы радиофармацевтическая композиция была стерильной и апирогенной. Такие стадии хорошо известны специалистам в данной области.
Согласно другим воплощениям раскрытия предложены наборы, включающие соединение, как раскрыто в данном документе, или его фармацевтически приемлемую соль. В некоторых воплощениях раскрытия в наборе предложены упакованные фармацевтические композиции, имеющие фармацевтически приемлемый носитель и соединение, как раскрыто в данном документе, или его фармацевтически приемлемую соль. В некоторых воплощениях раскрытия упакованная фармацевтическая композиция будет включать предшественники реакции, необходимые для создания соединения, как раскрыто в данном документе, или его фармацевтически приемлемой соли, при комбинации с радионуклидом. Другие упакованные фармацевтические композиции, предложенные настоящим раскрытием, дополнительно сдержат информацию, содержащую по меньшей мере одно из следующего: инструкции по получению соединений, как раскрыто в данном документе, или его фармацевтически приемлемых солей, из поставляемых предшественников, инструкции по использованию композиции для визуализации клеток или тканей, в частности, инструкции по использованию композиции для визуализации рака.
В некоторых воплощениях раскрытия настоящий набор содержит от примерно 1 мКи (милликюри) до примерно 30 мКи радионуклид-меченого визуализирующего средства, описанного выше, в комбинации с фармацевтически приемлемым носителем. Визуализирующее средство и носитель могут быть предоставлены в растворе или в лиофилизированной форме. Когда визуализирующее средство и носитель набора находятся в лиофилизированной форме, набор может, возможно, содержать стерильную и физиологически приемлемую среду для восстановления, такую как вода, физиологический раствор, буферизованный физиологический раствор и т.п.В наборе может быть предложено соединение, описанное в данном документе, в растворе или в лиофилизированной форме, и данные компоненты набора по раскрытию могут, возможно, содержать стабилизаторы, такие как NaCl, силикат, фосфатные буферы, аскорбиновая кислота, гентизиновая кислота и т.п. Дополнительные стабилизаторы компонентов набора могут быть предложены в данном воплощении, например, посредством предоставления восстанавливающего агента в форме, устойчивой к окислению. Определение и оптимизация таких стабилизаторов и способы стабилизации полностью находятся в пределах уровня мастерства в данной области.
Термин «фармацевтически приемлемый носитель» относится к биосовместимому раствору с должным учетом стерильности, p[Eta], изотоничности, стабильности и т.п., и может включать всевозможные растворители, разбавители (включая стерильный физиологический раствор, инъекцию хлорида натрия, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций, раствор Рингера-лактат для инъекций и другие водные буферные растворы), дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и т.п. Фармацевтически приемлемый носитель может также содержать стабилизаторы, консерванты, антиоксиданты или другие добавки, которые хорошо известны специалисту в данной области, или другой наполнитель, как известно в данной области.
Характеристика воплощений изобретения станет еще более очевидной из следующего подробного описания указанных ниже примеров.
Описание графических материалов
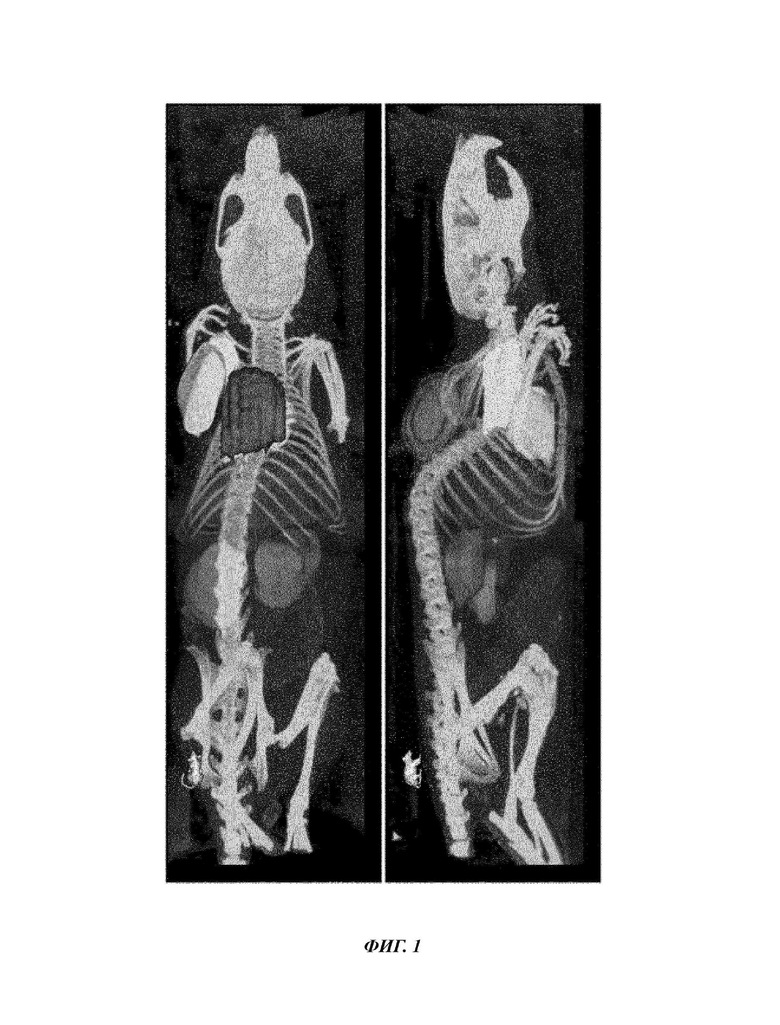
Фиг. 1: 3й-изображение количественно оцененных ROI (от англ. Region of interest - исследуемая область) на РЕТ/СТ. Изображены опухоль (красный), печень (синий), почки (зеленый), сердце (голубой), мышца (желтый) и мозги (розовый).
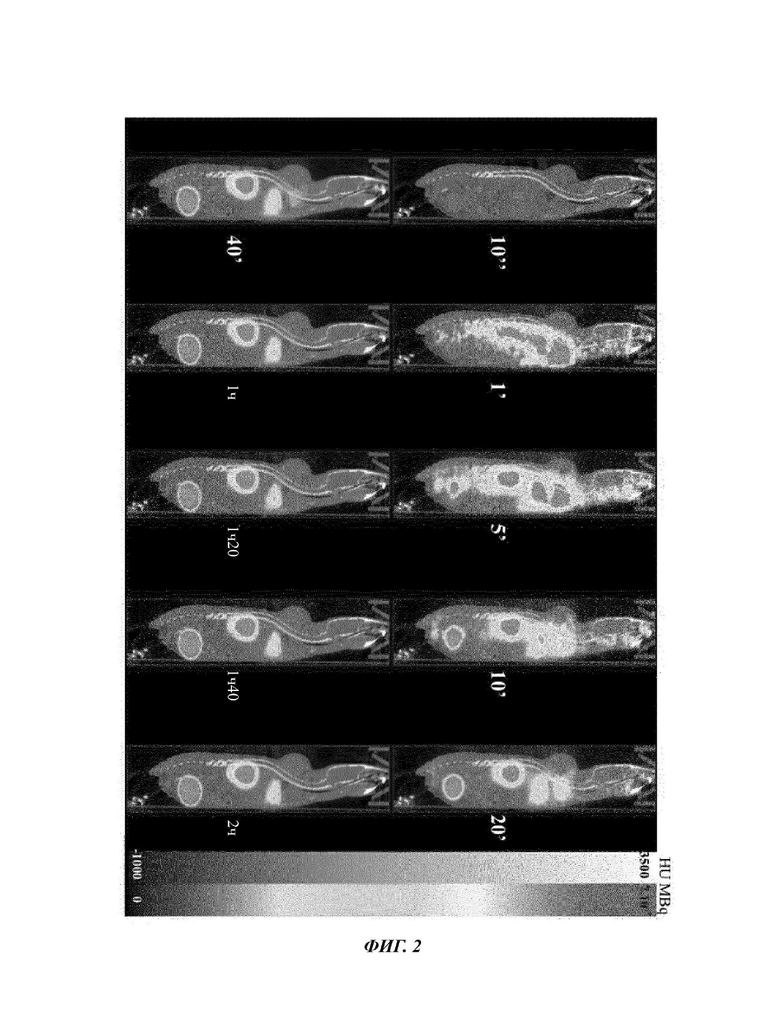
Фиг. 2: Сагиттальное изображение динамической РЕТ/СТ мыши C1S3 в разные моменты времени после инъекции 68Ga-NODAGA-Прогастрина.
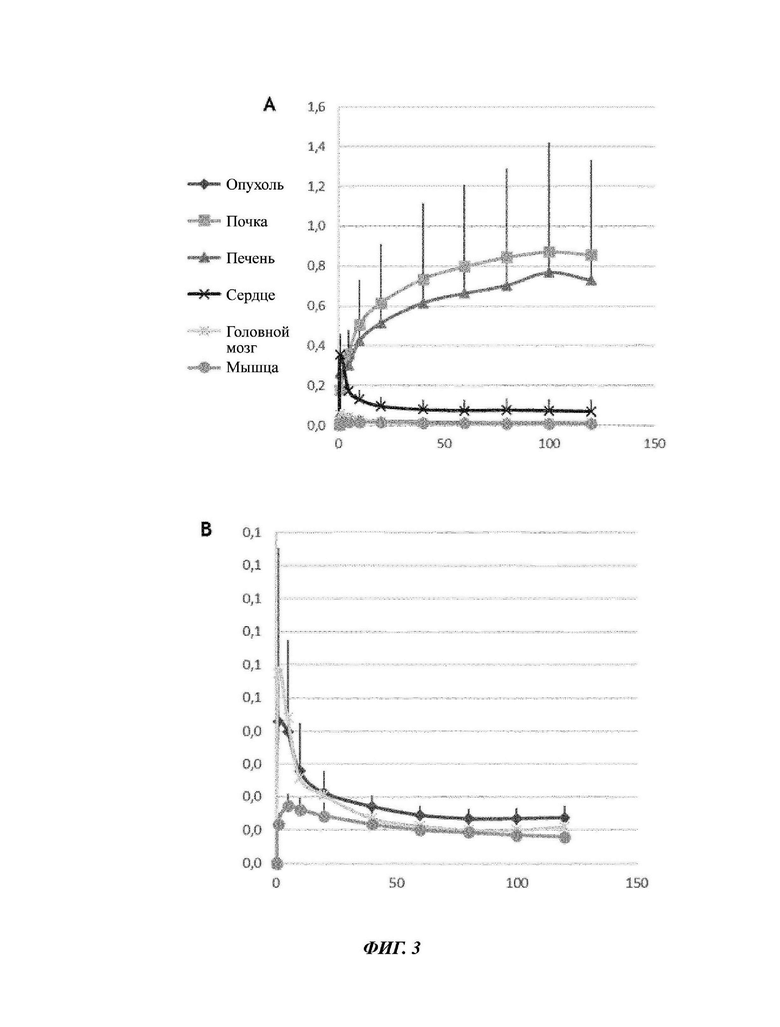
Фиг. 3: Среднее биологическое разнообразие 68Ga-NODAGA-Прогастрина в каждом количественно оцененном органе на протяжении 2 часов PET. Значения выражены в %ID (от англ. injected dose)/r плюс стандартное отклонение. (А) кинетика всех количественно оцененных областей, (В) кинетика, ограниченная мышцей, головным мозгом и опухолью.
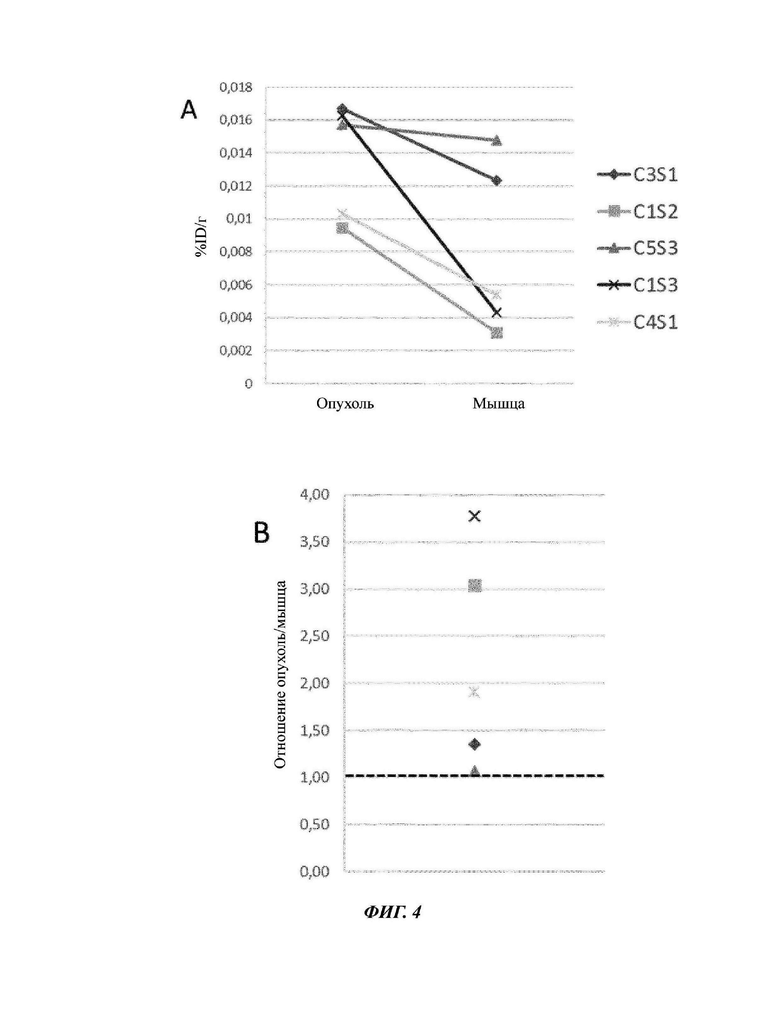
Фиг. 4: Количество в %ID/r 68Ga-NODAGA-пептида 1, измеренное в опухоле и мышце (А), и отношение Опухоли к Мышце (В) для каждой мыши после 2 часов сбора данных РЕТ/СТ.
Примеры
Связывание пептидов
Хелатор получают в концентрации 10 мг/мл в 0,2 М растворе бикарбоната натрия при рН, равном 9. Затем, 10 эквивалентов хелатора добавляют к аликвоте прогастрина. Реакции конъюгации проводят при 37°С в течение 2 часов. Очистку конечного продукта проводят на фильтрах AMICON. Посредством данных фильтров избыток не прореагировавшего хелатора удаляют.Авторы изобретения получают конъюгированный пептид, который авторы изобретения называют NODAGA-Пр гастрин.
Животная модель
Линию клеток рака толстой и прямой кишки Т84 культивировали в Т75 колбе и 4 раза пассировали после оттаивания для обеспечения продолжения оптимальной скорости роста до ксенотранспантации у мышей. Используемая культуральная среда представляла собой DMEM-F12 с Глютамаксом плюс 10% фетальная телячья сыворотка и 1% антибиотики (Стрептомицин, Пенициллин). В случае мышиного ксенотрансплантата культивирования клеток прекращают при 80%-ном слиянии, и клетки собирают в раствор DMEM-F12 без сыворотки и матригеля в соотношении 1:1 до концентрации 1,109 клеток/100 мкл.
Мышей быстро анестезировали посредством изофлурана, и инъекцию 100 мкл Т84 (1,109 клеток/100 мкл) осуществляют в подкожную область между лопатками. Животных помещают обратно в свои клетки сразу после их пробуждения и помещают в комнату со стабильными условиями до тех пор, пока рост опухоли не будет достаточным для проведения эксперимента.
Радиоактивное мечение и визуализация
100 мкл 2 М раствора ацетата аммония добавляют к аликвоте NODAGA-Прогастрина (10 мкг солюбилизировали в 50 мкл PBS). Затем, 500 мкл элюата галлия-68, [68Ga]GaCl3, из генератора IRE Elit, добавляют к приготовленному ранее раствору. Все количество инкубируют при комнатной температуре в течение 10 минут. Конечный рН составляет 4,8. Радиохимическая чистота составляет больше чем 90% (n равен 3), и ее определяют посредством тонкослойной хроматографии (подвижная фаза: 0,1 М цитрат натрия при рН, равном 5). 2 мкл 10 М гидроксида натрия добавляют к итоговой смеси для нейтрализации рН. Данный полученный раствор используют как есть для исследований биораспределения и РЕТ/СТ-визуализации.
Животных усыпляют посредством газового наркоза (изофлуран в концентрации 3% в случае введения и в концентрации 1,5-2% в случае эксплуатации маски). В хвостовую вену вводят катетер (катетер 27G). Мыши получают инъекцию радиоактивного индикатора в болюс 3,5±0,6 МБк для 2-х часовой динамики (Таблица 2).
Всю РЕТ/СТ-визуализацию осуществляют с помощью камеры папоРЕТ/СТ® (Mediso, Венгрия).
Получают изображения животных, размером 3×3. Для получения изображений кинетики биораспределения NODAGA-Прогастрина, изображения 2-х часовой динамической PET («энергетическое окно» 400-600 кэВ) в сочетании со сканером (35 кВп, время воздействия/проекция 450 мс) получают по всему телу мыши («окно» 10 см). Сбор данных PET начинается за 10 секунд до начала инъекции радиоактивного индикатора и обеспечивает получение инъекционного пика. Полученные РЕТ-изображения затем реконструируют посредством применения анатомического сдвига, коррекции ослабления и временного разделения. Временное разделение выглядит следующим образом: 10'', 1'', 1', 5', 10', 20', 40', 1 ч, 1 ч 20', 1 ч 20', 1 ч 40' и 2 ч.
Последующий анализ ЗО-изображений РЕТ/СТ проводили с помощью программного обеспечения VivoQuant 3.5 (Invicro, США). В случае динамики 6 исследуемых областей (ROI) расстраивают на сканере, затем переносят на РЕТ-изображения для количественной оценки. Количественно оцениваемые органы представляют собой печень, почки, сердце, головной мозг, опухоль и мышцу (Фиг. 3). Результаты количественных оценок выражают или в виде процента инъецируемой дозы на грамм ткани (%ID/г)* или в виде отношения Опухоль/Мышца**.
* %ID/г представляет собой активность, рассчитанную в ROI (МБк)/ (Инъецируемая активность (МБк) × Объем ткани (мл)) × 100
** Мышца рассматривается в качестве контрольной области при неспецифичной фиксации радиоактивного индикатора.
Результаты
В целом, кинетику биораспределения NODAGA-Прогастрина отслеживали и количественно оценивали всего на 5 мышах, у которых развивалась эктопическая опухоль Т84 от 100 до 600 мм3 (сбор данных РЕТ/СТ в Таблице 2).

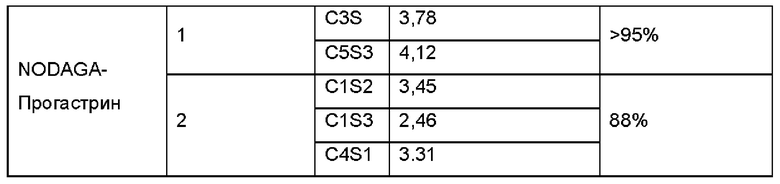
Объемы опухолей мышей измеряли по СТ-изображениям (Таблица 3).
На Фиг. 1 проиллюстрировано биологическое распределение данного индикатора во время 2 часов РЕТ-визуализации в мыши. Рассчитывали средние значения количественной оценки в %ID/г каждой исследуемой области, и они представлены на Фиг. 2.
Как ожидалось, авторы изобретения наблюдали высокую концентрацию в органах выведения - печени и почках, и гораздо более низкий уровень активности в мышце или головном мозге, которые специфично не фиксируют индикатор. Еще более интересно то, что уровень активности в опухоли выше, чем в мышце у мышей с отношением Опухоль/мышца, находящимся в интервале от 1 до 4 у 5 мышей (Фиг. 3).
Заключение
Авторы изобретения могут сделать вывод о том, что в данной модели имеет место включение радиоактивно меченного пептида Прогастрин в опухоль.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЧЕННЫЙ РАДИОАКТИВНЫМ ИЗОТОПОМ АНТАГОНИСТ GRPR ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕЧЕБНО-ДИАГНОСТИЧЕСКОГО СРЕДСТВА | 2020 |
|
RU2839888C1 |
| Радиофармацевтический препарат для диагностики рака предстательной железы методом позитронной эмиссионной томографии и способ его получения | 2022 |
|
RU2796106C1 |
| ПАРААМИНОГИППУРОВАЯ КИСЛОТА (ПАГ) КАК ВЕЩЕСТВО ДЛЯ ЗАЩИТЫ ПОЧЕК | 2020 |
|
RU2804349C2 |
| НОВЫЕ ПСА-СВЯЗЫВАЮЩИЕ АГЕНТЫ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2787105C2 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2693465C2 |
| ИНГИБИТОР FAP | 2019 |
|
RU2797409C2 |
| ПОЛИПЕПТИДЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687163C1 |
| ЛИГАНДЫ РЕЦЕПТОРА НЕЙРОТЕНЗИНА | 2013 |
|
RU2671970C2 |
| СОЕДИНЕНИЕ ДВОЙНОГО НАЦЕЛИВАНИЯ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2022 |
|
RU2838179C2 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ НАЦЕЛИВАЮЩЕЕСЯ НА PSMA СОЕДИНЕНИЕ, СВЯЗАННОЕ С РАДИОНУКЛИДОМ СВИНЦА ИЛИ ТОРИЯ | 2018 |
|
RU2795398C2 |
Настоящее изобретение относится к соединению или его фармацевтически приемлемой соли для визуализации рака. Предложенное соединение содержит: группировку прогастрина, имеющую последовательность SEQ ID NO: 1, и хелатирующую группировку, причем хелатирующая группировка представляет собой бифункциональный хелатор, выбранный из следующего списка: NODAGA (1,4,7-триазациклононан-1-глутаровая кислота-4,7-диуксусная кислота), NOTA (1,4,7-триазациклононан-1,4,7-триуксусная кислота), п-SCN-Bn-NOTA, п-SCN-Bn-PCTA, п-SCN-Bn-оксо-DO3A, дезферриоксамин-п-SCN, DTPA (диэтилентриаминпентауксусная кислота) и ТЕТА (1,4,8,11-тетраазациклотетрадекан -1,4,8,11-тетрауксусная кислота). Указанная хелатирующая группировка ассоциирована с радиоактивным изотопом. Группировка прогастрина и хелатирующая группировка ковалентно связаны. Также предложены способ получения указанного соединения, способ визуализации одной или более раковых клеток, органов или тканей у субъекта, способ определения локализации рака у субъекта, фармацевтическая композиция и набор для визуализации одной или более раковых клеток, содержащие указанное соединение. Соединения по изобретению способны связываться с раковыми клетками in vivo, таким образом обеспечивая визуализацию указанного рака, что особенно полезно для идентификации локализации рака. 6 н. и 6 з.п. ф-лы, 4 ил., 3 табл.
1. Соединение или его фармацевтически приемлемая соль для визуализации рака, причем указанное соединение содержит:
- группировку прогастрина, имеющую последовательность SEQ ID NO: 1, и
- хелатирующую группировку,
причем хелатирующая группировка представляет собой бифункциональный хелатор, выбранный из следующего списка: NODAGA (1,4,7-триазациклононан-1-глутаровая кислота-4,7-диуксусная кислота), NOTA (1,4,7-триазациклононан-1,4,7-триуксусная кислота), п-SCN-Bn-NOTA, п-SCN-Bn-PCTA, п-SCN-Bn-оксо-DO3A, дезферриоксамин-п-SCN, DTPA (диэтилентриаминпентауксусная кислота) и ТЕТА (1,4,8,11-тетраазациклотетрадекан -1,4,8,11-тетрауксусная кислота);
причем указанная хелатирующая группировка ассоциирована с радиоактивным изотопом и
причем указанные группировка прогастрина и хелатирующая группировка ковалентно связаны.
2. Соединение по п. 1, в котором бифункциональный хелатор представляет собой NODAGA или NOTA, предпочтительно NODAGA.
3. Соединение по любому из пп. 1 и 2, в котором радиоактивный изотоп выбран из списка, состоящего из 68Ga, 64Cu, 89Zr, 186/188Re, 90Y, 177Lu, 153Sm, 213Bi, 225Ac, 111In, 99mTc, 123I или 223Ra.
4. Соединение по любому из пп. 1-3, в котором радиоактивный изотоп представляет собой 68Ga или 64Cu, предпочтительно 68Ga.
5. Способ получения соединения по любому из пп. 1-4, включающий следующие стадии:
а) осуществление конъюгации амин-реактивной хелатирующей группировки с группировкой прогастрина;
б) выделение конъюгата прогастрина и хелатора;
в) инкубацию конъюгата програстрина и хелатора с комплементарным радиоактивным изотопом;
с получением таким образом соединения по изобретению.
6. Способ по п. 5, в котором амин-реактивная хелатирующая группировка представляет собой сложный эфир NOTA-NHS или NODAGA-NHS.
7. Способ по любому из пп. 5 и 6, в котором амин-реактивная хелатирующая группировка представляет собой сложный эфир NODAGA-NHS.
8. Способ визуализации одной или более раковых клеток, органов или тканей у субъекта, нуждающегося в этом, включающий:
а) введение соединения по любому из пп. 1-4 или его фармацевтически приемлемой соли указанному субъекту; и
б) выявление указанного соединения посредством позитронно-эмиссионной томографической (PET) визуализации или однофотонной эмиссионной компьютерной томографической (SPECT) визуализации in vivo.
9. Способ определения локализации рака у субъекта, нуждающегося в этом, включающий:
а) введение соединения по любому из пп. 1-4 или его фармацевтически приемлемой соли указанному субъекту; и
б) выявление указанного соединения посредством PET- или SPECT-визуализации in vivo.
10. Способ по п. 9, дополнительно включающий предварительную стадию определения уровня прогастрина, предпочтительно с использованием антител к прогастрину, в образце указанного субъекта.
11. Фармацевтическая композиция для визуализации одной или более раковых клеток, содержащая соединение по любому из пп. 1-4 и фармацевтически приемлемый носитель.
12. Набор для визуализации одной или более раковых клеток, содержащий соединение по любому из пп. 1-4.
| US 20110085986 A1, 14.04.2011 | |||
| LAPANJA N., Synthesis and radiolabeling of minigastrin analogues, conjugated with different bifunctional chelators, Master's diss., Ljubljana, 2014, р | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
| NAGEL V | |||
| et al., Synthesis and evaluation of NODAGA-and DOTA-Flurpiridaz-derivatives for myocardial perfusion imaging with 68Ga, Journal of Nuclear Medicine, v | |||
Авторы
Даты
2024-01-16—Публикация
2018-12-10—Подача