По настоящей заявке испрашивается приоритет по временной заявке США № 62/635943, поданной 27 февраля 2018 года, содержание которой, таким образом, включено в настоящее описание в качестве ссылки в полном объеме.
Область техники
Настоящее изобретение относится к способам очистки антител от примесей, таких как продукты деградации антител. Способы очистки по настоящему изобретению включают использование гидроксиапатитных смол.
Уровень техники
Антитела являются важными биологическими молекулами для медицинского, диагностического, промышленного и другого использования. Хотя доступно множество способов и реагентов для рекомбинантной продукции антител, по причине, например, размера и молекулярной сложности антител эффективное получение и очистка интересующего рекомбинантного антитела зачастую остаются затруднительными, в частности, в крупном/промышленном масштабе.
Например, во время получения интересующего рекомбинантного антитела иногда может образовываться продукт деградации, относящийся к интересующемуся антителу; продукт деградации является нежелательной примесью. Этот продукт деградации может обладать некоторыми молекулярными свойствами, очень схожими со свойствами интересующего антитела (например, идентичные или почти идентичные аминокислотные последовательности или массы). Из-за молекулярного сходства между интактным интересующим антителом и деградировавшей версией антитела, эффективное отделение интактного антитела от деградировавшего антитела может являться очень затруднительным.
Таким образом, существует потребность в новых и улучшенных способах очистки антител от примесей.
Сущность изобретения
Настоящее изобретение относится к способам очистки интересующего антитела от одной или более примесей.
В некоторых вариантах осуществления настоящее изобретение относится к способу очистки антитела, включающему: A) введение препарата антитела в загрузочный буфер на гидроксиапатитную (HA) смолу, где: препарат антитела содержит: I) интактное интересующее антитело и II) клиппированную версию интересующего антитела, где клиппированная версия интересующего антитела является продуктом деградации интактного интересующего антитела и имеет массу, отличающуюся на менее чем 10% от массы интактного интересующего антитела; и B) элюцию интактного интересующего антитела из HA-смолы с использованием элюирующего буфера.
В некоторых вариантах осуществления настоящее изобретение относится к способу очистки биспецифического антитела, включающему: A) введение препарата антитела в загрузочный буфер на гидроксиапатитную (HA) смолу, где: препарат антитела содержит: I) интактное интересующее биспецифическое антитело; и II) по меньшей мере один вид примесей, где вид примесей выбран из группы, состоящей из: a) клиппированной версии интересующего биспецифического антитела, где клиппированная версия интересующего биспецифического антитела является продуктом деградации интактного интересующего биспецифического антитела и имеет массу, отличающуюся на менее чем 10% от массы интактного интересующего биспецифического антитела; b) первое родительское антитело, где первое родительское антитело является моноспецифическим антителом, имеющим ту же антигенную специфичность, что и первое плечо интактного биспецифического антитела; c) второе родительское антитело, где второе родительское антитело является моноспецифическим антителом, имеющим ту же антигенную специфичность, что и второе плечо интактного биспецифического антитела; и d) высокомолекулярные соединения (HMMS); и B) элюцию интактного интересующего биспецифического антитела из HA-смолы с использованием элюирующего буфера.
В некоторых вариантах осуществления настоящее изобретение относится к способу очистки биспецифического антитела, включающему: A) введение препарата антитела в загрузочный буфер на гидроксиапатитную (HA) смолу, где: I) препарат антитела содержит: a) интактное интересующее биспецифическое антитело и b) клиппированную версию интересующего биспецифического антитела, где клиппированная версия интересующего антитела является продуктом деградации интактного интересующего биспецифического антитела и имеет массу, отличающуюся на менее чем 10% от массы интактного интересующего биспецифического антитела; и II) соотношение молекул клиппированного биспецифического антитела и молекул интактного биспецифического антитела в препарате антитела составляет от по меньшей мере 1:50 до не более чем 1:5; B) элюцию интактного биспецифического антитела из HA-смолы с использованием элюирующего буфера. В некоторых вариантах осуществления способ дополнительно включает стадию C) сбора очищенной фракции, элюируемой из HA-смолы, где очищенная фракция содержит интактное биспецифическое антитело.
В некоторых вариантах осуществления настоящее изобретение относится к способу очистки антитела, включающему: A) введение препарата антитела в загрузочный буфер на гидроксиапатитную (HA) смолу, где: I) препарат антитела содержит: a) интактное интересующее антитело и b) клиппированную версию интересующего антитела, где клиппированная версия интересующего антитела является продуктом деградации интактного интересующего антитела и имеет массу, отличающуюся на менее чем 10% от массы интактного интересующего антитела; и II) клиппированная версия антитела составляет по меньшей мере 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15% или 20% препарата антитела по массе; B) элюцию интактного антитела из HA-смолы с использованием элюирующего буфера, и C) сбор очищенной фракции, элюируемой из HA-смолы, где очищенная фракция содержит интактное антитело и содержит менее 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15% или 20% масс. клиппированного антитела, где очищенная фракция содержит более низкий % масс. клиппированного антитела, чем препарат антитела.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем элюцию интересующего антитела из HA-смолы с использованием элюирующего буфера, элюирующий буфер содержит ион. Необязательно, во время элюции повышают концентрацию иона в буфере. Необязательно, во время элюции повышают концентрацию иона в буфере вокруг HA-смолы.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем антитело, антитело является гетеродимерным биспецифическим антителом.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем сбор очищенной фракции, элюируемой из HA-смолы, где очищенная фракция содержит интактное интересующее антитело, очищенная фракция содержит по меньшей мере, 80%, 90%, 95%, 96%, 97%, 98% или 99% масс. интактного интересующего антитела.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем очищенную фракцию, содержащую интактное биспецифическое антитело и клиппированное биспецифическое антитело, соотношение молекул клиппированного биспецифического антитела и молекул интактного биспецифического антитела в очищенной фракции составляет не более 1:400, 1:200, 1:100 или 1:50.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем интересующее антитело, являющееся антителом против CD3 или биспецифическим антителом, содержащим плечо против CD3, антитело содержит по меньшей мере одно из следующего: i) область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 1; ii) тяжелую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2; iii) область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 1, и область VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 3; или iv) тяжелую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 4.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем биспецифическое антитело, биспецифическое антитело является: i) биспецифическим антителом против BCMA/против CD3, содержащим плечо против BCMA и плечо против CD3, или ii) биспецифическим антителом против FLT3/против CD3, содержащим плечо против FLT3 и плечо против CD3.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем биспецифическое антитело, содержащее плечо против BCMA, плечо против BCMA содержит по меньшей мере одно из следующего: i) область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5; ii) тяжелую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6; iii) область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, и область VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7; или iv) тяжелую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6, и легкую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 8.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем биспецифическое антитело, содержащее плечо против FLT3, плечо против FLT3 содержит по меньшей мере одно из следующего: i) область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 9; ii) тяжелую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 10; iii) область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 9, и область VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 11; или iv) тяжелую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 10, и легкую цепь, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 12.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем введение препарата антитела в HA-смолу, препарат антитела вводят в HA-смолу до плотности на смоле от 2, 3, 4 или 5 г/л до 8, 9, 10, 12, 15 или 20 г/л.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем введение препарата антитела в HA-смолу, в HA-смолу вводят по меньшей мере 1, 5, 10, 50, 100, 500, 1000 или 5000 граммов препарата антитела.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем препарат антитела, препарат антитела содержит по меньшей мере 50%, 60%, 70% или 80%, но менее 90%, 95%, 97%, 98% или 99% масс. интактного интересующего антитела.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем клиппированное антитело, клиппированное антитело имеет массу, отличающуюся на менее чем 0,1%, 0,5%, 1% или 2% от массы интактного антитела. В некоторых вариантах осуществления в способе по настоящему изобретению, включающем клиппированное антитело, клиппированное антитело имеет массу, составляющую на приблизительно от 5 до 100 Да больше массы интактного антитела. В некоторых вариантах осуществления в способе по настоящему изобретению, включающем клиппированное антитело, клиппированное антитело имеет массы, составляющую на приблизительно 18 Да больше массы интактного антитела.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем клиппированное антитело, клиппированное антитело имеет расщепленную пептидную связь в полипептидной цепи антитела, и где расщепленная пептидная связь находится в тяжелой цепи антитела. В некоторых вариантах осуществления в способе по настоящему изобретению, включающем клиппированное антитело, клиппированное антитело имеет расщепленную пептидную связь в полипептидной цепи антитела, и где расщепленная пептидная связь находится в легкой цепи антитела.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем клиппированное антитело, клиппированное антитело содержит то же количества аминокислот и те же аминокислотные последовательности, что и интактное антитело. Альтернативно, в некоторых вариантах осуществления клиппированное антитело содержит иное количество аминокислот, чем интактное антитело.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем интересующее антитело, содержащее домены VH и VL, специфически связывающиеся с CD3, соответствующее клиппированное антитело содержит расщепленную пептидную связь в домене VH, специфически связывающемся с CD3.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем HA-смолу, HA-смола является керамической гидроксиапатитной (cHA) смолой.
В некоторых вариантах осуществления в способе по настоящему изобретению HA-смолу промывают промывочным буфером, содержащим ион фосфата, после введения препарата антитела в HA-смолу, но перед элюцией интактного биспецифического антитела из смолы. Необязательно, промывочный буфер содержит ионы фосфата в концентрации приблизительно от 5, 10, 15, 20 до 30, 40 или 50 мМ.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем элюирующий буфер, содержащий ион, ион является фосфатом. В некоторых вариантах осуществления концентрация иона фосфата во время элюции может повышаться приблизительно от 30, 40 или 50 мМ до приблизительно 60, 70, 80, 100, 150 или 200 мМ.
В некоторых вариантах осуществления в способе по настоящему изобретению pH по меньшей мере одного из загрузочного буфера, промывочного буфера и элюирующего буфера составляет от 7,0 до 8,0 или приблизительно от 7,0 до 8,0.
В некоторых вариантах осуществления в способе по настоящему изобретению, включающем препарат антитела, препарат антитела содержит белки, ранее введенные и элюированные из по меньшей мере одного из: i) смолы с протеином A и ii) ионообменной смолы. Необязательно, препарат антитела содержит белки, ранее нагруженные и элюированные и из i) смолы с протеином A, и из ii) ионообменной смолы.
В некоторых вариантах осуществления антитело, полученное способом по настоящему изобретению, выделяют и/или очищают для применения в качестве фармацевтических средств или в получении фармацевтических средств.
В некоторых вариантах осуществления настоящее изобретение относится к антителу, очищенному способами по настоящему изобретению.
Краткое описание чертежей
На фиг. 1 показана схема способа получения биспецифического антитела, которое можно очищать способами по настоящему изобретению.
На фиг. 2 показана схема примера i) интактного биспецифического антитела (левая боковая панель) и ii) клиппированной версии биспецифического антитела (правая боковая панель), в которой клиппированное биспецифическое антитело является примесью, которая может присутствовать в препарате антитела с интактным биспецифическим антителом.
На фиг. 3 показана хроматограмма, на которой представлено отделение интересующего биспецифического антитела против BCMA/против CD3 ("POI") от множества различных примесей посредством элюции из HA-смолы.
На фиг. 4 показан график, на котором представлены относительные количества различных белков (включая интересующее антитело и различные примеси) в разных фракциях, элюируемых из HA-смолы в хроматографическом эксперименте на HA, показанном на хроматограмме на фиг. 3.
На фиг. 5 показана хроматограмма, на которой представлено отделение интересующего биспецифического антитела против BCMA/против CD3 ("POI") от множества различных примесей посредством элюции из HA-смолы.
На фиг. 6 показан график, на котором представлены относительные количества различных белков (включая интересующее антитело и различные примеси) в разных фракциях, элюируемых из HA-смолы в хроматографическом эксперименте на HA, показанном на хроматограмме на фиг. 5, в котором интересующее биспецифическое антитело против BCMA/против CD3 отделяют от множества разных примесей посредством элюции из HA-смолы.
На фиг. 7 показан график, на котором представлены относительные количества различных белков (включая интересующее антитело и различные примеси) в разных фракциях, элюируемых из HA-смолы в хроматографическом эксперименте на HA, в котором интересующее биспецифическое антитело против FLT3/против CD3 отделяют от множества разных примесей посредством элюции из HA-смолы.
Подробное описание
Настоящее изобретение относится к способам очистки интересующего антитела от одной или более примесей. Способы по настоящему изобретению включают использование гидроксиапатитной смолы для отделения интересующего антитела от примесей. В некоторых вариантах осуществления интересующее антитело является биспецифическим антителом. В некоторых вариантах осуществления примесь является антителом, относящимся к интересующему антителу (т.е. имеющим схожие или те же аминокислотные последовательности, что и интересующее антитело), но модифицированным одним или более способами по сравнению с интересующим антителом и имеющим иную массу, чем интересующее антитело. Необязательно, масса вида примесей антитела очень схожа с массой интересующего антитела. Например, в некоторых вариантах осуществления масса вида примесей антитела отличается на менее чем 5%, 2%, 1%, 0,5%, 0,2%, 0,1%, 0,05%, 0,02% или 0,01% от массы интересующего антитела. Необязательно, способы по настоящему изобретению можно использовать для крупномасштабной очистки интересующего антитела от одной или более примесей.
Определения
Если не указано иначе, все термины этой области, примечания и другие научные термины или терминология, используемые в настоящем описании, должны иметь значения, общепринято понятные специалистам в области, к которой принадлежит изобретение. В некоторых случаях термины с общепринято понимаемым значением определены в настоящем описании для ясности и/или в качестве справочного материала, и включение таких определений в настоящее описание не обязательно означает наличие существенного отличия от значения, как правило, понимаемого в этой области.
Если не указано иначе, следующие термины следует понимать как имеющие следующие значения:
"Антитело" является молекулой иммуноглобулина, которая может специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., с помощью по меньшей мере одного участка распознавания антигена, находящегося в вариабельной области молекулы иммуноглобулина. В рамках изобретения термин включает не только интактные поликлональные или моноклональные антитела, но также и их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv) и доменные антитела (включая, например, антитела акул и Верблюжьих), диатела и слитые белки, содержащие антитело, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, содержащей участок распознавания антигена. Термин "антитело" включает моноспецифические, биспецифические и полиспецифические антитела. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или его подкласса), и антитело может не относиться к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела, иммуноглобулины можно приписывать к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько из них можно дополнительно разделять на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие разным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
В рамках изобретения термины "тяжелая цепь", "легкая цепь", "вариабельная область" или "вариабельный домен", "каркасная область", "константный домен" и т.п. обладают своим значением, общепринятым в области иммунологии, и относятся к доменам в природных иммуноглобулинах и соответствующим доменам рекомбинантных связывающих белков (например, гуманизированных антител, биспецифических антител, одноцепочечных антител, химерных антител и т.д.). Основной структурной единицей природных иммуноглобулинов является тетрамер, содержащий две легкие цепи и две тяжелые цепи, как правило, экспрессирующиеся в виде гликопротеина приблизительно 150000 Да. Амино-концевая (N-концевая) часть каждой цепи включает вариабельную область приблизительно от 100 до 110 или более аминокислот, главным образом, отвечающих за распознавание антигена. Карбокси-концевая (C-концевая) часть каждой цепи определяет константную область. Каждая легкая цепь состоит из вариабельного домена легкой цепи (VL) и константного домена легкой цепи (CL). Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи, содержащей домен CH1, шарнирный домен, домены CH2 и CH3. Вариабельные области молекулы IgG содержат области гипервариабельности, обозначаемые как определяющие комплементарность области (CDR), содержащие остатки, контактирующие с антигеном, и не-CDR сегменты, обозначаемые как каркасные области (FR), как правило, поддерживающие структуру и определяющие позиционирование петель CDR (хотя некоторые каркасные остатки также могут контактировать с антигеном). Каждый VH и VL содержит три CDR и четыре FR, расположенные с амино-конца к карбокси-концу в следующем порядке: n-FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4-c. Молекулы иммуноглобулинов могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY) и класса (например, IgG1, IgG2, IgG 3, IgG4, IgA1 и IgA2) или подкласса.
"Биспецифическое" антитело или антитело с "двойной специфичностью" является гибридным антителом, содержащим два разных антигенсвязывающих участка. Два антигенсвязывающих участка биспецифического антитела связываются с двумя разными эпитопами, которые могут находиться на одинаковых или разных белковых мишенях.
Термин "интактное" антитело относится к рекомбинантному антителу, содержащему все из ожидаемых пептидных связей и аминокислот рекомбинантного антитела (т.е. ожидаемых с учетом последовательностей нуклеиновой кислоты, кодирующих полипептиды антитела). И наоборот, термин "клиппированное" антитело относится к версии соответствующего "интактного" антитела, в котором отсутствует по меньшей мере одна пептидная связь по сравнению с соответствующим "интактным" антителом. В настоящем описании ссылки на "интересующее антитело", как правило, относятся к интересующему интактному антителу, если контекст четко не указывает на иное.
В настоящем описании ссылка на "приблизительное" значение или параметр включает варианты осуществления, относящиеся к этому значению или параметру как таковому, а также значениям или параметрам, которые могут быть на 10% меньше или больше указанного числового значения этого параметра. Например, ссылка на "приблизительно 5 мг" включает 5 мг, а также любое значение от 4,5 мг до 5,5 мг.
Способы
Способы по настоящему изобретению можно использовать для очистки интересующего антитела от одной или более примесей. В способах по настоящему изобретению препарат антитела (также обозначаемый в настоящем описании как "исходный образец"), содержащий интересующее антитело и одну или более молекул примесей, вносят на гидроксиапатитную (HA) смолу, связывающуюся с интересующим антителом и, необязательно, одной или более молекулами примесей. Затем HA-смолу промывают для удаления любых непрочно связанных примесей (в некоторых вариантах осуществления все молекулы примесей могут протекать и не связываться с HA-смолой). Затем интересующее антитело элюируют из HA-смолы с использованием фосфатного элюирующего буфера, который, как правило, вносят в смолу с помощью градиента повышающейся концентрации иона фосфата. С помощью элюции интересующего антитела из HA-смолы получают очищенный образец, содержащий интересующее антитело и меньшее количество (или вообще не содержащий) примесей, чем было в исходном образце с интересующим антителом. Во время элюции интересующего антитела из HA-смолы любые молекулы примесей, связанные с HA-смолой, также можно элюировать в какой-то точке градиента повышающейся концентрации иона фосфата. Однако, молекулы примесей элюируют из HA-смолы в условиях, достаточно отличающихся от условий элюции интересующего антитела, таким образом, что интересующее антитело можно эффективно отделять от молекул примесей во время элюции. Ниже представлены дополнительные подробности об указанных выше стадиях способа и соответствующих материалах и стадиях.
Гидроксиапатитная смола
Различные гидроксиапатитные смолы доступны в коммерческих источниках, и в способах по настоящему изобретению можно использовать любую доступную форму материала. Необязательно, гидроксиапатит находится в кристаллической форме. Необязательно, гидроксиапатит агломерируют для получения частиц и спекают при высоких температурах в стабильную пористую керамическую массу.
В некоторых вариантах осуществления HA-смола по настоящему изобретению является керамической гидроксиапатитной (cHA) смолой. Термины "керамический гидроксиапатит"/"cHA" относятся к нерастворимому гидроксилированному фосфату кальция формулы Ca10(PO4)6(OH)2, спеченному при высоких температурах в сферическую, макропористую керамическую форму. В рамках изобретения термины "керамический гидроксиапатит"/"cHA" включают, в качестве неограничивающих примеров, керамический гидроксиапатит типа I и типа II, а также любой подходящий размер частиц, если не указано иначе. Типичные размеры частиц cHA, которые можно использовать в способах по настоящему изобретению, включают, например, размер частиц (диаметр) 1-100 мкм или 1-1000 мкм, такой как 20 мкм, 40 мкм или 80 мкм. Примеры cHA-смол, которые можно использовать в способах по настоящему изобретению, включают смолы CHT™ типа I и типа II (Bio-Rad). Любая ссылка в настоящем описании на "HA-смолу" или т.п. включает cHA-смолу.
Как правило, в способе по настоящему изобретению HA-смолу предоставляют в одной или более хроматографических колонок. Свойства колонки, такие как диаметр, длина и плотность упаковки колонки, можно выбирать с учетом различных факторов, включая потребности в рамках конкретного проекта по очистке (т.е. количество белка, подлежащего очистке), и факторов, относящихся к HA-смоле, предназначенной для использования в колонке, таких как размер пор, размер частиц, прессуемость, нагрузочная емкость и емкость динамического связывания. Кроме того, способы по настоящему изобретению зачастую описывают в отношении HA-смолы в хроматографической колонки; однако, не исключены другие подходящие связанные конфигурации смол. Кроме того, ссылка в настоящем описании на "HA-колонку" или т.п. относится к хроматографической колонке, заполненной HA-смолой.
Уравновешивание HA-колонки перед введением белка
В некоторых вариантах осуществления перед введением образца, содержащего интересующее антитело, в HA-колонку способы по настоящему изобретению могут включать стадию предварительного уравновешивания колонки одним или более уравновешивающими буферами. Уравновешивающие буферы можно вводить в колонку, например, для обеспечения того, что HA-смола будет чистой к началу осуществления способа (т.е. для обеспечения того, что смола не содержит примеси, уже связанные со смолой), и/или для обеспечения того, что раствор, окружающий HA-смолу, совместим с образцом, предназначенным для введения в смолу.
В некоторых вариантах осуществления уравновешивающий буфер является фосфатным буфером, содержащим, например, фосфат натрия, где концентрация ионов фосфата в буфере составляет приблизительно от 100 до 500 мМ. Такие уравновешивающие буферы также можно обозначать в настоящем описании как "высокофосфатные уравновешивающие буферы" или т.п. Например, в варианте осуществления высокофосфатный уравновешивающий буфер может содержать приблизительно от 250 до 450 мМ ионов фосфата; в других вариантах осуществления он может содержать приблизительно 200, 250, 300, 350, 400 или 450 мМ ионов фосфата. Этот уравновешивающий буфер имеет относительно высокую концентрацию ионов фосфата в буфере для элюции каких-либо загрязнений/примесей, уже присутствующих в HA-смоле (т.е. присутствующих до введения в смолу образца, содержащего интересующий белок; такие примеси могут присутствовать, например, если HA-смолу ранее уже использовали для способа очистки и ее не очистили полностью после предшествующего использования). Высокофосфатный уравновешивающий буфер может иметь pH приблизительно от 6,0 до 9,0. Например, в варианте осуществления высокофосфатный уравновешивающий буфер может иметь pH приблизительно от 7,0 до 8,0; в других вариантах осуществления он может иметь pH приблизительно 7,0, 7,5 или 8,0. В одном из вариантов осуществления высокофосфатный уравновешивающий буфер содержит приблизительно 400 мМ ионов фосфата и имеет pH приблизительно 7,5. В некоторых вариантах осуществления высокофосфатный уравновешивающий буфер также можно обозначать в настоящем описании как "уравновешивающий буфер 1".
В некоторых вариантах осуществления уравновешивающий буфер является фосфатным буфером, содержащим, например, фосфат натрия, где концентрация ионов фосфата в буфере составляет приблизительно от 1 до 20 мМ. Такие уравновешивающие буферы также можно обозначать в настоящем описании как "низкофосфатные уравновешивающие буферы" или т.п. Например, в варианте осуществления низкофосфатный уравновешивающий буфер может содержать приблизительно от 1 до 10 мМ ионов фосфата; в других вариантах осуществления он может содержать приблизительно 1, 2, 3, 4, 5 или 10 мМ ионов фосфата. Этот уравновешивающий буфер имеет относительно низкую концентрацию ионов фосфата в буфере для создания условий вокруг HA-смолы, благоприятных для того, чтобы интересующийся белок связывался со смолой. Необязательно, низкофосфатный уравновешивающий буфер может дополнительно содержать HEPES в концентрации приблизительно от 1 до 50 мМ. Например, в варианте осуществления низкофосфатный уравновешивающий буфер может содержать приблизительно от 2 до 30 мМ HEPES; в других вариантах осуществления он может содержать приблизительно 5, 10, 15, 20 или 25 мМ HEPES. Низкофосфатный уравновешивающий буфер может иметь pH приблизительно от 6,0 до 9,0. Например, в варианте осуществления низкофосфатный уравновешивающий буфер может иметь pH приблизительно от 7,0 до 8,0; в других вариантах осуществления он может иметь pH приблизительно 7,0, 7,5 или 8,0. В одном из вариантов осуществления низкофосфатный уравновешивающий буфер содержит приблизительно 2 мМ ионов фосфата, 20 мМ HEPES, и имеет pH приблизительно 7,5. В некоторых вариантах осуществления низкофосфатный уравновешивающий буфер также можно обозначать в настоящем описании как "уравновешивающий буфер 2". Однако, важно, что в способах по настоящему изобретению низкофосфатный уравновешивающий буфер можно использовать для предварительного уравновешивания смолы без предшествующего использования высокофосфатного уравновешивающего буфера во время осуществления способа.
Введение образца, содержащего интересующее антитело, в HA-колонку
Когда HA-колонка готова для введения белка, образец, содержащий интересующее антитело и примеси, вводят в HA-колонку. Буфер, в котором образец вводят в HA-колонку, можно обозначать в настоящем описании как "загрузочный буфер". В некоторых вариантах осуществления, если образец, содержащий интересующее антитело, исходно получают для использования в способе по настоящему изобретению, образец уже находится в подходящем загрузочном буфере для введения образца в HA-колонку. Однако, в других вариантах осуществления перед введением образца в HA-колонку, его можно обрабатывать (например, разводить, концентрировать или подвергать замене буфера) для модификации буферных условий образца таким образом, что образец будет находиться в подходящем буфере для введения в колонку. Например, в способах по настоящему изобретению загрузочный буфер не может иметь высокую концентрацию ионов фосфата, которые будут препятствовать связыванию интересующего антитела со HA-смолой. Таким образом, если исходный образец, содержащий интересующее антитело, имеет высокую концентрацию ионов фосфата, этот образец потребуется, например, развести или подвергнуть замене буфера до снижения концентрации ионов фосфата в образце до подходящей низкой концентрации, делающей возможной связывание интересующего антитела со HA-смолой.
В некоторых вариантах осуществления загрузочный буфер содержит не более приблизительно 10 мМ ионов фосфата. Например, в некоторых вариантах осуществления загрузочный буфер содержит менее приблизительно 10 мМ, 5 мМ, 4 мМ, 3 мМ, 2 мМ или 1 мМ ионов фосфата. В некоторых вариантах осуществления загрузочный буфер содержит 0 мМ ионов фосфата. Необязательно, загрузочный буфер может содержать различные другие соли или буферные компоненты (например, Трис, глицин). Загрузочный буфер может иметь pH приблизительно от 6,0 до 9,0. Например, в варианте осуществления загрузочный буфер может иметь pH приблизительно от 7,0 до 8,0; в других вариантах осуществления он может иметь pH приблизительно 7,0, 7,5 или 8,0.
В некоторых вариантах осуществления образец, содержащий интересующее антитело, можно вводить в HA-смолу до плотности на смоле по меньшей мере 1 г/л, 2 г/л, 3 г/л, 4 г/л, 5 г/л, 6г/л, 7 г/л, 8 г/л, 9 г/л, 10 г/л, 12 г/л, 15 г/л, 20 г/л, 25 г/л или 30 г/л. В некоторых вариантах осуществления образец, содержащий интересующее антитело, можно вводить в HA-смолу до плотности на смоле от по меньшей мере 1 г/л, 2 г/л, 3 г/л, 4 г/л, 5 г/л, 6г/л, 7 г/л, 8 г/л, 9 г/л, 10 г/л, 12 г/л, 15 г/л, 20 г/л или 25 г/л до не более 2 г/л, 3 г/л, 4 г/л, 5 г/л, 6 г/л, 7 г/л, 8 г/л, 9 г/л, 10 г/л, 12 г/л, 15 г/л, 20 г/л, 25 г/л или 30 г/л, где второе значение больше первого значения.
Промывка HA-колонки
После введения образца, содержащего интересующее антитело и примеси, в HA-колонку, но перед элюцией интересующего антитела способы по настоящему изобретению, необязательно, могут включать дополнительную стадию промывки нагруженной колонки одним или более промывочными буферами, например, для удаления неспецифически иммобилизованных примесей или иной подготовки или уравновешивания колонки для стадии элюции. Специалист в этой области может определять свойства любого промывочного буфера. В одном из вариантов осуществления промывочный буфер является фосфатным буфером, содержащим, например, фосфат натрия, и концентрация ионов фосфата в буфере составляет приблизительно от 5 до 50 мМ. Например, в варианте осуществления промывочный буфер может содержать приблизительно от 10 до 40 мМ ионов фосфата; в других вариантах осуществления он может содержать приблизительно 10, 20, 30, 40 или 50 мМ ионов фосфата. Необязательно, промывочный буфер может дополнительно содержать HEPES в концентрации приблизительно от 1 до 50 мМ. Например, в варианте осуществления промывочный буфер может содержать приблизительно от 2 до 30 мМ HEPES; в других вариантах осуществления он может содержать приблизительно 5, 10, 15, 20 или 25 мМ HEPES. Промывочный буфер может иметь pH приблизительно от 6,0 до 9,0. Например, в варианте осуществления промывочный буфер может иметь pH приблизительно от 7,0 до 8,0; в других вариантах осуществления он может иметь pH приблизительно 7,0, 7,5 или 8,0. В одном из вариантов осуществления промывочный буфер содержит приблизительно 40 мМ ионов фосфата, 20 мМ HEPES и имеет pH приблизительно 7,5.
Элюция интересующего антитела из HA-колонки
Способы по настоящему изобретению включают стадию элюции связанного интересующего антитела из HA-смолы. Связанное интересующее антитело элюируют с помощью одного или более элюирующих буферов. Как правило, элюирующий буфер содержит одну или более солей или ионов, и концентрация солей или ионов повышена во время элюции.
В некоторых вариантах осуществления элюирующий буфер, представленный в настоящем описании, содержит ионы фосфата. Необязательно, концентрацию ионов фосфата в элюирующем буфере повышают относительно исходной концентрации приблизительно 20 мМ до приблизительно 200 мМ во время элюции. Например, в варианте осуществления концентрацию ионов фосфата в элюирующем буфере повышают относительно исходной концентрации приблизительно 40 мМ до приблизительно 80 мМ или от приблизительно 40 мМ до приблизительно 100 мМ во время элюции. Конкретный способ и скорость повышения концентрации ионов фосфата в элюирующем буфере можно определять в соответствии с интересующим антителом, и при этом учитывают типы молекул примесей, также связанные со HA-смолой. Например, концентрацию ионов фосфата в элюирующем буфере можно повышать с помощью плавного/пологого линейного градиента. Использование пологого градиента может позволить эффективно разделять одну или более молекул, элюируемых из HA-смолы в схожих, но отличающихся условиях. Альтернативно, в некоторых вариантах осуществления концентрацию ионов фосфата в элюирующем буфере можно повышать с помощью резкого градиента или ее можно повышать ступенчато. Необязательно, элюирующий буфер может дополнительно содержать HEPES в концентрации приблизительно от 1 до 50 мМ. Например, в варианте осуществления элюирующий буфер может содержать приблизительно от 2 до 30 мМ HEPES; в других вариантах осуществления он может содержать приблизительно 5, 10, 15, 20 или 25 мМ HEPES. Элюирующий буфер может иметь pH приблизительно от 6,0 до 9,0. Например, в варианте осуществления элюирующий буфер может иметь pH приблизительно от 7,0 до 8,0; в других вариантах осуществления он может иметь pH приблизительно 7,0, 7,5 или 8,0. В одном из вариантов осуществления элюирующий буфер содержит приблизительно 40-80 мМ ионов фосфата (повышаемых с помощью градиента), 20 мМ HEPES и имеет pH приблизительно 7,5.
Для оптимизации элюции интересующего антитела из HA-колонки, а также отделения интересующего антитела от молекул примесей можно определять условия элюции, включая, в качестве неограничивающих примеров, свойства элюирующего буфера, подходящего для использования с HA-смолой (такие как композиция буфера, pH, концентрация, ионная сила и т.п.); любую необходимую стадию или изменение градиента в свойствах элюирующего буфера; количество используемых объемов колонки элюирующего буфера; скорость потока и т.п.
После элюции одну или более пиковых фракций, содержащих интересующее антитело, необязательно, собирают индивидуально или раздельно и, необязательно, объединяют, необязательно, корректируют pH, необязательно, фильтруют, а затем, необязательно, при желании, хранят перед дополнительной обработкой. Пиковые фракции для сбора можно идентифицировать любыми подходящими способами, такими как идентификация с помощью ультрафиолета при A280 и начальный сбор, когда сигнал ультрафиолета превышает желаемое количество и/или находится в желаемой точке, соответствующей условиям элюции.
Материал, элюируемый из HA-смолы и содержащий интересующее антитело, необязательно, можно обозначать в настоящем описании как "очищенную фракцию" или т.п. Очищенная фракция может содержать материал из одной фракции, элюируемой из HA-смолы, или она может представлять собой комбинацию множества объединенных фракций, элюируемых из HA-смолы. Как правило, очищенную фракцию получают так, чтобы сбалансировать сбор большого количества интересующего антитела при небольшом количестве молекул примесей. Эти конкурирующие цели зачастую необходимо сбалансировать, например, т.к. может быть по меньшей мере частичное перекрывание между условиями, в которых из HA-смолы элюируют интересующее антитело, и условиями, в которых из HA-смолы элюируют вид молекулы примеси.
Любой из буферов для способов по настоящему изобретению (например, уравновешивающий буфер, загрузочный буфер, промывочный буфер или элюирующий буфер) также может содержать дополнительные или альтернативные подходящие компоненты, такие как ацетат, сукцинат, MES, ACES, MOPSO, PIPES, BES, TAPSO, AMPSO, TRICINE, EPPS, бицин, DIPSO, HEPPSO, имидазол, Трис, бис-Трис, TAPS, аргинин, глицин, ацетонитрил, этанол, метанол, 1%-ный додецилсульфат натрия (SDS) или другие поверхностно-активные вещества и т.п.
В некоторых вариантах осуществления любой из буферов, представленных в настоящем описании, может иметь pH приблизительно от 6,0 до 9,0. В других вариантах осуществления любой из буферов, представленных в настоящем описании, может иметь pH приблизительно от 5,0 до 9,0, от 5,5 до 9,0, от 6,5 до 9,0, от 7,0 до 9,0, от 7,5 до 9,0, от 7,0 до 8,0 или от 6,5 до 8,5.
В буферах, представленных в настоящем описании и описанных как содержащие "ионы фосфата", ионы фосфата могут образовываться в буфере из любой подходящей фосфатной соли, такой как фосфат натрия или фосфат калия. Кроме того, растворы, представленные в настоящем описании и описанные как полученные с использованием "фосфата натрия", можно получать с использованием любой подходящей соли фосфата натрия (например, одноосновной или двухосновной).
После элюции интересующего антитела из HA-колонки, HA-колонку, необязательно, очищают для удаления примесей и других компонентов, которые могут ухудшать смолу в колонке, и подготавливают к хранению для последующего использования. В одном из вариантов осуществления колонку сначала регенерируют с использованием буфера, такого как буфер, содержащий фосфат натрия в концентрации приблизительно 0,4 M и при pH приблизительно 7,5; с последующей необязательной стадией санации с использованием очищающего раствора, такого как приблизительно 1 M NaOH и приблизительно 0,5 M фосфата калия, а затем подготавливают к хранению с использованием раствора для хранения, такого как приблизительно 0,1 M NaOH.
Антитела
Способы по настоящему изобретению можно использовать для очистки интересующего антитела от одной или более примесей. Например, очищенное антитело можно использовать в качестве фармацевтических средств или в получении фармацевтических средств.
В некоторых вариантах осуществления антитело, очищенное способом по настоящему изобретению, относится к любому типу антител, представленному в настоящем описании. Например, антитело, очищенное способом по настоящему изобретению, может являться полноразмерным антителом или фрагментом антитела (например, scFv или Fab) и может являться моноспецифическим или биспецифическим. Как правило, интересующее антитело, очищенное способом по настоящему изобретению, является рекомбинантным антителом.
Антитела IgG
В некоторых вариантах осуществления антитело, которое можно очищать способом по настоящему изобретению, является антителом-иммуноглобулином G (IgG). Как известно в этой области, антитело IgG содержит две тяжелые цепи и две легкие цепи и имеет общую "Y"-образную форму. В стандартных молекулах IgG две тяжелые цепи имеют одинаковую аминокислотную последовательность, и две легкие цепи имеют одинаковую аминокислотную последовательность. Антитело IgG можно описать как имеющее два "плеча" (т.е. "первое плечо" и "второе плечо"), где каждое плечо содержит одну тяжелую цепь и одну легкую цепь, соединенные дисульфидной связью. В стандартных молекулах IgG первое плечо антитела идентично второму плечу антитела (из-за того, что каждое плечо содержит тяжелую цепь и легкую цепь, имеющие ту же аминокислотную последовательность, что и тяжелая цепь и легкая цепь в другом плече, соответственно). N-концевая область тяжелой цепи содержит вариабельную область тяжелой цепи (VH), и N-концевая область легкой цепи содержит вариабельную область легкой цепи (VL). Области VH и VL содержат часть антитела, специфически связывающуюся с антигеном. Таким образом, каждое плечо антитела IgG может специфически связываться с антигеном. В стандартных молекулах IgG и первое плечо, и второе плечо антитела IgG связываются с одним и тем же антигеном (из-за того, что оба плеча содержат тяжелые цепи и легкие цепи, имеющие одинаковые соответствующие аминокислотные последовательности). Стандартное антитело IgG можно обозначать как "гомодимерное" с учетом того, что оно содержит 2 плеча, являющихся одинаковыми. Антитело IgG, очищенное способом по настоящему изобретению, может относиться к подклассу IgG1, IgG2, IgG3 или IgG4.
Биспецифические антитела IgG
В некоторых вариантах осуществления антитело, которое можно очищать способом по настоящему изобретению, является биспецифическим антителом IgG. В биспецифическом антителе IgG каждое из двух плеч антитела специфически связывается с другим антигеном. Кроме того, аминокислотная последовательность тяжелой цепи в первом плече биспецифического антитела IgG отличается от аминокислотной последовательности тяжелой цепи во втором плече того же биспецифического антитела IgG, и, аналогично, аминокислотная последовательность легкой цепи в первом плече биспецифического антитела IgG, как правило, отличается от аминокислотной последовательности легкой цепи во втором плече того же биспецифического антитела IgG. Таким образом, биспецифическое антитело IgG можно обозначать как "гетеродимерное" с учетом того, что оно содержит 2 плеча, являющихся разными. Первое плечо биспецифического антитела IgG можно описать как специфическое в отношении "первого антигена", и второе плечо биспецифического антитела IgG можно описать как специфическое в отношении "второго антигена". В некоторых вариантах осуществления биспецифическое антитело имеет изотип IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления биспецифическое антитело содержит иммунологически инертную Fc-область.
Биспецифические антитела IgG - способы получения
В этой области известны способы получения биспецифических антител (см., например, Suresh et al., Methods in Enzymology 121:210, 1986). Общепринято, рекомбинантное получение биспецифических антител основано на коэкспрессии двух пар тяжелая цепь иммуноглобулина-легкая цепь иммуноглобулина, при этом две тяжелые цепи имеют разные специфичности (Millstein and Cuello, Nature 305, 537-539, 1983).
В последнее время разработаны способы, в которых используют следующие общие стадии для получения биспецифических гетеродимерных антител:
1) Первое гомодимерное антитело (также обозначаемое в настоящем описании как "первое родительское антитело") и второе гомодимерное антитело (также обозначаемое в настоящем описании как "второе родительское антитело") индивидуально экспрессируют и очищают. Первое гомодимерное антитело является специфическим в отношении первого антигена-мишени получаемого биспецифического антитела, и второе гомодимерное антитело является специфическим в отношении второго антигена-мишени получаемого биспецифического антитела. Таким образом, например, если целью является получение биспецифического антитела, имеющего специфичность в отношении BCMA и CD3, раздельно экспрессируют и очищают моноклональное антитело против BCMA ("первое родительское антитело") и моноклональное антитело против CD3 ("второе родительское антитело").
2) Затем очищенное первое гомодимерное/родительское антитело и очищенное второе гомодимерное/родительское антитело смешивают и инкубируют совместно в условиях, способствующих обмену плеч антитела, таким образом, что образуются гетеродимерные биспецифические антитела, содержащие первое плечо из первого родительского антитела и второе плечо из второго родительского антитела. Эти условия, как правило, включают последовательность восстановительных условий, после которых следуют окислительные условия. Восстановительные условия способствуют расщеплению дисульфидных связей, удерживающих две тяжелые цепи гомодимерных антител вместе, и, таким образом, делают возможным переключение плеч антитела между первым родительским антителом и вторым родительским антителом. Затем в последующих окислительных условиях образуются новые дисульфидные мостики, стабилизирующие заново образующиеся биспецифические антитела. Этот общий подход для получения биспецифических антител показан на фиг. 1. На фиг. 1 показаны первое родительское антитело ("родительское антитело A"; серый цвет) и второе родительское антитело ("родительское антитело B"; черный цвет), каждое из которых является моноспецифическим гомодимером и содержит первое плечо и второе плечо. Как правило, первое родительское антитело и второе родительское антитело являются специфическими в отношении разных антигенов. Затем первое родительское антитело и второе родительское антитело смешивают и подвергают стадиям восстановления и окисления, что приводит к образованию интересующего биспецифического антитела, содержащего первое плечо из родительского антитела A и второе плечо из родительского антитела B и имеющего соответствующие специфичности обоих плеч.
Необязательно, аминокислотную последовательность тяжелой цепи антитела можно модифицировать одним или более способами для стимуляции образования биспецифических антител. Например, тяжелая цепь одного плеча биспецифического антитела может содержать модификацию аминокислот в первой шарнирной области, таким образом, что замененная аминокислота в первой шарнирной области имеет заряд, противоположный соответствующей аминокислоте в шарнирной области другого плеча образующегося биспецифического антитела. Это описано, например, в международной патентной заявке № PCT/US2011/036419 (WO2011/143545). В другом подходе образование желаемого гетеромультимерного или гетеродимерного белка (например, биспецифического антитела) усиливают посредством изменения или конструирования области контакта между первой и второй иммуноглобулин-подобной Fc-областью (например, шарнирной областью и/или областью CH3). В этом подходе биспецифическое антитело может содержать область CH3, где область CH3 содержит первый полипептид CH3 и второй полипептид CH3, взаимодействующие друг с другом, образуя область контакта CH3, где одна или более аминокислот в области контакта CH3 дестабилизируют образование гомодимера и не являются электростатически неблагоприятными для образования гомодимера. Этот подход также описан в международной патентной заявке № PCT/US2011/036419 (WO2011/143545).
Указанный выше способ и другие способы получения биспецифических антител дополнительно описаны, например, в международных патентных заявках №№ PCT/IB2011/054899 (WO2012/059882), PCT/US2011/036419 (WO2011/143545) и Giese et al, Biotechnology Progress, "Bispecific Antibody Process Development: Assembly and Purification of Knob and Hole Bispecific Antibodies", 17 Jan 2018, и цитируемых в них ссылках, каждая из которых включена в настоящее описание в качестве ссылки для всех целей. Способы очистки антител по настоящему изобретению можно использовать для очистки биспецифических антител, полученных любым подходящим способом.
Биспецифические антитела IgG - специфичность
В некоторых вариантах осуществления антитело, которое можно очищать способом по настоящему изобретению, является полноразмерным биспецифическим антителом IgG человека, где первый вариабельный домен первого плеча биспецифического антитела может связываться с первым антигеном, и второй вариабельный домен второго плеча биспецифического антитела может связываться со вторым антигеном. Первый антиген и второй антиген могут иметь любые характеристики антигена, представленные в настоящем описании. В некоторых вариантах осуществления первый антиген находится на первом типе клеток, и второй антиген находится на втором типе клеток.
В некоторых вариантах осуществления антитело, которое можно очищать способом по настоящему изобретению, является полноразмерным биспецифическим антителом IgG человека, где первый вариабельный домен антитела может рекрутировать активность иммунной эффекторной клетки человека посредством специфического связывания с эффекторным антигеном, находящимся на иммунной эффекторной клетке человека, и где второй вариабельный домен антитела может специфически связываться с антигеном-мишенью.
Иммунная эффекторная клетка человека, которая может быть связана антителом, представленным в настоящем описании, может являться любой из множества иммунных эффекторных клеток, известных в этой области. Например, иммунная эффекторная клетка может являться членом лимфоидного ростка клеток человека, включая, в качестве неограничивающих примеров, T-клетку (например, цитотоксическую T-клетку), B-клетку и естественный киллер (NK). Иммунная эффекторная клетка также может являться, например, членом миелоидного ростка человека, включая, в качестве неограничивающих примеров, моноцит, нейтрофильный гранулоцит и дендритную клетку. Такие иммунные эффекторные клетки могут иметь цитотоксический или апоптотический эффект в отношении клетки-мишени или любой желаемый эффект после активации посредством связывания эффекторного антигена. Эффекторный антиген является антигеном (например, белком или полипептидом), экспрессирующимся на иммунной эффекторной клетке человека. Примеры эффекторных антигенов, которые могут быть связаны антителом, представленным в настоящем описании, включают, в качестве неограничивающих примеров, CD3 человека (или комплекс CD3 (кластер дифференцировки)), CD16, NKG2D, NKp46, CD2, CD28, CD25, CD64 и CD89.
Антиген-мишень экспрессируется на клетке-мишени при заболевании (например, воспалительном заболевании, пролиферативном заболевании (например, злокачественном новообразовании), иммунологическом нарушении, неврологическом заболевании, нейродегенеративном заболевании, аутоиммунном заболевании, инфекционном заболевании (например, вирусной инфекции или паразитарной инфекции), аллергической реакции, реакции "трансплантат против хозяина" или реакции "хозяин против трансплантата"). Антиген-мишень не является эффекторным антигеном. Неограничивающие примеры антигенов-мишеней включают BCMA, EpCAM (молекулу адгезии эпителиальных клеток), CCR5 (хемокиновый рецептор типа 5), CD19, HER (рецептор эпидермального фактора роста человека)-2/neu, HER-3, HER-4, EGFR (рецептор эпидермального фактора роста), FLT3 (Fms-подобную тирозинкиназу 3), PSMA, CEA, MUC-1 (муцин), MUC2, MUC3, MUC4, MUC5AC, MUC5B, MUC7, CIhCG, антиген Льюиса Y, CD20, CD33, CD30, ганглиозид GD3, 9-O-ацетил-GD3, GM2, Globo H, фукозил-GM1, поли-SA, GD2, карбоангидразу IX (MN/CA IX), CD44v6, Shh (Sonic Hedgehog), Wue-1, антиген плазматических клеток, (мембраносвязанный) IgE, MCSP (меланома-специфический хондроитинсульфатный протеогликан), CCR8, предшественник ФНО-альфа, STEAP, мезотелин, антиген A33, PSCA (антиген стволовых клеток предстательной железы), Ly-6; десмоглеин 4, неоэпитоп E-кадгерин, фетальный ацетилхолиновый рецептор, CD25, маркер CA19-9, маркер CA-125 и MIS (мюллерову ингибирующую субстанцию) рецептор типа II, sTn (сиалированный антиген Tn; TAG-72), FAP (антиген активации фибробластов), эндосиалин, EGFRvIII, LG, SAS и CD63.
В некоторых вариантах осуществления антитело, очищенное способом по настоящему изобретению, может являться любым антителом, описанным в заявке США № 15/085644, поданной 30 марта 2016 года (публикация № US20160297885), или заявке США № 15/993874, поданной 31 мая 2018 года (публикация № US20180346601), включенных, таким образом, в настоящее описание в качестве ссылки в полном объеме для всех целей.
В некоторых вариантах осуществления антитело, очищенное способом по настоящему изобретению, может являться биспецифическим антителом IgG, в котором одно плечо антитела специфически связывается с кластером дифференцировки 3(CD3). Информация о CD3 приведена, например, в UniProtKB ID # P07766.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, область VH тяжелой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYYMTWVRQAPGKGLEWVAFIRNRARGYTSDHNPSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARDRPSYYVLDYWGQGTTVTVSS (SEQ ID NO: 1). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, тяжелая цепь CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYYMTWVRQAPGKGLEWVAFIRNRARGYTSDHNPSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARDRPSYYVLDYWGQGTTVTVSSastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkcrvrcprcpappvagpsvflfppkpkdtlmisrtpevtcvvvavshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpssiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflysrltvdksrwqqgnvfscsvmhealhnhytqkslslspgk (SEQ ID NO: 2). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, область VH тяжелой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VH, приведенной в SEQ ID NO: 1.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, область VL легкой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: DIVMTQSPDSLAVSLGERATINCKSSQSLFNVRSRKNYLAWYQQKPGQPPKLLISWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCKQSYDLFTFGSGTKLEIK (SEQ ID NO: 3). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, легкая цепь CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: DIVMTQSPDSLAVSLGERATINCKSSQSLFNVRSRKNYLAWYQQKPGQPPKLLISWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCKQSYDLFTFGSGTKLEIKrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec (SEQ ID NO: 4). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, область VL легкой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VL, приведенной в SEQ ID NO: 3.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, область VH тяжелой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 1, и область VL легкой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 3. В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, тяжелая цепь CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 2, и легкая цепь CD3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 4. В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с CD3, область VH тяжелой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VH, приведенной в SEQ ID NO: 1, и область VL легкой цепи CD3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VL, приведенной в SEQ ID NO: 3.
В некоторых вариантах осуществления антитело, очищенное способом по настоящему изобретению, может являться биспецифическим антителом IgG, в котором одно плечо антитела специфически связывается с антигеном созревания B-клеток (BCMA). Информация о BCMA приведена, например, в UniProtKB ID # Q02223.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VH тяжелой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYPMSWVRQAPGKGLEWVSAIGGSGGSLPYADIVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYWPMDIWGQGTLVTVSS (SEQ ID NO: 5). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, тяжелая цепь BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYPMSWVRQAPGKGLEWVSAIGGSGGSLPYADIVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYWPMDIWGQGTLVTVSSastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkcevecpecpappvagpsvflfppkpkdtlmisrtpevtcvvvavshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpssiektisktkgqprepqvytlppsreemtknqvsltcevkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk (SEQ ID NO: 6). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VH тяжелой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VH, приведенной в SEQ ID NO: 5.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VL легкой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLMYDASIRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYQSWPLTFGQGTKVEIK (SEQ ID NO: 7). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, легкая цепь BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLMYDASIRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYQSWPLTFGQGTKVEIKrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec (SEQ ID NO: 8). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VL легкой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VL, приведенной в SEQ ID NO: 7.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VH тяжелой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, и область VL легкой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7. В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, тяжелая цепь BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 6, и легкая цепь BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 8. В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VH тяжелой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VH, приведенной в SEQ ID NO: 5, и область VL легкой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VL, приведенной в SEQ ID NO: 7.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VH тяжелой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYPMSWVRQAPGKGLEWVSAIGgSGGSLPYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYWPMDIWGQGTLVTVSS (SEQ ID NO: 13). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с BCMA, область VL легкой цепи BCMA-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EIVLTQSPGTLSLSPGERATLSCRASQSVSSTYLAWYQQKPGQAPRLLMYDASIRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYQEWPLTFGQGTKVEIK (SEQ ID NO: 14). В некоторых вариантах осуществления в любой ссылке в настоящем описании на антитело, содержащее область VH, имеющую аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, антитело альтернативно может содержать область VH, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 13. В некоторых вариантах осуществления в любой ссылке в настоящем описании на антитело, содержащее область VL, имеющую аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 7, антитело альтернативно может содержать область VL, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 14. Аналогично, в настоящее описание также включены тяжелые и легкие цепи антитела против BCMA, содержащие последовательности VH и VL SEQ ID NO: 13 и SEQ ID NO: 14, соответственно.
В некоторых вариантах осуществления антитело, очищенное способом по настоящему изобретению, может являться биспецифическим антителом IgG, в котором одно плечо антитела специфически связывается с fms-подобной тирозинкиназой 3 (FLT3). Информация о FLT3 приведена, например, в UniProtKB ID # P36888.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, область VH тяжелой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMNWVRQAPGKGLEWVSAISGGGRSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLSPSDVGWGYGFDIWGQGTLVTVSS (SEQ ID NO: 9). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, тяжелая цепь FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMNWVRQAPGKGLEWVSAISGGGRSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLSPSDVGWGYGFDIWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCEVECPECPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVAVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPSSIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCEVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO: 10). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, область VH тяжелой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VH, приведенной в SEQ ID NO: 9.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, область VL легкой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EIVLTQSPATLSLSPGERATLSCRASQSVSSNLAWYQQKPGQAPRLLIYDTFTRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQYGSSPPTFGQGTRLEIK (SEQ ID NO: 11). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, легкая цепь FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность: EIVLTQSPATLSLSPGERATLSCRASQSVSSNLAWYQQKPGQAPRLLIYDTFTRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQYGSSPPTFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 12). В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, область VL легкой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VL, приведенной в SEQ ID NO: 11.
В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, область VH тяжелой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 9, и область VL легкой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 11. В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, тяжелая цепь FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 10, и легкая цепь FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 12. В некоторых вариантах осуществления в биспецифическом антителе IgG, в котором одно плечо антитела специфически связывается с FLT3, область VH тяжелой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VH, приведенной в SEQ ID NO: 9, и область VL легкой цепи FLT3-связывающего плеча имеет аминокислотную последовательность, содержащую CDR1, CDR2 и CDR3 последовательности VL, приведенной в SEQ ID NO: 11.
В некоторых вариантах осуществления настоящее изобретение относится к биспецифическому антителу против BCMA/против CD3, в котором плечо антитела против BCMA имеет любую из характеристик, описанных выше для плеча против BCMA, и плечо антитела против CD3 имеет любую из характеристик, описанных выше для плеча против CD3. В некоторых вариантах осуществления настоящее изобретение относится к биспецифическому антителу против FLT3/против CD3, в котором плечо антитела против FLT3 имеет любую из характеристик, описанных выше для плеча против FLT3, и плечо антитела против CD3 имеет любую из характеристик, описанных выше для плеча против CD3.
Настоящее изобретение также относится к способам очистки моноспецифического антитела, имеющего аффинность к любому из указанных выше антигенов и/или содержащего любую из описанных выше аминокислотных последовательностей. Например, настоящее изобретение также относится к очистке моноспецифического, гомодимерного антитела против CD3, содержащего аминокислотную последовательность VH, приведенную в SEQ ID NO: 1.
Примеси
Способы по настоящему изобретению можно использовать для очистки интересующего антитела от одной или более примесей.
Примеси включают, например, клиппированные версии интересующего антитела, белковые агрегаты и, в случае интересующего биспецифического антитела, родительские моноспецифические антитела, связанные с образованием интересующего биспецифического антитела. Эти разные примеси также можно обозначать в настоящем описании как разные "виды примесей", "молекулы примесей" или т.п.
Клиппированные версии интересующего антитела
Термины "клиппированные версии интересующего антитела", "клиппированные антитела" или т.п. относятся к рекомбинантному антителу, в котором одна или более полипептидных связей в антителе расщеплена по сравнению с соответствующим интактным интересующим антителом. В отличие от этого, термин "интактное" антитело относится к рекомбинантному антителу, содержащему все ожидаемые пептидные связи и аминокислоты рекомбинантного антитела (т.е. ожидаемые с учетом последовательностей нуклеиновой кислоты, кодирующих полипептиды антитела)
В связи с этим, клиппированные антитела можно считать продуктами деградации, относящимися к интересующему антителу. Расщепление пептидной связи в антителе может происходить, например, под действием ферментативной (например, протеаза-опосредованной) или неферментативной активности.
В некоторых вариантах осуществления, если пептидную связь в полипептиде антитела расщепляют, после расщепления отщепленная часть полипептидной цепи может больше не быть ковалентно связанной с остальной частью антитела; в этом случае отщепленная часть полипептидной цепи может диссоциировать от остальной части антитела. Чаще всего это встречается, когда расщепление происходит в пептидной связи близи N- или C-конца полипептидной цепи, и приводит к образованию клиппированного антитела, в котором отсутствует одна или более аминокислот по сравнению с соответствующим интактным антителом. Эти клиппированные антитела имеют меньшую массу, чем соответствующее интактное антитело, из-за потери одной или более аминокислот в антителе.
Альтернативно, в некоторых других вариантах осуществления, если пептидную связь в полипептиде антитела расщепляют, после расщепления отщепленная часть полипептидной цепи может оставаться ковалентно связанной с остальной частью антитела (например, посредством внутрицепочечной или межцепочечной дисульфидной связи). В этом случае, даже если происходит расщепление пептидной связи в антителе, отщепленная часть полипептидной цепи будет оставаться связанной с остальной частью антитела посредством остальных интактных ковалентных связей, соединяющих отщепленную часть полипептидной цепи с остальной частью антитела. В этом случае клиппированное антитело все равно будет иметь то же количество аминокислот и аминокислотных последовательностей, что и интактное антитело. Кроме того, по меньшей мере в некоторых вариантах осуществления этот тип клиппированного антитела может иметь немного большую массу, чем соответствующее интактное антитело. Это увеличение массы может являться результатом, например, одной или более химических реакций, происходящих после расщепления пептидной связи. В ходе таких реакций один или более атомов (например, H, O) могут реагировать с атомами полипептидной цепи антитела и становиться ковалентно связанными с цепью антитела, что приводит к увеличению массы клиппированного антитела по сравнению с соответствующим интактным антителом.
Т.к. "клиппированное" антитело образуется из соответствующего "интактного" антитела, "клиппированная" версия антитела имеет ту же аминокислотную последовательность (в случае отсутствия потери аминокислот в антителе в результате расщепления пептидной связи) или почти ту же аминокислотную последовательность (в случае потери одной или более аминокислотных последовательностей в антителе в результате расщепления пептидной связи), что и соответствующая "интактная" версия антитела.
Как правило, клиппированная версия антитела имеет массу, схожую с массой соответствующего интактного антитела. Как описано выше, в некоторых вариантах осуществления клиппированное антитело может иметь меньшую массу, чем соответствующее интактное антитело (например, в случае, если клиппирование приводит к потере одной или более аминокислот в антителе). Альтернативно, в некоторых вариантах осуществления клиппированное антитело может иметь большую массу, чем соответствующее интактное антитело (в случае, если клиппирование не приводит к потере каких-либо аминокислоты в антителе и, вместо этого, приводит к прибавлению по меньшей мере атома в антителе посредством одной или более реакций, происходящих в результате расщепления пептидной связи).
В некоторых вариантах осуществления клиппированная версия антитела имеет массу, отличающуюся на не более чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,05%, 0,04%, 0,03%, 0,02%, 0,01% от массы соответствующего интактного интересующего антитела. Иными словами, в некоторых вариантах осуществления клиппированная версия интересующего антитела имеет массу, отличающуюся от массы соответствующего интактного интересующего антитела на не более чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,05%, 0,04%, 0,03%, 0,02% или 0,01%.
Как описано выше, в некоторых вариантах осуществления клиппированная версия интересующего антитела имеет меньшую массу, чем соответствующее интактное интересующее антитело. Например, в некоторых вариантах осуществления клиппированная версия антитела имеет массу на не более чем 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,05%, 0,04%, 0,03%, 0,02%, 0,01% меньшую, чем масса соответствующего интактного интересующего антитела. Другими словами, если клиппированная версия антитела имеет массу, на не более чем 10% меньшую, чем масса соответствующего интактного интересующего антитела, то, например, если интактное интересующее антитело имеет массу 100000 Да, то клиппированная версия антитела имеет массу, на не более чем 10000 Да меньшую, чем масса интактного антитела (10% от 100000 составляют 10000), т.е. она имеет массу от 90000 до 100000 Да.
Как описано выше, в некоторых вариантах осуществления клиппированная версия интересующего антитела имеет большую массу, чем соответствующее интактное интересующее антитело. Например, в некоторых вариантах осуществления клиппированная версия антитела имеет массу, на не более чем 5%, 4%, 3%, 2%, 1%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,05%, 0,04%, 0,03%, 0,02% или 0,01% большую, чем масса соответствующего интактного интересующего антитела. Другими словами, если клиппированная версия антитела имеет массу, на не более чем 1% большую, чем масса соответствующего интактного интересующего антитела, то, например, если интактное интересующее антитело имеет массу 100000 Да, то клиппированная версия антитела имеет массу, на не более чем 1000 Да большую, чем масса интактного антитела (1% от 100000 составляет 1000), т.е. она имеет массу от 100000 до 101000 Да.
Высокомолекулярные соединения (HMMS)/белковые агрегаты
В некоторых вариантах осуществления примеси, ассоциированные со способом по настоящему изобретению, обозначают как "высокомолекулярные соединения" (HMMS). Термин "HMMS" относится к любым высокомолекулярным загрязнениям или примесям, но, как правило, представляет собой ассоциацию по меньшей мере двух белком, образующих агрегат. В качестве примера, HMMS могут включать множество агрегировавших молекул интересующего антитела и/или агрегаты белков клеток-хозяев, использованных для получения интересующего антитела. Агрегаты могут образовываться любым способом, включая, например, ковалентное или нековалентное связывание молекул.
Родительские антитела
В некоторых вариантах осуществления примесь, относящаяся к способу по настоящему изобретению, является "родительским антителом" или т.п. Этот тип молекулы примеси важен в случае способов по настоящему изобретению, в которых интересующее антитело является биспецифическим антителом, получаемым из двух разных родительских антител, например, как показано на фиг. 1. Эти родительские антитела являются моноспецифическими гомодимерами. Родительские антитела могут присутствовать в препарате антител с биспецифическим интересующим антителом по причине множества возможных механизмов, например: i) в некоторых случаях некоторые молекулы родительских антител не разделяются на первое плечо и второе плечо на стадии восстановления для разделения родительских антител на отдельные первое плечо и второе плечо (и таким образом, антитела остаются в виде моноспецифических гомодимеров); или ii) в некоторых случаях отдельные первое плечо и второе плечо из одного типа родительского антитела соединяются, таким образом, образуя моноспецифический гомодимер (а не участвуют в образовании гетеродимерного биспецифического антитела). В рамках изобретения термин "родительское антитело" относится к гомодимерным молекулам, образующимся в результате любого из указанных выше механизмов. Кроме того, препарат антитела, представленный в настоящем описании, может содержать в качестве примеси родительское антитело одного или обоих видов родительских антител.
Очистка интересующего антитела от примесей
Настоящее изобретение относится к способам очистки интересующего антитела от одной или более примесей.
В некоторых вариантах осуществления в способе по настоящему изобретению интересующее антитело находится в препарате антитела (также обозначаемом в настоящем описании как "исходный образец"), содержащем интересующее антитело, а также один или более видов молекул примесей. В этом исходном материале в случае способа по настоящему изобретению интересующее антитело может содержать, например, по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% масс. белка в препарате антитела. Кроме того, в некоторых вариантах осуществления способа по настоящему изобретению очищенную фракцию (также обозначаемую в настоящем описании как "очищенный образец") собирают в виде элюата из HA-смолы. Эта очищенная фракция содержит интересующее антитело и, в некоторых вариантах осуществления, все еще содержит одну или более молекул примесей. В некоторых вариантах осуществления в очищенной фракции, представленной в настоящем описании, интересующее антитело может содержать, например, по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% масс. белка в очищенной фракции.
В некоторых вариантах осуществления в способе по настоящему изобретению исходный образец содержит по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% масс. интересующего антитела, и последующий очищенный образец в том же способе содержит по меньшей мере приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% масс. интересующего антитела, где второе значение больше первого значения.
В некоторых вариантах осуществления в способе по настоящему изобретению исходный образец содержит по меньшей мере, приблизительно 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или 25% масс. клиппированной версии интересующего антитела. В некоторых вариантах осуществления в способе по настоящему изобретению очищенный образец содержит не более приблизительно 0,01%, 0,05%, 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15% или 20% масс. клиппированной версии интересующего антитела. В некоторых вариантах осуществления в способе по настоящему изобретению исходный образец содержит по меньшей мере приблизительно 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20% или 25% масс. клиппированной версии интересующего антитела, и последующий очищенный образец в том же способе содержит не более приблизительно 0,01%, 0,05%, 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15% или 20% масс. клиппированной версии интересующего антитела, где второе значение меньше первого значения.
В некоторых вариантах осуществления в способе по настоящему изобретению исходный образец содержит интактное интересующее антитело и клиппированную версию интересующего антитела, где соотношение клиппированного антитела и интактного антитела составляет по меньшей мере приблизительно 1:100, 1:50, 1:25, 1:20, 1:10, 1:5, 1:4 или 1:3. В некоторых вариантах осуществления в способе по настоящему изобретению очищенный образец содержит интактное интересующее антитело и клиппированную версию интересующего антитела, где соотношение клиппированного антитела и интактного антитела составляет не более приблизительно 1:100, 1:50, 1:25, 1:20 или 1:10. В некоторых вариантах осуществления в способе по настоящему изобретению исходный образец содержит интактное интересующее антитело и клиппированную версию интересующего антитела, где соотношение клиппированного антитела и интактного антитела в исходном образце составляет по меньшей мере приблизительно 1:100, 1:50, 1:25, 1:20, 1:10, 1:5, 1:4 или 1:3, и где соотношение клиппированного антитела и интактного антитела в последующем очищенном образце в том же способе составляет не более приблизительно 1:200, 1:100, 1:50, 1:25, 1:20 или 1:10, где второе соотношение меньше первого соотношения. В некоторых вариантах осуществления в способе по настоящему изобретению исходный образец содержит интактное интересующее антитело и клиппированную версию интересующего антитела, где соотношение клиппированного антитела и интактного антитела в исходном образце составляет от приблизительно одного из соотношений в группе A (соотношения группы A: 1:100, 1:50, 1:25, 1:20, 1:10, 1:5 или 1:4) до одного из соотношений в группе B (соотношения группы B: 1:50, 1:25, 1:20, 1:10, 1:5, 1:4 или 1:3), и где соотношение клиппированного антитела и интактного антитела в последующем очищенном образце в том же способе составляет не более приблизительно 1:200, 1:100, 1:50, 1:25, 1:20 или 1:10, где соотношение в очищенном образце меньше соотношения в исходном образце.
В некоторых вариантах осуществления исходный образец, полученный способом по настоящему изобретению, содержит, по меньшей мере 1, 5, 10, 15, 20, 25, 50, 100, 200, 500, 1000, 2000, 5000 или 10000 граммов интактного интересующего антитела. В некоторых вариантах осуществления очищенный образец, полученный способом по настоящему изобретению, содержит, по меньшей мере 1, 5, 10, 15, 20, 25, 50, 100, 200, 500, 1000, 2000, 5000 или 10000 граммов интактного интересующего антитела. В некоторых вариантах осуществления исходный образец, полученный способом по настоящему изобретению, содержит по меньшей мере 5, 10, 15, 20, 25, 50, 100, 200, 500, 1000, 2000, 5000 или 10000 граммов интактного интересующего антитела, и последующий очищенный образец в том же способе содержит по меньшей мере 1, 5, 10, 15, 20, 25, 50, 100, 200, 500, 1000, 2000 или 5000 граммов интактного интересующего антитела, где первое значение больше второго значения.
Кроме того, любые приведенные выше описания, касающиеся a) количества или b) чистоты интересующего антитела в исходном образце или очищенном образце, можно учитывать совместно по отношению к одному образцу. Например, как указано выше, исходный образец может содержать по меньшей мере приблизительно 80% масс. интересующего антитела; кроме того, как указано выше, исходный образец может содержать по меньшей мере приблизительно 10 граммов интересующего антитела. Таким образом, настоящее изобретение также относится к исходному образцу, содержащему по меньшей мере приблизительно 80% масс. интересующего антитела и по меньшей мере 10 граммов интересующего антитела и т.д.
Общие способы
Если не указано иначе, в практическом осуществлении настоящего изобретения используют общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, известные специалистам в этой области. Такие способы полностью описаны в литературе, такой как, Molecular Cloning: A Laboratory Manual, второе издание (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow и D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995), а также, в соответствующих случаях, последующие издания и соответствующие веб-сайты указанных выше ссылок.
Следующие примеры представлены исключительно в иллюстративных целях и не предназначены для ограничения объема настоящего изобретения каким-либо образом. Фактически, различные модификации изобретения в дополнение к представленным и описываемым в настоящем описании будут очевидны специалистам в этой области из изложенного выше описания, и они попадают в объем формулы изобретения.
Примеры
Пример 1: Очистка биспецифического антитела против BCMA/против CD3 посредством хроматографии на cHA-смоле
Цель:
В этом примере исследовали способы отделения полноразмерного интересующего биспецифического IgG человека от различных примесей. Интересующее антитело являлось гетеродимерным биспецифическим антителом против BCMA/против CD3 (т.е. одно плечо биспецифического антитела являлось специфическим в отношении BCMA, и другое плечо являлось специфическим в отношении CD3). Примеси, присутствующие вместе с интересующим биспецифическим антителом в начале очистки, включали: i) клиппированную версию интактного интересующего биспецифического антитела против BCMA/против CD3; ii) гомодимерные, моноспецифические родительские антитела против BCMA; iii) гомодимерные, моноспецифические антитела против CD3; и iv) белковые агрегаты/высокомолекулярные соединения (HMMS).
Очистка интактного интересующего биспецифического антитела от клиппированной версии биспецифического антитела представляет собой особую задачу, т.к. клиппированная версия биспецифического антитела содержала то же количество аминокислот и те же аминокислотные последовательности, что и интактное интересующее биспецифическое антитело, и отличалась по массе от интактного биспецифического антитела только на 18 Да. В частности, масса интактного биспецифического антитела против BCMA/CD3 составляет 148095,5 Да, в то время как масса соответствующей клиппированной версии биспецифического антитела составляет 148113,5 Да (что определено посредством масс-спектрометрии). Таким образом, клиппированное биспецифическое антитело имеет отличие по массе менее 0,1% (даже менее 0,02%) по сравнению с массой интактного биспецифического антитела (т.е. 0,1% от 148095 Да составляет 148 Да; 0,02% от 148095 Да составляет 29,6 Да). Другими словами, масса клиппированного биспецифического антитела составляет приблизительно 100,01% массы интактного интересующего биспецифического антитела. Таким образом, масса клиппированного биспецифического антитела очень схожа с массой интактного интересующего биспецифического антитела.
Клиппированная версия биспецифического антитела содержит расщепление пептидной связи в тяжелой цепи против CD3 между 56-ой и 57-ой аминокислотой тяжелой цепи. Тяжелая цепь против CD3 имеет аминокислотную последовательность, приведенную в SEQ ID NO: 2, и, таким образом, расщепление происходит между аминокислотами R и G в последовательности "RG" SEQ ID NO: 2 ("RG" встречается в SEQ ID NO: 2 только один раз). Полагают, что это расщепление приводит к прибавлению 1 атома кислорода и 2 атомов водорода в клиппированном биспецифическом антителе (что соответствует увеличению массы на 18 Да) по сравнению с интактным биспецифическим антителом. Кроме того, хотя в тяжелой цепи против CD3 находится расщепленная пептидная связь, отщепленная 56-аминокислотная часть тяжелой цепи (т.е. первые 56 аминокислот цепи) остается связанной с остальной частью антитела с помощью интактной, оставшейся внутрицепочечной дисульфидной связи. Внутрицепочечная дисульфидная связь находится между C22 и C98 тяжелой цепи против CD3 (т.е. C22 и C98 последовательности, приведенной в SEQ ID NO: 2). Продолжающееся связывание отщепленной 56-аминокислотной части с остальной частью антитела посредством внутрицепочечной пептидной связи схематически показано на. 2.
На фиг. 2 на схеме слева показано интактное интересующее биспецифическое антитело, содержащее интактные тяжелые и легкие цепи для плеча против CD3 и плеча против BCMA биспецифического антитела (на фигуре более длинные цепи соответствуют тяжелым цепям антитела, а более короткие цепи соответствуют легким цепям). Кроме того, на фиг. 2 также показаны различные дисульфидные связи внутри антитела, включая внутрицепочечные дисульфидные связи (например, связывающие разные аминокислоты в одной и той же легкой цепи или тяжелой цепи), а также межцепочечные дисульфидные связи (например, связывающие тяжелую цепь плеча против BCMA с тяжелой цепью плеча против CD3 или связывающие легкую цепь плеча против CD3 с тяжелой цепью плеча против CD3).
Другой задачей при разработке способа очистки интактного интересующего биспецифического антитела от различных примесей являлась разработка способа, с помощью которого будут эффективно отделять интересующее биспецифическое антитело от примесей, когда необходимо очистить относительно большие количества интересующего биспецифического антитела. Например, одной из целей в этом примере являлась разработка способа очистки биспецифического антитела, который был бы эффективным в случае способов, в которых необходимо очистить по меньшей мере 1 грамм биспецифического антитела. Как известно в этой области, при крупномасштабной очистке белков зачастую возникает множество затруднений, не возникающих (или являющихся гораздо менее проблематичными) при очистке тех же белков в малом масштабе, в результате, например, затруднений в достижении четкого хроматографического разрешения между разными белками при осуществлении хроматографии в крупном масштабе.
Материалы и способы:
Исходным материалом для этой работы являлся препарат антитела, содержащий биспецифическое интересующее антитело IgG против BCMA/CD3, а также различные примеси, такие как примеси, указанные выше. Аминокислотные последовательности полипептидов биспецифического антитела приведены в следующих SEQ ID NO: тяжелая цепь против BCMA: SEQ ID NO: 6; легкая цепь против BCMA: SEQ ID NO: 8; тяжелая цепь против CD3: SEQ ID NO: 2; легкая цепь против CD3: SEQ ID NO: 4. Интересующее биспецифическое антитело получают из двух отдельных родительских антител, как представлено выше в настоящем описании. Более конкретно, родительские моноспецифические антитела против CD3 и против BCMA очищают посредством хроматографии с протеином A, и эти очищенные родительские моноспецифические антитела против CD3 и против BCMA используют для получения интересующего биспецифического антитела против BCMA/CD3. Затем полученное биспецифическое антитело против BCMA/CD3 очищают посредством ионообменной хроматографии. Препарат антитела, используемый в качестве исходного материала для очистки в этом примере, элюировали из ионообменной колонки, и он содержал интересующее биспецифическое антитело и различные оставшиеся примеси, а также буферы/соли в приблизительной концентрации 50 мМ Трис и 60 мМ глицина, pH 7,5. Препарат антитела содержал более 85% масс. интактного интересующего биспецифического антитела; он также содержал приблизительно 8% клиппированного биспецифического антитела, приблизительно 1% моноспецифического родительского антитела против BCMA, приблизительно 1% моноспецифического родительского антитела против CD3 и приблизительно 2% белковых агрегатов/высокомолекулярных соединений (HMMS). Таким образом, хотя препарат антитела, используемый в качестве исходного материала в этом способе, содержал интактное интересующее биспецифическое антитело, уже являвшееся относительно чистым, целью являлась разработка способа для повышения чистоты интактного биспецифического антитела.
Результаты:
Тестировали множество разных хроматографических смол и условий в попытке идентифицировать подходящую смолу и буферные условия, которые сделают возможной эффективную очистку интактного интересующего биспецифического антитела против BCMA/CD3 от клиппированного биспецифического антитела, моноспецифических родительских антител и белковых агрегатов. В процессе этого тестировали, например, множество разных ионообменных смол и смол с гидрофобными взаимодействиями, а также различные буферные условия и pH. После обширного тестирования гидроксиапатитная смола оказалась единственной идентифицированной смолой, позволяющей эффективно очищать интактное биспецифическое антитело против BCMA/CD3 от различных примесей, включая клиппированное биспецифическое антитело.
На фиг. 3 показан хроматографический профиль элюции интересующего биспецифического антитела из колонки с керамической гидроксиапатитной ("cHA") смолой и конкурентное отделение интересующего биспецифического антитела против BCMA/CD3 от множества разных примесей, включая клиппированную версию биспецифического антитела, оба вида родительских антител и высокомолекулярные белки. В хроматографическом эксперименте, показанном на фиг. 3, в препарат антитела, введенный в cHA-смолу, добавляли дополнительные родительские антитела против BCMA и родительские антитела против CD3 для более четкой идентификации положения элюции этих молекул из cHA-колонки (однако, не добавляли дополнительные интактные или клиппированные биспецифические антитела). На фиг. 3 на оси X слева направо показана последовательность элюции из cHA-колонки (т.е. материал слева элюируют из cHA-колонки раньше/при более низкой концентрации соли, чем материал справа). Как правило, элюат собирают из колонки в последовательных фракциях; таким образом, ось X также можно считать отражающей последовательность фракций элюата из колонки с cHA-смолой. На оси Y показано поглощение УФ (при 280 нМ) и электропроводность, что раздельно указано на графике. Поглощение УФ соответствует наличию элюируемого белка, и электропроводность соответствует концентрации соли в элюируемом материале. Таким образом, на фиг. 3 показан профиль элюции разных белков из колонки с cHA-смолой, т.к. концентрация соли в элюирующем буфере, протекающем через cHA-смолу, повышается. Если смотреть на график УФ на фиг. 3 слева направо, на нем показаны различные пики и плечи, соответствующие интактному интересующему биспецифическому антителу против BCMA/CD3 или различным примесям. В частности, слева направо первый пик УФ соответствует элюции первого родительского антитела ("родительское антитело 1"; моноспецифический гомодимер против BCMA). Ранняя часть следующего большого пика (и наибольшего пика на графике) соответствует белку интактного интересующего биспецифического антитела ("POI"). Последняя/хвостовая часть того же большого пика соответствует клиппированной версии биспецифического антитела ("клиппированная версия"). Хотя есть некоторое перекрывание между профилем элюции интактного биспецифического антитела и клиппированного биспецифического антитела, эти два типа антител элюируют из cHA-колонки в существенно отличающихся солевых условиях и фракциях для значительного отделения интактного биспецифического антитела от клиппированной версии биспецифического антитела. И наконец, после элюции клиппированной версии биспецифического антитела последний большой пик/плечо из cHA-колонки соответствует элюции второго родительского антитела (моноспецифического гомодимера против CD3), а также высокомолекулярных соединений ("HMMS") (также обозначаемых как белковые агрегаты) из cHA-колонки. Таким образом, на графике на фиг. 3 показано, что интактное антитело против BCMA/CD3 можно эффективно очищать от множества примесей, включая соответствующие клиппированное и родительское антитело, посредством хроматографии на cHA-смоле.
На фиг. 4 показан график, на котором представлена более подробная информация о разных молекулах, присутствующих в последовательно элюируемых фракциях из колонки с cHA-смолой, в соответствии с профилем элюции из cHA, показанном на фиг. 3. В частности, на фиг. 4 представлена подробная информация об относительных количествах: i) интактного интересующего биспецифического антитела против BCMA/CD3 ("POI"); ii) клиппированной версии биспецифического антитела; iii) первого родительского антитела/моноспецифического антитела против BCMA; iv) второго родительского антитела/моноспецифического антитела против CD3; и v) высокомолекулярных соединений ("HMMS") в различных фракциях, элюируемых из cHA-колонки. На оси X на фиг. 4 слева направо представлена последовательность элюата из cHA-колонки (т.е. от низкой концентрации соли к высокой концентрации соли; каждая точка данных соответствует фракции, элюируемой из колонки). На оси Y на фиг. 4 слева показана процентная доля каждого из i) белка интактного интересующего биспецифического антитела против BCMA/CD3 ("POI"); ii) клиппированной версии биспецифического антитела; iii) первого родительского антитела/моноспецифического антитела против BCMA; и iv) второго родительского антитела/моноспецифического антитела против CD3 в каждой фракции. На оси Y фиг. 4 справа показан % HMMS в каждой фракции.
Способ, используемый для получения данных, показанных на фиг. 3, также использовали в отношении препарата антитела, в который не добавляли какие-либо дополнительные антитела; данные этого хроматографического эксперимента показаны на фиг. 5. Таким образом, данные на фиг. 5 отражают очистку с помощью cHA-смолы типичного препарата антитела, элюируемого из ионообменной колонки во время получения биспецифических антител против BCMA/CD3, содержащего, главным образом, интактное интересующее биспецифическое антитело против BCMA/CD3, а также различные примеси, включая клиппированную версию биспецифического антитела. На фиг. 5 на оси X слева направо показана последовательность элюируемого материала из cHA-колонки. На оси Y показано поглощение УФ (при 280 нМ) и электропроводность, что раздельно указано на графике. Пики родительского антитела 1 и родительского антитела 2 были меньше на фиг. 5, чем на фиг. 3, т.к. в образец, введенный в cHA-колонку, на фиг. 5 не добавляли дополнительное родительское антитело 1 и родительское антитело 2 (в то время как на фиг. 3, в образец добавляли дополнительное родительское антитело 1 и родительское антитело 2).
На фиг. 6 показан график, на котором приведена дополнительная информация о выходе интактного интересующего биспецифического антитела против BCMA/CD3 из cHA-смолы, а также относительном количестве клиппированного биспецифического антитела в различных фракциях, элюируемых из cHA-смолы. На оси X слева направо показана последовательность элюата из cHA-колонки (т.е. от низкой концентрации соли к высокой концентрации соли; каждая точка данных соответствует фракции, элюируемой из колонки). Вдоль вертикальной оси/оси Y откладывают три разные переменные для каждой фракции: переменная 1) (ромбы): суммарный выход интактного биспецифического антитела ("% POI"), представляющий собой общее количество интактного биспецифического антитела против BCMA/CD3 (т.е. интересующего белка), выделенное из cHA-колонки до этой фракции в хроматографическом эксперименте (другими словами, как если бы весь материал, элюируемый из cHA-колонки во время эксперимента до этой фракции и включая эту фракцию, собирали и объединяли, а затем измеряли общее количество интактного биспецифического антитела против BCMA/CD3 в этом объединенном материале); кроме того, значение "% POI" представляют в виде выделенного процента общего количества интактного против биспецифического антитела против BCMA/CD3/интересующего белка, введенного в cHA-колонку (т.е. а не значения в граммах). Переменная 2) (квадраты): % белка в каждой соответствующей фракции, являющегося клиппированныым биспецифическим антителом ("% клиппированного антитела"). Переменная 3) (треугольники): суммарный выход клиппированного биспецифического антитела ("суммарное клиппированное антитело"), представляющий собой общее количество клиппированного биспецифического антитела, выделенного из cHA-колонки до этой фракции в хроматографическом эксперименте. Кроме того, на графике на фиг. 6 на оси Y слева указаны значения % POI и на оси Y справа указаны значения % клиппированного антитела.
Фиг. 6 также содержит информацию о соответствии некоторых разных фракций на фиг. 6 разным точкам в поглощении УФ на хроматографическом профиле, показанном на фиг. 5. Таким образом, например, на фиг. 5 показано, что наибольший пик поглощения УФ/элюции белка из cHA-смолы соответствует интересующему белку/интактному биспецифическому антителу против BCMA/CD3. Верх этого крупного пика поглощения УФ/элюции белка из cHA-колонки также обозначают в эксперименте как "вершину"; хроматографический пик фракции, соответствующий этой точке вершины, указан на фиг. 6. Затем различные точки после вершины пика также указаны на фиг. 6. Эти точки представляют собой "90%", "80%", "70%", "60%" и "50%", и их вычисляют следующим образом. Значение поглощения УФ на вершине задают в качестве начальной точки для дополнительных вычислений. Затем определяют значение УФ, представляющее 90% значения УФ вершины. 90% значение УФ вершины, встречающееся после значения УФ вершины, достигнутое во время хроматографического эксперимента (т.е. в направлении хвоста пика), указывают как фракцию "90%"; ее также можно обозначать в настоящем описании как фракцию "90% после вершины" или т.п. То же самое повторяют для значений 80%, 70%, 60% и 50% (т.е. каждое из этих значений расположено все дальше к хвосту пика и, таким образом, соответствует все большему количеству собранного материала). Как показано на фиг. 6, со снижением значения % вершины, % клиппированного антитела во фракциях повышается. Это соответствует тому, что клиппированное биспецифическое антитело элюируют из cHA-колонки позже/при более высокой концентрации соли, чем интактное биспецифическое антитело против BCMA/CD3. Таким образом, если собирают более крупную фракцию вершины пика (т.е. с более низкой фракцией % после вершины пика), то также будут собирать больше клиппированного биспецифического антитела из-за частичного перекрывания между профилями элюции интактного биспецифического антитела и клиппированного биспецифического антитела.
Различные значения на фиг. 6 также представлены ниже в таблице 1. Как показано в таблице 1, в способе очистки с помощью cHA по настоящему изобретению, например, если собирают элюат 90% после вершины пика из cHA-колонки (т.е. % выхода POI до фракции "90% после вершины пика"), то выделяют 54% интактного биспецифического антитела/интересующего белка, введенного в cHA-колонку, и эта выделенная совокупность белка содержит 0% клиппированного биспецифического антитела. В другом примере, если собирают элюат 50% после вершины пика из cHA-колонки (т.е. % выхода POI до фракции "50% после вершины пика"), то выделяют 74% интактного биспецифического антитела/интересующего белка, введенного в cHA-колонку, и эта выделенная совокупность белка содержит 0,2% клиппированного биспецифического антитела. Таким образом, как показано на фиг. 6 и в таблице 1, с помощью cHA-смолы можно эффективно достигать надежной очистки интактного интересующего биспецифического антитела от клиппированного биспецифического антитела.
Таблица 1
Для получения результатов хроматографии на cHA, показанных на фиг. 3-6, хроматографию на cHA осуществляли следующим образом. Препарат антитела, содержащий интересующее биспецифическое антитело против BCMA/CD3 и различные примеси вводили в хроматографическую колонку, содержащую cHA-смолу. cHA-смола являлась cHA типа 1, размер частиц 40 мкм (Bio-Rad). В случае хроматографических экспериментов, показанных на фиг. 3 и 4, в cHA-смолу вводили образец до плотности белка на cHA-смоле 30 г/л. В случае хроматографических экспериментов, показанных на фиг. 5 и 6, в cHA-смолу вводили образец до плотности белка на cHA-смоле 10 г/л. Перед введением образца в cHA-смолу смолу предварительно уравновешивали 5 объемами колонки уравновешивающего буфера 1, а затем 5 объемами колонки уравновешивающего буфера 2. Композиция различных буферов в этом способе приведена ниже в таблице 2. Препарат антитела, содержащий частично очищенное интересующее биспецифическое антитело против BCMA/CD3, вводили в колонку со cHA-смолой в загрузочном буфере, содержащем приблизительно 50 мМ Трис и 60 мМ глицина, pH 7,5. После введения препарата антитела в колонку со cHA-смолой колонку промывали 3 объемами колонки промывочного буфера. Затем интересующее биспецифическое антитело (т.е. интактное биспецифическое антитело) элюировали из cHA-смолы с использованием 20 объемов колонки элюирующего буфера, в котором за время элюции концентрацию фосфата натрия повышали с 40 мМ до 80 мМ. Как показано на фиг. 3-6, различные примеси, присутствовавшие в препарате антитела с интересующим биспецифическим антителом, также элюируют из cHA-колонки под действием элюирующего буфера, но это осуществляют при существенно иных концентрациях соли по сравнению с интактным интересующим биспецифическим антителом против BCMA/CD3, таким образом, что интактное биспецифическое антитело можно эффективно отделять от различных примесей, включая клиппированную версию интактного биспецифического антитела.
После элюции интересующего белка из колонки с cHA-смолой с использованием элюирующего буфера описанным выше способом, cHA-смолу можно десорбировать 5 объемами колонки буфера для десорбции с последующей санацией 5 объемами колонки буфера для санации, а затем обработкой 5 объемами колонки буфера для хранения.
В случае каждого из указанных выше анализов разного материала, элюируемого из cHA-колонки, тип и количество разных видов молекул в различных фракциях/совокупностях определяли посредством аналитической катионообменной (CEX) хроматографии.
Таблица 2
Пример 2: Очистка биспецифического антитела против BCMA/против CD3 посредством хроматографии на cHA-смоле - пробы массовой нагрузки
Цель:
В этом примере целью являлось определение того, можно ли эффективно использовать способ очистки биспецифического антитела, описанный в примере 1, с различными пробами массовой нагрузки колонки со cHA-смолой. Например, конкретной целью являлось определение для различных проб массовой нагрузки на колонку со cHA-смолой того, можно ли неизменно выделять более 50% вводимого биспецифического антитела, одновременно получая не более 1% клиппированного биспецифического антитела в качестве примеси в выделенном продукте очищенного биспецифического антитела.
Материалы и способы:
Материалы и способы в этом примере являлись такими же, что и в примере 1, за исключением того, что в cHA-смолу вводили образец препарата антитела до плотности белка на cHA-смоле (в разных хроматографических экспериментах) 8 г/л, 10 г/л или 12 г/л.
Результаты:
Результаты этих хроматографических экспериментов обобщены ниже в таблице 3. Во всех 3 хроматографических экспериментах собирали и анализировали материал 90% после вершины пика (как описано в примере 1). Как показано в таблице 3, в случае каждой из массовых проб 8 г/л, 10 г/л и 12 г/л более 50% введенного интактного биспецифического антитела выделяли в виде очищенного биспецифического антитела, и выделенный продукт очищенного биспецифического антитела содержал менее 1% клиппированного биспецифического антитела в качестве примеси.
Таким образом, эти эксперименты показали, что интактное интересующее биспецифическое антитело можно неизменно эффективно отделять от клиппированного биспецифического антитела посредством хроматографии на cHA-смоле при различных пробах массовой нагрузки на cHA-смолу.
Таблица 3
Пример 3: Очистка биспецифического антитела против BCMA/против CD3 посредством хроматографии на cHA-смоле - разные пробы pH
Цель:
В этом примере целью являлось определение того, можно ли эффективно осуществлять способ очистки биспецифического антитела, описанный в примере 1, в разных условиях pH.
Материалы и способы:
Материалы и способы в этом примере являлись теми же, что и в примере 1, за исключением того, что pH буферов, используемых на всем протяжении осуществления способа, составлял pH 7,0, pH 7,5 или pH 8,0 (в разных хроматографических экспериментах). В этих хроматографических экспериментах в cHA-смолу вводили образец препарата антитела до плотности белка 30 г/л на cHA-смоле.
Результаты:
Результаты этих хроматографических экспериментов обобщены ниже в таблице 4. Во всех 3 хроматографических экспериментах собирали и анализировали материал вершины пика (как описано в примере 1). Как показано в таблице 4, белок интактного интересующего биспецифического антитела успешно выделяли в каждых из разных тестируемых условиях pH, и при pH 7,5 достигали наибольшего выхода интересующего белка (в этих хроматографических экспериментах количество клиппированного биспецифического антитела в очищенном материале отдельно не определяли).
Таким образом, эти эксперименты показали, что интактное интересующее биспецифическое антитело можно эффективно очищать посредством хроматографии на cHA-смоле в разных условиях pH.
Таблица 4
Пример 4: Очистка биспецифического антитела против FLT3/против CD3 посредством хроматографии на cHA-смоле
Цель:
В этом примере целью являлось определение того, можно ли эффективно осуществлять способ очистки биспецифического антитела, описанный в примере 1, с использованием иного биспецифического антитела, чем в примере 1, в случае которого также требовалось отделение интактного интересующего биспецифического антитела от различных примесей, включая соответствующее клиппированное биспецифическое антитело со схожей массой. В этом примере интересующее антитело являлось гетеродимерным биспецифическим антителом против FLT3/против CD3.
Материалы и способы:
Гетеродимерное биспецифическое антитело против FLT3/против CD3, используемое в этом примере, содержало ту же тяжелую цепь и легкую цепь против CD3, что и в примере 1. Аминокислотные последовательности полипептидов в FLT3-связывающем плече биспецифического антитела приведены в следующих SEQ ID NO: тяжелая цепь против FLT3: SEQ ID NO: 10; легкая цепь против FLT3: SEQ ID NO: 12.
Клиппированная версия биспецифического антитела в примере включала расщепление в том же положении тяжелой цепи против CD3, как описано в примере 1.
Материалы и способы в этом примере являлись теми же, что и в примере 1, за исключением того, что, как описано выше, препарат антитела образец содержал биспецифическое антитело против FLT3/против CD3. В cHA-смолу вводили образец препарата антитела до плотности белка на cHA-смоле 10 г/л.
Результаты:
На фиг. 7 показан график, на котором представлена информация о выходе интактного интересующего биспецифического антитела против FLT3/CD3 из cHA-смолы, а также относительном количестве клиппированного биспецифического антитела в различных элюируемых фракциях из cHA-смолы. На оси X слева направо показана последовательность элюата из cHA-колонки (т.е. от низкой концентрации соли до высокой концентрации соли; каждая точка данных соответствует фракции, элюируемой из колонки). По вертикальной оси/оси Y отложены три разные переменные для каждой фракции: переменная 1) (ромбы): % POI; переменная 2) (квадраты): % клиппированного антитела; и переменная 3) (треугольники), каждую из которых определяли, как описано в примере 1 и показано на Фиг. 6. Кроме того, на графике на фиг. 7 на оси Y слева указаны значения % POI и на оси Y справа указаны значения % клиппированного антитела. Фиг. 7 также включает информацию о соответствии некоторых фракций, показанных на фиг. 7, разным точкам поглощения УФ на соответствующем хроматографическом профиле (не показано). Точки, указанные как "вершина", "85%" и "60%", определяли так же, как и для фиг. 6.
Различные значения с фиг. 7 также приведены ниже в таблице 5. Как показано в таблице 5, способ очистки на cHA-смоле по настоящему изобретению делает возможным, например, выделение более 80% интактного интересующего биспецифического антитела против FLT3/CD3 при выделении менее 1% клиппированного биспецифического антитела в очищенном продукте антитела.
Таким образом, как показано на фиг. 7 и в таблице 5, с помощью cHA-смолы можно эффективно достигать очистки интактного биспецифического антитела против FLT3/CD3 от клиппированного биспецифического антитела.
Таблица 5
Хотя представленные идеи описаны со ссылкой на различное применение, способы, наборы и композиции, следует понимать, что можно осуществлять различные изменения и модификации без отклонения от идей, представленных в настоящем описании и формуле изобретения ниже. Описанные выше примеры приведены для лучшего иллюстрирования описанных идей, а не для ограничения объема идей, представленных в настоящем описании. Хотя представленные идеи описаны в терминах этих примеров вариантов осуществления, специалистам в этой области будет понятно, что возможны многочисленные варианты и модификации этих примеров вариантов осуществления без излишнего экспериментирования. Все такие варианты и модификации входят в объем идей по настоящему изобретению.
Все цитируемые в настоящем описании ссылки, включая патенты, патентные заявки, статьи, руководства и т.п., и цитируемые в них ссылки включены, таким образом, в настоящее описание в качестве ссылки в полном объеме. В случае если один или более из включенных литературных источников и схожих материалов отличается или противоречит настоящей заявке, включая, в качестве неограничивающих примеров, определенные термины, использование терминов, описанные способы или т.п., настоящая заявка обладает приоритетом.
В изложенном выше описании и примерах подробно описаны некоторые конкретные варианты осуществления изобретения и лучший способ осуществления, предусмотренный авторами настоящего изобретения. Однако следует понимать, что, несмотря на то, насколько подробным может являться изложенный выше текст, настоящее изобретение можно осуществлять на практике множеством способов, и настоящее изобретение следует рассматривать с учетом формулы изобретения и любых ее эквивалентов.
Следует понимать, что если варианты осуществления описаны в настоящем описании с использованием термина "содержащий", также предусмотрены в остальном аналогичные варианты осуществления, описанные с использованием терминов "состоящий из" и/или "состоящий, по существу, из".
Если аспекты или варианты осуществления изобретения описаны в терминах группы Маркуша или другого группирования альтернатив, настоящее изобретение включает не только всю группу, указанную в целом, но и каждого челна группы индивидуально и все возможные подгруппы основной группы, а также и основную группу, в которой отсутствует один или более членов группы. В настоящем изобретении также предусмотрено конкретное исключение одного или более из любых членов группы из описываемого в заявке изобретения.
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают значением, общепринято понятным специалисту в области, к которой принадлежит изобретение. В случае конфликта настоящее описание, включая определения, будет обладать приоритетом. На всем протяжении настоящего описания и формулы изобретения термин "содержат" или его варианты, такие как "содержит" или "содержащий", будут понимать как подразумевающие включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если контекст не требует иного, термины в единственном числе должны включать множественное число, и термины во множественном числе должны включать единственное число. Любые примеры, следующие после термина "например", не должны быть исчерпывающими или ограничивающими. Термин "или" при использовании в отношении перечисления множества вариантов (например, "A, B или C") следует интерпретировать как включающий любой один или более из вариантов, если контекст четко не указывает на иное.
В настоящем описании представлены примеры способов и материалов, хотя в практическом осуществлении или тестировании настоящего изобретения также можно использовать способы и материалы, схожие или эквивалентные представленным в настоящем описании. Материалы, способы и примеры являются исключительно иллюстративными, а не ограничивающими.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПФАЙЗЕР ИНК.
<120> ОЧИСТКА АНТИТЕЛ
<130> PC72423A
<150> US 62/635,943
<151> 2018-02-27
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Asn Arg Ala Arg Gly Tyr Thr Ser Asp His Asn Pro
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Arg Pro Ser Tyr Tyr Val Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 2
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Asn Arg Ala Arg Gly Tyr Thr Ser Asp His Asn Pro
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Arg Pro Ser Tyr Tyr Val Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Arg
210 215 220
Val Arg Cys Pro Arg Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
290 295 300
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 3
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Arg Ser Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Ser Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asp Leu Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 4
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Arg Ser Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Ser Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asp Leu Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 5
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Gly Ser Gly Gly Ser Leu Pro Tyr Ala Asp Ile Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Trp Pro Met Asp Ile Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 6
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Pro Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Gly Ser Gly Gly Ser Leu Pro Tyr Ala Asp Ile Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Trp Pro Met Asp Ile Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly
180 185 190
Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Thr Val Glu Arg Lys Cys Glu Val Glu Cys Pro Glu Cys
210 215 220
Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Ala Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
340 345 350
Thr Lys Asn Gln Val Ser Leu Thr Cys Glu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 7
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Met Tyr Asp Ala Ser Ile Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gln Ser Trp Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 8
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Met Tyr Asp Ala Ser Ile Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gln Ser Trp Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 9
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Ser Pro Ser Asp Val Gly Trp Gly Tyr Gly Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 10
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gly Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Ser Pro Ser Asp Val Gly Trp Gly Tyr Gly Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu
130 135 140
Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn
195 200 205
Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg
210 215 220
Lys Cys Glu Val Glu Cys Pro Glu Cys Pro Ala Pro Pro Val Ala Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg
290 295 300
Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Glu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 11
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Thr Phe Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 12
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Thr Phe Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ CD3E/BCMA И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800164C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2807216C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2790288C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2779489C2 |
| Биспецифическое антитело и его применение | 2019 |
|
RU2785292C2 |
| АНТИТЕЛА К LY6G6D И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2818569C1 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ВСМА, NKG2D И CD16 | 2018 |
|
RU2805254C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812322C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-T-КЛЕТКИ | 2020 |
|
RU2762942C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-NK-КЛЕТКИ | 2020 |
|
RU2795443C2 |
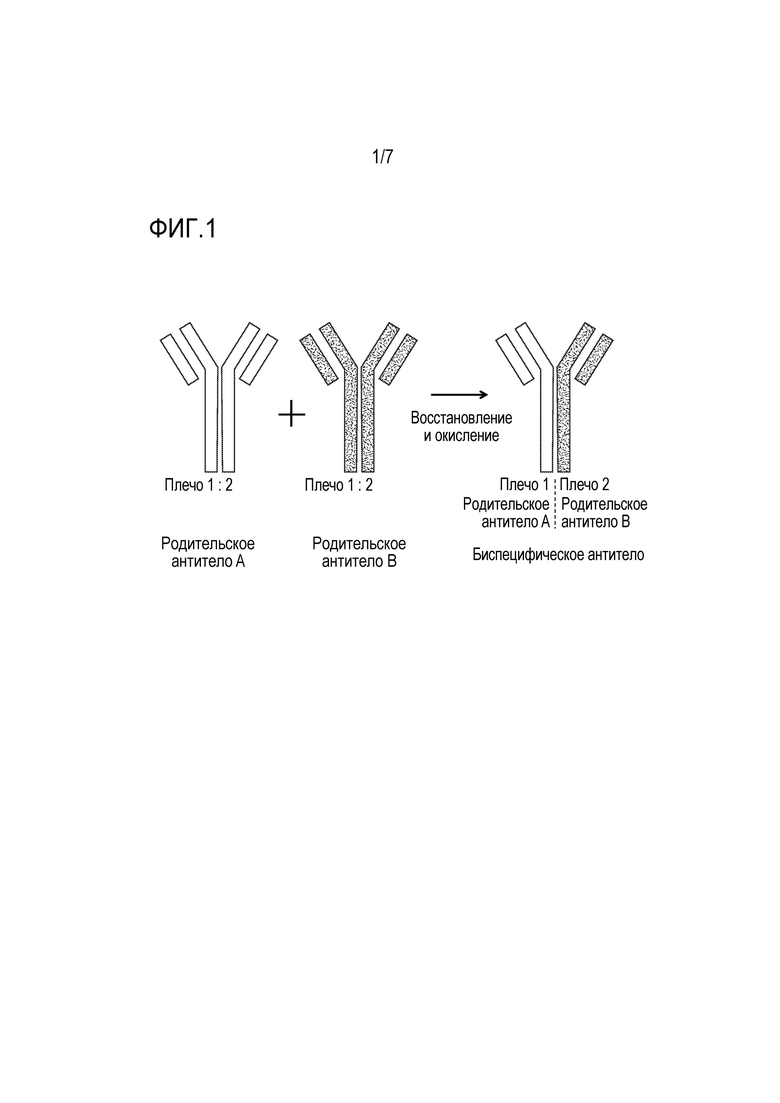
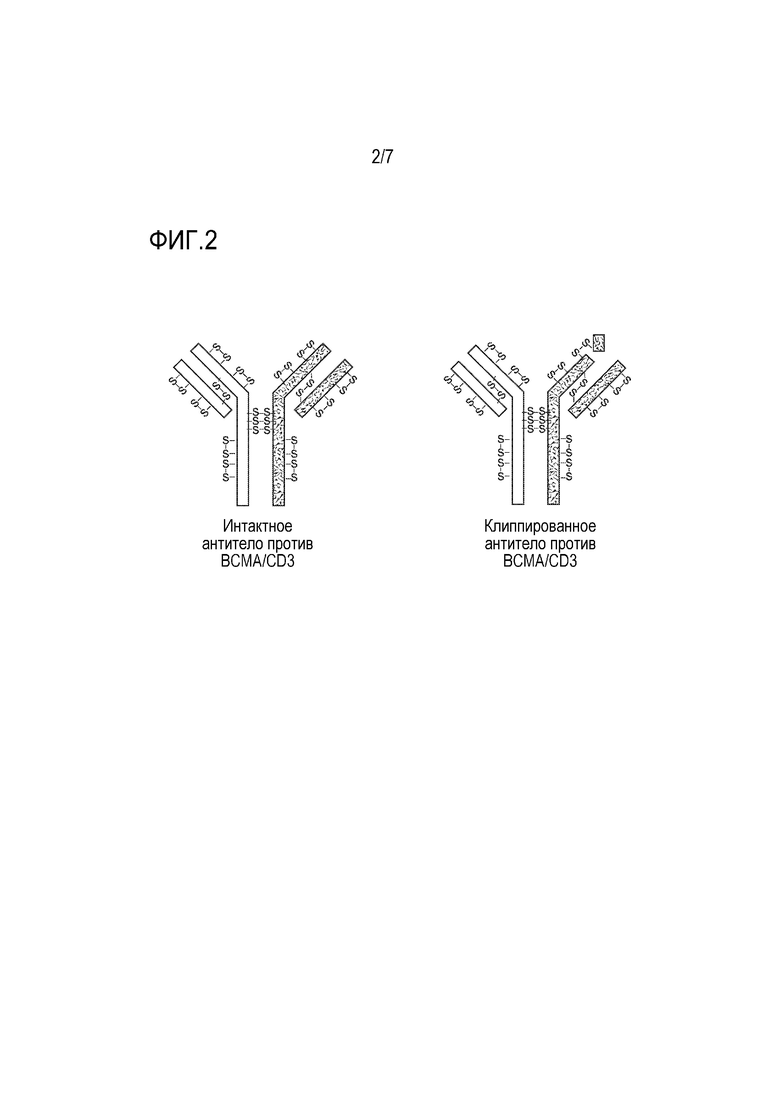

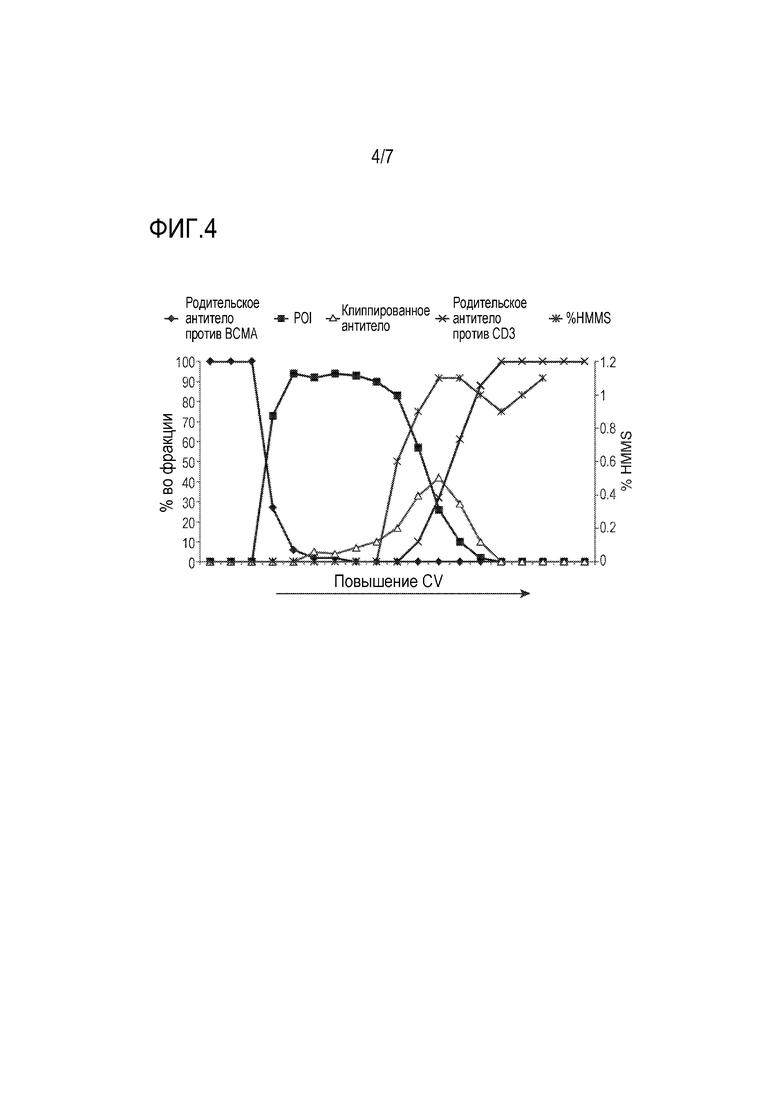

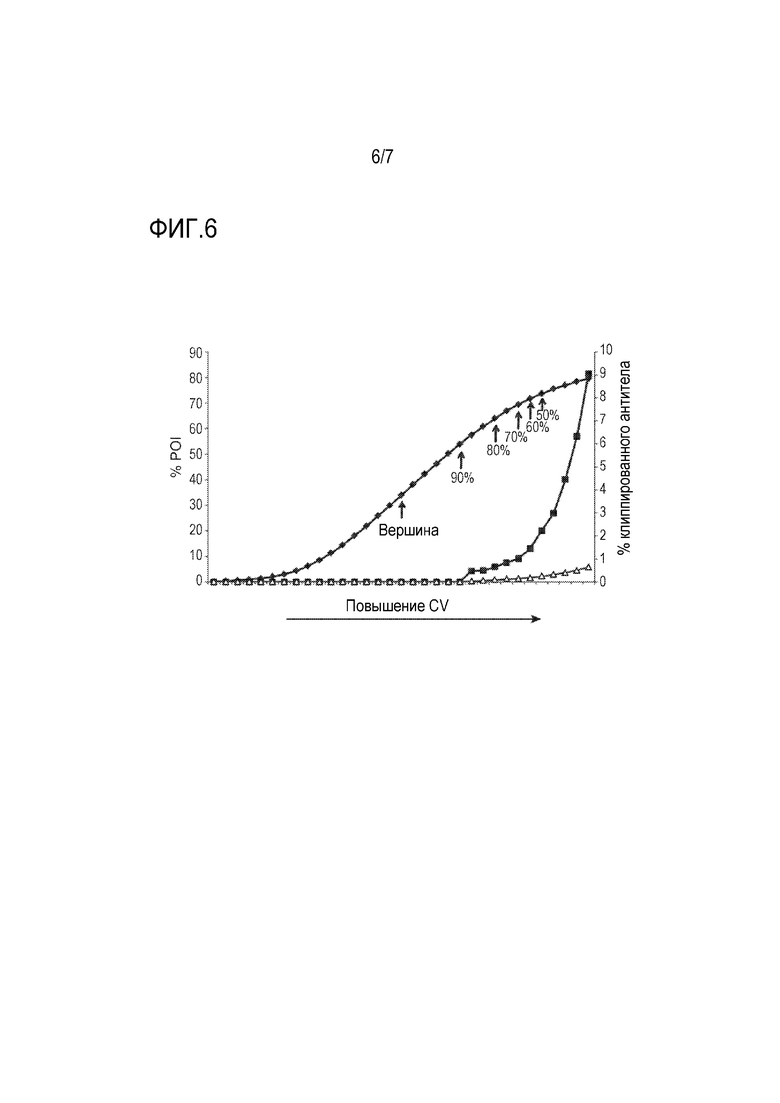

Группа изобретений относится к способу очистки антител от примесей, таких как продукты деградации антител. Предложен способ очистки анти-ВСМА/анти-CD3 биспецифического антитела. Вводят препарат антитела в загрузочный буфер на гидроксиапатитную (HA) смолу. Препарат антитела содержит интактное представляющее интерес биспецифическое антитело по меньшей мере один вид примесей. Промывают смолу промывочным буфером, содержащим ионы фосфата в концентрации от 10 до 50 мМ. Элюируют интактное представляющее интерес биспецифическое антитело из HA-смолы с использованием элюирующего буфера, содержащего ионы фосфата в концентрации от 40 до 100 мМ. Концентрация ионов фосфата повышена по сравнению с промывочным буфером, так что представляющее интерес биспецифическое антитело отделено по меньшей мере от одного вида примесей. pH загрузочного буфера, промывочного буфера и/или элюирующего буфера находится на уровне pH от 7,0 до 8,0. Полученный препарат анти-ВСМА/анти-CD3 биспецифического антитела содержит не более 1% обрезанного биспецифического антитела в качестве примеси. 2 н. и 11 з.п. ф-лы, 7 ил., 5 табл., 4 пр.
1. Способ очистки анти-ВСМА/анти-CD3 биспецифического антитела, включающий:
A) введение препарата антитела в загрузочный буфер на гидроксиапатитную (HA) смолу, где:
препарат антитела содержит:
I) интактное представляющее интерес биспецифическое антитело; и
II) по меньшей мере один вид примесей,
где вид примесей выбран из группы, состоящей из:
a) усеченная версия представляющего интерес биспецифического антитела, где усеченная версия представляющего интерес биспецифического антитела является продуктом деградации интактного представляющего интерес биспецифического антитела и имеет массу, отличающуюся менее чем на 1% от массы интактного представляющего интерес биспецифического антитела;
b) первое родительское антитело, где первое родительское антитело является моноспецифическим антителом, имеющим ту же антигенную специфичность, что и первое плечо интактного биспецифического антитела;
c) второе родительское антитело, где второе родительское антитело является моноспецифическим антителом, имеющим ту же антигенную специфичность, что и второе плечо интактного биспецифического антитела; и
d) высокомолекулярные соединения (HMMS);
В) промывание смолы промывочным буфером, содержащим ионы фосфата в концентрации от 10 до 50 мМ; и
С) элюцию интактного представляющего интерес биспецифического антитела из HA-смолы с использованием элюирующего буфера, содержащего ионы фосфата в концентрации от 40 до 100 мМ, где концентрация ионов фосфата повышена по сравнению с промывочным буфером, так что представляющее интерес биспецифическое антитело отделено по меньшей мере от одного вида примесей;
где pH по меньшей мере одного из загрузочного буфера, промывочного буфера и элюирующего буфера находится на уровне pH от 7,0 до 8,0 или между этими значениями; и
где анти-ВСМА/анти-CD3 биспецифическое антитело содержит плечо анти-ВСМА и плечо анти-CD3, где
(a) плечо анти-CD3 содержит
(i) область VH, содержащую аминокислотную последовательность SEQ ID NO:1, и область VL, содержащую аминокислотную последовательность SEQ ID NO:3, или
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:4; и
(b) плечо анти-BCMA содержит
(i) область VH, содержащую аминокислотную последовательность SEQ ID NO:5, и область VL, содержащую аминокислотную последовательность SEQ ID NO:7, или
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:6, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8.
2. Способ по п.1, где соотношение молекул усеченного биспецифического антитела и молекул интактного биспецифического антитела в препарате антитела составляет по меньшей мере от 1:50 до не более чем 1:5;
необязательно, где способ включает сбор очищенной фракции, элюируемой из HA-смолы,
где очищенная фракция содержит интактное биспецифическое антитело.
3. Способ по п.1, дополнительно включающий сбор очищенной фракции, элюируемой из HA-смолы,
где очищенная фракция содержит интактное интересующее антитело, и
где очищенная фракция содержит по меньшей мере 95% масс., 96% масс., 97% масс., 98% масс. или 99% масс. интактного интересующего антитела.
4. Способ по п.2 или 3, где очищенная фракция содержит интактное биспецифическое антитело и усеченное биспецифическое антитело, где соотношение молекул усеченного биспецифического антитела и молекул интактного биспецифического антитела в очищенной фракции составляет не более 1:100.
5. Способ по любому из пп.1-4, где усеченное антитело имеет массу, составляющую приблизительно на 5-100 Да больше, чем масса интактного антитела.
6. Способ по любому из пп.1-5, где усеченное антитело содержит расщепленную пептидную связь в полипептидной цепи антитела, и где расщепленная пептидная связь находится в тяжелой цепи антитела.
7. Способ по любому из пп.1-6, где усеченное антитело содержит то же количество аминокислот и те же аминокислотные последовательности, что и интактное антитело.
8. Способ по любому из пп.1-6, где усеченное антитело содержит иное количество аминокислот, чем интактное антитело.
9. Способ по любому из пп.1-8, где HA-смола является керамической гидроксиапатитной (cHA) смолой.
10. Способ по любому из пп.1-9, где концентрацию иона фосфата повышают во время элюции приблизительно от 40 до 100 мМ.
11. Способ по любому из пп.1-10, где препарат антитела содержит белки, ранее загруженные на или элюированные по меньшей мере из:
i) смолы с протеином A и
ii) ионообменной смолы.
12. Способ по любому из пп.1-11, где антитело выделяют и/или очищают для применения в качестве фармацевтических средств или для получения фармацевтических средств.
13. Препарат антитела, содержащий анти-BCMA/анти-CD3 биспецифическое антитело, содержащий плечо анти-BCMA и плечо анти-CD3, где
(a) плечо анти-CD3 содержит
(i) область VH, содержащую аминокислотную последовательность SEQ ID NO:1, и область VL, содержащую аминокислотную последовательность SEQ ID NO:3, или
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:4; и
(b) плечо анти-BCMA содержит
(i) область VH, содержащую аминокислотную последовательность SEQ ID NO:5, и область VL, содержащую аминокислотную последовательность SEQ ID NO:7, или
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:6, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:8; и
где препарат содержит не более 1% обрезанного биспецифического антитела в качестве примеси.
| MOCHIZUKI K | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Human Antibodies, 1991, 2 (3), p.116-123, doi:10.3233/hab-1991-2301 | |||
| WO 2015024896 A1, 26.02.2015 | |||
| US 2016297885 A1, 13.10.2016 | |||
| WO 2017021362 A1, 09.02.2017 | |||
| DE 4205938 A1, 02.09.1993 | |||
| SAITO M | |||
| et al | |||
| Separation and analysis of charged isomers of | |||
Авторы
Даты
2024-01-24—Публикация
2019-02-25—Подача